Author: Харнесс Дж.К. Вишер Д.Б.
Tags: хирургия ортопедия офтальмология медицина ультразвуковая диагностика
ISBN: 978-5-94774-296-1
Year: 2007
Text
УЛЬТРАЗВУКОВАЯ
ДИАГНОСТИКА
В ХИРУРГИИ
ОСНОВНЫЕ СВЕДЕНИЯ
И КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
БИНОМ
ULTRASOUND
IN SURGICAL
PRACTICE
BASIC PRINCIPLES AND
CLINICAL APPLICATIONS
Edited by
Jay K. Harness, M. D.
Dennis B. Wisher, R. D. M. S.
@ WILEY-LISS
A JOHN WILEY & SONS, INC., PUBLICATION
New York • Chichester • Weinheim • Brisbane • Singapore • Toronto
УЛЬТРАЗВУКОВАЯ
ДИАГНОСТИКА
В ХИРУРГИИ
ОСНОВНЫЕ СВЕДЕНИЯ
И КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
Под редакцией
Дж. К. Харнесса, Д. Б. Вишера
Перевод с английского
под редакцией С. А. Панфилова
Москва
БИНОМ. Лаборатория знаний
2007
УДК 617
ББК 54 5
У51
Ультразвуковая диагностика в хирургии: основные сведения и клини-
у51 ческое применение / под. ред. Дж. К. Харнесса, Д. Б. Вишера, пер. с англ
под ред. С. А. Панфилова. — М. : БИНОМ. Лаборатория знаний, 2007. —
597 с. : 16 с. ил : ил.
ISBN 0-471-24538-0 (англ.)
ISBN 978-5-94774-296-1 (русск.)
В данной книге ультразвуковое исследование рассматривается как один из
компонентов общей хирургии.
Чтобы сведения об основах и клиническом применении ультразвука были
понятны хирургам, в книге использованы разнообразные средства — материал
распределен в соответствии с анатомическими областями, текст каждой главы
сопровождается четкими иллюстрациями, понятными схемами, полезными с
практической точки зрения.
Для хирургов и специалистов по ультразвуковой диагностике.
УДК 617
ББК 54.5
Авторы, редактор и издатель полагают, что описание препаратов, их дозировка и специфика-
ция, а также описание использования оборудования и устройств, содержащиеся в этой книге,
соответствуют рекомендациям и практике их использования, принятым ко времени публика
ции. Они не несут никакой юридической ответственности за любые содержащиеся в тексте или
иллюстрациях ошибки или упущения. Ввиду продолжающейся модификации оборудования;
изменений в рекомендациях руководящих и надзирающих органов о применении препаратов,
оборудования и устройств, для получения сведений о правилах применения и дозировках, до-
бавленных предупреждениях и предосторожностях, читатель должен самостоятельно оцени-
вать информацию, прилагающуюся к каждому препарату, оборудованию или устройству.
По вопросам приобретения обращаться:
«БИНОМ. Лаборатория знаний»
(495) 157-52-72, e-mail Lbz@aha.ru
http://www.Lbz.ru
© 2001 by Wiley-Liss, Inc. All rights reserved.
Authorized translation from the English language
ISBN 0-471-24538-0 (англ.) edition published by John Wiley & Sons, Inc.
ISBN 978-5-94774-296-1 (русск.) © БИНОМ. Лаборатория знаний, 2007
СОДЕРЖАНИЕ
Предисловие......................................7
Введение.........................................10
Авторы...........................................12
1 Основные сведения об ультразвуке:
как звуковые волны становятся изображениями
Уильям Р. Фрай...............................14
2 Работа на ультразвуковом аппарате
Терренс Д. Кейс ...................... 38
3 Ультразвуковое исследование органов брюшной
полости: основные сведения
Деннис Б. Вишер..............................51
4 Ультразвуковое исследование органов брюшной
полости при травме (скрининг)
Р. Стефен Смит..............................153
5 Интервенционная ультрасонография
Алан Е. Зиперштейн.............................178
6 Ультразвуковое исследование молочной железы
Джей К. Харнесс и Марк А. Джиттлмен............195
7 Ультразвуковое исследование щитовидной
железы и паращитовидных желез
Джей К. Харнесс и Петер Ф. Чако.............279
8 Интраоперационное ультразвуковое
исследование
Элиот Дж. Фегельман.........................309
9 Лапароскопическая ультрасонография
Алан Е. Зиперштейн ................... 324
10 Трансэзофагеальная эндосонография
и эхокардиография..............................344
А. Эндосонографическое исследование пищевода
Марк Е. Поллок и Джон Г. Ли.................344
6
СОДЕРЖАНИЕ
Б. Трансэзофагеальная эхокардиография
Дж. Нилас Янг...............................35
В. Эффективность трансэзофагеальной эхокардиографии
в оценке повреждений грудной аорты
Пол А. Кехрней.............................371
11 Эндоскопическая ультрасонография желудка
Глория Сзе, Стенли Р. Кле и
Виктор Е. Исселейн.........................379
12 Эндоскопическая ультрасонография
поджелудочной железы
Джеймс Шайман и Парта С. Нанди.............402
13 Эндоскопическая ультрасонография
прямой кишки
Трейси Д. Арнелл и Майкл Дж. Стеймос.......430
14 Гинекология / акушерство
Эрик Р. Сноэй.................................448
15 Ультразвуковое исследование сосудов
Лоуренс Дж. Голдштейн и
Лаура С. Уилбур...................... 491
16 Ультразвуковое исследование в отделениях
неотложной помощи
Родни М. Дурхам............................542
17 Новые технологии
Джей К. Харнесс и Деннис Б. Вишер......... 559
18 УЗИ: аккредитация, аттестация, контроль качества
и получение разрешений хирургами
Джей К. Харнесс ..................... 579
ПРЕДИСЛОВИЕ
Хорошая книга поскольку она содержит важные, тщательно подобран-
ные и упорядоченные сведения, должна потребовать от читателя части та-
кого же внимательного изучения, которое потребовалось автору, чтобы со-
здать ее! [1]
Питер М. Латам,
III лекция курса клинической медицины
Мы — представители специальности, созданной технологией. Начиная со
Второй мировой войны, использование технологических достижений в хи-
рургии породило много революционных изменений в хирургической практи-
ке. По определению Webster, технология—это «совокупность средств, испо-
льзуемых для обеспечения насущных пот ребностей человека и его комфорта.
Наши периодические издания насыщены сведениями о технологических до-
стижениях и коммерческими предложениями. Если хирург не будет исполь-
зовать вычислительную технику, он не сможет соответствовать современ-
ным требованиям. Из новых технологий, внедренных в конце XX столетия,
ни одна не была так близка к хирургии, как ультразвук. Утверждение о том,
что ультразвук дополняет физикальное исследование и является полезным
диагностическим инструментом,—это скромное преуменьшение. Книга под
редакцией Джей К. Харнесс и Денниса Б. Вишера представляет собой резуль-
тат тесного сотрудничества хирурга и специалиста по ультразвуковой диа-
гностике, которые совместно создали этот заслуживающий внимания труд.
Сочетание их большого опыта в этом творческом усилии и сотрудничество со
зрелыми клиницистами позволило представить ультразвук как один из основ-
ных компонентов общей хирургии.
Ультразвук (ultra — чрезмерный или запредельный; sonus — звук) —
это технология, которая навсегда вошла в нашу жизнь. С каждым прошед-
шим днем открываются новые обширные области применения этого неинва-
зивного средства. Ультразвук безопасен, быстр и доступен, а также сравни-
тельно рентабелен. Исследователи объединили ультразвук с разнообразны-
ми методами биопсии, допплерографии, лапароскопии, другими новыми
технологиями, но это только верхушка айсберга. Такое новое дополнение к
оснащению врачебного кабинета проясняет, почему создатели учебных пла-
нов для медицинских школ в прошлые годы полагали, что знания физики яв-
ляются важной и необходимой научной основой.
Увеличивающаяся популярность ультрасонографии породила новую тер-
минологию: ультразвуковое исследование в А-, В-, М-режимах, серошкаль-
ные изображения в реальном времени, цветовая допплерометрия, трансрек-
тальная ультрасонография, внутриполостная ультрасонография и т. д. Исполь-
8
ПРЕДИСЛОВИЕ
зуемое для ультрасонографии портативное оборудование нашло применение в
операционной и за ее пределами, в кабинетах врачей, блоках интенсивной
терапии, травматологических и онкологических отделениях.
Эта книга станет превосходным источником знаний. Джей К. Харнесс и
Деннис Б. Вишер использовали разнообразные средства, чтобы сведения об
основах и клиническом применении ультразвука были понятны хирургам.
Материал распределен по анатомическим областям. Каждая глава — ориги-
нальная. Особенно впечатляют цветные иллюстрации в главе, посвященной
ультразвуковой диагностике заболеваний сосудов. Редакторы использовали со-
поставление ультрасонограмм с разъяснениями в тексте и поясняющими схе-
мами. Это — уникальная и заслуживающая внимания образовательная мето-
дика. Иллюстрации ясны и хорошо обозначены, схемы понятны и полезны с
практической точки зрения.
Важность научных основ в развитии диагностических и лечебных под-
ходов в последние годы была подчеркнута Американской информационной
хирургической коллегией, которая внесла ультрасонографию в список мето-
дов, с которыми «должен подробно ознакомиться общий хирург» [2]. Коми-
тет по наблюдению за клинической ординатурой по хирургии согласился с
этим в марте 1998 г.: «Клинические ординаторы должны иметь возможность
ознакомиться с ультразвуковыми исследованиями головы и шеи, молочной
железы, органов брюшной полости, включая лапароскопическую и транс-
ректальную ультрасонографию» [3]. Эти директивы привлекли внимание
хирургов к клинической значимости ультрасонографии и стимулировали их
профессиональные навыки. Американская корпорация хирургов, признавая
важность технологического прогресса в хирургии, учредила комитет, деятель-
ность которого направлена на внедрение технологических достижений, и
организовала курсовое обучение ультрасонографии. Использование ультра-
звука и объединение его возможностей с биомедицинским индустриальным
комплексом для решения диагностических задач в современной хирургии
продолжает расширяться.
Сегодняшний мир насыщен аппаратурой, которая иногда заменяет рас-
судок и здравый смысл. Все чаще хирург вытесняется технологией. Это —
недостаток хирурга, а не технологии. Хирурги стали верховными жрецами
лаборатории и сортировщиками рентгенограмм. Это унизило нашу профес-
сию как познавательную дисциплину. Короче говоря, мы стали зависимыми
от технологии. Энтузиазм одного десятилетия для отдельных технологий
часто дискредитируется или отвергается в следующем десятилетии. Ультра-
сонография уже показала достоинства, достаточные для долгосрочного при-
менения. Теперь мы анализируем знания, накопленные об этом диагности-
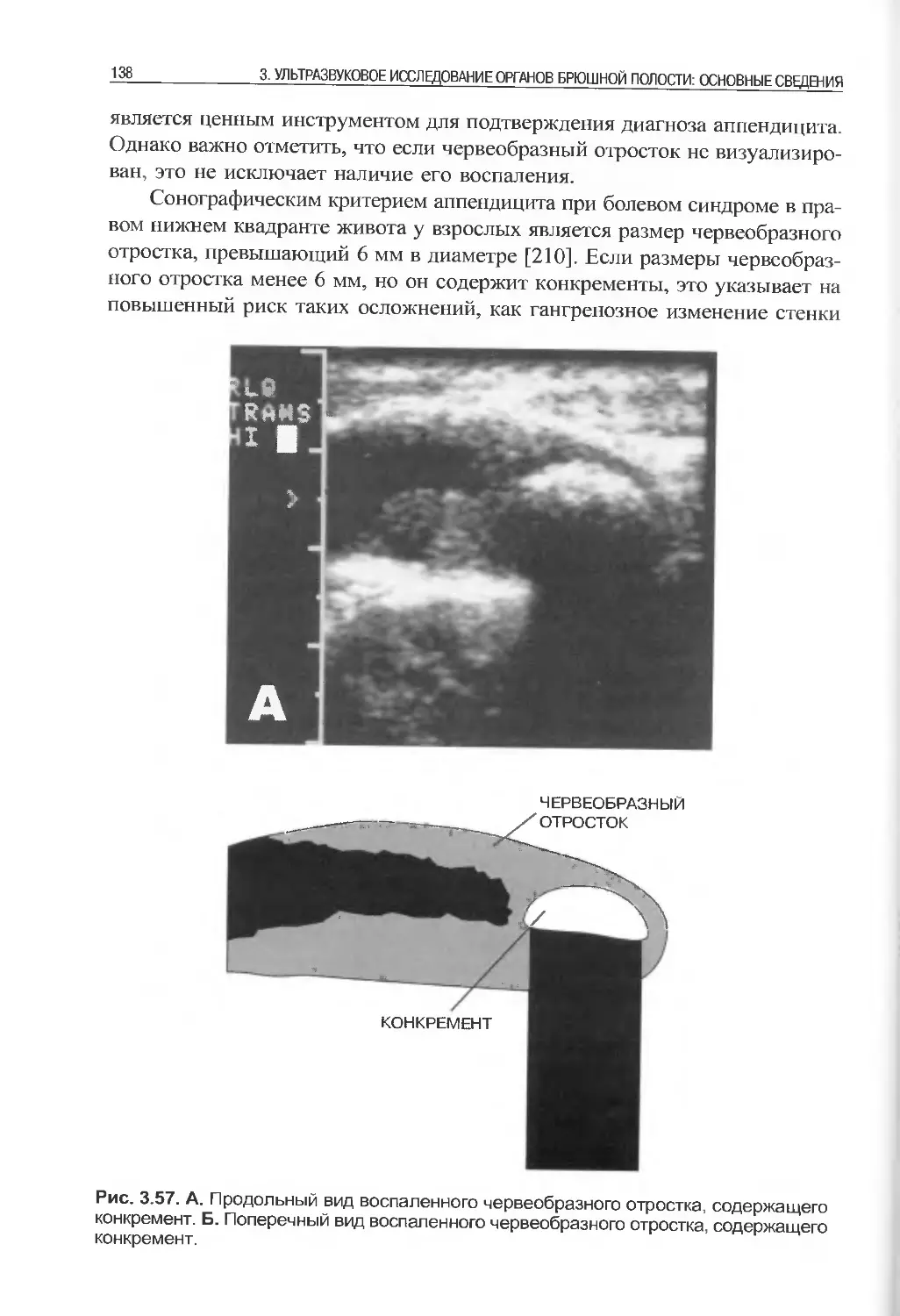
ческом средстве, и даем точную оценку этого современного технологиче-
ского достижения. Быстрый технологический рост затронул все области
здравоохранения, при этом ультрасонография — это символ происходящего
в технологическом мире.
ПРЕДИСЛОВИЕ
9
Вчерашние изыскания определяют сегодняшнее практическое примене-
ние ультрасонографии. Завтра будет так же. Эта книга представляет само-
стоятельный интерес для студентов, ординаторов и практикующих хирур-
гов, которые стали дипломированными специалистами более десяти лет на-
зад, когда эта методика широко не использовалась.
В 1980-х годах, при увеличении объема медицинской помощи, достиг-
нутого за счет технологий, мы столкнулись с проблемой обеспечения его ка-
чества. Нашей задачей в XXI столетии должно стать развитие средств конт-
роля качества, которые отразят действительные достижения и финансовые
препятствия. Этот быстрый рост знаний происходит в тесной связи с техно-
логическими достижениями. Второй причиной является важная и значитель-
ная роль ультрасонографии при диагностической помощи больным.
Хирургия — это, прежде всего, моральная деятельность с благородны-
ми традициями альтруизма и служения обществу. Настало время, чтобы
вновь поддержать эту традицию. Высокие технологии и человечество могут
сосуществовать. Достичь этой цели в нашем деле служения обществу на-
много проще саморегуляцией, чем навязыванием служебных инструкций.
Своей своевременной публикацией Джей К. Харнесс и Деннис Д. Вишер по-
могли нам поддерживать это движение вперед и эту традицию.
КЛОД Н. ОРГАН, МЛ., M.D.
Профессор кафедры хирургии
Калифорнийского университета им. Дэвиса
ЛИТЕРАТУРА
1. Peter М. Latham (1789-1875). Lectures on Clinical Medicine, Lecture III.
2. American Board of Surgery Booklet of Information 1998-1999. Philadelp-
hia, PA, pg. 11.
3. Residency Review Committee Newsletter (Chicago), March 1998, page 2.
ВВЕДЕНИЕ
Технологический уровень и клиническое применение ультрасонографии за
два прошедших десятилетия значительно выросли. Когда-то применявшаяся
исключительно радиологами, теперь ультразвуковая диагностика использу-
ется широким кругом клиницистов: акушерами и гинекологами, кардиологами
и сердечно-сосудистыми хирургами, урологами (и это далеко не весь перечень
специалистов). Paci пиряющееся применение ультразвука в хирургической прак-
тике (например, биопсия под ультразвуковым контролем, лапароскопическая и
внутриполостная ультрасонография, эндоскопическое УЗИ и т. д.) делает это
исследование настолько важным, что практикующие хирурги, хирурги-ор-
динаторы и студенты медицинских факультетов разбираются в ультразвуко-
вых изображениях, технологии и клиническом применении ультрасоногра-
фии.
Наш опыт говорит о том, что хирурги быстро обучаются ультразвуковой
диагностике — как только они понимают физические основы ультрасоногра-
фии, ультразвуковой аппаратуры и позиционирования датчика. Хирурги хо-
рошо знают анатомию, топографические соотношения и инвазивные процеду-
ры. Они действительно нуждаются только в правильно организованном обуче-
нии ультразвуковой диагностике.
Эта книга предназначена для введения в мир ультрасонографии и пре-
доставляет хирургу разносторонние сведения о ее применении, понятиях и
методиках. Врач, деятельность которого непосредственно не связана с диа-
гностическими изображениями, очень часто воспринимает ультразвуковые
изображения как неупорядоченный набор оттенков серого цвета, разобрать-
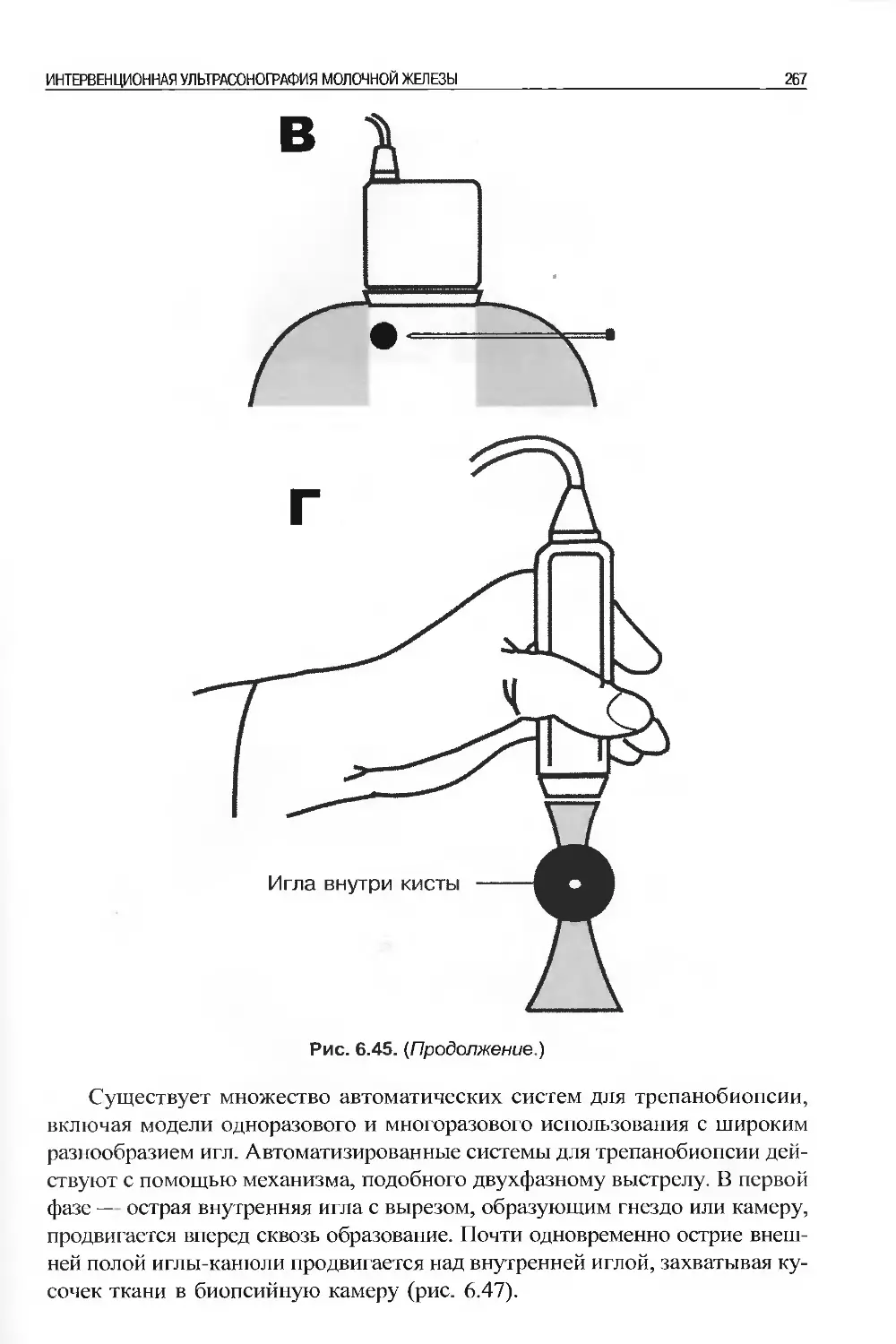
ся в котором невозможно. Цель этой книги — в удалении покрова тайны, ко-
торая часто окружала ультрасонографию, и представления ее в логическом,
легко понятном виде. На страницах этой книги вы найдете специально подо-
бранные для хирурга, собирающегося использовать ультразвук в своей
практике, сведения о технических и клинических аспектах ультрасоногра-
фии. Так как УЗИ не связано с ионизирующей радиацией, компактно и рента-
бельно, в мире управляемого здравоохранения оно было и будет диагности-
ческим средством выбора врачей самых разных специальностей.
Руководство такого объема, конечно, не может быть создано без учас-
тия многих людей. Мы выражаем глубокую признательность нашим соавто-
рам за их усилия. Без их опыта, знаний и обязательности было бы трудно до-
стичь общей цели этого руководства. Кроме наших соавторов есть и другие
люди, которые для создания этого первоклассного произведения приложили
усилия «выше служебного долга». Прежде всего, мы хотим поблагодарить
госпожу Кэролин Роак. Кэролин была основным художником, создавшим
ВВЕДЕНИЕ
11
почти все рисунки этого руководства. Она также являлась организационной
силой, обеспечивающей своевременный обмен материалами между нашими
соавторами и техническим редактором, и проделала огромную работу, необ-
ходимую для издания этой книги.
Мы хотим также выразить глубокую признательность нашему техниче-
скому редактору, госпоже Филлис Гейпн, потратившей бесчисленные часы
для корректировки текста, в результате чего он стал удобочитаемым и по-
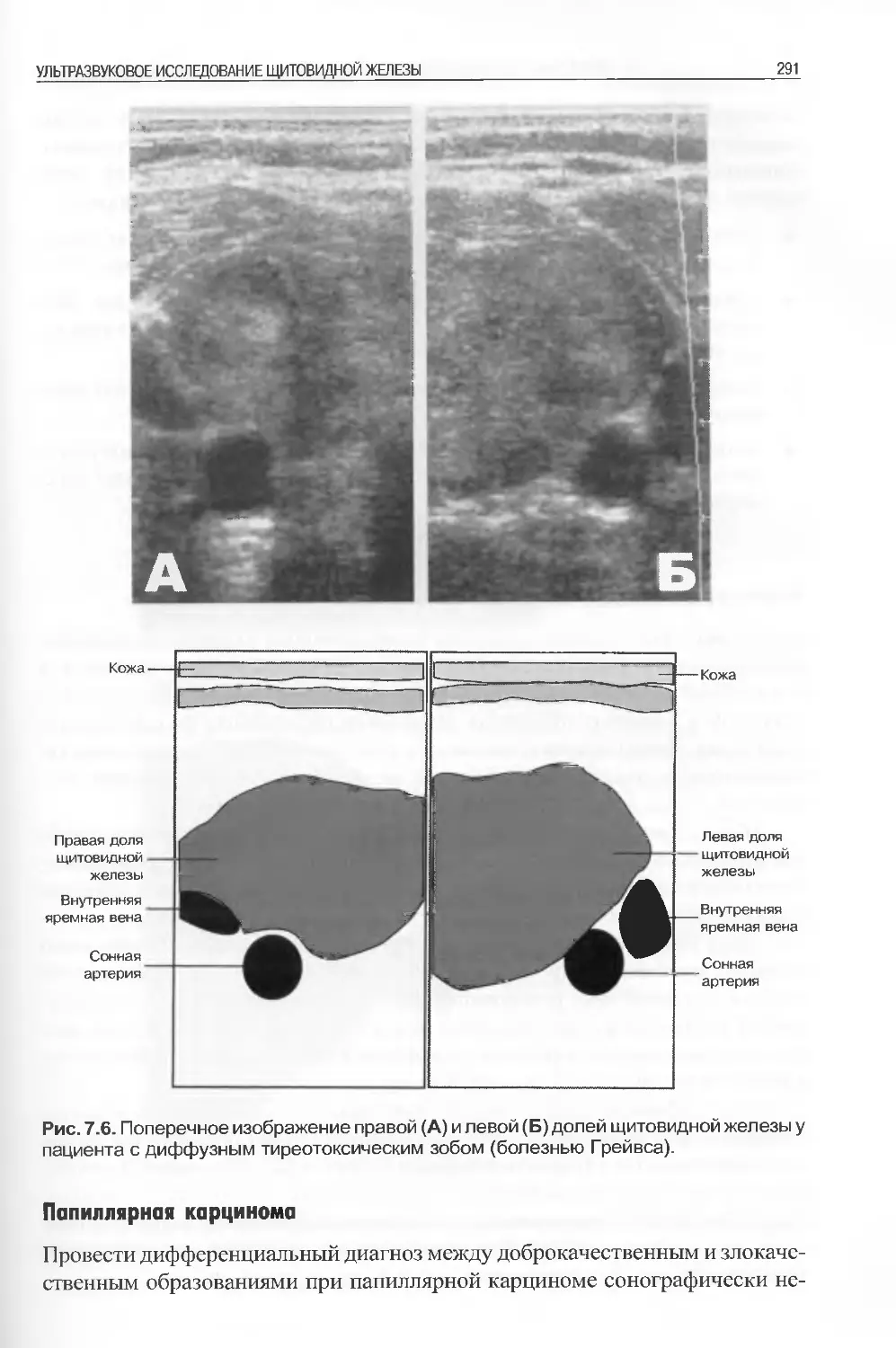
следовательно расположенным по главам. Полагаем, что она проделала
огромную работу и что наши читатели, используя это руководство, оценят
ее усилия. Мы также благодарим госпожу Андри Поликиккио. Андри явля-
лась художником в начале этого проекта, и благодаря ее опыту и мастерству
художественное оформление книги выполнено должным образом и обеспе-
чено превосходными рисунками. Особая благодарность Medison of Cypress,
СА, и Advance Technology Laboratories (ATL) of Bothell, WA за выделение
грантов для поддержки художественных работ госпожи Поликиккио.
Наконец, мы благодарим работников секретариата, которые потратили
бесконечные часы, печатая и перепечатывая главы, отправляя факсы и по-
сылая материалы нашим соавторам и издателю. Ведущим в этой маленькой
армии увлеченных своим делом людей была госпожа Дебби Расселл. Ее кол-
легами были госпожа Норма Хаднот и госпожа Лайза Диангсен.
ДЖЕЙ К. ХАРНЕСС, М. D.
Окленд, Калифорния
ДЕННИС Б. ВИШЕР, RDMS
Кипрее, Калифорния
АВТОРЫ
Арнелл Трейси Д.
Tracey D. Arnell, M.D., Assistant Professor of Surgery, UCLA School of Medicine,
Department of Surgery, Division of Colon and Rectal Surgery, Harbor-UCLA Medical
Center, Torrance, CA 90509
Вишер Деннис Б.
Dennis В. Wisher, RDMS, RVT, Director of Education, Medison, Cypress, CA 90630
Голдштейн Лоуренс Дж.
Lawrence J. Goldstein, M.D., RDMS, RVT, FACS, Assistant Professor of Surgery,
University of California, Davis, Chief, Division of Vascular Surgery, University of Ca-
lifornia, Davis-East Bay, Department of Surgery, Alameda County Medical Center,
Oakland, CA 94602
Джиттлмен Марк A.
Mark A. Gittleman, M.D., FACS, Clinical Assistant Professor of Surgery, Pen-
nsylvania State University College of Medicine, Departments of General Surgery,
Lehigh Valley Hospital, Sacred Heart Hospital, Allentown, PA 18103
Дурхам Родни M.
Rodney M. Durham, M.D., FACS, Director of Trauma and Associate Professor, Uni-
versity of Tennessee College of Medicine, Chattanooga, TN 37403
Зиперштейн Алан E.
Allan E. Siperstein, M.D., Chief, Section of Endocrine Surgery, Department of Gene-
ral Surgery, Cleveland Clinic Foundation, Cleveland, OH 44195
Исселейн Виктор E.
Viktor E. Eysselein, M.D., FACP, Professor of Medicine, UCLA School of Medicine,
Department of Internal Medicine, Division of Gastroenterology, Harbor-UCLA Medi-
cal Center, Torrance, CA 90509
Кейс Терренс Д.
Terrence D. Case, M.Ed., RVT, Director of Allied Health, Whitman Education Group,
Miami, FL 33137
К ле Стенли P.
Stanley R. Klein, M.D., FACS, Associate Professor of Surgery, UCLA School of Me-
dicine, Chief, Surgical Oncology, Department of Surgery, Harbor-UCLA Medical Cen-
ter, Torrance, CA 90509
Кехрней Пол A.
Paul A. Kearney, M.D., FACS, Associate Professor of Surgery, University of Kentuc-
ky School of Medicine, Chief, Section of Trauma and Critical Care, Department of Sur-
gery, Division of General Surgery, University of Kentucky Chandler Medical Center,
Lexington, KY 40536-0084
Ли Джон Г.
John G. Lee, M.D., FACP, Associate Professor of Medicine, U.C. Davis School of Me-
dicine, Director of Clinical Research, Division of Gastroenterology, U.C. Davis Medi-
cal Center, Sacramento, CA 95817
Нанди Парта С.
Partha S. Nandi, M.D., Department of Internal Medicine, Division of Gastroenterolo-
gy, University of Michigan Medical Center, Ann Arbor, MI 48109
АВТОРЫ
13
Поллок Марк Е.
Marc Е. Pollock, M.D., Assistant Professor of Surgery, University ofCalifomia, Davis
School of Medicine, Department of Surgery, Division of Cardiothoracic Surgery, Uni-
versity of California, Davis, Sacramento, CA 95817
Сзе Глория
Gloria Sze, M.D., Department of Internal Medicine, Division of Gastroenterology,
Harbor-UCLA Medical Center, Torrance, CA 90509-2097
Смит P. Стефен
R. Stephen Smith, M.D., RDMS, FACS*, Professor of Surgery, University of Kansas
School of Medicine, Department of Surgery, University of Kansas School of Medicine,
Wichita, KS 67214
Сноэй Эрик P.
Eric R. Snoey, M.D., Assistant Clinical Professor, Department of Internal Medicine,
University of California, San Francisco, Resident Director, Department of Emergency
Medicine, Alameda County Medical Center, Oakland, CA 94602
Стеймос Майкл Дж.
Michael J. Stamos, M.D., FASCRS, FACS, Associate Professor of Surgery, UCLA
School of Medicine, Chief, Colon and Rectal Surgery, Department of Surgery, Har-
bor-UCLA Medical Center, Torrance, CA 90509
Уилбур Лаура С.
Laura C. Wilbur, MS, RDMS, RVT, Chief Technologist, Vascular Diagnostic Cen-
ter, Alameda County Medical Center, Oakland, CA 94602
Фегел ьман Элиот Дж.
Elliott J. Fegehnan, M.D., FACS, Assistant Professor of Surgery, University of Cin-
cinnati College of Medicine, Department of Surgery, University Hospital, The Christ
Hospital, Cincinnati, OH 45219
Фрай Уильям P.
William R. Fry, M.D., RDMS, RVT, FACS*, Trauma Director, Penrose-St. Francis,
Healthcare System, Colorado Springs, CO 80907
Харнесс Джей К.
Jay К. Harness, M.D., FACS*, Professor of Surgery, University of California, Da-
vis, Chief, Surgical Oncology, University of California, Davis-East Bay, Department
of Surgery, Alameda County Medical Center, Oakland, C A 94602
Чако Петер Ф.
Peter F. Czako, M.D., FACS, Staff Attending Surgeon, William Beaumont Hospital,
Royal Oak, MI 48073
Шайман Джеймс
James M. Scheiman, M.D., FACG, FACP, Associate Professor of Medicine, Univer-
sity of Michigan School of Medicine, Department of Internal Medicine, Division of
Gastroenterology, University of Michigan Medical Center, Ann Arbor, MI 48109
Янг Дж. Нилас
J. Nilas Young, M.D., FACS, Associate Clinical Professor of Surgery, University of Ca-
lifornia, Davis, Chief, Cardiac Surgery, Alta Bates Medical Center, Berkeley, CA 94705
Member, American College of Surgeons' National Ultrasound Faculty.
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ УЛЬТРАЗВУКЕ:
КАК ЗВУКОВЫЕ ВОЛНЫ
СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
Уильям Р. Фрай
Звук — колебательное движение частиц упругой среды, распространяющее-
ся в виде волн. Он зависит от мощности источника, а также плотности и тем-
пературы среды распространения. Кроме этого, для распространения звуко-
вой энергии важна способность частиц среды отвечать движением на звуко-
вое воздействие.
Что такое ультразвук? Это упругие волны с частотой колебаний свыше
20 000 с т. е. 20 000 Гц, которую не может слышать человек. Частота ульт-
развука, используемого для получения изображений в медицине, составляет
обычно 2-14 МГц, т. е. (2 -г 14) х 106 колебаний в секунду. В некоторых датчи-
ках, используемых с катетерами, генерируемая частота возрастает до 30 МГц.
Использование ультразвука в диагностике основано на двух процессах:
пьезоэлектрическом эффекте и высокоскоростном определении энергии ульт-
развуковой волны. Бурное развитие вычислительной техники в 1980-2000
годах привело к быстрому совершенствованию диагностических ультразву-
ковых систем.
ДОПУЩЕНИЯ
При оценке ультразвукового изображения специалисты по диагностике осно-
вываются на некоторых допущениях. Первое состоит в усреднении скорости
распространения ультразвука в биологических тканях до 1540 м/с. Несмотря
на то, что это значение не всегда соответствует действительности, такое до-
пущение позволяет компьютеру определить расстояние, пройденное ультра-
звуковой волной. Волны распространяются от ультразвукового датчика до
отражающих звук объектов, называемых рефлекторами, и возвращаются об-
ратно к датчику. Будучи уверенными в том, что объекты на ультразвуковом
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
ВОЗМОЖНОСТЬ УПРАВЛЕНИЯ ЗВУКОМ
15
изображении размещены правильным образом, клиницисты в основном ин-
тересуются расстоянием между датчиком и рефлекторами.
Другое допущение состоит в том, что звуковая волна распространяется от
датчика к рефлектору и обратно по прямой линии. Основываясь на этом (на
ультразвуковом аппарате нельзя проверить точность этого допущения), со-
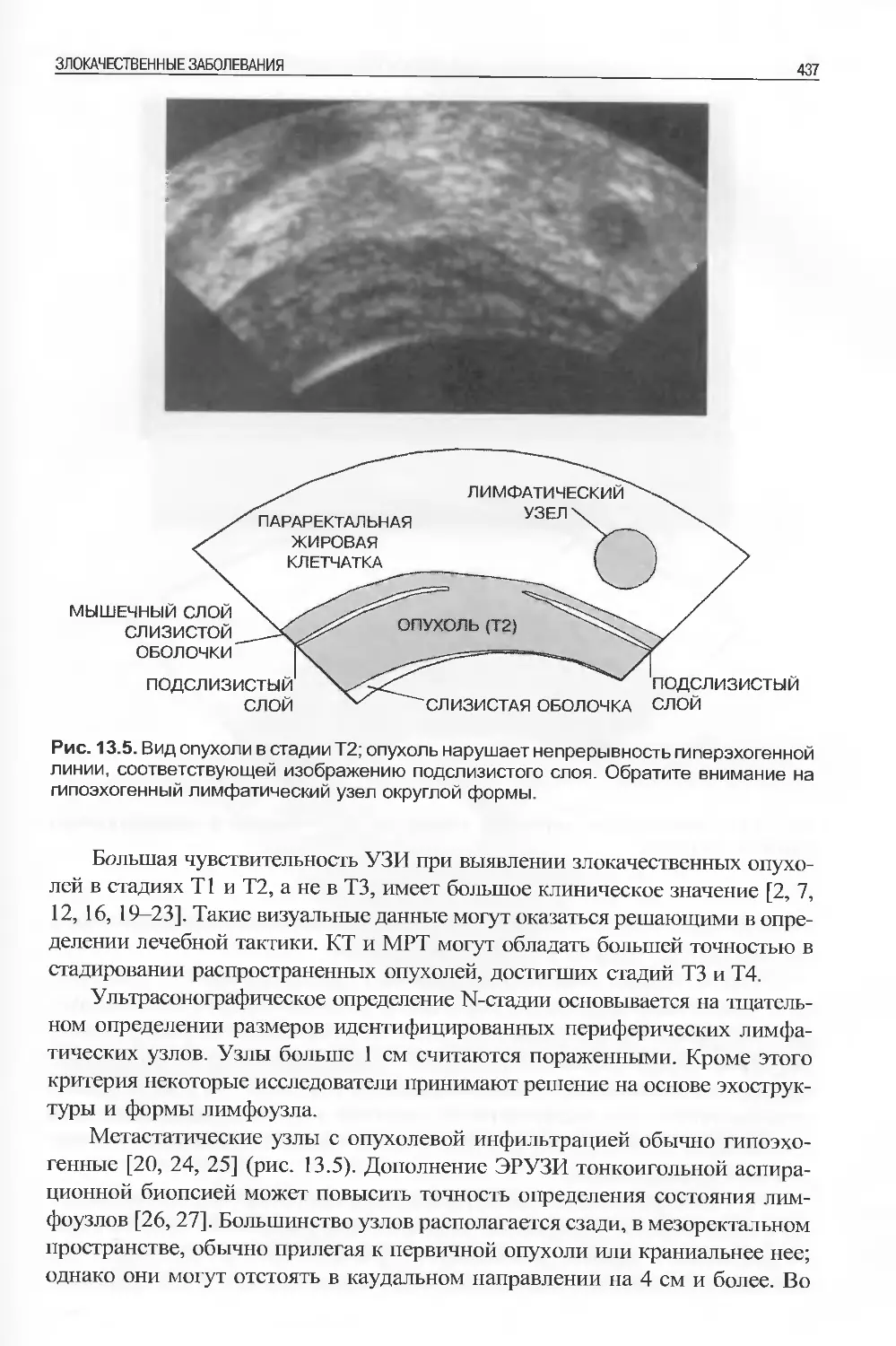
нограф измеряет время, затраченное звуковой волной на весь путь, и делит
его пополам. Умножение полученной таким образом величины на 1540 м/с
позволяет определить расстояние от датчика до рефлектора. Без этого допу-
щения не может быть выполнено построение изображения в аксиальной плос-
кости (плоскости, осевая линия которой перпендикулярна передней поверх-
ности датчика). Другого способа определения местоположения объекта, кро-
ме как вычисление расстояния от него до датчика, не существует.
Еще одно допущение состоит в том, что звуковые волны распростра-
няются только в направлении от ультразвукового кристалла, а возвращают-
ся обратно — только по направлению к этому кристаллу.
ВОЗМОЖНОСТЬ УПРАВЛЕНИЯ ЗВУКОМ
Почему, когда вы стараетесь сказать своему коллеге что-то доверительно,
другой коллега-осведомитель может подслушать и сообщить об этом ваше-
му начальству? Потому что вы не можете контролировать распространение
звука. Звуковые волны изменяют направление по объективным причинам,
вследствие контактов с частицами воздуха, поверхностями стен, потолка, а
также других предметов.
Что можно сделать, чтобы предотвратить рассеяние звуковой волны?
Один из способов заключается в том, чтобы направить звук непосредственно
тому, кому он адресован. Приложите руки, сложенные рупором у рта, к уху со-
беседника. Говорите тише, так чтобы звук имел достаточно низкую громкость
(или, выражаясь точнее, малую амплитуду), и тогда, смешиваясь с шумовым
фоном, он не будет услышан.
Однако даже при использовании такого приема звуковые волны будут
достигать свидетелей вашей беседы и могут быть подслушаны при помощи
специального оборудования.
Звуковые волны преломляются и отражаются в биологических тканях
во всех направлениях. Предполагается, что звуковые волны после отраже-
ния распространяются в обратном направлении вдоль той же прямой. Вол-
на, образовавшись в одной части ультразвукового датчика, может возвратить-
ся в его другую часть (как в случае со свидетелем, подслушивающим разго-
вор). При этом аппаратура создает изображение, которое выводится на
экран монитора. Несмотря на то, что время от времени происходит значитель-
ное изменение направления движения звуковой волны, все-таки можно счи-
тать, что она распространяется строго по прямой и так же по прямой возвра-
щается к своему источнику. В большинстве случаев это допущение позволя-
16
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: как звуковые волны становятся изображениями
ет правильно отобразить отраженный акустический сигнал в виде
ультразвукового изображения. Кроме этого, такое представление о распро-
странении ультразвука понятно врачу.
Каким образом ультразвуковой пьезоэлектрический кристалл становится
не заинтересованным в «подслушивании» того, что происходит вокруг? Компь-
ютер в аппарате выключает большинство пьезоэлектрических кристаллов в
определенное время, превращая их в «незаинтересованных свидетелей». Кри-
сталлы все еще вибрируют под действием отраженных звуковых волн и со-
здают разность потенциалов, но компьютер в ультразвуковом аппарате игно-
рирует любую разность потенциалов, созданную этой вибрацией.
Одновременно функционирует относительно небольшое количество кри-
сталлов. Они вибрируют и генерируют электрическое напряжение, величи-
на которого анализируется компьютером (рис. 1.1). С целью получения ин-
fl ьезоэлектрические
кристаллы
Рис. 1.1. Электрическое напряжение, полученное под воздействием отраженных
звуковых волн, воспринимается ультразвуковым аппаратом только тогда, когда
пьезоэлектрические кристаллы включены. Электрическое напряжение в областях,
помеченных знаком X, ультразвуковым аппаратом не воспринимается.
ГОРНОЕ ЭХО
17
Пьезоэлектрические кристаллы
Звуковая волна
Рис. 1.2. Ультразвуковая волна, сгенерированная фазовым датчиком, и фрагмент
полученного при этом изображения. Одновременно работает только небольшое
число кристаллов, поэтому изображение формируется из множества фрагментов.
формации, необходимой для создания полноценного изображения, последо-
вательно активируется определенная группа кристаллов (рис. 1.2).
Метод активации определенной группы пьезоэлектрических кристал-
лов с одновременным выключением других ученые называют фазовым. Фа-
зовая работа обеспечивает определенные преимущества. Например, этот ме-
тод уменьшает число артефактов и улучшает разрешение в боковых облас-
тях изображения, давая возможность различать объекты, соприкасающиеся
друг с другом.
ГОРНОЕ ЭХО
Звуковая энергия в веществе передается путем его циклического сжатия и
возвращения в исходное состояние. Когда одна молекула вещества сдвигается
к другой, передняя область сдвинутой молекулы уплотняется. Задняя область
смещенной молекулы вытягивается.
Смещенная молекула толкает молекулу перед собой, изменяя ее конфи-
гурацию. Однако силы, возникшие при смещении молекулы, действуют в
обратном направлении. Фактическое расстояние смещения молекулы зави-
сит от величины приложенного усилия и исходной величины межмолеку-
лярного взаимодействия.
Такие биологические ткани, как мышечная или костная, по-разному взаимо-
действуют со звуком. Однако звуковые свойства мышц похожи на свойства
кожи и жировой ткани. В чем же состоит различие в их взаимодействии со
звуком? Как мышцу можно отличить от жира с помощью ультразвука?
2 Ультразвуковая диагностика...
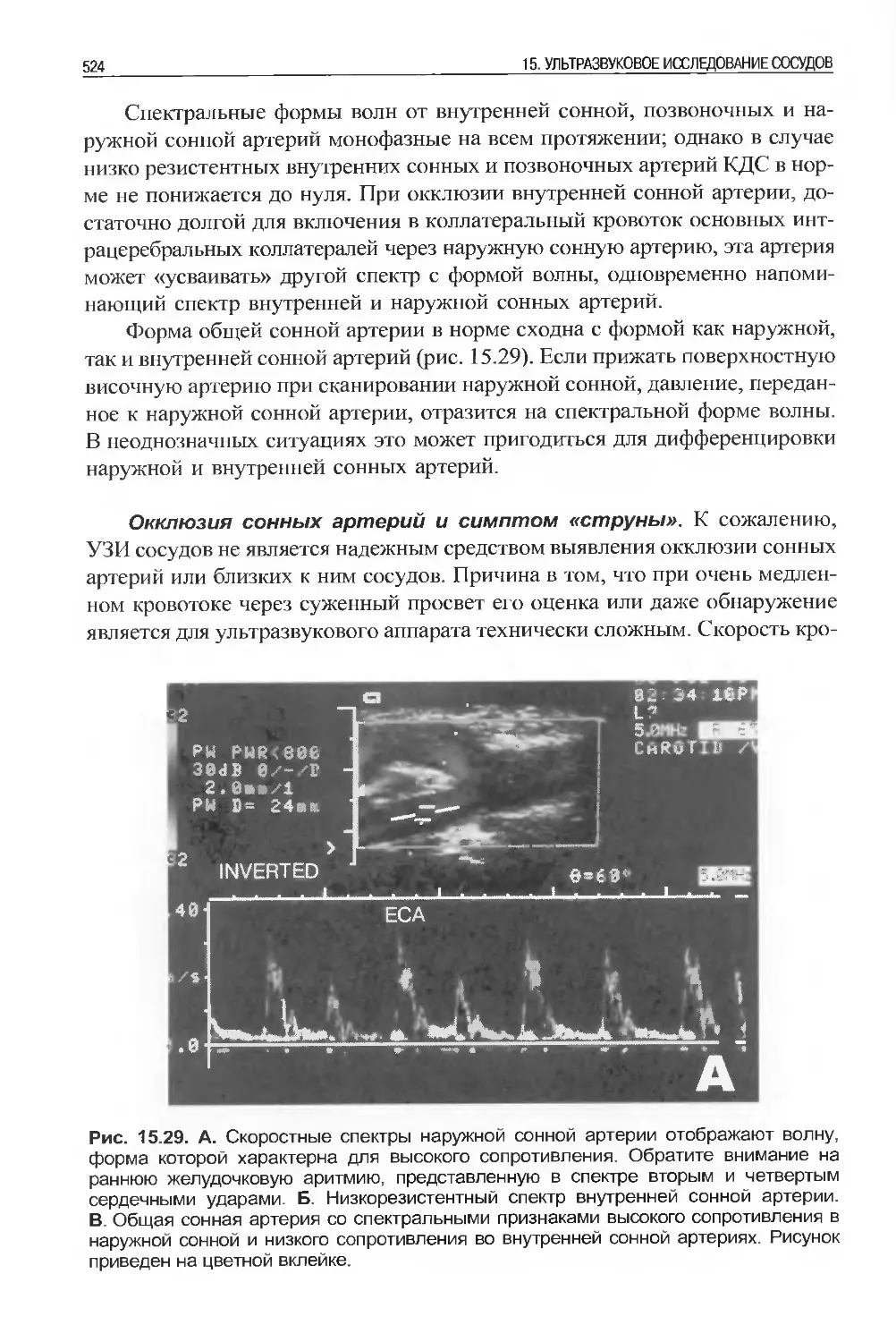
18 1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
ПОЖАЛУЙСТА, СОПРОТИВЛЯЙТЕСЬ МОЕЙ ЗВУКОВОЙ ВОЛНЕ!
Важными количественными характеристиками тканей являются их плот-
ность и скорость распространения звука в них. Способность звука проникать
сквозь вещество назвали импедансом (имперданс — устаревшее название со-
противления электрической цепи при синусоидальных напряжениях тока —
прим. ред.у.
Импеданс = Плотность вещества х Скорость распространения звука.
Что происходит, когда две различные ткани находятся рядом друг с другом,
но не соединены общим молекулярным пространством? Для ответа рассмот-
рим движение крайней молекулы первой ткани вперед. Крайняя молекула
первой ткани смешает первую молекулу второй ткани с частотой, отличной
от той, с которой движется сама. Вторая ткань сжимается больше или меньше
первой, в зависимости от ее способности к сжатию. Если сжатие меньше, чем
у первой ткани, то сила, приложенная к последней молекуле первой ткани, не
может распространяться, как раньше. Почему? Вторая ткань действует по-
добно неподвижному объекту.
Когда это происходит, кинетическая энергия двигающейся молекулы
расходуется не полностью. В сущности, последняя молекула первой ткани
отскакивает от молекулы второй ткани. С порцией кинетической энергии,
переадресованной теперь назад в первую ткань, звуковая волна распростра-
няется в обратном направлении. Это явление описывают как отражение, его
возникновение лежит в основе формирования эха и создания ультразвуково-
го изображения.
Когда вторая ткань сжимается сильнее, чем первая, сила, приложенная к
последней молекуле первой ткани, становится больше сил, действующих на
окружающие молекулы первой ткани. Снижение силы сопротивления по-
следней молекулы первой ткани вызывает деформацию во второй ткани.
Сила, приложенная к последней молекуле первой ткани, возрастает еще боль-
ше. Вторичная упругая отдача этих сил возвращает звуковую энергию на-
зад, в первую ткань.
Следовательно, взаимодействие между двумя тканями служит главной
причиной отражения звуковых волн. Пока ткани имеют различное сопро-
тивление, звук отражается назад; при этом порядок расположения тканей не
имеет значения. Только тогда, когда две ткани очень похожи, передача энер-
гии происходит почти с той же частотой (передача энергии не происходит
без потерь), и назад возвращается минимальное количество энергии.
Каждый тип ткани реагирует на вторичную энергию по-своему. Эта ре-
акция зависит от свойств ткани, расположенной рядом. Но когда звуковая
энергия передается от ткани одного типа к ткани другого, передача энергии
не может произойти без ее значимого изменения.
ПОЖАЛУЙСТА, СОПРОТИВЛЯЙТЕСЬ МОЕЙ ЗВУКОВОЙ ВОЛНЕ!
19
Чем больше различие в сопротивлении между двумя тканями, тем мень-
ше энергии передается следующей ткани. Не переданная звуковая энергия
отражается обратно в ткань, в которой звуковая энергия уже имеется. Чем
меньше различий между двумя тканями, тем больше энергии передается к
следующей ткани и тем меньше отражается.
Можно также рассматривать границу между двумя тканями как звуко-
вой барьер. Определяющим фактором для преодоления звуком этого барье-
ра является величина сопротивления между двумя тканями. Когда разница в
сопротивлении незначительна, большая часть звуковой энергии проходит.
При увеличении разницы в сопротивлении в обратном направлении отража-
ется или отклоняется больше звуковой энергии.
Таким образом, отражение происходит не из-за какого-либо вещества
или тела, а вследствие взаимодействия между двумя тканями. Когда разли-
чие сопротивления тканей становится достаточно большим, отражается
почти весь звук. В клинических условиях это явление наблюдается на грани-
це воздуха и мягкой ткани, а также между мягкой и костными тканями.
Для ультразвуковой диагностики (УЗД) различия в сопротивлении тканей
обычно выгодны. Однако в определенных условиях эти различия могут причи-
нить неудобства. На границе воздух — мягкая ткань разница в сопротивлениях
настолько велика, что почти весь звук отражается обратно. Поскольку звук от-
ражается, звуковые волны не проникают в тело, и клиницист не получает ника-
кой информации. Воздух между поверхностью датчика и поверхностью тела
часто служит причиной получения низкокачественных изображений.
Использование ультразвукового геля уменьшает разницу в сопротивле-
нии между датчиком и кожей, позволяя большему количеству звуковой
энергии проникать в тело. Интересно, что между пьезоэлектрическими кри-
сталлами и мягкими тканями имеется существенное различие в сопротивле-
нии. Поэтому перед пьезоэлектрическими кристаллами расположен специа-
льный слой, облегчающий проникновение звука в мягкие ткани (рис. 1.3).
Опорный слой
Специальный соответствующий слой
Рис. 1.3. Компоненты ультразвукового датчика. Опорный слой — амортизатор,
который препятствует слишком долгой вибрации пьезоэлектрических кристаллов.
Пьезоэлектрические кристаллы создают звуковую волну в зависимости от поданного
напряжения или генерируют напряжение в результате воздействия звуковой волны.
Специальный соответствующий слой служит для передачи звуковой волны в тело.
20
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
Существенные различия в сопротивлении имеются между мягкой и кост-
ной тканями, а также между желчью и желчными камнями. При значительной
разнице в сопротивлении почти вся сила звуковой волны (амплитуда) отра-
жается от границы тканей, значительно уменьшаясь.
Любые звуковые волны, способные распространяться за границу зон с
различным сопротивлением, имеют такую маленькую амплитуду, что к дат-
чику не возвращается никакая звуковая информация. Так как информации о
звуковой волне в глубоких слоях не поступает, пьезоэлектрические кристал-
лы не генерируют никакого напряжения. При отсутствии данных для ото-
бражения вычислительная система ультразвукового аппарата окрашивает
эту зону в специально установленный оттенок цветовой шкалы: черный. С
увеличением глубины, область изображения, окрашенная черным, расширя-
ется из-за дисперсии звуковой волны, что выглядит как появление тени за
освещенным объектом. На таком изображении формируется картина звуко-
вой тени.
Различия в сопротивлении между большинством мягких тканей неболь-
шие. Это позволяет звуку не только частично отразиться для получения не-
обходимой информации, но и сохранить амплитуду, достаточную для про-
никновения к более глубоким слоям. Скорость распространения и плот-
ность находятся в прямой зависимости. Но даже таких небольших различий
в сопротивлении достаточно, чтобы ультразвук стал доступным диагности-
ческим средством.
СКОЛЬКО ЗВУКА МОЖЕТ ТЕРЯТЬСЯ В ТКАНИ?
Процесс распространения звуковой волны достаточно сложен. При взаимо-
действии звуковых волн с тканью часть энергии передается ткани, преобра-
зуясь в другую форму энергии, такую как тепло. Сколько энергии перейдет в
ткань, а сколько в виде звуковой волны будет передаваться дальше, определя-
ется свойствами ткани.
Скорость распространения звука зависит от плотности и жесткости тка-
ни. Плотность — это масса в единице объема; жесткость — сила, противо-
действующая давлению, достаточному для изменения объема. Другой спо-
соб определения жесткости состоит в выявлении последствия давления —
деформации. Вообще, плотность и жесткость — взаимосвязанные понятия.
Большинство веществ, уплотняясь, становятся более жесткими. С увеличе-
нием плотности скорость распространения звука обычно замедляется, тогда
как с увеличением жесткости она возрастает. Для сонографиста преимущества,
обеспечивающиеся жесткостью, в целом перевешивают недостатки, связан-
ные с плотностью.
Как передается ультразвуковая энергия? Через движение частиц. По-
скольку каждая частица имеет массу, она обладает инерцией. Последнюю
СКОЛЬКО ЗВУКА МОЖЕТ ТЕРЯТЬСЯ В ТКАНИ?
21
можно определить как время, необходимое для начала движения одной час-
тицы и взаимодействия с другой. Каждая частица должна преодолеть инер-
цию следующей частицы, чтобы толкнуть ее и заставить двигаться, поэтому
мгновенной передачи звуковой энергии не происходит. Чем больше частиц,
тем больше требуется времени для распространения звуковой энергии через
них. Что все это означает для сонографиста? Через более плотные ткани
звук проходит медленнее.
С другой стороны, жесткость среды влияет на эффективность передачи
энергии через нее. Поскольку более жесткие материалы менее сжимаемы, то
для достижения другой частицы движущаяся частица должна переместиться
на более короткое расстояние. В сущности, более жесткие ткани переводят
звуковую энергию эффективнее. Такое увеличение эффективности приво-
дит к более быстрому распространению звуковой волны. Таким образом, в
среде с большей жесткостью звук передается быстрее, чем в среде с боль-
шей сжимаемостью.
Странно, но самое распространенное в человеческом теле вещество как
будто бы противоречит этому правилу. Вода не столь плотна, как ткани
тела. Но подобные воде жидкости не так сжимаемы, как ткани тела. При
увеличении содержания воды в мягких тканях скорость распространения
звука также возрастает (рис. 1.4). Кость, будучи самой жесткой тканью тела,
проводит звук с высокой скоростью, равной 2700-4100 м/с.
Рис. 1.4. Скорость распространения звука в различных тканях, м/с.
22
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
КАК ВОЛНА ВЫБИРАЕТ ПУТЬ?
Поскольку ультразвуковые изображения образуются отраженными звуковы-
ми волнами, различия в изображениях мягких тканей формируются при взаи-
модействии звука с тканью. Ультразвук взаимодействует с веществом на не-
скольких уровнях. Общий результат этого взаимодействия зависит от разме-
ров отражателя и может быть разделен на несколько типов, которые
соответствуют различным соотношениям поглощения и отражения и пред-
ставляют собой характерные результаты взаимодействия ультразвука с био-
логическими тканями.
Молекулярные взаимодействия являются наименьшими из всех взаимо-
действий. Поглощение ультразвуковых волн в межмолекулярных простран-
ствах заставляет молекулы сжиматься вместе, наподобие пружины. Жест-
кость пружины молекулярных сил определяет, как звуковая волна будет
проходить через ткань.
Если межмолекулярная связь жесткая, звуковые волны передаются через
ткань более эффективно, при этом самой ткани энергии передается меньше.
Ослабление ультразвуковой волны, движущейся через мягкую ткань, при-
близительно в 100 раз больше, чем ослабление той же волны при распро-
странении в воде. Это происходит несмотря на то, что вода является глав-
ным компонентом мягкой ткани.
Другим способом демонстрации уникальной способности тканей чело-
века передавать ультразвуковые волны является визуализация воды. Кроме
этого, главным поглотителем ультразвуковой энергии являются белковые
структуры. Гомогенизация воды, содержащейся в мягкой ткани, уменьшает
поглощение ультразвука приблизительно на одну треть. Денатурация бел-
ков оказывает еще более сильный эффект: при прохождении через продукты
распада гистидила поглощение снижается вдвое.
Воду и белковый компонент тканей можно сравнить в более простой
модели. В воде при поглощении теряется или отражается обратно к датчику
небольшое количество звуковой энергии. Как и при образовании тени на
ультразвуковом изображении, от воды не приходит никакой акустической
информации. Без информации, возвращающейся к датчику, ультразвуково-
му аппарату нечего показывать. При отсутствии информации бездействую-
щий монитор окрашен в черный цвет.
Поскольку концентрация белка в ткани больше, чем в воде, звуковая
энергия отражается и поглощается в большей степени. В зависимости от со-
отношения отраженного и поглощенного звука изменяется количество отра-
женной звуковой энергии. Большее количество возвращенной звуковой
энергии отображается более яркими фрагментами изображения.
Для обозначения оттенков в серой шкале часто используются термины
гипоэхогенный и гиперэхогенный. Гипоэхогенный оттенок — это более тем-
ное или черное изображение, отображающее более низкую амплитуду отра-
ЗАТУХАНИЕ ЗВУКА
23
женных звуковых волн. Гиперэхогенный оттенок — это более светлое или
белое изображение, отображающее более высокую амплитуду отраженных
звуковых волн.
ЗАТУХАНИЕ ЗВУКА
Как было сказано выше, не полностью проводящая звук ткань поглощает
часть звуковой энергии. Звуковые волны, проходя через ткань, теряют силу,
их амплитуда уменьшается. Ослабление ультразвукового луча происходит в
результате поглощения, отражения, преломления и рассеивания.
Для количественного определения степени затухания звука использует-
ся шкала децибел (дБ). При оценке ослабления интенсивность должна быть
измерена в двух различных точках:
1дБ = 10 х 1g Р2/Р], где
(Р2 — интенсивность звука во 2-й точке;
Pi — интенсивность звука в 1-й точке).
Поскольку используется логарифмическая шкала, 50%-ное уменьшение ин-
тенсивности звука соответствует уменьшению на 3 дБ; 75%-ное уменьшение
интенсивности — изменению на 6 дБ, и т. д.
Чем дальше распространяется звуковая волна, тем с большим числом
частиц она должна столкнуться. Если при взаимодействии с каждой части-
цей энергия звука одинаково уменьшается, то чем дольше распространяется
звуковая волна, тем больше она затухает. Измените условия подслушива-
ния: если человек находится рядом, то он может услышать вашу речь, но
если вас разделяет автомобильная стоянка, о содержании разговора станет
известно, только если вы начнете говорить очень громко.
Интересно, что затухание зависит не только от расстояния, но и от час-
тоты передаваемого звука. Всем знаком рев басов (наиболее низкие часто-
ты), который доносится из остановившегося рядом автомобиля, когда мы
ждем сигнала светофора. К счастью, музыкальные звуки с более высокой ча-
стотой значительно стихают недалеко от окон автомобиля.
Влияние частоты звука и дальности его распространения на изменение
амплитуды звуковой волны описывается математически следующим обра-
зом:
Ослабление [дБ] = 1/2 х Частота [МГц] х Расстояние [см].
Если ультразвуковое излучение имеет частоту 1 МГц, то звуковая волна на
расстоянии 6 см теряет 50% амплитуды (50%-ная потеря амплитуды соответ-
ствует уменьшению на 3 дБ):
24
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
3 дБ = 1/2 к 1 МГц х Расстояние [см];
Расстояние [см] = (3 дБ х 2)/1 МГц;
Расстояние [см] = 6.
Ультразвуковое излучение с частотой 10 МГц ослабнет на 50% (3 децибела),
пройдя только 3,3 см.
Пройдя одинаковое расстояние, звуковые волны с более низкой часто-
той затухают меньше, чем волны с высокой частотой. Это важно для
ультразвуковой диагностики. При попытке визуализировать структуры, распо-
ложенные глубоко в брюшной полости, высокочастотная звуковая волна затух-
нет настолько, что к датчику не поступит никакой информации. При исполь-
зовании датчиков с более низкой частотой ослабление происходит в мень-
шей степени, что позволяет звуковой волне проникнуть глубже в ткани тела
и возвратиться к датчику для формирования изображения:
Высокая частота = Более высокое разрешение
и более низкое проникновение;
Низкая частота = Более низкое разрешение
и большее проникновение.
Поглощение также зависит от плотности звукопроводящего материала. При
увеличении плотности увеличивается поглощение и возрастает ослабление.
Чтобы оценить это, предположите, что каждая часть тканей А и В составлена
из одних и тех же молекул, и каждая молекула поглотит 10% звуковой энер-
гии. Все в А и В одинаковое, включая объем, но матричная единица вещества
А состоит из 10 частиц, а В — из 20.
После прохождения звуковой волны через среду А останется
100 (О,9)10 дБ, или 35% от первоначальной интенсивности. После прохож-
дения через среду В интенсивность звуковой волны составит 100 (О,9)20 дБ,
или 12% от первоначальной интенсивности. Очевидно, что чем большее ко-
личество частиц передает энергию, тем больше звуковая волна ослабляется.
К моменту возвращения к ультразвуковому датчику звуковые волны
значительно затухают. Напряжение, поданное на пьезоэлектрический крис-
талл, больше напряжения, возникшего при действии на тот же кристалл воз-
вратившейся звуковой волны. Поскольку возвратное напряжение очень мало,
оно обычно усиливается в соответствии с установленной шкалой яркости.
Когда плотность ткани в целом высокая, общее ослабление ультразвука
тоже высоко. Небольшая амплитуда возвратного напряжения приводит к
формированию однородного темного изображения. Для компенсации этого
ультразвуковой аппарат снабжен размеченной шкалой усиления. Управле-
ние усилением позволяет сонографисту регулировать увеличение возвра-
щенного эхосигнала однородно по всему изображению, как при изменении
яркости телевизора.
ПЬЕЗОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ
25
Управление усилением также позволяет установить яркость изображе-
ния в зависимости от интенсивности окружающего света. При ярком окру-
жающим свете, например в травматологическом отделении, где освещение,
скорее всего, не может быть выключено, детали более темного ультразвуко-
вого изображения трудноразличимы. Повышение усиления делает изобра-
жение ярким, насколько это необходимо. Тогда его можно рассматривать
при суженных зрачках, которые не позволяют проникать низкоинтенсивно-
му свету. Обратимся к аналогии: в солнечный день трудно смотреть телеви-
зор на улице, если установлен тот же уровень яркости, который использо-
вался в закрытом помещении. Увеличение яркости позволяет зрителю, нахо-
дящемуся на улице, видеть на телевизионном экране более четкое
изображение.
Недостаток сильного увеличения яркости — снижение возможности
различать детали изображения. Чрезмерное увеличение усиления делает
тонкие детали белыми или неразборчивыми. Из-за этого усиление ультра-
звука должно оставаться на минимальном уровне. Соблюдение такого пра-
вила обеспечивает получение изображения с самым высоким разрешением.
Энергия ультразвука уменьшается также с расстоянием. Большинство
ультразвуковых аппаратов снабжены блоком компенсации этого явления.
Другой тип усиления, названный усилением временной компенсации (ком-
пенсации глубины), означает компенсацию ослабления звука с пройденным
расстоянием или временем. Управление усилением временной компенсации
осуществляется передвигающимися рукоятками, которые устанавливаются
так, чтобы оптимизировать изображение.
Каждый ползунок управляет усилением в области изображения, соот-
ветствующей определенному расстоянию от поверхности датчика. Переме-
щение ползунков позволяет оператору изменять спектр яркости в отдельных
областях изображения, чтобы достигнуть одинаковой яркости. Некоторые
упрощенные (менее дорогие) ультразвуковые аппараты делят изображение
на две части с отображением усиления в поверхностных и глубоких слоях,
но не обеспечивают истинного усиления временной компенсации.
ПЬЕЗОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ
Воздействуя электрическим напряжением на некоторые тела, такие как ян-
тарь, кварц и освинцованный цирконат титана (пьезоэлектрический измери-
тельный преобразователь), ультразвуковой аппарат генерирует сжатую вол-
ну. Освинцованный цирконат титана испускает сжатую волну в виде ультра-
звука. Характеристики сжатой волны зависят от приложенного напряжения и
толщины создающего тела. Например, более высокое напряжение вызывает
волну с более высокой амплитудой, а более тонкие кристаллы генерируют
более высокую резонансную частоту.
26
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
Действие напряжения на пьезоэлектрический кристалл можно срав-
нить с действием молоточка, ударяющего звонок. Так же как звонок зво-
нит при ударе по нему, пьезоэлектрические кристаллы звучат под воздейст-
вием напряжения. И звонок, и пьезоэлектрический кристалл демонстрируют
разнородный набор частот, сосредоточенных в определенном частотном
диапазоне.
Представьте себе автомобиль, разгоняющийся с места до 100 км/ч. По-
сле нажатия на педаль газа для достижения скорости 100 км/ч требуется
определенное время, которое зависит от характеристик автомобиля. Ультра-
звуковой кристалл также не может мгновенно начать колебаться с частотой
7 МГц. Требуемая частота достигается путем ускорения. При ускорении и
замедлении кристалл генерирует волны с любой частотой, не только с за-
данной. В технике при этом явлении используют два подхода. В одном слу-
чае разнородность частот суммируется, в другом — минимизируется.
Известно, что чем выше частота звука, тем на меньшую глубину он
успеет проникнуть до затухания. Но высокие частоты способны давать бо-
лее высокое разрешение объектов, расположенных около датчика. Посылая
звуковую волну, состоящую из низких и высоких частот, модуль формиро-
вания изображения максимизирует оптимальную частоту для определенной
глубины и создает оптимальное изображение. Датчики, используемые для
этого типа сканирования, обозначаются по диапазону генерируемых частот
(2-5 МГц).
Другой подход основан на максимальном сужении частотного диапазо-
на, генерируемого датчиком, и, что более важно, интерпретации отражен-
ных звуковых волн только заданной частоты. Такой подход приводит к
улучшению качества изображения. Разрешение улучшается посредством со-
здания более короткой и эффективной длины звуковой волны, которая в
свою очередь увеличивает осевое разрешение (способность различать два
объекта на разной глубине).
Однако существует предел ускорения пьезоэлектрического кристалла и
предел частотной однородности генерируемого ультразвука по сравнению с
эталоном. Поэтому один из способов укорочения звукового импульса за-
ключается в том, чтобы воспринимать отражение только определенной час-
тоты. При этом сонографист может задать укороченный звуковой импульс и
улучшить осевое разрешение. Поскольку генерируется не одна частота, а
целый частотный диапазон, в котором каждая частота может восприниматься
отдельно, эти типы датчиков называют мультигерцевыми датчиками; их основ-
ные частоты указаны в руководствах изготовителей.
СОЗДАНИЕ УЛЬТРАЗВУКОВОГО ДАТЧИКА
При работе пьезоэлектрического кристалла волны исходят от него подобно
волнам, вызванным брошенным в воду камнем. По мере распространения
СОЗДАНИЕ УЛЬТРАЗВУКОВОГО ДАТЧИКА
27
волны от кристалла, деформация ее формы становится более выраженной.
Некоторый контроль над формой звуковой волны или ее распространением
возможен только для одного кристалла.
Если проектировщики ультразвукового датчика при его создании исполь-
зуют только один большой пьезоэлектрический кристалл, они сталкиваются
с несколькими проблемами. Для фокусировки звукового луча на определен-
ной глубине должна использоваться линза. К сожалению, когда фокус уста-
навливается линзой, он не может быть изменен без изменения самой линзы,
а это неприемлемо на практике.
Вследствие склонности звуковой волны или волнового фронта к дефор-
мации, каждое новое положение звуковой волны в координатной системе
пространство-время значительно различается. Хотя положение и искривле-
ние волнового фронта могут быть рассчитаны на основе пройденного рас-
стояния, главные проблемы возникают при попытке определить место отра-
жения волны, чтобы правильно позиционировать полученные данные. Один
большой пьезоэлектрический кристалл не может обеспечить условия для
дифференцировки двух рядом расположенных объектов — так называемого
бокового разрешения (рис. 1.5).
В первых ультразвуковых датчиках использовался один небольшой крис-
талл. Установленный на механической рукоятке, он просто колебался впе-
ред и назад. Предсказанные недостатки были очевидными. Колеблющаяся
рукоятка двигалась быстро, часто перегревалась, двигатель сгорал, особен-
Ультразвуковые кристаллы
Рис. 1.5. Боковое разрешение — это способность различить два расположенных
рядом объекта; оно определяется шириной ультразвукового луча. Если ширина луча
меньше, чем расстояние между двумя объектами, они будут отображены на экране
как два различных объекта. Если ширина луча больше этого расстояния, объекты
будут показаны как единое целое. Когда пуч отклоняется, боковое разрешение
уменьшается (два объекта, находящиеся в конце луча, будут показаны как одно
целое).
28
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
А
П ьезоэлектрические
кристаллы
Пьезоэлектрические
кристаллы
Звуковые
волны
Рис. 1.6. А. Звуковые волны, генерированные без конструктивного или деструктивного
взаимодействия. Б. Звуковые волны, генерированные с конструктивным и
деструктивным взаимодействием, создают линейный фронт волны.
но когда аппарат не выключался после использования. Движение кристал-
лов приводило к появлению артефактов, а фиксированная зона фокуса не
позволяла адаптироваться к условиям исследования.
Когда рядом размещено несколько маленьких пьезоэлектрических крис-
таллов, конструктивное и деструктивное взаимодействие звуковых волн приво-
дит к формированию линейного фронта (рис. 1.6). Позволяя каждому крис-
таллу работать независимо, с помощью электроники можно сфокусировать
звуковой луч на любой выбранной глубине, не используя при этом фокус-
ную линзу. Также с помощью электроники луч может быть направлен в лю-
бую заданную область.
К сожалению, это решение не может создать для клиницистов идеаль-
ные ультразвуковые условия. Образование по всей поверхности датчика ли-
нейного фронта волны из нескольких небольших звуковых волн требует со-
ответствующего времени и расстояния. Чем больше отдельных кристаллов
ЭТО ВСЕГО ЛИШЬ ОДНА ИЗ СТАДИЙ ФОРМИРОВАНИЯ ИЗОБРАЖЕНИЯ 29
используется для создания фронта волны, тем большее расстояние должны
пройти отдельные звуковые волны перед объединением в волну с организо-
ванным фронтом. Это приводит к образованию мертвой зоны, протяжен-
ность которой соответствует расстоянию между поверхностью датчика и
точкой формирования линейного фронта волны.
Однако при таких условиях существуют дополнительные возможности.
Среди прочего очень полезной для формирования ультразвукового изображе-
ния является предсказуемость места образования волны с линейным фрон-
том. То есть перед образованием волны с линейным фронтом отражения
ультразвука либо не происходит вовсе, либо отражаются только низкочас-
тотные волны.
Особенности формирования такого волнового фронта имеют значение
при отображении структур, расположенных близко к поверхности кожи, на-
пример тканей грудной стенки. Однако это явление не влияет на отображе-
ние более глубоких структур, например, во время диагностического поиска
при брюшной травме. Как и предполагалось, протяженность мертвой зоны
уменьшается при визуализации поверхностных структур с помощью высо-
кочастотных датчиков и увеличивается при визуализации внутрибрюшных
структур низкочастотными датчиками.
Другой проблемой при большой фронтовой волне, порожденной не-
сколькими маленькими пьезоэлектрическими кристаллами, являются арте-
факты. Работа ультразвукового аппарата основана на предположении, что
пьезоэлектрический кристалл, посылающий звуковые волны, после отраже-
ния получает обратно те же волны. С учетом этого предположения форми-
руется изображение, основанное на информации от «родительских» крис-
таллов. При взаимодействии с тканями тела не во всех плоскостях угол меж-
ду падением и отражением волны к датчику равен 180°. Отраженные волны,
которые не направляются прямо к датчику, отклоняются от заданного пути.
Они не доходят до кристаллов, их породивших, а попадают к другим крис-
таллам датчика. Когда звуковые волны достигают не предназначенных для
них кристаллов, они неправильно позиционируются в изображении (для до-
стижения другого, не родительского, кристалла волны должны пройти боль-
шее расстояние, поэтому они отображаются как отразившиеся на большей
глубине).
ЭТО ВСЕГО ЛИШЬ ОДНА ИЗ СТАДИЙ ФОРМИРОВАНИЯ ИЗОБРАЖЕНИЯ
Для чего предназначен ультразвуковой аппарат? Сонографу нужно создать
изображения в режиме реального времени. Как при просмотре видеозаписи,
для восприятия непрерывного движения в реальном времени человеческий
глаз должен получить приблизительно 30 изображений в секунду. Однако
средняя скорость звука в биологических тканях составляет 1540 м/с
30
1. ОСНОВНЫЕ СВВДЕНИЯ ОБ УЛЬТРАЗВУКЕ: как звуковые волны становятся изображениями
(154 000 см/с). Поэтому при сканировании объекта, расположенного на 10 см
глубже поверхности кожи, звуковая волна должна пройти туда и обратно рас-
стояние в 20 см. При такой глубине сканирования для создания 30 кадров в 1 с
аппарат затратит только 3,9 х 10 3 с (без учета времени на обработку). Следо-
вательно, остается достаточно времени, чтобы внести некоторые изменения.
Поскольку времени достаточно, вычислительная система ультразвуко-
вого аппарата успевает рассмотреть весь звуковой пучок как совокупность
лучей, намного меньших. Это достигается одновременным запуском только
нескольких кристаллов в так называемом фазовом режиме. Даже для того,
чтобы разбить весь пучок на 100 отдельных лучей, сонографу требуется все-
го 0,39 с из отведенного времени. Однако временной фактор важен, посколь-
ку нужно обработать 100 отдельных лучей. Тем не менее значительного уве-
личения времени обработки, скорее всего, не потребуется, так как размер
луча является меньшим, и в отведенное время обрабатывается меньше ин-
формации.
Так к чему привело расщепление звукового пучка? Поскольку число от-
дельных звуковых волн, которые должны объединиться, уменьшилось, для
создания волнового фронта требуется меньшее расстояние. Протяженность
сводится к минимуму, что делает возможным исследование областей, распо-
ложенных близко к датчику. Поскольку ширина каждого небольшого волно-
вого фронта не изменяется, боковое разрешение значительно улучшается.
Так как в определенный момент активны только несколько кристаллов, чис-
ло артефактных зон также уменьшается. Эта стратегия уменьшает возмож-
ность кристаллов, расположенных вне активного участка, генерировать на-
пряжение, которое бы учитывалось при формировании ультразвукового изоб-
ражения (рис. 1.1).
Расположенные на передней поверхности ультразвукового датчика пье-
зоэлектрические кристаллы маленькие и могут функционировать независи-
мо друг от друга. Этот подход основан на обработке множества небольших
ультразвуковых пучков, которые генерируются в определенной последова-
тельности Окончательное ультразвуковое изображение формируется из не-
скольких меньших изображений. Позволяя каждому небольшому ультра-
звуковому лучу быть более узким, чем луч, созданный всем датчиком, такая
стратегия улучшает боковое разрешение.
Фазовый режим имеет и другие преимущества. Изменяя последователь-
ность возбуждения пьезоэлектрических кристаллов, можно управлять зву-
ковой волной в различных направлениях. Поэтому при использовании дат-
чиков с плоской поверхностью можно получить изображение в виде куска
пирога (секторное изображение). При активации части пьезоэлектрических
кристаллов и исключении внешних кристаллов (которые также могут стать
внутренними), в зависимости от времени задержки активации отдельных
групп кристаллов, создается звуковой луч, сфокусированный на различных
глубинах. Это называют электронной фокусировкой.
ПОЧЕМУ ВАЖНА ФОКУСИРОВКА ЛУЧА?
31
ПОЧЕМУ ВАЖНА ФОКУСИРОВКА ЛУЧА?
В компьютерной томографии (КТ) каждое созданное изображение соответст-
вует усредненным значениям рентгеновской плотности тканей на определен-
ном уровне тела. При обычном исследовании органов брюшной полости бе-
рется слой толщиной 1 см, который отображается только в двух измерениях.
При необходимости большей детализации используется более тонкий слой.
Этот принцип используется и при обработке ультразвукового луча. Как
и КТ-слой, ультразвуковой луч является трехмерным. Изображение получа-
ют путем усреднения эхоплотности в каждой взятой точке. Создание более
тонких срезов во всех точках сразу невозможно; но фазовый режим ультра-
звукового луча, заданный в определенной последовательности, позволяет
изменить толщину луча в отдельной точке.
Сосредоточенный на данной глубине ультразвукового изображения луч
называют фокусом. Поскольку луч в точке фокуса имеет наименьшую тол-
щину, на этой глубине производится усреднение эхоплотности меньшего
объема тканей. Таким образом, в фокусной зоне увеличивается достовер-
ность и четкость изображения.
Большинство ультразвуковых аппаратов способно создать множество
фокусных зон. Хотя такая возможность может увеличить четкость изобра-
жения, частота кадров значительно снижается (изображения обновляются
медленно или не гладко). Почему это происходит? Вместо того чтобы фор-
мировать одно изображение с фокусной зоной в одной точке (более ранние
вычисления), аппарат должен создать отдельные изображения в каждой из
выбранных фокусных зон. Для создания одного многофокусного изображе-
ния отдельные изображения в каждой из фокусной зон накладываются друг
на друга. Это хорошо подходит для исследования неподвижных структур,
например щитовидной железы или молочных желез; но при исследовании
сосудов, сердца или брюшной полости у неконтактного пациента с травмой
число фокусных зон желательно уменьшить.
Сонографисты улучшают разрешение, выбирая наиболее подходящий
для данного исследования ультразвуковой датчик. От его частоты зависит
осевое разрешение, упомянутое ранее. Переменное напряжение, используе-
мое компьютерной системой ультразвукового аппарата, можно сравнить с
гонгом звонящего колокола (роль которого в этом случае играет пьезоэлект-
рический кристалл). Отрезок времени, в течение которого звонит колокол
или вибрирует пьезоэлектрический кристалл, пропорционален дальности
распространения звуковой волны. Для ультразвука этот интервал называют
пространственной протяженностью импульса, и его можно считать особым
видом измерительной линейки (рис. 1.7). Самый короткий импульс позволяет
измерить наиболее короткую дистанцию в аксиальной плоскости (рис. 1.8).
Наименьшее деление на линейке или наименьшая протяженность импуль-
са достигаются двумя способами. При первом способе создания наиболее
32
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
111111111ШП111Ш1Ш1Ш1Ш11111Ш1ШШ11Ш111ШШ1Ш1Уи11111
Рис. 1.7. Пространство, преодолеваемое ультразвуковым лучом, называют
протяженностью импульса. С помощью этой величины можно измерить расстояние
между двумя объектами в аксиальной плоскости (перпендикулярной излучающей
поверхности датчика).
Аксиальная плоскость
Рис. 1.8. Разрешение в аксиальной плоскости. Поскольку отраженные волны
накладываются друг на друга, на экране ультразвукового аппарата нет промежутка
между отражающими частицами. Это происходит только в тех случаях, когда
расстояние между этими двумя частицами больше половины протяженности
импульса.
СБОР И ИНТЕРПРЕТАЦИЯ ДАННЫХ
33
короткого промежутка времени звучания пьезоэлектрического кристалла
добиваются с помощью размещенной сразу под ним пластины (рис. 1.3).
При сокращении времени вибрации пьезоэлектрического кристалла протя-
женность импульса сокращается. Другой способ сокращения протяженно-
сти импульса основан на уменьшении длины волны. Если пьезоэлектриче-
скому кристаллу позволяют вибрировать только заданное число циклов с од-
новременным уменьшением длины волны (частота при этом увеличивается),
протяженность импульса сокращается. Следовательно, датчик с более высо-
кой частотой дает лучшее аксиальное разрешение.
СБОР И ИНТЕРПРЕТАЦИЯ ДАННЫХ
Амплитуда напряжения, приложенного к кристаллу, пропорциональна амп-
литуде звуковой волны и наоборот. Поэтому возвращающиеся ультразвуко-
вые волны могут быть преобразованы в напряжение пропорциональной амп-
литуды. Это явление обозначают как амплитудный режим (А-режим).
Амплитуда давления ультразвуковой волны, и, таким образом, ампли-
туда напряжения, создает аналоговый, а не цифровой сигнал. Различные
ультразвуковые системы преобразовывают аналоговый амплитудный сиг-
нал в цифровой на различных стадиях вычислительной обработки, в резуль-
тате которой появляется изображение. Чем раньше аналоговый сигнал пу-
тем вычислений будет преобразован в цифровой вид, тем меньше будут ин-
формационные потери. Благодаря ранней обработке аналогового сигнала
удается наилучшим образом сохранить данные и получить качественное
ультразвуковое изображение.
Несмотря на то, что и первые ультразвуковое аппараты анализировали
изменения напряжения, интерпретировать их стало возможным только бла-
годаря легендарным техническим новшествам 70-х годов. Чтобы делать ин-
формацию более понятной, амплитуды напряжения были преобразованы к
шкале относительной яркости (В-режим). Шкала яркости является более от-
носительной информацией, чем отображение абсолютной величины сигна-
ла, поскольку ослабление ультразвуковой волны зависит от расстояния и со-
става объектов, с которыми взаимодействует звук.
Научные исследования направлены на определение абсолютной шкалы,
что позволит вычислять абсолютную акустическую плотность различных
тканей. Тогда преобразование амплитуды напряжения в яркость можно про-
изводить относительно излучившего ультразвук кристалла, который полу-
чил его после отражения, а шкалу каждого излучающего кристалла — пред-
ставить в виде колонки распределения яркости, соответствующей линии
сканирования.
Для создания ультразвукового изображения линии сканирования распо-
лагаются рядом друг с другом. Таким образом, линии сканирования пред-
3 Ультразвуковая диагностика...
34
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
Рис. 1.9. Создание линии сканирования. Возвращенное напряжение преобразовано к
относительной шкале серого цвета (В-режим). Чем выше напряжение, тем ярче
изображение.
ставляют собой серошкальное графическое отражение информации, опреде-
ляемой расстоянием от датчика (рис. 1.9). Ориентация линий сканирования
зависит от типа используемого датчика.
ТИПЫ ДАТЧИКОВ
В настоящее время обычно используются три основных типа датчиков: ли-
нейный, изогнутый линейный и секторный. Линейный датчик отображает
линии сканирования перпендикулярно своей излучающей поверхности и па-
раллельно друг другу. Изогнутый линейный и секторный датчики обеспечи-
вают сканирование линиями, расположенными близко друг к другу около из-
лучающей поверхности датчика и отклоняющимися друг от друга с увеличе-
нием расстояния от датчика (рис. 1.10).
Информация, содержащаяся в каждой линии сканирования, известна. К
сожалению, пространство между линиями остается вне сканирования. Для
заполнения этих пустых мест экстраполируют данные, полученные от ли-
ний сканирования с каждой из сторон такого промежутка (рис. 1.11). Посколь-
ку линии сканирования отклоняются от изогнутого линейного и секторного
датчиков, объем реальных данных пропорционально уменьшается.
При относительно глубоком сканировании внимание обычно сосредото-
чивается на больших объектах, например печени или почке. При сканирова-
ТИПЫ ДАТЧИКОВ
35
Линейный
Изогнутый линейный
Секторный
Рис. 1.10. Ориентация линий сканирования линейного, изогнутого линейного и
секторного датчиков.
Линейный
Изогнутый линейный
Рис. 1.11. Области сканирования линейным, изогнутым линейным и секторным
датчиками.
Секторный
36
1. ОСНОВНЫЕ СВЕДЕНИЯ ОБ УЛЬТРАЗВУКЕ: КАК ЗВУКОВЫЕ ВОЛНЫ СТАНОВЯТСЯ ИЗОБРАЖЕНИЯМИ
нии таких органов степень разрешения уже не столь существенна, как при
исследовании поверхностных структур, например молочной или щитовид-
ной железы. Поэтому при сканировании поверхностных тканей по возмож-
ности должен использоваться линейный датчик.
У датчиков различных типов скорость формирования изображения раз-
ная. При одинаковой глубине сканирования линейный датчик обеспечивает
самое быстрое получение изображения; секторный — самое медленное. По-
чему? Потому что, в отличие от построения линейного изображения, для по-
лучения секторного требуется фазовая последовательность работы пьезо-
электрических кристаллов. При исследовании секторным датчиком необхо-
дим больший объем работы кристаллов, чем при сканировании линейным
датчиком. Скорость получения изображения изогнутым линейным датчи-
ком является средней.
Итак, какой же датчик лучше? Ответ на этот вопрос не будет неожидан-
ным, если сказать, что выбор определяется необходимой врачу информа-
цией, а также свойствами тканей, через которые ведется сканирование.
Большие или маленькие объекты визуализирует клиницист? При использо-
вании линейного датчика расхождение линий сканирования не создает
проблем. При визуализации поверхностных объектов, например тканей мо-
лочной или щитовидной железы, линейный датчик обеспечивает получение
большей информации.
Движется изображение или нет? Для движущихся объектов более быст-
рое построение изображения позволяет сделать его более четким. Если объ-
ект перемещается, лучшим выбором является линейный датчик (включая и
движение крови в сосуде). Поэтому сонографисты для визуализации пери-
ферических сосудов часто используют линейные датчики (рис. 1.12А).
К сожалению, линейный датчик не позволят достаточно хорошо иссле-
довать сердце через межреберья. Секторный датчик позволяет сканировать
через небольшое окно (межреберье) и получить значительное количество
информации (рис. 1.12Б). Частота кадров в этом случае меньше, чем при ис-
пользовании линейного датчика, однако обмен скорости на дополнитель-
ную информацию вполне оправдан. Секторный датчик также хорошо под-
ходит для прицельного сканирования брюшной полости при травме, особен-
но для оценки правого подпеченочного и спленоренального пространств.
Эти исследования в основном проводятся через межреберные промежутки и
связны с такими же ограничениями, как и исследование сердца.
Изогнутый линейный датчик не идеален для визуализации через межре-
берья (рис. 1.12В). Негибкая грудная стенка препятствует контакту с датчи-
ком по всей его поверхности (при переломе нескольких ребер пациент, скорее
всего, не оценит упорного давления для достижения полного контакта с по-
верхностью датчика). Одной из наиболее полезных областей применения
изогнутого линейного датчика является исследование органов брюшной по-
лости. Брюшная стена обычно достаточно податлива, и изогнутый линейный
ВНИМАНИЕ, ОПАСНОСТЬ!
37
Рис. 1.12. Линейный (А), секторный (Б) и изогнутый линейный (В) датчики.
датчик в необходимой степени контактирует с кожей, позволяя сонографисту
воспользоваться преимуществом полного осмотра исследуемой области.
ВНИМАНИЕ, ОПАСНОСТЬ!
Как в отношении любого медицинского средства, для ультразвукого иссле-
дования (УЗИ) существует проблема безопасности. Передача энергии к био-
логическим тканям сверхзвуковыми волнами вследствие эффектов кавита-
ции, вибрации и поглощения может привести к их значительному разрушению
(вспомните, что при ультразвуковой литотрипсии для дробления почечных
камней используется ультразвук). Специалисты из Amirican Institute of Uet-
rasoand in Medicine (AIUM) определили, что диагностическое применение
ультразвука безопасно при мощности излучения до 1 Вт/см3 в сфокусирован-
ном луче. Подъем температуры ткани, подвергающейся ультразвуковому из-
лучению, более чем на 1 °C по сравнению с физиологической нормой свиде-
тельствует о превышении границы пределов безопасности.
Местная температура выше + 41 °C считается опасной для тканей эмб-
риона. Можно предположить, что с увеличением продолжительности иссле-
дования увеличивается и вероятность повреждения. Это означает, что время
проведения ультразвукового исследования для получения необходимой ин-
формации должно быть минимальным.
ЛИТЕРАТУРА
Auld В A. Acoustic fields and waves in solids. 2nd ed. Malabar, Florida: Krieger, 1990. Greenle-
af JF, Sehgal CM. Biologic system evaluation with ultrasound. New York: Springer-
Verlag, 1992. Kremkau FW. Diagnostic ultrasound, principles and practice. 4th ed. Philadelp-
hia: Saunders, Philadelphia, 1993.
РАБОТА НА УЛЬТРАЗВУКОВОМ
АППАРАТЕ
Терренс Д. Кейс
Хирург, самостоятельно проводящий УЗИ, имеет несомненное преимущест-
во. Овладев этим методом, он может получать оптимальные ультразвуковые
изображения. В отличие от обычного УЗИ, при котором сонографист получа-
ет и сохраняет необходимые ультразвуковые изображения для их интерпре-
тации другим врачом, хирург одновременно проводит сканирование и интер-
претацию полученных изображений.
Достижению наилучших результатов при этом способствуют правиль-
ный выбор ультразвукового датчика и соответствующая настройка оборудо-
вания, позволяющая улучшить разрешение изображения и способствующая
его распознаванию и предотвращению часто встречающихся ультразвуко-
вых артефактов и ошибок.
ОБЩИЕ СВЕДЕНИЯ
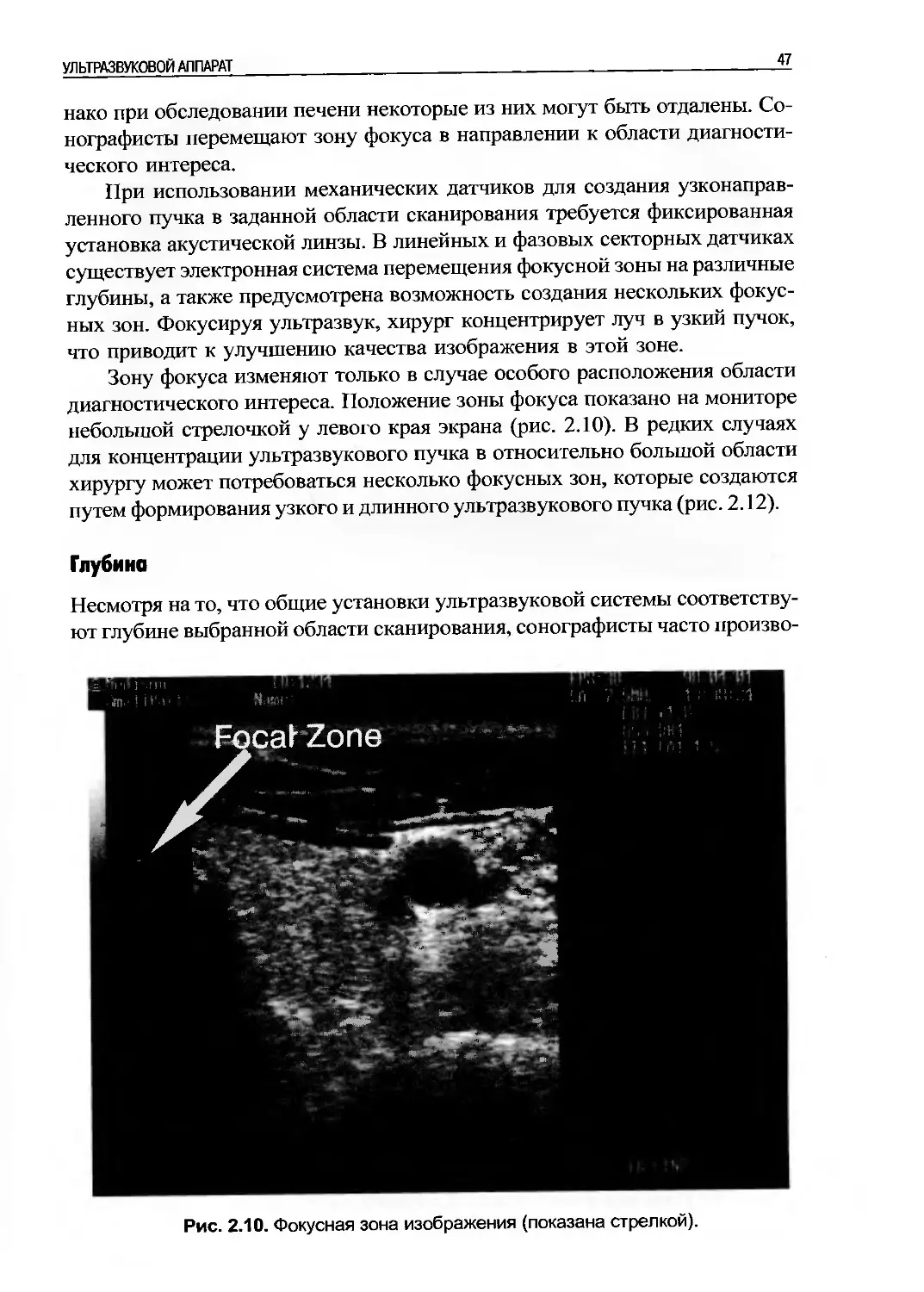
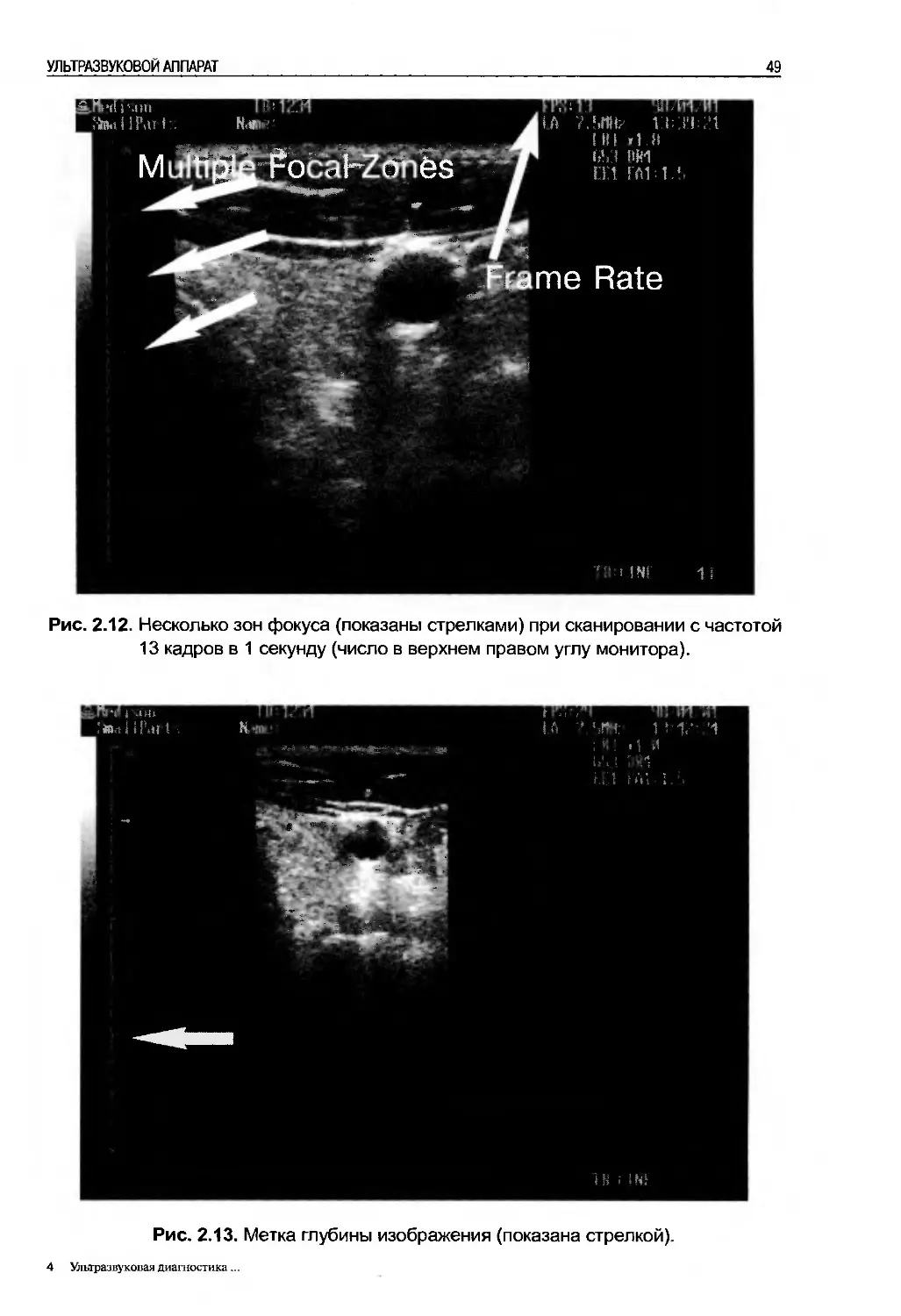
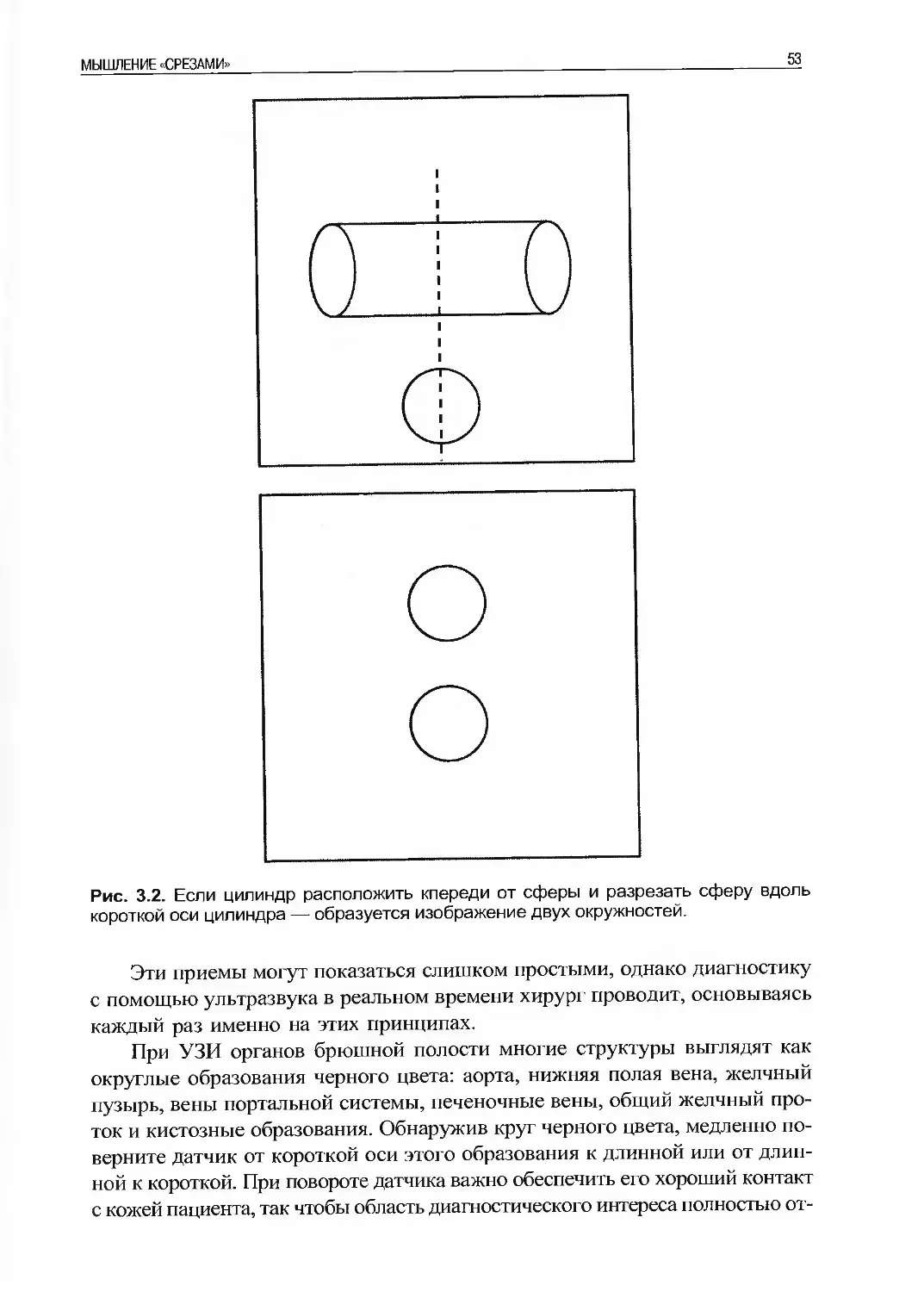
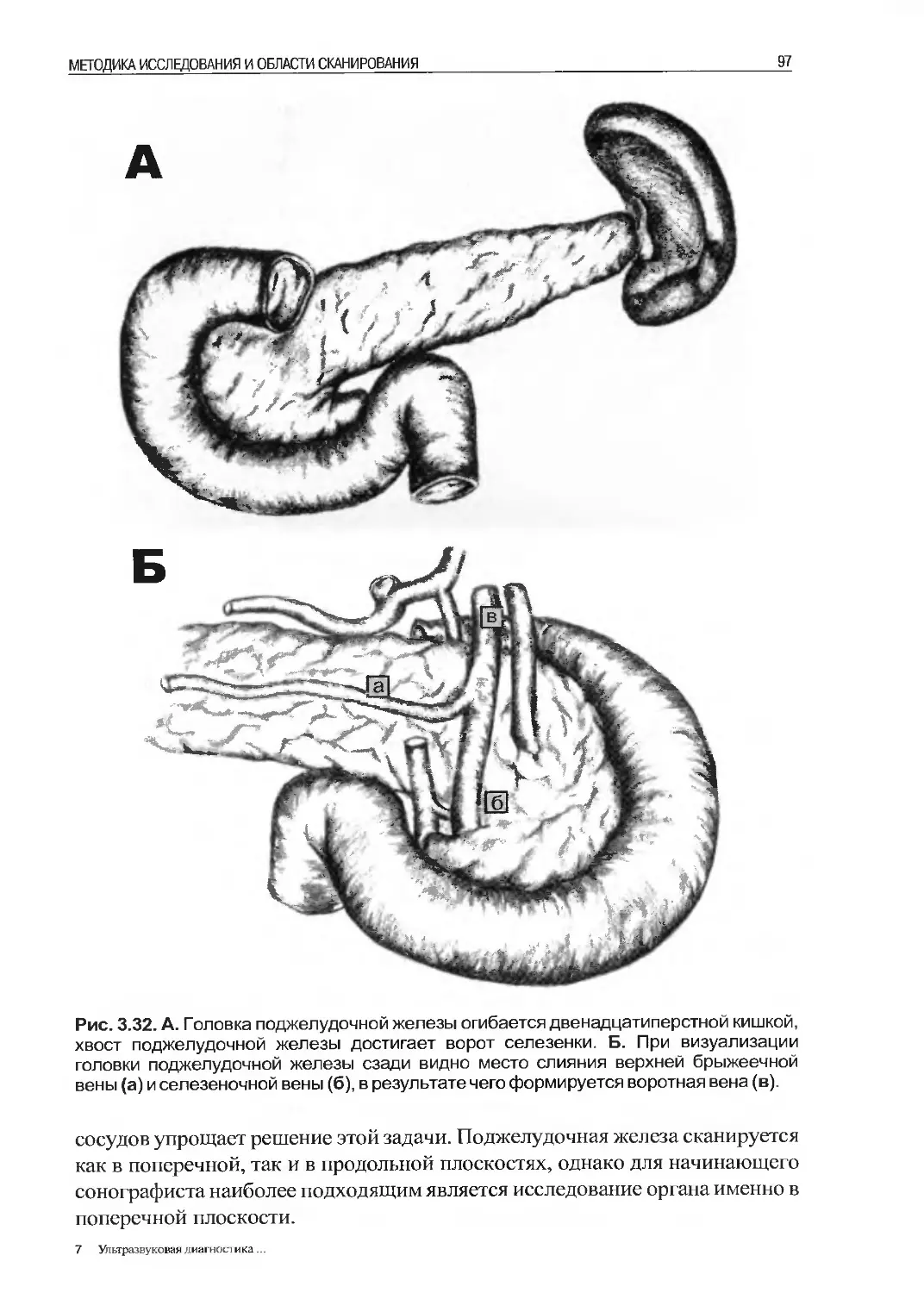
Несмотря на то, что ультразвуковая система снабжена множеством кнопок и
индикаторов, которые зачастую отпугивают хирурга, для начала выполнения
УЗИ ему необходимо быть знакомым всего с несколькими элементами управ-
ления (рис. 2.1). Большинство ультразвуковых аппаратов поставляются уже
настроенными таким образом, что для получения и сохранения ультразвуко-
вого изображения требуется минимальное управление.
В действительности, управление большинством современных ультра-
звуковых систем сходно с управлением цифровыми фотоаппаратами и ви-
деокамерами. Другими словами, после выбора области получения изобра-
жения необходимо минимальное управление системой. Для упрощения све-
дений об ультразвуковой системе в этой главе приведены описания
монитора, панели управления и самого ультразвукового модуля.
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
МОНИТОР
39
Рис. 2.1. Ультразвуковая установка.
МОНИТОР
В состав ультразвукового монитора входит катодная электронно-лучевая
трубка (ЭЛТ). Это устройство позволяет отображать ультразвуковые волны
на телевизионном или компьютерном мониторе. Монитор в ультразвуковой
системе может быть цветным или черно-белым. Некоторые ультразвуковые
системы имеют два монитора с увеличенным разрешением цветного или чер-
но-белого; однако большинство современных систем снабжены одним мони-
тором.
Как и в любой ЭЛТ, пользователь может изменять яркость и контраст-
ность изображения. Настройка этих параметров нередко становится самой
важной во всей ультразвуковой системе.
40
2. РАБОТА НА УЛЬТРАЗВУКОВОМ АППАРАТЕ
ПАНЕЛЬ УПРАВЛЕНИЯ
Предварительные установки
Как современные автоматизирование фото- и видеокамеры способны к на-
стройке величины диафрагмы и глубины резкости, так и ультразвуковая сис-
тема обладает множеством градаций мощности и глубины. Эти настройки
позволяют получить изображение поверхностных тканей, органов брюшной
полости или сердца, оптимальное для специальных хирургических целей.
Кроме этого, после определения установленного датчика система настраива-
ется соответствующим образом, подходящим для данного исследования.
Например, установка «SMALL PARTS» используется для сканирования
поверхностных тканей относительно неглубоко расположенных органов, таких
как молочная или щитовидная железа, яички (рис. 2.2). При этом глубина ска-
нирования является минимальной, а зона фокуса находится в области, ближай-
шей к датчику. Когда хирург выбирает установку «BODY MARKERS» для ска-
нирования отдельных органов или анатомических зон, ультразвуковой аппарат
автоматически перенастраивается. Наиболее распространенными предвари-
тельными установками являются установки для выполнения эхокардиографии
Рис. 2.2. На мониторе ультразвукового аппарата отображаются данные о его
предварительных установках, сведения о пациенте, зонах фокуса и частота
излучения датчика (указано стрелками).
ВЫБОР ДАТЧИКА
41
(CARDIAC), сканирования органов брюшной полости ABDOMINAL, исследо-
ваний в акушерско-гинекологической практике (OB/GYN), исследования по-
верхностных структур (SMALL PARTS) и сосудов (VASCULAR).
ВЫБОР ДАТЧИКА
После включения аппарата хирург может выбрать датчик, наиболее подходя-
щий для предстоящего УЗИ. Например, для получения изображения молоч-
ной железы требуется высокочастотный датчик с частотой сканирования
7,5 МГц. Почему? Потому что он позволяет получить ультразвуковое изоб-
ражение наилучшего качества при относительно небольшой глубине скани-
рования. Кроме того, выбор такого датчика приведет к установке парамо ров
системы, наиболее подходящих для сканирования на этой глубине.
Большинство современных ультразвуковых систем снабжены активны-
ми элементами управления, позволяющими хирургу выбирать различные дат-
чики без их отсоединения и повторного присоединения к аппарату (рис. 2.3). В
более ранних системах требовалось каждый раз отсоединять ненужный в
Рис. 2.3. Вид ультразвуковой системы с гнездами
для присоединения датчиков (стрелки).
42
2. РАБОТА НА УЛЬТРАЗВУКОВОМ АППАРАТЕ
Таблица 2.1. Типичные частоты сканирования для различных
ультразвуковых исследований
Частота сканирования, МГц Применение
2,25 Тучные пациенты; исследования в глубине брюшной полости
3,5 Обычное исследование органов брюшной полости, исследования в акушерстве и гинекологии
5,0 Сканирование плода, исследования в неонатологии, педиатрии; исследование периферических артерий и вен
7,5 Исследование сосудов головного мозга, молочной железы, яичек
10,0 Исследование глазного яблока, картирование венозной системы, исследование поверхностных мягких тканей
настоящий момент датчик при замене его на другой. В общем, для специфи-
ческих исследований клиницист должен выбирать датчик с большей, чем
для обычных исследований, частотой (табл. 2.1).
УЛЬТРАЗВУКОВОЙ АППАРАТ
Мощность
Акустическая мощность — это количество энергии, излученной источником
и переданной в виде пучка за единицу времени. Мгновенный объем акустиче-
ской энергии имеет периодическую зависимость от времени. Для получения
ультразвуковых изображений используется импульсное излучение или излу-
чение короткими вспышками, в промежутках между которыми излучение от-
сутствует. Датчик работает в циклическом режиме, генерируя ультразвуко-
вые волны только в отдельные периоды времени. После прекращения ультра-
звукового излучения акустическая мощность становится равной нулю.
Поэтому средняя мощность ультразвукового излучения складывается
из периодов, в течение которых это излучение генерируется и отсутствует.
Ее величина представлена средним временем между пиками излучения энер-
гии, измеряется в ваттах (Вт) и является основной для характеристики акусти-
ческой мощности. Однако American Institute of Ultrasund in Medicune (AIUM)
в последнее время представил новые требования к характеристике ультра-
звукового излучения к ним относятся термальный индекс (ТИ) и механиче-
ский индекс (МИ). Каждый из этих показателей отражает безопасный уро-
вень ультразвуковой мощности для тех или иных исследований. В каждом
случае эти индексы определяются для каждой ультразвуковой системы в со-
УЛЬТРАЗВУКОВОЙ АППАРАТ
43
ответствии с указаниями AIUM. Пользователь не может изменять значения
термального и механического индексов.
Чувствительность
При прохождении через ткани ультразвуковая волна обычно затухает или
рассеивается. Повышение чувствительности позволяет хирургу компенсиро-
вать потери отраженного ультразвукового сигнала (рис. 2.4). Работа с чувст-
вительностью напоминает изменение громкости в радиоприемнике. При ее
повышении слушатель может уловить звуки, не слышимые до регулировки.
Для ультразвука ситуация схожа: хирург может улучшить видимость изобра-
жения, интенсивность которого будет усилена путем повышения чувствитель-
ности. Обычно сонографисты настраивают чувствительность таким образом,
чтобы все изображение не было ни слишком темным (рис. 2.5), ни слишком
бледным (рис. 2.6).
Компенсация временных потерь
При прохождении через ткани ультразвуковой сигнал обычно ослабевает или
рассеивается. Для компенсации ослабления сонографисты используют вре-
менную компенсацию чувствительности путем изменения зависимости ин-
тенсивности сигнала от времени и глубины. Для выравнивания интенсивно-
сти отраженного потока при более далеком распространении сигнала от дат-
чика требуется большее усиление. Для такого выравнивания большинство
Рис. 2.4. Положение рукоятки для управления чувствительностью
(показано стрелкой).
44
2. РАБОТА НА УЛЬТРАЗВУКОВОМ АППАРАТЕ
Рис. 2.5. Слишком темное изображение.
Рис. 2.6. Слишком светлое изображение.
УЛЬТРАЗВУКОВОЙ АППАРАТ
45
Рис. 2.7. Положение переключателей компенсации временных потерь
(показано стрелкой).
ультразвуковых систем снабжены движущимися переключателями (рис. 2.7).
Верхние переключатели предназначены для выравнивания чувствительно-
сти в ближайших к датчику зонах, нижние — для управления чувствительно-
стью в дальних зонах. Обычно требуется небольшая компенсация временных
потерь или ее не требуется вовсе; управление чувствительностью наиболее
полезно для тонких настроек при получении ультразвуковых изображений,
предназначенных для документации или обучения (рис. 2.8 и 2.9).
Фокусировка
Одной из наиболее важных целей УЗИ является получение четкого и сфоку-
сированного изображения. Используя технологии электронной фокусировки
и управляя ультразвуковым лучом в ограниченной области сканирования, со-
нографисты получают четкие изображения. Поверхностные зоны при скани-
ровании являются ближайшими к датчику. В этих областях ультразвуковое
излучение собрано в узкий пучок и полученное изображение обладает наиболь-
шим разрешением. Такую область называют зоной фокуса. За пределами
этой области ультразвуковой пучок быстро рассеивается; такую область уль-
тразвукового изображения обозначают как отдаленную.
Так же как в фото- и видеокамерах, качество изображения является наи-
лучшим в зоне фокуса. Однако область диагностического интереса может
располагаться не только поверхностно, но и глубже. При сканировании мо-
лочной железы исследуемые зоны расположены в близлежащей области; од-
46
2. РАБОТА НА УЛЬТРАЗВУКОВОМ АППАРАТЕ
Рис. 2.8. Ближайшая к датчику слишком темная зона изображения
(показана стрелкой).
Рис. 2.9. Изображение, полученное при правильных настройках.
УЛЬТРАЗВУКОВОЙ АППАРАТ
47
нако при обследовании печени некоторые из них могут быть отдалены. Со-
нографисты перемещают зону фокуса в направлении к области диагности-
ческого интереса.
При использовании механических датчиков для создания узконаправ-
ленного пучка в заданной области сканирования требуется фиксированная
установка акустической линзы. В линейных и фазовых секторных датчиках
существует электронная система перемещения фокусной зоны на различные
глубины, а также предусмотрена возможность создания нескольких фокус-
ных зон. Фокусируя ультразвук, хирург концентрирует луч в узкий пучок,
что приводит к улучшению качества изображения в этой зоне.
Зону фокуса изменяют только в случае особого расположения области
диагностического интереса. Положение зоны фокуса показано на мониторе
небольшой стрелочкой у левого края экрана (рис. 2.10). В редких случаях
для концентрации ультразвукового пучка в относительно большой области
хирургу может потребоваться несколько фокусных зон, которые создаются
путем формирования узкого и длинного ультразвукового пучка (рис. 2.12).
Глубина
Несмотря на то, что общие установки ультразвуковой системы соответству-
ют глубине выбранной области сканирования, сонографисты часто произво-
Рис. 2.10. Фокусная зона изображения (показана стрелкой).
48
2. РАБОТА НА УЛЬТРАЗВУКОВОМ АППАРАТЕ
дят небольшие изменения этой величины. Особенности телосложения, ожи-
рение, возраст пациента часто мешают хирургу добиться отчетливой визуа-
лизации тканей в области сканирования. Управляя ультразвуковой системой,
можно изменять глубину и область сканирования (рис. 2.13). Эти изменения
производят только при необходимости, поскольку большая область сканиро-
вания или глубина влияют на частоту кадров. Частота кадров—это скорость,
с которой происходит обновление ультразвукового изображения. Поскольку
ультразвуковая волна должна полностью вернуться к датчику перед тем, как
будет послана другая порция ультразвука, использование нескольких фокус-
ных зон приводит к значительному снижению частоты кадров (сравните час-
тоту кадров на рис. 2.11 и 2.12).
Фиксация, измерения и обозначения
Проводя ультразвуковое исследование, хирург действует как клиницист, до-
кументируя результаты исследования в минимальном, по сравнению с радио-
логом, объеме. Однако даже в этом случае хирург должен зафиксировать ре-
зультаты исследования исходя из финансовых, медицинских и юридических
соображений. Важно, чтобы область патологических изменений была отра-
жена в двух плоскостях — продольной и поперечной. Большинство совре-
менных ультразвуковых систем позволяют хирургу выполнить измерения,
ввести обозначения ираспечатать зафиксированное изображение (рис. 2.14).
Рис. 2.11. Одна зона фокуса (показана стрелкой) при сканировании с частотой
38 кадров в 1 секунду (число в верхнем правом углу монитора).
УЛЬТРАЗВУКОВОЙ АППАРАТ
49
Рис. 2.12. Несколько зон фокуса (показаны стрелками) при сканировании с частотой
13 кадров в 1 секунду (число в верхнем правом углу монитора).
Рис. 2.13. Метка глубины изображения (показана стрелкой).
4 Ультразвуковая диагностика...
50
2. РАБОТА НА УЛЬТРАЗВУКОВОМ АППАРАТЕ
Рис. 2.14. Положение кнопки для фиксации изображения (показано стрелкой).
ЛИТЕРАТУРА
Atkinson Р, Woodcock JP. Doppler ultrasound and its use in clinical measurement. London:
Academic Press, 1982.
Bums PN. Physical principles of Doppler ultrasound and spectral analysis. J Clin Ultrasound
1987;15:567-590.
Case T. Primer in vascular technology. Boston: Little, Brown, 1995.
Edelman S. Understanding ultrasound physics. Houston: ESP, 1992.
Gill RW, Kossoff MB, Kossoff G, Grifiths KA. New class of pulsed Doppler ultrasound at short
ranges. Radiology 1989;173:272-275.
Namekawa K, Kasai C, Omoto R. Real time two-dimensional imaging using Doppler ultraso-
und. Ultrasound Med 1983;2:10-15.
Wells PNT. Biomedical ultrasonics. London: Academic Press, 1977.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
ОРГАНОВ БРЮШНОЙ ПОЛОСТИ:
ОСНОВНЫЕ СВЕДЕНИЯ
Деннис Б. Вишер
Эта глава знакомит хирурга с основами использования УЗИ как диагностиче-
ского метода в реальном времени у больных с абдоминальными симптомами.
Предпринята попытка развития мышления на основе анатомических срезов, а
также способ! юсти paci юзнавать и различать среди оттенков серого, составляю-
щих ультразвуковое изображение, нормальные структуры и патологические об-
разования.
Ультразвуковое исследование позволяет представить анатомические осо-
бенности пациента в виде набора тонких срезов. Понимание и осмысление
секционной анатомии является главным для диагностической оценки изоб-
ражений, получаемых с помощью этой технологии. Ультразвуковая анато-
мия часто вызывает замешательство. Многие студенты сравнивают ультра-
звуковое изображение с видами в дождливую погоду. Однако опытные кли-
ницисты среди множества беспорядочных черных, серых и белых полей
распознают полноценную диагностическую информацию.
МЫШЛЕНИЕ «СРЕЗАМИ»
Изучение секционной анатомии является важным и начинается с некоторых
основных концепций, облегчающих это изучение. Изменение мышления
должно быть основано на понимании технологических особенностей Для
того чтобы ориентироваться в трехмерном пространстве, необходим опыт; к
счастью, вы уже сталкивались с основами трехмерного мышления. Еще ре-
бенком вы познакомились с закономерностями очертаний окружающих пред-
метов. Основу ультразвуковых образов составляет набор сечений сфер и ци-
линдров. Вот несколько примеров:
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications. Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright© 2001 Wiley-Liss, Inc
52 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
• Если цилиндр разрезать вдоль короткой оси, то какое изображение мы
получим? Правильный ответ на этот вопрос — окружность (рис. 3.1).
• Если цилиндр расположить кпереди от сферы и разрезать сферу вдоль
короткой оси цилиндра, какое изображение получится? Правильный от-
вет на этот вопрос — две окружности (рис. 3.2).
При любом рассечении цилиндра вдоль короткой оси образуется окруж-
ность. При рассечении цилиндра вдоль длинной оси образуется изображе-
ние из двух линий. Это является важным отличием цилиндра от сферы: при
рассечении сферы вдоль любой оси будет образовываться окружность.
Рис. 3.1. Результатом рассечения цилиндра вдоль короткой оси является
изображение окружности.
МЫШЛЕНИЕ «СРЕЗАМИ»
53
Рис. 3.2. Если цилиндр расположить кпереди от сферы и разрезать сферу вдоль
короткой оси цилиндра — образуется изображение двух окружностей.
Эти приемы могут показаться слишком простыми, однако диагностику
с помощью ультразвука в реальном времени хирург проводит, основываясь
каждый раз именно на этих принципах.
При УЗИ органов брюшной полости многие структуры выглядят как
округлые образования черного цвета: аорта, нижняя полая вена, желчный
пузырь, вены портальной системы, печеночные вены, общий желчный про-
ток и кистозные образования. Обнаружив круг черного цвета, медленно по-
верните датчик от короткой оси этого образования к длинной или от длин-
ной к короткой. При повороте датчика важно обеспечить его хороший контакт
с кожей пациента, так чтобы область диагностического интереса полностью от-
54 3. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВВДЕНИЯ
ражалась на мониторе. Поскольку сечением цилиндра вдоль его длинной
оси является плоскость, а сечением вдоль короткой — круг, изображения
просветов аорты, нижней полой вены, вен портальной системы и печеноч-
ных вен будут выглядеть именно так. Наполненный желчный пузырь будет
выглядеть как круг при сканировании вдоль его короткой оси и как удлинен-
ный овал при сканировании вдоль длинной оси.
Если какая-либо структура выглядит как круг при сканировании как
вдоль длинной, так и вдоль короткой оси, ее форма должна быть шаровид-
ной. Согласно общему правилу, если при сканировании брюшной полости
обнаружена структура, имеющая округлое сечение в обеих плоскостях, хи-
рург должен заподозрить наличие патологического образования. Кисты (как
простые, так и сложные) обычно выглядят как округлые образования черно-
го цвета, метастатические опухоли печени чаще имеют темно-серый цвет,
овальную или округлую форму.
Клиницисты всегда должны получать изображение в двух плоскостях.
Почему? Потому что простым поворотом датчика от одной плоскости ска-
нирования к другой может быть получена чрезвычайно ценная диагностиче-
ская информация.
Ориентация изображения
Чтобы увидеть простой цилиндр, визуализируйте аорту. Если аорта будет
сканироваться вдоль длинной оси тела, какое из изображений, представлен-
ных на рис. 3.3, должно получиться? Правильным ответом является А. На
рис. 3.4 А показана правильная стандартная ориентация продольного скани-
рования при исследовании брюшной полости. Стандартная ориентация дат-
чика при поперечном сканировании показана на рис. 3.4 Б. При проведении
ультразвукового исследования органов брюшной полости всегда используй-
те стандартные ориентации датчика как при продольном, так и при попереч-
ном сканировании. Эти ориентиры являются также стандартными для трансаб-
доминального исследования органов малого таза, щитовидной железы и яичка.
ОПЕНКИ СЕРОГО
Теоретические основы формирования ультразвукового изображения приве-
дены в главе 1. Эта глава содержит сочетание теоретических сведений с прак-
тикой получения ультразвуковых изображений в клинике. Ультразвуковое
изображение состоит из маленьких точек, называемых пикселями. Каждый
пиксель окрашен одним из 256 оттенков серого цвета, который придает ему
ультразвуковая система. Интенсивность серого цвета для каждого пикселя
имеет прямую зависимость от величины отраженного ультразвукового сиг-
нала. При сильном отражении эта окраска будет светло-серой или белой, в то
время как слабое отражение даст темно-серый или черный цвет. Таким обра-
ОБУЧЕНИЕ НОВОМУ ЯЗЫКУ
55
Рис. 3.3. На рисунке А показана ориентация изображения, которая будет получена
при сканировании аорты вдоль длинной оси.
зом, формируется изображение, состоящее из различных оттенков серого
цвета. На их основе ультрасонографист делает важные клинические заключе-
ния.
ОБУЧЕНИЕ НОВОМУ ЯЗЫКУ
При просмотре или описании ультразвукового изображения клиницисты ис-
пользуют специальные термины. Ниже приводится пояснение значений
основных слов:
Гиперэхогенностъ. Белесоватые или яркие оттенки серого; например, си-
нус почки выглядит гиперэхогенным по сравнению с почечной па-
ренхимой.
Гипоэхогенность. Темные или менее яркие оттенки серого; например,
паренхима почки является гипоэхогенной по отношению к почечно-
му синусу.
56
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
ПРОДОЛЬНАЯ ОРИЕНТАЦИЯ
ПРАВЫЙ БОК
ПАЦИЕНТА
ПОПЕРЕЧНАЯ ОРИЕНТАЦИЯ
ЛЕВЫЙ БОК
ПАЦИЕНТА
Рис. 3.4. Стандартные ориентации для трансабдоминальных продольных (А) и
поперечных (Б) ультразвуковых изображений.
Анэхогенностъ Отсутствие внутренней эхогенности; например, анэхо-
генной является простая киста почки. При сканировании с использо-
ванием черного фона анэхогенные структуры выглядят черными.
Эхогенность. Светлые зоны на темном фоне; например, диафрагма вы-
глядит как эхогенная дугообразная структура линейной формы.
Гомогенность. Однородная окраска всего органа, обычно наблюдается
при сканировании нормальных органов; например, структура нор-
мальной печени является гомогенной без очаговых образований
(рис. 3.5).
КИСТЫ, КАЛЬЦИФИКАТЫ И СОЛИДНЫЕ ОБРАЗОВАНИЯ
57
Рис. 3.5. Однородное или гомогенно окрашенное оттенками серого цвета
ультразвуковое изображение нормальной печени при продольном сканировании.
Гетерогенность. Неоднородная окраска органа оттенками серого цвета
обычно наблюдается при патологических изменениях органа; напри-
мер, при алкогольном ожирении печени ее ультразвуковое изобра-
жение может быть гетерогенным (рис. 3.6). Изображение органа мо-
жет быть представлено различными оттенками серого и содержать
как гиперэхогенные, так и гипоэхогенные поля (рис. 3.6).
КИСТЫ, КАЛЬЦИФИКАТЫ И СОЛИДНЫЕ ОБРАЗОВАНИЯ
Способность выявлять кисты, камни и солидные образования делает ультра-
звуковое исследование незаменимым диагностическим средством для иссле-
дований в реальном времени.
58
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
LIVER RT
LONG
81 43
S228
ВЕРТИ
LIVER
PMR •
55dB
GAIN*
Рис. 3.6. Гетерогенное ультразвуковое изображение печени у пациента с
алкогольным жировым гепатозом.
Кисты
Простая киста обладает следующими ультразвуковыми признаками: а) явля-
ется анэхогенным (без внутренней эхогенности, черным); б) имеет тонкие
стенки и в) дает эффект дорсального усиления ультразвука (яркое свечение
позади кисты). Обладающие этими признаками образования обычно являют-
ся доброкачественными.
На рис. 3.7 показано яркое свечение позади кисты как пример дорсаль-
ного усиления ультразвука. Как образуется дорсальное усиление? Феномен
этого артефакта обусловлен меньшей ультразвуковой плотностью кисты по
отношению к окружающим ее тканям. Дорсальное усиление ультразвука в
целом характерно для кистозных образований. При диагностической оценке
КИСТЫ, КАЛЬЦИФИКАТЫ И СОЛИДНЫЕ ОБРАЗОВАНИЯ
59
Рис. 3.7. Продольное изображение правой почки, содержащей кисту.
образования, которое может являться кистозным, тщательно проверяйте,
обладает ли оно всеми признаками простой кисты. Если образование не со-
ответствует этим ультразвуковым критериям, оно может являться сложной
кистой (рис. 3.8).
Классические признаки сложных кист включают в себя: а) утолщенную
стенку или стенку неправильной формы; б) перегородки; в) содержимое в
полости кисты. Для оценки сложных кист обычно требуется несколько ульт-
развуковых срезов. При диагностике сложных кистозных образований мо-
60
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.8. А. Киста печени неправильной формы. Б. Сложная киста почки, содержащая
эхогенный детрит.
гут быть использованы другие методы визуализации или пункционные ме-
тодики. Абсцесс, опухоль или гематома при ультразвуковом исследовании
могут выглядеть как сложное кистозное образование.
Конкременты
Камни обычно определяются как эхогенные структуры, оставляющие за со-
бой акустическую тень (рис. 3.9). Акустическая тень — это артефакт, возни-
кающий в результате значительной разницы в акустической плотности меж-
КИСТЫ, КАЛЬЦИФИКАТЫ И СОЛИДНЫЕ ОБРАЗОВАНИЯ
61
ду камнем и окружающей его желчью. Значительное отражение звука от кам-
ня приводит к тому, что звук за ним не распространяется, и это выглядит как
тень. Сонографическими критериями калькулеза являются: а) эхогенное об-
разование и б) расположенная позади него акустическая тень. Желчные кам-
ни могут перемещаться в желчном пузыре при изменении положения тела па-
циента.
62
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.9. Ультразвуковое изображение камня желчного пузыря с акустической тенью
позади него.
Необходимо избегать путаницы между такими явлениями, как дорсаль-
ное усиление ультразвука и акустическая тень. Дорсальное усиление выгля-
дит как яркая область, возникающая при кистозных образованиях (рис. 3.7).
Напротив, акустическая тень представляет собой анэхогенную зону, и ее об-
разование вызвано наличием камней. Вспомните, что ваше тело на солнце
отбрасывает тень. В реальном мире тени черные; тень от ультразвука также
является черной (рис. 3.9).
При УЗИ органов брюшной полости возникновение акустической тени
обычно связано с такими структурами, как кальцификаты и кости (ребра).
Двенадцатиперстная кишка и желудок также могут оставлять позади себя
ЖЕЛЧНЫЙ ПУЗЫРЬ
63
акустическую тень вследствие наличия в их полости газа. Г аз препятствует
распространению ультразвука. Это выражается в значительной разнице акус-
тической плотности газа и мягких тканей, что в свою очередь приводит к об-
разованию акустической тени. Злокачественные образования молочной же-
лезы часто дают акустическую тень, несмотря на то, что они не содержа! каль-
цификатов.
Солидные образования
Солидные образования органов брюшной полости при ультразвуковом ска-
нировании окрашиваются в самые различные оттенки серого. Такие опухоли,
как гемангиомы, могут определяться как эхогенные образования. Большин-
ство же метастатических опухолей визуализируется как гипоэхогенные или
гиперэхогенные образования. Большие гепатомы иногда выглядят как гете-
рогенные образования (рис. 3.10). Края солидных образований могут быть
сглаженными, неровными, хорошо или плохо отграниченными.
ЖЕЛЧНЫЙ ПУЗЫРЬ
Ультразвуковое изображение
Опытный сонографист при УЗИ, проводящемся натощак, без труда визуали-
зирует у большинства пациентов неизмененный желчный пузырь. Обычно
предпочитают 3,5-МГц конвексный или секторный датчики, позволяющие
наилучшим образом выполнить сканирование органа в подреберье или через
межреберные промежутки. У худощавых пациентов при поверхностном рас-
положении желчного пузыря может быть использован датчик 5,0 МГц.
Если пациент обследуется натощак, желчный пузырь определяется как
анэхогенная тонкостенная структура овальной формы, сужающаяся в на-
правлении шейки. Диаметр нормального желчного пузыря составляет 3-4
см, длина может достигать 10 см. Для наилучшей визуализации желчного
пузыря пациент должен обследоваться натощак для того, чтобы пузырь до-
статочно наполнился желчью. Для подготовки к исследованию пациенту
предлагают воздержаться от еды и питья в течение 8 ч. Если после 8 ч голо-
дания желчный пузырь не визуализируется или недостаточно наполнен, это
с вероятностью до 96% свидетельствует о патологических изменениях [1].
В 70% случаев можно увидеть основную долевую борозду печени, опре-
деляющуюся при продольном сканировании в виде эхогенной линейной
структуры, проходящую от правой ветви воротной вены до желчного пузы-
ря [2]. Линейная эхоструктура может быть использована как ориентир при
поиске желчного пузыря, который особенно полезен при попытках обнару-
жения конкрементов в сокращенном желчном пузыре (рис. 3.11).
64
3. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.10. А. Поперечное ультразвуковое изображение печени, содержащей солидное
образование (гепатому). Б. Множественные эхогенные метастазы печени.
Заболевания желчного пузыря
Возможность точной и неинвазивной оценки состояния желчного пузыря де-
лает УЗИ средством выбора при диагностическом поиске у пациентов с бо-
лью в правом подреберье или эпигастральной области. При ультразвуковом
исследовании можно в считанные минуты определить патологические изме-
нения в желчном пузыре (камни, взвесь и/или утолщение стенки). При этом
число состояний для дифференциального диагноза значительно снижается
ЖЕЛЧНЫЙ ПУЗЫРЬ
65
Рис. 3.10. (Продолжение.)
Г
Холелитиаз. Для выявления камней желчного пузыря УЗИ является пред-
почтительным диагностическим методом, его точность достигает 95 -99%
[3,4]. Большинство желчных камней состоит из смеси холестерола, желчных
пигментов и солей кальция. При УЗИ желчные камни определяются как внут-
рипросветные эхогенные образования, дающие акустическую тень; при ска-
нировании на черном фоне — в виде образований белого цвета с черной те-
нью позади себя (рис. 3.9). Акустическая плотность желчи в желчном пузыре
значительно отличается от акустической плотности конкрементов, в резуль-
тате чего звук в значительно большей степени отражается от камня. Вследст-
вие того что звук не проникает через камень, в этой области образуется акус-
тическая тень.
5 Ультразвуковая диагностика...
66
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.11. Визуализация основной долевой борозды печени как линейной эхогенной
структуры между правой ветвью воротной вены и желчным пузырем.
Для обнаружения акустической тени от камней размером менее 3 мм не-
обходимо тщательное сканирование. Сонографист должен соответствую-
щим образом направить ультразвуковой луч, что является основным факто-
ром для выявления конкремента. Акустическая тень обычно видна тогда,
когда поверхность камня перпендикулярна ультразвуковому лучу, а сам ка-
мень расположен в центральной зоне ультразвукового луча.
Визуализация акустической тени от очень маленьких (менее 2 мм) зер-
новидных камней может быть затруднена. Положение пациента лежа на ле-
ЖЕЛЧНЫЙ ПУЗЫРЬ
67
вом боку приводит к тому, что камни перекатываются в желчном пузыре,
слипаются друг с другом, в результате чего визуализация акустической тени
от них облегчается. При исследовании желчного пузыря визуализацию кам-
ней необходимо проводить как при продольном, так и при поперечном ска-
нировании в положении на спине, а также в положении на боку. Перед рас-
печаткой ультразвукового изображения отметьте на нем положение пациента
во время получения снимка. Исследование всегда проводите как в положении
на спине, так и в положении на боку, даже если камни не визуализируются.
Это способствует выявлению мелких камней, которые скрыты в шеечной
части желчного пузыря и могут быть обнаружены во время их перекатыва-
ния в область дна.
Для подтверждения наличия камней в желчном пузыре необходимо при-
сутствие следующих сонографических критериев: а) эхогенное образование
(камень); б) акустическая тень и в) перемещение камней при изменении по-
ложения пациента (если конкремент не является вколоченным). Ложнопо-
ложительный диагноз билиарного калькулеза может быть связан со следую-
щими ситуациями: а) тень от газа в двенадцатиперстной кишке; б) полипы
желчного пузыря; в) сгустки желчи; г) выраженные складки стенки пузыря и
д) аденомиоматоз [5].
Утолщение стенки желчного пузыря. При сканировании желчного пузы-
ря у пациентов натощак необходимо измерить толщину стенки органа. Неиз-
мененная стенка должна быть тонкой (3 мм или меньше). Если толщина стен-
ки желчного пузыря превышает 3 мм, необходимо подозревать наличие пато-
логических изменений (рис. 3.12). Утолщение стенки желчного пузыря
является неспецпфическим признаком и может быть вызвано его сокращени-
ем после приема пищи, холециститом, асцитом, СПИДом, гипоальбумине-
мией, гепатитом, застоем при сердечной недостаточности, аденомиоматозом
или опухолью.
Поскольку утолщение стенки является неспецифическим признаком, то
устанавливать диагноз холецистита только по одному этому признаку кли-
ницист должен с осторожностью [6-14]. Врач должен получить ультразвуко-
вое изображение желчного пузыря как натощак, так и после приема пищи,
который вызывает сокращение желчного пузыря, чья стенка при этом может
выглядеть утолщенной.
Сонографический вид утолщенной стенки желчного пузыря зависит от
степени утолщения и от степени выраженности отека. Ультразвуковое изоб-
ражение утолщенной стенки имеет среднюю или низкую эхоплотность.
Иногда изображение является исчерченным, например стенка может одно-
временно содержать беспорядочно расположенные анэхогенные поля или
эхогенные включения [15].
При оценке желчного пузыря следует отличать диффузное утолщение
его стенки от локального. Как уже было отмечено, диффузное утолщение
68
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.12. Ультразвуковое изображение желчного пузыря при продольном
сканировании: определяется утолщение стенки, а также наличие в просвете
эхогенного конкремента и сгустков желчи
стенки желчного пузыря может наблюдаться при широком спектре патоло-
гических изменений, в то время как локальное утолщение может быть вы-
звано опухолью.
Холецистит. При осмотре пациента, жалующегося на боль в животе, хи-
рург должен предполагать наличие острого холецистита. В большинстве слу-
чаев острого холецистита выявляются желчные камни (камни часто распола-
ЖЕЛЧНЫЙ ПУЗЫРЬ
69
гаются в пузырном протоке или шейке желчного пузыря). Острое воспаление
желчного пузыря вызывается обструкцией желчного протока. Стенка желч-
ного пузыря считается утолщенной, если она толще 3 мм. Ультразвуковая
плотность стенки при холецистите колеблется от средней до гипо- или анэхо-
генной (расслоенной) [9, 16-25].
При проведении исследования сканирование должно выполняться в по-
ложении пациента на спине и на левом боку. Как уже было отмечено, пово-
рот пациента на бок создает условия для перемещения мелких камней, нахо-
дящихся в шейке желчного пузыря, в сторону дна. Если камень не перемеща-
ется из шейки желчного пузыря, это указывает на то, что он может оказаться
«вколоченным».
Ультразвуковые данные, характерные для острого холецистита, включа-
ют в себя: а) утолщение стенки (более 3 мм); б) желчные камни; в) положи-
тельный сонографический симптом Murphy; г) возможное наличие сгустков
желчи; д) возможное расширение желчного пузыря (до 5 см или более в попе-
речном размере); е) возможное наличие перипузырной жидкости (рис. 3.13).
Если во время УЗИ выявлены желчные камни и утолщение стенки желч-
ного пузыря, попробуйте оказать умеренное давление на переднюю брюш-
ную стенку датчиком, расположенным непосредственно над дном желчного
пузыря (рис. 3.12). Возникновение локального напряжения мышц брюшной
стенки свидетельствует, скорее всего, о наличии острого холецистита. Вра-
чи обозначают местное мышечное напряжение как ультразвуковой симптом
Murphy [19, 22, 25].
Серьезным осложнением острого холецистита является гангренозный
холецистит. При гангренозных изменениях стенки желчного пузыря в ней
определяются зоны кровоизлияний и некроза, изъязвлений, а также форми-
руются микроабсцессы. Основываясь только на ультразвуковых данных, от-
личить гангренозный холецистит от острого негангренозного холецистита
сложно. Симптомы заболевания и ультрасонографические находки у боль-
ных с гангренозными изменениями желчного пузыря могут быть схожими с
клиническими данными при остром негангренозном холецистите. Таким об-
разом, сонографист может выявить билиарный калькулез, утолщение стен-
ки желчного пузыря и его расширение, наличие сгустков желчи и/или поло-
жительный симптом Murphy [26-28].
Описано два интересных признака [28], обнаруженных у 11 из 100 хи-
рургически подтвержденных случаев гангренозного холецистита: наличие
тонких линейных пленок внутри просвета пузыря и беспорядочно располо-
женных очагов в стенке желчного пузыря. Внутрипросветные пленки, опи-
санные в исследовании, на разрезе пузыря представляли собой обычный
фибринозный экссудат и участки некротизированной слизистой оболочки.
Наличие этих ультрасонографических признаков даже без дополнительных
клинических данных должно насторожить сонографиста в отношении ганг-
ренозного холецистита.
70
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.13. Поперечное ультразвуковое изображение желчного пузыря, имеющего
толстую стенку, содержащего в своем просвете камень и сгустки желчи.
УЗИ играет значительную роль при обследовании больных с острой бо-
лью в животе. Возможность визуализировать желчный пузырь и определить
наличие в нем камней и образований, толщину его стенки при исследовании в
реальном времени делает ультрасонографию диагностическим средством вы-
бора в хирургической практике.
Сгустки желчи. Сгустки желчи часто наблюдаются при ее застое и при УЗИ
определяются как слабоинтенсивные слоистые образования, не дающие аку-
ЖЕЛЧНЫЙ ПУЗЫРЬ
71
Рис. 3.14. Продольное ультразвуковое изображение желчного пузыря с низкоинтенсивными
эхопозитивными включениями, представляющими собой сгустки желчи.
стической тени. Чаще всего такие сгустки обнаруживаются без наличия до-
полнительных симптомов в глубоких областях желчного пузыря. Слабоин-
тенсивные включения представляют собой частицы, состоящие из кристал-
лов холестерола и/или гранул желчных солей кальция, взвешенных в желчи
[29, 32] (рис. 3.14).
Сгустки желчи следует дифференцировать от опухоли желчного пузыря
путем помещения больного в положение на боку, при котором сгустки под
действием силы тяжести будут перемещаться в наиболее глубоко располо-
женную часть желчного пузыря. Скорость этого перемещения может со-
ставлять от нескольких секунд до нескольких минут в зависимости от плот-
ности сгустков. Если плотные сгустки заполняют весь просвет желчного пу-
72
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
зыря, он визуализируется с трудом. Иногда желчный пузырь неотличим по
эхоплотности от паренхимы печени.
Опухолевидные сгустки (сгустки шаровидной формы) могут определять-
ся в желчном пузыре как небольшие образования. И в этом случае, для того
чтобы отличить шаровидные сгустки от опухоли, лучше переместить боль-
ного из положения на спине в положение на левом боку [32, 33].
Перихолецистит. Признаком перихолецистита обычно является наличие
анэхогенной зоны вокруг желчного пузыря. При этом между печенью и желч-
ным пузырем определяется слой эхонегативной жидкости, что может быть
выявлено как при продольном, так и при поперечном сканировании. Утол-
щенная, отечная стенка желчного пузыря также может быть гипоэхогенной и
на отдельных участках сливается с изображением перипузырной жидкости.
Перихолецистит может наблюдаться как при простом остром, так и при
гангренозном холецистите в результате перфорации стенки желчного пузы-
ря и/или формирования абсцесса. Нельзя путать анэхогенное содержимое
двенадцатиперстной кишки с перипузырной жидкостью. Наличие перипу-
зырной жидкости можно легко исключить путем наблюдения за перемеще-
нием жидкости в просвете двенадцатиперстной кишки при неподвижном
датчике.
На рис. 3.15 представлено ультразвуковое изображение желчного пузы-
ря при поперечном сканировании. Сонографист должен исследовать стенку
желчного пузыря, особенно тот ее участок, который прилежит к печени. В
норме стенка желчного пузыря выглядит как тонкая эхооднородная поло-
ска, прилежащая к паренхиме печени. Анэхогенная полоска между печенью
и желчным пузырем свидетельствует о наличии перипузырной жидкости.
Сокращенный желчный пузырь. В случаях, когда желчный пузырь нато-
щак не визуализируется, а холецистэктомия у больного не выполнялась, не-
обходимо провести тщательное повторное сканирование в области подребе-
рья. Если желчный пузырь не визуализируется после 8-часового голодания,
это с высокой вероятностью указывает на заболевание желчного пузыря.
Если желчный пузырь содержит камни или сокращен, сонографист не смо-
жет получить обычное изображение анэхогенного желчного пузыря округ-
лой формы. Для обозначения признаков сокращенного желчного пузыря ис-
пользуют аббревиатуру СГТ (35-37). На ультразвуковом изображении опреде-
ляется стенка желчного пузыря (С), линейная гиперэхогенная дугообразная
зона отражения ультразвука от камня (Г) и акустическая тень (Т) (рис. 3.16).
Для подтверждения диагноза с помощью этих признаков предложите паци-
енту переместиться из положения на спине на левый бок. Этот прием помога-
ет отличить изображение сокращенного желчного пузыря от изображения
двенадцатиперстной кишки, дающей акустическую тень. При сокращенном
желчном пузыре изменение положения тела пациента не окажет влияния на
указанные выше сонографические признаки.
ЖЕЛЧНЫЙ ПУЗЫРЬ
73
Рис. 3.15. Перипузырная жидкость выявляется в виде анэхогенной полоски,
прилежащей к желчному пузырю
Полипы. При У^И полипы определяются как очаговые округлые образова-
ния средней эхоплотности, исходящие из стенки желчного пузыря. Полипы
могут быть единичными или множественными, их размер обычно составляет
2-3 мм, иногда они могут быть ошибочно приняты за камни. Полипы не дают
акустической тени и не перекатываются в глубокие области желчного пузыря
при изменении положения тела больного. Любые диагностические сомнения
относительно наличия полипов или камней могут быть легко преодолены при
использовании ультразвуковых критериев, характерных для конкрементов.
74
3. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВВДЕНИЯ
Рис. 3.16. Ультразвуковые признаки СГТ при сокращенном желчном пузыре,
содержащем камень.
Рак желчного пузыря. При исследовании желчного пузыря следует отли-
чать диффузное утолщение стенки органа от ее локального неравномерного
утолщения, поскольку последний признак может быть ранним симптомом
развивающейся в желчном пузыре опухоли. Первичные опухоли желчного
пузыря часто определяются как солидные полиповидные образования, исхо-
дящие из стенки органа, или как большие гетерогенные образования, выпол-
няющие большую часть просвета желчного пузыря [38-47]. Опухоли, полно-
ЖЕЛЧНЫЙ ПУЗЫРЬ
75
стью заполняющие просвет, могут вызвать затруднения при УЗИ желчного
пузыря, поскольку орган может быть ошибочно принят за гетерогенное обра-
зование печени. В результате исследований было установлено, что карцино-
ма желчного пузыря в большинстве случаев (70-90 %) сочетается с его каль-
кулезом, а случаи сочетания с изъязвлениями слизистой оболочки являются
чрезвычайно редкими [48,49]. Для оценки возможной инвазии опухоли дол-
жен быть тщательно исследован прилегающий к желчному пузырю участок
паренхимы печени. Необходимо также оценить состояние желчных протоков
и ветвей воротной вены, а для выявления регионарного метастазирования
опухоли — исследовать зоны вероятного увеличения лимфатических узлов.
Для оценки возможности хирургического лечения, выявления небольших
внутрибрюшных образований и определения увеличения лимфоузлов необ-
ходимо выполнение компьютерной томографии органов брюшной полости и
малого таза.
При раке желчного пузыря могут наблюдаться такие же симптомы, как
при холецистите или холелитиазе. К сожалению, заболевание часто проте-
кает бессимптомно до тех пор, пока опухоль не распространится на весь ор-
ган. После установки диагноза прогноз обычно плохой.
Диагностические трудности при исследовании желчного пузыря
Двенадцатиперстная кишка или желчные камни? Расположение две-
надцатиперстной кишки в непосредственной близости от желчного пузыря
может вызывать затруднения при интерпретации сонографических данных.
Газ, содержащийся в просвете двенадцатиперстной кишки, препятствует
проникновению ультразвукового луча, создавая акустические тени; это явле-
ние может наблюдаться при прилежании к кишке задней стенки желчного пу-
зыря. Более того, отражение звука от пузырьков газа часто приводит к появ-
лению эхогенных зон, которые могут быть ошибочно приняты за небольшие
камни.
Для устранения путаницы и предотвращения возможных ошибок необ-
ходимо проводить сканирование в двух плоскостях (продольной и попереч-
ной), а также перемещать больного из положения на спине в положение на
левом боку. При диагностике желчных камней учитывайте все критерии,
включающие в себя наличие эхогенных образований и акустической тени, а
также смещение камней при изменении положения тела пациента. Эти при-
знаки позволяют уверенно отличить изображение желчного пузыря от изоб-
ражения двенадцатиперстной кишки.
Тени. Акустические тени нередко обусловлены конкрементами, однако на-
личие затенения может быть вызвано и другими факторами. Во время уль гра-
звукового сканирования органов брюшной полости затенение возникает при
отражении звука от камней, костей (ребер), газа (в просвете желудка, в две-
надцатиперстной кишке, тонкой кишке) и других артефактов.
76 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Конкременты желчного пузыря выглядят как эхогенные образования,
дающие позади себя акустическую тень. Затенение возникает в результате
различной акустической плотности желчи и камня, находящегося в желч-
ном пузыре. Кости и кальцификаты также могут образовывать интенсивные
акустические тени вследствие разницы акустической плотности между
ними и окружающими их тканями. Поскольку газ плохо проводит звук, на-
ходясь в просвете желудка, двенадцатиперстной кишки или кишечника, он
также вызывает образование акустической тени.
Тени, вызываемые конкрементами, обычно являются анэхогенными (чер-
ными) с четко отграниченным краем: такие тени клиницисты называют «чис-
тыми». Тень, возникшая в результате отражения звука от газа, обычно не
имеет четких контуров и часто не полностью анэхогенная. Такие тени назы-
вают «нечистыми».
На рис. 3.17 показаны четко выраженные тени. Две тени расположены
позади желчных камней; еще одна тень образуется от края стенки желчного
пузыря, эта тень представляет собой краевой артефакт. Как он образуется?
Когда ультразвуковой луч попадает на объект со сглаженной, закругленной
поверхностью, он может отражаться с образованием краевой артефактной
тени [50]. При оценке ультразвуковых изображений, содержащих тени, не-
обходимо прослеживать их на всем протяжении. Это позволяет врачу опре-
делить происхождение тени; помогает уменьшить число ошибочных иден-
тификаций камней, ребер, дуоденального газа или краевых артефактов и поста-
вить диагноз более уверенно. Опытный сонографист может быстро определить
причину затенения и поставить с помощью УЗИ обоснованный и окончатель-
ный диагноз
Билиарная система
Несмотря на то, что желчные протоки, проходя через печень, идут вдоль во-
ротной вены, они при УЗИ обычно не видны. Внепеченочная часть билиар-
ной системы состоит из правого и левого печеночных протоков, общего пече-
ночного протока, пузырного протока, общего желчного протока и протока
желчного пузыря. Правый и левый печеночные протоки, выйдя из печени, в
области ворот образуют общий печеночный проток. Пузырный проток отхо-
дит от шейки желчного пузыря, после его соединения с общим печеночным
протоком образуется общий желчный проток. Общий желчный проток про-
ходит позади двенадцатиперстной кишки к головке поджелудочной железы и
открывается в нисходящей части двенадцатиперстной кишки в ампулу фате-
рова соска (рис. 13.18).
Ультрасонографический вид билиарного тракта. При обычном УЗИ
неизмененные внутрипеченочные желчные протоки трудно выявить из-за
слишком малых размеров. Расширенные внутрипеченочные желчные прото-
желчный пузырь
77
КРАЕВОЙ
АРТЕФАКТ
ЖЕЛЧНЫЙ
ПУЗЫРЬ
ВОРОТНАЯ
ВЕНА
КАМЕНЬ
|-АКУСТИЧЕСКАЯ
ТЕНЬ
Рис. 3.17. Аккустические тени на узображении желчного пузыря обычно вызваны
камнями. Обратите внимание на тень краевого артефакта.
ки, однако, выглядят как анэхогенные тубулярные структуры, прилежащие к
венам воротной системы. Такой своеобразный вид обусловлен близким рас-
положением ветвей воротной вены и желчных протоков при их прохождении
в печеночной паренхиме.
При сканировании в поперечной плоскости неизмененная левая ветвь
воротной вены выглядит как одиночная вертикальная тубулярная структу-
ра, напоминающая букву Т или I. При расширении внутрипеченочных желч-
78
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.18. Желчный пузырь и желчные протоки.
ных протоков вдоль левой ветви воротной вены можно увидеть похожую на
нее тубулярную структуру. Это явление описывают как симптом параллель-
ных каналов или признак того, что «трубок слишком много» (рис. 3.19).
При УЗИ желчного пузыря врач может оценить большую часть внепече-
ночного билиарного тракта, за исключением нормального пузырного прото-
ка, который расположен между желчным пузырем и общим желчным прото-
ком. Несмотря на внепеченочное расположение этого протока, у большинства
пациентов он визуализируется с трудом. При сканировании в продольной пло-
скости общий печеночный проток выглядит как тубулярная структура, про-
ходящая кпереди от воротной вены, он может быть легко визуализирован и
измерен у большинства пациентов. Благодаря совершенствованию техноло-
гий УЗИ сегодняшние электронные датчики позволяют врачу легко увидеть
неизмененный обший печеночный проток в большинстве случаев.
При измерении просвета желчного протока неодходимо всегда изме-
рять расстояние от внутреннего края одной его стенки до внутреннего края
другой, если вы хотите получить точный размер просвета протока. Посколь-
ку общий печеночный проток располагается кпереди от воротной вены, имею-
щей округлое сечение с четкими контурами, он является важным ультразвуке-
ЖЕЛЧНЫЙ ПУЗЫРЬ
79
Рис. 3.19. Расширение внутрипеченочных желчных протоков на уровне левой ветви
воротной вены.
вым ориентиром при диагностическом поиске у больных с болями в правом
подреберье (рис. 3.20).
При УЗИ нелегко обнаружить место, где общий печеночный проток пе-
реходит в общий желчный. Часть протока, расположенного кпереди от пра-
вой ветви воротной вены, обычно обозначают как общий печеночный про-
ток. Общий желчный проток врачи определяют как дистальную часть тубуляр-
ной структуры, проходящую в головке поджелудочной железы. Способность
80
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.20. А — Общий печеночный проток определяется как тубулярная структура
расположенная кпереди от воротной вены. Б — измерение просвета общего
печеночного протока проводится от внутреннего края одной стенки до внутреннего
края другой (пунктирная линия). В — Классический вид общего печеночного протока,
необходимый для измерения его просвета.
визуализировать общий печеночный проток в руках опытного специалиста
становится важным диагностическим инструментом. Почему? Потому, что
эта тубулярная структура является классическим ориентиром для выявле-
ния дилятации внепеченочной части билиарного тракта. Расширение гепа-
тикохоледоха обычно наступает раньше, чем расширение внутрипеченоч-
ЖЕЛЧНЫЙ ПУЗЫРЬ
81
Б
Рис. 3.20. (Продолжение.)
ной части билиарного тракта, что легко обнаружить при измерении ширины
этого протока. УЗИ является важным диагностическим инструментом при
обследовании больных с желтухой [51 -54], поскольку помогает врачу легко
установить наличие билиарной гипертензии. Если при УЗИ определяется
расширение общего желчного протока, необходимо установить уровень и
причину обструкции. Laing с соавторами [55] выделяют следующие уровни
6 Ультразвуковая диагностика...
82 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ. ОСНОВНЫЕ СВЕДЕ11ИЯ
обструкции: панкреатический, супрапанкреатический и обструкцию в воро-
тах печени. Расширение общего печеночного протока или более проксималь-
ной части билиарного тракта происходит при блокаде на уровне ворот пече-
ни. Расширение гепатикохоледоха между воротами печени и поджелудоч-
ной железой обозначается как супрапанкреатическое. Дилятация части
протока, проходящей в поджелудочной железе, определяется как интрапан-
креатический уровень обструкции. Наиболее часто обструкция наблюдается
на уровне головки поджелудочной железы, что приводит к расширению вне-
печеночной части билиарного тракта [55]. Частыми причинами дистальной
обструкции являются холедохолитиаз, стриктуры протока, хронический
панкреатит и злокачественные новообразования.
Первоначально сонографический вид нескольких желчных протоков,
как внутри-, так и внепеченочных, может смутить врача. Расширение дисталь-
ной части билиарного тракта помогает отличить расширенные желчные
протоки от ветвей воротной вены [56]
При сканировании в поперечной плоскости можно визуализировать толь-
ко одну тубулярную структуру, входящую в ворота печени, — воротную
вену. При обструкции гепатикохоледоха может визуализироваться две та-
ких структуры, передняя из них представляет собой расширенный общий
желчный проток (рис. 3.21).
Стенки расширенных внутрипеченочных протоков могут становиться
неровными, приводя к образованию извилистых, по сравнению с ветвями
воротной вены, структур. Нормальные внутрипеченочные протоки обычно
не видны, однако при их расширении они могут визуализироваться даже в
периферических отделах печени. Кзади от расширенных протоков может
определяться акустическое усиление ультразвука.
Использование цветной допплерографии может помочь в дифференци-
ровке расширенного внутрипеченочного желчного протока от расположен-
ной рядом печеночной артерии [57]. Те тубулярные структуры, которые бу-
дут окрашиваться, являются сосудами. Если предполагается расширение
дистальной части внутрипеченочного билиарного тракта, цветовое картиро-
вание помогает поставить окончательный диагноз.
Измерение желчных протоков. Ультразвуковое сканирование позволяет
врачу наиболее простым способом увидеть неизмененный общепеченочный
и общий желчный протоки. Однако в исследованиях по определению разме-
ров нормальных протоков приводятся различные данные как для общего пе-
ченочного, так и для общего желчного протоков [58-62].
Большинство ультрасонографистов верхним пределом ширины неизме-
ненного общего печеночного протока считают его внутренний диамегр, рав-
ный 4 мм. Диаметр 5—7 мм многими исследователями расценивается как не-
определенная ситуация, возможно, требующая дальнейшего наблюдения;
внутренний диаметр более 8 мм признан как показатель расширения протока.
ЖЕЛЧНЫЙ ПУЗЫРЬ
83
Рис. 3.21. Симптом двух цилиндров («двустволки»), В норме, при поперечном
сканировании печени в области ворот определяется только одна тубулярная
структура (воротная вена), тубулярная структура, расположенная кпереди, является
расширенным общим печеночным протоком.
84
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВВДЕНИЯ
Стандартное ультразвуковое измерение общего печеночного протока
проводится от одного его внутреннего края до другого в наиболее широкой
части в месте прохождения кпереди от правой ветви воротной вены (рис.
3 20). При измерении просвета общего печеночного протока нельзя путать
его с просветом шейки желчного пузыря [63]. Вероятность ложноположитель-
ного диагноза расширения внепеченочной части билиарного тракта может
быть снижена при полипозиционном сканировании в разных положениях
пациента. Клиницистам не ясен вопрос о влиянии возрастных изменений на
размер общего печеночного протока [64], однако увеличение гепатикохоле-
доха часто описываю! как изменения, связанные с возрастом, когда обнару-
живают его беспричинное увеличение у пожилых пациентов. Установлено,
что увеличение ширины протока может быть связано со снижением элас-
тичности его стенки или с длительно существовавшей, но разрешившейся к
настоящему времени частичной обструкцией. В литературе такой увеличен-
ный проток часто описывают как «вялый».
Другими исследователями изучена связь между расширением гепатико-
холедоха и холецистэктомией [66-69]. Авторами обсуждалась возможность
расширения протока в отсутствие обструкции вследствие того, что он вы-
полняет функцию резервуара для желчи. Другие исследования были посвя-
щены влиянию длительной дистальной обструкции на эластичность стенки
протока. Кроме этого, ставится вопрос о непосредственном влиянии холеци-
стэктомии на размер гепатикохоледоха.
Установлено [65], что диаметр гепатикохоледоха у больных с неослож-
ненной желчекаменной болезнью остается постоянным, если желчный пу-
зырь не удален или несколько увеличивается после холецистэктомии. У боль-
ных с осложненным билиарным калькулезом диаметр гепатикохоледоха не
изменяется или уменьшается.
Размер общего желчного протока и употребление жирной пищи. Если
размер общего желчного протока вызывает сомнения, а его дистальная часть
не может быть визуализирована, возникает вопрос о наличии дистальной об-
струкции. Расположение протока за двенадцатиперстной кишкой может пре-
пятствовать визуализации его ретродуоденальной части. Газ, находящийся в
просвете двенадцатиперстной кишки, приводит к плохому проведению ульт-
развука, вызывает образование нечетких теней, закрывающих дистальную
часть протока. Если дистальная часть протока при положении больного на
спине не визуализирована, пациент должен быть перемещен на левый бок.
После этого дистальная часть протока сканируется в поперечной плоскости.
Это помогает визуализировать панкреатическую часть протока.
Помощь в определении возможной дистальной обструкции может ока-
зать прием пациентом жирной пищи, что приведет к сокращению желчного
пузыря и поступлению дополнительной порции желчи в общий желчный
проток. Повторное исследование необходимо провести через 45 минут пос-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
85
ле приема пищи; если диаметр протока увеличился, можно подозревать на-
личие дистальной обструкции. Диаметр нормального протока не будет ме-
няться или несколько уменьшится [70, 73].
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
Несмотря на то, что для получения изображения и постановки диагноза пре-
дусмотрены различные протоколы, в каждом случае для подтверждения диа-
гноза существует минимально необходимый набор изображений.
В отделениях ультразвуковой диагностики во время обычного УЗИ про-
водится детальное сканирование органов брюшной полости. Такой значитель-
ный набор данных помогает сонографисту установить правильный диагноз.
Область интереса хирурга и сонографиста, а также используемые ими про-
токолы исследования различны. Хирург использует ультразвук для целево-
го исследования или сканирования одного органа у больного с определен-
ными симптомами. Несмотря на то, что для подтверждения диагноза необ-
ходим специфический набор изображений, строго определенных правил для
проведения УЗИ не существует. Однако, поскольку протоколы все же име-
ются, хирурги должны придерживаться их в каждом случае исследования.
Это необходимо не только в период обучения, но и при эффективном поиске
основных анатомических структур.
Для проведения УЗИ в определенной последовательности хирург дол-
жен хорошо знать секционную анатомию и при сканировании брюшной по-
лости должен понимать, как один анатомический срез связан с другим. Во-
образите себе пятый этаж десятиэтажного здания. Если вам нужно попасть в
подвал, куда вы направите лифт — вверх или вниз? Это, конечно, простой
вопрос: лифт необходимо направить вниз. Если нужно попасть на крышу,
вы должны направить лифт вверх. Подобные рассуждения применимы и к
сканированию брюшной полости.
Будем более конкретны. Ультразвуковой датчик помешен на брюшную
стенку пациента для визуализации правой ветви воротной вены в попереч-
ной плоскости; куда вы направите датчик для визуализации печеночных
вен, впадающих в нижнюю полую вену, вверх или вниз? При визуализации
желчного пузыря в поперечной плоскости, для того чтобы увидеть правую
почку, куда вы направите датчик, вверх или вниз? При визуализации левой
ветви воротной вены в поперечной плоскости, для того чтобы увидеть желч-
ный пузырь, куда вы направите датчик, вверх или вниз?
Опытный сонографист может легко ответить на эти вопросы. Остальная
часть этой главы посвящена обсуждению основных ультразвуковых ориен-
тиров, которые могут облегчить хирургу проведение УЗИ брюшной поло-
сти. Для более эффективного совершенствования мастерства совмещайте
чтение этого текста с ультразвуковыми исследованиями в клинике.
86
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.22. Расположение датчика в продольной плоскости вдоль нижнего края правой
реберной дуги для продольного сканирования печени и почки.
Последовательность сканирования желчного пузыря
При обследовании пациента с болью в правом подреберье нередко подозре-
вают заболевание желчного пузыря. Для подтверждения такого диагноза
УЗИ может быть проведено непосредственно в палате. Врач проводит целе-
направленное исследование, стараясь получить ультразвуковые изображе-
ния, подтверждающие первоначальный диагноз.
Перед началом исследования убедитесь, что величина компенсации вре-
менных потерь и общая чувствительность установлены на оптимальном уров-
не. Начните исследование 3,5-МГц секторным или конвексным датчиком
для того, чтобы иметь возможность проведения сканирования как в подре-
берье, так и через межреберные промежутки.
Установите датчик в продольное положение вдоль правого края ребер-
ной дуги так, чтобы можно было визуализировать правый задний сегмент
печени и прилежащую к нему часть правой почки (рис. 3.22). Отрегулируйте
общую чувствительность и уровень компенсации временных потерь таким
образом, чтобы паренхима печени выглядела однородной. Паренхима пра-
вой почки обычно менее эхогенна (несколько темнее), чем печень. Это соот-
ношение эхоплотности указывает на правильность настройки ультразвуко-
вого аппарата для выполнения исследования.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
87
Рис. 3.23. Расположение конвексного датчика в поперечной плоскости сразу ниже
мечевидного отростка.
Я всегда произвожу быстрый обзор области правого подреберья для по-
лучения общего представления о состоянии органов. На это требуется около
одной минуты, при этом число заболеваний для дифференциальной диагно-
стики быстро уменьшается.
Поместите датчик в поперечное положение сразу ниже мечевидного от-
ростка (рис. 3.23). Попросите пациента задержать дыхание на высоте вдоха,
при этом печень сместится вниз и перестанет смещаться при дыхательных
движениях. Чтобы увидеть верхнюю часть печени, немного отклоните дат-
чик в цефалическом направлении. Визуализируйте печеночные вены, впада-
ющие в нижнюю полую вену (рис. 3.24). Только при направленном в сторо-
ну верхней части печени и расположенном в поперечной плоскости датчике
можно увидеть эту анатомическую область. Такой прием помогает увидеть
очаговые образования в верхних сегментах печени.
Затем немного переместите датчик в каудальном направлении. Вы должны
увидеть левую ветвь воротной вены. Она визуализируется как вертикальная
анэхогенная тубулярная структура, напоминающая букву Т или I. Этот ана-
томический ориентир помогает определить расширение внутрипеченочных
желчных протоков (рис. 3.25).
При сканировании левой ветви воротной вены не должны выявляться
другие тубулярные структуры. Наличие в этой области дополнительных ту-
булярных структур указывает на расширение внутрипеченочных желчных
88
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.24. Ультразвуковое изображение печеночных вен, впадающих в нижнюю полую
вену при поперечном сканировании.
протоков; такой признак называют симптомом «лишних стволов» или симп-
томом «параллельных каналов» (рис. 3.19). Отличить левую ветвь воротной
вены от многочисленных расширенных желчных протоков часто невозмож-
но, и обычно в этом нет необходимости. Внимание должно быть сосредото-
чено на распознавании дилатации внутрипеченочной части билиарного
тракта. Отличить расширенные желчные протоки от печеночной артерии
можно при помощи цветовой допплерографии.
Продолжайте перемещать датчик в каудальном направлении вдоль ре-
берного края (рис. 3.26). Следующим большим ориентиром будет место
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
89
Рис. 3.25. Левая ветвь воротной вены при поперечном сканировании похожа на букву
Т или I
вхождения воротной вены в печень (рис. 3.27). Визуализация этого ориенти-
ра помогает выявить расширение внепеченочных желчных путей. Обычно
при сканировании в поперечной плоскости в печень входит только одна
большая тубулярная структура (воротная вена). Визуализация двух тубу-
лярных структур указывает на расширение внепеченочной части билиар-
ного тракта (рис. 3.21); это называют симптомом двух цилиндров или
«двустволки» [53, 54].
Продолжайте перемещать датчик вдоль реберного края в каудальном
направлении до визуализации желчного пузыря. Поперечный срез желчного
90
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.26. Поперечное положение конвексного датчика в подреберье для
визуализации воротной вены в месте ее входа в печень (наилучшее положение для
выявления расширения внепеченочной части билиарного тракта).
пузыря выглядит как анэхогенная структура округлой формы, расположен-
ная сразу ниже уровня воротной вены. При сканировании желчного пузыря
может быть выявлено наличие камней или утолщение его стенки (рис. 3.13).
После перемещения датчика вдоль края реберной дуги ниже проекции
желчного пузыря визуализируется правый задний сегмент печени. В шкале
серого неизмененный правый задний сегмент должен выглядеть однород-
ным и не содержать очаговых образований.
Продолжайте перемещать датчик в каудальном направлении, сканируя
правый задний сегмент печени (рис. 3.20). Следующей структурой может быть
верхний полюс правой почки, расположенный позади печени (рис. 3.29). Про-
должайте перемещать датчик вниз до исчезновения изображения нижнего
полюса правой почки.
Теперь вернитесь к мечевидному отростку и проведите сканирование в
продольной плоскости. Попросите пациента задержать дыхание после глу-
бокого вдоха, а затем медленно перемещайте датчик в каудальном направ-
лении вдоль реберного края до тех пор, пока можно наблюдать печень.
Осмотрите левую и правую доли печени, хвостатую долю, аорту и нижнюю
полую вену. Продолжайте сканирование до перемещения датчика за печень
и правую почку.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
91
Рис. 3.27. Поперечный срез неизмененной воротной вены.
После завершения обзорного сканирования проведите тщательное ис-
следование желчного пузыря. Этот орган расположен приблизительно на
том же уровне, что и локоть пациента при его положении на спине. При
сканировании желчного пузыря в продольной плоскости он выглядит как
анэхогенная структура овальной формы, сужающаяся в виде конуса в облас-
ти шейки.
92
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВВДЕНИЯ
Рис. 3.28. При поперечном положении конвексного датчика визуализируется правый
задний сегмент печени и верхний полюс правой почки.
При положении пациента лежа на спине попросите его сделать глубо-
кий вдох и задержать дыхание. Медленно просканируйте желчный пузырь в
поперечной плоскости (рис. 3.11 и 3.30). Тщательно исследуйте толщину
стенки желчного пузыря, определите наличие или отсутствие конкрементов,
а также перипузырной жидкости. Сканируйте желчный пузырь до получе-
ния уверенной оценки его состояния. Не теряя контакта датчика с кожей па-
циента, медленно поверните его для поперечного сканирования.
При повороте датчика старайтесь сохранить четкую визуализацию желч-
ного пузыря. Это помогает видеть в поперечной плоскости именно желчный
пузырь, а не смежные с ним структуры. Такой прием к тому же помогает
уменьшить число непонятных ситуаций (для неопытного сонографиста мно-
гие структуры в брюшной полости, включая нижнюю полую вену, аорту и
двенадцатиперстную кишку, кажутся похожими на желчный пузырь).
Последовательно просканируйте желчный пузырь в поперечной плос-
кости, перемещая датчик в каудальном направлении. Сканирование должно
продолжаться до получения уверенного представления о состоянии желчно-
го пузыря. Обратите внимание на то, находится ли пациент натощак.
Далее пациент должен лечь на левый бок. Это может привести к смеще-
нию камней в сторону дна желчного пузыря, которое в таком положении
становится самой глубокой частью органа. Перемещение пациента в поло-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
93
Рис. 3.29. Поперечный срез правого заднего сегмента печени и верхнего полюса
правой почки.
94
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.30. Положение датчика в правом подреберье для визуализации желчного
пузыря в продольной плоскости.
жение на бок важно, поскольку небольшие камни могут скрываться в шейке
желчного пузыря и при положении на спине их нелегко заметить. Этот при-
ем помогает также определить, является ли камень, находящийся в положе-
нии больного на спине в шейке желчного пузыря, неподвижным. Если ка-
мень перемещается, он не является «вколоченным». Остается исследовать и
измерить все выявленные камни.
Измерение общего печеночного протока
После завершения сканирования желчного пузыря найдите общий печеноч-
ный проток (рис. 3.20). Его легко визуализировать при положении пациента
на боку под углом 45° (правая сторона тела приподнята и находится посере-
дине между положением на спине и полным поворотом на левый бок). При
измерении общего печеночного протока начинающий исследователь легко
обнаружит воротную вену в месте ее входа в печень при поперечном сканиро-
вании. Датчик располагается посередине правой реберной дуги (рис. 3.31 А).
Попросите пациента сделать глубокий вдох и задержать дыхание. При
изменении плоскости сканирования от поперечной к продольной (рис. 3.31 Б)
продольный вид воротной вены будет изменяться на изображение в виде
структуры округлой формы. Небольшая тубулярная структура, визуализи-
руемая кпереди от поперечного сечения воротной вены, является общим пе-
ченочным протоком (рис. 3.20 В).
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
95
Рис. 3.31. А. Визуализируйте воротную вену в поперечной плоскости при положении
пациента на левом боку под углом 45°, расположив датчик в подреберье
Б. Поверните датчик для сканирования в продольной плоскости без потери его
контакта с кожей пациента и при непрерывной визуализации воротной вены.
96 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Неопытный сонографист при визуализации воротной вены должен по-
лагаться именно на поперечное сканирование по двум причинам. Во-пер-
вых, обычно в печень на этом уровне входит только одна крупная тубуляр-
ная структура — воротная вена. Во-вторых, это важно для правильной и бы-
строй координации движений при наличии каких-либо изменений в этой
области. Поворот датчика из поперечного положения в продольное должен
осуществляться без потери изображения воротной вены, а также при посто-
янном контакте датчика с кожей пациента.
Для получения точных данных о диаметре общего печеночного протока
измерение должно проводиться от внутреннего края одной стенки до внут-
реннего края другой. У большинства пациентов диаметр общего желчного
протока составляет 4 мм или меньше.
Минимальный набор изображений при исследовании желчного
пузыря и желчных протоков
1. Вид желчного пузыря при поперечном и продольном сканировании в
положении пациента на спине и на левом боку.
2. Вид общего печеночного протока при продольном сканировании с
измерением его внутреннего диаметра.
3. Вид воротной вены при поперечном сканировании.
4. Основной ствол или правая ветвь воротной вены при поперечном ска-
нировании.
Дополнительный набор изображений при исследовании желчного
пузыря и желчных протоков
1. Вид печеночных вен, впадающих в нижнюю полую вену, при попе-
речном сканировании.
2. Вид поджелудочной железы при поперечном сканировании.
3. Вид печени и почки при продольном сканировании.
Поджелудочная железа
Остановимся подробнее на сосудистых структурах, расположенных в облас-
ти сканирования поджелудочной железы. Эти структуры используются как
ориентиры во время исследования органа.
Ультразвуковой вид. Неизмененная поджелудочная железа имеет одно-
родную ультразвуковую плотность, которая несколько выше эхоплотности
печени [74,83]. При исследовании поджелудочной железы в реальном време-
ни клиницист легко может сравнить ее эхоплотность с эхоплотностью левой
доли печени Ткань поджелудочной железы может казаться плохо различи-
мой на черно-белом изображении, что делает трудным ее выявление неопыт-
ным сонографистом. Хорошее знание окружающих поджелудочную железу
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
97
Рис. 3.32. А. Головка поджелудочной железы огибается двенадцатиперстной кишкой,
хвост поджелудочной железы достигает ворот селезенки. Б. При визуализации
головки поджелудочной железы сзади видно место слияния верхней брыжеечной
вены (а) и селезеночной вены (б), в результате чего формируется воротная вена (в).
сосудов упрощает решение этой задачи. Поджелудочная железа сканируется
как в поперечной, так и в продольной плоскостях, однако для начинающего
сонографиста наиболее подходящим является исследование органа именно в
поперечной плоскости.
7 Ультразвуковая диагностика...
98
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.33. Поперечный вид поджелудочной железы и окружающих ее сосудов.
При поперечном расположении датчика ниже мечевидного отростка се-
лезеночная вена определяется как анэхогенная, горизонтально расположен-
ная, изогнутая тубулярная структура (рис. 3.33). Позади селезеночной вены
имеется небольшой анэхогенный кружок, являющийся изображением попе-
речного среза верхней брыжеечной артерии. Позади этой артерии имеется
больший анэхогенный круг, являющийся изображением поперечного среза
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
99
абдоминальной аорты. Эти структуры являются ориентирами для обнаруже-
ния поджелудочной железы при сканировании в поперечной плоскости.
Поджелудочная железа расположена кпереди от селезеночной вены.
В этой области может быть визуализировано множество других сосуди-
стых структур. Кпереди от аорты и позади верхней брыжеечной артерии мо-
жет визуализироваться левая печеночная вена. К головке поджелудочной
железы прилежат два небольших анэхогенных кружка. Передний из них яв-
ляется изображением гастродуоденальной артерии, задний — дистальной
частью общего желчного протока. Вначале обнаружение поджелудочной
железы при продольном сканировании кажется трудным. Расположите дат-
чик в продольном положении справа от срединной линии и затем визуализи-
руйте нижнюю полую вену; она будет выглядеть как длинная анэхогенная
тубулярная структура. Головка поджелудочной железы лежит кпереди от
нижней полой вены, располагаясь на уровне между воротной веной (распо-
ложена сверху) и двенадцатиперстной кишкой (расположена снизу). Такое
изображение является идеальным для исследования паренхимы поджелу-
дочной железы. Увеличенная головка поджелудочной железы должна вы-
глядеть как вдавление в нижнюю полую вену.
При смещении датчика в сторону срединной линии можно увидеть верх-
нюю брыжеечную вену (анэхогенная тубулярная структура), соединяющую-
ся с селезеночной и воротной венами (анэхогенная тубулярная структура).
Эти структуры являются ориентирами, позволяющими отличить головку и
тело поджелудочной железы друг от друга.
При положении датчика за средней линией визуализируется продоль-
ное сечение аорты. Тело поджелудочной железы лежит кпереди от аорты,
располагаясь между селезеночной веной и желудком (рис. 3.34).
Панкреатический проток. Развитие ультразвуковых технологий позволя-
ет визуализировать панкреатический проток (вирсунгов проток) и измерить
его в большинстве случаев даже при отсутствии его расширения, если паци-
ент не страдает ожирением. Эта структура может быть визуализирована лег-
че в теле поджелудочной железы, чем в головке или хвостовой части органа,
поскольку в теле проток располагается перпендикулярнее к ультразвуковому
пучку. Это обстоятельство создает хорошие условия для акустической визуа-
лизации, в то время как в головке поджелудочной железы проток располага-
ется в искривленном положении.
Тень от газа, находяшегося в просвете двенадцатиперстной кишки, мо-
жет затруднять визуализацию головки поджелудочной железы. Хвост под-
желудочной железы может быть скрыт за тенью от газа, находяшегося в же-
лудке или селезеночном изгибе толстой кишки. При визуализации панкреа-
тического протока его диаметр считается неизмененным, если эта величина
не превышает двух миллиметров.
100
3. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ОСНОВНЫЕ СВЕДЕНИЯ
ЖЕЛУДОК
ПЕЧЕНЬ
ПОДЖЕЛУДОЧНАЯ
ЖЕЛЕЗА
АОРТА
ЧРЕВНЫЙ
СТВОЛ
ЛЕВАЯ ПОЧЕЧНАЯ
ВЕНА
3 01НАЯ
ВЕН
ВЕРХНЯЯ
БРЫЖЕЕЧНАЯ
АРТЕРИЯ
Рис. 3.34. Продольный вид аорты с артериями чревного ствола и верхней
брыжеечной артерией. Тело поджелудочной железы расположено кпереди от аорты.
Осмотрите желудок, как показано на рис. 3.33. Граница со стенкой же-
лудка выглядит как анэхогенная зона. Не спутайте эту структуру с хорошо
заметным панкреатическим протоком. Перед постановкой диагноза тща-
тельно изучите анатомические особенности в двух плоскостях. При визуали-
зации тубулярной структуры, которая может оказаться расширенным панкре-
атическим протоком, помните, что по соседству расположена селезеночная
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
101
Рис. 3.35. Поперечный вид поджелудочной железы с хорошо заметным панкреатическим
протоком.
вена. Обратите внимание на направление ее кривизны. У большинства паци-
ентов изгиб в направлении кпереди указывает на то, что визуализировано
пространство между желудком и поджелудочной железой [89].
Поперечное изображение поджелудочной железы, показанное на рис. 3.35,
содержит анэхогенную тубулярную структуру диаметром более двух мил-
лиметров. Это — пример хорошо заметного панкреатического протока. Обра-
тите внимание на отсутствие выраженного изгиба кпереди задней стенки
желудка, а также на горизонтальное расположение этой структуры и ее из-
гиб кзади.
102 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Причиной расширения панкреатического протока, определяемого при
УЗИ, может быть небольшая обтурирующая опухоль на уровне ампулы фа-
терова соска — структуры, которую не всегда можно увидеть. Это новооб-
разование может быть не распознано у пациента с желтухой даже очень
опытным сонографистом. В этих обстоятельствах выявление расширения
панкреатического протока является веским основанием для предположения
о том, что опухоль, которая вызвала обструкцию, просто не видна.
Иногда поджелудочную железу трудно визуализировать; чтобы улуч-
шить условия прохождения ультразвука, попросите пациента выпить стакан
воды. Вода в желудке создает акустическое окно, которое улучшает условия
визуализации поджелудочной железы. Для получения акустического окна,
позволяющего наилучшим образом визуализировать поджелудочную желе-
зу, сонографист должен попросить пациента сесть или повернуться на бок
[90, 92].
Острый панкреатит. Несмотря на все разнообразие форм острого панкре-
атита, можно выделить легкую или тяжелую его форму. Первая возникает
при минимальном нарушении функции органа, заболевание быстро регрес-
сирует при правильном консервативном лечении. Тяжелая форма острого
панкреатита проявляется более выраженными клиническими признаками и
отклонениями лабораторных показателей.
Ультразвуковое изображение часто неправильно отражает степень вы-
раженности заболевания при легкой форме панкреатита. В случае невыра-
женного воспаления поджелудочная железа при УЗИ часто выглядит нормаль-
ной. У больных с более выраженным приступом острого панкреатита опре-
деляется увеличенная отечная поджелудочная железа, эхоплотность которой
ниже, чем в норме [93, 98] (рис. 3.36). Чтобы определить, является ли эхоп-
лотность поджелудочной железы нормальной, сравните ее с эхогшотностью
левой доли печени. Нормальная поджелудочная железа имеет несколько бо-
льшую эхоплотность, чем печень.
Хронический панкреатит. При хроническом панкреатите эхогенность
поджелудочной железы может быть значительно большей (она выглядит
ярче), чем эхогенность неизмененной печени (рис. 3.37). Кроме этого, подже-
лудочная железа может выглядеть гетерогенной с зонами некротических из-
менений и множественными кальцификатами. Панкреатический проток ино-
гда расширен, могут определяться псевдокисты [99,100]. В отдельных случа-
ях выявить хронический панкреатит трудно. Зоны кальцификации и
неравномерного изменения эхоплотности препятствуют визуализации орга-
на, при этом эхогенность измененной поджелудочной железы становится
близкой к эхогенности расположенного рядом газа, дающего акустическую
тень.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
103
104
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.37. Поперечный вид гетерогенной поджелудочной железы, содержащей
эхоплотные кальцификаты при хроническом панкреатите.
Псевдокисты поджелудочной железы. Псевдокисты поджелудочной же-
лезы чаще определяются в виде анэхогенных образований округлой формы с
очень тонкой ровной или неровной оболочкой, дают эффект дорсального
усиления ультразвука различной выраженности и содержат эхогенный дет-
рит, а иногда и перегородки [101, 110]. Псевдокисты чаще всего расположе-
ны в области ложа поджелудочной железы, хотя могут определяться в уда-
ленных местах.
Наличие гетерогенного или анэхогенного образования в области подже-
лудочной железы может навести на мысль о наличии псевдокисты. Однако
эта «находка» может оказаться и неизмененным желудком. Для проверки
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
105
того, чем на самом деле является анэхогенное образование, необходимо
дать пациенту медленно выпить стакан воды. Если в образовании определя-
ется движение жидкости, это указывает на то, что визуализирован желудок.
Если движение жидкости в образовании отсутствует, следует попробовать
найти другое анэхогенное образование в эпигастральной области. Если вновь
найденное образование является желудком, это означает, что первое образо-
вание может быть псевдокистой поджелудочной железы. Поскольку ультра-
сонография является неинвазивным методом исследования, она представля-
ет собой прекрасный инструмент для проведения серии исследований, на-
правленных на выявление псевдокисты и определения эффективной
программы лечения [111]
Карцинома поджелудочной железы. При проведении исследования оце-
нивайте общий размер поджелудочной железы и ее форму, определяйте на-
личие очаговых образований, а также изменение контуров или эхоплотности.
Большинство образований поджелудочной железы при УЗИ являются гипо-
эхогенными с неровными контурами [108,112]. Они обычно располагаются в
головке поджелудочной железы (рис. 3.38). Наличие образования помогает
определить смещение сосудистых структур, прилегающих к головке подже-
лудочной железы. Опухоль, расположенная в хвостовой части поджелудоч-
ной железы, часто видна хуже, поскольку она находится в теневой зоне от
газа, содержащегося в желудке. В качестве акустического окна при сканиро-
вании через межреберья может быть использована селезенка, что помогает
достичь наилучшей визуализации хвостовой части поджелудочной железы.
Сонографист должен оценить, имеется ли расширение панкреатическо-
го и желчного протоков, а также исследовать перипанкреатические области
для выявления увеличенных лимфоузлов. Осмотр печени выявляет наличие
в ней метастазов. Расширение панкреатического протока должно усилить
подозрение о наличии новообразования в головке поджелудочной железы.
При использовании только УЗИ изменения поджелудочной железы, вызван-
ные воспалением, могут быть неотличимы от карциномы органа.
Печень
Печень является природным акустическим окном, сквозь которое можно
увидеть множество структур, таких как правая почка, желчный пузырь, под-
желудочная железа, желчные протоки, проксимальная часть внутренней по-
лой вены и аорта.
Ультразвуковой вид. Неизмененная печень здорового человека при ульт-
развуковом сканировании выглядит гомогенной с равномерной серой окрас-
кой на протяжении всего органа [113,114]. Изменение оттенков серого, опре-
106
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.38. Карцинома головки поджелудочной железы определяется в виде большого
гипоэхогенного образования.
деляющих рисунок паренхимы печени, помогает выявить широкий спектр
заболеваний органа, например жировой гепатоз и новообразования.
Для того чтобы определить, является ли эхогенность печени нормаль-
ной, сравните ее с эхогенностью правой почки. Изображение печени должно
быть немного ярче, чем изображение коркового слоя почки (корковый слой
будет немного более эхогенным). При исследовании печени сонографист
может визуализировать печеночные вены и вены воротной системы. Отли-
МЕТОДИКА ИССЛВДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
107
Рис. 3.39. Поперечный вид воротной и печеночных вен (Обозначения: IVC — нижняя
полая вена; RHV — правая печеночная вена; LHV — левая печеночная вена; MHV —
средняя печеночная вена; LPV — левая долевая ветвь воротной вены; RPV — правая
долевая ветвь воротной вены; MPV — основной ствол воротной вены)
чие воротных вен от печеночных вначале может вызвать затруднение, одна-
ко каждая из них имеет свои особенности [115, 118]. Воротная система со-
стоит из главного ствола и правой и левой ветвей (рис. 3.39). Повышенное
отражение звука от стенки воротных вен делает их эхогенными (яркими)
(рис. 3.27). Печеночные вены представлены правой, средней и левой ветвя-
ми, их стенка обычно неэхогенна. Они впадают в нижнюю полую вену
(рис. 3.24). Кроме этого, печеночные вены проходят между сегментами пе-
чени, в то время как основные ветви воротной системы проходят сквозь сег-
менты печени.
108 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
В первые годы развития серошкальной ультрасонографии ветви ворот-
ной вены описывались как структуры с эхогенными стенками. Печеночные
вены обычно описывались как не отражающие ультразвук или отражающие
его в меньшей степени, чем воротные вены. Слабая степень отражения от
стенки печеночной вены наблюдалась только в случае, когда ультразвуко-
вой луч оказывался перпендикулярен ей.
В исследовании по изучению микроскопических изменений стенок во-
ротных и печеночных вен, проведенном на трех трупах, [119] было установ-
лено, что эхогенное отражение от воротной вены обусловлено неупорядо-
ченным расположением и ориентацией соединительно-тканных волокон в
ее стенке, разнонаправленные волокна вызывают множественное отражение
ультразвукового луча. Волокна в стенке печеночных вен описываются авто-
рами как структуры, располагающиеся параллельно и более компактно, бла-
годаря чему поверхность отражения становится меньше. Для значительного
отражения ультразвукового луча он должен попадать на поверхность, рас-
положенную перпендикулярно к направлению его распространения. При
УЗИ печеночные вены оказываются обычно неперпендикулярными к ультра-
звуковому лучу, поэтому видимого отражения от их стенки не происходит.
Сегментарная анатомия печени. Вены, борозды и связки печени образу-
ют естественные ориентиры для подразделения органа на различные сегмен-
ты и их идентификации [113]. Используя эти структуры в качестве анатоми-
ческих ориентиров, сонографист имеет возможность дать точное анатомиче-
ское описание местоположения образования в печени, что помогает при
планировании лечения в случае, если требуется резекция печени. Важные
сегментарные структуры печени включают в себя: печеночные вены, ветви
воротной вены, венозную связку и серповидную связку.
Печеночные вены легко визуализируются и служат прекрасными есте-
ственными ориентирами для подразделения печени на анатомические сег-
менты. Правая печеночная вена делит правую долю печени на передний и
задний сегменты. Средняя печеночная вена делит печень на правую и левую
доли, левая печеночная вена делит левую долю печени на медиальный и ла-
теральный сегменты (рис. 3.24).
В системе воротной вены выделяют главный ствол, а также его правую
и левую долевые ветви. Наиболее значима для определения сегментов левая
долевая ветвь воротной вены, которая делит левую долю печени на медиаль-
ный и латеральный сегменты.
Борозда, содержащая венозную связку, отделяет хвостатую долю от ле-
вой доли печени; она определяется как проходящая в печени эхогенная ли-
нейная структура. Хвостатая доля является наименьшей долей печени и лег-
ко определяется при продольном сканировании [120]. В продольном срезе
хвостатая доля располагается кзади от борозды венозной связки и кпереди
от нижней полой вены. Серповидная связка (в состав которой входит круг-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ 109
лая связка) делит левую долю печени на медиальный и латеральный сегмен-
ты. При сканировании в поперечной плоскости эта структура часто ошибоч-
но принимается за эхогенное очаговое образование (например, гемангиому,
расположенную в левой доле печени).
Заболевания печени. Ультразвуковой вид неизмененной печени является
гомогенным; для оценки степени эхогенности его можно сравнить с видом
коркового слоя почки. Общее повышение эхоплотности (повышение ярко-
сти) и/или гетерогенный вид паренхимы печени не являются специфически-
ми признаками. Такие изменения могут наблюдаться при широком спектре
заболеваний. Наиболее часто встречаются такие заболевания печени, как жи-
ровой гепатоз, цирроз и опухоли.
Жировая инфильтрация. Жировая инфильтрация печени может быть связа-
на с ожирением, диабетом, злоупотреблением алкоголем, гиперлипидемией,
заболеваниями, сопровождающимися нарушением накопления гликогена,
недостаточным поступлением белков с пищей, кистозным фиброзом, прие-
мом кортикостероидов, тяжелым гепатитом и застойной сердечной недоста-
точностью. Жировая инфильтрация часто проявляется повышением эхоплот-
ности печени вследствие накопления капель жира в ее паренхиме. Этот со-
нографический вид может вызывать различные затруднения в зависимости
оттого, является жировая инфильтрация диффузной или очаговой [121,127].
Диффузные изменения часто сочетаются с гепатомегалией, что может вы-
звать ошибочную мысль о циррозе. Чтобы выявить гепатомегалию, получите
продольный срез печени и правой почки, после чего измерьте наибольшую
длину от купола правой доли печени до ее наиболее нижней точки [128]. Та-
кой прием не обеспечивает точного измерения печени, однако с помощью
него можно выявить гепатомегалию. Если размер правой доли превышает 16
см, печень считается увеличенной.
Часто небольшие гипоэхогенные поля в печени, расположенные рядом
с желчным пузырем или кпереди от бифуркации воротной вены, могут быть
приняты за участки, подвергшиеся жировой инфильтрации, что вносит до-
полнительную путаницу в распознавание нормальной и измененной эхо-
плотности. Небольшие гипоэхогенные «нормальные» зоны при диффузных
изменениях печени выглядят как измененные участки. Напротив, если оча-
говые изменения печени имеют небольшие размеры, они могут быть приня-
ты за очаговые образования. При дальнейших исследованиях возможна раз-
личная степень регрессии явлений жировой инфильтрации, если принима-
ются во внимание такие факторы, как воздержание от приема алкоголя,
улучшение питания и диета.
Цирроз. Хронические изменения в печени при циррозе происходят в резуль-
тате разрушения паренхимы и последующих фиброзных изменений. Ультра-
110 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
звуковой вид печени при циррозе зависит от стадии заболевания [129-135].
Вначале эхогенность печени повышается незначительно; однако повышение
эхоплотности в сочетании с гепатомегалией часто связано с сопутствующим
жировым гепатозом (рис. 3.6). При прогрессировании заболевания размер пе-
чени часто уменьшается, ее структура становится гетерогенной, а поверх-
ность бугристой; печеночные вены и ветви воротной вены визуализируются
труднее. Среди симптомов, сопутствующих циррозу, отмечаются асцит, уве-
личение хвостатой доли, портальная гипертензия, спленомегалия и рекана-
лизация параумбиликальной вены.
Диффузные изменения печени. При исследовании печени оцените равно-
мерность эхоструктурного рисунка ее паренхимы Поскольку звуковая энер-
гия равномерно проникает через неизмененную паренхиму этого органа, от-
ражение звука происходит с небольшим рассеиванием, что формирует нор-
мальный гомогенный ультразвуковой вид. При развитии в паренхиме печени
фиброзных изменений или инфильтрации при диффузном росте опухоли в ри-
сунке отраженного эхосигнала могут наблюдаться едва уловимые изменения.
При этом определяется нечетко выраженное образование, однако чаще выяв-
ляются отклонения в эхотекстуре паренхимы.
Очаговые образования. УЗИ успешно применяют для выявления очаговых
образований печени. К сожалению, большинство опухолей печени не имеют
характерного ультразвукового вида [136, 137]. С достаточной уверенностью
могут быть диагностированы только простые кисты печени, если они строго
соответствуют определенным ультразвуковым критериям. Образование должно
быть анэхогенным, с ровной, тонкой стенкой, и вызывать эффект дорсально-
го усиления ультразвука. Анэхогенное образование не может быть отнесено
к простым кистам, если оно содержит взвесь, имеет утолщение стенки или пе-
регородки. В таких случаях образование классифицируется как сложная кис-
та и может встречаться при широком спектре заболеваний, включая кровоиз-
лияния, абсцессы или опухоли [148-150].
Сонографически абсцесс печени часто представлен анэхогенным или
полиморфным образованием округлой формы с неровными контурами и эф-
фектом дорсального усиления ультразвука [151-154]. Образование может
содержать эхогенные структуры, составляющие взвесь. Абсцесс, заполнен-
ный эхогенными частицами, нередко принимают за солидное образование;
такая ошибка возможна из-за неправильных установок мощности ультра-
звукового луча. При тщательном исследовании обнаруживается характер-
ное для жидкостного образования дорсальное усиление ультразвука. В по-
лости абсцесса может присутствовать воздух или другой газ, что приведет к
отражению ультразвука с формированием нечеткой тени. Этот феномен не
следует путать с отражением звука от содержимого тонкой, например, две-
надцатиперстной кишки. Если образование визуализировано в двух плоско-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
111
ЗОНА ДОРСАЛЬНОГО
УСИЛЕНИЯ
Рис. 3.40. Большое полиморфное образование в правом заднем сегменте печени
является абсцессом.
стях, его можно легко отличить от кишки. Поскольку сонографический вид
абсцессов различен, постарайтесь получить достоверные анамнестические
сведения. На рис. 3.40 показан большой абсцесс, расположенный в правом
заднем сегменте печени.
Уточнить диагноз можно при проведении аспирационной биопсии, вы-
полненной под ультразвуковым контролем. Во многих случаях УЗИ помога-
112 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВВДЕНИЯ
ет провести безопасное, минимально инвазивное и недорогое диагностиче-
ское вмешательство.
Наиболее часто встречающимся доброкачественным новообразованием
печени является гемангиома. Она нередко оказывается случайной находкой
при УЗИ органов брюшной полости. Образование представляет собой сосу-
дистую опухоль, замедленный кровоток в которой обусловливает трудности
интерпретации данных цветовой допплерографии. У взрослых такие образо-
вания обычно небольшого размера (3 см и менее) с незначительными темпа-
ми роста. При ультрасонографии гемангиома выявляется как небольшое
одиночное и хорошо выраженное эхогенное образование. В отдельных случа-
ях она гетерогенна, содержит гипоэхогенные поля и имеет большие размеры.
Наиболее часто встречающимися злокачественными образованиями пе-
чени являются метастазы. Они наблюдаются при развитии первичной опу-
холи в толстой кишке, легком или молочной железе. Метастатические обра-
зования печени обычно множественны, но могут быть представлены солитар-
ным образованием. Ультразвуковой вид метастазов разнообразен: встречаются
гипоэхогенные и гиперэхогенные образования, а также образования с хоро-
шо выраженным ободком. Метастазы колоректального рака обычно гипер-
эхогенные. Гипоэхогенные образования наблюдаются при раке молочной
железы и лимфомах. Метастазы рака легкого часто имеют выраженный ги-
поэхогенный ободок.
Несмотря на то, что УЗИ достаточно хорошо выявляет многие опухоли
печени, все они определяются только как «новообразования». На основании
сономорфологических данных составляется дифференциально-диагности-
ческий список; важно помнить, что УЗИ не может служить источником аб-
солютных данных для определения типа опухоли.
Все более широкое применение находит интраоперационная ультрасо-
нография, ставшая неотъемлемой частью хирургического вмешательства и
являющаяся наиболее чувствительным методом для выявления опухолей
печени [146]. При проведении УЗИ печени учитывайте данные, косвенно
указывающие на наличие образований: смещение сосудистых структур пе-
чени, деформацию и изменение контура органа. В современных исследова-
ниях была показана возможность улучшения выявления образований в пе-
чени при сочетанном применении цветной допплерографии с новейшими
эхоконтрастными препаратами [147]. Эхоконтрастные препараты позволя-
ют лучше визуализировать многие опухоли и получить недоступные ранее
данные о кровотоке.
Наиболее распространенной первичной злокачественной опухолью пе-
чени является гепатоклеточная карцинома; чаще всего она развивается у боль-
ных, страдающих циррозом [155]. Опухоль проявляется болями в правом
подреберье, потерей веса, увеличением живота (асцит), а также повышени-
ем уровня альфа-фетопротеина.
MEГОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
113
Рис. 3.41. А. Гепатома в правой доле печени. Б. Большое гетерогенное образование и
гипоэхогенное образование меньшего размера (гепатоклеточная карцинома),
окруженное асцитической жидкостью, определяются в цирротически измененной
печени. В. Большое гетерогенное образование (гепатоклеточная карцинома) на фоне
цирроза печени
Сонографические данные при гепатоклеточной карциноме разнообраз-
ны [136, 155-160]. Опухоль может быть представлена одним или нескольки-
ми узлами, а также диффузно инфильтрировать паренхиму печени (рис. 3.41).
Эхоструктура таких образований тоже различна: небольшие опухоли (раз-
8 Ультразвуковая диагностика...
114
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.41. (Продолжение.)
мером менее 3 см) обычно гипоэхогенные, в то время как опухоли больших
размеров обладают диффузной гетерогенностью или мозаичной эхострукту-
рой. Гипоэхогенными подобные опухоли бывают редко
Визуализация опухоли при циррозе печени может быть затруднена
вследствие того, что измененная паренхима становится гетерогенной. Во
время УЗИ необходимо определить, имеются ли признаки прорастания опу-
холью сосудов [164]. При исследовании печени КТ и ультрасонография не-
редко дополняют друг друга, повышая вероятность выявления гепатокле-
точной карциномы. Раннее выявление таких опухолей важно для планиро-
МЕТОДИКА ИССЛВДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
115
Рис. 3.41. (Продолжение.)
вания таких видов лечения, как инъекция алкоголя, резекция или
трансплантация печени [157]. Прогноз зависит от сохранения функции пе-
чени и распространенности опухоли.
Протокол исследования и анатомия печени. При сканировании печени
опытный сонографист визуализирует основные ориентиры, интуитивно пере-
мещая датчик и находя те или иные внутриорганные структуры. Специального
116
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.42. Продольное изображение неизмененной печени и диафрагмы (слева)
Анэхогенная зона между диафрагмой и печенью (справа) при асците В правой почке
множественные мелкие кисты.
протокола для исследования печени не существует — анатомические струк-
туры могут быть визуализированы в произвольной последовательности в те-
чение всего исследования. Очень важным является понимание пространст-
венного расположения анатомических срезов, благодаря которому анатомия
брюшной полости может быть представлена в виде набора поперечных сече-
ний, расположенных, как карты в колоде. Зная порядок следования срезов, от
верхнего к нижнему, сонографист может быстро и последовательно осматри-
вать зону диагностического интереса.
Заданного протокола легче придерживаться при исследовании желчно-
го пузыря, во время которого сканирование ведется в двух плоскостях (про-
дольной и поперечной). Благодаря этому можно четко установить различия
между нормальными анатомическими особенностями и патологическими
изменениями. Более того, такой подход помогает отличить анатомические
структуры от артефактов. Обратите внимание на взаиморасположение диа-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
117
фрагмы и печени. Изменения расположения диафрагмы помогают выявить
такие патологические состояния, как асцит (рис. 3.42), поддиафрагмальный
абсцесс, плевральный выпот и образования в печени [162].
Почки
Ультразвуковое изображение почек состоит из двух основных компонентов:
изображений коркового слоя и синуса. Корковый слой почки выглядит гомо-
генным и нередко обладает меньшей эхоплотностью (гипоэхогенный), чем
печень. Синус почки содержит жир, большие и малые чашечки, а также круп-
ные ветви почечных сосудов. Жир, содержащийся в синусе почки, обуслов-
ливает его эхогенность. Небольшие анэхогенные структуры округлой фор-
мы, часто видимые по краю коркового вещества почки, соответствуют неиз-
мененным пирамидам медуллярного слоя [163]. Эти структуры не должны
ошибочно приниматься за простые кисты. При УЗИ размеры неизмененной
почки составляют 9-12 см в длину и 4-5 см — в ширину.
Несмотря на то, что область ворот почки при УЗИ визуализируется лег-
ко, неизмененный мочеточник не виден. В брюшной полости большая часть
мочеточника закрыта тенью от газа, содержащегося в кишечнике Дисталь-
ная часть мочеточника в месте впадения в мочевой пузырь может быть визу-
ализирована как анэхогенная тубулярная структура [164].
Заболевания почек
Нефролитиаз. УЗИ является прекрасным методом выявления камней, со-
держащихся в почках [165]. Нефролитиаз, не сопровождающийся обструк-
цией, часто протекает бессимптомно, однако камни, вызвавшие обструкцию,
могут приводить к боли в боку, а также развитию инфекции и гематурии.
Почечные камни выглядят эхогенными (ярко-белыми) с выраженной
акустической тенью (рис. 3.43). Акустическая тень возникает вследствие
разности в акустической плотности камня и ткани почки и в результате мак-
симального отражения звука от камня. Отсутствие звука позади камня при-
водит к появлению акустической тени. Конкремент и синус выглядят эхо-
генными, а наличие конкремента определяется по месту начала акустиче-
ской тени.
Ангиомиолипома (доброкачественная опухоль, содержащая жировую
ткань) почки может выглядеть как эхогенное очаговое образование [ 166 171] и
при освоении основ ультразвуковой диагностики кажется похожей на ка-
мень. Внимательное исследование обнаруживает отсутствие акустической
тени, значительно снижая вероятность путаницы. Небольшая карцинома
почки может выглядеть как ангиомиолипома [169]. В этом случае для полу-
чения дополнительных дифференциальных признаков между двумя эхоген-
ными образованиями выполняется компьютерная томография.
118
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.43. Продольное изображение почки, содержащей конкремент. Конкремент дает
четкую акустическую тень.
Образования почек. Простые кисты представляют собой полости, заполнен-
ные жидкостью, которые не проявляются какими-либо симптомами. Эти
доброкачественные образования наиболее часто встречаются у пожилых паци-
ентов. Для идентификации образования как простой кисты почки, оно должно
соответствовать всем критериям, указанным выше (см. раздел «Киста»).
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
119
Несколько простых кист, расположенных в почечной лоханке, могут
напоминать картину, характерную для гидронефроза. Сканирование в
двух плоскостях поможет определить, являются эти кисты изолированны-
ми или они соединены между собой. Наличие соединения подтверждает
гидронефроз.
Сложные кисты почек. При оценке анэхогенного очагового образования
почки сонографист должен убедиться в наличии диагностических критериев,
соответствующих простой кисте. Если образование не соответствует этим
критериям, оно не является простой кистой. Киста диагностируется как
сложная, если она обладает признаками, указывающими на наличие перего-
родок, взвеси или утолщение стенки. Сложная киста может иметь признаки
инфицирования, кровоизлияния, разрастания опухоли, что в свою очередь
потребует дополнительных исследований (рис. 3.8). При исследовании слож-
ной кисты врач должен провести несколько последовательных ультразвуко-
вых сканирований, а также соотнести данные ультразвука и компьютерной
томографии или аспирационной биопсии.
Поликистоз почек. Поликистоз почек у взрослых часто сопровождается их
двусторонним увеличением. При этом в почках определяются множествен-
ные кисты [172]. Кисты выявляются и в печени (в 33% случаев), менее час-
то — в поджелудочной железе и селезенке [173]. Некоторые кисты являются
сложными и содержат эхогенные комплексы, обусловленные инфицирова-
нием или кровоизлиянием.
Колонки Бертена. Колонки Бертена являются одним из вариантов нормаль-
ной анатомии почек (рис. 3.44). Они выглядят как продолжение коркового
слоя почки в почечный синус [174—176]. Эти структуры не следует ошибочно
принимать за опухоли почек. Колонки являются продолжением коркового
вещества почки, и их эхоструктура является такой же, как эхоструктура кор-
кового вещества. В этих колонках нередко можно видеть пирамиды медул-
лярного слоя.
Гидронефроз. Умеренное расширение чашечно-лоханочной системы почек
с расширением больших и малых чашечек выражается в появлении анэхоген-
ных пальцевидных структур на протяжении всего почечного синуса (рис. 3.45).
Причиной гидронефроза могут явиться камни мочеточника, отек его стенок
или новообразования [177, 179]. Мочеточник обычно не визуализируется
даже при значительном гидронефрозе. На рис. 3.46 показано исключение из
этого правила: визуализируется расширенный вследствие обструкции моче-
точник. На рис. 3.47 показана правая почечная вена на протяжении выхода из
правой почки до впадения в нижнюю полую вену.
120
3, УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.44. Колонка Бертена является вариантом нормальной анатомии почки и не
должна ошибочно приниматься за опухолевидное образование.
Карцинома почки. Большая часть карцином почек выглядит как солидное
очаговое образование. Эти опухоли могут быть изоэхогенными или гипоэхо-
генными; небольшие карциномы почек часто гиперэхогенны. Менее часто
подобные образования определяются в виде сложных кист. При проведении
УЗИ почки, содержащей образование, необходимо визуализировать почеч-
ные вены и нижнюю полую вену для исключения наличия в их просвете опу-
холевого тромба [ 179 183]. Сочетание ультразвуковых данных и данных КТ
повышает точность описания опухоли.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
121
Рис. 3.45. Анэхогенная пальцевидная структура в почке при средневыраженном
(II степень) гидронефрозе.
Во время УЗИ проводится тщательное и систематическое сканирова-
ние. При сканировании в продольной плоскости всегда перемещайте датчик
от одного края почки к другому (от медиального к латеральному, от латераль-
ного к медиальному); кроме этого, визуализируйте и оцените все структуры
при сканировании в поперечной плоскости. Такая методика исследования
снижает вероятность того, что очаговое образование почки будет пропущено.
122
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ, СВЕДЕНИЯ
Рис. 3.46. Гидронефроз, сопровождающийся расширением мочеточника.
На рис. 3.48А представлен продольный вид почки. Нижний полюс поч-
ки не полностью визуализирован из-за тени, падающей от ребра При недо-
статочной визуализации перемещайте датчик (и/или пациента) для того,
чтобы добиться полноценного вида нижнего полюса. На рис. 3.48Б показан
нижний полюс почки после перемещения пациента на бок. После этого в
нижнем полюсе почки визуализируется большое солидное образование.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
123
Рис. 3.47. Правая почка, правая почечная вена и нижняя полая вена при сканировании
в поперечной плоскости.
Хроническая почечная недостаточность. Хроническая почечная недоста-
точность приводит к некоторому сморщиванию почек, что повышает их эхо-
генность. При этом визуализация почек затруднена, поскольку их эхоген-
ность становится близкой к эхогенности окружающих тканей.
124
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВВДЕНИЯ
Рис. 3.48. А. Продольное изображение почки. Нижний полюс почки скрыт за тенью от
ребра. Б. После перемещения датчика в нижнем полюсе почки визуализируется
большое солидное образование.
Мочевой пузырь
Если мочевой пузырь наполнен, его форма при сканировании в поперечной
плоскости близка к квадратной (рис. 3 49) и к овальной — в продольной плос-
кости. Если мочевой пузырь не заполнен достаточным количеством мочи,
при УЗИ его визуализация бывает затруднена. Исследование мочевого пузы-
ря включает в себя выявление камней, опухолей, дивертикулов и утолщений
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
125
стенки. Исследование этого органа должно составлять часть протокола ис-
следования почек, особенно в случаях выявления гидронефроза.
Магистральные сосуды и забрюшинное пространство
Аорта. Обычно абдоминальная аорта визуализируется у большинства паци-
ентов в виде анэхогенной тубулярной структуры, расположенной кпереди от
позвоночника (рис. 3.50). Аорта проходит сквозь диафрагму и входит в
брюшную полость. В верхней части брюшной аорты можно видеть две ее от-
126
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.49. Поперечный вид наполненного мочевого пузыря.
носительно небольшие ветви, отходящие кпереди: первой ветвью является
чревный ствол, второй — верхняя брыжеечная артерия (рис. 3.34). Чревный
ствол отходит на уровне первых двух сантиметров абдоминальной части аор-
ты и делится на общую печеночную, селезеночную и левую желудочную ар-
терии. Перемещая датчик в цефалическом направлении выше поджелудоч-
ной железы при сканировании в поперечной плоскости можно легко увидеть
общую печеночную и селезеночные артерии в месте их отхождения от чрев-
ного ствола.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
127
Рис. 3.50. Поперечный вид неизмененной абдоминальной аорты.
При прохождении через брюшную полость диаметр аорты несколько
уменьшается; верхней границей нормы считается диаметр 3 см (рис. 3.51). В
брюшной полости аорта прослеживается обычно до уровня пупка, где она
делится на правую и левую подвздошные артерии.
Аневризма абдоминального отдела аорты Аневризмы абдоминального
отдела аорты обычно протекают бессимптомно и наблюдаются у курильщи-
ков и/или при атеросклерозе. Заболевание чаще встречается у мужчин. В недав-
них исследованиях показано, что курение является наиболее значимым факто-
128
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.51. А, Продольный вид аневризмы аорты, содержащей тромб. Обратите
внимание на разницу в размере между ложным и истинным просветом сосуда. Б,
Поперечный вид аневризмы аорты, содержащей тромб
ром риска развития аневризмы абдоминального отдела аорты [ 184]. Атеро-
склеротические изменения приводят к истончению стенки аорты, которое по
мере прогрессирования может вызвать расширение или разрыв. Кальцифи-
цированные атеросклеротические бляшки выглядят как эхогенные образова-
ния неправильной формы, расположенные в стенке аорты и дающие акусти-
ческую тень. Выраженное акустическое затенение затрудняет визуализацию
и измерение задней стенки аорты.
Аневризмы аорты в зависимости от формы могут быть подразделены на
два вида: цилиндрические и мешковидные. Цилиндрические аневризмы встре-
чаются наиболее часто и характеризуются равномерным расширением стен-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
129
Рис. 3.51. (Продолжение.)
ки аорты. Мешковидные аневризмы возникают на ограниченном участке
стенки. Они чаще встречаются в грудной части аорты, чем в абдоминальной.
Для исключения аневризмы абдоминального отдела аорты при наличии
пульсирующего образования в брюшной полости у пожилых пациентов час-
то требуется проведение УЗИ [184]. Возможность выявления и точного из-
мерения аневризмы аорты делает УЗИ доступным (в отношении стоимости)
диагностическим инструментом [185]. Наиболее часто аневризма абдоми-
нального отдела аорты диагностируется при ее расширении более 3 см. Из-
мерения проводятся вдоль поперечной оси от внутреннего края одной стен-
ки до внутреннего края другой [185-188]. Для получения точных данных из-
мерение необходимо производить как при продольном, так и при поперечном
сканировании. Это также важно при извилистом ходе аорты, поскольку из-
мерение в одной плоскости может привести к ошибочному увеличению разме-
9 Ультразвуковая диагностика...
130 3. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
ра. Большая часть аневризмы абдоминальной аорты располагается ниже уров-
ня почечных артерий [189].
При оценке аорты во время УЗИ важно определить возможное наличие
тромба, который может выглядеть как гетерогенное или гипоэхогенное об-
разование. Это приводит к тому, что изображение тромба сливается с окру-
жающим его содержимым брюшной полости. В результате, часто измеряется
ложный просвет аорты и недооценивается ее истинный размер. Для предот-
вращения такой ошибки измерение аорты необходимо проводить при скани-
ровании в двух плоскостях (рис. 3.51).
При небольших бессимптомных аневризмах (протяженностью менее
5 см), без признаков угрозы кровотечения или разрыва, проводится не-
сколько УЗИ в срок от 6 до 12 месяцев, что позволяет оценить изменение
диаметра аорты. Такой график исследований дает возможность врачу
определить скорость роста аневризмы за определенный интервал времени
[190-192]. При аневризмах размером более 6 см в связи с возрастанием ри-
ска их разрыва обычно требуется проведение хирургического вмешатель-
ства.
КТ играет важную роль в оценке таких осложнений трасплантации аор-
ты, как образование псевдоаневризмы в области анастомоза или формирова-
ние фистулы [193, 194].
Протокол исследования абдоминальной аорты. Датчиком выбора для ис-
следования аорты является конвексный или секторный датчик с частотой
сканирования 3,5 МГц. Абдоминальная аор та обычно может быть визуализи-
рована у большинства пациентов, не страдающих ожирением. Начинайте ис-
следование при положении пациента лежа на спине. Поместите датчик под
мечевидный отросток в положение для поперечного сканирования с минималь-
ным отступом от срединной линии. Проксимальная часть абдоминальной
аорты имеет вид анэхогенной тубулярной структуры, кпереди от которой в
виде четко очерченного треугольника визуализируется левая доля печени. Из-
мерьте аорту от наружного края одной стенки до наружного края другой. Мо-
гут также визуализироваться чревный ствол и верхняя брыжеечная артерия,
которые определяются в виде двух небольших ветвей, отходящих от перед-
ней поверхности аорты (рис. 3.34). Нередко кпереди от абдоминальной аорты
выше уровня чревного ствола может определяться небольшая гипоэхогенная
структура овальной формы с гиперэхогенной центральной частью. Так выгля-
дит пищеводно-желудочное углубление, которое не должно ошибочно при-
ниматься за внутрибрюшное образование (рис. 3.52).
Перемещая датчик от мечевидного отростка к пупку, постоянно оцени-
вайте изменение диаметра аорты, а также определяйте наличие атеросклеро-
тических бляшек. Чтобы определить, находится ли диаметр аорты в нормаль-
ных пределах, следует измерить ее верхнюю и срединную части, а также
провести измерения на уровне пупка. Визуализируйте место бифуркации
МЕТОДИКА ИССЛВДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
131
Рис. 3.52. Пищеводно-желудочное углубление определяется кпереди от аорты в виде
структуры округлой формы.
аорты на правую и левую подвздошные артерии. Диаметр неизмененной
аорты должен составлять не более 2 см.
Вновь поместите датчик под мечевидный отросток и поверните его для
сканирования в поперечной плоскости. Чтобы увидеть проксимальную часть
абдоминальной аорты, отклоните датчик в цефалическом направлении. Аорта
будет определяться в виде анэхогенной структуры округлой формы; верх-
ним пределом нормы является размер 3 см.
Перемещая датчик в каудальном направлении, остановитесь на уровне
поджелудочной железы. Сканирование на этом уровне важно для определе-
ния возможного вовлечения почечной артерии в аневризму аорты. При УЗИ
у взрослых почечные артерии нередко визуализируются с трудом. Почеч-
132
3. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
ные вены увидеть легче. Поскольку прохождение почечных артерий и вен
совпадает с плоскостью сканирования, почечные вены и верхняя брыжееч-
ная артерия являются ценными ориентирами. Обратите внимание, что на
рис. 3.33 левая почечная вена проходит кпереди от аорты и кзади от верхней
брыжеечной артерии.
Измерение аорты на этом уровне при поперечном сканировании дает
возможность врачу определить наличие аневризмы и, в случае ее присутст-
вия, установить, вовлечена ли в патологический процесс почечная артерия.
Продолжая перемещать поперечно расположенный датчик в каудальном на-
правлении, оценивайте изменение диаметра аорты.
При затрудненной визуализации дистальной части аорты (например,
вследствие затения газом, содержащимся в кишечнике) осторожно усильте
давление датчика на кожу пациента. Этот прием может привести к некото-
рому смещению кишечных петель, заполненных газом, что позволяет со-
здать акустическое окно. На уровне пупка в поперечной плоскости визуали-
зируйте бифуркацию аорты на правую и левую подвздошные артерии. Если
подвздошные артерии с трудом визуализируются при продольном сканиро-
вании, то сканирование в поперечной плоскости окажется дополнительным
способом визуализации и измерения подвздошных артерий. Внимательное
сканирование позволяет визуализировать подвздошные артерии. На уровне
бифуркации от аорты отходят две небольшие анэхогенные структуры округ-
лой формы. Обычно визуализируется только проксимальная часть подвздош-
ных артерий.
Нижняя полая вена. Нижняя полая вена образуется при слиянии правой и
левой общих подвздошных вен, расположена справа от аорты, проходит по-
зади печени, затем через диафрагму и впадает в правое предсердие. При УЗИ
наиболее часто визуализируемыми ветвями нижней полой вены являются пе-
ченочные и почечные вены.
В начальном периоде обучения ультразвуковому исследованию врач
может спутать нижнюю полую вену с аортой, поскольку оба сосуда опреде-
ляются как анэхогенные тубулярные структуры. Однако внимательное иссле-
дование позволяет выявить значительные различия ультразвукового вида этих
структур. Стенка аорты выглядит ригидной в сравнении с передней стенкой
нижней полой вены, которая кажется «провисшей» (рис. 3.53). Кроме этого,
от передней поверхности проксимальной части абдоминальной аорты отхо-
дят две небольшие ветви (чревный ствол и верхняя брыжеечная артерия), в
то время как в нижнюю полую вену впадают печеночные вены.
При проведении УЗИ тщательно оценивайте просвет нижней полой вены
на предмет тромбов, что часто наблюдается при опухолях почек и печени
[195]. Оценивайте местоположение нижней полой вены — она может сме-
щаться кпереди от позвоночника забрюшинными опухолями. Для исключе-
ния изменений в забрюшинном пространстве требуется тщательное иссле-
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
133
Рис. 3.53. Вид нижней полой вены при продольном сканировании.
дование. Смещение сосудистых структур может помочь в обнаружении за-
брюшинного образования.
Кроме солидных образований при УЗИ могут быть визуализированы за-
брюшинные скопления жидкости, такие как абсцесс, гематома, лимфоцеле.
Ретроперитонеальный абсцесс может выглядеть как анэхогенное образова-
ние, которое нередко содержит некоторое количество эхогенных частиц.
134 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Свежее кровоизлияние также выглядит как анэхогенное образование; после
начала процесса организации гематомы в ее изображении могут появляться
эхогенные структуры. Лимфоцеле обычно выглядит как анэхогенное жидко-
стное образование без какого-либо значимого внутреннего содержимого.
Селезенка
Селезенка является самым большим органом ретикуло-эндотелиальной сис-
темы и функционирует как гематологический фильтр организма. Форма и
размеры селезенки могут быть различными, однако обычно она визуализиру-
ется как структура в форме полумесяца в левом верхнем квадранте брюшной
полости ниже левой половины диафрагмы. Медиальнее и кпереди от селезен-
ки расположен желудок, хвост поджелудочной железы — медиальнее ворот
селезенки. Левая почка лежит ниже и медиальнее селезенки.
Вследствие особенностей анатомического расположения, визуализация
селезенки часто затруднена. Акустический доступ ухудшают желудок, селе-
зеночный изгиб толстой кишки и левое легкое. Ультразвуковая структура
селезенки является гомогенной; эхоплотность ее паренхимы несколько ниже
эхоплотности паренхимы печени (рис 3.54).
При проведении УЗИ наилучший акустический доступ к селезенке мож-
но получить при сканировании через межреберья по боковой или заднебоко-
вой поверхности туловища (рис. 3.55). Если селезенка с трудом визуализи-
руется при положении пациента лежа на спине, поверните его на правый бок
(левым боком кверху) для более удобного перемещения датчика. Если после
этого визуализация селезенки остается неудовлетворительной, положите под
правый бок пациента туго свернутое в виде валика полотенце, благодаря ко-
торому межреберные промежутки расширятся, и акустический доступ улуч-
шится.
Наличие дополнительных долек селезенки является вариантом нормаль-
ного анатомического строения. Дольки часто определяются в виде гомоген-
ных образований округлой формы, расположенных в области ворот селезен-
ки [196]. Их эхогенность схожа с эхогенностью селезенки (рис. 3.56).
Спленомегалия. Для исключения спленомегалии часто используется УЗИ.
За прошедшие годы для определения размеров селезенки было предложено
несколько требующих значительных временных затрат методик [197 201].
Эти утомительные процедуры не всегда используются в загруженном рабо-
той отделении ультразвуковой диагностики. Несмотря на то, что размеры и
форма селезенки различны, верхней границей нормальной длины селезенки
принято считать размер 13 см [202]. Измеряют наибольшую длину селезенки
при ее продольном сканировании (рис. 3.54). Эта упрощенная методика по-
зволяет без затруднений выявить спленомегалию.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
135
Рис. 3.54. Вид селезенки и левой почки при продольном сканировании.
Спленомегалия может сочетаться с циррозом печени, гепатитом, лим-
фомой, лейкемией, истинной полицитемией и инфекционным мононуклео-
зом. При выявлении спленомегалии установите, имеется увеличение диа-
метра или извилистость хода селезеночной вены, что является косвенным
признаком портальной гипертензии.
136
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
Рис. 3.55. Для полноценной визуализации селезенки необходимо сканирование через
межреберья.
Среди доброкачественных образований селезенки встречаются геман-
гиомы, абсцессы, кальцификаты (при гистоплазмозе), кисты и инфаркты
[204, 205]. В селезенке могут выявляться злокачественные лимфомы и мета-
стазы, которые обычно выглядят гипоэхогенными [206 208].
Как последствие закрытой травмы могут выявляться субкапсулярные
гематомы, а при разрыве капсулы селезенки — внутрибрюшные гематомы.
Важно помнить, что сонографический вид крови со временем меняется.
Свежее кровоизлияние обычно выглядит анэхогенным, однако по мере об-
разования сгустков появляются эхогенные включения и гематома может вы-
глядеть как солидное гетерогенное образование. Абсцессы селезенки по
своему сонографическому виду похожи на сложные кисты и содержат раз-
личные количества эхогенных включений [209].
Спустя длительное время после травмы селезенки в ней может сформи-
роваться киста; кальцификация стенки может наблюдаться как при кисте,
так и при гематоме. Кальцифицированная киста определяется в виде анэхо-
генного образования округлой формы с эхогенным краем.
Червеобразный отросток
Обычно неизмененный червеобразный отросток при УЗИ визуализируется с
трудом. Если он виден, то определяется в виде тубулярной структуры с хоро-
МЕТОДИКА ИССЛВДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
137
Рис. 3.56. Добавочная долька селезенки определяется в виде гомогенного
образования, расположенного обычно в области ворот органа.
шо различимой стенкой. Поперечный размер неизмененного червеобразного
отростка при измерении от одного внутреннего контура стенки до другого со-
ставляет менее 6 мм [210].
Для подтверждения воспаления червеобразного отростка при УЗИ ис-
пользуется линейный датчик с частотой 5 МГц. Датчик помещается над об-
ластью диагностического интереса, после чего проводится сканирование с
использованием методики дозированной компрессии [211, 212]. Вначале
давление, оказываемое на датчик, небольшое, затем оно увеличивается, при-
водя к сдавливанию слепой кишки и петель тонкого кишечника, которые
могут препятствовать полноценной визуализации червеобразного отростка.
Применение такой методики у пациентов с болями в брюшной полости по-
могает им легче переносить давление датчика, неожиданная сильная ком-
прессия переносится хуже.
Воспаленный червеобразный отросток увидеть легче, чем неизменен-
ный, особенно при увеличении его размера и заполнении жидкостью. УЗИ
138
3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ОСНОВНЫЕ СВЕДЕНИЯ
является ценным инструментом для подтверждения диагноза аппендицита.
Однако важно отметить, что если червеобразный отросток не визуализиро-
ван, это не исключает наличие его воспаления.
Сонографическим критерием аппендицита при болевом синдроме в пра-
вом нижнем квадранте живота у взрослых является размер червеобразного
отростка, превышающий 6 мм в диаметре [210]. Если размеры червеобраз-
ного отростка менее 6 мм, но он содержит конкременты, это указывает на
повышенный риск таких осложнений, как гангренозное изменение стенки
ЧЕРВЕОБРАЗНЫЙ
ОТРОСТОК
КОНКРЕМЕНТ
Рис. 3.57. А. Продольный вид воспаленного червеобразного отростка, содержащего
конкремент. Б. Поперечный вид воспаленного червеобразного отростка, содержащего
конкремент.
МЕТОДИКА ИССЛЕДОВАНИЯ И ОБЛАСТИ СКАНИРОВАНИЯ
139
ЧЕРВЕОБРАЗНЫЙ
ОТРОСТОК
КОНКРЕМЕНТ
Рис. 3.57. (Продолжение.)
отростка или ее перфорация (рис. 3.57). Дополнительные диагностические
признаки могут включать в себя потерю эластичности, отсутствие перисталь-
тики или перифокальное скопление жидкости, указывающее на нарушение
целостности отростка.
У пациентов с болевым синдромом в правом нижнем квадранте брюш-
ной полости УЗИ помогает хирургу выбрать между ранним оперативным
вмешательством или клиническим наблюдением. В хирургической практи-
ке УЗИ также может явиться дополнительным диагностическим инструмен-
том для исключения аппендицита. Наибольшее значение для дифференциаль-
ной диагностики имеют гинекологические и урологические заболевания, а
также другие воспалительные процессы в малом тазу [213].
140
3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
ЛИТЕРАТУРА
1. Worthen N, Uszler J, Funamura J. Cholecystitis: prospective evaluation of
sonography and Tc-HIDA cholescinigraphy. A.IR. Am J Roentgenol 1981;
137:973-978.
2. Callen P, Filly R. Ultrasonographic localization of the gallbladder. Radiolo-
gy 1979;133:687-691.
3. Cooperburg P, Gibney R. Imaging of the gallbladder, 1987. Radiology
1987:163:605-613.
4. Cooperburg P, Burhene H. Real time ultrasonography: diagnostic technique
of choice in calculus GB disease. N Engl J Med 1980;302:1277-1279.
5. Rice J, Sauerbrei E, Semogas P, et al. Sonographic appearance of adenomy-
omatosis of the gallbladder. J Clin Ultrasound 1981:9:336 337.
6. Romano A, van Sonnenberg E, Casola G, et al. Gallbladder and bile duct ab-
normalities in AIDS: sonographic findings in 8 patients. AJR. American Jo-
urnal of Roentgenology, 1988 Jan, 150(l):123-7.
7. Shlaer W, Leopold G, Scheible F. Sonography of the thickened gallbladder
wall: a nonspecific finding AJR Am J Roentgenol 1981; 136:337 -339.
8. Fiske C, Laing F, Brown T. Ultrasonographic evidence of gallbladder wall
thickening in association with hypoalbumenia. Radiology 1980;135:
713-716.
9. Laing F, Federle M, Jeffrey R et al. US evaluation of patients with acute
RUQ pain. Radiology 1981;140:449-455.
10. Rails P, Quinn M, Juttner H et al. Gallbladder wall thickening: patients wit-
hout intrinsic GB disease. AJR Am J Roentgenol !98;137:65-68.
11. Engel J, Dietch E, Sikkema W. GB wall thickness: sonographic accuracy
and relationship to disease. AJR Am J Roentgenol 1980;134:907-909.
12. Sanders R. The significance of sonographic GB wall thickening. J Clin Ult-
rasound 1980:8:143-146.
13. Ekberg O, Weiber S. The clinical importance of a thick walled, tender GB
without stones on ultrasonography. Clin Radial 1991;44:38-41.
14. McIntosh D, Penney H. Gray scale ultrasonography as a screening procedu-
re in the detection of GB disease. Radiology 1980;136:725-727.
15. Cohen R, Mahony B, Bowie J. Striated intramural GB lucencies on US stu-
dies: predictors of acute cholecystitis. 1987;164:31-35.
16. Raghavendia N, Ferner H, Subramanyan B, et al. Sonographic-pathologic
analysis. AJR, Am J Roentenol 1981;137:327-332.
17. Weissmann H, Frank M, Bernstein LH, Brown T. Rapid and accurate diag-
nosis of acute cholecystitis with Tc-HIDA cholescintigraphy. AJR Am J
Roentgenol 1979;132:523-528.
ЛИТЕРАТУРА
141
18. Mirvis S, Vainright J, Nelson A, et al. The diagnosis of acute calculous cho-
lecystitis: a comparison of sonography, scintigraphy and CT. AJR Am J Ro-
entgenol 1986;147:1171-1175.
19. Rails P, Colletti P, Lapin S, et al. Real time sonography in suspected acute
cholecystitis: prospective evaluation of primary and secondary signs. Radi-
ology 1985;155:767-771.
20. Marchal G, Casaer M, Baert A, et al. Gall bladder wall sonolucency in acute
cholecystitis. Radiology 1979;133:429-433.
21. Vitetta L, Sali A, Chou S, et al. Gallstones at autopsy and cholecystectomy:
a comparative study. Aust NZ J Surg 1988;58:561-568.
22. Laing F. Ultrasonography of the acute abdomen. Radio Clin North Am
1992;30:389-340.
23. Colletti P, Rails P, Siegel M, Halls J. Acute cholecystitis: diagnosis with ra-
dionuclide angiography. Radiology 1987;163:615-618.
24. Handler S. Ultrasound of gallbladder wall thickening and its relationship to
cholecystitis. AJR Am J Roentgenol 1979;132:581-585.
25. Bree RL. Further observations on the usefulness of the sonographic Murphy
sign in the evaluation of suspected acute cholecystitis. J Clin Ultrasound
1995;23:169-172.
26. Kane RA. Ultrasonographic diagnosis of gangrenous cholecystitis and em-
pyema of the gallbladder. Radiology 1980;134:191-194.
27. Simeone J, Brink J, Mueller P, et al. The sonographic diagnosis of acute
gangrenous cholecystitis: importance of the sonographic Murphy sign. AJR
Am J Roentgenol 1989;289-290.
28. Jeffery RB, Laing FC, Wong W, Callen PW. Gangrenous choloecystitis: di-
agnosis by ultrasound. Radiology 1983;148:219-221.
29. Filly RA, Alien B, Minton MJ, Bemhoft R, Way LW; In vitro investigation of
the origin of echoes with biliary sludge. J Clin Ultrasound 1980;8:193-200.
30. Ohara N, Schaefer J. Clinical significance of biliary sludge. J Clin Gastroen-
terol 1990:12:291-294.
31. Conrad MR, Janes JO, Dietchy J. Significance of low level echoes with in
the gallbladder. AJR Am J Roentgenol 1979;132:967-972.
32. Fakhry J. Sonography of tumefactive sludge. AJR Am J Roentgenol 1982;
139:717-719.
33. Britten JS, Golding RH, Cooperberg PL. Sludge balls to gallstones. J Ultra-
sound Med 1984;3:81-82.
34. Bergman, AB, Neimen HL, Kraut B. Ultrasonic evaluation of pericholecys-
tic abscess. AJR Am J Roentgenol 1979;132:201-203.
35. MacDonald FR, Cooperburg PL, Cohen MN. The WES triad-a sonographic
sign of gallstones in the contracted gallbladder. Gastrointest Radiol 1981;
6:39—41.
142 3 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ. ОСНОВНЫЕ СВЕДЕНИЯ
36. Conrad MR, Leonard J, Landay M. Left lateral decubitus sonography of gal-
lstones in the contracted gallbladder. AJR Am J Roentgenol 1980; 134:
141-144.
37. Laing FC, Gooding GA, Herzog KA. Gallstones preventing ultrasonograp-
hic visualization of the gallbladder. Gastrointest Radiol 1977;25:301-303.
38. Yum HA, Fink AH. Sonographic findings in primary carcinoma of the gall-
bladder. Radiology 1980;134:693-696.
39. Bach AM, Loring LA, Hahn LE, et al. Gallbladder cancer: can ultrasonog-
raphy evaluate extent of disease? J Ultrasound Med 1998;17:303-309.
40. Kumar A, MacGregor JH, Aggarwal S. Late solitary abdominal wall metas-
tasis from an incidental carcinoma of the gallbladder: ultrasound demonstra-
tion. J Clin Ultrasound 1991;19:380-382.
41. Hahn ST, Part SH, Choi HS, et al. Ultrasonographic features of metastatic
melanoma of the gallbladder. J Clin Ultrasound 1993;21:542-546.
42. Avila AN, Shawker TH, Fraker D. Color flow Doppler ultrasonography in
metastatic melanoma of the gallbladder. J Clin Ultrasound 1994;22:342-347.
43. Li D, Dong BW, Wu YL, Yan K. Image-directed and color Doppler studies
of gallbladder tumors. J Clin Ultrasound 1994;22:551-555.
44. Ren PL, Liu CD, Lee TL, Wu CN. Ultrasonographic assessment of intralu-
minal gallbladder masses. J Clin Ultrasound 1994;22:401-404.
45. Allibone GW, Pagan CJ, Porter SC. Sonographic features of carcinoma of
the gallbladder. Gastrointest Radiol 1981;6:169-173.
46. Kuo YC, Liu JY, Sheen IS, et al. Ultrasonographic difficulties and pitfalls in
diagnosing primary carcinoma of the gallbladder. J Clin Ultrasound 1990;
18:639 647.
47. Kumar A, Aggarwal S, Berry M, et al. Ultrasonography of carcinoma of the
gallbladder: an analysis of 80 cases. J Clin Ultrasound 1990;18:715-720.
48. Jones RS. Carcinoma of the GB. Surg Clin North Am 1990;70:1419-1428.
49. Weiner SN, Koenigsberg M, Morehouse H, et al. Sonography and computed
tomography in the diagnosis of carcinoma of the gallbladder. AJR Am J Ro-
entgenol 1984;142:735-739.
50. Sommer FG, Filly RA, Minton MJ. Acoustic shadowing due to refractive
and reflective effects. AJR Am J Roentgenol 1979;132:973-979.
51. Sample WF, Sarti DA, Goldstein LI, et al. Grayscale ultrasonography of the
jaundiced patient. Radiology 1978;128:719-725.
52. Leopold GR. Ultrasonography of jaundice. Radiol Clin North Am 1979; 17:
127-136.
53. Conrad MR, Landay MJ, James J. Sonographic parallel channel sign of bili-
ary tree enlargement in mild to moderate obstructive jaundice. AJR Am J
Roentgenol 1978;130:279-286.
ЛИТЕРАТУРА
143
54. Weill F, Eisencher A, Zeltner F. Ultrasonic study of the normal and dilated
biliary tree. The «shotgun» sign. Radiology 1978;127:221-224.
55. Laing FC, Jeffrey RB Jr, Wing VW, Nyberg DA. Biliary dilation: defining
the level and cause by real time ultrasound. Radiology 1986; 160:39—42.
56. Laing FC, London LA, Filly RA. Ultrasonographic identification of dilated
intrahep-atic bile ducts and their differentiation from portal venous structu-
res. J Clin Ultrasound 1978;6:90-94.
57. Rails PW, Mayekawa DS, Lee KP, et al. The use of color Doppler sonograp-
hy to distinguish dilated intrahepatic ducts from vascular structures. AJR
Am J Roentgenol 1989;152:291-292.
58. Cooperburg PL. High resolution real time ultrasound in the evaluation of the
normal and obstructed biliary tract. Radiology 1978;129:477-480.
59. Cooperbuig PL, Li D, Wong P, et al. Accuracy of common hepatic duct size in
the evaluation of extrahepatic biliary obstruction. Radiology 1980;135:141-144.
60. Parulekar SG. Ultrasound evaluation of common bile duct size. Radiology
1979;133:703-707.
61. Niederau C, Muller J, Sonnenberg A, et al. Extrahepatic bile ducts in healt-
hy subjects, in patients with cholelithiasis and in postcholecystectomy pati-
ents. A prospective study. J Clin Ultrasound 1983;11:23-27.
62. Sauerbrei EE, Cooperburg PL, Gordon P, et al. The discrepancy between ra-
diographic and sonographic bile duct measurements. Radiology 1980; 137:
751-755.
63. Laing FC, Jeffrey RB. The pseudo-dilated common bile duct: Ultrasonog-
raphic appearance created by the gallbladder neck. Radiology 1980; 135:
405—107.
64. Wu CC, Ho YH, Chen CY. Effect of aging on CBD diameter: a real time Ul-
trasonographic study. J Clin Ultrasound 1984; 12:473—178.
65. Wedmann B, Borsh G, Coenen C, Parssen A. Effect of cholecystectomy on
CBD diameters: a longitudinal prospective ultrasound study. J Clin Ultraso-
und 1988;16:619-624.
66. Stoh M, Farrands P, Guyer P, Dewbury K, et al. Ultrasound of the common
bile duct in patients undergoing cholecystectomy. J Clin Ultrasound 1991;
19:73-76.
67. Graham MF, Cooperburg PL, Cohen MM, et al. The size of the normal com-
mon hepatic duct following cholecystectomy: an ultrasound study. Radiolo-
gy 1980;135:137-139.
68. Mueller PR, Ferrucci JT, Simeone JF, et al. Postcholecystectomy bile duct
dilatation: myth or reality? AJR Am J Roentgenol 1981;136:355-358.
69. Graham MF, Cooperburg PL, Cohen MM, Burhenne HJ. Ultrasound scree-
ning of the common hepatic duct in symptomatic patients after cholecystec-
tomy. Radiology 1981;138:137-139.
144 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
70. Darweesh RMA, Dodds WJ, Hogan WJ, et al. Fatty meal sonography for
evaluating patients with suspected partial common duct obstruction. AJR
Am J Roentgenol 1988;151:63 68.
71. Willson SA, Gosink BB, van Sonnenberg E. Unchanged size of a dilated
CBD after a fatty meal: results and significance. Radiology 1986:160:29-31.
72. Mueller PR, Ferrucii JT Jr, Simeone JF, et al. Sonography of the bile ducts
after a fatty meal. Radiology 1982;143:211-215.
73. Laing FC, Jeffrey RB, Wing VW. Improved visualization of choledocholit-
hiasis by sonography. AJR Am J Roentgenol 1984;143:949-952.
74. Filly RA, London SS. The normal pancreas: acoustic characteristics and fre-
quency of imaging. J Clin Ultrasound 1979;7:121-124.
75. Marks WM, Filly RA, Callen PW. Ultrasonic evaluation of normal pancrea-
tic echogenic-ity and its relationship to fat deposition. Radiology 1980; 137:
475-449.
76. Sample WF, Po JP, Gray PK, et al. Gray scale ultrasonography: techniques
in pancreatic scanning. Appl Radiol 1975;4:66-91.
77. Weill F, Schraub A, Eisencher A, et al. Ultrasonography of the normal panc-
reas: success rate and criteria for normality. Radiology 1977; 123:417-423.
78. Leopold GR. Echographic study of pancreas. JAMA 1975;232:287-289.
79. Arger PH, Mulhern CB, Bonavita JA, et al. Analysis of pancreatic sonog-
raphy in suspected pancreatic disease. J Clin Ultrasound 1979;7:91-97.
80. Haber K, Freimanis AK, Asher WM. Demonstration and dimensional analy-
sis of normal pancreas with gray scale echogenicity. AJR Am J Roentgenol
1976;126:624-628.
81. De Graaf CS, Taylor KJW, Simmis BD, et al. Grayscale echogenicity of the
pancreas. Radiology 1978;129:157-161.
82. Worthen NJ, Beabeau D. Normal pancreatic echogenicity relationship to
age and body fat. AJR Am J Roentgenol 1982;139:1905-1908.
83. Coleman BG, Arger PH, Rosenberg HK, et al. Gray scale assessment of
pancreatitis in children. Radiology 1983;146:145-150.
84. Weinstein DP, Weinstein BJ. Ultrasonic demonstration of the pancreatic
duct: an analysis of 41 cases. Radiology 1979;130:729-734.
85. Parulekar SG. Ultrasonic evaluation of the pancreatic duct. J Clin Ultraso-
und 1980;8:457-463.
86. Lawson TL, Berland LL, Foley WD et al. Ultrasonic visualization of the
pancreatic duct. Radiology 1982;144:865-871.
87. Gosink BB, Leopold GR. The dilated pancreatic duct: ultrasonic evaluation.
Radiology 1978;126:475-478.
88. Hadidi A. Pancreatic duct diameter: sonographic measurement in normal
subjects. J Clin Ultrasound 1983;11:17-22.
ЛИТЕРАТУРА
145
89. MacGahan JP. The posterior gastric wall: a possible source of confusion in
identification of the pancreas duct. J Clin Ultrasound 1984;12:366-368.
90. MacHahon H, Bowie J, Beezhold C. Erect scanning of pancreas using a gas-
tric window. Am J Roentgenol 1979;132:587 591.
91. Weighali SL, Wolfman NT, Watson N. The fluid filled stomach: a new so-
nic window. J Clin Ultrasound 1979;7:353-356.
92. Grade M, Taylor KJM, Rosenfield AT. Water distention of the gut in evalu-
ation of the pancreas by ultrasound. AJR Am J Roentgenol 1978;131:
348-349.
93. Silverstein W, Isikoff M, Hill M, Barkin J. Diagnostic imaging of acute pan-
creatitis: prospective study using CT and sonography. AJR Am J Roentge-
nol 1981;137:497-502.
94. Balthazar E, Freeny P, van Sonnenberg E. Imaging and intervention in acute
pancreatitis. Radiology 1994;193:297-306.
95. Jeffrey R Jr. Sonography in acute pancreatitis. Radiol Clin North Am 1989;
27:5-17.
96. Gooding GA. Ultrasound of a superior mesenteric aneurysm secondary to
pancreatitis: a plea for real-time ultrasound of sonolucant masses in pancre-
atitis. J Clin Ultrasound 1981;9:255-256.
97. Doust BD, Pearce JD. Grayscale properties of the normal and inflammed
pancreas. Radiology 1976;120:653-657.
98. DiGiandomenico V, Filiponne A, Basilico R, et al. Reproductibility of ultra-
sound measurement of pancreatic size with new advanced high resolution
dynamic image scanners. J Clin Ultrasound 1993;21:77-86
99. Luetmer PH, Stephens DH, Ward EM. Chronic pancreatitis: reassessment
with current CT. Radiology 1989;171:353-357.
100. Weinstein BJ, Weinstein DP, Brodmerkel GJ. Ultrasonography of pancrea-
tic lithiasis. Radiology 1980;134:185-189.
101. Laing FC, Gooding GA, Brown T, Leopold GR. Atypical pseudocysts of
the pancreas: an ultrasonographic evaluation. J Clin Ultrasound 1979;7:
27-33.
102. Freeny PC, Lewis GP, Traverse LW, et al. Infected pancreatic fluid collecti-
ons. Radiology 1988;167:435-438.
103. Karunamoy D, Rakesh K, Satyender KP, et al. Double pigtail cystogastric
stent in the management of pancreatic pseudocyst. J Clin Ultrasound 1992;
20:11-17.
104. Sitzmann JV, Imbembo AL. Splenic complications of a pancreatic pseudo-
cyst. Am J Surg 1984,147:191 196.
105. Conrad MR, Landay MJ. Pancreatic pseudocysts: unusual ultrasound featu-
res. AJR Am J Roentgenol 1978;130:265-268.
10 Ультразвуковая диагностика...
146 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
106. Freeny PC, Weinstein CJ, Taft DA, Alien FH. Cystic neoplasms of the pan-
creas: new angiographic and ultrasonographic findings. AJR Am J Roentge-
nol 1978;131:795-802.
107. Friedman AC, Lichtenstein JE, Dachman AH. Cystic neoplasms of the pan-
creas. Radiology 1983;149:45-50.
108. Campbell JP, Wilson SR. Pancreatic neoplasm: how useful is evaluation
with Ultrasound? Radiology 1988;167:341-344.
109. Yeo C, Bastidas J, Lynch-Nyhan A, et al. The natural history of pancreatic
pseudocysts documented by computed tomography. Surg Gynecol Obstet
1990; 170:41 1-417.
110. Gonzalez AC, Bradley EL, Clements JL. Pseudocyst formation in acute
pancreatitis- ultrasonographic evaluation of 99 cases. AJR Am J Roentgenol
1976;127:315-317.
111. Sarti DA. Rapid development and spontaneous regression of pancreatic pse-
udocysts documented by ultrasound. Radiology 1977;125:789.
112. Wright CH, Maklad F, Rosenthal S. Gray scale in ultrasonic characteristics
of carcinoma of the pancreas. Br J Radiol 1979;52:281-288.
113. Sexton SC, Zeman RK. Correlation of computed tomography, sonography
and gross anatomy of the 1 iver. AJR Am J Roentgenol 1983;141:711-718.
114. Filly R. Ultrasonic anatomy of liver: a review with new applications. J Clin
Ultrasound 1979; 1 137-146.
115. Filly R. The left portal vein: a possible source of confusion on ultrasonog-
rams. Radiology 1979; 130:205 206.
116. Filly R. Anatomy of the upper abdomen: the portal and hepatic vein anato-
my. J Clin Ultrasound 1976;4:85-90
117. Subramanyan BR, Balthazar EJ, Madamba MR, et al Sonography of porto-
systemic venous collaterals in portal hypertension. Radiology 1983:146:
161-166.
118. Filly RA, Laing FC. Anatomic variation of portal venous anatomy in the
porta hepatis: ultrasonographic evaluation. J Clin Ultrasound 1978;6:83-89.
119. Washberg R, Angyal EA, Klein KM, et al. Echogenicity of hepatic versus
portal vein walls revisited with histologic correlation. J Ultrasound Med
1997;16:807-810.
120. Brown MB, Filly RA, Callen PW. Ultrasonographic anatomy of the caudate
lobe. J Ultrasound Med 1982;1:189-192.
121. Wang SS, Chiang JH, Tsai YT, et al. Focal hepatic fatty infiltration as a cau-
se of pseudotumors, ultrasonographic patterns and clinical differentiation. J
Clin Ultrasound 1990;18:401-409,
122. Scott WW, Sanders RC, Siegelman SS. Irregular fatty infiltration of the li-
ver: diagnostic dilemmas. AJR Am J Roentgenol 1980;135:67-71.
ЛИТЕРАТУРА
147
123. Kurtz АВ, Rubin CS, Cooper HS, et al. Ultrasound findings in hepatitis. Ra-
diology 1980;136:717.
124. Scatarige JC, Scott WW, Donovan PJ, et al. Fatty infiltration of the liver: ul-
trasonographic and computed tomographic correlation. J Ultrasound Med
1984;3:9-14.
125. Chong VF, Fan YF. Ultrasonographic hepatic pseudo lesions: normal paren-
chyma mimicking mass lesions in fatty liver. Clin Radiol 1994;49:326-329.
126. Rubaltelli L, Savastano S, Cellini et al. Hyperechoic pseudotumors in seg-
ment 4 of the liver. J Ultrasound Med 1997;16:569-572.
127. Quinn SF, Gosink BB. Characteristic sonographic signs of hepatic fatty in-
filtration. AJR Am J Roentgenol 1985;145:753-755.
128. Gosink B, Leymaster GE. Ultrasonic determination of hepatomegaly. J Clin
Ultrasound 1981;9:37-41.
129. Harbin WP, Robert NJ, Ferrucci JT Jr. Diagnosis of cirrhosis based on regi-
onal changes in hepatic morphology. Radiology 1980;135:273-283.
130. Taylor KJW, Gorelick FS, Rosenfield AT, Riely C A. Ultrasonography of
alcoholic liver disease with histological correlation. Radiology 1981; 141:
157 161.
131. Lin DY, Sheen IS, Chiu CT, et al. Ultrasonographic changes of early liver
cirrhosis in chronic hepatitis B: a longitudinal study. J Clin Ultrasound
1993;21:303-308.
132. Joseph AEA, Dewbury КС, McGuire PG. Ultrasound detection of chronic
liver disease («the bright liver») Br J Radiol 1979;52:184-188.
133. Giorgio A, Amoroso P, Fico P, et al. Ultrasound evaluation of uncomplica-
ted and complicated acute viral hepatitis. J Clin Ultrasound 1986; 14:
675-679.
134. Sanford NL, Walsk P, Mates C, et al. Is ultrasonography useful in the asses-
sment of diffuse parenchyma liver disease? Gastroenterology 1985;89:
186- 191.
135. Martinez-Noguera A, Calonge E, Coscojuela P, et al. Chronic liver disease:
comparison of ultrasound patterns with laparoscopy and biopsy. J Clin Ult-
rasound 1993;21:325-330.
136. Sheu J, Sung J, Chen D, et al. Ultrasonography of small hepatic tumors
using high resolution linear array real time instruments. Radiology 1984;
150:797-802.
137. Bruneton JN, Raffaelli C, Padovani B, et al. Etiologic diagnosis of hepatic
lesions in cancer patients. Value of ultrasound and liver function tests. Clin
Imaging 1997;21:366-371.
138. Scheible W, Gosink BB, Leopold GR. Gray scale echographic patterns of
hepatic metastatic disease. AJR Am J Roentgenol 1977;129:983-987.
148 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
139. Mirk Р, Rubaltelli L, Bazzocchi М, et al Ultrasonic patterns in hepatic he-
mangiomas. J Clin Ultrasound 1982;10:373 -378.
140. Itai Y, Ohtomo K, Araki T, et al. Computed tomography and sonography of
cavernous hemangioma of the liver. AJR Am J Roentgenol 1983; 141:
315-320.
141. Spamer C, Brambs H, Koch H, Gerok W. Benign circumscribed lesions of
the liver diagnosed by ultrasonography guided fine needle biopsy. J Clin Ul-
trasound 1986;14:83-88.
142. Scholmerich J, Volk B. Differential diagnosis of anechoic/hypoechoic lesi-
ons in the abdomen detected by ultrasound. J Clin Ultrasound
1986;14:339-353.
143. Townsend R, Laing F, Jeffrey RB, Bottles K. Abdominal lymphoma in
AIDS: evaluation with US. Radiology 1989;171:719-724.
144. Gibney RG, Hendin AP, Cooperberg PL. Sonographically detected hepatic
hemangiomas: absence of change over time. AJR Am J Roentgenol
1987;149:953-957.
145. Yoshida T, Matsue H, Okazaki N, Yoshino M. Ultrasonographic differenti-
ation of he-patocellular carcinoma from metastatic liver cancer. J Clin Ult-
rasound 1987;15:431-437.
146. Staren E, Gambia M, Deziel D, et al. Intraoperative ultrasound in the mana-
gement of liver neoplasms. Am Surg 1997;63:691-696.
147. Ernst H, Balzer T, Schlief R, et al. Color Doppler ultrasound of liver lesions:
signal enhancement after intravenous injection of the ultrasound contrast
agent. J Clin Ultrasound 1996;24:31-35.
148. Wicks JD, Silver TM, Bree RL. Grayscale features of hematomas: an ultra-
sound spectrum. AJR Am J Roentgenol 1978;131:977-980.
149. Federle MP, Filly RA, Moss AA. Cystic hepatic neoplasms: complementary
roles of CT and sonography. AJR Am J Roentgenol 1981;136:345-348.
150. Weaver RM, Goldstein HM, Green B, et al. Grayscale evaluation of hepatic
cystic disease. AJR Am J Roentgenol 1978;130:849-852.
151. Rubinson HA, Isikoff MB, Hill MC. Diagnostic imaging of hepatic absces-
ses: a retrospective analysis. AJR Am J Roentgenol 1980;135:735-740.
152. Kressel HY, Filly RA. Ultrasonographic appearance of gas-containing abs-
cesses in the abdomen. AJR Am J Roentgenol 1978;130;71-73.
153. Berry M, Bazaz R, Bhargava S. Amebic liver abscess: sonographic diagno-
sis and management. J Clin Ultrasound. 1986;14:239-242.
154. Basile J A, Klein SR, Worthen NJ, et al. Amebic liver abscess. The surgeon's
role in management. Am J Surg 1983;146:67-71.
155. Solmi L, Primerano A, Gandolfi L. Ultrasound follow up of patients at risk
for hepa-tocellular carcinoma: results of a prospective study on 360 cases.
Am J Gastroenterol 1996;91:1189-1194.
ЛИТЕРАТУРА
149
156. Tanaka S, Kitamura T, Kasugai H, et al. Early diagnosis of hepatocellular
carcinoma: usefullness of ultrasonographically guided fine needle aspirati-
on biopsy. J Clin Ultrasound 1986; 14:11 16.
157. Giorgio A, Tarantino L, Francica G, et al. Percutaneous ethanol injection
under sonographic guidance of hepatocellular carcinoma in compensated
and decompensated cir-rhotic patients. J Ultrasound Med 1992; 11:587 595.
158. Gosink BB, Lemon Sk, Schieble W, Leopold GR. Accuracy of ultrasonog-
raphy in diagnosis of hepatocellular disease. AJR Am J Roentgenol 1979;
133:19-23.
159. LaBerge JM, Laing FC, Federle MP, et al. Hepatocellular carcinoma: asses-
sment of resectability of computed tomography and ultrasound. Radiology
1984;152:485-490.
160. Sheu J, Chen D, Sung J, et al. Hepatocellular evaluation in the early stage
Radiology 1985; 155:463^167.
161. Atri M, de Stempel J, Bret P, Illescas F. Incidence of portal vein thrombosis
complicating liver metastasis as detected by duplex ultrasound. J Ultrasound
Med 1990;9:285-289.
162. Pery M, Kaftori J, Rosenberger A. Causes of abnormal right diaphragmatic
position diagnosed by ultrasound. J Clin Ultrasound 1983;! 1:269-275.
163. Cook JH, Rosenfield A, Taylor K. Ultrasonic demonstration of intrarenal
anatomy. AJR Am J Roentgenol 1977;129:831-835.
164. Mirk P, Maresca G, Fileni A, Vincenzoni M. Sonography of normal lower
uterus. J Clin Ultrasound 1988;16:635-642.
165. Middletown WD, Dodds WJ, Lawson TL, et al. Renal calculi: sensitivity for
detection with ultrasound. Radiology 1988;167:239-244.
166. Scheible W, Ellenbogen P, Leopold G, Slao N. Lipomatous tumors of the
kidney and adrenal: apparent echogenic specificity. Radiology 1978;129
153-156.
167. Hobarth K, Klinger HC, Kuber W, Kratzik C. Value of routine sonography
in the diagnosis and conservative management of renal angiomyolipoma.
Eur Urol 1993;24:239-243.
168. Clark E, Palubinskas AJ. The angiographic spectrum of renal hemartoma.
Am J Roentgenol 1972;114:715-721.
169. Siegel CL, Middleton WD, Teefey SA, McClennan BL. Angiomyolipoma
and renal cell carcinoma: ultrasound differentiation. Radiology 1996; 198:
789-793.
170. Kennelly MJ, Grossman HB, Cho KJ. Outcome analysis of 42 cases of renal
angiomyolipoma. J Urology 1994; 152'1988-1991.
171. Silverman SC, Pearson GD, Seltzer et al. Small hyperechoic renal masses.
Am J Roentgenol 1996;167:877-881.
150 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ: ОСНОВНЫЕ СВЕДЕНИЯ
172. Rosenfield A, Curtis A, Putman СЕ, et al. Grayscale ultrasonography, com-
puterized tomography and nephrotomography in evaluation of polycystic li-
ver and kidney disease. Urology 1977;4:436^138.
173. Lanius K, Pearson J. A review of polycystic kidney disease. JDMS 1992:8:
232-237.
174. Lafortune M, Constantin A, Breton G, Vallee C. Sonography of the hypert-
rophied column of Berlin. Am J Roentgenol 1986;146:53-56.
175. Yeh YC, Halton KP, Shapiro RS, et al. Junctional parenchyma: revised defi-
nition of hypertrophic column of Berlin. Radiology 1992;185:725-732.
176. Leekam RN, Matzinger MA, Brunelle M, et al. The sonography of renal co-
lumnar hypertrophy. J Clin Ultrasound 1983;11:491-494.
177. Chen MYM, Zagoria RJ, Dyer RB. Radiologic findings in acute urinary
tract obstruction. J Emerg Med 1997;15:339-343.
178. Chuah SK, Changchien CS, Tai DI, et al. Hydronephrosis accidentally de-
tected by gastrointestinal sonography. J Clin Ultrasound. 1994;22:183-186.
179. James-Dow CA, Choyke PI, Jennings SB, et al. Small renal masses: detecti-
on with CT versus US and pathologic correlation. Radiology 1996; 198:
785-788.
180. Charboneau JW, Hattery, Ernst EC, et al. Spectrum of sonographic findings
in 125 renal masses other than benign simple cyst. AJR Am J Roentgenol
1983;140:87-94.
181. Ambos M, Bosniak M, Madayag M, Lefleur R. Infiltrating neoplasms of the
kidney. AJR Am J Roentgenol 1977;129:859-864.
182. Zeman R, Cronan J, Rosenfield A, et al. Renal call carcinoma: dynamic thin
sliced CT assessment of vascular invasion and tumor vascularity. Radiology
1988;167:393-396.
183. Goldstein HM, Weaver RM. Ultrasonic detection of renal tumor extension
into the inferior vena cava. AJR Am J Roentgenol 1978;130:1083-1085.
184. Lederle FA, Johnson GR, Wilson SE, et al. Prevalence and associations of
abdominal aortic aneurysms detected through screening. Ann Intern Med
1997; 126:441-449.
185. Kiev J, Eckhart A, Kerstein M. Reliability and accuracy of physical examinati-
on in detection of abdominal aortic aneurysms. J Vase Surg 1997;31:143-146.
186. Chervu A, Clagett GP, Valentine RJ, et al. Role of physical examination in
detection of abdominal aortic aneurysms. Surgery 1995; 117:454^457.
187. La Roy L, Cormier P, Matalon T, et al. Imaging of abdominal aortic aneu-
rysms. Am J Roentgenol 1989;152:785-792.
188. Lederle FA, Wilson SE, Johnson GR, et al. Variability in measurement of
abdominal aortic aneurysms. Abdominal aortic aneurysm detection and ma-
nagement Veterans Administration cooperative study group. J Vase Surg
1995;21:945-952.
ЛИТЕРАТУРА
151
189. Cohan RH, Siegel CL, Korobkin M, et al. Abdominal aortic aneurysms: CT
evaluation of renal artery involvement. Radiology 1995;194:751-776.
190. Bernstein EF, Dilley RB, Goldberger LE, et al. Growth rates of small abdo-
minal aortic aneurysms. Surgery 1976;80:765-773.
191. Masclans JR, Planas M, Bermejo B, et al. Ruptured abdominal aortic aneu-
rysms: morbidity and mortality rates in 80 consecutive cases. J Vase Surg
1994;28:459 466.
192. Nevitt MP, Ballard DJ, Hallett JW Jr. Prognosis of abdominal aortic aneu-
rysms: a population-based study. N Engl J Med 1989;321:1009-1014.
193. Siegel CL, Cohan RH, Korobkin M, et al. Abdominal aortic aneurysm mor-
phology: CT features in patients with raptured and nonruptured aneurysms.
AJR Am J Roentgenol 1994;163:1123-1129.
194. Amparo EG, Hoddick WK, Hricak H, et al. Comparison of magnetic reso-
nance imaging and ultrasonography in the evaluation of abdominal aortic
aneurysms. Radiology 1985;154:451-156.
195. Yeon MK, Kim CH. Sonographic evaluation of inferior vena caval obstruc-
tion: correlative study with vena cavography. AJR Am J Roentgenol 1985;
145:757-762.
196. Subramanyam BR, Balthazar EJ, Horii SC. Sonography of the accessory
spleen AJR Am J Roentgenol 1984; 143:47-49.
197. Niederau C, Sonnenberg A, Muller JE, et al. Sonographic measurements of
the normal liver, spleen, pancreas and portal vein. Radiology 1983; 149:
537-540.
198. Koga T. Correlation between sectional area of the spleen by ultrasonic to-
mography and actual volume of the removed spleen. J Clin Ultrasound
1979;119-120.
199. Koga T, Morikawa Y. Ultrasonic determination of the splenic size and its
clinical usefulness in various liver diseases. Radiology 1975;115:157-161.
200. Pietri H, Boscani M. Determination of splenic volume index by ultrasonic
scanning. J Ultrasound Med 1984;3:19-23.
201. Ishibashi H, Higuchi N, Shimamura R, et al. Sonographic assessment and
grading of spleen size. J Clin Ultrasound 1991;19:21-25.
202. Rosenberg HK, Markowitz R, Kolberg H, et al. Normal splenic size in in-
fants and children: Sonographic measurements. AJR Am J Roentgenol
1991;157:119-121.
203. Masamune A, Okano T, Satake K, Toyota T. Ultrasonic diagnosis of torsion
of the wandering spleen. J Clin Ultrasound 1994;22:126-128.
204. Goerg C, Schwerk WB, Georg K. Sonography of focal lesions of the spleen.
AJR Am J Roentgenol 1991;156:949-953.
205. Barbara B, Colagrande C. Sonographic patterns in splenic infarct. J Clin Ul-
trasound 1986;14:23-28.
152 3. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ. ОСНОВНЫЕ СВЕДЕНИЯ
206. Mittelstaedt С, Partain С. Ultrasonic-pathologic classification of splenic ab-
normalities: gray scale patterns. Radiology 1980:134:697 705.
207. Ishida H, Konno K, Ishida J, et al. Isolated splenic metastases. J Ultrasound
Med 1997;16:743-749.
208. Goerg C, Schwerk W, Goerg K, Havemann K. Sonographic patterns of the
affected spleen in malignant lymphoma. J Clin Ultrasound 1990; 18:
569-574.
209. Schwerk W, Gorg C, Gorg K, Pestrepo I. Ultrasound guided percutaneous
drainage of pyogenic splenic abscesses. J Clin Ultrasound 1986;14:23-28.
210. Jeffrey RB, Laing F, Townsend R. Acute appendicitis: sonographic criteria
based on 250 cases. Radiology 1988;167:327-329.
211. Puylaert J. Acute appendicitis: US evaluation using graded compression.
Radiology 1986;158:355-360.
212. Townsend R, Jeffrey RB, Laing F. Cecal diverticulitis from appendicitis
using graded compression sonography. AJR Am J Roentgenol 1989; 152:
1229-1230.
213. Gaensler E, Jeffrey RB, Laing F, Townsend R. Sonography in patients with
suspected acute appendicitis: value in establishing alternative diagnoses.
AJR Am J Roentgenol 1989;152:49-51.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
ОРГАНОВ БРЮШНОЙ ПОЛОСТИ
ПРИ ТРАВМЕ (СКРИНИНГ)
4
Р. Стефен Смит
Точная и быстрая оценка возможности развития у пациента внутригрудной
или внутрибрюшной катастрофы является одной из наиболее важных обязан-
ностей врача, оказывающего помощь при травме.
Поиск оптимального диагностического алгоритма при брюшной травме
выдвинул ультрасонографию к вершине списка диагностических исследова-
ний. В этот список входит физикальное исследование, диагностический пе-
ритонеальный лаваж, компьютерная томография и диагностическая лапаро-
скопия.
До представления хирургам, врачам скорой помощи и другим специали-
стам по ультрасонографии как лучшего средства в диагностической оценке
при травме необходимо рассмотреть несколько вопросов.
Может ли своевременное и точное УЗИ у больного с травмой быть прове-
дено в реанимационной палате?
Должно такое исследование быть выполнено и оценено хирургом, радио-
логом, врачом скорой помощи или специально обученным средним
медицинским персоналом?
Как должно проводиться прицельное УЗИ при травме?
Каковы преимущества ультрасонографии по сравнению с другими мето-
дами исследования, включая диагностический перитонеальный ла-
важ и компьютерную томографию?
Как должен быть организован процесс УЗИ при травме в больницах и
травматологических центрах, и как должны сертифицироваться вра-
чи, проводящие это исследование?
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
154
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
ИСПОЛЬЗОВАНИЕ УЛЬТРАСОНОГРАФИИ ПРИ ТРАВМЕ
В Северной Америке при обследовании больных с травмой проведением ульт-
расонографического исследования пренебрегали до 1990-х годов, несмотря
на обнадеживающие результаты нескольких ранних исследований, выпол-
ненных в 1970-х. К счастью, врачи в Азии и Европе используют ультрасоно-
графию как компонент диагностической оценки при травме уже в течение
двух десятилетий. На этих континентах обучение врачей ультразвуковой
диагностике стало обязательным. За прошлое десятилетие японские и евро-
пейские журналы опубликовали множество статей, подтверждающих диа-
гностическую пользу ультрасонографии при травме [1—4].
Позже американские журналы опубликовали ряд статей из травматоло-
гических центров в Соединенных Штатах, Канаде, Азии, и Европе. Эти ис-
следования подтвердили результаты более ранних сообщений и положили
начало использования ультрасонографии при травме хирургами и врачами
скорой помощи в Северной Америке. В ранних исследованиях Kimura и Ot-
suka [5] предположительно оценили роль УЗИ в работе отделения неотлож-
ной помощи при выявлении травматического гемоперитонеума. Эта перво-
начальная положительная оценка дала импульс для дальнейших исследова-
ний во многих травматологических центрах Соединенных Штатов и Канады.
Возможности травматологов (6-го года обучения), обучавшихся в тече-
ние только 2 ч проведению УЗИ при травме, оценили Tso et al. [6]. Ультраз-
вуковые изображения были получены в течение 1 ч после поступления боль-
ных. Данные ультрасонографии сравнивались с данными стандартных ис-
следований (диагностический перитонеальный лаваж и компьютерная
томография). Ультразвуковые исследования, выполненные травматологами-
стажерами, оценивались штатными радиологами клиники. Рецензенты не зна-
ли об интерпретации ультразвуковых данных стажерами, что гарантировало
независимость их оценки. За 8-месячный период чувствительность, специ-
фичность и точность составили 69%, 99%, и 96% соответственно. В работе
сделан вывод, что УЗИ, выполненные в отделении неотложной помощи,
явились ценным дополнением к диагностическим данным, полученным у
больных с абдоминальной травмой.
Оценен опыт проведения УЗИ у больных с торакальной или абдоминаль-
ной травмой [7]. Исследования выполнялись хирургами в период с 1989 по
1991 год. Авторами установлено, что ультрасонография в значительной сте-
пени увеличивала возможность быстрого получения хирургами дополни-
тельных данных у больных с отрицательным или сомнительным результатом
физикального обследования. В этом исследовании диагностическая чувстви-
тельность составила 90%, а специфичность — 99,5%.
Другими авторами [8] проведен ретроспективный анализ данных, полу-
ченных врачами, применившими ультрасонографию у 312 больных с серьез-
ной брюшной травмой; оценивалась необходимость проведения лапарото-
ДИАГНОСТИЧЕСКАЯ ПОЛЬЗА УЛЬТРАЗВУКОВОГО ИССЛВДОВАНИЯ ПРИ ТРАВМЕ
155
мии, при этом УЗИ служило обычным диагностическим средством. Было
сообщено о превосходных результатах в группе больных с серьезной трав-
мой, где чувствительность составила 93%, специфичность — 100%, точ-
ность — 99%, точность положительного прогноза — 100%. отрицательного
прогноза — 99%.
Wherrett et al. [9] оценили роль отделения неотложной ультразвуковой
диагностики в сортировке 69 больных с серьезной травмой (среднее значе-
ние по шкале выраженности повреждений — 32); у больных предполагалось
развитие гиповолемического шока. У 22 из них УЗИ позволило выявить ге-
моперитонеум. У 19 из 22 больных с позитивными ультразвуковыми данны-
ми потребовалось проведение неотложной лапаротомии, при этом ни у од-
ного из остальных 47 больных с отрицательными ультразвуковыми данными
проведение неотложной лапаротомии не потребовалось. Авторы заключили,
что неотложная ультрасонография, выполняемая непосредственно в палате,
является превосходным методом для определения необходимости срочной
лапаротомии у травмированных больных с гипотонией. Важно подчеркнуть,
что отрицательные результаты УЗИ позволили исключить органы брюшной
полости как источник клинически значимого кровотечения при травме.
На основании литературных данных можно заключить, что УЗИ играет
значительную роль в ранней диагностике у больных с травмой. Более того,
ультрасонография очень важна для раннего выявления гемоперитонеума,
тампонады сердца, гемо- и пневмоторакса.
ДИАГНОСТИЧЕСКАЯ ПОЛЬЗА УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ПРИ ТРАВМЕ
Каждая методика оценки травматических повреждений туловища имеет свои
преимущества и недостатки.
Несмотря на то, что физикальное исследование недорого и доступно
всем, такой метод обследования обычно не точен и не надежен у больного с
множественными повреждениями, особенно если его сознание изменено
влиянием алкоголя, лекарственных препаратов или тяжелым повреждением
мозга. Из-за высокой частоты ложноотрицательных результатов четырех-
квадрантный парацентез в Северной Америке практически не применяется.
Другими факторами, способствовавшими снижению популярности этого ме-
тода, явились затруднения при оценке объема и источника кровопотери.
Диагностический перитонеальный лаваж, впервые описанный Root с соав-
торами [10], — чрезвычайно чувствительный и точный метод выявления
внутрибрюшного кровотечения. Эта методика позволяет обнаружить в
брюшной полости относительно небольшое количество крови (менее 30 мл).
Однако диагностический перитонеальный лаваж является инвазивным мето-
дом диагностики и сопровождается осложнениями с частотой 1-5%.
Несмотря на то, что диагностический перитонеальный лаваж доста-
точно простой метод, доступный даже врачу с базовыми хирургическими
навыками, эта методика при использовании стандартных критериев подсче-
156
4. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
та числа клеток (100 000 эритроцитов, 500 лейкоцитов) была связана с высо-
кой частотой нелечебной лапаротомии. Кроме этого, у больных с оператив-
ными вмешательствами на органах брюшной полости в анамнезе выполне-
ние диагностического перитонеального лаважа связано с достаточно
высоким риском осложнений. По этим и другим причинам КТ стала факти-
чески золотым стандартом для неинвазивного выявления признаков абдо-
минальной травмы. Почему? КТ обеспечивает детальную органоспецифич-
ную информацию о состоянии брюшной полости, таза, забрюшинного про-
странства и грудной полости. К сожалению, организационные проблемы,
включающие транспортировку, наблюдение и непрерывное проведение реа-
нимационных мероприятий у больных с нестабильными показателями, все
еще существуют в большинстве травматологических центров. У больных с
нестабильной гемодинамикой выполнение КТ противопоказано.
Кроме этого, КТ относится к числу дорогостоящих исследований. В
1995 году в одном из травматологических центров стоимость КТ органов
брюшной полости и малого таза составляла 1900 $. Такой вид исследования
является источником значимой для пациента дозы ионизирующей радиа-
ции. Поэтому при беременности, если существуют другие возможности, КТ
выполняться не должна.
Сонографическая оценка больных с травмой является неинвазивной и
не связана с ионизирующей радиацией. Новейшие портативные ультразву-
ковые аппараты могут использоваться у кровати больного в отделениях не-
отложной помощи, операционных, блоках интенсивной терапии. Осложне-
ния использования сонографии при травме не известны. Такие факторы делают
обычное УЗИ в палате практичным и полезным. Среди других преимуществ
отмечается отсутствие необходимости в транспортировке потенциально не-
стабильных больных в радиологическое отделение.
Абсолютные противопоказания для выполнения сонографии отсутству-
ют. УЗИ может проводиться при беременности, когда использование КТ не-
желательно, а также у больных с оперативными вмешательствами на орга-
нах брюшной полости в анамнезе, у которых выполнение диагностического
перитонеального лаважа затруднено. Проведена проспективная оценка диа-
гностического алгоритма у больных с закрытой травмой [11]. Прицельное
УЗИ органов брюшной полости использовалось как первоначальный диа-
гностический тест. Было отмечено, что при травме сонографическое иссле-
дование проводилось быстро. Большинство исследований врачи завершали
менее чем за 3 мин, что ускоряло и расширяло помощь больным с травмой.
По данным авторов, точность метода составила 94%, отрицательная прогно-
стическая ценность — 96% и положительная прогностическая ценность —
82%. Авторы пришли к заключению, что сонография представляет собой су-
щественный компонент диагностического поиска у больных с закрытой
травмой и является лучшим методом первоначальной оценки состояния
брюшной полости при острой травме.
ДИАГНОСТИЧЕСКАЯ ПОЛЬЗА УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ПРИ ТРАВМЕ
157
Ряд исследователей [12] провели ретроспективную оценку использова-
ния портативных ультразвуковых аппаратов при массовом скрининге постра-
давших от разрушительного землетрясения в Армении в 1988 г. Внима-
тельное выполнение ультрасонографии в качестве первичного метода оцен-
ки состояния брюшной полости проводилось более чем у 400 жертв, достав-
ленных на третий эвакуационный этап в первые 72 ч после землетрясения.
На третьем эвакуационном этапе находились два ультразвуковых сканера. В
таких трудных условиях проведение УЗИ было ограничено приблизительно 4
минутами для каждого пострадавшего. В большинстве случаев выполнялось
однократное УЗИ, однако у 130 пострадавших потребовалось проведение
нескольких исследований. Авторы сообщили, что у 12,8% из 400 пациентов
при первоначальной оценке были заподозрены существенные внутрибрю-
шинные и забрюшинные повреждения. Только у 1% пациентов были полу-
чены ложноотрицательные данные, ни в одном из случаев не было сделано
ложноположительных заключений. Авторы пришли к выводу, что проведе-
ние сонографии при травме особенно необходимо в условиях массового по-
ражения.
Несмотря на очевидные выгоды проведения сонографии при травме,
включая повышение точности первоначальной диагностической оценки, у
этого метода есть недостатки. УЗИ брюшной полости достоверно опреде-
ляет только значительный гемоперитонеум (более 150 мл), поэтому раннее
обнаружение повреждения полых внутренних органов может быть затруд-
нено.
Сделана попытка определить минимальный объем перитонеальной жид-
кости, который можно обнаружить при УЗИ [13]. В интересном и хорошо
спланированном исследовании у 100 больных по стандартной методике был
выполнен диагностический перитонеальный лаваж. Затем для сканирования
правого подпеченочного пространства после введения в него лаважной жид-
кости было проведено УЗИ в реальном времени и В-режиме. Сонографисты
не знали объема лаважной жидкости, введенной в брюшную полость. Сред-
ний объем жидкости, достаточный для ее сонографического определения,
составил 619 мл. При инфузии в правое подпеченочное пространство менее
400 мл жидкости она была определена только в 10% случаев. Авторы заклю-
чили, что объем жидкости в брюшной полости, достаточный для ее обнару-
жения при ультрасонографии, является большим, чем это предполагалось
ранее.
Если бы это исследование было повторено и были получены ультразву-
ковые изображения спленоренального углубления и Дугласова пространст-
ва, положительных результатов было бы больше. Кроме того, можно предпо-
ложить, что для заполнения такого зависимого от гравитации отдела брюш-
ной полости, как правое подпеченочное пространство, после инфузии жидко-
сти через катетер (установленный через переднюю брюшную стенку) должно
было пройти какое-то время.
158
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
В исследовании Вгаппеу с соавторами определялся больший объем внут-
рибрюшной жидкости, чем требуется для ее обнаружения при сонографии.
Но авторы действительно показали, что небольшие количества жидкости
при прицельном УЗИ брюшной полости могут быть не замечены.
Сделана попытка оценить точность сонографии в определении повреж-
дения полых внутренних органов у 34 пострадавших с закрытой травмой
[14]. В этом исследовании методом ультрасонографии не обнаружена сво-
бодная жидкость в брюшной полости у 20% пострадавших с повреждением
кишечника. Авторы подчеркнули важность обычного физикального иссле-
дования и проведения повторной сонографии у пациентов с высоким рис-
ком повреждения кишечника. Кроме того, они предположили, что дополни-
тельные диагностические методы, такие как диагностический перитонеаль-
ный лаваж, в таких случаях особенно необходимы.
На трудности раннего выявления изолированных повреждений полых
органов при травме с помощью сонографии указали Кет с соавторами [15].
Материалом для исследования послужили ретроспективные данные 518 па-
циентов; в 5 из 8 случаев изолированного повреждения полых органов были
получены ложноотрицательные сонографические заключения об отсутст-
вии внутрибрюшного скопления жидкости.
Несмотря на то, что сонография при травме не во всех случаях позволяет
поставить быстрый диагноз повреждения полых органов, этот недостаток яв-
ляется относительным. Ни одно из ныне доступных диагностических средств
не обладает высокой точностью в решении этой задачи. В целом, применение
ультрасонографии при травме обладает многими преимуществами по сравне-
нию с другими методами исследования брюшной полости. Кроме этого, при-
цельное УЗИ при тупой травме живота представляется методом выбора для
быстрой первоначальной оценки состояния брюшной полости.
ТРАВМАТОЛОГ-СОНОГРАФИСТ
Кто должен проводить ультрасонографию при травме? Этот вопрос относит-
ся к одному из самых спорных аспектов использования ультрасонографии в
травматологических центрах Северной Америки. Ответ диктуется экономи-
ческими, а не клиническими соображениями. Европейские и японские хирур-
ги давно включили ультразвуковое диагностическое оборудование в оснаще-
ние хирургического кабинета. Обучение хирургии для получения сертифика-
ционного свидетельства в Германии должно включать в себя приобретение
минимального сонографического опыта (500 сеансов УЗИ).
В отличие от Японии и Германии, ультрасонография в Соединенных
Штатах остается радиологической специальностью. Акушеры и некоторые
сосудистые хирурги выполняют УЗИ, но большинство других клиницистов
для проведения специальных УЗИ обращается к сонографистам или радио-
логам, которые, однако, не получают сколько-нибудь лучших результатов
ТРАВМАТОЛОГ-СОНОГРАФИСТ
159
по сравнению с другими специалистами. Несколько клинических центров в
Соединенных Штатах и Канаде подтвердили, что хирурги могут проводить
прицельное УЗИ при травме и получать результаты, аналогичные получен-
ным радиологами [16-20]. При этом среди оцениваемых показателей были
чувствительность, специфичность, диагностическая и прогностическая точ-
ность. В группу сравнения с радиологами входили врачи-стажеры и ордина-
торы, а также врачи отделений неотложной помощи.
Было проведено проспективное изучение возможностей врачей отделе-
ния неотложной травматологической помощи в выполнении прицельного
УЗИ при травме [12]. Авторы проанализировали данные 245 пациентов, ко-
торым выполнялось УЗИ и такие подтверждающие исследования, как КТ,
диагностический перитонеальный лаваж, эксплоративные вмешательства,
эхокардиография. Было установлено, что чувствительность сонографии со-
ставила 90%, специфичность — 99%, точность — 99%.
Другими авторами проанализирована возможность старших врачей-ста-
жеров (4-й и 5-й год обучения) самостоятельного выполнении УЗИ при
травме после 8-часового вводного курса, включавшего в себя как лекции,
так и практические занятия В общей сложности, в реальных клинических
условиях было проведено 10 испытаний. Выявлено, что чувствительность
при этих исследованиях составила 73%, специфичность — 98%, точность —
96,1%. Сделан вывод о быстрой обучаемости хирургов-стажеров выполне-
нию техники прицельного УЗИ при травме и о быстром получении диагнос-
тических данных лечащими врачами. Более того, установлено, что при вы-
полнении УЗИ непосредственно хирургом количество приведенных КТ
снижается без ухудшения качества помощи, оказываемой пострадавшему.
Поэтому использование стратегического подхода к выполнению соногра-
фии уменьшает нагрузку на пациента с травмой.
Несмотря на то. что сонография при травме может быть выполнена вра-
чами различных специальностей, хирурги обладают более точной информа-
цией о ежеминутном состоянии пострадавшего и лучше других способны
выбрать оптимальное время для проведения УЗИ. В отличие от радиолога
или сонографиста, хирург остается рядом с больным в течение всего перио-
да диагностического поиска и реанимационных мероприятий и поэтому мо-
жет получить наиболее своевременные сонографические данные.
Установлено, что при проведении ультрасонографии хирургами время
исследования составляло 2,6 ± 1,4 мин [22]. Подобные результаты были по-
лучены в травматологическом центре, в котором сонография входит в стан-
дартный набор диагностических исследований при травме. Продемонстри-
ровано [23], что радиологи, выполняющие УЗИ при травме, тратят для полу-
чения тех же данных значительно больше времени. По данным авторов,
радиологу для завершения УЗИ больного с травмой требовалось около
35 мин. Он тратил в среднем 17,3 мин на доставку ультразвукового аппара-
та в палату интенсивной терапии и в среднем 7 мин до начала ультразвуке-
160 4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
вого исследования. Само же исследование занимало в среднем 10,6 мин.
Круглосуточное присутствие радиолога или сонографиста в бригаде неот-
ложной травматологической помощи требует от клиники выплат по допол-
нительной ставке или гонораров за вызовы. Кроме того, проведение УЗИ
хирургами отделения неотложной травматологической помощи снижало
затраты приблизительно на 100 000 $ в год [24].
При сравнении результатов УЗИ, выполненных радиологами и хирурга-
ми двух отделений неотложной травматологической помощи, Buzzas с соав-
торами [19] обнаружили, что чувствительность, специфичность и точность
исследований в обеих группах специалистов статистически не отличались.
Однако исследователи установили, что при выполнении травматологиче-
ских УЗИ хирургами расходы на пациентов снизились на 125 000 $ в год. Та-
ким образом, программа, предусматривающая выполнение УЗИ при травме
именно хирургами, ускоряет оказание помощи и снижает ее стоимость.
Показано [25], что краткий семинар по ультрасонографии, входящий в
дидактический и практический курс, значительно увеличивает возможности
лечащих врачей и ординаторов в ультразвуковой диагностике при травме.
Во время практических занятий врачи получали навыки проведения
УЗИ в реальных клинических условиях. Кроме этого, в обучении использо-
вались видеозаписи, демонстрирующие различные сонографические наход-
ки. Авторы пришли к заключению, что хорошо разработанный курс был по-
лезен для обучения основным навыкам ультразвуковой диагностики при
травме.
В другом лечебном учреждении также сделана попытка оценить резуль-
таты прохождение врачами курса ультрасонографии при травме [20]. Авто-
ры установили, что хирурги, окончившие такой курс, выполняли УЗИ с высо-
кой степенью точности. Тем не менее сделан вывод, что навыки, приобретен-
ные за время обучения, не должны контролироваться сверх 24-месячного
периода. Группе, окончившей экстенсивный цикл обучения ультрасоногра-
фии при травме, такой контроль не требовался.
ПРОВЕДЕНИЕ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ПРИ ТРАВМЕ
Основной целью проведения сонографии в постели больного при травме яв-
ляется быстрое обнаружение патологических скоплений жидкости (крови) в
брюшной полости и полости перикарда. Когда пациент лежит на спине, сво-
бодная жидкость в брюшной полости вначале накапливается в ее самых глу-
боких отделах, поэтому сонографист должен начать исследование со скани-
рования именно этих отделов. Получение детальных, органоспецифических
данных не является целью УЗИ брюшной полости при травме. В отдельных
случаях сонография может обнаружить разрыв или внутриорганную гемато-
му печени, почки или селезенки, однако компьютерная томография позволя-
ет получить более детальные данные об отдельных органах.
ПРОВЕДЕНИЕ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ПРИ ТРАВМЕ
161
Рис. 4.1. Четыре основных положения датчика при проведении прицельного УЗИ при
травме для выявления свободной жидкости в брюшной и перикардиальной полости,
а — правое подпеченочное пространство; б — спленоренальное углубление;
в — Дугласово пространство; г — перикардиальная полость.
В нескольких уже упомянутых исследованиях была определена оптималь-
ная методика выполнения сонографии при тупой травме живота [16-18].
Проведение прицельного УЗИ при травме позволяет быстро оценить состоя-
ние следующих отделов брюшной и грудной полости: а) правое гепатореналь-
ное (подпеченочное) пространство; б) спленоренальное углубление и левое
поддиафрагмалы юе пространство; в) Дугласово пространство, г) перикар-
диальную полость (рис. 4.1 и 4.2).
При травме многие сонографисты сначала исследуют перикардиальную
полость, чтобы перед исследованием брюшной полости исключить тампо-
наду сердца. Я начинаю исследование с правого подпеченочного простран-
ства и затем провожу оценку зон интереса, перемещая датчик по ходу часо-
вой стрелки. Некоторые авторы, для выявления крови между петлями ки-
шечника, рекомендуют сканирование других отделов брюшной полости,
11 Ультразвуковая диагностика ...
162
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.2. Взаимоположение печени, правой почки и правого подпеченочного
пространства. Пунктирными линиями обозначена область сканирования конвексного
датчика.
таких как боковые каналы и эпигастральная область [26]. Однако в нашей
практике затраты дополнительного времени для осмотра этих областей не
приносили существенной диагностической пользы.
Сонография этих областей проводится в стандартном В-режиме с исполь-
зованием 2,5-5,0 МГц датчиков. У обычного взрослого пациента датчик с
частотой сканирования 3,5 МГц обеспечивал необходимое сочетание доста-
точной проникающей способности и получения изображения с хорошим
разрешением.
У тучных пациентов используются датчики с более низкой частой
(2,5 МГц); они позволяют визуализировать более глубокие структуры, но не
обеспечивают такого разрешения, как датчики с более высокой частотой.
Визуализация спленоренального углубления и левого поддиафрагмального
пространства является более трудной вследствие анатомических особенно-
стей. Находящиеся рядом, заполненные воздухом органы (желудок, толстая
кишка) часто затеняют спленоренальное углубление. Это в особенной сте-
пени относится к пациентам, желудок которых раздут недавно принятой пи-
щей и заглоченным воздухом. Декомпрессия желудка назогастральным зон-
дом часто позволяет улучшить условия сканирования этой области.
При возможности, полость малого таза и Дугласово пространство должны
быть осмотрены до установки мочеотводящего катетера. Сонография, вы-
полненная перед катетеризацией мочевого пузыря, позволяет использовать
его как полезный анатомический ориентир и акустическое окно для визуа-
лизации более глубоких структур. Некоторые хирурги, чтобы улучшить ви-
зуализацию, заполняют мочевой пузырь стерильным солевым раствором,
но, на наш взгляд, в этом нет необходимости.
ПРОВЕДЕНИЕ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ПРИ ТРАВМЕ
163
Минимальное количество свободной жидкости в брюшной полости, ко-
торое можно обнаружить при сонографии, зависит от индивидуального объ-
ема брюшной полости и выраженности адгезии. Минимальное количество
жидкости, определяемое в брюшной полости обычного взрослого человека
при сонографическом исследовании, составляет 150 мл. Поэтому, если со-
нография проводится сразу же после полученной травмы, изолированное
повреждение полого органа может быть трудно определимым. Только при
наличии 250-500 мл крови УЗИ надежно выявляет типичную анэхогенную
зону скопления жидкости [13]. Если значимое количество жидкости (крови)
обнаружено в двух из трех областях брюшной полости, это говорит о гемо-
перитонеуме объемом 1 л. Чувствительность сонографии при травме может
быть повышена при выполнении нескольких исследований в интервале от
30 минут до 6 часов после первоначального осмотра [16-18].
Сонография позволяет выявить гемоторакс и разрыв плевры при коло-
тых и огнестрельных ранах органов грудной полости, несмотря на то, что
это не является стандартным компонентом исследования при травме. Ма и
Mateer [27] провели ретроспективное сравнение сонографии со стандартной
рентгенографией при выявлении гемоторакса в отделении неотложной по-
мощи. В каждом случае, для подтверждения сонографических или рентгено-
логических данных, проводилось дополнительное диагностическое иссле-
дование (компьютерная томография или торакоскопия). Чувствительность,
специфичность, точность, ценность положительного прогноза и ценность
отрицательного прогноза для обоих методов оказались одинаковыми. Авто-
ры пришли к выводу, что УЗИ может выявлять гемоторакс, так же как и
обычная рентгенография. Более того, они предположили, что использование
сонографии может ускорить распознавание гемоторакса.
В одном из недавних исследований [28] оценены возможности хирур-
гов, имеющих опыт проведения ультрасонографического исследования с
высоким разрешением, в определении хода раневого канала при проникаю-
щих ранениях грудной и брюшной полостей. Для обнаружения раневого ка-
нала и пенетрации плевры или брюшины авторы использовали датчик с час-
тотой 7 МГц. Ультрасонографические данные подтверждались эксплора-
тивными вмешательствами, лапароскопией, рентгенографией грудной клетки
или данными нескольких физикальных исследований. Как положительная,
так и отрицательная прогностическая ценность составила 100%. Исследова-
тели предположили, что использование сонографии в этой группе больных
может заменить другие диагностические средства, например эксплора-
тивные вмешательства или рентгенографию. Однако у неопытных соногра-
фистов могут отсутствовать необходимые для определения хода раневого
канала навыки. Кроме этого, такие исследования не могут проводиться дат-
чиками с низкой частотой, которые обычно используются для сканирования
брюшной полости.
164
4 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.3. У больного с травматическим разрывом печени 3-й степени в правом
подпеченочном пространстве определяется большое количество крови.
ПРЕИМУЩЕСТВА УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПРИ ТРАВМЕ
165
Рис. 4.4. При сканировании верхнего правого квадранта брюшной полости датчиком с
частотой 3,5 МГц в правом подпеченочном пространстве определяется жидкая кровь
(анэхогенная зона) и организованный сгусток (гиперэхогенная зона).
ПРЕИМУЩЕСТВА УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПРИ ТРАВМЕ
Сонография это мобильная методика исследования. Она без труда прово-
дится в больничной палате, блоке интенсивной терапии и многих других от-
делениях клиники. Поскольку ионизирующая радиация отсутствует, серии
166
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.5. Сканирование датчиком с частотой 3,5 МГц выявляет разрыв печени и
небольшое количество крови в правом подпеченочном пространстве.
УЗИ могут выполняться настолько часто, насколько это необходимо для
уточнения диагноза [16-18]. Неинвазивная природа ультразвука подразуме-
вает отсутствие осложнений при его клиническом использовании.
Противопоказаний для проведения УЗИ нет, сонография может использо-
ваться в условиях, при которых применение других диагностических средств,
ПРЕИМУЩЕСТВА УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПРИ ТРАВМЕ
167
Рис. 4.6. Сагиттальный срез, полученный при сканировании датчиком с частотой
3,5 МГц у пациента со стабильной гемодинамикой, в эпигастральной области которого
имеется колотая рана шириной 1 см.
168
4 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.7. Сканирование датчиком с частотой 3,5 МГц у 13-летней девочки с тупой травмой
живота Обратите внимание на большое количество крови в поддиафрагмальном
пространстве и спленоренальном углублении
ПРЕИМУЩЕСТВА УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПРИ ТРАВМЕ
169
Рис. 4.8. Вид левого верхнего квадранта брюшной полости у пациента с разрывом
селезенки и расположенным впереди нее скоплением крови.
170
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.9. Сканирование фазовым датчиком с частотой 3,5 МГц у 48-летнего мужчины с
вздутием живота и гипотонией после автомобильной аварии. Обратите внимание на
обширную анэхогенную зону над селезенкой, наличие которой достоверно указывает
на гемоперитонеум Вследствие повреждения брыжеечной артерии в брюшной
полости было обнаружено около 1 л крови.
ПРЕИМУЩЕСТВА УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ ПРИ ТРАВМЕ
171
Рис. 4.10. Вид левого верхнего квадранта брюшной полости при сканировании
датчиком с частотой 3,5 МГц. Обратите внимание на очень небольшое количество
крови в спленоренальном углублении.
таких как КТ и диагностический перитонеальный лаваж, противопоказаны,
например, при беременности или при наличии оперативных вмешательств
на органах брюшной полости в анамнезе. По сравнению с другими метода-
ми диагностики (КТ, диагностический перитонеальный лаваж), проведение
сонографии хирургами требует наименьших финансовых затрат [15, 19,24].
172
4. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.11. Сканирование фазовым датчиком с частотой 3,5 МГц у пациента,
переведенного в травматологический центр из неспециализированной клиники.
Обратите внимание на образовавшуюся гематому, расположенную позади селезенки.
ОРГАНИЗАЦИЯ УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ ПРИ ТРАВМЕ
Внедрение УЗИ при оказании помощи пациентам с травмой в стационарных
условиях требует совместных усилий хирургов, радиологов, специалистов
по ультразвуковой диагностике и врачей отделений неотложной помощи. К
сожалению, во многих травматологических центрах пустые дискуссии пре-
обладают над желанием улучшить оказание помощи больным. Хирурги или
врачи неотложной помощи, заинтересованные в проведении УЗИ у пациен-
ОРГАНИЗАЦИЯ УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ ПРИ ТРАВМЕ
173
Рис. 4.12. Вид малого таза при поперечном сканировании у молодого мужчины с
разрывом селезенки. Скопление крови в полости малого таза имеет типичный вид
«мышиных ушей». Обратите внимание на то, что мочевой пузырь наполнен и кровь
располагается кпереди от него.
174
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
Рис. 4.13. Сканирование в сагиттальной плоскости у 20-летнего пациента с разрывом
селезенки. Обратите внимание на катетер и остаточную мочу в мочевом пузыре, а
также на небольшое количество крови в цефалическом направлении от пузыря.
тов с травмой, получили бы большую пользу, посещая хорошо организован-
ный курс ультразвуковой диагностики, который предлагает и дидактические
лекции, и приобретение широких практических навыков [15, 24, 25, 29].
Каждое хирургическое отделение или отделение неотложной помощи
должно развивать и в дальнейшем придерживаться специфических критери-
ев применения сонографии в травматологи. Очевидно, что за неопытным со-
нографистом должно быть установлено непродолжительное наблюдение,
однако объем минимального клинического опыта, необходимого для дости-
жения нужного профессионализма, остается спорным [6,15,19-21, 29]. Резуль-
таты УЗИ должны обязательно регистрироваться и подтверждаться другими
ОРГАНИЗАЦИЯ УЛЬТРАЗВУКОВЫХ ИССЛВДОВАНИИ ПРИ ТРАВМЕ
175
Рис. 4.14. Сканирование в сагиттальной плоскости датчиком с частотой 3,5 МГц у
молодого мужчины с тупой травмой живота в анамнезе. Обратите внимание на
большое количество крови (анэхогенная зона) кверху от мочевого пузыря и петель
кишки (гиперэхогенная зона) в цефалическом направлении от пузыря.
диагностическими методами до тех пор, пока травматолог не станет настоя-
щим специалистом-сонографом. Каждое отделение хирургии должно уста-
новить определенные требования к проведению УЗИ и постоянно контроли-
ровать их качество [29].
176
4. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ ПРИ ТРАВМЕ (СКРИНИНГ)
ЛИТЕРАТУРА
1. Jarowenko DG, Hess RM, Herr MS, et al. Use of ultrasonography in the
evaluation of blunt abdominal trauma. J. Trauma 1989;29:1031-1037.
2. Gruessner R, Menteges B, Duber C, et al. Sonography versus peritoneal la-
vage in blunt abdominal trauma. J Trauma 1990;29:242-244.
3. Hoffman R, Nerlich M, Muggia-Sullam M, et al. Blunt abdominal trauma in
cases of multiple trauma evaluated by ultrasonography: a prospective analy-
sis of 291 patients. J Trauma 1991;32:452-458.
4. Kuhn PR Schreyer T, Schild H, et aL Sonographie beim stumpfen Bauchtra-
uma. Fortschr Roentgenstr 1993;139:310-313.
5. Kimura A, Otsuka T. Emergency center ultrasonography in the evlauation
of hemoperi-toneum: a prospective study. J Trauma 1991;31:20-23.
6. Tso P, Rodriguez A, Cooper C, et al. Sonography in blunt abdominal trau-
ma: a preliminary progress report. J Trauma 1992;33:39-44.
7. Rothlin MA, Naf R, Amgwerd M, et al. Ultrasound in blunt abdominal and
thoracic trauma. J Trauma 1993;34:488-495.
8. Bode PJ, Niezen RA, van Vugt AB, et al. Abdominal ultrasound as a reliable
indicator for conclusive laparotomy in blunt abdominal trauma. J Trauma
1993;34:27-31.
9. Wherrett LJ, Boulanger BR, McLellan BA, et al. Hypotension after blunt
abdominal trauma: the role of emergent abdominal sonography in surgical
triage. J Trauma 1996;41:815-820.
10. Root HD. Hauser CW, McKinley CR, et al. Diagnostic peritoneal lavage.
Surgery 1965;57:633-637,
11. Boulanger BR, McLellan MA, Brenneman FD. Emergent abdominal sonog-
raphy as a screening test in a new diagnostic algorithm for blunt trauma. J
Trauma 1996;40:867-874.
12. Sarkisian AE, Khondkarian A, Amirbekian NM, et al. Sonographie scree-
ning of mass casualties for abdominal and renal injuries following the 1988
Armenian earthquake. J Trauma 1991;31:247-250.
13. Branney SW, Wolfe RE, Moore EE, et al. Quantitative sensitivity of ultraso-
und in detecting free intraperitoneal fluid. J Trauma 1995;39:375 381.
14. Shih HC, Liu M, Wu JK, et aL Blunt gastrointestinal injury in trauma pati-
ents. Am J Emerg Med 1995;13:82-84.
15. Kern SJ, Smith RS, Fry WR, et al. Sonographie examination of abdominal
trauma by senior surgical residents. Am Surg 1997;63:669-674.
16. Rozycki GS, Ochsner MG, Jaffin JH, et al. Prospective evaluation of surge-
ons use of ultrasound in the evaluation of trauma patients. J Trauma 1993;
34:516-526.
ЛИТЕРАТУРА
177
17. Rozycki GS, Ochsner MG, Schmidt JA, et al. A prospective study of surge-
on-performed ultrasound as the primary adjuvant modality for injured pati-
ent assessment. J Trauma 1995;39:492 -498.
18. McElveen TS, Collin GR. The role of ultrasonography in blunt abdominal
trauma: a prospective study. Am Surg 1997;63:184-188.
19. Buzzas GR, Kern SJ, Smith RS, et al. A comparison of sonographic exami-
nations for trauma performed by surgeons and radiologists. J Trauma 44:
604 608. 1998.
20. Smith RS, Kern SJ, Fry WR, Helmer SD. The institutional learning curve of
surgeon performed trauma ultrasound. Arch Surg 133:530-536, 1998.
21. Ma OJ, Mateer JR, Ogata M, et al. Prospective analysis of a rapid trauma ul-
trasound examination performed by emergency physicians. J Trauma 1995;
38:879-885.
22. Boulanger BR, Brenneman FD, McLellan BA, et al. A prospective study of
emergent abdominal sonography after blunt trauma. J Trauma 1995;39:
325-330.
23. Healey MA, Simons RK, Winchell RJ. et al. A prospective evaluation of ab-
dominal ultrasound in blunt trauma: is it useful? J Trauma 1995;40:
875-883.
24. Thomas B, Falcone RE, Vasquez D, et al. Ultrasound evaluation of blunt ab-
dominal trauma: program implementation, initial experience, and learning
curve. J Trauma 1997;42:384-388.
25. Ali J, Rozycki GS, Campbell JP, et al. Trauma ultrasound workshop impro-
ves physician detection of peritoneal and pericardial fluid. J Surg Res 1996;
63:275-279.
26. Goletti O, Ghiselli G, Lippolis PV, et al.: The role of ultrasonography in
blunt trauma: results of 250 consecutive cases. J Trauma 1994;36:178-183.
27. Ma О J, Mateer JR. Trauma ultrasound examination versus chest radiograp-
hy in the detection of hemothorax. Ann Emerg Med 1997;29:312-315.
28. Fry WR, Smith RS, Schneider JJ, et al. Ultrasonographic examination of
wound tracts. Arch Surg 1995;130:605-608.
29. Smith RS. The focused ultrasound examination for trauma. Curr Op Crit
Care 1997;3:455-459.
12 Ультразвуковая диагностика...
ИНТЕРВЕНЦИОННАЯ
УЛЬТРАСОНОГРАФИЯ
5
Алан Е. Зиперштейн
Когда хирург при УЗИ обнаруживает в брюшной полости опухолевидное об-
разование или скопление жидкости, то следующим шагом в обследовании та-
кого пациента является получение образцов тканей через проведенную внутрь
образования иглу. Такая процедура производится вне зависимости от вида
ультрасонографии: чрескожной, интраоперационной или лапароскопической.
Интервенционная ультрасонография подразумевает использование УЗИ для
контроля положения иглы в тканях. Другие формы ультразвуковой энергии,
способные нагреть или разрушить ткани, здесь не применяются. Наиболее
часто интервенционную ультрасонографию используют для проведения тре-
панобиопсии или тонкоигольной аспирационной биопсии солидных образо-
ваний, аспирации или дренирования скоплений жидкости, а также для пунк-
ции вен.
ПРЕИМУЩЕСТВА ИНТЕРВЕНЦИОННОЙ УЛЬТРАСОНОГРАФИИ
Использование ультразвука для визуального контроля за продвижением иглы
дает множество преимуществ над другими методами непрямой визуализа-
ции. Обеспечивая исключительную точность, интервенционная ультрасо-
нография позволяет расположить кончик иглы в зоне диагностического инте-
реса с точностью до нескольких миллиметров. Ультразвуковой луч «рассекает»
ткани на срезы всего лишь несколько миллиметров шириной. Манипулируя
кончиком металлической иглы в таких условиях, можно добиться его про-
странственного позиционирования с особой точностью во всех трех плоско-
стях. УЗИ обеспечивает визуализацию продвижения иглы в тканях в реаль-
ном времени. Это дает возможность врачу перемещать иглу с высокой точно-
стью и избегать повреждения жизненно важных структур.
Ultrasound in Surgical Practice Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright© 2001 Wiley-Liss, Inc.
МЕТОДИКИ ПОЗИЦИОНИРОВАНИЯ игл
179
Ультразвуковые технологии отличаются от широко распространенных
в настоящее время методов позиционирования иглы под контролем КТ, при
которых игла направляется только по заранее запланированной траектории,
а для изменения положения иглы требуется получение нового рентгеновско-
го изображения. Чем уникален ультразвуковой контроль иглы? Столь необ-
ходимая визуализация иглы в реальном времени становится возможной в
трех плоскостях. В результате, при использовании интервенционной ульт-
расонографии врачи получают возможность достаточно быстрой диагности-
ческой визуализации нередко с минимальными временными затратами.
МЕТОДИКИ
Поскольку врачи могут произвольно изменять положение ультразвукового
датчика, доступ к области диагностического интереса может осуществляться
ими под любым углом. В целом, перемещение иглы под ультразвуковым кон-
тролем должно обеспечивать ее направление параллельно плоскости ультра-
звукового сканирования. Поскольку оборудование, используемое для этой
процедуры, является портативным, интервенционная ультрасонография мо-
жет проводиться в любых клинических условиях, включая отделения интен-
сивной терапии и операционные. В большинстве случаев применение интер-
венционной ультрасонографии дешевле, чем КТ-контроль расположения
иглы [1]. Основные методики, используемые сонографистами при чрескож-
ных, интраоперационных или лапароскопических пункциях, одинаковы. Ин-
тервенционная ультрасонография, однако, ограничена в выявлении струк-
тур, затененных костями, воздухом или газами в кишечнике. В настоящее
время большинство хирургов мало знакомо с методиками применения и обо-
рудованием для ультрасонографии.
МЕТОДИКИ ПОЗИЦИОНИРОВАНИЯ игл
Методики позиционирования игл могут быть разделены на три категории:
непрямой ультразвуковой контроль, пункция «свободной рукой», использо-
вание направляющих устройств [2].
Непрямой ультразвуковой контроль
Непрямой ультразвуковой контроль используется лишь для дренирования
больших скопления жидкостей, например плеврального выпота. Во время
УЗИ, выполняемого без обеспечения условий стерильности, в точке предпо-
лагаемого ввода иглы на кожу каким-либо маркером наносится метка. Затем,
после хирургической обработки кожи, выполняющий пункционное вмеша-
тельство врач вводит иглу, направляя ее в соответствии с данными проведен-
ного ранее УЗИ. Хирурги редко используют эту методику, поскольку она не
так точна, как методики с непосредственным контролем положения иглы.
180
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Пункция «свободной рукой»
Позиционирование иглы «свободной рукой» осуществляется врачами путем
удерживания ультразвукового датчика неосновной рукой, в то время как
основная (доминантная) рука направляет иглу к намеченной цели. Просле-
живая иглу на протяжении всей плоскости ультразвукового сканирования,
врач легко справляется с такой задачей. При совмещении траектории иглы и
плоскости ультразвукового изображения эта методика позволяет проследить
движение иглы через ткани на всем ее протяжении (гл. 6).
Результат определяет очень точная координация движений и осторож-
ное перемещение иглы и ультразвукового датчика так, чтобы игла не была
потеряна из виду. На практике пункция «свободной рукой» выполняется до-
статочно легко. Вначале кончик иглы располагается на ультразвуковом мо-
ниторе со стороны пациента, противоположной оператору, при этом датчик
ориентируется так, чтобы плоскость ультразвукового сканирования была
параллельна взгляду оператора. Это позволяет хирургу контролировать по-
ложение иглы при ее продвижении в тканях и при необходимости корректи-
ровать положение самой иглы или датчика.
В некоторых ситуациях при использовании такой методики не удается избе-
жать проникновения в структуры, расположенные рядом с зоной диагностиче-
ского интереса. В этих случаях ультрасонографпст может несколько отклонять
плоскость ультразвукового сканирования от траектории иглы. Сонографист про-
водит иглу, предпринимая небольшие отклонения датчика вперед и назад.
Направляющие устройства
Направляющие устройства прикрепляются к ультразвуковому датчику. Та-
кое оборудование позволяет провести иглу под заданным углом в выбранной
плоскости сканирования (рис. 5.1). В большинстве ультразвуковых систем на
мониторе может быть отражена линия, соответствующая траектории иглы к
цели. Современные ультразвуковые машины не способны рассчитать траек-
торию движения иглы, однако имеется соответствующее программное обес-
печение для использования направляющих устройств.
Несмотря на то, что использование таких устройств может быть обреме-
нительно, они обеспечивают наибольшую точность позиционирования игл,
при этом корректировка их положения требуется редко. После закрепления
направляющего устройства на датчике врач может проверить точность вы-
равнивания, контролируя движение иглы в емкости с водой. Перемещая иглу
в направляющем устройстве, можно выполнить его выравнивание по меткам
траектории, расположенным на мониторе. Большинство моделей направляю-
щих устройств закрепляются на датчик так, чтобы можно было слегка подров-
нять их. Направляющее устройство фиксирует иглу в плоскости ультразвуко-
вого сканирования. В результате этого игла движется только вдоль заданной
траектории; ее необходимо расположить на правильной глубине.
ИСПОЛЬЗОВАНИЕ ИНТЕРВЕНЦИОННОЙ УЛЬТРАСОНОГРАФИИ
181
Рис. 5.1. Интраоперационный ультразвуковой датчик с присоединенным устройством
для направления иглы на экране отображена игла и маркеры траектории ее
продвижения. На протяжении 1 см кончик иглы обработан так, чтобы он был более
эхогенным и лучше определялся в тканях.
При освоении врачом биопсии, проводимой под ультразвуком, исполь-
зование направляющих устройств особенно полезно, поскольку они позво-
ляют контролировать траекторию иглы. Однако с опытом биопсия методом
«свободной руки» может выполняться со сравнимой скоростью и точно-
стью, при отсутствии необходимости всегда иметь под рукой стерильное на-
правляющее устройство.
Одним из наиболее простых и наиболее ясных применений интервенци-
онной ультрасонографии является аспирация содержимого простых кист
молочной железы (рис. 5.2). Эта процедура выполняется с использованием
игл диаметром 23 G, которые доставляют пациенткам минимальное неудоб-
ство. После получения ультразвукового изображения кисты врач, применяя
технику «свободной руки» или направляющее устройство, проводит иглу в
центр образования. После аспирации шприцем киста обычно спадается, что
видно на ультрасонографе. Небольшое перемещение иглы помогает осуще-
ствить полную аспирацию содержимого.
ИСПОЛЬЗОВАНИЕ ИНТЕРВЕНЦИОННОЙ УЛЬТРАСОНОГРАФИИ
ДЛЯ ЭКСЦИЗИОННОЙ БИОПСИИ МОЛОЧНОЙ ЖЕЛЕЗЫ
Под контролем УЗИ возможно также выполнение биопсии молочной железы
[3] (рис. 5.3). Использование этой методики требует обязательной визуализа-
182
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 5.2. А. Киста молочной железы менее 2 см в диаметре. Б. Для аспирации методом
«свободной руки» игла продвигается параллельно плоскости ультразвукового
сканирования до тех пор, пока ее кончик не будет визуализирован в полости кисты.
В. После аспирации жидкости киста спадается. Г. Перед извлечением иглы врач
должен убедиться, что аспирировано все содержимое.
ции образования при УЗИ. Для диагностического доступа к микрокальцина-
там молочной железы обычно используется стереотаксическая маммогра-
фия. При обнаружении непальпируемого солидного образования следующий
шаг очевиден. Опыт убеждает в необходимости определения положения иглы
под ультразвуковым контролем непосредственно перед проведением эксци-
зионной биопсии.
Пациентка укладывается на операционный стол, кожа обрабатывается и
обкладывается. После этого получают ультразвуковое изображение образо-
вания. Траектория движения иглы выбирается так, чтобы она находилась в
ДОСТУП К ЦЕНТРАЛЬНЫМ ВЕНАМ
183
центральной части предполагаемого разреза, — это позволит при резекции
образования двигаться по траектории движения иглы. Для установки прово-
лочного маркера используется игла типа Корап. Сонографист перемещает
проволоку, находящуюся в просвете иглы, к ее кончику. Под ультразвуко-
вым контролем и проволока, и игла подводятся непосредственно к образова-
нию. После осторожного выталкивания проволочной петли сонографист изв-
лекает внешнюю иглу, не меняя при этом глубину расположения проволоки.
После удаления иглы проволока при УЗИ может визуализироваться нечетко.
Однако, если проволочная петля установлена правильно, ее осторожное пере-
мещение вперед и назад приведет к перемещению самого образования
После проведения эксцизионной биопсии образования хирург может
визуализировать образовавшуюся в результате диссекции полость для вери-
фикации его удаления. Кроме этого, сразу после удаления микрокальцина-
тов, под контролем маммографии хирург может визуализировать удаленные
ткани в емкости с солевым раствором для дополнительной верификации
удаления (рис. 5.3 Г).
ВНУТРИБРЮШНЫЕ АБСЦЕССЫ ИЛИ СКОПЛЕНИЯ ЖИДКОСТИ
При получении ультразвуковых изображений внутрибрюшных абсцессов
или скоплений жидкости хирург может успешно применять интервенцион-
ную ультрасонографию для аспирации их содержимого или дренирования
[4]. Эти жидкостные образования обычно дренируются петлеобразным дре-
нажем с несколькими отверстиями. После визуализации жидкостного обра-
зования в него проводится игла диаметром 18 G, и затем образование дрени-
руется через катетер. Аспирация часто позволяет верифицировать правиль-
ное положение кончика иглы. Через иглу проводится направляющая проволока,
которая легко визуализируется при УЗИ (рис. 5.4). При необходимости исполь-
зуются бужи-расширители, затем по проволоке устанавливается дренирую-
щий катетер. Необходимость в непосредственном ультразвуковом контроле
возникает редко. Правильное положение катетера подтверждается аспира-
цией через него жидкости. Может оказаться полезным рентгеноконтрастное
исследование (рис. 5.4 В).
ДОСТУП К ЦЕНТРАЛЬНЫМ ВЕНАМ
Другим применением интервенционных методик является использование
УЗИ для контроля доступа к центральным венам (5-7). Несмотря на то, что
УЗИ применяется не в каждом случае пункционного доступа к центральным
венам, оно часто оказывается полезным большой группе пациентов, включая
больных, страдающих ожирением с плохо выраженными анатомическими
ориентирами, пациентов с легочными заболеваниями, которые могут плохо
перенести пневмоторакс, а также в тех случаях, когда в месте установки кате-
тера необходимо выявить особенности сосудистого русла. Для подключил-
184
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 5.3. А. Маммограмма непальпируемого образования молочной железы,
увеличение которого выявлено при нескольких контрольных исследованиях. Б. На
ультразвуковом изображении для подготовки биопсии молочной железы образование
совмещено с маркерами траектории, по которой будет установлена проволочная
метка В. Через образование проведена проволочная петля типа Корап. Г. Удаленное
образование молочной железы помещено в солевой раствор и визуализировано для
подтверждения удаления.
ДОСТУП К ЦЕНТРАЛЬНЫМ ВЕНАМ
185
Рис. 5.3. (Продолжение.)
186
5 ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 5.4. А. Для дренирования внутрибрюшного абсцесса под ультразвуковым
контролем изображение его полости совмещено с маркерами траектории иглы, игла
проведена до центра абсцесса. Б. Направляющая проволока проведена в полость
абсцесса, петлеобразный дренажный катетер проведен по направляющей проволоке
В. Рентгеноконтрастное исследование подтверждает, что дренаж находится в
полости абсцесса.
МЕТАСТАЗЫ ПЕЧЕНИ
187
Рис. 5.4. (Продолжение.)
него доступа сонографисты используют те же ориентиры и траекторию иглы,
что и для установки катетера без ультразвукового контроля (рис. 5.5).
В начале обучения действия хирургов могут служить наглядным приме-
ром того, как легко можно проникнуть в подключичную артерию или повре-
дить легкое при неправильном направлении иглы. Успешное проведение био-
псии под ультразвуковым контролем заключается в точном позиционирова-
нии иглы. При прохождении иглы через ткани часто можно увидеть, как она
смещает переднюю стенку вены к задней (перед тем, как проникнет в просвет
сосуда). Это объясняет феномен отсутствия аспирации крови при продвиже-
нии иглы вперед и ее интенсивного поступления при извлечении иглы.
После того как кончик иглы становится виден в центре просвета вены,
обычным способом устанавливается проводник, положение которого под-
тверждается рентгенографическим контролем (рис. 5.5 В). Использование
ультразвукового контроля при доступе к центральным венам получает все
большее распространение. Это происходит благодаря использованию пор-
тативных ультразвуковых сканеров.
МЕТАСТАЗЫ ПЕЧЕНИ
Для интраоперационной сонографии ультрасонографисты используют те
же методики, что были описаны выше. Наиболее широкое применение ин-
тервенционная сонография нашла при проведении биопсии при подозрении
188
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 5.5. А. Стандартный подключичный доступ для установки катетера в
центральную вену под ультразвуковым контролем. Б. После проведения иглы в вену в
ее просвет начинает проводиться J-образный проводник. В. При рентгенографии
виден подкожный порт, размещенный на левой грудной стенке.
МЕТАСТАЗЫ ПЕЧЕНИ
189
на метастазы в печени [8,10]. После визуализации подозрительного образо-
вания в печени, биопсия может быть проведена либо спинальной иглой диа-
метром 22 G с последующей тонкоигольной аспирацией и цитологическим
анализом пунктата, либо устройством для трепанобиопсии. Автоматиче-
ские пистолеты для трепанобиопсии позволяют получить полноценный
столбик ткани при использовании игл диаметром 18 G. Иглы диаметром
18 G вызывают меньшее кровотечение из паренхимы печени, чем иглы диа-
метром 14 G, и в то же время позволяют получить достаточное количество
ткани для гистологического исследования. При использовании игл для тре-
панобиопсии помните, что их кончик выдвинут вперед на 1-2 см в зависи-
мости от модели.
Выполняя биопсию, продвигайте кончик иглы только до внешней гра-
ницы образования, после чего с помощью ультразвуковой визуализации
оцените расстояние, пройденное иглой после ее перемещения. Это преду-
предит нежелательное повреждение жизненно важных структур.
Анатомическая клиновидная или сегментарная резекция печени
Интервенционная ультрасонография нередко оказывается полезной при про-
ведении анатомической клиновидной или сегментарной резекции печени
(рис. 5.6). После визуализации опухоли датчик перемещается в направлении
ворот печени для идентификации сегментарных или субсегментарных ветвей
воротной вены. Для пункции ветвей воротной вены используется игла диа-
метром 22 G и направляющее иглу устройство. Для точного выделения сег-
мента печени, предназначенного для резекции, используется его окраска рас-
твором метиленовой сини, который вводят в портальную вену Действие
красителя является преходящим, однако достаточным для выполнения
электродиатермии клиновидного участка печени.
При проведении этой резекции хирурги не встречаются ни с ветвями пе-
ченочной артерии, ни с ветвями воротной вены, за исключением места инъ-
екции. По границам резекции пересекаются только ветви печеночных вен.
Такие инъекции дают важную информацию, поскольку они демонстрируют
индивидуальные особенности сегментарной анатомии печени, обнаружи-
вая, что границы между сегментами печени не являются ровными.
Операция Puestow
При проведении операции Puestow хирурги часто встречаются с трудностя-
ми, связанными с определением местоположения расширенного панкреати-
ческого протока в уплотненной ткани поджелудочной железы. Интраопераци-
онная ультрасонография позволяет хирургам точно определить расположение
панкреатического протока и находящихся в нем конкрементов. Действительно,
позиционирование иглы под ультразвуковым контролем может быть исполь-
зовано для определения местоположения протока и доступа к нему путем вы-
полнения точного рассечения тканей вдоль иглы.
190
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 5.6. А. Метастаз колоректального рака в печень, размером 3 см. Б. Опухоль с
ветвью воротной вены, несущей кровь в этот сегмент печени. В. Для облегчения
ориентировки при субсегментарной резекции печени игла диаметром 22 G при
помощи направляющего устройства проведена в просвет 3-мм ветви воротной вены
(видна под другим углом) для инъекции метиленовой сини.
Биопсия очаговых образований печени при подозрении на метастазы
Интервенционная ультрасонография может быть использована при проведе-
нии лапароскопических исследований. Наиболее часто ее применяют для
проведения биопсии очаговых образований печени при подозрении на мета-
стазы. К сожалению, в настоящее время устройств, направляющих иглу, для
лапароскопических ультразвуковых датчиков не выпускается. Поэтому та-
кие биопсии должны проводиться методом «свободной руки», а их успех за-
висит от индивидуальных способностей, даже в тех случаях, когда ультразву-
ковой датчик и игла находятся в зоне прямой видимости. Когда ультразвуко-
вой датчик и игла могут быть визуализированы на телевизионном мониторе,
их пространственное взаимоотношение в некоторых случаях может пред-
ставляться более сложным. Перед проведением лапароскопических биопсий
для улучшения пространственной ориентировки врачам рекомендуется упраж-
нение на специальном тренажере или животных.
После визуализации подозрительного в отношении опухоли образова-
ния через переднюю брюшную стенку как можно параллельнее к плоскости
ультразвукового сканирования проводится игла (рис. 5.7). Игла визуализи-
руется почти так же хорошо, как в открытой хирургии, и ее местоположение
обычно легко определяется (вследствие наличия маленьких пузырьков, ко-
торые остаются после срабатывания биопсийного пистолета).
Врачи могут проводить биопсию любого паренхиматозного органа: пе-
чени, селезенки, почек или поджелудочной железы, однако глубина про-
никновения ультразвуковой волны, генерированной лапароскопическим дат-
чиком, обычно не превышает 4 см. Поскольку продвижение рабочей части
большинства биопсийных пистолетов осуществляется на глубину до 2 см,
РАДИОЧАСТОТНАЯ ТЕРМАЛЬНАЯ АБЛАЦИЯ
191
перед выполнением биопсии хирург должен очень точно оценить направле-
ние движения иглы. Кровотечение обычно минимально и легко останавли-
вается электрокоагуляцией.
За исключением случаев, когда планируется расширенное вмешательст-
во, большинство биопсий под лапароскопическим контролем выполняется
при использовании всего двух троакаров: один используется для камеры,
другой — для ультразвукового датчика. Иглу обычно лучше проводить не-
посредственно через брюшную стенку, чем через дополнительный троакар,
поскольку для выполнения биопсии различных очагов может потребоваться
несколько точек вкола иглы.
РАДИОЧАСТОТНАЯ ТЕРМАЛЬНАЯ АБЛАЦИЯ
Возможность контроля положения иглы при лапароскопическом УЗИ позво-
ляет врачам проводить не только диагностические, но и лечебные процеду-
ры. Радиочастотная термальная аблация является относительно новой мето-
дикой. При ее проведении используется высокочастотная электрическая
энергия, такая же, как используется для электрохирургии — местный нагрев
Рис. 5.7. А. Вид метастаза меланомы в печень размером 1,5 см при сканировании
лапароскопическим ультразвуковым датчиком. Обратите внимание на то, что в желчном
пузыре имеется конкремент с характерным ультразвуковым видом. Б. Биопсия
опухоли для подтверждения метастаза меланомы под контролем лапароскопического
ультразвукового исследования. Игла автоматического биопсийного пистолета
диаметром 18 G находится в опухоли. В. Лапароскопический вид процедуры биопсии
192
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
тканей приводит к их разрушению. Несмотря на то, что такие процедуры про-
водятся чрескожно, мы адаптировали эту методику для использования при
лапараскопической интервенционной ультрасонографии, что позволило при-
менять ее при опухолях различного вида.
После идентификации очагового образования в печени и его гистологи-
ческой верификации по материалу, полученному путем трепанобиопсии, в
центр образования, для термальной аблации проводится катетер диаметром
15 G (рис 5.8). Из центра катетера развертываются 4 ветви, которые обеспечи-
ваю! распространение электрической энергии в сфере диаметром 3,5—4 см.
Электрический ток мощностью 50 Ватт вызывает нагрев тканей до 60-70 °C;
тканевая температура измеряется небольшими датчиками, помещенными на
каждом из 4 ответвлений. При нагревании тканей выделяется азот с образо-
ванием микропузырьков, диаметр которых меньше размера клеток. Они дают
яркое свечение на ультразвуковом изображении, что подтверждает разогре-
вание тканей, а также показывает границы зоны аблации (рис. 5.8В). Про-
должительность аблации составляет приблизительно 10 мин.
Для идентификации сосудов, содержащихся в крупных образованиях,
можно использовать цветовую допплерографию. Обильно васкуляризиро-
ванный квадрант опухоли может быть подвергнут аблации в первую оче-
редь. Это позволяет последующие циклы аблации сделать более короткими,
поскольку кровоток способствует охлаждению тканей, что видно при вы-
полнении аблации. Используя такую установку, мы выполнили аблацию бо-
лее 125 образований с различной тканевой структурой; предварительные ре-
зультаты подтверждают, что у отобранных больных подобная процедура
при местном лечении опухолей является эффективной.
ЗАКЛЮЧЕНИЕ
Интервенционная ультрасонография позволяет быстро и с высокой точно-
стью позиционировать иглу. При различных показаниях может быть исполь-
зовано чрескожное интраоперационное или лапароскопическое введение
иглы. Уверенное владение этими методиками позволяет хирургу быстро по-
лучить необходимую информацию, которая является основной при выборе
общей лечебной или интраоперационной тактики, а также при проведении
лечебных хирургических процедур.
ЛИТЕРАТУРА
1. Takes RP, Righi Р. The value of ultrasound with ultrasound-guided fine-ne-
edle aspiration biopsy compared to computed tomography in the detection
of regional metastases in the clinically negative neck. Int. J Radiol Oncol
Biol Physiol 1998;40:1027-1032.
2. McGahan J, Brant W. Interventional ultrasound. Baltimore. Williams &
Wilkins, 1990.
ЛИТЕРАТУРА
193
Рис. 5.8. А. Катетер для радиочастотной термальной аблации под контролем
лапароскопического УЗИ. Б. Катетер для радиочастотной термальной аблации
помещен в образование, являющееся метастазом рака. На лапароскопическом
изображении виден жесткий линейный датчик и размещение иглы перед началом
аблации. В. После выполнения аблации в результате образования и распространения
микропузырьков азота гипоэхогенная опухоль стала гиперэхогенной.
13 Ультразвуковая диагностика...
194
5. ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ
Радиочастотная
игла
Ультразвуковое
изображение*
S
Рис. 5.8. (Продолжение.)
рмя im
••MX
Опухоль
Лапароскопическое
изображение
Датчик
-Я
3. Roe SM, Mathews JA, Bums RP, et al. Stereotactic and ultrasound core ne-
edle breast biopsy performed by surgeons. Am J Surg 1997;174:699 704.
4. Goletti O, Lippolis PV, Chiaragi M, et al. Percutaneous ultrasound-guided
drainage of intra-abdominal abscesses. J Surg 1993;80:336-339.
5. Farrell J, Gellens M. Ultrasound-guided cannulation versus the landmark-
guided technique for acute haemodialysis access. Nephrol Dial Transplant
1997;12:1234-1237.
6. Hudson PA, Rose JS. Real-time ultrasound guided internal jugular vein cathe-
terization in the emergency department. Am J Emerg Med 1997;15:79-82.
7. Lane P, Waldron RJ. Real-time ultrasound-guided central venous access via
the subclavian approach. Anaesth Intensive Care 1995;23:728-730.
8. Kruskal JB, Kane RA. Intraoperative ultrasonography of the liver. Crit Rev
Diag Imaging 1995;36:175-226.
9. Barbot DJ, Marks JH, Feld RI, et al. Improved staging of liver tumors using
laparoscopic intraoperative ultrasound. J Surg Oncol 1997;64:63-67.
10. Solomon MJ, Stephen MS, Gallinger S, White GH. Does intraoperative he-
patic ultrasonography change surgical decision making during liver resecti-
on? Am J Surg 1994,168:307 310.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Siperstein AE, Rogers SJ, Hansen PD, Gitomirsky A. Laparoscopic thermal ablation of hepatic
neuroendocrine tumor metastases. Surgery 1997;122:1147-1155.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
МОЛОЧНОЙ ЖЕЛЕЗЫ
Джей К Харнесс и Марк А Джиттлмен
Основную роль в диагностике и лечении пациентов с заболеваниями молоч-
ной железы играют хирурги общей практики. Интенсивными политическими
и социальными усилиями раннее распознавание и лечение рака молочной же-
лезы возведено в ранг одной из наиболее значимых национальных задач.
Внедрение маммографического скрининга привело к увеличению числа па-
циентов с непальпируемыми или неопределяемыми другими методами диа-
гностики образованиями. Значительное технологическое усовершенствова-
ние ультразвуковых систем сделало ультрасонографию важным диагности-
ческим инструментом и неотъемлемой составной частью в обследовании
пациентов с заболеваниями молочных желез.
Пациентки с характерными жалобами, относящимися к молочным же-
лезам, обычно наблюдаются у хирурга общей практики. Жалобы включают:
ощущение уплотнения в молочной железе, выделения из соска, боли в мо-
лочной железе, а также повышенный риск заболевания раком молочной же-
лезы. Многие пациентки вначале обследуются постоянным семейным вра-
чом и проходят скрининговое маммографическое исследование. Роль хи-
рурга заключается в оценке жалоб, анамнеза, маммографических данных,
проведении физикального исследования и принятии решения о начале лече-
ния. В настоящее время УЗИ молочной железы является важнейшим допол-
нительным методом исследования для обоснованной диагностической оцен-
ки, проводимой хирургом.
Используя ультразвук, хирург становится врачом ультразвуковой диа-
гностики, синтезируя анамнестические, физикальные, ультразвуковые и мам-
мографические данные для постановки диагноза и/или принятия решения о
дальнейшем обследовании. Поэтому оценка хирурга является более полной,
а помощь пациентке — более эффективной. Эффективность диагностиче-
Ultrusound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
196
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
ского поиска особенно важна для пациентов, стремящихся совместить лече-
ние с активной жизнью в современных условиях. Добавление УЗИ в набор
диагностических средств, используемых хирургом, полезно как для самого
хирурга, так и для пациентки и наблюдающего ее врача.
В этой главе изложены основные сведения по диагностической и интер-
венционной ультрасонографии молочной железы. Она поможет научиться
лучше интерпретировать ультразвуковые изображения молочной железы, а
также более эффективно использовать УЗИ в маммологической практике.
ОБОРУДОВАНИЕ ДЛЯ УЗИ МОЛОЧНОЙ ЖЕЛЕЗЫ
Оборудование для УЗИ молочной железы должно обеспечивать получение
высококонтрастных изображений с большим разрешением. Необходимо раз-
решение, достаточное как по горизонтальной, так и по вертикальной оси.
Ультразвуковое изображение молочной железы получают в реальном времени
высокочастотным линейным датчиком с минимальной частотой 7-7,5 МГц и
фокусом, находящимся на глубине 3 см или менее. Диагностическое обору-
дование позволяет врачу изменять расположение фокусной зоны и при необ-
ходимости использовать многофокусный режим.
При использовании цветной допплерографии аппаратура должна об-
ладать достаточной чувствительностью для регистрации низкоскоростного
кровотока, что позволяет выявлять гиперваскуляризированные образования.
Для получения диагностической информации необходимо использовать на-
иболее низкую выходную мошность (50%). Все большее распространение по-
лучает УЗИ молочной железы датчиками сверхвысокой частоты (10-13 МГц),
особенно для визуализации протоковой системы.
Как наилучшим образом расположить ультразвуковое оборудование в
кабинете хирурга? Найдите место, в котором излученный ультразвук не от-
ражается. Оптимальными условиями является тихое, лишенное окон поме-
щение с регулируемым светом и достаточным пространством для кушетки,
на которой проводится исследование. Кроме того, необходимо ультразвуко-
вое оборудование, два или три человека персонала, столик с набором инст-
рументов, рабочий стол и раковина. Хорошо, если имеется возможность ис-
пользования устройства для подогревания геля. Небольшая манипуляционная
или процедурная комната часто являются идеальным местом для размещения
диагностического и интервенционного ультразвукового оборудования с це-
лью исследования молочной железы (рис. 6.1).
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ
Проведение УЗИ молочной железы в Соединенных Штатах для диагностиче-
ских целей используется чаше, чем для скрининга. В некоторых странах Ев-
ропы врачи полагаются как на диагностические, так и на скрининговые воз-
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ
197
Рис. 6.1. Ультразвуковой аппарат и столик для трепанобиопсии, установленные в
хирургическом процедурном кабинете.
можности УЗИ. В большинстве случаев УЗИ молочной железы проводится
после получения соответствующих клинических или маммографических дан-
ных. Неопытный сонографист должен использовать УЗИ молочной железы
при всех пальпируемых образованиях органа. В целом УЗИ должно проводиться
при наличии пальпируемых образований молочной железы, особенно если
это образование рентгенонегативно или обладает неспецифическими мам-
мографическими признаками. При маммографическом исследовании, в от-
личие от ультрасонографического, нельзя отличить солидное образование
молочной железы от кист. УЗИ молочной железы должно выполняться также
в тех случаях, когда на маммограмме определяется пальпируемое или непа-
льпируемое очаговое образование или узел с неспецифическими или добро-
качественными признаками.
В табл. 6.1 перечислены общие показания для УЗИ молочной железы.
УЗИ позволяет врачу провести дифференциальный диагноз между солидны-
ми и жидкостными образованиями, а также выявить те признаки, которые
указывают на доброкачественную или злокачественную природу образова-
ния. УЗИ может быть использовано для выполнения тонкоигольной аспира-
ционной биопсии или трепанобиопсии с целью получения образца ткани.
Использование последних технологических достижений позволяет ускорить
диагностический процесс.
198
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Таблица 6.1. Показания к проведению УЗИ молочной железы
Пальпируемое образование молочной железы
Высокая рентгенографическая плотность молочной железы
Маммографически неопределяемое образование
Аксиллярные лимфатические узлы
Беременность и лактация
Онкологический контроль
После мастэктомии
После органосохраняющей операции
Послеоперационное наблюдение
Гематома
Серома
Протезы
Вмешательство под ультрасонографическим контролем
Аспирация кист
Биопсия солидных образований
Предоперационная установка проволочного маркера
Тонкоигольная пункционная аспирационная биопсия аксиллярных лимфатических узлов
Перитуморальная инъекция для идентификации и биопсии регионарных лимфатических
узлов
Акустические свойства тканей молочной железы более благоприятны
для проведения УЗИ, чем ее рентгеновская плотность для проведения мам-
мографии. Ультразвук может визуализировать образования (кисты, фибро-
аденомы или рак), которые могут быть с трудом различимы или незаметны
на маммограмме.
Одним из наиболее важных аспектов ультразвуковой диагностики явля-
ется исследование образований молочной железы (как пальпируемых, так и
не пальпируемых), которые не определяются маммографически. К счастью,
ультразвуковые характеристики этих образований являются достаточно опре-
деленными, а биопсия молочной железы под ультразвуковым контролем мо-
жет быть быстро и легко выполнена как в клинике, так и в кабинете хирурга.
Использование ультразвука позволяет сократить время диагностического
поиска при таких образованиях и избежать проведения открытой эксцизион-
ной биопсии.
Во время беременности и лактации изменение плотности молочных же-
лез часто затрудняет проведение физикального исследования. УЗИ является
средством выбора для диагностики абсцессов молочной железы или галак-
тоцеле. Оно может быть также использовано для получения дополнитель-
ных диагностических данных о пальпируемых образованиях молочных же-
MEI ИКИ СКАНИРОВАНИЯ
199
лез, изредка наблюдающихся во время беременности, например быстро рас-
тущих фиброаденомах или раке. Расширяется применение УЗИ молочной
железы для контрольных наблюдений в онкологии. Ультрасонография обла-
дает высокой чувствительностью в отношении выявления и распознавания
новообразований, возникающих в грудной стенке после мастэктомии. По-
сле органосохраняющего лечения ультрасонография может использоваться
как дополнение к маммографии и физикальному исследованию для выявле-
ния местных рецидивов.
УЗИ может выявить такие общие постлучевые изменения, как истонче-
ние кожи, повышение плотности подкожно-жировой клетчатки, деструктив-
ные изменения нормальной паренхимы, а также появление гиперэхогенных
структур. УЗИ может использоваться для определения эффективности хи-
миотерапии (уменьшение размеров опухоли и уменьшение утолщения кожи
или отека, наблюдаемого у многих пациентов со стадией рака ТЗ).
УЗИ служит прекрасным средством для выявления таких послеопера-
ционных осложнений, как гематомы, серомы, нарушение целостности им-
плантатов при протезировании молочных желез. При УЗИ можно с высокой
точностью контролировать положение иглы для диагностики этих осложне-
ний и дренирования сером.
УЗИ также помогает врачу в проведении других процедур, включая ас-
пирацию кист, биопсию солидных образований, предоперационную локали-
зацию образований, проведение перитуморальных инъекций для выявления
и биопсии регионарных лимфатических узлов. Во время операции хирурги
используют ультразвук для уточнения линии разреза при доступе к протоко-
вой системе, определения местоположения непальпируемых образований, а
также для определения толщины кожного лоскута во время мастэктомии.
Другим применением УЗИ является оценка лимфатических узлов. Неиз-
мененные аксиллярные лимфоузлы визуализируются в 60-65% случаев [1].
Неизмененные лимфоузлы при УЗИ визуализируются отчетливо. Рост мета-
статической опухоли в лимфатических узлах изменяет их ультразвуковой
вид, размер и форму. При этом биопсия подозрительных в отношении мета-
стазирования лимфатических узлов может быть проведена под ультразвуко-
вым контролем.
МЕТОДИКИ СКАНИРОВАНИЯ
Пациентка укладывается в то же положение, которое используется для физи-
кального исследования: на спину с заведенной за голову рукой на стороне об-
следования (рис. 6.2). При таком положении достигаются два условия: молочная
железа истончается и максимально распластывается, а ее ткани располагаются
параллельно поверхности кожи. Эти обстоятельства позволяют использовать
высокочастотные датчики, излучение которых может проникать до грудной
стенки при оптимальном расположении фокусных зон. Положение на спине
200
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.2. Стандартное положение для ультрасонографического исследования
молочной железы. Печатается с разрешения.
также сводит к минимуму краевое затенение и предотвращает ухудшение фо-
кусных характеристик.
Положение пациентки с приподнятым боком (незавершенный поворот
на бок) позволяет минимизировать толщину тканей в верхне-наружном квад-
ранте. Образования, расположенные в латеральных квадрантах, требуют еще
большего, но все же неполного поворота пациентки на бок. Образования,
расположенные в медиальных квадрантах, наилучшим образом могут быть
визуализированы при стандартном положении на спине.
Объем УЗИ молочной железы остается предметом дискуссии клиници-
стов. Некоторые врачи настаивают на сканировании всей молочной железы
для выявления любых отклонений от эхоструктуры нормальной жировой
или железистой ткани [2, 3]. При этом может проводиться наблюдение за
образованиями, не имеющими признаков малигнизации. Лучше всего, если
сканирование всей молочной железы будет проведено по обычной методи-
ке. В начале УЗИ датчик помещается в стандартное положение на 3 часа,
при этом одна из его сторон находится у ареолы (рис. 6.3). Подобным обра-
зом датчик устанавливается в положение как для поперечного, так и для ра-
диального сканирования. Затем датчик перемещается к периферии железы в
радиальной плоскости с отклонением кверху и книзу. Датчик перемещается
к периферии железы до тех пор, пока не исчезнет изображение ее тканей. За-
тем датчик помещается в положение на 4 ч, и описанная выше последователь-
ность сканирования повторяется. Этот процесс продолжается до завершения
круга хода часовой стрелки и исследования всей молочной железы.
МЕТОДИКИ СКАНИРОВАНИЯ
201
Рис. 6.3. А. Датчик помещается в положение на 3 часа, при этом один из его краев
находится рядом с ареолой. Б. Движение датчика радиально к периферии молочной
железы. Печатается с разрешения.
Визуализация комплекса сосок ареола и расположенной под ним части
протоковой системы требует особых приемов сканирования, поскольку в
этой области имеется плотная соединительная ткань Комплекс сосок- арео-
ла может вызвать выраженное акустическое затенение вследствие затухания
ультразвукового луча. Что является причиной этого затухания? Оно вызва-
202
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.4. Датчик отклонен для визуализации субареолярной области. Печатается с
разрешения.
но неровностями поверхности кожи и плотной соединительной ткани. Для
избежания трудностей, связанных с затенением, поместите датчик рядом с
соском и отклоните ультразвуковой луч так, чтобы он попал в субареоляр-
ную область (рис. 6.4).
Исследование молочной железы заканчивается сериями поперечных дви-
жений датчика через железу, которые позволяют сонографисту оценить стро-
ение молочной железы в целом и правильность расположения связок Купе-
ра. При этом случайно могут быть обнаружены небольшие опухоли, вызы-
вающие деформацию этих связок.
Наиболее часто УЗИ молочной железы проводится хирургами после по-
лучения направленных клинических или маммографических данных. Такое
исследование обычно ограничено зоной диагностического интереса. Полное
УЗИ молочной железы должно проводиться в следующих случаях:
• неблагоприятный семейный анамнез в отношении рака молочной желе-
зы, а также в случае рентгенологически плотных молочных желез;
• пациентка отказывается от маммографии, потому что боится радиации;
• для исключения случаев мульцентрического рака после выполнения ра-
дикальной резекции и лучевого лечения;
• у пациенток с метастазами, источником которых может быть злокачест-
венная опухоль молочной железы, при негативных физикальных и мам-
мографических данных;
• при деформации соска;
МЕТОДИКИ СКАНИРОВАНИЯ
203
• при наблюдении за множественными образованиями молочной железы;
• при подозрении на разрыв силиконового протеза.
Исследование солидных образований молочной железы в радиальной и
антирадиальной плоскостях предпочтительнее, чем в продольной и попе-
речной (рис. 6.5). Сканирование в плоскости, совпадающей с ходом прото-
ковой системы, поможет выявить прорастание протоков злокачественной опу-
холью. Расширение протока, изменение его формы могут служить косвен-
ными ультразвуковыми признаками злокачественного новообразования
(рассматривается ниже).
Важно помнить, что непальпируемые, выявленные при маммографии
образования при УЗИ могут определяться в другом месте. Почему? При
маммографии пациентка стоит, а при УЗИ — лежит на спине или полубоку.
Следует добиваться полного совпадения маммографических и ультразвуко-
вых данных, что может потребовать сканирования всего квадранта и/или
всей железы.
Оформление результатов УЗИ является неотъемлемой частью высоко-
качественной диагностической помощи. Должны быть получены и сохране-
ны изображения всех основных областей (как в норме, так и при изменени-
ях). На изображении должны находиться данные о дате исследования, фами-
лия и номер медицинской карты пациентки, место получения изображения,
сторона тела (правая или левая), положение датчика относительно цифер-
блата часов (это может быть указано на дополнительной диаграмме молоч-
ной железы). При использовании часовой диаграммы отмечается как поча-
совое расположение образования, так и его расстояние от соска.
Рис. 6.5. А. Положение датчика для продольного и поперечного сканирования.
Б. Положение датчика для радиального и перпендикулярного к нему сканирования
204
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.6. Вращение датчика.
При выявлении образования необходимо установить его наибольший
горизонтальный размер, повернув для этого датчик соответствующим обра-
зом (рис. 6.6). Это измерение следует зафиксировать на изображении наряду
с величиной образования, полученной под прямым углом к самому длинно-
му размеру. Несмотря на то, что существуют другие системы документации
результатов УЗИ молочной железы, именно система, описанная выше, полу-
чила одобрение такой организации, как American Institute of Ultrasound in
Medicine (AIUM).
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ
Анатомические составляющие молочной железы и окружающих ее структур
имеют типичные сонографические особенности. Эти составляющие включа-
ют в себя кожу, подкожную жировую клетчатку, связки Купера, поверхност-
ную фасцию, паренхиму, ареолу, глубокую фасцию, ретромаммарное про-
странство. грудные мышцы, ребра, плевру, а также интрамаммарные и аксил-
лярные лимфатические узлы (рис. 6.7)
Подкожная, ретромаммарная и интрамаммарная жировая ткань гипо-
эхогенна в сравнении с железистой тканью. Почему? Потому что в этой тка-
ни имеется относительно небольшое число компонентов, отражающих ульт-
развуковой луч. У большинства пациенток при УЗИ молочной железы пре-
обладает изображение жировой ткани. Шкала компенсации временных по-
терь должна быть установлена так, чтобы жировая клетчатка выглядела од-
нородной во всех отделах молочной железы (средние значения на шкале се-
рого цвета).
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ
205
Рис. 6.7. Схема поперечного среза молочной железы с главными анатомическими
ориентирами.
Сонографисты используют эхоплотность жировой клетчатки для срав-
нительной оценки эхоплотности других структур, при этом изоэхогенными
называются узлы с такой же эхо плотностью, как у жировой ткани. Гипоэхо-
генные образования темнее, чем жировая ткань. Такие ткани, как кожа, под-
держивающие связки, фасции, соединительная ткань в дольках железы, вы-
глядят светлее, чем жировая ткань, и являются гиперэхогенными. Нормаль-
ная железистая ткань гиперэхогенна по сравнению с жировой, поскольку
она состоит из протоков, железистых долек, жировых и соединительноткан-
ных элементов — все вместе они более интенсивно отражают ультразвуко-
вой луч.
Кожа
Неизмененный кожный покров обычно представлен двумя тонкими эхоген-
ными линиями, разделенными узкой гипоэхогенной полоской (дермой) [4].
Толщина кожи обычно составляет 1-2 мм. Чтобы хорошо рассмотреть кожу,
сонографист может использовать специальную насадку на датчик, содержа-
щую жидкость. При использовании датчика с высоким разрешением опреде-
ляется внутренняя граница эпидермиса, в то время как наружный контур
кожи сливается с полоской, образованной отражением звука от самого датчи-
ка (рис. 6.8). В нижних квадрантах молочной железы толщина кожи обычно
меньше. Толщина кожи может изменяться при воспалительных заболевани-
ях, после облучения, в результате нарушения оттока лимфы, или инфильтра-
ции злокачественной опухолью. Утолщение кожи до 5-10 мм часто встреча-
ется при лимфедеме молочной железы.
Жировая ткань
Содержание жировой клетчатки в молочной железе зависит от возраста, веса
тела и акушерского анамнеза. У молодых худощавых женщин жировой клет-
206
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Полоска,
образованная
отражением
звука от датчика
Кожа
Вена
Рис. 6.8. Изображение кожи над молочной железой, замещенной жировой тканью.
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
207
чатки мало, или она отсутствует вовсе, в то время как в постменопаузальном
периоде железистая ткань может полностью замещаться жировой (рис. 6.8).
Жировые дольки выглядят овальными в одной плоскости и удлиненными в
перпендикулярной плоскости сканирования [5]. Жировые дольки, находящи-
еся в подкожно-жировой клетчатке молочной железы, обычно имеют боль-
ший размер, чем жировые дольки, заполняющие ретромаммарное простран-
ство.
Куперовские связки
Куперовские связки обеспечивают соединительнотканную поддержку мо-
лочной железы. При УЗИ они выглядят как тонкие шатровидные эхогенные
дуги (рис. 6.9). Куперовские связки могут давать акустическую тень. Измене-
ние угла наклона датчика относительно поверхности молочной железы часто
устраняет это затенение и позволяет более четко визуализировать паренхиму
молочной железы.
Поверхностный листок поверхностной фасции
Поверхностный листок поверхностной фасции обычно легко визуализирует-
ся, поскольку имеет вид гиперэхогенной полоски, расположенной между жи-
ровой клетчаткой и железистой тканью [6] (рис. 6.10). Злокачественные обра-
зования вовлекают или нарушают целостность смежной фасции из-за дес-
мопластической реакции организма на рак. Доброкачественные образования
только смещают фасцию по мере того, как увеличиваются в размерах.
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
Структуры, составляющие паренхиму молочной железы, обычно выглядят
более гомогенными по сравнению с жировыми дольками. Однако в паренхи-
матозной зоне могут определяться гипоэхогенные участки, соответствую-
щие жировой ткани. Изображение железистой ткани обычно сочетается с
изображением небольших гипоэхогенных участков протоковой системы мо-
лочной железы. Можно выделить четыре основных типа изображений парен-
химы молочной железы: ювенильный, пременопаузальный, постменопаузаль-
ный, а также возникающий при беременности и лактации [7].
Ювенильная железа выглядит гиперэхогенной и содержит небольшое
количество жировой ткани. В пременопаузальной молочной железе часто
определяются участки паренхимы, замещенные жиром, что является отра-
жением начинающихся инволютивных изменений (рис. 6.11). Может также
увеличиваться объем подкожной и ретромаммарной жировой ткани. В пост-
менопаузальном периоде в молочных железах может определяться сниже-
ние эхоплотности соединительной ткани на фоне общего снижения эхоген-
ности. В целом в постменопаузальном периоде основная масса молочной
208
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.9. Куперовские связки выглядят как яркие гиперэхогенные шатровидные дуги,
идущие от паренхимы молочной железы сквозь подкожную жировую клетчатку к коже.
железы замещается жировой тканью (рис. 6.8 и 6.10). В жировой клетчатке
заметны Куперовские связки, а также соединительная ткань фасций и пере-
городок. Во время беременности и лактации наблюдается повышение объе-
ма железистой ткани и расширение протоковой системы молочной железы;
большая часть подкожно-жировой и ретромаммарной клетчатки замещается
увеличивающейся в объеме паренхимой (рис. 6.12).
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
209
Рис. 6.10. Вид поверхностной фасции в молочной железе, замещенной жировой
тканью.
Область соска
За ареолярной областью сонографисты обычно наблюдают акустическую
тень (рис. 6.13). Она образуется в основном плотной соединительной тканью
соска и соединительной тканью сливающихся млечных протоков. Кожа арео-
14 Ультразвуковая диагностика ...
210
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.11. УЗИ молочной железы женщины 41 года с неизмененной кожей,
подкожно-жировой клетчаткой и некоторой эхонеоднородностью железистой ткани.
лярной области менее эхогенна, чем окружающая ее кожа молочной железы.
Млечные протоки от области соска отходят в радиальном направлении. По
мере приближения протоков к соску они увеличиваются, образуя млечные
синусы. Протоки визуализируются как анэхогенные тубулярные структуры
диаметром 1-8 мм, прогрессивно уменьшаются и становятся невидимыми в
периферической части молочной железы [6] (рис. 6.14).
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
211
Рис. 6.12. А. Вид нормальной молочной железы при беременности. Обратите
внимание на повышение плотности паренхимы и множество расширенных протоков.
Б. Вид расширенных протоков во время беременности при радиально расположенном
датчике.
212
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Глубокий листок поверхностной фасции
Глубокий листок поверхностной фасции сонографисты определяют в виде
тонкой гиперэхогенной линии, расположенной над ретромаммарной клет-
чаткой и грудной мышцей.
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
213
Кожа
-Тень
за соском
Рис. 6.13. Акустическая тень при расположении датчика над соском.
Ретромаммарная клетчатка
Ретромаммарная клетчатка заполняет пространство, расположенное позади
железистой ткани кпереди от грудной мышцы (рис. 6.15). Размеры этого про-
странства различны и зависят от объема жировой клетчатки. Поскольку в по-
ложении лежа на спине, принимаемом пациенткой во время ультразвукового
исследования, передне-задний размер этого пространства уменьшается, на
сонограммах оно может выглядеть меньшим, чем на маммограммах.
214
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.14. Нормальный вид протоковой системы с радиальным ходом протоков в
области соска.
Грудные мышцы
Эти мышцы хорошо видны во время УЗИ при сканировании вдоль направле-
ния их волокон (при поперечном положении датчика). Мышцы находятся
между эхогенными фасциальными листками и разделены эхогенной соеди-
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
215
Кожа-
Куперовская
связка
Железистая
ткань
Ретромаммарная
клетчатка
Г рудная
мышца
Рис. 6.15. Значимые анатомические структуры неизмененной молочной железы.
нительнотканной перегородкой. Мышечные пучки выглядят гипоэхогенны-
ми, они расположены кпереди от ребер и ориентированы параллельно коже
(рис. 6.16). Визуализация грудных мышц убеждает в том, что паренхима мо-
лочной железы на стороне исследования пройдена ультразвуковым лучом
полностью на всю глубину.
216
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.16. А. Грудная мышца расположена кпереди от ребер. Б. Грудная мышца
расположена ниже железистой ткани.
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
217
Рис. 6.16. (Продолжение.)
218
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Ребра
При продольном сканировании через медиальные парастернальные участки ре-
бер они определяются как структуры овальной формы с гомогенным внутренним
эхосигналом. Ребра представлены гипоэхогенными или анэхогенными структура-
ми, располагающимися позади грудных мышц. Они задерживают ультразвук, что
приводит к образованию выраженной акустической тени за ними (рис. 6.17).
Между ребрами могут визуализироваться межреберные мышцы.
Рис. 6.17. А. Продольное сканирование через хрящевую часть ребра. Обратите
внимание на акустическую тень позади ребра и изображение плевры. Б. Изображение
плевры и тени позади ребра при продольном сканировании через ребро.
ПАРЕНХИМА МОЛОЧНОЙ ЖЕЛЕЗЫ
219
Рис. 6.17. (Продолжение.)
Кожа
Ребро
Плевра
220
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Плевра
Плевра выглядит как широкая гиперэхогенная линия позади ребер (рис. 6.16 А
и 6.17).
Аксиллярные сосуды
Аксиллярные сосуды определяются в виде тубулярных структур, пульсиру-
ющих во время исследования.
Лимфатические узлы
Лимфатические узлы могут выявляться как в паренхиме молочной железы,
так и в аксиллярной области. Неизмененные лимфатические узлы часто оваль-
ной формы с эхогенной жировой тканью в области ворот (рис. 6.18). Малень-
кие, неизмененные лимфатические узлы могут иметь сходство с жировой доль-
кой или сложной кистой [8, 9].
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
Доброкачественные и злокачественные новообразования молочной железы
имеют широкий спектр ультрасонографических проявлений. Наибольшей
специфичностью обладает сочетание сонографических признаков злокачест-
венных новообразований. Однако признака со 100%-ной специфичностью не
существует. На рис. 6.19 перечислены 6 основных признаков, используемых
большинством ультрасонографистов при проведении УЗИ молочной желе-
зы: контуры; акустические феномены, возникающие позади образования;
эхоструктура образования; его эхогенность; изменение формы при компрес-
сии и влияние компрессии на внутреннюю эхоструктуру [7]. Каждый из этих
признаков имеет различные проявления при доброкачественных, злокачест-
венных и неопределенных образованиях. Важным признаком является фор-
ма образования, которая в отдельных случаях может указывать на его добро-
качественную или злокачественную природу. Кроме перечисленных, сущест-
вуют и другие признаки, помогающие определить, является ли образование
злокачественным.
Контуры
Оценка контуров образования является важным шагом исследования, поскольку
позволяет определить степень отграниченное™ образования от окружаю-
щих его тканей. Четкие контуры между неизмененными тканями и образова-
нием возникают при их незначительном влиянии друг на друга, в то время как
нечеткие контуры указывают на ответную реакцию организма [3]. Контуры
кист и фиброаденом обычно четкие с резким ограничением образования от
окружающей железистой ткани [10] (рис. 6.20). Малигнизированное образо-
вание, а также участок фиброзно-кистозных изменений обычно выглядят
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
221
Рис. 6.18. Неизмененный лимфатический узел овальной формы с жировой тканью в
области ворот.
222
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
1. Контуры
о О)
f нечеткие, неровные
четкие неровные
четкие и ровные
нечеткие, но сглаженные
о> гомогенная
о о анэхогенная
3. Эхоструктура
негомогенная
слабоэхогенная,
негомогенная
2. Ретротуморальные акустические
эффекты
4. Эхоплотность
о о
0) о
« х близкая к анэхогенной
Рис. 6.19. Аналитические критерии для интерпретации ультразвуковых данных при
очаговых образованиях молочной железы. Печатается с разрешения [7].
Ь
сливающимися с окружающими тканями (рис. 6.20 В). В начале своего роста
небольшие карциномы могут вызывать минимальную реакцию со стороны
окружающих тканей, в результате чего их контуры выглядят достаточно чет-
кими (рис. 6.20 Г).
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
223
Артефакт
Киста
Краевая
тень
Зона-
дорсапьного
усиления
Рис. 6.20. А. Обычный вид кисты. Обратите внимание на ее ровные контуры, анэхогенное
содержимое с реверберационным артефактом, краевые тени и дорсальное усиление
ультразвука. Б, Фиброаденома с ровными контурами. В. Карцинома с неровными
контурами, нечетко отграниченная от окружающих тканей. Г. Образование размером
7 мм с ровными четкими контурами в начальной стадии роста.
224
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
Фиброаденома
Рис. 6.20. (Продолжение.)
Гиперэхогенный ободок возникает в результате ответной реакции на
опухоль (десмопластическая реакция) и наиболее часто наблюдается при
малигнизации [11] (рис. 6.21). При абсцессах молочной железы, а также при
некоторых формах фиброзно-кистозной мастопатии сонографисты наблю-
дают схожую ответную реакцию (рис. 6.22).
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
225
Рис. 6.20. {Продолжение.)
15 Ультразвуковая диагноста ка ...
226
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
Карцинома
Рис. 6.20. {Продолжение.)
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
227
Кожа
Г иперэхогенный
ободок
Карцинома
Акустическая
тень
Рис. 6.21. Карцинома молочной железы с гиперэхогенным ободком, эхонеоднородной
внутренней структурой и акустической тенью.
228
6, УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.22. Абсцесс молочной железы (анэхогенная область) с перифокальными
гипоэхогенными изменениями в паренхиме.
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
229
Рис. 6.23. Фиброаденома со сглаженными контурами (А) и злокачественное
образование с инфильтрирующим ростом, неровным контуром (Б) и гиперэхогенным
ободком (десмопластическая реакция) у женщины 61 года.
Сглаженность контуров указывает на то, каким является край образова-
ния: дольчатым, шиповатым или гладким на всем протяжении. Десмопла-
стическая реакция приводит к появлению неровного контура (рис. 6.23). Уг-
ловатые (с выраженными углами) контуры и мелкодольчатая структура мо-
гут отмечаться при злокачественных образованиях молочной железы,
описание которых приведено ниже.
Акустические феномены, возникающие за опухолью
Глубже образования может наблюдаться несколько акустических феноме-
нов. К ним относятся дорсальное акустическое затенение, дорсальное усиле-
ние, краевое затенение. Эти явления не связаны с эхоструктурой зон, окружаю-
щих образование. Изменение эхопроницаемости оценивается по относитель-
ному количеству (по сравнению с окружающими неизмененными тканями)
230
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.24. Гиперэхогенный край и акустическая тень, наблюдающаяся в двух
различных плоскостях, при почти анэхогенной карциноме с инфильтративным ростом.
ультразвуковой энергии, прошедшей через образование, если часть ультра-
звукового луча была поглощена или отражена. Развитие десмопластической
реакции при многих злокачественных образованиях вызывает поглощение и
отражение значительной части ультразвукового луча, в результате чего за ча-
стью опухоли или за всем образованием наблюдается возникновение акусти-
ческой тени. Наличие истинной акустической тени можно определить только
в том случае, если она наблюдается при сканировании в двух различных
плоскостях (рис. 6.24).
Дорсальное усиление выглядит как светлая полоска, возникающая позади
образования, в результате повышения проницаемости образования для ульт-
развукового луча, т. е. ультразвуковой луч, проходя через образование, не
поглощается им или не отражается вовсе или в меньшей степени по сравне-
нию с окружающим тканями. Классическим примером дорсального усиления
является светлая полоса, возникающая позади простой кисты (рис. 6.20 А).
Дорсальное усиление может также наблюдаться позади таких солидных об-
разований, как фиброаденома, и некоторых видов злокачественных новооб-
разований (рис. 6.25).
Краевое затенение представляет собой артефакт, возникающий в резуль-
тате отражения ультразвукового луча от сглаженного края. Такие края име-
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
231
Кожа
-Карцинома
Зона
-дорсального
усиления
-Краевая
тень
Рис. 6.25. Внутренняя эхонеоднородная структура, краевые тени и дорсальное
усиление ультразвука от раковой опухоли, видимые в двух различных плоскостях.
ют кисты и фиброаденомы (рис. 6.23 А). Двустороннее краевое затенение на-
блюдается при доброкачественных образованиях молочной железы: односто-
роннее затенение — при злокачественных новообразованиях [7]. На рис. 6.26
приведено сравнение акустической тени от злокачественного новообразова-
ния с дорсальным усилением ультразвука, возникающим при прохождении
им полости кисты.
Внутренняя эхоструктура
Под внутренней эхоструктурой понимают упорядоченность или текстуру
эхосигналов от внутренней части образования. Внутреннюю эхоструктуру
описывают как гомогенную или гетерогенную. Фиброаденомы обычно вы-
глядят как образования с гомогенной эхоструктурой (рис. 6.27). Полное от-
сутствие отражения эхосигнала наблюдается при простых кистах. Зоны фиб-
розно-кистозных изменений молочной железы обычно имеют гетерогенную
эхоструктуру, поскольку содержат участки фиброза, микрокисты и/или рас-
ширенные протоки [15] (рис. 6.28). Карциномы могут обладать широким
спектром различий в гомогенности эхоструктуры. Некоторые небольшие
карциномы могут выглядеть относительно гомогенными (рис. 6.20 Г), в то
232
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
время как другие—с более выраженным инфильтративным ростом—имеют
гетерогенную эхоструктуру [16] (рис. 6.29). В целом для доброкачественных
образований характерна большая гомогенность. Напротив, эхоструктура зло-
качественных новообразований более гетерогенна [16].
Эхоплотность
Эхоинтенсивность образования различают анэхогенную, гипоэхогенную, изо-
эхогенную или гиперэхогенную по сравнению с неизмененной нодкожно-жи-
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
233
Рис. 6.27. Большая двухузловая фиброаденома. Обратите внимание на то, что
эхоструктура образования является в основном гомогенной.
ровой клетчаткой. В отношении того, что считать стандартом для сравнения
эхоплотности, нет единодушного мнения. Некоторые авторы указывают, что
фоном для сравнения эхоплотности должна быть неизмененная железистая
ткань [12]. Однако железистая ткань с фиброзными элементами не является
хорошей «точкой отсчета», поскольку любая структура, за исключением каль-
цификатов, будет являться гшюэхогенной по сравнению с железистой тка-
нью. Из литературы, посвященной УЗИ молочных желез, видно, что приня-
тие в качестве фона эхоплотности жировой или железистой ткани использу-
ется в равной степени. Эхоплотность образования зависит от гомогенности
составляющих его тканей. Простые кисты являются анэхогенными, потому
что не содержат субстрата, способного отразить ультразвуковой луч. Слож-
ные кисты содержат частицы, которые отражают ультразвуковой луч. что
приводит к появлению гиперэхогенных участков (рис. 6.30). С другой сторо-
ны, карциномы могут быть анэхогенными (рис. 6.31), почти анэхогенными
(рис. 6.25), гипоэхогенными или изоэхогенными по сравнению с жировой
клетчаткой [17]. При инфильтративном росте опухоли ткань молочной желе-
зы без формирования очаговых образований становится изоэхогенной, сме-
234
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.28. Гетерогенная эхоструктура зоны фиброзно-кистозных изменений (фиброз
стромы, гиперплазия железистой ткани и расширение протоков).
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
235
Рис. 6.29. Гетерогенная эхоструктура карциномы. Обратите внимание на
одностороннюю краевую тень и дорсальное усиление ультразвука.
шанной эхогенности или даже гиперэхогенной по сравнению с неизмененной
железистой тканью [3].
Изменение формы и эхоструктуры при компрессии
Одним из преимуществ УЗИ, проводимого в режиме реального времени, яв-
ляется возможность получения динамических изображений. После компрес-
236
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.30. Многокамерная, разделенная перегородками киста с гиперэхогенными
внутренними структурами.
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
237
Рис. 6.31. Карцинома с анэхогенной внутренней эхоструктурой.
Кожа
Карцинома
238
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
сии тканей датчиком сонографист может наблюдать изменение формы обра-
зования. Если форма изменяется, образование, скорее всего, является добро-
качественным. Отсутствие изменения формы при компрессии, однако, не
является значимым признаком, поскольку приблизительно 50% всех злока-
чественных и доброкачественных образований не меняют свою форму под
воздействием компрессии [18]. Образования молочной железы, внутренняя
эхоструктура которых при компрессии становится более гомогенной, с высо-
кой вероятностью являются доброкачественными.
Другие признаки
Солидные образования молочной железы могут обладать и другими соногра-
фическими признаками. Помните, что использование набора признаков должно
привести к классификации образования как доброкачественного, злокачест-
венного или неопределенного.
«Выше, чем шире». Эта характеристика означает, что высота образования
больше, чем поперечный или кранио-каудальный размер [17]. Другим спосо-
бом оценки этой характеристики является вычисление соотношения между
продольным и поперечным размерами образования (больше 1). Плоскости
тканей молочной железы располагаются горизонтально при стандартном по-
ложении пациентки. Образования, которые «выше, чем шире», растут сквозь
плоскости тканей и с наибольшей вероятностью являются злокачественны-
ми, чем образования, направление роста которых совпадает с плоскостью
расположения тканей (рис. 6.32).
«Шире, чем выше». Рост доброкачественных образований происходит
параллельно плоскости тканей, поэтому их форму можно определить как
«шире, чем выше» (соотношение продольного и поперечного размеров мень-
ше 1) (рис. 6.20 Б). Другим признаком доброкачественных образований, ко-
торые «шире, чем выше», является их эллипсовидная форма [17]. Фиброаде-
нома, представленная на рис. 6.23, имеет эллипсовидную форму. Тонкая эхо-
генная капсула, окружающая солидный узел, указывает на оттесняющий,
неинвазивный характер роста, что является признаком доброкачественности.
Приблизительно 67% образований, доброкачественный характер которых
подтверждается биопсией, имеют тонкую эхогенную капсулу [17].
Клиницистами установлено, что УЗИ не является достаточно хорошим
средством для выявления микрокальцинатов. Это является одной из причин
того, что ультрасонография не может рассматриваться как скрининговый
метод в отношении рака молочной железы. Датчиками с высоким разреше-
нием микрокальцинаты могут определяться как эхогенные точки (рис. 6.33).
Кальцификаты размером больше 1 мм дают акустическую тень. Поскольку
большинство карцином молочной железы являются гипоэхогенными или
очень гипоэхогенными, белые эхопозитивные точки кальцификатов хорошо
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
239
Рис. 6.32. А. Карцинома, размеры которой «выше, чем шире», имеет неровные
контуры, гетерогенную эхоструктуру и дает акустическую тень. Б. Почти анэхогенная
карцинома с формой «выше, чем шире», гетерогенной структурой и невыраженным
эффектом дорсального усиления.
240
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
Карцинома
Зона
дорсального
усиления
Рис. 6.32. (Продолжение.)
ДИАГНОСТИЧЕСКИЕ УЛЬТРАЗВУКОВЫЕ КРИТЕРИИ
241
Рис. 6.33. А. В гипоэхогенной карциноме с гетерогенной структурой и акустической
тенью определяются два кальцификата. Б. Множественные микрокальцификаты в
изоэхогенной карциноме с гетерогенной структурой.
16 Ультразвуковая диагностика...
242
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.33. {Продолжение.)
СОНОГРАФИЧЕСКАЯ КЛАССИФИКАЦИЯ ОБРАЗОВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ 243
выделяются на относительно черном гипоэхогенном фоне (рис. 6.33). Если
при ультрасонографии выявляются кальцификаты, то образование, скорее,
является злокачественным, чем доброкачественным [19]. Белый фон нормаль-
ной гиперэхогенной железистой ткани с выраженным развитием соединитель-
ной ткани затрудняет визуализацию гиперэхогенных микрокальцинатов.
Поэтому частота сонографического выявления кальцификатов в малигнизи-
рованных образованиях выше, чем в доброкачественных.
Признаки локализации. Расширение протока, ветвистая форма, мелкодоль-
чатый вид считаются признаками внутрипротоковой локализации образова-
ния и повышают вероятность его злокачественности [17]. Для выявления
этих признаков образование следует сканировать в плоскости расположения
протоковой системы (радиально и антирадиально) (рис. 6.34). Доброкачест-
венные образования могут иметь мелкодольчатое строение, но количество
таких долек обычно не превышает трех.
СОНОГРАФИЧЕСКАЯ КЛАССИФИКАЦИЯ ОБРАЗОВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ
Однозначного сонографического признака, позволяющего определить, явля-
ется образование злокачественным или доброкачественным, не обнаружено.
Определение природы образования возможно только по набору диагностиче-
ских признаков Установить вид любого образования абсолютно точно мо-
жет только биопсия.
Исследование Stavros
В 1995 г. были опубликованы результаты классического исследования, в ко-
тором ультрасонография использовалась для выявления различий между
доброкачественными и злокачественными образованиями [17]. В исследова-
нии 750 солидных образований, выявленных при УЗИ у 622 женщин, были
разделены на три категории: доброкачественные, неопределенные и злокаче-
ственные. В табл. 6.2 представлен перечень индивидуальных ультразвуко-
вых признаков, используемых для оценки образований в соответствии с э ти-
ми категориями. Была выполнена биопсия всех образований — либо трепа-
нобиопсия, которая проводилась иглой 14 G, либо эксцизионная биопсия.
Общая точность УЗИ в распознавании доброкачественной или злокачествен-
ной природы образования составила 72,9%, чувствительность—98,4% и спе-
цифичность — 68,7%. Точность положительной оценки была 38,0%, отрица-
тельной — 99,5%.
Приведенное исследование укрепило уверенность в том, что ультразву-
ковое сканирование молочной железы с высоким разрешением может ока-
зать значительную помощь в дифференцировании многих доброкачествен-
ных образований от солидных злокачественных. Сделано два существенных
вывода: образование не должно расцениваться как доброкачественное, если
244
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
Расширение
протока
Карцинома
Акустическая
тень
Рис. 6.34. Сканирование в радиальной плоскости выявляет расширение протоков
{стрелка) вследствие инфильтративного роста карциномы.
СОНОГРАФИЧЕСКАЯ КЛАССИФИКАЦИЯ ОБРАЗОВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ______________________________245
Таблица 6.2. Ультрасонографические признаки, в исследовании Stavros использованные
Злокачественные" Доброкачественные6 Неопределенные®
Шиповатые края Отсутствие признаков Максимальный диаметр1
Угловатые контуры злокачественности Изоэхогенность
Г ипоэхогенность Акустическая тень Выраженная гиперэхогенность Средняя гипоэхогенность Проведение ультразвука без
Кальцификаты Эллипсовидная форма его изменения
Расширение протока Невыраженная двух- или трехдольчатость Усиление ультразвука
Древовидная форма Тонкая эхогенная Гетерогенная структура
Микро дольчатость псевдокапсула Гомогенная структура
"При наличии хотя бы одного признака злокачественности образование не можег считаться
доброкачественным.
^Признаки доброкачественности.
®3начения большинства показателей были близки к единице, что указывает на их слабую
прогностическую ценность.
гНаиболыпий размер, полученный в любой плоскости.
оно имеет хотя бы один признак злокачественности, а окончательный диа-
гноз должен устанавливаться по данным биопсии. Кроме того, чтобы узло-
вое образование могло быть классифицировано как доброкачественное, требу-
ется сочетание определенных признаков. Наличие следующих трех сочетаний
признаков позволяет классифицировать образование как доброкачественное:
а) выраженная и однородная гиперэхогенность; б) эллипсовидная форма в
сочетании с тонкой эхопозитивной капсулой; в) невыраженная дольчатость
(2-3 дольки) в сочетании с тонкой эхопозитивной капсулой.
Исследование Kelly
Kelly с соавторами [20] провели ретроспективное изучение данных УЗИ 887
образований молочной железы у 832 пациенток. Авторы создали шкалу ма-
лигнизации, которая включала в себя 13 параметров (табл. 6.3). Если значе-
ние параметра соответствовало признаку доброкачественного образования,
ему присваивалось значение, равное 0, если злокачественному — значение,
равное 1. Значение S использовалось только для двух параметров (четкость
контуров и форма). Используя все 13 параметров, авторы вычисляли общий
сонографический показатель для каждого образования.
Окончательные результаты исследования Kelly приведены в табл. 6.4.
Значения общего показателя от 0 до 0,5 указывают на отсутствие малигниза-
ции. При общем показателе от 1,0 до 5,0 процент малигнизированных обра-
зований повышался до 98,6. Наличие одного признака малигнизации на
100% исключало доброкачественную природу образования.
246
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Таблица 6.3. Параметры, использованные для шкалы малигнизации
в исследовании Kelly
Доброкачественное Злокачественное
Параметр Количество Процент Количество Процент
Четкость контура 23/386 6,0 274/452 60.0
Неопределенная 83/386 21,5 134/452 28,2
Форма 23/386 6,2 252/452 55,8
Неопределенная 96/386 24,9 157/452 34,7
Эхогенный ободок 6/374 1,6 121/452 26,7
Отношение вертикального размера 19/377 5,0 103/421 24,5
к горизонтальному
Акустическая тень 39/388 10,1 194/454 42,7
Визуализация небольших протоков 34/412 8,3 365/475 76,8
Фи брозирование 19/412 4,6 284/475 59,8
Сопротивление компрессии 37/280 13,2 234/334 70,1
Васкуляризация 69/342 20,2 278/374 74,3
Визуализация крупных протоков 18/412 4,4 34/475 7,2
Кальцификаты 15/53 28,3 135/138 97,8
Прорастание кожи 0/412 0,0 44/475 10,8
Признаки изменения 3/40 7,5 59/345 17,1
лимфатических узлов
Таблица 6.4. Количественные показатели малигнизации
877 образований в исследовании Kelly
Оценка Злокачественное Доброкачественное Исключения
Количество Процент Количество Процент
0,0-0,5 0 0 218 100,0
1,0 2 2,5 79 97,5 9 протоковых карцином in situ и метастатический узел
1,5 5 14,7 29 85,3 3 рубца
2,0-2,5 37 41,6 52 58,4
3,0-3,5 65 76,5 20 23,5
4,0-4,5 74 91,4 7 8,6
5,0+ 282 98,6 4 1,4
Общая 465 97,5 409 99,2 13 (10 злокачественных; 3 доброкачественных)
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
247
Анализ Staren
Радиологами были усовершенствованы две описанные схемы классифика-
ции. Staren [21, 22] предложил модификацию классификации результатов
УЗИ молочной железы с точки зрения хирурга. Используя различные диагно-
стические признаки, Staren и O'Neill [23] отметили, что определяемые при
ультрасонографии образования молочной железы могут быть разделены на
четыре категории: простые кисты, фиброаденомы или доброкачественные
фиброзные узлы, неопределенные (в том числе сложные кисты и образова-
ния, эхоструктура которых не позволяет определить, являются они солидны-
ми или кистозными), а также образования, подозрительные в отношении ма-
лигнизации. Далее Staren предложил классифицировать образования как
имеющие низкий, неопределенный или высокий риск малигнизации. Образо-
вания, связанные с низким риском, имеют гомогенную структуру, четкие
контуры, дают дорсальное усиление ультразвука и в некоторых случаях дву-
стороннюю краевую тень. Овальная форма образований, скорее всего, свиде-
тельствует о низком риске малигнизации. В большинстве таких случаев ре-
комендовно выполнять аспирационную и/или трепанобиопсию под ультра-
звуковым контролем. Наблюдение за любым образованием, признанным
доброкачественным, является безопасным.
Образования с неопределенным риском малигнизации характеризуют-
ся гетерогенной структурой с несколько дольчатым, но гладким краем Об-
щим признаком таких образований является превышение их длины над вы-
сотой. Обычно это фиброаденомы большого размера, реже сложные кис-
ты. Однако в 10-15% таких образований обнаруживается малигнизация
[23]. Авторами рекомендовано выполнять под ультразвуковым контролем
биопсию всех образований с неопределенным риском. Безопасно наблю-
дать можно только те образования, доброкачественная природа которых
верифицирована.
Образования с высоким риском имеют ультрасонографические призна-
ки малигнизации. Биопсия в таких случаях выполняется обязательно. Для
образований с признаками малигнизации биопсия может выполняться непо-
средственно перед операцией. При подтверждении малигнизации проводит-
ся соответствующее предоперационное планирование.
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
Фиброзно-кистозные изменения
Фиброзно-кистозные изменения характеризуются наличием крупных или
мелких кист и узлов фибросклероза. Крупные кисты могут быть как просты-
ми, так и сложными.
248
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Простые кисты
Простые кисты полностью анэхогенны, с четкими контурами и заключены в
тонкую капсулу. Вследствие хорошей проводимости ультразвука эти кисты
дают эффект дорсального усиления и образуют тонкие краевые тени. С таки-
ми кистами также может быть связано возникновение реверберационных ар-
тефактов в передней (расположенной ближе к датчику) трети или половине
образования (рис. 6.35). Эти артефакты могут быть устранены при изменении
величины отражения ультразвука в зоне расположения кисты. Если киста об-
ладает вышеуказанными признаками, вероятность ее малигнизации практи-
чески исключена.
Сложные кисты
К сложным кистам относятся кисты с гипоэхогенным внутренним содержи-
мым и кисты, содержащие внутри себя элементы распада (рис. 6.36А). Слож-
ные кисты могут содержать тонкие и/или толстые внутренние перегородки,
вогнутые или выпуклые утолщения стенок, а также гроздевидные скопления
множественных мелких кист (рис. 6.36Б). Стенки кист должны тщательно
исследоваться во всех плоскостях, поскольку в редких случаях причиной об-
разования кисты могут быть находящиеся в ее полости папиллярная карци-
нома или доброкачественные папилломы небольшого размера [3]. В кистах с
эхопозитивными жидкостными включениями имеется повышенное содержа-
ние крови или газа. Карциномы, содержащие коллоидные массы, могут быть
очень похожи на кисты с эхопозитивными жидкостными включениями [3].
Содержимое сложных кист должно быть аспирировано под контролем УЗИ, а
полученная жидкость — направлена на цитологическое исследование.
Фиброаденомы
Большинство фиброаденом легко диагностируется при УЗИ. Фиброаденомы
молочной железы гипоэхогенны относительно фиброзно-железистой парен-
химы, они могут быть изоэхогенны жировым долькам [14]. Большая часть та-
ких образований гомогенна, однако могут отмечаться участки с гетерогенной
эхоструктурой. Большинство фиброаденом овальной формы, «шире, чем
выше», с четкими очертаниями; их контуры крупнобугристые [17, 24]. Фиб-
роаденомы обладают различной эхоплотностью; многие из них дают неболь-
шое дорсальное усиление ультразвука (рис. 6.3 7А). Дорсальное затенение на-
блюдается редко (рис. 6.37 Б, рис. 6.3 8А). Иногда в фиброаденомах наблюда-
ются микро- и даже макрокальцификаты.
Точное измерение фиброаденомы на ультрасонографическом изобра-
жении рекомендуется проводить в двух плоскостях. Такие измерения исполь-
зуются для дальнейшего наблюдения за образованием и оценки изменения
его размеров с течением времени. Фиброаденомы — это наиболее часто
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
249
Рис. 6.35. Простая анэхогенная киста с реверберационными артефактами в передней
(ближайшей к датчику) половине образования.
250
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
Киста
Краевая
тень
Зона
акустического
усиления
Рис. 6.36. А. Сложная киста с эхопозитивным содержимым. Б. Сложная киста с
внутренними перегородками.
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
251
Рис. 6.36. (Продолжение.)
252
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
Фиброаденома
Дорсальное
усиление
Рис. 6.37. А. Типичный вид фиброаденомы. Б. Четко ограниченная, анэхогенная
фиброаденома размером 7 мм с невыраженной дорсальной акустической тенью.
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
253
Кожа
Фиброаденома
Вена
Рис. 6.37. (Продолжение.)
254
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
-Тень
Рис. 6.38. А. Хорошо очерченная фиброаденома (13 х 12 х 7 см) с разнородной
гомогенной и гетерогенной внутренней эхоструктурой. Б Филлоидная опухоль с
гиперэхогенной внутренней эхоструктурой, гипоэхогенными включениями и
дорсальной акустической тенью.
Кожа
Фиброаденома
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
255
Кожа
-Г ипоэхогенные
включения
Акустическая
тень
Листовидная
---опухоль
Рис. 6.38. (Продолжение)
256
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
встречающиеся образования молочной железы у женщин моложе 30 лет. У
цветных женщин встречаются множественные и двусторонние формы обра-
зования.
Листовидные опухоли
Филлоидные опухоли—это крупные, четко отграниченные дольчатые обра-
зования, развивающиеся главным образом у женщин старше 30 лет. Их рост
часто характеризуется высокой скоростью. Более чем у 40% пациенток с этой
опухолью обнаруживаются также и фиброаденомы [25]. Сонографические
данные при этом образовании неспецифичны. Отмечаются сглаженность
контуров и гетерогенная внутренняя эхоструктура, дорсальное затенение и
гипоэхогенные включения [26] (рис. 6.38 Б).
Абсцессы
Абсцессы молочной железы наиболее часто наблюдаются в период лактации.
Физикальное обследование, как правило, выявляет классические симптомы —
красноту, припухлость, боль и повышение температуры. У нелактирующих
пациенток абсцесс обычно локализован в ретроареолярной области (рис. 6.22).
Сонографический вид абсцессов молочной железы различен [27]. Это могут
быть сложные образования с неровными контурами или весьма хорошо очер-
ченные образования эллипсовидной формы с незначительным внутренним
эхосигналом и дорсальным усилением. Тонкоигольная аспирация под конт-
ролем УЗИ может помочь в постановке диагноза.
Дуктильная эктазия
Расширение протоков является наиболее частой причиной выделений из со-
ска, особенно у женщин в постменопаузальном периоде. Выделения обычно
зеленоватые, серозные, иногда кровянистые и могут наблюдаться из обоих
сосков. УЗИ является хорошим методом оценки состояния пациенток с выде-
лениями из соска. При дуктальной эктазии сонографически определяются
множественные расширенные протоки, сходящиеся к соску [28]. Содержи-
мое протоков может быть анэхогенным, но при включениях просвет протока
выглядит гипоэхогенным. Если встречаются только единичные расширенные
протоки, следует исключить интрадуктальную папиллому или карциному.
Интрадуктальные папилломы
В типичных случаях интрадуктальные папилломы проявляются выделения-
ми из одного соска, которые по своей природе чаще либо кровянистые, либо
серозные. «Золотым» стандартом в диагностике этих поражений являлась
дуктография (рис. 6.39). В настоящее время с помощью высокочастотных
датчиков (7,5-13 МГц) можно получать качественное изображение протоко-
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
257
Рис. 6.39. Дуктограмма выявляющая дефекты наполнения вызванные интрадуктальной
папилломой.
вой системы. Для исследования молочной железы в повседневной практике
применяют датчики с частотой 10—13 МГц, особенно при выделениях из соска.
Сонографический вид интрадуктальной папилломы варьирует от малень-
ких внутрипротоковых образований при небольшом расширении протоков
до увеличивающихся обширных разрастаний с прогрессирующим расшире-
нием и окончательной обструкцией протоков (рис. 6.40). Внутрикистозные
папилломы могут оказаться интрадуктальными папилломами, заключенными
в закупоренном сегменте протока, увеличение размера которого за счет сек-
рета папилломы приводит к формированию вторичной кисты [29] (рис. 6.41).
Рекомендуется хирургическое иссечение такого образования, поскольку со-
нографически доброкачественные папилломы нельзя отличить от атипич-
ной папилломы или маленькой папиллярной карциномы.
Карциномы молочной железы
Инвазивные карциномы имеют различные сонографические проявления, обу-
словленные их размером, локализацией и степенью десмопластической реак-
17 Ультразвуковая диагностика...
258
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Кожа
-Проток
Внутрипротоковая
папиллома
Рис. 6.40. Радиальное сканирование, демонстрирующее внутрипротоковую
папиллому.
ции организма. Для типичной инвазивной карциномы характерны следую-
щие признаки [3]:
• гипоэхогенная структура с гетерогенной внутренней эхоструктурой
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
259
Рис. 6.41. А и Б. Два различных вида кисты с внутрикистозной папилломой
В. Внутрикистозная папиллома в анэхогенной кисте.
• неровные контуры (прорастающие капсулу)
• преобладание высоты над шириной (вертикальная ориентация)
• отбрасывание плотной дорсальной тени
• тесная связь с толстым эхогенным ободком (десмопластическая реак-
ция, сдавление паренхимы)
• деструкция соседних фасциальных перегородок
• обструкция соседних протоков.
Средний размер карциномы молочной железы у женщин, регулярно подвер-
гающихся маммографическому скринингу в Соединенных Штатах, ограни-
чивается 1 см [30]. Если реакция организма мала или отсутствует вовсе, ульт-
расонографический вид минимальных карцином (и некоторых крупных) бу-
дет отличаться от приведенного здесь описания. В таком случае карцинома
может быть гипоэхогенной, почти сферической формы и обнаруживать сво-
бодное проведение излучения (рис. 6.25 и 6.42). Такие образования, однако,
плохо сжимаемы, а на границе с ними могут отмечаться дилатированные про-
токи. Следует осмотреть протоки на всем их протяжении, сканируя железу с
применением радиального и антирадиального методов (рис. 6.34).
260
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Папиллома
Кожа
Киста
Рис. 6.41. (Продолжение.)
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
261
Кожа
Опухоль
Рис. 6.42. Небольшая сферическая, гипоэхогенная, по размеру «выше, чем ниже» опухоль.
Большинство карцином молочной железы проявляются как гипоэхоген-
ные или почти анэхогенные образования — из-за десмопластической реак-
ции и потому, что опухоль может замещать собой все другие ткани
(рис. 6.43). В результате для формирования отражающей поверхности оста-
262
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
•Кожа
Г иперэхогенный
ободок
Опухоль
Рис. 6.43. А. Почти анэхогенная карцинома с неправильными контурами с
гиперэхогенной (десмопластической) реакцией. Б. Гиперэхогенная, инфильтративная
дуктальная карцинома с неправильными контурами
СОНОГРАФИЧЕСКИЕ ПРИЗНАКИ ОТДЕЛЬНЫХ ЗАБОЛЕВАНИЙ
263
Кожа
Опухоль
Рис. 6.43. (Продолжение.)
264
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
ется небольшое разнообразие тканей [3]. Некоторые карциномы молочной
железы проявляются исключительно как инфильтративные опухоли (напри-
мер, инвазивная дольковая карцинома) и обнаруживают гиперэхогенную
или смешанную эхогенность, поскольку увеличивают число отражающих
поверхностей, пенетрируя нормальную жировую и железистую ткань. Эти
отростки также создают хорошо различимую дорсальную акустическую
тень [16]. Такие опухоли зачастую трудно и даже невозможно описать, ис-
пользуя маммографию.
В исследованиях Stavros [17] и Kelly [20] более 98% всех малигнизиро-
ванных образований при ультрасонографии были классифицированы как не-
определенные или, вероятно, злокачественные. Хирурги должны действо-
вать как сонографисты-клиницисты, которые в процессе постановки диагноза
учитывают анамнестические данные, результаты физикального, маммогра-
фического и ультразвукового исследования. При любом неопределенном
образовании или подозрении на злокачественное заболевание хирург дол-
жен без замешательства выполнять биопсию под ультразвуковым контро-
лем (рис. 6.44).
ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
Для выполнения вмешательства на молочной железе под ультрасонографи-
ческим контролем пациентка помещается в то же положение, что и для диа-
гностического исследования; т. е. в положение лежа на спине с заведенной за
голову рукой. Иногда необходимо немного повернуть пациентку для обеспе-
чения лучшего доступа к образованию.
Если при диагностическом УЗИ определяется сложная киста или неяс-
ное образование, то для подтверждения солидной или кистозной природы
поражения проводится тонкоигольная аспирация под ультразвуковым конт-
ролем. Новичку-ультрасонографисту можно порекомендовать использова-
ние биопсийных проводников, облегчающих расположение иглы внутри об-
разования. Более опытные сонографисты предпочитают технику «свободной
руки», особенно в случаях предполагаемого наличия кистозного образования.
Целью обеих методик является поддержание траектории иглы в преде-
лах длинной оси ультразвукового луча, чтобы иметь возможность визуали-
зации иглы по мере ее продвижения к образованию (рис. 6.45 А и Б). Распо-
ложение иглы, наиболее параллельное датчику (при технике «свободной
руки»), дает ее полное изображение (рис. 6.45 В и Г).
Как только кончик иглы введен в образование, производится аспирация
шприцем. Если область определяется как киста, дальнейшие манипуляции с
жидкостью зависят от ее характеристик и степени разрешения кисты
(рис. 6.46 А и Б). Напротив, если поражение определяется как солидное, или
если оно было идентифицировано как солидное при диагностическом УЗИ, то
это является показанием к выполнению тонкоигольной или трепанобиопсии.
ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
265
Кожа
Дорсальное
усиление—
Рис. 6.44. Неопределенное патологическое образование, оказавшееся в дальнейшем
инфильтрирующей карциномой протока молочной железы.
266
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.45. А. Типичная траектория иглы при биопсии через проводник. Б. Траектория
иглы при косом доступе к образованию, применяется при пункции с проводником и
«свободной рукой». В. Параллельная (датчику) траектория иглы к образованию
Г. Вид поперечного среза иглы (параллельной датчику) в кисте.
Как в случае тонкоигольной аспирации, так и при трепанобиопсии под
ультразвуковым контролем кожа над областью интереса предварительно об-
рабатывается и обкладывается стандартным способом. Тем временем дат-
чик обрабатывается диальдегидным раствором. При готовности пациентки
на открытый лоток помещаются датчик, стерильный акустический гель и
трепан.
ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
267
Рис. 6.45. (Продолжение.)
Существует множество автоматических систем для трепанобиопсии,
включая модели одноразового и многоразового использования с широким
разнообразием игл. Автоматизированные системы для трепанобиопсии дей-
ствуют с помощью механизма, подобного двухфазному выстрелу. В первой
фазе — острая внутренняя игла с вырезом, образующим гнездо или камеру,
продвигается вперед сквозь образование. Почти одновременно острие внеш-
ней полой иглы-канюли продвигается над внутренней иглой, захватывая ку-
сочек ткани в биопсийную камеру (рис. 6.47).
268
6, УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.46. Киста до (А) и после (Б) аспирации
Рис. 6.47. Игла для трепанобиопсии с тканью в рабочей камере
ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ 269
Для выполнения трепанобиопсии под контролем ультразвука использу-
ются трепаны, или иглы большого диаметра (14 G). Различные исследова-
ния показали уменьшение числа случаев неопределенного или неудовлетво-
рительного гистологического диагноза при использовании игл большого
диаметра [21,22, 31, 32]. Кроме того, крупнокалиберные иглы вызывают не-
значительное увеличение числа осложнений по сравнению с иглами мень-
шего диаметра. В наших учреждениях используются стандартные иглы для
трепанобиопсии диаметром 14 G с 23-мм амплитудой и 17-мм биопсийной
камерой внутри канюли.
Для облегчения продвижения трепана на коже делается маленький над-
рез скальпелем №11. Игла продвигается с помощью пункционного адапте-
ра и/или техники «свободной руки» в плоскости, параллельной длинной оси
ультразвукового датчика. Игла проходит сквозь кожу и подкожно-жировую
клетчатку в паренхиму молочной железы вплоть до пунктируемого образо-
вания (рис. 6.48 А). В этой точке автоматическое биопсийное устройство
выстреливает, и игла выдвигается вперед (рис. 6.48 Б-Д). Для обеспечения
безопасности и удовлетворительного выполнения биопсии, рекомендуется
визуализировать весь путь движения иглы сквозь образование на мониторе.
После каждого выстреливания игла извлекается; открывается камера и
оценивается качество полученного образца ткани. Ткань незамедлительно
замачивается в растворе формальдегида. Солидная ткань быстро погружает-
ся на дно флакона, в то время как жировая — всплывает. В большинстве слу-
чаев рекомендуется i [роведение минимум пяти или шести пункций для обес-
печения получения адекватных образцов ткани. Несмотря на то, что иногда
выполняется оценка замороженных срезов этих тканей, для послойного гис-
топатологического исследования более распространена обработка ткани фор-
малином.
Биопсия молочной железы под ультразвуковым контролем, выполнен-
ная, как описано выше, наглядно показывает возможность ее точного, лег-
кого и воспроизводимого проведения [23]. Множество неопределенных
образований может быть диагностировано как кисты или доброкачествен-
ные солидные образования (рис. 6.49); следовательно, хирурги, применяю-
щие ультразвук, могут избежать выполнения ненужной открытой эксцизи-
онной биопсии. Злокачественные новообразования также могут быть иден-
тифицированы с помощью ультразвуковой техники, которая облегчает
планирование лечебного подхода. В результате, в большинстве случаев не-
обходимо только одно — окончательное оперативное вмешательство.
Интервенционная ультрасонография может применяться для ТПАБ вы-
зывающих подозрение аксиллярных лимфатических узлов у пациенток с
морфологически подтвержденным раком молочной железы [33] (рис. 6.50).
Ультразвук используется также при размещении проволочного маркера внутри
подозрительного образования до проведения биопсии или люмпэктомии.
Кроме того, ультразвук в реальном времени может применяться в операци-
270
6. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.48. А. Трепанобиопсия молочной железы свободной рукой. Положение иглы до
(Б и Г) и после (ВиД) «выстрела».
ИНТЕРВЕНЦИОННАЯ УЛЬТРАСОНОГРАФИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
271
Выстрелившая
игла для------
трепанобиопсии
Рис. 6.48. (Продолжение.)
Выстрелившая
-------игла для
трепанобиопсии
онной для непосредственного направления действий хирургов при образо-
ваниях молочной железы, для контролирования диссекции протоковой сис-
темы, особенно при наличии отдаленной интрадуктальной папилломы. Уль-
тразвук можно также применять для определения толщины кожного лоскута
во время кожесохраняющей мастэктомии и при дренировании однокамерно-
го абсцесса молочной железы, наблюдающегося у женщин в период лакта-
ции.
Методики биопсии сторожевых лимфоузлов при определении стадии
заболевания у пациенток с выявленным первично инвазивным раком молоч-
ной железы в настоящее время модифицируются, поскольку эта диагности-
ческая технология постоянно совершенствуется. Остается много вопросов:
являются ли необходимыми обе инъекции — технеция и изосульфана сине-
го или достаточно применения одного из них? Какой промежуток времени
оптимален для инъекции радиоизотопного вещества, предшествующей хи-
рургическому исследованию? Какая область оптимальна для инъекции
кожа, подкожная клетчатка, периареолярная или перитуморальная? Многие
исследователи описывают технику перитуморальной инъекции одного из
двух или обоих меченых веществ. При перитуморальной инъекции ультра-
272
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.49. Маммографически неопределенное, непальпируемое образование
(стрелка).
звук оказывает неоценимую помощь, обеспечивая прямую визуализацию
этой процедуры. Перитуморалытое введение технеция под ультразвуковым
контролем (в том случае, если образование может быть обнаружено при
ультрасонографии) должно выполняться приблизительно за 4 ч перед опера-
тивным вмешательством и в специальном помещении радиоизотопного от-
деления. За 5 мин до хирургического вмешательства в предоперационной
комнате под ультразвуковым контролем может быть выполнена дополнитель-
ная перитуморальная инъекция изосульфана синего. Методика подобна той,
которая применяется для локализации иглы под ультразвуковым контролем
непосредственно перед выполнением люмпэктомии.
ОГРАНИЧЕНИЯ И ОШИБКИ ПРИ УЛЬТРАЗВУКОВОМ ИССЛЕДОВАНИИ
МОЛОЧНОЙ ЖЕЛЕЗЫ
Применение современного УЗИ в определении пальпируемых и непальпиру-
емых образований молочной железы расширяет показания и использование
ОГРАНИЧЕНИЯ И ОШИБКИ ПРИ УЛЬТРАЗВУКОВОМ ИССЛЕДОВАНИИ МОЛОЧНОЙ ЖЕЛЕЗЫ
273
Рис. 6.50. Нормальный лимфоузел овальной формы с жировой тканью в воротах (А) и
дольчатый метастатический лимфоузел (Б).
этой технологии. Несмотря на то, что ультразвуковые изображения молоч-
ной железы были явно улучшены, их трактовка, безусловно, имеет ограниче-
ния и ошибки, связанные с техникой.
Самым важным для современного УЗИ является качество изображения,
связаное с несколькими факторами: классом (и износом) аппарата, качест-
вом и моделью датчика, использованием оборудования надлежащим обра-
зом (усиление, TGC, фокальная зона, техника сканирования), а также опы-
том работы и эрудицией производящего исследование.
УЗИ молочной железы требует применения высококачественного осна-
щения и высокочастотных датчиков. В целом, для получения хороших изоб-
ражений молочной железы имеет смысл приобретать оборудование стоимо-
стью 40000 долл, и более. Дорогостоящее оборудование позволяет получить
изображения высокого качества и имеет больше дополнительных возмож-
ностей (например, цветной допплер). Датчики с большой частотой дороже,
но они обеспечивают более высокое разрешение изображения молочной же-
лезы.
Качество изображения напрямую связано с умением сонографиста пра-
вильно использовать оборудование. За среднее значение шкалы серого при
18 Ультразвуковая диагностика...
274
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
УЗИ молочной железы принимается один из оттенков серого цвета изобра-
жения подкожно-жировой клетчатки. TGC регулировка должна обеспечи-
вать равномерность усиления как в близлежащих, так и отдаленных облас-
тях. Жировая ткань должна быть представлена однородным серым цветом
во всех квадрантах молочной железы. Настройка фокусных зон имеет реша-
ющее значение не только для обнаружения поражения, но и для точного
описания его характеристик.
Технику сканирования можно освоить во время посещения курса обуче-
ния УЗИ молочной железы, практики на манекенах, совместной работы с
опытным сонографистом и самостоятельного обследования пациентов. Тех-
нике УЗИ молочной железы хирурги обычно обучаются быстро в силу хоро-
шей координации между руками и зрением и способности ориентироваться
в трехмерном пространстве.
УЗИ может выявлять даже маленькие образования, диаметром всего
2-3 мм, но его способность к дифференцировке солидных образований и
кист при таких размерах в большинстве случаев ограничена, даже когда
применяется передовое оборудование. УЗИ также ограничено в идентифи-
цикации образований, являющихся изоэхогенными относительно нормаль-
ной железистой ткани молочной железы [31].
Сонографисты, исследующие молочную железу, должны помнить: даже
единственный сонографический признак малигнизации или атипии означа-
ет, что данное поражение не является доброкачественным на 100%. Вслед-
ствие этого биопсия под контролем ультразвука (тонкоигольная или трепа-
нобиопсия) является средством предупреждения ложно-отрицательной интер-
претации [23]. Кроме того, важно избежать «потери» образований, видимых на
маммограммах, предотвращая небрежность в распознавании при УЗИ вто-
ричного поражения, чтобы не пропустить его вместе с первичным образова-
нием. Внимательное сопоставление результатов маммографического и ульт-
расонографического исследований является неотъемлемой частью диагнос-
тического поиска [3].
Интерпретация артефактов ультразвуковых изображений молочной
железы служит хорошим напоминанием о правиле медицины никогда не
говорить «никогда» и никогда не говорить «всегда». Хорошим примером
этого правила является ретротуморальное (дорсальное) затенение и усиле-
ние ультразвука. Дорсальное усиление подразумевает, что природа обра-
зования доброкачественная, а дорсальное затенение — что образование
злокачественное. В действительности может встречаться противополож-
ное соотношение. Некоторые карциномы молочной железы (например, ме-
дуллярный рак) могут давать дорсальное усиление ультразвука. Как дорсаль-
ное затенение может выглядеть внутренняя (задняя) сторона Куперовских
связок, зарубцевавшиеся биопсийные шрамы, а также кальцифицирован-
ные фиброаденомы. Неодходимо остерегаться и не принимать мнимое за
действительное.
ЗАКЛЮЧЕНИЕ
275
Обучение биопсии молочной железы под ультразвуковым контролем
требует времени и терпения (рис. 6.51). Навыки не следует приобретать на
ультрасонографических курсах: для этого больше подойдут ультразвуковые
фантомы, затем, по мере развития сноровки, можно переходить на пациен-
тов. Прежде чем осваивать трудную технику пункции маленьких, непальпи-
руемых образований, лучше начать с пунктирования легко пальпируемых
образований. Огромной осторожности требует биопсия образования, приле-
жащего к грудной стенке, — небрежность не должна привести к развитию
п невмоторакса.
ЗАКЛЮЧЕНИЕ
УЗИ молочной железы должно рассматриваться хирургами как существен-
ное дополнение к физикальному обследованию и клиническому процессу
принятия решения (постановки диагноза). На сегодняшний день УЗИ не толь-
ко позволяет отличать солидное образование от кистозного. Эта технология
обеспечивает клинициста значимой информацией о природе образования мо-
Рис. 6.51. А и Б. Ранний опыт ТПАБ фиброаденомы Игла для ТПАБ визуализируется
не в центре образования. В и Г. Трепанобиопсия карциномы. Отмечается хорошее
расположение иглы.
276
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 6.51. (Продолжение.)
лочной железы, гарантируя точность тонкоигольной и трепанобиопсии, и помо-
гает в других манипуляциях и лечении заболеваний молочной железы. УЗИ
необходимо принять на вооружение в новом тысячелетии, расширяя его ис-
пользование.
ССЫЛКИ
1. Yang WT, Ahuja A, Tang A, et al. Ultrasonographic demonstration of nor-
mal axillary lymph nodes-а learning curve. J Ultrasound Med 1995; 14:
823-827.
2. Khattar S, Staren ED. Diagnostic breast ultrasound. In: Staren ED, Arregui
MA, eds., Ultrasound for the surgeon. Philadelphia: Lippincott-Raven,
1997:85-108.
ссылки
277
3. Kelly КМ. Sonographic evaluation of benign and malignant breast lesions.
Crit Diag Imaging 1996;37:79-161.
4. Kopans DB, Meyer JE, Proper KII. Double line of skin thickening on sonog-
rams of the breast. Radiology 1981;141:485-487.
5. Spencer GM, Rubens DJ, Roach DJ. Hypoechoic fat monographic pitfall.
AJR Am J Roentgenol 1995; 164:1277-1280.
6. Rosen PP. Breast pathology. Philadelphia: Lippincott-Raven, 1997.
7. Leucht D, Madjar EL Teaching atlas of breast ultrasound. New York: Thie-
me Medical, 1996.
8. Gordon PB, Gilks B. Sonographic appearance of normal intramammary
lymph nodes. J Ultrasound Med 1988;7:545-548.
9. Chan 1NV, Troupin RH, Yeh I-T. Solid axillary masses: attempts at Sonog-
raphic differentiation of an axillary lymph node from fibroadenoma. Breast
Dis 1989;2:187-194.
10. Tohno E, Cosgrove D, Slone J. Fibroadenoma. In: Tohno E, Cosgrove D,
Sloane J, eds., Ultrasound diagnosis of breast diseases. Edinburgh: Churc-
hill Livingstone, 1994:76-81.
11. Marguet KL, Funk A, Fendel H, et al. Der echodichte Randsaum und hyper-
reflexive Auslaufer: Sensible Kriterien maligner Prozesse in der Mammoso-
nographie. Geburtshilfe Frauenheilkd 1993;53:20-23.
12. Leucht W, Rabe D, Schmidt W. Beurteilungskriterien fur die Mammoso-
nographie. Geburtshilfe Frauenheilkd 1988;48:78-79.
13. Jackson VP. Sonography of malignant breast disease. Semin Ultrasound CT
MR 1989;10:119-131.
14. Jackson VP, Rothschild PA, Kreipke DL, et al. The spectrum of Sonograp-
hic findings of fibroadenoma of the breast. Invest Radiol 1986;21:31-40
15. Bader W, Bohmer S, Otto WR, et al. Teturanalyse: ein neues verfahren zur
beurteilung sonographisch darstellbarer hcrdbefunde der mamma. Bildge-
bung, 1994;61:284 290.
16. Teubner J, Bohrer M, van Kaick G, et al. Correlations between histopatholo-
gy and echomorphology in breast cancer. In: Madjar H, Teubner J, Hackelo-
er B-J, eds., Breast ultrasound update. Basil: Karger, 1994:63-67.
17. Stavros AT, Thickman D, Rapp CL, et al. Solid breast nodules: use of so-
nography to distinguish between benign and malignant lesions. Radiology
1995;196:123-134.
18. Salvador M, Salvador R, Olona M. Tumor hardness: an ultrasonographic
sign in breast pathology. Bildgebung 1993;60(suppl 2):62-65.
19. Kasumi F, Sakuma H. Identification of microcalcifications in breast cancers
by ultrasound. In: Madjar H, Teubner J, Hackeloer B-J, eds., Basel: Karger,
1994:154-155.
278
6. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
20. Kelly КМ, Vesolowski CA, Bryan DC, et al. A new paradigm for the sonog-
raphic evaluation of the breast for malignancy. In press.
21. Staren ED. Ultrasound-guided biopsy of nonpalpable breast masses by sur-
geons. Ann Surg Oncol 1996;3:476-482.
22. Staren ED. Ultrasound for surgeons. Curr Surg 1997;54.339-353.
23. Staren ED, O'Neill TP. Breast ultrasound. Surg Clin North Am 1998;78:
219-235.
24. Fomage BD, Lorigan JG, Andry E. Fibroadenoma of the breast: sonograp-
hic appearance. Radiology 1989; 172:671 675.
25. Rosen PP. Breast pathology. Philadelphia: Lippincott-Raven, 1997.
26. Jackson VP Benign breast lesions In: Bassett LW, Jackson VP, Jahan R, et
al., eds., Diagnosis of diseases of the breast. Philadelphia. Saunders, 1997:
429-435.
27. Mendelson EB. The breast. In: Rumack CM, Wilson SR, Charboneau JW.
eds., Diagnostic ultrasound. 2nd ed. St. Louis: Mosby, 1998:751-789.
28. Rizzatto G, Chersevani R. High resolution breast sonography and mammary
duct ectasia. In: Madjar H, Teubner J, Hackeloer B-J, eds., Breast ultraso-
und update. Basel: Karger, 1994:189-190.
29. Tohno E, Cosgrove D, Sloane J. Intraduct papilloma. In: Tohno E, Cosgrove
D, Sloane J, eds., Ultrasound diagnosis of breast diseases Edinburgh: Chur-
chill Livingstone, 1994:94-95.
30. Cady B, Stone MD, Schuler JG, et al. The new era in breast cancer-invasion,
size and nodal involvement dramatically decreasing as result of mammog-
raphic screening. Arch Surg 1996:131:301 308.
31. Staren ED. Surgical office-based ultrasound of the breast. Am Surg 1995;
61:619-627
32. Staren ED, Fine R. Breast ultrasound for surgeons. Am Surg 1996;62:
108-112.
33. Bonnema J, van Cell AN, van Ooljen B, et al. Ultrasound-guided aspiration
biopsy for detection of nonpalpable axillary node metastases in breast can-
cer patients-new diagnostic method. World J Surg 1997:21:270-274.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Джей К. Харнесс и Петер Ф. Чако
Ключевую роль в диагностике и лечении пациентов с заболеваниями щито-
видной и паращитовидных желез играют хирурги общей практики и опериру-
ющие эндокринологи. Хирурги должны владеть терапевтическими и хирур-
гическими аспектами этих заболеваний, соответствующими предопераци-
онными диагностическими методиками, интраоперационной техникой и
послеоперационным наблюдением за пациентом. Большинство больных, нуж-
дающихся в хирургическом лечении эндокринного заболевания, всесторонне
обследовано и имеет установленный диагноз еще до обращения к хирургу.
Обычно им выполнялись лабораторные исследования и разнообразные
диагностические процедуры, включая диагностическую тонкоигольную пунк-
ционную аспирационную биопсию (ТПАБ) узлов щитовидной железы. Если
для установления диагноза были предприняты такие обширные усилия, для
чего хирургу общей практики или оперирующему эндокринологу необходимо
умение выполнять ультрасоно! рафическое исследование таких пациентов?
Осваивая ультразвуковую технологию, хирурги нередко находят ей твор-
ческое применение. Хирургу-сонографисту следует помнить, что ультра-
звук служит дополнением к физикальному исследованию и изучает про-
странственную (трехмерную) анатомию исследуемых органов. Радиологи
сталкиваются с некоторыми трудностями: обычно, в отсутствие физикаль-
ного обследования и при наличии только ограниченных анамнестических
сведений, единственный путь к установлению диагноза для них — это полу-
чение и исследование изображения. Хирурги, напротив, используют изобра-
жения комплексно, чтобы сформулировать диагноз и мысленно воссоздать
картину, с которой они столкнутся в операционной.
Относительно поверхностное расположение щитовидной и паращито-
видных желез делает эти органы легкодоступными для исследования ульт-
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications,, Edited by Jay K. Hamess
and Dennis В Wisher. ISBN: 0-471 24538-0 Copyright© 2001 Wiley-Liss, Inc.
280 7 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
развуком высокого разрешения в реальном времени (либо серошкальным,
либо допплеровским). Нормальная анатомия и патологические состояния
могут быть отражены с удивительной ясностью. Хирурги общего профиля и
оперирующие эндокринологи находят, что информация, полученная в резуль-
тате ультрасонографического исследования указанных желез, выполняемо-
го ими самостоятельно, оказывается полезной в принятии диагностического
решения и выборе хирургической тактики.
ОБОРУДОВАНИЕ И МЕТОДИКА
УЗИ щитовидной и паращитовидных желез следует проводить высокочас-
тотными линейными датчиками с частотой 7,5-15 МГц в реальном времени.
Линейные датчики обеспечивают прямое широкое поле обзора и могут ис-
пользоваться как для серошкального, так и для цветного допплеровского
исследования. Ультрасонографическое оборудование должно допускать
регулировку передаваемой фокусной зоны и позволять использовать мно-
жество фокусных зон.
Пациенты обследуются обычно в положении лежа на спине, с валиком
или небольшой подушкой, помещенной под плечи; шея — вытянута. Это по-
ложение подобно тому, какое используется при оперативных вмешательствах
на щитовидной и паращитовидных железах. Область проекции щитовидной
железы должна исследоваться как в поперечной, так и продольной плоско-
сти (рис. 7.1).
Полное исследование щитовидной железы включает в себя исследование
перешейка. Железу следует визуализировать от верхних полюсов (включая
сосуды верхнего полюса) до самой нижней части — нижних полюсов. Ис-
следование продолжают в латеральном направлении, в правую и левую сто-
роны до внутренних яремных вен, внутренних яремных лимфатических уз-
лов и сонных артерий. Внутренние яремные лимфатические узлы от под-
нижнечелюстной области до надключичной ямки следует искать, главным
образом, при подозрении на карциному щитовидной железы. С помощью
ультразвука могут быть исследованы лимфатические узлы в заднем треуголь-
нике шеи. Неизмененные лимфатические узлы зачастую овальной формы и
имеют эхогенный жировой хилус [1].
АНАТОМИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
При исследовании паращитовидных желез хирург должен помнить об их эм-
бриологии и анатомии. Большинство людей имеет четыре паращитовидные
железы. Доля индивидуумов с большим числом желез колеблется от 2,5 до
22% [2]. Паращитовидные железы лежат на задней поверхности щитовидной
железы. Большинство неизмененных паращитовидных желез находится в
жировой клетчатке, окружающей щитовидную железу в виде «ореола».
АНАТОМИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
281
Рис. 7.1. А. Исследование щитовидной и паращитовидных желез в поперечной
плоскости. Б. Исследование этих же желез в продольной плоскости.
Верхние паращитовидные железы локализуются в основном по задне-
медиальной поверхности щитовидной железы около трахеоэзофагеального
углубления. Они обнаруживаются в пределах области диаметром 2 см, при-
близительно на 1 см выше места пересечения возвратного гортанного нерва
и нижней тиреоидной артерии. Когда верхние паращитовидные железы уве-
личиваются (гиперпаратиреоидизм), они могут смещаться кзади и книзу.
Верхние паратиреоидные железы почти всегда располагаются сверху или
позади косо идущего возвратного гортанного нерва. Увеличенные верхние
паращитовидные железы могут смещаться книзу, насколько позволяет зад-
282
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
не-верхнее средостение. Хирурги, оперирующие на паращитовидных желе-
зах, должны учитывать эту менее распространенную локализацию верхних
паращитовидных желез.
Нижние паращитовидные железы обычно сильно рассредоточены [3] В
норме они расположены на заднелатеральной поверхности нижних полюсов
щитовидной железы. Они находятся ниже нижней тиреоидной артерии, но
кпереди и книзу от косо идущего возвратного гортанного нерва. Эти железы
могут также находиться книзу от щитовидной железы, близко от тиротими-
ческого тракта или связки, в пределах затылочной части тимуса, в переднем
средостении, на бифуркации сонной артерии и в паренхиме щитовидной же-
лезы [4, 5].
Подлинно пнтратиреоидные паратиреоидные железы встречаются
приблизительно в 3% случаев, являясь предположительно нижними пара-
тиреоидными железами и располагаясь в нижней трети щитовидной желе-
зы [4]. Если нижние паратиреоидные железы во время эмбрионального
развития опускаются недостаточно, они могут находиться выше уровня
верхнего полюса щитовидной железы в каротидном влагалище. Увеличен-
ные нижние паращитовидные железы имеют склонность перемещаться
книзу.
При большем, чем в норме, количестве желез пятая железа обычно лока-
лизуется в тимусе или прилежит к тиреотимическому тракту [3 5]. Пара-
тиреоидные железы варьируют в размерах и форме. В большинстве случаев
они округлые, немного сплющенные или овальные; их форма может быть
обусловлена давлением окружающих структур. Средние значения размеров
железы составляют 5x3x1 мм. Паратиреоидные железы можно спутать с
маленькими дольками жира, добавочными дольками ткани щитовидной же-
лезы или лимфатическими узлами [3-5]. У большинства пациентов нормаль-
ные паращитовидные железы не могут быть визуализированы при помощи
ультразвука [6-8].
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Нормальная анатомия поперечных ультрасонографических сечений щито-
видной железы, трахеи и сонных артерий показана на рис. П.2. Неизмененная
тиреоидная паренхима гомогенна, со средним или высоким уровнем эхоген-
ности [9], что в большинстве случаев облегчает обнаружение гипоэхогенных
очагов или кистозных изменений щитовидной железы. Если капсула щито-
видной железы визуализируется, то выглядит она как тонкая гиперэхогенная
линия.
Верхняя тиреоидная артерия и вена образуют бифуркации на верхних
полюсах каждой доли. Эти сосуды могут быть свободно визуализированы в
продольной плоскости и при В-режиме. Применение высокочастотного цве-
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
283
Рис. 7.2. Поперечное изображение неизмененной щитовидной железы
и сонных артерий
тового допплеровского датчика делает идентификацию этих сосудов отно-
сительно легкой.
Нижние тиреоидные артерии располагаются позади нижней трети
каждой доли. Нижние тиреоидные вены находятся на нижних полюсах с
обеих сторон и без труда визуализируются в продольной плоскости. Ре-
менные мышцы видны как относительно тонкие, гипоэхогенные полоски,
предшествующие щитовидной железе. Грудино-ключично-сосцевидная
мышца визуализируется как широкий овальный гипоэхогенный тяж, рас-
положенный латеральнее щитовидной железы и кпереди от внутренней
яремной вены.
Узлы щитовидной железы
Узлы щитовидной железы представляют собой общую проблему для хирур-
гов и эндокринологов. Подсчитано, что узлы щитовидной железы встречают-
284
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
ся у 4-7% взрослого населения США. Узловые образования в большей степе-
ни распространены среди женщин [10]. Скрытые непальпируемые карцино-
мы щитовидной железы, выявленные на серии аутопсий, проведенных в
США, составили более 12% случаев.
Три четверти всех узловых заболеваний щитовидной железы возникают
как следствие гиперплазии щитовидных желез, вторичной по отношению к
дефициту йода — наследственного заболевания щитовидной железы и недо-
статочного применения йода в результате лечения [11]. При тиреоидной ги-
перплазии общий объем тиреоидных желез может увеличиваться, в резуль-
тате чего формируется зоб. По мере развития гиперплазии формируются
макро- и микроузлы. Эти узлы, в свою очередь, могут подвергаться жидко-
стной дегенерации с накоплением крови, серозной жидкости и коллоида.
Большинство кистозных образований щитовидной железы являются узла-
ми, подвергшимися обширной жидкостной дегенерации. При кистозном пе-
рерождении могут отмечаться фиброз и кальцификация [12].
Большинство гиперпластических узлов являются изоэхогенными по срав-
нению с неизмененной тканью щитовидной железы [9]. Может отмечаться
тонкий гипоэхогенный ободок. В зависимости от степени гиперплазии, де-
генерации и развития многочисленных перегородок между клетками и кол-
лоидной субстанцией, такие узлы могут становиться гиперэхогенными [13].
В результате кистозно-дегенеративных изменений аденоматозных (кол-
лоидных) узлов могут отмечаться разнообразные сонографические находки,
включая образования, являющиеся простыми кистами (анэхогенные), и об-
разования с эхогенной жидкостью, подобной геморрагической. Густое кол-
лоидное вещество может создавать яркие эхогенные фокусы, а внутрикис-
тозные перегородки различной толщины — формировать многокамерное об-
разование. У некоторых пациентов присутствуют оба этих признака [9, 14]
(рис. 7.3). Истинные кисты щитовидной железы встречаются нечасто [6].
Большинство кист в действительности являются аденоматозными узлами,
подвергшимися дегенерации. Истинные кисты могут быть совершенно
анэхогенными, иметь гладкую стенку и вызывать дорсальное усиление уль-
тразвука.
Фолликулярная аденома
Фолликулярная аденома представляет собой доброкачественную опухоль
щитовидной железы, имеющую железистое или фолликулярное строение.
Эта опухоль обычно одиночная и менее 3 см в диаметре. Она имеет тенден-
цию к медленному росту внутри капсулы из окружающей, сдавленной желе-
зистой ткани щитовидной железы. С течением времени развивается плотная
капсула, окружающая образование [15]. Сонографически аденома обычно
является солидным образованием, которое может быть изо-, гипо- или гипер-
эхогенным. Вокруг нее может определяться периферический гипоэхогенный
1
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
I H JI ft
285
Рис. 7.3. Поперечный (А) и продольный (Б) виды аденоматозного узла с кистозной
дегенерацией. Поперечный (В) и продольный (Г) виды наиболее крупного дегенеративно-
измененного аденоматозного узла при многоузловом изменении левой доли
щитовидной железы Д. Поперечный вид доброкачественного аденоматозного узла
левой доли щитовидной железы и перешейка. Отмечаются кистозно-дегенеративные
изменения с фокальным интерстициальным кровоизлиянием.
ободок вследствие наличия фиброзной капсулы. Капсула может быть гладкая
и толстая [9], а кистозная дегенерация представлена единичными или множе-
ственными фокусами [16] (рис. 7.4, 7.5).
Геморрагические кисты
Геморрагические кисты чаще всего образуются в результате спонтанных
кровотечений внутри фолликулярной аденомы [6]. Сонографически, гемор-
286
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Поперечный вид
Продольный вид
Рис. 7.3. (Продолжение.)
рагические кисты проявляются как прозрачные для звука образования с не-
ровными контурами и множественными внутренними перегородками [17].
Диффузное увеличение щитовидной железы
К увеличению щитовидной железы могут приводить несколько состояний:
болезнь Грейвса, тиреоидит Хашимото и ряд других тиреоидитов, дефицит
йода, инфекции. При диффузном увеличении щитовидной железы могут вы-
являться разнообразные сонографические признаки, обусловленные вызвав-
шими их причинами (рис. 7.6). У пациентов с многоузловым зобом отмечает-
ся распространенное нарушение железистого строения щитовидной железы
[17]. Тиреоидит имеет типичные, но неспецифические сонографические про-
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
287
Кожа
Перешеек
Киста----
Левая доля
железы
Дорсальное усиление
Г рудино-ключично-
сосцевидная мышца
Краевой артефакт
Внутренняя яремная
вена
Сонная артерия
Рис. 7.3. (Продолжение.)
288_________________7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Рис. 7.4. Хорошо очерченный, инкапсулированный узел левой доли щитовидной
железы размером 7,5x5x3 см у 41-летнего мужчины.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
289
Рис. 7.5. Поперечные (А и Б) и продольные (В и Г) изображения щитовидной железы
31-летней женщины с узлом в правой доле.
явления: диффузное увеличение с неоднородной эхоструктурой и низкой ам-
плитудой эхосигнала [18]. Типично выявление измененной паренхимы.
Карцинома щитовидной железы
Карцинома шитовидной железы является редко встречающимся злокачест-
венным образованием, составляющим около 1% от всех раковых опухолей.
Доля случаев возникновения рака щитовидной железы в отдельном солитар-
19 Ультразвуковая диагностика...
290
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Правая доля щитовидной железы
продольный вид
Рис. 7.5. (Продолжение)
Левая доля щитовидной железы
продольный вид
ном узле щитовидной железы приближается к 30%. Риск образования злока-
чественных узлов при многоузловом зобе менее 1% [19]. Большинство кар-
цином щит овидной железы представлено хорошо дифференцированным па-
пиллярным или папиллярно-фолликулярным раком, которые составляют от
75 до 90% от всех диагностированных случаев [20]. Медуллярный, фоллику-
лярный, анапластический рак и рак из клеток Гюртля составляют в общей
сложности от 10 до 25% от всех карцином щитовидной железы, наблюдае-
мых в Соединенных Штатах и Канаде [9].
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
291
Рис. 7.6. Поперечное изображение правой (А) и левой (Б) долей щитовидной железы у
пациента с диффузным тиреотоксическим зобом (болезнью Грейвса).
Папиллярная карцинома
Провести дифференциальный диагноз между доброкачественным и злокаче-
ственным образованиями при папиллярной карциноме сонографически не-
292 7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
возможно. Сонографические признаки этой карциномы щитовидной железы
вариабельны, но обычно образование проявляется неровными контурами и
гипоэхогенно по сравнению с паренхимой щитовидной железы [14]. Ниже
перечислены сонографические характеристики папиллярной карциномы:
• гипоэхогенность, обусловленная незначительным количеством коллоид-
ного вещества и плотноупакованным клеточным содержимым (рис. 7.7);
• микрокальцификаты (псаммомные тельца), проявляющиеся как кро-
шечные, точечные гиперэхогенные фокусы [12] (рис. 7.8). Эти структу-
ры могут давать позади себя акустическую тень;
• гиперваскуляризация, хорошо видимая при цветной допплеровской ульт-
расонографии [21];
• метастазы в шейные лимфатические узлы, которые могут содержать
псаммомные тельца и кисты, являющиеся результатом обширной деге-
нерации [9] (рис. 7.9).
Фолликулярная карцинома
Истинная фолликулярная карцинома является вторым типом хорошо диффе-
ренцированного рака шитовидной железы. Эта карцинома встречается в
5-15% всех случаев хорошо дифференцированного рака. Наблюдается в
основном у пожилых пациентов. Выделяют два варианта фолликулярной
карциномы: минимальная инвазивная и инвазивная. Минимальная инвазив-
ная карцинома инкапсулирована и при гистологическом исследовании про-
является только фокусной капсулярной и васкуллярной инвазией.
Проведение патологического исследования позволяет клиницисту диф-
ференцировать фолликулярную аденому от минимальной инвазивной фол-
ликулярной карциномы. Пациенты, страдающие минимальным инвазивным
фолликулярным раком, в общем, имеют благоприятный прогноз.
Более инвазивная форма фолликулярной карциномы представлена плохо
инкапсулированными опухолями. Инвазия окружающей ткани щитовидной
железы и кровеносных сосудов определяется значительно чаще. Фоллику-
лярная карцинома распространяется путем сосудистой инвазии и более час-
то, чем метастазирует в шейные лимфатические узлы, дает отдаленные ме-
тастазы (в кости, легкие, печень, и т. д.).
Сонографические проявления фолликулярной карциномы определяются
особенностями выявленного типа. Запущенные случаи проявляются неров-
ным краем опухоли и широким неровным венчиком [22]. При цветном доппле-
ровском исследовании выявляется беспорядочное расположение извили-
стых сосудов [23]. Уникальных сонографических признаков, которые позво-
лили бы дифференцировать фолликулярную карциному (минимальный
инвазивный тип) от доброкачественной фолликулярной аденомы, нет.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
293
Кожа
Папиллярная
карцинома
__Внутренняя
яремная вена
Сонная
артерия
Рис. 7.7. Поперечное изображение гипоэхогенной и гомогенной папиллярной
карциномы левой доли щитовидной железы размером 5,4 см.
294
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Рис. 7.8. Поперечный вид папиллярной карциномы в перешейке щитовидной железы
у 45-летней женщины. Хорошо заметны микрокальцификаты (псаммомные тельца)
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
295
Сонная
артерия
Кожа
Метастатическая
папиллярная
карцинома
Микрокальцификаты
Кистозная
дегенерация
Рис. 7.9. А. Поперечный вид увеличенного метастатически измененного левого
внутреннего яремного лимфатического узла. Б. Поперечное изображение,
полученное у того же пациента при более каудальном положении датчика.
296
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Рис. 7.9. (Продолжение.)
ПРИМЕНЕНИЕ УЛЬТРАЗВУКА ДЛЯ ОЦЕНКИ УЗЛОВЫХ ОБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
297
Медуллярная карцинома
Наиболее часто спорадическая медуллярная карцинома может быть связана с
синдромом множественной эндокринной неоплазии II типа. Эта карцинома,
как правило, встречается в 5-10 % случаев злокачественных заболеваний щи-
товидной железы [24]. Сонографические признаки медуллярной карциномы
до некоторой степени подобны таковым при папиллярной карциноме [9]. Од-
нако пациенты с пальпируемой медуллярной карциномой подвержены более
высокому риску местной инвазии и метастазирования в шейные лимфоузлы,
чем пациенты с папиллярной карциномой. Скопления амилоида и микрокаль-
цификаты, встречающиеся в медуллярной карциноме, выявляются как яркие
эхогенные фокусы [25]. Подобные фокусы могут наблюдаться также в мета-
стазах в лимфатических узлах и печени.
Анапластическая карцинома щитовидной железы
Анапластическая карцинома щитовидной железы представляет собой наибо-
лее злокачественный тип рака щитовидной железы. В богатых йодом стра-
нах, таких как Соединенные Штаты, эта карцинома встречается в менее чем
5% от всех карцином щитовидной железы [26]. Анапластическая карцинома
может быть связана с папиллярным и фолликулярным раком. Клиницисты
полагают, что анапластическая карцинома представляет собой недифферен-
цированную форму этих хорошо дифференцированных карцином [27]. Такая
карцинома энергично распространяется, замуровывая кровеносные сосуды и
мышцы шеи. Ультрасонографически этот рак обычно гипоэхогенный [9].
ПРИМЕНЕНИЕ УЛЬТРАЗВУКА ДЛЯ ОЦЕНКИ УЗЛОВЫХ ОБРАЗОВАНИЙ
ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Тонкоигольная пункционная аспирационная биопсия (ТПАБ) узловых обра-
зований щитовидной железы стала «золотым» стандартом обследования па-
циентов с клинически пальпируемыми узлами щитовидной железы. Ультра-
звук высокого разрешения тем не менее обеспечивает несколько клиниче-
ских применений:
• контроль ТПАБ узлов щитовидной железы и лимфатических узлов шеи;
• характеристика пальпируемых образований шеи (солидных, кистозных,
смешанных, щитовидной железы, лимфатических узлов, сосудистых об-
разований, признаков доброкачественности или злокачественности);
• определение точной локализации пальпируемых и непальпируемых об-
разований шеи;
• определение скрытых узлов щитовидной железы у пациентов с высоким
риском (облучение головы и шеи в детстве, случаи карциномы щито-
видной железы в семейном анамнезе);
298
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Кожа
Метастатически
измененный
лимфоузел
Метастатически
измененный
лимфоузел
Рис. 7.10. Поперечное (А) и продольное (Б) изображения метастатически измененных
шейных лимфатических узлов.
• обнаружение рецидива или метастазирования карциномы (рис. 7.10);
• получение данных о незатронутой части щитовидной железы (доли щи-
товидной железы на стороне, противоположной от пальпируемого узла).
Ультрасонографическое исследование шеи обнаруживает богатство по-
лезной анатомической информации. Такая информация обеспечивает хи-
рурга важными дооперационными данными и приводит к более эффектив-
ному исследованию во время операции.
Как и в случае с образованиями молочной железы, не сущестует единого
сонографического критерия, отличающего доброкачественные узлы щито-
видной железы от злокачественных. Основные сонографические характери-
стики учитывают внутреннюю структуру, эхогенность, края, наличие каль-
цификации, периферического ободка и сосудистый рисунок [9].
ПРИМЕНЕНИЕ УЛЬТРАЗВУКА ДЛЯ ОЦЕНКИ УЗЛОВЫХ ОБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
299
Внутренняя структура
Внутренняя структура образования может быть солидной, смешанной солид-
но-кистозной и исключительно кистозной. Доброкачественные аденоматоз-
ные (коллоидные) узлы зачастую содержат существенный кистозный компо-
нент. Большинство малигнизированных образований полностью солидные,
но папиллярная карцинома, изредка обнаруживая кистозные изменения, вы-
глядит почти идентично доброкачественному кистозному узлу [28].
Эхогенность
Большинство узлов щитовидной железы — доброкачественные и злокачест-
венные—являются гипоэхогенными по сравнению с неизмененной тиреоид-
ной паренхимой [9] (рис. 7.7). Гиперэхогенные узлы, однако, являются, веро-
ятнее всего, доброкачественными [14]. Изоэхогенные узлы имеют средний
риск малигнизации.
Контуры
Доброкачественные узлы щитовидной железы обычно имеют хорошо очер-
ченные, четкие контуры. Малигнизированные образования, как правило,
имеют неровные или плохо очерченные контуры [9].
Кальцификация
Кальцификация обычно не связана с узловыми образованиями щитовидной
железы. При выявлении крупных грубых кальцификатов узлы, вероятно, ока-
жутся доброкачественными. Если отложения мелкие и точечные, узлы, ско-
рее всего, злокачественные. Псаммомные тельца (мелкие микрокальцифика-
ты) отмечаются обычно при папиллярной карциноме [14] (рис. 7.8 и 7.9).
Периферический венчик
От 60 до 80% доброкачественных узлов щитовидной железы окружены пери-
ферическим звукопроницаемым венчиком различной степени выраженно-
сти. Но только у 15% малигнизированных образований определяется подоб-
ный «ореол» [15,29]. Большинство клиницистов считают, что «ореол» пред-
ставляет собой сдавленную нормальную паренхиму щитовидной железы.
Сосудистый рисунок
Большинство гиперпластических узлов шитовидной железы являются менее
васкуляризированными, чем нормальная тиреоидная паренхима. Наиболее
хорошо дифференцированные карциномы щитовидной железы являются ги-
перваскулярными. Малодифференцированная и анапластическая карцино-
мы являются гиповаскулярными, поскольку вслед за быстрым ростом этих
300 7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
образований наблюдаются обширные некрозы. Расположение сосудов, выяв-
ляемое при допплерографии, может оказаться полезным для дифференци-
ровки злокачественного образования от доброкачественного. В большинстве
доброкачественных поражений выявляется периферическая васкуляризация,
в то время как большинство малигнизированных образований имеет внутрен-
нюю васкуляризацию, с периферическим компонентом или без него [9, 23]
БИОПСИЯ ПОД КОНТРОЛЕМ УЛЬТРАЗВУКА
Поскольку доля ложноположительных заключений исследования составляет
менее 2%, ТПАБ имеет огромное значение, когда результат в отношении ма-
лигнизации оказывается положительным [30]. Ложноотрицательная ТПАБ,
как правило, является результатом неправильного получения образцов (кон-
чик иглы позиционирован неверно) либо недостаточного получения матери-
ала. При ТПАБ обычно используются 4 класса цитологической классифика-
ции: 0—образец, неудовлетворительный для классификации; 1 — без сомнения
доброкачественный; 2—подозрительный; 3—без сомнения злокачественный.
ТПАБ под контролем ультразвука позволяет клиницистам видеть иглу,
обеспечивая ее правильное положение в образовании, подвергающемся био-
псии. Несмотря на то, что ультразвук обычно не применяется для выполне-
ния ТПАБ пальпируемых образований (шитовидной железы и шейных лим-
фоузлов), он часто используется и в этих случаях, гарантируя правильное
размещение иглы, что дает начинающему сонографисту существенный опыт,
необходимый для пунктирования непальпируемых образований.
При ультрасонографии высокого разрешения обычно могут быть визуа-
лизированы нормальные и измененные лимфатические узлы шеи. Доброка-
чественные шейные лимфоузлы выглядят овальными, тонко очерченными
образованиями с эхогенной центральной полосой, которая представляет со-
бой жировую ткань в воротах органа. Большинство малигнизированных лим-
фатических узлов утрачивают эхогенный хилус и являются обычно вторич-
ным циклом опухолевой инфильтрации [9]. ТПАБ шейных лимфатических
узлов под контролем ультразвука является чрезвычайно важным методом
дифференцировки доброкачественных узлов от злокачественных.
ЧАСТОТА ЗАБОЛЕВАЕМОСТИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Узлы щитовидной железы являются широко распространенной находкой
среди взрослого населения. Тщательная оценка щитовидной железы во время
аутопсии выявила небольшие (непальпируемые) узлы щитовидной железы
более чем в 49% случаев [31]. Сонография высокого разрешения обнаружи-
вает узлы щитовидной железы приблизительно в 40% случаев гиперкальце-
мии [32]. Обобщающее исследование этих образований должно затрагивать
его размеры и ультрасонографические проявления.
УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
301
Образования размером 1,5 см и больше при измерении максимального
размера требуют дальнейшей оценки, независимо от их сонографических и
физикальных особенностей [33]. Образования размером менее 1,5 см, без
признаков злокачественного роста и дополнительных данных о малигнизации,
таких как пальпирующиеся шейные лимфоузлы, можно наблюдать. Узловые
образования щитовидной железы с ультразвуковыми признаками малигни-
зации (например, неровными контурами, микрокальцификатами, выражен-
ным «ореолом» и т. п.) должны подвергаться тонкоигольной аспирационной
биопсии под ультразвуковым контролем.
Большинство узловых образований щитовидной железы имеют неболь-
шие размеры и доброкачественную природу. В связи с этим они могут ква-
лифицированно наблюдаться при помощи ультразвукового или физикаль-
ного исследования.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Первичный гиперпаратиреоидизм — относительно распространенное эндо-
кринное расстройство; в Соединенных Штатах каждый год регистрируется
приблизительно 100000 новых случаев заболевания [34]. Первичный гипер-
паратиреоидизм и злокачественные новообразования обнаруживаются в 90%
случаев гиперкальпемии.
Диагноз 11ервичного гипер! [аратиреоидизма устанавливается относительно
легко. Лечащий врач выявляет либо повышение кальция сыворотки крови и
интактной сыворотки, либо паратиреоидного гормона (ПТГ) наряду с нормаль-
ным уровнем или повышением концентрации кальция в моче. До оператив-
ного вмешательства врач должен удостовериться в диагнозе. Одна из основ-
ных дискуссий в хирургии паращитовидных желез касается предоперацион-
ного изучения их локализации. По данным большинства больниц общего
профиля, первичный гиперпаратиреоидизм в 80-94% случаев вызван одно-
сторонней аденомой паращитовидной железы [4, 35]. Хирургическое лече-
ние первичного гиперпаратиреоидизма приносит успех более чем в 90%
случаев.
Для локализации паращитовидных желез было разработано несколько
методов, которые улучшают результаты реэксплоративных вмешательств у
больных с персистируюшим или рецидивирующим гиперпаратиреоидизмом.
Однако в использовании предоперационной локализации перед вмешательст-
вом на паращитовидных железах имеется ряд противоречий [36]. Doppman [37]
заметил, что «опытный в операциях на паращитовидной железе хирург дол-
жен ограничить показания к дооперационной локализации только случаями
нелеченого первичного гиперпаратиреоидизмома». Разумно использовать
дооперационное определение у пациентов с предшествующим хирургиче-
ским вмешательством на щитовидной железе или у пациентов с гиперкалие-
мическим кризом. Хотя эта тема выходит за пределы главы, необходимо от-
302
7. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Рис. 7.11. Сцинтиграммы (сестамиби-технеций 99m) 54-летнего мужчины с
правосторонней гемитиреоидэктомией в анамнезе и диагнозом первичного
гиперпаратиреоидизма. А. Поглощение изотопа в левой доле щитовидной железы и
узлом внизу. Б. После 70 мин, остатки изотопа доказывают существование аденомы
С любезного разрешения Dr. Shelby Miller.
метить, что на фоне продолжающегося обсуждения по использованию доо-
перационной локализации это исследование приобретает все большую
популярность во всем мире.
Неинвазивные предоперационные исследования
Неинвазивные предоперационные методы исследования включают в себя
ультрасонографию, КТ, МРТ, сцинтиграфию таллием, 201-технецием 99m,
пертехнетатом и сестамиби-технецием 99m (рис. 7.11).
Инвазивные исследования
Инвазивные предоперационные методики включают в себя ТПАБ под конт-
ролем ультразвука, паратиреоидную артериографию и взятие проб венозной
крови для определения уровня ПТГ [38—40]. Методы интраоперационной ло-
кализации включают в себя ультразвук высокого разрешения, инъекцию ме-
тиленовой сини или толуидиновой сини и интраоперативный анализ ПТГ
(срочное исследование) [4143].
Процедура исследования
Для проведения исследования пациент помещается в положение, описанное для
УЗИ щитовидной железы. Начинают с одной стороны шеи и обращают внима-
ние на области, где обычно располагаются аденомы верхней и нижней парати-
реоидных желез. Обнаружить аденомы помогает их подвижность при глотании.
Типичное расположение аденомы верхней паращитовидной железы —
по задней поверхности среднего сегмента доли щитовидной железы [4]. Рас-
УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
303
положение аденом нижних паращитовидных желез более изменчиво, но не-
редко они находятся у вершины нижнего полюса щитовидной железы. Аде-
номы нижних паращитовидных желез могут также смещаться вниз вдоль ти-
реотимусного тракта.
Паратиреоидные аденомы встречаются в различных эктопированных
положениях. Некоторые из них хорошо визуализируются при УЗИ (интра-
тиреоидные и каротидные), другие обнаруживаются с трудом или вовсе не
находятся при ультрасонографии (рстротрахеальные и медиастенальные).
Точность и ошибки
Клиницисты рассматривают ультразвук высокого разрешения в реальном
времени как достоверный метод визуализации измененных паратиреоидных
желез. Его точность колеблется от 76 до 92%, но окончательный успех часто
зависит от врача-хирурга [44^46].
Аденомы паратиреоидных желез в большинстве случаев имеют оваль-
ную или продолговатую форму, со смещением тканей шеи в продольной
плоскости [44, 47] (рис. 7.12А). Их мономорфный светлоклеточный состав
представляет собой незначительную поверхность для отражения ультразву-
кового пучка. В результате, они обычно выглядят типично гипоэхогенными
по сравнению с щитовидной железой [48] (рис. 7.12Б). Большинство парати-
реоидных аденом — это гомогенные солидные образования. Кистозная де-
генерация аденом паращитовидной железы наблюдается менее чем в 5%
случаев [49]. Паратиреоидные аденомы вариабельны в размерах, но в боль-
шинстве случаев они от 8 до 15 мм длиной и весом от 500 до 1000 мг [2].
Получение ложноотрицательных результатов УЗИ при увеличении пара-
тиреоидных желез связано с несколькими причинами, такими как незначи-
тельный размер аденомы, многоузловой зоб и эктопированное местополо-
жение аденомы [48]. Ложноположительные результаты исследования могут
быть вызваны выступающими кровеносными сосудами, протрузией пище-
вода, расположением длинной мышцы шеи в поперечной плоскости, узлами
щитовидной железы и увеличением лимфатических узлов шеи [48]. Как и
большинство ультрасонографических исследований, сканирование парати-
реодных желез необходимо проводить в двух плоскостях.
Заключение
Дискуссии о локализации паратиреоидных желез и их УЗИ будут продолжать-
ся. Определение местоположения должно рассматриваться как дополнитель-
ное средство улучшения объединенных диагностических данных [50]. Более
опытные эндокринные хирурги определяют локализацию только перед по-
вторными операциями. Менее опытные в операциях на паращитовидных же-
лезах хирурги в результате этих исследований могут получить ложное пред-
ставление о безопасности вмешательства. Результаты диагностических ис-
304
7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Щитовидная
железа
Паращитовидная
железа
Рис. 7.12. А. Продольное изображение паратиреоидной аденомы продолговатой
формы позади щитовидной железы. Б. Поперечный вид гипоэхогенной
паратиреоидной аденомы на заднелатеральной поверхности щитовидной железы. С
любезного разрешения Dr. James J. Karo.
УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
305
Рис. 7.12. (Продолжение.)
Кожа
Щитовидная железа
Сонная артерия
Паращитовидная железа
20 Ультразвуковая диагностика...
306 7. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
следований не могут заменить знаний об эмбриологии, анатомии,
патофизиологии, а также об обычном и эктопированном расположениях уве-
личенных паратиреоидных желез.
ССЫЛКИ
1. Bruneton JN, Normand F. Cervical lymph nodes. In: Bruneton JN, ed., Ult-
rasonography of the neck. Berlin: Springer-Verlog, 1987:81-82.
2. Herrera MF, Gamoba-Dominguez A. Parathyroid embryology, anatomy,
and pathology. In: Clark OH, Duh Q-Y, eds., Textbook of endocrine surge-
ry. Philadelphia: Saunders, 1997:277-283.
3. Wang CH. The anatomic basis of parathyroid surgery. Ann Surg. 1976;
183:271-275.
4. Thompson NW, Eckhauser FE, Hamess. JK. The anatomy of primary hy-
perparathyroidism. Surgery 1982;92:814-821.
5. Akerstrom G, Malmaeus J, Bergstrom R. Surgical anatomy of human parat-
hyroid glands. Surgery 1984;95:14-21.
6. Butch, RJ, Simeone JF, Mueller PR. Thyroid and parathyroid ultrasonog-
raphy. Radiol Clin Norm Am 1985;23:57-71.
7. Clark OH, Okerlund MD, Moss AA, et al. Localization studies in patients
with persistent or recurrent hyperparathyroidism. Surgery 1985;98:
1083 1094.
8. Sample WF, Mitchell SP, Bledsoe RC. Parathyroid ultrasonography. Radio-
logy 1978; 127:485-490.
9. Solbiati L, Charboneau JW, James EM, Hay ID: The thyroid gland. In Rumack
CM, Wilson SR, Charboneau JW (eds) St. Louis, Mosby, pp 703-729,1988.
10. Vander JB, Gaston EA, Dawber TR. The significance of nontoxic thyroid
nodules. Final report of a 15-year study of the incidence of thyroid malig-
nancy. Ann Intern Med 1968;69:537-540.
11. HennemannG. Non-toxic goitic. Clin Endocrinol Metab 1979;8:167-179.
12. Solbiati L, Cioffi V, Ballarati E. Ultrasonography of the neck. Radiol Clin
North Am 1992;30:941-954.
13. Muller HW, Schroder S, Schneider C, Seifert G. Sonographic tissue charac-
terization in thyroid gland diagnosis. Klin Woncheschr 1985 ;63:706 710.
14. Solibiati L, Volterrani L, Rizzatto G, et al. The thyroid gland with low upta-
ke lesions: evaluation by ultrasound. Radiology 1985;155:187-191.
15. Smeds S, Heldin N-E. Growth factor, thyroid hyperplasia, and neoplasia. In:
Clark OH, Duh Q-Y, eds., Textbook of endocrine surgery. Philadelphia: Sa-
unders, 1997:205-213.
16. Noyek AM, Greyson ND, Steinhardt, MI, et al. Thyroid tumor imaging arch
Otolaryngol. 1983;109:205-224.
ссылки
307
17. Katz JF, Kane RA, Reyes J. Thyroid nodules: sonographic-pathologic corre-
lation. Radiology 1984;151:741-745.
18. Blum M, Passalaqua AM, Sackler JP, Pudlowski R. Thyroid echography of
subacute thyroiditis. Radiology 1997; 125:795 798.
19. Brown CL. Pathology of the cold nodule. Clin Endocrinol Metab
1981;10:235-245.
20. Hay ID. Thyroid cancer. Curr Ther Int Med 1991;3:931-935.
21. Solbiati L, lerace T, Lagalla R, et al. Reliability of high frequency US and
color Doppler US of thyroid nodules: Italian multicenter study of 1,042 pat-
hologically confirmed cases. Which role for scintigraphy and biopsy? Paper
presented at the Radiological Society of North America Meetings, 1995.
22. Solbiati L, Livragh T, Ballarati E, et al. Thyroid gland. In: Solbiati L, Riz-
zatto G, eds., Ultrasound of superficial structures. Edinburgh: Churchill Li-
vingstone 1995:49-85.
23. Lagalla R, Caruso G, Midiri M, Cardinale AE. Echo Doppler-couleur et pat-
hologic thy-roidienne. JEMU 1992;13:44-47.
24. Moley JF. Medullary thyroid cancer. In: Clark OH, Duh Q-Y, eds., Textook
of endocrine surgery. Philadelphia: Saunders, 1997:108-118.
25. Gorman B, Charboneau JW, James EM, et al. Medullary thyroid carcinoma:
role of high-resolution ultrasound. Radiology 1987;162:147-150.
26. Tann R, Finlay R, Driscoll D, et al. Anaplastic carcinoma of the thyroid: a
24 year experience. Head Neck 1995;17:41At8.
27. van der Laan F, Freeman JL, Tsang RW, Asa SL. The association of
well-differentiated thyroid carcinoma with insular or anaplastic thyroid car-
cinoma: evidence for dedifferen-tiation in tumor progression. Endocrinol
Pathol 1993;4:215-219.
28. Hammer M, Wortsman J, Folse R. Cancer in cystic lesions of the thyroid.
Arch Surg 1982;117:1020-1023.
29. Propper RA, Skolnick ML, Weinstein BJ, et al. The nonspecificity of the
thyroid halo sign. J Clin Ultrasound 1980;8:129 132.
30. Rosen IB, Azadian A, Walfish PG, et al. Ultrasound-guided fine-needle as-
piration biopsy in the management of thyroid disease. Am J Surg
1993;166:346-349.
31. Mortensen JD, Woolner LB, Bennett WA. Gross and microscopic findings
in clinically normal thyroid glands. J Clin Endocrinol Metab
1955;15:1270-1280.
32. Horlocker TT, Hay JE, James EM, et al. Prevalence of incidental nodular
thyroid disease detected during high-resolution parathyroid ultrasonograp-
hy. In: Medeiros-Net G, Gaitan E, eds., Frontiers.
33. Giuffrida D, Gharib H. Controversies in the management of cold, hot, and
occult thyroid nodules. Am J Med 1995;79:642-650.
308 7. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ ЩИТОВИДНОМ ЖЕЛЕЗЫ И ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
34. Proceedings of the NIH consensus development conference on diagnosis and
management of asymptomatic primary hyperparathyroidism. Bethesda, Ma-
ryland, October 29-31, 1990. J Bone Miner Res 1991 ;6 (suppl 2):S1-166.
35. Ryan, JA Jr. Eisenberg B, Pado KM, Lee F: Efficacy of selective unilateral
exploration in hyperparathyroidism based on localization tests. Arch Surg
1997; 132:886-891.
36. Thompson NW. Localization studies in patients with primary hyperparathy-
roidism. Br J Surg 1988;75:97-98.
37. Doppman JL. Reoperative parathyroid surgery: localization procedures. Pa-
rathyroid surgery. Prog Surg 1968;18:1171-1175.
38. Doppman JL, Krudy AG, Marx SJ. Aspiration of enlarged parathyroid
glands for parathyroid hormone assay. Radiology 1983;148:31-35.
39. Miller DL, Doppmann JL, Krudy AG, et al. Localization of parathyroid ade-
nomas in patients who have undergone surgery: part II. Invasive procedures.
Radiology 1987;162:138-141.
40. Nilsson BE, Tissell LE, Janson S, et al. Parathyroid localization by cathete-
rization of large cervical and mediastinal veins to determine serum concent-
rations of intact parathyroid hormone. World J Surg 1994;18:605-611.
41. Norton JA, Shawker TH, Jones BL, et al. Intraoperative ultrasound and reo-
perative parathyroid surgery: an initial evaluation. World J Surg
1986;10:631-639.
42. Brennan MF, Norton JA. Reopcration for persistent and recurrent hyperpa-
rathyroidism. Ann Surg 1985;201:40-44.
43. Irvin GL, Dembron VD, Prudhome DL. Clinical usefulness of an intraope-
rative «quick РТН» assay. Surgery 1993; 114:1019-1023.
44. Graif M, Itzchak Y, Strauss S, et al. Parathyroid sonography: diagnostic ac-
curacy related to shape, location, and texture of the gland. Br J Radiol
1987;60:439л43.
45. Stark, DD, Gooding GA, Clark OH. Noninvasive parathyroid imaging. Se-
min Ultrasound CTMR 1985;6:310-320.
46. Winzclberg GG. Parathyroid imaging. Ann Intern Med 1987;107:64-70.
47. Reading CC, Charboneau JW, James EM, et al. High-resolution parathyroid
sonography. AJR Am J Roentgenol 1982;139:539-546.
48. Hopkins CR, Reading CC. The parathyroid glands. In: Rumack CM, Wilson SR,
Charboneau JW, eds., Diagnostic ultrasound. St. Louis: Mosby, 1998:731 -750.
49. Krudy AG, Doppman JL, Shawker TH, et al. Hyperfunctioning cystic parat-
hyroid glands: computer tomography and sonographic findings. AJR Am J
Roentgenol 1984;142:175-178.
50. Rodrigeuz, JM, Tezelman S, Siperstein AAE, et al. Localization procedures
in patients with persistent or recurrent hyperparathyroidism. Arch Surg
1994;129:870-875.
ИНТРАОПЕРАЦИОННОЕ
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Элиот Дж Фегельман
Хирурги обладают тонким осязанием и полагаются на него для получения
точного представления о тканях, на которых работают. Опытный хирург лег-
ко оценивает состав ткани или органа, васкуляризацию и присутствие ново-
образования или стриктуры. Паренхиматозные органы брюшной полости,
однако, не поддаются полной оценке путем пальпации. Обычное рентгеноло-
гическое или флюорологическое исследования хотя и помогают хирургу, но
ограничены в силу своего статического характера или проблем, вызываемых
лучевой нагрузкой. Бурное развитие видеоскопических хирургических мето-
дов дистанцировало хирурга от оперируемых тканей, делая палы 1ацию почти
невозможной.
Использование ультрасонографии при оперативном вмешательстве дало
хирургу «глаза» и «уши» там, где он мог рассчитывать только на прикосно-
вение. Ультрасонография во время операции на паренхиматозных органах
брюшной полости позволяет в реальном времени получить детальное пред-
ставление об анатомических структурах, сосудистом русле и изменениях
строения, вызванных заболеванием. Еще предыдущему поколению врачей
такой обзор не был доступен. УЗИ приносит еше одну пользу: оно позволяет
определить, успешно ли завершено хирургическое вмешательство.
Присутствие ультразвукового аппарата в операционной —- не новость.
Современные небольшие датчики (разнообразных конфигураций) обеспе-
чиваю! сонографистам, проводящим интраоперационное исследование, боль-
шую, чем раньше, свободу движения, гибкость и точность в процессе оцен-
ки (рис. 8.1). В настоящее время доступно широкое разнообразие частот скани-
рования и программного обеспечения. Такое усовершенствование позволяет
хирургу подбирать глубину проникновения с частотой сканирования, под-
ходящей для каждого пациента.
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
310
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Рис. 8.1. Низкопрофильные ультразвуковые датчики для интраоперационного УЗИ.
ФИЗИКА ДЛЯ ХИРУРГОВ
Всестороннее обсуждение физических принципов, лежащих в основе совре-
менной ультрасонографии, приводилось в гл. 1. Хирурги общей практики,
выполняющие интраоперационное УЗИ, должны усвоить некоторые правила
для точной интерпретации изображений. Во-первых, хирург должен учиты-
вать взаимоотношение частоты датчика к глубине проникновения и разреше-
нию. С повышением частоты увеличивается разрешение, но глубина проник-
новения в ткани уменьшается. В большинстве случаев внутрибрюшных ис-
следований необходимая комбинация глубины проникновения и разрешения
обеспечивается датчиками с диапазоном частот от 7,5 до 10 МГц.
Во-вторых, хирург должен понять, что звуковые волны плохо распро-
страняются через воздух. Для исследования печени и почек лучше исполь-
зовать методику непосредственного контакта. При оценке внепеченочных
желчных протоков и поджелудочной железы весьма эффективна методика
исследования через солевой раствор.
Наконец, цветная допплерография основана на изменении частоты, на-
блюдающемся при движении объекта. Объекты (например, клетки крови),
перемещающиеся к датчику, символизирую ! положительный частотный сдвш
и часто отображаются красным цветом. Объекты, перемещающиеся от дат-
чика, представляют отрицательный частотный сдвиг и в большинстве случа-
ев отображаются синим цветом. Цветное представление может управляться
сопографистом; красные и синие оттенки, используемые на современном
ПРИМЕНЕНИЕ ДЛЯ ОПРЕДЕЛЕННЫХ ОРГАНОВ
311
ультразвуковом оборудовании, — компьютерно-генерируемые цвета, осно-
ванные на движении и не представляющие собой нативные артериальные
или венозные структуры (вены не всегда синие, и артерии не всегда красные)
(см. гл. 15).
ПРИМЕНЕНИЕ ДЛЯ ОПРЕДЕЛЕННЫХ ОРГАНОВ
Печень
Печень является внутрибрюшным органом, который во время операции луч-
ше всего поддается ультрасонографической оценке. Это, прежде всего, связа-
но с тем, что печеночная паренхима обеспечивает ультразвуковой доступ к
таким важнейшим структурам, как ворота печени и системные вены, а ее мор-
фологические особенности позволяют провести точную диагностическую
оценку внутриорганных образований. Интраоперационная ультрасоногра-
фия помогает хирургу определить расположение этих образований и устано-
вить их взаимоотношения с другими структурами, провести поиск метаста-
тических опухолей печени и ориентироваться при ее резекции.
Для выполнения УЗИ печени более всего подходит небольшой Т-образ-
ный датчик. Такой датчик дает возможность устойчивого позиционирова-
ния головки над латеральными сегментами печени, где ригидная грудная
стенка исключает применение традиционных устройств (рис. 8.2). Датчи-
ком, размещенным для визуализации поперечного вида печени, начните ис-
следование с левого медиального сегмента и сканируйте по направлению к
позадипеченочной части нижней полой вены. При этом ультразвуковой луч
проходит через портальные сосуды точно так же, как они входят в печень на
ее срезе (рис. 8.3А). Дополнив исследование цветным допплером, можно иден-
тифицировать кровоток в портальной вене и печеночной артерии (рис. 8.ЗБ).
Правильному распознаванию способствует оценка размера, а не цвета струк-
тур. Правый и левый печеночные желчные протоки не будут окрашиваться
допплером, но обычно проявляются ярким гиперэхогенным ободком стенки
протока. Ветви воротной вены обычно прослеживаются до одного или двух
ветвлений, после чего теряются. Нерасширенные внутрипеченочные желч-
ные протоки на внутрипеченочном уровне, однако, не прослеживаются.
Как только найдены портальные сосуды, датчик проводится в краниаль-
ном направлении над передней поверхностью печени. Паренхима печени
имеет гомогенный, матово-стеклянный вид, на фоне которого в различных
тангенциальных плоскостях видны эхонегативные отверстия — системные
печеночные вены (рис. 8.4).
Если датчик расположен над средней частью печени и направлен к по-
лой вене, печеночные вены можно увидеть в месте их слияния и впадения в
полую вену. Могут быть идентифицированы правая, средняя и левая пече-
ночные вены, а их ход легко прослеживается в проксимальном направлении
до мест их формирования.
312
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ
Рис. 8.2. Правильное расположение низкопрофильного датчика.
При сканировании образований печени поместите датчик на ее поверх-
ность, а затем, для анатомической ориентации, изменяйте проекции скани-
рования с использованием цветной допплерографии. Мобилизация печеноч-
ных связок может облегчить исследование. Метастатические опухоли колорек-
тального рака, рака желудка и поджелудочной железы имеют характерный
выраженный ободок, который может быть ярким гиперэхогенным или тем-
ным гипоэхогенным. Яркий центр образования, окруженный гетерогенной
полоской, хорошо выделяется на фоне гомогенной неизмененной печеноч-
ной паренхимы (рис. 8.5).
Помимо идентификации первичных и метастатических опухолей, ульт-
развук может использоваться для определения резектабельности при хирур-
гических заболеваниях печени. С помощью цветной допплерографии можно
четко определить отношение образований печени к ее основным структу-
рам, включая портальные вены и печеночные вены. Мобилизуя печень и из-
меняя положение датчика, хирург может выявить образования, которые не
были замечены при дооперационном исследовании, и определить их резек-
табельность.
Поджелудочная железа
Интраоперационная ультрасонография может оказаться полезной и при ис-
следовании поджелудочной железы, хотя обычно намного меньше, чем при
исследовании печени. Общепринятое применение интраоперационного уль-
ПРИМЕНЕНИЕ ДЛЯ ОПРЕДЕЛЕННЫХ ОРГАНОВ
313
Рис. 8.3. А. Портальные сосуды на «срезе» печени. Б. Те же структуры, отображенные
цветным допплеровским ультразвуком
трасонографического исследования поджелудочной железы включает в себя
точную идентификацию опухолей из клеток островковой ткани, оценку ре-
зектабельности аденокарциномы головки поджелудочной железы и обнару-
жение панкреатического протока. Чтобы тщательно осмотреть поджелудоч-
ную железу, хирург должен сначала вскрыть сальниковую сумку путем выде-
314
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ
Рис. 8.3. (Продолжение.)
ления желудочно-ободочной связки. Если парапанкреатической жировой
клетчатки достаточно, то для выявления внутрипанкреатических образова-
ний, селезеночной вены и панкреатического протока может применяться тех-
ника контактного сканирования. Однако при использовании низко- и средне-
частотных датчиков глубина проникновения и разрешение ограничивают ее
ПРИМЕНЕНИЕ ДЛЯ ОПРЕДЕЛЕННЫХ ОРГАНОВ
315
Рис. 8.4. Нормальная печень с основными сосудами. Изображение печени при
интраоперационном УЗИ.
применение. В таком случае для предотвращения образования воздушной
прослойки хирург должен применить насадку типа маленького мешочка с
обыкновенным солевым раствором. Цветная допплерография идентифици-
316
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ
Рис. 8.5. А. Метастазы колоректального рака в печени. Б. Компьютерная томография,
тот же случай.
рует главные сосудистые структуры, включая аорту, нижнюю полую вену и
слияние селезеночной вены с верхней брыжеечной веной (формирующие
портальную вену). Сама поджелудочная железа имеет гомогенный вид мато-
вого стекла. Панкреатический проток может выявляться как поперечная ги-
поэхогенная структура, которая проходит сквозь середину поджелудочной
железы.
Поскольку оперативные вмешательства при хроническом панкреатите
становятся все более распространенными в Соединенных Штатах, интраопе-
рационный ультразвук получит новое практическое применение. На рис. 8.6А
показана дооперационная эндоскопическая ретроградная холангиопанкреа-
тограмма (ЭРХПГ) расширенного панкреатического протока с четкообраз-
ной структурой и внутрипротоковым камнем. Ультразвуковое исследование
того же пациента демонстрирует рис. 8.6Б; отчетливо видны эхогенные кам-
ПРИМЕНЕНИЕ ДЛЯ ОПРВДЕЛЕННЫХ ОРГАНОВ
317
Рис. 8.5. (Продолжение.)
ни, дающие плотную акустическую тень. Как только камень идентифициро-
ван, хирург, также с помощью ультразвука, может контролировать проведе-
ние иглы внутрь расширенного протока для получения интраоперационной
панкреатикограммы или для надреза протока при подготовке к панкреато-
еюностомии.
Резектабельность аденокарциномы головки поджелудочной железы из-
вестна трудностью определения без исследования и мобилизации двенадца-
типерстной кишки и головки поджелудочной железы. Но сегодня, используя
318
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Рис. 8.6. А. ЭРХПГ при расширении панкреатического протока и камне в его просвете
Б Интраоперационное сканирование подтверждает наличие конкремента.
ПРИМЕНЕНИЕ ДЛЯ ОПРЕДЕЛЕННЫХ ОРГАНОВ
319
высокочастотные датчики, хирург может точно идентифицировать структуры,
пораженные карциномой поджелудочной железы. Применяя цветное до-
пплеровское исследование для идентификации портальной вены и форми-
рующих ее сосудов, можно заметить образование, примыкающее к сосуди-
стой стенке. Шероховатый вид сосудистой стенки с высокой скоростью
допплеровского потока в суженном канале свидетельствуют об инвазии опу-
холи.
Внепеченочные желчные протоки
Несмотря на то, что интраоперационный ультразвук может применяться для
выявления холангиокарциномы и ее местного распространения, более широ-
ко его используют для диагностики доброкачественных заболеваний. С появ-
лением и быстрым развитием лапароскопических холецистэктомий, хирурги
получили в свое распоряжение неионизационный метод исследования для
оценки анатомических взаимоотношений и уровня обструкции протоков, вы-
званной желчными камнями. С появлением нового поколения лапароскопи-
ческих датчиков хирурги в нашем учреждении накопили значительный опыт
их применения в качестве замены или дополнения холангиографии. Методи-
ка, описанная здесь, применима как для открытого, так и для лапароскопиче-
ского доступа.
В обоих случаях, для того чтобы получить точные изображения, должна
использоваться насадка для обеспечения более плотного контакта. Вначале
из стандартного положения идентифицируйте портальную триаду печени,
имеющую вид головы Микки Мауса (рис. 8.7): большой эхонегативный
круг, соответствующий лицу Микки, — портальная вена, его левое ухо
печеночная артерия, а правое — общий желчный проток. Для установления
кровотока и облегчения идентификации можно применить цветное доппле-
ровское исследование (в желчном протоке не определяется никакого тече-
ния). Переориентируйте датчик так, чтобы луч проникал вдоль портальных
сосудов. Это даст возможность увидеть косое взаиморасположение пече-
ночной артерии и общего желчного протока (рис. 8.8).
Переместите датчик по ходу портальной триады, чтобы увидеть бифур-
кацию всех трех структур на «срезе» печени (рис. 8.9). Если датчик направ-
лен к двенадцатиперстной кишке, иногда можно рассмотреть место впаде-
ния пузырного протока. По мере того как датчик перемещается в каудаль-
ном направлении, обратите внимание на то, что вокруг общего желчного
протока отмечается область в виде гомогенного матового стекла, которая
представляет собой внутрипанкреатический участок его хода. Наконец, ультра-
сонографическое изображение начинает ослабевать, поскольку заполненная
воздухом двенадцатиперстная кишка не в состоянии проводить звуковые
волны.
320
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Рис. 8.7. Внепеченочные портальные структуры в виде головы Микки Мауса.
Вследствие интенсивной эхогенности и полного затенения рисунка, кам-
ни общего желчного протока легко определяются, как только оператор сори-
ентируется в портальных структурах (рис. 8.10). Интраоперационный ульт-
развук имеет явное преимущество, облегчая опенку портальных структур
перед проведением холедохотомии. Кроме того, во время традиционного
исследования общего желчного протока и холангиографии проток заполня-
ется рентгеноконтрастным веществом, которое может затенить камни. Ульт-
развук проникнет через контраст и поможет определить, восстановлена ли
проходимость протока.
По нашему опыту, интраоперационный лапароскопический ультразвук
столь же быстр и точен, как интраоперационная холангиография, но не ис-
пользует ионизирующее излучение и может быстро осваиваться хирургом
общей практики. Интраоперационный ультразвук не только обеспечивает
выводы
321
Рис. 8.8. Косое расположение печеночной артерии и общего печеночного протока
более детальное представление органов, но и позволяет хирургу оценить
успех выполненной процедуры.
ВЫВОДЫ
Не требуя применения ионизирующего излучения, интраоперационное УЗИ
дополняет обычную тактильную и визуальную оценку хирурга и обеспечива-
ет получение изображений в реальном времени с увеличением и высоким раз-
решением. Методика проста и быстроизучаема на практике хирургом или ор-
динатором. Работая совместно с радиологами, хирурги находят более широ-
кое применение ультразвука в операционной. Используя эту методику, лечащий
врач в состоянии обеспечить своим пациентам лучшую оперативную по-
мощь.
21 Уп ьтразвуковая диагностика...
322
8. ИНТРАОПЕРАЦИОННОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Рис. 8.9. Бифуркации портальных структур на «срезе» печени.
БЛАГОДАРНОСТЬ
Хотелось бы выразить слова благодарности Gary L. Merhar, M.D. из отделе-
ния радиологии Университета города Цинциннати за помощь в подборе изоб-
ражений, использованных в этой главе.
ЛИТЕРАТУРА
1. Kruskal JB, Kane RA. Intraoperative ultrasonography of the liver. Crit Rev
Diagn Imaging 1995;36:175-226.
2. Machi J, Sigel, B. Operative ultrasound in general surgery. Am J Surg
1996;172:15-20.
ЛИТЕРАТУРА
323
3. Machi J, Sigel В. Intraoperative ultrasonography. Radiol Clin Norm Am
1992;30:1085-1103.
4. Van Stiegmann G, McIntyre RC. Laparoscopic ultrasonography, has it ex-
tended the horizon? Gastrointestinal Endosc Clin North Am 1995;5:
869-878.
ЛАПАРОСКОПИЧЕСКАЯ
УЛЬТРАСОНОГРАФИЯ
Алан Е. Зиперштейн
Лапароскопическая ультрасонография представляет собой относительно но-
вую область хирургической сонографии. В прошлом множество исследова-
ний в открытой интраоперационной ультрасонографии сонографисты вы-
полняли, используя датчики, предназначенные для чрескожного применения.
На современном этапе требования к используемой аппаратуре расширились.
Успешное внедрение методики лапароскопической ультрасонографии по-
требовало разработки специализированных датчиков, свободно проводимых
через обычный лапароскопический троакар.
К счастью, технологии развиваются быстро, и в настоящее время произ-
водители предлагают несколько конфигураций датчиков для существую-
щих ультразвуковых аппаратов. Кроме того, ими представлены специализи-
рованные ультрасонографические модули для лапароскопической хирур-
гии. Развитие высокочастотных датчиков устранило появление артефактов,
вызванное кожей и подкожно-жировой клетчаткой, позволяя клиницистам
получать высококонтрастные изображения с большим разрешением.
Многие модули снабжены такими передовыми возможностями, как вы-
полнение цветной или энергетической допплерографии. Они проявляют вы-
сокие эксплуатационные качества, надежность и легкость эксплуатации. В
результате, выполнение лапароскопической ультрасонографии становится
рутинным исследованием без дополнительных обременительных усилий.
ТРЕБОВАНИЯ
Невозможность пальпации ткани остается одним из главных ограничений ла-
пароскопической хирургии. Через лапароскопические зажимы может быть
получена только элементарная осязательная обратная связь. Такое оборудо-
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
ТРЕБОВАНИЯ
325
ванне дает клиницисту весьма ограниченную способность определения стро-
ения ткани или образования, залегающего под поверхностными структура-
ми. Лапароскопическая ультрасонография компенсирует указанные ограни-
чения и позволяет оперирующему хирургу видеть ткани.
Лапароскопическая ультрасонография часто имитирует действия в от-
крытой хирургии, как, например, в тех случаях, когда хирурги пытаются об-
наружить метастазы печени. Но здесь открывается множество новых воз-
можностей, которые при традиционном открытом вмешательстве широко
не используются. Получение изображения желчных протоков во время ла-
пароскопического ультрасонографического исследования представляет со-
бой одну из таких возможностей.
Лапароскопическая ультрасонография начала свое развитие в 1981 г.,
когда Fukuda и соавторы [1] сообщили о разработке модуля для практического
выполнения лапароскопической ультрасонографии. В этом исследовании про-
водилась систематизированная оценка пациентов с опухолями печени, стадия
которых устанавливалась лапароскопически. Исследование было предприня-
то до широкого распространения КТ для определения стадии этих заболева-
ний, так что лапароскопия в таких случаях была основным диагностическим
инструментом хирургов и гастроэнтерологов.
Описанный модуль свободно проводится через лапароскопический тро-
акар диаметром 10 мм и расположен на радиально сканирующем (360°) дат-
чике, подобно находящемуся на гибком эндоскопе. Модуль снабжен гибким
наконечником — последнее усовершенствование в современном оборудова-
нии. Одновременная визуализация была достигнута размещением 5-мм ла-
пароскопа с угловой оптикой в углубление датчика на дистальном конце од-
ной из сторон модуля таким образом, чтобы датчик был виден при поворо-
тах лапароскопа. Это было вызвано технической необходимостью, поскольку
видеокамер с одним чипом еще не существовало. Оператору приходилось че-
редовать вид через лапароскоп с изображением на экране сонографа.
Выводы, сделанные в результате исследования, имеют значение и се-
годня. Авторы продемонстрировали, что при выявлении метастазов в пече-
ни лапароскопическая ультрасонография является полезным дополнением к
обычной диагностической лапароскопии. Как известно из данных трансаб-
доминальной и интраоперационной ультрасонографии, ультразвукой вид
образования слабо коррелирует с гистологическими данными. Наиболее важ-
ное наблюдение состояло в том, что лапароскопическая ультрасонография
могла использоваться для выполнения биопсии печени и обеспечивала по-
лучение информации, которая ранее могла быть доступна только при лапа-
ротомии. С созданием улучшенных КТ и МРТ сканеров необходимость в та-
кой диагностической лапароскопии снизилась. Однако в настоящее время
производители медицинского оборудования снова обратились к развитию
технологии лапароскопической ультрасонографии.
326
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
ОБОРУДОВАНИЕ
В настоящее время существует много конфигураций лапароскопических ульт-
развуковых датчиков, использующихся для различных целей [2] (рис. 9.1).
Современные датчики свободно проводятся сквозь обычный 10-мм лапаро-
скопический троакар. Простым и во многих отношениях удобным вариантом
представляется ригидный линейный датчик с боковым излучением. Для это-
го датчика используется легкий штифт диаметром 10 мм, 4 дистальных сан-
тиметра которого и занимает линейный трансдьюсер. Последний сканирует
под углом 90° к продольной оси датчика, вдоль которой установлена кристал-
лическая группа. Поскольку трансдьюсер представляет собой длинный дат-
чик с тупыми краями, он позволяет сонографисту легко приподнимать ткани
и манипулировать ими.
Такие трансдьюсеры позволяют получить превосходную визуализацию
и великолепное разрешение даже на расстоянии 8 10 см от датчика. Многие
аппараты оснащены цветным или энергетическим допплером. Тем не менее
существуют определенные недостатки. Для исследования структуры в двух
плоскостях ригидный датчик придется размещать в различных троакарах
Например, при визуализации желчного тракта клиницисты легко получают
поперечные изображения через подмечевидный порт; но для получения
продольного изображения протоков необходимо переместить датчик в троа-
кар, установленный в пупочной области.
Даже в этом случае получение прецизионных продольных изображений
протоковой системы целиком весьма затруднительно. Добавление гибкого
Рис. 9.1. Конфигурации лапароскопических ультразвуковых датчиков с соответствующими
им полями обзора. А и Б — это механические секторные датчики, требующие только
небольшой области соприкосновения между кончиком и тканью. В и Г — линейные
датчики, выпускаемые в жестком и гибком вариантах
ОБОРУДОВАНИЕ
327
шарнира проксимальнее ультрасонографического трансдьюсера дает воз-
можность его отклонения в одной или двух плоскостях, по замыслу изгото-
вителя. Такая конфигурация позволяет отображать исследуемую структуру
как в поперечной, так и в продольной плоскости, не перемещаясь в другой
троакар. Для поперечного изображения общего желчного протока через суб-
ксифоидный порт датчик следует позиционировать линейно. Придавая
трансдьюсеру L-образную форму и вращая модуль на 90° по оси порта, кли-
ницист получает продольный вид.
Подобные трансдьюсеры обычно имеют большие размеры, посколь-
ку кнопки для сгибания датчика напоминают кнопки, расположенные на
колоноскопе. Гибкий трансдьюсер может быть неудобен в управлении, а
гибкий наконечник делает его несколько неуклюжим при манипуляции
тканями.
Так же как при чрескожной и интраоперационной ультрасонографии во
время открытого вмешательства, при лапароскопическом УЗИ для опреде-
ленных целей применяются разнообразные конфигурации датчиков; ультра-
сонографический датчик одного вида не может справиться со всеми задача-
ми. В начале 1990-х годов специализированный лапароскопический модуль
небольшого размера, устанавливаемый на стандартной лапароскопической
стойке, был усовершенствован. Трансдьюсер состоит из стержня диаметром
10 мм и механического секторного датчика, обеспечивающего обзор конце-
вым излучением. При помещении кончика датчика на исследуемый орган
возникает веерообразное поле зрения. При такой конфигурации датчика
требуется только небольшая область контакта кончика трансдьюсера с тка-
нями.
Для получения полноценного изображения линейно сканирующим дат-
чиком вся его дистальная 4-см часть должна прилежать к тканям. Для неко-
торых структур, например желчного дерева, может потребоваться адекват-
ная компрессия тканей. Из-за этого просвет общего желчного протока мо-
жет быть сглажен, что ухудшает условия его идентификации. Однако при
использовании датчика, излучающего со своей концевой части, для визуали-
зации всей портальной триады требуется незначительный контакт и неболь-
шая компрессия.
Концевой датчик имеет и другое уникальное свойство. При повороте на
90° поперечный вид изменяется на продольный, и наоборот. Благодаря это-
му можно избежать обременительной репозиции, требующейся для датчика
с боковым излучением.
Основной недостаток концевого датчика состоит в том, что поверхност-
ные образования, прилежащие непосредственно к трансдьюсеру, выпадают
из поля зрения. Таким образом, этот тип датчика не годится, например, для
сканирования печени при ее метастатическом поражении, так как поверхно-
стные новообразования могут быть пропущены.
328
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
УЗИ обычно проводят в затемненном помещении, чтобы различать от-
тенки серого цвета на экране монитора. Панель управления ультразвукового
аппарата нередко отпугивает неподготовленный персонал, поэтому обучите
сотрудников операционного блока основам его использования, а наиболее
часто используемые элементы управления снабдите дополнительными яр-
лыками. В будущем изготовители ультразвукового оборудования, вероятно,
смогут обеспечить дистанционное управление наиболее часто используе-
мыми хирургом элементами.
ПОДГОТОВКА К ЛАПАРОСКОПИЧЕСКОМУ ИССЛЕДОВАНИЮ
Подготовка к выполнению лапароскопической ультрасонографии проста.
Наиболее удобно стерилизовать датчик оксидом этилена или обрабатывать
его раствором глютаральдегида. Изготовители предоставляют специфика-
цию относительно типа стерилизации, которой может быть подвергнут дан-
ный датчик. Предварительная стерилизация датчика полностью и его разъема
оксидом этилена и последующее обертывание оборудования стерильным
способом до применения являются единственно правильным подходом. То-
лько ограниченное число датчиков совместимо с системой Steris, поскольку
разъем в основном ультразвуковом модуле невозможно сделать водонепроница-
емым. К счастью, это не является проблемой при стерилизации оксидом этилена.
Лаборанты преднамеренно избегают герметичного запечатывания разъема и
монтажного кабеля, застраховываясь от того, чтобы сниженное атмосферное
давление, используемое во время стерилизации, не явилось причиной расшире-
ния воздуха, находящегося внутри монтажного кабеля, приводя к его разрыву.
При обработке датчика раствором глютаральдегида необходимо сле-
дить за тем, чтобы в жидкость не погружались кабельные разъемы. Несмот-
ря на то, что эта предосторожность кажется очевидной, невнимательность
может привести к погружению разъема кабеля с весьма дорогостоящими по-
следствиями. Отметьте разъемы датчика этикетками «Не мочить».
Некоторые сонографисты используют стерильные чехлы, чтобы закрыть
нестерилизовавшиеся лапароскопические ультразвуковые датчики. Однако
при проведении через лапароскопический троакар пластиковые чехлы мо-
гут быть легко порваны с риском внутрибрюшного загрязнения ультрасо-
нографическим трансмиссионным гелем.
УВЕЛИЧЕНИЕ КАРТИНКИ В КАРТИНКЕ
Вставка картинки в картинку (PIP) значительно улучшает условия работы хи-
рургов, применяющих лапароскопическое УЗИ. Возможность наложения ла-
пароскопического изображения на ультразвуковое позволяет хирургу при
проведении исследования смотреть на один монитор вместо необходимости
переводить взгляд с лапароскопического изображения на монитор ул ьтразву-
КОНТАКТНОЕ СКАНИРОВАНИЕ
329
кого аппарата. Хорошая координация рук и зрения при выполнении лапаро-
скопического УЗИ может оказать существенную помощь и без этого допол-
нительного усовершенствования.
Использование технологии PIP позволяет получить лапароскопическое
и ультразвуковое изображения на одной видеозаписи, что оказывается осо-
бенно полезным при обучении или повторном анализе этого случая. Не-
смотря на то, что эта технология используется несколькими изготовителями
лапароскопических камер, коммерческие фирмы предлагают гораздо менее
дорогие, но также высококачественные модули, снабженные разъемами типа
S-видео. Обычно вставляемое изображение, размещаемое сонографистом, за-
нимает четверть экрана, после чего рамка PIP передвигается в зависимости
от вида ультразвукового изображения.
КОНТАКТНОЕ СКАНИРОВАНИЕ
При большинстве исследований с применением интраоперационного ультра-
звука во время открытого вмешательства клиницисты заполняют операцион-
ное поле солевым раствором, который выступает в роли нейтральной среды
между датчиком и отображаемым органом. Для новейших датчиков, которые
предоставляют превосходное разрешение прилежащей области, редко требу-
ется применение солевого раствора. Почему? Небольшой объем крови в со-
левом растворе затрудняет распознавание подлежаших структур во время ла-
пароскопического вмешательства. Поэтому почти при всех видах лапароско-
пического исследования применяют контактное сканирование. При такой
методике тонкая пленка жидкости на поверхности органа действует как сред-
ство акустического сопряжения (от датчика в ткани).
ФЛЮОРОХОЛАНГИОГРАФИЯ
Исследованиями установлена эффективность использования лапароскопи-
ческой ультрасонографии в различных случаях. Одним из самых ранних и
наиболее широко изученных видов ее применения является исследование
желчных протоков во время лапароскопической холецистэктомии. Флюоро-
холангиография — наиболее простой способ изображения желчного дерева
как в случае открытой, так и в случае лапароскопической холецистэктомии
[3]. Исследования, выполненные в эпоху открытой холецистэктомии, под-
твердили, что интраоперационная ультрасонография являлась чувствитель-
ным и неинвазивным методом обнаружения камней в просвете общего желч-
ного протока [4]. Недостаточность оснащения и обучения воспрепятствовала
завоеванию этим подходом широкого признания. В лапароскопическую эпо-
ху возобновился интерес к обнаружению камней общего желчного протока
при выполнении ультрасонографии желчного дерева [5 9].
330
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
Описан опыт 300 лапароскопических холецистоэктомий [10], во время
которых предпринимались и ультрасонографическое и флюорохолангиогра-
фическое исследование. После установления троакара, но до рассечения
треугольника Кало, выполнялось лапароскопическое ультрасонографическое
исследование внепеченочных желчных протоков. Такой систематический
метод, основанный на определении анатомических ориентиров, позволяет
другим клиницистам воспроизвести методику сканирования.
Вначале, для подтверждения наличия камней и гарантии правильности на-
стройки ультразвукового аппарата визуализируется желчный пузырь (рис. 9.2).
Следующее позиционирование датчика выполняется для получения попе-
речного вида портальной триады на уровне отхождения пузырного протока
(рис. 9.3). Приблизительно в двух третях случаев пузырный проток может
четко прослеживаться до места впадения в общий желчный проток. Струк-
турные составляющие портальной триады можно дифференцировать, пола-
гаясь на их ультрасонографические признаки и анатомические взаимоотно-
шения.
Общий желчный проток расположен кпереди и латерально и обычно
выглядш как тонкостенная структура с анэхогенным просветом. Воротная
вена расположена кзади и медиальнее. Медленный кровоток в этом сосуде
проявляется искрением в просвете сосуда, обусловленным отражением уль-
тразвукового луча от небольших групп клеток крови. При несильном надав-
ливании ультрасонографическим датчиком и общий желчный проток и пор-
тальная вена легко сжимаются, что заметно отражается на их изображении.
Рис. 9.2. На ультразвуковом и лапароскопическом изображениях отмечается осадок в
просвете желчного пузыря.
ФЛЮОРОХОЛАНГИОГРАФИЯ
331
Рис. 9.3. Поперечный вид через портальную триаду на уровне пузырного протока
(ОЖП, общий желчный проток).
Анатомическое расположение печеночной артерии вариабельно, посколь-
ку на всем пути следования в портальной триаде ее ход извилист. На уровне би-
фуркации протока и портальной вены артерия в типичных случаях рас-
полагается между этими структурами. Для нее характерна пульсация и от-
сутствие компрессии при легком надавливании. Нижняя полая вена визуа-
лизируется глубже портальной триады. Эта крупная структура проявляет
типичную А- и V-волновую пульсацию и легкосжимаема.
Для облегчения идентификации общего желчного протока переместите
датчик краниальнее по ходу портальной триады (рис. 9.4). Затем передвинь-
те датчик дистальнее вниз от общего желчного протока (рис. 9.5) и продол-
жайте движение в дистальном направлении до сфинктера Одди и двенадца-
типерстной кишки. Как только внепеченочная часть протока будет визуали-
зирована в поперечной плоскости, переориентируйте датчик, чтобы выполнить
ее продольное сканирование (рис. 9.6).
Какие критерии успешного сканирования общего желчного протока вы-
деляем мы? Поперечный и продольный виды внепеченочных протоков. Хи-
рурги не пытаются визуализировать внепеченочные протоки лапароскопи-
чески, за исключением случаев множественных камней общего желчного
протока, потому что таким пациентам требуется проведение флюорохолан-
гиографии как части лапароскопического исследования общего желчного
протока.
Для специального исследования [10] использовались различные типы
датчиков, в том числе ригидные и гибкие датчики с боковым излучением и
332
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 9.4. Поперечный вид неизмененной бифуркации общего желчного протока
(ОЖГТ) в паренхиме печени.
секторные датчики с концевым типом излучения. Хотя все датчики позволя-
ют получать превосходное изображение желчных протоков, обнаружено,
что датчики с концевым типом излучения наиболее легки в использовании,
поскольку им требуется только небольшая область контакта с портальной
триадой. Более того, эта модель легко вращается вдоль оси троакара, что по-
зволяет получать изображения как в продольной, так и в поперечной плос-
кости. К сожалению, такой специфический датчик уже не производится.
Другие конфигурации датчиков обеспечили лучшее качество изображения
общего желчного протока, однако их позиционирование немного сложнее.
Из 300 исследуемых пациентов успешное проведение лапароскопиче-
ской ультрасонографии выполнено во всех случаях, а флюорохолангиогра-
фии — в 94% случаев. Камни общего желчного протока были выявлены у
26 пациентов; каждым из методов визуализации обнаружено 25 из 26 кам-
ней. Ложноположительных результатов ни при одном из методов получено
не было. Так же как и некоторые другие исследователи, авторы данной рабо-
ты отметили, что ультрасонография является чувствительным и точным ин-
струментом выявления камней общего желчного протока [11, 12].
Важно отметить, что лапароскопическая ультрасонография оказалась
полезным методом для получения изображения желчных протоков перед их
диссекцией. У большинства пациентов со средневыраженным хроническим
холециститом общий желчный проток визуализируется полностью. Хирур-
ги редко подвергают сомнению анатомические взаимоотношения между об-
щим желчным протоком, пузырным протоком и желчным пузырем. У мно-
ФЛЮОРОХОЛАНГИОГРАФИЯ
333
Рис. 9.5. А. Поперечный вид через портальную триаду на уровне верхнего края
поджелудочной железы. Б. Поперечный вид более дистального сегмента общего
желчного протока (ОЖП).
гих пациентов с острыми воспалительными изменениями или аберрантной
анатомией анатомические взаимоотношения этих структур не настолько оче-
видны.
Четко идентифицируя общий желчный проток с помощью лапароскопи-
ческой ультрасонографии, можно уверенно определить место пересечения
334
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 9.6. Продольный вид более дистального сегмента общего желчного протока.
пузырного протока с необходимым отступом. Наше субъективное ощуще-
ние таково (необходимо провести рандомизированное исследование), что
риск повреждения общего желчного протока может быть снижен, если сле-
довать нашей методике. Кроме того, мы имели возможность избежать при-
менения открытой операции у некоторых пациентов.
Во время диссекции лапароскопический ультразвук можно повторить
для подтверждения анатомических ориентиров и чтобы убедиться, что хи-
рург работает в безопасной области. Также следует выявить аберрантное
строение, такое как низкое отхождение правого желчного протока, чтобы не
принять его за пузырный проток. Время и стоимость исследования также на-
водят на мысль, что лапароскопическая ультрасонография билиарного трак-
та может оказаться менее дорогостоящей, чем флюорохолангиография. Хо-
лангиография обычно выполняется в течение 10—15 мин, однако возможны
задержки, если рентгенологи не могут принять участие в исследовании не-
медленно. Для полного исследования билиарного тракта с помощью лапаро-
скопического ультразвука достаточно 5-7 мин [11, 12].
КАМНИ ЖЕЛЧНОГО ДЕРЕВА
Лапароскопическая ультрасонография легко идентифицирует камни в про-
свете желчного протока. Как и при трансабдоминальном сканировании, кам-
ни общего желчного протока имеют эхогенный вид и типичную акустиче-
скую тень («хвост кометы»), направленную от датчика (рис. 9.7). Флотирую-
ВИЗУАЛИЗАЦИЯ ПЕЧЕНИ
335
Воротная
вена
••г
а •
се*
Ультразвуковое
изображение
Датчик
апароскопичеся
J изображение
Рис. 9.7. Поперечный вид средней трети общего желчного протока, полученный с
помощью гибкого линейного датчика. Внутри протока с утолщенной стенкой
определяется камень размером 4 мм.
щие камни в просвете общего желчного протока являются хорошо заметными
образованиями, а хирурги могут отмечать осадок из 1-2 мм крупиц (рис. 9.8).
Камни, плотно вколоченные в дистальную часть общего желчного протока,
вначале могут различаться немного труднее, чем флотирующие.
Общий желчный проток нередко сужается; в его окончании типично
изображение камня с эхогенной структурой и дорсальной тенью — оно об-
наруживается до визуализации двенадцатиперстной кишки (рис. 9.9). В та-
ких случаях воспалительная реакция на конкремент и обтурацию служит
причиной видимого утолщения стенки общего желчного протока, указыва-
ющего на то, что скоро в ходе исследования может встретиться камень.
После лапароскопического осмотра общего желчного протока, допол-
ненного флюороскопией или холедохоскопией, завершение исследования
холангиографией имеет преимущества над ультрасонографией. Почему? Хи-
рурги могут идентифицировать перфорацию общего желчного протока при
вытекании контраста, а также обнаружить сохранившиеся внутрипеченоч-
ные конкременты.
ВИЗУАЛИЗАЦИЯ ПЕЧЕНИ
Лапароскопическая ультрасонография незаменима при визуализации пече-
ни. Тревоги исследователей относительно объема вмешательства при онко-
логической лапароскопической колэктомии и опухолевого обсеменения во-
336
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 9.8. А. Продольное изображение средней трети общего желчного протока,
полученное с помощью механического секторного датчика. В просвете определяется
камень размером 5 мм. Б. Холангиограмма того же пациента. Камень в просвете
общего желчного протока, над ним меньший конкремент или взвесь.
рот печени в значительной степени разрешились [13]. Но отказ от выполне-
ния тщательного осмотра печени для выявления метастатического поражения
означает необоснованность колэктомии. Как и при открытой резекции ободоч-
ной кишки, хирурги в большей степени, чем на пальпацию и дооперационное
КТ-сканирование, полагаются на интраоперационную ультрасонографию.
ВИЗУАЛИЗАЦИЯ ПЕЧЕНИ
337
Рис. 9.9. А. Продольное изображение вколоченного камня в дистальном отделе
общего желчного протока. Стенки протока утолщены. Б. Флюороскопическое
изображение того же пациента.
Лапароскопическая ультрасонография обещает стать чувствительным
методом оценки печени во время лапароскопической резекции ободочной
кишки. У большинства пациентов при использовании гибкого ультрасоно-
графического датчика с боковым излучением, проведенного сквозь троакар в
правую подреберную область по среднеключичной линии, паренхима печени
22 Ультразвуковая диагностика...
338
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
может быть исследована полностью. Начав в типичных случаях с правой
стороны и двигаясь влево, можно методично выполнить многократно пере-
крывающиеся «проходы» печени. Несмотря на то, что толщина печени ино-
гда достигает пределов глубины видимости датчика частотой 7,5 МГц. хи-
рург может легко идентифицировать все отделы правой доли, позиционируя
датчик в правом боковом канале. У некоторых пациентов ригидным датчи-
ком трудно отобразить большую часть верхней стороны 7 и 8 сегментов. В
такой ситуации клиницисты могут разместить гибкий датчик над куполом
печени в слегка согнутом положении.
Размещение датчика слева от серповидной связки позволяет полностью
исследовать 2-й и 3-й сегменты как по передней, так по задней поверхности.
С превосходным разрешением лапароскопического изображения соногра-
фист имеет возможность проследить ветви портальной вены, чтобы устано-
вить точную сегментарную локализацию идентифицируемого образования.
Для гистологического подтверждения диагноза под контролем лапароско-
пического ультразвука может быть выполнена биопсия подозрительных ме-
тастатических фокусов.
Метастатические очаги аденокарциномы в печени в типичных случаях
имеют гипоэхогенную периферическую и гипо-, изо- или гиперэхогенную
центральную часть (рис 9 10). Центральная область таких опухолей утрачи-
вает гомогенное строение, характерное для паренхимы печени и ее сосудов.
Сосуды, смежные с опухолью, часто оттесняются или изгибаются вокруг
образования. Метастазы нейроэндокринных опухолей в печень в типичных
случаях гиперэхогенны, однако подобный сонографический вид могут иметь
и гемангиомы. При КТ гемангиомы характеризуются периферическим на-
коплением контраста. Внутри метастатических фокусов иногда отмечается
центральная кальцификация.
ДРУГИЕ ПРИМЕНЕНИЯ
Дренирование кист печени
Лапароскопическая ультрасонография может помочь в проведении дренажа
множественных кист печени. Большие кисты обычно видны на поверхности
и не представляют никакой трудности в определении их локализации. Кисты,
не достигающие поверхности печени, легко идентифицируются с помощью
лапароскопической ультрасонографии, так как они проявляются в виде анэхо-
генных структур с четкими контурами.
Выявление аденокарциномы поджелудочной железы
Лапароскопическая ультрасонография способствует выявления аденокарци-
номы и других злокачественных новообразований поджелудочной железы
[ 18] (рис. 9.11). Продемонстрировано улучшение выявления метастатическо-
ДРУГИЕ ПРИМЕНЕНИЯ
339
Рис. 9.10. Лапароскопический вид двух небольших метастатических очагов внутри
печени. Размер большего образования 1,2 см, меньшего — 1 см.
го поражения в тех случаях, когда диагностическая лапароскопия дополня-
лась ультрасонографией. Для обследования пациента с аденокарциномой
поджелудочной железы хирурги могут применять лапароскопическую ульт-
расонографию поджелудочной железы, портальной триады, периаортальных
лимфатических узлов и паренхимы печены.
Во многих случаях обнаружение значительного распространения забо-
левания избавляет пациента от лапаротомии, существенно улучшая качест-
во его жизни. Методика исследования портальной триады и головки подже-
лудочной железы та же, что и при исследовании общего желчного протока
при желчекаменной болезни. Лимфатические узлы в типичных случаях выгля-
дят как овальные гипоэхогенные структуры. Ультрасонографическая иден-
тификация подозрительного узла помогает провести последующую точную
диссекцию вблизи портальной триады для гистологического исследования.
Портальная вена и опухолевая инвазия визуализируются при ультрасо-
нографии даже без использования цветной флоуметрии; однако такую опу-
холь обычно обнаруживает дооперационная КТ.
Помощь в лапароскопической адреналэктомии
При проведении лапароскопической адреналэктомии ультрасонография мо-
жет применяться для определения локализации опухоли и идентификации
смежных с ней структур [19]. 11равосторонние образования склонны к более
340
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
Рис. 9.11. Автоматический (черно-белый) вид сектора периапулярной опухоли
головки поджелудочной железы с обтурацией общего желчного протока
тесным анатомическим связям с нижней полой веной, и сонографисты легко
идентифицируют большие образования с обеих сторон. Маленькие левосто-
ронние опухоли не так заметны, особенно у тучных пациентов. Применение
лапароскопической ультрасонографии обычно позволяет отчетливо иденти-
фицировать опухоли надпочечника. Нормальная паренхима надпочечника у
большинства пациентов не отличается от окружающей жировой ткани с до-
статочной ясностью. Большинство новообразований надпочечников опреде-
ляются как гипоэхогенные структуры с гиперэхогенным ободком. Определе-
ние анатомических взаимоотношений между опухолью надпочечника, верхним
полюсом почки, смежными внутренними органами и сосудами оказывается по-
лезным при выборе соответствующей области для разреза.
Помощь при малоинвазивных вмешательствах
Лапароскопическая ультрасонография используется врачами при выполне-
нии некоторых специализированных процедур. Например, эта методика яв-
ляется полезным дополнением при трансгастральном дренировании псевдо-
кист поджелудочной железы. Клиницисты осматривают просвет желудка эн-
доскопом, проведенным через пищевод, или лапароскопом, проведенным
сквозь троакар, введенный в просвет желудка через брюшную стенку.
Местоположение псевдокисты по задней стенке желудка часто не столь
очевидно, как можно было бы предположить при дооперационном КТ. Уточ-
нив локализацию, проведение лапароскопической ультрасонографии можно
предпринять для определения центра псевдокисты и наиболее тонкой облас-
ОГРАНИЧЕНИЯ ЛАПАРОСКОПИЧЕСКОГО УЛЬТРАЗВУКА
341
ти соприкосновения кисты и желудка. Несмотря на то, что содержимое
псевдокисты при дооперационном КТ-сканировании может показаться от-
носительно гомогенным, ультрасонографическое изображение часто выяв-
ляет его гетерогенный характер. Поэтому получение таких данных еще не
означает, что пациент не страдает кистозным новообразованием поджелу-
дочной железы.
ОГРАНИЧЕНИЯ ЛАПАРОСКОПИЧЕСКОГО УЛЬТРАЗВУКА
Лапароскопическая ультрасонография не требуется при идентификации опу-
холей толстой и тонкой кишки. Большие опухоли легко распознаются с помо-
щью диагностической лапароскопии. Маленькие опухоли, однако, могут за-
теняться газом, присутствующим в просвете органа. Врачами накоплен зна-
чительный опыт применения внут рипросветного ультразвука для определения
степени трансмуральной инвазии злокачественных образований прямой кишки.
Учитывая трудность в лапароскопическом отображении опухолей толстой
кишки, эта методика потерпела неудачу при испытании ее применения в ка-
честве дополнительного метода исследования.
ДОППЛЕРОВСКОЕ ИССЛЕДОВАНИЕ
Высококачественное серошкальное изображение с превосходной, почти пол-
ной, видимостью остается наиболее важной особенностью лапароскопиче-
ского ультразвукового оборудования. Цветной и энергетический допплеры
хотя и отражают стремление хирургов к высоким технологиям, весьма огра-
ничены в применении на практике.
Например, при отображении портальной триады анатомическая локали-
зация, пульсация и сжимаемость структур позволяют провести их четкую
идентификацию. Проведение цветного допплеровского исследования явля-
ется дополнительным и излишним подтверждением подлинности этих струк-
тур. Цветной допплер может помочь при обучении распознавания структур
портальной триады или внутрипеченочных сосудов.
Некоторые специальные процедуры, такие как лапароскопическое вы-
полнение приема Pringle, могут подтвержаться данными о снижении внутри-
печеночного кровотока. В случаях применения с научно-исследовательской
целью таких как термическая аблация опухолей печени, изучение допплеров-
ского потока до и после процедуры может подтвердить успешное завершение
разрушения опухоли [20].
ВЫВОДЫ
Лапароскопическая ультрасонография предлагает относительно новое и увле-
кательное дополнение в области хирургической сонографии. Интересно, что
342
9. ЛАПАРОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ
эта технология почти полностью получила свое развитие на хирургическом, а
не на радиологическом поприще. Поскольку применение ультрасонографи-
ческих аппаратов в операционной становится все более и более обычным яв-
лением, применение лапароскопического ультразвукового датчика оправды-
вает затраты. Доступность оборудования и обучение хирургов этой методике
позволят лапароскопическому УЗИ стать мощным оружием лапароскопиче-
ского арсенала.
ССЫЛКИ
1. Fukuda М, Mima F, Nakano, Y. Studies in echolaparoscopy. Scand J Gast-
roenterol 1982;17(suppl 78): 186—187.
2. Siperstein AE. Laparoscopic ultrasonography. In: Braverman MH, Tawes
RL, eds., Surgical technology international II. San Francisco: Surgical Tec-
hnology International, 1993:113-116.
3. Berci G, Sackier J, Paz-Partlow M. Routine or selected intraoperative cho-
langiography during laparoscopic cholecystectomy. Am J Surg 1991; 161:
335-360.
4. Sigel B, Machi J, Beitler C, et al. Comparative accuracy of operative ultra-
sonography and cholangiography in detecting common duct calculi. Surge-
ry 1983;94:715-720.
5. Barteau JA, Castro D, Arregui ME, et al. A comparison of intraoperative ul-
trasound versus cholangiography in the evaluation of the common bile duct
during laparoscopic cholecystectomy. Surg Endosc I995;9:49O 496.
6. Kubota K, Bandai Y, Sano K, et al. Appraisal of intraoperative ultrasonog-
raphy during laparoscopic cholecystectomy. Surgery 1995;118:555-561.
7. Orda R, Sayfan J, Levy Y. Routine laparoscopic ultrasonography in biliary
surgery. A preliminary experience. Surg Endosc 1994;8:1239 1242.
8. Pietrabissa A, Di Candio G, Giulianotti PC, et al. Comparative evaluation of
contact ultrasonography and transcystic cholangiography during laparosco-
pic cholecystectomy: a prospective study. Arch Surg 1995; 130:1110-1114.
9. Reothlin MA, Scheob O, Schlumpf R, Largiader F. Laparoscopic ultraso-
nography during cholecystectomy. Br J Surg 1996;83:1512-1516.
10. Siperstein AE, Pearl JM, Hansen P, et al. Comparison of laparoscopic ultra-
sonography and fluorocholangiography in 300 patients undergoing laparos-
copic cholecystectomy. Surg Endosc 1998; 13(2): 113—117.
11. Stiegmann GV, Soper NJ, Filipi CJ, et al. Laparoscopic ultrasonography as
compared with static or dynamic cholangiography at laparoscopic cholecys-
tectomy. A prospective multicenter trial. Surg Endosc 1995;9:1269-1273.
12. Teefey SA, Soper NJ, Middleton WD, et al. Imaging of the common bile
duct during laparoscopic cholecystectomy: sonography versus videofluo-
roscopic cholangiography. AJR Am J Roentgenol 1995;165:847-851.
ссылки
343
13. Vukasin Р, Ortega АЕ, Greene FL, et al. Wound recurrence following laparos-
copic colon cancer resection. Results of the American Society of Colon and
Rectal Surgeons Laparoscopic Registry. Colon Rectum 1996;39:S2O-S23.
14. Herman K. Intraoperative ultrasound in gastrointestinal cancer. An analysis
of 272 operated patients. Hepatogastroenterology 1996;43:565-570.
15. Machi J, Sigel B, Zaren HA, et al. Operative ultrasonography during hepato-
biliary and pancreatic surgery. World J Surg 1993;17:640-646.
16. Fortunato L, Clair M, Hoffman J, et al. Is CT portography (СТАР) really
useful in patients with liver tumors who undergo intraoperative ultrasonog-
raphy (IOUS)? Am Surg 1995;61:560-565.
17. Staren ED, Gambia M, Deziel DJ, et al. Intraoperative ultrasound in the ma-
nagement of liver neoplasms. Am Surg 1997;63:591-597.
18. Champault G. The use of laparoscopic ultrasound in the assessment of panc-
reatic cancer. WiadLek 1997;50(suppl 1); 195-203.
19. Heniford ВТ, lannitti DA, Hale J, Gagner M. The role of intraoperative ult-
rasonography during laparoscopic adrenalectomy. Surgery 1997; 122:
1068-1073.
20. Siperstein AE, Rogers SJ, Hansen PD, Gitomirsky A. Laparoscopic thermal
ablation of hepatic neuroendocrine tumor metastases. Surgery 1997; 122:
1147-1155.
ТРАНСЭЗОФАГЕАЛЬНАЯ
ЭНДОСОНОГРАФИЯ
И ЭХОКАРДИОГРАФИЯ
10
Трансэзофагеальная ультрасонография может быть использована для иссле-
дования пищевода, сердца и грудной аорты. Эта глава состоит из трех частей:
А — эндоскопическая эндосонография, проводимая для определения стадии
эзофагеальной карциномы, Б—трансэзофагеальная эхокардиография (ТЭЭ)
и В — ТЭЭ для оценки тупой травмы грудной аорты.
Эндоскопическая эндосонография пищевода интересна не только гаст-
роэнтерологам, а ТЭЭ — кардиологамов и анестезиологам. Хирурги также
хорошо понимают основные принципы и клиническое применение этих ме-
тодик Успех проведения трансэзофагеальной ультрасонографии и ТЭЭ за-
висит от. 1) знания соответствующих показаний; 2) владения методикой эзо-
фагогастроскопии; 3) знания физических основ ультразвука и 4) способности
правильно интерпретировать изображения и выносить соответствующие кли-
нические заключения. Приобретение таких навыков требует значительного
времени и практики на рабочем месте с опытным хирургом, анестезиологом,
кардиологом или гастроэнтерологом (для эндоскопической эндосонографии).
Эта глава дает не детальный анализ, а краткий обзор таких методик.
А. ЭНДОСОНОГРАФ И ЧЕСКОЕ ИССЛЕДОВАНИЕ ПИЩЕВОДА
Марк Е. Поллок и Джон Г. Ли
До недавнего времени приемы классификации стадий эзофагеальной карци-
номы достигли предела и в рутинной практике не применялись. Без хирурги-
ческого исследования точное установление стадии заболевания затруднитель-
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
345
Таблица 10.1. ТМН-классификация рака пищевода
Стадия Первичная опухоль Гистология Региональные лимфоузлы Отдаленные метастазы
0 tis Карцинома in situ N0 МО
I Т1 Инвазия слизистой или подслизистой оболочки N0 МО
Т2 Инвазия собственной мышечной пластинки N0 МО
ТЗ Инвазия адвентиции N0 МО
ИА Т1 Инвазия слизистой или подслизистой оболочки N0 МО
НВ Т2 Инвазия собственной мышечной пластинки N1 МО
ТЗ Инвазия адвентиции N1 МО
П1 Т4 Инвазия смежных структур N0-N1 МО
IV Т1-Т4 Инвазия слизистой смежных структур N0-N1 Ml
но, а клиническая корреляция между установленной стадией и выбором ва-
рианта лечения была недостаточной. К счастью, выдающиеся успехи в
гастроинтестинальной эндоскопии обещают изменить эту картину. Особен-
но возможности расширяются при проведении эндоскопической эндосо-
нографии [1—3].
Что особенного в эндоскопической эндосонографии? Прежде всего, ме-
тод предоставляет детальные изображения стенки пищевода и смежных с
ней структур (рис. 10.1). Такие изображения позволяют клиницисту без хи-
рургического вмешательства точно определять глубину опухолевой инва-
зии (стадия Т) и наличие метастатических лимфатических узлов (стадия N).
Применяя эндосонографию для описания аспектов вовлечения в патологи-
ческий процесс, клиницисты могут соотнести ультрасонографические на-
ходки с процедурой установления TNM-стадий (опухоль, лимфатические
узлы, отдаленные метастазы) для пищевода [4, 5] (табл. 10.1).
Установлено, что опухоли стадии Tie интактной мышечной оболочкой
и опухоли стадии Т2 с интактной адвентицией визуализируются в пределах
первых трех слоев пищевода (рис. 10.2). Опухоли ТЗ- и Т4-стадий простирают-
ся в адвентицию пищевода или сквозь нее в прилежащие органы (рис. 10.3).
Отдаленные метастазы (М-стадия) в печень, легкие и другие органы обнаружи-
ваются плохо вследствие ограниченной глубины проникновения датчика час-
тотой 7,5-12 МГц [6, 7].
Исследования и практика показали, что для пациентов с раком пищево-
да точное установление Т- и N-стадии является решающим фактором про-
гнозирования и выбора тактики лечения.
346
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.1. Изображение нормального пищевода состоит из трех гиперэхогенных
(белых) и двух гипоэхогенных (черных) слоев.
ТОЧНОСТЬ
Как показало сравнение с гистопатологическими данными, полученными
при исследовании резецированных образцов, эзофагеальная эндосонография
оказалась точным методом определения Т- и N-стадий рака пищевода [2,6-8].
По данным литературы, точность установления Т-стадии варьирует между
80 и 90%; лучших результатов клиницисты добиваются при определении ТЗ-
и Т4-стадий образования. Неудачи эзофагеального УЗИ при II стадии (точ-
ность около 80%) связаны с переоценкой (завышением) стадии, поскольку
перитуморальные тканевые реакции зачастую неверно истолковываются как
опухоль. Недооценка ТЗ-стадии (точность около 90%) наблюдается прежде
всего потому, что инфильтрация адвентиции определяется лишь на микро-
точность
347
Рис. 10.2. А. Большая опухоль пищевода (Т1), расположенная целиком в пределах
подслизистого слоя. Б. Распространенный плоскоклеточный рак пищевода (Т2)
дистального отдела пищевода у 70-летнего мужчины. Отмечается инвазия опухоли
через мышечную оболочку и лимфатический узел размером 1,3x1,4 см.
КАРЦИНОМА
ДАТЧИК
348
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
ДАТЧИК
ЛИМФАТИЧЕСКИЙ
УЗЕЛ
АОРТА
КАРЦИНОМА
Рис. 10.2. (Продолжение.)
точность
349
Рис. 10.3. А. Эндоскопическое изображение практически циркулярного роста опухоли
ТЗ. Б. Отмечается трансмуральное поражение и прорастание адвентиции.
В. Эндоскопическое УЗИ выявляет карциному пищевода, распространяющуюся на
аорту (Т4). Г. Для сравнения показано непораженное пространство между аортой и
пищеводом.
скопическом уровне. Кроме того, установлению надлежащей стадии распро-
страненных опухолей может помешать проксимальный стеноз, вызванный
опухолью. Наличие такого сужения означает, что эзофагеальный датчик не
может преодолеть область, нуждающуюся в оценке [9]. Прогнозирование ме-
тастатического поражения лимфатических узлов с помощью эзофагеального
ультразвука оказывается более проблематичным. Определение N-стадии в
настоящее время имеет более низкую степень точности, чем определение
стадии Т [ 10, 11].
Точное определение NO-стадии с помощью эзофагеального ультразвука
возможно в 60% случаев. Некоторые признаки эндосонографического изоб-
ражения лимфатических узлов, такие как гипоэхогенная структура, резко
ограниченные края, округлые контуры и увеличение в размере более 1 см,
могут указать на злокачественную инвазию лимфатических узлов [6, 10-12].
В двух обширных исследованиях [9, 13] резецированных образцов, исполь-
зовавших сходные методы — сравнение узла с узлом и компьютерный ана-
лиз, получены противоречивые заключения относительно использования ха-
рактеристик лимфатического узла (in vitro) для возможности проведения
различий между его доброкачественным и злокачественным поражением.
350
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.3. (Продолжение.)
точность
351
Рис. 10.3. (Продолжение.)
Исследования ясно установили связь между увеличением глубины опухоле-
вой пенетрации и более высокой степенью метастазирования в лимфатиче-
ские узлы [14]. Эффективность эзофагеального ультразвука в правильном
определении стадии N повышается с увеличением Т-стадии (приблизитель-
но 80% для ТЗ- и Т4-опухолей), выявление высокой Т-стадии — один из
наиболее чувствительных индикаторов метастазирования в лимфоузел.
352
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
ПИЩЕВОД
СВОБОДНОЕ
• ПРОСТРАНСТВО
МЕЖДУ ПИЩЕВОДОМ
И АОРТОЙ
АОРТА
Рис. 10.3. (Продолжение.)
Сравнительные исследования показали, что при определении стадии
рака пищевода эзофагеальный ультразвук обеспечивает большую точность,
чем КТ-сканирование [12]. Однако КТ-сканирование продолжает играть зна-
чительную роль в обнаружении отдаленных метастазов и вовлечения других
органов средостения вокруг пищевода. КТ-сканирование выполняется обыч-
но перед проведением эзофагеальной эндоскопии и эндосонографии. После
исключения возможности метастатического поражения клиницисты с помо-
ОГРАНИЧЕНИЯ
353
щью эндосонографии более точно устанавливаю! стадию местного распро-
странения. В дальнейшем врач заполняет протокол лечения, зависящего от
стадии.
ОГРАНИЧЕНИЯ
В настоящее время усилия эндосонографистов затрагивают несколько хорошо
известных проблем. Они включают в себя ошибки в определении стадии забо-
левания, связанные с ограниченным разрешением обычного радиально скани-
рующего датчика частотой 7,5 МГц; субъективную оценку состояния регио-
нальных лимфатических узлов; неполноценное определение стадии, связанное
со злокачественной стриктурой, препятствующей исследованию образования на
всем его протяжении. Технологические усовершенствования, в конечном сче-
те, помогут преодолеть некоторые ограничения этого исследования.
Например, создаются тонкие пищеводные датчики [15]. Линейно-ради-
альный переключаемый 20 МГц-датчик (Fuji Photo Optical Со) совместим с
инструментальным каналом панэндоскопа диаметром 2,8 мм или более (но
намного тоньше, чем обычный датчик диаметром 7,9 мм). Устройство фир-
мы Fuji обладает улучшенным разрешением при оценке поверхностных
злокачественных опухолей пищевода. В настоящее время изучаются воз-
можности тонкоигольной аспирационной биопсии подозрительных в отно-
шении малигнизации параэзофагеальных лимфоузлов под ультразвуковым
контролем. Это может повысить точность оценки их состояния [10].
Множество врачей подвергает сомнению практику дилатации злокаче-
ственной стриктуры пищевода для оценки поражения на всем протяжении, в
связи с 10-20% риском перфорации [2, 3]. Кроме этого, наличие сужения
пищевода достоверно связано с распространенной опухолью, так что дила-
тация не намного повышает точность определения стадии Т и N и не улуч-
шает оценку резектабельности или прогноза заболевания. Полагают, что ди-
латация пищевода при его сужении злокачественной опухолью не оправды-
вает повышения точности определения стадии заболевания. Поскольку риск
перфорации превышает диагностическую пользу от этой процедуры, мно-
гие клиницисты ее не применяют.
Некоторые проблемы возникают при использовании УЗИ пищевода для
оценки результатов лечения при последующем наблюдении пациентов [16].
Изменения эхоструктуры опухоли, вызванные в ней лечебным воздействи-
ем, незначительны. На основе системы Т—N не удается достигнуть точного
прогноза. Кроме этого, получению достаточно четких изображений при вы-
полнении эндосонографического исследования после хирургического вме-
шательства препятствуют воспалительные или фиброзные изменения, а так-
же артефакты, возникновение которых связано с оперативными действиями.
В настоящее время эти изменения ограничивают возможности трансэзофа-
геального УЗИ в выявлении рецидива заболевания.
23 Ультразвуковая диагностика...
354
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ
Несмотря на достаточно точную дооперационную оценку стадии рака пище-
вода, эндоскопическое УЗИ будет по-настоящему полезным только тогда,
когда результаты этого стадирования повлияют на отбор пациентов для того
или иного вида лечения. В некоторых ситуациях точная дооперационная
оценка не имеет никакого значения, например, когда в лечебном учреждении
оперируют всех пациентов без отдаленных метастазов и клинических проти-
вопоказаний, связанных с сопутствующими заболеваниями. При подобной
тактике стадия заболевания может быть установлена сочетанием торакоско-
пической и лапароскопической оценки или после простого эксплоративного
вмешательства. Аналогично, если в лечебном учреждении большинство па-
циентов с раком пищевода не оперируют, результаты трансэзофагеальной
ультрасонографии также лишены клинической ценности.
При намерении изменить лечебную тактику, полагаясь на определение
стадии заболевания, УЗИ пищевода оказывается весьма полезным и допол-
няет данные КТ. Точная информация о Т- и N-стадии может использоваться
как основание для выбора между первичным хирургическим лечением и
неоадьювантной терапией и паллиативной операцией, а при поверхностных
опухолях — для выбора между хирургической или эндоскопической резек-
цией [17]. Если стадию заболевания пациента удается установить перед на-
чалом лечения, его эффективность может быть оценена более точно. У па-
циентов с начальными стадиями заболевания таким образом можно избе-
жать дорогостоящего и потенциально токсичного комплексного лечения.
Кроме этого, при показаниях к хирургическому лечению можно обосновать
отсутствие необходимости в проведении дорогой и токсичной комплексной
терапии, эффективность которой будет низкой из-за наличия отдаленных
метастазов
ССЫЛКИ
1. Hiele М, De Leyn R Relation between endoscopic ultrasound and outcome
of patients with tumors of the esophagus or esophagogastric junction. Gast-
rointest Endosc 1997;45:381-386.
2. Rice TW, Boyce GA. Esophageal ultrasound and the preoperative staging of
carcinoma of the esophagus. J Thorac Cardiovasc Surg 1991; 101:536-544.
3. Rosch T. Endoscopic ultrasonography. Endoscopy 1994;26:148-168.
4. Beahrs OH, Henson DE, Hutter RVP, eds., American Joint Committee on
Cancer: manual for staging of cancer. 4th ed. Philadelphia: Lippincott, 1992.
5. Heranek P, Sobin LH, eds., International Union Against Cancer: TNM clas-
sification of malignant tumours. 4th ed. Berlin: Springer, 1987.
6. Souquet JC, Napoleon B. Endoscopic ultrasonography in the preoperative
staging of esophageal cancer. Endoscopy 1994;26:764-766.
ссылки
355
7. Murata Y, Suzuki S, Hashimoto H. Endoscopic ultrasound of the upper gas-
trointestinal tract. Surg Endosc 1988;2:180-183.
8. Brugge WR, Lee MJ, Carey DJ, Mathiesen DJ. Endoscopic ultrasound sta-
ging criteria for esophageal cancer. Gastrointest Endosc 1997;45:47-152.
9. Kallimanis GE, Gupta PK. Endoscopic ultrasound for staging esophageal
cancer, with or without dilation, is clinically important and safe. Gastroin-
test Endosc 1995;41:540-546.
10. Bhutani MS, Hawes RH, Hoffman BJ. A comparison of the accuracy of
echo features during endoscopic ultrasound (EUS) and EUS-guided fine-ne-
edle aspiration for the diagnosis of malignant lymph node invasion. Gastro-
intest Endosc 1997;45:474-479.
11. Natsugoe, S, Yoshinaka H. Ultrasonographic detection of lymph node metasta-
ses in superficial carcinoma of the esophagus. Endoscopy 1997;28:674-679.
12. Saunders HS, Wolfman NT, Ott DJ. Gastrointestinal cancer radiologic diag-
nosis and staging. Radiol Clin North Am 1997;35:281-294.
13. Catalano MF, Van Dam J, Sivak MV. Malignant esophageal strictures; staging
accuracy of endoscopic ultrasound. Gastrointest Endosc 1995;41:535-539.
14. Van Dam J, Rice TW, Catalano MF. High-grade malignant stricture is pre-
dictive of esophageal tumor stage; risks of endosonographic evaluation.
Cancer 1993;71:2910-2917.
15. Yanai H, Yoshida T, Harada T, Matsumoto Y. Endoscopic ultrasonography
of superficial esophageal cancers using a thin ultrasound probe system equ-
ipped with switchable radial and linear scanning modes. Gastrointest En-
dosc 1996;44:578-582.
16. Souquet JC, Napoleon B, Descos F, et al. Contributions of endosonography
to the follow-up of esophageal squamous cell carcinoma treated by multi-
modal protocol. Gastrointest Endosc 1991;37:AB243.
17. Fok M, Cheng SWK, Wong J. Endosonography in patient selection for sur-
gical treatment of esophageal carcinoma. World J Surg 1992;16:1098-1103.
Б. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
Дж. Нилас Янг
Технологические совершенствования ультрасонографии за последние два
десятилетия расширили ее применение для разнообразных медицинских це-
лей. Уменьшение размера датчиков и совершенствование мультипланарной
визуализации позволили значительно улучшить качество трансэзофагеаль-
ной эхокардиографии (ТЭЭ), которая становится все более важным инстру-
ментом оценки анатомии сердца и его функции. Когда-то применявшаяся толь-
356
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
ко кардиологами, в настоящее время ТЭЭ используется анестезиологами, ре-
аниматологами и хирургами. Интраоперационная ТЭЭ стала рутинным
исследованием в кардиохирургических отделениях многих лечебных учреж-
дений, а также часто используется в отделениях интенсивной терапии и неот-
ложной помощи.
ТЭЭ позволяет непрерывно в реальном времени проводить двухмерный и
цветной допплерографический анализ сердечной деятельности, включая из-
мерения объемов выброса, оценку движений стенок желудочков и клапанов,
перикардиального пространства, а также получать гемодинамические показа-
тели до операции, во время ее проведения и в послеоперационном периоде.
СРАВНЕНИЕ ТРАНСТОРАКАЛЬНОЙ И ТРАНСЭЗОФАГЕАЛЬНОЙ
ЭХОКАРДИОГРАФИИ
Трансторакальная и трансэзофагеальная эхокардиорафии имеют важные для
понимания хирурга преимущества и недостатки. При проведении транстора-
кальной эхокардиорафии (ТТЭ) для проникновения звука через грудную
стенку и отображения внутригрудных и особенно медиастинальных струк-
тур используются низкочастотные датчики (2—3,5 МГц). Наиболее часто при-
меняется датчик с частотой 2,5 МГц. Главное неудобство ТТЭ — невысокое
разрешение и качество изображения, что связано с низкой частотой сканиро-
вания. Воздух в легких, пневмоторакс, пневмомедиастинум, пневмоперикар-
диум или костные структуры, такие как ребра и грудина, препятствуют нор-
мальной визуализации. При ТТЭ датчик должен быть размещен так, чтобы
избежать сканирования ткани легких и костных структур, которые создают
протяженную акустическую тень.
При обычной оценке перикардиального пространства и сердца ТТЭ
должна проводиться вначале. Это исследование легковыполнимо и обычно
проводится специально обученным сонографистом. Во многих случаях при
ТТЭ удается получить превосходную до- и послеоперационную визуализа-
цию. Выполнение ТТЭ в операционной затруднено необходимостью при-
сутствия сонографиста и размещением датчика на грудной стенке.
Трансэзофагеальная эхокардиография обладает преимуществом близ-
кого расположения датчика к пищеводу, аорте и структурам сердца. Так как
требуется меньшая глубина проникновения, может быть использован дат-
чик с большей частотой. Применяемый для ТЭЭ датчик с частотой 5 МГц
обеспечивает заметно лучшее разрешение, чем типичный датчик с частотой
2,5 МГц, используемый при ТТЭ. Отсутствие влияния анатомических струк-
тур и заполненных воздухом пространств между датчиком и органами сре-
достения при ТЭЭ способствует получению четкого и более детального
изображения. ТЭЭ полезна при исследовании аорты, особенно ее нисходя-
щего отдела. В операционной ТЭЭ обладает особыми преимуществами, так
как датчик и сонографист (анестезиолог) находятся вне зоны хирургических
ДАТЧИКИ для тээ
357
манипуляций. Кроме обычного использования во многих кардиохирургиче-
ских центрах ТЭЭ часто применяется при проведении внесердечных хирур-
гических вмешательств, особенно у больных с заболеваниями сердца, а так-
же при манипуляциях, вызывающих нарушение гемодинамики.
Основные неудобства ТЭЭ — это покупка специализированного обору-
дования (рис. 10.4) и необходимость обучения врача эндоскопическому ис-
следованию верхних отделов желудочно-кишечного тракта, а также эхокар-
диографии. ТЭЭ требует дополнительного внимания анестезиологов, хирургов
и кардиологов, что также немаловажно. Это исследование противопоказано
при недостаточно безопасном доступе в пишевод, например при массивной
травме лица, нестабильности шейного отдела позвоночника, раке пищевода,
его стриктурах или перепончатом эзофагите. Осложнения ТЭЭ встречаются
редко, но могут быть опасны для жизни. В настоящее время наиболее распро-
страненной проблемой является неверная интерпретация результатов иссле-
дования из-за недостаточного технического оснащения или неопытности со-
нографиста. Кроме того, были получены данные, свидетельствующие об
увеличении частоты послеоперационной дисфазии при применении ТЭЭ.
ДАТЧИКИ ДЛЯ ТЭЭ
Первые трансдьюсеры для ТЭЭ обеспечивали изображения только в попе-
речной (0°) плоскости. Внеосевое или продольное сканирование такими мо-
нопланарными датчиками было невозможно. Бипланарные датчики позволя-
ют получить изображения как в поперечной (0°), так и в продольной (90°)
Рис. 10.4. Мультипланарный датчик HP OmniPlane II TEE 5.0 MHz (Agilent Technologies,
Andover, MA). (Фотография любезно предоставлена Agilent Technologies )
358
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
плоскости, поскольку в них встроено два перпендикулярных друг другу ска-
нирующих элемента. Возможность получения дополнительных изображе-
ний бипланарными датчиками придает ТЭЭ большее клиническое значение.
Мультипланарные (омнипланарные) трансдьюсеры снабжены возможностью
поворота сканирующего элемента от 0 до 180° (от поперечной плоскости к
продольной до зеркального отображения поперечного пучка). Такие датчики
позволяют выполнить полное исследование структур средостения при мень-
шем количестве манипуляций.
ПРОВЕДЕНИЕ ТРАНСЭЗОФАГЕАЛЬНОЙ ЭХОКАРДИОГРАФИИ
Проведение ТЭЭ сочетает в себе основные методы стандартной ТТЭ и эзофа-
гогастроскопии. Получение изображения основывается на многих факторах,
таких как: 1) расположение датчика в пищеводе или желудке; 2) вращение
датчика вокруг продольной оси (от 0 к 360°); 3) ретрофлексия и антифлексия
наконечника; 4) тип используемого датчика (бипланарный или мультипла-
нарный); 5) перемещение датчика (от 0 к 180°).
После калибровки сканера и подбора величины излучения для система-
тического осмотра следует получить четыре основных изображения: 1) че-
рез желудок; 2) на уровне середины пищевода; 3) на уровне верхней части
пищевода и 4) аорты. Ориентация изображений должна быть такой, чтобы
ближайшие к датчику структуры отображались в верхней части монитора
(например, левое предсердие в среднепищеводной позиции), структуры ле-
вой половины тела пациента — на правой стороне монитора. Как и при всех
УЗИ, сканирование сосредоточивается в области диагностического интере-
са, а в случае необходимости следует применить цветную допплерографию.
Новейшие сканеры позволяют сохранить «кинопетлю» и в реальном време-
ни провести сравнение с результатами предыдущего исследования. Все за-
писи необходимо копировать на носитель длительного хранения (например,
VHS-пленку) для возможности последующего просмотра.
Сканирование через желудок
Датчик вводится в желудок (приблизительно на 35-40 см от резцов), а нако-
нечник датчика изгибается кпереди. Трансгастральное изображение по ко-
роткой оси визуализируется при поперечном положении датчика (0°). Такое
изображение позволяет получить «срез» стенки желудочка и оценить ее дви-
жение и функцию (рис. 10.5). Ишемия миокарда лучше всего выявляется
именно в таком положении, поскольку участок стенки левого желудочка на
этом уровне кровоснабжается ветвями всех основных коронарных артерий.
Поворот датчика к продольный плоскости (90°) позволяет визуализировать
длинную ось левого желудочка, а поворот на 120° — место отхождения аор-
ты. Трансгастральное сканирование с допплерографическим анализом по-
зволяет определить параметры сердечного выброса.
ПРОВЕДЕНИЕ ТРАНСЭЗОФАГЕАЛЬНОЙ ЭХОКАРДИОГРАФИИ
359
Рис. 10.5. А. Схематичный вид положения датчика в желудке. Б. Схематичный вид
сечения сердца при расположении датчика внутри желудка (0°). В. Трансгастральное
ультразвуковое изображение сердца (0°) (схемы A-В и ультразвуковые изображения
любезно предоставлены Agilent Technologies). Г. Линейный рисунок ультрасоногра-
фического изображения.
360
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Сканирование через среднюю часть пищевода
Датчик помещается посередине пищевода (приблизительно 30 см от резцов)
в поперечное положение с небольшим изгибом назад. Такое положение по-
зволяет получить четырехкамерный вид сердца и оценить состояние атрио-
вентрикулярных клапанов, изменения в предсердиях и функцию желудочков
(рис. 10.6). При таком положении датчика лучше всего визуализируется пе-
ПРОВЕДЕНИЕ ТРАНСЭЗОФАГЕАЛЬНОЙ ЭХОКАРДИОГРАФИИ
361
Рис. 10.6. А. Схематичный вид ТЭЭ при среднепищеводном положении датчика.
Б. Схематичный четырехкамерный вид при среднепищеводном положении датчика с
его поворотом на 45°. В. Типичный четырехкамерный вид при ТЭЭ в средне-
пищеводном положении датчика с его поворотом на 45° (схемы A-В и ультразвуковые
изображения любезно предоставлены Agilent Technologies). Г. Линейный рисунок при
четырехкамерном виде.
362
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.6. (Продолжение.)
рикардиальное пространство. Перевод датчика в продольное положение дает
двухкамерное изображение левой половины сердца. При этом можно оце-
нить состояние левого предсердия, митрального клапана, левого желу-
дочка, левой легочной вены и ушка левого предсердия. При повороте датчика
возникает аналогичное правостороннее двухкамерное изображение. Неболь-
шое отведение датчика позволяет визуализировать аорту и описанный выше че-
ФУНКЦИЯ ЖЕЛУДОЧКОВ
363
тырсхкамерный вид. Поворот датчика на 45° дает превосходный вид аортально-
го клапана — наилучший для оценки его анатомических и патологических
особенностей.
Сканирование через верхнюю часть пищевода
Дальнейшее отведение датчика (приблизительно 25-30 см от резцов) позволя-
ет визуализировать основание сердца и окружающие его структуры (рис. 10.7).
При положении датчика в поперечной плоскости возникает изображение ле-
вого предсердия, аортального клапана и сосудов, несущих кровь от правого
желудочка. Смещение датчика в проксимальном направлении позволяет ви-
зуализировать легочную артерию, восходящий отдел аорты и верхнюю по-
лую вену. Расположение датчика в продольной плоскости дает изображение
левого и правого предсердий и верхней полой вены.
Аорта
При отведении датчика от уровня основания сердца возникает изображение
восходящего отдела аорты. Его полная визуализация невозможна из-за сле-
пой зоны, образованной воздухом, заполняющим трахею и ствол левого глав-
ного бронха. После исследования дуги аорты датчик поворачиваться против
часовой стрелки и продвигается в пищеводе в каудальном направлении для
визуализации нисходящего отдела аорты от ее дуги до диафрагмы. Передняя
и задняя стенки нисходящей аорты визуализируются при сканировании в
продольной плоскости.
ФУНКЦИЯ ЖЕЛУДОЧКОВ
По сравнению с другими диагностическими средствами ТЭЭ обеспечивает
наиболее точную интраоперационную оценку функции обоих желудочков
как целиком, так и отдельных сегментов их стенки. При гиповолемии, очаго-
вой ишемии миокарда или нарушении сократительной способности желу-
дочков информативность ТЭЭ значительно превосходит данные, получае-
мые при катетеризации легочной артерии или ЭКГ.
Местная сократительная способность левого желудочка весьма чувст-
вительна к резкому снижению коронарного кровотока. Острая ишемия при-
водит к почти немедленному угнетению сократительной функции в области
поражения. Такая очаговая депрессия лучше всего распознается по умень-
шению утолщения стенки желудочка, а также по снижению подвижности эн-
докарда в пораженной области. Точно так же легко распознается угнетение
общей сократительной способности миокарда, обусловленное такими более
частыми, чем острая коронарная недостаточность, причинами, как альвеоляр-
ная гипоксемия, системный ацидоз или электролитный дисбаланс. Спонтан-
ное контрастирование («дым») в предсердиях или желудочках указывает на
замедление кровотока и значительное нарушение сердечной функции.
364
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.7. А. Схематичный вид ТЭЭ в верхнепищеводном положении датчика или
уровне основания сердца. Б. Схематичный вид базального изображения при
повороте датчика на 48е. В. Ультразвуковой вид базального изображения при
повороте датчика на 48е (схемы A-В и ультразвуковые изображения любезно
предоставлены Agilent Technologies). Г. Линейный рисунок базального вида.
РАССЛОЕНИЕАОРТЫ
365
РАССЛОЕНИЕ АОРТЫ
Трансэзофагеальная эхокардиография—это одно из немногих средств, кото-
рые используются для подтверждения диагноза расслоения аорты (как типа
А, так и типа Б) (рис. 10.8). Другими диагностическими средствами этого со-
стояния являются МРТ, КТ и ангиография. По сравнению с ними ТЭЭ обла-
366
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.8. Нисходящая аорта, продольный вид, расслоение грудной аорты
выявляется по наличию ложного просвета, отслойки интимы и истинного просвета
грудной аорты.
дает большей чувствительностью и специфичностью и имеет несколько пре-
имуществ. Этот метод исследования является средством выбора у больных с
нестабильной гемодинамикой. При ТЭЭ можно точно определить локализа-
цию расслоения, что облегчает предоперационное планирование. ТЭЭ помо-
ГИДРОПЕРИКАРД И ТАМПОНАДА СЕРДЦА
367
гает точно оценить вовлечение аортального клапана и наличие выпота в по-
лости перикарда. Выполнение ТЭЭ требует меньшего времени, чем выполне-
ние КТ, МРТ или ангиографии, и позволяет одновременно с исследованием
проводить лечебные мероприятия, что особенно важно при неотложной си-
туации.
В настоящее время во многих лечебных учреждениях предпочтитель-
ным диагностическим средством для оценки расслоения аорты считается
ТЭЭ. Как было отмечено ранее, этот метод недостаточно чувствителен для
оценки состояния дистальной части восходящей аорты и проксимальной ча-
сти ее дуги. Если патологические изменения предположительно затрагива-
ют именно эти области, зачастую требуется выполнение дополнительных
исследований (КТ, МРТ или ангиографии). ТЭЭ позволяет выявить травма-
тический разрыв аорты (см. часть В), однако нередко из-за ограниченного
размера повреждения стенки аорты и ложноотрицательных результатов до-
пплерографического исследования, травматическое повреждение аорты об-
наружить более сложно, чем ее спонтанное расслоение.
ГИДРОПЕРИКАРД И ТАМПОНАДА СЕРДЦА
Как трансабдоминальное УЗИ (при положении датчика под мечевидным от-
ростком), так и ТЭЭ достаточно эффективны в выявлении выпота в полости
перикарда и тампонады сердца. ТЭЭ обеспечивает лучшую визуализацию,
особенно у тучных пациентов и в послеоперационном периоде при наличии
повязок на грудной или брюшной стенке, дренажей или отеке мягких тканей
и гематомах. Гидроперикард выглядит как гипоэхогенное (или анэхогенное)
пространство между париетальным перикардом и эпикардом желудочков.
Скопление жидкости в полости перикарда наиболее часто обнаруживается
вдоль задней стороны сердечной сорочки (рис. 10.9). Тампонада сердца мо-
жет быть вызвана накоплением перикардиальной жидкости, интраперикар-
диальным тромбом или сгустком и обычно приводит к уменьшению наполне-
ния или сдавлению камер правого предсердия и/или правого желудочка (см.
гл. 16).
СТРУКТУРА КЛАПАНОВ И ВЕГЕТАЦИИ
Эхокардиография позволяет получить в реальном времени ценную инфор-
мацию об анатомии сердечных клапанов, их структуре, функции, кальцифи-
кации, наличии или отсутствии бактериальных или грибковых разрастаний.
Несмотря на то, что первоначальное исследование сердечных клапанов мо-
жет быть легко выполнено с помощью ТТЭ, ТЭЭ обеспечивает получение бо-
лее детальной информации (рис. 10.10). Значительные гемодинамические
расстройства могут привести к нарушению функции клапанов сердца, напри-
368
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.9. Визуализация перикардиального выпота на продольном или двухкамерном
изображении при средне-пищеводном положении датчика.
мер, увеличение/снижение митральной регургитации отмечается при изме-
нении системного артериального давления (т. е. при постнагрузке). При ис-
следовании должны выявляться признаки любого острого нарушения функ-
ции клапанов и назначаться соответствующее лечение.
ПРИСТЕНОЧНЫЙ ТРОМБ
369
Рис. 10.10. Ультразвуковое изображение, демонстрирующее вегетации на митральном
клапане.
ПРИСТЕНОЧНЫЙ ТРОМБ
Как ТТЭ, так и ТЭЭ являются превосходными диагностическими средствами
для выявления пристеночных тромбов в полостях сердца, которые могут
стать источником эмболии периферических сосудов (рис. 10.11). Системная
24 Ультразвуковая диагностика...
370
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.11. Трансгастральное ультразвуковое изображение, демонстрирующее
пристеночный тромб в левом желудочке.
артериальная эмболия может также проявляться как «парадоксальная эмбо-
лия», если пациент страдает незаращением овального отверстия с развитием
шунтирования слева-направо. Наличие овального отверстия может быть лег-
ко выявлено при ТЭЭ. Информативность этого исследования повышается
при системном венозном введении микропузырьков в дополнение к цветно-
му допплерографическому исследованию. ТЭЭ особенно полезна для точно-
го описания размера, прогрессии или регрессии тромбов в предсердиях или
ЛИТЕРАТУРА
371
желудочках. Для оценки эффективности антикоагулянтной терапии при сер-
дечных тромбах часто требуется несколько исследований.
ЛИТЕРАТУРА
1. Spotnitz НМ (Guest Editor). Interoperative Echocardiography. Seminars in thoracic and car-
diovascular surgery 1998;10:238-283.
2. Johnson SB, Sisley AC. The surgeon's use of transesophageal echocardiography. Surg Clin
North Am 1998;78:311-336.
3. Child JS, Kjivokapich J. Echocardiography. In: Baue A, editor. Glenn's Thoracic and Cardio-
vascular Surgery. Stamford, CT: Appleton & Lange; 1996. p. 1711- 1734.
4. Lambert AS, Miller JP, et al. Improved evaluation of the location and mechanisms of mitral
valve regurgitation with a systematic transesophageal examination. Anesth Analg
1999;88:1205 -1212.
В. ЭФФЕКТИВНОСТЬ ТРАНСЭЗОФАГЕАЛЬНОЙ
ЭХОКАРДИОГРАФИИ В ОЦЕНКЕ
ПОВРЕЖДЕНИЙ ГРУДНОЙ АОРТЫ
Пол А. Кирней
Обсуждение применения трансэзофагеальной эхокардиографии было бы не-
полным без описания роли ТЭЭ в диагностике повреждений грудной аорты.
Высокоскоростные автокатастрофы могут стать причиной внезапных по-
вреждений, вызванных резким торможением, с частичным или полным раз-
рывом грудной аорты. Внезапное замедление грудной клетки и сжатие диа-
фрагмы подвергают аорту чрезвычайному боковому смещению и давлению
на точки ее фиксации: синусы Вальсальвы, перешеек и диафрагму. При сжа-
тии средостения сердце может быть смещено в левую или правую половину
грудной полости, что приводит к дополнительному напряжению в этих точ-
ках. Выраженная нагрузка на стенки аорты вызывает натяжение и разрыв ин-
тимы, который может продолжаться в мышечный и адвентициальный слои.
Полный разрыв аорты обычно оканчивается смертью на месте несчастного
случая, тогда как при образовании гематомы пациенты могут жить до госпи-
тализации в отделение интенсивной терапии.
Недиагностированный и нелеченный разрыв грудной аорты приводит к
смерти в 40% случаев, если пациента не оперируют в первые 24 ч после
травмы [18]. Бригады травматологов и реаниматологов должны всегда по-
мнить о возможном разрыве грудной аорты и без промедления обнаружи-
вать это повреждение.
372
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Первоначальное обследование пациентов, у которых выявлена или по-
дозревается тупая травма органов грудной полости, должно включать рент-
генографию. Рентгенологические признаки гематомы включают в себя рас-
ширение средостения, нечеткость контура дуги аорты, тень над верхушкой
левого легкого, изменение контуров аортопульмонального окна, отклонение
трахеи, смещение назогастрального зонда и левосторонний гемоторакс. По-
вреждение грудной аорты сочеталось с переломами первого или второго ре-
бер, ключицы и грудины [20]. Проблема заключается в том, что каждая из
перечисленных выше находок в отдельности или вместе взятые недостаточ-
но чувствительны и специфичны для точного выявления больных с разры-
вом аорты. Сделанный в начале обследования рентгеновский снимок лишь
доказывает необходимость более детального исследования.
Аортография дуги аорты является диагностическим стандартом при трав-
матическом разрыве аорты, начиная с сообщения Parmley в 1958 г. [18]. Од-
нако исследование при низком числе положительных результатов (прибли-
зительно 1 из 9) требовало сложного и дорого оборудования. Кроме того,
аортография вызывает осложнения и может быть рискованной и трудновы-
полнимой у нестабильных пациентов.
Большинство травматологических центров в Соединенных Штатах для
исследования пациентов с травмой головы, груди, живота и таза использует
КТ. КТ органов грудной полости у пациентов с тупой травмой груди была
предложена как эффективное средство выявления гематомы средостения
[21]. Однако установлено, что чувствительность обычной КТ недостаточна
(55 88%), чтобы считать ее стандартным методом выявления повреждения
грудной аорты [22, 23]. В то время как гематомы средостения при обычной
КТ обнаруживались довольно хорошо, патологические изменения грудной
аорты визуализировались плохо. Применение новейшей спиральной КТ для
диагностики повреждений аорты при тупой травме обладает преимущества-
ми более быстрого исследования, с улучшенным по сравнению с предшест-
вующими поколениями КТ-сканеров разрешением [21].
Спиральная компьютерная томография (СКТ) органов грудной клетки
оценивается как наиболее быстрый и наименее сложный метод диагностики
травматического повреждения грудной аорты. Fabian и его коллеги провели
4-летнее ре троспективное сравнительное исследование СКТ и аортографии.
Они установили, что чувствительность СКТ составляет 100%, аортогра-
фии — 92%, специфичность СКТ — 83%, аортографии — 99%, точность
СКТ — 86%, аортографии — 97%, положительная прогностическая цен-
ность СКТ — 50 %, аортографии — 97% и, что наиболее важно, отрицатель-
ная прогностическая ценность СКТ — 100%, аортографии — 97% [21]. Это
исследование показывает, что СКТ является чувствительным методом диа-
гностики скрытых повреждений грудной аорты. Основные недостатки СКТ
заключаются в необходимости использования контрастных препаратов,
трудности выполнения исследования у нестабильных пациентов и низкой
10, ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
373
по сравнению с аортографией специфичности. Преимуществами СКТ явля-
ются скорость выполнения исследования, его высокая отрицательная про-
гностическая ценность, а также возможность получения двух- и трехмерных
аортограмм, схожих с изображениями, получаемыми при обычной ангио-
графии.
При ТЭЭ можно получить детальные, высококачественные изображе-
ния сердца и грудной аорты. Поэтому все большее число лечебных учрежде-
ний использует ТЭЭ как наиболее предпочтительный метод исследования
сердечно-сосудистой системы у пациентов с тупой травмой груди и подо-
зрением на повреждение аорты. Метод позволяет безопасно получить по-
слойные изображения грудной аорты, оценить состояние сердечно-сосуди-
стой системы у пациентов с множественными повреждениями и контролиро-
вать сердечную гемодинамику [24]. Метод ТЭЭ оценивается как удобный,
быстрый, безопасный и чувствительный метод исследования сердца и груд-
ной аорты [25].
Трансэзофагеальная эхокардиография выполняется по схожей с эзофа-
гогастроскопией методике. Датчик вводится после аэрозольной обработки
задней стенки глотки лидокаином и (при необходимости) внутривенного
введения седативного препарата. При поперечном и продольном сканирова-
нии визуализируются аортальный клапан, синусы Вальсальвы, восходяшая
аорта, ее дуга, нисходящая часть грудной аорты и фрагмент брюшной аор-
ты. Верхняя 3—5-см часть восходящей аорты является «мертвой зоной», по-
скольку закрыта трахеей. Для выявления контузии миокарда, перикардиаль-
ного выпота, недостаточности створок клапанов и нарушения функции ле-
вых желудочков может быть выполнена визуализация сердца, начальных
отделов магистральных сосудов и клапанов.
На изображениях, полученных при ТЭЭ. грудная аорта находится за пи-
щеводом. Это означает, что в верхней части сонограммы (ближняя зона)
отображается передняя стенка аорты, а в нижней части изображения (даль-
няя зона) — задняя стенка аорты, расположенная дальше от датчика
(рис. 10.12-10.14). Характерное флотирование интимы (рис. 10.12-10.14),
которое свидетельствует о тупом травматическом повреждении аорты, обычно
выявляется (в зависимости от комплекции пациента) приблизительно в 24 см
от резцов. В большинстве случаев при тупой травме аорты повреждается ее
перешеек, расположенный сразу за местом отхождения левой подключич-
ной артерии [26]. Другая локализация повреждения — какой-либо участок
по ходу грудной или брюшной аорты. Повреждения, не выходящие за пре-
делы 3-5-см («мертвой») зоны в верхней части восходящей аорты, встреча-
ются крайне редко [25].
Как любое средство визуализации, ТЭЭ имеет свои ограничения и пре-
имущества. Основное ограничение ТЭЭ — невозможность точного опреде-
ления толщины стенки аорты во всех случаях [27]. Интерпретация результа-
тов ТЭЭ может быть затруднена при артериосклерозе, поскольку поверх-
374
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.12. На изображении в поперечной плоскости визуализируется типичное
отслоение интимы стенки аорты на уровне ее перешейка.
ность интимы грудной аорты в этом случае имеет неровные контуры. При
ТЭЭ обычно не визуализируются основные ветви дуги аорты (сонная и под-
ключичная артерии). Противопоказанием для проведения ТЭЭ является не-
стабильный перелом в шейном отделе позвоночника. Тяжелая челюстно-ли-
цевая травма, острые или хронические заболевания пищевода также могут
служить относительными противопоказаниями. Основная задача при трав-
10 ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
375
Рис. 10.13. На изображении в поперечной плоскости визуализируется типичное
отслоение интимы стенки аорты на уровне ее перешейка.
ме часто заключается в постоянном контроле состояния дыхательных путей
пациента. Решение об интубации должно быть основано на показаниях, от-
личных от необходимости проведения ТЭЭ.
Имеется несколько преимуществ ТЭЭ над СКТ и аортографией. Основ-
ным преимуществом ТЭЭ над другими диагностическими средствами явля-
ется возможность проведения этого исследования у кровати больного. При
ТЭЭ пациент остается в хорошо оборудованной палате интенсивной тера-
376
10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
Рис. 10.14. На изображении в поперечной плоскости визуализируется типичный,
образовавшийся в результате травмы, лоскут интимы.
пии под постоянным наблюдением. При наличии показаний к неотложному
хирургическому вмешательству исследование проводится в операционной.
ТЭЭ выполняется быстрее, чем аортография, не требует применения конт-
растных средств, позволяет получать изображения в реальном времени, эко-
номична. Область интереса может быть неоднократно исследована в различ-
ных плоскостях. Кроме этого, ТЭЭ используют для определения функции
желудочков и состояния клапанов.
Наконец, ТЭЭ обычно дает более детальные (по сравнению с аортогра-
фией) изображения поверхности интимы аорты. В целом ТЭЭ может рас-
сматриваться как более чувствительный и специфичный метод, чем обыч-
ная контрастная аортография [27].
РЕЗЮМЕ
В главе был дан ограниченный краткий обзор применения ТЭЭ при раке пи-
щевода, приведены некоторые сведения о возможностях ТЭЭ. Преимущест-
во ТЭЭ при раке пищевода заключается в возможности точного предопера-
ЛИТЕРАТУРА
377
ционного определения стадии заболевания, особенно глубины опухолевой
инвазии стенки пищевода.
ТЭЭ служит важным диагностическим средст вом точной оценки анато-
мии и функции сердца, а также аорты. Она является основным достижением
в совершенствовании диагностического арсенала хирургов, анестезиологов,
кардиологов и реаниматологов. Необходимо, чтобы взаимное сотрудниче-
ство ттих специалистов привело к максимальному использованию диагности-
ческого потенциала данного метода. Качество диагностики и лечения травми-
рованных и тяжелобольных пациентов с применением ТЭЭ повысилось, и
такой метод исследования должен широко применяться во всех медицинских
учреждениях для лечения больных в критическом состоянии. Интраопераци-
онная ТЭЭ обеспечивает безопасные условия работы хирургической брига-
ды и должна применяться с соответствующей широтой. В ближайшем буду-
щем в диагностическом поиске возможно применение в реальном времени
трехмерной эхокардиографии.
Проблемы, связанные с сертификацией хирургов, использующих ТЭЭ и
трансэзофагеальную эндосонографию, активно изучаются и обсуждаются.
Хирургам, заинтересованным в использовании этих методик, не должны
припятствовать нерешенные вопросы сертификации. Применение средств
визуализации хирургами должно стать неотъемлемым компонентом их прак-
тического обучения.
ЛИТЕРАТУРА
18. Parmley LF, Mattingly TW, Manion WC, Jahnke EJ Jr. Nonpenetrating tra-
umatic injury of the aorta. Circulation 1958;17:1086-1101.
19. Woodring JH, Dillon ML. Radiographic manifestations of mediastinal he-
morrhage from blunt chest trauma. Ann Thorac Surg 1984;37:171-178.
20. Kirsh MM, Behrendt DM, Orringer MB, et al. The treatment of acute trau-
matic rupture of the aorta: a 10 year experience. Ann Surg 1976; 184:
308-314.
21. Fabian TC, Davis KA, Gavant ML, et al. Prospective study of blunt aortic
injury: helical CT is diagnostic and anti-hypertension therapy reduces ruptu-
re. Ann Surg 1998;227:666-677.
22. Miller FB, Richardson D, Thomas HA, et al. Role of CT in diagnosis of ma-
jor arterial injury after blunt thoracic trauma. Surgery 1989; 106:596-603.
23. Durham RM, Zuckerman D, Wolverson M, et al. Computed tomography as
a screening exam in patients with suspected blunt aortic injury. Ann Surg
1994;220:699-704.
24. Kearney PA, Smith W, Johnson SB, et al. Use of transesophageal echocardi-
ography in the evaluation of traumatic aortic injury. J Trauma 1993;34:
696-703.
378 10. ТРАНСЭЗОФАГЕАЛЬНАЯ ЭНДОСОНОГРАФИЯ И ЭХОКАРДИОГРАФИЯ
25. Smith MD, Cassidy JM, Souther S, et al. Transesophageal echocardiograp-
hy in the diagnosis of traumatic rupture of the aorta. N Eng J Med 1995;332:
356-362.
26. Weiss JP, Feld M, Sclafani SJA, et al. Traumatic rupture of the thoracic aor-
ta. Emery Med Clin North Am 1991;9:789-804.
27. Buckmaster MJ, Kearney PA, Johnson SB, et al. Further experience with
transesophageal echocardiography in the evaluation of traumatic aortic inju-
ry. J Trauma 1993;35:983-990.
ЭНДОСКОПИЧЕСКАЯ
УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Глория Сзе, Стенли Р. Клейн и Виктор Е Исселейн
Эндоскопическое ультразвуковое исследование (ЭУЗИ) желудка—уникаль-
ный инструмент для определения стадии злокачественного процесса и оцен-
ки поражения стенки органа и смежных с ней образовании, неопределяемых
при обычном эндоскопическом исследовании [1-6]. К поражениям такого
типа относятся подслизистые опухоли, утолщающие желудочные складки, а
также изменения, возникающие при портальной гипертензии. Результаты
ЭУЗИ влияют на клиническую тактику и сокращают затраты лечебных уч-
реждений. Мультицентрическое исследование, проведенное Американским
эндосонографическим обществом, показало, что данные, полученные с по-
мощью ЭУЗИ, повлияли на выбор клинической тактики более чем в двух тре-
тях случаев [7]. Более чем у половины пациентов эти изменения позволили
провести менее дорогостоящее, менее опасное или инвазивное лечение [7,8].
В этой главе обсуждаются показания для проведения ЭУЗИ при заболевани-
ях желудка.
ОБОРУДОВАНИЕ И ТЕХНИЧЕСКИЕ АСПЕКТЫ ЭНДОСКОПИЧЕСКОГО
УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ ЖЕЛУДКА
Оборудование
В настоящее время существует два типа эхоэндоскопов, применяемых для
исследования желудка. Эхоэндоскоп Olympus UM20 с 360°-сканером с час-
тотой 12 или 7,5 МГц, расположенным перпендикулярно к длинной оси эндо-
скопа, наиболее предпочтителен для исследования желудка. Он дает обзор
360°, что особенно важно для оценки поражений стенки желудка и смежных с
ней образований. Эндоскоп Pentax FG32UA сканирует параллельно длинной
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright© 2001 Wiley-Liss, Inc.
380
11 ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
оси эндоскопа и имеет сектор обзора 100° и частоту 7,5 и 5 МГц. Этот инстру-
мент снабжен модулем для цветной допплерографии и особенно полезен при
исследовании сосудов. Оба эхоэндоскопа снабжены фиброоптикой с боко-
вым обзором; операторы должны быть знакомы с применением эндоскопов
такого типа.
Поднося датчик вплотную к подозрительному образованию, исследова-
тель способен оценить поражение стенки желудка. Заполненный водой бал-
лон, помещенный поверх датчика, позволяет осуществить тесное соприкос-
новение датчика и образования, обеспечивая оптимальные условия сканиро-
вания. Однако баллон может сдавливать образование, вызывая появление
артефактов, затрудняющих интерпретацию. Поэ тому для того, чтобы оце-
нить поражение стенки желудка, часто используется методика, предусмат-
ривающая наполнение желудка водой. Желудок заполняется 200 -500 мл
воды, что позволяет получить хорошие ультразвуковые изображения струк-
тур стенки желудка без появления каких-либо артефактов, вызываемых
компрессией (рис. 11.1). Ультразвуковые изображения получаются при про-
движении эндоскопа вперед и назад; исследуется весь желудок. Дно и малая
кривизна — относительно трудные для визуализации области, и требуется
сочетанное применение методик, использующих заполненный водой баллон
и наполнение желудка водой с вращением датчика или поворотами пациен-
та. Для исследования небольших слизистых или подслизистых образова-
ний можно применять также ультразвуковой датчик, встроенный в катетер
(Olympus).
Рис. 11.1. Эхоэндоскоп в желудке, заполненном 200-500 мл воды.
ЭУЗИ НЕИЗМЕНЕННОГО ЖЕЛУДКА
381
Приобретение практических навыков
ЭУЗИ должен выполнять врач, уже имеющий опыт проведения гастродуоде-
носкопии. ЭУЗИ является более сложной методикой, потому что эхоэндо-
скоп снабжен оптикой с боковым обзором (как дуоденоскоп, используемый
для выполнения ЭРХПГ), и жесткая часть эндоскопа длиннее, чем на обыч-
ном гастродуоденоскопе. Такая конструкция увеличивает риск перфорации,
особенно если эндоскоп продвигается из желудка в нисходящую часть две-
надцатиперстной кишки. Весьма полезен опыт в проведении трансабдоминаль-
ного УЗИ, поскольку он дает представление об эхосемиотике внутрибрюш-
ных органов, таких как печень, селезенка, поджелудочная железа, почки, и
внутрибрюшных сосудов. В нашем учреждении перед ЭУЗИ всегда выполня-
ется трансабдоминальное УЗИ, что позволяет получить общее представле-
ние. Что касается гастродуоденоскопии, то для приобретения навыка прове-
дения ЭУЗИ потребуется выполнить от 80 до 100 таких исследований. Пер-
вые исследования следует проводить под непосредственным руководством
опытного эндоскописта-ультрасонографиста. Обучение ЭУЗИ на курсах с
практическими занятиями значительно облегчает приобретение навыков.
Хотя распознавание подслизистых образований относительно просто, опре-
деление стадии рака желудка требует значительного опыта, особенно при
признаках инвазивного роста. Поскольку наличие IV (Т4) стадии рака желуд-
ка может повлиять на тактику ведения больного с заменой первичного хирур-
гического лечения на паллиативное (особенно при вовлечении поджелудоч-
ной железы), постольку компетентность в установлении стадии заболевания
является критическим моментом.
ЭУЗИ НЕИЗМЕНЕННОГО ЖЕЛУДКА
Толщина неизмененной стенки желудка составляет 2-4 мм и имеет пяти-
слойное строение, соответствующее ее гистологическим слоям (рис. 11.2)
[9, 10]. Анэхогенная область, окружающая датчик, — это изображение
воды, заполняющей баллон. За баллоном определяется чередование гипер-
эхогенных и гипоэхогенных слоев неизмененной стенки желудка. Слизи-
стая оболочка представлена первыми двумя слоями: первый слой более
тонкий и гиперэхогенный, второй слой — гипоэхогенный. Третий слой со-
ответствует изображению подслизистой оболочки, он гиперэхогенный и
обычно хорошо заметен. Четвертый гипоэхогенный слой представлен соб-
ственно мышечной оболочкой и обычно самый толстый слой неизменен-
ного желудка. Пятый гиперэхогенный слой соответствует серозной обо-
лочке желудка, обычно он очень тонкий и иногда визуализируется недо-
статочно отчетливо.
382
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
MUCOSA
SUBMUCOSA
MUSCLE LAYER
SEROSA
Рис. 11.2. А. Пять эхослоев неизмененного желудка, выявляемые при сканировании
7,5-МГц датчиком на глубине 4 см. Б. Пять слоев, выявляемые при сканировании
12-МГц датчиком, погруженным в желудок, наполненный водой.
Визуализируя образование желудка при сканировании в плоскости, пер-
пендикулярной к поражению, следует проявить осторожность, поскольку в
косых проекциях размер образования может увеличиваться, а его края и
слои желудка затеняться. Все пять эхослоев стенки желудка прекрасно про-
сматриваются на близком расстоянии при использовании ультразвуковой
частоты 12 МГц. Для точной идентификации слоев без артефактов, создава-
емых давлением датчика на стенку желудка, может потребоваться его запол-
нение водой.
РАК ЖЕЛУДКА
383
(Hyperechoic Layer on
j MUCOSA top of Hypoechoic)
SUBMUCOSA (Hyperechoic)
*— MUSCLE LAYER (Hypoechoic)
*— SEROSA (Hyperechoic)
РАК ЖЕЛУДКА
Карцинома желудка обычно представляет собой визуализируемое при ЭУ ЗИ
гипоэхогенное, гетерогенное образование с неровными контурами. Класси-
фикация по стадиям соответственно размеру опухоли, поражению лимфати-
ческих узлов и отдаленному метастазированию (TNM) выглядит следующим
образом [ 11, 12] (рис. 11.3).
384
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Т1. Опухоль инфильтрирует слизистую и подслизистую оболочки; собст-
венно мышечный слой остается незатронутым и неповрежденным.
Т2. Опухоль инфильтрирует собственно мышечный слой и субсерозную
оболочку; субсерозный слой при ЭУЗИ обычно не дифференцирует-
ся от серозного слоя, что делает сомнительным возможность точно-
го определения инвазии подслизистого слоя.
ТЗ. Опухоль проникает через серозную оболочку без инвазии в близле-
жащие органы.
Т4. Инвазия опухоли в близлежащие органы или ткани (печень, поджелу-
дочная железа, ободочная кишка).
NO. Метастазирования в региональные лимфатические узлы нет.
N1. Вовлечение в процесс перигастральных узлов в пределах 3 см от края
опухоли.
N2. Вовлечение в процесс перигастральных узлов далее 3 см от края пер-
вичной опухоли или узлов по ходу левой желудочной, общей пече-
ночной, брыжеечной, селезеночной или чревной артерий.
МО. Отдаленных метастазов нет.
Ml. Отдаленное метастазирование: поражение печени или перитонеаль-
ная диссеминация.
Мх. Метастазирование нельзя оценить.
Стадия IA. T1N0M0
Стадия IB. T1N1M0, T2N0M0
Стадия II. T1N2M0, T2N1M0 и T3N0M0
Стадия 7/M.T2N2M0, T3N1M0 и T4N0M0
Стадия ШВ. T3N2M0, T4N1M0
Стадия IV. T4N2M0; любая стадия Т, любая стадия N, Ml
При дифференциальной диагностике между пластическим линитом и
гиперплазией складок желудка точность ЭУЗИ составила 88%, и результаты
исследования должны побудить врача приложить большие усилия для под-
тверждения диагноза гистологическим методом [13]. ЭУЗИ обычно выпол-
няется после установления первичного диагноза рака желудка при гастодуо-
деноскопии и биопсии. При определении местной распространенности опу-
холи по результатам ЭУЗИ можно достаточно точно предсказать Т-стадию
(78%) и несколько менее точно определить N-стадию (70%) рака желудка
(обобщенные данные многократных исследований, включающих более
2500 пациентов при определении Т-стадии и более 1 000 — при определении
N-стадии) [1, 14]. В недавно проведенном исследовании точность при опре-
делении Т- и N-стадии составила 89 и 68% соответственно [15].
РАК ЖЕЛУДКА
385
Рис. 11.3. А. Рак желудка, стадия Т1. Датчик погружен в воду, расположен близко и
перпендикулярно к опухоли, но без давления на нее. Б. Рак желудка, стадия Т2.
Датчик внутри заполненного водой баллона. В. Рак желудка, стадия ТЗ. Г. Рак
желудка, стадия Т4, инвазия опухоли в поджелудочную железу. Д. Рак желудка,
стадия Т4, инвазия опухоли в печень.
Некоторой проблемой, возникающей при оценке с помощью ЭУЗИ рака
желудка, является завышение стадии опухоли, обусловленное перитумороз-
ными воспалительными изменениями, изъязвлением опухоли и развитием
25 Ультразвуковая диагностика...
386
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Рис. 11.3. (Продолжение.)
фиброза окружающих тканей. Занижение стадии заболевания происходит
при наличии микроскопических метастазов, не визуализирующихся при ЭУЗИ.
Как отмечалось выше, определение стадии Т2 с помощью ЭУЗИ может быть
неточным из-за трудности в дифференцировке инфильтрации серозного и
субсерозного слоев.
РАК ЖЕЛУДКА
387
Рис. 11.3. (Продолжение.)
Для оценки злокачественной инвазии лимфатических узлов было исполь-
зовано несколько критериев: размер больше 1 см, гипоэхогенный вид, отчет-
ливые контуры и округлая форма указывали на малигнизацию узла с точно-
стью 80-100%, если отмечались все перечисленные признаки [16, 17]. К со-
жалению, совокупность этих признаков была выявлена только в одной
388
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Рис. 11.3. (Продолжение.)
четверти исследованных лимфатических узлов. Таким образом, диагностика
поражения лимфоузлов в большинстве случаев затруднительна. Современ-
ное развитие тонкоигольной аспирационной биопсии под контролем ЭУЗ
помогло разрешить эту задачу. Тонкоигольная аспирация из лимфатических
узлов дает точные результаты приблизительно в 80% случаев [18]. Правиль-
РАК ЖЕЛУДКА
389
ное определение стадии поражения лимфатических узлов исключительно
важно, поскольку их малигнизация изменяет тактику ведения больного.
Было установлено, что при определении Т- и N-стадий рака желудка
ЭУЗИ превосходит КТ (табл. 11.1). Точность определения Т-стадии при ис-
пользовании ЭУЗИ варьирует от 78 до 92% и от 24 до 44% — при примене-
390
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Таблица 11.1. Точность ЭУЗИ и КТ органов брюшной полости для
определения стадии рака желудка а
Классификация ЭУЗИ КТ
Т-стадия 78-92% 24 44%
N-стадия 74-87% 29-51%
а Данные из [ 21-23].
нии абдоминальной КТ [19-23]. Точность определения N-стадии в этих ис-
следованиях составила 74-87% для ЭУЗИ и 29-51 % — для абдоминальной
КТ. Среди 254 пациентов ЭУЗИ оказалось высокоточным методом прогно-
зирования резектабельности в 96% случаях [24]. Новые данные по оценке
возможности ЭУЗИ, КТ и МРТ в определении Т-стадии показали более низ-
кую точность КТ и МРТ (50- 60%) по сравнению с ЭУЗИ (85-90%) [25].
Точность определения глубины опухолевой инвазии при использовании
ультрасонографических мини-датчиков (15 или 20 МГц) во время проведе-
ния гастродуоденоскопии для определения стадии рака желудка составила
61 % случаев при всех опухолях (Т-стадия) и 72% — при Т1 - и Т2-новообра-
зованиях [26]. Точность при определении поражения лимфатических узлов
(N-стадия) составила 69% [26]. При использовании мини-датчиков с часто-
той 20 МГц точность ЭУЗИ в определении стадии раннего рака желудка со-
ставила 65%; для опухолей, ограниченных только слизистой оболочкой,
чувствительность составила 92% [27]. Таким образом, применение мини-
датчиков оказывается наиболее эффективным для оценки раннего рака же-
лудка, ограниченного слизистой оболочкой. В этих случаях может применя-
ться удаление опухоли с использованием техники петлевой биопсии [28-30].
ЭУЗИ применялось также для определения стадии рака желудка с це-
лью выявления пациентов, у которых резекция будет наиболее эффектив-
ной. Инфильтрация стенки органа (стадия IV) обычно указывает на нерезек-
табельность. Точность определения стадии Т4 колеблется от 64 до 100% со
средним значением, равным 83% [19, 20, 22-24, 31, 32]. ЭУЗИ может также
выявлять пациентов с распространенным заболеванием, для которых значи-
тельную роль играет дооперационная химиотерапия [31-33]. Показано, что
проведение дооперационной неоадъювантной химиотерапии увеличило долю
радикальных резекций (80%) у больных с местно-распространенным раком
желудка (стадии III и IV), выявленным при ЭУЗИ; в 25% случаев рецидива
опухоли не наблюдалось [34]. В проспективном исследовании пациентов с
раком пищевода эффективность хирургического лечения сравнивалась с эф-
фективностью комбинированной терапии, включающей в себя химиотера-
пию, радиотерипию и хирургическое лечение [35]; показатель 3-летней вы-
живаемости в группе больных, получавших комбинированное лечение
ЛИМФОМА ЖЕЛУДКА
391
(32%), превышал аналогичный показатель в группе больных, которым про-
водилось лишь оперативное лечение (6%), более чем на 25%. Эти результа-
ты могут быть применимы и к больным раком желудка. ЭУЗИ является так-
же высокоточным методом наблюдения за пациентами после хирургиче-
ской резекции для раннего обнаружения рецидива заболевания [36].
Для определения стадии рака желудка разработан следующий алгоритм
[37]. После установления диагноза рака желудка при помощи гастроскопии
и биопсии для исключения стадии заболевания Ml необходимо проведение
рентгенологического исследования грудной клетки и КТ (или УЗИ) органов
брюшной полости. Если отдаленное метастазирование исключено, для опре-
деления местной распространенности рекомендуется проведение ЭУЗИ.
Больные с опухолевой инвазией в поджелудочную железу должны получать
химиотерапию или паллиативное лечение. Пациентов с опухолевой инва-
зией в левую долю печени или брыжейку ободочной кишки следует под-
вергнуть хирургической резекции. Пациентам с обширным поражением
лимфатических узлов (таких как лимфоузлы чревного ствола, N2), незави-
симо от стадии Т, должна назначаться дооперационная химиотерапия. Вы-
шеперечисленные рекомендации опыта могут изменяться, так как большо-
го, проспективного, рандомизированного исследования, изучающего эффек-
тивность дооперационной адъювантной терапии, основанной на установлении
стадии заболевания с помощью ЭУЗИ, не проводилось.
ЛИМФОМА ЖЕЛУДКА
Желудок является наиболее частой экстранодальной локализацией лимфо-
мы; первичная лимфома желудка составляет приблизительно 5% от всех его
опухолей. При эндоскопическом исследовании лимфома желудка может вы-
являться либо как опухолевидное образование, либо просто как утолщение
складок слизистой. Гипоэхогенная инфильтрация, обычно отмечаемая при
ЭУЗИ, затрагивает второй или третий эхослой, или даже всю толщу желудоч-
ной стенки, и может быть отграниченной или диффузной (рис 11.4). Досто-
верно отличить лимфому от других случаев утолщения стенки желудка, ру-
ководствуясь только данными ЭУЗИ, невозможно. Если по результатам
ЭУЗИ предполагается лимфома желудка, то для получения гистологического
диагноза следует выполнить биопсию. TNM-классификация лимфомы же-
лудка аналогична классификации рака желудка с дополнением стадии N3 при
вовлечении таких неудаляемых при операции, интраабдоминальных лимфа-
тических узлов, как парааортальные, гепатодуоденальные, ретропанкреати-
ческие и мезентериальные.
Точность ЭУЗИ в определении Т-стадии составляет 88-96% и 72-88% —
в определении стадии вовлечения лимфатических узлов [21, 23, 38-41].
Вследствие ограниченной глубины проникновения, с помощью ЭУЗИ уда-
ется выявить лишь регионарные лимфатические узлы; поэтому вместе с ним
392
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Рис. 11.4. Диффузная гипоэхогенная инфильтрация всех слоев стенки желудка при
лимфоме.
необходимо использовать другие методы визуализации органов брюшной
полости. ЭУЗИ применяется также для дальнейшего наблюдения за больны-
ми после химиотерапии или оперативного лечения [42]. Регрессия лимфомы
из лимфоидной ткани, ассоциированной со слизистой оболочкой желудка
(MALT), после ликвидации Helicobacter pylori, выявленная при ЭУЗИ-опре-
делении стадии опухоли, показывает, что подобная регрессия могла ожидать-
ся только в тех случаях, когда лимфома ограничивалась слизистой и подели-
ПОДСЛИЗИСТЫЕ ОПУХОЛИ ЖЕЛУДКА
393
зистой оболочками желудка (у 12 из 14 пациентов), но не в случаях более
высокой стадии заболевания [38].
ПОДСЛИЗИСТЫЕ ОПУХОЛИ ЖЕЛУДКА
Подслизистые образования желудка являются одним из основных показаний
к проведению ЭУЗИ. При помощи ЭУЗИ можно четко дифференцировать эк-
страмуральную компрессию, сосудистое поражение и солидную опухоль и,
кроме того, точно определить слой желудка, из которого возникла опухоль.
Перед попыткой выполнения биопсии подслизистого образования для исклю-
чения экстрамуральной компрессии или поражения сосудов всегда должна
выполняться ЭУЗИ. Частота выявления при ЭУЗИ различных подслизистых
образований желудка приведена в табл. 11.2.
Среди подслизистых образований при ЭУЗИ наиболее часто встречают-
ся лейомиомы. Эти образования обычно возникают из мышечной оболочки
(четвертый эхослой), однако небольшие опухоли могут развиваться из вто-
рого эхослоя желудка (рис. 11.5). Лейомиомы обычно гипоэхогенные. гомо-
генные и с четкими контурами.
Таблица 11.2. Подслизистые образования желудка а
Образование Частота (%)6 Ультразвуковые данные
Лейомиома 46 Гипоэхогенное. гомогенное, происходит из 4-го (мышечный) или 2-го (мышечная пластинка слизистой оболочки) слоя
Лейомиосаркома 6 > 4 см, неровные края, гиперэхогенные фокусы, жидкостные включения
Киста 21 Анэхогенное, округлое, хорошо отграниченное (в 3-м слое — подслизистой оболочке)
Аберрантная поджелудочная железа 18 Неоднородная эхоструктура (в 3-м слое — подслизистой оболочке)
Липома 5 Гиперэхогенное (в 3-м слое — подслизистой оболочке)
Карциноид 1,5 Средней эхогенности (в 3-м слое — подслизистой оболочке)
Эозинофильная гранулема <1 Г етерогенное
Гранулярно-клеточная миобластома <1 Г ипоэхогенное
° печатается с любезного разрешения Yasuda et al. [43].
6N= I3l образование.
394
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Рис. 11.5. Гипоэхогенное гомогенное образование — лейомиома желудка.
По данным ЭУЗИ проведена оценка наиболее важных признаков, от-
личающих доброкачественные и злокачественные стромальные опухоли
[44]. Образования размером более 4 см, с неровными контурами, гиперэхо-
генными и жидкостными включениями во всех случаях были расценены
как злокачественные. Если определялось два из этих признаков, чувстви-
тельность ЭУЗИ в выявлении малигнизации по данным разных авторов,
составила 80-100%. Если не определялся ни один из признаков, малигни-
ПОДСЛИЗИСТЫЕ ОПУХОЛИ ЖЕЛУДКА
395
Рис. 11.6. Данные ЭУЗИ у пациентов с утолщением складок слизистой оболочки
желудка.
зированные образования встречались в 0-11% случаев, по оценке различ-
ных авторов. Однако при наличии любого подозрительного признака злока-
чественности для установления диагноза часто требуется выполнение тре-
панобиопсии или эндохирургическое удаление образования. ЭУЗИ может
использоваться для наблюдения за доброкачественными новообразова-
ниями.
Другие подслизистые образования могут быть идентифицированы при
ЭУЗИ по характерным признакам. Липома — гомогененное, гиперэхоген-
396
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
ное образование — хорошо отграничена и расположена в пределах подслизи-
стого слоя. Карциноидные опухоли в основном расположены в третьем (под-
слизистом) слое, имеют среднюю эхогенность и четко выраженные контуры
[45]. Кистозные образования, как правило, анэхогенны, хорошо отграниче-
ны и чаще расположены в подслизистом слое. Также в подслизистом слое
нередко обнаруживается эктопированная ткань поджелудочной железы, вид
которой аналогичен виду панкреатической паренхимы с мелкими гиперэхо-
генными участками, а в отдельных случаях и с трубчатыми структурами
правильной формы.
УТОЛЩЕНИЕ СКЛАДОК СЛИЗИСТОЙ ОБОЛОЧКИ
Утолщение складок слизистой оболочки желудка может наблюдаться как
при доброкачественных, так и при злокачественных заболеваниях
(рис. 11.6). Если гастроскопия с биопсией не могут определить природу
этих изменений, необходимо выполнение ЭУЗИ [3,4,46]. В то время как га-
стрит, фовеолярная и железистая гиперплазия могут быть легко верифици-
рованы при биопсии слизистой оболочки, диагностика при диффузном раке
желудка (при котором слизистая оболочка может быть не изменена), лим-
фоме или варикозном расширении вен желудка в отдельных случаях вызы-
вает затруднения. Если определяется утолщение четвертого слоя и глубо-
кие биопсии (включая соскабливание), выполненные при гастроскопии,
оказались не информативными, для подтверждения диагноза рака желудка
рекомендуется эксплоративное хирургическое вмешательство [46]. Имеет-
ся сообщение о данных ЭУЗИ при утолщениях складок слизистой оболочки
желудка, вызванных различными причинами [3]. У пациентов с болезнью
Менетрие (аденопапилломатоз, гигантский гипертрофический гастрит)
был утолщен только второй слой; у пациентов, страдающих анизакидозом
(зоонозный гельминтоз), утолщался только третий слой. В большинстве
случаев скиррозного рака было выявлено утолщение третьего и четвертого
слоев. У здоровых людей при случайно обнаруженном утолщении складок
слизистой оболочки желудка определялось увеличение толщины второго и
третьего слоев; напротив, утолщение четвертого слоя наблюдалось только
при злокачественных поражениях. У пациентов с фовеолярной гиперпла-
зией утолщены два внутренних слоя [47]. Варикозное расширение вен же-
лудка проявляется наличием гипоэхогенных сосудов в подслизистом слое и
перш астральной области (рис. 11.7). Для подтверждения сосудистой при-
роды изменений может использоваться ЭУЗИ с допплерографией, но обыч-
но в этом нет необходимости. Диагностические правила, приведенные в
табл. 11.3 в сочетании с эндоскопическими данными, могут использоваться
при диагностике и лечении пациентов с утолщением складок слизистой
оболочки желудка.
РЕЗЮМЕ
397
Рис. 11.7. Варикозное расширение вен желудка проявляется наличием гипоэхогенных
сосудов.
РЕЗЮМЕ
ЭУЗИ помогает оценить поражения стенки желудка и перигастральной обла-
сти. Во многих лечебных учреждениях ЭУЗИ используется для определения
стадии злокачественных новообразований желудка и выработки лечебной
тактики. Это наиболее надежный метод для установления стадии опухоли и
диагностики подслизистых образований. Тонкоигольная аспирационная био-
псия под контролем ЭУЗИ позволяет поставить точный диагноз и определить
стадию заболевания (включая поражение лимфатических узлов). Было пока-
зано, что ЭУЗИ может повлиять на выбор лечебной тактики более чем у двух
398
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
Таблица 11.3. Данные ЭУЗИ у пациентов с утолщением складок
слизистой оболочки желудка
Утолщение эхослоев по данным ЭУЗИ Гистологические данные
Слои 1 и 2, слизистая Гастрит, гиперплазия слизистой, рак желудка, лимфома
Слои 1 и 2, слизистая; слой 3, подслизистая; Слой 4, мышечный Аденокарцинома желудка, лимфома
Слой 2, слизистая Болезнь Менетрие
Слой 2, слизистая; слой 3, подслизистая; Слой 4, мышечный Скиррозный рак, лимфома
Слой 3, подслизистая Варикоз, анизакидоз
Слой 3, подслизистая; слой 4, мышечный Скирр, лимфома
третей больных [7, 8]. Более чем в половине случаев эти данные позволяют
провести менее дорогостоящее, опасное и/ или инвазивное лечение.
ССЫЛКИ
1. Rosch Т. Endosonographic staging of gastric cancer: a review of literature
results. Gastrointest Endosc Clin North Am 1995;5:549-557.
2. Rosch T. Endoscopic ultrasonography in upper gastrointestinal submucosal
tumors: a literature review. Gastrointest Endosc Clin North Am 1995;5:
609-614
3. Songur Y Okai T, Watanabe El, et al. Endosonographic evaluation of giant
gastric folds. Gastrointest Endosc 1995;41:468-474.
4. Tio TL. Large gastric folds evaluated by endoscopic ultrasonography. Gast-
rointest Endosc Clin North N Am 1995;5:683-691.
5. Okada M, lizuka Y, Oh K, et al. Gastritis cystica profunda presenting as gi-
ant gastric mucosal folds: the role of endoscopic ultrasonography and muco-
sectomy in the diagnostic work-up. Gastrointest Endosc 1994;40:640-644.
6. Motoo Y, Okai T, Ohta H, et al. Endoscopic ultrasonography in the diagno-
sis of extralu-minal compressions mimicking gastric submucosal tumors.
Endoscopy 1994;26:239-242.
7. Nicki NJ, Bhutani MS, Catalano M, et al. Clinical implications of endosco-
pic ultrasound: the American Endosonography Cub study. Gastrointest En-
dosc 1996;44:371-377.
8. Jafri IH, Saltzman JR, Colby JM, Krims PE. Evaluation of the clinical im-
pact of endoscopic ultrasonography in gastrointestinal disease. Gastrointest
Endosc 1996;44:367-370.
ссылки
399
9. Tio TL, Tytgat GN. Endoscopic ultrasonography of normal and pathologic
upper gastrointestinal wall structure. Comparison of studies in vivo and in
vitro with histology. Scand J Gastroenterol Suppl 1986;123:27 -33.
10. Kimmey MB, Martin RW, Haggitt RC, et al. Histologic correlates of gastro-
intestinal ultrasound image. Gastroenterology 1989;96:433-441.
11. Sobin LH, Hermanek P, Hutter RV. TNM classification of malignant tu-
mors. A comparison between the new (1987) and the old editions. Cancer
1988;61:2310-2314.
12. Tio TL. The TNM staging system. Gastrointest Endosc 1996;43:S19-S24.
13. Andriulli A, Recchia S, De Angelis C, et al. Endoscopic ultrasonographic
evaluation of patients with biopsy negative gastric linitis plastica. Gastroin-
test Endosc 1990;36:611-615.
14. Roesch T, Classen M. Gastric carcinoma. In: Roesch T, Classen M, eds.,
Gastroenterologic endosonography. New York: Thieme, 1992:71-80.
15. Massari M, Cioffi U, De Simone M, et al. Endoscopic ultrasonography for
preoperative staging of gastric carcinoma. Hepatogastroenterology 1996;
43:542-546.
16. Bhutan! MS, Hawes RH, and Hoffman BJ. A comparison of the accuracy of
echo features during endoscopic ultrasound (EUS) and EUS-guided fine-ne-
edle aspiration for diagnosis of malignant lymph node invasion. Gastrointest
Endosc 1997;45:474-179.
17. Catalano MF, Sivak MV Jr, Rice T, et al. Endosonographic features predic-
tive of lymph node metastasis. Gastrointest Endosc 1994;40:442-446.
18. Hoffman BJ, Hawes RH. Endoscopic ultrasonography-guided puncture of
the lymph nodes: first experience and clinical consequences. Gastrointest
Endosc Clin North Am 1995;5:587-593.
19. Botet JF, Light dale CJ, Zauber AG, et al. Preoperative staging of gastric
cancer: comparison of endoscopic US and dynamic CT. Radiology 1991;
181:426-432.
20. Grimm H, Soehendra N, Hamper K, Maas R. Contribution of endosonog-
raphy to preoperative staging in esophageal and stomach cancer. Chirurg
1989;60:684-69.
21. Caletti G, Ferrari A, Brocchi E, Barbara L. Accuracy of endoscopic ultraso-
nography in the diagnosis and staging of gastric cancer and lymphoma. Sur-
gery 1993;113:14-27.
22. Ziegler K, Sanft C, Zimmer T, et al. Comparison of computed tomography,
endosonography, and intraoperative assessment in TN staging of gastric car-
cinoma. Gut 1993;34:604-610.
23. Nattermann C, Dancygier H. Endosonography in diagnosis and staging of
malignant tumors of the stomach. A prospective comparative study between
400
11. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ЖЕЛУДКА
endosonography, computerized tomography and conventional ultrasonog-
raphy. Z Gastroenterol 1993;31:719-726.
24. Dittler HJ, Siewert JR. Role of endoscopic ultrasonography in gastric carci-
noma. Endoscopy 1993;25:162-16.
25. Catalano MF. Endoscopic ultrasonography for esophageal and gastric mass
lesions. Gas-troenterologist 1997;5:3-9.
26. Akahoshi K, Chijiiwa Y, Sasaki I, et al. Preoperative TN staging of gastric
cancer using a 15 MHz ultrasound miniprobe. Br J Radiol 1997;70:703-707.
27. Yanai H, Matsumoto Y, Harada T, et al. Endoscopic ultrasonography and
endoscopy for staging depth of invasion in early gastric cancer: a pilot stu-
dy. Gastrointest Endosc 1997;46:212-216.
28. Yasuda K. Endoscopic ultrasonic probes and mucosectomy for early gastric
carcinoma. Gastrointest Endosc 1996;43:S29 S3.
29. Akahoshi K, Chijiiwa Y, Tanaka M, et al. Endosonography probe-guided
endoscopic mucosal resection of gastnc neoplasms. Gastrointest Endosc
1995;42:248-252.
30. Motoo Y, Okai T, Songur Y, et al. Endoscopic therapy for early gastric can-
cer. Utility of endosonography and evaluation of prognosis. J Clin Gastroen-
terol 1995;21:17-23.
31. Rosch T, Lorenz R, Zenker K, et al. Local staging and assessment of resec-
tability in carcinoma of the esophagus, stomach, and duodenum by endosco-
pic ultrasonography. Gastrointest Endosc 1992;38:460-167.
32. Tio TL, Schouwink MH, Cikot RJ, and Tytgat GN, Preoperative TNM clas-
sification of gastric carcinoma by endosonography in comparison with the
pathological TNM system: a prospective study of 72 cases. Hepatogastroen-
terology 1989;36:51-56.
33. Akahoshi K, Misawa T, Fujishima H, et al. Preoperative evaluation of gast-
ric cancer by endoscopic ultrasound. Gut 1991;32:479-482.
34. Fink U, Schuhmacher C, Stein HJ, et al. Preoperative chemotherapy for sta-
ge III-IV gastric carcinoma: feasibility, response and outcome after comple-
te resection. Br J Surg 1995;82:1248-1252.
35. Walsh TN, Noonan N, Hollywood D, et al. A comparison of multimodal
therapy and surgery for esophageal adenocarcinoma. N Engl J Med 1996;
335:462-510.
36. Lightdale CJ. Detection of anastomotic recurrence by endoscopic ultraso-
nography. Gastrointest Endosc Clin North Am 1995;5:595-600.
37. Vargas HI, Stabile BE, Leon L, et al. Endoscopic ultrasonography (EUS)
staging of gastric cancer. Am J Surg in press.
38. Sackmann M, Morgner A, Rudolph B, Neubauer A, et al. Regression of gas-
tric MALT lymphoma after eradication of Helicobacter pylori is predicted
ссылки
401
by endosonographic staging. MALT Lymphoma Study Group. Gastroente-
rology 1997;113:1087-1090.
39. Tio TL, den Hartog Jager FC, Tijtgat GN, Endoscopic ultrasonography of
non-Hodgkin lymphoma of the stomach. Gastroenterology 1986;91:
401^18.
40. Fujishima H, Misawa T, Maruoka A, et al. Staging and follow-up of primary
gastric lymphoma by endoscopic ultrasonography. Am J Gastroenterol
1991;86:719-724.
41. Suekane H, lida M, Yao T, et al. Endoscopic ultrasonography in primary
gastric lymphoma: correlation with endoscopic and histologic findings.
Gastrointest Endosc 1993;39:139-145.
42. Pavlick AC, Gerdes H, Portlock CS. Endoscopic ultrasound in the evaluati-
on of gastric small lymphocytic mucosa-associated lymphoid tumors. J Clin
Oncol 1997;15:1761-1766.
43. Yasuda K, Cho E, Nakajima M, Kawai K. Diagnosis of submucosal lesions
of the upper gastrointestinal tract by endoscopic ultrasonography. Gastroin-
test Endosc 1990;36:S17-S20.
44. Chak A, Canto MI, Rosch T, et al. Endosonographic differentiation of be-
nign and malignant stromal cell tumors. Gastrointest Endosc 1997;45:
468^173.
45. Yoshikane H, Tsukamoto Y, Niwa Y, et al. Carcinoid tumors of the gastro-
intestinal tract: evaluation with endoscopic ultrasonography. Gastrointest
Endosc 1993;39:375-383.
46. Mendis RE, Gerdes H, Lightdale CJ, Botet JF. Large gastric folds: a diag-
nostic approach using endoscopic ultrasonography. Gastrointest Endosc
1994;40:437-441.
47. Strohm WD, Classen M. Benign lesions of the upper G1 tract by means of
endoscopic ultrasonography. Scand J Gastroenterol Suppl 1986; 123:41^16.
26 Ультразвуковая диагностика...
ЭНДОСКОПИЧЕСКАЯ
УЛЬТРАСОНОГРАФИЯ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
12
Джеймс Шайман и Парта С Нанди
Эндоскопическое ультразвуковое исследование (ЭУЗИ), называемое также
эндосонографией, является в Соединенных Штатах относительно новой диа-
гностической методикой. Эндоскопист помещает датчик в непосредствен-
ной близости от области интереса, например кишечной стенки или поджелу-
дочной железы. Исследования с помощью этой методики позволяют полу-
чить высококачественные изображения как самой поджелудочной железы,
так и окружающих ее структур.
При оценке состояния поджелудочной железы ЭУЗИ имеет существен-
ное превосходство над УЗИ, проводимым через переднюю брюшную стен-
ку, поскольку петли кишечника, заполненные газом, не препятствуют визуа-
лизации. Методом выбора для скринингового исследования пациентов при
подозрении у них новообразования поджелудочной железы является дина-
мическая компьютерная томография. Несмотря на то, что КТ обеспечивает
наилучшую первоначальную неинвазивную оценку поджелудочной железы,
ЭУЗИ обладает значительными преимуществами в распознавании панкреа-
тологических изменений и облегчает определение стадии местной распро-
страненности опухолей поджелудочной железы. Выполнение ЭУЗИ также
полезно для оценки состояния паренхимы поджелудочной железы и пери-
панкреатических структур и часто используется для диагностики хрониче-
ского панкреатита, папиллярных опухолей и холедохолитиаза.
Кроме того, ЭУЗИ может применяться для визуального контроля траек-
тории пункционной иглы при взятии цитологического материала для полу-
чения данных о стадии местной распространенности опухолевого процесса
и о резектабельности образования поджелудочной железе. Замечательно,
что всю эту информацию можно получить при одном исследовании [1].
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher ISBN: 0-471-24538-0 Copyright© 2001 Wiley-Liss, Inc.
АППАРАТУРА
403
АППАРАТУРА
Что такое эхоэндоскоп? Инструмент представляет собой эндоскоп с ко-
сым расположением оптики и ультразвуковым датчиком, расположенным
в его наконечнике. В таких устройствах имеется канал для заполнения же-
лудочно-кишечного тракта водой, а также биопсионный канал, используе-
мый для проведения биопсии слизистой оболочки и тонкоигольной аспи-
рационной биопсии. Присоединенный к концу эндоскопа баллон помогает
создать водную прослойку, необходимую для ультразвукового сканирова-
ния.
В настоящее время доступно два вида фиброоптических устройств, из-
готовленных для ЭУЗИ верхних отделов желудочно-кишечного тракта: мо-
дель GF-UM20 (Olympus) и FG32-UA (Pentax). Фирмой Olympus недавно
выпущен видеоэндоскопический УЗ сканер (GF-UM130). В этих системах
используются различные технологии получения изображения. Радиально
сканирующий эхоэндоскоп Olympus использует механический датчик, по-
ворачивающийся на 360° в плоскости, перпендикулярной к длинной оси эн-
доскопа. Для воссоздания изображения из ультразвуковых данных исполь-
зуется вычислительная система сонографа.
Секторный эхоэндоскоп Pentax FG32-UA использует электронный
датчик, подсоединенный к 160-сантиметровому проводнику, а также
фиброскоп с косым расположением оптики и сектором в 100с. направлен-
ным вдоль длинной оси эндоскопа. Это оборудование снабжено ультра-
звуковым процессором Phillips/Hitachi. Система Pentax снабжена также
модулем для пульсовой цветной допплерографии, которая улучшает
идентификацию перипанкреатических структур. Такое усовершенствова-
ние помогает оператору точно и безопасно избегать кровеносных сосу-
дов при проведении тонкоигольной аспирационной биопсии под контро-
лем ЭУЗИ.
Фирмой Olympus создан инструмент, позволяющий выполнять биопсию
в заданном направлении. Несмотря на то, что предварительные данные под-
твердили возможность выполнения биопсии этим устройством, создавае-
мые им изображения отличаются от изображений в других современных си-
стемах. Что означает эта ситуация для эндосонографиста? Необходимо
развивать дополнительные навыки для успешного использования этого
инструмента. К счастью, для выполнения направленной биопсии не требу-
ется второго типа ультразвукового процессора.
Для эндосонографиста ЭУЗИ поджелудочной железы является наибо-
лее ответственным исследованием. Для успешного получения изображений
наиболее важным фактором служит опыт оператора. Хотя исследований,
посвященных прямому сравнению этих двух систем, было проведено не-
много, в опытных руках использование обоих инструментов дает схожие ре-
зультаты.
404
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ПОКАЗАНИЯ
Показания к проведению ЭУЗИ поджелудочной железы включают в себя:
определение стадии рака, оценку известных или подозреваемых образований,
локализацию эндокринных опухолей, подтверждение хронического панкре-
атита. На эхоэндоскопических изображениях поджелудочной железы можно
выявить опухоли размером менее 2 см, которые не видны при КТ. ЭУЗИ явля-
ется также одним из наиболее точных методов определения опухолевой ин-
вазии в вены воротной системы и определения резектабельности. ЭУЗИ по-
могает обнаружить невыраженные изменения при хроническом панкреатите,
недоступные другим методам визуализации.
МЕТОДИКИ ИССЛЕДОВАНИЯ
Пациент находится в положении на левом боку, седация достигается сочета-
нием бензодиазепина и наркотического аналгетика, для анестезии глотки
применяется местный анестетик. Датчик проводится в пищевод, желудок и
затем в двенадцатиперстную кишку. Для получения детального изображения
поджелудочной железы движения инструмента должны быть медленными.
Достаточное качество изображения достигается сканированием через жид-
кость, для чего используется баллон, размещенный на конце эндоскопа или за-
полнение желудка и двенадцатиперстной кишки 200^400 мл воды (см. гл. 11).
Для достижения необходимых условий сканирования эндосонографисты не-
редко используют обе методики. Чтобы визуализировать все отделы подже-
лудочной железы, используют местные анатомические ориентиры, включая
окружающие железу сосуды и органы.
ВИЗУАЛИЗАЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Для отчетливой визуализации поджелудочной железы эндосонографисты
обычно используют шесть мест расположения датчика: три в двенадцатипер-
стной кишке и три в желудке (табл. 12.1; рис. 12.1). Для достижения первой
позиции датчик продвигается в нисходящую часть двенадцатиперстной киш-
ки до визуализации обшего желчного протока (ОЖП), панкреатического про-
тока, головки поджелудочной железы и ампулярной части ОЖП. Во второй
позиции датчик располагается в дистальной части луковицы двенадцатипер-
стной кишки (рис. 12.2), в трезьей позиции датчик также находится в лукови-
це двенадцатиперстной кишки (рис. 12.3). В четвертой позиции датчик нахо-
дится в антральном отделе желудка (рис. 12.4), в пятой позиции — в теле же-
лудка (рис. 12.5) и в шестой позиции — в области дна желудка. Такие
положения датчика являются основными при визуализации поджелудочной
железы. Индивидуальные анатомические особенности могут потребовать
проведения сканирования из других мест расположения датчика, обеспечи-
вающих визуализацию всех отделов поджелудочной железы.
ВИЗУАЛИЗАЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
405
Таблица 12.1. Поджелудочная железа/забрюшинное пространство:
стандартные положения датчика
Уровень Положение датчика Визуализируемые структуры
1 Нисходящая часть двенадцатиперстной кишки ОЖП, ППр, ПЖ (г), ампула, ПП
II Верхушка луковицы двенадцатиперстной кишки ПЖ (г), ВВ, НПВ, С, ОЖП, ЖП
III Луковица двенадцатиперстной кишки СВ, ПЖ (г). ВБА. печень
IV Антральный отдел желудка Печень, ПЖ (т), СВ, С
V Тело желудка ПЖ (т), ППр, СВ, СА, ЧС, ПА, ПС
VI Дно желудка ПЖ (х), ППр, селезенка, С А, СВ, ЛП
ПЖ (г) — головка поджелудочной железы; ПЖ (т) — тело поджелудочной железы;
ПЖ (х) — хвост поджелудочной железы; ВВ—воротная вена; С—слияние панкреатиче-
ского и общего желчного протоков; ЖП — желчный пузырь; СВ — селезеночная вена;
ВБА—верхняя брыжеечная артерия; ПП — правая почка; ОЖП—общий желчный проток;
ППр — панкреатический проток; СА — селезеночная артерия; ЧС — чревный ствол;
ПА — печеночная артерия; ПС — почечные сосуды; ЛП — левая почка; Н ПВ — нижняя
полая вена.
Адаптировано из: Catalano MF. Normal structures on endoscopic ultrasonography: Visualiza-
tion measurement data and interobserver variation. Gastrointestinal Endoscopy Clinics ofNorth
America, 1995: 5:475-486. [3]
Рис. 12.1. Положения эндоскопического ультразвукового датчика для визуализации
поджелудочной железы и перипанкреатических структур.
406
12, ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Рис. 12.2. А. Радиальное сканирование во второй эндоскопической позиции.
Б. Нормальное эхоэндоскопическое изображение, полученное во второй позиции.
ВИЗУАЛИЗАЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
407
Рис. 12.3. А. Радиальное сканирование в третьей эндоскопической позиции.
Б. Нормальное эхоэндоскопическое изображение, полученное в третьей позиции.
408
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ДАТЧИК
ПАНКРЕАТИЧЕСКИЙ
ВЕРХНЯЯ
БРЫЖЕЕЧНАЯ
АРТЕРИЯ
СЛИЯНИЕ
ПАНКРЕАТИЧЕСКОГО
И ОБЩЕГО
ЖЕЛЧНОГО
ПРОТОКОВ
Рис. 12.4. А. Радиальное сканирование в четвертой эндоскопической позиции
Б. Нормальное эхоэндоскопическое изображение, полученное в четвертой позиции.
ВИЗУАЛИЗАЦИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
409
Рис. 12.5. А. Радиальное сканирование в пятой эндоскопической позиции.
Б. Нормальное эхоэндоскопическое изображение, полученное в пятой позиции.
410
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Нормальная анатомия
Неизмененная поджелудочная железа имеет однородную зернистую струк-
туру и выглядит немного более эхогенной, чем печень. Для правильной иден-
тификации панкреатических структур обычно требуется идентификация окру-
жающих железу сосудов и органов. Кроме этого, для предотвращения оши-
бочной интерпретации эндосонографисты должны хорошо знать варианты
индивидуальной анатомии. В нормальной поджелудочной железе головка,
вентральные и дорсальные сегменты могут обладать различной эхогенно-
стью [4] (рис. 12.6). Хвостатая доля печени, если она выступает и отделена пе-
регородкой от остальной поджелудочной железы, может выглядеть как опу-
холевидное образование в воротах печени или головке поджелудочной желе-
зы. Близко прилегающая к антральному отделу желудка петля кишки может
симулировать опухоль головки поджелудочной железы.
При получении косых срезов, проходящих между головкой поджелу-
дочной железы и воротной или селезеночной веной, также могут быть полу-
чены ошибочные результаты. Такие изображения могут наводить на мысль
о неоднородности сосудистой стенки и сосудистой инфильтрации. Эндосо-
но! рафисту всегда следует пытаться визуализировать все отделы поджелу-
дочной железы, однако получить изображение нижней части головки под-
желудочной железы и крючковидного отростка зачастую бывает трудно.
Кроме этого, полная оценка головки поджелудочной железы бывает неред-
ко затруднена у пациентов, перенесших хирургические вмешательства на
желудке, особенно резекцию по Бильрот-2.
ОЦЕНКА ОПУХОЛЕВИДНЫХ ОБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Аденокарцинома поджелудочной железы является пятой по частоте причи-
ной смерти от рака в Соединенных II Катах. В 1997 году было выявлено около
27000 новых случаев этого заболевания [5]. Большинство пациентов обраща-
ются к врачу, имея уже запущенную форму заболевания. Только у 15% боль-
ных опухоль ограничивается местным распространением и может быть под-
вергнута резекции [6].
Прогноз у 85% пациентов с инкурабельным заболеванием остается пло-
хим. Средняя продолжительность жизни составляет только 6 месяцев, а
основной целью терапевтических мероприятий является паллиативное лече-
ние [7]. Рандомизированное исследование показало, что эндопротезирова-
ние билиарного тракта также эффективно в устранении механической жел-
тухи, как и наложение билиодигистивного анастомоза [8]. При использова-
нии эндопротезов частота послеоперационной летальности и осложнений
значительно ниже, а сроки госпитализации короче. Билиодигистивный ана-
стомоз является средством выбора при дуоденальной обструкции. С про-
грессированием заболевания наложение анастомоза становится возможным
менее чем у 10% пациентов [9].
ОЦЕНКА ОПУХОЛЕВИДНЫХ ОБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
411
Появление нехирургических паллиативных средств лечения подчеркну-
ло важность предоперационного определения стадии рака поджелудочной
железы и оценки возможности радикальной резекции. У кандидатов на вы-
полнение радикального хирургического лечения не должно быть отдален-
ных метастазов. Кроме этого, должна иметься возможность полного удале-
ния опухоли, означающая отсутствие инвазии в крупные сосуды и ложе под-
желудочной железы. КТ, а позже и лапароскопия зарекомендовали себя как
незаменимые средства выявления субклинических метастазов в печени и по
брюшине [10,11]. Поскольку КТ является неинвазивным средством и позво-
ляет объективно оценить распространенность заболевания, это исследова-
ние должно проводиться в первую очередь, независимо от тактики опреде-
ления стадии. Традиционно, определение опухолевой инвазии в портальные
и мезентериальные сосуды проводилось при мезентериальной ангиографии
[12]. Однако ЭУЗИ, являясь новейшим средством визуализации, позволяет
точно установить стадию рака поджелудочной железы более чем в 90% слу-
чаев [13, 14]. Несмотря на то, что возможности ЭУЗИ в определении отда-
ленного распространения заболевания ограничены, при выявлении сосуди-
стой инвазии опухоли оно превосходит ангиографию и КТ [15, 16].
Рак поджелудочной железы
При ЭУЗИ большинство опухолей поджелудочной железы определяются как
четко выраженные, обычно гипоэхогенные образования, отличающиеся от
однородной гиперэхогенной структуры неизмененной железы (рис. 12.7).
Опухоль может быть гетерогенной и иногда содержать анэхогенные (воз-
можно, зоны некроза) и гиперэхогенные (гетеротопические кальцификаты)
участки. Такие выделяющиеся участки вместе с акустическими тенями от каль-
цификатов можно спутать с новообразованиями, выявленными при панкреа-
тите. Поэтому, если есть подозрение на наличие злокачественной опухоли,
выполнение биопсии обязательно. Контуры опухоли неровные из-за «вырос-
тов», а с увеличением размеров новообразования возрастает его гетерогенность.
В связи с ограниченной проникающей способностью ЭУЗИ большие образо-
вания могут визуализироваться не полностью.
Рак поджелудочной железы обычно вызывает обструктивную дилата-
цию панкреатической и билиарной систем. Опухоли, возникшие не из под-
желудочной железы, но прорастающие ее, такие как лимфома, не имеют ха-
рактерных признаков отличия от первичных новообразований поджелудоч-
ной железы, что увеличивает важность цитологических данных. Кистозные
опухоли выглядят многокомпонентными. Они могут определяться как изо-
лированные скопления множества мелких кист, окруженных опухолью, или
как крупная единичная киста с неравномерно утолщенной стенкой, окру-
женная гетерогенной опухолевой тканью.
412
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ДАТЧИК
ПОДЖЕЛУДОЧНАЯ
ЖЕЛЕЗА
ПЕЧЕНЬ
ВОРОТНАЯ
ВЕНА-
ВЕРХНЯЯ
БРЫЖЕЕЧНАЯ
ВЕНА
ВЕРХНЯЯ
БРЫЖЕЕЧНАЯ
АРТЕРИЯ
ПАНКРЕАТИЧЕСКИЙ
ПРОТОК
ВЕНТРАЛЬНАЯ
ЧАСТЬ
ПОДЖЕЛУДОЧНОЙ
ЖЕЛЕЗЫ
Рис. 12.6. Вентральная часть поджелудочной железы может быть слегка гипоэхогенна
по сравнению с крючковидным отростком, который может ошибочно расцениваться
как опухоль.
Муцинозная дуктальная эктазия — редко встречающееся предраковое
состояние, которое может проявляться полиповидными образованиями в
просвете расширенного протока. ЭУЗИ выполняется для оценки как внут-
ри-, так и внепротокового распространения опухоли.
Эндосонография наиболее полезна в тех случаях, когда КТ не в состоя-
нии выявить опухолевидное образование. ЭУЗИ обладает 100%-ной точно-
стью в выявлении опухолей размером менее 3 см, значительно превосходя в
этом КТ (53%) и эндоскопическую ретроградную холангиопанкреатогра-
ОЦЕНКА ОПУХОЛЕВИДНЫХ ОБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
413
Рис. 12.7. А, Б. Опухоль головки поджелудочной железы размером 2,5 х 3,7 см;
промежуток между образованием и стенкой воротной вены отсутствует, что
свидетельствует о прорастании стенки сосуда и нерезектабельности образования.
фию (ЭРХПГ; 85%) [14]. Следовательно, ЭУЗИ полезно для визуализации
поджелудочной железы в тех случаях, когда ЭРХПГ оказывается неинфор-
мативной и для оценки стриктуры протока (в сочетании с биопсией для иск-
лючения малигнизации), отмечаемой при ЭРХПГ. Если опухолевый про-
цесс сопровождается стриктурой, только выполнение ЭУЗИ может помочь в
проведении биопсии и определении резектабельности.
414
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Рис. 12.7. (Продолжение.)
ОЦЕНКА ОПУХОЛЕВИДНЫХ ОБРАЗОВАНИЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ 415
Местное иодирование рака поджелудочной железы
В системе TMN стадия рака поджелудочной железы определяется по размеру
опухоли, лимфатическим узлам и отдаленному метастазированию следую-
щим образом [17]:
Т1 — опухоль, не выходящая за пределы поджелудочной железы, разме-
ром менее 2 см;
Т2 — опухоль, не выходящая за пределы поджелудочной железы, разме-
ром более 2 см;
ТЗ — опухоль, прорастающая в двенадцатиперстную кишку и обший
желчный проток;
Т4 - опухоль, распространяющаяся на перипанкреатические сосуды (не
селезеночные), желудок, селезенку или ободочную кишку.
Наиболее важным критерием для оценки резектабельности при любом
методе визуализации является распространение опухоли на крупные пери-
панкреатические сосуды. К таким сосудам относятся вены портальной сис-
темы (воротная вена, место впадения верхней брыжеечной вены, селезеноч-
ная вена), а также ветви чревного ствола — общая печеночная и селезеноч-
ная артерии.
В настоящее время клиницисты выделяют три достоверных критерия
опухолевой инвазии в сосуды, определяемых при ЭУЗИ [18]: а) опухоль в
просвете сосуда; б) нарушение контура сосуда с исчезновением гиперэхо-
генной полоски, отделяющей его от паренхимы, и в) венозные коллатерали
в области образования, нарушающего нормальное местоположение слияния
основных вен портальной системы.
Оценка артерий при ЭУЗИ, как и при КТ, основана на определении
взаимоотношений сосуда и опухоли. Проникновение опухоли в просвет со-
суда встречается редко. ЭУЗИ при исследовании артерий является менее на-
дежным методом, чем при исследовании вен портальной системы. Ошибка в
определении стадии заболевания при ЭУЗИ может достигать 8%, поэтому в
некоторых клинических ситуациях полезно использование нескольких ме-
тодов исследования [19].
В исследовании, основанном на результатах наблюдения 40 больных
раком поджелудочной железы и ампулярного отдела ОЖП, точность ЭУЗИ
в определении изменений в портальных венах составила 95%, в то время как
точность ангиографии и КТ оказалась равной 85% и 73% соответственно [16].
При ЭУЗИ могут быть выявлены метастазы в перипанкреатические лим-
фатические узлы, при этом имеют значение как их размеры (более 5 мм в диа-
метре), так и эхоструктурные особенности. Малигнизированные лимфатиче-
ские узлы выглядят гипоэхогенными, округлыми и хорошо визуализируются.
ЭУЗИ позволяет с высокой точностью определить глубину опухолевой инва-
зии (Т-стадия) и наличие изменения лимфатических узлов (N-стадия).
416
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Таблица 12.2. Сравнение возможностей ЭУЗИ и спиральной КТ
в стадировании рака поджелудочной железы
Спиральная КТ ЭУЗИ
Чувствительность (резектабельность) 31% 77%
С пецифичность (резектабельность) 100% 91%
ИПР (резектабельность) 100% 94%
Точность (Т-стадия) 63% 89%
Пояснения: данные о возможностях ЭУЗИ и спиральной КТ в определении резектабель-
ностн при раке головки поджелудочной железы получены в проспективном исследовании
в Мичиганском университете. ИПР—истинно положительные результаты в определении
резектабельности опухоли.
Определение причины увеличения — воспаления или неопластического
процесса — является очень важным, и если от этого зависит план лечения,
необходимо выполнить аспирационную биопсию. Однако потребность в та-
кой биопсии возникает редко, так как при раке поджелудочной железы пер-
востепенное значение имеют сосудистая инвазия и резектабельность.
При определении Т- (распространенность опухоли) и N- (поражение
лимфатических узлов) стадий панкреатогенного рака ЭУЗИ обладает точно-
стью более 90% [14, 16]. Окончательно не решено, смогут ли такие техниче-
ские новшества, как спиральная КТ, превзойти возможности ЭУЗИ. Было
проведено ретроспективное сравнение возможностей спиральной КТ и ЭУЗИ
при установлении стадии рака ампулы протока поджелудочной железы [20].
На основании анализа данных 42 больных показано, что во всех случаях ре-
зультаты визуальных методов исследования подтверждаются хирургически-
ми данными. Авторы установили, что спиральная КТ высокоспецифична, но
малочувствительна в определении сосудистой инвазии небольших ипанкре-
атических опухолей (табл. 12.2). ЭУЗИ было более чувствительным, чем
спиральная КТ, в выявлении прорастания в сосуды и более точным в опре-
делении Т-стадии заболевания.
Высокая специфичность спиральной КТ предполагает, что в случаях
выявления сосудистой инвазии с помощью этого метода исследования нет
необходимости в проведении других диагностических процедур (включая
ЭУЗИ) для определения стадии заболевания. Однако ЭУЗИ — более точный
метод, чем спиральная КТ, и позволяет уменьшить число ненужных хирур-
гических вмешательств. Поэтому для определения нерезектабельной опухо-
ли с перипанкреатическим ростом мы рекомендуем использование ЭУЗИ
без выполнения КТ.
ПАНКРЕАТОГЕННЫЕ ЭНДОКРИННЫЕ ОПУХОЛИ
417
В исследовании со схожими целями, включающем больных с опухоля-
ми билиарной системы, ЭУЗИ показало значительное превосходство в точ-
ности определения Т-стадии и сосудистой инвазии опухоли [21]. Может ли
МРТ вытеснить ЭУЗИ в стадировании рака поджелудочной железы, остает-
ся неясным. Прямые сравнения показали, что ЭУЗИ более точный метод, но
продолжают появляться различные усовершенствования МРТ, включая ан-
гиографию [22, 23].
Тонкоигольная аспирационная биопсия опухолевидных образований
поджелудочной железы
Применение эндосонографии для целенаправленного получения клеточного
материала из поджелудочной железы под контролем ультразвукового эндо-
скопа является безопасным и эффективным способом идентификации опухо-
левидных образований этого органа и получения диагностической информа-
ции для планирования предоперационного лечения. Игла длиной 10 см и диа-
метром 23 G проводится через биопсийный канал эндоскопа Pentax (рис. 12.8).
Процедура обычно выполняется после оценки стадии опухоли с использова-
нием радиально сканирующего датчика. Несмотря на то, что радиальное ска-
нирование требуется не во всех случаях, большинство лечебных учреждений
использует оба инструмента, поскольку многие врачи обладают большим
опытом проведения исследований радиальным датчиком. Данные ретроспек-
тивных сравнений показывают, что точность стадирования у опытных эндо-
сонографистов одинакова. Цитопатологическое исследование аспирата, про-
водимое во время эндосонографии, позволяет повысить точность метода.
Точность тонкоигольной аспирационной биопсии под контролем ЭУЗИ в реаль-
ном времени составляет 80-95%; частота осложнений менее чем 1% [24,25].
ПАНКРЕАТОГЕННЫЕ ЭНДОКРИННЫЕ ОПУХОЛИ
Нейроэндокринные опухоли поджелудочной железы диагностируются на
основе клинических признаков, связанных с патологической гормональной
секрецией. Вероятность малигнизации таких опухолей различна. На основа-
нии долгосрочных наблюдений установлено, что она составляет 5-10% для
инсулом и 50-90% для других опухолей.
Гастриномы
Гастриномы диагностируются по повышению уровня гастрина в плазме кро-
ви и положительному тесту стимуляции секретином. Для исключения синд-
рома множественных эндокринных неоплазий 1 типа (МЭН-1) требуется
определение уровня кальция в сыворотке крови. Приблизительно 60% гаст-
рином — злокачественные, а у 50% больных обнаруживается отдаленное мета-
стазирование. В типичных случаях (80-89%) они располагаются в «треугольни-
27 Ультразвуковая диагностика ...
418
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Рис. 12.8. А. Положение эндоскопа Pentax. Б. Тонкоигольная аспирационная биопсия
головки поджелудочной железы под контролем ЭУЗИ.
ПАНКРЕАТОГЕННЫЕ ЭНДОКРИННЫЕ ОПУХОЛИ
419
ке гастриомы» — области, ограниченной слиянием пузырного и общего
желчного протоков, соединением шейки и тела поджелудочной железы и
дистальным отделом двенадцатиперстной кишки [26]. Хирургическое лече-
ние возможно почти у 60% пациентов, поэтому предоперационная топиче-
ская диагностика имеет большое значение.
Инсуломы
Инсуломы диагностируются по повышению уровня инсулина и С-пептида
инсулина в плазме крови на фоне повторяющихся приступов гипогликемии.
Приблизительно в 10% случаев образование инсулом обусловлено МЭН-1 син-
дромом. Почти 90% инсулом имеют диаметр меньше 2 см; в 86% случаев эти
опухоли являются единичными и доброкачественными; и более чем в 40%
случаев размер опухоли менее 1 см, что затрудняет дооперапионную диагно-
стику. Почти все инсуломы находятся внутри поджелудочной железы или
прилежат к ней (опухоли на ножке).
При визуализации важно определить расположение первичной опухоли и
исключить ее матастатическое распространение, при котором хирургическое
вмешательство противопоказано. Определение локализации опухоли тради-
ционными методами исследования, такими как ультрасонография, КТ, МРТ и
ангиография, оказывается неудачным в 40-60% случаев [27]. При выявлении
метастазов в печень МРТ может быть более чувствительной, чем КТ [28].
ЭУЗИ показало себя идеальным методом в локализации этих неболь-
ших опухолей вследствие своей способности обеспечивать получение изоб-
ражений поджелудочной железы и окружающих структур ее с высоким раз-
решением. При ЭУЗИ инсуломы обычно выглядят как гомогенные, или ги-
поэхогенные, хорошо отграниченные образования, расположенные в подже-
лудочной железе (рис. 12.9). Могут также выявляться кистозные образова-
ния. Когда образование прилежит к стене кишки, в его идентификации по-
могает использование высокочастотного датчика (12 МГц). Для точной ло-
кализации образования внутри железы исследуйте его взаимоотношения с
крупными сосудами и протоком.
Дифференциация между лимфатическими узлами и опухолями бывает
затруднена, а инсуломы, расположенные на ножке, не всегда визуализируют-
ся. Ценность применения ЭУЗИ увеличивается при близком профессиональ-
ном сотрудничестве эндокринного хирурга и эндосонографиста.
В университете г. Мичиган существует практика изображения схем, на
которых отражаются результаты исследования. Эти наброски позволяют эн-
досонографисту оценивать совпадение до- и интраоперационных данных.
Локализация опухоли
В 1992 г. были опубликованы внушительные результаты мультицентрическо-
го исследования локализации опухолей поджелудочной железы при ЭУЗИ, ох-
420
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
ПАНКРЕАТИЧЕСКИЙ
ПРОТОК
Рис. 12.9. Вид инсуломы в поджелудочной железе при ЭУЗИ.
ватившего 37 пациентов с образованиями, не выявленными при транабдоми-
нальном УЗИ или КТ [29]. Применяя ЭУЗИ, авторы локализовали 82% панк-
реатогенных опухолей, что значительно превосходит возможности
ангиографии. В нашем учреждении ЭУЗИ быстро заменило селективную ве-
нографию в качестве первоначального диагностического средства локализа-
ции панкреатогенных нейроэндокринных опухолей. ЭУЗИ было использовано
более чем у 60 пациентов с клиническими проявлениями нейроэндокринных
новообразований. В недавнем обзоре приведены данные о результатах хи-
рургических вмешательств у 44 пациентов (табл. 12.3) [30]. В целом чувстви-
тельность ЭУЗИ в локализации панкреатогенных нейроэндокринных опухо-
лей составила 83%, точность — 89%. Чувствительность ЭУЗИ для идентифика-
ПАНКРЕАТОГЕННЫЕ ЭНДОКРИННЫЕ ОПУХОЛИ
421
Таблица 12.3. Локализация панкреатогенных нейроэндокринных
опухолей: опыт Мичиганского университета
Дооперационное ЭУЗИ/ Хирургические данные
Положительные хирургические данные Отрицательные хирургические данные
Положительные данные ЭУЗИ 24 (16 И, 8 Г, 1 Гл) 0
Отрицательные данные ЭУЗИ 5 (5 И. 0 Г) 15 (14 Г, 11)
Всего (п = 44) Гастриома (п = 21) Инсулома (п = 22)
Чувствительность 83% 100% 76%
Специфичность 100% 100% 100%
Ценность положительного прогноза 100% 100% 100%
Ценность отрицательного прогноза 76% 100% 17%
Точность 89% 100% 77%
Обозначения: Результаты ЭУЗИ при панкреатогенных нейроэндокринных опухолях по
данным Мичиганского университета. И = инсулома, Г = гастринома, Гл=глюкагонома.
ции гастриномы поджелудочной железы оказалась выше, чем для инсуломы. В
наших исследованиях отрицательные результаты ЭУЗИ у пациентов с гаст-
риномой являлись показанием к хирургическому вмешательству и позволяли
предполагать экстрапанкреатическое расположение опухолей (прежде всего
в стенке двенадцатиперстной кишки). Поскольку большинство инсулом рас-
положено в поджелудочной железе, низкая ценность отрицательного прогно-
за ЭУЗИ указывает на то, что, если при ультрасонографии не удается иденти-
фицировать опухоль, ее наличие в железе все-таки не исключено. В течение
этого исследования ни одна из инсулом не осталась незамеченной при ЭУЗИ.
Снижение стоимости лечения
В контролируемом исследовании группой специалистов нашего учреждения
было установлено, что при использовании ЭУЗИ в качестве первоначального
метода локализации финансовые затраты снижаются. В общей сложности
были изучены данные 56 пациентов с биохимическими проявлениями нейро-
эндокринных опухолей. Применение ЭУЗИ для первоначальной диагности-
ческой оценки устранило необходимость в выполнении дооперационной ан-
гиографии и селективной венографии почти во всех случаях. Такой подход
422
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
также позволил уменьшить число дооперационных процедур и существенно
уменьшить расходы. В группе больных, которым было выполнено ЭУЗИ,
время операции и анестезии, а также продолжительность пребывания в кини-
ке после операции были меньшими.
В применяемой нами диагностической последовательности ангиогра-
фия сосудов поджелудочной железы и определение уровня гормонов прово-
дились только при отрицательных данных ЭУЗИ. Расходы на одного паци-
ента (в 1991 году) при предоперационной локализации опухолей по данным
ЭУЗИ составили 2620$, в группе пациентов без использования ЭУЗИ —
4846$ (экономия — 2226$ на каждого пациента). Фактически снижение за-
трат было даже больше, поскольку определение уровня гормонов не потре-
бовалось, а сроки госпитализации сократились.
Сокращение числа инвазивных процедур
При использовании ЭУЗИ в качестве первичного метода визуализации необ-
ходимо меньшее количество инвазивных процедур. Частота выполнения ан-
гиографии уменьшилась с 30 до 10, исследования уровня гормонов в венах
печени — с 29 до 7. Существенно снизилось число случаев длительного до-
операционного пребывания в стационаре — с 28 до 1. Ожидалось, что точная
доопсрационная локализация должна помочь xnpypiy в проведении более
эффективного исследования перипанкреатитической зоны и способствовать
снижению тяжести течения послеоперационного периода. Действительно,
при выполнении ЭУЗИ отмечалась тенденция к сокращению продолжитель-
ности хирургического вмешательства и сроков госпитализации [31].
После локализации опухоли
Наши данные поддерживают концепцию, согласно которой у пациентов со
спорадической инсуломой первоочередным исследованием должно являться
ЭУЗИ Кроме того, если опухоль локализована, хирургу следует приступить
непосредственно к ее удалению без проведения дополнительных исследова-
ний. При гастриноме необходим другой подход. Случаи первичной дуоденаль-
ной гастриномы составляют 50 и более процентов, а случаи первичной панк-
реатической гастриномы с метастазами в печень на момент ее выявления —
30 -50%. ЭУЗИ играет важную роль в локализации панкреатической гастри-
номы, поскольку его чувствительность в выявлении этих первичных опухо-
лей составляет 100%. Отрицательные результаты ЭУЗИ поджелудочной же-
лезы надежно предсказывают наличие экстрапанкреатической гастриномы,
неизменно расположенной в двенадцатиперстной кишке. У таких пациентов
должна выполняться дуоденотомия.
У пациентов с гастриномой и синдромом МЭН-1 ЭУЗИ используется
для выявления образований в головке поджелудочной железы, которые мо-
гут быть подвергнуты энуклеации при выполнении дистальной панкреато-
ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
423
томии. У этих пациентов также требуется выполнение дуоденотомии для
обнаружения микрогастрином, проявляющихся в 70-90% случаев МЭН-1
синдромом Золлингера-Эллисона.
Сцинтиграфия соматостатиновых рецепторов
Возможности ЭУЗИ в выявлении дуоденальных гастрином и метастазов пе-
чени ограничены. Это противоречит диагностической концепции, согласно
которой метод, используемый для первичной визуализации, должен быть
наиболее чувствительным в выявлении такого грозного проявления болезни,
как метастазы в печени. Могут использоваться КТ или МРТ, однако ни один
из этих методов не обладает должной чувствительностью. Были продемонст-
рированы многообещающие возможности сцинтиграфии соматостатиновых
рецепторов (ССР) в выявлении экстрапанкреатических гастрином и метаста-
зов печени. Сообщалось, что чувствительность ССР при локализации опухо-
лей составила 70% и 92% — при выявлении метастазов печени. [32]. У боль-
ных с гастриномой авторы рекомендуют вначале проводить ССР, а затем, для
определения размеров опухоли, выполнять МРТ. Эти данные наводят на
мысль о пользе применения ССР в качестве первоначальной оценки пациен-
тов с гастриномой, с последующим проведением ЭУЗИ для визуализации
поджелудочной железы. После этого, в необходимом объеме, выполняется
хирургическое вмешательство. Ангиографические методы остаются допол-
нительными, подтверждающими исследованиями. Для оценки такой тактики
необходимы дальнейшие проспективные исследования.
Опыт нашего учреждения показывает высокую точность ЭУЗИ в лока-
лизации панкреатогенных нейроэндокринных опухолей и рентабельность
этой методики при ее использовании в первоначальной дооперационной
оценке. Обладая равными возможностями с другими методами, ЭУЗИ сни-
зило потребность в проведении дополнительных инвазивных исследований
и позволило уменьшить связанные с ними осложнения и использование ма-
териально-технических ресурсов. Поэтому ЭУЗИ должно играть основную
роль в дооперационной локализации панкреатогенных нейроэндокринных
опухолей.
ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
Гистологическое исследование остается «золотым» стандартом в диагности-
ке хронического панкреатита. Отсутствие гистологических данных в боль-
шинстве случаев затрудняет дифференциальную диагностику этого заболе-
вания. В настоящее время для выявления хронического панкреатита наибо-
лее чувствительным методом является эндоскопическая ретроградная
холангиопанкреатография. Возможности ЭУЗИ используются для оценки
выраженности заболевания.
424
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Наблюдения
Наиболее часто клиницисты встречаются со следующими проявлениями
заболевания:
Паренхиматозные изменения, проявляющиеся гетерогенностью эхострук-
туры с пестрым или пятнистым рисунком.
Кальцификация тканей железы, которая приводит к появлению эхоген-
ных фокусов, нрспят ствующих визуализации.
Внутрипротоковые конкременты.
Изменения протока, включающие его расширение, извитой ход, повы-
шение эхогенности стенки.
Анэхогенные или гипоэхогенные кисты.
При тщательном исследовании может быть обнаружено расширение вет-
вей основного протока.
Стриктуры и расширения сегментов вирсунгова протока.
Кисты, которые выглядят как анэхогенные структуры округлой формы.
(Кисты с эхогенным содержимым или неравномерно утолщенной
стенкой могут являться кистозными опухолями, должна быть вы-
полнена аспирационная биопсия для получения цитологического
материала и определен уровень опухолевых маркеров.)
Раннее выявление хронического панкреатита
Раннее выявление хронического панкреатита требует значительных уси-
лий. В начальных стадиях заболевания могут происходить только измене-
ния в паренхиме, без каких-либо изменений протоков, поэтому данные
ЭРХПГ будут нормальными. В ретроспективном сравнительном исследо-
вании пациентов с хронической болью в животе, которая, скорее всего,
была связана с поджелудочной железой, в 69 случаях была выполнена
ЭРХПГ [33]. У 16 пациентов после стимуляции секретином была измерена
концентрация бикарбоната в панкреатическом секрете. Авторы сравнили
точность ЭУЗИ с данными ЭРХПГ и установили, что чувствительность
ЭУЗИ и ЭРХПГ составила 86 и 50% соответственно. Были определены
ЭУЗ-признаки, характерные для хронического панкреатита. Для ранней
диагностики хронического панкреатита сочетание ЭУЗИ и ЭРХПГ было
более эффективным, чем выполнение только одного из этих методов ис-
следования.
В ретроспективном сравнительном исследовании возможностей ЭУЗИ
и ЭРХПГ у пациентов с подозреваемым хроническим панкреатитом данные
ЭУЗИ оказывались положительными в тех случаях, когда данные ЭРХПГ не
выявляли никаких изменений [34]. Поэтому у пациентов с начальными ста-
ХРОНИЧЕСКИЙ ПАНКРЕАТИТ
425
днями хронического панкреатита ЭУЗИ может оказаться более чувствитель-
ным методом, чем ЭРХПГ, которая в настоящее время является «золотым»
стандартом в выявлении данного заболевания [35].
ЭУЗИ наиболее приемлемо при выявлении хронического панкреатита
на фоне неизмененных данных ЭРХПГ, описании стриктуры, обнаруженной
на ЭРХПГ, а также в тех случаях, когда выполнение ЭРХПГ невозможно.
При ЭУЗИ могут выявляться внутрипротоковые конкременты, являющиеся
причиной окклюзии протока, однако дифференцирование очагового панкре-
атита от малигнизированных образований остается затрудненным. Несмот-
ря на то, что в решении этого вопроса помогает выполнение тонкоигольной
аспирационной биопсии под контролем ЭУЗИ, невысокая отрицательная
прогностическая ценность этого метода служит источником остающегося
беспокойства, и в сомнительных случаях может потребоваться эксплоратив-
ное хирургическое вмешательство [36].
Псевдокисты
ЭУЗИ обычно выполняется до эндоскопического дренирования псевдокист.
Перед выполнением эндоскопической цистогастростомии или цистодуоде-
ностомии ЭУЗИ позволяет оценить расстояние между кистой и кишечной
стенкой и исключить наличие крупных сосудов. Использование ЭУЗИ в та-
кой ситуации оказалось полезным для выбора оптимального эндоскопиче-
ского доступа [37].
Холедохолитиаз
ЭУЗИ является альтернативой ЭРХПГ в диагностическом поиске у пациен-
тов при подозрении на заболевание внепеченочных желчных протоков, в том
числе и при холедохолитиазе (рис. 12.10). Принимая во внимание потенциаль-
ные осложнения ЭРХПГ, особенно панкреатит и холангит, оценка заболева-
ния внепеченочных желчных протоков может быть выполнена при менее ин-
вазивном ЭУЗИ.
Чувствительность ЭУЗИ выше, чем у ЭРХПГ, и сонография может ис-
пользоваться при низкой вероятности холедохолитиаза, когда лечебные ме-
роприятия вряд ли понадобятся. По некоторым данным [38, 39], при выпол-
нении ЭУЗИ очень опытным эндосонографистом чувствительность метода
в обнаружении холедохолитиаза превышала 90%. Кроме этого, использова-
ние ЭУЗИ у пациентов с заболеваниями внепеченочных желчных путей мо-
жет оказаться более рентабельным, чем выполнение ЭРХПГ и лечение свя-
занных с этим исследованием осложнений [40].
426
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Рис. 12.10. ЭУЗИ при конкременте в общем желчном протоке.
РЕЗЮМЕ
ЭУЗИ обеспечивает получение высококачественных изображений поджелу-
дочной железы и перипанкреатических структур. Информация, полученная
опытным эндосонограф истом, способствует выявлению панкреатических
образований и помогает в оценке резектабельности опухоли. ЭУЗИ повыша-
ет точность хирургического планирования и является важным компонентом
междисциплинарной диагностики и лечения пациентов с заболеваниями под-
желудочной железы и билиарного тракта.
ссылки
427
ССЫЛКИ
1. Faigel DO, Ginsberg GG, Bentz JS. Pancreatic cancer: diagnosis and sta-
ging at one sitting. J Clin Oncol 1997;15:1439-1443.
2. Giovannini M, Seitz JF. Endoscopic ultrasonography with a linear-type ec-
hoendoscope in the evaluation of 94 patients with pancreaticobiliary disea-
se. Endoscopy 1994;26:579-585.
3. Catalano MR Normal structures on endoscopic ultrasonography: visualiza-
tion measurement data and interobserver variation. Gastrointest Endosc
Clin North Am 1995;5:475-486.
4. Zaidi S, Gress F, Sherman S. Different echo characteristics of the ventral
and dorsal pancreas in patients with chronic abdominal pain. Gastrointest
Endosc 1994;40:71-74.
5. Parker SL, Tong T, Bolden S, Wingo PA. Cancer statistics, 1996. CA Can-
cer J Clin 1996;65:5-27.
6. Yeo CJ, Cameron JL, Lillemoe KD. Pancreaticoduodenectomy for cancer of
the head of the pancreas: 201 patients. Ann Surg 1995;221:721-733.
7. Ettinghausen SE, Schwartzentruber DJ, Sindelar WF. Evolving strategies
for the treatment of adenocarcinoma of the pancreas. J Clin Gastroenterol
1995;21:48-60.
8. Smith AC, Dowsett JF, Russell RCG. Randomised trial of endoscopic sten-
ting versus surgical bypass in malignant low bile duct obstruction. Lancet
1994;344:1655-1660.
9. Shepherd HA, Royle G, Ross APR. Endoscopic biliary endoprosthesis in
the palliation of malignant obstruction of the distal common bile duct: a ran-
domized trial. Br J Surg 1988;75:1166-1168.
10. Warshaw AL, Gu Z, Wittenberg J, Waltman AC. Preoperative staging and as-
sessment of resectability of pancreatic cancer. Arch Surg 1990;125:230-233.
11. Castillo CF, Rattner DW, Warshaw AL. Further experience with laparosco-
py and peritoneal cytology in the staging of pancreatic cancer. Br J Surg
1995;82:1127-1129.
12. Murugiah M, Windsor JA, Redhead DN. The role of selective visceral angi-
ography in the management of pancreatic and periampullary cancer. World
J Surg 1993;17:796-800.
13. Palazzo L, Roseau G, Gayet B, Vilgrain V. Endoscopic ultrasound criteria
of vascular invasion by potentially resectable pancreatic tumors. Gastroin-
test Endosc 1994;40: 326-333.
14. Rosch T, Classen. Gastroenterologic endosonography. New York: Thieme,
Stuttgart, 1992.
15. Tio TL, Hoei Sie L, Kallimanis G. Staging of ampullary and pancreatic car-
cinoma: comparison between endosonography and surgery. Gastrointest
Endosc 1996;44:706-713.
428
12. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
16. Faigel DO, Kochman ML: The role of endoscopic ultrasound in the preope-
rative staging of pancreatic malignancies. Gastrointest Endosc 1996;43:
626-628.
17. Fleming ID, Cooper JS, Hesson DE, et al. The American Joint Commission
on Cancer. ACCC Cancer Staging Manual. 5th ed. Philadelphia: Lippin-
cott-Raven, 1997.
18. Snady H, Bruckner H, Siegel J, et al. Endoscopic ultrasound criteria of vas-
cular invasion by potentially resectable pancreatic tumors. Gastrointest En-
dosc 1994;40:326-333.
19. Brugge WR, Lee MJ, Kelsey PB, et al. The use of EUS to diagnose malig-
nant portal venous system invasion by pancreatic cancer. Gastrointest En-
dosc 1996;43:561 567.
20. Teimey EM, Carpenter SL, Bansal R, Eckhauser. Accuracy and economic
impact of helical CT and EUS in the local staging of ampullopancreatic tu-
mors. Gastrointest Endosc 1997;45:AB183.
21. Gress F, Ciaccia D. Endoscopic ultrasound versus spiral computed tomog-
raphy for staging pancreatic, biliary and ampullary tumors: a prospective
comparison. Gastroeintest Endosc 1997;45:AB173.
22. Muller MF, Meyenberger C, Bertschinger P, et al. Pancreatic tumors: evalu-
ation with endoscopic US, CT, and MR imaging. Radiology 1994; 190:
745-751.
23. Trede M, Rumstadt B, Wendl K. Ultrafast magnetic resonance imaging im-
proves the staging of pancreatic tumors. Ann Surg 1997;226:393/407.
24. Wiersema MJ, Vilmann P, Giovannini M, et al. Endosonography-guided fi-
ne-needle aspiration biopsy: diagnostic accuracy and complication asses-
sment. Gastroenterology 1997;112:1087-1095.
25. Chang KJ, Nguyen P, Erickson RA, et al. The clinical utility of endoscopic
ultrasound-guided fine-needle aspiration in the diagnosis and staging of
pancreatic carcinoma. Gastrointest Endosc 1997;45:387-393.
26. Jensen RT, Norton JA. Endocrine neoplasms of the pancreas. In: Yamada T,
ed., Textbook of gastroenterology. 2nd ed. Philadelphia: Lippincott, 1995:
2131-2160
27. Pasieka JL, McLeod MK, Thompson NW, Burney RE. Surgical approach to
insulinomas: assessing the need for preoperative localization. Arch Surg
1992;127:442-147.
28. Pisegna JR, Doppman DL, Norton JA, et al. Prospective comparative study
of ability of MR imaging and other imaging modalities to localize tumors in
patients with Zollinger-Ellison syndrome. Dig Dis Sci 1993;38:1318 1 128.
29. Rosch T, Lightdale CJ, Botet JF. Localization of pancreatic endocrine tu-
mors by endoscopic ultrasonography. N Engl J Med 1992;326:1721- 1726.
30. Carpenter SL, Bansal R, Nostrant TT. Accuracy of endoscopic ultrasound in pan-
creatic neuroendocrine tumor localization. Gastroenterology 1996;110:A38L
ссылки
429
31. Bansal R, Tierney W, Carpenter S, et al. Cost-effectiveness of endoscopic
ultrasound for preoperative localization of pancreatic neuroendocrine tu-
mors. Gastrointest Endosc 1999;49:19-25.
32. Gibril F, Reynolds JC, Doppman JL. Somatostatin receptor scintigraphy: its
sensitivity compared to that of other imaging methods in detecting primary
and metastatic gastrinomas. Ann Intern Med 1996;125:26-34.
33. Wiersetna MJ, Hawes RH, Lehman GA, et al. Prospective evaluation of en-
doscopic ultrasonography and endoscopic retrograde cholangiopancreatog-
raphy in patients with chronic abdominal pain of suspected pancreatic
origin. Endoscopy 1993;25:555-564.
34. Nattermann C, Goldschmidt AJW, Dancygier H. Endosonography in chro-
nic pancreatitis-a comparison between endoscopic retrograde pancreatog-
raphy and endoscopic ultrasonography. Endoscopy 1993;25:565-570.
35. Buscail J, Escourrou J, Moreau J. Endoscopic ultrasonography in chronic
pancreatitis: a comparative prospective study with conventional ultrasonog-
raphy, computed tomography, and ERCP. Pancreas 1995;10:251-257.
36. Barthet M, Portal I, Boujaoude J, et al. Endoscopic ultrasonographic diagno-
sis of pancreatic cancer complicating chronic pancreatitis. Endoscopy 1996;
28:487^191.
37. Fockens P, Johnson TG, Hendrik M. Endosonographic imaging of pancrea-
tic pseudocysts before endoscopic transmural drainage. Gastrointest Endosc
1997;46:412-26.
38. Prat F, Amouyal G, Pelletier G. Prospective controlled study of endoscopic
ultrasonography and endoscopic retrograde cholangiography in patients
with suspected common bile duct lithiasis. Lancet 1996;347:75 79.
39. Amouyal P, Amouyal G, Levy P, Tuzet S. Diagnosis of choledocholithiasis
by endoscopic ultrasonography. Gastroenterology 1994;106:1062-1067.
40. Erickson RA, Chang KJ: ERCP, EUS + ERCP or MRCP + ERCP prior to la-
paroscopic Cholecystectomy: A Cost-Benefit Analysis. Gastroenterology
1995;103:A13.
ЭНДОСКОПИЧЕСКАЯ
УЛЬТРАСОНОГРАФИЯ
ПРЯМОЙ КИШКИ
13
Трейси Д. Арнелл и Майкл Дж. Стеймос
Использование эндоректального ультразвукого исследования (ЭРУЗИ) при
заболеваниях предстательной железы хорошо известно. Большинство уроло-
гов успешно применяет это исследование на амбулаторном приеме [1, 2]. В
последние годы ЭРУЗИ используется для диагностики колоректальных забо-
леваний. С совершенствованием знаний ультразвуковой анатомии аноректаль-
ной области и ее особенностей, применение ЭРУЗИ расширилось: от выявле-
ния рака прямой кишки до использования как при злокачественных, так и при
доброкачественных колоректальных заболеваниях, таких как гнойный па-
рапроктит, свищи, недержание кала.
ТЕХНИКА ИССЛЕДОВАНИЯ
Для исследования аноректального канала наиболее часто используется дат-
чик с частотой 7 МГц, который обеспечивает фокусную зону протяженно-
стью 2—4 см с разрешением в 1 мм. Кроме этого, имеются датчики с частотой
5 и 10 МГц с фокусной зоной протяженностью 1—4 см. В отличие от датчиков
с более низкой частотой, датчик с частотой 10 МГц позволяет лучше визуали-
зировать слои стенки прямой кишки [2-5]. Датчик с частотой 5 МГц из-за бо-
лее протяженной фокусной зоны может облегчить выявление анатомических
особенностей параректальной области, например анальных сфинктеров, пу-
боректальной мышцы, седалищно-прямокишечной ямки и параректальных
лимфатических узлов [6].
В настоящее время вниманию специалистов представлено оборудова-
ние двух типов. Первый — это секторный датчик, обеспечивающий клино-
видную зону осмотра в 100°, с некруговым изображением аноректального
канала. Чтобы осмотреть канал полностью, необходимо получить серию по-
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
ТЕХНИКА ИССЛЕДОВАНИЯ
431
Рис. 13.1. А. Эндоректальный секторный датчик Accoson. Б. Эндоректальный
радиальный датчик В&К.
следовательных изображений (рис. 13.1 А). Второй тип оборудования — ра-
диальный датчик, создающий изображение с обзором 360°, что обеспечива-
ет одновременную визуализацию всей окружности канала (рис. 13.1 Б). При
позиционировании в канале этот датчик часто приводит к получению асим-
метричного изображения стенки кишки. Если датчик расположен в канале
эксцентрично, фрагмент стенки, к которой он прилежит, отображается с хо-
рошим разрешением, а изображение противоположного участка стенки по-
лучается некачественным.
Для получения обзорных изображений радиальный ультразвуковой дат-
чик может использоваться также с гибким эндоскопом. Гибкий эндоскоп де-
лает возможным УЗИ других отделов ободочной кишки, недоступных жест-
кому инструменту. В анальном канале с помощью радиального датчика
можно получить превосходные изображения сфинктеров и выявить любые
нарушения их целостности. В руках квалифицированного специалиста оба
датчика обеспечивают получение удовлетворительных изображений. Поэто-
432
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
му выбор того или иного датчика зависит от мастерства и предпочтений ис-
следователя. Каждый из широкораспространенных датчиков менее 2 см в
диаметре, и пациенты хорошо переносят исследование.
Перед началом исследования пациенту следует очистить кишечник с
помощью клизмы. Разместите заполненный водой баллон поверх датчика и
удалите весь воздух (дегазация), чтобы предотвратить отражения, иногда
вызываемые пузырьками воздуха и приводящие к возникновению артефак-
тов. Баллон растягивает стенку прямой кишки и сглаживает складки слизи-
стой, благодаря чему слои приобретаю! привычный циркулярный вид. За-
тем наденьте на датчик презерватив, заполненный ультразвуковым гелем.
Поскольку диаметр анального канала небольшой, чтобы минимизировать
дискомфорт у пациента и избежать искажения анатомии, используйте твер-
дый наконечник минимального диаметра без баллона.
Пациент помещается в положение для литотомии, животом вниз с опо-
рой на колени или в боковое положение Симса (лежачее положение). Вы-
полните пальцевое ректальное исследование, затем введите датчик выше
области интереса (обычно на 15 см выше ануса). Это действие выполняется
вслепую; но при необходимости может быть выполнено под проктоскопиче-
ским контролем. В любом случае изображения получают, медленно извле-
кая датчик с интервалами в 1 см.
Если используется радиальный датчик, качество изображения изменя-
ется в зависимости от расположения в канале. Для улучшения получаемых
изображений в зависимости от области интереса можно использовать вра-
щательные движения, давление и отклонения датчика.
Интерпретация изображений возможна при понимании принципов ульт-
расонографии. Ткани с высоким содержанием воды, например мышцы, вы-
глядят гипоэхогенными (темными). Ткани с более низким содержанием воды
или большим количеством коллагена, такие как жировая клетчатка и под-
слизистая основа, выглядят гиперэхогенными (светлыми) [3, 5]. С учетом
этого в стенке прямой кишки можно выделить пять слоев. От внутреннего
слоя к наружному: слизистая оболочка — гиперэхогенная, мышечная плас-
тинка слизистой оболочки — гипоэхогенная, подслизистая основа — гипер-
эхогенная, собственно мышечный слой — гипоэхогенный, сероза и парарек-
тальный жир — гиперэхогенные [3-5, 7] (рис. 13.2). В анальном канале от
внутреннего слоя к наружному: слизистая оболочка — гипоэхогенная, суб-
эпителиальные ткани — гиперэхогенные, внутренний анальный сфинк-
тер — гипоэхогенный, межсфинктерное пространство — гиперэхогенное,
наружный анальный сфинктер обладав! смешанной эхогенностью [2, 5, 6,
8, 9] (рис. 13.3).
Такие мышечные структуры, как анальные крипты и заслонки, а также
геморроидальное сплетение, обычно не видны. Почему? Они, как правило,
сдавливаются датчиком и находятся вне фокусной зоны (ближе 1 см). Внут-
ренний анальный сфинктер имеет протяженность 2—4 см и простирается от
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
433
Рис. 13.2. Изображение неизмененной стенки прямой кишки, полученное секторным
датчиком. С любезного разрешения Robert Sinow.
дистальной части пуборектальной мышцы до ануса. Изображение наружно-
го анального сфинктера гетерогенное, из-за структуры поперечно-полоса-
той мышечной ткани. У женщин наружный сфинктер обычно выглядит умень-
шенным в области промежностного сухожильного центра. У представителей
обоих полов копчик является причиной затенения, распространяющегося
кзади [2, 5, 6, 8, 9]. Седалищно-прямокишечная ямка обычно не визуализи-
руется вследствие ее расположения вне фокусной зоны датчиков с частотой
7 и 10 МГц.
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
Альтернативные по отношению к брюшно-промежностной резекции спосо-
бы хиругического лечения рака прямой кишки у отдельных пациентов не ме-
нее эффективны, что подчеркивает важность диагностических средств в ста-
дировании ректального рака и определении поражения сфиктеров [10, 11].
При стадировании этого заболевания по системе TNM, при оценке опухоли и
состояния регионарных лимфоузлов ЭРУЗИ обеспечивает большую точ-
ность, чем физикальное исследование, КТ и МРТ (табл. 13.1) [7, 12-18].
28 Ул ьтразвуковая диагностика...
434
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
Рис. 13.3. Изображение неизмененного анального канала в его средней трети. С
любезного разрешения Frank Opelka.
Таблица 13.1. Определение стадии рака прямой кишки
Первичная опухоль
ТО первичная опухоль не выявлена
Tis рак in situ: внутриэпителиальное расположение или инвазия собственной пластики
слизистой
Т! Инвазия опухоли в подслизистый слой
Т2 Инвазия опухоли в мышечный слой
ТЗ Опухоль прорастает через мышечный слой в субсерозный или в
неперитонизированные параободочные или параректальные ткани
Т4 Опухоль распространяется на другие органы или структуры и/или проникает через
висцеральную брюшину
Региональные лимфатические узлы
NO метастазов в региональных лимфатических узлах нет
N1 в региональных лимфатических узлах от 1 до 3 метастазов
N2 в региональных лимфатических узлах более 4 метастазов
Отдаленные метастазы
МО отдаленных метастазов нет
Ml определяются отдаленные метастазы
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
435
Т-стадия определяется по инвазии опухоли в слои стенки прямой кишки
(табл. 13.2). Образования in situ (Tis) обычно ограничены слизистой, без ин-
вазии во внутренний гиперэхогенный слой. Опухоли стадии Т1 ограничены
подслизистым слоем и также не проникают во внутренний гиперэхогенный
слой (нередко утолщенный) (рис. 13.4). Образования стадии Т2 вторгаются
в мышечный слой, но не проникают сквозь него, что определяется по нару-
шению непрерывности среднего гиперэхогенного слоя. Нередко достаточно
выражено утолщение гиперэхогенного мышечного слоя (рис. 13.5). Проник-
новение опухоли в параректальную жировую клетчатку указывает на
ТЗ-стадию заболевания, определяемую по прерывистому виду или вдавле-
ниям на внешней гиперэхогенной белой линии (рис. 13.6). Опухоли стадии
Т4 прорастают в смежные органы, такие как влагалище или мочевой пузырь
(рис. 13.7). При оценке глубины опухолевой инвазии точность ЭРУЗИ со-
ставляет 80-90%. Эти результаты превосходят возможности МРТ и КТ, со-
ставляющие 45-80% соответственно (табл. 13.2).
Рис. 13.4. На изображении опухоли в стадии Т1 определяется неизмененная
гиперэхогенная линия, соответствующая подслизистому слою С любезного
разрешения Robert Sinow.
436
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
Рис. 13.4. (Продолжение.)
Таблица 13.2. Сравнение точности ЭРУЗИ и КТ
Исследование Точность %
ЭРУЗИ KT
Beynon et al. [17]: п = 44 91 82
Waizer et al. [15]; n = 68 76 65
Herzog et al. [18]; n = 118 91 75
Hamsverger et al. [7]; n = 24 52 32
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
437
Рис. 13.5. Вид опухоли в стадии Т2; опухоль нарушает непрерывность гиперэхогенной
линии, соответствующей изображению подслизистого слоя. Обратите внимание на
гипоэхогенный лимфатический узел округлой формы.
Большая чувствительность УЗИ при выявлении злокачественных опухо-
лей в стадиях Т1 и Т2, а не в ТЗ, имеет большое клиническое значение [2, 7,
12, 16, 19-23]. Такие визуальные данные могут оказаться решающими в опре-
делении лечебной тактики. КТ и МРТ могут обладать большей точностью в
стадировании распространенных опухолей, достигших стадий ТЗ и Т4
Ультрасонографическое определение N-стадии основывается на тщатель-
ном определении размеров идентифицированных периферических лимфа-
тических узлов. Узлы больше 1 см считаются пораженными. Кроме этого
критерия некоторые исследователи принимают решение на основе эхострук-
туры и формы лимфоузла.
Метастатические узлы с опухолевой инфильтрацией обычно гипоэхо-
генные [20, 24, 25] (рис. 13.5). Дополнение ЭРУЗИ тонкоигольной аспира-
ционной биопсией может повысить точность определения состояния лим-
фоузлов [26, 27]. Большинство узлов располагается сзади, в мезоректальном
пространстве, обычно прилегая к первичной опухоли или краниальнее нее;
однако они могут отстоять в каудальном направлении на 4 см и более. Во
438
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
Рис. 13.6. Изображение опухоли в стадии ТЗ, проникающей в параректальную
жировую клетчатку.
всех случаях, когда подозревается рак прямой кишки, должен выполняться
полный осмотр мезоректального пространства.
Польза ЭРУЗИ заключается в точности диагностического стадирова-
ния, обеспечении визуального контроля за положением иглы при выполне-
нии тонкоигольной аспирационной биопсии лимфатических узлов, подсли-
зистых или параректальных образований, а также в возможности определения
прорастания сфинктеров. Ограничения связаны с трудностями в визуализации
стенозирующих или обструктивных опухолей и возможным завышением
стадии из-за неспособности различить десмопластическую реакцию и опу-
холевую инфильтрацию.
При дооперационной оценке рака прямой кишки ЭРУЗИ может обеспе-
чить получение значимой вспомогательной информации. В настоящее вре-
мя оно является важным дополнением к физикальному исследованию, вы-
полненному опытным клиницистом. При использовании ЭРУЗИ клиници-
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
439
Рис. 13.7. Изображение опухоли в стадии Т4, прорастающей семенные пузырьки. С
любезного разрешения Robert Smow.
сты могут лучше оценить показания к проведению неоадьювантной терапии
и сфинктеросохраняющих операций.
Когда при дооперационном исследовании установлена Tis—Т2- и NO-ста-
дия заболевания, альтернативой брюшно-промежностной резекции может
стать ограниченная (трансанальная) резекция. У пациентов с распростра-
ненным или неоперабельным раком в стадиях ТЗ или Т4 может оказаться
440
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
Т1 NO
T2N0
T3N0iuihTxN1
Ограниченная резекция
Ограниченная резекция
течение
лечение
Лучевое лечение
Лучевое лечение
и химиотерапия
I
Рис. 13.8. Лечебная тактика при раке прямой кишки.
Лучевое лечение
и химиотерапия
Радикальная
операция
полезной неоадъювантная терапия, направленная на понижение стадии за-
болевания. Таким образом, точное дооперационное стадирование является
важным [10, 11] (рис. 13.8).
При выполнении ЭРУЗИ после окончания неоадъювантной терапии и
после резекций могут быть получены менее точные данные. В этих случаях
рубцевание и десмопластические реакции затрудняют дифференциацию из-
мененных слоев стенки кишки [28]. Такие обстоятельства оказываются осо-
бенно важными в дооперационной оценке пациентов при снижении стадии
после неоадъювантной терапии, поскольку стадия заболевания, устанавли-
ваемая при УЗИ, может быть преувеличена, а клиническая оценка — завы-
шена. [18]. После резекции тонкоигольная аспирационная биопсия под кон-
тролем ЭРУЗИ нередко оказывает помощь в раннем выявлении местных
и/или региональных рецидивов. Однако в таких случаях для повышения
точности необходимо дальнейшее обследование.
ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
Недержание кала
На основе опыта, полученного при использовании ЭРУЗИ для изучения из-
менений анального канала при злокачественных новообразованиях, клини-
цисты стали применять этот диагностический метод при доброкачественных
аноректальных заболеваниях. В настоящее время установлено, что ЭРУЗИ яв-
ляется полезным средством диагностики недержания кала. До этого, основ-
ными методами оценки функционального компонента недержания являлись
электромиография, анальная манометрия и физикальное исследование.
Анальная манометрия является наилучшим способом определения функцио-
нального компонента недержания кала. Электромиография обеспечивает по-
лучение информации о сохранности срамного нерва и сокращении сфинкте-
ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ
441
ров. К сожалению, выполнение обычной электромио!рафии вызывает у пациен-
та значительный дискомфорт. При измерении латентности периферического
двигательного мускула срамного нерва может использоваться электрод, уста-
новленный на перчатке, что позволяет оценить сохранность нерва менее ин-
вазивным способом.
Пациенты хорошо переносят ЭРУЗИ; метод позволяет детально оце-
нить анатомические особенности сфинктеров и сравнить полученные дан-
ные с данными физикального исследования, электромиографии и анальной
манометрии. Отклонения, которые могут быть выявлены, включают в себя
нарушение целостности сфинктеров, изменение эхогенности мускулатуры,
а также участки истончения или диффузной атрофии сфинктеров (рис. 13.9).
Эти анатомические изменения коррелируют со снижением давления, выяв-
ляемым при манометрии [8, 29, 31].
НАРУЖНЫЙ
АНАЛЬНЫЙ
СФИНКТЕР
ВНУТРЕННИЙ
АНАЛЬНЫЙ
СФИНКТЕР
Рис. 13.9. А. Дефект в передней области наружного края сфинктера. Отмечается
истончение передней части внутреннего анального сфинктера. Б. (продолжение). Вид
сфинктера после оперативной коррекции с перекрытием его волокон. С любезного
разрешения Frank Opelka.
442
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
ЗОНА ПЕРЕКРЫТИЯ
ВОЛОКОН СФИНКТЕРА
ВНУТРЕННИЙ
АНАЛЬНЫЙ
.СФИНКТЕР
ВНУТРЕННИЙ
АНАЛЬНЫЙ
СФИНКТЕР'
ДАТЧИК
НАРУЖНЫЙ
АНАЛЬНЫЙ
СФИНКТЕР
Рис. 13.9. (Продолжение.)
ЭРУЗИ может быть использовано как средство визуального контроля
при выполнении электромиографии. Это позволяет сократить область ис-
следования и таким образом уменьшить число вводимых игл и дискомфорт
пациента [5, 31]. Обеспечивая точное определение места нарушения целост-
ности сфинктера во время операции, ЭРУЗИ помогает хирургу найти дефект
и устранить его.
В настоящее время врачи используют ЭРУЗИ как дополнение к физикаль-
ному исследованию, электромиографии, определению латентности перифе-
рического двигательного мускула срамного нерва и манометрии. При исполь-
зовании метода в случаях недержания кала можно предположить идиопати-
ческую, нейрогенную или другую, не связанную с дефектом сфинктера
причину заболевания, выявить анатомические изменения сфинктера и реко-
мендовать пациенту выполнение хирургической коррекции [32-36].
РЕЗЮМЕ
443
Свищи
Новая область применения ЭРУЗИ — использование при оценке пациентов с
аноректальными абсцессами при наличии свищей. Целью проведения ЭРУЗИ
в таких случаях является выявление свищевого отверстия, определение мес-
тоположения и направления свищевого хода и локализация связанных с ним
гнойных затеков. Эти данные помогают при хирургическом вмешательстве,
уменьшая затраты времени на поиск свищевых отверстий, их маркеров, а так-
же любых, связанных со свищевым ходом, затеков, требующих дренирова-
ния. При эндоанальном УЗИ свищевые ходы определяются как гипоэхоген-
ные линии, пересекающие сфинктер. Они также могут выглядеть как наруше-
ние непрерывности любого из слоев тканей [37, 38].
При оценке свищей и затеков врачи сталкиваются с некоторыми огра-
ничениями возможностей эндосонографии. Прежде всего, может быть за-
труднена визуализация свищевых отверстий. Как было указано, давление
датчика и короткое фокусное расстояние ограничивают детальное иссле-
дование слизистой оболочки. Кроме этого, верхний и нижний леваторы, а
также область седалищно-прямокишечной ямки могут оказаться вне фо-
кусной зоны датчика. Добиться лучшей визуализации этих зон можно пу-
тем использования датчика с более низкой частотой (5 МГц) [6]. Наконец,
интерпретацию результатов УЗИ усложняют послеоперационные рубцы
или деформации, вызванные повреждениями сфинктера. Улучшению ви-
зуализации свищевых ходов способствует введение в их полость перекиси
водорода, после чего изображение свища становится гиперэхогенным [39]
(рис. 13.10).
ЭРУЗИ оказывается наиболее полезным при сочетании свищей и пара-
ректальных абсцессов. Различают несколько типов сложных свищей, таких
как свищи при болезни Крона, подковообразные свищи, рецидивирующие
свищи; сюда также относятся ситуации, когда подозревается наличие на-
ружных или надсфннктерных свищей. Такие состояния наиболее часто свя-
заны с повреждениями сфинктера или персистирующим воспалительным
заболеванием [40]. При самых простых свищах и абсцессах можно ограни-
читься данными только физикального исследования.
РЕЗЮМЕ
При диагностике и лечении аноректальных заболеваний ЭРУЗИ играет важ-
ную роль. Поскольку его применение становится все более распространен-
ным, а новое оборудование более совершенным, возможности визуализации
и интерпретации данных должны также улучшаться, расширяя применение
ЭРУЗИ в клинической практике.
444
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
Рис. 13.10. А. Вид аноректального свища и абсцесса без усиления изображения.
Б. Аноректальный свищ после введения перекиси водорода. С любезного разрешения
Juan Nogueras.
ССЫЛКИ
1. Rifkin D. Endosonography of the prostate: clinical implications. AJR Am J
Roentgenol 1987;148:1137-1142.
2. Law PJ, Bartram CI. Anal endosonography: technique and normal anatomy.
Gastrointest Radiol 1989;14:349-353.
ссылки
445
Рис. 13.10. {Продолжение.)
3. Senagore AJ. Intrarectal and intra-anal ultrasonography in the evaluation of
colorectal pathology. Surg Clinic North Am 1994;74:1465-1473.
4. Beynon J, Foy DM, Temple LN, et al. The endosonic appearances of normal
colon and rectum. Dis Colon Rectum 1986;29:810-813.
5. Bartram C. Atlas of anal endosonography. Boston: Butterworth-Heine-
mann, 1991.
6. Tjandra JJ, Milsom JW, Stolfi VM, et al. Endoluminal ultrasound defines
anatomy of the anal canal and pelvic floor. Dis Colon Rectum 1992;35:
465-170.
446
13. ЭНДОСКОПИЧЕСКАЯ УЛЬТРАСОНОГРАФИЯ ПРЯМОЙ КИШКИ
7. Harnsberger JR, Charvat Р, Longo WE, et al. The role of intrarectal ultraso-
und (IRUS) in staging of rectal cancer and detection of extrarectal patholo-
gy. Am Surg 1994;60:571-577.
8. Sultan AH, Kamm MA, Hudson CN. Endosonography of the anal sphinc-
ters: normal anatomy and comparison with manometry. Clin Radiol 1994;
49:368-374.
9. Sultan AH, Nicholls RJ, Kamm MA, et al. Anal endosonography and corre-
lation with in vitro and in vivo anatomy. Br J Surg 1993;80:508-511.
10. Amell TD, Stamos MJ. Alternatives in therapy of low rectal cancer. J Wo-
und Ostomy Continence Nurse 1996;23:150-155.
11. Stamos MJ. What's new in colon and rectal surgery. J Am Coll Surg 1998;
186:134-140.
12. Milsom JW, Graffner H. Intrarectal ultrasonography in rectal cancer staging
and in the evaluation of pelvic disease: clinical uses of intrarectal ultraso-
und. Ann Surg 1990;212:602-606.
13. Waizer A, Powsner E, Russo I, et al. Prospective comparative study of mag-
netic resonance imaging versus transrectal ultrasound for preoperative sta-
ging and follow-up of rectal cancer. Dis Colon Rectum 1991;54:1068-1072.
14. Thaler W, Watzka S, Martin F, et al. Preoperative staging of rectal cancer by
endoluminal ultrasound vs. magnetic resonance imaging. Dis Colon Rectum
1994;35:1189-1193.
15. Waizer A, Zitron S, Ben Baruch D, et al. Comparative study for preoperati-
ve staging of rectal cancer. Dis Colon Rectum 1989;32:53-56.
16. Kramann B, Hildebrandt U. Comparative tomography versus endosonog-
raphy in the staging of rectal cancer: a comparative study. Int J Colorectal
Dis 1986;1:216-218.
17. Beynon J, Mortansensen NJ, Foy FM, et al. Preoperative assessment of local
invasion in rectal cancer: digital examination, endoluminal sonography or
computed tomography. Br J Surg 1986;73:1015-1017.
18. Herzog U, von Flue M, Tondell P, Schuppisser JP. How accurate is endorec-
tal ultrasound in the preoperative staging of rectal cancer. Dis Colon Rec-
tum 1993;36:127-134.
19. Durdey P, Williams NS. Pre-operative evaluation of patients with low rectal
carcinomas. World J Surg 1992;16:430-36.
20. Jochem RJ, Reading CC, Dozois RR, et al. Endorectal ultrasonographic sta-
ging of rectal cancer. Mayo Clin Proc 1995;65:1571-1577.
21. Sinow RM, Stamos MJ, Renslo R. Transrectal ultrasound in the preoperati-
ve staging of rectal cancer. J Ultrasound Med S21, 1995; 14:3.
22. Sinow RM, Stamos MJ, Renslo R, Preoperative staging of rectal tumors and
perirectal disease with transrectal ultrasound. AJR Am J Roentgenol 1994;
162:247.
23. Sinow RM, Stamos M, Van Appledom S, Hachigian M. The role of trans-
rectal ultrasound in the preoperative staging of primary rectal neoplasms.
Eur Radiol 1997;7:S185.
ссылки
447
24. Saclarides TJ, Bhattacharyya AK, Britton Kuzel C, et al. Predicting lymph
node metastases in rectal cancer. Dis Colon Rectum 1994;37:52-57.
25. Dershaw DD, Enker WE, Cohen AM, Sigurdson ER. Transrectal ultraso-
nography of rectal carcinoma. Cancer 1990;66:2336-2340.
26. Milsom JW, Czyrko C, Hull TL, et al. Preoperative biopsy of pararectal
lymph nodes in rectal cancer using endoluminal ultrasonography. Dis Colon
Rectum 1994;37:364-368.
27. Sinow RM, Stamos MJ, Atamdede F. Transrectal ultrasound guided biopsy
of rectal and perirectal masses. Radiology 1996;201.
28. Williamson PR, Hellinger MD, Larach SW, Ferara A. Endorectal ultraso-
und of T3 and T4 rectal cancers after preoperative chemoradiation. Dis Co-
lon Rectum 1996;39:45-49.
29. Den KI, Kumar D, Williams JG, et al. Anal sphincter defects. Correlation
between endo-anal ultrasound and surgery. Ann Surg 1993;218:201-205.
30. Fait PM, Blatchford GJ, Cali RL, et al. Transanal ultrasound and manometry
in the evaluation of fecal incontinence. Dis Colon Rectum 1994;3 7:468 172.
31. Sultan AH, Kamm MA, Talbot IC, et al. Anal endosonography for identify-
ing external sphincter defects confirmed histologically. Br J Surg 1994;
81:463-465.
32. Tjandra JJ, Milsom JW, Schroeder T, Fazio VW. Endoluminal ultrasound is
preferable to electromyography in mapping anal sphincteric defects. Dis
Colon Rectum 1993;36:689-692.
33. Felt-Bersma RTF, Cuesta MA, Koorevaar M. Anal sphincter repair impro-
ves anorectal function and endosonographic image: a prospective clinical
study. Dis Colon Rectum 1996;39:878-885.
34. Law PJ, Kamm MA, Bartram CI. Anal endosonography in the investigation
of fecal incontinence. Br J Surg 1991;78:312-314.
35. Rieger NA, Sweeney JL, Hoffmann DC, et al. Investigation of fecal inconti-
nence with endoanal ultrasound. Dis Colon Rectum 1996;39:860-864.
36. Neilsen MB, Hauge C, Rasmussen OO, et al. Anal endosonographic fin-
dings in the follow-up of primarily sutured sphincteric ruptures. Br J Surg
1992;79:104-106.
37. Law PJ, Talbot RW, Bartram CI, Northover JM. Anal endosonography in the
evaluation of perianal sepsis and fistula in ano. Br J Surg 1989;76:752-755.
38. Cataldo PA, Senagore A, Luchtefeld MA. Intrarectal ultrasound in the eva-
luation of perirectal abscesses. Dis Colon Rectum 1993:36:554 558.
39. Cheong DM, Nogueras JJ, Wexner SS, Jagelman DG. Anal endosonograp-
hy for recurrent anal fistulas: image enhancement with hydrogen peroxide.
Dis Colon Rectum 1993;36:1158-1160.
40. Van Outryve MJ, Pelckmans PA, Michielsen PP, et al. Value of transrectal ul-
trasonography in Crohn's disease. Gastroenterology 1991;101:1171-1177.
ГИНЕКОЛОГИЯ / АКУШЕРСТВО
ЭрикР Сноэй
14
Гинекологические и акушерские расстройства — частая причина обращения
в отделение неотложной помощи или посещения первичного амбулаторного
приема. Определение необходимости хирургического лечения при болях
внизу живота или области таза у женщин нередко связано со значительными
диагностическими трудностями. Проявления заболеваний органов малого
таза могут быть схожими с симптомами внутрибрюшных расстройств, и наобо-
рот, что часто усложняет вопросы госпитализации и ведения таких пациен-
тов. Об этом свидетельствуют поздняя диагностика и высокая частота на-
прасных лапаротомий при аппендиците у женщин.
Начиная с 1980-х годов, УЗИ становится наиболее распространенным
средством визуализации при акушерских и гинекологических расстройст-
вах. Ультрасонография является диагностическим инструментом, значительно
расширяющим анатомическую составляющую в клинической оценке врача.
Это особенно важно при известной сложности тазовой анатомии. В несколь-
ких исследованиях были подтверждены низкая чувствительность и слабые
диагностические возможности бимануального вагинального исследования
[1-3]. Ультрасонография, являясь частью оценки состояния органов брюш-
ной полости и малого таза, помогает уточнить местоположение и структуру
зон болезненности и пальпируемых образований. Такая стратегия, направ-
ленная на объединение клинической и сонографической информации, мо-
жет значительно упростить оценку состояния органов брюшной полости и
малого таза у женщин. У пациенток с острой болью в животе выявляются
различные клинические признаки и симптомы, которые могут быть вызваны
как хирургическими, так и гинекологическими причинами. После всесто-
роннего обследования, включающего ультрасонографию, врач может уве-
ренно интерпретировать жалобы пациентки.
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications,, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
ТЕХНИКА ИССЛВДОВАНИЯ 449
Роль УЗИ в оценке «острого живота» хорошо изучена. Эта методика мо-
жет оказаться полезной и при широком разнообразии менее острых состоя-
ний, наиболее типичными и безопасными из которых являются менометрор-
рагия и дисменорея. И все же каждое из них может свидетельствовать о бо-
лее серьезном заболевании. Точно так же, при наличии новообразований
матки и придатков, обнаруженных при обычном обследовании, выдвигается
широкий диапазон диагнозов — от малозначимых до серьезных. В таких си-
туациях УЗИ нередко дает неоценимые дополнительные сведения, и под-
тверждение диагноза вносит взаимопонимание между врачом и пациенткой.
Наконец, УЗИ играет особую роль в обследовании пациентки с призна-
ками беременности. Используемое для исключения эктопированной бере-
менности, подтверждения жизнедеятельности эмбриона и получения сведе-
ний о возможном влиянии хирургического заболевания на его состояние,
УЗИ является «золотым стандартом» методов визуализации.
Обычное целенаправленное применение УЗИ в гинекологии и акушер-
стве способствует повышению диагностической точности, обеспечивает ра-
циональное направление дальнейшего диагностического поиска, позволяет
получить информацию, необходимую для внешних консультантов и начала
лечения.
ТЕХНИКА ИССЛЕДОВАНИЯ
Диагностические изображения должны использоваться исключительно в ка-
честве дополнительной информации к традиционной клинической оценке,
связывающей отклонения от нормальной сонографической картины с симп-
томами заболевания. Вид и объем любого визуального исследования должны
определяться клинической ситуацией и конкретными информационными по-
требностями. Исследование должно выполняться только при хорошо обосно-
ванном подозрении на наличие гинекологического заболевания и быть на-
правлено в большей степени на поиск патологических изменений, чем на вы-
явление тонких анатомических особенностей. Как при многих лабораторных
и визуальных исследованиях, если вероятность обнаружения проблемы (пре-
диагностическая) низкая, то увеличивается шанс, что положительный резуль-
тат в действительности является ложноположительным. Поэтому результаты
УЗИ важно сопоставлять с клиническими проявлениями заболевания.
Для исследования органов малого таза у женщин применяются две ме-
тодики: трансабдоминальное ультрасонографическое исследование (ТАУЗИ)
и трансвагинальное ультрасонографическое исследование (ТВУЗИ). ТАУЗИ
основано на низкочастотном эхосигнале, что обеспечивает более глубокое
проникновение в ткани и широкую область визуализации. Это облегчает
пространственную ориентацию и позволяет хирургу визуализировать боль-
шие структуры, в том числе расположенные вне полости малого таза. Основ-
ная методика осмотра и экранные ориентиры при ТАУЗИ аналогичны уже
29 Ультразвуковая диагностика...
450
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
описанным для исследования органов брюшной полости (см. гл. 3). При
ТВУЗИ используется более высокая частота эхосигнала, которая позволяет
получить более детальные изображения анатомических структур таза, осо-
бенно придатков матки. В нескольких исследованиях было подтверждено
значительное превосходство этой методики над ТАУЗИ [4-6]. К недостат-
кам ТВУЗИ относятся трудности пространственной ориентировки и неболь-
шое поле обзора.
В большинстве случаев ТАУЗИ должно выполняться перед ТВУЗИ, что
помогает врачу в пространственной ориентации и позволяет получить пер-
воначальное представление об анатомических особенностях органов малого
таза. Нередко ТАУЗИ дает достаточно информации, и необходимости в вы-
полнении ТВУЗИ не возникает. Для подготовки к ТВУЗИ после проведения
ТАУЗИ пациентка должна опорожнить мочевой пузырь. При ТВУЗИ дета-
льно визуализируются те патологические изменения, которые не были четко
видны при ТАУЗИ, особенно в области придатков и эндометрия.
Трансабдоминальная ультрасонография
Наполненный мочевой пузырь значительно увеличивает чувствительность и
разрешение ТАУЗИ, создавая сонографическое окно. Это позволяет лучше
визуализировать глубокие тазовые структуры и уменьшить вероятность ин-
терпозиции кишечной петли, что может привести к появлению артефактов.
Мочевой пузырь заполняется либо выпитой пациенткой жидкостью, либо
ретроградно, через введенный катетер Фолея. Последняя методика более на-
дежна.
При исследовании пациентка лежит на спине, на кожу нижней части
живота наносится ультразвуковой гель. ТАУЗИ предполагает получение
изображений в двух плоскостях: сагиттальной (продольной) и поперечной
(рис. 14.1). Для получения вида в продольной плоскости расположите дат-
чик по средней линии живота сразу выше лонного сочленения. Указатель
стороны датчика должен быть направлен к голове пациентки. Экранные
ориентиры соответствуют таковым при выполнении исследования органов
брюшной полости. Верхняя часть экранного изображения (вершина секто-
ра) соответствует передней поверхности брюшной полости. Левая сторона
экрана соответствует краниальному направлению, правая — каудальному.
В нижней части экрана отображаются наиболее удаленные от датчика обла-
сти брюшной полости (рис. 14.2).
Для получения изображения в поперечной плоскости поверните датчик
на 90° против часовой стрелки. Теперь ориентация экранного изображения
напоминает таковую на снимке, полученном при КТ брюшной полости: левая
сторона изображения соответствует правой стороне тела пациентки. Изоб-
ражение в верхней части экрана по-прежнему соответствует передней по-
верхности живота (рис. 14.3). Дальнейшее вращение датчика вправо или
техника исследования
451
Рис. 14.1. А. Плоскости сканирования, используемые при ТАУЗИ. Б. Продольная
(сагиттальная) (а), поперечная (б) и фронтальная (в) плоскости (см. рисунок).
влево в сагиттальной плоскости и вверх или вниз в поперечной плоскости
позволяет получить косые сечения. Как правило, каждая структура должна
быть визуализирована, по крайней мере, в двух плоскостях (продольной и
поперечной).
Трансвагинальная ультрасонография
В отличие от ТАУЗИ, наполненный мочевой пузырь может препятствовать
адекватной визуализации тазовых структур при ТВ УЗИ. Поэтому процедура
выполняется при опорожненном мочевом пузыре. Противопоказаний к вы-
полнению ТВУЗИ нет, за исключением состояния после недавно выполненной
гинекологической операции. Исследование может быть выполнено в любой
день менструального цикла, а также при наличии инфекционного процесса [7].
Перед введением на датчик надевают защитное покрытие (презерватив
или латексную перчатку), заполненное небольшим количеством ультразву-
кового геля. Так как пузырьки воздуха могут стать причиной появления ар-
тефактов, проведите пальцем по поверхности датчика, распределяя гель и
удаляя пузырьки. Пациентка располагается в положении для литотомии,
лучше всего использовать гинекологическое кресло. Если кресло регулируе-
мое, поднимите бедра пациентки, что облегчит манипуляции датчиком. Пе-
ред введением во влагалище смажьте ультразвуковым гелем (или Surgilube)
датчик, покрытый презервативом. Поскольку ультразвуковой гель ухудшает
подвижность сперматозоидов, может использоваться вода.
452
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Рис. 14.1. (Продолжение.)
Двумя основными плоскостями для получения изображений при ТВУЗИ
являю гея сагиттальная (продольная) и фронтальная. Введите датчик во вла-
галище в положении, при котором указатель стороны направлен к симфизу.
Медленно продвиньте датчик по направлению к шейке, наблюдая за получа-
емым изображением на мониторе. Первым изображением является сагитта-
льный вид согнутой кпереди матки (рис. 14.4). При обучении проведения
ТВУЗИ экранная ориентация может вызывать путаницу, поскольку поверх-
ность датчика расположена в непривычной плоскости. Важно помнить, что
верхняя часть экрана всегда соответствует поверхности датчика. Однако
при ТВУЗИ поверхность датчика находится в вертикальной плоскости про-
межности, перпендикулярно к плоскости, использующейся при ТАУЗИ.
Левая сторона изображения соответствует передней поверхности брюшной
полости, а правая сторона — задней. В нижней части экрана визуализируют-
ся глубокие отделы брюшной полости по отношению к голове пациентки.
ТЕХНИКА ИССЛЕДОВАНИЯ
453
КРАНИАЛЬНО
Рис. 14.2. А. Продольное изображение нормальной матки при ТАУЗИ с минимальным
объемом жидкости в мочевом пузыре. Б. Продольное изображение органов малого
таза при наполненном мочевом пузыре. В (продолжение).
При ТВУЗИ во фронтальной плоскости ориентация экрана подобна стандар-
тному виду поперечной плоскости при ТАУЗИ. Левая часть экрана соответ-
ствует правой стороне тела пациентки, нижняя часть экрана — ближайшей к
голове части тела. Имейте в виду, что изображение в верхней части экрана
находится в плоскости промежности (рис. 14.5). Некоторые ультразвуковые
аппараты оснащены вагинальными датчиками со скошенной поверхностью,
454
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Рис. 14.2. (Продолжение)
что затрудняет полную визуализацию левых придатков (рис. 14.6). Одно из
решений дилеммы заключается в повороте датчика на 180° так, чтобы его
наклонная поверхность была направлена к левой половине тела пациентки
[7]; помните, что право-левосторонняя ориентация изображения будет пред-
ставлена в отраженном виде. Скорректируйте ультразвуковое изображение
его переворотом на экране, эта функция доступна на большинстве современ-
ных аппаратов.
НОРМАЛЬНАЯ АНАТОМИЯ
455
Рис. 14.2. (Продолжение.)
НОРМАЛЬНАЯ АНАТОМИЯ
Учитывая сложные пространственные взаимоотношения различных струк-
тур малого таза, для получения клинической информации необходимо в со-
вершенстве владеть знанием нормальной анатомии этой области (рис. 14.7).
Помните, что нормальная анатомия у женщин весьма изменчива, подчинена
циклическим и возрастным гормональным влияниям. Врач должен предпо-
лагать и интерпретировать результаты УЗИ, учитывая индивидуальный мен-
струальный и гормональный фон. Например, утолщение эндометрия являет-
ся нормой у молодых женщин в пролиферативной стадии менструального
цикла, но тот же признак в постклимактерическом периоде указывает на дис-
плазию эндометрия [8-10].
456
14 ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Рис. 14.3. А. Поперечное изображение нормальной матки при ТАУЗИ. Обратите
внимание на небольшое количество жидкости в прямокишечно-маточном углублении.
Б. Поперечное изображение органов малого таза при ТАУЗИ.
НОРМАЛЬНАЯ АНАТОМИЯ
457
Рис. 14.4. А. Продольное изображение органов малого таза при ТВУЗИ. Обозначения-.
Р, лонная кость; С, краниальное направление, А, кпереди; rs, ректосигмоидный отдел
ободочной кишки; и, матка; Ь, мочевой пузырь, f, зев; СА, каудально. Б. (продолжение),
Таз подразделяется на большой и малый. Сверху полость малого таза
ограничена мысом крестца и пограничной линией (дугообразные линии под-
вздошных костей, подвздошно-лобковая линия и лобковый гребень). Как
правило, короткое фокусное расстояние при ТВУЗИ не позволяет визуали-
зировать анатомические структуры в пределах малого таза, расположенные
приблизительно в К) см от датчика. Большие структуры или выходящие за
пределы малого таза могут визуализироваться при ТВУЗИ не полностью.
Для их исследования наиболее предпочтительным методом является стан-
дартное ТАУЗИ с высокой проникающей способностью и протяженной фо-
кусной зоной [7].
Тело и шейка матки
Изображение матки в полости малого таза получить не трудно, его можно ис-
пользовать как основной ориентир на протяжении всего исследования. Мат-
ка имее т вид солидного грушевидного образования и находится за мочевым
пузырем и перед ректосигмоидным отделом ободочной кишки. Размеры мат-
ки и ее вид зависят от возраста. Шейка матки (наиболее близкая к датчику
часть органа при ТВУЗИ) — это фиксированная структура, расположенная
под углом к шейке мочевого пузыря. Угол, который шейка образует с влага-
лищем, называют отклонением матки (версия). Угол между телом матки и
шейкой называют перегибом матки (флексия). Наиболее частые положе-
458
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Рис. 14.4. (Продолжение.)
him — это антеверсия (отклонение кпереди) и антефлексия (перегиб кпере-
ди), что связано почти с вертикальной ориентацией матки при положении
женщины на спине.
Относительно фиксированная шейка расположена экстраперитонеаль-
но, более подвижная матка покрыта брюшиной. Широкие связки, образо-
ванные листками брюшины, покрывают матку, окружают придатки и сосу-
ды и являются основным элементом, поддерживающим матку. Изгибы брю-
НОРМАЛЬНАЯ АНАТОМИЯ
459
Рис. 14.5. А. Изображение органов малого таза во фронтальной плоскости при
ТВУЗИ. Б. Продолжение.
шины перед маткой и позади нее образуют углубления — пузырно-маточное
и пространство Дугласа соответственно. В норме в пространстве Дугласа
может находиться небольшое количество жидкости, которая выглядит как
анэхогенная область, расположенная сразу за шейкой матки (рис. 14.8). Ге-
терогенная эхоструктура жидкости указывает на присутствие в ней сгустков
крови или гноя. Наличие жидкости в переднем, пузырно-маточном, углуб-
лении указывает на ее значительный объем, обычно при асците или гемопе-
ритонеуме. Иногда в пространстве Дугласа может располагаться петля киш-
ки, ее можно отличить по характерным газовым артефактам и перистальтике.
460
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Мышечный слой матки по сравнению с гиперэхогенной полоской эндо-
метрия, расположенной в центральной части органа, обладает средней эхо-
генностью. Во внешнем слое миометрия могут визуализироваться дуговые
артерии, они выглядят как небольшие гипоэхогенные зоны правильной фор-
мы (рис. 14.9). При ТВУЗИ в продольной плоскости матка имеет грушевид-
ную форму и располагается сразу за наполненным мочевым пузырем. При
сканировании в поперечной плоскости форма матки становится эллипсо-
видной, а изображение полоски эндометрия переходит из поперечной плос-
кости в продольную. Яичники обычно визуализируются латеральнее стенок
матки. Изображение при ТВУЗИ в продольной плоскости аналогично изоб-
ражению при ТАУЗИ в продольной плоскости, за исключением того, что
датчик находится рядом с шейкой матки. При ТВУЗИ во фронтальной плос-
кости форма матки снова становится эллипсовидной.
НОРМАЛЬНАЯ АНАТОМИЯ
461
Рис. 14.6. Анатомия органов малого таза во фронтальной плоскости при ТВУЗИ.
Эндометрий
Как уже было сказано, вид нормального эндометрия зависит от гормонально-
го фона пациентки и фазы менструального цикла (рис. 14.10). Во время про-
лиферативной фазы эндометрий постепенно утолщается и становится более
контрастным относительно окружающего его миометрия. В фазе секреции
эндометрий становится более гомогенным и менее эхогенным вплоть до на-
ступления менструации. Толщину эндометрия лучше измерять при ТАУЗИ в
продольной плоскости от его переднего края до заднего. Утолщение эндо-
метрия более 10 мм в постклимактерический период является отклонением
от нормы; после гормонозамещающего лечения такое утолщение может сви-
детельствовать о дисплазии. Напротив, утолщение эндометрия при беремен-
ности является нормой. Если этого не происходит, можно заподозрить непра-
вильное развитие беременности. Толщина эндометрия менее 8 мм в случаях,
когда уровень хорионического гонадотропина превышает 1000, с вероятно-
стью 97% указывает на патологическое течение беременности [8-10].
Фаллопиевы трубы
Фаллопиевы трубы расположены сразу ниже дна матки и суживаются по на-
правлению к ее боковым стенкам. Диаметр нормальной трубы 0,1-3 мм, дли-
на — 10 см [ 12]. Средняя часть трубы является наибольшей; обычно при УЗИ
можно увидеть только ее. В норме (без расширения и без окружающей ее
жидкости) остальные части фаллопиевой трубы не видны.
462
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Б
Рис. 14.7. А. Сагиттальное (продольное) сечение таза. Б. Поперечное сечение таза
(вид сверху).
НОРМАЛЬНАЯ АНАТОМИЯ
463
4 LONG ML
LONG
Матка
Жидкость
Матка .
Мочевой
пузырь
Петля
кишки
Рис. 14.8. А. При ТВУЗИ в продольной плоскости определяется неизмененная петля кишки
с отражающим эхогенным содержимым и перистальтическим движением. Б. При ТАУЗИ в
продольной плоскости определяется анэхогенная жидкость. В. При ТАУЗИ в продольной
плоскости определяется гной или сгустки крови.
Жидкость
дкостбг
Рис. 14.9. Вид нормальной матки при ТВУЗИ во фронтальной плоскости Обратите
внимание на дуговые сосуды, определяемые как гипоэхогенные структуры
правильной формы, расположенные по периферии миометрия.
464
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Яичники
Яичники имеют овальную форму, среднюю эхогенность и находятся непо-
средственно около боковых стенок матки. Для их визуализации при ТАУЗИ
получите изображение матки по средней линии в продольной плоскости, за-
тем измените угол сканирования так, чтобы были видны боковые стенки мат-
ки. Яичники обладают дискретной, обычно гетерогенной эхоструктурой, ко-
торая может казаться почти прилежащей к миометрию. Вторым полезным
ориентиром для поиска яичников является внутренняя подвздошная артерия
[13]. Артерия легко распознается по цилиндрической форме и пульсации.
Яичник может находиться непосредственно у передне-медиальной стороны
сосуда. Как и у всех репродуктивных органов, вид и размер яичников значи-
тельно изменяются при гормональной стимуляции. В среднем размеры яич-
ника взрослой женщины составляют 2,5-5,0 см в длину и 1,5-3,0 см в ширину
[14]. У менструирующих женщин наличие внутренних фолликулов может зна-
чительно облегчить визуализацию яичников (рис. 14.11). Напротив, в постмено-
НОРМАЛЬНАЯ АНАТОМИЯ
465
ТРИ ЛИНИИ ЭНДОМЕТРИЯ
В ПРОЛИФЕРАТИВНУЮ ФАЗУ
УТОЛЩЕНИЕ ЭНДОМЕТРИЯ
В ПОЗДНЮЮ ПРОЛИФЕРАТИВНУЮ
ФАЗУ
Рис. 14.10. Изменения нормального эндометрия в зависимости от фазы
менструального цикла. Печатается с любезного разрешения Hagen-Ansert [11].
30 Ультразвуковая диагностика...
466
14. ГИНЕКОЛОГИЯ / АКУШЕРСТВО
Рис. 14.11. ТВУЗИ: продольный вид нормального яичника, содержащего фолликулы.
паузе визуализация яичников затруднена, поскольку они небольшие, атро-
фичные, с небольшим числом фолликулов или без них.
В ранней пролиферативной фазе менструального цикла в паренхиме
яичника может отмечаться 5—11 фолликулярных кист. Ближе к середине
цикла развивается доминирующий фолликул, который достигает 1,5 2,0 см
в диаметре, что приводит почти к удвоению размера яичника [15]. При по-
следующем разрыве доминирующего фолликула и успешной овуляции в
50% случаев в яичнике может быть визуализировано желтое тело (рис. 14.12).
Оно выглядит как кистозная структура с неровными контурами и эхогенным
содержимым (обычно кровью). Желтое тело персистирует всю секреторную
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
467
Рис. 14.12. Овариальный цикл. Печатается с любезного разрешения Hagen-Ansert [11].
фазу, но оно не должно визуализироваться позже первых 72 ч следующего
цикла [16]. В пространстве Дугласа в период овуляции может определяться
небольшое количество жидкости, которая является истекшим содержимым
доминирующего фолликула [17]. Раздражение, связанное с накоплением
этой интраперитонеальной жидкости, обычно расценивается как источник
боли в середине менструального цикла.
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
В клинических условиях необходимость в УЗИ может быть определена толь-
ко после всестороннего сбора анамнеза и физикального исследования. Оцен-
468
14. ГИНЕКОЛОГИЯ / АКУШЕРСТВО
ка времени возникновения, продолжительности и характера жалоб наряду с
физикальными данными создает основу для проведения дифференциального
диагноза. Вместе с этим УЗИ дает дополнительную или эксклюзивную анато-
мическую информацию.
Необходимость в любой визуализации зависит от вероятности того или
иного заболевания и возможности получить положительный или отрицатель-
ный результат исследования. Подтверждающее УЗИ в случае высокой веро-
ятности диагноза во время предварительной оценки может тем не менее ока-
заться важным, если заболевание или предполагаемое лечение связаны с се-
рьезной угрозой для здоровья. Если та же ситуация возникает при
положительных данных УЗИ, но низкой вероятности заболевания по предвари-
тельной оценке, из-за риска ложноположительного результата могут потребо-
ваться дополнительные исследования. Аналогично, врач ультразвуковой
диагностики должен качественно оценивать результаты исследования в за-
висимости от особенностей пациента (ожирения, плохой эходоступности),
развития заболевания и своей уверенности. Хирург-сонографист может при-
нимать во внимание большое число неотложных и амбулаторных состояний
(табл. 14.1 и 14.2).
Таблица 14.1. Причины острой тазовой боли у небеременных
женщин
Матка
Острое нарушение питания или перекрут узла лейомиомы
Эндометрит
Внутриматочные средства
Перфорация матки
Фаллопиевы трубы
Перекрут придатков
Воспалительные заболевания органов малого таза
Яичники
Боли в середине менструального цикла
Разрыв кисты или кровоизлияние
Тубоовариальные абсцессы
Перекрут яичника
Внутриопухолевая инфекция или кровоизлияние
Другое
Эндометриоз, разрыв кисты
Заболевания скелетно-мышечной системы
Урологические заболевания
Желудочно-кишечные заболевания
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
469
Таблица 14.2. Причины хронической или рецидивирующей
тазовой боли
Матка
Лейомиома
Рак тела или шейки матки
Дисменорея
Внутриматочные средства
Предменструальный синдром
Яичники
Опухоли яичников
Кисты яичников
Фаллопиевы трубы
Опухоли труб
Г идросальпинкс
Другое
Эндометриоз
Заболевания скелетно-мышечной системы
Урологические заболевания
Желудочно-кишечные заболевания
Яичники
Образования яичников
Яичники подвержены значительным изменениям, зависящим от гормональ-
ного фона. Наиболее частой причиной боли или кровотечения у женщин в
преклимактерический период являются функциональные патологические из-
менения. Боль в области придатков и их увеличение могут быть связаны с
инфекционным процессом в существовавшей ранее кисте яичника или с
диспластическими изменениями (табл. 14 3).
Таблица 14.3. Дифференциальная диагностика при тазовых
образованиях
Кистозные Сложные Солидные
Физиологическая овариальная киста Цистаденома Г идросальпинкс Эндометриома Параовариальная киста Эктопированная беременность Кистозная тератома Герминогенная опухоль Киста желтого тела Цистаденома Геморрагическая киста Эндометриома Тубоовариальный абсцесс Лейомиома Рак эндометрия, саркома Солидные опухоли яичников
470
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Физиологические кисты
Физиологические кисты возникают в предменструальном периоде и нередко
являются случайной находкой при отсутствии симптомов. Во время проли-
феративной фазы менструального цикла один из фолликулов может увеличить-
ся в объеме в 100 раз, достигая размеров 3 см в течение 10-дневного периода
[13]. Иногда доминирующий фолликул не разрывается и продолжает свое су-
ществование в секреторную фазу уже как фолликулярная киста (рис. 14.13).
Фолликулярные кисты имеют размер 3-8 см и являются тонкостенными и
полностью анэхогенными структурами. Кисты желтого тела возникают при
сохранении желтого тела. В отличие от простых фолликулярных кист, эта
разновидность кист имеет тенденцию к увеличению и симптоматическому
Рис. 14.13. ТВУЗИ: продольный вид яичника с фолликулярной кистой
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
471
проявлению. Сонографически, кисты желтого тела имеют толстую капсулу и
обладают неоднородной внутренней эхоструктурой из-за крови и сгустков,
образовавшихся в результате кровоизлияний. Иногда в кистах содержится
жидкая кровь [18]. Физиологические кисты обычно спонтанно регрессируют
в течение нескольких циклов, и срочное вмешательство, как правило, не тре-
буется. Для подтверждения регрессии показано повторное УЗИ. Кисты, кото-
рые сохраняются свыше 8 недель, можно рассматривать как показания к гор-
мональной супрессии, тонкоигольной аспирации или хирургическому дре-
нированию [4].
Геморрагические кисты
Острое начало тазовой боли у пациентки с кистами придатков в анамнезе или
выявленными сонографически может быть связано с острым кровоизлияни-
ем в полость кисты. Вид геморрагических кист в значительной степени зави-
сит от объема излившейся крови и образовавшихся сгустков. Большинство
тонкостенных структур — типичные функциональные кисты с различным
количеством эхопозитивных включений [4, 19]. Они могут быть полностью
эхогенными, что указывает на высокую плотность кровяного сгустка по отно-
шению к содержащейся в кисте жидкости. Клинические данные обычно выявля-
ют наличие функциональной кисты, задержку или пролонгацию менструаль-
ного кровотечения и внезапное начало односторонней боли в области придат-
ков. Физикальное исследование позволяет предположить новообразование
придатков при отсутствии или наличии маточного кровотечения. В этих слу-
чаях важно исключить эктопированную беременность.
Разорвавшиеся кисты
Другая причина внезапного начала боли в области придатков — острый раз-
рыв физиологической кисты. Пациентки часто связывают факт выявления
кисты с началом боли, спровоцированной физической активностью (поло-
вым сношением, упражнениями). Симптомы могут быстро разрешаться, и
физикальное исследование часто неинформативно. При УЗИ обнаруживает-
ся неизмененный яичник или частично спавшаяся киста с умеренным количе-
ством жидкости в пространстве Дугласа, что свидетельствует о разрыве кис-
ты. Несмотря на то, что чаще требуется выжидательная лечебная тактика, в
некоторых случаях, обычно при нарушениях свертывающей системы, может
наблюдаться существенная потеря крови [4,20,21]. При большом количестве
интраперитонеальной крови она будет скапливаться прежде всего в пузыр-
но-маточном углублении и боковых отделах малого таза.
Перекрут яичника
Перекрут яичника — редкое заболевание, но оно должно рассматриваться
как подлинно неотложное хирургическое состояние. Для ранней диагности-
ки требуется как высокая настороженность в отношении этого заболевания,
так и его подтверждение сонографическими данными. В анамнезе обычно
472
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
имеются сведения о перемежающейся боли, обусловленной чередованием
перекручивания и раскручивания вовлеченного придатка. Могут отмечаться
субфебрильная температура и другие неспецифические симптомы, такие как
тошнота, диарея и даже обмороки [22,23]. Наиболее частым предрасполага-
ющим состоянием являются образования придатков среднего или большого
размера, обычно доброкачественные опухоли и кисты яичника. Поэтому со-
нографические находки при перекруте различны и могут включать в себя
данные о наличии кистозного, сложного или солидного образования придат-
ков [24] (рис. 14.14). Специфического ультрасонографического признака пе-
рекрута не существует. Сочетание длительной выраженной односторонней
боли с ультразвуковым выявлением неоднородного образования в проекции
придатка должно заставить предположить наличие перекрута. Ультразвуко-
вая визуализация неизмененных придатков делает этот диагноз маловероят-
ным. Однако в редких случаях может перекручиваться даже яичник нормаль-
ного размера [4]. Лечение предполагает хирургическую деторсию с восста-
новлением нормального положения придатков.
Опухоли яичников
Опухоли яичников редко проявляются болью или кровотечением и обычно
являются случайной находкой при рутинном исследовании органов малого
таза или при ультрасонографии. Иногда опухоли яичников становятся симп-
томатичными, проявляя себя воздействием на окружающие ткани. Как уже
было отмечено, склонность к вращению большого образования придатков
может привести к их перекруту. Сдавление прилегающих к опухоли тканей
может вызывать боль, одностороннюю почечную блокаду вследствие сдав-
ления мочеточника и даже сдавление вены. Иногда, при некоторых формах
аденомы яичников, отмечается асцит.
В одной главе нет возможности привести описание дифференциальной
диагностики доброкачественных и злокачественных образований придатков;
однако опухоли яичников обычно имеют сложную или солидную структуру.
Полностью кистозное образование — это почти стопроцентный признак
доброкачественности, даже в постклимактерическом периоде [25]. Несмот-
ря на это, даже кистозные образования требуют дальнейшего наблюдения с
проведением серии исследований до их полного разрешения. Цистаденома,
доброкачественная опухоль яичников, является наиболее распространен-
ным видом диспластических образований придатков. На ранних стадиях
развития такая опухоль может быть неотличима от физиологической овари-
альной кисты. Признаки, которые указывают на рак яичников, включают в
себя больший размер образования, утолщенные стенки, внутриполостные
перегородки и папиллярные разрастания внутри кистозной полости [26, 27]
(рис. 14.15). Для детального изучения этих признаков обычно требуется вы-
полнение ТВУЗИ.
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
473
МНОГОКОМПОНЕНТНОЕ
ОБРАЗОВАНИЕ ЯИЧНИКА
С АНЭХОГЕННЫМИ КИСТАМИ,
ТОНКОЙ ОБОЛОЧКОЙ
И ТОНКИМИ ВНУТРЕННИМИ
ПЕРЕГОРОДКАМИ
Рис. 14.14. Многокомпонентное образование яичника.
Образования матки
Лейомиофиброма является доброкачественной опухолью из гладкомышеч-
ной ткани матки. Это наиболее часто встречающееся солидное образование
органов малого таза и самая распространенная опухоль у женщин [13, 28].
Лейомиофиброма может обнаруживаться в разных отделах матки: под эндо-
метрием (субмукозно), в пределах мышечного слоя матки (интрамурально),
под серозной оболочкой (субсерозно), а также быть подвешенной (иметь
474
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Рис. 14.15. А. Опухолевидное образование яичника с жидкостными включениями —
геморрагическая киста. Б. Сложное образование яичника с преобладанием
кистозного компонента. В Эхогенное однородное содержимое, характерное для
дермоидного образования яичника. Г. Тонкие перегородки и эхогенное содержимое
позволяют предположить наличие геморрагической кисты яичника со сгустком крови.
ножку). Хотя большинство лейомиом обнаруживаются случайно при обыч-
ном исследовании, некоторые пациентки могут жаловаться на чувство тяже-
сти, дискомфорт в области таза, метеоризм, нарушение менструального цик-
ла. Эти опухоли могут стать причиной бесплодия и частых выкидышей, осо-
бенно при субмукозной и интрамуральной локализации, мешая имплантации.
При перекруте ножки опухолевого узла и нарушении его питания может на-
блюдаться острая тазовая боль.
Сонографические признаки лейомиофибром крайне разнообразны и за-
висят от местоположения, формы, и состава опухоли. Интрамуральные лейо-
миомы могут лишь незначительно отличаться от окружающего их нормаль-
ного миометрия. Наиболее важные признаки включают в себя изменение
обычной грушевидной формы матки и деформацию контура мочевого пузы-
ря по задней поверхности (рис. 14.16). Лейомиофибромы с высоким содер-
жанием кальция более эхогенны, чем окружающий их миометрий, и могут
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ 475
Рис. 14.16. А. Эхогенный узел лейомиомы, приводящий к дольчатому виду матки и
вдавлению по задней стенке мочевого пузыря. Б. Эхогенная лейомиома, неотличимая
от окружающего миометрия и вызывающая общее увеличение матки. В. Вид
эхогенного интрамурального узла лейомиомы при ТВУЗИ.
создавать классическое акустическое затенение. Дегенерация и некроз лейо-
миомы приводят к появлению в опухоли областей сниженной эхогенности
или зон кистозного перерождения [4]. Такие явления чаще встречаются при
беременности и обнаруживаются в 8% случаев у пациенток с лейомиофибро-
мой, жалующихся на боль в этой области [28]. После того как при физикаль-
ном или ультразвуковом исследовании установлено наличие узла лейомио-
мы, изменение его размеров и структуры должно фиксироваться при после-
дующих исследованиях. Быстрое увеличение при отсутствии беременности
может указывать на малигнизацию.
Образования фаллопиевых труб
В норме может быть визуализирована только самая средняя часть фаллопие-
вой трубы. Дистальные отделы трубы визуализируются в тех случаях, когда
они окружены жидкостью, утолщены или расширены (рис. 14.17). Тазовые
воспалительные заболевания (ТВЗ) могут приводить ко всем трем состояни-
ям и являются наиболее частыми причинами изменений фаллопиевых труб.
476
14. ГИНЕКОЛОГИЯ /АКУШЕРСТВО
Рис. 14.17. А. Гидросальпикс проявляется расширением трубы, содержащей
анэхогенную жидкость. Б. Гидросальпикс может выглядеть как яичник с фолликулами.
ТВЗ обычно начинаются как острый гонококковый или хламидиальный цер-
вицит. Инфекция проникает через слизистую оболочку, поражая миометрий
(эндометрит), фаллопиевые трубы (сальпингит) и, наконец, оба яичника и
брюшину. В клинических условиях неосложненные ТВЗ обычно диагности-
руются по субфебрильной температуре, гнойным выделениям из влагалища
и двусторонней боли в области придатков.
УЗИ применяется в дифференциальной диагностике простых ТВЗ от
случаев, осложненных гидросальпинксом, пиосальпинксом и тубоовариаль-
ным абсцессом (рис. 14.18). Сонографически гидросальпинкс проявляется
как многокомпонентное кистозное образование, которое легко можно при-
нять за кисту яичника. Правильная веретеновидная форма трубы более оче-
видна при ТВУЗИ, особенно если прилежащий неизменный яичник легко
идентифицируется. Отсутствие перистальтики и структурная связь с маткой
также могут помочь отличить трубы от других тазовых структур, например
кишечной петли.
Эндометриоз
Эндометриоз возникает при эктопии эндометрия. Эктопированные участ ки
ткани гормонально зависимы и подвержены кровотечению и пролиферации в
соответствии с фазой менструального цикла. Они могут встречаться в любом
месте брюшной полости, но обычно находятся на маточно-крестцовых связ-
ках, серозной поверхности кишечника и париетальной брюшине. Проявлени-
ем этого заболевания обычно является боль внизу живота, которая носит цик-
лический характер. Многие пациентки страдают бесплодием, а рубцевание
вследствие эндометриоза считается причиной хронических тазовых болей.
Острый разрыв эднометриоидной кисты может вызвать внезапную сильную
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
477
Рис. 14.18. А. Пиосальпинкс выглядит как тубулярная структура с эхогенным
содержимым, окружающим расположенный рядом яичник. Б. Многокомпонентное
образование придатков.
боль в животе, которая неотличима от боли, связанной с разрывом кисты яич-
ника или эктопированного плодного яйца [4, 13].
При УЗИ эндометриоз обнаружить трудно, поскольку его очаги нередко
небольшие, с недостаточным акустическим контрастом относительно окру-
жающих структур. При соединении множества кист с образованием поликис-
тозного комплекса (шоколадные кисты) они могут визуализироваться, осо-
бенно при ТВУЗИ. Увеличение объема жидкости в дугласовом пространстве
может свидетельствовать об остром разрыве эндометриоидной кисты [4, 13,
29, 30].
478
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Инородные тело
Внутиматочные средства (ВМС) могут вызывать тазовую боль и являться
причиной нерегулярного месячного цикла и болезненной менструации, а так-
же (редко) приводить к перфорации матки. Проверка наличия и определение
местоположения ВМС крайне необходимы во всех случаях отсутствия «уси-
ков» ВМС и у забеременевших пациенток, ранее установивших ВМС. В по-
следнем случае важно исключить эктопированную беременность, поскольку
ее развитие часто связано с использованием ВМС. Как металлические, так и
неметаллические ВМС легко визуализируются при УЗИ [31]. Они выглядят
как однородная гиперэхогенная структура линейной формы в полости матки
(рис. 14.19). Если ВМС при УЗИ не определяется, для исключения ее внутри-
ВМС
ВМС
Рис. 14.19. ВМС имеет вид гиперэхогенной структуры линейной формы.
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
479
брюшного расположения может быть выполнена обзорная рентгенография
брюшной полости и полости малого таза [4].
Патологическая беременность
Клинический осмотр любой женщины в репродуктивном возрасте должен
включать определение признаков возможной беременности. Соблюдение
этого хорошо известного правила особенно важно при острой боли в животе
у женщин преклимактерического возраста. Не менее важно помнить, что не
всякая боль во время беременности вызвана ее развитием. В любом случае
следует оценить признаки беременности, а при ее наличии убедиться в ее
нормальном течении.
Экспресс-анализ мочи на наличие человеческого хорионического гона-
дотропина (ХГЧ) значительно увеличивает возможности ранней и точной
диагностики беременности. Чувствительный в пределах 50 мкг ХГЧ, этот
качественный тест позволяет обнаружить беременность нередко еще до опре-
деления ее признаков самой пациенткой. Количественное определение ХГЧ
в сыворотке крови для выявления беременности имеет меньшее значение,
но крайне важно для оценки ее срока и развития.
УЗИ является диагностическим средством выбора в оценке симптомов
беременности [32]. В первом триместре ультрасонография может использо-
ваться при оценке боли в животе и кровотечения, для того чтобы помочь от-
личить внутриматочную беременность от эктопированной. УЗИ также ис-
пользуется для определения срока беременности, раннего выявления наруше-
ния развития эмбриона или его гибели. В третьем триместре острое начало
брюшной боли может указывать на отслойку плаценты; а при травме во вре-
мя беременности может понадобиться определение ее срока, положения
плода и его жизнеспособности [4, 33]. Очевидно, что оценка патологической
беременности не является обычной ситуацией для хирурга-сонографиста.
Это обсуждение касается только основных аспектов УЗИ в акушерской прак-
тике. Методики сканирования при УЗИ в акушерстве идентичны описанным
ранее.
Первый триместр беременности
На ранних стадиях беременности сонографическое появление эмбриональ-
ных структур строго определяется сроком беременности. Любое отклонение
от этой нормальной последовательности может указывать на патологиче-
скую беременность [4].
Определение срока беременности. Срок беременности обычно опреде-
ляется по менструальному циклу; 1-й день — это первый день последней
нормальной менструации. По этой схеме овуляция и оплодотворение проис-
ходят приблизительно на 14-й день. Гестационный возраст определяется со-
ответственно как срок от первого дня последней менструации за вычетом
480
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
двух недель [34]. В этой главе все сроки указываются по отношению к сроку
последней менструации (табл. 14.4 и 14.5).
На 14-й день в полости трубы происходит оплодотворение, и формиру-
ется зигота. Зигота начинает перемещаться в направлении матки, а ее им-
плантация начинается на 20-й день. Имплантация завершается к 23-му дню,
после чего начинается формирование желточного мешка. На 28-й день начи-
нается децидуальная реакция, и внутри плодных оболочек формируется вто-
ричный желточный мешок [4, 28].
Визуализация желточного мешка внутри плодных оболочек является
самым ранним сонографическим признаком, указывающим на внутрима-
точную беременность (рис. 14.20). Обнаружение только плодного пузыря в
эндометриальном канале не указывает на внутриматочную беременность.
Обычная децидуальная реакция без формирования вторичного желточного
мешка может быть вызвана беременностью любой локализации. Наличие
псевдоплодных оболочек при эктопированной беременности неверно истол-
ковывается как ранняя внутриматочная беременность, что является наибо-
лее частой причиной нераспознанной сонографистом патологической бере-
менности [4, 28, 35].
Таблица 14.4. Наиболее ранняя визуализация эмбриональных структур
при ультразвуковом исследовании
Структура ТАУЗИ, недели ТВУЗИ, недели
Плодные оболочки 5,5-6 4.5-5
Желточный мешок 6-6,5 5-5,5
Головной и тазовый концы 7 5,5-6
Сердечная деятельность 7 6
Части тела плода > 8 8
Таблица 14.5. Определение срока беременности в первом триместре
по данным ТВУЗИ
Сонографические данные Срок беременности, недели
Плодные оболочки; желточный мешок, эмбрион или сердечная деятельность не определяются 5
Плодные оболочки и желточный мешок; эмбрион или сердечная деятельность не определяются 5,5
Определяются плодные оболочки, сердечная деятельность и эмбрион размером менее 5 мм в длину 6
Плод / эмбрион размером более 5 мм в длину Срок определяется по теменно-крестцовому размеру
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
481
Рис. 14.20. Продольный вид плодных оболочек и желточного мешка при ТАУЗИ при
беременности сроком около 6 недель.
В первые 5—7 недель срок беременности определяется по величине плод-
ного пузыря. Современные сонографы автоматически определяют гестаци-
онный возраст, основываясь на размерах плодного пузыря. На 30-й день
диаметр плодного пузыря составляет 1 мм и должен увеличиваться на 1 мм в
день [11]. К 5 с половиной неделям должен визуализироваться желточный
мешок. На 6-й неделе определяется сердечная деятельность эмбриона. Более
надежный индикатор нормальной ранней беременности — это визуализация
внутриматочного эмбриона с сердечной деятельностью; риск выкидыша на
этой стадии беременности составляет 2-2,3% [4, 36]. Спонтанный аборт яв-
31 Ультразвуковая диагностика...
482
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
ляется наиболее вероятным последствием отсутствия сердечных сокраще-
ний плода.
Эктопированная беременность. Эктопированная беременность опре-
деляется как любая беременность, развитие которой происходит вне поло-
сти матки. Несмотря на то, что трубная беременность возникает наиболее
часто, также наблюдается яичниковая, интерстициальная, цервикальная, кор-
ниальная и брюшная беременность. Частота возникновения эктопированной
беременности составляет 1 случай на 65 беременностей. Факторы риска раз-
вития эктопированной беременности включают в себя болезни, передавае-
мые половым путем, оперативные вмешательства на органах малого таза,
применение внутриматочных средств, недавно выполненный медицинский
аборт, а также случаи внематочной беременности в анамнезе [37].
Типичная пациентка, у которой следует исключить эктопированную бе-
ременность, может быть описана следующим образом: молодая женщина с
положительным (в данное время) тестом на беременность, с признаками ва-
гинального кровотечения и жалобами на боли внизу живота. В большинстве
случаев, менее чем у 15% пациенток с болью или кровотечением в первом
триместре была, в конечном счете, диагностирована эктопическая беремен-
ность [3, 32]. Остальные относились к общей группе случаев с угрозой вы-
кидыша. При ТВУЗИ визуализация желточного мешка в пределах плодного
пузыря может подтвердить внутриматочное развитие беременности уже к 5
с половиной неделям. Если определяется жизнеспособный плод при внутри-
маточной беременности, риск эктопической беременности становится небо-
льшим (гетеротопическая беременность встречается в I случае на 30000
основной популяции и в 1 случае на 5000 женщин детородного возраста)
[38]. Следовательно, основной целью направленного УЗИ является исключе-
ние возможной эктопической беременности, путем подтверждения развития
внутриматочной беременности. Классическая триада ультразвуковых при-
знаков эктопированной беременности (пустая матка, образование яичника и
жидкость в пространстве Дугласа) обнаруживается менее чем в 20% случаев
внематочной беременности (рис. 14.21). Наиболее часто сонографически
определяется пустая матка, а остальные признаки — обычные для беремен-
ной пациентки [4, 39].
Если при ТВУЗИ внутриматочная беременность не подтверждена, то в
таком случае возможны три состояния: эктопическая беременность, нормаль-
ная внутриматочная беременность небольшого срока или патологическая
внутриматочная беременность. Следующим диагностическим шагом является
совместная оценка результатов ТВУЗИ с уровнем бета-хорионического гона-
дотропина человека (рис. 14.22). Внутриматочная беременность должна опре-
деляться на ТВУЗИ при уровне этого гормона в диапазоне 1250-1500 мЕд/мл,
иначе называемого дискриминационной зоной. Если беременность не иден-
тифицирована, данные исследования в остальных отношениях нормальные
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
483
Рис. 14.21. А. Фронтальный вид внематочного плодного пузыря при ТВУЗИ указывает
на эктопированную беременность. Б. Продольное изображение кистозного
образования яичника при ТВУЗИ. Внутриматочный эмбриональный полюс наводит на
мысль о персистирующем желтом теле. В. Продольное изображение значительного
объема жидкости в полости малого таза при ТВУЗИ у пациентки с разрывом
эктопированного плодного яйца.
и уровень ХГЧ ниже 1250 мЕд/мл, пациентка при стабильном состоянии мо-
жет быть выписана с условием проведения повторного УЗИ и определения
уровня ХГЧ через 2 дня. В первом триместре нормально протекающей бере-
менности уровень ХГЧ должен удваиваться каждые 24 36 ч. При эктопиро-
ванной или патологической внутриматочной беременности низкий исход-
ный уровень ХГЧ впоследствии не изменяется, снижается или не удваивается
484
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
за необходимый промежуток времени. Поскольку признаки эктопической бе-
ременности могут появиться при уровне ХГЧ ниже порогового, всех выпи-
санных пациенток необходимо предупредить о том, что при усилении боли,
боли в плечевой области, головокружении или обмороке, а также обнару-
женном кровотечении им следует вернуться в клинику [4, 40].
Если уровень ХГЧ превышает дискриминационный порог и признаки
внутриматочной беременности не определяются, у пациентки предполагает-
ся наличие эктопической беременности; должна быть проведена гинеколо-
гическая консультация. В действительности, у большинства таких пациен-
ток обнаруживается патологическая неэктопированная беременность, на-
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
485
пример несостоявшийся выкидыш или гибель плодного яйца [41]. Лечебная
тактика зависит от срока беременности (определяется по уровню ХГЧ и сро-
ку последней менструации) и клинической стабильности пациентки, а также
от того, желательна беременность или нет. Может быть выбрано активное
наблюдение, терапия метотрексатом или лапароскопия.
Второй и третий триместры патологической беременности
Формально, УЗИ во втором и третьем триместрах сосредоточивается, прежде
всего, на оценке роста и развития плода; эта тема выходит за рамки главы и
здесь не рассматривается. На этих стадиях целенаправленное исследование
486
14. ГИНЕКОЛОГИЯ/АКУШЕРСТВО
Ультразвуковое исследование
(трансабдоминальное / трансвагинальное)
Определяется
Определяется
Неопределенное
внутриматочная беременность
Оценка жизнеспособности
плода, возраста
Интерпретация жалоб
Определение резус-фактора
Сбор акушерского
состояние
Определение уровня ХГЧ
эктопированная беременность
I
Предоперационные
лабораторные анализы
Срочная гинекологическая
консультация
и гинекологического анамнеза
<1500 -------------------
Повторное определение уровня ХГЧ через 48 ч
Настороженность в отношении эктопии*
При нестабильном состоянии срочная
гинекологическая консультация
-------- >1500
I
Гинекологическая консультация
Наблюдение за беременностью
с выполнением повторных УЗИ,
анализов уровня ХГ4, если беременность
желательна, в противном случае
медикаментозное лечение,
лапароскопия или лапаротомия
*пациентка немедленно возвращается в клинику при усилении боли, кровотечении, боли в плечевой
области, головокружении или обмороке
Рис. 14.22. Диагностическая и лечебная тактика в первом триместре беременности
при стабильном состоянии пациентки с вагинальным кровотечением или тазовой
болью.
фокусируется на определении гестационного возраста, жизнеспособности
плода, а также причин кровотечения или болей в третьем триместре.
Наиболее точное определение гестационного возраста возможно в тече-
ние первого триместра [4]. Точность дальнейших измерений прогрессивно
снижается. Большинство ультразвуковых аппаратов может определять гес-
тационный возраст, основываясь на ряде измерений, включая окружность
головки плода, ее бипариетальный размер и длину бедра. Чтобы оценить
развитие плода, должна быть получена диаграмма роста. УЗИ позволяет
точно определить частоту сердечных сокращений и движение эмбриона и
предоставляет важную информацию о жизнеспособности и состоянии пло-
да, что может быть особенно важно во время реанимационных мероприятий
при травме матери, когда необходимо учитывать и состояние матери, и со-
стояние плода.
Кровотечения в третьем триместре связаны с двумя основными диагно-
зами: предлежанием плаценты и отслойкой плаценты. При этом только от-
слойка является действительно критическим медицинским состоянием. От-
слойка плаценты наблюдается при ее отделении от места имплантации еще
до родов. На 500 беременных женщин с такими факторами риска как травма,
кокаинизм, курение, сосудистые заболевания и гипертония, приходится один
случай отслойки плаценты [11, 28]. Необходимо подчеркнуть, что отслойка
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
487
плаценты это, прежде всего, клинический диагноз. В классическом случае
пациентка страдает от сильной боли, у нее определяется вагинальное крово-
течение и резкое ухудшение состояния плода. В этой ситуации кесарево се-
чение должно быть выполнено без задержки, связанной с ожиданием ульт-
расонографического подтверждения диагноза. Однако, если диагноз неясен,
УЗИ может обеспечить получение дополнительной диагностической инфор-
мации. Присутствие эхонегативной крови между стенкой матки и плацен-
той— редкий, но надежный диагностический признак (рис. 14.23). Другие
ключевые признаки включают в себя утолщение плаценты, появление внут-
риплацентарных анэхогенных зон и взвеси в амниотической жидкости. От-
рицательные диагностические данные не исключает отслойку, потому что
значимые участки отделения плаценты могут быть просто не замечены.
Наиболее чувствительные показатели отслойки — это соответствующее кли-
нические данные и признаки патологического состояния плода.
Рис. 14.23. Отслойка плаценты. Перепечатано с разрешения Haden-Ansert [11]
488
14. ГИНЕКОЛОГИЯ / АКУШЕРСТВО
ЗАКЛЮЧЕНИЕ
Целенаправленное УЗИ играет важную роль и широко применяется в хирур-
гической оценке состояний, вызывающих внутрибрюшную и тазовую боль.
Ультрасонография часто улучшает анатомическое понимание многих гине-
кологических и акушерских заболеваний, которые могут усложнять выбор
хирургической тактики у женщин, приводя к выполнению ненужных иссле-
дований, задержке лечения и неудовлетворению пациентки.
ССЫЛКИ
1. Carter J, Fowler J, Carson L et al. How accurate is the pelvic examination as
compared to transvaginal sonography. J Reprod Med 1994;39:32-34:
2. Vine HS, Birholz JC. Ultrasound evaluation of pelvic pain. JAMA 1980;
244:2540-2542.
3. Kaplan BC, Dart RG, Moskos M, et al. Ectopic pregnancy: prospective stu-
dy with improved diagnostic accuracy. Ann Emerg Med 1996;28:10.
4. Mendelson ED, Bohn-Veelez M, Joseph N, Nieman HL. Gynecologic ima-
ging: comparison of transabdominal and transvaginal sonography, Radiolo-
gy 1988;168:639-643.
5. Emanuel MH, Ankum WM, Verdel MJ et al. The reproducibility of the re-
sults of transvaginal sonography of the uterus in patients with abnormal ute-
rine bleeding. Ultrasound Obstet Gynecol 1996;8:346 349.
6. Bulas D, Ahlstom, P, Sivit CJ, et al. Pelvic inflammatory disease in the ado-
lescent: comparison of transabdominal and transvaginal sonographic evalu-
ation. Radiology 1992;183:435-439.
7. Nguyen H, Snoey E. Gynecology. In: Simon B, Snoey E, eds., Ultrasound in
emergency and ambulatory medicine. St Louis: Mosby, 1997:76 104.
8. Fleischer AC, Roberto R, Manning F, et al. The principle and practice of ult-
rasonography in obstetrics and gynecology. East Norwalk: Appleton & Lan-
ge, 1991.
9. Spandorker SD, Barnhart KT. Endometrical stripe thickness as a predictor
of ectopic pregnancy. Fert Steril 1996;66:474-176.
10. Brooks SE, et al. Thickened endometrial stripe and/or endometrial fluid as a
marker of pathology: fact or fancy. Gynecol Oncol 1996;63:19-24.
11. Hagen-Ansert SL. Textbook of diagnostic ultrasonography. 4th ed. St Lou-
is: Mosby, 1995;853-856.
12. None noted. Splanchnology: reproductive organs of the female. In: Willi-
ams PM, Warwick R, eds., Gray's anatomy. Edinburgh, UK: Churchill Li-
vingston, 1980:1426-1430.
13. Heller M, Jehle D. Ultrasound in emergency medicine. Philadelphia: Saun-
ders, 1995; 172-174.
ссылки
489
14. Hall DA. Sonographic appearance of normal ovary, of polycystic disease
and of functional ovarian cysts. Semin Ultrasound 1983;4:149-151.
15. Hackeloer BJ. Ultrasound scanning of the ovarian cycle. J In Vitro Fert Em-
bryo Transf. 1984;1:217-220.
16. Ritchie W. Ultrasound evaluation of normal and induced ovulation. In: Cal-
len PW, ed., Ultrasonography in obsetric and gynecology. 3rd ed. Philadelp-
hia: Saunders, 1994;509-585.
17. Hall DA, Hann LE, Ferrucci JT, et al. Sonographic morphology of the nor-
mal menstrual cycle. Radiology 1979;133:185-188.
18. Sutton CL, McKinney CD, Jones JE, Gray SB. Ovarian masses revisited: ra-
diologic and pathologic correlation. Radiographics 1992;12:853-877.
19. Reynolds T, Hill MC, Glassman LM. Sonography of hemorrhagic ovarian
cysts, J Clin Ultrasound 1986;14:440-453.
20. Hallat JG, Steele CH, Snyder M. Ruptured corpus luteum with hemoperito-
neum: a study of 173 surgical cases. Am J Obstet Gynecol 1984; 149:5-9.
21. Itskovitz J, Brandess JM, Urbach J, et al. Ovarian hematoma and hemoperi-
toneum complicating anticoagulant therapy. Int Surg 1982;67(supp):
533-534.
22. Hibbard LT. Adnexal torsion, Am J Obstet Gynecol 1985; 152:456 161.
23. Lomano JM, Trelford JD, Ullery JC. Torsion of the uterine adnexa causing
acute abdomen. Obstet Gynecol 1970;35:221-225.
24. Helvic MA, Silver TM. Ovarian torsion: sonographic evaluation. J Clin Ult-
rasound 1989;17:327-332.
25. Filly RA. Ovarian masses: what to look for, what to do. In. Callen PW, ed.,
Ultrasonography in obstetrics and gynecology. 3rd ed. Philadelphia: Saun-
ders, 1994:625-640.
26. De Priest PD, Varner E, Powell, J, et al. The efficacy of a sonographic morp-
hology index in identifying ovarian cancer: a multi-institutional investigati-
on. Gynecol Oncol 1994;55:174-178.
27. Hermann UJ, Locher GW, Goldhirsch A. Sonographic patterns of ovarian
tumors: prediction of malignancy. Obstet Gynecol 1987;69:777-781.
28. Rumack C, Wilson S, Charboneau JW. Diagnostic ultrasound. 3rd ed. St
Louis: Mosby, 199l;689—721.
29. Friedman AJ, Volgclzang RL, Mendelson EB, et al. Endometriosis detecti-
on by US with laparoscopic correlation, Radiology 1985;157:217-220.
30. Coleman BG. Transvaginal sonography of adnexal masses. Radiol Clin
North Am 1992;30:677-691.
31. Hall DA, Yoder IC. Ultrasound evaluation of the uterus. In: Callen PW, ed.,
Ultrasonography in obstetrics and gynecology. Philadelphia: Saunders,
1997;586-614.
490
14. ГИНЕКОЛОГИЯ / АКУШЕРСТВО
32. Braffman ВН, Coleman BG, Ramchandani P, et al. Emergency department
screening for ectopic pregnancy: a prospective US study. Radiology 1994;
190:797 802.
33. Barnhart K, Mennuti MT, Benjamin I, et al. Prompt diagnosis of ectopic
pregnancy in an emergency department setting, Obstet Gynecol
1994;84:1010-1015.
34. Jehle D, Davis E, Evans T, et al. Emergency department sonography by
emergency physicians. Am J Emerg Med 1989;7:605-611.
35. Timor-Tritsch I, Greenidge S, Admon D, et al. Emergency room use of tran-
svaginal sonography by obstetrics and gynecology residents. Am J Obstet
Gynecol 1992;166:866-872.
36. Abbot J, Emmans LS, Lowenstein SR. Ectopic pregnancy: ten common pit-
falls in the diagnosis. Am J Emerg Med 1990;8:515-522.
37. Abbott J. Complications related to pregnancy. In Rosen P, ed., Emergency
medicine: concepts and clinical practice. St Louis: Mosby, 1992;
2342-2364.
38. Cacciatore B, Stenman UH, Ylostalo P. Early screening for ectopic pre-
gnancy in high risk symptom free women. Lancet 1994;343:517-518.
39. Ledger WL, Sweeting UH, Chatterjee S. Rapid diagnosis of early ectopic
pregnancy in an emergency gynecologic service-are measurements of pro-
gesterone, intact and free beta human chorionic gonadotropin helpful? Hum
Reprod 1994;9 157-160.
40. Klee GG. Human chorionic gonadotropin. Mayo Clin Proc 1994:69:
391-392.
41. Dart R, et al. Normal intrauterine pregnancy is unlikely in emergency depar-
tment patients with either menstrual days > 38 days or В HCG > 3000
mlU/ml, but with out a gestational sac on ultrasound. Acad Emerg Med
1997;4:967-971.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
СОСУДОВ
15
Лоуренс Дж. Голдштейн и Лаура С. Уилбур
ТЕРМИНОЛОГИЯ
Первым шагом в изучении УЗИ сосудов является понимание различия между
тремя терминами: ультразвук, допплер и дуплекс. Ультразвук — это разно-
видность звука, который нельзя услышать, потому что его частота выше час-
тоты, воспринимаемой человеческими органами слуха. Любой звук с часто-
той выше 20 кГц считается ультразвуком. Современные ультразвуковые ап-
параты используют частоты в пределах 1-30 МГц, но обычно частотный
диапазон составляет 2-10 МГц.
Допплерометрия — это измерение изменения частоты, вызванное пере-
мещением отражателя звука, например клеток крови. Чтобы обнаружить из-
менения частоты при допплерометрии, используется ультразвук; но это.
очевидно, не эквивалентно самому ультразвуку. При УЗИ сосудов использу-
ется эффект Допплера, чтобы создать комплексное изображение на основе
ультразвука. Вспомните изменение гудка поезда по мере его приближения
или удаления. Такое изменение высоты звука называют допплеровским эф-
фектом.
Дуплекс означает «два в одном» (частица du — «два», plex — «склады-
вать»). В ультразвуковом понимании, дуплекс — это объединение изобра-
жения в В-режиме и допплерографии. Некоторые специалисты при УЗИ со-
судов используют термин триплекс. Триплекс означает дополнение стан-
дартного дуплексного сканирования цветом для отображения величины и
направления доплеровских изменений.
Сканирование сосудов и допплерография представляют собой широкую
и сложную область клинического исследования. В этой главе рассматрива-
Ultrasound in Surgical Practice Basic Principles and Clinical Applications, Edited by Jay K. Harness
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
492
15 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
ются только основы такого исследования. Нашей целью было описание фи-
зических основ допплеровского эффекта и обсуждение клинического при-
менения ультразвуковой допплерографии.
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
Вообразите непрерывный источник звука, испускающий неизмененный си-
нусоидальный сигнал с длиной волны 1 (рис. 15.1). Как только звук достигает
приемника,/н считается частотой источника (/н =/,). Если источник смещает-
ся в направлении наблюдателя, произведенные им волны будут сближаться
около наблюдателя (точка а на рис. 15.2) и расходиться друг от друга при уда-
лении от него (точка б). Поскольку частота, которую воспринимает наблюда-
тель, зависит от числа дошедших до него волн за определенный промежуток
времени,/,, частота, слышимая наблюдателем, будет выше, чем фактическая
исходная частота источника/,, в точке а и ниже в точке б. Разница между вос-
принятой и исходной частотами и есть допплеровская частота, появление ко-
торой вызвано движением источника звука.
Допплеровская частота = fn
(15.1)
Определение допплеровской частоты
Если источник звука остается неподвижным, а наблюдатель движется к нему
и от него, он будет слышать больше и меньше волн в секунду соответственно,
ЗВУКОВЫЕ волны
Рис. 15.1. При неподвижном камертоне с частотой звучания и неподвижном
приемнике звука звук воспринимается с той же частотой (fH).
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
493
ЗВУКОВЫЕ ВОЛНЫ
Рис. 15.2. Если вибрирующий камертон движется к наблюдателю (со скоростью v„), в
направлении движения волны становятся ближе друг к другу и дальше друг от друга
при их распространении в противоположенном направлении. Наблюдатель
воспринимает частоту камертона как более высокую в точке а и как более низкую в
точке б.
Рис. 15.3. Если наблюдатель движется к неподвижному источнику звука со скоростью
Vo, он слышит звук более высокой частоты, чем частота источника
494
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
и звук будет восприниматься как более высокий или низкий по сравнению с
исходной частотой (рис. 15.3). Такая закономерность не имеет значения при
УЗИ сосудов, за исключением случаев возникновения артефактов, поскольку
движения ультразвукового датчика или наблюдателя не определяются по до-
пплеровской частоте. Математически изменение допплеровской частоты мо-
жет быть представлено как
/н
_/и(с ±vo)
(с+ v„)
(15.2)
где с — скорость звука в среде, vo—скорость, с которой наблюдатель переме-
щается к источнику звука, и v„ — скорость, с которой источник звука переме-
щается к наблюдателю.
Современные ультразвуковые аппараты посылают в ткани ультразвуко-
вые волны. Некоторая часть ультразвуковой энергии возвращается к источ-
нику, в основном это отражение происходит вследствие различной способ-
ности тканей проводить звук и возникает на границе между ними (см. гл. 1).
Возвращенные ультразвуковые волны называют эхом, а ткани, которые по-
рождают эхо, называют отражателями.
Если отражатели неподвижны относительно источника ультразвука, ча-
стота возвращенного эха будет та же, что и частота переданного сигнала
(рис. 15.4 А). Когда отражателями являются красные клетки крови и их дви-
жение направлено к датчику, частота возвращенного эха будет выше (поло-
жительное изменение частоты), чем первоначальное ультразвуковое излуче-
ние (рис. 15.4 Б). Когда кровь течет от источника ультразвука, возвращен-
ное эхо будет более низкой частоты (отрицательная допплеровская частота),
чем излучение источника (рис. 15.4 В). Математически изменение частоты
описывается уравнением Допплера (рис. 15.5):
= 2/“',C°se (15.3)
С
где/л — допплеровская частота, б — острый угол между лучом ультразвука и
потоком жидкости ис — скорость ультразвука в данной среде (принятая рав-
ной 1540 м/с для всех тканей). Коэффициент 2 в верхней части выражения
введен потому, что звуковые волны до их регистрации должны преодолеть
путь от датчика до отражателя и затем вернуться назад; таким образом, дис-
танция от датчика до отражателя удваивается.
Если частота ультразвукового датчика fK равна 7 МГц, а кровь движется
по направлению к датчику со скоростью 1 м/с, приемник (при 0 = 0) получит
переданное с частотой 7 МГц излучение и дополнительно к нему (из-за пе-
ремещения крови) 9,091-кГц доплеровской частоты (рис. 15.6 А). Проверь-
те, подставив эти числа в уравнение Допплера (уравнение 15.3). Если ско-
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
495
Рис. 15.4. А. И датчик и отражатель (печень) неподвижны; таким образом, 6 = /н
Б. Датчик неподвижен, но отражатели (клетки крови) перемещаются к датчику; таким
образом, fH> f„. В. Датчик неподвижен, но отражатели (клетки крови) перемещаются от
датчика; таким образом, fH < fK.
рость движения крови увеличивается до 2 м/с, допплеровская частота также
удваивается, что подтверждается уравнением 15.3 (рис. 15.6 Б). К сожале-
нию, если частота излучения источника fK возрастает, допплеровская часто-
та fa также увеличивается, несмотря на неизменную скорость крови, что вид-
но из уравнения 15.3 (рис. 15.7).
Зависимость допплеровской частоты от частоты источника описывает-
ся уравнением Допплера для скорости:
v -—----
2/и cos6
(15 4)
Поскольку скорость пропорциональна отношению изменения допплеров-
ской частоты и частоты источника, зависимость изменения допплеровской
частоты нивелируется изменением частоты источника звука. Многие специа-
листы в УЗИ сосудов сообщают о том, что избежать неверной трактовки дан-
ных, вызванной изменением скорости кровотока, удается только при измене-
нии частоты датчика.
Измерение скорости потока крови
Изменение допплеровской частоты пропорционально cos 0, поскольку дат-
чик улавливает скорость клетки крови (фактическое изменение частоты) по
отношению к нему, однако ультрасонографист заинтересован в измерении
скорости по отношению к сосуду. Поэтому при определении датчиком скоро-
496
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Отражатели перемещаются от источника
Рис. 15.4. (Продолжение.)
ста в направлении потока крови необходимо принимать во внимание угол
сканирования. Чем острее угол сканирования 0, тем больше изменение до-
пплеровской частоты, потому что, когда величина угла б приближается к
нулю, его косинус приближается к 1; но фактическая скорость крови опреде-
ляется вне зависимости от угла сканирования, выбранного исследователем
(рис. 15.8).
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
497
Рис. 15.5. Параметры уравнения Допплера.
f„= 7 МГц
(переданная
частота)
-Ультразвуковой датчик 7 МГц
(переданная (допплеровская
частота) частота)
ffl= 7 МГц + 9,091 кГц
(частота
отраженного
сигнала)
7 009 091
Рис. 15.6. А. Положительное изменение допплеровской частоты, вызванное
движением клеток крови к датчику. Б. Удвоение скорости кровотока приводит к
увеличению допплеровской частоты вдвое.
32 Ультразвуковая диагностика ...
498
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
(переданная
частота)
1Д= 7 МГц
— Ультразвуковой датчик 7 МГц
f„= 7 МГц
(переданная
частота)
(допплеровская
частота)
+ 18,181 кГц
(частота
отраженного
сигнала)
7 018 181 Гц
Клетки крови
Сосуд
v = 2 м/с
Рис. 15.6. (Продолжение.)
Рассеивание луча
Клетки крови намного меньше длины ультразвуковой волны (120 р по срав-
нению с ~0,1 мм при 5 МГц); их импеданс по сравнению с окружающими тка-
нями низкий, поэтому они слабо отражают ультразвук. Интенсивность эха
пропорциональна четвертой части интенсивности ультразвука, и это свойст-
во может дать преимущество при анализе возвращенного сигнала низкого
уровня. Клетки крови обладают таким свойством и называются рассеивате-
лями лучей.
Допплеровские режимы
Существует два типа допплеровского возбуждения: непрерывная волна (НВ)
и пульсовое излучение (ПИ). Ультразвуковые кристаллы всегда участвуют в
создании НВ и только очень короткое время в ПИ (обычно около 1%).
НВ-допплеровские кристаллы всегда активны, поэтому их называют не-
прерывными. Таким образом, в набор должны входить два кристалла, пото-
му что один из кристаллов все время генерирует ультразвуковую волну, а
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
499
Ультразвуковой датчик 7 МГц
f„= 7 МГц =.g V
(переданная ===
частота)
(переданная (допплеровская
частота) частота)
7 МГц + 9,091 кГц
(частота
отраженного
сигнала)
7 009 091 Гц
V = 1 м/с
Ультразвуковой датчик 10 МГц
fM= 10 МГц
(переданная
частота)
v = 1 м/с
(переданная
частота)
10 МГц
(допплеровская
частота)
12,987 кГц
Клетки крови
...Сосуд
(частота
отраженного
сигнала)
10 012 9В7 Гц
Рис. 15.7. Увеличение частоты ультразвукового излучения приводит к увеличению
частоты отраженного сигнала, даже при постоянной скорости кровотока.
500
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.8. Изменение допплеровской частоты (F cos 0) зависит от угла сканирования 0;
уменьшение угла сканирования приводит к увеличению допплеровской частоты. Это
изменение максимально при 0 = 0. F определяется из уравнения Допплера (15.3)
перед умножением на cos в.
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
501
другой всегда ее получает. Примером НВ-устройства может служить до-
пплеровский датчик. Если посмотреть на рабочий конец допплеровского
датчика с близкого расстояния, можно увидеть два расположенных напро-
тив друг друга элемента (рис. 15.9). К сожалению, мы не можем выбирать
определенную область сканирования НВ-допплером, что делает его менее
полезным, чем инструмент с ПИ. Так, например, при НВ-допплерографии
все сосуды при ультразвуковом сканировании возвратят к датчику смешан-
ное эхо, состоящее из сигналов, отраженных как от артерий, так и от вен.
Пульсовая допплерография действует по другому принципу. Каждый
датчик использует много кристаллов (в среднем около 100). Каждый крис-
талл передает ультразвук только в определенный для него временной отре-
зок, а в остальное время получает отраженный сигнал. Тот же элемент, кото-
рый генерирует ультразвуковой луч, мгновением позже получает его эхо.
Это позволяет управлять всем множеством кристаллов с помощью электро-
ники и в реальном времени получать двухмерное изображение и допплеров-
ские данные.
Элементы возбуждаются таким образом, чтобы создать управляемый
луч, сканирующий через ткани исследуемой области (см. гл. 1). Кроме фор-
Рис. 15.9. При НВ-допплерографии эхо возвращается от всех структур, на которые
падает ультразвуковой луч, что затрудняет сканирование определенного сосуда или
его участка.
502
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
мирования изображения в В-режиме, для вычисления скорости потоков в
областях, выбранных ультрасонографистом, в пределах этого изображения
применяется уравнение Допплера.
Например, изменение допплеровской частоты или скорости может быть
отображено графически в реальном времени цветом, что называется спект-
ральным анализом; каждый цвет соответствует различной скорости или час-
тоте. Помните, что если вы знаете изменение частоты, то, используя уравне-
ние (15.4), можно вычислить скорость движения крови. В каждый момент
времени и в каждой точке трехмерного потока скорость крови непрерывно
изменяется с сердечным циклом и в зависимости от того, с чем она контак-
тирует. Если сканируется обширная область потока крови, одновременно
может быть представлен широкий спектр скоростей. Далее объясняется, как
допплеровская аппаратура отображает спектр скорости потока для пользо-
вателя.
На рис. 15.10 показан спектральный анализ потока крови, ограниченно-
го заданными рамками в пределах сосуда. Этот поток трехфазовый. По оси
Y показана скорость (или частота), по оси X — время. Когда изменение до-
пплеровской частоты положительно, кровь движется к датчику и волна фор-
мируется выше нулевого уровня. Это происходит в систолу и в раннюю диа-
столу. Когда волна находится на нулевом уровне, кровь не перемещается ни
в направлении датчика, ни от него — она неподвижна. Когда кровь движет-
ся от датчика, формирование волны происходит ниже нулевого значения
оси, что указывает на отрицательное изменение допплеровской частоты.
В третьей фазе (поздняя диастола) кровоток вновь меняет направление и
снова движется к датчику. Каждая из частей графика называется фазой; а
так как отдельная волна проходит три из них, она называется трехфазовой.
Обратите внимание, что след волны не может быть отражен единствен-
ной тонкой линией, и его толщина изменяется. В каждый момент времени
отображается мультичастотный спектр, что соответствует различным ско-
ростям потока в области интереса, ограниченной двумя линиями. На яр-
кость или цвет этого отображения влияет не только скорость крови, но и от-
носительное число клеток, перемещающихся с различной скоростью. В этом
примере движущиеся с определенной скоростью эритроциты будут отобра-
жаться тем ярче, чем большее их число движется с данной скоростью. Тем-
ные области будут соответствовать небольшому числу клеток, перемежаю-
щихся с одной скоростью.
Заданный объем
При небольшой области интереса формируется тонкая спектральная волна,
потому что большинство эритроцитов в пределах этой области перемещается
с одинаковой скоростью. Если объем или границы области увеличатся, фор-
ма спектральной волны расширится (утолщится), потому что применение
ФИЗИЧЕСКИЕ ОСНОВЫ ЭФФЕКТА ДОППЛЕРА
503
Рис. 15.10 Спектральный анализ скорости на небольшом участке (ограниченном
курсорами) сосуда.
уравнения Допплера ко всем клеткам крови в пределах этой области приведет
к отображению клеток, движущихся с различными скоростями. Например, в
ламинарном потоке его центральная часть перемещается с наибольшей ско-
ростью, которая параболически уменьшается в направлении стенок сосуда.
Это происходит из-за высокой силы трения между клетками крови и непо-
движной интимой, по сравнению с силой трения, возникающей только между
клетками крови (рис. 15.11). Кровь в центре потока перемещается ламинарно
с наибольшей скоростью, в то время как кровь около стенки сосуда движется
с наименьшей скоростью. Если заданная область измерения охватывает весь
поток, на мониторе ультразвукового аппарата отображаются все скорости от
самой медленной до самой быстрой. Соотношения эритроцитов, перемещаю-
щихся с различными скоростями, аппарат показывает разной яркостью. На
рис. 15.12 с целью ориентации показаны результаты типичной допплерогра-
фии. Датчик расположен сверху изображения на линии Т. Косая пунктирная
линия (/) соответствует направлению спектрального допплеровского луча.
Две короткие параллельные линии (g) ограничивают область измерения ско-
рости потока, которую можно изменять. Длинная ломаная линия (а), распо-
ложенная с обеих сторон этой области, служит для корректировки угла и должна
быть расположена параллельно направлению потока. Правильное располо-
504
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
жение этой линии важно для правильного вычисления скорости. Острый
угол, созданный линиями а и / (угол 0), используется в уравнении Допплера.
Поток окрашивается цветом только в пределах области (с), выбранной поль-
зователем. Значение цвета в допплерографии детально будет объяснено в
этой главе позже.
Когда спектральный след тонок, большинство эритроцитов перемеща-
ется с одинаковой скоростью. Утолщение следа известно как спектральное
Рис. 15.11. Ламинарный (параболический) поток. Длина стрелок пропорциональна
относительной скорости кровотока
Рис. 15.12 Определение обозначений при допплерографии. Рисунок приведен также
на цветной вклейке
КЛИНИЧЕСКИЕ ПРИМЕРЫ
505
расширение. Если спектральное расширение не создано артефактами, это
признак стеноза.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
Результаты УЗИ могут быть неверно истолкованы. Квалифицированный спе-
циалист может выполнить ультразвуковую визуализацию так. что повреж-
денная область при спектральном анализе будет выглядеть как неповрежден-
ная. Тот же человек может добиться такой визуализации неизмененной обла-
сти, чтобы она выглядела измененной. К сожалению, специалист низкой
квалификации может совершить такие «подвиги» случайно. Понимание основ-
ных принципов УЗИ и внимательное изучение вспомогательных клиниче-
ских примеров поможет предотвратить наиболее распространенные ошибки.
На рис. 15.13 А представлено цветное дуплексное ультразвуковое изоб-
ражение фантомной модели, на котором представлена четко определяемая
стенка сосуда, так называемая двойная линия Pignoly, ламинарный кровоток
в просвете сосуда и окружающие мягкие ткани. Такая ясность и точность де-
талей не обычны для клинической практики. На рис. 15.13 Б представлена
другая крайность — преобладание фоновых сигналов, отсутствие даже кос-
венных признаков изображения сосудистой стенки и ламинарного кровотока.
Ламинарный поток
Идеальный поток крови — ламинарный (рис. 15.11). В центре потока силы
трения минимальны, и поэтому скорость крови здесь самая быстрая. По мере
приближения клеток крови к стенкам сосуда сила трения увеличивается, что
приводит к снижению скорое™. Измерение скорости в центре потока указы-
вает на то, что здесь она самая высокая. У стенок сосуда скорость более низ-
кая. Поскольку стенка сосуда не перемещается в продольном направлении, ее
сканирование должно показать нулевую скорость. Все это отчетливо изобра-
жено на рис. 15 14. В центре сосуда цвет, отображающий скорость, — жел-
тый, соответствует самой высокой скорости по цветовой карте. Ближе к стен-
кам сосуда цвет переходит в красный, что указывает на снижение скорости;
область стенки сосуда — черная (нет кровотока). В действительное™, поток
крови не может быть ламинарным, но при усреднении скоростей выглядит
именно так (рис. 15.15А). При этом возникает гомогенное окрашивание (рис.
15.15Б), потому что скорость крови относительно одинаковая во всех точках
сечения, кроме области, соответствующей стенке сосуда, где она нулевая по
определению.
Аппроксимация цвета
Чтобы ультразвуковой аппарат мог показать цветовое распределение, изме-
нение допплеровской частоты должно быть измерено в каждой точке облас-
506
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.13. А,. Цветное дуплексное сканирование фантомной модели. Обратите
внимание на четкость изображения. Печатается с любезного разрешения Goldberg и
соавторов [1]. Б. Трудно различимое дуплексное изображение вен нижней конечности.
Рис. 15.14. Цветное дуплексное изображение ламинарного кровотока в общей сонной
артерии. Детальное объяснение в тексте. Рисунок приведен на цветной вклейке.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
507
Рис. 15.15. А. В усредненном потоке его составляющие движутся приблизительно с
одинаковой скоростью, кроме участков, прилежащих к стенке сосуда, где эта скорость
снижается. Б. Гомогенная окраска усредненного потока. Рисунок приведен на цветной
вклейке.
ти, ограниченной заданным параллелограммом. Все, что не движется внутри
этой области, отображается в обычной шкале серого цвета В-режима. Но, по-
скольку угол q в каждой точке потока изменяется, вычисление изменения ча-
стоты с помощью уравнения Допплера в реальном времени без мерцания или
задержки изображения из-за перегруженного процессора было бы техноло-
гическим подвигом. Для преодоления этого используются более быстрые, но
менее точные методы вычисления, позволяющие определить скорость и на-
правление потока крови. Такие методы называются автокорреляцией и квад-
ратурой соответственно. Поэтому окрашивание цветом указывает только на
наличие и направление кровотока с грубой оценкой его скорости. Изменение
508
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
цвета при различных углах сканирования сосуда в условиях неменяющегося
кровотока может вводить в заблуждение неопытного исследователя. I Цветное
окрашивание не предназначено для замены спектрального анализа. Оно должно
использоваться как визуальная помощь для ориентировки исследователя и
выявления областей, требующих более глубокого изучения.
Цвет и угол луча
Если датчик размещен перпендикулярно к кровеносному сосуду, то поток
крови справа от центра в точке а на рис. 15.16 определяется как приближаю-
щийся к датчику, а слева от центра, в точке в — как удаляющийся от него.
В центре, в точке б, датчик не может определить направление движения кро-
ви, потому что скоростная составляющая по отношению к датчику равна
нулю (cos 90° = 0) (рис. 15.17). Слева от средней линии регистрируется поло-
жительная скорость, направленная к датчику; справа — отрицательная, на-
правленная от датчика. В центре устройство либо правильно отобразит нуле-
Рис. 15.16. Объяснение негомогенного окрашивания части просвета сосуда,
перпендикулярной ультразвуковому датчику. Детальное объяснение в тексте.
Рисунок приведен на цветной вклейке.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
509
Рис. 15.17. Цветное дуплексное изображение артериального кровотока. Детальное
объяснение в тексте. Рисунок приведен на цветной вклейке.
вую скорость (черная линия), либо не сможет ее определить. В последнем
случае на изображении могут возникнуть артефактные области округлой
формы (рис. 15.17).
На рис. 15.18 показан результат сканирования изогнутой общей сонной
артерии. Обратите внимание на то, что цвета, отображающие кровоток, на-
правленный к датчику, — это оттенки синего, а цвета, отображающие кро-
воток, направленный от датчика, — это оттенки красного. Между этими на-
правлениями кровотока имеется тонкая черная линия, потому что даже в не-
прерывном потоке при изменении направления существует точка, в которой
кровь не движется по отношению к ультразвуковому лучу (т. е. изменение
частоты здесь не определяется).
Оценка стеноза в В-режиме и при спектральном анализе
Можно было бы предполагать, что УЗИ окажется полезным для непосредст-
венной визуализации зоны артериального стеноза. Однако, несмотря на
возможность сканирования сосуда в различных плоскостях, в двухмерных
изображениях легко обмануться (рис. 15.19). Например, бывает трудно
определить местонахождение внешнего контура сосуда, так как он может
сливаться с переадвентициальными тканями. На «неправильных» попереч-
ных сечениях или продольных изображениях вне центральной зоны сосуда
можно получить ложное представление о трехмерном виде области стеноза.
Некоторые бляшки могут быть гипоэхогенными, что затрудняет их визуа-
510
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.18. Цветное дуплексное изображение изогнутой общей сонной артерии.
Детальное объяснение в тексте. Рисунок приведен на цветной вклейке.
лизацию. При небольшой степени сужения (менее 50%), если бляшка визуа-
лизирована, двухмерные сечения дают достаточно точную информацию.
Однако при более выраженных стенозах для точной оценки необходимы
другие критерии. В настоящее время критерии оценки стеноза артерий или
трансплантатов основаны на спектральном анализе. Классические исследо-
вания показали, что при увеличении стеноза происходят предсказуемые из-
менения пиковой систолической скорости (ПСС) и конечной диастоличе-
ской скорости (КДС), а также спектральное расширение. Периферическая
артериальная окклюзия может быть оценена по этим трем параметрам
(табл. 15.1).
На рис. 15.20 показано, что может происходить при артериальном сте-
нозе. Проксимальнее стеноза кровоток может быть ламинарным (или пря-
молинейным), в зависимости от степени стеноза. Ниже места стеноза скорость
кровотока может быть снижена. В центральной зоне стеноза максимальная сис-
толическая скорость увеличивается. Около бляшки могут формироваться за-
вихрения или выявляться зоны отсутствия кровотока, которые исчезают
сразу ниже места стеноза. На рис. 15.21 показано цветное дуплексное изоб-
ражение стеноза левой поверхностной бедренной артерии с характерными
признаками стеноза.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
511
ПЕРЕОЦЕНКА СТЕПЕНИ СТЕНОЗА
НОРМАЛЬНЫЙ СОСУД ВЫГЛЯДИТ
ОККУПИРОВАННЫМ, ПОСКОЛЬКУ СЕЧЕНИЕ
НАХОДИТСЯ ВНЕ ЕГО ОСИ
Рис. 15.19. Выбор неправильной плоскости сканирования может привести к
недооценке или переоценке степени стеноза или к его нераспознаванию. В худшем
случае нормальный сосуд может быть признан окклюзированным.
ПРОПУЩЕНО ИЗЪЯЗВЛЕНИЕ
И НЕДООЦЕНЕН СТЕНОЗ
512
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Таблица 15.1. Классификация заболеваний периферических артерий на
основе спектрального анализа формы волны (в модификации Zwiebel [2])
Классификация Критерии
Нет стеноза Трехфазная волна, спектральное расширение отсутствует
Сокращение просвета на 1 19% диаметра Трехфазная волна с минимальным спектральным расширением, пиковая систолическая скорость относительно проксимального сегмента < 30%; нормальная форма волны на проксимальном и дистальном участках
Сокращение просвета на 20 49% диаметра Обычно трехфазная волна, хотя обратный компонент потока (вторая стадия) может быть уменьшен; определяется спектральное расширение и заполнение области под систолическим пиком; пиковая систолическая скорость относительно проксимального сегмента увеличивается на 30-100%: нормальная форма волны на проксимальном и дистальном участках
Сокращение просвета на 50 99% диаметра Монофазная волна на протяжении всей систолы; значительное спектральное расширение; пиковая систолическая скорость относительно проксимального сегмента увеличена более чем на 100%; на дистальном участке монофазная волна со снижением систолической скорости
Окклюзия В визуализированном сегменте артерии кровоток не определяется; «удар» можно слышать только проксимальнее места окклюзии; на дистальном участке монофазная волна со снижением систолической скорости
Ошибки в спектральном анализе при стенозе
Картина стеноза при использовании спектральной допплерографии может
быть искажена по нескольким причинам. Если область ультразвукового из-
мерения скорости слишком большая, спектральное расширение будет арте-
фактным вследствие большего числа частиц с высокими скоростями в цент-
ральной части потока и меньшего их числа у стенки сосуда или бляшки. На
Рис. 15.20. Турбулентный кровоток, вызванный артериальным стенозом. Детальное
объяснение в тексте.
Рис. 15.12. Определение обозначений при допплерографии.
Рис. 15.14. Цветное дуплексное изображение ламинарного кровотока в общей сонной артерии.
Детальное объяснение в тексте.
Рис. 15.15. Б, Гомогенная окраска усредненного потока.
Рис. 15.16. Объяснение негомогенного окрашивания части просвета сосуда, перпендикулярной
ультразвуковому датчику. Детальное объяснение в тексте
СТЕНКА СОСУДА
Рис. 15.17. Цветное дуплексное изображение артериального кровотока. Детальное объяснение в
тексте.
Рис. 15.18. Цветное дуплексное изображение изогнутой общей сонной артерии. Детальное
объяснение в тексте.
04-JUN-98
06 52-55PM
L5fc8
5.0МНг
VEH LG 7V
•L CALIPER
R10%
PRE-LESION LSFA FLOW
04-JUN-98
06-54.46PM
L5$8
5.8MHz
VEH LG/V
1 J ‘ "
S§ И I
INVERTED 8=60°
_b_.I ........................1....^. , l . ,
CALIPER
AT STENOSIS IN LSFA
DOPPLER
6-INVRBOW
Рис. 15.21. А. Цветное дуплексное изображение стеноза левой поверхностной бедренной артерии.
Обратите внимание на монофазную низкоскоростную (0,60 м/с) спектральную волну с умеренным
спектральным расширением перед зоной стеноза. Б. Цветной дуплексный спектр в зоне стеноза
показывает пиковую систолическую скорость более 4,78 м/с со спектральным расширением более
чем на 2 м/с. Обратите внимание на неоднородность окрашивания области стеноза и изменение
формы спектральной волны. В, Ниже стеноза пиковая систолическая скорость возвращается к
0,6 м/с, но спектральное расширение сохраняется.
04-JUN-98
PW PWR<800
30dB 0/-/D
1.5mm/l >”
PW D = 18mm
06:52:50РЧ
L5$8
5.0111
VEN
ь
ЕВ 4 I
INVERTED e=60<> ЗЙГСЕ
1 O, . ..........I ....... 1 i i ь I , , ,
m/$
POST STENOTIC LESION IN LSFA
Рис. 15.21. (Продолжение.)
Рис. 15.22. А, Спектральный анализ неизмененной внутренней сонной артерии показывает
нормальную пиковую систолическую скорость 0,6 м/с, конечную диастолическую скорость 0,2 м/с, и
небольшое спектральное расширение.
Рис. 15.22. Б, Спектральное расширение, видимое в той же самой сонной артерии, после слишком
большого расширения области измерения скорости. В, Спектральное расширение, вызванное
измерением, слишком близким к стенке сосуда
Рис. 15.24. Неизмененная бифуркация сонной артерии.
Рис. 15.25. А, Разделение потока крови в месте бифуркации сонной артерии — нормальное
явление
Рис. 15.26. Изменение диаметра внутренней сонной артерии на 60-79%.
Рис. 15.27. Ретроградный кровоток в наружной сонной и верхней тиреоидной артериях,
заполняющий внутреннюю сонную артерию при окклюзии общей сонной артерии.
Рис. 15.28. Дуплексное сканирование позвоночной артерии. Обратите внимание на акустическую
тень от поперечного отростка и спектр антеградного непрерывного кровотока.
Рис. 15.29. А, Скоростные спектры наружной сонной артерии отображают волну, форма которой
характерна для высокого сопротивления Обратите внимание на раннюю желудочковую аритмию
представленную в спектре вторым и четвертым сердечными ударами
Рис. 15.29. Б, Низко резистентный спектр внутренней сонной артерии.
Рис. 15.29. В, Общая сонная артерия со спектральными признаками высокого сопротивления в
наружной сонной и низкого сопротивления во внутренней сонной артериях.
Рис. 15.30. А, Едва заметный кровоток в месте отхождения внутренней сонной артерии может быть
легко принят за признак окклюзии.
Рис. 15.31. А, Продольный вид отхождения чревного ствола (СА) и верхней брыжеечной артерии
(SMA).
Рис. 15.32. Частичная окклюзия при хроническом тромбозе (Т) поверхностной бедренной вены.
Рис. 15.33. Острый тромбоз поверхностной бедренной вены. Обратите внимание на
эхонегативный просвет сосуда без допплеровских признаков кровотока.
Рис. 15.34. А, Артерии голени часто окружены парными венами. Обратите внимание, что задняя
большеберцовая артерия расположена между парными задними большеберцовыми венами. Б,
Острый анэхогенный тромбоз одной из парных задних большеберцовых вен.
Рис. 15.36. А, Фистула между артерией и веной. Б, Допплеровское возмущение вокруг
артериовенозной фистулы.
Рис. 15.37. А, Спектральная волна (белого цвета) венозной части артериовенозной фистулы. Б,
Спектральная волна артериальной части артериовенозной фистулы.
Рис. 15.39. Цветовое наложение в общей сонной артерии.
Рис. 15.40. Артефакты, вызванные кальцием. Печатается с разрешения Bernstein [6].
КЛИНИЧЕСКИЕ ПРИМЕРЫ
513
Рис. 15.21. А. Цветное дуплексное изображение стеноза левой поверхностной
бедренной артерии. Обратите внимание на монофазную низкоскоростную (0,60 м/с)
спектральную волну с умеренным спектральным расширением перед зоной стеноза.
Б. Цветной дуплексный спектр в зоне стеноза показывает пиковую систолическую
скорость более 4,78 м/с со спектральным расширением более чем на 2 м/с. Обратите
внимание на неоднородность окрашивания области стеноза и изменение формы
спектральной волны. В. Ниже стеноза пиковая систолическая скорость возвращается
к 0,6 м/с, но спектральное расширение сохраняется. Рисунок приведен на цветной
вклейке.
33 Ультразвуковая диагностика ...
514
15, УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.21. (Продолжение.)
рис. 15.22 А показано формирование спектральной волны при небольшой об-
ласти изменения скорости, размещенной в центре потока в просвете нормаль-
ной внутренней сонной артерии. Когда область измерения скорости расши-
ряется до полного диаметра сосуда, область, расположенная ниже формиро-
вания спектральной волны, заполняется (спектральное расширение), потому
что начинается отображение низкоскоростного потока около стенки сосуда
(рис. 15.22 Б).
Спектральное расширение происходит и тогда, когда область измере-
ния скорости находится слишком близко к стенке сосуда (рис. 15.22 В).
Если эта область накладывается на бляшку, изменяющую гемодинамику,
может возникать спектральное расширение, потому что скорости у краев
бляшки будут более низкими, вследствие чего малозначимый гемодинамиче-
ски стеноз будет казаться более существенным. Наоборот, производя измере-
ния слишком далеко от стеноза, существенное сужение можно принять за не-
значительное.
Расположение датчика под неправильным углом к потоку крови может
привести к отображению более высоких скоростей, величины которых мо-
гут оказаться гемодинамически существенными, если величина этого угла
приблизится к нулю. Небольшие ошибки в оценке угла могут привести к бо-
льшим ошибкам в расчетной скорости (или частоте), особенно если величи-
на угла приближается к 90°. Поэтому при исследовании угол сканирования
должен удерживаться в пределах 45°-60°. Если добиться этого диапазона
КЛИНИЧЕСКИЕ ПРИМЕРЫ
515
Рис. 15.22. А. Спектральный анализ неизмененной внутренней сонной артерии
показывает нормальную пиковую систолическую скорость 0,6 м/с, конечную
диастолическую скорость 0,2 м/с и небольшое спектральное расширение.
Б. Спектральное расширение, видимое в той же самой сонной артерии, после
слишком большого расширения области измерения скорости. В. Спектральное
расширение, вызванное измерением, слишком близким к стенке сосуда. Рисунок
приведен на цветной вклейке.
516
15. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ СОСУДОВ
Рис. 15.22. (Продолжение )
углов невозможно, для того чтобы минимизировать ошибки в измерении
скорости, разместите датчик под углом в 0°. Если выполняется измерение ча-
стоты, то следует иметь в виду, что эта величина зависит от частоты датчика.
Наблюдение за трансплантатом и травма
Какую пользу может принести дуплексное сканирование при наблюдении за
т рансплантатом или при повреждении сосудов? На сегодняшнем оборудова-
нии стеноз трансплантата на продольных или поперечных сечениях при
двухмерном сканировании в В-режиме может вообще не визуализироваться.
Для точной оценки степени стеноза клиницисты используют спектральные
исследования. Основные принципы оценки стеноза трансплантата приведе-
ны в табл. 15.2. Обратите внимание, что критерии стеноза трансплантата не-
сколько отличаются от критериев артериального стеноза.
При травме, среди прочего, хирурги ищут такие едва уловимые признаки,
как «трепетание» интимы, расслоение или спазмированные участки. Наибо-
лее часто выявляемые изменения — это псевдоаневризмы, артериовенозные
фистулы и окклюзии. Ультрасонография полезна, если исследователь может
увидеть любое из этих изменений. Часто металлические фрагменты раня-
щих снарядов, раневые каналы, содержащие воздух, или открытые перело-
мы, а также недоступность исследуемых сосудов и невозможность получе-
ния четких двухмерных изображений делают ультрасонографические изобра-
КЛИНИЧЕСКИЕ ПРИМЕРЫ
517
Таблица 15.2. Классификация изменений венозного трансплантата на
основе анализа формы спектральной волны а
Класс иф и кация Критерии
(Сокращение просвета на 1 19% диаметра Соотношение скоростей < 2,0, умеренное спектральное расширение в систолу; 45 < ПСС < 150 см/с
Сокращение просвета на 20 49% диаметра Соотношение скоростей > 2,0, спектральное расширение на протяжении всей систолы; нет изменения формы волны в зоне стеноза, ПСС < 150 см/с
Сокращение просвета на 50-75% диаметра Соотношение скоростей > 2,5, выраженное спектральное расширение с реверсивным потоком; ПСС > 150 см/с
Сокращение просвета более чем на 75% диаметра Соотношение скоростей >3,5; конечная диастолическая скорость >100 см/ с
° Из Zierler и Zierler [3] с изменениями. ПСС — пиковая систолическая скорость (PSV),
скоростное отношение (ПСС/престенотическая ПСС).
жения неинформативными. В таких случаях может понадобиться проведение
других исследований или выполнение эксплоративного хирургического вме-
шательства.
При исследовании политетра-флюорэтиленового (PTFE) трансплантата
в раннем послеоперационном периоде хирург бывает не в состоянии иден-
тифицировать кровоток. Несмотря на хорошую визуализацию такого транс-
плантата, его стенки изначально содержат воздух, отражающий ультразвук.
Сканирование становится возможным только тогда, когда поры трансплан-
тата заполнятся сывороткой или прорастут тканью (обычно через несколько
дней после заполнения их жидкостью). На рис. 15.23 показано появление
двойной линии в стенке PTFE трансплантата и трех фазового потока в его
просвете В целом можно согласиться с тем, что за аутотрансплантатами
следует наблюдать не только для предсказания их несостоятельности еще до
развития такой несостоятельности, но и для предотвращения внезапного
тромбоза в месте бифуркации.
Ультразвуковое исследование сонной артерии
Изображение на рис. 15.24 является дуплексным ультразвуковым изображе-
нием бифуркации сонной артерии. Общая сонная артерия обозначена симво-
лом «а», наружная сонная артерия—«Ь», а внутренняя сонная артерия — «с».
Если поместить ультразвуковой датчик над передней поверхностью груди-
но-ключично-сосцевидной мышцы, получится похожее изображение. Одна-
ко чаще всего датчик размещают в позадигрудино-ключично-сосцевидном
направлении. Ультразвуковой луч в этом случае попадает сначала на внут-
518
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.23. Двойная линия стенки трансплантата и трехфазовый поток в его просвете.
реннюю сонную артерию (в точке 6), поскольку эта область ближе всего к
датчику, а наружная сонная артерия будет находиться тогда в точке Ь. В еже-
дневной практике такая ясная и четкая картина, как эта, встречается редко.
Рис. 15.24. Неизмененная бифуркация сонной артерии. Рисунок приведен на цветной
вклейке.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
519
Можно столкнуться с изображением (рис. 15.25А), на котором, на пер-
вый взгляд, определяется образование, ограничивающее кровоток во внут-
ренней сонной артерии. Однако это не так. Разделение потока является нор-
мальным следствием его деления в области бифуркации сонной артерии. Та-
кое разделение приводит к нарушению обычного вида потока (завихрения,
переориентации) по заднебоковой поверхности разделенного потока (отобра-
жено цветом на рис. 15.25А). Инъекция микропузырьков водорода в стеклян-
ную модель сонной артерии демонстрирует это явление (рис. 15.25Б). Это
нормально и не должно приниматься за повреждение.
Как определить степень стеноза при исследовании сонной артерии, если
двухмерное изображение вводит нас в заблуждение? Когда стеноз умерен-
ный (меньше 50%), его корректная оценка может быть сделана по попереч-
ным ультразвуковым сечениям. При выраженном стенозе такой метод нена-
дежен: точная степень стеноза определяется тогда спектральным анализом.
Несмотря на выраженность стеноза и соблазн его непосредственной визуа-
лизации, спектральный анализ является общепризнанным методом оценки
степени стеноза.
Спектральный анализ стеноза сонной артерии. Когда степень сте-
ноза увеличивается, ПСС или частота, а также КДС в гемодинамически зна-
чимом стенозе обычно тоже увеличиваются. Кроме этого, при увеличении
степени стеноза ухудшается спектральное расширение. Сравнение резуль-
татов УЗИ с интраоперационными и ангиографическими данными показало,
что по трем перечисленным выше показателям степень стеноза может быть
определена достаточно точно. В табл. 15.3 приведены степени стеноза, опре-
деляемые по этим спектральным параметрам. Нужно отметить, что боль-
шинство врачей признает важность спектрального расширения, но рассмат-
ривает его в основном как качественный фактор.
Таблица 15.3. Спектральный допплерографический анализ сонной
артерии
Стеноз в процентном отношении от диаметра сосуда ПСС, см/с КДС, см/с Спектральное расширение
0 < 110 <40 <30
1-39 < ПО <40 <40
40-59 < 130 <40 <40
60-79 > 130 > 40 >40
80-99 > 250 > 100 > 80
По Zwiebel [2], с изменениями.
520
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.25. А. Разделение потока крови в месте бифуркации сонной артерии —
нормальное явление. Рисунок также приведен на цветной вклейке. Б. Инъекция
микропузырьков водорода в стеклянную модель бифуркации сонной артерии
демонстрирует разделение потока по заднебоковой стенке внутренней сонной
артерии. Печатается с разрешения Ernst et al. [4].
КЛИНИЧЕСКИЕ ПРИМЕРЫ
521
Рис. 15.26. Изменение диаметра внутренней сонной артерии на 60-79%. Рисунок
приведен на цветной вклейке.
На рис. 15.26 приведены результаты цветного дуплексного сканирова-
ния со спектральным анализом кровотока во внутренней сонной артерии
при ее стенозе. ПСС — 2,03 м/с, пик КДС — только около 1 м/с, спектраль-
ное расширение составляет приблизительно 1 м/с. В табл. 15.3 эти три пара-
метра соответствуют стенозу от 60 до 79%.
Применение спектральных данных. Специалисты обычно обобщают
критерии, приведенные в табл. 15.3, не определяя на практике отдельные па-
раметры при исследовании наружной сонной и общей сонной артерии. Нуж-
но помнить, что все параметры кровотока определялись только для внутрен-
ней сонной артерии. Критерии, содержащиеся в табл. 15.3, характерны для
пациентов с односторонним ипсилатеральным стенозом внутренней сонной
артерии. Если окклюзирована контралатеральная внутренняя сонная арте-
рия, кровоток через ипсилатеральную внутреннюю сонную артерию может
компенсаторно возрастать с ложным увеличением его скорости, из-за ипси-
латерального стеноза. При этом исследователь сделает ложный вывод о на-
личии здесь выраженного стеноза. Наоборот, сердечная недостаточность со
снижением выброса или гипотензии могут маскировать гемодинамические
признаки стеноза из-за снижения скорости крови в сонной артерии. В таких
случаях гемодинамически существенный стеноз может показаться незначи-
тельным. Для получения правильного диагноза потребуются дополнитель-
ные исследования.
522
15. УЛЬТРАЗВУКОВОЕ ИССЛВДОВАНИЕ СОСУДОВ
Ограничения. В настоящее время мозговое кровообращение при УЗИ
не может быть оценено полностью. Стандартные методы исследования не
обеспечивают получение полноценных изображений мест отхождения сон-
ных и других артерий от дуги аорты. Визуализацию внутренних сонных ар-
терий около основания черепа затрудняют костные структуры. Внутриче-
репная часть сонной артерии может быть частично исследована при транскра-
ниальной допплерографии, однако обычно этого не делается и интерпретация
результатов усложняется даже при использовании стандартных диагности-
ческих критериев. Сравнение форм волны от правой и левой сонных арте-
рий может помочь в выявлении проксимальных или дистальных (по отно-
шению к границе ультразвуковой доступности) поражений, но это же срав-
нение может внести путаницу при двусторонней окклюзии.
Окклюзия общей сонной артерии. На рис. 15.27 приведены результа-
ты цветного дуплексного сканирования области бифуркации сонной арте-
рии. Обратите внимание, что кровоток в общей сонной артерии отсутствует,
а в наружной сонной артерии отмечается ретроградный ток крови, что вы-
звано окклюзией общей сонной артерии. Наружная сонная артерия является
причиной ретроградного кровотока во внутренней сонной артерии. Также
обратите внимание на верхнюю тиреоидную артерию, отходящую от осно-
вания наружной сонной артерии.
Рис. 15.27. Ретроградный кровоток в наружной сонной и верхней тиреоидной
артериях, заполняющий внутреннюю сонную артерию при окклюзии общей сонной
артерии. Рисунок приведен на цветной вклейке
КЛИНИЧЕСКИЕ ПРИМЕРЫ
523
Позвоночная артерия. С некоторыми трудностями позвоночные арте-
рии могут быть исследованы в области их отхождения от подключичной ар-
терии. При оптимальных условиях визуализируют второй (С2 С6) и, воз-
можно, даже третий (С1-С2) сегменты позвоночной артерии, но только
между отверстиями в поперечных отростках позвонков, в которых эта арте-
рия проходит (рис. 15.28). Поэтому при УЗИ изменения в позвоночных арте-
риях могут быть легко пропущены. Обычно врач констатирует, доступны ли
визуализации позвоночные артерии, и для оценки синдрома обкрадывания
подключичных артерий определяет в них направление кровотока.
Спектр сонных и позвоночных артерий. Мозг является низкорези-
стентной системой; кровь течет в нем всегда (монофазные скорости выше
нулевого уровня). В норме возвратный кровоток, как в сосудах нижних ко-
нечностей, отсутствует. Один из способов отличия внутренней сонной или
позвоночной артерии от наружной сонной артерии заключается в оценке
спектральной формы волны. Можно было бы ожидать, что во внутренней
сонной артерии и позвоночных артериях скорость будет всегда положитель-
на, т. е. выше нулевого уровня на протяжении всего сердечного цикла. Этого
не наблюдается в наружной сонной артерии, которая питает высокорези-
стентное сосудистое русло лица. В этом случае форма волны опускается
ниже нулевого уровня, но обычно с резкой остановкой этого снижения в от-
рицательной части спектра.
Рис. 15.28 Дуплексное сканирование позвоночной артерии. Обратите внимание на
акустическую тень от поперечного отростка и спектр антеградного непрерывного
кровотока. Рисунок приведен на цветной вклейке.
524
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Спектральные формы волн от внутренней сонной, позвоночных и на-
ружной сонной артерий монофазные на всем протяжении; однако в случае
низко резистентных внутренних сонных и позвоночных артерий КДС в нор-
ме не понижается до нуля. При окклюзии внутренней сонной артерии, до-
статочно долгой для включения в коллатеральный кровоток основных инт-
рацеребральных коллатералей через наружную сонную артерию, эта артерия
может «усваивать» другой спектр с формой волны, одновременно напоми-
нающий спектр внутренней и наружной сонных артерий.
Форма общей сонной артерии в норме сходна с формой как наружной,
так и внутренней сонной артерий (рис. 15.29). Если прижать поверхностную
височную артерию при сканировании наружной сонной, давление, передан-
ное к наружной сонной артерии, отразится на спектральной форме волны.
В неоднозначных ситуациях это может пригодиться для дифференцировки
наружной и внутренней сонных артерий.
Окклюзия сонных артерий и симптом «струны». К сожалению,
УЗИ сосудов не является надежным средством выявления окклюзии сонных
артерий или близких к ним сосудов. Причина в том, что при очень медлен-
ном кровотоке через суженный просвет его оценка или даже обнаружение
является для ультразвукового аппарата технически сложным. Скорость кро-
Рис. 15.29. А. Скоростные спектры наружной сонной артерии отображают волну,
форма которой характерна для высокого сопротивления. Обратите внимание на
раннюю желудочковую аритмию, представленную в спектре вторым и четвертым
сердечными ударами. Б. Низкорезистентный спектр внутренней сонной артерии.
В. Общая сонная артерия со спектральными признаками высокого сопротивления в
наружной сонной и низкого сопротивления во внутренней сонной артериях. Рисунок
приведен на цветной вклейке
КЛИНИЧЕСКИЕ ПРИМЕРЫ
525
Рис. 15.29. (Продолжение.)
вотока может быть ниже уровня, определяемого сонографом, либо исходная
настройка аппарата может быть слишком высокой. Несмотря на наличие
кровотока при симптоме «струны», ситуация может быть ошибочно расце-
нена как окклюзия, поскольку крохотная перфузия может остаться незаме-
ченной (рис. 15.30). С другой стороны, у пациентов с окклюзией может на-
блюдаться интернализация наружной артерии сонной артерии, которая мо-
526
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
жет ввести оператора в заблуждение. В результате сонная артерия или ее
ветвь принимается за внутреннюю. В сомнительных случаях требуется про-
ведение таких дополнительных методов исследования, как МРТ, КТ или ан-
гиография.
Рис. 15.30. А. Едва заметный кровоток в месте отхождения внутренней сонной артерии
может быть легко принят за признак окклюзии. Б. На поперечном изображении в
В-режиме той же внутренней сонной артерии определяется сложная бляшка, почти
перекрывающая просвет сосуда. Рисунок приведен на цветной вклейке.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
527
Стеноз почечной артерии
При использовании двухмерных изображений определение степени стеноза
почечной артерии является трудной и даже невозможной задачей. Один из
методов обнаружения гемодинамически существенных изменений без пря-
мой визуализации их причины заключается в измерении пиковой систоличе-
ской скорости в почечной артерии и ближайшем к ней отделе аорты. В норме
соотношение этих показателей равно 2. Если оно превышает 3,5 — это указы-
вает на уменьшение диаметра почечной артерии более чем на 60%. Этот по-
казатель называют ренально-аортальным индексом (РАИ). Из-за возможного
повышения ПСС, РАИ не может использоваться при выраженном аорталь-
ном стенозе. В таком случае ПСС почечной артерии от 180 до 200 см/с указы-
вает более чем на 60%-ный стеноз. Другим способом измерения стеноза по-
чечной артерии служит вычисление соотношения КДД к ПСС. В норме это
соотношение больше 0,33, его уменьшение до 0,23 соответствует уменьше-
нию диаметра на 60% или более. Последовательно рассуждая, можно обосно-
вать правильность такого определения: почка, подобно мозгу, является орга-
ном с низким гемодинамическим сопротивлением. Увеличение сопротивле-
ния при гемодинамически значимом стенозе приводит к уменьшению КДС
до нуля или даже к прекращению кровотока. То же рассуждение можно при-
менять к последнему из приведенных методов определения стеноза почечной
артерии, который основан на разнице между ПСС и КДС, деленной на ПСС.
Значение меньше 0,7 является нормой.
Стеноз верхней брыжеечной артерии
Во время активного пищеварения спектр верхней брыжеечной артерии (ВБА)
становится низкорезистентным. При голодании желудочно-кишечный тракт
потребляет небольшое количество кислорода, поэтому кровоток через ВБА
низкий, что приводит к высокой резистентности. Однако после приема пищи
открытие капиллярного русла снижает сопротивление. Оба этих состояния
могут быть выявлены при наблюдении за изменением спектральной формы
волны от ВБА с высокого сопротивления (КДС приближается к нулю) на низ-
кое сопротивление (пик КДС над нулевым уровнем). Эта реакция может быть
воспроизведена при приеме так называемой «стандартной» пищи, после ко-
торого сосудистое русло кишечника раскрывается и. в случае стеноза верх-
ней брыжеечной артерии, появляются его гемодинамические признаки. Было
показано, что ПСС более 275 см/с указывает на стеноз более 70% диаметра.
Эта величина скорости соответствует чувствительности, равной 92%, специ-
фичности — 96%, положительной прогностической ценности — 80% и отри-
цательной прогностической ценности — 99%, что в целом соответствует точ-
ности в 96%.
528
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Стеноз чревного ствола
В выявлении стеноза чревного ствола более 70% диаметра ПСС, равная
200 см/с, обладает чувствительностью 87% и специфичностью 80%. Этот
критерий имеет положительную прогностическую ценность, равную 63%, и
отрицательную прогностическую ценность — 94%, с общей точностью 82%.
Поскольку капилляры печени обладают низким сопротивлением, в чревном
стволе не выявляется двойственное изменение (повышение/понижение рези-
стентности) кровотока, связанное с приемом пищи и характерное для ВБА.
Однако для обнаружения стеноза чревного ствола как возможной причины
висцеральной ишемии может использоваться метод определения ПСС. На
рис. 15.31 А показан сагиттальный вид аорты в месте отхождения чревного
ствола и ВБА. На рис. 15.31Б можно видеть непрерывный антеградный кро-
воток в чревном стволе. Сравните эту картину с трехфазным высокорезистен-
тным кровотоком в ВБА натощак (рис. 15.31В).
Портальная гипертензия
УЗИ может быть использовано для диагностики портальной гипертензии.
Сонографические критерии портальной гипертензии включают в себя увели-
чение диаметра воротной вены более 13 мм, расширение пупочной вены, на-
личие внутрибрюшных коллатералей или спленомегалию с расширением се-
лезеночной вены и утрату нормальных циклических изменений диаметра
Рис. 15.31. А. Продольный вид отхождения чревного ствола (СА) и верхней
брыжеечной артерии (SMA). Б. Непрерывный антеградный спектр кровотока в
чревном стволе. В. Высокорезистентный спектр ВБА натощак. Рисунок приведен на
цветной вклейке.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
529
Рис. 15.31. (Продолжение.)
вены с дыханием. Ультрасонография помогает оценить состояние воротной и
печеночных вен, внутри- и экстрапеченочных анастомозов. Может быть так-
же определено направление портального кровотока — от печени или к пече-
ни (в норме).
34 Ультразвуковая диагностика ...
530
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Тромбоз глубоких вен нижних конечностей
Хронический тромбоз глубоких вен с частичной окклюзией. На
рис. 15.32 показана частичная окклюзия при тромбозе глубоких вен (ТГВ).
Просвет поверхностной бедренной вены окрашен в синий цвет, и зона тром-
боза обозначена литерой Т. Обратите внимание на яркое эхо от тромба по
сравнению с фоном, что указывает на хронический тромбоз. По мере орга-
низации тромба его эхогенность может значительно возрастать.
Острый тромбоз глубоких вен. Острый тромбоз — эхонегативный.
Обратите внимание, что на рис. 15.33 просвет поверхностной бедренной
вены не заполнен цветом, а расположенная рядом поверхностная бедренная
артерия имеет красный цвет. Имея только эти данные, невозможно опреде-
лить наличие венозного тромбоза, так как если кровоток в поверхностной
бедренной вене медленнее той величины, которая может быть определена
ультразвуковым аппаратом, просвет этого сосуда также будет окрашен в
черный цвет (движение отсутствует).
Критерии оценки тромбоза глубоких вен. Как при распознавании
артериального стеноза, так и при венозном тромбозе двухмерное изображе-
ние может вводить в заблуждение. Предложено множество критериев, по-
зволяющих определить, тромбирована ли вена (табл. 15.4). При частичной
или полной окклюзии вены можно ожидать визуализации образования, пре-
пятствующего кровотоку (рис. 15.32 и 15.33).
Рис. 15.32. Частичная окклюзия при хроническом тромбозе (7) поверхностной
бедренной вены. Рисунок приведен на цветной вклейке.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
531
Рис. 15.33. Острый тромбоз поверхностной бедренной вены. Обратите внимание на
эхонегативный просвет сосуда без допплеровских признаков кровотока. Рисунок
приведен на цветной вклейке.
Эхогенность тромба зависит от его возраста. При остром тромбозе эхо-
генность слабая или отсутствует. Хронический организованный или фибро-
зированный тромб может обладать выраженной эхогенностью, а подостро-
му тромбу соответствует промежуточная степень эхогенности. Очень старый
тромб с реканализацией и кровотоком внутри может обладать выраженной
эхогенностью.
При дефекте наполнения вены должен определяться и дефект кровотока
в виде области, не окрашенной цветом (нет кровотока). При остром веноз-
ном тромбозе дистальнее тромба нередко наблюдается дилатация, которая
может не выявляться при подостром и хроническом венозном тромбозе, по-
скольку развитие коллатералей может снизить венозную гипертензию в
этом сегменте.
Таблица 15.4. Критерии для определения венозного тромбоза
Дефект наполнения (эхогенный)
Недостаток кровотока
Расширение
Сжимаемость (при хроническом тромбозе)
Коллатерали, рефлюксы, неподвижные клапаны
532
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
При подостром и хроническом тромбозе тромбированный сегмент вены,
как правило, не сжимается; но в ранней острой стадии процесса он может
сжиматься, что также указывает на хронический процесс. Множество колла-
тералей, рефлюксный кровоток или неподвижные клапаны позволяют под-
твердить диагноз венозного тромбоза, а также указывают на степень его
хронизации. Любой из этих критериев может оказаться достаточным для
диагноза ТГВ; однако в случае выявления двух или более критериев можно
быть уверенным в точном диагнозе.
В табл. 15.5 отражена чувствительность, специфичность и диагностиче-
ская точность симптоматического острого ТГВ при УЗИ по сравнению с зо-
лотым стандартом (венографией). Хотя ультрасонография широко используется
для исключения бессимптомного и симптоматического ТГВ, а также для на-
блюдений в этой группе больных, УЗИ еще не стало «золотым» стандартом
для оценки бессимптомного ТГВ.
Затруднения. Для точной диагностики ТГВ клиницисты должны знать
особенности венозной анатомии. В нижней конечности артерия, как прави-
ло, окружена парой одноименных вен, например задняя большеберцовая ар-
терия (рис. 15.34А). На рис. 15.34Б преставлена задняя большеберцовая ар-
терия, одна из задних большеберцовых вен и анэхогенная область под зад-
ней большеберцовой артерией. Эта анэхогенная область представляет собой
другую, тромбированную заднюю большеберцовую вену. Исследователь, не
ожидающий увидеть парные вены, может пропустить эти изменения. На
рис. 15.35 показана поверхностная бедренная артерия, окрашенная в крас-
ный цвет, поверхностная бедренная вена, окрашенная в синий цвет, и анэхо-
генная область, расположенная глубже поверхностной бедренной артерии.
Такая необычная картина вызвана острым тромбозом дублирующей поверх-
ностной бедренной вены. Исследователь, не учитывающий наличия особен-
ностей венозного русла, мог бы легко не заметить этот клинически значи-
мый тромбоз.
Артериовенозные фистулы и шунты
На рис. 15.36А приведены результаты цветного дуплексного сканирования
артериовенозной фистулы, наличие которой доказывает визуализация косо
расположенной структуры, окрашенной в синий цвет. В месте отхождения
фистулы окружающие ткани тоже окрашены (рис. 15.36Б). Окрашивание
цветом не означает присутствия свободно циркулирующей крови в мягких
тканях: фистула вызывает вибрацию мягких тканей (допплеровское возму-
щение), датчик воспринимает это движение и окрашивает их изображение
так же, как была окрашена движущаяся в просвете сосуда кровь. Это визуаль-
ное отражение колебаний, создаваемых фистулой. Спектральный анализ фи-
стулы показывает беспорядочный низкорезистентный белый шум в ее веноз-
ной части (рис. 15.37А) и сильнее пульсирующую высокоскоростную волну в
Таблица 15.5. Сравнение дуплексного исследования, импедансной плетизмографии (ИП) и фибриногенного теста
(ФТ) в диагностике ТГВ
Показатели Дуплексное исследование, % ИП, % ФТ, % ИП и ФТ, %
обш. выше колена ниже колена обш. выше колена ниже колена обш. выше колена ниже колена общ. выше ниже коленаiколена
Чувствительность Специфичность Положит, прогност. ценность Отрицат. прогност. ценность Без симптомов Наблюдение □ С симптомами Компрессионная техника Наблюдение, с симптомами р 98 86 91 96 Значение не определено Чувств ИТ. Чувствит. Чувствит. Чувствит. 100 94 99 58 96 86 79 97 16 99 49 85 80 58 68 8 73 71 72 72 63 81 90 95 93 93 100 69
Данные из Bergqvist [5].
534
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.34. А. Артерии голени часто окружены парными венами. Обратите внимание,
что задняя большеберцовая артерия расположена между парными задними
большеберцовыми венами. Б Острый анэхогенный тромбоз одной из парных задних
большеберцовых вен. Рисунок приведен на цветной вклейке.
ее артериальной части, с полным спектральным расширением, непрерывным
положительным потоком в течение всего сердечного цикла (рис. 15.37Б).
Псевдоаневризмы
На рис. 15.38 показана псевдоаневризма бедренной артерии. Видна шейка
аневризмы; артерия расположена ниже, псевдоаневризма выше. Обратите
внимание на движение крови в псевдоаневризме, область острого тромбоза
(анэхогенную и черную) и яркий гиперэхогенный ободок, соответствующий
области хронического тромбоза. Эти аневризмы могут быть с успехом тром-
КЛИНИЧЕСКИЕ ПРИМЕРЫ
535
Рис. 15.35. Острый анэхогенный тромбоз одной из поверхностных бедренных вен.
Печатается с разрешения Bernstein [6].
Рис. 15.36. А. Фистула между артерией и веной. Б. Допплеровское возмущение вокруг
артериовенозной фистулы. Рисунок приведен на цветной вклейке.
536
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.37. А. Спектральная волна (белого цвета) венозной части артериовенозной
фистулы. Б. Спектральная волна артериальной части артериовенозной фистулы.
Рисунок приведен на цветной вклейке.
бированы путем их компрессии ультразвуковым датчиком вплоть до полного
прекращения кровотока, без ограничения кровотока в бедренных сосудах.
Такая методика предотвращает оперативное вмешательство более чем в 90%
случаев. Новая методика облитерации псевдоаневризмы основана на введе-
нии в ее полость тромбина под контролем ультрасонографии.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
537
Рис. 15.38. Бедренная псевдоаневризма. Печатается с разрешения Bernstein [6].
Артефакты и наложения
Пульсовая допплерография основана на излучении ультразвуковых волн и
регистрации возвращенного эха. За одну секунду эти процессы могут повто-
ряться до нескольких тысяч раз. Если допплеровская частота составляет
1 кГц, сколько раз в секунду должны быть восприняты возвращенные сигна-
лы, чтобы точно воспроизвести эту допплеровскую частоту? Можно опреде-
лить, что частота таких сигналов должна быть в два раза больше, чем предпо-
лагаемая допплеровская частота (предел Никвиста). Если соотношение этих
частот меньше, происходит их наложение.
На рис. 15.39 приведен пример цветового наложения. Обратите внима-
ние на ярко-красную окраску справа. Слева к ней прилежит область желтого
цвета, рядом с которой имеется участок, окрашенный в зеленый цвет. Левая
часть карты распределения скоростей отражает увеличение скорости, по-
скольку окраска меняется с красной на желтую; но изменение желтого цвета
на зеленый должно соответствовать изменению направления кровотока, при
этом зона, окрашенная в четный цвет (нулевая скорость потока), отсутству-
ет. Отсутствие черного цвета является простым признаком неадекватного
повторения отраженной волны, приводящей к наложению волн. При изме-
нении направления кровотока окраска должна содержать черный цвет, в
противном случае мы сталкиваемся с наложением волн.
В спектральном виде наложение волн отражается в исчезновении вы-
сокоскоростной части волны и ее появлении ниже нулевого уровня (рис.
15.21Б). Совмещение может быть предотвращено увеличением частоты
отраженного сигнала так, чтобы цветовой картой могли быть представле-
ны более высокие частоты или скорости, для чего следует переключить
датчик на более низкую частоту или использовать не импульсный, а непре-
рывный режим допплерографии (при котором не может возникать наложе-
ния).
538
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.39. Цветовое наложение в общей сонной артерии. Рисунок приведен в
цветной вклейке.
Артефакты, вызванные кальцием
На рис 15.40 области, окрашенные красным цветом, чередуются с черными
линиями. Это не вызвано наложением волн, но это не нормально. Причиной
такого явления служат артефакты, вызванные кальцием. Отложения кальция
выглядят как яркие гиперэхогенные участки, расположенные над артерией.
Поскольку большая часть ультразвуковой энергии отражается, позади отло-
жений кальция возникает акустическая тень. Эта тень распространяется и на
область мягких тканей, лежащих за артерией, что свидетельствует о мощном
отражении.
А тест
На рис 15.41 слева от А расположена область, окрашенная красным, после
нее следует черный цвет, а затем—синий. Такая картина представляет собой
нормальное чередование направлений кровотока по мере перемещения дат-
чика. Синий цвет перейдет в красный, затем — в черный, а затем — снова в
красный цвет. Почему это происходит? Потому что в центре этой области
расположена умбиликальная вена, обвитая двумя артериями пуповины. Это
поможет понять, что именно сканировалось при получении ультразвуковых
изображений.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
539
Рис. 15.40. Артефакты, вызванные кальцием. Печатается с разрешения Bernstein [6]
Ультразвуковое исследование яичек
Клиницистам может потребоваться оценка жизнеспособности яичка, воз-
можно, после его перекрута или после паховой герниографии. В норме яичко
кровоснабжается капсулярными артериями, которые кровоснабжают цент-
рипетальные паренхиматозые артерии, окрашенные в синий цвет. Сравните
нормальное правое яичко с левым яичком, пораженным инфарктом и имею-
щим нормальный, или даже увеличенный капсулярный кровоток, но без при-
знаков перфузии в центральной части яичка (рис. 15.42).
Рис. 15.41. В пуповине две артерии (красные) обвивают умбиликальную вену (синюю)
Печатается с разрешения Bernstein [6].
540
15. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ СОСУДОВ
Рис. 15.42. В центральной части левого яичка, пораженного инфарктом, кровоток не
определяется, в периферической части органа определяется нормальный или
усиленный кровоток. Печатается с разрешения Goldberg et. al [1].
ИТОГИ
Даже сам Допплер не мог бы предположить, какую помощь оказывает врачам
ультразвук сегодня. Ультразвук использует почти каждая область медицины
и хирургии. В будущем эта технология обещает улучшить диагностические
возможности с помощью более совершенных и удобных ультразвуковых ап-
паратов. Но даже когда сверхточное и трехмерное, дополненное цветной кон-
трастной допплерометрией исследование в реальном времени станет обыч-
ной действительностью, ультразвуковое сканирование всегда будет иметь
некоторые свойственные ему ограничения, обусловленные физическими за-
конами. К счастью, для того чтобы понять принципы работы следующих по-
колений ультразвуковых аппаратов, клиницист может использовать те же
знания, что и сегодня.
БЛАГОДАРНОСТИ
Я хотел бы выразить слова благодарности Лауре Уилбер, главному специали-
сту в исследовании сосудов Окружного Медицинского Центра Аламиды, за
исключительные изображения, предоставленные для иллюстрации этой гла-
вы, а также поблагодарить Кэролин Роач за ее выдающиеся технические ил-
люстрации.
ссылки
541
ССЫЛКИ
1. Goldberg ВВ, Merton DA, Deane, CR. An atlas of ultrasound color flow
imaging. St. Louis: Mosby, 1997
2. Zwiebel W.L Introduction to vascular ultrasonography. 3rd ed. Philadelphia:
Saunders, 1992.
3. Zierler RE, Zierler BK. Duplex sonography of lower extremity arteries. Se-
min ultrasound CT MRI 1997;18:39-56.
4. Ernst CB, Stanley JC. Current therapy in vascular surgery. 2nd ed. St. Louis:
Mosby, 1991.
5. Bergqvist D, Comerota AJ, Nicolaides AN, Scurr .IH. Prevention of venous
thromboembolism. Los Angeles: Med-Orion, 1994.
6. Bernstein EF. Vascular diagnosis. 4th ed. St. Louis: Mosby, 1993.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
AbuRahma AF, Pollack JA, Robinson PA, Mullin D. The reliability of color duplex ultrasound
in diagnosing total carotid artery occlusion. Am J Surg 1997;174:185-187.
Case TD. Primer of non-invasive vascular technology. Boston: Little, Brown, 1995.
Cronon JJ. Controversies in venous ultrasound. Semin ultrasound CT MRI 1997;18:33-38
Hoballah JJ, Nazzal MM, Ryan SM, et al. Is color duplex surveillance of infrainguinal poly-tet-
rafluoroethylene grafts worthwhile? Am J Surg 1997;174:131-135.
Resnick D, Halliday R. Physics. New York: Wiley, 1966.
Rumwell C, McPharlin M. Vascular technology: an illustrated review for the registry exam. Pa-
sadena, CA: Davis, 1996.
Strandness ED Jr. Duplex scanning in vascular disorders. 2nd ed. New York: Raven, 1993
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ
ПОМОЩИ
16
Родни М. Дурхам
УЗИ стало обязательным диагностическим средством при многих заболева-
ниях, лечение которых проводится в отделениях неотложной помощи (ОНП).
Это исследование не дорого и не связано с воздействием на пациента излуча-
ющей радиации. Кроме диагностических целей УЗИ применяется как средст-
во визуального контроля при проведении аспирации и дренирования, обеспе-
чивая лечение некоторых заболеваний. Наконец, благодаря портативности
ультразвукового оборудования удается избежать транспортировки больных
в другие отделения стационара.
В связи с широким применением УЗИ, в этой главе нет всестороннего
обсуждения использования сонографии в ОНП. Будут выделены основные
области применения УЗИ, в то время как диагностические аспекты будут толь-
ко упомянуты. Области наиболее частого использования сонографии включа-
ют в себя исследование желчного пузыря, сосудистой системы (в том числе
диагностику тромбоза глубоких вен) и эхокардиографию. Данные УЗИ мо-
гут быть использованы при острой почечной недостаточности, после транс-
плантации органов, а также при внутрибрюшных абсцессах.
ЖЕЛЧНЫЙ ПУЗЫРЬ
Холедохолитиаз
Острый холецистит, вызванный холелитиазом, с развитием гнойного воспа-
ления — нередкая причина госпитализации пациента в ОНП. Точность ульт-
расонографии в обнаружении камней желчного пузыря составляет 90-95%.
Такой диагноз формируется на основании трех критериев: наличия эхогенно-
го образования, акустической тени и положительной гравитационной пробы,
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright© 2001 Wiley-Liss, Inc.
ЖЕЛЧНЫЙ ПУЗЫРЬ
543
для проведения которой желчный пузырь визуализируется в различных по-
ложениях пациента, что приводит к перемещению камней внутри желчного
пузыря. Факторы, которые препятствуют полноценному исследованию желч-
ного пузыря, включают в себя ожирение, газ в верхних отделах кишечника и
подкожную эмфизему. Наиболее чувствительным критерием в диагностике
острого холецистита является наличие конкрементов в желчном пузыре, вы-
являемых при УЗИ, в сочетании с болезненностью при пальпации мышц пра-
вого верхнего квадранта брюшной стенки и признаками инфекционного про-
цесса. Ультразвуковые данные при холелитиазе и остром холецистите по-
дробно обсуждаются в 3-й главе.
Некалькулезный холецистит
Несмотря на то, что конкременты в желчном пузыре обнаруживаются в
90—95% всех случаев холецистита, некалькулезный холецистит составляет
более 50% случаев поступений в ОНП. Диагностика некалькулезного холе-
цистита у этой группы пациентов может быть достаточно трудной. У пациен-
тов обычно выявляются признаки острого инфекционного процесса неясного
происхождения, поскольку при критических состояниях клинические дан-
ные нередко неопределенны, а сами пациенты уже не способны жаловаться
на боль. В одном из ретроспективных исследований проведено сравнение
данных КТ и ультрасонографии при исследовании органов гепатобилиарной
области при выявлении некалькулезного холецистита. Эти методы исследо-
вания оказывались полезными для исключения холецистита, если желчный
пузырь удавалось визуализировать; однако, если получить изображение желч-
ного пузыря не удавалось, ложноположительные заключения в этой группе
больных были сделаны в 50% случаев. В целом получение изображений гепа-
тобилиарной зоны было признано второстепенным по отношению к другим
диагностическим средствам. Возможности КТ и ультрасонографии в диагно-
стике некалькулезного холецистита оказались сопоставимыми. Однако по-
скольку УЗИ менее дорого и более компактно, оно выполняется в первую
очередь. В целом чувствительность ультрасонографии в диагностике некаль-
кулезного холецистита составила 67%, специфичность — 90%. Ультразвуко-
вые признаки некалькулезного холецистита включают в себя растяжение жел-
чного пузыря, субсерозный отек и наличие эхопозитивной взвеси. Одним из
диагностических критериев некалькулезного холецистита является утолще-
ние стенки желчного пузыря более 3,5 мм (рис. 16.1).
Наличие взвеси в желчном пузыре как признак холецистита в одном из
исследований обеспечивало чувствительность, равную только 61% (рис. 16.2).
Характерными ультрасонографическими признаками, которые позволяют
отличить взвесь от конкрементов желчного пузыря, являются отсутствие
акустической тени и более медленное смещение взвеси при гравитационной
пробе. Наличие перипузырной жидкости является наиболее поздним при-
544
16 УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
Рис. 16.1. На сагиттальном срезе желчного пузыря определяется утолщение его
стенок.
знаком заболевания и связано с проникновением воспалительного экссудата
через стенку желчного пузыря (рис. 16.3). Этот процесс может прогрессиро-
вать до развития некротических изменений стенки и формирования перипу-
зырного абсцесса. Необходимо заметить, что жидкость, окружающая жел-
чный пузырь, может быть асцитической, это обстоятельство необходимо
исключить и только после этого считать перипузырное скопление жидкости
признаком холецистита.
Поскольку при выраженном некалькулезном холецистите летальность
может достигать 20% от всех больных, подвергшихся открытой холецистэк-
томии, при лечении таких больных нужно отдавать предпочтение чрескож-
ной холецистостомии. Ультрасонография может быть использована для конт-
ЖЕЛЧНЫЙ ПУЗЫРЬ
545
Рис. 16.2. На сагиттальном срезе желчного пузыря определяется эхопозитивная
взвесь (стрелки).
роля чрескожного введения холецистостомического дренажа у постели боль-
ного (рис. 16.4). Дренажи обычно проводятся через печень, ткань которой
закрывает место прокола желчного пузыря, предотвращая истечение желчи
и способствуя фиксации дренажа. Поскольку ультразвуковая визуализация
иглы может быть затруднена, мы предпочитаем устанавливать дренаж под
контролем КТ, если состояние пациента позволяет его транспортировать.
Самым частым осложнением чрескожного дренирования является подтека-
ние желчи, наблюдающееся у 3% больных. Общая частота осложнений со-
ставляет около 9%. Несмотря на то, что полноценного дренирования удает-
ся достигнуть более чем у 90% пациентов, летальность, связанная с прогрес-
сированием основного заболевания, остается высокой.
35 Ультразвуковая диагностика...
546
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
Рис. 16.3. На сагиттальном срезе желчного пузыря определяется утолщение его
стенок и перипузырное скопление жидкости.
ЖЕЛЧНЫЙ ПУЗЫРЬ
547
Рис. 16.4. Чрескожное чрезпеченочное (L) проведение дренажной трубки в
перерастянутый желчный пузырь (В).
548
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ВЕН
Тромбоз глубоких вен
Одним из наиболее частых применений ультрасонографии в ОНП является
диагностика тромбоза глубоких вен (ТГВ). Бессимптомный ТГВ выявляется
почти у 12% пациентов ОНП при обычном УЗИ и у 25% больных, входящих в
группу высокого риска (при переломе костей таза, протезировании коленно-
го сустава, онкохирургических вмешательствах). Использование в диагнос-
тике ТГВ только клинических данных приводит к ошибочным заключениям
в 50% случаев. Несмотря на то, что венография, в общем, считается «золо-
тым» стандартом в диагностике ТГВ, ультрасонография неинвазивна и обла-
дает преимуществом возможности неоднократного проведения в больнич-
ной палате. Другие неинвазивные методы диагностики ТГВ, например пле-
тизмография, оказались менее надежными.
УЗИ вен обычно проводится 5 МГц-линейным датчиком со сканирова-
нием области от паховой связки до трифуркации подколенной артерии. В
сомнительных случаях исследование может быть дополнено допплерогра-
фией, позволяющей оценить спонтанный кровоток, его фазы и увеличение.
Диагностическим критерием ТГВ является визуализация тромба в просвете
вены. Однако этот признак часто не определяется из-за обычно присутству-
ющих артефактов, затрудняющих визуализацию тромбов, а также вследст-
вие меняющейся эхогенности свежего тромба (рис. 16.5). По мере созрева-
ния тромбов их эхогенность повышается, вена сжимается, а коллатерали
становятся более заметными. На этой стадии заболевания диагноз ТГВ уста-
навливается достаточно легко.
Из-за этих проблем главным критерием в диагностике ТГВ считается
податливость вен внешней компрессии (рис. 16.6). Вены, не содержащие
тромба, будут спадаться даже при минимальной компрессии ультразвуко-
вым датчиком. Стандартная величина силы, необходимой для сжатия вены,
определена в 104 дин/см2. Этой силы должно хватить для создания углубле-
ния в коже, но недостаточно для сдавливания артерии. Недостаточное сдав-
ливание вены указывает на присутствие тромба.
Более чем в 20 исследованиях было проведено сравнение компрессии
ультразвуковым датчиком с венографией в диагностике ТГВ у больных с со-
ответствующими симптомами. Большинство исследований ограничивалось
оценкой состояний бедренной и подколенной вен. В некоторых работах ве-
нография была выполнена во всех случаях, в других — только при положи-
тельных ультразвуковых данных.
По данным 20 исследований (1660 больных) общая чувствительность
ультрасонографии в выявлении тромбоза проксимальных вен нижних ко-
нечностей составила 96%, специфичность — 98%, точность — 97%. Даль-
нейшее наблюдение 1022 пациентов с отрицательными данными УЗИ в пе-
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ВЕН
549
Рис. 16.5. Изображение гиперэхогенного тромба в просвете внутренней яремной
вены.
риод от 8 до 33 месяцев выявило только 3 случая развития ТГВ. Только 2 па-
циента, оба с метастазами рака и отрицательными данными УЗИ, умерли; по
клиническим признакам, их смерть наступила в результате эмболии ветвей
легочной артерии, однако аутопсическое подтверждение диагноза получено
не было. На основе этого можно сделать вывод об обоснованной отсрочке
лечения ТГВ у пациентов с нормальными ультразвуковыми данными.
УЗИ больше всего необходимо при выявлении тромбов в просвете под-
коленной и бедренной вен, однако его возможности в диагностике тромбоза
тазовых вен и вен голени ограничены. В одном из исследований только у
71% пациентов с тромбозом тазовых вен, подтвержденным венографией,
при УЗИ были получены положительные диагностические данные. При тром-
бозе вен голени чувствительность ультрасонографии варьировала от 50 до
550
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
Рис. 16.6. Сагиттальный срез нормальной вены с (А) компрессией и (Б) без
компрессии.
ТРАНСЭЗОФАГЕАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
551
80%. Исследование вен голени лучше проводить при свешенной конечно-
сти, на которой заметно увеличение их диаметра.
Вопрос о необходимости лечения тромбоза вен голени остается спор-
ным. Некоторые авторы рекомендуют применение антикоагулянтов. Одна-
ко тромбоз вен голени в проксимальном направлении прогрессирует только
у 20% пациентов. В связи с этим другие авторы рекомендуют выполнение
повторных сеансов УЗИ проксимальных вен для определения распростране-
ния тромбоза. При его подтверждении должно быть назначено соответству-
ющее лечение.
Визуализация вен для установки центральных венозных катетеров
Кроме диагностики венозного тромбоза ультрасонография может с успехом
применяться при установке центральных венозных катетеров. По этой мето-
дике игла проводится через направляющее устройство, прикрепленное к дат-
чику, а вена визуализируется в поперечной плоскости (рис. 16.7). Для под-
тверждения визуализации венозного ствола используется дозированная ком-
прессия. После того как вена локализована и виден ее просвет, выполняется
пункция. Такой метод наиболее полезен при обучении неопытных операто-
ров для установки центральных катетеров и уменьшения числа проходов
иглы. Кроме этого, он может оказать пользу опытным в установке централь-
ных венозных катетеров врачам, когда обычная техника выполнения этой
процедуры, основанная на анатомических ориентирах, не принесла успеха.
Центральный венозный катетер может быть также установлен и без направ-
ляющего иглу устройства. Может применяться и методика «свободной руки»,
и электронная направляющая система (см. гл. би 17).
ТРАНСЭЗОФАГЕАЛЬНАЯ ЭХОКАРДИОГРАФИЯ
Внедрение трансэзофагеальной эхокардиографии (ТЭЭГ) значительно уве-
личило клиническое применение эхокардиографии в ОНП, начиная с 1990 г.
Трансэзофагеальный доступ позволяет избежать многих технических проб-
лем, связанных с получением полноценных изображений, при трансторакаль-
ной эхокардиографии (ТТЭГ). Ограничения трансторакального доступа свя-
заны с недостаточным акустическим окном у пациентов, находящихся на ис-
кусственной вентиляции легких, и проблем, возникающих при изменении
положения тела. В одном из исследований только 36% трансторакальных
изображений, полученных у больных в критическом состоянии, были при-
знаны информативными, в то время как этот же показатель для трансэзофаге-
альных изображений составил 97%. Трансторакальную и трансэзофагеаль-
ную эхокардиографию применяют для обнаружения жидкости в перикардиаль-
ной полости и тампонады сердца, расслоения аорты и инородных тел в
сердце; для оценки движения сердечной стенки, эндокардита, сердца как ис-
552
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
Рис. 16.7. Ультразвуковой датчик с направляющим устройством для установки
венозных катетеров. Печатается с разрешения.
точника эмболии, функции клапанов; наблюдения за гемодинамикой. Неко-
торые из этих исследований будут обсуждены более подробно.
Гидроперикард и тампонада сердца
Эхокардиография (как ТТЭГ, так и ТЭЭГ) является диагностическим средст-
вом выбора при выявлении скопления жидкости в полости перикарда и там-
понады сердца. На рис. 16.8 показан верхушечный двухкамерный вид сердца
ДРУГИЕ ПРИМЕНЕНИЯ УЛЬТРАЗВУКОВОГО ИССЛВДОВАНИЯ В ОНП
553
у пациента с большим объемом перикардиальной жидкости, тампонадой и
признаками циркулярной компрессии правого желудочка. В качестве лечеб-
ной процедуры в этом случае в полость перикарда под контролем УЗИ был
установлен катетер. В норме в полости перикарда присутствует около 20 мл
жидкости. Вначале перикардиальная жидкость накапливается в заднем отде-
ле полости, являющемся наиболее глубоким в положении пациента лежа на
спине. Небольшой объем выпота может проявляться эхонегативной поло-
ской в систолу, пропадающей в диастолу. При большом объеме выпота жид-
кость окружает сердце. Тампонада сердца может быть выявлена при ультра-
сонографии по компрессии правого желудочка и уменьшению размеров ле-
вого желудочка, вызванному смещением межжелудочковой перегородки во
время вдоха.
Эхокардиографический мониторинг сердечной гемодинамики
Трансэзофагеальная эхокардиография может быть использована для на-
блюдения за сердечной гемодинамикой. Сердечный выброс определяется
измерением площади поперечного сечения корня аорты и скорости крово-
тока через аортальный клапан. Произведение интегральной скорости кро-
вотока на диаметр корня аорты эквивалентно ударному объему. Давление
заклинивания в легочных капиллярах может быть определено при измере-
нии конечной диастолической площади левого желудочка, которая пропор-
циональна конечному диастолическому объему левого желудочка. В ряде
исследований была выявлена хорошая корреляция между величиной сер-
дечного индекса, измеренного при эхокардиографии, и данными, получен-
ными при помощи внутриартериального катетера, с коэффициентом корре-
ляции от 0,85 до 0,94. Кроме этого, было показано, что конечный диастоли-
ческий объем левого желудочка коррелирует с давлением заклинивания в
легочных капиллярах с коэффициентом корреляции, равным 0,88. Однако в
других исследованиях был выявлен низкий коэффициент корреляции или
говорилось о невозможности согласования данных, полученных при термо-
делюции в 10% случаев. Одной из причин этой проблемы является необхо-
димость точного измерения диаметра корня аорты. Ошибка такого измере-
ния всего лишь в 2 мм приводит к ошибке вычисления сердечного индекса
на 14%, поскольку площадь поперечного сечения сосуда получают путем
возведения в квадрат.
ДРУГИЕ ПРИМЕНЕНИЯ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ В ОНП
Почечная недостаточность
В ОНП ультрасонография может применяться для определения причин по-
чечной недостаточности. Основной ролью ультрасонографии при острой по-
чечной недостаточности является исключение обструкции как причины этой
554
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
Рис. 16.8. ТТЭГ верхушечный двухкамерный вид сердца, на котором видны большой
объем перикардиальной жидкости, правый желудочек, левый желудочек и тампонада
правого желудочка в систолу (стрелки).
556
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
Рис. 16.10. Сагиттальный вид увеличенной отечной почки при почечной
недостаточности.
может быть проведена и под ультрасонографическим контролем, особенно
при внутрипеченочных абсцессах. Для этого обычно используется датчик с
частотой 3,5 МГц. Абсцессы выглядят как гипоэхогенные образования с раз-
личным количеством содержимого, дающие эффект дорсального усиления
РЕЗЮМЕ
557
Рис. 16.11. Сагиттальный вид отторженной пересаженной почки с увеличением
пирамид и общих размеров органа.
ультразвука. Общая чувствительность УЗИ при выявлении абсцессов печени
составляет 80%, однако небольшие абсцессы или абсцессы, расположенные у
диафрагмальной поверхности печени, могут остаться не замеченными. Об-
щая чувствительность ультрасонографии при выявлении внутрибрюшых
воспалительных процессов составляет 75%. В большинстве случаев КТ явля-
ется более предпочтительным первоначальным исследованием с общей чув-
ствительностью 80-100%.
РЕЗЮМЕ
Сонография стала незаменимым средством в диагностике критических со-
стояний. Метод применяется в основном для исследования билиарного трак-
та, венозной системы (в частности, при тромбозе глубоких вен) и сердца.
558
16. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ В ОТДЕЛЕНИЯХ НЕОТЛОЖНОЙ ПОМОЩИ
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Agnelli G, Radicchia S, Nenci G. Diagnosis of deep vein thrombosis in asymptomatic high-risk
patients. Haemostasis 1995;25:40-48.
Babb R. Acute acalculous cholecystitis. J Clin Gastroenterol 1992;15(3):238-241.
Baker W, Bick R. Deep vein thrombosis. Med Clin North Am 1994;78(3):685—712.
Barie P, Fischer E. Acute acalculous cholecystitis. J Am College Surg 1995;180:232-244.
Boland G, Lee M, Mueller P. Acute cholecystitis in the intensive care unit. N Horiz 1993;
l(2):246-260.
Chenzbraun A, Pinto F, Schnittger I. Transesophageal echocardiography in the intensive care
unit: impact on diagnosis and decision-making. Clin Cardiol 1994:17:438 444.
Dabaghi S, Rokey R, Rivera J, et al. Comparison of echocardiographic assessment of cardiac he-
modynamics in the intensive care unit with right-sided cardiac catheterization. Am J Cardiol
1995;76:392-395.
Foster E, Schiller N. Transesophageal echocardiography in the critical care patient. Cardiol Clin
1993;11(3):489—503.
Gualtieri E, Deppe S, Sipperly M, Thompson D. Subclavian venous catheterization: greater suc-
cess rate for less experienced operators using ultrasound guidance. Crit Care Med 1995;
23(4):692-697.
Heidenreich P, Stainback R, Redberg R, et al. Transesophageal echocardiography predicts mor-
tality in critically ill patients with unexplained hypotension. J Am College Cardiol 1995;
26(1): 152-158.
Koopman M, Van Веек E, Ten Cate J. Diagnosis of deep vein thrombosis. Prog Cardiovasc Dis
1994;37(1):1—12.
Moulton J, Braley S, Groner T. Percutaneous abscess drainage in the management of sepsis. N
Horiz 1993;1(2):231-245.
Poelaert J, Trouerbach J, DeBuyzere M, et al. Evaluation of transesophageal echocardiography
in a diagnostic and therapeutic aid in a critical care setting. Chest 1995;107(3):774-779.
Sheridan R, Ryan C, Lee M. et al. Percutaneous cholecystostomy in the critically ill bum patient.
J Trauma 1995;38(2):248-251.
Vignon P, Mentec H, Terre S, et al. Diagnostic accuracy and therapeutic impact of transthoracic
and transesophageal echocardiography in mechanically ventilated patients in the ICU. Chest
1994; 106(6): 1829-1834.
Yu C, Y ang P, Chang D, Luh K. Diagnostic and therapeutic use of chest sonography: value in cri-
tically ill patients. Am J Roentgenol 1992;159:695-701.
НОВЫЕ ТЕХНОЛОГИИ
Джей К. Харнесс и Деннис Б. Вишер
17
Совершенствование ультразвуковой техники происходит столь стремитель-
но, что даже на простое перечисление всех новых технологий в этой главе
просто не хватит места. Некоторые из новых методик могут применяться в
хирургии. В данной главе представлен краткий обзор технологий, примене-
ние которых позволит улучшить качество изображения и контроль за поло-
жением пункционной иглы, находящейся вне плоскости сканирования, рас-
ширит список показаний для трепан-биопсии, а также поможет в выполнении
высокочастотной аблации первичных и метастатических злокачественных
опухолей. Кроме того, приводится описание новых методик обучения прове-
дению УЗИ.
ТРЕХМЕРНОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Стандартное — двухмерное (2-D) — ультразвуковое изображение часто
сравнивают с отрезанным куском хлеба. В отличие от двухмерного, трехмер-
ное (3-D) ультразвуковое сканирование не ограничивается визуализацией в
пределах одной плоскости и позволяет получать объемное изображение
зоны интереса. Продолжая аналогию с хлебом, можно сказать, что 3-D ульт-
развуковое сканирование позволяет визуализировать каждую крошку хлеб-
ного батона в любом требуемом ракурсе. Использование данной технологии
способствует повышению точности диагностики.
Само понятие «трехмерный ультразвук» у многих ассоциируется с ви-
зуализацией лица или конечностей плода (рис. 17.1). В действительности,
трехмерное ультразвуковое сканирование состоит из четырех основных эта-
пов: получения сигнала, трехмерной количественной мультипланарной ре-
конструкции, трехмерного рендеринга и создания «живого» трехмерного
Ultrasound in Surgical Practict: Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright © 2001 Wiley-Liss, Inc.
560
17. НОВЫЕ ТЕХНОЛОГИИ
Рис. 17.1. Трехмерное изображение лица плода (беременность 32 недели).
изображения (часто обозначаемого как 4-D). Первым и наиболее важным
моментом построения трехмерных изображений является получение объем-
ного сигнала, т. е. получение объемных данных об анатомии пациента. Су-
ществует две основные методики получения исходных данных: ручное
сканирование (часто обозначаемое как техника «свободной руки» (англ.
«free-hand»)) и автоматическое сканирование.
При ручном сканировании исследователь перемещает датчик по поверх-
ности кожи, при этом в памяти аппарата накапливается серия двухмерных
изображений (рис. 17.2). В связи с тем что невозможно двигать датчик с по-
Рис. 17.2. Перемещение датчика по поверхности кожи с получением множества 2-D
изображений (сканов).
ТРЕХМЕРНОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
561
стоянной скоростью, получаемые анатомические данные отличаются неод-
нородностью. Проще говоря, расстояние между полученными сканами неоди-
наково, а, следовательно, объемные измерения недостоверны.
При использовании автоматического сканировании нет необходимости
в ручном перемещении датчика. Исследователь помещает датчик над зоной
интереса, и после включения объемного сканирования кристаллы, находя-
щиеся в датчике, выполняю ! сканирование зоны интереса, собирая трехмер-
ные анатомические данные (рис. 17.3). Так как датчик не перемещается,
данный метод более приемлем для пациентов, особенно при проведении
трехмерного эндовагинального сканирования и исследования простаты. Пол-
ное трансректальное сканирование простаты или эндовагинальное сканиро-
вание матки занимает всего 3 секунды, при этом датчик не перемещается.
После получения необходимого набора трехмерных данных они прохо-
дят количественную мультипланарную реконструкцию. В результате на эк-
ран одновременно выводятся изображения в трех разных плоскостях (про-
дольной, поперечной и горизонтальной) (рис. 17.4). Необходимо отметить,
Рис. 17.3. А. Аппарат Voluson 530D (Medison, Cypress Калифорная, США) позволяет
проводить стандартное двух- и трехмерное УЗИ. Б. Датчик для автоматического
трехмерного сканирования органов брюшной полости. Зона сканирования датчика
представляет собой усеченную пирамиду (белого цвета)
36 Ультразвуковая диагностика...
562
17. НОВЫЕ ТЕХНОЛОГИИ
Рис. 17.4. Мультипланарная реконструкция позволяет визуализировать небольшую
эндофитную внутрипротоковую карциному молочной железы. А. Изображение в
продольной плоскости. Б. Изображение в поперечной плоскости. В. Изображение в
горизонтальной плоскости. Белой точкой отмечены зоны, соответствующие друг другу
на разных сканах.
что изображение в горизонтальной плоскости невозможно получить при
традиционном — двухмерном — сканировании. Проведенные исследования
показали, что «срезы» в горизонтальной плоскости позволяют визуализиро-
вать некоторые виды рака молочной железы, которые не могут быть визуа-
лизированы при стандартном двухмерном сканировании.
С диагностической точки зрения, основные возможности и преимуще-
ства трехмерного ультразвука связаны именно с мультипланарной реконст-
рукцией, которая позволяет исследователю вращать полученные объемные
данные по трем осям (х, у и z) и визуализировать зону диагностического ин-
тереса в оптимальном ракурсе. Изучение полученных данных может произ-
водиться как во время исследования, так и после того, как пациент покинет
отделение ультразвуковой диагностики или клинику. Такая возможность
обследования «виртуального» пациента особенно полезна, когда речь идет о
трудных или неясных случаях. Благодаря возможности одновременного ото-
бражения срезов, полученных в трех различных плоскостях, хирург получа-
ет более ясные представления о топографо-анатомических взаимоотноше-
ниях в зоне интереса. При этом чем сложнее патологические изменения, тем
ярче проявляются преимущества 3-D мультипланарной реконструкции.
Трехмерная мультипланарная реконструкция позволяет точно произво-
дить объемные измерения независимо от формы исследуемого объекта. Та-
ТРЕХМЕРНОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
563
кая возможность особенно ценна при исследовании опухолей (и их крово-
снабжения) на этапе подготовки к малоинвавзивным или хирургическим
вмешательствам. В настоящее время компания Medison (Cypress, Калифор-
ния, США) является единственной, получившей разрешение Управления по
контролю за качеством продуктов питания и лекарственных препаратов (Food
and Drug Administration, FDA) на выпуск аппаратов, позволяющих произво-
дить точные трехмерные объемные измерения. Это отчасти обусловлено
тем, что при автоматизированном сканировании необходимо получать стан-
дартные анатомические данные.
Следующим этапом трехмерной визуализации является рендеринг. Наи-
более известными примерами трехмерного рендеринга являются изображе-
ния лица и других частей плода (рис. 17.5). Данная методика позволяет ис-
следователю изучать объемное изображение зоны интереса, которое можно
вращать до получения оптимального ракурса. При использовании трехмер-
ного рендеринга могут быть изучены как поверхностные, так и внутренние
структуры.
Под «живым» трехмерным изображением {англ. «live З-D») понимают
возможность ультразвуковых систем получать исходные данные, рассчиты-
вать и отображать трехмерные данные несколько раз в секунду, что позволя-
Рис. 17.5. Трехмерный рендеринг изображения лица плода (беременность 38 недель).
564
17. НОВЫЕ ТЕХНОЛОГИИ
ет наблюдать трехмерные структуры в движении. Эта технология имеет боль-
шие перспективы в области повышения точности таких манипуляций, как
введение игл, катетеров и других интервенционных устройств.
Большинство врачей ультразвуковой диагностики согласны с тем, что
будущее диагностического ультразвука принадлежит трехмерной визуали-
зации. Врачи больше не будут ограничены необходимостью изучения толь-
ко двухмерных изображений, а получат возможность изучения трехмерного
массива диагностических данных, что в свою очередь повысит уровень диа-
гностики за счет более точных объемных вычислений. Использование трех-
мерных изображений расширит сферу применения УЗИ и превратит его из
сугубо диагностической процедуры в один из основных методов проведе-
ния лечебных и интервенционных вмешательств (рис. 17.6).
ВАКУУМНАЯ ТРЕПАН-БИОПСИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
Вакуумная трепан-биопсия молочной железы стала применяться в США с се-
редины 1990-х гг. Первоначально методика использовалась при выполнении
стереотаксической биопсии под рентгеноскопическим контролем, однако
данная процедура может выполняться и под контролем ультрасонографии с
использованием большого шарнирного кронштейна. При УЗИ визуализиру-
ется большинство пальпируемых и непальпируемых образований молочной
Рис. 17.6. Мультипланарная визуализация пункционной аспирации содержимого
кисты молочной железы. А. Изображение в продольной плоскости. Б. Изображение в
поперечной плоскости. В. Изображение в горизонтальной плоскости. Белой точкой
отмечены зоны, соответствующие друг другу на разных сканах.
ВАКУУМНАЯ ТРЕПАН-БИОПСИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
565
железы, за исключением микрокальцинатов. Как было отмечено в гл. 6, био-
псия молочной железы под эхографическим контролем становится все более
распространенной процедурой, что обусловлено возрастающей потребно-
стью в более экономичных и менее инвазивных способах диагностики забо-
леваний этого органа.
Вакуумная биопсия имеет следующие преимущества:
1. Требуется только одно введение устройства. Под действием вакуума
ткани присасываются к специальному отверстию и отсекаются вра-
щающимся с большой скоростью лезвием.
2. Вакуумное устройство с иглой калибром 11 G позволяет за несколько
минут получить несколько образцов тканей, которые в восемь раз боль-
ше образцов, полученных с помощью 14 G систем для трепан-био-
псии, снабженных пружинным механизмом.
3. Наибольшие трудности при использовании систем, снабженных пру-
жинным механизмом, возникаю! при трепан-биопсии образований
небольшого размера (менее 1 см). При использовании вакуумного
устройства оно располагается под образованием, которое за счет при-
сасывающего действия попадает в отверстие иглы, что повышает шан-
сы на получение материала (рис. 17.7).
4. Возможность позиционирования отверстия за образованием делает
вакуумную биопсию под эхографическим контролем идеальной ме-
тодикой для выполнения биопсии поверхностно расположенных об-
разований и образований, прилежащих к имплантатам или грудной
стенке.
5. FDA одобрило применение прибора Mammotome (Ethicon Endo- Sur-
gery, Цинциннати, США) для вакуумной трепан-биопсии (с частич-
ным или полным удалением) визуализируемых (маммографически
или эхографически) образований молочных желез. Прибор может
применяться для чрескожного иссечения зон фиброзно-кистозных из-
менений, сложных кист, рецидивирующих простых кист, фиброаде-
ном и внутрипротоковых папиллом. Кроме того, Mammotome может
с успехом применяться для полного или частичного удаления пальпи-
руемых образований молочной железы, что позволяет избежать хи-
рургической резекции при доброкачественных заболеваниях.
6. Mammotome не только упрощает извлечение образцов тканей, но и
позволяет получить доступ к зоне биопсии для введения жидкостей и
установки рентгеноконтрастных меток MicroMark, которые служат
для контроля изменений в зоне биопсии.
С технологической точки зрения, новая конструкция Mammotome
Hand Held более совершенна по сравнению с первой системой Mammoto-
566
17. НОВЫЕ ТЕХНОЛОГИИ
Рис. 17.7. А. Введение иглы Mammotome - в проекции отверстия для забора тканей
определяется артефакт в виде хвоста кометы. Б. Завершение процедуры:
визуализируется полость, образовавшаяся в результате биопсии, и «хвост кометы» в
проекции отверстия для забора тканей.
те (рис. 17.8). Новый прибор снабжен двойной вакуумной системой
(SmartVac), которая создает вакуум как в области отверстия для забора
тканей, так и в зоне взятого столбика тканей при удалении лезвия. Под
действием вакуума биоптат извлекается из молочной железы и помеща-
ется в специальную камеру. Построенное на базе развитой компьютерной
системы устройство снабжено быстро вращающимся ножом, скорость
вращения которого автоматически регулируется с учетом плотности ис-
секаемых тканей, благодаря чему по сравнению с оригинальной системой
Mammotome объем получаемых биоптатов увеличивается на 10%. В на-
стоящее время Mammotome Hand Held применяется только для биопсии
под контролем ультрасонографии. В скором времени планируется вы-
пуск аппаратов для стереотаксической биопсии под рентгеноскопиче-
ским и МРТ-контролем.
Система Mammotome Hand Held, несомненно, будет играть важную роль
в хирургическом лечении заболеваний молочной железы. В настоящее вре-
мя проводится изучение возможностей черескожной резекции и/или абла-
ции доброкачественных и злокачественных образований молочной железы.
В большинстве случаев подобные вмешательства будут выполняться под
контролем ультрасонографии. В дальнейшем хирурги-маммологи должны
будут владеть навыками ультразвукового сканирования, которое из допол-
нительного метода исследования превратится в основной метод визуализа-
ции при проведении диагностических и лечебных вмешательств при заболе-
ваниях молочной железы.
ВАКУУМНАЯ ТРЕПАН-БИОПСИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
567
Рис. 17.8. А. Устройство для трепан-биопсии Mammotome Hand-Held на передвижной
стойке. Б. Одноразовая Hand-Heid игла, закрепленная на держателе. В. Hand Heid
система в собранном виде.
568
17. НОВЫЕ ТЕХНОЛОГИИ
Отпершие для взятия биотэта
Камера для
хранения биоптата
вакуумная система
Рис. 17.8. (Продолжение)
СИСТЕМЫ ЭЛЕКТРОННОГО КОНТРОЛЯ ПРИ ВМЕШАТЕЛЬСТВАХ,
ВЫПОЛНЯЕМЫХ ПОД УЛЬТРАСОНОГРАФИЧЕСКОЙ ВИЗУАЛИЗАЦИЕЙ
Большинство современных ультразвуковых аппаратов снабжены системами,
облегчающими выполнение интервенционных процедур. Основными эле-
ментами таких систем являются: насадка на датчик, служащая направляю-
щей для иглы, и «траектория» иглы, отображаемая на мониторе аппарата. Как
। щавило, насадки на датчик позволяют вводить иглу только по одной, заранее
заданной, траектории. Некоторые насадки позволяют вводить иглу по несколь-
ким траекториям. Траектория движения иглы всегда располагается в плоско-
сти сканирования (рис. 6.45) и накладывается на ультразвуковое изображе-
ние. Перемещая ультразвуковой датчик, врач совмещает отображаемую тра-
екторию с зоной интереса, а затем вводит иглу. При отсутствии изгибов
фиксированная в направляющих игла визуализируется на всем протяжении.
Подобные приспособления хороши для начинающих, однако опытные врачи
ультразвуковой диагностики считают, что их использование излишне и толь-
ко отнимает время.
Значение вмешательств, выполняемых под ультразвуковым контролем
(тонкоигольная аспирационная и трепан-биопсия, введение лекарственных
веществ и аблация тканей), постоянно растет. Введение иглы строго в плос-
кости сканирования не всегда возможно (например, при некоторых локали-
зациях метастазов в печени). Безусловно, необходимо устройство, которое
позволяло бы вводить иглу под любым углом к ультразвуковому датчику.
Подобное устройство (UltraGuide 1000 и 1200) было разработано и получило
одобрение регулирующих органов США, Канады и Европы (рис. 17.9). Сие-
СИСТЕМЫ ЭЛЕКТРОННОГО КОНТРОЛЯ
569
Рис. 17.9. A. UltraGuide 1000. Б. Ультразвуковой аппарат Logiq 400 MD (слева)
(General Electric, Милуоки, США) с интегрированной системой UltraGuide 1200
(справа)
тема UltraGuide выпускается в двух модификациях — в виде отдельного
устройства или блока, встроенного в ультразвуковой аппарат. В то время
как модель 1000 может применяться со многими ультразвуковыми аппара-
тами, модель 1200 более специализирована и предназначена для использо-
вания только с одним ультразвуковым сканером. В последнем случае аппа-
ратная и программная части системы UltraGuide (за исключением электро-
магнитного трансмиттера) встраиваются в ультразвуковой аппарат.
Система UltraGuide 1000 непрерывно производит определение положе-
ния и ориентации инструмента, которым производится вмешательство (на-
пример, иглы), и ультразвукового датчика в зоне трехмерного пространства
в так называемой «рабочей области», находящейся перед ультразвуковым
аппаратом. Рабочая зона соответствует области магнитного поля, создавае-
мого трансмиттерами, расположенными во взаимоперпендикулярных плос-
костях на мониторе. Уровень напряженности магнитного поля, создаваемо-
го системой, не превышает уровень напряженности магнитного поля Земли.
Для определения положения датчика и иглы служат два сенсора, один из ко-
торых фиксируется с помощью одноразового адаптера на канюле игле, а
другой закреплен на датчике. Используя данные о точном положении конца
иглы и датчика, а также учитывая длину иглы или другого инструмента, сис-
тема рассчитывает и отображает на мониторе положение и траекторию иглы.
На рис. 17.10 приведено типичное изображение, выводимое на монитор
системы UltraGuide 1000. На мониторе отображается взаимоотношение иглы
и центра ультразвукового «луча» в горизонтальной проекции, благодаря
37 Ультразвуковая диагностика...
570
17. НОВЫЕ ТЕХНОЛОГИИ
чему исследователь может позиционировать иглу в одной плоскости с дат-
чиком, независимо от расстояния между ними. Синие параллельные штрихо-
вые линии на основном экране соответствуют текущему положению иглы,
между линиями определяется ультразвуковое положение иглы, конец пунк-
тирной линии соответствует положению кончика иглы. Дальнейшая траек-
тория иглы обозначена пунктирной линией другого цвета. Когда игла и ее
дальнейшая траектория располагаются в плоскости сканирования, траекто-
рия отображается зеленой пунктирной линией. Визуализация возможной
траектории позволяет врачу выбрать правильный угол введения иглы. При
прохождении возможной траектории движения иглы вне зоны сканирова-
ния точка пересечения с плоскостью датчика обозначается в виде желтого
«прицела» (перекрестье) (рис. 17.11). Движения прицела на экране соответ-
ствуют перемещению кончика иглы. Расстояние (в см) от кончика иглы до
плоскости пресечения с плоскостью сканирования постоянно отображается
над прицелом. Часть траектории, расположенная кпереди от плоскости ска-
нирования, отображается зеленой пунктирной линией, а расположенная за
плоскостью сканирования - красной (рис. 17.11). Одним из важнейших пре-
имуществ UltraGuide 1000 является возможность контролировать переме-
щение интервенционного инструмента, находящегося вне плоскости скани-
рования, и точно позиционировать его в образование. Подобные системы
расширяют возможности использования ультрасонографии как быстрого и
менее дорогостоящего способа контроля при проведении интервенционных
процедур. В настоящее время модуль UltraGuide встраивается в большинст-
Рис. 17.10. На экране UltraGuide 1000 отображено введение биопсийной иглы,
расположенной в плоскости сканирования. Двухмерный вид сверху используется для
выравнивания иглы и оси, проходящей через центр излучателя датчика (вверху
слева).
ВЫСОКОЧАСТОТНАЯ АБЛАЦИЯ
571
Рис. 17.11. На экране UltraGuide 1000 отображено введение биопсийной иглы,
расположенной вне плоскости сканирования. Трехмерная реконструкция положения
иглы относительно центра излучателя датчика (вверху слева).
во ультразвуковых сканеров класса high-end, а также выпускается в виде под-
ключаемого модуля для использования совместно с другими аппаратами.
ВЫСОКОЧАСТОТНАЯ АБЛАЦИЯ
Высокочастотная термическая аблация (ВТА) (англ, radiofrequency thermal
ablation, RFA) первичных и вторичных злокачественных опухолей стала при-
меняться в клинической практике с 1990 г. Большинство исследований, на-
правленных на изучение возможностей ВТА, было проведено в Европе, одна-
ко со второй половины 1990-х годов рост количества подобного рода иссле-
дований отмечен и в США. В исследования, проведенные в США, как
правило, включались пациенты, страдающие метастатическими или первич-
ными злокачественными опухолями печени, имеющие четыре или менее
опухолевых узла размером не более 4,5 см с отсутствием признаков внепече-
ночного метастазирования и чья ожидаемая продолжительность жизни пре-
вышала 6 месяцев. У большинства пациентов, отобранных для ВТА, имелись
противопоказания к хирургической резекции, такие как тяжесть основного забо-
левания, цирроз печени, наличие более четырех отдельных образований и др.
Типичный план обследования перед ВТА включает: чрескожную био-
псию, функциональные пробы печени, определение уровня раково-эмбрио-
нального антигена (РЭА) у пациентов с метастатическими опухолями обо-
дочной и прямой кишки, определение уровня альфа-фетопротеина (АФП) у
572
17. НОВЫЕ ТЕХНОЛОГИИ
Рис. 17.12. А. Компьютерная томограмма перед процедурой RFA: визуализируется
очаговое образование печени (показано черными стрелками). Б. Компьютерная
томограмма после процедуры аблации определяется зона некроза (показана
черными стрелками)
пациентов, страдающих гепатоклеточной карциномой, определение уровня
других онкомаркеров (например, маркеров, уровень которых повышается у
пациентов с метастатическими нейроэндокринными опухолями), а также
тест на гепатит. Для визуализации опухолевых узлов и зон аблации исполь-
зуется спиральная компьютерная томография и трансабдоминальное ульт-
развуковое сканирование (рис. I7 12).
Оборудование
Оборудования для ВТА производится многими компаниями, в частности
Radiofrequency Interstitial Tissue Ablation (RITA) Medical Systems. Аблацион-
ная система RITA состоит из одноразовых 14G или 15G зондов и высокочас-
тотного (ВЧ) генератора. Зонды длиной 15 и 25 см различаются количеством
электродов — от 2 до 9 (рис. 17.13) Под действием ВЧ-энергии, поступаю-
Рис. 17.13. Аблационные зонды RITA двух размеров
ВЫСОКОЧАСТОТНАЯ АБЛАЦИЯ
573
щей по электродам, происходит нагрев тканей, вызванный активизацией
ионов. В зонах с наибольшей плотностью ВЧ-тока происходит значительное
повышение температуры. В зонах, удаленных от электродов, плотность тока
незначительна, поэтому нагревания тканей не происходит. В системе RITA
температура тканей контролируется с помощью термопары, расположенной
на конце электрода. Поступающие данные о температуре тканей используют-
ся для коррекции мощности ВЧ-генератора RITA. Разное количество и распо-
ложение электродов в сочетании с изменением температуры позволяют про-
изводить аблацию разного объема тканей. Последняя модель ВЧ-генератора
RITA (модель 1500) (рис. 17.14) в сочетании с зондом Slarburst XL позволяет
создавать зоны аблации от 3 до 5 см в диаметре. Указанный зонд калибром
14G имеет 9 электродов, на которых располагается 5 термопар. Мощность
ВЧ-генератора модели 1500 достигает 150 Ватт при частоте 460 кГц. Рабочий
импеданс (волновое сопротивление) генератора составляет 10—999 Q. При
этом импеданс тканей в большинстве случаев находится в переделах 30-70 Q.
Система RITA может присоединяться к портативному или настольному
компьютеру, на экране которого в графическом виде отображается темпера-
тура тканей, мощность, импеданс, а также динамика охлаждения тканей по-
сле завершения процедуры. Кроме того, специальное программное обеспече-
ние позволяет хранить другие важные данные пациентов.
Рис. 17.14. Генератор RITA 1500, соединенный с ноутбуком, на дисплее которого
отображается процедура аблации.
574
17. НОВЫЕ ТЕХНОЛОГИИ
Процесс аблации
Высокочастотная аблация может выполняться как чрескожно, так и в ходе от-
крытых или лапароскопических (см. гл. 5) вмешательств. Ультразвуковой
контроль позволяет вводить ВЧ-зонд точно в выбранную зону опухоли. Для
оптимизации распространения электрической энергии процедуру следует
проводить в определенной последовательности. Так использование оборудо-
вания компании RITA Medical Systems (генератора модели 1500 и зонда Star-
burst XL) позволяет производить аблацию тканей в зоне диаметром 5 см. Для
этого электроды сначала выдвигают на 3 см, нагревают ткани до 105 °C и под-
держивают указанную температуру в течение 5 минут. Затем электроды вы-
двигают еще на 1 см и осуществляют воздействие на ткани при температуре
105 °C в течение 10 минут. На заключительном этапе процедуры электроды
выдвигаются на 5 см, а воздействие при заданной температуре (105 °C) осу-
ществляют в течение 20 мин. Новые алгоритмы позволят оптимизировать
время процедуры, температуру и мощность воздействия.
В ходе процедуры ткани, расположенные в зоне аблации вокруг высоко-
частотного зонда, претерпевают ряд последовательных изменений. Энергия
доставляется в ткани не за счет нагревания электрода, а за счет передачи
электрического импульса. Плотность электрического тока наиболее высока
вокруг электродов, поэтому первоначальная зона нагрева имеет форму кле-
верного листа. С течением времени первоначальные зоны нагрева сливают-
ся в сферическую зону аблации (рис. 17.15) до достижения равновесия между
тепловой энергией, подводимой к тканям, и потерей тепла за счет кондукции и
конвекции. Процесс высокочастотной аблации контролируется посредством
ультразвукового сканирования и постоянного измерения температуры, мощ-
ности импеданса. При нагревании до 45 °C в клетках происходит денатура-
ция протеинов и нарушение целостности клеточных мембран за счет рас-
плавления их липидной составляющей. Из денатурированных тканей выде-
ляется азот в виде пузырьков, размер которых меньше размера клеток. При
ультразвуковом сканировании пузырьки азота и некротизированные ткани
визуализируются в виде гиперэхогенной зоны (см. рис. 5.8 В). Наружные
границы зоны аблации также дают гиперэхогенный сигнал.
Чрескожная и лапароскопическая ВТА
Чрескожная и лапароскопическая ВТА имеют свои преимущества и недо-
статки. Чрескожная аблация может выполняться в амбулаторных условиях с
использованием тех же основных приемов, что и чрескожная биопсия пече-
ни. Для чрескожной ВТА отбирают контактных пациентов, способных пери-
одически задерживать дыхание. Основным недостатком чрескожной ВТА
является отсутствие доступа к некоторым образованиям при чрескожном
введении электродов. Кроме того, ВТА может быть противопоказана при на-
личии поверхностно расположенных образований, когда существует риск
ВЫСОКОЧАСТОТНАЯ АБЛАЦИЯ
575
Рис. 17.15. Процедура аблации с использованием зонда RITAStarBurstXL. А. Введение
зонда Б. Выдвижение электродов. В Зона некроза.
нагрева окружающих органов и структур. Осложнения чрескожной ВТА в
целом совпадают с осложнениями чрескожной биопсии печени.
Лапароскопическая ВТА под контролем ультразвукового сканирования
может выполняться более прецизионно благодаря тому, что по сравнению с
чрескожными ультразвуковыми датчиками лапароскопические датчики по-
зволяют лучше визуализировать образования небольшого размера. Кроме
того, лапароскопический доступ позволяет провести полное диагностиче-
ское обследование брюшной полости. При лапароскопическом доступе воз-
можен непосредственный визуальный осмотр окружающих структур и ак-
тивная защита этих структур в процессе аблации. Одним из возможных
осложнений является кровотечение в месте введения зонда в печень, кото-
рое легче распознается и устраняется при выполнении лапароскопической
процедуры. Основными недостатками лапароскопической ВТА считаются
576
17. НОВЫЕ ТЕХНОЛОГИИ
необходимость использования общей анестезии и трудности при доступе к
глубоко расположенным образованиям.
Наконец, можно использовать комбинированный подход, сочетающий
в себе резекцию образований большого размера с высокочастотной абла-
цией глубоко расположенных и/или небольших образований. В последнем
случае аблация производится под контролем интраоперационного ультра-
звукового сканирования.
Другие области применения ВТА
В настоящее время изучается возможность применения ВТА при лечении
злокачественных опухолей молочной железы, легкого, простаты и почек, а
также метастазов в кости.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ: ОБУЧЕНИЕ С ИСПОЛЬЗОВАНИЕМ
КОМПЬЮТЕРНЫХ ТРЕНАЖЕРОВ
Владение практическими навыками проведения УЗИ становится все более
важным для практикующих хирургов и является обязательным для вра-
чей-ординаторов, завершающих обучение по специальности хирургия. Хи-
рург должен уметь интерпретировать ультразвуковые данные, знать эхосе-
миотику различных заболеваний, а также самостоятельно проводить иссле-
дование. В план обучения врачей-хирургов включены лекции по физике
ультразвука, принципам устройства ультразвуковых аппаратов, нормальной
ультразвуковой анатомии и эхосемиотике поражений внутренних органов, а
также занятия по овладению практическими навыками проведения УЗИ и, в
частности, выбору и позиционированию ультразвуковых датчиков. Для полу-
чения высококачественных ультразвуковых изображений требуется хорошая
координация в системе «глаз-рука». Большинство программ обучения УЗИ
включает практические занятия на живых моделях и фантомах. Предоставле-
ние обучающимся возможности исследования патологических изменений ор-
ганов в условиях реального времени остается трудновыполнимой задачей.
Обучение хирургов проведению УЗИ имеет много общего с обучением
летчиков. Летные симуляторы используются для обучения пилотированию
не только полностью исправного воздушного судна в идеальных метеоусло-
виях, но и для получения навыков управления самолетом при возникнове-
нии технических неполадок и в плохих погодных условиях. Технологии
имитационного моделирования (компьютерные симуляторы) могут с успе-
хом применяться и при обучении хирургов проведению УЗИ.
Симулятор UltraSim (MedSim, Форт-Лодердейл, США) состоит из
устройства, внешне и функционально схожего с ультразвуковым аппара-
том, и манекена (рис. 17.16). Аппарат снабжен датчиками с различной час-
тотой сканирования, имеет стандартные органы управления (усиление,
управление временной компенсацией, фокус, измерение размеров). При ска-
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ОБУЧЕНИЕ С ИСПОЛЬЗОВАНИЕМ КОМПЬЮТЕРНЫХ ТРЕНАЖЕРОВ
577
нировании манекена на экран аппарата выводятся изображения органов в
норме и их патологических изменений, полученные у пациентов в реальных
условиях в 3-D режиме и хранящиеся на компакт-диске (CD-ROM). При ра-
боте на аппарате UltraSim обучаемый проводит виртуальное УЗИ манекена
и оценивает данные, полученные при обследовании реальных пациентов.
Благодаря технологии трехмерного позиционирования, основанной на испо-
льзовании магнитного поля, симулятор способен точно определять положе-
ние, угол наклона и перемещение датчика относительно зоны исследования.
При перемещении датчика по манекену на экране происходит соответству-
ющая смена изображений, что позволяет обучаемому получить собствен-
ный опыт сканирования в масштабе реального времени.
Кроме того, симулятор UltraSim позволяет фиксировать результаты прак-
тических тестовых заданий, выполняемых обучаемыми (например, направ-
ленное обследование органов брюшной полости при травме). Преимуществом
ультразвукового симулятора является возможность многократной демонстра-
ции обучающимся одинаковых ультрасонограмм, отражающих структуру ор-
ганов в норме и при патологических изменениях. Использование симулято-
Рис. 17.16. Симулятор UltraSim.
578
17 НОВЫЕ ТЕХНОЛОГИИ
ра позволяет проводить обучение хирургов навыкам УЗИ в безопасных для
пациентов условиях.
Курсы обучения УЗИ в США должны быть стандартизованы по приме-
ру курсов Advanced Trauma Life Support (ATLS), разработанных American
College of Surgeons (ACS). Курс ATLS включает в себя набор стандартных
лекций, подготовленных высококвалифицированными преподавателями, ко-
торые используют одни и те же обучающие материалы. Обучение и конт-
роль мануальных навыков также максимально стандартизованы. Националь-
ный Совет преподавателей ультразвука (National Ultrasound Faculty) ACS
продолжает разработку программы курсов, основанных на модели ATLS
(см. гл. 18). В этой программе ультразвуковому симулятору, снабженному
системой записи результатов оценки практических навыков, отведена роль
«стандартных» пациентов, имеющих идентичную анатомию и «страдаю-
щих» идентичными заболеваниями. Обоснованность использования симу-
лятора UltraSim в обучении хирургов-ординаторов проведению ультразву-
кового обследования при травме уже подтверждена; в настоящее время изуча-
ется возможность применения данной технологии в курсах ACS. построенных
по модели ATLS.
ЗАКЛЮЧЕНИЕ
Новые технологии, описанные в данной главе, позволяют судить о перспек-
тивах, которые открывает перед нами будущее. Хирургические вмешатель-
ства под контролем методов медицинской визуализации в скором времени
станут нормой. Подобно тому, как в 1990-х годах хирурги осваивали лапаро-
скопическую технику, теперь им предстоит овладеть навыками УЗИ и выпол-
нения вмешательств под эхографическим контролем. Ультрасонография, как
и другие методики, основанные на использовании компьютерных техноло-
гий, взаимно обогащая друг друга, будут продолжать неуклонно совершенст-
воваться за счет повышения качества и разнообразия получаемых изобра-
жений. Параллельно развитию ультразвуковых технологий будет совер-
шенствоваться и хирургический инструментарий. Важно, чтобы в эру
беспрецедентного развития технологий хирурги не остались позади.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Knudson ММ, Sisley AC. Training residents using simulation technology: experience with ult-
rasound for trauma. J Trauma 2000;48:659-665.
Parker SH, Dennis MA, Stavros AT, Johnson KK. Ulrasound-guided mammotomy-a new breast
biopsy technique. J Diag Med Sono 1996; 12:113—118.
Scudamore CH, Lee SI, Patterson EJ, et al. Radiofrequency ablation followed by resection of
malignant liver tumors. Am J Surg 1999; 177:411—117.
Siperstein AE, Rogers SJ, Hansen PD, Gitomirsky A. Laparoscopic thermal ablation of hepatic
neuroendocrine tumor metastases. Surgery 1997; 122:1147-1155.
УЗИ: АККРЕДИТАЦИЯ,
АТТЕСТАЦИЯ, КОНТРОЛЬ
КАЧЕСТВА И ПОЛУЧЕНИЕ
РАЗРЕШЕНИЙ ХИРУРГАМИ
18
Джей К. Харнесс
Хирурги стали самостоятельно выполнять диагностические и лечебные про-
цедуры с использованием ультрасонографии относительно недавно. Боль-
шинство новых хирургических методик и использование нового оборудова-
ния первоначально изучаются на коммерческих курсах, которые проводят
врачи-специалисты, работающие с производителями оборудования. Обуча-
ющиеся на подобных курсах могут не только наблюдать, но и ассистировать
хирургам, использующим новые методики и/или оборудование. Приобрете-
ние знаний такими способами не всегда качественно и редко подтверждается
документально. Хирурги испытывают потребность в высококачественных
курсах, посвященных новым технологиям, гарантирующих медицинским
факультетам и обучающимся хирургам приобретение новых знаний и навы-
ков, а также безопасное внедрение новых технологий и/или процедур в собст-
венную практику.
ПРОГРАММА ОБУЧЕНИЯ УЛЬТРАСОНОГРАФИИ АМЕРИКАНСКОЙ КОЛЛЕГИИ
ХИРУРГОВ
Первой организацией, которая в конце 1970-х годов поставила вопрос о необ-
ходимости освоения методики УЗИ практикующими хирургами, закончив-
шими ординатуру, стала Американская Коллегия хирургов (American College
of Surgeons, ACS). В октябре 1977 г. Управляющий совет ACS выработал
стандарты для курсов подготовки практикующих хирургов к использованию
этой технологии в клинической практике. Ниже приведены сведения из раз-
работанных ACS Стандартов курсов усовершенствования по новым мето-
дикам, которые являются частью Положения об утверждении курсов обуче-
ния [1].
Ultrasound in Surgical Practice Basic Principles and Clinical Applications, Edited by Jay K. Hamess
and Dennis B. Wisher. ISBN: 0-471-24538-0 Copyright© 2001 Wiley-Liss, Inc.
580 18. УЗИ: АККРЕДИТАЦИЯ, АТТЕСТАЦИЯ, КОНТРОЛЬ КАЧЕСТВА И ПОЛУЧЕНИЕ РАЗРЕШЕНИЙ ХИРУРГАМИ
1. Сформулирована цель(и) программы. Подробно изложены задачи курса, в
том числе принципы, на которых основана методика, показания и противо-
показания к ее применению, возможные осложнения, исходы и последующее
лечение. Перечислены навыки, необходимые для безопасного и эффективно-
го проведения процедуры
2. Содержание учебной программы курсов соответствует поставленным зада-
чам обучения, а методика обучения позволяет получить перечисленные на-
выки.
3. Знания обучающихся оцениваются при помощи методики, описанной разра-
ботчиками курса. Подобная оценка будет включать тестирование перед нача-
лом курсов и после их завершения; при необходимости могут использоваться
другие утвержденные методики оценки знаний
4. Приобретенные навыки оцениваются индивидуально у каждого студента
путем сравнения с установленными стандартами по каждому показателю
(время, точность, успешное завершение задания, правильная трактовка
отображаемых данных и др.).
И
Инструктор наблюдает и оценивает общий и индивидуальный уровни навы-
ков, демонстрируемых студентом. Методика оценки навыков должна быть
апробирована и утверждена (например, путем повторных измерений или не-
зависимыми экспертами) в начале курса.
5. Учебный план курса содержит ссылки на соответствующую литературу по
данной технике, показания и противопоказания к проведению процедуры,
осложнения, исходы и последующее лечение, а также краткое изложение це-
лей и задач курса.
В соответствии со Стандартами курсов усовершенствования по новым
технологиям руководитель курсов, финансируемых ACS, должен предоста-
вить установленную документацию [1]:
Уровень 1. Подтверждение посещения:
Хирург посещал курс в течение всего времени его проведения.
Уровень 2. Подтверждение удовлетворительного выполнения задач курса:
Хирург удовлетворительно выполнил определенные задачи обучения.
Уровень 3. Уровень преподавателя:
Хирург обладает практическим опытом применения методики, зафиксированы
хорошие результаты использования изученной методики у пациентов; хирург
участвовал в разработке целей и задач для программ обучения методике и име-
ет опыт обучения других хирургов.
Комитет ACS по новым хирургическим технологиям и образованию
(Committee on Emerging Surgical Technologies and Education, CESTE) являет-
ся органом, ответственным за решение всех вопросов, касающихся новых
хирургических технологий. В середине 1990-х годов CESTE поддержал
ПРОГРАММА ОБУЧЕНИЯУЛЬТРАСОНОГРАФИИ АМЕРИКАНСКОЙ КОЛЛЕГИИ ХИРУРГОВ
581
идею создания Ultrasound Users Group, задачей которой стала разработка
программ обучения ультрасонографии, рекомендуемых коллегией.
Ultrasound Users Group ACS была сформирована в середине 1990-х гг.
несколькими хирургами, которые самостоятельно освоили разнообразные
ультразвуковые методики. Некоторые из первых членов Ultrasound Users
Group принимали участие в публикации статей и руководств по УЗИ для об-
щих хирургов. Все большее число хирургов, занимающихся травматически-
ми повреждениями, заболеваниями молочных желез, раком прямой и обо-
дочной кишки и др., стали прибегать к помощи ультразвука. К этому моменту
урологи, сосудистые хирурги и хирурги-кардиологи уже широко использовали
ультразвуковые методики в своей практике.
Одной из целей Ultrasound Users Group стала разработка программы
обучения практикующих хирургов и хирургов-ординаторов. Моделью для
этой программы послужили курсы «Помощь при политравме» (Advanced
Trauma Life Support, ATLS). Первоначально был разработан цикл обучения
основам ультрасонографии, который должен быть пройден всеми хирурга-
ми, желающими освоить методику УЗИ. После прохождения базового цикла
по ультрасонографии хирург имеет право пройти специализированные цик-
лы (например, по обследованию молочных желез, головы и шеи, органов
брюшной полости при травматических повреждениях/острых состояниях,
органов гепатопакреатобилиарной зоны, сосудов, а также трансректально-
му, интраоперационному и лапароскопическому исследованию). В настоя-
щее время ACS предлагает несколько курсов по ультрасонографии: «Ульт-
расонография для хирургов», «Биопсия молочной железы под контролем
визуализации», «Ультразвуковое исследование молочной железы» и «Ульт-
развуковое исследование при острых состояниях». Разрабатываются допол-
нительные курсы по ультрасонографии. Для прохождения предлагаемых
коллегией углубленных курсов по УЗИ молочных желез или стереотаксиче-
ской биопсии молочных желез хирург должен пройти базовый цикл, посвя-
щенный молочной железе.
В 1998 г. произошла встреча CESTE с председателем Ultrasound Users
Group, по результатам которой Комитет утвердил предложенный формат
обучения, одобрил идею формирования государственного совета препода-
вателей ультрасонографии, дал согласие на подготовку Национальным со-
ветом экзаменаторов по медицине (National Board of Medical Examiners) во-
просов тестовых экзаменов по программам обучения ультрасонографии, кото-
рые будут представлены на весеннем и ежегодном съезде коллегии, одобрил
разработку курсов для преподавателей и согласился включить Ultrasound
Users Group в web-сайт ACS. В результате действий CESTE Ultrasound Users
Group разработала курс для преподавателей. Первые преподаватели ультра-
сонографии (уровень 3), окончившие курсы, получили сертификаты на еже-
годном Клиническом конгрессе (Clinical Congress), который прошел в Ор-
ландо (штат Флорида) в октябре 1998 г.
582 18. УЗИ: АККРЕДИТАЦИЯ, АТТЕСТАЦИЯ, КОНТРОЛЬ КАЧЕСТВА И ПОЛУЧЕНИЕ РАЗРЕШЕНИЙ ХИРУРГАМИ
На встрече в апреле 1999 г. CESTE рекомендовал переименовать Ultra-
sound Users Group в Ultrasound Imaging Group. Кроме того, коллегия утвер-
дила первый государственный совет преподавателей ультрасонографии, в
который вошли 18 членов коллегии. Отбор членов совета производился с
учетом квалификации и интересов в различных областях обучения и приме-
нения ультрасонографии. С переименованием Ultrasound Users Group в Ult-
rasound Imaging Group было решено, что государственный совет преподава-
телей будет выполнять функции исполнительного комитета Imaging Group.
Государственный совет преподавателей отвечает за разработку обучающих
и экзаменационных материалов, предназначенных для практикующих хи-
рургов и хирургов-ординаторов, изучающих ультрасонографию. Государст-
венный совет преподавателей также вырабатывает минимальные стандарты
непрерывного образования в области ультрасонографии и определяет стан-
дарты подтверждения владения методикой на 2-м и 3-м уровнях. Члены го-
сударственного совета должны являться членами коллегии; иметь подтвер-
жденный опыт проведения УЗИ; участвовать в качестве преподавателей в
программах по ультрасонографии; и вносить вклад в развитие клинического
использования ультрасонографии, подтверждением которого могут служить
публикации, исследования или работа в качестве преподавателя. Ultrasound
Imaging Group консультирует государственный совет по вопросам, касаю-
щимся ультразвуковых исследований. Члены Imaging Group участвуют в ка-
честве преподавателей в образовательных программах коллегии по ультра-
сонографии.
АККРЕДИТАЦИЯ
Американская коллегия радиологов (American College of Radiology, ACR) —
организация, аналогичная ACS; членами ACR являются радиологи. Амери-
канский институт по использованию ультразвука в медицине (American Insti-
tute of Ultrasound in Medicine, AIUM) объединяет 9500 врачей, ученых, инже-
неров, ветеринаров, врачей ультразвуковой диагностики, техников, произво-
дителей, представителей производства и студентов медицинских факультетов.
Членами AIUM являются рентгенологи, акушеры, гинекологи, эндокриноло-
ги, хирурги и врачи других специальностей. AIUM открывает перед своими
членами широкие возможности обучения в области диагностической ультра-
сонографии, среди которых участие в ежегодных съездах, курсах, возможно-
сти публиковаться (в том числе в Журнале по использованию ультразвука в
медицине (Journal of Ultrasound in Medicine)), приобретать видеокассеты,
участвовать в комитетах и секциях, представляющих различные медицин-
ские специальности, в которых применяется УЗИ.
ACR и AIUM учредили аккредитационные программы по ультразвуко-
вым исследованиям. Эти программы устанавливают минимальные требова-
ния к знаниям врачей, обучению, непрерывному медицинскому образова-
АТТЕСТАЦИЯ
583
нию (НМО) и изучению дисциплины после прохождения первоначального
курса обучения. По мнению этих организаций, для получения аккредитации
все врачи, проводящие УЗИ в клинической практике, должны выполнять
определенные минимальные требования. Обратите внимание, что страхо-
вые компании и правительственные организации учитывают наличие аккре-
дитации при возмещении расходов на лечение.
Целью аккредитации является повышение качества диагностических УЗИ.
Добровольная Программа аккредитации практикующих врачей ультразву-
ковой диагностики (Ultrasound Practice Accreditation Program) AIUM позво-
ляет врачам оценить степень владения методикой, правильность выполне-
ния процедур и сравнить их с государственными стандартами. AIUM пред-
лагает аккредитацию в следующих областях:
УЗР1 в акушерстве.
УЗИ в гинекологии.
Абдоминальная/общая ультрасонография.
УЗИ молочных желез.
Комплексное УЗИ: УЗИ сосудов и любая комбинация вышеперечислен-
ных методов обследования.
Практикующие хирурги, проводящие УЗИ сосудов, молочных желез и дру-
гие специальные обследования, могут получить аккредитацию AIUM (обра-
щаться в AIUM, Accreditation Department, 14750 Sweitzer Lane, Suite 100, Lau-
rel, MD 20707-5906).
АТТЕСТАЦИЯ
Американский реестр врачей ультразвуковой диагностики (American Regist-
ry of Diagnostic Medical Sonographers, ARDMS) является независимой неком-
мерческой организацией, проводящей экзамены и выдающей сертификаты
по диагностической ультрасонографии, эхокардиографии, УЗИ сосудов и
биометрии в офтальмологии. ARDMS предлагает претендентам (включая хи-
рургов) три вида сертификатов: Зарегистрированный врач ультразвуковой
диагностики (Registered Diagnostic Medical Sonographers, RDMS), Зарегист-
рированный специалист по эхокардиографии (Registered Diagnostic Cardiac
Sonographers, RDCS) и Зарегистрированный специалист по УЗИ сосудов (Re-
gistered Vascular Technologists, RVT). Сертификаты ARDMS подтверждают
высокий профессиональный уровень и признаются медицинским сообщест-
вом и профессиональными организациями, объединяющими специалистов
по УЗИ и заболеваниями сосудов. ARDMS возглавляет совет директоров, со-
стоящий из врачей УЗИ, специалистов по исследованию сосудов, терапевтов,
ученых-исследователей и представителей общественности. Единственным
способом получения сертификата ARDMS является сдача экзамена. Перед
проведением экзамена ARDMS претенденты должны выполнить одно из
584
18. УЗИ: АККРЕДИТАЦИЯ, АТТЕСТАЦИЯ, КОНТРОЛЬ КАЧЕСТВА И ПОЛУЧЕНИЕ РАЗРЕШЕНИЙ ХИРУРГАМИ
предварительных условий. Для хирургов возможность сдачи экзамена опре-
деляется 4 условиями. К уровню образования предъявляются следующие
требования:
1. Общие: Степень M.D. или D.O. при наличии действующей в настоя-
щее время лицензии.
и
2. Формальное обучение: Окончание ординатуры или аспирантуры, про-
грамма обучения в которой включала теоретические практические за-
нятия по общеклиническому УЗИ или исследованию сосудов.
или
3. Неформальное обучение: Не менее 40 часов АМА НМО 1-й категории
в течение предшествующих 3 лет, по теме ультразвук/диагностика за-
болеваний сосудов.
Претенденты, прошедшие «неформальное обучение», также должны иметь
дополнительный клинический опыт — проведение общеклинического УЗИ
или исследования сосудов в течение 12 месяцев при полной занятости. Хи-
рурги, и особенно сосудистые хирурги, которые возглавляют сосудистые по-
дразделения, проходят аттестацию ARDMS. Пять авторов этой книги также
аттестованы ARDMS.
ПРОГРАММА КОНТРОЛЯ КАЧЕСТВА УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ ACS
Ультразвуковая служба и/или сосудистое отделение, руководителем которой
является общий или сосудистый хирург, может быть аккредитована АШМ.
Отдельные хирурги могут получить сертификаты ARDMS. Не существует
программ аккредитации или сертификации, предназначенных специально
для хирургов.
ACS признала важность получения хирургами навыков проведения УЗИ
и выполнения лечебных вмешательств под ультразвуковым контролем. В
связи с этим CESTE издал Положение 31, которое было одобрено Управля-
ющим советом коллегии в 1998 г. [2]. Ниже приведен текст положения:
Введение
Ультрасонография используется в разных областях хирургии, она стала рутин-
ным способом неинвазивного обследования различных органов и систем, а так-
же методом визуализации зоны вмешательства. Примерами служат УЗИ глаза,
шеи, половых органов, а также сосудистой, нервной систем и опорно-двигатель-
ного аппарата. Клиническое применение ультрасонографии требует специаль-
ных знаний и навыков. С целью подтверждения квалификации хирургов,
проводящих УЗИ, обеспечения соответствия используемой ультразвуковой ап-
паратуры требованиям, предъявляемым к медицинскому оборудованию, а так-
же для поддерживания качества УЗИ на высоком уровне для членов коллегии
ПРОГРАММА КОНТРОЛЯ КАЧЕСТВА УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ ACS
585
была разработана добровольная программа контроля. Данная программа вклю-
чает в себя несколько требований: во-первых, хирург должен иметь соответствую-
щий уровень образования/опыт; во-вторых, аппаратура и оборудование должны
соответствовать рекомендуемым стандартам; в-третьих, хирург должен под-
держивать уровень квалификации за счет постоянной практики и участия в
программах непрерывного медицинского образования; и, в-четвертых, резуль-
таты УЗИ, проводимых хирургом, должны оцениваться по программе непре-
рывного повышения качества.
Добровольная Программа контроля качества проведения УЗИ для хирургов
(Voluntary Verification Program for Surgeons in the Use of Ultrasound) разработа-
на Американской коллегией хирургов.
Хирурги, проводящие УЗИ и лечебные вмешательства под контролем ультра-
сонографии. должны быть знакомы с принципами физики ультразвука, а также
с показаниями, преимуществами и ограничениями методики, с проведением и
интерпретацией данных ультразвуковых обследований. Хирург должен исполь-
зовать соответствующую аппаратуру, а оборудование должно использоваться в
соответствии со своим предназначением. Технические специалисты, работающие
под наблюдением хирурга, должны быть надлежащим образом подготовлены и
сертифицированы, а их работа должна регулярно оцениваться в рамках процес-
са улучшения качества.
1. Отбор и контроль хирургов по основам ультрасонографии. Хирург должен
подтвердить имеющийся уровень образования, соответствующий следую-
щим критериям
А. Успешное окончание ординатуры по хирургии, например наличие серти-
фикатов ABMS или их эквивалентов.
Б. В случае если ординатура и/или аспирантура включала обучение физи-
ческим основам ультразвука, показаниям, преимуществам и ограничениям
ультрасонографии, а также при наличии опыта проведения и интерпрета-
ции данных УЗИ, инвазивных процедур под контролем ультрасонографии,
включая знания показаний к проведению этих процедур, возможных ослож-
нений и методик их устранения, хирург будет допущен для подтвержде-
ния квалификации по основам использования ультрасонографии после
рассмотрения документов.
В. В случае если ординатура и/или аспирантура не включала обучение и
приобретение опыта использования ультрасонографии, для подтвержде-
ния квалификации по основам использования ультрасонографии требу-
ется прохождение (уровень 2) базового цикла утвержденной программы
обучения физическим основам ультразвука и инструментальному осна-
щению, включающей теоретическую и практическую часть (курсы должны
соответствовать критериям Утверждения курсов по новым методикам, Аме-
риканской коллегии хирургов, 1998)
Базовый уровень опыта проведения УЗИ включает способность получать
и интерпретировать изображения при нормальной ультразвуковой анато-
мии.
2. Контроль хирургов, независимо проводящих специальные УЗИ и процедуры.
Примерами специального применения УЗИ являются: прицельное УЗИ при
38 Ультразвуковая диагностика...
586
18. УЗИ: АККРЕДИТАЦИЯ, АТТЕСТАЦИЯ, КОНТРОЛЬ КАЧЕСТВА И ПОЛУЧЕНИЕ РАЗРЕШЕНИЙ ХИРУРГАМИ
травматических повреждениях; исследование и биопсия молочных желез;
исследование щитовидной железы и паращитовидных желез; трансректаль-
ное исследование предстательной железы и опухолей прямой кишки; эндо-
скопическое исследование верхних отделов желудочно-кишечного тракта
(ЖКТ) и гепатобилиарной системы; интраоперационное и лапароскопиче-
ское исследование органов брюшной полости и грудной клетки; сосудистые,
акушерские, гинекологические, офтальмологические и транскраниальные ис-
следования. Хирург, самостоятельно использующий специальные УЗИ, дол-
жен иметь опыт проведения основных и специальных методов исследования.
Для проведения специальных исследований необходимо:
А. Подтверждение владения основами ультрасонографии.
Б. Наличие фундаментальных знаний и владение методиками ведения па-
циентов с соответствующими клиническими состояниями, а также наличие
дополнительного клинического опыта и прохождение обучения прове-
дению диагностических УЗИ. Кроме того, необходимо уметь распозна-
вать патологические изменения и выполнять процедуры под контролем
ультрасонографии при соответствующих клинических состояниях.
Квалификация может быть подтверждена следующим образом:
Прохождение (уровень 2) утвержденной программы обучения по примене-
нию ультрасонографии в определенной клинической области (травматиче-
ские повреждения и др.).
ИЛИ
Документально подтвержденный опыт и удовлетворительные результаты
применения УЗИ в определенной клинической области, а также выполнение
конкретных задач определенного цикла обучения (например, успешная сда-
ча письменного экзамена).
[Критериям (а) и (Ь) удовлетворяет обучение в ординатуре или аспирантуре,
включающее обучение и опыт практической работы под наблюдением ква-
лифицированного врача.]
3. Рекомендации по поддержанию уровня квалификации. Для поддержания уров-
ня квалификации проведения УЗИ хирурги должны проводить УЗИ и трак-
товать их результаты, а также регулярно участвовать в мероприятиях НМО
Категории 1 по ультрасонографии. Хирурги должны документально под-
твердить, что идет процесс непрерывного повышения качества и ведутся со-
ответствующие записи
4. Указания по ультразвуковому оборудованию.
А. Медицинский персонал/руководитель.
Назначенный врач, имеющий лицензию, отвечает за определение и до-
кументирование качества и правильности тестирования. Под его ответст-
венностью находится выработка письменного регламента предоставления
разрешений медицинскому персоналу. Регламент должен описывать объ-
ем прав, опыт работы по специальности, а также пройденное обучение и
опыт проведения ультразвуковых исследований.
Б. Объем практической деятельности.
ПРОГРАММА КОНТРОЛЯ КАЧЕСТВА УЛЬТРАЗВУКОВЫХ ИССЛВДОВАНИЙ ACS
587
Объем практической деятельности (перечень всех типов обследований и
процедур) должен быть подробно изложен и документирован.
В. Электробезопасность.
Должна регулярно проводиться проверка электробезопасности ультра-
звукового оборудования. Результаты проверки должны фиксироваться
соответствующим образом.
Г. Оборудование.
При проведении диагностических обследований и/или лечебных вмеша-
тельств для получения оптимальных изображений высокого разрешения
наиболее важен правильный выбор оборудования и датчика.
Д. Контроль качества.
Калибровка ультразвукового оборудования должна производиться при
вводе в эксплуатацию и впоследствии не реже одного раза в год. В про-
грамму контроля качества рекомендуется включить следующие тесты,
которые необходимо проводить не реже одного раза в год:
1. Максимальная глубина визуализации и получение печатной копии,
полученной при сканировании фантома.
2. Точность измерения размеров.
а. Точность измерения размеров по вертикали.
б. Точность измерения размеров по горизонтали.
3. Однородность.
4. Восприятие анэхогенного пространства.
5. Определение «хвоста кометы» и мертвого пространства.
6. Разрешение по горизонтали.
7. Разрешение по вертикали.
8. Регистрация рабочих характеристик системы и примеры результатов.
Должны быть приведены ссылки на методику тестирования и стан-
дартные значения рабочих характеристик. Контроль знаний и навыков
технологов должен проводиться ежеквартально, с записью полученных
результатов. Минимальная оценка должна включать:
а) обеспечение соблюдения универсальных мер профилактики инфи-
цирования;
б) ежеквартальную калибровку измерения расстояний;
в) ежеквартальные серошкальные фотографии.
Е. Клинические изображения.
Для анализа должны быть доступны фотоизображения и пленки с изоб-
ражениями в норме и при патологии. Необходимо четко маркировать
пленки и фотоизображения, полученные перед проведением процедуры
и после нее.
Ж. Контроль качества оборудования.
Каждое подразделение должно иметь письменное руководство по конт-
ролю исправности и правильности обращения с диагностическим обору-
дованием. Должны быть разработаны программы повышения качества
588 18. УЗИ: АККРВДИТАЦИЯ, АТТЕСТАЦИЯ, КОНТРОЛЬ КАЧЕСТВА И ПОЛУЧЕНИЕ РАЗРЕШЕНИЙ ХИРУРГАМИ
получаемой диагностической информации. Рабочие характеристики обо-
рудования должны регулярно контролироваться в соответствии со стан-
дартами, принятыми для ультразвуковых изображений, с использованием
фантомов для определения разрешающей способности аппаратуры. По-
добный контроль может осуществляться как часть рутинной программы
профилактического обслуживания.
3. Повышение качества.
Действия по повышению качества, должны систематически проверяться
на предмет пригодности, технической точности и точности интерпрета-
ции результатов. Необходимо ежеквартально записывать общее число
проведенных обследований и процедур. Следует регистрировать и регу-
лярно анализировать частоту возникновения осложнений и побочных эф-
фектов во время проведения инвазивных вмешательств под контролем
ультрасонографии с целью выявления возможностей повышения качест-
ва лечения пациентов.
Программа ACS только начинает развиваться. Ожидается, что эта про-
грамма станет конкурентом аккредитационных программ, предлагаемых
AIUM.
Хирурги, заинтересованные в участии в Программе контроля качества,
должны обращаться напрямую в ACS (633 North St. Clair Street, Chicago. IL
60611-3211). Бланк заявления для участия в Программе можно найти на сай-
те коллегии (http://www.facs.org).
ПРАВО НА ПРОВЕДЕНИЕ УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ
Диагностические УЗИ и процедуры под контролем ультрасонографии могут
проводиться в разных клинических условиях. Право на проведение УЗИ
представляется хирургам, проводящим эти процедуры в стационаре или ам-
булаторном отделении, аккредитованном Объединенной комиссией по ак-
кредитации медицинских организаций (Joint Commission on Accreditations of
Healthcare Organizations, JCAHO). Американская медицинская ассоциация
(American Medical Association, AMA), JCAHO, Американская больничная ас-
социация (American Hospital Association), ACS и другие организации имеют
собственные правила, регламентирующие права врачей, порядок сертифика-
ции и получения новых или расширенных прав.
Ограничение клинических прав является процессом, в результате кото-
рого врачи получают разрешение на проведение лечения пациентов в опре-
деленной области. Разрешения предоставляются на основании установлен-
ных критериев. Предоставление разрешений включает проверку во время
испытательного срока, с последующим предоставлением полных прав при
непрерывном контроле результатов лечения пациентов.
Проблема приобретения новых навыков после обучения в ординатуре и
расширения прав врача в больнице или амбулаторном отделении является
задачей комитетов, выдающих сертификаты. Запрашиваемые права должны
ПРАВО НА ПРОВЕДЕНИЕ УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ
589
находиться в пределах основного образования и практической деятельности
врачей, обращающихся с просьбой о расширении прав. Компетентность врача
в новой области практической деятельности должна тщательно оцениваться
комитетом, выдающим сертификаты. Комитет должен требовать докумен-
тальное подтверждение прохождения обучения по тематике запрашиваемо-
го разрешения и оценивать уровень компетентности с помощью апробиро-
ванной методики или с привлечением соответствующих специалистов.
В декабре 1999 г. палата делегатов АМА рассмотрела резолюцию по
разрешениям на проведение УЗИ. Эта резолюция (N802) была предложена
Американской коллегией врачей скорой помощи (American College of Emer-
gency Physicians) и Американской ассоциацией акушеров и гинекологов (Ame-
rican Association of Obstetricians and Gynecologists). Данные организации от-
метили, что ультрасонография является надежным методом диагностики,
широко применяющейся при проведении различных процедур врачами раз-
ных специальностей. Другими словами, врачи ни одной из специальностей
не имеют исключительных прав на проведение УЗИ. Было также отмечено,
что инструкция АМА (Н-230.989), посвященная проблеме предоставления
разрешений медицинскому персоналу, в частности гласит [3]:
Вопрос о предоставлении и ограничении прав должен решаться индивидуаль-
но, с учетом образования претендента, пройденным обучением, имеющимся
опытом и демонстрируемым в настоящее время уровнем знаний. В процессе
внедрения указанных критериев, каждое учреждение должно выработать и ис-
пользовать рациональные, не дискриминационные стандарты оценки прав пре-
тендента, без антиконкурентных намерений и целей.
После внесения поправок резолюция 802 была принята палатой делега-
тов АМА (Н-230.960) в следующем виде [4]:
(1) АМА подтверждает, что ультрасонография входит в сферу практической де-
ятельности врачей, прошедших соответствующее обучение;
(2) АМА признает, что ультразвуковые технологии нашли широкое применение
в медицинской практике;
(3) в соответствии с регламентом АМА, получение врачом разрешения на пове-
дение УЗИ в больнице должно быть функцией медицинского персонала и
специально отмечаться в штатном расписании отделения;
(4) в соответствии с регламентом АМА, каждый сотрудник больницы должен
изучить и выполнять требования к предоставлению разрешения на проведение
УЗИ с учетом пройденного обучения и опыта использования ультразвуковых
технологий и настоятельно рекомендует, чтобы эти критерии соответствовали
рекомендуемым стандартам обучения, разработанным в соответствии со специ-
альностью каждого врача. (Res. 802, 1-99).
590 18. УЗИ: АККРЕДИТАЦИЯ, АТТЕСТАЦИЯ, КОНТРОЛЬ КАЧЕСТВА И ПОЛУЧЕНИЕ РАЗРЕШЕНИЙ ХИРУРГАМИ
РЕЗЮМЕ -
В этой главе обсуждены основные вопросы аккредитации, получения серти-
фикатов, контроля качества проводимых УЗИ и получения разрешения на
проведение данных исследований хирургами. Применение УЗИ в хирургиче-
ской практике может быть аккредитовано AIUM. Хирурги могут получить
сертификаты по ультрасонографии от ARDMS. Члены ACS могут участво-
вать в добровольной программе контроля качества УЗИ для хирургов. Хи-
рургам и врачам других специальностей в аккредитованных JCAHO больни-
цах и амбулаторных отделениях разрешено обращаться за разрешением на
проведение УЗИ. Программа обучения УЗИ ACS отвечает потребностям хи-
рургов, желающих получить разрешение на использование новых знаний и
навыков. Программа ACS основана на ИМО и посвящена основным вопро-
сам: физики ультразвука, оборудования, техники сканирования, а также обзо-
ру клинического применения и оценке навыков. Программа ACS предназначе-
на для того, чтобы подготовить обучающихся к возвращению на свое рабочее
место и работе под контролем, в ходе которого будут оцениваться приобре-
тенные навыки диагностического УЗИ и выполнения лечебных вмеша-
тельств под контролем ультрасонографии. После завершения этого процесса
и обращения за разрешением хирург должен ожидать предоставления права
на проведение УЗИ.
ССЫЛКИ
1. American College of Surgeons. Approval of courses in new skills (state-
ment 27). Bull Am Coll Surg 1998;83:35-36.
2. Committee on Emerging Surgical Technologies and Education. Statement
on ultrasound examinations by surgeons (statement 31). Bull Am Coll Surg
1998;83:37^l0.
3. American Medical Association. Patient protection and clinical privileges
(H-230.989). www.ama.assn.org/apps/pf online/pf_online (accessed Octo-
ber 23, 2000).
4. American Medical Association. Privileging for ultrasound imaging
(H-230.960). www.ama.assn.org/apps/pf_online/pf online (accessed Octo-
ber 23, 2000).
предметный указатель
Абсцесс
внутрибрюшной 183, 555
дренирование 186
молочной железы 256
Аневризма
абдоминального отдела аорты 127, 129, 130
мешковидные 129
Аорта 99, 125
абдоминальная часть 126
аневризмы 128
бифуркация 132
грудная 373
диаметр 132
исследования абдоминальной аорты 130
ложный просвет 130
оценка повреждений грудной аорты 371
толщина стенки 373
тупая травма 373
чревный ствол 126
Артерии
верхняя брыжеечная 98-99, 126, 132
гастродуоденальная 99
голени 534
нижние тиреоидные 283
общая печеночная 126
подключичная 187
почечные 131
позвоночная 523
селезеночные 126
сонная
дуплексное сканирование позвоночной арте-
рии 523
интернализация наружной артерии 525
исследование 519, 521
УЗИ 517
Аккредитационные программы по ультразвуко-
вым исследованиям 582
Аппараты ультразвуковые 38
акустическая мощность 42
градации глубины, мощности 40
компенсация
временных потерь 43
потерь отраженного ультразвукового сигна-
ла 43
усиление временной компенсации 25
монитор 39
панель управления 40
ультразвуковая система 38
фокусировка 45
Аппендицит 138—139
Артериовенозные фистулы 516
Артериовенозные фистулы и шунты 532
Б
Беременность
бета-хорионический гонадотропин человека
480, 482
вид плодных оболочек и желточного мешка 481
диагностическая тактика в первом триместре
486
желточный мешок 480
зигота 480
определение срока 479, 480
первый триместр 479
плодный пузырь 480
симптомы 479
Беременность патологическая 479
вид внематочного плодного пузыря 483
второй и третий триместры 485
кровотечения в третьем триместре 486
отслойка плаценты 487
Беременность эктопированная 480, 482
триада ультразвуковых признаков 482
Билиарная
гипертензия 81
система 76
пузырный проток 78
Биопсия
вакуумная 565
лапароскопическая 190
молочной железы 181, 269
опухоли 191
очаговых образований печени 190
стереотаксическая 564, 565
сторожевых лимфоузлов 271
эксцизионная 183
Бифуркация сонной артерии 520
неизмененная 518
Вены
верхняя брыжеечная 415
ветви воротной вены 108
592
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
внутренние яремные 280, 283
воротная 89, 99, 330
дефект наполнения 531
левая печеночная 99
нижние тиреоидные 283
нижняя полая 99, 107, 132
печеночные 106-108
почечные 132
пупочная 528
селезеночные 98, 415, 100
Верхняя тиреоидная артерия и вена 282
Внутриматочные средства 478
Волны высокой и низкой частоты 24
Высокочастотная термальная аблация (ВТА) 571
лапароскопическая 575
«Выше, чем шире» 238, 239
Г
Гидроперикард 367, 552
д
Датчики
выбор 41
компоненты 19
типы 34-35
изогнутый линейный 34
линейный 34
секторный 34, 36
интраоперационный 181
Двустороннее краевое затенение 231
Допплеровская частота 494, 495
изменение 495-502
определение 492
Допплеровские режимы 498
Допплерография 491
НВ-допплерография 501
обозначения при допплерографии 504
пульсовая 501, 537
Дорсальное усиление ультразвука 58, 62, 230
при исследовании печени 110
при исследовании поджелудочной железы 104
при исследовании молочной железы 230
Дренирование кист печени 338
Дуктальная эктазия 256
Ж
Желудок
неизмененный 381-382
ЭУЗИ 381
эхослои 382
оценка злокачественной инвазии лимфатиче-
ских узлов 387
подслизистые опухоли 393, 395
утолщение складок слизистой оболочки 396
Желчные протоки 311
измерение 82
просвет 78
Желчный пузырь
взвеси 543
желчные камни 75
исследование 91
камни в шейке 94
неизмененный 63
общий печеночный проток 79
измерение 94
перихолецистит 72
печеночные вены 87, 311
полипы 73
просвет желчного протока 78
рак 74
симптом Murphy 69
сканирование 86
сокращенный 72
тени от конкрементов 76
утолщение стенки 67
холелитиаз 65
холецистит острый, гангренозный 69
шейка 94
Желчь
сгустки 70
3
Звук
мера затухания 23
частота 23
Звуковая волна
амплитуда 23
распространение 21
Звуковая энергия. Отражение и поглощение 22
Звуковой барьер 19
Звуковой пучок 30
И
Изображение ультразвуковое
акустическая тень 60, 62,66, 67, 117
многофокусное 31
ориентация 54
оттенки серого цвета 54
создание 18
формирование 29
скорость 36
яркость 25
Интервенционная ультрасонография 178-179,
269
ветви воротной вены 189
датчик 181
доступ к центральным венам 183, 187
дренирование внутрибрюшного абсцесса 186
жидкостные образования 183
направляющие устройства 180, 181
панкреатический проток 189
подключичная артерия 187
подключичный доступ 188
позиционирование игл 180
пункция «свободной рукой» 179, 180
резекции печени 189
ультразвуковой контроль иглы 179
установка катетера 187
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
593
Интервенционная ультрасонография молочной
железы 264-271
артефакты УЗ-изображений 274
биопсия 269
обучение 275
техника «свободной руки» 264
Интрадуктальные папилломы 256, 257
Интраоперационная ультрасонография 311—312,
314, 316, 318, 320, 322
желчные протоки 311
внепеченочные 319
камни общего желчного протока 320
панкреатический проток 316
печень 311
поджелудочная железа 312
портальная триада печени 319
портальная вена 311
Интраоперационный лапароскопический ультра-
звук 320
К
Калькулез 61
Карцинома щитовидной железы 289, 290
медуллярная 297
папиллярная 291
фолликулярная 292
Качество УЗИ, программа контроля 584-585 587
Киста
геморрагические 285
желтого тела 470, 471
многокамерная 236
молочной железы 182
анэхогенная 249
почек (простые, сложные) 118, 119
простая 58, НО, 248, 284
аспирация содержимого 181
сложная 59, НО, 248, 250
щитовидной железы 284
физиологические 470-471
острый разрыв 471
функциональные 471
шоколадные 477
эндометриоидная 476
разрыв 477
Куперовские связки 207 - 208
Л
Лапароскопическая адреналэктомия 339
Лапароскопическая ультрасонография 324-325,
332, 334, 338, 340, 341
выполнение 328
лапароскопический ультразвук 338
надпочечника 340
общий желчный проток 330, 335
бифуркация 332
идентификация 331
камни 334, 335
печень 335, 337
печеночная артерия 331
поджелудочная железа 339
портальная триада 331, 333
ультразвуковые датчики 326
Лейомиома, интрамуральный узел при ТВУЗИ
475
Лимфатические узлы шеи 300
М
Матка
вид при ТВУЗИ 463
изображение в полости малого таза 457
изображение при ТАУЗИ 456
мышечный слой 460
шейка 457
Матки образования 473
интрамуральные лейомиомы 474
при ТВУЗИ 475
лейомиофиброма 473, 474
образование яичника с жидкостными включе-
ниями 474
Менструальный цикл 466, 470
Метастазы опухолей в печень 338
Миокарда сократительная способность 363
Молочная железа
абсцесс 256
аксиллярные лимфоузлы 199
акустическая тень 230
дорсальная 252
акустические феномены, возникающие за опу-
холью 229
карцинома 257, 259, 261-262
киста 182, 236
классификация результатов УЗИ 247
микрокальцинаты 238, 243
млечные протоки 210
паренхима 207, 209, 211, 213, 215, 217, 219
показания к проведению УЗИ 198
солидные образования 238
схема поперечного среза 205
УЗИ 195-197, 199-200, 202, 204, 210, 220, 273,
275
точность 243
УЗ-изображения 196, 273
ультразвуковая анатомия 204-205
фиброаденомы 248
филлоидная опухоль 254, 256
шкала малигнизации Kelly 246
Мочевой пузырь 124
Муцинозная дуктальная эктазия 412
Н
Нижняя полая вена 99, 107, 132
лимфоцеле 134
ретроперитонеальный абсцесс 133
О
Обучение УЗИ
с использованием компьютерных тренажеров
576-577
594
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
программа обучения ультрасонографии 579,581
Общий печеночный проток 79, 84
измерение 94
расширение 82
Овариальный цикл 467
Окклюзия
внутренней сонной артерии 524
общей сонной артерии 522
периферическая артериальная 510
при хроническом тромбозе, частичная 530
сонных артерий 524
Органы малого таза
заболевания 448
изображение при ТВУЗИ 457
нормальная анатомия у женщин 455
поперечное сечение таза 462
причины тазовой боли 468-469
острой 468
хронической 469
пространство Дугласа 459, 467, 471
пузырно-маточное углубление 459
сагиттальное сечение таза 462
ТАУЗИ 450—451,460,463
ТВУЗИ 450-451, 476, 452^153, 457, 460, 463,
482
фаллопиевы трубы 461
широкие связки 458
Оценка контуров образования 220
Оценка стеноза
в В-режиме 509
критерии оценки 510
ошибки в расчетной скорости 514
П
Панкреатит
острый 102
хронический 102
Панкреатический проток 99—102, 189
акустическое окно 102
ампула фатерова соска 102
желудок 100
поджелудочная железа 102
селезеночная вена 100
Панкреатогенные нейроэндокринные опухоли
420
Паращитовидные железы 282
исследование 280
Перипанкреатические лимфатические узлы 415
Печени очаговые образования 110
абсцесс 110
выявление 557
асцит ПО, 112
гемангиома 112
гепатоклеточная карцинома 113, 114
дорсальное усиление ультразвука 110
метастатические образования 112
опухоли 112
первичная злокачественная 112
простые кисты 110
Печень
анатомия 115
сегментарная 108
венозная связка 108
гепатомегалия 109
диффузные изменения 110
жировая инфильтрация 109
изображение 106
метастазы 189
портальная гипертензия 110
резекция 189
серповидная связка 108
спленомегалия 110, 135
хвостатая доля печени 108
цирроз 109
Поджелудочная железа
воротная система 107
карцинома 105, 319
неизмененная 96
общий желчный проток 99
псевдокисты 104
Портальная гипертензия 528
Почки
ангиомиолипома 117
гидронефроз 119
карцинома 120
колонки Бертена 119
мочеточник 119
неизмененный 117
нефролитиаз 117
оценка состояния пересаженной почки 555
поликистоз 119
почечные камни 117
почечный синус 117, 119
ультразвуковое изображение 117
хроническая почечная недостаточность 123
Право на проведение УЗИ 588
Предел Никвиста 537
Преимущества ТЭЭ 375
Прямая кишка
анальный канал 432
аноректальные абсцессы при наличии свищей
443
вид аноректального свища 444
недержание кала 440, 442
стенка 432
Псевдоаневризмы 516
бедренной артерии 534
Пьезоэлектрический кристалл 26-29
ультразвуковой 16
Р
Радиочастотная термальная аблация 191 193
анэхогенная карцинома 262
анэхогенная эхоструктура 237
гетерогенная эхоструктура 234-235
дорсальное усиление 230
краевое затенение 230
маммография 203
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
595
микрокальцификаты 241
киста
многокамерная 236
простая 248
электрохирургия 191
Рак желудка
карцинома 383
лимфома 391
стадии 391
определение 391
N-стадия 384
Т-стадия 384
Рак пищевода ТМН-классификация 345
Рак поджелудочной железы 411,416
аденокарцинома 317, 410
биопсия 403-418
локализация опухолей 419
TMN-стадирование 415
Рак прямой кишки 433
дооперационная оценка 438
оценка глубины опухолевой инвазии 435
стадирование 433
Расслоение аорты 365. 367
Режим
амплитудный 33
фазовый 30
шкала относительной яркости (В-режим) 33
Ретромаммарная клетчатка 213
С
Селезенка 134-136
абсцессы 136
доброкачественные образования 136
дополнительные дольки 134
злокачественные лимфомы 136
портальная гипертензия 135
разрыв капсулы 136
селезеночная вена 135
спленомегалия 134
разрыв 174
Симулятор UltraSim 576. 577
Синдром множественных эндокринных неопла-
зий 417
Синусы Вальсальвы 373
Сканирование
глубина 48
желчный пузырь 86
контактное 329
неправильная плоскость 511
типичные частоты 42
Спектральный анализ
классификация заболеваний периферических
артерий 512
неизмененная внутренняя сонная артерия 515
ошибки при стенозе 512
применение 521
спектр сонных и позвоночных артерий 523
спектральная волна 514
спектральное расширение 514
стеноз сонной артерии 519
Спленомегалия ПО, 134 135
Стеноз
артериальный 510
верхней брыжеечной артерии 527
левой поверхностной бедренной артерии 513
почечной артерии 527
чревного ствола 528
Структура клапанов 367
Т
Тампонада сердца 367
Тень
акустическая 60, 62, 66, 67, 117
вызываемая конкрементами 76
Тиреоидная гиперплазия 284
Ткани 18
взаимодействие звука с тканью 22
плотность 18, 24
различия в сопротивлении между тканями 20
скорость распространения звука 18, 20
ослабление ультразвукового луча 23
Травма
абдоминальная 154
брюшная 153
гемоперитонеум 157, 163, 170
гемоторакс 163
диагностический перитонеальный лаваж 155,
157-159
закрытая I56
неотложная ультрасонография 155, 154, 158
определение хода раневого канала 163
оценка больных с травмой 156
свободная жидкость в брюшной полости 158,
163
УЗИ органов брюшной полости 156, 157
Траектория движения
иглы 180
иглы при биопсии 266
Трансгастральное изображение 358
Трансплантат
классификация изменений на основе анализа
формы спектральной волны 517
критерии стеноза 516
наблюдение 516
повреждение сосудов 516
Трансэзофагеальная ультрасонография (ТЭУ)
344-353
датчики 353
пищевод 353-354
рак 345
УЗИ 353-354
эндосонографическое исследование 344
эндоскопическая эндосонография 344-345,
349, 379, 402
Трансэзофагеальная эхокардиография (ТЭЭ)
355-359, 361, 371, 551
датчики для ТЭЭ 357
оценка повреждений грудной аорты 371
596
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
оценка функций желудочков 363
пристеночный тромб 369
разрыв грудной аорты 371
тупая травма органов грудной полости 372
Трепанобиопсия 189, 266
игла для трепанобиопсии 268
молочной железы 270
под контролем ультразвука 269
Трехмерное УЗИ 559, 561-563
аблационные зонды 572
«живое» трехмерное изображение 563
мультипланарная реконструкция 562
набор трехмерных данных 561
объемное изображение 559
система Mammotome 566
система UltraGuide 1000 569
траектория движения иглы 568
«трехмерный ультразвук» 559
Тромб
с реканализацией 531
эхогенность 531
Тромбоз
вен голени 551
глубоких вен 530
критерии оценки 530
острый 530
хронический 530
дублирующей поверхностной бедренной вены,
острый 531, 532
острый анэхогенный 535
хронический 532
5
УЗИ в гинекологии и акушерстве 449
УЗИ в отделениях неотложной помощи 542—558
гидронефроз 555
гравитационная проба 543
камни желчного пузыря 542
конкременты в желчном пузыре 543
мониторинг сердечной гемодинамики 553
перикардиальная жидкость 553
почечная недостаточность 553
сердечный индекс 553
тампонада сердца 552, 553
установка центральных венозных катетеров
551
утолщение стенки ЖП 543
УЗИ проблема безопасности 37
УЗИ сосудов 491-540
УЗИ щитовидной железы 279-308
паратиреоидные аденомы 303, 304
первичный гиперпаратиреоидизм 301
УЗИ паращитовидных желез 301, 303, 305
УЗИ вен 548-549
УЗИ яичек 539
Ультразвук 14
дорсальное усиление 62, 58, 104, 230
ослабление 24
Ультразвуковое изображение
почек 117
печени 106
Ультрасонографические признаки Stavros 245
Уравнение Допплера 494, 500, 502
Ф
Фаллопиевых труб образования 475
гидросальпинкс 476
пиоеальпинкс 477
Флюорохолангиография 329-331, 333
Фокус 31
точка фокуса 31
фокусные зоны 31
электронная фокусировка 30
Фолликулярная аденома щитовидной железы 284
X
Холангиография 319
Холангиокарцинома 319
Холедохолитиаз 425
Холелитиаз 543
Холецистит
введение холецистоетомического дренажа 545
желчного пузыря 69
некалькулезный 543, 544
острый 542
Холецистэктомия 329
Хронический панкреатит 423, 425
Ч
Червеобразный отросток 136
воспаленный 137
Ш
Шкала усиления 24
«Шире, чем выше» 238
щ
Щитовидная железа
аденоматозные узлы 284, 285
карцинома 297
анапластическая 297
медуллярная 297
диффузное увеличение 286
класс цитологической классификации 300
нормальная анатомия 282
техника «свободной руки» 181. 264
ТПАБ узловых образований 297
Э
Электрохирургия 191
Эндометрий
вид в норме 461
изменения 465
толщина 461
Эндоскопическая ретроградная холангиопанкреа-
тограмма 316
Эндоскопическая ретроградная холангиопанкреа-
тография (ЭРХПГ) 412, 413, 424-425
ПРЕДМЕТНЫЙ УКАЗАН ЛЬ
597
Эндоскопическая ультрасонография желудка
(ЭУЗИ) 379-400
технические аспекты ЭУЗИ 379
ультразвуковой датчик, встроенный в катетер
380
утолщение эхослоев 398
Эндоскопическая ультрасонография прямой киш-
ки 430-446
аспирационная биопсия лимфатических узлов
438
исследование аноректального канала 430
радиальный ультразвуковой датчик 431
эндоректальное (ЭРУЗИ) 430. 435. 437, 442
ЭУЗИ 381-425
ЭУЗИ поджелудочной железы 402-428
биопсия 417
выявление хронического панкреатита 424
гастриномы 417, 422
идентификация панкреатических структур 410
инсуломы 419, 421
неизмененная 410
нейроэндокринные опухоли 417
обструктивная дилатация 411
оценка артерий 415
оценка опухолевидных образований 410-411,
413, 415
оценка резектабельности 415
положения датчика для визуализации ПЖ 405
псевдокисты 425
расходы 422
сцинтиграфия соматостатиновых рецепторов
423
экстрапанкреатическая гастринома 422
эхоэндоскоп 403
Эффект Допплера
артериального кровотока изображение 509,
594
артефакты, вызванные кальцием 538
аппроксимация цвега 505
измерение скорости потока крови 495
ламинарный поток 504
ламинарного кровотока изображение 506
рассеивание луча 498
скорость звука в среде 494
спектральный анализ скорости 503
угол луча 508
угол сканирования 500
физические основы 492-503
цветовое наложение 537
Эхогенность 56
анэхогенность 56
гиперэхогенность 23, 55
Эхоплотность
сравнение 233
усреднение 31
Я
Яичники 464
доминирующий фолликул 470
многокомпонентное образование 473
образования яичников 469
опухоли 472
доброкачественная 472
рак 472
перекрут 471
продольный вид 466
яичника с фолликулярной кистой 470
Яремные лимфатические узлы 280
Научное издание
Харнесс Джей К., Вишер Деннис Б., Фрай Уильям Р. и др.
УЛЬТРАЗБУКОВАЯ ДИАГНОСТИКА В ХИРУРГИИ:
основные сведения и клиническое применение
Ведущий редактор В- Гейдебрехт
Художник Ф. Инфантэ
Художественный редактор О- Лапко
Корректор Е. Клитина
Компьютерная верстка Л- Катуркина
Подписано в печать 29.06.07. Бумага мелованная. Формат 70x100,16.
Гарнитура Таймс. Усл. печ. л. 50,05. Печать офсетная. Тираж 2000 экз.
Заказ 4999
Издательство «БИНОМ. Лаборатория знаний».
Адрес для переписки: 125167, Москва, проезд Аэропорта, 3.
Телефон: (495) 157-5272. E-mail: Lbzfalaha.ru
http://www.Lbz.ru
При участии ООО «ЭМ П РЕЗА»
Отпечатано в ОАО «ИПК «Ульяновский Дом печати»
432980, г. Ульяновск, ул. Гончарова, 14
Книга «Ультразвуковая диагностика в хирургии: основные
сведения и клиническое применение» под редакцией
Джея К. Харнесса и Денниса Б. Вишера представляет собой
результат тесного сотрудничества хирургов и специалистов
по ультразвуковой диагностике. Сочетание большого
практического опыта авторов и их взаимодействие с клиницистами
позволило представить ультразвук одним из компонентов общей
хирургии.
С каждым днем открываются новые области применения этого
неинвазивного инструмента исследования. Ультразвук безопасен,
быстр, доступен. Авторы описывают его применение наряду
с другими традиционными методами, такими как биопсия,
и сравнительно новыми как допплерография и лапароскопия.
Книга станет бесценным помощником практикующему хирургу.
Каждая анатомическая область рассматривается в отдельной
главе, иллюстрации и схемы ясны и полезны с практической точки
зрения.
ISBN 978-5-94774-296-1