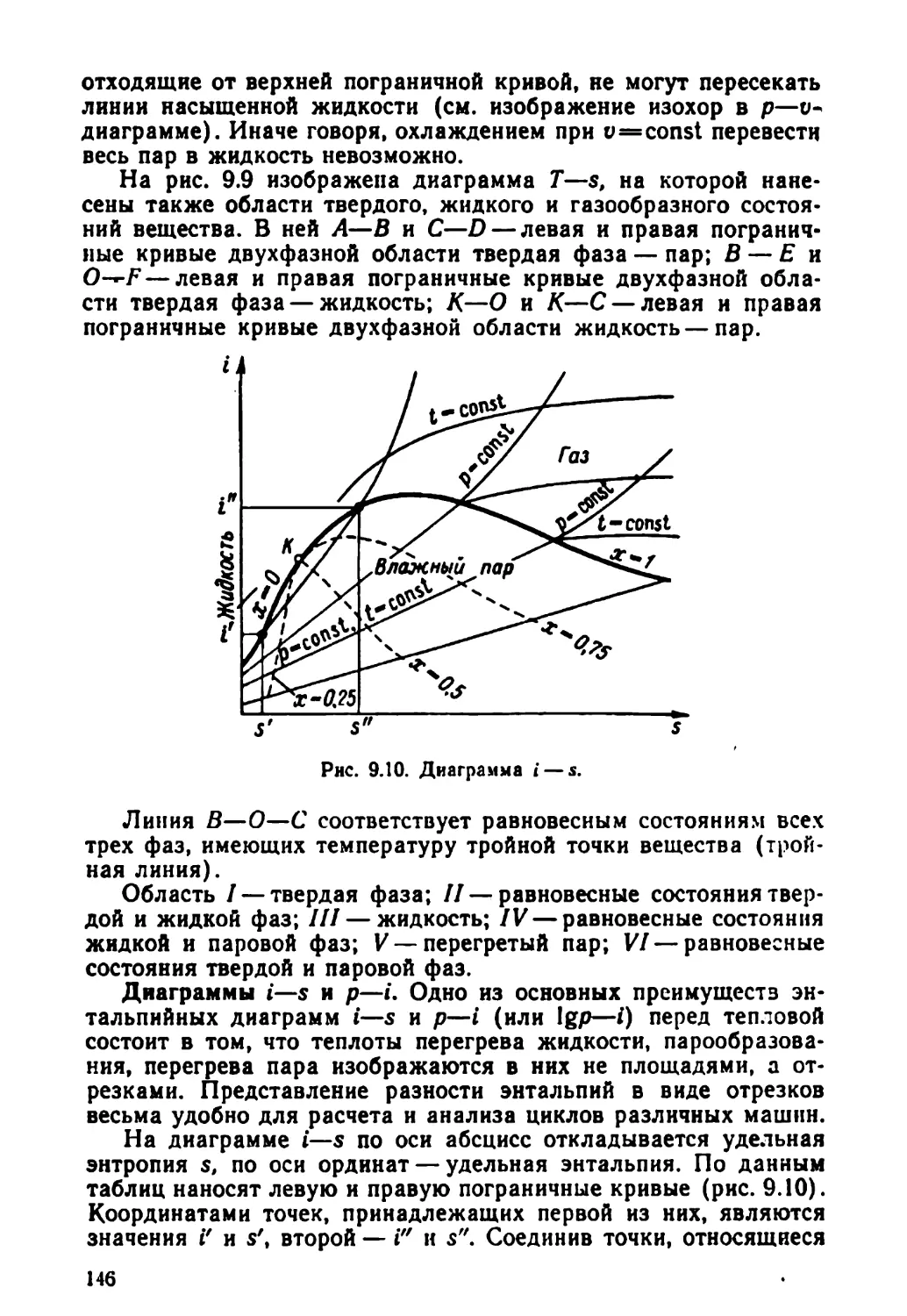
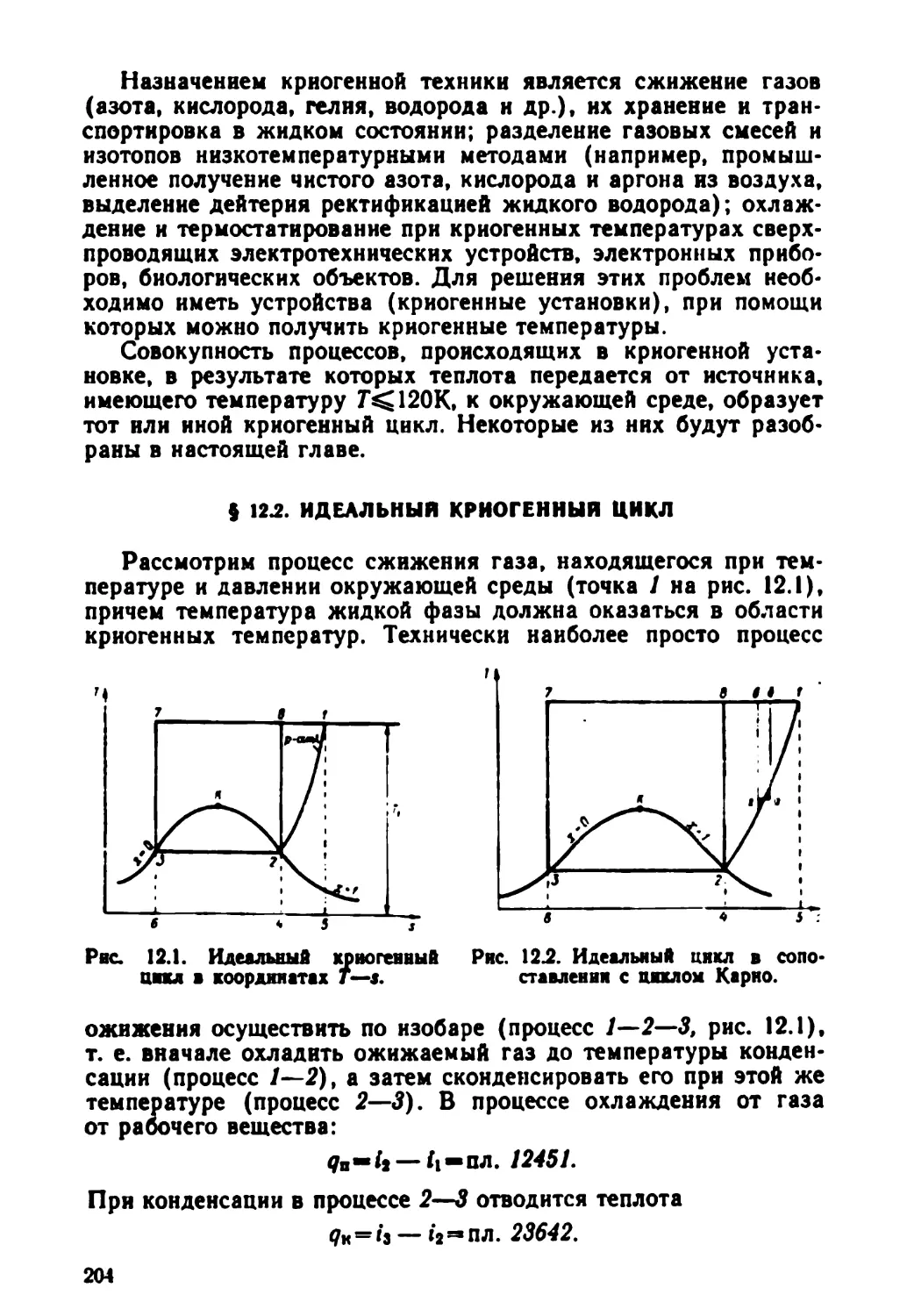
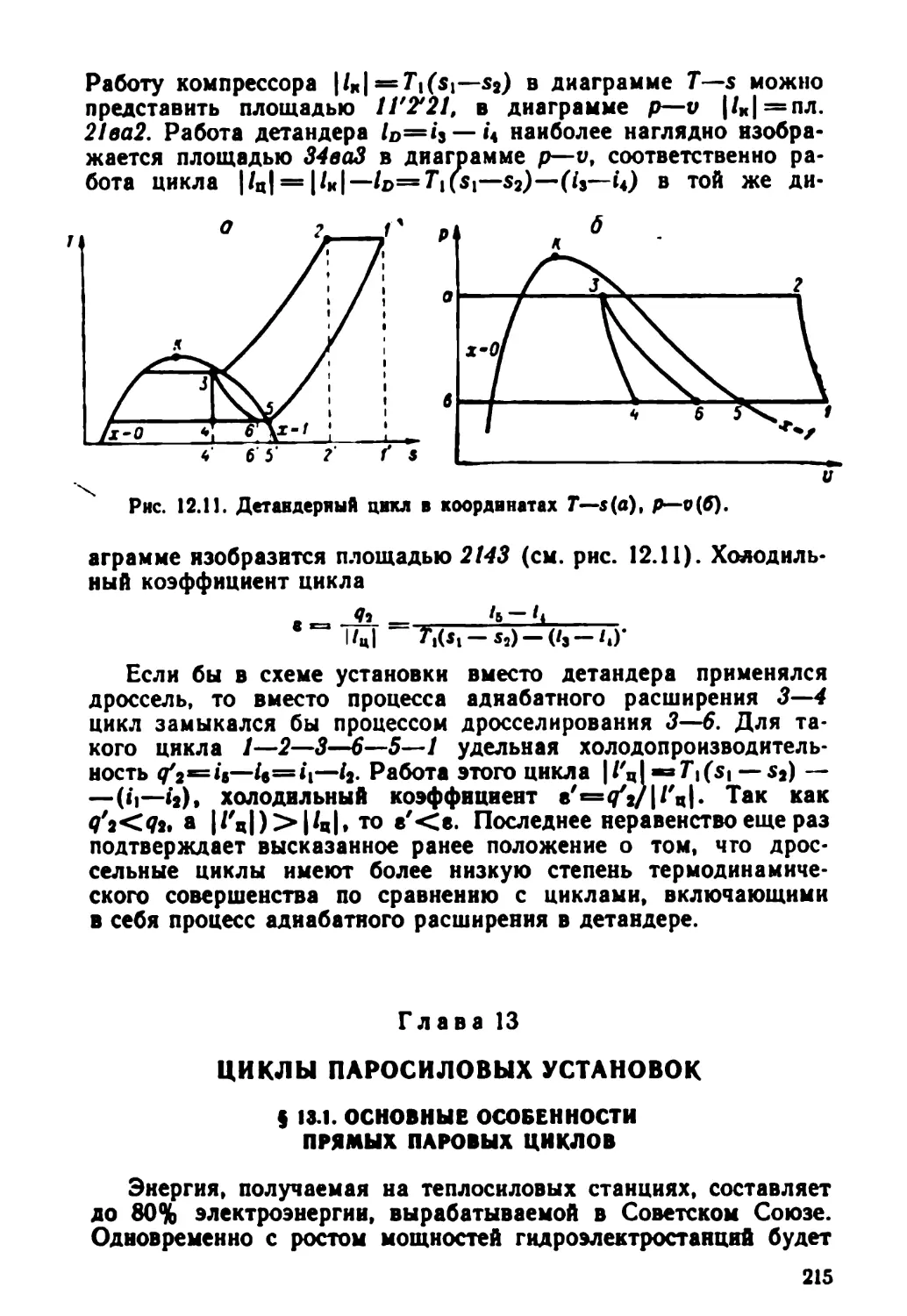
Text
МИНИСТЕРСТВО ВЫСШЕГО И СРЕДНЕГО
СПЕЦИАЛЬНОГО ОБРАЗОВАНИЯ РСФСР
ТЕХНИЧЕСКАЯ
ТЕРМОДИНАМИКА
Учебное пособие
Под общей редакцией проф. Э. И. Гуйго
Ленинград
Издательство Ленинградского университета
1984
Представлено к изданню
Ленинградским ордена Трудового Красного Знамени
технологическим институтом холодильной промышленности
УДК 621.1 .016.621.56
Техническая термодинамика: Учеб, пособие / Под ред. проф. Э. И. Гуйго.
2-е нзд^ мспр. н доп. — Л .: Изд-во Ленннгр. ун-та, 1964. 296 с
Настоящее пособие отличается от известных учебников по термодинамике
более подробным и систематизированным изложением материала, необходи
мого для подготовки инженеров холодильных специальностей. В нем на
ряду с рассмотрением основных положений термодинамики особое внимание
уделено циклам газовых и паровых холодильных машин, циклам криогенной
техники и условиям нх технической реализации, процессам дросселирования,
термодинамике влаж ного во здуха, термодинамике растворов, основным прин
ципам вксергетнческого анализа. Кроме того, приводится теоретический м а
териал, необходимый для подготовки студентов при изучении к урса про
мышленной теплотехники.
Пособие рассчитано на студентов институтов и факультетов, готовящих
инженеров по специальностям «холодильные машины и установки», «машины
н аппараты кондиционирования воздуха» , «криогенная техника». Библиогр.
10 назв. Ил. 150. Табл. 9.
Рецензенты: кафедра холодильных машин и установок (Моек, ки т
мясн. н молочи. пром-стн), проф. Г . А . Михайловский (Ленннгр. нн-т вод.
трансп.)
Т
2996010000— 165
070(02)—64
126—84
О Издательство
Ленинградского
университета,
1984 г.
ПРЕДИСЛОВИЕ
Техническая термодинамика и теория теплообмена состав
ляют теоретические основы теплотехники и хладотехники. И зу
чение этих дисциплин предшествует специальным практическим
курсам: по паровым котлам, паровым турбинам, двигателям
пнутреннего сгорания и пр. — в
вузах теплотехнического про
филя; по холодильным машинам и установкам, криогенной тех
нике, кондиционированию воздуха и пр. — в
вузах, подготавли
вающих инженеров холодильных специальностей.
Имеющаяся учебная литература по технической термодина
м и к е в большинстве ориентирована на подготовку специалнстов-
к плотехников; вопросы, относящиеся к основным закономерно-
• I ям работы холодильных машин и теплообменных устройств,
шчюльзуемых в условиях низких температур, изложены в ней,
. .(к правило, в недостаточном объеме.
Настоящее учебное пособие предназначено д л я студентов,
поучающихся в вузах и на факультетах холодильного профиля,
к отличается более подробным изложением разделов термодина
м и к и , связанных с подготовкой инженеров-холодилыциков. Од
новременно д ается теоретический материал, необходимый для
последующего изучения специального курса промышленной теп
лотехники.
Пособие написано на основе многолетнего опыта п реподава
нии курса технической термодинамики в старейшем холодиль
ном вузе страны — Ленинградском ордена Трудового Красного
Знамени технологическом институте холодильной промышлен
ности.
В составлении пособия «Техническая термодинамика» участ
вовали: проф., д-р техн. наук Э. И. Гуйго (главы 1— 7); проф.,
| |> техн. наук Г. Н. Данилова (глава 14, части глав 8 и 9);
проф., д-р техн. наук В. Н . Фнлаткин (глава 12 ); проф., д-р
гехн. наук О. П . Иванов (глава 16); и. о. проф., канд. техн. наук
з
С. Н. Богданов (главы 1 1 , 13, часть главы 15); проф., д*р техн.
наук А. В . Клецкий (части глав 8, 9); доц., д-р . техн. наук
О. Б . Цветков (глава 10 ); доц., канд. техн. наук В. Т . Плотни
ков (часть главы 15).
Общее редактирование пособия выполнено Э. И. Гуйго.
Авторы выраж аю т благодарность инженерам О. М . Оване
совой и Р . В . Клюевой за большую работу, выполненную ими
при подготовке рукописи.
Авторы с признательностью примут все замечания и предло
жения по улучшению настоящего пособия.
Глава 1
ОСНОВНЫЕ понятия, идеальный газ
§ 1 .1 . ЗАДАЧИ ИЗУЧЕНИЯ КУРСА
В широком понимании термодинамика представляет собой
пауку об энергии, в ней изучаются законы превращения энергии
и физических, химических и других процессах, сопровождаю
щихся тепловыми эффектами. Накопление опытного и теорети
ческого материала, характеризующего эти процессы, привело
к необходимости разделения термодинамики на отдельные спе
циализированные области. В настоящее время в зависимости
от круга рассматриваемых вопросов и целей исследования тер
модинамику делят на общую, химическую и техническую. Физи
ческая термодинамика изучает общие теоретические основы, з а
кономерности превращения энергии в различных физических
явлениях и процессах и свойства веществ, участвующих в этих
процессах. Химическая термодинамика имеет своей целью изу
чение теплового эффекта химических реакций, расчет химиче
ского равновесия, исследование свойств растворов и т. д . В те х
нической термодинамике рассматривается применение ее зако
нов к процессам взаимного превращения теплоты и работы.
Такое превращение энергии происходит в тепловых двигателях
к холодильных машинах, поэтому курс технической термодина
мики является теоретической базой для изучения и расчета про
цессов, происходящих в тепловых машинах. Очевидно, что к тех
нической термодинамике относятся и элементы физической, по
скольку в тепло- и хладотехнике носителями энергии являются
газообразные, жидкие и твердые тела.
Техническая термодинамика оформилась в самостоятельную
научную дисциплину в 50-х годах X IX столетия. Главные же
предпосылки ее были сделаны за 100 лет до этого М. В . Ломо
носовым, разработавшим основы механической теории теплоты
и открывшим законы сохранения и превращения материн и
энергии. Однако гениальные открытия Ломоносова, касающиеся
природы теплоты, не получили должного развития в его время.
5
Только со второй половины прошлого века после изобретения
И. И . Ползуновым паровой машины и в соответствии с запро
сами все более развивавшегося капиталистического производ
ства, нуждавшегося в тепловых двигателях, открытия Ломоно
сова были признаны основанием науки о теплоте и развиты
в трудах многих ученых. Работами С. Карно, Р . Майера, Р. Кла
узиуса, Б . Клапейрона, наших соотечественников — Д . И. Мен
делеева, Г. И. Гесса, Г. Ленца, Г. В . Рнхмана н многих других
созданы теоретические основы термодинамики. Решению задач
развития теплоэнергетики нашей страны способствовали труды
советских ученых М. В . Кирпичева, Л . К . Рамзина, А. А . Рал-
цига, А. К. Предводителева, М. П. Вукаловича и других; науч
ных коллективов Всесоюзного теплотехнического института,
Центрального котлотурбинного института, Всесоюзного научно-
исследовательского института холодильной промышленности
(ВНИИхолодпром).
В С ССР энергетика развивается главным образом на базе
тепловых электростанций, на которых вырабатывается более
80% всей электроэнергии. Пятнлетннм планом развития народ
ного хозяйства на 19 8 1— 1985 гг. в соответствии с директивами
XXVI съезда КПСС предусматривается довести производство
электроэнергии до 1550— 1600 млрд. кВт*ч , в основном за счет
ввода тепловых электростанций, существенно снизить удельный
расход топлива.
Непрерывно возрастает потребность народного хозяйства и
в холодильных машинах. Увеличивается выпуск продукции сель
ского хозяйства, пищевых отраслей промышленности, химиче
ской и нефтехимической промышленности, являю щихся наибо
лее массовыми потребителями холодильной техники. В соответ
ствии с потребностями названных и многих других отраслей на
родного хозяй ства производство холодильного оборудовани я
должно быть значительно увеличено с одновременным повыше
нием его эффективности.
$ 1.2 . ИДЕАЛЬНЫМ ГАЗ.
ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ.
УРАВНЕНИЕ СОСТОЯНИЯ
Процессы, происходящие в тепловых машинах (двигатели,
холодильные машины), могут быть осуществлены только при
посредстве некоторого вещества, называемого рабочим те
лом. Поэтому для анализа действия любой тепловой машины
необходимо знание термодинамических свойств рабочего тела.
Наиболее легким объектом изучения является рабочее тело,
обладающее свойствами так называемого идеального газа.
Идеальным называется газ, состоящий из упругих молекул,
между которыми не действуют силы взаимного притяжения.
причем объем, занимаемый молекулами, незначителен по ср ав
нению с объемом межмолекулярного пространства, т. е. моле
кулы являются материальными точками.
В реальных газах в зависимости от их состояния в большей
или меньшей степени проявляются молекулярные силы сцепле
ния и молекулы занимают определенную часть объема газа.
Однако отклонения свойств реального газа от свойств идеаль
ного уменьшаются с повышением температуры и понижением
давления (относительно критических параметров). Во многих
случаях реальные газы, например двухатомные (азот, водород,
кислород и др.) , в условиях их практического использования в
тепловых машинах близки к идеальному состоянию, с достаточ
ной точностью подчиняются законам, установленным для иде
ального газа. Следовательно, выводы, полученные из рассмот
рения идеального газа, могут найти применение и в практике.
Каждое состояние рабочего тела характеризуется определен
ным значением физических величин, называемых парамет
рами. В качестве основных параметров состояния в термоди
намике принимаются давление, температура, удельный объем.
Помимо этих, доступных непосредственному измерению пара
метров, в дальнейшем будут введены и некоторые другие.
Если параметры не изменяются, рабочее тело находится
в стабильном, равновесном состоянии; если один или несколько
параметров меняются — осуществляется
термодинамический
процесс.
Состояние газа определяется двумя независимыми парамет
рами: давлением и температурой, температурой и объемом или
объемом и давлением. Другие параметры могут быть выражены
функциями выбранной пары независимых основных параметров.
Удельный объем. Удельным называется объем единицы коли
чества вещества. Количество вещества может быть задано раз
личными способами в зависимости от принятой системы единиц
измерения физических величин.
В международной системе единиц СИ мерой количества ве
щества служит его масса М, измеряемая в килограммах. Сила ^
является производной величиной (кг-м /с*), называемой ньюто
ном (Н).
В соответствии со сказанным удельный объем V (м3/кг):
ю-У/М,
(1.1)
где V— объем тела (м*)\М— его масса (кг).
Масса единицы объема называется плотностью р. Очевидно,
что р =*М !У, (кг/м3):
Р-1/о.
(1-2)
Давление. Давление газа р является результатом ударов его
молекул о стенки сосуда, в котором он находится, и численно
равно силе, действующей на единицу поверхности сосуда. В СИ
7
единицей измерения давления служит давление силы 1 Н (нью
тон) на 1 м2, т. е. 1 Н/м2= 1 Па (паскаль). Кроме паскаля (еди
ницы СИ) в технике используют кратные и дольные от паскаля
величины: гнгапаскаль (1 Г П а = 1 0 9 П а), мегапаскаль (1МПа=
— 10е П а), килопаскаль (1 кПа = 103 Па), миллипаскаль (1 мПа —
= 10~3Па) идр.
На практике продолжают использовать и другие единицы из
мерения давления, такие, как техническая атмосфера (1 кгс/см2),
бар, физическая атмосфера, т. е. величина среднего давления
атмосферного воздуха на уровне моря, соответствующая д авле
нию столба ртути высотой 760 мм при температуре 0е С, и дру
гие.
Ниже приведены соотношения между наиболее употребитель
ными единицами измерения давлений:
1 кгс/м2=1 мм вод. ст.=9,807 Па« 10 Па;
1 кгс/см2=98,07 кПа«100 кПа«0,1 МПа;
1 ф. атм.=760 мм рт. ст.= 101,325 кПа;,
1 ммрт.ст.- 133,322Па«133Па;
1бар=0,1 МПа=105Па; 1мбар=100 Па.
Атмосферное давление измеряют с помощью барометров — жидкостных
(ртутных), сильфонных, мембранных н др.
Приборы, применяемые для измерения давления газа, превышающего
атмосферное, называют манометрами; для измерения давления газа, мень
шего атмосферного, — вакуумметрами.
На рис. 1 . 1 показана схема жидкостного манометра, присоединенного
к сосуду. Действительное давление рабочего тела в сосуде р«ве назы
вают абсолютным. На жидкость, находящуюся в ¿/-образной трубке мано
метра, действует помимо р такж е н давление атмосферного воздуха (баро
метрическое давление) В — через открытый канал трубки. Если р ас < > В .
жидкость занимает положение, соответствующее рнс. 1 . 1 , а. В этом случае
разность уровней столбов жидкости в правом и левом коленах ¿/-образной
трубки А соответствует разности значений абсолютного и атмосферного д а в
лений. Разность р .вс — В —риал называется избыточным или манометриче
ским давлением. Следовательно,
В том случае, когда давление в сосуде р *ве меньше атмосферного, уро
вень жидкости в левом колене окажется выше, нежели в правом (рнс. 1 .1 ,6 ).
Разность уровнен в этом случае уравновешивает разность значений В — р .с с ,
т. е. прибор покажет, насколько атмосферное давление больше абсолютного
в сосуде. Величина В — Раоса Раак называется разрежением или вакуумом.
Абсолютное давление и этом с лучае определяется из соотношения
Прибор, схема которого изображена па рис. 1 .1 , может быть использован
без изменения устройства как для измерения избыточного давления, так и
для измерения разрежения. Поэтому такие приборы часто называют мано-
вакуумметрами. В технике давление чаще всего измеряют пружинными ме
таллическими приборами (рис. 1 . 1 , в ) . Такой прибор состоит из металлической
трубки. Один конец ее запаян, а второй, открытый, закрепленный неподвижно
в корпусе прибора, сообщается с пространством, давление в котором под
леж ит измерению. Запаянный конец трубки связан со стрелкой прибора.
На внутреннюю поверхность трубки действует абсолютное давлепне равс,
а на внешнюю — давление окружающего воздуха В, т. е. барометрическое
давление.
Раб с TM/3+Рша6-
(1.3)
( 14)
8
Под действием разности давлений р . с с и В , т. е. избытка одного над
другим, трубка
изгибается, и ее свободный
конец, а следовательно, и
стрелка прибора эш имаю т определенное положение. Если рав в > В , трубка
разгибается и прибор показывает избыточное давление, он представляет
собой манометр; при р » в о < Я запаянный конец трубки перемещается вправо,
и стрелка прибора показывает значение вакуума » в данном случае он пред
ставляет собой вакуумметр.
В технике применяются металлические манометры н другого устройства,
например мембранные.
Из формул (1.3) и (1.4) видно, что при изменениях барометрического
давления ра>« и р 9»и будут изменяться, лишь р*ос остается постоянным при
Рис. 1.1. Схемы приборов для измерения давления.
а — жядкостяыв маяоиетр; б — жодкостоый вакуумметр; а — оружия-
яыЯ манометр.
неизменном состоянии газа в сосуде. П оэтому параметром состояния газа
может служить только его абсолютное давление, именно вта величина вхо
дит во все используемые далее термодинамические зависимости.
Температура. Понятие температуры связано с переходом теп
лоты от одного тела к другому при их соприкосновении. Если
теплота переходит от первого тела ко второму, это означает, что
температура первого Тх выше, чем второго 7*а(7*|>7**). Если пе
рехода теплоты между телами не происходит, то они находятся
в тепловом равновесии, и их температуры одинаковы (7*1 = 7'*).
Следовательно, температура есть мера нагретости тела. Значе
ние температуры тела может быть измерено с помощью различ
ных термометрических устройств или термометров, применение
которых базируется на том факте, что д ва соприкасающихся
9
тела через некоторое время приходят к состоянию теплового
равновесия и принимают одинаковую температуру.
В основу устройства термометров положена зависимость от
температуры каких-либо свойств вещества, например контакт
ной э.д .с . (термопары), электрического сопротивления (термо
метры сопротивления) и др.
Отсчет температуры производится по шкале температур. Ш кала темпе
ратур устанавливается путем деления разности показаний термометра в двух
произвольно выбранных постоянных температурных точках на некоторое
равное число частей, называемых градусами. Т ак как выбор постоянных
температурных точек н цены деления шкалы является совершенно произволь
ным, то имеется несколько шкал температуры.
По СТ СЭВ 1052-78 приняты две температурные шкалы — термодинами
ческая температурная шкала, имеющая одну воспроизводимую опытным пу
тем постоянную — тройную точку воды, и международная практическая
температурная шкала, основанная на одиннадцати реперных точках — посто
янных воспроизводимых температурах фазового равновесия. Отсчеты по
каждой нз этих шкал существенно не отличаются и могут быть выражены
либо в кельвинах (ГК), либо в градусах Цельсия (te C) в зависимости от
положения пуля в шкале. Поскольку значение температуры тройной точки
для воды составляет 2 73,16 К и 0,01ЪС, соотношение между температурами,
выраженными в кельвинах и градусах Цельсия, имеет вид
ГК—t®С+273,16.
О*)
Уравнение состояния идеального газа. Параметры р, v и Г,
определяющие состояние газа, находятся м еж ду собой в опреде
ленной зависимости, аналитически выраж аемой уравнением
f(p, о,7)-0,
(1.6)
которое называется уравнением состояния.
Уравнение состояния играет большую роль в развитии тео
рии термодинамики и в практике теплотехнических расчетов.
Прежде всего оно позволяет вычислить параметры газов. М еж
ду тем задача вывода уравнения состояния газов является
исключительно сложной и в настоящее время полностью, ре
шена лишь для идеального газа, подчиняющегося ряду простых
закономерностей. Напомним основные законы идеального газа,
известные из курсов химии и физики.
Закон Бойли — М арнотта. При постоянной температуре произведение
давления на объем данной массы газа есть величина постоянная и, следо
вательно, объемы данной массы газа обратно пропорциональны давлениям:
приГ= const, ру=const
Vi/Vi-ра/р,.
(1.7)
Закон Гей-Люссака. При постоянном давлении объемы данной массы
газа прямо пропорциональны его абсолютным темп ературам:
при p~const, u/reconst
Ъ\/иг~ Т х/Тг.
(1.8)
Закон Авогадро. Все газы при одинаковых температуре н давлении со
держат в равных объемах одно и то же число молекул.
Пусть в двух равных по объему сосудах находятся прн одинаковых дав
лении и температуре два газа с молекулярными массами Ц| н ц2 н массами
молекул Ш| и ша.
10
В соответствии с законом Авогадро в этом случае число молекул пер
вого газа равно числу молекул второго. Обозначим его N. Тогда масса пер
вого газа Mtm*Nmi и второго A ft * М и * Поделив первое на второе, полу
чим:
или, поскольку
(молекулярная масса газа
пропорциональна
массе его молекулы) н M/V=Qi/Qi=Pi/lh- Следова
тельно, p/Q— Idem и, так как Q— \/v,
р о —idem,
(1:9)
т. е. при одинаковых температурах и давлепнях произведение удельного объ
ема на молекулярную массу не зависит от природы газа и для всех газов
имеет одно н то ж е значение.
Количество газа в килограммах, равное числу единиц в молекулярной
массе р. называется кнломолем. М асса киломоля, например для кислорода,
равна 32 кг, кнломоля водовода — 2 ,016 кг. Очевидно, что произведение ро
есть объем киломоля (в мукмоль), поэтому уравнение (1.9), а следо
вательно, и закон Авогадро, можно формулировать так: объем кнломоля
прп одинаковых температурах н давлениях для всех газов одинаков.
При нормальных технических условиях (р— 0.1 МПа (1 бар) н t* 2 0 ® С)
объем кнломоля любого газа равен 24,4 м’ /кмоль.
Из этих условий можно определить удельный объем, а следовательно,
и плотность любого газа при нормальных условиях. Д л я этого достаточно
лишь знать молекулярную массу газа.
В ряде случаев оказывается удобным задавать количество вещества
числом его молей. Обозначив число молей газа л, получим
n-М/р нлиМ-лр.
(1.10)
На основании законов Бойля — Марнотта и Гей-Люссака
в 1834 г. Клапейроном было выведено уравнение состояния
идеальных газов.
Для 1 кг газа
pv/T—const и pv—RT,
(1.11)
где /?— рр/Г — газовая постоянная, отнесенная к 1 кг газа, яв
ляю щаяся физической константой, зависящей от природы газа.
Единица измерения газовой постоянной может быть вы ве
дена из уравнения (1.11). В СИ [/?]=Ы •м/(кг-К)-Дж/(кг*К).
Газовая постоянная R имеет физический смысл удельной
работы, которая производится единицей количества рабочего
тела при изменении его температуры на 1 К — при постоянном
давлении, как это будет видно из дальнейшего; р — абсолютное
давление газа в паскалях, определяемое в зависимости от состо
яния газа по формулам (1.3) или (1.4).
Уравнение состояния для произвольного количества газа
(AÍ, кг) получается при подстановке в уравнение (1.11) значения
удельного объема
V/M.
При этом получим
рК/М-ЯГ, pV-MRT.
(1.11а)
Уравнение Клапейрона является уравнением частного сл у
чая, поскольку содержит в себе константу Я, отнесенную к 1 кг
газа и зависящую от природы газа.
В 1874 г. Д . И . Менделеевым было выведено уравнение со
стояния идеальных газов в общем виде. Умножив обе части
и
уравнения (1.11) на молекулярную массу газа р, он получил
рир=рЯ7\
Величину и\1 — объем кнломоля — обозначим Ум. Тогда
уравнение состояния для 1 киломоля газа можно записать в сле
дующем виде:
рУ«=рЯ7\
(1.12)
Так как в соответствии с законом Авогадро объем 1 кнло
моля при одинаковых р и Т для всех газов одинаков, величина
р/?=рУ м/7\ постоянная для 1 киломоля, одинакова для всех
газов при всех состояниях. Поэтому величина рЯ называется
универсальной газовой постоянной. Е е численное значение мо
ж ет быть определено из уравнения (1.12), если известен объем
киломоля Ум для определенных давлений и температуры. Так,
например, для нормальных физических условий имеем р =
= 101,3 кПа, Г = 273 К; Ум=*22,4 м3/кмоль. Тогда значение уни
версальной газовой постоянной
рЯ=рУм/7'-8 314 Дж/(кмоль-К).
(1.13)
Отсюда уравнение (1.12) получает вид
рУм=8314 Т.
Универсальная газовая постоянная рЯ представляет собой
удельную работу одного кнломоля газа при изменении его тем
пературы на 1 К при постоянном давлении.
Зн ая численное значение универсальной газовой постоянной,
легко вычислить газовую постоянную (в Д ж/(кг -К)) для лю
бого газа, молекулярная масса которого известна
Я=8314/р.
§ 1.3 . СМЕСИ ГАЗОВ
В технике часто приходится иметь дело не с однородным
(чистым) газом, все молекулы которого одинаковы, а с газо
выми смесями различного состава. Таковы, например, газооб
разные продукты сгорания, горючие смеси, являющиеся рабо
чим телом в газовых двигателях, воздух и т. д . Здесь рассмат
риваются газовые смеси, компоненты которых обладают свой
ствами идеальных газов и не вступают друг с другом в хими
ческое взаимодействие. Каждый газ, входящий в смесь, ведет
себя независимо от других компонентов и оказывает на стенки
сосуда собственное давление, называемое парциальным.
Такие смесн подчиняются названным выше законам идеальных
газов; для них также справедлив закон Дальтона, согласно
которому давление смеси равняется сумме давлений отдельных
газов, входящих в смесь, т. е. сумме их парциальных
12
давлений. Обозначая давление смеси через рсм, а парциаль
ные давления входящих в смесь компонентов через р\, р% ••••
р *, будем иметь
|я
Рем«=Р|+Ра+ ...+ р < +
или Рем- £ Р<-
(114)
/-1
Очевидно, что в соответствии с этим условием каждый газ,
входящий в смесь, занимает полный объем смеси.
К таким смесям применимо уравнение состояния идеального
газа, т. е.
Ремнем в ЯсмТсн»
Рем^см в ^смЛсм^см»
РемУм, СМ“ 8314 Тсы.
Дал ее для простоты написания индекс, обозначающий смесь,
будем опускать.
Количественное соотношение отдельных газов, входящи х
в смесь, в термодинамике чаще всего задается массовыми, объ
емными и мольными долями.
Задание смеси массовыми долями. Массовой долей назы
вается отношение массы отдельного газа к массе смеси. Обо
значив массовые доли через g^t можем записать
Ь = МХ/М%В2 = М2/М......... *п-А*п/М,
(1.15)
где М|, М2, ...,МП— массы отдельных газов, входящих в смесь,
М — масса смеси.
Очевидно, что М—М1+М2+ ... +МПи
0-16)
Я
Массовые доли выраж аю тся долями единицы или в процен
тах. Например, массовые доли азота и кислорода воздуха при
ближенно равны: #N,-77%; £о,=23%.
Задание смеси объемными долями. Компоненты смеси, рас
пространенные по всему ее объему, имеют определенные пар
циальные давления, которые могут быть найдены из уравнения
состояния
откуда р|=М </?(Г/^, где V и Г — объем и температура смеси.
Определим объем Уи который имел бы газ при давлении
и температуре смеси. В этом случае уравнение состояния запи
шется в следующем виде:
рУ{-М&Т.
(1.17)
Из д вух предыдущих уравнений в соответствии с законом
Бойля — Мариотта имеем: рУ{=*р{У и Ух= Ур^р . Объем
13
Vi называется приведенным или парциальным объемом д ан
ного газа.
Таким образом, парциальный или приведенный объем ком
понента смеси — это объем, который занял бы данный компо
нент, если бы при температуре смеси его давление от парци
ального мы довели до давления смеси. Очевидно, что парциаль
ным объем составит некоторую часть объема смеси, т. с . того
объема, который занимал данный газ, находясь в смеси с дру
гими газами.
Сумм а парциальных объемов всех компонентов данной смеси
р&вннется полному объему смеси. Действительно,
VI+Уг+ ...+ У„-Ур1/р+Ург/р+ ...+Уря/р.
илиУ1+У,+...+У»-У(Р1+Р1+-..Рп)/Р’=У.
Отношения парциальных объемов компонентов к полному
объему смеси называют объемными долями компонентов. Их
обозначаю т буквой г<:
г.-У./У,
............гя= У п/У.
(1.18)
ТаккакУ,+Уг+...+У.=
У,тог1+г,+
...
+»-.=
1.
/-Я
или
1-1
(1.19)
Объемные доли выражаются долями единицы или в процентах.
Например, объемные доли азота и кислорода воздуха прибли
женно равны: /*N ,= 79%, го, = 21%.
Задание смеси мольными долями. Обозначим число молей
смеси через л, а число молей компонентов через Я|, л 2, .... л».
Тогда л=Л|+л*+ ... +ги . Из определения моля газа следует,
что между молекулярными массами отдельных газов, их мас
сой н числом молей существуют соотношения: п ^ М х/ри яа=»
« Л 1 2/р2, ..., ппш=М»/\т. Соответственно для всей смеси л*=
« М / р . Отношение числа молей компонента к числу молей
смеси называют мольной долей данного газа, входящего в смесь.
Обозначив мольную долю через х, можем записать Х\= п\/п,
хг^пг/п, .... х»=ги/л.
Легко убедиться, что два последних способа задания состава
смеси тождественны. Парциальным объемам всех газов,
а именно У\, У2, .... Уп соответствуют одинаковые давления р
и температуры Г, равные давлению и температуре смеси. Так
как при этих условиях, согласно закону Авогадро, объемы мо
лей компонентов и всей смеси будут одинаковыми, то парци
альный объем любого ¿-го компонента может быть определен
из формулы: У{= У мпи а полный объем смеси Уж*Умп. Оче
видно, что
П-У</У-УыП{/(УыП)-л</л«х,,
(1.20)
14
т. е. мольные и объемные доли имеют для каждого газа, вхо
дящего в смесь, одинаковые численные значения.
Переход от объемных долей к массовым. Д ля каждого газа,
входящего в смесь, можно записать:
или, так как из закона Авогадро ос/р«р</ц,
£<-(щ/ц)г<.
(1.22)
Используя понятие универсальной газовой постоянной, мо
жем написать цЯ=/?<щ =8314 Дж/(кмоль* К).
Следовательно,
Переход от массовых долей к объемным.
(1.21) — (1.23) видно, что
(1.23)
Из соотношений
_
Р
ITM
—
тгЕг ЛЕг IчЕг -£*»•
(1.24)
Кроме того, использовав соотношение (,1.20), можем запи
сать: Г,—У{/У— —П{/(П\+П2+ . . .
=лп)или
г<=(Л1с/щ)/(М1/р|-»-Л12/р2+ ••• + М я/цп).
Разделив числитель и знаменатель последней формулы на
массу смеси М , получим
.
„ ________ Ш
________ „
* ‘1п
,,
Г< е 1>1+^г/1Н+ •••+*«/>.
’
и .Л)
Определение кажущей ся молекулярной массы и газовой по
стоянной смеси. Поскольку здесь рассматриваются смеси раз
личных газов, имеющих разные молекулярные массы, можно го
ворить лишь об условной или кажущейся молекулярной массе
смеси. Именно такой смысл необходимо придать величине
р—А1/л.
Газовая постоянная смеси может быть определена из ур ав
нения универсальной газовой постоянной по значению к а ж у
щейся молекулярной массы смеси.
Расчетные формулы для кажущейся молекулярной массы и
газовой постоянной смеси можно получить следующими спо
собами.
а)
При задании смеси массовыми долями. Из уравнения
(1.24)
Суммируя левую и правую части уравнения
для всей смеси, получим 2г*= !£</?<//?= 1, откуда
(1.26)
или
/г-8314Г(*,/р<).
(1.27)
так как /?<п8314/|й'
15
Поскольку ц= * 8 314/Я, можем записать, что
Р- 8314/(2*Л,) - 1 / 2 (gi!ii().
(1.28)
б)
При задании смеси объемными долями. Из уравнения
(1.22) имеем Zgi=Zrnii/p= 1, откуда
р- 2г,ц<- 83142(rJRJ.
(1.29)
Для газовой постоянной смеси
R- 8314/р- 8314/2(*,р,) = 1/2(г,Я,).
(1.30)
Очевидно, что формулы (1.29) и (1.30) могут использоваться
н в том случае, когда смесь задана мольными долями.
Определение плотности смеси. Плотность смеси может быть
определена по значениям плотностей отдельных газов. При за
дании смеси объемными долями расчетная формула может быть
определена из равенства Af*»Af14-Af2+ . . . + A fn при подста
новке в него значений М=*рУ, A
fx
=
p i ит.д.Тогда
pVa-piVi+paVVI- . • .+P»iV\,.
После почленного деления на
объем смеси V получим
/—я
P=Piri+p2*a+ ••• +рпГп= 2^(р<г<).
(1.31)
При задании смеси массовыми долями формула для опре
деления плотности смеси выводится из уравнения (1.17): V *
e Vi+ Ka4-
...
так как V~M/p, rj = M|/pi,
ит.д.
Можем написать, что М/р=М 1/рх+М 2/рг+ ... + Afnpn или
l/p-= £i/pi+£i/pa+ ••• +£«/рп, откуда
P-l/l(tf./pi) + (*2/pa) + ••• +(*n/pn)]«l/21 (gi/pi). (1.32)
Определение парциальных давлений. Из определения парци
ального объема
(pJp)V следует, что
Pi-pVilV+pn.
(1.33)
В случае задания смеси массовыми долями
Р<*Р£<(Я|/Я) *Р£<(р/р<)-
(1*34)
| 1.4. РАВНОВЕСНОЕ СОСТОЯНИЕ
И РАВНОВЕСНЫЙ ПРОЦЕСС
СИСТЕМА КООРДИНАТ р - и
В термодинамике изучаются процессы, происходящие в р аз
личных термодинамических системах. Термодинамической си
стемой называют систему материальных тел, находящихся как
в механическом, так и в тепловом взаимодействии друг с дру-
16
том н с окружающей систему внешней средой. Механическое
взаимодействие означает, что системой (или наоборот, над си
стемой) совершается механическая работа. Тепловое взаимодей
ствие состоит из перехода теплоты от одного тела системы
к другому или от системы к окружающей среде. Простейшим
примером термодинамической системы может служ и ть поршне
вая машина с рабочим телом — газом, заключенным в ее ци
линдре под поршнем. В этом случае внешней средой являются
стенки цилиндра, поршень и окружающий цилиндр воздух.
М еж ду газом и внешней средой происходит взаимодействие —
в общем случае механическое и тепловое.
Пели параметры системы одинаковы во всех точках занимае
мого ею объема и равны параметрам окружающей среды, то го
ворят, что система находится в термодинамическом равновесии.
Иначе, при термодинамическом равновесии имеют место р а в
новесия:
а) тепловое или термическое, т. е . одинаковость темпера
туры во всех точках объема газа н внешней среды;
б) динамическое или механическое, т. е . одинаковость д а в
ления во всех точках газа и окружающей среды.
Следовательно, под равновесным состоянием газа пони
мается такое состояние, при котором во всех точках объема,
занимаемого газом, давление и тем пература одинаковы и равны
давлению и температуре внешней среды.
Ряд последовательных изменений термодинамических со
стояний газа в результате взаимодействия с внешней средой на
зывается термодинамическим процессом.
Разли чаю т равновесные и неравновесные про
цессы изменения состояния газа.
Равновесным называется процесс, если в каждом из проме
жуточных состояний во всем объеме газа успевает устанавли
ваться термодинамическое равновесие. Иначе говоря, равно
весный процесс представляет собой совокупность последова
тельно проходимых газом состояний равновесия. Очевидно, что
изменение внешних давления или температуры неизбежно при
водит к нарушению равновесия, поскольку выравнивание д ав
ления и температуры по всему объему происходит лишь посте
пенно с некоторой конечной скоростью. Следовательно, все дей
ствительные термодинамические процессы являются неравно
весными, т. е . термическое и механическое равновесия непре
рывно нарушаются.
Меж ду тем применение уравнения состояния р ц —Л7* при ис
следовании процессов возможно лишь в том случае, если газ,
например, расширяясь или сжимаясь, проходит через отдель
ные равновесные состояния, т. е. если удельный объем, д ав л е
ние и температура, изменяясь в холе процесса, в каждом из
промежуточных состояний одинаковы по всему объему, зани
маемому газом.
2
Зах. 80
17
Это противоречие можно устранить лишь обусловив, что из
менение температуры и давления внешней среды, а следова
тельно, и газа происходит бесконечно медленно, так, что в каж
дый момент разности температур н давлений газа и внешней
среды бесконечно малы. Это возможно допустить, так как в тер
модинамике фактор времени не учитывается.
При таком условии можно считать, что термодинамический
процесс есть непрерывный ряд равновесных состояний, а сл едо
вательно, на всем его протяже
нии можно применять уравнение
pv=sRT.
Равновесиый процесс может
быть изображен графически. Д ля
этой цели в термодинамике ши
роко используется двухосная си
стема координат р—V (рис. 1 .2 ),
в которой ось абсцисс служит
осью удельных объемов, а ось ор
динат— осью давлений. Каждая
точка (7—3) в этой системе коор
динат будет соответствовать опре
деленному равновесному состоя
нию рабочего тела, поскольку для
любой точки находящегося в рав
новесии тела величины р, V и Т
имеют определенное численное
Рис. 1.2. Иллюстрация равновесно-
значение. Т ак как равновесный
го процесса в координатах р—V
.
процес является совокупностью
ряда последовательно изменяю
щихся равновесных состояний, линия 1 —2 —3 является изобра
жением равновесного термодинамического процесса. Таким об
разом, каждому равновесному процессу в системе координат
р — V будет соответствовать определенная кривая.
Процессы расширения принято называть прямыми процес
сами, сж ати я— обратными. Следует иметь в виду, что обяза
тельным и единственным признаком расширения газа служи т
увеличение его удельного объема; давление при этом может
уменьшаться, оставаться постоянным или д аж е увеличиваться —
это зависит от того, в каком количестве подводится или отво
дится теплота от газа в процессе его расширения. По тем ж е
причинам единственным признаком процесса сжатия служ и т
уменьшение удельного объема газа.
Графическое изображение процессов представляет значи
тельные удобства для их изучения и поэтому широко приме
няется в термодинамике.
В силу сказанного только равновесные процессы могут быть
точно представлены графически. Графическое изображение не-
18
равновесных процессов, если к нему прибегают, может иметь
лишь условный характер.
Обратимые процессы. О существление равновесного процесса
расширения газа может быть представлено следующим образом.
Положим, что точка а (см. рис. 1 .2) характеризует равновесное
состояние газа при термическом и механическом равновесиях
с окружающей средой. Допустим, что внешнее давление умень
шается на бесконечно малую величину ёр. Это изменение на
рушает равновесие системы, и газ начинает расширяться и ото
двигать поршень. Движение поршня, совершающееся беско
нечно медленно, прекратится, когда в системе вновь наступит
равновесие, т. е. когда давление газа во всех точках объема
уменьшится на величину ёр.
Если внешнее давление газа продолжать последовательно
уменьшать на величину ёр, то в системе указанные явления пов
торяются н происходит бесконечно медленный процесс, в кото
ром газ, изменяясь, проходит через отдельные равновесные со
стояния: А, а, Ь, с, ..., /, л, В . Такой процесс будет равновесным.
Если затем при некотором конечном состоянии В увеличить
внешнее давление на величину ё р , то это вызовет изменение
направления процесса: поршень будет двигаться в обратную
сторону, а газ начнет сжиматься до состояния, при котором его
давление вновь станет равным внешнему. При последователь
ном увеличении внешнего давления на ёр газ, постепенно сж и
маясь, проходит через равновесные состояния В , л, /, ..., с,
Ь, а, А, т. е. через те же состояния, которые он проходил в пря
мом процессе расширения, но в обратной последовательности.
При выполнении таких условий графики процессов сжатия н
расширения совпадают. В результате прямого и обратного те
чений обратимых процессов газ и термодинамическая система
в целом возвращаются в начальное состояние, ибо работа / (см.
рис. 1 .2), затраченная извне на сжатие газа, равна произведен
ной перед тем работе, затраченной на его расширение.
Процессы, в результате осуществления которых в прямом и
обратном направлениях в энергии окружающей системы не
происходит изменений, т. е . отсутствую т затраты энергии извне,
называются обратимыми.
Очевидно, что обратимый процесс наиболее эффективен, мо
ж ет обеспечить получение максимальной работы при данном
изменении состояния, является предельным в смысле количе
с тва получаемой работы.
Необратимые процессы. При отсутствии механического или
термического равновесия процесс необратим, т. е . он или вообще
неосуществим в обратном направлении, или ж е обратный про
цесс происходит при других параметрах и с затратой работы
извне. Иначе говоря, при обратном процессе не восстанавли
вается первоначальное состояние и рабочего тела, н внешней
среды. При заметном неравенстве давлений газа и внешнего
2*
19
давления он быстро расширяется или сжимается, в результате
чего возникают вихревые движения, которые с течением вре
мени затухаю т, а их энергия переходит в теплоту, воспринимае
мую газом наряду с внешней теплотой.
При отсутствии термического равновесия процесс т акж е не
обратим. Если при прямом процессе газ отдает теплоту внеш
ней среде, температура которой заметно ниже температуры
газа, то обратный процесс, связанный с получением газом теп
лоты, окажется возможным лишь в случае, когда температура
среды будет превышать температуру газа, что приводит к з а
тратам теплоты извне.
В дополнение к двум указанным условиям обратимости про
цессов необходимо назвать третье: отсутствие трепня в процессе
изменения состояния газа. При наличии трення процесс необ
ратим, так как и при расширении, и при сжатии часть работы
затрачивается на трение, превращается в теплоту.
Обратимый процесс можно рассматривать лишь в качестве
идеального. В реальных условиях подвод и отвод теплоты всегда
совершаются при конечной разности температур тел, участвую
щих в теплообмене; механическое равновесие никогда не со
блюдается; всякое изменение объема неизбежно связано с тре
нием. Поэтому все реальные процессы в земных условиях не
обратимы.
Тем не менее в дальнейшем мы будем в основном рассмат
ривать обратимые процессы, поскольку теория классической
термодинамики разработана лишь применительно к обратимым
процессам. Ли шь при рассмотрении обратимых процессов мы
можем использовать математический аппарат, основанный на
применении уравнения состояния ри=- /?7\ и зображ ать процессы
графически в различных системах координат. Зам еняя реальные
процессы обратимыми, мы абстрагируемся от действительности,
но такая абстракция методически оправдана, так как она обес
печивает возможность изучения общих закономерностей, уп
равляю щих процессами. Переход ж е от обратимых процессов
к реальным, необратимым осуществляется с помощью введения
эмпирических коэффициентов определенными способами, ко
торые рассматриваются в специальных курсах тепло- и хладо-
техиики.
Глава 2
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
| 2.1 . ТЕПЛОТА.
ЭКВИВАЛЕНТНОСТЬ ТЕПЛОТЫ И РАБОТЫ
Содержанием первого закона термодинамики является ут
верждение возможности взаимного превращения работы в теп
лоту и теплоты в работу.
Следовательно, первый закон термодинамики представляет
собой приложение к тепловым явлениям всеобщего закона
сохранения н превращения энергии, открытого русским ученым
М. В . Ломоносовым (работы 1744— 1747 гг.) . Из закона сохра
нения энергии следует, что энергия не создается, не уничто
ж ается н что один вид энергии может переходить в другой,
причем превращение энергии совершается таким образом, что
определенному количеству одного вида энергии всегда соответ
ствует точно определенное количество энергии другого вида.
Ф. Энгельс и В. И. Ленин рассматривали закон сохранения
энергии как выражение основных положений материализма.
Ф. Энгельс указывал, что этот закон имеет не только количе
ственную сторону, заключающуюся в констатации того факта,
что при любых действительных процессах количество энергии
остается неизменным, но такж е и качественную сторону, со
стоящую в утверждении того, что энергия, будучи физической
мерой различных форм движения материи, качественно нераз
рушима и обладает беспредельной способностью превращения
из одной формы в другую.
После Ломоносова обоснованием и развитием закона сохра
нения энергии занимались С. Карно (1832), Г. И. Гесс (1840),
Д. Джоуль (1840), Р. Майер (1842), Г. Гельмгольц (1847).
Первый закон термодинамики, как и общий закон сохранения
энергии, установлен из обобщения данных практики и не явл я
ется следствием каких-либо других положений или законов.
Поэтому часто первый закон называют первым началом тер
модинамики.
Как показывает опыт, различные тела, взаимодействуя ме
ж ду собой, передают друг другу некоторое количество энергии.
Передача энергии от одного тела к другому может происходить
разными способами, из которых для целей технической термо
динамики особо важны д ва. Первый способ передачи энергии из
вестен из механики и состоит в совершении работы одним телом
над другим. В этом случае увеличение энергии тела равно про
изведенной над ннм работе со стороны второго тела. Передача
энергии в виде работы всегда связана с изменением внешних
условий и, в частности, с перемещением тела как целого илн
21
отдельных его частей, иначе говоря, макротел. Второй способ
состоит в непосредственной передаче энергии от более нагре
того тела к менее нагретому при их тепловом контакте. Эту
ч асть энергии, которая передается от более нагретого те ла
к менее нагретому в результате их теплового контакта, и назы
ваю т теплотой.
Количество работы н количество теплоты являются мерой
энергии, переданной телу в форме работы н в форме теплоты.
Теплота представляет собой форму передачи энергии от одного
тела к другом у путем непосредственного молекулярного взаи
модействия, т. е. посредством обмена энергией м ежду хаоти
чески движущимися молекулами обоих тел, микротелами.
Работа в отличие от теплоты представляет собой упорядо
ченную форму передачи энергии в результате взаимодействия
макротел. В этом и заклю чается качественное различие понятий
«работа» и «теплота».
Установленная ж е принципиальная общность этих д вух форм
перехода энергии позволяет формулировать первый закон тер
модинамики.
В основу первого закона термодинамики могут быть поло
жены различные экспериментальные данные, что приводит
к многообразным, но тождественным его формулировкам. Так,
например, формулировками первого закона могут служить сле
дующие.
Теплота и работа обладаю т свойствами взаимного превра
щения в определенных количественных соотношениях. Или: не
возможно создать вечный двигатель (первого рода), который
непрерывно производил бы работу, не получая непрерывно энер
гию из окружающей среды.
Исходя из возможности экспериментальной проверки, целе
сообразно в основу первого закона положить принцип эквива
лентности, согласно которому превращение различных видов
энергии происходит в строго определенных постоянных коли
чественных соотношениях.
В соответствии с принципом эквивалентности теплота Я»
полученная из работы I , не зависит от характера превращения
I в <?; иными словами, отношение (?/£ всегда будет одним и
тем же, строго определенным и постоянным.
Обозначая константу отношения Я/1~ через А, получим
ЯИ=А, Я -АЬ.
(2.1)
Константа Л, называемая тепловым эквивалентом работы,
соответствует количеству теплоты, эквивалентному единице р а
боты. Если измерять теплоту в килокалориях, а работу в ки
лограммометрах, тепловой эквивалент работы А численно бу
дет равен 1/427 ккал/кгм. В технике работу чаще измеряют
более крупными единицами — лошадиными силами в час
22
Таблица 2.1. Соотаовснне между единицами измерения анергии
Единица
Кило
джоуль
Килока
лория
Киловатт-час
Килограм
мометр
Лошадиная
сила-час
1 килоджоуль . .
1 киловатт-час . .
1,0
3600
ода
860
0,00278
1.0
102,0
367200
0.000378
1,38
1 лошадиная си
ла-час ....
1 килокалория
1 килограммометр
2,646
4,1866
0,00981
632,3
1Д>
0.00234
0.736
0.00М6
0,00000272
270000
427
1.0
1.0
0.00168
0,0б000374
(л. с«ч) или киловаттами в час (кВт*ч). Тогда
Л —1/427 ккал/кгм = 632 ккал/(л. с-ч) —
= 800 ккал/(кВт-ч)—0,86 ккал/(Вт-ч).
В СИ и механическая работа, н теплота измеряются одной и
той ж е единицей — джоулями. Следовательно, при пользова
нии этой системой единиц (?/1—1, ¿4= 1 л уравнение (2.1) при
мет вид
<1-1.
(2.1а)
Соотношения м еж ду наиболее употребительными единицами
измерения энергии приведены в табл. 2 . 1 .
| 22. АНАЛИТИЧЕСКОЕ ВЫРАЖЕНИЕ
ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ
Как будет показано далее, уравнение <? = £ не может быть
применено для описания любого произвольного термодинамиче
ского процесса, в результате которого рабочее тело не возвра
щается в начальное состояние; является лишь частным выра
жением первого закона термодинамики, справедливым для з ам
кнутых круговых процессов. В энергетическом балансе произ
вольного процесса нужно учитывать энергию, затраченную на
изменение состояния рабочего тела. Получим выражение пер
вого начала термодинамики для этого наиболее общего случая.
Пусть в цилиндре под поршнем (рис. 2.1) в объеме V з а
ключен газ в количестве М с температурой Т, испытывающий
внешнее давление р. Если газу сообщается извне бесконечно
малое количество теплоты </(?, то в общем случае температура
тела повышается на величину с!Т и тело расширяется, увеличи
вая свой объем на ёУ (при перемещении поршня на высоту
(11) . Повышение те мпературы означает увеличение кинетической
энергии и молекулярного н внутримолекулярного движения ч а
стиц газа. Иначе говоря, при этом происходит приращение внут
ренней кинетической энергии газа, которое и воспринимается
23
•нами как повышение температуры. Обозначим это приращение
внутренней кинетической энергии газа через ёК. Увеличение
объема газа обусловливает увеличение расстояния между моле
кулами. Так как в общем случае между молекулами действуют
силы взаимного притяжения и отталкивания, увеличение рас
стояния м еж ду ними связано с изменением внутренней потен
циальной энергии газа, которое обозначим через ёР.
В некоторых случаях увеличение расстояния между моле
кулам и связано с изменением агрегатого состояния нагревае
мого тела, переходящего из твердого со
стояния в ж идкое (плавление) или из
|жидкого в пар (парообразование).
В результате увеличения объема газ,
кроме того, совершает работу преодоле
ния внешнего давления — внешнюю ра
боту расширения, которую обозначим че
рез
При отсутствии каких-либо других из
менений газа, например химических и
электрических, на основе закона сохране
ния энергии получим уравнение тепло
вого баланса:
ёЯ^ёК+ёР+ёЬ.
Первые два члена правой части уравне
ния, очевидно, представляют собой изме
нение внутренней энергии тела. Вводя
обозначение ёК+ёР=<Ш , получаем
ё<)=ёи+ё1.
(2.2)
•
Уравнение (2.2) является аналитиче
ским выражением первого закона термо
динамики, который, следовательно, м ож
но сформулировать и так: теплота ё 0 .у
сообщаемая телу, расходуется в двух направлениях, а именно:
часть ее идет на изменение внутренней энергии тела ё 1 ) %а осталь
н а я — на совершение внешней работы (работы расширения) ё Ь .
Отметим, что это уравнение получено для тела, находяще
гося в покое (отсутствует изменение его внешней кинетической
и потенциальной энергии).
Переходя к удельным величинам (на 1 к г), уравнение (2.2)
можно переписать в виде
ёя=ёи+ё1,
(2.2а)
где я
и=и/М,/=¿/¿1
Далее рассматриваются каждый из членов уравнения (2.2).
Рис. 2 .1 . К выводу ана
литического выражения
первого закона термоди
намики.
24
f 2.3. ВНУТРЕННЯЯ ЭНЕРГИЯ
Всякое тело облад ает определенной внутренней энергией,,
зависящей от его состояния. Из уравнения (2.2а) du**dq — dl .
При этом знак изменения внутренней энергии тела будет зав и
сеть от соотношения меж ду теплотой и работой, т. е. от знака
разности dq — dl . Из этой записи следует, что внутренняя энер
гия тела есть энергия, которой обладает газ и которую он при
своем изменении от некоторого состояния, принятого за нуле
вое, способен отдать в виде теплоты и произведенной им работы.
Отсюда следует также, что абсолютную величину внутренней
энергии определить невозможно, так как нельзя представить
себе состояние тела, при котором оно не обладало бы энергией.
Предположение такого состояния означало бы отрицание основ
ного свойства материи — движения.
Для термодинамических расчетов этот ф акт не имеет зн а
чения, так как обычно вычисляется не абсолютная величина
внутренней энергий, а ее изменение. Поэтому в термодинамике
рассматриваются лишь те составляющие внутренней энергии,
которые подвергаются изменению при осуществлении термоди
намических процессов.
К этим составляющим внутренней энергии относятся энер
гия поступательного и вращательного движений молекул газа,
энергия колебательного движения атомов, а такж е энергия меж-
моле'кулярного взаимодействия, т. е., как это и было принята
ранее, составляю щими внутренней энергии являются внутрен
няя кинетическая энергия тела, зависящая от скорости дви
жения его микрочастиц, и внутренняя потенциальная энергия,
зависящая от сил взаимодействия частиц и их взаимного р ас
положения. Изменение этих видов энергии зависит от измене
ний термодинамических параметров р, v и Т.
Как уже отмечалось, каждое тело в данном состоянии обла
дает определенным запасом внутренней энергии. Следовательно,,
внутренняя энергия есть некоторая однозначная функция со
стояния тела или, иначе, любых двух независимых парамет
ров, определяющих состояние тела:
u=f\(p,v),
u=it{o,T),
u*=f3(p, Т).
Являясь функцией состояния, функцией основных парамет
ров состояния, удельная внутренняя энергия газа сама явля
ется параметром состояния, величиной которого можно х а р а к
теризовать состояние рабочего тела. Из этого основного свойства
внутренней энергии следует, что ее изменение не зависит от
характера процесса, т. е. от промежуточных состояний тела,
а полностью определяется начальным и конечным его состоя
ниями.
Значит, в соответствии с известными математическими по
нятиями о дифференциалах бесконечно малое изменение внут-
25
ренней энергии тела ёи является полным дифференциалом, ре
зультат интегрирования которого есть разность величин внут
ренней энергии в конечном состоянии и2 и начальном состоянии
тела щ
з
р,) —¡(Ри »!>-«»
—
«1=Ли,
(2.3)
где Ди-иг
—
« 1 — конечное изменение внутренней энергии.
Установленные общие свойства внутренней энергии и при
менении к идеальным газам могут быть выражены в иной
форме. Действительно, потенциальная составляющая внутрен
ней энергии идеального газа, силами сцепления между молеку
лами которого пренебрегаем, равна нулю. Вторая составляю
щая— внутренняя кинетическая энергия является лишь функ
цией температуры газа, что известно из кинетической теории
вещества. Тогда для идеального газа имеем
и -/(Г).
(2Л)
т. е. изменение внутренней энергии идеального г аза зависит
лишь от начальной и конечной температуры газа (закон Д ж о
ул я ) . Единица измерения удельной величины внутренней энер
гии— 1 джоуль на килограмм.
| 2.4. РАБОТА ИЗМЕНЕНИЯ ОБЪЕМА
Аналитическое выражение. В процессе расширения тело, из
меняя свое состояние, совершает работу по преодолению дей
ствия внешних сил; наоборот, в процессе сжатия тело воспри
нимает работу этих сил.
Покажем на примере поршневого двигателя вывод общей
формулы работы тела для равновесного процесса, в котором
в каждый момент времени давление в системе равно действую
щему на нее внешнему давлению. В металлический цилиндр
(рис. 2 .1) плотно вставлен подвижный поршень. Под поршнем
в цилиндре находится какой-либо газ с давлением р. Бесконечно
малое расширение газа на ёУ %происходящее, например, при
подводе к газу теплоты ё(1, вызывает бесконечно малое пере
мещение поршня на ё г до положения, обозначенного пунктиром,
причем ёУ —Рёг, где
—
площадь поршня. Поршень переме
щается, преодолевая внешнее давление р, в любой момент про
цесса равное давлению р газа в цилиндре. Работа, совершаемая
газом, может быть вычислена путем перемножения силы р р на
путь поршня ё г :
ёЬ-рРёг-рёУ.
(2.6)
Как видно из полученного уравнения, работа газа нераз
рывно связана с изменением объема и определяется им и д а в
лением. При У-сопв^ т. е. ёУ—0, ёЬ=0 . Так как абсолютное
26
давление р всегда величина положительная, йЬ и (IV имеют
одинаковые знаки: если йУ>0, то и ¿ ¿ > 0 , т. е. при расшире
нии работа газа положительна, газ совершает работу; если ж е
(IV< .0, то и ¿ ¿ < 0 , т. е. при сжатии работа газа отрицательна,
газ не совершает работу, а на его сжатие затрачивается работа
извне.
Для 1 кг газа уравнение (2.5) примет вид ¿/=р */о. Работа
1 кг при конечном изменении удельного объема от и\ до V* мо
ж ет быть получена интегрированием уравнения (2.5) в соот
ветствующих пределах:
/-?рЖ/.
(2.6)
о.
Очевидно, что поскольку в общем случае давление р есть
величина переменная, интегрирование правой части уравнения
О
О
Рис. 2 2 . Графическое выражение внешней работы при расширении
(а) и сжатии (б).
(2.6) возможно лишь при условии, если имеется функциональ
ная зависимость между переменными р и о, т. е. если известно,
как изменяется давление с изменением объема. Если, например,
рз=/(и), то определение удельной работы сводится к вычисле
нию определенного интеграла
/= /рЛ> —
г,
vl
Графическое изображение работы. Если имеется функцио
нальная зависимость м еж ду р и и в ходе термодинамического
процесса, то она может быть наглядно представлена графи
чески в координатах р — V
.
Откладывая значение удельного объема о в пределах от щ
до
и соответствующие значения давления р, определяемые из
уравнения р = / (и ) , получаем ряд точек, совокупность которых
в общем случае составляет кривую процесса 1 —2 (рис. 2 .2, а)
с уравнением
27
При бесконечно малом ¿ о площадь заштрихованной обла
сти равна рёи=*ё1. Следовательно, работа газа в процессе / —2,
равная / —^ р ё с\ изображается в принятом масштабе площадью,
Г,
ограниченной кривой процесса, осью абсцисс н крайними ор
динатами, или площадью под кривой процесса. На рис. 2 .2,
а представлен процесс расширения (оа> 0 |), работа которого
положительна. В случае обратного направления процесса 1 — 2
(рис. 2 .2, б) происходит сжатие газа (0 2< ^ 1), работа такого
процесса отрицательна.
Таким образом, графическое изображение процесса в коор
динатах р — V позволяет получить ясное представление о том,
как изменяется давление н объем
(расширяется газ или сжимается),
а также позволяет определить ра
боту газа в виде площади под кри
вой процесса, вследствие чего д и а
грамму р — V часто называют ра
бочей.
Из диаграммы видно, что вели
чина работы / не определяется
лишь начальным и конечным со
стоянием газа, а зависит такж е от
характера процесса.
Действительно, для изображен
ных на рис. 2.3 различных по ха
рактеру процессов I— III с общими
точками а и Ь площади под кри
выми процессов различны, а следо
вательно, различны и значения полученной работы. Таким об
разом, работа — не функция состояния газа, а функция про
цесса. Работа есть результат изменения объема, поэтому не мо
ж ет быть речи о работе в данном состоянии тела, т. е. при не
изменном объеме. Поскольку работа / — не функция состояния
тела, то <И— неполный дифференциал. Поэтому для конечного
процесса работа равна /, а не /а— /ь что не имело бы смысла,
т. е.
^/==/.
Количество теплоты
сообщаемой телу, также зависит от
харак тера процесса, т. е . не только от начального и конечного
состояний тела, но и от условий перехода тела из одного состоя
ния в другое, иначе говоря, является функцией термодинами
ческого процесса.
Поскольку в уравнении ёд^=ёи+ё1 ё и — полный дифферен
циал, а ё \ — неполный, то и ёд, являющийся их суммой, — не-
2
полный дифференциал. Поэтому { ё д —д, и для конечного про-
иы работы от характера про-
'
цесса.
28
цесса теплота равна
а не Яг—Яь так как эта разность не
имеет смысла. Следовательно, выражения ё 1 и с1я следует по
нимать лишь как элементарные значения работы и теплоты. Т ак
как теплота преобразуется в работу в результате расширения
рабочего тела, то в качестве последнего целесообразно выби
рать тело, способное значительно увеличивать своА объем. Этим
свойством обладаю т газы и пары различных жидкостей. П о
этому рабочими телами в тепловых двигателях являются газы,
а именно: газообразные продукты сгорания того или иного
топлива (в двигателях внутреннего сгорания), пары воды или
других жидкостей (в паровых машинах).
Уравнение первого закона термодинамики в расчетном виде
можно получить, интегрируя все члены уравнения (2.2) в пре
дел ах изменения состояния газа в рассматриваемом процессе
1— 2:
/¿<7—I(1и+ ¡М.
В соответствии с изложенным получим
—
«1+/,
ИЛИ
?-Ди+/.
(2.7)
Глава 3
ТЕПЛОЕМКОСТЬ.
ЭНТАЛЬПИЯ И ЭНТРОПИЯ
| 3.1 . ТЕПЛОЕМКОСТЬ МАССОВАЯ,
ОБЪЕМНАЯ. МОЛЬНАЯ
Теплоемкость тела необходимо знать для вычисления коли
чества теплоты, участвующей в термодинамическом процессе,
изучение теплоемкости играет большую роль при построении
теории термодинамики. Так, например, экспериментальные ис
следования теплоемкости позволяют составлять уравнения со
стояния реальных газов, необходимые для вычисления их п а
раметров.
Рассмотрим общие понятия, относящиеся к теплоемкости, и
способы ее определения.
Теплоемкостью тела называют количество теплоты, ко
торое нужно сообщить телу любой массы, чтобы его темпера
тура в данном процессе изменилась на 1 К. В зависимости от
того, в каки х единицах измерено количество вещества, разли
чают теплоемкость удельную (массовую), объемную и моль
ную (молярную).
29
Удельная, или массовая, теплоемкость определяется от
ношением теплоемкости рабочего тела к его массе. Она изме
ряется в килоджоулях на килограмм-кельвин (кД ж/(кг-К)
и обозначается обычно буквой с.
Объемная теплоемкость cf относится к объему тела при
вполне определенных условиях, так как в 1 м* при различных
условиях может содержаться различное количество вещества.
Обычно cf относят к единице объема тела при нормальных у с
ловиях (/вTM0еС и рк= 760 мм рт. ст.= 1,013 бар= 101,3 кПа),
единица измерения с' — кДж/(м*в • К).
Мольная (или молярная) теплоемкость измеряется коли
чеством теплоты, необходимой для изменения _ температуры
I кмоля тела на 1 К, обозначается через \лс или с (измеряется
в кДж/(кмоль*К)).
Зависимость между массовой, объемной н мольной теплоем
костями устанавливается следующими очевидными формулами:
с —де/ц, с7—iic/22,4—рс, \лс—с'22А.
(3.1)
Дал ее в основном будет использоваться понятие массовой
теплоемкости, которую будем называть просто теплоемкостью.
Зависимость теплоемкости от температуры. Средняя и истин
ная теплоемкости. Рассмотрим процесс, в котором единице
массы сообщается теплота q. Отношение количества теплоты
к соответствующему изменению температуры тела и является
его теплоемкостью:
е—jfbrx-
(3-2)
Экспериментально установлено, что теплоемкость тела з а
висит от его температуры. Если температура тела в данном
процессе меняется, теплоемкость на разных участках процесса
неодинакова.
Из формулы (3.2) можно определить лишь то количество
теплоты, которое в среднем сообщается при нагревании тела
на 1 К, и теплоемкость, вычисляемая по этой формуле, назы
вается средней. Таким образом, средней
теплоем
костью называется отношение количества теплоты, сообщае
мой телу, к конечному изменению температуры тела в данном
процессе.
Если рассматривать малый участок процесса, в котором тем
пература изменяется на Д Г < (Г а — Г]), и взять предел отно
шения A<//A7\ т. е. уменьшить рассматриваемый интервал тем
ператур до бесконечно малой величины, то величину такого
предела можно назвать истииной теплоемкостью при
данной температуре. Следовательно, если в некотором процессе
AB средняя теплоемкость С л-вз а Д^/Д7'» то истинная теплоем
кость в состоянии А будет
с-lim (Дд/ДГ) или c —dq/dT.
(3.3)
аг- о
30
Таким образом, истинной называется теплоемкость, со
ответствующая бесконечно малому изменению температуры тела,
в пределе — теплоемкость тела при данной температуре.
Обычно истинную теплоемкость обозначают буквой с без
каких-либо значков, а среднюю — ст или [с]£.
Из формул (3.2) н (3.3) следует, что
«-МЙЪ-Г .). dq.cdr,
(3.4)
Л
или
<7—
(
3
.
5
)
Как правило, теплоемкость возрастает с повышением тем
пературы, причем эта зависимость изображается кривой, имею
щей различный характер для различных веществ.
Пусть кривая 1 —2 (рис. & .1) отражает зависимость истин
ной теплоемкости от температуры: с = / (Г ) . Истинная теплоем
кость тела при данной температуре измеряется ординатой л ю
бой точки на кривой 1 — 2 . Количество теплоты <7, необходимое
для повышения температуры тела от 7*1 до Г 2, определяется по
уравнению (3.5) н, как видно, измеряется площадью е 12 \ под
кривой 1 —2 .
Эту же теплоту можно подсчитать по формуле (3.4): <7 —
жяст(Г2— 7*1), отсюда
Ст—я!(7*1—Г1)=пл . е12(1е{.
При замене криволинейной трапеции е 1 2 ( равновеликим ей
прямоугольником етп[ имеем ст =»пл. етл//е/—л/.
Следовательно, средняя теплоемкость для интервала темпе
ратур от Т\ до Гг может быть измерена высотой прямоугольни
ка, равновеликого площади под кривой, СшЧ(Т).
Способы определения истинной и средней теплоемкости.
Уравнение кривой 1 —2 (см. рис. 3 .1) может быть записано
в следующем виде:
с-а+ЬГ-И *Р.
(3.6)
Это уравнение может быть использовано в качестве расчет
ного, если известны коэффициенты а, Ь н й, зависящие от при
роды газа. Численные значения а, Ь и й для наиболее часто ис
пользуемых рабочих тел приводятся в справочной литературе.
Для двухатомных газов при температуре не выше 1 0 0 0 К
зависимость теплоемкости от температуры с достаточной точ
ностью можно полагать линейной (рис. 3 .2). В этом случае урав
нение для истинной теплоемкости будет иметь вид
с-а+6Г,
(3.7)
соответственно для средней теплоемкости:
ст -а+6(Г, + 72)/2.
(3.8)
31
Как видно, эта формула отличается от формулы для истин
ной теплоемкости только тем, что в нее нужно вместо данной
температуры подставить среднюю арифметическую температуру
процесса.
Более удобным и точным является использование подробных
таблиц теплоемкостей, приводимых в учебной и справочной ли
тературе. Однако в таблицах приводятся лишь значения истин
ных теплоемкостей, а также средних теплоемкостей для ннтер-
Ряс. 3 . 1 . Зависимость теплоемкости
Рис. 3 .2 . К выводу формулы средней
от температуры.
теплоемкости для заданного интер
вала температур.
валов температур от нуля до данной температуры — [с]£. При
чина этого очевидна: чтобы привести в таблице значения [с]**
для всех интервалов температур, размеры ее должны были бы
быть бесконечно большими. Но для вычисления количества теп
лоты, участвующей в процессе изменения температуры от Г] до
Г2. по формуле (3.4), нужна именно средняя теплоемкость (с]^'.
Формулу для вычисления ее по данным таблиц легко получить
из следующих соображений. Теплота, сообщаемая телу в про
цессе изменения температуры от Т\ до 7**, равная д —[ с]£(Т а—
— Т\), измеряется площадью e í 2 f (см. рис. 3 .2)
пл. el2f. Но
эта площадь может быть определена как разность площадей
od!2f и odie: <7=пл. е/2/«пл. odl2f — пл. odie. Площадью
o d l2f измеряется количество теплоты, сообщаемой телу в про
цессе изменения температуры от 0 до Тъ оно может быть вы
числено по формуле ? (о-г,) —W J’fT j—0). Аналогично площадь
o d íe равна теплоте ^<o-rj. определимой по формуле g<o-i,)—
—
[e]p(Tt — 0). Следовательно,
Жт.-тЛ= \с]%(Г,-Г ,) -[с]l‘T,-
letf Г,.
32
Отсюда среднюю для данного интервала температур тепло
емкость можно определить из выражения
И £ - (Ио’Ъ - ИвГ‘Т.)/(Г, - г,).
(3.9)
где [<.]£’ и (с)0г‘ — табличные данные.
§ 3.2. ЗАВИСИМОСТЬ ТЕПЛОЕМКОСТИ
ОТ ПРОЦЕССА
Каждый отдельный термодинамический процесс осуществля
ется при определенных физических условиях. В связи с этим ко
личество теплоты, сообщаемой телу, зависит от особенностей
процесса. Так, например, при одинаковом изменении темпера
туры в процессе, осуществляемом при постоянном давлении,
расходуется теплоты больше, чем в процессе с постоянным объ
емом. Это объясняется тем, что при постоянном объеме теплота,
сообщаемая телу, расходуется лишь на изменение его внутрен
ней энергии, тогда как при постоянном давлении теплота р асхо
дуется не только на увеличение внутренней энергии, но н на со
вершение работы расширения. При этих условиях будут зави
сеть от особенностей процесса и теплоемкости тела (как удель
ные расходы теплоты).
В термодинамике имеют важное значение теплоемкости именно
этих двух процессов, — при постоянном объеме (с„) и при
постоянном давлении (сР). Теплоемкость ср называют и з о бар
ной, а
— нзохорной.
Зависимость между теплоемкостями ср и с„. Изохорная теп
лоемкость можетбытьнайдена из формулы
Из
уравнения первогозакона термодинамики ¿<7 —d u + pdv , но так
как при ц-сопя^ рс1и= 0, то dq9=du и
ёи/с1Т. Отсюда сле
дует, что
сЫ~СрйТ%
(3.10)
или после интегрирования
—
И|“ С „(Г2 — Тх).
(3.10а)
В выражении (3.10 а) с„ — средняя теплоемкость; индекс
« т » здесь и далее опущен для простоты написания. Следует ус
воить, что во всех формулах, описывающих процессы с конеч
ным изменением температуры, например <7= с „ (Т а — Т\), участ
вует средняя теплоемкость, а в выражениях вида с1д=сс1Т —
истинная.
Так как изменение внутренней энергии идеального газа зави
сит не от характера процесса, а лишь от изменения температу
ры, то выведенная формула будет общей для определения изме
нения внутренней энергии во всех термодинамических процессах,
в которых температура идеального газа изменяется от Т\ до Т2.
3 Зам. «о
33
Следовательно, изменение внутренней энергии идеального газа
во всех термодинамических процессах равно произведению теп
лоемкости газа, определяемой для процесса при постоянном
объеме, на разность температур в конце и начале данного тер
модинамического процесса.
Д ля расчета изобарной темплоемкости ср необходимо ис
пользовать равнение cp= d q p/dTt причем учитывать, что dqP=
= >du+pdv. Подставив это значение dqp в уравнение сР, полу
чим
ср—(du+ pdv) ¡dT—du/dT+ pdvJdT= c p-f pdv/dT.
Обозначая pdv/dT—h, имеем:
(3.11)
Величина работы h для идеального газа может быть вычис
лена следующим образом.
Из уравнения состояния идеального газа при р —const pdv —
= R dT. Подставив это значение pdv в формулу для h, получим
h—RdT/dT, h —R , т. е., как было сказано в гл. 1, величина /?—
удельная работа газа, отнесенная к изменению его температуры
при постоянном давлении.
Следовательно, изобарная и нзохорная темплоемкости иде
ального газа связаны соотношением
cp —c9-\-Rt
(3.12)
которое известно как формула Майера.
Физический смысл того обстоятельства, что всегда cp> c v%
был у ж е пояснен выше рассмотрением особенностей процессов
постоянного давления и постоянного объема, он очевиден и из
сравнения уравнений первого закона для двух процессов: при
v=const dq9= c 9dT, при />**const dqp=Ct4T+pdv.
Зависимость (3.12 ) справедлива как для истинных, так и
для средних теплоемкостей.
Формула Майера неточна для реальных газов, для них
cp— c9> R . Это соотношение обусловливается тем, что при рас
ширении реальных газов (при постоянном давлении) соверша
ется не только внешняя, но и внутренняя работа против сил вз а
имодействия молекул.
§ 3.3. ЭНТАЛЬПИЯ
Ранее были рассмотрены четыре параметра состояния рабо
чего тела: р, V, Т н внутренняя энергия тела и.
Д ля исследования термодинамических процессов и циклов,
построения необходимых расчетных формул целесообразно в ве
сти новую величину, характеризующую состояние тел,— энталь
пию. Этот параметр может быть введен на основе следующих
соображений.
34
В уравнении первого закона термодинамики dq = d u + pdv
произведение pdv можно представить как разность д вух вели
чин pdv-d(pv)—vdp. Тогда dq~du + d(pv)—vdp, или йщ*-
= d (u + p v) —vdp. Заключенную в скобки сумму обозначают бук
вой i и называют энтальпией
М+/70 —/.
(3.13)
(Термин энтальпия, от греческого слова «энтальпос»— на
греваться, введен в 1909 г. Каммерлннг-Оннесом.)
Тогда уравнение первого закона можно записать в следую
щем виде:
dq—di— vdp.
(3.14)
Как видно из уравнения (3.14), величина I определяется
только параметрами состояния — внутренней энергией тела,
удельным давлением и объемом н, следовательно, сама является
функцией состояния рабочего тела.
Подобно внутренней энергии, энтальпия может быть пред
ставлена функцией д вух любых параметров состояния.
Поскольку энтальпия является функцией состояния, ее диф
ференциал di является полным дифференциалом, интеграл ко
торого равен конечной разности значений энтальпии в данном
процессе:
^л-ь
—
м.
Здесь ¿ — удельная энтальпия (на единицу массы вещ ества).
Энтальпия тела любой массы М
1-1М = и+рУ.
Энтальпия измеряется в тех ж е единицах, что и теплота, работа,
внутренняя энергия.
Физическому содержанию этой функции состояния могут быть
даны следующие истолкования. В выражении i —u + p v второе
слагаемое представляет собой работу, которую необходимо зат
ратить, чтобы ввести рассматриваемое тело с объемом V в ок
ружающую среду, имеющую давление р и находящуюся с те
лом в равновесном состоянии. Эта работа, отдаваемая среде,
называется потенциальной энергией давления. Следовательно,
энтальпия является суммой внутренней энергии тела и потен
циальной энергии давления среды.
Иное истолкование энтальпии можно дать, анализируя ур ав
нение первого закона термодинамики (3.14), полученное для
случая, когда единственным видом работы является работа из
менения объем а.
Для процесса с постоянным давлением vdp= 0 и dqv =di,т .e .
теплота, подводимая к системе в изобарном процессе, расходу
ется только на изменение энтальпии системы.
3*
31
Интегрируя это уравнение, получим для некоторого изобар
ного процесса / — 2
Я\~2 —¿2 — И.
(3.15)
Для идеального газа 12— 1\ = ср(Т2 — Г ,) . Рассматривая процесс
нагревания от 0°С до Гг®*7 и полагая ц —О (начало отсчета
функции СОСТОЯНИЯ произвольно) И 1*2 = / , получим
«■-Мог^
(3.16)
Следовательно, энтальпия идеального газа численно равна ко
личеству теплоты, которую необходимо подвести к одному ки
лограмму газа, чтобы перевести его при постоянном давлении
из начального состояния, характеризуемого, например, темпера
турой 0 °С , в данное состояние, характеризуемое температу
рой Г.
Введение энтальпии значительно упрощает расчеты многих
термодинамических процессов, вид и структуру ряда формул и
позволяет ввести графический метод исследования процессов
<как это будет показано далее).
$ 3.4. ЭНТРОПИЯ. ТЕПЛОВАЯ ДИАГРАММА
Существование этого параметра может быть доказано сле
дующим образом. В уравнении (1д = с1и + рс1и с1и ^скс1Т и для
идеального газа р = /?7 / п . Следовательно, <1д=*сь(Н+(11Т/и)<1и.
Легко убедиться, что при умножении этого выражения на
1 / 7 оно интегрируется, т. е. йд/Т есть полный дифференциал:
dq|T- (с^Т)йТ+ (/?/©)*>.
Для того чтобы правая часть этого уравнения была выраже
нием полного дифференциала, согласно соотношению взаимно
сти, производная
долж на быть равна производной
-дуГ— )
.
Они, действительно, равны, так как вследствие незави
симости теплоемкости
идеального газа от объема и производ
ная
обращается в нуль; равна нулю и производная по
стоянной Я, т. е.
Д (с./Г)т=^ <ЛЛ»).-0.
Следовательно, йд/Т является полным дифференциалом,
а 1 / 7 — интегрирующим множителем; умножив на эту величину
неполный дифференциал йд, мы получим полный дифференциал.
за
Из этого следует, что величина йд/Т не зависит от характера
процесса и представляет собой полный дифференциал ¿ 5 неко
торой однозначной функции состояния 5, называемой э н т р о
пией:
(3.17)
(Термин «энтропия» от греческого слова «энтропос» — пре вр а
щение, изменение введен Р. Клаузиусом в 1865 г.) .
Проинтегрировав обе части равенства (3.17) по любому пути
перехода из состояния 1 в состояние 2, получим
| ёд/Т«
—
з,-Л5.
(3.18)
Удельное изменение энтропии измеряется в к Д ж /(кг *К ).
Для М кг рабочего тела (кДж/К)
|ё<}/Т- ¿2—5! =Л5.
(3.18а)
Из сказанного следует, что энтрдпня есть функция любой
пары параметров, т. е. 5«Л(Г, V); з=Ь(р, Т); 5 = Ы(р, V).
В соответствии с формулой (3.17) знак изменения энтропии
связан лишь со знаком с1д, так как Т — величина положитель
ная. Д л я процессов, в которых теплота подводится, </<7>0 и
¿5>0; для процессов, идущих с отводом теплоты, ёд<0 и ¿ 5 < 0.
Вычисление изменения энтропии. Д л я термических расчетов
обычно представляет интерес не абсолютное значение энтропии
тела в каком-либо состоянии, а ее изменение, причем за начало
отсчета может быть принято любое значение, например 5 = 0
при 1 = 0 °С . Расчетную формулу для вычисления изменения эн
тропии в случае представления ее как функции 5 —}Х(Т, о) мож
но получить интегрированием уравнения (3 .17 ), в соответствии
с которым
Д-(с^Г)<*Г+(*/(’)<*'’•
2
2
2
или
| ск | <ЩТ+/? | йи/и.
Интегрируя, получим
52_ 5 ,вСг1п (Т2/Т1) +/? 1п (02М ).
(3.19)
При задании состояния тела другой парой параметров, на
пример Т и р, р и V, уравнения для расчета изменения энтропии
можно получить из предыдущего, используя уравнение состоя
ния идеального газа.
Например, при известных р и и
52 — 5,-с„1п (р2/Р1)+Ср\п (vг/v^).
(3.19а)
37
Введение энтропии в качестве параметра облегчает многие
термодинамические расчеты. Физический смысл его будет рас
смотрен позже на основе изучения общих свойств те рмодинами
ческих циклов.
Тепловая, или энтропийная, диаграмма (диаграмма Т—5).
Одно из важнейших направлений использования понятия об эн
тропии определяется тем, что, зная изменение энтропии, можно
подсчитать теплоту, участвующую в процессе. Так как (¡5 =
«=¿<7/Т, dq^~Tds и (7 — /77/$.
*
Этот расчет можно сделать особенно наглядным и простым,
прибегая к помощи энтропийной, или тепловой, диаграммы.
Изобразим графически для какого-нибудь процесса 1 —2 ход
изменения температуры Т в зависимости от изменения энтропии,
откладывая на ординате величины Т, а на абсциссе — соответ
ствующие значения энтропии 5, совершенно аналогично тому,
как мы это делали в рабочей диаграмме р—о. Так как каж
дом у состоянию тела соответ
ствуют определенные значения
Г и 5, в системе координат
Т — 5 отдельно взятое равно
весное состояние газа изобра
жается точкой, а равновесный
процесс — некоторой
линией.
На рис. 3 .3 нанесена кривая
Л —В обратимого процесса об
щего характера и стрелкой
указано его направление.
Если рассмотреть участок
процесса, на котором энтро
пия нзмспяется па бесконечно
малую величину <1$, заштрихо
ванная площадь равна
Так как ц= |77/5, то теплота, сообщаемая телу или отнимае
мая от него, изображается в координатах Г —5 площадью АВйС,
ограниченной линией процесса А — В , ординатами крайних точек
АС и Вй и осью абсцисс. Таким образом, на диаграмме Т—5
площадь под кривой процесса определяет количество теплоты
<7, полученное или отданное газом, вследствие чего диаграмма и
называется тепловой. Из диаграммы видно, что изменение энтро
пии к ак функции состояния вполне определяется начальным и ко
нечным состоянием тела, т. е. точками А и В; количество же
теплоты <7, сообщаемое телу, зависит от характера процесса,
т. е. от вида кривой А—В . Диаграмма наглядно иллюстрирует
приведенный анализ уравнения (3.17), из которого следует, что
при ds>0 <1д> 0 и при ds<0 dq<0, т. е. уменьшение энтропии
38
свидетельствует об отводе теплоты, увеличение — о подводе теп
лоты в термодинамическом процессе. Таким образом, если рас
четным путем для какого-либо процесса определено изменение
энтропии, то по его знаку можно судить о направлении пере
хода теплоты м еж ду внешней средой и рабочим телом. С по
мощью диаграммы / — 5 можно графически определять истин
ную массовую теплоемкость рабочего тела. Нанесем в диаграм
ме Т—з линию какого-либо процесса I —2 (рис. 3 .4). Проведем
к точке М на кривой процесса касательную до пересечения
с осью абсцисс в точке А.
Рассмотрим элементарный участок процесса МЫ, для кото
рого изменение энтропии составляет ¿5 , а изменение темпера-
Рис. 3 .4 . Графическое определение истинной теплоемкости (а) и
пределы изменении значений теплоемкости (б).
туры dT. Отложив ds и dT от точки М и полагая отрезок кри
вой МЫ совпадающим с касательной и прямолинейным (вслед
ствие его малости ), получим элементарный треугольник МЫК,
подобный треугольнику АМВ. Из подобия треугольников сле-
дет, что АВ/МВ-МК/ЫК или AB/T-ds/dT, AB~Tds/dT=*
= d q /d T = c . Следовательно, истинная теплоемкость газа в со
стоянии, характеризуемом точкой М, представляется отрезком
под касательной А В на оси абсцисс. С изменением кривизны ли
нии процесса длина этого отрезка будет изменяться. Этим на
глядно иллюстрируется тот факт, что теплоемкость одного и
того же газа в различных процессах различна. Различна истин
ная теплоемкость и для каждой точки данного процесса, ибо
она зависит от температуры. С помощью графика (рис. 3 .4, б)
легко определить, в каких пределах может изменяться тепло
емкость. Отрезок под касательной к процессу, изображенному
вертикально (s**const), очевидно, обращается в нуль. Для лю
бой точки этого процесса с —0. Отрезок под касательной к го
ризонтали ( Г = const) равен бесконечности, с = о о . Следова-
39
тельно, теплоемкость численно может изменяться в пределах от
нуля до бесконечности. Проводя через точку М как угодно
направленные процессы, увидим, что отрезки под касательной
могут располагаться и справа и слева от нулевого значения с,
т. е. теплоемкость может быть и положительной и отрицатель
ной. Линии
const и s = const, проведенные через точку М, де
лят всю координатную плоскость на четыре квадранта.
Из диаграммы видно, что изменению состояния газа из точки
М по любой кривой, проходящей через квадранты / и ///, со
ответствует положительная теплоемкость. Действительно, так
как c^dq/dT, для любого процесса, выходящего из точки М и
проходящего через квадранты / и III, как бы он ни был направ
лен, знак dq всегда одинаков со знаком dT, т. е. всегда с > 0.
В этих процессах при сообщении газу теплоты его температура
возрастает. Д ля понижения температуры необходимо от газа
отводить теплоту.
Изменению состояния газа из точки М по любой кривой
в квадрантах II и IV соответствует теплоемкость с < 0 , так как
dq и dT имеют обратные знаки. Здесь, несмотря на подведение
теплоты к газу, температура его падает; повышение темпера
туры имеет место при отводе теплоты от газа.
Поясним физическую сущность понятия об отрицательной
теплоемкости. Обратимся к уравнению первого закона термоди
намики q = A u + l . Термодинамический процесс может проходить
таким образом, что работа, совершаемая в нем, будет больше
подведенной теплоты. Это возможно вследствие расходования
на совершение работы части запаса внутренней энергии тела.
Если, например, при подводе теплоты в количестве 5 кД ж /к г
совершается работа расширения, эквивалентная 10 к Д ж/кг, из
менение внутренней энергии те ла в этом процессе составит
— 5 кДж/кг. Следовательно, в таком процессе температура тела
будет уменьшаться, так как &u = cv(T2—T\).
Таким образом, в данном процессе положительному значе
нию dq будет соответствовать отрицательное значение dT и
c=dq/dT<0.
Понятие отрицательной теплоемкости существенно лишь для
газов и паров, так как они обладают неограниченной способ
ностью расширяться. Д ля твердых и жидких тел значение
pdv о балансе, описываемом уравнением dq~du-\ -pdv, не
велика, и понятие об отрицательной теплоемкости обычно не
вводится.
Следовательно, тепловая диаграмма Т—s, кроме изменения
температуры и энтропии в процессе, отчетливо устанавливает,
сообщается теплота или отводится и в каком количестве,
а такж е позволяет определить для любого состояния истинную
теплоемкость тела с. Эти свойства диаграммы Т—s делают ее
весьма ценной для термодинамических исследований и объяс
няют широкое применение ее наряду с рабочей диаграммой.
40
Глава 4
ПРОЦЕССЫ ИЗМЕНЕНИЯ
СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
| 4.1 . ЗАДАЧИ И ПОСЛЕДОВАТЕЛЬНОСТЬ
ИЗУЧЕНИЯ ПРОЦЕССОВ
Из рассмотрения первого закона термодинамики следует,
что внутренняя энергия газа может проявить себя в виде теп
лоты dq (при тепловом взаимодействии газа с окружающей сре
дой) и в виде внешней работы еИ— при механическом взаимо
действии, т. е.
Последние две величины (¿4 и <И)
являются функциями процесса, следовательно, для вычисления
их необходимо знать не только то, как изменялись параметры
состояния газа, но и по какому пути он протекал.
Исследованию обратимых термодинамических процессов р аз
личного характера и посвящена эта глава.
Как уж е указывалось, это исследование будет относиться
к обратимым процессам идеальных газов.
В самом общем случае изменения состояния теплота сооб
щается газу или отводится от него, и одновременно изменяются
его давление, объем и температура.
Целесообразно, однако, вначале рассмотреть не общий про
цесс произвольного характера, а ряд частных, играющих боль
шую роль в теплотехнике. Это удобио и в методическом отно
шении, поскольку рассмотрение частных процессов облегчает
получение и понимание расчетных зависимостей для термоди
намического процесса общего характера. Поэтому рассмотрим
последовательно следующие термодинамические процессы:
1) изохорный, т. е. процесс при постоянном объеме;
2) изобарный, т. е. процесс при постоянном давлении;
3) изотермический, т. е. процесс прн постоянной темпера
туре;
4) адиабатный, т. е. процесс при отсутствии теплообмена
рабочего тела с окружающей средой;
5) политропный, т. е . термодинамический процесс общего
характера, для которого предыдущие четыре процесса являются
частными случаями.
Примем следующий порядок изучения каждого из процессов:
1) на основании рассмотрения условий, при которых осуще
ствляется процесс, выводится уравнение процесса;
2) выводятся формулы зависимостей между параметрами
вида: р=/|(У); Г-/,(Ч); Г=/»0);
3) определяется изменение внутренней энергии идеального
газа по общей для всех процессов формуле ё и ^ с ^ Т ;
4) определяется внешняя работа газа из уравнения <И=рёи;
5) определяется теплоемкость процесса;
41
6) определяется теплота, сообщаемая или отнимаемая в про
цессе от газа;
7) определяется величина изменения энтропии в процессе;
8) исследуется метод построения кривой процесса в коорди
натах Г— s и р— v на основании полученных расчетных формул.
f 4.2. ИЗОХОРНЫЛ ПРОЦЕСС
1. Примером нзохорного процесса может служить нагрева
ние или охлаждение газа в закрытом сосуде. Уравнением про
цесса будет о -con st, отражающее одновременно и условия, при
которых он осуществляется.
2. Д ля вывода формулы соотношения параметров газа в рас
сматриваемом процессе напишем уравнения состояния, отнесен
ные к крайним точкам процесса: p xv=*RT\ и p2v = R T 2. Из этих
уравнений имеем Р2/Р1 —Г2/Г 1.
Таким образом, в нзохорных процессах давление газа изме
няется пропорционально абсолютной температуре.
3. Изменение внутренней энергии га за в нзохорных процес
сах как величина, не зависящая от особенностей процессов, оп
ределяется из формулы dw-CvdT. Отсюда для 1 кг газа
Дм-Ц2—
—
^i);
для М кг газа
Д£/=-Мсв(Г2— Г ,) .
4. В процессах с постоянным объемом внешняя работа не
совершается: <*/—рйр, но
0,значит¿/=*0и/=0.
5. Массовая теплоемкость процесса с„(кД ж/(кг*К)).
6. Так как внешняя работа нзохорного процесса равна нулю,
основное уравнение первого закона термодинамики примет вид:
¿7—Дц— м2— Ц|или ^— с„(Г
2— ГО.
(4.1)
Эта формула свидетельствует о том, что в нзохорных процес
сах теплота, сообщаемая газу, идет на увеличение его внутрен
ней энергии.
7. Изменение энтропии в нзохорном процессе вычисляется
путем подстановки в общее уравнение (& = ^ < 7/Г значения </<7 =
ш*СуДТ и интегрирования полученного выражения
Д5-5а —5 , - ^С,4Г/Г-Ср^Г/Г-Со1п (Т2/Тх).
(4.2)
или для М кг газа
Д5=Л!со 1п (Га/ГО-
8. Рассмотрим процесс изменения состояния 1 кг газа, заклю
ченного в цилиндре поршневой машины, поршень которой з а
креплен неподвижно (рис. 4.1). Очевидно, что в системе коор-
42
динат р—v график уравнения u —const (изохора) будет изобра
жаться вертикалью. При подводе теплоты к газу начального со
стояния / изменение его состояния изображается линией 1 —2
(давление растет).
Пзохора в диаграме Т—5 в соответствии с уравнением (4.2)
изображается логарифмической кривой, отббражающей одно
временное увеличение энтропии (так как теплота подводится)
и температуры газа. Площадь под изохорой в тепловой диаг
рамме соответствует теплоте процесса (в данном случае д > 0 ) .
§ 4.3 . ИЗОБАРНЫЙ ПРОЦЕСС
1. Уравнение процесса р = const. Осуществить изобарный про
цесс можно при условии, если подвод теплоты к газу сопровож
дается его расширением, либо отвод теплоты — сжатием.
2. Формула соотношения между параметрами устанавлива
ется законом Гей-Люссака. При p=const, о /Г—const, т. е.
vx/v2= T x/T2.
.
Следовательно, в изобарных процессах объем газа изменя
ется пропорционално абсолютной тем пе ратуре .
3. Изменение внутренней энергии подсчитывается по форму
лам:
A«e Co(72— Тх)
и
&U~Mcv(T2— Г|).
4. Ф ормула внешней работы в изобарном процессе получа
ется в результате интегрирования общего выражения работы
расширения при р —const
/-p/d»=p(t>j —oi)
(4.3)
или, так как pvx=RTxиpv2=RT2t
l=R(T2— Tx).
(4.4)
Допуская, что в изобарном процессе 1 кг газа нагревается
на 1К , найдем: /?= /. Эта формула свидетельствует о том, что
43
газовая постоянная есть работа, производимая в изобарном про
цессе 1 кг газа при его нагревании на 1К .
Для работы М кг газа в изобарном процессе получим фор
мулы:
L-piVi-Vy) и L—Af/?(72— Т\).
5. Массовая теплоемкость процесса ср(кД ж/(кг-К)).
6. Теплота, сообщаемая газу в изобарном процессе, опреде
ляется по формуле
<7-МГ2-7\),
(4.5)
получаемой из соотношений:
9-Д« + /-с ,(Г3—7,) +Я(72—Г,) -
—(г«>+/?) (72 — 7j) —ср(72— 7|).
Можно получить расчетную ф ормулу для теплоты изобар
ного процесса и в ином виде, представляющем в ряде случаев
Р и с 4.2. Изобарный процесс.
значительные удобства. Так как / —р(оа—и\).
«1+
+р(и2—0|). Иначе, д=*(иг+ри2)—(и\+ри1). А так как м+ру**
= 1,то
^“ 1*2—И.
(4.6)
Формула (4.6) показывает, что теплота, сообщаемая газу
в изобарном процессе, идет на увеличение его энтальпии.
Для М кг газа имеем: <?—Л1 ср(Т2— Т\) и <2—А4(72— *|).
7. Изменение энтропии 1 кг газа в изобарном процессе
А5 - ; ^ р/ 7 - ;ср</7/7=Ср[^7/7 = Ср 1п (72/7,) . (4.7)
^
г1
Изменение энтропии М кг газа Д 5~М ср1п(Т2/7|).
8. Графики процесса в диаграммах рабочей и тепловой пред
ставлены на рис. 4 .2 . В диаграмме р — и процесс р — сопз! изоб
ражается, как видно, горизонтальной прямой. В случае подвода
теплоты газ расширяется (процесс 1 —2), площадью под изо
барой в диаграмме р— и измеряется работа расширения.
Изобара в диаграмме Г—s в со
ответствии с уравнением (4.7) изоб
ражается логарифмической кривой.
При подводе теплоты энтропия газа
и его температура растут. Пло
щадью под изобарой измеряется
подведенная теплота.
Следовательно, изохора и изо
бара изображаются в тепловой диа
грамме логарифмическими кривы
ми, притом одинаково направлен
ными: знаки изменения энтропии и
температуры газа в этих процессах
всегда одинаковы.
Для того чтобы иметь возмож
ность различать графические изоб
ражения этих двух процессов в диа
грамме Т—5, необходимо установить, как располагаются в ней
относительно друг друга изохора и изобара.
Это устанавливается наиболее просто из рассмотрения уже
знакомого нам свойства диаграммы Т— s, согласно которому
истинная теплоемкость любой точки любого процесса измеря
ется отрезком под касательной к данной точке на оси абсцисс.
Проведя через заданную точку 1 (рис. 4 .3) две кривые раз
личной крутизны (соответствующие одновременному росту тем
пературы и энтропии), видим, что лишь кривая большей кру
тизны может быть изохорой, так как cv< c p, а меньший отрезок
подкасательной в общей точке 1 получается именно для более
крутой кривой. Следовательно, в диаграмме Г—s изохора всегда
круче изобары.
« 4.4. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
1. Уравнение процесса, выражающее закон Бойля — Мари-
отта, имеет вид ри = const при Т— const. Д л я идеального газа
изотермическим может быть лишь такой процесс, в котором вся
теплота, сообщаемая газу, идет на осуществление внешней ра
боты.
2. Соотношение между параметрами следующее: так как
p1t;i=p 2V2a!SConst при Г —const
Pl/Pi=Vi/Vi.
3. Изменения внутренней энергии в изотермическом процессе
идеального газа нс происходит, поскольку внутренняя энергия
идеального газа является функцией лишь температуры. Поэтому
в данном процессе du*=*cvdT*=0, и2^ и и w = c o n st. Очевидно, что
в изотермическом процессе не происходит изменения и энтал ь
пии идеального газа. Действительно, при d T = 0, dl=Cj>dT=0 ,
откуда ¿=const.
Рис. 4 .3. Взаиморасположение
изохоры и изобары в тепловой
диаграмме.
45
4. Расчетные формулы для работы изотермического процесса
могут быть получены из общеА формулы внешней работы
l*=¡pdu. Подставив вместо p=*RT/v, получим для 1 кг газа
/- } (RTIv)dv-RT¡dvlv-RT\n (vjvx\ ,
(4.8)
1
г,
или, так как t>a/0i=Pi/P2.
/-/?Г In (pi/p2).
(4.9)
Поскольку RT~*P\V\ = P2V2, то
/-Plül In (Р1/Р2) -Pl0i In (O2IV1) “ PjUj In (P1/P2) -
-
P 2O2 I11 (vjvt).
(4.10)
Работа Af кг газа в изотермическом процессе может быть
подсчитана по формулам:
L-piVjIn(v2М)-PiViIn(P1/P2)-P2V2In(02/01)-
— P2 V2 In (pi/p2)>
(4.11)
так как vM—V или
L —AÍ/гГ In (02/0 1) —MRT In (P1/P2).
5. Теплоемкость изотермического процесса равна бесконеч
ности. При dT—0, c =dq/dT—± 00.
6. Теплота, сообщаемая газу в этом процессе, может быть
найдена по общему уравнению первого закона термодинамики,
которое для изотермического процесса (Ли—>0) примет вид
Р-/ .
?-Pi»i In (г*/о,) -ЯГ In (Pi/P,).
Q-p .y , In(va/cr,) -МЯГ In(p,/pa).
(4U'
7. Изменение энтропии одного килограмма газа в изотер
мическом процессе м ожет быть найдено путем интегрирования
общего выражения ds=dq/T. При 7= co n st
S2-s,-(l/r)jdp,
(4.13)
Л5-р/Г,
или, подставив значение q, получим
Лз-Л In (Р1/Р2)-Л In (02/01).
лз-м/г in(Р1/Р2)-м/гin(02/01).
(4.14)
Из формулы (4.13) следует, что теплота в изотермическом
процессе может быть определена из выражения ^ = Г (3 2 — Si).
8. Из уравнения процесса p0 **const следует, что изотермой
в диаграмме р — v будет равнобокая гипербола, для которой
46
Pi2\
Т
2L-* .
5
1
Рве. 4 .4 . Изотермический процесс.
координатные оси служ ат асимптотами (рис. 4 .4). Изотерма
в диаграмме Г — s изображается горизонтальной прямой ( Г *
«»const).
1. Адиабатный процесс, т. е. процесс без теплообмена меж ду
газом и окружающей средой (dq*= 0; 9 — 0 ), в идеальном слу
чае может быть осуществлен лишь в сосуде (например, в ци
линдре поршневой машины), абсолютно изолированном в теп
ловом отношении от окружающей среды.
В действительности ж е абсолютной тепловой изоляции не
существует, тем не менее изучение адиабатных процессов имеет
большое практическое значение, так как многие процессы р ас
ширения и сжатия осуществляются в технике за очень короткий
промежуток времени, теплообмен газа с окружающей средой
за это малое время пренебрежимо мал, н такие процессы можно
полагать адиабатными.
Уравнение адиабатного процесса может быть выведено из
уравнения первого закона термодинамики, которое для рассмат
риваемого процесса (¿ф=*0) принимает вид cJdT + pd v ^ 0, или
ж е из рассмотрения того обстоятельства, что адиабатный про
цесс является в то же время процессом изоэнтропнйным. В с а
мом деле, так как ds=dq/T и dq=0; ds—0; As—0; s2=S\;
s —const — в адиабатном процессе не происходит изменения эн
тропии.
Используя одно из ранее выведенных общих уравнений для
расчета изменения энтропии, запишем для адиабатного процесса'
coln(p2/Pi)+Cpln(i/2/ o i ) = 0 . Поделив последнее уравнение на
с0, получим \n(p2/Pi) + (cp/cv)ln{V i/vi)^ 0, или, обозначив
Cp/Co^k,
§ 4.5 . АДИАБАТНЫЙ ПРОЦЕСС
(4.15)
47
Это и есть уравнение адиабатного процесс^, уравнение ади
абаты в координатах р — и.
/
Величина к называется показателем адиабаты. Д ля идеаль
ного газа величина к всегда больше единицы, так как сР> с г.
Показатель адиабаты различен для разных газов, для од
ного и того же газа изменяется с изменением температуры.
Примерные значения показателя адиабаты для газов раз
личной атомности можно выяснить, использовав известные из
кинетической теории значения их молярных теплоемкостей, взя
тые без учета зависимости их от температуры.
2. Соотношения между параметрами в адиабатном
про
цессе:
а) Р=К у)- Из уравнения адиабаты р,и ,* ® р 21>2\ Следова
тельно,
¿>|/Р| = (0 1/02)*.
или
02/01 —(Р1/Р2) ,/Л-
(4.16)
б) Т = /(и ) . Характеристические уравнения для начального
и конечного состояний газа: р ,и ,~ Л гь /од~/?Т2. Разделив
первое на второе р|/р2— (Т\/Т2) (02/ 0 1) и учитывая, что
р,/Р2=(02/0|)\ получим (Г1/Г2)(02/01)= (02/01)*
или
7УГ2= (02/01)*"1
и
0 2 / 0 1 — (7'1/7'2) 1/<*-1).
(4.17)
в) Т={(р). Записав из предыдущего уравнения и2/0| =
~ (Р\/Рг)'/к* возведем его правую и левую части в степень к — 1 ,
получим (02/Н|)Л“ |= (Р1/Р2)1*“ 0 V Так как (02/ 0 1)*“ *
имеем
Г ,/Г а- (р./р2)<*-*>/*
и
р2/р, - (7У7- ,) */<*-*>.
(4.18)
Изменение внутренней энергии определяется по общей
для всех процессов формуле Дм—с„(7* — Т{) и Д1/=М сг(Г2—
—
Т\)-
4. Выражение для работы адиабатного процесса получим из
2
общей формулы внешней работы /■ » ^р^и.
Из уравнения (4.16), написанного для процесса, в котором
давление и удельный объем изменяются от ри до р ^ , имеем
О,
VI
/в р,0|* I йи/ок= р|П|* /
Г,
VI
Интегрируя и подставляя пределы интегрирования, получим
к
1~Т ~Гк (02,_*
—
или, изменив знаки числителя и знаменателя:
48
Теперь введем произведение р&\к в скобки; при этом, учитывая,
что piV\k= p 2V2k, будем умножать на первый член, стоящий
в скобках, произведение piV\h, а на второй — Р2^2к- Тогда по
лучим
\
1=
(ptVihVil-h — p2vihvi l-h) ,
или
/» -¿у (PitM—p2Vj).
(4.19)
Из формулы (4.19) могут быть получены следующие про
изводные формулы: так как piV\=RT\ и p2V2= RTb
.
(4 20).
или, вынеся в формуле (4.19) произведение p {v x за скобки
/=
I 1 — (Pi/Pi) («»a/wi)]
и подставляя вместо v2fv\ = (Р\/Р2) 1 к = (Р2/Р 1 ) “ 1 *» получим
l~NoV
- (P2/Pi)ik-"lk\-
(4-21)
Формула работы может быть получена также из уравнения
первого закона термодинамики, которое для адиабатного про
цесса принимает вид u2—Mi+/=0;
1=щ —и3=св(Т,— Т3).
Эта формула, которая может быть преобразована в фор
мулу (4.19), показывает, что внешняя работа газа в адиабат
ном процессе осуществляется вследствие уменьшения его внут
ренней энергии. Следовательно, в адиабатном процессе расши
рения наряду с получением работы достигается снижение тем
пературы газа, что используется в холодильной технике.
5. Теплоемкость газа в адиабатном процессе равна нулю.
Действительно, c =dq/dT=Q , так как dq=0 .
6. Теплообмен в адиабатном процессе отсутствует, dq— 0.
7. Изменения энтропии в адиабатном процессе нет, 5 »co n st.
8. Графики адиабатного процесса в координатах р — v и
Т — s можно получить, рассматривая процессы сжатия или рас
ширения газа, заключенного в цилиндре, идеально изолирован
ном от возможности теплообмена с окружающей средой (d<7 = 0).
Как видно (рис. 4 .5), адиабата в диаграмме Т — s изобра
жается вертикалью (s = const), а в диаграмме р—и — кривой,
являющейся неравнобокой гиперболой, не пересекающей коор
динатных осей. Последнее очевидно из уравнения (4.15). Пре
образовав это уравнение к виду (4.16), имеем: t/i= 0 при p i= o o
ир2=0прии2=оо.
Относительное расположение адиабаты и изотермы в диа
грамме можно установить, рассматривая совместно уравнения
4* Зак. 80
49
Рис. 4 .5 . Адиабатный процесс.
Рис. 4.6. Взаиморасположение
изотермы и адиабаты в рабо
чей диаграмме.
(4.16) и уравнение зависимости между р и и для изотермиче
ского процесса р2/Р| = ^1/^ 2-
Так как А > 1, очевидно, что при расширении по адиабате
падение давления интенсивнее,^чем по изотерме (рис. 4 .6). С л е
довательно, в диаграмме р — V адиабата всегда круче изотермы.
$ 4.6. ПОЛИТРОПНЫЛ ПРОЦЕСС
Политропным называется всякий термодинамический про
цесс, в котором превращение энергии осуществляется согласно
определенному закону.
Уравнение политропного процесса может быть записано
в виде
руп = соп$^
(4.22)
где показатель степени п, называемый показателем политропы,
может принимать любое численное значение, но постоянен для
данного процесса.
Докаж ем, что уравнение (4.22) является обобщающим для
всех политропных термодинамических процессов, в том числе
и для разобранных нами выше — изохорного, изобарного, изо
термического и адиабатного.
Уравнение рип= с о г ^ после извлечения из него корня сте
пени п можно переписать в виде р ,‘ ли = омЫ . Задавая показа-
50
телю п значения ±оо, получим pV°°v=const или р°и =const,
т. е. и = const. Значит, изохора есть политропа с показателем
п*=±оо. Принимая
0, получим из уравнения ри"*—const;
р —const — уравнение изобары, т. е . показатель политропы для
изобарного процесса равен нулю. Аналогично предыдущему
легко доказать, что показатель политропы для изотермического
процесса равен единице, для адиабатного — n = k .
Ввиду указанных свойств политропными процессами назы
вают все процессы, подчиняющиеся уравнению р о " « const. Как
видно, значение показателя политропы п может изменяться от
+ оо до — о о , принимая любые численные значения.
Таким образом, графическое изображение политропы воз
можно лишь в том случае, когда задано численное значение ее
показателя п. Политропа в системе координат р — v может быть
построена по двум точкам. При этом для первой точки должны
быть заданы значения двух параметров (р и v), а для второй —
хотя бы один параметр, так как второй может быть легко опре
делен следующим образом: в соответствии с уравнением поли-
тропы р|0|--р ,1»а* и р,— P i(0|М)* или о*- (Pi/Pi),/"W|.
Соотношения параметров газа в политропном процессе, ко
торые являются следствием уравнений р ц = /? Г и рцп*= const,
очевидно, будут иметь тот же вид, что и соотношения парамет
ров адиабатного процесса, полученных из уравнений ри * =* const
и p v = R T t в них только показатель адиабаты k заменяется по
казателем политропы п. При этом получим
Pt/Pi“ (vilvt) \ 7 У Г |- (Ui/o*)n- 1,
j2/7,-(p,/pO^Vn.
(4.23)
На том же основании получим/*чNo"$ормулы работы в поли-
тропиом процессе будут иметь вид
/— (Pi»«—PiVt),
(4.24)
-
Тг>*
(4.25)
Н^Н 1- Wpi)("-,>/"].
(4.26)
Исходя из уравнения первого закона термодинамики ? =
« Д :/ + /, выведем формулы для теплоты политропного процесса.
Изменение внутренней энергии в полнтропном процессе опреде
ляется по общей формуле Д ц = с г(7,2 — Т\). Подставив в урав
нение первого закона термодинамики значения Ди и /=*
= [/?/(л — 1)](Г| — Г2) =
— [/?/(л— 1)](Г2— Г ,), получим
или
<7«[С„— /?/(п—11 (Г2—Г,).
Выражение, стоящее в первой скобке, можно преобразо
вать следующим образом: с* — Я/(л — 1) = (пс„ —
—ср+
4*
51
+с0)/(л— 1), так как /?= ср— cv по уравнению Майера. Со
кращая + с© и — с„ и заменяя сР=Лс* полупим
—
/?/(л— 1) =
= с*(л— к)/(п— 1). Следовательно,
Я-с^Ъ-ТО.
(4.27)
Выражение cv(n — k)/(n — I) соответствует в формуле
(4.27) теплоемкости политропного процесса. Обозначим сс с п
Сп=Ср(п — Л)/(п— I),
(4.28)
тогда
<7 - с п(Га— Т\).
(4.29)
Правомерность такого представления теплоемкости поли*
тройного процесса будет доказана, если окажется, что вы раже*
нне (4.28) имеет общий для всех процессов характер: теплоем
кость любого частного процесса может быть получена из (4.28)
подстановкой соответствующего значения показателя поли
тропы.
Нетрудно убедиться в этом. Из уравнения (4.28) получим
для изохорного процесса, т. е . при п — + оо:
Cn-c0(n— к)/(п — 1),
с„/с,- (л—*)/(л —1),
Сп/Со—1 -(л—Л)/(л—1)—1=
=
0-*)/("-1)=(1-*)/оо-0 .
Таким образом, Cn/c0«= 1; с п= с„.
Для изобарного процесса при л = 0 : сп*=Со(0 — Л)/(0 — 1)« *
= с«Л— сР;
для изотермического процесса при л = 1 : сп= с „ ( 1 —Л)/
/(1—1)-сеоо=оо;
для адиабатного процесса при л * = £: сп= с г (Л—Л)/(Л— I) =
—с „ 0 = 0 , что и является требуемым доказательством.
Выраже ни е для изменения энтропии в политропном процессе
получается из общей формулы изменения энтропии d s — dq/T.
Подставляя вместо d q = c ndT, получим d s = c ndT/T и после ин
тегрирования
As~s* — S|—с„ In (T2ITX)=
e ce((n — к)/(п— 1)) In (7УГ,).
(4.30)
На рис. 4 .7, а представлен в диаграмме р — v ряд политроп
с различными значениями постоянного показателя п, проходя
щий через данную точку А. Из рисунка хорошо видно относи
тельное расположение политроп и их различный характер.
При о о > л > 0 политропы имеют гиперболический характер,
в частности, изотерма и адиабата; при 0 > л > — оо политропы
представляют собой кривые, проходящие через начало коорди
нат, причем при л > — 1 они направлены выпуклостью вверх,
април<—1
—
вниз. В частности, при л = — 1
политропа —
52
6
Рис. 4 .7 . Изображение полнтропных процессов в рабо
чей (о) и тепловой (б) диаграммах.
53
прямая линия. Теплоемкость с„ отрицательна для политроп,
проходящих через данную точку А в заштрихованной области
(*>л>1). Политропа в диаграмме р — о тем круче, чем
больше по абсолютной величине ее показатель л, так как он об
ратно пропорционален длине подкасательной политропы.
На основании из аналитической геометрии, величина подка
сательной для любой кривой в координатах р — V равна т =
*=^pdv/dp. Дифференцируя же уравнение политропы рип—сот\,
получаем pnvл- ídv+ vлdp^-0, откуда m z=pdv/dp= — п/л, т. е.
длина подкасательной политропы в координатах р — V равна
абсциссе точки, деленной на показатель политропы. Таким об
разом, чем больше абсолютная величина показателя л, тем ко
роче под касательная и тем круче политропа. В частности, ади
абата круче изотермы потому, что А > 1; наиболее пологая по
литр опа— изобара (горизонталь), для которой л —0; наиболее
крутая — изохора (вертикаль), для которой л = ± о о .
Аналитически показатель данной политропы может быть оп
ределен по координатам двух любых ее точек р|Р| и р^о* так
как р\\)\щ2=
Логарифмируя это выражение, получим
(18Р|+л^«|)=18Ра+л18«*
откуда
п = (1др2— 1вР|)/(1в«, —
—
18»»).
Очевидно, что значения р и 1М. Рг и
можно получить из ди
аграммы непосредственно в миллиметрах, не учитывая м ас
штабы координат.
Изображение рассмотренных здесь политроп в системе ко
ординат Т — 5 показано на рис. 4 .7 ,6 . Здесь заштрихована об
ласть, через которую проходят политропы с отрицательными
показателями. По направлению политропы от точки А в диа
грамме Г — з легко установить, отводится или подводится теп
лота в данном процессе.
| 4.7. СЖАТИЕ ГАЗОВ.
ТЕОРЕТИЧЕСКИЙ ПРОЦЕСС
ГАЗОВОГО КОМПРЕССОРА
В качестве простейшего примера технического применения
газовых процессов рассмотрим работу газового компрессора.
Компрессором называют машину, предназначенную для с ж а
тия газообразных тел от низкого давления до более высокого.
Компрессор является машиной (орудием), приводимой в дей
ствие от внешнего источника энергии.
Сжатые газы имеют широкое применение во многих маши
нах, инструментах и технологических процессах. Они использу
ются, например, в пневматических молотах и других пневма
тических орудиях, в двигателях внутреннего сгорания. Компрес
соры применяются в холодильных установках, газотурбинных и
реактивных двигателях. Компрессоры могут быть поршневыми,
центробежными, инжекционнымн.
54
Рассмотрим работу поршневого воздушного компрессора как
более простой машины. Задачей термодинамического анализа
компрессора является определение работы, которую необходимо
затратить для получения определенного количества (например,
1 кг) сжатого воздуха при заданных начальных и конечных его
параметрах.
Одноступенчатый компрессор. Действие одноступенчатого,
компрессора состоит из всасывания в цилиндр воздуха низкого
давления, сжатия его до более высокого давления и выталкива
ния сжатого воздуха.
Рассмотрим так называемый теоретический или идеальный
процесс компрессора, сделав следующие допущения: а) весь
объем цилиндра компрессора является рабочим объемом; б) тре
ние поршня о стенки цилиндра отсутствует, затрата работы
на трение равна нулю; в) давление воздуха в процессах вса
сывания и выталкивания не изменяется.
На рис. 4.8 приведены принципиальная схема поршневого
компрессора и теоретическая индикаторная диаграмма происхо
дящи х в нем процессов. Компрессор состоит из цилиндра /
с поршнем 2, пдлучающим движение через кривошипный м еха
низм 3 от вала, вращаемого двигателем, и двух клапанов —
всасывающего 4 и нагнетательного 5. Оба клапана автомати
чески открываются и закрываются воздухом под влиянием из
менения давления в цилиндре.
Р
Ряс. 4 .8 . Прявинпнальная
схема
поршневого
компрессора
м теоретическая
индикаторная
диаграмма его работы.
55
При работе компрессора, как и всякой машины с поступа
тельным движением поршня, с помощью специального при
бора — индикатора — может быть снята индикаторная диа
грамма, ординаты которой (в координатах р, П а — V, м3) со
ответствуют давлению внутри цилиндра при разных положениях
поршня, а площадь ее — работе на один рабочий процесс.
Теоретическая индикаторная диаграмма на рис. 4.8 изоб
раж ает процессы в идеальном (теоретическом)
компрессоре
с учетом сделанных ранее допущений. Индикаторную диаграмму
нельзя отождествлять с рабочей диаграммой р — о.
При ходе поршня из крайнего левого положения в крайнее
правое через всасывающий клапан 4 всасывается наружный воз
дух в объеме, равном объему цилиндра Vu при атмосферном
давлении р и чему на диаграмме соот
ветствует отрезок горизонтали а — / .
При обратном ходе всасывающий
клапан закрывается, и поршень сжи
мает воздух в цилиндре по кривой
1 —2 до тех пор, пока давление в ци
линдре не достигнет p 2t равного (точ
нее, несколько большего) давлению
сжатого воздуха в резервуаре 6. Тогда
открывается нагнетательный клапан,
и поршень выталкивает до конца хода
сжатый воздух в объеме V2 из цилинд
ра, нагнетая его в резервуар при дав
лении р2. Этому периоду нагнетания
соответствует горизонталь 2—b ди а
граммы. С началом нового хода поршня снова открывается
всасывающий клапан, давление в цилиндре падает от р2 до р\
теоретически мгновенно, т. е. по вертикали b — а, и рабочий
процесс повторяется, осуществляясь, таким образом, за два по
следовательных хода поршня.
Разумеется, реальный процесс газового компрессора отли
чается от теоретического. Примерный вид реальной индикатор
ной диаграммы представлен на рис. 4.9 .
Реальная индикаторная диаграмма отличается от теорети
ческой прежде всего тем, что вследствие сопротивления, оказы
ваемого впускным и нагнетательным клапанами проходящему
воздуху, всасывание происходит при давлении ниже давления
среды, из которой забирается воздух, а давление сж атого воз
духа в цилиндре компрессора должно быть несколько больше
давления в нагнетательном трубопроводе и резервуаре — сбор
нике сжатого воздуха.
Кроме того, объем, описываемый поршнем, не может быть
в точности равен объему цилиндра. Практически неизбежно на
личие свободного пространства м еж ду поршнем в крайнем по
ложении и крышкой цилиндра, необходимого для устройства
Рис. 4.9. Реальная ипдика*
торная диаграмма работы
поршневого компрессора.
56
клапанов и обеспечения безопасности работы компрессора (нс-
ключения возможности удара поршня о крышку цилиндра). Э то
свободное пространство назы ваю т мертвым нли вредным прост
ранством. Поэтому процесс нагнетания заканчивается на ре
альной индикаторной диаграмме в точке с1, отстоящей от оси ор
динат на расстоянии Уо, где У 0 — объем вредного простран
ства. Происхождение этого названия становится понятным на
следующего: при наличии воздуха с давлением р2 во вредном
пространстве открытие всасывающего клапана не будет озна
чать мгновенного падения давления в цилиндре от р2 до р\, как
это мы предположили раньше, произойдет расширение остав
шегося в этом пространстве воздуха (линия ¿/а), занимаю щее
часть хода поршня слева направо. Таким образом, вследствие
этого расширения уменьшается
количество всасываемого за
один ход поршня воздуха, т. е. уменьшается производительность
компрессора.
Как уже говорилось, здесь мы ограничимся рассмотрением
лишь теоретического компрессора. Полученные таким образом
основные соотношения подвергнутся дальнейшим уточнениям
в специальных курсах (компрессорные и расширительные м а
шины, холодильные машины, процессы и аппараты).
Рассмотрим подробнее теоретическую индикаторную ди а
грамму компрессора (см. рис. 4.8) для вывода общей формулы
работы компрессора. Термодинамическим процессом является
лишь процесс сжатия 1 —2, ибо в процессах всасывания а — /
и выталкивания (нагнетания) 2 — Ь не происходит изменения
термодинамических параметров рабочего тела, изменяется лишь
объем V газа в цилиндре.
Процесс сжатия /—2 в зависимости от условий может быть
изотермическим, адиабатным или полнтропным.
Работа компрессора ¿ к может быть выражена в виде алгеб
раической суммы трех работ: всасывания
с» сжатия 1*ст и на
гнетания ¿я. Работа всасывания, связанная с увеличением объ
ема газа, положительна; сжатия и нагнетания — отрицательна.
Так как компрессор есть машина, потребляющая энергию, сум
марная работа его отрицательна.
Процессы всасывания и нагнетания, по существу, являются
механическими процессами наполнения и освобождения цилин
дра. Вследствие этого работу их определяем аналогично работе
механических процессов. Если поверхность поршня г (м2),
а ход его £ 1» (м), то произведение Е на $ 1 есть объем цилиндра,
тогда
!*%<:**Р\Р$\~Р\У\.
Обозначив часть хода поршня, соответствующую процессу
выталкивания 5 2, можно написать
— раМ*—РаУ2.
57
Очевидно, что произведения р\Ух и р2У* могут быть выра
жены в диаграмме р — V площадями оа!п и оЬ2т, хотя процессы
всасывания и нагнетания и не являются термодинамическими.
Работа сжатия может быть вычислена по общей формуле
работы термодинамического процесса
¿с*- \pdLV
и измеряется площадью под процессом, т. е. £ сж= п л . т21п . Так
как У2< У |, работа сжатия, вычисленная по этой формуле, бу
дет отрицательной.
Теперь нетрудно выяснить, какой площадью измеряется р а
бота компрессора. Д л я этого просуммируем площади, соответ
ствующие работам сжатия и нагнетания, и вычтем площадь, со
ответствующую положительной работе всасывания:
1 К*=пл.т21п+ пл.оЬ2т— пл.оа/л-= пл.аЬ21а.
(4.31)
Эта площадь, как видно из рис. 4.8, может быть найдена
суммированием элементарных площадок Уйр в интервале от р х
до р2:
и--*УЛр,
Рх
/к- —Гщ/р.
(4.32)
Рх
Знак «минус» перед интегралом позволяет получить отрица
тельное значение работы компрессора без перемены пределов
интегрирования. Выражения (4.32) являются общими форму
лами работы, затрачиваемой на привод компрессора (ее часто
называют технической работой).
Можно получить такж е и другую формулу для вычисления
технической работы компрессора. Ранее было получено вы ра
жение (3.14)
—
идр. Интегрируя его в пределах от р х
р%
доръ имеем ц—'ъ—ь
—
) ьар. Учитывая второе выражение
Рх
(4.32), получим
/«=1*1 — 1*2+<7.
(4.33)
Рассмотрим изменение работы, потребляемой компрессором,
в зависимости от характера термодинамического процесса
сжатия.
Изотермический процесс. Из выражения (4.31) очевидно, что
£к= £сж+Р1У1—Ра^а-
(4.34)
В случае изотермического сжатия для изотермы /—2: р\Ух=*
- = р 2У2. Следовательно, уравнение (4.34) примет вид
(4.35)
58
Значит, в данном случае для вычисления работы компрес
сора может быть использована любая нэ выведенных ранее
формул работы изотермического процесса, например
1п (р1/«|)=ЛШ '1п (р\1рг)\
для 1 кг массы рабочего тела
/„= Р10 11п (оа/оО-ЛПп (р\!р1).
(4.36)
Адиабатный процесс. Подставив в уравнение (4.34) значение
работы адиабатного процесса сжатия 1 Сж = [1/(Л — ОНрМ —
—
РаУ*), получим
и - [1/(А— 1)](РхУх-рМ)+рхУх- р ,У 2.
Вынесем за скобки разность р М — р2У2, тогда
¿к-[1 + 1/(*-1)](Р1У,-ЛУз)
или
(*/(* -
1)](р,V, -
раУа) -
= [А/(А — 1)]А1/?(Г, — Г2);
для 1 кг массы рабочего тела
/*= [*/(* — 1)](р|Г|—РаОа)=
= [А/(А— 1)]/?(Г1 — Г2).
(4.37)
В отличие от изотермического сжатия работа компрессора
при адиабатном сжатии в к раз больше работы процесса сжатия
(4.за)
Так как Л—ср/с* всегда больше единицы, то в последнем слу
чае компрессор будет потреблять для одного и того ж е повы
шения давления газа большее количество энергии.
Другая формула работы компрессора при адиабатном сж а
тии, удобная для расчетов с помощью диаграмм, непосред
ственно следует из общей формулы (4.33).
Так как для адиабатного процесса сжатия <7*0, работа ком
прессора при адиабатном сжатии может быть измерена раз
ностью энтальпий в начале и конце процесса сж атия
(4.39)
Очевидно, что при этом работа компрессора будет отрица
тельной.
Политропное сжатие. Подставляя в формулу (4.34) значе
ние работы политропного сжатия, получим аналогично случаю
адиабатного сжатия:
(4.40)
Сопоставляя формулы (4.35), (4.38) и (4.40), видим, что за
траты рабцты на привод компрессора минимальны при изотер
мическом сжатии. Это становится особенно наглядным при р ас
смотрении различных процессов сж ати я в индикаторной д и а
грамме (рис. 4 .10 ), из которой видно, что площадь, соответст
вую щ ая работе компрессора, увеличивается с увеличением кру
тизны линии процесса сжатия, т. е . с увеличением показателя
политропы.
Наиболее выгодный энергетически изотермический процесс
сжатия 1 —2 практически трудно осуществим, так как для этого
необходимо интенсивное охлаждение цилиндра компрессора; ко
личество отведенной теплоты должно быть равным затраченной
работе.
В большинстве случаев, несмотря на устройство охлаждаю
щих рубашек на цилиндрах компрессоров, удается отвести лишь
часть этой теплоты, поэтому процесс сжатия приближается
к адиабатному /— 2 "; соответствует показателям политропы
А > л > 1 (линия 1 —2 ') . В случае отсутствия охлаждающей ру
башки сжимаемый воздух воспринимает теплоту, создаваемую
трением; такой процесс сжатия (линия 1 —2 " ') соответствует
показателю политропы п > & и характеризуется наибольшим
значением работы компрессора.
Процессы сжатия газа в компрессоре могут быть изображены
на диаграмме Т — 5 (рис. 4.11). Здесь точка /, лежащая на
изобаре ри соответствует начальному состоянию газа; точки 2,
2', 2 " — на изобаре рг — конечному состоянию сжатия газов, из
меняющемуся в зависимости от характера процесса сжатия.
Линия 1 —2 и зображ ает изотермический
процесс сжатия
газа; 1 —2 " — адиабатное сжатие; 1 —2! — политропное сжатие
с неполным (сравнительно с изотермой) отводом теплоты от
газа.
Адиабатное сжатие при наличии трения изображается ли
нией
соответствующей политропному сж ати ю с подво
дом теплоты (энтропия растет). Очевидно, что индикаторные
линии (а—/,2—Ъ,Ь—анарис.4.10) вдиаграммеТ—жне
изображаются (превращаются в точки), так как отображаемые
ими процессы не являются термодинамическими.
¥
5
Рис. 4 .10. Работа компрессора
при разных процессах сжатия.
Рис. 4 .11 . Процессы сжатия в
тепловой диаграмме.
60
Многоступенчатый компрессор. Н а практике часто необхо
димо получать сжатые газы весьма высокого давления. Приме
нение для этих целей одноступенчатого компрессора нецеле
сообразно, как в смысле термодинамическом, так и по ряду
практических соображений.
При большом отношении давлений нагнетания и вс ас ы ва
ния неизбежно значительное отклонение реального процесса
сжатия от изотермического, следовательно, большой перерасход
работы. Кроме того, в этом случае неизбежная высокая темпе
ратура конца сжатия может быть причиной нежелательных тем
пературных деформаций, а такж е и самовозгорания масла, см а
зывающего цилиндр. Поэтому одноступенчатые компрессоры
Рис. 4 .12 . Принципиальная схема
Рис. 4 .13. Работа двухступенчатого
применяются лишь в том случае, когда отношение р*/р| < 4—5 .
При необходимости получить большее повышение давления
применяют многоступенчатое сж атие.
Сущность многоступенчатого сжатия может быть пояснена
на примере двухступенчатой установки, схема которой представ
лена на рис. 4 .12 , а изображение процессов в диаграмме р — и —
на рис. 4 .13.
Работа компрессора при двухступенчатом сжатии будет
равна сумме работ первой и второй ступеней: /к=/к|+*ка, а так
как /и^пл. Ь21а и /л -=пл. с43Ь, то /к=пл . с4321а.
Одноступенчатое сж атие с тем ж е политропным процессом
(1<л< £ ) потребовало бы в этих условиях затраты работы,
выражаемой в • р — (/-диаграмме площадью с51а, которая
больше площади с4321 а, сэкономленная работа измеряется пло
щадью 5234.
Причина получаемой экономии работы вполне очевидна:
в компрессор второй ступени поступает газ, объем которого
уменьшился в процессе промежуточного охлаждения (о3< сг2) ;
Рк
двухступенчатого компрессора.
компрессора при различных процес
сах сжатия.
61
соответственно уменьшается и работа, потребная для сж атия
газа.
При адиабатном одноступенчатом сжатии (п = к ) затрата
работы была бы еще большей (пл. с 7 1а) . Очевидно, что полу
чающаяся при двухступенчатом сжатии экономия работы будет
еще более значительной при увеличении числа ступеней.
По мере увеличения числа ступеней и уменьшения перепадов
давления в каждом из них процесс сжатия в многоступенчатом
компрессоре, как нетрудно видеть из рис. 4.13, будет все более
приближаться к наиболее выгодному изотермическому (линия
/-б).
Глава 5
второй закон термодинамики
§ 5.1 . ФОРМУЛИРОВКИ ВТОРОГО ЗАКОНА.
ОСНОВНЫЕ понятия
Первым законом термодинамики устанавливаются лишь ко
личественные соотношения при взаимных превращениях теп
лоты и работы. Возможность осуществления того или иного
процесса, направление и предел его развития не рассматрива
ются первым законом. М еж ду тем в природе наблюдается мно
ж ество различных процессов, которые сами собой, без вм е ш а
тельства извне, без какого-либо компенсирующего процесса про
текают лишь в одном вполне определенном направлении. Т а
ковы процессы диффузии, растворения, свободного падения и
многие другие.
Рассмотрение вопросов об осуществимости того или иного
процесса и его вероятном направлении является содержанием
второго закона (или второго начала) термодинамики.
Наиболее общей формулировкой второго начала термодина
мики можно считать формулировку, предложенную Больцманом:
«Природа стремится к переходу от менее вероятных состояний
к более вероятным».
Рассмотрим применимость этого утверждения к процессам
взаимного превращения теплоты и работы, которые являются
основным предметом технической термодинамики. Тепловое дви
жение, как известно, является хаотическим движением молекул,
совершающимся в различных направлениях и с различными ско
ростями. Из всевозможных движений молекул беспорядочное
движение, естественно, является наиболее вероятным. В эту
форму движения легко переходит направленное движение моле
кул, присущее, например, процессам совершения механической
работы. Такие превращения (организованного движения моле-
62
кул в хаотическое) являются, по существу, необратимыми про
цессами, приводящими систему от состояния менее вероятного
к состоянию более вероятному.
Обратный переход беспорядочного движения молекул в ор
ганизованное без внешних причин совершаться не может. В этом
случае система от состояния более вероятного переходила бы
к состоянию менее вероятному.
Сказанное поясняет хорошо известный из опыта ф акт воз
можности самопроизвольного превращения различных видов
энергии в теплоту и невероятность обратного самопроизволь
ного превращения теплоты в другие виды энергии. Следующее
краткое суммирование сказанного может служить еще одной
формулировкой второго закона термодинамики: самопроизволь
ные процессы необратимы.
Самопроизвольными мы будем называть процессы, происхо
дящие в данных условиях сами по себе, без внешнего воздейст
вия, в отличие от несамопроизвольных, требующих для своего
осуществления внешнего воздействия.
Очевидно, что самопроизвольные процессы возможны лишь
в том случае, когда в системе нет равновесия, и что этп про
цессы осуществляются всегда в направлении, приближающем
систему к равновесию; при достижении системой равновесия
такие процессы заканчиваются.
С древнейших времен человечеству известны способы получе
ния теплоты за счет затраты работы (например, добывание
огня за счет теплоты, выделяющейся при трении). Такое пре
вращение происходит само собой, без обеспечения каких-либо
предварительных условий и полностью.
Наоборот, самопроизвольное превращение теплоты в работу
в природе не наблюдается, оно может быть достигнуто лишь
техническими средствами при обеспечении ряда условий и не
полностью. Суммируя этот опыт, М. Планк предложил следую
щую формулировку второго начала термодинамики: «Невоз
можно построить периодически действующую тепловую машину,
результатами действия которой были бы только получение м еха
нической работы и охлаждение источника теплоты».
Процессы получения механической работы за счет теплоты
в технике осуществляются в машинах, называемых тепловыми
двигателями.
Формулировку Планка применительно к работе теплового
двигателя следует понимать следующим образом.
Теплота может быть частично превращена в работу лишь
при посредстве рабочего тела (агента). Лиш ь часть теплоты,
полученной рабочим телом от источника, может переходить
в работу, другая часть неизбежно должна отдаваться некото
рому холодному телу (холодильнику, приемнику теплоты), что
и является процессом, компенсирующим несамопроизвольность
превращения теплоты в работу.
63
Таким образом, для осуществления несамопронзвольного про
цесса получения работы за счет теплоты необходимы следую
щие условия: наличие по меньшей мере д вух источников теп
л от ы — с большей и с меньшей температурами — и рабочего
тела.
Принципиальная схем а действия теплового двигателя пред
ставлена на рис. 5 .1 ,а.
При наличии источников теплоты с температурами Г, и Г5
( Т | > Г 2) и рабочего тела возможно получение работы в коли
честве /, равном разности м еж ду количествами теплоты, под
веденной к рабочему телу от источника с большей температурой
а
б
Рис. 5 .1 . Принципиальная схема действия теплового двига
тел я (а) и холодильной машины (б).
<71 и отданной телом источнику с меньшей температурой ? а ,т . е .
Содержание второго закона термодинамики может быть
выражено и следующим образом: «Невозможно осуществить
вечный двигатель второго рода».
Идея вечного двигателя второго рода (в отличие от вечного двигателя
первого рода, в котором предполагалось получать анергию без затраты ее
в какой-либо другой форме) состоит в том, чтобы получать работу за счет
той теплоты, которая может быть взята от природных источников, но
при наличии лишь одного источника теплоты. Подсчитано, например, что при
частичном использовании теплоты, которую мож но было бы получить при
охлаждении воды Мирового океана па сотые доли градуса, можно было бы
получить работу, достаточную для привода машин всех заводов мира в тече
ние сотен лет, т. е. такой двигатель мог бы быть вечным. Действие такого
двигателя не противоречило бы зако ну сохранения энергии, а следовательно,
и первому закону термодинамики.
Опыт показывает, однако, что такая машина неосуществима, так как идея
ее противоречит второму зако ну термодинамики. Получение работы невоз
можно без наличия разности температур, поэтому для использования гро-
64
мадных природных источников теплоты (вода океанов, атыосфера, земная
кора) необходимо еще наличие приемника теплоты сто ль ж е емкого, но мень
шей температуры. Наличие естественных перепадов температур (например,
м ежду поверхностными и глубнппымн слоями воды в морях) в принципе
позволяет построить двигатель, использующий теп лоту природных источни
ков. однако он уж е нс будет являтьсх вечным двигателем второго р ода,
ибо вполпе соответствует схеме рис. 5 .1 . Кроме того, применимость и эффек
тивность таких двигателей весьма ограничены техническими условиями их
осуществления.
Таким образом, процесс превращения работы в теплоту
является несамопроизвольным процессом.
В технической термодинамике изучается еще один важней
ший самопроизвольный процесс — переход теплоты от горячего
тела к холодному. В прямом направлении он протекает сам по
себе, в чем легко убедиться из опыта, переход ж е теплоты от
холодного тела к горячему невозможен без проведения допол
нительных процессов — компенсации в виде затраты энергии.
Применительно к этому процессу второй закон термодинамики
сформулирован Клаузиусом: «Теплота никогда не может пере
ходить сама собой от тела менее нагретого к телу более на
гретому».
Меж ду тем задачей важной отрасли промышленности — хо
лодильной техники — является осуществление именно такого про
ц е сс а— переноса теплоты от менее нагретых к более нагретым
телам, ибо искусственное охлаждение тел есть охлаждение их
ниже температуры окружающей среды.
Такой несамопронзвольный процесс м ожет быть осуществ
лен лишь техническими средствами в холодильной установке,
действие которой связано с обязательной затратой энергии на
компенсацию несамопроизвольности процесса искусственного
охлаждения. Эта компенсация может быть осуществлена в виде
затраты механической работы либо выполнения какого-нибудь
другого процесса, эквивалентного по возможности произвести
полезную внешнюю работу (например, путем перехода теплоты
от дополнительного, введенного в цикл, более нагретого тела
к менее нагретому).
По первому способу (компенсация в виде затраты механи
ческой энергии) работаю т компрессорные холодильные машины;
по второму — абсорбционные и пароэжекторные холодильные
машины, относящиеся к классу теплонспольэующих холодиль
ных машин.
В том и другом случае переход теплоты от более холодного
к более нагретому телу может быть осуществлен не непосред
ственно, а лишь при посредстве рабочего тела (холодильного
агента). В соответствии со сказанным на рис. 6 . 1 , б представ
лена общая принципиальная схем а действия холодильной м а
шины.
Теплота 92 может быть отнята от охлаждаемого тела В
с температурой
и передана рабочему телу с помощью само-
5Зая.N
53
произвольного процесса при условии, что температура холо
дильного агента в этом процессе ниже температуры Т2. Затем
при совершении по отношению к агенту работы / температура
его может быть повышена до значения, большего температуры
среды Г ь что обеспечит возможность самопроизвольного пере
хода теплоты в количестве <71 от холодильного агента к окруж а
ющей среде С.
Таким образом, несамопроизвольный процесс переноса теп
лоты от В к С заменяется двумя самопроизвольными процес
сами теплообмена, осуществимыми при условии затраты работы
и наличия посредника — холодильного агента.
9 5.2 . КРУГОВЫЕ ПРОЦЕССЫ ИЛИ ЦИКЛЫ
Круговым процессом или циклом называю т ряд последова
тельных термодинамических процессов, в результате которых
рабочее тело, пройдя ряд промежуточных состояний, возвраща
ется в начальное состояние.
Французский физик и инженер С. Карно впервые применил
круговые процессы (циклы) как метод изучения действия теп
ловых машрн.
Циклы, состоящие лишь из обратимых процессов, называ
ются обратимыми; наличие хотя бы одного необратимого про
цесса делает цикл необратимым.
Различают циклы прямые и обратные. Прямыми циклами
называются такие, в которых теплота превращается в работу.
Прямые циклы осуществляются в тепловых двигателях (паро
вые машины, двигатели внутреннего сгорания и пр.) .
Обратными циклами называют циклы, в результате осуще
ствления которых теплота передается с более низкого темпера
турного уровня на более высокий. Обратные циклы осуществ
ляются в холодильных машинах и тепловых насосах.
Прямые циклы. По конструктивным особенностям различают
двигатели поршневые, ротационные, реактивные и пр.
Реальные процессы, осуществляемые в тепловых двигателях,
отличаются большой сложностью. При термодинамическом ис
следовании не учитываю тся многие конкретные особенности
действительных процессов, они идеализируются для выявления
основных факторов, влияющих на экономичность машин. При
этом реальные процессы, осуществляемые в машинах, прибли
женно заменяют обратимыми термодинамическими процессами;
процессы сгорания топлива рассматривают как процессы под
ведения к рабочему телу тождественного количества теплоты и
т. д.
При таком методе исследований определяется наибольшее
возможное с термодинамической точки зрения значение к. п. д.
превращения теплоты в работу при заданных условиях. Д ейст
вительные к. п. д . тепловых машин, разумеется, меньше к. п. д .
66
соответствующих циклов, так как в циклах не учитываются мно-
гие факторы, снижающие степень совершенства превращения
в них теплоты в работу.
Так, в циклах не учитываются трение в машине, потери теп
лоты в окружающую среду, циклы рассматриваются замкну
тыми, в то время как в двигателях после каждого рабочего хода
поступает новая порция рабочего тела.
Несмотря на это рассматриваемые в термодинамике идеаль
ные схемы тепловых двигателей позволяют обнаружить принци
пиальные закономерности действия тепловой машины.
Применим термодинамический метод исследования к схеме
поршневого двигателя. В соответствии со схемой рис. 5 .1 , а бу
дем полагать, что к рабочему телу, находящемуся в цилиндре
(рис. 5 .2 ) , от источника теплоты с температурой Т\ подводится
теплота 9 1. В результате расширения рабочего тела поршень
переместится в крайнее правое положение, при этом соверша
ется внешняя работа. Д алее для возвращения рабочего тела
в первоначальное состояние нужно произвести его сж атие с от
водом теплоты к приемнику с температурой Г2.
Рассмотрим эти процессы в координатах р— и. Пусть про
цесс расширения рабочего тела изображается кривой А—В — С.
В результате этого процесса получается работа, измеряемая пло
щадью аАВСЬ. Процесс возвращения рабочего тела в начальное
состояние А можно представить идущим, например, по той ж е
кривой С—В —А. Тогда работа, затрачиваемая на сжатие, была
бы р авна всей работе, полученной при расширении рабочего
тела, т. е. от двигателя не могла бы быть получена внешняя
работа. Еще менее логично вести процесс сж атия по линии
С—О —А, в этом случае машина потребляла бы работу извне,
т. е. перестала бы быть двигателем.
Таким образом, единственно целесообразным является про
цесс сжатия, характеризуемый линией, расположенной ниже
линии, соответствующей процессу расширения (например, С —
Е —А). Следовательно, внешним признаком полученного пря
мого цикла А—В —С —£
— А является его обязательная направ
ленность по часовой стрелке. Следует подчеркнуть еще одну
условность схем, изображенных на рис. 5 .1 и 5.2 . Прн наличии
одного источника и одного приемника теплоты может быть рас
смотрен только обратимый цикл Карно (см. далее, § 5.3).
Процесс подвода теплоты к рабочему телу по линии >4—В — С
может быть обратимым лишь при наличии бесчисленного мно
жества точечных источников, температура которых переменна
вдоль процесса А—В —С, но на каждом элементарном участке
лишь на бесконечно малую величину превышает температуру
рабочего тела. Процесс С—Е —А такж е является усредняющим
для всех процессов отдачи теплоты рабочим телом бесчислен
ному множеству теплоприемннков при бесконечно малой раз
ности температур между рабочим телом и приемником на каж-
5*
67
дом элементарном участке. В этом случае Тх и 72 следует пони
мать как усредненные температуры всех источников (Г,) и
всех приемников (72) теплоты. Величину щ\ далее будем пола
гать как суммарную теплоту, полученную рабочим телом от
зс е х источников, величину ? 2 — как суммарную теплоту, отданную
рабочим телом всем теплопрнемникам.
Ряс. 5 .2 . Принципиальная
схема
Ряс. 5 .3 . Общий вид прямого
поршневого двигателя (а) в общий
цикла в тепловой диаграмме,
вид прямого цикла в рабочей диа
грамме (б).
Внешняя работа, полученная в результате осуществления
цикла А—В —С —£
— А, будет равна
/щ»/раом — |/е*|.
Следовательно,
/ц—пл. аАВСВ — пл. оАЕСЬ —пл. АВСЕА,
(5.1)
т. е. работа цикла измеряется его площадью.
Поскольку работа сжатия /сж — отрицательная величина,
а в выражении (5 .1 ) фигурирует лишь ее абсолютное значение,
будем в этом и в других случаях помещать отрицательную вели
чину в прямые скобки |/Сж| - — /с*.
Прямой цикл в диаграмме 7 — 5 представлен на рис. 5 .3 .
Здесь пл. ЬЛВСа- ^ 1 — подведенная к рабочему телу теплота;
пл. ЬАЕСа— ^ 2— теплота, отведенная от рабочего тела к при
емнику теплоты.
Тепловой баланс цикла может быть представлен в виде
М-
(52)
По первому закону термодинамики
Ди+ /Ц. Но так как
для замкнутого цикла Ай—0 , то уравнение 9Ц= / Ц и является
68
выражением первого закона термодинамики для круговых зам
кнутых процессов (циклов), как это указывалось выше.
Очевидно, что /ц= < 7ц=*пл. АВСЕА, т. е. площадь прямого
цикла в диаграмме Т— 5 изображает полученную работу, рав
ную теплоте цикла.
Термодинамическая эффективность цикла, т. е. полнота ис
пользования затраченной теплоты д ля получения работы, х а
рактери зуется термическим коэффициентом полезного действия.
Термический к. п. д . обозначается обычно tj* и определяется как
отношение полезного результата цикла к затраченной теплоте:
или
(pi — I )/^i ” 1 — |<72|/<7i.
(5.3)
Величина тц, как видно из формулы (5.3), может изменяться
в пределах от нуля (I^а| =Vi) А° единицы (при ^ = 0 или
<7,= о о). Очевидно, что
1 — неосуществимое значение, ибо
</2 ¥ = 0 в соответствии со вторым законом термодинамики.
Pi = оо — практически неосуществимо.
Обратные циклы. Обобщенное изображение цикла холодиль
ной машины (обратный цикл) можно получить, исходя из сл е
дующих соображений.
Рис. 5 .4 . Принципиальная схема холодильной машины (а), общий
вид обратного цикла в рабочей (б) и тепловой (в) диаграммах.
В соответствии со схемой, представленной на рис. 5 .1 , б
(с учетом сделанных выше оговорок по рис. 5 .1 , а и 5.2), изо
бразим поршневую машину, в цилиндре которой находится р а
бочее тело, способное обмениваться теплотой с источниками теп
лоты большей Т\ и меньшей
температуры (рис. 5.4, а).
Газу, находящемуся в состоянии. Л (см. диаграмму р—о),
предоставлена возможность расширяться. Когда его темпера-
69
тура упадет ниже Г2, к рабочему телу от источника теплоты
с температурой Г* подводится теплота в количестве <72. вследст
вие чего газ продолжает расширяться. Поршень идет вправо,
совершая работу против внешних сил (процесс Л—В —С).
Для того чтобы рабочее тело было способно воспринимать
теплоту неоднократно, его следует вернуть в первоначальное
состояние А . Д ля этого необходимо осуществить его сжатие
(поршень идет влево, работа затрачивается).
По достижении температуры, большей температуры среды
Г|, теплота в количестве Я\ отдается рабочим телом среде.
В обратном цикле линия сжатия расположена всегда выше
линии расширения, так как цикл осуществим лишь при усло
вии затраты работы; поэтому обратный цикл в диаграммах
всегда направлен против часовой стрелки.
Баланс работы цикла запишется следующим образом:
1'«1 = 1<«| —/рмш—пл. ЬАОСа = пл. МВСа—
-п
л . АИСВА.
(5.4)
Таким образом, площадь обратного цикла в диаграмме
р—V изображает затраченную работу.
Рассмотрим обратный цикл в диаграмме 7 — 5 (рис. 5 .4, б).
Здесь 9 2м пл. ЬАВСа и 9 1—пл. ЬАОСа. Тепловой баланс цикла
|^ц| —|/ц| —1^1|— (¡2*
(5.5)
Следовательно, |фц|~пл . АйСВА. Площадь обратного цик
ла в диаграмме Т—5 соответствует количеству теплоты, эквива
лентному затраченной работе. Термодинамическую эффектив
ность обратного цикла, осуществляемого в холодильной маши
не, принято характеризовать холодильным коэффициентом, кото
рый обозначается буквой в и определяется как отношение по
лезного результата цикла (отнятой от охлаждаемого тела теп
лоты (72) к затратам (работа цикла |/ц|), т. е.
е —<7а/|М*
(5-6)
Таким образом, холодильный коэффициент характеризует
эффективность использования работы, затрачиваемой для дос
тижения холодильного эффекта. Холодильный коэффициент мо
ж ет изменяться в пределах от нуля (<72 = 0 ) до бесконечности
(/ця 0 ). Величина <72 называется удельной холодопроизводнтель-
ностью холодильной машины.
Машины, в которых осуществляется обратный цикл, исполь
зуются в двух направлениях. Если цикл используется для воз
действия на состояние холодного тела — теплоотдатчика, то она
называется холодильной и применяется для искусственного ох
лаждения (производство льда, охлаждение помещений и т. д .) .
Процесс теплообмена рабочего тела с теплоприемннком (окру
жающей средой) не имеет здесь решающего значения, главная
70
цель — отнятие теплоты от охлаждаемого тела. Именно о такой
машине говорилось до енх пор.
Если ж е объектом воздействия является нагретое тело —
теплоприемник, то машина называется тепловым насосом. Теп
ловые насосы применяются для отопительных целей, соответ
ствующий цикл называю т циклом динамического отопления.
При работе теплового насоса теплота отнимается от окруж аю
щей среды и после повышения ее температурного уровня вслед
ствие затраты работы передается отапливаемому помещению.
Здесь полезным результатом цикла является теплота в коли
честве
поэтому эффективность цикла динамического отопле
ния оценивается не холодильным коэффициентом е< а отопитель
ным коэффициентом ц
Ц-<71//ц.
(5.7)
Пределы изменения ц от 1 до оо. Более подробно работа
теплового насоса будет рассмотрена в гл. 1 1 .
§ 5.3 . ЦИКЛ КАРНО
С. Карно, рассматривая вопрос о максимально возможной
экономичности цикла, предложил и обосновал как наивыгод-
нейшнй простейший обратимый цикл с д вум я источниками теп
лоты. Исследование этого цикла позволяет разрешить ряд тео
ретических вопросов термодинамики, кроме того, он может быть
использован как эталон для сравнения с ним эффективности
других циклов с двумя источниками теплоты постоянной тем
пературы.
Прямой цикл Карно. О существление прямого обратимого
цикла Карно можно представить, исходя из следующего. Пусть
1 кг идеального газа находится в изолированном, непроводящем
теплоту цилиндре (рис. 5 .5), имея, однако, возможность попе
ременно вступать в соприкосновение с двумя источниками теп
лоты с температурами Т\ и Г* (Г|>Г а). Эту возможность обес
печим (для наглядности) устройством съемной изоляционной
крышки цилиндра К.
Пусть источники теплоты бесконечно велики по сравнению
с рабочим телом — настолько, что теплообмен с рабочим телом
не может заметно изменить их температуру.
Рассмотрим последовательно процессы, происходящие в дви
гателе при таких условиях, изображая их в рабочей и тепловой
диаграммах (рис. 5 .6).
Обозначим начальное состояние рабочего тела буквой А.
Откроем изоляционную крышку К, обеспечив этим возможность
перехода теплоты от источника с температурой Т} к рабочему
телу. Температура рабочего тела, масса которого весьма мала
по сравнению с массой источника, могла бы быстро сравняться
с температурой источника Г|.
71
Но так как рабочему телу предоставлена возможность рас
ширяться в цилиндре (перемещая поршень вправо), передача
теплоты от источника к рабочему телу будет продолжаться при
бесконечно малой разности температур меж ду ними.
Следовательно, такой процесс расширения тела будет обра
тимым изотермическим процессом, в течение которого темпе-
Рис. 5 .5 . Схема осуществления пря
мого обратимого цикла Карно.
ратура тела отличается от температуры источника лишь на
бесконечно малую величину. Пренебрегая этой разностью, бу
дем полагать, что процесс изотермического расширения А—В
происходит при температуре источника Т\.
Рис. 5.6 . Прямой обратимый цикл Карно в рабочей
(а) и тепловой (б) диаграммах.
За время этого процесса к рабочему телу подводится т.еп.тота
в количестве 9 1, измеряемая в диаграмме 7 — 5 пл. ЬАВё. В диа
грамме р—V пл. ЬАВй измеряется работа, полученная в этом
процессе. При достижении поршнем положения, соответствую
щего состоянию В, цилиндр закрываем крышкой /С, прекращая
теплообмен. Но так как рабочее тело имеет температуру и дав
ление большие, нежели в окружающей среде, расширение его
продолжается теперь уж е без теплообмена, т. е. адиабатно (про
цесс В —С). Площадь йВСа в диаграмме р—V соответствует ра
боте адиабатного расширения.
Для того чтобы рабочее тело было способно вновь совершить
работу, его нужно вернуть в первоначальное состояние, а пор
та
шсиь — в крайнее левое положение. Д л я этого, отодвинув
крышку К, обеспечим вначале возможность отнятия от тела
теплоты в количестве 4 2 теплоприемником с температурой Гг.
Результатом этого явится процесс сж атия С — 0 , который будет,
как и процесс А—В , изотермическим. Температура тела в этом
процессе лишь на бесконечно малую величину выше Гг.
Соответствующими площадями под процессом С—£ в ди а
грамме 7 —5 измеряется отведенная от рабочего тела теплота,
а в диаграмме р—V — эквивалентная ей работа сжатия. В точке
7) прекращаем теплообмен, закрывая крышку /С, и дальнейшее
сжатие тела до начального состояния ведем адиабатно, с за
тратой внешней работы, которая измеряется пл. ЬАйс в р— о -
диаграмме. Процесс адиабатного сжатия, как и соответствую
щий процесс расширения, предполагается идущим бесконечно
медленно (в условиях динамического равновесия).
Таким образом, полученный цикл Карно обратим, ибо со
стоит только из обратимых процессов: д вух адиабатных обра
тимых процессов сжатия и расширения и двух изотермических
обратимых процессов теплообмена, причем процессы теплооб
мена рабочего тела с источником теплоты происходят на уровне
температур источников. Следовательно, осуществление цикла
Карно не вызывало бы потерь энергии, связанных с необрати
мостью процессов; с помощью этого цикла максимальная доля
теплоты источника могла бы быть превращена в работу.
В реальных условиях обратимый цикл Карно неосуществим,
так как реальные процессы необратимы.
Практическое значение изучения цикла Карно состоит в том,
что он является циклом-образцом, с которым можно сопостав
лять некоторые реальные циклы.
Термический к. П. д. цикла Карно может быть вычислен
по общей формуле
Но в данном случае в соответ
ствии с диаграммой 7—5(рис. 5.6) /ц=?ц=?|—1^2|«пл. АВСй
и ? 1 =*пл. ЬАВа. Отсюда
т)*,к—пл. АВСй/пл.
[(52—5|)(7|— 72)]/(52—51)71.
Следовательно, для термического к. п. д . цикла Карно спра
ведлива формула
Л*.« = (7, - 7»)/7«= 1 - Т2/Ти
(5.8)
где Т\ и 7 2 — абсолютные температуры источников.
Формулой (5.8) наглядно иллюстрируется формулировка
второго закона термодинамики, предложенная Планком. При
отсутствии разности температур м еж ду источниками теплоты
невозможно получение работы (при Т2= Т и Л/,кв 0 ), иначе го
воря, невозможно превратить в работу всю теплоту источника,
так как т)/,и окажется равным единице лишь в предпо
ложении 7 2 = 0 или 7 |= оо, что неосуществимо.
73
Легко убедиться в том, что вычисленный по формуле (5.8)
термический к. п. д . имеет максимально возможное значение
при заданном интервале температур источников, т. е. цикл К ар
но является циклом наибольшей возможной эффективности.
Совместим в диаграмме 7 —з (рис. 5 .7) произвольный обра
тимый цикл А -В
-С
-
й-А
с
циклом
Карно
I—
2—3 —4— 1 , проведенным в тех же пределах изменения энтро
пии. Поскольку в цикле Карно изотермические процессы тепло
обмена происходят при температурах источников (7т*х и 7Ющ
для данной системы), прямой цикл Карно всегда будет огиба
ющим по отношению к любому произвольному прямому циклу.
Для цикла Карно 1 —2 —3 'щ
~
т4' I т^,
/*~—
7"т1п/7*т«т. В цикле
А—В — С —П —А теплообмен происходит при переменных темпе
ратурах по линиям А—В —С и С—Ъ —А. Можно принять, что
Рис. 5 .7 . Сопоставление эффективно
сти цикла Карно и произвольного
прямого цикла.
теплота подводится к телу при некоторой средней температуре
Т\ и отводится от него при средней температуре 7 2. Заменяя
площади ЬАВСа и ЬАОСа равновеликими им прямоугольниками
ЪЫМа и ЬРЯа с общим основанием Ьа%можно получить значения
этих средних температур.
Тогда для цикла Л—В —С —О —А (преобразованного в рав
нозначный ему цикл Р —Ы—М —/?—Р) г\г,к =1 —Т2/Тх. Очевидно,
что 7 2> 7 щ1п н 7 г<Стах- Следовательно, л*<П*.к*
Вместе с тем заметим, что цикл Р—N —М —Р
— Р является
условным изображением необратимого цикла Карно, осуществ
ляемого при наличии источников с температурами 7 т*х и Тщш.
Действительно, процессы теплообмена происходят при конечных
разностях температур меж ду источниками и рабочим телом
(Г«**— 7| и 7о—7ты). результатом чего и является необрати
мость этого цикла.
Таким образом, мы доказали, что термический к. п. д, обра
тимого цикла Карно действительно имеет максимально возмож
ное значение при данной разности температур меж ду двумя
источниками (температуры которых не изменяются); эта вели
чина больше
любого другого цикла (произвольного обрати
мого или цикла Карно необратимого), осуществляемого в тех
же условиях.
74
Обратный цикл Карно. Осуществление обратного обратимого
цикла Карно легко представить себе, пользуясь тем же мето
дом рассуждения н делая те же допущения, как н при рассмот
рении прямого.
Обратный цикл Карно Л—В —С —О —Л (рис. 5 .8) состоит
из следующих процессов:
1 ) адиабатного расширения рабочего тела (Л—В );
2 ) изотермического подведения теплоты к рабочему телу
от источника с температурой Г? (В —С );
3) адиабатного сжатия с затратой работы (С—В );
4 ) изотермического отвода теплоты к источнику с темпера
турой Тх (О—А ).
Рис. 5.8 . Обратный цикл Карно в рабочей (а) и теп
ловой (б) диаграммах.
Работа цикла численно равна пл. АВСй в диаграмме р— V
н по знаку отрицательна:
|/ц|«|/сж| —/рас-пл . ЬАОСЛ— пл. ЬАВС(1~
—п л. ЛВСВ.
Холодильный коэффициент цикла
ек=<72/|Н=пл . 1ВС2/пл. ВЛВС= (5*—
$1) (Т*—Тг),
еи-ТУ^-Г,).
(5.9)
Ниже на конкретном примере будет показано, что с по
мощью этой формулы можно получить максимально возмож
ное значение холодильного коэффициента при заданных темпе
ратурах источников Т\ и Г2-
Аналогичным способом можно получить формулу для ото
пительного коэффициента цикла Карно:
ц—7,/(Г, — Га).
(5.10)
К ак видно, отопительный коэффициент есть величина, обрат
ная термическому к. п. д . прямого цикла при одних и тех же
температурах источников ц —\/щ.
75
Следовательно, цикл теплового насоса, а не холодильный,
обратен прямому циклу.
Теорема Карно. Ф ормула (5.8) была выведена нами в пред
положении, что рабочим телом, совершающим круговой процесс,
является идеальный газ. Однако она справедлива и в том слу
чае, когда рабочим телом будет служить любое вещество (на
пример, пар), т. е. к. п. д . обратимого кругового процесса Карно
не зависит от природы рабочего тела. Это положение является
содержанием теоремы Карно.
Эта теорема доказывается различными способами, рассмот
рение которых здесь не представляется необходимым. Е е спра
ведливость с очевидностью иллюстрируется полученными фор
мулами (5.8)—(5.10), которые не содержат величин, характе
ризующих свойства рабочего тела.
| 5.4 . РЕГЕНЕРАТИВНЫЙ ЦИКЛ
'
В цикле Карно процессы сжатия и расширения происходят
без теплообмена, аднабатно.
Воспользовавшись диаграммой Г—з, можно показать, что
существуют обратимые циклы, отличающиеся по своей конфигу
рации от цикла Карно, но имеющие одинаковый с ним теорети
ческий к. п. д . Докажем, что такой же, как в цикле Карно,
к. и. д . может быть получен в круговом процессе Л—В —С —В
—
А (рис. 5 .9), состоящем из изотерм Л—В и С—В и двух экви
дистантных в горизонтальном направлении кривых В — С и
В —Л, если усложнить установку включением в ее схему допол
нительного теплообменника, называемого регенератором.
Назначение регенератора состоит в поглощении теплоты., от
даваемой рабочим телом во время процесса В —С, и в обрати
мой передаче этой теплоты рабочему телу в процессе В —Л.
Поскольку кривые В —С и В —Л эквидистантны, то заштрихо
ванные площади одинаковы:
|?в-с|=пл . ¿СВе=*7о-л*япл. аВЛВ,
т. с. дв-с и Яп-л численно одинаковы и отличаются только зна
ком. Действие такой установки происходит следующим образом:
на пути Л—В тело получает от источника теплоту ди измеряе
мую пл. ЬАВе, отдает регенератору в процессе В —С теплоту
9в-с» измеряемую пл. йСВе%а затем приемнику— теплоту да,
соответствующую пл. аОСй%и в заключение цикла получает от
регенератора теплоту до-л> измеряемую пл. аОАЬ.
Таким образом, из-за наличия регенерации на осуществле
ние цикла расходуется то же количество теплоты ди получае
мой от источника, что и в цикле Карно Л—В —£
—£
— Л. Далее,
так как кривые В—С и В —Л эквидистантны, то В —Л —Л —В
—
■ ■ ££ и, следовательно, пл. ВС(/а= пл. РЕеЬ, т. е. теплота д%
76
в цикле Л—В —С —О—А та же, что и в цикле Карно
Л—В —£
—5
—А
Ори равенстве для обоих циклов
и <7? имеем, естественно,
равенство работ, полученных в этих циклах (пл. А В С й «=пл.
АВЕР) и равенство к. п. д .
Следовательно, при наличии регенератора к. п. д . цикла
А—В —С —О—А
—
7*/Г|.
Простейший регенератор можно представить себе в виде
длинной толстостенной трубы большой теплоемкости, тем пера
тура которой падает по длине в одном направлении от Тх до
Г2, будучи постоянной в к аж дом поперечном сечении.
В течение процесса В —С рабочее тело проходит через трубу
к теплоприемиику в этом направлении, а во время процесса
Ь —А оно идет по трубе в противоположном направлении и полу
чает от нее обратно то ж е количество теплоты. В общем слу
чае регенератором можно считать бесконечное множество источ
ников, значения температур которых составляют непрерывный
ряд от Тх до Т2. Эти источники называются промежуточными,
они участвуют лишь во внутреннем теплообмене, не влияющем
на величину теплообмена рабочего тела с источниками теплоты
постоянных температур Т\ н Т2.
Очевидно, что в той же системе может быть осуществлен
и обратный регенеративный цикл, перенос теплоты от источника
с температурой Т2 к источнику с температурой 7\. Холодильный
коэффициент такого цикла е такж е получится равным холодиль
ному коэффициенту цикла Карно
в=ек—7У(7*| —Т2).
Следовательно, регенеративный цикл, состоящий из двух изо
терм и двух эквидистантных кривых (в частном случае — поли
троп с одинаковым показателем п), может служить в качестве
образца как цикл наибольшей эффективности, при условии пос
тоянства температур основных источников. В связи с большей
общностью регенеративного цикла, равноценного циклу Карно,
такой цикл иногда называют обобщенным циклом Карно.
77
§ 5.5 . СВОЙСТВА И ФИЗИЧЕСКИЙ СМЫСЛ ЭНТРОПИИ.
НЕКОТОРЫЕ СВОЙСТВА ОБРАТИМЫХ
И НЕОБРАТИМЫХ ЦИКЛОВ
/
Обратимые циклы. Из общего уравнения для термического
к. п. д . прямого обратимого цикла Карно следует, что 1 — |<7г1/
/(71= 1—Т*/Тх.Отсюда Т2/Тх= Ы /?1 или ях/Тг—Ь7а|/^а=0 .Но
так как |?2|в— томожно написать ^|/Г|+^1//2—0 .
Отношение количества теплоты ях, полученной телом при об
ратимом изотермическом процессе, к абсолютной температуре
процесса Т (т. е. к температуре источника теплоты) называется
приведенной теплотой.
Последнее уравнение свидетельствует о том, что алгебраиче
ская сумма приведенных теплот в цикле Карно равна нулю.
В более короткой записи имеем
2(<7/П* 0.
(5.11)
Легко доказать, что этот результат сохраняет свою силу для
любого произвольного обратимого цикла.
Рве. 5 .10 . Определение суммы
приведенных теплот для про
извольного обратимого цикла.
Рис. 5 . 1 1 . К расчету изменения
энтропии в необратимом про
цессе.
Положим, что имеем обратимый цикл самого общего хар ак
тера А—В —С —О —А в диаграмме Г— 5 (рис. 5 .10). Проведя
ряд бесконечно близких адиабат, разобьем этот цикл на беско
нечно большое число элементарных циклов: а—Ь—с —д.— а, Ь—/ —
л—с —Ь и т. д. Каждый нз этих элементарных циклов состоит
из двух адиабат и двух элементарных отрезков контура данного
цикла. Поскольку из-за бесконечно малой длины этих отрезков
изменения температуры по ним бесконечно малы, в пределе
можно считать эти отрезки изотермами.
Таким образом, при бесконечно большом числе элементар
ных циклов их можно полагать элементарными циклами Карно.
В каждом элементарном цикле подводится теплота в количестве
йя\ и отводится ¿ 9*. Д ля каждого элементарного цикла Карно
согласно уравнению (5.11): 2(^/Г)« 0 и, следовательно, для
78
совокупности бесконечно большого числа этих элементарных
циклов, т. е. для цикла Л—В —С —О —А
$(йЯ!Т)- 0 .
(5.12)
($ — круговой интеграл, взятый по всему замкнутому контуру).
Это вполне соответствует ранее доказанному (§ 3.4), что
¿ ^ = ¿ 5 есть полный дифференциал, поскольку выражение
$ ¿ 5 = 0 означает, что энтропия системы, совершающей замкну
тый обратимый цикл, не претерпе вает изменений; энтропия есть
функция состояния. Интеграл (5.12) носит название интеграла
Клаузиуса и является характеристикой любого обратимого цик
ла, совершаемого любым рабочим телом.
Необратимые циклы. Д ля необратимого цикла Карно воз
можно применить общую формулу термического к. п. д .
Л*иоовр= 1 — \Qi\IQ\'
Так как для обратимого цикла Карно тцобр“ 1 — 7УГ| и
Л*яео«Р<П<овр. очевидно, что |<7*|/?!>7У Г1 или я%1Т%>Я\1Т\-
Значит,
Я\!Т\ — |ЯъI/^*2<0,
<7|/7'|+^2/7'2<0,
2(я1Т)<0.
(5.13)
Переходя к произвольному необратимому циклу, получим
Н<*Я/Т)<0.
(5.14)
Рассмотрим произвольный необратимый цикл. Пусть рабочее
тело необратимым процессом / — а — 2 переходит из состояния /
в состояние 2, в которых его энтропия будет равна 51 и 52
(рис. 5 .1 1 ) . Возвратим тело из состояния 2 в состояние 1 не
которым обратимым процессом 2 —6 —/ . Тогда цикл / —а —2 —
6—/ будет необратимым и для него $ Noя!Т) < 0 или | (¿^/7) +
1«-2
+ Г У я1Т )< 0 . Интеграл 5 (¿^/Г) относится к обратимому
2—Ь—1
9-6 -1
1
процессу и потому 5 (¿^/7) = Г ¿5 = 5 1—52. Тогда предыдущее
1 —6—1
2
неравенство примет вид
/ (¿<7/Г) + (5, -
52)<0
ИЛИ / (¿<7/Г)- (52- 5.)<0,
1-в -а
1 —«—а
2
откуда
52—51> /(¿?/Г).
Из этого следует, что хотя изменение энтропии в необрати
мом процессе будет таким же, как и в соответствующем обрати
мом (точки 1 и 2 общие), но только для обратимого процесса
2
изменение энтропии 52—5* будет равно Г (¿<7/Г ), а для не-
79
обратимого процесса оно будет больше этого интеграла. После
дифференцирования последнего неравенства имеем
ds>dq/T.
(5.15)
Рассмотрим изменения, вызываемые в конечных изолирован
ных системах обратимыми и необратимыми процессами. Изоли
рованными называются системы, состоящие из источников теп
лоты, рабочего тела и теплоприемников, которые не обменива
ются теплотой с окружающей средой и не имеют с нею механи
ческого взаимодействия. Д ля изолированных адиабатных си
стем имеем dq—0 .
Если в изолированной системе протекают какие-либо обра
тимые процессы, то изменение энтропии системы будет равно
ds=dq/T. Но так как dq*=0, то ds=0 или s=const. Значит,
при осуществлении в изолированной системе обратимых процес
сов энтропия в ней нс меняется. Если же в изолированной сис
теме осуществляются необратимые процессы, то изменение эн
тропии системы определится по формулеd s> dq!T или при dq**Q
ds> 0 и $2> $ 1* т. е. энтропия изолированной системы при осу
ществлении в ней необратимых процессов возрастает.
Обобщая полученные результаты, будем иметь
ds> 0,
Tds^dq.
(5.16)
Здесь знак равенства относится к обратимым, а неравенства —
к необратимым процессам.
Соотношение (5 .1 6 ), полученное на основании использования
второго закона термодинамики, может рассматриваться как ма
тематическое выражение этого закона.
Физическое содержание энтропии. Полученные результаты
можно обобщить следующим образом: энтропия изолированной
системы может оставаться без изменений (при обратимых про
цессах), может возрастать (при необратимых процессах), но
никогда не может уменьшаться. И наоборот, возрастание энтро
пии изолированной системы означает, что выполняемые в си
стеме процессы являются необратимыми, самопроизвольными,
происходящими только в одном направлении. Процесс, не вызы
вающий изменения энтропии системы, может быть обращен,
т. е. может происходить как в прямом, так и в обратном направ
лениях. Из этого следует, что энтропия является: во-первых,
критерием направления происходящих в изолированной системе
процессов и, во-вторых, мерой необратимости реальных процес
сов. Последнее и является одной из формулировок физического
смысла одного из параметров термодинамического процесса —
энтропии.
Необходимо различать понятия изменения энтропии системы
и отдельного тела. Энтропия отдельного тела может оставаться
без изменений, может возрастать, либо уменьшаться.
Выражение d s = 0 , s —const, полученное нами для изолиро-
80
ванной системы, в которой осуществляются обратимые процессы,
относится ко всей системе в целом. Оно свидетельствует лишь
о том, что при оуществленин обратимых процессов отрицатель
ные изменения энтропии отдельных тел равны положительным
изменениям энтропии других тел системы. Тот факт, что не
обратимые процессы всегда приводят систему к состоянию р ав
новесия как наиболее вероятному состоянию, позволил К л ау
зиусу вы сказать принцип «возрастания энтропии»: энтропия изо
лированной системы может лишь увеличиваться, но никогда не
уменьшается, и принимает максимальное значение при равно
весии системы.
Потеря работоспособности системы вследствие необратимо
сти процессов. Тот факт, что течение необратимого процесса
^ 1*-)?мо»
^Га
всегда сопровождается увеличением энтропии, имеет огромное
практическое значение. Во-первых, это дает основание для реше
ния вопроса о возможном направлении процессов. Самопроиз
вольные процессы возможны лишь в направлении, при котором
энтропия системы возрастает. Во-вторых, это положение дает
основание для суждения о возможной глубине самопроизволь
ных процессов, которые прекращаются при максимальном зна
чении энтропии. В -третьих, чрезвычайно важ но то обстоятель
ство, что одновременно с увеличением энтропии изолированной
системы при осуществлении в ней необратимых процессов про
исходит уменьшение работоспособности системы.
Для доказательства последнего утверждения рассмотрим сле
дующий частный пример. Д опустим, что в изолированной си
стеме (рис. 5 .12 ), состоящей из тел А, В и С, происходит не
обратимый процесс передачи теплоты от горячего тела А к бо
лее холодному В. Обозначим температуру тел через Г * Ть и
Тс н примем, что температура тела А будет максимальной в си
стеме, а температура тела С —-минимальной.
Рис. 5 .12 . К расчету уменьшения работоспособности си
стемы .вследствие необратимости происходящих в ней про
цессов.
6 Зак. 80
81
Рассмотрим, как повлияет на такую систему необратимая
передача теплоты в количестве д от тела А к телу В. Заметим,
что при этом изолированная система не теряет теплоты, сниж а
ется лишь ее температурный уровень.
При этом процессе уменьшается энтропия тела А и увеличи
вается энтропия тела В. Примем для простоты, что тела А и В
весьма велики и поэтому переход малого количества теплоты д
от одного тела к другому вызывает лишь ничтожные изменения
температур, которыми можно пренебречь.
Тогда изменения эатропин этих тел можно принять, как для
изотермических процессов Д5в= — д/Та; Азь=д/Ть-
Тело С не участвует в теплообмене, поэтому Д$с—0. Следова
тельно, изменение энтропии системы равно
Д^спст = Д$а "ЬД$6 Ч*Д$с= Д$а Ч Д$6,
"
Д$сист= — <?/Та+ д/Ть = д(1/Ть \/Та) .
Так как Ть< Т а, то последняя формула свидетельствует о том,
что в результате рассматриваемого необратимого процесса эн
тропия системы увеличивается.
Рассмотрим далее влияние этого необратимого процесса па
работоспособность системы. Д ля этого определим максимальную
работу, которую можно было бы получить от количества теп
лоты д в случаях, когда в системе еще не осуществлялся не
обратимый процесс и когда этот процесс перехода теплоты от
А к В был уже осуществлен.
Максимальная работа получается при заданных условиях
в цикле Карно.
В первом случае (см. рис. 5 .12 , а), когда тело В не участ
вует в теплообмене и цикл совершается между источниками А
и С (Ттлх=*Та и Гш т—Т’г), максимальная работа будет равна
/,=л^ - (1 -Гс/Г0)^
так как г|«'=/|/^= 1 —Гс/Гв.
Во втором случае (рис. 5 .12 , б) количество теплоты д пере
дается телом А телу В, цикл Карно совершается между те
лами В и С (ТтйХ= Ть и 7\п|П= 7 с), та же самая теплота д со
вершит работу
(1-7УГь)<7,
так как ц/'^Ыд^ 1—7С/Гб-
Сравнивая формулы для 1\ и /2, легко убедиться, что поскольку
Ть < Т а, то /2< / ь Это уменьшение механической работы, полу
чаемой из количества теплоты д, вызванное осуществлением
в системе необратимого процесса перехода теплоты от тела А
к телу В, будет равно Д/=*»/1— /2= 7с(1/7ь— 11Та)д или, так как
согласно ранее выведенному д(\/Ть— 1 / 7 а) =Д$сист, то
Д^“ 7еДЗсмст= 7т1пДискет*
(5.17)
82
Следовательно, необратимые процессы, вызывающие увели
чение энтропии изолированной системы, уменьшают ее работо
способность. При этом уменьшение работоспособности будет
пропорционально произведению минимальной температуры си
стемы на увеличение ее энтропии.
Как видно из примера, снижение температурного уровня
теплоты ведет к некоторому ее обесцениванию в смысле возмож
ностей получения работы из этой теплоты. Мерой этого обесце
нивания энергии тела — источника теплоты — и является увели
чение энтропии системы.
Неправильность обобщений Клаузи уса. Исходя из постулата
об односторонней направленности теплообмена, Р . К лаузиус, ос
новываясь на ненаучном представлении о конечности вселен
ной, сформулировал второй закон термодинамики следующим
образом: «Энтропия вселенной стремится к максимуму».
По Клаузиусу, вселенная представляет замкнутую систему,
в которой все время происходят необратимые процессы и, сле
довательно, возрастание энтропии.
При этом, хотя общее количество энергии системы не изме
няется, но вследствие необратимости процессов энергия д ег р а
дирует. В итоге все преобразования энергии должны сводиться
к превращению любых видов энергии в теплоту; последняя
путем теплообмена снижает свой температурный уровень до
минимального (т. е. до уровня О К) и, наконец, наступит так
называемая «тепловая смерть», т. е. всякие процессы прекра
тятся. Эти утверждения, разумеется, совершенно неправильны.
Вспомним, что односторонность естественных процессов, л е
жащих в основе постулата Клаузиуса, установлена из опыта н,
следовательно, ограничена его рамками.
Экстраполяция на всю вселенную опытного материала, полу
ченного на Земле — в маленьком уголке безграничного про
странства, в течение бесконечно малого отрезка времени суще
ствования науки в сравнении с бесконечным временем, — не
допустима. Утверждать, что в природе постоянно происходит
только необратимое рассеяние энергии, — значит совершать гру
бейшую ошибку, противоречащую всем нашим знаниям о про
исходящих во вселенной процессах и основным представлениям
диалектического материализма о неуничтожимости движения и
бесконечности процесса развития материи.
Ф. Энгельс с исчерпывающей полнотой показал, что при
знание положения К л аузи уса о стремлении энтропии вселенной
к максимуму приводит к отрицанию закона сохранения и пре
вращения энергии. В природе, наряду с рассеянием энергии,
всегда происходят обратные процессы концентрации «рассеян
ной» тепловой энергии в новые виды энергии, например эне р
гии электрических зарядов, энергии возбуждения н распада
атомов и т. п. Энгельс первым указал на возможность такой
концентрации.
6*
83
Работы советских астрофизиков (В. А . Амбарцумяна, В . Г . Ф е
сенкова, Д . К . Рожковского) показывают, что во вселенной меж
звездная пыль, газы и другие формы материи постоянно под
воздействием сил тяготения концентрируются в туманности,
масса которых может в несколько раз превышать массу Солнца.
По мере сжатия такой туманности происходит увеличение тем
пературы до нескольких сот тысяч градусов, при которой на
чинаются ядерные реакции превращения легких элементов в бо
лее тяжелые, например водорода в гелий. Возникновение тер
моядерных реакций приводит к дальнейшему увеличению темпе
ратуры, результатом которого является взрыв первичной тум ан
ности и образование множества новых звезд-планет, т. е. воз
растание энергии и ее концентрация, приводящая к уменьшению
энтропии рассматриваемой системы.
Сказанное является ярким, но далеко не единственным при
мером, подтверждающим научные основы материализма и опро
вергающим ненаучную «теорию» тепловой смерти.
Глава 6
ЦИКЛЫ ГАЗОВЫХ МАШИН
§ 6.1 . ТЕОРЕТИЧЕСКИЙ ЦИКЛ
ВОЗДУШНОЙ ХОЛОДИЛЬНОЙ МАШИНЫ
Посредством рабочего тела — газа могут быть осуществлены
прямые и обратные циклы.
Для изучения основных принципов действия газовых машин
будет применен термодинамический метод исследования циклов,
об особенностях которого говорилось в § 5.2 .
Вначале рассмотрим обратный цикл, осуществляемый в газо
вой (воздушной) холодильной машине.
Обратный газовый цикл осуществляется в воздушных холо
дильных машинах. Воздух, будучи вполне доступным для ис
пользования и совершенно безвредным газом, является в прин
ципе наиболее подходящим рабочим телом газового обратного
цикла.
Рассмотрим принцип работы воздушной компрессорной х о
лодильной машины.
На рис. 6 .1 показаны четыре основных элемента установки.
Воздух из теплообменника, расположенного в охлаждаемом
помещении £ , засасывается компрессором А и подвергается
адиабатному сжатию, в результате чего температура воздуха
возрастает. Сжатый воздух выталкивается в воздухоохладитель
В и охлаждается водой, после чего поступает в расширитель
ный цилиндр (или детандер) С, где расширяется до началь
ного давления, производя при этом полезную работу. При рас-
84
ширении температура воздуха значительно падает, достигая,
например, — 60— 70*С (или ниже, в зависимости от режима
работы установки). Холодный воздух поступает в теплообменник
охлаждаемого помещения £ , где, нагреваясь, отнимает теплоту
¿72 от охлаждаемых тел. Далее цикл повторяется.
Теоретический цикл воздушной холодильной машины пред
ставлен на диаграмме р—и (рис. 6.2, а ). Теоретическим этот
цикл называется потому, что процессы сж атия и расширения
в нем принимаются адиабатными обратимыми без учета не
обратимых потерь на теплообмен с окружающей средой и тре
ние, имеющих место в реальных компрессорах и детандерах.
Процессы нагрева и охлаждения рабочего тела также счи
таются обратимыми.
Рис. 6 .1 . Схема устройства воз
душной холодильной машины.
Линия а— 1 соответствует всасыванию компрессором воздуха
из охлаждаемого помещения; 1 —2
—
адиабатному сжатию воз
духа от начального давления р0 до конечного давления р;
2 — Ь — выталкиванию сжатого воздуха в воздухоохладитель.
Затем осуществляются последовательно изобарное охлаждение
сжатого воздуха в холодильнике (линия 2 —3), адиабатное рас
ширение воздуха в детандере (3— 4) и изобарное нагревание
воздуха (4— 1) при отводе теплоты рг от охлаждаемого тела
(помещения).
Постоянство давлений в процессах теплообмена, соответст
вующих линиям 2 —5 и 4—1 , обеспечивается балансом количе
ства рабочего тела, входящего в теплообменник и выходящего из
него, и постоянством режимов работы компрессора и детандера.
Площадь Ь21а соответствует работе компрессора /к, а пло
щадь Ь34а — работе расширительного цилиндра /о, причем ин
дикаторные линии а—4 и Ь—3 соответствуют лишь перемеще
нию поршня при всасывании воздуха в расширительный цилиндр
и выталкивании из него; отображаемые ими процессы не явля
ются термодинамическими.
Таким образом, получаем обратимый обратный цикл 1 — 2 —
3— 4—1, состоящий из двух адиабат и двух изобар.
Работа, затрачиваемая в воздушной холодильной машине,
равна разности работ сж атия в компрессоре и расширения в д е
тандере |/ц|в |/и| —/д=пл . 3214. За счет этой работы и совер
шается обратный цикл с холодильным агентом — воздухом, в ре-
85
зультате которого теплота переносится от тела более холод
ного— охлаждаемого помещения, к телу более нагретому —
воде в воздухоохладителе.
На рис. 6.2, б рассматриваемый цикл 1 —2 —3 —4 —1 изобра
жен в диаграмме t —s.
Количество теплоты q9t отводимое одним килограммом агента
от охлаж даемого помещения (удельная холодопроизводитель-
ность установки), соответствует площади Ь41а, количество теп
лоты ф1, отдаваемое одним килограммом агента источнику боль
шей температуры (воде), — площади а23Ь, количество затрачен
ной работы — площади цикла 1 —2 —3 —4 . Холодильный коэф
фициент этого цикла е легко подсчитать, если учесть, что при
Рис. 6 .2 . Цикл воздушной холодильной машины в рабочей (а)
и тепловой (0) диаграммах.
постоянной теплоемкости во здуха ЯгжСр(Т\—Т*)> \Я\\явСр (Т7—
— Тг),
• -?*//ц-*1/(Ы —Яг)-
-
(Г, -
Г,)/[(Г, -
Тг)-(Г, -
Г,)).
Так как процессы сжатия 1 —2 и расширения 3—4 происходят
по адиабатам между одними и теми же давлениями р0 и р, то
Т^Тх-Т^Ть поэтому можно записать:
7УГ,= 7УГ4-(Т2- Г,)(Г, -
Г4).
(6.1)
В формуле теоретического холодильного коэффициента
в —(Г 1— Г4)Д(Г|— Га)—(Тх—Г4)] разделим числитель и знамена
тель первой части на разность Т\—Т^. Получим е —1/[(Г*— Г|)/
/(Тх—Г4)— 1 ]. Используя (6.1), можно написать окончательно
е= 1/(Г2/Г, -
1)-Т х!(Т2- Тх)
(6.2)
е= 1/(Га/Г4- 1) - ТЛТ9- Г4).
(6.3)
или
86
Рассмотренный цикл малоэффективен при постоянных тем
пературах охлаждаемого помещения и среды (воды в воздухо
охладителе). В этих условиях изобарные процессы теплообмена
можно полагать обратимыми лишь условно, поскольку они про
исходят при конечной разности температур м еж ду источниками
теплоты и рабочим телом.
Реальная необратимость цикла связана с дополнительным
расходом работы на обеспечение нужной холодопроизводитель-
ности установки, величину этого дополнительного расхода мож
но определить, сравнив данный цикл с циклом Карно, осуществ
ляемом в том же интервале температур источников.
В цикле 1 —2 —3 —4—1 (см. рис. 6.2) постоянная темпера
тура охлаждающей воды нс должна превышать величину Г3,
а постоянная температура охлаждаемого помещения не может
быть ниже Ти иначе теплообмен между рабочим телом и источ
ником теплоты был бы неосуществим. Поэтому температуры
Г| и Гз, являясь предельными температурами источников теп
лоты, могут быть приняты в качестве предельных температур
для обратимого цикла Карно 1—2'—3 —3'— 1.
Как видно из рисунка, холодопроизводительность обратного
цикла Карно, осуществляемого с теми же источниками теплоты,
что и цикл воздушной холодильной машины, численно равная
пл. Ь3 ' 1 а, больше холодопроизводительности цикла воздушной
холодильной машины на величину пл. 4 34.
Затраченная в цикле Карно работа, соответствующая за
штрихованной площади 3 2 4 3 \ меньше работы цикла воздуш
ной холодильной машины на сумму площадей 344 и 3 2 2 Холо
дильный коэффициент обратного цикла Карно 1 —2 ' —3 —3 ' — 1
равен ек=7'|/(7з—Т}). Так как 73 всегда меньше Г2. то из
сравнения этой формулы с формулой (6 .2 ) видно, что е к > е .
Рассмотренный цикл воздушной холодильной машины тер
модинамически целесообразен при наличии источников перемен
ной температуры, т. е. в том* случае, когда температура охлаж
даемого помещения (тела) снижается за время процесса тепло
обмена его с рабочим телом, а температура воды в воздухоохла
дителе повышается в процессе отдачи ей теплоты рабочим те
лом.
В этом случае необратимые потерн при использовании цикла
существенно снижаются.
Нужно иметь в виду, что для обеспечения более или менее
значительной холодопроизводительности машины приходится
прогонять через нее весьма большое количество воздуха. По
этому применение в качестве компрессора и детандера поршне
вых машин (как это было принято на схеме рис. 6 .1 ) становится
нецелесообразным из-за больших размеров и высокой стоимости
этих машин.
Это обстоятельство долгое время препятствовало широкому
применению воздушных холодильных машин. В настоящее вре-
87
ыя в связи с успехами, достигнутыми в строительстве турбо*
машин, есть возможность делать вполне экономичные воздуш
ные холодильные машины с использованием турбокомпрессоров
и турбодетандеров.
§де.циклыпоршневых
ГАЗОВЫХ ДВИГАТЕЛЕЙ
Прямой газовый цикл осуществляется в двигателях внутрен
него сгорания. Двигателями внутреннего сгорания называют
большую группу тепловых двигателей различных конструкций,
в которых рабочим телом является газ или приближающаяся
по свойствам к газу горючая смесь, при этом горение смеси осу
ществляется в цилиндре двигателя.
По конструктивным особенностям и принципу действия дви
гатели
внутреннего
сгорания
(ДВС) делятся на поршневые,
газотурбинные и реактивные.
Циклы поршневых ДВС мож
но свести к трем основным ви
дам;
1 ) с подводом к рабочему
телу теплоты при постоянном
объеме;
2 ) с подводом теплоты при
постоянном давлении;
3) с подводом теплоты сн а
чала при
постояном
объеме,
а потом при постоянном давле
нии (смешанные циклы).
Циклы Д В С с подводом теп
лоты при постоянном объеме.
В двигателях, работающих по циклу с таким подводом теплоты,
применяется жидкое или газообразное топливо (бензин, керо
син, генераторный и светильный газ и т. п .) .
Этот цикл часто называют циклом Отто. Принцип действия
Д В С , использующего такой цикл, рассмотрим на примере четы
рехтактного двигателя, схема и индикаторная диаграмма ко
торого изображены на рис. 6 .3 .
При ходе поршня вправо (первый такт) в цилиндр двигателя
через всасывающий клапан / засасывается рабочая смесь, пред
ставляющая собой либо смесь горючего газа с воздухом, либо
смесь с воздухом паров и мельчайших капелек жидкого топ
л и в а— горючая смесь, получаемая в специальном аппарате —
карбюраторе. Процесс всасывания соответствует линии О—А
При ходе поршня влево (клапаны закрыты) происходит сж атие
рабочей смеси по линии А—В (второй такт). В тот момент,
V
Рас. 6 .3 . Схема и индикаторная
диаграмма Д ВС с подводом теп
лоты при постоянном объеме.
когда поршень достигает крайнего левого положения, горючая
смесь воспламеняется от электрической искры, полученной в з а
пальной свече. Быстрое нарастание давления вследствие сгора
ния смеси при весьма малом смещении поршня характеризуется
линией В —С. Затем продукты сгорания расширяются, переме
щая поршень вправо (третий такт), совершается рабочий ход
С— £ , соответствующий совершению полезной работы. К огда
поршень приходит в крайнее правое положение, открывается
выхлопной клапан 2 и вследствие вытекания газов в атмосферу
давление в цилиндре резко падает (отрезок й —£ индикаторной
диаграммы). Четвертый такт происходит при открытом выхлоп
ном клапане и представляет собой выталкивание или выхлоп
отработанных газов, имеющих давление, несколько превышаю
щее атмосферное (линия £ — 0 ) . Д ал ее перечисленные процессы
повторяются.
Так же как прн анализе работы компрессора, рассматривая
индикаторную диаграмму, нельзя отождествлять ее с термоди
намическим циклом. Однако, вводя ряд допущений при р ас
смотрении процессов, м ожно с некоторой степенью условности
принять, что двигатель работает по термодинамическому циклу.
Во-первых, можно, пренебрегая сопротивлением клапанов, по
лагать, что всасывание и выхлоп происходят при одинаковом
(атмосферном) давлении и поэтому работа этих процессов оди
накова по величине и противоположна по знаку. Тогда суммар
ное значение работы обоих процессов равно нулю и эти вспо
могательные процессы в термодинамическом анализе можно не
учитывать.
Реальные процессы сжатия и расширения рабочего тела
условно заменяются обратимыми адиабатами; реальный процесс
сгорания горючей смеси рассматривается как обратимый под
вод теплоты к неизменному рабочему телу. Кроме того, счита
ется, что сгорание происходит мгновенно (имеет характер взры
ва ), т. е. принимается, что подвод всего количества теплоты осу
ществляется при неподвижном поршне и, следовательно, при
постоянном объеме. Процесс падения давления в цилиндре
при открытии выхлопного клапана (линия О—£ ) условно за
меняется изохорным процессом отвода теплоты от рабочего тела
к теплоприемиику (окружающей среде). Процесс выхлопа дей
ствительно можно считать эквивалентным изохорному процессу
охлаждения рабочего тела, поскольку полезная работа при вы
хлопе равна нулю и отдаваемая газами теплота идет лишь на
увеличение внутренней энергии окруж ающ ей среды.
Таким образом, цикл двигателя Отто состоит из двух изохор
и двух адиабат. На рис. 6.4 он представлен в рабочей (р— о)
и тепловой (Г—5) диаграммах, где 1 —2
—
адиабатное сжатие
горючей смеси; 2 —3
—
изохорный подвод теплоты (при горе
нии топлива); 3—4 — адиабатное расширение продуктов сгора-
89
ния; 4— 1
—
условный изохорный процесс отвода теплоты, экви
валентной выхлопу отработанного газа.
Этот цикл однозначно определяется заданием начального со
стояния рабочего тела (точка /) и значениями степеней сжатия
и повышения давления. Степенью сжатия е называют отноше
ние объемов 0 1/0 2; степенью повышения давления А. — отноше
ние Ра/Р2.
Определим к. п. д . цикла, полагая для простоты ср и с«, сле
довательно, и к —сР1 с9 во всем цикле постоянными.
Количество теплоты, сообщаемой рабочему телу источником
в процессе 2—£, измеряется площадью й23с в диаграмме Г—5
и может быть вычислено по формуле д\*=с9(Т%— 7У).
Рис. 6.4. Цикл Д ВС с подводом теплоты прн по
стоянном объеме в рабочей (а) и тепловой (б)
диаграммах.
Теплота отводится только в процессе 4— / (пл. Л14с) в коли
честве Я г~ с9(Тх—ТА). Очевидно, что по этой формуле значение
Ра отрицательно, в абсолютном выражении \я%\-*с9(ТА—Тх).
Работу цикла в соответствии с первым законом термоди
намики можно найти из формулы
М
(площадь цикла 1 —2 —3 —4 в диаграмме Т—5) или из фор
мулы
/ц«/расш— |/сш|
(площадь цикла 1 —2 —3 —4 в диаграмме р—г»). Термический
к. п .д . цикла может быть вычислен по общей формуле т)<=
в 1— |ра|/рь либо можно вывести формулу для к. п. д ., при
сущую именно данному циклу и потому удобную для анализа
работы двигателя. Д ля этого подставим в общую формулу
к.п .д . значения Я\ и |рз|, определенные выше:
1 - с9(Т4- ГО/ЫГз - Т2)]- 1
-
(Г4- Т\)ЦТъ - Г2).
90
В числителе дроби правой части этого выраж ения вынесем
за скобки Ти а в знаменателе Т2, получим
_
(Г,/Г2) (Г4/Г! — 1)]/(Гз/Г2— 1).
Для адиабаты 7—2 справедливо соотношение между пара
метрами Тт/Тх*= (»1/0 2) “ в* “ 1 и аналогично для адиабаты
3—7: Гз/Л«(01/02)*"'“ е*“ 1.
Следовательно,
Г2/Л = Га/Л;
Л/Г^Гз/Л -и формула термического к. п. д. получит вид
Л1-1 -Г ,/Г1-1 -1/в*-1.
(6.4)
Как видно из уравнения (6.4), термический к. п. д . цикла
с изохорным подводом тепла вполне определяется степенью
адиабатного сжатия или расширения е = 0 1/0 2 и возрастает с ее
увеличением.
Повышая е, мы увеличиваем 0 | или уменьшаем о2, т. е. опус
каем изохору 4— 7 или поднимаем изохору 2 —3 (на диаграмме
Г—5 ), другими словами, уменьшаем |ф2| или увеличиваем <71 и»
следовательно, повышаем т|*.
Влияние е на величину
можно иллюстрировать следую
щими численными примерами (здесь Л—1 ,3 3):
с
4
5
6
7
8
9
36,7 41,2 44,6 47,4 49,6 51,5
Поэтому развитие и усовершенствование двигателей вну
треннего сгорания неизменно были связаны с повышением сте
пени сжатия: в первых двигателях обеспечивалась степень сж а
тия, равная 2—4, в современных — 8 — 1 2.
Однако увеличению е в двигателе Отто имеется предел, зна
чение которого зависит от состава горючей смеси. В самом деле,
при адиабатном сжатии горючей смеси одновременно с повыше
нием давления возрастает и ее температура (от Т\ до Г2), при
чем температура конца сжатия Т2 обязательно должна быть
ниже температуры самовоспламенения горючей смеси. В про
тивном случае возможна самопроизвольная преждевременная
вспышка до возвращения поршня в левое крайнее положение,
что не только ухудшит работу двигателя в тепловом отношении,
но может привести и к поломке машины.
Цикл Д В С с подводом теплоты при постоянном давлении.
Необходимость ограничения в увеличении степени сжатия от
падает, если горючее и воздух сжимать отдельно. Раздельное
сжатие имеет еще и то практическое удобство, что горючее,
вводимое в цилиндр двигателя, уж е содержащий сжатый воз
дух с температурой, превышающей температуру самовоспламе
нения горючего, сгорает само собой, без применения запальных
приспособлений, при этом не нужен и карбюратор. Введение
в цилиндр потребного количества топлива, а следовательно, и
процесс сгорания его, начинаясь в мертвом положении поршня,
9!
требуют некоторого времени и могут происходить в разных
условиях. Обычно подача горючего регулируется таким обра
зом, чтобы сгорание шло при постоянном давлении. Такие дви
гатели работают исключительно на жидком топливе — нефти,
мазуте, соляровом масле и т. п.
Создание двигателя со сгоранием топлива при постоянном
давлении связано с именем Р. Дизеля, поэтому часто такой
двигатель называют двигателем Дизеля.
*
Принцип работы этого двигателя рассмотрим одновременно
с рассмотрением его термодинамического цикла, изображаемого
Ряс. 6 .5 . Цикл ДВС с подводом теплоты пря по
стоянном давлении в рабочей (о) и тепловой (б)
диаграммах.
В цилиндр двигателя засасывается атмосферный воздух, за
тем всасывающий клапан закрывается и воздух адиабатно сжи
мается при ходе поршня влево. Процесс сжатия воздуха изо
бражен на диаграммах (рис. 6 .5) адиабатой 1 —2 .
В конце сжатия давление воздуха достигает 3,0— 4,0 МПа
(30—40 ат), а температура 600—800° С. После этого в цилиндр
вводится через форсунку жидкое топливо в мелкораспыленном
виде.
Распыление топлива осуществляется сжатым воздухом при
давлении 5,0—6 ,0 МПа (50—60 ат), подаваемым от специаль
ного компрессора. Топливо, попадая в среду сжатого воздуха,
воспламеняется и сгорает по мере его ввода, при постоянном
давлении, выделяя на 1 кг рабочего тела количество теплоты
Этот процесс соответствует в диаграммах отрезку изобары
2 —3.
В состоянии, соответствующем точке 3 %горение топлива пре
кращается, а образовавшиеся горючие газы начинают адиа
батно расширяться (процесс 3 —4). Следовательно, в этом цик
ле работа производится в д вух процессах: 2 —3 и 3 —4.
По окончании процесса расширения открывается выхлопной
клапан и продукты сгорания удаляются в атмосферу; этот про-
92
цесс, как и в предыдущем случае, условно изображается изохо-
рой 4—1 . В этом процессе рабочее тело отдает теплоприемнику
(атмосфере) теплоту д%.
Отношение объемов 0 1/ 0 3 по-прежнему будем называть сте
пенью сжатия е. Отношение объемов 0 3/0 2 называется степенью
предварительного расширения и обозначается р. Обычно в дви
гателях Дизеля степень сжатия е достигает 13 — 18. Дальней
шее повышение степени сжатия нецелесообразно, так как уве
личение термического к. п. д . при этом сводится на нет умень
шением механического к. п. д .
Количество теплоты ди подведенное к рабочему телу в про
цессе 2 —3 , соответствует площади под этим процессом в ди а
грамме Г— 5 и может быть вычислено по формуле
^1«»Ср(7з — Гз).
Теплота, отдаваемая рабочим телом атмосферному воздуху
при выхлопе: дг^с^Т х—Г4), поскольку 7*|<Г4, значение теп
лоты <7з, вычисленной по этой формуле, будет отрицательным.
В абсолютном выражении: | ^ | —с *(74—Т\). Теплота цикла и
эквивалентная ей работа, полученная за цикл, д ^ 1ц» д г— |ф2|
соответствуют площади цикла в диаграммах Т— 5 и р—0 .
Формулу для термического к. п. д . цикла, отражающую его
особенности, получим из общей формулы к. п. д .
Температуры Т\9 Т* и 74 можно выразить через Г9. Для изо
бары 2—3: Гз/7а—0 э/о2 =-р и, значит, 7зв 7з/р. Д ля адиабаты
3—4: Г3/Г4—(0 |/оз)*“ 1* Обозначим 0 1/0 3—6
—
степень адиабат
ного расширения, тогда 74—7з/6*- 1 . Для адиабаты 1 —2: 7У 7 1 —
— ( » 1/03)*-*
—е* " 1 и 7'1 = 7Уек~, -=7з/(ре*"1)* В таком случае
в выражении для т)(
<Г4- Тх)ПТ%- Г,) - [7У6*-1 - 7У (ре*-')Л/(Г, -
7Ур) -
— (1/6*“ 1 — 1/(ре*“ |))/(1 — 1/р).
Величины р, е и б связаны меж ду собой простым соотно
шением 6 =v\|vъ—v^|v2^í=vг/vi=г|p, т. е. две из них определяют
третью, так что можно написать (Т4—7|)/(7У -7 а) —{(р*“ 1/«*"1—
—
1)/(оел—*)]/[(р—1)/р]= (1/е*“ 1) (р*— 1)/(р—1) и,
следова-
телъно,
Л1-1
—
О/*) О/е*-1) (Р* - 1)/(р - 1).
(6.5)
Формула (6.5) показывает, что термический к. п. д . цикла
с подводом теплоты при постоянном давлении увеличивается
с возрастанием степени сжатия в и уменьшается с возрастанием
степени предварительного расширения р.
Цикл со смешанным подводом теплоты. Двигатели с изобар
ным сгоранием топлива имеют ряд недостатков (наличие ком
прессора для распыливания топлива, усложняющее конструк
цию и снижающее экономичность двигателя, высокое конечное
давление при больших степенях сжатия, делающее необходимым
утяжеление двигателя, сложное устройство форсунок и т. п .) .
93
Поэтому возникли попытки создать двигатель, работающий
без компрессора, по циклу, являющемуся комбинацией циклов
с подводом тепла при о«const и при р —const и занимающему
промежуточное место между ними. Такой цикл, именуемый цик
лом со смешанным сгоранием, был предложен и осуществлен
впервые русским инженером Г. В . Тринклером. Все современ
ные двигатели с самовоспламенением работают по смешанному
циклу. В этих двигателях воздух и топливо также сжимаются
раздельно. Воздух всасывается в цилиндр двигателя и сжима
ется в нем до давления, соответствующего температуре воспла
менения.
Ряс. 6.6. Цикл Д ВС со смешанным подводом теплоты
в рабочей (а) я тепловой (б) диаграммах.
Последующее распыливанне жидкого топлива производится
при помощи механических форсунок. Подача топлива к форсун
кам осуществляется жидкостным насосом при высоких давле
ниях, достигающих 30—40 МПа (300— 400 ат), причем неравно
мерно: часть жидкого топлива (меньшая) вводится в сжатый
в цилиндре воздух точно в левом мертвом положении поршня
и сгорает теоретически мгновенно (при о —const), а остальная
(большая) поступает в цилиндр при движении поршня, сгорая
при постоянном давлении.
Таким образом, теоретический цикл двигателя со смешанным
подводом теплоты имеет форму 1 —2 —3 —4 —5 — / (рис. 6 .6 ) и
состоит из следующих процессов: 1 —2
—
адиабатное сжатие
воздуха; 2—3
—
нзохорный подвод теплоты; 3 — 4 — изобарный
подвод теплоты; 4—5
—
адиабатное расширение продуктов сго
рания; 5—1
—
нзохорный отвод теплоты.
Теплота, подводимая в процессе 2 —3 , равна q\~>c9(Ti— Тг)
и в процессе 3—4:
ср(Т4—Тг). Всего же расходуется на
цикл
94
qiamqi'+ q i"ssc9(Tt — 7*) +Ср(Г| — Г*).
В процессе 5 — / отдается теплота в количестве q2= c v(T\— Г#)
или |9з| в С*(Т8—Т\), поэтому к. п. д . цикла
Л«в 1 — I^a|/^i“ 1 — c9(Ts — T\)J\c9(Tz — 7 *2) +
+сР(Г4-Г ,)) -1
-
(Г* — Г0/|Г» — Г9+1к(Г« — Г*)1.
Обозначив Гз/Г2 «ра/Рак Я. и проведя ряд алгебраических
преобразований, можно получить
Л<=1 - (l/е*“1)(V-ОД*“
1+*Мр-1)]. (6.6)
Как видно, термический к. п. д . цикла возрастает с увеличе
нием е и Я. н с уменьшением р.
Рве. 6 .7. Сопостявление циклов Д ВС при одинаковой степени сж а
тия (а) и при одинаковых максимальных температуре н дав
лении (б).
При А ,* 1 смешанный цикл обращается в цикл с изобарным
подводом теплоты, а при р — 1
—
в цикл с изохорным подводом
теплоты; при этом уравнение (6 .6 ) переходит соответственно
в уравнения (6.5) или (6.4).
Сравнение циклов поршневых двигателей. Д л я с равн и тел ь
ного анализа эффективности различных типов поршневых Д В С
можно ограничиться сопоставлением термических к. п. д . циклов
этих двигателей, поскольку эффективный к. п. д . их меняется
при переходе от одного двигателя к другому примерно так же,
как т)г.
Наиболее наглядным является сопоставление циклов в диа
граммах, например в диаграмме Т— 5 (рис. 6 .7).
На рис. 6.7, а изображены цикл 1 —2 —3 —4—1 со сгоранием
при v= const; цикл 1—2 —3 " —4—t со сгоранием при р—const
и цикл 1 —2 —5 —3 " —4 —1 со смешанным сгоранием с одинако
вой степенью сж атия е и с одинаковым значением q2.
Поскольку для любого из этих циклов справедлива общая
формула термического к. п. д .
1 — |<7а|/<7ь а подведенная
теплота q\ для цикла со сгоранием при 0 —const больше, чем
95
для д вух других циклов, очевидно, что при одинаковом q2
см>т1 м ь т. е. при одинаковых степенях сжатия наи
более эффективным оказывается цикл с подводом теплоты при
постоянном объеме, наименее эффективным — цикл с подводом
теплоты при р —const; цикл со смешанным подводом теплоты
занимает промежуточное положение.
Однако сравнение циклов при одинаковых степенях сжатия
нс соответствует действительным условиям работы двигателей,
поскольку отличительной особенностью двигателя с подводом
теплоты при р —const как раз является возможность использо
вания больших степеней сжатия, чем в двигателе с подводом
теплоты при v = const.
Наиболее целесообразно сравнивать циклы поршневых Д В С
при одинаковых максимальных давлениях и температуре, так
как именно эти условия определяют конструктивные особенно
сти двигателей, их прочность, надежность в эксплуатации и пр.
При этом для однозначного определения смешанного цикла
необходимо, кроме того, задать значение степени сжатия еСм*
Очевидно, что это значение будет удовлетворять условию е г<
< е См <еР, где еР и еР — степени сжатия соответственно для
циклов с подводом теплоты при v = const и р = const.
Сравниваемые циклы с одинаковыми значениями максималь
ных температур и. давлений (в общей точке 3) изображены
нарис.6.7,б,где1—2—3—4—1
—
с горением при u = const;
1—2"—3 —4—1
— q горением при p=const; 1—2'—5 —3 —4—1
—
цикл со смешанным подводом теплоты.
В этих условиях соотношение между термическим к. п. д.
рассматриваемых циклов будет следующее: r\t,v<r\t,cM <4 t, я»
поскольку, как это видно из рис. 6 .7, б, для всех циклов значе
ние q2 (площадь Ь41а) одинаково, а значения <7 1, соответствую
щие площадям под кривыми подвода теплоты, различны и удов
летворяют очевидному соотношению <7i,p > < 7i,cM><7i,t>. В этом
случае наиболее эффективным оказывается цикл с изобарным
процессом горения, наименее эффективным — цикл с изохорнйм
процессом горения.
§ 6.3. ЦИКЛЫ ГАЗОТУРБИННЫХ УСТАНОВОК
Существенным недостатком поршневых Д В С является не
возможность в силу самого способа их работы осуществления
в цилиндре полного адиабатного расширения продуктов сгора
ния до давления наружного воздуха, с чем связана потеря из
вестной части работы двигателя. З ато полное расширение вполне
осуществимо в двигателях ротационного ти п а— турбинах, что
заметно увеличивает термический к. п. д. цикла.
Кроме того, турбины как двигатели ротационные, нс имею
щие частей с возвратно-поступательным движением, характер
ным для поршневых машин, могут выполняться весьма быстро-
96
ходнымн, с большой частотой вращения и в связи с этим более
мощными при умеренных размерах и небольшой массе. В газо
турбинных установках полезная работа производится за счет
кинетической энергии движущегося с большой скоростью газа.
Рабочим телом в этих установках служ ат продукты сгорания,
образующиеся при сгорании топлива в специальных камерах
под давлением, а такж е воздух и некоторые газы. Поток боль
шой скорости создается путем истечения газа из сопел (направ
ляющих лопаток) турбины. Протекая затем по криволинейным
каналам, образуемым насаженными на ротор лопатками, газ
приводит во вращение ротор турбины, а через него электрогене
ратор или какое-либо другое устройство.
Соответственно двум основным процессам горения, применя
емым в двигателях внутреннего сгорания, а именно при постоян
ных давлении или объеме, возможны два цикла турбин вну
треннего сгорания.
Рассмотрим наиболее часто применяемый цикл газотурбин
ной установки со сгоранием топлива при постоянном давлении.
Принципиальная схема установки представлена на рнс. 6 .8 .
Компрессор 1 засасывает атмосферный воздух, сжимает его и
направляет в камеру сгорания 2, в которую через форсунку 3
впрыскивается жидкое топливо, подаваемое топливным насо
сом 4. Газообразные продукты сгорания после расширения
в соплах 5 поступают на лопатки 6 газовой турбины Г, а затем
выбрасываются в атмосферу через выхлопной патрубок 7. Тур
бина является приводом электрогенератора 8.
Теоретический цикл установки изображен на рис. 6.9 в ко
ординатах р— V и 7 —5.
В качестве определяющих параметров .цикла принимаются
степень повышения давления при адиабатном сжатии р = р 2/р!
и степень предварительного расширения р«низ/с;2.
Для вывода формулы термического к. п. д . цикла определим
вначале температуру газа в точках цикла 2, 3, 4.
Для процесса 1 —2: Т^Тх —(Р2/Р|)(*~,*/* = Р <*” 1)/\ откуда
7*-7,рЙ-п/*.
Для процесса 2—3: Гз/Г^оз/оа-р; Гз= Т2р=7|р<*“ 1>/*р-
Для процесса 3—4: 74/73~ (Р4/Рз)(*~1)М в(Р|/Р2)(*“ |)/* ”
== (Р|/Р4Р)**_ ,*/* = ч 1 /Р(*~1у\ откуда 7 4=7з/р<*-,>/* —7ф .
Найдем теплоты д х и | * | . Если считать рабочее тело идеаль
ным газом с постоянной теплоемкостью, то <7|—£р(Т3—Т2) —
в
(
р
—
1). <72«ср(7,-74) или |*| -сР(Т4-7 ,) -
1(р—1).
Тогда термический к. п. д . рассматриваемого цикла будет
равен
ги=1 - |*|/<7.-1
-
Ср7,(р- 1)/1сР7,р<*-'>Л(р_ 1)),
П|— 1
— 1/рс*-«л.
(6.7)
Если адиабатный процесс сж атия 1 —2 определить не через
7 Зак. 80
97
степень повышения давления Р «р г/рь а через степень сжатия
е « 0 1/с?2, то формула термического к. п. д . цикла будет иметь
вид
—1
—
1/е*“ 1,
(6.8)
так как р=Ря/рг=-(0|/о*)*=е\
Как видно, формула термического к. п. д . одинакова для
д и кл а газотурбинной установки с изобарным подводом теплоты
и д ля поршневого Д В С с изохорным подводом теплоты.
Рас. 6.8. Схема гаэотурбшшой установки со сгоранием
топлива при постошшои давлении.
Формулы (6.7) и (6 .8 ) показывают, что термический к. п. д.
цикла газотурбинной установки с изобарным подводом теплоты
является прямой функцией степени повышения давления (в ади
абатном процессе), или иначе, прямой функцией степени
Рис. 6.9. Цикл гаэотурбшшой
установки в рабочей (а) и теп
ловой (6) диаграммах.
сжатия. Верхний предел допустимой степени сжатия в газотур
бинной установке лимитируется температурой газов на входе
в турбину. При высоких температурах понижается степень на
дежности работы лопаток.
Д ля повышения r\t рассмотренной газотурбинной установки
на практике используются регенерация теплоты, ступенчатое сго
рание топлива и другие усовершенствования, изменяющие в не
которой степени принцип работы установки.
88
f 6.4. ЦИКЛЫ РЕАКТИВНЫХ ДВИГАТЕЛЕЙ
Принцип работы реактивных двигателей состоит в следую
щем.
Струя, выходящая из сопла, вызывает реактивную силу
вдоль его оси, приложенную к соплу и направленную в сторону,
противоположную направлению струи. Если сопло может пере
мещаться в пространстве, то под действием реактивной струи
оно придет в поступательное движение и, следовательно, реак
тивная сила будет совершать работу перемещения сопла и свя
занных с ним частей с определенной скоростью.
Другими словами, в реактивном двигателе теплота, получа
ющаяся от сгорания топлива, преобразуется в соплах в кинети
ческую энергию газообразных продуктов сгорания и использу
ется непосредственно для перемещения сопла н с ним летатель
ного аппарата.
Все существующие реактивные двигатели могут быть раз
делены на следующие основные группы.
1 . Пороховые ракеты, т. е. реактивные двигатели на твер
дом топливе — порохе, имеющем в своем составе кислород, не
обходимый для горения.
2. Жидкостные реактивные двигатели, в которых для сж ига
ния жидкого топлива используется жидкий окислитель: сжи
женный кислород, азотная кислота, перекись водорода и т. п.
3. Воздушно-реактивные двигатели, в которых для сжигания
жидкого топлива используется атмосферный воздух.
В свою очередь воздушно-реактивные двигатели в зависи
мости от способа сжатия воздуха, поступающего в камеру сго
рания, разделяются на бескомпрессорные (прямоточные или
пульсирующие) н на турбокомпрессорные реактивные двигатели.
В качестве примера рассмотрим принципиальные схемы и
циклы д вух воздушно-реактивных двигателей: прямоточного бес-
ком прессорного и турбокомпрессорного.
Прямоточный бескомпрессорный реактивный двигатель (с го
рением топлива при постоянном давлени и). Принципиальная
схема этого двигателя представлена на рис. 6 .1 0 , а.
Двигатель состоит из диффузора А%камеры горения В и
сопла С. Больш ая скорость встречного воздуха относительно
самолета позволяет использовать ее для сжатия воздуха по
становкой диффузора А и обойтись без компрессора.
Циклы, осуществляемые в воздушно-реактивных двигателях,
те же, что и в газовых турбинах. На рис. 6 .10, б приведена
р— (/-диаграмма рассматриваемого реактивного двигателя.
Соответственно этому термический к. п. д . цикла воздушно-
реактивного двигателя с подводом теплоты при р —const может
быть определен по той же формуле, что и тц газотурбинной ус
тановки с изобарным подводом теплоты: 1ц - 1 — 1 /а*“ 1.
Степень адиабатного сж атия е, осуществляемого диффузор
7*
9Й
ром, невысока, поэтому термический к. п. д . цикла таких дви
гателей незначителен.
Рис. 6 .10 . Принципиальная схема пря
моточного реактявного двигателя (а)
и изображена* цикла в рабочей диа
грамме (б).
а
Повышения степени сжатия, а следовательно, и т)( можно
добиться усложнением двигателя, а именно установкой в перед
ней его части за диффузором турбокомпрессора.
Турбокомпрессорный
воздушно-реактивный
двигатель
(ТВРД ). Принципиальная схема Т В РД и изображение цикла
в р— и -диаграмме представлены на рис. 6 .11 . Воздух из вход-
Рис 6 .11 . Принципиальная схема турбо-
компрессорного воздушно-реактивного дви
гателя (а) и изображение цикла в рабочей
диаграмме (б).
ного диффузора А направляется в компрессор Д из которого
попадает в камеру сгорания В , затем газы проходят газовую
турбину £ , а из нее через выходное сопло С вылетают в атмо-
сферу.
100
Компрессор получает привод от газовой турбины, в которой
используется только часть располагаемой работы газов, необхо
димая для привода компрессора; отходящие же из турбины газы
поступают в сопло, где и расширяются, создавая реактивную
силу.
В диаграмме р—и : й—е
—
сжатие воздуха в диффузоре; е—
а — сжатие воздуха в компрессоре; а—Ь — сгорание топлива
в турбине; Ь—I
—
расширение продуктов сгорания в турбине;
/—с
—
расширение продуктов сгорания в сопле.
В целом ж е этот цикл аналогичен циклу прямоточного воз
душно-реактивного двигателя и состоит из тех же процессов,
поэтому для определения термического к. п. д . турбореактив
ного двигателя может быть использована формула
1/е*"1.
Турбореактивный двигатель вследствие дополнительного с ж а
тия воздуха в компрессоре имеет бблыпую (по сравнению
с прямоточным воздушно-реактивным двигателем) степень с ж а
тия, а следовательно, более высокий термический к. п. д ., который
увеличивается с увеличением скорости полета н достигает мак
симального значения при звуковых скоростях. В связи с этим
преимуществом турбореактивный двигатель в настоящее время
является одним из основных типов двигателя для скоростных
самолетов.
Глава 7
ч
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ
ТЕРМОДИНАМИКИ
§ 7.1 . ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ
ПРИ НЕЗАВИСИМЫХ ПЕРЕМЕННЫХ ршТ
Параметры состояния рабочего тела р, V и Т доступны не
посредственному определению из эксперимента. Сложные ж е
функции состояния— внутренняя энергия, энтропия и некоторые
другие могут быть найдены лишь из аналитических зависимо
стей, связывающих их с этими основными параметрами. Вывод
таких зависимостей, имеющих форму дифференциальных урав
нений, является целью настоящей главы.
Дифференциальные уравнения сложных функций состояния
имеют весьма принципиальное значение в построении и разви
тии общей теории термодинамики. Некоторые разделы термо
динамики строятся применительно к тому или иному уравнению
состояния (идеального, реального газа); в этом случае и выводы,
получаемые из теории, носят частный характер. Теория диф
ференциальных уравнений термодинамики, базирующаяся лишь
101
на использовании д вух основных законов термодинамики, сво
бодна от этих ограничений. Так, при использовании уравнения
состояния Клапейрона— Менделеева из дифференциальных у р а в
нений могут быть получены основные законы и расчетные у р ав
нения идеального г аза; при использовании уравнения состояния
реального газа (например, Ван-дер-Ваальса)— общие положе
ния термодинамики реального (вандерваальсовского) газа.
Кроме того, дифференциальные уравнения используются для
составления уравнений состояния реального газа более точных,
нежели уравнение Ван-дер-Ваальса, а также для анализа точ
ности и пригодности любого уравнения состояния газа. Такой
анализ часто бывает необходим, ибо в литературе встречается
большое число уравнений состояния реальных газов, предлага
емых разными авторами.
Для вывода дифференциальных уравнений внутренней энер
гии, энтальпии, энтропии, а та кж е теплоты могут быть исполь
зованы различные приемы. Наиболее часто основой построения
теории дифференциальных уравнений являются независимые
параметры.
Известно, что два любых основных параметра (р и Т, V и Т
или р и о), являясь независимыми переменными, определяют со
бой состояние тела и остальные параметры — функции со
стояния.
Взяв за независимые переменные р и 7, можно написать за
висимости общего вида о =Ы Р . 7); ив/2(р, 7); /—/з(р, 7), 5 —
-
Мр.Т).
Для раскрытия вида этих функций произведем следующие
рассуждения.
По первому закону термодинамики для обратимых процессов
(1я—<1и+рйи%или в другом варианте dq—di—vdp.
По второму закону (для обратимых процессов) d q—Tds.
Сопоставляя два последних уравнения, получаем T d s = d i—
— vdpt откуда
си=Ш/Т - (о/7)4р.
((7.1)
Поскольку ; является функцией состояния и, учитывая, что
d^ — полный дифференциал, функцию I —/з(Р* 7 ) можем пред
ставить в виде
(д1/др) тёр+ (31/дТ),4Т .
(7.2)
Здесь индексы 7 и р означают, что производная ёЦёр бе
рется при постоянной температуре, а производная д 1/дг — при
постоянном давлении.
Подставляя значение d^ из (7.2) в уравнение (7.1), получим
ds - (д(/дТ)Pd7/7+7-■ ((дЦдр)т— V]dp.
(7.3)
Аналогично этому, поскольку з —/4(р, Т),
сЬ « (дз/д7) Рё 7 + (дз/др) тёр.
(7.3а)
102
Сопоставляя два последних уравнения для ds н приравнивая
множители при dT и dp в правых частях уравнений, можем з а
писать
(ds/dT)P-T -'(di/dT)P9
(7.4)
(ds/dp)г- Г -' [(di/dp)т - v].
(7.6)
Частные производные от (7.4) по р при f^const и от (7.5) по
Т при р «»const имеют вид
d*s/(dTdp) - ( 1 /Т) (d*i/dTdp)9
d2s/(dT/dp) — ( \/Т) [d2i/dTdp — (dv/dT) P] —
-
d/P) l(di/dp)T-v).
Приравнивая правые части этих производных и сокращая
на Т, получим d2i/(dT/dp)=d 2i/(dp/dT — (dv/dT) Р— (\/Т)
l(di/dp)T— v), или, сокращая
на d2i/(dT/dp)f (dvfdT)p=
= — (1/Т) [(di/dp)т— v), откуда
(di/dp) т - — T(dv/dT)p+ v .
(7.6)
Подставляя это значение в (7.5), получим
(ds/dp)T--(dv/dT)P.
(7.7)
По уравнениям (7.6) и (7.7) можно судить об изменении
i н s при изотермическом процессе, но, кроме того, с их помощью
можно получить величины di и ds в любом процессе, поскольку
« Н 5 являются функциями состояния.
Подставим в уравнение (7.2) выражение для (di/dp) т из
(7.6), а вместо частной производной (di/dT)p равную ей ср.
Последнее возможно, ибо при р —const уравнение первого з а
кона термодинамики d q - d i—vdp преобразуется к виду dip—
= zdq=cpdTP, а значит,
(di/dT)p- c P.
(7.8)
Тогда
di=dT - [Т(dv/dT)Р— v}dp.
(7.9)
Аналогично получим выражение для ds:
ds = (ds/dT) j4 T + (ds/dp) Tdp.
Здесь выражение для производной (ds/dT)p также может
быть упрощено. Из уравнения второго закона термодинамики,
написанного для изобарного процесса CpdTp= T d s P9 следует, что
Ср=Г(д$/дГ)р и
(ds/dT) Р= с р/Т.
(7.10)
Подставив в написанное выше выражение для ds значение
(ds/dT)р из (7.10), а также (ds/dp)т= — (dv/dT)р из (7.7),
получим
ds—c^TJT — (dv/dT)pdp.
(7.11)
103
Уравнение (7.11) можно использовать для получения диф
ференциального уравнения теплоты. Т ак как ¿ 9 —77/5 , то
йц-СрйТ — Т(^1дТ)рйр.
(7.12)
Покажем общность полученных дифференциальных уравне
ний на следующем примере. Д ля идеальных газов
При
или (ди1дТ)р^Щр. Подставив это выра
жение в общее дифференциальное уравнение^ энтальпии (7.9),
получим частное решение для (И идеального газа:
срЛТ—
—
(7?7Ур— и)<1р—сраТ—(7?7—ръ!р)йр и, так как р о = /?Г , ¿ 1*—
= срйТ.
Подставив значение (ди/дТ)р= 1 * / Т в (7.6),
получим
(д|/д р )т = 0 , т. е. при изотермическом изменении состояния
энтальпия идеального газа не изменяется, другими словами, его
энтальпия не зависит от давления и является функцией только
температуры. Отсюда следует, что н ср является функцией
только температуры.
•
Здесь рассмотрен общий метод получения дифференциаль
ных уравнений, выведены некоторые зависимости, которые нам
будут нужны в дальнейшем. (Совершенно аналогично могут
быть получены соответствующие дифференциальные уравнения,
если в качестве независимых переменных будут приняты р и и
илиоиГ.
Из сопоставления дифференциальных уравнений, выведенных
для разных пар независимых параметров, может быть полу
чено уравнение состояния газа в наиболее общем виде, для
которого уравнение Клапейрона—Менделеева p v = R T и различ
ные записи уравнения состояния реального газа (например, ур ав
нение Вукаловича и Новикова — см. далее, гл. 8 ) будут лишь
его частными случаями.
§ 7.2. НЕКОТОРЫЕ ПРИЛОЖЕНИЯ
ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИИ ТЕРМОДИНАМИКИ
Дифференциальна уравнения могут быть использованы для
непосредственного вычисления физических величин реального
газа, для составления уравнения его состояния и анализа точ
ности полученного уравнения, для вывода ряда зависимостей, не
обходимых для построения диаграмм, и т. д.
Рассмотрим для примера общий метод составления уравне
ния состояния реального газа по данным экспериментальных
исследований свойств изобарной теплоемкости.
На основании экспериментальных данных составляется ур а в
нение с р —{(р, Т). Согласно этому уравнению определяется зна
чение частной производной (дср/ор)т, которое подставляется
в формулу зависимости ср от давления. Эта формула может
быть легко получена из предыдущего. В соответствии с (7.10 )
(д$/др)р= с рТ. Возьмем производную этого уравнения по р
104
при Г-сопв^ ^ /(дТ др)= (\1Т)(дсР1др)Т. Но, с другой сто
роны, по уравнению (7.7) (дз/др)т= — (др1дТ)р. Вэяв частную
производную этого уравнения по Т при р = с о г ^ , получим
д2$/(дрдТ)-* (д*и /дТ2)р. Эти частные производные одинаковы,
т. с . (дср/др)т= — Т(д*и/дТ2) р, или
(*о/дГ’)Р= (1/Т) (дсР/др)т.
(7.13)
Если экспериментальным путем найдена зависимость тепло
емкости ср от давления н температуры, то двукратным интегри
рованием уравнения (7.13) можно получить связь между пара
метрами р, V и Т:
Р(р\о, Г)=О,
т. е. уравнение состояния, имеющее общий вид
* = /(р)+ф(р)Г- Я Т~1(дсР1др)Т(1Т*.
§ 7.3 . ХАРАКТЕРИСТИЧЕСКИЕ ФУНКЦИИ
Исследование физических свойств рабочих тел может быть
выполнено аналитическим путем, если ввести в рассмотрение осо
бые функции состояния, называемые характеристичес
кими. К а ж д а я из этих функций имеет вполне определенное
значение в любом состоянии рабочего тела, причем основное
свойство их состоит в том, что, зная аналитическое выражение
характеристической функции через соответствующую пару неза
висимых параметров, можно в явной форме определить все
остальные параметры рассматриваемой системы.
У ж е введенные ранее функции состояния (внутренняя энер
гия^ энтальпия и энтропия) являются характеристическими функ
циями. В самом деле, записав уравнение первого закона термо
динамика в виде ТЛв—Л и+рйи и решив его относительно Ли,
получим
ёи=Т(к—рЛи.
(7.14)
Реш ая это уравнение при условии постоянства объема, най
дем
Т^(ди/д5)9
(7.15)
при условии постоянства энтропии
р = — (ди!ди)л.
(7.16)
Соответственно
/=и+рц»и — и(ди/ди)9.
(7.17)
Таким образом, если внутренняя энергия и задана в виде
функции энтропии 5 и объема о, то все другие параметры, ха
рактеризующие состояние тела (Т, р, (), могут быть определены
путем простого дифференцирования функции и (в, V).
ЮЗ
Анализируя уравнение первого закона термодинамики, запи
санное в виде Ш—Тёз + ис1р9 для случая, когда в качестве не
зависимых параметров заданы энтропия з и давление р, полу
чаем 7=(д|/дз)р, и«=(д//др). и и = 1—ри=/ —р(д1/др)в, т. е.
энтальпия является такж е характеристической функцией.
Энтропия з, заданная как функция внутренней энергии и
и объема и, есть характеристическая функция, что очевидно из
анализа уравнения ¿ з —7
- ,Ж|+ (р/Т)^:
при о-сопэ! 7—1/(дз/до)*,
при о—сопв! и и =сопз! р^ (дs/дv)u/(дз/ди)^
откуда 1*= и+ри=и+и(д$1ду)и1(дз1ди)9.
Помимо названных широко используются и другие характе
ристические функции, которые рассматриваются далее.
Свободная энергия. Выражение этой новой характеристиче
ской функции может быть получено следующим образом. Ф ор
мула второго закона термодинамики (для обратимого процесса)
¿ з —</?/7 может быть преобразована к виду йз—(йи+р(1и)1Т
или </ц—7^з+р*/о=0.
Прибавив к левой части этого равенства и вычтя из него
выражение з<*7, получим: ¿и—Г^з+з^Г—з<*7+р^о=0, иля
б(и— 7 з ) ——збТ—рёи.
Величина и— 7з, являющаяся некоторой функцией состояния,
называется свободной энергией и обозначается буквой 7 , т. е.
7-а
—
7з.
(7.18)
Тогда
¿7-—з47—рйи.
(7.19)
Изуравнения (7.19) следует, чтоз*= — (д7/д7)в ир— —(д7/до)т.
Соответственно и—7 + 7з*= 7 —7(бр/дТ)9; и—7 + ро—7
—
— Т(бР/дТ)9— и(бР/ди)т, т. е. свободная энергия является ха
рактеристической функцией.
Для необратимых процессов (¿/з>^р/Г) уравнение (7.19)
примет вид бР+зёТ+р<1и<0.
Следовательно, общей записью уравнения второго закона
термодинамики, пригодной как для обратимых, так и для необ
ратимых процессов, может быть следующее выражение:
¿7+зс/7+рби< 0.
(7.20)
Д ля нзохорно-нзотермическнх процессов, при которых ¿ о —О
и ¿7*0 , получим
</7<0.
(7.21)
Последнее уравнение означает, что свободная энергия изо
лированной системы при осуществлении в ней обратимых изо-
хорно-изотермнческих процессов не изменяется, а при осуществ
лении пеобратимых процесов — уменьшается. Следовательно,
при равновесии, которое наступает в результате осуществления
106
в изолированной системе необратимых изохорно-изотермическнх
процессов, свободная энергия системы достигает минимума:
<1Р=0.
Таким образом, осуществление самопроизвольных процессов
при
и ¿/Г- 0 сопровождается всегда увеличением энтро*
пин системы и уменьшением ее свободной энергии.
Физический смысл свободной энергии может быть выяснен
из рассмотрения обратимого изотермического процесса измене*
ння состояния тела. В этом случае ¿ Г —0, и из (7.19) следует,
что
dF-
(7.22)
Так как pdv с отрицательным знаком есть работа (—(II),
совершаемая над телом при изменении его объема, полученное
уравнение показывает, что работа изменения объема, произво
димая над телом при обратимом изотермическом процессе, р ав
на приращению свободной энергии тела, т. е .
dF= —<//.
(7.23)
Свободная энергия 7 системы служит, таким образом, мерой
работоспособности изотермической системы, чем и объясняется
данное ей название.
Из уравнения (7.18) следует, что внутреннюю энергию си
стемы можно представить в виде суммы д вух частей: свободной
энергии системы и произведения 7 5, т. е.
и«/7+75.
(7.24)
Величина 7* называется связанной энергией, ибо,
как это видно из (7.23), при изотермическом процессе вся р а
бота совершается только вследствие уменьшения свободной
энергии системы Г , а вторая часть внутренней энергии, равная
7 5, не'преобразуется в работу.
Свободная энергия г является одной из главнейших характе
ристических функций, широко используемой при решении р аз
личных термодинамических задач.
Изобарный (термодинамический) потенциал. Понятие об изо
барном потенциале может быть получено при исследовании вли
яния на изолированную систему обратимых и необратимых изо
барно-и зотермических процессов.
Из уравнения второго закона термодинамики d sщ
^dq^Tщ^
'&(du+pdv)|T следует, что du+pdv—745^ 0.
Прибавив к обеим частям этого уравнения выражение
vdp—sdT, получим: du+pdv—vdp—Tds—sdT^vdp—sdT, или
du+d(pv)—d(sT)^vdp—sdT, d(u+pv—Ts)^vdp—sdT, откуда
ё(1— 75)^vdp—sdT.
(7.25)
Величина /— 7 5, определяемая лишь параметрами состояния,
является, очевидно, некоторой функцией состояния, которая на-
107
звана изобарным (термодинамическим) потенциалом, и обозна
чается обычно буквой Ф :
Ф-/
— 7s.
(7.26)
Следовательно,
d<D^vdp — sdT.
(7.27)
Из уравнения (7.2 7), написанного для обратимого процесса,
можно получить
s = — (дФ/дГ)Р,
(7.28)
и - — (дФ/др)г.
(7.29)
Кроме того, из (7.26) и (7.28) следует
/«=Ф + 75«Ф — (дФ/дТ)р.
(7.30)
Далее, так как u=i—pv, то
и^ф+Ts—ро—Ф
—
Т(дФ/дТ)р — р(дФ/др)т.
(7.31)
Из (7.18), решаемого совместно с (7.26), получаем: F = u —
— Ts=i—pv—Ts**i—Ts—ри**Ф—pv, т. e.
F-Ф
—
р{дФ/др)т.
(7.32)
Таким образом, изобарный потенциал является характери
стической функцией, так как, зная его значение, можно вычис
лить все ранее рассмотренные параметры н функции состояния
системы.
Термодинамические потенциалы. К ак у ж е известно из рас
смотрения второго закона термодинамики, при обратимом
процессе для перевода тела из одного состояния в другое тре
буется минимальное количество работы /min. Соответственно р а
бота, производимая самим телом при обратимом переходе из
одного состояния в другое, является максимальной н равной
/шах—— /mm. Поэтому в уравнении для свободной энергии (7.2 3),
написанном для обратимого изотермического процесса, £ 1 пред
ставляет собой минимальную удельную работу <f/min, производи
мую внешней средой над телом в данном процессе, или макси
мальную работу dim**, совершаемую самим телом, взятую с об
ратным знаком, т. е. dF-d/m m - —<Wmax. После интегрирования
получаем: F2— F i——/max. или
F|-F a=/max.
(7.33)
т. е. максимальная работа, производимая системой над внеш
ней средой при обратимом изотермическом процессе, равна убы
ли свободной энергии системы.
Аналогичным образом могут быть получены соотношения:
/max—Mi— «а (при о —const и s —const); /шах—« Ф1—Фа (при
р—const и /-const); /max-/»—/а (при р = const и s=const).
Поэтому по аналогии с теоретической механикой, в которой
108
работа в поле постоянных сил, не зависящая от пути процесса,
принимается равной разности потенциалов в начальной и конеч
ной точках пути, величины Л и, I, Ф получили название тер
модинамических потенциалов, поскольку разность
значений этих величин в двух состояниях представляет собой
полезную работу, которая могла бы быть произведена систе
мой над внешним объектом при переходе от одного состояния
в другое.
Глава 8
РЕАЛЬНЫЕ ГАЗЫ
1
1Жидкая
<р<па к
Тбердоя С! п/ИзоЬора
(роза
г.
р, ■ С0П51
ГазооЬрозноя
фоЗо
------------- ► Т
$ 8.1 . ОБЩИЕ ПРЕДСТАВЛЕНИЯ.
ФАЗОВАЯ ДИАГРАММА р - Т
Все вещества в зависимости от внешних условий способны
находиться в твердом, жидком или газообразном состояниях.
На рис. 8 .1 представлена диаграмма, р — Г, на которой пока
заны области различных агрегатных состояний и линии пере
хода из одного состояния в другое для чистого (однокомпонент
ного) вещества. Каждое из агре
гатных состояний называется ф а
зой, а диаграмма р—Т
—
фазо
вой.
Слева от линии А—О—В на
ходится область твердого состоя
ния вещества, справа от линии
/С—О—В
—
область газообразно
го состояния. М еж ду линиями
А—О и К —О расположена об
ласть жидкого состояния. Имея
диаграмму р—Т для какого-либо вещества и зная его давление
и температуру, можно определить, в каком агрегатном состоя
нии находится вещество при заданных условиях.
Линия А —О характеризует переход из твердого состояния
в жидкое, и наоборот. Эта линия называется кривой плавления
(затвердевания).
Линия К —О характеризует переход из жидкого состояния
в газообразное, и наоборот, она называется кривой (или ли
нией) кипения (конденсации). Кривую кипения называют так
ж е линией насыщения.
Линия В —О характеризует переход из твердого состояния
в газообразное, н наоборот. Эта линия называется кривой субли
мации (десублимации).
Точка О, в которой вещество находится в трех агрегатных
состояниях, называется тройной точкой.
Рис. 8 .1. Фазовая диаграмма р — Г .
109
Линия сублимации уходит вниз в сторону низких темпе
ратур. Линия плавления уходит в сторону высоких и сверх
высоких давлений (порядка десятков и сотен мегапаскалей).
Линия насыщения оканчивается точкой К, называемой крити
ческой.
Давление и температура в этой точке (называемые критиче
скими) являются максимальными для области сосуществования
двух фаз (двухфазных состояний) жидкость—пар.
Фазовые диаграммы для различных веществ различны. Од
нако наклон линий сублимации и насыщения для всех чистых
веществ положителен, т. е. с ростом давления температура
фазового перехода повышается. Линия плавления может иметь
как положительный, так и отрицательный наклон (например,
для воды). Во втором случае с ростом давления температура
плавления понижается. С помощью диаграммы р—Т можно
проследить, как изменяется состояние вещества при подводе
теплоты в процессер=р|=сопэ1.
При изобарном нагревании твердого тела достигается линия
плавления в точке С (см. рис. 8 .1 ), вещество плавится и пере
ходит в жидкое состояние. При дальнейшем нагревании ж ид
кость переходит в состояние, определяемое точкой й , леж ащей
на линии кипения, и превращается в пар, а затем (правее точки
Ь ) происходит повышение температуры паровой (газовой) фазы.
Для каждой из трех фаз может быть установлена связь
между термическими параметрами, которая описывается тер
мическим уравнением состояния
f (Р, ". Т)—0.
(8.1 )
Однако вид этой функции весьма сложен и до сих пор ни для
одной из фаз не может быть точно выражен. Тем более сложно
получить уравнение состояния, описывающее поведение всех
трех фаз.
Ниже будут рассмотрены термодинамические свойства газо
образной фазы вещества. Как следует из рассмотрения ди
аграммы р—Г, газообразная фаза охватывает состояния веще
ства справа от линии насыщения (О—К), иначе говоря, состоя
ния пара, перегретого по сравнению с температурой насыщения
при данном давлении. Эти состояния могут быть такж е названы
паровой фазой.
Таким образом, понятия «газ» и «пар» по существу иден
тичны, так как обозначают одно и то ж е агрегатное состояние
вещества. Однако в технике термин «газ» относят (вплоть до
состояния насыщения) к веществам, имеющим низкие критиче
ские температуры и находящимся при обычных условиях (дав
лении и температуре окружающего воздуха) в газообразном
состоянии (воздух, водород, кислород, азот, гелий, окись угле
рода н др.) .
Термин «пар» (водяной, аммиачный и т. д .) применяют для
ПО
обозначения газробразной фазы веществ, находящихся при
обычных условиях в состоянии жидкости или в двухфазном со
стоянии «жидкость— пар» (на линии насыщения О—К ). Необ
ходимо четко представлять, что различие здесь только термино
логическое, так как существуют двухфазные и жидкое состоя
ние кислорода и других «газов» и существуют состояния водя
ного или аммиачного пара, значительно перегретого относи
тельно температуры насыщения. В этом случае эти вещества
ведут себя как обычные газы.
В качестве рабочих веществ холодильных машин, а в ряде
случаев и паросиловых установок широко используются фтор-,
хлор-, бром производные углеводородов. Эти соединения длитель
ное время называли фреонами. В настоящее время использу-
Таблица 8 . 1 . Критические параметры я нормальная
температура кипения для некоторых веществ
Вещество
*кр*
мй*
'-.«••с
Вещество
•с
РКр. МПа
Гелий
- 267,9
0,228 —268,8
И22
96,1
4.99
— 40,8
Водород
- 230,9
1,29
—252,6
412
112,0 4,119
- 29.8
Азот
— 147,0
3,39
— 195,6 Аммиак
132,4 1:1 Д5
—3 3,3
Воздух
—4140,6
3,77
— 194.5
411
198,0
4.Э7
23,7
Окись угле
— 140до 3,50
- н191„5
1ШЗ 214,1
3,42
47,7
рода
Вода
374,1
22.13
100,0
Кислород
— 1 18.4 5,08
— 182.8
Ртуть
1490
161
354,9
413
28,75 3,868
—в 1,5
Двуокись
31,05 7,383
— 78,47*
углерода
дмм —
« субл1МВЦИИ.
ется и другое название — хладоны. В соответствии с м еж ду
народным стандартом условное обозначение хладагентов со
стоит из символа И и числа, определяемого* структурой моле
кулы (например, СС12р2—К 12, СНС1Р2—И22, СгаВг—ШЗВ1 и
т.д.).
Критическая температура /яр, критическое давление ркр и
нормальная температура кипения /Вл (при р =760 мм рт. ст.=*
=
10 1325 Па) для некоторых веществ приведены в табл. 8 .1 .
| 8.2. КАЧЕСТВЕННЫЕ ОСОБЕННОСТИ
И КОЛИЧЕСТВЕННЫЕ ОТКЛОНЕНИЯ
РЕАЛЬНЫХ ГАЗОВ ОТ ИДЕАЛЬНЫХ
В термодинамике удельный объем, давление, температура
называются термическими параметрами состояния, а внутрен
няя энергия, изобарная и нзохорная теплоемкости, энтальпия,
энтропия — калорическими параметрами или свойствами.
111
Уравнение состояния, связывающее между собой термические
параметры вещества, называется термическим уравне
нием состояния (8 .1 ), а уравнение, с помощью которого мо
жет быть представлена функциональная связь трех переменных,
из которых хотя бы одна отражает калорические свойства, на
зывается
калорическим уравнением
состояния
(зависимости вида 1~Мр, Т) и и—/(о, Т) и т. д .). В случае
идеального газа эти* зависимости вырождаются в однопарамет
рические (см. § 2.3).
Таким образом, термодинамическое поведение идеального
газа можно описать: термическим уравнением Клапейрона p v ^
« Я Г и калорическим уравнением, например и —}(Т).
Для реальных газов эти уравнения строго справедливы
только при очень малых давлениях (в пределе при р—* 0). Оче
видно, что в этом случае плотность газа мала и, следовательно,
его свойства приближаются к свойствам идеального. При уве
личении давления свойства всех реальных газов отклоняются
от идеального и нс подчиняются указанным уравнениям состоя
ния. С приближением к области сжижения плотность газа уве
личивается, особенно при высоких давлениях, взаимодействие
между молекулами становится более существенным и возрас
тают отклонения от законов для идеального газа.
Рассмотрим качественные особенности поведения реальных
газов. Теория идеальных газов не объясняет фазовых перехо
дов из газообразного состояния в жидкое. Все реальные газы,
как показывают наблюдения, при определенных условиях пре
вращаются в жидкость. Между паром и образующейся из него
жидкостью существует четкая поверхность раздела, при пере
ходе через которую некоторые свойства меняются скачками
(внутренняя энергия, плотность и др.) , тогда как давление и
температура по обе стороны от поверхности раздела одинаковы.
На рис. 8 .2 сплошными линиями изображены изотермы д ву
окиси углерода, полученные впервые в опытах Эндрюса (1857—
1869 гг.) . Эндрюс изучал зависимость V от р для СОз при раз
ных Г. Он установил, что при определенных температурах при
повышении давления газообразной двуокиси углерода ее агрегат
ное состояние не изменяется и каждому значению р соответст
вует одно определенное значение о (линии при Т > Т К1>). При
других более низких температурах в процессе сжатия достига
ется состояние, при котором начинается превращение газа в ж ид
кость (точка В). Процесс превращения газа в жидкость при
постоянной температуре характеризуется постоянством давле
ния, уменьшением объема и увеличением плотности (линия
В — С). После того как весь газ превратится в жидкость (точка
С), происходит сжатие жидкости, сопровождающееся весьма
слабым изменением ее объема (линия С —й ) .
С повышением температуры различие между объемами Vв и
пс> т. е. длина горизонтальных участков изотерм, уменьшается.
112
В точке К оба предельные состояния переходной области В —С
сливаются, плотности жидкости н пара становятся одинако
выми— это критическая точка. Параметры, которые имеет веще
ство в критическом состоянии, называются критическим давле
нием ркр, критической температурой Гкр, критическим объемом
Окр. В состоянии, характеризуемом точкой К, исчезает различие
м еж ду жидкой и газообразной фазами, изотерма имеет перегиб
и касательную, параллельную оси абсцисс.
Впервые существование точки К было обнаружено Д . И. Мен
делеевым (1861 г.).-
На основании опытов, проведенных с эфи
ром, Менделеев установил, что существует температура, прп
которой вся жидкость сразу переходит в пар, занимающий тот
же объем, что и жидкость. Эту температуру Менделеев назвал
температурой абсолютного кипения и дал следующее определе
ние ее особенностей: «Абсолютной температурой кипения я на-
р.НЛа
зываю такую температуру, при которой частицы жидкости те
ряют свое сцепление (поднятие в капиллярной трубке равно
нулю, скрытая теплота равна нулю) и при которой жидкость,
несмотря ни на какие давления н объем, вся превращается
в пар».
В опытах Эндрюса критическое состояние было обнаружено
при ведении процесса в обратном направлении, т. с . при с ж а
тии газообразной двуокиси углерода. Температура Гкр нм была
названа критической и этот термин остался в' термодинамике.
Критическая температура определяет верхнюю границу дву х
фазной области состояний жидкость— пар.
Кроме Гкр существенной характеристикой поведения веще
ства является также давление в точке К — критическое давле
ние Ркр. При давлениях выше Ркр, каким бы изменениям состоя
ния ни подвергался реальный газ, он остается однородным,
например при непрерывном подводе теплоты происходит непре
рывное увеличение температуры, сопровождающееся непрерыв
ным приращением объема без разделения тела на газ и жид
кость. Такие процессы осуществляются с водой и фреонами в п а
ровых котлах, работающих при сверхкрнтических давлениях.
8 За«. 80
113
Следует отметить, что в области выше Ркр отличие газооб
разного состояния от жидкого является довольно условным.
Сравним состояние т и п на рис. 8.2. Казалось бы, состояние
вещества в точке т должно обладать всеми признаками газа,
так как оно может быть достигнуто в результате его сжатия
по изотерме Aim. Напротив, состояние вещества в точке п мо
жет быть получено при изотермическом сжатии жидкости по
линии с—л, и, следовательно, точка п должна характеризовать
жидкость. Однако это ж е состояние п может быть достигнуто
и путем изобарного охлаждения вещества по линии т — л, а со
стояние т — путем изобарного нагревания по линии л— т.
Отсюда следует, что установить четкие различия между двумя
агрегатными состояниями вещества — газообразным и ж ид
ким— в области, лежащей выше p*p, сложно.
При переходе вещества из состояния т в состояние л (см.
рис. 8 .2 ) плотность его монотонно возрастает, изменяются и дру
гие свойства, в частности сжимаемость падает, приближаясь
к нулю при подходе к линии плавления.
Таким образом, при изменении состояния вещества от точки
т к точке л или в обратном направлении термические н механи
ческие свойства его меняются непрерывно, н невозможно на
звать какое-либо свойство, качественно различающее назван
ные состояния. Поэтому условно относят состояния вещества
при удельных объемах, меньших критического, к жидким, и
наоборот, состояния вещества при и > о Кр — к газообразным.
Термин «реальный газ» относится как к жидким, так и к газо
образным состояниям вещества.
Только при высоких, превышающих критическую, темпера
турах изотермы реального газа мало отклоняются от изотерм
идеального газа, описываемых уравнением р и « const. Причем
и в этом случае в зависимости от значения температуры харак
тер их отклонения различен. При очень высоких температурах
изотермы реальных газов круче идеальных, при более низких
в начале сжатия — положе, а затем круче.
Докритическис изотермы реального газа (вплоть до области
двухфазных состояний) в координатах р—и располагаются бо
лее полого и ниже соответствующих изотерм идеального газа.
Рассмотрим количественные отклонения
пове
дения реальных газов от идеальных.
Отклонения термических свойств. Д л я идеальных газов, ис
ходя из уравнения Клапейрона, отношение pv/RT = 1 не зависит
от р и Г. Это отношение называется коэффициентом сж имае
мости
z
pv
RT-
(8.2)
Для реальных газов сжимаемость является величиной пере
менной, зависящей от природы газа, давления и температуры.
114
Зависимость г от давления при /—О0С для некоторых газов
представлена на рис. 8 .3 .
При р = 0 ,1 МПа коэффициент сжимаемости всех газов прак
тически равен единице, а при давлении около 2 МП а для воз
духа и водорода отклонение от единицы составляет ~1% . С по
вышением давления, особенно вблизи состояния сжижения, от
клонения возрастают. Так, для паров И12 при р —0 ,1 МПа и
*—
30°Сг-0,96;прир»1,8МПа и/=70вС 2—0,72.
Совместное влияние температуры и давления на коэффи
циент сжимаемости 1322 показано на рис. 8.4.
С помощью коэффициентов сжимаемости можно выразить
зависимость между параметрами реальных газов в виде урав
нения
ро«=г/?Г,
(8.3)
которое позволяет определять неизвестный параметр по двум
известным, если задана функция г = 1 ( и , Г). Уравнение Клапей-
2
1,0
0,6
о.в
ом
5Ю15202530¿5
р. МПа
Рис. 8.4. Зависимость коэффициента
сжимаемости И22 от давления при
разных температурах.
рона— Менделеева можно рассматривать как частный вид вы
ражения (8.2) при г = 1 .
Отклонение свойств реальных газов от идеально-газовых з а
конов легко обнаруживается также при рассмотрении диаграм
мы ри—р (рис. 8 .5). В отличие от изотерм идеальных газов,
которые в этих координатах должны иметь вид прямых, парал
лельных оси абсцисс, изотермы реальных газов представляют
собой кривые, имеющие при определенном давлении минимум.
С повышением температуры точка минимума смещается сна
чала в сторону больших давлений, а затем — меньших. Кривая
(пунктир на рис. 8 .5), проведенная через точки минимума, назы
вается кривой Бойля. Она соответствует уравнению
[Щ-о
-
«“>
Отклонение действительных изотерм от горизонтали иллю
стрирует отклонение от закона Бойля—Мариотта.
0.71--- ,
--- 1
--- 1—1 I---1_
_
_
0 5 ГО15 202530риЛа
Рис. 8.3. Коэффициенты сжимае
мости разных газов при 0 °С .
8*
115
Изотерма, у которой точка минимума находится на оси ор
динат (р—0 ), незначительно отклоняется от горизонтальной
прямой. Температура, соответствующая этой изотерме, называ
ется температурой ьойля ( Г б)* При температуре Бойля и вбли
зи нее газ при не слишком высоких давлениях с достаточной
степенью точности подчиняется уравнению состояния идеальных
газов. Таким образом, реальные газы подчиняются закону p v =
= const не только при р**0, но при Г —Гб и при более высоких
давлениях. Изотермы при Г > Г б представляют собой восходя
щие кривые, а при Г < Г Б— сначала нисходящие, а затем — вос
ходящие.
Область в левом нижнем углу диаграммы между осью pv
и пограничными кривыми, проходящими через критическую
точку, соответствует области двухф азных состояний, в которой
изотермы имеют вертикальное направление.
Определение величины Г Б имеет практическое значение, так
как охлаждение газов путем дросселирования (положительный
эффект Д ж оуля—Томсона) возможно осуществить, если началь
ная температура не превышает Г Б. Как показывает опыт, для мно
гих веществ примерное значение температуры Бойля можно
получить из соотношения
Гб/Гкр=2 ,75.
(8.5)
Отклонения калорических свойств. В отличие от теплоем
кости идеальных газов теплоемкости сР и cv реальных газов
зависят не только от температуры, но и от давления (или объ
е м а). Эти зависимости имеют сложный характер. В области
низких давлений зависимости изохорной и изобарной теплоем
костей от температуры близки к линейным.
При давлениях ниже критического теплоемкости ср и сг воз
растают с понижением температуры и приближением к состоя
нию сжижения, что связано с процессом ассоциации молекул.
В области высоких температур влияние температуры оказыва
ется незначительным. Повышение давления в этой области при
водит к увеличению теплоемкости. Эти положения иллюстриру
ются для перегретых пара R 2 2 (рис. 8 .6 ) и водяного пара
(рис. 8 .7, а). Пунктиром показана линия насыщения.
В области сверхкритическнх давлений изобары теплоемкости
проходят через максимум, который с повышением давления
смещается в сторону высоких температур. Величина ср (или
с0) в точке максимума увеличивается с приближением к p*p
(рис. 8 .7, б). В критической точке изобарная теплоемкость
равна бесконечности. Объяснение этому факту приводится в § 2
следующей главы.
Зависимости для определения теплоемкостей реальных газов
можно представить в следующей форме:
Ср=Сро+АСр,
(8*6)
Ce“ Cceo*fАСр,
(8.7)
116
Рис. 8.5.Диаграммару—р и кри
вая БоДля д л я аргона.
Рис. 8.8. Зависимость сР**{(рь Т)
дляР22.
Рис. 8.7. Зависимость
Г) для водяного пара при р < р кр (а)
и р>рНр (б).
117
где Ср0 и с9т— теплоемкости данного газа в сильно разрежен
ном состоянии (р—
или V—► «>), иначе их называют теплоем
костями в идеально-газовом состоянии; Дср и Дс„ — поправки,
учитывающие взаимодействие молекул и отражающие влияние
давления (или объема).
Значения сРо и с9т могут быть с высокой точностью рассчи
таны методами квантовой статистики на основании данных
о структуре молекул вещества. Значения Дср и Дс„ можно вы
числить с помощью дифференциальных уравнений термодина
мики по термическому уравнению состояния вещества. Изохор-
ная и изобарная теплоемкости для многих веществ измерены
экспериментально.
Внутренняя энергия и энтальпия реальных газов такж е за
висятотоднойизтрехпарпараметров (риТ,VиТилири
Энтальпия реального газа может быть найдена либо экспери
ментально, либо на основе данных о р-, и-, ^-зависимости, или
измеренных значений ср= / (Т , р). Если известно значение эн
тальпии при температуре Т0 и давлении р, а также имеются
данные о ср= /(Т) при этом давлении, то энтальпия при тем
пературе Т определится из соотношения
1(р, Г)=*(р, Т0)+]ср*Т.
(8.8)
то
Аналогично внутренняя энергия реального газа и на задан
ной нзохоре V при температуре Т может быть найдена по урав
нению
ц(ц, Т)=и(и, Г0) + £с„47\
(8.9)
где и — значение внутренней энергии для изохоры V при тем
пературе То; с9= 1 ( Т ) — истинная теплоемкость для этой изо
хоры.
| 8.3. УРАВНЕНИЯ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ
Отклонения поведения реальных газов от уравнения К л а
пейрона—Менделеева объясняются влиянием сил притяжения и
отталкивания между молекулами и тем, что молекулы газа
занимают некоторый объем.
Для реальных газов предложено много уравнений состояния,
но ни одно из них не обладает достаточной общностью и точ
ностью.
Физические особенности реальных газов качественно хорошо
отражаются уравнением Ван-дер-Ваальса. Оно же является и
наиболее простым, единым для жидкой и газовой фаз, терми
ческим уравнением состояния.
Ван-дер-Ваальс учел влияние сил взаимодействия молекул
и влияние их объема путем введения поправочных факторов
118
п уравнение состояния идеального газа. Предложенное им у р ав
нение состояния реальных газов имеет вид
(р+а/02)(и-Ь)=Я7\
(8.10)
где а и Ь — постоянные для каждого газа величины.
Величина а/о2, называемая внутренним давлением, учиты-
иает силы притяжения между молекулами. Эти силы приводят
к уменьшению давления газа р, измеряемого прибором, по срав
нению с действительным давлением газа р\ определяющим его
термическое состояние:
р'=р+а/и2.
(8.1 1)
Внутреннее (илн молекулярное) давление представляет со
бой равнодействующую сил притяжения молекул, которая воз
растает с увеличением числа взаимодействующих молекул и
уменьшением расстояния между ними. Каждый из этих факто
ров пропорционален плотности, отсюда наличие V2 в знамена
теле выражения (8 . 1 1 ) для внутреннего давления.
Величина Ь (8.10) учитывает объем, недоступный для дви
жения молекул. При сближении молекул между ними возни
кают очень большие силы отталкивания. Вследствие этого во
круг каждой молекулы образуется некоторый объем, в кото
рый не могут проникать другие движущиеся молекулы. Вели
чина объема, недоступного для движущихся молекул, обозна
чена Ван-дер-Ваальсом через 6 . Д ля простейшей модели она
равна учетверенному объему всех молекул данного количества
газа. Поэтому в уравнении состояния фигурирует свободный для
термического движения молекул объем (о—Ь).
При очень больших разрежениях, когда V—► «> и
фор
м ула (8 .1 0 ) переходит в уравнение состояния идеального газа.
Поэтому в уравнении Ван-дер-Ваальса Л является обычной га
зовой постоянной идеального газа, т. е. Л =83 14/ц .
Реш ая (8.10) относительно объема о, получим
_
и2(ЯТ1р + Ь)+ иа/р — а&/р=0.
(8.12)
По отношению к объему выражение (8.1 2 ) является уравне
нием третьей степени и, следовательно, имеет три корня. При
этом возможны следующие случаи: 1 ) один из корней уравне
ния действительный, два мнимых; 2 ) все три корня действи
тельные и различные; 3) все три корня действительные и рав
ные между собой.
Случай одного действительного корня и д вух мнимых соот
ветствует сверхкритическим температурам, так как при задан
ных р и Т возможно одно значение V, а два мнимых не имеют
физического смысла. Случай трех действительных различных
корней соответствует докритическим температурам. Случай трех
действительных равных корней соответствует критической точке.
На рис. 8 .8 уравнение (8 . 1 2 ) представлено в виде семейства
119
изотерм. Все кривые имеют вертикальную асимптоту и = 6 . При
р > а / V2 и о > 6 изотермы переходят в гиперболы, описываемые
уравнением состояния идеального газа. Сверхкритические изо
термы Ван-дер-Ваальса качественно соответствуют изотермам
идеального газа. Докрнтические изотермы вместо прямолиней
ного участка, соответствующего двухфазному состоянию п а р -
жидкость (пунктирная а —а), имеют волнообразный участок
Д—Ь—с—й —е. Этот участок можно охарактеризовать следую
щим образом. Линия а—Ь соответствует метастабильным со
стояниям переохлажденного (пересыщенного) пара, т. е. пара,
температура которого ниже температуры конденсации при дан
ном давлении. Такие состояния могут быть достигнуты, напри
мер, при адиабатном расширении
пара в турбине или в высоких
слоях атмосферы, если в паре от
сутствуют центры конденсации.
Линия е— с1 соответствует со
стояниям перегретой жидкости,
т. е. жидкости, температура кото
рой выше температуры кипения
при данном давлении. Такие со
стояния можно получить путем
осторожного нагревания весьма
чистой жидкости в сосуде с глад
кими стенками (при отсутствии
центров парообразования). Дру
гой путь получения таких состоя
ний—резкое уменьшение давле
ния жидкости, реализуемое, на
пример, в так называемых пу
зырьковых камерах.
Состояния перегретой жидкости и переохлажденного пара
являются метастабильными, потому что они устойчивы только
по отношению к малым возмущениям. При больших возмуще
ниях метастабильное однофазное состояние скачком переходит
в стабильное двухфазное, причем этот переход сопровождается
приращением энтропии.
Состояния, соответствующие линии Ь— с—
нестабильны и
не могут быть реализованы на практике, так как в этом случае
увеличение объема должно было бы сопровождаться увеличе
нием давления.
С ростом температуры длина волнообразного участка изо
терм уменьшается и в точке К становится равной нулю, а точки
экстремумов сливаются в одну, для которой имеется одно зна
чение объема, и все три корня уравнения (8 .1 2 ) равны.
Таким образом, уравнение Ван-дер-Ваальса описывает каче
ственные особенности всех газов, предсказывая возможность
120
Рис. 8.8. Изотермы Ван-дер-Ва
альса.
существования различных ф аз, непрерывность перехода вещест
ва нз газообразного состояния в жидкое, и наоборот, наличие
критической точки. Поэтому оно применяется для качествен
ного анализа и сопоставления свойств ряда газов.
Величины а и Ь называются константами Ван-дер-Ваальса.
Они зависят от критических параметров и могут быть найдены
на основании следующих соображений. Изотерма, соответствую
щая критической температуре, имеет точку перегиба, касатель
ная к которой горизонтальна. Следовательно, в этой точке про
изводные (др]дь)т и (д*р/ди2) т равны нулю.
Если к этим соотношениям добавить уравнение (8.10), то
получится система из трех уравнений с тремя неизвестными:
р- лг/(о—г»)—о/»*,
(др/ду)т- —/?Г/(о — Ъ) *■ +2«/«» - 0,
(8.13)
д»р/до*)г— 2/?Г/ (о — Ь)» — 6а/1><— 0.
Ее решение дает следующие выражения для критических
параметров:
Окр-3Ь% Гкр—8д/(276Я), Ржр*в/(27&1)
(8.14)
и для констант Ван-дер-Ваальса:
Ь = \) кр/3, а = Зр»фи2кр, Я = врир^нр/(ЗГкр). (8.15)
В отличие от идеального газа, для которого газовая постоян
ная равна #=ркрикр/Гкр, здесь появляется множитель 8/3= 2 ,6 7.
Выражение
Лир■ »
кр/ (РкрУир)
(8.16>
называется критическим коэффициентом. Очевидно, что по Ван-
дер-Ваальсу ¿крас 2,67. Однако, как показала экспериментальная
проверка, для большинства газов критические коэффициенты
отличаются от этого значения ¿ . Ниже приведены ¿кр для не
которых газов:
Газ Оа
N3
N0
Не
Н3
Н30
СОз
*кр 3,14 3,41 3,60 3,12
3,03 4,46
3,48
Кроме того, в результате ряда исследований было установ
лено, что коэффициенты а и Ь не остаю тся постоянными для
данного газа, как это следует нз (8.15), а изменяются в зависи
мости от давления и температуры.
Таким образом, уравнением Ван-дер-Ваальса весьма при
ближенно описываются особенности свойств реальных газов.
Оно не полностью отражает силовое взаимодействие молекул
н количественно плохо согласуется с экспериментальными зна
чениями термических параметров, особенно при высоких д ав
лениях.
121
Попытки усовершенствовать уравнение состояния реального
газа привели к созданию многочисленных уравнений, различных
по структуре н по ширине описываемой области параметров.
Так, М. П . Вукаловичем и И. И . Новиковым на основе разрабо
танной ими теории ассоциации молекул получено уравнение со
стояния для ряда газов и водяного пара.
Развитие кинетической теории привело к тому, что в 19 37—
1946 гг. американским физиком Д . Майером и советским м ате
матиком Н. Н . Боголюбовым независимо друг от друга было
получено точное уравнение состояния реальных газов, называе
мое уравнением М айера— Боголюбова. Это уравнение имеет
вид:
*-ч
-
45-+
-
§-+4*-+• ••+^
<8Л7>
Здесь коэффициенты В 2, В 3, В4, ..., В п+и именуемые вири-
альными, являются функциями температуры. Они могут быть
вычислены по потенциальной энергии взаимодействия молекул
газа. Однако для большинства веществ аналитическое выраж е
ние закона взаимодействия молекул неизвестно. Вычисление ви-
риальных коэффициентов представляет сложную математиче
скую задачу. Поэтому на практике младшие вирнальные коэф
фициенты определяют по экспериментальным данным.
| 8.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЯ.
ТЕРМОДИНАМИЧЕСКОЕ ПОДОБИЕ
Уравнение состояния реального газа независимо от его вида
содержит несколько индивидуальных констант, характеризую
щих природу данного вещества (например, величины а и Ь
в уравнении Ван-дер-Ваальса). Помимо них в уравнения состоя
ния входят универсальные константы, например универсальная
газовая постоянная (¿А, постоянная Больцмана и др.
Если число независимых индивидуальных постоянных в ур а в
нении состояния меньше или равно двум, то оно может быть
приведено к безразмерному виду, общему для всех веществ,
которые подчиняются рассматриваемому уравнению состояния.
В этом случае величины давления, температуры и объема заме
няются их отношениями к соответствующим критическим п ара
метрам:
Я *“ р/Р|ф*
т “ Г/7*|ф,
<р=о/Ркр»
(8.18)
где я, т и ф — приведенные давление, температура и объем.
Рассмотрим такое преобразование на примере уравнения
Ван-дер-Ваальса. Подставим в формулу (8.10) выражения а,
ЬиА из (8.15):
(Р+Зрир»*,*/®*)(О—Р«ц/3)«=8ргрОщ,Т/(ЗГвр).
122
Разделив обе части полученного соотношения на РкрОкр, вве
дя в него приведенные параметры н осуществив некоторые алге
браические преобразования:
(р/Ркр+3(окр/о)*] (о/0|ф—|/»)«8Т/(ЗГкр), (я +3/ф1) (ф—*/•).■ •
—®/»т, получим
(я+3/ф2)(Зф — 1) —8т.
(8.19)
Соотношение (8.19) называется
приведенным
урав
нением Ван-дер-Ваальса.
Оно не содержит величин,
отражающих природу вещества, а следовательно, характеризует
зависимость между приведенными параметрами всех газов, со
стояния которых описывается уравнением (8.10).
Состояния веществ, в которых они имеют одинаковые при
веденные параметры, называются
соответственными.
Очевидно, что, например, критические состояния всех веществ
являются соответственными, ибо для них я, ф, т равны единице.
Уравнение (8.19) выражает одновременно так называемый
закон соответственных состояний, который может быть сфор
мулирован следующим образом: если разные вещества описы
ваются одним и тем же уравнением состояния и имеют два оди
наковых приведенных параметра, то и третий приведенный пар а
метр для этих веществ будет одинаковым. Иначе говоря, эти
вещества находятся в соответственных состояниях.
В частности, можно построить изотермы Ван-дер-Ваальса
в приведенных координатах я —ф, они будут общими для всех
газов, подчиняющихся уравнению (8.10) (вандерваальсовскнх
газов).
Приведенные уравнения могут быть получены и на основе
других уравнений состояния, в том числе эмпирических.
Вещества, подчиняющиеся закону соответственных состоя
ний,
называются
термодинамически
подобными.
Термодинамическое подобие распространяется не только на
зависимость между приведенными термодинамическими пара
метрами, но и на другие термодинамические и теплофизические
величины. Так, например, выражения цСр/(ц/?), цзДр/?) и др.
являются функциями приведенных параметров и величины
р с ^ ц / ? ) . Это значит, что при одинаковых значениях последних
термодинамически подобные вещества будут иметь одинаковые
мольные теплоемкости и энтропии.
Наличие термодинамического подобия между различными ве
ществами позволяет по известным свойствам одного из веществ
определить свойства других (при равных я и т ), не производя
сложных экспериментальных исследований, что неоднократно
использовалось для предварительной оценки свойств новых х л ад
агентов.
Теория термодинамического подобия развита в работах
И. И. Новикова, П. И. Поварина, М. Л . Мостннского, Л. П . Фи
липпова и др.
123
Для расчета термодинамических свойств рабочих тел холо
дильных машин термодинамическое подобие было использовано
в работах И. И. Левина, И. С . Бадылькеса н И. И. Перель-
штейна.
Глава 9
ПАРЫ
§ 9.1 . ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
Рабочими телами паровых холодильных машин н тепловых
насосов являются вещества, имеющие при атмосферном давле
нии низкую, в большинстве случаев отрицательную (по стогра
дусной шкале), температуру кипения. Эти вещества называются
холодильными агентами. К ним относятся уж е упоминавшиеся
амм иак, хладоны и некоторые другие соединения. В паросило
вых установках в качестве рабочего тела используется водяной
пар.
Агрегатное состояние рабочего тела, использующегося для
осуществления кругового процесса в названных выше машинах
и установках, изменяется. В одним элементах машины нахо
дится жидкость, в других — пар, в третьих происходит процесс
превращения жидкости в пар, либо пара в жидкость. В связи
с этим необходимо знать общие закономерности, определяющие
параметры вещества в жидком и газообразном состояниях, и
процессы перехода из одного агрегатного состояния в другое.
Как указывалось в гл. 8, разделение понятий «газ» и «пар»
весьма условно. Здесь в соответствии с общепринятой термино
логией мы будем для обозначения газообразного состояния и зу
чаемых веществ применять термин «пар».
Процесс превращения жидкости в пар называется парообра
зованием. Парообразование имеет место при испарении н кипе
нии жидкостей.
Испарением
называется процесс парообразования на
свободной поверхности жидкости, когда наиболее быстро дви
гающиеся молекулы вылетают из нее в окружающее свободное
пространство. Испарение может происходить при любой тем
пературе, величина которой вместе со свойствами жидкости
определяют интенсивность испарения. При испарении жидкость
охлаждается, так как из нее уходят наиболее быстрые моле
кулы, и средняя кинетическая энергия остающихся молекул
уменьшается.
Вылетающие из жидкости молекулы образуют над ее поверх
ностью тонкий паровой слой — в случае открытого сосуда, либо
заполняют свободное пространство над жидкостью — в закры-
124
том сосуде. В обоих случаях устанавливается динамическое рав
новесие между количеством молекул, переходящих из жидкости
в пар и обратно. Плотность и давление пара при данной тем
пературе принимают определенные значения, а состояние такого
пара называется насыщенным. Количество испарившейся
жидкости зависит от объема парового пространства. При неог
раниченном объеме испарение может быть полным.
Испарение может происходить и внутрь паровых пузырьков,
образующихся в объеме жидкости при определенных условиях.
Для существования таких пузырьков давление пара в них долж
но быть несколько больше внешнего давления, под которым
находится жидкость. В качестве центров зарождения паровых
пузырьков могут служить включения нерастворенных в ж ид
кости газов, мелкие частицы твердого тела, впадины и ц ара
пины на стенках сосуда. Зародившийся паровой пузырек увели
чивается в объеме за счет испаряющейся в него жидкости.
Вследствие этого растет его подъемная сила и при достижении
определенного диаметра он отрывается от стенки и проходит
через объем жидкости в паровое пространство. В месте его
образования остается паровой зародыш, в котором вновь про
исходит испарение жидкости. В е сь процесс повторяется.
В начальной стадии подвода теплоты к жидкости ее темпе
ратура повышается, а процесс испарения интенсифицируется.
При достижении определенной для данного давления темпера
туры процесс парообразования происходит во всем объеме ж ид
кости с образованием большого числа паровых пузырей. Такой
процесс называется кипением.
Следовательно, кипение в отличие от испарения происходит
не только на поверхности, но и в толще жидкости при опреде
ленной для каждого давления температуре, которая остается
постоянной, пока вся жидкость не превратится в пар. При таком
равновесном кипении соблюдается равенство давлений и темпе
ратур жидкой и паровой фаз: р'в р"; Т'=Т ".
Состояние равновесия между жидкостью и образовавшимся
из нее паром называется состоянием
насыщения.
Каж дому давлению соответствует определенная температура
насыщения Г я(/п).
Температурой кипения, или насыщения, на
зывается температура равновесного фазового перехода жид
кости в пар при постоянном давлении.
При отводе теплоты от насыщенного пара число молекул,
переходящих из пара в жидкость, становится больше числа
молекул, переходящих из жидкости в пар, н часть пара превра
щается в жидкость — конденсируется. Если этот процесс проис
ходит при постоянном давлении, то температура не меняется,
а занимаемый телом объем уменьшается.
Таким образом, конденсацией называется процесс, об
ратный парообразованию, т. е. процесс превращения пара в жид-
125
кость. Образующаяся при этом жидкость называется конденса
том. Температура процесса конденсации (равная температуре
насыщения) называется температурой конденсации.
Если процессы кипения и конденсации происходят при оди
наковом внешнем давлении, то и температура вещества в этих
процессах будет постоянной и одинаковой (здесь имеются в виду
однокомпонентные вещ ества). Образующийся в процессе кипе-
р.нпа
ния пар, так же как и пар, из которого образуется жидкость
при конденсации, находится в состоянии равновесия с ж ид
костью и является насыщенным.
Величина температуры насыщения зависит от свойств ж ид
кости и давления. Различные жидкости при одном н том же
давлении имеют разные температуры насыщения. С повышением
давления температура насыщения всех жидкостей возрастает,
н, наоборот, давление насыщения увеличивается с ростом тем
пературы. Зависимость между давлением и температурой на
сыщения определяется кривой давления пара. На рис. 9 .1
представлены кривые давления пара некоторых веществ в коор
динатах р—Т.
Температура насыщения (кипения) при нормальном атмо
сферном давлении (р—760 мм рт. ст. — 101,325 кПа) называется
нормальной температурой кипения. В ы ш е приведены нормаль-
126
nue температуры кипения некоторых веществ (см. табл. 8 .1).
В паровой холодильной машине процесс кипения холодиль
ного агента используется для отвода теплоты от охлаждаемого
тела и осуществляется в аппарате, который называют испа
рителем. В паросиловых и паротурбинных установках рабочий
пар получают в процессе кипения воды в паровых котлах при
подводе к ней теплоты от продуктов сгорания топлива. Незави
симо от конструктивных особенностей аппаратов и в первом и
во втором случаях пар получается принципиально одинаковым
способом: путем кипения жидкости при постоянном давлении.
Значения ж е давлений различны: от долей мегапаскаля до од
ного-двух мегапаскалей в холодильных машинах и от несколь
ких мегапаскалей до нескольких десятков мегапаскалей в паро
силовых установках. Процессы конденсации пара в циклах на
званных установок осуществляются такж е при постоянном д ав
лении.
| 9.2. ПРОЦЕСС ПАРООБРАЗОВАНИЯ
ПРИ ПОСТОЯННОМ ДАВЛЕНИИ.
ДИАГРАММА р-о ДЛЯ ПАРА
Представим себе, что в цилиндрическом сосуде со свободно
движущимся, нагруженным постоянной силой поршнем, нахо
дится 1 кг воды при постоянном давлении р и начальной тем
пературе *0= 0 ° С (положение а на рис. 9 .2). Начнем подводить
теплоту к воде. Тогда температура ее будет возрастать, а объем
увеличиваться до тех пор, пока температура не станет равной
температуре насыщения /я при данном давлении (положение
Ь). Жидкость в этом состоянии называется насыщенной.
При подводе теплоты к насыщенной жидкости начинается
процесс кипения, который продолжается, пока вся жидкость
не перейдет в пар (положение л( на рис. 9 .2). Несмотря на под
вод теплоты, температура в процессе кипения при р —сопз! оста
ется постоянной, вся теплота расходуется на фазовый переход.
Удельный объем при этом значительно увеличивается. Пар, име
ющий температуру насыщения и не содержащий жидкости (по
ложение й) , называется сухим насыщенным.
Любое промежуточное состояние в процессе кипения соот
ветствует смеси жидкости и пара при температуре насыщения
(например, положение с ). Смесь насыщенной жидкости и сухого
насыщенного пара называется влажным
насыщенным
паром. Заметим, что это понятие применяется также для
пара с равномерно распределенными в нем (взвешенными) к а
пельками жидкости при температуре *я.
Подвод теплоты к сухому насыщенному пару повышает его
температуру. Пар, температура которого выше температуры
насыщения при данном давлении, называется перегретым
(например, положение е на рис. 9 .2). Процесс превращения су-
127
хого пара в перегретый называется процессом перегрева
пара. Температура перегрева может иметь различные значения
при данном давлении.
Представим рассмотренные процессы в рабочей диаграмме
р—и (рис. 9 .3). Д л я этого проведем изобару р и нанесем на пей
Рис. 9.2 . Процесс парообразования орн р — const.
состояния: жидкости при 0 ° С (а), жидкости насыщенной (b)f
сухого насыщенного пара (d) и перегретого пара (а).
Процесс подогрева жидкости изображается отрезком а— Ьу
кипения — b —d перегрева пара — d —а. На отрезке b—d правее
точки Ь и левее точки d находятся состояния влажного насы
щенного пара, одно из которых показано точкой с. Положение
точки с в диаграмме зависит от соотношения между количест
вом сухого пара и насыщенной жидкости, которое определяет
плотность (или удельный объем) смеси. Обычно для определе
ния состояния влажного пара (положение точки с) используют
понятие степени сухости пара (см. § 9.5).
128
Рассматривая процессы парообразования при нескольких
различных и постоянных значениях давления, можно заметить,
что с повышением давления, при котором осуществляется про
цесс, точка, характеризующая состояние насыщенной жидкости
(6), будет перемещаться вправо (положения Ь\ 6") . а точка,
характеризующая состояние сухого насыщенного пара (</),—
влево. Это объясняется тем, что на величину V' из-за малой
сжимаемости жидкости в большей степени влияет повышение
температуры насыщения, чем увеличение р. Поэтому и' увели
чивается при переходе от меньших давлений к большим. На
оборот, о " в этих случаях уменьшается, так как на изменение
этой величины более существенное влияние оказывает измене
ние р, чем увеличение Тм.
При постоянной температуре объем жидкости с повышением
давления изменяется незначительно, поэтому можно считать,
что объем жидкости при 0 ° С (о0) практически постоянен и точ
ки а, а ', а " расположены почти на вертикальной линии (линия
М на рис. 9 .3). При небольших давлениях объем и' не на
много больше оо. а объем о" — в сотни раз превышает и'. Изо
браженная на рис. 9 .3 диаграмма построена для большей на
глядности без соблюдения м асштаба.
Разность объемов и " — о ' уменьшается с увеличением давле
ния и при некотором его значении становится равной нулю
(точка л ). Соединив между собой точки а, а\ а" , ..., а также
точку К с точками 6", Ь\ Ьи с точками <*", д>\й, получим три
линии.
Кривая I —М
—
так называемая нулевая изотерма — харак
теризует состояние жидкости при 0 ° С . В точке М давление
соответствует температуре насыщения 0 °С .
Кривая /С—М называется линией насыщенной жидкости,
иначе — нижней или левой пограничной кривой.
Кривая К —Ы называется линией сухого насыщенного пара,
иначе — верхней или правой пограничной кривой.
В точке К обе пограничные кривые сходятся, и, следовательно
в этом состоянии исчезают различия между жидкостью и па
ром. Это и ость предельное состояние вещества, называемое
критическим, о котором говорилось в гл. 8 . Критическая точка
является особой точкой термодинамической поверхности. В ней
пар и жидкость имеют одинаковую плотность, поверхностное
натяжение равно нулю, вследствие чего исчезает мениск, раз
деляющий эти две фазы вещества. Так, если заполнить прозрач
ный сосуд веществом до критической плотности и медленно
подогревать его, приближаясь к критической точке со стороны
области двухфазных состояний, то четкий вначале мениск раз
дела фаз бледнеет и становится неразличимым при критической
температуре. Эта температура является верхней температурной
границей совместного существования жидкости и насыщенного
пара.
9За*.И
129
В процессе парообразования при р ^ с о п э ! (например, на ли
ниях 6 —Л, Ъ'—й ',
теплоемкость вещества равна беско
нечности, так как теплота подводится, а температура не изме
няется. По той же причине и в критической точке в пределе
Ср= оо.
Нижняя и верхняя пограничные кривые делят диаграмму
р—v на несколько областей. Все точки в области слева от линии
/С—М соответствуют состояниям жидкости, имеющей темпера
туру ниже температуры кипения, т. е. состояниям, ненасы
щенной (недогретой) жидкости. Д л я воды эта область
простирается до изотермы /—0еС — линии затвердевания воды
(линия L —Ai, рис. 9 .3), а слева
от последней находится об
ласть водного льда.
Таким образом, область на
сыщенной
жидкости
лежит
между линией затвердевания
(плавления) н линией насы
щенной жидкости (К—М ).
Область,
ограниченная
нижней и верхней погранич
ными кривыми (К —М
и
/С—N), соответствует состоя
ниям влаж ного насыщенного
пара, а область справа и выше
верхней пограничной кривой —
состояниям перегретого пара.
Для каждого
вещества
температура затвердевания /зт зависит от давления, поэтому
линия затвердевания не является изотермой. Однако для
обычно применяемых в технике диапазонов давления влияние
его на /1Т незначительно, и величину /ат можно приближенно
принять постоянной. Так, например, для NH3 /ггв —77 ,7е С,
для R12 fjr——155еС.
На рнс. 9 .4 изображена диаграмма р—v с пограничными
кривыми для различных фазовых переходов и областями твер
дого, жидкого и газообразного состояния вещества. В этой ди а
грамме линии О—К и С—К являются пограничными кривыми
рассмотренной выше двухфазной области IV — жидкость— пар.
Линия О— /С соответствует состояниям насыщенной жидкости,
Ркс. 9.4. Диаграмма р — о с изотер
мами и пограничными линиями д в у х
фазных областей.
линия С— /С— сухого насыщенного пара.
Линии А—В и С—О
—
левая и правая пограничные кривые
двухфазной области VI — твердая ф аза—пар. Линия А—В со
ответствует состояниям твердого тела при температуре сублима
ции, линии С —й
—
состояниям пара при температуре сублима
ции.
Линин В —£ н О— £ представляют собой пограничные кри
вые двухфазной области I I — твердая фаза—жидкость. Линии
130
Б —£ соответствуют состояния твердой фазы при температуре
плавления, линия О— £
—
состояниям жидкости при той ж е тем
пературе. Д ля воды температура точки О соответствует 0 е С и
линия О— £
—
линии М—£ на рис. 9.3.
Область I между осью р и линией Л—Б —£ соответствует
состояниям твердой фазы, имеющей температуру ниже темпе
ратуры насыщения, область V — состояниям пара с температу
рой выше температуры насыщения.
Вся область II изображается в диаграмме р—Т (см. рис.8 .1)
линией О—Л, область IV — линий О—/С, область V I — линией
Б—О. Линия В —О—С, на диаграмме р—V (см. рис. 9.4) кото
рой отражает равновесные состояния трех фаз (твердой, жид
кой и газообразной), соответствует тройной точке в диаграмме
р—Т (точка О на рис. 8 .1).
Кроме рабочей диаграммы для изображения и анализа тер
модинамических процессов для пара широко применяется теп
ловая диаграмма Г—5 . В ней так же, как в рабочей, нанесены
кривые насыщенной жидкости и сухого насыщенного пара, раз
деляющие области жидкого и газообразного состояний веще
ства. Метод построения диаграммы Т— 5 для пара рассмотрен
в§9.7.
§ 9.3. ПРОЦЕСС ПОДОГРЕВА ЖИДКОСТИ.
ПАРАМЕТРЫ НАСЫЩЕННОЙ ЖИДКОСТИ
Процесс подогрева жидкости прн р —const представлен на
рис. 9 .5 линией а—b в рабочей (а) и тепловой (б, в) диаграм
мах. Для воды точка М на диаграмме Г—s лежит на оси орди
нат, для холодильных агентов ось ординат смещена относи
тельно точки Af на величину s 0, РО для избежания отрицатель
ных значений энтропии при низких температурах.
Параметры насыщенной жидкости обозначаются: o', u’, i',
s ' и т. д . Темпеоатура насыщенной жидкости равна температуре
насыщения Tn(tu), соответствующей данному давлению р. К ак
уж е отмечалось выше, с увеличением давления удельный объем
v ' возрастает, так как влияние повышения давления сказыва
ется здесь в меньшей степени, чем влияние увеличивающейся
температуры насыщения. Зависимость v ' от Тн или р находится
экспериментально. Поскольку на линии насыщения р и Тп свя
заны меж ду собой однозначно, то д ля определения состояния
насыщенной жидкости достаточно задать только один из пара*
метров (р, Тл или любой другой).
Количество теплоты, которое необходимо подвести к 1 кг
жидкости, чтобы при постоянном давлении повысить ее темпе
ратуру от 0 ° С до /и, называется теплотой жидкости и
обозначается через q'. Очевидно, что р'—
(см. рис. 9 .6).
Как известно, теплота есть функция процесса. Однако при
небольших давлениях, а точнее, при давлениях и температурах»
не слишком близких к критическим, можно считать, что q не
»I»
9*
131
зависит от характера процесса подвода теплоты и что д*ъ~дМъ.
В этом случае, выражая дйь и дмь через теплоемкости, получим
д'- )СрёТ^сж'ёТ9
(9.1)
где ср — истинная изобарная теплоемкость жидкости (процесс
а —Ь); сх' — истинная теплоемкость жидкости вдоль линии на
сыщения (процесс Л1— Ь ).
а
Р в е 9.5 . Изображение процесса подогрева жидкости в диаграммах
р— V (а). Г —5 (6) для воды и Г — з (в) для холодильных агентов.
Используя среднее значение теплоемкости в интервале
от 0 е С до ¿* (или от 273 до ТпК), получим выражение
<7'-[Ср]о‘ - / н^(СхТ1о,-/е.
(9.2)
В соотношениях (9.1) и (9.2) предполагается, что теплоем
кости ср н с*' примерно равны, а следовательно, теплоемкость
жидкости не зависит от условий протекания процесса. Д л я воды
и холодильных агентов такая предпосылка не вносит заметной
погрешности в расчете д' при р^0,4ркр и Г^О^Гцр. С ростом
давления различие между ср и сх' возрастает.
132
В табл. 9 .1 приведены значения изобарной теплоемкости на
сыщенной жидкости с,/ и теплоемкости сх\ а такж е другие па
раметры для И2 2, подтверждающие эти соображения.
Таблица 9.1 . Зависимость некоторых параметров 1122
от температуры насыщения
Параметр
'н. °с
- 100
-60
0
50
70
р, 10*Па
0,0199
0,645
4.96
19,42
29,97
т/т„
0,47
0.60
0,74
0,87
0,93
р/р* р
0,0004
0.013
0,101
0,393
0,596
кДж/(кг-К)
1,070
>1,093
1,157
1*341
1,578
с'. , кДж/(кг*К)
1,070
1,094
1,167
•1.4*16
1,764
(с , —с'х)/с'Р
0
0,001
0,0085
0.063
0,105
Из таблицы видно, что для К22 при р/ркр^0,4 и 7/Гнр<0,87
теплоемкости ср' и сх' отличаются менее чем на 5% . С повыше
нием давления (или температуры насыщения) различие между
ними увеличиваются.
На основании изложенного можно заключить, что вдали от
критической точки теплота д' практически не зависит от усл о
вий протекания процесса нагревания жидкости. Учитывая это,
найдем соотношения для вычисления внутренней энергии и эн
тальпии насыщенной жидкости. Применив первый закон терм о
динамики к процессу аб, получим
д'= и'— и0'+р(р'—1>о')•
(9.3)
Реш ая уравнение (9.3) относительно и\ найдем
и' - д '4-и<>' — р(о' — vo,).
(9.4)
Энтальпию насыщенной жидкости определим из условия,
что для процесса постоянного давления теплота равна прираще
нию энтальпии:
6—«а или ? ' = Г —/о', откуда
¿'-¿о'+р'.
(9.5)
В уравнениях (9.3) — (9.5) и о', ¿' — параметры насыщенной
жидкости при давлении р (точка 6 ); ио', о0' , ¿о'— параметры
жидкости при температуре 0 ° С и том же давлении (точка а)
или близком к нему (точка М) .
133
Выражение для
можно такж е получить, исходя из общего
понятия энтальпии, согласно которому для состояния насыщен
ной жидкости:
i'~ u '+po'.
Подставив (9.4) в это выражение и сократив одинаковые
члены, имеющие разные знаки, получим
i'= и</+ рио'+ q*.
(9.6)
Очевидно, что формулы (9.5) и (9.6) идентичны, так к ак
io'=u0'+ pv0'.
(9.7)
При решении технических задач обычно имеют дело с раз
ностью внутренних энергий и энтальпий, поэтому несущественно,
какое состояние принимать за начало отсчета каждой из этих
величин. Следует только иметь в виду, что ио и /0 зависят не
только от температуры, но и от давления.
Для водяного пара в качестве начального состояния прини
мают воду при температуре /0в ОвС и соответствующем давле
нии насыщения ро—6 10 П а. Энтальпия воды в этом состоянии
(точка М на рис. 9 .5) принимается равной нулю. Тогда в со
ответствии с выражением (9.7) и численным значением v c'
для воды внутренняя энергия жидкости при * = 0 ° С и р0:
wo/p. = ío,'p .’ — Poüo'= — 0,00061 кДж/кг.
Значение ио'.р, значительно меньше неизбежных ошибок
калорических измерений, поэтому принимают ы'о.Ро —0 . При
повышении давления воды при /0= 0 ° С внутренняя энергия ос
тается близкой к нулю, вплоть до давлений примерно 10 М Па.
Следовательно, при любом давлении в этом интервале энталь
пия io'*=pvo\ т. е. пропорциональна давлению. Заметим, что ве
личина pvо' представляет собой работу насоса, которую надо
затратить на повышение давления жидкости от р0 до р. При
р—10 МПа со' =10 кДж/кг, что составляет менее 1% от общей
величины
В соответствии с приведенными выше соображениями н вы
ражениями (9.4) и (9.5) при р=10 МПа для воды с большой
степенью точности to/= u o' = 0 ,
При составлении таблиц холодильных агентов большинство
исследователей производит отсчет энтальпии такж е от состоя
ния насыщенной жидкости при foe O °C . Логичнее было бы по
аналогии с водяным паром за начало отсчета принимать насы
щенную жидкость при соответствующей для данного агента тем
пературе замерзания, считая энтальпию этого состояния равной
нулю. Однако из-за сложности экспериментального исследования
таких состояний имеющиеся в настоящее время сведения о них
недостаточны и они менее надежны, чем для *о~Ов С.
134
Для того чтобы не получить отрицательных значений эн
тальпий во всей области жидкости вплоть до температур замер
зания, для холодильных агентов энтальпия насыщенной ж ид
кости при 0 ° С и сответствующем давлении принимается равной
некоторому целому положительному числу. Так, при расчете
свойств агентов в немецкой технической литературе принима
ется
i\p9 — 1000 кДж/кг;
в
таблицах
составленных
в ЛТИХП, |'о,Рв=5О0 кДж/кг,
в таблицах ВНИИхолодпрома
*'о.р
—400 кДж/кг.
Для аммиака и большинства хладонов, так же как и для
воды, величина ро^'о.р« м ала в сравнении с
(от 0,5 до
1%), и можно считать и'о,р.~
(ошибка увеличивается для
агентов с низкими нормальными температурами кипения, на
пример, для хладона-13 она составляет около 5% ). Принимая,
что при р<0,5ркр внутренняя энергия жидкости при 0°С не
зависит от давления и пренебрегая величиной ри0» получаем
Рв. Различие между i'o и м'о при таких давлениях ме
нее 5%. В соответствии с этим при давлениях, не превышаю
щих половину критического, расчет энтальпии насыщенной ж ид
кости хладагентов может осуществляться по уравнению (9.5),
внутренняя энергия — по уравнению (9.6).
Заметим, что при любом давлении точное определение пара
метров насыщенной и ненасыщенной ж идкости обычно прово
дится с помощью дифференциальных уравнений термодинамики
по термическому уравнению состояния.
Энтропия насыщенной жидкости может быть подсчитана
с помощью второго закона термодинамики для обратимых про
цессов. Д ля процесса М —b
где — энтропия насыщенной жидкости; з'о .р * — энтропия на
сыщенной жидкости при /о*~ 0°С (Г0— 273 К) н соответствую
щем давлении насыщения р0 (см. рис., 9.5, б, в).
Уравнение (9.8), записанное с помощью средней теплоем
кости, имеет вид
При составлении таблиц насыщенных паров принимают для
воды 5/о .ь = В80, для холодильных агентов з'0. Р, = 4 , 5 или
10 кДж/(кг’ К).
Приращение энтропии в процессе а—Ь
где $о.|> — значение энтропии при /0в 0°С (Г0*= 273 К) и дав
лении р. Т ак как ср несколько больше с'х, то $о.р несколько
'ш
8ь—
—
So.,'- £Cx'dTJT,
(9.8)
s'-lc«']iiln (7У273).
(9.9)
135
меньше 5 ' 0,
Это обстоятельство учтено при изображении про
цесса в диаграмме 7—5 (рис. 9 .5, б, в). Точка Ь лежит на кри
вой насыщенной жидкости. В точке а энтропия меньше, чем
в точке М (50,р О 'о ,р ,) . Следовательно, в диаграмме 7 —5 изо
бара а—Ь теоретически расположена несколько левее нижней
пограничной кривой. П л ощ адь под процессом аЬ (площадь
АаЬВ) равна теплоте жидкости или разности энтальпий V—
площадь под процессом М —Ь (площадь ОМЬВ) — произведению
\сж\гNoТш— 273).
Вместе с тем, как было показано выше, в определенном ин
тервале давлений теплоемкость ср ^ с х' , а следовательно, з0, р—.
р» и для вычисления энтропии насыщенной жидкости мо
ж ет быть применено выражение
*'^0. '*+ £^Г/Г-*о.V +[Ср]йш No 73). (9.10)
При этом можно считать, что площади под процессами а —Ь
и М—6 в диаграмме 7 —5 равны и изобары жидкости при не
высоких давлениях в тепловой диаграмме практически совпа
д аю т с нижней пограничной кривой.
| 9.4. ПРОЦЕСС ПАРООБРАЗОВАНИЯ.
ПАРАМЕТРЫ СУХОГО НАСЫЩЕННОГО ПАРА
На рис. 9 .6 процесс парообразования изображен в коорди
натах р—V и 7 —5 (линия 6—¿). В этом процессе остаются
постоянными давление н температура.
Параметры сухого насыщенного пара обозначаются р, 7 Н,
и", и",
5" . Состояния сухого насыщенного пара изобража
ются точками на верхней пограничной кривой и так же, как
состояния насыщенной жидкости, полностью определяются д ав
лением или температурой. Каждому давлению соответствуют
вполне определенные для данной жидкости температура насы
щения 7„ и объем и" . Значения V" при разных давлениях (или
7 Н) находят по уравнению состояния, решая его совместно
с уравнением кривой давления насыщенного пара.
Для жидкостей с повышением температуры и" уменьшается.
Объемы насыщенной жидкости о7 и сухого насыщенного пара
и " связаны между собой эмпирической зависимостью
1/о'+ 1/о" —2/икр+Ь(7ир — 7И),
(9.11)
где Ь — коэффициент, различный для разных веществ, имею
щий положительное численное значение.
Формула (9.11) описывает так называемое «правило прямо
линейного диаметра», которое состоит в том, что в координа
тах плотность р — температура насыщения 7 В диаметр кривой.
р —1(Тш) является прямой линией.
136
Количество теплоты, которое надо подвести к 1 кг насыщен
ной жидкости, чтобы при постоянном давлении превратить ее
в сухой насыщенный пар, называется теплотой парообразова
ния и обозначается буквой г. Величина г равна площади под
процессом 6—б в диаграмме Г—5 (рис. 9.6, б).
В соответствии с первым законом термодинамики теплота
парообразования расходуется на изменение внутренней энергии
н работу изменения объема. Первая составляющая
называ
ется внутренней теплотой парообразования. Она затрачивается
о
б
на преодоление сил притяжения между молекулами (работу
«днсгрегацни» — разъединения молекул) и равна
Твя« а" _
а'.
(9.12)
Вторая составляющая ф называется внешней теплотой па
рообразования. Она расходуется на изменение объема при пе
реходе из состояния насыщенной жидкости в сухой насыщен
ный пар и равна
(9.13)
Величина ф изображается площадью под процессом в ра
бочей диаграмме (рис. 9 .6 ,а ). Очевидно, что
—
**'+0(0*-- о').
(9.14)
Примерные значения г д ля некоторых рабочих тел приве
дены в табл. 9 .2 . Величина г зависит от природы жидкости и
температуры насыщения. С повышением давления или темпера
туры г уменьшается и в критической точке становится равной
нулю. Отношение количества теплоты парообразования к ко-
137
Таблица 9.2 . Значения теплоты парообразования г, к Д ж / к г
Рабочее тело
Р. МПа
0.1
1
а
3
10
Водяной пар
2256
2015 1891
1796
1*317
Аммиак
1370
1166 1064
965
383
1*12
167,6
131.5
104.777 .5
—
1*22
233.8
<183,8
152,4
122.7
—
лнчеству теплоты жидкости при увеличении р также умень
шается.
Поскольку процесс парообразования является изобарным»
теплота этого процесса равна разности энтальпий
Яьл*=и — ¿ь*5 — */.
отсюда энтальпия сухого насыщенного пара
Г-1Чг.
(9.16)
Внутренняя энергия сухого насыщенного пара может быть
найдена из выражения этальпни
(9.16)
Энтропию насыщенного пара можно определить» рассм ат
ривая изменение энтропии в изотермическом процессе Ь — 4
Sd — Sьmms " — а'—[¿Я м !Т— Г¿г/Г—г/Гж,
*т
*я
отсюда
5"-5'+г/Гя.
(9.17)
Теплоемкость сухого насыщенного пара с ” для большинства
веществ, в том числе воды, аммиака и многих хладонов. отри
цательна, поэтому наклон верхней пограничной кривой в д иа
грамме 7 — з для этих тел соответствует изображенному на
рис. 9 .5 и 9.6 . Однако сущест-
Рис. 9 .7. Пограничные кривые для
воды и 1*0316.
вуют вещества, для которых
с * " > 0 (за исключением облас
ти вблизи критической точки).
В качестве примера на рис. 9 .7
изображены пограничные кри
вые для хладона 1?С318 и
воды.
Теплоемкость насыщенной
жидкости Сх всегда положи
тельна. В критической точке
сх'=оо иСх"TM —°° (чтосле
дует из анализа дифференци
альных уравнений теплоемко
138
стей). Этот факт подтверждается тем, что в Г — « -диаграмме
касательные к линиям насыщенной жидкости и сухого насыщен
ного пара становятся в критической точке горизонтальными пря
мыми, а длина подкасательных стремится к бесконечности
(см. § 4.1).
§ 9Л. ПАРАМЕТРЫ ВЛАЖНОГО ПАРА
Состояние влажного пара при данном давлении (или тем
пературе) насыщения можно характеризовать степенью сухо
сти (или паросодержанием) парожидкостной смеси.
Степенью сухости х называется относительное массовое со
держание сухого насыщенного пара во влажном:
х—М7(ЛГ+ЛГ').
(9.18)
Рис. 9.8. К определению параметров влажного пара.
где Л!" — масса сухого насыщенного пара; М' — масса насы
щенной жидкости; М '+ М " — масса влажного насыщенного пара.
Иначе, степень сухости можно определить как массу сухого
пара, содержащегося в 1 кг влажного пара. Поэтому х изме
ряется в килограммах сухого пара на килограмм влажного —
кг/кг.
Величина 1 — х характеризует степень влажности насыщен
ного пара и представляет массовое содержание жидкости в од
ном килограмме влажного пара. Очевидно, что при давлении
р температура влажного пара равна Тп или /в. Удельный объем
влаж ного пара подсчитывается по уравнению
юх-ю "х+ю'{\—х),
(9.19)
где
—
объем, занимаемый сухим паром в 1 кг влажного;
о'(1— х) — объем, занимаемый насыщенной жидкостью в 1 кг
влажного пара.
Из рис. 9.8 можно видеть, что отношение отрезков
Ьс/Ьс1=(ох— и ')/(и" — и') —в диаграмме
р— о,
Ьс/ЬЛ»
*=($*—$')/($" —$') —вдиаграммеГ—«.
139
Но в соответствии с формулами (9.19) и (9.22) правая часть
последних соотношений равна х. Следовательно, величина сте
пени сухости может быть найдена по положению точки на диа
грамме, если измерить расстояние от этой точки до нижней по
граничной кривой и отрезок м е ж ду пограничными кривыми.
Учитывая это положение, строят линии постоянного паросодер-
жания в диаграммах. Все они сходятся в критической точке.
Понятие х относится только к области влажного пара. Д ля
нижней пограничной кривой де—О, для верхней х = 1 . Таким об
разом, степень сухости может меняться в пределах 0 < х ^ 1 .
Аналогично удельному объему на основании свойства адди
тивности термодинамических функций можно найти выражения
внутренней энергии и*, энтальпии 1Х и энтропии 5* влажного
насыщенного пара.
Внутренняя энергия влаж ного пара
их=и"х+и'(1—х)«*«Ч(а" — и')х%
их-и '+уШтХ.
(9.20)
Энтальпия влажного пара
(1 —Х)-¿Ч (*" — Г)х,
/х-Г+гх
(9.21)
Энтропия влаж ного пара
5х=5"х+5'(1 —Х)-5/Ч(5/' — $')*.
5*—5'«г/Гя» 5,-5Ч/’Х/Гя.
(9.22)
Заметим, что формулы (9.20) — (9.22)можно получить ме
тодом, примененным в § 9.4, рассматривая процесс 6 — с (рис.
9.8), в котором подводится теплота уьпх, расходуемая на изме
нение внутренней энергии (и* — и')» И теплота гх, расходуемая
на изменение энтальпии (*х — / ')•
| 9.6. ПРОЦЕСС ПЕРЕГРЕВА ПАРА.
ПАРАМЕТРЫ ПЕРЕГРЕТОГО ПАРА
Процесс перегрева пара соответствует на рис. 9 .6 линии
Л — е. Если к сухом у насыщенному пару (состояние (I) подво
дить теплоту при постоянном давлении, то температура его нач
нет повышаться и он превратится в перегретый пар состояния е.
Зависимость между параметрами перегретого пара р, Тп и
Во вы раж ается уравнением состояния
/(Р. *П.г„)=0,
(9.23)
которое находится аппроксимацией термических, калорических»
и акустических экспериментальных данных.
140
Каждое рабочее тело характеризуется своим уравнением со
стояния. Ф орм а этих уравнений может быть одинаковой, однако
численные значения постоянных величин различны.
Количество теплоты, которое необходимо подвести к 1 кг
сухого насыщенного пара, чтобы превратить его в перегретый
(в процессе р « с о п з1), называется теплотой перегрева и обозна
чается фп' Теплота перегрева
I СрёТ,
(9.24)
где Та — температура перегрева; ср — массовая теплоемкость
перегретого пара.
Последняя в отличие от теплоемкости идеального газа зави
сит не только от температуры, но и от давления (см. гл. 8).
Ее значения для каждого тела можно найти экспериментальным
путем или вычислить по уравнению состояния с помощью диф
ференциальных уравнений термодинамики. Значения ср приво
дятся в таблицах термодинамических свойств рабочих тел.
С помощью средней теплоемкости, взятой в интервале тем
ператур от Тн до Та, теплоту перегрева можно представить как
<7п- [Ср]^(Та— Та).
(9.25)
Разность температур Тп— Гп*»/п—
называется степенью пе
регрева пара.
Энтальпия, внутренняя энергия и энтропия перегретого пара
могут быть найдены из следующих соотношений:
*п-Г+?СрАТ%
(9.26)
'я
ЦаTM (в — роп»
(9.27)
а„«з'Ч Гср<1Т/Т.
(9.28)
*в
Значения энтальпии и энтропии перегретого пара та кж е при
водятся в таблицах термодинамических свойств рабочих тел.
Считая в интервале температур от Тя до Тп теплоемкость по
стоянной и равной [сР1 можно написать
/п-Г+(сР]^(Гп-Гш).
(9.29)
*„-*"+М г»1п(7УГ.).
(9.30)
| 9.7. ТЕРМОДИНАМИЧЕСКИЕ ТАБЛИЦЫ И ДИАГРАММЫ
Зависимость между параметрами насыщенного пара невоз
можно, как это уже указывалось, описать термическим уравне
нием состояния типа риж=ЯТ, Д авлени е насыщенного пара одно*
141
значно (для данного вещества) определяется температурой и
потому параметрами р и Тя нельзя задать его конкретное состо
яние. Удельный объем влажного насыщенного пара может при
нимать любые значения от х/ до V" в зависимости от степени с у
хости. Величины г/ и о" зависят от природы вещества и давле
ния (илн температуры), а величина удельного объема влажного
пара и* кроме того, и от х.
Таким образом, параметры насыщенного пара р, и и Тш
связаны меж ду собой рядом аналитических зависимостей: р =
—¡(Тщ), о7—/| (Тц) ,
довольно сложных и различных
для разных веществ. Их применение потребовало бы в каждом
случае выполнения инженерного расчета. В связи с этим для
ряда веществ, используемых в технике, по данным эксперимен
тальных исследований найдены указанные выше зависимости,
а по ним рассчитаны таблицы насыщенных паров, в которых при
ведены значения х/, V " , V, V з7, з77 и г, соответствующие различ
ным давлениям и температурам.
Параметры влажного пара могут быть найдены с помощью
данных этих таблиц по формулам, приведенным в § 9.5 .
С целью упрощения техники термодинамических расчетов
для многих рабочих тел составлены такж е таблицы свойств пе
регретых паров и ненасыщенной (сжатой) жидкости. Они со
держ ат значения удельных объемов, энтальпий и энтропий для
разных давлений и температур.
В ряде случаев в таблицах для области однофазных состоя
ний, так же как и в таблицах насыщенных паров, приводятся
значения изохорных и изобарных теплоемкостей, скорости звука
и других термодинамических параметров.
В настоящее время широкодиапазонные подробные и точные
таблицы имеются для воды и водяного пара, двуокиси углерода,
азота, воздуха, метана, аммиака, И12, Я22 и ряда других тех
нически важных газов н жидкостей.
Составлению таблиц предшествуют широкие эксперименталь
ные исследования свойств рабочих тел, анализ совокупности
всех имеющихся опытных данных по конкретному веществу, со
вместная обработка нх на ЭВМ . Эти работы проводятся вузами
и научно-исследовательскими институтами нашей страны и ряда
зарубежных организаций. Советскому Союзу принадлежит ве
дущее место в этой области.
Первые таблицы термодинамических свойств холодильных
агентов в нашей стране были составлены в Ленинградском холо
дильном институте в 1939 г. И. И. Левиным путем обработки
имевшихся к тому времени опытных данных по аммиаку и И 12.
В настоящее время в ЛТИХП, ВНИИхолодпроме, МЭИ и др.
составлены таблицы насыщенного и перегретого пара многих
хладоиов.
Ниже в качестве примера приведена часть таблиц термоди
намических свойств И22 (табл. 9 .3 и 9.4). В табл. 9 .3, в допол-
142
пение к ранее встречавшимся обозначениям, с / , с»", ср\ ср'\
гв', и>" — со ответственно изохорные и изобарные теплоемкости
и скорости звука насыщенной жидкости и сухого насыщенного
пара. В табл. 9 .4 выше горизонтальной черты приведены д ан
ные для насыщенной жидкости, ниже — для перегретого пара.
В отличие от приведенного примера таблицы термодинамиче
ских свойств, публикующиеся в сокращенных справочных изда
ниях, обычно содержат минимальный перечень параметров
(Рв, V', о
" ,Г,г,в,в").
Таблица 9.3. Термодинамические свойства Н22
в состой—и насыщения
it *с
р. МПа р' кг/м» р’ кг/мР
кДж/кг Л «Дж/кг
а'
кДж/<кг*К)
а
кДж/(кг• К)
— 100
0.00199
1669
0,М98 389,69 658.83 0.5003
2.0547
-60
0,06453 1436
3.092 443,60 683,00
0,7735 1,8463
(»
0.49*1
1382 21.28
500,00 704.43 1.0000
1.7464
60
1,942
1063 86.03 562,85 716.93
1.2067 1.6636
80 3,664
894,1
196.2
610,46 711,55
1,3422
1.6284
96.13
4,966
512.8 912.8
668,61 668.61
1.4972
1.4972
Продолжение
г , кДж/кг
V
кДжДкг’* К)
К
*Дж/(кг • К)
»
ср
кДж/(к • К)
*
е
р
*Дж/(кг К) м/с
V* м/с
269,14
0,699
0,400
1,070
0,498
1090
143.6
239.40
0,660
0,461
1,004
0,592
912,9
168,2
204,43
0.646
0,583
1,167
0.754
694.3
•163,1
154.08
0.690
0711
1,461
1.126
431,5
152,2
101.09
0,808
0.616
2.215
2746
242,7
133,4
0
оо
оо
оо
оо
Определение различных термодинамических величин, р ас
четы н исследование термодинамических процессов для паров
наиболее удобно проводить при наличии диаграмм. На диаграм
мах в масштабе строятся нижняя и верхняя пограничные кри
вые и наносится сетка изобар, изохор, изотерм, линий постоян
ных энтальпий, энтропий и степени сухости. Наибольшее рас
пространение имеют диаграммы Г—5 и I—5 для водяного пара
и диаграммы Т—5 и р—I для холодильных агентов. Последняя
часто строится в полулогарифмической сетке 1^ р — в.
Тепловая диаграмма Г—5. На диаграмме 7 —5 по оси абсцисс
откладываются значения удельной энтропии вещества, а по оси
ординат — температура Т, К или t9°С (рис. 9 .9). В этих коорди-
143
ыатах строятся пограничные кривые и наносятся линии изобар,
нзоэнталъп, изохор. В области м еж ду кривыми насыщенной
жидкости и сухого пара строятся линии постоянной степени с у
хости.
Кривая насыщенной жидкости (левая пограничная кривая)
строится по табличным величинам Т и з'. Теплоемкость насы
щенной жидкости всегда положительна. Вдали от критической
точки нижняя пограничная кривая имеет вид, похожий на изо
хору для идеальных газов. С повышением температуры кривая
имеет перегиб, после которого меняет свою кривизну. В крити
ческой точке сх'® = оо, а левая пограничная кривая имеет гори
зонтальное направление.
Таблица 9.4. Термодинамические саойстаа Ц22
в однофазной области при давлении 1 МПа
вС р. «Г/Ы1 1, кДж/кг
8.
кДж/(кг • К) кДж/(кг • К)
еР*
кДж/(кг • К)
V, м/с
—80
1518
411.55
0.6162
0.682
1,072
1024
—40
1406
464,93
0.8203
0,658
мог
873.6
0
1284
500Л'1
0,9990
0.648
1,164
686,9
40
36,46
725,05
1.7634
0,633
0,825
169,2
80
32,21
758.12
1,8593
0.616
0,791
186,9
120
28,06
789.90
1.9451
0.674
0,801
199,5
160
25.03
822,39
2,0238
0,706
0,824
211,4
Кривую сухого насыщенного пара (правую пограничную кри
вую) получают, отложив от левой при нескольких значениях тем
пературы отрезки длиной г/Тп и соединив концы этих отрезков
плавной линией ($" —з '+ г /Г н). Форма верхней пограничной кри
вой вдали от критического состояния зависит от знака теплоем
кости сх" (см. рис. 9 .7). Вблизи от критической точки теплоем
кость сухого насыщенного пара становится для всех веществ от
рицательной, и верхняя пограничная кривая меняет свой наклон.
При Г-Гкр, с * " = — оо кривая имеет горизонтальное направле
ние.
Очевидно, что линии Г —сопз1 в рассматриваемых координа
тах являются горизонтальными, а $ —а и Ы — вертикальными
прямыми.
Кривые постоянной степени сухости получаются путем дел е
ния горизонтальных участков между пограничными кривыми на
равное число частей и соединения точек одинаковых делений.
Изобары в области ненасыщенной жидкости и перегретого
пара изображаются кривыми, поднимающимися слева направо.
Наклон изобар можно установить из анализа общего выраже-
144
1 ;ня энтропии для изобарного термодинамического процесса од
нофазной системы
= с р(1Тр/Т.
Из уравнения следует, что тангенс угла наклона изобары
к оси абсцисс в координатах Т— з равен
(дТ/дэ)р= йТр^р - Т/ср.
(9.31)
Он возрастает с ростом температуры и уменьшением тепло
емкости сР.
Для построения изобар жидкости можно воспользоваться
уравнением (9.10 ), изобар перегретого пара — уравнением
(9.28) либо табличными данными. В области влаж ного пара
Рис. 9.9. Тепловая диаграмма.
изобары совпадают с изотермами, т. е. изображаются горизон
тальными прямыми. Критическая и сверхкритическне изобары
имеют перегиб.
Линии i = const изображаются кривыми, опускающимися
слева направо и обращенными выпуклостью вниз. При переходе
из области влажного пара к перегретому крутизна линий по
стоянных энтальпий монотонно уменьшается. В области перегре
того пара, удаленной от верхней пограничной кривой, линии i =
= c o n s t приближаются к горизонталям (для идеального газа при
7»=const этальпия постоянна, так как ср не зависит от темпе
ратуры). В области жидкости изоэнтальпы имеют максимумы,
через которые проходит линия инверсии (см. гл . 10 ).
Изохоры в области перегретого пара изображаются линиями
более крутыми, чем изобары. В области влажного пара эти линии
представляют собой обращенные выпуклостью вверх кривые бо
лее пологие, чем для перегретого пара. Они сближаются между
собой и приближаются к нижней пограничной кривой по мере
снижения температуры. Заметим, что линии постоянного объема,
ю Зак. 80
145
отходящие от верхней пограничной кривой, не могут пересекать
линии насыщенной жидкости (см. изображение изохор в р— и -
диаграмме). Иначе говоря, охлаждением при v = const перевести
весь пар в жидкость невозможно.
На рис. 9.9 изображена диаграмма Т—s, на которой нане
сены такж е области твердого, жидкого и газообразного состоя
ний вещества. В ней А—В и С—D
—
левая и правая погранич
ные кривые двухфазной области твердая фаза — пар; В — Е и
0 —*~F — левая и правая пограничные кривые двухфазной обла
сти твердая фаза — жидкость; К—О и К—С
—
левая и правая
пограничные кривые двухфазной области ж идкость— пар.
Линия В — О—С соответствует равновесным состояниям всех
трех фаз, имеющих температуру тройной точки вещества (трой
ная линия).
Область / — твердая фаза; // — равновесные состояния твер
дой и жидкой фаз; III — жидкость; IV — равновесные состояния
жидкой и паровой фаз; V — перегретый пар; VI — равновесные
состояния твердой и паровой фаз.
Диаграммы ¿—5 и р—/. Одно из основных преимуществ эн
тальпийных диаграмм I—5 и р—I (или
— I) перед тепловой
состоит в том, что теплоты перегрева жидкости, парообразова
ния, перегрева пара изображаются в них не площадями, а от
резками. Представление разности энтальпий в виде отрезков
весьма удобно для расчета и анализа циклов различных машин.
На диаграмме £—5 по оси абсцисс откладывается удельная
энтропия 5, по оси ординат — удельная энтальпия. По данным
таблиц наносят левую и правую пограничные кривые (рис. 9 .10 ).
Координатами точек, принадлежащих первой из них, являются
значения V и
второй—Г и
Соединив точки, относящиеся
146
к одному и тому же давлению, получают прямые, являющиеся
изобарами в области влажного пара.
Эти линии являются одновременно и изотермами. Линии по*
стоянной степени сухости наносятся так же, как и в диаграмме
7 —5, делением отрезков изобар меж ду кривыми на равное чис
ло частей и соединением соответствующих точек. Так как при
изобарном процессе ¿ $Р~<ИР/Т, то (д1/д$)р —<Ир/с1$р=яТ.
Из этого соотношения следует, что тангенс угла между каса
тельной к изобаре и осью абсцисс зависит от температуры, уве
личиваясь с ее повышением.
Прямолинейные изобары влажного пара являются касатель
ными к изобарам жидкости, которые практически совпадают
с нижней пограничной кривой. Изобары влажного пара одно
временно являются касательными к изобарам перегретого пара,
которые изображаются кривыми, поднимающимися слева н а
право и обращенными выпуклостью вниз.
У верхней пограничной кривой изотермы расходятся с изо
барами, имеют перегиб и переходят в кривые, полого поднима
ющиеся слева направо и обращенные выпуклостью вверх. С по
вышением Т и удалением от пограничной кривой они приближа
ются к горизонталям.
Изохоры влажного и перегретого пара изображаются кри
выми, имеющими большую крутизну, чем изобары.
Длина изобар в области влажного пара определяется вели
чиной
V, которая графически равна проекции изобары на
Ю*
147
ось ординат. В критической точке тангенс угла наклона изобары
к оси 5 равен Г** а длина стремится к нулю (г-*0). Поэтому
критическая точка лежит на левом склоне, а не на вершине
линии насыщения.
В диаграмме 1gp— I, которая широко используется в холо
дильной технике, по оси абсцисс откладываются удельные эн
тальпии I, а по оси ординат в логарифмическом масштабе ве
личины давлений р. Строятся пограничные кривые и наносятся
линии изотерм, адиабат и изохор, а такж е линии ж—const.
Изображение различных процессов в диаграмме 1gp—i ясно
из рис. 9.11.
| 9.8. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ДЛЯ ПАРА
Рассмотрим закономерности, которые описывают основные
термодинамические процессы, происходящие с парами, и спо
собы расчета величин, характеризующих процесс: изменения
внутренней энергии, работы, теплоты.
При анализе паровых процессов будем использовать соот
ношения, имеющие общее значение, т. е. не связанные со свой-
ские уравнения первого и второго законов термодинамики н
уравнение энтальпии.
Изохорный процесс. К влажному насыщенному пару состоя-
яння / (рис. 9 .12 ) начнем подводить теплоту при постоянном
объеме (закрытый сосуд) до тех пор, пока пар не превратится
в перегретый (точка 2). Очевидно, что при этом давление н тем
пература пара будут повышаться. Увеличатся также энтальпия
и энтропия пара.
Работа процесса на основании общего выражения /■ =
равна нулю. По первому закону термодинамики теплота про
цесса
Рис. 9 .12 . Изохорный процесс для пара.
/
ствами вещества. К таким соотношениям относятся аналитиче
148
?«Ди-Н
—Дм.
Значение теплоты, подведенной к 1 кг рабочего тела в про
цессе 1 —2, равно заштрихованной в диаграмме Т—з площади.
Аналитически она может быть найдена с помощью выражения
внутренней энергии:
и\ -/| — рхх>,
и*-/2— р20,
Я-02—их -12—»1—V(р2—Рх).
(9.32)
Значения р, V, I приводятся в термодинамических таблицах.
Изобарный процесс. К влажному пару состояния 1 (рис. 9 .13)
будем подводить теплоту при р»соп$1. Сначала при Г=соп$1
вся содержащаяся в нем жидкость перейдет в пар, а затем тем
пература пара повысится, и он станет перегретым (точка 2 ).
Ряс. 9 .13. Изобарный процесс для пара.
При этом объем и температура пара, так же как энтальпия и
энтропия, примут ббльшие, чем в начальном состоянии, значе
ния.
Работа процесса
а
/—| р4о—р{о2— 0|).
(9.33)
Заштрихованная площадь под процессом 1 —2 в диаграмме
р—V равна величине /. Теплота процесса на основании свойства
энтальпии
1.
(9.34)
Заштрихованная площадь под процессом 1 —2 в диаграмме
Г— з соответствует количеству теплоты процесса.
Изменение внутренней энергии
Ди—ф—/—12— 1\ — р(с>2— »г) •
(9.35)
Изотермический процесс. Рассм отрим изотермический про
цесс подвода теплоты к влажному пару состояния 1 (рис. 9 .14).
В этом процессе сначала при постоянном давлении будет проис
ходить парообразование и превращение влаж ного пара в сухой
насыщенный. При дальнейшем подводе теплоты давление будет
понижаться, объем увеличиваться. Так как более низкому дав-
149
лению соответствует и более низкая температура насыщения
Тщ, то пар при температуре Т и давлении рз окажется перегре
тым (точка 2). Энтропия н энтальпия в точке 2 будут иметь
большие значения, чем в точке /. Теплота процесса
—
з,).
(9.36)
Она равна заштрихованной площади под процессом 1 —2 в ди
агр а м м е Т— 5. Изменение внутренней энергии
Ди-11
—
*1 — (Р&з — Р1О1).
(9.37)
Заметим, что в отличие от процесса с постоянной температу
рой для идеального газа здесь Ди не равно нулю, так как из
меняется внутренняя потенциальная энергия, зави сящ ая не
только от температуры, но и от р и V.
Адиабатный процесс. Рассмотрим процесс адиабатного с ж а
тия влажного насыщенного пара (рис. 9 .15). Энтропия в этом
процессе остается постоянной, энтальпия, давление и темпера
тура увеличиваются. В этом процессе пар сначала превраща
ется в сухой насыщенный, а затем в перегретый (Гз>Гна). За
метим, что в случае
адиабатное сжатие перегретого пара
может привести к его увлажнению (см. рис. 9 .7 для КС318).
Адиабатное сжатие влажного пара с х < 0 ,5 ведет к понижению
степени сухости и к превращению пара в жидкость.
Теплота процесса
р —О,
(9.39)
изменение внутренней энергии
Ди- (¿з — й) — (Ра&а— Р1^1),
(9.40)
150
работа процесса в соответствии с первым законом термодина
мики
/- —Au—(ii—i2)+(PaOa—
-
(9.41)
Параметры конечного состояния в этом процессе находят нз
условия s * const.
Кроме того, при аналитическом расчете здесь так же, как
и для идеального газа, может быть применено соотношение
PiPn\BmP2Vm2- Только в данном случае к определяется из условия
адиабатного процесса ( s —const) для реального газа и не равно
отношению теплоемкостей cp/cv, как это было для идеального
газа.
Рис. 9 .15 . Адиабатный процесс для пара.
Расчеты процессов изменения состояния пара, т. е . определе
ние параметров, а также ц, Ли и / осуществляются либо с по
мощью диаграмм, либо с помощью таблиц н формул (для влаж
ного насыщенного пара). При этом для начального состояния
должны быть заданы два параметра (в случае насыщенной жид
кости или сухого пара — один, так как второй — х
—
известен).
Для конечного состояния должен быть известен один параметр,
кроме характерного для процеса.
| 9.9. УРАВНЕНИЕ КЛАПЕНРОНЛ-КЛЛУЗИУСЛ
Соотношение меж ду величинами, характеризующими про
цесс перехода из одного агрегатного состояния в другое, у с т а
навливается с помощью уравнения Клапейрона — Клаузиуса.
Один из возможных выводов этого уравнения приводится ниже.
Рассмотрим элементарный цикл К ар н о ,' осуществляемый
в области влажного пара между двумя пограничными кривыми
(цикл abed на рис. 9 .16).
Термический к. п .д . цикла Карно может быть найден по фор*
муле
1\ик=11яIе (7*1 —Тг)!Т\.
151
Применительно к циклу abed — работа, равная площади
цикла d l~( v " —x/)dp. Подведенная теплота ^ i—г
—
теплота
процесса парообразования. Температура Т\ = Т, а разность тем
ператур, соответствующая бесконечно малому изменению д авле
ния dp, равна dT, отсюда
1к «- (*" -y')dplr=dTIT.
(9.42)
Формула (9.42) может быть представлена в виде
r-7>" — v^dp/dT*
(9.43)
Рис. 9 .16. Элементарный цикл Карно ^ля пара.
Полученное соотношение может быть распространено не
только на парообразование, но и на другие процессы фазового
превращения (плавление, сублимация). Так, для плавления
гм -Г(ош- ип)(¿р#Т)„л.
(9.44)
Выраж ения (9.43) и (9.44) позволяют определить теплоту
парообразования г и теплоту плавления гпл, если известны раз
ность объемов фаз на линиях насыщения и кривая изменения
давления в зависимости от температуры фазового перехода.
Эти формулы могут служить и для решения обратной задачи
определения и" — и' по известным г н (dp/dTв). Имея экспери
ментальные значения о7, можно найти V", что весьма существенно,
учитывая сложность точного определения и" непосредственно
из опыта.
Глава 10
ТЕРМОДИНАМИКА ПРОЦЕССОВ
ИСТЕЧЕНИЯ ГАЗОВ И ПАРОВ.
ПРОЦЕСС ДРОССЕЛИРОВАНИЯ
§ 10.1 . ИСТЕЧЕНИЕ ГАЗОВ И ПАРОВ.
ОСНОВНЫЕ ПОНЯТИЯ
И МАТЕМАТИЧЕСКОЕ ОПИСАНИЕ
В данной главе рассматривается истечение газа (или пара)
из сосуда бесконечно большой емкости через канал переменного
сечения. При этом будем полагать, что начальные параметры,
например температура и давление газа (или пара), в сосуде
остаются в процессе истечения неизменными, а начальная его
скорость близка к нулю.
Истечение газа через канал происходит в результате пере
пада давлений вдоль оси канала: давление на входе в канал
отличается от давления среды, в которую происходит истечение
(в устье канала). Естественно, что при равенстве давлений
внутри канала истечение невозможно.
В соответствии с существующей технической терминологией
каналы, в которых движется рабочее тело (газ или пар), носят
название сопел и диффузоров. Сопло —это канал, в кото
ром потенциальная энергия потока превращается в кинетиче
скую , предназначенный для получения высоких скоростей дви
жущегося потока. Диффузор — канал, обеспечивающий тормо
жение потока газа (или пара), сжатие рабочего тела, играющий
роль своеобразного компрессора. В первом случае (сопло) д ав
ление газа на входе в канал значительно больше давления
в устье канала. Во втором случае (диффузор)— картина обрат
ная.
Процессы преобразования энергии в потоке представляют
значительный практический интерес.
Сопло является неотъемлемой частью паровых и газовых
турбин, реактивных двигателей. Так, около 120 лет до н. э.
Герои Александрийский описал прибор, в котором струей пара,
вытекающей из изогнутых сопел, вращался шар. В 1629 г.
Бранко описал прибор, прообраз современной турбины, в кото
ром струя пара, выходя из неподвижного сопла, направлялась на
лопатки колеса и заставляла его вращаться. Первые действую
щие модели паровых турбин были сконструированы в 1813 г.
русским изобретателем Поликарпом Залесовым . Первые модели
газовых турбин, где струя газа, направляясь на лопатки, вра
щала ротор турбины, построены П. Д . Кузьминским (1982 г.)
и В. В . Караводиным (1908 г.) .
1КЗ
Мощности ежегодно выпускае
мых в С С СР современных турбин,
используемых в народном хозяйст
ве, охватывают диапазон от 0,6 до
1000 МВт и более.
Диффузоры широко используют
ся в конструкциях прямоточных воз
душно-реактивных двигателей, т ур
бокомпрессоров,
пароэжекторных
холодильных машин, струйных на
сосов и т. д.
Рассмотрим основные законо
мерности процесса истечения. У р а в
нение (2.2) первого закона термо
динамики
имеет общий
характер и справедливо для любых
систем — неподвижных и движу
щихся. Однако в случае движущих
ся систем, т. е. если рабочее тело перемещается в простран
стве со значительной скоростью (десятки и сотни метров в се
к унду), необходимо учитывать некоторые дополнительные о б
стоятельства. Д ело в том, что работа изменения объема газа
в этом случае расходуется на перемещение газа в канале (пре
одоление сопротивления внешней среды) и на приращение ки
нетической энергии (скорости) потока г а за :
Л = ’^/,+</(а>,/2).
(10.1)
Здесь Ш' — часть работы <к, затрачиваемой на перемещение
газа в канале — работа проталкивания; й(и>2/2) — изменение ки
нетической энергии потока. Произведя замену в уравнении (2.2)
в соответствии с (10.1), получаем
йя-Ли+Ле+Л{&&).
(10.2)
Выражение (10.2) представляет собой уравнение первого за
кона термодинамики для потока газа в одномерном прибли
жении.
Для получения количественных соотношений, определяю
щих работу проталкивания в уравнениях (10.1) и (10.2), рас
смотрим рис. 10.1, где сечениями /—/ и II—II выделена внртри
канала некоторая масса рабочего тела, участвующего в устано
вившемся потоке газа.
Действие соседних слоев на выделенный объем заменим
внешними силами: р /— действует на левую поверхность слоя
с площадью { и (р+кр) {¡+(11) — на правую поверхность слоя
с площадью /+<*/. Допустим, что общее направление движения
потока происходит слева направо. Тогда для перемещения вы
деленной массы потока рабочего тела в указанном направлении
потребуется за единицу времени совершить работу, равную ал-
г
Рве. 10.1 . К «налезу процесса
истечения внутри ш а л а .
154
гебраической сум ме работы, которую производят внешние силы
над потоком (знак минус), и работы, которую производит поток
(эта работа считается положительной) над внешними силами:
dL'- (p+dp)(f+df)(w+dw) —pfw9
где p — давление; w — скорость; U — работа, отнесенная к массе
газа. После сокращения и отбрасывания малых величин второго
н высшего порядка получаем
dL'—pfdw+pwdf+ wfdp-pd(/w) +wfdp.
(10.3)
Напомним, что для установившегося потока количество рабо
чего тела, проходящее через любое сечение канала площадью /
в единицу времени, равно
M—fw/v,
где М — секундный массовый расход рабочего тела; о — удель
ный объем газа или пара в данном сечении канала.
Учитывая, что расход М — величина постоянная (примем
М « 1 кг/с), уравнение (10.3) можно привести к виду
di'—pdv+ vdp—d(pv)t
(10.4)
так как d(fw)—dv и wf—v
.
С учетом (10.4) уравнение (10 .1)
можно записать в виде
pdv-d(pv) 4-d(wl/2).
(10.5)
Поскольку работа проталкивания d l ' - d (p v) является неотъ
емлемой частью всякого истечения, ясно, что из работы расши
рения d i—pdv полезно может быть использована лишь та ее
часть, которая остается за вычетом работы проталкивания, т. е.
величина di—di'.
Но di—dl'*=pdv—d(pv)= —vdp, и так как
d(pv)—pdv+vdp, имеем из (10.5)
dl—dl'-d(w2/2).
(10.6)
Итак, превратить в другие виды работы можно лишь ту часть
работы расширения, которая расходуется на увеличение кинети
ческой энергии потока. Исходя из этих соображений, величину
d(w2/2) ——vdp—di—di' называют* располагаемой ра
ботой и обозначают dio, т. е.
di—di'-dio.
(10.7)
Интегрируя (10.5) с учетом (10 .7), имеем следующие соот
ношения:
/-/'+Ь.
(10.8)
lo-
-
ш,*)/2- /
-
(10.9)
lo—— Г vdp—'¡vdp.
(.10.10)
р.
р*
155
Необходимым условием (см. уравнения (10.6) и ( 10 .10 )) по
лучения располагаемой работы является понижение давления,
так как только при й р < 0 /о>0. Если процесс истечения изобра
зить в координатах р—V (рис. 10 .2 ,а ), то располагаемая работа
в соответствии с равенством (10 .10 ) изобразится в виде пло-
щади а '12 Ь ', а работа расширения потока / = )р<1и изобразится
*1
площадью а12Ь.
Рассмотрим конкретные аналитические зависимости для оп
ределения располагаемой работы наиболее распространенных
термодинамических процессов идеального газа. Если расшире-
ние происходит по люлитропе с уравнением
const, то ра
бота расширения, /как известно, равна / —
Pio^).
Тогда, поскольку ив уравнения (10.4) имеем / ' = Р а ^ 2—Pi^i-, по
лучим, следуя (10.9):
/о- i
—
/'= ■ ~Т ~ (Pi»i — P*Oj)—ixl.
Другими словами, в зависимости от значения показателя
политропы п располагаемая работа может быть больше, равна
или меньше работы расширения. Так, в изотермическом про
цессе л =* 1 н /о=/, т. е. работа расширения равна располагаемой
работе. В процессе адиабатного расширения п = к и располага
ем ая работа всегда (напомним, что для идеальных газов
= cp/cv> 1) больше работы расширения. Предостережем от ча
сто встречающейся ошибки при определении располагаемой ра
боты в изохорном процессе. В этом случае предыдущее уравне
ние обращается в неопределенность, так как /—0, а л » ± о о .
156
В действительности располагаемая работа существует и в этом
процессе и согласно формуле (10 .10 ) равна /ов (Р|—
Теперь целесообразно вернуться к уравнению первого закона
термодинамики. Подставив в (10.2) выражение для работы про
талкивания (10.4), получим
dq—du+d(pv) +d(w2|2) =d(u+pv) +d(w 2|2).
Поскольку
имеем
dq=di+d(w2/2)9
(10.11)
или
dq—di+dlo.
(10.12)
Сравнивая две формы записи первого закона термодинамики
dq***du+dl и dq=di+dlo, можно лучше понять физический
смысл энтальпии. Действительно, при исследовании процессов,
в которых газ не перемещается в пространстве, энергия рабочего
тела, зависящая от его состояния, характеризуется значением
внутренней энергии и. В процессах, связанных с истечением р а
бочего тела внутри каналов, собственной энергией рабочего тела
является сумма внутренней энергии газа и потенциальной энер
гии его давления, т. е . энтальпия. Речь, таким бразом, идет об
аналогии, поскольку энтальпия в потоке движущегося газа иг
рает ту ж е роль, что и внутренняя энергия для неподвижного
рабочего тела.
Из уравнения (10 .12 ) следует еще одно важное заключение.
Поскольку d k жsdq—dit для адиабатного течения газа No « = 0 )
имеем
- чИ^1о=й(ч;212)9
(10.13)
т.е.
(10.14)
Следовательно, в адиабатном процессе приращение энталь
пии равно располагаемой работе потока. Из уравнения ( 10 .13)
т а к ж е видно, что изменение кинетической энергии потока и из
менение энтальпии равны по абсолютной величине и противопо
ложны по знаку. Другими словами,* уменьшение энтальпии по
тока сопровождается его ускорением, и, наоборот, торможение
потока соответствует увеличению его энтальпии. Сказанное поз
воляет в этом случае классифицировать энтальпию как потен
циальную энергию потока.
На рис. 10.2 , б обратимый процесс ади абатного истечения
газа представлен в диаграмме i—5. Отрезок /—2, соединяющий
точки, характеризующие начальное и конечное состояние дви
жущегося потока, изображает в масштабе располагаемую ра
боту, численно равную (см. уравнение ( 10 .14)) разности энталь
пий потока, т. е. располагаемому теплоперепаду.
Основные закономерности течения в каналах переменного
сечения. Обратимся к полученному уравнению для располагае-
157
мой работы й(хю*/2) = * — ийр. Дифференцируя левую часть, имеем
нч/ш= — щ/р.
(10.15)
Равенство (10 .15) устанавливает основные особенности исте
чения, а именно увеличение скорости потока (процесс в сопле)
всегда связано с понижением давления, и, наоборот, уменьше
ние скорости (процесс в диффузоре) сопровождается сжатием
газа или жидкости. Эти важные выводы используем при рас
смотрении закономерностей течения в к а н ал а х. При течении
газа (жидкости) в канале в условиях установившегося, стацио
нарного режима истечения для любого сечения канала справед
ливо соотношение
.
М=/ш/и=*сопви
(10.16)
называемое уравнением сплошности, или уравнением неразрыв
ности потока, Прологарифмируем его 1п/-Нпа>— 1пс;=соп$1, да
лее, продифференцировав это соотношение, получим
—
dw/w.
(10.17)
Э то ,и есть уравнение неразрывности в дифференциальной
форме. Обратим внимание на особенности уравнения ( 1 0 .1 7 ) .
При расширении рабочего тела ¿ п / и > 0 и (1хю/и»0 (увеличе
ние скорости движения потока в сопле). Возможен случай, когда
4(//с;>¿ю/ш и йи/и<ёх£}/1ю. В первом случае ¿///> 0 (канал
расширяется), во втором — ¿///< 0 (сечение канала суживается
по ходу течения потока). При сжатии рабочего тела (процесс
в диффузоре) ¿с/ц < 0 и ёш/хю<0 (торможение потока). В за
висимости от соотношения этих величин в уравнении ( 10 .17 )
канал диффузора мржет быть как расширяющимся, так п су
живающимся.
/
•'
~
Для практического использования этих принципиальных по
ложений, касающикся профиля каналов, исследуем уравнение
(10.17) для случая обратимого адиабатного ( з ^ о м Ы ) истече
ния идеального газа. Найдем значения ёи/и н (Ию/хю. При от
сутствии теплообмена для идеального газа справедливо урав
нение адиабаты рок=со п ь \, откуда, дифференцируя, имеем
+ у*^р=0. Поделив на
запишем с/и/о» (— \/к)(1р/р
или рЫо/о+^р—0.
Из уравнения (10.15), разделив его на ш2, имеем ¿ш/ю—
*= — и/(и>3с1р). Подставляя значения ¿о/о и Льи/хю в уравнение
(10.17) , получим
поле.
Как известно из физики, местная скорость звука в газе или
паре, имеющем параметры состояния р н V,
а-\Гкро.
(10.19)
158
С учетом (10.19) уравнение (10.18) преобразуем к виду
Л/_ а9—»з ¿р
/~
кт*
~У
или, что то же самое,
Отношение скорости истечения ш к местной скорости з в у к а
а называется числом М аха (Ма). Если Ма<1, то скорость исте
чения называют дозвуковой; если М а > 1 — сверхзвуковой.
Уравнение (10.20) связывает изменение площади сечения канала
с изменением давления в потоке и со значением числа М аха.
Если вместо (1р в (10.20) подставить выражение из уравнения
(10 .15 ), то находим форму зависимости изменения площади се
чения от изменения скорости потока
у-«=^Ма* — 1^ Щ .
(10.21)
Анализ уравнения (10.21) дает возможность рассмотреть два
основных случая.
Дозвуковые скорости ( М а < 1 ) . В уравнении (10.20) измене
ние площади сечения одинаково по знаку с изменением давле
ния, в уравнении ( 1 0 .2 1 ) — противоположно по знаку измене
нию скорости. Это означает, что при расширении газа в сопле
(¿ю/ш >0, dp/p<0) сечение канала будет суживающимся
(¿//{< 0 ), а при сжатии газа в диффузоре (<1и>/ьи<0, йр/р>
>0) — канал будет расширяющимся (<*ш>0).
Скорости истечения превышают скорость звука ( М а > 1 ) .
Из уравнений (10.21) и (10.20) следует, что для сопла
(¿ссг/ю>0, Л р/р< 0) канал должен быть расширяющимся
(¿///> 0 ), для диффузора — сужающимся (
).
| 10.2 . АДИАБАТНОЕ ИСТЕЧЕНИЕ
ИЗ СУЖИВАЮЩЕГОСЯ СОПЛА
Пусть в резервуаре, размеры которого достаточно большие,
находится газ, вытекающий через суж ивающееся сопло. Обо
значим параметры газа в резервуаре через р ь
Т\. Значения
этих параметров нз-эа размеров резервуара со временем не из
меняются. Давление среды, в которую вытекает газ, обозначим
через ра. Начальную скорость газа в резервуаре примем рав
ной нулю (ич —О). Определим скорость истечения газа из сопла
и его расход.
Скорость, с которой рабочее тело вытекает из сопла, состав
ляет практически несколько сотен метров в секунду. При т а
кой скорости истечение газа или пара происходит столь быстро,
что рабочее тело не успевает ни получить от окружающей среды,
нн отдать ей сколько-нибудь значительного количества теплоты.
159
Поэтому правомерно считать такой процесс истечения адиа
батным.
Воспользуемся соотношением (10.9) для располагаемой ра
боты: (ш|— ю ?)/2—4>. откуда
V 2/0+ ю * . Учитывая, что
ом—0, имеем
ъ2-У2Г0.
(10.22)
Для обратимого адиабатного истечения располагаемая работа
вычисляется по уравнению
или, поскольку/„ '“ ¿(А ® ,—/>1^), имеем /»
—
—
А®,),
откуда
I,
.- т=тл».[|-(л)*‘']-
Подставляя значение /0 в уравнение (10.22), получаем для ско
рости истечения газа из сопла:
*>г-]/2-¿ТРМ[>-(
-
7г)^]-
00-23)
Массовый расход газа через сопло может быть найден из
г
равнения сплошности
М-М«*,
(10.24)
не /г — площадь выходного сечения сопла; о3 — удельный
бъем газа в выходном сечении.
Поскольку для адиабатного процесса
то 1/02=*
Ра/Р|),,*ОЛ'|) и М=(/аИ»а/и ,)(Ра/Р|) •
Подставляя сюда значение и>3 из уравнения (10 .23), имеем
"-'•Vат=т^[(^)”-(2'Г1
<ш5)
Из уравнения (10.25) следует, что для газа при данных на
чальных параметрах р\, v x и сечении сопла на выходе /2 расход
и скорость истечения зависят только от давления среды, в ко
торую происходит истечение, точнее, от отношения давлений
Рг/Р\-Действительно, при Pa/Pi= I, т. е. p2=pi, Ai=0 . В то же
время при истечении в вакуум (Ра—0) получим, что М —0. Этот
несколько необычный результат объясняет формула (10.24). Из
нее видно, что при / * = const секундный расход зависит от ско
рости и>2 и удельного объема газа и2. С уменьшением давления
Р2 скорость и удельный объем увеличиваются. Однако вначале
скорость W2 с уменьшением давления растет быстрее, чем объем
V2, поэтому расход М такж е растет. Достигнув некоторого мак-
160
симального значения, расход газа начинает уменьшаться. Это
происходит потому, что при дальнейшем уменьшении р2 ско
рость истечения ш2 растет медленнее, чем удельный объем и2.
Так, при р2= 0 скорость будет иметь конечное значение, хотя
v2— ► оо> т. е. М —►О. На рис. 10.3 кривая о—к —т представляет
собой соответствующую уравнению
(10.25) зависимость рас
хода газа от отношения давлений р2/р 1 = р.
Давление р2 на срезе сопла, при котором расход газа до
стигает максимума, называется критическим, отношение давле
ний Ргх?/Р\ обозначают через Ркр, скорость истечения газа из
суживающегося сопла при максимальном расходе называется
критической и обозначается Шэд.
Значение рНр, при котором устанавливается максимальный
секундный расход и критическая скорость (в соответствии
с правилами отыскания экстремума), может быть получено,
если взять в формуле (10.25) первую производную от выраже
ния в квадратных скобках и приравнять ее к нулю
д
д(Ро1Р|)
откуда
рнр=[2/(Л+1)]*/ ‘'"'>.
(10.26)
Оказывается, что ркр целиком определяется значением пока
зателя адиабаты к, т. е. физическими свойствами вытекающего
газа. Так, при¿=1,4 Ркр=0,538; при¿=1,3 ркр=0,55. Можно
в первом приближении считать ВКр» 0 ,5 .
Подставив в выражения (10.24) и (10.25) значения ркр из
уравнения (10.26), получим формулы для определения
и
Мтат*
«*кр = у 2[Л/(*-Ы )!/>,*),.
(10.27)
М„
о*
Р\
Г/ 2 у/«»-.»
/ 2 ч(*+1)/(*-1)1
*
1 V,[1*+'/
1*+•) \
-/У
«'о-28*
Обратимся к графику на рис. 10.4 . Экспериментально уста
новлено, что при истечении из сопла при всех значениях р2/рь
меньших р.ф, расход н скорость газа остаются неизменными
(отрезок ¿ — п) и равными соответственно М тах и критической
скорости истечения.
Для того чтобы объяснить это расхождение теории с экспери
ментом, в 1839 г. Г . Сен-Венан высказал предположение, что
при расширении газа в суживающемся сопле невозможно полу
чить давление газа в выходном сечении сопла ниже критиче
ского давления ргир. Это означает, что при сколь угодно низких
11 3«х. 80
161
давлениях среды за соплом, меньших род, давление газа в вы
ходном сечении суживающегося сопла (на срезе сопла) остается
постоянным и равным р2нр. Дальнейшие исследования показали,
что эта гипотеза была правильной.
Из формулы X10.23) следует, что скорость газа на выходе
из сопла растет с уменьшением давления р2. Но этот рост в со
ответствии с вышесказанным имеет место лишь до тех пор, пока
р2 не уменьшится до род. Дальнейшее снижение давления за
суживающимся соплом не приводит к росту
Рис. 10.3 . Зависимость расхода Рис. 10.4 . Зависимость скорости
газа при истечении через сужн-
истечения газа через суживаю-
веющееся сопло от отношения
шееся сопло от отношения дав-
давлений Рг!р\.
леи иА ра/р!-
Соотношение м еж ду критической скоростью и местной ско
ростью звука. Значение критической скорости истечения газа
можно вычислить по формуле (10.27). Д ля удельного объема У|
из уравнения адиабаты в случае, когда в выходном сечении
сопла устанавливаются параметры род и Под, имеем
V l= V2нp(Род/Р|)1**“ ПодРкр1
Заменяя ркр по уравнению (10.26), получаем
°'“ ‘Ц -*тг)1М-1)
и для давления р х
Р.= Р2кР[2/(Л+1)]-*/<*-,>.
Подставляя полученные значения П1 и р\ в (10.27), после пре
образования получнм уравнение для критической скорости
Юод==уЛ/?одНод=а,
(10.29)
где а — скорость распространения звука в выходном сечении
сопла.
Итак, критическая скорость истечения о^кр равна местной
скорости звука в выходном сечении сопла. Другими словами,
получить с помощью суживающегося сопла более высокую
(сверхзвуковую) скорость потока невозможно. Этот факт яв-
162
ляется ключевым при объяснении постоянства расхода газа при
Р2<Ргкр‘ Любое слабое возмущение, например уменьшение д ав
ления, распространяется по струе газа со скоростью, равной
скорости звука. При малых скоростях истечения уменьшение
внешнего давления передается по струе газа внутрь сопла н
приводит к перераспределению давления в сопле. В этом случае
давление в выходном сечении сопла уменьшается до значения
внешнего давления, а скорость и расход соответственно возра
стают. Но как только скорость газа на выходе из сопла дости
гает скорости звука, никакое уменьшение давления окружаю
щей среды по струе газа передать невозможно. Оно как бы
сносится потоком газа, вытекающим с той же скоростью, с к а
кой распространяется изменение давления. Вот почему при
уменьшении давления за соплом ниже ргкр ( 0 ^ р < р кр) скорость
и давление в выходном сечении сопла остаются теми ж е
(югкр и р2кР) независимо от величины внешнего давления р2.
Перепад давления от р2кр до р2 остается неиспользованным для
увеличения кинетической энергии струи вытекающего газа и
почти полностью теряется на образование вихрей при истечении.
Приступая к расчету истечения идеального газа из суживаю
щегося сопла при заданных значениях р{ и р2, следует прежде
всего сравнить отношение р2/ р 1 с величиной ркр, определяемой
уравнением (10.26). Если
Р2/р1>Ркр,
то давление в выходном сечении сопла будет равно давлению
окружающей среды, и расчет истечения следует вести по урав
нениям (10.23) и (10.25). Если же Рг/Р1= Ркр, то р2кР= р 2, для
расчета следует применять уравнения (10.27) и (10.28). В слу
чае, когда
Р2/Р1<Ркр» Р2кр<р2.
расчет сопла ведется по тем же, что и в предыдущем случае,
уравнениям (10.27) и (10.28).
Для паров качественная картина процесса истечения не из
меняется. Однако расчетные формулы, в которые входит вели
чина показателя адиабаты к, будут приближенными, поскольку
его значение для пара в процессе истечения не сохраняется по
стоянным. Поэтомуприменяют соотношения, полученные из
(10.14) /0= / , —
¿2:
ш 2=У2(||-/2),
(10.30)
М- (/2М)У2(/, -
«,
(10.31)
если р2/р 1 >Ркр. Характеристики истечения в случае р2/р\^Ркр
определяются из уравнений
^2кр=У2(«|—х2Кр),
(10.32)
Л * ш а х - (/я/02кр)У2(11-/2кр).
(10.33)
!!•
163
Такие параметры пара на выходе из сопла, как удельный
объем, температура, энтальпия и другие, могут быть найдены
для обратимого адиабатного истечения из диаграммы I — 5
(рис. 10.5). Д ля этого из точки /, соответствующей начальному
состоянию пара перед истечением, нужно провести ади абату
расширения 1 —2 до пересечения с изобарой ръ если ра/Р|>Ркр,
или с изобарой ргкр» если Рг/Рг^Р*р .
В термодинамических соотношениях, описывающих процесс
истечения, фигурирует только одна геометрическая характери
стика канала, а именно величина выходного сечения канала
Казалось бы, в этом случае вместо сопла можно использовать
ч
Рве. 10.5 . Процесс обратимого адиа-
Рис. 10.6 . Процесс адиабатного исте-
батного истечения в координатах i—5.
чения с трением в координатах í—s.
просто отверстие в стенке резервуара высокого давления. Од
нако конструкция реальных аппаратов, используемых для прев
ращения потенциальной энергии давления в кинетическую энер
гию потока, осуществляется с таким расчетом, чтобы свести
к минимуму необратимые потери на трение. При истечении р а
бочего тела из отверстия за острыми передними и задними кром
ками этого отверстия образуются многочисленные завихрения,
что вызывает существенную потерю энергии потока. Несколько
меньшие, но все же ощутимые потери энергии потока имеют
место в случае истечения из трубы постоянного сечения. П о
этом у вместо истечения из отверстия применяют истечение из
канала, сечение которого плавно меняется с длиной.
Практически потери энергии потока на трение исключить
невозможно. Эти потери обусловливаются вязкостью рабочего
тела, шероховатостью стенок канала и т. д . Процесс истечения
остается, разумеется, адиабатным, т. е. осуществляется при от
сутствии теплообмена с внешней средой, однако поскольку при
164
течении рабочего тела выделяется теплота трения, увеличива
ется энтропия газа и процесс становится необратимым. Кри
вая процесса адиабатного течения с трением в диаграмме *'— 5
может быть изображена в виде линии Л — С (рис. 10.6), а про
цесс адиабатного обратимого (без трения) течения в виде вер
тикальной прямой А — В. Поскольку при истечении и без тре
ния и с трением расширение газа в потоке происходит до од
ного и того же давления на выходе из сопла р2, то очевидно,
что точка, соответствующая действительному процессу истечения
с трением, будет лежать на той же изобаре, но правее точки В,
так как 5С>5«. Величину энтальпии рабочего тела на выходе
из сопла при истечении с трением обозначим ¿го- Поскольку эн
тальпия в конечном состоянии при течении с трением (точка С)
будет иметь большее значение, чем энтальпия в конечном со
стоянии при течении без трения (точка В), т. е. 12в>«2. то рас
полагаемый теплоперепад м — «2о в процессе истечения с тре
нием будет меньше, чем в случае обратимого течения без тре
ния. Следовательно, скорость газа на выходе из сопла при исте
чении с трением будет меньше, чем при течении без трения.
Отношение скорости истечения ш2д действительного процесса
(А — С) к скорости истечения т2 без трения процесса (А — В )
называется коэффициентом скорости фск:
фск= »2д/«;2-
(10.34)
Коэффициент скорости фск различен для разных сопел. З н а
чения его берутся из опыта. Д л я сопел современных турбин.
Феи составляет 0,93— 0,98.
§ 10.3 . ИСТЕЧЕНИЕ ЧЕРЕЗ КОМБИНИРОВАННОЕ СОПЛО.
ПЕРЕХОД ЧЕРЕЗ СКОРОСТЬ ЗВУКА
Естествен вопрос, возможно ли получить поток газа или
пара, имеющий скорость выше скорости звука. Д ля ответа на
него обратимся к рис. 10.7 .
В случае Рг/Р|<Ркр, когда для суживающегося сопла зна
чение скорости не превышает местной скорости звука (Ш2к р = а ),
а давление среды р2, куда происходит истечение, может быть
значительно ниже р2кр, располагаемая работа (рис. 10.7) будет
определяться площадью меж ду осью ординат и участком адиа
баты, соответствующим перепаду давления от р\ до р2кр (от ¿1
до ¿2кр, см. рис. 10.5). Из рис. 10.7 видно, что значительная
часть давления от р2кр до р2 (от ¿гкр до 12 на рис. 10.5) не ис
пользуется.
Из анализа, проведенного ранее (уравнение ( 10 .2 1) ) , стано
вится очевидным, как полностью использовать весь перепад
давлений от р\ до р2. Д ля этого канал должен иметь после с у
живающегося участка расширяющуюся
часть. Канал суж и
вается, давление в канале становится равным критическому
165
давлению истечения рзкр» а скорость потока достигает местной
скорости звука. З а этим сечением канал должен быть выполнен
расширяющимся. Поток в этом случае перейдет через скорость
звука (М а > 1) и будет продолжать ускоряться в расширяю
щейся части сопла. Д л я ускорения потока будет использован
весь перепад давлений от р\ до ра» а не часть этого перепада
от р\ и ръф, реализуемая в суживающемся дозвуковом сопле.
Комбинированное сопло, состоящее из суживающейся и рас
ширяющейся частей, впервые было применено шведским инже
нером К. Г . П . де Лавалем и получило название сопла Лаваля.
Сопло Лаваля (рис. 10.8) используется в случаях, когда Рг/Р\<
< Ркр. В наименьшем сечении /щщ сопла (в горловине) давление
пра истечение через суживающее
ся сопло при р^р\< 0цр.
Рис. 10.8 . Общий вид комбинированного
сопла.
потока равно Риф —Р\$кр, а скорость движения достигает
Юзярава. П лощадь минимального сечения определяется из соот
ношения
/ш1пв (Мтах^Яф) /Ша*ф.
(10.35)
Скорость С02кр определяют из (10.27) или (10.32), а рас
ход— по (10.28) или (10.33).
Особо отметим, что сопло Л аваля позволяет получить только
сверхзвуковую скорость истечения, но максимальная пропуск
ная способность сопла не изменяется и определяется из (10.28)
или (10.33) по величине р^ф. Поскольку расход газа в горло
вине сопла н на его срезе один и тот же, можно записать
(/ш1вЩ31(р)/021фм (/тах*0*)/02*
(10.36)
откуда легко найти величину выходного сечения сопла Л аваля
/тжх= /тщ (®21ф/®а) (Рз/о&ф)" (Мтжх0а)/Ш|. (10.37)
Величина удельного объема оа газа определяется из ур ав
нения адиабаты
Ъ-Оп/ршУРЬи
00.38)
166
а скорость на выходе из сопла
—
по формуле (10.22).
Непременным условием получения скорости истечения, пре
вышающей скорость звука, является отсутствие отрыва струи
от стенок сопла. Д л я этого необходимо, чтобы угол конусности
а расширяющейся части сопла был не более 10— 12°. Длина Л2
расширяющейся части сопла Л ав ал я определяется по формуле
¿2“ (4т»х— ¿тт)/(2 igа/2),
(10.39)
где ¿тах и ¿тш — диаметры в выходном сечении и в горловине
сопла. Длина суживающейся части сопла А| выбирается мини
мальной.
Сопло Л авал я обеспечивает преобразование всей работы
истечения в кинетическую энергию струи. Поэтому располагае
мая работа /0 будет равна всей площади, заключенной м ежду
адиабатой и осью ординат на рис. 10.7 и вычисляется по фор
муле (10.14).
§ 10.4 . ПРОЦЕСС ДРОССЕЛИРОВАНИЯ
Если на пути движения газа или жидкости в канале встре
чается какое-либо местное резкое сужение (вентиль, шайба,
кран, клапан, пористая перегородка и т. д .) , то давление про
текающего газа (жидкости) за препятствием всегда оказывается
меньше, чем перед ним.
Явление падения давления струи рабочего тела в процессе
протекания через сужение в канале называется дросселиро
ванием, или мятием (также редуцированием). В технике этим
явлением пользуются для понижения давления путем установки
на трубопроводах специальных вентилей, задвиж ек, шиберов,
кранов при регулировании мощности паровых турбин, в уста
новках получения искусственного холода, в установках для сжи
жения газа, при измерении расходов жидкостей и газов и т. п.
Рассмотрим закономерности процесса дросселирования на
примере потока, проходящего через небольшое отверстие ди
афрагмы, установленной на пути движения рабочего тела в тру
бопроводе (рис. 10.9).
Будем считать течение стационарным. Выберем на некото
ром удалении от сужения сечение I —/ и соответственно за
диафрагмой сеченйе II —II . Усредненные параметры обозна
чим: давление, удельный объем, температуру, энтальпию и
скорость потока перед сужением через ри см, Ти и и ш 1; после
сужения через ръ иъ Тъ ¿ъ и ш2. Напишем уравнение первого
закона термодинамики для потока газа или жидкости до и после
дросселирования:
о >2/2),
или после интегрирования
<7= /2— 1,4- (о>22— ш,2)/2.
(10.40)
167
Из-за большой величины сил трения течение рабочего тела
через сужение не вызывает сколько-нибудь заметного увеличе
ния скорости потока. Поэтому, хотя и са2> с в ь это изменение
весьм а незначительно. Приращением кинетической энергии по
тока (ш|— а ^ )/2 практически можно пренебречь по сравнению
р
1,
*1/Л
с величиной энтальпии потока. Другими словами, дросселиро
вание не сопровождается полезной
внешней работой, т. е. /о« 0 . По
скольку полезной внешней работы
при дросселировании не произво
дится,
работа расширения газа
(жидкости) от давления р х до
р% (Р2< Р\) полностью затрачивает
ся на проталкивание газа через
местное сопротивление, т. е. в дан
ном случае на работу против сил
трения. Напомним, что трение яв
ляется
причиной
необратимости.
Значит, процесс дросселирования —
необратимый. Однако этого для
характеристики процесса дроссели
рования недостаточно: степень не
обратимости может быть различ
ной. Процесс дросселирования я в
ляется полностью необратимым, по
скольку полезная работа равна
нулю. Дросселирование можно рас
сматривать как предельный случай
течения рабочего тела в канале
при наличии трения (см. рис. 10 .6).
Наибольший практический инте
рес представляет случай течения,
когда к газу (жидкости) извне
теплота не подводится и соответст
венно не отводится, т. е . так назы
ваемое адиабатное дросселирова
ние. Этот случай можно реализовать, предположив, что стенки
трубы окружены совершенной теплоизоляцией, так что тепло
обмен между рабочим телом и окружающей средой через
д
Ш,
1*г
Рис. 10.9 . Изменение давления
и скорости потока при дроссе
лировании
через
отверстие
диафрагмы.
стенки к ан ал а не происходит.
В соответствии со сказанным
ёд —0 и, поскольку
изДШ.40) получаем
12—и
-0,
(10.41)
или
**2 =«*1.
(10.42)
т. е. энтальпия потока в результате адиабатного дросселирова
ния не изменяется.
Уравнение (10.42) строго справедливо лишь при ус;ювиях
168
d q~ 0 и wi —u>2- В практически реализуемых процессах дроссе
лирования эти условия с некоторой степенью приближения
обычно выполняются, поэтому в дальнейшем будем полагать,
что значения энтальпий рабочего тела до входа в местное с у
жение и после него одинаковы.
Процесс дросселирования необратим и поэтому равенство эн
тальпий рабочего тела до и после сужения ни в коем случае не
означает, что процесс является нзоэнтальпическнм (¿—co nst):
м еж ду состояниями / и // процесс протекает при переменном
значении энтальпий. Допускается условное изображение в тер
модинамических д и агр ам м ах процесса дросселирования в виде
штриховой линии ¿—const (рис. 1 0 .10 ) , чтобы определить ко-
Рис. 10 .10 . Условное изображен не процессов
адиабатного
дросселирования в координатах Г — а и \ g p - i -
нечное состояние рабочего тела. Так, например, если из началь
ной точки а проведем вертикаль в диаграмме 1£р — < до пересе
чения с изобарой конечного давления в точке б, мы найдем зна
чение температуры, удельного объема и энтропии рабочего тела
после дросселирования непосредственно из диаграммы.
Несмотря на совершение работы против сил трения энталь
пия потока сохраняется постоянной вследствие того, что р а
бота, затраченная на преодоление сил сопротивления, преобра
зуясь в теплоту, возвращается рабочему телу. Последнее об
стоятельство и объясняет восстановление прежнего значения
энтальпии потока.
Являясь адиабатным, дросселирование в силу необратимо
сти процесса связано с увеличением энтропии. Ввиду того, что
работа против сил трения превращается в теплоту трения dq^t^
поглощаемую потоком, можем записать
ёд1р=сИ — ис1р,
(10.43)
а так как ¿¿=0 (¿1=/*). dqn^= — vdp. С учетом dqrv=гTds
получаем
—
(v/T)dp,
(10.44)
169
т. е. энтропия потока возрастает тем больше, чем больше пе
репад давления йр и ниже температура рабочего тела.
Эффект Джоуля — Томсона. В 1852— 1861 гг. Д . Джоуль и
В. Томсон-Кельвин впервые исследовали процесс дросселиро
вания, выполнив ряд опытов с протеканием газа (воздух, уг
лекислый газ) через пористую перегородку, установленную
в теплоизолированной трубке. Они установили, что для всех ре
альных газов при дросселировании наблю дается изменение
температуры. При этом чем больше при дросселировании
перепад давлений, тем больше
изменение температуры.
Явлени е
изменения
температуры
при дросселировании
называется
эффектом
Джоуля—Томсона,
или
дроссель-эффектом. В зависимости от условий протека
ния газа надо различать адиабатный и изотермический эф
фекты Дж оуля — Томсона. Учитывая, что в технике представ
ляет интерес главным образом адиабатный эффект, рассмот
рим только его основные закономерности и прежде всего его
физическую картину. Поскольку i = u + p v f из условия неизмен
ности энтальпии потока до и после препятствия следует
их— ц2= р 21>2 — Р1У\= 1 ', т. е. работа проталкивания V совер
ш ается за счет убыли внутренней энергии. Внутренняя энергия,
как известно, состоит из двух составляющих: кинетической энер
гии молекул Ию которая является функцией только темпера
туры, и потенциальной энергии взаимодействия молекул ип, з а
висящей от объема газа и увеличивающейся с возрастанием
последнего. Можно записать, следовательно, и = и к+ и „ и пред
ставить предыдущее уравнение в виде
(Ицс+ «т) —(И2к+ И2п)-Р202—Р&и
или
и Х1с— Ц»“ (р2и2 — РхУх)+ («20 — Нт).
(10.45)
Поскольку при дросселировании объем реального газа воз
растает, потенциальная составляющая внутренней энергии газа
увеличивается ИгпЖ т, что означает и%п— И т>0. Знак изме
нения кинетической энергии, характеризующий изменение тем
пературы при дросселировании, зависит, таким образом, только
от значения работы проталкивания Г = ( р 2ц2 — Р|П|). Так, воз
можны следующие значения работы проталкивания:
1) р202--Р10|=О,/'= 0;
2) р21>2— Рх1>х>Ъ,1'>Ъ\
3) Р202—Р1»1<0, /'<0.
Для первого и второго случаев, так как и2п — ихп> 0 9 имеем
из (10.45) Ц|К— Ц2к>0, т. е. температура газа при дроссели
ровании понижается.
Дросселирование обычно сопровождается затратой внеш
ней работы для проталкивания газа через дроссель (третий слу
чай). Так, если по абсолютной величине работа проталкивания
170
больше величины изменения потенциальной энергии, т . е .
\P2V2— PiVi|> |wte — «ml.
из (10.45) получаем
Цщ~ «*»<0.
В результате газ при дросселировании нагревается. Р а
бота проталкивания в третьем случае может по абсолютной
величине быть так ж е равна изменению потенциальной энергии
|Ра^а—Pi^l =4 и» — «ml.
Температура газа не изменяется:
Мщ—«» -О .
Наконец, если работа проталкивания в третьем случае по аб
солютной величине оказывается меньше, чем изменение потен
циальной части внутренней энергии
IP2Vt— PiViI< Ium— «inI,
часть кинетической энергии газа будет использована на его рас
ширение и температура газа понижается:
И|К — «2М>0.
Дифференциальный дроссельный
эффект. Итак,
при
дросселировании можно наблюдать охлаждение, нагревание газа
(жидкости) либо случай, когда температура рабочего тела ос
тается постоянной. Д ля количественной характеристики явле
ния введем понятие дифференциального дроссель
ного эффекта:
а{=(дТ/др){.
(10.46)
Он представляет собой отношение бесконечно малого измене
ния температуры газа при адиабатном дросселировании ( i =
*= const) к бесконечно малому изменению давления.
Рассмотрим полученное ранее уравнение (7.8) для энталь
пии реального газа
di-CjAT — [T(dv/dT)p — v]dp.
Для адиабатного дросселирования dl*= 0 и
CpdT- [T(dv/dT)p — v]dp,
откуда
с ц = (дТ/др){- [T(dv/6T)P — ofl/Cp.
(10.47)
Если газ идеальный, p v = RT и (dv/dT)p=Rp . Тогда в урав
нении (10.47) числитель обращается в нуль н
а,-(д77др),-0,
т. е. температура идеального газа при дросселировании не из
меняется. Д ля реальных газов, поскольку теплоемкость газа
171
Ср>0, знак дроссель-эффекта определяется знаком числителя
выражения (10.47). Если числитель больше нуля, то и а<>0
(положительный эффект дросселирования). Поскольку при
дросселировании Лр< 0 (давление падает), то в этом случае
имеем к т < 0, т. е. температура реального газа пони
жается. Если числитель меньше нуля, имеет место отрицатель
ный эффект дросселирования а < < 0 , и ¿ Г > 0 — температура
газа повышается. Если числитель выражения
(10.47) равен
нулю, а { = 0 н ¿ Г = 0 , т. е. имеем нулевой дроссель-эффект, тем
пература газа не изменяется. Следует подчеркнуть, что один
и тот же газ в зависимости от его начальных параметров (в ча
стности, от начальной температуры Т) в результате дроссель-
эффекта может нагреваться, охлаждаться, либо не изменять
своей температуры.
Параметры газа, при которых эффект Джоуля — Томсона
меняет знак, носят названия точек инверсии. Начальная
температура газа, при которой а < = 0 , называется температурой
инверсии и обозначается Г*. Значения начальных параметров
р. Г, V, при которых наступает тот или иной дроссель-эффект,
можно графически представить в координатах Т — V (рис.
10.1 1).
На рис. 1 0 .1 1 в координатах Т — V представлена изобара для
некоего реального газа. В точках А, В, С и й для различных
начальных температур рабочего тела к изобаре проведены к а
сательные. Рассмотрим одну из них (В — £), соответствующую
начальной температуре Т. Из треугольника В £ £ имеем Е — £«=
=
(В—Е)/1%р, но В—£ *7\ аigPlsss(дT/дv)ptтогда £ —£ ^
—Т(ди/дТ)р. Отрезок О — £ равен разности £ £ — ОЕ. По
скольку О— £ = и, имеем О— £ =7'(ди/ВТ)Р— и, т. е. отрезок
О — £ графически изображает числитель уравнения (10.47), от
знака которого зависит знак изменения температуры при адиа
батном дросселировании. Касательная В — £ пересекает ось
абсцисс слева от начала координат, т. е. величина Т(ди/дТ)р —
—
ц > 0 . Значит, рабочее тело при дросселировании охлаж
дается.
Для точки В касательная В — N пересекает ось абсцисс
справа от начала координат и Т (дх>/дт) р — о < 0 , т. е. при
начальной температуре дросселирования То газ будет нагре
ваться. Д ля точек инверсии А и С эффект дросселирования не
наблюдается:
Т(ди/дТ)Р— п«0.
(10.48)
Кривая инверсии. Отметим, что для каждого давления име
ются две инверсионные температуры: одна в области жидкости
(нижняя точка инверсии), другая в области перегретого пара
(верхняя точка инверсии). Температура инверсии зависит от
давления, при котором находится тело. К ак показывает опыт,
с повышением давления температура инверсии для жидкости
172
повышается, а для пара понижается. Совокупность точек ин
версии при различных давлениях представляет графически кри
вую инверсии данного вещ ества. Точки на кривой инверсии
удовлетворяют уравнению (10.48).
Точки кривой инверсии определяют те начальные условия
(значения р, Т и и), при которых нет ни нагревания, ни охлаж
дения газа при дросселировании. Каждый газ имеет свою кри
вую инверсии. Кривая
инверсии, полученная по уравнению
(10.48) для газа, подчиняющегося уравнению Ван-дер-Ваальса,
представлена на рис. 10 .12 . В соответствии с отмеченными выше
особенностями точек инверсии для представлени я кривой инвер-
чек инверсии в координатах Т—и.
сии выбрана диаграмма р — Т. Д ве координаты — температура
и давление — определяют каждую точку инверсии. Соединив
точки инверсии между собой (а их две для каждого давления),
получим две ветви кривой инверсии рассматриваемого вещества.
Левая ветвь характерна для жидкой фазы, правая — для области
перегретого пара. Ветви кривой инверсии нельзя отождествлять
с линиями насыщения на ранее рассмотренных диаграм мах
Т—р
—
Т, I — ж, р — и. Поэтому точка, где эти ветви соединя
ются (рис. 10 .12 ), не должна смешиваться с критической
точкой рабочего тела. Как уж е отмечалось ранее, критической
точкой оканчивается кривая насыщения О — С
—
К. Эта кри
вая характеризует в диаграмме р — Т зависимость между дав
лением насыщенного пара ра и температурой насыщения
Тв. Каждой точке кривой насыщения О — С
—
К соответствует
тк
к
о
Рнс. 1 0 . 1 1 . Графическое представление
изменения знака дифференциального
адиабатного дроссель-эффекта и то-
Рис. 10.12 . Изображение кривой
инверсии реального газа в диа
грамме р—Г.
173
состояние равновесия жидкой и паровой фаз (насыщенная жид
кость, сухой насыщенный п ар), причем выше кривой насыщения
вещество находится в жидкой фазе, а ниже — в состоянии пере
гретого пара. Если ф азовый переход от состояния насыщенной
жидкости к состоянию сухого насыщенного пара (и обратно)
в диаграммах Т — 5, I — 5, р — и изображается горизонтальной
прямой, то в диаграмме р — Т
—
только одной точкой. Выше
этой точки существует ненасыщенная жидкость, ниже — пере
гретый пар.
Выясним расположение характерных точек кривой инверсии
в координатах р — Т, в частности положение ее максимума.
Параметры в этой точке обозначаются Ти и рп. Д ля максимума
кривой инверсии в соответствии с правилом исследования функ
ций на экстремум (д2и/д7'2) р= 0. Используя это условие совме
стно с известным уравнением Ван-дер-Ваальса, можно получить
численные значения параметров максимума кривой инверсии
для вандерваальсового газа
Рл== 9ркр| 7'н^ЗГкр, С?я=0кр-
Уравнение Ван-дер-Ваальса неточно отражает свойства ре
альных газов. Сравнение с экспериментальными данными по
казывает, что параметры точки максимума кривой инверсии
должны быть несколько скорректированы в среднем для разных
веществ:
ри»11ркР, Ги» (1,6-н2,1)Гкр.
Для вандерваальсового газа правая ветвь кривой инверсии
пересекает ось температур ( р = 0) при 7а=6 ,75 Ткр. Значение
Та для реальных газов достаточно близко к этой величине. К ак
следует из расчетов, левая ветвь кривой инверсии для вандер
ваальсового газа должна пересекать ось абсцисс при 7 ^ = 0 ,757^ .
В действительности же левая ветвь кривой инверсии не пересе
кает ось температур, а доходит до кривой насыщения и сопри
касается с ней в некоторой точке с (см. рис. 10.12). Значения
температур, при которых кривая инверсии подходит к линии на
сыщения, различны и зависят от природы рабочих тел. Напри
мер, для воды 7С=508 К (*с=235°С).
Интересно сравнить температуры Тс и Тв. Как было отме
чено ранее, 7*#= 0,75 ГКр, т. е. для воды Гв=0 ,75« 647,27=485,5 К.
Температуры Тш и Те не равны меж ду собой, хотя различие
меж ду ними и не столь значительно.
Отрезок кривой насыщения от точки С до точки К располо
жен под кривой инверсии, т. е. в области, где дросселирование
сопровождается понижением температуры рабочего тела ( (1Т <
< 0 , а < > 0 ) . Д ля состояния насыщения производная (дГ/др)<
всегда положительна (с увеличением давления температура на
сыщения соответственно возрастает, и наоборот). Поэтому на
174
участке О —- С, как и для всей кривой насыщения О — С
—
К,
имеет место так ж е положительный дроссель-эффект. Более
того, во всей области влажного насыщенного пара дросселиро
вание непременно сопровождается понижением температуры.
Область перегретого пара при параметрах, применяемых
обычно в тепло- и хладотехнике, располагается внутри кривой
инверсии и, следовательно, при адиабатном дросселировании
такой пар охлаждается.
Важ но подчеркнуть, что для многих газов максимум кривой
инверсии (рю Ти) расположен значительно выше температуры
окружающей среды. Для двух газов — водорода (7\ф«=33,25К)
и гелия (Гкрв5,19 К )— максимум кривой инверсии располо
жен ниже температуры окружающей среды. Водород и гелий
при температуре окружающей среды ( 7 о = 2 9 3 К) находятся
в области состояний вне кривой инверсии, где имеет место от
рицательный дроссель-эффект.
Дросселирование
гелия
и
водорода при температуре окружающей среды ведет не к охлаж
дению, а к нагреванию этих газов. Д ля получения положитель
ного дроссель-эффекта необходимо предварительное глубокое
охлаждение водорода и гелия.
При дросселировании воздуха при комнатной температуре
наблюдается охлаждение приблизительно на 0,25° С при пере
паде давлений, равном 0,1 М П а. Однако такое понижение тем
пературы, разумеется, совершенно недостаточно для сжижения
воздуха. Поэтому воздух перед дросселированием для дости
жения температур, необходимых для его сжижения, также пред
варительно охлаждают (метод Линде, см. гл. 12).
Для практических расчетов точек инверсии можно исполь
зо вать обобщенное уравнение кривой инверсии, полученное по
экспериментальным данным для группы криогенных газов (Аг,
N2, СО, СН4, С2Н4и др.):
я * —36,275+71,598т — 41,567т*+1 1,826т3—
—
1,6721т4+ 0,091167т®.
(10.491
Здесь д=р//?|ф, т = Г/Гкр — приведенные температура и дав
ление.
На рис. 10 .13 кривая инверсии изображена штриховой ли
нией в диаграмме Т — 5. Левая ветвь кривой инверсии пере
секает линию насыщения в точке С (см. рис. 10 .12 ), правая —
проходит в области перегретого пара. Кривая инверсии соеди
няет вершины линий постоянной энтальпии. С права от кривой
инверсии линии ¿ » c o n s t имеют наклон в сторону понижения
температуры (рабочее тело при дросселировании охлаждается),
слева от нее — температура газа при дросселировании повы
шается. Выше кривой инверсии характер кривых ¿» co n st ме
няется: максимумы сглаживаются, кривые обращены выпук
лостью вверх. В этой области состояний при дросселировании
температура газа только повышается.
175
Из рис. 10 .13 видно, что для насыщенной жидкости, влаж
ного пара, сухого насыщенного пара и значительной части пере
гретого пара адиабатное дросселирование сопровождается по
нижением температуры.
Эта особенность широко используется в паровых холодиль
ных машинах, где для получения отрицательных тeмпepatyp
применяют эффект дросселирования насыщенной или несколько
переохлажденной жидкости вследствие перепада давлений в кон
денсаторе и в испарителе. В качестве дросселя обычно приме
няют вентиль с малым проходным сечением (регулирующий
вентиль).
Рис. 10 .13 . Представление интегрального дроссель-
эффекта в координатах Т—5.
Интегральный дроссель-эффект. Если газ дросселируется от
начального состояния р и Т\ (точка 1) до давления ръ то конеч
ное состояние определяется в соответствии с основным условием
адиабатного дросселирования, т. е. на кривой постоянной эн
тальпии (точка 2 ). При конечном изменении давления от р х до
р2 температурный перепад получится интегрированием вы р а
жения, которое следует из (10.46) ёТ=(ц(1р . Получим
ЛГ=Г2—Г,= 7 а{йр.
(10.50)
р.
Уравнение (10.50) характеризует интегральный дроссель-
эффект. Интегрирование этого уравнения затруднительно, по
этому на практике пользуются диаграммами состояния, на ко
торые наносятся линии ¿=согЫ . Так, в диаграмме
Г—5,
176
найдя точку пересечения изоэнтальпы t = c o n s t с изобарой
= »const, получим температуру за дросселем Т%. Определение
величины интегрального дроссель-эффекта удобно выполнять
с помощью диаграмм /— s, Т — s, lgp — i . Интегральный дрос
сель-эффект может достигать весьма большого значения. На
пример, при адиабатном дросселировании водяного пара от д а в
ления 29,4 МПа и температуры 450е С до давления, равного
0,1 МПа, температура пара уменьшается до 180еС.
Процессы дросселирования жидкости и пара представлены
на рис. 10.14 вдиаграммах р—v, Т—s, i—s, Igp—i-
Как видно из диаграмм, при дросселировании насыщенная
жидкость становится влажным паром, поскольку теплота тре
ния, подводимая к жидкости, приводит к ее частичному испа
рению. Влажный пар в зависимости от начального давления,
начальной степени сухости и конечного давления может остаться
влажным, сделаться сухим и даж е перегретым (процессы 3— 4t
5 —5 ). Перегретый пар в результате дросселирования может
остаться перегретым (7—8), сделаться сухим, потом влажным,
снова сухим и перегретым (процесс 9—10 в диаграмме i — s ).
Процесс дросселирования как полностью необратимый при
водит к потере работоспособности рабочего тела, что наглядно
иллюстрируется рис. 10.15. Здесь в диаграмме i — s представ
лен процесс обратимого адиабатного расширения перегретого
пара от давления р\ до давления р3. Располагаемый теплопе-
репад равен (процесс /—3)
ho^ii — is.
Если ж е перегретый пар подвергнуть дросселированию до
промежуточного давления р /, а затем осуществить процесс об
ратимого адиабатного расширения до давления р2 (процесс 2 —
4), то располагаемый теплоперепад окажется значительно
меньшим:
Ло, =
is—и“h—14-
Потеря работоспособности равна разности энтальпий:
he— ho'“
Д/ов ^4— 1*з-
Этим свойством процесса дросселирования пользуются, напри
мер, для регулирования мощности паровых турбин (дроссель
ное регулирование).
Эффект Джоуля — Томсона имеет не только большое прак
тическое значение. Измеряя этот эффект в теплофнзическнх
экспериментах, можно обнаружить отклонение свойств реаль
ного газа от идеального, получить информацию о силах меж
молекулярного взаимодействия.
Эффект Д ж о у л я — Томсона в 1895 г. был использован
К. Линде для получения жидкого воздуха. Предложенный Линде
метод впервые дал возможность получать жидкий воздух в про-
12 Зак. 80
177
мышленных масштабах н достаточно дешевым способом. Поль
зуясь методом Линде, Д . Д ьюару удалось в 1898 г. превратить
в жидкость водород. Как уж е упоминалось, водород перед дрос
селированием должен быть охлажден ниже максимума кривой
инверсии, что достигалось с помощью жидкого азота. В 1908 г.
последний из известных газов — гелий был сжижен Г. Каммер-
10.14 . Условное представление процессов адиабатного дроссе
лирования пара н жидкости в координатах р — о (о),
Г—а(б),/— *(*), 1*р —Цг).
линг—Оннесом. Д ля охлаждения гелия ниже точки инверсии
был использован жидкий водород.
В настоящее время сжижение газов приобрело большое про
мышленное значение. Широких масштабов достигла техника
сжижения природного газа (метана), азота, водорода и гелия.
В предыдущих главах было показано, что одним из эффек
тивных способов охлаждения газов является процесс обратимого
адиабатного (изоэнтропического) расширения (с отдачей внеш-
178
пен работы). Такой способ, например, осуществляется в цикле
газовой (воздушной) холодильной машины. Представляет инте
рес сравнение двух способов охлаждения газа — адиабатного
дросселирования и адиабатного расширения.
Сравнивая между собой величины а# и он, можно установить,
какой из этих д вух способов обеспечивает большее понижение
температуры:
a* — (dT/dp)9t a t=(dTldp)i.
(10.51)
Рве. 10.15. Илдюараамя потери ра
ботоспособности рабочего тела вслед
ствие дросселирования.
Первая из этих величин — температурный эффект обрати
мого адиабатного изоэнтропического расширения, вторая — тем
пературный эффект необратимого адиабатного дросселирования.
В соответствии с (7.3) для изменения энтропии можно запи
сать:
(£)>*•
Учитывая, что
¿«/¿Г-ТТЬДПГ) -ЛяНТаГ) ^сйТЦТйТ) =с/Г,
имеем
(<Ь/дТ)р=ср/Т.
(10.52)
В соответствии с уравнением (7.7)
(05/др)т-
—(ди/дГ)р.
В процессе адиабатного обратимого расширения, как из
вестно, <*5»0. Тогда из (7.3) следует
(дТ/др)$=* -(д8/др)т1(д51дТ)р.
12*
(10.53)
179
Подставив в (10.53) уравнения (10.52) и (7.7), получим
а , - (дТ1др)9ш>Т(ду/дТ)т1ср.
(10.54)
Производная (ди/дТ)р для газообразного (или жидкого)
состояния обычно больше нуля. Следовательно, адиабатное об
ратимое расширение газа во всех случаях сопровождается ох
лаждением расширяющегося газа ( а * > 0 ) .
Вычитая из формулы (10.47) выражение (10.54), получаем
возможность сравнить два способа охлаждения
о,—а.= т
м,
_
ГУу1дТ)р - У ш_ ^
(10 55)
Ср
Ср
Ср
Поскольку удельный объем и теплоемкость при постоянном
давлении не могут быть меньше нуля, всегда
а*>сц.
(10.56)
Другими словами, при адиабатном обратимом расширении
газа (или жидкости) с отдачей внешней работы происходит бо
лее значительное охлаждение рабочего тела, чем при необрати
мом процессе дросселирования. Только при расширении вл аж
ного насыщенного пара в связи с тем, что для этого состояния
Ср—*
-о
о, а*=а<.
Глава
11
ЦИКЛЫ ПАРОВЫХ
ХОЛОДИЛЬНЫХ МАШИН
§ 11 . 1 . ОСНОВНЫЕ ОСОБЕННОСТИ
ОБРАТНЫХ ПАРОВЫХ ЦИКЛОВ
В холодильных машинах совершается совокупность процес
сов, в результате которых теплота отнимается от тел с низкой
температурой и передается среде с более высокой температу
рой. К ак уж е говорилось в гл. 5 , переход теплоты от менее
нагретого к более нагретому телу в соответствии с вторым з а
коном термодинамики возможен только в результате осуществ
ления некоторого компенсирующего процесса, причем по хар ак
теру этого процесса холодильные машины подразделяются на ком*
прессорные, пароэжекторные и абсорбционные. В компрессор
ных машинах получение холода сопровождается процессом
превращения механической работы в теплоту. В пароэжектор
ных и абсорбционных машинах, относящихся к классу теплоис
пользующих, компенсацией при получении холода является зат
рата извне некоторого количества теплоты, переходящей набо -
180
лее низкий температурный уровень. В них совмещены прямой
цикл преобразования теплоты в работу и обратный — получе
ния холода с затратой работы.
В настоящее время наиболее распространены компрессор
ные холодильные машины. По роду используемого ими рабо
чего тела они делятся на два основных типа: воздушные и паро
вые. Цикл воздушной холодильной машины был рассмотрен р а
нее (см. гл. 6 ). В паровых холодильных машинах в качестве ра
бочего тела используются вещества с технически допусти
мыми давлениями насыщенных паров во всем диапазоне темпе
ратур цикла. Из-за этого
требования
в
компрессорных
холодильных машинах вода как рабочее тело не используется,
несмотря на ее дешевизну и безвредность. Это объясняется
тем, что вода имеет чрезмерно низкое давление кипения при тем
пературах, желательных для получения холода. Так, например,
температура кипения воды 4 *2 °С соответствует давлению 700 Па,
которое в компрессорной машине поддержать технически
весьма сложно.
Наиболее распространенными рабочими телами в паровых
компрессорных машинах являются аммиак н фторхлорпроиз-
водные метана и этана — хладоны. Большинство из этих веществ
даже при давлении в 0,098 МПа (т. е. при отсутствии вакуума)
имеют весьма низкие температуры кипения: аммиак —33,4, К 12
— 29,8, Ц22 — 40,8° С и т. д . Выбор того или иного рабочего
тела обусловливается рядом соображений, о которых будет
сказано ниже.
В паровой холодильной машине, в отличие от воздушной,
рабочее тело в ряде процессов претерпевает изменение агрегат
ного состояния. Это обстоятельство не только способствует ин
тенсификации процессов теплообмена, но и делает принципи
ально возможным осуществление обратного цикла Карно как
наиболее эффективного в заданном температурном интервале.
§ 11.2 . ЦИКЛ КАРНО
ДЛЯ ПАРОВОЙ ХОЛОДИЛЬНОЙ МАШИНЫ
Схем а паровой компрессорной машины, работающей по
циклу Карно, представлена на рис. 1 1 . 1 , а изображение цикла
в диаграмме р—V и Г—5
—
нарис. 11.2.
Влажный пар состояния / поступает из испарителя в ком
прессор Л, где он адиабатно сжимается от давления р0 до дав
ления р. В процессе сжатия 1 —2 затрачивается работа /к. Со
стояние в точке 2 соответствует сухом у насыщенному пару. При
уменьшении степени сухости пара перед компрессором, т. е.
смещении точки / влево по изобаре ро. возможно получить
в конце сжатия и влажный насыщенный пар. Сжатое рабочее
тело (точка 2) поступает в конденсатор В, где от него в процессе
2 —3 при неизменном давлении отводится теплота 9 1. В конце
181
процесса конденсации 2 —3 получается
насыщенная
жид
кость высокого давления р (точка 3). Адиабатное рас
ширение
рабочего
тела
(процесс 3 — 4) происходит
в расширительном цилиндре С, при этом совершается полезная
работа /р.ц. В результате расширения получается влажный пар
(точка 4) с низким давлением р0 и низкой температурой То.
В испарителе О жидкость, содержащаяся во влажном паре, ки
пит при постоянном давлении (процесс 4— 1) . Степень сухости
пара при этом возрастает от х4 до х%. Процесс 4—1 осуществля
ется за счет подвода к холодильному агенту теплоты д * кото-
Рве. 1 1 .1 . Схема паровой холодильной маши
ны, выполняющей цикл Карно.
рая отнимается от тел, подлежащих охлаждению, и потому на
зывается удельной холодопроизводнтельностью.
Изобарные процесы теплообмена 2—3 и 4—1 , если они вы
полняются в области насыщения, являются одновременно и изо
термическими. Таким образом, цикл Карно может быть рассмат
риваем только в области насыщения.
На диаграмме р—V работа, затрачиваемая в компрессоре,
может быть показана в виде площади 12аЬ, а работа, получае
мая в расширительном цилиндре,— в виде площади 34Ьа. Тогда
работа цикла, равная
|1ц| * 1М — /р.ц»
выразится площадью 1234, ограниченной линиями процессов
цикла. Так как работа компрессора имеет отрицательное значе
ние, а по абсолютной величине она больше положительной ра
боты расширительного цилиндра, то и работа цикла отрица
тельна.
183
Подведенная к рабочему телу теплота <72 в диаграмме Г—$
выражается площадью 1пт4, а отведенная (71— площадью 2птЗ.
Учитывая, что тепловой баланс обратного цикла записыва
ется как
М*?1+|/ц|.
откуда |/ц| = |^||—<72» можно отметить, что и в диаграмме Т—б
площадь 1234 представляет собой работу цикла.
Теплота изобарного процесса, а так ж е работа компрессора и
расширительного цилиндра при осуществлении в них адиабатных
процессов могут быть выражены через разности энтальпий. Д л я
нашего случая <7а“ *1“ ^ |<7 1|
|/м| = ¿2—И» /р.ц
—
<’«
•
Рис. 1 1 .2 . Обратный цикл Карно для пара в рабочей (о) и тепловой (б)
диаграммах.
Эффективность рассматриваемого цикла оценивается с по
мощью холодильного коэффициента е —ф а/ К п !-
Как уж е указывалось, холодильный коэффициент обратного
цикла Карно не зависит от свойств холодильного агента, а оп
ределяется только температурами Г и Т0:
вн"<7а/|^ц| " ? 2/(|?||— Я2) (а* — зт )/[Т*(зЛ— $т) —
- Го(5п-5т)]-Го/(Г-Го).
Работа цикла /ц при одном н том же количестве теплоты Яъ
отводимой от охлаждаемых тел, обратно пропорциональна хо
лодильному коэффициенту: |/ц|в <7*/«- Отсюда следует, что чем
больше холодильный коэффициент, тем меньше работа, затр а
чиваемая на получение единицы количества холода (отнятой
теплоты) в данных условиях. Величина работы, затраченной на
получение единицы холода, характеризует его термодинамиче
с кую ценность.
Из полученного выше выражения для ек видно, что холодиль
ный коэффициент уменьшается при понижении температуры Т0
183
н повышении температуры 7. Понижение 7 0 вызывает большее
уменьшение е»о чем такое же увеличение 7. Это видно из сле
дующего. Изменение, связанное с повышением 7, определяется
значением производной дг/дТ—*
—
70/(7 — 70)а. Аналогично из
менение е, связанное с понижением 7 0, определяется производной
дг/дТо—7/(7—70)а. Так как 7 > 7 0, то всегда дг/дТо>дъ/дТ.
Температура окружающей среды 7 для определенного геогра
фического пункта — величина мало изменяющаяся, и термоди
намическая ценность холода, производимого в этом пункте в з а
данное время, характеризуется прежде всего температурой 70
охлаждаемого источника. Чем ниже эта температура, тем доро
же получаемый холод, т. е. тем
больше работа, затрачиваемая
на его получение.
Для упрощения
анализа
термодинамической эффектив
ности циклов в ряде учебни
ков вводятся понятия о внеш
ней и внутренней необрати
мости. Внешне необрати
мым процессом будем назы
вать процесс, для которого не
выполняются условия равнове
сия между рабочим телом и
средой (внешнее равновесие)
при существовании внутреннего равновесия. Под внутрен
ним равновесием будет понимать одинаковость д а в л е
ния и температуры в любой точке объема рабочего тела. Введе
ние понятия о внешней и внутренней необратимости является
условным приемом, так как в действительности внутреннее р ав
новесие в рабочем теле в большинстве случаев может существо
вать лишь при наличии равновесия между телом и средой, т. е.
внешнего равновесия. Говорить о внутреннем равновесии при
отсутствии внешнего можно только в том случае, когда значения
температур н давлений в различных точках рабочего тела отли
чаются лишь на очень малые величины А/ и Ар (за исключением
процессов кипения н конденсации).
Рассмотренный цикл Карно является полностью обратимым,
т. е . состоит из процессов, удовлетворяющих условиям внутрен
него и внешнего равновесий. В действительности же выполнить
процессы теплообмена при сохранении внешнего равновесия,
т. е., например, при отсутствии разности температур между ра
бочим телом и источником, невозможно. Это означает, что тем
пература рабочего тела, кипящего в испарителе То, должна быть
ниже, чем температура охлаждаемых тел 7<Л а температура кон
денсации рабочего тела 7 должна быть выше температуры 7 '
среды, воспринимающей теплоту. Только при существовании ко
нечных разностей температур А70 н А7 (рис. 11 .3) возможна
Рис. 11 .3 . Обратный цикл Карно с
необратимыми процессами теплооб
мена.
184
передача теплоты <72 рабочему телу и теплоты ¿71 окружающей
среде. Подставляя в выражение холодильного коэффициента дей
ствительные температуры источников 7У и Т\ можно видеть,
что холодильный коэффициент уменьшается при возникновении
необратимости в цикле. Так как Т'<Т и7У>Г0, то
То'1(Тг — То')<То/(Т — 7 0).
Уменьшение холодильного коэффициента вследствие внешней
необратимости указывает на соответствующее увеличение ра
боты, затраченной при получении единицы холода. Однако не
одно термодинамическое совершенство определяет общую эко
номичность холодильной машины. Больш ую роль играют так ж е
расход металла и затраты труда при изготовлении этих машин.
Если исходить только из термодинамического совершенства, то
необходимо стремиться к отсутствию разностей температур
АТ и АТ0 в процессах теплообмена между холодильным агентом
и источниками. К выполнению этого условия можно прибли
зиться только при бесконечно больших поверхностях теплопере
дачи. Отсюда следует, что для улучшения термодинамического
совершенства холодильной машины нужно значительно увели
чить габариты теплообменных аппаратов.
Таким образом, стремление к термодинамическому совершен
ству ведет, с одной стороны, к сокращению расхода энергии,
а с другой — к существенному увеличению стоимости машины.
Очевидно, что выбор необходимых перепадов температур в про
цессах теплообмена должен предусматривать обе стороны воп
роса для получения наибольшего экономического эффекта.
Использование в качестве образца термодинамического со
вершенства обратимого цикла Карно целесообразно лишь для
случая, когда температуры источников в процессах теплообмена
остаются постоянными.
Практическое осуществление цикла Карно в паровой холо
дильной машине связано со значительными трудностями конст
руктивного и эксплуатационного характера. Обратный цикл,
осуществляемый в современных холодильных машинах, имеет
несколько отличий от цикла Карно. Рассмотрим основные из
них.
Зам ена расширительного цилиндра регулирующим вентилем.
Изготовление и эксплуатация расширительного цилиндра, в ко
тором работа производилась бы вследствие расширения р або
чего тела от состояния насыщенной жидкости, представляют
большие трудности, связанные прежде всего с возможностью
гидравлического удар а. Величина ж е работы расширения в т а
ком цилиндре столь незначительна, что практически почти вся
она расходуется на трение в механизме. Поэтому в паровых хо
лодильных машинах отказываются от расширительного ци
линдра и заменяют его дроссельным вентилем (чаще называе-
135
мым регулирующим). В этом случае понижение давления и тем
пературы холодильного агента перед поступлением в испари
тель происходит не в процессе адиабатного расширения 3 —4,
а в процессе адиабатного дросселирования 3 —4' (рис. 11 .4 ).
Тогда цикл холодильной машины будет: 1 —2 —3 —4'— 1 .
Процесс дросселирования (см. § 10 ф) необратим, энтропия
в этом процессе возрастает, энтальпии начального и конечного
состояний могут быть приняты одинаковыми, следовательно,
точка 4 \ отвечающая состоянию за регулирующим вентилем,
должна располагаться в диаграмме T—s на кривой i— const,
проходящей через точку 3. Процесс дросселирования 3 — 4' пред
ставлен в диаграмме Т—s пунктирной линией, так как, будучи
заведомо необратимым, он может быть изображен в диаграммах
лишь условно. В процессе дросселирования увеличивается объ
ем рабочего тела, хотя полезная внешняя работа при этом не
совершается. Дросселируемая жидкость «самоохлаждается», ча*
стично испаряясь и превращаясь во влажный пар с температу
рой насыщения, соответствующей более низкому давлению после
сужения.
Замена расширительного цилиндра регулирующим вентилем
весьма целесообразна с точки зрения упрощения устройства хо
лодильной машины. Вместе с тем эта замена ведет к некоторым
изменениям в цикле, делая его заведомо необратимым и внося
в него определенные потери. Прежде всего в цикле с дроссели
рованием холодопроизводнтельность уменьшается на некоторую
величину по сравнению с циклом, в котором осуществляется
адиабатное расширение холодильного агента. На диаграмме
Г— з (см. рис. 11 .4) это уменьшение холодопроизводительности
186
Д<7г может быть выражено площадью т44'п. Оно равно Д?2=
=
Ц'— *4«
С физической точки зрения уменьшение холодопроизводи-
тельности объясняется тем, что в конце дросселирования полу
чается влажный пар с большей степенью сухости, чем при ади а
батном расширении до того же давления, и в испаритель холо
дильной машины попадает меньше жидкости. Кроме того,
в цикле с дросселированием увеличивается работа цикла на ве
личину Д/ц, равную «потерянной» работе расширительного ци
линдра /р.ц=/ з — «V На диаграмме Т—5 (см. рис. 11 .4) работа
расширительного цилиндра может быть показана в виде пло
щади Ь34, так как *3 равно площади оаЗтп, а и — площади
оаЬ4ш.
Если в цикле Карно с адиабатным расширением холодиль
ного агента работа цикла выраж алась площадью 1234, то
в цикле с дросселированием она равна площади 123Ь, т. е. воз
росла на величину площади Ь34. Действительно, в цикле с дрос
селированием работа цикла равна работе компрессора (работа
регулирующего вентиля равна нулю): |/ц| = |/к| = * 2 — ¿1— пл.
123Ь,так как *2=пл. оа32к, а и= пл.оаЫк.
Увеличение работы цикла Д/ц равно уменьшению холодопро-
изводительности Д*/2 (пл. ¿>34=пл. т44'п). Равенство Д/ц=
= Д <72 следует из того, что теплота <7 1, отводимая в конденсаторе,
одинакова для обоих циклов (площадь к23т). В цикле с адиа
батным расширением она может быть выражена как |?1 | =
= 02+|М* в цикле с дросселированием как |0 1| = 02—Д02+
+ |/ц| 4-Д/ц. Тогда <72“Ь | * ц | = *72—Д0 2+* |/ц|+Д/ц. Последнее ра
венство справедливо лишь при Д0 2= Д/ц. Это же следует и из
того обстоятельства, что в результате процесса дросселирова
ния энтальпия рабочего тела не изменяется, т. е. *3 = 1*4 «Тогда
Д<72, равное ц»—*4, может быть выражено как *3—Ц. А именно
такой разности энтальпий равно увеличение работы цикла Д/ц.
Работа цикла с дросселированием, помимо площади 123Ь,
может быть выражена площадью 1 2 3 т п 4 что лучше увязыва
ется с выражением работы цикла из теплового баланса: |/ц| =
=
1^1 —472, так как 01=пл. к23т, а ^2=пл. к14'п.
При изучении основных положений второго закона термоди
намики отмечалось, что потеря работы в прямом цикле или из
быток работы в обратном цикле, вызванные необратимостью,
равны произведению тем пературы холодного источника на изме
нение энтропии системы, т. е. Д/=Гаснет-
В нашем случае Г2= 7 о (если определяется избыток работы
в цикле 1—2 —3 —4г—1 по сравнению с циклом Карно 1—2 —3 —
4— /); ДЗспст можно найти из следующего баланса для измене*
ния энтропии тел, участвующих в процессах:
1)
энтропия холодильного агента в результате осуществления
цикла не изменилась, так как агент вернулся в начальное со
стояние;
187
2 ) энтропия среды, воспринимающей теплоту, возросла на
величину щ\!7 (в случае изотермического процесса передачи теп
лоты) ;
3) энтропия охлаждаемого тела уменьшилась на величину
(<72— А <7 2) / 7 о ( в случае изотермического процесса передачи теп
лоты). Отсюда (см. рис. 11 .4)
Атеист = Я\/Т+ (<72/7*0 — А^/Го) =А<7а/7'о=шп,
так как
Таким образом, для рассматриваемого цикла с дросселиро
ванием
Д/ц = Т 2Атеист = ТоА^г/Т*о= А<7г»
т. е. и такой способ анализа потерь, вносимых необратимым
процессом дросселирования, приводит к полученному ранее ре
зультату.
^Необратим ость цикла, связанная с заменой расширительного
цилиндра регулирующим вентилем, ведет к уменьшению холо
дильного коэффициента е. Это уменьшение учитывается отноше
нием холодильного коэффициента рассматриваемого цикла
(в нашем случае цикла с дросселированием 1 —2 —3 —4 '— 1 на
рис. 11 .4) к холодильному коэффициенту обратного цикла Карно
/—2 -3—4—/,т.е.
ТЦ>— в/вк — [(<72 — А<72)//ц]/ (<72//ц .н ).
Отношение е/ек. называемое обычно степенью обрати
мости цикла
имеет значение, меньшее единицы, так как
всегда е<ек.
Холодильный коэффициент цикла с дросселированием может
быть выраж ен через холодильный коэффициент цикла Карно,
осуществляемого в том же интервале температур, следующим
образом:
в — (<7г — А<72)//ц— (<7а — А<72)//ц. к"Ь А/ц) —
=
(<72 — /рл) / (/ц.к+/р.ц) ,
где <72— удельная холодопроизводительность цикла Карно; Д<7г—
потеря холодопроизводительности при переходе к дросселиро
ванию; /ц — работа цикла с дросселированием; /цк — работа
цикла Карно; А/ц — увеличение работы цикла при переходе
к дросселированию; /р^ — работа расширительного цилиндра
в цикле Карно (7р.ц=Д<72=Д/ц).
Разделив числитель и знаменатель полученного выражения
для е на /ц.к, получим
в = (<7г/^ц. к — /р. ц//ц. и )/( 1 4*/р. ц//ц.к) в
=
(вк — /р.ц//ц.к) / (1 — 7р.ц//ц.н) •
188
Из этого уравнения видно, что холодильный коэффициент
цикла с дросселированием зависит от отношения /рл//ц.к. Если
в цикле Карно это отношение мало, то при переходе к циклу
с дросселированием холодильный коэффициент такого цикла
близок к ек. Иначе говоря, при 1р.п/1ц.к—*0 е— ► ей.
На величину дроссельных потерь значительное влияние о к а
зывают свойства рабочего тела. Таким образом, выбором рабо
чего тела для цикла с дросселированием можно повлиять на ве
личину холодильного коэффициента, что существенно отличает
этот цикл от цикла Карно.
Рассмотрим некоторые характеристики, определяющие свой
ства рабочих тел.
Критическая температура. Применение рабочего тела с от
носительно низкой критической температурой, приближающейся
к температуре окружающей среды, ведет к увеличению дрос
сельных потерь. Т ак, например, велики необратимые потерн от
дросселирования при использовании в качестве рабочего тела д ву
окиси углерода, критическая температура которой (Лф= 3 1 0 С)
весьма близка к обычной температуре охлаждающей воды (/«
« 15 - * - 2 0 °С ). В этом случае удельная холодопроизводительность
Рис. 1 1 .5 . Влиянне на величину дроссельных потерь критической темпера
туры рабочего тела (о) и разности температур Г—Г 0(б).
очень мала (см. заштрихованную площадь на рис. 11 .5 , а). Не
большое понижение температуры Т0 в испарителе или повыше
ние температуры охлаждающей воды Т может довести значение
<72 до нуля.
Теплота парообразования. При осуществлении цикла с дрос
селированием относительная потеря холодопроизводительности
будет тем меньше, чем больше теплота парообразования г0 ра
бочего тела при температуре Т0, т. е. чем больше ширина изоб
ражения цикла при прочих равных условиях. Под относительной
лотерей холодопроизводительности будем понимать отношение
Д?г/<7а= (/<» — /4)/[г0— (»« — ¿ь) — («* — *,)].
189
На рис. 11 .4 теплота парообразования г0 представляет собой
площадь /Ьсе.
Теплоемкость рабочего тела в жидком состоянии. Чем
меньше теплоемкость жидкости с7 на левой пограничной кривой,
тем круче проходит эта пограничная кривая и тем меньше пло
щадь Ь34 (см. рис. 11 .4), представляющая собой увеличение
работы цикла в результате замены расширительного цилиндра
регулирующим вентилем.
Помимо названных свойств рабочего тела на величину дрос
сельных потерь оказывает влияние и разность температур 7 —
— Го» с возрастанием которой потери увеличиваются. Это наглядно
иллюстрирует рис. 11 .5 , б; при увеличении разности температур
7 — Т0 вследствие понижения температуры в испарителе от / 0
до 7 0' увеличивается и относительная потеря холодопроизводи-
тельностн. При температуре в испарителе 7 0
(Д<71/<7*)70- пл. ш Л 'п/пл.
(/4#— Ц)Ц(\ — Ь Ь
При 70'
(Д<71/?2)7о' - пл. тббл'/пл. т ^ /'Л —(¿в — ^в)/(Л— *в).
Так как «в—и>Ц'—
а —*в<*1—** то
(А?а1Ъ)Т, > (ЬяМ г)Т0.
Все сказанное позволяет отметить, что дроссельные потерн
достаточно полно могут быть оценены с помощью безразмерного
комплекса, равного к о=Г о/[с'(Т — 7 0)].
Чем больше значение ¿л» тем больше степень обратимости
цикла с дросселированием (т)о). т . е. тем меньше отличаются
холодильные коэффициенты такого цикла н цикла Карно, осу
ществленного в том ж е интервале температур.
В табл. 11.1 приведены значения комплекса ко и степени об
ратимости г\о для некоторых рабочих тел. Эти значения подсчи
таны для двух интервалов температур: 1) 7— 70=»35К (темпера-
Таблица 11.1. Свойства рабочих тел и характеристика цикла
г*. еДж/Вг
*о-V
Пс, «-«1
ко яа
Рабочее
тево
Vе
е\
кДж/(*г* К)
о
Ь
7
и
2»
7
1
6
о5>
и«в
К
и
?А
ЫН*
132.4
4.65
1296
1310 7,95 6,28
0,93
0,90
СРС1,
(ИИ)
съа,
196.0
0,38
194
195 6,30 4.94 0.88
0,86
112,0
0,96
159
161,5 4.72 3,73 0,84 0,81
со,
31.0
3,20
362
273 2,53 1,90
0.47 0,22
190
тура конденсации /= 25°С, кипения — /0= — 10°С); 2) Т— Г0в
= 45К (температура конденсации/=30°С, кипения— /0“
— 15°С).
Необходимо подчеркнуть, что приведенная в таблице хар акте
ристика т]£ свидетельствует, насколько близок к холодильному
коэффициенту цикла Карно холодильный коэффициент цикла,
в котором единственным источником необратимости является
процесс дросселирования.
Переохлаждение рабочего тела перед регулирующим венти
лем. В рассмотренном ранее цикле (см. рис. 11 .4 ) для дроссели
рования в регулирующий вентиль направлялась насыщенная
жидкость (состояние 3), полученная в результате процесса кон
денсации. Если ж е имеется
возможность охладить эту ж ид
кость перед дросселированием
до температуры более низкой,
чем
температура
конденса
ции 7, то это приведет к уве
личению удельной холодопро-
изводительности при той ж е
затрате
работы
в
цикле.
Сказанное
иллюстрируется
рис. 11 .6 . Здесь удельная хо-
лодопроизводительность
при
дросселировании насыщенной
жидкости с температурой 7
(точка 3) выражается пло
щадью п'сШг. Если же жид
кость перед дросселированием охлаждена до более низкой
температуры, чем Г, например до Ти (точка 3), то полу
ченная холодопроизводительность в этом случае измеря
ется площадью т 4'1к, т. е. увеличивается на значение, соответ
ствующее площади т4'(1п'. Работа цикла в обоих случаях оди
накова и выражается площадью 123Ь. В рассмотренном примере
точка 3 ' соответствует ненасыщенной жидкости высокого давле
ния р. Следует заметить, что укоренившийся в холодильной тех
нике термин спереохлажденная жидкость» для обозначения со
стояния 3 не соответствует известному физическому представле
нию о переохлажденной жидкости (индекс и при температуре
точки 3' (7и) является первой буквой немецкого слова ип!егкй-
1ш ^ — переохлаждение).
Переохлаждение жидкости перед регулирующим вентилем
позволяет сократить дроссельные потери. Особенно эффективно
переохлаждение для рабочих тел с низкой критической темпе
ратурой (например, С 0 2). В этом случае малый наклон нижней
пограничной кривой в околокритической области ведет к тому,
что даж е малое переохлаждение значительно смещает влево
точку 3' и заметно увеличивает удельную холодопроизводитель
ность.
Рис. 11 .6 . Влияние переохлаждения
жидкости на холодопроизводитель
ность цикла.
191
Переохлаждение жидкого рабочего тела может быть достиг
нуто в самом конденсаторе при достаточно большой теплообмен
ной поверхности, так как поступающая в конденсатор вода
имеет более низкую температуру, чем температура конденсации.
Осуществляя процесс переохлаждения в специальном теплооб
менном аппарате — противоточном переохладителе, можно до
биться понижения температуры жидкого рабочего тела почти до
температуры входящей охлаждающей воды. При этом целесо
образно изыскивать для подачи в переохладитесь воду с наи
меньшей температурой, например воду из артезианских колод
цев. Отвод ж е теплоты в конденсаторе осуществляется обычно
более дешевой водой (например, речной), имеющей более высо
кую температуру.
Сжатие сухого пара. Другой особенностью современной холо
дильной машины является то, что компрессор всасывает не
влажный пар, как это следовало бы из условия осуществления
цикла Карно, а сухой насыщенный (часто даж е слегка перегре
тый). В этом случае машина работает ссухим ходом» компрес
сора.
Переход к сухому ходу компрессора обусловлен только прак
тическими соображениями. Так, например, всасывание компрес
сором влажного пара с капельками жидкости может привести
к гидравлическому удару. Кроме того, нежелательный теплооб
мен м еж ду паром и стенками цилиндра компрессора происходит
интенсивнее, когда всасывается влажный пар, и т. д . Переход
к сухому ходу позволяет избавиться от этих явлений. Всасыва
ние сухого пара в цилиндр компрессора обеспечивается включе
нием в схему установки отделителя жидкости, в котором оседа
ют капли жидкости, уносимые паром из испарителя. Схема уста
новки с расширительным цилиндром и отделителем жидкости
приведена на рис. 11 .7 , о.
На рис. 11 .7 , б в диаграмме Т—5 изображен цикл V—2*—
2—3 —4—Г со сжатием сухого пара (без дросселирования и
переохлаждения жидкости). В рассматриваемом цикле в конце
адиабатного сжатия
2* получается перегретый пар высокого
давления р (точка 2 ') . В этом случае отвод теплоты в конденса
торе происходит в двух процессах: 2,—2
—
превращение перегре
того пара в сухой насыщенный (так называемое снятие пере
грева) и 2—3
—
собственно конденсация.
В цикле V—2' — 2 —3 —4—V со сжатием сухого пара по
сравнению с циклом Карно /— 2 —3 —4 — 1 происходит увеличе
ние как удельной холодопроизводнтельности (Д<7з = п л . 1 Г е к ) %
так и работы цикла (Л/Ц=пл . !22'У).
Для цикла с адиабатным расширением жидкости (3— 4) пе
реход к сжатию сухого пара ведет к понижению холодильного
коэффициента, так как приращение холодопронзводитсльности
(Л<72) оказывается меньшим, чем возрастание работы цикла
(Д/м). Это видно из того, что при смещении точки 1 вправо при-
102
ращение работы d l = (T n— T0)ds (где Тп — температура пере
гретого пара, возрастающая от 2 до 2') соответствует кривой
постоянных давлений р в области перегретого пара. В то ж е
время элементарное приращение холодопроизводительности
Tods определяется площадью под горизонтальным участком
изобары ро в области влажного пара.
Рис. 11 .7 . Схема (а) н цикл (б) холодильной машины со сжатием в компрес
соре сухого пара.
Для цикла с дросселированием переход к сжатию сухого
пара не обязательно ведет к уменьшению холодильного коэф
фициента. Может быть показано, что при весьма пологом рас
положении нижней пограничной кривой (т. е. для рабочих тел,
имеющих большие дроссельные потери) сухой ход в некоторых
случаях будет теоретически более выгодным, чем влажный.
§11.3. теоретический цикл паровой
ХОЛОДИЛЬНОЙ МАШИНЫ С РЕГУЛИРУЮЩИМ ВЕНТИЛЕМ
Выше были рассмотрены те основные отклонения от цикла
Карно, которые свойственны теоретическому циклу современ
ной паровой холодильной машины. С хем а холодильной машины
с регулирующим вентилем, переохлаждением жидкости и всасы
ванием в компрессор сухого пара изображена на рис. 11 .8 , цикл
такой машины в диаграммах р — V, Т — $ и 1 — 5 представлен
на рис. 11.9.
Компрессор А холодильной машины всасывает сухой насы
щений пар низкого давления ро (состояние /) и сжимает его
адиабатно до высокого давления р (процесс 1 — 2). При этом
в компрессоре затрачивается механическая работа /к. Так как
при расширении в регулирующем вентиле полезная работа не
Испаритель
13 За*. 80
193
производится, то работа цикла равна работе компрессора.
В конце адиабатного сжатия (точка 2) получается перегретый
пар, температура которого значительно превышает температуру
среды, воспринимающей в дальнейших процессах теплоту qx.
Перегретый пар состояния 2 направляется в коиденсатор В, где
вначале происходит процесс снятия перегрева 2—5 . Отдавая
теплоту окружающей среде (речная вода, воздух) при постоян
ном давлении р, пар превращается в этом процессе из перегре
того в сухой насыщенный состояния 5. При дальнейшем отводе
теплоты начинается процесс конденсации 3 —4, протекающий
при постоянном давлении р и
температуре 7. Полученная в
результате конденсации насы
щенная жидкость состояния 4,
попав в переохладитель С,
продолжает отдавать теплоту
в изобарном процессе 4 —5. Из
переохладителя выходит пере
охлажденная (точнее, ненасы
щенная) жидкость состояния 5,
имеющая давление р и темпе
ратуру 7 М. Таким образом, в
конденсаторе ц переохл а дителе
в процессах 2—5, 3 —4 и 4—5
от рабочего тела отводится
теплота qu которая в диаграм
ме 7 —s может быть выражена
площадью k2345m (рис. 11 .9 ,
б). Ненасыщенная жидкость
состояния 5, проходя через су
жение регулирующего венти
ля D , дросселируется и пре
вращается во влажный насы
щенный пар (состояние 6) низкого давления ро и соответствую
щей этому давлению низкой температуры насыщения 7 0. Необ
ратимый процесс дросселирования 5 —6 соответствует линии
!■ = const.
Полученный влажный пар (точка 6) имеет весьма малую
степень сухости (при обычных режимах де« 0 ,15-гО,2 5). Основ
ной компонент такого влажногодара — насыщенная жидкость —
отделяется от сухого пара в отдё^ителе жидкости Е и направ
ляется в испаритель F. Необходимо подчеркнуть, что во многих
схем ах холодильных машин отделитель жидкости отсутствует
и в испаритель поступает влаж ный пар непосредственно после
регулирующего вентиля. В испарителе F при постоянном д ав
лении ро и температуре 7 0 идет процесс кипения жидкости 6— /
за счет теплоты, отнимаемой от тел, подлежащих охлаждению.
По отношению к рабочему телу эта теплота q* является подве-
Ряс. 11 .8 . Схема холодильной маши
ны с регулирующим вентилем и пе
реохл адителем.
194
денной в цикле. Теплоту ^ в холодильной практике называют
удельной холодопроизводительностыо и обычно
обозначают ? 0 (кДж/кг).
Удельная холодопроизводительность — это теплота, отводи
мая от охлаждаемых тел одним килограммом рабочего тела.
Эта теплота в диаграмме Г — а может быть представлена в виде
площади п61к. Полученный в конце кипения сухой насыщен
ный пар состояния / всасывается компрессором и подвергается
в нем адиабатному сжатию. Таким образом, замыкается цикл,
в результате которого теплота отнимается от тел менее на
гретых, переводится на более высокий температурный уровень
при затрате механической работы и передается среде более на
гретой. На практике компрессор всасывает обычно не сухой
пар, а слегка перегретый. Перегрев может происходить как
в самом испарителе (когда подведенной теплоты больше, чем
необходимо только для испарения рабочего тела), так и в тру
бопроводах от испарителя до компрессора. В этом случае со*
стоянию пара перед компрессором соответствует не точка /,
а точка /', и процесс сжатия в компрессоре изобразится адиа
батой
2' (на рис. 11.9, б — пунктиром).
В большинстве холодильных машин, работающих на хла-
донах, осуществляется регенерация теплоты, и пар перед ком
прессором перегревается в специальном теплообменнике, ох
лаж дая жидкость, идущую к регулирующему вентилю.
13* V
195
Из теплового баланса обратного цикла |<7i| = < 72+|/ц| сле
дует, что работа цикла может быть выражена как разность
теплот |/ц|= |<7i| — q2 и показана в диаграмме Т — s в виде
площади 12345тп6, или (что было доказано выше) в виде пло
щади 1234b.
Все составляющие теплового баланса могут быть выражены
через разности энтальпий в соответствующих точках цикла.
Так,<7,= t2—/5;^o=ti—xe;Ku|= *2—«V
На диаграмме i — s (см. рис. 11 .9 , в) эти величины изобра
жаются отрезками на оси ординат. Эффективность цикла холо
дильной машины характеризуется холодильным коэффициентом
e= W N = ai-W/(/2-ii).
Значения холодильного коэффициента определяются прежде
всего температурами Т и Т0 и свойствами рабочего тела; теоре
тически г изменяется от 0 до оо.
Полная холодопроизводительность машины определяется как
произведение удельной холодопроизводительности на м асс у х о
лодильного агента, циркулирующего в единицу времени: Q0=
=
<7oAi, гд% Qo— полная холодопроизводительность машины
(кВт), М — масса холодильного агента (кг/с).
Адиабатная мощность (кВт) компрессора может быть най
дена из соотношения N * = M lH.
Холодопроизводительность холодильной машины уменьш а
ется при понижении температуры кипения рабочего тела в испа
рителе. Это легко пояснить, если ввести широко применяемую
в хладотехнике величину — объемную холодопроизво
дительность qVf которая равна qv= q 0/ vi и представляет со
бой количество холода, отнесенное к 1 м3 пара рабочего тела,
всасываемого компрессором (v\— удельный объем пара в точке
/ цикла; см. рис. 11 .9 , а ) . Холодопроизводительность связана
с величиной qv следующим образом: Q o=<7t>V, где V — объем
пара, всасываемого компрессором, мэ/с.
Объемная холодопроизводительность qv значительно умень
шается при понижении температуры испарения, так как удель
ный объем сухого пара при этом сильно возрастает, а удельная
холодопроизводительность изменяется очень мало. Уменьшение
qv с понижением температуры кипения ведет и к уменьше
нию Q0.
В холодильной технике при расчете циклов паровых холодиль
ных машин широкое распространение приобрела диаграмма
р — i (точнее, lgp—/). На рис. 11.10 приведена такая диа
грамма с нанесением в ней линий основных процессов (/— const,
s = c o n s t) и контура цикла паровой холодильной машины со
всасыванием в компрессор перегретого пара.
Проиллюстрируем расчет цикла паровой холодильной м а
шины с помощью диаграммы Igp— i следующим примером.
196
Пример. Найти параметры узловых точек цикла, холодильный коэффи
циент цикла, холодопроиэводительность машины, адиабатн ую мощность ком
прессора и теоретический объем, описываемый поршнем компрессора в 1 ч,
седи известно, что температура кипения в испарителе / о » — 40* С темпера
тура конденсации / — 30° С , температура переохлажденной жидкости перед ре
гулирующим вентилем / « - 2 0 * С, в компрессор всасывается перегретый пар
с температурой /в — — 35* С Рабочим телом является Ц22, часовой расход
которого М=500 кг/ч.
цикл холодильной машины, соответствующий заданным условиям, изо
бражен в диаграмме \gp~~i на рис. 1 1 . 1 0 . В действительной диаграмме по
строение цикла целесообразно вести следующим образом. Найдем положение
точек 4 и а. Оно определится пересечением изотерм / — 30* С и /о=
—
40° С
с нижней пограничной кривой. Точки 4 и а расположены такж е на изобарах,
соответствующих давлениям в конденсаторе и испарителе.
Рис. 11.10. Теоретический шли холодильной ма
шины со сжатием перегретого пара в диаграмме
Отметив изобары р и ро и взяв на оси ординат соответствующие значе
ния давлений (р— 1 ,2 М Па, ро— 0 .1055 М Па), определим положение точек
3 и 7. Эти точки леж ат на верхней пограничной кривой и соответствуют
давлениям р и р». Состояние пара на входе в компрессор (точка /) опреде
лится в месте пересечения изотермы /в - *
—
35* С с изобарой р* Так как
теоретический процесс с ж атия в компрессоре считают обычно ад иабатным,
то точка 2 (конец сжатия) определятся пересечением адиабаты (з-со п а1),
проведенной черев точку 1. с изобарой р. Точка 5 перед регулирующим вен
тилем лежит на пересечении изотермы ¿в =*20* С с изобарой р. Точка 6 нахо
дится из условия равенства ¿»— ¿с, т. е. на пересечении вертикали, прове
денной через точку 5 с изобарой д>. Найдя таким образом положение всех
узловых точек цикла, определим с помощью диаграммы параметры 1122
в этих точках. Необходимо отметить, что параметры насыщенной жидкости
(точка 4) и сухого насыщенного пара (точки 3 н 7) могут быть уточнены
по соответствующим таблицам.
Не загромождая пример выписыванием всех параметров для всех точек,
приведем лишь необходимые для дальнейших расчетов значения энтальпий:
1,-611
кДж/кг; /,— 637 хДж/кг;
¿»-674 кДж/кг; ¿«-457 кДж/кг;
¿,-¿,«44 4 кдж/кг; ¿7-605 кДж/кг.
Удельная холодопроиэводительность может быть найдена из формулы:
—
¿.«ж606—444 -16 1 кДж/кг.
107
Работа цикла, равная работе компрессора: |/ц| - I * —
— 674—611 —
= 63 кДж/кг.
Холодильный коэффициент цикла е “ ?о/1*ч1 —16 1/63 = 2,56.
Холодопроизводительность машины: Оо—
—
161*500—80500 кДж/ч—
= 22,36 кВт.
Адиабатная
мощность
компрессора: Л^—М/и/3600-500-63/3600—
=8,73кВт.
Объемная холодопроюводнтелыюстъ: я* - 9в/»1“ 16 1/ 07 1 - 766 кДж/м*.
Теоретический объем, описываемый
поршнем
компрессора в 1 ч:
V —Яо/Я* " 80500/766 —10 5 н*/ч.
§ 11.4 . ЦИКЛ ПАРОЭЖЕКТОРНОП
ХОЛОДИЛЬНОЙ МАШИНЫ
В качестве примера холодильной машины, которая потреб
ляет извне не механическую работу, а теплоту, рассмотрим па
роэжекторную холодильную машину (ПЭХМ). В ПЭХМ от
сутствует громоздкий и дорогостоящий компрессор, а сж атие
пара, поступающего из испарителя, осуществляется в пароструй
ном аппарате — диффузоре. Рабочим телом ПЭХМ обычно яв
ляется вода, которую практически невозможно применять
в компрессионных
машинах из-за очень больших значений
удельного объема сухого насыщенного пара при низких темпе
ратурах. Так, например, при поддержании в испарителе темпе
ратуры насыщения 5е С ( р = 872 П а) компрессору пришлось бы
отсасывать водяной пар, имеющий удельный объем 147,2 м3/кг,
что можно было бы осуществить лишь при огромных р азм е
рах цилиндров (для сравнения: сухой насыщенный пар И22 при
той же температуре имеет и" = 0 ,0486 м*/кг).
На рис. 11.11, а изображена простейшая схема ПЭХМ. В ней
рабочий пар, поступающий из парового котла, расширяется
в сопле от высокого давления р\ до более низкого и приобретает
большую скорость (до 1000 м/с и более). Сопло рассчитывается
таким образом, чтобы давление рабочего пара на выходе из него
было бы несколько меньше давления в испарителе. Вследствие
этого в камеру смешения засасывается холодный пар из испа
рителя. Смесь рабочего и холодного пара, проходя затем через
диффузор, теряет скорость н повышает давление до значения
рт. Таким образом, для сжатия холодильного агента исполь
зуется кинетическая энергия потока рабочего пара, которую
он приобретает вследствие затраты теплоты Я\ в котле. Смесь
рабочего и холодного пара при высоком давлении рт после диф
фузора направляется в конденсатор, где конденсируется, отда
вая теплоту охлаждающей воде. Образовавшийся конденсат
разделяется затем на два потока. Один поток дросселируется
в регулирующем вентиле до низкого давления р0 и снова посту
пает в испаритель, а другой подается насосом в котел при д а в
лении р\.
Если обозначить через М массу рабочего пара, необходимую
для получения 1 кг смеси при промежуточном давлении рт, то
198
тогда количество рабочего пара, необходимое для сжатия 1 кг
холодильного агента, составит М /( 1 — М ).
Изображение цикла пароэжекторной холодильной машины
и тепловой диаграмме является условным, так как количество
холодильного агента и рабочего пара различно для д вух частей
никла. Поэтому площадь, изображающая теплоту, подводимую
ч цикле к 1 кг рабочего пара, для определения действительного
количества теплоты, затрачиваемой на 1 кг холодильного агента,
должна быть умножена на величину М/{ 1 — М). С этой ого-
о
Рис. 11 .11 . Схема (а) и цикл (б)
пароэжекторной холодильной м а
шины.
воркой теоретический (без учета необратимости процесса) цикл
ПЭХМ представлен в диаграмме Т — 5 на рис. 11.11,6. Он скла
дывается из следующих процессов: 1 —2
—
расширение рабо
чего пара в эжекторе; образовавшийся в конце расширения пар
состояния 2 смешивается в камере с паром состояния 2" , посту
пающим из испарителя; точка 3 соответствует состоянию смеси
рабочего и холодного пара перед диффузором; процесс 3 —4
—
сжатие смеси в диффузоре до промежуточного давления рт;
процесс 4—5
—
охлаждение пара в конденсаторе; 5 —6
—
про
цесс конденсации. Образовавшийся конденсат состояния 6 р аз
деляется. Часть его направляется в насос, где в процессе о— 7
давление конденсата повышается до давления в котле р\. Затем
эта часть конденсата подогревается до состояния насыщения
199
(процесс 7—8) и кипит в котле, превращаясь в сухой насыщен
ный пар состояния 1 (процесс 8— /). Другая часть конденсата
дросселируется в регулирующем вентиле (процесс б—0 ). Обра
зовавшийся влажный насыщенный пар состояния 9 направляется
в испаритель, где, отнимая теплоту
от тел, подлежащих ох
лаждению, превращается в сухой насыщенный пар состояния
2" . Далее этот пар отсасывается в камеру смешения, и процессы
повторяются.
Удельная холодопронзводительность цикла ф0 изображается
на диаграмме площадью с92"с1. Теплота <7ь подводимая в цикле
к 1 кг холодильного агента, изображается площадью а781Ь, ум
ноженной на величину М /(1 — М).
Эффективность ПЭХМ, затрачивающей для получения хо
лода энергию не в виде работы, а в виде теплоты высокого
потенциала, оценивается коэффициентом использования теплоты
(тепловым коэффициентом):
1 “ Яо/Я\-
Существенным недостатком пароэжекторной машины явля
ется значительная потеря энергии из-за необратимого ха р а к
тера процесса в эжекторе. Поэтому термодинамическое совер
шенство ПЭХМ ниже по сравнению с компрессионной холо
дильной машиной.
§ 11.5 . ТЕПЛОВОЙ НАСОС
Обратный цикл, с помощью которого теплота передается
с низкого температурного уровня на более высокий, может быть
осуществлен не только в холодильных машинах, т. е. в целях
отнятия теплоты от тел, подлежащих охлаждению. С помощью
обратного цикла можно отнимать теплоту от окружающей
среды (например, от речной воды) и передавать эту теплоту
среде с более высокой температурой в целях ее нагревания
(например, воде, циркулирующей в отопительных батареях жи
лых помещений). Установка, в которой протекает такой обрат
ный цикл, называется тепловым насосом (см. §5.2).
Идея использования тепловых насосов для отопления впервые
была высказана В. Томсоном.
Принципиальных отличий м еж ду циклами холодильной м а
шины н теплового насоса нет. Они отличаются лишь целями
осуществления н интервалами температур, между которыми вы
полняется цикл. На рис. 11.12 показаны схемы действия тепло
вого насоса (слева) и холодильной машины. Температурные ин
тервалы взяты условные для некоторого произвольно выбран
ного случая.
Эффективность теплового насоса особенно велика, когда
требуется достижение сравнительно невысоких температур (на
пример, в целях отопления, для технологических нужд, неко
торых отраслей пищевой промышленности, для опреснения мор-
200
ской воды и т. д .) . Прямое использование в этих целях теплоты,
получаемой при сгорании топлива, ведет к очень большим не
обратимым потерям. Тепловая энергия обесценивается, пере
ходя с высокого температурного уровня (100 0 — 1500° С) на
сравнительно низкий (50— 150 °С), ¿толь же невыгодным яв
ляется и непосредственное использование для перечисленных
пыше целей электрической энергии. Гораздо эффективнее з а
тратить электроэнергию на привод компрессора в установке
теплового насоса, «перекачивающего» теплоту из окружающей
среды на более высокий температурный уровень. Принципи
альная схема теплового на- £*с
coca, используемого для ото- j 0.
плення жилых зданий, пред
ставлена на рис. 11.13.
Установка
включает в
себя те ж е основные звенья,
что и холодильная машина.
В испарителе 1 холодиль-
о
ный агент кипит за спет теп
лоты <7о» отнимаемой от реч
ной воды. После адиабат
ного сжатия паров холо
дильного агента в компрес-
-20
cope II их температура зна
чительно возрастает. В кон-
р,
денсаторе III пары конден-
бс
сируются, отдавая теплоту
9 i воде отопительной си
стемы. Жидкий холодильный агент дросселируется в регули
рующем вентиле IV и в состоянии влажного насыщенного пара
поступает в испаритель. Н а рисунке показаны ориентировочные
температуры холодильного агента до и после сж атия, а такж е
температуры речной воды и воды-теплоносителя в отопительной
сети. Изображение цикла в диаграммах ничем не отличается
от изображения цикла паровой холодильной машины.
Анализ теплового баланса цикла теплового насоса
М-«о+|/я|
позволяет сделать вывод, что нагреваемому телу, кроме теп
лоты, эквивалентной работе сжатия /ц, сообщается и теплота
<7о, отнятая от низкотемпературного источника. При благопри
ятных внешних условиях теплопроизводительность q\ в не
сколько раз превышает затрату работы /ц. Эффективность цикла
характеризуется отопительным
коэффициентом р, представ
ляющим собой отношение теплоты qi, переданной нагреваемой
среде, к затраченной в цикле работе:
и-Ы/|/ц|-* ./'«•
1 1 .1 2 . Сопоставление условий ра-
холодильной машины и теплового
насоса.
201
Значение р всегда больше единицы, так как числитель
больше знаменателя на величину ^ Теоретически р меняется
впределах: 1<р<оо.
Связь между отопительным коэффициентом р и холодиль
ным коэффициентом е определяется соотношением
-
(<7о+ |/д|)/|М «<7о/*ц+1 - в + 1 .
Отопительный
коэффициент имеет наибольшее значение
тогда, когда в установке теплового насоса осуществляется об
ратный цикл Карно. В этом случае он легко может быть вы
ражен через температуры Г и Т0:
ц—М/1М—М/(М—
<7о) =
= Г(5»- 5«)ДГ(5, - 5.) - То(«6- 5 .)]-Г/(Г- Го).
Рис. 1 1 . 1 3 . Принципиальная схема теплового насоса.
Очевидно, что значение р тем больше, чем меньше разность
7 — Г * т. е. чем на меньший температурный уровень приходится
«поднимать» теплоту <7о- С этой точки зрения чрезвычайно вы
годно использовать в качестве источника теплоты <70 сбросовые
воды различных производств, воду, используемую для о хл аж
дения крупных электрогенераторов, и т. д .
Экономическая целесообразность применения теплового на
соса видна из следующего примера. Если тепловой насос рабо
тает по циклу Карно между температурами источников 70=
= 300 К и 7=360 К> то его отопительный коэффициент р =
= 7/(7 — То)=350/(350—300) =7 . Это означает, что при за
трате в компрессоре установки 1 кД ж работы нагреваемой
среде
сообщается 7 кД ж теплоты,
из которых 6 кДж
отобрано у низкотемпературного источника и лишь 1 кД ж
получено вследствие расходования ценной электроэнергии на
привод компрессора. Д а ж е с учетом того, что в действительном
цикле отопительный коэффициент будет значительно меньше
(для принятого температурного интервала р * = 3 -г 4), целесо
образность применения теплового насоса для получения теплоты
невысокого потенциала вполне очевидна. Д л я осуществления
202
цикла теплового насоса требуется такая же установка, что и
для осуществления цикла холодильной машины. Т ак как пер
воначальные затраты на создание установки сравнительно ве
лики, то экономически выгодным является использование одной
и той ж е установки для отопления какого-либо помещения зи
мой и для охлаждения (например, в системе кондиционирования
поздуха) летом. В этом случае при работе зимой в испарителе
установки агент кипит за счет теплоты, отнимаемой от среды,
обладающей большими запасам и низкотемпературной теплоты,
например, от речной воды. Теплота конденсации отводится
к воде-теплоносителю, циркулирующей в отопительных б а т а
реях. Летом речная вода подается в конденсатор и к ней отво
дится теплота <7ь через испаритель же циркулирует вода-хладо-
носнтель, которая, отдав теплоту на кипение агента и охладив
шись при этом, поступает затем в воздухоохладитель системы
кондиционирования.
При выборе рабочих тел д ля теплового насоса необходимо
учитывать некоторые особенности его работы. Преж де всего в теп
лонасосных установках, применяемых для отопления, исклю
чается использование веществ, вредных для организма чело
века, а также взрывоопасных и огнеопасных. Весьма существен
ное влияние на выбор рабочего тела оказывает высокая темпе
ратура при конденсации в теплонасосных установках. Это за
ставляет отдавать предпочтение веществам, имеющим сравни
тельно низкое давление в конденсаторах. Названным требова
ниям отвечают многие хладоны, например И11, Н12, И113, Н142.
Необходимо отметить, что ИИ и К113 следует применять в уста
новках с турбокомпрессорами, так как малая величина объем
ной производительности (<?„) препятствует их применению
в поршневых машинах.
Глава 12
циклы криогенной техники
§ 12.1 . НАЗНАЧЕНИЕ КРИОГЕННОЙ ТЕХНИКИ
В пятой, шестой, одиннадцатой гл авах рассмотрены обрат
ные циклы газовых и паровых холодильных машин. Однако
там не учитывались особенности получения особо низких темпе
ратур: от 120К и ниже. Эти температуры называются криоген
ными. Область холодильной техники и технологии, связанная
с получением или использованием температур ниже 120К» назы
вается криогеникой. Техника для создания и применения низких
температур, не наблюдаемых в естественных условиях, называ
ется криогенной.
203
Назначением криогенной техники является сжижение газов
(азота, кислорода, гелия, водорода и др.) , их хранение и тран
спортировка в жидком состоянии; разделение газовых смесей и
изотопов низкотемпературными методами (например, промыш
ленное получение чистого азота, кислорода и аргона из воздуха,
выделение дейтерия ректификацией жидкого водорода); охлаж
дение и термостатированне при криогенных температурах сверх
проводящих электротехнических устройств, электронных прибо
ров, биологических объектов. Д л я решения этих проблем необ
ходимо иметь устройства (криогенные установки), при помощи
которых можно получить криогенные температуры.
Совокупность процессов, происходящих в криогенной уста
новке, в результате которых теплота передается от источника,
имеющего температуру Г <12 0 К , к окружающей среде, образует
тот или иной криогенный цикл. Некоторые из них будут разоб
раны в настоящей главе.
§ 12.2 . ИДЕАЛЬНЫЙ КРИОГЕННЫЙ ЦИКЛ
Рассмотрим процесс сжижения газа, находящегося при тем
пературе и давлении окружающей среды (точка / на рис. 12 .1),
причем температура жидкой фазы должна оказаться в области
криогенных температур. Технически наиболее просто процесс
Рве. 12 .1 . Идеальный криогенный Рис. 12 .2 . Идеальный цикл в соло-
цикл в координатах г —а.
ставлення с шилом Карно.
ожижения осуществить по изобаре (процесс /—2 —5, рис. 12 .1),
т. е. вначале охладить ожижаемый газ до температуры конден
сации (процесс / — 2 ) , а затем сконденсировать его при этой же
температуре (процесс 2—5). В процессе охлаждения от газа
от рабочего вещества:
—
/I—пл. 12451.
При конденсации в процессе 2 —5 отводится теплота
<7к=1з — *2я пл. 23642.
204
Общее количество теплоты, отнятое от единицы массы газа
при его ожижении в изобарном процессе 1 —2 —3:
Я* -ьЯл+Яж*
—
и —пл. 12365!.
Эта теплота должна быть передана рабочему телу, изменяю
щему свое состояние в обратном обратимом цикле 1 —7—3 —
2—1 . Этот цикл можно представить состоящим из двух циклов:
цикла Карно 2—8—7—3 —2 и цикла 2—1 —8—2. В свою оче
редь цикл 2 — 1 —8 —2 такж е можно представить состоящим из
бесконечно большой суммы элементарных циклов Карно. Один
из таких циклов а—б —в —г —а представлен на рис. 12 .2 . Прин
ципиальная схема установки, в кото
рой возможно бы было осуществить
цикл 1 —7—3 —2 —1, представлена на
рис. 12 .3 . Установка включает в себя
компрессор /, детандер II и теплооб
менник III. Рабочее тело (криоагент)
сжимается в компрессоре при постоян
ной температуре 7*1 (процесс 1 —7),
адиабатно расширяется в детандере
до состояния жидкости (точка 3) и на
правляется в теплообменник, где вос
принимает теплоту от ожижаемого га
за, причем во всех сечениях аппарата
рабочее тело и ожижаемый газ имеют
одинаковую температуру, но отделены
друг от друга теплопередающей по
верхностью. Цикл 1 —7—3 —2 —1 в
криогенной технике называют идеаль
ным. Работа этого цикла
|/|-Г,(*1— аУ) - No
—«.
(12.1)
Рис. 12 .3 . Схема установки
для осуществления обрати
мого цикла для сжижения
газов.
При заданных температурах источников она минимальна, так
как выше было доказано, что этот цикл возможно представить
суммой элементарных циклов Карно. При рассматриваемых ус
ловиях степень термодинамического совершенства у цикла Кар*
но нанвысшая. Удельная холодопронзводительность его Я2— Ь —
— ¿э. Удельная холодопронзводительность Яг численно равна теп
лоте, отнимаемой от ожижаемого газа я%- Теплота, отведенная
от рабочего вещества:
Я\~Т\ («7 — 5 |).
Холодильный коэффициент
в
_?*_
/1 ~ * 1______
11Г
^|($1—*1)“ "(*!— *з)*
На рис. 12 .4 идеальный цикл криогенной техники изображен
в координатах р—и и ¡—з. В диаграмме р—и (рис. 12 .4, а) ра-
205
бота цикла изображается площадью 1731. В диаграмме I—5
(рис. 12 .4 , б) удельная холодопроизводительность определяется
отрезком 9—1 . Процесс ожижения можно осуществить и по-дру
гому, если в качестве ожижаемого газа и рабочего тела цикла
(криоагента) используется одно и то ж е вещество.
Таблица 12.1 . Основные характеристики
ожижении некоторых газов идеального цикла
Газ
[/|, аДж/кг Ш.
кВт • ч/л
*2.
кДж/кг
а
Азот...
760.6
ОД7 2
433.1
0,563
Аргон
4*78,6
0,184
273,6
0,572
Водород
11900
0.236
3980
0,334
Гелий*
.
.
6660
0*237
1662
0,228
Кислород
636,4
0201
407,1
0,638
Метан*
.
.
1:1110
0.13
915
0,824
Неон*
1331
0,445
371,2
0,279
Примечание. Звездочка — при Т| —300 К и р. -
- 0 .1013 МПа
Если ожижаемый газ вначале изотермически сж ать в ком
прессоре (процесс 1 — 7) у а затем адиабатно расширить в детан
дере (процесс 7—3) у то можно получить насыщенную жидкость
Рис. 12 .4 . Идеальный цикл в координатах р—V (а) и в координатах /—5 (б).
в состоянии, соответствующем точке 3 (см. рис. 1 2 .1 ) . Если
оба процесса обратимые, то необходимая для ожижения газа ра
бота имеет минимальное значение и равна работе цикла 1 — 7 —
3 —2 — 1 (см. (12.1)). Если происходит ожижение воздуха, имею
щего начальные параметры 7*1=303,15К (30° С) и р1= 0 ,1 МПа,
то работа цикла 1—7—3 —2 —1 |/|=754 кДж/кг, а давление
206
р7= 5 • 10* М Па. Получить такое высокое давление практически
невозможно. Минимальная удельная работа ожижения некото
рых газов, находящихся при р|= 0 ,1 МПа и температуре Т\=
= 300К, а также соответствующие удельная холодопроизводи-
тельность и холодильный коэффициент идеального цикла при
ведены в табл. 12 .1 .
§ 12.3 . ЦИКЛЫ КРИОГЕННОЙ ТЕХНИКИ
ДЛЯ СЖИЖЕНИЯ ГАЗОВ В МАСШТАБАХ ПРОМЫШЛЕННОСТИ
Получить криогенные температуры возможно в различных
устройствах. Д ля сжижения газов в промышленных количест
вах в настоящее время, как правило, применяются установки,
в которых используется либо эффект Д ж оуля—Томсона, либо
адиабатное расширение, либо то и другое вместе, т. е. установка
включает в себя как элементы, в которых осуществляется дрос
селирование, так и элементы, в которых происходит адиабатное
расширение. В разных криогенных установках осуществляются
циклы с одно- или двукратным дросселированием. В каждом
из этих циклов может быть процесс предварительного охлаж де
ния, осуществляемый установкой умеренного холода. Цикл,
в котором имеется процесс дросселирования, но нет процесса
адиабатного расширения, известен в промышленности и технике
как цикл Линде.
К циклам, включающим в себя процесс адиабатного расши
рения, происходящий в детандере, относится цикл высокого
давления (цикл Гейлендта), среднего давления (цикл Клода),
низкого давления (цикл П. Капицы), цикл с двухступенчатым
расширением воздуха в детандере (также предложенный Кло
дом), цикл с детандером на обратном потоке (цикл Л е-Руж а).
Как было показано в гл. 10, обратные циклы с адиабатным
расширением имеют лучшие показатели термодинамической
эффективности, чем циклы с дросселированием.
Всесторонний анализ этих, а такж е более сложных циклов
криогенных установок излагается в специальных курсах. В дан
ной главе будут рассмотрены лишь основные термодинамические
представления о циклах криогенной техники.
| 12.4 . ЦИКЛ С ОДНОКРАТНЫМ ДРОССЕЛИРОВАНИЕМ
Цикл с однократным дросселированием можно представить
состоящим из трех процессов (рис. 12 .5 , а, б): изотермического
сжатия ( 1 —2), дросселирования (2—3), изобарного расшире
ния (3— 1) . Этот цикл необратим вследствие необратимости про
цесса дросселирования. В подавляющем большинстве случаев
207
процесс дросселирования осуществляется таким образом, что
¿г= 4 . Теплота, отведенная в процессе 1 —2:
Я\*=Т\ (¿2 — $|)*
(12.2)
Теплота, подведенная (удельная холодопроизводительность):
4а-*1—
—
Ь-пл . 31653.
(12.3)
Работа цикла /*= пл. 12аб1. В соответствии с первым законом
термодинамики |/| = |</|| —Яг или с учетом соотношений (12 .2 )
и (12.3)
|/1—7*1(«| —5г) — М
—
/а).
Ряс.
12.5 . Цикл с однократным
дросселированием
в
координатах
Г—5 (а), р—и(б).
В диаграмме Г —$ работа цикла измеряется площадью 127531.
Холодильный коэффициент цикла
.
_
/1-
I/I Т1(51— —(/»—/:)'
Д ля получения той ж е удельной холодопроизводительности
в идеальном цикле 1 — 4—3 — 1 необходимо затратить работу
|/в|= 7*1(5|—54)—(1\—/$)=пл . 4134.
Холодильный коэффициент этого идеального цикла
_
?2_
и —*2
н
1/.1 ' “ Г,(а|-5*)-(/3-/,) •
(12.4)
Так как Г,(51—54)<Г|(5^5а), то а*>а.
В теории криогенной техники для характеристики термодина
мического совершенства исследуемого цикла вводят понятие от-
206
носительного термодинамического к .п д. цикла: для цикла 1 —
2—5 —/
ЯгМ
Т7ГЯг9
ИЛИ «о
7\(5Х— 54) —(/] — /а)
Т|(51 — *») —(*1 — *|)
ил, 3413
«и. 2135»” *
Из соотношения площадей видно, что е о < 1, чем подтвержда
ется известное положение о том, что всякая необратимость ухуд
ш ает термодинамическое совершенство цикла.
Как видно из диаграммы (рис. 12 .5, а), самая низкая темпе
ратура рабочего тела (точка 3 ) значительно выше критической.
Следовательно, пользуясь циклом /—2 —3, невозможно привести
рабочее тело в жидкое состояние.
Температурный уровень получаемого холода (теплоты, под
водимой к рабочему телу) можно понизить, включив в схему
установки теплообменник для охлаждения сжатого компрессо
ром воздуха («теплого потока») расширенным в дросселе воз
духом («холодным потоком»). В установке, снабженной тепло
обменником, впервые в промышленном масштабе был получен
жидкий воздух, а затем и жидкий кислород. Такая схема была
предложена Линде, именем которого н назван соответствующий
цикл.
§ 12.5 .ЦИКЛ ЛИНДЕ
Принципиальная схема установки, в которой осуществляется
цикл Линде, приведена на рис. 12 .6 . В качестве рабочего тела
здесь, как правило, служит ожиженный воздух. При работе
установки различают два периода — пусковой и рабочий.
Процессы, происходящие в установке во время пускового пе
риода, представлены на рис. 12 .7 , а во время рабочего — на рис.
12.8, а —в. Воздух, осушенный и очищенный от углекислоты
(в состоянии /, рис. 12 .7), засасывается компрессором / и
в идеальном случае сжимается изотермически в интервале д ав
лений от р\ до рз (10—20 М П а). В реальных условиях сжатие
воздуха осуществляется по политропе (до состояния 2И). При
этом температура его повышается. Проходя теплообменник 2,
воздух охлаждается окружающей средой до начальной темпера
туры t\. Затем воздух последовательно проходит основной теп
лообменник <?, дроссель 4, сборник жидкости 5, снова основной
теплообменник и направляется в компрессор. Температурный
уровень получаемого холода в рассматриваемом цикле понижа
ется благодаря включению в схему теплообменника 3, который
в криогенной технике называется основным. В теплообменнике
протекают навстречу друг другу два потока воздуха: «теплый»
(сжатый в компрессоре) и «холодный» (расширенный в дрос
с ел е ). Таким образом без передачи теплоты внешним источнн-
14 Зак. 10
20ч
кам осуществляется внутренний теплообмен. Принципиальная
картина подобных процессов рассмотрена в § 5.4 .
Остановимся на исследовании пускового периода работы
установки. Первая порция воздуха в состоянии 3, пройдя ком
прессор, теплообменники, дроссель и сборник жидкости, д але е
вновь поступает в основной теплообменник, где воспринимает
теплоту второй порции воздуха с высоким давлением, которая
поступила, пройдя компрессор и теплообменник 2 . При этом
Рис. 12 .6 . Схема установки, в которой осуществ
ляется цикл Линде.
/ —компрессор; 2 — тоолообмоаакк; 3 —осиомоЯ тепло*
обмояпкх; « —дроссель; 5 —сборках жадкоств.
первая порция воздуха нагревается от
до и, переходя от со
стояния 3 к состоянию 1, а вторая — охлаждается от
до*4,‘
переходя от состояния 2 к состоянию 4.
При идеальном теплообмене должно соблюдаться равенство
ср\(*1 —
*з)“ £ра(*а— Л)
или*4—
Так как средняя теплоемкость воздуха высокого давления
ср2 выше теплоемкости воздуха низкого давления ср1, то
Первая порция воздуха из основного теплообменника всасыва
ется компрессором. Вторая порция воздуха, .охладившись в ос
новном теплообменнике до температуры
дросселируется, пе-
-О
реходя к состоянию 5, и за
тем, пройдя сборник жидко
сти, снрва поступает в ос
новной теплообменник, где
воспринимает теплоту от
третьей порции, воздуха. П о
следняя охлаждается от t2
до ht переходя от состоя
ния 2 к состоянию б, при
этом в реальных условиях
Далее
третья
порция
охлаждает в основном теп
лообменнике последующую,
т. е. четвертую порцию воз
духа от /2 до /в» переходя от
состояния 2 к состоянию 8 , при этом третья порция нагревается
от U до tu переходя от состояния 7 к состоянию I.
Наконец, охлаждение воздуха высокого давления станет
столь значительно, что кривая дросселирования из точки Ю пе-
Рис. 12 .7 . Цикл Линде в координатах
Т—s (пусковой период).
ресечет пограничную кривую и попадет в область влажного пара
(точка I I ) . Влажный пар, поступив в сборник жидкости, раз
деляется на составляющие: сухой насыщенный пар (точка 1 2 )
и насыщенную жидкость (точка 1 3 ) .
14*
211
На этом заканчивается предварительный или пусковой пе
риод и начинается рабочий режим сжижения воздуха.
На рис. 12 .8, а —а представлен цикл Линде для установки,
работающей в установившемся режиме.
В процессе 4—5 — / к рабочему телу подводится теплота
<7=/1—
часть этой теплоты <7 2 = 1 5 — 14 является полезной
(удельная холодопроизводительность цикла). Ее можно исполь
зовать для ожижения газов, обеспечения процессов разделения
смесей п т. д . Вторая часть — теплота, подводимая в основном
теплообменнике (рис. 12 .8 , а) к рабочему телу в процессе 5 —1 :
</2р=а/,— 15. Она отводится от воздуха высокого давления в про
цессе 2—5 : <72_з= / 3—/2. При отсутствии потерь <72р = | <7а-з| или
<1—15*=<2— или«1—*2= '5—
а так как /3= 1*4 (в процессе
5—4 осуществляется дросселирование), то
/1—/2-/5—<4.
Таким образом, используемый холод определяется разностью
энтальпий в начале и конце процесса изотермического сж ати я
/— 2 . В координатах Г— 5 удельная холодопроизводительность
определяется площадью <72= пл. 455'4 '4 , а в координатах /—з
—
отрезком 5 —/ . Работа цикла
и I“ |4|I—Яг—Тх(*|—«а)—(¿»—ч) •
Так как |<7|| = Г|(5|—$,). а <7а=¿5— ¡*, холодильный коэффнцн*
ент цикла
Сг
.
*»-*«
1/1 7’1(з1-5а)-(/ь-/4)*
§ 12.6 . ПОТЕРЯ ХОЛОДОПРОИЗВОДИТЕЛЬНОСТИ
ОТ НЕДОРЕКУПЕРАЦИИ И НЕСОВЕРШЕНСТВА ИЗОЛЯЦИИ
В предыдущем параграфе рассматривался цикл, осуществля
емый по идеальной схеме, в которой предполагалось, что в ап
паратах установки все процессы обратимы (происходят при
бесконечно малой разности температур) и нет притоков тепла
через изоляцию. В аппаратах
реальных установок процессы
теплообмена протекают при ко
нечной разности температур и
имеются теплопритоки через
изоляцию.
Проходя основной теплооб
менник, обменивающиеся теп
лотой среды не достигают тех
температур, которые могли бы
быть получены в обратимом
процессе. Холодное рабочее те
ло, поступив в основной тепло
обменник с температурой Ти
ную холодопроизводительность.
212
выходит из него с температурой 7в, а нс 7 ь как было бы
в случае обратимого процесса (рис. 12 .9). Теплое рабочее тело,
поступив в основной теплообменник с температурой Гг, выйдет
из него с температурой Г7, а не 7з в случае обратимого про*
цесса. Разность температур Д 7 = 7 |—Тб на степлом» конце ос
новного теплообменника в теории криогенной техники назы
вается недорекуперацней.
Соответствующая теплота (потерянный от недорекуперации
холод) может быть определена соотношением
Яшр=/| — ¿б«ср(Г, — Г«)«=пл. 611'6 'в .
Эта величина соответствует уменьшению полезной холодопроиз-
водительности цикла. Следовательно, процесс дросселирования
начнется не из состояния, характеризуемого точкой 3, а из со
стояния, характеризуемого точкой 7 (рис. 12 .9). Энтальпия
этого состояния определится соотношением
17—¿з—¿1 — /«.
Потеря от недорекуперации на рис. 12 .9 изображается пло
щадью 488'4'4, так как 13=14и¿7
В криогенных установках процессы протекают при темпера
турах ниже температуры окружающей среды. Так как абсолют
ной изоляции не существует, от окружающей среды через изо*
ляцию к рабочему телу передается теплота <7т.п
-
Зная я1Л>можно
определить состояние рабочего тела, поступающего в дроссель
ное устройство (точка 9, рис. 12 .9 ), используя соотношение
^.Пек- *7.
Потеря удельной холодопроизводительности, обусловленная
теплопритоками через изоляцию, в координатах 7 — 5 (рис. 12 .9)
определится площадью 8101(У8'8, так как ¿з— Ь , а м0= ^ -
С учетом недорекуперации и теплопритоков из окружающей
среды полезная удельная холодопроизводительности цикла бу
дет равна (рис. 12 .9):
Яга=^—|',0=пл . ¡055'КУЮ.
Только эта часть удельной холодопроизводительности может
быть использована для получения сжиженного газа.
Если в криогенной установке требуется холод только на не-
дорекуперацию и покрытие потерь через изоляцию, что большей
частью и имеет место в воздухоразделительных установках, то
для обеспечения необходимой холодопроизводительности следует
подобрать такое давление сжатия, при котором 1\—¡2= 1\о— и.
| 12.7 . ЦИКЛ С ДЕТАНДЕРОМ
Схема установки, в которой выполняется этот цикл, пред
ставлена на рис. 1 2 . 1 0 , изображение цикла в координатах т— 5
и р—о
—
на рис. 1 2 . 1 1 . Цикл состоит из процесса изотермиче-
213
ского сжатия /—2, изобарного охлаждения 2—3, адиабатного
расширения 3 —4 и изобарного процесса расширения 4—5 — 1 .
Рабочее тело сжимается в компрессоре 1. Если процесс сж а
тия осуществляется по политропе, то в теплообменнике 2 рабо
чее тело охлаждается окружающей средой до начальной темпе
ратуры. Затем рабочее тело поступает в основной теплообмен
ник 3 9 где охлаждается до состояния 3 и направляется в детан
дер. Адиабатно расширившись в детандере 4, рабочее тело
направляется в холодоЛриемник 5, а затем поступает в основной
теплообменник, в котором за счет теплоты процесса 2—3 нагре
вается в процессе 5—1 .
Рис. 12 .10. Схема установки, в которой осуществляется дстан*
дерный цикл.
/ — компрессор; 7 — теалообиааанк; 5 — осаомой теалообмашак; 4 — де-
тендер; 8 — хоаодоораемнак.
При отсутствии потерь в теплообменнике: — ^з=^1— ¿в или
— ¿3. Линия 3—6
—
изоэнтальпа. Поэтому последнее
выражение можно записать и так:
1*1 —- 1*1 ■ /5— ¿в**пл. 655'6'6.
Эту теплоту ¿1 — ¿2 в теории криогенной техники называют холо
дом, полученным в компрессоре, а 13—14— /в— ¿« — холодом, полу
ченным в детандере.
С учетом только внешних источников удельная холодопроиз-
водительность (теплота, подведенная к рабочему те л у):
<72-* 5—¿4=цЛ.455'4'4,
ИЛИ
<72* (¿5— ¿в)+ (и— 1б).
Теплота, отведенная от рабочего тела (рис. 12.11, а);
Ях= Тх($1—эО-пл. /22'/'/.
214
Работу компрессора |/*| = 71(51—э2) в диаграмме 7 —5 можно
представить площадью //'Я 'З/, в диаграмме р— V |/и| — пл.
2/ва2. Работа детандера /о = /з — «4 наиболее наглядно изобра
жается площадью 34ва3 в диаграмме р— и, соответственно ра
бота цикла |/ц| = |/н|—/г>=7|(51—52) —(/з—Ц) в той же ди
аграмме изобразится площадью 2 143 (см. рис. 12.11). Холодиль
ный коэффициент цикла
ва Л1-
—
^
^______
!/ц|
7,(5,- а9)-(/,-! .)•
Если бы в схеме установки вместо детандера применялся
дроссель, то вместо процесса адиабатного расширения 3 —4
цикл замыкался бы процессом дросселирования 3 —6. Д ля та
кого цикла /— 2 —3 —6 —5 — 1 удельная холодопроизводитель-
ность
/«=**1—(г Работа этого цикла |/'ц1 « 7 ,(5 1 — 5*) —
— (и—
холодильный коэффициент в ' « 9 /|/|/'ц|. Так как
в |У'ц|) > |Уц| * то в '< е . Последнее неравенство еще раз
подтверждает высказанное ранее положение о том, что дрос
сельные циклы имеют более низкую степень термодинамиче
ского совершенства по сравнению с циклами, включающими
в себя процесс адиабатного расширения в детандере.
Глава 13
ЦИКЛЫ ПАРОСИЛОВЫХ УСТАНОВОК
§ 13.1 . ОСНОВНЫЕ ОСОБЕННОСТИ
ПРЯМЫХ ПАРОВЫХ ЦИКЛОВ
Энергия, получаемая на теплосиловых станциях, составляет
до 80% электроэнергии, вырабатываемой в Советском Союзе.
Одноврем енно с ростом мощностей гидроэлектростанций буд ет
215
по-прежнему интенсивно возрастать мощность паросиловых уста
новок. В настоящее время создаются гигантские установки
с мощностью более 2 млн. кВт при давлении пара до 30 МПа
при температуре 600° С. Техническое оснащение современных
паросиловых установок ушло далеко вперед по сравнению с пер
выми паровыми машинами. Однако основные особенности р а
боты подобных установок остались неизменными. Это, во-пер
вых, наличие в цикле фазовых превращений рабочего вещества,
и, во-вторых, то, что продукты сгорания топлива непосредст
венно не участвуют в рабочем цикле, а являются лишь источни
ком теплоты. Рабочим же веществом служи т пар какой-либо
жидкости, чаще всего воды.
Начало теории циклов паросиловых установок заложено
в исследованиях С. Карно. Введенный им в рассмотрение обра
тимый цикл в заданном интервале температур наиболее эконо
мичен при переводе теплоты в работу. То обстоятельство, что
к. п.д. такого цикла не зависит от природы рабочего тела, поз
воляет рассмотреть его в качестве образца и для циклов паро
силовых установок. Если рабочим телом в цикле Карно явл я
ется насыщенный пар, то осуществить такой цикл представля
ется технически более возможным, чем подобный цикл с идеаль
ным газом. В последнем случае изотермические процессы под
вода и отвода теплоты могут протекать лишь при одновремен
ном совершении нлн потреблении механической работы, что
в техническом отношении выполнить очень сложно. Если ж е
в цикле Карно рабочим телом является влажный пар, то посто
янство температуры в изотермическом (а для области насыще
ния одновременно и изобарическом) процессе обеспечивается
кипением или конденсацией рабочего тела.
§ 13.2 . ЦИКЛ КАРНО ДЛЯ НАСЫЩЕННОГО ПАРА
Принципиальная схема установки, осуществляющей цикл
Карно в области насыщенного пара, представлена на рис. 13.1.
На рис. 13.2 приведено изображение цикла в координатах р — V,
Т—5И1—5.
Образующийся в котле IV сухой насыщенный пар высокого
давления (точка 1) адиабатно расширяется в цилиндре I до со
стояния влажного насыщенного пара низкого давления рг (точ
ка 2). Этот пар поступает в конденсатор II, где от него в изо
барном, (и одновременно изотермическом, так как в области на
сыщения изобара и изотерма совпадают) процессе 2 —3 отво
дится теплота <72. При этом происходит частичная конденсация
и степень сухости влажного пара уменьшается. Особенностью
рассматриваемого цикла является то, что конденсация не дово
дится до конца, т. е. до получения насыщенной жидкости низ
кого давления Р2 (ей соответствовала бы точка Я7). Достигаемая
при неполной конденсации точка 3 выбирается таким образом,
216
чтобы последующее адиабатическое сжатие 3 —4 в компрессоре
/// привело влажный пар (точка 3) к состоянию 4, т. е. к состоя
нию насыщенной жидкости при давлении в точке р\. Насыщен
ная жидкость состояния 4 подается в котел IV, где при подводе
теплоты ?| в изобарном (и одновременно изотермическом) про
цессе 4— 1 образуется сухой насыщенный пар. Процесс 4— 1 —
это процесс кипения, в котором степень сухости меняется от
нуля (точка 4) до единицы (точка /).
Рассмотренный цикл, так ж е как и изучавшийся ранее цикл
Карно для идеального газа, состоит из двух изотерм (4—1 и
Рас. 1 3 .1 . Схема паросиловой установки, выполняющей цикл Карно.
2—3) и двух адиабат (I—2 и 3—4). Теоретическая полезная
работа
производимая 1 кг пара при адиабатном расширении
в паровой машине, численно равна интегралу ¡уйр. На диаг
рамме р —и эта работа в определенном масштабе может быть
представлена площадью а12Ь. Работа /* теоретически затрачи
ваемая на сжатие 1 кг влажного пара в компрессоре, численно
равна интегралу /
На диаграмме р—V работа /к может быть
представлена площадью а43Ь.
Работа цикла, являющаяся алгебраической суммой работ
паровой машины и компрессора, на диаграмме измеряется пло
щадью , ограниченной контуром 1234, т. е. 1п— 1пм—1М-
Теплота
подведенная к рабочему телу в процессе кипения
4— I, может быть представлена на диаграмме Г—5 площадью
с41й. Теплота
отведенная от рабочего тела в процессе кон
денсации 2—3, может быть представлена площадью с32<1.
Для любого прямого цикла тепловой баланс записывается
в виде
Р|а/ц+|р3|.
217
Из этого следует, что площадь 1234 в диаграмме Т— а, пред
ставляющая собой разность
и |<7г|, выражает работу цикла
/ц=<74— \я*\-
Ранее было показано, что работа компрессора и паровой
машины при адиабатных процессах сжатия или расширения мо
жет быть представлена в виде разности энтальпий. Т ак же мо
жет быть представлена и теплота, подводимая или отводимая
в изобарном процессе. В нашем случае можно записать: <71 =
= 1|—и; |<721 = <2—1*3/ ¿П-М==<1—*2/ |М = ^4—<3-
В диаграмме 1— 5 все эти величины выражаются соответст
вующими отрезками на оси ординат.
Термический к.п .д . рассмотренного цикла, как и любого дру
гого прямого цикла, в общем виде записывается так:
Л|= /ц/<71-(<?|— М )М * = 1 — М/<?1.
Если ж е полагать, что температура источника теплоты р ав
на V , а приемника — Г " (т. е. считать, что процессы теплооб
мена м еж ду рабочим телом и источниками протекают приЛГ-* -
—
► О), то тогда
цикла Карно выражается через температуру
источников как Т 1* ,к =1— Тп/Т* и имеет наибольшее значение по
218
сравнению с т]< любого другого цикла, осуществленного в том
же интервале температур.
Несмотря на это, цикл Карно в паросиловых установках не
применяется. Объясняется это тем, что осуществление ряда про
цессов этого цикла (как и ранее рассмотренного обратного
цикла Карно) связано со значительными трудностями конструк
тивного и эксплуатационного характера. Прямой цикл, выполня
емый в современных паросиловых установках, имеет ряд отли
чий от цикла Карно. Рассмотрим основные из них.
Первым изменением, вносимым в схему паросиловой уста
новки, является замена компрессора водяным насосом. В ком
прессоре приходится сжимать (процесс 3 — 4) влажный пар, име
ющий достаточно большой начальный объем. При этом работа
сжатия /к составляет 20— 30% от полезной работы, получаемой
в паровой машине /&м- Кроме того, большой начальный объем
сжимаемого пара (точка 3) вызывает необходимость иметь гро
моздкий компрессор, что приводит к дополнительным потерям
(прежде всего на трение). Из-за этого действительная работа
сжатия значительно возрастает, а полезная работа цикла умень
ш а е т с я . В этом случае действительное использование теплоты
в цикле значительно меньше, чем характеризуемое величиной
т)Г|К. В аж ным препятствием в осуществлении процесса сж атия
влажного пара в компрессоре является такж е возможность гид
ра вл ического «удара .
В 50-х годах прошлого столетия К лаузи ус, а затем Ренкин
предложили цикл, позволяющий избежать недостатков, связан
ных с использованием компрессора. Этот цикл — с введением
в дальнейшем ряда усовершенствований термодинамических
принципов работы — и осуществляется в большинстве современ
ных установок.
§ 13.3 . ЦИКЛ РЕНКИНА
Цикл Ренкина может быть осуществлен с помощью уста
новки, подобной представленной на рис. 1 3 . 1 с заменой в ней
компрессора на водяной насос. Необходимо такж е отметить, что
в современных установках получение механической работы
вследствие расширения пара осуществляется не в паровых м а
шинах, а в турбинах. Принципиальная схем а установки, о с у
ществляющей цикл Ренкина для насыщенного пара, представ
лена на рис. 13.3 . На рис. 13.4 цикл Ренкина изображен в ко
ординатах р — V, Т — 5, I — з. Сухой насыщенный пар, полу
ченный в котле IV, адиабатно расширяется в турбине I от со
стояния 1 до состояния 2. Полученная при этом теоретическая
полезная работа на диаграмме р — V (рис. 13.4 , а) выражается
площадью а12Ь. Влажный пар низкого давления (точка 2) после
турбины направляется в конденсатор //, где от него при* посто
янном давлении и температуре отводится теплота ръ (процесс
219
2—3), На диаграмме Т — 5 (рис. 13.4 ,6) теплота д2 может быть
представлена в виде площади с32(.
Процесс конденсации в цикле Ренкина в отличие от цикла
Карно доводится до конца, т. е. до получения насыщенной ж ид
кости при давлении р2 (точка 3). Эта жидкость поступает в на
сос ///, где адиабатно сжимается до высокого давления р\ (про
цесс 3 — 4) и подается в котел. Теоретическая работа сжатия
жидкости в насосе очень мала (в диаграмме р — V — это пло
щадь а43Ь) и составляет лишь около 1% от полезной работы
турбины. Это объясняется тем, что жидкость практически не
сжимаема, и поэтому вся затрачиваемая в насосе работа сво-
Охпотдаю-
таи Вода
Рис. 13.3 . Схема паросиловой установки, осуществляющей цикл Рен
кина для насыщенного пара.
дится к работе проталкивания. А так как удельный объем жид
кости невелик, то и работа проталкивания, равная (р\ — р2)п',
мала. В рассматриваемом случае правильнее называть процесс
3—4 в насосе не сжатием жидкости, а повышением давления
от р2 до р\. Если пренебречь ничтожно малым повышением
температуры при адиабатном сжатии жидкости от р2 до рь то
в диаграмме Т — $ процесс в насосе выродится в точку, т. е.
точка 4 , изображающая ненасыщенную жидкость при давлении
Ри совпадает с точкой 3, изображающей насыщенную жидкость
при давлении р2.
В большинстве тепловых диаграмм, предназначенных для
практического использования, совпадение точек 3 и 4 предопре
деляется уж е тем, что изобары жидкости наносятся совпадаю
щими с нижней пограничной кривой. Ц елесообразно, однако,
более строго показать процесс 3 —4 в рабочей и тепловой ди а
граммах. Это сделано на рис. 13.5 , где в более крупном мас
штабе показана область, примыкающая к нижней пограничной
кривой.
Из рис. 13.5, а видно, что
Это и позволяет
считать работу в насосе равной 1я= (р\ — р2)о'.
На этом же
220
рисунке для сравнения нанесен процесс $ к— ¿к в компрессоре при
осуществлении цикла Карно. Так как из насоса выходит нена
сыщенная жидкость (точка 4 ), то необходимо нагреть ее до
температуры насыщения, соответствующей давлению в котле р\.
Допустим, что изобарный процесс подогрева жидкости 4—5
осуществляется в том ж е котле, где дальше происходит процесс
кипения 5 — /. На самом же деле для непрерывности процесса
кипения подогрев жидкости (4—5) проводится в специальном
5
теплообменном
аппарате — экономайзере,
предшествующем
котлу. В рассматриваемом цикле Ренкина теплота q\ подводится
в двух процессах (4—5 и 5 —1) н в отличие от цикла Карно
расходуется не только на парообразование, tío и на предвари*
тельный подогрев жидкости. На диаграмме Т — s теплота мо
жет быть представлена площадью c45lf (рис. 13.4 ,6).
Работа цикла представляет собой алгебраическую сумму ра
бот турбины и насоса /ц= / т — |М и выражается на диаграмме
р — v площадью 12345. В координатах Т — s эта площадь, пред
ставляющая собой разность теплот q\ и 19 21* выражает работу
цикла: /ц=<7, — Iftl- Кроме того,
^i= ¿, — ú; |^21= ¿2—¿з;
lr= i —í2. Тогда ln=i\'—¿4—<2+ 1*3«¿1--Í2, так как ís« í4-
221
Этот ж е результат для работы цикла получим, если в вы
ражении /ц=/т—\и\= *> —
(р\—ръNo пренебрежем малой
работой насоса. Тогда опять-таки получим /ц« и — ¿ъ т. е. р а
бота цикла практически может быть принята равной полезной
работе турбины.
Термический к.п .д . цикла Ренкина выражается формулой
[(<, — Ь)—(р, — р,)о'1/(/|—¿«).
Упрощение этого выражения до т)«=(/| — »»)/(»! — «4) допу-
стимо лишь в тех случаях, когда установка работает при срав
нительно невысоком начальном давлении р\ (давление ръ опре-
Рис. 13 .5 . Процесс повышения давления жидкости в насосе паросиловой уста
новки в рабочей (а) и тепловой (б) диаграммах.
деляемое температурой охлаждающей воды в конденсаторе,
всегда меньше 0,1 МПа и колеблется в небольших пределах).
Например, при давлении р != 1,96 МПа и р2=0 ,0049 МПа зна
чение ¡1 — 12 составляет 598 кДж/кг, а (р{— р2) о' — всего лишь
1,97 кД ж/к г и пренебрежение этой величиной допустимо. Если
же р! = 19,6 МПа, а по-прежнему р2= 0,0049 МПа. то и — ¿2=
= 712 кДж/кг, (р! — р2)и '= 19,6 кДж/кг и пренебрежение ра
ботой насоса ведет к ошибке в
около 2,8%. Значение л«
в этом случае равно 30,5% и подсчитывается обычно с точностью
до 0,1%. Следовательно, в этом случае работу насосов необхо
димо учитывать.
Термический к.п .д . цикла Ренкина меньше такового для
цикла Карно. Это объясняется тем, что увеличение работы
цикла Ренкина обусловлено большим расходом теплоты щ\9
часть которой приходится затрачивать на подогрев воды в про
цессе 4—5 . Необходимо обратить внимание и на то, что подвод
222
теплоты в цикл Ренкина происходит при более низкой темпе
ратуре, чем в цикле Карно. Если температура источника теплоты
одинакова в обоих циклах и для обратимых циклов равна тем
пературе парообразования в котле (т. е . в процессе теплооб
мена ДГ-М)), то процессы кипения (а для цикла Карно это
единственный процесс с подводом теплоты) происходят при оди
наковых максимальных температурах. Процесс же подогрева
'жидкости в цикле Ренкина происходит при переменной темпера
туре, причем начальная температура воды при подогреве имеет
весьма низкое значение, определяемое давлением р2 (напри
мер, при ра=4900 Па, / „ = 32 ,5 °С). Средняя температура под
вода теплоты в цикле Ренкина оказывается значительно ниже,
Р я с 13.6 . Схема паросиловой установки, работающей по циклу Ревккна
для перегретого пара.
что снижает его 1)| по сравнению с тц, к цикла Карно, совершаю
щегося между теми же температурами насыщения в котле и
конденсаторе. Кроме того, чтобы представить процесс подогрева
жидкости 4— 5 в цикле Ренкина обратимым процессом, надо по
лагать, что он протекает при существовании бесчисленного
множества источников теплоты с постепенно возрастающей тем
пературой. Теплообмен же подогреваемой жидкости с каж дым
из этих источников происходит при Л 7"—► О.
Несмотря на неизбежное понижение теоретического к.п .д .
в цикле Ренкина, действительное использование теплоты в т а
кой установке будет лучшим, чем в установке, работающей по
циклу Карно, не говоря уж е о ес большей компактности и
меньшей стоимости. Повышение средней температуры подвода
теплоты в цикле Ренкина с насыщенным паром можно осуще
ствить лишь за счет повышения температуры в котле. Это по
влечет за собой некоторое увеличение
Вместе с тем это при
ведет к значительным трудностям при эксплуатации установки.
Повышение температуры насыщения в котле связано с од нов ре-
223
ценным увеличением р\. При этом возрастает влажность пара
в конце расширения (точка /, а соответственно и точка 2 на
диаграммах смещаются влево, как это можно видеть, напри
мер, на рис. 13.4), что ведет к усиленному износу лопаток тур
бины из-за ударов капель влаги, содержащейся в паре.
Иной путь повышения т)ь позволяющий без увеличения на
чального давления повысить среднюю температуру подвода
теплоты в цикле, состоит в применении перегретого пара. П ере
греть пар непосредственно в котле, где он находится в контакте
с кипящей жидкостью, невозможно. Это обстоятельство вызы
вает появление в схеме установки (рис. 13.6) еще одного эле
мента — пароперегревателя. На рис. 13.7 даны изображения
такого цикла в диаграммах р — и (а),'Т — 5 (б), I — з (в).
Сухой насыщенный пар состояния 6 (см. диаграммы) после
котла попадает в пароперегреватель V, обогреваемый тем же
источником теплоты, что и котел, т. е. продуктами сгорания
топлива. В пароперегревателе в изобарном процессе 6 — / пар
из сухого насыщенного превращается в перегретый с темпера
турой 7„. Перегретый пар состояния / направляется в турбину
/, где он, адиабатно расширяясь до состояния влажного пара
224
низкого давления (процесс 1 — 2 ), совершает полезную работу.
Дальнейшие процессы цикла полностью совпадают с про
цессами цикла для насыщенного пара: 2—3
—
процесс конден
сации при pa=*const и Г" = * const; 3—4
—
ади абатный процесс
повышения давления в насосе; 4—5
—
изобарный подогрев ж и д
кости до состояния насыщения; 5—6
—
процесс кипения в котле
при р , = const и Г = const. При изображении процессов в диа
граммах сделаны те же упрощения, что и в предыдущем цикле.
Теоретическая полезная работа турбины в координатах р — v
изображается площадью а 12Ь; теоретическая работа, затрачи-
иаемая в насосе, — площадью а43Ь. Теплота q x подводится на
трех участках изобарного процесса и в диаграмме Г — s изоб
ражается площадью c4561g. Она складывается из теплоты, иду
щей на подогрев воды в процессе 4—5 (площадь c45d), на ис
парение воды в процессе 5 —в (d56f) и на перегрев пара в про
цессе 6—1 (f6 1g). Отводимая в конденсаторе теплота q2 изобра
жается площадью c632g.
Разность теплоты qx и |?2| представляет собой работу цикла
и изображается площадью 123456, ограниченной процессом
цикла.
Все рассмотренные величины могут быть выражены разно
стями энтальпий для соответствующих точек (см. рис. 13.7 , б):
/т=|’|
—
—
/4*
. |?а|“ =*2—
Выражение для q1 может быть получено суммированием
теплот, подведенных на трех участках изобарного процесса
(р, =*const): q^qt-i+qs-t+qt-i •* (¿5-/4)+ (¿в—«в)+ (¿1—*в)=■
= 1 1- / 4. В диаграмме i—s значения qu Я2 и /т представлены
в виде отрезков на оси ординат. Разность энтальпий ix— <2, оп
ределяющая удельную работу пара в турбине, называется рас
полагаемым теплопаденнем и обозначается обычно
через Л.
Если пренебречь величиной работы, затрачиваемой в насосе
(допустимость такого упрощения рассматривалось выше), то
тогда /ц» / т, и ранее записанное выражение работы турбины
через разность энтальпий может быть получено из теплового
баланса следующим образом: lr asln= *qx— |ф3|
/4—¿2+
+ fj=i| —/2, так как и««У
Термический к.п .д . цикла Ренкина с перегретым паром вы
ражается формулой
Л«“ 1п1Я\& (*1 — М/Oi *4).
Термический к.п .д . цикла с перегретым паром выше, чем
к.п .д . цикла с насыщенным паром, так как средняя температура
подвода теплоты в первом случае выше. Это происходит из-за
того, что теплота, идущая на перегрев пара на участке 6—1,
подводится при температуре более высокой, чем температура
парообразования в котле.
15 з*«. ю
225
Наглядное сравнение термических к.п .д . циклов с насыщен
ным н перегретым паром может быть проведено с помощью
диаграммы Г — 5 . На рис. 13.7, б совмещены циклы: /—2 —3 —
4— 5 —6—1 с перегревом и 6—ш —3 —4 —5 —6 для насыщенного
пара. Покажем, что т)< первого цикла больше, чем второго.
Введем дополнительно в рассмотрение цикл п—2 —3 — 4—
5— п (сокращенно обозначим его цикл А). В нем перегрев пара
достигается по изотерме б—п с одновременным падением д а в
ления. Цикл А можно рассматривать состоящим из цикла Рен-
кина для насыщенного пара б— т —3 —4 —5 —6 (сокращенно
цикл Р) и цикла Карно п—2 —т —6 —п (сокращенно цикл К).
Совместное действие циклов Р и К эквивалентно действию цикла
А, так как 6—т в цикле Р является расширением, а т—6
в цикле К — сжатием.
Сравнивая термические к.п .д . циклов, можно отметить, что
Л*А>Л *Р.
(а)
так как в цикл А входит цикл Карно, имеющий наибольший
термический к.п .д . в данном интервале температур. Вместе
с тем т)1 цикла Р с перегревом больше, чем л< цикла А, т. е.
11<|-а -з -4 -5 -е -1>11влв
(б)
Это следует из рассмотрения формулы термического* к.п .д .,
написанной в виде
—
\Я^\/Яь
Сравним ^ 1 и Яг в обоих циклах. Значения <73 для них оди
наковы — это площадь под процессом 2 —3. Значение ж е Я\
в цикле с перегревом больше на величину площади /пб (на д и а
грамме заштрихована). Рассматривая совместно неравенства
(а) и(б), видим, что л<1“2“3^ в_^",>Л*р»т* е* л*1“2“*”4*5“*“ ^
—
3—14—5—6^
Кроме того что цикл с перегревом имеет больший термиче
ский к.п .д., весьма существенным является и то обстоятельство,
что влаж ность пара в конце процесса расширения в этом цикле
значительно ниже, чем в цикле с насыщенным паром. Это
видно из сравнения положения точек 2 и т на рис. 13.7 , б.
Современные паросиловые установки обычно работают по
циклу с перегревом пара.
| 13.4. МЕТОДЫ ПОВЫШЕНИЯ
ТЕРМИЧЕСКОГО К.ПД. ПАРОСИЛОВЫХ УСТАНОВОК
Влияние параметров пара на величину лг- Рассмотрение во
проса о влиянии параметров пара удобно проводить, используя
понятие средней планиметрической (или средиеннтегральной)
температуры (Гер оя)- Средняя планиметрическая температура
в любом процессе равна отношению теплоты процесса к изме
нению энтропии в нем. Д ля лучшего представления о Г гр Пл рас
смотрим простейший пример. В произвольном прямом цикле
226
/—а —2 —6 —7 (рис. 13.8) подведенная теплота 9 1 и отведенная
теплота 9 2 могут быть выражены площадями т\а2п и п\1Ь2п.
Если ж е использовать понятие о средней планиметрической тем
пературе, то теплоту
можно выразить площадью прямоуголь
ника, равновеликой т 1а2п и равной произведению Г 'ср .пяХ
Х($п — 5т ). Теплота <73 аналогично может быть выражена как
Т "Ср.пл (зл—зт ) • Д ля рассматриваемого произвольного прямого
цикла термический к.п .д . равен
.Л*"! “ М/91.
Воспользовавшись полученными выражениями для 9 1 и 9 1,
можно записать:
П*“ *
Прм(5п ~~5т)/1^ер.пл(5" 5т) 1 —1
—
Пр-ил/^ерли*
« Таким образом, с помощью средних планиметрических тем
ператур процессов подвода и отвода теплоты может быть вы
ражен термический к.п .д . любого цикла.
Рис. 1 3 В . К определению средней
планиметрической те мпературы про
цесса.
Влияние начального давления пара. На рис. 13.9; а изобра
жены циклы Ренкина для перегретого пара: 7—2 —3 —4—5 —
6—7 (цикл I) и/'—2х
—3
—4
—5r—6 '—í ' (цикл II). Второй цикл
отличается от первого более высоким давлением в котле
(p 'i> P i)- Температура перегретого пара Т\ перед турбиной,
так же как и давление р2 в конденсаторе, в обоих циклах оди
наковы. Выразим термические к.п .д . обоих циклов через средние
планиметрические температуры подвода и отвода теплоты:
^/1** ^
^Ср.ПЛ|/^ср.*Л|»
1
^вр.ВЛ||/^ср.влП *
Температуры 7 * ^ , , и Т”^ плй одинаковы в обоих циклах и
равны температуре конденсации, соответствующей давлению
р2. Средняя планиметрическая температура подвода теплоты
в цикле II выше, чем в цикле I:
> ' ср.„л,*отсюда следует,
ЧТО tlf |1>Т|| i.
Повышение начального давления является одним из эффек
тивных методов увеличения r\t цикла паросиловой установки.
Здесь ж е необходимо обратить внимание на то, что повышение
15*
227
т)г с ростом давления обусловлено связанным с ним увеличением
средней температуры подвода теплоты. Само же начальное д ав
ление является только показателем, но не причиной увеличения
термического к.п .д .
Наиболее существенное увеличение ц* происходит при по
вышении р\ примерно до 9 МПа, затем рост
замедляется. Это
объясняется тем, что при высоких давлениях доля подводимой
теплоты (71, идущая на подогрев воды, возрастает по сравнению
с долей, идущей на парообразование, и средняя температура
подвода теплоты возрастает все медленнее. Представление
о том, как меняется т)< с повышением ри можно получить из
следующего примера. Если р2=0 ,00392 МПа, а *1=500° С, то
при /?1= 0,98 МПа т|«=0 ,34; при Р1=5,88 МПа т|с=0,41; при
р, = 19,6 МПа т||=0,44 .
Повышение начального давления имеет и свои отрицатель
ные стороны. Оно вызывает увеличение влажности пара в конце
расширения (видно из сравнения взаимного расположения то
чек 2 и 2* на диаграмме рис. 13.9 , а), что приводит к ускорен
ному износу лопаток турбины. Кроме того, высокое давление
пара вызывает значительное утяжеление и удорожание уста-
221
iio bkh . Ухудшается и работа турбины из-за частичной конден
сации пара в ней.
Влияние начальной температуры пара. Повышение началь
ной температуры пара от Т\ до Т'\ (рис. 13.9 ,6) приводит
к возрастанию средней планиметрической температуры подвода
теплоты при неизменной температуре его отвода и соответст
венно к увеличению термического к.п.д . цикла. Этим же об
стоятельством объяснялся и переход в цикле Ренкина от на-
сыщеного пара к перегретому.
Следует отметить, что повышение начальной температуры
влияет на к.п .д . цикла тем интенсивнее, чем больше начальное
давление. Так, например, при изменении температуры пара от
350 до 550е С при начальном давлении 1,96 МПа термический
к.п.д. увеличивается от 0,35 до 0,375, т. е . на 7%, а при том
же изменении температуры, но при начальном давлении
К?,7 МПа он увеличивается от 0,4 до 0,45, т. е. на
12,5%. В обоих случаях конечное давление пара при
нималось равным 0,00392 М П а. Помимо увеличения r\t перегрев
пара приводит к уменьшению его конечной влажности, что
видно из рис. 13.9 ,6 . Поэтому при больших начальных давле
ниях перегрев пара является совершенно необходимым.
В настоящее время осваиваются установки с температурой
перегретого пара около 600° С. Дальнейшее повышение темпе
ратуры перегрева определяется современными возможностями
металлургии, так как при высоких температурах снижается спо
собность металла длительно выдерживать весьма значительные
напряжения, существующие, например, в лопатках турбин.
Влияние конечного давления р 2. При понижении давления
в конденсаторе от давления р2 до р' 2 (рис. 13.9 , в) несколько
уменьшается средняя планиметрическая температура подвода
теплоты. Это вызывается тем, что подогрев воды приходится
в этом случае начинать от более низкой температуры, опреде
ляемой на диаграмме положением точки 4'. Однако на измене
ние термического к.п .д . цикла в гораздо большей степени с к а
зывается понижение температуры отвода теплоты от
до Г'з,
вызывающее значительное увеличение г|с. Так, например, по
нижение давления р2 от 0,098 до 0,00392 МПа (при pi— 2,94 МПа
и /j=500°C) приводит к увеличению т]< от 0,24 до 0,38, т. е.
почти на 60% . Установки, работающие с выхлопом отработан
ного пара в атмосферу (паровозы, некоторые мелкие уста
новки), имеют очень низкие значения r\t. Давление р2 в конден
саторе паросиловой установки определяется температурой и ин
тенсивностью циркуляции охлаждающей воды. В современных
крупных установках давление в конденсаторе р2 равняется
0,00392—0,00343 МПа, что соответствует температуре насыще
ния 29—26° С. Дальнейшее понижение р2 при использовании
в качестве рабочего тела водяного пара весьма затруднительно.
Прежде всего оно ограничено трудностями, связанными с оты-
229
сканием низкотемпературного приемника теплоты </2. Кроме
того, существенным обстоятельством является и то, что с по
нижением давления очень быстро возрастает удельный объем
пара. Это ведет к значительному увеличению габаритов уста
новки.
Так же как и в случае анализа влияния начального давле
ния, необходимо подчеркнуть, что действительной причиной ув е
личения является понижение температуры отвода теплоты. Ко
нечное же давление является лишь легко наблюдаемым внеш
ним показателем режима работы установки.
Цикл с промежуточным перегревом пара. Обычно влаж ность
пара на выходе из турбины по причинам, упоминавшимся выше,
не допускается больше 1 0 —
12% . Вместе с тем конечная
влажность столь сильно возрас
тает при увеличении начально
го давления рь что даже на
чальная
температура
пара,
равная 450—550° С, не всегда
обеспечивает получение допус
тимой конечной влажности.
Одним из способов сниже
ния влажности пара в турбине
при одноврем енном повышении
экономичности работы пароси
ловой установки является вто
ричный перегрев. Этот способ
состоит в том, что пар, приблизившийся в результате расши
рения в турбине к со с^ ян и ю насыщения, отводят в специальный
перегреватель, в котором его подвергают вторичному перегреву,
а затем возвращают в турбину, где он продолжает расширяться
до давления ръ которое поддерживается в конденсаторе. Обычно
при правильно выбранном давлении вторичного перегрева пара
термический к.п .д . цикла при применении одного повторного пе
регрева увеличивается на 2 —3 ,5% . С увеличением числа проме
жуточных перегревов тц цикла будет возрастать.
Регенеративный цикл. Д л я выяснения сущности регенера
тивного цикла рассмотрим как более простой цикл Ренкина для
насыщенного пара 1—2 —3 —4 —5 —1 (рис. 13.10). Если в этом
цикле процесс адиабатного расширения пара 1 —2 заменить
политропным процессом 1 — а, график которого эквидистантен
графику процесса 4—5, а всю теплоту, отводимую от пара в про
цессе 1 — а, использовать для подогрева воды в процессе 4—5,
то мы получим регенеративный цикл 1 —а —3 —4—5 —/ . Выше
(в гл. 5) было показано, что регенеративный цикл имеет терми
ческий к.п .д ., равный к.п .д . цикла Карно, действующего в том
же интервале предельных температур. Практическому осуще
ствлению регенеративного цикла /— а —3 — 4—5 —1 препятствует
ней регенерацией.
230
невозможность провести процесс расширения пара 1 — а непре
рывным отводом теплоты д ля нагревания воды. Приблизиться
же к такому процессу можно, осуществляя совокупность процес
сов 1—Ь,Ь—с#с—й,(1—е, е—а* в цикле, изображенном
на рнс. 13.11, а. Схема установки, работающей по такому циклу,
приведена на рис. 13.11,6 .
Насыщенный пар состояния 1 поступает в первую ступень
турбины и аднабатно расширяется в ней (в процессе / — Ь) до
какого-то промежуточного давления р'. Затем влажный пар со
стояния Ь направляется в теплообменник
где в изобарном
Рв с .13 .11 . Тепловая диаграмма (а) и схема (б) паросиловой установки,
работающей по регенеративному циклу.
процессе Ь — с отдает теплоту воде, нагревающейся в процессе
т — п. Влажный пар состояния с аднабатно расширяется во
второй ступени турбины (процесс с — Л) до давления р* и на
правляется во второй теплообменник б , где в изобарном про
цессе 6. — е отдает теплоту воде, подогревая ее от состояния 4
(после насоса) до состояния т . После второго теплообменника
в адиабатном процессе е — р пар расширяется в третьей сту
пени турбины до конечного давления ра. Конечное состояние
пара после этого (точка о/) может быть весьма близким со
стоянию а, в ранее предполагавшемся политропном процессе
/ — а. Влажный пар состояния а направляется в конденсатор
£>. Образовавшийся конденсат состояния 3 поступает в насос
£ , где его давление повышается до р\. Затем конденсат подо
гревается паром в теплообменниках (процессы 4 — м и т — я ),
а на участке п — 5 догревается до состояния насыщения продук
тами сгорания.
В описанном цикле очень существенным является то, что
процессы подогрева воды паром (4 — т и т — п)и продуктами
сгорания топлива (л — 5) происходят при гораздо меньших
231
разностях температур, чем это имело бы место, если бы вода от
состояния 4 сразу подогревалась продуктами сгорания. С умень
шением разностей температур в процессах теплообмена ум ень
шаю тся и потерн из-за необратимости в них, а соответственно
н в цикле в целом. Термический к.п .д . цикла с применением
регенерации может быть увеличен на 1 0 — 1 2 %.
На практике регенеративный подогрев питающей воды о су
ществляется несколько иначе, чем изложено. После каждой сту
пени турбины отбирается некоторое количество пара, который,
конденсируясь в специальных теплообменниках, отдает теплоту
питающей воде. При таком способе отбора теплоты количество
пара, проходящего через ступень турбины, последовательно
уменьшается, а состояние основного потока пара в турбине
остается таким же, как и для цикла без регенерации. Прямое
изображение регенеративного цикла с отбором пара в термоди
намических диаграммах затруднено тем, что эти диаграммы
строятся для постоянного количества рабочего вещества (обыч
но 1 кг), а в цикле с отбором пара количество его меняется от
ступени к ступени.
Термический к .п л . цикла возрастает при увеличении числа
отборов пара.
Применение регенеративного подогрева воды д ае т некоторые
преимущества и в конструктивном выполнении установки.
Уменьшение количества пара, проходящего через последние ст у
пени турбины, уменьшает их проходные сечения и общие габа
риты. Устраняется необходимость применения экономайзеров
для подогрева питающей воды, при этом теплота отходящи х
газов может быть использована на подогрев воздуха, поступаю
щего в топку.
Бинарные циклы. Ран ее было показано, что термический
к.п .д . цикла Ренкина повышается с повышением средней пла
ниметрической температуры подвода теплоты. Эта тем пература
в свою очередь в значительной степени определяется темпера
турой парообразования в котле, так как в этом процессе к ра
бочему телу подводится наибольшая доля теплоты q x. Если
в качестве рабочего тела используется вода, то повышение тем
пературы насыщения в котле ограничено сравнительно низким
значением критической температуры воды (f* p « 374е С) при со
ответствующем весьма высоком давлении (ркр« 2 2 ,1 М П а).
Продукты сгорания топлива имеют температуру 1000° С и
выше, и перепад температур при теплообмене в котле между ними
и водой чрезвычайно велик. Велики и потери из-за необратимо
сти в этом процессе. Если перейти к другому рабочему телу с бо
лее высокой критической температурой, например, к ртути (/нр«
« 14 0 0 еС), то встречается иная трудность. При температуре кон
денсации около 30° С (температура, которая может быть достиг
нута с помощью речной охлаждающей воды) давление насыщен
ных паров ртути
0,294 Па, т. е. приближается к полному
232
вакууму. Создать конденсатор, работающий при таком давле
нии, практически невозможно, уж е из-за того, что при столь
низком давлении удельный объем, ртутного пара достигает гро
мадных значений. Если же поддерживать в конденсаторе давле
ние, принятое в практике для водяного пара ( р * « 0,00392 М П а),
то температура конденсации ртути будет около 2 0 0е С и возник
нет большой перепад темпера
тур между ртутным паром и
охлаждающей
водой (* »
2 0 °С). При этом резко возрас
тет необратимость
процесса
теплообмена с низкотемпера
турным источником.
Таким образом, физические
свойства ртути благоприятны
для использования ее в области
высоких температур цикла, а
воды — низких. Эти особенно
сти привели к созданию комбн-
а
6
нированных ртутно-водяных, или так называемых бинарных
циклов (помимо пары воды — ртуть могут быть использованы
и иные сочетания рабочих тел). Схема установки для осуществ
ления бинарного цикла приведена на рис. 13 .12 , б, а изображе
ние цикла в координатах Т— 5 — на рис. 13.12 , а.
233
Ртутный пар, образующийся в ртутном котле А, поступает
в ртутную турбину В. Давление ртутного пара при этом колеб
лется в пределах 0,49—0,98 МПа, чему соответствует темпера
тура 460— 620° С, очень близкая к предельно допустимой верх
ней температуре (660—600° С) паросиловых установок. После
расширения в турбине ртутный пар направляется в так называ
емый конденсатор-испаритель F, где конденсируется, а отдавае
мая им при этом теплота идет на образование водяного пара
с давлением 1,6 —3,0 МПа. Жидкая ртуть насосом D снова
направляется в котел, а водяной пар поступает в пароперегрева
тель £ и из него — в паровую турбину М. Отработанный водя
ной пар конденсируется в конденсаторе Ы, а затем о бразовав
шаяся вода насосом С снова подается в теплообменник F , яв
ляющийся испарителем для воды. М еж ду ртутью, конденсирую
щейся в процесе II—III , и водой, кипящей в процессе 5—6, су
ществует небольшая разность температур (А/ж 10 °С), и необ
ратимость этого процесса сравнительно невелика.
Для осуществления цикла в водяном н ртутном контурах
должны циркулировать различные количества вещества. Это
объясняется тем, что теплота конденсации ртути много меньше,
чем теплота парообразования воды. На 1 кг воды через конден
сатор-испаритель должно проходить т кг ртути. В этом случае
т называется кратностью циркуляции ртути и может быть най
дено из уравнения
/я—( и — ц)/(*п— *ш).
Обычно значение т колеблется в пределах 10— 12 .
Термический к.п .д . бинарных циклов достигает 0,90—0,95 от
величины т]< цикла Карно, осуществляемого в том же интервале
температур, и является наибольшим по сравнению со всеми дру
гими циклами. Так, например, для температурного интервала,
указанного на рис. 1 3 .1 2 , ч\г бинарного цикла (с регенерацией
теплоты) достигает 57% . Увеличение термического к.п .д . бинар
ного цикла происходит вследствие сокращения потерь от необ
ратимости в процессе подвода теплоты при повышении средней
планиметрической температуры этого процесса. Кроме того,
в увеличении термического к.п .д . бинарного цикла немаловаж
ную роль играет и то, что ртутный цикл приближается к циклу
Карно. Действительно, процесс подогрева ртути IV — V имеет
большую крутизну и приближается к адиабате. Это объясня
ется очень малым значением теплоемкости жидкой ртути ( с ' —
= 0 ,138 кДж/(кг-К)), что ведет и к малому изменению энтро
пии в процессе, так как
Л«1т-т- Я* с'йТ!Т .
Т1У
Распространению установок, работающих по бинарному цик
лу, препятствуют сравнительно сложное конструктивное вы пол-
234
пение установки, дороговизна ртути и сильная ядовитость ртут
ных паров. Более перспективным является использование в би
нарных циклах сочетания вода — хладон.
§ 13.5 . ТЕПЛОФИКАЦИОННЫЕ УСТАНОВКИ
Значения термического к.п .д . даж е в самых совершенных
установках, работающих по циклу Ренкина, не превышают 50% .
Это означает, что большая часть теплоты, подведенной к рабо
чему телу, безвозвратно теряется, переходя к низкотемператур
ному источнику. Использование отводимой в конденсаторе теп
лоты
в отопительных или производственных целях невоз
можно при существующих режимах работы конденсационных
установок. Так, при давлении в конденсаторе р2= 0,00392 МПа
температура пара равна лишь 28,6° С. Если же повысить конеч
ное давление пара р2, то повысится и температура отработан
ного пара. Тогда теплота 9 * обычно теряемая в конденсацион
ных установках, может быть использована для различных целей:
на нагревание отопительных приборов, для осуществления тех
нологических процессов, идущих с потреблением теплоты, и т .д .
Комбинированная выработка на тепловых электростанциях
электрической энергии и теплоты для технологических и быто
вых нужд называется теплофикацией, а установки, служащие
для этих целей, теплоэлектроцентралями. При осуществлении
теплофикационного цикла давление пара после турбины состав
ляет 0 ,12 —0 ,15 МПа, если теплота используется для отопления,
или 0,2— 0,4 М П а при обеспечении теплотой технологических
процессов. Повышение давления
отработанного пара приво
дит к уменьшению получаемой в цикле механической работы,
а соответственно и к уменьшению термического к.п .д . цикла.
Однако судить об экономичности теплофикационной ус та
новки лишь по значению х\1 нельзя, так как в этом случае ис
пользуется не только механическая работа, но и отводимая теп
лота 92-
Эффективность работы теплофикационной установки оцени
вается иногда коэффициентом использования теплоты Ат, под
которым понимается отношение суммарного количества теплоты,
превращенной в работу и переданной потребителям, к количе
ству теплоты, выделившейся при полном сгорании топлива:
¿Г“ (*+ 02)/91-
Если не учитывать потерн теплоты в котле, двигателе, теп
лообменных аппаратах потребителей и т. д ., то Ат окажется
равным единице. В реальных установках этот коэффициент со
ставляет 65—7 0% . Другой характеристикой теплофикационной
установки является удельная выработка электроэнергии на базе
потребляемой теплоты. Она определяется отношением 1/д2- Чем
235
больше это отношение, тем выше экономичность теплофикаци
онной установки. На рис. 13 .13 в диаграмме Т—5 изображен
цикл Ренкина, осуществляемый в теплофикационной установке
с использованием теплоты <7а (площадь т32п) в целях отопле
ния. На этой же диаграмме нанесена изобара р '2 для цикла
Рис. 1 3 . 1 3 . Теплофикационный цикл
в тепловой диаграмме.
обычной конденсационной установки. Заштрихованная площадь
соответствует потере механической работы в теплофикационной
установке.
Помимо улучшения использования теплоты, сообщенной пару,
в цикле теплофикационной установки происходит и улучшение
эксплуатационных условий работы турбины, выраж ающееся
в том, что с повышением давления р% уменьшается влажность
отработанного пара (на рис. 13 .13 х2> х /2).
Глава 14
ОСНОВЫ ТЕРМОДИНАМИКИ
ВЛАЖНОГО ВОЗДУХА
| 14.1 . ОСНОВНЫЕ ПОНЯТИЯ.
ПАРАМЕТРЫ. УРАВНЕНИЕ СОСТОЯНИЯ
В холодильной технике, при кондиционировании воздуха,
процессах сушки и других приходится иметь дело с различными
состояниями окружающего нас воздуха. Воздух представляет
собой смесь сухого воздуха и водяного пара и называется влаж
ным воздухом. Хотя сухой воздух в свою очередь является
смесью газов, мы будем рассматривать его как единое целое,
так как состав его в рассматриваемых в настоящей главе про
цессах не изменяется.
Для практики представляет интерес воздух при атмосферном
давлении в интервале температур от — 50 до 100° С. В этих ус
ловиях сухой воздух, или первый компонент влажного воздуха,
236
может находиться в смеси только в газообразном состоянии.
Второй компонент может быть как в газообразном, так и в жид
ком или твердом состояниях.
Как известно из гл. 9, давление насыщения зависит от тем
пературы. Если давление водяного пара, находящегося в воз
духе, меньше давления насыщения при данной температуре, то
водяной пар является перегретым. Влажный воздух, содержа
щий перегретый водяной пар, называется ненасыщенным.
Если давление водяного пара в воздухе равно давлению на
сыщения при данной температуре, то водяной пар находится
и воздухе в состоянии насыщения. Влажный воздух, содержа
щий сухой насыщенный пар, называется насыщенным.
При охлаждении воздуха ниже температуры насыщения, со
ответствующей парциальному давлению содержащегося в нем
водяного пара, последний частично конденсируется, переходя
в жидкую (капельки воды) или твердую (кристаллики льда)
фазу. В этих случаях влажный воздух можно рассматривать как
смесь насыщенного воздуха и »оды (или льда), либо как смесь
сухого воздуха и влажного водяного пйра. При даль
нейшем изложении мы будем исходить из первой*представления
и относить понятие пар к газообразном у состоянию водяного
пара в воздухе, т. е. к перегрето^
Смесь насыщенного воздуха
дяным туманом, насыщенно
(снег) —ледяным тумано!
духе могут одновременно существовать и жидкая и твер
(мокрый снег)— смешанный туман.
Количество одного из компонентов смеси — сухого йоздуха
в рассматриваемых далее процессах\ютается постоянным\коли-
чество других — обычно меняется. Поэтому удобно в качестве
единицы, к которой относятся все остальные величины, выбрать
1 кг массы сухого воздуха.
Влагосодержание. Влагосодержанием называется м ассфое
количество влаги, приходящееся на 1 кг сухого воздуха.
Обозначим массу влаги, находящейся во влажном воздухе
Мшл (кг), массу сухого воздуха М9 (кг), тогда влагосодержание
й будет равно
й~М шл/М9.
(14.1)
Единица измерения <1 — кг/кг нлй г/кг. В общем случае
Мъд^Мц'Ь
Мд,
(14.2)
где Ма, Мт и Мд — масса водяного пара, воды и льда во влаж
ном воздухе.
Для количеств водяного пара, воды и льда, приходящихся
на 1 кг сухого воздуха, справедливы выражения:
/
I
dп-Ma/MШl йт-М ^М * йя-Мд1Мш.
Очевидно, что d=*du+dm+dл.
/>
[У и сухому насыщенному пару,
капелек воды называется во*
Го воздуха и кристаллов льда
При температуре \|Р С в воз-
ааяфазы
Если влажный воздух содержит влагу только в виде пара
(Мж^О , Мл= 0 , МВЛ= М П), то влагосодержание представляет
собой массовое количество водяного пара, приходящееся на 1 кг
сухого воздуха, или, иначе говоря, отношение масс водяного
пара и сухого воздуха:
ё=ё п-Мц/А!..
(14.3)
Величину йп точнее было бы называть паросодсржанием
влажного воздуха, однако в технике ее обычно тоже называют
влагосодержаннем. Величины ё и ё п можно также рассматри
вать как массовые количества влаги и водяного пара, приходя
щиеся соответственно на ( 1+ 4 ) и (1+</п) кг влажного воздуха.
Очевидно, что максимально возможное давление водяного
пара в воздухе соответствует давлению насыщения при темпе
ратуре воздуха. Д ля указанного выше интервала температур
это давление всегда меньше атмосферного, а в процессах холо
дильной техники и кондиционирования воздуха — менее 3 ,3 кПа
(25 мм рт. ст.) . Вследствие этого свойства водяного пара во
влажном воздухе и идеальных газов близки. Таким образом, не
насыщенный и насыщенный влажный воздух можно рассматри
вать как смесь, подчиняющуюся законам идеальных газов.
На основании закона Дальтона давление влажного воздуха
р равно сумме парциальных давлений сухого воздуха рл и водя
ного пара рп:
Р=Р»+Рп.
(14.4)
Величина влагосодержания ё а зависит от парциального д ав
ления пара в воздухе. Найдем эту зависимость. Д ля этого на
пишем уравнение состояния для пара
РнК=М вЛпГ
(14.5)
и для сухого воздуха
р.У =ЛЦ?в7\
(14.6)
Здесь V — объем рассматриваемого количества воздуха (в м3);
7 — температура воздуха (в К); р0 и рв — соответственно пар
циальные давления пара и сухого воздуха в смеси; /?п и /?в —
газовые постоянные пара и сухого воздуха.
Величины р, р» и рп измеряются в паскалях (Па), /?п и
—
в килоджоулях на килограмм-кельвин (кД ж/(кг/К));
Поделив уравнение (14 .5) на (14.6) и выразив газовые по
стоянные Ап и А» через универсальную газовую постоянную
рЛ, найдем отношение
Мп_РпЯ\
•
_
Ип
Л,
18.02
Учитывая соотношения (14 .3) и (14 .4), получим
du=0fi22pwl(p-pn).j
(14.7)
Для сухого воздуха*рп* 0 и dn= 0 ; для чистого пара рп—Р
II с/п—оо.
Если парциальное давление пара равно давлению насыще-
пня при данной температуре, то соответствующее количество во
дяного пара в воздухе определится как
x d; = 0fi22pl/(p-p:).y
(14.8)
Это максимальное количество пара, которое может содер
жаться в воздухе при данной температуре. В случае, когда дав
ление пара в воздухе равно /Ль а влагосодержанне d " п, говорят,
что воздух насыщен водяным паром. Величины р "п и d '"п увели
чиваются с повышением температуры воздуха.
В атмосфере встречаются случаи, когда da> d " & это — со
стояние перенасыщенного влажного воздуха, наблюдаемое
обычно перед грозой.
Точка росы. Если ненасыщенный влажный воздух, характери
зующийся влагосодержанием da и парциальным давлением во
дяного пара рш подвергнуть охлаждению при d —const, то при
некоторой температуре /р он станет насыщенным. Дальнейшее
понижение температуры приведет к конденсации водяного пара
и его выпадению из воздуха в виде воды или льда.
Состояние, при котором парциальное давление пара, содер
жащегося в воздухе, равно давлению насыщения, называется
точкой росы, а соответствующая ему температура tp— темпера
турой точки росы. Очевидно, что в точке росы заданное влаго-
содержание воздуха соответствует влагосодержанню насыщен
ного воздуха.
При температурах влажного воздуха более низких, чем tp,
в нем кроме водяного пара могут находиться капельки воды или
кристаллики льда, либо то и другое (при /=»0°С). В этом слу
чае влагосодержанне воздуха равно d = d " + d m+ d x.
Степень насыщения. Отношение влагосодержания воздуха
в данном состоянии к влагосодержанню насыщенного воздуха
при той же температуре называется степенью насыщения. С те
пень насыщения равна
Ф-
dn
Ра
Ра
а
Р—Ра
(14.9)
I
Степень насыщения изменяется в пределах 0 < ф < 1 . При
</пв 0, рп=0 (сухой воздух) —ф=»0. При dn—d?'at Рп*=р"п (на
сыщенный воздух) — ф *1 .
Объемная (абсолютная) влажность. Количество водяного
пара, содержащееся в 1 ма влажного воздуха, называется объ
емной, или абсолютной, влажностью. Она обозначается через е
239
и измеряется в кг/м8 или г/м8. Иначе говоря, она представляет
собой плотность водяного пара в воздухе: е = р п = Р п/(Л пГ)* Оче-
видно, что е = М п/У, где У — объем влажного воздуха массой М.
Часто под абсолютной влажностью понимают величину пар
циального давления водяного пара в воздухе рш выраж ая пос
леднюю в миллиметрах ртутного столба. Численно рп в мм рт.
ст н е в г/м8 примерно одинаковы, а при / = 16.5еС точно равны.
Относительная влажность. Отношение абсолютной влаж но
сти воздуха в данном состоянии к абсолютной влажности насы
щенного воздуха (е") при той же температуре называется от
носительной влажностью:
Ф-е/е".
(14.10)
Напишем уравнение состояния для 1 м8 влажного воздуха
в данном состоянии и в состоянии насыщения:
Рп-<?/?п7\
(14.11)
Рта-е^пТ.
(14.12)
Разделив (14.11) на (14 .12 ), получим
Ф"-Рп1Р1 или ?-р я/р;.
(14.13)
Для сухого воздуха рп—0 и, следовательно ф = 0 , для воз
духа, насыщенного водяным паром, ра=Р "п и ф«1. Таким об
разом, относительная влажность может изменяться в пределах
0<Ф<1.
Сравнив выражение (14.9) и (14 .13), получим
♦- 9(Р~Р'МР-Рп) = ?(0,622+ ¿)//0,622+ <Г). (14.14)
Так как при низких температурах (/ < 15 ° С) величины ра и
р"в малы по сравнению с р и, кроме того, мало отличаются
между собой, то в этом случае ф «ф .
^ Удельный объем и плотность влаж ного воздуха. Удельный
объем влажного воздуха
—
TM-твг?яг-
(14Л5)
Здесь V — объем; М — масса влажного воздуха; М, и Мп-
массы соответственно сухого воздуха и пара, входящих во влаж
ный воздух.
По закону Дальтона
У-У.+ Уп,
(14.16)
где V» и Уп — парциальные объемы сухого воздуха и водяного
пара соответственно. Определив их значения с помощью у р ав
нения Клапейрона — Менделеева Ув—М »/?.7/р, Уп* М пЛп//Р и
подставив найденные выражения в уравнение (14 .16 ), а послед
нее в (14.15), получим
_
М9ЛлТ1р+Л1„Р„Г/р
------- ЯГТЖа------- •
240
Преобразовываем полученное соотношение, вынося в числи
теле #вГ/р за скобки н деля числитель и знаменатель на Мв:
Учитывая, что Мп/Мш—с1п и /?ц//?ш— 1*61, получаем
^ (*»Г/р)(1+1*1*Л
*
Плотность влажного воздуха равна
1
р
И-<*п
рвв V Яш7* 1+ 1,61*0•
Плотность сухого воздуха
р. - р/(Я.7’).
Сравнивая (14.18) и (14.19), получаем
.
.
1+4.
Р Рв1+1,б1*в"
(14.17)
(14.18)
(14.19)
(14.20)
Таким образом, р <д * , т. е. влажный ненасыщенный и насы
щенный воздух всегда легче сухого. Это объясняется меньшей
плотностью водяного пара по сравнению с сухим воздухом при
равной температуре и обычных значениях парциальных давле
ний компонентов рп и р в.
Массовая концентрация. Состав влажного воздуха можно
такж е характеризовать массовыми концентрациями (массовыми
долями) компонентов. М ассовая концентрация водяного пара
в ненасыщенном н насыщенном влажном воздухе (#а) представ
ляет собой отношение массы пара к массе влажного воздуха
^п=Мп/М“ Мп/(Мш+М п).
(14 .21)
Массовая концентрация сухого воздуха #■ равна отношению:
g^=Лlв/M-M в/(Mв+M a)t
(14.22)
причемсумма£п+£а=1.
Найдем соотношение м еж ду массовыми концентрациями и
влагосодержанием. Д ля этого разделим числитель н знамена
тель выражения (14.21) и (14.22) на Мв
м,1М,
«■
Мш1Мь+Мв1Мш
Л,
И-* .’
(14.23)
Мщ1Мл
М»1Мш+ М а1М ,
1
Т+2Г
(14.24)
Уравнения (14.23) и (14.24) позволяют по заданному влаго-
содержанию вычислить массовые концентрации водяного пара
и сухого воздуха во влажном.
15 За*. 80
241
Для определения с1п по заданным концентрациям решаем
уравнения (14.23) и (14.24) относительно с10 и получаем
<14И>
Другие параметры влажного воздуха также можно выразить
через массовые доли. Так, например, подставляя в уравнение
(14.20) вместо
соотношение (14 .2 5), получим
р= р,1+о.б1£„ =
р,1.б1- 0.б1г ,
(14.26)
Можно для характеристики состава влажного воздуха ис
пользовать в объемные концентрации (объемные доли) гл*=
- Уш/У, Гп^Уп/У.
Уравнение состояния влажного воздуха. Запишем уравнение
состояния для 1 кг влажного воздуха ри = ЯТ или р/р = Л7\
Здесь /? — газовая постоянная влажного воздуха, которая мо
жет быть найдена через универсальную газовую постоянную
и кажущуюся молекулярную массу смеси сухого воздуха и
пара: /? = 83 14/р; р=»ГвРв+ГпРп. Учитывая, что объемные доли
сухого воздуха и водяного пара могут быть выражены через
отношение давлений, получим
^=^-N+-^
-
^=-^
-
28,96+
+
18,02 = 28,96 - 10,94 р„/р.
Газовая постоянная влажного воздуха
Уравнение состояния
я=
8314
(14.27)
28,96 - 10.94рп!р ‘
рт/ =
8314 Т
(14.28)
28.93 - 10.94 р„/р ‘
$ 14.2 . ЭНТАЛЬПИЯ ВЛАЖНОГО ВОЗДУХА
На основании свойства аддитивности энтальпия влаж ного
воздуха, отнесенная к 1 кг сухого или (1+ < 0 кг влажного воз
духа, может быть представлена как сумма энтальпий сухого
воздуха in и водяного пара W n:
i-í .+Wn.
(14.29)
Здесь i» отнесена к 1 кг сухого воздуха, a in — к 1 кг водяного
пара. Произведение W n представляет собой энтальпию содер
ж ащегося в смеси водяного пара, отнесенную к 1 кг сухого
воздуха.
За начало отсчета энтальпий сухого воздуха принимают со-
242
стояние при / —0 °С . Тогда энтальпия сухого воздуха при дан
ной температуре
«.-С р,,*«*.
(14.30)
Здесь сР|Ш« 1 ,0 к Д ж/(кг -К )— среднее значение теплоемкости
сухого воздуха при постоянном давлении в интервале темпера
тур, применяющихся в холодильной технике и технике конди
ционирования воздуха.
Отсчет энтальпий водяного пара осуществляют от состоя
ния насыщенной жидкости при /0=ОвС, ее давление в этом слу
чае равно ро^бЮ.в Па (точка 0 на рис. 14.1).
Энтальпия водяного пара при давлении ро и температуре /
(точка / на рис. 14 .1) будет равна
^п. ро^о+ср.п^.
(14.31)
Состояние водяного пара при его парциальном давлении во
влажном воздухе рп1 и той же температуре t характеризуется
точкой 2 на рис. 14.1 . Для идеального газа линии i«const и
/» c o n s t совпадают (обе параллельны оси s) и, следовательно,
i2*=i\. В области, близкой к насыщению, линия постоянной эн
тальпии ii несколько отклоняется от изотермы (кривая 1 —2 ') .
Однако при малых рп и в этом случае с достаточной для техни
ческих расчетов точностью можно считать ia«fi*
При этом мы допускаем ошибку, которая на диаграмме изоб
ражается площадью под процессом 2—2 так как искомая эн
тальпия i% (точка 2) будет меньше энтальпии ia—ii именно на
эту величину (^t-a* ■ »ia* — *а)-
Таким образом, энтальпия пара in при давлении рп и темпе
ратуре пара t равна in,p .. т. е.
/п^го+Ср, nf#
(14.32)
где г0» 2500 кДж/кг.
243
Значение теплоемкости водяного пара в рассматриваемом
интервале температур может быть принято постоянным н р ав
ным сР(па 1.89 кД ж/(кГ’ К).
С учетом этого
/„«2500 +1,89/.
(14.33)
Подставив в (14.29) значение 1Л из (14.30) и ia нз (14.32),
получим
(го+ср, иО^п#
(14 .34)
характеризующее энтальпию влажного воздуха, содержащего
сухой воздух и водяной пар.
С учетом численных значений, входящих в уравнение (14 .34)
величин, взятых нз соотношений (14.30) и (14 .33):
*«/+(2500+1,890*.
(14 .35)
Выражения (14.34) и (14.35) можно представить несколько
иначе:
t-= (<v,.+c„.nda)t + r</iB= c'pt+ rji„
(14.36)
i—(1 + 1 ,894a)/+ 2500dn.
(14.37)
Вели чина
Cp,»+Cp.ndBTM > 1 + 1 ,8 М я называется теплоем*
костью влажного воздуха. Так же как н другие величины, ха
рактеризующие влажный воздух, с / отнесена к 1 кг сухого воз
духа, или ( 1+d) влажного.
Выражения
(14.34) — (14.37) характеризуют энтальпию
ненасыщенного и насыщенного влажного воздуха (при g>— 1).
Во втором случае вместо dn надо подставлять dñ\
Если во влажном воздухе, помимо водяного пара, содер
жится вода н лед (смешанный туман), то его энтальпия
определяется выражением
I=
+w:+W*+iА.
(14 .38)
Здесь /я « с ж/ — энтальпия воды; /д « — Гпл+Сд* — энтальпия
льда (в кДж на 1 кг воды и льда сответственно); lmdm и Uda —
энтальпии воды и льда во влажном воздухе, отнесенные-к 1 кг
сухого воздуха.
При </д«0 (водяной туман)
í-<b+w;+íA.
причем dm=d —d ” .
При </ж» 0 (ледяной туман)
гдеdn=d —dn.
Теплоемкость жидкости сж- 4 , 1 9
кД ж/(кг-К); теплоем
кость льда сд= 2,095«2,1 кДж/(кг-К); теплота плавления
льда гпд« — 335 кДж/кг.
244
В соответствии со сказанным выражение (14.38) можно за
писать в виде
I-Ср^+(г0+с,,„О*;+сЛж+( +
<у)
(14.39)
или, подставляя численные значения,
I- *+ (2500+ 1.890^ + 4,19*</ж+ (-335 + 2,И)аЛ9 (14.40)
либо /-(1+1,89с/;)/+ 250(И; Ь4,19^ж+
+ (2,И —335)ёя.
(14 .4 1)
Аналогичным образом можно преобразовать уравнения для сл у
чаев ¿*«=0 или ¿д= 0.
Из выражений (14.39) — (14.41) как частные случаи при
¿ж —О и ад —О, получают уравнения (14.34) — (14.37), в кото
рых ёаК4п •
Рассмотрим теперь, как можно выразить энтальпию вл аж
ного воздуха через массовые концентрации. Д л я этого предста
вим энтальпию смеси (/, кД ж/кг), отнесенную к 1 кг влажного
воздуха, как сумму энтальпий компонентов. Например, для не
насыщенного и насыщенного воздуха уравнение энтальпии смеси
запишется в виде
/-/•£»+1п£«1.
(14.42)
Это же соотношение можно получить, подставив в (14.29) вме
сто
выражение (14.25):
Учитывая, что 1 — £ „« =£», а произведение
и есть энтальпия
смеси, отнесенная к единице ее массы, получаем:
/-/£ • = *»£»+¿«#11.
Для определения / в численном выражении в (14.42) надо
подставить *• из (14.30) н *0 из (14.33).
| 14Л. ТАБЛИЦЫ ПАРАМЕТРОВ
ВЛАЖНОГО ВОЗДУХА. ДИАГРАММА 1 - 4
С помощью приведенных выше формул можно рассчитать па
раметры влажного воздуха при любой температуре и степени
насыщения (или относительной влаж ности). Д ля удобства р а
счетов составляют таблицы, в которых приводятся значения
парциального давления, энтальпии и влагосодержания насыщен
ного воздуха. При вычислении параметров должно быть изве
стно давление влажного воздуха. Таблицы составляются для
интересующего практику случая применения атмосферного воз
духа, в соответствии с этим имеются таблицы для р —760; 745;
735,6 ммрт. ст. идля р—750 мм рт. ст.—100 кПа.
245
В технических расчетах удобно пользоваться диаграммой
¿ — А в которой можно изобразить различные состояния и про
цессы влажного воздуха. В такой диаграмме осью ординат
служит энтальпия /, а осью абсцисс влагосодержание ё (рис.
14.2). Диаграмма строится для определенного постоянного дав
ления.
Рис. 14.2. Диграмма i—d ь
прямоугольных координатах.
Как следует из уравнения (14 .34), изотермы в области
dv&d й" будут изображаться прямыми линиями, угол наклона
которых определится, если продифференцировать это уравнение
по du при постоянной температуре:
(di/ddu) t- сР,nt+ Го= 1 ,89/+2500.
(14.43)
Этот угол растет с повышением /.
При¿=0 и/=0 /—0. При £/0=0 и />0 /=/,=*/. Отсюда
для каждой температуры находят состояния сухого воздуха.
Они изображаются точками, лежащими на оси энтальпий (см.
рис. 14.2).
На проведенных через эти точки изотермах отмечают состоя
ния насыщенного воздуха, для чего вычисляют значения dn" ,
либо Г . Соединив точки, соответствующие состояниям насыщен
ного воздуха при различных температурах, получают линию
246
ф = ф * 1 . Слева от нее будет лежать область ненасыщенного
поздуха, имеющая наибольший практический интерес. Однако
при таком способе построения диаграммы эта область нзобра-
ж ается узкой полосой, что для расчетов неудобно.
Для того чтобы исправить это положение, диаграмму <— d
строят в косоугольной системе координат. Л . К . Рамзин выбрал
угол между осями i и d, равный 135°.
Р. Молье предложил принимать такой угол, чтобы нулевая
изотерма являлась горизонтальной линией. Д ля дальнейших
рассуждений так же, как и для использования диаграммы, ве
личина угла не имеет принципиального значения.
Рассмотрим косоугольную систему координат i — d , в кото
рой изотерма с / * 0 ° С в области ненасыщенного воздуха гори
зонтальна (рис. 14 .3).
Построим область ненасыщенного воздуха. Линия ф = ф = 0
совпадает с осью L Если расстояние между d-О и d =d n" для
каждой t разделить на равное число отрезков, пропорциональ
ных d
а затем соединить на каждой изотерме соответствующие
точки, то получим линии постоянных ф. Учитывая соотношение
(14 .14), можно построить линии <p«const. Для температур ниже
15 ° С линии постоянных ф и <р практически совпадают. Если
диаграмму i — d строят для атмосферного давления, линия на
сыщения с ростом температуры будет асимптотически прибли
жаться к изотерме 100е С. Это вытекает из того, что при атмо
сферном давлении температуре насыщения 100е С соответствует
/>п"=РИ</„"«оо.
Линии постоянных энтальпий изображ аю тся наклонными
прямыми, параллельными оси d, линии постоянных d — верти
кальными прямыми.
Справа от линии <р=1 находится область, называемая тума
ном, в которой влажный воздух, кроме сухого воздуха и пара,
содержит при ¿>0°С воду, при /<0еС лед, при /=0еС либо
воду, либо лед, или то и другое.
Рассмотрим расположение изотерм в области водяного т у
мана (см. рис. 14 .3). Дифференцируя уравнение (14 .39), получим
приd*—0,т.е.при/>0еС,
(«/М)|-*«-Сш*-4 .19/,
(14.44)
так как в этом случае </„«==d n* —const.
Из сравнения уравнений (14.43) и (14.44) следует, что
в области водяного тумана угол наклона изотерм по отношению
к оси d значительно меньше, чем в области ненасыщенного воз
духа. При переходе через линию насыщения угол наклона изо
термы изменяется.
Угол наклона изотерм в области водяного тумана, особенно
при невысоких температурах, незначительно отличается от угла
наклона линий ¿—const, равного нулю. Таким образом, в этой
области изотермы почти параллельны изоэнтальпам. Это поло-
247
женне используется при практическом применении диаграммы
I—±
Вобласти ледяного тумана (/<0°С) ^п=^в"=сопз1; ^*—0.
Дифференцируя уравнение (14 .39), получим
(д//д</),-/л- —Гвл+Сд*- —335+2,09/.
(14.46)
В области ледяного тумана (рис. 14.4) в соответствии с урав
нением (14.45) изотермы имеют большую крутизну, чем в об-
Рис. 14.4 . Области различных состояний в л аж
ного воздуха в
¿-диаграмме.
ласти водяного тумана, линия насыщения при ¿ » 0 претерпевает
изгиб.
При температуре 0 °С имеется область смешанного тумана,
ограниченная изотермами жидкости и льда. Первая имеет угол
наклона
(д//М),-0
(14.46)
и, следовательно, расположена параллельно оси й. Угол наклона
второй опр еделяется соотношением
(д//<М),«-Гпл.
(14 .47)
Между ними находится воздух при / —0е С, содержащий
кроме водяного пара воду и лед.
248
Для анализа процессов в i — d -диаграмме весьма полезным
является применение понятия о тепловлажностном отношении
которое характеризует угол наклона в i — ¿ -диа
грамме линий изменения состояния воздуха (обычно прямых).
Па рис. 14.5 схематически показано изменение значений и знака
р при разных направлениях изменения состояния воздуха в i —
¿•диаграмме. Обычно по краям сетки i — ¿ -диаграммы нанесены
линии различных уклонов е.
Диаграммы i — ¿ выполняются обычно для определенного
давления воздуха. При изменении давления основной скелет
диаграммы (линии i —const, ¿ = const, /«con st) сохраняется, так
как зависимость i = f{d , /), согласно уравнению (14.37) не зави
сит от давления. Однако при этом изменяются значения влаго-
содержання насыщенного воздуха (уравнение (14 .7)), а следо
вательно, и относительной влажности в каждой рассматривае
мой точке. Поэтому для давлений, повышенных или понижен
ных в сравнении с атмосферным, часто строятся отдельные
диаграммы.
С некоторым приближением в этом случае можно использо
вать и обычные диаграммы. Из уравнений (14.7) и (14 .13)
'
-р-Р"
--
«ЦР-Р .) -;
<*-
Р,
0.622/»,
0.622/»' ^
Здесь пренебрегается значением рп по сравнению с р, что состав
ляет неточность примерно в 1— 2 % . Поскольку в заданной точке
величины ¿ п и рп не зависят от давления, можно написать
ф/ре* const.
Таким образом, диаграмму / — ¿ , составленную для давления
100 кПа (750 мм рт. ст.), можно применять, например, для дав
ления 200 кПа, рассматривая в качестве линии ф = 1 прежнюю
линию <р=>0,5 и соответственно уменьшив вдвое все значения
относительных влажностей в той же диаграмме. При давлении
меньше атмосферного рекомендуется построить новую линию на
сыщения с помощью уравнения (14 .8), принимая значения рп"
по таблицам насыщенного водяного пара, а затем определять
относительно этой линии значения относительной влажности ф
по уравнениям (14.9) и (14.14).
| 14.4 . НЕКОТОРЫЕ ПРОЦЕССЫ
ИЗМЕНЕНИЯ СОСТОЯНИЯ ВЛАЖНОГО ВОЗДУХА
Охлаждение и нагревание влажного воздуха. Рассмотрим
процесс охлаждения определенного количества влажного воз
духа при постоянном давлении и постоянном общем влагосодер-
жании воздуха. В диаграмме / — ¿ этот процесс изобразится
вертикальной линией (рис. 14 .6).
249
Начальное состояние воздуха (точка /) характеризуется тем
пературой /1 и относительной влажностью фь При охлаждении
воздух достигнет состояния насыщения, т. е. точки росы
(точка 2). Охлаждение воздуха из состояния 2 приведет к вы
падению жидкости, или, иначе говоря, к конденсации части
водяного пара. Точка 3 характеризует смесь насыщенного воз
духа состояния 5 " и воды, состояние которой лежит на изотерме
tг при ¿ = о о . Отделив влагу, можно из состояния 3 получить
насыщенный воздух состояния 3".
Рис. 14 .5 . Процессы с различным
тепловлажноствым отношением.
Если теперь воздух состояния 3 " нагреть до температуры
*1 при постоянном ¿з , то получим состояние 4, в котором отно
сительная влажность воздуха меньше, чем ф]. Таким образом,
последовательным охлаждением до температуры ниже
а за
тем нагреванием насыщенного воздуха (точка 3") его можно
осушить (точка 4).
Так как все рассматриваемые процессы совершаются при
р = с о п з 1, то количество теплоты, отведенной при охлаждении:
(14.48)
количество теплоты, подведенной при нагревании:
С}г-а= Мш(14-1г),
(14.49)
количество сконденсировавшегося пара:
Мж=ЛМ<*1-<*э,/).
250
(14.501
Смешение двух потоков влажного воздуха. Представим себе,
что в камеру смешения поступают два потока воздуха, в кото
рых расход сухого воздуха соответственно равен: Л4ц и Мш2
(кг/с). Параметры потоков обозначим соответствующими бук
вами с индексами I и 2. Будем считать, что в процессе смеше
ния давление остается постоянным, теплообмен с внешней ср е
дой отсутствует и работа против внешних сил не производится.
Состояние воздуха после смешения обозначим индексом «см».
Условия равенства поступающего н уходящего количества
воздуха и водяного пара запишем в виде
Af.c -Af.i+Aftf,
(14 .5 1)
Ali
(14.52)
Решая совместно уравнения (14 .5 1) и (14 .52), получаем
¿с-
Мшх+ М*
(14.53)
Уравнение теплового баланса для состояний до смешения
и после него запишем следующим образом:
тсм^см*
(14.54)
откуда с учетом (14 .5 1)
-}- МК1а
М%\ + МШ9
(1455)
Формулы (14 .5 1), (14.53) и (14.55) могут быть применены
для расчета параметров состояния смеси.
Процесс смешения весьма просто может быть рассчитан и
с помощью диаграммы * — (I (рис. 14.7).
Подставим в (14.52) и (14.54) выражение. (14 .5 1):
(М»1+Мш2)^см- М В1</1+М1А ,
(М.1+М*)*с«-Мш1*,+Л!.Л
.
Разделив правую и левую части последних соотношений на
М* 1 , обозначив Мщл/Мъх через а и произведя поеобразования,
получим (1+ а)*/См=^1+<М*2 или (¿/с11^ 1)= *(а1—¿см)А, ОТ-
сюда
(^см — Л\)!(йъ — dcы)
Подобным образом
(1 + û)ÎcMe *l+в*2>
(¿СМ — ¿l) *" (¿2 — ¿См)**»
и, следовательно,
(¿см — ¿^/(¿2 — ¿см) и О-
Тогда
(dcu - dül(d2- d eu) - (fc - ii)Hk - ¿см). (14.56)
251
Уравнение (14.56) в координатах 1 — й характеризует пря
мую линию. Значит, процесс смешения в этой диаграмме изоб
ражается прямой, проведенной через точки / и 2, определяющие
состояние воздуха до смешения (см. рис. 14 .7). Состояние
смеси определяется на этой прямой точкой т, которая нахо
дится из условия
No -й сы)/(<1сы- 4) =/2//,= Л1.1/М»2—1/а,
(14.57)
Рис. 14.7 . Процесс смешения д в ух
количеств
влажного воздуха.
т. е. расстояния точки т от состояний / и 2 обратно пропорцио
нальны количеству сухого воздуха в этих состояниях («правило
рычага»).
Подмешивание к воздуху воды или водяного пара. Пусть
к влажному воздуху (состояние /) подмешивается вода или
пар. Очевидно, что в этом случае состояние подмешиваемого
компонента характеризуется к — оо , так что изобразить его
в диаграмме ¿— (1 нельзя. Д ля того чтобы найти состояние
смеси, рассуждаем следующим образом. Примем расход сухого
воздуха Мь, расход добавляемой воды (или водяного пара)
Мж(Мп)- Обозначим энтальпию воды (водяного пара) (ж(*'п)‘
252
Тогда условия материального и теплового балансов до и после
смешения можно записать в виде соотношений
Mш(d0Ы- d l)-M Яt
(14.58)
'
ЛМЬм — ¿О-Мя/вь
(14.59)
Разделив второе на первое, получим
(('си— ^1 ) /
(14.60)
Соответственно если подмешивается пар:
(*м-*|)/(4см —4)-Ь
(14 .6 1)
Конечное состояние после смешения определится парамет
рами ¿си и /Си, найденными из соотношений (14 .58) и (14 .59):
dcм-d l+Mж/Mш
(14.62)
ИЛИ
dcы= d^+ M1JM Ш9
(14.63)
/ем-*1+(Мщ/Л1.)*..
(14.64)
или
*с«-(| +(ЛиМш)^
(14 .65)
Из уравнений (14.60) и (14 .6 1) следует, что прямая смеше
ния воздуха и воды проходит через точку 1 и имеет угол на
клона к оси d, равный ¿ж, а прямая подмешивания пара — ¿п.
Процесс подмешивания (впрыскивания) воды с температу
рой /ж в воздух состояния 1 изображен на рис. 14.8 . Через точку
/ проведена сплошная линия (/—2Ш), имеющая угол наклона
к оси d, равный im= c mtt„. Местоположение точки, характери
зующей смесь воздуха и воды на линии процесса, зависит от
соотношения Мж/М л и определяется значением d cм. которое мо
ж ет быть вычислено по уравнению (14.62). При невысокой тем
пературе воды (/ж) уклон линии процесса впрыскивания прак
тически совпадает с нулевым, и линия /—2Шсовпадает с линией
i, ж const.
Нужно отметить, что при впрыскивании воды воздух интен
сивно охлаждается, в предельном случае до состояния насыще
ния (точка пересечения процесса /—2т и линии <р = 1). При
этом его температура может быть ниже не только начальной
температуры воздуха t\, но и температуры впрыскиваемой воды.
Объясняется это явление тем, что теплота, необходимая для
испарения воды, отнимается у воздуха, и последний охлаж
дается. После того как достигнуто состояние насыщения, испа
рение воды, а следовательно, и охлаждение воздуха прекра
тятся.
В случае подмешивания к воздуху пара через начальное
состояние проводится линия / — 2л (см. рис. 14.8) с уклоном
e - in ; состояние смеси лежит на этой линии и имеет параметры,
•определяемые формулами (14.63) и (14.65).
253
При температуре подмешиваемого пара, равной температуре
воздуха, процесс смешения совпадает с изотермой точки /,
а при *п > * 1 — с линией /—2т имеющей несколько больший ук
лон (см. рис. 14.8).
Адиабатное испарение воды во влажный воздух. При обду
вании водяной поверхности воздухом м еж ду ними происходит
теплообмен и влагообмен. Если тем пература воздуха и а тем
пература воды /ж» то у водяной поверхности они равны м еж ду
Рис. 14.8 . Подмешивание воды (ливня
Рнс. 14.9 . Адиабатное испарение
1 —2ж) и водяного пара (ливня 1 —2а)
воды во влажный воздух,
к влажному воздуху.
собой 1гр=/ж,гр» Парциальное давление водяного пара в воз
духе на границе раздела с водой равно давлению насыщения
при температуре /гр. Из-за разности температур * и
проис
ходит теплообмен, из-за разности парциальных давлений водя
ного пара в воздухе вдали от поверхности рв и у поверхности
воды р п.гр происходит испарение или конденсация.
Процесс тепло- и массообмена может быть рассмотрен в ко
ординатах I — <Х (рис. 14.9). Состояние воздуха вдали от воды —
точка /, у воды — точка 2 . В результате смешения частиц воз
духа образуется смесь — точка 3 . Одновременно частицы воз
духа, соприкасаясь с водяной поверхностью насыщаются: вода
254
1- температурой /ш= **2 подмешивается к воздуху; в результате
*того состояние воздуха будет изображаться точкой на липни
3—2', имеющей уклон е«^ ж 2— £ *2*- Благодаря влагообмену
температура воздуха у поверхности воды и температура воды
изменяется. Если предположить, что новое состояние воздуха
у поверхности воды характеризуется точкой 2', то рассужде
ниями, аналогичными приведенным, можно сказать, что прои
зойдет его дальнейшее охлаждение. Изменения состояния воз
духа у поверхности воды будут происходить до тех пор, пока
направление линии процесса / —г не совпадет с уклоном
В этом случае влагообмен не изменяет больше
состояние воздуха у поверхности воды, температура которой
во всей массе становится одинаковой. Система приходит в со
стояние равновесия. Температуру состояния г называют преде
лом охлаждения. Все эти рассуждения справедливы для адиа
батной системы воздух — вода и турбулентного движения воз
духа.
Для определения влажности воздуха служит прибор, назыпаемый пси
хрометром. Принцип действия »того прибора основан на существования пре
дела охлаждения воздуха при испарении в него воды. Психрометр состоит
из двух термометров: сухого и влажного, ртутный шарик которого обернут
влажной тканью. Сухой термометр измеряет температуру воздуха
При ин
тенсивном обдувании влажного термометра исследуемым воздухом испарение
воды будет происходить непосредственно у ртутного шарика и последний при
мет температуру, равную пределу охлаждения (/*), которая также назы
вается температурой мокрого термометра. Если изотерму /. (см. ри с 14.9)
из области тумапа продолжить в область ненасыщенного воздуха до пере
сечения с изотермой, соответствующей температуре сухого термометра и, то
точка их пересечения соответствует искомому состоянию воздуха (точка /).
По этим данным может быть вычислена относительная влажность воздуха.
В таблицах, называемых психрометрическими, приводятся значения ф для
разных /| и и.
Глава 15
ОСНОВЫ ТЕРМОДИНАМИКИ РАСТВОРОВ.
АБСОРБЦИОННАЯ ХОЛОДИЛЬНАЯ МАШИНА
§ 15.1 . ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНОМЕРНОСТИ
В технологических процессах большинства пищевых и хи
мических производств, в холодильных машинах, в установках
криогенной техники и техники кондиционирования воздуха в к а
честве обрабатываемых продуктов или рабочих тел обычно у ч а
ствуют не отдельные (чистые) вещества, а их смеси. Такие смеси
могут образовываться в результате технических условий прове
дения процессов с чистым рабочим веществом (например, вслед
ствие попадания м асл а в холодильный агент компрессорной
холодильной машины), или создаваться специально, в частности
255
в ц елях использования особенностей их свойств при реализации
прямых и обратных термодинамических циклов.
В предыдущих главах рассматривались так называемые за
крытые термодинамические системы, для которых отсутствовал
обмен массой между веществами, образующими систему. Д ля
смесей необходимо расширить понятие термодинамиче
ской системы. В этом случае под системой будем понимать
совокупность материальных тел и окружающей среды, находя
щихся в механическом и тепловом взаимодействии, а такж е
обменивающихся друг с другом веществом. Т а
кие системы называю т открытыми. Д л я открытых систем
расширяется такж е понятие термодинамического равновесия:
это состояние системы при отсутствии потоков вещества, энер
гии и внешних воздействий.
Термодинамические системы могут быть гомогенными
или гетерогенными. Гомогенной или однородной на зы ва
ется система, химический состав и физические свойства любых
м алых частиц которой одинаковы или непрерывно изменяются
от одной точки системы к другой.
Простейшими гомогенными системами являются чистое ве
щество в газообразном, жидком или твердом состоянии, смесь
газов и т. д.
Гетерогенной или неоднородной называется система, состоя
щая из нескольких различных гомогенных частей, отделенных
друг от друга поверхностями раздела. Гомогенные области в ге
терогенной системе называются фазами. К аж дая из фаз мо
жет быть в трех агрегатных состояниях: газообразном, жидком
или твердом. При переходе через поверхности раздела меж ду
фазами изменяются хотя бы некоторые свойства вещества, мо
жет иметь место неодинаковость состава и свойств каждой из
фаз в их объеме и у поверхности раздела. Характерным свой
ством фазы является возможность выделения ее механическим
путем (фильтрованием, центрифугированием и т. п .) . Простей
шие гетерогенные системы — смеси: парожидкостная, воды и
водного льда и т. д . В пределах одной фазы вещества подраз
деляются по качественному составу на однокомпонент
ные (чистые) и многокомпонентные (растворы).
Раствор — это устойчивая гомогенная система перемен
ного состава — твердая, жидкая или газообразная, состоящая
не менее чем из д ву х компонентов. Это однородные смеси мо
лекул (в частном случае атомов, ионов) двух или более веществ,
м е ж ду которыми имеются физические или физико-химические
взаимодействия. Примерами растворов являются: а) газообраз
н ы х — смеси идеальных газов, рассмотренные в § 1.3 , воздух,
природные газы; б) жидких — бензин, растворы аммиака и со
лей в воде, хладонов в масле, смесь взаиморастворимых х л а
донов, сжиженные природные газы и т. д .; в) твердых — некото
рые сплавы, кристаллогидраты.
256
Наибольшее значение имеют жидкие растворы. Хорошо из
вестна огромная роль в современной химической промышлен
ности и в энергетике такого раствора, как нефть. Растворами
являются многие жидкие пищевые продукты. В компрессорной
холодильной машине циркулирует не чистый аммиак или х л а
дон, а раствор масла в том или ином холодильном агенте. Р а
бочим телом абсорбционной холодильной машины является ра
створ аммиака или бромистого лития в воде. В схемах холодиль
ных установок в качестве хладоноснтелей используются различ
ные водные растворы (хлористого кальция, этиленгликоля и
т.д.).
Составляющие раствор чистые (химически однородные) ве
щества называются компонентами. Понятие вещества пред
полагает возможность существования компонента вне раствора,
поэтому отдельные ионы в растворе не могут рассматриваться
как компоненты.
Компонент, содержащийся в растворе в большем количестве,
обычно называется растворителем, а содержащийся в меньшем
количестве — растворенным веществом.
Как гомогенная, так и гетерогенная системы могут быть од
но-, двух-(бинарными) или многокомпонентными.
Для определения состояния двух- н многокомпонентных си
стем, наряду с заданием таких параметров, как температура,
давление, необходимо такж е иметь данные о концентрациях
компонентов. Концентрацией называется содержание одного из
компонентов в единице количества смеси. В зависимости оттого,
какие приняты единицы измерения количества вещества, разли
чают массовую— с< (не смешивать с обозначением теплоемко
сти), объемную п или мольную концентрацию лг< (не смешивать
с обозначением степени сухости). В теории разбавленных раст
воров для задания состава раствора часто используют понятие
моляльной концентрации т<, представляющей собой число мо
лей растворенного вещества, приходящееся на 1000 г раствори
теля.
Для возможности применения в расчетах реальных раство
ров термодинамических соотношений идеальных газов вводят
новую функцию, называемую летучестью. Эта функция вво
дится с помощью изобарного потенциала (см. гл. 7) Ф - /
—
7*5,
для которого ¿Ф= * Уйр —
2
Для изотермического процесса ДФ= * / Ус1р, откуда для
идеального газа
ДФ-ДПп (ра/р,).
(15.1)
Формулу (15 .1) можно использовать и для реальных раство
ров, если заменить давления некоторой функцией /, названной
17 8аж. Ю
257
летучестью. При этом Д Ф=/?7' 1п (/2//1) . отсюда можно опреде
лить значение летучести:
<1Фт=ЯТс1(\п /),
/=ф(7>*/TM*,
(15.2)
или
Ф —/?Г1п/+ф(Г).
Из этих формул видно, что в общем случае реального веще
ства летучесть является сложной функцией состояния, например
давления и температуры. При приближении реального вещества
к идеально-газовому состоянию значение летучести мало отли
чается от соответствующего значения давления. Соответственно
коэффициент летучести у, представляющий собой отношение //р,
стремится к единице. Значения летучести для каждого вещества
приводятся в специальных справочниках. При малых давлениях
летучесть можно определить по приближенной формуле
(15.3)
где Рид — давление, которое имел бы идеальный газ при тех же
V и Г, что и рассматриваемый реальный газ; р — действительное
давление реального газа.
Летучести жидкостей и твердых тел. находящихся в равнове
сии с их насыщенным паром, определяются значением летучести
для этого сухого насыщенного пара, которую можно вычислить
с помощью формул (15.2) или (15 .3). Летучесть ненасыщенной
жидкости при не очень высоких давлениях приближенно может
быть определена как летучесть насыщенной жидкости при той
ж е температуре. Последняя в свою очередь практически очень
близка к значению давления насыщенного пара жидкости. Так,
например, для воды при температуре 25° С и давлении 0,1 МПа
/=3 ,0 63-10~3 МПа; при той же температуре и давлении 10 МПа
/=3 ,2 96-10” 3 МПа. Оба этих значения летучести достаточно
близки к значению давления сухого насыщенного пара воды при
25° С, которое равно для этой температуры 3,166-10_3 МПа.
§ 15.2 . ПРАВИЛО ФАЗ ГИББСА
Представление об устойчивости фаз в системе и о направле
нии фазовых превращений в ней тесно связано с понятием о хи
мическом потенциале. Химический потенциал — функция состоя
ния, используемая для описания открытых термодинамических
систем. В общем случае химический потенциал щ 1 -го компо
нента численно равен приращению изобарного (термодинамиче
ского) потенциала Ф системы или фазы при увеличении
на единицу количества
л* ¿-го
компонента. При усл о
вии, что давление р, температура Т и количества лк всех осталь
ных компонентов системы остаются неизменными, т. е. р<=
* = (дФ/д/и)р,т,пк- Д л я метастабильного состояния (состояния
258
относительно устойчивого равновесия) двух ф аз более устойчи-
ной при данных р и Т является та, у которой химический потен
циал имеет меньшее значение, а перенос массы осуществляется
и направлении от большего химического потенциала к меньше
му. При этом разность химических потенциалов является дви
жущей силой переноса. Из сказанного следует, что при термоди
намическом равновесии и независимых переменных р и Т спра
ведливы равенства
Ц|,= Ц|"-
•••
“ Ц|ь,
...
(15.4)
...
где индексы ', " и т. д . соответствуют первой, второй и т. д .
фазам , I* — число фаз системы к — число компонентов.
Рассмотрение системы уравнений (15 .4) позволяет сформули
ровать правило фаз, которое оказывается чрезвычайно полез
ным при анализе фазовых равновесий в многокомпонентных
системах. Оно устанавливает соотношение между числом сте
пеней свободы
компонентов к и ф аз I* в равновесной гетеро
генной системе. Числом степеней свободы н азы вается число не
зависимых переменных, определяющих состояние системы, нахо
дящейся в равновесии. Таким образом, правило фаз позволяет
ответить на весьма важный практический вопрос о том, сколько
взаимно независимых параметров определяет состояние равно
весной гетерогенной системы:
Ы—к
—
¿4-2 .
Число степеней свободы не может быть отрицательным, но
может равняться нулю. В последнем случае
2,т.е.врав
новесной системе число фаз не может превышать число компо
нентов больше чем на две единицы. При несоблюдении этого у с
ловия не может быть равновесия и для его достижения излиш
ние фазы должны исчезнуть, превратившись в другие.
Правило фаз в однокомпонентных системах. В этом случае
1 и правило фаз примет вид:
—
I.
Первый вывод, который может быть сделан при рассмотре
нии такой записи состоит в том, что в однокомпонентной системе
одновременно может находиться в равновесии не более трех
фаз. Д л я однофазной системы число степеней свободы равня
ется двум, т. е. для однозначного определения равновесного со
стояния системы в этом случае необходимо и достаточно нали
чие двух независимых параметров. Так, для воды при наличии
17*
259
лишь одной фазы (вода, или лед, или пар) можно произвольно
менять два параметра, например давление н температуру. Тогда
в координатах р— / любой точке на плоскости соответствует
определенное равновесное состояние системы.
Если в равновесии находятся две фазы, то N=1, т. е. неза
висимо может изменяться только один параметр. Если таким
параметром является, например, температура, то другой пара
м етр — давление — связан с первым функциональной зависи
мостью р = / ( 7 ) , и геометрическим местом точек, соответствую
щих состояниям равновесия двух фаз, например пара и жидкости,
будет соответствующая кривая. Так как возможно три сочетания
из двух различных фаз (жидкость — пар, жидкость — твердое
тело, твердое тело — пар), то на диаграмме р—Т должно быть
три кривых р = /(Т ). Равновесию всех трех фаз соответствует
отсутствие у такой системы степеней свободы ( ¿ = 3 и No—0).
На диаграмме р — Т этому соответствует жестко зафиксирован
ная точка, в которой сходятся все три кривые равновесия д вух
фазных состояний. Эта точка называется тройной. Д л я воды
тройная точка соответствует температуре 0,01° С и давлению
610,8 Па. Наклон кривых, соответствующих равновесию двух
любых фаз, на диаграмме р—Т определяется уравнением Кла
пейрона-Клаузиуса (см. гл. 9) dp/dTш^=r/T(v2—V\). Линия
равновесия системы твердое тело — пар имеет на диаграмме
р— Т большую крутизну, чем линия жидкость — пар. Это под
тверждает уравнение Клапейрона — Клаузиуса. В обоих случаях
знаменатель в правой части уравнения можно считать одинако
вым, так как удельный объем пара значительно больше удель
ного объема как жидкости, так и твердого тела. Однако для
случая перехода твердого тела в пар (или обратно) в числителе
окажется теплота сублимации, а не теплота парообразования,
как для случая перехода жидкости в парообразное состояние.
Так как теплота сублимации является суммой теплоты парооб
разования и теплоты плавления, то значение dpfdTmдля линии
равновесия твердое тело — пар будет больше, чем для линии
жидкость — пар.
Правило ф аз в двухкомпонентных (бинарных) системах.
В этом случае к = 2 и правило фаз примет вид
N-4 -1.
Таким образом, в бинарной системе число фаз, находящихся
в равновесии, не может быть больше четырех (при N «»0). Для
однофазной системы число степеней свободы равно N —4 — 1
—3.
Следовательно, состояние бинарной системы может быть одно
значно определено при наличии трех параметров, например дав
ления, температуры и концентрации. Д ля изображения бинар
ной системы необходима пространственная диаграмма. В ней
каждой фазе соответствует участок объема. Сосуществование
двух ф аз изображается поверхностями, ограничивающими со-
260
|ивстствующие области объема; сосуществование трех фаз —
.ИН1ИЯМИ, по которым сходятся эти поверхности и, наконец, со-
гуществование четырех ф аз — четверной точкой, в которой схо-
чмтся эти линии.
В системах, в которых основное значение имеют твердые и
жидкие фазы, влияние давления невелико и им можно пренеб
речь. В этом случае рассматривают систему при постоянном
давлении (обычно при атмосферном). Тем самым одна из пере
менных фиксируется и уменьшается на единицу число коорди
нат (независимых переменных). Этому соответствует следую
щая запись правила фаз:
—1
+1или
3— £ , аналогично
однокомпонентной системе. Состояние такой супрощенной* си
стемы
геометрически может
быть описано с помощью плос
кой диаграммы с координатами
температура н концентрация.
С физической точки зрения это
означает, что в рассмотрении
не участвует одна из фаз,
в данном случае — паровая.
Диаграмма Т—с для бинар
ной системы КаО +Н гО , имею
щей применение в холодиль
ной технике, изображена на
рис. 15.1 . Координата с—со
держание соли в растворе. На
диаграмме область I отвечает
однофазному жидкому раствору соли No С 1 в воде. В этой
области
число
степеней
свободы равно
двум,
поэтому
в растворе можно произвольно менять и температуру и
концентрацию, пока состояние раствора не соответствует кри
вым АЕ или ВЕ. Кривая АЕ — это кривая замерзания раствора
(начала выпадения кристаллов льда), а В Е — кривая раствори
мости соли в воде (начала выпадения кристаллов соли). Состоя
ние раствора на каждой из этих кривых характеризуется одной
степенью свободы, т. е. каждому составу раствора соответствует
вполне определенная температура замерзания или выпадения
кристаллов соли. Области // и III отвечают сосуществованию
соответственно двух фаз: лед и раствор и соль и раствор. Число
степеней свободы для них равно единице. Это значит, что к а ж
дой температуре соответствует вполне определенная концент
рация, поэтому раствор не может иметь состава, соответствую
щего точкам внутри этих областей. При каждой температуре
состав распадается на раствор, соответствующий точке на кри
вой А Е или В Е и на избыточной твердый компонент. Точка Е
соответствует одновременному выпадению соли и льда. В этом
случае сосуществуют три фазы: лед, соль и раствор, при этом
число степеней свободы равно нулю (ЛГ—3 —3 ), т. е. точке Е
261
отвечают определенный состав смеси и определенная темпера
тура. Д ля раствора поваренной соли /Е=
—2 1,2°СисЕ=23,1%.
Раствор первоначального состава ск переходит в твердые фазы,
как и чистая жидкость, при постоянной температуре. Точка £
называется эвтектической, а выпадающая в ней смесь обоих
твердых компонентов называет эвтектикой. Плавление эвтек
тики происходит такж е при постоянной температуре — темпе
ратуре эвтектической точки. Это свойство эвтектики использу
ется в холодильной технике для устойчивого поддержания низ
ких температур в помещениях малого объема. Теплота плавления
эвтектики меньше, чем чистого водного льда. Д л я эвтектики си
стемы Н20 —ЫаС1 она равна 236 кДж/кг.
Ниже изотермы Ир жидкая фаза существовать не может.
В области IV находится смесь льда и эвтектики, а в области V—
смесь соли и эвтектики.
В заключение рассмотрим, как будет протекать процесс ох
лаждения растворов ^ С 1 от начального состояния, отмечен
ного на диаграмме точкой I, до состояния 2. На отрезке 1 —т
охлаждение раствора будет происходить без изменения его кон
центрации. В точке т начнут выпадать первые кристаллы льда,
а остающийся раствор будет становиться все более концентри
рованным. Любое промежуточное состояние в области II, на
пример точка п, представляет собой смесь раствора состояния
лг и льда состояния пл.
При охлаждении до температуры, определяемой изотермой
оставшийся жидкий раствор превратится в эвтектику, ко
торая будет содержать в себе ранее выпавшие кристаллы льда.
Эта твердая смесь и будет подвергаться дальнейшему охлажде
нию до требуемой температуры Г 2.
$ 15.3 . ВИДЫ РАСТВОРИМОСТИ.
ЯВЛЕНИЯ, ПРОИСХОДЯЩИЕ
ПРИ ОБРАЗОВАНИИ РАСТВОРОВ
При умеренных давлениях газы могут смешиваться между
собой в любых пропорциях, жидкости ж е в различных сочета
ниях ведут себя при смешивании по-разному. Могут иметь ме
сто следующие случаи.
Полная взаимная растворимость, примером ко
торой может служить растворимость друг в друге воды и амми
ака, воды и этилового спирта, бензина и смазочного м асл аи т.д .
Полная взаимная нерастворимость — характе
ризует такие сочетания жидкостей, как этиловый спирт и ртуть,
вода и керосин и т. д.
Ограниченная взаимная растворимость, при
которой жидкости в некоторой области температур и концентра
ций образуют гомогенные смеси, а вне этой области расслаива-
262
ютея на два слоя: насыщенный раствор первой во второй и на
сыщенный раствор второй в первой. Типичным примером о гр а
ниченной растворимости является смесь водь* и анилина
(С2НбИН2). Если в каком-то сосуде смешать примерно равные
количества этих веществ, то образуются два слоя: внизу слой
лнилина, насыщенного водой (плотность анилина больше, чем
у воды, и равна 1040 кг/м3), а вверху слой воды, насыщенный
«шилином. Взаимная растворимость этих веществ растет с по
вышением температуры и при так называемой критической тем
пературе растворимости, равной в данном случае 167° С, насту
пает полная растворимость. На рис. 15.2 кривая А К представ
ляет собой растворимость воды в анилине, а кривая ВК — ани
лина в воде. Обе кривые схо
дятся в точке К при критиче
ской
температуре раствора.
Между кривыми АК и ВК на
ходится область гетерогенного
состояния, за пределами ее —
область гомогенного раствора.
Точкам, отвечающим темпера
турам н концентрациям внутри
кривых, не могут соответство
вать однородные растворы с
одинаковой концентрацией во
всем объеме. Так, например,
при смешении примерно оди
наковых количеств анилина н
воды при температуре 20° С
смесь, изображаемая точкой
а , будет представлять собой
два слоя: нижний — анилина,
в котором растворено 5% воды (точка в ) , и верхний — воды
в котором растворено 3 ,1% анилина (точка й).
Для других сочетаний жидкостей может иметь место обрат
ная зависимость растворимости от температуры, т. е. уменьше;
ние ее при повышении температуры. Примером такого сочета*
ния являются вода и фенол.
Явления, происходящие при смешивании двух жидкостей.
При смешивании д вух жидкостей объем образовавшейся смеси
обычно оказывается несколько меньшим по сравнению с сум
марным объемом компонентов до смешения. Причины этого
явления достаточно сложны н связаны с природой сил межмо
лекулярного воздействия. Разность меж ду действительным
удельным объемом смеси V и удельным объемом смеси, опреде
ленным путем арифметического сложения удельных объемов
компонентов, называется изменением объема при смешении:
ДИ« Ц — (П|С|+1*2^2)
Рис. 15.2 . Фазовая диаграмма Г—с
неидеальной двухкомпонентяой си
стемы с ограниченной взаимной раст
воримостью компонентов.
263
или, полагая, что первый компонент является растворенным ве
ществом и задавая только его концентрацию:
[0|С+ 02(1 — с)].
Надо отметить, что имеются смеси, у которых объем не умень
шается, а увеличивается при образовании раствора или же сна
чала уменьшается, а затем с возрастанием концентрации такж е
увеличивается. Обычно в расчетах пользуются значениями удель
ных объемов смесей из таблиц, составленных на основании эк
спериментальных данных для разных растворов.
При смешении многих жидкостей имеет место выделение
(реж е — поглощение) теплоты. Т ак, например, существенным
выделением теплоты сопровождается смешение жидкого ам
миака и воды, серной кислоты и воды и т. д . Если смешение
происходит при постоянных давлении и температуре, то ин
тегральная теплота растворения может быть определена как
разность энтальпии раствора I и компонентов до смешения:
*-*
-
[*,с+М1-с)|.
(15.5)
Кроме интегральной теплоты растворения используется по
нятие дифференциальной теплоты растворения, под которой по
нимают количество теплоты, выделяемое или поглощаемое при
добавлении к раствору бесконечного малого количества одного
из компонентов.
Теплоемкость раствора заданной концентрации с для изо
барного процесса может быть определена как
СР-(д1/дТ)р.с .
Подставив сюда выражение для энтальпии, найденное из урав
нения (15 .5), получим
Ср—Ср С+Ср, (1 — с)+ (¿<7,/дГ)Р. с.
В этом выражении величину ('д4(/дГ)р,с называю т теплоем-
костью процесса растворения.
| 15.4 . ЗАКОНЫ, ОПИСЫВАЮЩИЕ СВОЙСТВА РАСТВОРОВ
Наибольшее практическое значение имеют разбавленные
растворы, в которых мольные доли растворенных веществ очень
малы. Предельное значение летучести таких растворов
Иш1Ы(1-дг)]-/|в.
(15.6)
х-0
где /| — летучесть растворителя в данном растворе; ( 1 — х) —
мольная концентрация растворителя в растворе; /? — летучесть
растворителя— чистого вещества при заданных р и Т раствора.
Выражение (15.6) называется законом Рауля. Аналогично
264
этому можно получить соотношение, называемое законом Генри:
Нш(Га/х)=Лр.т .
(15.7)
/-»О
где /а — летучесть растворенного вещества при его мольной кон
центрации в растворе, равной х\ кр, т — коэффициент Генри,
представляющий собой летучесть соответствующего компонента
(в данном случае — растворенного вещества) при давлении, рав
ном общему давлению над раствором.
Оба закона можно объединить следствием, вытекающим из
них: при стремлении мольной доли растворенного вещества
к нулю летучесть веществ прямо пропорциональна их мольным
долям.
Законы Р аул я и Генри справедливы при произвольных д ав
лении, температуре и агрегатном состоянии. В ряде случаев эти
законы позволяют удовлетворительно описывать свойства реаль
ных растворов с малыми, но конечными концентрациями. Это
в первую очередь относится к растворам неэлектролитов и с л а
бых электролитов при х<0,001.
Условно можно представить себе растворы, которые подчи
няются законам Рауля н Генри при любых составах и у кото
рыхДои
равны нулю. Такие растворы называются идеаль
ны м и. Для идеальных растворов выражения (15.6) и (15.7)
принимают вид
/г-(1-*)/А
(15.8)
В данном случае коэффициент Генри оказывается равным
летучести чистого растворенного вещества при давлении и тем
пературе раствора. Если учесть, что летучести компонентов жид
кости равны летучести компонентов пара, а последние в свою
очередь приближенно — парциальным давлениям компонентов
в паре р\ и ря, то выражения (15.8) можно записать как
Р|—(1 — Х)р, Рг~хр,
где р — полное давление пара над раствором при данной тем
пературе.
Очевидно, что записанные таким образом законы Р ау л я и
Генрн для смеси идеальных газов приобретают вид выражения
закона Дальтона.
Для понимания и оценки поведения растворбв в ряде с л у
чаев оказывается удобной следующая формулировка закона
Р ау л я : для идеального раствора относительное понижение д а в-
ления насыщенного пара растворителя над раствором равно
мольной концентрации растворенного вещества:
(р«1° — Р .0/Р110- * ,
где р ^ — давление насыщенного пара над чистым растворителем
(над первым компонентом); рм — парциальное давление насы-
265
щенного пара растворителя в паре над раствором; х — мольная
концентрация растворенного ве щ е ст ва.
В случае идеального раствора зависимость летучестей ком
понентов жидкого раствора от концентрации в соответствии
с законом Рауля изображается прямыми (см. уравнение (15 .8)).
Линейная зависимость парциальных давлений от концентрации
приводит к тому, что и общее давление такж е линейно зависит
от концентрации. Соответствующая прямая рв(хж) называется
линией насыщенной жидкости в р — ¿ -диаграмме (рис. 15.3).
Идеальный раствор представляет собой только предельный
случай, к которому в большей или меньшей степени приближа-
15.3 . Зависимость между давлением и кон
центрацией компонентов в идеальном растворе
при Т — const.
ются все реальные растворы. Бинарные системы, растворы кото
рых заметно отклоняются от идеального, можно разделить на
три различных типа в зависимости от формы линии кипения при
постоянной температуре.
К первому типу относятся системы, у которых линия насы
щенной жидкости, отклоняясь от прямой, соответствующей з а
кону Рауля, в ту или другую сторону, сохраняет монотонный
характер (рис. 15 .4 ,а). Пунктирная прямая на рисунке отве
чает идеальному раствору. Примерами систем первого типа яв
ляются смеси воды и аммиака, жидких кислорода и азота
ит.д.
Системы второго и третьего типов (рис. 15 .4 ,6) представляют
собой крайние случаи систем первого типа, при которых откло
нения линии насыщенной жидкости от закона Рауля столь зна
чительны, что кривая имеет максимум (система второго типа)
или минимум (система третьего типа). Примером системы вто
рого типа является смесь воды и этилового спирта, второго
типа — смесь воды и хлористого водорода.
Линия насыщенной жидкости р»(хж) представляет собой з а
висимость давления над жидким раствором от концентрации
компонентов при постоянной температуре 7. Линия Ря(дгп)»
266
представляющая собой зависимость давления насыщенного
пара от его концентрации при той же температуре, не совпа
дает с линией насыщенной жидкости и называется линией су
хого насыщенного пара. Это несовпадение объясняется первым
законом Коновалова, который может быть сформулиро
ван так: «Пар над раствором обогащен тем компонентом, до
бавление которого к жидкости повышает давление пара над ней
при постоянной температуре» или «П ар над раствором обогащен
более летучим компонентом». На диаграмме р — х линия на
сыщенной жидкости располагается выше линии сухого насыщен-
Рис. 15.4 . Талы отклонений растворов от закона Рауля в диаграмме р—х
пря Г —согни
а —орн олиомпв от меиыого раствора ■ лолаоА пашоА растворимости: б —ори
валявва вкстрамуиа в дваграмма р —х ,
ного пара, а на диаграмме Т — х
—
ниже. В технических ра
счетах вместо мольной чаще используют м ассовую концентра
цию и соответственно вместо р—х- и Т—¿-диаграмм р—с-
н Т — с -диаграммы. Такая замена не вызывает качественных
изменений в сделанных выше выводах. Рассмотрим диаграммы
р—си Г—сна примере системы вода—аммиак (рис. 15.5,
а, б). Диаграмма р — с построена при постоянной произвольной
температуре *=-50° С, а Диаграмма Т — с при постоянном про
извольном давлении р —0,1 МПа. Если в диаграмме р — с про
вести произвольную изобару р = 0 ,1 МПа, то при температуре
кипения раствора * = 5 0 ° С концентрация будет соответствовать
кипящей жидкости по амм иаку, равной приблизительно 18%
(точка т ) , при этом образующийся сухой насыщенный пар бу
дет иметь концентрацию 90% по аммиаку (точка п). Анало
гично на диаграмме Т — с точке / кривой насыщенной жид
кости и точке к кривой сухого насыщенного пара соответствуют
названные концентрации. На диаграммах приведены значения
267
давлений н температур насыщения обоих чистых компонентов
(с « 0 и 1 ) . Линии насыщенной жидкости и сухого насыщенного
пара делят все поле диаграммы на три области: ненасыщенной
жидкости, перегретого пара и двухфазных состояний (т. е.
влажного пара).
Взаимное расположение кривых насыщенной жидкости и
насыщенного пара для растворов второго и третьего типа каче
ственно опр еделяется вторым законом Коновалова,
который можно сформулировать следующим образом: «Если
бинарная смесь такова, что кривая раствора проходит через
Рис. 15.5 . Фазовые диаграммы двухкомпонентной системы 1 типа (иа при
мере системы Н |0 — ЫН*),
а—р
-
Цс) прв / —5<ГС. б —Г
-
Нс)прир-0.1МП*.
максимум или минимум, то в точках экстремума состав жид
кости и пара одинаков». При этом расположение обеих кривых
м е ж ду значениями для чистых компонентов и экстремальными
точками определяется первым законом Коновалова. На рис.
15.6 изображены диаграммы р — х (а) и Г — х (б) для раст
вора второго типа, а на рис. 15.7
—
третьего.
Смеси, состав которых соответствует составу в экстремаль
ных точках, называются постоянно кипящими или азеотроп
ными, их особенностью является одинаковость состава жидко
сти и равновесного ей пара. Различаю т минимально кипящие
азеотропные смеси — их образуют системы второго типа и м ак
симально кипящие, образованные системами третьего типа.
Примером минимально кипящей азеотропной смеси может слу
жить система вода — бензол при концентрации воды с —8,9%.
Если при р«=0,1 М Па чистая вода имеет температуру кипения
около 100е С, а чистый бензол — около 80еС, то такая смесь ки-
268
Рис. 15.6 . Фазовые диаграммы двухкомпонентиой системы II типа.
а—р
-
f(x) при Т- const; б—Т»/(*) ярир- const.
о
ff
Ряс. 15.7 . Фазовые диаграммы двухкомпояектноА системы Ш типа,
а—р
-
/(*) приГ-con»t:б—Т -Цх)прир-const.
269
пит при 69,3ЭС. Максимально кипящей является, например,
38-процентная смесь азотной кислоты с водой. Ее чистые ком
поненты имеют температуры кипения при р —0 ,1 МПа 100 и
86° С, а названная смесь кипит при 120,5 ° С. В холодильной тех
нике все более широкое применение находит такое рабочее
тело, как R502. Этот хладон представляет собой минимально
кипящую азеотропную смесь R22 (48,8%) и R115 (51,2 % ).
Температуры кипения при р = 0 , 1 МПа хладонов R22, R115 и
R502 соответственно равны —4 1, — 38 и »—45,6° С.
§ 15.5 . ДИАГРАММА ЭНТАЛЬПИЯ - КОНЦЕНТРАЦИЯ,
ПРОЦЕССЫ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ
Для расчета многих процессов, происходящих в бинарных
системах, удобно применять диаграммы энтальпия — концентра
ция. Концентрацию обычно вы раж аю т массовыми долями. Эти
диаграммы существенно отличаются для двух групп смесей.
Первую группу составляют растворы, в которых оба компонента
являются летучими. Представителем первой группы является ра
створ NHs — Н20 . В растворах второй группы один из компо
нентов — обычно
растворенное
вещество — характеризуется
пренебрежимо малой, практически нулевой, летучестью. При
мером такого раствора является раствор бромистого лития
в воде. В паровой фазе растворов первой группы присутствуют
оба компонента, а второй группы — только один. На рис. 15.8
приведены диаграммы i — с для растворов первой группы (а)
и второй группы (б). Д л я веществ первой группы линия O'b'd'p'
соответствует состояниям насыщенной жидкости при давлении
p=const и различных концентрациях, линия о"& "сгр''— сухому
насыщенного пару при том же давлении. Аналогично диаграм
мам чистых веществ эти линии называют пограничными кри
выми, но для одного определенного давления р. Выш е линии
o"b "d "p "лежит область перегретого пара, ниже линии o'b 'd 'p ' —
область ненасыщенной жидкости, между ними — область влаж
ного пара. Температура насыщения зависит от концентрации ра
створа и изменяется, возрастая от температуры насыщения пер
вого чистого компонента 7V при с«=0 до температуры насыще
ния второго чистого компонента Тр>при с = 1. Рассмотрим раз
личные состояния раствор а при произвольно выбранной кон
центрации св= const. В точке а жидкость ненасыщена и для
описания ее состояния согласно правилу Гиббса необходимо
знать три независимых параметра, например, р, Та и сл (изо
бара, соответствующая состоянию а, на диаграмме не нанесена).
При нагревании жидкости она в какой-то момент закипит.
В рассматриваемом случае состоянию насыщенной жидкости
соответствует точка Ь\ для которой число степеней свободы
равно двум, например Тши са. Состояние пара, равновесного з а
кипевшей жидкости, определяется точкой 5" .
По первому за-
270
кону Коновалова с « * < с 9'( в данном случае с — концентрация
менее летучего компонента) и изотерма в области влажного
пара имеет наклон. Обычно в этой области изотермы не нано
сятся. Д ля их построения имеется вспомогательная
кривая
о” Ь*(1*р".
Принцип построения изотерм показан на рисунке
пунктиром. Точка й определяет произвольное состояние в л аж
ного пара в тот момент процесса кипения, когда кипящая жид
кость и насыщенный пар имеют температуру Т* н концентрации
соответственно с / и с& . Состояние влажного пара имеет две
----Ц
--- ^ -------- 1
------1
_
---- - ---------- ---------- -----
-------
1— IтЛС
ОсьС4
СфСё Сё С-1
С4
Ряс. 15.8 . Изображение изобарного равновесия в I—с -диаграмме для
веществ первой (а) и второй (б) групп.
степени свободы, например Г* и св. Энтальпия влажного пара,
как и в случае однокомпонентных веществ, определяется с по
мощью уравнения
*-Гх+Г(1—х),
(15.9)
где х — степень сухости влаж ного пара.
Аналогичными являются зависимости и для удельного объ
ема и энтропии
о-и "х+0'(1 —х),
(15.10)
•
а-«"***'*!—х).
(15.11)
Из уравнения баланса массы можно записать
с = с в-«с"дс+с, (1—х).
(15.12)
Откуда степень сухости (паросодержание) смеси можно вы
разить так ж е, как и для однокомпонентных рабочих веществ,
рассмотренных в предыдущих главах
*= (*- 0/(<" - О -(*—5')/(5" - 5')-
-
(V-
—
и') =(с—с')/(с" — с'). (15.13)
271
Состояние е " соответствует сухому насыщенному пару при
давлении р и концентрации с„ (число степеней свободы равно
двум). Точка g соответствует произвольному состоянию пере
гретого пара (число степеней свободы равно трем). Отрезок
</о" представляет собой (в масштабе) теплоту парообразова
ния более летучего компонента, отрезок //р" — менее летучего.
Изобарное равновесие в / — ¿диаграм ме для вещести вто
рой группы (рис. 15.8, б) в общих чертах аналогично. Суще
ственным отличием является лишь то, что паровая ф аза содер
жит только один летучий компонент, для которого с —0. По
этому линия равновесия пара o"b "d " лежит на оси i. Для по
строения изотерм в области влаж ного пара используется прием,
аналогичный рассмотренному выше. Справедливы такж е урав
нения (15.9) — (15 .13). Следует обратить внимание на то, что
на рис. 15.8 ,6 точки е й g отсутствуют, а диаграмма не имеет
области с—1
.
Это объясняется тем, что пар не имеет второго
нелетучего компонента, и поэтому полный переход раствора
с начальной концентрацией са в паровую область невозможен;
можно представить себе гипотетические условия при весьма вы
соких температурах, когда это возможно, но в таком случае
система потеряет признаки второй группы и перейдет в первую.
Перед рассмотрением отдельных процессов двухкомпонент
ных систем сделаем некоторые важные замечания.
Во-первых, как и для чистых веществ, методики нахождения
таких термодинамических характеристик двухфазных сред, как
энтальпия, энтропия и удельный объем аналогичны. Различие
состоит лишь в том, что для каждой из фаз эти величины при
р - const и однокомпонентной среде не изменяются, а при двух-
компонентных — зависят от концентрации, что следует из пра
вила фаз Гиббса. Поэтому процессы фазового перехода для
неазеотропных систем происходят при переменной тем пера
туре.
Во-вторых, общие закономерности термодинамики, которые
не зависят от природы веществ и были рассмотрены в гл. 2 —5,
7— 10, справедливы и для многокомпонентных систем.
В-третьих, описание термодинамического состояния много
компонентных веществ так ж е производится с применением у р а в
нений состояния, которые имеют дополнительными параметрами
концентрации компонентов.
Процессы нагрева, кипения, охлаждения, конденсации. Дли
изобарных процессов переноса теплоты общей закономерностью
является равенство переданной теплоты и изменения полных
энтальпий внутренней системы. Поэтому для процесса нагрева
1 кг ненасыщенного раствора с концентрацией са (рис. 15.8 , а.
б) от температуры Та до температуры насыщения Т9:
ЯаЬ■ — ie-
При Г —7# с'**са= с из (15.13) х = 0 . Дальнейший нагрев раст-
272
вора также происходит при переменной температуре, но харак
тер изменения температур другой, так как происходит процесс
парообразования. Различие составов паровой и жидкой фаз при
сохранении общей концентрации системы са приводит к тому,
что с увеличением паросодержания возрастает концентрация
в жидкости труднокипящего компонента. Например, при тем
пературе Та концентрация раствора составит
, характери
стики системы в этом состоянии определятся уравнениями
(16 .11) — (15 .13). Количество теплоты, подведенной извне:
Яьл
—
<6*
В состоянии е для системы, представленной на рис. 15.8 , а.
весь раствор выкипит, так как при Г -Г / # *
и *«*1.
Дальнейший нагрев этой системы приведет к образованию пере
гретого пара (точка # ):
—
и-
Для системы, представленной на рис. 15 .8 , б, процесс
проводят до определенной максимальной температуры ки
пения Ттшх- Этой температуре соответствует максимальная кон
центрация раствора Сщ«* общее количество теплоты, подведен
ной от начала процесса, составит Яалж1ё — *в- Процесс охлаж
дения и конденсации происходит в направлении, обратном на
греву и кипению, с последовательностью процессов, представ
ленных на рис. 15.8, а: це — охлаждение пара до состояния на*
сыщения, еЬ — конденсация при переменной температуре, Ь а—
охлаждение раствора. Количественные закономерности процесса
те же. Аналогично для рис. 15 .8 ,6 : [Ь — конденсация при пере
менной температуре, Ьа — охлаждение раствора.
Ректификация. Ректификацией называют сложный процесс
обогащения паровой фазы одним или несколькими компонен
тами, основанный на фазовых превращениях гетерогенной си
стемы с различным составом паровой и жидкой фаз.
В абсорбционных холодильных машинах и газоразделитель
ных установках процессы кипения осуществляют для разделе
ния компонентов. В случае веществ второй группы, диаграмма
которых соответствует рис. 15.8 , 6, паровая фаза содержит чи
стый компонент. В этом случае простым выпариванием раствора
и разделением паровой я жидкой фаз получают этот чистый
компонент и нет необходимости в процессе ректификации.
Для веществ первой группы (рис. 15.8, а) из раствора кон
центрации са при давлении р невозможно получить в процессе
кипения пар с концентрацией второго компонента ниже с« * .
В предельном случае при 7 = 7 , х = 0 . Предположим, что в про
цессе ас! получен пар с концентрацией с . Попробуем пони
зить ее до с = с е . Конденсацией гетерогенной системы это недо
стижимо, так как при Г * Тшх = 0 . Однако, если парожндкост*
ную смесь состояния 6 разделить, а затем провести процесс кон-
18 3«Х. 80
273
денсации (1"к, то получим пар требуемого состава. Его количе
ство из 1 кг исходной смеси составит
М
сл —с<г
—
а отведенная теплота.
—
/а).
Можно получить и более низкую концентрацию в паре вто
рого компонента многоступенчатым отбором жидкости и частич
ной его конденсацией. Однако рассмотренный способ имеет ог
раниченное применение, так как н парообразование и частич
ная конденсация связаны с дополнительными затратами. Обычно
ректификацию производят жидкостью, подаваемой на испаре
ние в парогенератор. На рис. 15.9 представлена схема потоков
О
б
Рис. 15.9 . Прпшшшьная схема процесса (а) ректифика
ции ■ его иаображеияе в ¿-с -диаграмме (б).
в аппарате н изображение процесса в 1 — с -диаграмме. Паро
вая фаза после разделения в парогенераторе подается в ректи
фикатор, где промывается жидким раствором. При этом про
исходит тепло- и массообмен, при котором пар охлаждается
и обогащается первым компонентом (процесс й "Ь ") вследствие
нагрева и разбавления раствора (процесс Ьп). Раствор уда
ляется в парогенератор. Принято, что пар на выходе из ректи
фикатора равновесен подаваемой жидкости. Процессы измене
ния состояния пара и жидкости являются полезными и осуще
ствляются без дополнительных затрат на охлаждение и нагрев
(аппарат адиабатен относительно внешних условий). Нензве-
274
стные расход пара на выходе М (кг) и концентрация жидкости
сп находятся из баланса теплоты н массы:
1ъ+хЖ%•
+ (\+Хл — М)1п*
сь+Х4Сг «А!Сб* + (1 +х* — М)сп
и зависимости ¿« .« /(с*) на линии насыщения жидкости.
Смешение. Н а рис. 15 .10 представлен для примера процесс
неизотермического смешения потоков насыщенной жидкости
(точка /) и сухого насыщенного пара (точка 2 ). В результате
получается парожидкостная смесь (точка 3). Эта точка лежит
на линии, соединяющей точки / и 2. Количество вещества в вы
ходящем потоке равно сумме входящих веществ. Так как сме-
О.нг, Г/.Г,
О
б
Рис. 15.10. Принштвальная схема процесса смешения (а), абсорб
ция (б) и нх »обряжение в ¿-с -диаграмме (в).
шенпе происходит в изолированной относительно внешних усл о
вий системе, то баланс теплоты и массы можно представить
в виде
а£,+Ь*,-(а+Ь)/*3,
ас1+Ьс2« (а+&)/с»,
(15.14)
откуда 13=» (аь+Ы2)/(а+Ь), с3=» (ас1+Ьс7)/(а+Ь). (15.15)
Аналогично можно рассмотреть процессы смешения для других
условий.
Абсорбция. Абсорбцией называется процесс поглощения га
зов или паров жидкими поглотителями (абсорбентами). Абсорб
ция включает в себя два процесса — смешение жндкой и па
ровой фаз и поглощение пара жидкостью. Воспользуемся тем
ж е рисунком (см. рис. 15 .10 ) для объяснения процесса аб
сорбции.
Рассмотрим те же исходные условия, что и для процесса
смешения — абсорбцию сухого насыщенного пара состояния 2.
18#
275
насыщенной жидкостью в состоянии /. В результате процесса
смешения образуется парожидкостная смесь. Поэтому для пол
ной абсорбции паровой фазы необходим отвод теплоты. Если
процесс абсорбции представить по составляющим процессам,
то для смешения по (15.14) и (15.15) рассчитывают состояние
3, а теплота, отводимая в абсорбере, определится из процесса
2-3
—4:
Свьв (л+Ь)(/а — /4)“ в**1+5/2— (а+Ь)и.
(15.16)
Рпс.15.11 . Диаграмма /—с для веществ первой (а) ■ второй (б) групп.
К тому же результату мы придем, составляя уравнение ба
ланса теплоты для аппарата в целом. Нами рассмотрены изо
барные процессы и их представления в ( — с -диаграммах. Д ля
установок различного назначения приходится рассчитывать про
цессы при нескольких давлениях, либо неизобарные. На рис.
15 .11 приведены I — с -днаграммы для двух рассмотренных групп
бинарных систем. При этом Рг>р*>Рэ>Р4> ..., /1>7’*>7’з>
> Г 4."Iа области за пределами растворимости не приводятся.
| 15Л. АБСОРБЦИОННАЯ ХОЛОДИЛЬНАЯ МАШИНА
Как уж е указывалось, абсорбционные холодильные машины
относятся к классу теплоиспользующих, в которых эффект ох
лаждения достигается вследствие трансформации теплоты пу
тем совмещения прямого цикла преобразования ее в работу и
обратного цикла — получения холода с затратой работы. По-
276
этому в осуществлении цикла машины участвуют три источника
теплоты: нагреватель, окружающая среда и охлаждаемый объ
ект. На рис. 1 5 . 1 2 приведена схем а простейшей абсорбционной
холодильной машины, которая может работать на бинарных си
стемах как первого, так и второго типов (см. § 15 .3). Изобра
жение циклов в i — ¿ -диаграмме для каждой группы приведено
на рис. 15 .13 . Машина состоит из парогенератора /, конденса
тора //, испарителя III, абсорбера IV, насоса V, рекуператив
ного теплообменника VI н регулирующих вентилей Р В 1 и РВ 2 .
Раствор с концентрацией стпри температуре Т4 и давлении
кипения ро (точка 4) подается в насос, где его давление повы
шается до давления конденса
ции рк. Естественно, что концент
рация раствора не изменяется.
Из-за несжимаемости жидкости
i4=¿fl и узловые точки 4 и 9 тер
модинамического цикла совпа
дают. Однако раствор при с=*сг,
Г » Г 4 и р=*=рк ненасыщен. В ре
куперативном теплообменнике VI
он нагревается до состояния на
сыщения (точка 1) потоком раст
вора, подаваемым из парогенера
тора /. В парогенераторе при
подводе теплоты от греющего ис
точника qtt раствор кипит, его
концентрация по труднокипяще-
му компоненту повышается от
Ст до са (процесс по раствору
/—2 ). При этом образуется пар (точка 5), равновесный
среднему состоянию раствора (точка т ) . Пар направляется
в конденсатор, где сжижается при рк* const (процесс 5—6)
и отводе теплоты конденсации qKg. Затем жидкость состоя
ния, соответствующего точке 5, дросселируется в регулирую
щем вентиле Р В 1 . Так как процесс происходит при
const
и Cd—const, точки 6 и 7 совпадают. Однако состояние 7 соответ
ствует влажному насыщенному пару, который поступает в ис
паритель, где он кипит при подводе теплоты qo от охлаждае
мого объекта (процесс 7—8). Поток из испарителя в состоянии,
соответствующем точке 8, направляется в абсорбер. Туда ж е
поступает раствор из парогенератора с концентрацией са после
охлаждения в рекуперативном теплообменнике (процесс 2—3)
и дросселирования в регулирующем вентиле (процесс 3 —За).
Оба процесса происходят при ce~con st. Как и ранее, при дрос
селировании точки 3 и Jo совпадают. Положение точки 3 на
диаграмме зависит от относительных количеств потоков раст
вора и недорекуперацин в теплообменнике VI (ДГ г ,—T j— Т4).
В абсорбере происходит поглощение пара раствором, при от
ряс. 15 .12 . Прянаипиальиая схема
абсорбционной холодильной м а
шины.
277
воде теплоты абсорбции <7«. Концентрация раствора изменяется
при этом от са до ¿V. Параметры потока раствора на выходе из
абсорбера соответствуют точке 4. На этом цикл замыкается.
Различие термодинамических циклов по рис. 15 .13 , а и
15 .13, б состоит только в том, что во втором случае из генера
тора подается пар, не содержащий труднокипящего компонента
(£¿ = 0 ) . Поэтому процессы конденсации и кипения происходят
при постоянных температурах. В первом случае с * Ф 0, а конден
сация и кипение происходят при переменных температурах. Ог
раничение температурного уровня охлаждаемого объекта при-
Рв с. 1 5 . 1 3 . Изображение цикла абсорбционной холодильной машины
в I—¿ -диаграмме для рабочих веществ первой (а) и второй (б) групп.
водит к тому, что приходится ограничивать максимальную тем
пературу кипения в испарителе / 0т*х. Поэтому для рабочих ве
ществ первой группы из испарителя выходит влажный насыщен
ный пар (точка ¿ ), содержащий сухой насыщенный пар (со
стояния 8” ) и насыщенную жидкость (состояния 8'). Темпера
ту р а кипения в испарителе меняется от Гошт (равновесной р=>
= Р о и с —с г ) до Тотах- Отнесем массовые количества потоков,
проходящих через разные элементы машины, к 1 кг пара, посту
пающего в конденсатор. Отношение массы раствора, подавае
мого из абсорбера в парогенератор, к массе пара, поступающего
в конденсатор, называю т кратностью циркуляции
раствора /;ее определяют из массового баланса парогене
ратора или абсорбера. Количество подведенных или отведенных
теплот для каждого процесса определится из тепловых балан
сов. Д л я упрощения получения расчетных зависимостей каждый
278
из аппаратов с входящими и выходящими потоками выделяется
контрольной поверхностью, и для нее составляются балансные
соотношения. Н а рис. 1 5 . 1 2 пунктиром проведена контрольная
поверхность для парогенератора.
Из массового н теплового балансов /сгв 1с« |+(/— 1)с в н
//1 — 1* |5+ ( / — 1)¿2, получаем кратность циркуляции и удельное
количество тепла, подведенного к парогенератору / » ( с в — сл)/
(с«—Сг). <7п*=(*в—^ )+/(^ 2—М*
Аналогично из тепловых балансов других аппаратов полу
чим удельные теплоты: отведенную в конденсаторе и подведен
ную в испарителе соответственно Я щ = 1ъ — ¿в* <7о = * 7— «в***«— *в»
отведенную в абсорбере и передаваемую в рекуперативном теп
лообменнике соответственно
яа=(и- ь .)нох- м
.
ятй—Ц1\— ад—(/— 1)No — *з).
Естественно, что для машины в целом количества подведен
ных и отведенных теплот равны:
Удельная теплота
г, связана с внутренней рекуперацией и
поэтому во внешний баланс не входит.
Термодинамическое совершенство машины оценивают теп
ловым коэффициентом
6-<7о/?п,
либо эксергетическим к.п .д .:
Паке TM Д£ота/Л£подв*
где Д £ Ств и ДЕоодв — отведенные н подведенные потоки эксергии.
Глава 16
ОСНОВНЫЕ ПРИНЦИПЫ
ЭКСЕРГЕТИЧЕСКОГО МЕТОДА АНАЛИЗА
| 16.1 . РАБОТОСПОСОБНОСТЬ СИСТЕМЫ.
ЭКСЕРГИИ
Как уж е указывалось, в заданных условиях окружающей
среды только часть теплоты может быть превращена в другой
вид энергии (например, р аботу). При проведении теплотехниче
ских расчетов нас обычно интересует лишь та часть энергии,
которая может быть использована для получения того или
иного технического эффекта. Е е называют «пригодной». Л и ш ь
в некоторых сл уч ая х энергетических преобразований значения
всей и пригодной энергии могут совпадать (например, ндеали-
279
знрованный процесс превращения электрической энергии в м еха
ническую и т. д .) . Часть энергии, которую нельзя превратить
в другие виды в заданных условиях окружающей среды, явля
ется обесцененной.
Примером системы, обладающей огромным количеством обес
цененной энергии, является сама окружающая среда. (Со
стояние равновесия относительно окружаю щ ей среды вполне
удачно называется в английских учебниках термодинамики
«мертвым» состоянием.) Можно сформулировать следующие
положения.
1. Только система, находящаяся в неравновесном состоянии
с окружающей средой, обладает пригодной энергией.
2. После достижения системой равновесного с окружающей
средой состояния ее работоспособность оказывается исчер
панной.
3. Д л я производства максимально возможной работы при
переходе системы из данного состояния в состояние, равновес
ное с окружающей средой, все процессы, происходящие в ней,
должны быть обратимыми.
Определим понятие работоспособности, или максимальной
работы. Рассмотрим систему, состоящую из тела с начальными
параметрами ТХч Уи рь
и окружающей среды с неизменными
параметрами р<ь Го. Исследуем процессы перехода тела из д ан
ного состояния в равновесное с окружающей средой, обозначив
внутреннюю энергию среды в начальный момент через и 0\ и
в конечный — ¿Лю. Параметры тела в состоянии, равновесном
с окружающей средой, обозначим через Г2,
р% и2.
Суммарная внутренняя энергия системы в начальном и ко
нечном состояниях соответственно равна
£/'-£/,+ £/«.
и"=и2+ип.
Если будем рассматривать замкнутую систему, то работа
может быть произведена только за счет уменьшения ее внутрен
ней энергии:
Г-£/'— £/"- (С/,— и2)+(£Л>|—ад.
(16.1)
Тело в общем случае может обмениваться со средой энергией
в форме теплоты (?0 и в форме работы расширения или сжатия
Ь. Согласно первому закону термодинамики
Цп — £/<>1 = (?о+£о.
При условии неизменности давления окружающей среды
Го=Ро(1^2 — УО,
следовательно,
I/« — £/<>2 “
— Яо—Ро(Уа— У|)
или, подставляя значение и 01 — и 02 из выражения (16 .1), имеем
I-(их- и2)- <?„-
Ро( - V|).
280
Примем, что процесс теплообмена тела с окружающей сре
дой происходит обратимо, т. е . изотермически при Т0 и при бес
конечно малой разности те мператур. Это количество теплоты
можно представить как
Qo—To(Sm — S oi),
где Soi и S 02 — значения энтропии окружающей среды в началь
ном и конечном состояниях. Поскольку при осуществлении об
ратимых процессов суммарное изменение энтропии системы
должно равняться нулю, изменение энтропии среды (S0 2— S 0i)
равно изменению энтропии тела, взятому с обратным знаком.
т. е. 5 , —- Бг. Тогда окончательное выражение для максималь
ной работы примет вид
£тах*= (£/|— и*) —7о(5|—$2)—ро(Уг— УО,
а для удельной максимальной работы
/т*х-(«1 — Иа) — 7о($| —$2) —Ро(^2— »1>,
(16.2)
или иначе, поскольку И1+Ро0 1=М и и2+Р<>0 2= « 2.
/шхя *1-- ¿2-- 7*0(51 --$2).
Изобразим в координатах р — и процессы, происходящие
в нашей системе при переходе ее из неравновесного состояния 1
в состояние 2, равновесное с окружающей средой (рис. 16 .1, на
котором все обозначения соответствуют принятым ранее). Так
как по принятому условию все процессы должны быть обрати
мыми, а рассматриваемая система состоит из рабочего тела и
одного источника теплоты — окружающей среды, процесс со-
281
вершения работы 1 — а должен проходить без теплообмена,
т. е. аднабатно.
Работа расширения в этом процессе для случая 7 1 > Т 0,
р > р 0 (рис. 16 .1 , а) соответствует площади 1аес. Процесс пере
дачи теплоты должен происходить изотермически при темпера
туре окружающей среды Т0. Работа, затрачиваемая в этом про
цессе, соответствует площади а2(1е. Площадь 2Ьсй соответствует
работе сжатия, производимой окружающей средой над рабочим
телом и равной р(иг— Н|). Максимально возможная работа,
произведенная телом при переходе из состояния 1 в состояние
2 %соответствует площади 1а2Ь.
Для случая, когда Т\<Т о, р<Сро (рис. 16 .1,6), минимальная
подведенная работа определяется аналогичным путем и может
быть представлена площадью 1а2Ь.
По 3 . Ранту, максимально возможная работа, которая мо
ж ет быть произведена телом в результате его взаимодействия
с окружающей средой, называется эксергией. Величину пол
ной эксергии обозначают через Е * а удельное значение ее ех.
При использовании этого понятия работа, подсчитанная по ф ор
муле (16 .2), может быть определена как удельная эксергия
неподвижного тела, обладающего внутренней энергией щ и за
писана в виде
(Ы1 — и2) — Гр(51— 52) — Ро(од—У\).
Поскольку в большинстве теплосиловых и холодильных уста
новок приходится иметь дело с непрерывным потоком рабочего
тела, то для удобства анализа работоспособности этих устано
вок представляется целесообразным ввести понятие эксергии
потока.
Рассмотрим неизолированную систему, состоящую из источ
ника работы, потока рабочего тела с параметрами Ти Ри ¡\
и окружающей среды с параметрами 7 0, ро. ¿о-
Проанализируем в диаграмме 7 — 5 (рис. 16.2) обратимо
происходящие процессы при переходе потока из неравновесного
состояния 1 в равновесное состояние 2. Работа, совершаемая
потоком в обратимом адиабатном процессе при изменении тем
пературы от Г| до То, равна
^обр ■**1
,Л»
где 1а — энтальпия потока, соответствующая температуре среды
Т0.
В состоянии а давление ра в потоке будет ниже, чем давле
ние окружающей среды. Д ля достижения состояния, равновес
ного с окружающей средой, от потока, имеющего температуру
То, изотермически долж но быть отведено количество теплоты
Фа-* необходимое для повышения давления потока до значения
р2=Ро-
282
Работа, совершаемая потоком в обратимом изотермическом
процессе, будет равна
С,’-
где индекс 2 соответствует параметрам потока в состоянии 2,
равновесном окружающей среде (рз^-ро* 7 з« зГ 0).
| 1в £ . ПОТЕРИ РАБОТОСПОСОБНОСТИ
И ЭКСЕРГЕТИЧЕСКИИ К.ПД.
Понятие эксергии приобретает определенные преимущества
при анализе степени совершенства того или иного элемента
тепловой или холодильной машины (турбины, компрессора, на
соса, теплообменника, дросселя и т. д .) . Рассмотрим какой-либо
элемент, в который входит поток рабочего вещества, обладаю
щего эксергней ехлг\ значение эксергии на выходе из элемента
обозначим через еХШых- Внутри элемента поток производит по
лезную работу /, или по отношению к потоку совершается ра
бота; к потоку подводится или от него отводится теплота.
Механическая работа может быть целиком преобразована
в другой вид энергии, например в теплоту. Что же касается теп
лоты, то согласно второму закону термодинамики только часть
ее может быть реализована в виде работы. Если теплота под
водится при температуре Г, а отводится при температуре окру
жающей среды Та, то эта реализуемая часть может быть рас
считана как <7(1 — Т0/Т), где 1 — Та/Т=*гц,к — к.п.д. цикла
Карно.
Отсюда баланс работоспособности элемента в случае обра
тимого протекания процессов может быть представлен уравне
нием
0«2е„+2:?»(1 - Го/Т)+!/„.
(16.3)
<
к
т
При использовании этого уравнения следует помнить, что
все подводимые потоки энергии берутся с положительным зн а
ком, а отводимые — с отрицательным.
В выражении (16.3) можно заменить знак суммы интегра
лом (например, в случае подвода теплоты при переменной тем
пературе) .
В случае необратимого протекания процессов в элементе
неизбежно имеют место потери работоспособности (эксергии).
При этом сумма в левой части не будет равна нулю, и выраже
ние (16.3) примет вид
То1Т) Ч"2/т*
1
к
ж
В каждом элементе установки в результате подведения или
отведения некоторой энергии и массы выходная работоспособ
ность возрастает или уменьшается. Исходя из соображений по
тери работоспособности, м ожет быть введен эксергетический
283
к.п.д. элемента, который представляет собой отношение отве
денной работоспособности (эксергии) еХОтшко всёй подведенной
¿*ХПОД»*
Т|вКСа“ £жОТ»/£хПОД1 “ 1 --- Лбх/вхоодв»
где Дех — внутренние потери эксергин в данном элементе.
Если в элементе нет никаких потерь, связанных с необра
тимостью процессов, то Ч а к о » !. Следовательно, эксергетический
анализ имеет смысл только при наличии необратимости про
цессов.
Следует различать к.п.д . отдельного элемента и общий к.п .д .
установки. Если установка предназначена для получения меха
нической работы /, к .п л . имеет вид
Лесе ■ = ¿/¿хаодв*
Если установка предназначена для производства холода,
к.пл . имеет вид
Я«о в ¿жо/^жподв»
где еХо — эксергня, отведенная от объекта охлаждения.
| 16Л. ЭКСЕРГЕТИЧЕСКИЙ АНАЛИЗ РАБОТЫ
ПАРОВОЙ ХОЛОДИЛЬНОЙ МАШИНЫ
Эксергетический анализ позволяет судить о термодинами
ческом совершенстве процессов, происходящих внутри каж дого
элемента машины. Сумма потерь во всех элементах соответ
ствует общей потере работоспособности и может служить мерой
оценки степени совершенства всей машины. Используя этот
метод, выполним анализ потерь работоспособности в элемен
т а х паровой холодильной машины.
Пусть на привод компрессора затрачивается электроэнергия
в количестве
Тогда удельное количество энергии, вводимое
в установку:
где М — расход холодильного агента.
На рис. 16.3 изображен цикл /—-2
—5—4—5—6—1вдиа
грамме /—1
Внутренние потери в компрессоре описываю тся
выражением
£х*~е*вх+£ж1 — ехг.
Здесь и в дальнейшем числовые индексы соответствуют но
мерам точек на рисунке.
Потери в конденсаторе состоят из двух слагаемых:
1) эксергии, отводимой охлаждающей водой:
*х|"°ШЛшЧштл{1 - Го/Г),
284
где <7коад — удельное количество теплоты, отводимой в конден
саторе;
2) эксергнн, теряемой из-за необратимости процесса тепло
обмена в конденсаторе:
¿„"овд«** — ех<—
Если теплота, отведенная в конденсаторе, используется,
то
ех1ковд*0.
Потери эксергнн в переохл адителе
Де*"»**« —
Рис. 16.2 . Процессы взаимодействия
Рис. 16.3 . Сопоставление эксергети-
системы с окружающей средой в
веских к .п .д . холодильных машин,
координатах Г—з.
Потерн эксергнн в регулирующем вентиле
Де*р ш= е х6—ехв.
Отвод эксергнн в испарителе
г*"«** —
причем из этого количества используется для охлаждения
рассола при Гр только часть, называемая в дальнейшем приве
денной холодопроизводительностью:
£хс=* — <7о(1 ~ - То/Тр).
Остальная часть эксергнн теряется из-за необратимости про
цесса теплообмена:
Де*"«е*я— <?,о.
Сведем удельный баланс эксергнн для двух циклов /—2 —3 —
4—5 —6—/ и 0—/6—3 — 6
—
Я изображенных на рис. 16.3 .
285
Таблвца 16.1 Исходные характеристики м клов
Величина
Цикл
¡-2
—
3-4
—
5
-
б-/
Цикл
9-М
-3
-4
-
8-9
Т е м п е р а т у р а р а с с о л а Г » * К .................................................
258
273
Д а в л е н и е в с а с ы в а н и я Р ше, П а ...........................................
190000
291000
Давлен ие нагнетания Р а. П а ...........................................
1165000
1165000
Температура конденсации ТЯОЛл> К
.........................
303
303
Температура кипения Тяяп, К
...........................................
253
263
Температура окружающей среды Г©, К
.
.
.
.
293
293
А д и а б а т н ы й к п . д . х\л .............................................................
0.9
0.9
В соответствии с обозначениями в качестве исходных данных
примем значения, указанные в табл. 16.1 . Температура окру
жающей среды принята для обоих циклов одинаковой.
Эксергетическнй к.п .д . холодильной машины может быть под
считан к ак отношение приведенной холодопронзводительности
к подведенной эксергин:
Т)аксв £жО?£хах.
Для первого цикла т)акс— 0,487, для второго — т)Жс = 0,3584.
Холодильный коэффициент е = ф о А < для рассмотренных циклов
равен соответственно 4,24 и 5,436. Из сравнения можно сделать
вывод о том, что цикл 9—10—З —4 —о —9 совершеннее цикла
1 —2 —3 —4—5 —6—1. На самом деле в первом цикле приходится
переносить теплоту Qo к окружающей среде с более низкого тем
пературного уровня, а сам цикл осуществляется более совер
шенно. Это видно нз сравнения значений относительных потерь
в испарителе.
Приведенный анализ демонстрирует определенные преиму
щества эксергетнческого метода перед энтропийным, а именно
возможность анализа необратимых потерь в отдельно взятом
элементе и возможность оценки совершенства цикла с точки
зрения его необратимости с помощью т)ш . характеризующего не
только количество холода, получаемого при затрате единицы
мощности, но и его энергетическую ценность.
| 16.4 . ЭКСЕРГЕТИЧЕСКНЙ АНАЛИЗ
РАБОТЫ ПАРОСИЛОВОЙ УСТАНОВКИ
Пусть в паросиловой установке при сжигании топлива к р а
бочему телу подводится теплота (?, тогда
£*подвв
(1 — То1Ттъх)9
где М — паропроизводительность котла; Гт »х и Го — темпера
туры источников теплоты.
286
На рис. 16.4 представлен цикл Ренкина паросиловой учти
новки.
В котел поступает вода с температурой ТЬд при давлении р и
ее эксергия может быть рассчитана по выражению:
ех\■хКв
—<
’о) —То^ьд —50).
В котле к воде подводится поток теплоты р ' от горячего ис
точника, имеющего температуру Гт, следовательно,
ежт^'О -Го/Гт).
Пар, покидающий котел с температурой Т\ и давлением р и
обладает эксергней
е*.«*-(^1°—¿о)- Го(5,°- 50).
Тогда потеря эксергии в
котле может быть рассчи
тана из выражения
(^|их “Ь
вы х*
Поток пара поступает в
паропровод с параметрами
р\° и Г|°, а выходит с пара
метрами р| и Т\. Очевидно,
что эксергии пара на входе
и на выходе из котла рав
ны между собой
Сх»ХП* ^Х1 ЫХК*
эксергия же пара на вы
ходе
из
паропровода
елвых■"(*!—¿0)— *о($1—$о).
Тогда потеря эксергии в па
ропроводе
А**п= ехяг* — ^г»ыхп.
В турбину подается пар с начальными параметрами р х н Т\,
параметры пара на выходе из нее рз и Т2ч. Естественно, что
^хвхТ ж ^хвых°| в то время, как
СвыхТ "
—
¿о)— То($1д— 5о).
Поскольку турбина производит полезную работу /т, то эк
сергия в этом элементе будет
Д£*т TM (е*вхт — ех*ы1т) — /т.
Эксергия пара, поступающего в конденсатор:
е*тх*овя ■ паевых7.
Вместе с тем эксергия конденсата, покидающего конденса
тор, рассчитывается из выражения
Рве. 16.4 . Потерн эксергия в элементах
паросиловое установки.
287
еХшы1*оп* = ( Ь - 1о) -Г 0(5а-50).
Потеря эксергни в конденсаторе оценивается уравнением
е**0“* —еХтх|1011Я- ехшыхмоал-
Эксергня конденсата, поступающего в насос, равна
е*.хи-*х»ы*ковд,
а эксергня воды, выходящей из насоса
Для привода насоса затрачивается работа
/н* *5#— *3*
Тогда потеря эксергни в насосе составит
Д*х" = *хвхн “ <?хвыхв.
Эксергетический к.п .д . паросиловой установки может быть
рассчитан по выражению
Лжс * 1 — 2Дех/ехподв= 1 — 2Авх/|</(1 — Го/Т}].
§ 16.5 . ГРАФИЧЕСКОЕ ИЗОБРАЖЕНИЕ
ЭКСЕРГИИ И ЭКСЕРГЕТИЧЕСКАЯ ДИАГРАММА
Как было показано, эксергетический метод позволяет оценить
внутреннюю несовершенность того или иного процесса, происхо
дящего в элементе установки, оперируя внешней его характе
ристикой. Д л я этого достаточно знать значения эксергни на
входе и на выходе из элемента и эксергию внешнего теплового
¿ю тока, если таковой имеется.
Из определения эксергни потока, следует, что она зависит
только лишь от параметров состояния потока н параметров
среды. Таким образом, при ус
ловии постоянства параметров
среды (ро и Го) эксергию можно
рассматривать как новый пара
метр
потока, взаимодействую
щего со средой.
Эксергня потока может быть
представлена в диаграмме /—э.
Пусть точка 1 на рис. 16.5 соот
ветствует состоянию вещества
•при давлении р и температуре Г,
точка же О — состоянию веще-
Рис. 16.5 . Эксергня потом 1 ко-
ства- равновесному окружающей
ординат« I—*.
среде, имеющей параметры р0
2в8
и Го- Проведем касательную к изобаре р0 через точку О.
Можно легко доказать справедливость следующего выра
жения:
(д*/дз)р- Г .
Тогда из рис. 16.5 следует, что 1 д а = Г . Значение угла мо
жет быть определено из условия а ^ а г ^ з Г0. Прямую, прове
денную через точку О под углом а , называют прямой среды.
Тогда отрезки 06=5| —
аЬ=(5, — 5г)1£а=(5|—50)Г0;
1Ь = 1\—¿о и, следовательно, отрезок /а=1‘Г—¿о— Г0(5!—
5о), а это и есть эксергня потока ех-
Таким образом, можно сформулировать следующее правило:
в диаграмме <— 5 эксергня потока может быть показана верти
кальным отрезком, прове
денным из точки, отвечаю
щей состоянию потока, на
прямую среды.
Для удобства пользова
ния в диаграмме можно на
нести
несколько
прямых
среды,
соответствующих
различным температурам. В
таком виде диаграмма I—5
более удобна при проведении
эксергетического
анализа.
Существует другой более
сложный способ дополнения
диаграмм, а именно нанесе
ние линий постоянной эксер-
гии. Однако при использовании таких диаграмм следует вносить
коррекцию в случае, если температура окружающей среды от
личается от принятой при построении диаграммы.
Наряду с описанными способами возможно построение ди а
грамм, в которых эксергня потока выступает в качестве одного
из основных параметров.
Так, английский термодинамик Д ж . Кинан предложил диа
грамму ех — $ для водяного пара. Позднее П. К. Гроссманом,
В. М . Бродянским и И. П . Ишкиным были построены для воз
духа и некоторых холодильных агентов диаграммы / — е * кото
рые нашли применение при анализе соответствующих циклов.
Эти диаграммы также построены для одной конкретной темпе
ратуры среды и требуют коррекции при переходе к другому ее
значению.
На рис. 16.6 приведена схема ех — 5 -диаграммы. В этой диа
грамме по оси ординат отложены значения эксергий, по оси
абсцисс — энтропий. Линии постоянных энтальпий развернуты
на некоторый угол по отношению к осям ординат. В левом и
правом нижних углах диаграммы приведены масштабы темпе
ратуры окружающей среды в пределах от 0 до 50° С. Нулевая
19 Зак. 80
289
изотерма окружающей среды совпадает с осью 5. Значения ех,
помеченные по оси ординат, соответствуют температуре окру
жающей среды, равной 0°С . Для температур среды в пределах
О—5 0 °С значение ех определяется по разности значений эксер-
гни для рассматриваемой точки и точки на линии среды.
Для оценки эффективности системы кондиционирования воз
духа (СК В) можно воспользоваться понятием эксергетического
к.п .д ., представляющего собой отношение полученного в кон
диционере приращения эксергии £ » и эксергни, затраченной на
осуществление процессов в системе.
Рассмотрим схему СКВ, показанную на рис. 16.7, в соответ
ствии с которой наружный воздух (состояние О) подогревается
в первом калорифере (О— /), обрабатывается в камере ороше-
Рис. 16.7 . Схема прямоточной СКВ.
I . / / / — калоряфвры; // — капера орошанва; /V — веаткдатор; V — насосы.
ння (/— 2 ), а затем доводится до требуемых параметров во вто
ром калорифере (2—5), далее воздух вентилятором подается
в помещение в состоянии 4 .
Как и прежде, термодинамическую эффективность системы
можно оценить в соответствии с эксергетическнм к.п .д . форму
лой
в (£*4 — £*<>)/(Д£*1с1+Д£*ко+А£ажа4*Л^1+2ДОн)*
где £ Хасо— используемая
эксергия;
2 £ х пода — затраченная
эксергия,
в
том
числе: Д£»оч Д£хяз — в
калориферах;
Д£жко — в камере орошения; NШt ЛГ,, — мощность вентилятора и
насосов соответственно; Е Х4=вМлеХ1+* и £ хоя*Л!*ех1+а — пол
ная эксергия влажного воздуха, подаваемого в помещение и на
входе в кондиционер.
| 16.6 . ЭКСЕРГЕТИЧЕСКИИ МЕТОД АНАЛИЗА
СИСТЕМ КОНДИЦИОНИРОВАНИЯ ВОЗДУХА
Г4
▲
290
Удельное значение зксергии рассчитывается по формуле
— ¿»о—
— 5м)4 “<А(^п— ¿по) — 7о($п — ¿оо)Ь
где в, п — индексы, обозначающие соответственно сухой воз
дух н водяной пар; 0 — индекс, обозначающий параметры, соот
ветствующие состоянию окружающей среды.
Следует отметить, что удельное значение ех\*4 отнесено
к смеси 1 кг сухого воздуха и й кг водяного пара.
19*
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Кириллин В, А. н др. Техническая термодинамика. М , 1979. 5 12 с.
2. Бэр Г. Л . Техническая термодинамика. М ., 1977. 5 18 с.
3. Арнольд Л . В . и др. Техническая термодинамика н теплопередача.
М., 1979. 443 с.
4. Архаров А. М* Марфвнина Я. В ., Микулин Е. И. Теория и расчет
криогенных установок. М ., 1978. 4 16 с.
5. Епифанова В. Я . . Аксельрод Л. С. Разделение воздуха методами глу
бокого охлаждения. М .. 1973. 472 с.
6. Кириллин В . А . и др. Термодинамика растворов. М .,
1980. 287 с.
7. Бродянский В. М. Эксергетический метод термодинамического ан а
лиза. М ., 1973. 296 с.
8. Холодильные машины / Под ред. Н. Н. Кошкина. М .,
1973. 512 с.
9. Теплофизические основы получения искусственного холода. Справоч
ник. Мм 1980. 231 с.
10. Бадылькес Я . С.,
Данилов Р. Л . Абсорбционные холодильные м а
шины. Мм 1966. 217 с
ОГЛАВЛЕНИЕ
П р е д и с л о в и е ......................................................................................................................3
Гл ава 1 . Основные яо яа т яа . Идеальный г а з .................................................... 3
4 1 . 1 . Задачи изучения к у р с а ................................................................................ —
$ 1.2 . Идеальный газ. Термодинамические параметры состояния.
Уравнение с о с т о я н и я ...................................................................................... 6
4 1.3 . Смес и г а з о в ...................................................................................................... 1 2
§ 1.4 . Равновесное состояние и раановсспый процесс. Система ко
ординат р — о
................................................................................................ 16
Гл а ва 2. Первый закон т е р м о д и н а м и к и .................................................................2 1
4 2 .1 . Теплота. Эквивалентность теплоты и р аб о т ы .............................
4 2 2 . Аналитическое выражение первого закона термодинамики.
4 2.3 . В нутренняя э н е р г и я ..........................................................................
§ 2.4 . Р або та изменения о б ъ е м а ..................................................................
Гл а ва 3 . Теплоемкость. Энтальп ия и в и т р о л я я ............................................
4 3 . 1 . Теплоемкость массовая, объемная, м о л ь н а я .............................
4 3.2 . Зависимость теплоемкости от п р о ц е с с а .....................................
4 3.3 . Э н т а л ь п и я ................................................................................................
§ 3.4 . Энтропия. Т епловая д и а г р а м м а ....................................................
Глава 4. Процессы изменения состояния идеального газа ....
! I 4.1 . Задачи и последовательность изучения процессов .
|' 4 .2 . Иэохорный п р о ц е с с .................................................................................
1 1 4 .3 Изобарный процесс .................................................................................
!' 4.4. ИэотермическШГ п р о ц е с с ............................................
1 >4.5 . Адиабатный п р о ц е с с .........................................................................
|> 4.6 . Политропкый п р о ц е с с .........................................................................
4.7. Сж ати е газов. Теоретический процесс газового компрессора.
Гла ва 5. Второй закон т е р м о д и н а м и к и ...........................................................
4 5 .1 . Формулировки второго закона. Основные понятия .
4 5.2 . Круговые процессы или ц и к л ы ....................................................
§ 5.3 . Цикл К а р н о ........................................................................................
4 5.4. Регенеративный ц и к л ............................................................................
§ 5.5 . Свойствами физический смысл энтропии. Некоторые свойства
обратимых и необратимых ц и к л о в ............................................
Г лав а 6. Циклы газовых м а ш и н .........................................................................
§ 6 .1 . Теоретический цикл воздушной холодильной машины <
4 6.2. Циклы поршневых газовых д в и г а т е л е й .....................................
4 6.3 . Циклы газотурбинных у с т а н о в о к ....................................................
$ 6.4. Циклы реактивных двигателей ....
.
.
.
.
293
$
8
8
1
3
?
а
3
2
8
1
£
8
5
2
8
1
8
Ж
Глава 7. Дифференциальные уравнения термодинамики .
.
.
.
Ю1
§ 7 .1 . Дифференциальные уравнения при независимых переменных
Д и Г ....................................................................................................... —
ехоторые приложения дифференциальных уравнений тер
модинамики
................................................................................................ 104
§ 7.3 . Характеристические ф у н к ц и и ...................................................... 10 5
Гл ава 8. Реальные г а з ы .................................................................................... 10 0
§ 8.1 . Общие представления. Фазовая диаграммар — Т
.
.
.
—
§ 8.2 . Качественные особенности и количественныеотклонения
реальных газов от и д е а л ь н ы х ....................................................... 1 1 1
§ 8.3 . Уравнения состояния реальных г а з о в ....................................... 1 1 8
4 8.4. Закон соответственных состояний. Термодинамическое по
добие
......................................................
.
.
.
.
.
.122
Гл ава 9. П а р ы ........................................................................................................ 1 2 4
§ 9 .1 . Основные понятия и о п р ед е л е н и я ..................................................
§ 9.2 . Процесс парообразования при постоянном давлении. Диа-
Д >амма р — и д л я п а р а .............................................................. 1 2 7
роцесс подогрева жидкости.
Параметры
насыщенной
ж и д к о с т и ................................................................................................... 1 3 1
§ 9.4 . Процесс парообразования. Параметры сухого насыщенного
пара ....
.
.
.
.
136
8 9Д _И ар ам е г р ы в лаж но го п а р а ........................................................... ¡ 3 9
§1Гб. Процесс перегрева пара. Параметры перегретого пара .
140
I 9.7 . Термодинамические таблицы и д и а г р а м м ы ..............................14 1
4 9.8 . Термодинамические процессы д ля п а р а .......................................... 14 8
$ 9.9 . Уравнение Клапейрона— К л а у з и у с а ............................................ 1 5 1
Глава 10. Термодинамика процессов истечения газов и иаров. Про
цесс д р ос се л и р о в ан и я ...........................................................
153
$ 10 .1 . Истечение газов и паров. Основные понятия и математи
ческое о п и с а н и е ................................................................................. - г
4 10.2 . Адиабатное нстечеяие из суживающегося сопла .
ДО
$ 10.3 . Истечение через комбинированное соп ла Переход через
скорость з в у к а .................................................................................1 6 5
$ 10.4 . Процесс д р о с с е л и р о в а н и я ..........................................................16 7
Гл ава 11. Циклы паровых холодильных м а ш и н ............................................ 18 0
4 11.1. Основные особенности обратных п аров ых циклов .
.
.
—
4 11.2 . Цикл Карно для паровой холодильной машины.
.
.
181
$ 1 1 . 3 . Теоретический цикл паровой холодильной машины с ре
гулирующим в е н т и л е м * ....................................................................... ДЭЗ
4 11.4 . цикл пароэжекторной холодильной машины....
198
§ 1 1 . 5 . Тепловой н а с о с .....................................................................................200
Гл ава 12 . Циклы криогенной т е х н и к и ............................................................... 203
§ 12 . 1 . Назначение криогенной т е х н и к и .......................................................... —
4 12 .2 . Идеальный криогенный ц и к л ............................................................... 204
§ 12.3 . Циклы криогенной техники для сжижения газов в мас
ш табах п ро м ы ш л е н н ос т и ....................................................................... 207
§ 12.4 . Цикл с однократным д р о с с е л и р о в а н и е м ..................................... —
§ 12 .5 . Ц икл Л и н д е ............................................................................................. 209
§ 12.6 . Потеря холодопроизводительности от недорекупсрадии
и нес овершенства и з о л я ц и и .................................................................. 2 1 2
§ 12.7 . Цикл с д е т а н д е р о м .............................................................................. 2 1 3
Гл ава 13 . Циклы паросиловых у с т а н о в о к ......................................................... 2 1 5
1 3 . 1 . Основные особенности прямых паровых циклов
—
13 . 2 . Цикл Карно для насыщенного п а р а ................................................. 2 1 6
294
§ 13 .3 . Ц нк л Р е н к н н а ........................................................................................ 2 1 0
§ 13.4 . Методы повышения термического к .пд. паросиловых уста
новок .............................................................................................................. 220
$ 13 .5 . Теплофикацион ные ус т а н о в к и » ........................................................ 2 .15
Глава 14 . Основы термодинамики влажного в о з д у х а ..............................236
§ 14 .1 . Основные понятия. Параметры. Уравнение состояния .
—
| 14 .2 . Энтальпия в лаж ного в о з д у х а ........................................................ 242
| 14.3 . Таблицы параметров влажного воздуха. Диа^амма ¿— й, 245
§ 14.4 . Некоторые процессы изменения состояния влажного воз
духа
............................................................................................................. 249
Глава 15. Основы термодинамики растворов. Абсорбционная холо
дильная м а ш и н а ......................................................................................25 5
| 15 . 1 . Основные понятия и з а к о н о м е р н о с т и ............................................ —
| 15.2 . Правило ф аз Г и б б с а ...............................................................................258
$ 15 .3 . Виды растворимости. Явления, происходящие при обра
зовании р а с т в о р о в .............................................................................. 262
§ 15.4 . Законы, описывающие свойства р а с т в о р о в .................................. 264
§ 15.5 . Диаграмма энтальпия — концентрация, процессы в двух
компонентных с и с т е м а х ....................................................................... 270
§ 15.6 . Абсорбцион ная холодильная м а ш и н а .......................................... 276
Глава 16. Основные принципы аксергетнческого метода
анализа. 279
€ 16 .1 Работоспособность системы.
Э к с е р г н я ....................................... —
$ 16.2 . Потери работоспособности и эксергетический к. а . д .
.
. 283
§ 16 .3 . Эксергетический анализ работы паровой
холодильной
м а ш и н ы .................................................................................................... 284
| 16.4 . Эксергетический анализ работы паросиловойустановки. 286
$ 16.5 . Графическое изображение эксергни и эксергетнческая диа
грамма ............................................................................................................288
§ 16.6 . Эксергетический метод анализа систем кондиционирования
в о з д у х а ..........................................................................................................290
Реко мендуем ая л и т е р а т у р а ............................................................................................. 292
ИБ М 1992
Учебное пособие
Редактор Г. А. Григенч
Художественный редактор О. Н. Соеетникова
Технический редактор А. В . Борщева
Корректоры С. К Школьникова, /С. Я . Бенина
Сдаао а яабор 13.01.83. Подвясаио в в и т 04 09.84. М -11363.
Формат бум. 60X90/1«. Бумага тип. М 3. Гараитура литературная. Печать высокая.
Усл. оач. л. 18А Усл. кр.-отт. 18.60. Уч.-яяд. л. 18.18. Тяраж 4000 ака.
Заказ 80. Цаяа 80 коп.
Издательство ЛГУ кмакм А. А. Жданова
100184. Лакмяград. Умиварсятатская наб., 7/0.
Типография М 2 Ленупрвэдата. 19 110 4 , Ленинград, Литейный прч 56.
ОПЕЧАТКИ
Огр.
10
Отрока,
уравнение,
Напечатано
рис.
Ур.Х.5
Т.
-
♦ ?7Э.Гб
Следует читать
тк-1"°С♦273,15
26
31
0.19
лф.*)
I джоуль на килограмм
с-а. *61*ы.12
джоуль на килограмм
с-а.*6Т»СТ2
31
0.9 ,10
сниаУ
л.$■<<■
а,£
иЙ
40 о.И
снизу
звачеше
значимость
54 0,6
сверху
На основании из ана
литической геометрии
На основании аналити
ческой геометрии
89 с.6
оверху
совершав тоя
про походят
102
М
.
В
о
о
произведем
проведем
ИЗ о.15
оверхУ
определение ее осо
бенностей :
определение е е . ’
123
0.4
оверху
рч/**)«- /ДН*г
124
о.II,$9.1
В одним
оверху
в одних
126
с.2
сверху
Температура процеооа
конденсации
Температура процеооа
130
Ъ
о
о
Линии0-Д
ЛинияС-Д
131 С.12
сверху
огревает
отображаются
132
0.1
оверху
£4£
<^аС *
132
132
с.2
оверху
кр-М
%•*
**Я**
1с,1о*? и
.
Я.и
«
1Э6 0.14
СНИЗУ
для данной жидкости
для данвого веиества
136
о
-
~
й
о
о
Для жидкостей с повы
ше кием температуры
С повышением температуры
—
137,
138
o.I
СНИЗУ
o.I
сверху
Отновение количества
теплоты парообразования
к количеству теплоты
Огноиевде количества
теплоты парообразования
и теплоты
144
o.II
сннзУ
Т
*Р
'
Т-Ткр
148
Hie
сверху
Рассмотрим закономер
ности, которые описы
вают основные термо
динамические процессы
Рассмотрим основные
термодинамические
процеосы
234
n
l
о
о
aSvt-i'jJ'с'*т/т
ъ*
235
с.3
сверху
...вода - хладон
...вода - хладон
С в других температур
ных Уровнях )
235
I
с
\
в
>
м
.
я
*
о
о
так как в этом случае
так как в пей
236 0.3
ire
Воздух представляет
оо бой
Он представляет ообой
259
0.14.
сверху
L - число фаз системы
К. •* число компонентов
1 - число фаз системы,
К.
-
число компонентов
273 0.12
сверху
Т*ТеСе*
* сс.
Т*Те
с,•
*е,
*
ЛТИХП,1.152,т.1000.15-02.85