Text
ФАУНА СССР
ИНФУЗОРИИ
II
выпуск
АКАДЕМИЯ НАУК СССР
ЗООЛОГИЧЕСКИЙ ИНСТИТУТ
НОВАЯ СЕРИЯ № 103
ИНФУЗОРИИ
Том II, выпуск 1
А. В. ЯНКОВСКИЙ
ПОДКЛАСС CHONOTRICHA
ИЗДАТЕЛЬСТВО «НАУКА» ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ Ленинград • 1973
УДК 593.17
Подкласс Chonolricha. Янковский А. В. В серии: Фауна СССР (Новая серия, № 103). Инфузории, том II, вып. 1. 1973. Изд-во «Наука», Ленингр. отд., Л. 1—356.
Подкласс Chonolricha с одним отрядом Chonotrichida, считавшийся ранее мелкой, аберрантной группой инфузорий, в действительности богат родами и видами и имеет сложную внутреннюю структуру. Различаются 2 подотряда хонотрих—Ехо-gemmina (6 семейств, 15 родов) и Endogemmina (5 семейств, 29 родов); они приурочены к разным группам хозяев. Большинство описанных родов и видов обоих подотрядов и часть семейств эндемичны для фауны СССР. Дается детальный обзор морфологии и морфогенеза хонотрих, прослежен их сложный и своеобразный жизненный цикл, коррелированный с экзувиальным циклом хозяев, приведены данные по экологии хонотрих и их географическому распространению в морях и пресных водах. Обсуждаются родственные связи родов и семейств хонотрих, происхождение отряда, его место в системе инфузорий. Вопреки прежним предположениям, нет свидетельств «исключительной» геологической древности хонотрих и параллелизма эволюции хонотрих и хозяев; наиболее примитивные хонотрихи обитают на высших перакаридах — лимнориях, тихоокеанских талитридах и гаммаридах, а не на филлокаридах (Leptostraca); с амфипод и изопод они перешли на другие группы хозяев. Хонотрихи, несомненно, — геологически молодая группа, возникшая не ранее начала палеогена (65—70 млн лет назад) и находящаяся ныне в расцвете эволюции. Илл.—200, схемы—3, библ.—312 назв.
Главный редактор акад. Б. Е. Быховский
Редакционная коллегия:
И. М. Громов, А. С. Монч адский, О- А. Скарлато, А. А. Стрелков, А. А. Штакельберг
2106-1025
Ш042 (02J-73
800-73
Natura minimis maxime miranda!
ПРЕДИСЛОВИЕ
Монография посвящена одному из пяти подклассов класса Clliata (ресничные простейшие) подтипа Ciliophora типа Protozoa — подклассу Chonotricha Calkins, 1933 (воротничковые инфузории), с одним отрядом — Chonotrichida Wallengren, 1895. Это эктокомменсалы морских, частично пресноводных ракообразных, в основном высших — Crustacea Malacostraca (отряды Leptostraca, Isopoda, Amphipoda и Deca-poda всех четырех подгрупп — Natantia, Reptantia Macrura, Anomura, Brachyura). Единичные формы известны на Entomostraca (на паразитической копеподе Balaenophi-lus с сейвалов) и на багряной водоросли Epymenia. Такая приуроченность изучаемой группы инфузорий потребовала сборов больших количеств ракообразных наших морей и пресных вод и просмотра эпифауны морских водорослей и Entomostraca.
Выбор группы обусловлен прежде всего слабой изученностью хонотрих не только в СССР, но и за рубежом: литературные сведения по фаунистике, морфологии и циклу развития этих форм очень скудны и противоречивы, В СССР ранее изучались лишь некоторые байкальские виды; нет никаких сведений по морской фауне. Вместе с тем хонотрихи это один из основных объектов дискуссии по систематике Ciliophora-. положение их в системе все еще остается спорным, группе придается различный ранг — от семейства до класса (1), она противопоставляется разным таксонам. Если морфологии и систематике остальных групп Ciliophora (Suctoria, Peritricha, Entodinio-morpha и др.) посвящен ряд монографий (Коллен, Канелла, Лом, Нуаро-Тимоте и др.), то Chonotricha не привлекли должного внимания; более того, в прошлом веке они вызывали даже больший интерес, чем сейчас (авторов интересовали необычные ядер-ный и ротовой аппараты этих форм). Целесообразно поэтому иметь монографический очерк хонотрих, дающий представление об их строении, жизненном цикле, филогении, эволюции, распространении и видовом разнообразии, а также достаточно полно освещающий состав фауны хонотрих наших морей и пресных вод.
Всего в литературе до настоящего времени, за 120 лет после открытия первой хонотрихи, описано 24 вида и 9 родов хонотрих (рис. 1); 5 видов из них мы не считаем достоверными. Всегда подчеркивается, что это лишь очень маленькая группа аберрантных узкоспециализированных форм, хотя из-за своеобразия признаков она получает высокий ранг. Однако наш материал и данные калифорнийских авторов (Мор, Мацудо, Лёнг, Ле-Век) показывают, что Chonotrichida — один из крупнейших отрядов инфузорий, составляющий полноправный подкласс Ciliata, богатый родами и видами и имеющий сложную внутреннюю структуру. Достаточно сказать, что, по Мору и Мацудо, род Lobochona предположительно включает около 30 видов (по числу возможных хозяев — видов Limnoriidae'), Chilodochona — несколько сотен видов (на крабах). В фауне СССР ранее было известно, по работам Б. А. Сварчевского на Байкале, всего 9 видов одного рода (Spirochona-, из них 2 недостоверных); осталась совершенно незатронутой морская фауна, оказавшаяся очень богатой.
В данной сводке мы приводим описания 41 рода хонотрих (33 новых) и 102 достоверных видов (83 новых), отнесенных к 11 семействам (8 новых) двух новых подотрядов (рис. 2—4). Заново описан ряд плохо изученных ранее форм, устраняется путаница в номенклатуре.
Изучение.хонотрих начато автором в 1963 г. на Мурмане; в 1963—1967 гг. осматривались собственные сборы ракообразных Баренцева, Черного и Японского морей, оз. Байкал, ручьев в окрестностях Ленинграда и в Крыму. Сборы 1968—1969 гг. на Сахалине и Курильских островах обработаны пока частично. Нам был любезно предоставлен также коллекционный материал по гаммаридам оз. Байкал и прибайкальских озер (М. Ю. Бекман, А. Я. Базикалова), сборы древоточцев сем. Limnoriidae морей СССР (О. Г. Кусакин), различные расы Nebalia (Е. Ф. Гурьянова, О. Г. Куса-кин), некоторые виды амфипод дальневосточных морей (Н. Л. Цветкова, В. В. Кудряшов), северных морей (Н. Л. Цветкова) и Каспия (Ф. Агамалиев).
Обработка этого материала дала возможность подробно охарактеризовать фауну хонотрих морей и внутренних вод СССР, изучить их строение, питание, размножение, наметить пути эволюции родов в пределах отряда, разграничить роды, семейства и подотряды, указать новые группы хозяев (например, креветки). Отряд впервые под-
Рис. 1. Известные хонотрихи. Типовые рисунки авторов, описавших виды. А — Spiro-chona gemmipara; Б — «S. pusilia»; В — S. simplex', Г — S. elegantula; Д — «S. patella»', E — S. elegans; Ж — S. globulus', 3 — S. anthus; И — S. tuba', К — S. halo-phila; Л — Stylochona sivertseni; M — Oenophorachona ectenolaemus; H — Heliochona sessilis; Olt O2 — H. scheutenii; П — H. psychra; P — Stylochona coronata; C — S', neba-lina; T — Lobochona limnoriae; У — L. prorates; Ф — L. insularum; X — Chilodochona qvennerstedti; Ц — «Ch. microchilus»; 4 — «форма Kentrochona nebaliae с максиллулы»; ID — Trichochona lecythoides; III — Kentrochona nebaliae; Э — Kentrochonopsis multipara
Рис. 2. Типовые и характерные виды родов подотряда Exogemmina. А — Lobochona limnoriae; Б — Oenophorachona ectenolaemus', В — Toxochona mirabilis; J\—Г3 — Eleu-therochona sivertseni', Д — Heterochona crinita; Elt E2 — Heliochona sessilis; Ж, 3 — мизидохона (по Мору); И — клематохона (по Мору); К — Phyllochona vexlllata; Л — Aurichona armata; Mlt M2 — Filichona paradoxa; H1—Hs — Vasichona paguri; О — Chilodochona qvennerstedti; П, P — Cryptochona tumida; C — Spirochona gemmipara;
T±—Тя — Cavichona elegans; У1г У2 — Serpentiehona anthus.
Рис. 3. Типовые и характерные ви^ы родов подотряда Endogemmina. А — Isochona migratofia; Б — Trichochona lecythoides; В, Г — Crassichona insolita; Д — Cristichona pacifica; E — Cartnichona globulus', Ж — Rhizochona armata; 3 — Pleochona coronata; И — циамихона (цетохона); К — антеннохона (по Лёнгу); Л — Stylochona glabra; М — Dentichona marginata; Н, О — Spinichona horrida; П, Р — Armichona gibbosa; С, Т — Flectichona crenata; У, Ф — Oxychona multifida; X — Eriochona glacialis; Ц — E.- horrida; 4 — Paraoxychona inversa.
Рис. 4. Типовые и характерные виды родов подотряда Endogemmina. Б — CtA ,enochona ternipara; Blt B2 — Pterochona pacifica', Г — Oxychona multifida', Дг, Д2 — Eurychona vitrea', E — Echinichona regina; Ж, 3 — Coronochona pectinata', И±, И2 — Kentrochonop-sis multipara', К—M — Actinichona gaucho', H — I nversochona peregra', О, П — Cerato-chona scandens; P, Cv C2 — Kentrochona nebaliae', T — Chonosaurus rex.
разделяется нами на подотряды Exogemmina (с наружным почкованием) и Endogem-mina («сумчатые хонотрихи», с внутренним почкованием), приуроченные к разным группам хозяев.
Хонотрихи интересны буквально во всех отношениях — высокой степенью адаптации к хозяевам (развитие сложнейших защитных систем — шипов, пластинок, складок, панциря, папилл, завитков, появление и усложнение ресничной предрото-вой воронки, различных форм цилиатуры и прикрепительного аппарата), своеобразием ядерного аппарата (гетеромерный макронуклеус со сложным способом деления), своеобразием способа конъюгации (слияние стационарной особи и мигранта), корреляцией способов размножения со стадиями линечного цикла хозяина (моногеммическое наружное или внутреннее почкование на нелиняющих рачках; полигеммия, диминуция, образование телотомитов и трофотомитов при линьке). На хозяевах хонотрихи занимают узкие, определенные локусы. Хонотрихи, как правило, узкоспецифичны к видам хозяев и поэтому высокоэндемичны, ареал их часто уже ареала хозяина.
В нашей фауне удивительно бедно хонотрихами Черное море; в Каспии их не найдено совсем. В Баренцевом море хонотрих много, здесь наблюдается вспышка развития экзогеммин Helio chonidae. Пацифика от Посьета до Камчатки очень богата хонотрихами — это основной центр развития эндогеммин, с большим числом эндемичных родов. В Байкале обитают 3 рода и 20 четких видов спирохонид.
Данная работа не могла быть выполнена без содействия сотрудников различных исследовательских учреждений. Мы считаем своим долгом выразить искреннюю признательность сотрудникам Института лимнологии Сибирского отделения АН СССР (пос. Лиственичное, Байкал) М. Ю. Бекман, А. Я. Базикаловой за предоставление в наше распоряжение сборов гаммарид Байкала, К. К. Вотинцеву за содействие в сборе материала на биостанции института в бухте Песчаной, заведующему биостанцией Иркутского университета М. М. Кожову (Большие Коты, Байкал) за содействие в сборе материала. Ряд хонотрих был найден в коллекционном материале, любезно предоставленном в наше распоряжение О. Г. Кусакиным, И. Л. Цветковой, Е. Ф. Гурьяновой (Зоологический институт АН СССР, Ленинград), В. В. Кудряшовым (Дальневосточный университет, Владивосток); всем названным лицам мы приносим глубокую благодарность. Д-р Джон Л. Мор (Калифорнийский университет, Лос-Анджелес) любезно сообщил нам в целях корреляции названий хонотрих ряд неопубликованных еще данных по хозяевам, морфологии и распространению этих форм, в основном с Тихоокеанского побережья США; эти сведения позволили сделать данную сводку более полной. Мы благодарны этому автору также за возможность ознакомления с рукописью монографии Мора и Мацудо «The Ciliate Taxon Chonotricha» (1970) до ее выхода из печати. Сотруднику биостанции в Эльсиноре (Хельсин-гере, Дания) Тому Фенхелю мы признательны за присланный материал по Gammarus zaddachi.
Автор выражает благодарность проф. А. А. Стрелкову за редактирование книги.
Все иллюстрации выполнены автором. В тексте приняты следующие сокращения: АЗМ — адоральная зона мембранелл; Ма — макронуклеус; Ми — микронуклеус; ПВ — предротовая воронка; СВ — сократительная вакуоль; РПА — ресничный пред-ротовой аппарат.
Выпуски серии «Фауна СССР. Инфузории (подтип Ciliophora)» будут выходить в 6 томах, соответственно числу высших таксонов подтипа: тт. I—V — класс Ciliata (т. I — подкласс Holotricha, т. II — подкласс Chonotricha, т. III — подкласс Peritricha, т. IV — подкласс Spirotricha, т. V — подкласс Entodiniomorpha)-, т. VI — класс Suctoria. Выпуски в томах будут нумероваться в порядке очередности их подготовки, без заранее намеченного плана.
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ ВИДОВ
Подтип CIJEIOFHOEIA Doflein, 1901
Класс CILIATA Perty, 1852
Подкласс CHONOTRICHA Calkins, 1933
Отряд Chonotrichida Wallengren, 1895
I. Подотряд Exogemmina Jankowski, 1972
I. Семейство Lob о chonidae Jankowski, 1967
1. Род Lobochona Dons, 1940
Стр.
1. L. limnoriae Dons, 1940 ....................................... 188
2. L. prorates Mohr, LeVeque et Matsudo,’1963 ...................... 188
3. L. insularum Matsudo et Mohr, 1964 .............................. 191
4. L. tenue Jankowski sp. nov....................................... 194
2. Род Oenophorachona Matsudo et Mohr, 1968
1. Oe. ectenolaemus Matsudo et Mohr, 1968 ......................... 195
2. Oe. urceolata Jankowski sp. nov.................................. 196
3. Oe. sagitta Jankowski sp. nov.................................... 197
3. Род Toxoehona Jankowski, 1972
1. T. mirabilis Jankowski, 1972 .................................... 199
4. Род Eleutherochona Jankowski, 1971
1. E. sivertseni (Dons, 1948) Jankowski, 1971....................... 199
II. Семейство Filichonidae Jankowski fam. nov.
1. Род Aurlchona Jankowski gen. nov.
I. A. armata Jankowski sp. nov...................................... 202
2. Род Filichona Jankowski gen. nov.
1. F. paradoxa Jankowski sp. nov................................... 203
III. Семейство Phylloehonidae Jankowski, 1972
(1. Род Phyllochona Jankowski, 1.972
1. Ph. vexillata Jankowski, 1972 ................................. 205
IV. Семейство Heliochonidae Jankowski, 1972
1. Род Heterochona Jankowski , 1972
1. H. scheutenii (Stein, 1854) Jankowski, 1972 ..................... 206
2. H. crinita Jankowski, 1972 .................................... 210
3. H. psychra (Matsudo et Mohr, 1965) Jankowski, 1972 ......... . . 211
4. H. coronata (Kent, 1881) Jankowski, 1972 ....................... 211
5. H. peregra Jankowski sp. nov. .................................. 216
6. H. exilis Jankowski sp. nov..................................... 217
7. H. trifaria Jankowski, 1972 218
Приложение: «Vaginicola crystallina Ehr.», in Bate, 1861 ............ 219
2. Род H eliochona Plate, 1888
1. II. sessilis Plate, 1888 .............................................. 221
2. II. pontica Jankowski sp. nov.......................................... 223
3. II. elegans Jankowski, 1972 ........................................... 223
4. H. alternans Jankowski, 1972 .......................................... 227
V. Семейство Chilodochonidae Wallengren, 1895
1. Род V asichona Jankowski, 1972
1. V. 'paguri Jankowski, 1972 ............................................ 230
2. Род Cryptochona Jankowski, gen. nov.
1. C. tumida Jankowski sp. nov ........................................... 232
3. Род Chilodochona Wallengren, 1895
1. Ch. qvennerstedti Wallengren, 1895 .................................... 232
2. Ch. carcini Jankowski sp. nov.......................................... 234
•3 . Ch. aranei Jankowski sp. nov......................................... 234
4. Ch. palinuri Jankowski sp. nov......................................... 235
Приложение: «Ch. microchilus» Wallengren, 1895 ........................ 235
VI. Семейство Spirochonidae Stein, 1854
1. Род Spirochona Stein, 1852
1. S. gemmipara Stein, 1852 .............................................. 239
Приложение: «S. gemmipara» в Байкале................................... 244
.2. S. brevis Jankowski sp. nov.......................................... 246
3. S. globulus Swarczewsky, 1928 ..................................... 246
4. <9. simplex Swarczewsky, 1928 ..................................... 248
5. S. gnathopodialis Jankowski sp. nov................................... 249
6. S. tuba Swarczewsky, 1928 ............................................ 251
7. S. halophila Matsudo et Mohr, 1968 .................................. 253
•8. S. marina Jankowski sp. nov.......................................... 253
Приложение: «S. patella» Swarczewsky, 1928 ............................ 254
2. Род Cavichona Jankowski gen. nov.
1. C. elegans (Swarczewsky, 1928) comb. nov. . .......................... 256
2. C. cincinnata Jankowski sp. nov...................................... 259
3. C. oligocineta Jankowski sp. nov...................................... 261
4. C. protecta Jankowski sp. nov......................................... 262
,5. C. multifida Jankowski sp. nov....................................... 264
6. C. acanthogammari Jankowski sp. nov................................... 266
7. C. tenue Jankowski sp. nov............................................ 266
8. C. crassa Jankowski sp. nov. . . ..................................... 267
9. C. abyssalis Jankowski sp. nov........................................ 268
10. C. brevistyla Jankowski sp. nov...................................... 268
11. C. virgata Jankowski sp. nov. . ............... . /................. 268
12. C. rhabdomorpha Jankowski sp. nov..................................... 270
13. C. exilis Jankowski sp. nov.......................................... 270
14. C. carinuri Jankowski sp. nov......................................... 272
15. C. laticollis Jankowski sp. nov. . . ................................. 273
16. C. elegantula (Swarczewsky, 1928) comb, nov........................... 273
3. Род Serpentichona Jankowski gen. nov.
1. S. anthus (Swarczewsky, 1928) comb, noy................................ 278
II. Подотряд Endogemmina Jankowski, 1972
I. Семейство Isochonidae Jankowski, 1973
1. Род Isochona Jankowski, 1973
t. I. migratoria Jankowski sp. nov......................................... 283
2. I. antennaria Jankowski sp. nov......................................... 284
3. I. rotundata Jankowski, 1973 .......................................... 284
4. I. peltifera Jankowski sp. nov.......................................... 284
5. I. crassa Jankowski sp. nov............................................. 284
6. I. pleonicola Jankowski sp. nov......................................... 287
2. Род Trichochona Mohr, 1948
1. T. surgens Jankowski sp. nov............................................. 287
2. T. lecythoides Mohr, 1948 ............................................... 288
Другие изохониды......................................................... 289
II. Семейство Aetinichonidae Jankowski fam. nov.
1. Род Cristichona Jankowski, 1973
1. C. tesselata Jankowski sp. nov..............................'........... 290
2. C. pacifica Jankowski, 1973 ............................................ 291
2. Род Carinichona Jankowski, 1973
1. C. globulus Jankowski, 1973 ............................................ 292
3. Род Rhizochona Jankowski gen. nov.
1. Rh. armata Jankowski sp. nov............................................ 292
4. Род Actinichona Jankowski gen. nov.
1. A. cuspidata Jankowski sp. nov.......................................... 295
2. A. gaucho Jankowski sp. nov............................................. 298
5. Род' Kentrochonopsis Doflein, 1897
1. K. multipara Doflein, 1897 . . . , ;.................................... 300
6. Род Crassichona Jankowski gen. nov.
1. C. insplita Jankowski sp. nov.......................................... '301
III. Семейство Stylochonidae Mohr, 1948
1. Род Stylochona Kent, 1881
1. STnebalina Kent, 1881 ...................................'.............. 304
2. S. glabra Jankowski sp. nov............................................. 307
3. 5. maxillarts Jankowski sp. nov........................................ 307
4. S. setaria Jankowski sp. nov............................................ 307
5. S. villosa Jankowski sp. nov.......................................... 308
2. Род Spinichona Jankowski, 1973
1. S. horrida Jankowski, 1973 . . . ....................................... 309
3. Род Dentichona Jankowski, 1973
1. D. marginata Jankowski, 1973 ........................................... 311
4. Род Flectichona Jankowski gen. nov.
1. F. crenata Jankowski sp. nov............................................ 311
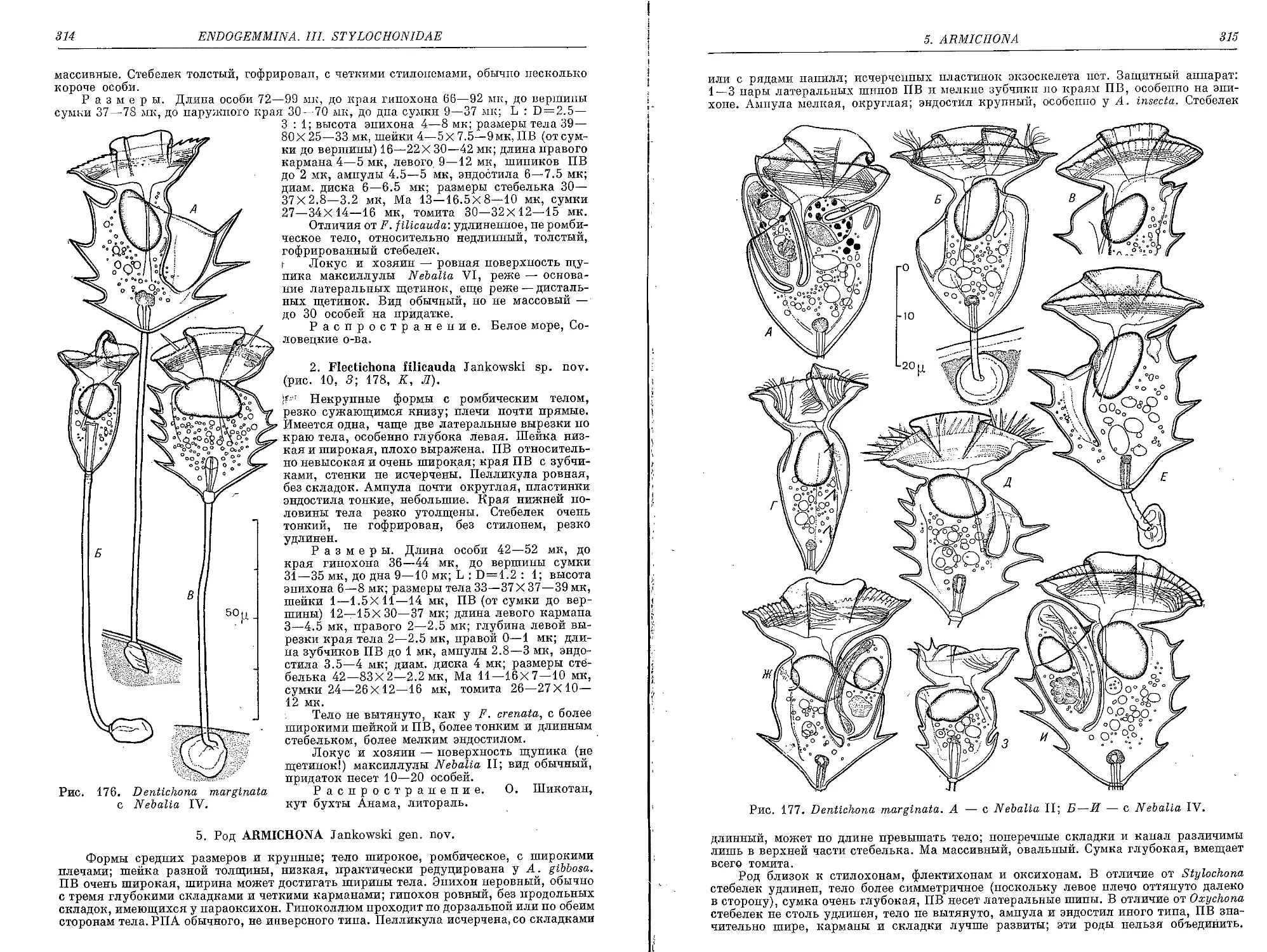
2. F. filicauda Jankowski sp. nov.......................................... 314
5. Род Armichona Jankowski gen. nov.
1. A. insecta Jankowski sp. nov....................-....................... 317
2. A. gibbosa Jankowski sp. nov............................................ 317
3. A. hexadenta Jankowski sp. nov.......................................... 318
6. Род Oxychona Jankowski, 1973
1. O. suprema Jankowski sp. nov............................................ 319
2. O. multifida Jankowski, 1973 ........................................... 319
7. Род Eriochona Jankowski gen. nov.
1. E. glacialis Jankowski sp. nov.......................................... 322
2. E. horrida Jankowski sp. nov. . . ...................................... 322
8. Род Paraoxychona Jankowski gen. nov.
1. P. inversa Jankowski sp. nov.......................................... 323
9. Род Pterochona Jankowski, 1973
1. P. pacifica Jankowski, 1973 .......................................... 323
10. Род Ctenochona Jankowski gen. nov.
1. C. ternipara Jankowski sp. nov........................................ 326
' IV. Семейство Echinichonidae Jankowski fam. nov.
1. Род Eurychona Jankowski gen. nov.
1. E. vitrea Jankowski sp. nov........................................... 328
2. Род Echinichona Jankowski, 1973
1. E. simplex Jankowski sp. nov.......................................... 329
2. E. regina Jankowski, 1973 ......................... 329
3. Род Coronochona Jankowski gen. nov.
1. C. pectinata Jankowski sp. nov. ......................... 331
V. Семейство Inversochonidae Jankowski, 1973
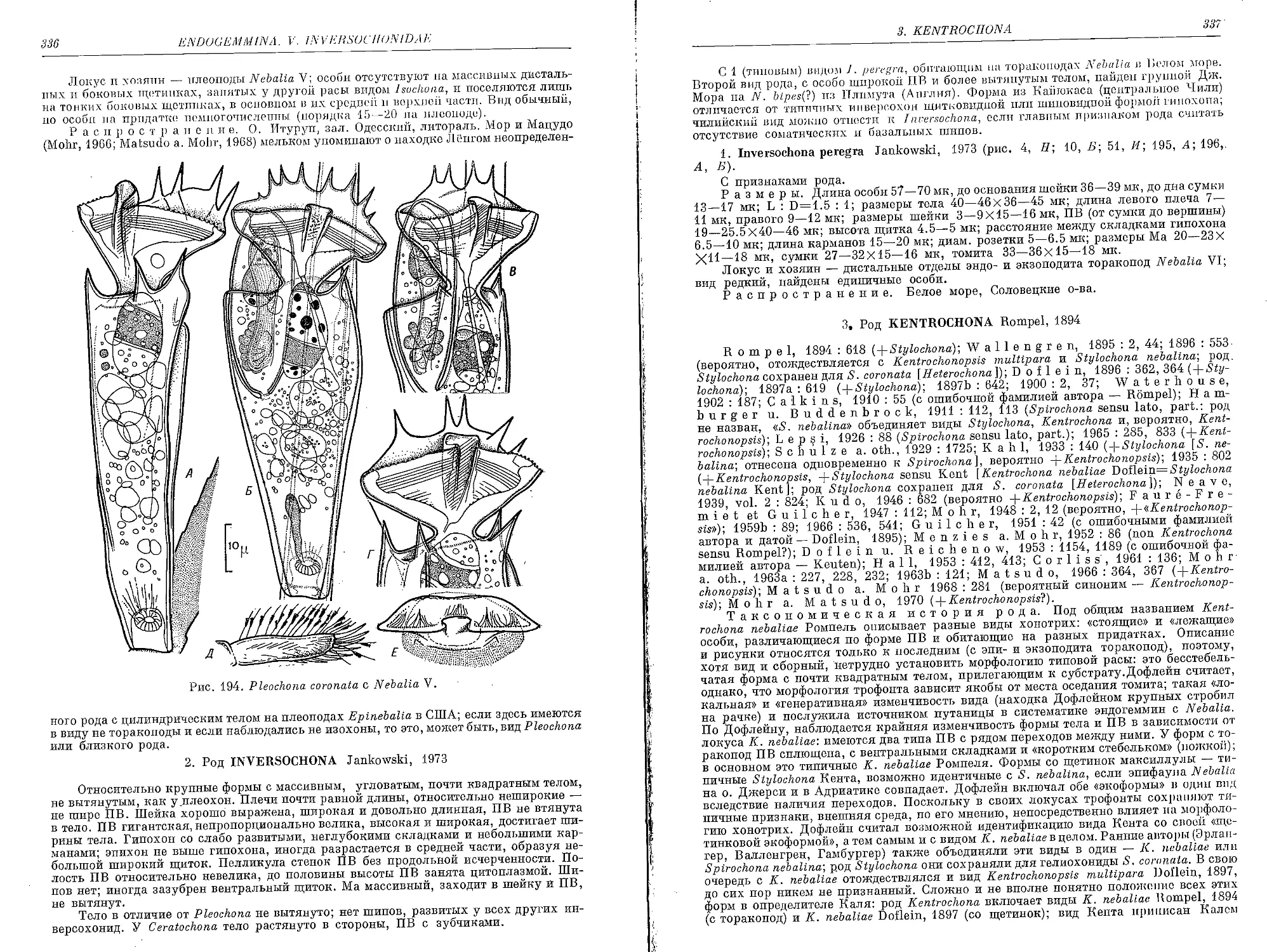
1. Род Pleochona Jankowski, 1973
1. P. coronata Jankowski, 1973 ........................................... 335
2. Род Inversochona. Jankowski, 1973
1. I. peregra Jankowski, 1973 ............................................ 337
' 3. Род Kentrochona Rompel, 1894
1. K. nebaliae Rompel, 1894 .............................................. 340
2. jK. robusta Jankowski sp. nov........................................ 342
4. Род Ceratochona Jankowski gen. nov.
1. C. cimex Jankowski sp. nov........................................... 343
2. C. scandens Jankowski sp. nov.......................................... 343
5. Род Chonosaurus Jankowski, 1973
1. Ch. galeatus Jankowski sp. nov......................................... 346
2. Ch. rex Jankowski, 1973 ............................................... 346
ВВЕДЕНИЕ
КРАТКАЯ ИСТОРИЯ ИЗУЧЕНИЯ ХОНОТРИХ
Хонотрих изучал ряд ведущих протистологов прошлого века: Фридрих фон Штейн (Stein, 185.2, 1854), описавший в 1852 г. первый род и вид — Spirochona gemmipara, Отто Бючли (Biitschli, 1877), Рихард Гертвиг (Hertwig, 1877а), Вильям Севиль-Кент (Kent, 1881), Э.-Ж. Бальбиани (Balbiani, 1895) и Франц Дофлейн (Doflein, 1896, 1897а, 1897b, 1900). Важные исследования опубликовали также Ганс Валленгрен (Wallengren, 1895, 1896), Иозеф Ромпель (Rompel, 1894), Юзеф Эйсмонд (Eismond, 1890а, 1895), Людвиг Плате (Plate, 1886, 1888). Валленгрен является автором таксона Chonotricha. Названные авторы интересовались прежде всего необычной морфологией хонотрих, строением и делением их макронуклеуса. Представляют интерес и мелкие фаунистические заметки ранних авторов (Кану, Бэйт), а также довольно точные зарисовки хонотрих в работе Рентша (Rentsch, 1860), возрождающего учение о трансмутации форм на примере эпибионтов гаммарид. Подробный обзор данных предыдущих авторов по морфологии, развитию, экологии и систематике хонотрих приведен в соответствующих разделах книги.
В период 1852—1900 гг. было описано 9 видов 6 родов хонотрих (рис. 1) — Spirochona Stein, 1852, Stylochona Kent, 1881, Heliochona Plate, 1888, Kentrochona Rompel, 1894, Chilodochona Wallengren, 1895 и Kentrochonopsts Doflein, 1897. В текущем столетии к ним добавилось всего три рода —• Lobochona Dons, 1940, Trichochona Mohr, 1948 и Oenophorachona Matsudo et Mohr, 1968.
С начала нашего столетия примерно до 1950 г. преобладает фаунистическое, а не морфологическое направление. Появляются многочисленные заметки о находках хонотрих в разных странах, расширяется круг хозяев хонотрих. Авторы находят чаще всего спирохон, реже гелиохон. Особо выделяются в этот период работы Бориса Александровича Сварчевского (1928а, 19286) по эндемичным спирохонам Байкала. При осмотре живых гаммарид Ангары и коллекций гаммарид Байкала (3000 особей 118 видов 29 родов) Сварчевский нашел Spirochona gemmipara и 8 новых видов спирохон на 34 видах хозяев. Поскольку Сварчевский работал с фиксированным материалом, многие авторы ставят под сомнение его данные (Кожов, 1962; Догель с сотр., 1962а). Надежда Станиславовна Гаевская (1927, 1933, 1949) считает, что в Байкале живет лишь один полиморфный и поликсенный вид хонотрих — S. gemmipara.
Альфред Каль (Kahl, 1933, 1935) дважды публикует определитель хонотрих; им восстановлен таксон Chonotricha, не признанный никем после Балленгрена. Каль различает одно семейство хонотрих (Sptrochonidae) с 5 родами. Важные фаунистические работы публикуют Герберт Прехт (Precht, 1935) в Германии, Карл Доне (Dons, 1940, 1948) в Норвегии, Василий Големанский (1964) в Болгарии, Том Фенхель (Fenchel, 1965) в Дании. С конца 1940-х годов хонотрих интенсивно исследуют во Франции; французские авторы акцентируют внимание на строении и размножении хонотрих, не затрагивая фаунистико-таксономический аспект. Иветта Гийше (Guilcher, 1950, 1951) изучала морфологию и морфогенез хонотрих, Эммануэль Форе-Фремье (Faure-Fremiet a. oth.; 1956) — их ультраструктуру, Мишель Тюффро (Tuffrau, 1953) — ядерный аппарат и процесс конъюгации. Янина Добжанская-Качановская (Dobr-zanska-Kaczanowska, 1963) проследила в Польше почкование одного из морских видов хонотрих. Треплем (Grell, 1963) отснят кинофильм по пресноводным простейшим, в частности по спирохонам.
В 1948 г. калифорнийский зоолог Джон Лютер Mop (Mohr, 1948) публикует свою первую работу по хонотрихам; позднее им была основана лаборатория, занимающаяся в основном изучением хонотрих Мирового океана. Дж. Мор и Хитоси Мацудо (Mohr, 1959а, 1966; Matsudo, 1966, 1967а, 1967b; Matsudo a. Mohr, 1964, 1965, 1968) интересуются прежде всего фаунистикой экзогеммовых хонотрих; последний автор изучает также морфологию (в частности, ультраструктуру) и размножение хонотрихи Lobochona prorates, Жан Антони Ле-Век (LeVeque, 1947) — экологию того же вида. Юк-маан Лёнг начал в последние годы фаунистическое исследование эндогеммовых
(сумчатых) хонотрих. Основные итоги работы калифорнийской группы авторов отражены в вышедшей недавно сводке Мора и Мацудо (Mohr a. Matsudo, 1970), известной нам по рукописи 1967 г. В этой работе упомянут ряд новых хозяев хонотрих (мизиды, талитриды, ряд изопод и крабов), пересмотрен состав таксона, обсуждаются филогения, эволюция и геологическая история хонотрих, их положение в системе инфузорий.
В настоящее время находятся в печати две статьи автора по хонотрихам, открытым после завершения работы над книгой и не вошедшим в данную сводку. В одной из них описываются 11 новых видов 3 новых родов эндогеммовых хонотрих с эктопаразитов и эктокомменсалов китообразных (Янковский, 1971). В другой статье даются диагнозы части морских видов, приведенных в настоящей книге, и описания 17 новых видов экзогеммовых хонотрих, открытых во время Сахалинской (1968 г.) и Курильской (1969 г.) экспедиций (Янковский, 1973).
ХОЗЯЕВА ХОНОТРИХ
Вводные замечания. В отличие от сукторий и перитрих, обитающих на самом разнообразнейшем субстрате (экто- и эндокомменсалы, паразиты водных беспозвоночных и позвоночных, виды с обрастаний поверхностей, с водорослей, свободноживущие формы и т. д.), хонотрихи в отношении субстрата узко специализированы — приурочены, за исключением аберрантных форм с водорослей и копепод, к придаткам высших ракообразных (Crustacea Malacostraca). Кроме Мора и Мацудо, никто из авторов не упоминает собственно о форме с водорослей, хотя она описана еще в 1948 г. (Dons, 1948 — uStylochona sivertseni»). Кроме категорических утверждений о том, что «все известные хонотрихи — это комменсалы Crustacea» (Dales, 1966 : 302), можно прочесть и о том, что хонотрихи «прикреплены к водным животным, особенно к ракообразным» (Kudo, 1946 : 681; Jahn a. Jahn, 1949 : 216) или «обычно к ракообразным» (Manwell, 1961 : 345). Хонотрихи на других беспозвоночных, однако, еще не найдены. «Spirochona tintinnabulum» с тритонов (Kent, 1881) давно уже выделена в особый род перитрих — Glossatella (Biitschli, 1889). По Кальмусу (Kalmus, 1928 : 398), «типичная Spirochona, вид которой, возможно, идентичен с S. gemmipara, была найдена в трех экземплярах на Stylaria nobilis в мае у Кампы (р. Влтава в Чехословакии, — А. Я.)»; это, без сомнения, могла быть только Glossatella или близкий род Scyphidia, виды которых обычны на пресноводных олигохетах (Стокес, Каль и др.).
Часто хозяевами хонотрих указывается только одна группа ракообразных — отряд Amphipoda (Каль, Догель, Йировец, Ветцель, Раабе и др.). Так, по Раабе (Raabe, 1964с : 177), «хонотрихи обитают на жабрах и на конечностях, прикрывающих жабры ракообразных группы Amphipoda». В этом Раабе явно повторяет ошибку Каля, утверждавшего, что «данная группа инфузорий живет эпизоотически исключительно на Amphipoda» (Kahl, 1935 : 799), хотя далее в тексте названы Nebalia, Ebalia и Рог-tunus и Каль не упоминает о находках хонотрих на Limnoria и Pagurus (Canu, 1886; Wallengren, 1895). Судя по накопленным к настоящему времени материалам, основные хозяева хонотрих среди Malacostraca — виды 5 отрядов (Leptostraca, Isopoda, A mphi-poda, Mysidacea и Decapo da). В пределах отрядов распределение хонотрих по семействам также неравномерное. Так, в отряде Amphipoda хонотрих несут многие виды семейств Gammaridae, Amphithoidae, Cyamidae и единичные виды семейств Photidae, Talitridae и Cheluridae; пока нет находок на других амфиподах. Аналогично этому не все роды в пределах семейств хозяев несут хонотрих; так, в семействе Idotheidae хонотрихи известны только на Pentidothea. В пределах родов заражены не все виды (за исключением родов Limnoria, Nebalia и Cyamus).
Ниже приведен список основных таксонов ракообразных (Waterman a. Chace, 1960 : 24—26, с дополнениями по: Grasse a. oth., 1961 : 563—567; Green, 1961 : 167— 169); полужирным шрифтом выделены группы, на которых отмечены хонотрихи (в нашем материале и в литературе), разрядкой — группы, на которых возможны находки хонотрих. Указаны примерное число видов и характерные роды.
Класс CRUSTACEA (26 000 видов)
Группа ENTOMOSTRACA (8200)
Подкласс Cephalocarida (2): Hutchinsoniella
Подкласс Branchiopoda (800): Artemia, Daphnia, Lepidurus
Подкласс Mystacocarida (3): Derocheilocaris
Подкласс Ostracoda (2020): Cypridina, Cypris
Подкласс Copepoda (4500)
Отряд Calanoida (1200): Calanus
Отряд Harpacticoida (1200): Balaenophilus
Отряд Cyclopoida (1000): Cyclops
Отряд Notodelphyoida (300): Doropygus
Отряд Monstrilloida (35): Monstrilla
Отряд Caligoida (400): Penella
Отряд Lernaeoida (300): Salminicola, Lernaea
Отряд Herpyllobioida (по Грину)
Подкласс Branchiura (75): Argulus
Подкласс Cirripedia (800): Balanus, Lepas, Coronula
Группа MALACOSTRACA (18 000)
Подкласс Leptostraca=Phyllocdrida (7)
Отряд Nebaliaeea (7): Nebalia, Nebaliopsis
Подкласс Eumalacostraca (18 000)
Надотряд Syncarida (6)
Отряд Anaspidacea (6): Anaspides, Bathynella
Надотряд Per ас arid a (9000)
Отряд Thermosbaenacea (4): Thermosbaena
Отряд Spelaeogriphacea (1): Spelaeogriphus
Отряд Mysidacea (450)
Подотряд L о pho gastrin a (30): Gnathophausia
Подотряд Mysida (420): Boreomysis, Mysis
Отряд С и m a c e a (425): Diastylts, Cuma
Отряд Tanaidacea (250): Apseudes, Tanais
Отряд Isopod a (4000)
Подотряд Gnathiidea (75): Gnathia
Подотряд A nthuridea (100): Anthura
Подотряд Flabellifera (1400): Limnoria, Sphaeroma
Подотряд Valvifera (600): Idothea, Pentidothea
Подотряд Asellota (500): Asellus
Подотряд Phreattcoidea (50): Phreaticus
Подотряд Epicaridea (350): Bopyrus
Подотряд Oniscoidea (900): Ligia, Oniscus
Отряд Amphipoda (3600)
Подотряд Gammaridea (3000): Gammarus, Marinogammarus
Подотряд Hyperiidea (300): Phronima, Hyperia
Подотряд Caprellidea (250): Caprella, Phthisica, Cyamus
Подотряд Ingolfiellidea (4): Ingolfiella
Надотряд Eucarida (8600) ,
Отряд Euphausiacea (90): Euphausia, Nyctiphanes
Отряд Decapoda (8320)
Подотряд Natantia (1930)
Секция Penaeidea (320): Sergestes, Penaeus
Секция Caridea (1590): Crangon, Pandalus
Секция Stenopodidea (22): Stenopus
Подотряд Reptantia (6390)
Секция Macrura (690)
Надсемейство Eryonidea (40): Polycheles
Надсемейство Scyllaridea (84): Palinurus
Надсемейство N ep hr о p side a (313): Homarus
Надсемейство Thalassinidea (257): Callianassa
Секция Anomura (1270)
Надсемейство Galatheidea (572): Galathea
Надсемейство Pagwridea (642): Pagurus
Надсемейство Hippidea (56): Emerita
Секция Brachyura (4428)
Подсекция Gymnopleura (30): Banina
Подсекция Dromiacea (200): Dromia
Подсекция Oxystomata (480): Calappa
Подсекция Braehygnatha (3718): Cancer, Maja
Надотряд Hoplocarida (180)
Отряд Stomatopoda (180): Squilla
Хонотрихи на водорослях (Algae, Rhodophycea). «Stylochonair [Eleutherochona] sivertseni в массе обнаружена Донсом (Dons, 1948) на «листьях» бурой нитчатой водоросли Epymenia sp. на литорали о. Тристан-да-Кунья в южной Атлантике (описание водоросли см.: Baardseth, 1941). Препараты Донса изучены позднее Мором, также относившим этот вид к особому роду. Доне допускал, что вид обитает не только на Epymenia, но и на других водорослях и на ином прочном субстрате. По Мору (Mohr, 1966 : 540), «существование вида вызывает назойливый вопрос о на
личии других хонотрих не на ракообразных». Мы неоднократно осматривали водоросли литорали и сублиторали наших морей — на них обычны перитрихи, суктории, фоллпкулиниды и дистерииды, хонотрих же найдено не было. В нашей альгофлоре видов Epymenia нет. В Ботаническом музее Осло сохранены лишь высушенные образцы Epymenia, непригодные для изучения простейших.
Хонотрихи на низших ракообразных (Copepoda, Harpacti-coida). Mop (Mohr a. oth., 1963b) упоминает о нахождении Райсом (Dale W. Rice) хонотрих на комменсальной копеподе Вalaenophilus sp. с китов (Balaena sp.?). По Мору (Mohr, 1966), они открыты одновременно Райсом (США, шт. Вашингтон, Ситтл) и Гриндли (John R. Grindley) на китах-полосатиках — синем ките Balaenoptera muscu-lus и финвале В. physalus (ЮАР, Дурбан). По Гриндли (in: Bannister a. Grindley, 1966 : 299—300), «очень высокий процент взрослых Balaenophilus в Дурбанской коллекции густо зарос наружными паразитами и комменсалами. Длинные цепи бактерий придавали им волосатый вид; были обычны Ellobiopsis и интересная инфузория-хоно-
Рис. 5. Копепода Balaenophilus unisetus (по Ауривиллиусу).
триха. Хонотриха была длиной от 60 до 90 мк, характерной вазообразной формы. Многие имели латеральные почки». Balaenophilus unisetus Aurivillius, 1879 (рис. 5) — крупный рачок, длиной до 0.5 см, обычен на пластинках китового уса полосатиков, питается частью процеживаемой пищи. В. unisetus находят только на видах Balaenoptera — на финвалах В. physalus в северной Атлантике, на сайдяном ките (сейвале) В. borealis и на синем ките В. musculus (Лилли, Аллен, Фервоорт, Трантер и др.; см.: Томилин, 1957), но их нет на малом (остромордом) полосатике В. acutorostrata. Возможно, что на разных китах обитают разные виды копепод, отличающиеся и по своей эпифауне.
Хонотрихи на Leptostraca. Отряд Nebaliacea заслуживает особого внимания: на Nebalia живет не менее половины родов и видов хонотрих. Изучение комменсалов затруднено, однако, очень плохим состоянием изученности хозяев. В последней сводке по лептостракам (Cannon, 1960) упомянуты следующие таксоны: семейство Nebaliidae, роды Nebalia Leach, 1814 (A. bipes [Fabricius, 1780]; N. typh-lops G. O. Sars, 1869; N. geoffroyi Milne-Edwatds, 1828; N. longicornis Thomson, 1879), Paranebalia Claus, 1880 (P. longipes [Willemoes-Suhm, 1875 ]), Nebaliopsis Sars, 1887 (N. typica Sars, 1887) и Nebaliella Thiele, 1904 (A. extrema Thiele, 1905; A. antarctica Thiele, 1904; A. caboti Clark, 1932). С Тихоокеанского побережья США описан сомнительный род Epinebalia, лишь деталями строения отличающийся от Nebalia; Е. pugettensis обычно отождествляют с A. bipes, хотя это четкие виды, либо обозначают как A. pugettensis. Рачков из северных и дальневосточных морей СССР определяют всегда как A. bipes (Гурьянова, Яшнов, Дерюгин, Ломакина, Кусакин и др.; см. рис. 6, А). Бирштейном (1951) кроме A. bipes в Охотском море найдены единичные особи Nebaliopsis typica; отдельные рачки напоминают Epinebalia pugettensis.
В первой половине XIX столетия был описан ряд ныне забытых видов Nebalia-. Cancer emeritus Linne, 1766; C. bipes Fabricius, 1790 (восточная Гренландия); Monoculus rostratus Montagu, 1813 (Англия, Девон); Nebalia herbstii Leach, 1814 (юг и юго-восток Англии); A. glabra Lamarck, 1818 (nom. п. для Cancer bipes); N. ciliata Lamarck, 1818 (nom. n. для Monoculus rostratus и A. herbstii); N. Straus (sic) Risso, 1826 (Ницца); A. Geoffroyi Milne-Edwards, 1828 (Бретань); A. Montagui Thompson, 1850 (Англия). Остались неизвестными также виды Клауса (Claus, 1888), предложившего считать формы из Японии и Чили самостоятельными видами A. japanensis и A. chilensis или подвидами (наряду с гренландской A. bipes и лузитанской A. Geoffroyi) всесветно распро
страненного вида, названного Л", sen-ata. К забытым видам относится и N. capensis Barnard, 1914.
Клаус (Claus, 1888 : 119) сообщает о находке на N. Geoffroyi (-N. rostrata) в Неаполе «наружных морских паразитических инфузорий очень своеобразных родов», но не приводит детален. Из 6 особей «IV. Sipes», выловленных близ Убатуба (Бразилия), только на одной отсутствовали «ресничные эктопаразиты» (Wakabara, 1965). Хонотрих с «Nebalium bipes» впервые описывает Кент (Kent, 1881 : 663 — Stylochona nebalina; на стр. 724 по ошибке «Spirochona nebalii» — о. Джерси, Ла-Манш у берегов Нормандии). Поскольку о. Джерси и южная Нормандия имеют лузитанскую литоральную фауну, Кент осматривал скорее всего X. rostrata. В Адриатическом море на том же хозяине найдены два других рода хонотрих — Kentrochona nebaliae (Rompel, 1894— Италия, Триест; Doflein, 1896 — Югославия, Ровиньо; Doflein, 1897а— Ровиньо и Триест) и Kentrochonopsis multipara (Doflein, 1897b — Ровиньо). Kentrochona sp. отмечена на плеоподах небалииды типа Epinebalia pugettensis (Menzies a. Mohr, 1952 — США, Калифорния, бухта Морро); либо это не кентрохона, либо она найдена не на плеоподах. На Тихоокеанском побережье США Kentrochona sp. найдена на жабрах Epinebalia pugettensis, новый род — на плеоподах этого вида (Matsudo a. Mohr, 1968). На небали-идах в целом обитают «хорошо очерченные роды стилохонид» (Mohr, 1959а: 652); на Nebalia s. str., подроде Epinebalia и на Paranebalia из Средиземного моря, северной Атлантики и северной Пацифики найдены особи Stylochona nebalina, Kentrochona, Kentrochonopsis и других близких к ним форм (Mohr, 1966 : 536). По Мору, Лёнг обнаружил на Leptostraca широкий круг форм, в основном новых родов. На микрофотографиях Ленга, любезно присланных Дж. Мором, нами определены следующие хонотрихи: Oxychona типа О. suprema на экзоподите Nebalia sp. из Японии (Вакаяма-кен), Pterochona sp. на щетинках щупика максиллулы Epinebalia sp. из США (Вашингтон), Dentichona sp. на внутренней поверхности панциря того же хозяина, Inversochona sp. на торакоподе Xebalia bipes ив Англии (Плимут), Inversochona sp. или Kentrochona sp. на торакоподе Epinebalia sp. из США (Калифорния), антеннохона (условное название для нового рода хонотрих с антенн Epinebalia sp.) из США (Калифорния), Kentrochonopsis sp. на эндоподите торакопод Xebalia longicornis из США (о. Тортугас в Мексиканском заливе и Майами во Флориде), Cristichona sp. на экзоподите торакопод и Spinichona sp. на щетинках щупика максиллулы того же хозяина.
Мор и Мацудо (Mohr a. Matsudo, 1970) упоминают о находках вероятных видов Stylochona, Kentrochona (с шипами и без них) или близких родов на жабрах и максил-липедах леитострак: Epinebalia pugettensis — на Тихоокеанском побережье США (Калифорния, Вашингтон); Paranebalia — в Британской Вест-Индии, Флориде; Xebaliella antarctica — на о. Мак-Куори и антарктической станции Мак-Мердо; Xebalia spp. — в Европе, Японии и США. Хонотрихи не найдены пока на батипелагической Xebaliopsis typica (Mohr, 1966).
По нашим данным, Nebalia — это хозяева основной массы эндогеммин: на одной особи рачка можно найти до 12 видов 8 родов хонотрих, на других же Crustacea — максимум 3 рода с 3—4 видами одновременно. На разных расах Xebalia могут резко раз-' личаться комплексы видов хонотрих и перитрих (род Cothurnia); так, практически нет общих видов на расах с Сахалина и Путятина. Судя по различиям эпифауны, в нашем материале имелось 3—4 вида Nebalia, занимающих разные ареалы, отличающихся также морфологически и экологически. Эти расы можно различить по морфологии антенн, форме зубцов и дентофизов на сегментах тела, по вооружению придатков. Баренцево- и беломорская расы принадлежат скорее всего к N. bipes, камчатская раса — К X. bipes valida Thiele, 1904 (мы считаем эту форму самостоятельным видом N. valida; типовая раса — с Прибыловых островов Берингова моря). Наши япономорские расы не идентичны с X. japanensis и будут описаны как новый вид Nebalia. Другой новый • вид, отличающийся от японо- и беринговоморской рас, обитает на Итурупе; вид с Па-рамушира может быть идентичен с камчатским (X. valida). В Черном море лептострак еще никогда не находили, по в коллекциях ЗИН АН СССР есть особь из Севастопольской бухты — возможно, X. geoffroyi.
Хонотрихи найдены нами на следующих расах Xebalia фауны СССР: 1) Nebalia sp. (вероятно, X. bipes-, условное обозначение — Nebalia I) — Баренцево море, о. Киль-дин, глуб. 10.5—21 м, сборы С. М. Герценштейиа, 1887 г., 4 особи из коллекций ЗИН АН СССР; 2) Nebalia II (новый вид) — о. Шикотан, кут бухты Анама, зостера, сборы О. Г. Кусакипа, 3 VIII 1949, 8 особей из коллекций ЗИН АН СССР; 3) Nebalia III (A. valida?) — Камчатка, бухта Авачинская, глуб. 18.9 м, сборы Л. М. Старокадом-ского, 5 X 1910, 4 особи из коллекций ЗИН АН СССР; 4) Nebalia IV (вид, близкий к Nebalia II) — Японское морс, 0. Пугятин, глуб. 1 м, в ходах Teredo в пирсе, сборы автора, 28 VI 1967, около 90 особей; 5) Nebalia V (вероятный новый вид) — Охотское море, о. Итуруп, зал. Одесский, литораль, сборы О. Г. Кусакина, 15 VIII 1954, 2 особи из коллекций ЗИН АН СССР; 6) Nebalia VI (X. bipes?) — Белое море, Соловки, сборы А. А. Бирули, 3 особи из коллекций ЗИН АН СССР.
2 Заказ № 213
Хонотрихи п а М у si d асе а. В недавнее время хонотрихи обнаружены на видах обоих подотрядов мнзмд — Lophogasirlda (рис. 6, Г) и Mysida (рис. 6, В). На ротовых частях примитивной ба гипелагической лофогастрицы Gnalhophausia ingens Бенсон (Peter Benson, in: Mohr a. Matsudo, 1970) обнаружил голубую колониальную форму, отнесенную Мором к новому роду «клематохона» (США, Калифорния, пролив Каталина, в 10 милях от Лос-Анджелеса, глуб. 400 м), и одиночных особей — веро-
Рис. 6. Хозяева хонотрих. А — Nebalia geoffroyi (по Клаусу); Бг, Б % — торакопода Nebalia и ее щетинки; В — Pseudomma truncatum (по Яшнову); Г — Gnalhophausia gigas (по Ломакиной); Д—G. zoea (по Кальману); Е, Ж — Crangon dalli (по Кобяковой); 3 — Pandalus latirostris (по Кобяковой); И — Cyamus ceti (по Грассе).
ятно, представителей другого рода мизидохон (личное сообщение Мора). Род Gnathophausia космополитный, имеется и в нашей фауне; поэтому возможна находка мизидо-хонид и в наших водах. По личному сообщению Мора, Гейгером (Stephen Geiger) на ледовой станции Arlis II, в пунктах с координатами 73° 27' N и 16° 02' W и 75° 21' N и 140° 53' W из тралов в северной Атлантике, к северо-востоку от Гренландии, собраны Pseudomma theeli и Boreomysis nobilis', Мор обнаружил на их ротовых частях, конечностях и оостегитах мизидохон, напоминающих молодых клематохон (основателей колоний).
Хонотрихи на Isopod а. Отряд Isopoda, включающий около 1/7 видов ракообразных, подразделяется на 8 подотрядов; хонотрихи найдены только на Fla-
bellifera (семейства Limnoriidae и Sphaeromidae} и Valvifera (сем. Idotheidae}. Сферомиды и идотеиды в наших сборах из Черного, Баренцева и дальневосточных морей оказались без хонотрих. Мор отметил виды Stylochonidae (не названы) на «нескольких линиях изо-под» (Mohr, 1948, 1959b), «четкий новый род» на Idotheidae (Mohr, 1959а, 1959b), новый укзогеммовый род и вид стебельчатых стилохопид на Pentidothea resecata из США (Вашингтон, о. Сан-Хуан) (Mohr, 1966; Mohr a. Matsudo, 1970). Хонотрих на Sphaeromidae отметил Мензис (Robert J. Menzies, in: Mohr, 1966 : 539); по Мору (Mohr, 1959а, 1959b), это «четкий новый род стилохопид». На Gnorimosphaeroma из США (Калифорния) Мензис наблюдал тот же род, что и на Р entidothea, но особый вид — стебельчатые формы без сумки (in: Mohr a. Matsudo, 1970). Третий вид этого рода найден на плеоподах Ехо-sphaeroma sp., вероятно Е. gigas (Чили, Магелланов пролив, близ Пунта-Аренас). Указание Калкинса (Calkins, 1941) о находке Spirochona на Asellus — несомненная ошибка.
Хонотрих находят практически на всех осмотренных видах и расах Limnoriidae. Изучение комменсалов облегчает ревизия систематики хозяев. Долгое время древоточцев из любой точки Мирового океана и с любой глубины обозначали как Limnoria ligno--rum (рис. 8, В, Г), и лишь в конце 1940-х годов были начаты исследования по сравнительной морфологии разных рас. К концу 1950-х годов (Menzies, 1957, 1959) в составе рода различается уже 21 вид; эти виды группируются в 3 подрода: 1 Limnoria s. str. (16 видов — *L. lignorum, L. pfeifferi, L. platycauda, L. simulata, L. japonica, L. unicornis, L. multipunctata, L. insulae, L. antarctica, L. rugosima, * L. quadripunctata, * L. tripun-ctata, L. saseboensis, L. septima, L. foveolata, L. sublittorale}, Paralimnoria (1 вид — *L. and-rewsi) и Phycolimnoria (4 вида — *L. algarum, L. segnis, L. nonsegnis, L. stephenseni}. Подрод Paralimnoria иногда считают самостоятельным родом. Phycolimnoria включает виды из бурых водорослей типа Egregia, Postelsia, Macrocystis, Laminaria’, Mop (Mohr, 1966) считает Phycolimnoria «подродом или близким к Limnoria родом». В фауне СССР долгое время различали лишь один вид — L. lignorum (Рябчиков, 1957); в 1960-е годы описаны L. magadanensis (Есакова, 1961), L. borealis (Кусакин, 1963); для черноморского вида Есаковой (1965) восстановлено название L. tuberculata (=L. lignorum var. tubercu-lata Sowinsky, 1884). Мензис определяет средиземноморских лимнорий как L. tripunctata; это название становится синонимом L. tuberculata. Однако, если начать восстановление забытых названий, вид должен быть обозначен как L. californica-HewsUrn, 1874. Кроме L. lignorum, для Японского моря Гурьяновой (1936: 97—98) указана также L. japonica; если это не синоним L. borealis (отмеченного Брюнелем в Канаде), считающегося холодноводным видом, то это уже пятый вид лимнорий нашей фауны. Подрод Phycolimnoria (с новым видом Ph. zinovae} признан Кусакинымсамостоятельным родом. Тропическая Paralimnoria в нашей фауне отсутствует,-
На лимнориидах в целом, по Мору (Mohr, 1959а, 1959b), живет «четко очерченный род стилохонид». Кану (Canu, 1886) отмечает новый вид Spirochona crystallina (Lobochona sp.) на Limnoria lignorum (L. tripunctata, — Clapp a. Kenk, 1963) во Франции, у Круа и Ла-Креш близ Вимерё. Инфузории без описаний и рисунков отмечены на плеоподах L. lignorum (L. tripunctata} в Мавритании и Марокко, в Средиземном море (Monod, 1925), Spirochona sp. — на L. lignorum (L. quadripunctata} в США (Калифорния, бухта Сан-Франциско) (Kofoid, 1927). Mop (Mohr, 1959b) изображает хонотрих c L. tripunctata из бухты Морро в Калифорнии; это, вероятно, Lobochona prorates. Доне (Dons, 1940) описывает Lobochona limnoriae с норвежской расы Limnoria lignorum (Хьеллеботн в Бейтстадфьорде, внутренней части Трондхеймсфьорда). Неопределенные хонотрихи отмечены на L. lignorum в северной, западной и южной Норвегии и в США (Вашингтон и Орегон) (Mohr, 1950, 1959b); Lobochona limnoriae позднее найдена Мором (Mohr а. oth., 1963а) в Норвегии и в трех тихоокеанских штатах США (Вашингтон, Орегон, Калифорния). В одной из работ Мора (Mohr, 1959b) зарисованы хонотрихи с Limnoria lignorum, L. tripunctata и L. andrewsi. Калифорнийские авторы (Mohr, 1950, 1959a, 1959b, 1966; Mohr a. oth., 1963a; Mohr a. Matsudo, 1970; Matsudo, 1966; Matsudo a. Mohr, 1964) осмотрели богатые коллекции лимнориид из различных морей; хонотрихами заражены почти все виды и расы. На Limnoria и Paralimnoria были найдены только виды Lobochona, на Phycolimnoria — виды близкого рода (не изучены). Хонотрихи обнаружены этими авторами на Limnoria lignorum, L. tripunctata, L. quadripunctata, L. (Paralimnoria} andrewsi и на Phycolimnoria sp. в коллекциях из Норвегии (Тромсё), Англии (Плимут), Испании, Португалии (эстуарий Доуро и устье р. Тагус), Италии (Неаполь), Греции (Тазос), Коста-Рики (Сантос и Лимон), ЮАР (Кейптаун), Филиппин (Манила), Австралии (Мельбурн), Тасмании (Хобарт), Новой Зеландии, Японии, Канады и США (Атлантическое и Тихоокеанское побережья, Мексиканский залив и Гавайские острова) (Mohr, 1959b; Mohr a. oth;, 1963а; Mohr a. Matsudo, 1970). С Limnoria tripunctataMop и Мацудо (Mohr, 1959b; Mohr a. oth., 1963a; Matsudo, 1966) описали новый вид Lobochona prorates, отмеченный ими в США (Калифорния, гавани Сан-Педро и Ньюпорт, заливы Лонг-Бич, Сан-Диего и др.), в Португалии, Греции, в Адриатическом море и на Филин-
1 Звездочкой отмечены виды, на которых обнаружены хонотрихи.
пинах. L. prorates распространена, как полагают, в теплом климатическом поясе Мирового океана (Matsudo, 1967а), в теплых, умеренных водах разных стран (Mohr a. Matsudo, 1970); вероятно, она идентична со «спирохопой» Капу.
Новая хонотриха (зарисована, но не названа) отмечена ла Limnoria (Paralimnoria) andrewsi в США (Гавайские о-ва, о. Оаху, Гонолулу; см.: Mohr, 1959b); определение хозяина условное, поскольку осмотрены лишь плеопоцы рачков. Позднее эта хонотриха описана уже как Lobochona insularum (Mohr a. oth., 1963а — Гавайи, Ваикики). Р. andrewsi — предположительно пантропический космополит (Индийский океан, Пацифика), отсутствует в нашей фауне. Хонотрихи отмечены также на Limnoria из водорослей (Mohr, 1959b; Mohr a. Matsudo, 1970 — США, Вашингтон); Мор уточняет, что это виды Lobochona с лимнорий подрода Phycolimnoria (Mohr a. oth., 1963а). По Мору (Mohr а. Matsudo, 1970), Limnoria (Phycolimnoria) algarum несут хонотрих, напоминающих Lobochona, но отличающихся по крайней мере на уровне подрода (США, Орегон, Калифорния).
В нашем материале на видах Limnoria обнаружены виды Lobochona и трех четких новых родов (Aurichona, Filichona и Phyllochona). Осмотрены следующие виды древоточцев: 1) Limnoria lignorum: а) Белое море, Чупа, глуб. 4—5 м, сборы О. Г. Кусакина, лето 1965 г., около 40 особей из коллекций ЗИН АН СССР (найдена Lobochona limnoriae); б) Японское море, Сов. Гавань, сборы О. Ключаревой, 1933 г., 5 особей из коллекций ЗИН АН СССР (L. limnoriae?); в) Японское море, о. Путятин, глуб. 1 м, сборы автора, 27 VI 1966, около 200 особей (L. tenue); г) о. Кунашир, зал. Измены, литораль, сборы О. Г. Кусакина, 1 VIII 1951, 9 особей из коллекций ЗИН АН СССР (L. tenue); д) о. Итуруп, зал. Китовый, сборы О. Г. Кусакина, 30 VIII 1954, 4 особи из коллекций ЗИН АН СССР'(Lobochona sp.); е) Камчатка, Авачинская бухта, сборы Н. Гребницкого, 1880 г., 3 особи из коллекций ЗИН АН СССР (L. limnoriae, Phyllochona vexillata); ж) Баренцево море, Мурман, пос. Дальние Зеленцы, глуб. 2 м, несколько тысяч особей, сборы автора, август 1967 г, (L. limnoriae, Ph. vexillata); 2) L. borealis: а) Баренцево море, Кольский зал., глуб. 188—220 м, сборы К. М. Дерюгина, 8 IX 1908, 4 особи из коллекций ЗИН АН СССР (Ph. vexillata, Aurichona armata); б) Японское море, мыс Егорова, глуб. 92—111 м, сборы А. В. Иванова, 27 VII 1931, 2 особи из коллекций ЗИН АН СССР (A. armata, Ph. vexillata и Filichona sp.); 3) L. magadanensis: а) Сахалин, пос. Антоново, глуб. 16—50 м, сборы 3. И. Кобяковой и Е. Ф. Гурьяновой, 8 X 1946 и 14 IX 1946, 5 особей из коллекций ЗИН АН СССР (Filichona paradoxa); б) Камчатка, Авачинская бухта, сборы Н. Гребницкого, 1880 г., 1 особь из коллекций ЗИН АН СССР (F. paradoxa).
Хонотрихи не найдены нами на Phycolimnoria zinovae (2 особи из бухты Сивучьей, зал. Посьет), но отмечены на Phycolimnoria sp. с южного Кунашира (из ствола ламинарий).
Хонотрихи на морских видах Gammarus. ОтрядAmphipoda включает 4 подотряда; хонотрихи найдены только на части видов подотрядов Gammari-dea и Caprellidea,, насчитывающих в сумме 3250 из 3600 видов амфипод. Основная масса родов и видов Gammaridea относится к семейству Gammaridae. В морях представлены 2 рода гаммарид, несущие хонотрих, — Gammarus и A nisogammarus. Род Gammarus подразделяется обычно на 4 подрода, включающие, по личному сообщению Н. Л. Цветковой, следующие характерные виды: 1 Gammarus s. str. (* G. locusta, G. aequicauda, G. simoni, G. tigrinus), В oreogammarus (*G. oceanicus, *G. zaddachi, *G. setosus, G. wil-kitzkii, *G. salinus, *G. kamtchaticus), Marinogammarus (*G. obtusatus, G. finmarchicus, G. stracensis, G. pirloti, G. olivii, *G. marinus; по Стоку, название Marino gammarus неприемлемо) и Rivulogammarus (*G. duebeni и пресноводные виды типа *G. pulex, *G. lacustris и др.). Морских гаммарусов Европы ранее определяли как G. locusta; считалось, что этот вид легко адаптируется к всевозможным условиям среды, образуя подвиды. Для Мурмана указаны G. locusta и G. marinus (Яшнов, 1948; Кузнецов, 1960, 1964), но это, вероятно, комплекс G. setosus-\-G. oceanicus и G. obtusatus. Исследования ряда авторов (Секстон, Сегерштрале, Кинне, Сток и др.) показали существование группы морфологически близких видов, в частности G. setosus, G. oceanicus, G. zaddachi и др., отличающихся прежде всего требованиями разной солености среды и различной способностью выносить опреснение. Ареал G. locusta — теплые моря (Средиземное, Черное).
По литературе на гаммаридах обитают виды 3 родов хонотрих (Heliochona, Spirochona и Oenophorachona), по нашим данным — 7 родов (включая новые роды—Hetero-chona, Toxochona, Cavichona и S er pe nt i chon а); комменсалы заселяют плеоподы, жабры, антенны, гнатоподы и ротовые придатки хозяев. Впервые хонотрих на гаммарусах нашел Шейтен, позднее их описал Штейн (Stein, 1854) как S pirochona [Heterochona ] scheu-tenii на Gammarus sp. (G. zaddachi wstsG. duebeni) в солоноватом канале близ Амстердама. По Эйсмонду (Eismond, 1890а), вид был найден на задних ногах G. pulex, что неверно. IIlTeHH(Stein, 1859) находит Я. scheutenii на неопределенном рачке из Балтийского моря. На Gammarus sp. в Северном море (вероятнее всего на о. Боркум, а не в Висмарской
1 Звездочкой отмечены виды, на которых обнаружены хонотрихи.
бухте, как указывает Добжапская-Качановская) найдена Heliochona sessilis (Plate, 1888), на «морском Gammarus» [G. obtusatus?) — Stylochona [Heterochona] coronata (Kent, 1881 — Англия, о. Джерси, бухта Септ-Клсмептс). Хозяева всех трех видов хонотрих, описанных с морских гаммарид в прошлом веке, до вида не определены. Плате собирал вероятнее всего G. locusta или G. oceanicus.
В литературе хонотрихи отмечены па следующих морских и солоноватоводпых видах Gammarus. Подрод Gammarus: 1) G. locusta [-[-Gammarus spp.): Heliochona sessilis, Heterochona scheutenii (Wallengren, 1895 — Швеция, Кристинеберг близ Богусленса, Эресунд, Ландскрона, Мальмё Скельдервикеи, Куллаберг, Хельсингборг; Precht, 1935 — Германия, Кильская бухта; Fenchel, 1965 — Дания, Эресунд). Подрод Rivulo gammarus: 1) Gammarus duebeni : Heliochona [Heterochona] scheutenii (Precht, 1935 — Германия, Боттсандская банка в Кильской бухте; Fenchel, 1965 — Дания, Изефьорд; Швеция, Аскё, окрестности Стокгольма), Heliochona sp. [Heterochona) (Mohr, 1966 — Финляндия, Тверминне; Англия, Плимут). Подрод Вoreogammarus: 1) Gammarus oceanicus: Heliochona sessilis, Heterochona scheutenii (Fenchel, 1965— Дания,
Рис. 7. Бокоплав Gammarus locusta и его ротовые части (по Сарсу и Борра-дейлю).
Эресунд; Швеция, Аскё, Изефьорд); 2) G. setosus : неопределенная хонотриха на плеоподах и жабрах (Mohr, 1952, 1953 — США, северная Аляска, море Бофорта, оз. Ну-вук у мыса Барроу), Heliochona n. sp. (Mohr a. oth., 1961 — там же), Н. psychra (Mohr, 1966; Matsudo a. Mohr,1965; Mohr a. Geiger, 1969 — там же); 3) G. salinus: Heliochona sessilis ti H. scheutenii (Fenchel, 1965 — Дания, Изефьорд); 4) G. zaddachi: H. scheutenii (Precht, 1935 — Германия, Кильская бухта; Dobrzahska-Kaczanowska, 1963 — Польша, солоноватый рукав Мартва Висла близ Гданьска, в 1 км от моря; Fenchel, 1965 — Швеция, Аскё), Heliochona sp. па плеоподах (Matsudo a. Mohr, 1965; Mohr, 1966); 5) G. ornatus [G. duebeni?): Spirochona [Heterochona] scheutenii (Rentsch, 1860 — Германия, Висмарская бухта в Балтийском море). Подрод Marinogammarus: 1) G. marinus [G. obtusatus?): «вероятно, Vaginicola crystallina» [Heterochona cororaaia?)(Tuffen West, in: Bate a. Westwood, 1861 —.Англия, Плимут). Указание Кента (Kent, 1881) о находке «Spirochona scheutenii» на G. marinus «и других Entomostraca» ошибочно.
Кроме конкретных данных, в литературе имеется и ряд общих указаний. Так, Heliochona sensu lato указана Мором (Mohr, 1966) для группы Gammarus locusta [G. locu-' sta, G. zaddachi, G. chevreuxi) и для арктической G. setosus; гелиохонины — для комплекса G. zaddachi-\-G. duebeni (Matsudo a. Mohr, 1968— Англия, Плимут); Heliochona scheutenii — для комплекса G. locusta (Mohr a. Matsudo, 1970); Heliochona — для «Gammarus, в основном на комплексе G. locusta или на Rivulogammarus duebeni» (Mohr a. Matsudo, 1970 — Англия, Плимут, западная Шотландия; США, Новая Англия, мыс Барроу на Аляске, Пьюджет-Саунд), и для G. zaddachi и его подвидов (Mohr, 1966 — Англия, Плимут).
Нами осмотрены следующие виды морских гаммарусов. Подрод Gammarus: 1) G. locusta (рис. 7) — Черное море, Крым, литораль близ Алушты, сборы автора, май 1965 г., 12 особей [Heliochona pontica). Подрод Rivulogammarus: 1) G. duebeni: а) Белое море, зал. Чупа, о. Зеленый, литораль, сборы А. Н. Голикова, 24 VI 1964, 2 особи из коллекций ЗИН АН СССР; б) там же, бухта Круглая, литораль, сборы Н. Л. Цветковой, 11 VI 1964, 3 особи из коллекций ЗИН АН СССР; в) Баренцево море, Мурман, пос. Дальние Зеленцы, кут губы Ярнышной и устье речки на Дальнем пляже, сборы автора, август 1967 г., несколько тысяч особей [Heterochona scheutenii на всех
трех расах). Подрод Boreogammarus: 1) G. Oceanians: а) Белое море, мыс Картеш, сборы Н. Л. Цветковой, 8 VI 1964, 44 особи из коллекций ЗИИ АН СССР (редкие особи Heterochona crinita и Heliochona sessilis); б) Баренцево море, Мурман, пос. Дальние Зеленцы, губа Ярнышпаяи бухта Дальпе-Зелепецкая, литораль, сборы автора, несколько тысяч особей, август 1967 г. {Heterochona crinita, II. psychra, II. trifaria и Heliochona sessilis); 2) G. setosus — Баренцево море, совместно c G. oceanicus, несколько сотен особей (те же хонотрихи, что и на G. oceanicus); 3) G. kamtschaticus — Камчатка, Кроноц-кий зал., сборы Н. Спасского, 1934—1935 гг., 3 особи из коллекций ЗИН АН СССР (Н. psychra1}); 4) G. zaddachi: а) Балтийский порт, глуб. 0—13 м, сборы К. М. Книповича, 16 VII 1908, 6 особей из коллекций ЗИН АН СССР (без хонотрих); б) Дания, литораль, сборы Т. Фенхеля {Heterochona scheutenii). Подрод (род?) Marinogammarus: 1) G. obtu-satus: а) Белое море, зал. Чупа, бухта Сельдевая, литораль, сборы Н. Л. Цветковой, 23 VI 1964, 26 особей из коллекций ЗИН АН СССР {Heterochona coronata); б) Баренцево море, Мурман, бухта Дальне-Зеленецкая и залив к востоку от нее, сборы автора, август 1967 г., несколько тысяч особей {Heterochona coronata, Н. peregra, Н. exilis и Heliochona elegans). Ранее (Янковский, 19676) мы зарисовали под названием Stylochona coronata форму с плеопод мурманских G. obtusatus.
Хонотрихи на Anisogammarus. Виды Gammarus обычны в северных морях в участках с нормальной соленостью, с периодическим опреснением и в постоянно пресных водах; те же ниши в Пацифике занимают виды Л nisogammarus. По Цветковой, этот род включает два подрода — Anisogammarus s. str. (один вид — A. puget-tensis) и Eogammarus (включает все остальные виды рода; среди них выделяется группа spinosa, бывшие Echinogammarus, — A. ochotensis, A. spasskii, A. subcarinatus и др.; см.; Цветкова, 1970). Спирохониды отмечались на морских и солоноватоводных гамма-ридах (Mohr, 1966); позднее Mop (Mohr, 1959а; Mohr a. oth., 1963а) уточняет, что это Spirochona с A nisogammarus из морских и солоноватых вод северо-запада США (Вашингтон, о. Сан-Хуан; Орегон, бухта Коос; Калифорния; см.: Matsudo a. Mohr, 1965). Heliochona («или нечто подобное») отмечена на плеоподах, Spirochona — на жабрах Anisogammarus вдоль Тихоокеанского побережья США, «от морских до почти пресных вод» (Mohr, 1966), не определенные до вида Spirochona и Heliochona — на северо-западе США (Matsudo, 1966) и на Тихоокеанском побережье США (Matsudo a. Mohr, 1968) на «амфиподе группы Gammaridea». Скорее всего авторы имеют в виду здесь не Heliochona на жабрах, a Heterochona на плеоподах Anisogammarus. Новые хонотрихи, Oenopho-rachona ectenolaemus it Spirochona halophila, описаны с плеопод и жабр A nisogammarus sp. (A. confervicolus1}) (Matsudo a. Mohr, 1968 — США, Калифорния, Крисент-Сити, Эурека и Фильдс-Лэндинг; Вашингтон, о. Сан-Хуан). Новые виды Spirochona, Heliochona и Oenophorachona, отличающиеся от вышеназванных, отмечены на A nisogammarus в США, от Калифорнии до Пьюджет-Саунда, в частности в солоноватых и морских водах бухты Фрайди в шт. Вашингтон (Mohr a. Matsudo, 1970). Боррадейл (Borradaile, 1959 : 113) упоминает о морских спирохонах на Gammarus, явно имея в виду не спирохон с A nisogammarus, a «Spirochona scheutenii» с Gammarus duebeni.
Нами осмотрены следующие виды Anisogammarus. Подрод Eogammarus: 1) А . ochotensis — Охотское море, Ейринейск, литораль, сборы О. Мокиевского, 17 особей из коллекций ЗИН АН СССР {Oenophorachona urceolata, Spirochona marina); 2) A. spasskii: а) о. Шикотан, бухта Крабовая, сборы О. Г. Кусакина, 1964 г., 8 особей из коллекций ЗИН АН СССР; б) о. Беринга, северный берег, литораль, сборы'О. Колотовкина, 24 VII 1964, 2 особи из коллекций Дальневосточного гос. университета (ДВГУ) {Ое. urceolata, S. marina на обеих расах); 3) A. pribiloffensis: а) Японское море, бухта Ша-мора близ Владивостока, литораль, сборы О. Г. Кусакина, 21 IV 1963, 3 особи из коллекций ДВГУ {Toxochona mirabilis); б) Японское море, о. Путятин, глуб. 1—1.5 м, сборы автора, июнь 1965 г., 14 особей {Oenophorachona sp.); 4) A. tiuschovi: а) Японское море, зал. Посьет, сборы В. В. Кудряшова, 20 VII 1965, 3 особи из коллекций ДВГУ; б) Приморье, озера в Шкотовском районе, сборы В. В. Кудряшова, 1 XI 1965, 7 особей из коллекций ДВГУ {Oe. sagitta); 5) A. locustoides: а) Охотское море, о. Итуруп, бухта на юге острова, сборы О. А. Скарлато, 10 VIII 1947, 3 особи из Коллекций ЗИН АН СССР; б) о. Беринга, западный берег, пос. Никольское, литораль, сборы О. Колотовкина, 8 VII 1964, 4 особи из коллекций ДВГУ {Oe. urceolata, S. marina).
Хонотрихи обнаружены нами также на A nisogammarus posjeticus из Посьета {Spirochona), на неопределенных видах с южного Сахалина {Spirochona, Heterochona, Oenophorachona), на A. makarovi {Oenophorachona) и A. subcarinatus с Парамушира {Heliochona, Oenophorachona и Toxochona; см.: Янковский, 1973), saA.confervicolus {Spirochona), собранных Мором в США (Калифорния, Санта-Барбара). В одной из наших статей (Янковский, 1967г) отмечалась находка Spirochona на Echinogammarus spasskii и «Е. brandti» {Е. locustoides) на южных Курильских островах..
Хонотрихи на пресноводных видах Gammarus. В отличие от морских видов пресноводные Gammarus несут только спирохон, впервые описанных с G. pulex (Stein, 1852) и многократно отмеченных позднее в разных странах Европы. G. pulex обычен в континентальной Европе, встречается в Англии (но не в Ир
ландии, Шотландии и Корнуэлле, 1'де его замещает G. duebeni); вид указывался и для прибайкальских озер и соров Байкала, однако это пе речной, а озерный вид G. lacustris (Бекман, 1954), ибо G. pulex распространен па восток лишь до Урала. Указания па находки G. pulex в опресненных бухтах Японского и Берингова морей (Гурьянова, Булычева) ошибочны — имелись в виду эвригалинные виды A nisogammarus. Для G. lacustris в сумме получается довольно странный ареал: восточная и западная Европа (включая Карелию и Кавказ), Азия от Ирана до Лепы и от Урала до Амура, Камчатка, Курильские острова, Сахалин, Япония и даже Северная Америка; вероятно, вид сборный или распадается на подвиты. Пресные воды Европы богаты гаммаридами; возможно поэтому, что стандартные определения рачков как G. pulex не всегда правильны. К примеру, в бассейне Дуная обитает 61 вид 15 родов гаммарид, в частности G. pulex, G. fossarum., G. tatrensis и G. roeseli; в бассейнах Днестра и Прута найдено 8 родов гаммарид с 38 видами и подвидами, включая G. ischnus, G. warpachowskyi, G. balkanicus и G. kischi-neffensis. Комменсалы разных видов гаммарусов, кроме G. pulex, изучены еще плохо; находимых на них спирохон всегда определяют как Spirochona gemmipara. Богата пресноводными гаммаридами и талитридами фауна Капады и США; однако, хотя эпифауна отдельных видов и изучалась (Келликотт, Стокес и др.), хонотрих на них (Spirochona на G. lacustris в шт. Монтана в США) нашел лишь в недавнее время Тиббс (John Tibbs).
S. gemmipara отмечена на G. pulex в следующих работах: Stein, 1852 — Германия, Таранд на Эльбе, пригород Дрездена; Stein, 1854, 1859 — Германия; Butschli, 1877, 1889 — Германия; Hertwig, 1877а — Германия, окрестности Иены; Сапп, 1886 Франция; Plate, 1886, 1888 — Германия, Мюнхен; Erlanger, 1889 — Германия; Eis-mond, 1890а, 1890b, 1895 —Польша, окрестности Варшавы, Беляны; Zacharias, 1893 — Германия, Гроссе Пленерзее; Balbiani, 1895—Франция, окрестности Парижа; Richard, 1899 — Франция; Roux, 1900 — Швейцария, литораль оз. Леман; Roux, 1901 — Швейцария, Хоте-Савойе, пруд у Веррье; Doflein, 1900 — Германия; Hickson, 1903 — Англия, Манчестер; Henderson, 1905 —Германия, Фрейбург, Брейсгау; Sakowsky-Campi-oni, 1907 — Швейцария, Берн, Гласбрюннен; Faure-Fremiet, 1905, 1910 — Франция; Lampert, 1910 — Германия; Andre, 1912 — Швейцария, Базель и окрестности; Thienemann, 1912, 1913а, 1913b — Германия, Зауэрланд, ручей близ Брауншвейга; Mermod, 1914—Швейцария, ручей у Вод близ Сент-Круа и Санье в окрестностях Базеля; Keiser, 1921 — Швейцария, Ланге-Эрлейн в Базеле и пригороды Базеля; Penard, 1922 — Швейцария, окрестности Женевы, Тонекс; Kalmus, 1928 — Чехословакия, окрестности Праги; De Geest, 1933 — Бельгия; Guilcher, 1949, 1950,
1951 — Франция; Tuffrau, 1953 — Франция; Dudich, 1967 — Венгрия; Matsudo a. Mohr, 1968 — ГДР, Иена, и Англия; Mohr a. Matsudo, 1970 — ГДР, Иена, река Саале, приток Эльбы, близко от типового местонахождения на Эльбе близ Таранда.
5. gemmipara отмечена на Gammarus без указания вида хозяина в следующих работах: CLaparede et Lachmann, 1858 — Германия, окрестности Берлина; Wurmbach, 1962 — ФРГ; Raabe, 1964с — Польша. Ссылки без уточнения рода хозяина или вида хонотрихи содержатся у следующих авторов: Hertwig, 1877b — Германия; Doflein, 1897а — Германия; Kahl, 1930, 1935 — Германия; Mohr, 1948 — Англия, Манчестер; Lom, in: Jirovec a. oth., 1953 — Чехословакия. Спирохоны отмечены наследующих подвидах G. pulex и на других видах Gammarus (подвиды часто признают самостоятельными видами): Rivulbgammarus pulex pulex (Fritz, 1961 — ГДР); G. pulex fossarum (Bu-char, 1959 — Чехословакия, окрестности Праги; Големански, 1964.— Болгария, Опи-цвят и Белоградчик); G. pulex komareki (Големански, 1964 — Болгария, Долни Раковец и Лакатник); G. balkanicus (Болгария, Витоша, Лакатник, Опицвят и Панчарево); Carinogammarus roeseli (Kalmus, 1928 — Чехословакия, окрестности Праги); G. roeseli (Green, 1960 — Югославия, оз. Охрида; Дж. Тиббс — США, Монтана [Spirochona sp. ]). Нами осмотрено 2 пресноводных вида Gammarus'. 1) G. pulex — окрестности Ленинграда, ручей у Нового Петергофа, сборы автора, ноябрь 1966 г., около 60 особей (S. gemmipara); 2) G. lacustris — оз. Гусиное в Прибайкалье и соры Байкала в районе Харауза, дельта Селенги, сборы М. 10. Бекман, 1966 г., 27 особей из коллекций Лимнологического института Сибирского отделения АН СССР (.S', gemmipara).
Хонотрихи на Gammaridae Байкала. Хонотрихи широко распространены в Байкале. Фауна Байкала насчитывает около 33 эндемичных родов с 241 видом и 77 подвидами гаммарид (Россолимо, 1966); преобладают виды крупных родов — Eulimno gammarus, Poekilogammarus, Micruropus, Pallasea, Hyalellopsis и др., остальные роды монотийичны или олиготипичны. Количество родов и видов гаммарид может уменьшиться соответственно до 30 и 200 в связи с ревизией крупных родов (Ко-жов, 1962), особенно рода Eulimnogammarus, включающего около 40 видов (Базикалова, 1945, 1948). Базикаловой ликвидировано уже 4 рода: Brandtia и Spinacanthus объединены в род Brandtia; Hyalellopsis, Dorogammarus, Gammarosphaera и Boeckaxelia (Axel-boeckia) — в род Hyalellopsis; Brachyuropus окончательно признан синонимом Acantho-gammarus (рис. 8, Б), разделяемого на 3 подрода. Выделен новый род Рseudomicruropus.
Гаевской (1927, 1933, 1949) на большинстве осмотренных ею гаммарид, кроме Macrohectopus и других родов, отмечен один вид хонотрих — Spirochona gemmipara.
Списка хозяев нет, автором по названо вообще ни одного зараженного вида, хотя в тексте указывается, что хонотрих несут до 70% осмотренных особей байкальских гамма-рид. Поскольку Гаевская пе изучала коллекций, опа могла осмотреть лишь небольшую часть видов гаммарид Байкала. Вероятно, ею были найдены виды 5pirochona и С avichona, но не 5. gemmipara, отсутствующая в самом Байкале. Кроме того, в южном Байкале до липии Листвспичпое—Мурипо, где сю был собрапматсрпал, пет соров, в которых обитает Gammarus lacustris — хозяин S. gemmipara. Сварчевским (1928а, 19286) на гамма-ридах Ангары и Байкала найдено 9 видов спирохонид — S. gemmipara и 8 новых, которыми заражено 34 вида 17 родов гаммарид. Много ошибок в написании названий этих хозяев у Каля (Kahl, 1935).
В 1966 г. мы проводили сборы гаммарид Байкала и изучали коллекционный материал ЛИН СО АН СССР; были собраны гаммариды литорали, сублиторали, глубин до 50 м и рачки из Ангары у пос. Никола. Коллекционный материал включал как определенные формы, так и массовые сборы неопределенных рачков; определения проводились только при находках хонотрих, В целом мы осмотрели, по-видимому, особей не менее 1/2 видов и 3/4 родов гаммарид Байкала; были изучены, в частности, почти все хозяева, упоминаемые Сварчевским. Значительно расширен список байкальских спирохонид и их хозяев; мы различаем не один, как ранее, а 3 рода байкальских хонотрих (Spirochona, Cavichona, Serpentichona) с 24 видами.
Сварчевский (1928а) описывает Spirochona elegans с трех хозяев из Ангары у Иркутска — Е chino gammarus [Eulimno gammarus] verrucosus («особо излюбленный хозяин»), Pallasea cancelloides и P. cancellus; по нашим данным, они несут Cavichona elegans, C. crassa и Cavichona sp.
Ниже приводится список байкальских хонотрих и их хозяев по Сварчев-скому (19286); нами исправлены ошибочные или устаревшие названия хозяев; для каждого из хозяев в скобках указаны виды хонотрих, найденные нами.
1. Spirochona gemmipara: Gammarus pulex=G. lacustris (S. gemmipara)', Hyallelopsis [Hyalellopsis] costata (Spirochona sp., non gemmipara)', Brandtia latissima=B. lata (Cavichona protecta)', Оdontogammarus demjanowitschi=O. calcaratus (C. elegantula); Gammarus (Eulimnogammarus] hyacinthinus (Cavichona sp.?); Carlnogammarus [Gmelinoides] fasciatus (S. brevis); C. cinnamoneus (Cavichona virgata); Pallasea cancellus (Cavichona sp.?); Garjaewia cabanisi (C. laticollis).
2. Spirochona elegans: Brandtia lata (Cavichona protecta); Ommatogammarus carneolus (C. rhabdomorpha); Echinogammarus [Eulimnogammarus] aheneus (Cavichona sp.); E.fuscus (Cavichona sp.); E. lividus (C. exilis); E. ussolzewi (Cavichona sp.); E. viridis (C. brevistyla); E. verrucosus (C. elegans); E. cyanoides—E. cyaneus? (C. multifida); Pallasea bicornis= P. cancelloides? (C. crassa?); Eucarinogammarus wagi (C. cincinnata); Carinurus solskii (Cavichona carinuri); Axelboeckia [Hyalellopsis] carpenteri (Cavichona sp.?); A. castanea— Hyalellopsis carpenteri (Cavichona sp.?); Pallasea cancellus (Cavichona sp.?); Parapallasea borowskii (Cavichona sp.?); Heterogammarus [Eulimnogammarus] sofianosi (Cavichona sp.); Acanthogammarus victorii (Cavichona sp.); A. albus (C. acanthogammari).
' 3. Spirochona patella (nomen nudum): Acanthogammarus albus (Cavichona acanthogammari); A. godlewskii (Cavichona sp.); Оdontogammarus pulcherrimus=O. calcaratus (C. elegantula).
4. Spirochona tuba: Coniurus radaschkowskii=C. radoezkowskii (S. tuba).
5. Spirochona elegantula: Оdontogammarus dem]anowitschi—O. calcaratus (Cavichona elegantula); Parapallasea lagowskyi (Cavichona sp.?).
6. Spirochona anthus: Brachiuropus [Acanthogammarus] reicherti (Serpentichona anthus); Acanthogammarus albus (Cavichona acanthogammari).
7. Spirochona globulus: Ommatogammarus flavus (S. globulus); Pallasea kessleri (Cavichona sp.?).
8. Spirochona simplex: Ommatogammarus flavus (S. simplex).
9. Spirochona pusilia: Ommatogammarus flavus (S. globulus).
Ниж е перечислен просмотренный нами материал по гаммаридам Байкала.1
Виды Spirochona найдены нами на 3 видах рачков: 1) Gmelinoides fasciatus: а) Лист-веничное, литораль до истока Ангары; б) бухта Песчаная, глуб. 1—10 м (5. brevis); 2) Coniurus radoezkowskii — мыс Черемшанка, глуб. 200—250 м, VIII 1949, 3 особи (S. tuba); 3) Ommatogammarus flavus: а) Большие Коты, глуб. 75—100 м, 18 VI 1948, 21 особь; б) Лиственичное, глуб. 200 м, 26 II 1957, 60 особей (S. globulus, S. simplex, S. gnathopodialis).
Виды Serpentichona найдены на 2 видах рачков: 1) Acanthogammarus (Brachyuropus) reicherti — Большие Коты, глуб. 160—260 м, 18 X 1946; глуб. 150—230 м, 25 XI 1948,
1 Количество особей указано только для глубоководных видов гаммарид, полученных из коллекций Лимнологического института Сибирского отделения АН СССР. Литоральные и сублиторальные сборы автора включают обычно массовый материал — десятки или сотни особей.
9 особой (S. anthus)', 2) Р achyschcsis branchialis, паразитический рачок из зародышевых камер Acanthogammarus reicherti, 7 особей (Serpentichona sp. — мигранты S. anthus?).
Виды Cavichona. найдены памп на 23 определенных видах рачков и па ряде неопределенных форм: 1) Eulimnogammarus cyaneus: а) Листвсиичнос, глуб. О — 0.2 м; б) ст. Байкал, глуб. 0—0.2 м; в) бухта Песчаная, глуб. 0.5 — 1 м (Cavichona multifida)', 2) Е. verrucosus: а) Листвопичпос, глуб. 0.5—1 м; б), ст. Байкал, глуб. 0.5—1.5 м (С. elegans); 3) Е. maacki: а) Лиственичное, глуб. 0.5 м; б) Большие Коты, глуб. 2—5 м; в) ст. Байкал,, глуб. 1—1.5 м (Cavichona sp.); 4) Е. viridis: а) Лиственичное, глуб. 0.2—0.8 м; б) Большие Коты, глуб. 1—3 м (С. brevistyla); 5) Е. lividus: а) ст. Байкал, глуб. 1—1.5 м;. б) бухта Песчаная, глуб. 1—3 м (С. exilis); 6) Eulimnogammarus sp. типа Е. murinus — Большие Коты, глуб. 150—230 м, 18 X 1946, 1 особь (С. oligocineta); 7) Eulimnogammarus spp.: а) Большие Коты, глуб. 1—5 м; б) ст. Байкал, глуб. 1—1.5 м; в) Лиственичное, глуб. 0.5—1 м; г) бухта Песчаная, глуб. 10—15 м (Cavichona spp.); 8) Abyssogammarus-sarmatus — Лиственичное, глуб. 400—500 м, 5 IX 1948; глуб. 613 м, 3 VI 1935, 9 особей (Cavichona sp.); 9) Eucarinogammarus wagi: а) Лиственичное, глуб. 200 м, 17 XI 1948,. 36 особей; б) Большие Коты, 25 XI 1948, 6 особей (С. cincinnata); 10) Paragarjaewia petersi — разрез от Боярской, глуб. 310 м, 29 VII 1962, 3 особи (С. abyssalis); 11) Garjae--wia cabanisi: а) Лиственичное, глуб. 150—200 м, 30 IX 1949, 6 особей; б) Ушканьи острова, мыс Елохин, глуб. 30—50 м, 18 IX 1951, 4 особи (С. laticollis); 12) Carinurus solskii: а) Посольский сор, глуб. 47 м, 18 VII 1962, 17 особей; б) Селенгинскоо мелководье, глуб. 15 м; в) Большие Коты, глуб. 4 м (Cavichona carinuri); 13) Оdontogammaruspulcher-rimus=O. calcaratus: а) Лиственичное, глуб. 150—200 м, 30 IX 1949, 2 особи; б) в 175 м от истока Ангары, 6 особей (С. elegantula); 14) Parapallasea lagowskyi: а) южный Байкал,, глуб. 950 м, 27 VII 1936, 4 особи; б) бухта Песчаная, глуб. 15—30 м, 6 особей (Cavichona sp.); 15) Р. puzylli carinulata — бухта Песчаная, глуб. 15—25 м, 16 особей (С. tenue); 16) Ommatogammarus carneolus: а) пос. Маритуй, 17 особей; б) Большие Коты, глуб. 300 м,. 12—13 VII 1949, 40 особей (С. rhabdomorpha); 17) Carinogammarus cinnamoneus: a) Xa-рауз, глуб. 25—27 м, 15 VII1961, 12 особей; б) Большие Коты, глуб. 300 м, 12 VII 1949, 11 особей (С. virgata); 18) Poeckilogammarus spp.: а) Большие Коты, глуб. 3—8 м; б)’ бухта Песчаная, глуб. 5—50 м; в) Селенгинское мелководье, глуб. 15 м; г) Лиственичное, глуб. 200 м, 15 XI 1948, 35 особей; д) Харауз, глуб. 25—27 м, 15 VII 1961, 38 особей (Cavichona spp.); 19) Brandtia lata: а) ст. Байкал, глуб. 0.3—0.5 м; б) бухта Песчаная,, глуб. 3—5 м (С. protecta); 20) В. (Spinacanthus) insularis: а) Большие Коты, глуб. 4—5 м,. с губок; б) о-ва Большие Ушканьи, глуб. 1.5—3 м, 23 IX 1945, 12 особей (С. protecta); 21) Pallasea cancelloides: а) ст. Байкал, глуб. 1.5 м; б) бухта Песчаная, глуб. 3 м (С. crassa); 22) Acanthogammarus flavus — бухта Песчаная, глуб. 30 м (Cavichona sp.);. 23) A. victorii: а) Лиственичное, глуб. 20—25 м; б) бухта Песчаная, глуб. 25—30 м (Cavichona sp.); 24) A. albus: а) Большие Коты, глуб. 25—30м, 25 X1 1948,30 особей; б) бухта Песчаная, глуб. 25—30 м; в) Посольск, глуб. 47 м, 18 VII 1962, 3 особи (С. acanthogammari); 25) С arino gammarus siedlitzi — Харауз, глуб. 25—27 м, 15 VII 1961, 5 особей (Cavichona sp.).
Хонотрихи на Amphithoidae. Виды A mphithoe широко представлены в дальневосточных морях СССР, менее — в северных (Гурьянова, 1951; Булычева, 1957а; Цветкова, 1967). На Мурмане обычен А . rubricata, в Посьете найдено 8 видов. Амфитоиды в отличие от гаммарид не образуют массовых скоплений, живут обычно парами в трубках. Mop (Mohr, 1948) обнаружил Trichochona lecythoides на e.Amp[h]ithob sp.» в США (Калифорния, Редондо-Бич); Гийше (Guilcher, 1950,. 1951) отметила «Heliochona scheutenii» (И. alternans) на A. rubricata во Франции. Осмотренный Мором вид хозяина позднее провизорно определен Стефенсеном как А. lacer-tosa (?). Для амфитоид в целом указан «четко определенный род стилохопид» (Mohr, 1959а). Виды Trichochona (не названы) отмечены в США на A. humeralis, A. valida, A. rubricata (Mohr, 1966) и на неопределенной амфитоиде в Чили (Винья-дель-Мар) (Mohr a. Matsudo, 1970).
По нашим данным, на севере Европы A mphithoe песет экзогеммовых хонотрих,-в Пацифике — только эндогеммовых. Нами осмотрены следующие виды рачков: 1) A . japonica — Японское море, о. Путятин, литораль, глуб. 1.5 м, среди водорослей, сборы и опр. автора, июнь 1966 г., 14 особей (Isochona migratoria); 2) A. rubricata: а) Баренцево море, Мурман, Дальне-Зеленецкая бухта, литораль, сборы и опр.. А. И. Булычевой, 25 II 1940, 5 особей из коллекций ЗИН АН СССР (Heliochona alternans); б) там же, сборы автора в августе 1967 г., 26 особей из верхней сублиторали в зоне-Strongylocentrotus на камнях, опр. Н. Л. Цветковой (Н. alternans); в) Командорские’ о-ва, о. Беринга, западный берег, скалистая платформа, нижний этаж среднего горизонта литорали, сборы О. Колотовкина, 13 VI 1964, опр. В. В. Кудряшова, 4 особи из коллекций ДВГУ (Isochona sp.); 3) A. rubricatoides (?): а) Командорские о-ва, о. Беринга, северный берег, биоценоз Holosaccion, средний этаж среднего горизонта литорали, сборы О. Колотовкина, 24 VII 1964, опр. В. В. Кудряшова, 2 особи из коллекций ДВГУ; б) там же, западный берег, риф у Орлова Камня, литораль, сборы О. Ко-
лотовкипа, 28 VII 1964, 4 особи из коллекций ДВГУ (Trichochona surgens); 4) A mphilhoe spp. — сборы автора на Сахалине (лагуна Буссе), Кунашире (Южпо-Курильск, Головнине), Итурупе (пос. Рыбаки, пос. Буревестник), Парамушире (Северо-Курильск) (Isochona spp.).
Хонотрихи и a Haustoriidae. Байт и Вествуд (Bate a. Westwood, 1861 : 191) упоминают об «инфузориях на волосках плавательных придатков» Sulcator [Bellia или Haustorius] arenarius в Англии. Вероятнее всего это хонотрихи: мы не знаем случаев обитания на щетинках плеопод морских гаммарид других инфузорий. Н. аге-narius распространен в северной Атлантике (США, Канада, Англия, Голландия, Франция).
Хонотрихи п а Р h о t i d а е. «Четко очерченный род стилохонид» отмечен на фотидах (Mohr, 1959а). Хозяин определен сначала как Photis californica (Mohr, 1966), позднее — как Photis sp. типа Ph. californica (Mohr a. Matsudo, 1970 — США, Калифорния, пролив Каталина). Это мелкие веретеновидные формы с простой ПВ и коротким стебельком (типа трихохон?). Род Photis обычен и в наших морях, поэтому возможна находка таких хонотрих и в СССР.
Хонотрихи на Cheluridae. Виды Chelura — обитатели теплых морей, где они сверлят древесину вместе с Limnoria-, в СССР Chelura найдена только в Черном море (Рябчиков, 1957). Находка одиночных особей хонотрих на Chelura (Mohr а. oth., 1963а) объяснялась сначала их неспецифической миграцией с лимнорий; позднее Мор и Мацудо (Mohr a. Matsudo, 1970) указывали, что лимнории и Chelura имеют своих собственных «спирохоноид». По личному сообщению Мора, тонкие хонотрихи без четкой шейки, вероятно нового рода, обнаружены им на Chelura в Неаполе.
Хонотрихи на Talitroidea. Булычева (1957) считает Talitroidea надсемейством, разделяя его на семейства Hyalidae, Talitridae и Hyalellidae. Комменсалов талитрид изучал ряд авторов (Киддер, Саммерс, Добжанская и др.); хонотрих («новый род стилохонид») нашли лишь недавно на A llorchestes angusta (Hyalidae) в CUIA, в Калифорнии (Mohr, 1966; Mohr a. Matsudo, 1970). Определение хозяина нуждается в проверке, .поскольку, по Булычевой, нет ни одного достоверного вида Allorchestes не только в Калифорнии, но и вообще на западном берегу США. В нашем материале виды Oenophorachona обнаружены на A. malleolus carinatus (мы считаем этот гребенчатый подвид особым видом—A. carinatus), Allorchestes sp. и на Parhyale ochoiensis, виды Spirochona — на Р. ochotensis и на неопределенных талитридах дальневосточных морей (описания видов см: Янковский, 1973). Хонотрих нет на всех других осмотренных нами водных и супралиторальных талитридах Черного, Баренцева и дальневосточных морей.
Хонотрихи на Су ami d а е. В подотряде Caprellidea хонотрихи отсутствуют на Caprellidae и обычны на Cyamidae-, в наших обширных сборах капреллид Мурмана и дальневосточных морей найдены суктории, перитрихи, апостоматы, но не хонотрихи. О находке «четко определенного рода стилохонид» на Cyamus мельком упоминает Mop (Mohr, 1959а, 1959b). Последующие сообщения более подробны. Так, Кальман (W. Т. Caiman, in: Mohr a. oth., 1963b; Mohr a. Matsudo, 1970) обнаружил хонотрих на циамидах с гренландского нарвала (Monodon monoceros, несущий Cyamus monodontis и С. nodosus), Мор и др. (Mohr a. oth., 1963b) — на циамидах с горбача, или серого кита (Eschri chtius gibbosus= Rhachianectes gtbbosus, несущий C. scammoni, а также C. ceti и C. kessleri) в Северной Атлантике, северной, южной, восточной и западной Па-цифике и в Чукотском море. Это виды нового рода типа Trichochona. («цетохона»; см.: Mohr, 1966), резко отличающиеся от форм с Balaenophilus. Цетохоны найдены на Cyamus и близких родах с полосатиков и с зубастых китов (особенно с горбачей, с серых и бутылконосых китов). Мацудо (Matsudo, 1966 : 360) приводит некоторые данные по размножению цетохон, без указания хозяев. Нами коллекция циамид рассмотрена лишь в последнее время; цетохоны найдены на видах Cyamus, особенно на С. ovalis; это достоверный, очень четкий род примитивных эндогеммин (изохонид). Вместе с хозяевами циамид — китообразными —хонотрихи широко рассеяны по всему Мировому -океану: цетохоны найдены на различных видах Cyamus, особенно С. ceti (рис. 6, И), С. boopis и С. scammoni, на одном из видов Neocyamus, на Isocyamus и Platycyamus в море Бофорта (США, северная Аляска, мыс Барроу), в Чукотском море, в северной Атлантике, у о. Ванкувера (Канада), в северной и южной Пацифике, в «Южном океане» (Mohr a. Matsudo, 1970).
Поскольку хонотрихами заражены все известные циамиды, целесообразно привести список достоверных родов и видов этого семейства (Leung, 1965, 1967) с указанием в скобках хозяев рачков. Формы с усатых китов; Cyamus ceti (рис. 6, И — Balaena, Eschrichtius); С. kessleri, С. scammoni (Eschrichtius); С. balaenopterae (В alaenoptera); С. boopis (Megaptera); C. erraticus, C. ovalis, C. gracilis (Balaena).-Формы с зубатых китов: Cyamus catodontis, С. bahamondei, С. ovalis (Physeter); C. monodontis, C. nodosu-(Monodon, Delphinapterus); Cyamus sp. (Berardius); Neocyamus physeteris (Physeter, Phos caenoides); Syncyamus pseudorcae (Pseudorca)-, Syncyamus sp. (Tursiops, Stenella); Platycyamus thompsoni (Hyperoodon); Platycyamus sp. (Berardius)', Isocyamus delphini (Grampus,
Clobicephala, Delphinus, Pseudorca). Два родовых названия циамид недостоверны: Рагасуamus — синоним Cyamus (Харли и Mop), Sirenocyamus — nomen nudum (Лёнг).
Хонотрихи н a Decapod a. Decapoda — самый крупный отряд ракообразных (около 8000 видов из 26 000). Хонотрихи обнаружены впервые Валлепгре-jiom (VVallcngrei), 1895) на крабах и раках-отшелышках. До настоящего времени оставались неизвестными виды с примитивных декапод — Natantia (креветок); мы нашли пх в дальневосточных морях. Определены следующие креветки: травяной шримс, или чилим — Pandalus latirostris (Сахалин, лагуна Буссе; Кунашир, залив Измены), песча-
Рис. 8. Хозяева хонотрих. А — Ebalia sp. (по Боррадейлю); Б — Acantho-gammarus victori (по Базикаловой); В, Г — Limnoria lignorum (по Мензису и Рябчикову); Д — Pagurus pubescens (по Кобяковой); Е — Portunus depura-tor (по Хлудовой).
ный шримс — Crangon dalli (Сахалин, песчаные пляжи Анивского берега близ Муравьева и Озерной; Кунашир, Южно-Курильск) и шримс-медвежонок — Sclerocrangon salebrosa (Сахалин, аквалангистские сборы 1968 г. в Аниве). На глубоководных креветках Sclerocrangon sp. из Охотского моря (коллекция ДВГУ) найден новый род и вид хилодохонид — Cryptochona tumida. Вероятно, хонотрихи широко распространены на креветках, хотя бы в северной Пацифике; на креветках Черного и Баренцева морей (пока осмотрены немногочисленные особи) эпифауна богатая, но хонотрих нет.
По Мору (Mohr, 1959а: 651), виды Chilodochona встречаются исключительно на крабах, однако это ошибка. Гийше (Guilcher, 1951) отметила их на лангусте Scyllarus arctus (Reptantia Macrura) во Франции (Ch. qvennerstedti= Chilodochona sp.). С лангуста Pali-nurus vulgaris из улова рыболовецких траулеров в Средиземном море (21 особь фиксирована формалином после размораживания) мы описываем новый вид — Ch. palinuri. Можно ожидать находок хилодохон и на других морских Macrura, в частности на омарах. Валленгрен (Wallengren, 1895,1896) отметил особей Ch. qvennerstedti (Chilodochona sp. или Vasichona sp.) на Pagurus [Eupagurus] hernhardus (Reptantia Anomura), считая это случайной инфекцией (Швеция, Кристинеберг; в аквариуме с Ebalia и Portunus).
Позднее виды хилодохон были отмечены на A’upugu/'us bernhardas (Англия, Плимут), Е. prideauxi (там же), Pagurus forceps, Parapagurus dimorphus, Paguristes oculatus (Италия, Неаполь), Cervimunida johni (центральное Чили, разрез от Вальпарайсо) и на Ра-ralithodes kamtchaticus (США, Аляска, Омер; см.: Mohr a. Matsudo, 1970). Новый род V asichona paguri найден нами на Eupagurus bernhardus (Баренцево море, Мурман, Дальние Зеленцы; около 30 особей собрано в августе 1962 г. автором на литорали, глуб. 0.5—1.5 м, и в верхней сублиторали; 7 особей собрано аквалангистами, глуб. 10—15 м; 16 особей взяты из траловых сборов в Ярнышной губе, глуб. 10—40 м). Хилодохониды нередки на крупных пагуридах Охотского моря и Курильских островов, отсутствуют на мелких литоральных видах (Янковский, 1973).
Chilodochona qvennerstedti отмечена Валленгреном (Wallengren, 1895, 1896) в Швеции (Кристинеберг) на Portunus depurator si Ebalia tumefacta (рис. 8, Л), «Ch. microchi-lus» — на P. depurator. На этих крабах живут несомненно разные виды хилодохонид. Гийше (Guilcher, 1949, 1950) находила Ch. qvennerstedti на «различных морских ракообразных», «на ротовых придатках крабов» (списка хозяев нет); позднее ею названы Р. [Macropipus] depurator (Франция, Вилльфранш-сюр-мер), Pachygrapsus sp. (Кон-карно), Carcinus [Carcinides] maenas (несет Ch. carcini) и Cancer [Platycarcinus] pagurus (Коикарно и Роскофф) (Guilcher, 1951; Faure-Fremiet a. oth., 1956). Ch. qvennerstedti или близкий вид отмечены Батиссом (Adrien Batisse, личное сообщение) на Carcinides maenas и Portunus puber во Франции. Хилодохоны, но вероятно не Ch. qvennerstedti, обнаружены Мором (Mohr, 1966) на лейкозиидах, портунидах, майидах в Англии (Девон, Плимут), на портунидах и майидах в Италии (Неаполь), на Inachus в Чили (Вальпарайсо). По Мору и Мацудо (Mohr a. Matsudo, 1970), заражены следующие виды хозяев: Inachus dorsettensis (Англия, Плимут), I. dorsettensisf (Италия, Неаполь), Inachoi-des macrorhynchus (Чили), Halicarcinus planatus (Чили, к югу от Пунта-Аренас в Магеллановом проливе), Macropipus corrugatus (Италия, Неаполь), М. holsatus (Англия, Плимут), Ovalipes punctatus (центральное Чили, Вальпарайсо), Polybius henslowi (Англия, Плимут), С ancer plebejus (Чтши, Вальпарайсо), Portunus depurator, Мata squinada (Англия, Плимут), М. verrucosa (Италия, Неаполь), Hyas coarctatus var. alutaceus (Берингов пролив, Чукотское море). Новые виды хилодохон обнаружены нами на Telmes-sus cheiragonus (Кунашир, Итуруп), Chionocetes opilio (Парамушир, Камчатка); в настоящей работе описывается только Chilodochona aranei с Hyas araneus var. hoecki (Баренцево море, Мурман, Дальние Зеленцы; около 20 особей с литорали, сборы автора в августе 1967 г.; 8 особей из сборов аквалангистов на глуб. 5—15 м; около 20 особей из траловых сборов в Ярнышной губе, глуб. 15—40 м). В итоге хилодохониды известны на видах всех 4 подгрупп Decapoda, наиболее обычны на крабах и креветках. Мор ц Мацудо (Mohr a. Matsudo, 1970) указывают хилодохон для Scyllaridea, Galatheidea, Paguridea, Leucosiidae, Mafidae, Portunidae, Cancridae и Grapsidae (Англия, Плимут; Италия, Неаполь; центральное и южное Чили; США, Тихоокеанский берег и Аляска; южная Аргентина, пролив Дрейка).
СПЕЦИФИЧНОСТЬ К ХОЗЯЕВАМ
Под специфичностью мы понимаем приуроченность таксона хонотрих к определенной группе хозяев. Так; род Lobochona встречается только на видах Isopoda Flabellifera (Limnoriidae) и поэтому специфичен для названных групп. Однако род хонотрих может встречаться на разных родах хозяев и в таком случае оказывается неспецифичным для определенного рода рачков; к примеру, Lobochona обитает на Limnoria и Phycolim-noria. Для удобства изложения мы будем сравнивать ниже таксоны хонотрих и хозяев равного ранга.
Как видно из схемы 1, отряд хонотрих и оба его подотряда неспецифичны для определенного отряда ракообразных. Хонотрихи живут на видах Isopoda, Amphipoda, Decapoda и других отрядов; лишь Amphipoda оказываются общей группой хозяев для экзо- и эндогеммин. Из 8 семейств экзогеммин 5 приурочены только к одному семейству хозяев, одно (Heliochonidae) — к двум и одно (Lobochonidae) — к трем. Из 5 семейств эндогеммин 4 приурочены к одному семейству хозяев, одно (Isochonidae) — к пяти. Круг хозяев оказывается особо широким у наиболее примитивных форм каждого из подотрядов хонотрих.
Три рода эндогеммин и половина родов экзогеммип не приурочены только к одному роду хозяина; можно различить поэтому моноксенные (с одним хозяином) и поликсен-ные роды хонотрих (с рядом хозяев). В свою очередь поликсенные роды можно подразделить на категории гомоксенных (с близкородственными хозяевами) и аллоксенных (с чужеродными хозяевами). Большинство поликсенных родов гомоксеничны (цето-хона, спирохона и др.), аллоксенные роды единичны (Heliochona, Isochona и Chilodochona).
Виды хонотрих обычно моноксеничны; поликсенные виды единичны, и их хозяева обычно родственны. Такова Cavichona protecta на видах Brandtia, Phyllochona vexillata
па. видах Limnoria. Одинаковые комплексы из 4 видов Heliochonidae имеют барепцсво-морские Gammarus setosus и G. oceanicus; хозяева здесь вообще не изолированы, образуют массовые смешанные популяции, ранее определялись как один вид — G. locusta. Вместо с ними обитает G. obtusatus (подрод Marinogammarus)', все 4 вида хонотрих этого рачка отличаются от таковых комплекса G. setosus-(-G. oceanicus, хотя популяции хозяев часто также перемешаны. Spirochona gemmipara известна, напротив, с экологически различных видов гаммарид (G. lacustris, G. pulex); во всяком случае не удается найти видовых различий хонотрих на этих хозяевах; возможно, что это «биологические виды», приуроченные к разным хозяевам, но еще не имеющие морфологических отличий.
Для ряда видов в литературе указан широкий круг хозяев — виды разных родов, семейств и даже подотрядов (5. gemmipara, S. elegans, Chilodochona qvennerstedti). У нас есть основания, однако, признать такие виды сборными и резко сузить (до 1—2 видов) круг хозяев подобных форм; во всех этих случаях авторы не изучали морфологию рас с разных хозяев и поэтому неправильно определяли виды хонотрих. Так, Spirochona gemmipara в понимании Гаевской соответствует на самом деле нескольким десяткам видов трех родов байкальских спирохонид, в основном моноксенных. Фенхель (Fenchel, 1965; Green, 1968) вообще отрицает видовую специфичность хонотрих с гаммарид; они, по его мнению, специфичны для рода Gammarus, распределение же их на разных видах гаммарусов контролируется якобы лишь внешними факторами, прежде всего соленостью. И эта ошибка объясняется неправильным определением хонотрих: не различались виды Heterochona с G. oceanicus и G. duebeni.
Возможны расовые различия эпифауны рачков в разных участках ареала. Так, Amphithoe rubricata во Франции и на Мурмане несет Heliochona alternans на жабрах, на Командорах — Isochona sp. на плеоподах, в США — Trichochona на плеоподах. Gammarus oceanicus в Дании имеет только Heliochona sessilis на жабрах и Heterochona scheutenii на плеоподах (Fenchel, 1965); на Мурмане же на этом рачке обычны и 2 других вида — Н. psychra на плеоподах и Н. trifaria на максиллипедах и гнатоподах. Те же 4 вида хонотрих обычны на Мурмане и у G. setosus, а на Аляске на этом хозяине отмечены лишь Н. psychra и редкие хонотрихи на жабрах (Matsudo a. Mohr, 1965). G. locusta в Крыму несет Heliochona pontica, в Дании — Н. sessilis si Heterochona scheutenii. Limnoria lignorum в Норвегии несет Lobochona limnoriae, на Мурмане — также Phyllochona vexillata, на Кунашире — лишь L. tenue. Расовая специфичность хонотрих в итоге проявляется в двух формах: либо на разных расах обитают разные виды и даже комплексы видов комменсалов, либо в дополнение к одним и тем же видам добавляются другие, эндемичные. Оба этих явления в равной мере часты у хонотрих, причем далеко не всегда их можно объяснить географической изоляцией: достаточно близки, к примеру, расы Limnoria Мурмана и Норвегии, Nebalia Кунашира и Итурупа, Pagurus Мурмана и Швеции. Проблему расовой специфичности эпифауны усложняет возможность неправильного определения видов хозяев или их неправильной дифференцировки; возможно, к примеру, что Amphithoe rubricata с Мурмана, Командорских островов и из-США — это разные виды амфитоид, систематика которых вообще очень сложна. Определения любой расы лептострак как Nebalia bipes безусловно неверны. Но даже с учетом неправильного определения и неверной дифференцировки хозяев есть примеры несомненной расовой специфичности хонотрих, например у форм, живущих на лимнориях.
Наличие рас рачков без хонотрих Mop (Mohr, 1966 : 540) объясняет неспособностью томитов к длительному активному плаванию. Переселение хонотрих в новые зоны и на новых хозяев, по Мору, протекает медленно, поскольку томитам трудно перейти на свободных рачков и легче осесть на молодь в зародышевой камере самок. На Мурмане действительно один и тот же вид рачка (Gammarus obtusatus) интенсивно заражен хоно-трихами в одной бухте и слабо либо вовсе не заражен в соседней (наши наблюдения в августе 1967 г.); аналогичным образом чередуются чистые и зараженные расы G. duebeni в устьях рек и ручьев. Такую неравномерную зараженность рачков можно объяснить контуром береговой линии: осушная зона с гаммарусами хорошо выражена в кутах бухт, в,море же выдвинуты отвесные, круто обрывающиеся скалы; гаммариды из одного фиорда не могут перейти в соседний и образуют массовые изолированные популяции. Указанные препятствия непреодолимы и для хозяев, и для слабых, малоподвижных томитов хонотрих; поэтому хонотрихи могут в массе встречаться в одних бухтах и отсутствовать в смежных. Незараженность отдельных рас хозяев может быть обусловлена и действием неблагоприятных факторов среды, выносимых только хозяином.
В настоящее время хорошо изучена эпифауна многих групп ракообразных, и, вероятно, наличие хонотрих не могло остаться незамеченным. Негативные данные (об отсутствии хонотрих на видах рачков) могут, конечно, оказаться ошибочными при просмотре достаточно большого материала, но мы вправе утверждать, что хонотрих несут далеко не все группы Crustacea. Хорошо изучены, к примеру, комменсалы A sellus (Швец, Пенар, Плате, Захариас, Бухар и др.; наш материал по A. aquaticus из Петергофа и A. middendorfi с южного Сахалина), по хонотрихи до сих пор никем не отмечались и их
здесь несомненно нет. По Калкинсу, правда, Spirochona и Dendrocometes обитают на Сат-marus и на Asellus (Calkins, 1941 : 7), но это ошибка. Мор и Мацудо (Mohr, 1959а, 1959b, 1966; Mohr a. Matsudo, 1970) также признают возможным, что заражены по все виды и группы Crustacea, например не несут хонотрих Euphausiacea, Hyperiidae, Caprellidae, хотя опи и включают массовые виды. В Англии (Плимут) Мором осмотрено большое число особей Gammarus marinus и G. pirloti', хонотрихи па пих отсутствуют , но обычны на плеоподах других видов — G. zaddachi и G. duebeni. Полярный вид G. wilkitzkii, образующий скопления на нижней стороне льда, осмотрен Мором (Mohr, 1959с, 1966) и нами по сборам дрейфующих станций СП-3 и СП-6; хонотрих здесь нет, хотя обычны суктории и перитрихи. В Польше (Добжанская) хонотрихи найдены на G. zaddachi и не обнаружены на Talitrus saltator и Orchestia cavimanw, на Аляске (Мор) они заселяют G. setosus и отсутствуют на Mysis relicta и Pseudalibotrus birulai, хотя эти виды обитают совместно. В Кильской бухте хонотрихи найдены иа G. locusta и отсутствуют на видах Leander adspersus, Crangon crangon, Neomysis vulgaris, Idothea viridis, I. tricuspidata, Sphaeroma rugicauda, Jaera marina, C alliopius laeviusculus, Corophium bonelli, Microdeu-topus gryllotalpa, Hyperia galba, на различных Entomostraca (Precht, 1935). В Байкале из 220—240 видов гаммарид хонотрих песет лишь часть видов. Больше половины видов байкальских гаммарид приходится на крупные ^ojs,№Eulimnogammarus, Poeckilogam-marus и Micruropus', хонотрихи часты на двух первых, отсутствуют на третьем роде; их нет также на В aikalo gammarus, Homocerisca, Macrohectopus и др., на многих видах Acanthogammarus, Hyalellopsis, Pallasea и др. Часто хонотрих нет на одном из двух близких видов рачков. Так, например, Ommatogammarus albinus не несет их, а О. flavus сильно заражен. В итоге на Байкале имеется не 240 (по числу гаммарид), а максимум 50—60 видов Spirochonidae.
Возможна миграция эктокомменсалов на неспецифических хозяев. Валленгрен (Wallengren, 1895) отметил хонотрих (Chilodochona qvennerstedti) на Pagurus, считая их мигрантами с крабов в том же аквариуме; сейчас известны, однако, «свои» хонотрихи, специфичные для пагурид. Mop (Mohr a. oth., 1963а; Matsudo a. Mohr, 1968) нашел одну «заблудившуюся» особь Lobochona prorates на плеоподах Chelura из ходов Limnoria tripunctata в Калифорнии; позднее выяснилось, что лимнории и Chelura имеют собственных хонотрих, которыми не обмениваются. На 3 из 11 осмотренных особей паразитического рачка Pachyschesis branchialis из зародышевой сумки Acanthogammarus reicherti, хозяина Serpentichona anthus, мы нашли хонотрих, напоминающих серпентихон, но более мелких размеров. Недостаток материала не позволяет решить, имеем ли мы дело с мигрантами S. anthus.
Нередки совместные находки нескольких видов хонотрих на хозяине. К примеру,. Ommatogammarus flavus несет на жабрах, плеоподах и гнатоподах 3 вида Spirochona, Gammarus setosus — 4 вида Heliochonidae, включая 3 вида Heterochona. По Мацудо и Мору (Matsudo a. Mohr, 1968), совместная находка Oenophorachona ectenolaemus. и Spirochona halophila на A nisogammarus sp. в Калифорнии — это якобы первая находка хонотрих разных родов на одном рачке. Однако Мором (Mohr, 1966 : 538) отмечался ранее и другой комплекс: «В водах Тихоокеанского побережья США, от морских до почти пресных, некоторые особи гаммарид (4 nisogammarus). имеют Heliochona на плеоподах и Spirochona на жабрах». Дофлейн (Doflein, 1897а, 1897b) обнаружил на Nebalia geoffroyi 2 рода хонотрих, Kentrochona и Kentrochonopsis, и, кроме них,, стебельчатых особей на максиллуле — вероятно, Stylochona nebalina Кента. Жаберных и плеоподиальных хонотрих, обычных на гаммаридах морей Европы, мы относим к разным родам — Heliochona и Heterochona. Находки комплексов хонотрих на рачках очень обычны в нашем материале; так, на дальневосточных видах A nisogammarus можно, найти комплексы Heterochona-)-Spirochona, или те же po)3fiL-\-Oenophorachona, или Не-liochona-\-Heterochona-)-Oenophorachona; на лимнориях — Lobochona-\-Phyllochona и £о-bochona^-Filichona. Особо показательны Nebalia'. на одной особи рачка можно найти 2—3 рода эндогеммин; максимальное число (8 родов, 12 видов) отмечено на путятин-ской расе Nebalia. На мизиде Gnathophausia Мор обнаружил виды двух родов — мизидохон и клематохон. На Decapoda такие комплексы еще неизвестны, но наши предварительные наблюдения по Chilodochona aranei с Hyas araneus hoecki показывают, что сето- и планибионты могут относиться к разным видам. Еще неизвестны рачки, несущие одновременно экзо- и эндогеммин; на разных расах Amphithoe rubricata отмечены либо экзогеммины Heliochona (Франция, Мурман), либо эндогеммины Isochona и Trichochona (Командорские острова, США), но определения хозяев в этих случаях сомнительны; к тому же они разделены Северным Ледовитым океаном, и не исключено, что здесь проходит граница (горный хребет Арктида — остаток затонувшего «Арктического моста» между Сибирью и Канадской Арктикой?), восточнее которой Amphithoe-несет эндогеммин, западнее — экзогеммин.
Как возникают комплексы хонотрих на хозяевах? По Мору и Мацудо (Mohr а.. Matsudo, 1970), «проблематично, обязано ли наличие более чем одного рода или вида на одном хозяине вторичной инфестации хозяина хонотрихами. Многочисленные случаи говорят о том, что перекрестная инфекция редка». Однако наличие неродственных
форм, например па A nisogammarus (Oenophorachona, Spirochona и Heterochona), должно, быть обязало именно «перекрестному заражению»: па один вид рачка хонотрихи мигрируют с другого. Можно допустить, что Spirochona впервые возникла па одном из видов A nisogammarus, далее род распространился и ио другим видам A nisogammarus, не претерпевая особых изменений (виды с восточной и западной Пацифики очень, сходны). Виды, сформировавшиеся па хозяине, мы обозначаем ниже как «аутойки», виды-«пришельцы» — как «адвенойки»; последние всегда моноксеничны. Пример аутой-ков — род Toxochona. Oenophorachona, распространяясь по тихоокеанским видам A nisogammarus, оседает на плеоподах, в типичном локусе, и пе претерпевает особых изменений; па одном из рачков (4. pribiloffensis) хонотрихи осели на плеоподах, и часть последних перешла на гнатоподы, дав начало роду с необычно длинной шейкой — Toxochona. Новый род у хонотрих может возникнуть на новом локусе хозяина, а затем остаться только на этом хозяине либо расселиться и по другим хозяевам. В процессе-расселения он колонизует рачков, лишенных хонотрих, либо добавляется к уже имеющемуся виду хонотрих, как правило к виду, относящемуся к другому роду и имеющему другой ареал на рачке. Комплекс хонотрих на рачке может состоять в итоге из форм, возникших на том же рачке (аутойков), и из адвенойков, причем разграничить их нетрудно. Так, на Ommato gammarus flavus вид Spirochona на обычном локусе — на жабре (S. globulus) —представляет несомненный адвенойк; виды 5. gnathopodialis-и S. simplex, заселяющие гнатоподы и плеоподы того же хозяина, — столь же несомненные аутойки. Такие смешанные комплексы весьма часты на разных расах Nebalia.
Приуроченность хонотрих к определенным группам хозяев позволяет судить о том,, какие условия нужны для существования комменсалов. «Идеальный» хозяин — это-массовый вид крупного литорального ракообразного с зародышевой сумкой. Хонотрих нет на пелагических видах, на неподвижных видах типа Peltogaster, на супралитораль-ных рачках (мокрицы, талитриды, лигии), сохраняющих перитрих, на многих глубоководных формах, на мелких личинкоподобных рачках типа Homocerisca, Baikalogam-marus, Micruropus и др. Исключена возможность находки их на большинстве Ento-mostraca. По Мору (Mohr, 1953 : 17), «у хонотрих еще не была обнаружена способность образовывать защитные стадии. Их находят только на ракообразных, о которых известно или можно предполагать, что они активны весь год»; в замерзающих или пересыхающих водоемах сохраняются лишь эфиппии Entomostraca и цисты перитрих. С другой стороны, хонотрих, кроме родов с китообразных, «находят на рачках с зародышевыми камерами или на видах, некоторое время удерживающих при себе молодь» (Mohr а. oth., 1963b : 121). Это объясняется несовершенством цилиатуры томита: «У немногих видов, у которых была описана стадия бродяжки или мигранта, она имеет слабую цилиа-ТУРУ и живет недолго. Инфестация новой особи хозяина происходит вероятнее всего там, где придатки, покрытые хонотрихами, ударяют по оостегитам зародышевой камеры с развивающимися рачками» (Mohr, 1959а : 652). Наличие марсупиума выгодно для-, эпибионтов: «самка держит свою молодь в вентральной зародышевой камере, пока они не станут активными и почти взрослыми, тем самым продлевая экспозицию для, заражения их теми организмами, которые паразитируют на материнской особи и ее-соседях» (Mohr, 1959b : 84). Важность этой особенности рачков подчеркивает и Доб-жанская-Качановская. Неясно, однако, насколько часто хонотрих находят на молоди рачков: Мор и Мацудо ссылаются лишь на данные Дж. Анклесса, наблюдавшего хо-нотриху на молодой особи Cyamus, прикрепленной к материнской особи. Мы не могли, как правило, найти хонотрих на молоди из камер лимнорий, лептострак, крабов, понаблюдали значительные инфекции на молоди Gammarus obtusatus на Мурмане. Вероятно, есть виды хонотрих, охотнее других поселяющиеся на молоди рачков; достаточно-лишь немногих томитов-«колонистов», чтобы основать новую популяцию хонотрих на личинках.
Форма томита и его цилиатура не приспособлены для активного плавания, срок его свободной жизни ограничен несколькими часами, в то время как «бродяжки» перитрих в чистой воде без хозяев живут несколько дней (Fenchel, 1965). Хонотрихи встречаются поэтому в основном на массовых литоральных ,и сублиторальных хозяевах — на видах Gammarus, A nisogammarus, Photis, Chelura, Limnoria, Sphaeroma, Pentidothea, Nebalia, на ряде крабов, креветок, пагурид и т. д. Amphithoe обычно-живут парами в домиках, где легко заражается и молодь; Cyamidae образуют на коже китов массовые поселения, иногда из сотен и тысяч особей. По Мору (Mohr, 1966),. хонотрихи особенно обычны на тех циамидах, которые встречаются в большом количестве (на горбатом, сером и бутылконосом китах). Рачки могут скапливаться во время питания (Ommatogammarus на рыбе, Nebalia в экзувиях Telmessus, в акулах рода Sco-liodon). По Мору (Mohr, 1959b : 84), «массовые животные, поскольку они обеспечивают-повторные контакты, как правило, могут заражаться более легко, чем одиночные организмы. Особи, занимающие ограниченное пространство (или прикрепленные), более подвержены заражению, чем свободноплавающие организмы. Сверлящие животные,, которые дают приют не только себе, очень часто имеют нахлебников. Limnoria, поскольку она массовая, занимает ограниченную зону и также сверлит, должна быть.
достаточно сильно заражена». На литорали возможность заражения других особей рачка, вероятно, больше, чем в глубинных водах: рассеиванию томитов могут способствовать приливно-отливные течения, волны, активность подвижных животных; к активному фактору (движение томита) могут добавляться пассивные — перенос томитов токами воды. Кинеты полимеризованы у томитов хилодохонид; возможно, они способны к активной и длительной миграции. Заражение новых хозяев обеспечивается и длительным прекопуляционным контактом рачков (Добжанская-Качанов-ская, Фенхель), а также многократной линькой; перед линькой начинается массовое диминутивное почкование, в среду выделяется много томитов (Ромпель, Фенхель, Мацудо). Наконец, в ряде работ Мор подчеркивает, что хонотрихи могут питаться только с косвенной помощью хозяина: предротовая цилиатура трофонтов несовершенна и может создавать лишь слабый вортекс, движения же придатков хозяина обеспечивают приток пищи к комменсалам. Как исключение, известны хонотрихи с неподвижных хозяев (Cyamidae, Balaenophilus), но это паразиты китообразных, омываемые активным током воды.
Приуроченность хонотрих именно к Crustacea Mop (Mohr, 1948 : 9) объясняет «эко-.логическими условиями на заселенных частях рачков», имея в виду, вероятно, доступ О2 и токи воды с пищей; однако такие условия можно найти и на других беспозвоночных (на мшанках, в мантии моллюсков), на сифонах асцидий. Возможно, хонотрихам нужен прежде всего прочный хитиновый субстрат. В этом отношении следует обратить внимание на мечехвостов, комменсалы которых вообще не изучены. В принципе возможны находки хонотрих на разных группах водных животных и на водорослях. Одна из таких аберрантных форм уже известна — Eleutherochona, которая живет на литорали (на багрянке Epymenia), где движение воды особо активное.
В принципе хонотрихи могут встречаться на различных группах класса, в зависимости уже от морфологии и экологии последних. Вполне вероятна находка хонотрих на Stomatopoda, Ситасеа — это достаточно крупные формы, иногда образующие скопления, однако комменсалы их пока не изучались. Возможны находки хонотрих также на Tanaidacea и Euphatisiacea, маловероятны — на мелких рачках групп Spelaeogri-phacea, Syncarida и Thermosbaenacea, имеющих плохо развитые придатки. В тех отрядах Malacostraca, на представителях которых известны хонотрихи, заражены не все группы рачков, хотя теоретически можно ожидать более широкого, чем известно сейчас, распространения этих комменсалов. Как отмечено выше, отсутствие хонотрих на многих хозяевах объяснимо пелагическим образом жизни последних либо их неподвижностью, малочисленностью, паразитизмом на других животных и т. д. Необъяснимо все же отсутствие хонотрих на Asellota, на большинстве Idotheidae, на пресноводных A nisogammarus и т. д. Казалось бы, хорошие условия должны существовать для хонотрих на циррусах Cirrlpedia — крупных массовых рачков, хорошо представленных на литорали и на подвижных морских животных, однако хонотрих на них нет; нет их и на Lepas с обрастаний плавучей древесины (сборы на Сахалине, Кунашире и Парамушире) и на Conchoderma с китов в зоне, занятой циамидами. В принципе возможны все же находки хонотрих на крупных Entomostraca, по крайней мере на Cir-.ripedia с китообразных.
Сейчас можно примерно наметить объем отряда Chonotrichida. Почти все авторы, кроме Мора, считают хонотрих маленькой аберрантной группой видов (Каль, Бхатиа, Доне, Боррадейл, Мэнвелл, Мак-Киннон, Раабе, Грелль и др.); типично следующее определение: «Этот отряд образован маленькой группой форм, сидячий образ жизни которых привел к высокой степени специализации» (Bhatia, 1936 : 422). Судя по нашему материалу, однако, это один из крупнейших отрядов Ciliophora. Логично допустить, что число видов хонотрих не превышает числа видов Crustacea (26 000), точнее, числа видов Malacostraca (18 000), поскольку находки на Entomostraca единичны. В пределах Malacostraca хонотрих нет на всех видах отрядов Euphausiacea, Tanaidacea, Stomatopoda, на большинстве видов отрядов Isopoda, Amphipoda, Mysidacea', заражены .лишь Leptostraca, Limnoriidae, Cyamidae, Gammaridae, Amphithoidae, многие Decapoda и ДР- Судя по нашим данным, заражен примерно 1 морской вид Malacostraca из каждых 10—15 осматриваемых, т. е. можно ожидать находок хонотрих примерно на 1500— 2000 видах Crustacea. Число хонотрих может несколько возрасти вследствие расовых различий эпифауны и находок целых комплексов хонотрих на отдельных рачках, особенно па Leptostraca. Сейчас известно около 50 000 видов Protozoa, включая 6000 видов инфузорий (400 родов) (Corliss, 1961, 1967); число хонотрих может достичь примерно трети известных сейчас видов инфузорий. Число родов (сейчас 33) может возрасти в несколько раз, но основной рост числа видов в отряде мы ожидаем за счет укрупнения родов Chilodochona, Lobochona, Spirochona, Cavichona, Isochona, Heterochona, Heliochona, Stylochona. Уместно вспомнить следующие слова Каля (Kahl, 1935 : 801): «Судя по результатам Сварчевского по эндемичным гаммаридам, особенно в Байкале, можно предположить, что число видов (т. е. эндемичных видов хонотрих, — А. Я.) намного возрастет, когда будут проведены тщательные наблюдения по сходным районам».
Отметим вкратце значение данных но комменсалам для систематики хозяев. Паразитологический критерий вида важен и для дифференцировки, и для определения видов хозяев; находка необычной эпифауны на одной из рас рачка может указывать, что она определена неверно. Из осмотренных нами форм к объектам, требующим ревизии, принадлежат в первую очередь Nebalia bipes и Amphithoe rubricata. Резкое различие разных рас Nebalia по своей эпифауне позволяет думать о наличии только в дальневосточных морях как минимум трех видов рода, а не одной N. bipes. Определение командорских рачков как A mphithoe rubricata несомненно неправильно; этот вид, описанный из Англии, в Европе несет лишь экзогеммовых хонотрих. Черноморский вид Gammarus locusta отличается по эпифауне от северных рас, вероятно принадлежащих к другому виду. Различие хонотрих на северных и япономорских Limnoria lignorum ставит под сомнение их видовую идентичность. Массовая встречаемость хонотрих на северокурильской талитриде A llorchestes malleolus carinatus и отсутствие их на южнокурильской расе, лишенной к тому же четкого киля (А. malleolus), говорят о том, что это разные виды, а не подвиды рачка.
ЛОКАЛИЗАЦИЯ
Хонотрихи, в отличие от некоторых перитрих и сукторий, не рассеяны в беспорядке по покровам рачка, а приурочены к определенным участкам тепа (локусам, или микроареалам). Локус может быть довольно широким, но всегда обнаруживаются незаселенные участки тела; обычно же ареал узок. В локусах широко расселенных видов (циамихон, кристихон) можно найти зоны, где вид встречается чаще всего. Хонотрихи обычно занимают локус, достаточный для размещения нескольких десятков особей; отнюдь не обязательно число особей пропорционально широте локуса, иногда узкий локус плотно заселен, а в широком особи немногочисленны.
Хонотрих можно найти на всевозможных придатках Crustacea — на жабрах, антеннах, антеннулах, гнатоподах, максиллах, торакоподах (переоподах), плеоподах, иногда и на панцире (рис. 6, 9—11). Однако у разных групп заселены разные придатки; например, у амфипод — чаще всего плеоподы и жабры, у декапод — только розовые части, у изопод — плеоподы. У Nebalia заселены практически все придатки тела, включая тельсон, а также панцирь. На рачках мы находим часто комплекс хонотрих, зачастую разных родов; каждый вид занимает свой локус, иногда граничащий с локусом смежного вида, но не совпадающий с ним. Мы до сих пор не знаем случая, когда популяции двух видов, даже близких, были бы перемешаны на одном придатке. По Сварчевскому, правда, на жабрах Odontogammarus demjanowitschl живут Spirochona gemmipara и S. patella, на Acanthogammarus albus— S. elegans и S. patella, на Ommatogammarus flavus — S. globulus и A. pusilia', однако мы нашли здесь только по одному виду. Пример разграничения локусов — расположение хонотрих на плеоподах гаммарид; мы различаем здесь три локуса: стебелек плеоподы, базальную и остальную часть щетинок. Виды хонотрих не переходят на несвойственные им участки плеопод, даже если у данной особи или расы хозяина они никем не заняты. Разные таксоны хонотрих приурочены к определенным локусам хозяев. По Мору (Mohr, 1966 : 536, 540), «стилохониды, исключая формы с небалйид и циамид, приурочены к педальным придаткам, спирохониды — к грудным жаберным пластинкам, хилодохониды — к ротовым придаткам своих хозяев». Он считает Heliochona и Lobochona обитателями плеопод, Spirochona и Kentrochona — переопод, но это ошибка: Heliochona описана с жабр гаммарид, Spirochona — с жабр и с плеопод (5. simplex), но не с переопод. По Мору, Stylochonidae в отличие от хилодохонид «почти неизменно ограничены торакальными или брюшными придатками, за исключением Cyamus, у которых они прикрепляются почти к любой поверхности» (Mohr, 1959а : 652). Однако и это утверждение ошибочно: на ротовых придатках (щупике максиллулы) Nebalia Ромпель, Кент и Дофлейн нашли виды стилохон. По Форе-Фремье (Faure-Fremiet a. oth., 1956 : 188), хонотрихи обычны на «ротовых частях и жаберных пластинках различных ракообразных», но это лишь часть известных локусов.
Судя по нашим материалам, экзо- и эндогеммины заселяют одни и те же придатки на разных группах хозяев. Для видов семейств хонотрих характерна тенденция к заселению одних и тех же придатков хозяев. На придатках хонотрихи могут оседать на ровной поверхности и на щетинках, соответственно чему мы обозначаем их как пла-нибионтов или сетобионтов.
На пластинчатой водоросли Epymenia, по снимкам Донса (Dons, 1948), хонотрихи прикрепляются только к краю таллома, не переходя на его ровную поверхность. Эндогеммины на низших ракообразных (Balaenophilus) занимают очень узкие локусы на придатках, реже на панцире рачка (Янковский, 1971). Кент, впервые изучавший комменсалов Nebalia, отметил Stylochona nebalina на «торакальных придатках», однако такие формы мы находили только на щупике максиллулы, где их изображает и Дофлейн. По Мору и Мацудо, Кент нашел стилохон якобы на плеоподах. Ромпель (Rompel,
3 Заказ № 213
1894) обнаружил Kentrochona nebaliae на эпиподитах и экзоподитах торакопод Nebalia, «Spirochona» — на щупике максиллулы. По нашим данным, Kentrochona не встречается вне торакопод. По Дофлейну (Doflein, 1897а, 1897b), типичные особи К. nebaliae живут на дистальной части экзоподита, реже эпи- и эндоподита торакопод, Stylochona sp. — на щетинках щупика максиллулы, Kentrochonopsis — на «жаберных пластинках» (эпиподите торакопод?). Mop (Menzies a. Mohr, 1952) мельком отмечает, что плеоподы Epinebalia sp. были заселены видом Kentrochona; очевидно, как «плео-поды» им ошибочно обозначены торакоподы. Лёнг (см.: Mohr, 1966) нашел на Lep-tostraca большую серию форм, в основном новых, с цилиндрическим телом на плеоподах, с плоским — на «жабрах»; ряд особей найден им на «максиллипедах» (у Lepto-straca их нет!) и на панцире. Позднее (Matsudo a. Mohr, 1968) отмечалось, что Kentrochona sp. была найдена на «жабрах», а новый род — на плеоподах Epinebalia. На микрофотографиях хонотрих с небалиид (Лёнг), присланных Мором, видны формы типа Dentichona на внутренней поверхности панциря, формы типа Pterochona — на щетинках максиллулы, формы типа Cristichona — на краю экзоподита торакоподы, «антен-нохона» — на антеннах, вид Kentrochonopsis — на основании щетинок коксоподита торакоподы, формы типа Inversochona — на дистальном отделе экзо- и эндоподита торакопод, Oxychona sp. — на дистальном отделе эпиподита торакопод.
В нашем материале хонотрихами заселены следующие локусы Nebalia (рис. 6, А, В; 9—11). На антеннах хонотрихи редки; только у части рас они заселяют стебелек антеннулы и группу щетинок у основания антенны (Isochona, Cristichona). На мак-силлуле различимы пять локусов: базальная часть щупика, средний и дистальный отделы щупика, латеральные щетинки и дистальные, в свою очередь включающие два локуса — вершину и остальную часть щетинки. На щетинках базальной части максиллулы у основания щупика найдена Isochona peltifera. К небольшому участку основания щупика Nebalia IV прикрепляется Pterochona, весь щупик занят видом Armi-chona. На основании и в средней части щупика Nebalia V живет Ctenochona ternipara, на остальной поверхности щупика — виды Flectichona, Coronochona и единичные Ctenochona. Редкие особи Flectichona и A rmichona могут переходить со щупика на нижнюю часть щетинок. Латеральные щетинки щупика Nebalia обычно несут хонотрих трех родов — Stylochona, Eurychona и Spinichona, занимающих чаще всего среднюю и дистальную, но не цроксимальную часть щетинок. На вершине дистальных щетинок щупика можно встретить виды Echinichona, остальную часть этих же щетинок занимают стилохоны, спинихоны и эурихоны. В целом на максиллуле разных рас Nebalia обитает И родов эндогеммин — х/3 родов хонотрих.
Мандибулы и максиллы Nebalia практически лишены хонотрих, лишь иногда на них отмечаются единичные Isochona и Cristichona. Торакоподы Nebalia (называемые также кормоподами, плеоподами, переоподами, филлоподами и жабрами) причудливо расчленены и сплющены, условия обитания в разных отделах придатков разнообразны, локусы хонотрих поэтому здесь многочисленны. К наружной поверхности эпиподита или к небольшим бугоркам (видоизмененным щетинкам) прикрепляются Dentichona. Дистальный отдел может быть занят видами Kentrochona и Chonosaurus, внутренняя поверхность эпиподита, обращенная к экзоподиту, — видами Ceratochona. К основанию щетинок экзоподита прикрепляются особи Oxychona и Paraoxychona, К ровной поверхности дистального отдела — Kentrochona, Inversochona и Chonosaurus, к краям экзоподита, обращенным к эпи- и эндоподиту, — Ceratochona. На щетинках экзоподита можно встретить и единичных особей кристихон. Наиболее густо заселены остальные части торакоподы (прото-, бази- и коксоподит). К эндоподиту в его дистальной части прикрепляются инверсохониды Kentrochona, Inversochona и Chonosaurus, к его внутреннему краю, обращенному к экзоподиту, — Ceratochona. Сегменты торакопод, обращенные внутрь тела, несут щетинки нескольких типов, образующие в совокупности сложный фильтрационный комплекс; хонотрихи прикрепляются в основном к основанию щетинок. Дистальные, особо мощные щетинки эндоподита (играющие роль оостегитов у самок) обычно не заселены хонотрихами, лишь иногда в их базальной части видны немногочисленные особи Isochona или Cristichona. Латеральные щетинки придатка заняты также редко: Isochona отмечена у Nebalia I, Cristichona — у Nebalia IV, единичные Carinichona — у Nebalia IV и V. На ровной поверхности базиподита хонотрихи (Ceratochona) отмечены только у Nebalia III (на внутреннем крае придатка). На базальной части протоподита, частично и на теле рачка у основания торакоподы обитают планибионты Isochona crassa, на прото- и коксоподите — редкие планибионты рода Crassichona. Все остальные хонотрихи с торакопод — сетобионты, фиксированы на основании щетинок. В зоне протоподита, частично базиподита к щетинкам I фильтрационного ряда прикрепляются Actinichona или Isochona (I. rotundata — предшественник актинихон); дистальнее, на базиподите (частично на прото- и эндо-подите), лежит зона Carinichona и Rhizochona. При отсутствии последних родов здесь поселяются Cristichona или Isochona, не образующие больших скоплений. На торако-подах в целом живет 12 родов хонотрих — примерно столько же, сколько и на максиллуле; часть родов на этих придатках общие.
Рис. 9. Локусы хонотрих на Nebalia. А — внешний вид рачка; В—Г — эпифауна Nebalia I: 1 — Armichona hexadenta, 2 — A. insecta, 3 — Cristichona tesselata, 4 — Isochona crassa, 5— Chonosaurus galeatus, 6 — Stylochona sp., 7 — Ceratochona scandens, 8 — Eriochona horrida; Д—3 — эпифауна Nebalia V: 9 — Coronochona pectinata, 10 — Ctenochona ternipara, 11 — Stylochona villosa, 12 — Eurychona vitrea, 13 — Paraoxychona inversa, 14 — Chonosaurus rex, 15 — Actinichona cuspidata, 16 — Rhizochona armata, 17 — Isochona antennaria, 18 — Pleochona coronata; И, К — эпифауна Nebalia III: 19 — Eriochona glacialis, 20 — Armichona insecta, 21 — Stylochona maxillaris, 22 — Isochona pelttfera, 23 — Kentrochona coronata, 24 — Ceratochona scandens.
3*'
Рис. 10. Локусы хонотрих на Nebalia. А, В — эпифауна Nebalia VI: 1 — Flectichona sp., 2 — F. crenata, 3 — Stylochona glabra, 4 — Inversochona peregra; В, Г — эпифауна Nebalia geoffroyi'. 5 — Stylochona nebalina?., 6 — Kentrochonopsts rhultipara, 7' — Kentrochona nebaliae; Д—Ж — эпифауна Nebalia IV: 8 — Echinichona regina, 9 — Pterochona pacifica, 10 — Spinichona horrida, 11 — Armichona gibbosa, 12 — Cristichona pacifica, 13 — Isochona crassa, 14 — Carinichona globulus, 15 — Chonosaurus sp., 16 — Oxychona multifida, 17 — Dentichona marginata, 18 — Actinichona gaucho; 3—К — эпифауна Nebalia II: 19 — Echinichona simplex, 20 — Stylochona setaria, 21 — Eurychona vitrea, 22 — Flectichona filtcauda, 23 — Isochona pleonicola, 24 — I. rotuhdata, 25 — Crassi-chona insolita, 26 — Ceratochona cimex, 27 — Oxychona supreme, 28 — Dentichona sp., 29 — Cristichona pacifica.
Хонотрихи {Isochona и Pleochona) отмечены на плеоподах только двух рас Nebalia — с Итурупа и Шикотана; изохоны найдены и в новых сборах на Сахалине и Кунашире. Isochona заселяет лишь массивные дистальные щетинки плеопод и тельсона в их ниж-
Рис. 11. Локусы хонотрих на Nebalia. А — локусы вне панциря, схема; Б—Г — Cristichona pacifica', Д — Isochona antennaria; Е — локусы тора-копод: баз — базиподит, кокс — коксоподит, прот — протоподит, зкз — экзоподит, энд — эндоподит, эп — эпиподит; Ж — Echinichona ге-gina и Armichona gibbosa; 3, И — Dentichona marginata.
ней части, Pleochona — тонкие латеральные щетинки в их средней и нижней части. Изохоны заселяют все шесть пар плеопод, включая рудиментарные одноветвистые V и VI пары.
У изопод Exosphaeroma типа Е. gigas (Мор) хонотрихи заселяют плеоподы, у Phycolimnoria (наш материал) — щетинки плеопод. Локус на Idotheidae Мором не указан.
Lobochona limnoriae обитает «на волосках уропод» Limnoria lignorum (Dons, 1940); судя по рисункам Донса, это щетинки плеопод. Все последующие авторы находят хонотрих только на плеоподах, не уточняя отдела щетинок; между тем у Lobochona могут быть такие же микроареалы, как у Heterochona. Lobochona limnoriae, L. tenue и Aurichona обитают в среднем и верхнем отделах щетинок, очень редко в нижнем отделе. Локус L. prorates Мором и Мацудо не указан; судя по некоторым иллюстрациям Мацудо (Matsudo, 1966), этот вид оседает лишь на базальном отделе щетинок (как Heterochona psychra на гаммаридах Мурмана). Вазальные виды у Lobochona и Heterochona встречаются реже дистальных. По Мору (Mohr a. oth., 1963а), лобохоны почти никогда не встречаются вне щетинок плеопод. По Дэйлсу (Dales, 1966), побохон редко находят где-либо, кроме этих щетинок. Создается впечатление, что Lobochona изредка может встречаться и на других участках плеопод, но это неверно. Три других новых рода с Limnoria, найденные в нашем материале, различаются и по морфологии и по локусам (рис. 12): локус Aurichona совпадает с локусом лобохон типа L. limnoriae, локус Phyllochona — с локусом L. prorates', планибионт Filichona живет на поверхности плеоподы у ее верхнего края, между смежными щетинками.
На Amphipoda Gammaridea пока были известны лишь формы с жабр и плеопод; мельком упоминалось о находке хонотрих на переоподах (редкие особи плеоподиаль-ной Trichochona lecythoides', см.: Mohr, 1948). Мы нашли хонотрих в трех новых локусах — на антеннах, ротовых частях и гнатоподах гаммарид; впервые дифференцированы не различавшиеся ранее три локуса на плеоподах (рис. 7; 13; 14, А—Г). Кент (Kent, 1881) как локус не изученной им Spirochona gemmipara указал «яйцевые капсулы» (оосте-гиты) Gammarus pulex, но это явная ошибка. Photis несет хонотрих типа Trichochona на плеоподах, A llorchestes и Parhyale — виды Oenophorachona на стебельке плеопод. Из 9 родов хонотрих с амфипод 5 родов приурочены к плеоподам, 4 — к жабрам, 3 — к гнатоподам и максиллам, 1 — к антеннам.
Только на жабрах встречаются виды Cavichona, Serpentichona и Heliochona', виды Spirochona заселяют также и другие придатки. Почти все авторы, изучавшие S. gemmipara, указывают один и тот же локус — края жабр; ровная же поверхность жабры заселена перитрихами и сукториями (Штейн, Эйсмонд и др.). У спирохон имеется тенденция к заселению дистального отдела жабры (Гертвиг, Сварчевский). Реже указывается, что занята также и свободная поверхность жабры, близко от края (Гертвиг, Кайзер). По Эйсмонду, спирохонами занята передняя половина выпуклого (медиального) края жабры. По нашим данным, виды Spirochona занимают обычно дистальный отдел жабр, как правило, выпуклую часть лепестков; часть особей встречается нередко на удалении 50—120 мк от края. Необычен локус S. globulus, куда входит не только дистальный край, но и все остальные края лепестка, вплоть до основания жабры. S. halophila встречается только на медиальном крае жабры (Matsudo a. Mohr, 1968), S. marina — на дистальном и выпуклом краях основных жабр и на краях придаточных жабр Anisogammarus. Для S. halophila Мацудо и Мор в качестве локуса в одном месте статьи указывают «щетинки плеопод», что неверно. Большинство видов Cavichona Ti Serpentichona anthus поселяются, как и спирохоны, у края жабры, в основном у ее вершины; часть видов (S. anthus, С. laticollis) обитает и на большом удалении от края жабры.
Плате находил Heliochona sessilis на плоской поверхности, реже на периферии жабр Gammarus, Фенхель — на дистальной и наружной части жабр. По Прехту, вид оседает на краях жабр, от их вершины до середины, редко встречаясь на вентральном (медиальном) и дорзальном краях. Мы находили гелиохон в том же локусе, что и спирохон, т. е. непосредственно у края жабры в дистальном отделе, реже на медиальном, еще реже на дорзальном крае. Есть и сомнительные находки. Так, по Мацудо и Мору (Matsudo а. Mohr, 1965), Heterochona psychra обитает на щетинках плеопод, реже на жабрах Gammarus setosus, но последнее невозможно, поскольку Heterochona — сетобионт. По Доб-жанской-Качановской, Н. scheutenii обитает исключительно на жабрах G. zaddachi, но на жабрах солоноватоводных гаммарид типа G. zaddachi и G. duebeni вообще нет хонотрих, виды гетерохон заселяют лишь щетинки придатков.
Антенны A nisogammarus subcarinatus на Парамушире заселяет Toxochona, плеоподы этого вида — Oenophorachona', в обоих локусах трофонты прикрепляются к членикам придатков, а не к щетинкам. На гнатоподах гаммарид мы обнаружили большую группу видов, ранее остававшуюся неизвестной (Heterochona, Toxochona и Spirochona). Spirochona gnathop о dialis прикрепляется к поверхности гнатоподы между щетинками на сочленениях, но не в зоне клешни, — это планибионт. Toxochona прикрепляется к придатку на сочленениях и в зоне клешни. Виды Heterochona обитают только на щетинках, а не на ровной поверхности гнатопод; на щетинках различимы два локуса — средняя и верхняя части (Н. peregrd) и базальная часть (Н. exilis).
Род Oenophorachona приурочен только к плеоподам, роды Heterochona, Isochona и Trichochona — преимущественно к плеоподам; на плеоподах живет и один из видов спирохон. До сих пор не обращали внимания на различие локусов на плеоподах; мы различаем три локуса — стебелек плеоподы, базальную и остальную части щетинок.
Для Oenophorachona ectenolaemus Мацудо и Мором в качестве локуса указаны щетинки плеопод, но это явная ошибка: все найденные нами виды рода приурочены к верхней (обращенной к жабрам) части стебелька, в основном к дистальному отделу. Гаевская
Рис. 12. Локусы хонотрих на Limnoria. А — общий вид рачка; -Б, В — Lobochona limnoriae на беломорских (В) и норвежских (В) рачках (по: Dons, 1940); Г — Phyllochona vexillata', Д, Е — локусы хонотрих на плеоподе, схемы; Ж — Lobochona tenue', 3 — Filichona paradoxa', И — связь пути ПВ с длиной тела.
(1933) как локус «.Spirochona gemmipara» указывает «края жабр, реже их свободную поверхность или придаточный стебелек» (?), а также конечности между щетинками. Сварчевский (19286) нашел S. simplex в массе на «абдоминальных ножках» (плеоподах?) О mmato gammarus flavus, а именно на членистых частях ножек, между щетинками, по всей длине стебелька до его вершины. Мы находили этот вид в том же локусе, обычно в дистальном отделе плеопод.
Предыдущие авторы не различали локусов Heterochona на щетинках плеопод, отсюда путаница в систематике гелиохонид. Так, Фенхель изображает особей на базальной и остальной частях щетинок Gammarus locusta под общим названием II. scheute-
Рис. 13. Локусы хонотрих на Amphipoda. А — Heterochona peregra; Б — Isochona migratoria; В — Spirochona gnathop о dialis; Г — T oxochona mira-bilis; Д — Heterochona psychra.
nii, но это могут быть разные виды. Точный локус на плеоподе не указан и для Н. psychra (Matsudo a. Mohr, 1965); на Мурмане Н. psychra живет лишь на базальной части щетинок; тот же локус у G. obtusatus занимает Н. peregra. На средней и верхней частях щетинок гаммарид и амфитоид поселяются Isochona, Heterochona и Trichochona. Мурманские гаммарусы несут обычно по два вида гетерохон на базальной и остальной частях щетинок; в Дании и Швеции найден лишь дистальный вид Н. scheutenii, на Аля
ске — лишь базальный вид Н. psychra. Н. scheutenii найдена Штейном «только на длинных членистых щетинках, отходящих парами от одного базального членика» (Stein, 1854 : 216) — очевидно, здесь имеется в виду двуветвистая плеопода в целом. Поскольку «каждая щетинка часто песет многочисленных животных», вид Штейна явно не базальный. На солоиоватоводных гаммаридах базальных видов хонотрих вообще нет. По Фенхелю, Н. scheutenii заселяет переднюю сторону плеопод; в нашем материале вид поселяется с обеих сторон щетинок, но чаще на передней, обращенной к жабрам.
Почти все виды Heterochona занимают в основном среднюю и верхнюю части щетинок у вершины плеоподы; Н. coronata, виды Isochona и Trichochona — в равной мере все щетинки, до основания плеоподы; они могут спускаться и ниже, на редкие щетинки базального членика плеоподы, и переходить на щетинки смежных переопод. Видов хонотрих, приуроченных только к переоподам амфипод, нет; на щетинки переопод могут перейти лишь единичные особи массовых плеоподиальных видов,’причем никогда не переходят базальные виды типа Н. psychra и виды со стебелька плеопод. По Мору (Mohr, 1948), особи на плеоподах составляют основную часть популяции Т. lecytho-ides, но некоторые особи поселяются на дистальной части задних (близких к плеоподам) переопод. В нашем материале на щетинки переопод мигрирует часть особей массового вида Isochona migratoria с плеопод Amphithoe. На уроподах и панцире рачков хонотрих нет. По Эйсмонду (Eismond, 1890а), Штейн обнаружил Н. scheutenii на задних ногах Gammarus pulex (в действительности на плеоподах Gammarus sp.). Кент и Каль как локус Stylochona coronata указывают торакальные ножки (переоподы), однако изображает Кент щетинки абдоминальных плеопод. По Мору (Mohr a. oth., 1963а), Сварчевский обнаружил Cavichona elegans на передних переоподах гаммарид, в действительности же — на жабрах, особенно в передней части тела. Mop (Mohr, 1966) пишет, что «плеоподиальные консорты, такие как Heliochona и Lobochona, относительно легко видны по сравнению с переоподиальными (Spirochona, Kentrochona)», однако спирохон на переоподах нет. Наконец, по Раабе (Raabe, 1964с), хонотрихи в целом живут «на жабрах и на конечностях, прикрывающих жабры A mphipoda», но прикрывают жабры переоподы, а не плеоподы.
На щетинках ротовых придатков Gammarus setosus, G. oceanicus и G. obtusatus на Мурмане (на максиллипедах, в меньшей степени на максиллах, единичные особи — на мандибуле) обычны виды Heterochona. Н. trljarua приурочена только к ротовым придаткам, Н. peregra встречается также на гнатоподах и на базальной части щетинок плеопод; во всяком случае мы не нашли морфологических различий этих популяций. Особи прикрепляются к нижней, реже к средней и очень редко к верхней части щетинок лопастей и щупиков (эндоподитов) ротовых придатков.
Хонотрихи на Cyamidae не приурочены, по Мору (Mohr, 1959а; Mohr a. oth., 1963b), к определенному участку тела рачка, рассеяны по всему телу, избегая лишь жабр; это формы с ограниченной специфичностью. Однако на осмотренных нами циа-мидах хонотрихи локализованы на нижней стороне тела, в основном в местах сочленений, образуя агрегаты у ануса, на основании задних конечностей и в передней части тела, частично на основании антенн. На ротовых придатках мизиды. Gnathophausia (рис. 6, Г, Д) Бенсоном найдены клематохоны, Мором — одиночные особи мизидохон. По Гейгеру (личное сообщение Дж. Л. Мора), мизидохоны обитают также на ротовых частях, конечностях и (единственный случай у хонотрих!) на оостегитах Boreomysis nobilis.
На видах всех 4 подгрупп Decapoda (рис. 6, Е—3;, 8, Д—Е; 14, Д—Л) хонотрихи заселяют только ротовые части. Для Chilodochona ‘qvennerstedti в качестве локуса указаны максиллы и максиллипеды Ebalia turnejacta и ротовые части Portunus depurator (Wallengren, 1895); локус на Pagurus не отмечен. По Гийше и Фо-ре-Фремье, Ch. carcini встречается лишь на эндитах (невысоких пластинчатых придатках с длинными жесткими щетинками), максилл и двух пар максиллипе- ' дов Carcinus maenas и Cancer pagurus. По литературе, Ch. carcini прикрепляется только к щетинкам придатков. Мы находили виды трех родов хилодохонид также только на ротовых частях декапод (креветок, лангустов, пагурид и крабов); локус их шире, чем у Ch. carcini, причем заселены не только эндиты. Так, Vasichona paguri заселяет на Pagurus pubescens в основном щетинки максиллулы и максиллипед, особенно эндопо-диты I и II пары в их дистальных отделах. Найдены особи и на жгутике экзоподита максиллипед Hyas araneus. На шримсе Pandalus latirostris хонотрихи широко расселены по поверхности и щетинкам всех ротовых придатков; очень много их и на мастигобранхе I максиллипеды, скрытом под панцирем в жаберной полости хозяина (аналогия с хо-нотрихами на щупике I максиллы Nebalia). Часть особей хилодохон, особенно на Hyas и Palinurus, оседает не только на щетинках, но и на ровной поверхности придатков, образуя здесь иногда целые скопления. Сето- и планибионты на Hyas araneus hoecki могут относиться к разным видам. Ранее было распространено мнение о том, что морфология особей одного и того же вида хонотрих зависит от их локуса на рачке (Ромпель, Дофлейн, Бючли, Гамбургер, Каль и др.); правильнее считать, однако, что морфоло
гические различия в сочетании с различиями в локализации указывают на возможность обитания разных видов рода.
Эволюцию комменсальных перитрих обычно представляют как постепенное сужение круга хозяев и затем постепенное сужение локуса на хозяине (Кайзер, Неннингер,
Рис. 14. Локусы хонотрих на A mphipoda и Decapoda. А — локусы на бокоплавах, схема, Б, В -— путь ПВ при осцилляции придатков; Г — локусы на плеоподе; Д — общий вид Carcinus maenas; Е—Л — локусы Chilodochona carcini на ротовых придатках С. maenas (по: Guilcher, 1951).
Люст, Стеффан): сначала вид заселяет все части тела хозяина или большинство их, затем некоторые, затем одну. «Перитриха» Spirochona с жабр рачков причислена Кайзером к последней категории. Mop (Mohr, 1959b), подразделяя комменсалов лимнорий на случайных и облигатных, учитывал лишь особенности их локализации: перитрихи, суктории и Conidophrys широко рассеяны по телу и поэтому якобы неспецифичны, хонотрихи же специфичны, поскольку занимают узкий локус, Эйсмонд (Eismond, 1895) различал виды, оседающие на любом субстрате — детрите, растениях, животных
(например, Vorticella nebulifera, способная заселять и всю поверхность гаммарид), и виды, по встречающиеся па детрите, как Spirochona па жабрах гаммарид. Однако широкий локус комменсала вовсе не означает, что это обязательно случайный, неспецифичный вид. Так, цетохона специфична для Cyamus, Cristichona — для части рас Nebalia, хотя это виды именно с широким локусом и, кстати, вовсе не примитивные; у примитивных форм {Lobochona, Oenophorachona, Isochona) локус, напротив, очень узок. Видообразование происходит при миграции части особей на новый, тоже узкий локус на том же рачке или при заселении прежнего локуса на новом виде рачка; никакого «постепенного сужения первоначально широкого локуса» у хонотрих нет.
Mop (Mohr, 1959а : 652) утверждает, что, поскольку химизм хозяина не может, по-видимому, ограничивать распределение хонотрих в большей степени, чем перитрих и сукторий, которые гораздо шире и менее закономерно распределены по поверхности хозяина, причины жесткой видовой и пространственной специфичности следует искать в несовершенстве цилиатуры трофонтов и томитов. Неясно, однако, почему хонотрихи со сходной формой тела и с одинаковым прикрепительным аппаратом (к примеру, Isochona и Oenophorachona) заселяют разные локусы; возможно, это объяснимо именно химизмом субстратов и «химическим чутьем» томитов, благодаря которому «реакция оседания» может произойти только при контакте с определенным субстратом. Распознавание субстрата должно быть основано на какой-то реакции типа «антиген»-(-«антитело»; томит имеет лишь определенный набор таких «антител» и может оседать лишь на строго определенном субстрате. В итоге виды хонотрих, как правило, не могут заселять несвойственные им участки тела хозяина. Панцирь рачка — не сплошной покров, он пронизан порами, выделяющими разные вещества; к ним, возможно, и чувствительны томиты. Трофонты адаптированы к условиям обитания в определенных локусах; к примеру, Toxochona с резко вытянутой шейкой (живущая между длинных щетинок гнатопод) едва ли могла бы жить на жабрах; A ctinichona, обрастающая щетинки коксоподита, едва ли может жить вне этих щетинок. Вследствие различия субстрата, морфологии придатка и вызванных ими адаптаций трофонта и томита обитающего здесь вида хонотрихи не образуют смешанных популяций, локус одного вида отграничен от локуса другого. Само наличие многочисленных локусов на рачке — это свидетельство постепенного заселения поверхности придатков аутойками и адвенойками. Если на рачке заселен, к примеру, стебелек плеопод и остаются свободными щетинки, их может занять аутойк со стебелька или адвенойк с другого вида рачка. Достаточно одного мутантного томита с нарушенным химическим чутьем, чтобы осесть в новом локусе; не обязательно он даст начало новому виду и тем более роду, но обычно такая миграция не сводится к простому расширению локуса на рачке и сопровождается видообразованием в зонах, условия в которых существенно отличаются от исходных. Широкое расселение некоторых хонотрих (типа цетохон) на покровах рачков свидетельствует о постепенном расширении локуса вида.
Хонотрихи расположены на придатках с удивительным постоянством: ПВ обращена к вершине придатка (плеоподы, жабры, щетинки), тело расположено под углом порядка 30—45° к субстрату. На всех придатках гаммарид и на большинстве придатков небалиид хонотрихи свешиваются вниз своими воронками, 'Направлены к брюшной стороне тела, где имеется интенсивный ток воды. Валленгрен считал, правда, что Chilodochona на ротовых придатках крабов повернута к току воды своим аборальным концом; стебелек и опорный диск отклоняют в сторону ток воды, идущий из жаберной полости, предотвращая отрыв особи. Судя по рисункам Гийше и нашим препаратам, нет определенной ориентации хилодохон по отношению к жаберной полости хозяина; оси трофонтов проходят по всевозможным направлениям, но всегда под прямым углом к субстрату. Хонотрихам свойственна тенденция к поднятию рта над субстратом, что достигается удлинением шейки {Toxochona), образованием ложных {Cavichona) и настоящих {Chilodochona) стебельков; чем выше поднята ПВ, тем больше возможности дотянуться до токов воды с пищей. По Мору (Mohr, 1948), Trichochona прикрепляется к дистальной части плеопод, поскольку здесь дуга, описываемая ПВ при ударе придатка, наиболее велика (рис. 14, Б, В). Чем больший путь проходит ПВ, тем больше может быть заглочено пищи. Отсюда тенденция к локализации хонотрих на дистальных отделах большинства придатков. По Эйсмонду, спирохоны прикреплены к жаберным пластинкам хозяев так, что лежат в одной плоскости с ними, и эта особенность также увеличивает путь ПВ.
В расположении хонотрих можно отметить еще одну общую закономерность: особи прикреплены только к придаткам, находящимся в непрерывном движении. Исключение — формы с китообразных и с панциря Nebalia. У последних формы типа Dentichona оседают на внутренней поверхности панциря и свисают на длинных стебельках в полость между панцирем и торакоподами, где ток воды достаточно интенсивен. Все тело циамид, живущих на китах, также омывается током воды при движении хозяина, а тело В alaenophilus — при процеживании воды сквозь сито «китового уса», к которому они прикреплены. На таких рачках хонотрихи могут быть прикреплены непосредственно к поверхности тела, а не к придаткам. Питанию свободноживущей Eleuthero-
chona с литоральных водорослей способствуют, возможно, приливно-отливные течения. Приуроченность остальных хонотрих к наиболее активным придаткам хозяев объяснима прежде всего невозможностью их питания без косвенной помощи рачка. Мор неоднократно подчеркивал, что предротовые реснички хонотрих могут создать лишь незначительный вортекс, эффективный лишь в потоке частиц, создаваемом придатками хозяина. У перитрих или фолликулинид вортекс более эффективный, особи могут питаться самостоятельно и поэтому заселяют любые части тела рачков. «Хонотрихи встречаются на тех местах своих хозяев, где имеются потоки пищевых частиц, — факт, объясняемый слабой ротовой цилиатурой» (Mohr a. oth., 1963b : 121). По Фенхелю (Fenchel, 1965 : 285), гелиохониды «занимают на хозяине места, которые наиболее подвержены водным течениям, — места, редко занимаемые перитрихами». Перит-рихи действительно почти никогда не оседают на плеоподах рачков — обычном локусе' хонотрих; они заселяют панцирь, жабры, переоподы, антенны, тельсон. Известны одновременные находки хонотрих и перитрих в разных локусах на лимнориях («Spi-rochona» на плеоподах, Epistylis на головогруди и эпимерах), на Epinebalia (Kentrochona на плеоподах, Cothurnia на абдомене) и на Amphithoe (Trichochona на плеоподах и переоподах, Cothurnia у основания этих ножек) (Kofoid, 1927; Mohr, 1948; Menzies а. Mohr, 1952). Такие примеры многочисленны. Ограниченная способность к самостоятельному питанию препятствует расселению хонотрих по всему хозяину, в частности по дорзальной поверхности панциря, где обычно много фолликулинид, сукторий и колониальных перитрих.
В литературе часто указывается и на необходимость для хонотрих постоянного доступа кислорода. В локализации ’хонотрих на особо подвижных придатках обычно-видят свидетельство их оксифильности (Тинеманн, Прехт и др.). Так, по Кайзеру (Keiser, 1921 : 228), условия жизни спирохон — это «быстрый водообмен и обновление-кислорода». По Сварчевскому (1928а : 186), «Spirochona — очень нежная форма, зависящая от обновления воды. Она занимает следующие места: 1) на тех участках жаберных пластинок, которые подвергаются наибольшему обмену воды; 2) на тех жаберных пластинках, которые находятся в наиболее быстром движении; 3) на тех особях хозяина, которые способны к наиболее сильному и быстрому движению». Mop (Mohr,. 1948 : 8) отмечает, что «Chonotrichida занимают высокоспециализированную нишу. Насколько известно, все они — комменсалы активных ракообразных и локализованы на таких структурах последних, которые получают максимальное количество, растворенного кислорода».
КОЛИЧЕСТВО ОСОБЕЙ НА ХОЗЯИНЕ
Представление о заселенности рачка хонотрихами можно получить, умножив; примерное число особей на одном придатке на число всех придатков. Следует руководствоваться следующими цифрами. Gammarus имеет 6 пар жабр, A nisogammarus — 12 пар. Плеопод у гаммарид 3 пары, каждая включает 2 равные ветви. Щетинок на-одной плеоподе у взрослого рачка примерно 80. У Limnoria плеопод 5 пар, каждая состоит из неравныхщегментов с 20 и 10 щетинками. Торакопод у Nebalia 8 пар, плеопод 4 пары крупных "двуветвистых и 2 пары рудиментарных одноветвистых.
Вид в целом может быть известен как носитель хонотрих, но заражены не обязательно все расы и особи; отсюда противоречивые сведения по встречаемости и численности хонотрих. Хотя авторы иногда связывают отсутствие хонотрих с экологическими условиями (Тинеманн, Мор, Кайзер и др.), оно может быть и случайным. Плотность популяции хонотрих зависит, естественно, от внешних факторов (соленость среды, наличие О2, загрязнение воды, температура) и от физиологического состояния рачков (стадии линечного цикла); действие внешней среды рассматривается в главах об экологии и размножении хонотрих, здесь же мы обратим внимание лишь на связь числа хонотрих с их локусом. «Вместимость» локуса — важнейший фактор, определяющий численность хонотрих на рачке; так, эндогеммйны Echinichona и Pterochona занимают локус, достаточный для размещения лишь единичных особей, Stylochona и Carinichona — локус, вмещающий десятки особей. В пределах своего локуса вид стремится заселить лучшие участки, например дистальные отделы плеопод или жабр, что также уменьшает теоретически возможное число особей на придатке. В разных частях тела придатки заселяются неравномерно. По Прехту, Heliochona sessilis оседает в основном на передних жабрах Gammarus. По Сварчевскому, Cavichona elegans на Eulimnogammarus заселяет обычно 2—3 передние пары жабр, где видны сотни инфузорий; далее их число уменьшается, и на двух последних парах видны лишь единичные особи.
Пол хозяина, вероятно, не влияет на зараженность. Сварчевский отметил отсутствие спирохонид на яйценосных самках Eulimnogammarus verrucosus, но мы не могли найти различий в зараженности самцов и самок (с молодью в камерах) Е. cyaneus и ряда других хозяев. Кальмус (Kalmus, 1928) в массе нашел Spirochona на самках
Gammarus, хотя вид в целом редок. Наблюдается зависимость числа хонотрих от возраста рачка. По Прехту, наиболее мелкий Gammarus, несущий хонотрих, имел длину 3.4 мм; отсюда Прехт предполагает, что хонотрихи нуждаются в сильных токах воды, который могут создать лишь взрослые гаммарусы. Эта закономерность отмечена и для Heterochona. По Сварчевскому, молодые особи Eulimnogammarus заражены слабое взрослых; мы смогли подтвердить это явление на большом числе ракообразных, кроме циамид. По Мору (Mohr a. oth., 1963b), цетохоны более обычны на молодых циамидах, чем на взрослых; при просмотре большого материала по Cyamus ovalis мы также нашли массовые поселения цетохон именно на молодых особях. Прямой зависимости плотности популяций хонотрих от размеров хозяев нет уже потому, что хозяева регулярно линяют; после линьки колонизация начинается заново. Личинки в сумках рачков, за исключением молоди Gammarus obtusatus, практически всегда лишены хонотрих. Заметим также, что шансы для колонизации новых хозяев больше у видов хонотрих, образующих плотные популяции: они выделяют в среду больше томитов. Вероятно поэтому, виды с узким локусом встречаются не на каждом рачке и их всегда значительно меньше, чем вмещает придаток. Если рачок несет комплекс хонотрих, на разных расах могут доминировать разные виды комменсалов. Так, Heliochona на жабрах Gammarus setosus редка на Аляске и обычна на Мурмане, Heterochona trifaria обычна на Мурмане, но не найдена в Белом -море. На 19 особях Anisogammarus из Филдс-Лэндинга (США, Калифорния) и 15 из Крисент-Сити (там же) Мацудо и Mop (Matsudo a. Mohr, 1968) нашли соответственно 168 и 1890 особей энофорахон и 582 и 421 особь спирохон. Возможно, эти различия объяснимы различием требований к условиям среды у эктокомменсалов.
У лимнорий Незаряженные расы редки. По Мору (Mohr a. oth., 1963а), из многочисленных оборов лимнорий только одна раса из Тринидада (Британская Вест-Индия) оказалась без хонотрих. Хонотрих можно найти и на фиколимнориях из водорослей, но, очевидно, не в каждой колонии. К массовым формам принадлежат Lobochona limnoriae (Dons, 1940) и особенно L. tenue (рис. 12, Ж); щетинка плеоподы может нести 5—7 особей L. tenue, плеопода — 90—100 особей, рачок в целом — около 1500 особей. Мор насчитывал до 13 особей L. insularum на плеоподе лимнорий. L. prorates •оседает лишь у основания щетинок, плеопода может нести максимум 15—20 особей; заражено лишь 10—15% лимнорий, осмотренных Мацудо. По Кофойду (Kofoid, 1927), Lobochona и Epistylis — это, вероятно, наиболее многочисленные и наиболее часто находимые комменсалы лимнорий в Калифорнии. Aurichona редка на лимнориях, мы находили не более 4—5 особей на плеоподе; Phyllochona обычна на Мурмане (до '30 особей, обычно меньше на придатке); Filichona очень редка — теоретически на плеоподе между щетинками могут поселиться 15—20 особей, но мы находили максимум 2—3. На гаммаридах лобохониды занимают узкие локусы (антенны, гнатоподы, стебелек плеопод) и поэтому немногочисленны, до 10—30 особей на придатке. Eleu-therochona, судя по снимкам Донса, образует на водорослях большие скопления.
По Шейтену и Штейну, одна щетинка у Gammarus несет обычно многочисленных •особей Heterochona scheutenii. По Валленгрену плеопода этого рачка несет всего 15— 20 особей вида, по Прехту — до 160. По Мору (Mohr, 1966 : 538), «большинство особей G. duebeni из Плимута были заражены Heliochona» (Heterochona). «Vaginicola cry-.stallina» (H. coronatai) образует на Gammarus marinus толстый покров на щетинках плеопод (Bate a. Westwood,'1861; на 4 щетинках изображена 21 особь). Хонотрих на плеоподах G. marinus и Haustorius arenarius так много, что, как предполагают, они могут тормозить движение рачков. По нашим данным, численность Heterochona на гаммаридах зависит прежде всего от их локусов. Н. coronata заселяет все щетинки .плеопод G. obtusatus (до 250—280 особей на одной ветви плеоподы, до 3000 на рачке). У форм с тенденцией к заселению вершины плеопод — Н. scheutenii, Н. crinita — хонотрих намного меньше; еще меньше на плеоподах особей Н. psychra, заселяющих лишь основания щетинок. На гнатоподах G. obtusatus редки особи базального вида Н. exilis и обычен дистальный вид Н. peregra. Фенхель насчитал на жабрах G. locusta при оптимальной солености до 120 особей Heliochona sessilis; следовательно, рачок .должен нести примерно 1440 хонотрих. Обычно же гелиохон находят в меньшем числе — 8—10 (Валленгрен), максимум 74 особи на жабре (Прехт). Мы находили около 10—30 особей Н. sessilis на жабре G. setosus (120—160 особей на рачке); редкими были особи на G. locusta (Н. pontica), более частыми — на G. obtusatus, Amphithoe xubricata и Anisogammarus sp.
На крабе Portunus depurator Валленгрен нашел значительное число особей Chilo-.dochona qvennerstedti. Хилодохоны обычны на крабах Роскоффа (Франция), где образуют массовые поселения на ротовых частях (Гийше, Форе-Фремье); одна лишь щетинка ротовых придатков Carcinus maenas может нести около 50 особей Ch. carcini, общее же их число на крабе должно измеряться тысячами. Ротовые придатки дека-под крупнее, чем у остальных хозяев хонотрих, могут вместить больше комменсалов. Мы находили Vasichona и Chilodochona на пагуридах, креветках и крабах также в больших количествах.
Европейскую Spirochona gemmipara Бючли считает редким видом; Эйсмонд нашел спирохон лишь на одной из 4 рас Gammarus pulex близ Варшавы, кальмус — в небольшом количестве на 3 из 5 рас этого рачка близ Праги. Другие авторы считают S. gemmipara частым видом; так, Тинеманн регулярно находил спирохон близ Брауншвейга, кайзер — на большинстве рас рачков в Базеле и его окрестностях, Бухар — близ Праги. Големанский отметил спирохон на 3 из 6 рас G. balkanicus, на 1 из 3 рас G. pulex fossarum и на обеих осмотренных расах G. р. komareki; заражено, однако, по его данным, всего 29.9% рачков. По Гертвигу, спирохоны образуют плотные поселения; Кайзер насчитывал до 30 и более особей спирохон на жабре гаммаруса, считая это также «исключительным числом». Массовые популяции спирохон нашел Тюффро. Данные Штейна противоречивы: указывается одновременно, что это очень редкий и очень частый вид, встречающийся в значительных количествах и образующий «богатый гарнитур на краю жаберного лепестка» (Stein, 1854 : 205—206). Кальмус находил спирохон в небольшом числе на G. pulex, реже на G. lacustris. У форм с G. pulex komareki Големанский насчитывает до 34 спирохон на жабре, до 181 особи на одном рачке. По Мору, спирохоны в Англии заселяют G. pulex в относительно небольших количествах, «дюжинами или десятками». На жабрах G. pulex в Петергофе мы находили небольшие поселения спирохон — максимум 10—12 особей (120—144 на рачке), на G. lacustris в Прибайкалье по 10—15 особей (120—180 на рачке). На жабрах Anisogammarus Мацудо и Мор находили до 7 особей Spirochona halophila-, мы отмечали по 10—40 особей S. marina на основной жабре и по 15—20 на придаточной.
«S. gemmipara» в массе отмечена Сварчевским (19286) на жабрах 9 видов 7 родов гаммарид Байкала; остальные виды спирохон включают массовые (S. globulus, S. ап-thus) и редкие формы (S. elegantula, S. tuba, S. patella). По нашим препаратам, на Байкале преобладают массовые виды Spirochona (до 80—140 особей на жабре). Особо плотные поселения (до 220 особей на жабре) образует S. globulus, заселяющая весь край жабры вплоть до ее основания. Меньше число особей S. tuba, очень мало особей S. brevis. Плеоподы О mmato gammarus flavus несут 10—30 особей S. simplex на одной ветви, сегменты гнатопод — по 10—14 особей S. gnathopodialis. По Сварчев-скому (1928а), Cavichona elegans — это самый массовый комменсал гаммарид у Иркутска, образующий на своем «излюбленном хозяине» — Eulimno gammarus verrucosus «колоссальные поселения» в виде густой бахромы по краям жабр. По нашим данным, род Cavichona включает в основном массовые виды; особи С. brevistyla, С. oli-gocineta, С. tenue и С. abyssalis были найдены в небольшом числе, но мы осмотрели всего несколько их хозяев. С. acanthogammari и С. laticollis редки на своих хозяевах, особенно на чистых жабрах; их больше на жабрах, пораженных грибком — сапро-легнией. Serpentichona редка, особенно на Pachyschesis, не образует очень плотных поселений.
Эндогеммины, живущие на Amphipoda, представлены массовыми видами семейства Isochonidae. На Amphithoe Mop (Mohr, 1948) нашел на плеоподах и частично на переоподах около 2000 особей Trichochona lecythoides-, Мор считает, что это экстремальные цифры (Mohr a. oth., 1963а). Одна ветвь плеоподы, по Мору, должна нести около 166 трихохон. Мурманские Marinogammarus, однако, могут нести до 3000 хонотрих (Heterochona peregra). В нашем материале отмечены массовые виды мелких хонотрих Trichochona surgens и Isochona spp. на дальневосточных видах Amphithoidae (от Путятина до о. Беринга). Цетохоны очень крупны и поэтому не столь обильны на циамидах, но мы находили особей хозяев, несущих около 100—140 хонотрих.
Кент (Kent, 1881) отметил большое число особей Stylochona nebalina на «торакальных придатках» Nebalia. Kentrochona nebaliae немногочисленны: Дофлейн изображает 4 особи на эндоподите, 3 на эпиподите и 12 на экзоподите торакопод; на щетинках максиллулы изображены 4 особи типа Stylochona. Kentrochonopsis multipara редок, представлен единичными особями. Комменсалов 7 рас Nebalia, изученных нами, по численности на хозяине можно разделить на 4 группы. К редким формам (1—4 особи на придатке) принадлежат Paraoxychona inversa, Crassichona insolita, Isochona anten-naria, Armichona hexadenta, Pterochona pacifica, Inversochona peregra, Ceratochona ci-mex, Eriochona glacialis, E. horrida; более часты (5—10 особей на придатке) Isochona peltifera, I. crassa, I. rotundata, Echinichona simplex, E. regina, Coronochona pectinata, Oxychona suprema, O. multifida, Ctenochona ternipara, Kentrochona robusta, Chonosaurus rex\ 10—20 особями на придатке представлены Cristichona pacifica, C. tesselata, Isochona pleonicola, Pleochona coronata, Stylochona villosa, Dentichona marginata, Actini-chona cuspidata, A. gaucho, Ceratochona scandens, Flectichonafilicauda, Armichona insecta, A. gibbosa; массовыми видами (более 20 особей на придатке) являются Spinichona horrida, Stylochona glabra, S. maxillaris, S. setaria, Rhizochona armata, Carinichona globulus, Eurychona vitrea, Flectichona crenata. Крайности — виды типа Carinichona globulus (до 150 особей на торакоподе) и Crassichona insolita (1—2 особи на тора-коподе). Популяции всех перечисленных видов дублируются на разном числе придатков, поскольку Nebalia имеет 16 торакопод, 12 плеопод и только 2 максиллулы. Поэтому данные по суммарной зараженности рачка каким-либо видом не обязательно
совпадают с данными по зараженности придатков. Так, если на торакоподе насчитывается 5—10 особей Chonosaurus, а на максиллуле — 10—20 особей Flectichona, то в сумме рачок несет 80—160 первых и всего 20—40 вторых. Для видов с особо резким различием численности па придатках получаем наглядные суммарные данные — порядка 1600—2400 особей Carinichona globulus и 16—32 особи Crassichona insolita на одном рачке.
МОРФОЛОГИЧЕСКИЙ ОЧЕРК
РАЗМЕРЫ, ФОРМА ТЕЛА
Хонотрихи в целом — относительно некрупные инфузории, длиной в основном порядка 50—100 мк; наиболее мелкие виды достигают в длину 32—42 мк (Ceratochona scandens), 40—50 мк (С. cimex, Kentrochona robusta, Carinichona globulus}, наиболее крупные — 310 и 345 мк (Serpentichona anthus, Cavichona cincinnata). Удлинены формы с листовидным и цилиндрическим телом, массивных мешковидных форм мало (Crassichona, Chilodochonidae). Виды экзогеммин (60—100 мк) в целом крупнее эндогеммин (40—90 мк). Размеры примитивных хонотрих следующие: лобохона — 60—85 мк, энофорахона — до 90 мк, токсохона — до 210 мк. Филлохониды очень мелкие (40— 52 мк), филихониды крупнее (90—97 мк у аурихон, до 158 мк у филихон). Среди ге-лиохонид преобладают формы величиной 65—80 мк; резко удлинены Heliochona elegans, Н. alternans и Heterochona exilis (соответственно до 83, 132 и 155 мк). Хилодохониды — крупные формы, величиной порядка 80—130 мк. Морские виды Spirochona очень мелки (36—57 мк), пресноводная S. gemmipara достигает в длину 90—105 мк, байкальские виды мельче (60—90 мк, исключая S. gnathopodialis, имеющую длину до 107 мк). Все виды кавихон превышают в длину 100 мк вследствие развития псев-достила; размеры видов колеблются от 109 (Cavichona brevistyla) до 345 мк (С. cincinnata). Serpentichona anthus с Acanthogammarus имеет в длйну 270—310 мк, с Ра-chyschesis — 130—170 мк. Примитивные Endogemmina, живущие на амфиподах (виды Isochona и Trichochona), достигают 60—85 мк. Виды изохон с Nebalia разнообразны по длине (всего 42—43 мк у I. crassa, 60—65 мк у I. rotundata, до 87—94 мк у остальных форм). Актинихонида Crassichona достигает в длину 96—115 мк, остальные роды мелкие (45—78 мк). Среди стилохонид преобладают мелкие формы (порядка 50—70 мк); длина Oxychona равна 80—95 мк, Pterochona — 107—120 мк. Эхинихониды включают мелкие (Eurychona, Coronochona — 55—65 мк) и крупные формы (Echini-chona — 93—105 мк). Среди инверсохонид особо велика примитивная плеохона, длиной 70—90 мк, остальные роды невелики (30—80 мк). Стебельчатые формы встречаются в обоих подотрядах хонотрих, стебельки увеличивают высоту поднятия рта над субстратом. Нет, однако, прямой зависимости между размерами тела и наличием и длиной стебелька; возможны все сочетания.
Почти все авторы различают у хонотрих три отдела особи — тело, шейку и перистом; границы отделов обычно четкие. Тело расширено, несет ядра, вакуоли, ампулы. У хонотрих произошла фактически цефализация: ПВ, едва наметившаяся у дисте-риид, достигла особого развития и отделилась перетяжкой (шейкой) от тела. Еще Плате говорил о «головном отделе» спирохон. ПВ обычно сплющена дорзо-вентрально, особенно у эндогеммин, теряет исходную коническую форму; отверстие становится серповидным или щелевидным. Тем не менее она остается воронкой: верхняя ее часть намного шире ротовой. Там, где прекращается сужение ПВ, она переходит в шейку, обычно цилиндрическую. Нижняя граница шейки также отчетливая — это отдел, где начинается расширение тела. В этой зоне у эндогеммин часто образуется гипоколлюм (защитная складка кутикулы), у экзогеммины Fllichona — защитная шипоносная площадка.
Внешний облик хонотрих удивительно разнообразен. По Мору и Мацудо, у спи-рохонин тело вазообразное, у хилодохонин пузыревидное, иногда округлое. Условно можно сказать, что тело многих экзогеммин вазообразное, но эти «вазы» имеют всевозможные, причудливые очертания. Разнообразие облика хонотрих сводится к различиям в пропорциях тела, шейки и ПВ, к различиям формы ПВ и к наличию защитных и прикрепительных органелл разного типа. У наиболее примитивных родов обоих подотрядов (Lobochona, Oenophorachona, Isochona) тело бутылковидное, с округлым сечением; ПВ коническая, практически не сплющена. Такой облик сохраняют многие экзогеммины (спирохониды, гелиохониды, Eleutherochona), но ПВ у них уже заметно сплющена, тело может быть растянуто либо, как у Heliochona, сплющено на нижнем конце. Листовидные формы среди экзогеммин встречаются лишь как исключение (Phyllochona)-, такой облик имеет, напротив, большинство высших эндогеммин (Sty-lochonidae, Echtnichonidae): тело их резко сплющено дорзо-вентрально, с плоской стороны выглядит веретеновидным. Цилиндрические формы редки (Trichochona, Actini-chona, Pleochona). Тело не сплющено у каринихонин, инверсохонид и Crassichona,
но эти формы все равно нельзя назвать бутылковидными. Для экзогеммин характерно удлинение шейки: эта тенденция отмечается у примитивных Lobochona, Oenophorachona и достигает особого развития у Aurichona, Toxochona, Filichona и у части видов Heterochona и Heliochona-, шейка особенно длинна у планибионтов (135 мк). Одновременно и шейка и нижняя часть тела удлинены у Oenophorachona sagitta, шейка и верхняя часть тела (выше Ма) — у Aurichona armata-, границу тела и шейки здесь маркируют шипы. При резком удлинении нижней части тела образуется подобие стебелька — псев-достил (Cavichona, Serpentichona, отдельные виды Heterochona и Oenophorachona). Среди эндогеммин шейка отчетливо выражена, даже слегка вытянута, только у трех родов — у каринихонин Carinichona, Rhizochona и Cristichona, причем у кристихон удлинена и верхняя часть тела. У всех остальных эндогеммин шейка рудиментарна. У большинства хонотрих шейка намного тоньше ПВ и тела, отчетливо выражена, но иногда она укорочена настолько, что ПВ кажется втянутой в тело (Chilodochona, Chono-saurus). Ряд авторов, подчеркивая своеобразие облика хилодохонид, говорит о том, что они вообще лишены шейки (Валленгрен, Каль, Холл, Мор, Мацудо); так, по Лепши (Берщ, 1965), перистом хилодохон, в виде поперечной щели, не изолирован от тела; у Kentrochonopsis, по Дофлейну, имеется слабо отшнурованная шейка. Правильнее считать, что шейка (перетяжка между телом и ПВ) имеется у всех хонотрих, но она удлинена только у части родов. Среди экзогеммин шейка укорочена у хилодохонид, Eleutherochona и Phyllochona. Редукция ее у эндогеммин приводит к сближению ПВ и краев сумки и образованию гипоколлюма — характерной поперечной складки у основания ПВ; фактически это продолжение одного или обоих краев сумки, огибающих основание ПВ.
Бесстебельчатые хонотрихи иногда прилегают к субстрату сплющенной и расширенной нижней частью тела (подошвой), сохраняя прикрепительный диск (ножку). У стебельчатых форм разнообразие внешнего облика выражено в гораздо меньшей степени: нет форм с подошвой, с псевдостилом, с резким удлинением тела и шейки; цетохоны и Trichochona сохраняют исходную бутылковидную форму тела, но чаще у эндогеммин тело становится листовидным, а у экзогеммин — мешковидным.
Томитов хонотрих всегда ориентировали правильно — по ресничному желобку, проходящему на вентральной стороне тела (хотя рот и глотка отмечались редко). Трофонтов ориентировать трудно: после оседания томита желобок смещается вверх и превращается в ПВ; к ПВ применяли поэтому совершенно непригодный термин «вентральный диск» (Добжанская-Качановская). Мор и Мацудо избегают терминов «вентральная» и «дорзальная» стороны в применении к хонотрихам, говоря о «стороне сумки», «стороне адорального поля» и т. д. Обычно же сторона хонотрих, обращенная к субстрату, произвольно обозначается как вентральная (Ромпель, Дофлейн, Валленгрен и др.). Однако этот критерий непригоден — комменсалы всех групп инфузорий (Trichodina, Scyphidia, Licnophora, Hemispeira, Folliculina и др.) прилегают к субстрату, напротив, аборальной, дорзальной стороной. Кроме того, почти половина родов хонотрих — стебельчатые формы, не прилегающие к субстрату. Были бы полезны термины, обозначающие стороны тела по отношению к субстрату, безотносительно к положению рта. По Валленгрену, почка у Chilodochona образуется на вентральной стороне — на стороне ПВ, отогнутой назад; эта сторона более выпуклая, чем дорзальная. Различаются соответственно вентральная и дорзальная губы ПВ. У Heliochonidae учитывали положение лепестков: сторона с лепестками обозначалась как дорзальная (Плате, Гамбургер, Каль) или как вентральная (Добжанская-Качановская, Валленгрен). Аналогично по отношению к Kentrochona говорят о дорзальных и вентральных шипах (Ромпель, Валленгрен). Лепши (Lep^i, 1926) обозначает дорзальной у Heliochona то сторону с лепестками, то противоположную. У Spirochona gemmipara, по Эйсмонду, при рассматривании особи сбоку одна из сторон тела плоская, другая выпуклая, горбовидная, здесь находится Ма. Цитостом, если смотреть сверху, лежит ближе к выпуклой стороне; эта сторона, следовательно, вентральная, противоположная (без завитка) — дорзальная. Гертвиг за цитостом принял экскреторный канал и не рисует настоящего рта и глотки; соответственно этому сторона с отверстием канала (и с завитком) обозначается им как вентральная, что случайно совпадает со схемой Эйсмонда. Сварчевский следует Гертвигу, также не рисуя рта. Остальные авторы говорят о дорзо-вентральном сплющивании хонотрих, не уточняя положения сторон (Плате, Андре и др.).
Есть, однако, совершенно объективные критерии для различения сторон тела у фаготрофных инфузорий любой формы. Особь нужно ориентировать так, чтобы расположение компонентов предротовой цилиатуры соответствовало правилу стомодексии (стр. 85): рот должен лежать правее особо активных и сложных комплексов, обычно правее метамерной зоны поперечных или диагональных гаплокинет или мембранелл. РПА хонотрих превосходно отвечает правилу стомодексии; вентральная сторона этих форм — та, при рассматривании с которой рот лежит правее серии диагональных гаплокинет — зоны В предротовой цилиатуры (рис. 31, К—М). К субстрату хонотрихи обращены поэтому дорзальной стороной, что вполне логично и соответствует
ориентации тела остальных групп комменсалов. Лепестки, складки, защитные пластинки и завитки образуются, как теперь очевидно, на дорзальной стенке ПВ (эпихоне); вентральная стенка (гипохон) ниже дорзальной и обычно ровная.
Хотя в диагнозах хонотрих иногда указывается как признак «билатеральная симметрия» (Валленгрен), такой симметрии нет. При рассматривании сбоку дорзальная сторона тела обычно выпуклая; гипоколлюм проходит часто только на одной из сторон тела; стебелек и ножка прикреплены под углом к субстрату. Эпихон и гипохон различаются по высоте, форме, цилиатуре. У всех хонотрих глотка отклонена вправо. Билатеральная симметрия у эндогеммин невозможна уже вследствие наличия правосторонней зародышевой сумки. Особо выражена асимметрия ПВ. Ось ПВ обычно отклонена от оси тела (Эйсмонд, Доне, Мор) и не совпадает с осью стебелька (Мор, Валленгрен); ось ПВ образует с субстратом угол порядка 30—45°. Симметрию нарушают также левосторонний завиток эпихона спирохонид и отходящая от левого края ПВ защитная пластинка филлохонид; ось завитка отклонена влево, не совпадает с осями ПВ и тела. Рот хонотрих несколько сдвинут вправо. РПА несимметричен: кинеты эпихона (зона В) идут косо, под углом около 45° к оси тела. Лепестки ПВ у лобохон часто неравны — сильнее развит левый. Вероятно, именно эта тенденция привела к аллометрическому росту левого лепестка и превращению его в завиток у Spirochona. Складки и карманы эпихона эндогеммин сильнее развиты обычно также на левой половине ПВ; здесь соответственно удлинены и кинеты горизонтальной полосы (зоны А). Ножка или стебелек прикреплены к субстрату всегда под углом; кроме того, ось тела наклонена к оси стебелька (на 30° у хилодохон по Гийше, на 45° у спи-рохон по Сварчевскому, на 60—70° у трихохон по Мору). Тело трофонта, таким образом, лежит под углом к субстрату, по Ромпелю — даже параллельно субстрату (Kentrochona); у Сетобионтов (Heterochona, Lobochona, Isochona) ПВ направлена к вершине щетинки. У Chilodochona не совпадают оси стебелька, тела и ПВ, у Spirochona не совпадает и четвертая ось — завитка ПВ, отклоненного влево; кроме того, при рассматривании особи сбоку завиток резко наклонен на вентральную сторону тела, к гипохону, — это уже пятая ось, исключающая билатеральную симметрию.
ЦИТОПЛАЗМА, СОКРАТИТЕЛЬНЫЕ ВАКУОЛИ
Ряд авторов говорит о четком разграничении экю- и эндоплазмы у хонотрих. Так, по Валленгрену, Heliochona имеет эктоплазму и зернистую эндоплазму; слабее различимы эти зоны, по Дофлейну, у Kentrochona nebaliae, где эндоплазма альвеолярная, особенно на гематоксилиновых препаратах. Ромпель изображает у кентрохоны четкую гомогенную эктоплазму и зернистую «внутреннюю протоплазму». По Эйс-монду, цитоплазма Spirochona gemmipara кажется бесцветной гомогенной прозрачной массой; только окраска кармином выявляет мелкоячеистую структуру периферического слоя и грубоячеистую — внутренней массы. Дофлейн (Doflein, 1900) рисует у спирохон мелкоячеистую цитоплазму по периферии и крупноячеистую в центре, указывая, что S. gemmipara — хороший объект для изучения альвеолярной структуры цитоплазмы. Наконец, Каль говорит о «прочной эктоплазме», «эктоплазменной воронке» и о «плазматических шипах» у хонотрих, явно имея в виду кутикулу. Чаще встречаются указания на отсутствие такой дифференцировки. Валленгрен не обнаружил ее у хилодохон, Мор и Мацудо — у трихохон, гетерохон, спирохон и энофора-хон; отмечается лишь, что вся цитоплазма мелкозернистая.
Мы не нашли альвеол и четкой эктоплазмы на окрашенных препаратах большинства хонотрих; ее нет, вероятно, вследствие развития кутикулярного панциря и отсутствия трихоцист. Вместо обычной у инфузорий дифференцировки на экто- и эндоплазму мы находим у хонотрих горизонтальную стратификацию — три четких пояса, обозначаемые далее как гелео-, трофо- и склероплазма (рис. 14, К). Первый пояс — это светлая однородная и, видимо, густая цитоплазма на уровне Ма и выше, в шейке и ПВ; здесь нет пищевых вакуолей, но могут быть сферулы липидов и гранулы ва-куома. В толстых стенках ПВ кентрохон и хилодохон находили даже сократительные вакуоли (Ромпель) и пищевые включения (Валленгрен), но это уже ошибка. Трофо-плазма начинается обычно от нижнего конца Ма и доходит до задней четверти тела; это зона пищевых включений. Нижний отдел, склероплазма, вновь лишен пищевых вакуолей, но неоднороден: здесь размещается секреторный комплекс — ампулы и отходящие от них радиальные фибриллы. С особой четкостью зоны разграничиваются при окраске спирохон in vivo нейтральротом; при этом выявляются редкие гранулы вакуома и вакуоли в трофоплазме.
Такую стратификацию можно видеть на рисунках некоторых авторов (Гертвиг, Валленгрен, Дофлейн и др.); по Эйсмонду, пищевые вакуоли занимают определенное место в «саркоде тела» Спирохон. Гийше рисует рассеянные по всему телу пищевые вакуоли у гелиохон, но на ее снимках хилодохон все трофонты имеют четкий темный пояс (зону трофоплазмы), пересекающий клетку. На рисунке среза трофонта хило-дохоны у Гийше трофоплазма не доходит до кутикулы. По нашим наблюдениям, по
4 Заказ 213
периферии тела хонотрих пищевых вакуолей мало, по четкой эктоплазмы нет. В зоне склероплазмы хилодохон на снимках Форе-Фремье различимы бесструктурный матрикс, масса белковых гранул, опорные радиальные палочки эндостила и группа ампул. Склероплазма хонотрих настолько четко отграничена от трофоплазмы, что мы можем допустить существование пограничной системы фибрилл, препятствующей входу в склероплазму пищевых вакуолей. Склероплазма имеет очень сильное светопреломление, вероятно плотная. Граница между трофо- и гелеоплазмой менее четкая. Нижний конец глотки располагается у нижнего конца Ма; здесь образуются пищевые вакуоли. Часть их смещается затем несколько выше, но очень редко вакуоли располагаются выше Ма. Вероятно, и гелеоплазма очень плотная: здесь нет заметного циклоза.
Относительная величина трех поясов зависит от облика особи, варьирует в зависимости от пропорций тела, шейки и ПВ. Склероплазма относительно невелика у примитивных бутылковидных форм (лобохон, изохон). Если образуется псевдостил, удлиняется именно зона склероплазмы, хотя в верхней части псевдостила можно видеть иногда пищевые вакуоли. У хилодохон эта зона занимает 1/3—1/4 длины тела, у вазихон — 1/8. Протяженность зоны гелеоплазмы также определяется формой тела: она относительно невелика у бутылковидных форм и увеличивается при удлинении шейки, удлинении передней части тела особи между Ма и шейкой и при резком утолщении стенок ПВ. У высших хонотрих трофоплазма занимает лишь незначительную часть общей цитоплазмы особи; обычное соотношение гелео-, трофо- и склероплазмы —' около 5:9:2, у форм с удлиненной шейкой и псевдостилом (типа Heterochona exi-lis) 5 : 3,5 : 6.
Пигментные включения — вероятно, заглоченный пигмент хозяина — найдены у клематохон и у хилодохон с чилийских крабов (Mohr a. Matsudo, 1970). Гранулы вакуома, по нашим наблюдениям на Spirochona и Cavichona, немногочисленны, концентрируются в трофоплазме и нижней части гелеоплазмы, сохраняются и у томитов. У хонотрих нет трихитов, трихоцист, минеральных конкреций, кристаллов и сферических литосом; по клетке рассеяны часто, особенно у спирохон и крассихон, светопреломляющие сферулы, возможно липиды. Эйсмонд обнаружил у спирохон буроватые тельца — вероятно, «продукты метаболизма». Аморфные включения подобного рода мы постоянно отмечали лишь у петергофских спирохонид. Электронно-микроскопические исследования (Matsudo, 1966, 1967а, 1967b) выявили в клетке Lobochona prorates обычный комплекс ультраструктур — митохондрии, эргастоплазму (эндоплаз-менный ретикулюм), рибосомы, аппарат Гольджи. Частично эти структуры видны на немногих опубликованных пока снимках хонотрих (Faure-Fremiet a. oth., 1956; Matsudo, 1966). По Мацудо, митохондрии лобохоны многочисленны, имеют овальную или удлиненную форму, ограничены двумя мембранами. Кристы обильны — это микротубулы, образованные впячиванием внутренней мембраны. При почковании томита старые митохондрии дегенерируют, происходит новообразование органоидов. В склероплазме хилодохон, по Форе-Фремье, обильны особые гранулы, связанные с ампулами (гетеросомы?).
Данные по сократительным вакуолям (СВ) хонотрих крайне противоречивы. По Штейну (Stein, 1852), Spirochona имеет СВ у конца глотки, ниже Ма; она пульсирует «только в длительных интервалах» (Stein, 1854 : 207). В диагнозе Spirochona Андре указывает как признак «наличие СВ вблизи глотки». Пенар находит у трофон-тов спирохоны две СВ, основную и придаточную; томиты имеют 3—4 СВ, но только одна из них более активна, чем другие. СВ нарисована Бюйсаном у спирохоны, но этот рисунок фантастичен. Остальные авторы не нашли СВ у спирохон. Бючли изучал СВ перитрих и сукторий с Gammarus, но не отметил ее у трофотомонта и томита спирохон. По Гертвигу, в цитоплазме спирохон много водянистых и пищевых вакуолей, но нет СВ. Эйсмонд отметил среди массы водянистых вакуолей молодого трофонта спирохоны одну непульсирующую вакуоль, медленно изменявшую свою форму; это, конечно, не СВ. Столь же противоречивы данные по Heliochonidae. По Рентшу, у солоноватоводной Heterochona scheutenii имеется вакуоль, «медленно пульсирующая, с большими интервалами». Слабо и очень нерегулярно функционирующая СВ найдена Добжанской-Качановской у того же вида в районе Ма вблизи глотки. У Н. coronata Кент (Kent, 1881) изображает СВ близ нижнего конца глотки, как и у перитрих; однако она пририсована им, поскольку Кент был уверен, что спирохона — это пери-триха. В диагнозе отряда Каль, а вслед за ним Кудо и Холл, явно следуя Кенту, пишут о наличии СВ, опорожняющейся в глотку (нечто подобное изображено Калем у спирохоны); это якобы конвергенция с Peritricha. В то же время, однако, Каль находит странным, что СВ имеется у морского вида. Ромпель изображает 6 СВ в утолщенной стенке Kentrochona (иногда их 4 или 5); сокращение их не наблюдалось. У томита эти СВ лежат вдоль оси тела. Дофлейн признал такие «несократимые СВ» артефактом: у мертвых инфузорий вакуолизуется вся цитоплазма. По Дофлейну, сомнительно наличие СВ и у спирохон. Валленгрен не нашел ее у Chilodochona. По Гийше, у томитов Ch. carcini функционируют 2—3 СВ. Мор и Мацудо не нашли подобной структуры у изученных ими видов гетерохон, лобохон, энофорахон, трихохон, спи-
рохон и др., причем Heterochona psychra собиралась и в морских, и в пресных водах. СВ не наблюдалась нами у морских и пресноводных хонотрих.
Остается заключить, что у хонотрих нет активно пульсирующей СВ обычного типа; либо имеется медленно пульсирующая СВ близ Ма, либо этой вакуоли вообще нет. Мор и Мацудо (Mohr a. Matsudo, 1970) находят возможным, что при отсутствии СВ частью системы водного баланса у хонотрих становятся ряды пелликулярных пор (псевдокинеты); эти ряды — це дыхательная система, поскольку здесь нет агрегации митохондрий. Однако наличие таких псевдокинет — не исключительная особенность хонотрих: они найдены и у форм, имеющих типичные СВ (у перитрих, энтодиниоморф, сукторий, Didinium). Нельзя забывать, что почти все роды хонотрих, включая многих спирохон, обитают в море, где и возник этот отряд; пресноводные формы могли попросту не выработать новую органеллу — СВ. Важно и то, что хонотрихи имеют прочный панцирь, ограничивающий водообмен.
ПРИКРЕПЛЕНИЕ К СУБСТРАТУ
Все хонотрихи прочно прикреплены к покровам хозяина. Описания прикрепительного аппарата противоречивы: в диагнозах отряда можно прочесть, что особи прикреплены задней частью тела (Андре), нижней частью или коротким стебельком (Иировец), ножкой (Раабе), подошвой (Стрелков), несократимым коротким или длинным стебельком (Валленгрен, Гийше), эндоплазменным стебельком (Добжанская-Качановская), прикрепительным диском или коротким стебельком (Гамбургер, Холл), маленькой базальной корзинкой или удлиненным стебельком (Форе-Фремье), сократимым стебельком (Лешли).
Мор и Мацудо (Mohr a. Matsudo, 1970) различают у хонотрих 4 типа прикрепительных структур: простой прикрепительный диск (Heliochona, Spirochona), широкая ножка (Lobochona, Oenophorachona), короткий, сужающийся кверху стебелек (Kentrochona — по описанию Дофлейна) или однородный длинный цилиндрический стебелек (Eleutherochona, Chilodochona) (рис. 15, 16). Ножка, по Мору, это диск, в отличие от спирохон поднятый над субстратом и не прилегающий к нему. Диск гелиохон иногда называют «рудиментарным стебельком» (Валленгрен, Гамбургер). Mop (Mohr, 1948) считал вначале простые прикрепительные диски гелиохон и спирохон примитивными структурами, а длинные стебельки трихохон и хилодохон их производными. Позднее Mop (Mohr a. Matsudo, 1970) отмечает, что, судя по гомологии стебелька хилодохон и прикрепительной нити дистериид (по данным Форе-Фремье), стебелек у хонотрих — более примитивная структура, чем широкий исчерченный диск. Об этом, по Мору, говорит и тот факт, что среди современных хонотрих распространен длинный стебелек (у форм с декапод, мизид, филлокарид, копепод, водорослей, с большинства амфипод — амфитоид, циамид, фотид), диск же встречается редко, только у форм с гаммарид, а ножка — у форм с лимнорий. Такой путь рассуждения нелогичен; например, в отряде перитрих обычны стебельчатые формы, а группа произошла от бесстебель-чатых гемиспейрид. Все примитивные хонотрихи лишены стебелька. Мы различаем у хонотрих лишь два типа структур — ножку и стебелек; простого диска не существует, кентрохона же имеет типичную ножку. Ножка и стебелек сходны по структуре и различаются своей высотой: высота ножки примерно равна ширине (Lobochona) игл ненамного меньше (Spirochona) или больше ее (Toxochona)-, длина стебелька более чем вдвое больше его ширины. Ножки служат только для прикрепления, стебелек — для поднятия рта над субстратом. В разных группах хонотрих можно видеть постепенный переход от ножки к стебельку; так, у лобохон ножка низкая, у изохон более высокая, а у трихохон это уже стебелек различной длины у разных видов.
Стебельчатые формы вовсе не так широко распространены, как считает Мор. Ножки имеют все роды и виды четырех из шести семейств экзогеммин (Filichonidae, Phyllo-chonidae, Heliochonidae и Spirochonidae) и большинство родов Lobochonidae', среди эндо-геммин ножки имеют все формы двух семейств (Actinichonidae и Inver sochonidae) п по одному роду в остальных семействах (Isochona среди Isochonidae, Ctenochona среди Stylochonidae, Coronochona среди Echinichonidae).
Наиболее детально изучена ножка у лобохон. Lobochona limnoriae, по Донсу, лишена стебелька и прикрепляется мелким «базальным узелком». По Мору и Мацудо, прикрепительный диск такого рода свойствен только лобохонам, не отмечается у других хонотрих и служит четким признаком рода. От светлой ампулы, ограниченной мембраной, отходит тонкий, очевидно гибкий стебелек с основанием в центре чаши прикрепительного диска, прилегающего к субстрату. Чаша диска облегает основание тела.
. Мы различаем в ножке лобохон не один, а два диска — опорный (у основания тела) и базальный, или подошвенный (собственно прикрепительный диск, распластанный по субстрату); диски эти не параллельны, лежат под углом друг к другу, между ними находится аморфная масса. Именно последний компонент и удлинен у ряда других хонотрих, образуя более высокую ножку (Oenophorachona) или стебе
лек. Иногда виден и стебелечек между верхним (опорным) диском и основанием тела, как в схеме Мора. Внутриклеточную часть ножки (между опорным диском и ампулой), остающуюся при отрыве трофонта на ножке, мы обозначаем термином «эндостил»;
Рис. 15. Прикрепительные органеллы. А—Г — стебелек Oxychona multi-fida; Д, Е — три типа стебельков хонотрих; Ж—О — псевдостил у Spirochona gemmipara (Ж), S. marina (3, И), Cavichona laticollis (К—H) и С. cincinnata (О); П — псевдостил Toxochona mirabilis; Р — подошва Filichona paradoxa.
он состоит примерно из 16 продольных септ и внутреннего канала. По Мору и Мацудо, у изученных ими родов пелликула тела имеет континиум с прикрепительной органеллой; так, у Heterochona psychra пелликула, толщиной 0.5 мк в передней половине тела, постепенно, к основанию тела, утолщается, достигая 1.5 мк, и продолжается
в прикрепительный диск, вероятно составляя его кортекс. Неясно в таком случае, почему так легко отделяется ножка или стебелек при отрыве трофонтов.
Данные по спирохоиам, как отмечалось, очень противоречивы. По Штейну (Stein, 1852), Spirochona прикрепляется очень коротким, почти неразвитым стебельком, либо «непосредственно расширенным нижним концом, или особым, очень коротким стебелечком» (Stein, 1854 : 207). По Фроментелю, особи прикреплены округлой, очень короткой ножкой. По Гертвигу, спирохона не имеет стебелька и прикрепляется с помощью «присосковидной модификации нижней части тела»; кутикула здесь утолщена, образует диск с 16 радиальными палочками. Кент явно следует Гертвигу: особь, по его данным, прикреплена «присасывательным диском», «округлым, радиально исчерченным диском», «модификацией нижнего конца тела, наподобие ацетабулюма» (присоски трематод). По Плате, у спирохон имеется базальная пластинка с радиально исчерченной верхней частью; Бючли сравнивает ее с диском триходин. Широкий исчерченный диск находят у спирохон Форе-Фремье (Faure-Fremiet, 1910) и Пенар, также сравнивающий его с присоской триходин. По Калю, «скопула» спирохон напоминает скорее скопулу Вортицелид, также имеющую радиальные палочки (вероятно, имеются в виду фибриллы и складки пелликулы, расходящиеся вверх от скопулы). По Эйсмонду, утолщенная кутикула спирохоны образует чашечку с волнистым краем и 12 короткими широкими радиальными ребрами на вогнутой (внутренней) поверхности; Гийше говорит о чашечке, напоминающей присоску.
Ряд байкальских спирохонид имеет, по Сварчевскому, простой, радиально исчерченный диск; при его удлинении образуется подобие стебелька с широкой подошвой; у Cavichona elegantula стебелек имеет вид ножки величиной 5—6Х 10 мк, у Spirochona simplex — 4.5X12 мк, у S. globulus—5—7X12 мк. Стебелек у байкальских спирохон обычно узкий сверху, плавно расширяется книзу, переходя в подошву; дисков нет. Такая структура свойственна и Serpentichona. В диагнозе рода Spirochona у Сварчевского (19286) приведен ошибочный признак: «тело с мелким прикрепительным диском или коротким стебельком». Гаевская (1933) изображает крупные диски у мелких спирохон и мелкие у крупных, что также неправильно: внеклеточная структура не может уменьшаться при росте особи. Воспроизводя рисунки спирохон ранних авторов (Штейна, Гертвига), авторы часто видоизменяют по своему усмотрению прикрепительный аппарат спирохоны (рис. 100, 101), иногда рисуя даже длинный игольчатый, сужающийся книзу (I) стебелек (Jahn a. Jahn, 1949); нередки «гибридные» рисунки, когда одна половина особи изображена из одного источника, вторая — из другого (Raabe, 1964с; Corliss, 1956, 1959, 1961; Lep?i, 1965; Mackinnon a. Hawes, 1961, и др.). У S. halophila найден диск такого типа, как у Heliochona (Matsudo a. Mohr, 1968). Иногда указывается, что специальных прикрепительных органелл у спирохон вообще нет. По Кайзеру (Keiser, 1921 : 228), у спирохон «веретеновидное тело на своем нижнем конце тупое, прикреплено к субстрату без образования стебелька»; это якобы адаптация к условиям жизни на хозяине. По Андре (Andre, 1912 : 148), тело спирохонид «бесстебельчатое, прикреплено. . . поверхностью трубчатой задней части тела, представляющей собой прикрепительный диск с короткими продольными палочками». На рисунках спирохон у Бальбиани, Бючли и Бюйсана нет никаких прикрепительных органелл.
Как ни удивительно, но, несмотря на такие разногласия в литературе, у всех осмотренных нами морских и пресноводных спирохонид найдены одинаковые ножки — такого типа, как у лобохон, но с более широким опорным диском; стебелек же не обнаружен. Эндостил и здесь — внеклеточная структура: хотя он лежит в особой выемке заднего конца тела, ведущей к ампуле, он остается всегда с ножкой при отрыве трофонта. Эндостил придает диску радиальную исчерченйость, обычно отмечаемую авторами; при рассматривании сбоку исчерченность продольная, вызвана септами. Сам диск ровный, не исчерчен. По форме диска, розетки и по числу септ виды спирохон, кавихон и серпентихон сходны. Изменчивы лишь размеры этих структур: диск особенно велик у серпентихон и у части кавихон, подошва — у Spirochona simplex. Септ обычно 16, с вариациями в пределах 12—22 внутри популяций; иногда видны короткие V-образные двойные септы. В одном случае у Cavichona cincinnata найден аномальный опорный диск с двумя розетками. Между опорным и базальным дисками ножки спирохон лежит плотная аморфная масса, заметная при виде сбоку.
Если ножку не замечали у спирохон либо описывали ее как диск, то тем более могли не найти ее у Heliochona. Только Валленгрен рисует диск (не ножку!) у Н. sessilis. По Плате, Гийше и Фенхелю, особи прикреплены резко расширенной задней частью тела. По Мору и Мацудо, спирохоны и гелиохоны имеют совершенно идентичные диски. Мы нашли у видов гелиохон такую же ножку, как у спирохон, но больших размеров; высота ножки значительно меньше ширины. Heterochona имеет ножку в точности такого же типа, как Lobochona; однако и у этого рода ножку не заметил ряд авторов (Бэйт и Вествуд, Кент и др.). По Кенту, Heterochona scheutenii прикреплена, вероятно, как и спирохона, присосковидным расширением заднего конца тела, а не короткой ножкой. Штейн рисует у этого вида короткий цилиндрический стебе
лечек, как и на его рисунках у спирохоны; Рентш говорит о «дисковидной или чашевидной ножке с многочисленными палочками» (изображен лишь диск). Широкий диск рисуют Мацудо и Мор у Н. psychra, Добжанская-Качаповская у Н. scheutenii. Явно ошибочен рисунок Фенхеля, показывающий очень широкий диск (шире тела!) с внутренним каналом. Наконец, Валленгрен рисует у большинства особей Н. scheutenii только диск, но на одном рисунке показывает и значительный слой между диском и субстратом — типичную ножку. Именно такую ножку мы обнаружили у осмотренных нами гетерохон (рис. 16, А—Д'); опорный диск крупный, изогнутый, особо велик у базального вида Н. psychra, наиболее мелкий у Heterochona sp. с дальневосточных Anisogammarus. Типичную ножку имеют и особи Н. coronata, которым Кент ошибочно пририсовал удлиненные игольчатые стебельки.
Рис. 16. Прикрепительные органеллы и ампулы. А—Д — виды Heterochona', Е — Chilodochona', Ж — Lobochona', 3 — Armichona; И — Cristi-chona; К — Oenophorachona; Л — Crassichona; M — Armichona; H, О — сходство стебелька сукторий и хонотрих.
Ножки обычного типа мы нашли также у других бесстебельчатых экзо- и эндогеммин (филлохон, аурихон, филихон, актинихонид, инверсохонид и др.). Ножки очень высоки у лобохонид Oenophorachona Т£ Toxochona и у эндогеммины Isochona, но это еще не стебелек; поверхность их неровная, с натеками. По нашим данным, ножку имеет и Kentrochona, которой приписывали ранее необычный прикрепительный комплекс. Ромпель принял ножку и ампулы К. nebaliae за «побочные ядра»; Дофлейн изображает короткий стебелек, погруженный в глубокую воронку в нижней части тела. У Kentrochonopsls им показаны и стебельки и ножки неясного строения; это, однако, также бесстебельчатый вид с типичной ножкой. За «внутренний стебелек» этих форм Дофлейн принял пластинки эндостила.
Стебельки имеются у хилодохонид, у лобохониды Eleutherochona и у большинства родов трех из пяти семейств эндогеммин (у изохонид, стилохонид и эхинихонид). Длина стебелька у экзогеммин обычно примерно равна длине тела (40—55 мк у элейтерохон, 80—130 мк у хилодохонид). Стебелек трихохон значительно короче тела (15 мк у Trt-chochona surgens, цр 50 мк у Т. lecythoides), длина его не превышает длину тела у цето-хон (циамихон). Стебельки относительно невелики у эхинихонид, но у крупной Echi-nichona они больше (35—40 мк), чем у мелкой Eurychona (18—24 мк). Длина стебелька у стилохонид варьирует от 7—15 мк у мелких форм типа Stylochona и Spinichona до 300—650 мк у Oxychona, однако нет прямой зависимости длины стебелька от размеров тела. В целом длина стебелька у стилохонид — и родовой, и видовой признак. Максимальная длина отмечена нами у О. suprema (622 мк) и О. multifida (648 мк); томиты этих видов прежде всего образуют дл инный стебелек и лишь затем принимают облик трофонтов. Можно проследить процесс удлинения стебелька у разных видов
одного рода; так, стебелек короткий у Chilodochona carcini, длиннее тела у Ch. aranei п особенно длинный у Ch. palinuri.
В отличие от стебельков перитрих и сукторий, образующих чаши, раковинки, диски ит. д., стебельки хонотрих в целом однотипны — это тонкие органеллы равномерной толщины, с округлым сечением (рис. 15, А—Е); они состоят, как и ножки, из трех отделов — опорного диска у основания тела, базального диска на субстрате и плотного стержня между ними (собственно стебелька); диски не параллельны, лежат под углом друг к другу. Поверхность стебелька ровная у экзогеммин (кроме токсо-хон), обычно складчатая у эндогеммин; вероятно, стебелек секретируется наплывами, как и ножка. Наличие складок — не признак несовершенства секреторного аппарата хонотрих: гофрированная поверхность прочнее ровной. По внутренней структуре в световом микроскопе можно различить стебельки трех типов: гомогенный, с внутренним каналом по всей длине или с каналом только в верхней части. Структурные типы стебельков не связаны с их длиной: независимо от длины у экзогеммин стебельки всегда без каналов, а у эндогеммин обычно с каналом. Канал в стебельке перитрих известен только у сократимых форм с мионемой; у хонотрих же он не связан с сократимостью. Осевой стержень стебелька, ограничивающий канал, обозначается далее как «стилонема». Стебелек хонотрих эластичен, может изгибаться и скручиваться без разрыва.
У Eleutherochona Доне (Dons, 1948) различает внутриклеточную часть прикрепительного аппарата — «шарнир», высотой 6—7 мк, и собственно стебелек, длиной 40—55 мк; оба отдела продольно исчерчены. Такого «шарнира», по Донсу, якобы нет у форм с Crustacea. Он связан, как считает Доне, с «эпифитным» образом жизни элей-терохоны, обеспечивая подвижность особи: она может отклоняться в разные стороны от вершины стебелька и поэтому быстро и легко приспосабливаться к меняющимся токам воды в среде. Мор допускал возможность такого отклонения у Trichochona, не зная еще о работе Донса. В действительности «шарнир» — это всего лишь эндостил, имеющийся у всех хонотрих, независимо от типа прикрепительного аппарата; он обеспечивает жесткое соединение трофонта со стебельком или ножкой. У Т. lecythoides, по Мору (Mohr, 1948), пелликула, толщиной 0.4—0.5 мк почти по всему телу, достигает 1 мк толщины непосредственно над стебельком и вновь утоньшается, входя в стебелек и образуя его кортекс. От плотного сидерофильного кольца диаметром 5 мк в верхней части стебелька в глубь тела идет мешковидная ампула величиной 7—21Х Х2—3.5 мк, с тонкой мембраной и светлым содержимым. Внизу, у стебелька, на этой мембране лежат 10 светлых и 10 темных полосок, входящих в стебелек и образующих его средний слой; содержимое ампулы также продолжается в стебелек. Кольцо обеспечивает возможность отклонения тела; весь комплекс в целом позволяет особи, по Мору, отклоняться на 90°. К щетинке стебелек прикреплен цементирующим веществом, растекающимся в зоне диаметром 10—14 мк. У Т. surgens, судя по нашим препаратам, стебелек относительно короткий, гофрированный, с каналом и стилонемой; четкий опорный диск на 90° отклонен от базального диска. Сходно строение ножки у видов Isochona.
Хорошо изучен стебелек Chilodochona. По Валленгрену, стебелек Ch. qvennerstedti выделяется в цитоплазме группой параллельных фибрилл, красящихся гематоксилином и нерастворимых, как и стебелек, в слабых кислотах и щелочах. Опорный диск — это якобы открытая снизу воронка диаметром 7 мк, в которую снизу входит стебелек; она служит для рассеяния тока воды, который, будучи направлен снизу из жаберной полости, может оторвать особь от стебелька.
По Гийше, стебелек у Ch. carcini прочный, широкий, с крупным опорным диском; внутриклеточная его часть несет группу прочных радиальных опорных палочек; и стебелек, и диск продольно исчерчены. Стебельки анизотропны, имеют положительное двойное лучепреломление, что говорит, по мнению Гийше, о наличии определенной продольной внутренней структуры; сильное светопреломление свидетельствует о большой концентрации вещества и прочности органеллы. Стебельки интенсивно красятся обычными методами (гематоксилин, анилинблау, борный кармин, смесь Маллори), слабо красятся in vivo конгоротом; исключительно интенсивна реакция на белок — бромфеноловым синим красятся стебелек, внутренние палочки и диск. Ранее отмечалось, что ножка или стебелек хонотрих красятся гематоксилином (Дофлейн, Валленгрен) или эозином в смеси гематоксилин-эозин (Доне). Дофлейн (Doflein, 1900) красил ножку спирохоны «всеми имевшимися хроматиновыми красителями». Реакция стебелька хилодохон на полисахариды отрицательна (Форе-Фремье).
Электронно-микроскопическое исследование (Faure-Fremiet a. oth., 1956) показывает у Ch. carcini правильное чередование фибрилл стебелька (рис. 17, А, Б, Г, Д)\ на срезах видно несколько сотен фибрилл диаметром 60—100 ммк, без внутренних субфибрилл, с шестигранным сечением. Смежные фибриллы соединены тонкими пластинками (септами), идущими продольно; это, возможно, нити, образованные коагуляцией интерстициального вещества. Весь пучок фибрилл окружен тонким кортек-сом, возможно образованным слиянием периферических фибрилл; по периферии рас-
Рис. 17. Прикрепительные органеллы. А, Б — срезы ампул и стебелька Chilodochona carcini (по: Faure-Fremiet a. oth., 1956); В — секреторная «железа» и коллекторные ампулы у Hartmannula oliva (по Форе-Фремье); Г — эннеанемы у Opercularia (по Форе-Фремье); Д — септы стебелька хилодохон; Е — секреторный отдел и стебелек хилодохон, схема.
положены протоплазматический слой и кутикула. На поперечном срезе стебелек хилодохон не напоминает таковой перитрих; так, например, у Opercularia в плотном матриксе, секретируемом поверхностью скопулы вне кипетосом, проходят канальцы, ограниченные со всех сторон продольной энпеанемой — пучком из 9 склеропротеиновых фибрилл (рис. 17, Г). Эпнеапема — это продолжение 9 периферических фибрилл кипетосом (центральных фибрилл в кииетосоме нет). Примитивные перитрихи (Scyphidia) прикрепляются секрецией резко расширенной скопулы, в которой проходят видоизмененные реснички, превратившиеся в эпиеанемы. В этом отношении стебелек хонотрих и перитрих не гомологичен: он секретируется у первых некинето-сомной ампулой, а у вторых — кинетосомной скопулой. Шестигранные фибриллы на срезах стебелька хонотрих (рис. 17, Д) напоминают вместе с тем шестигранники со светлыми альвеолами по краям на срезах раковинки сукторий Paracineta и Meta-cineta (Батисс), секретируемой у них не скопулой, а поверхностью тела. И все же поразительное конвергентное внешнее сходство стебелька хонотрих и некоторых сукторий (рис. 16, Н, О) говорит о возможности сходного пути их образования — с участием кинетосом.
От нижнего конца ресничного желобка томитов в глубь тела отходит группа ампул. В литературе они отмечались редко (Гертвиг, Дофлейн). Дофлейн не рисует их у томитов Kentrochona п изображает у Kentrochonopsis как некую «загадочную структуру» — либо фрагменты Ма после конъюгации, либо аппарат, имеющий отношение к стебельку. Лишь на одном рисунке у Дофлейна видны типичные радиальные ампулы, отходящие от светлого диска. Остальные авторы не изображают ампулу или рисуют ее схематически (Валленгрен, Пенар, Добжанская-Качановская и др.). Ампула и скопула томитов, однако, четко видны прижизненно и на препаратах, занимают значительную часть тела. У Spirochona gemmipara они многочисленны (вероятно, по числу септ эндостила), интенсивно красятся в оранжевый цвет нейтральротом (pH нейтральная), активно красятся на белок бромфеноловым синим, на обычных препаратах — гематоксилином Бемера. Ампулы крупные, мешковидные или удлиненно-овальные, грубозернистые. В литературе еще не отмечалось, что томит и даже протомит имеют уже готовую розетку эндостила. Прикрепительный комплекс однотипен у томитов всех осмотренных нами хонотрих, изменчива лишь величина ампул.
- У трофонтов, напротив, ампулы разнообразны. Впервые ампулу изображает Рентш у Heterochona scheutenii, приняв ее за нижний отдел «спирального кишечника». Ромпель считает ее добавочным ядром у Kentrochona, Дофлейн — воронкой стебелька кентрохон. Ампула схематично показана у видов Heterochona Добжанской-Качанов-ской, Фенхелем, Мацудо и Мором, более правильно — Валленгреном. Никем не найдены пока ампулы у Heliochona и у Spirochonidae, хотя это хорошо изученные формы. Гийше рисует, правда, радиальные полоски, отходящие от основания тела Heliochona (как и у томитов; см. рис. 19, В), но таких структур у гелиохон нет. Мацудо и Мор находят ампулу у видов Trichochona, Lobochona, Heterochona и Oenophorachona', многочисленные (около 25) четкие ампулы найдены у Chilodochona carcini (Гийше, Форе-Фремье).
Мы обнаружили ампулы у большинства, но не у всех хонотрих; их нет у трофонтов Spirochonidae, вероятно у видов Heliochona, т. е. у части планибионтов, лишенных стебелька. Насколько сходны форма и число ампул у томитов хонотрих, настолько же поразительно их многообразие у трофонтов. После оседания томитов ампулы теряют четкий контур и дедифференцируются у всех родов, кроме хилодохонид; как правило, они заменяются одной крупной ампулой, но у Chilodochonidae ни дедифференцировки, ни замены ампул нет; они сохраняются в процессе метаморфоза томита без изменений, что мы считаем педоморфным признаком хилодохон. У спирохонид и гелиохон происходит нормальная дедифференцировка ампул томита без их замены, можпо-различить лишь эндостил и отходящие от него неясные радиальные фибриллы (рис. 15, 3—Н). В типичной для хонотрих ампуле (рис. 16, Д) различимы толстые стенки и внутренняя полость, выводной проток которой проходит внутри эндостила; на уровне эндостила лежит особо плотная, гомогенная склероплазма, отграниченная от остальной зоны (на уровне ампулы и выше, до границы с трофоплазмой) либо слабозаметной линией — фибриллами или мембранами, либо прочными кутикулярными пластинками, обозначаемыми ниже как опорные пластинки. Эти пластинки различимы только у части эндогеммин, они образуют внутренний скелет особи в зоне секреторного комплекса. Несомненно, это дериваты кутикулы. У разных родов и видов-внутри рода варьируют величина и форма эндостила, длина и толщина отходящих от него пучков фибрилл, величина и облик ампул, степень развития опорного диска и опорных пластинок (рис. 16, А—М). Так, ампула очень мелка у Heterochona psychra (3 мк длиной), крупнее у Н. trifaria (11—12 мк) и Н. coronata (8—17 мк) и достигает особого развития у формы с псевдостилом — Н. exilis (до 51 мк); у видов Oenophorachona длина ампулы варьирует от 3—4.5 мк у Ое. ectenolaemus до 12 мк у Ое. игсео-lata и до 41 мк у Ое. sagitta, также имеющей длинный псевдостил. Встречаются округлые, овальные, мешковидные и вытянутые ампулы с тупым или заостренным верх
ним концом. Пластинки (септы) эндостила особо изменчивы у эидогеммин — встречаются палочковидные, треугольные, дуговидные септы, расширяющиеся кверху или книзу; они очень мелки у Cristichona и Carinichona, более крупные у Armichona insecta (3—4 и 12—15 мк).
По Форе-Фремье (Faure-Fremiet a. oth., 1956), секреторная ампула у Chilodochona carcini состоит из двух отделов — собственно секреторного и выводного протока. Первый покрыт мембраной толщиной 40—50 ммк с двойным контуром. Цитоплазма вокруг ампулы очень плотная, несет мелкие альвеолы и крупные белковые тела (длиной до 1 мк) с неправильным контуром, состоящие из мелких гранул. Содержимое ампулы — это непрозрачная плотная аморфная масса; такое же вещество видно и в выводном протоке, где оно, вероятно, уплотняется, превращаясь в гомогенную фибриллу толщиной 60—100 ммк. Ампула секретирует мукопротеиды (Faure-Fremiet, 1959). Число ампул Ch. carcini (около 25) не соответствует, однако, числу фибрилл стебелька (несколько сотен; см. рис. 17, А, Б); возможно поэтому, что ампулы сборные, выделяют одновременно по нескольку фибрилл. Реснички или кинетосомы в секреторной зоне не обнаружены. Реакция на белок и полисахариды интенсивна в цитоплазме вокруг ампулы; здесь имеются бесструктурный матрикс, белковые гранулы, опорные палочки эндостила. Ампулы имеют вид удлиненных грушевидных мешочков с плотными стенками, особо толстыми в нижней части. Оболочка и содержимое ампул, но не стебелька, интенсивно красится по Мак-Манусу и Готчкиссу на полисахариды; белок имеется только в оболочке ампулы.
У дистерииды Hartmannula oliva секреторный комплекс состоит из трех отделов (Faure-Fremiet a. oth., 1968): 1) коллекторной ампулы, выводной канал которой продолжается в подите; 2) многочисленных гетерогенных телец, обращенных темной половиной к ампуле; 3) собственно железы, открывающейся тонким длинным каналом в коллекторную ампулу (рис. 17, В). Длина железы 8 мк у Dysteria, 2.2 мк у Hartmannula. Пока неясно, соответствует ли ампула хонотрих железе или (что более вероятно) коллекторному пузырьку дистериид. Процесс секреции стебелька у хонотрих Гийше и Форе-Фремье, а вслед за ними Корлисс, Боррадейл и Мэнвелл гомологизи-руют с таковым у дистериид, но не у перитрих и сукторий, где стебелек выделяется кинетосомами скопулы. Так, по Корлиссу (Corliss, 1961), стебелек у хонотрих образуется точно так же, как у Dysteria-. без скопулы, имеющейся у сукторий, тиг-мотрих и перитрих, и с помощью стилета — секреторной органеллы, не гомологичной скопуле (Corliss, 1959). Однако у томитов всех хонотрих стилета нет, поэтому прикрепительный аппарат хонотрих и их предков не идентичен. Мы считаем, что ножке и стебельку хонотрих соответствует прикрепительная секреция дистериид; стилет у хонотрих превратился в эндостил.
При удлинении нижней части тела у ряда экзогеммин образуется псевдостил, прикрепленный к субстрату типичной ножкой. Кутикула псевдостила утолщена, придает ему особую прочность. Склероплазма, занимающая весь псевдостил у гетерохон или часть его у спирохонид, несет длинные ампулы у первых и короткие радиальные фибриллы у вторых. Как и вся поверхность тела, поверхность псевдостила может нести продольные складки или псевдокинеты. Псевдостил невелик, но отчетлив у Spirochona, удлинен у Cavichona (рис. 15, Ж—О) и достигает особой длины у Serpentichona. Ранее у хонотрих эта органелла не описывалась. Правда, Штейн рисует у спирохон продольную складку в нижней части тела (она ограничивает псевдостил), но считает ее артефактом, вызванным сильным течением, отклоняющим особь к субстрату.
У Filichona (рис. 15, Р) нижняя часть тела расплющена по субстрату, образуя подошву. Типичную подошву имеет Heliochona, менее четкую — многие планибионты, особенно инверсохониды.
Разнообразие способов прикрепления хонотрих к субстрату частично объяснимо различием их локусов, прежде всего принадлежностью комменсалов к группе сето-или планибионтов. Планибионты обычно лишены стебельков, у них нередко развита подошва; отсутствие стебелька обычно компенсируется удлинением шейки, тела или псевдостила. Большинство стебельчатых эидогеммин живет на щетинках. Иногда стебелек развит у планибионтов (4 рода— Eleutherochona, Pterochona, Armichona и Flectichona} и отсутствует у сетобионтов первичнобесстебельчатых родов. Сето-и планибиоз имеют все же решающее значение: так, стебелек развивается в линии Lobochona—Isochona—Trichochona на щетинках плеопод гаммарид и амфитоид и, напротив, утрачивается в линиях Echinichona—Coronochona и Eriochona—Ctenochona при миграции особей со щетинок на ровную поверхность придатков. У последних форм, как и у томитов, ножка сохраняет субтерминальное положение, особь прилегает к субстрату частью дорзальной стороны тела; отсутствие стебелька у них поэтому мы считаем одним из проявлений педоморфоза.
ПРОБЛЕМА СОМАТИЧЕСКОЙ ИНФРАЦИЛИАТУРЫ
Обычно подчеркиваемый в диагнозах Chonotrichida признак «отсутствие соматической цилиатуры» требует оговорки: нет ресничек, но импрегнация выявляет продольные ряды гранул. По Холлу (Hall, 1953 : 412), «поверхность тела у хонотрих обычно лишена респичек», но это неудачная формулировка. Только Корлисс (Corliss, 1961 : 43), вероятно ссылаясь на Гийше, отметил, что у хонотрих «нет соматической цилиатуры, но в течение всего жизненного цикла сохраняется локализованная соматическая инфрацилиатура». Впервые применив к хонотрихам метод Шаттона— Львова, Гийше (Guilcher, 1949, 1950, 1951) выявила у трофонтов Spirochona gemmipara, Heliochona alternans и Chilodochona carcini инфрацилиатуру — мелкие сближенные кинетосомы в продольных рядах на поверхности тела, шейки и ПВ (рис. 18, Д\ 19, В); топография кинет простая, дифференцированных комплексов нет. У томитов хилодохон ряды не найдены, безресничные кинетосомы рассеяны в беспорядке по дорзальной поверхности. После оседания томита начинается реорганизация его кортекса; внезапно появляются (как и в цикле Conidophrys) продольные ряды кинетосом. Поскольку они отмечены у трех форм, относимых к разным семействам, логично ожидать, что их имеют все без исключения хонотрихи. По Добжанской-Качановской, у Heterochona scheutenii «все тело покрыто нежными пелликулярными полосами, сходящимися к основанию воронки. Как их внешний вид, так и роль в морфогенетических процессах Chonotricha показывают, что они не аналогичны кинетам, как это допускает Гийше» (Dobrzanska-Kaczanowska, 1963 : 368). Импрегнация этим автором не применялась, поэтому отрицание ею роли рядов в морфогенезе ни на чем не основано. К тому же эти ряды у Heterochona идут всегда на поверхности ПВ, но не тела; это складки кутикулы. Мор с сотрудниками во всех работах применяли метод импрегнации Бодиана; ими обнаружены ротовые, но не соматические кинеты (Mohr, 1948; Mohr a. oth., 1963а; Matsudo a. Mohr, 1964, 1965; Matsudo, 1966). Протарголь, однако, обычно не выявляет аргиром, импрегнируя реснички, мембранеллы, кинетосомы. Методом Шаттона—Львова у Lobochona prorates и Heterochona psychra позднее были выявлены параллельные продольные ряды аргиросом (Mohr a. Matsudo, 1970).
Методом Кляйна у Cavichona multifida и С. elegans мы выявили ряды телец на теле, шейке и ПВ с более сложной топографией, чем на рисунках Гийше: вентральные ряды параллельны друг другу, дорзальные же несимметричны вследствие наличия цитопрокта у основания шейки. Ряды можно видеть нередко и на фиксированном материале без импрегнации; лучшие объекты — С. laticollis, С. multifida, С. virgata, Cristichona pacifica, С. tesselata, некоторые расы Lobochona limnoriae (рис. 18, 19). У беломорской расы L. limnoriae вместо правильных продольных рядов видны короткие, беспорядочно расположенные фрагменты (рис. 18, Ж; 19, Е). Тельца, составляющие ряды, — мелкие бугорки пелликулы — превращены у ряда эидогеммин в папиллы и даже в короткие шипики (рис. 18, В, Г, 3); это наводит на мысль о том, что и у остальных форм, включая Cavichona, мы видим не кинетосомы, а какие-то импрегни-руемые структуры пелликулы, поразительно точно имитирующие ряды кинетосом (инфракипеты). Такие тельца можно обозначить термином «аргиросомы»: это широкое понятие, обозначающее любую аргентофильную структуру — поры трихоцист, утолщения (папиллы) пелликулы, кинетосомы, поры пелликулы. Термин применяется, когда неясна природа изучаемой структуры. Ряды аргиросом можно обозначать как инфракинеты, если это кинетосомы, и псевдокинеты, если это ряды пелликулярных пор.
Сведений по ультраструктуре пелликулы хонотрих еще нет. Мор и Мацудо (Mohr a. Matsudo, 1970) находят у Lobochona prorates и Heterochona psychra ряды пелликулярных пор; именно последние импрегнируются серебром. В структуре пор нет ничего общего со структурой кинетосом на внутренних стенках ПВ. Снимки пор пока не опубликованы. Инфузории, теряющие соматическую цилиатуру (Didinium, пери-трихи, энтодиниоморфы), часто сохраняют инфрацилиатуру, обычно в виде продольных рядов (Бретшнейдер, Кляйн, Кантор, Вилленев-Брашон, Шаттон, Вольска, Гелей и др.), реже кинетосомы рассеяны в беспорядке. Электронная микроскопия тех же форм показывает, что импрегнируются не кинетосомы, а складки или поры пелликулы (Ягиу, Рот, Шигенака, Брэдбери, Нуаро-Тимоте, Форе-Фремье, Хоббс, Ланг и др.); безресничные кинетосомы сохраняются лишь в некоторых специализированных отделах (тигмотактических зонах, скопулах и т. д.). По Диппел (Dippel, 1962), кинетосомы вообще не импрегнируются серебром, осаждающимся вблизи них на пелликуле. Бретшнейдер, вероятно, прав, говоря не о кинетосомах, а о «точкообразных утолщениях пелликулы», соединенных у офриосколецид фибриллами аргентофильной сети в продольные ряды. Некоторые авторы (Canella, 1957) считают, что в безресничных зонах вообще нет кинетосом, импрегнируются лишь «поры-канальцы»; при размножении особей кинетосомы возникают de novo. Проблема аргиросом решена исследованиями Рудзинской и Батисса (Batisse, 1968, и др.): у сукторий обнаружены и ряды импрегнируемых пелликулярных пор. и кинетосомы, лежащие парами близ канальца каждой поры.
В конце 1940-х годов Гийше несомненно не могла дать иной трактовки обнаруженных ею рядов, так как основывалась на теории инфрацилиатуры, сформулированной в 1930-е годы Шаттопом и Львовым (Chatton a. Lwoff, 1935). Согласно теории
сиР. 18. Пелликула хонотрих. А, В — Cristichona tesselata; В, Г — Armichona gibbosa; Д — Chilodochona carcini (по: Guilcher, 1951); Е, Ж — Lobochona limnoriae; 3 — Cristichona pacifica; И, К — Toxochona mirabilis;
Л — Carinichona globulus.
утверждалось, в частности, что у всех инфузорий, теряющих цилиатуру, в безреснич-ных зонах должна быть сохранена инфрацилиатура — кинетосомы, рассеянные в беспорядке или собранные в ряды. Одно из положений теории — тезис о генетическом континиуме (размножении) кинетосом. Названные авторы разработали свою теорию
на апостоматах, тигмотрихах, перитрихах и сукториях; Гийше отмечает, что ее результаты на хонотрихах полностью подтверждают основные положения теории. Судя по данным Батисса, теория «морфогенетической аргентофильной сети» Кляйна и Раабе, считавших, что кинетосомы возникают de novo из элементов аргентофильной сети, явно неверна. Гипотеза о континиуме верна, но с оговоркой, что импрегнация выявляет в безресничных зонах не кинетосомы, а расположенные над ними пелликулярные
Рис. 19. Пелликула хонотрих. А — Cavichona laticollis', Б — Armichona gibbosa; В — Heliochona alternans (no: Guilcher, 1951); Г — панцирь Dy-steria sp.; Д, E — Lobochona limnoriae из Белого моря; Ж, 3 — Carinichona globulus.
поры. Нужна, правда, и оговорка к тезису о размножении кинетосом: правильнее говорить об индуктивном способе образования новых кинетосом.
Аргиросомы на поверхности тела хонотрих нельзя считать компонентом соматической инфрацилиатуры, поскольку это поры, а не кинетосомы. Вероятно, у хонотрих будут найдены те же ряды, какие обнаружены Рудзинской и Батиссом у сукто-рий: инфрацилиатура у хонотрих сохранена, но кинетосомы глубоко погружены в цитоплазму и не импрегнируютсЯ. Итак, у хонотрих выявляются инфракинеты на внутренних стенках ПВ и псевдокинеты на всей поверхности ПВ и тела; настоящие кинетосомы должны залегать под аргиросомами. Важен и филогенетический аспект про
блемы инфрацилиатуры хонотрих. Продольных соматических псевдокинет нет ни у томитов хонотрих, ни у Hypostomatida, за исключением Trochilioides rigtda с дорзальными рядами протрихоцист; у Dysteria панцирь обычпо несет складки (рис. 19, Г). Система псевдокинет у трофонтов хонотрих, таким образом, является новообразованием, которого не было у предковых форм и соответственно нет у томитов. Поскольку, по Мацудо (Matsudo, 1967а), реснички или кинетосомы принимают участие в секреции стебелька у Lobochona prorates, они могут быть сохранены в зоне ампулы.
ПОКРОВЫ ТЕЛА И ЗАЩИТНЫЙ АППАРАТ
Хонотрихи обитают на наиболее подвижных придатках хозяина (ротовых частях, гнатоподах, плеоподах, торакоподах, антеннах) и на жабрах, омываемых сильным током воды; они должны подвергаться непрерывному механическому воздействию.. На придатках можно нередко видеть стебельки и ножки, оставшиеся при отрыве трофонтов. Для защиты от механических повреждений у хонотрих образуется сложный комплекс структур — локальные утолщения и складки кутикулы, лепестки ПВ, папиллы, шипы; хонотрих вследствие этого можно назвать панцирными инфузориями.
У хонотрих резко утолщена не пелликула, как часто пишут, а эпиплазматиче-ский слой — кутикула; пелликулой же следует обозначать тончайшую непрерывную пленочку, одевающую все тело и реснички. По Форе-Фремье (Faure-Fremiet, 1957, 1959), твердые эпиплазматические покровы некоторых инфузорий образуют панцирь, жесткость которого вызвана содержанием кальция (Coleps) или мукополисахаридов (Dysteria)', поскольку хонотрихи — потомки дистерий, они сохраняют мукополисахаридный панцирь. Кутикула у хонотрих четкая, утолщена во всех участках тела. Штейн сравнивает «мембрану тела» Spirochona с раковинкой 'Vaginicola crystallina и относит спирохон к группе панцирных инфузорий типа Euplotes. По Гертвигу, кутикула спирохоны особо утолщена у основания шейки и в стенках ПВ. По Эйсмонду и Валленгрену, напротив, она более тонкая на стенках ПВ. У Cavichona elegans, по-Сварчевскому, все тело покрыто резко развитым кутикулярным слоем. После гибели особи поэтому 2—3 дня сохраняется нормальная форма тела, затем «перистомальная мембрана» лопается, наружу выливается цитоплазма, кутикула же еще 3—4 суток остается без изменений. Только Плате пишет, что у Heliochona все тело одето тонкой кутикулой, особо нежной в месте прикрепления. Холл (Hall, 1953) изображает у Kentrochona nebaliae раковинку типа Lagenophrys (рис. 21, 3) с подписью: «К. nebaliae,. форма с лорикой» (с раковинкой). Ромпель показал слишком четкую границу экто-и эндоплазмы у кентрохон; Каль рисует контур тела штрихами, границу — жирной линией, поэтому рисунок и производит обманчивое впечатление наличия раковинки. Именно вследствие развития прочной кутикулы у хонотрих нет необходимости в развитии раковинок — в отличие от перитрих, фолликулинид, олиготрих. По Валленгрену, правда, тело хонотрих несократимо или слабо сократимо, но это ошибка. По Мору и Мацудо, толщина кутикулы у трихохон, спирохон и энофорахон составляет 0.4—0.5 мк в верхней части тела, до 1—1.5 мк в нижней, где кутикула переходит в кортекс стебелька или ножки. По нашим препаратам, кутикула хонотрих особо утолщена в двух отделах — у основания ПВ и у основания тела на стороне, противолежащей субстрату; максимальная толщина кутикулы отмечена у Echinichona (2.5—3 мк). Кутикула хонотрих, с ее локальными утолщениями, — это фактически наружный скелет особи. В утолщенных зонах видна иногда правильная исчер-ченность, особенно у Cristichona и Spinichona (рис. 18, 3); кутикула состоит как бы из кирпичиков; иногда исчерчены и опорные пластинки между эндостилом и ампулой эндогеммин. Об ультраструктуре покровов хонотрих сведений пока нет; в одной из работ (Faure-Fremiet a. oth., 1956) на микрофотографии среза Chilodochona carcini видна очень толстая, плотная кутикула в нижней части тела.
Аргентофильная сеть из многогранных ячеек найдена только у томитов (не трофонтов!) Ch. carcini (Guilcher, 1950, 1951), хотя она свойственна всем гипостоматам, включая Dysteria.
Наружная поверхность кутикулы хонотрих не всегда выглядит ровной: нередки ребровидные складки, отмеченные в литературе пока только у спирохон и гелиохон. По Гертвигу, кутикула Spirochona продольно исчерчена, особенно на шейке молодых особей. Плате считал, что складки — это свидетельство изгиба шейки при росте трофонта для конъюгации. По Эйсмонду, вся кутикула спирохоны гладкая и только в нижней части, особенно у молодых особей, можно наблюдать тонкую продольную штриховатость, обусловленную продольными ложбинками. У Heterochona Валленгрен отметил редкие поперечные складки в области томита и в нижней части тела, Добжанская-Качановская — нежные пелликулярные полоски, покрывающие все тело вплоть до основания ПВ. По Мору, у Trichochona на окрашенных препаратах все тело несет мелкие пелликулярные зернышки. На наших препаратах, как отмечалось, складки панциря видны у многих хонотрих; они идут обычно вдоль тела, у беломорских лобохон фрагментированы (рис. 18, А—Г, Ж—К; 19, А, Е); у Carinichona видны
только поперечные складки (рис. 19, Ж, 3). Локальные поперечные складки отмечаются часто, например у ножки Heterochona, по краям тела Flectichona, у основания шейки Lobochona (рис. 18, Е). Складки состоят нередко из тесно сближенных мельчайших папилл (панример, у спирохонид), они хорошо совпадают с псевдокинетами на импрегнированных препаратах; папиллы резко удлинены у ряда эндогеммин (изохон, армихон), у птерохон это уже шипики. Складки, по-видимому, играют защитную роль, повышая прочность панциря и отдельных его участков; они обычно развиваются в безресничных зонах перитрих, энтодиниоморф, сукторий. При сохранении цилиатуры прочность кортекса повышают фибриллы и кинетодесмы, отходящие от кинетосом.
У Heliochonidae и некоторых эндогеммин с маргинальными шипами, зубчиками или с неровным краем ПВ иногда видны и продольные ребровидные складки на наружной поверхности ПВ (рис. 20, Г; 22, Д, /К). Плате отмечает продолжение шипов Heliochona в стенке ПВ; рисунки Валленгрена создают впечатление, что у гелиохонид шипы прилегают к стенкам ПВ и лишь в своей верхней части поднимаются над краем воронки. Схематически такие шипы показаны позднее Добжанской-Качановской и Фенхелем, считавшими, что они якобы погружены в эндоплазму. По Ромпелю, шипы Kentrochona продолжаются в эктоплазме вплоть до «зоны мембранелл». По нашим данным, у молодых гелиохонид стенки ПВ становятся продольно исчерченными, затем эти ребрышки растут вверх, становясь шипами. Шипы у гелиохонид — кутикулярное, а не «эндоплазменное» образование. Крупные складки продолжаются в более крупные шипы.
Защитную роль играют и волнистые, зубчатые края ПВ. Гипохон у хонотрих обычно ровный или зазубренный, эпихон несет очень глубокие складки, участки между которыми могут разрастаться с образованием щитков или лепестков. Такие формы обычны среди экзогеммин {Lobochona, Heterochona, Heliochona, часть видов Oenophorachona), но встречаются и у эндогеммин {Dentichona, Stylochona, Spinichona и др.). Все эти структуры рассмотрены в главе о строении ПВ. Один из двух лепестков предковых лобохонид, разрастаясь, превратился в гигантскую защитную пластинку фил-лохоны; у Vasichona и особенно у Cryptochona такая пластинка образована разрастанием всего дорзального края ПВ. Зубчики лепестков различимы уже у примитивных хонотрих {Lobochona), часто они сочетаются с продольной исчерченностью лепестков (рис. 20, Е—Л)-, четкие зубцы отмечены нами на эпихоне Cavichona multifida (рис. 20, А) и С. protecta. ПВ высших спирохонид несет глубокую вырезку или серию складок гипохона, несомненно служащих для укрепления стенок ПВ (рис. 20, А, Д). Волнистые или зубчатые края ПВ обнаружены и у ряда эндогеммин (рис. 20, Б—Г, М; 22, А, Д, 3). Глубокие складки гипохона отмечаются редко, в основном у форм с инверсией зон РПА (у Phyllochona среди экзогеммин, у инверсохонид и Paraoxychona среди эндогеммин).
Спиральный завиток ПВ (дейтерохон) свойствен только спирохонидам. Несмотря па хорошую изученность спирохон, никто не интересовался причинами развития и назначением завитка; только у Раабе (Raabe, 1964с : 178) мы читаем, что «расположенные в складке ПВ реснички создают ток воды, несущий пищу ко рту, а затем выходящий наружу через спиральную воронку». Трудно найти более нелепое объяснение; едва ли столь сложный комплекс возник и претерпел значительную прогрессивную эволюцию лишь для удаления воды из ПВ. Кроме того, по нашим наблюдениям in vivo на Cavichona multifida, ток воды направлен не наружу, а внутрь завитка. Несомненно, завиток играет некоторую роль в питании спирохонид, он напоминает поднятые надо ртом ресничные диски перитрих типа Opercularia. Однако реснички в завитке немногочисленны и слишком далеко удалены от рта, ток воды должен быть слабым и малоэффективным. Мы считаем, что завиток играет двойную роль: это прежде всего защитная структура — замена шипов, лепестков или защитных пластинок, обычных у других хонотрих; в меньшей степени он служит для питания. Стенки завитка прочные, иногда с зубцами и складками. Как и защитная пластинка у Phyllochona., завиток у спирохон возник при аллометрическом росте левого лепестка ПВ низших экзогеммин, который также представляет защитную структуру. Правый лепесток исчез, левый же резко разросся и свернулся спиралью.
У ряда видов шейка плавно переходит в тело, но нередко переход более отчетливый, тело у основания шейки расширено. Здесь могут образоваться поперечные складки, прежде всего на дорзальной стороне (Dentichona, Eurychona, Echinichona), реже на обеих сторонах тела (Spinichona) (рис. 20, В, Г; 21, Д, 22, Б, Г, 3). У Filichona в основании шейки видна расширенная площадка. Края площадки или складок обычно несут шипы. Среди эндогеммин такая структура (гипоколлюм) отсутствует у примитивных изохон, намечается у трихохон, хорошо выражена на дорзальной стороне тела кристихон; у армихон и спинихон складка описывает полный круг, возвращаясь к вентральному краю зародышевой сумки. Гипоколлярная складка — это фактически продолжение краев сумки; именно поэтому она обычна у эндогеммин и отсутствует у экзогеммин, где гораздо реже укорачивается шейка.
У Lobochona и Oenophorachona в основании ПВ или шейки, на уровне рта или несколько ниже, Мор и Мацудо (Mohr, 1959b; Mohr a. oth., 1963а; Matsudo а. Mohr, 1964) обнаружили на окрашенных и имнрегнированных препаратах четкое темное кольцо, вероятно образованное эктоплазмой или кутикулой. Судя по нашим пре-
Рис. 20. Складки стенок ПВ. А — Cavichona multifida-, Б — Cristichona pacifica', В — Dentichona marginata; Г — Carinichona globulus', Д — Serpentichona anthus', E—И — Lobochona limnoriae', R, Л — L. tenue', M — Actinichona gaucho.
паратам, сидерофильное кольцо обычно у экзогеммин, где довольно однотипно: оно расположено всегда несколько выше Ма и ниже рта; это не замкнутое кольцо, а полуколь-цевое утолщение дорзальной стенки тела. У Lobochona и у гелиохонид структура обруча простая, толщина не превышает 1 мк; у спирохонид это — сложное, возможно двухслойное образование толщиной до 3 мк у Cavichona protecta (рис. 31, П, Р). Кольцо
хорошо красится бромфеполовым сипим на белок и гематоксилином Бемера; поскольку кутикула не красится, это, видимо, не только локальное утолщение кутикулы, но и специализированный отдел цитоплазмы клетки.
Отметим, наконец, резкое утолщение отдельных частой тела у хонотрих, также играющее защитную роль. По Дофлейну, ПВ Kentrochonopsis окружена очень толстыми зернистыми губами; такое же утолщение стенок ПВ отметил позднее Валленгрен у Chilodochona. Это не артефакт, утолщенные зоны четко видны на снимках и рисунках хилодохон у Гийше и Форе-Фремье; толстые стенки ПВ хилодохон обычно называют губами, а саму ПВ — вестибулярной щелью. Такое утолщение отмечено у всех изученных нами хилодохонид, среди эидогеммин — у Crasslchona. У инверсохонид утолщены не стенки, а дно ПВ, рот высоко поднят над основанием шейки. Толщина стенок ПВ у хилодохон достигает 14 мк, у крассихон — 27 мк; только у последних резко утолщены (до 13 мк) и стенки зародышевой сумки.
По Дофлейну, если томит Kentrochona оседает около щетинки рачка, трофонт по мере роста облегает ее с обеих сторон специальными выростами тела и включает ее в свой защитный аппарат. Такое случайное разрастание особи вряд ли возможно. Регулярное, закономерное разрастание обнаружено нами у актинихонид: эти формы обитают между тесно сближенными щетинками торакопод Nebalia, особь втиснута между двумя щетинками и как бы цепляется за них выростами тела. Четкий утолщенный киль образуется у Carinichona (рис. 20, Г), два киля и якорные отростки — у Rhizochona. Край зародышевой сумки оттянут в сторону и образует киль и у части других эидогеммин (Coronochona, Ctenochona и др.); иногда разрастается верхний край сумки, с образованием защитных пластинок (Paraoxychona, Oxychona).
Для хонотрих характерно развитие шипов; можно найти все переходы от папилл, зубчиков, ребрышек кутикулы до настоящих шипов; иногда даже трудно сказать, с какой структурой мы имеем дело. По форме можно различить 5 категорий шипов: зубцевидные, саблевидные, игольчатые, крючковидные и массивные цилиндрические шипы с округлым сечением. Зубцы ПВ у Lobochona и Cavichona тупые, в их расположении, размерах и форме нет той четкости и стабильности, какая характерна для систем шипов. Однако шипами, например, вполне можно назвать короткие зубчики у Pleochona и Echinichona (рис. 21, Ж) — они заострены, образуют определенный комплекс. Шипы хонотрих почти всегда заострены (исключая Filichona)-, тупые шипы изображались у видов Heterochona Добжанской-Качановской и Мацудо, но в действительности вершина этих шипов отогнута вбок, крючковидная. В другом аспекте — с учетом расположения шипов на особи — можно различить 7 категорий шипов (рис. 21, И): соматические (по краям тела), гипоколлярные (на гипоколлярной складке), латеральные (по бокам ПВ, часто у шейки), маргинальные (по краям воронки, здесь различимы вентральные и дорзальные шипы), субмаргинальные (мелкие шипики несколько ниже края ПВ), базальные (шипы, растущие от дорзальной стенки ПВ намного ниже ее вершины) и эписоматические (на дорзальной стороне тела). Найдены формы с 5 типами шипов одновременно (Chonosaurus). Шипы хонотрих различаются и по их внутренней структуре. Обычно это плотное гомогенное локальное разрастание кутикулы, реже встречаются шипы с зернистой цитоплазмой. Шипы правой и левой сторон тела обычно симметричны, но у эидогеммин симметрию нарушает зародышевая сумка: сторона тела с сумкой может нести меньше шипов, чем противоположная. Шипы гипоколлюма у пле-охон развиты иногда лишь на левой стороне тела. Непарные шипы расположены по оси тела, за исключением Rhizochona с боковым шипом. Латеральные, гипоколлярные и базальные шипы обычно не дифференцированы; маргинальные, напротив, образуют сложные комплексы. Вентральные шипы по форме, размерам и числу почти всегда отличаются от дорзальных. У гелиохонид обычно чередуются саблевидные и крючковидные либо игольчатые шипы гипохона. Шипы различаются и по способу их образования в онтогенезе. Одни из них являются выростами ребер кутикулы (маргинальные шипы), другие не имеют видимой связи с какими-либо ребрами или складками, это локальные разрастания кутикулы либо выросты тела с зернистой цитоплазмой (соматические и гипоколлярные шипы).
Шипоносные формы встречаются в обоих подотрядах, но более характерны для эидогеммин, где образуют и более сложные комплексы. Шипы имеются у 5 из 15 родов Exogemmina (все роды семейств Filichonidae, Phyllochonidae и Heliochonldae). Гипокол-люм Filichona несет до 10 массивных шипов; шипы A urichona гомологичны гипоколляр-ным, растут от границы тела и шейки, хотя гипоколлюма у аурихоны нет. Phyllochona имеет небольшие латеральные шипики в нижней части ПВ, что редко у хонотрих. Маргинальные шипы, образующие сложные комплексы, имеются у всех гелиохонид. Вентральные шипы не дифференцированы у примитивных видов Heterochona-, у Н. coronata чередуются длинные и короткие саблевидные шипы, у Н. exilis и Н. peregra — игольчатые шипы нескольких типов.
Особо сложен комплекс шипов Н. trifaria — видны шипы трех типов, в основном крючковидные. Саблевидных плоских шипов нет у Heliochona, все шипы тонкие, игольчатые или крючковидные (рис. 22, R, Г, Е)-, здесь также нетрудно составить
5 Заказ М 213
ряд с постепенным усложнением комплекса вентральных шипов, от недифференцированного набора у Heliochona sp. (рис. 21, Г) до комплекса у Н. sessilis, где один игольчатый шип чередуется с 5—7 мелкими крючковидными, направленными в разные стороны.
Рис.. 21. Шипы хонотрих. А — развитие шипов в зонах утолщения кутикулы эндогеммин; Б — развитие шипов из складок гипохона; В—Д — шипы Dentichona marginata (В), Heliochona elegans (Г) и Spinichona horrida (Д); Е — типы шипов гелиохонид; Ж — шипы Echinichona regina; 3 — «раковинка» Kentrochona (по: Hall, 1953); И — типы шипов хонотрих.
Шипы имеют около 80% родов эндогеммин (20 из 26, если учитывать и мелкие маргинальные шипики); шипов нет у Isochonidae, у Crassichona и Inversochona, а также у ряда примитивных видов, отнесенных нами к шипоносным родам. Актинихониды в целом лишены обычных у эндогеммин соматических шипов, имеют мелкие апикаль
ные зубчики (Carinichona, Cristichona) или базальные шипы (Actinichona, Kentrocho-nopsis; у первого рода с системой маргинальных шипов). Крупный непарный шип появляется у Hhizochona в области сумки. У примитивной инверсохониды Pleochona.
Рис. 22. Шипы хонотрих. А — Pterochona pacifica', Б — Spinichona horrida', В, Г — Heliochona alternans; Д — Flectichona crenata; E — Heliochona pontica; Щ — Heterochona scheutenii c Gammarus zaddachi', 3 — Chonosau-rus rex.
имеются небольшие маргинальные шипы, особо развитые на эпихоне, и несколько ги-поколлярных шипов. У высших родов эндогеммин появляются соматические шипы, немногочисленные у Ceratochona и Kentrochona и полимеризующиеся у Chonosaurus. Ch. rex имеет наиболее сложную систему шипов — одновременно соматические, ги-
поколлярные, маргинальные вентральные и дорзальные, непарный базальный шип и (единственный случай у хонотрих!) массивные многочисленные эписоматические шипы, усеивающие всю дорзальную поверхность тела (рис. 21, И; 199, А— Д-, 200). У Echinichona хорошо развиты соматические шипы, слабее — маргинальные, в особенности на гипохоне (рис. 21, Ж)', иногда видны и мелкие гипоколляриые шипики. Со-ronochona имеет сходные с Echinichona шипы и новообразование — крупные латеральные шипы. Развитых шипов нет у примитивной стилохониды Stylochona, хотя нередко видны зубчики на эпихоне либо по краям тела; Paraoxychona имеет лишь непарный дорзальный шип, виды Flectichona — мелкие маргинальные шипики. У остальных родов стилохопид комплексы шипов сложны и разнообразны. Небольшие маргинальные и крупные латеральные шипы видны у Armichona, зубцевидные соматические шипы — у Dentichona, многочисленные игольчатые шипы—по краям тела, гипоколлюма и ПВ Spinichona (рис. 21, В, Д-, 22, Б). Соматические шипы полимеризованы у остальных родов стилохопид в связи с укрупнением тела, но маргинальные шипы у них развиты слабо. Шипы у Oxychona и Pterochona окаймляют часть тела, у Eriochona и Ctenochona— весь край. Особо сложен комплекс шипов у Pterochona pacifica, имеющей два гигантских крыловидных шипа, усеянных мелкими зубчиками. Эти шипы мы считаем аллометрически развитой нижней парой соматических шипов предка (формы типа Oxychona multifida).
Итак, защитный аппарат хонотрих включает: кутикулярный панцирь и его локальные утолщения; исчерченные пластинки; складки тела и ряды папилл; гипоколляр-ную складку или площадку; щитки и лепестки, защитные пластинки и завитки ПВ; щитковидные и килевидные выросты краев сумки; выросты тела; резко утолщённые стенки сумки, дно и стенки ПВ; шипы различных категорий в разных участках ПВ и тела. Хотя шипоносных родов много (25 из 41), шипов нет у самых крупных родов хонотрих (Isochona, Lobochona, Spirochona, Cavichona, Oenophorachona, Chilodochona), поэтому шипоносных видов относительно мало; это часть форм с лимнорий, гаммарид и Nebalia. Образование у хонотрих определенной категории защитного аппарата трудно объяснить локальными условиями жизни этих форм, эволюция идет по разным направлениям. Так, на жабрах гаммарид мы находим либо формы с завитком ПВ (Spirochona), либо формы с очень сложной системой маргинальных шипов (Heliochona). Оба защитных аппарата, вероятно, достаточно эффективны. На щетинках плеопод бокоплавов можно встретить бесшиповые (Isochona) и шипоносные формы (Heterochona), на члениках стебелька плеоподы — формы с простой ПВ (Oenophorachona) и с завитком (Spirochona). На максиллипедах декапод живут хонотрихи с резким утолщением стенок ПВ и тела (Chilodochona), на тех же придатках гаммарид — шипоносные формы (Heterochona). Формы со сходным защитным аппаратом могут обитать, таким образом, на разных придатках, формы с разными типами защитных систем — на одних и тех же придатках разных хозяев. Отметим также, что мы знаем случаи упрощения в эволюции прикрепительного аппарата хонотрих (утрата стебелька при смене локуса), но нет ни одного случая упрощения защитного аппарата; во всех эволюционных линиях он усложняется, претерпевает прогрессивную эволюцию. Еще не выяснена, правда, природа анакти-нид у эндогеммин.
Развитие складок пелликулы, как отмечалось, характерно для инфузорий, теряющих соматическую цилиатуру (Peritricha, Gymnostomatida и др.). Скелетные пластинки такого типа, как у Cristichona, известны у Entodtniomorpha', шипы имеются у Агто-phorida, Odontostomatida, Entodtniomorpha и т. д.; панцирь—у большинства форм хотя бы с частичной редукцией кинетома. Хонотрихи интересны тем, что у них как бы воедино собраны все известные у других инфузорий типы защитных органелл и добавляется много новых. Кроме того, ни в одной из групп инфузорий шипы не образуют столь сложных комплексов, как у хонотрих.
ПРЕДРОТОВАЯ ВОРОНКА
Для обозначения ПВ Донсом (Dons, 1940) введен термин «трихохон». Почти все авторы отождествляют ПВ хонотрих с перистомом, но иногда под перистомом понимают лишь ротовое отверстие. По Холлу (Hall, 1953), перистом хонотрих окружен воронкой с тонкими стенками. По Кудо (Kudo, 1946), вокруг апикального перистома простирается эктоплазменный воротничок. Такие определения неточны.
За редкими исключениями авторы обозначали стенку ПВ терминами «мембрана» или «пластинка». Так, по Гаевской (1949 : 305), у Spirochona «край перистома представляет собой тонкую плазматическую мембрану, закрученную вправо». О пластинчатом крае перистома или о воронке, образованной мембраной, говорят Гертвиг, Эйс-монд, Гамбургер, Сварчевский и др. Встречаются термины «эктоплазменный воротничок» (Kahl, 1935; Mohr, 1948; Jahn a. Jahn, 1949), «плазматическая воронка» (Догель и др., 1962а) и «цитоплазменная воронка» (Хейсин и Полянский, 1963). По Раабе (Raabe, 1964b) и Ветцелю (Wetzel, 1954), рот хонотрих окаймлен высокой плазматической складкой, свернутой в сложную спираль. Однако в действительности стенка ПВ
хонотрих не мембрана и не пластинка: между толстой наружной (кутикулярной) и топкой внутренней стенками ПВ залегает слой цитоплазмы, сужающийся к се вершине. В этом слое у спирохон и крассихон видны иногда жировые сферулы, гранулы вакуома, мелкие тельца (митохондрии?).
Четкой классификации форм ПВ у хонотрих пока нет. Холл (Hall, 1953 : 412) различает несколько типов ПВ: «Воронка у Kentrochona — простая структура с непрерывной стенкой. Более часто стенка неполная, и один ее конец закручен с образованием вторичной спиральной воронки. Stylochona необычна в том отношении, что широкая воронка типа Kentrochona окружает внутреннюю и, очевидно, самостоятельную воронку». Различают также ПВ Chilodochona — щелевидную полость с толстыми губо-образными стенками (Валленгрен, Мор). В диагнозах хонотрих нередко отмечается, что ПВ закручена по спирали (Догель, Ветцель, Раабе и др.); это, однако, лишь одна из многих форм ПВ, в целом нетипичная для отряда. Рассмотрим ниже ПВ разных семейств (рис. 23—28).
Рис. 23. ПВ лобохон. А — Lobochona sp.; В, В — L. limnoriae.
Наиболее простую ПВ мы находим у Lobochonidae (Lobochona и Oenophorachona). ПВ лобохон коническая или слабо сплющена, гипохон ровный, эпихон несет лепестковидные выросты; лепестки намечаются у L. insularum, укрупняются у L. prorates и достигают особого развития у L. limnoriae (рис. 23). Мацудо и Мор не отмечают у этих трех видов продольных складок эпихона; по нашим данным, складки слабо развиты у Lobochona sp. с Итурупа, лучше — у L. limnoriae и L. tenue; образование их вызвано наклоном участка эпихона к гипохону. По Донсу (Dons, 1940 : 117), перистомальный аппарат L. limnoriae «состоит частично из трихохона, частично из двухлепесткового языка. . . стоящего в виде воронки в середине трихохона». Это неверно: лепестки — лишь выросты края эпихона. «Внутренняя воронка» — оптический обман, вызванный наличием продольных складок ПВ (как и в случае с «Stylochona sivertseni»). Эпихон поднят над гипохоном, чтобы задерживать ток пищевых частиц; сами лепестки, их зубцы и шипы — это защитные структуры, не служащие для питания. Гофрирован-ность, зазубренность, разрастание лепестков (у многих рас лобохон) должны придавать им большую прочность по сравнению с ровным гипохоном. Количество дорзальных складок варьирует у разных рас и особей, но можно наметить тенденции, характерные для видов. У L. tenue складок обычно 2, реже 3—4 (I—IV); эти складки или часть их мы найдем далее у большинства хонотрих. При утрате части складок почти всегда сохраняется складка III левее ресничной зоны В; теряются чаще всего складки I и II, реже — IV. Лепестки — это выросты эпихона между складками I и II, III и IV; если лепестков нет, участки эпихона между этими складками глубоко вдаются внутрь ПВ. Эпихон при наличии хорошо выраженных складок образует четкие карманы («придаточные воронки» Дофлейна) — обычно два боковых и один осевой; первые несут часть ресничной зоны А, осевой карман — зону В; складки эпихона лишены ресничек. Эти карманы, так же как и складки, мы найдем у большинства хонотрих. Складки, ограничивающие боковые карманы у L. limnoriae, были приняты Мором за «вырезки» эпихона. ПВ как у лобохон, но с небольшими лепестками или без них имеют другие лобохо-ниды. У Oenophorachona ectenolaemus Мацудо и Мор изображают ровную ПВ; мы находили лишь виды с заметными лепестками. У Toxochona mirabilis лепестки мелкие, тесно сближены; у обоих видов нет карманов ПВ, иногда .сохраняется складка III. Eleutherochona, по Донсу (Dons, 1948), имеет две субконические воронки, вероятно эластичные, поскольку форма их у фиксированных особей сильно варьирует. Им изображены ПВ различного типа, но в целом напоминающие ПВ лобохон — без складок эпихона или с двумя складками и карманами, в одном случае с двумя лепестками, как у токсохон. Внутренней концентрической воронки у элейтерохон нет.
Оба рода Filichonidae (A urichona и Filichona) сохраняют ПВ такого типа, как у лобохон, — со слабо выраженными складками и лепестками. ПВ Phyllochonidae необычна по всем признакам: очень велика, сплющена, не расширяется, как обычно, а сужается к вершине. Гипохон неровный, с широкой вырезкой; эпихон разрастается в гигантскую защитную пластинку — вероятно, это непропорционально развитый левый лепесток, правый же исчез вследствие аллометрического роста левого.
Контуры ПВ Heliochonidae сходны с таковыми ПВ ряда лобохон: гипохон ровный, эпихон поднят и образует изогнутые лепестки, обычно перекрывающие полость ПВ. Хорошо развиты все четыре дорзальные складки, они очень глубокие; крупные боковые карманы ПВ отогнуты далеко назад. Карманы хорошо изображены у гелиохонид Рентшем и Валленгреном; рисунки Фенхеля неправильны. Добжанская-Качановская изображает у гетерохон не два боковых кармана, как в норме, а один осевой, в виде впячивания внутрь стенки ПВ. Рисунок ее ошибочен, вероятно, эпихон зарисован на просвет с вентральной стороны. Рисунки «Stylochona coronata» Кента до сих пор вводят авторов в заблуждение: изображены две концентрические ПВ, вложенные одна в другую. Обычно авторы не высказывают сомнений в правильности этих данных (Валлен-грен, Каль, Мор, Йировец, Холл, Лепши и др.); по Йировцу, к примеру, признак рода Stylochona — наличие четко очерченной высокой внутренней воронки. Валленгрен допускал существование линии Spirochona—Stylochona—Heliochona с редукцией завитка и постепенным усложнением шипов. Валленгрен, видимо, считал ПВ стилохоны спиральной, а не концентрической: ПВ описывает два оборота, наружный край усеян шипами. Мор считает, что Кент зарисовал плохо фиксированную особь, однако никакая фиксация не даст артефакта в виде внутренней воронки. Кент, видимо, рисовал особь при малом увеличении, приняв шипы за края воронки.
Перистом Chilodochona ограничен, по Валленгрену, Вентральной и дорзальной губами; ПВ хилодохонид и других хонотрих не противопоставлялась у него так резко, как у всех последующих авторов. По мнению Валленгрена, ПВ якобы может открываться и закрываться, в связи с чем меняются ее контур и степень изгиба; губы действуют как сфинктер. При полном раскрытии образуется широкая неглубокая воронка; в закрытой ПВ эпихон прилегает к выпуклому гипохону, отверстие становится серповидным. Последующие авторы обычно не называют ПВ хилодохонид воронкой, говоря •о ротовой щели, ограниченной двумя губами; только Бхатиа говорит о воронковидном перистоме хилодохон. Наиболее резко противопоставляет ПВ хилодохон и других хонотрих Мор, считавший вначале хилодохон примитивными формами без настоящей ПВ (Mohr, 1948); признав их позднее высшими, Mop (Mohr, 1959а : 651) по-прежнему указывает, что виды Chilodochona — это скорее «формы с сильно выдающимися, неравными парными губами, чем с воронковидным воротничком». Мор и Мацудо разделили отряд хонотрих на два подотряда — с передним воротничком или с парой разросшихся губ, ограничивающих «вестибулюм» (Matsudo, 1966; Mohr a. Matsudo, 1970); Корлисс (Corliss, 1967) применяет термин «вестибулюм» ко всем хонотрихам, учитывая не контуры ПВ, а наличие простой (соматической) цилиатуры.
Судя по нашим препаратам, примитивная Vasichona имеет цилиндрическую толстостенную ПВ с ровным гипохоном; эпихон ее без складок, несет непарный лепесток. Это воронка обычного типа, без губ. Полость ПВ сужается книзу, хотя сама ПВ несколько сужается кверху. Губ нет и у Cryptochona', лепесток эпихона превращен в крупную пластинку, перекрывающую отверстие ПВ. Род Chilodochona включает виды со сплющенной ПВ, слабо расширяющейся кверху, и с широко раскрытой ПВ с резко неравными губами {Ch. paltnuri, Ch. aranei). У криптохон и хилодохон часто видны небольшие складки гипохона.
Спирохонидам посвящена большая литература. Многие авторы (Штейн, Гертвиг, Эйсмонд и др.) различают в ПВ Spirochona gemmipara два отдела — периодом (собственно воронка) и завиток, закрученный вокруг стебелька. В участке эпихона, несущем зону В, Штейн и Сварчевский ошибочно изображают глубокую вырезку — «боковое устье», или «устье воронки»; пища поступает внутрь ПВ сверху через завиток и сбоку через это «устье». Учитывая разное положение колюмеллы, Штейн допускал возможность медленного движения завитка, но это опровергли последующие авторы. По Эйсмонду, эти вариации — лишь стадии роста ПВ. Штейн находит у S. gemmipara особей как с левым, так и с правым завитком; эта же ошибка повторена и Сварчевским. Гертвиг и Эйсмонд правы в том, что вырезка эпихона — лишь оптический обман, здесь проходит продольная складка кутикулы. Колюмелла и краевая линия ПВ, по их данным, сильно утолщены, представляют собой кутикулярные пружины, поддерживающие ПВ и предохраняющие нежную пластинчатую стенку от сморщивания и спадания. Такого утолщения, однако, нет: края ПВ отогнуты вниз, образуя карниз, не отмеченный в литературе; у всех спирохонид он проходит по вентральному краю ПВ и завитков. Неправильны рисунки Пенара, показывающего вырезку эпихона, и Бюйсана, изобразившего две концентрические воронки. В целом верны рисунки спирохон у Гийше и Мора, но Мором не показаны складки эпихона.
ПВ S. gemmipara (рис. 24, Г) имеет карниз, четкую складку II, складку III вдоль колюмеллы и иногда едва выраженную складку IV. На ранних стадиях развития (рис. 24, Б) видны складки II и III по краям зоны В, как у энофорахон (рис. 24, А) — предшественников спирохон. Разрастается и скручивается участок между складками III и IV, т. е. левый лепесток предка (рис. 24, Б—Г, И).
У спирохонид Байкала Сварчевским описана ПВ самого различного типа (рис. 97). У «S. .gemmipara» и S. pusilia имеется щелевидная вырезка эпихона, у других видов
край щели свертывается во вторичпую правостороннюю воронку; это, однако, не завиток, а лишь глубокая складка эпихона. У кавихон и серпентихон Сварчевским не показана, напротив, характерная и легко видимая вырезка гипохопа. По направлению закручивания ПВ Сварчевский различает четыре группы видов: у «S. gemmipara» и S. pusilia «перистомальная мембрана» закручена против часовой стрелки, у S. patella — по часовой стрелке; у S. anthus, S. elegans, S. tuba и S. elegantula оба края ПВ свернуты в спираль в разных направлениях; у S. simplex и S. globulus ПВ пластична, у разных особей вида закручена то вправо, то влево.
Рис. 24. Происхождение и модификации ПВ спирохонид. А — ПВ Oenophorachona urceolata', Б—Е — онтогенез ПВ Spirochona gemmipara', Ж — ПВ Serpentichona anthus', 3, И — ПВ Spirochona tuba', К — рудиментарные лепестки у Oenophorachona sp. с Сахалина.
Все эти данные Сварчевского ошибочны. Спирохониды изучались им на гематок-силиновых препаратах, на которых трудно разобрать строение хромофобной ПВ. Особи ориентировались неправильно, за вентральную принималась то одна, то другая сторона тела. На рисунках не изображены рот, глотка и ресничные зоны ПВ, по которым можно безошибочно ориентировать особь. Естественно при этом, что ПВ у разных особей и видов оказывалась закрученной в разные стороны. Особи S. globulus, S. elegans, S. anthus и S. simplex зарисованы Сварчевским и с вентральной, и с дорзальной стороны, направление закручивания ПВ у них поэтому совпадает. Правосторонний завиток Сварчевским пририсован, мы не видели ни одной особи байкальских спирохонид с такой структурой. Удивительно, что этот автор пририсовал глубокую вырезку эпихона, вплоть до основания ПВ, но не заметил четкой вырезки гипохона.
По нашим данным, у видов Spirochona гипохон ровный, у других спирохонид с широкой вырезкой; в дополнение к ней у серпеитихон появляется серия складок и мелких вентральных карманов. ПВ S. gemmipara и S. brevis однотипна; у S. globulus завиток часто недоразвит, у S. tuba восстанавливаются утраченные спирохонидами складки I и IV, появляются и дополнительные складки эпихона. Складки очень глубокие, крупные карманы ПВ отогнуты далеко назад. Для видов Cavichona характерна тенденция к полимеризации витков спирали, для Serpentichona—олигомеризация. За точку отсчета мы принимаем место соединения завитка с эпихоном; направление отсчета — против часовой стрелки. Для Spirochona gemmipara указывается 2 1/i витка спирали (Гертвиг), 3 (Кент, Фроментель, Эйсмонд, Андре, Пенар) и 31/2 витка (Гийше). Для S. tuba Сварчевский указывает 2 витка, для S. patella, S. pusilia и S. globulus — 2— 2 г12, для S. simplex — 2—3, для S. anthus — 3, для S. elegantula — минимум 3— 3 1/2, для S. elegans — 3—4. Нами для видов Spirochona получены следующие цифры: 3 (S. gemmipara), 2 */2—2 3/4 (S. brevis, S. fu&a), до 2 1/2, но часто 13/4—2 (S. globulus), 2 1/2 (5. simplex), 23/4—31/2 (>S. gnathopodialis), 2 1/2, редко 2 или 2 3/4 (S. marina), для видов Cavichona 2 1/2—2 3/4 (С. protecta, С. crassa), 3 (С. tenue, С. exilis), 3—3 1/2 (С. abyssalis, С. brevistyla, С. carinuri), 31/2—4 (С. multijida, С. virgata, С. rhabdomorpha), 4—4 iy2 (с. acanthogammari, С. elegantula), 4 х/2—5 (С. elegans, С. cincinnata, С. oli-gocineta, С. laticollis), для Serpentichona anthus 2—2 1/2, изредка до 3 1/2 витков.
Вопросу о направлении закручивания ПВ спирохон посвящена большая литература, поскольку этот признак ранее считали важнейшим в систематике и филогенетике сидячих инфузорий. Совпадения мнений не могло быть уже потому, что авторы по-разному ориентировали объекты и по-разному определяли исходную точку спирали. Отсюда субъективизм и глубокие противоречия в определении направления спирали и в оценке его значимости. По ряду авторов, спираль у спирохоны закручена дек-стрально, т. е. слева направо (Штейн, Гертвиг, Веньон, Каль, Сварчевский, Бюйсан, Гаевская, Йировец, Дофлейн, Рейхенов, Мацудо и Мор) или по часовой стрелке (Бха-тиа, Бок, Джен, Боррадейл, Догель и др.). Правозакрученная спираль хонотрих противопоставляется левозакрученной спирали перитрих. Однако можно прочесть и о том, что спираль хонотрих закручена справа налево или против часовой стрелки (Бючли, Эйсмонд, Валленгрен, Гийше, Клапаред и Лахманн; последние авторы ссылаются на рисунки Штейна, хотя Штейн говорит о правозакрученной спирали). По Хартогу, направление спирали декстральное у всех cPeritrichaceae» (включая спирохон), кроме Licnophora. Однако авторы сравнивают совершенно разнородные и несравнимые, негомологичные структуры — кутикулярный край ПВ, АЗМ гетеротрих, двойную спираль (УМ-|-М2) перитрих, гаплокинеты спирохон. Если не принимать во внимание строение этих органелл, нет смысла проверять совпадение их направления и тем более делать из этого какие-либо выводы. Направление спирали может совпадать и у разнородных структур. До сих пор, однако, можно прочесть, что «различие в направлении спирали считается важным таксономическим признаком и используется для отделения Spirotrichida и Chonotrtchida (по часовой стрелке) от Peritrichida (против часовой стрелки)» (Jahn a. Jahn, 1949 : 72). Стандартная определительная таблица выглядит следующим образом: «Адоральная спираль левозакручена — Peritricha, правозакручена — Chonotricha». Отметим, что у спирохон спираль закручена против часовой стрелки, если за исходную точку принимать место контакта завитка с эпихоном и ориентировать особь вентральной (а не дорзальной, как обычно в литературе) стороной; другими словами, спираль идет вниз справа налево, т. е. левозакручена. Различия в направлении спирали не мешали авторам включать спирохон в состав перитрих (Веньон, Ламеер, Бюйсан, Хартог и др..); нередко пытаются определить, как из спирали перитрих могла получиться спираль ликнофор и хонотрих (Бючли, Деляж и Эруар, Минчин). Правозакрученную спираль Ламеер смог найти даже у сукторий. До сих пор некоторые авторы делят отряд перитрих на группы Sceotricha (включая спирохон) и Dexiotricha. Пожалуй, достаточно ясно, что такому мелкому и второстепенному вопросу, как направление закручивания ПВ спирохон, в литературе было уделено слишком много внимания. К тому же Spirochona — аберрантный род, спиральная ПВ нетипична для хонотрих в целом. Завиток — одна из многих форм защитного аппарата, он заменяет отсутствующие у спирохон лепестки, щитки, шипы, пластинки эпихона; участие в питании — это второстепенная функция органеллы.
Хотя многие авторы сравнивают спирали спирохон и перитрих, вопрос о гомологиях структур рассматривают лишь Кент, Штейн, Бючли и (особенно подробно) Эйсмонд. По Кенту, перистом перитрих однотипен, но у отдельных родов наблюдается крайнее развитие одного из элементов по сравнению с другими. Так, у Spirochona «наружный край разросшейся спиральной стенки перистома в основном угнетен, а внутренний особо сильно развит, имеет вид прозрачной и высоко поднятой спиральной мембраны. Свернутая воронка Spirochona — это, видимо, собственно перистом, вытянутый в виде мембраноидной спирали, третий или базальный оборот которой гомологичен перистому» (Kent, 1881 : 661). Та же девиация, но в меньшей степени, характерна, по Кенту, для перистома Pyxidium, Opercularia и Lagenophrys. Сходны рассуж
дения Штейна и Бючли. Эйсмонд (Eismond, 1890а, 1890b, 1895) не цитирует Кента, но фактически придерживается его схемы.
Низшие Endogemmina (Isochonidae) имеют простую коническую, почти пе сплющенную ПВ. У них нет парных лепестков, имеющихся у лобохопид, но часто развит непарный дорзальный щиток. Складки эпихона отсутствуют либо едва намечаются у отдельных видов изохон и трихохон. У цетохон утолщены стенки ПВ.
Простая коническая ПВ сохранена у большинства Actinichonidae (рис. 28); у них отчетливо выражена складка II, иногда и III. Защитный щиток развит у актинихон. У Kentrochonopsis ПВ растянута в стороны и, видимо, сплющена; описание Дофлейна плохое, в нем много неясного. ПВ Crassichona совершенно нетипична для хонотрих, напоминает ПВ экзогеммины Vasichona. Стенки ПВ крассихон резко утолщены, полость имеет вид не воронки, а узкого извитого канала, идущего в толще гелеоплазмы. Сохранен (но резко утолщен) щиток эпихона.
У Stylochonidae имеется тенденция к резкому сплющиванию ПВ, растянутой далеко в стороны, к развитию дорзальных складок и карманов (рис. 26—28). Складки еще слабо развиты у примитивных видов Stylochona-, у S. maxillaris различимы довольно глубокие складки I, III и IV, у Spinichona развиты все 4 складки, у Dentichona — обычно 2, реже 3—4. Эти роды имеют заметные карманы, отогнутые назад, как у гетерохон. У Flectichona ПВ крупнее, складки и карманы глубже, чем у стилохон; складка II, если имеется, развита слабо; левый карман ПВ крупнее правого — особенность, характерная для всех остальных стилохонид. Карманы относительно слабо выражены у Oxychona, Pardoxychona, Ctenochona, очень глубоки у Pterochona и Eriochona-, A rmichona сохраняет ПВ типа Flectichona. Гипохон ровный у всех родов, кроме Paraoxychona, где он несет две продольные складки, между которыми лежит сместившаяся с эпихона зона В предротовой цилиатуры.
Echinichonidae выделяются среди экзогеммин и хонотрих в целом отсутствием складок на гипо- и эпихоне. ПВ резко сплющена дорзо-вентрально, растянута в стороны, особенно у Echinichona-, у Eurychona едва различима складка III; у эхинихон она редуцирована. Края ПВ ровные и почти параллельные; боковых карманов нет (рис. 27, £)— это редкий случай упрощения ПВ в эволюции.
ПВ Inversochonidae имеет продольные вентральные складки, что для хонотрих в целом нетипично (рис. 28, В); это связано с инверсией зон РПА. Участок между складками вогнут внутрь ПВ. ПВ всегда сплющена дорзо-вентрально, относительно неширокая у Pleochona и растянута у остальных родов, особенно у Ceratochona. Эпихон у ряда инверсохонид ровный, лишен карманов и складок (Pleochona, Ceratochona, Inversochona) либо (у высших родов) несет небольшие складки (Kentrochona, Chonosaurus). Инверсия проявляется не только в расположении ресничных зон, но и в перемещении дорзальных складок на гипохон. Образуются широкие вентральные карманы ПВ, находимые, кроме инверсохонид, только у неродственных им родов Phyllochona и Paraoxychona. У большинства инверсохонид, кроме Ceratochona, произошло резкое утолщение слоя цитоплазмы на дне ПВ; рот высоко поднят, объем предротовой полости уменьшен. У Kentrochona robusta образуется и вентральный, и дорзальный щитки ПВ, у хонозавра — небольшой дорзальный щиток. У К. nebaliae, по Ромпелю, края ПВ ровные (если не считать шипов); Дофлейн рисует у вида ПВ всевозможных типов: складки отсутствуют либо расположены на одной или обеих стенках ПВ, обращены внутрь или наружу; они ограничивают добавочные или вторичные воронки на стороне, обращенной к субстрату.
В итоге при всем внешнем многообразии ПВ хонотрих нетрудно выявить ряд структурных особенностей, общих для всех типов ПВ. У всех хонотрих эпихон поднят над гипохоном, эта тенденция приводит к разрастанию именно эпихона, образующего парные или непарные щитки, лепестки, пластинки. В одной из групп (Spirochonidae) по мере роста пластинка свертывается спиралью, что повышает ее прочность. Гипохон, напротив, почти всегда ровный, иногда с вырезкой и лишь в одном случае (у Kentrochona robusta) со щитком. Коническая ПВ свойственна лишь наиболее примитивным экзо- и эндогемминам; у остальных родов она сплющена (только дорзо-вентрально) и растянута в стороны, особенно у эидогеммин. Гипохон поднимается прямо вверх, эпихон или его выросты наклонены к гипохону настолько, что иногда почти перекрывают предротовую полость; защитный аппарат развивается в ущерб питанию. У примитивных Lobochona появляются 4 складки эпихона, расположенные в строго определенных местах и разграничивающие три отдела дорзальной цилиатуры; мы находим их у большинства хонотрих (иногда недоразвиты определенные складки). Складки ограничивают осевой и два боковых дорзальных кармана, отогнутых назад; у эидогеммин лучше развит левый карман. Складки и карманы вторично утрачены только у эхини-хонид, сохранивших сплющенную ПВ. Вырезка гипохона без инверсии зон РПА наблюдается только у высших спирохонид, с инверсией — у Phyllochona, чаще у эн-догеммин (Paraoxychona и Inversochonidae)-, при инверсии цилиатуры зона В перемещается с эпихона на гипохон вместе с ограничивающими ее продольными складками. Роды с инверсией имеют вентральные, а не дорзальные карманы. Стабильное Отличие
Рис. 25. ПВ Crassichona insolita.
Рис. 26. ПВ эндогеммин. А — Stylochona maxillaris; В — Spinichona horrida; В — Stylochona glabra; Г — Carinichona globulus.
Рис. 28. ПВ эндогеммин. А — Pterochona pacifica; В — Actinichona gaucho; В — Chonosaurus rex.
эпихона от гипохона у большинства родов подтверждает правильность ориентировки хонотрих согласно правилу стомодексии: вполне логично, что именно на вентральной стенке пет защитных структур, препятствующих питанию (кроме шипов), и что эта стенка всегда ниже дорзальной. Особое развитие левого кармана, несущего часть ци-лиатуры, — также проявление правила стомодексии. В жизненном цикле ПВ пластична: возможна инволюция воронки при конъюгации (частичная редукция у макро-конъюганта и полная у микроконъюганта) и при диминутивном почковании.
РОТОВОЙ АППАРАТ
Рот хонотрих лежит на дне глубокой предротовой полости; в глубь тела отходит глотка, иногда обозначаемая как пищевод (Плате, Эйсмонд, Валленгрен, Дофлейн, Гийше). По Гийше, рот у Heliochona alternans и Chilodochona carcini 'имеет вид узкой щели, ограниченной двумя аргентофильными складками. У томита хилодохон найден рот, а не глотка. Рот у импрегнированных спирохон выглядит /-образным. Литературные данные по форме и положению глотки противоречивы, могут создать ошибочное представление, что у хонотрих имеется глотка самого различного типа. Авторы изображали широкую короткую глотку, не достигающую Ma (Heterochona — Кент; Kentrochonopsis — Дофлейн), либо короткую узкую глотку, заканчивающуюся у основания шейки (Heliochona — Гийше; Heterochona — Добжанская-Качановская; Spirochona — Штейн). По Мацудо и Мору, глотка доходит до заднего конца Ма у спирохон, энофорахон и гетерохон. Эйсмонд рисует у спирохон слишком длинную и широкую глотку, заканчивающуюся в нижней трети тела; она расширена в своей верхней и средней части, узкий нижний конец теряется среди вакуолей. Рентш изображает у гетерохон удлиненный спиральный «кишечник», переходящий в светлую полость у ножки (это ампула). По Кенту, гетерохона имеет очень широкую ресничную глотку и отходящую от нее тонкую трубку, но за глотку у гетерохон он принял контуры Ма, у стилохон — зародышевую камеру. Валленгрен рисует у гелиохонид длинную трубчатую глотку, доходящую до нижней трети тела, у хилодохон — очень короткую изогнутую глотку. По Эйсмонду, S-образная глотка спирохон начинается на дорзальной стороне тела, огибает сверху Ма и трофоплазму и идет под вентральной поверхностью. По Дофлейну, более резок изгиб глотки у кентрохон. Рот и глотка не изображены у всех байкальских спирохонид Сварчевским, Гаевская же приводит рисунок, даже отдаленно не напоминающий ротовой аппарат спирохон: рот начинается у основания шейки и ведет в широкую полость, достигающую середины ^ела. По Гийше, у спирохон имеется длинный пищевод, заканчивающийся вакуолью. Гертвиг, Плате и Пенар приняли за рот и глотку 5. gemmipara экскреторный канал, открывающийся на дорзальной поверхности тела у основания шейки и не имеющий контакта с полостью ПВ; настоящая же глотка имине показана, хотя ее легко увидеть. У Trichochona и Lobochona Мор и Мацудо изображают длинную трубчатую глотку, расширенную у нижнего конца Ма.
Удивительно, что после столь противоречивых литературных сведений мы обнаруживаем у всех изученных нами хонотрих совершенно однотипную глотку: совпадают •ее форма, относительная длина и направление. Полость ПВ постепенно сужается, но близ рта вновь расширяется, образуя характерный «атриум» (рис. 33, 3), — этим термином Корлисс обозначает небольшую полость между ртом и РПА нассулид. ПВ состоит как бы из двух полостей, ресничной (вестибулярной) и безресничной (атриальной). Рот лежит в глубине атриума; это участок, где прекращается сужение полости. От рта отходит тонкая длинная трубчатая глотка; стенки ее параллельны, расходятся лишь при заглатывании крупной пищи (диатомей, грибков, хлорофит), вероятно эластичны; нижний конец всегда расширен. Обычно глотка заканчивается у нижнего конца Ма либо несколько ниже; если ядро растянуто по горизонталй (Ceratochona) или смещено вверх (Crassichona), глотка заканчивается намного ниже его. Относительная длина глотки варьирует в зависимости от отношения длины тела к длине ПВ — глотка может заканчиваться и в передней трети, и в середине тела, но редко ниже. Рот лежит не строго по оси тела, а несколько смещен направо, что особо заметно у эндогеммин с плоской ПВ. Глотка направлена всегда направо и вниз, у эндогеммин — к сумке. Рот и глотка возникают на самой ранней стадии томитогенеза, однотипны у протомитов и трофонтов и, видимо, не замещаются при метаморфозе; ошибочны данные Гертвига о том, что эти структуры появляются лишь с началом метаморфоза осевшего томита, когда уже развита ПВ и трофонт в целом похож на взрослую форму. Окраска S. gemmipara нейтральротом показывает, что протомиты и томиты всегда лишены пищевых вакуолей (но имеют многочисленные гранулы вакуома); они образуются сразу же после оседания томита, еще до стадии распрямления особи и образования типичной ПВ — до стадии фиалохоны.
Гийше не нашла у хонотрих «буккальной арматуры» (немадесм глотки?). По Мору (Mohr, 1948), у Trichochona lecythoides цитостом хорошо очерчен 3—6 продольными фибриллами, отходящими назад. Фибриллы найдены также у видов Lobochona, Hete-
rochonan Oenophorachona (Mohr a. oth., 1963a; Matsudo a. Mohr, 1964, 1965, 1968). Однако немадесм такого типа, как у гимностомат, по было найдено на ультратонких срезах Lobochona prorates (Matsudo, 1967а). Нам пе удалось различить немадесмы у хопо-трих; скорее всего их нет, имеется цельная трубчатая глотка такого типа, как у Rhyn-chodida.
ПРЕДРОТОВАЯ ЦИЛИАТУРА
Приведем прежде всего сжатый очерк строения РПА инфузорий в целом: особенности строения РПА хонотрих легче понять, сравнивая его с таковым других инфузорий. РПА мог произойти от тигмотактических кинет простомат (рис. 29, А—Г). Мы различаем у цилиостомат три общих типа РПА (Янковский, 19676; см. рис. 29): кине-тофрагмон (фрагменты гаплокинет у рта), тетрахимениум (ундулирующая мембрана с гапло- или диплокинетой в основании и 3 мембранеллыс поликинетами — УМ-j-Mj,. М2, М3) и полихимениум (результат полимеризации мембранелл — УМ-^Мц М2, М3. . . М„). Способ стоматогенеза зависит от типа РПА, наличия послеротовых и других соматических кинет; можно различать соматический стоматогенез (фрагментация кинет), автономный монолокальный и мультилокальный (зачатковая группа кинетосом выделяется одной и более кинетами), независимый (зачатковую группу выделяет основание УМ или УМ-|-М3) и апокинетический (зачаток образуется без видимой связи с материнской цилиатурой). С утерей послеротовой соматической цилиатуры формы с кинетофрагмоном могут перейти к автономному стоматогенезу, формы с тетрахимениумом — к независимому, формы с полихимениумом — к апокинети-ческому. Апокинез (апокинетический морфогенез) всего кинетома, а не только ротового отдела свойствен почкующимся инфузориям, в частности хонотрихам; это не эпигенетический морфогенез, поскольку имеются безресничные кинетосомы, не собранные в ряды.
Недостаток большинства работ по кинетому — резкое разграничение соматической и предротовой цилиатуры: под предротовой понимают лишь особо сложный комплекс, лежащий у рта (тетра- или полихимениум). Это упрощает реальную картину дифференцировки кинетома. Мы различаем первичный и вторичный РПА инфузорий — кинетофрагмон, тетра- или полихимениум и особый вспомогательный отдел, служащий одновременно для движения и питания. Нет четкой границы между РПА и соматическим покровом; вторичный РПА легко распознать по топографии кинет, наличию адесмокинет и сгущению кинетосом в рядах. Вторичный РПА всегда примитивен — нет поликинет, мембран и мембранелл; он воспроизводится простым путем — при изгибе или фрагментации кинет либо при перегруппировке кинетосом. Если первичный РПА слишком удален от переднего конца тела или погружен и деятельность его может стать неэффективной, неизменно возникает вторичный РПА при изменении участка соматической цилиатуры. Онтогенез этого отдела всегда повторяет филогенез.
Предротовые полости следует различать по типу РПА, который они несут; мы различаем вестибулярную, буккальную и перистомальную полости (с кинетофрагмоном,. тетра- и полихименовым РПА). Если погружена лишь часть первичного РПА, лучше говорить о зонах, а не о полостях (у перитрих, тигмотрих). Независимо от типа РПА каждая зона делится на два отдела — наружный префундибулюм и внутренний ин-фундибулюм, различающиеся и по строению.
Ряд авторов говорит о наличии у хонотрих спирали мембранелл (АЗМ). Так,, по Калкинсу (Calkins, 1926), перистомальная зона с АЗМ закручена у хонотрих спирально. Догель с сотрудниками (1962а : 179) указывают: «У спиральноресничных (Spirotricha'j особое развитие получают не ундулирующие мембраны, а адоральные мембранеллы ... У Chonotricha, Hypotricha, Entodiniomorpha и Heterotricha спираль мембранелл закручена по часовой стрелке, тогда как у Peritricha она закручена в обратном направлении. Особенно подчеркнуто спиральное строение адорального аппарата у небольшой группы Chonotricha. У них на переднем конце имеется не только спираль мембранелл, но еще окаймляющая ее складка эктоплазмы, или губа, образующая у разных родов Chonotricha от 2г/2 до 5 оборотов». О нахождении у хонотрих АЗМ ранее говорил Ромпель, но это ошибка: за АЗМ у Kentrochona nebaliae им приняты адесмокинеты горизонтальной ресничной полосы. Валленгрен не нашел АЗМ у гелиохонид и хилодохон, но в его диагнозе хонотрих указано, что стенка ПВ усеяна мелкими ресничками, а иногда несет и венчик мембранелл (возможно, по Ромпелю). Бхатиа отмечает наличие параллельных ресничных рядов на дне перистома и отсутствие мембранелл, но в диагнозе Spirochonidae указывает, что перистомальная область с АЗМ закручена спиралью. Часто говорят об «адоральной ресничной зоне» (или спирали), не уточняя ее строения (Гаевская, Йировец и др.). По Раабе, хонотрихи — это формы со своеобразно устроенной двойной адоральной спиралью. По Калю, адоральная зона закручена вправо ко рту, но не состоит из поперечных мембранелл. По Андре, адоральная зона образована спиральной полосой мелких ресничек, но в его диагнозе спирохонид мы вровь читаем, что спиральная адоральная зона, продолжающаяся и в глотку, состоит из полосы
Рис. 29. Предротовая цилиатура инфузорий. А —Г — вероятный путь происхождения РПА; Д—О — типы стоматогенеза (соматический, автономный моно- и мультилокальный, независимый и апокинетический); П—С — кинетофрагмон; Т — тетрахимениум; У — полихимениум; Ф, X— адесмокинеты у Dexiotricha', Ц — общая схема организации РПА инфузорий (очерчен эффективный сектор).
ресничек или мембранелл. По литературе и нашим данным, у хонотрих нет ни нолики-нет и мембранелл, ни мембран, есть лишь гаплокинеты, несущие свободные реснички (рис. 30). РПА хонотрих соответствует вентральной цилиатуре дистериид, также лишенных поликинет и мембранелл, но сохраняющих три коротких мембраны кинетофра-гмона у рта. Ниже приведены результаты изучения РПА разных групп хонотрих.
Рис. 30. Предротовая цилиатура хонотрих. А — Oenophorachona urceolata; Б — Heterochona scheutenii (по: Dobrzanska-Kaczanowska, 1963); В — Heliochona sessilis (no: Wallengren, 1895); Г—Е — Cristichona pacifica', Ж — Lobochona prorates (no: Mohr a. oth., 1963a); 3, И — Heliochona alternans (no: Guilcher, 1951); К — Lobochona limnoriae с Камчатки; Л — Toxochona mira-bilis; M—П —.РПА Heliochonidae (H—П — no: Wallengren, 1895).
У импрегнированных Trichochona lecythoides Mop (Mohr, 1948) обнаружил два поля густых ресничек — горизонтальное поле с 24—32 кинетами на гипохоне и трапециевидное, обращенное основанием вверх, адоральное поле примерно с 20 диагональными кинетами на эпихоне, идущими под углом около 45°. Безресничная зона лежит правее адоральной. У томитов и молодых трофонтов число кинет в обеих зонах меньше, чем у взрослых форм. Мы обозначаем горизонтальное и диагональное поля как зоны А и В. РПА такого типа Mop (Mohr, 1959а) считает признаком отряда в целом; позднее (Mohr, 1966) он акцентирует внимание на двух типах РПА хонотрих, с двумя зонами (типа Stylochona) и якобы с одной ресничной полосой (Spirochona).
Зона В у Oenophorachona ectenolaemus намного крупнее, чем у остальных изученных форм (Matsudo a. Mohr, 1968; см. рис. 31, О); имеются две выемки, делящие зону на три отдела с 12, 3 и 8 кинетами; зона А содержит 8 кинет. У изученных нами энофо-рахон выемки нет, зона А содержит примерно 7—10 кинет, зона В — 20—22 кинеты (рис. 30, А). По данным Мора, у Lobochona prorates зоны А и В включают до 8 и 21 кинеты (рис. 30, Жу, у изученных нами других лобохон 7—10 и 15—19 кинет (рис. 30, К\ 31, Г—3-, 32, Д). Зона В несимметрична, сужается книзу. У трихохон зона А крупнее, смещена влево, а зона В меньше, чем у лобохон. Судя по нашему материалу, иногда наблюдается сгущение кинет в нижней части зоны В; кинеты зоны А у лобохон не дифференцированы. РПА Eleutherochona не описан, но скорее всего эта форма имеет ПВ и РПА такого типа, как у Lobochona.
На дне ПВ Heterochona scheutenii, по Штейну, лежит поле нежных, медленно движущихся ресничек; Шейтеном и Штейном показана лишь — при этом весьма неточно — зона В. Рентш рисует реснички зоны В и две группы ресничек вблизи рта, по краям атриума. Валленгрен рисует многочисленные реснички на эпи- и гипохоне гетерохон, не уточняя топографии кинет. Схема Добжанской-Качановской (рис. 30, Б) поразительно неточна. ПВ зарисована с дорзальной стороны, а цилиатура — так, как она видна с вентральной. Всю внутреннюю поверхность ПВ огибает полоса из трех кинет, заходящая на один из лепестков; неясно, контактирует ли эта полоса с зоной В. Такая цилиатура не была найдена Мором и Мацудо у всех изученных ими хонотрих. Н. psychra, по их данным (Matsudo a. Mohr, 1965), имеет около 4 и 13 кинет в зонах А и В; выше зоны А идет линия, не связанная с ресничками (рис. 32, В). Такую линию рисовал и Рентш.
У всех изученных нами видов Heterochona и Heliochona РПА однотипен и резко отличается от литературных схем. Валленгрен рисует у Н. sessilis РПА разного типа (рис. 30, В, Н—Н)', на общей схеме им показана единая полоса из 5 кинет, заканчивающаяся у основания левого лепестка. Гийше рисует у Н. alternans 5 кинет в зоне А и 6-в зоне В (рис. 30, 3), но пишет о том, что 4—6 рядов зоны А сгруппированы попарно. У Heliochonidae, по нашим данным, имеются не 2, а 3 зоны гаплокинет: зона А включает верхний и нижний отделы (А', А") примерно с 3—4 и 4—6 кинетами (рис. 32, А, Б). Кинетосомы зоны А' очень мелкие, тесно сближены; ряды почти вплотную прилегают друг1 к другу, полоса идет параллельно краю гипохона, заходя справа и слева на эпихон. Кинеты зоны А" дуговидные, состоят из крупных кинетосом, разрознены, асимметричны, не параллельны полосе А' и краю ПВ; длина их возрастает справа налево (Янковский, 19676). Зона В у гелиохонид обычного типа, крупная, с 18—22 концентрическими кинетами.
Литература по РПА Spirochona gemmipara противоречива. По Штейну, на дне ПВ много очень нежных ресничек, но на краю ПВ и в завитке их нет, что неверно. Гертвиг рисует единую полосу с большим числом (около 14) кинет, огибающую гипохон, переходящую в завиток и в зону В (рис. 100, К—М). Эйсмонд (Eismond, 1890а, 1895} дважды публикует один и тот же рисунок спирохоны, но с разными РПА (рис. 101, К, МУ, на первом показана вентральная полоса из 4 гаплокинет (в тексте говорится о 4—6 рядах), продолжающаяся без сужения и в завитке; на втором видно уже 8 вентральных рядов и 6 рядов в завитке. Пенар впервые рисует неконтактирующие зоны А и В, но не показывает кинет в завитке и карманах ПВ (рис. 101, Б, By, зоны содержат 7 и 10 кинет. Подчеркивается, что у спирохон нет «поперечно исчерченной спирали», как у перитрих. Сварчевский не изучал РПА байкальских спирохонид; реснички изображены им лишь у Cavichona elegans — не только в завитке, но и на колюмелле, что неверно. У Cavichona sp. Гаевская рисует лишь 3 кинеты, идущие на больших расстояниях друг от друга по стенкам ПВ и в завитке. Каль находит у спирохон короткие простые ряды свободных ресничек, не идентичные мембранеллам Spirotricha', им изображены горизонтальные (вместо диагональных) кинеты в зоне В, идущие до вершины эпихона, и отдельные реснички правее и левее рта (рис. 101, А); в тексте говорится о многочисленных рядах на дне ПВ. Многие авторы (Бок, Кудо, Джен и др.), следуя,, вероятно, Калю, говорят о ресничной зоне на дне ПВ у хонотрих. Гийше, изучавшая импрегнированных спирохон, приводит две несовпадающие схемы (рис. 33, А, Б); кроме зон А и В, ею обнаружены 4 коротких фрагмента выше рта спирохон, не отмеченные ею у гелиохон и хилодохон. У Spirochona halophila Мацудо и Мор нашли две зоны кинет с 5 и 10 рядами (рис. 33, ,Е).
РПА изучен нами у большого числа спирохонид; это однотипный комплекс с двумя зонами кинет, А и В. Зона А включает, как и у лобохонид, обычно 7, иногда 8—9 кинет (рис. 31—33), идущих единой полосой на большом удалении от края гипохона. Нетрудно различить два дифференцированных отдела (А', А") в полосе А: 3 верхних ряда несколько обособлены от 4—6 нижних, их кинетосомы лежат на особой площадке,, на 30° отклоненной от плоскости остальных рядов (рис. 33, Ж). Все кинеты зоны А подходят к основанию завитка, заканчиваясь в нем на разных уровнях; в завиток входят именно 3 верхних ряда (полоса А'). Полоса А не контактирует с зоной В. Последняя занимает значительную часть эпихона, смещена ко рту и не достигает вершины ПВ; 19—22 кинеты лежат в неглубоком осевом кармане (рис. 34, В, Г). Зона В имеет
Рис. 31. Предротовая цилиатура хонотрих. А— В — схемы цилиатуры хонотрих и гипостомат (Б — по: Guilcher, 1951); Г—3 — РПА Lobochona limnoriae (Г—Е) и L. tenue (Ж, 3); И — РПА Cavichona laticollis; К—М — эффективный сектор РПА хонотрих; Н — вероятные токи воды в ПВ; О — зона В энофорахон (до: Matsudo a. Mohr, 1968); П, Р — зона В в онтогенезе Cavichona protecta', С — цитопиг гетерохон (по: Wallengren, 1895); Т—Ч — РПА лобохон (Т), гелиохон (У), филлохон (Ф), хилодохон (X), эхинихон (Ц) и коронохон (9).
Рис. 32. Предротовая цилиатура хонотрих. А, Б — Heliochona sessilis; В — Heterochona psychra (по: Matsudo a. Mohr, 1965); Г — Cristichona pacifica; Д — Lobochona limnoriae из Белого моря; Е — Ceratochona scandens; Ж — Spirochona globulus.
6 Заказ № 213
угловатый контур, кинеты удлинены в ее средней части, укорочены в верхней и нижней частях. У молодых трофонтов число кинет меньше, чему взрослых (рис. 31, И, П, Р).
У Chilodochona qvennerstedti Валленгрен изображает широкую и глубокую -ПВ с 26 кинетами, образующими крупное ресничное поле. Форе-Фремье и Гийше находят у Ch. carcini полосы «равноресничного» типа, правую и левую, пе уточняя топографии кинет. На одном из рисунков Гийше видно 12 рядов в зоне А, на другом — по 40 кинетосом на обеих стенках ПВ. На снимке Форе-Фремье видно 12 рядов в зоне А и 30 ки-
Рис. 33. Предротовая цилиатура хонотрих. А, Б — Spirochona gemmipara (по: Guilcher, 1951); В — Trochilioides littoralis; Г, Д — Serpentichona anthus; Е — Spirochona halophila (no: Matsudo a. Mohr, 1968); Ж — положение кинетосом на гипохоне спирохонид; 3 — предротовая полость (а) и атриум (б) хонотрих.
нетосом в зоне В; однако неясно, контактируют ли эти зоны. По нашим препаратам, у Vasichona paguri кинеты полимеризованы — видно примерно 32 ряда в зоне А и 26 в зоне В; зоны контактируют в районе складки II (рис. 93, Д), но, видимо, нет контакта с другой стороны зон. У Ch. aranei мы насчитали 25 кинет в зоне А, 17 в зоне В; хотя бы часть первых контактирует с кинетами зоны В справа, но не слева от зоны В. Создается впечатление, что ряды зоны А переходят непосредственно в ряды зоны В. Кинеты занимают у этого вида почти всю поверхность ПВ, вплоть до ее вершины.
Toxochona имеет такой же РПА, как Oenophorachona, с двумя цельными полями ресничек (рис. 30, Л). Филихониды близки к Lobochona и, вероятно, сохраняют тот же тип РПА. РПА Phyllochona резко отличается от всех рассмотренных выше схем, состоит из трех неконтактирующих зон. Зона В у филлохон обычного типа, но очень крупна.
Зона А изменена: вместо горизонтальной полосы видны две пластинки кинетосом иа дне боковых карманов.
РПА Endogemmina изучен в литературе намного хуже, чем РПА экзогеммип. У Trichochona Мор обнаружил простой двухзональный РПА такого же типа, как у лобохо-нид. Ромпель отмечает у Kentrochona широкую и глубокую глотку с ресничками, одиночные реснички на стенках ПВ и поперечно исчерченную полосу вдоль нижнего края ПВ, принимая ее за АЗМ, фильтрующую пищевые частицы. При действии фиксаторов, по Ромпелю, мембрапеллы не распадаются на одиночные реснички. Дофлейи не заметил порядка в расположении ресничек кентрохон, но указал, что это одиночные рес-
Рис. 34. А— Д — предротовая цилиатура хонотрих: А — Isochona mtgratoria,. Б — циамихона, В — Cavichona sp. с Eulimnogammarus murinus, Г — С. cincinnata, Д — Heterochona coronata\ Е — вероятный путь токов воды у спирохонид; Ж, 3 — имитация ПВ у «.Spirochona» [Glossatelia] tintinnabulum, нички, а не мембранеллы. Единственные реснички у Kentrochonopsis были обнаружены им на стенках «пищевода». За мембранеллы Ромпель принял адесмокинеты.
По нашим материалам, у низших эндогеммин (Isochontdae) наблюдается полимеризация кинет в полосе А. Полоса эта, вероятно, цельная у форм с циамид, копепод и ам-фитоид, как и у близкой к ним экзогеммины Oenophorachona, но зона В имеет вид узкой вертикальной полоски на эпихоне, смещена влево и контактирует там с одним из концов полосы А. У форм с небалиид, на которых идет дальнейшее эволюционное развитие эндогеммин, продолжается редукция зоны В, вторично сдвигаемой вправо и теряющей контакт с зоной А; последняя расслаивается на два отдела: верхний (А') — с 6—7 кинетами с мелкими, тесно сближенными кинетосомами и нижний (А") — с 5—7 горизонтальными разрозненными рядами крупных кинетосом; эти ряды обычно плохо видны и зарисованы нами не у всех эндогеммин. В линии Oenophorachona—Isochona с амфитоид—Isochona с небалиид происходит, вероятно, сначала полимеризация кинет зоны А, затем расслоение зоны на два отдела. Менее вероятна вторая альтернатива,, что зона А" появилась de novo в дополнение к зоне А'. Зона А" сохраняется без особых изменений у всех эндогеммин, прерываясь у форм с инверсным РПА. Зона В резко, уменьшается у видов Isochona, едва различима у I. peltifera и I. rotundala. Каринихо-
нины имеют довольно крупную зону В (рис. 30, Г—Е; 32, Г); у Actinichona эта зона вновь очень мелкая. Резкое укрупнение и изменение структуры ПВ у Crassichona не сопровождались существенным изменением РПА — видны обычные зоны А', А" и В.
ПВ Stylochonidae вместе с зонами А' и А” резко растянута в стороны; зона В остается непропорционально мелкой, рудиментарной — это узкая полоска, толщиной в 2—3 кинетосомы. Несмотря на ее мелкие размеры, обычно хорошо развит осевой карман ПВ. Инверсный РПА мы находим у Р araoxychona inversa: необычно широкая, прямоугольная зона В (вторичная полимеризация?) смещена на гипохон и прерывает полосы А' и А”; эпихон остается без цилиатуры.
Echinichonidae имеют ровную, почти без складок ПВ, и редукция зоны В видна здесь особенно наглядно. При резком укрупнении ПВ Echlnichona эта полоска осталась мелкой, а зона А удлинилась. Inversochonidae произошли, видимо, от форм типа Isochona pleonicola, с зоной В, которая еще не стала рудиментом; она сохраняется без особых изменений у всех родов семейства. Зона А', с 7 тесно сближенными рядами мелких кинетосом, идет вдоль края ПВ; зона А", с 7 рядами крупных разрозненных кинетосом, лежит в глубине ПВ. Полоса В переместилась с эпихона на гипохон, разорвав надвое обе вентральные полосы. Эпихон практически лишен складок и цилиатуры, ровный, но тем не менее полосы А' и А” здесь не удлинены.
Реснички Lobochona prorates имеют типичную ультраструктуру — 9 пар периферических фибрилл и 2 центральные фибриллы (Matsudo, 1966, 1967а). По Мору (Mohr, 1948), ресничные ряды у трихохон занимают около 3/4 внутренней поверхности ПВ; реснички очень короткие (3—4 мк), лежат целиком внутри ПВ высотой до 21.5 мк. Короткие реснички, не достигающие края ПВ, изображают Штейн у спирохон, Дофлейн — в «пищеводе» Kentrochonopsis, Рентш — у гетерохон и т. д.; часто указывается, что реснички хонотрих лежат на дне ПВ. Доне рисует у элейтерохон длинные реснички, далеко выходящие за края ПВ на одних рисунках и резко укороченные на других, но, видимо, только Дофлейн различает внутри ПВ два типа ресничек — сильные, удлиненные у краев и мелкие, тесно сближенные в глубине ПВ; первые создают водоворот и подгоняют частицы пищи ко вторым. По Мору и Мацудо, реснички горизонтального поля бьют по направлению к диагональному полю, реснички диагонального — ко рту. Скорость биения ресничек у трофонтов и томитов гетерохон, по Добжанской-Качанов-ской, одинакова, их движение медленное и вялое. По Гертвигу, реснички у спирохон также малоподвижные и слабые, движение их неправильное, значение завитка для питания ограничено — это лишь несовершенный заменитель ресничного диска перитрих. Поскольку цилиатура слабая и глубоко погружена, спирохоны не могут заглатывать крупные частицы; вакуоли водянистые либо содержат мелкие частички. По Калю (Kahl, 1933), хонотрихи и перитрихи питаются только бактериями. Пенар говорит об очень коротких и тонких ресничках в ПВ Spirochona gemmipara.
По нашим наблюдениям, реснички в ПВ хонотрих всегда имеют равную длину, несмотря на дифференцировку отделов РПА, и в целом довольно длинные (6—9 мк). Кинетосомы, видимо, двух типов — очень мелкие в рядах зоны А' и крупные в зонах А" и В; у форм с единой вентральной полосой кинетосомы не дифференцированы. Тельца обычно тесно сближены, реснички собраны в густые пучки. Только у аберрантной Phyllochona все реснички погружены, не достигают вершины ПВ; обычно же у хонотрих погружены респички зоны А" и нижиих рядов зоны В, остальные настолько длинны, что высоко возвышаются над краем ПВ, компенсируя тем самым утрату у хонотрих наружной предротовой цилиатуры. Реснички зоны А направлены обычно вверх, зоны В — вбок. В завитке спирохонид реснички погружены, отходят от основания колюмеллы.
На гематоксилиновых препаратах Trichochona Мор находит более простую, чем у перитрих, систему фибрилл, связанных с ресничными полями: параллельные фибриллы, соединяющие кинетосомы в зонах А и В, группу продольных фибрилл, ограничивающих глотку, и короткие коннективы в зоне рта, соединяющие ресничные поля с фибриллами глотки. В зонах псевдо- и инфракинет на поверхности тела и внутренних стенках ПВ кинетодесмы обычными методами импрегнации найдены не были. По электронно-микроскопическим данным Мацудо (Matsudo, 1967а, 1967b), инфрацилиатура Lobochona prorates не подчиняется правилу десмодексии: кинетодесмы лежат под кине-тосомами, а не правее их, что наблюдается почтиЗу всех инфузорий. L. prorates—не исключение из правила десмодексии, поскольку оно предложено Шаттоном и Львовым для соматической, а не для предротовой цилиатуры и не для псевдокинет, структура которых видоизменена.
У хонотрих встречается особый вид рядов, названных нами ранее «адесмокине-тами». Это вторичные ряды, образованные не изменением топографии первичных рядов (продольных, связанных кинетодесмой), а перегруппировкой кинетосом в них (рис. 29, Ф, X). Кинетосомы группы соматических кинет располагаются на одном уровне, так что образуется поперечный или диагональный ряд, в котором базальные гранулы соединены кинетодесмой. Гелей называл такие ряды «ложными ресничными рядами» (термин неудачен, поскольку это все же ряды ресничек), Дражеско — «псевдомембра-
пелламп»; Эрот вводит термин «паратены». Адесмокипеты образуются в отделах кине-тома, служащих по столько для движения, сколько для питания или тигмотаксиса. Они весьма широко распространены у инфузорий, от низших форм типа Holophrya до высших спиротрих; у парамеций, к примеру, они образуют очень сложный комплекс, имитирующий АЗМ. Хотя адесмокипеты никем не описаны у хонотрих, они характерны и для этой группы. «Система мембранелл», найденная Ромпелем у Kentrochona, — это несомненно адесмокипеты зоны А'. Адесмокинет нет в зоне В у хонотрих, но они обычны в зоне А; так, у спирохонид в зоне А вместо 7 горизонтальных рядов можно видеть часто большое число коротких параллельных вертикальных рядов с 7 ки-нетосомами в каждом либо правильную «решетку» из кинетосом (рис. 20,71). Такие ряды обычны и у эндогеммин, включая высшие формы (стилохониды, инверсохониды). При горизонтальном положении рядов гипохона, очевидно невыгодном для хонотрих, РПА может быть существенно видоизменен путем простой перегруппировки кинетосом в рядах без изменения топографии последних. Образуется подобие кинетофрагмона три-хостомат или АЗМ спиротрих.
Внешне РПА хонотрих не напоминает столь сложные комплексы, как тетра- и полихимениум: нет мембран, поликинет, мембранелл; в строении их, однако, оказывается сходным припцип расположения компонентов РПА относительно рта. Почти всегда у инфузорий активные компоненты РПА лежат левее рта, менее активные и пассивные — правее. Зону расположения активных компонентов РПА (рис. 29, Ц) мы называем «эффективным сектором», а сам принцип расположения активных ресничных структур левее рта — «правилом стомодексии». Это такое же общее правило, как и правило десмодексии. В принципе любой РПА любой группы инфузорий соответствует схеме на рис. 29, Ц: рот расположен между пассивным барьером и активным левосторонним комплексом, представленным обычно серией адесмо-, гапло- или поликинет.. Сравним с этой схемой РПА хонотрих (рис. 31, К—Н). Ко рту ведет «классическая» серия метамерных диагональных кинет. Непосредственно правее рта нет барьерной системы (хотя у гипостомат здесь расположена группа фрагментов с мембранами; возможно, она будет обнаружена и у хонотрих). Ток воды с пищей подходит ко рту слева; роль барьера могут выполнять высокие стенки ПВ, облегчающие создание вортекса и: не позволяющие частицам, попавшим в полость ПВ, проноситься мимо рта. РПА хонотрих удовлетворяет правилу стомодексии, хотя это апикальный комплекс. Рот лежит обычно не строго по оси тела, как на схеме Мора и Мацудо, а смещен вправо, как на схеме Гийше. Одно из проявлений правила стомодексии у хонотрих — тенденция к укрупнению левосторонних ресничных структур, лежащих в эффективном секторе (рис. 31, К—М): у спирохонид этот отдел закручен спиралью, у высших эндогеммин левый карман , ПВ крупнее правого.
Правило стомодексии впервые позволяет найти объективные критерии для различения у хонотрих (как и у других сидячих форм) вентральной и дорзальной стороны тела. Поскольку рот апикален, эти стороны обозначались ранее произвольно: вентральной называли то сторону, обращенную к субстрату, то противоположную, нередко отмечая условность понятий. По правилу стомодексии, при рассматривании инфузорий с' вентральной стороны тела рот должен лежать правее особо сложных, обычно метамерных ресничных рядов, концентрически расходящихся от рта; следовательно, у хонотрих вентральной нужно назвать сторону, при рассматривании с которой РПА лежит так, как на рис. 29, Ц. Это сторона, противолежащая субстрату, а не прилегающая к нему, что вполне логично, поскольку субстрат нужен лишь для прикрепления, а не является источником пищи. Вентральная стенка ПВ (гипохон) обычно ниже дорзальной (эпихона), может нести шипы, но лишена защитных выростов (щитков, лепестков, завитков), препятствующих питанию. Зона В лежит обычно на эпихоне; миграция ее на гипохон не противоречит правилу стомодексии, поскольку сохраняется левостороннее положение кинет по отношению ко рту.
В целом у хонотрих мы смогли различить 8 типов РПА (рис. 31, Т—Д): типа цилиатуры родов Lobochona (с единой полосой A), Spirochona (зона А' несколько обособлена от остальных кинет полосы А и закручена спиралью в завитке), Heliochona (зона А разделена на две далеко отстоящие зоны А' и А", последняя с асимметричными кинетами разной длины), Stylochona (кинеты в зонах А' и А” полимеризованы, в последней симметричны, параллельны; зона В рудиментарна), Inversochona (зона В смещается с эпихона на гипохон, разрывая зоны А' и A"), Chilodochona (кинеты зон А и В полимеризованы, занимают всю внутреннюю поверхность ПВ, контактируют в зоне складки II), Trichochona (зона А единая; в зонах А и В кинеты полимеризованы, зона В смещена влево и контактирует с зоной А) и Phyllochona (зона А разорвана надвое и оставшиеся ряды погружены на дно карманов; зона В крупная, лежит на эпихоне).
К какой категории следует отнести РПА хонотрих, что в этом комплексе является первичной и что вторичной цилиатурой? Авторы находили ранее только две зоны ки-. нет, А и В; Гийше открыла третью зону — фрагменты кинет между ртом и правым концом зоны А у спирохон. Обозначим эти фрагменты как зону С; она не соответствует зоне А", которую мы нашли у многих хонотрих. Мы не видели зону С у живых, фикси-
роваппых п окрашенных хонотрих, ио едва ли эта зопа представляет собой артефакт или аргентофильные складки кутикулы: именно в этом месте у предков хонотрих, Ну-postomatida, лежит кинетофрагмон — 3—5 коротких поперечных рядов с мембранами (рис. 31, В; 33, В). Поскольку фрагменты найдены у одного из высших родов хонотрих (Spirochona), можно ожидать паходки их и у остальных родов; вероятны находки фрагментов и у томитов, так как трофопты сохраняют почти неизмененной пх цилиатуру. У гипостомат в эффективном секторе расположены верхние отделы правых и левых соматических кинет (рис. 29, П—С)', у хонотрих, по крайней мере у спирохон, сохранена первичная предротовая цилиатура (кинетофрагмон зоны С), в качестве же вторичной функционирует вся вентральная соматическая цилиатура, без изменений унаследованная томитами от гипостомат. Зона В у хонотрих соответствует левосторонним соматическим кинетам гипостомат (рис. 31, А—В), зона А' — трем удлиненным правым кинетам, зона А в целом — послеротовым и правосторонним рядам предка. У примитивных хонотрих произошла, по сравнению с предковыми дистериидами, полимеризация кинет в зоне В, но не в зоне А. Поскольку у хонотрих произошла переориентация сторон тела (рис. 29, Ц; 31, К), эффективные секторы гипостомат и хонотрих не совпадают: у последних сектор включает не концы зон А и В, а всю зону В и нижний (не верхний, как у гипостомат) конец зоны А. Кинетофрагмон (зона С) оказывается лежащим справа, а не слева от рта, и в соответствии с правилом стомодексии не усложняется в эволюции хонотрих, играя роль барьера.
Корлисс (Corliss, 1959, 1961, 1967) и вслед за ним Лепши говорят о наличии у хонотрих вестибулярной цилиатуры, поскольку она происходит от поля вентральных ресничек томита; буккальной и соматической цилиатуры у хонотрих нет, рту предшествует только вестибулюм с цилиатурой соматического происхождения. РПА хонотрих действительно состоит из фрагментов кинет и погруженного отдела соматической (вторичной предротовой) цилиатуры, как и у трихостомат. ПВ хонотрих, таким образом,— это вестибулярная полость с кинетофрагмоном (первичный РПА) и целыми погруженными соматическими кинетами (вторичный РПА).
ПИТАНИЕ ХОНОТРИХ
Фенхель делит эпибионтов Gammarus на 4 группы: суспензиотрофы, или седимен-таторы (в частности, хонотрихи), альгофаги, хищники и паразиты. По литературе и нашим данным, хонотрихи питаются органическими частичками, бактериями, грибками, кусками нитчатых багряных и зеленых водорослей, диатомеями, клетками и тканями добычи хозяина, его пигментом; это всеядные формы. В опытах они заглатывают частицы кармина, графита (Фенхель) и туши, хотя и не столь активно, как сувойки и парамеции в той же суспензии.
Нитчатые багрянки (Bangia sp.?), в массе усеивающие щетинки придатков Amphithoe и стебельки трихохон, составляют, по Мору, «основную и почти единственную пищу» Trichochona lecythoides. Фрагменты нитей видны в пищевых вакуолях, лишенных четкой мембраны; в одной Особи отмечен панцирь диатомеи. Heliochona sessilis, по Валленгрену, питается «диатомеями или водорослями», очевидно беспанцирными; в вакуолях Heterochona scheutenii Фенхелем найдены в основном диатомовые и другие водоросли. Аль-гофагия отмечена и у цетохон с циамид: «У некоторых особей видны водоросли такого же типа, какие растут на них или поблизости» (Mohr a. oth., 1963b : 121). По Мору, «в цитоплазме Lobochona prorates, в отличие от Trichochona, не наблюдали непереваренной пищи; однако в воронке были видны нитчатые водоросли, множество' которых росло на щетинках плеопод Limnoria» (Mohr a. oth., 1963а : 231). Нитчатки и остатки грибков найдены в вакуолях L. prorates в световом и электронном микроскопе (Mohr a. oth., 1963а; Matsudo, 1966, 1967а). Эти данные могут создать представление, что водоросли, особенно диатомовые, — основная пища хонотрих; на наших же препаратах названных и других родов особи с водорослями, особенно с диатомеями, встречаются лишь как исключение. Содержимое вакуолей обычно мелкозернистое, бесцветное, с обилием жидкости. Виды с литоральных байкальских гаммарид Gmellnoides, Eulimnogammarus и Pallasea, живущих в сгустках нитчатки Ulothrix zonata, лишь в редчайших случаях заглатывают частички водорослей. Вероятно, водоросли могут составлять основную пищу немногих локальных рас, но обычно они заглатываются лишь случайно.
Мацудо (Matsudo, 1967а) упоминает мельком о находках «остатков грибков» в вакуолях Lobochona prorates', возможно, это грибки, обычно развивающиеся на стенках ходов лимнорий. Жабры амфипод и придатки небалиид иногда покрыты массой нитей эпизоотического грибка; отдельные виды Cavichona (С. elegantula, С. acanthogammart, С. virgata) активно питаются спорами грибка, которые заполняют иногда все тело особи и не заключены в видимые (жидкостные) вакуоли. Споры грибков, видимо, активируют фагоцитоз у хонотрих — такая активация при добавлении дрожжей известна у парамеций. Однако споры не заглатываются большинством байкальских спирохонид, хо-иотрихами с тихоокеанских Л nisogammarus и Nebalia.
У живых и фиксированных хонотрих часто нот или почти пет включений в вакуолях. По Штейну, Spirochona gemmipara имеет лишь мелкие вакуоли с водой и единичными мелкими частичками, без крупных включений. По Гертвигу, поскольку респички у спирохоны мелкие, могут заглатываться лишь мелкие частички; они свободно лежат в цитоплазме или заключены в водянистые вакуолп. В клетке много и водных вакуолей без пищи. У спирохон, по Эйсмонду, пищевых вакуолей нет, но в цитоплазме можно обычно видеть до 40 водянистых вакуолей; имеются лишь «зернышки пищи», иногда желтоватые или буроватые, не заключенные в вакуоли. По Гийше, S. gemmipara отличается от хилодохон отсутствием крупных пищевых включений; окрашивается лишь серия мелких вакуолей. По нашим данным, в пищевых вакуолях спирохон и других хонотрих часто действительно нет включений, поскольку они заглатывают жидкость из среды. Во многих вакуолях, однако, нейтральрот окрашивает пищевые включения (бактерии).
По Валленгрену, Chilodochona на ротовых частях крабов питается клетками и даже кусками тканей добычи хозяина; в вакуолях красится хроматин яДер этих клеток. .Дофлейн говорит о питании кентрохон «органическими частицами» из пищи хозяина. По Гийше, Ch. carcini питается той же пищей, что и крабы, заглатывая лишь круглые частички диаметром в несколько микрон и слегка деформированные более крупные куски; последние не заключаются в видимую вакуоль, остаются непосредственно в цитоплазме, и, накапливаясь, делают ее темной. Пищеварение происходит медленно. На изолированных придатках Ch. carcini охотно ест суспензию печени и семенников. Крабы питаются, однако, не беспрерывно; в промежутках между питанием хозяина хонотрихи должны заглатывать обычную пищу, очевидно бактерий. У хилодохонид мы часто обнаруживали клетки в пищевых вакуолях, но у эидогеммин с максиллулы Nebalia и у экзогеммин с гнатопод и максиллипед гаммарид мы находили лишь светлые вакуоли с жидкостью, мелкими частичками или диатомеями, хотя эти придатки разрывают ткани добычи. На ротовых придатках Crustacea живет в целом небольшой процент видов хонотрих, большинство удалено от рта, заселяет переоподы, плеоподы, жабры, антенны, панцирь рачков. Максиллула Nebalia несет целый комплекс эидогеммин, но почти все они расположены на щупике, далеко удаленном от рта. Отметим, что Chilodochona заселяет на крабах не те придатки, которые расщепляют добычу, а лишь наиболее подвижные, находящиеся в непрерывной осцилляции ротовые части, непосредственно у рта или в жаберной полости (максиллулы, мастигобранхи максиллипед). Ясно видна зависимость хилодохон от непрерывного тока воды.
Необычна пища хилодохон с чилийских крабов Cancer plebejus и Ovalipes punctatus: .большинство трофонтов (более 1000), осмотренных Мором и Мацудо, имели в цитоплазме гранулы красного пигмента такого же типа, как у хозяина; клематохоны с ротовых придатков мизиды Gnathophausia ingens содержали в клетке темно-синий пигмент хозяина. Неясно пока, каким образом он заглатывается.
Нейтральрот окрашивает у инфузорий гранулы вакуома (пищеварительные тельца); обычно они скапливаются у глотки, плотным слоем окружают пищевую вакуоль и постепенно исчезают, входя в нее. У Ch. carcini нейтральрот окрашивает, по Гийше, только пищевые вакуоли — в вишневый, красный, розовый и оранжевый цвет, т.. е. pH кислая и нейтральная. У Spirochona gemmipara мы окрашивали в малиновый и оранжевый цвет пищевые вакуоли и редкие (несколько десятков в клетке) гранулы вакуома, не скапливающиеся в зоне глотки или на вакуолях. В оранжевый цвет, красятся и секреторные ампулы томитов.
Валленгрен рисует у Heterochona крупный дорзальный карман (цитопрокт) у основания шейки. Ранее Гертвиг, напротив, принял эту полость у спирохон за рот и глотку. Цитопрокт найден нами у всех изученных видов гелиохонид и спирохонид. С наружной средой он сообщается постоянно открытым дорзальным отверстием, часто содержит экскреторные частицы.
Обитание на ракообразных выгодно для хонотрих: рачки живут в среде, богатой пищевыми частицами, часть которых при движении или питании рачка поступает к хонотрихам; даже у неподвижных непитающихся особей беспрерывно работают плеоподы и жабры, создавая ток частиц. Покровы рачков часто загрязнены, покрыты сгустками диатомей, бактерий, грибков. По способу питания среди хозяев хонотрих различимы всеядные, альготрофные, ксилотрофные формы, хищники, эктопаразиты и дет-ритофаги (седиментаторы). Последние, судя по описаниям ряда авторов, создают столь эффективный ток воды, что хонотрихам нет необходимости создавать значительный дополнительный вортекс в предротовой зоне каждой особи.
По Мору, существование хонотрих зависит от их локализации в течениях, создаваемых придатками хозяина. Хонотрихи располагаются неизменно на тех придатках, которые лежат вдоль потоков, уносящих пищевые частицы изо рта хозяина. Это объясняется слабой ротовой цилиатурой у хонотрих: в отличие от вортекса у вортицеллид или тинтиннид, вортекс у хонотрих невелик и действует лишь в потоке частиц. Особенно слаб пищевой вортекс у стилохонид, спирохонид и других групп без полимеризации кинет; у хилодохонид вортекс должен быть несколько сильнее.
Косвенная роль хозяев в питании хонотрих очевидна. Фенхель показал, что гелио-хониды и Zoothamnium на изолированных придатках гаммарид поглощают меньше частиц кармина и графита, чем на живых рачках. Использование токов воды, создаваемых хозяином, обозначается им как «энергетический комменсализм» (экономия энергии, расходуемой на создание вортекса). Цилиатура хонотрих слишком слаба, чтобы обеспечить, к примеру, поднятие с субстрата диатомовых и других водорослей; между тем эти водоросли составляют, по Фенхелю, основную пищу гелиохонид. Вследствие несовершенства РПА хонотрихи не могли бы питаться без косвенной помощи хозяина. Несовершенство РПА заключается в небольшом числе кинет, их простой структуре (пет поликинет, мембран и мембранелл) и погруженности в ПВ. Хонотрихи — единственная группа инфузорий без наружного РПА; обычно же у инфузорий погружается лишь часть РПА, а если погружается весь РПА, то образуется вторичная наружная предротовая цилиатура. У перитрих, к примеру, тетрахимениум подразделен на наружный и погруженный отделы. Потеря наружного РПА у хонотрих стала возможной именно вследствие обитания их на участках рачков с постоянным притоком пищи. Тот факт, что по мере эволюции РПА хонотрих не усложняется, а, напротив, иногда упрощается (у эндогеммин), также говорит о большой роли хозяев в питании комменсалов.
Нельзя забывать и об особенностях структуры РПА, полезных для хонотрих. Перитрихи и стенторы питаются не беспрерывно, они легко сократимы, надолго прекращают питание при движении и при малейшем раздражении. В период деления РПА также реорганизуется и питание прекращается. Хонотрихи же неподвижны, несократимы, питаются непрерывно, даже в период почкования. ПВ хонотрих очень крупна, нередко шире тела, высота ее может быть равной длине тела либо ненамного короче тела. Соответственно у хонотрих очень велика зона, занятая предротовыми ресничками. Реснички в кинетах многочисленны, сближены между собой; в зонах А' и В сближены и сами кинеты, образующие широкие ресничные поля. Благодаря погружению РПА эффективна каждая ресничка, что не характерно для других инфузорий, к примеру для спиротрих и перитрих. ПВ хонотрих — превосходный улавливающий аппарат: наличие высоко поднятых стенок и погруженность ресничек не позволяют пищевым частицам проноситься мимо рта. Отсутствие наружного РПА компенсируют реснички верхних рядов зон А и В, выходящие за край ПВ. С увеличением размеров РПА у других инфузорий (например, при удлинении полосы мембранелл) удаленная от рта часть РПА оказывается малоэффективной, часто служит уже не для питания, а для плавания (у олиготрих), тигмотаксиса (у гипотрих); у нассулид дорзальный отдел АЗМ. превращен в опорный обруч. Такая смена функций невозможна у хонотрих: при любых размерах ПВ реснички остаются погруженными и служат лишь для питания. Все частички, попавшие в воронковидную полость с высокими стенками, «сортируются» и либо направляются ко рту, либо отбрасываются; удаленные от рта (верхние) реснички, вероятно, столь же эффективны, как и нижние. Все перечисленные особенности во многом компенсируют простоту строения РПА хонотрих; поскольку в эволюции нет заметного усложнения РПА, он должен вполне «устраивать» хонотрих. ПВ, судя по опытам Фенхеля, функционирует и без токов воды в окружающей среде (о чем говорит и находка хонотрих на водорослях), но особо эффективна при наличии течений с пищевыми частицами, которые создают хозяева.
Плате и Каль отмечают, что питанию Heliochona sessilis способствуют маргинальные шипы ПВ: только наиболее мелкие из отфильтрованных частиц пищи могут пройти сквозь сито из шипов и достичь глотки. Это несомненно неверно: многочисленные изогнутые шипы и лепестки ПВ у гелиохон перекрывают и без того неширокое отверстие ПВ, препятствуя созданию эффективного водоворота. Шипы развиваются только для защиты от повреждений, в ущерб питанию; отбор частиц пищи могут вести лишь реснички на внутренних стенках ПВ.
ЯДЕРНЫЙ АППАРАТ
Микронуклеус
Ядерный аппарат хонотрих включает один макронуклеус (Ма) и несколько (1—7, обычно 2—3) микронуклеусов (Ми) (рис. 35, А). Хотя Ми хонотрих ничем не отличаются от Ми других инфузорий, у ряда авторов мы находим ошибочные сведения о них; пожалуй, ни по одной другой группе инфузорий не было предложено столько фантастических гипотез. Кратко рассмотреть их нужно хотя бы потому, что они еще не забыты, повторяются и в современной литературе.
Ромпель (Rompel, 1894) принял Ми Kentrochona nebaliae за внеядерные центросомы, а в качестве Ми обозначил неточно зарисованный прикрепительный диск; ампула принята им за веретено деления Ми. Находка Гертвигом трех, а не двух Ми у спирохон объяснялась тем, что два из них — это центросомы, третье же ядро не делится, сохраняет свое место и дает новые центросомы. Ромпель изобразил картину миграции цент
росом к полюсам делящегося Ма до стадии ранней анафазы (рис. 36, Г). Многие авторы выступили с резкой критикой данных Ромпеля сразу же после их опубликования (Ва1-biani, 1895; Erlanger, 1896; Doflein, 1896, 1897а, 1897b, и др.). Дофлейп, специально изучая кептрохон, показал, что за центросомы Ромпель принял обычные Ми; стадии миграции центросом — это вариации положения Ми относительно Ма, а стадии деления Ма, по Ромпелю, — лишь вариации строения иптеркипетического ядра. Ошибочны
Рис. 35. Ядерный аппарат. А, Б — наклон Ма к оси тела; В—Д — положение зон Ма разных родов; Е — индивидуальные вариации положения зон у спирохоны (по: Balbiani, 1895); Ж — Ма гипостомат (по Кайеда); 3 — типичный Ма экзогеммин; И, К — инверсия зон Ма у томитов; Л — положение зон у предка хонотрих (Dysteria)-, М — Ма Chilodochona sp. с Pandalus latirostris; Н — Ма Isochona migratoria; О — «гомология» ядер спирохон и парамеций (по Гелей); П—У — «гомология» парамера спирохон (П, Р), Ми других инфузорий (С, Т) и центросферы Metazoa (У; по: Eismond, 1895).
у Ромпеля рисунки гомогенного Ма: слоистость Ма — интерфазное состояние, а не стадии образования двух полярных групп хромосом.
Эйсмонд (Eismond, 1890а, 1895) вначале описывает у Spirochona gemmipara типичные Ми вблизи Ма, но позднее меняет свои взгляды, обращая внимание на структуру Ма. Верхний хроматиновый сегмент Ма — это, по его словам, типичное ядро, настоящий Ма; нижний сегмент не связан с ним, сегменты не имеют общей оболочки, разделены слоем ячеистой цитоплазмы, при обилии которой далеко расходятся. Нижний сегмент, бедный хроматином, — это клеточный центр (центросфера), какой находят у Metazoa, эндосома сферы — это центросома, или полярное тельце (рис. 35, П—У). Возможно, что сфера произошла от Ма. Мелкие же тельца близ Ма, принятые ранее за Ми, считаются продуктами метаболизма или дегенерирующими фрагментами Ма после конъюгации; такие тельца наряду с Ма и Ми видны у сувоек. Иногда у спирохон они удлиненные или гантелевидные, но не образуют типичных веретен деления. Ми других инфузорий (рис. 35, С, Т) — это протоплазменная сфера с центральным хроматиновым тель
цем (центриолью), также прилегающая к Ма или отделяющаяся от пего слоем пенистой цитоплазмы. Эта сфера — одновременно и Ми, и клеточный центр; у спирохон же Ми и центросфере соответствует пижпий сегмент Ма. Эйсмонд ссылается па данные Плате, нашедшего у Dendrocometes «типктиповыс тельца» и крупный Ми; первые хромофильны, по не делятся при почковании, как и у спирохон. Гипотеза Эйсмопда, в отличие от предположений Ромпеля, осталась неизвестной авторам.
По Сварчевскому (1928а, 19286), хроматиновые тельца близ Ма Cavichona elegans — пе Ми, поскольку они красятся слабее, чем Ма; число их изменчиво, они видны не у всех особей, часто имеются у томонта и отсутствуют у томита — следовательно, не делятся при почковании, распределяясь механически. При диминуции они часто остаются в рудименте томонтов, не переходя в томитов; они не делятся при конъюгации и не всегда даже видны у партнеров; напротив, они часто дегенерируют — укрупняются, бледнеют и исчезают. Деление их никогда не отмечалось. В итоге такие тельца, по Сварчевскому, это не Ми, а особые «дегенерационные тельца», образующиеся после деления Ма: в ах-роматиновой, иногда и в хроматиновой зонах образуются ярко или слабо красящиеся хроматиновые тельца. При избытке пищи все ядро теряет слоистость и становится хроматиновым; тогда избыток хроматина удаляется в виде «не имеющих значения» телец. Вероятнее всего, речь идет о нуклеолах, многочисленных в Ма хонотрих; случаи выхода хроматиновых телец у хонотрих еще неизвестны. Деление Ма, по Сварчевскому, включает два процесса — собственно деление ядра и деление центрального тела. Сначала расходятся 16—18 толстых хромосом, удвоившихся путем расщепления в экваториальной зоне; это «примитивный митоз». Когда он подходит к концу, в середине анафазного веретена Ма образуется второе веретено: центральное тело разделяется примерно на 20 мелких хромосом, образующих экваториальную пластинку, которая при делении дает два крупных тела, расходящихся к полюсам (рис. 37, В). Поскольку образуются наружное и внутреннее веретена, центральное тело (эндосома) — это Ми, замаскированный в периоде покоя: он распылен по поверхности хроматиновой части ядра и регенерирует при его делении. Такое двойное ядро, как считает Сварчевский, обычно встречается у Rhizopoda и Flagellata и, вероятно, имеется у многих инфузорий, например у у Chilodonella. Центральное тело он принимает за «промикронуклеус», еще не отделившийся от Ма.
По Калю (Kahl, 1930,1935), Ми инфузорий произошел от Ма; у «предположительно давно ответвившихся Spirochonidae» сохранилась первоначальная форма Ми: это «наследуемая нуклеола», лежащая в центре Ма. 'Каль ссылается только на данные Свар-чевского.
Гелей (Gelei, 1950) сравнивает Ма спирохон и парамеций (рис. 35, О) и считает, что у первых нет типичного Ми. Верхняя хромофильная половина Ма спирохон, по Гелей,— гомолог Ми парамеций, светлая нижняя — гомолог Ма. Такой «гомологией» он иллюстрирует одну из морфогенетических закономерностей эволюции — раскол органов и их функций (Северцов). Гелей предполагает, что исходное цельное ядро раскололось пополам и превратилось в Ма и Ми. Вероятно, Гелей неправильно понял гипотезу Сварчевского.
По Стрелкову (1941 : 89; 1958 : 107), «ядро у Spirochona представляет значительные отклонения от типичных взаимоотношений у других инфузорий: у них известно только одно ядро — овальной формы. По данным Сварчевского, это Ма, внутрь которого включен Ми, выступающий на сцену при половых процессах» (последнего утверждения у Сварчевского нет).
По Боррадейлу (Borradaile, 1959), у хонотрих в отличие от всех иных инфузорий имеется ядро только одного типа (рис. 100, Е)-, оно образует два набора хромосом, наружный и внутренний, последовательно делящиеся при митозе. Компоненты наружного набора (мегахромосомы), более крупные и менее правильные, чем таковые внутреннего (микрохромосомы), — это Ма, компоненты внутреннего набора — Ми. Крупная ахро-матиновая масса в Ма является центром деления (центросферой), а ее эндосома — Ми. Такая трактовка — еще одно неточное отражение гипотезы Сварчевского, не считавшего все же парамер центросферой. Как отмечалось выше, Эйсмонд в свою очередь не считал парамер («центросферу с Ми») компонентом Ма. Мы убеждаемся, что увидеть у хонотрих Ми обычного типа помешало своеобразие строения и деления Ма: с Ми отождествляли один из сегментов Ма или эндосому парамера.
По Мацудо и Мору, изменчивость числа Ми внутри вида — очевидно, обычное явление в отряде. У разных особей вида обычно находят 2—4 Ми, типичным числом можно считать 2—3 (табл. 1). Бюйсан рисует у спирохоны один гигантский Ми, но такого ядра у хонотрих нет. Максимальное число Ми (18) отмечено у Kentrochonopsis. Необычная изменчивость числа Ми в связи с возрастом особи отмечена Мором у Trichochona: молодь имеет 1 Ми, взрослые формы — 2—3, иногда 4; однако, судя по нашим препаратам, трихохоны, изохоны, циамихоны и близкие роды с копепод имеют только по одному Ми. Хиксон придавал изменчивости числа Ми таксономическое значение, допуская, что манчестерская раса спирохон с одним Ми может быть особым видом рода; Мор, однако, нашел обычную вариацию числа Ми (2—4) у манчестерских спирохон.
Таблица 1
Количество и размеры микропуклеусов у хонотрих
Вид хонотрих Микронуклеусы Литература
число размеры, в мк
3, иногда 1—2 2 Hertwig, 1877а
3, реже 1—2 или 4 — Plate, 1886
Обычно 3 — Plate, 1888
2—4 — Eismond, 1890а
Spirochona gemmipara . . 2-3 — Balbiani, 1895
1 — Hickson, 1903
2-4 Mohr, 1948
2 — Guilcher, 1951
2, реже 1 или 3—4 — Tuffrau, 1953
S. halophila 2, нередко 3—4 2 Matsudo a. Mohr, 1968
«S. gemmipara» 3 — Сварчевский, 19286
«S. pusilia» 5 —• To же
Cavichona elegans .... 0—10, часто 2—3 — Сварчевский, 1928a Wallengren, 1895
Heliochona sessilis . . . . 3-4 2-5
Heterochona scheutenii . . . 1—7, обычно 3—4 3 2—5 Wallengren, 1895 Dobrzanska-Kaczanow-
ska, 1963
H. trifaria 2-3 3.3 Данные автора
H. psychra 3, реже 2 2.1-2.8 Matsudo a. Mohr, 1965
Trichochona lecythoides . . 1—3, редко 4 2.5 Mohr, 1948
Lobochona prorates 3, часто 2 или 4 2—4, в основном 3 1-2 1-2 Mohr a. oth., 1963a Matsudo, 1966
L. insularum Oenophorachona ectenolae- 2—3 2.1—2.3 Matsudo a. Mohr, 1964
mus .......... 3, реже 2 или 4 2—2.2 Matsudo a. Mohr, 1968
Kentrochona nebaliae . . . 3, максимум 4 Doflein, 1896, 1897a
Kentrochonopsis muliipara 6 (на рисунках 3—18) — Doflein, 1897b Данные автора
Циамихоны и талассохоны 1 1.5-2
Мы находим у хонотрих обычно 2—3, иногда до 8 Ми (у Crassichona). По Мацудо, у Lobochona обычно рядом располагаются особи, имеющие одно и то же число Ми, поскольку их томиты не могут далеко уплыть от материнской особи.
По Мацудо и Мору, у неделящихся особей Ми обычно удалены от Ма, располагаясь в нижней половине тела, у лобохон и гетерохон — в нижней трети тела; Ми смещаются к Ма при делении ядер, с момента появления кариосомы в парамере. Другие авторы, однако, постоянно находят Ми вблизи Ма; по Гертвигу и Эйсмонду, положение Ми у спирохон непостоянно, но обычно они лежат вблизи Ма, нередко вплотную прилегают к нему. Ми показаны близ Ма у кентрохон, спирохон и кентрохонопсиса на рисунках Дофлейна, Бальбиани, Ромпеля, Сварчевского и других авторов; как правило, Ми рисуют ниже Ма, рёже сбоку. По два Ми показано Гийше и Тюффро у нижнего конца Ма спирохоны. Это, по нашим данным, наиболее частое положение Ми у хонотрих; они могут встречаться и сбоку от ядра, но никогда не выше и не в глубине трофо-плазмы, как в схеме Мацудо и Мора.
Контуры Ми, по данным ряда авторов, округлые или слегка овальные, реже угловатые (Гийше) или палочковидные (Эйсмонд). Гертвиг отметил у спирохон и серповидные Ми. Мы находили в основном округлые или овальные, реже палочковидные или .угловатые Ми.
Размеры Ми у разных родов и видов отряда, судя по литературе и нашим данным, довольно стабильны, порядка 1.2—2.5 мк. Необычно крупные Ми найдены нами у Heterochona trifaria. Ми эндогеммин, особенно высших, несколько мельче, чем у экзогеммин, порядка 1.5 мк. Размеры всех Ми внутри особи одинаковы; Дофлейн, правда, изображает особь кентрохоны с двумя крупными и одним мелким Ми. Необычную изменчивость размеров Ми у Н. scheutenii описывает Валленгрен: у особей с 2 Ми размеры
их составляют 5 мк, с 3 Ми — 4 мк, с 6 Ми — 2 мк. По Плате, у спирохоны очень редки особи с одним крупным Ми, более часты особи с 2—4 мелкими Ми. Гетероплоидия Ми внутри особи столь редка у инфузорий, что трудно ожидать находки ее у хонотрих, с их стабильным ядерным аппаратом.
За исключением Гертвига, авторы обычно рисуют Ми у хонотрих не гомогенным, а различают хроматиновый и ахроматиновый отделы. Плате подчеркивал, что не только Ма, но и Ми спирохон состоят из таких же двух отделов; светлая ахроматиновая шапочка лежит в центре ядра или эксцентрична. Бальбиани рисует светлую полярную шапочку, длиной до половины Ми, в телофазных ядрах спирохон. Эйсмонд и Дофлейн > изображают у спирохон и кентрохон везикулярный (кольцевидный) Ми. На рисунках Валленгрена Ми гетерохон гомогенны в интерфазе, но перед делением появляются 1 — 2 светлые шапочки. По Гийше, в Ми спирохон видны хромофильные глыбки, удлиненные по оси ядра, и тонкая внутренняя сеть. Мор и Мацудо находят в Ми трихохон и лобохон тонкую, но четкую мембрану и мелкие сидерофильные гранулы в нуклеоплазме, красящиеся на ДНК. Судя по нашим препаратам, Ми хонотрих очень плотные, однородные, иногда с зонами, бедными хроматином, но всегда без четкой полярной шапочки.
Ми не образуют веретен до появления эндосомы в Ма; с началом почкования они смещаются к Ма, веретена деления достигают в длину 4 мк у трихохон и 5 мк у лобохон при длине интерфазного Ми 2—2.5 мк (Мор, Мацудо). Резко вытянутые веретена изображает Дофлейн у кентрохон. Деление Ми подробно изучали. Гертвиг, Гийше и Мацудо; данные Валленгрена и Тюффро отрывочны (рис. 36, И; 37, Б', 38; 39, М). По Валленгрену, у Heterochona scheutenii перед делением образуются две светлые шапочки, по мере роста веретена становятся видными две анафазные группы мелких хромосом; веретено мелкое, ромбическое. Мацудо и Гийше изображают тонкие длинные хромосомы. Важны прижизненные наблюдения Гертвига по корреляции деления Ма и Ми (рис. 42, Д): Ми становятся веретеновидными на стадии образования эндосомы в парамере, удлиняются с началом резорбции эндосомы, затем образуют длинные гантелевидные веретена и делятся к моменту возникновения двух полярных парамеров. Тюффро отмечена такая же координация на окрашенных препаратах. По Гийше, Ми спирохон делится в момент перехода от «концентрической» стадии с центральной эндосомой к стадии хроматиновых тяжей, еще до начала удлинения Ма и образования полярных парамеров. По Мацудо, в Ми лобохон образуется.ахроматиновая шапочка; ядра становятся веретеновидными с началом обтекания парамера ортомером, далее удлиняются и делятся на стадии резорбции эндосомы, до начала удлинения Ма.
Происхождение и строение гетеромерного макронуклеуса
Полиплоидные макронуклеусы (Ма) инфузорий в структурном отношении делятся на две группы, названные Форе-Фремье (Faure-Fremiet, 1957) гомео- и гетеромерными; последние обозначались ранее (Форе-Фремье, Тюффро, Гийше) как «гетерогенные». В гомеомерном Ма хроматиновые гранулы и нуклеолы распределены равномерно, в гетеромерном видны две зоны ядра (кариомеры) — хромофильная и хромофобная. Нуклеолы видны в обеих зонах, хроматиновые глыбки — в первой, мелкие гранулы или крупная хроматиновая эндосома — во второй зоне (Райков, 1967). Гетеромерные Ма известны у Hypostomatida и Chonotrichlda-, элементы гетеромерности находят сейчас и в Ма нассулид (Л mbthymenida). Гетеромерному Ма предшествовал, вероятно, Ма такого типа, какой распространен у наиболее примитивных Gymnostoma-tida (Prostomata), например у Prorodon,— округлое или овальное ядро с конденсацией хроматина в центре (рис. 36, Б). У Prostomata впервые появляется эндосома, нечетко отграниченная от остальной части ядра — нет светлой полоски (септы), находимой в гетеромерном Ма. Перед делением такого ядра эндосома исчезает, перед разрывом веретена образуется кольцо хроматиновых частиц. Ма такого рода мы называем «криптомерным»; это промежуточная категория между гомео- и гетеромерным ядрами. Вероятно, криптомерный Ма свойствен кольподидам и другим Trichostoma-tida, произошедшим от простомат. Криптомерное ядро напоминает также ядра некоторых жгутиконосцев — предков инфузорий.
Ма Hypostomatida делится на две группы: хромофильный и хромофобный отделы располагаются концентрически либо разграничены в ядре поперечной септой; положение слоев строго определенное — хромофильный слой лежит либо по периферии, либо в задней половине ядра. Эти две группы ядер обозначаются ниже как «цикломерный» и «септимерный» Ма. Цикломерное ядро проще септимерного, обнаружено у более примитивных гипостомат — у большинства Chlamydodontidae'. Chilodonella, Trithigmostoma, Phascolodon, Allosphaerium' септимерный Ma — у Hartmannula, Chla-mydodon, Trochilioides, Trochilia, Dysteria, Lynchella, Trichopodiella, Mirodysteria, Pa-ratrochilia, Hartmannulopsis, Pithites (Мак-ДугалЛ, Рейхенов, Сешахар, Канеда, Форе
Рис. 36. Ядерный аппарат. А — происхождение септимерного Ма хонотрих; Б — деление Ма Prorodon nucleolatus (по Дражеско); В — pfiwsze Ма Allosphaerium paraconvexa (по Добжанской); Г — «деление» Ма Kentrochona nebaliae (по: Rompel, 1894); Д — начальные стадии деления Ма спирохоны (по: Eismond, 1890а); Е — деление Ма спирохоны (по: Doflein, 1900); Ж — веретено у ночесветок (по Дофлейну); 3 — срез Ма спирохоны (по: Doflein, 1900); И, К — деление Ма Kentrochona nebaliae (по: Doflein, 1896, 1897а); Л — деление Ма Spirochona gemmipara (по: Hertwig, 1877а);
М — деление Ма Нeterochona scheutenii (по: DobrzaAska, 1963).
Фремье, Добжапская-Качановская, Радзиковский, Деру, Дражеско и др.). Перед делением Ма дистериид расположение полос меняется: ортомер (=ортокариомер у Форе-Фремье) кольцом окружает хромофобный парамер (=иаракариомер); это фактически возврат к исходному цпкломерпому строению ядра. У части дистериид, например у Hartmannulopsts, положение зон инвертировано: ортомер занимает переднюю, парамер — заднюю половину ядра. В центре цикломерных ядер гипостомат (но, вероятно, не у A llosphaerium) лежит постоянная хроматиновая эндосома, исчезающая при делении Ма (рис. 36, В). В септимерном ядре гипостомат эндосома сохраняется в парамере одних видов (Chlamydodon) и отсутствует у других (Dysteria)-, во втором случае она регенерирует и вновь резорбируется незадолго до деления ядра (Faure-Fremiet, 1957).
Наиболее детально изучены Ма Dysteria и Chlamydodon (рис. 35, Ж). Нуклеолы у них распределены по обеим зонам Ма, располагаясь по периферии. Ортомер сходен по строению с гетеромерными ядрами — это скопление хроматиновых телец и пиро-нинофильных нуклеол. Парамер, если не считать эндосомы и иуклеол, прижизненно кажется бесструктурным; реакция Фельгена положительна, но очень слабая. Электронно-микроскопическое исследование выявляет в парамере и в эндосоме тонкие нити (Райков, 1967); эндосома — это лишь агрегат нитей, не отделенных мембраной от кариоплазмы. Бесструктурная септа делит ортомер на две неравные части сходного строения.
Гетеро- и криптомерные ядра имеют почти всегда простой, округлый или чаще овальный контур; у дистериид ядро яйцевидное. Овальная форма Ма сохранена у томитов хонотрих независимо от очертаний ядра трофонтов. У трофонтов хонотрих можно найти все переходы от почти округлых (у стилохон) или овальных (у спирохонид, гелиохонид) до аморфных или вытянутых ядер. Обычно парамер меньше ортомера, что делает ядро асимметричным, угловатым. У экзогеммин Ма обычно несколько расширены в верхней части, у эндогеммин — в нижней; нередко обнаруживаются грушевидные, у каринихонин даже каплевидные ядра, вытянутые по оси тела. Массивные угловатые ядра характерны для инверсохонид типа Inversochona, Kentrochona, Chono-saurus; у многих стилохонид и эхинихонид Ма имеют форму вытянутых овалов. Наиболее видоизменены ядра хилодохонид и инверсохониды Ceratochona— Ма резко вытянут, колбасовиден. В какой-то мере форма Ма зависит от формы тела: обычно Ма овальные у бутылковидных форм с нормальной шейкой, яйцевидные или грушевидные у форм с длинной шейкой, колбасовидные или аморфные у форм с широкой шейкой, но это не общее правило.
Для ядер обычного типа (овальных) большинство авторов указывают размеры порядка 10—14x6—9 мк; к примеру, величина Ма Lobochona limnoriae составляет 8—14x5—7 мк (Доне), L. prorates 8—10x7—9 мк (Мацудо), L. insularum 11—13Х Х7.5—11 мк (Мацудо и Mop), Eleutherochona sivertseni 11 —13 мк (Допе), Oenophorachona ectenolaemus 10—1.4x9—10 мк (Мацудо и Мор), и т. д. Крупный Ма отмечен у Trichochona lecythoides (9—22 мк по Мору), мелкий — у Spirochona halophtla (8—10x3.8— 6 мк по Мацудо и Мору). По нашим измерениям, наиболее крупны Ма хилодохонид Vasichona paguri (28—33x16—18 мк) и Chilodochona aranei (около 40X10 мк).
Положение Ма в клетке определяется формой Ма и особи. Ма лежит всегда в передней части тела у основания шейки, ближе к дорзальной, чем к вентральной стороне; по данным ряда авторов, глотка образует характерный изгиб, огибая ядро (Герт-виг, Эйсмонд, Валленгрен, Дофлейн). Ма отклонен от оси тела при рассматривании и с вентральной стороны и сбоку (рис. 35, А, Б); в литературе такой наклон отмечался у спирохон, трихохон и лобохон (Эйсмонд, Мор, Мацудо). У гелиохонид ошибочно изображали Ма в центре тела, без наклона к оси тела (Гийше, Добжанская-Качановская). Ортомер и парамер расположены, однако, по оси, не совпадающей с осью тела, причем ортомер обращен к правому «плечу» особи (где образуется почка). Вершина Ма лежит обычно на уровне основания шейки, особенно у эндогеммин; если резко вытянут участок тела ниже шейки, Ма либо смещается вниз (у лобохон, аурихон, филихон), либо удлиняется внутрь шейки (у кристихон, каринихон). У хилодохонид и инверсохонид Ма вытянут поперек тела, направлен ортомером вправо. Иногда у части эндогеммин Ма заходит в резко утолщенный слой цитоплазмы на дне ПВ.
По нашим препаратам, у большинства экзогеммин вверх обращен ортомер, вниз — парамер; у эндогеммин, напротив, широкий ортомер лежит внизу, узкий парамер — вверху. Это стабильные различия, характеризующие подотряды хонотрих. Только у наиболее примитивного рода хонотрих, у Oenophorachona, имеются виды с обоими типами Ма. Вероятно, экзогеммины произошли от энофорахон с апикальным ортомером, эндогеммины (Isochona) — от энофорахон с апикальным парамером. У предков хонотрих (Dysteria) верхнюю половину Ма занимает парамер, поэтому у части энофорахон и у всех экзогеммин произошла инверсия зон Ма, эндогеммины же сохранили предковый Ма.
Однородный Ма у хонотрих изображали редко. По Штейну, Ма спирохон всегда содержит вакуоль с эксцентричной эндосомой, отсутствующей у томитов. Плате рисует
мелкозернистое ядро у гелиохон и сегментированное у спирохон, Ромпель—обычное гомсомсрпое ядро с равномерно рассеянными глыбками хроматина у кентрохоп; Ма становится слоистым, по Ромпелю, только при делении, когда он образует веретено. По Бючли, Ма спирохон не разделен на сегменты; хроматин рассеян по всему ядру, «ахроматиповый» сегмент — это лишь часть ядра, сильно вакуолизованная вследствие локального вспенивания «водянистой нуклеохилемы»; граница зон есть, но ядро имеет все же единую структуру.
Ма спирохон обращен ортомером вверх; отклонения отмечены лишь Бальбиани (рис. 35, Е) у части особей, он объясняет их «скольжением зон» в связи с делением Ма. Мор отмечает инверсию положения зон и наличие 2—3 чередующихся темных и светлых полос в Ма Trichochona. Вариации положения зон обычны у беломорской расы лобохоны, но полная инверсия зон не отмечалась. Картины увеличения числа сегментов могут быть связаны с профазными изменениями в Ма. Мацудо и Мор обнаружили у особей Lobochona и Heterochona интенсивно красящийся гомогенный слой над септой, но это одна из ранних фаз деления Ма. У трихохоны Мор постоянно отмечал гомогенное, слабо красящееся тельце неясной природы у нижнего конца Ма (явно Ми). Основной источник противоречий в описании структуры Ма — то, что интеркинетические стадии не отграничивались от стадий деления ядра. Дофлейн (Doflein, 1900 : 37—38) отмечает: «Я не знаю ни одной клетки, у которой ядро показывает такое исключительное разнообразие структуры в период покоя, как основное ядро Spirochona». Такое «разнообразие» может относиться лишь к прекинетическим, но не к интерфазным ядрам.
Хотя септа — широкая светлая хромофобная полоса, разделяющая орто- и парамер, — четко видна in vivo, ее часто считали артефактом. По Штейну, такой «линзовидной ядерной щели» нет у томитов и у молодых спирохон; она появляется у взрослых форм, расширяется, внутри нее образуется эндосома. Септа отмечена им также у гетерохоны. Бючли находит в Ма томитов спирохон бесцветную щель, разделяющую волокнистую и гомогенную части. По Гертвигу, септа у Штейна и Бючли — артефакт, вызванный действием уксусной кислоты или осмия; сегменты Ма граничат непосредственно, септы не видно и in vivo. Септу признают артефактом также Бальбиани и Сварчевский; ее не изображает и ряд других авторов, включая Тюффро. Ромпель рисует септу у томитов, но не у трофонтов кентрохон, имеющих однородный Ма; ее нет, по этому автору, и на стадии деления Ма. Валленгрен в основном не рисует септу у Heterochona, но показывает ее у Chilodochona. Четкую септу находят Дофлейн, Эйсмонд, Мор, Гийше и Мацудо; так, по Эйсмонду (Eismond, 1890а : 35), «сегменты ядра склеены какбй-то субстанцией, сильно набухающей от действия воды и принимающей форму линзы». Такую линзовидную септу обычно рисует Мацудо у лобохон. Мы находим септы (обычно 2, редко до 4) на границах всех зон ядра трофонтов и томитов всех осмотренных хонотрих; это хромофобные поперечные широкие полосы.
По некоторым авторам, сегменты Ма почти равны у трофонтов Trichochona (Мор), Cavichona (Сварчевский), Spirochona (Сварчевский, Тюффро), едва различаются по величине у Heterochona (Валленгрен). Чаще отмечается, что ортомер значительно крупнее парамера (Гертвиг, Эйсмонд, Валленгрен, Дофлейн, Гийше, Добжанская-Качановская, Мацудо и Мор и др.); такое различие свойственно также Dysteriidae, и оно сохранено у хонотрих. Сварчевский рисует обычно резко неравные зоны у томитов и равные зоны у трофонтов кавихон; однако на самом деле ортомер у всех хонотрих крупнее парамера на всех стадиях развития. В веретенах деления ядра полярные шапочки (зоны парамера дочерних ядер) занимают относительно небольшую часть Ма.
По Бальбиани, оба сегмента Ма не составляют единой структуры, окружены своими мембранами и просто контактируют; у отдельных особей парамер может отделяться и уходить в цитоплазму. Иллюстрации этого автора, правда, неубедительны. По Эйсмонду (Eismond, 1895), сегменты Ма одеты своими мембранами, разъединены слоем ячеистой цитоплазмы; иногда этот слой сильно вакуолизован и далеко раздвигает сегменты. Парамер был принят Эйсмондом за внеядерное тело. По Дофлейну (Doflein, 1900), парамер может отделяться и лежать вблизи ортомера; это иногда отмечается в интерфазе, не связано с делением или конъюгацией. По Сварчевскому, парамер кавихон обычно отделяется от ортомера при конъюгации, в конечном итоге резорбируясь; ортомеры партнеров в это время сливаются. Однако на наших препаратах отделение парамера не наблюдалось.
Ма инфузорий обычно плохо виден in vivo, кажется гомогенным у аэробных форм и имеет четкий контур, структурирован у анаэробных. Хонотрихи — оксифильные формы, о чем говорят их экология и обилие митохондрий в цитоплазме; однако Ма прижизненно виден с исключительной четкостью. Гертвиг, Плате, Эйсмонд, Бальбиани и Гийше изучали на живом материале не только строение, но и деление Ма. Более того, по Гертвигу, Spirochona gemmipara — лучший объект среди инфузорий и животных в целом для прижизненного изучения ядерпого деления. Структурированность ядер, видимо, не обязательно объясняется анаэробными условиями жизпи.
Ядра томитов в 2—4 раза мельче, чем у трофонтов, имеют простую овальную форму независимо от формы Ма трофоита; размеры Ма возрастают после оседания томита, по Мацудо — в основном при укрупнении парамера. Веретено деления Ма то-монта направлено так, что у протомита экзогеммин положение зон по сравнению с зонами Ма трофонта инвертировано (рис. 35, И, К), совпадает с таковым у дистерий; у эндогеммин и части энофорахон инверсии нет. Инверсия видна на рисунках Сварчевского у томитов кавихон; Гертвиг рисует апикальный ортомер у томитов спирохон, Валленгрен и Ромпель — латеральный ортомер у гетерохон и кентрохон; инверсию не показывают у томитов лобохон Мор и Мацудо. По нашим данным, инверсия характерна и для нормального, и для диминутивного почкования, причем инвертированы даже ядра телотомитов, переходящие в клетку без деления из рудимента томонта. Реверсия зон должна происходить на ранних стадиях метаморфоза, возможно даже до момента оседания томита. Сегменты Ма у томитов обычно рисуют неравными, ортомер — крупнее парамера; иногда находят и третью зону — эпимер, или полярную шапочку (Валленгрен, Дофлейн, Гийше, Мацудо).
Ортомер, по описанию большинства авторов, грубозернистый, содержит крупные глыбки или сферулы, красящиеся по Фельгену. Дофлейн различает в ортомере спирохон ахроматиновую основу и хроматиновые гранулы, сближенные настолько тесно, '
что их можно видеть лишь на срезах. Хроматиновые элементы ортомера описываются по-разному: это или мелкие, равномерно рассеянные гранулы (Валленгрен, Дофлейн), или плотная губчатая сеть (Сварчевский, Мор); по Гийше, это сеть разрозненных, интенсивно красящихся гранул (рис. 38, Л). По Эйсмонду, ортомер имеет типичное для инфузорий строение: он различает мелкозернистую «кариоплазматйческую строму» и «кариолимфу»; хроматин собран в «капельки или ручейки». В целом ортомер — это зернисто-волокнистая масса; в интерфазе преобладает зернистое состояние, при делении — волокнистое. Иногда отмечали вакуолизацию ортомера (Гийше, Тюффро): в ячейках найдены нуклеолы (Сварчевский, Мацудо, Мор), диаметром до 3 мк у гетеро- (
хон; Сварчевский наблюдал их выход в цитоплазму. Мацудо изучал цитохимию и ультраструктуру Ма Lobochona prorates. По его данным, Ма имеет везикулярное строение (рис. 35, 3); ДНК выявлена в гранулах ортомера и особенно в ярко-красящемся ;
нижнем крае сегмента; окраска парамера слабее, но, когда нет эндосомы, то видна сетчатая (везикулярная) структура; светлая передняя часть ортомера обособлена. Эндосома ярко красится, не разрушается РНК-азой; РНК выявляется в нуклеолах , обеих зон, но слабее красится в нижней. Ми содержит в основном ДНК. На электронных микрофотографиях Мацудо виден выход в цитоплазму нуклеол, состоящих из гранул диаметром 10—20 ммк (рибосом). Эти тельца в массе видны в цитоплазме, в основном на мембранах эргастоплазмы. Нуклеолы интенсивно красятся гематоксилином, но не по Фельгену; при делении Ма они скапливаются на внутренней стороне ядер-ной мембраны. Бальбиани детально сравнивает орто- и парамер спирохон; ортомер ।
быстро и интенсивно красится гематоксилином и кармином (парамер — слабо и медленно), сильно гранулируется фиксаторами, красится в ярко-зеленый цвет метилгрю-ном в смеси метилгрюн-эозин (прообраз реакции Унна). Только Бальбиани описывает в неделящемся ядре хонотрих тонкие нитчатые структуры, состоящие из хроматиновых бусинок — «микросом». i
По Бальбиани, у молодых спирохон Ма септимерный, у взрослых ортомер окружает парамер, образуя его кортикальный хроматиновый слой (рис. 37, А), во это не интерфазный Ма, а начальная стадия деления. Парамер гомогеннее, светлее ортомера, красится слабо, состоит из тех же трех компонентов, что и ортомер: имеются ахроматиновый матрикс, хроматиновые тельца и нуклеолы в ячейках. Нуклеолы в парамере отмечены рядом авторов (Валленгрен, Сварчевский, Мор, Мацудо); так, по Мору, парамер трихохон — это мелкозернистая зона с 1—6 гомогенными темными сферулами в светлых альвеолах. Крупные глыбки или сферулы в парамере, помимо эндосомы, изображают Гертвиг, Бальбиани, Пенар и др.; Сварчевский наблюдал их выход в цитоплазму, возможно спутав нуклеолы и Ми. Мацудо изображает в парамере гетерохон более мелкие нуклеолы, чем в ортомере. Пенисто-ячеистая структура ,
парамера показана на рисунках Ма спирохон у Дофлейна и Гийше. Ранние авторы (Герт-виг, Бючли) считали парамер гомогенной жидкой вакуолью, в которой при конденсации вещества может возникать плотная эндосома; Гертвиг говорил о мелкозерни- '
стой (ортомер) и гомогенной зонах ядра.
Обнаружение хроматина в парамере обычно приписывают Гийше и Тюффро, но об этом сообщали и многие ранние авторы. Плате (Plate, 1886) отмечал, что оба сег- ! мента у спирохон красятся кармином и только один — сафранином; поэтому окраску парамера он считал артефактом, а сам парамер — ахроматиновой зоной. Гранулы в ней образуются только при окраске, но в верхней части видны и in vivo. Фактически Плате первым обнаружил хроматиновые гранулы в парамере, однако не поверил в их существование. Эйсмонд (Eismond, 1890а) впервые правильно истолковал структуру Ма хонотрих: в обеих зонах обнаруживаются мельчайшие хроматиновые гранулы или капельки, но в нижней части Ма они малочисленны, разрознены, поэтому
окраска слабая, а в верхней многочисленны, расположены компактно. По Эйсмопду, парамер выглядит гомогенным лишь при малых увеличениях, в действительности же имеет мелкозернистую структуру; сегменты поэтому нельзя называть хроматиновым и ахроматиповым, как принято. Валлепгреп (Wallengren, 1896) говорит о наличии в Ма хилодохон зон, богатой и бедной хроматином (но не ахроматиновой). По Доф-лейну (Doflein, 1897а), в парамере кентрохон и спирохон имеются гранулы, красящиеся сафранином, но только в покоящемся Ма, без эндосомы; позднее Дофлейн (Doflein, 1900) отмечает, что пластиновые тельца в парамере он ошибочно называл хроматиновыми; тем не менее он по-прежнему различает два отдела Ма — хроматиновый и «преимущественно ахроматиновый». По Бальбиани (Balbiani, 1895), парамер спирохон слабо и медленно красится смесью кармин-гематоксилин; метилгрюн в смеси с эозином интенсивно красит ортомер, слабее — парамер. Бальбиани, однако, приписал этот результат плохой фиксации; при хорошей фиксации, по его словам, красятся лишь ортомер и эндосома, в парамере же нет и следа окраски; сегмент может краситься эозином, как и цитоплазма. В обеих зонах Ма Бальбиани находит нити; у молодых спирохон парамер грубозернистый, у взрослых на препаратах видна лучистая сфера (рис. 37, А): нити короче, тоньше, чем в ортомере, немногочисленны, не собраны в ряды и не красятся на хроматин; они видны лишь в ядрах без эпимера (т. е. в профазных). По Гийше (Guilcher, 1951), парамер спирохон слабо красится по Фельгену, почти не красится метилгрюном, содержит очень мало ДНК. Тюффро (Tuffrau, 1953) находит в парамере очень мелкие гранулы с ДНК, из-за наличия которых сегмент слабо Фельген-пози-тивен. Термины «хроматиновый» и «ахроматиновый сегменты» к Ма хонотрих, таким образом, неприменимы, хотя они используются по традиции отдельными авторами (Гийше, Добжанская-Качановская); Мацудо говорит о хромофильной и хромофобной зонах Ма.
Хотя почти все авторы говорят о наличии в Ма гипостомат и хонотрих лишь двух зон, орто- и парамера, такая двухсегментная модель ядра представляется нам ошибочной. Ортомер часто разделен поперечной септой на две зоны, различающиеся по яркости окраски (рис. 35, 3); апикальную зону, фактически третий сегмент Ма, мы называем «эпимером». В делящемся Ма незадолго до образования веретена, как правило, отмечали темную или светлую полярную шапочку; ее считали временным образованием, возникающим до или после деления; дольше всего длится стадия двух зон (Гертвиг, Тюффро, Добжанская-Качановская и др.). . По Плате, появление эпимера вызвано локальным распадом хроматина ортомера, «перекочевывающего» затем в парамер, что является первым признаком деления. По Гертвигу, напротив, эпимер образуется вследствие перемещения вверх и обособления ортомерного хроматина. Эпимер часто изображали в интеркинетических Ма; так, Ромпель рисует трехслойные Ма у кентрохон, приняв их за стадии деления Ма; Валленгрен находит эпимер, иногда эксцентричный, у части особей хилодохон и гетерохон на разных стадиях развития, отмечая, что эпимер красится слабее ортомера и сильнее парамера. Сварчевский рисует темный эпимер у молодых кавихон, считая его еще не удаленным после деления остаточным тельцем. По Эйсмонду (Eismond, 1890а : 35), «на вершине большого сегмента ядра часто можно заметить обособившийся из его массы округлый участок, отделенный от остальной части прозрачным бесцветным поясом». Дофлейн на большинстве препаратов кентрохон отмечает трехслойный Ма, включающий слабо красящуюся, очевидно ахроматиновую, зернистую апикальную зону. По Бальбиани, эпимер образуется у спирохон вскоре после деления Ма и сохраняется долго, вплоть до начала нового деления, когда он переходит в парамер. По Тюффро, напротив, стадия эпимера быстротекущая.
Три зоны, хотя иногда с очень крупным эпимером, изображают и другие авторы у лобохон, хилодохон, гелиохон и трихохон (Мор, Гийше, Мацудо). Мацудо находит эпимер почти на всех стадиях развития лобохон, кроме фазы деления Ма (рис. 39); четкая полярная шапочка, отделенная полосой от остальной части ортомера, образуется после разрыва веретена за счет его нитчатой срединной части, сохраняется в интеркинезе и исчезает с появлением эндосомы. Мы нашли эпимер у основной массы изученных хонотрих на стадиях трофонтов и томитов; он слабо красится, обычно лишен нуклеол, нередко содержит полярное хроматиновое тельце. При делении эпимер возникает из специализированного отдела веретена, несущего мелкие хроматиновые частички (микрохромосомы Боррадейля). По Сварчевскому, эти частицы — дериват эндосомы, они удаляются в цитоплазму. Возможно, что эпимер — дериват прежней эндосомы; в дочерних парамерах должны возникать новые эндосомы, не связанные с предыдущей.
Деление макронуклеуса
Описания процесса деления Ма различаются прежде всего в связи с различием взглядов на строение интеркинетического ядра. Штейн и Клапаред считали, что при почковании Ма не делится; у томита он мелкий, гомогенный, возникает de novo. Эту точку зрения опровергли одновременно Гертвиг и Бючли.
7 Заказ М 213
Бючли (Biitschli, 1877) рисует одну из стадий деления Ма спирохоны — гантелевидное ядро с продольной исчерченностыо и полярными парамерами. Плате изображает стадии деления Ма спирохоны с явными ошибками, располагая их без определенной закономерности. Деление, по Плате, начинается с появления светлого эпимера с мелкими гранулами, что говорит о растворении хроматина в ортомере и переходе его вниз; в парамере хроматин образует эндосому («центриоль»). Смысл этих изменений — в смешивании хроматиновой и ахроматиновой зон ядра, что дает ему «новую энергию». Ромпель рисует расслоение Ма кентрохон на три зоны и формирование двух «анафазных» групп хромосом в средней зоне (рис. 36, Г); Ми приняты им за центриоли. Однако Ромпель изучал интерфазные, а не делящиеся ядра. По Эйсмонду, Ма спирохоны расслаивается на три зоны, включая эпимер (рис. 36, Д); в парамере возникает эндосома; эпимер далее исчезает, ортомер обтекает парамер. Дальнейшие процессы Эйсмондом не прослежены. По Дофлейну (Doflein, 1900), эпимер у спирохон отсутствует; большие перемещения частей Ма ведут к появлению двух массивных полярных телец (рис. 36, Е). Тельца ведут себя как сферы веретена, способствуя делению, но лишены центрального тела, отделены мембраной и от ядра, и от цитоплазмы, несут в альвеолах пластин (РНК), а не хроматин. Несмотря на большое внешнее сходство (рис. 36, Ж), полярные массы у спирохон — не гомолог центросферы и центриолей; в них нет и радиально расположенных фибрилл. Хроматиновые гранулы ортомера собраны в ряды, кажущиеся двойными, но это оптический обман; по мере их концентрации на полюсах образуется экваториальная пластинка, возможно связанная с прикрепительным аппаратом особи. Ма двойной, но ахроматиновая часть не служит для деления ортомера; очевидно, она играет специальную роль в вегетативной фазе. Дофлейн опровергает гипотезу Исикавы (Ishikava, 1894, 1899) о гомологии центросферы ядер Noctiluca и парамера спирохон. На Kentrochona Дофлейном проверялась гипотеза Ромпеля о наличии внеядерных центросом, участвующих в делении. В первом сообщении Дофлейн (Doflein, 1896) описывает появление эндосомы в парамере и формирование независимо от нее дочерней эндосомы томита. Центриоли Ромпеля — это типичные Ми. Позднее Дофлейн (Doflein, 1897а; см. рис. 36, К) изучил деление Ма кентрохон. Исходная стадия — трехслойный Ма со срединным хроматиновым поясом. Парамер постепенно округляется, окружается ортомером, в котором различаются концентрические, затем радиальные тяжи; эндосома не исчезает. С удлинением ядра парамер остается сбоку; в почку входит пальцевидный отросток Ма, в котором образуется второй парамер с новой эндосомой; веретено разрывается. Поскольку середина- веретена ахроматиновая, дочерние ядра состоят из трех сегментов, как и исходное ядро.
Гертвиг (Hertwig, 1877а; см. рис. 36, Л; 42, Г—Е'; проследил деление Ма спирохоны на живых и окрашенных особях. Процесс длится 3—4 часа (считая профазу). У вершины Ма обособляется участок, отделенный септой; он расширяется, септа проходит сквозь весь ортомер, в парамере одновременно возникает эндосома. Парамер обтекается ортомером, эндосома исчезает позднее, на стадии радиальных хроматиновых тяжей. Затем следует переход к продольно исчерченному веретену, обособляются парамеры без эндосомы. Двухсегментное строение ядер сохраняется до нового деления.
Схема Бальбиани (рис. 37, Л) составлена также по наблюдениям на живых и окрашенных спирохонах. У вершины двухсегментного Ма образуется вакуоль, куда отделяется часть микросом, составляющих хроматиновые нити ортомера. Микросомы конденсируются с образованием цельной сферулы, мигрирующей через ортомер в парамер, но это не миграция, а лишь вариация положения эпимера. В парамере вокруг эндосомы образуются радиальные лучи; лучистая сфера уменьшается в размерах, становится амебоидной и исчезает. Ортомер в это время обтекает парамер. Дальнейшие изменения происходят по схеме Гертвига. Отмечены центральная вакуоль веретена (как у Дофлейна) и экваториальная хроматиновая пластинка, которую мы обозначаем ниже термином «хромосфен» (от греч. sphenos — клин).
В схеме Валленгрена (рис. 37, Б) эндосома у Heterochona возникает вероятнее всего в парамере; эпимер смещается и исчезает. Ортомер делится на две зоны — зону обычного строения и другую, с плотным, интенсивно красящимся хроматином (полоска на границе с парамером, которую мы называем «пикномером»). Сначала пикномер, затем остальная часть ортомера («мезомер») окружают парамер, все еще сохраняющий эндосому; затем происходит возврат к цикломерной стадии. Хроматиновую массу вокруг парамера мы обозначаем как «цикломер». По мере формирования радиальных - тяжей цикломера эндосома исчезает, ядро удлиняется, тонкие тяжи располагаются теперь по оси ядра. На полюсах возникают новые парамеры; на месте исчезнувшей эндосомы сохраняются гранулы, образующие хромосфен.
По Сварчевскому (рис. 37, В), эпимер обособляется у вершины ортомера Cavichona перед делением Ма, сначала красится слабо, затем конденсируется и мигрирует сквозь ортомер, «строма» которого в этот период разрыхляется. Процесс миграции, однако, не прослежен. С переходом эндосомы в парамер возникает пикномер, но Свар-
чевский считает это случайностью: у части особей разрыхляется не весь хроматин, и в конечном итоге и пикномер становится светлым. Ортомер в этой схеме окружает парамер, становясь цикломером; в нем обособляются продольные (радиальные со стороны полюса) тяжи хроматина. Ядро удлиняется, на полюсах образуются парамеры; эндосома красится слабо, образует собственное, вторичное веретено. Часть хромо-
Рис. 37. Строение и деление ядер хонотрих. А — Spirochona gemmipara (по: Balbiani, 1895); Б — Heterochona scheutenii (по: Wallengren, 1895); В — Cavichona elegans (по: Сварчевский, 1928а).
сфена отходит к томиту, часть остается в материнском Ма; эти остатки хромосфена удаляются у молодых трофонтов.
По Гийше (рис. 38, Л) эндосома образуется в ортомере Ма спирохон (эпимер вообще не показан) и мигрирует в парамер. Без промежуточных фаз показаны Ма с концентрическими тяжами в цикломере и с эндосомой в парамере, Ма с беспорядочно расположенными тяжами, без эндосомы и веретено с полярными парамерами и хромосфе-ном. Деление хромосфена не прослежено; гранулы и тяжи хроматина показаны слишком крупными. Дочерние ядра, по Гийше, двухсегментные.
По Тюффро (рис. 38, В), исходное ядро у спирохон двухслойное, без эпимера. У границы сегментов появляется септа, идущая вверх; после ее миграции образуется эндосома парамера. Цельный ортомер (без дифференцировки на мезо- и пикномер) окружает парамер, вскоре теряющий эндосому. Хромосфсп образуется из хроматиновых частиц, возникших при распылспии эпдосомы. В цикломсре появляются радиальные тяжи, которые после образования полярных парамеров вытягиваются по оси ядра. В дочерних ядрах виден эпимер с остаточным тельцем (частью хромосфена), удаляемым после деления.
Рис. 38. Деление ядер Spirochona gemmipara. А, Б — по: Guilcher, 1951; В — по: Tuffrau, 1953.
Отдельные стадии деления Ма гетерохон показаны Добжанской-Качановской (рис. 36, М). По ее данным, Ма томитов однородный; после их оседания образуются орто- и парамер'. В момент их разделения возникает реорганизационная полоса, идущая вверх по ортомеру, затем появляется эндосома. Эпимер в этой схеме — временная стадия. Параллельно этим процессам продолжается метаморфоз томита; почкование начинается еще до конца метаморфоза. Перед делением Ма цельный ортомер окружает парамер с эндосомой.
По Мацудо (рис. 39), ядра трофонтов Lobochona трехслойные, с эпимером. В парамере появляется эндосома, затем сегмент окружается ортомером без обособленного пикномера. Тяжи хроматина располагаются радиально, затем беспорядочно и далее продольно; делятся они поперечно, а не продольно, как у некоторых ранних авторов. Хромосфен нечеткий; после разрыва веретена остается часть хроматина, резорбирующаяся в цитоплазме,— вероятно, дериват эндосомы. Это не то «остаточное тельце», о котором говорят Тюффро и Сварчевский (не эпимер). Дочерние ядра, по Мацудо, трехслойные.
При недостаточной изученности процесса деления Ма можно наметить все же общую схему процесса. Исходное ядро состоит из трех слоев — эпи-, орто- и парамера. Эпимер не имеет никакого отношения к новой эндосоме, образуемой при агрегации хроматиновых частиц парамера. По мере формирования эндосомы эпимер исчезает, пе мигрируя сквозь толщу ортомера, ортомер же расслаивается на мезо- и пикномер. Пикномер, вероятно, зона синтеза ДНК; неясно, идет ли синтез по всему ортомеру.
Логично допустить, что дупликация ДНК идет одновременно и в эндосоме и что временное появление эндосомы, остававшееся загадкой, служит именно для синтеза
Рис, 39. Почкование и развитие трофонтов Lobochona. prorates (по: Matsudo, 1966).
ДНК. Пикномер постепенно окружает весь парамер, граница пикно- и мезомера теряется,— это стадия цикломерного ядра, как у примитивных гипостомат; в Ма различаются теперь цикломер и парамер. Эндосома распыляется вновь при переходе от концентрического к радиальному и далее к продольному расположению хроматиновых
тяжей в цикломере. Синтез ДНК к цикломерной стадии несомненно уже закончен, и тяжи цикломера образуются лишь для дупликации хромосом Ма. Тяжи расщепляются скорее всего продольно, Поскольку число их возрастает, толщина же уменьшается; Валленгрен рисует на радиальной стадии широкие, продольно исчерченные тяжи, какие найдены Райковым (1962) в профазных Ма Nassula. Образование двух «анафаз-ных» групп тяжей в Ма хонотрих должно быть обязано, следовательно, расхождению дочерних хромосом к полюсам, а не поперечному разрыву тяжей. Четкой экваториальной пластинки тяжей, какую рисует лишь Сварчевский, вероятно, нет, хромосомы разъединяются в период перехода от радиальной стадии к продольной. Веретено вытягивается, материал парамера скапливается на полюсах; распыленная эндосома ,регенерирует вновь, но уже в виде центрального хроматинового пояска веретена — хромосфена; неясно, превращается ли в хромосфен вся эндосома или часть ее частиц остается рассеянной в полярных парамерах. После разрыва веретена образуются готовые трехслойные дочерние ядра, сохраняющие эпимер вплоть до новой профазы. Ахроматиновая средняя часть веретена и хромосфен делятся на две части, преврат щающиеся в эпимеры; частицы хроматина равномерно рассеиваются по эпимеру. Итак, ДНК эпимера соответствует части ДНК прежней эндосомы, матрикс — специализированному отделу веретена, имеющему ахроматиновые нити.
Подробнее остановимся на роли эндосомы. Эта структура обозначалась ранее как нуклеола, или нуклеолюс (Гертвиг, Пенар), кариосома (Бальбиани, Гийше, Тюффро, Мацудо), центральное тельце (Бючли, Сварчевский), нуклеоцентрум (поскольку она, по Дофлейну, сочетает признаки нуклеолы и центросомы), промикронуклеус (Сварчевский) и микронуклеус (Боррадейл). Однако применимы лишь термины «кариосома» и «эндосома». По Штейну, эндосома имеется в интерфазном Ма взрослых спирохон, однако он рисует профазную стадию Ма. По Плате, Сварчевскому, Бальбиани и Гийше, эндосома образуется в вйде эпимера и мигрирует сквозь ортомер как цельное тельце либо в виде растворенных веществ, конденсирующихся в парамере. По Гертвигу, Тюффро, Дофлейну, Мацудо и Добжанской-Качановской, эндосома отсутствует в интерфазе, возникает в парамере перед делением Ма, по выражению Эйс-монда — «путем стяжания хроматиновой субстанции» парамера. Бючли и Тюффро говорят об агрегации хроматиновых частиц парамера. Все эти авторы не связывают появление эндосомы с обособлением эпимера. Пока никем не дана убедительная картина миграции эпимера; Валленгрен И некоторые другие авторы рисуют эпимер несколько ниже вершины Ма, считая это положение свидетельством миграции. Нередки ссылки на Бальбиани, утверждавшего, что эндосома образуется в телофазе после завершения деления Ма; образование эндосомы — это конец деления, а не начало нового. Однако у Бальбиани речь идет об эпимере, обозначенном термином «нуклеола»; эпимер же действительно образуется в телофазе. Ошибка Бальбиани — в описании «миграции» эпимера перед делением Ма.
Какова роль эндосомы в гетеромерном ядре? По Форе-Фремье (Faure-Fremiet, 1957), ДНК парамера либо генетически неактивная (негенная) и служит лишь для синтеза белка и нуклеол, либо активна и делится эндомитотически. Не могут ли, однако, совпадать обе функции ДНК? Если считать хромосфен дериватом эндосомы, то по схемам Мацудо, Тюффро и Сварчевского эндосома обособляется фактически как излишняя ДНК, удаляемая после деления. Это маловероятно, если учесть, что гетеромерные ядра имеют очень низкую степень плоидности. По Райкову (1967 : 188), «изменения гетеромерных Ма при делении весьма сложны и не до конца еще понятны. В поведении ортомера здесь нет ничего необычного. Продольные тяжи хроматина наблюдаются и при делении гомеомерных Ма. Гораздо своеобразнее поведение парамера и эндосомы». Парамер в целом и его эндосому, возможно, следует считать «специализированной зоной ядра, из которой при делении возникает фибриллярное опорное тело (как бы склад белкового материала для постройки веретена)» (там же : 189). Мы считаем, что временное появление эндосомы служит для дупликации ДНК. Веретено деления Ма должно образовываться из ахроматинового матрикса парамера, ДНК в этом едва ли принимает участие, она служит для обеспечения синтеза РНК в парамере. Нуклеолы, обычные в парамере, не могли бы образоваться в отсутствие ДНК.
Светлая полоса в Ма хонотрих ранее сравнивалась с таковой в Ма гипотрих (Бючли, Бальбиани, Дофлейн и др.). Миграция полос (иногда сразу двух) описана у гипостоматид (Форе-Фремье, Канеда, Добжанская-Качановская) и у хонотрих (Гертвиг, Тюффро, Добжанская-Качановская). Форе-Фремье описывает появление новой полосы у Dysteria после миграции старой через ортомер; Канеда находит ее у Chla-mydodon. У Allosphaerium отмечались две реорганизационные полосы, идущие от середины к обоим полюсам ядра. По Гертвигу, полосы нет в интерфазном Ма спирохон, она появляется и мигрирует вверх перед делением Ма. По Бальбиани, эпимер мигрирует вниз в ортомер. Отметим, что оба последних автора изучали деление Ма на препаратах и прижизненно. Тюффро описывает миграцию септы вверх через ортомер, не сравнивая септу с реорганизационной полосой гипотрих. Добжанская-Качановская отождествляет полосу, мигрирующую вверх у гетерохоны, с реорганизационной по
лосой гипотрих — волной митозов, идущей через Ма перед делением (Прескотт, Кимбалл, Галл п др.)- Схемы ряда авторов и паши препараты убеждают в том, что мигрирующей реорганизационной полосы у хонотрих пет. Ортомер отделен двумя широкими септами от эпи- и парамера; при делении, по схеме Валленгрена и Мацудо, мезо-мер отделен септой от пикномера, но нет свидетельств миграции этих септ. Пикномер, возможно, это зона эндомитозов, но она не распространяется по всему ортомеру.
Стадии деления гетеромерных Ма гипостомат и хонотрих настолько напоминают стадии митоза, что их обозначают нередко как «метафаза», «анафаза» и т. д. (Иванич, Канеда, Боррадейл и др.). Грелль говорит о «митозоподобном» делении Ма Dysteria. По Дофлейну (Doflein, 1896), деление Ма кентрохон — типичный митоз, поскольку образуются полярные шапочки (парамеры) с нуклеоцентрумом (эндосомой) в каждом. Позднее им было доказано, что сходство веретен у хонотрих и других простейших поверхностное, парамеры — не центросферы, они не образуют фибриллярного веретена (Doflein, 1900), но деление Ма вновь названо митозом. По Гийше, Ма хонотрих, несмотря .на особенности своего строения, делится путем нормального амитоза, но одновременно она говорит о «митотическом цикле». По Райкову (1967 : 188), деление гетеромерных Ма — «это все-таки не митоз; здесь нет главного признака митоза — закономерного расхождения сестринских хроматид в дочерние ядра». Такое деление — одна из форм сегрегации геномов; тяжи такого типа, как у хонотрих, найдены Райковым у различных Nassulidae', они считаются сборными хромосомами, появляющимися в период деления ядра.
Ма томита всегда мельче ядра томонта; это дает повод говорить о «почковании ядра» (Дофлейн, Рейхенов и др.). У сукторий деление Ма с самого начала анизотоми-ческое, гетерополярное, у хонотрих же оно начинается как изотомическое, структурные изменения в обеих половинах Ма протекают синхронно и однотипно. Правильнее говорить поэтому не о почковании, а о делении Ма хонотрих, принимающем анизото-мический характер на поздних стадиях.
В заключение отметим, что хонотрихи сохранили такой же структурный тип Ма, какой характерен для их предков (гипостомат); в сущности не изменился и процесс деления Ма. У дистериид и хонотрих есть возврат к исходному цикломерному Ма, какой имеет, к примеру, примитивная’ гипостомата Chilo do nella. При делении цикломерного Ма образуются сначала два типичных септимерных ядра (рис. 36, Б); именно эта стадия онтогенеза закрепилась у высших гипостомат, Ма не вернулся к цикломерному типу. Первым таким «мутантом» с септимерным ядром был, вероятно, Chlamydo-don. Произошла как бы фиксация фаз, с выпадением конечных стадий реконструкции ядра; септимерный Ма, таким образом,— педоморфный признак у гипостомат и хонотрих. Мацудо (Matsudo, 1966) считает возможным, что различия в способах размно-’ жения (в делении Ма) характерны для разных родов и даже видов хонотрих; однако таких различий, по-видимому, нет. Уже Дофлейн обратил внимание на сходство структуры и деления Ма у Kentrochona и Spirochona, а это высшие роды двух подотрядов. Если не считать различий формы, размеров Ма, строения зон и их инверсии у экзо-геммин, общий план строения и способ деления Ма хонотрих — это стабильный, консервативный признак, не затронутый эволюцией; усложняются лишь ротовой, защитный и прикрепительный аппараты.
ЖИЗНЕННЫЙ ЦИКЛ
ОБЩЕЕ ОПИСАНИЕ И ТЕРМИНОЛОГИЯ
К инфузориям понятие «онтогенез» почти не применяется. По Кормошу, онтогенез имеется лишь у небольшой группы сукторий с особо сложным внутренним почкованием. По Добжанской-Качановской, онтогенез существует у хонотрих, но только до момента отделения почки, которая уже «в значительной мере преформирована». Мы считаем, что онтогенез (процесс развития) есть у всех инфузорий, независимо от способа размножения, и начинается он с момента появления зачатка цилиатуры новой особи (у хонотрих томита). Развитие томита не закончено к моменту отделения; после оседания следует сложный метаморфоз (развитие трофонта), пока выросший трофонт не образует зачатка цилиатуры нового томита.
Для обозначения стадий развития почкующихся и палинтомирующих форм приняты термины «трофонт», «томонт» и «томит». Трофонт — активно питающаяся и растущая форма; томонт — делящаяся или почкующаяся, непитатощаяся форма (иногда термин применяют и к монотомическим инфузориям); томит — это почка (до отделения) или бродяжка (после отделения). Томиты не питаются, оседают на субстрат и начинают метаморфоз, превращаясь в трофонтов. Мы вводим три новых термина: «трофотомонт» — форма, питающаяся в период размножения (томонты не питаются и обычно превращаются в томитов без остатка); «протомит» — томит на ранних стадиях развития, от закладки цилиатуры до отделения; «трофотомит» — гигантский то
мит, образованный при тотальной трансформации трофонта, без почкования обычного типа.
В жизненном цикле хонотрих иногда различают две фазы — бесполое размножение (почкование) и половое (конъюгация); встречается и выражение «бесполое почко-
Рис. 40. Жизненный цикл хонотрих. А — типичный цикл: развитие на нелиняющих (а) и линяющих (б) рачках; Б — образование телотомитов;
В — образование трофотомитов.
вание» (Кудо, Мор, Мацудо). Поскольку полового размножения у инфузорий вообще нет (есть лишь реорганизация ядер), разграничение этих фаз излишне. Сварчевский различал у Cavichona «вегетативное размножение» (образование одного томита) и «образование гамет», или «эпидемическое множественное почкование», что также ошибочно: при полигеммии образуются томиты обычного типа. По ряду авторов, томиты
хонотрих служат для конъюгации («гаметы» Сварчевского и Боррадейля, «микрого-пидии» Энгельманна) — по аналогии с перитрихами, у которых мелкие почки играют роль микроконъюгантов. Конъюгируют, однако, только сидячие трофонты хонотрих.
Жизненный цикл Chonotrichida можно разделить на две общие фазы — развитие па нелиняющих и на линяющих рачках. Типичный цикл складывается из 6 стадий: 1) развитие протомита до момента отделения; 2) рождение особи — отделение томита, короткая свободноплавающая фаза; 3) развитие трофонта — прикрепление томита к субстрату и метаморфоз; 4) конъюгация (редкий процесс); один из партнеров гибнет, другой продолжает развитие; 5) почкование выросшего трофонта, продолжающего питание,— стадия трофотомонта; 6) диминутивное почкование и полигеммия непитаю-щихся томонтов на линяющих рачках; гибель особи, почкующейся без остатка; заселение томитами нового нелиняющего рачка. Цикл развития экзогеммин проще, чем у эндогеммин; у хилодохонид стадии диминуции и полигеммии на линяющих рачках заменены стадией трофотомитов, иногда образуемых также у лобохон и энофорахон.
Типичный для большинства хонотрих жизненный цикл показан на рис. 40. Томит, отделившийся от томонта, оседает после кратковременного плавания, прикрепляясь вентральной стороной; особь лежит под углом к субстрату, затем выпрямляется. Вентральная цилиатура томита подтягивается к вершине тела, где имеется преформи-рованная ПВ (апикальный отдел желобка), и развертывается на внутренних стенках ПВ. ПВ постепенно отделяется шейкой от тела. Начальную стадию развития трофонта мы обозначаем как «стадию фиалохоны». Томит начинает питаться только с момента оседания, превращаясь в трофонта. Начинается рост особи, усложнение ее строения, развитие защитного аппарата. Не все трофонты вырастают во взрослые формы; начиная со стадии молодого, недоразвитого трофонта развитие может пойти двумя путями — с конъюгацией или без нее. К конъюгации способны только молодые трофонты; конъюганты встречаются редко, в основном на только что слинявших рачках. В конъюгацию вступают две особи примерно равных размеров, случайно оказавшиеся рядом; неподвижные трофонты касаются друг друга стенками ПВ, прочно соединяются в зоне ПВ, затем один из них отделяется от субстрата и постепенно уменьшается в размерах, пока от него не останется небольшой рудимент. Пока неясно, отпадает ли рудимент или же полностью адсорбируется партнером, что менее вероятно; так или иначе, одна из особей гибнет, обеспечивая реорганизацию ядер в другой. Морфология остающегося партнера почти не-меняется, упрощается лишь строение ПВ. Нижнего партнера можно назвать стационарным, или макроконъюгантом, верхнего — мигрирующим (мигрантом), или микроконъюгантом. Вместо «эксконъюгант» следует говорить «синконъюгант». После отшнуровки рудимента мигранта следуют восстановление нормальной структуры ПВ синконъюганта и ядерная реконструкция, замена старого Ма новым. Возможно, имеет место полная реорганизация кинетома ПВ. Молодые трофонты после конъюгации возобновляют питание и рост и, достигнув максимальной величины, приступают к наружному или внутреннему почкованию.
Вопреки мнению Мацудо о возможности и моногеммии и полигеммии на нелиняющих рачках, мы считаем, что в этот период хонотрихи способны только к моногеммии. Когда мы видим полигеммические формы хотя бы с двумя почками, то на таких рачках удается найти и стадии диминутивного почкования хонотрих, и стадии образования трофотомитов у перитрих и сукторий, что говорит о начале линьки хозяина; количество таких полигеммических хонотрих возрастает к моменту экзувиации (сбрасывание панциря). У экзогеммин нет особой разницы в морфогенезе первого (у выросшей особи) и последующих томитов на нелиняющих рачках, у эндогеммин же различие существенное: при первом почковании образуется зародышевая сумка, несущая протомита. Долгое время протомит остается в сумке без видимых изменений морфологии, затем отделяется и уплывает. Сумка остается, в ней быстро закладывается цилиатура нового томита. Фактически у хонотрих нет возврата к стадии трофонта в промежутке между почкованиями, либо эта стадия быстротечна; выросший трофонт превращается в трофотомонта. Томонтами эти формы назвать нельзя: они беспрерывно питаются, особь не растет или почти не растет, весь приток пищи идет на образование новых томитов. Беспрерывно повторяется томитогенный цикл, отделившиеся томиты начинают метаморфоз. К первым «колонистам», начавшим томитогенный цикл, добавляются почкующиеся трофотомонты второго поколения, третьего и т. д.; покровы рачка заселяются все новыми и новыми поколениями первых поселенцев, осевших на рачке после его линьки; оседают также томиты с других рачков.
Томитогенный цикл продолжается до тех пор, пока в организме рачка не начнутся изменения, приводящие в итоге к линьке. Еще задолго до первых признаков приближения лИньки (отслоение старой кутикулы, рост новой, выделение экзувиальной жидкости) становится редким, а затем и вовсе прекращается оседание томитов на рачке. Молоди хонотрих на таких рачках не видно, стадий конъюгации нет. Крупные трофонты еще некоторое время сохраняют нормальные размеры, типичное вооружение и ПВ, отделяют по одному томиту, продолжают питаться; это еще типичные трофотомонты. Нормальный моногеммический томитогенез длится, однако, недолго: питание
особи прекращается, томитогенез же ускоряется, идет теперь уже за счет содержимого тела особи. Второй томит закладывается еще до отделения первого и часто успевает вырасти, пока первый еще не отплыл. Эта стадия — крупный томонт с 2 томи-тами — очень характерна для предлипечных рачков. Особи с 2 томитами иногда могут питаться, но для ускоренного томитогепеза пищи уже не хватает; с прекращением питания начинается резорбция ПВ (инволюция завитка у спирохон, рассасывание шипов у эндогеммин и т. д.). Тело томонта уменьшается в размерах, строение упрощается; такое почкование Мацудо называет диминутивным (от лат. diminutio — уменьшение). Количество отделяемых томитов варьирует у разных родов — в какой-то мере оно зависит от размеров томонта. У многих хонотрих образуется до 2, реже до 3 томитов, у Kentrochonopsis— до 7; это не одновременная, а последовательная полигеммия (стробиляция). Томиты образуются быстро, до завершения образования предыдущих, а отделяются после долгой задержки (как и при нормальной моногеммии); поэтому и образуется характерная стробила. У отдельных видов диминуция идет только при моногеммии. В период диминуции томонт выпускает в среду большое число томитов; диминуция завершается тотальным превращением остатка тела томонта в томита без деления Ма; остается безъядерный рудимент. Последнего томита мы называем «тело-томитом» (от греч. telos — последний). Томиты расплываются в поисках нового нелиняющего хозяина. Иногда размножение томонтов затягивается, заканчиваясь уже на сброшенном панцире рачка.
У эндогеммин с Nebalia кроме нормальных форм наблюдались также бесшиповые трофонты и томонты; мы обозначаем их термином «анактиниды»; это наиболее загадочная стадия цикла. Среди рачков с нормальными шипоносными комменсалами можно встретить особей, на которых весь комплекс хонотрих или большинство их лишены шипов или имеют недоразвитые шипы (рис. 172, 191); эти особи крупные, типичных очертаний. Возможно, что это явление вызвано приближением линьки рачка, поскольку анактиниды неизменно вступают в диминутивный цикл. Можно предположить, что если томиты оседают на предлинечных рачках, в конце межлинечного периода, то они растут, не образуя развитых шипов. Полигеммия и диминуция неизвестны пока и, видимо, отсутствуют у Chilodochonidae: перед линькой хозяина трофонты без почкования превращаются в трофотомитов, покидающих стебелек; здесь не образуется характерного для других хонотрих рудимента томонта. По Гийше, трансформация томита не сопровождается реорганизацией кинетома, но это сомнительно.
Цикл развития хонотрих в конечном итоге оказывается очень сложным, остается еще ряд нерешенных вопросов. Пока обнаружены четыре общих типа циклов развития — у эндогеммин, хилодохонид, части лобохонид и у остальных экзогеммин. Нельзя согласиться с Гийше (Guilcher, 1950 : 466), утверждающей, что «из всех циклов развития инфузорий цикл у почкующихся форм наиболее простой».
МОНОГЕММИЧЕСКОЕ ПОЧКОВАНИЕ (НА НЕЛИНЯЮЩИХ РАЧКАХ)
У сукторий, ринходид, перитрих и апостомат найдено и деление и почкование, у хонотрих — только почкование. В диагнозе Spirochona Кент говорит о размножении почкованием или поперечным делением, но последнее относится к перитрихе «Spirochona» tintinnabulum. Коллен говорит о «неравном делении надвое» спирохон, т. е. об анизотомии, а не о почковании. По Фенхелю, гелиохоны «делятся», но это ошибка. Почкование, по Мацудо, представляет собой несколько видоизмененное деление надвое, сохраняющее строение родительской особи; это адаптация к сидячей жизни у эктокомменсалов. Родительская особь сохраняет свое прежнее положение, а томит может прикрепиться на некотором расстоянии на тех же придатках хозяина, требуя «минимальной цилиатуры для минимальной миграции».
Мы различаем у инфузорий 6 типов почкования: моно- и полигеммию (с учетом числа почек), экзо- и эндогеммию (с учетом их положения), одновременное и последовательное почкование (с учетом очередности отделения томитов). У хонотрих имеются 5 способов из 6 (кроме одновременной полигеммии). Каль говорит, правда, о синхронной полигеммии, явно имея в виду данные по Kentrochonopsis, но Дофлейн не был уверен, что это одновременный томитогенез.
И. Кормош и К. Кормош (Kormos J. und К., 1957а, 1957b, 1958) различают иные типы почкования: одиночное гомоморфное (наружное и внутреннее), одиночное гетероморфное (наружное и внутреннее, которое в свою очередь подразделяется на инва-гинативное, циркумвагинативное и семициркумвагинативное) и множественное. У сукторий эти авторы различают 6 способов размножения: тотальный переход в томита, дифференциальное деление, почкование наружное, внутреннее циркумвагинативное, внутреннее инвагинативное и множественное. Процессы различаются по месту закладки и направлению разрастания нового кортекса томита. У хонотрих, если следовать этой схеме, встречаются три способа размножения — образование трофотомитов, наружное и внутреннее циркумвагинативное почкование; кроме того, добавляются три новых процесса — образование телотомитов (процесс, сочетающий при-
•знаки почкования и тотального перехода в томита) и наружная и внутренняя стробиляция. Кроме того, мы различаем две формы циркумвагинативного почкования.
Мор и Мацудо различают три типа моногеммии хонотрих, допуская находку в будущем промежуточных форм. У хилодохоп и гелиохон почки образуются в передней части тела, в области плеча, ниже ПВ, и прикрепляются без помощи блюдцевидного выступа; у лобохон, спирохон и ряда гелиохонид почки возникают в средней части тела из раковинообразного выступа тела (рис. 41, В; 42, А); у эндогеммин внутренние почки образуются в сумке, частично выступая из нее на поздних стадиях развития (рис. 41, В). Эти три способа составляют эволюционный ряд — подобие ряда, ведущего от экзогеммин к эндогеммин у сукторий. После почкования у хилодохон не остается и следа томита, у лобохон образуется выступ, у трихохон — сумка, отсутствующая у молодых особей и остающаяся навсегда у взрослых. Иными сло-
Рис. 41. Размножение хонотрих (схемы). А — локус зачатка кинетома по нашим данным (I), по Добжанской-Качановской (2) и Гийше (5); Б — различие глубины сумки у эндогеммин; В — три типа почкования хонотрих по описанию Мора; Г — стробиляция у эндогеммин; Д — томиты спирохон (1, 2), хилодохон (3) и эндогеммин (4); Е, Ж — полная и частичная циркумвагинация у эндогеммин.
вами, Мор и Мацудо предлагают различать у хонотрих наружное почкование, наружное с элементами внутреннего и внутреннее. Различия двух первых способов все же ничтожны: при обоих способах сумки нет, это типичная экзогеммин; небольшое углубление, в котором лежит стебелек протомита, имеется далеко не всегда, возникает и исчезает на конечных стадиях почкования. У эндогеммин же с самого начала все развитие томита протекает в сумке.
В ряде работ можно прочесть, что хонотрихи размножаются лишь наружным почкованием (Каль, Гийше, Догель), но это ошибка. По Мору и Мацудо, первой известной хонотрихой с эндогеммией («сумчатой») была Trichochona; позднее сумку нашли у форм с китообразных, близких к трихохоне (Mohr, 1948; Mohr a. oth., 1963b). До работ Мора авторы не знали о наличии у хонотрих разных способов размножения и, соответственно, не использовали эти различия в систематике. Каль, к примеру, видел единственное различие морфологии Kentrochona и Heliochona в разном вооружении ПВ. До сих пор экзо- и эндогеммины объединяются всеми авторами, включая Мора, в рамках одного рода и семейства.
Хотя Мор отрицает наличие сумки у всех хонотрих, открытых до 1948 г. (когда им был описан род Trichochona), типичную сумку имеют установленные еще в прошлом веке роды Stylochona, Kentrochona и Kentrochonopsis. Кент, правда, не изображает почкования стилохон; он отмечает лишь, что они почкуются как спирохоны. Ромпель не рисует сумку у кентрохон; в его описании процесса почкования трудно увидеть эндогеммию. Дофлейн показывает у кентрохон стадии и наружного (рис. 36, И), и внутреннего почкования, но очень схематически и неточно; у Kentrochonopsis им изображена уже настоящая эндогеммия, сумка содержит 1—7 томитов. По нашим препаратам, стилохоны и кентрохоны размножаются только внутренним почкованием.
Экзо- и эндогеммин мы относим к разным подотрядам хонотрих. У эндогеммин сумка лежит всегда по левую сторону тела (рис. 43), но Мору — па стороне, «противолежащей глотке», но в действительности глотка идет вдоль края сумки. У акти-нихонид произошел поворот ПВ, сумка оказалась на дорзальной стороне тела. Раз-
Рис. 42. Почкование и метаморфоз. А—В — Lobochona prorates (по: Matsudo, 1966); Г—Е — Spirochona gemmipara (по: Hertwig, 1877а).
личин длины сумки в какой-то мере связаны с различиями величины трофонта: она наиболее мелкая у Carinichona (вмещает обычно менее половины тела томита), крупнее у большинства хонотрих (около 2/3 томита); у ряда родов сумка вмещает всего томита или даже группу их (Pterochona, Oxychona, Armichona, Echinichona, Crassichona, изохониды с китов). Наиболее примитивные эндогеммины (Isochona, Trichochona) имеют сумку обычного типа; переходных форм между экзо- и эндогемминами
нет. По Мору, сумка едва развита у кентрохон (имеется лишь узкая борозда — гомолог сумки), вмещает почти всего томита у трихохон и 1—2 томитов у цетохон; это, однако, неверно, так как сумка у кентрохон и трихохон одинакова. Как отмечалось,
Рис. 43. Зародышевая сумка у эндогеммин. А, Б — Crassichona insolita-, В — разрастание краев сумки и образование гипоколлюма, схема; Г — Cristichona pacifica', Д—3 — К entro chonop sis multipara (no: Doflein, 1897b); И — Oxychona multifida-, R — Carinichona globulus.
у лобохон после отделения Томита остается небольшое углубление, быстро исчезаю -щее у томонта. Благодаря «мутации» возникла Isochona с глубоким карманом, сохраняющимся и после отделения томита. До первого почкования у эндогеммин нет и следа сумки; зачаток кинетома лежит в небольшом желобке у правого плеча особи.
Онтогенез сумки, таким образом, может свидетельствовать о ее происхождении. Сумка — это, вероятно, защитное образование: погруженных томитов труднее повредить, чем наружных. Нередко развит и специальный защитный аппарат сумки: шипы, выросты верхнего края (например, у Paraoxychona)', стенки сумки резко утолщены у крассихон.
При диминутивном почковании эидогеммин томиты образуются иногда так быстро, что часть их вытесняется на поверхность тела; это все же не экзогеммия, так как развитие томитов прошло в сумке.
У сукторий нет постоянной зародышевой сумки, томиты образуются в зародышевой камере, открывающейся наружу небольшим апикальным отверстием. Мы различаем у эидогеммин две формы циркумвагинации — полную (при отделении первого томита) и частичную (при отделении любого последующего томита). В первом случае томит обособляется со всех сторон от тела томонта, образуется сумка, во втором томит растет в полости готовой сумки и обособляется от ее стенки только слева (рис. 41, Е, Ж.).
Мацудо различает у хонотрих три типа морфогенеза кинетома: у Lobochona зачаток образуется на ровной поверхности тела, у Heterochona (по Добжанской-Качанов-ской, спутавшей нормальное почкование и диминуцию) — на небольшом выступе-в средней части тела, у Chilodochona (по Гийше) — на поверхности протомита, уже близкого к отделению (рис. 41, Л; 44, Л). Невозможно допустить, что зачаток образуется на столь поздней стадии; Гийше приписывает ту же особенность спирохонам и гелиохонам, но у них с достоверностью описана закладка цилиатуры на самой ранней стадии развития томита. Данные о локализации зачатка противоречивы. Рентш различал у гетерохон почки в области шейки, ножки и внутри ПВ (это протомит на разных стадиях развития и мигрант). Почка лежит у хонотрих обычно справа, но ее часто пририсовывают слева (Бальбиани, Штейн, Каль). По Гертвигу почка у спирохон образуется на дорзальной стороне, по Плате — у гелиохон на вентральной; по Дофлейну у кентрохон она лежит то правее, то левее ПВ. Протомита рисовали у основания шейки (Плате) или тела (Гийше, Мор); у хилодохон, по Гийше, почка лежит ниже эпихона. По Мацудо, почки у лобохон образуются в передней трети или половине тела, правее зоны В; у трихохон, напротив, почка растет внутри сумки, в нижней части особи. По нашим данным, в обоих подотрядах томит образуется в определенном месте — несколько ниже правого плеча, на дорзальной стороне; далее почка обособляется от томонта, и сформированный протомит лежит значительно ниже места закладки зачатка цилиатуры. Положение почки зависит от длины тела, шейки, псевдостила.
Ниже приведены литературные данные о ходе почкования хонотрих. У Lobochona prorates, по Мацудо (рис. 39, 42, А—В), кинетосомы появляются на дорзальной стороне, справа от рта, образуют два поля, занимающие эллипс длиной 5 мк. По мере развития почки возрастают число кинетосом, длина эллипса, обособляется С-образный ряд кинетосом или диплокинета. У вершины зачатка появляются пять коротких рядов; в их верхней части кинетосомы сближены, в нижней — расположены редко. Вторая группа кинет появляется у нижнего конца С-кинеты, но видна плохо, ее заслоняет зачаток ножки. По электронномикроскопическим данным, зачаток кинетома имеет вид кармана, дающего начало ресничкам, глотке и ножке. Кинетосомы развиваются, вероятно, de novo на внутренних стенках кармана из скоплений субпелли-кулярных фибрилл. По методу Бодиана импрегнируются лишь кинетосомы, но не-эти пучки фибрилл. Вероятно, в прокинетосоме сначала нет аргентофильных веществ, они появляются с ее созреванием. Зачаток ножки возникает как вырост кармана и также связан с субпелликулярными фибриллами; это ампула с плотно упакованными мембранами и серией пустых пузырьков у верхнего края. Ножка, вероятно, секретируется гранулами цитоплазмы. Глотка — пелликулярное образование, возникает как вырост стенки кармана. Развитая почка прикрепляется основанием (стебелек не отмечен) ко дну неширокого кармана томонта, который остается в задней трети особи,, но сохраняется до нового почкования только при полигеммии.
Штейн считал, что все органеллы томита, включая ядро, образуются у Spirochona gemmipara de novo. Гертвиг показал, что и Ма, и кинетом почки имеют преемственность с материнскими. На дорзальной стороне ПВ, по Гертвигу, образуется горб,, в который входит вырост перистома с кутикулярной выстилкой и рядами подвижных ресничек (рис. 42, Д). С ростом горба зачаток перистома отшнуровывается от ПВ томонта; томит растет вверх и одновременно отделяется от томонта продольной бороздой. Развитая почка прикреплена коротким широким стебельком. Продолжается морфогенез: ресничный желобок открывается наружу и образует продольную борозду;, в ее нижней части возникает «опухоль» с радиальными палочками, видимо образующими палочки ножки. Томонт долго сохраняет ямку со стебельком.
По данным Гийше (рис. 44, А—Д), у томонта Chilodochona carcini тело покрыто-продольными рядами кинетосом; сбоку, ниже ПВ, образуется зародышевый желобок, равномерно покрытый кинетосомами. В верхней части желобка они принимают упорядоченное расположение и путем размножения и элинеации образуют полосу
Рис. 44. Томиты хонотрих. А —Д — томитогенез у Chilodochona carcini (по: Guilcher, 1951); Е — томит Heliochona alternans (по: Guilcher, 1951); Ж—И — томиты Cavichona acanthogammari; К — томит С. multifida', Л. — томит С. 1а-ticollis', М — окраска ампул нейтральротом у томита спирохоны; Н, О — стебелек и розетка у протомита С. multifida', Ht—типичный томит эидогеммин;
Р, С — смещение цилиатуры у осевшего томита С. brevistyla.
из 8—10 коротких кинет. На нижнем конце почки полоса закручивается налево; одновременно появляется более короткая полоса слева, продолжается размножение кинетосом. Обе полосы лежат теперь одна против другой на стенках желобка; появляются многочисленные складки желобка — зачаток ПВ. Образуется ножка; к то-монту почка прикреплена тонким мостиком цитоплазмы. Сходен, но Гийше, морфогенез томита у спирохон и Heliochona alternans, однако описания этих процессов нет.
В описании почкования Heterochona scheutenit у Добжанской-Качановской (рис. 45, Д—3) спутаны стадии нормального и диминутивного процесса. Выступ тела (остающийся после отделения томита), по ее мнению, это зачаток томита, который гомологизируется с сумкой; поперечные складки кутикулы на нем приняты за «морфогенетическое поле кинетосом». Эти кинеты параллельны ротовым и поэтому возникают независимо от них; по мере роста почки они вытягиваются вдоль тела. Кине-тосомы зачатка несут реснички. Сначала образуется правая полоса (6 кинет), затем левая (7—9). После отделения томита остается поперечно исчерченная сумка, в которой ранее находился нижний конец томита. Продольные ряды на теле томонта — это складки, а не кинеты. Для изучения процесса почкования этим автором был выбран, вероятно, линяющий рачок с массовой диминуцией; конечные стадии диминуции приняты за начальные стадии почкования и развития трофонтов.
Первый признак почкования Trichochona lecythoides, по Мору, — выпячивание участка тела в нижней части сумки; почка растет далее вверх, к отверстию сумки (Mohr, 1948). Несколько выше экватора лежит пузырек с тонкими линиями; они становятся четкими и удлиняются вдоль оси тела. В передней части пузырька линии состоят из гранул, в задней — это сеть тонких фибрилл; на протарголевых и гематоксилиновых препаратах виден континиум между кинетами и фибриллами. Кинеты группируются в два неравных сектора (вероятно, в зоны А и В). Сеть фибрилл постепенно отделяется от кинет, образуя зачаток стебелька. Ротовая цилиатура и фибриллярная часть стебелька развиваются из общего зачатка, возникающего de novo в цитоплазме эмбриона. Крупные почки имеют узкий продольный желобок, на стенках которого расположены полосы ресничек.
У Cavichona multifida, по нашим препаратам (рис. 126—128), образуется дорзальный горб с внутренним ресничным желобком, не связанным с полостью ПВ томонта. До образования первого томита псевдокинеты идут продольно; они не переходят на поверхность протомита, где импрегнация по Кляйну выявляет лишь рассеянные тельца. Желобок не замкнут, с самого начала томитогенеза открывается на поверхность томита. Ресничные полосы удлиняются по мере отшнуровки почки; когда освобождается нижняя треть тела, возникает спиральная розетка с длинными ампулами. Протомит прикреплен к томонту небольшим гомогенным мостиком, лежащим в чашевидном выступе тела, исчезающем после отделения почки. С момента образования мостика и до отделения почки не происходит никаких видимых морфогенетических процессов. Расположение псевдокинет после отделения томита нарушено, на дорзальной поверхности томонта они идут поперек тела.
По Раабе (Raabe, 1963), зачаток цилиатуры у инфузорий образуется из части кинетосом инфракинет, либо из рассеянных в беспорядке безресничных кинетосом, либо не из кинетосом, a de novo из участка кортикальной плазмы (у хонотрих и сукторий), при появлении в нем организационного поля. В последнем случае нарушается правило континиума материнской и дочерней цилиатуры. «Процесс новообразования, т. е. эпигенетический морфогенез, становится особенно выраженным там, где далеко заходит процесс соматизации, — у таких Ciliata, как Suctoria или Chonotricha. У этих форм четко продемонстрировано не только новообразование органов и их систем (Кормош, Добжанская-Качановская), но также и некоторые другие явления, связанные с соматизацией и свойственные скорее Metazoa» (Raabe, 1964а : 10). Об эпигенезе говорит и Тартар (Tartar, 1967 : 61), ссылаясь лишь на работу Добжанской-Качановской: «Ltcnophora и Opisthotricha лишены рядов кинет, новые ротовые структуры возникают путем агрегации кинетосом. Гипотрихи, а также Strombidium, Cyathodinium и Heliochona принадлежат к той же группе, ротовые зачатки у них не связаны с предшествующими ресничными рядами».
«У хонотрих, — пишет Добжанская-Качановская, — имеет место почкование. Вся соматическая цилиатура томита образуется независимо от соматической цилиатуры родительской особи. На голой кортикальной поверхности образуется совершенно самостоятельно морфогенетическое поле. Этот маленький зачаток как до, так и после почкования проходит многочисленные фазы развития, ведущие к формированию особи такого же строения, как и родительская. У Chonotricha, следовательно, особо выражен эпигенетический характер развития» (Dobrzanska-Kaczanowska, 1963 : 354). И далее: «В морфогенетической полосе возникают в свою очередь параллельные кинеты. Эти короткие кинеты образуются совершенно независимо от соматической цилиатуры ПВ. Очевидно также, что образованию кинет не предшествует возникновение поля беспорядочно расположенных кинетосом. Действительно, кинеты образуются сразу как линии, а не возникают при реорганизации анархического поля. Вначале
образующиеся кинеты параллельны цилиатуре материнской особи и перпендикулярны ее морфологической оси. В итоге новая морфогенетическая полоса образуется независимо от соматической цилиатуры материнской особи, параллельно этой специализированной цилиатуре» (ibid. : 368). За кипеты приняты, одпако, поперечные складки кутикулы, и уже поэтому мнение об эпигенезе ошибочно. Импрегнация автором не применялась, хотя следовало бы доказать, что в зоне зачатка нет кинетосом. Ни Раабе, ни Тартар не цитируют Мора, Гийше и Мацудо, выявивших продольные аргентофильные ряды, представляющие собой, вероятно, псевдокинеты; судя по данным Рудзин-ской и Батисса, под псевдокинетами залегают настоящие кинетосомы, импрегни-руются же пелликулярные поры. В настоящее время говорить об эпигенезе цилиатуры, да еще без импрегнации и электронной микроскопии, просто несерьезно. Отметим также, что Добжанская-Качановская говорит об эпигенезе зачатка по отношению к ротовой цилиатуре томонта, но зачаток не обязательно должен иметь к ней отношение. Морфогенез РПА без участия ротовой цилиатуры свойствен большинству инфузорий; если в зоне зачатка нет кинет, он возникает из безресничных кинетосом. Это не эпигенез; наличие последнего будет доказано в том случае, если авторы не найдут в зоне зачатка у хонотрих ни кинетосом, ни описываемых Мацудо фибриллярных неаргентофильных прокинетосом, что, на наш взгляд, совершенно исключено.
Гертвиг первым отметил отделение зачатка ножки (скопулы) от соматической цилиатуры у протомитов спирохон; общее происхождение этих структур подтвердил позднее Мор у Trichochona. По Гийше (Guilcher, 1951 : 50), «розетка, с помощью которой секретируется стебелек, образуется, очевидно, de novo и не имеет никакого прямого отношения к комплексу кинетома»; кинеты огибают розетку томита Chilodochona л не доходят до нее у Heliochona. По Мацудо, ножка лобохон, как и стебелек хилодохон, секретируется внутриклеточной железистой ампулой, но последняя имеет все же ресничное происхождение. У томита Мацудо нашел «гранулы зачатка прикрепительного диска» (кинетосомы скопулы?). «Предварительные электронномикроскопические наблюдения по Lobochona prorates показывают, что зачаток прикрепительного диска имеет, несомненно, общее происхождение или по крайней мере фибриллярные связи с развивающимся перистомальным ресничным механизмом и что прикрепительная органелла взрослых особей имеет некоторые структурные признаки, общие с ресничками» (Matsudo, 1966 : 366). Зачаток ножки отпочковывается от ресничного «зародышевого кармана»; кинетосом в нем на снимке Мацудо не видно.
Перед отделением от томонта протомит еще долгое время остается в контакте с ним — видимо, более часа, поскольку эта стадия весьма обычна на препаратах. Хотя Гертвиг говорит о том, что в этой фазе продолжаются морфогенетические процессы, свидетельств этого нет — нет ни роста особи, ни полимеризации кинет. Именно вследствие такой лаг-фазы образуются характерные стробилы при полигеммии; у Со-nidophryidae со щетинок рачков, где стробиляция — нормальный процесс размножения, протомиты продолжают развитие и поочередно эксцистируются. Томиты хонотрих прикреплены к томонту стебельком. Такой короткий и узкий стебелек впервые отметил у спирохоны Штейн, его находит и ряд последующих авторов. Мы регулярно наблюдали стебелек у различных экзо- и эндогеммин, он характерен для отряда в целом; это цитоплазменное, а не прочное внеклеточное образование, как обычный стебелек. Штейн считал, что томит отделяется при резорбции стебелька; по нашим данным, томит отрывается от стебелька, остающегося у томонта. Ромпель, не отмечая стебелька томита, пишет, что томит отделяется при активном движении после долгого покоя.
Наблюдений по отделившимся томитам мало; часто указывается, что они плавают медленно, на короткие расстояния, быстро гибнут в отсутствие рачков, срок их жизни измеряется часами (Штейн, Гертвиг, Гийше, Добжанская-Качановская, Фенхель и др.). В перемещении их важную роль должны играть токи воды, движения придатков хозяина — пассивные факторы среды; томиты хонотрих существенно отличаются в этом от бродяжек перитрих. Мацудо отметил тенденцию к оседанию томитов вблизи родительской особи. Активное' движение отмечено Гийше лишь у томитов хилодохон, имеющих многочисленные кинеты.
Кинетом томитов Lobochona prorates необычен (Matsudo, 1966; см. рис. 42, Б): кинеты занимают небольшую часть тела, зона А включает 5 кинет (одна из них резко удлинена), зона В — также 5 кинет. Вероятно, кинеты зарисованы Мацудо с дорзальной стороны. Стебелек не отмечен; скопула имеет вид сферы с радиальными пальцевидными выростами. Ниже полосы кинет в зоне скопулы на поверхности тела лежат импрегнируемые тельца. Описание томита Trichochona lecythoides у Мора краткое, без рисунка (Mohr, 1948). На стенках желобка лежат две полосы кинет, максимум 6 кинет в зоне А у томитов, 12 у молодых трофонтов, 18—32 у взрослых. Мацудо (по препаратам Мора) отмечает, что кинеты у томитов трихохон занимают значительно меньшую площадь, чем у лобохон (несмотря на полимеризацию); с ними связан сложный фибриллярный комплекс. У томита Heterochona scheutenii, по Валленгрену (рис. 45, А — В), ресничный желобок широкий, несет симметричную цилиатуру; полоса А включает
8 . Заказ № 213
8 — 9 кинет, полоса В — 11—12 кинет. Вместо массивных ампул изображены тонкие радиальные нити; к ампуле снизу ведет ресничная мешковидная полость. По Доб-жанской-Качановской (рис. 45, Д), но краю желобка томита Н. scheutenii залегают «трихиты» — «зачаток опорных радиальных палочек» (шипов?) ПВ; рта и глотки нет. Кинеты параллельны, зоны А и В включают 7 и 8 кинет (у трофонта 14 в зоне В); три крайних правых ряда зоны А удлинены и изогнуты влево. Автором изображен, видимо, уже прикрепленный томит, так как скопула удалена от кинет. По Гийше (рис. 44, Е), зоны А и В томита Heliochona alternans включают 7 и 6 кинет; шов между ними идет почти продольно, правые ряды зоны А не изогнуты. Зона А укорочена, не достигает розетки, зарисованной схематически и неточно. Длина кинет зоны В возрастает слева направо (вероятно, ошибка). У томита Kentrochonopsis multipara, по Дофлейну, желобок узкий, расширен сверху; ампулы у большинства томитов показаны неправильно. Ампулы отходят от плотного хромофильного диска — скопулы.
Томиты у Chilodochona qvennerstedti, по Валленгрену (рис. 45, И), почти округлые, с глубоким желобком и многочисленными ресничками. Томиты Ch. carcini, по Гийше (рис. 44, Д), очень крупные, сплющены дорзо-вентрально. Корлисс указывает последний признак как общий для томитов всех хонотрих, но они сплющены лате-рально (как Dysteria). По Гийше, желобок хилодохон слабо выражен, широкий и неглубокий. Зоны А и В включают около 14 и 16 кинет. Рот имеет вид узкой продольной щели (по Холлу, он отсутствует); полоса А резко изогнута налево, шов почти поперечный. Поверхность тела несет аргентофильную сеть и многочисленные кинетосомы (аргиросомы), не собранные в ряды. Зачаток стебелька (широкий плотный диск) лежит на том же меридиане, что и рот; в глубь тела от него отходит розетковидная группа мелких палочек, отмеченная, кроме Гийше, и Форе-Фремье. Томиты Spirochona gemmipara неоднократно изображались в литературе (Штейн, Бючли, Гертвиг, Каль, Пенар, Бальбиани; см. рис. 45, К—Н), однако точных, детальных зарисовок нет. Контуры томита мешковидные или угловатые, почти ромбические. По Гертвигу, желобок узкий, почти замкнут в средней части, слегка расширен в апикальной; ресничная полоса, как и у трофонта, единая. Иногда отмечают, что апикальные реснички крупнее остальных. «Рот» рисует лишь Бючли (рис. 45, Л), но это скопула. Гийше различает у томитов спирохон две полосы кинет, правую и левую; рот, по ее данным, лежит в небольшом углублении спереди между этими полосами, ограничен двумя складками, ведет в глотку (не находимую ранее у томитов), расположен на меридиане розетки.
' Кажущееся многообразие томитов хонотрих обязано скорее, неточностям наблюдений; судя по нашим препаратам, они удивительно сходны в разных группах хонотрих, что объяснимо сходством процессов томитогенеза. По внешнему облику и кинетому можно определить род и вид томитов апостомат, ринходид, сукторий, но не хонотрих; у последних различимы всего три основных типа томитов (рис. 46, 47). Томиты Spirochonidae массивные, сплющенные, с угловатым, почти прямоугольным телом, с Г-образным желобком; передний конец тела широкий, с четкими складками, окаймляющими зачаток ПВ — апикальную часть желобка. Томиты Chilodochonidae массивные, мешковидные или почти округлые, с непропорционально крупным, очень глубоким желобком, с полимеризацией кинет; апикальный отдел широкий, с высокими складками. У томитов остальных хонотрих тело почти цилиндрическое, трубчатое, слабо сплющенное, с закругленными концами; желобок С-образный, апикальный отдел неширокий и неглубокий, складки довольно слабо выражены. Томиты эндогеммин мельче и тоньше, чем у экзогеммин. Размеры томитов в отдельных группах зависят от величины трофонтов (17 мк у Carinichona, до 56 мк у Crassichona), по это не общее правило. Томиты хонотрих обычно сплющены латерально; пелликула ровная, без ребер, панилл, псевдокинет; Ма овальный, трехслойный, лежит в передней половине тела; Ми находятся ниже Ма. Соматическая цилиатура погружена в вентральный желобок, расширенный сзади и особенно в верхней части. Апикальный отдел или весь желобок в литературе часто называют зачатком перистома. Ресничные полосы состоят обычно, особенно у спирохонид, из четких адесмокинет. Имеются рот (на дне апикальной полости) и тонкая длинная трубчатая глотка, как у трофонтов, но томиты не питаются: нейтральрот выявляет лишь редкие гранулы вакуома и широкие ярко-оранжевые (со щелочным содержимым) секреторные ампулы (рис. 44, М), собранные в крупную розетку; протоки их открываются в зоне префор-мированного розетковидного эндостила и скопулы— плотного диска у нижнего конца желобка. За трихиты Добжанская-Качановская приняла четко видимые крупные кинетосомы зоны А. Оба конца С-образного желобка томитов отогнуты направо, от ПВ томонта. Томиты Cavichona laticollis имеют 5—7 кинет в зоне А, 14—16 в зоне В; длина кинет уменьшается справа налево. У эндогеммин зоны очень узкие и содержат обычно 5—8 кинет. Зона С у томитов пока не обнаружена. Кроме зоны С у хонотрих' должна быть найдена также короткая дорзальная тигмотактическая кинета, свойственная всем .HypOstomatida-, по Деру, у дистерий она инкорпорирована в РПА, лежит в дорзальной части ПВ. Интересно совпадение локуса этой кинеты и зоны зачатка цилиа-
Рис. 45. Томиты хонотрих и их метаморфоз. А—3 — томиты Heterochona scheutenii (А—Г — по: Wallengren, 1895; Д—3 — по: Dobrzanska-Kacza-nowska, 1963); — томиты Chilodochona qvennerstedti и Ch. micro-
chilus (no: Wallengren, 1895); К—H — томиты Spirochona gemmipara (по: Hertwig, 1877а; Biitschli, 1877; Penard, 1922; Stein, 1854); О — метаморфоз Chilodochona carcini (no: Guilcher, 1951); 77*—Hs — томиты спирохонид; P — смещение цилиатуры при разрастании кортекса томитов, схема; С — топография цилиатуры гипостомат, томитов и трофонтов хонотрих.
туры у томонта; не исключена поэтому роль кинеты или рассеянных кинетосом данного локуса в морфогенезе томита.
Поскольку томиты хонотрих в целом сходны, а трофонты поразительно многообразны, метаморфоз протекает по-разному в разных группах; наиболее интересны начальные стадии, протекающие сходным образом у всех хонотрих. Дивергенция начинается со стадии фиалохоны.
У томитов Lobochona prorates Мацудо (Matsudo, 1966; см. рис. 39; 42, В) рисует лишь ядра и кинеты; им не показаны преформированная ПВ и желобок. Вентральная скопула, лежащая в задней трети тела, по Мацудо, принимает после прикрепления
Рис. 46. Томиты хонотрих. А—Г — Cavichona laticollis; Д—И — С. brevi-styla (на рис. 3 очерчена зона разрастания кортекса).
терминальное положение благодаря перекручиванию тела. Только теперь инваги-нируются верхняя часть С-образного ряда и зона В, возникают складки и выросты апикальной части панциря — зачаток ПВ. Нижняя группа кинет удлиняется и закручивается полукольцом; полимеризация кинет происходит на самых ранних стадиях, до цефализации. Постепенно сжимается тело, образуется шейка, укрупняется ПВ, разросшийся эпихон образует лепестки.
По Валленгрену (Wallengren, 1895, 1896), ПВ уже преформирована у томита Chilodochona qvennerstedti'. передняя часть тела несет две губы, ограничивающие глубокую ресничную полость. Метаморфоз поэтому несложен: осевший томит быстро образует длинный стебелек, начинает питаться. По мере его роста укрупняются губы ПВ. По Гийше (Guilcher, 1949—1951; см. рис. 45, О'), томит Ch. carcini 3—4 часа плавает в пределах ротовых частей хозяина, затем оседает на субстрат, вращается некоторое время и теряет подвижность. Дорзальная сторона тела резко утолщается, сплющенный томит становится грушевидным. Быстро секретируется стебелек, достигающий нормальной длины еще задолго до образования ПВ. Оси тела и органелл,
согласно Гийше, ориентированы по-разному на разных стадиях развития. Томит вначале лежит параллельно субстрату, отклоняясь на 180° по мере секреции стебелька; рот при этом обращен вверх, а не вниз. С ростом дорзальной части тела весь ресничный диск смещается вверх, образуя расширенный апикальный отдел; полосы кинет лежат теперь па внутренней поверхности двух параллельных складок. Особо велика вентральная складка. При выпрямлении томита скопула окончательно отделяется от кинет и смещается вниз; цилиатура смещается вверх целиком, без изменений. Это описание неточное: по нашим данным, у томитов хилодохон (Ch. aranei) имеется преформированная ПВ — апикальный отдел желобка со складками; после оседания сюда втягивается нижняя (латеральная) часть цилиатуры желобка. Стебелек выделяется молодыми трофонтами, уже потерявшими облик томитов.
У молодых трофонтов Trichochona lecythoides с неразвитой ПВ еще нет шейки; различимы обе зоны кинет с 12 рядами в зоне А; у почки зона А содержит 6 рядов, у трофотомонта 18—32 (Mohr, 1948). По Валленгрену (рис. 45, А — Г), У осевших томитов Heterochona scheutenii расширяется апикальный отдел, появляется глотка, кинеты занимают всю внутреннюю поверхность ПВ. По Добжанской-Качановской, томиты Н. scheutenii очень тигмотактичны, оседают обычно на ближайшей «жабре» (плеоподе); возможно, они прикрепляются сначала всей вентральной поверхностью, затем скопулой. При разрастании дорзальной части тела (рис. 45, Д—3) скопула смещается вниз, ресничная поверхность — вверх, мелкие «трихиты» образуют шипы (I). Трофонт имеет теперь 7 правых и 5—9 левых кинет. С возрастом кинеты зоны В полимеризуются. Уже на самых ранних стадиях метаморфоза появляется якобы зачаток цилиатуры нового томита, но это явно стадии диминуции.
По Штейну (Stein, 1854; см. рис. 45, Н), расширенная апикальная часть желобка несет длинные реснички (для плавания), вентральные же реснички у томита Spirochona gemmipara укорочены, погружены в желобок. Вначале (Stein, 1852) рот был отмечен у томита; позднее (Stein, 1854) указано, что он скорее всего появляется сразу после оседания томита в зоне длинных ресничек. Только эти реснички образуют ПВ, латеральный желобок резорбируется.
В целом правильны данные Гертвига (рис. 42, Д), согласно которым томит спирохон безротый, не питается, движется вяло и медленно. Найдя место, он непрочно прикрепляется нижним концом и начинает медленно вращать верхний конец, затем успокаивается. Края ПВ — это резко расширенные края апикальной части желобка томита Узкий латеральный отдел после оседания подтягивается вверх, отделяясь от розетки. Особь пока не питается; рот и глотка (зарисован дорзальный канал!) возникают, когда трофонт похож на взрослых спирохон, но мельче их и имеет меньшее число витков. Появляются первые пищевые вакуоли. После втягивания желобка края ПВ смыкаются; в месте соединения остается складка, растущая внутрь ПВ (зачаток завитка). Намечается шейка, начинается рост завитка вверх. Складка.или вырезка стенки ПВ, указывающая на положение желобка, видна-у молодых спирохо-нид в работах Эйсмонда и Сварчевского. Гийше объясняет распрямление томита спирохон (метаморфоз не описан) не только разрастанием дорзальной стороны тела, но и миграцией скопулы вниз после вращения- особи на 90°. По мере роста трофонта нижняя часть полосы А закручивается спиралью. Меняется структура пелликулы, появляются складки (Гертвиг) или кинеты (Гийше).
По нашим наблюдениям (рис. 44, К—С; 46, 47), осевшие томиты спирохонид прикрепляются дисковидной скопулой; ампулы уменьшаются в размерах, становятся аморфными и исчезают, на их месте видна группа фибрилл, отходящих от эндостила. Ножка образуется розеткой (эндостилом) томита сразу же после его оседания, до распрямления и до резорбции ампул. Видимо, содержимое ампул расходуется на образование ножки. Ампулы резорбируются у спирохонид, сохраняются без изменений у хилодохонид; у большинства же хонотрих они заменяются в ходе метаморфоза одной крупной ампулой. Образование ПВ начинается сразу после оседания томита. В апикальной воронке томита лежат рот, полоса В и верхняя часть полосы А; в воронку втягивается латеральная часть зоны А. Сдвиг ее может быть вызван только разрастанием зоны, очерченной на рис. 46, 3; расширяется и апикальный отдел, куда смещается цилиатура. Когда полоса втянута в ПВ, томит еще прилегает к субстрату; затем продолжается разрастание дорзальной поверхности (обращенной к субстрату), вызывающее распрямление особи. Намечается шейка, появляется цитопрокт; контур ПВ становится почковидным. Дорзальная складка начинает расти в глубь воронки, образуя завиток; эпихон остается складчатым, гипохон — ровным. На рис. 47 показана стадия фиалохоны — общая для хонотрих стадия распрямленного трофонта с простой ПВ и едва наметившейся шейкой. Дальнейшие пути развития расходятся. У спирохон, к примеру, укрупняется тело, образуется завиток, полимеризуются кинеты зоны В; у Cavichona laticollis в зоне В видно 12 кинет у молодых трофонтов, 20 у взрослых. Рот и глотка, возникшие уже у протомита, сохраняются без изменений у томитов и трофонтов. Питание начинается сразу же после оседания томита, задолго до стадии фиалохоны. Вентральная сторона томита соответствует дорзаль
ной, а не вентральной стороне трофонта; в онтогенезе хонотрих имеет место, следовательно, инверсия сторон тела. ПВ дистерий сплющена латерально, ПВ хонотрих — дорзо-вентрально.
Метаморфоз томитов был прослежен нами у большого числа экзо- и эндогеммин. Независимо от субстрата (у сето- и планибионтов) и облика дефинитивного трофонта у всех хонотрих ранние стадии метаморфоза сходны: томиты прикрепляются, втягивают латеральную полосу в расширяющуюся ПВ, распрямляются при локальном разрастании кортекса. В онтогенезе рекапитулируются стадии дистерии и фиало-
Рис. 47. Стадия фиалохоны в метаморфозе томитов. А—Д — фиалохона Cavichona laticollis; Е—3 — развитие Spirochona brevis', И— адесмоки-неты спирохон; К—Н — полимеризация кинет зоны В у растущих трофонтов С. laticollis.
хоны (примитивной гипотетической хонотрихи, предшественницы лобохонид). Томит прикрепляется скопулой, остающейся далее на месте; нет ее миграции, о которой говорит ряд авторов, есть лишь разрастание кортекса между скопулой и ПВ. После стадии фиалохоны начинаются образование защитного аппарата, видоизменение РПА, секреция стебелька, развитие гипоколлюма, удлинение шейки и другие процессы, в зависимости от морфологии вида. Стебелек секретируется быстро, на самых ранних стадиях роста. Взрослые трофонты настолько отличаются от томитов,- что последних иногда называют личинками или эмбрионами, а сложный цикл развития трофонтов, с рядом промежуточных стадий, — своего рода эмбриональным развитием (Kahl, 1935; Mohr, 1948; Guilcher, 1951; Fenchel, 1965). Основные отклонения от типичной схемы развития следующие: образование очень длинного эндостила у сте
бельчатых эндогеммин; инверсия зон и складок НВ у филлохоп, параоксихоп и ипвер-сохопид; выпадение стадии полного распрямления у отдельных первично- и вторично-бесстебельчатых форм (типа Ctenochona)', поворот ПВ вправо у актинихопид; резорбция ампул у спирохонид и некоторых других родов; сохранение их числа у хилодо-хопид.
ДИМИНУТИВНОЕ ПОЧКОВАНИЕ И ПОЛИГЕММИЯ (НА ЛИНЯЮЩИХ РАЧКАХ)
При почковании сидячих инфузорий томонт не дедифференцируется, он сохраняет ротовой аппарат, продолжает питаться; в этом одно из отличий почкования от монотомии и палинтомии. Гертвиг отметил, однако, необычное почкование спирохон с уменьшением томонта: исчезают ПВ, завиток, от особи остается лишь рудимент; одновременно образуется группа почек. Такое явление наблюдали и ранее, но считали его преждевременным (личиночным) почкованием. Это необычное почкование обозначалось позднее как эпидемическое (Сварчевский), рудиментарное (Валленгрен) или диминутивное почкование (Мацудо); оно отмечено у Spirochona gemmipara (Stein, 1852, 1854; Hertwig, 1877a; Plate, 1886; Balbiani, 1895; Penard, 1922), Spirochona sp., Cavichona elegans (Сварчевский, 1928a, 19286), S. halophila, Oenophorachona ectenolaemus (Matsudo a. Mohr, 1968), Heterochona scheutenii (Rentsch, 1860; Wallengren, 1895; Dobrzanska-Kaczanowska, 1963), H. coronata (Bate a. Westwood, 1861), Lobochona prorates (Matsudo, 1966), Kentrochona nebaliae (Rompel, 1894; Doflein, 1897a) и Kentrochonopsis multipara (Doflein, 1897b). Мы наблюдали диминуцию у многих экзо- и эндогеммин, исключая гелиохон, филлохон, хилодохонид и некоторые другие формы. Диминуция — это последовательное почкование без питания особи, пока от нее не останется рудимент; полигеммия — отделение двух и более томитов, независимо от наличия или отсутствия диминуции. Пока остается неясной связь этих процессов. Часто указывается, что полигеммия возможна и при нормальном почковании, и при диминуции (у трофотомонтов и томонтов). По Штейну, при размножении спирохон и гетерохон могут образоваться 1—2 почки. По Гийше, хонотрихи обычно размножаются одиночным почкованием, как исключение — множественным (Kentrochonopsis). О полигеммии говорят Лепши, Холл и др., также не уточняя, что это процесс, завершающий жизнь томонта. Kentrochonopsis в норме размножается моногеммией. По Мору и Мацудо (Matsudo, 1966; Mohr a. Matsudo, 1970), у хонотрих, по крайней Мере у лобохон, спирохон и гетерохон, имеются два разных способа почкования: при первом способе родительская особь сохраняет свою структуру, при втором уменьшается. При обоих типах почкования (нормальном и диминутивном) могут быть образованы множественные почки; томонтов обоих типов можно встретить иногда на одном и том же придатке.
Причина путаницы, по нашим данным, в том, что в начале диминуции, когда особь может отделять двух томитов, она часто выглядит еще нормальной — имеет развитую ПВ, шипы или завитки, достаточно крупна. Судя по нашему материалу, полигеммия никогда не встречается на нелиняющих рачках; образование же внешне нормальными томонтами двух почек — это уже ускорение почкования, начало диминуции. На таких рачках можно наблюдать и начавшуюся полигеммию или тотальное превращение в томитов у перитрих и сукторий. Среди хонотрих с двумя почками мы найдем и отдельных особей на более продвинутых стадиях диминуции и типичных моногёммических томонтов: начало диминуции не строго синхронное, поэтому часть томонтов успевает отпочковаться до экзувиации, часть почкуется на сброшенном панцире. Если виден зачаток кинетома третьего томита, то мы наверняка найдем признаки упрощения строения томонта, его диминуции. На этих придатках томиты уже не оседают.
По Штейну, почкуются не только взрослые, но и недоразвитые особи Spirochona gemmipara, достигшие 1/3—х/2 нормальной длины; часто почкуются и сами почки сразу после оседания; новая почка вырастает у основания исходной (рис. 48, Г—Е). Осевший томит не развивается в трофонта. Штейном изображены мелкая особь с двумя томитами, почка с боковым выростом; отмечен томит с длинным стебельком. Это, однако, стадии диминуции — томонты и тёлотомиты на рудименте томонта. По Гертвигу, процесс почкования у спирохоны идет неоднократно и иногда так оживленно, что вторая почка образуется еще до отделения первой. R этом случае особь не растет, а, напротив, мельчает; ПВ уменьшается и исчезает. В итоге столь интенсивного почкования томонт настолько мельчает, что томит оказывается крупнее его; остается «стебелек» — безъядерный рудимент, несомненно погибающий (рис. 48, 3, И). Сходно описание Плате: кроме моногеммии, у спирохон найдена и полигеммия, при которой постепенно прекращается рост клетки, почки отделяются одна за другой, причем новая образуется до отделения предыдущей. Ма, не делясь, переходит в телотомита; рудимент томонта лишен ядра, не регенерирует (рис. 48, Ж). Хотя Бальбиани мельком отмечает, что с молодыми трофонтами можно спутать мелких томонтов, атрофированных после серии почкований, он также их спутал: показаны не стадии развития,
Рис. 48. Диминутивное почкование. А—И — Spirochona gemmipara (Л15 А2 — по: Penard, 1922; Б, В — по: Balbiani, 1895; Г—Е — по: Stein, 1852, 1854; Ж — по: Plate, 1885; 3, И — по: Hertwig, 1877а); К—П — Heterochona scheutenii (К, Л — по: Wallengren, 1895; М — по: Rentsch, 1860; Нг, Н2, О — по: Dobrzadska-Kaczanowska, 1963; П — ориг.); Р15 Р2 — Lobochona prorates (по: Matsudo, 1966); С—У — Kentrochona nebaliae (по: Doflein, 1897а); Ф, X — Chilodochona carcini (по: Guilcher, 1951); Ц — Ch. microchilus (по: Wallengren, 1895).
а типичный телотомит с рудиментом томонта (в подписи — «бродяжка непосредственно после оседапия») и явно диминутивный томонт. По Пепару, стадии диминуции у спирохон очень редки, по на некоторых гаммарусах томонты встречаются в большом числе; па первый взгляд кажется, что па этих рачках живут особые виды хонотрих. По мере почкования, по Пенару, томонт уменьшается, резорбируется ПВ; телотомит сидит на стебельке — остатке томонта (рис. 48, А). Такие стебельки часто остаются после отделения телотомита. Причин диминуции названные авторы не обсуждают.
Сварчевский отмечает «эпидемическое» почкование у <iS pirochona gemmipara» (Cavichona sp.?) в Байкале; им изображена группа телотомитов. Слишком крупный томит (до 37X28 мк) показан им у 3. simplex (рис. 49, О). При диминуции у С. elegans, по Сварчевскому (рис. 50, В—К), образуется сразу несколько, обычно 2—3 «гаметы», томонт дегенерирует. Почкование идет непрерывно, Ма делится без интерфазы, клетка не растет. Телотомит образуется без деления Ма. Почки плавают медленно, описывают широкие круги, раскачиваются (поскольку реснички лежат в латеральном желобке), живут 1—2 часа, далее гибнут. Они могут оседать на жабрах рачка или на дне сосуда, но не развиваются: для развития нужен новый хозяин.
Диминуция у Lobochona, по Мацудо (рис. 49, Б—М), идет одновременно у всех особей на плеоподе. Почкование начинается как обычное, но размеры томонта уменьшаются по мере роста почки, исчезают лепестки ПВ; когда томит полностью сформирован, от томонта остается рудимент длиной 9 мк. Создается впечатление, что томонт отделяет лишь одну почку; действительно, у некоторых видов энофорахон мы отмечали массовое образование трофотомитов. По Мацудо, чаще всего томонты лобохон несут одну развитую и одну образующуюся почку; диминуция может иметь место при оно- и полигеммии.
Внешне нормального томонта, но с двумя почками, рисуют у гетерохон Байт и Валленгрен. ПВ крупных особей теряет шипы, уменьшается, становится трубчатой и почти исчезает при образовании телотомита (рис. 48, К, Л). Многочисленные стадии диминуции, но в беспорядке изображает Рентш у Heterochona scheutenii (рис. 48, 7W); диминуция заканчивается образованием телотомитов, сидящих на стебельке — рудименте томонта. Добжанская-Качановская не разграничила нормальное почкование и диминуцию у Н. scheutenii; стадии диминуции расположены ею в обратном порядке и приняты за стадии роста и преждевременного почкования трофонта (рис. 45, Д—3; 48, Н, О). Поперечно исчерченный выступ тела появляется якобы на самой ранней стадий роста трофонта, это зачаток цилиатуры томита (в действительности одна из конечных стадий диминуции: выступ остается после отделения томита). Первый томит начинает расти параллельно росту «молодого трофонта»; сразу же после его образования закладывается цилиатура новой почки. Деления Ма не коррелированы с морфогенезом цилиатуры. В итоге образуется группа (до трех) почек, отличающихся размерами,’числом кинет. ПВ не резорбируется, продолжает расти и полностью формируется к моменту образования третьего томита. Только теперь начинается дегенерация крупных томонтов; после полигеммии уже не восстанавливается нормальный облик. Добжанская-Качановская описывает «почкование почки» (педогенез): нет деления Ма, морфогенез кинетома прост — отсекается часть кинет. Это, однако, не педогенез, а ранняя стадия образования телотомита: видны кинеты телотомита и рудимента томонта. Вероятно, для изучения метаморфоза трофонтов автором был выбран рачок с массовым диминутивным почкованием.
Ромпель отметил мелких особей Kentrochona nebaliae без шипов, с рудиментом ПВ или без него, с 1—2 томитами (рис. 199); они остаются после интенсивного почкования. Дофлейн отмечает образование у кентрохон новой почки в период, пока еще не отделилась первая; после интенсивного почкования остаются,мелкие дегенерирующие особи с рудиментом ПВ (рис. 48, С—У). Им изображены также стробилы Kentro-chonopsis с 4 и 7 протомитами, уже потерявшие облик типичных томонтов (рис. 43, Д—3): нет шипов, воронки, гигантская аморфная сумка заполняет почти все тело. Дофлейном показан и томонт кентрохонопсиса с нормальным внешним обликом, но с томитом в сумке и с ядром на стадии нового деления. Им найдены дегенерирующие особи без ПВ, с одним массивным томитом и рудименты без томитов, но с цикломерным Ма, еще не закончившие почкования. Дофлейн не выяснил, образуются ли стробилы одновременно или последовательно; Каль ошибочно говорит о синхронной полигеммии. Лёнг находил у Kentrochonopsis sp. из США нормальныхтомонтов с 3 томитами и диминутивные стробилы с 4—6 томитами.
Диминуция наблюдалась нами у большого числа родов и видов экзо- и эндогеммин, но она, вероятно, отсутствует у отдельных родов экзогеммин (гелиохон, элей-терохон, хилодохонид). Диминуция у хонотрих протекает однотипно. Более или менее синхронно почкуются все особи на придатке, сохраняющие вначале нормальный облик; отделяется один томит, быстро образуется второй, начинается рост третьего. Томонт постепенно уменьшается; после образования телотомита от него остается чашевидный или стебельчатый рудимент без Ма, иногда с остатком ПВ (рис. 50, А; 51). Довольно часты диминирующие томонты с двумя томитами, более редки — с тремя.
На образование телотомита расходуется почти весь остаток томоита, за исключением рудимента ПВ и участка склероплазмы с эндостилом и ножкой (стебельком). Тело-томпты нередко крупнее отделившихся рапсе почек. Инволюция ПВ особо наглядна
Рис. 49. Диминуция и полигеммия. А — Cavichona elegans', В—М — Lobochona prorates (по: Matsudo, 1966); Н — Heterochona scheutenii (по: Wallengren, 1895); О — Spirochona simplex (по: Сварчевский, 19286); П — Cristichona paeijica', Р — Dentichona marginata; С — Spirochona gemmipara', T — S. globulus.
у форм с шипами или завитком эпихона: сложная спиральная ПВ последних превращается в простую коническую воронку, как на стадии фиалохоны, и далее резорбируется. Изменения ПВ при диминуции идут в обратном порядке по сравнению с метаморфозом. Зачаток кинетома томита при диминуции может возникать в разных точках.
что и делает возможной иолигеммию. У эидогеммин диминуции усложнена наличием сумки. Первый томит закладывается внутри сумки, второй — на стенке сумки, выше или ниже, и по мере роста может вытеснить первого из сумки; в свою очередь его может вытеснить третий томит, и т. д. (рис. 51, И). Развитие наружных почек прошло все же в сумке, это эидогеммин. Другой вариант — резкое расширение сумки внутри томонта, вмещающей большое число (2—7) томитов; такие сумки отмечены у цетохон, Isochona, Ctenochona, Pterochona, Kentrochonopsis. Только в одном случае наблюдалось удвоение сумок (рис. 49, И).
Началом диминуции, которое приводит к гибели томонта, является момент закладки зачатка второго томита до обособления первого. Формирование двух первых,
Рис. 50. Диминуция и полигеммия. А — Oenophorachona urceolata; Б—К — Cavichona elegans', Л — «Spirochona gemmipara» (по: Сварчевский, 1928а, 19286).
еще не отделившихся томитов обычно не отражается заметным образом на морфологии томонта, еще продолжающего питаться, но на образование третьей почки уходит уже значительная часть тела. С момента прекращения питания все содержимое томонта расходуется на томитогенез. Отделяется еще серия томитов, после чего образуется телотомит. Пока неясно, как протекают инволюция ПВ и резорбция стенок тела, ПВ, шипов, кинетосом при диминуции; нужны электронномикроскопические наблюдения. Мы говорили пока о последовательном почковании (стробиляции) у полигемми-ческих томонтов. При образовании серии томитов Ма томонта делится последовательно, а морфогенез кинетома новой почки начинается еще до завершения образования предыдущей. Такое размножение — последовательное почкование (по отношению к Ма) с элементами одновременного (по отношению к кинетому). Интересно поведение Ма при стробиляции. Томонт не растет, томиты образуются непрерывно; Ма делится несколько раз (обычно 5—8) без интерфазы. Сварчевский говорит о четырех делениях Ма у Cavichona, исходя лишь из «гомологии» с мейозом, но столь крупные хонотрихи при диминуции почкуются несомненно значительно чаще. Из телофазы одного деления Ма должен вступать в профазу нового, минуя интерфазу. Когда в таком случае происходит синтез ДНК и возможен ли он вообще? Не исключено, что синтеза нет и Ма делится анизотомически.
Рудимент томонта особо велик у форм с псевдостилом (высшие спирохониды, отдельные виды гетерохон, энофорахон); обычно резорбируются ампулы, но нет случаев резорбции эндостила, ножки и стебелька — вероятно, потому, что это внеклеточные структуры. У эидогеммин исчезают шипы ПВ, но нередко остается часть соматических шипов (рис. 51, Ж, 3). Сохранение склероплазмы тем более странно, что на образо-
ванне почки идет и менее пригодный, казалось бы, материал — шипы, кутикула, реснички; видимо, склероплазма — слишком специализированный отдел томонта. Величина рудимента может варьировать внутри вида у разных особей. Ядра в рудименте нет, к развитию оп неспособен. По Дофлейиу, Сварчевскому и Добжапской-Качановской, остается дегенерирующий Ма или Ми, по это еще не конечные стадии диминуции. По Мацудо, у лобохон остается аморфная, слабо красящаяся масса хроматина, но это скорее остаток ампулы, а не Ма.
Рис. 51. Диминуция и полигеммия. А—Е — Heterochona coronata', Ж, 3 — Dentichona marginata; И — Inversochona peregra.
Под названием Chilodochona microchilus Валленгрен описал томитоподобных особей без типичной ПВ, сидящих на длинном стебельке (рис. 45, 48, /(). Найдена
небольшая «колония» на ротовых частях Portunus depurator, в норме несущего Ch. qvennerstedti. «Возможно, что эти формы возникли при случайной задержке роста, либо вентральная губа у Ch. qvennerstedti редуцировалась при повторном почковании, как часто редуцируется перистому Spirochona и Heliochona» (Wallengren, 1896 : 551). Большинство авторов признало особей, зарисованных Валленгреном, томитами или трофонтами на ранних стадиях развития, что неверно. Гийше рисует в точности таких же особей у Ch. carcini (рис. 48, Ф, X): это стадии тотального превращения трофонта в трофотомита. Процесс происходит при «особых, строго определенных обстоятельствах, в целом неблагоприятных для жизни инфузорий». В январе на литорали Роскоффа (Франция) на двух из 15 экзувиев молоди Carcinus maenas были отмечены поселения хилодохон, в которых все особи превратились в трофотомитов; видна и масса покинутых стебельков. При тотальной трансформации, по Гийше, морфогенез протекает в обратном порядке по сравнению с метаморфозом томита: исчезают складки ПВ, реснич
ная зона располагается вертикально, вдоль тела трофотомита, особь поворачивается на 90°, оставляет стебелек и уплывает. Трудно допустить, что происходит лишь смещение, а не реорганизация кинетома. Трофотомиты отмочены нами у различных видов хилодохон, у вазихоп и криптохоп; вероятно, у хилодохонид пет полигеммии и диминуции, а у большинства других хонотрих, кроме части лобохон и энофорахон, нет трофотомитов. У последних родов возможны типичная диминуция и, реже, образование трофотомитов; закономерности встречаемости этих процессов пока неизучены. Телотомиты, образуемые в конце диминуции, не гомологичны трофотомитам. Поскольку хилодохониды произошли от форм с типичным циклом, полигеммия и диминуция утрачены ими вторично.
Каковы же причины диминуции? По Сварчевскому (1928а), «эпидемии» почкования у Cavichona elegans начинаются весной и осенью и продолжаются много дней. Полигеммия служит для конъюгации — спариваются молодые трофонты, образовавшиеся из таких почек («гамет»). Незначительное снижение температуры воды в Ангаре в эти периоды (с -|-4 до -f-1.50 С) не могло быть причиной «эпидемий». Питание также не играло роли, скорее в этот период оно было даже более активным. Минеральное солевое содержание в воде упало, но незначительно. В итоге причины «эпидемий» почкования неясны; возможно, что названные факторы действуют косвенно, например изменяя pH или условия питания. Позднее, обнаружив полигеммию у спирохон в Байкале на глубине 150 м, Сварчевский (19286) указывает, что в Ангаре диминуция связана с периодами понижения температуры ниже -|-40 С, в Байкале же на такой глубине эта температура держится весь год и диминуция возможна поэтому в любое время.
В тралах и литоральных пробах мы находили байкальских гаммарид и с нормальным, и с диминутивным почкованием; в коллекциях, собранных в разные сезоны года (включая подледные сборы рачков), отмечены те же две группы хозяев. Отдельные рачки с массовой диминуцией встречаются также в наших пробах у Gammarus, Aniso-gammarus, Allorchestes, Limnoria, Nebalia и т. д.; это предлинечные особи либо рачки, находящиеся в процессе линьки (экзувиации).
Ромпель и Валленгрен первыми правильно истолковали переход от нормальной моногеммии к диминуции, считая, что процесс связан с линькой рачка. УKentrochona nebaliae «почкование становится особенно интенсивным когда Nebalia сбрасывают покров. В это время оно способствует поискам нового рачка. Образование почек многократно имеет место и у одиночных особей, обитающих на живых Nebalia» (Rompel, 1894 : 633). Дофлейн пишет, правда, что на экзувиях небалий хонотрихи встречаются на всевозможных участках панциря; почки, отделяемые при интенсивном почковании, не ищут якобы нового хозяина, а оседают на излюбленных местах панциря и постепенно дегенерируют. По Фенхелю (Fenchel, 1965 : 281), «образование бродяжек у сидячих комменсалов (перитрих и хонотрих) коррелировано с линькой хозяина». «Очевидно, что линька хозяина представляет затруднения для любой живущей на нем ком-менсальной инфузории. Перитрихи, как и хонотрихи, образуют свободно плавающих бродяжек перед линькой хозяина. Было найдено несколько особей Gammarus locusta, на которых почти все Zoothamnium hicketes и Zoothamnium sp. развили венчик ресничек, как у телотрохов, и были близки к тому, чтобы покинуть стебелек. Почти все особи Heliochona обоих видов, находимых на этих бокоплавах, делились, образуя свободноплавающих личинок. Такие амфиподы всегда линяли в пределах нескольких часов, и почти немедленно после линьки инфузории покидали свои стебельки и прикреплялись вновь к своему хозяину на характерных для них участках» (ibid. : 300—301).
Судя по нашим материалам, диминуция начинается задолго до начала линьки; к моменту экзувиации часть томонтов еще не успевает отпочковаться, оставаясь на панцире. Мацудо и Мор также объясняют диминуцию линькой рачка, хотя считают, что полигеммия возможна и как нормальный процесс. Гийше и Мацудо, как и Ромпель и Дофлейн, осматривали экзувии рачков и отметили массовое образование трофотомитов на крабах и телотомитов на лимнориях (рис. 48, Р, Ф). По Мацудо, «диминутивное почкование — это, вероятно, механизм, позволяющий этим сидячим инфузориям покинуть экзувии и поселиться на первоначальном или другом хозяине. Хотя тот же процесс — линька Cryptocercus — вызывает конъюгацию между эндозойными жгутиконосцами (Кливленд), при диминуции у Lobochona prorates не образуются гаметы или почки, вступающие в конъюгацию, как допускал Сварчевский для Spirochona elegans. Возможно, однако, что почки, образуемые диминирующими томонтами, становятся половозрелыми молодыми формами» (Matsudo, 1966 : 360). Сварчевский не говорил, однако, о копуляции томитов и имел в виду именно копуляцию выросших из них «гамет» — молодых трофонтов. Поскольку диминуция у лобохон начинается еще до экзувиации, должен существовать какой-то сигнальный или спусковой фактор— механический, гормональный, возможно просто прекращение активности хозяина, в норме поддерживающей питание хонотрих (Mohr a. Matsudo, 1970). В межлинечный период, по Мору, резко возрастает число особей в популяции; с началом линьки идет эпидемия почкования, массовое образование личинок. Пока сходит старый покров,
томиты переходят с него на новый (аутоинвазия), имея значительное время для колонизации рачка. Экзоскелет в это время мягкий, поэтому движение придатков слабое, не может рассеять томитов. Мы часто находили слинявших рачков с массой томитов на сходных стадиях фиксации л метаморфоза.
Очень важно попытаться связать фазы ДП с фазами линьки рачков. В цикле развития рачков чередуются пять фаз: С — межлинечная фаза (разной длительности у разных видов; происходит рост тканей, но не панциря); D — предлинечная фаза, с тремя подфазами: Do—Dx — проэкдизис (Do — эпидермальная и гепато-паикреати-ческая активация, Dx — образование эпикутикулы и начало образования шипов), D2—D3 — пилер (D2 — начало секреции экзокутикулы, D3 — основная часть процесса резорбции скелета), D4 — непосредственно предлинечная стадия, открытие экзувиаль-ных швов; Е — фаза линьки, или экзувиации (экдизис — быстрое поглощение воды и сбрасывание панциря); А — метэкдизис или послелинечная фаза (кальцификация и затвердение скелета; рачки в этой фазе не питаются); В — фаза «бумажного панциря», активное образование эндокутикулы. В фазе D удаляется кальций из экзоскелета, возрастает его количество в крови, закладывается новый панцирь под старым. Фазы Do и Dx находятся под контролем центральной нервной системы: нейросекреторные и эндокринные системы прекращают выделение секретов, ингибирующих действие Х-органа на линечные железы, которое имело место в фазе С. Последние начинают синтез и выделение гормона линьки, с максимальной активностью к концу фазы D. Кутикула и эпидермис — не сплошной покров, местами имеются каналы, заканчивающиеся в эпикутикуле порами протоков субэпидермальных тегументарных желез, очевидно секретирующих эпикутикулу при линьке; много и пор-канальцев, отходящих непосредственно от эпидермальных клетой для газообмена (особенно в жабрах) и солевого обмена. Через все эти поры и могут выделяться вещества, сигнализирующие о приближении линьки задолго до экзувиации. Они и вызывают переход от нормального почкования к непрерывному, действуя на всю эпифауну в целом. Можно предположить, что хонотрихи размножаются нормальной моногеммией в фазе С; в начале фазы D среди нормальных томонтов отмечаются и особи с двумя томитами — первый признак приближения линьки. Томиты еще могут оседать на таких рачках, но вскоре оседание их прекращается; все активнее идет диминуция томонтов, прекративших (вследствие редукции ПВ) питание. Оседание на слинявшем рачке может идти синхронно, вероятно в фазе Е (в момент линьки) или А (сразу после линьки). В фазах В и С происходит рост трофонтов и оседание новых томитов, вплоть до наступления новой предлинечной фазы D.
Появление анактинид можно объяснить следующим образом. Томиты охотно оседают в фазе С, развиваясь в нормальные шипоносные формы. В конце фазы Сив фазе D, когда уже идет диминуция, такого оседания, как правило, нет. Между фазами С и D существует, видимо, промежуточный период, когда томиты могут оседать, питаться и расти, но не образуют шипов: сказывается активация линечных желез хозяина. Постепенно шипоносные и бесшиповые формы вступают в диминутивный цикл.
ПРОЦЕСС КОНЪЮГАЦИИ
Внеконъюгационные способы ядерной реорганизации (автогамия, эндомиксис) и расщепление Ма (гемиксис) у хонотрих неизвестны, реорганизация происходит только при конъюгации. Конъюгация отмечена пока только у 5 родов (Spirochona, Cavichona, Heterochona, Lobochona и Kentrochona)', удивительно, что она не найдена пока у Chilodochonidae, хотя это наиболее массовые формы. Среди предшественников хонотрих (Нypostomatida) конъюгация часта у Chilodonella и неизвестна у Dysteriidae. Известны инфузории, у которых конъюгация крайне редка или не отмечалась вовсе (Colpoda, Cyclidium и др.); видимо,- дистерииды, хилодохониды, гелиохоны и другие формы принадлежат к этим группам. Отдельные пары у Heterochona наблюдали уже ранние авторы (Рентш, Валленгрен); Рентш принял конъюгацию за процесс «образования почек в перистоме» (рис. 52, Н, О). Дофлейн мельком отмечает, что Kentrochona nebaliae конъюгирует так же, как спирохона и гетерохона; на его рисунке показана одна из стадий. Данные Плате, Пенара, Сварчевского и Мацудо отрывочны и во многом противоречивы; в наиболее полном сообщении Тюффро содержится ряд .неясных и сомнительных моментов. Конъюганты хонотрих часто наблюдались в нашем материале, в равной мере часто у экзо- и эндогеммин; результаты цитологического изучения процесса (у Heterochona coronata) будут нами опубликованы отдельно.
По Плате, Spirochona gemmipara не образует массовых поселений, поэтому про- • цент конъюгантов невелик; только просмотр большого материала дает достаточное число партнеров. По Тюффро, однако, конъюганты у спирохон нередки; в массовых популяциях из Франции отмечены почти все стадии реорганизации ядер. По Сварчевскому, конъюганты у Cavichona elegans встречаются в большом проценте, вид образует на жабрах «колоссальные поселения». Конъюганты относительно редки у Lobochona prorates (Matsudo, 1966). По нашим наблюдениям, процент конъюгантов обычно зависит
от массовости вида: конъюганты часты у видов Heterochona, Carinichona, Isochona, Actinichona, не отмечены пока у редких форм типа Pierochona, Echinichona, Coronochona. Одпако у некоторых редких видов (например, у Denllchona margtnata) пары отмеча-
Рис. 52. Конъюгация хонотрих. А—Л — Spirochona gemmipara (А—И— по: Plate, 1886; К, Л — по: Penard, 1922); М — Stylochona sp. (по: Doflein, 1897а); Н, О — Heterochona scheutenii (по: Rentsch, 1860); Н±—П3 — Cavichona elegans (по: Сварчевский, 1928а); Р—Щ — Lobochona prorates (по: Matsudo, 1966).
ются постоянно. У хонотрих, видимо, есть виды охотно конъюгирующие, редко конъюгирующие и не конъюгирующие.
По Боррадейлю (Borradaile, 1959:113), хонотрихи отличаются от остальных форм «класса Ciliophora» тем, что они «образуют множественные гаметы, которые соединяются таким же образом, как и у других классов подтипа (копулируют). У Chonotricha как половое, так и бесполое размножение ведется с помощью почек». «Для Ciliophora (кроме некоторых из Chonotricha) характерен гермафродитизм» (ibid. ;
37). Ничего подобного у хонотрих, конечно, пет, хотя и Мацудо (Matsudo, 1966 : 367) считает, что «нельзя полностью исключить возможность ларвальной конъюгации». По Донсу (Dons, 1940 : 117), почкование лобохон— это по сути дела неравное деление, назначение которого еще неизвестно. Вероятно, оно имеет не вегетативное значение, а служит для размножения, заканчиваясь образованием макро- и микрогамет». Все эти авторы, видимо, неправильно поняли данные Сварчевского: «гаметы» (томиты), образуемые при «гаметогенезе» («эпидемическом почковании»), вырастают в молодых особей, способных к «копуляции» в массовых поселениях. Вводят в заблуждение применяемые им термины «гаметы», «гаметогенез», «копуляция», «макрогаметы» и «микрогаметы» (молодые трофонты). Конъюгируют всегда лишь трофонты на ранних стадиях развития, с недоразвитыми ПВ; только Тюффро рисует взрослых трофонтов спирохон с развитыми завитками. По Мацудо, длина взрослых трофонтов лобохон составляет 45—60 мк, конъюгантов,— 25—35 мк, томитов — 25—28 мк; Ма партнеров также ювенильного типа, лепестки ПВ недоразвиты. По Добжанской-Качановской, никогда не конъюгируют гетерохоны с полностью развитой ПВ; она предполагает, что в растущей популяции часть молодых особей почкуется, часть конъюгирует.
Начальные стадии конъюгации авторы описывают одинаково: две соседние особи, случайно оказавшиеся рядом, склоняются воронками одна к другой (при изгибе шейки), перистомы их сливаются; быстро и полностью редуцируется ПВ микроконъюганта (мы называем его «мигрантом»), медленно и лишь частично — ПВ макроконъюганта, у которого исчезает лишь внутренний завиток ПВ или лепестки (Плате, Пенар, Сварчевский, Тюффро, Мацудо). По Мацудо, ПВ мигранта исчезает уже к моменту распрямления пары. Плате считает, что изменения морфологии особи, ведущие к конъюгации (изгиб шейки к партнеру), начинаются еще до контакта клеток, когда они разделены пространством; вероятно, спирохоны выделяют вещества, действующие на других особей. По Мацудо (Matsudo, 1966 : 367), «конъюгация, вероятно, должна вызываться какой-то секрецией одной или обеих особей, или, возможно, изменением окружающей среды, или состоянием самого хозяина, или даже механически». Плате считает, что мигрант отделяется от субстрата при растворении ножки, после чего остается ямка на нижнем конце тела. Однако рядом с синконъюгантом Плате рисует и оставшуюся на субстрате ножку (рис. 52, Ж). По Мацудо, рядом с синконъюгантом у лобохон всегда виден прикрепительный диск — свидетельство того, что конъюгируют два трофонта, а не трофонт и томит. Отрыв от ножки регулярно наблюдается на наших препаратах хонотрих. Тюффро и Мацудо говорят об анизогамии партнеров. По Тюффро, от субстрата отделяется обычно более мелкая особь. По Мацудо, партнеры лобохон неравны по величине еще до начала конъюгации; более мелкий, со слабо развитыми лепестками — мигрант, другой, крупнее первого на 10 мк, — стационарный партнер. При слиянии ПВ образуется широкий цитоплазменный мостик (Плате, Сварчевский и др.), по которому содержимое одной особи перетекает в другую. Резорбируется не только ПВ, но и глотка мигранта, хотя она некоторое время сохраняется без изменений (Плате). Только Сварчевский пишет об укрупнении нижней особи по мере уменьшения верхней; как ни странно, признаков такого укрупнения нет, хотя в стационарную особь переходит почти вся верхняя.
Судьба мигранта описывается по-разному; наблюдений in vivo нет, есть лишь догадки по препаратам. По Тюффро, мигрант не целиком поглощается макроконъю-гантом — остается и отпадает рудимент с Ма. Это подтверждают и наши препараты: зона контакта сужается, приводя к отрыву рудимента мигранта. Пенар также рисует пары с рудиментами мигрантов, сохраняющими Ма (рис. 52, К, Л). Остальные авторы считают, что мигрант целиком перетекает в макроконъюганта (Сварчевский, Каль, Бок, Лепши и др.). Мацудо допускает, что мигрант с его ядрами переходит в нижнюю особь, но не проследил этот процесс. Ма и Ми мигранта, по его данным, перемещаются в макроконъюганта, а рудимент мигранта остается в ПВ макроконъюганта в виде цилиндрической «пробки» величиной 7X4 мк. На поздних стадиях рудимента нет; неясно, адсорбируется ли он или отпадает.
По Плате (Plate, 1886, 1888), конъюгация у Spirochona gemmipara длится около суток, хотя точно это не установлено вследствие большей, чем у трофонтов, чувствительности партнеров к условиям среды. Партнеры имеют по три слабо красящихся сафранином Ми (рис. 52, А—И), которые принимают веретеновидную форму и остаются такими до момента перехода мигранта в нижнюю особь. Судьба их неясна: к моменту слияния двух Ма видны Ми — возможно, также результат попарного слияния Ми партнеров. Итак, сливаются особи, их Ма и Ми. Характерна длительная стадия перехода гантелевидного Ма мигранта в нижнюю особь. Мигрант полностью резорбируется, начинаются реорганизация ПВ нижней особи и ее быстрый рост. Плате подробно описывает изменения в Ма, но не в Ми: происходит смешивание хроматиновой и ахроматиновой зон, причем у обоих партнеров по-разному. Это описание фантастично. Мы опустим здесь рассуждения Плате о роли Ма и сущности процесса конъюгации.
По Сварчевскому (1928а), после соединения партнеров Cavichona elegans Ма их распадается (рис. 52, П): округляется хроматиновая зона, от нее отделяется и деге
нерирует ахроматиновая зона. Процессы эти не фиксированы строго во времени, распад ядер можно видеть в самом начале конъюгации либо после слияния П В партнеров. Резорбируется ПВ мигранта. Хроматиновые сегменты Ма, оказавшиеся в одпой особи, сближаются и сливаются; видпы единое темное ядро и два дегенерировавших светлых.
Рис. 53. Жизненный цикл хонотрих. А, Б — оседание томитов и почкование у Cavichona brevlstyla; В — телотомиты Spirochona marina; Г—Н — конъюгация S. gemmipara (по: Tuffrau, 1953).
После слияния сегментов начинается регенерация ПВ. Описание конъюгации не могло быть правильным уже потому, что Сварчевский отрицал наличие Ми у хонотрих; их деления им не описаны и не изображены. У партнеров нередко видны красящиеся тельца вблизи Ма, но это якобы не Ми, поскольку они образуются после конъюгации — выделяются новым Ма (Ми спутаны с нуклеолами). Поскольку и это описание фантас-
9 Заказ № 213
тично, мы опустим все теоретические рассуждения Сварчевского о редукции числа хромосом, о схемах ядерных процессов инфузорий и т. д. Сварчевский считает, к примеру, что редукция имеет место при образовании томонтом четырех последовательных томитов («гамет») и обсуждает, при каком конкретно делении это происходит.
По Тюффро (рис. 53, Г—Н), деления Ми у спирохоны начинаются после резорбции ПВ мигранта, когда он еще достаточно крупный. В ходе первых прогамных делений Ми наступает полная резорбция ПВ, поэтому деления идут в разных партнерах и редко' после установления континиума. Число делений не определено из-за изменчивости числа Ми (1—4, обычно 2); число Ми у партнеров нередко неодинаково. Скорее всего-имеются три деления Ми. Из многих образовавшихся ядер остаются два пронуклеуса, остальные дегенерируют, особенно быстро у мигранта; пронуклеусы сближаются попарно на уровне ПВ (на рисунках Тюффро видна граница партнеров) и образуют два синкариона, лежащие уже в нижней особи. Интересно, что Каль (Kahl, 1935) без ссылки на источник писал, что у S. gemmipara образуются два синкариона, один из них дегенерирует, другой делится. Возможно, это гипотеза. По Тюффро, оба синкариона жизнеспособны, делятся 2—3 раза; остаются 4 ядра (3 Ми, 1 зачаток Ма), остальные исчезают при пикнотической дегенерации. Ма макроконъюганта распадается на фрагменты и дегенерирует (фрагментация не изображена). Остаток мигранта отделяется и дегенерирует после делений синкарионов: сужается зона контакта клеток, мигрант становится грушевидным, сидит на тонкой ножке, затем отрывается и гибнет, его Ма не переходит в нижнюю особь. С момента отрыва мигранта в син-конъюганте зачаток Ма быстро растет; по периферии обнаруживаются нитчатые хроматиновые тела, заполняющие затем весь зачаток и группирующиеся в хроматиновые хлопья. Райковым (1967) отмечено, что отсутствие спиремы (нитевидных хромосом) на ранних стадиях развития Ма для инфузорий в целом нетипично. Хроматиновые тельца концентрируются в верхней половине ядра; в нижней, светлой, появляется кариосома. Поскольку в вегетативном Ма ее нет, Тюффро предполагает, что зачаток Ма развивается не в покоящийся Ма, а в ядро, готовящееся к новому делению. Не связано ли это, однако, с реорганизацией РПА синконъюганта? После конъюгации, по Тюффро, нужно одно деление Ма для восстановления его нормальной структуры.
По отрывочным данным Мацудо (рис. 52, Р—Щ), Ма и Ми мигранта Lobochona prorates входят в макроконъюганта; число делений Ми не выяснено, они начинаются, видимо, вскоре после начала образования синконъюганта. Автором показаны и некоторые поздние стадии: особь с 2 Ма, 6 Ми и гранулярной сферой диаметром 10 мк (зачаток Ма?) и особи с Ма, Ми и 2 хроматиновыми массами диаметром 3—4 мк (остатками дегенерирующего Ма).
По Сварчевскому, у перитрих (в частности, у относимых к ним спирохон)-половой процесс идет только в форме копуляции. По Дофлейну и Рейхенову, у хонотрих, как и у сукторий и перитрих, имеется «тотальная конъюгация» (копуляция). Коллен отмечает сходство конъюгации хонотрих и сукторий. Кормош различает внутреннюю конъюгацию (у Discophrya, с двумя синкарионами) и тотальную (у перитрих и сукторий, в начале изо- и анизогамную, с одним синкарионом); у хонотрих, если следовать этой схеме, имеется третий тип конъюгации, с образованием гибнущего рудимента мигранта. Плате пишет, что конъюгация спирохон — это прямой переход от конъюгации к копуляции. По Тюффро, конъюгация хонотрих с частичной адсорбцией партнера является промежуточной между классической (изогамной) и тотальной (у вортицелл) конъюгацией. Поскольку нет полного поглощения мигранта, следует говорить об ани-зогамной конъюгации (хотя она начинается как изогамная), а не о «копуляции гамет», как у Сварчевского. Конъюгацию спирохоны Тюффро сравнивает с таковой Metopus sigmotdes (по Ноланду): это единственная известная ранее инфузория, где один из партнеров первоначально изогамной пары постепенно мельчает и дегенерирует, не адсорбируясь полностью другим. Такое слияние не является тотальной конъюгацией. В отличие от спирохон у Metopus дегенерируют 2 из 4 пронуклеусов, образуется один синкарион. Анизогамная конъюгация в принципе такого типа, как у хонотрих, описана у гипотрих (Мольденхауэр, Гекман) и у Chllodonella cucullulus (Радзиковский). У последнего вида кроме нормальной конъюгации, длящейся 24 часа, возможна 8-часовая тотальная конъюгация: соединяются два нормальных партнера, но вскоре один из них резко уменьшается и полностью адсорбируется другим. Как и хонотрихи, партнеры контактируют только в ротовой зоне. У Ch. unclnata конъюгация анизогамная, но не в такой мере, как у Ch. cucullulus, особи не сливаются. Как и у хонотрих, у гипостомат образуется только один зачаток Ма (Мак-Дугалл, Радзиковский).
ВНУТРИВИДОВАЯ ИЗМЕНЧИВОСТЬ ПРИЗНАКОВ
Нет, вероятно, видов хонотрих без неопределенной (индивидуальной) изменчивости признаков. Это предъявляет особые требования к описаниям видов: важно изучить большой материал, чтобы в хаосе неопределенной изменчивости можно было
наметить признаки, типичные для типовой расы (о видовых нужно говорить с большой осторожностью). Только при сравнении группы рас можно выявить свойственные виду размах и направление изменчивости и определить тенденцию к образованию определенного комплекса признаков. С индивидуальной изменчивостью по имеет ничего общего изменчивость, описанная рядом ранних авторов. Так, Ромпель и Дофлейн под одним названием Kentrochona nebaliae описывают группу видов с разных придатков рачка. «Пластичность» (лево- и правозакрученность) ПВ разных особей байкальских спирохонид у Сварчевского объясняется их неправильной ориентировкой. Гаевская (1933 : 184) считает Spirochona gemmipara видом с особо выраженной изменчивостью: «даже на одном рачке и на одной жабре имеется огромный ряд изменчивости со всеми переходами», но и она не разграничивала ни виды байкальских спирохонид, ни стадии их роста.
Хорошая модель — изменчивость лепестков ПВ у Lobochona. Мор с сотрудниками (Mohr, 1959b; Mohr a. oth., 1963а) отмечали различие их величины и формы у изученных пока видов рода. Лепестки особо крупные и прямоугольные у L. limnoriae,. более округлые и мелкие у L. prorates, слабо выраженные у L. insularum. Имеется тенденция к уменьшению лепестков у лобохон при смене их хозяев в направлении с севера на юг в такой последовательности: Limnoria lignorum — L. tripunctata — L. quadripunctata — L. andrewsi (Matsudo a. Mohr, 1964). При всей этой кажущейся четкости видов остается неизученной, однако, расовая и индивидуальная изменчивость лепестков, ее связь с факторами среды. Mop (Mohr, 1959b : 89) писал: «Различия такого типа, какие мы наблюдали, могут быть объяснены как результат разного' роста при разных температурах или как проявление популяционной изменчивости внутри ареала одного вида. Однако в настоящее время Ле-Век и я склоняемся к тому, что различия характеризуют три самостоятельных вида». У типовых Lobochona limnoriae из Норвегии Донсом (Dons, 1940; см. рис. 56, А—И) изображены короткие округленные, длинные округленные и прямоугольные лепестки с ровным или зубчатым краем; возможна асимметрия лепестков особи. В целом характерна тенденция к образованию длинных угловатых, расширяющихся кверху лепестков. Раса с Мурмана и Белого моря крупнее типовой, сходна по форме тела, но лепестки обычно зазубрены. Сходна вариация лепестков у камчатской расы, но процент особей с зубчатым краем здесь невелик, размеры особей небольшие. Все эти расы еще можно отнести к одному виду, поскольку принципиальных различий морфологии трофонтов нет и совпадает тенденция к образованию лепестков определенного типа. Особи с лимнорий Кунашира и Путятина, однако, имеют короткие округлые лепестки; иногда лепестки слабо развиты, имеют треугольный контур; зубчатых лепестков нет. Если учесть мелкие размеры этих рас, становится ясно, что изменчивость лепестков выходит за рамки видовой; вид признается новым — L. tenue.
У спирохонид изменчивы форма тела, размеры особей, число витков ПВ; так, для Serpentichona anthus характерно недоразвитие завитка, но можно встретить особей без завитка и с резко вытянутым завитком. В популяциях Cavichona multifida можно найти особей с ровным и с зубчатым краем завитка. Среди особей С. crassa с коротким, типичным псевдостилом встречаются отдельные особи с вытянутым псевдостилом. Изменчивость вооружения хорошо выражена у шипоносных форм, особенно у эндогеммин. Так, у Dentichona marginata мы нашли все переходы от типичной для вида ПВ с волнистым или слегка зазубренным краем гипохона До ПВ с ровным или шипоносным гипохоном. Резко изменчива и длина стебелька дентихон — от 8 до 45 мк; длинный стебелек образуется на ранних либо на поздних стадиях развития. Все особи Pterochona pacifica имеют шипики по верхнему краю крыльев, но нет особей, у которых бы число, положение и форма этих шипиков были сходны; более того, не совпадает и вооружение крыльев одной особи. Изменчивость признаков у Chilodochona aranei нам удалось связать с их локусами: на щетинках придатков живут мелкие формы с коротким стебейьком, на ровной поверхности — крупные формы с длинным стебельком; возможно, что сето- и планибионты Ch. aranei принадлежат к разным видам.
Изменчивы и другие признаки хонотрих — число Ми и септ эндостила, топография складок пелликулы и т. д. Это не возрастная изменчивость, речь идет только о взрослых трофонтах. Она необъяснима действием внешних факторов: все особи одного локуса находятся в равных условиях. Неопределенная изменчивость имеет свои рамки, и, несмотря на нее, при наличии большого материала можно определить вид хонотрих. У инфузорий в целом неизменчивых признаков, по-видимому, нет; нестабильны даже плоидность Ма и Ми, число и топография соматических кинет — признаки, которые долгое время считались устойчивыми. У хонотрих с эволюцией совершенствуются не кинетом и не ядерный аппарат, а прежде всего ПВ и защитный комплекс (шипы, лепестки, завитки, зубцы, складки, пластинки), в меньшей мере прикрепительный (ампулы, ножки, настоящие и ложные стебельки); эти комплексы особо изменчивы соответственно в популяциях видов. Хонотрихи несомненно находятся сейчас в расцвете эволюции, о чем говорят необычайное многообразие их внешнего облика, находки целых комплексов родов и видов на одном хозяине. Новые
виды хонотрих возникают при миграции части особей на другой локус рачка или при заселении того же локуса другого хозяина, с соответствующими адаптивными изменениями на основе неопределенной изменчивости.
ВЗАИМООТНОШЕНИЯ ХОНОТРИХ И ХОЗЯЕВ
Для обозначения характера ассоциации с хозяевами предыдущие авторы применяли к хонотрихам всевозможные термины: паразиты (Гертвиг, Калкинс, Кальмус), эктопаразиты (Плате, Эйсмонд, Андре, Бхатиа, Гийше, Доне, Мэнвелл), раумпаразиты (Ромпель, Тинеманн, Доне), эпизооны (Каль, Раабе, Гийше, Ветцель, Мацудо, Мор), энтозооны (Мор), симбионты (Сварчевский, Доне), эписимбионты (Корлисс), комменсалы (Кент, Валленгрен, Дофлейн, Раабе), эктокомменсалы (Мор, Холл, Корлисс, Мацудо, Фенхель, Янковский), эпизоотические комменсалы (Доне), консорты (термин Пирса; применяется группой Мора), симфорионты (Кайзер, Прехт), эпиойки (Тинеманн), эпибионты (Форе-Фремье, Штиллер, Големанский) и даже эпифиты (Доне, по отношению к Eleutherochona). Многие термины синонимичны, близки по смыслу.
Общепринято разграничение трех основных форм сожительства организмов в природе: паразитизм, комменсализм и мутуализм (симбиоз). Паразиты питаются тканями хозяина либо отнимают у него часть уже переваренной им пищи; мы относим к паразитам и эндобионтов, пользующихся и заглоченной, но еще не переваренной пищей (всех эндобиотических Protozoa в целом). По Эйсмонду, спирохоны — эктопаразиты лишь потому, что они специфичны для гаммарусов и могут жить только на них, прирастая к покровам тела; это, конечно, не критерий паразитизма. Плате справедливо отметил, что спирохоны — не паразиты; они живут на рачках лишь потому, что движе -.ния хозяина снабжают их свежей водой и питанием.
При паразитизме один из организмов наносит прямой вред другому, может быть детален для него; при комменсализме он имеет лишь пространственную связь с ним (например, прикрепляется к его поверхности, как многие Protozoa), не наносит ему вреда и питается самостоятельно либо незначительной частью еще не заглоченной пищи носителя; наконец, мутуализм выгоден для обоих организмов. О мутуализме в отношении хонотрих, как и о паразитизме, говорить не приходится, представители этого подкласса являются эктокомменсалами. Если они и оказывают какое-либо положительное или отрицательное воздействие на хозяина, то масштабы его ничтожно малы. Хонотрихи на ротовых частях и гнатоподах могут питаться буквально микроскопическими крохами пищи хозяина. Формы с широкими дисками нередко в массе усеивают края жабр гаммарид, что в какой-то мере может ограничить доступ О2 к хозяину. Плеоподы гаммарид и лимнорий, щупик максиллулы Nebalia и ротовые части декапод могут быть усеяны десятками и сотнями трофонтов хонотрих, что утяжеляет придатки; рачок должен затратить больше энергии на их движение. Хонотрихи в целом .имеют тенденцию к оседанию на наиболее подвижных придатках хозяина; удельный .вес их должен быть велик вследствие образования прочного кутикулярного панциря. Бэйт и Вествуд (Bate a. Westwood, 1861 : 191) допускают, что бокоплав Sulcator arena-,-rlus — «очевидно, очень медлительное существо, поскольку к волоскам плавательных придатков прикрепляются инфузории», и что у Gammarus marinus «поведение, вероятно, ше так активно, как у других видов, поскольку плавательные придатки часто густо покрыты видом Vaginicola» (ibid. : 374). Это, однако, лишь предположения. Мор (Mohr, 1948 : 9) писал: «Хотя плеоподы бокоплава (Amphithoe sp.) были, по-видимому, тяжело нагружены ресничными комменсалами (здесь было, вероятно, около 2000 осо-.бей), нельзя сказать, что движения этих придатков были заметно заторможены». .Лишь колониальные перитрихи типа Epistylis, в массе обрастающие мелких Entomos-.traca, могут заметно тормозить их движение (Кайзер, Канелла и др.).
По Кайзеру, о взаимовыгодной ассоциации (мутуализме) в отношении хонотрих йнельзя говорить уже потому, что рачки живут без инфузорий, а инфузории без них гибнут. Единственным свидетельством положительного воздействия хонотрих на хозяев — столь же ничтожного, как и отрицательное, — может быть обнаружение мицето-.филии у некоторых байкальских хонотрих. Если на жабрах рачка имеются эпифитные >грибки, часть видов Spirochona и Cavichona питаются в основном их спорами, уничтожая их в огромном количестве и в какой-то мере предотвращая их рассеяние в окружающей среде. Однако даже триходин, очищающих покровы хозяев от бактерий, .нельзя назвать мутуалистами.
Можно ли считать хонотрих комменсалами? Понятие «комменсализм» очень неопределенно. Кайзер определяет комменсала как вид, не вредящий другому, живущий .на нем или внутри него и использующий незначительную часть его пищи; среди инфузорий таких форм якобы мало; основная часть эпибионтов поселяется не у рта хозяина и питается самостоятельно, хозяин нужен лишь как субстрат для оседания. Поэтому и хонотрихи, по его мнению, не являются комменсалами. По Раабе (Raabe, 1964b : 226), «комменсалами мы можем назвать такие виды, которые пользуются уже раздроб
ленной или другой доступной нищей более крупных животных; таковы, например, эпизоотические Peritricha, оседающие па панцирях ракообразных, особенно в их ротовой области, а также Chonotricha и Suctorial. Автор термина, ван Бепеден, вовсе не считал основным признаком комменсализма «использование части пищи носителя»; подчеркивалось то, что это безвредная ассоциация. Действительно, сводить-все отношения к пищевым нельзя: хозяин — не просто субстрат для оседания, хонотрихи в большей мере, чем другие комменсалы, нуждаются в токах воды, создаваемых придатками хозяина. Если они в основной массе удалены от рта и не питаются частью пищи хозяина, они зависят все же от токов воды с пищей. Пищевые связи хонотрих и хозяев поэтому всегда имеются, но они не прямые, а косвенные, опосредованные. С другой стороны, все многообразие хонотрих, по нашему мнению, — это результат адаптации их к обитанию на разных участках тела хозяина; отношения хонотрих с хозяином гораздо глубже, чем обычно считают. Хонотрихи — типичные эктокомменсалы: обитание на рачках выгодно для них, связи их с хозяином очень глубоки (пищевые ассоциации, морфологические адаптации и связанная с ними активная дивергентная эволюция, корреляция цикла развития с линечным циклом хозяина); для рачков они совершенно безразличны, не приносят им ни видимой пользы, ни вреда.
Догель (19626) не пользуется терминами «комменсализм» и «мутуализм», заменяя их термином «симбиоз»; с учетом локализации симбионта им различаются три типа ассоциаций — синойкия, эпиойкия и энтойкия. Эпибионтные инфузории, к примеру Stylocometes и Dendrocometes, — это эпиойкные симбионты, квартиранты на поверхности тела хозяина. Вне хозяина эпиойки гибнут, движения рачка обеспечивают их жизнедеятельность. Энтойкия, внутреннее квартирантство (у офриосколецид, гипер-мастигин), — это уже переход к паразитизму. По Раабе (Raabe, 1947 : 345), «существует ряд эпизоотических форм хонотрих, типа скорее всего синойков или симбионтов; в этих случаях организм связан с хозяином только прикреплением к поверхности».
Термин «симбиоз» первоначально имел, однако, совершенно иное значение. Керби (Kirby, 1941) отмечает, что автор термина де Бари имел в виду ассоциацию двух организмов любого характера; с учетом же пользы или вреда этих отношений для одной из сторон различался симбиоз антагонистический и мутуалистический. Незадолго до работы де Бари вышла книга ван Бенедена, различавшего три типа ассоциации животных — комменсализм, мутуализм и паразитизм; все это формально категории симбиоза. Как это бывает со многими понятиями, термин «симбиоз» со временем стали ошибочно применять совсем не в том значении, в каком его ввели первоначально, а в значении «совместная жизнь», «взаимовыгодная связь». Попытки ряда авторитетных исследователей (Ченг, Марк-Генри и др.) восстановить понятие «симбиоз» в первоначальном его значении встречают, к сожалению, незаслуженно резкую критику (Теодоридес). Если термин не будет общепринят в первоначальном значении, пользоваться им нельзя, так как открывается широкое поле для субъективизма и противоречий.
Mop (Mohr a. oth., 1963а) заменяет термин «симбионты» термином «консорты» (англ, consort — сожитель), но введение нового термина при обилии прежних излишне. Термин «эпизооны» (или «эпибионты» — животные, оседающие на растениях и животных, в отличие от «эпифитов») Кайзер не рекомендует применять лишь потому, что это слишком общее, неопределенное понятие: это могут быть эктопаразиты, симфорионты и мутуалисты. В принципе, однако, термин вполне применим к хонотрихам. Никем ранее к хонотрихам не применялся термин «эпифоронты», которым мы широко пользуемся. Эпифоретизм — это частный случай эктокомменсализма (эпибиотии, эпизоизма), когда имеются в виду не подвижные, а сидячие, в частности стебельчатые, эктокомменсалы. Комплекс эпибионтов обозначается как «эпифауна». Процесс заражения паразитами, следуя Бирсу, можно обозначить термином «инфекция», или «инфестация»; заселение безвредными эндокомменсалами, например «инквилинами» в морских ежах, — «инфаунация», заселение эктокомменсалами — «эпифаунация».
Деегенером предложен термин «симфоризм» (симфоретизм, симфорезия, симфория) для обозначения одной из 29 различаемых им форм ассоциаций, которые свойственны сидячим перитрихам. По Кайзеру (Keiser, 1921 : 321), симфоризм — «такой случай, когда одно или несколько животных оседают на теле особи другого вида, никоим образом не нанося вреда своему носителю, не паразитируя на его пище. Между ними не возникает также и мутуалистических отношений». Кайзер различает три типа симфорион-тов: обычные симфорионты (оседающие на водорослях и на животных разных групп), специфические симфорионты sensu lato (на животных крупных таксонов, например Lagenophrys vaginicola на различных Copepoda) и sensu stricto (на одном виде хозяина, а иногда и на определенном участке его тела, например Spirochona gemmipara). Прехт (Precht, 1935) выделяет три формы «эпизоизма»: симбиотический эпизоизм (актинии на Pagurus), комменсализм и симфоризм — факультативный (вид оседает на любом доступном субстрате — детрите, растениях, животных) и облигатный, в свою очередь подразделяемый на эуриойкный, мезойкный и стенойкный (Heliochona). По Прехту, среди инфузорий нет симбионтов и комменсалов, есть только симфорионты. Мы не раз-
!
дичаем симфоризм как категорию, равноценную комменсализму, и считаем всех иепа-разитпых эпибионтных инфузорий комменсалами: рачки для хонотрих, как отмечалось, это не только субстрат для оседания.
Комменсалы и паразиты хонотрих неизвестны; нет симбиоза с зоохлореллами и зооксантеллами (такую форму симбиоза мы обозначаем термином «синальгия», а животных, содержащих в своих клетках водоросли, — термином «синальги»), нет эпифоретических бактерий на теле хонотрих, в отличие от многих других инфузорий, но весьма обычны грибки и бактерии на прикрепительном аппарате хонотрих. Паразитарные суктории типа Pseudogemma, Endosphaera или Podophrya, нередкие на других инфузориях, особенно на перитрихах и сукториях, никогда не заражают хонотрих; нет и хищников, питающихся трофонтами хонотрих. По Калю и Лепши, сукто-рия Dendrocometes на жабрах Gammarus питается в основном бродяжками спирохон, амфилептида Branchioecetes — перитрихами. Суктории обычны в местах прикрепления перитрих и хонотрих, но поедание ими последних пока никем не наблюдалось. Мацудо и Мор допускают возможность конкуренции перитрих и хонотрих на одном придатке рачка; первые могут сместить вторых на нетипичный локус. На хонотрихах живут лишь неспецифические для них эпифоретические микроорганизмы, особенно грибки; по Мору (Mohr, 1948), на щетинках плеопод Amphithoe sp. и на стебельках Trichochona видны крупные и мелкие нити родофит, вероятно Bangia. Эти водоросли безвредны, более того, они, видимо, составляют основную и почти единственную пищу этих инфузорий. У цетохон также некоторые особи имели в пищевых вакуолях водоросли такого типа, какие растут на них и их соседях (Mohr a. oth., 1963b). Гиперфоре-тические ассоциации, нередкие у перитрих и иногда отмечаемые у сукторий, наблюдались нами лишь у одной хонотрихи — хилодохониды с краба Chionocetes opilio.
ЭКОЛОГИЯ ХОНОТРИХ
Виды хонотрих приурочены к одному, реже нескольким видам хозяев, близким морфологически и обычно экологически. Во многом поэтому экология хонотрих — это экология их хозяев. На хонотрих действует, однако, более сложный комплекс факторов; несомненно различаются условия обитания в разных локусах: скорость и направление тока воды, степень притока и род пищевых частиц, степень механического повреждения особи придатками рачка. В разных локусах хонотрихи меняют форму тела, вырабатывают стебельки и различные защитные комплексы, чтобы лучше закрепиться на субстрате, уберечься от повреждений и дотянуться до токов воды с пищей. Все эти адаптации к локальным условиям — проблема морфологии, а не экологии; ниже мы рассматриваем только факторы среды, действующие одновременно на весь комплекс комменсалов рачка и на самих хозяев, — глубину обитания хозяина, соленость и температуру среды, наличие кислорода, чистоту воды.
По литературе, лучший пример Эврибатных хонотрих — Spirochona gemmipara: вид находили на рачках из рек, ручьев и озер, на литорали Охриды (Югославия). По Гаевской, вид повсеместно распространен и в Байкале от уреза воды до глубин свыше 1000 м; эврибатность вида обусловлена его одновременной встречаемостью на большом числе стенобатных видов и родов хозяев. Эти данные приведены и Догелем (1951 : 494): «Прикрепленные формы, достигающие предельных глубин Байкала (1320 м), оказались такими, которых вне Байкала находили в совсем мелких водоемах: Lagenophrys labiata, Carchesium spectabile, Vortlcella crassicaulis, Dendrocometes paradoxa, Tokophrya cyclopum, Spirochona gemmipara и т. д. Таким образом, специфических глубоководных видов в фауне Байкала не оказалось». Определение спирохон у Гаевской, однако, ошибочно. Сварчевский (19286) приводит следующие глубины для 9 различаемых им видов байкальских спирохон: «5. gemmipara» — 5, 10, 20, 30, 40, 50, 100, 150, 200, 300, 400 м; S. simplex — 40, 250 м; S. globulus — 200, 300 м; «S. pusilia» — 200, 300 м; S. elegans — 5, 10, 20, 30, 40, 60, 80, 100, 150, 200, 250, 300 м; S. anthus — 250 м; S. elegantula — 200, 300 м; S. tuba — 300 м; «S. patella» — 60, 200 м. «5. gemmipara» и S. elegans здесь эврибатные виды, остальные — глубоководные; литоральных спирохон нет. Автором допущена та же ошибка, что и Гаевской: не изучались расы с разных хозяев, поэтому ряд видов, особенно эврибатных, сборные, экологические выводы неверны. По нашим данным (табл. 2), основная масса хонотрих Байкала обитает на глубинах 0—200 м, где особенно разнообразны виды хозяев; глубины свыше 200 м слабее заселены гаммаридами. Мы имели материал с глубин до 613 м, находя хонотрих и здесь на Abyssogammarus sarmatus. Эврибатных хонотрих в Байкале нет, имеется определенная стратификация и стенобатных гаммарид, и их комменсалов. Виды Spirochona и Cavichona обычны на литорали и на глубинах, Ser-pentichona — глубоководный род.
Основная масса морских хонотрих известна с литорали и верхней сублиторали (формы с Gammarus, Marinogammarus, Anisogammarus, Allorchestes, Amphithoe, Hausto-rius, Idothea, Gnorimosphaeroma, Nebalia, Pagurus, Carcinus, Hyas, Palaemon, Telmes-
Т а б л и ц а 2
Распределение хонотрих и их хозяев по глубинам в озере Байкал
Вид хонотрих Хозяин Глубина, в м
SPIROCHONA А1. gemmipara Gammarus lacustris 0-3
S. brevis Gmellnoides fasciatus 0-0.5
S. globulus Ommatogammarus flavus 200
S. simplex » » 200
S. gnathopodialis » » ' 200
S. tuba Conlurus radoczkowskii 250—300
CAVICHONA C. multifida Eulimnogammarus cyaneus 0-0..2
Cavichona sp. E. maackl 0.1—0.3
C. brevlstyla E. viridis 0.3-0.5
C. elegans E. verrucosus 0.3-2
C. crassa Pallasea cancelloides 0.5-3
C. protecta Brandtla lata, B. insularis 0.8-5
C. exilis Eullmnogammarus lividus 1-5
Cavichona sp. Crypturopus inflatus 5-6
C. virgata Carinogammarus cinnamoneus 25—27
C. tenue Parapallasea puzyllt carinulata 15—25 '
Cavichona sp. Acanthogammarus victori 25—30
Cavichona sp. A. flavus ( 30
C. carlnuri Carinurus solskii 4-47
C. acanthogammari Acanthogammarus albus 25-47
Cavichona sp. Parapallasea lagowskyi 15—50
Cavichona spp. Poekilogammarus spp. 10-200
C. laticollis Garfaewia cabanisi 150—200
C. elegantula Odontogammarus calcaratus 150-200
C. cincinnata Eucarinogammarus ivagi 200
Cavichona spp. Eullmnogammarus spp. 15—230
C. oligocineta Eulimnogammarus sp. 150-230
C. rhabdomorpha Ommatogammarus carneolus 300
C. abyssalis Paragarjaewia petersi 310
Cavichona sp. Abyssogammarus sarmatus 400—450, 613
SERPENTICHONA <S. anthus Brachyuropus reicherti 150—230
Serpentichona sp. Pachyschesis branchialis । 150-260
Примечание. В таблице указаны лишь глубины, на которых были собраны осмотренные рачки; подробные сведения о распределении гаммарид Байкала по глубинам приведены в сводке Базикаловой (1945).
sus и др.). По Гийше, Chilodochona обитает на Carcinus maenas, Cancer pagurus и на других литоральных крабах Роскоффа, но не на крабах, добываемых тралом. Древоточцы Limnoriidae встречаются чаще всего на литорали, где особенно много древесины (полу-затонувшие суда, сваи пирсов, плавник), но они отмечены и на больших глубинах, где также несут хонотрих. На песчаной литорали ракообразные встречаются реже, но и здесь они заселены хонотрихами (Crangon dalli, Haustorius arenarius, некоторые талитриды). Типичный сублиторальный хозяин хонотрих — Phycolimnoria, На пелагических рачках, например на крупном байкальском бокоплаве Macrohectopus brani-ckii, хонотрих не нашли ни мы, ни предыдущие авторы, хотя мы располагали сборами из разных участков Байкала и с разных глубин. Отсутствие на нем спирохон Гаевская объясняет «пассивной планктонной жизнью рачка»; это, однако, активный пловец, совершающий ежедневные миграции между поверхностным слоем (ночью) и глубинами порядка 150—200 м (днем) (Базикалова, Кожов). На морских хозяевах из приповерхностной пелагиали хонотрихи пока неизвестны. Прехт отметил, что у пелагических животных из Кильской бухты инфузорий мало, но они являются облигатными симфо-рионтами, в противоположность литоральным. Формы с циамид и копепод на кито
образных нельзя, конечно, отнести к пелагическим видам; гиперииды пока пикем не осматривались. На глубоководных придонных и батипелагических хозяевах хонотрихи встречаются редко (на лимнориях, мизидах, небалиидах, крабах, креветках). Мы имели сборы Limnoria borealis с богатой эпифауной хонотрих с глубин 100—200 м. Хонотрихи найдены калифорнийскими авторами на батипелагических мизидах Pseudomma theeli, Boreomysis nobilis и Gnathophausia ingens (последний с глубины около 400 м). Хонотрихи известны на литоральных небалиидах Nebalia, Epinebalia, Parane-balia и, по данным Мора, «отсутствуют, очевидно, на батипелагических одиночных Nebaliopsis и на удаленном от берега бентическом роде Nebaliella» (Mohr, 1966 : 536). Однако в недавнее время хонотрихи найдены и на Nebaliella (Mohr a. Matsudo, 1970).
С учетом отношения к солености воды хонотрих, как и их хозяев, можно подразделить на четыре группы; пресноводные, солоноватоводные, солоноводные и эвригалинные виды; преобладают виды второй и третьей групп. Пресноводных видов относительно немного — это большинство спирохонид, исключая тихоокеанские виды Spirochona. В основном это обитатели Байкала; в Европе и в Прибайкалье обитает S. gemmipara, в Монтане (США) найдены спирохоны на Gammarus lacustris (Дж. Тиббс). В пресные воды могут заходить эвригалинные рачки, сохраняя хонотрих (к примеру, G. setosus с Heterochona psychra на Аляске — Matsudo a. Mohr, 1965).
Н. psychra — классический пример эвригалинного вида: впервые описанный из пресной зоны оз. Нувук на Аляске, у побережья моря Бофорта, вид был найден нами на том же хозяине и на G. oceanicus на Мурмане, в участках нормальной морской солености (32—33°/00) и в частично опресненных устьях мелких рек. Нувук — одно из реликтовых озер, образованных морем, типа оз. Могильного на Кильдине; верхний слой воды в некоторые сезоны года почти пресный (5о/оо), нижний — гипергалинный (6Оо/оо) (Mohr, 1952, 1953; Mohr a. oth., 1961; Matsudo a. Mohr, 1965). Зимой соленость превышает 6О°/оо, летом поверхностный, средний и глубоководный слои имеют соленость, равную соответственно 5, 34 и 6О°/оо- При таянии льда рачки мигрируют из слоя с —3°С и соленостью 3°/00 в слой с 4-4° С и 30°/оо, сохраняя Н. psychra. По Мацудо и Мору (Matsudo a. Mohr, 1965), гаммариды свободно проходят границу пресных и соленых слоев; такая устойчивость к солености известна для некоторых ракообразных, но еще не отмечалась в литературе по простейшим. Кайзер, ссылаясь на Тинеманна, говорит о том, что Spirochona gemmipara — вид в высшей степени оксифильный и эвригалинный, но Тинеманн ни словом не говорит об эвригалинности спирохон и их хозяев.
Heterochona scheutenti обитает на гаммаридах, по данным ряда авторов, нередко совместно с Heliochona sessilis, и сравнение их экологии особенно показательно: первый вид считается солоноватоводным (эвригалинным), второй — солоноводным (стеногалинным). Сразу же отметим, что в нашем материале совместно с гелиохоной встречается близкий вид Heterochona crinita, но не Н. scheutenii. Н. scheutenii была отмечена Штейном на Gammarus sp. (G. zaddachi или G. duebeni) в солоноватом канале близ Амстердама, затем в Северном море на Gammarus sp., позднее Рентшем на «G. ornatus» в Висмарской бухте (западная Балтика), Валленгреном на G. locusta в проливе Эресунн (южная Швеция), Прехтом на том же хозяине в Кильской бухте, Добжанской-Кача-новской на G. zaddachi в солоноватом рукаве Вислы в Польше; Мацудо и Мор считают солоноватоводными виды гелиохонид с рачков группы G. zaddachi из Плимута (Англия). Наиболее подробны данные Прехта и Фенхеля. Прехт отметил оба вида гелиохонид на G. locusta в Кильской бухте (при солености 3—17°/00); Heliochona sessiZis была найдена им в местах с относительно высокой соленостью; она не следует за своим хозяином в солоноватые участки, требуя минимум 15°/00. Солоноватоводные гаммарусы («G. locusta f. zaddachi» и G. duebeni) из участков бухты с соленостью 3°/00 несут Heterochona scheutenii. По Фенхелю, на биостанциях в Балтике (Дания, Аске) и Северном море (Швеция, Изефьорд и северная часть Эресунда) встречаемость пяти видов Gammarus и различия их эпифауны.связаны с соленостью. Соленость в Аске 0—1О°/оо, в Изефь-орде 15—2О°/оо, в Эресунде у берега 15—20°/00, на глубине 25—ЗО°/оо. Фенхелем найдены G. oceanicus (солоноватые воды с наибольшей соленостью), G. locusta (морские или солоноватые воды с высокой соленостью), G. salinus (редкий солоноватоводный вид), G. duebeni (разбавленные солоноватые воды, пресные ванны и ручьи, текущие в море) и G. zaddachi (солоноватые воды с минимальной соленостью). Heterochona scheutenii найдена на G. oceanicus в Аске (редко), Изефьорде, Эресунде, на G. locusta в Эресунде, на G. salinus в Изефьорде, на G. zaddachi в Аске (редко); в целом вид редок на G. oceanicus и G. zaddachi, но почти всегда встречается в массе на G. duebeni. Heliochona sessilis найдена на G. oceanicus в Изефьорде и Эресунде, на G. locusta в Эресунде, на G. salinus в Изефьорде и всегда отсутствует на G. duebeni и G. zaddachi. Фенхель приходит к следующему выводу: «Хотя большинство инфузорий, находимых на Gammarus, видимо, специфичны для рода, распределение их на разных видах Gammarus контролируется скорее всего внешними факторами, и прежде всего соленостью. В большинстве случаев два вида Gammarus, живущие в одной и той же местности, заселены одинаковыми видами инфузорий. Heliochona sessilis встречается только в морской воде и в солоноватой с высокой соленостью (очевидно, не ниже 10—15°/00). Heterochona
scheutenii была найдена в воде с диапазоном от чисто морской до чисто пресной. Распространение Heliochona контролируется, очевидно, в основном соленостью» (Eenchel, 1965 : 301). Вместе с тем солоиоватоводпые виды Gammarus не имеют хонотрих, общих с G. lacustris; даже G. duebeni, собранные в пресной воде, сохраняют обедненную эпифауну морского типа. Фенхель правильно указывает, что «С. locusta» Прехта в Кильской бухте соответствует, вероятно, четырем видам рода, поэтому экологические выводы Прехта неверны. Однако и Фенхель не изучал морфологию хонотрих с разных хозяев, что обесценивает полученные им результаты: виды хонотрих определены им неправильно, встречаемость их на разных хозяевах, конечно, не может определяться соленостью.
На Мурмане в районе Дальних Зеленцов обычны три вида Gammarus — G. duebeni, G. setosus и G. oceanicus; первый несет Heterochona scheutenii, два других сходны по эпифауне хонотрих, несут Н. psychra и Н. crinita на плеоподах, Н. trifaria на гна-топодах и максиллах, Heliochona sessilis на жабрах. G. duebeni, выносящего, ио Баус-филду, соленость от 1 до 85°/00, мы собирали в устьях ручьев и рек в приливной зоне, где рачки дважды в сутки выносят колебания солености от чисто морской до чисто пресной; в постоянно пресных участках рек и ручьев, удаленных от устья, хонотрих на рачках уже нет. Остальные гаммарусы собраны не только в участках с морской соленостью, но и близ устьев рек, где вода солоноватая и регулярно опресняется; и здесь сохраняется характерный комплекс из четырех видов гелиохонид. Если это не эвригалинные виды, то во всяком случае виды, легко и быстро адаптирующиеся к резким изменениям солености среды. Данные Фенхеля по обогащению видами эпифауны гаммарид в солоноватых водах Балтики (поскольку здесь гуще популяции Gammarus) относятся, видимо, только к солоноватоводным видам типа G. zaddachi или G. duebeni; нельзя переносить их на виды типа G. oceanicus, у которых и размеры рачков и их число уменьшаются (вместе с обеднением эпифауны) в солоноватых водах. Это ясно из сравнения баренцево- и беломорской рас вида.
В дальневосточных морях в солоноватые и пресные воды заходят некоторые виды A nisogammarus; рачки из кутов бухт, лагун и устьев рек должны выносить длительное регулярное опреснение. По Мацудо (in: Mohr, 1966), виды Spirochona и Heliochona (видимо, Heterochona) встречаются вдоль Тихоокеанского побережья США от морских до почти пресных вод; для S. halophila и Oenophorachona указана встречаемость в морских и солоноватых, но не пресных водах (Matsudo a. Mohr, 1968). В лагуне Буссе на Сахалине мы находили виды спирохон и гетерохон в местах с нормальной соленостью и в опресненных, лишь на короткое время заливаемых приливными водами ручьях; в ручьях и озерцах с типичной пресноводной фауной, удаленных от берега, сохраняются 1—2 вида A nisogammarus, но всегда без хонотрих. По Донсу, на лимнориях юга Норвегии обычны Folliculina, Mirofolliculina и Cothurnia; только в Хьеллеботне (Трондхеймсфьорд) найдены Lobochona limnoriae и Platycola circularis. Поскольку вода здесь солоноватая, комменсалы и их хозяин названы «эвригалинными». Лимно-рии, однако, не встречаются в пресной воде — это морские формы, выносящие понижение солености до 10—12о/оо. Все наши расы лимнорий собраны в местах с нормальной океанической соленостью.
Хозяева хонотрих включают виды холодо- и теплолюбивые, эври- и стенотермные.. Пример первых — глубинные гаммариды Байкала, весь год живущие при,температурах, близких к 0° С; хонотрихи на них должны быть стенотермными и холодолюбивыми. Арктические хонотрихи должны отличаться по теплоустойчивости от видов тех же родов из южных морей, но прямых данных об этом нет. Хонотрих нет, как теперь очевидно, на высокоширотном арктическом рачке Gammarus wilkitzkti, хотя это-обычный вид; однако едва ли это вызвано низкими температурами, поскольку на G. ivil-kitzkii немало других комменсалов, а сами хонотрихи обильны на Мурмане, т. е. также в суровых условиях. К холодолюбивым видам относится и Heterochona psychra из оз. Нувук (северная Аляска), где температура воды варьирует от —3° С зимой до 4-4° С летом, с сохранением —3° С в гипергалинном слое. Вид част и на Мурмане, но не отмечен южнее (как и хозяин), в Балтике и на юге Северного моря. Mop (Mohr,. 1959с : 96) не нашел хонотрих на арктических амфиподах Gammarus, Pseudalibotrus, Parathemisto и др., допуская, что «эпизоотические простейшие . . . вероятно, представлены в меньшем разнообразии и числе, когда они встречаются на арктических животных, чем в более низких широтах». Едва ли это правильно, поскольку наиболее регулярные и массовые инфекции хонотрих на гаммаридах мы наблюдали именно в Арктике (Мурман); здесь на рачках ряда видов живут целые комплексы, по 3—4 вида хонотрих. В обширных сборах амфипод Черного моря, напротив, мы нашли пока всего один вид. хонотрих {Heliochona pontica).
Мор с сотрудниками часто отмечают приуроченность различных видов Lobochona к разным тепловым поясам, точнее, к видам лимнорий из разных климатических зон; такая «зональная стратификация» — косвенное свидетельство различий теплоустойчивости хозяев и комменсалов. Limnoria andreivsi живет в теплых и субтропических морях (Гавайи, Флорида), L. tripunctata — в теплых (Калифорния, Средиземноморье) f
L. lignorum — в холодных (Норвегия; см.: Menzies, 1957); они несут соответственно Lobochona insularum, L. prorates и L. limnoriae. Есть данные, что виды лобохон более чувствительны к температуре среды, чем их хозяева: опи остаются «в цитологически приемлемой форме», если вода с древоточцами сохраняет исходную температуру среды при переносе в лабораторию, и повреждаются и гибнут, если вода становится теплой (Mohr a. oth., 1963а). Предполагается, что те же факторы имеют значение и в природе. По Ле-Веку (LeVeque, 1947), хонотрихи хорошо выдерживают перенос в лабораторию и размножаются в древоточцах в аквариумах при оптимальных условиях (аэрация, фильтрация воды) и сохранении исходной температуры воды. По Мацудо, около 40% осмотренных особей L. prorates почкуются в теплое время года и около 20% — в холодное; понижение температуры угнетает размножение этого теплолюбивого вида. Примером эвритермных комменсалов Гаевская (1933) считает «Spirochona gemmipara», живущую в Байкале якобы во всех слоях воды при 0—19° С (по Кожову, максимальная летняя температура воды в Байкале 13—14°, в сорах 18—20°, но летом обычно вся толща воды имеет температуру 4° С). Данные Гаевской недостоверны: на гаммари-дах Байкала обитают десятки видов хонотрих, приуроченные к разным условиям. По Сварчевскому, хонотрихи с гаммарид Ангары более чувствительны к температуре, чем их хозяева. Зимой при переносе в лабораторию особи Cavichona elegans гибнут обычно через 1—1х/2 часа, максимум через 5—6 часов; рачки живут 2—3 дня. Это объясняется различием температуры воды в Ангаре (от 0 до 4-5° С зимой, максимум +13° С летом) и в лаборатории, хотя были предприняты попытки культивировать рачков в проточной воде из Ангары. Согласно Сварчевскому, «эпидемии» почкования у С. elegans наблюдаются при понижении температуры воды до -j-4° С; это ошибка, поскольку диминутивное почкование связано с линькой рачков, а не с температурой воды. Хозяев, указанных для S. gemmipara, можно разделить на группы холодноводных (типа Gammarus pulex из ручьев и рек) и теплолюбивых (типа G. lacustris из прогреваемых озерных мелководий). На этих рачках живут, вероятно, разные биологические виды спирохон, но, поскольку они внешне сходны, мы вынуждены определять вид как S. gemmipara. Такой вид трудно назвать эвритермным.
У отдельных авторов мы находим указания на возможность массового развития хонотрих в определенные месяцы. По Андре, S. gemmipara в Швейцарии обычна во все периоды года. По Кайзеру, в окрестностях Базеля вид встречается весь год, но преобладает в феврале, июле и августе, малочислен в январе, апреле и октябре. Эйсмонд находил спирохон в Белянах близ Варшавы только в октябре и ноябре. Сварчевский отмечал массовые поселения кавихон на гаммаридах Ангары осенью 1919 г., и весь сезон в период 1922—1925 гг.; хонотрих не было весной 1920 и 1921 гг. По Мацудо, лобохона в Калифорнии встречается весь год, хотя в холодные месяцы размножение подавлено; по Ле-Веку — также весь год, но особенно часто в декабре и апреле. Chilodochona carcini на литорали Роскоффа (Франция), по Гийше, обычна во все сезоны года, особенно весной и осенью. Ромпель находил Kentrochona nebaliae близ Триеста (Италия) только в феврале 1894 г. По Дофлейну, в Ровиньо (Югославия) вид был обычен осенью 1896 и 1897 гг., но отсутствовал весной. Пр Мацудо, распространение Gammarus setosus с Heterochona psychra в реликтовых озерах Аляски (мыс Барроу) регулирует не зимняя температура воды, а лишь толщина льда: рачков нет в промерзающих до дна водоемах. В целом приведенные выше данные противоречивы и не дают представления о зависимости числа хонотрих от сезона года; находки хонотрих в одни месяцы и их отсутствие в другие могут быть объяснены и случайной незараженностью особей и рас.
Существуют, по-видимому, определенные различия в отношении хонотрих к чистоте воды и к наличию О2. Так, Gammarus pulex живет в чистой воде ручьев и рек, G. lacustris — в мелких непроточных озерах; расы S. gemmipara с этих хозяев должны отличаться по своей экологии. По Тинеманну и Кайзеру, G. pulex, являющийся в норме оксифильным видом, в широких границах выдерживает изменения условий и может приспосабливаться к водам, бедным О2; у спирохон же потребность к 02 выше, без кислорода они гибнут. Оксифильными можно считать всех хонотрих Ангары и Байкала (воды озера насыщены О2 до предельных глубин). Морские хонотрихи обитают преимущественно на литорали, где насыщенность О2 также велика; глубоководных форм в море меньше. Косвенным свидетельством оксифильности хонотрих могут служить •отмеченное Мацудо обилие митохондрий в цитоплазме Lobochona prorates и обилие крист в митохондриях, что характерно, по Вивье, для оксифильных простейших. Другое косвенное свидетельство оксифильности — локализация хонотрих: часто подчеркивают, что они поселяются на активных придатках, получающих максимальное количество О2 при непрерывном обновлении воды (Сварчевский, Мор). Кайзер имеет в виду, очевидно, локализацию на жабрах, когда указывает, что для спирохоны и D endrocometes основным условием существования служит высокое содержание О2. Трудности переноса в лабораторию и разведения хонотрих в аквариумах и культурах часто объясняют уменьшением доступа О2 (LeVeque, 1947; Mohr a. oth., 1963а); Мор рекомендует — очевидно, для улучшения аэрации — переносить древесину
с лимнориями не погруженной в воду, а влажной. Изредка смачивая древесину с лим-нориями, мы сохраняли их живыми в течение трех месяцев.
Загрязнение среды действует на хонотрих, по-видимому, косвенным образом, в основном уменьшая доступ О2. По Типсмапну (Thiencmann, 1913а), в окрестностях Брауншвейга у Тиде в водах, богатых О2 (8.007 см3/л, насыщенность 0.3343), G. pulex в изобилии несет комменсалов,-в частности S. gemmipara-, у Лейферде в реке Окер вода загрязняется заводскими стоками, количество О2 снижается до 2.7048 см3/л (насыщенность 1.6572); здесь еще есть гаммарусы, но нет ни спирохон, ни Dendrocometes. По Мору (Mohr a. oth., 1963а : 231), в гавани Сан-Педро (Калифорния), «где древоточцы способны жить в присутствии креозота и газов гниения, в загрязненных водах на них встречалось множество паразитических и комменсальных нематод и перитрих. В более чистой воде в необработанных сваях гавани Ньюпорта по крайней мере несколько особей Lobochona prorates были найдены на рачках из каждого собранного источенного образца древесины. Можно предполагать, что лимнории' д-ра Мак-Кон-наги (из Гонолулу, предположительно Limnoria andrewsi, несущие Lobochona insularum, — А. Я.), которые сильно заражены, были из очень чистого места». Этому противоречат, однако, более ранние данные Мора (Mohr, 1950): на Limnoria lignorum (L. tripunctata?) из пропитанной креозотом древесины в бухте Коос (США, шт. Орегон) был найден полный набор комменсалов, включая хонотрих. Мы находили хонотрих на лимнориях из древесины, пропитанной ржавчиной, на юге Кунашира и на лимно-риях из древесины, покрытой пленкой мазута, на о. Путятин; и хозяин, и комменсалы, видимо, очень устойчивы к загрязнению. Сварчевский отмечает гибель «нежной и чувствительной» Cavichona elegans на гаммаридах Ангары, но выживание самих рачков в периоды загрязнения реки стоком городских отходов; другие комменсалы на жабрах рачков при этом сохраняются. Виды рачков из скоплений черного гниющего ила :(И nisogammarus, Nebalia и др.) заселяют лишь те участки литорали, где приливы и течения освежают воду и приносят О2 (Ricketts a. Calwin, 1962); они обычно обильно заражены хонотрихами. По Тиле, Nebalia вообще отличается большой жизнеспособностью, дольше всех рачков живет в испорченной морской воде, что облегчает разведение этого рода в аквариумах.
Ряд авторов отмечает слабую жизнеспособность хонотрих на изолированных придатках хозяев. Сварчевский рекомендует для приготовления препаратов Cavichona elegans отделять жабры фиксированных, а не живых рачков, иначе вследствие большой чувствительности вида мы окрасим дегенерирующих особей. Трудно изучать спирохон на жабрах в висячих каплях и даже в проточной воде, так как особи быстро гибнут. Мы встретились на Байкале с теми же затруднениями. Возможно, слишком велика разница температур воды озера и лаборатории; однако и для более теплолюбивой формы Trichochona lecythoides из Калифорнии Мор рекомендует возможно более быстрый осмотр in vivo, так как хонотрихи крайне чувствительны к условиям среды. Особо чувствительны, по Плате, конъюганты-спирохон; на изолированных придатках без обновления воды они гибнут за полчаса, в камере с текущей водой живут 3—4 часа. Эти наблюдения могут указывать на необходимость для хонотрих тока воды, в норме создаваемого движениями жабр или плеопод. Гертвиг и Бальбиани подробно изучали, правда, почкование и деление Ма у спирохон, также на изолированных придатках, ни словом не упоминая о трудностях работы. Гийше разводила в лаборатории хилодохон и спирохон (при регулярном встряхивании жабр). Трудно сказать, от чего зависит гибель хонотрих в лаборатории — от уменьшения доступа О2, неподвижности придатка, неподходящей пищи, загрязнения среды или от изменения температуры.
Дофлейн, годами содержавший Nebalia из Ровиньо в аквариуме в Мюнхене, отмечал на них хонотрих не весь год; предполагалось, что часть времени хонотрихи проводят в цистах. Другие авторы о цистах не упоминают. Мор считает, что хонотрихи к инцистированию неспособны; именно отсутствием цист объясняется встречаемость хонотрих только на рачках из незамерзающих вод — на Malacostraca (Mohr, 1952); у Entomostraca же зимой рачки гибнут, вмерзая в лед, перезимовывают их эфиппии и (в цистах) комменсальные перитрихи, выходящие после таяния льда. Мацудо и Мор добывали Heterochona psychra из оз. Нувук зимой при наибольшей толщине льда; вид оставался массовым, не инцистировался. Хонотрих и их хозяев нет в пересыхающих водоемах, но здесь могут быть обильны Entomostraca и перитрихи, переносящие засуху в цистах. Перед линькой рачка Трофонты хонотрих переходят к полигеммии, почти целиком превращаясь в томитов; однако никто еще не наблюдал поведения их при гибели рачка. Томиты хонотрих, как обычно считается, быстро гибнут, если не найдут нового хозяина; томиты сукторий, по нашим наблюдениям, инцистируются. Среди инфузорий известно немало видов, неспособных к инцистированию (например, парамеции); среди Hypostomatida цисты пока с достоверностью описаны лишь у Chilo-donella и не отмечены у Dysteriidae. В итоге цисты неизвестны ни у хонотрих, ни у их непосредственных предшественников, хотя возможность их находки у хонотрих (особенно у томитов) все же полностью не исключена.
Приведенные данные по экологии хонотрих настолько противоречивы, что нельзя, решить даже основного вопроса: более или менее чувствительны хонотрихи к факторам среды, чем их хозяева? Большинство данных говорит о большей чувствительности. Так, Андре (Andre, 1912) отмечал, что хотя Spirochona gemmipara вполне обычна, однако в некоторые периоды года и в некоторых прудах, обильно заселенных Gammarus, ее совершенно нет; он считал поэтому, что Spirochona «требует для своего развития определенных условий». По Мору (Mohr a. oth., 1963а : 227), «в источенной древесине, взятой в лабораторию, Limnoria жила месяцами и явно размножалась. Множество' лимнорий были способны оставаться активными в древесине, погруженной в морскую воду. Комменсалы, однако, не были столь адаптивными, и Lobochona среди них была, по-видимому, особенно уязвимой». Chelura несет хонотрих в Неаполе, но не в Калифорнии, где вообще нет комменсалов; Мор предполагает, что Chelura и хонотрихи: очень чувствительны к понижению О2, а последние также и к другим факторам среды,, ограничивающим их распространение в большей мере, чем хозяев. Случай исключительной приспособляемости Heterochona psychra говорит, с другой стороны, о том, что фактором, лимитирующим распространение, в некоторых случаях может быть скорее выносливость хозяина, а не хонотрих (Mohr a. Matsudo, 1970). Другой пример Мора касается Limnoria-. рачок выносит относительно небольшие колебания солености, но никто еще не проверил, не шире ли диапазон солености, выдерживаемой, лобохонами. Кайзер отмечает, что у Spirochona gemmipara встречаемость ограничена, горизонтальным и вертикальным распространением хозяина; этот факт, по .Мору и Мацудо, также указывает, что S. gemmipara может вынести больший диапазон внешних факторов, чем хозяин. Об этом собственно говорят и находки одного и того же вида на озерных и речных бокоплавах от Англии до Прибайкалья.
Деятельность человека косвенным образом отражается на фауне хонотрих. Постройка пирсов, затопление судов, обилие деревянных предметов в воде должны иметь, следствием массовое размножение лимнорий, несущих хонотрих. В источенных днищах кораблей лимнории могут широко расселяться по Мировому океану, хотя бы в пределах своих тепловых поясов. Ряду хозяев (амфиподам, лангустам, креветкам, крабам),, обычному объекту сбора или промысла, едва ли грозит вымирание; иное дело — промысел китообразных: ожидается их постепенное и полное уничтожение. Уже через несколько десятилетий при современных темпах промысла эктопаразитические рачки, с Cetacea и живущие на них три рода хонотрих смогут сохраниться лишь в музейных коллекциях, станут фактически «ископаемыми». Уже сейчас истреблена, к примеру, Стеллерова морская корова Hydrodamalus gigas (Rhytina borealis), несущая циамиду Sirenocyamus rhytinae; не сохранилась ни одна особь этого рачка, несомненно несущего хонотрих (поскольку хонотрихи есть на всех современных циамидах). Отметим также происходящее в наше время в значительных масштабах смешение фаун беспозвоночных разных континентов (в обрастаниях кораблей, через каналы), что должно привести к смешению фаун хонотрих, а. также ожидаемое исчезновение коралловых рифов и ряда тропических островов и атоллов с их богатейший фауной Crustacea,. хозяев хонотрих,
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
По Мору (Mohr, 1959а), хонотрихи встречаются на континентальном шельфе всех материков, в открытом море (на китах) и в пресных водах Голарктики. Отряд Chono-trichida и оба подотряда имеют действительно космополитное распространение в морях Мирового океана, но отдельные группы хонотрих могут быть обычными в одних районах и отсутствовать в других (табл. 3). Распространение хонотрих обусловлено их специфичностью к определенным хозяевам, и ареалы комменсалов должны совпадать с ареалами их хозяев. Древоточцы сем. Limnoriidae, к примеру, встречаются по всему Мировому океану, и повсюду они несут хонотрих рода Lobochona. Род/ Chilodochona приурочен к отряду Decapoda в целом и поэтому также является космополитным. Чаще ареал рода хонотрих ограничен ареалом лишь одного-двух родов хозяев; так, Heliochona встречается лишь на Gammarus и A nisogammarus, распространенных в северном полушарии, и представляет, таким образом, широко распространенный, но не космополитный род. Род хонотрих может быть приурочен к группе видов или даже лишь к одному виду хозяина; такие хонотрихи имеют небольшой ареал, как правило эндемичны. Filichona, например, живет только на Limnoria magadanensis и встречается лишь в Охотском море. Эндемичных родов особенно много в подотряде Endogemmina.
Ареал вида хонотрих может соответствовать ареалу вида или локальной расы хозяина. К примеру, Amphithoe rubricata во Франции и на Мурмане несетHeliochona alternans, в Беринговом море — Trichochona surgens. Степень эндемизма видов хонотрих гораздо выше, чем родов. Такую закономерность хорошо иллюстрирует сравнение фауны хонотрих наших дальневосточных морей и Тихоокеанского побережья США: в этих районах можно обнаружить разные виды одних и тех же родов хонотрих (Tricho-
Таблица 3
Географическое распространение Chonotricha
Семейство и род хонотрих Фауна СССР Находки вне СССР
пресные воды Европы Байкал Баренцево море Белое море Черное море Камчатка и Командорские о-ва Охотское море и Курильские о-ва Японское море и южный Сахалин
Exogemmina + + + + + + + +
Сем. Lobochonidae — — + + — + + +
Lobochona . . . + + + + + Норвегия, Англия, Франция, Португалия, Италия, Греция (о. Тазос), Адриатика, Марокко, Мавритания, ЮАР, Япония, Филиппины, Австралия, Тасмания, Новая Зеландия, Атлантическое и Тихоокеанское побережья США (Мексиканский залив и штаты Орегон,Вашингтон, Калифорния), Канада (Ванкувер), Гавайские о-ва, Коста-Рика.
Oenophorachona + + Тихоокеанское побережье США (Орегон, Вашингтон, Калифорния).
Тoxochona . . . — — — — — — — +
Eleutherochona — — — — — — — Чили (о. Тристан-да-Кунья).
Сем. Filichonidae — — — + — + + +
Aurichona . . . — — — + — +
Filichona . . . Сем. Phyllochoni- — — — — + + +
dae — — + + — + — +
Phyllochona . . — — + + — + —. +
Сем. Heliochonidae — — + + + + + +
Heterochona . . + + + + + + Швеция, Дания, ГДР, ФРГ, Голландия, Англия (о. Джерси, Шотландия), Финляндия, Польша, сев. Аляска (оз. Нувук), Тихоокеанское побережье США.
Heliochona . . Сем. Chilodochoni- + + + + + — Швеция, Дания, ГДР, ФРГ, Франция, -Аляска (оз. Нувук), северо-запад США.
dae •— — + — — — + +
Vasichona . . . — — + * . .
Cryptochona . . + —
Chilodochona . . + + + Швеция, Англия, Италия, атлантический и средиземноморский берега Франции, Аляска (Омер), запад США, центр и юг Чили (Вальпарайсо, Магелланов пролив), Аргентина, неопределенный район Средиземного мо-
Сем. Spirochonidae + + — — — + + + ря (на Palinurus, наш материал).
Spirochona . . + + 1 + + + Пресноводные виды: ГДР, ФРГ, Голландия, Англия, Франция, Швейцария, Польша, Чехослот вакия, Венгрия, Болгария, Югославия, США (Монтана). Морские виды: Тихоокеанское побережье США (Вашингтон, Орегон, Калифорния).
Таблица 3 (продолжение)
Семейство и род хонотрих пресные воды I Европы Байкал Баренцево море Фауна СССР Охотское море и Курильские о-ва Японское море и южный Сахалин Находки вне СССР
Белое море Черное море Камчатка и Командорские о-ва
Cavichona . . . +
Serpentichona — + — — — — — —
Endogemmina — — + 4- — + + 4-
Сем. Isochonidae — — + — — + 4- +
Isochona . . . — — + — — + 4- 4-
Trichochona . . — — — — + США (Калифорния), Чили
Сем. Actinichonidae . 4- 4- (В инья-де ль-М ар).
Cristichona . . — — — — — — + + США (о. Тортугас).
Carlnichona . . — — — — 4-
Rhizochona . . — 4-
Actinichona . . 4- 4-
Kentrochonopsis — Югославия (Ровиньо), США
Crassichona . . 4- (Флорида, Майами, о. Тортугас).
Сем. Stylochonidae — + + + — + + + Англия (о. Джерси), Адриати-
Stylochona . . . — + — 4- 4-
Spinichona . . + 4- ческое море (Триест, Ровиньо), Северная Атлантика 1и Тихоокеанское побережье США. США (Флорида, Майами).
Dentichona . . 4- 4- США (Вашингтон, о. Сан-Хуан).
Flectichona . . — 4- — 4-
Armichona . . . 4- 4- 4-
Oxychona . . . 4- 4- Япония (зал. Вакаяма-кен).
Eriochona . . + — — 4-
Paraoxychona. . 4-
Pterochona . . . 4- США (Вашингтон, о. Сан-Хуан).
Ctenochona . . 4-
Сем. Echinichoni-dae Eurychona . . . — — — — — — + 4- +
Echinichona . . 4- 4-
Coronochona . . 4-
Сем. Inversochoni-dae + 4- 4- 4- +
Pleochona . . . 4-
Inversochona . . 4- Англия (Плимут), США (Кали-
Kentrochona . . 4- форния). Адриатическое море (Триест,
Ceratochona . . 4-- Ровиньо), Тихоокеанское (Калифорния) и Атлантическое побережья США.
Chonosaurus . . — — + — + + +
Провизорные роды хонотрих
Ha Phycolimnoria 4- — США (Орегон, Калифорния).
Ha Allorchestes + — США (Калифорния).
Ha Chelura . . . — Италия (Неаполь).
Ha Haustorius . . — Англия.
Ha Photis .... — США (Калифорния).
Фауна СССР
Таблица 3 (продолжение)
Семейство и род хонотрих
S о к ж сб
S ? сб о § «
s а
К н
Находки вне СССР
На Pentidothea . . На Gnorimosphae-гота.............
На Nebalia, Epi-nebalia, Nebali-ella, Paraneba-lia.............
Атеннохона . . . Мизидохона . . .
Клематохона . .
Цетохона . . . .
Парацетохона и фаллайнохона
США (Вашингтон).
США (Калифорния), Чили (Магелланов пролив).
США (Калифорния, Вашингтон, северо-восточный берег, Флорида), Британская Вест-Индия, моря Европы, Антарктика (станция Мак-Мердо).
США (Калифорния, Монтерей).
Северо-восток Гренландии, США (Калифорния).
США (Калифорния, пролив Ка-талина-Ченнел).
Северная Атлантика, северная и южная, восточная и западная Пацифика, Чукотское море, северная Аляска, моря Антарктики (космополиты).
США (Вашингтон, Ситтл), ЮАР (Дурбан); предположительно всесветное распространение на Balaenoptera.
chona, Oenophorachona, Lobochona, Spirochona, Heterochona). Эндемичные роды, в основном эндогеммины, нередки в наших дальневосточных морях (Toxochona, Isochona, Pleochona, Ctenochona и др.); мы объясняем этот эндемизм не только лучшей изученностью нашей фауны хонотрих, но и большим, чем на западе США, разнообразием их хозяев. Для фауны СССР в целом эндемичны все байкальские спирохониды и, вероятно, около трети родов и половины видов морских форм. Интересно, что Многие эндемичные роды имеют в наших морях очень широкое распространение; например, представителей родов Chonosaurus, Vasichona и Phyllochona можно найти и в северных, и в дальневосточных морях, виды Isochona — во всех дальневосточных морях от Владивостока до Камчатки.
Поскольку почти все виды китообразных указаны для морей СССР (Томилин, 1957, 1962; Бобринский и др., 1962), живущие на них хонотрихиформально принадлежат к нашей фауне. Однако возможно различие видов хонотрих на изолированных локальных стадах (расах) хозяев.
Хотя морские хонотрихи еще далеко не достаточно изучены в фаунистическом отношении, уже сейчас можно выявить центры эволюции отдельных групп. Так, лобо-хониды (Oenophorachona, Toxochona) и спирохоны весьма обычны в северной Пацифике и еще не были отмечены в других океанах; их хозяин — A nisogammarus — живет лишь в Пацифике. Гелиохониды доминируют в северной Атлантике, обильны в Баренцевом море (на Gammarus)-, часть видов распространяется по Северному Ледовитому океану на восток до Берингова пролива и входит с севера в Тихий океан. Хотя гелиохониды перешли в Пацифике на Anisogammarus и один из их родов (Heterochona) распространился далеко на юг, активной дивергентной эволюции гелиохонид в Пацифике нет, семейство представлено здесь всего двумя видами.
В разных участках Мирового океана образуются локальные фауны хонотрих, состоящие из видов крупных, широко распространенных родов, из видов с относи
тельно небольшим ареалом и с разной степенью эндемизма. Так, в лагунах южного Кунашира мы находили виды космополитных родов (Lobochona, Chilodochona), а также виды родов, эндемичных для СССР в целом (Vasichona, Spinichona), эпдемичных только для пашпх дальневосточных морей (Actinichona, Oxychona) или для южных Курильских островов (Crassichona). В пресных водах обитает большинство Spirochonidae', один вид, Spirochona gemmipara, обычен в Европе и в Прибайкалье, остальные спиро-хониды живут в Байкале и связанных с ним реках. Многие из них не эндемичны для Байкала, встречаются на рачках Ангары и по системе Ангара—Енисей могут достигать Северного Ледовитого океана. По Кожову (1962), в районе Иркутска, в 70 км от истока Ангары, встречается до 50 видов байкальских гаммарид (1/8 от их общего числа), включая все прибрежные виды родов Brandtia, Pallasea, Eulimnogammarus, Gmeli-noides и другие, на которых живут хонотрихи. Поскольку Сварчевский обнаружил в Ангаре «колоссальные поселения» комменсалов, в частности хонотрих, можно думать, что хонотрихи обитают и в Енисее. В Енисее известно до 20 видов байкальских гаммарид; часть из них доходит до Таймыра и встречается в солоноватоводных заливах Карского моря. В итоге для Байкала эндемичны лишь один род Serpentichona и глубоководное виды двух других родов спирохонид.
Возможно, особый вид спирохон живет в Охридском озере (Югославия); здесь обитает лишь 5 форм амфипод (Stankovic, 1960), только одна из которых несет хонотрих. Еще не осматривалась эпифауна большого числа пресноводных ракообразных других континентов, поэтому мы вынуждены считать пресноводных хонотрих эндемиками севера Евразии и США.
МЕТОДИКА ИЗУЧЕНИЯ ХОНОТРИХ
Живых хонотрих можно изучать на изолированных придатках хозяев в капле воды или в вазелиновых камерах Коммандона и де Фонбрюна: придаток помещается в каплю на тонком слое вазелинового масла, либо маслом окантовываются края покровного стекла (Гийше применяет вазелин). Масло не токсично, пропускает О2. Для задержки движения томитов можно использовать поливиниловый спирт, сок табака, раствор Корри, гуммиарабик, вишневый сироп, 10%-й метоцель (метилцеллюлозу) и другие предлагаемые для инфузорий вещества. Движение ресничек ПВ, по Добжанской-Качановской, хорошо видно в эмульсии в темном поле.
Для витальной и суправитальной окраски хонотрих применялись метиленовый синий, нейтральрот, янусгрюн В и конгорот (Doflein, 1897а; Guilcher, 1951); нами использован нейтральрот, красящий пищевые вакуоли, вакуом трофонтов и секреторные ампулы томитов. Полезно помещать живых рачков в краску для выявления хонотрих на гнато- и переоподах, где без окраски их среди щетинок можно не заметить. Для окраски цитоплазмы применим бисмаркбраун.
Для окраски ядер инфузорий на временных препаратах применяют 1 % -й метилен-азур, 1%-й метилгрюн в слабой уксусной кислоте, орсеин, ацетоорсеин (2%-й орсеин в 45%-й уксусной кислоте), ацетокармин; орсеин красит ядра интенсивнее, чем метилгрюн. Лучшими считаются двойные ядерно-цитоплазменные окраски: ацетоорсеин+ +фастгрин (Курник и Рис), ацетокармин-рфастгрин (Диппел) — 10.5 частей кармина, 4.5 части 45%-й уксусной кислоты, 2 части 1 N НС1 и 1 часть 1%-го фастгрина (возможна замена лихтгрюном?) в 96°-м спирту. Мы пользовались готовой смесью метил-грюн+пиронин по Унна.
Для заключения в смеси, смешивающиеся с водой при нагревании и застывающие при охлаждении, Пирс и Ромейс рекомендуют лактофенол по Амманну (фенол, глицерин, молочная кислота, вода), гумми-сироп по Апати (гуммиарабик, тростниковый сахар, вода, тимол), сахарозу, смесь Фарранта (гуммиарабик, вода, мышьяковистая кислота, камфара) и многочисленные варианты глицерин-желатиновой смеси (обычные компоненты — глицерин, желатина, карбол или тимол, вода; заключение из фиксатора через 50%-й глицерин). Жидкость Фора неприменима, так как слишком просветляет хонотрих. Глицерин-желатиновые смеси без окантовки усыхают, объект постепенно просветляется. С фиксаторами желатину смешивать нельзя: осмий зачернивает хонотрих, сулема в них кристаллизуется, формалин коагулирует желатину, не растворяясь в ней. В итоге глицерин-желатиновые препараты применимы лишь для временных (10—15 дней) наблюдений.
На окрашенных бальзамных препаратах видны ядра, ампулы, эндостил, но совершенно невозможно разобрать хромофобные структуры — складки пелликулы, шипы, строение ПВ. Необходимо применение постоянных неокрашенных препаратов, на которых эти структуры видны с той же или большей четкостью, чем in vivo. Застывающие среды для этого оказались непригодными. После ряда проб мы разработали следующий метод. Придаток рачка переносится из формалина в 70°-й или 90°-й спирт, затем в смесь 20%-го глицерина и 4%-го формалина (1 : 4) со спиртом (1 : 1) и опять в ту же смесь, но без спирта. Непосредственно из формалина переносить инфузорий
нельзя, так как они сморщиваются. После окантовки препараты сохраняются очень долго, годами. Распространено ошибочное мнение о том, что фиксация искажает структуру простейших: «Как строение, так и форму тела инфузорий можно наблюдать только лишь при жпзпп этих существ» (Eismond, 1895 : 107); «Нет заменителя для изучения живых простейших; убивающие и фиксирующие их агенты почти неизменно разрушают их и делают непригодными для точного определения» (Pennak, 1953 : 35). Неясно в таком случае, почему так превосходно сохраняются форма и структура несократимых инфузорий на окрашенных, импрегнированных препаратах и на препаратах для электронного микроскопа. Дело скорее в неумелой и неправильной фиксации, а не в том, что любой фиксатор разрушает простейших. Если использован подходящий фиксатор в нужной концентрации, инфузории, особенно панцирные формы типа хонотрих, сукторий, армофорид и т. д., сохраняются без изменений; резко повышается контраст структур, контуры тела и внутреннее строение особей видны с исключительной четкостью. Одним из таких фиксаторов является формалин.
Для окантовки желатиновых препаратов Ромейс рекомендует бальзам, даммар-лак, белый эмалевый лак по Камптнеру (янтарный лак с цинковыми белилами), целлулоид по Мак-Клангу (в ацетоне), желатин-бихромат по де Рюйтеру. Смеси типа ланолин-канифоль, различные смолы, воск, парафин дают плохие, крошащиеся рамки, не прилегающие к стеклу. В США применяют синтетические среды — кларит, или ни-веллит (в толуоле), мерреит (в бензоле) и др. После двухлетних проб мы остановились на следующем методе. Препараты окантовываются полистиролом (10%-й раствор в толуоле); рамка прозрачная, очень быстро сохнет, но препараты могут усыхать через невидимые зазоры. Поэтому спустя сутки рамку полистирола надо обвести бальзамом. Если объект заключен в формол-глицерин, а не в чистый формалин, достаточно окантовки бальзамом или эпоксидом. Для иммерсии применяется легко стираемое, не сохнущее вазелиновое масло.
Хонотрих можно изучать и на коллекционном материале по Crustacea, обычно спиртовом. Спирт — консервирующая, но не фиксирующая жидкость, поэтому сохранность комменсалов и окраска их ядер бывают плохими. Лучше собирать живых рачков, фиксировать их 4—8%-м формалином и хранить в формалине, изредка сменяя раствор; смесь спирт-формол неприменима. Перед окраской материал следует дофикси-ровать смесью Буэна. Уже ранние авторы применяли для фиксации и сохранения рачков с хонотрихами гистологические фиксаторы, например Ромпель использовал хром-осмий-уксусную кислоту. Дофлейн рекомендует эту смесь для окраски ядер, а сулему, смесь пикриновой и уксусной кислот, сулему со спиртом и слабый раствор Флемминга для окраски всех структур клетки. Эйсмонд пользуется смесью хромовой и уксусной кислот, сулемы и уксусной кислоты (4 : 1) и фиксатором Фоля. Мор фиксирует рачков смесями Буэна, Шаудинна, Холланда, Шампи, Карнуа, Гейденгайна («СУСА»), Ценкера, Флемминга, Ворчестера, Рата; Для морских форм добавляется морская вода. Сварчевский использует ряд смесей из сулемы, уксусной и пикриновой кислот, в частности смесь Буэна. Поскольку со временем теряется способность ядер к окраске (при медленном гидролизе в кислотах), рачков спустя несколько недель лучше перевести в формалин.
При обычных методах хранения рачков коллекции могут быть испорчены при испарении фиксатора из неплотно закрытых или разбитых банок. Пеннак предлагает простой «вечный фиксатор» — раствор 2%-го глицерина в 2—5%-м формалине; можно добавлять также 5%-й глицерин к коллекциям в спирту или 4%-м формалине. Глицерин рекомендовался и более ранними авторами, но в практике хранения беспозвоночных он используется редко. При испарении или вытекании фиксатора рачки, пропитанные глицерином, не сохнут и сохраняются неопределенно долго. Рачков можно заключать и в чистый (абсолютный) глицерин (сначала в смесь 5—20 %-го глицерина с 50—95°-м спиртом, затем спирт испаряют), но комменсалы сохраняются лучше в смеси глицерин-формол (1:5).
Мелкие и плоские придатки перед окраской лучше приклеить к предметному стеклу. Обычно на стекло наносят слой альбумина Майера с коагуляцией спирт-формо-лом (Гийше). Излишне усложнен метод Мак-Ардля: живых инфузорий смешивают с OsO4 и с белком, коагулируемым после одночасового нагревания при 60° С. Для одновременного приклеивания и фиксации инфузорий применяют метод Ниссенбаума и целый ряд методик с использованием эфир-целлоидиновой смеси. Методы Вегенер, Хейвса, Канвара и другие излишне сложны и дают плохие препараты; метод Вегенер в оригинальной прописи, требующей 4—5-минутного высушивания особей, вообще неприменим. Лучший метод — Чена (Chen, 1944): материал фиксируется смесью Буэна и располагается на предметном стекле; после удаления излишка жидкости капается смесь абсолютного спирта с эфиром, затем капля целлоидина, коагулируемого в 70°-м спирту, с отмывкой спирта в воде.
Бальбиани фиксировал гаммарид в спиртовом растворе сулемы, через несколько часов отмывал их и переводил в спирт, где они сохранялись неопределенно долго; перед приготовлением препаратов жабры отделялись. Форма и детали строения спиро-
Ю Заказ Ki 213
хон и других комменсалов при этом прекрасно сохранялись. Mop (Mohr a. oth., 1963а) фиксирует, отбирает зараженных особей, подвергает гидролизу (для реакции Фель-гена) и окрашивает целых рачков; лишь после окраски придатки отделяются и заключаются через спирты в бальзам. Метод этот удобен лишь на первый взгляд: невозможно контролировать ход окраски, дифференцировки, окраска получается слишком неравномерная, красители загрязняются. Чаще отделяются и затем окрашиваются придатки тела живых (Mohr, 1948) или фиксированных рачков (Matsudo, 1966; Matsudo a. Mohr, 1965). Мы отделяем обычно придатки фиксированных формалином рачков, отбираем заселенные хонотрихами и помещаем их в смесь Буэна (5 мин.); все последующие операции (окраска, дифференцировка, обезвоживание) проводятся в солонке при непрерывном контроле под микроскопом. К предметным стеклам можно приклеивать' почти все придатки, особенно жабры и плеоподы.
Для окраски хонотрих на постоянных препаратах ранее применяли метилблау, аналинблау по Коневу, гематоксилины Галигера, Рего, Коула, Томаса, Деляфильда, Кляйненберга, Гарриса, Гейденгайна (мы пользуемся гематоксилином: Бемера), квасцовый кармин Чокора, алаун-кармин и триацид Эрлиха, насыщенный борный кармин Линча и Гренахера, бразилин, сафранин по Бабесу, ацетоорсеин по Дарлингтону,, толуидиновый синий, смеси Гимза, Маллори, Манна, Пренанта, метилгрюн-эозин. Из цитохимических методов применялись окраска сулемовым раствором бромфенол-блау по Мэйзиа (Форе-Фремье, Мацудо), реакция на РНК (пиронин) по Браше и Унна— Паппенгейму (Гийше, Мацудо, Мор), окраска полисахаридов по Мак-Манусу и Готч-киссу (Форе-Фремье), реакция Фельгена на ДНК (у ряда авторов). Гийше выявляет митохондрии фуксином Альтманна после фиксации по Шампи. Применимы также модификации реакции Фельгена (Ламатер, Рафалко, Савойе). Мы пользуемся методом Ламатера в упрощенной форме: после гидролиза в HCI препараты красятся 5 минут в теплом (40—50°) 0.5 %-м растворе основного фуксина с дифференцировкой в 70°-м спирту с лихтгрюном; окраска столь же элективна, прочна и интенсивна, как и по Фельгену. Хорошие препараты по общей морфологии и прикрепительному аппарату дает бромфенолблау-сулема.
К хонотрихам применяли пока только три метода импрегнации кинетома и арги-рома — методы Кляйна (наши препараты), Шаттона—Львова (Гийше, Форе-Фремье) и Бодиана (Мацудо, Мор, Лёнг). При импрегнации по Кляйну придаток рачка высушивается на стекле и на 5—20 минут погружается в 1—3%-й раствор AgNO3; серебро проявляется на солнечном свету или под кварцевой лампой. Мы пользуемся разбавленным в 25—30 раз метол-гидрохиноновым проявителем для фотобумаги. Для метода Шаттона—Львова (Chatton et Lwoff, 1936) нужен материал, фиксированный смесью Шампи и хранимый (до месяца) в растворе да Фано; после заключения особей в соленую желатину и импрегнации 3%-м раствором AgNO3 серебро восстанавливают, как и после импрегнации по Кляйну. Метод Бодиана сложен и капризен, редко дает хорошие препараты, но при удачной импрегнации выявляет целый комплекс клеточных структур. Инфузорий при этом фиксируют смесью Буэна, Холланда или, по рекомендации Мора, смесью Гейденгайна — «СУСА» (сулема-формол). После длительной импрегнации протарголем и промывки препараты обрабатывают в щелочи. Сейчас известны многочисленные модификации прописи Бодиана (Тюффро, Дражеско и др.), не применявшиеся пока к изучению хонотрих. Из остальных методов заслуживают внимания методы Бюссе, Диллера (импрегнация по Холмсу), Вейгерта (по Гольджи), Везен-берга (по Рио-Ортега), Фернандеса-Гальяно (по Рио-Ортега). Вольская (Wolska, 1966b) комбинирует методы Шаттона—Львова и Фернандеса-Гальяно: инфузорий фиксируют 10%-м формолом, заключают в соленую желатину, обрабатывают аммиачным раствором карбоната серебра по Бильшовскому и вновь 10%-м формолом, обезвоживают и заключают в бальзам. Судя по снимкам Вольской, это превосходный метод, заслуживающий широкого применения. Из ранних методов импрегнации отметим забытые ныне модификации метода Яброва (Пикард, Линч, Буш и др.), применявшиеся до введения «влажного» метода Шаттона—Львова в 1927—1935 гг., и трудный в применении метод' Гелей—Хорвата.
К хонотрихам применимы, вероятно, следующие методы выявления цилиатуры и аргирома без импрегнации. Бресслау и Деляфильд выявляют рельеф пелликулы простейших опаловой синькой и нигрозином на сухих мазках; Ноланд применяет для ресничек смесь фенола, формалина, глицерина и генциан-виолета (одновременно фиксатор и краситель). Репак и Хиршфельд обрабатывают гетеротрих в смеси Шампи, промывают в растворе да Фано, заключают в желатину или через спирты в бальзам. Применяются фиксация инфузорий OsO4 и окраска ресничек кристалл-виолетом (Перец-Сильва и Рамирец-Монтесинос). Как контроль к методике Шаттона—Львова Гийше предлагает окраску нигрозином и гематоксилином Деляфильда после фосфомолибденовой фиксации. Хорват красит реснички раствором толуидинового синего в сулеме, Пардуц — метиленовым синим после мгновенной осмиевой фиксации, Деру и Файди красят ядра, реснички и кинетосомы 5—50%-м раствором нигрозина в формалине. Боррор комбинирует эту смесь с фиксатором Ниссенбаума (сулема-(-уксусная
кислота । формол4бутанол); на постоянных препаратах красятся кинетосомы, реснички, циррусы, складки пелликулы, погруженная (буккальная) цилиатура, нема-десмы.
Ракообразных можно месяцами держать в аквариумах; так, Ромпель разводил Nebalia geoffroyi в Праге (материал из Триеста), отметив, правда, потерю комменсалов; Дофлейн наблюдал, напротив, массовое размножение кентрохон в тех же условиях. Валленгрен содержал в аквариуме крабов и пагурид с Chilodochona-, на Pagurus и Hyas в проточных аквариумах на Мурмане мы нашли массовые поселения хонотрих. Долго живет в проточной воде в лаборатории при 9—13° Gammarus pulex (Эйсмонд), но быстро гибнут гаммариды Ангары (Сварчевский). Лимнории, по Мору, могут жить в лаборатории долгое время, но хонотрихи на них гибнут; в нашем же материале они оставались живыми в течение почти трех месяцев.
По наблюдениям многих авторов, хонотрихи быстро гибнут при отделении придатков рачка; за одним исключением (Гийше), попытки разведения их в лаборатории были неудачными. Гийше изолировала ротовые придатки Carcinus maenas в чашку Петри с профильтрованной подщелоченной морской водой; Chilodochona carcini хорошо живет в таких условиях, питаясь печеночно-панкреатической суспензией или взвесью семенников. Долгое время поддерживались также «культуры» Spirochona^ gemmipara на изолированных жабрах Gammarus pulex при небольшом механическом сотрясении.
Сведения по технике электронной микроскопии хонотрих (хилодохон и лобохон) можно найти в отдельных статьях (Faure-Fremiet a. oth., 1956; Matsudo, 1966). Мацудо фиксировал в OsO4, обезвоживал и заключал в синтетические среды целых рачков (лимнорий).
В протозоологии принято обозначать не типовых особей, а типовые препараты, т. е. не голотип (одну из особей типовой серии), а синтип — всю типовую серию. Эта практика применяется калифорнийскими авторами, приводящими в диагнозах хонотрих следующие сведения: типовой хозяин, типовое местонахождение, косин-типы (типовой препарат с группой особей) и парасинтипы (другие препараты с того же рачка). По возможности следует сохранять тройную серию типовых препаратов: им-прегнированные (кинетом, псевдокинеты), окрашенные (ядра, ампулы, стебельки или ножки) и глицерин-формоловые (для изучения шипов, складок ПВ и тела, плохо видимых на первых двух). Необходимо сохранять и часть рачков — хозяев типовой расы — для проверки их определения и для приготовления новых препаратов; следует помнить и о меняющейся систематике ракообразных. Хранить их лучше в глице-рин-формоловой смеси, гарантирующей надежную сохранность.
Необходима стандартизация измерений хонотрих. Мы отбираем для измерений 5—8 развитых трофонтов или, чаще, трофотомонтов без признаков диминуции и поли-геммии; размеры отдельных структур проверяются на разном числе (3—20) других особей.
ЛИТЕРАТУРА
Основные- оригинальные работы по Chonotricha
(Гаевская Н. C.)Gajewskaja N. S. 1933. Zur Okologie, Morphologie und Systematik der Infusorien des Baikalsees. Zoologica, 32 : 1—298.
(Сварчевский Б. A.) Swarczewsky B. 1928a. Beobachtungen uber Spirochona elegans n. sp. Arch. Protistenk., 61 : 185—^222.
(Сварчевский Б. A.) Swarczewsky B. 19286. Zur Kenntnis der Baikal-protistenfauna. Die an den Baikalgammariden lebenden Infusorien. V. Spiro-chonina, Arch. Protistenk., 64 : 44—60.
Янковский A. B. 1971. Комменсологические очерки. 1. Хонотрихи (Protozoa, Ciliata) на эпибионтах китообразных. Зоол. журн., 50 : 1445—1456.
(Янковский А. В.) Jankowski A. W; 1973. Commensological sketches.
8. Chonotricha Exogemmina from North Pacific. Acta Protozool., 11.
Големански В. 1964. Изучвания върху епибионтните инфузории по ракообраз-ните от род Gammarus (Rivulogammarus) в България. Изв. Зоол. инет, с Музей Бълг. Акад., 17 : 157—165.
Balbiani Е. G. 1895. Sur la structure et la division du noyau chez le Spirochona gemmipara. Ann. Microgr., 7 : 241—260, 289—312.
Butschli 0. 1877. Bemerkungen fiber die Knospung von Spirochona. gemmipara. In: Butschli O. Uber den Dendrocometes paradoxus, Stein, nebst einigen Bemerkungen uber Spirochona gemmipara und die contractilen Vacuolen der Vorticellen. Theil 2. Zeitschr. wiss. Zool., 28 : 59—61.
С a n u E. 1886. Note sur le genre Spirochona (Stein). Bull. Scient. Dept, du Nord et des Pays Voisins, 17 (=BuII. Biol. France Belg., ser. 2, 9) : 21—31.
Dobrzanska-Kaczanowska J. 1963. Comparaison de la morphogenese des cilies: Chilodonella uncinata (Ehrbg.), Allosphaerium paraconvexa sp. n. et Heliochona scheuteni (Stein). Acta Protozool., 1 : 353—394.
Doflein F. J. Th. 1896. Uber die Kerntheilung bei Kentrochona nebaliae. Vorlau-fige Mittheilung. Zool. Anz., 19, 510 : 362—366.
Doflein F. J. Th. 1897a. Studien zur Naturgeschichte der Protozoen. I. Kentrochona nebaliae Rompel. Zool. Jahrb., Abth. Anal. Ontog. Thiere, 10 : 619—641.
Doflein F. J. Th. 1897b. Studien zur Naturgeschichte der Protozoen. II. Kentrocho-nopsis multipara n. g., n. sp., ein Ciliat mit multipler Knospung. Zool. Jahrb., Abth. Anat. Ontog. Thiere, 10 : 642—646.
Doflein F. J. Th. 1900. Kerntheilung und Knospenbildung bei Spirochona gemmipara u. a. In: D о f 1 e i n F. J. Th. Studien zur Naturgeschichte der Protozoen. IV. Zur Morphologie und Physiologie der Kern- und Zelltheilung. Nach Unter-suchungen an Noctiluca und andern Organismen. Zool. Jahrb., Abth. Anat. Ontog. Thiere, 14 : 37—42.
Dons C. 1940. Zwei neue Ciliaten. Kongel. Norsks Videnskabers Selskab. ForhandL, 13 (28) : 115—118.
Dons C. 1948. On some marine sedentary protozoans from Tristan da Cunha. Results Norweg. Sci. Exp. Tristan da Cunha, 1937—1938, Oslo, № 16 : 1—16.
(Eismond J.) Эйсмонд О. 1890a. Spirochona gemmipara. R кн.: Эйсмонд O. Инфузорш, живущ!я на ракообразных рода Gammarus (из окрестностей г. Варшавы), гл. III. Варшава : 28—37.
Eismond J. 1895. Studya nad pierwotniakami okolic Warszawy. Pami^tnik Fizy-jograficzny, 13 : 97—227.
Faure - Fremiet E., C. Rouiller et M. Gaucher y. 1956. Structure et origine du pedoncule chez Chilodochona. Journ. ProtozooL, 3 : 188—193.
Fenchel T. 1965. On the ciliate fauna associated with the marine species of the amphipod genus Gammarus J. G. Fabricius. Ophelia, 2 : 281—303.
Fritz H. 1961. Protozoen auf der Kiemen des Bachflohkrebses. Mikrokosmos, 50 : 49-50.
Green J. I960. Crustacea in Lake Ohrid, with special reference to their parasites and epibionts. Rev. Travaux Stat. Hydrobiol. Ohrid, 8 : 1—12.
Guilcher Y. 1949. Morphogenese et affinites structurales des cilies Chonotriches. Compt. Rerid. XIII Intern. Congr. Zool., Paris (1948) : 214—215.
Guilcher Y. 1950. Morphogenese et morphologie comparee chez les cilies Gemmipa-res : Chonotriches et Tentaculiferes. Annee Biol., 26 : 465—478.
Guilcher Y. 1951.1 Contribution a 1’etude des cilies Gemmipares, Chonotriches et Tentaculiferes. Ann. Sci. Nat., Zool., ser. 11, 13 : 33—132.
Hertwig R. 1877a. Uber den Bau und Entwicklung der Spirochona gemmipara. Jenaische Zeitschr. Naturwiss., 11 (N. F., 4) : 149—187.
Keiser A. 1921. Die sessilen Peritrichen Infusorien und Suctorien von Basel und Umgebung. Rev. Suisse Zool., 28 : 221—341.
Kent W. Saville. 1881. A manual of the Infusoria : including a description of all known flagellate, ciliate and tentaculiferous Protozoa, British and foreign. London, vol. 2 : 660—664; vol. 3, Atlas : pl. XXXIII.
LeVeque J. A. 1947. Thesis. University of Southern California, Biology Department, Los Angeles (цит. no: MohrJ. L. a. H. Matsudo, 1970).
Matsudo H. 1966. A cytological study of a chonotrichous ciliate protozoan, Lobochona prorates, from the gribble. Journ. Morphol., 120 : 359—390.
Matsudo H. 1967a. On the ultrastructure and morphogenesis of a marine chonotrichous ciliate protozoan, Lobochona prorates. In: University of Southern California, The graduate school. Dissertation abstract : 1—4.
Matsudo H. 1967b. Thesis. University of Southern California, Biology Department, Los Angeles (цит. no: Mohr J. L. a. H. M a t s u d o, 1970).
Matsudo H. a. J. L. Mohr. 1964. A new species of Lobochona, L. insularum sp. nov. (Ciliata : Chonotrichida) on a gribble from Hawaii. Parasitol., 54 : 125—128.
Matsudo H. a. J. L. Mohr. 1965. A new species of Heliochona, H. psychra n. sp. (Ciliata : Chonotrichida), from Nuwuk Lake, Alaska. Journ. ProtozooL, 12 : 522—527.
Matsudo H. a. J. L. Mohr. 1968. Oenophorachona ectenolaenius n. g., n. sp. and Spirochona halophila n. sp., two new marine chonotrichous ciliates. Journ. Proto-zool., 15 : 281—286.
Mohr J. L. 1948. Trichochona lecythoides, a new genus and species of marine chonotrichous ciliate from California, with a consideration of the composition of the or
1 Мы не смогли установить точную дату публикации этой работы. Имеется отдельное издание с пагинацией журнала, вышедшее, вероятно, К маю—июню 1950 г. (Theses prdsentes a la Faculte des Sciences de 1'Universite de Paris. Serie A, № 2369, № d’ordre 3241, Paris, 1950).
der Chonotricha Wallengren, 1895. Occasional Papers from the Allan Hancock Found., 5 : 1—21.
Mohr J. L. 1959a. Ciliates on crustaceans: the evolution of the order Chonotrichida. Proc. XV Intern. Congr. Zool., 16—23 July 1958, London, sect. VIII, paper 7 : 651—652; Discussion : 653.
Mohr J. L. 1959b. On the protozoan associates of Limnoria. In: R a у D. L. Marine boring and fouling organisms. Friday Harbor Symposia. Seattle : 84—91.
Mohr J. L. 1966. On the age of the ciliate group Chonotricha. In: В a r n e s H. Some contemporary studies in marine science. A collection of original scientific papers presented to Dr S. M. Marshall. London : 535—543.
Mohr J. L., J. A. Le Veque a. H. Matsudo [Mohr a. oth.]. 1963a. On a new collar ciliate of a gribble: Lobochona prorates n. sp. on Limnoria tripun-ctata. Journ. ProtozooL, 10 : 226—233.
Mohr J. L. a. H. Matsudo. 1970. The ciliate taxon Chonotricha. In: В a r n e s H. Oceanography and marine biology. An annual review. London (цит. по рукописи 1967 г.).
M о h r J. L., Н. Matsudo a. Yuk-maan Leung [Mohr a. oth.]. 1963b. A ciliate protozoan of whale lice. Proc. XVI Intern. Congr. Zool., 20—27 August 1963, Washington, 1 : 121.
P e n a r d E. 1922. Etudes sur les Infusoires d’eau douce. Geneve : 1—331.
Plate L. 1886. Untersuchungen einiger an den Kiemenblattern des Gammarus pulex lebenden Ektoparasiten. Zeitschr. wiss. Zool., 43 : 175—241.
Plate L. H. 1888. Protozoen-Studien. Habilitationsschrift. Uber die verschiedenen Formen der Fortpflanzung im Thierreiche. V. Heliochona sessilis mihi, eine neue Vorticelline. IX. Schlupbetrachtungen fiber das Wesen der Copulation und der Conjugation. Zool. Jahrb., Abth. Anat. Ontog. Thiere, 3 : 135—198 (также отдельное издание: Jena : 1—66).
Precht H. 1935. Epizoen der Kieler Bucht. Nova Acta Leopold. Carol., Abhandl. Kaiserl. Leopoldinisch-Carol. Deutsche Akad. der Naturforsch., N. F., 3: 405-474.
Rentsch S. 1860. Spirochona Scheutenii (Stein). In: R e n t s c h S. Homoiogene-sis. Beitrage zur Natur- und Heilkunde. I. Heft. Gammarus ornatus und seine Schmarotzer, Kapitel V. Wismar : 89—93.
Rompel J. 1894. Kentrochona nebaliae n. g., n. sp. Ein neues Infusor aus derFamilie der Spirochoninen, zugleich ein Beitrag zur Lehre von der Kerntheilung und dem Centrosoma. Zeitschr. wiss. Zool., 58 : 618—635.
Stein F., von. 1852.1 Spirochona gemmipara, eine neue Gattung und Art von Infusi-onsthieren aus der Familie der Vorticellinen. In: S t e i n F., von. Neue Beitrage zur Kenntniss der Entwicklungsgeschichte und des feineren Baues der Infu-sionsthiere. Theil II. Zeitschr. wiss. Zool., 3 : 485—492.
Stein F., von. 1854. Uber Spirochona gemmipara und S. Scheutenii und den Acine-tenzustand Dendrocometes paradoxus. In: Stein F., von. Die Infusionsthiere auf ihre Entwicklungsgeschichte untersucht, § 19. Leipzig : 205—217.
Tuffrau M. 1953. Les processus cytologiques de la conjugaison chez Spirochona gemmipara Stein. Bull. Biol. France Belg., 87 : 314—322.
Wallengren H. 1895. Studier ofver Ciliata Infusorier. II. Slagtet Heliochona Plate. Slagtet Chilodochona n. g. Slagtet Hemispeira Fabre-Domergue. Lunds Uni-versitets Arsskrift (=Acta Univ. Lund, 1; =Acta Reg. Soc. Physiogr. Lundsi 6), 31 : 1—77 (также отдельное издание: Lund, 1895).
Wallengren H. 1896. Einige neue Ciliate Infusorien. Biol. Cbl., 16 : 547—556.
Прочая литература1 2
Вазикалова А. Я. 1'945. Амфиподы озера Байкал. Тр. Байкальск, лимнолог, станции, 11 : 1—440.
Вазикалова А. Я. 1948. Заметки об амфиподах Байкала. Тр. Байкальсй. лимнолог, станции, 12 : 20—32.
Бекман М. Ю. 1954. Биология Gammarus lacustris Sars прибайкальских водоемов. Тр. Байкальск, лимнолог, станции, 14 : 263—311.
Бирштейн Я. А. 1951. Тонкопанцирные ракообразные {Leptostraca'} Берингова и Охотского морей. Докл. АН СССР, 78 : 1251—1254.
1 Дата публикации этой работы почти всегда указывается неправильно (1851). Статья написана в октябре 1851 г. й опубликована в 4-м (заключительном) выпуске тома, 15 февраля 1852 г.; предыдущие выпуски вышли 10 марта, 30 июня и 12.Ой-трября 1851 г., но на обложке всего тома ошибочно указан только 1851 г.
2 Звездочкой отмечены работы, в которых упомянуты хонотрихи.
Бобринский Н. А. и др. 1962. Определитель млекопитающих СССР. Изд. 2-е. М. : 1-382.
Булычева А. И. 1957. Морские блохи морей СССР и сопредельных вод (Amphi-poda—Talitroidea). Определители по фауне СССР, издав. Зоол. инет. АН СССР, 65, М.—Л. : 1—190.
* (Г а е ъ с к а я Н. С.) G a j е w s k a j a N. S. 1927. Zur Kenntnis der Infusorien des Baikalsees. Докл. АН СССР, A 19 : 313—318.
* Гаев с кая H. C. 1949. Простейшие (Protozoa). В кн.: Жизнь пресных вод, т. 2. Ред. В. И. Жадин. М.—Л. : 229—310.
Гурьянова Е. Ф. 1936. Равноногие ракообразные дальневосточных морей. Фауна СССР, Ракообразные, т. 7, вып. 3, М.—Л. : 1—279.
Гурьянова Е. Ф. 1951. Бокоплавы морей СССР и сопредельных вод (Amphi-poda—Gammaridea). Определители по фауне СССР, издав. Зоол. инет. АН СССР, 41, М.—Л. : 1—1029.
Гурьянова Е. Ф. 1962. Бокоплавы северной части Тихого океана (Amphipoda— Gammaridea, I). Определители по фауне СССР, издав. Зоол. инет. АН СССР, 74, М.—Л. : 1—440.
* Д о г.е л ь В. А. 1951. Общая протистология. М. : 1—604.
*Д огель В. А., Ю. И. Полянский иЕ. М. Хейси н. 1962а. Общая протозоология. М.—Л. : 1—592.
Догель. В, А., Ю. И. Полянский иЕ. М. Хейси н. 19626. Общая паразитология. Л. : 1—464.
Е с а к о в а С. Е.' 1961. Новый вид сверлящей дерево лимнории — Limnoria [Limnoria] magadanensis sp. nov. (Crustacea : Isopoda). Tp. Инет, океанол., 49 : 180—186.-
Еса к.о в а С. Е. 1965. Систематическое положение Limnoria (Crustacea, Isopoda), живущей у советских берегов Черного моря. Зоол. жури., 44 : 456—458.
К о ж.о в М.. М. 1962. Биология озера Байкал. М. : 1—315.
Кузнецов В. В. 1960. Белое море и биологические особенности его фауны и флоры. М.—Л. : 1—322.
Кузнецов В. В. 1964. Биология массовых и наиболее обычных видов ракообразных Баренцева и Белого морей. М.—Л. : 1—242.
(К у с а к и н О. Г.) К u s s a k i п О. G. 1963. Some data on the systematics of the ... family Limnoriidae (Isopoda) from northern and far-eastern seas of the USSR. Crustaceana, 5 : 281—292.
* H олянский Ю. И. иЕ.М.Хейсин. 1964. Спорные вопросы построения системы простейших, ч. 2. Зоол. журн., 43 : 1754—1766.
(Райков И. Б.) R a i к о v I. В. 1962. Der Kernapparat von Nassula ornata Ehrbg. (Ciliata, Holotricha). Zur Frage uber den Chromosomenaufbau des Makro-nucleus. Arch. Protistenk., 105 : 463—488.
* P а й к о в И. Б. 1967. Кариология простейших. Л. : 1—259.
Р о с с о л и м о Л. Л. 1966. Байкал. М. : 1—165.
Рябчиков П.И. 1957. Распространение древоточцев в морях СССР. М. : 1—230.
* С т р е л к о в А. А. 1941, 1958. Отряд Chonotricha. В кн.: Иванов А. В., Г. К. Петрушевский, Ю. И. Полянский и А. А. Стрелков. Большой практикум по зоологии беспозвоночных, ч. I. Изд. 1-е. Л. : 81; изд. 2-е. М. : 105—107.
Томилин А. Г; 1957. Китообразные. Звери СССР и прилежащих стран, т. IX. М. : 1—756.
Томилин А. Г. 1962. Китообразные фауны морей СССР. Определители по фауне СССР, издав. Зоол. инет. АН СССР, 79, М.—Л. : 1—212.
* (Х е й с и н Е. М. и Ю. И. Полянский) С h е i s s i n E. M. a. G. I. P o-1 j a n s k y. 1963. On the taxonomic system of Protozoa. Acta Protozool., 1 : 327—352.
Цветкова H. Л. 1970. Бокоплавы родов Gammarus, Marinogammarus, Anisogammarus и Mesogammarus (Amphipoda, Gammaridae) северных и дальневосточных морей СССР и сопредельных вод. Зоол. инет. АН СССР. Канд. дисс. : 1— 389; автореферат : 1—22.
* (Я нковский А. В.) Jankowski A. W. 1964. Morphology and evolution of Ciliophora, III. Arch. Protistenk., 107 : 185—294,.
Янковский А. В. 1966a. Происхождение отряда Apostomatida Chatton et Lwoff. В кн.: Вопросы морской биологии. Тезисы докладов конференции. Киев : 137—140.
Я н к о в с к и й А. В. 19666. Морфология Ciliophora. VI. Морфология и цикл развития Conidophrys enkystotrophos sp. nov. В кн.: Материалы IV конференции ученых, секция зоологии. Кишинев : 123—129.
♦ Янковский А. В. 1967а. Принципы построения новой системы ресничных простейших (Protozoa : Ciliophora). В кн.: Научная сессия Зоологического института АН СССР, поев. 50-летию Советской власти. Тезисы докладов. Л. : 17-18.
* Я н к о в с к и й А. В. 19676. Новая система ресничных простейших (Ciliophora). Тр. Зоол. инет. АН СССР, 43 : 3—52.
Янковский А. В. 1967в. Систематика рода Chilodonella и предлагаемый новый род Trithigmostoma gen. п. Зоол. журн., 46 : 1247—1250.
♦ Янковский А. В. 1967г. Аллометрическое развитие стебелька у кругоресничных инфузорий. Докл. АН СССР, 176 : 725—727.
♦ Янковский А. В. 1972. Повторение филогенеза в онтогенезе инфузорий. Вопросы эволюции, 2, Новосибирск : 95—123.
Я ш н о в В. А. 1948. Класс Crustacea — ракообразные. В кн.: Определитель фауны и фло,ры северных морей СССР. М. : 175—344. .
* А n d г ё Е. 1912. Infusoires. Catalogue des Invertebres de la Suisse, fasc. 6. Museum d’Histoire naturelie de Geneve : 1—228.
Baardseth E. 1941. The marine algae of Tristan da Cunha. Res. Norweg. Sci. Exp. to Tristan da Cunha, 1937—1938. Oslo.
* B al bi ani E. G. 1881. Lemons sur les Protozoaires faites au College de France en 1881. Journ. Micrographie, 5 : 398, 425 (цит. no: Balbiani E. G., 1895).
♦ Bannister J. L. a. J. R. Grindley. 1966. Notes on Balaenophilus unisetus P. О. C. Aurivillius, 1879, and its occurence.in the Southern Hemisphere (Copepoda Harpacticoida). Crustaceana, 10 : 296—302.
* B a t e Ch. Spence a. J. 0. We s t w oo d. 1861. A history of the British sessile-eyed Crustacea, vol. I, pt. I—X. London : 1—507.
В a t i s s e A. 1968. Quelques donnees sur la permanence des cinetosomes durant . la phase adulte des Acinetiens. Compt. Rend. Acad. Sci. Paris, D 266 : 130—132. ♦Beck D, E. a. L. F. Braithwaite. 1962. Invertebrate zoology laboratory workbook. 2 ed. Minneapolis, Minn. : 1—289 (Ciliata and Suctoria : 35—46). *B h a t i a B. L. 1936. Protozoa : Ciliophora. In : S e w e 11 R. B. S. The fauna of British India, including Ceylon and Burma. London : 1—493.
♦ Blochmann F. 1886. Die mikroskopische Thierwelt des Siisswassers. In : К i r-c liner 0. u. F. Bloch maun. Die mikroskopische Pflanzen- und Thierwelt des Siisswassers. Bd. 2. Braunschweig : 1—122.
♦ Blochmann F. 1895. Abth. I. Protozoa. In: Kirchner 0. u. F. Blochmann. Mikroskopische Thierwelt des Siisswassers. Hamburg : 1—134.
* B о c k F. 1938. Protozoa. In: S c h u 1 z e P. Biologie der Tiere Deutschlands. Bd. I. Protozoa, Spongiaria, Cnidaria, Vermes I (bis Gastrotricha), Lief. 40, Teil I. Berlin : 1—199.
♦ Borradaile L. A. 1959, 1961. The subkingdom Protozoa', Class Crustacea. In: Borradaile L. A.,F. A. Potts, L.E.S. Eastham, J. T, Sau nr d e r s. The Invertebrata : a manual for the use of students. 3 ed., 1959; 4 ed., 1961. Cambridge, Mass. : 10—115; 340—419.
♦ Buchar J. 1959. Die in der Prager Umgebung auf den Krebsen Gammarus pulex fossarum Koch lebende Fauna der Ordnung Peritricha. Acta Univ, Carplinae, Bio-logica, 1 : 1—16.
♦ Buisan E. G. 1947. Clasificacion de los Protozoos. Publ. Inst. Biol. Apl., ser. taxonomica, Barcelona, 1 : 1—84.
* B ii t s c h 1 i 0. 1889.,Protozoa. Abth. III. Infusoria und System der Radiolaria. In : В г о n n H. G. Klassen und Ordnungen des Thier-Reichs, 1. Leipzig : 1098—2035.
♦Calkins G. N. 1910. Protozoology. London : 1—349 (перепечатка книги: Calkins G. N. 1901. The Protozoa. New York : 1—347).
* C a 1 k i n s G. N. 1926, 1933. The biology of the Protozoa. Philadelphia. 1 ed., 1926 : 1—623; 2 ed., 1933 : 1—607. .
♦ Calkins G. N. 1941. General considerations. In: С a 1 k i n s G. N. a.F.M.S um-m e г s. Protozoa in Biological Research. New York : 3—42.
Canella M. F. 1957. Studi e richerche sui Tentaculiferi nel quadro della biologia generale. Ann. Univ. Ferrara, n. s., sez. Ill, 7 : 259—716.
Cannon H. G. 1960. Leptostraca. In : В г о n n H. G. Klassen und Ordnungen des Thier-Reichs, Bd. 5, Abt. I, Buch 4, Teil 1. Leipzig : 1—81.
Chatton Ё. et A. Lwoff. 1935. Les Cilies Apostomes. I. Apergu historique et general; etude monographique des genres et des especes. Arch. Zool. Exp. Gen., 77 : 1—453.
. Chatton Ё. et A. Lwoff. 1936. Techniques pour 1’etude des Protozoaires, spe-cialement de leurs structures superficielles (cinetome et argyrome). Bull. Soc. Ft. Microsc., 5 : 25—39.
Chen Т.-Т. 1944. Staining nuclei and chromosomes in Protozoa. Stain Technology^ 19 : 83—90. , ’Claparedc E. et J. L a c h m a n n. 1858—1861. Etudes sur les Inlusoires et les Rhizopodes. Mem. Inst. Nat. Genevois, 5, 1858 : 1—260; 6, 1859 : 261—482; 7, 1861 : 1—291.
Clapp W. F. a. R. К e n k. 1963. Marine borers. An annotated bibliography. Office of Naval Research, Dept, of Navy, Washington : I—XII, 1—1136.
Claus C. 1888. Uber den Organismus der Nebaliiden und die systematische Stel-lung der Leptostraken. Arb. Zool. Inst. Wien, 8 : 1—148.
*C о 11 i n B. 1912. Etude monographique sur les Acinetiens. II. Morphologie, physiologic, systematique. Arch. Zool. Exp. Gen., 51 : 1—457.
’Copeland H. F. 1956. The classification of lower organisms. Pacific Books, Palo Alto, California : 1—302.
*C о r 1 i s s J. 0. 1956. On the evolution and systematics of ciliated Protozoa. Syst. Zool., 5 : 68—91, 121—140.
*C о r 1 i s s J. O. 1957. Nomenclatural history of the higher taxa in the subphylum Ciliophora. Arch. Protistenk., 102 : 113—146.
’Corliss J. O. 1958a. The phylogenetic significance of the genus Pseudomicrothorax in the evolution of holotrichous ciliates. Acta Biol. Acad. Sei. Hung., 8 : 367—388.
’Corliss J. O. 1958b. Proposed type genera for higher taxa within the subphylum Ciliophora (phylum Protozoa). Bull. Zool. Nomenci., 15 : 520—522.
Corliss J. 0. 1958c. Order/class names: problems in the selection of type genera. Bull. Zool. Nomenci., 15 : 1073—1079.
’Corliss J. 0. 1958d. Problems in selection of types for higher categories within the subphylum Ciliophora. Joum. Protozool., 5, suppl. : 17.
’Corliss J. 0. 1959. An illustrated key to the higher groups of the ciliated Protozoa, with definition of terms. Journ. Protozool., 6 : 265—281.
’Corliss J. 0. 1960. Comments on the systematics and phylogeny of the Protozoa. Syst. Zoology, 8 : 169—190.
’Corliss J. 0. 1961. The ciliated Protozoa', characterization, classification, and guide to the literature. Int. Series Monogr. Pure Appl. Biology, Div. Zool., 7 : 1—310.
Corliss J. 0. 1963. Application of phylogenetic considerations to protozoan systematics. Progress in Protozoology, Proc. I Intern. Conf. Protozool., Praha : 47—56. ’Corliss J. 0. 1964. [Ciliophora]. In: H о n i g b e r g В. M. a. oth. (the Committee on Taxonomy). A revised classification of the phylum Protozoa. Journ. Protozool., 11 : 7—20.
’Corliss J. 0. 1967. Systematics of the phylum Protozoa. In: F 1 о г к i n M. а. В. T. Scheer. Chemical Zoology, vol. I. Protozoa. New York and London : 1—20.
Corliss J. 0. 1969. The changing world of Ciliate taxonomy. Progress in Protozoology, Proc. Ill Intern. Congr. Protozool., Leningrad : 364—365.
’Czapik A. 1962. Wsp6Iczesne poglqdy na systematykq i ewolucjq wymoezkow. Przeglqd Zoologiczny, 6 : 126—134.
* D ales R. Ph. 1966. Symbiosis in marine organisms. In: H e n г у S. M. Symbiosis, vol. I. Associations of microorganisms, plants and marine organisms. New York and London : 299—326.
* D e Geest B. 1933. Protozoaires : Rhizopodes — Mycetozoaires — Flagelles — Infusoires. Les Naturalistes Belg., Bruxelles.
’Delage Y. etE.Herouard. 1896. La cellule et les Protozoaires. Traite de Zoo-logie Concrete, vol. I. Paris : 1—584.
D e г о u x G. 1965. Origine des cineties anterieures, gauches et buccales dans le genre Dysteria Huxley. Compt. Rend. Acad. Sci. Paris, 260 : 6689—6691.
* D er о u x G. 1968. Projet d’une revision systematique de deux families actuelles de Cyrtophorina a ciliature ventrale. Rotaprint : 1—8.
Deroux G. etJ. Dragesco. 1968. Nouvelles donnees sur quelques cilies Holo-triches Cyrtophores a ciliature ventrale. Protistologica, 4 : 365—403.
Dippel R. V. 1962. The site of silver impregnation in Paramecium aurelia. Journ. Protozool., 9, suppl. : 24.
’Discussions of the classification of Protozoa at the II International Conference of Protozoology, London, England. 1966. Journ. Protozool., 13 : 187—195.
* D ob rzanska J. 1961. Recherches sur Allosphaerium Kidder et Summers, 1935-In: Abstracts of papers, presented at I International Congress of Protozoology. Praha. Rotaprint : 107—108.
* D obrzanska J. 1963. Studies on the genus Allosphaerium Kidder et Summers, 1935. Progress in Protozoology, Proc. I Intern. Conf, on Protozool., Praha -533—536.
Doflein F. J. Th. 1902. Das System der Protozoen. Arch. Protistenk., 1 : 169—192.
♦Doflein F. u. E. Reichenow. 1927—1929, 1953. Lehrbuch der Protozoen-kunde. Jena. 5. Aufl., 1927-1929 : 1-1262; 6. Aufl., 1953 : 1-1214.
Dragesco J. 1966a. Quelques cilies libres du Gabon. Biologia Gabonica, 2: 91—117.
Dragesco J. 1966b. Observations sur quelques cilies libres. Arch. Protistenk., 109 : 155-206.
♦Dudich E. 1967. Systematisches Verzeichnis der Tierwelt der Donau mit einer zusammenfassenden Erlauterung. In: R. L i e p о 1 t. Limnologie der Donau. Eine monographische Darstellung, V. Die Biologie der Donau, B. Faunistisch-floristisches Uberblick. Stuttgart : 4—69.
Eismond J. 1890b. Uber die Struktur des Peristoms bei Vorticellinen. Biol. Cbl.t 10 : 255—256.
♦ Enriques P. 1908. Di un nuovo Infusorio olotrico (Turbilina insta,bilis n. gen., n. sp.) e suo significato per la filogenia dei Peritrichi. Rend. Accad. Lincei, Cl. Sci. Fiz., Mat., Natur., sez. 5, 17 : 224—235.
* E ntz G. 1884. Uber Infusorien des Golfes von Neapel. Mitt. Zool. Stat. Neapel, 5 : 289-444.
♦ Erdmann K. 1965. Einfiihrung in die Zoologie fur Landwirte und Tierarzte. Jena : 1—329.
Erlanger K., von. 1889. Zur Kenntniss einiger Infusorien. Zeitschr. wiss. Zool., 49 : 649—669.
♦ Erlanger K., von. 1896. Neuere Ansichten fiber die Struktur des Protoplasmas, die karyokinetische Spindel und das Centrosom. Zool. Cbl., Ill, 9 : 297—310.
♦ Faure-Fremiet E. 1905. La structure de 1’appareil fixateur chez les Vorticel-lidae. Arch. Protistenk., 6 : 207—226.|
♦ Faure-Fremiet E. 1910. Etudes de cytologie comparee. La fixation chez les Infusoires cilies. Bull. Sci. France Beige, (7), ser. 5, 44 : 27—50.
♦ Faure-Fremiet E. 1950a. Morphologie comparee et systematique des Cilies. Bull. Soc. Zool. France, 75 : 109—122.
Faure-Fremiet E. 1950b. Mecanismes de la morphogenese chez quelques Cilies Gymnostomes Hypostomiens.' Arch. Anat. Mier. MorphoL Exp., 39 : 1—14.
Faure-Fremiet E. 1950c. Morphologie comparee des Cilies Holotriches Tri-chostomes. Ann. Acad. Brasil. Sci., 22 : 257—261.
Faure-Fremiet E. 1957. Le macronucleus heteromere de quelques cilies. Journ. Protozool., 4 : 7—17.
Faure-Fremiet E. 1959. Ultrastructure et differenciations protoplasmiques chez les Ciliata. Proc. XV Intern. Congr. Zool., London : 475.
♦ Faure-Fremiet E. 1961. Les cilies Cyrtophorina et leur diversification morpho-logique. Compt. Rend. Acad. Sci. Paris, 252 : 3912—3916.
Faure-Fremiet E. 1965. Morphologie des Dysteriidae (Ciliata Cyrtophorina). Compt. Rend. Acad. Sci. Paris, 260 : 6679—6684.
♦ Faure-Fremiet E. 1969. Organites et appareils de fixation chez les Ciliata. Progress in Protozoology, Proc. Ill Intern. Congr. Protozool., Leningrad : 7—8.
Faure-Fremiet E., J. Andre et M.-C. G a n i e r. 1968. Structure fine de 1’organite fixateur des Dysteriidae (Ciliata Cyrtophorina). Compt. Rend. Acad. Sci. Paris, 267 : 954—957.
♦ Faure-Fremiet E. et Y. Guilcher. 1947. Trochilioides filans n. sp., in-fusoire holotriche de la famille Dysteriidae. Bull. Soc. Zool. France, 72 : 106—112.
♦ Fol H. 1881. Contribution a la connaissance de la famille des Tintinnodea. Arch. Sci. Phys. Nat. Geneve (3) 5 : 5—24.
♦ Fromentel E., de. 1874. Etudes sur les Microzoaires ou Infusoires proprement dits. Paris : 1—364.
* G e 1 e i J. 1950. Die Morphogenese der Einzeller mit Rucksicht auf die morphogene-tischen Prinzipen von Sewertzoff. Acta Biol. Hung., 1 : 69—134.
♦ G ot tschalk R. 1967. Protozoa. In: Urania Tierreich, Bd. I. Wirbellose Thiere 1 (Protozoa bis Echiurida). Leipzig, Jena, Berlin : 24—78.
Grasse P.-Р., R. A. Poisson et О. T u z e t. 1961. Zoologie, I. Invertebres. Paris : 1—919 (Infusoires : 98—109; Taxonomie des Crustaces : 563—567).
Green J. 1961. A biology of Crustacea. Aspects of Zoology Series, London : I—XVI, 1—180.
* G r e e n J. 1968. The biology of estuarine animals. Biology Series. London : 1—401. ♦Grell K. G. 1956, 1968. Protozoologie. Berlin. 1. Aufl., 1956 : 1—284; 2. Aufl., 1968 : 1—511.
♦ Grell K. G. 1963. Morphologie der Ciliaten. II. Spirotricha, Peritricha, Chonotricha, Suctoria. Film C-882, Unterrichtsfilme, 11.5 min (может быть заказан: Institut fur den wissenschaftlichen Film in Gottingen, Nonnestieg 72, DBR).
* G г о Ь Ь е п К. 1904—1905. Lehrbuch der Zoologie, begriindet von C. Claus. 7. Aufl. Marburg im Hesse : 1—955.
• Guilcher Y. 1948. Affinites structurales des bourgeons migrateurs d’infusoires Acinetiens. Compt. Rend. Acad. Sci. Paris, 226 : 958—960.
* H all R. P. 1953. Protozoology. Prentice-Hall, New York : 1—682 (Chonotrichida: 411—413).
* H am b urger Cl. u. W. von Buddenbrock. 1911. Nordische Ciliata mit Ausschlup der Tintinnoidea. In : В r a n d t К. u. C. A p s t e i n. Nordisches Plankton, Lief. 13. Kiel u. Leipzig.: 1—152.
* Hartog M. 1906. Protozoa. In:H. armerS. F. a. A. E. Shipley. The Cambridge Natural History. London, 1 : 3—162.
* H enderson W. D. 1905. Notes on the Infusoria of Freiburg in Breisgau. Zool. Anz., 29 : 1—24.
• Hennig W. 1957. Taschenbuch der Zoologie. Heft 2. Wirbellose, Theil I. Leipzig : 1—147. .. ..
• Hertwig R. 1877b. Uber Leptodiscus medusoides, eine neue den Noctilucen ver-' wandte Flagellate. Jenaische Zeitschr. Naturwiss., 11 : 307—323.
* H i с к s о n S. J. 1903. The Infusoria or Cortlcata Heterokaryota. In : R a у L a n-, kester E. A treatise on zoology. 2 ed. Vol. I. Introduction and Protozoa, fasc. 2, sect. L. London : 361—426.
Hurley D. E. -a. J. L. Mo hr. 1957. On whale-lice (Amphipoda : Cyamldae) from the California gray whale, Eschrichtius glaucus. Journ. Parasitol., 43 : 352—357.
* H у m a n L. H. 1940. The invertebrates : Protozoa through Ctenophora, vol. I. 4 ed. New York : 1—726.
Ishikawa C. 1894. Uber die Kerntheilung bei Noctiluca miliaris. Ber. Naturfr. Ges. Freiburg, 8 : 54—69.
Ishikawa C. 1899. Further observations on the nuclear division of Noctiluca. Journ. Coll. Sci. Univ. Tokyo, 12 : 243—262.
* J a e с к e 1 S. G. A. 1962. Die Tierwelt der Schlei. Ubersicht einer Brackwasser-fauna. Schriften Naturwiss. Vereins fur Schleswig-Holstein, Kiel, 33 : 11—32. _
* J a g e r s к i о 1 d L. A. 1896. Реферат статьи: Wallengren H. 1895. Studier ofver Ciliata Infusorier. II. Zool. Gentralblatt, 3, № 26 : 889—891.
* J a h n T. L. a. F. F. Jah n. 1949. How to know the Protozoa. Picture-Key Nature Series. Iowa : 1—234. „
* J i г о v e с О., K. W e n i g, B. F о t t, E. Bartos, J. Weiser a. R. Sra-mek-Husek. 1953. Protozoologie. Praha : 1—643.
* K ahi A. 1930—1935. Urtiere bder Protozoa. I. Wimpertiere oder Ciliata (Infusoria). In : D a h 1 F. Die Tierwelt Deutschlands. Jena. Teil 18, 1930; 21, 1931; 25, 1932; 30, 1935 : 1—886 (Chonotricha : 799—805).
* K ahi A. 1933. Ciliata libera et ectocommensalia. In: G r i m p e G. u. E. W a g-1 e r. Die Tierwelt der Nord- und Ostsee. Lief. 23, Teil II C 3. Leipzig : 29—146 (Chonotricha : 140—141).
• К a 1 m u s H. 1928. Uber die Bodenfauna der Moldau im Gebiete von Prag. Ein Ja-hreszyklus. II. Protozoa, Hydrozoa, Crustacea, Targigrada, Hydracarina. Mit einem Anhang: okologische Beobachtungen und Versuche. Rev. Ges. Hydrobiol., 19: 349________429.
* K e 11 i с о t t D. S. 1885. Class 4. Infusoria. In: Kingsley' J. S. The Standard Natural History, vol. I. Lower Invertebrates. Boston : 26—48.
Kirby H. 1941. Relationships between certain Protozoa and other ianimals. In: Calkins G. N. a. F. M. Summers. Protozoa in Biological Research. New York : 890—1008.
Klein В. M. 1926. Uber eine neue Eigentiimlichkeit der Pellicula von Chilodon uncinatus Ehrbg. Zool. Anz., 67 : 160—162.
* K о f о i d Ch. A. 1927. Parasites and commensals. In: H i 11 C. L. a. Ch. A. К o-f о i d. Marine borers and their relations to marine construction on the Pacific Coast. San Francisco : 188—357.
К о r m о s J. u. J. Kormos. 1957a. Die entwicklungsgeschichtlichen Grund-lagen des System der Suctorien. Acta Zool. Hung., 3 : 147—162.
Kormos J. u. K.Kormos. 1957b. Die Ontogenese der Protozoen. Acta Biol. Hung., 7 : 385—402.
Kormos J. u. K. Kormos. 1958. Die Zellteilungstypen der Protozoen. Acta Biol. Hung., 8 : 127—148.
* K u d о R. R. 1931—1966. Protozoology. Springfield. 1 ed., 1931; 2 ed., 1939; 3 ed., 1946; 4 ed., 1954; 5 ed., 1966.
• Lameere A. 1932. Precis de Zoologie. T. I. La Cellule; L’espece des Protozoai-res; Caracteres fondamentaux des Metazoaires; Les Coelenteres. 2 ed. Liege : 1—394.
* L am р er t К. 1910. Das Leben der Binnengewasser. 2. Aufl. Leipzig : 1—856 (Spirochona : 438—439).
* L e p ? i J. 1926. Die Infusorien des Siisswassers und Meeres. Hilfsbuch zum Bestim-men nebst einer kurzen Einfiihrung in deren Biologie. Berlin—Lichterfelde : 1—100.
* Lep?i J. 1965. Protozoologie. Bucure?ti : 1—999.
Leung Y. M. (Yuk-maan Leung). 1965. A collection of whale-lice (Cyamidae : Amphipoda). Bull. Southern Calif. Acad. Sci., 64 : 132—143.
Leung Y. M. (Yuk-maan Leung). 1967. An illustrated key to the species of whale-lice (Amphipoda : Cyamidae), ectoparasites of Cetacea, with a guide to the literature. Crustaceana, 12 : 279—291.
* Mackinnon D. L. a. R. S. J. Hawes. 1961. An introduction to the study of Protozoa. London : 1—506.
Malzahn E. 1958. Ein neuer jungpalaozoischer Krebs aus dem niederrheinschen Zechstein. Zeitschr. Deutsch. Geol. Ges., 110 : 352—359.
* M a n w e 1 1 R. D. 1961. Introduction to protozoology. New York : I—XII, 1—642.
* M arshall A. 1873. Nomenclator zoologicus; nomina systematica generum ani-malium. Vindobonae : I—IV, 1—482.
* M eglitsch P. A. 1967. Invertebrate zoology. Oxford Univ. Press, New York, London, Toronto : I—XX, 1—961.
Menzies R. J. 1957. The marine borer family Limnoriidae (Crustacea Isopoda). Bull. Marine Sci. Gulf a. Caribbean, 7 : 101—200.
Menzies R. J. 1959. The identification and distribution of the species of Limnoria. In: Ray D. L. Marine boring and fouling organisms. Seattle : 10—33.
* M e n z i e s R. J. a. J. L. M о h r. 1952. The occurence of the wood-boring crustacean Limnoria and of Nebaliacea in Morro Bay, California. Wasmann Journ. Biol., 10 : 81—86.
* M e r m о d G. 1914. Recherches sur la faune infusorienne des tourbierres et des eaux voisines de Sainte-Croix (Jura vaudois). Rev. Suisse Zool., 22 : 31—114.
* M о h r J. L. 1950. Observations of marine borers, Limnoria, and their consortes in or near Coos Bay. Proc. Oregon Acad. Sci., 11 : 88—89.
* M о h r J. L. 1952. Notes on epibionts of some crustaceans at Point Barrow, Alaska. Abstract. Proc. Soc. ProtozooL, 3 : 14.
* M о h r J. L. 1953. Some observations on arctic crustaceans and their associates: notes on the fauna of Nuwuk Pond, Point Barrow. Current Biol. Research in the Alaskan Arctic. Stanford Univ. Publ. Univ, ser., Biol. Sci., 11 : 14—18.
* M о h r J. L. 1959c. Marine biological work. Scientific studies at Fletcher’s Ice Island, T-3, 1952—1955, vol. I. Geophysical Research Papers, 63 : 82—103.
* M о h r J. L. a. S. R. Geiger.' 1969. In : J e s p e r s e n A. a. J. E. Safer. Proceedings of the Arctic Drifting Station Symposium. Washington.
* Mohr J. L., D. J. R e i s h, J. L. Barnard, R. W. Lewis a. S. R. G e-i g e r. 1961. The marine nature of Nuwuk Lake and small ponds of the Peninsula of Point Barrow, Alaska. Arctic, Journ. of the Arctic Inst, of N. America, 14 : 211—223.
* M о n о d J. 1925. Tanaidaces et Isopodes aquatiques de 1’Afrique occidentale et septentrionale. II. Bull. Soc. Sci. Natur. Maroc, 5 : 233 —247.
* N eave Sh. A. 1939—1966. Nomenclator zoologicum (1758—1955). Vol. 1, 1939; vol. 2, 1939; vol. 3, 1940; vol. 4, 1940;. vol. 5, 1950; vol. 6, 1966, London.
Noirot-Timothee C. 1960. Etude d'une famille des Cilies: les Ophrybsco-lecidae. Structures et ultrastructures. Ann. Sci. Nat. Zool., ser. 12, 2 : 527—718.
Noirot-Timothee C. 1969. Les affinites des Entodiniomorphida (Ciliata). Progress in Protozoology, Abstracts of papers of III Intern. Congr. of ProtozooL, Leningrad : 371.
* P ear se A.- S. 1936—1949. Zoological names. A list of Protozoa prepared for AAAS. Durham. Ed. 1, 1936; ed. 3, 1947; ed. 4, 1949 : 1—22.
* P earse A. S. 1942. Introduction to parasitology. Springfield—Baltimore :
P e n n a к R. W. 1953. Fresh-water Invertebrates of the United States. New York : 1—769 (Protozoa : 20—76; Amphipoda : 435—446).
* Р о c h e F. 1913. Das System der Protozoa. Arch. Protistenk., 30 : 125—321.
* P r e 11 e A. 1962. Position systematique du Cilie holotriche Leptopharynx costatus Mermod, 1914. Compt. Rend. Acad. Sci. Paris, 254 : 4071—4073.
* P rite hard A. 1861. A history of Infusoria, British and foreign, including the Desmidiacea and Diatomeae. 4 ed. London : 1—968.
* R a a b e Z. 1947. Drogi przystosowan morfologicznych do zycia pasozytnego wsrdd wymoezkow. Ann. Univ; Mariae Curie-Sktodowska, sect. C, 2 : 299—411.
♦ Raabe Z. 1948. Proba rewizji systemu pierwotniakow. Ann. Univ. Mariae Curie-Sklodowska, sect. C, 3 : 259—276.
Raabe Z. 1961. О Sjewercowowskich zasadach morfogenetycznych, ich uzupelnie-niach i konsekwencjach. Kosmos (Polska), ser. A, Biol., rok 10, zeszyt 3 (50) : 223—236.
Raabe Z. 1963. Kontynuacja a reorganizacja w procesach morfogenetycznych or-zqskow (Ciliata). Kosmos (Polska), ser. A, Biol.', rok 12, zeszyt 1 (60) : 13—24.
♦ Raabe Z. 1964a. Remarks on the principles and outline of the system of Protozoa, Acta Protozool., 2 : 1—18.
Raabe Z. 1964b. The taxonomic position and rank of Peritricha. Acta Protozool., 2 : 19-32.
♦ Raabe Z. 1964c. Zarys protozoologii. Warszawa : 1—283.
R e m a n e A. 1967. Geschichte der Tiere. In: Heberer G. Die Evolution des Organismen. Ergebnisse und Probleme der Abstammungslehre. 3. Aufl., Bd. 1. Stuttgart : 589—677.
* R i c h a r d J. 1899. Essai sur les parasites et les commensaux des Crustaces. Arch. Parasitol., 2 : 548—595.
Ricketts E. F. a. J. Calwin. 1962. Between Pacific Tides. 3 ed., revised by J. W. Hedgpeth. Stanford : 1—516.
♦ Riedl R. 1963. Fauna und Flora der Adria. Ein systematischer Meeresfiihrer fiir Biologen und Naturfreunde. Hamburg und Berlin : 1—640.
♦ Roux J. 1900. Note sur les Infusoires cilies du Lac Leman. Rev. Suisse Zool., 8 : 459—465.
♦ Roux J. 1901. Faune infusorienne des eaux stagnantes des environs de Geneve. Mem. Inst. Natur. Genevois, 19 : 1—149.
♦ Sakowsky-Campioni Fr. 1907. Verzeichnis der Infusorien der Umgebung von Bern. Mitt. Naturforsch. Ges. Bern, Jahrg. 1906 : 135—137.
♦ S an d о n H. 1963. Essays on Protozoology. Hutchinson Biological Monographs. Hutchinson Educational, London : 1—143.
Schellenberg A. 1943. Die Amphipoden des Ochridasees. Zool. Anz., 143: 97—103.
♦ Schonichen W. 1909, 1927. Protozoa, Klasse Infusoria. In: E у f e r t h B. u. W. Schonichen. Einfachste Lebensformen des Thier- und Pflanzen-reiches. 4. Aufl., 1909; 5. Aufl., 1927. Braunschweig. (Spirochona : 440—441; 243).
♦ Schulze F.-E., W. Kiikenthal, K. Heide r, R. Hesse. 1927—1936. Nomenclatorum animalium generum et subgenerum. Berlin, Bd. 2—5 (1927, 1928, 1930, 1936) : 477—3532.
♦ Scudder S. H. 1882. Nomenclator zoologicus. Part I. Supplemental list; part II. Universal index. Bull. US Nat. Mus., 19 : I—XIX, 1—376; 1—340. >
Simon W. u. H. J. Lippolt. 1967. Geochronologie als Zeitgeriist der Phylo-genie. In: H e b e r e r G. Die Evolution der Organismen. Ergebnisse und Pro-bleme der Abstammungslehre. Bd. I. Stuttgart : 161—237.
♦ bramek-Husek R. 1953. Predbezny seznam nalevnikh (Ciliata) z Cech, Moravy a Slezska. II. Spirotricha, Peritricha a -Chonotricha. Casopis narodniho Musea v Praze, Oddil prirodovedny, roonik 122 : 76—88.
S tank ovU S. 1960. The Balkan Lake Ohrid and its living world. Monogra-phiae Biologicae, Den Haag, 9 : 1—357.
* S t e i n F. 1859. Der Organismus der Infusionsthiere nach eigenen Forschungen in systematischer Reihenfolge bearbeitet. I. Abth. Allgemeiner Theil und Natur-geschichte der Hypotrichen Infusionsthiere. Leipzig : 1—206.
* S t e i n F. 1867. II. Abth., 1. Darstellung der neuesten Forschungsergebnissen fiber Bau, Fortpflanzung und Entwickelung der Infusionsthiere; 2. Naturgeschichte der Heterotrichen Infusorien. Leipzig : VIII+1—355.
* S t i 11 e r J. 1960. Protozoa. Allati egysejtiiek. Altalanos bevezetes. Magyarorszag Allatvilaga. I. Kotet (Protozoa), 1. Fiizetek. (Fauna Hungarica, 57). Budapest : 1—25.
Stock J. H. 1967. A revision of the european species of Gammarus locusta group (Crustacea, Amphipoda). Zool. Verh., 90 : 1—56.
♦ Tartar V. 1967. Morphogenesis in Protozoa. In: Tse-tuan Chen. Research in Protozoology, vol. 2. Oxford : 1—116.
* T hien em ann A. 1912. Der Bergbach des Sauerlandes. Faunistisch-biologische Untersuchungen. Intern. Revue d. Ges. Hydrobiol. u. Hydrographie, Biol. Suppl., ser. IV : 1—125.
♦ Thienemann A. 1913a. Die Faktoren, welche die Verbreitung der Siisswaperor-ganismen regeln. Arch. Hydrobiol. Planktonkunde, 8 : 267—288.
♦ Thienemann A. 1913b. Der Bergbach des Sauerlandes. Kurze Zusammenfas-sung der Ergebnisse faunistisch-biologische Untersuchungen. Arch. Hydrobiol. Planktonkunde, 8 : 432—445.
Wakabara Y. 1965. On Nebalia from Brasil (Leptostraca'j. Crustaceana, 9: 245—248.
* W aterhouse Ch. 0. 1902. Index Zoologicus. An alphabetical list of names of genera and subgenera proposed for use in zoology. London : I—XII, 1—421.
Waterman T. H. a. F. A. C h a c e. 1960. General crustacean biology. In: W a-t e r m a n T. H. The physiology of Crustacea, vol. I, ch. 1. New York—London : 1—33.
W e i s z P. B. 1966. The science of zoology. New York : 1—875.
* W e n у о n С. M. 1926, 1965. Protozoology, vol. 1—2. London : 1—1563.
* W e t z e 1 A. 1954, 1965. Protozoa. In: Kaestner A. Lehrbuch der Speziellen Zoologie. Teil I. Wirbellose, Halbband, 1. Protozoa bis Protostomia ohne Arthro-poda. Jena. 1. Aufl., 1954 : 23—75; 2. Aufl., 1965 : 1—95.
Whittington H. B. a. W. D. I. R о 1 f e. 1963. Phylogeny and evolution of Crustacea. Proc. Conf., Cambridge : 1—192.
W о 1 s к a M. 1966a. Division morphogenesis in the genus Didesmis Fior. of the family Buetschliidae (Ciliata, Gymnostomata). Acta Protozool., 4 : 15—18.
W о 1 s к a M. 1966b. Application of the ammonium-silver impregnat.on method to the investigation of ciliates from the rumen of herbivorous mammals. Acta Protozool., 4 : 105—108.
* W urmbach H. 1962. Lehrbuch der Zoologie. Bd. II. Spezielle Zoologie. Stuttgart : I—V, 1—838. (Klasse Chonotricha : 108).
♦ Zacharias O. 1893. Faunistische und biologische Beobachtungen an Gr. Ploner See. Forschungsberichte aus der Biologischen Station zu Pion, Theil I. Berlin : 1-52.
Подтип Ciliophora Doflein, 1901
Класс CILIATA Perty, 1852
Подкласс CHONOTRICHA Calkins, 1933
Отряд CHONOTRICHIDA Wallengren, 1895
Wallengren, 1895 : 47, 48; 1896 : 552, 553 (секция Chonotricha, — таксон типа надсемейства, вероятно в подотряде Spirotricha отряда Trichostomata подкласса Ciliata класса Infusoria по системе Бючли); Enriques, 1908 : 232 (Chonotricha)', Р о с h е, 1913 : 260 (отряд Chonotricha класса Infusoria)', Doflein u. Reichenow, 1927—1929 : 1211 (отряд Chonotricha класса Ciliata)', 1953 : 1153 (класса Euciliata); Kahl, 1930 : 43; 1935 : 799 (отряд Chonotricha класса Euciliata)', 1933 : 45, 140 (подкласса Infusoria)', Calkins, 1933 : 314 (подкласс Chonotricha класса Ciliata)', Гаевская, 1933 : 184 (отряд Chonotricha)', 1949 : 267, 305 (отряд Chonotricha класса Ciliata)', В h a 1 i a, 1936 : 422 (отряд Chonotricha подкласса Euciliata)', Pearse, 1936 : 12 (отряд Chonotrichida подкласса Euciliata)', 1942 : 116 (Chonotrichida); Bock, 1938 : 8 (отряд Chonotricha подкласса Euciliata)', Hyman, 1940 : 230 (отряд Chonotricha)', Kudo, 1946 : 681 (отряд Chonotricha подкласса Euciliata)', Raabe, 1947 : 305, 311; 1948 : 107 (класс Chonotricha типа Ciliata)', Dons, 1948 : 12 (отряд Chonotricha)', Mohr, 1948 : 1 (в заголовке отряд Chonotricha, в тексте Chonotrichida)', 1959а : 651 (отряд Chonotrichida/)', 1959b : 87 (Chonotrichida)', 1966 : 535 (Chonotricha)', Mohr a. oth., 1963a : 227 (отряд Chonotrichida)', Jahn a. Jahn, 1949 : 43 (отряд Chonotricha класса Ciliatea); Faure-Fremiet, 1950a : 119 (отряд Chonotriches подкласса Holotriches); 1961 : 3916 («Cilies Chonotrichida»); Faure-Fremiet a. oth., 1956 : 188 (Chonotriches); Guilcher, 1950 : 475 (Chonotriches); 1951 : 41 (отряд Chonotriches); Догель, 1951 : 10 (отряд Chonotricha подкласса Euciliata)', Д о г e л ь и сотр., 1962а : 554 (подкласс Chonotricha класса Ciliata=Infusoria); Hall, 1953 : 333 (отряд Chonotrichida подкласса Euciliata)', Jirovec a. oth., 1953 : 527 (отряд Chonotricha класса Ciliata)', Р е n n a k, 1953 : 33 (Chonotricha, класс Ciliata)', Sramek-Husek, 1953 : 83 (отряд Chonotricha)', Wetzel, 1954 : 58, 74 (отряд Chonotricha класса Euciliata)', 1965 : 89 (подкласса Holotricha, по Корлиссу); Copeland, 1956 : 102 (Chonotricha (Wall.), subordo nov.); Corliss, 1956 : 85 (Chonotrichida)', 1957 : 117, 124; 1958a : 379; 1958b : 521; 1958d : 17; 1959 : 277; 1960 : 178; 1961 : 42, 135; 1963 : 51; 1964 : 18; 1967 : 16 (отряд Chonotrichida подкласса Holotricha или Holotrichia)', Grell, 1956 : 268 (отряд Chonotricha подкласса Euciliata)', Hennig, 1957 : 13 (отряд Chonotricha подкласса Euciliata)', Стрелков, 1958 : 105 (отряд Chonotricha подкласса Ciliata класса Infusoria); Borradaile, 1959 : 113; 1961 : 110 (отряд Chonotricha подкласса Ciliata); В u c h a r, 1959 : 14 (Chonotricha); Stiller, 1960 : 19 (Chonotricha); Dohrzaiska, 1961 : 107 (Chonotrichida); 1963 : 533 (отряд Chonotricha); Dobrzanska-Kaczanowska, 1963 387 (Chonotricha — «подотряд, а возможно и семейство» в отряде Gymnostomata класса Holotricha); F г i t z, 1961 : 49 (Chonotricha); Mackinnon a. Hawes, 1961 : 255 (отряд Chonotrichida подкласса Holotricha); M anwell, 1961 : 345, 352 (отряд Chonotrichida подкласса Holotricha); Beck a. Braithwaite, 1962 : 36 (отряд Chonotricha подкласса Euciliata); C z a p i k, 1962 : 130 (отряд Chonotrichida); J a e c k e 1, 1962 : 14 (Chonotricha); К о ж о в, 1962 : 28 (Chonotricha); Р г е 11 е, 1962 : 4073 (Chonotrichida); Хейсин и Полянский, 1963 : 345 (подкласс Chonotricha класса Ciliata); Riedl, 1963 : 97 (отряд Chonotricha класса Euciliata типа Infusoria); S a n d о n, 1963 : 134 (отряд Chonotrichida подкласса Holotricha); Големански, 1964 : 160 (отряд Chonotricha); Полянский и Хейсин, 1964 :1756 (подкласс Chonotricha
класса Ciliata); Matsudo a. Mohr, 1964 : 127 (отряд Chonotrichida); 1965 : 523 (Chonotrichida, Ciliata); 1968 : 283 (отряд Chonotricha); Raabe, 1964a: 16; 1964c: 177 (подотряд Chonotricha отряда Gymnostomata класса Holotricha); Erdmann, 1965 : 96 (отряд Chonotricha класса Euciliata); F e n c h e 1, 1965 : 283 (отряд Chonotrichida); L e p i, 1965 : 853 (отряд Chonotrichida подкласса Holotricha); M a t s u d o, 1966 : 359 (отряд Chonotrichida, равноценный отряду Holotrichida); Weisz, 1966 : 107 (отряд Chonotrichida подкласса Holotricha); Янковский, 1967a : 18; 19676 : 40 (отряд Chonotrichida нового надотряда Chonotrichidea подкласса Fragmophora класса Cili-ostomea); D u d i c h, 1967 : 9 (Chonotricha); F aure-Fremiet, 1969 : 8 (Chonotrichida; очевидно, отряд Holotricha); Mohr a. Matsudo, 1970 (подкласс Chonotricha, эквивалентный Holotricha, с новым отрядом Spirochonida).
ДИАГНОЗ
Одиночные, не колониальные инфузории (исключая клематохон). Трофонты неподвижны, несократимы, прикреплены к субстрату ножкой или прочным стебельком разной длины. Относительно некрупные формы, длиной обычно порядка 70—120 мк. Различимы три отдела особи: тело, шейка (часто укорочена) и ПВ, обычно сплющенная дорзо-вентрально. Кутикула утолщена, играет роль панциря, поэтому вет раковинных форм. Хорошо развит и специальный защитный аппарат: шипы (у половины родов), складки, локальные утолщения кутикулы, папиллы, лепестки, щитки, завитки стенки ПВ. Рот лежит на дне ПВ, в атриуме; к нему ведет глубокая коническая полость с примитивным РПА из трех зон гаплокинет — горизонтальной (зона А), диагональной (В) и собственно предротовой в виде серии фрагментов у рта (С); зона А часто расслаивается на две. Зона С соответствует первичному РПА (кинетофрагмону) гипо-стоматид, А и В — всей вентральной соматической.цилиатуре; зоны А и В образуют у хонотрих вторичный РПА. Возможно наличие мембран (в зоне С), но нет поликинет и мембранелл. В глубь тела от рта отходит длинная трубчатая глотка без немадесм. Поверхность тела лишена ресничек, но несет продольные ряды аргиросом — псевдо-кинеты (ряды пелликулярных пор), имитирующие соматическую инфрацилиатуру; вероятно, под ними залегают кинетосомы. Сократительной вакуоли нет. Питание путем фильтрации, бактериями, реже водорослями, грибками и частью пищи хозяина, возможна гистиотрофия. Ядерный аппарат однотипен у всех хонотрих, включает овальный или удлиненный Ма и 1—7, обычно 2—3 мелких округлых Ми. Ма гетеромерного (септимерного) типа, трехслойный, состоит из эпи-, орто- и парамера без эндосомы в интерфазе; деление Ма протекает сложным путем, с возвратом к цикломерному типу, с восстановлением эндосомы.
Жизненный цикл включает две общие фазы: размножение на нелиняющих и на линяющих рачках. В первом случае трофонты питаются, вырастают в трофотомонтов, размножающихся моногеммическим почкованием (наружным или внутренним); во втором они прекращают питание и последовательно почкуются, пока от томонта (правильнее, от шизонта) не останется безъядерный рудимент. Томиты отделяются после длительной лаг-фазы; поэтому в процессе диминутивного почкования (при линьке) часто образуются, особенно у эндогеммин, стробилы из 2—7 протомитов, не претерпевающих видимых морфогенетических изменений. Такое размножение — одна из форм полигеммии: быстрое последовательное почкование с задержкой отделения томитов (стробиляция). Конъюгация редка; спариваются, как и у сукторий, молодые трофонты, расположенные рядом. Один из них отделяется от субстрата, уменьшается в размерах и, по Плате, полностью адсорбируется макроконъюгантом. По Тюффро, остается рудимент, отпадающий после кариогамии. В синконъюганте образуется один зачаток Ма и несколько новых Ми.
Исключая формы с водорослей (Е leather о chona) и парацетохон и фаллайнохон с копеподы В alaenophilus (мигранты с циамид), хонотрихи приурочены к высшим ракообразным — Malacostraca, в основном к Leptostraca, Amphipoda, Isopoda, Decapoda и Mysidacea. Большинство видов известно с литоральных хозяев. За исключением форм с циамид и копепод, хонотрихи обитают на свободноживущих рачках. Заселены почти исключительно подвижные придатки хозяев — жабры, плео-, перео-, гнато- и торакоподы, антенны, ротовые части; на придатках заняты узкие, строго очерченные локусы. Характерна жесткая специфичность к хозяину, нередко и расовая (локальная) специфичность; поликсенные виды единичны, хозяева их обычно близки морфологически и экологически.
Хонотрихи — преимущественно морская группа: из 38 родов только на морских рачках обитают виды 35 родов, на пресноводных — 2 родов. Виды одного рода, Spirochona, найдены и в море, и в пресной воде (Европа, Байкал, Прибайкалье; иммигранты из Байкала найдены в Ангаре, возможны в Енисее). В морях хонотрихи широко распространены, образуют богатые локальные фауны. Эндемичны, как правило, виды
хонотрих, реже роды; большинство семейств (кроме филло- и спирохонид) космо-политно.
Отряд богат видами, имеет сложную внутреннюю структуру. Изученный нами материал позволил расширить список родов с 9 до 38 и список видов с 24 до 104; роды группируются в 11 семейств. Отряд подразделен нами на два подотряда — Exogemmina и Endogemmina, различаемые по морфологии, способу почкования и эволюционным тенденциям; важное отличие — наличие или отсутствие зародышевой сумки. Виды подотрядов приурочены к разным группам хозяев; только бокоплавы рода Amphithoe несут и экзогеммин (в Европе), и эндогеммин (в Пацифике). Соотношение числа известных видов, родов и семейств экзо- и эндогеммин составляет 57 : 48, 14 : : 24 и 6 : 5. Провизорные таксоны: семейства мизидохонид и клематохонид (Мор); роды цетохона, парацетохона, фаллайнохона (Лент); циамихона, талассохона, инер-михона (Янковский, 1971).
Типовой род отряда — Spirochona Stein, 1852.
ПРОИСХОЖДЕНИЕ ХОНОТРИХ
ОБЗОР ЛИТЕРАТУРЫ
Ранние гипотезы. По Штейну (Stein, 1852, 1854), томиты спирохон и Dendrocometes сходны; часть первых развивается в спирохон, часть — в сукторий; иногда часть почек сукторий развивается в спирохон. Штейн считал сукторий «аци-нетной стадией» цилиат. Томиты D. paradoxus зарисованы им неправильно — они ничем не напоминают томитов спирохон. Трофонты спирохон — это «своего рода Epistylis, застывший, ставший неподвижными прочным» (Stein, 1852 : 491). По Штейну, спирохоны занимают промежуточное положение между вортицеллинами и офридинами. По Коллену (Collin, 1912), предполагаемое родство спирохон и перитрих возможно, но есть ряд общих признаков также у спирохон и сукторий — полигеммия, наклон оси почкования к оси тела, изогамная конъюгация без подвижного микроконъюганта. Коллен считал перитрих предками сукторий, чем и объяснял «сходство» этих групп. Хонотрих и позднее считали видоизмененными перитрихами (Бючли, Плате, Дофлейн, Эйсмонд, Хартог, Ланг, Хендерсон, Андре, Калкинс, Минчин, Кайзер, Кальмус, Лепши и др.); иногда отмечались черты сходства их с другими инфузориями, но этому не придавали значения. Отдельные авторы высказали сомнения в правильности отнесения спирохон к перитрихам. Клапаред и Лахманн считали, что включение спирохон в состав Vorticellina «не вполне невозможно», но указывали, что у хонотрих буккальная спираль левозакручена (по Штейну наоборот!) и, кроме того, у спирохон не найдена еще «ундулирующая мембрана». Род приведен ими под рубрикой «Дополнение к семейству Vorticellina'». Штейн (Stein, 1859, 1867) подтверждает, что спираль спирохон правозакручена и что это не вортицеллины. Даже при сходном направлении спирали группы различаются по остальным признакам, имеют разный план строения. Признав неродственность групп, Штейн все же включает спирохон в сборный отряд Peritricha. По Кенту (Kent, 1881 : 660), ПВ у спирохон и стилохон — это результат «крайнего развития мембраноидного воронковидного выроста края перистома у Орег-cularia и Lagenophrys»-, «некоторые из фаз развития спирохон удивительно напоминают . . . Chlamydodon и зародышей Hemiophrya (=Ephelota) gemmipara, Dendrocometes paradoxus и других Acinetidae». Филогенетического значения этому сходству не придавалось.
Энтц (Entz, 1884) считает перитрих гетерогенными; только вортицеллины, офри-дины и урцеоляриины (прежние Vorticellina sensu lato), цо его мнению, образуют в отряде естественную группу, остальные же семейства (включая спирохонин) чужеродны. Схема Энтца отражает скорее неродственность групп, а не их общее происхождение от «.Охуtrichina». Различаются фактически четыре естественные группы — современные гипотрихи, перитрихи, олиготрихи и хонотрихи. Новые отряды для двух последних групп предложили позднее Дофлейн и Валленгрен. Фроментель (Fromentel, 1884), не изучавший спирохон, с сомнением относит их к Vorticellina. По Фолю (Fol, 1881), томиты спирохон напоминают Chlamydodon, но только полное изучение цикла развития спирохон выяснит их действительные связи. Кану (Canu, 1886), как и Энтц, считает отряд Peritricha Штейна искусственным; спирохона, по его мнению, неродственна вортицеллинам, сходство их только «физиологическое» (конвергентное), а не филогенетическое, вызвано апикальным положением рта, как у многих сидячих форм. Андре (Andre, 1912) отмечает, что томиты спирохон лишены ресничного обруча, видимого у бродяжек перитрих.
Эйсмонд (Eismond, 1890а, 1890Ь, 1895) подробно сравнивает перистом спирохон и ряда перитрих, находя сходные элементы, развитые в разной степени; Spirochona считается им одной из высших перитрих, по типу РПА близкой к Lagenophrys. Многие авторы акцентируют внимание лишь на одном признаке — направлении ротовой спи
рали у сппрохоп и перитрих, игнорируя остальные; даже при введении сппрохон в состав перитрих всегда отмечается, что спирали их закручены в разные стороны. В пределах отряда спирохон выделяют обычно в особое семейство, изредка даже в особый подотряд — Sceotricha {Scaiotricha). Валленгрен (Wallengren, 1895, 1896) впервые рассматривает хонотрих (не обсуждая их филогении) как таксон, эквивалентный перитрихам. Пенар (Penard, 1922) находит у спирохон «адоральную спираль», не гомологичную таковой у перитрих: в отличие от перитрих, это не мембраны, а полоса параллельных кинет без ресничного инфундибулюма. Группы отличаются и по особенностям размножения, конъюгации; томиты спирохон напоминают бродяжек сукторий {Dendrocometes), а не перитрих. Прикрепительный диск спирохон с радиальными палочками похож на присоску триходин. Ма особого типа — слоистый, с эндосомой; имеется дейтерохон; тело несократимое. Только- у спирохон среди перитрих нет кольцевых складок пелликулы, но это «не настоящее исключение», так как родство групп сомнительное. Для Spirochona Пенар предлагает отряд Scaiotricha без обычно включаемых в него ликнофор и триходин. Филогения спирохон им не обсуждается. Каль (Kahl, 1935 : 799—800) писал: «Эту маленькую группу инфузорий до последнего времени включали в отряд Peritricha. В действительности эта группа не имеет ни малейшего отношения к Peritricha и сходство ограничивается лишь внешностью».
Вопрос о родстве хонотрих оставался нерешенным во многом потому, что изучали аберрантный, нетипичный для отряда в целом род Spirochona, а не простые, неизвестные ранее формы типа лобохон, энофорахон и изохон. Поэтому внимание акцентировали на завитке, не гомологичном перистому перитрих, а не на РПА и фазах онтогенеза.
Гипостоматиды, в частности Dysteria (с которой ныне сближают хонотрих), были достаточно хорошо изучены еще в прошлом веке (Гексли, Штейн, Энтц, Валленгрен, Левандер и др.); до Гийше авторы не обращали внимания на возможное филогенетическое значение структуры Ма хонотрих, хотя нередко отмечали, что такие ядра имеют и другие простейшие. По Штейну (Stein, 1854), у спирохон окрашивается Ма такого же строения, как у Chilodonella cucullulus, — с центральной «нуклеолой». Гертвиг (Hertwig, 1877b) находит гетеромерное, иногда цикломерное ядро типа спирохон у нокти-люциды Leptodiscus medusoides; Исикава (Ishikawa, 1899) сравнивает позднее ядра Spirochona и Noctiluca', Эйсмонд (Eismond, 1895) находит поперечную септу в ядрах Dendrocometes. Плате (Plate, 1888) пишет, что такого ядра, как у спирохон, нет пи у одной другой инфузории, но в той же работе отмечает, что «Aegyria oliva» {Dysteria sp.) имеет ядро из двух половинок, хроматиновой и ахроматиновой, как у Spirochona, Leptodiscus и ризопод. По Бючли (Butschli, 1889), внутренняя сфера (парамер с эндосомой) ядра Chilodonella cucullulus соответствует «ядерной вакуоли и ядрышку» спирохон. Каль указывает, что Ма такого типа, как у Dysteriidae, обнаружен также у «далеко от них стоящих в системе Spirochonidae»', последние, однако, «отделились, как и Peritricha, от одной из групп ресничноротых инфузорий» (Kahl, 1935 : 25, 800).
Гипотеза Гийше и Форе-Фремье. По Гийше (Guilcher, 1950 : 36; 1951 : 4), «исследования Шаттона и Львова по Apostomata и Conidophryidae позволяют установить, что ресничная бродяжка или томит — это наиболее постоянная форма из стадий, следующих в цикле развития инфузорий, и что признаки томита отражают первичную или предковую организацию». Оба примера неправильны: томит у этих форм вторично изменен, анцестральные признаки выражены в строении трофонта (Янковский, 1966а, 19666); Шаттон и Львов, собственно, так и не выяснили филогению обеих групп. Биогенетический закон не догма, но для хонотрих он действительно справедлив. Трофонт хонотрих, по Гийше, глубоко видоизменен; бродяжка должна быть похожей на свободноживущего предка, ее метаморфоз помогает объяснить строение трофонтов, предковые признаки в которых увидеть труднее. Томит хонотрих напоминает и Chlamydodontidae (две вентральные полосы кинет) и Dysteriidae (прикрепительный аппарат); по типу Ма хонотрихи стоят ближе к дистериидам, поскольку хламидодонтиды ёще сохраняют эндосому, делящуюся при кариокинезе. У хонотрих сохранены три буккальных сегмента, как у гипостомат; немадесмальной корзинки у них нет. Стебелек, несмотря на вторичнотерминальное положение, имеет вентральное происхождение, как и фиксаторный стилет дистерий. Не прикрепительная нить, а сам стилет, выделяющий ее, — гомолог стебелька хонотрих. Вывод Гийше нелогичен: «Строение мигранта хонотрихи не имеет ничего общего со строением бродяжки перитрихи и полностью сходно с таковым Chilodonella» (Guilcher, 1949 : 215).
В серии работ Форе-Фремье выводит хонотрих от «тигмотактических Gymnostoma-tida Cyrtophorina», т. е. от гипостоматид. «Тонкая и гибкая нить, которая обеспечивает фиксацию Hartmannula acrobates или Trochilioides filans, — это гомолог одной из фибрилл стебелька Chilodochona', первые имеют у основания ножки простую железку, вторые — у основания стебелька сложную» (Faure-Fremiet a. oth., 1956 : 193). «Сложная структура Dysteriidae проявляется в образовании весьма разнообразных родовых и видовых форм. Она привела к возникновению удивительно устроенных инфузорий —
И Заказ № 213
Chonotrichida, перистом которых соответствует вентральной стороне Chlamydodonti-dae, в то время как фиксаторный стебелек можно прямо сравнить с нитью, секретируемой подитом Dysteriidae» (Faure-Fremiet, 1961а : 3916). Как видно, стебелек хонотрих гомологизируется авторами то со стилетом, то с выделяемой им питью дистериид, которая в свою очередь гомологизируется лишь с одной из фибрилл стебелька. Конкретно предок хонотрих среди гипостоматид не назван.
Сомнения в гипотезе Гийше высказал Mop (Mohr, 1959а), однако другой гипотезы он не предложил. В последнее время Мор соглашается с мнением Гийше. По Холлу (Hall, 1953), пока ясно лишь, что хонотрихи более тесно связаны с Holotrichida, чем с другими группами. Мацудо (Matsudo, 1967а) считает, что связи Lobochona с голоротыми инфузориями, которых считают близкородственными, остаются неясными. Гипотезу Гийше активно поддерживают Корлисс (Corliss, 1958а, 1959, 1960, 1961, 1967) и вслед за ним ряд авторов (Mackinnon a. Hawes, 1961; Manwell, 1961; Borradaile, 1961; Lep^i, 1965; Wetzel, 1965), опять-таки не указывая конкретных предшественников среди циртофорин. Корлисс ссылается на данные Гийше, Тюффро и Форе-Фремье, показавших сходство внешнего облика томитов, цилиатуры, органелл прикрепления и ядер у гипостоматид и хонотрих. Им допущена неточность (Corliss, 1959): у хонотрих и циртофорин стебелек, по его словам, возникает из специальной органеллы фиксации — стилета. Однако в действительности нет ни стилета у томитов и трофонтов хонотрих, ни стебелька у циртофорин. Корлисс подчеркивает, что стебелек у хонотрих секретируется так, как у дистериид, а не у перитрих и сукторий, где он выделяется группой кинетосом в зоне скопулы. Стилет (подит) — это секреторная органелла, не гомологичная скопуле других групп. Холл же говорит, однако, о скопулбобразной органелле фиксации хонотрих.
Гипотезы последних лет. Добжанская-Качановская активно поддерживает тезис Гийше о родстве хонотрих с гипостоматами. В строении Allosphaerium (с талитрид) ею обнаружены признаки, общие с циртофоринами и с хонотрихами. Как и у других гипостомат, тело Allosphaerium сплющено, кинеты собраны в две вентральные полосы, РПА включает фрагменты кинет с мембранами, стоматогенез простой. Общее с хонотрихами: связь с амфиподами, сходная (с томитами) форма тела, наличие ножки, вентральной цилиатуры («ресничного диска») с двумя полосами кинет, четырех фрагментов у рта (как на рисунке спирохон у Гийше), сходный тип Ма, отсутствие глоточной корзинки. Ножка хонотрих — гомолог секреции мукопротеидов Allosphaerium, красящейся по Маллори; как и у аллосфериума, новая ножка возникает у хонотрих в связи с зачатком РПА. Весь ротовой комплекс спирохонид считается сдвинутым влево; это неверно, поскольку особи ориентированы неправильно. В итоге A llosphaerium сочетает признаки, общие для циртофорин и хонотрих; это промежуточное звено между Chlamydodonttdae и Dysteriidae (поэтому они объединяются в одно семейство) и между последними и хонотрихами (поэтому хонотрихи вводятся в состав Gymnostomata). По сути дела, Добжанской-Качановской из состава гипостоматид взят род довольно обычного типа и противопоставлен таксону Cyrtophorina в целом. Так и составлена определительная таблица в одной из ее работ: формы с глоточной корзинкой составляют группу Dysteriidae-\-Chlamydodontidae; формы без корзинки, с мембранами — Allosphaerium-, формы с соматической цилиатурой, служащей для питания, — Chonotrichida. «Все наблюдения показывают общее происхождение Cyrtophorina, Chonotrichida и A llosphaerium. Мозаика морфологических признаков Cyrtophorina и Chonotrichida у Allosphaerium позволяет говорить о третьей филогенетической линии эволюции» (Dobrzanska, 1963 : 536). Начиная от предковых циртофорин специализация идет в разных направлениях — к нассулидам, циртофоринам и т. д.; аллосфе-риум — предок хонотрих, поскольку он напоминает их томитов; по отношению к ги-постоматам хонотрихи — это сидячие формы с гипертрофией дорзальной поверхности. Предлагается морфологическая линия Rhabdophorina (типа Platyophrya)—Nassuli-dae— Chlamy dodontidae—D ysteriidae—Chonotrichida.
По Раабе (Raabe, 1964c : 178), у хонотрих «сидячая, взрослая трофическая форма очень четко отличается от других отрядов Ciliata и не позволяет найти для них каких-либо филогенетических и систематических связей; родственные связи Chonotricha с ними, однако, обнаруживают свободноплавающие стадии развития — томиты, изученные в последнее время. Почка эта, или томит, несколько сплющена и на одной из сторон тела имеет систему немногочисленных, но сильных кинет, внешне вполне напоминающих цилиатуру многих представителей голоротых инфузорий из подотряда Hypostomata, как Chilodonella, а особенно Allosphaerium». Оба автора не сравнивают хонотрих с другими родами гипостоматид, прежде всего с Dysteria', для сравнения произвольно выбран один из многих родов, резко отличающийся от томитов: нет вентрального желобка, кинеты не олигомеризованы, отсутствует глоточный канал, кутикула не панциревидная. Прелль (Prelle, 1962), не изучавшая хонотрих и гипостомат, говорит о «многочисленных общих признаках у A llosphaerium, Chonotrichida и Cyrtophorina». Схема Прелль безусловно неверна: хонотрих нельзя выводить от хламидодон-тид, лишенных желобка и органелл прикрепления. В схеме Деру (Deroux, 1968) на древе
гипостоматид хонотрихи ответвляются от наиболее примитивной дистерииды (Hartmannula) — от самого основания древа. У Hartmannula, однако, нет желобка, слишком многочисленны кинеты, растянут рот.
ГИПОТЕЗА АВТОРА
Род Dysteria как предшественник хонотрих. Мы высказывались ранее в поддержку мнения Гийше о родстве дистериид и хонотрих (Янковский, 19676, 1967в); аргументация приведена ниже. Прежде всего дадим очень краткий очерк отряда Hypostomatida. Отряд хорошо изучен (основные работы: Kahl, 1932, 1935; Faure-Fremiet, 1950b, 1961, 1965; Deroux, 1968; Deroux et Dragesco, 1968). Общие признаки отряда: редукция цилиатуры (сохранена только на вентральной стороне), погружение ее у высших форм (Phascolodon, Dysteria} в продольный желобок, сплющенность тела, несократимость, простой РПА — фрагменты кинет, палочковый аппарат глотки, гетеромерный Ма. Различимы три группы соматических кинет: полосы А', А" и В. У примитивных форм типа Trithigmostoma кинеты трех полос равномерно покрывают вентральную сторону, у группы Chilodonella исчезла зона А"; у дистериид зона А' резко удлинена, зоны А" и особенно В резко укорочены. Обычное число кинет гипостомат около 15—25; полимеризация наблюдается у Hartmannula, Chlamydodon, Hartmannulopsis, олигомеризация — у Chilodonella, Trochilioides, Trochilia и особенно Dysteria. Тенденция к укорочению кинет особо характерна для дистериид. РПА гипостомат включает 3—5 фрагментов гаплокинет с мембранами; иногда они растянуты поперек тела (Gastronauta, Lynchella). Стоматогенез простой, соматического типа (фрагментация или регенерация кинет). Вторичный РПА — это части кинет зон В и С, лежащие в эффективном секторе; эти участки не исчезают даже при полной редукции ниже лежащих отделов кинет (Trochilia, Dysteria). Прибавляясь к кинетам зоны С, они создают характерную для инфузорий в целом метамерную зону кинет выше и левее рта. Аллометрический изгиб кинет зоны А' (у всех гипостомат) служит для усиления простого первичного РПА. Фрагменты лежат на поверхности тела; предротовая полость появляется у Phascolodon и Dysteria'. все кинеты погружены в желобок, расширенный сверху. Это подобие ПВ хонотрих. Рот гипостомат лежит в передней части тела, часто щелевиден, ведет в длинную глотку, утерянную у A llosphaerium. Стенки глотки составлены немадесмами, между ними и ртом залегают зубцы, пластинки или «ма-ксиллы», особо сложные у дистерий. Кутикула части родов превращена в панцирь, у остальных тело гибкое. Аргиром — сеть неправильных фигур или прямоугольников — покрывает все тело, включая безресничные зоны; иногда видны и продольные ребровидные дорзальные складки пелликулы (Dysteria sulcata, Trochilioides? rigida, Chlamydodon, Trochilia spp.).
В разных линиях прослеживается развитие безресничной зоны, служащей для фиксации (скопулы). У примитивных тритигмостом укорочены три послеротовых ряда и образуется зачаточная скопула; у хилодонелл эти ряды исчезают, вся метастомаль-ная зона служит для фиксации. Скопула несет прикрепительные органеллы разного типа — плотный диск у Allosphaerium, ампулу без стилета у форм с япономорских та-литрид (рис. 54, Д), бесструктурные палочки у Lynchella, стилет и эндоплазменную ампулу У дистериид. С помощью аморфной секреции или нити особи прикрепляются к субстрату. Размножение только изотомией. Конъюгация обычна у хилодонелл и тритигмостом, у которых носит анизогамный характер, у других родов неизвестна. Цисты отмечаются редко (у хилодонелл, Gastronauta). Питаются бактериями и водорослями, обычно цианофитами, диатомеями. Сократительных вакуолей обычно две. Образ жизни придонный (исключая планктонных Phascolodon)-, не менее половины родов включают комменсальные или (реже) паразитические виды, а многие роды вообще не имеют свободноживущих представителей.
К отряду Hypostomatida мы относим следующие-роды (рис. 54, 55). Сем. Chlamy-dodontidae: Chilodonella, Trithigmostoma, Phascolodon, Chlamydodon, Atopochilodon, Lynchella, Gastronauta, Odontochlamys, Phyllotrichium, Chlamydonella', сем. Dysteriidae'. Hartmannula, Trichopodiella, Trochilioides, Trochilia, Allosphaerium, Plesiotrichopus, Pithites, Hartmannulopsis, Dysterioides, Mirodysteria, Scaphidiodon (синоним Trochilioides?), Para-chilodonella, Dysteria. Сомнительные и чужеродные роды: Opisthodon — амфилептида; Chilodina — nomen nudum (кинетом не описан); О nycho dactylus, Aegyria, возможной Sigmocineta — синонимы Hartmannula', Ervilia, Iduna, Dysteropsis, частично Aegyria — синонимы Dysteria', Paratrochilia — возможно, синоним Hartmannula', Chilodonatella. — по кинетому напоминает томитов сукторий; Cryptopharynx — возможно, трихостома-тида; Lophophorina, вероятно идентичная с Silenella, — не гипостоматида, скорее всего ринходида или томит сукторий или апостоматид.
Совершенно исключено родство хонотрих и Chlamydodontidae. Томиты хонотрих сплющены латерально, а не дорзо-вентрально; у них нет метастомальной зоны, рот и вся цилиатура погружены в желобок; Ма септимерный, а не цикломерный; кинеты олигомеризованы, зоны А'' и В укорочены. Предка хонотрих нужно искать среди Dyste-11*
Рис. 54. Представители отряда Hypostomatida. А, Б — Trochilioides fi-lans; В — Chilodonella uncinata', Г, Д — Allosphaerium spp.; E, Ж — Trochilioides dispar', 3—К — Phascolodon vorticella' Л — Plesiotrichopus na-tans\ M — Allosphaerium paraconvexa', H — Chlamydodon mnemosyne.
riidae. Примитивные дистерииды (Hartmannula) напоминают Chlamydodon'. кинеты полимеризованы, тело сплющено дорзо-вентрально, нет сходства с томитами. Trichopo-diella — видоизмененная Hartmannula без желобка, с полимеризацией спиральных кипет, с нетипичным фиксаторным аппаратом. Pithites — аберрантная форма с фронтальной тигмотактической полосой, как у Нartmannula, но с редукцией числа кинет. Parachilodonella лишена желобка и имеет необычную для дистериид метастомальную зону. Scaphidiodon — форма с дорзальным килем; кинетом как у Trochilioides. У Р1е-
Рис. 55. Строение дистериид. А— Д — общий вид Dysteria armata; Е — немадёсмы Chlamydodon; Ж, 3 — ротовой отдел Trochilia и Dysteria; И — цилиатура D. monostyla.
siotrichopus тело плоское, вытянутое, немногочисленные кинеты занимают почти всю вентральную поверхность. Allosphaerium, Trochilioides и Trochilia лишены вентрального желобка, имеющегося у Hartmannulopsis, Dysteria и у томитов. Hartmannulopsis отличается от томитов по строению кинетома.
Род Dysteria, хорошо изученный рядом авторов (Гексли, Энтц, Плате, Морган, Форе-Фремье, Дражеско, Деру), заслуживает особого внимания. Формой тела дисте-рии напоминают Сургаеа, тело их сплющено латерально, кутикула превращена в прочный панцирь, продольно исчерчена (рис. 55, А—Д). Ресничный желобок слабо расширяется снизу и сильнее сверху; он возник при аллометрическом разрастании дорзальной поверхности тела. Имеются и локальные утолщения кортекса внутри желобка — складки, зубцы. Немадесмальный аппарат своеобразен: сохранены два плоских стилета глотки, апикальные зубцы превращены в сфинктер — «максиллы». Первичный РПА включает 3 фрагмента кинет. Соматическая цилиатура плохо развита: полоса А' включает обычно 2—3 ряда, А" — 2—4 коротких верхних и группу экваториальных фрагментов, В — 2—3 мелких фрагмента левее рта, входящих во вторичный РПА
Дорзальная кинета лежит в желобке, а не на поверхности тела, как обычно (рис. 55, Ж, 3). ПВ дистерий сплющена латерально, не отделена шейкой от тела. Прикрепительный аппарат включает секреторную «железу», коллекторную ампулу -с каналом в подите и подит — шиповидный вырост тела. Вследствие разрастания .краев панциря подит оказался погруженным в желобок.
Томиты хонотрих с большой точностью воспроизводят внешний облик и строение дистерий. У них сходная форма тела, имеется прочный панцирь, цилиатура лежит в желобке с расширенной апикальной частью — зачатком ПВ. Число кинет томита меньше, чем у трофонта, особенно в зоне В. Вероятно, у томитов будут найдены зона С и тигмотактический дорзальный ряд, лежащий в ПВ дистерий. Примерно совпадает число кинет у дистерий и томитов примитивных хонотрих (в зоне А). Ма томитов инвертирован по отношению к Ма томонтов; зоны расположены так, как у дистерий. Именно у дистериид в интерфазном Ма нет эндосомы, как и у хонотрих. У Hartmannu-lopsis кинеты полимеризованы, имеют сложную и необычную топографию; желобок очень крупный; рот и глотка непропорционально велики, имеются типичные немадесмы; следовательно, предшественником хонотрих эта форма быть не может. Томиты и дисте-рии различаются в основном по ротовому и прикрепительному аппарату. Томиты имеют тонкую трубчатую глотку без немадесм; у них нет стилетов, «максилл», апикальных зубцов. У видов Dysteria «максиллы» развиты в разной степени: едва выражены у D. ovalis, лучше — у D. monostyla и особо хорошо — у D. armata. Вид рода без «максилл» — D. meridionalis описан Дражеско (Dragesco, 1966b); глотка у него трубчатая, без немадесм. У D. balani мы обнаружили простые пластинки вместо сложных «максилл». Хонотрихи могли произойти от примитивных или вторично упрощенных видов дистерий, но не от высших форм типа D. armata.. Прикрепительный аппарат томитов не напоминает таковой дистерий: у последних нет спиральной розетки, нет группы ампул, имеется подит; ампула одна, мелкая.
Имеется сходство гипостоматид и трофонтов хонотрих. Трофонты сохраняют септимерный Ма без эндосомы, как у дистерий. Кутикула прочная, продольно исчерчена, но несет новообразование — псевдокинеты. Цилиатура на стенках ПВ соответствует вентральной цилиатуре и РПА дистерий, но в зоне В кинеты полимеризованы. Зачаточная ПВ есть и у дистерий. Прикрепительный аппарат трофонтов более напоминает таковой дистерий, чем томитов: большинство родов имеет лишь одну ампулу с протоком в эндостиле — гомологе подита; ампула секретирует диск или стебелек. После оседания томита хонотрих ампулы быстро уменьшаются в размерах и либо исчезают полностью (у спирохонид), либо заменяются одной крупной ампулой; только у хилодохонид все они остаются функциональными (педоморфоз). В итоге у трофонтов хонотрих прикрепительный комплекс сохранен без особых изменений, у томитов вторично видоизменен. Поскольку томиты хонотрих однотипны и воспроизводят строение Dysteria, столь же консервативной должна быть и следующая фаза развития трофонта — стадия фиалохоны: латеральная часть желобка подтягивается вверх и развертывается на стенке ПВ, не обособленной еще шейкой от тела. Вероятно, дистерии превратились именно в такую форму, от которой уже взяли начало наиболее примитивные роды хонотрих.
Экологический аспект филогении хонотрих. Гипосто-матиды — малоподвижные тигмотактические инфузории; цилиатура у них приспособлена лишь для медленного перемещения по субстрату, тело сплющено. Формы с полимеризацией кинет редки и нетипичны. Тенденция к редукции и без того слабого ресничного покрова (укорочение, олигомеризация кинет), уменьшение вентральной стороны тела при разрастании дорзальной, погружение вентральной цилиатуры в желобок — все это говорит о том, что гипостоматиды находятся в состоянии перехода к неподвижному образу жизни. Отсюда и многообразие органелл прикрепления. У сессильных форм цилиатура обычно смещается вверх и развертывается вокруг рта (Vorticella, Stentor, Hemispeira)', эта тенденция намечается у дистерий (возникает апикальная ПВ) и достигает особого развития у хонотрих. Хонотрихи в конечном итоге возникли вследствие свойственной гипостоматидам тенденции к прикреплению и к терминализа-ции РПА. Гипостоматиды, особенно Dysteria, обычны в обрастаниях субстратов, часты на водорослях и водных животных; около трети родов известны только с покровов Crustacea и не менее половины остальных родов представлены на них же частью видов; другие хозяева — губки, рыбы, амфибии, змеи. На Crustacea обитают все виды родов Chilodonatella, Allosphaerium, Sigmocineta, Parachilodonella, Dysterioides, Plesiotricho-pus, Dysteropsis, Lophophorina, Silenella, часть видов Trochilia, Gastronauta, Trithigmo-stoma, Chilodonella, Trochilioides, Dysteria. По справедливому замечанию Фенхеля (Fenchel, 1965 : 285), «тот факт, что дистерииды играют важную роль как комменсалы Gammarus, делает взгляды Гийше на происхождение хонотрих приемлемыми и с экологической точки зрения».
Происхождение иэволюция гипостоматид. Прелль выводит гипостоматид от неуточненных предков (низших циртофорин?); другие авторы (Шевяков, Шаттон, Форе-Фремье, Добжанская-Качановская) — от нассулид. По Форе-
Фремье (Faure-Fremiet, 1957, 1961), Paranassula дает начало Nassula и семействам хла-мидодонтид и дистериид с гетеромерным Ма. Отряд Ambihymenida (нассулиды и микро-торацпды) отнесен нами к высшим, тетрахименовым Holotricha. Если следовать Форе-Фремье и выводить от пих гипостоматид, то это регрессивная линия. Однако гипостоматиды произошли скорее от Prostomata', они родственны нассулидам, но не являются их потомками или предками: на каком-то этапе эволюции группы, выводимые от общего предка, отделились. Линия нассулид прогрессивная, с усложнением строения, гипостоматид — регрессивная, со специализацией. Цикломерный Ма примитивных гипостоматид (с постоянной эндосомой у хилодонелл) скорее произошел от криптомерного Ма Prorodon, чем от «гомеомерного» Ма нассулид. РПА примитивен у гипостоматид (гаплокинеты) и очень сложен у нассулид; это типичный тетрахимениум у низших нассулид, поли- и синхимениум у высших. Стоматогенез примитивен у гипостоматид (фрагментация кинет) и сложен, автономного типа у нассулид, у которых образуется кине-тосомный зачаток, как у гименостоматид и спиротрих; у микроторацид исчезают после-ротовые кинеты, РПА самовоспроизводится. По мере эволюции инфузорий способы стоматогенеза только усложняются, свидетельств упрощения нет; РПА все более отделяется от соматической цилиатуры. Гипостоматиды, таким образом, не могли произойти от нассулид. У хилодонеллид и Prorodon сходны аргиром и палочковый аппарат глотки, имеется эндосома в Ма; тело асимметрично, изогнуто влево. Три фрагмента гаплокинет — первичный РПА гипостомат — мы считаем гомологами нескольких, обычно также трех, тигмотактических фрагментов простомат. У предка гипостоматид произошло смещение рта правее группы фрагментов (рис. 29, А), превратившихся в РПА. Такая гипотетическая форма дала начало сплющенным формам с редукцией дорзальных кинет и с примитивным РПА (хилодонеллиды и их потомки) и плавающим формам с развитой цилиатурой и усложняющимся РПА (нассулиды). К хонотрихам от низших инфузорий ведет, таким образом, ортогенетическая линия Н olophryldae—Prorodontidae—Chlamydodontidae—Dysteriidae—Lobochonidae (Oenophorachona).
От гипостоматид авторы выводили разные группы инфузорий, а иногда считали их тупиковой ветвью (Шевяков, Лепши). Мы считаем достоверными только две линии— к Apostomatida (от форм типа Chilodonella uncinata; см.: Янковский, 1966а) и к Chonotrichida (от Dysteria). Обе группы связаны почти исключительно с Crustacea, но эволюция их с самого начала пошла полностью противоположными путями. В отличие от хонотрих апостоматиды — плавающие формы с усложнением соматической и упрощением ротовой цилиатуры, без панциря и защитного аппарата, питающиеся в экзувиях.
ЭВОЛЮЦИЯ ХОНОТРИХ
ОБЗОР! ЛИТЕРАТУРЫ
Сварчевский (19286) выводил Spirochona anthus от S. elegans, а последних от S. gemmipara; эта линия безусловно правильна.
Гипотетический предок хонотрих, по Мору (Mohr, 1948), — это бесстебельчатая форма с ротовой щелью. При развитии стебелька от нее произошла Chilodochona, а при превращении губ в воронку — наиболее примитивная стилохонида, давшая начало Trichochona (со стебельком и сумкой) и Heliochona (с шипами ПВ). Stylochona coronata с двумя воронками — это потомок гелиохон, Kentrochona же произошла от ветви Heliochona—S. coronata при развитии стебелька и видоизменении шипов. Spirocho-nidae выводятся от «ранних стилохонид» без стебелька и шипов ПВ, что подтверждает, по Мору, и онтогенез спирохон. Поскольку у томитов хонотрих реснички находятся в желобке, ограниченном двумя губами (как у взрослых хилодохон), Мор говорит о «хилодохонидной личинке» хонотрих. В жизненном цикле хонотрих далее следует стадия с воронкой, образованной в результате расширения губ.
Позднее схема Мора видоизменяется. По Мору (Mohr, 1959а), в своем онтогенезе Spirochona и Chilodochona проходят стадию с простой стилохонидной воронкой; далее образуется завиток у спирохон и сложные губы у хилодохон. Хилодохониды поэтому не примитивны; напротив, это потомки стилохонид со сравнительно неизмененными воронками. «Стилохониды, вероятно, анцестральная группа, т. е. семейство, скорее всего включающее форму, от которой можно было бы вывести всех известных хонотрих. Молодые особи стило-, спиро- и хилодохонид во всяком случае должны хорошо удовлетворять стилохонидному плану строения. Предыдущее замечание о том, что хилодохониды, возможно, примитивны, было сделано до осмотра их живыми» (Mohr, 1966 : 536). Поскольку Форе-Фремье показал гомологию прикрепительной нити дистериид и стебелька хонотрих, Мор признает примитивными стебельчатые формы, а не спиро- и гелиохонид с диском. Стебельчатые хонотрихи встречаются на большинстве хозяев, что также говорит, по Мору, о примитивности признака. Хилодохониды
противопоставляются теперь всем остальным хопотрпхам; они отделились от основного ствола отряда на самых ранних стадиях эволюцпп. Lobochona — ие примитивных! род, поскольку имеет широкую ножку, а не стебелек. ПВ спирохонид произошла от простой ПВ без складок и лепестков. Наиболее примитивна поэтому форма тела, какую имеют томпты после прикрепления, — такую же, как у широкой сплющенной Kentrochona с субтерминальным ртом и стебельком. Цилиндрическая форма тела, с округлым сечением — вторичный признак (у трихо- и цетохон). Кентрохоны, по Мору, примитивны и потому, что стенка ПВ у них лишена выростов, свойственных остальным родам. Ромпель также отмечал сходство ПВ у трофонтов кентрохон и у молодых спирохон. В итоге хилодо- и спирохониды выводятся Мором независимо от стилохонид.
ДАННЫЕ АВТОРА
Наиболее примитивный род хонотрих. Поразительно сходство томитов разных групп хонотрих при многообразии внешнего облика, защитного аппарата и способов размножения трофонтов. В этом проявляется биогенетический закон: сохранена единая для отряда личиночная стадия. Эволюция хонотрих идет скорее всего как «надставка» новых стадий онтогенеза с сохранением старых. Томит имеет вид дистерий; далее следует стадия фиалохоны: особь выпрямляется, часть желобка втягивается в расширяющуюся ПВ, преформированную у томита. Края ПВ еще ровные, шейка слабо выражена. Стадия фиалохоны закреплена в онтогенезе всех хонотрих. Развитие'идет далее разными путями, но всегда повторяются стадии непосредственного предшественника. Так, Cavichona cincinnata проходит стадии дистерии, фиалохоны, форм типа Spirochona gemmipara и С. elegans. В цикле Spinichona horrida повторяются стадии дистерии, фиалохоны и стилохоны. Наиболее простыми из современных хонотрих следует считать формы, остающиеся на стадии фиалохон; таковы Lobochona, Oenophorachona и Isochona. Тело этих форм цилиндрическое, без завитка ПВ, шипов и длинного стебелька. Isochona — эндогеммина и поэтому не наиболее примитивна, поскольку эволюция форм размножения идет по пути: изотомия—анизотомия— экзогеммин—эндогеммин. Роды лобо- и энофорахон очень близки. Различия их малосущественны: у первых сильнее развиты лепестки ПВ, короче ножка и шейка, часто удлиняется передняя часть тела между Ма и шейкой. Наиболее примитивным мы считаем род Oenophorachona, поскольку многие виды рода имеют такое же ядро, как у Dysteria — с апикальным парамером. У других видов произошла инверсия зон Ма, унаследованная у Lobochona и у остальных экзогеммин. Стадия фиалохоны у эндогеммин соответствует роду Isochona, у экзогеммин с лимнорий — роду Lobochona, у всех остальных экзогеммин — роду Oenophorachona, как примитивным родам названных групп.
Родственные связи экзогеммин. Среди форм с Limnoria наиболее примитивна Ldbochona. У Filichona шейка удлиняется, становится нитевидной. Aurichona напоминает лобохон, но имеет шипы у основания шейки. Филихон и аури-хон можно вывести от общего предка (с гипоколлярными шипами), родственного Lobochona. Резко видоизменена Phyllochona: один из лепестков разросся, образовал защитную пластинку. Этот род мог произойти от видов лобохон с широким телом, поселяющихся на базальной части щетинок плеопод (типа L. prorates').
Из 7 родов, обитающих на Gammaridea, наиболее примитивен род Oenophorachona с плеопод талитрид и A nisogammarus; гнатоподы и максиллы последних заняты формами с нитевидной шейкой (Toxochona'). Heterochona сохраняет типичную для энофо-рахон бутылковидную форму тела, но имеет маргинальные шипы. Виды гетерохон широко расселились по хозяину, заняв и жабры; здесь они дали начало роду Heliochona с очень широким прикрепительным диском. Среди спирохонид наиболее примитивен род Spirochona, морские и пресноводные виды которого однотипны. У Cavichona резко удлиняется ложный стебелек, полимеризуются витки спирали, появляется вырезка гипохона; Serpentichona сохраняет облик кавихон, но витки олигомеризуются, появляются вторичные складки стенки ПВ. Судя по онтогенезу, Spirochona произошла от энофорахон: завиток образуется при разрастании и скручивании стенки ПВ в зоне левого лепестка лобохонид.
Среди форм с Decapoda род Chilodochona считали и наиболее примитивным (Мор), и наиболее развитым (Форе-Фремье, Гийше) родом хонотрих. Однако ПВ хилодохон — это модификация ПВ обычного типа: произошло утолщение ее стенок, укорочение шейки. Наиболее примитивной хилодохонидой мы считаем Vasichona, в ПВ которой можно узнать воронку типа энофорахон, хотя и существенно видоизмененную. Эволюция идет далее двумя путями: у Cryptochona резко разрастается дорзальный щиток вазихон; у Chilodochona разрастается, напротив, вентральная губа.
Форма с водорослей, Eleutherochona, лишена шипов, завитков, стенки ПВ не утолщены, тело не сплющено; род принадлежит поэтому к лобохонидам. Доне рисует ПВ обычного для лобохонид типа, со складчатой дорзальной и ровной вентральной стен
ками. Род мог произойти от Oenophorachona или от Lobochona. Пока неизвестны промежуточные формы между энофорахоной и родом Phyllochona и основателями трех крупных семейств хонотрих — Vasichona, Spirochona и Heterochona.
Родственные связи эндогеммин. Наиболее примитивные эндогеммины, живущие па Amphithoe (Isochona), напоминают энофорахон: имеют простую ПВ, высокую ножку, бутылковидное тело; новообразованием у изохон является сумка. Trichochona во всем напоминает изохон, но у нее развивается длинный стебелек. От трихохон мы выводим эндогеммин с циамид (циамихон), а от последних — роды с копепод (инермихону и шипоносную талассохону).
На Nebalia род Isochona представлен группой видов, часть которых (типа I. ап-tennaria) напоминает виды с амфитоид. У Cristichona шейка удлинена, тело сплющено в нижней половине, сумка очень велика; род можно вывести от изохон типа I. rotun-data. Carinichona — несомненный потомок кристихон: размеры тела уменьшены, сумка непропорционально крупная, оттянута в сторону. У Rhizochona развиваются шипы и якорные отростки тела; род выводится от каринихон. К кристихонам близка также группа родов с ПВ, повернутой на 90° влево (Crassichona, Actinichona). У красси-хон произошло утолщение стенок сумки и ПВ, у актинихон развиваются шипы; в отличие от кристи-, карини- и ризохон у обоих этих родов редуцирована шейка. Акти-нихонин можно вывести от каринихонин либо от изохон типа Z. г о tundata, обитающих в том же локусе хозяина (на основании щетинок протоподита торакопод). Род Kentrochonopsis плохо изучен, но по облику, вооружению и локализации он явно близок к Actinichona. Аберрантный род Pleochona с инверсией зон ПВ можно вывести от I. pleonicola с того же локуса (щетинки плеопод); это формы с субтерминальной ножкой (педоморфоз).
На торакоподах живет группа. родственных форм; наиболее примитивна из них бесшиповая Inversochona с массивной ПВ и квадратным телом. От инверсохон можно вывести роды Ceratochona (с маргинальными зубчиками ПВ и соматическими шипами) и Kentrochona (с дорзальными и соматическими шипами). Chonosaurus с особо сложной системой шипов (в частности, с базальными шипами) во многом близок к Kentrochona, особенно к К. robusta, и мог взять начало от этого рода. Инверсохониды близки к плео-хонам: ножка у них субтерминальна, гипохон несет складки, РПА инверсного типа, эпихон щитковидный. Мы выводим инверсохон от общего с плеохонами предка. Остальные роды стилохонид приурочены в основном к максиллуле и к экзоподиту торакопод; выделяются группы Flectichona-\-Armichona, Stylochona -\-Spinichona-]-Dentichona, Oxychona~\~Eriochona, Eurychona-\-Echinichona. Armichona отличается от Flectichona появлением двух и более латеральных шипов ПВ, остальные признаки родов совпадают. У Oxychona соматические шипы занимают не весь край тела; у Eriochona они доходят до нижнего конца тела, возникают латеральные шипы ПВ. Такое [же вооружение имеет бесстебельчатая Ctenochona с субтермйнальной ножкой — явный педоморфоз, как у филло- и инверсохонид. Pterochona — потомок Oxychona'. произошло разрастание бесшиповой (нижней) части тела с образованием двух крыловидных выростов. Между ними имеется-и переходная форма — вид, найденный Ленгом на Epinebalia из США. Род Paraoxychona напоминает примитивных оксихон (Oxychona suprema), лишенных шипов, но отличается инверсией зон РПА, имеет вентральные складки ПВ (конвергенция с плеохоной и хонозавром). Род Flectichona можно вывести непосредственно от Stylochona'. имеется сходная ПВ, нет соматических шипов. Oxychona родственна скорее флектихоне, а не стилохоне: хорошо совпадает форма тела и ПВ, имеется удлиненный стебелек; у оксихон развиваются соматические шипы. Сходен облик Stylochona и Spinichona, но у последнего развивается сложная система шипов. Связи Dentichona пока не вполне ясны: род мог произойти от Stylochona или от примитивных видов Spinichona при развитии соматических шипов; ПВ у него лишена шипов или имеет зубчики, как у ряда стилохон.
Происхождение Stylochona пока остается неясным; среди изохонид к ней ближе всего стоят роды Cristichona и Isochona, но последние имеют небольшую коническую ПВ без складок и карманов; у кристихон, кроме того, чересчур удлинена шейка. Eury-chona — несомненный предшественник Echinichona, сохраняющей тот же тип ПВ (без складок и карманов, с редукцией зоны В). Эурихона проще и мельче [эхи-нихон, лишена шипов; ПВ у нее сплющена, с ровными краями, стебелек относительно короткий. У эхинихон появляются соматические и маргинальные шипы, тело укрупняется. ПВ типа воронки эхинихон имеет аберрантный бесстебельчатый род Coronochona с субтерминальной ножкой (педоморфоз). Конвергентное появление подобных форм у инверсо-, стило- и эхинихонид мы объясняем миграцией их на нетипичный субстрат — со щетинок на ровную поверхность придатков. Особый, несвойственный субстрат мог блокировать развитие томитов, вследствие чего возникла серия аберрантных родов. Изменения эти несомненно адаптивные. В группе Endogemmina не установлены еще точные связи серии родов и двух семейств (Actini-chonidae a Stylochonidae)', нужен больший материал, хотя он может принести и новые загадки. Результаты проведенных сравнений суммированы в схеме 1.
ОБЩИЙ ВЗГЛЯД НА ЭВОЛЮЦИЮ ХОНОТРИХ
Дивергенция и конвергенция признаков. Для хонотрих характерна активная дивергентная эволюция; большинство линий начинается от нескольких наиболее примитивных родов отряда. Непосредственно от Oenophorachona
CHONOTRICHIDA (Crustacea, Algae)
Gammaridea,
SPIROCHONIDAE
Е
га
о
FILICHONIDAE
а>
Chilodochona (23 рода 4 под групп Decapoda)
Serpentichona (Acanthogammarus. Pachyschesis)
ф ra
5 св
Cavichona (14 родов гаммарид Байкала)
EXOGEMMINA
(Mysidacea, Isopoda, Amphipoda Talitroidea, Decapoda, Algae Rhodophycea)
CHILODOCHONIDAE
Dysteria
Phyllochona
(Limnoria)
Eleutherochona
(Epymenia)
Aurichona
(Limnoria)
Heliochona
Toxochona
(Anisogammarus)
Oenophorachona
(Anisogammarus,
Allorchestes,
- .Parhyale)_
Vasichona
(Anomura; Eupagurus)
Lobochona —
(Limnoria,
Paralimnoria,
Cryptochona (Natantia: Sclerocrangon)
PHYLLOCHONIDAE
Spirochona (Anisogammarus, Gammarus, Ommatogammarus, (i Gmelinoides, Coniurus, Allorchestes)
HELIOCHONIDAE
(Gammarus, Amphithoe, Anisogammarus)
Filichona (Limnoria)
Phycolimnoria)
Heterochona (Gammarus» Anisogammarus)
LOBOCHONIDAE
Схема 1. Структура отряда Chonotrichida, родственные связи родов и семейств, хозяева.
Звездочкой отмечены формы с признаками педоморфоза. Подчеркнуты названия родов с инверсией зон предротовой цилиатуры.
мы выводим основателей трех семейств экзогеммин и два аберрантных рода лобохо-нид, от Lobochona — три рода хонотрих с лимнорий, от Isochona — серию родов изо-хонид и основателей двух семейств эидогеммин. Примитивные роды богаты видами, что и является основой дивергенции; формообразование происходит при освоении новых локусов и хозяев. От низших родов берут начало стебельчатые и бесстебельча-тые, шипоносные и бесшиповые, удлиненные и листовидные формы. Эпихон образует
щитки, шипы, завитки, пластинки, лепестки и т. д. Есть немало примеров и конвергенции признаков, параллелизма развития. Так, ПВ эндогеммины Spinichona по форме, числу, расположению складок, частично и по вооружению — копия ПВ экзогеммины Heterochona. Стебельки возникают независимо в разных группах обоих подотрядов, утрачиваются в четырех семействах. Параллелизм объясним приспособлением к сход-
Схема 1 (продолжение).
ным условиям, например при переходе от сетобиоза к планибиозу. Пути эволюции ограничены, что также приводит к параллелизму. Например, выгодное для хонотрих поднятие рта над субстратом может быть достигнуто четырьмя путями — удлинением шейки, верхней или нижней части тела и образованием стебелька; все эти процессы реализуются у хонотрих, что приводит к сходству облика неродственных форм. Heterochona exilis, к примеру, — точная копия Oenophorachona sagitta. Ограничены и пути развития защитного аппарата: так, у Dentichona, Oxychona, Echinichona и Ceratochona,
выводимых от бесшиповых форм, образуется почти идентичный комплекс соматических шипов. Общее направление эволюции хонотрих (совершенствование прикрепительного, защитного, в меньшей степени ротового аппаратов) ограничивает размах дивергенции и направляет развитие систем органелл по определенным каналам.
Прогресс и р е г р е с с в эволюции. Направление эволюции хонотрих в целом прогрессивное; в большинстве линий совершенствуется защитный, а часто и прикрепительный аппарат, усложняется цилиатура. Есть и признаки регресса: потеря удлиненного стебелька у вторичнопланибионтных эндогеммин; упрощение структуры ПВ у эхинихонид (исчезают складки и боковые карманы); уменьшение числа витков у Serpentichona. РПА усложняется у экзогеммин, особенно у хилодо-хонид, и явно регрессирует у высших эндогеммин. У последних от зоны В постепенно остается небольшой рудимент, нет удлинения и полимеризации кинет обеих зон. Возможность упрощения РПА хонотрих можно объяснить тем, что движения рачка обеспечивают обильный приток пищи комменсалам. По Гийше (Guilcher, 1951 : 118), «у Chilodochona, Spirochona и Heliochona наблюдается прогрессивная редукция пери-стомальной цилиатуры; ряды стремятся к краевой локализации, как у Chlamydodon-tidae». Это, однако, ошибка: названные роды не составляют эволюционной линии, и РПА их усложнен по сравнению с таковым лобохонид. Аналогична ошибка Мора и Мацудо: примитивным они считают удлиненный стебелек, при редукции которого возникают «прикрепительные диски» спиро- и гелиохон, ножки лобохон и приписываемый кентрохонам «короткий конический стебелек». Если не считать вторичнобессте-бельчатые формы (ктено- и коронохоны), эволюция идет в обратном направлении: в разных линиях от форм с ножкой берут начало стебельчатые виды. Не исключено, что среди анактинид имеются первично- и вторичнобесшиповые формы и что бесшипо-вые роды и виды — не обязательно предшественники шипоносных. У хонотрих имеются и стабильные признаки, не меняющиеся с эволюцией, например план строения Ма в каждом из подотрядов, деление ядер. Форма тела трофонтов не столь варьирует, как, к примеру, у сукторий: нет червеобразных, дисковидных и других форм, Ма которых обычно видоизменен.
Морфологические адаптации. По Раабе (Raabe, 1947 : 345), «существует ряд эпизоотических форм хонотрих, типа скорее всего синойков или симбионтов. В этих случаях организм связан с хозяином . . . только прикреплением к поверхности». У перитрих, кроме Ellobiophrya, адаптации к субстрату якобы нет. «Подобно Peritricha Sessilia в целом, приспособление к сидячему образу жизни имеет особая, хотя поверхностно близкая группа Chonotricha. У нее также нет заметных приспособлений к жизни на теле других организмов, поскольку все Chonotricha —эктокомменсалы» (ibid. : 346). Адаптации, по Раабе, выражены якобы только у паразитических форм. Ошибочность такого мнения очевидна: без адаптаций не было бы того поразительного многообразия форм, которое характерно для отряда. Примитивные роды отряда (лобо- и энофорахоны) — уже типичные хонотрихи с ПВ, ножкой и т. д. Если бы эктокомменсалам не требовалось «приспособлений к жизни на теле других организмов», едва ли эти роды дали бы начало другим хонотрихам. Между тем хонотрихи — активно эволюционирующая группа; совершенствуется защитный и прикрепительный аппарат, меняется форма тела — все это адаптивные видоизменения. Возникновение хонотрих— несомненно, результат адаптации дистериид к эктокомменсализму, неподвижному образу жизни и питанию путем фильтрации. По Мацудо, и почкование представляет собой адаптацию к сидячей жизни, поскольку сохраняется строение трофотомонта, продолжающего питаться.
Конкретные адаптивные признаки у хонотрих в литературе отмечались редко. Эйсмонд и Каль указывают, что организация хонотрих — результат глубокой адаптации к эпизоотизму. Дофлейн считает адаптивным различие облика тела у «популяций» кентрохон с торакопод и максиллулы Nebalia (в действительности это разные роды эндогеммин). Приведенный им другой пример также ошибочен: если Kentrochona оседает около щетинки, она якобы обрастает ее, включая в свой защитный комплекс. Кайзер считает, что отсутствие стебелька у Spirochona — это проявление адаптации к активному движению жабр хозяина; при длинном стебельке «был бы утрачен прочный контакт с субстратом». Прехт, Мор и Гейгер также объясняют наличие или отсутствие стебелька влиянием токов воды. Хонотрихи, по нашим наблюдениям, дают богатейший материал по адаптациям; все многообразие их мы объясняем адаптацией к локальным условиям. У амфипод и изопод известны три локуса хонотрих на плеоподах; достаточно сравнить форму тела Lobochona и Filichona из этих локусов, чтобы убедиться в наличии адаптаций. Уже отмечались утеря стебелька и сохранение субтерминального положения ножки при миграции сетобионтов на ровную поверхность; такие формы плотнее прилегают к субстрату. В отличие от форм с жабр, Spirochona simplex со стебелька плеопод резко сплющена; Heterochona trijaria, обитающая среди мощных шипов максилл рачка, имеет наиболее сложную систему шипов; шейка коротка у Н. peregra с вершины щетинок гнатопод и вытянута у Н. exilis с основания этих щетинок. Примеры подобных адаптаций многочисленны.
Освоение нового локуса почти всегда приводит к появлению новых адаптивных признаков. Многообразие хонотрих определяется поэтому прежде всего числом занятых ими локусов. Яркий пример — сравнение локусов па жабрах гаммарпд и па тора-коподах лептострак: па жабрах различимы лишь два локуса (край и поверхность жабры); торакоподы же причудливо расчленены, несут щетинки разных типов, заселены богатой фауной эндогеммин. Столь же богата эпифауна иаксилл небалиид, но не гаммарид. По три локуса различимы на плеоподах гаммарид и лимнорий; их заселяют разные роды и виды. Адаптации к субстрату у хонотрих и перитрих идут разными путями: у последних эволюционирует прежде всего прикрепительный аппарат (например, при разрастании стебелька образуются чаши или раковины), у хонотрих же стебельки вполне однотипны, эволюционируют прежде всего защитный аппарат тро-фонтов и их ПВ.
Мы не обсуждаем в данной книге вопроса о применимости к хонотрихам морфогенетических принципов Северцева. Список принципов эволюции значительно расширен протистологами (Gelei, 1950; Raabe, 1961); по Раабе, можно ввести еще десятки новых. К каждому из них нетрудно подобрать примеры по хонотрихам, однако прежде всего нужен анализ работ Гелей и Раабе.
ГЕОЛОГИЧЕСКАЯ ИСТОРИЯ ХОНОТРИХ
И ПРОБЛЕМА ПАРАЛЛЕЛЬНОЙ ЭВОЛЮЦИИ
По Калю (Kahl, 1935), хонотрихи живут исключительно на Amphipoda и поэтому имеют, как и их хозяева, исключительно древний геологический возраст. Гипотеза Каля без оговорок принята Раабе (Raabe, 1'947) и Йировцем (Jirovec, 1953). Отметим, что Каль допустил существенную ошибку: еще в XIX в. хонотрихи были отмечены не только на бокоплавах, но и на лимнориях, пагуридах, крабах и Leptostraca. Геологический возраст хонотрих поэтому отнюдь не обязательно должен определяться возрастом амфипод.
По Мору и Мацудо (Mohr, 1959а, 1966; Mohr a. Matsudo, 1970), приуроченность определенных групп хонотрих к группам хозяев (например, спирохонид к Gammari-dae, хилодохонид к Decapoda) говорит об их длительной совместной (параллельной) эволюции. Особое внимание Мор обращает на ассоциацию хонотрих с Leptostraca — наиболее древней из всех известных ныне групп хозяев хонотрих, известной с нижнего палеозоя. Поскольку, по Мору, на этих рачках живет особо разнообразная фауна хонотрих, заселяющих большинство придатков, хонотрихи возникли вероятнее всего на Leptostraca. На других современных хозяевах хюнотрихи единичны и поэтому возникли позже, не успели пройти дивергентную эволюцию. На Leptostraca живут, в частности, формы и с простой ПЕ [Stylochona), от которых могли произойти другие хонотрихи.
В палеозое от рачков типа лептострак ответвились Decapoda (Whittington a. Rolfe, 1963); хонотрихи, обитавшие на ротовых частях их предков, видоизменились и дали начало хилодохонидам. Морские спирохониды, по Мору, — геологически молодая группа, поскольку они встречаются лишь в северной Пацифике и хозяева их (бокоплавы рода Anisogammarus) возникли относительно недавно. Пресноводные спирохониды моложе морских, возникли примерно в третичный период, когда образовался Байкал — основной центр эволюции спирохонид. Возраст хонотрих, живущих на эпи-бионтах китообразных, не может превышать возраст самих китообразных (возникших в третичном периоде кайнозоя); поскольку китовые вши (циамиды) считаются потомками капреллид, Мор допускает существование хонотрих на капреллидах и параллельную эволюцию этих групп. Мор и Мацудо отмечают, что ряд предыдущих гипотез о параллелизме эволюции простейших и их хозяев (опалинид и амфибий — по Меткалфу, полимастигин и термитов — по Керби) оказался ошибочным, но что ассоциация хонотрих и ракообразных является прекрасным примером такого параллелизма.
Мы считаем, что проблема параллелизма решена Мором неправильно. Понятие «параллельная эволюция» Мор сводил лишь к приуроченности (специфичности) хонотрих к определенным группам хозяев. Родственные связи хонотрих не были установлены; экзогеммовые хонотрихи выводились Мором от эндогеммин, что не соответствует нашей схеме (схема 1). Мор не предпринял попытки сопоставить филогенетические древа хонотрих и хозяев.
На схемах 1 и 2 представлены пути эволюции хонотрих и Crustacea (по данным Грина, Даля, Ремане, Секретан, Симона и Липпольта, Севинга, Тиггса и Мантона, Вайсса, Уайтингтона и Рольфе). Если к названиям родов хонотрих на схеме 1 дописать названия хозяев, мы и получим наглядный ответ на вопрос, имеется ли параллелизм на уровне родов и более высоких таксонов. Нетрудно увидеть несовпадение схем эволюции хонотрих и хозяев: перед нами не параллелизм, а явная и повсеместная миграция, «перескок» хонотрих с одной группы хозяев на другую, обычно неродственную. Проследим кратко пути миграции. Примитивные роды Lobochona и Оепор-
horachona приурочены соответственно к плеоподам Limnoria и A nisogammarus; поскольку наиболее примитивна энофорахона, можно сказать, что первыми хозяевами хонотрих были амфиподы типа A nisogammarus пли A llorchestes, Leptostraca же заселены высшими
Схема 2. Расселение хонотрих по хозяевам.
А — переход хонотрих с амфипод на другие группы ракообразных и на водоросли; схема эволюции ракообразных дана по Ремане (Remane, 1967); Б — переход хонотрих с низших амфипод на высших и с последних на копепод и лептострак; В — переход хонотрих с Апотига на другие группы декапод.
Жирные стрелки — достоверные пути миграции хонотрих, прерывистые стрелки — предполагаемые пути; светлая стрелка — путь параллельной эволюции по гипотезе Мора; цифры в кружках — число известных родов хонотрих на данной группе хозяев.
(эндогеммовыми) хонотрихами. Геологический возраст хонотрих определяется воз» растом гаммарид. По Гурьяновой (1962 : 15), «исходной для бокоплавов следует считать форму, близкую к представителям сем. Gammaridae, подобную Helenis из нижнемиоценовых отложений Ашперонского полуострова». По Цветковой (1970 : 16), «обра-
зовапие североатлантических родов Gammarus и М arino gammarus и северотихоокеанского рода A nisogammarus можно отнести к верхнему мелу—нижнему палеогену». Примерный возраст хонотрих поэтому максимум 60—70 млн лет (начало палеогена), но не 300 млн лет (верхний палеозой), когда появились первые филлокариды типа современных лептострак, несущие, по гипотезе Мора, первых хонотрих.
Lobochona эволюционирует на лимнориидах, не мигрируя на других рачков и образуя аутойкные роды Phyllochona, Aurichona и Filichona. Родственные связи видов лимнорий не установлены, но параллелизма скорее всего нет, поскольку филло- и филихон можно найти на ряде видов лимнорий. Oenophorachona с Anisogammarus дает начало аутойкным родам Spirochona, Heterochona, Toxochona; некоторые виды энофора-хон мигрируют на водоросли, на амфитоид и декапод, образуя новые адвенойкные роды Eleutherochona, Isochona и Vasichona. Изохоны мигрируют далее на Nebalia, а один из их потомков — аутойкный род Trichochona с амфитоид — мигрирует на циамид и с них на копепод Balaenophilus (схема 2, Б). Возможно, что и мизидох'оны произошли от форм с амфипод. Параллельной эволюции нет и на уровне высших таксонов Crustacea, и на более низких уровнях. Так, примитивные хилодохониды (Vasichona) известны пока с высших декапод (Апотига и Brachyura), a Cryptochona — с Natantia; хилодохон же можно найти на всех четырех подгруппах декапод.
По мнению Мора, миграция хонотрих с одного рода хозяина на другой — редкое явление, обычно хонотрихи и хозяева эволюционируют вместе. По нашим данным, напротив, миграция — обычнейшее явление у хонотрих. Хонотрихи возникли на высших Peracarida (на амфиподах) и с амфипод перешли на рачков других отрядов, подклассов, даже на копепод и водоросли. В пределах отрядов высшие хонотрихи могут быть найдены на низших таксонах хозяев; такую инверсию мы видим у Decapoda; в группе Mysidacea одиночные мизидохоны поселяются на видах подотряда Mysida, а колониальные клематохоны — на примитивных Lophogastrida. Такие инверсии очень часты на уровне семейств и родов хозяев. Возможен переход хонотрих с низших форм (к примеру, с Amphipoda Gammaridea) на высшие (Caprellidea, Cyamidae), но и это «перескок», а не параллелизм: капреллиды не потомки амфитоид. Ниже рассматривается происхождение хонотрих на разных группах хозяев.
Хонотрихи на Leptostraca. Примитивный род эидогеммин (Isochona) представлен видами на Amphithoe и Nebalia; формы с амфитоид повторяют структуру энофорахон, лишены щитка ПВ, имеют высокую ножку. Отсюда следует, что эндо-геммины возникли на амфиподах (Amphithoe) и с них, а не с изопод, перешли на Leptostraca. На последних нет ни одной экзогеммины; уже поэтому Leptostraca — не первоначальный хозяин хонотрих. Кроме небалиид, эндогеммины. встречаются также на циамидах и копеподах, но это потомки форм с амфитоид (Trichochona). На амфитоидах от изохон произошли лишь трихохоны, а на Leptostraca возникает ряд перспективных эволюционных линий. Вспышку развития хонотрих на Nebalia мы объясняем не древностью последних, а прежде всего значительно большим, чем у гаммарид, разнообразием локусов, особенно на максиллах и торакоподах. Хотя изучена еще небольшая часть эидогеммин, уже сейчас нетрудно найти переходные формы между изохоной и рядом высших родов. Если хонотрихи на ископаемых лептостраках (филлокаридах) — действительно древнейшая группа, в основном вымершая со своими хозяевами, едва ли сохранились бы с такой полнотой промежуточные формы. По нашей схеме, отряд хонотрих возник не ранее верхнего мела, когда уже вымерли филлокариды; с гаммарид они перешли на амфитоид (сменив способ размножения) и с последних на единичные сохранившиеся ныне виды лептострак. Хонотрихи и сейчас — активно эволюционирующая группа; взрывная эволюция их продолжается на небалиидах, что может говорить о молодости эидогеммин по сравнению с экзогемминами. Один род Nebalia дает сейчас около половины видов и родов хонотрих; аутойки и адвенойки на видах и расах небалий настолько перемешаны, что ни о каком параллелизме говорить не приходится. '
Хонотрихи на Gammaridae. Рассмотрим возможный путь перехода морских спирохон в пресную воду и происхождение байкальской фауны. Мор отмечает находки спирохон на морских и эстуарных видах A nisogammarus в восточной Па-цифике, но, поскольку в пресных водах США спирохон еще не находили, придает значение как переносчикам эстуарным европейским видам Gammarus. По Баусфильду и Мору (Mohr, 1966 : 538), ".Gammarus duebeni появился ранее G. pulex, занимающего пресные водоемы Европы, включая Британские острова, Исландию, и северо-восток Северной Америки. . . G. pulex более успешно приспособился к пресным водам, вытесняя первый вид в Европе, но не достиг еще Ирландии и части западной Англии, где в отсутствие G. pulex пресноводные ручьи заселяет G. duebeni». Важно отметить, однако, что спирохон нет на G. duebeni и других эстуарных гаммарусах и что в Пацифике нет видов Gammarus. Внимание нужно акцентировать поэтому на роде A nisogammarus. На видах этого рода спирохоны обычны в США и в наших морях, от Посьета до Камчатки; род включает немало эвригалинных видов, способных жить в пресной воде, к примеру A. kygi и A. tiuschovi, выносящие соленость 0—28°/00. Такие виды и могли
занести спирохон в пресные воды, передав их видам Gammarus, обычпым в Евразии и в Северной Америке. Геологический возраст спирохонид можно определить по таковому Anisogammarus.
Байкальские спирохонпды моложе тихоокеанских: по Кожову (1962), озеро возникло во вторую половину третичного периода, когда формировалась современная фауна. По Сегерштрале, G. pulex вслед за ледником двигался в Азию, достиг Байкала и дал здесь вспышку видов. По Верещагину и Базикаловой, фауна Байкала состоит в основном из гаммарид морского происхождения. Россолимо (1966 :144—145) уточняет, что «сторонники морского происхождения некоторых групп байкальского населения подавляющую его часть все же производят из пресноводных фаун, населявших в разные времена континентальные водоемы, образовавшиеся вследствие постепенного опреснения моря». По Сварчевскому, Spirochona — не исключение среди байкальских простейших, которые образуют массу видов в этом водоеме; исходный вид — S. gemmipara, но он «угнетен» и играет здесь меньшую роль, чем S. elegans (соответственно на 9 и 18 хозяевах). Мы находили S. gemmipara в сорах Байкала; к ней близок литоральный вид 5. brevis. На предполагаемых морских элементах в фауне гаммарид (Carinogam-marus, Eulimnogammarus, Pallasea) обитают не спирохоны, а эндемичные кавихоны. Видов тихоокеанского типа (с мелким телом и массивной ПВ) в Байкале нет. Итак, основателем эндемичной байкальской фауны явилась 5. gemmipara, которую занес на литораль Gammarus lacustris. И здесь почти нет примеров параллелизма, часты инверсии: на примитивных Eulimnogammarus живет Cavichona, на высших гаммаридах (типа Odontogammarus, Ommatogammarus, Coniurus) — Spirochona', один из видов Ommatogammarus несет спирохон, другой — кавихон. Единственное проявление параллелизма — вероятное происхождение Gmelinoides fasciatus с 5. brevis от сорового Gammarus lacustris с S. gemmipara.
Хонотрихи на Decapod а. Линии Leptostraca — Decapoda, о которой говорит Мор, не существует: лептостраки произошли от Dicranostraca независимо от линии, ведущей к Eumalacostraca, в частности к Decapoda. Хилодохониды молодая группа: первые декаподы (креветки) появились в раннем мезозое, крабы — в меловом периоде, высшие перакариды (изо- и амфиподы) — в среднем или нижнем кайнозое; хонотрихи вообще не могли появиться раньше амфипод. Нет и линии Stylochona — Chilodochona', примитивные хилодохониды (Vasichona) могли произойти от энофорахон с амфипод.
Хонотрихи на Cetacea. В морфологическом отношении цетохоны — несомненные потомки Trichochona с Amphithoe', на копепод хонотрихи могли перейти с циамид. Цетохоны, вероятно, молодая группа, появившаяся в конце четвертичного периода. Путь заражения циамид от литоральных амфитоид можно представить, учтя особенности биологии китов; к примеру, серый кит Eschrichtius gibbosus из северной Пацифики — обитатель прибрежных вод, «питается исключительно придонными организмами — бокоплавами и другимй низшими рачками, морской капустой . . . спасается от врагов на отмелях и избавляется]отпаразитов, скребясь о грунт» (Бобринский и др., 1962 : 200).
СТРУКТУРА ОТРЯДА
КРИТЕРИЙ РОДА И СЕМЕЙСТВА У ХОНОТРИХ
Род у хонотрих включает аберрантный вид либо группу близких видов, объединенных общими признаками. Многие роды хонотрих представляют собой крупные гетерогенные наборы форм из разных линий; таковы, к примеру, роды Spirochona («очищенные» нами от Stylochona и Heliochona), Stylochona (часть видов мы выделяем в роды Heterochona и Eleutherochona). Мы признаем роды более дробными, чем принято в литературе: в ряде родов можно различить группы видов, характеризующиеся важными признаками. Так, Heliochona включает виды со щетинок (с терминальной ножкой) и виды с жабр (с широкой подошвой и субтерминальной ножкой — педоморфный признак); группы эти большие, четкие, мы считаем их самостоятельными родами. Многие роды, выделенные нами, включают аберрантные формы; так, только у Pterochona среди стилохопид развиты гигантские крыловидные шипы, только у Ctenochona вторично теряется стебелек, только у Paraoxychona наблюдается инверсия ресничных зон ПВ и появляются вентральные складки ПВ (редчайший случай у хонотрих). Разграничение родов у Endogemmina труднее, чем у экзогеммин, вследствие широкого распространения бесшиповых анактинид — «копий» шипоносных видов. Обычно бесши-повые виды составляют особые роды (Eurychona, Carinichona и др.), но хонотрих с ши-котано-сахалинской расы Nebalia, где весь комплекс эндогеммин лишен шипов (явно вторично), мы относим к шипоносным родам Oxychona, Echinichona, Dentichona и др.
Прежде чем обсудить критерии семейств хонотрих, рассмотрим историю их классификации (табл. 4). Вначале хонотрих относили к семействам Vorticellina или Spiro-
chonina Stein, 1854; семейство Chilodochonina Wall., 1895, никем не было принято, исключая Похе, до 1948 г. (Mohr, 1948). Похе считает автором названия семейства спирохонид Гроббена (Grobben, 1904—1905), изменившего окончание на -idae, но название Spirochonidae мы находим впервые у Егершельда (Jagerskiold, 1896:890) — возможно, по ошибке, так как им же упомянуты Chilodochonina. По правилам номенклатуры, изменение окончания названия не меняет авторства Штейна. Автором семейства Chilodochonidae обычно считают Похе (Poche, 1913), изменившего окончание на -idae (Бхатиа, Мор, Дофлейн и Рейхенов), но следует сохранить авторство Валленгрена.
Сохраняя семейства спиро- и хилодохонид, Mop (Mohr, 1948) выделяет ряд родов спирохонид в новое семейство Stylochonidae. Им приведены следующие диагнозы семейств. Chilodochonidae'. формы без ПВ; имеются скорее губы, чем воронка; 1 род (Chilodochona) с ротовых придатков морских Brachyura. Stylochonidae-. сог стебельком и без него; ПВ хорошо развита, но без спиральных складок; 4 рода (Stylochona, Heliochona, Trichochona, Kentrochona) с морских амфипод, изопод, небалиид. Spirochonidae-. бесстебельчатые формы; ПВ со спиральными складками; 1 род (Spirochona) с пресноводных гаммарид. Позднее Мор и Корлисс дают сходные диагнозы, но в состав спирохонид включается и род Lobochona (табл. 4), перенесенный затем в сем. Stylo-
Таблица 4
Структура таксона Chonotricha
Wallengren, 1896 Corliss, 1961
Секция Chonotricha Wall., 1895
Сем. Spirochonina Stein Kentrochona Rompel K. nebaliae Rompel
Heliochona Plate
H. sessilis Plate
H. scheutenii (Stein)
Stylochona^ Kent
5. coronata Kent
Spirochona Stein
S. gemmipara Stein
Сем. Chilodochonina Wall., 1895 Chilodochona Wall.
Ch. qvennerstedti Wall.
Ch. mtcrochilus Wall.
Kahl, 1935
Отряд Chonotricha Wall., 1895
Сем. Spirochonidae Stein, 1867
Chilodochona Wall., 1895
Ch. quennerstedti Wall., 1895
Ch. microchilus ? Wall., 1895
Kentrochona Rompel, 1894
K. nebaliae Rompel, 1894
K. nebaliae Doflein, 1897=5iy-lochona nebalina Kent
K. multipara Doflein, 1897
Heliochona Plate, 1888
II. scheutenii Stein, 1854
H. sessilis Plate, 1888
Spirochona Stein, 1851
S. gemmipara Stein, 1851
S. elegans Swarcz., 1928
S. pusilia Swarcz., 1928
S. patella Swarcz., 1928
5. anthus Swarcz., 1928
5. simplex Swarcz., 1928
S. globulus Swarcz., 1928
S. tuba Swarcz., 1928
5. elegantula Swarcz., 1928
5. nebalina Kent, 1889
Stylochona Kent, 1881
S. coronata Kent, 1881
12 Заказ M 213
Отряд Chonotrichida Wall., 1895
Сем. Spirochonidae Stein, 1854 Spirochona Stein Lobochona Dons
Сем. Chilodochonidae Wall., 1895 Chilodochona Wall.
Сем. Stylochonidae Mohr, 1948 Heliochona Plate Kentrochona Rompel Kentrochonopsis Doflein Stylochona Kent Trichochona Mohr
Mohr a. Matsudo, 1970
Подкласс Chonotricha
Отряд спирохонид
Подотряд спирохонин
Сем. Stylochonidae Mohr, 1948 Подсемейство стилохонин
Stylochona Kent, 1881
Kentrochona Rompel, 1894 «Stylochona» sivertseni (Dons) Подсемейство трихохонин
Trichochona Mohr, 1948 Формы c Cetacea Подсемейство лобохонин
Lobochona Dons, 1940 Oenophorachona Matsudo et
Mohr, 1968
Подсемейство гелиохонин Heliochona Plate, 1888
Сем. Spirochonidae Grobben, 1904 Spirochona Stein, 1851
Подотряд хилодохонин
Сем. Chilodochonidae Mohr, 1948 Chilodochona Wall., 1895
Семейство мизидохонид Мизидохона
Семейство клематохонид Клематохона
chonidae (Mohr a. oth., 1963а). По Мору (Mohr, 1959), три уровня организации заслуживают ранга семейства. У примитивных стилохонид ПВ простая либо несет ребра, складки и шипы; тело цилиндрическое или слегка сплющенное, иногда со стебельком. У спирохонид имеется завиток, вырастающий из простой, стилохонидного типа воронки молодых трофонтов. У хилодохонид ПВ не воронковидная, имеются скорее «заметновыдающиеся, неравные парные губы». Позднее Mop (Mohr, 1966) приводит эти диагнозы почти без изменений.
Схема Мора была принята отдельными авторами (Hall, 1953; Corliss, 1961; Lep.^i, 1965, и др.); Лешли при этом допускает ошибку: роды Stylochona и Chilodochona отнесены им не только к стило- и хилодохонидам, но одновременно и к спирохонидам. Дофлейн и Рейхенов различают группы спиро- и хилодохонид, не упоминая о Stylochona. Против схемы Мора высказалась Гийше (Guilcher, 1951 : 171): «Классификация вызывает возражения. Мы не видим никакого смысла в подразделении на многочисленные семейства, поскольку почки совершенно идентичны у всех видов и роды представляются достаточно близкими для объединения их в одно единственное семейство». Предложение Гийше неприемлемо: мы классифицируем все же трофонтов, а не томитов, нельзя игнорировать различие их организации. Эта тенденция к переоценке значения томитов для систематики и привела к введению хонотрих и сукторий в состав Holotricha (Гийше, Форе-Фремье, Корлисс) и хонотрих в состав Gymnosto-mata (Добжанская-Качановская, Раабе).
Семейства у хонотрих мы понимаем в более узком смысле: это либо один аберрантный род, организация которого нетипична для группы в целом (например, Phyllo-chona), либо, чаще, группа близких родов со сходными формой тела, ПВ, РПА, способом размножения, с определенной эволюционной тенденцией. Так, можно объединить в составе одного семейства экзогеммин Heterochona и Heliochona с шипами ПВ, формы типа Spirochona с завитком ПВ. Нельзя, однако, объединять в одном семействе экзо-и эндогеммин, что сделал Мор, так как это уже сборная группа. Отсюда неопределенность диагноза Stylochonidae по Мору: говорится об отсутствии губ и завитка ПВ, но конкретный тип ПВ не указан, т. е. диагноз негативный, что недопустимо. Это семейство — набор бесшиповых и шипоносных, бесстебельчатых и стебельчатых неродственных форм с разными типами ПВ и РПА. Из четырех родов семейства типовым у Мора признан наименее изученный род Stylochona Кента. Кент не указал типового вида, отнес к роду экзо- и эндогеммин, пририсовал первым стебелек; позднее к роду добавился еще один вид (5. sivertseni Донса), не имеющий к нему отношения. Описания Кента плохие, многие авторы вообще не признают этот род. Kentrochona как типовой род'-также неприемлема, лучше подошли бы Trichochona или Heliochona.
Новый вариант Мора и Мацудо (табл. 4) известен нам по рукописи, в публикации возможны изменения.
ПРЕДЛАГАЕМАЯ СТРУКТУРА ОТРЯДА
. Подразделение на подотряды. В составе подкласса мы различаем один отряд Chonotrichida, который можно подразделить на подотряды только по способу размножения — экзо- и эндогеммин. Обе эти группы не сборные, поскольку эндогеммин не возникала в эволюции многократно (как у сукторий); с самого начала Эволюции от ствола экзогеммин отделилась крупная ветвь эндогеммин, развитие отряда пошло по двум направлениям на разных хозяевах. Группам можно дать и определенную морфологическую характеристику (см. стр. 186). В протозоологии при различении подотрядов принято давать не номинативные, а смысловые названия, к примеру Rhabdophorina и Cyrtophorina в отряде Gymnostomatida, Stichotrichina и Sporadotri-china в отряде Hypotrichida, Sessilia и Mobilia в отряде Peritricha, Stomatina и Rhyn-chodina в отряде Thigmotrichida. Соответственно подотрядам хонотрих мы даем смысловые названия Exogemmina и Endogemmina. Подотряды, предложенные Мором и Мацудо, неприемлемы: предполагаемая древность хилодохонид и их ассоциация с Decapoda не имеют никакого отношения к вопросу об их ранге, особенности же строения не столь велики, чтобы противопоставить их всем остальным хонотрихам. Поскольку мы нашли промежуточные формы, не известные Мору (Vasichona), хилодохонидыне отстоят далеко от общего ствола хонотрих. Подотряды Мора неэквивалентны, «спиро-хонины» — набор форм без определенной характеристики, которых ничто не объединяет.
Структура подотряда Exogemmina. По форме тела и типу защитного аппарата выделяется несколько естественных групп родов. У спирохонид тело бутылковидное, стебелька нет,'имеется завиток; у гелиохонид тело бутылковидное, стебелька нет, имеются лепестки и маргинальные шипы ПВ; у хилодохонид тело массивное, шейка редуцирована, нет ни завитка, ни шипов резко утолщены стенки ПВ,
кинеты полимеризованы, имеется стебелек. Эти группы — несомненные семейства. По ряду признаков выделяется аберрантная Phyllochona с листовидным телом, субтер-мппально!! ножкой; ПВ массивная, с необычной системой складок, с крупной защитной пластинкой. Во мпогом близки A urichona п Filichona с плеопод лимпорий: шейка у ппх удлинена, развиты гипоколлярные шипы; роды можно объединить в рамках одного' семейства. Другие роды экзогеммин (Lobochona, Oenophorachona, Toxochona, Eleu-therochona) — это примитивные формы без шипов, завитков, часто с лепестками эпихона; их вполне можно отнести к одному семейству, в котором три первых рода образуют компактную группу, а элейтерохона (с длинным стебельком и с редукцией шейки} стоит несколько в стороне.
Структура подотряда Endog.emmina. Родов эндогеммин больше, чем экзогеммин, дивергенция их сложнее, имеется много переходных форм; возможных вариантов классификации больше. Объединить все роды в одном семействе нельзя; оно не будет эквивалентно семействам экзогеммин, у которых шипоносные и бесшиповые, бутылковидные и листовидные формы распределены по разным семействам. В разных линиях эндогеммин имеются и шипоносные формы, и анактиниды; нельзя поэтому различать семейства только по вооружению, первостепенное внимание нужно уделять форме тела и строению ПВ. Обычно эти признаки взаимосвязаны. С учетом облика и симметрии тела, строения ПВ, типа РПА и вооружения особей мы различаем пять обособленных групп родов (семейств) эндогеммин (схема 1). Примитивных эндогеммин с бутылковидным, не сплющенным телом, конической ПВ и простым, не инверсным РПА (Isochona, Trichochona и роды с китообразных) мы относим к семейству Isochonidae. Семейство Inversochonidae объединяет аберрантные формы типа Inverso-chona и Chonosaurus — с массивным сплющенным телом, широкой подошвой,' крупной сплющенной ПВ, с инверсией зон РПА и с тенденцией к развитию сложной системй шипов; это первичнобесстебельчатые формы. Stylochonidae объединяет 10 родов с плоским листовидным телом, сплющенной ПВ с четкими дорзальными складками и не инверсным РПА (исключение — Paraoxychona с инверсией зон РПА). Почти все роды стебельчатые; у Ctenochona стебелек утерян вследствие перехода от сето- к планибиозу. Echinichonidae, включающие стебельчатые Eurychona, Echinichona и вторичнобесстё-бельчатую Coronochona, во многом близки к стилохонидам, но имеют необычную ПВ — без складок и карманов, с параллельными краями эпи- и гипохона. Поскольку такая ПВ не встречается у других хонотрих, желательно выделение названных родов в особое семейство.
Шесть остальных родов эндогеммин — Cristichona, Carinichona, Rhizochona, Acti-nichona, Crassichona и Kentrochonopsis — выделяются в провизорное семейство Acti-nichonidae. Они несколько различаются по внешнему облику, но их объединяет поворот ПВ на 90° вправо. Тело актинихонид не сплющено, имеет округлое сечение. Все названные роды, исключая часть особей кристихон, заселяют один и тот же локус хозяев — основание щетинок протоподита торакопод Nebalia; особи втиснуты между щетинками, тело их образует причудливые опорные выросты, ПВ при развитии томита отклоняется вправо.
В качестве типового рода для новых семейств мы выбираем простой род, если мы хотим подчеркнуть примитивность группы, и один из высших, если подчеркивается специализация в определенном направлении. •
Чужеродные элементы в отряде. С хонотрихами иногда путали перитрих, например Spirochona tintinnabulum Kent, 1881, с жабр Triton cristata. Бючли установил для этого вида новый род Glossatella Biitschli, 1889. Неясно, не является ли он синонимом Apiosoma Blanchard, 1884, как считают Лом и Банина. Вид обычный, отмечается на молоди тритонов в Европе и США (Келликотт, Ру, Андре, Кайзер, Мер-мод, Форе-Фремье, Неннингер, Фогт, Стокес и др.). Вероятно, таких же перитрих (вид Rhabdostyla или Scyphidia) видел Кальмус (Kalmus, 1928) на олигохете Stylaria nobilis, предполагавший, что это «Spirochona, вероятно идентичная с S. gemmipara». Вест (Bate a. Westwood, 1863) неправильно определил хонотрих типа Heterochona coronata как Vaginicola crystallina. Последний вид, перенесенный Клапаредом в род Cothurnia, был предложен Эренбергом для типичной перитрихи.
По Раабе (Raabe, 1947 : 338), «в сем. Pilisuctoridae следует включить своеобразные безротые организмы, описываемые авторами как Kentrochonopsis Doflein, а вероятно также и Chilodochona Wallengren, провизорно отнесенные Калемк Chonotricha». Пили-сукторид мы считаем видоизмененными апостоматами группы Gymnodinioides (Янковский, 19666): это неотенический форонт, постоянно инцистированный на щетинках рачка, питающийся через канал щетинок, размножающийся стробиляцией; томиты эксцистируются поочередно после долгой лаг-фазы. Стробилы Conidophrys не напоминают стробилы Kentrochonopsis, между родами нет ничего общего.
ПОЛОЖЕНИЕ ХОНОТРИХ В СИСТЕМЕ ИНФУЗОРИЙ
РАННИЕ СХЕМЫ КЛАССИФИКАЦИИ
До 1895 г. все авторы включали хонотрих в Peritricha. Штейн считал спирохону промежуточной формой между Vorticellina и Ophrydina. Вместо мелких семейств перитрих по Эренбергу Штейн различал одно, Vorticellina, с 6 секциями родов — типа Trichodtna, Ophrydium, Vorticella, Lagenophrys, Epistylis и Spirochona (с очень прочным стебельком). Позднее Штейн (Stein, 1854) включает спирохон в группу V orticellinen sensu lato с 3 семействами — Vorticellina, Ophrydina и Spirochonina (Spirochona А-D ino-physis). В 1859 г. Infusoria подразделены им на 4 отряда — Holotricha, Heterotricha, Hypotricha и Peritricha, примерно соответствующие 4 секциям Эренберга; перитрихи включали 3 названных семейства, в 1867 г. — уже 9. Различие в направлении спирали у спирохон и вортицеллин, по Штейну, — основной признак семейств. Клапаред и Лахман подразделяют отряд Ciliata Petty, 1852 на 10 семейств; род Spirochona упомянут ими в «Приложении к сем. Vorticellina». Фроментель (Fromentel, 1874) делит класс Infusoria, отряд Microzoa Vorticosa, на подотряды Paramecidae и V orticellidae", спирохона — единственный чужеродный род вортицеллин. Кент различает 8 семейств перитрих; спиро- и стилохоны отнесены им к подсемейству Vorticellina семейства Vor-ticellidae. Предложенное Кентом деление инфузорий на Ciliata и Suctoria постепенно принимается большинством авторов (Келликотт, Фойгт, Ланг, Кюкенталь, Деляж и др.). Клаус считает сукторий эквивалентными каждому из отрядов цилиат, что также встречается в позднейших системах. Позднее начинается разгрузка перитрих от чужеродных форм; Энтц (Entz, 1884) различает 4 неродственные группы семейств перитрих, включая спирохонин. Бючли оставляет в составе перитрих лишь Vorticellina, Licnophorina и Spirochonina'. он предлагает новую систему инфузорий •— один из лучших вариантов, к сожалению обойденный молчанием всеми последующими авторами.
Валленгрен считает включение ликнофор и хонотрих в состав Peritricha ошибочным; для спиро- и хилодохонин им предлагается «секция» Chonotricha Wall., 1895, таксон ранга Peritricha. По Корлиссу (Corliss, 1957), Похе первый придал хонотрихам ранг отряда, но автором названия следует признать Валленгрена, поскольку тот выделил новую секцию как эквивалент других секций (отрядов или подотрядов) спиро-трих в схеме Бючли. Формально, однако, Валленгрен предложил не отряд, а новое надсемейство подотряда спиротрих. Хейсиным и Полянским (1963) неточно указано, что в независимый таксон, рангом не ниже отряда, хонотрих выделили Шаттон и Львов.
После Валленгрена и. до работ Каля большинство авторов по-прежнему относят хонотрих к перитрихам, хотя не раз высказывались сомнения в их родстве. Продолжает совершенствоваться система инфузорий: меняется состав групп, вводятся новые подотряды и отряды; к началу XX в. становится общепринятым различение класса Ciliata (с Отрядами Штейна) и Suctoria. В составе перитрих группу хонотрих все еще включают в семейство вортицеллид (Ланг, Хиксон, Хартог, Гамбургер, Лепши, Веньон, Сварчевский, Кальмус, Кудо и др.) либо сохраняют для них семейство Spirochonina (Эйсмонд, Дофлейн, Хендерсон, Калкинс, Андре, Коллен, Мёрмод, Кайзер, Бюйсан и др.). Гаевская (1933) признает отряд Chonotricha, но в то же время отмечает, что, «по литературным данным, Spirochona gemmipara — это одна из распространеннейших перитрих». Во многих, довольно подробных работах хонотрихи вообще не упоминаются (Дофлейн, Рейхенов, Пратт, Грассе, Комарек и др.). Сравнение хонотрих, ликнофор и перитрих, объединявшихся в одном отряде, приводит к разграничению подотрядов Dexiotrichidae и Scaiotrichidae (Delage et Herouard, 1896), имеющих декси--отропную и лейотропную «ротовую спираль». Этот вариант приняли немногие авторы (Коллен, Андре, Кайзер, Ламеер, Бюйсан и др.), сохраняющие для спирохон семейство Spirochonina. Кроме перитрих, Ламеер включает в состав дексиотрих и сукторий, якобы/имеющих «правозакрученную ротовую спираль» (!); это вызвало критику Форе-Фремье и Раабе.
Ряд авторов, не принявших группу сцеотрих, считали спирохон и перитрих неродственными, но сохраняли их в одном отряде. Независимо от Валленгрена Пенар (Ре-nard, 1922) отмечал, что спирохоны почти во всем отличаются от типичных перитрих; для них восстановлен им отряд Scaiotricha (без ликнофор). Отряд Chonotricha Валленгрена приняли отдельные ранние авторы (Энрикес, Похе, Дофлейн и Рейхенов, Каль), а после работ Каля — большинство авторов. К 1930 г. система инфузорий складывается уже в современной форме; можно говорить поэтому о системе Штейна—Каля. По Калю, подкласс Infusoria включает четыре отряда; «Chonotricha содержат относительно мало видов, но по своей организации они настолько отклонились в сторону, что самое лучшее было бы противопоставить их трем другим крупным отрядам» (Kahl, 1933 : 45).
Система Каля становится общепринятой, отличаясь у авторов лишь деталями: снижается или повышается ранг таксонов, удаляется группа протоцилиат, не разли
чаются Euciliata, возрастает число подотрядов. Суктории и Ciliata обычно считаются эквивалентными классами, но изредка сукторий вводят в состав Ciliata как подкласс (Йекель, Хенниг, Полянский и Хейсин). Многими авторами хонотрихи признаны отрядом, эквивалентным Holotricha, Peritricha и Spirotricha, как правило в рамках подкласса Euciliata класса Ciliata (Дофлейн и Рейхенов, Бхатиа, Каль, Гаевская, Пирс, Джен, Кудо, Бок, Догель, Холл, Йировец, Пеннак, Ветцель, Грелль, Бухар, Борра-дейл, Бек, Эрдманн, Големанский и др.). Удивительна ошибка Донса (Dons, 1948 : 13), у которого отряд Chonotricha включает якобы одно семейство eChonotrichidae». В ряде работ упоминается отряд Chonotricha, или Chonotrichida, но без уточнения, каким группам он эквивалентен. Копленд (Copeland, 1956) считал хонотрих подотрядом. Калкинс (Calkins, 1933) придает четырем традиционным отрядам класса Ciliata ранг подкласса (включая хонотрих). Сходна с этим схема Догеля и сотрудников (1962а), но здесь суктории составляют пятый подкласс Ciliata, Раабе (Raabe, 1947, 1948) занимает крайнюю позицию, считая Protozoa — подцарством, Ciliophora — типом, Ciliata — подтипом; все таксоны повышаются на один ранг, хонотрихи получают у него ранг класса. Мор и Мацудо вначале не уточняли, каким таксонам эквивалентны Chonotrichida-, лишь в одной из работ Мацудо (Matsudo, 1966) отряды Chonotrichida и Holotrichida упоминаются как равноценные группы. Mop (Mohr, 1966) считает геологическую древность группы подтверждением позиции Хейсина и Полянского, придающих таксону высокий ранг. Отвергается возможность включения хонотрих в состав Holotricha (Mohr a. Matsudo, 1970); ранг отряда для древней и своеобразной группы хонотрих низок, но ранг подкласса несколько высок, поскольку хонотрихи во многом близки к холотрихам. Следует выбрать все же вторую альтернативу.
СОВРЕМЕННЫЕ СХЕМЫ КЛАССИФИКАЦИИ ИНФУЗОРИЙ
С 1950 г. ряд авторов вносит в общепринятую схему существенные изменения, касающиеся в основном перитрих, хонотрих и сукторий (табл. 5). Краткий обзор этих модификаций приведен в нашей ранней работе (Янковский, 19676); здесь мы осветим мотивы, побуждающие авторов снижать или повышать ранг хонотрих.
Гийше и Форе-Фремье, изучив кинетом и развитие хонотрих, перитрих и сукторий, снижают ранг групп, вводя их как отряды в подкласс Holotricha. Фактически это возврат к схемам Дофлейна, Минчина, Лепши и Веньона, различавшим группы холотрих и Spirigera. По Гийше, сукторий нужно классифицировать не по морфологии трофонтов («это функция разных факторов») и не по способу почкования, а по морфологии томитов: «Тот факт, что цилиатура этих бродяжек соответствует холотрихоидному типу, позволяет ввести сукторий непосредственно в отряд холотрих». Этот вывод переносится и на хонотрих: «Мы собираемся произвести аналогичное перемещение хонотрих, из которых нами изучался вид Chilodochona quennerstedtw (Guilcher, 1948 : 960). Гийше не интересует, насколько диагноз сукторий и хонотрих совпадает с таковым холотрих, сходен ли у них план строения. Объединить же группы можно только при сходстве диагнозов. Вопрос о несовпадении диагнозов не обсуждают позднее ни Форе-Фремье, ни Корлисс; он просто обойден молчанием. При таком подходе естественная система построена быть не может.
Отметив общие признаки у хламидодонтид, дистериид и у томитов хонотрих, Гийше (Guilcher, 1950 : 476) пишет: «Мы приходим к выводу о том, что отряд Chonotricha скорее всего монофилетичен; его следует поместить в подкласс Holotricha близ отряда Gymnostomata Cyrtophorina, от которого он, вполне вероятно, и произошел». Эти цитаты исчерпывают все аргументы Гийше. Аргументация Форе-Фремье (Faure-Fremiet, 1950а : 115) в свою очередь сводится к следующему: «Наблюдения Гийше над томитами Chilodochona и Spirochona, над их вентральной цилиатурой, их сйособом фиксации и их трансформацией, показали, что эти загадочные инфузории близкородственны Gymnostomata Cyrtophorina типа Dysteria. У обеих групп имеются и общие признаки в строении Ма». Форе-Фремье не комментирует свой вариант (табл. 5) в последующих статьях; до сих пор неясно, поддерживает ли его автор сейчас.
Схема Гийше—Форе-Фремье была обойдена молчанием авторами всех протозоо-логических руководств 1951—1956 гг., но с 1956 г. получила энергичную поддержку Корлисса (табл. 5), исходящего из спорного положения о том, что определение филогении таксона говорит не только о его месте в системе, но и о ранге (Corliss, 1963). Ссылаясь на данные Гийше, Форе-Фремье и Тюффро, Корлисс (Corliss, 1959 : 178) пишет: «Между хонотрихами и циртофориновыми Gymnostomatida должны быть очень тесные связи. Поэтому отряд Chonotrichida можно поместить теперь между низшими холо-трихами с достаточной уверенностью в том, что такое таксономическое решение не противоречит филогенетической истории группы». Нельзя, конечно, в такой мере игнорировать диагнозы групп. Вариант Гийше и после серии статей Корлисса не получил очевидного признания; им пользовались отдельные авторы в США и Европе, не ведущие (исключая Боррора) исследований по систематике (Мэнвелл, Макиннон и Хейвс, Тартар, Боррор, Сэндон, Лепши, Ветцель, Вайсс). Против снижения ранга перитрих,
Таблица 5
Современные варианты классификации инфузорий
Faure-Fremiet, 1950 Подтип Ciliophora Класс Ciliata Подкласс Holotricha Gymnostomes Rhabdophores Gymnostomes Cyrtophores Chonotriches Trichostomes Hymenostomes Thigmotriches Peri triches Apostomes Astomes Tentaculiferes Подкласс Spirotricha Heterotriches Hypotriches Ctenostomes Oligotriches Tintinnoidiens Oligotriches Ophryoscolecides Corliss, 1964 Подтип Ciliophora Класс Ciliatea Подкласс Holotrichia Gymnostomatida . Trichostomatida Chonotrichida A postomatida Astomatida H ymenostomatida Thigmotrichida Подкласс Peritrichia Peritrichida Подкласс Suctoria S uctorida Подкласс Spirotrichia Heterotrichida Oligotrichida Tintinnida Entodiniomorphida 0 dontostomatida Hypotrichtda
Raabe, 1964a, 1964b Тип Ciliophora Подтип Ciliata Класс Holotricha Gymnostomata 1 Apostomea Suctoria Trichostomata H ymenostomata Thtgmotricha Astomata Класс Spirotricha Heterotricha Oligotricha Tintinno idea Odontostomata Hypotricha Entodiniomorpha Класс Peritricha Sessilia Mobilia Raabe, 1964c Тип Ciliophora Подтип Ciliata Класс Holotricha Подкласс Holotricha Gymnostomata Trichostomata Apostomata Подкласс Hymenotricha Hymenostomata Thtgmotricha Astomata Класс Spirotricha Heterotricha Hypotricha Oligotricha Odontostomata Entodiniomorpha^ Класс Suctoria Acinetida Ephelotida Dendrocometida
Класс Peritricha
1 C 4 подотрядами — Prostomata, Pleu-rostomata, Hypostomata, Chonotricha. Sessilia Mobilia
сукторий и хонотрих высказался ряд авторов. Грассе восстановил класс Suctoria, сохранив подразделение цилиат на холотрих и спиротрих. Хейсин и Полянский (1963; Полянский и Хейсин, 1964) подчеркивают, что в процессе эволюции перитрихи настолько далеко отошли от остальных групп, что различия между ними и холотрихами (в частности, с предками — тигмотрихами) стали глубже, чем различия отрядов в рамках холотрих. Диагнозы перитрих и холотрих несовместимы; в диагнозе холотрих не должно быть оговорок, полностью ему противоречащих. По той же причине несовместимы и диагнозы хонотрих и холотрих: «Принимая во внимание степень морфологических, экологических различий и различий развития, Chonotricha нужно поместить на одинаковый уровень с Peritricha и Spirotricha, то есть следует считать их одним из подклассов Ciliatai> (Хейсин и Полянский, 1963 : 347).
После дискуссий на съездах и в печати (Полянский и Хейсин, 1964; Raabe, 1964а; Discussions, 1966, и др.) Корлисс предложил новый, компромиссный вариант. Он повысил ранг Peritricha и Suctoria, но не хонотрих: поскольку у хонотрих и циртофорин
сходны ядра, прикрепительный аппарат и цилиатура, они, по Корлиссу, по-прежнему составляют «маленький, но независимый отряд холотрих», помещаемый близ подотряда Cyrtophorina отряда Gymnostomatida. В комментариях Корлисса пет уверенности в правильности схемы: «Мы хорошо созпаем, что по мере получения дополнительной информации в последующие годы будут неизбежны изменения. В самом крайнем случае она должна служить стимулом для дальнейших исследований в систематике простейших» (Corliss, 1964 : 8). В 1967 г. этот вариант был повторен Корлиссом без изменений; некоторые изменения, не касающиеся хонотрих, предложены Корлиссом в 1969 г.
Добжанская-Качановская, найдя общие черты в строении Heterochona и A llosphae-rium, вводит хонотрих в состав Gymnostomata; «вследствие ароморфного характера морфогенеза» для них предлагается ранг подотряда. Правомерность введения хонотрих в отряд гимностомат ею даже не обсуждается. У настоящих гимностомат РПА нет, у хонотрих же РПА достаточно сложный; вопреки этому автор указывает, что у хонотрих «ротовые кинеты недоразвиты», «цитостом голый — без корзинки, без специализированных буккальных сегментов соматических кинет». Добжанская-Качановская считает, что в связи с предлагаемым снижением ранга хонотрих до подотряда и, возможно, до семейства необходимо дать иной диагноз всему отряду Gymnostomata, но отсутствие достаточных данных по Prostomata и Pleurostomata (Rhabdophorina в целом) делает эту попытку невозможной. Логично поступить наоборот: сначала сравнить диагнозы групп, а затем решить, совместимы ли они. Естественно, что при объединении подобных таксонов невозможно дать характеристику получившемуся набору форм. Кроме того, нельзя менять диагноз таксона до неузнаваемости. Столь же скудна аргументация Раабе: томиты хонотрих, по данным Гийше и Добжанской-Качановской, настолько напоминают Hypostomata, что Chonotricha можно включить в Gymnostomata как один из подотрядов (Raabe, 1964а, 1964с).
Новая схема Раабе отличается от предыдущей повышением ранга сукторий до класса и подразделением холотрих на низших и высших. У Holotricha s. str. РПА простой, якобы без мембран и мембранелл, имеющихся у Hymenotricha. Хонотрихи сохраняют прежний ранг и место (подотряд гимностомат). По Раабе (Raabe, 1964с : 179), хонотрих, поскольку томиты их напоминают хилодонелл и Allosphaerium, «можно трактовать как сильно специализированную ветвь развития Gymnostomata; высокая степень этой специализации позволяет рассматривать их как отдельный подотряд». При включении хонотрих в состав гимностомат не изменен традиционный диагноз голоротых, в котором всегда отрицается наличие РПА: «этот отряд считается наиболее примитивной группой среди Holotricha и в целом среди Ciliata, в основном в связи с простым строением своего ротового аппарата. Цитостом их лежит на поверхности тела, а не на дне какого-либо углубления, как у больпгинства других инфузорий, и не снабжен никакими дифференцировками ресничного аппарата» (ibid. : 173). Отрицать наличие у хонотрих предротовой полости и специального РПА нельзя, поэтому диагнозы гимностомат и хонотрих у Раабе попросту не сравниваются. Мор не поддерживает эту схему, оперируя, правда, косвенными, не имеющими отношения к делу признаками: подчеркивается геологическая древность группы и длительная параллельная эволюция хонотрих и хозяев (Mohr, 1966). Выяснение близкого родства хонотрих и гимностомат еще не указывает «горизонтального и вертикального» положения хонотрих в системе (ранга и места); это скорее подкласс (Mohr a. Matsudo, 1970).
ПЕРВЫЙ ВАРИАНТ АВТОРА
Вариант Штейна—Каля на первый взгляд четкий, логичный, но при внимательном анализе обнаруживается ряд серьезных недостатков, нуждающихся в обсуждении и исправлении. В основном наши замечания сводятся к следующему (Янковский, 1967а, 19676): диагнозы ряда групп не соответствуют фактическому материалу; названия некоторых таксонов используются не в первоначальном значении; имеются гетерогенные группы с неопределенной характеристикой.
Приведем краткое пояснение предложенной нами схемы (Янковский, 19676). Нами принято введенное Бючли подразделение инфузорий на три общие группы по способу питания — классы Gymnostomea, Trichostomata sensu Biitschli и Tentacultfera. У первых имеются рот и глотка без РПА и предротовой полости; у вторых рот обычно погружен, имеется РПА (не считая вторичнобезротых паразитов); третьи питаются с помощью щупалец. Это логичное и естественное подразделение. Название Trichostomata используется всеми авторами для отряда цилиат, а не для всех ресничноротых, как предложил Бючли; поэтому мы заменили его новым — Ciliostomea. Gymnostomata очищены от ресничноротых форм, диагноз группы теперь соответствует ее составу. Формы с РПА перенесены в состав цилиостомат, где локсодиды включены в Trichostomatida, гипосто-матиды выделены в самостоятельный отряд, а нассулиды объединены с микротораци-дами в новый отряд Ambihymenida, сближаемый с Hymenostomatida. Классы Gymnostomea и Tentaculifera довольно однородны и делятся непосредственно на отряды; к Ciliostomea относится большинство инфузорий, пути эволюции их многообразны.
дивергенция шире, чем в двух первых группах; структура таксона поэтому сложная. В эволюции цилиостомат различимы три этапа, три уровня организации — формы с кп-нетофрагмоном, с тетрахименовым и полихименовым РПА. Мы подразделили вначале Holotricha на низшие и высшие формы; затем пившие холотрихи были объединены с хонотрихами (имеющими кинетофрагмон), высшие — с перитрихами (имеющими те-трахименовую АЗМ); в составе спиротрих низшие и высшие формы (Polytrlcha и ОН-gotricha) были выделены Бючли.
Класс цилиостомат разделен нами на три подкласса — Fragmophora,. Tetrahymeno-phora и Polyhymenophora (спиротрихи). Инфузории в каждом подклассе при сходном типе РПА различаются по наличию или отсутствию соматической цилиатуры, образуя надотряды. Такая дифференцировка определяет различия по всему комплексу признаков. Низшие цилиостоматы (фрагмофоры) включают надотряд подвижных инфузорий, сохраняющих цилиатуру, и надотряд хонотрих; к тетрахименовым цилиостоматам относятся подвижные формы и перитрихи (сидячие и вторичноподвижные, но без цилиатуры обычного типа). В составе высших цилиостомат формам с соматической цилиату-рой противопоставляются олиготрихи, утерявшие этот покров и плавающие с помощью апикальной части АЗМ. В этой системе перитрихи, хонотрихи и олиготрихи сравниваются с предками в рамках подклассов, получая при этом достаточно высокий ранг. Система основана на серии соподчиненных признаков: тип ротового аппарата и способ питания (классы инфузорий), тип РПА и способ стоматогенеза (подклассы в классе цилиостомат), наличие или утеря соматической цилиатуры (надотряды в каждом подклассе).
ВТОРОЙ ВАРИАНТ АВТОРА
Данные по филогении Entodiniomorphida имеют решающее значение для систематики инфузорий. В цикле работ Нуаро-Тимоте (Noirot-Timothee, 1960, 1969) и Вольской (Wolska, 1966а, 1966b) на основе инфрацилиатуры и ее морфогенеза у гимностомат, трихостомат и энтодиниоморф из непарнокопытных и жвачных авторы ставят вопрос о неправомерности включения энтодиниоморф в Spirotricha. Пожалуй, ранее никто не сомневался в том, что это высшие спиротрихи; их сближали с олиго-трихами и гетеротрихами, никогда не указывая конкретных предков. В работах ряда авторов по РПА энтодиниоморф нет все же описания типичного для спиротрих по-лихимениума (УМ+МХ, М2, М3 . . . Мя), легко видимого у остальных групп подкласса и весьма стабильного в эволюции спиротрих; находили лишь полукольцо тесно сближенных гаплокинет и инфундибулярную полосу кинетосом, отделенную от наружной. ' У большинства родов видна и дополнительная, третья полоса кинет. Хорошо изучен стоматогенез энтодиниоморф: одна из полос закладывается в средней части тела, вентрально, затем справа от нее — другая; они растут друг к другу, соединяются и погружаются в предротовую полость. Такого рода стоматогенеза нет у спиротрих, но он обычен у трихостомат типа Plagiopyla, Balantidium (Faure-Fremiet, 1950с). РПА энтодиниоморф напоминает РПА трихостомат и тигмотактические зоны у рта гимностомат из тех же хозяев. К сожалению, мы не обратили ранее внимания на эти очевидные гомологии, считая энтодиниоморф достаточно хорошо изученной группой. Как правило, у гимно- и трихостомат различимы две полосы кинет, нет УМ и мембранелл. Как и у энтодиниоморф, соматическая цилиатура у многих гимностомат почти редуцирована, остались лишь продольные псевдокинеты (ряды аргиросом). Те же две полосы кинет различимы у рта свободноживущих трихостомат (у кольподид, баланти-диид, вудреффиид); они несколько видоизменены у локсодид, гелеиид и т. д. Полосы можно распознать также у аберрантных трихостомат типа Trimyema, Plagiopyla, Isotricha. Можно вспомнить, что именно вследствие обнаружения таких полос гаплокинет и стоматогенеза по типу Plagiopyla (появление двух экваториальных полос фрагментов) Форе-Фремье перенес род Balantidium из спиротрих в отряд трихостомат; другими авторами из спиротрих удалены Woodruffia, Stentoropsis, Balantidioides, Paranyctotherus (в отряд Trichostomata), Andreula, Porpostoma, Neobursaridium (в отряд Hymenostomata), Cyathodinium (в класс Suctoria или в Trichostomata}. По гипотезе Вольской, чужеродными оказываются уже не отдельные роды, а группа энтодиниоморф в целом.
Большое филогенетическое значение имеет способ стоматогенеза. У спиротрих имеются два способа — автономный и апокинетический. В первом случае сохранена соматическая цилиатура, зачатковая группа кинетосом (не кинет!) выделяется группой вентральных рядов, постепенно в аморфном зачатке обособляется ряд поликинет — оснований мембранелл. При утрате цилиатуры имеет место апокинетический Стоматогенез: зачаток образуется вблизи РПА особи, но вне связи с ним (путем индукции?). Погружение зачатка происходит быстро, а у олиготрих стоматогенез вообще идет глубоко под поверхностью тела, в «стоматогенном канале». Апокинетический морфогенез не встречается у холотрих и перитрих. У нас сложилось глубокое убеждение в том, что по мере эволюции инфузорий РПА может упрощаться и исчезать, но стоматогенез
только усложняется (в последовательности: соматический—автономный—независимый—апокинетический). При соматическом стоматогенезе отделяются либо регенерируют фрагменты соматических кипет, у части трихостомат к ним добавляются интер-калярпые фрагменты. Если энтодиниоморфы — действительно спиротрихи, у них мы нашли бы апокинетический морфогенез, а не соматический, как у трихостомат. Вольской выявлена идентичность хода стоматогенеза у энтодиниоморф и трпхостомат типа Paraisotricha и Rhizotricha; Нуаро-Тимоте обращает внимание на стоматогенев у рода Raabena и сем. Blepharocorythidae в целом. И структура РПА, и способ его вое произведения действительно исключают родство энтодиниоморф со спиротрихами и
CILIOPHORA
FLAGELLATA
Схема 3. Схема классификации инфузорий.
Звездочкой отмечены условные, не латинские названия групп.
сближают их с трихостоматами. У гимно- и трихостомат имеется латеральная тигмо-тактическая полоса из нескольких сближенных фрагментов кинет. Ее нет у всех остальных инфузорий, кроме энтодиниоморф. И это сходство не может быть случайностью.
Энтодиниоморф считали высшими инфузориями, пожалуй, лишь ввиду их сложного строения, но это не значит, что столь сложным инфузориям место только в группе Spirotrlcha. Для определения филогении важен и экологический аспект. Неизвестна ни одна эндопаразитическая олиготриха, кроме Strobilldium из морских ежей. Среди гетеротрих известно немало паразитов, но они живут в беспозвоночных, рыбах, амфибиях и рептилиях, т. е. в холоднокровных хозяевах (например, Plagiotomidae, Cleve-landellidae, часть Metopidae), и никогда не встречаются в теплокровных (млекопитающих), В морфологическом отношении энтодиниоморфы не имеют с ними ничего общего. В то же время виды гимно- и трихостомат не только обычны в млекопитающих, но и образуют богатейшую фауну в пищевом тракте непарнокопытных и жвачных, встречаясь совместно с энтодиниоморфами. Последние вполне могли взять начало от одной из групп трихостомат, а затем широко расселились по хозяевам.
Выведение отряда энтодиниоморф из состава спиротрих усложняет систему инфузорий. Энтодиниоморф, несомненно, нельзя включить в состав Holotricha, хотя они
произошли от трихостомат: у холотрих, исключая отдельные аберрантные роды, сохранена соматическая цилиатура, утерянная у энтодиниоморф. В схеме Штейна—Каля для них следует выделить новый, пятый подкласс цилиат; это хорошо отразит и своеобразие группы, и отсутствие ее родства со спиротрихами. Нельзя сохранить без изменений и нашу схему 1967 г. Основная работа Вольской с изложением гипотезы вышла в 1966 г., когда наша статья была уже в печати; понадобилось также время, чтобы ознакомиться с другой литературой по энтодиниоморфам, паразитическим гимно- и три-хостомдтам и составить собственное мнение о происхождении первой группы. В схеме 1967 г. энтодиниоморфы отнесены поэтому к спиротрихам.
С исключением Entodiniomorpha из состава спиротрих сохранить далее наш вариант нельзя. Формально группа энтодиниоморф удовлетворяет диагнозу Fragmo-phora (наличие кинетофрагмона), и само по себе выведение ее из состава спиротрих не нарушает принципов нашей схемы: инфузорий по-прежнему можно подразделять на голоротых, ресничноротых и щупальцевых, а ресничноротых далее на группы с тремя разными типами РПА (кинетофрагмон, тетра- и полихимениум). Однако если ввести Entodiniomorpha в состав Fragmophora в качестве третьего надотряда (ранг отряда для них слишком низок), то таксон Fragmophora (а с ним и вся схема) будет выглядеть искусственным. Он объединит три довольно разнородные группы — подвижные формы типа Balantidium, крупные аберрантные таксоны Chonotricha и Entodiniomorpha.
В итоге мы вынуждены вернуться к общепринятой системе Штейна—Каля с небольшой модификацией: к пяти высшим таксонам схемы (Holotricha, Peritricha, Chono-tricha, Spirotricha и Suctoria) добавляется новый — подкласс Entodiniomorpha Jankowski, 1970, класса Ciliata (с одним отрядом Entodiniomorphida Reichenow, 1929).
В остальном состав отрядов и подотрядов в классе Ciliata по сравнению с нашим прежним вариантом не изменен; неясно лишь, являются ли щелеротые Gymnostomata цельной монофилетической группой. Поэтому в составе голоротых мы различаем пока один отряд. Внесены некоторые изменения в структуру класса Suctoria (схема 3).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ПОДОТРЯДОВ ОТРЯДА CHONOTRICHIDA
1 (2). Почкование наружное; зародышевая сумка (marsupium) отсутствует . . . . .........................................I. Подотряд Exogemmina (стр. 186).
2 (1). Почкование внутреннее; имеется зародышевая сумка, в которой развивается томит.................................II. Подотряд Endogemmina (стр. 279).
I. Подотряд EXOGEMMINA Jankowski, 1972
Почкование наружное, зародышевой сумки нет. Одиночные и колониальные (кле-матохона) инфузории, в основном крупные, вытянутые (60—180 мк, максимум 360 мк). Тело обычно удлиненное, цилиндрическое, не сплющенное; шейка хорошо выражена у большинства родов, часто вытянута. ПВ коническая или слабо сплющена. РПА хорошо развит, усложнен, полоса А часто расслаивается на две; у хилодохонид кинеты полимеризованы. Инверсия зон РПА, частая у эидогеммин, отсутствует. ПВ с непарным защитным щитком или лепестками, превратившимися у филлохон в гигантскую пластинку и у спирохон в завиток. Шипы в целом плохо развиты, встречаются у 5 из 14 родов, причем каждый имеет лишь один тип шипов (маргинальные, гипоколлярные или латеральные), в отличие от эидогеммин, у которых часто образуются комплексы шипов. Гипоколлюм имеется только у Filichona. Прикрепление к субстрату обычно ножкой (11 родов), реже стебельком (4 рода); ампула обычно одна (у трофонтов спирохонид утеряна; у хилодохонид ампулы многочисленны). Подошва с субтерминальной ножкой (педоморфоз) имеется у филлохон и гелиохон, возможно и у филихон. Ложные стебельки нередки у лобохон, энофорахон, гетерохон и у высших спирохонид. Особенности жизненного цикла: небольшое число томитов, отделяемых при полигёммии (2—3); отсутствие анактинид (бесшиповых копий); отсутствие диминутивного почкования и поли-геммии у хилодохонид, способных к тотальному переходу в томита (трофотомита).
Подотряд включает 6 семейств, 15 родов и 54 вида (около половины видов, семейств и 2/6 родов отряда). Провизорные группы по Мору: мизидохониды (мизидохона) и кле-матохониды (клематохона). Экзогеммины, как и их хозяева, — обычные, широко распространенные формы, живущие на водорослях (Epymenia) и Crustacea отрядов Isopoda (Limnoriidae, Sphaeromidae, Idotheidae), Amphipoda (Gammaridae, Amphithoidae, Talit-ridae), Mysidacea (Lophogastrida, Mysidd) и Decapoda (N atantia, Reptantia Brachyura, Macrura, Апотига). Локализация: у декапод на ротовых придатках, у изопод на плеоподах, у мизид на ротовых частях, конечностях и оостегитах, у амфипод почти на всех придатках, кроме тельсона. Пресноводные (в Голарктике), морские и солоноватоводные виды.
Эволюция экзогеммин начинается с примитивнейших хонотрих (Lobochona и Oenophorachona), далее идет разными путями: у спирохонид образуются дейтерохон, спирально свернутая защитная пластинка, у филлохонид — листовидный вырост ПВ, у гелиохонид — маргинальные шипы, у филихопид — гипоколлярные шипы, у хилодохонид полимеризуются кинеты ПВ и образуется стебелек. Типовой род — Spirochona Stein, 1852.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ СЕМЕЙСТВ ПОДОТРЯДА EXOGEMMINA .
1 (4). ПВ вооружена шипами.
2 (3). Тело листовидное, сплющено дорзо-вентрально; дорзальный край ПВ с защитной пластинкой...........................III. Сем. Phyllochonidae (стр. 203).
3 (2). Тело бутылковидное; дорзальный край ПВ с парными лепестками . . . . ......................................... IV. Сем. Heliochonidae (стр. 205).
4 (1). Края ПВ лишены шипов.
5 (6). Имеются гипоколлярные шипы..........II. Сем. Filichonidae (стр. 199).
6 (5). Гипоколлярных шипов нет.
7 (8). Имеется спиральный завиток дорзальной стенки ПВ..................
................................... VI. Сем. Spirochonidae (стр. 235).
8 (7). Спирального завитка ПВ нет.
9 (10). Стенки тела и ПВ утолщены. Предротовые кинеты и ампулы полимеризованы ..........................................V. Сем. Chilodochonidae (стр. 228).
10 (9). Стенки тела и ПВ не утолщены, обычного типа. Нет полимеризации кинет и ампул.....................................I. Сем. Lobochonidae (стр. 187).
I. Семейство LOBOCHONIDAE Jankowski, 1967
Янковский, 19676 : 41.
Крупные одиночные инфузории с бутылковидным, удлиненным, несплющенным телом; шейка четкая, удлиненная (кроме элейтерохон). ПВ простая, коническая, не сплющена, без вентральных складок; дорзальный край приподнят, обычно с лепестками; боковые карманы развиты лишь у некоторых лобохон. Кинеты не полимеризованы (7—8 в полосе А, 20—22 в полосе В); полоса А цельная. Нет гипоколлюма и шипов. Ма овальный. Прикрепление терминальной ножкой или (у элейтерохон) стебельком. Ампула одна. Форм с подошвой нет; псевдостил развит лишь у одного из видов эно-форахон.
Семейство предложено для наиболее примитивных хонотрих с простой формой тела и воронки, без шипов (отличие от Heliochonidae и Filichonidae), без дейтерохона (отличие от Spirochonidae), без полимеризации кинет и ампул (отличие от Chilodochonidae)', от аберрантных Phyllochonidae лобохониды отличаются практически по всем признакам.
С 4 родами — Lobochona (типовой), Oenophorachona, Toxochona и Eleutherochona. Первых три рода образуют компактную группу, стебельчатая энофорахона с короткой шейкой обособлена. Субстрат и хозяева: водоросли Epymenia', плеоподы изопод Limnoria', антенны, ротовые части, плео- и гнатоподы амфипод Anisogammarus. Обитают в чисто морской и в солоноватой воде. Lobochona имеет всесветное распространение, Oenophorachona и Toxochona встречаются в северной Пацифике, Eleutherochona—эндемик о. Трйстан-да-Кунья (Чили).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА LOBOCHONIDAE
1 (2). Стебельчатые формы . . . ,...........4. Род Eleutherochona (стр. 199).
2 (1). Стебелька нет, имеется ножка.
3 (4). Высота ножки не превышает ее ширину. Развиты дорзальные лепестки ПВ ..............................................1. Род Lobochona (стр. 187).
4 (3). Высота ножки значительно превышает ее толщину. Лепестки ПВ едва намечаются или отсутствуют.
5 (6). Шейка длиннее тела......................3. Род Toxochona (стр. 198).
6 (5). Шейка короче тела....................2. Род Oenophorachona (стр. 194).
1. Род LOBOCHONA Dons, 1940
Сапп, 1886 : 30 (Spirochona, part.); К о f о i d, 1927 : 330 (Spirochona, part.); Dons, 1940 : 115, 116; N e a v e, 1950 : 141 (с ошибочной датой: 1941);C о г 1 i s s, 1961 : 135; Mohr a. oth., 1963a : 227; 1963b : 121; Matsudo a. Mohr, 1964:125; 1965 : 524; Dales, 1966 : 302; M a t s u d o, 1966 : 359; 1967a : 3; Mohr, 1966: 359; M a t s u d о a. M о h г, 1968 : 281.
Тело удлиненное, веретеновидное, с характерным перехватом на границе с шейкой; шейка четкая, по относительно короткая (1/4—1/е длины тела). Часто сужена и вытянута передняя половина или треть тела, между Ма и шейкой. ПВ крупная, с развитыми, иногда зазубренными лепестками, с дорзальными складками, иногда с карманами. Прикрепление короткой ножкой, ширина которой превышает высоту. Псевдостил отсутствует.
Род четкий: нет стебелька (отличие от элейтерохон), резкого удлинения шейки и ножки (отличие от энофорахон и токсохон); развиты лепестки ПВ, отсутствующие у других родов. Род крупный, включает, вероятно, около 30 видов (по числу видов лимнорий); пока описаны 4 вида с плеопод Limnoria и Рaralimnoria : Lobochona limnoriae (типовой), L. 'prorates, L. insularum и L. tenue. Стеногалинные формы, не выносящие опреснения. Как и хозяева, род имеет космополитное распространение, обычен и в наших морях (Баренцевом, Белом, Японском, Охотском, Беринговом). Находки вне СССР см. в табл. 3.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА LOBOCHONA
1 (2). Лепестки ПВ очень крупные, прямоугольные или трапециевидные, часто за-
зубрены ...................................................1. L. limnoriae.
2 (1). Лепестки мелкие, сужаются к вершине, не зазубрены.
3 (4). Лепестки едва выражены, почти треугольные.................3. L. insularum.
4 (3). Лепестки отчетливые, плавно закругленные.
5 (6). ПВ со складками и боковыми карманами..........................4. L. tenue.
6 (5). Складок и карманов ПВ нет . . . . ......................... 2. L. prorates.
1. Lobochona limnoriae Dons, 1940 (рис. 1, Г; 2, А; 12, Б, В; 18, Е, Ж; 19, Д, Е; 20, Е—И; 23, Б, В; 30, К; 31, Г—Е-, 32, Д; 56, А— И, Л, С; 57—59; 60, Д—И-, 63, А).
Dons, 1940 : 115, 116, Fig. 1, 4, 5; Mohr, 1959b : 88, fig. 7, А (вид не указан); Mohr a. oth., 1963a : 228, fig. 5; Matsudo a. Mohr, 1964 : 125, fig. 3.
Крупные удлиненные формы; тело веретеновидное, наиболее широкое в нижней трети. Участок между Ма и шейкой сужен и вытянут. Шейка тонкая, четкая, плавно переходит в ПВ и резко отграничена перехватом от тела. ПВ очень крупная, с 2—4 дорзальными складками и боковыми карманами. Лепестки крупные, прямоугольные и иногда трапециевидные, расширяются кверху; вершина их часто с зубцами и складками. Ампула, эндостил и ножка относительно небольшие.
Установлена расовая изменчивость. С типовой расой (рис. 56, А —И) внешне сходны баренцевоморская и беломорская расы, но последняя значительно крупнее типовой. Камчатская раса мелкая, особи тонкие, Ма удален далеко вниз от шейки.
Размеры. Типовая раса (по Донсу): длина особи ( с лепестками?) 54—87 мк; размеры тела 40—67 X 14—20 мк; длина шейки и ПВ 15—20 мк; ширина шейки 3—5 мк, ПВ 17—27 мк; размеры Ма 8—14 >< 5—7 мк. Раса Мора (Mohr a. oth., 1963а — Норвегия или западный берег США): длина особи 40—67 мк, шейки 3—5 мк; размеры тела 35— 42x13—19 мк, ПВ 12—20x13—27 мк, Ма 8—14x5—7 мк; диам. диска 4.5—6 мк. Мурманская раса: длина особи 64—69 мк, с лепестками 70—75 мк; Б : D (отношение длины особи к ширине)=3.5 : 1; размеры тела 50Х 19 мк; длина шейки 4 мк, ПВ 25 мк, лепестков 6—7 мк; размеры Ма 15x8 мк, томита 20—23х 11—13 мк. Беринговоморская раса: длина особи 69—75 мк; размеры тела 50—54х 15—17 мк, шейки 6—7Х 4—4.5 мк, ПВ 12—14X20—24.5 мк; L : D=5 : 1; длина лепестков 6—6.5 мк, ампулы 2.5—3 мк, эндостила 3 мк; диам. диска 5.5—6 мк; размеры ножки 2X5.5 мк, Ма 13—16X6—8 мк, томита 20—23Х 14 мк. Беломорская раса: длина особи 93—101 мк, с лепестками 103— 110 мк; L : D=4 : 1; размеры тела 66—77 X 20—24 мк, шейки Их 3—5 мк, ПВ 15—17 X Х26—33 мк, лепестков 9x7—9 мк; длина ампулы 4.5—5 мк, эндостила 4.5 мк; диам. диска 6—8 мк; размеры ножки 3.5x5—5.5 мк, Ма 16—19><10—12 мк, томитов 33— 34x18—21 мк.
Вид четкий, крупнее других известных лобохон; перехват наиболее узкий, ПВ наиболее широкая, лепестки особо развиты, угловатые, не закругленные.
Локус и хозяин — щетинки плеопод Limnoria lignorum по всей их длине, обычно в средней и верхней части. Вид весьма частый, массовый (6—20 особей на плеоподе).
Распространение. СССР: Баренцево море, Мурман, Дальние Зеленцы, глуб. 1 м; Белое море, Чупа, глуб. 4—5 м; Камчатка, Авачинская губа. Находки вне СССР: Норвегия (типовая раса описана Донсом из Хьеллеботна в Бейтстадфьордё, внутри Трондхеймсфьорда; другие расы найдены Мором по всему побережью Норвегии) и США (Вашингтон, бухта Фрайди; Орегон, бухта Коос; Калифорния, бухта Гумбольдта — Мор, Мацудо). Хозяин распространен в холодных морях северного полушария.
2. Lobochona prorates Mohr, LeVeque et Matsudo, 1963 (рис. 1, У; 30, Ж; 39; 42, А—В; 48, P; 49, Б—M; 52, Р—Щ; 56, М, О—Р).
С а п и, 1886 : 30 {Spirochona crystallina?); К о f о i d, 1927 : 330 {Spirochona sp.); Mohr, 1959b : 88, fig. 7B (вид не назван); Mohr a. oth., 1963a : 228, fig. 1, 6—11;,
Matsudo a. Mohr, 1964 : 125, fig. 2; Matsudo, 1966 : 359, pl. 1—9 (кроме рис. 12, 22—24 и 60); 1967a :3; Matsudo a. Mohr, 1968 : 284.
Относительно некрупные формы; тело овальное, особо широкое в пижпой части. Участок тепа выше Ма не удлинен. Шейка шире и короче, чем у L. limnoriae. ПВ не столь широка; нет дорзальных складок и боковых карманов. Лепестки ПВ относительно невысокие, плавно закруглены, никогда не зазубрены. Ампула и эндостил крупные.
Рис. 56. А—И — Lobochona limnoriae с Limnoria lignorum (по: Dons, 1940);' R—M — лобохоны c Limnoria andrewsi, L. lignoruni и L. tripunctata (no: Mohr, 1959b); H — Lobochona insularum c Limnoria andrewsi (no: Matsudo a. Mohr, 1964); О—P — Lobochona prorates c Limnoria tripunctata; C —
Lobochona limnoriae c Limnoria lignorum (no: Mohr a. oth., 1963a).
P а в м e p ы. Типовая раса (по Мору и сотр.): длина особи (с лепестками?) 43.5— 64.5 мк; L : D=3.2 : 1; размеры тела 32.2—46.7X10.7—13 мк; длина шейки+ПВ 12.2—17.6 мк; ширина шейки 4.9—6.2 мк, ПВ 16.1—20.7 мк, ножки (диаметр диска?) 6.9—9.2 мк; размеры Ма 10—17.6x7.7—10 мк, Ми 1—2 мк. Калифорнийская раса (по Мацудо): длина особи 45—60 мк; размеры Ма 8—10x7—9 мк; длина томита 25— 28 мк.
Вид четкий, меньше L. limnoriae, с более широким телом, короткой шейкой и закругленными лепестками, более крупными, чем у L. insularum. ПВ без складок, имеющихся у L. tenue.
Локус и хозяин — основание щетинок плеопод Limnoria tripunctata(L. tuberculata). Такой локус — тоже видовой признак, хотя на него не обратили внимания Мор и Ма-
цудо: остальные виды рода заселяют лишь среднюю и верхнюю части щетинок. Одиночные особи вида на амфиподе Chelura из ходов лимнорий (Mohr a. oth., 1963а; Matsudo a. Mohr, 1968) оказались особым видом (и родом?) хонотрих. Заражение лпмпорпй слабое: осмотр более 1000 особей выявил единичных хонотрих у 10—15% рачков (Мацудо).
Рис. 57. Lobochona limnoriae с Limnoria lignorum. Белое море.
Распространение. Место сбора типовой расы не указано; Мором упомянуты бухты Ньюпорт, Лос-Анджелес и Сан-Педро в Калифорнии (США). Хозяин обычен в теплых морях; L. prorates или формы такого типа отмечены во Франции (Круа и Ла-Креш близ Вимерё, Дуврский пролив), у берегов Марокко, Мавритании, Греции (о. Тазос), в Адриатике, Португалии (эстуарий Доуро), на Филиппинах (Манила),
в калифорнийских заливах (Лонг-Бич, Сан-Диего, Ньюпорт и др.; см.: Сапп, 1886; Monod, 1925; Kofoid, 1927; Mohr, 1959b; Mohr a. oth., 1963a; Mohr a. Matsudo, 1970; Matsudo, 1966).
Рис. 58. Lobochona limnoriae c Limnoria lignorum. Белое море.
3. Lobochona insularum Matsudo et Mohr, 1964 (рис. 1, Ф; 56, jK, H).
Mohr, 1959b: fig. 7, С (вид не назван); M at sudo a. Mohr, 1964 : 125, fig. 1; M a t s u d o, 1966 : 364; Mohr, 1966 : 536, fig. 1, A.
Рис. 59. Lobochona limnoriae c Limnoria lignorum. Камчатка.
Относительно некрупные формы, тело овальное, края почти параллельны. Участок между Ма и шейкой не вытянут. Шейка длинная и широкая, без столь четкого перехвата, как у L. limnoriae. ПВ неширокая, обычно не шире тела, лишена дорзальных складок и боковых карманов. Лепестки ПВ плохо развиты — мелкие, почти треугольные, всегда без зубчиков. Ампула небольшая; опорный диск очень широкий.
Размеры (Matsudo a. Mohr, 1964). Длина особи 50—63 мк; L : D=3.1 : 1; размеры тела 34—50X15—18 мк; высота ПВ (и шейки?) 15—25 мк; ширина шейки 5—7.5 мк, ПВ 13—17 мк; длина лепестков 2.5—5 мк; диам. диска 7.5—12 мк; размеры Ма 11—13X7.5—11 мк, Ми 2.1—2.3 мк.
Рис. 60. Хонотрихи с Limnoria lignorum. А—Г — Lobochona sp., Итуруп; Д—И — L. limnoriae, Камчатка (Д—Ж) и Белое море (3, И}', К—Н — L. tenue, Путятин.
Формой тела вид напоминает L. prorates", лепестки ПВ не прямоугольные, как у L. limnoriae, и не закругленные, как у L. prorates", нет складок и карманов ПВ, имеющихся у L. limnoriae и L. tenue.
Локус и хозяин — щетинки плеопод (вероятно, средний и дистальный отделы) Limnoria sp., предположительно L. (Paralimnoria) andrewst: осматривались лишь фик
сированные плеоподы рачков из Гонолулу, где встречается также L. tuberculata и могут быть другие виды.
Распространение. США, Гавайские о-ва, о. Оаху, пос. Ваикики близ Гонолулу (Mohr, 1959b; Mohr a. oth., 1963а; Matsudo a. Mohr, 1964; Mohr a. Matsudo,
Рис.
61. Lobochona tenue
c Limnoria lignorum. Путятин,
Рис. 62. Lobochona tenue c Limnoria lignorum. Путятин.
1970). По Мору, возможна находка вида в других субтропических зонах, в частности в южной Флориде, где встречается хозяин. Первоначально L. andrew'si описан с о. Пасхи, затем найден на Самоа, Гавайях; в фауне СССР отсутствует.
13 Заказ № 213
4. Lobochona tenue Jankowski sp. nov. (рис. 12, 7Л'; 20, K, JI; 31, Ж, 3; 60, K—H; 61; 62; 63, Б—Г).
Относительно некрупные формы; тело тонкое, вытянутое, трубчатое. Участок тела выше Ма тонкий и длинный. Шейка тонкая, отделена от тела перехватом. ПВ некрупная; развиты 2—3, иногда все 4 складки эпихона и боковые карманы. Лепестки развиты плохо, небольшие, закругленные, иногда с исчерченностыо, но всегда без зубчиков, отсутствуют у части особей. Ампула очень мелкая.
Размеры. Типовая раса с Путятина: длина особи 68—82 мк; L : D=5—6 : 1; размеры тела 55—62 х 13—18 мк, шейки 7—9 X 3.5—4 мк, ПВ 10—14x20—21 мк; длина лепестков до 3 мк, ампулы 2—2.5 мк, эндостила 4 мк; диам. диска 6—6.5 мк; размеры ножки 2x6 мк, Ма 14—15x7.5—8 мк, Ми 1.7 мк, томита 26—32x13—15 мк. Раса с Кунашира: длина особи до 60 мк; L : D = 4 : 1; размеры тела 40—42\12—14 мк, шейки 5—6x3—4 мк, ПВ 12—13X15—19 мк; длина лепестков 2—4 мк, ампулы 4 мк, эндостила 3—4 мк; диам. диска 6—7 мк; размеры ножки 2—Зх 6 мк, Ма 15—16x6—9мк, томита 21—24x16—18 мк.
В отличие от L. insularum и L. prorates тело 'L. tenue вытянуто, ПВ складчатая; лепестки развиты слабее, чем у L. limnoriae.
Локус и хозяин — средняя и верхняя части щетинок плеопод Limnoria lignorum', щетинка может нести 5—7 особей, плеопода — 90—100 особей, рачок — до 1500 особей. Это наиболее массовый вид рода.
Распространение. Японское море, о. Путятин, литораль, глуб. 1 м (типовая раса); о. Кунашир, зал. Измены, литораль.
ПРИЛОЖЕНИЕ
«Spirochona crystallina» Сапп, 1886.
В работе по спирохонам Кану мельком упоминает о находке нового вида на Limnoria lignorum во Франции (у Круа и Ла-Креш близ Вимерё, в Дуврском проливе). Морфология не описана; отмечено лишь, что вид мельче S. gemmipara и совершенно прозрачный; рисунков нет. Вид никем позднее не признавался; Мор и Мацудо (Mohr, 1948 [с ошибочной датой описания вида — 1888]; Mohr a. oth., 1963а; Mohr a. Matsudo, 1970) считают название Кану nomen nudum: это Lobochona или другая хонотриха, но, очевидно, не L. limnoriae, поскольку здесь обитает Limnoria tuberculata с Lobochona prorates, а не северная Limnoria lignorum.
2. Род OENOPHORACHONA Matsudo et Mohr, 1968
Matsudo a. Mohr, 1968 : 281.
Тело вытянутое, бутылковидное; шейка широкая, удлинённая, равномерной толщины или слегка вздутая в среднем отделе, без перехвата у основания, выраженного у лобохон. Участок тела выше Ма не удлинен; вытянута, напротив, нижняя часть тела, образующая подобие ложного стебелька спирохонид. ПВ массивная, шире тела. ПВ типового вида Ое. ectenolaemus в целом нетипична для рода, слишком простая; мы находили лишь формы с 2—3 неглубокими дорзальными складками ПВ, небольшими боковыми карманами, а часто и с едва развитыми лепестками. Прикрепление к субстрату высокой ножкой, длина которой примерно вдвое превышает ширину. Ампула намного крупнее, чем у лобохон.
В отличие от Eleutherochona нет настоящего, удлиненного стебелька, тело и шейка вытянуты; ножка и ампула крупнее, чем у лобохон, лепестки (если имеются) значительно мельче; шейка короче, чем у Toxochona. Род очень близок к Lobochona', основные отличия: удлинение ножки, шейки, слабое развитие лепестков, развитие ложного стебелька, обитание на разных хозяевах. Сливать роды в один нецелесообразно.
Род крупный; пока описано 3 вида со стебелька плеопод A nisogammarus (локус, редкий у хонотрих): Ое. ectenolaemus (типовой вид), Ое. urceolata и Ое. sagitta. Это обитатели морской и солоноватой воды, выносят регулярное опреснение. Ареал рода должен совпадать с ареалом хозяев (A nisogammarus) — моря северо-восточной и северо-западной частей Тихого океана (Берингово, Охотское, Японское моря; побережья штатов Вашингтон, Орегон и Северная Калифорния в США).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА OENOPHORACHONA
1 (2). Верхняя, и нижняя части тела резко удлинены, L : D=8 : 1 . . . 3. Ое. sagitta. 2 (1). Верхняя и нижняя части тела умеренной длины, L : D=4—5 : 1.
3 (4). Дорзальный край ПВ ровный, без лепестков, складок и боковых карманов ..... . ...................................... . . . 1. Ое. ectenolaemus.
4 (3). Дорзальный край ПВ неровный, с хорошо выраженными складками и карманами, с мелкими лепестками . . . . ..................2. Ое. urceolata.-
1 . Oenophorachona ectenolaemus Matsudo et Mohr, 1968 (рис. 1, M; 2, Б; 63, И—М). Matsudo a. Mohr, 1968 : 281, fig. 1—4,
Относительно некрупные формы; тело огурцевидное, расширено в передней трети-Участок тела выше Ма не вытянут, широкий. Шейка широкая, примерно в 5 раз ко-
Рис. 63.— Lobochona limnoriae с Limnoria lignorum, Белое море; Б—Г — L. tenue', Д—3 — Oenophorachona urceolata C A nisogammarus locustoides', И—М —Ое. ectenolaemus (по: Matsudo a; Mohr, 1968).
роче тела. ПВ конусовидная, простая, без продольных складок и боковых карйандв? дорзальный край выше вентрального, но не образует лепестков. Ложный стебёлей не выражен. Ножка высокая, не гофрирована; ампула округлая. ' -
Размеры. По Мацудо и Мору: длина особи 42—84.5 мк; размеры тела 40— 50.5x14—16 мк, ПВ (с шейкой?) 16—22x16—20.5 мк; ширина шейки 6—8мк; размеры ножки 3.8—4 мк, Ма 10— 14x9—10 мк.
Вид резко отличается от остальных лобохон: тело расширено в верхней части, не вытянуто, ПВ без лепестков и складок.
Локус и хозяин — плеоподы Anisogammarus sp. Мацудо и Мор дважды называют как локус «щетинки плеопод», но это, возможно, ошибка: мы находили энофорахон только на стебельке плеопод. Вид обычный, но не массовый: в США на 19 рачках из Филдс-Лендинга найдено 168 особей, на 15 из Крисент-Сити — 1890 особей.
Распространение. Морские и солоноватые воды западных штатов США— Калифорния (типовая раса; Эурека и Филдс-Лендинг в бухте Гумбольдт) и Вашингтон (о. Сан-Хуан, бухта Аргил).
2 . Oenophorachona urceolata Jankowski sp. nov. (рис. 24, A; 30, A; 50, A; 63, Д—3; 64; 65, A — E).
Крупные формы; тело удлиненное, веретеновидное, наиболее широкое в средней части, ниже Ма. Заметно сужен и вытянут участок тела выше Ма. Шейка широкая,
Рис. 64. Oenophorachona urceolata с A nisogamma-rus locustotdes.
не столь четко отграничена от тела, как у типового вида. ПВ с продольными дорзальными складками, иногда с лепестками, зубчиками; хорошо выражены боковые карманы. Ложный стебелек четкий, длинный, ампула поэтому вытянута. Ножка высокая, гофрированная, образована натеками плотного вещества.
Размеры. Типовая раса: размеры особи 82—88 мк; L : D=4 : 1; размеры тела 57—62x17—20 мк, шейки 12—16x7.5—8 мк, ПВ 19—20x27—28 мк; длина лепестков до 2 мк, ампулы 11—12 мк, эндостила 4 мк, псевдостила 11—15 мк; диам. диска 7—8 мк;. размеры ложки 6X4.5 мк, Ма 16—18x8—10 мк, Ми 1.8 мк, томита 32—ЗбХ 13—16 мк.
В отличие от Ое. ectenolaemus ПВ Ое. urceolata несет лепестки, складки; шейка и псевдостил короче, чем у Ое. sagitta.
Локус и хозяин — стебелек плеопод (в основном у вершины на стороне, обращенной к жабрам) Anisogammarus locustotdes. Вид обычный, массовый, придаток несет 10—40 трофонтов.
Распространение. О. Итуруп, бухта на юге острова, литораль (типовая раса); литораль Сахалина, Кунашира, Парамушира.
3 . Oenophorachona sagitta Jankowski sp. nov. (рис. 65, Ж, 3).
Наиболее крупный вид рода; тело удлинено в верхней и нижней части. Шейка резко вытянута. ПВ без лепестков, с глубокими складками и карманами. Псевдостил четкий, удлиненный; длина ампулы достигает V3 длины тела. Ножка высокая, складчатая.
Размеры. Длина особи 134—165 мк; L : D=8 : 1; размеры тела 112—122Х Х20—23 мк, шейки до 25X10 мк, ПВ 20—23X26—34 мк; длина ампулы до 41 мк, эндо-
стила 5 мк, псевдостила 60—65 мк; диам. диска 8—9 мк; размеры ножки 6x7 мк, Ма 17—25x8—10 мк, томита 38—46x20—23 мк.
В отличие от других энофорахон тело, псевдостил и ампула резко вытянуты; ;в отличие от Ое. ectenolaemus ПВ складчатая.
Локус и хозяин — вершина стебелька плеопод Anisogammarus tiuschovi; вид редкий, пока найдены лишь единичные особи.
Распространение. Японское море, Шкотовский район, литораль.
3. Род TOXOCHONA Jankowski, 1972
Крупные формы с относительно небольшим телом и резко удлиненной шейкой; тело веретеновидное, наиболее широкое в средней части. Шейка тонкая, хорошо отграничена от тела и ПВ, в 1г/2—2х/2 раза длиннее тела. ПВ некрупная, со слабо развитыми
Рис. 66. Toxochona mi-rabilts с Anisogammarus pribilofrfensis.
лепестками; складки и карманы не выражены. Прикрепление к субстрату — удлиненной ножкой, как у энофорахон, псевдостила нет. Ампула овальная, небольшая.
От Eleutherochona отличается отсутствием стебелька, удлинением шейки, от Lobochona — удлинением ножки и шейки, от близкого рода Oenophorachona — удлинением шейки, отсутствием псевдостила.
Монотипический род, с типовым видом Т. mirabilis с гнатопод Anisogammarus. Найден в Амурском заливе Японского моря.
1. Toxochona mirabilis Jankowski, 1972 (рис. 2, В; 13, Г; 15, П; 18, И, 11; 30, Л; 66; 67).
С признаками рода.
Размер ы. Длина особи 186—210 мк; L : D=10 : 1; размеры тела 47—56х Х22—26 мк, шейки 70—140 х 7 мк, ПВ 12—17 х 23 мк; длина лепестков до 2.5 мк, ампулы
5 мк; диам. диска 7—8 мк; размеры пожки 8—10 X Хб—7 мк, Ма 14—18x8—10 мк.
Локус и хозяин — гнатоподы A nisogammarus pri-biloffensis; особи прикрепляются к поверхности придатка (не к щетинкам!) на сочленениях и в зоне клешни. Вид редкий, встречается в небольших количествах.
Распространение. Японское море, бухта Шамора близ Владивостока, литораль и верхняя сублитораль.
4. Род ELEUTHEROCHONA Jankowski, 1971
Тело мелкое, овальное или грушевидное, не сплющено, расширено в средней части. Шейка укорочена, практически редуцирована, особи кажутся горбатыми. ПВ крупная, растянута в стороны; вероятно, это воронка типа лобохон, с продольными складками, карманами и небольшими лепестками. Ма расположен непосредственно у основания ПВ. Имеется длинный стебелек; задняя часть тела несколько сужена, но псевдостила нет. В жизненном цикле, вероятно, нет стадий полигеммии и диминутивного почкования, поскольку это форма с водорослей. От всех остальных лобохонид род отличается наличием стебелька и удлинением шейки.
Род монотипичен, с типовым видом Е. sivertseni. Стеногалинные формы с литоральных водорослей о. Тристан-да-Кунья (Чили).
1. Eleutherochona sivertseni (Dons, 1948) Jankowski, 1971 (рис. 1, Л; 2, Г; 92, А—О).
Dons, 1948 : 12, fig. 17—21 (Stylochona); Mohr, 1959b : 89 (Stylochona); 1966 : 536, 540 (Stylochona); Mohr a. oth., 1963a : 228, 232 (Stylochona); 1963b : 121 (Stylochona); Matsudo a. Mohr, 1965 : 523 (Stylochona); 1968 : 281 (Stylochona).
С признаками рода.
Размеры. По Донсу: длина особи со стебельком 90—120 мк; размеры тела 45—62x27—35 мк, ПВ 15—20x30—40 мк; длина эндостила 7—9 мк; размеры стебелька 40—55Х 6—7 мк; длина Ма 11—13 мк; диам. диска 12 мк. Наши измерения по рисункам Донса: длина особи до вентрального края ПВ 63—65 мк; L : D = 2 : 1; ширина шейки 12—16 мк, ПВ 33—40 мк; длина стебелька 33—38 мк; размеры томита 36Х 17 мк.
Локус и субстрат — края «листьев» бурой нитчатой (?) водоросли Epymenia sp. (Rhodophycea); вид массовый. Доне и Мор допускают находки на других
Рис, 67. Toxochona mirabilis с A nisogammarus pri-biloffensis.
водорослях.
Распространение. Южная Атлантика, о. Тристан-да-Кунья, глуб. 0 м. Вероятно, эндемик острова. Epymenia в наших морях не встречается, на других водорослях хонотрих мы не обнаруживали.
II. Семейство FILICHO NIDAE Jankowski fam. nov.
Очень крупные формы с цилиндрическим или бутылковидным телом; тело не сплющено, шейка четкая, резко удлинена. ПВ простая, коническая, не сплющена, стенки не утолщены; дорзальный край неровный, с неглубокими складками, с карманами и едва развитыми лепестками. РПА такого же типа, как у лобохонид: имеется единая вентральная полоса А, кинеты не полимеризованы. Шейка четко отграничена от тела, у Filichona имеется гипоколлюм; на границе шейки и тела развиваются массивные гипоколлярные шипы. Стебелька нет, ножка невысокая, широкая; возможно, она субтер-
минальна у филихон. Ma яйцевидный или овальный, не удлинен. Ампула небольшая. Псевдостила нет, у филихон имеется подошва. Жизненный цикл типичный, с томон-тами и телотомитами (отсутствующими у хилодохонид).
Рис. 68. Aurichona armata с Limnoria borealis.
Семейство предлагается для форм с длинной шейкой, простой ПВ и гипрколлярными шипами, отсутствующими у других экзогеммин; это потомки лобохонид. Нет спирального завитка (отличие от спирохонид), утолщения стенок ПВ и полимеризации кинет (отличие от хилодохонид); тело не сплющено, как у филлохонид, лишено защитной пластинки.
С 2 родами, Aurichona и Filichona (типовой род). Морские стеногалинные формы с плеопод Limnoria. Пока обнаружены только в фауне СССР, на Мурмане и в дальневосточных морях.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА FILICIIONIDAE
1 (2). Тело вытянутое, с 2 шипами; шейка значительно короче тела........
..........................................1. Род Aurichona (стр. 201).
2 (1). Тело мешковидное, с 5—8 гипоколлярпыми шипами; шейка значительно длиннее тела........................................2. Род Filichona (стр. 203).
Рис. 69. Filichona paradoxa с Limnoria magadanensis.
1. Род AURICHONA Jankowski gen. nov.
Тело очень крупное, вытянутое, почти цилиндрическое, наиболее широкое в нижней трети. Участок тела между Ма и шейкой узкий и вытянутый (как у Lobochona limnoriae), лишен пищевых вакуолей; это как бы продолжение шейки; граница шейки, од
нако, начинается у оснований шипов. Псевдостил почти не выражен. Шейка тонкая, короче тела, отделена перехватом. ПВ крупная, слегка сплющена, без лепестков, с небольшими складками и карманами. На границе шейки п тела развиты два крупных плоских шипа — гомологи гипоколлярных шипов филихон. Ножка терминальная, подошвы нет. Ампула округлая. Род отличается от Filic/гопа рядом признаков: тело вытянутое, ножка терминальная, шейка короче тела, шипов только 2, нет гипоколлюма и подошвы.
Рис. 70. Filichona paradoxa с Limnoria magadanensis.
С одним (типовым) видом А. armata с плеопод Limnoria. Найден пока только в фауне СССР (Японское и Баренцево моря).
1. Aurichona armata Jankowski sp. nov. (рис. 2, Л; 68).
С признаками рода.
Размеры. Длина особей 89—97 мк; L : D=5 : 1; размеры тела 60—68X15— 19 мк, шейки 10—15x3.5—5 мк, ПВ 12—15x16—21 мк, шипов. 2—17X2.5—4 мк; длина псевдостила 2—6 мк, ампулы 4 мк, эндостила 3—4.5 мк; диам. диска 6—7 мк; размеры ножки 3x6 мк, Ма 14—18x7—8 мк, Ми 1.6 мк, томита 31—32X13—14 мк; размах шипов 14—33 мк.
Локус и хозяин — плеоподы Limnoria borealis', заселены средний и дистальный отделы щетинок. Вид редкий, 1—5 особей на плеоподе.
Распространение. Баренцево море, Кольский зал., глуб. 188—220 м (типовая раса); Японское море, мыс Егорова, глуб. 92—112 м.
2. Род FILICHONA Jankowski gen. nov.
Тело мелкое, мешковидное, очень широкое; участок между Ма и шейкой по удлинен. Шейка четко выражена, непропорционально длинпая, в несколько раз длиннее тела. ПВ относительно небольшая, без лепестков, хотя дорзальный край складчатый, неровный. У основания шейки тело расширено, образует защитную площадку (гипоколлюм) с 5—8 массивными тупыми шипами. Ма овальный. Псевдостила нет; ножка низкая, субтерминальная; ампула мелкая. Нижняя часть тела широкая, тесно прилегает к субстрату, образуя подошву (как у Heliochona).
Отличия от A urichona: резкое удлинение шейки, мешковидная форма тела, наличие подошвы, гипоколлюма, полимеризация шипов. Роды могли произойти от разных видов лобохон либо от общего предка типа Lobochona limnoriae.
С одним (типовым) видом F. paradoxa с плеопод Limnoria. Найден в Японском море (Сахалин) и у берегов Камчатки.
1. Filichona paradoxa Jankowski sp. nov. (рис. 2, M\ 12, 3; 15, P; 69; 70).
С признаками рода.
Размеры. Длина особи 150—158 мк; L : D=8 : 1; размеры тела 30—37Х 20— 23 мк, шейки 117—135X5—6 мк, ПВ 14—16X15—24 мк, шипов 20—28X2.5—3 мк; длина ампулы 4 мк, эндостила 4 мк, подошвы 12—18 мк; размеры Ма 12X4—8 мк.
Локус и хозяин — плеоподы Limnoria magadanensis, непосредственно на поверхности плеоподы между щетинками. Вид редкий (2—3 особи на плеоподе).
Распространение. Южный Сахалин, Антоново (япономорский берег), глуб. 50—60 м (типовая раса).; Японское море, мыс Егорова, глуб. 92—112 м.
III. Семейство PHYLLOCHONIDAE Jankowski, 1972
Некрупные формы с дорзо-вентрально сплющенным шейки. Тело не удлинено, псевдостила нет. ПВ необычного
листовидным телом, без
типа — гигантская, плос-
Рис. 71. Phyllochona vexillata с Limnoria lignorum. Мурман.
кая, сужающаяся кверху, шире тела. Вентральный край ПВ с широкой выемкой и продольными складками, ограничивающими ресничную зону В; дорзальный край разросся, образует гигантскую защитную пластину — вероятно, видоизмененный левый
лепесток ПВ лобохон. РПА совершенно нетипичен для экзогеммин, с разрывом зоны А. ПВ с короткими латеральными шипами. Ма массивный, лежит в горбовидном дорзальном выступе. Ножка крупная, субтерминальная (педоморфоз); прикрепление к субстрату широкой подошвой.
Рис. 72. Phyllochona
vexillata с Limnoria lignorum. Мурман.
Рис. 73. Phyllochona vexillata с Limnoria borealis.
Семейство предложено для одного рода Phyllochona с плеопод Limnoria-, это аберрантная форма, по всем признакам отличающаяся от остальных экзогеммин: своеобразны форма тела, ПВ, РПА, защитный аппарат, имеется подошва. Phyllochona — морской стеногалинный род, обычный на Мурмане, редкий у Камчатки и в Приморье.
1. Род PHYLLOCHONA Jankowski, 1972
С диагнозом семейства. Основные отличительные признаки рода: плоское листовидное тело, отсутствие шейки, массивная ПВ с защитной пластинкой, нетипичный РПА, наличие латеральных шипиков, отсутствие стебелька, наличие подошвы и субтерминальной ножки.
С одним (типовым) видом Ph. vexillata с плеопод Limnoria (Мурман, Японское море, Камчатка).
1. Phyllochona vexillata Jankowski, 1972 (рис. 2, /С; 12, Г; 71—73).
С признаками рода.
Размеры. Длина особи без пластинки 40—52 мк, с пластинкой 56—73 мк; L : D=1.5 : 1; размерыПВ 18—21X39—51 мк, пластинки24—3'0X39—51 мк, вентральной выемки ПВ 2—3.5Х 12—15 мк; длина когтевидных латеральныхшипиков (5—8 пар) 1.5—3 мк, эндостила 4 мк, розетки 7 мк; диам. диска 8—9 мк; размеры Ма 13—16Х Х12—15 мк, томита 23—26X14—15 мк.
Локус и хозяева — нижняя часть щетинок плеопод Limnoria lignorum (типовой хозяин) и L. borealis; вид обычный, но встречается в небольшом количестве, до 10—11 особей на плеоподе. На одной щетинке могут разместиться всего 3 особи, на плеоподе — до 20, но обычно меньше.
Распространение. Баренцево море, Мурман, Дальние Зеленцы, глуб. 2 м (типовая раса на L. lignorum); Кольский зал., глуб. 188—220 м (на L. borealis); Авачинская бухта, Камчатка (на L. lignorum); Японское море, мыс Егорова, глуб. 92—112 м (на L. borealis).
IV. Семейство HELIOCHO NIDAE Jankowski, 1972
Бутылковидные, несплющенные формы с четкой границей тела, шейки и ПВ; тело удлинено у Heterochona, более мешковидное у Heliochona. Шейка обычно короткая, удлинена у аберрантных форм. ПВ крупная, сплющена дорзо-вентрально, стенки не утолщены; всегда имеются складки, карманы и лепестки, наклоненные к вентральному краю. Вентральная полоса РПА расслоена на две подзоны — А' (верхняя, из 3 сближенных кинет) и А" (нижняя, с 4—6 короткими асимметричными кинетами); такой комплекс свойствен только гелиохонидам. Кутикула стенок ПВ исчерчена. Шипы только одного типа — маргинальные, усеивают края ПВ илепестков, образуют сложные комплексы; вентральные шипы всегда отличаются от дорзальных по форме, числу, направлению. Особо изменчивы вентральные комплексы, дорзальные более однотипны. Ма овальный или грушевидный. Прикрепление ножкой; псевдостил иногда образуется у гетерохон, у гелиохон же развита подошва. Жизненный цикл типичный, с полигем-мией.
Отличие от Spirochonidae — отсутствие завитка ПВ, от Phyllochonidae — бутылковидная форма тела, отсутствие пластинки, от Filichonidae — отсутствие гипоколлярных шипов, от Chilodochonidae — отсутствие стебелька, другой тип РПА и ПВ, от всех названных семейств и Lobochonidae — наличие маргинальных шипов ПВ.
С 2 родами — Heliochona (типовой) и Heterochona, с придатков тела (плео-, гнато-и переопод, ротовых частей, жабр) бокоплавов Gammaridae и, реже, A mphithoidae. Весьма обычны в морях и эстуариях северного полушария, отсутствуют в пресных водах.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА HELIOCHONIDAE
1 (2). Тело цилиндрическое, ножка терминальна; подошвы нет..............
.........................................1. Род Heterochona (стр. 205).
2 (1). Тело бутылковидное, с широкой подошвой и субтерминальной ножкой . . ..............................................2. Род Heliochona (стр. 219).
1. Род HETEROCHONA Jankowski, 1972
Stein, 1854 : 205, 216 {Spirochona, part.); 1859: 74 {Spirochona, part.); C la-pa r e d e et Lachmann, 1858 : 131 {Spirochona, part.); R entsch, 1860 : 89 {Spirochona, part.); Bate a. Westwood, 1863 : 374 {Vaginicola, par lapsus); Fromen tel, 1874 : 145 {Spirochona, part.); Kent, 1881 : 661, 663 {Spirochona, part.; Stylochona, part.); Butschli, 1889 : 1757 {Spirochona, part.); E i s m о n d, 1890a : 5; 1895 : 104, 106 {Spirochona, part.); W allengren, 1895 : 7, 44; 1896 : 553
(.Heliochona, part.; Stylochona, part.); Hamburger u. Buddenbrock, 1911 : 110, 111 (Spirochona, part.); Andre, 1912 : 149 (Spirochona, part.; Stylochona, part.); Lep ? i, 1926 : 88 (Spirochona, part.); 1965 : 854 (Stylochona, part.); К a h 1, 1933 : 141; 1935 : 803, 805 (Heliochona, part.; Stylochona, part.); Precht, 1935 : 464 (Heliochona, part.); Kudo, 1946 : 681 (Stylochona, part.; Heliochona, part.); Mohr, 1948 : 2, 12, 13 (Heliochona, part.; Stylochona, part.); 1966 : 537 (Heliochona, part.); Hall, 1953 : 413 (Stylochona, part.); Jirovec a. oth., 1953 : 527 (Stylochona, part.); Mohr a. oth., 1961 : 220 (Heliochona, part.); 1963a : 228, 231 (Heliochona, part.; Stylochona, part.); J a e с к e 1, 1962 : 14 (Heliochona, part.); Dobrzahska-Kaczanowska, 1963 : 353 (Heliochona, part.); Големански, 1964 : 157 (Spirochona, part.); F e n c h e 1, 1965 : 283 (Heliochona, part.); Matsudo a. Mohr, 1965 : 523 (Heliochona, part.); 1968 : 280, 281 (Heliochona, part.; Stylochona, part.); M a t s u d o, 1966 : 361 (Heliochona, part.); Янковский, 19676 : 35, 41 (Stylochona, part.).
Тело веретеновидное или цилиндрическое, сужающееся к ножке и к шейке. Шейка четкая, изредка удлинена. Лепестки ПВ слабо развиты у II. psychra и Н. coronata, крупнее у остальных видов; всегда имеются складки и карманы ПВ. Система шипов проще, чему Heliochona: дорзальные шипы могут быть саблевидными, плоскими (у большинства гетерохон и у всех гелиохон ошфсрючковидные), вентральные шипы — саблевидными, игольчатыми и крючковидными. Типичный набор — длинные изогнутые дорзальные и короткие прямые вентральные шипы. На вентральной стенке ПВ могут чередоваться шипы разного типа. Ножка высокая, терминальная, диск широкий; имеется ампула. Подошвы нет, иногда развит псевдостил (Н. exilis, Н. coronata).
Отличия от Heliochona: веретеновидная форма тела, отсутствие подошвы, терминальное положение ножки, наличие ампул (утеряны у гелиохон), более простая система шипов, другой локус (щетинки, а не ровная поверхность жабр).
Род крупный, включает 3 известных вида — Н. scheutenil, Н. coronata, Н. psychra и 4 новых — Н. crinita, Н. peregra, Н. exilis, Н. trifaria. Типовыми нельзя обозначать два первых: Штейном и Кентом не указаны их хозяева, виды описаны крайне плохо. Для Н. psychra не указан точный локус на щетинках (что важно); вид описан с Аляски и для многих авторов будет недоступен. Типовым мы обозначаем поэтому один из новых видов — Н. crinita с Мурмана. Род очень ширбко распространен в морях, лагунах, эстуариях, устьях рек и ручьев (в постоянно пресной воде) на Gammarus и Anisogammarus; иногда рачка заселяет целый комплекс гетерохон. Род известен из северного полушария (Баренцево, Белое и все дальневосточные моря, побережья Голландии, Дании, Швеции, ГДР, ФРГ, Польши, Финляндии, Шотландии, Англии, Франции, северной Аляски, тихоокеанских штатов США); особенно богата и разнообразна североевропейская фауна видов рода.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА HETEROCHONA
1 (8). Вентральные шипы прямые, игольчатые или саблевидные.
2 (3). На вентральной стенке ПВ чередуются удлиненные и укороченные шипы ..................................................... 4. Н. coronata.
3 (2). Все вентральные шипы равных размеров.
4 (5). Нижний конец тела и опорный диск резко расширены до 11—15 мк . . . ...............................................................3.- Н. psychra.
5 (4). Нижний конец тела сужается; диск неширокий, порядка 6—8 мк.
6 (7). На лепестке с вентральной стороны видно 8—10 шипов; вентральный край ПВ примерно с 30 шипами........................................1. Н. scheutenii.
7 (6). На лепестке с вентральной стороны видно 15—20 шипов; вентральный край ПВ примерно с 45—50 шипами........................................2. Н. crinita.
8 (1). Вентральные шипы изогнутые, крючковидные.
9 (12). Вентральные шипы расположены двумя рядами.
10 (11). Тело обычных пропорций, L : D=4.5 : 1.................5. Н. peregra.
11 (10). Тело резко вытянуто, L : D=8 : 1 ..................... . . 6. Н. exilis.
12 (9)'. Вентральные шипы расположены тремя рядами.............7. Н. trifaria,
1. Heterochona scheutenii (Stein, 1854) Jank., 1972 (рис. 1, О; 22, Ж; 30, В; 36, М; 37, В; 45, А—3; 48, К—П; 49, Н; 52, Н, О; 74; 75, А-Л; 78, 3; 79, Л—Н).
Stein, 1854 : 205, 216—217, Taf. V, Fig. 29—30 (Spirochona Scheutenii); 1859 : 74 (Spirochona); Claparede et Lachmann, 1858 : 131, 132 (Spirochona: sheu-tenii ъ); R en t s c h, 1860 : 89, Taf. VI—VII (Spirochona; S. sheutenii на стр. 180); Pritchard, 1861 : 598 (Spirochona); Fromentel, 1874 : 145, pl. 30, fig. 27—28 (Spirochona,);' Kent, 1881 : 661—664 (Spirochona sheutenii (стр. 661), S. scheuteni
1 Здесь и далее видовое название приводится лишь в случае его ошибочного написания авторами; написание со строчной буквы за ошибку не считается.
(стр. 663), 5. Sheuteni (стр. 664); сии. Vaginicola crystallina); Bii tschli, 1889 : 1757 (Spirochona; син. Stylochona coronata); E ismond, 1890 : 5 (Spirochona); 1895 : 104, 106 (Spirochona Schentenii); W allengren, 1895 : 44, pl. I, fig. 1, 2, 7, 9, 10, 15, 16; pl. II, fig. 17—21, 23—4G; text-fig. 3—10 (Heliochona); 1896 : 553 (Heliochona); Hamburger u. Buddenbrock, 1911 : 111, Fig. 137, a (Spirochona; S. sessilis par lapsus); Lep f i, 1926 : 88, fig. 475 (Spirochona; S. sessilis par lapsus); 1965 : 285 (Heliochona scheuteni); Kahl, 1933 : 141, Fig. 26, 1, 4 (с ошибочной подписью к рис. 26, 4 — Heliochona sessilis; в тексте Н. scheutenii, в подписи к рис. 26 Н. scheuteni); 1935 : 803, Fig. 148, 5—7 (Heliochona scheuteni); P r e c h t, 1935 : 420, 464 (Heliochona scheuteni); Kudo, 1946 : 682, fig. 320, d (Heliochona scheuteni); Mohr, 1948 : 12 (Heliochona); J a e c k e 1, 1962 : 14 (Heliochona scheuteni); Dobrzahsk a-K a c z a-п о w s k a, 1963 : 353, 356, fig. 4, 5, e (подписи нет; возможно, относятся к данному виду), 10, 11; pl. IV, fig. 15—18 (Heliochona scheuteni); Mohr a. oth., 1963a: 231 (Heliochona); Големански, 1964 : 157 (Spirochona); Fenchel, 1965 : 283, fig. 2, B, A, 5 (Heliochona scheuteni); Matsudo a. Mohr, 1965 : 524, fig. 2—4, 10 (Heliochona); Kudo, 1966 : 940 (Heliochona scheutini); M a t s u d o, 1966 : 361, pl. 1, fig. 12; pl. 2, fig. 23, 24 (Heliochona); Matsudo a. Mohr, 1968 : 280 (Heliochona).
Таксономическая история вида. Вид найден Шейтеном на Gammarus sp. в солоноватом канале у Амстердама; спиртовой материал изучен Штейном, считавшим, что фиксация разрывает ПВ. Позднее Штейн (Stein, 1859) находит вид на Gammarus sp. в Балтике; ПВ имеет вид спиральной воронки, как у спирохон; шипы окружают весь край, располагаясь вплотную. Эйсмонд и Големанский ошибочно указывают, что вид описан с G. pulex. Плохое описание и неточные рисунки вида — источник путаницы, не ликвидированной и ныне. Рентш хорошо иллюстрирует морфологию гетерохон с «G. ornatus»; по его рисункам можно определить и хозяина (вероятно, это G. duebeni, а не G. zaddachi, как считает Мор).'. Кент идентифицирует виды Рентша, Штейна и Веста, поэтому хозяевами Н. scheutenii указаны у него G. marinus «и другие Entomostraca» в соленой и солоноватой воде. Очень важно знать, с какого хозяина мог быть описан вид Штейна: как Н. scheutenii позднее определяли гетерохон с G. locusta, G. duebeni, G. zaddachi, G. marinus, G,. oceanicus, G. salinus,G. ornatus й даже c Amphithoe rubricata. В солоноватых каналах, однако, могут встречаться лишь G. zaddachi и G. duebeni; другие виды не выносят сильного понижения солености. Доб-жанская-Качановская собирала G. zaddachi на расстоянии 1 км от устья солоноватого рукава Мартва Висла в Польше; Тинеманн обнаружило, duebeni в 1913 г. в Германии, в Дортмундском канале у Сендена (220 км от устья Эльбы). Шейтен и Штейн находили хонотрих только на плеоподах рачка. Так как у Amphithoe заселены лишь жабры, а у О. setosus, G. oceanicus, G. obtusatus — плеоподы, жабры, гнатоподы и максилли-педы, то вполне очевидно, что Шейтен собрал именно G. duebeni или G. zaddachi, у которых никогда не бывает хонотрих вне плеопод.
По нашим данным, гетерохоны с гаммарид в целом моноксенны; вид с плеопод комплекса G. oceanicus +<?. setosus не тождествен с таковым комплекса G. duebeni-\--\-G. zaddachi. У последних заселен лишь один локус на плеоподе (середина и вершина щетинок), у первых — два локуса (включая и основание щетинок). Оба комплекса несут разные виды хонотрих. Сравнение рас Н. scheutenii с обоих хозяев (G. duebeni с Мурмана, G. zaddachi из Дании) выявило некоторые различия морфологии, в целом не очень существенные (размеры тела, величина и форма ампулы); пока не будет изучено достаточное число рас с обоих видов хозяев, относить комменсалов к разным подвидам или видам не следует. Возникает проблема, какого хозяина следует считать типовым, какого — дополнительным. Поскольку в равной мере вероятно, что Штейн собрал G. duebeni и G. zaddachi, а рисунки и описания Шейтенаи Штейна не позволяют решить этот вопрос, остается произвольно указать типового хозяина, а именно G. duebeni; G. zaddachi — дополнительный хозяин. Если они несут разные виды комменсалов, новое название должна получить форма с G. zaddachi, но не с G. duebeni.
Диагноз. Форма тела и вооружение ПВ обеих рас сходны. Тело относительно некрупное, веретеновидное, особо широкое в средней части, резко сужается к шейке и ножке; участок между шейкой и Ма не удлинен, нижняя часть тела слегка вытянута. Шейка узкая при рассматривании с вентральной стороны, толстая при виде сбоку. ПВ шире тела, с четкими карманами; лепестки хорошо развиты, наклонены к вентральной стенке. Вентральные шипы плоские, саблевидные (но верхний конец часто крючковидный), не дифференцированы; дорзальные шипы игольчатые, слегка изогнуты, сходной длины. Все шипы расположены на равных промежутках. На лепестке с вентральной стороны видно 8—10 шипов, на вентральной стенке — 29—31. Ма небольшой, при фиксации формалином кажется очень светлым, беловатым. Это важное отличие от'Н. crinita, у которой Ма всегда четкий, плотный, легко видимый. Цитоплазма Н. scheutenii беловатая, с неясной структурой (у других видов сероватая, с четкими тельцами). Ножка невысокая и неширокая, с диском диаметром 6—7 мк. Расы с разных хозяев различимы по морфологии ампулы: у расы с G. duebeni ампула очень высокая, клиновидная, плавно сужается кверху, заострена на вершине; у расы
c G. zaddachi ампула низкая, почти круглая, верхний конец узкий и вытянутый. Поскольку форма ампулы у Heterochona — важный видовой признак, расы с указанных хозяев могут принадлежать к разным видам.
Раз мер ы. Раса с G. locusta (?) (по Валленгрену): размеры особи 87.035Х 21.125 мк, Ма 16.9x10.14 мк, Ми 2—5 мк (в зависимости от их числа); длина шейки 11.83 мк;
Рис. 74. Heterochona scheutenii. А, В — с Gammarus sp. (по: Stein, 1854);
В—М — с G. locusta (по: Wallengren, 1895); Н—Ч — с G. ornatus (по: Rentsch, 1860).
ширина ПВ 27 мк, цитопрокта 3.999 мк; длина особи по Кенту 1/300'' (33 мк), по Калю 54, 80 и 87 мк. Раса с G. zaddachi (по Добжанской-Качановской): длина особи 80— 90X20—30 мк; ширина ПВ 30 мк. Мурманская раса с G. duebeni: длина особи 80— 105 мк, обычно 86—92 мк; L : D=5.3 : 1; размеры тела 55—63x15—18 мк, шейки 3—7X8—10 мк, ПВ 12—14x31—35 мк, ампулы 15—17X4.5 мк; длина эндостила 6 мк, ножки 6 мк; диам. диска 6—7 мк; длина дорзальных шипов до 11 мк, вентраль
ных до 7 мк. Датская раса с G. zaddachi: длина особи 75—87 мк, ширина 15—21 мк; длина ампулы 15—18 мк; диам. диска 5—7.5 мк.
Л о к у с. По Штейну (Stein, 1854 : 216), вид заселяет только «длинные членистые щетинки, отходящие парами от одного базального членика; каждая щетинка несет
Рис. 75. А—Ж — общий вид Heterochona scheutenii с Gammarus duebeni; 3—Л — ампула расы с G. zaddachi, Дания; ‘М—О — ампулы Н. crinita, Heterochona sp. и Н. psychra.
многочисленных животных» (это две ветви плеопод). Фенхель рисует часть особей на базальной части щетинок и даже на стебельке ветвей, что неверно: Н. scheutenii — это не базальный вид типа Н. psychra. По Добжанской-Качановской, локус «исключительно жаберные пластинки»; скорее всего это неправильное обозначение плеопод. Вид массовый — до 15—20 особей на щетинке (Валленгрен), до 160 на плео-поде (Прехт).
14 Заказ № 213
Хозяева и распространение. Gammarus spp.: Голландия, солоноватый канал близ Амстердама (Шейтен); Германия, побережье Северного моря (Stein, 1859). G. ornatus (G. duebeni): Германия, Висмарская бухта (Rentsch, 1860). G. locusta: Швеция, Эресунд, Ландскрона, Мальмё, Куллаберг, Хельсингборг (Wallongren, 1895). Комплекс G. locusta, G. locusta f. zaddachi и G. duebeni: Германия, Боттсандская банка с соленостью 3°/00 в Кильской бухте (Precht, 1935). Комплекс G. locusta, G. осе-anicus, G. salinus, G. zaddachi и G. duebeni: Дания, Аскё; Швеция, Изефьорд; Англия, Плимут; Финляндия, Тверминне (Fenchel, 1965; Mohr, 1966; Matsudo a. Mohr, 1968;
Рис. 76. Heterochona crinita c Gammarus oceanicus.
Mohr a. Matsudo, 1970). G. zaddachi и его подвиды: Англия, Плимут (Mohr, 1966). Типовой хозяин — G. duebeni (Баренцево море, Мурман, типовая раса; Белое море, Чупа), дополнительный хозяин — G. zaddachi. Общее распространение вида — моря северной Европы, от южной Англии до Мурмана, в Балтийском море до Гданьского залива.
2. Heterochona crinita Jankowski, 1972 (рис. 2, Д', 75, М\ 76;77,А—Е;78,Ж,Н).
Wallengren, 1895 : 44 (Heliochona scheutenii, part.?); Precht, 1935 : 420, 464 (Heliochona scheuteni, part.?); Fenchel, 1965 : 283 (Heliochona scheuteni, part.?).
Крупные формы с удлиненным веретеновидным телом, особо широким на уровне Ма. Шейка очень широкая и короткая; нижняя часть тела слабо оттянута, но без псевдостила. ПВ крупная, с прекрасно развитыми карманами и лепестками, наклоненными к вентральному краю. Вооружение ПВ такого типа, как у Н. scheutenii: вентральные шипы плоские, дорзальные — изогнутые; в каждом комплексе шипы не дифференцированы, сходны по длине. Количество их, однако, значительно больше, чем у Н. scheutenii, располагаются они почти вплотную. На лепестке с вентральной стороны
видно 15—20 шипов, на вентральной стенке ПВ — 45—50 (а у Н. scheutenii соответственно 8—9 и 29—31). Ма крупный, с очень резким контуром, темноватый при фиксации формалином (также отличие от Н. scheutenii). Ножка неширокая; эндостнл крупный; ампула массивная, мешковидная.
Размеры. Длина особи 81—99 мк, с лепестками 90—107 мк; L : D=4.2 : 1; размеры тела 67—72X21—29 мк, шейки 3—8X12 мк, ПВ 15x30—41 мк, ампулы 15—20X4.5 мк; длина эндостила 5—6 мк; диам. диска 10.5—12 мк; размеры ножки 6X9—11 мк, Ма 16—21X7—11 мк, томита 42—46x13—18 мк; длина вентральных шипов до 4.5 мк, дорзальных до 6.5 мк.
В отличие от Н. coronata, Н. exilis и Н. trifaria вентральные шипы не дифференцированы. У Н. psychra лепестки слабее выражены, не изогнуты, диск шире, чем у Н. crinita. У Н. peregra все шипы крючковидные. Вид близок к Н. scheutenii, но тело крупнее, шипов больше, ядро темнее, ампула складчатая, мешковидная.
Локус и хозяева — средняя часть и вершина щетинок плеопод Gammarus oceanicus-(типовой хозяин) и G. setosus (дополнительный хозяин); расы с этих хозяев морфологически неотличимы, популяции хозяев на Мурмане перемешаны, но доминирует G. oceanicus. Вид массовый, обычный, выносит слабое, но не полное опреснение, избегает рек и эстуариев (отличие от Н. scheutenii).
Распространение. Баренцево море, Мурман, Ярнышная губа (типовая раса на G. oceanicus), Дальне-Зеленецкая и смежные бухты, литораль (на G. oceanicus-и G. setosus); Берингово море, о. Беринга (на Anisogammarus). Вероятно, эту форму видели Валленгрен в южной Швеции, Прехт в Кильской бухте и Фенхель на биостанциях Дании и Швеции на G. locusta, G. salinus и G. oceanicus. G. setosus — циркумбореальный арктический вид, на Аляске несет только Н. psychra (Matsudo a. Mohr, 1965; не осматривались, однако, морские формы), G. oceanicus же обитает на севере Европы. Возможно, что в зоне контакта видов (Мурман) эпифауна G. setosus обогащается хоно-трихами с G. oceanicus, в частности Н. crinita.
3. Heterochona psychra (Matsudo et Mohr, 1965) Jankowski, 1972 (рис. 1, П; 13, Д; 32, В; 75, О; П, Ж, 3; 78, А—Е).
Тело некрупное, широкое, почти цилиндрическое, особо широкое в средней части, слегка сужено сверху и снизу, но без псевдостила. Шейка невысокая, узкая. ПВ очень крупная, широко раскинутая; боковые карманы относительно неглубокие. Лепестки слабо развиты, не наклонены или едва изогнуты. Вентральный край ПВ несет 40—45 одинаковых саблевидных шипов, дорзальный край — 10—12 коротких и 4—5 пар длинных игольчатых (на вершине лепестков). Типовая раса с Аляски имеет в сумме 70 шипов, из них 5 пар удлиненных; шипы, по Мору, тупые, крючковидная вершина не показана. Ножка и диск шире, чем у остальных гетерохон, хотя вид некрупный; ампула, напротив, наиболее мелкая, круглая. Нижняя часть тела резко расширена. Эндостил невысокий и широкий.
Размеры. Типовая раса с Аляски (по Мацудо и Мору): длина особи 34—57 мк; Б : D=3.5 : 1; размеры тела 21—50x7—17 мк, Ма 10—18X4—7 мк, Ми 2.1—2.8 мк; ширина ПВ 7—17 мк, диска 7—11 мк; длина шипов гипохона 4 мк, шипов эпихона 4 и 10 мк. Мурманская раса с G. oceanicus'. длина особи 69—81 мк, с лепестками до 87 мк; L : D=4 : 1; размеры тела 51—56X17—20 мк, шейки 6—9X8—9 мк, ПВ 16X26— 33 мк; длина ампулы 3 мк, эндостила 4 мк, шипов гипохона 4 мк, шипов эпихона 10 мк; диам. диска 15 мк; размеры ножки 3x8—9 мк, Ма 15—18X7—7.5 мк, томита 30—32Х Х12—15.5 мк.
В отличие от видов типа Н. exilis нет дифференцировки шипов гипохона; в отличие от Н. scheutenii и Н. crinita лепестки мелкие, не наклонены. Ампула мельче и диск шире, чем у остальных видов рода.
JIoKyc на плеоподе Мацудо и Мором не указан; ими отмечена «редкая встречаемость на жабрах», но это может быть только Heliochona. На Мурмане вид заселяет только базальную часть щетинок плеопод. Типовой хозяин — Gammarus setosus, дополнительные — G. oceanicus и G. kamtschaticus. Особи обычно немногочисленны.
Распространение. США, северная Аляска, побережье моря Бофорта, реликтовое озеро Нувук (типовая раса, на G. setosus); Мурман, литораль Дальних Зеленцов и смежных бухт (на G. setosus и G. oceanicus); Белое море, зал. Чула (на G. oceanicus); Камчатка, Кроноцкий зал. (на G. kamtschaticus).
4. Heterochona coronata (Kent, 1881) Jankowski, 1972 (рис. 1, P; 34, Д; 51, A — E; 77, И, K; 79, A— K; 80; 82, Г).
Bate a. Westwood, 1861 : 374, fig. (Vaginicola crystallina, non Ehrenberg, 1833); Kent, 1881 : 663, pl. XXXIII, fig. 54—55 (Stylochona); Biitschli, 1889 : 1757, Taf. LXXV, Fig. 8 (Spirochona Scheutenii, part.; сии. Vaginicola crystallina); Wallengren, 1895 : 7, 44; 1896 : 553 {Stylochona); Hamburger u. Buddenbrock, 1911 : 110—111, Fig. 139 (Spirochona; S. coranata на стр. 110); Andre, 1912 : 149 (Spirochona Scheutenii, part.); L ep$i, 1926 : 88, Taf, XIV, Fig. 478 (Spi-14*
rochona); Kahl, 1933 : 141, Fig. 26, 2 (Stylochona); 1935 : 805, Fig. 148, 4 (Stylochona; «вероятная модификация Heliochona scheuteni»); Kudo, 1946 : 681—682, fig. 320, b (Stylochona); M oh r, 1948 : 2, 13 (Stylochona); Hall, 1953 : 413, fig. 7, 49B (Stylo-
Рис. 77. A—E — Heterochona crintta c Gammarus oceanicus; Ж, 3 — H. psychra c G. setosus, Мурман (Ж) и Аляска (5; по: Matsudo a. Mohr, 1965);
И, К — Н. coronata с G. obtusatus.
chona); J i г о v е с, 1953 : 527, fig. 244, I (Stylochona); Mohr a. oth., 1963а : 228 (Stylochona); L е р § i, 1965 : 285, 854 (Stylochona); Янковский, 19676: 35, 41, рис. 3, 3 (Stylochona); Matsudo a. Mohr, 1968 : 281 (Stylochona); Mohr a. Matsudo, 1970 (Stylochona; nomen nudum).
Таксономическая история вида. Диагноз Кента (Kent, 1881 : 663): «Тело удлиненно-веретеновидное, несколько согнутое, длиной примерно втрое
больше, чем в ширину, расширено в центре, сужается почти в равной мере к обоим концам, сидит на коротком тонком прочном стебельке. Мембраноидный вырост, напоминающий инфундибулюм, хорошо развит, образует свернутую спираль из двух оборотов;
Рис. 78. А—Е — Heterachona psychra с Gammarus oceanicus, Мурман (Л—Д) и G. setosus, Аляска (Е; по: Matsudo a. Mohr, 1965); Ж — Н. crinita с G. oceanicus', 3, И — ПВ Н. scheutenii и Н. crinita.
базальный наружный оборот почти вдвое больше диаметра тела; свободный край воронки бахромчатый или с фибриллами (шипами); фибриллы щетинковидные, двух размеров, в сумме их около 50; 1 крупный шип чередуется с 4 короткими мелкими; апикальная внутренняя воронка значительно поднята над базальной, ее свободный край без бахромы; вестибулярная щель сильно расширена, продолжается назад в четкий глоточный канал; сократительная вакуоль расположена вплотную к вестибу-
люму; эндопласт (Ma) удлиненно-овальный, почти в центре. Длина тела, включая инфундибулюм, 1/400" (85 мк; у Гамбургер, Лепши и Каля 60 мк, —А. Я.). Местообитание — соленая вода; прикреплены к грудным ножкам Gammarus sp.». Отличия от Н. scheutenii — иные пропорции тела, наличие стебелька и внутренней воронки; шипы одинаковы у Н. scheutenii и напоминают микрометрическую шкалу у Н. coronata'. каждый пятый шип вдвое выше интеркалярных, всего имеется 50—60 шипов.
Вид позднее не изучали, но часто отождествляли с Н. scheutenii (Эрлангер, Бточли, Андре и др.), хотя на рисунках Кента и Штейна они резко различаются. Бючли ликви-
Рис. 79. А—К — Heterochona coronata (А—В — по: Kent, 1881; Г—Е — по: Bate a. Westwood, 1861); Л—Н — Heterochona scheutenii (по: Fenchel, 1965).
дировал роды Stylochona и Heliochona, объединив ряд видов. Описание «двойной воронки» считали сомнительным, поэтому ставилась под сомнение и реальность вида. Валленгрен и Каль сохраняли род Stylochona только для S. coronata, сомневаясь в его реальности. По Мору и Мацудо, 5. coronata — nomen nudum, поскольку Кент зарисовал, видимо, особь с деформированной складчатой ПВ, материал его был в плохом состоянии и хозяин хонотрихи неопределим («морской Gammarus» Кента может быть любым видом Gammarus и Marinogammarus). Данные о S. coronata и S. nebalina настолько несовершенны, что эти виды «неопределимы». Мор осмотрел в Плимуте 3 вида Gammarus и 2 вида Marinogammarus, найдя на первых лишь Н. scheutenii-, М. marinus и М. pirloti оказались незараженными. В Англии встречаются 5 видов подрода Marinogammarus (по Н. Л. Цветковой): М. marinus, М. pirloti, М. stracensls, М. olivii и М. obtusatus; Мор не осмотрел три последних вида. Осмотренные нами три особи М. marinus из Англии оказались незараженными, но массовые поселения хонотрих отмечены Вестом (Bate a. Westwood, 1861) на М. marinus и нами на мурманских G.
obtusatus. Mop и Мацудо, собствеппо, сами не определили .видов хозяев Trichochona, Oenophorachona, Spirochona halophila, лишь предположительно указали хозяипа Lobochona insularum, часто не отмечали или неправильно указывали локусы, что затрудняет определение. Вид Кента в конечном итоге реальный, не nomen nudum, легко определимый уже по уникальной системе шипов; хозяин его — G. obtusatus и, возможно, G. marinus. В описаниях и рисунках Кента неправильны пять деталей: 1) наличие внутренней воронки, что представляет оптический обман: за края воронки приняты 2 длинных дорзальных шипа ПВ; 2) пририсована ресничная глотка, за которую Кент принял контуры Ма; 3) поскольку хонотрих Кент считал высшими перит-
Рис. 80. Heterochona coronata с плеопод Gammarus obtusatus.
рихами, пририсована и сократительная вакуоль у «глотки», как у перитрих; 4) Ма на его рисунке удлиненный, ниже типичного положения; 5) пририсован удлиненный тонкий стебелек. Эти неточности не препятствуют определению, так как известны форма тела, вооружение ПВ, локус, предположительно и хозяин.
Диагноз. Тело относительно некрупное, тонкое, расширено в средней части; шейка и нижняя часть тела удлинены. Шейка очень узкая; ПВ широкая, крупная, s с неглубокими складками и довольно слабо развитыми карманами. На вентральной стенке ПВ длинные саблевидные шипы обычного типа чередуются с 2—8, обычно с 3—6 укороченными; дорзальные шипы неодинаковы по размерам, часто недоразвиты, лепесток несет всего 3—5 шипов. Иногда резко удлинены два шипа по краям дорзальной вырезки. Диск небольшой, ампула крупная. Нижние щетинки плеопод часто заселены формами с длинным псевдостилом, средние и верхние заняты типичными Н. coronata с едва развитым псевдостилом. Между этими формами имеется ряд переходов. Вероятно, облик тела данного вида нестабилен, зависит от места оседания в пределах своего локуса.
Размеры. Длина типичных трофонтов 75—86 мк; L : D=5 : 1; размеры тела 52—55Х 16—18.5 мк, шейки 7.5—10X4.5—5 мк, ПВ 13—14Х26—28 мк, ампулы 6—8Х Х2 мк, ножки 5Х-6 мк, томита 36—42x11—18 мк; длина эндостила 6 мк, шипов
гипохона 3 и 6 мк, шипов эпихона до 11 мк. Длина особей с нижних щетинок плеопод 103—126 мк, шейки+ПВ 30 мк, ампулы 16—17 мк, псевдостила до 27 мк.
В отличие от всех остальных видов рода у Н. coronata чередуются крупные и мелкие саблевидные шипы гипохона; лепестки и дорзальные шипы прямые, не наклонены, едва развиты.
Рис. 81. Heterochona peregra с гнатопод Gammarus obtusatus.
Локус и хозяин — средняя и верхняя части щетинок плеопод Gammarus (Marino-gammarus) obtusatus (указывается как типовой хозяин, поскольку вид, собранный Кентом, уже неопределим); заселены все щетинки плеопод и часть щетинок базальных члеников. Это наиболее массовый вид рода (до 250—280 особей на ветви плеопод, около 3000 особей на рачке).
Распространение. Англия, о. Джерси в Дуврском проливе близ Нормандии, бухта Сент-Клементс (типовая раса Кента, на G. marinus или С. obtusatus); Англия, точный пункт не указан, наб. marinus (Bate a. Westwood, 1861); Баренцево море. Мурман, бухта к востоку от Дальнего пляжа близ биостанции (на G. obtusatus).
5. Heterochona peregra Jankowski sp. nov. (рис. 13, A; 81; 82, A—B).
Тело мелкое, почти цилиндрическое, без четкого псевдостила; шейка четкая, тонкая, заметно удлинена. ПВ некрупная; дорзальный край высоко поднят, лепестки наклонены к вентральному краю, но не столь резко, как у Н. scheutenii. Хорошо вы
ряжены боковые карманы ПВ. Все шипы крючковидные; с вентральной стороны на лепестках видно по 7 шипов; на вентральной стенке чередуются шипы равной длины, но направленные в разные стороны, вверх и вбок, всего около 20 шипов.
Края боковых карманов несут у гелиохонид только недифференцированные шипы, направленные вверх. Ампула у II. peregra небольшая, тонкая.
Размеры. Длина особи 68—75 мк, с лепестками до 91 мк; L : D=5 : 1; размеры тела 46—51X16—18 мк, шейки 8—9x6—7.5 мк, ПВ 11—14x25—28 мк; длина
Рис. 82. Heterochona spp. с Gammarus obtusatus. А—В — Ht peregra', Г — Н. coronata; Д—3 — Н. extlis.
ампулы до 15 мк, эндостила 5 мк; диам. диска 6.5—7 мк; длина псевдостила 2—3 мк; размеры ножки 5X10 мк, томита около 36X15 мк; длина вентральных шипов 12—13 и 8—10 мк, боковых 8—11 мк, дорзальных 12—14.5 мк. В отличие от остальных гетерохон только у Н. peregra чередуются два типа крючковидных шипов; ПВ идентична у Н. peregra и Н. extlis, но у последнего вида тело и шейка резко удлинены, имеется псевдостил. Шейка у Н. peregra тоньше, чем у Н. scheutenii и Н. crinita; диск меньше, чем у Н. psychra; шипы не плоские, как у Н. coronata.
Локус и хозяин — щетинки ротовых придатков (типовой локус) и средняя и верхняя части щетинок гнатопод Gammarus obtusatus. Вид массовый, весьма обычен на Мурмане, встречается вместе с Н. . exilic.
Распространение. Баренцево море, Мурман, литораль бухты к востоку от Дальнего пляжа в районе биостанции.
6. Heterochona exilis Jankowski sp. nov. (рис. 82, Д—3).
Тело резко удлиненное, узкое, тонкое; вытянуты шейка, верхняя и особенно нижняя часть тела (псевдостил). ПВ и ее вооружение такого же типа, как у Н. peregra:
все шипы крючковидные, длинные, на вентральной стенке ПВ чередуются шипы, направленные вверх и вбок. Лепестки очень высокие, не наклонены к вентральному краю ПВ так резко, как у I/. scheutenii. Ампула тонкая и непропорционально длинная — до эО мк (у II. psychra всего 3 мк). Ножка невысокая, опорный диск мелкий.
Размеры. Длина особи 138—147 мк, с лепестками до 155 мк; L : D = 8 : 1; размеры тела 107—110X18 мк, шейки 21—27x6—10 мк, ПВ 12—14X27 мк; длина лепестков 8—9 мк, ампулы 47—51 мк, эндостила 5.5—6 мк; размеры ножки 4—7Х ХЮ мк; диам. диска 8 мк; длинапсевдостила до 66 мк; размеры Ма 21—22x8—10 мк, томита 30—40 X 15—16 мк; длина вентральных шипов 7 и 8 мк, дорзальных до 13—' 14.5 мк.
Рис. 83. Heterochona trifaria с Gammarus oceanicus.
Это наиболее крупный вид рода с резко удлиненными телом, шейкой, псевдости-лом и ампулой. Шипы не саблевидные, как у ряда гетерохон; вентральные шипы двух типов, а не трех, как у Н. trifaria. Вид близок к Н. peregra, отличаясь обликом тела и размерами; заселяет другой локус.
Локус и хозяин — базальная часть щетинок гнатопод Gammarus obtusatus; средняя и особенно верхняя части щетинок заняты Н. peregra. Заселена в основном Г пара гнатопод, в зоне проподуса и карпуса. Вид обычный, но встречается в небольшом числе особей.
Распространение. Баренцево море, Мурман, литораль бухты к востоку от Дальнего пляжа в районе биостанции.
7. Heterochona trifaria Jankowski, 1972 (рис. 83).
Крупные, несколько вытянутые формы с цилиндрическим телом, слабо сужающимся к вершине и основанию. Четкого псевдостила нет. Шейка удлинена, шире, чему видов с Marinogammarus. ПВ массивная, широко раскинутая, с глубокими дорзальными складками и прекрасно развитыми, отогнутыми далеко назад боковыми карманами. Лепестки очень высокие, наклонены к вентральному краю ПВ, как у Н. crinita, несут большое число тонких, слабо изогнутых шипов; с вентральной стороны на лепестке видно 20—22 шипа. Вентральные шипы имеют округлое сечение, не сплющены, несколько изогнуты, расположены тремя рядами (направлены вверх, вбок, вниз). Такой комплекс встречается только у Н. trifaria. Диск неширокий, ампула тонкая, длинная.
Размеры. Длина особи 90—99 мк, с лепестками 98—105 мк; L : D=4 : 1: размеры тела 63—72 Х24—27 мк, шейки 2—4x8—12 мк, ПВ 12—16X30—34 мк; длина
лепестков 6—8 мк, ампулы И—12 мк, эндостила 4 мк; диам. диска 10—10.5 мк; длина ножки 5—7 мк; размеры Ма 18—23X12—14 мк, Ми 3.3 мк (наиболее крупный Ми у хонотрих), томита 38—46Х 13—21 мк; длина вентральных шипов 8, 5 и 4 мк, дорзальных 9 —11 мк. В отличие от II. scheutenii, II. crinita п II. psychra шипы пе сплющены; вентральные шипы расположены в 3 ряда, а не в 2, как у других видов.
Локус и хозяева — щетинки ротовых придатков и гнатопод Gammarus oceanicus (типовой хозяин) и G. setosus (дополнительный хозяин); вид обычный, образует массовые поселения.
Распространение. Баренцево море, Мурман, литораль Ярнышной губы, Дальне-Зеленецкой бухты и залива к востоку от Дальнего пляжа.
ПРИЛОЖЕНИЕ
«Vaginicola crystallina» Ehr., 1833.
Вест (Tuffen West, in: Bate a. Westwood, 1863 : 374) приводит лишь рисунок (рис. 79, Г—Е) и следующее замечание о виде: «Поведение рачков, очевидно, не столь активно, поскольку мы нашли, что их плавательные придатки часто густо покрыты видом Vaginicola, — вероятно, V. crystallina». Хозяин — Gammarus marinus Leach; Вестом приведены синонимы: G. olivii, G. affinis, G. gracilis, G. poecilurus, G. kroyeri. Основной материал собран в Плимуте (Англия), но точный пункт сбора зараженных рачков не отмечен. Вид обычно отождествляют с Н. scheutenii (Кент, Мор, Мацудо, Бючли и др.), но это ошибка: у «И. crystallina» шейка вытянута, имеется псевдостил; G. marinus не встречается в эстуариях, где обитают хозяева Н. scheutenii. Интенсивность заражения велика: на 4 щетинках изображена 21 особь; щетинка заселена до основания, как у Н. coronata, но не у Н. scheutenii. Вероятнее всего это Н. coronata. Приведены и зарисовки рачка, что даст возможность его точного определения.
2. Род HELIOCHONA Plate, 1888
Plate, 1888 : 38; В u tschl i, 1889 : 1756 (Spirochona, part.); W allengr en, 1895 : 3, 4 (-j-Heterochona)', 1896 : 553 (+ Heterochona)', D о i 1 e i n, 1897a : 623; H a m-b u r g. e r u. Buddenbrock, 1911 :110 (Spirochona, part.); Lep 5 i, 1926 : 88 (Spirochona, part.); 1965 : 285, 833 (+ Heterochona); Kahl, 1933 : 141; 1935 : 803 (+ Heterochona); Precht, 1935 : 464 (+ Heterochona); Kudo, 1946 : 682 (+ Hete-.rochona); Mohr, 1948 : 2 (-j- Heterochona); Guilcher, 1950 : 468, 470; 1951 : 42, 56; Hall, 1953 : 413 (-)- Heterochona); F a u r ё-F r e raiet a. oth., 1956 : 188; Corl iss, 1961 : 136; Mohr a. oth., 1961 : 220 (+ Heterochona); 1963a : 228, 229; 1963b : 121 .(+ Heterochona); Dobrzahsk a-K aczanowska, 1963 : 367 (+ Heterochona); Fenchel, 1965 : 283 (+ Heterochona,); Matsudo a. Mohr, 1965 : 523, 524; 1968 : 280 (+ Heterochona).
Относительно некрупные формы с широким мешковидным телом, вытянутым в верхней части и особо широким, сплющенным в нижней. Шейка четкая, обычно удлинена. ПВ крупная, всегда с лепестками, наклоненными к вентральному краю ПВ и перекрывающими полость воронки. Вооружение ПВ в целом сложнее, чем у гетерохон: нет видов с недифференцированными и с саблевидными (плоскими) вентральными шипами, шипы всегда крюковидные, с округлым сечением, направлены в разные стороны, часто отличаются по размерам. Дорзальные шипы гелиохон однотипны: длинные, тесно сближенные, многочисленные, загнутые к вентральному краю ПВ, всегда недифференцированные. Стенка ПВ обычно исчерчена, как у ряда гетерохон; это продолжение шипов — ребра кутикулы. Ножка очень низкая, дисковидная, расположена субтерминально (педоморфный признак). Прочное прикрепление к субстрату и устойчивость обеспечивает подошва. Ампула, вероятно, отсутствует. Основные отличия от Heterochona'. мешковидное тело, субтерминальное положение дисковидной ножки, наличие, подошвы, отсутствие ампулы и псевдостила, однотипный комплекс шипов, отсутствие саблевидных шипов, приуроченность к жабрам, отсутствие на щетинках.
С 1 известным видом (Н. sessilis, типовой) и 3 новыми (II. pontica, Н. elegans, Н. alternans), обитающими на жабрах Gammaridae (Gammarus и, реже, A nisogammarus) и Amphitholdae (Amphithoe, редко). Стеногалинные виды, не выносящие сильного понижения солености и не встречающиеся в опресненных зонах морей и в реках. Гелиохоны обычны на Мурмане, в Белом море, один вид найден в Черном море (на Gammarus, Amphithoe); в дальневосточных морях очень редки. Находки вне СССР: Дания; южная Швеция (зона проливов); Англия (Плимут); Франция; ГДР; ФРГ (Северное и Балтийское моря). Мацудо и Мор упоминают о частых находках Heliochona на Anisogammarus spp. в восточной Пацифике, но это, вероятно, виды Heterochona с плеопод.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА HELIOCHONA
1 (2). На вентральной стенке ПВ удлиненные шипы чередуются с 4—7 короткими
.................................................... 1. Н. sessilis.
2 (1). Удлиненные вентральные шипы чередуются с 1—3 короткими.
Рис. 84. Heliochona sessilis. А—Н — с Gammarus locusta (4'—К — по: Wallengren, 1895; Л—Н — по: Fenchel, 1965); О—Р — с Gammarus sp. (по: Plate, 1888).
3 (4). Шейка короткая, обычного типа...........................2. Н. pontica.
4 (3). Шейка резко удлинена; система шипов простая.
5 (6). Шипы резко неравны по размерам, удлиненные чередуются с 1—2 короткими ............................................................... 3. Н, elegans.
б (5). Вентральные шины слабо отличаются по размерам; смежные шипы направлены в разные стороны............................................4. Н. alternans.
1. Heliochona sessilis Plate, 1888 (рис. 1,Я; 2, Е; 30, В; 32, А, Б; 84—86; 87,
Б—Г; 89, Д, Е; 90, Ж. -
Plate, 1888 : 38 (отдельное издание), 139 (в журнале), Taf. II, Fig. 49—51; В ii t-s с h 1 i, 1889 : 1756 (Spirochona, part.); W allengren, 1895 : 3, 44, pl. I, fig. 3—6, 8, 11-14; pl. II, fig. 22, textfig. 1—2; 1896 : 553; Hamburger u. Buddenbrock, 1911 : 110, Fig. 137, 138
(Spirochona; рис. 138 с ошибочной подписью — S. scheutenii); L e p ? i, 1926 : 88, Taf. XIV, Fig. 476—477 (Spirochona; рис. 477 с ошибочной подписью — S. scheutenii); Kahl, 1933 : 141, Fig. 26, 5, 10 (первый с ошибочной подписью — H. scheuteni; в тексте ссылка на рис. 26, 4, изображающий Н. scheutenii, но с ошибочной подписью — Н. sessilis); 1935 : 804, Fig. 148, 7, 18; Precht, 1935 : 419, 464; Kudo, 1946: 681, 682, fig. 320, e; Hall, 1953 : 413, fig. 7.49, E; D o-brzanska-K ac z a nows k a, 1963:367; Fenchel, 1965 : 283, fig. 2, A, 4; L e-p ? i, 1965 : 285, 833; M a-tsudo a. Mohr, 1965 : 523, 524, fig. 5—7, 9 (последний c ошибочной подписью — H. scheutenii); 1968 : 280.
Таксономическая история вида. Плате (Plate, 1888) изображает две особи, одну из них с равными шипами; рисунки крайне упрощены. Показано чередование 1 крупного и 2, чаще 3 мелких шипов гипохона. По Валлен-грену, чередуются 8—9 длинных шипов с 3, чаще ,4 мелкими, направленными" вниз и в стороны; лепестки несут по 7—10 шипов. Мацудо и Мор по рисункам Валленгрена определяют общее число шипов вида равным примерно 46 (9 дорзальных, 37 вентральных), но это число занижено на треть. После Валленгрена морфологию вида не изучали. Гамбургер дала правильный
Рис. 85. Heliochona sessilis с Gammarus oceanicus.
диагноз вида, но спутала ри-
сунки Н. sessilis и Н. scheutenii; Каль (Kahl, 1933) спутал также и диагнозы (Н. sessilis — с равными шипами, Н. scheutenii — с крупными й мелкими); ошибки исправлены им в 1935 г. Каль считает обе формы лишь модификациями одного вида, поскольку они живут на одном рачке и имеют «рудименты стебелька».
Диагноз. Некрупные формы с широким, мешковидным, а иногда цилиндрическим телом. Шейка широкая, не вытянута. ПВ несет шипы трех типов: длинные тонкие на эпихоне, длинные толстые и короткие тонкие на гипохоне. Лепесток несет
15—17 шипов, с вентральной стороны видно только 7—8 шипов. Каждый из 12—18 удлиненных шипов гипохона чередуется с 2—8, обычно с 6 мелкими шипами, направленными в разные стороны. Диск очень широкий.
Размеры. Типовая раса (по Плате): длина особи 54 мк, ПВ и шейки 20 мк, тела 34 мк; ширина тела 25 мк, при виде сбоку 7 мк. Раса Валленгрена: длина средней особи 52—60 мк; ширина тела 20—24 мк, шейки 9 мк, ПВ 35—37 мк. Мурманская раса: длина особи 60—87 мк; L : D=2.5 : 1; размеры тела 40—50X33—35 мк, шейки 8— 10X10—11 мк, ПВ 12X31—33 мк; длина лепестков 6—8 мк, шипов гипохона до 5 и 15 мк, шипов эпихона до 14 мк; диам. розетки 4—5 мк, диска до 30 мк; размеры Ма 13—18X11—12 мк, Ми 2.8 мк, томита 28—37X12—21 мк.
Рис. 86. Heliochona sessilis с Gammarus oceanicus.
Локус. По Плате, вид заселяет плоскую поверхность жабр, реже — периферию; по Прехту, Фенхелю и нашим данным — наружный, реже медиальный, еще реже дорзальный край жабр. Вид обычный, но не массовый; на жабре отмечались единичные особи (Плате), 8—10 особей (Валленгрен), 5—30 (наш материал), до 74 (Прехт) и до 120 при оптимальной солености (Фенхель); заселены обе стороны жабр.
Хозяева и распространение. По Добжанской-Качановской, Плате нашел Н. sessilis якобы в солоноватых водах «в окрестностях Висмарской бухты и на побережье Северного моря»; это ошибка: Плате указывает лишь Северное море, хозяин — Gammarus sp. Скорее всего рачки собраны на о. Боркум, поскольку в статье Плате упоминается о «многонедельном пребывании на о. Боркум в Северном море осенью 1886 г.» (Plate, 1888 : 40). Типовой хозяин, вероятно, G. locusta, G. oceanicus или G. salinus. Последующие находки вида: на G. locusta (Wallengrzen, 1895 — южная Швеция, Хельсингборг, биостанция в Кристинеберге у Богусленса; Precht, 1935 — Германия, Кильская бухта; Fenchel, 1965 — Дания, Эресунд), на G. salinus и G. oceanicus (Fenchel, 1965 — Швеция, Изефьорд; Дания, Эресунд). «Редкие особи Heliochona psychrait, найденные на жабрах G. setosus в США (Аляска, оз. Нувук — Matsudo а. Mohr, 1965), могут принадлежать только к Н. sessilis. Этот вид обычен в морях северной Европы и (на G. setosus) встречается в арктическом поясе Сибири и Северной Америки. В качестве типового хозяина нами обозначается G. oceanicus (Баренцево море, Мурман, район Дальних Зеленцов; Белое море, Чупа и Картеш), дополнительного — G. setosus (Мурман, Аляска).
2. Heliochona pontica Jankowski sp. nov. (рис. 22, E; 87, A; 88; 89, 4).
Некрупные формы с очень широким, угловатым телом, слабо сплющенным дорзо-вентрально. Шейка хорошо выражена, неширокая, не вытянута. ПВ ненамного шире тела; с вентральной стороны на лепестках видно по 7 толстых шипов; вентральные шипы двух типов: толстые удлиненные, направленные вверх и тонкие короткие, направленные в стороны. Крупные шипы чередуются с 2—3 мелкими.
Рис. 87. А — Heliochona pontica с Gammarus locusta; Б—Г — Н. sessilis с G. oceanicus.
Размеры. Длина особи 53—60 мк, с лепестками 62—64 мк; L : D=3 : 1; размеры тела 35—40X20—25 мк, шейки 8—9X7—8 мк, ПВ 10—14X26—30 мк; длина лепестков 6—8 мк, шипов гипохона 4—5 и 9—12 мк, шипов эпихона 10 мк; диам. розетки 5.5—6.5 мк; размеры Ма 12—14X8—9.5 мк, томита около 32X15 мк.
Система шипов у Н. pontica сложнее, чем у Н. elegans и Н. alternans, и проще, чем у Н. sessilis; шейка умеренной длины.
Локус и хозяин — края жабр Gammarus locusta; вид редкий, особи немногочисленны. По Стоку (Stock, 1967), балтийский вид G. locusta не встречается в Черном море, определение рачка поэтому провизорное.
Р аспространение. Черное море, Крым, литораль близ Алушты.
3. Heliochona elegans Jankowski, 1972 (рис. 21, Г; 91, А).
Тело высокое, шейка тонкая, вытянутая; удлинен и участок тела между Ма и шейкой. ПВ массивная, шире тела. На лепестке с вентральной стороны видно 10—12 толстых кривых шипов; удлиненные толстые вентральные шипы чередуются с 1—2 короткими, направленными вбок.
Рис. 88. Heliochona pontica c Gammarus locusta.
Рис. 89. А —• Heliochona pontica с Gammarus locusta', Б—Г — Н. alternans с Amphithoe rubricata, Мурман (Б, В) и Франция (Г; по: Guilcher, 1951);
Д, Е — Н. sessilis с G. oceanicus.
15 Заказ 21.
Размеры. Длина особи 71—74 мк, с лепестками 80—83 мк; L : D = 3.5 : 1; размеры тела 40—45X25 мк, шейки 20X6.5 мк, ПВ 13—14X28 мк; длина лепестков. 7 мк, вентральных шипов 17 и 5 мк, дорзальных 11 мк; диам. розетки 4.5—5 мк; размеры Ма 16—18X11—13 мк, томита 27—32X16—20 мк.
Рис. 90. А-—Е — Heliochona alternans с Amphithoe rubricala и Anisogamma-rus sp.; Ж — H. sessilis с Gammarus oceanicus.
В отличие от Н. pontica и Н. sessilis тело вытянуто, система шипов простая; у Н. alternans шейка длиннее, шипы тонкие, почти одинаковых размеров.
Локус и хозяин — края жабр Gammarus obtusatus (единственный вид гелиохон с подрода Marinogammarus); вид частый, массовый.
Распространение. Баренцево море, Мурман, район Дальних Зеленцов,, литораль бухты к востоку от Дальнего пляжа у биостанции.
i. Heliochona alternans Jankowski, 1972 (рис. 19, В; 22, В, Г; 30, 3, И: кА, Е; 89, Б—Г', 90, А — Е; 91, Б—Г).
Guilcher, 1950 : 468 (scheutenii)', 1951 : 42, 56, fig. 13—14 {scheutenii)', D ob-r z a n s к a-K aczanowska, 1963 : 367 {scheutenii)', Mohr a. oth., 1963a : 229, fig. 4 {scheutenii)', Matsudo a. Mohr, 1965 : 524, fig. 11 (scheutenii).
Рис. 91. A — Heliochona elegans c Gammarus obtusatus', В—Г — H. alternans c Amphithoe rubricata.
Тело крупное, тонкое, резко удлиненное в верхней ласти; шейка тонкая, вытянутая, иногда длиннее тела. ПВ крупная, значительно шире тела. С вентральной стороны на лепестке видно 15 шипов; вентральные шипы тонкие, слабо изогнутые, дифференцированы по длине и направлению (смежные шипы направлены вверх и вбок). Как Н. scheutenii Гийше обозначила хонотрих с локуса и хозяина (с жабр A mphithoe rubricata), никогда ранее не указывавшихся для гелиохонид, причем вид внешне ничем не напоминает Н. scheutenii. Определение могло проводиться по Гамбургер, спутавшей рисунки Н. sessilis и Н. scheutenii, или по Калю (КаЬГ, 1933), спутавшему и их
диагнозы. Мацудо и Mop (Matsudo a. Mohr, 1965) считают, что Гийше изучала II. sessilis или — что более вероятно — другой вид рода.
Размеры. Мурманская раса: длина особи 108—120 мк, с лепестками 121 — 132 мк; L : D=4—4.5 : 1; размеры тела 52—60x23—32 мк, ПВ 12—13x30—36 мк, шейки 48—55X9—10.5 мк; длина лепестков 9—14 мк, вентральных шипов 4—7 и 10 мк, дорзальных до 11 мк; диам. розетки 8 мк; размеры Ма 20—23X12—14 мк, то-мита 38—40x23—25 мк.
От других гелиохон вид отличается резким удлинением шейки; комплекс шипов проще, чем у Н. elegans и особенно у И. pontica и И. sessilis.
Локус и хозяин — края жабр Amphithoe rubricata; вид на Мурмане обычный, массовый, жабра может нести десятки особей гелиохон.
Распространение. Франция (Guilcher, 1951); Баренцево море, Мурман, верхняя сублитораль Дальне-Зеленецкой бухты (типовая раса). Близкий вид найден на Anisogammarus locustotdes на о. Беринга (рис. 90, Д—Е).
V. Семейство CHILODOCHONIDAE Wallengren, 1895
W а 1.1 е n g г е п, 1895 : 60; 1896 : 553 (Chilodochonina); I agerskiold, 1896 : 890 (Chilodochonina)-, Р о c'h е, 1913 : 182; Bhatia, 1936 : 422 (приписано Похе); Mohr, 1948 : 12 (приписано Похе); 1966 : 539; Guilcher, 1951 : 42 (Chilodochoninae par lapsus), 117; Hall, 1953 : 333, 412; Doflein u. Reich e-n о w, 1953 : 1154 (приписано Похе); Corliss, 1961 : 135; Dobrzanska-Kaczanowska, 1963 : 367; L e p ? i, 1965 : 853; Янковский, 19676 : 41.
Одиночные инфузории с массивным, не сплющенным телом, обычно овальным или грушевидным, реже цилиндрическим или почти округлым (рис. 92, И—Щ). Верхняя и нижняя части тела не удлинены, псевдостила нет. Шейка практически отсутствует; заметен все же перехват между телом и ПВ. ПВ массивная, цилиндрическая, с почти параллельными краями у примитивных форм (где она уже тела), широко раскрытая у высших. Дорзальный край ПВ поднят над вентральным, имеет вид лепестка или щитка, у одного из родов (Cryptochona) перекрывающего всю полость ПВ. Вентральная и небольшая дорзальная стенки ПВ у высшего рода Chilodochona в литературе обозначаются как «губы». Нет ни складок, ни карманов ПВ, контур отверстия ПВ округлый или серповидный. Нет парных лепестков, шипов, гипоколлюма. Стенки тела и ПВ резко утолщены, полость ПВ имеет вид узкого извитого канала. РПА особого типа: полимеризованы кинеты зоны А; вероятно, контактируют зоны А и В; полоса А цельная, не подразделена на подзоны. Ма вытянутый, лежит почти поперек тела; парамер расположен слева, а не внизу. Очень широка зона склероплазмы. Имеется длинный широкий стебелек с опорным диском, удаленным от тела; эндостил несет серию радиальных палочек. Ампулы полимеризованы (педоморфоз: нет их редукции при росте томита). Стебелек плотный, без канала и стилонем. Нет ни подошвы, ни псевдостила. В жизненном цикле неизвестны конъюгация, диминутивное почкование, полигеммия; найдены стадии тотального перехода трофонтов в трофотомитов, нетипичные для хонотрих.
Отличия от других семейств экзогеммин: отсутствие шипов, полимеризация кинет и ампул, утолщение стенок тела и ПВ, раскрытие ПВ у высших форм, наличие стебелька, особый жизненный цикл, отсутствие завитка ПВ, подошвы, ножки, шейки, вытянутый Ма.
Известен один (типовой) род Chilodochona-, нами найдены два новых — Vasichona и Cryptochona. Заселены только ротовые придатки всех 4 подгрупп Decapoda. Морские стеногалинные формы, не выносящие и небольшого опреснения. Весьма обычные хонотрихи, распространены на литорали и в сублиторали Мирового океана; семейство в целом космополитно (Атлантика, Пацифика, Южная и Северная Америка, Европа).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА CHILODOCHONIDA Е
1 (4). ПВ цилиндрическая, с почти параллельными стенками, не расширена.
2 (3). Дорзальный лепесток небольшой, не закрывает полости ПВ..................
............................................. 1. Род Vasichona (стр. 229).
3 (2). Дорзальный лепесток превращен в широкую защитную пластинку, перекрывающую полость ПВ.................................2. Род Cryptochona (стр. 231).
4 (1). ПВ раскрытая, резко расширена сверху; дорзальная стенка ПВ без лепестков или щитков........................................3. Род Chilodochona (стр. 232).
1. Род VASICHONA Jankowski, 1972
Тело почти равномерной толщины, цилиндрическое, очень слабо сужающееся в области шейки. ПВ относительно некрупная, не растянута в стороны, не раскрыта — края ПВ почти параллельны, воронка сужается кверху (ПВ всех хонотрих кверху
Рис. 92. А—О — Eleutherochona sivertseni с Epymenia sp. (по: Dons, 1948); П—Щ — Chilodochona qvennerstedti с Portunus depurator (no: Wallengren, 1895).
всегда расширяется). Ширина ПВ меньше толщины тела. Наружное отверстие ПВ небольшое, округлое. Вентральный край ровный, дорзальный — с толстым лепестком. Прикрепительный комплекс и Ма обычного для хилодохонид типа.
Даже при находках промежуточных форм род слишком резко отличается от Chi-lodochona, чтобы быть включенным в его состав: ПВ сужается у вазихон и расширяется у хилодохон, у которых края воронки имеют вид губ. Сходна форма ПВ у Vasichona п Cryptochona, по у последних лепесток резко разросся, превратился в щиток, закрывающий полость ПВ.
С одним (типовым) видом V. paguri, живущим на Pagurus.
Рис. 93. Vasichona paguri с Pagurus pubescens.
1. Vasichona paguri Jankowski, 1972 (рис. 2,.H; 93; 94, О, П).
С признаками рода.
Размеры. Длина особи 117—125 мк, с лепестком 125—131 мк; L : D=2.5 : 1; размеры тела 95—105x47—52 мк, ПВ 20—23X33—37 мк; ширина шейки 36—40 мк, отверстия ПВ 23—25-мк; толщина стенок ПВ до 12 мк; размеры лепестка 13—20X11— 12 мк; диам. диска 15—19 мк; размеры стебелька 74—117x8 мк, Ма 28—33x17 мк.
Локус и хозяин — щетинки ротовых придатков Pagurus pubescens', заражены отдельные особи, ио вид образует иногда массовые поселения. Заселены дистальные •отделы максиллулы и максиллипед, особенно эндоподиты I и II пары.
Распространение. Баренцево море, Мурман, Дальние Зеленцы, литораль и сублитораль до глубины 15 м.
Рис. 94. А, В — Chilodochona aranei с Hyas araneus; В—R — Cryptochona tumlda c Crangon dalli', JI—H — Chilodochona carcini c Carcinus maenas (no: Faure-Fremiet a. oth., 1956); О, П — Vasichona paguri c Pagurus pubescens.'
2. Род CRYPTOCHONA Jankowski gen. nov.
Тело вздутое, овальное, заметно суженное в зоне шейки. ПВ крупнее, чем у ва-зихон, с почти параллельными краями, несколько уже тела, не раскрыта и не растя
нута в стороны; стенки ПВ не имеют вид губ. Наружное отверстие ПВ относительно небольшое, бобовидное или овальное. Вентральный край ПВ складчатый, дорзальный резко разросся, превратился в очень крупный щиток, перекрывающий полость ПВ. Это гомолог лепестка вазихон и одной из губ хилодохоп.
Род четкий: ПВ не раскрыта, как у Chilodochona, края ПВ не имеют вид губ; лепестка нет, развита непропорционально крупная защитная пластинка, резко наклоненная к вентральному краю ПВ.
С одним (типовым) видом С. tumida, обитающим на ротовых придатках креветок Охотского моря.
1. Cryptochona tumida Jankowski sp. nov. (рис. 2, П, P; 94, В—К).
С признаками рода.
Размеры. Длина особи 95—103 мк, со щитком 98—111 мк; L : D=2.5 : 1; размеры тела 76—81X38—47 мк, ПВ 17—22X30—38 мк; ширина шейки 29—37 мк, отверстия ПВ до 35 мк; толщина стенок ПВ до 10 мк; диам. щитка 30—39 мк, диска 9—12 мк; размеры стебелька 51—82X9 мк, Ма 30—32x10—13 мк.
Локус и хозяин — щетинки ротовых придатков Crangon dalli; вид массовый, образует плотные поселения на максиллипедах.
Распространение. О. Кунашир, литораль.
3. Род CHILODOCHONA Wallengren, 1895
Wallengren, 1895 : 2, 49; 1896 : 547 (вторично указан как gen. nov.); W а-terhouse, 1902 : 618 (с ошибочной датой описания — 1896); F aure-Fre-m i е t, 1905 : 208; Hamburger u. Buddenbrock, 1911 : 113; L e p ? i, 1926 : 88; 1965 : 285, 853; Schulze, 1927 : 653; Kahl, 1933 : 140; 1935 : 802; N e a v e, 1939 : 692; Faure-Fremiet et Guilcher, 1947 : 112; Kudo, 1946 : 681—682; Raabe, 1947 : 338; Guilcher, 1948 : 960; 1949 : 214; 1950 : 467; 1951 : 42; Mohr, 1948 : 2, 9, 12; 1959a : 652; 1966 : 537, 539; Faure-Fremiet, 1950 : 115; 1959 : 475; Doflein u. Reichenow, 1953 : 1154; H all, 1953 : 412; Faure-Fr e.m i e t a. oth., 1956 : 188; Corliss, 1961 : 135; 1967 : 16; D obrzahsk a - Kacza no wsk a, 1963 : 368; Mohr a. oth., 1963a : 232; Raabe, 1964c : 178; M a t s u d o, 1966 : 359; Matsudo a. Mohr, 1968 : 281.
Тело очень широкое, вздутое, иногда почти сферическое, слабо сужающееся в области шейки. ПВ массивная, растянута в стороны, несколько сплющена дорзо-вент-рально, с серповидным или бобовидным контуром наружного отверстия. Вентральный край ПВ обычно с косыми складками. ПВ резко расширяется кверху, раскрытая; особо велика аллометрически разросшаяся вентральная стенка; дорзальная стенка небольшая, не образует лепестков или щитков, не выше вентральной или незначительно поднята над ней. При виде сбоку стенки имеют вид губ. Ма обычно вытянут сильнее, чем у вази- и криптохон.
В отличие от вази- и криптохон ПВ расширяется кверху, края воронки не параллельны; нет лепестка, свойственного Vasichona, и крупного щитка криптохон. ПВ хилодохон значительно шире тела, Ма вытянут.
С одним (типовым) видом Ch. qvennerstedti, если не считать недостоверного Ch. mic-rochilus, и с 3 новыми видами — Ch. aranei, Ch. palinuri и Ch. carcini. Заселены только ротовые придатки Decapoda групп Мастита (Scyllariidae, Pallnuridae), Anomura (Ра-guridae, Galatheidae, Lithodidae), Brachyura (Leucosiidae, Majidae, Hymenosomidae, Por-tunidae, Cancridae, Grapsidae), Natantia (Crangonidae, Pandalidae). Известные хозяева рода: Scyllarus, Palinurus, Cervimunida, Eupagurus, Pagurus, Parapagurus, Paguristes, Paralithodes, Ebalia, Inachus, Inachoides, Maja, Halicarcinus, Portunus, Ovalipes, Polybius, Cancer, Hyas, Pachygrapsus, Pandalus, Crangon, Telmessus, Erimacrus, Chionocetes (Wallengren, 1895, 1896; Guilcher, 1951; Mohr, 1966; Mohr a. Matsudo, 1970; наши сборы). Вероятно, это крупнейший род хонотрих, с сотнями видов. Распространение предположительно космополитное (табл. 3).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА CHILODOCHONA
1 (2). Стебелек очень толстый, до 9 мк ............................4. Ch. palinuri.
2 (1). Стебелек значительно тоньше, порядка 3—5 мк.
3 (4). Тело вытянутое, почти цилиндрическое ......................2. Ch. carcini.
4 (3). Тело широкое, мешковидное, иногда почти сферическое.
5 (6). Стебелек тонкий, порядка 3.3 мк..............................3. Ch. aranei.
6 (5). Стебелек толще, порядка 4.3—5.3 мк.....................1. Ch. qvennerstedti.
1. Chilodochona qvennerstedti Whllengren, 1895 (рис. 1, АГ; 2, О; 45, И-, 92, П—Ш).
Wallengren, 1895 : 49, 60, pl. Ill, fig. I—17 (Qvennerstedti)', 1896 : 547, 553, fig.*1—5 (Zvennerstedti', вторично указан как sp. nov. на стр. 547); Zoological Re
cord, 1896 : 21 (Avennerstadti); Hamburger u. Buddenbroc к, 1911 : 113, Fig. 141 (quennersledtl); Lepsi, 1926 : 88, Taf. XIV, Fig. 481 (quennersledtl); 1965 : 285, 853 (quennersledtl); 1926 : 100 (quennerstadtii); К a h 1, 1933 : 140, Fig. 26, 6 (qii ennerstedti); 1935 : 802, Fig. 148, 13 (quennersledtl); К u d o, 1946 : 682, fig. 320, / (Quen-nerstedti), 681 (quennersledtl); D о f 1 e i n u. Reichenow, 1953 : 1154 (quenner-stedti); R a a b e, 1964b : 178,1'ig. 121, В (Chilodochona, без указания вида); M a t su d о, 1966 : 359, 364 (quennerstedti); Mohr, 1966 : 537, fig. 1, E (guennerstedti).
Тело мешковидное, очень широкое, не удлиненное. Губы — утолщенные края ПВ — находятся примерно на одном уровне, иногда несут косые складки. Стебелек
Рис. 95. А—Г — внешний вид Chilodochona aranei с Hyas araneus; Д—Л — срезы томита и трофонта Ch. carcini (по: Guilcher, 1951).
относительно неширокий, порядка 4—5 мк, длина его равна длине тела или наполовину больше. Диск широкий, заостренный.
Размеры, по Валленгрену (Wallengren, 1895): длина особи 61.31—113.3 мк,. ширина 37.32—59.98 мк; размеры стебелька мелких особей 39.99x4.3 мк, крупных 159.96x5.33 мк; диам. диска 6.66—7.5 мк.
Стебелек вида намного тоньше, чем у Ch. palinuri, и толще, чем у Ch. aranei; тело не вытянуто, как у Ch. carcini.
Вид найден сначала на максиллах и максиллипедах краба Ebalia tumejacta, затем в массе на ротовых придатках Portunus depurator; типовой хозяин не отмечен,, вероятнее всего это Р. depurator, Отмечены и одиночные особи на Pagurus bernhardus,.
но это явно другой вид хилодохои. Хилодохоны с Eballa и Purlunus также не могут
относиться к одному виду.
Распространение. Швеция, биостанция Кристинеберг у Богусленса (Валленгрен). Возможна находка па Р. depurator в Черном море.
2. Chilodochona carcini
Тис. 96. А—Д — Chilodochona palinuri с Palinurus vulgaris; Е, Ж — Ch. aranei с Hyas araneus.
Jankowski sp. nov. (рис. 14, Е—Л; 17, А, Б; 18, Д; 4А.А—Д; 45, О; 48, Ф, X; 94, Л—Н; 95, Д—Л).
Guilcher, 1948 : 960; 1949 : 214; 1950 : 467, fig. 1 — 2; 1951 : 43, fig. 1—10; pl. I, fig. 2—3 (quennerstedti); Hall, 1953 : 412—413, fig. 7.49, I, J (quennerstedti); Faure-Fremiet a. oth., 1956 :188, fig. 1—6 (quennerstedti); Mohr a. oth., 1963a : 229, fig. 2' (quennerstedti).
Тело вытянутое, почти цилиндрическое. ПВ относительно неширокая, с резко неравными по величине губами; вентральная стенка без косых складок. Стебелек с овальным сечением (4x2.6 мк), примерно такой же длины, как тело, или несколько короче. Диск с тупым краем.
Размеры (по Гийше): длина особей 60—110 мк; размеры томита 70x40 мк.
Стебелек у Ch. carcini вдвое тоньше, чем у Ch. palinuri, и на 1 мк толще, чем у Ch. aranei; тело не мешковидное, как у Ch. qvennerstedti.
Локус и хозяин — нижняя часть щетинок ротовых придатков (максилл и двух первых пар максиллипед) краба Carcinus maenas (типовой хозяин); вид массовый. Гийше (Guilcher, 1951) считает хозяевами виды Масгига и Вга-chyura из Франции (Carcinus maenas, Cancer pagurus, Scyl-larus arctus — Конкарно, Poc-кофф; Pachygrapsus sp., Por-tunus depurator — Вилльфранш-сюр-мер); Форе-Фремье — два первых вида в Роскоффе и Конкарно. По Мору (Mohr, 1966), определение Гийше ошибочно, это не Ch. qvennerstedti. Типичная морфология — на снимках Форе-Фремье, изучавшего, видимо, только формы с Carcinus maenas.
Распрост ранение. Атлантический и средиземно-
морский берега Франции (Роскофф, Конкарно); возможна находка в Черном море.
3. Chilodochona aranei Jankowski sp. nov. (рис. 94, А, Б; 95, А—Г; 96, E, Ж).
Тело крупное, широкое, удлиненное у особей с ровной поверхности придатков, вздутое у форм со щетинок. Вентральная губа ниже, но крупнее дорзальной, без скла--док. Стебелек очень тонкий (3.3 мк), короче тела у форм со щетинок (сетобионтов),
.длиннее тела у цланпбпоптов. Диск крупный, заострен. Возможно, сото- и плапи-биопты относятся к разным видам хилодохои: первые некрупные, овальные, с коротким стебельком; вторые удлиненные, широкие, с длинным стебельком.
Р а з м е р ы. Сетобиопты; длина особи 43—75 мк; ширина тела 32—35 мк, шейки 23 мк, ПВ 15—25 мк, слоя склероплазмы 6—7 мк; диам. диска 10 мк; размеры стебелька 33—35x3.3 мк, Ма 20x4—5 мк, томита 40—42x30—35 мк. Планибиопты: длина особи 96—109 мк; L : D=1.8 : 1; размеры тела 58—67x54—66 мк; ширина шейки 54 мк; размеры ПВ 30—33x43—67 мк; высота дорзального края ПВ 6 мк; толщина слоя склероплазмы до 12 мк;. размеры стебелька 84—135x3.3 мк, Ма 30—39Х Х9—10 мк, томита около 60X37 мк.
Стебелек у Ch. aranei тоньше, чем у других хилодохои (ширина соответственно -3.3 и 4.5—9 мк); диск тоньше и острее, чем у Ch. palinuri, более конический.
Локус и хозяин — ротовые придатки краба Ну as araneus var. hoecki (максиллы, максиллипеды). Типовая раса — со щетинок. Заражены немногие особи крабов, но среди них встречаются экземпляры с массовыми поселениями хонотрих, порядка 100—200 особей на придатке.
Распространение. Баренцево море, Мурман, литораль и сублитораль Ярнышной губы и Дальне-Зеленецкой бухты, глуб. 0—40 м.
4. Chilodochona palinuri Jankowski sp. nov. (рис. 96, A—Д).
Тело широкое, угловатое. Дорзальная губа выше вентральной, растянута в стороны, шире, чем у остальных видов; губы тесно сближены, параллельны. Вентральная губа без складок. Стебелек очень широкий (до 9 мк), массивный, длиннее тела; диск тупой, широкий.
Размеры. Длина особи 73—88 мк; L : D = 2 : 1; размеры тела 58x42—48 мк, 'ПВ 18—23X47—54 мк; ширина шейки 38—47 мк; толщина губ до 11 мк, слоя склеро-шлазмы 12—20 мк; диам. диска 12—13 мк; размеры стебелька до 155X9 мк, Ма 36— 41X10—11 мк.
Основные отличия от других видов: толстый стебелек, широкий диск, разрастание дорзальной стенки ПВ, угловатые контуры тела.
Локус и хозяин — щетинки, реже ровная поверхность ротовых придатков лангуста Palinurus vulgaris-, сето- и планибионты неотличимы. Вид редкий, небольшие поселения отмечены на 3 из 14 особей лангустов.
Распространение. Средиземное море, из улова рыболовецких траулеров.
ПРИЛОЖЕНИЕ
Chilodochona microchilus Wallengren, 1895.
Wallengren, 1895:58, 60, 76, pl. IV, fig. 1—3 (microchilus; Microchilus; mikrochilus); 1896 : 551, 553, fig. 6 (на стр. 551 вторично обозначен как sp. nov.); Hamburger u. Buddenbrock, 1911 : 113, Fig. 142; L e p s i, 1926 : 88, Taf. XIV, Fig. 482; Kahl, 1933 : 140, Fig. 26, 11; 1935 : 802, Fig. 148,’ 14; M о h r, 1948 : 12; Doflein u. Reichenow, 1953 : 1154.
Вид дважды указан как новый, оба раза под знаком вопроса. Небольшое число особей найдено на максиллипедах Portunus depurator, хозяина Ch. qvennerstedti, в Кри-стинеберге (Швеция). Тело овальное, изогнутое (рис. 1, Ц; 45, И; 48, Ц). ПВ едва развита, вентральная губа рудиментарна, дорзальная — крупная, загнута на вентральную сторону тела. Размеры не приведены. Валленгрен не был уверен, что это самостоятельный вид, и допускал, что это лишь форма Ch. qvennerstedti — результат задержки роста или интенсивного почкования, с редукцией ПВ, как у Heliochona. Вид позднее редко принимали без оговорок, обычно выражали сомнение в его реальности. Так, по Калю, это, видимо, «наполовину развитые или дегенерирующие формы» Ch. qvennerstedti. Выше (стр. 124) отмечалось, что Ch. microchilus — это, судя по зарисовкам Гийше, лишь стадии трансформации трофонта в томита (процесс, характерный для хилодохонид). Интересно в этой связи замечание Пенара (Penard, 1922 : 24): •«Картины диминуции у Spirochona gemmipara встречаются редко, но зато на некоторых особях Gammarus сразу у большого числа особей, так что на первый взгляд они даже кажутся особым видом». Такой «вид» и описан Валленгреном. Ch. microchilus — синоним Ch. qvennerstedti; название неприемлемо поэтому для обозначения вида хило-дохон с Ebalia tumejacta.
VI. Семейство SPIROCHONIDAE Stein, 1854
Stein, 1854 : 205; 1859 : 87; 1867 : 119 (Spirochonina); Pritchard, 1861 : 581 (V orticellina); E n t z, 1884 : 407 (Spirochonina); Butschli, 1889 : 1756 (Spi-rochonina, с ошибочной датой 1867); R о m p e 1, 1894 : 625 (Spirochonina); E i s-m on d, 1895 : 128 (Spirochonina); W allengren 1895 : 44; 1896 : 553 (Spiro-
chonind); Delage elHerouard, 1896 : 21 (S pirocho ulnae)', D О 11 e i n, 1896 : 366 (Spirochonaceen); 1897b : 643 (Spirochoninen); J agerskiold, 1896 : 890 (Spi-rochonidae — первое современное написание); G г о b b e n, 1904 : 46 (Spirochonidae); Henderson, 1905 : 20 (Spirochonina); Galkins, 1910 : 55; Andre, 1912 : 148 (Spirochoninae); Collin, 1912 : 321; P о c h e, 1913 : 113; M erm о d, 1914 : 47 (Spirochoninae); Keiser, 1921 : 226 (Spirochoninae); Сварчевский, 19286 : 44 (Spirochonina)-, Гаевская, 1933 : 184 (приписано Гроббену); 1949 : 305; Kahl, 1933 : 140; 1935 : 801 (с датой 1867); Bhatia, 1936 : 422; Dons, 1940 :
Рис. 97. Спирохониды Байкала (по Сварчевскому, 19286). А, Б — Spirochona gemmipara; В, Г — «S. pusilia»; Д—Ж — S. globulus; 3, И — S. simplex; К — «S. patella»; Л—Н — S. elegans; О, П — S. tuba; Р, С — S. elegantula; Т—Ч — S. anthus.
115 (Spirochoniden); Kudo, 1946 : 681—682; В u i s a n, 1947 : 69, 72 (Esplrocbni-dos), 10, 82 (Espirocoridos); Mohr, 1948:12 (приписано Гроббену), Guilcber, 1951 : 41 (Spirochonina Stein, 1867), 42, 49 (Spirochoninae Stein, 1867), 117 (Spirochonidae); Doflein u. Reichenow, 1953 : 1154 (приписано Гроббену); Hall, 1953 : 412; Jiroveca. oth., 1953 : 527 (с датой 1867); § r a me k - Hu s ek, 1953 r 83 (с датой 1867); Corliss, 1961 : 135; Dobrzaiska-Kaczanowska, 1963 : 367, 388; Mohr a. oth., 1963a : 227 (приписано Гроббену); Гол ем а пеки, 1964 : 160 (с датой 1867); L е р $ i, 1965 : 853; Янковский, 19676 : 41; D п-d i с h, 1967 : 9; Matsudo a. Mohr, 1968 : 280.
Удлиненные формы с бутылковидным, несплющенным (исключая вид с плеопод) телом (рис. 97). Шейка короткая, не удлиненная. ПВ крупная, шире тела, стенки не утолщены. Вентральный край ровный у спирохон, с одной или несколькими вы-
Рис. 98. Спирохониды Байкала. А — Spirochona globulus с Ommatogamma-rus flaws', Б — S. simplex c 0. flaws', В — S. gnathopodialis c 0. flaws', Г — Cavichana oligocineta c Eulimno gammarus sp.; Д — Serpentichona anthus c A cantho gammarus reicherti.
резками у кавп- и серпентихон. Дорзальная стенка со складками, карманами и с характерным спиральным завитком (дейтерохопом), образованным при разрастании в скручивании стопки в зоне левого лепестка ПВ лобохоппд (рис. 98). Зоны А и В пред-ротовой цилиатуры не контактируют, включают типичное число кинет (7—9 и 19—22);. зона А не делится па две полосы, но три верхние кинеты лежат па особой наклонной площадке, под углом к остальным; эти ряды входят в дейтерохоп, оканчиваясь на разных уровнях. Кутикула тела (не ПВ, как у Heliochonidae) часто исчерчена. Шипов и гипоколлюма нет. Ма яйцевидный или овальный, не удлинен. Прикрепление к субстрату низкой широкой терминальной ножкой; стебелька и подошвы нет. Псевдостил намечается у спирохон и достигает особого развития у кави- и серпентихон. Ампулы у трофонтов отсутствуют, исчезают после оседания томита. Жизненный цикл типичный, с диминуцией и полигеммией; трофотомонты не образуются.
Семейство четкое: только у спирохонид имеется завиток ПВ, отогнуты вентральные края ПВ (с образованием карниза), несколько обособлены верхние кинеты полосы А. В отличие от хилодохонид нет стебелька, утолщения стенок ПВ, полимеризации кинет; в отличие от гелио-, филло- и филихонид нет шипов; от лобохонид отличается отсутствием лепестков ПВ.
Крупное семейство с 9 известными видами рода Spirochona; мы различаем 26 видов 3 родов (Spirochona — типовой род, Cavichona и Serpentichona). Хозяева — виды Gammaridae в пресных водах (север Евразии, предположительно и в США) и виды A nisogammarus в морях и эстуариях (литораль восточной и западной Пацифики). Заселены преимущественно жабры, как исключение — плеоподы и гнатоподы хозяев..
ТАБЛИЦА ДЛЯ. ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА SPIROCHON IDAE
1 (2). Вентральный край ПВ ровный, без складок и вырезок; псевдостил очень короткий ..........................................1. Род Spirochona (стр. 238).
2 (1). Вентральный край ПВ неровный, со складками и вырезками; псевдостил четкий, удлиненный у большинства видов.
3 (4). Имеется одна вырезка.......................2. Род Cavichona (стр. 254).
4 (3). Вырезки многочисленны...................3. Род Serpentichona (стр. 276).
1. Род SPIROCHONA Stein, 1852
Stein, 1852 : 485; 1854 : 205 (-(-Heterochona); Clap a red е et Bachmann, 1858:131, 132; 1860—1861:91, 105; Pritchard, 1861:598 (+He-terochona); Marschall, 1873 : 481 (Spirocona Stein, 1849, par lapsus; Spirochona Stein, 1867); Fromentel, 1874 : 145 (-(-Heterochona); В ii t s c h 1 i, 1877 : 59; 1889 : 1756 (с датой 1851; -(-Heterochona, Lobochona, Heliochona, Stylochona)', H e r t-wig, 1877a : 149; 1877b : 311; Kent, 1881 : 660 (-(-Heterochona)', В albiani, 1881 : 398; 1895 : 241; Scudder, 1884 : 298 (Spirocona Stein, 1849, par lapsuS; Spirochona Stein, 1867); Kellicott, 1885 : 45; C a n u, 1886 : 21 (-(-Lobochona); Plate, 1886 : 200; 1888 : 39 (Spirochona par lapsus); E i s m о n d, 1890a : 28; 1890b : 256; 1895 : 127 (-[-Heterochona', Spirocoma par lapsus на стр. 103); Romp el, 1894 : 631; Blochmann, 1895 : 116; Wallengren, 1895 : 2, 4 (с датой 1851); 1896 : 549, 553; D о f 1 e i n, 1896 : 363; 1897a : 625; 1897b : 644; 1900 : 2; Roux,. 1900 : 464; 1901 : 112; Hickson, 1903 : 416; Faure-Fremiet, 1905 : 208, 222; 1910 : 44; 1950a : 115; Henderson, 1905 : 20; H a r t о g, 1906 : 138, 144; Sakowsky-Campioni, 1907 : 137; Calkins, 1910 : 55; 1941 : 7; H a m-burger u. Buddenbrock, 1911 : 109 (-(-Heterochona, Heliochona, Stylochona, Kentrochona); Andre, 1912 : 148; Collin, 1912 : 321; Thienemann, 1912 : 52; 1913a : 283; 1913b : 437; M e r m о d, 1914:47; Keiser, 1921:226; P e-n a r d, 1922 : 243; L ep?i, 1926 : 88 (-(-Heterochona, Heliochona, Stylochona, Kentrochona)', 1965 : 533, 790, 853; W e.nyon, 1926 : 1224; 1965 : 1224; Гаевская, 1927 : 314; 1933 : 184; 1949 : 305; Сварчевский, 1928a : 188; 19286 : 46; К a 1-m u s, 1928': 383; Kahl, 1930 : 28; 1933 : 141 (-(-Stylochona)', 1935 : 804 (-(-Stylochona)', P r e c h t, 1935 : 470; Schulze a. oth., 1936 : 3249 (Spirochona, pro Spirocona Marschall, 1873); Bock, 1938 : 56, 101, 138, 159, 163; N e a v e, 1940 : 260 (с датой 1852); Kudo, 1946 : 681; В u i s a n, 1947 : 69; F a u r e - F r e m i e t et Guile h e r, 1947 : 112; Raabe, 1947 : 311; 1964c : 179, 248; Mohr, 1948 : 11 (с датой 1851 на стр. 11, 1852 на стр. 9); 1959а : 652; 1966 : 537; Jahn a. Jahn, 1949 -354; Guilcher, 1949 : 214; 1950 : 470; 1951 : 54; Doflein u. Reichenow, 1953 : 1154; Hall, 1953 : 412; J i г о v e c a. oth., 1953 : 168, 526 (Sptrochova par lapsus на стр. 527); Sramek-Husek, 1953 : 83, 87 (с датой 1851); Wetzel, 1954 : 74; 1965 : 93; Faure-Fremiet a. oth., 1956 : 188; Corliss,
1958b : 521; 1958d : 17; 1959 : 277; 1960 : 179; 1961 : 135; 1967 : 16; С т p e л-
ков, 1959 : 105; Borradaile, 1959 : 113; В u c h а г, 1959 : 14; Green, 1960 : 10; S t i I 1 e r, 1960 : 19; F r i t z, 1961 : 49; К о ж о в, 1962 : 30; С z а р i к, 1962 : 127; Dobrzanska-Kaczanowska, 1963 : 535; Mohr a. oth., 1963а : 229; Г о л е м а и с к и, 1964 : 160 (с датой 1851; -|-Пе/е7'осЛогаа); Matsudo а. Mohr, 1965 : 523; 1968 : 280, 283 (с датой 1851); М a t s u d о, 1966 : 359; P a fl-ков, 1967 : 163, 164, 188; Янковский, 19676 : 41; D u d i c h, 1967 : 9; M e g— 1 i t s c h, 1967 : 65; Gottschalk, 1967 : 76—77.
Относительно некрупные формы с цилиндрическим или бутылковидным телом,. сплющенным только у S. simplex. ПВ с относительно небольшим числом витков, порядка 2J/2—3 оборота. Вентральная стенка ПВ без складок и вырезок, с ровным краем. Нижняя часть тела широкая; псевдостил выражен слабо — небольшой, широкий, со складками.
В отличие от кавихон и серпентихон у видов Spirochona стенки ПВ лишены складок и вырезок, псевдостил не удлинен, число витков ПВ обычно невелико.
С 5 известными и 3 новыми видами (S. gemmipara — типовой вид, S. simplex,. S. globulus, S. tuba, S. brevis, S. halophila, S. marina, S. gnathopodialis). Хозяева — Gammaridae (роды Gammarus, Gmelinoides, Ommatogammarus, Coniurus, A nisogammarus); заселены жабры, как исключение — плеоподы и гнатоподы. Спирохоны обычны в пресных водах Европы, в Байкале, в морях и эстуариях северной Пацифики. Имеется, непроверенное сообщение о находке спирохон в США (Монтана).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА SPIROCHONA
1 (12). Пресноводные формы с относительно небольшой ПВ.
2 (3). Тело сплющено дорзо-вентрально .....................4. S. simplex.
3 (2). Тело не сплющено, с округлым сечением.
4 (5). Тело короткое и широкое, L : D=2 : 1................3. S. globulus.
5 (4). Тело удлиненное, L : D > 2 : 1.
6 (7). Развиты очень крупные боковые карманы и серия дополнительных дорзальных складок ПВ ...............................................6. S. tuba.
7 (6). Боковые карманы обычного типа, дополнительных складок ПВ нет.
8 (9). Некрупные формы (порядка 70 мк); ПВ с 2V2 оборотами спирали ....
....................................................... 2. S. brevis.-
9 (8). Крупные формы (порядка 90 мк); ПВ обычно с 3 витками.
10 (11). Шейка очень широкая, до 3/4 ширины тела; нижний конец тела широкий ........................................................ 1. S. gemmipara.
11 (10). Шейка неширокая, до х/2 ширины тела; нижняя часть тела заметно вытянута
................................................. 5. S. gnathopodialis..
12 (1). Морские формы с непропорционально крупной ПВ.
13 (14). Крупные формы с заметным псевдостилом....................8. S. marina.
14 (13). Мелкие формы без четкого псевдостила.............. . . 7. S. halophila.
1. Spirochona gemmipara Stein, 1852 (рис. 1, A; 2, С; 15, Ж; 24, Б—Е; 33, А, Б; 35, Е, П, Р; 36, Д, Е, 3, Л; 37, А; 44, М; 45, К—Н; 48, А—И; 49, С; 52, А — Л; 53,. Г—Н; 97, А, Б; 99, Ж; 100; 101; 102, В~3; 103; 104, Б—И).
Stein, 1852 : 485, Taf. XVIII, Fig. 14—17; 1854 : 205—216, Taf. V, Fig. 1-6; Clap a rede et Lachmann, 1858 : 131, 132; 1860—1861 : 91, 105; Pritchard, 1861 : 598, pl. XXX, fig. 17, 20; F г о m e n t e 1, 1874 : 145; В u t s c h 1 i, 1877 : 59, Taf. VI, Fig. 13—14; 1889 : 1756, Text-Fig. 24, Taf. LXXV, Fig. 7, al (с датой 1851); Hertwig, 1877a : 149, Taf. X—XII; 1877b : 311; Kent, 1881 : 660, pl. XLVIII, fig. 12 (томит S. gemmipara, но с ошибочной подписью «бродяжка Dendro-cometes paradoxus»), 43—49; Balbiani, 1881 : 398, 425; 1895 : 241, pl. II; В 1 о c h-m a n n, 1886 : 85; 1895 : 117, Taf. VII, Fig. 231; C a n u, 1886 : 21; P 1 a t e, 1886 175, 200, Taf. VII, Fig. 19—30, 43; 1888 : 39 (Spirochona par lapsus); Erlanger,. 1889:649; E i s m о n d, 1890a : 28, табл. I, рис. 9—12; 1890b : 256; 1895:127, tabl. II, fig. 1; tabl. Ill, fig. 15—18 (Spirocoma par lapsus на стр. 103); Zacharias,. 1893 : 5; R о m p e 1, 1894 : 631; W allengren, 1895 : 2, 45 (с датой 1851); 1896 : 553; D о f 1 e i n, 1897a : 622; 1900 : 37, Fig. T—X; Richard, 1899 : 548; Roux, 1900 : 464; 1901 : 112; Hickson, 1903 : 416; Henderson, 1905 : 20; H a r-t о g, 1906 : 138, 144; Sakowsky-Campioni, 1907 : 137; Faure-Fremiet, 1910 : 44; Andre, 1912 : 149; Thienemann, 1912 : 52; 1913a : 283, 284; 1913b : 437; M e r m о d, 1914 : 47, 103; Keiser, 1921 : 226, 303; Penard,. 1922 : 243, Fig. 232 (с датой 1851); L e p ? i, 1926 : 88, Taf. XIV, Fig. 480; 1965 : 790 (gemnipara), 853 (gemipara), fig. 80 (без подписи); Гаевская, 1927 : 314; 1933 :. 184 (Lagenophrys gemmipara в подписи к рис. 129); 1949 : 305 (sensu lato); С в а р ч е в-с к и й, 1928а : 188; 19286 : 44, 45 (sensu Stein), 46, Taf. 2, Fig. 1—3 (sensu lato); К a 1 m u s, 1928 : 383, 354, 424; Kahl, 1930 : 28, Fig. 3; 1935 : 804, Fig. 148, 2, 2a, 2b (с датой 1851); De Geest, 1933 (non vidi); P r e c h t, 1935 : 470; H у m a n,..
1940 : 620; Kudo, 1946 : 682, fig. 320, .a (gemnipara на стр. 771); Buisa n, 1947 : 69, fig. 165 (без указания вида); M о h г, 1948 : 1, 9 (с датой 1852), 11 (с датой 1851); (Spirochona sp. на стр. 2); 1966 : 537, 538, fig. 1, D; Guilche г, 1949 : 214; 1950 : 467; 1951 : 54, text-fig. 11, 12, 15; pl. I, fig. 1; J ahu a. Jahn, 1949 : 216, fig. 354; Doflein u. Reich enow, 1953 : 1154, Fig. 322; H a 1.1, 1953 : 412, fig. 3.25, G; Sraine k-H use k, 1953 : 83,87 (gemnipara; с датой 1851); S r a m e k-H u s e k, in J irovec a. oth., 1953 : 526, fig. 244, H (Spirochona gemnipara на стр. 527; с датой 1851); Lorn, in J irovec a. oth., 1953 : fig. 285; T u f f r a u, 1953 : 314, fig.
Рис. 99. ПВ спирохонид. A — Cavichona laticollis; Б, В — C. oligocineta; Г — Cavichona sp.; Д— C. protecta; E — Spirochona globulus; Ж —• S'. gem-mtpara. •
-4—32; Wetzel, 1954 : 74, Fig. 33, 4; 1965 : 94, Fig. 33; С т p e л к о в, 1958 : 105, рис. 91; В о г г a d a i 1 е, 1959 : 104, 109, 113, fig. 66, D; Buchar, 1959 : 14; • Corliss, 1959 : 274, fig. 25; 1960 : 179, pl. II (без указания вида); 1961 : 39, 135, pl. XII, fig. 2; pl. XXI, fig. (вид не указан); Green, 1960 (non vidi); Stiller, 1960 : 19, Fig. 18, a; F r i t z, 1961 : 49—50, text-fig.; Mackinnon a. Hawes, 1961 : 258; M a n w e 1 1, 1961 : 351; Догель и сотр., 1962a : 227, рис. 146; C za-p i k , 1962 : 131, fig.; D obr z an ska-K ac zano wska, 1963 : 371, fig. 5, F (без подписи), 6, Й; D о br z a n ska, 1963 : 535, fig. 3; M о h r a. oth., 1963a : 229, 231, fig. 3; Гол емански, 1964 : 160, fig. 3—4 (с датой 1851); Raabe, 1964c : 179, fig. 121, A; Matsudo a. Mohr, 1965 : 523, 524; 1968 : 283 (с датой 1851); M a t s u d o, 1966 : 359, pl. 5, fig. 60; Райков, 1967 : 188, рис. 77; Dudich, 1967 : 9; M e gli t sc h, 1967 : 63, fig. 3.25, G; Gottschalk, 1967 : 76—77, fig.
Тело крупное, удлиненное, не сплющенное, наиболее широкое на уровне Ма, ниже шейки. Шейка довольно узкая у рас Штейна, Гийше и Тюффро, широкая у расы Гертвига и наших рас из Петергофа и Прибайкалья. Длина ПВ с завитком около
1/3 длины особи; для вида указывается 2—21/а оборота спирали (Стрелков, 1958), 2Ч2 (Гертвиг), 2—3 (Лепши), «несколько менее трех» (Андре), 3 (Кент, Пенар, Эйс-монд), «минимум 3» (Фромснтель) и 3—3]72 (схема Гийше) оборота спирали. У наших рас обычно имеется 23/4—31/2 оборота. Складки ПВ выражены слабо- боковые карманы небольшие. Нижняя часть тела вытянута, с псевдостилом.
Рис. 100. Изображения Spirochona gemmipara в литературе. А—В — Stein, 1852; Г, Д -— Stein, 1854; Е — Borradaile, 1959; Ж — Jahn a. Jahn, 1949; 3 — Corliss, 1956; И — Lep?i, 1965; К—Н — Hertwig, 1877а;
О — Wetzel, 1954; П — Raabe, 1964; Р — Biitschli, 1877; С — Wurmbach, 1962; Т — Buisan, 1947; У — Meglitsch, 1967; Ф — Vosseler, in Lampert, 1910.
Имеются расовые различия морфологии вида. У типовой расы тело веретеновидное, резко сужается книзу, шейка узкая; сходные формы изображают Бальбиани, Тюффро и Гийше. У расы Гертвига из Йены тело более широкое в нижней части и в зоне шейки. Грин изображает спирохон с Gammarus roeseli (Югославия, оз. Охрида), имеющих ПВ, почти равную по длине телу. Не напоминают типичных спирохон и
16 Заказ № 213
удлиненные формы с гаммарид Болгарии (Големански). Раса с жабр G. lacustris в Прибайкалье вполне сходна с петергофской. Хиксон пашел у спирохон из Манчестера один Ми, допуская, что это особый вид, но Мор отметил 2—4 Ми у манчестерской
Рис. 101. Изображения Splrochona gemmipara в литературе. А — Kahl, 1935; В— Д — Penard, 1922; Е, Ж—Hertwig, 1877а; 3, И — Balbiani, 1895; К, Л — Eismond, 1890а; М—П — Eismond, 1895; Р, С — Големански, 1964; Т — Tuffrau, 1953; У — Guilcher, 1951; Ф, X — Lorn, in Jirovec a. oth., 1953.
расы. Необходим все же, по Мору, критический пересмотр S. gemmipara по всему ее ареалу. Следует изучить прежде всего типовую расу вида.
Размеры. 1) Литературные данные. По Штейну (Stein, 1852, 1854): длина особи х/63—Vis" (15.2—55.5 мк), ширина х/50" (20 мк), длина Ма х/126—1/1№” (8— 9.2 мк), размеры томита х/вз—1/to" (15.2—25 мк); цифры явно занижены. По Гертвигу (Hertwig, 1877а): длина особи 120 мк, шейки и ПВ — х/3 длины тела; размеры тела
80x30 мк. По Конту (Kent, 1881): длина особи 1/760—1/аы" (13.3—46.3 мк). По Ген-дерсону (Henderson, 1905): «тело средней длины, 100—120 мк». По другим авторам: размеры особи 40—80x11.5—35 мк (Големапски, 1964); 70 мк (Guilcher, 1951); 80— 120 мк (Kahl, 1935; J ahri a. J alm, 1949); 90—120 мк (Penard, 1922); 100—120X25—35 мк (Andre, 1912); 120 мк (Lep?i, 1926); «по большинству авторов 100—200 мк (!), в Байкале 68—300 мк» (Гаевская,
1933). 2) Наши измерения. Прибайкальская раса с G. lacustris: длина особи 74—91 мк, с завитком 87—105 мк; L : D=4 : 1; размеры тела 51 — 63x21—26 мк, шейки 7—13Х Х15—17 мк, ПВ 8—15x38— 45 мк; диам. диска 12—14 мк; размеры псевдостила 13—19 X ХИ—12 мк, Ма 15—20x10— 12 мк, Ми 1.6—1.8 мк; высота дорзального края ПВ 12— 17 мк, колюмеллы 20—26 мк. Петергофская раса: длина тела 72—86 мк, с завитком 83— 100 мк.
Это наиболее крупный вид рода, с широким телом и шейкой; ПВ относительно меньше, чем у морских видов; тело не сплющенное, как у S. simplex, не мешковидное, как у S. globulus. S. gemmipara несколько крупнее, чем близкий вид S. brevis, имеет большее число витков дейтерохона.
Локус—жабры гаммарид, непосредственно у края жабры или вблизи него на ровной поверхности лепестка. Заселен преимущественно дистальный, реже медиальный край; особи на наружном крае жабры очень редки. Локус, указанный Кентом («яйцевые капсулы» — оостегиты?), (явно ошибочен. Обычно вид считается массовым (Штейн, Гертвиг, Кайзер, Тюффро, Големан-ский, Мор и др.), авторы находят по нескольку десятков особей на жабре (по Големан-скому — до 34). Наши расы: 10—12 особей на жабре G. pulex, 10—15 на жабре G. lacustris (на рачке соответственно 120-144 и 120-180 особей). По сравнению с S. globulus или видами Cavichona вид все же не массовый.
Типовой хозяин — Gammarus pulex (Штейн). Хозяева вида обычно определяются как G. pulex, хотя в Европе встречаются десятки видов рода. Дополнительные хозяева: G. pulex komareki (=G. komareki), G. pulex fossarum (=G. fossarum), G. roeseli (= Carinogammarus roes-
Рис. 102. А, Б — Spirochona brevis c Gmelinoides fasetatus", В—3 — S. gemmipara c Gammarus pulex (B) и G. lacustris (Г—3).
elf), G. balkanicus. Нами вид найден на G. pulex и G. lacustris. Едва ли на хозяевахТс разной экологией обитает один и тот же вид спирохон, но мы не нашли особых различий наших рас; вероятно, это «биологические виды» в рамках <S. gemmipara.
Распространение. Пресные воды, преимущественно в Европе: Англия, Франция, Голландия, ГДР (типовая раса — у Таранда па Эльбе, близ Дрездена), Швейцария, Венгрия, Польша, Югославия, Болгария, Чехословакия, Румыния,
Рис. 103. Spirochona gemmipara с Gammarus lacustrls.
север европейской части СССР, Прибайкалье (соры Байкала и озера в дельте Селенги у Харауза; оз. Гусиное); США (по двум непроверенным указаниям — С. Геррика в 1884 г. и Дж. Тиббса в 1967 г.; последним автором спирохоны отмечены на G. lacustris в Монтане).
ПРИЛОЖЕНИЕ
«Spirochona gemmipara» в Байкале (рис. 97, А, В; 121, Е).
В списке инфузорий южного Байкала до линии Лиственичное— Мурино Гаевская (1927 : 314) приводит под № 68 «S. gemmipara St.», без комментариев и указания хозяев. Позднее этот вид признан ею (Гаевская, 1933 : 184) единственным видом хонотрих, якобы распространенным по всему Байкалу на глубинах 0— 1320 м, примерно на 70% гаммарид. Сомнительно, осмотрены ли ею все виды гаммарид и был ли материал с таких глубин, тем более что Гаевская не изучала коллекций по гам-маридам. Говоря об «эуриойкности» (поликсении) вида, автор не приводит данных о числе осмотренных видов и особей рачков, не называет вообще ни одного хозяина, не говоря уже об их списках. Отмечено лишь отсутствие спирохон на «пассивном» пелагическом рачке Macrohectopus bra-nickii. Рисунок Гаевской либо комплексный, либо на нем показаны стадии роста Cavichona', неправильно изображены ножки, глотка, Ма, ПВ, цилиатура. Вид встречается на краях жабр, реже на их свободной поверхности или на «конечностях»; мелкие формы встречаются реже средних и крупных и обитают обычно на краях жабр, на их придаточном стебельке (?) или на конечностях между щетинками. Между поверхностными и глубоководными формами, по Гаевской, нет никакой разницы, но, хотя они внешне сходны, изменчив завиток ПВ; даже на одном рачке и на одной жабре имеется вариационный ряд со всеми переходами. Длина особей составляет 68—300 мк; у наиболее мелких форм ПВ высокая, но всего с 11/2 витками, у крупных форм — с 3 витками, длина ПВ у них достигает х/5—х/7 длины тела.
Гаевская исходит из предвзятого мнения об эндемизме лишь свободноживущих пелагических инфузорий открытого Байкала; на гаммаридах же ею определены обычные европейские виды перитрих, сукторий и хонотрих. Работы Сварчевского она почти не комментирует, считая все его виды лишь расами крайне изменчивой эуриойкной 5. gemmipara. По Гаевской, неправильна уже сама методика Сварчевского: он пользовался материалом, фиксированным еще в 1915—1917 гг. и поэтому непригодным
для морфологических работ; нужно же изучать лишь живых простейших. В 1949 г. рисунок и диагноз вида перепечатаны Гаевской уже без упоминания о данных Сварчевского.
Следуя, к сожалению, за Гаевской, ряд авторов с недоверием относится к данным Сварчевского, работавшего намного тщательнее. Так, по Кожову (1962 : 28), реаль-
Рис. 104. А — Spirochona brevis с Gmelinoides fasciatus', В—И — S. gem-mlpara с Gammarus lacustrls.
ность большинства из 86 новых видов, описанных Сварчевским с гаммарид, подвергается сомнению. Догель с сотрудниками (1962а : 504) указывали, что «работы Сварчевского, к сожалению проведенные на фиксированном материале и поэтому недостаточно убедительные, позволяют думать, что на гаммаридах Байкала живет неболь
шая группа эпибиотических инфузорий (главным образом Suctoria), содержащая ряд новых видов». В основном же, по Гаевской, до предельных глубин (1320 м) встречаются обычнейшие формы, распространенные в пресных водоемах вне Байкала, в частности S. gemmipara. Это сказано о богатейшей фауне, насчитывающей, вероятно, не менее 1000 эндемичных видов перитрих, сукторий, гипостомат, хонотрих и апостомат (на рачке можно найти до 10—12 видов комменсалов; всего же известно более 200 видов гаммарид Байкала). Предубеждение к фиксированному материалу необоснованно: даже простая фиксация 4—8%-м формалином сохраняет хонотрих и сукторий в прекрасном состоянии. При осмотре коллекционного материала по 118 видам 29 родов гаммарид Сварчевский нашел хонотрих на 34 видах 17 родов, в частности S. gemmipara на 9 видах 7 (ныне 9) родов. Из 8 других описанных им новых видов спирохон 2 вида (8. patella и S. pusilia) мы не считаем достоверными. Сравнительная морфология S. gemmipara с разных хозяев Сварчевским не изучалась, размеры не приведены, но указано, что в Байкале обитают «типичные особи вида». Его рисунки не напоминают типичные соровые формы и типовую расу вида из ГДР. В ряде случаев за S. gemmipara этот автор мог принять ранние стадии развития видов Cavichona.
По нашим данным, лишь соровый и прибайкальский вид Gammarus lacustris, не Считающийся элементом байкальской фауны, несет хонотрих типа 8. gemmipara', их напоминает S. brevis с литорального рачка Gmelinoides fasciatus, в меньшей мере — 8. gnathopodialis', все же другие спирохоны сильно видоизменены. На 9 хозяевах сбор-
Рис. 105. Spirochona brevis с Gmelinoides fasciatus.
ного вида 5. gemmipara в действительности обитают 2 вида Spirochona и 7 видов Cavichona. Совместные находки двух видов на одной жабре — S. gemmipara и S. patella на Odontogammarus demjanowitschi (~О. calcaratus) — несомненная ошибка, на морфах О. calcaratus живет лишь С. elegantula. Суммарный ареал «8. gemmipara» по Сварчев-скому: Байкал, Лиственичное, Большие Коты, Голоустное, Ольхонские ворота, Малое море, устье Селенги, мыс Облом, бухты Анга и Смородовая, глуб. 1—400 м.
2. Spirochona brevis Jankowski sp. nov. (рис. 47, E—3; 102, A, B; 104, A; 105; 106).
Сварчевский, 19286 : 46—48 {gemmipara, part.; paca c «Carinogammarus fasciatus»).
Тело удлиненное, почти цилиндрическое, не сплющено; шейка неширокая. Длина ПВ с завитком составляет около 1/3 длины тела. ПВ с 2х/2—28/4 витками, не вытянута вверх. Складки неглубокие, карман плохо выражен. Нижняя часть тела широкая; псевдостил короткий.
Размеры. Длина особи 62—78 мк, с завитком до 85 мк; L : D=4.3 : 1; размеры тела 52—58х 18 мк, шейки 5—6х 12—13 мк, ПВ до Юх 40 мк; диам. диска 10 мк; размеры псевдостила 6—8x8—10 мк, Ма 13.5—15x8—9 мк, томита 30x20 мк.
ПВ у 8. brevis меньше, чем у морских видов; тело не сплющено, как у 8. simplex, не мешковидное, как у 8. globulus-, складки и карманы ПВ развиты слабее, чем.у 8. tuba', завиток не вытянут, более компактный, чем у 8. gnathopodialis. Отличия от близкого вида 8. gemmipara'. меньшие размеры тела (поскольку хозяин вида меньше Gammarus lacustris), меньшее число витков спирали, более узкая шейка, едва выраженныйпсевдостил.
Локус и хозяин — края жабр Gmelinoides fasciatus', встречается в небольших количествах. Рисунки Сварчевского (рис. 97, А—В) относятся не к 8. gemmipara, а вероятнее всего к данному виду.
Распространение. Южный Байкал, литораль и верхняя сублитораль; исток Ангары; вероятна находка в системе Ангара—Енисей, до Таймыра.
3. Spirochona globulus Swarczewsky, 1928 (рис. 1, Ж; 32, Ж; 49, Т; 97, Д~Ж; 98, А; 99, Е; 107—109; «8. pusilia» — рис. 1, Б; 97, В, Г).
Сварчевский, 19286 : 48, Taf. 2, Fig. 4—5 (pusilia); 49, Taf. 2, Fig. 9—11 (globulus); Kahl, 1935 : 805, Fig. 148, 20 (globulus), 148, 1 (pusilia); Mohr, 1948 : 10 (globulus-[-pusilia); Mohr, 1966 : 538 (globulus).
Тело невысокое it очень широкое, веретеповидпое шш мешковидное, нередко почти сферическое. Относительно некрупные формы. Шейка узкая; ПВ непропорционально крупная, широкая, длина составляет половину длины тела. Дорзальные складки и боковые карманы почти не выражены. Число витков — 2—21/, у S. pusilia, «в основном 21/2, но часто только 2» у S. globulus (Сварчевский), до 2х/2, но часто лишь 13/4—2 в нашем материале. Недоразвитие завитка — видовой признак 5. globulus. Ножка и диск очень широкие, псевдостил отсутствует или едва намечен у удлиненных особей. На одном и том же локусе (края жабр) хозяина Сварчевский нашел и другой
Рис. 106. Spirochona brevis с Gmelinoides fasciatus.
вид — S. pusilia (рис. 97, В—Г): удлиненные, особи с завитком, закрученным против часовой стрелки (у S. globulus по стрелке или против). Либо это форма с гнатопод, и тогда локус Сварчевским указан ошибочно, что трудно допустить, либо это удлиненные трофонты S. globulus, какие нередки и в нашем материале (рис. 109). Сварчевский не раз упоминает о совместных находках видов спирохонид на одной жабре (что невозможно); находка 5. pusilia и S. globulus — лишь один из таких случаев. Первое название мы признаем синонимом второго.
Размеры. По Сварчевскому: 1) «5. pusZZZa»: длина особи до 95 мк; длина ПВ до 30 мк, ширина до 45 мк; ширина тела в нижней части 9 мк, в верхней 16 мк; 2) S. globulus'. длина особи до 70 мк; размеры тела до 35 х 35 мк, ПВ до 35 х 30 мк, «стебелька» 5X7—12 мк. По нашим измерениям (S. globulus): длина особи 63—66 мк, с завитком до 77—87 мк; размеры тела 38—53x30—32 мк, шейки до 15Х 12 мк, ПВ 10—13х 36— 42 мк; высота колюмеллы 14—31 мк; диам. диска 11—12 мк; размеры псевдостила 5—6X13 мк, Ма около 18x10 мк, томита около 40x20 мк.
От всех остальных спирохон, в частности от 6'. simplex и S. gnathopodialis с того же хозяина, вид отличается широким, мешковидным телом, слабо развитыми завитком и псевдостилом, крупными размерами ПВ.
Локус и хозяин — жабры Ommatogammarus flavus (типовой хозяин), Pallasea kess-leri (по Сварчевскому; едва ли это правильно, поскольку на видах Pallasea мы находили только кавихон). Вид массовый (наиболее массовая форма среди спирохон), образует плотные поселения — до 220 особей на жабре. Заселены края жабры вплоть до ее основания, особенно дистальный отдел; часть особей удалена от края.
Распространение. Суммарный ареал по Сварчевскому (для форм с обоих хозяев): Байкал, Лиственичное, глуб. 200 м; бухты Анга, Смородовая, Половинная, глуб. 200 и 300 м. Наш материал: Большие Коты, глуб. 75—100 м; Лиственичное, глуб. 200 м.
Рис. 107. Spirochona globulus с жабр Оmmatogammarusflavus.
4. Spirochona simplex Swarczewsky, 1928 (рис 1, В; 49, О; 97, 3, И; 98, Б; НО).
С в а р ч е в с к и й, 19286 : 48, Tat. 2, Fig. 6—8; Kahl, 1935 : 805, Fig. 148, 15; M о h г, 1948 : 10.
Тело относительно крупное, широкое, сплющено дорзо-вентрально; шейка неширокая. Длина ПВ с завитком составляет не более 2/6 длины особи. Завиток, по Сварчевскому, обычно с 2—2х/2, реже с 3 витками, в нашем материале с 2х/2 витками. Складка эпихона и карман развиты очень слабо. Псевдостил отсутствует или едва развит.
Размеры. По Сварчевскому: длина особи обычно до 80 мк, реже до 140 мк; размеры тела 50—70х 30—40 мк, ПВ до 25—30x18—28 мк, «стебелька» до 4.5х 12 мк, томита до 37X28 мк. По нашим измерениям: длина особи 75—82 мк, с завитком 87— 97 мк; L : D=3 : 1; размеры тела 57—62x31—36 мк, шейки 3x12—13 мк, ПВ 18х Х32—33 мк; высота завитка 17—19 мк, колюмеллы 28—31 мк; диам. диска 7—8.5 мк; размеры Ма 18—23x10—11 мк, томита 36—42x23—27 мк.
В отличие от остальных спирохон тело S. simplex сплющено дорзо-вентрально, завиток не вытянут, карманы ПВ едва развиты.
Локус и хозяин — «абдоминальные ножки Ommatogammarus flavus, на членистых частях ножек между щетинками» (Сварчевский), от основания плеопод до вершины. Это единственный вид спирохонид с плеопод. Мор и Мацудо ошибочно указывают как локус «щетинки плеопод». Стебелек плеоподы несет до 30 особей S. simplex.
Распространение. Байкал, Большие Коты и Смородовая бухта, глуб. 40—250 м (Сварчевский); Большие Коты, глуб. 75—100 м, и Лиственичное, глуб. 200 м (паш материал).
5. Spirochona gnathopodialis Jankowski sp. nov. (рис. 13, В; 98, В; 111).
Крупные вытянутые формы с несплющенным веретеновидным или почти цилиндрическим телом, с широкой шейкой. Завиток вытянутый, составляет до 2/6 длины особи, обычно с 23/4—З1^ оборотами. Складки и карманы ПВ выражены очень слабо. Ножка неширокая; псевдостил четкий, нередко удлиненный.
Рис. 108.
Spirochona globulus
с жабр О mmato gammarus flavus.
Размеры. Длина особи 79—88 мк, с завитком 102—126 мк; L : D=4 : 1; размеры тела 64—68x26—28 мк, шейки 4—7x12—14.5 мк, ПВ 11—15x35—36 мк; высота завитка 16—24 мк, колюмеллы 26—31 мк; диам. диска 8—9 мк; размеры псевдо-стила 14—47X11—12 мк, Ма 18—21x9.5—12 мк.
Тело не сплющено, как у S. simplex, и не вздуто, как у S. globulus с того же хозяина. ПВ без четких складок и карманов, имеющихся у S. tuba. Завиток высокий и широкий, менее компактный, чем у S. gemmipara и S. brevis. Есть некоторое сходство облика нашего вида и S. pusilia, но последний указан для жабр хозяина и отождествляется нами с S. globulus.
Локус и хозяин — I пара, в меньшей мере II пара гнатопод Ommatogammarus flavus, на поверхности придатка между щетинками на сочленениях. Особи отсутствуют в зоне клешни; сетобионтов нет. Это единственный вид спирохонид с гнатопод. Вид обычный, но не массовый — до 10—40 особей на сегменте придатка.
Рис. 109. Spirochona globulus с жабр О mmato gammarus flavus.
Рис. 110. Spirochona simplex с плеопод О mmato gammarus flavus.
Распространение. Байкал, Большие Коты, глуб. 75—100 м; Листве-ничное, глуб. 200 м.
6. Spirochona tuba Swarczewsky, 1928 (рис. 1, 11', 24, 3, И; 97, О, П\ 112; ИЗ).
Сварчевский, 19286 : 54, Taf. 2, Fig. 21—22 (с ошибочной подписью — S. elegantula); К a h 1, 1935 : 805, Fig. 148, 21 (с ошибочной подписью — S. elegantula).
Рис. 111. Spirochona gnathop odialis c
гнатопод 0 mmatogammarus flavus.
Сварчевский спутал рисунки видов, Каль — и рисунки, и диагнозы видов. Тело S. tuba веретеновидное, узкое, резко сужающееся к диску и шейке. Шейка узкая, иногда слегка вытянутая. Размеры тела мелкие. ПВ высокая и очень широкая, намного шире тела, с 2 (по Сварчевскому) или 21/2—23/4 (по нашему материалу) витками. Складки' эпихона многочисленные, глубокие; карманы крупные, отогнуты далеко назад. Ножка неширокая, псевдостил короткий.
Размеры. По Сварчевскому: длина особи 60 мк, ширина 17—20 мк; длина шейки 9—10 мк; размеры ПВ до 15x16 мк, «правосторонней трубки» ПВ до 25X10 мк. По нашим измерениям: длина особи 60—73 мк, с завитком 78—90 мк; L : D=3.5 : 1; размеры тела 57x21—23 мк, шейки 3—7x9—10 мк, ПВ 10—14x45—48 мк; высота завитка до 17 мк, колюмеллы 21—26 мк; диам. диска 9 мк; размеры псевдостила 3— 5x10 мк, Ма 15x9—11 мк, томита около 33X24 мк.
Рис. 112. Spirochona tuba c Coniurus radoczkowskii.
Тело пе сплющено, как у 5. simplex, и не вздуто, как у S. globulus-, карниз плохо выражен, складки и карманы ПВ развиты паяного лучше, чем у всех остальных видов рода.
Локус и хозяин — края жабр (особенно дистальные) Coniurus radoczkowskii. Найдены Сварчевским в «крайне малом» количестве на двух рачках; вид обычный, массовый в нашем материале.
Распространение. Байкал, Большие Коты, глуб. 300 м (Сварчевский); Черемшанка, глуб. 250—300 м (наш материал).
Рис. 113. Spirochona tuba с Coniurus radoczkowskii.
Рис. 114.. Spirochona halophila c A nisogammarus sp. (no: Matsudo a. Mohr, 1968).
7. Spirochona halophila Matsudo et Mohr, .1968 (рис. 1, A'; 33, E; 114).
Matsudo a. Mohr, 1968 : 281, fig. 5—7.
Мелкие несплющенные, почти цилиндрические формы с нешироким телом, слабо сужающимся к шейке и диску. Шейка короткая и широкая. ПВ крупная, длиной до 2/6 длины тела, шире тела, лишена складок и карманов. Завиток с 13/4—3 оборотами. Ножка широкая, с ампулой (отсутствующей у других спирохон); псевдостила нет.
Размеры (по Мору и Мацудо): длина особи 36—40 мк; размеры тела 24—26x9— 12 мк, ПВ 12—16x16—24 мк, ножки 2X6—7 мк, Ма 8—10x4—6 мк, Ми 2 мк; ширина ПВ до 12—13 мк, шейки 6—8 мк.
Отличия от пресноводных видов: очень мелкие размеры, непропорционально крупная ПВ. Отличия от S. marina: отсутствие псевдостила, меньшая высота завитка.
Локус и хозяин — медиальный край жабр Anisogammarus sp.; вид рачка из Санта-Барбара (США, Калифорния) близ типового местонахождения определен, Н. Л. Цветковой как A. (Eogammarus) confervicolus. Мацудо и Мор в диагнозе указывают в качестве локуса «щетинки плеопод», что неверно. Особи редки, до 7 на жабре, на 15 и 19 рачках разных рас хозяина найдено 421 и 582 особи вида.
Распространение. Морские и солоноватые воды США (Калифорния, Эурека и Филдс-Лендинг в округе Гумбольдт, типовая раса; Вашингтон, Крисент-Сити, бухта Аргил, о. Сан-Хуан).
8. Spirochona marina Jankowski sp. nov. (рис. 15, 3, И: 53, В; 115; 116).
Крупные формы (по сравнению с S. halophila) с широким веретеновидным, часто почти цилиндрическим телом. Верхняя часть тела и в большей мере нижняя вытя-
нуты; последняя превращена в псевдостил. ПВ очень широкая и высокая, достигает 2/s длины особи; дорзальные складки и карман слабо выражены. Завиток с 21/2, реже с 2 или 23/4 оборотами. Ножка
II ° ° // широкая, дисковидная.
Рис. 115. Spirochona marina с A nisogammarus spasskii.
Размеры. Длина особи 44—78 мк, с завитком 51—78 мк; L : D=4 : 1; размеры тела 31— 57x12—18 мк, шейки!—2x8 мк, ПВ 7—9x24—32 мк; высота завитка 7—13 мк, колюмеллы 17— 20 мк; диам. диска 8.5—9.5 мк; размеры псевдостила 5—10x6— 9 мк; длина ножки 1.5 мк; размеры Ма 9—11 х 6—7 мк, моногем-мических томитов 26—ЗОХ 12— 15 мк, при диминуций 32—35х Х23—27 мк.
Вид резко отличается от I пресноводных форм пропорциями тела и ПВ, близок к S. halop-hila, но намного крупнее (примерно вполовину); при сходном числе витков ПВ S. marina более вытянута; псевдостил четкий.
Локус и хозяева — основные и придаточные жаберные лепестки A nlsogammarus spasskii (типовой хозяин), A. ochotensis, А. 1о-custoides и других видов (дополнительные хозяева)1. Вид массовый,, до 40 особей (обычно 10—20) на основной жабре, 15—20 на придаточной. Различать виды спироховг с видов Anisogammarus пока невозможно; это, видимо, «биологические виды», без четких морфологических различий.
Распростран е н и е. Охотское море, о. Шикотан, бухта Крабовая (типовая раса, на А. spasskii); Берингово море, о. Беринга, литораль (на расе A. locustoides); Охотское море, Ейринейск (на А. ochotensis); Приморье, Шкотовский район (на A. tiuschovi); Японское море, зал.
Посьет (на A. posjeticus); Сахалин, Курильские о-ва (в обработке).
ПРИЛОЖЕНИЕ
Spirochona patella Swarczewsky, 1928.
Сварчевский, 19286 : 55, Taf. 2, Fig. 25; К a h 1, 1935 : 805, Fig. 148, 3.
Единичные особи вида найдены на жабрах A canthog ammarus albus, A. godlewskii и Odontogammarus pulcherrimus (рис. 97, К). Тело вытянутое, относительно некрупное; завиток широкий и низкий, закручен якобы в одной плоскости с краем ПВ; вся же правосторонняя часть ПВ лежит на шейке и теле, занимая до 2 3/4 длины тела особи, и состоит из двух лепестков величиной 7x12 мк. На первом и третьем виде хозяев S. patella, по Сварчевскому, встречается совместно с S. elegans и S. gemmipara (что совершенно невозможно). Мы не встречали такие формы на названных гаммаридах; Сварчевским зарисована уродливая либо диминутивная особь. S. patella — nomen nudum; этим названием нельзя обозначать новые виды с A canthogammarus.
2. Род CAVICHONA Jankowski gen. nov.
Сварчевский, 1928а : 188; 19286 : 50 (Spirochona, part.); Г а е в с к а я, 1933 : 184; 1949 : 305 (Spirochona, part.); Kahl, 1935 : 804 (Spirochona, part.); Bock, 1938:102 (Spirochona, part.); Dons, 1940: 117 (Spirochona, part.); Mohr,
1948 : 1, 8 (Spirochona, part.); G e 1 e i, 1950 : 100 (Spirochona, part.); D oflein u. Reichenow, 1953 : 1154 (Spirochona, part.); H a 11, 1953 : 413 (Spirochona, part.); Mohr a. oth., 1963a : 231 (Spirochona, part.); M a t s u d o, 1966 : 361 (Spirochona, part.); Райков, 1967 : 186, 189 (Spirochona, part.); Matsudo a. Mohr, 1968 : 283 (Spirochona, part.).
В основном очень крупные формы, длиной до 360 мк (спирохоны до 105 мк). Тело не сплющено, с округлым сечением. ПВ крупная, с четким карнизом, обычно с полимеризацией витков дейтерохона (до 4х/2—5 витков); вентральная стенка ПВ с одной
Рис. 116. Spirochona marina с Anisogammarus ochotensis.
центральной вырезкой, но без продольных складок, в отличие от Serpentichona. Вырезка делит карниз на две части, расположенные под углом. Нижняя половина тела обычно резко вытянута, превращена в длинный четкий псевдостил, как правило лишенный пищевых вакуолей. В состав рода мы включили и два вида, промежуточных между Spirochona и Cavichona (С. elegantula и вид с Acanthogammarus), с типичной для кавихон воронкой, но с коротким псевдостилом, как у спирохон.
Отличия рода от Spirochona: наличие вырезки гипохона, тенденция к полимеризации витков, к резкому укрупнению тела, к образованию длинного псевдостила. Serpentichona имеет такой же облик, как типичные кавихоны, но у нее появляется целая серия продольных вентральных складок и вырезок ПВ, а число витков уменьшается.
Крупный род с 16 видами, включая два известных: С. elegans, С. elegantula (Сварчевский), С. cincinnata (типовой вид), С. oligocineta, С. protecta, С. multifida, С. асап-thogammari, С. tenue, С. crassa, С. abyssalis, С. brevistyla, С. virgata, С. rhabdomorpha, С. exilis, С. carinuri, С. laticollis. Хозяева — амфиподы сем. Gammaridae: Eulimnogam-
rnarus, Poecktlogammarus, Ommatogammarus, Odontogammarus, Abyssogammarus, Para-garjaewia, Garjaewia, Parapallasea, Pallasea, Brandtia, Carinurus, Carinogammarus, Acanthogammarus, Axelboeckia, Eucarinogammarus, Hyalellopsis. Все виды рода представлены в Байкале, но не все эндемики озера; часть видов с гаммаридами распространяется по Ангаре и, предположительно, по Енисею до Северного Ледовитого океана (район Таймыра).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА CAVICHONA
1 (8). Псевдостил слабо выражен, короткий, длина его составляет менее г/ъ длины особи.
2 (3). Длина ПВ с завитком составляет х/3 и более длины особи.........
.................................................. 16. С. elegantula.
3 (2). Длина ПВ с завитком менее х/3 длины особи.
4 (5). Карниз ПВ очень широкий, до 7 мк шириной..................9. С. abyssalis.
5 (4). Вентральный карниз неширокий (2—4 мк), обычного типа.
6 (7). Тело, шейка и псевдостил очень толстые......................8. С. crassa.
7 (6). Тело, шейка и псевдостил неширокие, шейка значительно уже ПВ . . . .
8 (1). Псевдостил удлиненный, порядка х/3—х/2 длины особи.
9 (10). Дорзальный край ПВ обычно зазубрен...............5. С. multifida.
10 (9). Дорзальный край ПВ ровный, всегда без зубцов.
11 (12). Выше Ма расположен очень толстый подковообразный опорный обруч . .
.......................................................... 4. С. protecta.
12 (11). Четкого опорного обруча на границе тела и шейки нет.
13 (22). ПВ с 4х/2—5 оборотами спирали.
14 (17). У фиксированных особей хорошо видны псевдокинеты.
15 (16). Количество псевдокинет невелико, около 30............3. С. oligocineta.
16 (15). Количество псевдокинет велико, 50—60 ................ 15. С. laticollis.
17 (14). Псевдокинеты у фиксированных особей не видны.
18 (19). Гигантские формы, наиболее крупный вид рода и хонотрих в целом (300—
350 мк) ................................................ 2. С. cincinnata.
19 (18). Длина тела менее 200 мк.
20 (21). Завиток узкий, высокий, вытянут.................6. С. acanthogammari.
21 (20). Завиток компактный, низкий............................ . 1. С. elegans.
22 (13). ПВ с 4 и менее оборотами спирали.
23 (28). ПВ с Зх/2—4 оборотами спирали.
24 (25). Четко выражены псевдокинеты ..........................11. С. virgata.
25 (24). Псевдокинеты у фиксированных особей не видны.
26 (27). Тело тонкое, плавно переходит в псевдостил.............14. С. carinuri.
27 (26). Тело широкое, резко сужается к ложному стебельку . . 12. С. rhabdomorpha. 28 (23). ПВ с 3 оборотами спирали.
29 (30). Тело в 2—2х/2 раза толще псевдостила.....................7. С. tenue.
30 (29). Тело в 3—Зх/2 раза толще псевдостила.....................13. С. exilis.
1. Cavichona elegans (Swarczewsky, 1928) comb. nov. (рис. 1, E; 2, T; 37, B; 49, A; 50, B—K; 52, П; 97, Л—Н; 117, А— Г; 121, Г—Д).
Сварчевский, 1928a : 188, Taf. 7, Fig. 1—31; Taf. 8, Fig. 32—57; 19286 : 50—52, Taf. 2, Fig. 12—14 (Spirochona; paca c Eulimnogammarus verrucosus); Kahl, 1935 : 804, Fig. 148, 4a (Spirochona); Bock, 1938 : 102 (Spirochona); Dons, 1940 : 117 (Spirochona); Mohr, 1948 : 1, 8 (Spirochona); G e 1 e i, 1950 : 100, Fig. 18, a (Spirochona; вид не указан); Doflein u. Reichenow, 1953 : 1154 (Spirochona); Hall, 1953 : 413, fig. 7.49, C, D, H (Spirochona); Mohr a. oth., 1963a : 231 (Spirochona); M a t s u d o, 1966 : 361 (Spirochona); Райков, 1967 : 189 (Spirochona); Matsudo a. Mohr, 1968 : 283 (Spirochona).
Тело очень крупное, резко удлиненное; длина порядка 200 мк; шейка короткая, умеренно широкая. ПВ крупная, с относительно небольшим карнизом; завиток компактный, не вытянут вверх, низкий и широкий. У сборной «В. elegans» отмечено 3— 4 витка (Сварчевский), у нашей расы с типового хозяина — 4—4х/2, реже до 5. Складка правее зоны В неглубокая, боковой карман слабо выражен. Пелликула не исчерчена. Псевдостил четкий, вытянут, длина его превышает х/3 длины особи.
Размеры. По Сварчевскому (1928а; вероятно, раса с типового хозяина): длина особи до 160—170 мк, ширина до 20—30 мк; высота ПВ х/в—х/7 длины особи. По Сварчевскому (19286; скорее всего раса с других хозяев): размеры особи до 225Х ХЗО мк; высота ПВ до 55 мк. По нашим измерениям: длина особи с завитком 165—190 мк; L : D=8 : 1; размеры тела 137—152x24—28 мк, шейки 2—3X17 мк, ПВ 33—38Х X 40 мк; высота завитка 20—23 мк, колюмеллы 30 мк, карниза 4 мк; диам. диска 14 мк; размеры псевдостила 75—95x8—Эмк, Ма около 21X 13мк, томита около 39X21 мк.
Вид принадлежит к группе крупнейших видов рода с максимальным числом витков. У близкого вида С. multifida ПВ зазубрена, у С. extlis имеется всего 3 витка, у С. protecta мепее трех.
Рис. 117. А—Г — Cavichona elegans с Eulimnogammarus verrucosus {В—Г — по: Сварчевский, 1928а); Д—Ж — С. cincinnata с Eucarinogammarus wagi;
3 — грибки у ножки С. abyssalis.
Локус и хозяева — края жабр, особенно передних, группы видов байкальских гаммарид (по Сварчевскому): Pallasea cancellus, Р. cancelloides и Eulimnogammarus verrucosus («особо излюбленный хозяин») в Ангаре. На последнем виде рачка спиро-хоны образуют «колоссальные поселения», «густую бахрому по краям жабр». В Ангаре виды Pallasea очень редки, доминируют виды Eulimnogammarus. Сварчевский изучал и рисовал, вероятно, формы с последних хозяев. На Pallasea cancellus мы вообще не
17 Заказ № 213
Рис. 118. Cavichona cincinnata c Eucarinogammarus wagi.
Рис. 119. Cavichona cincinnata c Eucarinogammarus wagi.
нашли хонотрих, на Р. cancelloides живет С. crassa. Mop (Mohr a. oth., 1963а) ошибочно говорит о локализации С. elegans на «передних переоподах». Список хозяев С. elegans позднее расширен Сварчевским до 18 видов 10 родов гаммарид; Сварчевский считает С. elegans самой распространенной спирохопидой в Апгаре и Байкале. «Одновременная встречаемость» С. elegans и S. patella на жабрах Acantho gammarus albus — несомненная ошибка. Сварчевский не изучал морфологию кавихон с байкальских гаммарид; формы с удлиненным телом попросту определялись им как С. elegans.
Рис. 120. Cavichona cincinnata с Eucarinogammarus wagi.
Р аспространение. Типовая раса: Ангара у Иркутска, в 70 км от истока. Суммарный ареал сборного вида включает, по Сварчевскому, 14 пунктов, в основном в среднем и южном Байкале, глуб. 0—300 м. Мы нашли С. elegans на типовом хозяине Eulimno gammarus verrucosus на литорали у Лиственичнбго, у ст. Байкал и у пос. Никола на Ангаре, глуб. 0.3—2 м. Вероятно, по системе Ангара—Енисей вид может доходить до озер и рек Таймыра и заливов арктических морей.
2. Cavichona cincinnata Jankowski sp. nov. (рис. 15, О; 34, Г; 117, Д—Ж; 118— 120; 121, В).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; раса с Eucarinogammarus wagi).
Рис. 121. А —Е — морфология спирохонид: А — Serpentichona anthus с Acanthogammarus reicherti, Б — Cavichona cincinnata с Eucarinogammarus wagi, В — C. protecta с Brandtia lata, Г, Д C. elegans с Eulimno gammarus verrucosus, E — «Spirochona gemmipara» (по: Гаевская, 1933); Ж—И — локусы спирохонид; К — эпифауна жабр Gammarus (по Эйсмонду).
Наиболее крупный вид хонотрих в целом, длиной до 350 мк. Тело резко удлиненное, слегка расширено в средней части, обычно почти цилиндрическое. Шейка умеренно широкая, короткая. ПВ очень крупная, с большим карнизом, слабо наклонена к гипохону. Завиток широкий, с 4х/2—5 оборотами, вытянут вверх. Складка и карман ПВ неглубокие. Псевдостил превышает х/3 длины особи. Пелликула не исчерчена.
Размеры. Длина особи до 218—323 мк, с завитком обычно 250—290 мк,(максимум 345 мк; L : D=10 : 1; размеры тела 210—270x26—35 мк, шейки 4—5x15—
Рис. 122. Cavichona ollgocineta с Eulimnogammarus sp.
25 мк, ПВ 16—18x53—62 мк; высота завитка 28—45 мк, колюмеллы 40—51 мк; диам. диска 13—14 мк; размеры псевдостила 85—158X10—13 мк, Ма 22—23x13—16 мк, томита 44—54x23—28 мк.
От других кавихон вид отличается наиболее крупными размерами тела, большим числом витков, наличием очень широкого карниза.
Локус и. хозяин — жаберные лепестки Eucarinogammarus wagi', вид образует массовые, плотные поселения по краям жабр.
Распространение. Байкал, Лиственичное, глуб. 200 м.
3. Cavichona oligocineta Jankowski sp. nov. (рис. 98, Г; 99, В, В; 122).
Крупные формы, длиной около 130 мк; тело вытянутое, почти цилиндрическое. Шейка умеренно короткая, широкая. ПВ широкая, с 41/2—5 витками и небольшим карнизом; завиток высокий, наклонен к гипохону. Дорзальная складка и карман едва выражены. Псевдостил четкий, небольшой, составляет менее х/3 длины особи. Пелликула несет примерно 30 псевдокинет.
Размеры. Длина особи 110—128 мк; L : D=5 : 1; размеры тела 85—91X 21— 23 мк, шейки 3x10—12 мк, ПВ 32—37x28—30 мк; высота завитка 20—23 мк, колю-
меллы 25—32 мк, карниза 2 мк; диам. диска 6.5 мк; размеры псевдостила 35—40x8— 11 мк, Ма 15—17x9—11 мк, томита 32—37X17—21 мк.
В отличие от большинства кавихоп вид имеет четкие псевдокнпеты; у С. laticollis их вдвое больше; у С. multifida эпихон несет складки и зубчики, у С. elegantula псевдо-стил не удлинен.
Локус и хозяин — края жабр Eulimnogammarus sp.; вид редкий.
Распространение. Байкал, Большие Коты, глуб. 150—230 м.
4. Cavichona protecta Jankowski sp. nov. (рис. 31, П, P; 99, Д; 121, В; 123).
Сварчевский, 19286 : 47 (Spirochona gemmipara, part.; paca c Brandtia latissima), 51 (В. elegans, part.; paca c Brandtia lata).
' Рис. 123. Cavichona protecta c Brandtia lata.
Тело крупное, длиной порядка 170 мк, довольно топкое; шейка широкая. ПВ некрупная, с небольшим карнизом; завиток мелкий, недоразвит, с 21/2—23/4 витками. Складка и карман развиты слабо. Псевдостил тонкий и очень длинный, часто составляет более половины длины особи. Пелликула не исчерчена. Выше Ма лежит массивный опорный обруч.
Размеры. Длина особи 142—154 мк, с завитком 160—174 мк; L : D=8.5 : 1; размеры тела 131—143X19—20 мк, шейки 7—11X12—15 мк, ПВ 10—13x39—41 мк; высота завитка 14—18 мк, колюмеллы 19—23 мк; диам. диска 8 мк; размеры псевдостила 78—93x6.5—8 мк, Ма 14—26x12—15 мк, томита 31—35X20—26 мк.
Вид четкий, выделяется слабым развитием завитка, образованием опорного обруча в основании ПВ, резким удлинением тела.
Локус и хозяин — края жабр Brandtia lata (основной хозяин) и В. (=Spinaeanthus) insularis (дополнительный хозяин); часто встречается в массовых количествах, более 100 особей на жабре.
Распространение. Байкал, литораль у ст. Байкал, глуб. 0—0.5 м (типовая раса на В. lata.)', бухта Песчаная, глуб. 3—5 м (на В. lata)', Большие Коты, о. Уш-каний, глуб. 1.5—5 м (на В. insularis).
Рис, 124. Cavichona multifida c Eulimnogammarus cyaneus.
5. Cavichona multifida Jankowski sp. nov. (рис. 20, A; 44, К, II, 0; 124—128).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; paca c Echinogammarus cyanoides= Eulimnogammarus cyaneus).
Рис. 125. Протомит Cavichona multifida c Eulimnogammarus cyaneus.
Рис. 126. Начало почкования Cavichona c Eulimnogammarus cyaneus.
multifida
Крупные формы (порядка 135—170 мк); тело умеренно широкое, удлиненное; шейка узкая, отчетливая. ПВ относительно некрупная, с нешироким карнизом; завиток широкий и низкий, не вытянут, резко наклонен к гипохону, компактного типа,
Рис. 127. Почкование Cavichona multifida с Eulimnogammarus cyaneus.
обычно с Зх/2—4 витками. Эпихон с глубокой складкой и четким карманом; край эпихона и завитка часто складчатый, зазубренный. Псевдостил достигает 1/3 длины особи. Пелликула с четкими многочисленными псевдокинетами.
Размеры. Длина особи с завитком до 145—173 мк; L : D=6 : 1; размеры тела 98—122x23—26 мк, шейки 5—7Х12—15 мк, ПВ 12x36—42 мк; высота завитка 17—22 мк, колюмеллы 21—26 мк; диам. диска 9.5—10 мк; длина псевдостила 33—36, в одном случае около 70 мк; размеры Ма 19—21 X9—11 мк, томита 33—35x20—22 мк.
Рис. 128. Конец почкования Cavichona multifida с Eulimnogammarus cyaneus.
Рис. 129. Cavichona acanthogammari c Acantho-gammarus albus.
От остальных видов рода С. multifida отличается узорчатым краем эпихона, от близких видов С. elegans и С. exilis — кроме того, небольшими размерами завитка, наличием псевдокинет.
Локус и хозяин — края жабр Eulimnogammarus (Philolimnogammarus) cyaneus; вид весьма обычный, массовый.
Распространение. Байкал, Лиственичное, Большие Коты, ст. Байкал, О м (у уреза воды и в нижней супралиторали).
6. Cavichona acanthogammari Jankowski sp. nov. (рис. 44, Ж'—И; 129; 130).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; paca c Acanthogammarus albus), 55—56 (S. patella, paca c A. albus).
Рис. 130. Cavichona acanthogammari c Acanthogammarus albus.
Массивные, крупные формы, длиной порядка 180—190 мк; тело умеренно вытянутое, очень широкое, шейка короткая и широкая. ПВ широкая, сильно сплющена, резко вытянута вверх и едва наклонена к вентральному краю; завиток с 4, реже 41/2 оборотами. Дорзальная складка глубокая, хорошо выражен боковой карман. Псевдостил относительно небольшой, составляет менее 1/3 длины тела; пелликула с тончайшими складками.
Размеры. Длина особи 132—159 мк, с завитком 165—183 мк (у нетипично крупных особей до 197 мк); размеры тела 114—138x32—37 мк, шейки 5—7X21 — 23 мк, ПВ 12—15 X 55—63 мк; высота завитка 33—40 мк, колюмеллы 42—48 мк, карниза 4 мк; диам. диска 15 мк; размеры псевдостила 60—68X10—12 мк, Ма 18—22Х Х12—18 мк, томита около 42X28 мк.
Отличия от других видов со сходным числом витков: резкое удлинение завитка, хорошее развитие кармана, сравнительно короткий псевдостил.
Локус и хозяин — края жабр Acanthogammarus albus; ряд особей 4встречается на большом удалении от края жабры. Вид редкий, не образует массовых скоплений.
Распространение. Байкал, бухта Песчаная, глуб. 25—30 м; Большие Коты, глуб. 25—30 м; разрез от Посольска, глуб. 47 м.
7. Cavichona tenue Jankowski sp. nov. (рис. 137, Д—E).
Некрупные особи длиной порядка 120—130 мк. Тело тонкое, вытянутое, неширокое; шейка относительно широкая. ПВ небольшая, невысокая, с карнизом обычного типа. Завиток мелкий, изогнутый, с 3 оборотами; дорзальная складка и боковой карман выражены слабо. Псевдостил нечетко отграничен, удлинен; пелликула не исчерчена.
Размеры. Длина особи 102—117 мк, с завитком 114—131 мк; L : D=7 : 1; размеры тела 75—96X16—19 мк, шейки 3X12 мк, 11В 8—11X28—37 мк; высота завитка 11—12 мк, колюмеллы 14—16 мк, карниза 2—4 мк; диам. диска 9—9.5 мк; размеры псевдостила до 60X6—7 мк, Ма 18—21X7—8 мк, томита около 37X19 мк.
По числу витков вид сходен с С. exilis, но последний вид более крупный, с длинным псевдостилом.
Рис. 131. Cavichona crassa с Pallasea cancelloides.
Локус и хозяин — края жабр Parapallasea puzylli var. carlnulata; вид обычный, но не массовый, до 10—20 особей на жабре.
Распространение. Байкал, бухта Песчаная, глуб. 15—25 м.
8. Cavichona crassa Jankowski sp. nov. (рис. 131, 132).
Сварчевский, 1928a : 188 (Spirochona elegans, part.; paca c Pallasea cancelloides).
Тело крупное, длиной порядка 125—140 мк, широкое, почти цилиндрическое; шейка короткая, широкая. ПВ невысокая, широкая, с небольшим карнизом, с 2х/2— 23/4, редко с 3 витками; завиток широкий, не вытянут, слабо наклонен к гипохону. Карман развит слабо. Псевдостил почти всегда недоразвит, короткий и широкий, нечетко отграничен от тела. Пелликула без складок.
Рис. 132. Cavichona crassa с Pallasea cancelloides.
Размеры. Длина особи 108—123 мк, с завитком 123—140 мк; Б : D = 5 : 1; размеры тела 86—98x22—26 мк, шейки 3x15—17 мк, ПВ 14—15x38—40 мк; высота завитка 16—18 мк, колюмеллы 20—26 мк, карниза 2.5—3 мк; диам. диска 10—11 мк; размеры псевдостила 25—45X 10 мк, Ма 14—18X10— 13 мк, томита 41—42 X 24—27 мк.
Вид принадлежит к группе кавихон с коротким псевдостилом. У С. elegantula ПВ крупнее, число витков больше; у С, abyssalis карниз широкий; у С. brevi-styla тело, шейка и псевдостил узкие.
Локус и хозяин — края жабр Pallasea cancelloi-des; отсутствует у близкого вида Р. cancellus' вид массовый, обычный.
Распространение. Байкал, бухта Песчаная, глуб. 1—3 м; ст. Байкал, глуб. 0—0.5 м; исток Ангары. Вероятна находка в Ангаре и Енисее.
9. Cavichona abyssalis Jankowski sp. nov. (рис. 117, 3; 133, 134).
Крупные формы, длиной 120—130 мк. Тело удлиненное, шейка узкая, короткая; ПВ очень широкая и высокая, с 3, редко с З1/^ оборотами и с наиболее широким: у кавихон карнизом (до 7 мк). Завиток крупный, изогнутый. Карман ПВ плохо выражен. Пелликула без складок. Характерно недоразвитие псевдостила, который составляет максимум 1/ъ длины тела.
Размеры. Длина особи с завитком 115— 131 мк; L : D=4.5—5 : 1; размеры тела 84—92X23— 26 мк; шейки 3—4X12—14.5 мк, ПВ 9—11.5x41 — 49 мк; высота завитка 24—27 мк, колюмеллы 31 — 35 мк; диам. диска 9—10 мк; размеры псевдостила до 30x9—10 мк, Ма 17—18X11 мк, томита около ЗбХ X 22 мк.
Вид относится к кавихонам с недоразвитым псевдостилом, но ПВ шире, чем у этих форм; витков меньше, чем у С. elegantula, и больше, чем у С. crassa', карниз очень широкий, как у гигантской С. cincinnata.
Локус и хозяин — края жабр Paragarjaewia (ранее A byssogammarus) petersi', вид редкий, найдены немногочисленные особи.
Распространение. Байкал, Боярская, глуб. 310 м.
10. Cavichona brevistyla Jankowski sp. nov. (рис. 44, P, C\ 46, Д—И-, 53, A, B; 135).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; paca c Eulimnogammarus viridis).
Тело некрупное, длиной порядка 96—109 мк, удлиненное и довольно широкое; шейка неширокая, короткая. ПВ относительно небольшая, сЗ—З1^ оборотами, с широким карнизом; завиток невысокий, компактный. Складка ПВ и боковой карман выражены
слабо. Пелликула не исчерчена. Псевдостил развит очень слабо, максимум до 20 мк. Размеры. Длина особи с завитком 96—109 мк; L : D = 4.5 : 1; размеры тела 68—75x20—23 мк, шейки 4X10—12 мк, ПВ 10—11X29—34 мк; высота завитка 16— 17 мк, колюмеллы 25—26 мк, карниза 2.5—3 мк; диам. диска 7.5 мк; размеры псевдостила 9—20X7—8 мк, Ма 15—17X10—11 мк, томита 33—38X19—21 мк.
Вид относится к кавихонам с недоразвитым псевдостилом; у С. elegantula тело мельче, но число витков больше; у С. abyssalis карниз шире; у С. crassa псевдостил длиннее, тело шире.
Локус и хозяин — края жабр Eulimnogammarus (Philolimnogammarus) viridis; вид частый, но не образует плотных поселений.
Распространение. Байкал, верхняя литораль (глуб. 0—0.5 м) у Ли-ственичного и в Больших Котах; возможны находки в Ангаре и Енисее.
11. Cavichona virgata Jankowski sp. nov. (рис. 136; 137, Б—Г).
Сварчевский, 19286 : 47 (Spirochona gemmipara, part.; paca c Carinogamma-rus cinnamoneus).
Некрупные формы, длиной порядка 100—110 мк. Тело вытянутое, очень широкое в верхней части и резко сужающееся к ложному стебельку. Шейка неширокая, корот-
Рис. 133. Cavichona abyssalis c Paragarjaewia petersi.
Рис. 134. Cavichona abyssalis c Paragarjaewia petersi.
кая. ПВ относительно невелика, с узким карнизом; завиток невысокий, резко изогнут. Края ПВ с 33/2—4 витками. Складка и карман выражены слабо. Псевдостил четкий, достигает 1/3—1/2 длины особи, очень тонкий. Пелликула примерно с 60 псевдо-
Рис. 135. Cavichona brevistyla с Eullmno gammarus viridis.
кипстами.
Размеры. Длина особи с завитком 97—ИЗ мк; L : D —6 : 1; размеры тела 83—97 X 15—19 мк, шейки 2—3X8—10.5 мк, ПВ 8— 9x28—34 мк; высота завитка 10—13 мк, колюмеллы 16—19 мк, карниза 2 мк; диам. диска 7.5—. 8 мк; размеры Ма 12—14x7— 10 мк, томита 28—32X13—17 мк.
Вид принадлежит к кавихо-нам с длинным псевдостилом и с четкими складками пелликулы. У С. multifida край ПВ зазубрен, у С. oligocineta число складок невелико (около 30); у С. laticollis тело и псевдостил утолщены, ПВ более низкая и широкая, с большим числом витков.
Локус и хозяин — края жабр Carinogammarus cinnamoneus; вид массовый, обычный, образует густые поселения.
Распростра нение. Байкал, Большие Коты, глуб. 300 м; Селенгинское мелководье, глуб. 25—27 м.
12. Cavichona rhabdomorpha Jankowski sp. nov. (рис. 138).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; paca c Ommatogammarus carneolus).
Крупные формы, длиной порядка 130—145 мк; тело вытянутое, довольно узкое. Шейка узкая, относительно длинная. ПВ очень крупная, с Зг/2—4 оборотами, с небольшим карнизом; завиток неширокий, вытянут высоко вверх. Складка неглубокая, карман ПВ плохо выражен. Псевдостил очень четкий, узкий, удлиненный; пелликула без складок.
Размеры. Длина особи с завитком 133—147 мк; L : D= =6.3:1; размеры тела до 110X20— 23 мк, шейки 5—6X13—15 мк, ПВ 12—14x42—44 мк; высота завитка 21—23 мк, колюмеллы 25—30 мк, карниза 2.5—3 мк; диам. диска 9—10 мк; размеры псевдостила 54—67x8—9 мк,
Ма 18—20X 8—12 мк, томита 29— 34x16—19 мк.
Вид принадлежит к кавихо-нам с З1^—4 витками. У С. vir-
gata имеются псевдокинеты, у С. carinuri шейка и ПВ неширокие, не вытянутые. Локус и хозяин — края жабр Ommatogammarus carneolus', вид обычный, образует
плотные поселения.
Распространение. Байкал, Маритуй, глуб. 300 м.
13. Cavichona exilis Jankowski sp. nov. (рис. 137, Л).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; paca c Eulimnogammarus lividus).
Рис. 136. Cavichona virgata c Carinogammarus cinnamoneus.
Рис. 137. A — Cavichona exilis c Eulimnogammarus lividus', Б—Г — C. vir-gata c Carinogammarus cinnamoneus’, Д, E — C. tenue c Parapallasea puzylli var. carinulata.
Тело относительно некрупное, длиной порядка 120—130 мк, удлиненное; шейка короткая и широкая. ПВ крупная, с относительно небольшим, невытянутым завитком; карниз узкий; обычно насчитываются 3 витка. Складка неглубокая, карман ПВ слабо развит. Пелликула не исчерчена. Псевдостил четкий, тонкий (втрое тоньше тела), вытянут.
Размеры. Длина особи с завитком 122—135 мк; размеры тела 84—95X19— 23 мк, шейки 2—3x8—11 мк, ПВ 10—12x36—39 мк; высота завитка 18—22 мк, колюмеллы 21—25 мк, карниза 3 мк; диам. диска 9 мк; размеры псевдостила 50—87X Хб—9'мк, Ма 15—21X14—15 мк, томита 35—38X18—22 мк.
Рис. 138. Cavichona rhabdomorpha с Оmmatogammarus carneolus.
Вид близок к С. tenue, также с 3 витками, но тело у С. exilis крупнее, толще, псевдостил длиннее.
Локус и хозяин — края жабр Eulimnogammarus lividus', вид весьма обычный, массовый.
Распространение. Байкал, бухта Песчаная (0—3 м); ст. Байкал, глуб. 0—0.5 м. Вероятны находки в Ангаре и Енисее.
14. Cavichona carinuri Jankowski sp. nov. (рис. 139).
Сварчевский, 19286 : 51 (Spirochona elegans, part.; paca c Carinurus solskii).
Относительно некрупные формы, длиной 110—130 мк. Тело удлиненное, тонкое; шейка узкая, короткая. ПВ относительно небольшая, с 31/2 витками; завиток широкий и низкий, компактный; карниз узкий; Складка ПВ и карман слабо развиты. Пелликула с псевдокинетами. Псевдостил тонкий, удлинен (до х/з длины особи), нечетко отграничен от тела.
Размеры. Длина особи с завитком 106—128 мк; L : D=6 : 1; размеры тела 94—101X16—23 мк, шейки 3—5x12—12.5 мк, ПВ 9—10x30—32 мк; высота завитка 11—14 мк, карниза 2.5 мк; диам. диска 9 мк; размеры псевдостила 31—44X6—7 мк, Ма 17—19x9—12 мк, томита около 32X18 мк.
В отличие от близких видов у С. carinuri псевдокинет меньше, чем у С. virgata, завиток ниже, чем у С. rhabdomorpha.
Локус и хозяин — края жабр Carinurus solskii', вид обычный, образует густые поселения.
Распространение. Байкал, Большие Коты (глуб. 4 м), Селенгинское мелководье (глуб. 15 м), Посольск (глуб. 47 м).
15. Cavichona laticollis Jankowski sp. nov. (рис.
4G, А—Г; 47, А—Д, K-U; 99, A; 140; 141).
Сварчевский, 19286 : 47 (Spirochona gemmipara, part.; paca c Garjaewia cabanisi).
Крупные формы, длиной порядка 160—170 мк. Тело удлиненное, широкое, почти цилиндрическое; шейка короткая и очень широкая. ПВ относительно некрупная, с широким карнизом, с 41/2, редко 5 витками. Завиток низкий, компактный, не вытянут. Складка и карман ПВ слабо выражены. Псевдостил невысокий и широкий, составляет менее 1/3 длины тела. Пелликула с большим числом псевдокинет.
Размеры. Длина особи с завитком до 172 мк; L ; D=7 : 1; размеры тела 120—156x24— 30 мк, шейки 3X17—21 мк, ПВ 14—16x39—45 мк; высота завитка 21—22 мк, колюмеллы 31—32 мк, карниза 2—3 мк; диам. диска 12—14 мк; размеры псевдостила 47—54X10—13 мк, Ма 18— 21X12—15 мк, томита около 41X Х20 мк.
Вид принадлежит к кавихо-нам с максимальным (41/2—5) числом витков; размеры тела вдвое меньше, чем у С. cincinnata; завиток не вытянут, как у С. acanthogammari; складок пелликулы в 2—3 раза больше, чем у С. oligo-cineta; тело и шейка шире, чем у С. elegans.
Локус и хозяин — жабры Garjaewia cabanisi; вид редкий, малочисленный; особи часто далеко удалены от края жаберного лепестка.
Распростран е н и е. Байкал, Лиственичное, глуб. 150— 200 м.
16. Cavichona elegantula (Swarczewsky) comb. nov. (рис. 1, Г; 97, P—С; 142; 143).
Сварчевский, 19286 : 53, Taf. 2, Pig. 23—24 (с ошибочной подписью — Spirochona tuba; Spirochona elegantula, part., paca c Odontogammarus demjanowitschi); 55—56, Taf. 2, Fig. 25 (S. patella, part., paca c Odontogammarus pulc-
15, K-H; 19, A; 31, И; 44, Л;
Рис. 139. Cavichona carinuri c Carinurus solskii.
herrimus); 47 (Spirochona gemmipara, part., paca c Odontogammarus demjanowitschi); Kahl, 1935 : 805, Fig. 148, 22 (с ошибочной подписью — Spirochona tuba; Spirochona elegantula); 805, Fig. 148, 3 (Spirochona patella); Mohr, 1948 : 10 (Spirochona patella); Hall, 1953 : 413, fig. 7. 49, A (Spirochona patella); Mohr, 1966 : 538 (Spirochona); M a t s u d о a. Mohr, 1968 : 283 (Spirochona).
18 Заказ № 213
Рис. 140. Cavichona laticollis c Garjaeivia cabanisi.
Вид найден Сварчевским (19286) в небольшом числе особей на жабрах Odontogam-marus demjanowitschi (нетаксономическая морфа О. calcaratus) и Parapallasea lagowslcyi. На видах второго рода мы находили лишь типичных кавихон с длинным псевдостилом; возможно, Сварчевский видел недоразвитых трофонтов. Типовым хозяином мы считаем О. calcaratus. Судя по нашему материалу, это крупные формы, длиной порядка 120— 130 мк, с веретеновидным телом, внешне типичные Spirochona, но с четкой вентральной вырезкой ПВ. Шейка неширокая, короткая, хорошо выражена. ПВ непропорционально крупная, широкая, очень высокая, с широким карнизом; завиток вытянут, слабо
Рис. 143. Cavichona elegantula с О donto gammarus calcaratus.
наклонен к гипохону. ПВ с 3*/2—4, редко с 41/2 витками. Складка эпихона глубокая, карман ПВ хорошо выражен. Псевдостил едва развит, как и у спирохон. Пелликула с многочисленными складками.
Размеры. Раса С. elegantula по Сварчевскому: длина особи 95—100' мк, тела* 50 мк, ПВ 26 мк; ширина тела до 20 мк, ПВ 70 мк; диам. диска 10 мк; размеры «стебелька» 5x5—6 мк; ПВ с 3—3% витками. Раса Spirochona patella по Сварчевскому: длина особи до 90 мк; размеры тела 80х 18 мк, ПВ 10—12Х 35 мк; ширина шейки 15 мк; 2х/2 оборота завитка закручены в одной плоскости. Раса С. elegantula с О. calcaratus по нашим данным: длина особи 102—107 мк, с завитком 120—143 мк; L : D=4 : 1; размеры тела 73—94X28—36 мк, шейки 5—8X17—18 мк, ПВ 15—18x48—55 мк; высота завитка 30—32 мк, колюмеллы 38—42 мк, карниза 5 мк; диам. диска 12—14 мк; размеры псевдостила 11—15X12—14 мк, Ма 18—20x13—17 мк, томита 31—36X22— 24 мк.
Вид принадлежит к группе кавихон с недоразвитым псевдостилом; последний может быть удлинен у части особей других видов, но всегда короткий у С. elegantula.
Локус и хозяин — края жабр О donto gammarus demjanowitschi (=О. calcaratus, типовой хозяин) и Parapallasea lagowskyi (вероятно, указан Сварчевским ошибочно). Для первого хозяина Сварчевским указаны и S. gemmipara, но это явно молодые особи кавихон. Загадочная 5. patella указана для трех: хозяев: Acanthi)gammarus albus, 18*
A. godlewskii и 0. pulcherrimus (также морфа О. calcaratus), причем на A. albus этот вид обитает якобы совместно с S. elegans, на О. pulcherrimus — с S. gemmipara. Свар-чевским зарисована явно стадия диминуции с выступом, остающимся после отделения томита («базальный лепесток ПВ»), с инволюцией ПВ. Это, конечно, не самостоятельный вид спирохонид: неясен ни конкретный хозяин, ни морфология нормальных, недиминутивных трофонтов.
Распространение. Сварчевский отмечал «5. patella-» на трех хозяевах (Байкал, Лиственичное, о. Ушканий, глуб. 60 и 200 м), С. elegantula — на двух хозяевах (Лиственичное, Смородовая бухта, Большие Коты, глуб. 200 и 300 м). Наша раса с О. calcaratus: Лиственичное, глуб. 150—200 м.
3. Род SERPENTICHONA Jankowski gen. nov.
Сварчевский, 19286 : 52 (Spirochona, part.); Kahl, 1935. : 805 . (Spirochona, part.).
Очень крупные формы, длиной до 300 мк. Тело резко удлиненное, относительно неширокое, не сплющено, в верхней части расширено. ПВ крупная, широкая и отно-
Рис. 144. Serpentichona anthus с A cantho gammarus reicherti.
сительно невысокая: характерна тенденция к недоразвитию завитка (обычно а менее, редко до 31/2 витков). Вентральный край ПВ неровный, с центральной вырезкой (как у Cavichona) н с серией дополнительных вырезок справа и слева от нее; они воз-
Рис. 145. Serpentichona anthus с Acanthogammarus reicherti.
никают уже на ранних стадиях онтогенеза. Карниз не единый, как у спирохон, и не двойной, как у кавихон, подразделен на ряд (до 8) самостоятельных карнизов. Шейка хорошо выражена. Псевдостил очень длинный, составляет до половины, изредка до 2/в Длины тела. Пелликула с продольными ребровидными складками.
Отличие от Spirochona — появление вентральных вырезок и складок ПВ, резкое удлинение псевдостила; отличие от Cavichona — полимеризация вентральных вырезок, появление складок, тенденция к недоразвитию завитка.
Рис. 146. Serpentichona anthus c Acanthogammarus reicherti.
Рис. 147. Serpentichona anthus. A — Г—с Acanthogammarus reicherti', Д с Pachyschesis branchialis.
Пресноводный род, эндемик Байкала; обитатель глубинных вод. С одним (типовым) видом S. anthus, обитающим на жабрах Acanthogammarus и предположительно Pachyschesis.
1. Serpentichona anthus (Swarczewsky) comb. nov. (рис. 1, 3; 2, У; 20, Д; 24, /Л’; 33, Г, Д; 97, Т—Ч; 98, Д; 121, А; 144—148).
Сварчевский, 19286 : 52, Taf. 2, Fig. 15—20 (Spirochona; authus par lapsus на стр. 46); 55—56 (patella, part.); Kahl, 1935 : 805, Fig. 148, 19 (Spirochona anthus; S. patella, part.).
Рис. 148. Serpentichona anthus. A—Г — с Acanthogammarus reicherti;
Д—Tff — c Pachyschesis branchialis.
С признаками рода. ПВ, по Сварчевскому, имеет 3, у «внутреннего завитка» 2 оборота спирали. Дорзальная складка и карман выражены слабо.
Размеры. Раса Сварчевского: длина особи обычно 200 мк, ширина в средней части 28 мк, в нижней 9 мк; высота ПВ с завитком 46 мк, ширина 50—60 мк; правый завиток с 21/2, левый с Зх/2 оборотами. Раса автора с Acanthogammarus'. длина особи с завитком 270—310 мк; L : D=10 : 1; размеры тела 232—268X27—31 мк, шейки 12—15X18—20 мк, ПВ 18—20x60—73 мк; высота завитка 14—20 мк, колюмеллы 24— 36 мк, карниза 3 мк; диам. диска 12—14 мк; размеры псевдостила 90—192 X 10—14 мк, Ма 20—26X13—18 мк. Раса автора с Pachyschesis'. длина особи 130—170 мк; размеры тела 114—140X32—37 мк, шейки 3—7X22—24 мк, ПВ 15—18X51—56 мк; высота завитка 20—22 мк, колюмеллы 30—35 мк, карниза до 5 мк; диам. диска 13—14 мк; размеры псевдостила 30—48X16 мк, Ма 24—29X18—20 мк, томита около 52X30 мк.
Локус и хозяин — жабры Acanthogammarus (Brachyuropus} reicherti; встречаются сравнительно редко, не образуют массовых поселений. Заселены края жабр и ровная поверхность лепестков на большом удалении от края. Единичные хонотрихи со склад
чатым вентральным краем ПВ, как у S. anthus, но с широким телом и более коротким псевдостилом найдены нами на жабрах Pachyschesis branchialis, паразитирующего в выводковой камере A. reicherti-, пока материала недостаточно, чтобы считать их особым видом; это могут быть мигранты с А. reicherti.
Распространение. Байкал, Большие Коты, глуб. 250 м (Сварчевский) и 150—260 м (наш материал).
II. Подотряд ENDOGEMMINA Jankowski, 1972
Почкование внутреннее, имеется зародышевая сумка, в которой протекает развитие томита. Исключительно одиночные, не колониальные, инфузории. В основном некрупные формы (длиной 50—70 мк, максимум 90—110 мк). Тело чаще всего не цилин-
Рис. 149. Эндогеммины с Nebalia I. А—В — Ceratochona scandens; Г, Д — •Cristichona tesselata’, Е—И — Chonosaurus galeatus', К — молодые трофонты Cristichona И Chonosaurus.
дрическое — сплющенное, листовидное, угловатое, очень широкое с вентральной стороны, растянуто в стороны; сечение тела округлое лишь у наиболее примитивных родов (рис. 149—151). Шейка обычно редуцирована, ПВ как бы втянута в тело. Как иравило, ПВ резко сплющена дорзо-вентрально, не коническая, очень широкая при рассматривании с вентральной стороны. Вентральный край ровный или нередко с продольными складками, дорзальный поднят над вентральным, часто имеет складки и карманы; парных лепестков нет. Нет спирального завитка, защитной пластинки;
лишь у одного рода {Crassichona) утолщены стенки ПВ и тела. РПА двух типов, с обычным и инверсным положением респичпых зон; при инверсии зона В перемещается на вентральную стенку, с разрывом зоп А' и А". В целом характерец регресс РПА — нет форм с полимеризацией кинет; размеры зоны В у большинства родов резко уменьшаются, у эхинихонид от нее остается лишь рудимент. Зона А цельная лишь у наиболее
Рис. 150. Эндогеммины с Nebalia I. А — Eriochona horrida\ Б, В — Аг-michona sp.; Г —A. hexadenta; Д — Isochona crassa\ Е—И —Cristichona tesselata.
/
примитивных родов. Основная форма защитного аппарата — шипы: большинство родов (20 из 26) включают шипоносные виды; обычно имеются несколько типов шипов, до пяти одновременно у Chonosaarus. Развитие большинства линий в подотряде приводит к возникновению шипоносных форм, выводимых от беспшповых предков. Вследствие редукции шейки, сближения ПВ и края сумки и разрастания последнего образуется характерный для многих родов гипоколлюм — защитная поперечная складка. Прикрепление к субстрату ножкой (14 родов) или стебельком разной длины (16 родов). 10 родов — первичнобесстебельчатые формы, 2 — вторичнобесстебельчатые (Cteno-chona и Coronochona)-, стебелек утерян при миграции сетобионтного предка на ровную поверхность придатка (вторичный планибиоз). Ножка субтерминальна (педоморфоз!) у половины бесстебельчатых родов. Псевдостил едва выражен у части низших эпдогем-
Рис. 151. Эндогеммины с Nebalia IV. А, Б — Spinichona horrida', В — Dentichona marginata; Г — Armichona glbbosa', Д — Cristichona paciftca.
мин (Isochonidae), отсутствует у других родов. Ампула одна, возможно утеряна у части родов; полимеризация ампул никогда не отмечается. Ампула и эндостил нередко разграничены пластинкой. Кутикула тела обычно без продольных складок, реже с рядами папилл; стопки ПВ часто исчерчены. Ма овальный или удлиненный. Жизненный цикл типичный, без трофотомитов, с диминутивным почкованием и образованием стробил из 2—3, иногда из 6—8 томитов. В отличие от экзогеммин возможно развитие вторично-беспшповых трофонтов (анактинид) шипоносных видов — процесс, причины которого пока неясны. Первичнобесшиповые формы мы обычно выделяем в особые роды.
Подотряд включает 5 семейств, 26 родов и 47 видов; аберрантных мопотииичпых родов больше, чем у экзогеммин. Провизорные роды: цетохона, парацетохона, фаллай-нохона и группа родов с небалиид (Лёнг, Мор). Эндогеммины широко распространены в прибрежной зоне и глубинах Мирового океана на основных хозяевах — Leptostraca (Nebaliidae), в открытом океане на эктопаразитах ракообразных (копеподах, циами-. дах), на литорали северной Пацифики на Amphipoda (Amphithoidae). У Amphithoe заселены плеоподы, редко переоподы, у циамид и Balaenophilus — конечности и панцирь, у небалиид — практически все придатки тела, реже панцирь. Стеногалинные солоноводные формы, не выносящие опреснения.
Эволюция эндогеммин начинается с примитивных форм типа Isochona- развитие идет далее разными путями, но в целом по пути адаптации к локальным условиям обитания на придатках. Типовой род Echinichona Jankowski, 1973.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ СЕМЕЙСТВ ПОДОТРЯДА ENDOGEMMINA
1 (4). ПВ простая, коническая, практически не сплющена.
2 (3). Дорзальная складка ПВ и ресничная зона В обращены к сумке, повернуты на 90° вправо..............................II. Сем. Actinichonidae (стр. 289).
3 (2). ПВ обычного типа........................I. Сем. Isochonidae (стр. 282).
4 (1). ПВ резко сплющена дорзо-вентрально.
5 (8). Дорзальная стенка ПВ со складками и четкими карманами.
6 (7). Цилиатура инверсного типа, вентральная стенка ПВ с продольными складками .......................................V. Сем. Inversochonidae (стр. 334).
7 (6). Цилиатура обычного типа, вентральная стенка ПВ без складок (исключая Paraoxychona)...............................III. Сем. Stylochonidae (стр. 301).
3 (5). Дорзальная стенка ПВ практически лишена складок, ровная, без карманов ......................................... IV. Сем. Echinichonidae (стр. 327).
I. Семейство ISOCHONIDAE Jankowski, 1973
Крупные вытянутые формы; тело цилиндрическое, с округлым сечением, не сплющено. Шейка короткая, плохо выражена. ПВ относительно некрупная, коническая, почти не сплющена; стенки не утолщены. Строение ПВ простое: вентральный край ровный, без складок, дорзальный ровный или с 1—2 очень слабо выраженными складками; карманы ПВ едва намечены или отсутствуют. Дорзальная стенка обычно выше вентральной, нередко несет непарный щиток. Гипоколлюм слабо выражен.у отдельных видов. РПА обычного, не инверсного типа, зоны А' и В очень широкие у форм с амфипод и уменьшены у видов с небалиид. Нет никаких шипов, защитный аппарат — лишь щиток ПВ. Ампула крупная, особенно у цетохон. Прикрепление высокой (у форм с Amphithoe) или низкой ножкой либо стебельком; подошвы нет. Ма овальный. Диминутивные стробилы с 2, редко с 3 томитами.
В отличие от примитивных изохонид у всех Inversochonidae РПА инверсного типа, ножка субтерминальна, имеется подошва; у Stylochonidae имеются развитые дорзальные складки и карманы ПВ; у двух последних семейств и Echinichonidae тело и ПВ резко сплющены. Actinichonidae имеют несплющенное, цилиндрическое тело и коническую ПВ, но последняя повернута на 90° вправо. Группа каринихонин в равной мере близка к изохонидам и актинихонидам, отличаясь от них резким удлинением шейки при уменьшении тела.
С 1 известным (Trichochona), 1 новым (Isochona, типовой род) и 3 провизорными родами (цето-, парацето-, фаллайнохона), обитающими на Amphithoe, N ebalia, Cyami-dae и В alaenophilus, предположительно и на Photidae. У амфипод заселены плеоподы, реже переоподы, у форм с китов — конечности и панцирь, у небалиид — почти все придатки, кроме щупика максиллулы. Амфитоиды заражены только в северной Паци-фике (в морях Европы несут экзогеммин), циамиды — по всему Мировому океану, от Аляски и Чукотского моря до Антарктики, в северной и южной Атлантике; изохоны с небалиид отмечены пока только в наших морях (в Баренцевом и в дальневосточных).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА ISOCHONIDAE
1 (2). Имеется длинный стебелек . .
2 (1). Стебелька нет, имеется ножка
2. Род Trichochona (стр. 287). . 1. Род Isochona (стр. 283).
1. Род ISOCHONA Jankowski, 1973
Крупные и мелкие формы с умеренно или сильно вытянутым телом. Шейка короткая и обычно очень узкая. Дорзальный край ПВ ровный или, чаще, с четким щитком, особо развитым у I. peltifera. У исходных форм (I. migratoria) видны 1—2 слабо выраженные складки ПВ, у остальных видов — одна складка. Прикрепление к субстрату
ножкой, высокой у видов с амфитоид и у I. antennaria, низкой у остальных видов. Пелликула гладкая, редко с продольными складками. Сумка неглубокая, вмещает около г/2—3/4 тела томита.
В отличие от Trichochona прикрепительный аппарат изохон имеет вид ножки, но не длинного стебелька.
С 6 новыми видами — I. migratoria, I. antennaria, I. rotundata (типовой вид), I. peltifera, I. crassa, I. pleonicola, обитающими на плеоподах Amphithoe и на придатках Nebalia. Виды рода редки в Баренцевом море и обычны в дальневосточных морях.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА ISOCHONA
1 (4). Ножка удлиненная, длина ее несколько превышает толщину.
2 (3). Имеются продольные ряды папилл ........................2. I. antennaria.
3 (2). Ряды папилл отсутствуют . . .
.................1.1. migratoria.
4 (1). Ножка низкая, высота ее меньше толщины.
5 (6). Ножка расположена субтерминально .................... 6. I. pleonicola.
6 (5). Ножка расположена терминально.
7 (8). ПВ с крупным дорзальным щитком .....................4. I. peltifera.
8 (7). Дорзального щитка ПВ нет.’
9 (10). Тело овальное, L : D — 2 : 1. . .
..................... 5.1. crassa.
10 (9). Тело удлиненное, L : D — 3:1. .........................3. I. rotundata.
1. Isochona migratoria Jankowski sp. nov. (рис. 3, A; 13, Б; 34, A; 35, H; 152).
Крупные формы с широким, почти ромбическим телом, резко сужающимся к основанию. ПВ широкая, дорзальная стенка значительно выше вентральной, неровная, но без четкого щитка, обычно с двумя слабо выраженными складками. Пелликула не исчерчена. Ножка высокая, ее длина пре-
Рис. 152. Isochona migratoria с Amphithoe japonica.
восходит толщину; ампула и эндостил круп-
ные. Гипоколлюм не выражен. Сумка вмещает несколько более половины тела томита.
Размеры. Длина особи 63—81 мк, до вентрального края ПВ 71—74 мк, до вершины сумки 53—59 мк, до дна 23—31 мк; L : D=2.5 : 1; размеры тела 48—52 X X23—30 мк, шейки 4—6X10—12 мк, ПВ (от сумки до вершины) 23—28x24—30 мк; длина эндостила и ампулы 15—16 мк; диам. диска 6—7 мк; размеры ножки 6—7x4— J5 мк, Ма 16—21x9—10 мк, сумки 22—31X12—14 мк, томита 36—39X13—14 мк.
Тело данного вида шире, чем у I. antennaria, более ромбическое, иногда почти треугольное; нет рядов папилл; ножка выше, чем у других изохон.
Локус и хозяин — средняя и дистальная частищетипокплеопод Amphithoe japonic а (типовой хозяин); образует массовые поселеппя. Незначительный процент особей мигрирует на щетинки переопод. Дополнительные хозяева: A. rubricata, Amphithoe sp.
Распространение. Японское море, о. Путятин, глуб. 1.5 м (типовая раса, на A. japonica)' Берингово море, о. Беринга (на A. rubricata); Сахалин, лагуна Буссе, устричник (на Amphithoe sp.).
2. Isochona antennaria Jankowski sp. nov. (рис. 9, AT; 11, Д', 153, Б),
Крупнейший вид рода; тело почти цилиндрическое, равномерной толщины, сужается в нижней трети. ПВ крупная, широкая; дорзальная стенка без четкого щитка, с 1—2 очень слабо выраженными складками. Пелликула с рядами папилл. Ножка высокая, складчатая, длина ее превышает ширину; эндостил удлиненный, ампула небольшая, овальная.
Размеры. Длина особи 76—87 мк, до вентрального края ПВ 69—77 мк, до-вершины сумки 52—55 мк, до дна 25—28 мк; L : D=3.3 : 1; высота дорзального края ПВ 6—7 мк; размеры тела 57—63x23—26 (у вершины сумки) —9—10 (у эндостила) мк, шейки 3—4x9—11 мк, ПВ (от сумки до вершины) 31—39x24—28 мк; длина ампулы 4—4.5 мк, эндостила 6—7 мк; диам. диска 6 мк; размеры ножки 7X4.5 мк, Ма 17— 21X8—12 мк, сумки 29—36X12—14 мк, томита около 35—37X13—16 мк.
Вид близок к I. migratoria с амфитоид, но отличается по форме тела (цилиндрическое, не треугольное), имеет четкие продольные ряды папилл.
Локус и хозяин — немногочисленные особи отмечены на шипах III сегмента ан-теннулы Nebalia V; вид очень редкий.
Распространение. О. Итуруп, зал. Одесский, литораль.
3. Isochona rotundata Jankowski, 1973 (рис. 10, К; 153, А).
Некрупные формы; тело узкое, цилиндрическое, плавно сужается к нижнему концу. Шейка широкая. ПВ относительно широкая, низкая, с невысокой дорзальной стенкой, несущей одну складку; щитка нет. Пелликула ровная, без папилл. Ножка маленькая, низкая, длина ее меньше толщины; эндостил мелкий; ампула небольшая, овальная.
Размеры. Шикотанская раса: длина особи 60—65 мк, до вентрального края ПВ 60—62 мк, до верхнего края сумки 46—50 мк, до дна 25 мк; L : D=3 : 1; высота дорзального края ПВ 2—4 мк; размеры тела 42—47 X 22—24 (у вершины сумки)—17 мк (у дна), шейки 4—5x8—10 мк, ПВ (от сумки до вершины) 17—20X16—19 мк; длина ампулы 3—4 мк, эндостила 3 мк; размеры Ма 11—12X7—7.5 мк, Ми 1.5 мк, сумки 21X11—12 мк, томита 33—35X10 мк. Раса с Итурупа: размеры особи до 54X18 мк; высота ПВ 13—15 мк; ширина шейки 7.5 мк; длина эндостила и ампулы 5 мк; размеры Ма около 12X7 мк, томита 23X6 мк.
Вид принадлежит к группе изохон с низкой ножкой; в отличие от I. peltiiera нет щитка ПВ; тело длиннее и крупнее, чем у мелкой I. crassa.
Локус и хозяин — щетинки протоподита торакопод Nebalia II (типовая раса); дополнительный хозяин — Nebalia V. Вид обычный, придаток несет 5—10, редко до 20— 25 особей хонотрих.
Распространение. О. Шикотан, литораль бухты Анама (на Nebalia II);. о. Итуруп, зал. Одесский, литораль (на Nebalia V); близкий вид найден на Сахалине..
4. Isochona peltifera Jankowski sp. nov. (рис. 9, И; 153, В—Е; 154).
Относительно крупные формы; тело узкое, цилиндрическое, равномерной толщины, резко сужается в нижней части. ПВ высокая и узкая, дорзальная стенка поднята над вентральной в виде щитка, несет слабо выраженную складку, не доходящую до вершины щитка. Ресничная зона В рудиментарна. Пелликула не исчерчена. Ножка неширокая, низкая, высота ее намного меньше толщины; эндостил крупный,
Размеры. Длина особи 76—94 мк, до края гипохона 66—86 мк, до вершины сумки 46—50 мк, до дна 16—26 мк; L : D=3.5 : 1; высота щитка 6—8 мк; размеры тела-51—72x23—24 мк, шейки 3—4x6—7 мк, ПВ 29—31X15—16 мк; длина ампулы 4— 5 мк, эндостила 3—4.5 мк; диам. диска 4—5.5 мк; размеры Ма 12—17X7—8 мк, сумки-21—25X10—11 мк, томита 32—36X10 мк.
Вид принадлежит к изохонам с короткой ножкой; тело крупнее, чем у I. crassa; в отличие от I. rotundata несет щиток ПВ. -
Локус и хозяин — средняя и нижняя части щетинок основания максиллулы Nebalia III; особи обычно немногочисленны.
Распространение. Камчатка, Авачинская губа, глуб. 19м.
5. Isochona crassa Jankowski sp. nov. (рис. 9, Г; 10, E; 150, Д; 155).
Наиболее мелкий вид рода. Тело широкое, почти овальное, плавно закругляется снизу. ПВ небольшая, низкая, гипохон ненамного ниже эпихона; складок и щитка нет.
Пелликула не исчерчена (раса с Nebalia IV) или с едва заметными складками (с Neba-lia I). Ножка узкая и низкая; эндостил и ампула мелкие.
Размер ы. Длина особи типовой расы 42—43 мк, до гппохона 37—42 мк, до вершины сумки 25—26 мк, до дна 11—12 мк; L : D=2.5 : 1; высота эпихона 2—2.5 мк;
Рис. 153. А — Isochona rotundata с Nebalia II; Б — I. antennaria с Nebalia V; В—Е — I. peltifera с Nebalia III.
размеры тела 28—29x15—18.5 мк, шейки 2—3.5x6—8 мк, ПВ 15X14—16 мк; длина ампулы 2—3 мк, эндостила 2 мк; диам. диска 3 мк; высота ножки 1.5 мк; размеры Ма 9—15X5—6 мк, сумки 14—15x11 мк, томита около 23x10 мк.
От остальных видов рода I. crassa отличается очень мелкими размерами, отсутствием щитка, овальной формой тела, светлой, беловатой цитоплазмой.
Рис. 154. Tsocho.na peltlfera c Nebalia III.
Рис. 155. Isochona crassa-c Nebalia IV.
Локус и хозяева — поверхность протоподита торакопод Nebalia IV (типовая раса) и Nebalia I; часть особей поселяется и на прилегающем участке тела. Придаток несет до 10 особей.
Распространение. Японское море, о. Путятин, глуб. 1 м (на Nebalia. IV); Баренцево море, о. Кильдин, глуб. 10.5 — 21 м (на Nebalia I).
6. Isochona pleonicola Jankowski sp. nov. (рис. 10, И\ 193, А, Б).
Очень крупные формы с широким клиновидным телом, плавно сужающимся книзу; нижний конец несколько сплющен. Шейка узкая. ПВ крупная, широкая, дорзальный край с неглубокими складками, неровный, обычно с двумя невысокими лепестками. Зона В крупная, не редуцирована. Пелликула без складок. Ножка низкая и широкая, несколько смещена на дорзальную сторону; ампула удлиненная. Хорошо развит ги-поколлюм.
Размеры. Длина особи 75—90 мк, до вентрального края ПВ1 69—85 мк, до вершины сумки 56—68 мк, до дна 42—48 мк; L : D=3 : 1; высота дорзального края ПВ 5—6 мк; размеры тела 58—69x24—31 мк, шейки 2x8—9 мк, ПВ (от сумки до вершины) -23—25Х 33—35 мк; длина ампулы 10—11 мк, эндостила 3—4.5 мк; диам. диска 5—6 мк; размеры Ма около 20Х 8 мк, сумки 21X13 мк, томита 34—40Х12—15 мк.
Отличия от остальных изохон: субтерминальное положение ножки, удлинение-ампулы, волнистый контур эпихона, крупные размеры тела.
Локус и хозяин — нижняя часть массивных дистальных, реже утолщенных боковых щетинок плеопод Nebalia II и расы с Сахалина. Вид обычный, но не массовый, порядка 10—20 особей на придатке. Поверхность щетинок неровная, в сплошных бугорках; это не «идеальный» субстрат для оседания.
Распространение. О. Шикотан, кут бухты Анама, литораль (типовая раса); южный Сахалин, лагуна Буссе.
2. Род TRICHOCHONA Mohr, 1948
Mohr, 1948 : 2; 1966 : 538; G u i 1 с h е г, 1950 : 469, 478; 1951 : 42, 49, 57, 131; Hall, 1953 :411, 412; F a ur e-F r e m i e t a. oth., 1956 : 188; Corliss, 1961 : 136; Mohr a. oth., 1963a : 227; 1963b : 121; M a t s u d о a. M о h r, 1964 : 127; 1965 : 524; 1968 : 281; M a t s u d o, 1966 : 364; N e a v e, 1966 : 299.
Крупные вытянутые формы с широким телом; шейка низкая, относительно широкая, хорошо отграничена от тела, не сплющена. Гипохон ровный, эпихон ровный или со щитком; боковых карманов нет; дорзальная складка одна или отсутствует. Пелликула не исчерчена. Имеется гипоколлюм. Ресничная зона А широкая, зона В недоразвита. Ампула крупная; эндостил массивный, удлиненный. Прикрепление стебельком разной длины, с четким каналом у Т. surgens. Ма овальный; сумка обычного типа, вмещает около половины тела томита.
Род очень близок к Isochona,- но имеет длинный стебелек; объединять эти роды не следует.
С 2 видами — Т. surgens и Т. lecythoides (типовой вид), обитающими на щетинках плеопод, реже переопод Amphithoe, предположительно и Photis-, встречаются только-в Пацифике (Командорские о-ва, Калифорния, Чили), видимо, доминируют в восточной Пацифике; в наших дальневосточных морях распространен род Isochona.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА TRICHOCHONA
1 (2). Длина стебелька до 1/5 длины тела; эпихон со щитком . . . . . 1. Т. surgens.
2 (1). Длина стебелька около г/2 длины тела; эпихон ровный . . . 2. Т. lecythoides.
1. Trichochona surgens Jankowski sp. nov. (рис. 156, А, Б).
Тело широкое, почти ромбическое, резко сужающееся в нижней трети. ПВ с одной дорзальной складкой; эпихон с крупным щитком. Стебелек небольшой (порядка 1/5_ длины особи), гофрирован, с каналом.
Размеры. Длина особи 80—86 мк, до края гипохона 73—80 мк, до вершины сумки 53—57 мк, до дна 30—40 мк; L : D=2.6 : 1; высота эпихона 6—8 мк; размеры тела 58—63 Х28—29 мк, шейки 6—7X11—12 мк, ПВ (от сумки до вершины) 27—ЗОХ Х19—25 мк; длина ампулы 4 мк, эндостила 8 мк; диам. диска 5—бмк; размеры стебелька . 14—15x4 мк, Ма 17—21x8—10 мк, сумки 22—26x15—16 мк, томита до 40—46Х Х14 мк.
Стебелек у Т. surgens короче, чем у Т. lecythoides, эпихон несет щиток.
Локус и хозяин — средняя и верхняя части щетинок плеопод Amphithoe rubri-catoides; вид массовый, образует густые поселения.
Распространение. Командорские о-ва, о. Беринга, литораль.
2. Trichochona Iccythoides Mohr, 1948 (рис. 1, Ш; 3, Б; lr>6, В—Hi').
Mohr, 1948 : 3, pl. I, fig. A—C; Guilcher, 1950 : 469 (lecithoides, par lapsus), 478 [lecithoides, par lapsus); 1951 : 49 (lecithoides, par lapsus); 131; Hall, 1953 : 411, 412, 413, fig. 7.49, G; M о h r a. oth., 1963a : 227; Matsudo a. Mo h r, 1964 : 127; 1965 : 524; 1968 : 281; M at sudo, 1966 : 364.
Тело относительно неширокое, почти цилиндрическое, постепенно сужающееся .в нижней половине. Стенки ПВ ровные, без щитков, возможно со слабо выраженными
Рис. 156. А, Б — Trichochona surgens с Amphithoe rubricatoides:, В—Ж — Т. lecythoides с Amphithoe sp. (по: Mohr, 1948); 3 — циамихона с Cyamus ovalis.
складками. Пелликула «в мелких точках» (Мор). Стебелек длинный, до 51 мк при длине особи 86 мк; вероятно, не гофрирован; канал Мором не изображен. Ампула и эндостил крупные.
Размеры (по Мору). Длина особи 35—86 мк, со стебельком 81—164 мк; L : D= =4.4:1; ширина тела 3—28 мк; высота ПВ 8—21.5 мк; длина стебелька 16—51 мк, Ма. 9—22 мк, эндостила и ампулы 7—21 мк; толщина ножки 2—3.5 мк; диаметр опорного диска 5 мк, базального 10—14 мк.
Отличия от Т. surgens: отсутствие дорзального щитка, резкое удлинение стебелька.
Локус и хозяин — щетинки плеопод Amphithoe sp. (Mohr, 1948); трихохоны найдены позднее на A. humeralis, A. valida и предположительно на A. rubricata; хозяин
T. lecythoides в недавнее время определен как A. lacertosa (Mohr a. Matsudo, 1970). Вероятно, это один из наиболее массовых видов хонотрих: ветвь плеоподы несет около 166 особей, рачок в целом — до 2000. Часть особей переходит на щетинки дистальных отделов нереопод, близких к плеоподам.
Распространение. США, Калифорния, Редондо-Бич в округе Лос-Анджелес.
Другие изохои иды
В новом материале по небалиидам нами найдены изохоны с поворотом ПВ на 90° вправо; они могут составить особый подрод, но, вероятно, не род. С паразитов китообразных — циамид, копепод — описано 3 рода эндогеммин (Mohr, 1959b; Mohr a. oth., 1963b; Mohr a. Matsudo, 1970). На циамидах обычны цетохоны — стебельчатые формы типа Trichochona с простой ПВ и очень глубокой сумкой; длина стебелька различается у разных видов цетохон. Мы изучали формы с Cyamus ovalis (рис. .156, 3); это достоверный род с особым строением ампулы, стебелька, с утолщением стенок ПВ. Парацетохоны и фаллайнохоны с копеподы Balaenophilus резко отличаются, по Лёнгу, от цетохон, но морфология их пока не описана, локус не указан. Распространение космополитное у циамид и их комменсалов, ограничено ареалами китов-полосатиков (род Balaenoptera) у форм с копепод. В состав предлагаемого подсемейства стило-хонин (где экзогеммины перемешаны с эндогемминами) Мор и Мацудо включают 2 новых рода с изопод; поскольку многих эндогеммин (например, кентрохон) считали эк-зогемминами, не исключено, что формы с изопод — сумчатые хонотрихи. На Photis sp. типа Ph. calif arnica обычна мелкая веретеновидная форма с коротким стебельком и простой ПВ; других сведений нет. Формы с изопод и Photis найдены в США (Калифорния, Лагуна Бич, о. Каталина). На плеоподах идотеид (Р entidothea resecata) и сфе-ромид (Gnorimosphaeroma sp., Exosphaeroma типа Е. gigas) найдены виды другого рода, они отмечены соответственно в США (Вашингтон, о. Сан-Хуан; южная Калифорния) и в Чили (Магелланов пролив, близ Пунта-Аренас).
II. Семейство ACTI NICHO NIDAE Jankowski fam. nov.
Мелкие, относительно некрупные, реже крупные формы с мешковидным или вытянутым, не цилиндрическим телом, обычно сплющенным (исключая Crassichona).Шейка удлинена у мелких форм и редуцирована у крупных, сумка и ПВ сближены; у всех родов очень хорошо выражен гипоколлюм. Пелликула ровная, со складками или рядами папилл. ПВ простая, коническая, не сплющена, без вентральных складок; эпихон с одной складкой или без нее. Боковых карманов ПВ нет. Край эпихона почти ровный у мелких форм, несет щиток или шипы у крупных. РПА обычного, не инверсного типа, с небольшой зоной В. ПВ повернута на 90° вправо, зона В обращена к сумке. Защитный аппарат: соматический шип у Rhizochona, маргинальные шипы у Actinlchona и Kentrochonopsis, утолщение стенок тела и ПВ у Crassichona. Стебельчатых форм нет; прикрепление ножкой, терминальной или слегка смещенной на дорзальную сторону тела. Четкой подошвы обычно нет, но участок тела с ножкой сплющен, прилегает к субстрату. Ма овальный. Сумка разной величины, вмещает до половины тела томита у мелких форм и всего томита у крупных. Диминутивные стробилы с 1—3, у Kentrochonopsis с 1—7 томитами.
Семейство предложено для группы близкородственных родов эндогеммин, обитающих в основном в одном и том же локусе — на основании щетинок протоподита торако-под. При внешнем разнообразии актинихонид их объединяют тенденция к разрастанию тела (иоявление киля, «якорных отростков», и т. д.) и поворот ПВ на 90° вправо; эту группу не следует поэтому объединять с изохонидами. В отличие от Inversochonidae РПА у актинихонид обычного, не инверсного типа; в отличие от Echinichonidae и Stylochonidae ПВ имеет простой конический контур, не сплющена.
С 6 родами: Cristichona, Carinichona, Rhizochona, Actinlchona (типовой род), Crassichona и Kentrochonopsis. Три первых рода образуют компактную группу каринихо-нин, с удлинением шейки и передней части тела. У двух последних родов, образующих группу актинихонин, шейка редуцирована, сумка очень глубокая. Эти обе группы можно считать подсемействами. Хозяева — виды Nebalia. Примитивные Cristichona расселены широко по хозяину, остальные роды заселяют щетинки протоподита; щетинки тесно сближены, хонотрихи втиснуты между ними, отсюда столь необычный облик тела — с разрастанием участков и поворотом ПВ. Распространение Cristichona очень широкое, возможно космополитное, остальные роды найдены в Средиземном море, в Мексиканском заливе, обычны в Пацифике, от Владивостока до Камчатки.
19 Заказ Ка 213
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА А С TINICHONIDA Е
1 (6). Мелкие формы с вытянутой шейкой.
2 (3). Имеются шипы и якорные отростки тела . ... 3. Род Rhizochona (стр. 292).
3 (2). Шипов и якорных отростков тела нет.
4 (5). Тело вытянутое, кальмаровидное...........1. Род Cristichona (стр. 290).
5 (4). Тело мешковидное или почти сферическое ... 2. Род Carinichona (стр. 291).
6 (1). Крупные формы с редукцией шейки.
7 (8). Стенки тела и ПВ утолщены................6. Род Crassichona (стр. 301).
8 (7). Стенки тела и ПВ не утолщены.
9 (10). ПВ не широкая, коническая, с мелкими шипами или без них............
............................................4. Род Actinichona (стр. 292).
10 (9). ПВ широкая, слабо сплющена, с длинными шипами.......................
.......................................5. Род Kentrochonopsis (стр. 299).
1. Род CRISTICHONA Jankowski, 1973
Некрупные формы с удлиненным телом, оттянутым в стороны, как у кальмаров; удлинена и шейка, и верхняя часть тела. У отдельных особей удлиненный участок составляет 2/3 длины тела. В отличие от большинства родов подотряда края сумки не сближены с ПВ, отодвинуты далеко вниз. Пелликула ровная или с рядами папилл. Локальные утолщения кутикулы — края нижней трети тела и пластинка, отделяющая ампулу от эндостила. ПВ коническая, неширокая и в целом небольшая; эпихон без щитка, с одной, очень редко с двумя складками. Хорошо развит гипоколлюм. Поворот ПВ не выражен так четко) как у всех остальных родов. Шипов нет, но края ПВ часто волнистые, несут зубцы; стенки ПВ нередко продольно исчерчены. Ампула округлая, относительно некрупная; ножка узкая, складчатая. Подошвы нет. Ма грушевидный или каплеобразный, заходит высоко в вытянутую верхнюю часть тела. Сумка неглубокая; при диминуции образуются 1—2 томита.
В отличие от Carinichona тело кристихон вытянутое, не мешковидное, без четкого киля; нет шипов и якорных отростков, как у Rhizochona.
С 2 видами — С. pacifica (типовой вид) и С. tesselata, обитающими на различных придатках (антеннах, торакоподах, на основании, но не на щупике максиллулы) рас Nebalia. Нередко заселяются незанятые локусы, например щетинки базиподита, если на них нет каринихон, или основание максиллулы, если нет изохон. В этом отношении кристихоны отличаются от большинства хонотрих. Обычные формы, отмечены в Баренцевом и в дальневосточных морях.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА CRISTICHONA
1 (2). Нижняя половина тела оттянута далеко в стороны, обычно с исчерченными пластинками кутикулы......................................2. С. pacifica.
2 (1). Нижняя половина тела умеренно широкая, без пластинок экзоскелета . . .
.. .................................................1. С. tesselata.
1. Cristichona tesselata Jankowski sp. nov. (рис. 9, В, Г', 18, А, В; 149, Г, Д, И; 150, Е—И).
Шейка очень длинная, нечетко отграничена от удлиненной верхней части тела. В нижней половине тело умеренно широкое, не растянуто в стороны так резко, как у С. pacifica-, не наблюдались пластинки экзоскелета. Пелликула с четкими рядами папилл.
Размеры. Длина особи 49—56 мк, до края гипохона 46—49 мк, до вершины сумки 27—29 мк, до дна 14—21 мк; L : D=3 : 1; высота эпихона 3—5 мк; размеры тела (до вершины Ма) 32—36 Х15—16 мк, шейки (от рта до Ма) 11—13X7 мк, ПВ (от сумки до вершины) 23—28x13—15 мк; длина ампулы и эндостила 4—4.5 мк; диам. диска 5 мк; размеры ножки 3x4.5 мк, Ма 11—15X5—5.5 мк, сумки 10—12x8—9.5 мк, томита 23—25x8—9 мк.
Вид проще, чем С. pacifica, с менее широким телом, без пластинок кутикулы. Это переходная форма между изохонами и С. pacifica.
Локус и хозяин — щетинки антенн и торакопод, реже свободная поверхность то-ракопод, особенно бази-и эндоподита Nebalia I. Особо характерный локус — щетинки IV сегмента антенн.
Распространение. Баренцево море, о. Кильдин, глуб. 10.5—21 м. Сходные формы, но с высоким щитовидным эпихоном, отмечены Лёнгом на экзоподите торакопод N. longicornis в США (о. Тортугас).
2. Crislicliona pacifica Jankowski, 1973 (рис. 3, Д; 10, E, Ж, R; 11, Б— Г; 20, B; 30, Г—N, 32, Г; 43, Г; 49, Я; 151, Д- 157).
Шейка длинная, широкая. В пижпей половине тело сильно растянуто в стороны, кальмаровидное. Кутикула нижней трети тела обычно резко утолщена, поперечно исчерчена, превращена в экзоскелетные пластинки. Пелликула часто исчерчена, с папиллами.
Размеры. Длина особи 48—62 мк, до края гипохона 46—61 мк, до вершины сумки 26—37 мк, до дна 12—15 мк; L : D=2.4 : 1; размеры тела 33—46x21—29 мк,.
Рис. 157. Cristichona pacifica с Nebalia IV.
шейки (от Ма до рта) 6—13x7.5—9.5 мк, ПВ (от сумки до вершины) 26—29x18— 25 мк; высота эпихона 1 мк; длина ампулы 2.5—4 мк, эндостила 3.5 мк; диам. диска 3.5—4 мк; размеры ножки до 3x5 мк, Ма 15—18x6—9 мк, сумки 16—23x6—11 мк, томита 20—24x7—10 мк, боковых пластинок 12—18x1—4 мк, септы эндостила 6— 12X1—2 мк.
В отличие от С. tesselata тело очень широкое, с развитым экзоскелетом.
Локус и хозяева — различные придатки тела Nebalia IV (типовой хозяин) и Nebalia spp.; заселены щетинки антенн, основания щетинок разных сегментов торакопод, реже их ровная поверхность, щетинки основания щупика максиллулы. Никогда не встречаются на антеннулах, на щупике максиллулы и на плеоподах.
Распространение. Японское море, о. Путятин, глуб. 1 м (типовая раса); о. Шикотан, бухта Анама, литораль; южный Сахалин, лагуна Вуссе, отмели (на Nebalia IV, II и Nebalia sp.).
2. Род CARINICHONA Jankowski, 1973
Мелкие формы с мешковидным телом, вытянутым лишь в верхней части, где оно переходит в шейку. Шейка четкая, удлиненная. Пелликула тела, особенно в зоне киля, обычно с поперечными складками, но без рядов папилл. Пластинок экзоскелета нет. ПВ простая, коническая, не сплющена, с одной, очень редко с двумя дорзальными складками. Эпихон лишь незначительно выше гипохона, без щитка. Гипоколлюм хорошо развит. РПА обычного типа, но ПВ повернута направо, зона В обращена к правому плечу (к сумке). Шипов нет; ПВ укреплена продольными складками, края воронки поэтому часто волнистые, с зубцами. Ампула и эндостил очень мелкие, не разделены скелетной пластинкой. Ножка почти терминальна, слегка смещена на дорзальную сторону; четкой подошвы нет. Ма каплевидный или грушевидный. Сумка мелкая, часто вмещает менее половины тела томита. Край сумки оттянут далеко в сторону и утолщен,
образует характерный ребристый киль, огибающий щетинку (рис. 160,5). Диминутивные стробилы с двумя томитами.
В отличие от Rhizochona пет шипов п якорных отростков; в отличие от близкого рода Cristichona тело не удлинено, имеется киль. При находке серии промежуточных форм Carinichona и Cristichona могут быть объединены в один род.
С одним видом С. globulus (типовой вид). Локус каринихон значительно ^же, чем у кристихон: только один из сегментов торакопод Nebalia. Пока найдены только в Японском море близ Владивостока.
1. Carinichona globulus Jankowski, 1973 (рис. 10, Е; 18, Л', 19, Ж, 3; 20, Г; 26, Г; 43, К; 158-160).
С диагнозом рода.
Размеры. Длина особи 38—56 мк, до вершины сумки 20—23 мк, до дна 5— 8 мк; L : D=1.5—2 : 1; размеры тела 22—34x17—19 мк, шейки (от вершины Ма до рта) 9x6—7.5 мк, ПВ (от сумки до вершины) 18—27x16—19 мк; длина ампулы 2.5— 3 мк, эндостила 3—4 мк; диам. диска 4—5 мк; размеры Ма 14—20x5—9 мк, сумки 12—14x9—10 мк, томита 20—22x8—10 мк; длина киля 9—14 мк, толщина около 2.5 мк, ширина 5—8 мк.
Локус и хозяин — основание щетинок протоподита, базиподита и проксимальной части эндоподита торакопод Nebalia IV; вид массовый, до 150 особей на придатке. Отдельных особей можно найти на щетинках экзоподита, оксиподита и в передней части эндоподита.
Распространение. Японское море, о. Путятин, литораль, глуб. 1 м.
3. Род RHIZOCHONA Jankowski gen. nov.
Мелкие формы с ромбическим или почти квадратным телом и вытянутой шейкой. Пелликула без складок и ребер; пластинок эйзоскелета нет. ПВ коническая, заметно повернута к правому плечу; эпихон с четкой складкой и небольшим треугольным щитком, незначительно выше гипохона. Гипоколлюм прекрасно развит. Защитный аппарат — массивный шип у правого плеча сумки, иногда мелкий шипик около него; складок ПВ и маргинальных зубчиков нет. Ножка очень мелкая, субтерминальная; подошвы обычного типа нет. Характерна тенденция к причудливому разрастанию тела: утолщены и оттянуты вбок края сумки, имеется длинный низкий киль с левой стороны, обычно массивный, крючковидный; только ризохона среди хонотрих имеет 3—4 изогнутых якорных отростка. Ма овальный, реже грушевидный. Сумка довольно глубокая, иногда вмещает до 3/4 тела томита. Стробилы с 1—2 томитами.
В отличие от Cristichona 'тело ризохон мелкое, квадратное, с килем и шипами; от Carinichona отличается наличием шипа, двух килей, якорных отростков.
С 1 (типовым) видом Rh. armata, обитающим на том же сегменте торакопод (Nebalia V), что и Carinichona, на Итурупе.
1. Rhizochona armata Jankowski sp. nov. (рис. 3, Tff; 161).
С признаками рода.
Размеры. Длина особи 42—52 мк, до края гипохона 41—50 мк, до вершины сумки 25—27 мк, до дна 3—12 мк; L : D = 2 : 1; высота эпихона 1^-2 мк; размеры тела 24—26x25—28 мк, шейки 7—8 Хб—8.5 мк, ПВ (от сумки до вершины) 18—23х Х16—22.5 мк; длина ампулы 2—2.5 мк, эндостила 2—3 мк; диам. диска 3—4 мк; размеры Ма 9—15x8—10 мк, сумки 13—14X11—12 мк, томита 23—26x10—11 мк, левостороннего киля 9—22.5x3.5—11 мк, правостороннего 3—9.5x6—11 мк; длина гипокол-лярного шипа 9—14 мк.
Локус и хозяин — основание щетинок базиподита, частично прото- и эндоподита торакопод Nebalia V; вид массовый.
Распространение. О. Итуруп, зал. Одесский, литораль.
4. Род ACTINICHONA Jankowski gen, nov.
Крупные формы с удлиненным, сплющенным, причудливо разросшимся телом, узким со стороны сумки, очень широким, почти треугольным с вентральной. Шейка резко укорочена, края сумки сближены с ПВ. Если ориентировать особь так, как других эндогеммин (сумка правее ПВ), мы увидим ПВ не с вентральной стороны, а сбоку; ПВ повернута на 90° вправо. Томиты оседают у основания тесно сближенных фильтрационных щетинок, втискиваясь между щетинками; поэтому трофонт может расти только вбок. Для рассматривания с вентральной или дорзальной сторон тела нужно отделять щетинки с комменсалами. Особи на торакоподе видны обычно со стороны сумки; противоположный край тела обращен внутрь, ко II ряду щетинок. Из-за! поворота ПВ вентральной следует называть сторону, противолежащую сумке; эта сто-
Рис. 158. Carinichona globulus c Nebalia IV.
Рис. 159. Carinichona globulus c Nebalia IV.
Рис. 160. Carinichona globulus c Nebalia IV.
рона узкая, противоположная — обычно разросшаяся, в нижней половине образует киль, огибающий щетинку и способствующий устойчивости тела. Между отверстием сумки и шейкой у A. gaucho видпы два выроста; мы находим их также у Rhizochona и Crassichona. Со стороны сумки тело выглядит кальмарообразпым. ПВ простая, коническая, не сплющена, с округлым контуром; дорзальная стенка без складок или с одной складкой, без следа боковых карманов. Пелликула ровная, без складок и па-
Рис. 161. Rhizochona armata с Nebalia V.
пилл; экзоскелетных пластинок нет. Очень хорошо развит гипоколлюм. Ресничная зона В довольно крупная, не редуцирована. Защитный аппарат: щиток и базальный шип у A. cuspidata, базальный и маргинальные шипы у A. gaucho. Ножка терминальная, с относительно небольшими эндостилом и ампулой; подошвы нет. Ма крупный, удлиненно-овальный; сумка вмещает около 3/4 тела томита; при диминутивном почковании образуется одновременно до 3 томитов.
Род принадлежит к актинихонидам с редукцией шейки; в отличие от Crassichona тело и ПВ не утолщены; нет группы массивных маргинальных (базальных?) шипов, имеющихся у Kentrochonopsis', ПВ не столь широка, коническая.
С 2 видами — A. gaucho (типовой) и A. cuspidata, обитающими на одном из сегментов торакопод Nebalia в дальневосточных Морях (острова Путятин, Сахалин, Шикотан, Итуруп).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА ACTINICHONA
1 (2). Развиты маргинальные шипы...........................’ 2. A. gaucho.
2 (1). Маргинальные шипы отсутствуют......................1. A. cuspidata.
1. Actinichona cuspidata Jankowski sp. nov. (рис. Q,E; 162, Д—Ж).
Форма тела типичная для рода, размеры несколько меньше, чем у A. gaucho. ПВ с одной, очень редко с двумя складками эпихона; края воронки ровные, без шипов, с четким и высоким треугольным щитком, за которым расположен широкий и высокий, всегда тупой (что редко у хонотрих) базальный шип. Поскольку вид найден на рачках, несущих комплекс шипоносных эндогеммин (Nebalia N), отсутствие маргинальных шипов у A. cuspidata следует считать первичным. Края сумки не отделены щитковидными выростами от шейки.
Размер ы. Длина особи 60—66 мк, до края гипохона 56—61 мк, до вершины сумки 40—48 мк, до дпа 23—26 мк; L : D = 2 : 1; высота щитка 4—6 мк; размеры тела 46—51X32—34 мк; ширила тела со стороны сумки 13—18 мк; размеры шейки 2—9Х
Рис. 162, А—Г — Actinichona gaucho с Nebalia IV; Д—Ж — A. cuspidata с Nebalia V.
Х7—9 мк, ПВ (от сумки до вершины) 12—17x18—21 мк; длина базального шипа 13.5 мк, ампулы 3—4.5 мк, эндостила 3 мк; диам. диска 4.5—5 мк; размеры ножки 4.5x3— 4.5 мк, Ма 13—16x7—10 мк, сумки 20—22x10—12 мк, томита 28—31x9—10 мк.
Отличия от A. gaucho: тсуксгвае маргинальных шипов, складок между шейкой и сумкой; базальный шип массивный, но не заострен.
Локус и хозяин — щетинки протоподита, частично базиподита торакопод Nе-balia V; особи прикрепляются только к нижней части щетинок непосредственно у ос-
Рис. 163. А — В — Actinichona gaucho с Nebalia IV; Г—Ж — Kentrochonop-sis multipara с Nebalia geoffroyi (no: Doflein, 1897b).
Рис. 164.' Actinichona gaucho c Nebalia IV.
новация, щетинка несет лишь одну особь. Заселен I фильтрационный ряд. Вид массовый, образует плотные поселения; встречается совместно с Isochona sp.
Распространение. О. Итуруп, зал. Одесский, литораль.
2. Actinichona gaucho Jankowski sp. nov. (рис. 4, Л'—M; 10, Е; 20, М; 28, Б; 162, А--Г: 163, А—В; 164; 165).
Форма тела как у A. cuspidata, размеры несколько крупнее. ПВ всегда с одной складкой, без карманов; дорзальный щиток ниже и шире, чем у A. cuspidata. Базаль-
Рис. 165. Actinichona gaucho с Nebalia IV.
ный шип относительно неширокий, всегда заострен. Имеются маргинальные шипы, число и форма которых крайне изменчивы: широкие и игольчатые, симметричные и неправильные, однородные и неоднородные (рис. 164). Нередко хорошо развиты шипы по одну из сторон ПВ; шипы эпихона обычно крупнее шипов гипохона. Края сумки высоко подняты, разрастаются в участке между сумкой и ПВ, образуя два легко видимых выроста (как у Crassichoпа).
Размеры. Длина особи 62—78 мк, до края гипохона 58—75 мк, до вершины сумки 47—62 мк, до дна 15—25 мк; L : D = 2—2.5 : 1; ширина тела у вершины сумки при виде сбоку 28—32 мк, в середине тела до 36 мк, у дна сумки 26—29 мк, с дорзальной узкой стороны 15—16 мк; длина вентрального плеча 11 —13 мк, дорзального 14— 16 мк; размеры ПВ (от сумки до щитка) 12—15X16—23 мк; высота щитка ПВ 2.5— 4 мк, щитков сумки 3—6 мк; расстояние между щитками 10—12 мк; размеры шейки до 2x7.5—9 мк; длина базального шипа 12—17 мк, маргинальных шипов 1—5 мк, ампулы 4—5.5 мк, эндостила 4—5 мк; диам. диска 4.5—5.5 мк; размеры ножки ЗХ Х4 мк, Ма 16—18x8.5—10.5мк, сумки 19—23X11.5—12 мк, томита 27—32x10—11.5 мк.
Отличия от A. cuspidata: развитие маргинальных шипов, заострение базального шипа, развитие щитков сумки, более крупные размеры тела.
Локус и хозяин — основание щетинок I фильтрационного ряда протоподита, частично базиподита торакопод Nebalia IV (типовой хозяин), Nebalia II и сахалинской расы Nebalia. На первом и третьем хозяине актинихоны образуют плотные поселения;
находки па шикотанских рачках единичны. На типовом хозяине правее зоны, занятой актинихонами, располагаются Carinichona, у основания протоподита — Isochona.
Распространение. Японское море, о. Путятин, литораль, глуб. 1 м (типовая раса, па Nebalia IV); южный Сахалин, лагуна Буссе, иловые отмели (на Nebalia sp.); о. Шикотан, бухта Апама, литораль (па Nebalia 11).
5. Род KENTROCHONOPSIS Doflein, 1897
D о f 1 е i n, 1897b : 642; W at er house, 1902 : 187; Calkins, 1910 : 55; Hamburger u. Buddenbrock, 1911 : 112 (Spirochona, part.); Collin, 1912 : 321; Lep^i, 1926 : 88 (JSpirochona, part.? род не назван, все хонотрихи отнесены к Spirochona)-, 1965 : 833 (Kentrochona, part.); Schulze a. oth., 1929 : 1725; Kahl, 1933 : 140, 141 (Kentrochona, part.); 1935 : 803 (Kentrochona, part.); N e a v e, 1939 : 824; Kudo, 1946 : 682 (Kentrochona, part.); Raabe, 1947 : 338; Mohr, 1948 : 6 («Kentrochonopsis»)-, 1966 : 536, 541; Guilcher, 1950 : 466, 469; 1951 : 41, 49; Doflein u. Reichenow, 1953 : 1154; Corliss, 1961 : 136; M a t s u d o, 1966 : 361, 367 (Kentrochona, part.); Matsudo a. Mohr, 1968 : 283 (вероятный синоним Kentrochona).
Таксономическая история рода. Дофлейном изучен небольшой фиксированный материал, но описание его достаточно хорошее. Тем не менее род почти никем не признается. Часто он вообще не приводится в списках хонотрих (Валленгрен, Гамбургер, Лепши, Холл и др.), где упоминается лишь Kentrochona nebaliae, с которой форму Дофлейна обычно отождествляют; встречается обозначение «Kentrochona-[-Kentrochonopsis» (Каль, Мор, Лепши — Берщ, 1965), либо прямо указывается, что этот род — синоним Kentrochona (Кудо и др.). Каль (Kahl, 1933, 1935) в первой своей работе еще различает род, считая его сомнительным, во второй же обозначает вид как «Kentrochona multipara». Очень редко род Дофлейна принимается без оговорок (Гийше, Дофлейн и Рейхенов, Корлисс). Раабе (Raabe, 1947) вообще не считает кентрохоноп-сиса хонотрихой, сближая его с апостоматидой Conidophrys. В чем причина этих разногласий? Дофлейн изображает группу нормальных трофонтов, трофотомонтов и томон-тов на разных стадиях диминуции. Распространено ошибочное мнение, что именно полигеммию Дофлейн считал отличительным признаком рода и вида; Каль, к примеру, в обоих определителях приводит лишь рисунок стробилы, а не нормального трофонта, принимая ее за кентрохону, видоизмененную при интенсивном почковании, известном и у спирохон. По его мнению, кентрохонопсис — это, «очевидно, лишь генеративная форма» вида «К. nebaliae Doflein, 1897». По Мацудо (Matsudo, 1966 : 367), Kentrocho-nopsis multipara — «это на самом деле Kentrochona nebaliae, образующая многочисленные почки». Неясно, относится ли название Kentrochonopsis к аберрантной кентрохоне или это самостоятельный род (Matsudo a. Mohr, 1968): на рисунках Дофлейна видны ядра, которые Мор и Мацудо считают «пикнотическими»; следовательно, это «больные, дегенерирующие формы», «монстры», «гибнущие К. nebaliae». Такие гигантские нежизнеспособные особи встречаются у инфузорий из амфибий при долгом содержании их в лаборатории. Дофлейн, однако, изучал не лабораторный, а фиксированный морской материал. Проблему рода решил Лёнг, найдя такие же формы, как у Дофлейна, на небалиидах Тортугаса и Флориды. При диминуции К. multipara образует стробилы с максимальным для хонотрих числом томитов (6—7); это, конечно, один из признаков рода, но вовсе не основное отличие от кентрохон: «Я уверен, — пишет Дофлейн (Doflein, 1897b : 645), — что выделение нового рода достаточно хорошо обосновано своеобразными пропорциями перистома». Род считался им провизорным лишь вследствие недостаточной изученности цикла развития. Вначале, учитывая некоторое сходство облика этой формы и кентрохон и изменчивость последних, Дофлейн сам считал кеи-трохонопсисов «слегка деформированными особями или продуктом конъюгации К. nebaliae», но затем нашел вид в большом числе особей; он намного крупнее кентрохон, производит больше томитов, имеет иное вооружение ПВ. Есть еще одно важное, оставшееся незамеченным обстоятельство: различие локусов. Kentrochona прикрепляется к ровной поверхности торакоиод; Kentrochonopsis— к основанию щетинок то-ракопод; у хонотрих же плани- и сетобионты почти всегда относятся к разным родам.
Диагноз. Крупные формы с асимметричным, изогнутым телом, наиболее широким у краев сумки (у Actinichona — в середине тела). Шейка очень широкая, едва выражена. ПВ крупная, растянута в стороны, у типового вида, вероятно, не сплющена или слабо сплющена. Складки эпихона и карманы не изображены. Пелликула без папилл и складок. Детали вооружения неясны: видимо, имеются 3 дорзальных шипа, либо 2 базальных шипа и длинный щиток, либо 2 базальных и длинный маргинальный шипы. Ма угловатый. Изображен длинный стебелек, но это ампула+эндостил -|-ножка; последняя расположена, видимо, субтерминально. Сумка вмещает около половины тела томита у единственного изображенного трофотомонта, но, вероятно, обычно она глубже: при диминуции образуется одновременно до 7 томитов.
С одним (типовым) видом К. multipara с торакопод Nebalia (Средиземное море). Новый вид найден Ленгом на N. longicornis (США, Мексиканский залив, о. Драй-Тортугас) и на Nebalia sp. (Флорида, Майами) в том же локусе, что и К. multipara', ПВ у него еще шире, с другим вооружением (вероятно, с 4 разрозненными маргиналь-
Рис. 166. Crassichona insolita с Nebalia II.
ными шипами); стробилы с 4—5 томитами. На снимках Лёнга ясно видно, что ПВ повернута к сумке на 90°, что характерно только для актинихонид.
1. Kentrochonopsis multipara Doflein, 1897 (рис. 1, Э; 4, И; 10, Г; 43, Д—3; 163, Г-Ж).
Doflein, 1897b : 642', Taf. 47, Fig. 1—8; Hamburger u. Buddenbrock, 1911 : 112 (Spirochona nebalina, part.); Collin, 1912 : 321; L e p $ i, 1926 : 88 (Spirochona nebalina, part.?); Kahl, 1933 : 141, Fig. 26, 9 (син. «Kentrochona ne-
baliae Doflein, 1897»); 1935 : 803, Fig. 148, 12 (виды Kentrochona nebaliae Doflein, K. nebaliae Rompel n Kentrochonopsis multipara приведены в списке видов рода Kentrochona}', М о 11 г, 1948 : 6 («Kentrochonopsis multipara»); Guilcher, 1950 : 466, 469; 1951 ; 41, 49; Matsudo, 1966 : 361, 367, pl. 2, fig. 22 (Kentrochona nebaliae).
С признаками рода. Размеры не приведены; судя по рисункам Дофлейна и снимкам Лёнга, это очень крупные формы, не умещающиеся, как и Crassichona, между двумя смежными щетинками.
Локус и хозяин — «жаберные пластинки» Nebalia geoffroyi (Дофлейн). Судя по иллюстрациям, особи прикреплены к наружной стороне крупных щетинок I фильтрационного ряда прото-, коксо- и базиподита торакопод, причем только к базальной части щетинок (как все актинихониды). Дофлейном найдены немногочисленные особи.
Распространение. Адриатическое море, Югославия (Ровииьо). Возможна находка на Nebalia в Черном море.
6. Род CRASSICHONA Jankowski gen. nov.
Массивные мешковидные формы неправильных очертаний; тело не сплющено, очень широкое, «мясистое». Резко утолщены края тела, ПВ и стенки сумки; шейка редуцирована. ПВ массивная, не сплющена, почти цилиндрическая, несколько расширена сверху; полость воронки имеет вид узкого извитого канала, проходящего в толще ПВ. В какой-то мере это подобие ПВ Vasichona. Эпихон со слабо выраженной складкой и с толстым выростом — видоизмененным щитком; боковых карманов нет. Пелликула гладкая, без складок, папилл, экзоскелета. Шипов нет. Хорошо выражен гипоколлюм. Тело с широким выростом в области сумки, огибающим щетинку, — гомолог киля кари-нихон и ризохон; точно такая же структура имеется у актинихон. Ножка широкая, субтерминальная или, скорее, терминальная; вероятно, имеется небольшая подошва. Ампула очень крупная, мешковидная. Сумка очень своеобразна — вмещает всего томита (что редко у хонотрих); вершина сумки расположена не ниже, а выше основания ПВ, что отмечается только у Actinichona gaucho. Высоко поднятый край сумки придает крас-сихоне «горбатый» вид; особенно высока и утолщена верхняя стенка сумки, образующая, как и у A. gaucho, характерные выросты (ср. рис. 163, Б; 164, Б и 166, Б). Стадии диминутивного почкования пока не наблюдались.
Род четкий, в принципе имеет тот же план строения, что и A ctinichona (особенно А. gaucho), но только у крассихон среди эндогеммин резко утолщены края тела, стенки сумки и ПВ; в отличие от Actinichona и Kentrochonopsis нет шипов ПВ.
С одним (типовым) видом С. insolita, найденным на торакоподах Nebalia на литорали о. Шикотан.
1. Crassichona insolita Jankowski sp. nov. (рис. 3, В, Г; 10, К; 25; 43, А, Б; 166).
С признаками рода.
Размеры. Длина особи 96—115 мк, до края гипохона 78—96 мк, до вершины сумки 102—103 мк, до дна 31—40 мк; L : D=1.4 : 1; высота эпихона 15—18 мк; размеры тела 61—75x72—86 мк, шейки 26—37X1—2 мк, ПВ (от сумки до вершины) 10— 11X32—48 мк, щитка 8—17X14—16 мк; стенки тела утолщены до 5—6 мк, стенки ПВ до 16—25 мк; диаметр отверстия ПВ 17—25 мк; размеры ампулы 9—11 Х8—10 мк; длина эндостила 9 мк; диам. диска 7—8 мк; размеры Ма 15—34x17—21 мк, полости сумки 61—63x19—24 мк, томита 54—62x18—21 мк; толщина дорзальной стенки сумки 6—9 мк, вентральной 10—15 мк; толщина сумки в верхнем отделе 25—33 мк; расстояние от вершины сумки до шейки 30—45 мк, до подошвы 90—100 мк.
Локус и хозяин — поверхность (видимо, не основания щетинок) протоподита, реже базиподита торакопод Nebalia II; вид редкий, мы находили лишь отдельных особей (в целом около 20).
Распространение. О. Шикотан, бухта Анама, литораль.
III. Семейство STYLOCHONIDAE Mohr, 1948
Mohr, 1948 : 12; G u i 1 с h е г, 1951 : 117 (все семейства хонотрих объединены здесь в одно, не названное); Hall, 1953 : 333, 412; Corliss, 1961 : 136; Dobr-z a n s k а-К а с z а п о w s k а, 1963 : 353, 367; M о h r a. oth., 1963a : 227; L e p § i, 1965 : 834 (с ошибочной фамилией автора — M о h 1); Янковский, 19676 : 41; Matsudo a. Mohr, 1968 : 280.
Мелкие и крупные формы; тело не цилиндрическое — листовидное, часто почти треугольное или ромбическое, резко сплющено дорзо-вентрально. Верх и низ тела не удлинены. Шейка едва выражена, короткая; тело достигает максимальной ширины на границе с шейкой. Пелликула иногда с рядами папилл. ПВ в целом однотипна: резко сплющена, растянута в стороны; гипохон ровный, эпихон высоко поднят, с многочисленными (3—4) четкими складками и с прекрасно развитыми карманами; стенки ПВ не
утолщены. РПА обычного, не инверсного типа; зона В резко уменьшена в размерах, почти редуцирована, лежит па эиихопе. Эпихон иногда щитковиден, ио у большинства видов щитка и лепестков нет. Обычно имеется гипоколлюм. В целом хорошо развиты шипы всех типов (кроме базальных), характерна тенденция к одновременному развитию соматических и маргинальных шипов; особо развиты первые. Экзоскелетпые пластинки встречаются редко. Ма овальный или яйцевидный, не вытянут, лежит по оси тела. Прикрепление стебельком разной длипы (утерян у вторичнобесстебельчатой Ctenochona с субтерминальной ножкой и подошвой). Ампула обычно мелкая у некрупных форм, крупная у вытянутых форм (типа Oxychona). В равной мере часты сето-и планибионты. Сумка обычного типа или (у крупных форм) очень глубокая, вмещает всего томита. При диминутивном почковании образуется одновременно не более 3 то-митов.
Семейство предложено Мором для всех хонотрих (включая экзо- и эндогеммин), кроме спирохон и хилодохон. Мы сохраняем его лишь для группы близкородственных эндогеммин, взявших начало от типового рода Stylochona. Основные характеристики семейства: листовидное тело, сплющенная широкая ПВ с ровным гипохоном и складчатым эпихоном, с прекрасно развитыми карманами, неинверсный РПА (кроме аберрантной Paraoxychona), терминальный стебелек. У Echinichonidae ПВ плоская, края ровные, без карманов й складок; у I nversochonidae тело массивное, с субтерминальной ножкой и подошвой, ПВ с вентральными складками и инверсной цилиатурой; у примитивных Isochonidae тело цилиндрическое , ПВ конусовидная, почти без складок, шипов нет; у Actinichonidae стебелька нет, ПВ коническая, повернута на 90° вправо, тело с причудливыми выростами.
С 10 родами, образующими ряд естественных подгрупп: Stylochona, Flectichona и Armichona (I), Stylochona, Spinichona и Dentichona (II),- Oxychona и Eriochona (III); к последней примыкают 3 аберрантных рода, Pterochona, Ctenochona и Paraoxychona. В I группе постепенно развиваются латеральные шипы, тело укрупняется; во II группе развиваются соматические шипы, тело остается мелким; III группа включает удлиненные формы с соматическими шипами и очень длинным стебельком. Pterochona — это видоизмененная Oxychona с крыловидными выростами тела; у бесшиповой Paraoxychona наблюдается инверсия зон РПА; у Ctenochona, по всем признакам близкой к Eriochona, утерян стебелек. Типовой род — Stylochona. Различать подсемейства у стилохонид, как и вообще у хонотрих, при современном уровне наших знаний нецелесообразно. Виды стилохонид обитают только на Nebalia', это в целом обычные, очень широко распространенные эндогеммины. Заселены все сегменты торакопод, щетинки и стебелек щупика максиллулы; нет форм с антеннулы, антенны и с плеопод. Лёнг нашел стилохонид на панцире рачков. Ряд родов эндемичен для локальных рас Nebalia (Ctenochona, Paraoxychona и др.), ряд родов широко распространен (Stylochona, Spinichona); семейство в целом космополитное. Стилохониды найдены пока в Баренцевом, Белом, Беринговом, Охотском, Японском морях, на Курильских островах, за рубежом в Англии, Японии, Средиземном море, на западе США (Калифорния, Вашингтон), в Карибском море и Мексиканском, заливе.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА STYLOCHONIDAE
1 (18). Прикрепление к субстрату с помощью стебелька; ножки нет.
2 (3). Имеются боковые крыловидные выросты тела . . 9. Род Pterochona (стр. 323). 3 (2). Крыловидных выростов тела нет.
4 (7). Стебелек значительно короче тела.
5 (6). Шипы отсутствуют или едва развиты.........1. Род Stylochona (стр. 303).
6 (5). Имеются резко удлиненные маргинальные и соматические шипы............
...........................................2. Род Spinichona (стр. 309).
7 (4). Стебелек удлиненный, длина его равна длине особи или превышает ее.
8 (9). Дорзальная стенка ПВ высоко поднята над вентральной, образует защитный щиток............................................3. Род Dentichona (стр. 309).
9 (8). Дорзального щитка ПВ нет.
10 (11). Соматические шипы покрывают весь край тела . . 7. Род Eriochona (стр. 321). 11 (10). Соматические шипы отсутствуют либо покрывают только часть края тела. 12 (15). Стебелек в несколько раз длиннее тела.
13 (14). РПА обычного типа, не инверсный............6. Род Oxychona (стр. 319).
14 (13). РПА инверсного типа ..................8. Род Paraoxychona (стр. 322).
15 (12). Длина стебелька примерно равна длине тела.
16 (17). Имеются латеральные шипы................5. Род Armichona (стр. 314).
17 (16). Латеральных шипов нет...................4. Род Flectichona (стр. 311).
18 (1). Стебелька нет, имеется субтерминальная ножка........................
......................................... 10. Род Ctenochona (стр. 323).
1. Род STYLOCHONA Kent, 1881
Kent, 1881 : GG2, G63 (Spirochona par lapsus на стр. 724; -j-S. coronata (Heterochona])', К e 1 ] i с о t t, 1885 : 45; Plate, 1888 : 38; Biitsclili, 1889 : 1756 (S pirochona sensu lato, part.); Wall engren, 1895 : 7, 44; 1896 : 553 (Kentrochona, part.; род Stylochona сохранен для S. coronata [Heterochona]); D о f 1 e i n, 1896 : 362, 364 (Kentrochona, part.); 1897a : 619 (Kentrochona, part.); 637; Hamburger u. Buddenbrock, 1911 : 112 (Spirochona sensu lato, part.; отождествляются Stylochona, Kentrochona и, вероятно, К entrochonopsis); L e p ? i, 1926 : 88 (Spirochona sensu lato, part.; отождествляются те же роды); 1965 : 834 (+S. coronata [Heterochona]); Kahl, 1933 : 141; 1935 : 805 (Spirochona, part.; Kentrochona, part.; род Stylochona сохранен только для S. coronata [Heterochona]); Schulze a. oth., 1936 : 3330; N e a v e, 1940 : 342; Kudo, 1946 : 682 (+<S. coronata [Heterochona]); Dons, 1948 : 12 (+5. sivert-seni [Eleutherochona]); Mohr, 1948 : 2, 13 (+<S. coronata [Heterochona]); Guilcher, 1951 : 42; Hall, 1953 : 412, 413 (род сохранен для S. coronata [Heterochona]); J i r o-v e c a. oth., 1953 : 527 (+N. coronata [Heterochona]); F a u r ё-F r e m i e t, 1956 : 188; Mohr, 1959b : 89 (+5. sivertseni [Eleutherochona]); Corliss, 1961 : 136; Dobrzansk a-K aczanowska, 1963 : 367; Mohr a. oth., 1963a : 228, 232 (+<S. coronata [Heterochona]); 1963b : 121 (+«S. sivertseni [Eleutherochona]); Mohr, 1966 : 536, 541 (+5. sivertseni [Eleutherochona]); Matsudo a. Mohr, 1968 : 281 (^[-«Stylochona» coronata [Heterochona]) +5. sivertseni [Eleutherochona]; Янковский, 19676 : 41 (+<S. coronata [Heterochona]).
Таксономическая история рода. Stylochona — наиболее «трудный» род хонотрих. Диагноз Кента (Kent, 1881 : 662): «Одиночные анималькули, овальные или удлиненные, сидящие на четком прочном стебельке; перистом развит как у рода Spirochona, образуя более или менее свернутое воронковидное мембраноидное расширение. Род введен здесь для двух морских типов, отличающихся от Spirochona наличием отчетливо развитых прочных стебельков. Почти до недавнего времени такая структура, как предполагали, имелась как рудимент у последнего рода. Однако Гертвиг недавно отметил, что у S. gemmipara такой элемент заменен довольно сложным органом прикрепления типа присоски». Кентом описаны Stylochona nebalina и S. coronata; типовой вид не указан, поэтому формально таковым является первый (S. nebalina). Это тем более правильно, что, как мы выяснили, стебелек имеется у S. nebalina и отсутствует у S. coronata. Взгляды авторов на состав рода и его самостоятельность крайне противоречивы. Так, Каль (Kahl, 1935) переносит S. nebalina в состав Kentrochona и даже Spirochona, оставляя «единственный, хотя и сомнительный» вид стилохон — S. coronata. По Мацудо и Мору (Matsudo a. Mohr, 1968 : 281), «Stylochona nebalina Кента не принадлежит, конечно, к одному роду с S. coronata и S. sivertseni; она попадает в заново определенный, расширенный род Kentrochona или в отдельный род, примыкающий к Kentrochona». Ныне Мор и Мацудо признают 5. coronata nomen nudum; однако они сохраняют и род Stylochona и сем. Stylochonidae. С 1881 г. оба вида Кента никем не изучались; отношение авторов к ним и к роду Stylochona довольно неопределенно. Часто род признается синонимом спирохон или кентрохон, а виды стилохон распределяются по разным родам либо вообще не признаются, особенно S. nebalina; нередко род сохраняют для S. coronata, но довольно часто 5. coronata отождествляют с «Heliochona» (Heterochona} scheutenii. Поскольку виды рода не изучались никем уже почти 90 лет и описание их у Кента плохое, пририсовано много деталей, мы имеем полное право признать род и виды nomen nudum; однако мы имели большой материал по комменсалам гаммарид и небалиид морей СССР, позволивший установить действительный облик видов Кента. Как отмечалось выше, S. coronata — типичный вид Heterochona, причем вид четкий, достоверный, несмотря на то что Кентом пририсованы длинный стебелек, колбасовидный Ма, ресничная глотка, сократительная вакуоль близ нее, внутренняя воронка. Это экзогеммовая форма.
Формы типа S. nebalina встречаются часто в Пацифике, причем только на латеральных щетинках щупика максиллулы, где их нашли Кент (ошибочно указавший торакоподы) и Дофлейн (Doflein, 1897а) по материалу из Адриатики. Это листовидные формы с плоской, растянутой в стороны ПВ, складчатым эпихоном, крупными карманами, довольно длинным стебельком. Рисунки и диагноз Кента ошибочны, но теперь ясны и локус, и морфология вида; вид, а с ним и род, следует сохранить. К Kentrochona стилохоны не имеют никакого отношения: это формы из разных эволюционных линий,.различающиеся практически по всем признакам (форме тела, ПВ, типу РПА — инверсный у кентрохон, — вооружению, прикрепительному аппарату и т. д.); это, соответственно, сето- и планибионты. S. nebalina не была отмечена Мором и Мацудо, но на Epineballa с западного побережья США и других частей Пацифики и Атлантики обычен стебельчатый веретеновидный вид с мелкими шипами ПВ, вероятно принадлежащий к стилохонам. Ранее (Mohr, 1966) упоминалось о находке близких к стилохонам форм в северной Атлантике и северной Пацифике.
Форму с водорослей (5. sivertseni), по Донсу (Dons, 1948 : 13), следует отнести к роду S tylochona вследствие наличия стебелька и двойной концентрической воронки, которую Кент нашел у S. coronata. Вид Донса не имеет ничего общего с гелиохонидой Heterochona coronata, лишенной внутренней воронки и стебелька (они пририсованы), и с эндогемминой 5. nebaltna, а следовательно, и с родом Stylochona', это примитивная экзогеммина. Мор и Мацудо, осмотревшие препараты Донса, также убеждены в родовой самостоятельности 5. sivertseni, но относят ее почему-то к эндогемминам. В итоге все три вида, приписанные ранее к Stylochona, принадлежат к трем разным родам — к Stylochona (S. nebaltna), к Heterochona (Н. coronata) и к Eleutherochona (Е. sivertseni)', две последние формы — экзогеммины.
Диагноз. Мелкие формы с плоским, почти треугольным телом, плавно сужающимся к нижнему концу. ПВ высокая и относительно некрупная, эпихон высоко поднят над гипохоном, часто образует два широких и низких лепестка. Вентральных складок нет; складки эпихона обычно неглубокие, боковые карманы небольшие (по сравнению с высшими стилохонидами). РПА обычного, не инверсного типа. Хорошо развита гипоколлярная складка. Пелликула ровная, без складок и папилл; у многих особей кутикула нижней трети тела превращена в экзоскелетные пластинки. Края тела с вырезками, очень характерными для рода. Шипы отсутствуют либо немногочисленны, мелкие; иногда зазубрен край эпихона. Ампула небольшая, отделена от эндостила пластинкой. Стебелек гофрирован, со стилонемами и каналом, небольшой .— в несколько раз короче тела. Сумка вмещает 1/2—3/4 тела томита.
Это наиболее примитивный род семейства: складки и карманы ПВ еще не столь глубоки, как у всех остальных родов; тело и стебелек не удлинены, как у Flectichona', шипы, если есть, едва развиты в отличие от Spinichona и Dentichona.
С 5 видами — S. nebaltna (типовой вид), S. glabra, S. maxillaris, S. setaria и S. vil-losa, обитающими на латеральных, реже дистальных щетинках щупика I максиллы Nebalia. Распространение очень широкое: Белое, Баренцево и Охотское моря, южные Курилы; у ряда рас Nebalia отсутствуют либо заменяются видами Spinichona. Достоверные находки за рубежом — Англия (Кент), Адриатика (Ромпель, Дофлейн), предполагаемые — в северной Атлантике и Пацифике (Мор).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА STYLOCHONA
1 (4). ПВ очень широкая, ширина ее достигает ширины тела.
2 (3). Имеется левосторонняя вырезка тела....................3. S. maxillaris.
31 .(2). Края тела ровные, без вырезок.......................... 1. S. nebalina.
4J(1). ПВ не широкая, уже тела.
5. (8). Имеется только одна (левосторонняя) вырезка края тела. 6(7). Эпихон ровный, без шипов...................................2. S. glabra.
7 (6). Эпихон, нередко и края тела с шипами................. . . 5. S. villosa.
8 (5). Имеются две латеральные вырезки, по правому и левому краям тела . . .
......................................................... 4. S. setaria.
1. Stylochona nebalina Kent, 1881 (рис. 1, С, Ч; 10, В', 167, Ж—И', 168, 3—М\ 197, 10, 19, 31, 32).
Kent, 1881 : 662, pl. XXXIII, fig. 56—57 (Spirochona nebalii par lapsus на стр. 724); В iitschli, 1889 : 1756 (Spirochona- вид не назван); Rompel, 1894 : 618 (Kentrochona nebaliae, part.); W a 1 lengr en, 1895 : 2, 44; 1896 : 553 (вид не назван; вероятно, отождествляется с Kentrochona nebaliae [A-Kentrochonopsis multipara])', Doflein, 1897a: 619, Text-Fig. B, L; Taf. XLV, Fig. 5-8; Taf. XLVI, Fig. 27, 43 (Kentrochona nebaliae, part.); 637; Hamburger u. Buddenbrock, 1911 : 112, Fig. 140, a (Spirochona nebalina', включает Kentrochona nebaliae и, вероятно, Kentrochonopsis'multipara)', Lep0, 1926 : 88, Taf. XIV, Fig. 479 (Spirochona nebalina', включает Kentrochona. ne.bat.iae и, вероятно, .Kentrochonopsis multipara)', Kahl, 1933 : 141, Fig. 26, 3 (Spirochona nebalina Kent, 1881); 140, Fig. 26, 7 (Kentrochona nebaliae Doflein пес K. nebaliae Rompel); 1935 : 803 (Spirochonal nebalina Kent, 1889; —Kentrochona nebaliae Doflein. 1897, пес K. nebaliae Rompel, 1894, отождествляемая c Kentrochonopsis multipara)', Kudo, 1946 :682, fig. 320, b; M о h r a. oth., 1963a : 228; 1963b : 121; M о h r, 1966 : 536, 541; M a t s u d о a. Mohr, 1968: 281 («Stylochona» nebalina).
Таксономическая история вида. Диагноз Кента (Kent, 1881 : 662—663): «Тело удлиненное, коническое, сужающееся кзади, наиболее широкое у переднего края, прикреплено коротким прочным стебельком, обычно равным 1/3 длины всего тела; мембранная воронка сжата у основания, описывает несколько более одного оборота спирали; ее терминальный край слегка поднят в виде язычка, равного по высоте почти половине длины тела. Длина тела без воронки и ножки 1/600" (т. е. 20 мк, — А. Я.). Местообитание: соленая вода, на Nebalium bipes». Отличия от «Spirochona sheuteni»: наличие стебелька, коническая, не веретеновидная форма тела, от-
сутствие шипов ПВ. Согласно Кенту, «большое количество зооидов этого нового вида было найдено прикрепленными к торакальным придаткам Nebalium bipes, собранных в бухте Сент-Клементс, о. Джерси, в феврале 1878 г. Многие особи претерпевали про-
Рис. 167. А—В — Stylochona glabra с Nebalia VI; Г,Д — S. villosa с Nebalia V; Е — S. setaria с Nebalia II; Ж—И — S. nebalina с Nebalia bipes (по: Kent, 1881).
цесс почкования, уже наблюдавшийся у S. gemmipara. У особей, помещенных в разбавленный спирт, мембранная воронка сохраняла свою характерную форму, но раскручивалась» (ibid. : 663; см. рис. 167, Ж). Ромпель (Rompel, 1894) отмечает различие формы ПВ в зависимости от локуса Kentrochona nebaliae, без описания вариаций; различаются популяции «лежащих» Kentrochona и «стоящих» форм типа Spirochona. Доф-
20 Заказ № 213
лейн (Doflein, 1897a) находит те же популяции наторакоподахи на щетинках щупика I максиллы; поскольку имеется ряд переходов, это, по его мнению, безусловпо один вид — К. nebaliae. На щетинках максилл кептрохоны представлены «в постоянно видоизмененной форме». Дофлейн не был уверен в идентичности этих форм и Stylochona nebalina Кента (собственно работу Кента Дофлейн прочел после опубликования статьи о Kentrochona'), Ромпель вообще не цитирует Кента; Дофлейн находит рисунки и описания Кента плохими, но считает возможным, что формы с максиллипед — вид того же рода (Kentrochona). Пока невозможно точное определение, род Kentrochona, по Доф-лейну, следует сохранить, не отождествляя его с родом Кента.
В последующем систематика этой группы хонотрих оказалась в крайне запутанном состоянии, тем более что до сих пор их никто не изучал; отношение к видам Кента, Ром-пеля и Дофлейна было чисто субъективным. Так, Валленгрен сохраняет род Stylochona только для S. coronata, не упоминая о >S’. nebalina и явно считая ее синонимом Kentrochona nebaliae-, Бючли, Эрлангер, Гамбургер и Лешли признали 5. nebalina синонимом кентрохоны и кентрохонопсиса, включив вид в состав Spirochona (куда помещены и все другие хонотрихи, кроме хилодохон). Гамбургер в определителе хонотрих пишет: «Вследствие большой вариабельности предротовой воронки у разных особей одного и того же вида, какую наблюдал Дофлейн у своей Kentrochona nebaliae в различных местах обитания, невозможно, по нашему мнению, подразделить все формы хонотрих на отдельные роды; Дофлейн также отмечает, что его вид стоит очень близко к Heliochona и Spirochona. Как отметил уже Эрлангер и как ясно из простого просмотра рисунков, Kentrochona nebaliae наверняка идентична с Stylochona nebalina Кента, а второй вид рода (S. coronata Кента) стоит так близко к Spirochona, что их отождествил Вючли, а Валленгрен, разделивший их на основе собственных наблюдений над 5. scheutenii, считал S. coronata переходной формой между Heliochona и Spirochona, не принимая во внимание Stylochona nebalina. Исходя из всех этих соображений, нам пока кажется лучшим отделять все эти формы друг от друга только на видовом уровне» (Hamburger п. Buddenbrock, 1911 : НО). По Гийше (Guilcher, 1951 : 117), напротив, «роды хонотрих немногочисленны и четко определены». Каль (Kahl, 1933) различает два вида кентро-хон — К. nebaliae Rompel, 1894, и К. nebaliae Doflein, 1897 (имеется в виду форма с максиллулы, хотя Дофлейн изучал в основном форму с торакопод); 5. nebalina «очень напоминает» второй вид, но они не отождествляются. Позднее вид Кента сохраняется Калем (Kahl, 1935) в составе рода Spirochona, но уже под вопросом. Как отмечает Каль, не исключено, хотя пока и нет уверенности, что бесстебельчатая форма Дофлейна с максиллулы идентична с видом Кента. Он по-прежнему различает два вида с одним названием (К. nebaliae). Mop (Mohr, 1966) вначале указывал, что S. nebalina имеется в материале Лёнга, а затем отмечал, что вид не могли найти даже в материале из Англии; на небалиидах разных рас была обнаружена мелкая стебельчатая форма с шипи-ками ПВ — явный вид Stylochona, наиболее постоянный комменсал небалиид. Локус указан Мором неточно, как и Кентом, — «максиллинеды», в другом месте «плеоподы» (Mohr a. Matsudo, 1970). Если имеются в виду именно плеоподы, формы с которых отмечались и ранее (Menzies a. Mohr, 1952; Matsudo a. Mohr, 1968), находка на них стилохон исключена; если как «плеоподы» обозначены торакоподы, здесь также нет ни стилохон, ни близкого рода Spinichona. Несогласованность в обозначении придатков рачков — один из источников путаницы в систематике хонотрих.
В конечном итоге мы приходим к следующим выводам. Типовой вид A. nebalina описан плохо, но в целом это стебельчатая бесшиповая эндогеммина со щетинок максиллулы, с высоким эпихоном. Такие формы нельзя спутать с видами Spinichona, живущими в том же локусе; других же форм хонотрих на щетинках данного локуса нет. Кент не рисует у S. nebalina тонкой трубчатой глотки, а изображает полость; за глотку приняты контуры Ма (рис. 167, Ж) и сумка на ранних стадиях томитогенеза (рис. 167, 3), реснички же пририсованы. В стилизованном виде показаны складки ПВ. Особь на рисунке Кента (рис. 167, 3) видна сбоку. О морфологии вида пока можно судить по более тщательной работе Дофлейна; окончательное суждение об идентичности форм Кента и Дофлейна (и их хозяев, которые могут относиться к разным видам — Nebalia herbstii и N. geoffroyi) можно получить только при повторном изучении рас Nebalia из Адриатики и с о. Джерси; идентичность стилохон может подтвердить находка на расе рачка с о. Джерси типичных Kentrochona nebaliae и Kentrochonopsis multipara.
Диагноз. Тело широкое, треугольное, без латеральных вырезок.ПВ непропорционально широкая, с прекрасно развитыми складками и карманами; нет ни маргинальных, ни соматических шипов. Эпихон высокий на рисунке Кента, возможно с лепестками, и низкий на рисунках Дофлейна. Пластинки экзоскелета не изображены.
Размеры. Длина тела 20 мк (Кент), 50 мк (Каль); размеры стебелька 6—15 X X 1—2 мк (Дофлейн); Дофлейн, а вслед за ним Гамбургер и Лепши приводят суммарные данные по S. nebaltna-^-K. nebaliae,
В отличие от S. nebalina у всех изученных нами видов рода имеются 1—2 латеральные вырезки тела, нередко шипы и зубчики по краям тела и ПВ.
Локус ir хозяин — «торакальные придатки» «Nebalium bipes» (Кент); вероятно, правильнее — латеральные щетинки щупика максиллулы, как у всех стилохон в нашем материале. Хозяин может принадлежать к Nebalia herbstii или к N. geoffroyi, но не к N. bipes.
Раснростра дени е. Англия, о. Джерси (в Дуврском проливе у берегов Нормандии), Сент-Хельерс, бухта Сент-Клементс, литораль (Кент); Адриатическое море, Италия (Триест), Югославия (Ровиньо), на N. geoffroyi (Ромпель, Дофлейн).
2. Stylochona glabra Jankowski sp. nov. (рис. 3, Л; 10, A; 26, В; 167, А—В; 168, E).
Относительно крупные формы с небольшой ПВ. Эпихон с тремя четкими складками, щитковидный, высокий; боковые карманы едва намечены. Края тела и ПВ ровные, без зубчиков. Гипоколлюм проходит по дорзальной и вентральной сторонам тела, окружая шейку. Хорошо выражены экзоскелетные пластинки, но нет пластинки в зоне ампулы.
Размеры. Длина особи 60—72 мк, до края гипохона 56—63 мк, до вершины сумки 42—50 мк, до дна 26—35 мк; L : D=3 : 1; высота эпихона 5—8 мк; размеры тела 51—55X30—35 мк, шейки 1—2X9—11 мк, ПВ (от сумки до вершины) 18—22X21 — 24 мк; длина ампулы 3—4.5 мк, эндостила 4—5.5 мк; диам. диска 4—4.5 мк; размеры стебелька 8—14X3 мк, Ма 12—14X9—11 мк, сумки 14—26x12—13 мк, томита 30— 32X11—12 мк; глубина вырезки края тела 2—3.5 мк.
ПВ у S. glabra относительно уже и выше, боковые карманы выражены слабее, чем у S. nebalina и 5. maxillaris; края ПВ не зазубрены как у 8. setaria', вырезка только одна; нет маргинальных и соматических шипиков, имеющихся у 5. villosa.
Локус и хозяин — латеральные и дистальные щетинки щупика максиллулы Nebalia VI; вид массовый, обычный.
Распространение. Белое море, Соловецкие о-ва.
3. Stylochona maxillaris Jankowski sp. nov. (рис. 9, И; 26, A; 168, A—Г).
Некрупные формы с очень широкой ПВ, растянутой в стороны и относительно невысокой. Эпихон невысокий, с очень глубокими складками и карманами. Края ПВ ровные; иногда различимы 1—2 мелких соматических шипика. Гипоколлюм расположен дорзально. Пластинок экзоскелета нет; между ампулой и эндостилом обычно видна тонкая септа. Края тела с одной (левосторонней) вырезкой, как у S. glabra.
Размеры. Длина особи 46—50 мк, до края гинохона 43—46 мк, до вершины сумки 36—38 мк, до дна 17 мк; L : D=2.3 : 1; высота эпихона 2.5—5.5 мк; размеры тела 34—38x22—24 мк, шейки 1X8.5—9 мк, ПВ (от сумки до вершины) 9—12X22— 26 мк; глубина боковой вырезки до 2- 3 мк; длина шипиков до 2 мк, ампулы 2.5—3 мк, эндостила 5 мк; диам. диска 4—4.5 мк; размеры стебелька 10—11 X 2.5 мк, Ма 11—12Х Хб—8.5 мк, сумки 15—19x9—11 мк, томита 24—28X8.5—9 мк.
ПВ данного вида значительно шире, чем у 5. glabra и S. setaria', имеется только одна (левосторонняя) вырезка края тела; нет маргинальных шипиков, имеющихся у S. villosa и 5. setaria.
Локус и хозяин — латеральные щетинки щупика максиллулы Nebalia III; вид массовый. Как и все хонотрихи со щетинок максиллулы (Stylochona, Spinichona, Eurychona, Echinichona), данный вид прикрепляется не к самой щетинке, а К отходящим от нее мелким щетинкам II порядка.
Распространение. Камчатка, Авачинская губа, глуб. 19 м.
4. Stylochona setaria Jankowski sp. nov. (рис. 10, 3; 167, E-, 168, Ж).
Некрупные формы с широкой ПВ; эпихон высокий, разросшийся, с двумя лепестковидными выростами. Складки эпихона выражены очень плохо, боковые карманы отсутствуют или едва намечены. Края лепестков обычно зазубрены; соматических шипов нет. Имеются две боковые вырезки края тела, левая крупнее правой. Пластинок экзоскелета нет; имеется септа в зоне ампулы. Гипоколлюм окружает шейку с обеих сторон.
Размеры. Длина особи 47—57 мк, до края гипохона 42—48 мк, до вершины сумки 31—37 мк, до дна 20—22 мк; L : D=2 : 1; размеры тела 33—39x28—30 мк, шейки 1.5—2x9—10.5 мк, ПВ (от сумки до вершины) 15—19x21—28.5 мк; длина ампулы 4 мк, эндостила 3.5—4 мк, септы 6 мк; диам. диска 3—4 мк; размеры стебелька 4.5—6X1.5—2 мк, Ма 8—13x6—8.5 мк, Ми 1.3 мк, сумки 17—19x9—10 мк, томита 23—26x9—9.5 мк; высота эпихона 4—7.5 мк; ширина лепестков 8—9 мк; глубина правой вырезки до 4—5 мк, левой до 1.5—2 мк.
Вид четкий, имеет две боковые вырезки (в отличие от всех остальных стилохон);' ПВ шире, чем у A. glabra, зазубрена; нет соматических шипиков, имеющихся у S. maxillaris и A. villosa.
Локус и хозяин — латеральные, частично дистальные щетппкп щупика макспл-лулы Nebalia II; вид обычный, по по массовый.
Р а с п р о с т р а н е н и е. О. Шикотан, бухта Анама, литораль.
Рис. 168. А—Г — Stylochona maxillaris с Nebalia III; Д — S. villosa c Nebalia V; E—S. glabra c Nebalia VI; Ж — S. setaria c Nebalia II; 3—M — S. nebalina? c Nebalia geoffroyi (no: Doflein, 1897a).
5. Stylochona villosa Jankowski sp. nov. (рис. 9, Д'; 167, Г, Д; 168, Д).
Некрупные формы; ПВ довольно широкая, эпихон высокий, почти без складок; карманы отсутствуют или едва намечены. Край эпихона неровный, иногда образует подобие лепестков. Края ПВ, особенно лепестков, и края тела, особенно левый, несут шипики. Имеется лишь левосторонняя вырезка края тела. Гипоколлюм дорзальный. Развиты пластинки экзоскелета и септа между эндостилом и ампулой.
Размеры. Длина особи 51—58 мк, до края гипохона 48—54 мк, до вершины сумки 39—44 мк, до дна 17—22 мк; L : D=2.7 : 1; размеры тела 40—44X22—23 мк; высота эпихона 3.5—4 мк; глубина вырезки 2—2.5 мк; размеры шейки 1.5Х 10—11 мк, ПВ (от сумки до вершины) 14—15X20—22 мк, пластинок экзоскелета 21—25x1.5— 1.7 мк; длина дорзальных шипов 2—4.5 мк, вентральных менее 1 мк, соматических 2— 6 мк, ампулы 5 мк, эндостила 5—6 мк, септы 3—5 мк; диам. диска 3 мк; размеры стебелька 6—7x2 мк, Ма 10—11x6—6.5 мк, сумки 18—20x8—10 мк, томита 21—26х Х7.5—8 мк.
ПВ относительно уже, чем у S. nebalina и 5. maxillaris; эпихон зазубрен, как у S. setaria, но в отличие от последней развиты шипы и имеется лишь одна вырезка края тела.
Локус и хозяин — латеральные и дистальные щетинки щупика максиллулы Nebalia V. Встречается совместно с Eurychona vitrea (доминирующий вид.) в небольших количествах. Это один из редчайших случаев, когда локусы двух видов совпадают на одном хозяине.
Распространение. О. Итуруп, зал. Одесский, литораль.
2. Род SPINICHONA Jankowski, 1973
Мелкие формы с широким треугольным телом, резко сужающимся к нижнему концу. ПВ крупная, растянута в стороны, без складок гипохона; прекрасно развиты складки эпихона (3, иногда все 4), ограничивающие четкие карманы; последние все же не столь глубоки, как у высших стилохонид. Имеются правая и более глубокая левая вырезки края тела. Нет щитка, четких лепестков; участки эпихона, ограниченные складками, вдаются глубоко в полость ПВ. Прекрасно развит гипоколлюм, окружающий шейку с обеих сторон. Пелликула не исчерчена, без папилл. Пластинки экзоскелета развиты у крупных особей. Шипы, наметившиеся у стилохон, достигают крайнего развития у спинихон; все шипы игольчатые, особо удлинены соматические, менее — гипокол-лярные, еще менее—дорзальные шипы; вентральные шипы ПВ коротки и не всегда развиты. Гипоколлюм несет шипы по обеим сторонам тела. Ампула и эндостил очень мелкие, разграничены тонкой септой. Стебелек очень тонкий, мелкий, без стилонем и канала, не гофрирован, длина его достигает х/6—х/5 длины особи. Ма крупный, широкий, часто угловатый. Сумка крупная, вмещает всего томита.
Род принадлежит к группе стилохонид с мелким телом и коротким стебельком, отличается от Stylochona великолепным развитием шипов четырех типов. Переходные формы типа S. maxillaris, S. villosa, где шипы едва намечены, лучше сохранять в составе рода Stylochona. У Dentichona стебелек удлинен, шипы зубцевидные, не игольчатые.
С 1 (типовым) видом S. horrida со щетинок максиллулы Nebalia из Японского моря (о. Путятин). Формы типа S. horrida, но с менее развитыми шипами мы находили на рачках с Кильдина и Сахалина. Близкий вид, но с более короткими и широкими шипами найден Лёнгом на щетинках максиллулы Nebalia в США (Флорида, Майами).
1. Spinichona horrida Jankowski, 1973 (рис. 3, Н, О; 10, Д; 21, Д; 22, Б; 26, Б; 151, А, Б; 169—173).
С признаками рода.
Размеры. Длина особи (без шипов) 36—59 мк, до края гипохона 34—56 мк, до вершины сумки 42—46 мк, до дна 18—21 мк; L : D=1.8 ; 1; высота эпихона 3—6 мк; глубина правой вырезки 2—5 мк, левой 4—7.5 мк; размеры тела 33—46X26—32 мк, шейки 1X8—9 мк, ПВ (от сумки до вершины) 9—15X20—27 мк, пластинок кутикулы 9—15X1—1.5 мк; длина соматических шипов 6—21 мк, гипоколлярных 6—11 мк, дорзальных 4—6.5 мк, вентральных до 4 мк, ампулы 3—4 мк, эндостила 4 мк, септы 3.5—4 мк; диам. диска 2 мк; размеры стебелька 7—11X1.5 мк, Ма 10—12x7—11 мк, сумки 24—26х 11 мк, томита 19—25Х 10 мк.
Локус и хозяин — латеральные, реже дистальные щетинки щупика максиллулы Nebalia IV; вид обычный, массовый.
Распространение. Японское море, о. Путятин, глуб. 1 м.
3. Род DENTICHONA Jankowski, 1973
Очень мелкие формы с ромбическим телом, довольно широкой шейкой. ПВ очень крупная, ширина ее достигает ширины тела. Гипохон без складок; эпихон с 2, реже с 3 складками, участок между которыми высоко поднят, образует дорзальный щиток. Боковые карманы выражены довольно слабо. РПА не инверсного, обычного типа. Пелликула не исчерчена, без папилл; гипоколлюм дорзальный, развит не у всех особей. Защитный аппарат: 3—4 пары зубцевидных соматических шипов, изредка мелкие зубчики на краях ПВ. Ампула округлая, мелкая, эндостил тонкий и длинный; попереч-
Рис. 169. Spinichona horrida c Nebalia IV.
Рис. 170. Spinichona horrida c Nebalia IV.
ной септы пет. Стебелек длинный, обычно по длине превышает особь, очень тонкий, не гофрирован, без стилопем и внутреннего канала. Ма овальный или яйцевидный. Сумка вмещает 1/.,, реже 3/4 тела томита.
Род близок к низшим стилохонидам; в отличие от Stylochona стебелек резко удлинен, имеются зубцевидцые шипы; в отличие от Spinichona шипы не игольчатые, карманы ПВ плохо развиты, стебелек длипнее; от Flectichona отличается наличием дорзального щитка, шипов и менее развитыми карманами ПВ.
С 1 (типовым) видом D. marginata, обитающим на торакоподах Nebalia IV с литорали о. Путятин. На рачках с Сахалина и Шикотана найдены анактиниды — формы типа D. marginata, но без шипов или с едва развитыми зубчиками; возможно, это самостоятельный вид рода. Род, вероятно, не эндемичен для фауны СССР: формы типа D. marginata, но с непропорционально длинным стебельком найдены Ленгом на внутренней поверхности панциря Epinebalia sp. (США, Вашингтон, о. Сан-Хуан в бухте Гаррисон).
1. Dentichona marginata Jankowski, 1973 (рис. 3, М; 10, Е; И, 3, И; 20, В; 21, В; 49, Р; 51, Ж—3; 151, В; 174—177; 185, В; 191, В).
С признаками рода.
Размеры. Длина особи 33—48 мк, до края гипохона 30—4'1 мк, до вершины сумки 20—29 мк, до дна 8—13 мк; L : D=1.5 : 1; высота эпихона 3.5—7 мк; размеры тела 27—35X 20—30 мк, шейки 1—1.5Х 10—11 мк, ПВ (от сумки до вершины) 12—14Х X 25—34 мк; ширина щитка 12—15 мк; длина соматических шипов 2—7 мк, маргинальных менее 1 мк, ампулы 2—3 мк, эндостила 3—5 мк; диам. диска 1.5—3 мк; размеры стебелька 4—62Х0.8 мк, Ма 11—15X7—10 мк, сумки 19—20Х 11—12 мк, томита 19— 20X9—10 мк.
Локус и хозяин — ровная поверхность и бугорки (видоизмененные щетинки) эпиподита торакопод Nebalia IV (типовой хозяин). Зубцы менее развиты у вида с Сахалина, не развиты у форм с Шикотана.
Распространение. Японское море, о. Путятин, глуб. 1 м (на Nebalia IV); Сахалин, лагуна Буссе, литораль (на Nebalia sp.).
4. Род FLECTICHONA Jankowski gen. nov.
Относительно некрупные формы с широким телом, ромбическим или почти овальным, с резко неравными по величине плечами. Шейка невысокая и обычно узкая. ПВ очень крупная, широкая, растянута в стороны. Гипохон без складок, эпихон с тремя глубокими складками, с дорзальным карманом и двумя крупными боковыми карманами (особо развит левый). РПА обычного, не инверсного типа. Гипоколлюм проходит по дорзальной стороне тела. Пелликула ровная или с насечками; края ПВ часто исчерчены. Соматических шипов нет; края ПВ обычно зазубрены, несут мелкие шипики. Пластинок экзоскелета нет. Ампула мелкая, эндостил у части видов крупный; имеется небольшая септа. Стебелек удлиненный, ровный или гофрированный, длина его составляет 1—1х/2 длины тела. Ма вытянутый, овальный. Сумка глубокая, вмещает всего томита.
Нет соматических шипов, развитых у Eriochona, Spinichona и у части видов Оху-chonaa Dentichona. Отличия от Stylochona-. удлиненный стебелек, мелкие зубчики ПВ, крупные боковые карманы, массивный эндостил, глубокая сумка. Род близок к Armi-chona и к бесшиповым Oxychona типа О. suprema. В отличие от армихон нет латеральных шипов ПВ. Объединять флектихон в один род с бесшиповыми оксихонами не следует: они различаются по форме тела, типу прикрепительного аппарата (у оксихон стебелек во много раз длиннее тела, ампула и эндостил не флектихонидного типа); кроме того, карманы ПВ плохо развиты у оксихон, лучше — у флектихон.
С 2 видами — F. crenata (типовой вид) и F. filicauda, обитающими на щупике, реже (как исключение) на щетинках максиллулы рас Nebalia с литорали Шикотана и Белого моря.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА FLECTICHONA
1 (2). Стебелек утолщенный, несколько короче особи...........1. F. crenata.
2 (1). Стебелек очень тонкий, нитевидный, значительно длиннее особи.......
..................................................... 2. F. filicauda.
1. Flectichona crenata Jankowski sp. nov. (рис. 3, С, T; 10, A; 22, Д; 178, А—И).
Крупные формы с удлиненным или овальным телом, плавно сужающимся книзу; плечи резко скошены. Нет латеральных вырезок тела. Шейка четкая, узкая, довольно высокая. ПВ массивная, оба края с шипиками, стенки исчерчены. Отмечены особи с поперечными складками в середине тела. Ампула овальная, пластинки эндостила
Рис. 171. Spinichona horrida c Nebalia IV.
Рис. 172. Spinichona horrida c Nebalia IV.
Рис. 173. Телотомиты Spinichona horrida c Nebalia IV:
Рис. 174. Dentichona marginata c Nebalia IV.
Рис. 175. Dentichona marginata c Nebalia IV.
массивные. Стебелек толстый, гофрирован, с четкими стилопемами, обычно несколько короче особи.
Размеры. Длина особи 72—99 мк, до края гипохона 66—92 мк, до вершины сумки 37—78 мк, до наружного края 30—70 мк, до дна сумки 9—37 мк; L : D = 2.5—
Рис. 176. Dentichona marginata с Nebalia IV.
3:1; высота эпихона 4—8 мк; размеры тела 39— 80Х 25—33 мк, шейки 4—5х 7.5—Эмк, ПВ (отсумки до вершины) 16—22X 30—42 мк; длина правого кармана 4—5 мк, левого 9—12 мк, шипиков ПВ до 2 мк, ампулы 4.5—5 мк, эндостила 6—7.5 мк; диам. диска 6—6.5 мк; размеры стебелька 30— 37X2.8—3.2 мк, Ма 13—16.5X8—10 мк, сумки 27—34X14—16 мк, томита 30—32X12—15 мк.
Отличия от F. filicauda: удлиненное, не ромбическое тело, относительно недлинный, толстый, гофрированный стебелек.
f Локус и хозяин — ровная поверхность щупика максиллулы Nebalia VI, реже — основание латеральных щетинок, еще реже — дистальных щетинок. Вид обычный, но не массовый — до 30 особей на придатке.
Распространение. Белое море, Соловецкие о-ва.
2. Flectichona filicauda Jankowski sp. nov. (рис. 10, 3; 178, К, Л).
}Р: Некрупные формы с ромбическим телом, резко сужающимся книзу; плечи почти прямые. Имеется одна, чаще две латеральные вырезки по краю тела, особенно глубока левая. Шейка низкая и широкая, плохо выражена. ПВ относительно невысокая и очень широкая; края ПВ с зубчиками, стенки не исчерчены. Пелликула ровная, без складок. Ампула почти округлая, пластинки эндостила тонкие, небольшие. Края нижней половины тела резко утолщены. Стебелек очень тонкий, не гофрирован, без стилонем, резко удлинен.
Размеры. Длина особи 42—52 мк, до края гипохона 36—44 мк, до вершины сумки 31—35 мк, до дна 9—10 мк; L : D=1.2 : 1; высота эпихона 6—8 мк; размеры тела 33—37X 37—39 мк, шейки 1—1.5X11—14 мк, ПВ (от сумки до вершины) 12—15X30—37 мк; длина левого кармана 3—4.5 мк, правого 2—2.5 мк; глубина левой вырезки края тела 2—2.5 мк, правой 0—1 мк; длина зубчиков ПВ до 1 мк, ампулы 2.8—3 мк, эндостила 3.5—4 мк; диам. диска 4 мк; размеры стебелька 42—83Х 2—2.2 мк, Ма 11—16x7—10 мк, сумки 24—26X12—16 мк, томита 26—27X10— 12 мк.
Тело не вытянуто, как у F. crenata, с более широкими шейкой и ПВ, более тонким и длинным стебельком, более мелким эндостилом.
Локус и хозяин — поверхность щупика (не щетинок!) максиллулы Nebalia II; вид обычный, придаток несет 10—20 особей.
Распространение. О. Шикотан, кут бухты Анама, литораль.
5. Род ARMICHONA Jankowski gen. nov.
Формы средних размеров и крупные; тело широкое, ромбическое, с широкими плечами; шейка разной толщины, низкая, практически редуцирована у A. gibbosa. ПВ очень широкая, ширина может достигать ширины тела. Эпихон неровный, обычно с тремя глубокими складками и четкими карманами; гипохон ровный, без продольных складок, имеющихся у параоксихон. Гипоколлюм проходит по дорзальной или по обеим сторонам тела. РПА обычного, не инверсного типа. Пелликула исчерчена, со складками
или с рядами папилл; исчерченпых пластинок экзоскелета пет. Защитный аппарат: 1—3 пары латеральных шипов ПВ и мелкие зубчики по краям ПВ, особенно на эпихоне. Ампула мелкая, округлая; эндостил крупный, особенно у A. insecta. Стебелек
Рис. 177. Dentichona marginata. А — с Nebalia II; Б—И — с Nebalia IV.
длинный, может по длине превышать тело; поперечные складки и канал различимы лишь в верхней части стебелька. Ма массивный, овальный. Сумка глубокая, вмещает всего томита.
Род близок к стилохонам, флектихонам и оксихонам. В отличие от Stylochona стебелек удлинен, тело более симметричное (поскольку левое плечо оттянуто далеко в сторону), сумка очень глубокая, ПВ несет латеральные шипы. В отличие от Oxychona стебелек не столь удлинен, тело не вытянуто, ампула и эндостил иного типа, ПВ значительно шире, карманы и складки лучше развиты; эти роды нельзя объединить.
Род Armichona очень близок к Flectichona, отличаясь практически лишь наличием латеральных шипов IIU; в сахалинских сборах найдена форма типа F. filicauda, по с мелкими шипиками. Армихон с полимеризацией шипов (A. hexadenta), с другой стороны,
Рис. 178. А—И — Flectichona crenata с Nebalia VI; К, Л — F. filicauda с Nebalia II.
трудно объединить с флектихонами. Род Armichona пока провизорный; возможно, что виды рода составят в будущем особый подрод рода Flectichona.
С 3 новыми видами — A. gibbosa (типовой вид), A. insecta и A. hexadenta, обитающими на поверхности щупика максиллулы Nebalia-, встречаются на Мурмане, Камчатке, Сахалине, Путятине. Никогда не встречаются совместно с флектихонами, заменяя их.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА ARMICHONA
1 (4). Латеральных шипов одна пара.
2 (3). Тело горбатое, шейка редуцирована........................2. A. gibbosa.
3 (2). Шейка узкая, ПВ пе втянута в тело.........................1. A.insecta.
4 (1). ПВ с 3 парами латеральных шипов........................3. A. hexadenta.
1. Armichona insecta Jankowski sp. nov. (рис. 9, 2>; 179, А—Г).
Некрупные формы с почти пятиугольным телом, левый край часто с небольшой вырезкой. Шейка четкая, узкая, в 3—4 раза уже ПВ, тело не выглядит горбатым. ПВ широкая, с исчерченной стенкой и мелкими зубчиками. Пелликула с продольными складками, часто с боковыми насечками. Латеральные шипы ПВ развиты слабо. Пластинки эндостила массивные, вероятно самые крупные (по отношению к длине тела) у эндогеммин, обычно составляют 1/i длины тела.
Размеры. Длина особи 49—60 мк, до края гипохона 47—55 мк, до вершины сумки 32—41 мк, до дна 9—15 мк; L : D=1.5 : 1; высота эпихона 2—5 мк; размеры тела 34—44X X32—41 мк, шейки 2—3X11—12 мк, ПВ (от сумки до вершины) 13—17X33—38 мк; длина шипов до 3 мк, ампулы 3—4 мк; диам. диска 6—7 мк; размеры эндостила 9—11 X 12—15 мк, стебелька 50—84x3—3.5 мк, Ма 13—17X9— 10 мк, сумки 18—20x9—11 мк, томита 21 — 27X11—13 мк.
Шипы не полимеризованы, как у А. hexadenta-, в отличие от A. gibbosa тело без рядов папилл, не горбатое, эндостил крупнее, шипы мельче.
Локус и хозяин — щупик максиллулы Nebalia III; заселена поверхность щупика, часть особей переходит на латеральные и дистальные щетинки в их нижней половине. Вид обычный, массовый.
Распространение. Камчатка, Авачинская губа, глуб. 19 м. Сходные формы найдены на сублиторали о. Кильдин на Nebalia I (рис. 150, Б, В).
2. Armichona gibbosa Jankowski sp. nov. (рис. 3, Я, P- 10, Д; 11, Ж; 18, В, Г; 19, Б; 27, А; 151, Г; 180; 192, Ж).
Некрупные формы с угловатым, несколько мешковидным телом; края тела вогнуты, левый край с заметной вырезкой. Шейка широкая, практически редуцирована; дорзальная часть тела горбовидная, ПВ наклонена к вентральной стороне. Все тело, включая стенки сумки и эпихон, покрыто рядами крупных папилл. Латеральные шипы массивные, острые; обычно различимы мелкие маргинальные зубчики и более длинные шипы по краям карманов. Ампула непропорционально мелкая, эндостил относительно небольшой; стебелек короче тела, стилонемы и канал различимы лишь в его верхней части.
Размеры. Длина особи 40—51 мк,
Рис. 179. Armichona insecta с Nebalia III.
до края гипохона 36—47 мк, до вершины
сумки 35—40 мк, до дна 8—11 мк; L : D=l—1.2 : 1; высота эпихона 4.5—6 мк; размеры тепа 35—40Х 32—45 мк, шейки 0.5—1X 12—13 мк, ПВ (от сумки до вершины) 14—18Х X 27—38 мк; длина правого плеча 18—20 мк, левого 10—12 мк, шипов 14—18 мк, маргинальных зубчиков менее 1 мк, боковых 2—2.5 мк, папилл 0.5—1 мк, ампулы 2—4 мк,
эндостила 3.5—4.5 мк, септы 8—10 мк; диам. диска 4—4.5 мк; размеры стебелька 27— 41x2—2.2 мк, Ма 13—16X9—10 мк, сумки 26—31X13—14 мк, томита 27—30X11 — 13 мк.
Шипы не полимеризованы, как у А. hexadentcr, в отличие от А. insecta тело горбатое, с рядами папилл, шипы крупнее, эндостил меньше, стебелек тоньше.
Локус и хозяин — щупик максиллулы Nebalia IV; сетобионты не найдены. Вид обычный, придаток несет 10—20 особей.
Распространение. Японское море, о. Путятин, литораль, глуб. 1 м.
Рис. 180. Armichona gibbosa с Nebalia IV.
3. Armichona hexadenta Jankowski sp. nov. (рис. 9, Б; 150, Г).
Очень крупные формы с широким мешковидным телом, без латеральных вырезок. Шейка четкая, узкая, тело не сгорблено. Папилл нет. Латеральные шипы полимеризованы (3 пары). Стебелек толстый, со стилонемами, несколько короче тела. Эндостил массивный.
Размеры. Длина особи 82—85 мк, до края гипохона 75—77 мк, до вершины сумки 60—62 мк, до дна 14—21 мк; L : D=l.,6 : 1; высота эпихона 7—8 мк; размеры тела 61 — 64x52—55 мк, шейки 1—2X13—15 мк, ПВ (от сумки до вершины) 16—18Х X 43—46 мк; длина шипов до 4 мк; эндостила 10 мк; диам. диска 10 мк; размеры стебелька 57—63X3 мк, Ма 22—24X12 мк, сумки 38—40X 18—20 мк, томита 30—ЗЗХ X 16—19 мк.
Отличия от A. insecta и А . gibbosa'. резкое укрупнение тела, полимеризация шипов ПВ; тело не горбатое, без папилл.
Локус и хозяин — поверхность щупика максиллулы Nebalia I; вид очень редкий, найдены всего 3 особи (трофонт и 2 трофотомопта).
Распространение. Баренцево море, о. Кильдин, глуб. 10.5—21 м.
6. Род OXYCHONA Jankowski, 1973
Очень крупные формы с резко сплющенным, листовидным, почти пластинчатым телом; тело очень широкое, удлиненное, длина его значительно больше ширины. Шейка узкая, четкая. ПВ высокая и относительно неширокая, у О. multifida уже тела, не растянута в стороны. Вентральных складок нет; эпихон с тремя продольными складками и довольно слабо выраженными карманами. РПА обычного, не инверсного типа. Гипоколлюм дорзальный. Пелликула не исчерчена, без папилл; пластинок экзоскелета нет, хотя кутикула ПВ,шейки и нижней части тела резко утолщена. Шипы отсутствуют у примитивной О. suprema, появляются у сахалинской Oxychona sp. и особо развиты у О. multifida-, соматические зубцевидные шипы покрывают не весь край тела, а лишь верхние 2/3; развиты также латеральные шипы ПВ. Ампула массивная, эндостил трубчатый, не треугольный, как у флектихон. Стебелек широкий, с четкими стилонемами и каналом, непропорционально длинный — до 650 мк (максимальная длина у хонотрих), обычно в 2—3 раза длиннее тела. Ма каплевидный, сужающийся кверху. Сумка относительно неглубока у О. suprema, вмещает всего томита у О. multifida.
Род включает стебельчатые формы (отличие от Ctenochond) без крыловидных выростов тела (отличие от Pterochona), близок к Paraoxychona, Eriochona и Flectichona-, РПА не инверсный, как у параоксихон, стебелек длиннее, чем у эриохон, шипы покрывают не весь край тела; в отличие от флектихон и армихон тело и стебелек резко удлинены, имеется тенденция к развитию соматических шипов; все перечисленные роды отличаются и по морфологии эндостила и ампулы.
С 2 видами —О. multifida (типовой вид) и О. suprema, обитающими на щетинках экзоподита торакопод Nebalia, собранных на литорали островов Путятин, Шикотан и Итуруп; форма с Сахалина составит, возможно, третий вид. На Nebalia sp. в Вакаяма-кен (Япония) Ленгом отмечены типичные бесшиповые О. suprema.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА OXYCHONA
1 (2). Имеются соматические и латеральные шипы..........2. О. multifida.
2 (1). Шипы отсутствуют..................................1. О. suprema.
1. Oxychona suprema Jankowski sp. nov. (рис. 10, R; 181, А, Б).
Тело несколько веретеновидное, расширено в середине; края тела с небольшой насечкой, не параллельны; выемка лежит в зоне вершины бесшиповой кутикулярной пластинки О. multifida. ПВ очень широкая; латеральных и соматических шипов нет. Сумка неглубокая.
Размеры. Длина особи 80—87 мк, до края гипохона 78—81 мк, до вершины сумки 57—65 мк, до дна 32—36 мк; L : D=2.7 : 1; высота эпихона 4—5 мк; размеры тела 59—67Х 29—33 мк, шейки 2Х 11—12 мк, ПВ (от сумки до вершины) 18—22Х 30— 36 мк; длина ампулы 14—17 мк, эндостила 6—7 мк; диам. диска 5 мк; размеры стебелька 120—622Х 2.2—2.8 мк, Ма 18—22Х 9—11 мк, сумки 29—ЗОХ 14—15 мк, томита 34—40X12—15 мк.
Тело более веретеновидное, чем у О. multifida, без шипов, с более широкой ПВ и с относительно неглубокой сумкой, вмещающей около 3/4 томита.
Локус и хозяин — основание щетинок экзоподита Nebalia II; особи немногочисленны, 5—10 на придатке. Массовые поселения оксихон (порядка 25 особей на придатке) отмечены Ленгом на эпиподите (не экзоподите) Nebalia sp. из Японии; внешне это типичные О. suprema, но, судя по необычному локусу, это может быть другой вид рода. Сахалинская раса, по морфологии промежуточная между О. suprema и О. multifida-, имеет немногочисленные шипы.
) Распространение. Курильские о-ва, о. Шикотан, кут бухты Анама, литораль (на Nebalia II).
2. Oxychona multifida Jankowski, 1973 (рис. 3, У, Ф; i, Г; 10, Е; 15, А—Г; 43, И; 181, В—Ж’, 182, Г- 185, А; 186, А).
Тело не веретеновидное, с почти параллельными краями, без боковых насечек. ПВ относительно небольшая, значительно уже тела, с латеральными шипами; края тела (кроме нижней трети) несут зубцевидные шипы. Сумка очень глубокая, вмещает всего томита.
Размеры. Длина особи 78—94 мк, до края гипохона 73—88 мк, до вершины сумки 68-83 мк, до дна 32—35 мк; L : D=3 : 1; высота эпихона 5—6 мк; размеры тела
62—72X33—39 мк, шейки 3—4X9—12 мк, ПВ (от сумки до вершипы) 20—26x20— 27 мк; длина соматических шипов 4—5 мк, латеральных 3.5—4.5 мк, ампулы 7—10 мк, эндостила у томитов 14—15 мк, у трофоптов 8—10 мк; размеры стебелька 180—648Х Х2—3 мк, Ма 18—21X9—12 мк, сумки 34—39Х 12—16 мк, томита 27—29X9—10 мк.
Рис. 181. А, В — Oxychona suprema с Nebalia II; В—Ж — О. multifida с Nebalia IV.
В отличие от О. suprema тело шире, с параллельными краями, ПВ меньше; развиты соматические и латеральные шипы.
Локус и хозяин — основание щетинок экзоподита торакопод Nebalia IV; особи немногочисленны, 5—10 на придатке.
Распространение. Японское море, о. Путятин, литораль, глуб. 1 м.
7. Род ERIOCHONA Jankowski gen. nov.
Очень крупные формы с вытянутым листовидным, веретенообразным или почти овальным, не ромбическим (как у оксихоп) телом. Шейка узкая, вытянутая. ПВ очень высокая и широкая. Вентральных складок пет; эпихон с очень глубокими складками и прекрасно развитыми, отогнутыми далеко назад карманами. РПА обычного, не инверсного типа. Гипоколлюм дорзальный. Пелликула с рядами папилл у Е. horrida, ровная у Е. glacialis. Пластинок экзоскелета нет. Прекрасно развито вооружение: соматические зубцевидные или вытянутые шипы усеивают весь край тела, до основания;
Рис. 182. А—В — Eriochona glacialis a Nebalia III; Г — Oxychona multifida c Nebalia IV.
латеральные шипы у Е. horrida полимеризованы. Края ПВ исчерчены, зазубрены. Ампула овальная, эндостил относительно небольшой, не вытянут. Стебелек широкий, длина достигает длины тела. Ма угловатый, вытянут по оси тела, заходит в шейку, иногда и в ПВ. Сумка глубокая, вмещает всего томита.
Род близок к Oxychona, Рaraoxychona и группе Flectichona-f-Armichona. В отличие от двух последних родов имеются соматические шипы; РПА не инверсный, как у параоксихон. В отличие от оксихон полимеризованы и латеральные и соматические шипы, покрывающие весь край тела.
Род Eriochona близок к вторичнобесстебельчатой Ctenochona, род Oxychona — к Paraoxychona', уже из-за наличия таких комплексов объединять оксихон и эриохон в одном роде не следует.
С 2 видами — Е. horrida (типовой вид) и Е. glacialis, обитающими на щупике максиллулы Nebalia с Мурмана и Камчатки.
1/121 Заказ № 213
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА
ERIOCHONA
1 (2). Имеется одна пара латеральных шинов НВ.................1. Е. glacialis.
2 (1). Латеральные шипы полимеризованы........................2. Е. horrida.
1. Eriochona glacialis Jankowski sp. nov. (рис. 3, X; 9, 77; 182, A—В).
Тело относительно неширокое; ПВ очень высокая, с крыловидными дорзальными складками. Края тела несут 12—15 пар шипов, длина которых уменьшается к нижнему и верхнему концам; шипы зубцевидные, с широким основанием. Два мелких латеральных шипика смещены вниз, лежат практически на шейке (на границе с ПВ), ниже уровня рта (у оксихон намного выше). Пелликула без складок и папилл.
Размеры. Длина особи 83—90 мк, до края гипохона 72—84 мк, до вершины сумки 49—61 мк, до дна 30—35 мк; L : D=3 ; 1; высота эпихона 9—11 мк; размеры тела 60—71X30—32 мк, шейки 5—7 Х9—10 мк, ПВ (от сумки до вершины) 36—40Х ХЗО—36 мк; длина соматических шипов 4—5.5 мк, латеральных 2—2.5 мк, ампулы 7— 9 мк, эндостила 4—5 мк; диам. диска 5—6 мк; размеры стебелька 70—90x2.8—3 мк, Ма 17—21x9—10 мк, сумки 34—36x10—15 мк, томита 35—38x12—13 мк.
В отличие от Е. horrida соматические шипы не удлинены, латеральные не полимеризованы; нет рядов папилл, ПВ относительно выше.
Локус и хозяин—щупик максиллулы Nebalia III; вид очень редкий, найдены лишь 2 трофотомонта и 1 растущий трофонт без сумки.
Распростране ни е. Камчатка, Авачинская губа, глуб. 19 м.
2. Eriochona horrida Jankowski sp. nov. (рис. 3, Ц; 9, Б; 150, А).
Тело широкое; ПВ пропорционально высокая, растянута в стороны, с хорошо развитыми карманами, не отогнутыми столь далеко на дорзальную сторону тела, как у Е. glacialis. Края тела несут по 14—15 удлиненных, но не игольчатых шипов, длина которых уменьшается книзу. Латеральные шипы полимеризованы (3—5 пар), также удлинены, занимают края ПВ от полосы А до границы с шейкой. Пелликула с продольными рядами папилл. с
Размеры. Длина особи 80—86 мк, до края гипохона 73—76 мк, до вершины сумки 57—63 мк, до дна 20—28 мк; L : D=2.5 : 1; высота эпихона 7—8 мк; размеры тела 60—66x34—37 мк, шейки 4—5x8—10 мк, ПВ (от сумки до вершины) 20—23х Х32-—35 мк, соматических шипов 8—10х 2.5—3 мк, латеральных 5—7Х 1.5—2 мк; длина ампулы 3.5—4 мк, эндостила 5—7 мк; диам. диска 6—7 мк; размеры стебелька до 68x3 мк, Ма 18—20x9—11 мк, сумки 32—36X12—16 мк, томита около 37x14 мк.
В отличие от Е. glacialis шипы тоньше, тело шире, ПВ не столь высока, латеральные шипы ПВ полимеризованы (что редко у эндогеммин).
Локус и хозяин — поверхность щупика максиллулы Nebalia I; вид редкий, найдено всего 6 особей (3 из них — растущие трофонты).
Распространение. Баренцево море, о. Кильдин, глуб. 10.5—21 м.
8. Род PARAOXYCHONA Jankowski gen. nov.
Крупные вытянутые формы с широким телом, слегка сужающимся к верхнему концу и заостряющимся к нижнему. Шейка узкая, короткая. ПВ треугольная, очень высокая, несколько уже тела. Гипохон с двумя продольными складками, участок между которыми впячивается глубоко в полость ПВ, несет шипик; различимы два широких вентральных кармана. Эпихон также высоко поднят, со складками и шипом. Края ПВ ровные или слегка волнистые, без зубчиков. РПА инверсного типа: зона В намного крупнее, чем у оксихон, смещена с эпихона на участок гипохона, вогнутый внутрь ПВ; зоны А' и А" разорваны вентральными складками на две части. Гипоколлюм дорзальный. Пелликула без складок и папилл. Пластинок экзоскелета нет. Соматических и латеральных шипов нет. Трофоплазма не доходит до краев тела, особенно .в нижней части особи. Ампула сферическая, некрупная; эндостил цилиндрический, узкий. Стебелек в несколько раз длиннее тела. Подошвы нет. Ма овальный. Сумка очень глубокая, вмещает всего томита; ее вентральная и дорзальная стенки разросшиеся, образуют своеобразные защитные щитки.
В отличие от эриохон и высших (шипоносных) оксихон нет шипов по краям тела и ПВ, развиты выросты краев сумки. В отличие от всех стилохонид РПА инверсного типа; это очень важный признак, исключающий возможность объединения оксихоп и параоксихон в один род.
С 1 (типовым) видом Р. inverse, обитающим на торакоподах расы Nebalia с Итурупа. Интересно отметить, что на этих рачках живут еще 2 вида с инверсией РПА — Pleochona coronata и Chonosaurus rex, относимые к другому семейству (Inversocho-nidae).
Рис. 183. Paraoxychona inversa с Nebalia V.
1. Paraoxychona inverse Jankowski sp. nov. (рис. 9, E; 183).
С признаками рода.
Размеры (измерена лишь 1 особь). Длина особи 97 мк; ширина тела 52 мк, шейки 12 мк, 11В 45 мк; высота эпихона 9 мк; размеры ампулы 9—10.5X 7 мк, эндостила 7—9x7 мк, стебелька 240x3.5 мк, Ма 11X12 мк, томита 33x16 мк.
Локус и хозяин — основание щетинок экзоподита торакопод Nebalia V; вид очень редкий, найдено всего 2 особи (трофонт и томонт).
Распространение. О. Итуруп, зал. Одесский, литораль.
9. Род PTEROCHONA Jankowski, 1973
Очень крупные формы с необычным крестовидным телом; края тела оттянуты далеко в стороны, образуя гигантские крыловидные шипы. Шейка относительно неширокая, короткая. ПВ крупная, резко растянута в стороны; гипохон без складок, эпихон с 4 очень глубокими складками, ограничивающими дорзальный карман и 2 боковых кармана, отогнутых далеко назад; особенно развит левый карман. Участки эпихона между карманами вдаются глубоко в полость ПВ и наклонены к гипохону. РПА не инверсного, обычного типа. Гипоколлюм не выражен. Пелликула ПВ и верхней половины тела с папиллами, особо крупными на стенках воронки. Исчерченных пластинок экзоскелета нет. Вооружение: крыловидные шипы, зубцевидные многочисленные шипы по верхнему краю «крыльев», мелкие апикальные шипики по краям ПВ. Стенки ПВ, особенно эпихон, продольно исчерчены. Ампула широкая, крупная, эндостил тонкий и длинный, без септы. Стебелек неширокий, несколько короче тела, стило-немы и канал различимы по всей его длине, особенно хорошо в верхней части. Сумка очень глубокая, вмещает томита.
Род бесспорный, четкий, близок к оксихонам: крыловидные выросты соответствуют самым нижним шипам оксихон и дентихон, а зубчики по верхнему краю «крыльев» — всем остальным шипам оксихон. У предка птеро-хон разрослись зоны А, С, сузилась зона В (рис. 186, А).
С 1 (типовым) видом Р. pacifica, обитающим на щупике максиллулы Nebalia в Японском море у Владивостока. Более простой вид с неширокими «крыльями» и, видимо,
без соматических шипов (рис. 186, Б) найден Лёнгом на латеральных щетинках щупика максиллулы Epinebalia sp. в США (Вашингтон, о. Сан-Хуан).
1. Pterochona pacifica Jankowski, 1973 (рис. 4, В; 10, Д; 22, А; 28, А; 184; 185, В—Е- 186, В—Л).
С признаками рода.
Размеры. Длина особи 107—120 мк, до края гипохона 97—102 мк, до внутреннего края сумки 78—84 мк, до наружного края 63—68 мк, до дна 32—38 мк; размах крыльев 117—123 мк; L : D=1.3 : 1; размеры тела 83—93x50—63 мк, шейки 3—4.5Х Х14—18 мк, ПВ (от сумки до вершины) 29—36x47—63 мк, крыльев до 25x4—6 мк; высота эпихона 16—19 мк; длина шипоносной зоны 20—22 мк, зубцов 1—1.5 мк, ампулы 17—19 мк, протока 2—4 мк, эндостила 9—10.5 мк; диам. диска 6—6.5 мк; размеры стебелька 50—57х 2 мк, Ма 18—22 X 12—14 мк, сумки 43—49x21—44 мк, томита 36—38x16—21 мк.
Локус и хозяин — поверхность щупика максиллулы Nebalia IV; заселен только ограниченный участок у основания щупика (рис. 184, А). Встречается постоянно, но в небольшом числе особей.
Распространение. Японское море, о. Путятин, глуб. 1 м.
10. Род CTENOCHONA Jankowski gen. nov.
Аберрантные формы с некрупным, очень широким и невысоким щитковидным телом, не вытянутым, как у большинства стилохонид. Трофоплазма далеко не доходит до края, оставляя широкий светлый киль. Шейка довольно узкая, низкая, ПВ крупная, 21 Заказ № 213
Рис. 184. Pterochona pacifica c Nebalia IV.
Рис. 185. Эндогеммины с Nebalia IV. А — Oxychona multifida; Б Dentichona marginata; B — E — Pterochona pacifica.
no по ширине уже тела; гипохон без складок, эпихон с 2—3 неглубокими продольными складками, дорзальным карманом и очень плохо развитыми боковыми карманами. На всем протяжении кран НВ гофрирован, зазубрен. РПА не инверсный, обычного типа. Гппоколлтом проходит по обеим сторонам тела. Защитный аппарат: зубцевидные шипы но всему краю тела до основания, 3—5 пар более длинных латеральных шипов ПВ, мелкие маргинальные шипики эпи- и гипохона. Часть латеральных шипов
Рис. 186. А —Oxychona multifida с Nebalia IV; Б — Pterochona sp. с Epinebalia sp. (по Лёнгу); В—Л — Pterochona pacifica с Nebalia IV. а, б, в — гомологичные участки тела.
смещена на стенки боковых карманов ПВ. Пелликула без складок и папилл. Исчерченных пластинок экзоскелета нет. Стебелька нет, имеются субтерминальная ножка и подошва; ампула овальная, мелкая, эндостил дисковидный. Ма овальный. Сумка очень глубокая, вмещает томита, при диминуции — одновременно 3 томитов (не вытесняемых на поверхность тела, как обычно у эндогеммин); наружный край сумки оттянут далеко в сторону, имеет вид киля, вооруженного шипами.
От всех остальных стилохонид род отличается вторичной утратой стебелька, развитием подошвы. Род близок к высшим стилохонидам типа Eriochona horrida; вооружение тела и ПВ у этих форм однотипно, но они настолько отличаются по внешнему облику и прикрепительному аппарату, что объединить их в один род невозможно.
С 1 (типовым) видом C. ternipara, обитающим на щупике максиллулы Nebalia на Итурупе; вероятно, эндемик фауны СССР.
1. Ctenochona ternipara Jankowski sp. nov. (рис. 4, A, Б; 9, Д; 187, A—Г).
С признаками рода.
Размеры. Длипа особи 49—60 мк, до края гипохона 44—55 мк, до вершины сумки 29—43 мк, до дна 8—10 мк; L : D=1 : 1; высота эпихона 3.5—5 мк; размеры тела
Рис. 187. А—Г — Ctenochona ternipara с Nebalia V; Д—Ж — Ceratochona cimex с Nebalia II.
27—40x45—55 мк, шейки 1.5—2X9—10.5 мк, ПВ (отсумки до вершины) 15—21 хЗЗ— 37.5 мк; длина правого плеча 16—17 мк, левого 15—17 мк, соматических шипов 3.5 — 4.5 мк, латеральных 6—9 мк, маргинальных менее 1 мк; ширина левого киля 5— 6.5 мк, правого (до стенки сумки) 7—8 мк; розетка, диам. 6—7.5 мк, на 6—9 мк сдви
нута от края тела; размеры Ма 13—15x10 мк, сумки 28—30x13—16 мк, томита 23— 29X12—14 мк.
Локус и хозяин — поверхность щупика максиллулы Nebalia V; заселена в основном проксимальная часть, средняя и дистальная части заняты видом Coronochona. Вид обычный, но не массовый, обычно 5—10, максимум 15—16 особей на одном придатке, до 32 на особи рачка.
Распространение. О. Итуруп, зал. Одесский, литораль.
IV. Семейство ECHI NICHO NIDAE Jankowski fam. nov.
Мелкие и крупные формы с ромбическим или веретеновидным телом, резко сплющенным дорзо-вентрально. Шейка четкая, узкая и обычно невысокая. ПВ высокая и очень широкая, примерно такой же ширины, как тело, резко сплющена дорзо-вентрально, не коническая, края эпи- и гипохона почти параллельны. Гипохон без продольных складок; эпихон ровный, также без складок или всего с одной, едва различимой III складкой левее зоны В, обычно не доходящей до края стенки. Нет ни дорзального, ни боковых карманов ПВ. РПА не инверсный, обычного типа; зона В почти рудиментарна. Гипоколлюм дорзальный. Пелликула ровная, редко с продольными складками и папиллами. Утолщенные участки кутикулы без поперечной исчерченности. Шипы едва намечены или отсутствуют у низших форм; у высших удлиняются зубчики ПВ, появляются соматические (у части видов Echinichona) и латеральные (у Coronochona) шипы. Прикрепительный аппарат: стебелек у Eurychona и Echinichona (до 1/3— х/2 длины тела), субтерминальная ножка у вторичнобесстебельчатой Coronochona. Ампула и эндостил разного типа у разных родов; стебелек всегда со стилонемами. Ма вытянут по оси тела. Сумка очень глубока, обычно вмещает всего томита; Echinichona имеет, по-видимому, наиболее глубокую сумку среди эндогеммин. Стробилы (при диминуции) с 2—3 томитами. Поскольку плоская ПВ с полной редукцией складок и карманов встречается только у группы близкородственных родов эндогеммин, эти формы желательно отделять от других в составе особого семейства Echinichonidae.
С 3 родами, составляющими ортогенетическую линию Eurychona—Echinichona (типовой род) — Coronochona. Заселяют щетинки и щупик максиллулы Nebalia в Японском море, на юге Сахалина и на южных Курильских островах.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА ECHINICHONIDAE
1 (4). Стебельчатые формы.
2 (3). Тело мелкое, ромбическое, наиболее широкое на уровне шейки; ПВ вазообразная ...........................................1. Род Eurychona (стр. 327).
3 (2). Тело крупное,..........................веретеновидное, наиболее широкое в среднем отделе; ПВ треугольная 2. Род Echinichona (стр. 329).
4 (1). Стебелька нет, имеется ножка...........3. Род Coronochona (стр. 331).
1. Род EURYCHONA Jankowski gen. nov.
Мелкие бокаловидные формы с широким телом, равномерно расширяющимся к вершине сумки. Отверстие сумки почти прямое, незначительно скошено; левое плечо также прямое, тело более или менее симметрично. Шейка узкая, четкая, иногда несколько удлинена. ПВ непропорционально крупная, высокая, обычно достигает ширины тела. Гипохон прямой, эпихон ровный или с небольшой выемкой в центре, над зоной В. Стенки ПВ несут лишь одну, иногда удлиненную складку левее зоны В; края ПВ зазубрены, причем зубчиков больше на эпихоне, где они мельче зубчиков гипохона. Соматических и латеральных шипов нет. Гипоколлюм треугольный, высокий, обычно доходит до уровня рта. Пелликула ровная, без складок и папилл. Ампула мелкая, округлая или вытянутая; хорошо развита септа; пластинки эндостила мелкие, расширены в верхней части. Стебелек относительно длинный (^/3 или несколько более длины особи), широкий, гофрированный; стилонемы сливаются в верхней части. Сумка вмещает всего томита, но в целом намного мельче, чем у Echinichona.
Это наиболее примитивный род эхинихонид; в отличие от Echinichona тело меньше, сумка мельче, ПВ не треугольная, нет тенденции к образованию соматических шипов; в отличие от Coronochona нет шипов и ножки, имеется стебелек, ПВ не треугольная. От Stylochona род отличается отсутствием складок и карманов эпихона, латеральных вырезок по краям тела, формой ПВ и тела: плечи почти прямые, равные (у стилохон резко неравные)^ тело относительно симметрично.
С 1 (типовым) видом E. vitrea, найденным па щетинках щупика максиллулы Nebalia па литорали Шикотана и Итурупа.
1. Eurychona vitrea Jankowski sp. nov. (рис. 4, Д\ 9, Д; 10, 3; 188, В—3).
С признаками рода.
Размеры. Длина особи 55—67 мк, до края гипохона 50—53 мк, до вершины сумки 29—37 мк, до дна 9—12 мк; L : D=2 : 1; высота эпихона 5—7.5 мк; размеры тела
Рис. 188. А, Б — Echinichona simplex с Nebalia II; В — 3 — Eurychona vitrea с Nebalia V (В, Г) и Nebalia II (Д—3).
33—43 Х24—33 мк, шейки 2.5X9 мк, ПВ (от сумки до вершины) 10.5—15x27—34 мк; длина левого плеча 6—7.5 мк, правого 11—13 мк, ампулы 3—4.5 мк, эндостила 3—
4.5 мк; диам. диска 6 мк; размеры стебелька 18—24x2—2.2 мк, Ма 12 — 15 Х8—10.5 мк, сумки 22—25x13—14 мк, томита 23—31x13—15 мк.
Локус и хозяева — латеральные и, что более характерно, дистальные щетинки щупика максиллулы Nebalia V (типовом хозяин) и Nebalia II; вид обычный, массовый. На втором хозяине встречается совместно с Stylochona setaria (редчайший случай совпадения локусов).
Распространение. О. Шикотан, кут бухты Анама, литораль (на Nebalia II); о. Итуруп, зал. Одесский, литораль (на Nebalia V).
2. Род ECHINICHONA Jankowski, 1973
Очень крупные формы с вытянутым веретеиовидным телом, наиболее широким в средней части и резко сужающимся к шейке и стебельку. Шейка узкая и не столь высокая, как нередко у Eurychona. Тело почти симметрично, но плечи резко неравны по величине: правое (верхний край сумки) во много раз шире левого. ПВ гигантская, треугольная, такой же ширины, как тело, а нередко и шире; эпихон почти вплотную прилегает к гипохону, края их почти параллельны. При укрупнении ПВ зона В осталась мелкой, едва заметной. Пелликула ровная, редко с едва различимыми складками. Гипоколлюм дорзальный; складка выгнутая, не треугольная. Шипы отсутствуют у примитивной Е. simplex (хотя обычно зазубрены края тела и ПВ) и хорошо развиты у Е. regina, имеющей небольшие зубцевидные соматические и маргинальные шипы. Ампула резко вытянута, крупная; эндостил неширокий, трубчатый. Длина стебелька достигает половины длины тела; отношение длины особи к длине стебелька (1 : 0.33— 0.37) совпадает у Eurychona и Echinichona. Септы между ампулой и эндостилом нет. Сумка обширная, вмещает всего томита у Е. regina.
От примитивной Eurychona род отличается большими размерами, веретеновидной формой тела, треугольной ПВ, иной структурой ампулы и эндостила, развитием шипов. В отличие от Coronochona тело не мешковидное, имеется стебелек.
С 2 видами — Echinichona regina (типовой вид) и Е. simplex, обитающими на вершине дистальных щетинок щупика максиллулы Nebalia, собранных на Сахалине, Шикотане и Путятине.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА ECHINICHONA
1 (2). Края тела и ПВ с развитыми шипами...........................2. Е. regina.
2 (1). Шипов нет либо имеются мелкие зубцы .......................1. Е. simplex.
1. Echinichona simplex Jankowski sp. nov. (рис. 10, 3; 188, А, Б).
Тело угловатое, почти пятиугольное, более или менее равномерной ширины в верхней половине, плавно сужается книзу. ПВ исключительно широкая, всегда шире тела. Края тела и ПВ ровные у сахалинской расы, с небольшими зубцами у шикотанской расы, особенно по левому краю. Сумка крупная, вмещает 2 3/4 томита.
Размеры. Длина особи 93—105 мк, до края гипохона 83—100 мк, до вершины сумки 69—73 мк, до дна 30—33 мк; L : D=2.2 : 1; высота эпихона 4—8 мк; размеры тела 70—75x42—46 мк; длина левого плеча 4.5—7 мк, правого 18—23 мк; размеры шейки 1.5x12—15 мк, ПВ (от сумки до вершины) 25—26x54—62 мк; длина соматических зубцов до 2 мк, ампулы 13.5—17 мк, эндостила 6—8 мк; диам. диска б.8 мк; размеры стебелька 34.5—40\3 мк, Ма 12—16X11—13.5 мк, сумки 33—37X15—16.5 мк, томита 35—41X12—15 мк.
В отличие от Е. regina тело не закруглено, сумка мельче, ПВ шире, шипы не развиты.
Локус и хозяева — дистальный отдел концевых щетинок щупика максиллулы Nebalia II и расы с Сахалина; щетинка несет у первых 5—10, у вторых до 30 особей. В данном локусе, но обычно ниже, встречаются и отдельные особи Eurychona или Stylochona.
Распространение. О. Шикотан, кут бухты Анама, литораль (типовая раса, на Nebalia II); Японское море, южный Сахалин, лагуна Буссе, иловые отмели (на Nebalia sp.).
2. Echinichona regina Jankowski, 1973 (рис. 4, E; 10, Д-, 11, Ж; 21, Ж; 189; 190; 191, A).
Контуры тела плавно закругленные, с резким сужением к шейке и стебельку; ширина ПВ не превышает ширины тела. Края сумки иногда подняты, образуют защитную пластинку. Превосходно развиты зубцевидные соматические шипы (10— 14 пар), обычно разной длины и формы; ПВ несет 2—4 пары крупных боковых шипов, крупные зубчики эпихона и мельчайшие, многочисленные зубчики гипохона. Ветре-
чаются популяции аиактинид (рис. 191, А), вероятно на предлинечиых рачках. Сумка исключительно глубока, с очень широким отверстием.
Размеры. Длина особи 96—123 мк, до края гипохопа 95—109 мк, до вершины сумки 78—94 мк, до диа 32—40 мк, до наружного края 66—83 мк; L : D=1.6 : 1; вы-
Рис. 189. Echinichona regina с Nebalia IV.
сота эпихона 7.5—11 мк; размеры тела 82—97x54—65 мк; длина левого плеча 7.5— 8 мк, правого 25—28 мк; размеры шейки 1—2X15—19 мк, ПВ (от сумки до вершины) 25—28x62—74 мк; длина соматических шипов 5—8 мк, вентральных менее 1 мк, -дорзальных 1.5—2 мк, боковых 3.5—5 мк, ампулы 15—18 мк, эндостила 7.5—10 мк; диам. диска 7.5 мк; размеры стебелька 35—45X3.5—4 мк, Ма 22—28x10—16 мк, сумки 35—49x22—38 мк, томита 38—41x15—21 мк.
Отличия от Е. simplex-, развитие шипов, глубокая сумка, не столь широкая ПВ.
Локус и хозяин — дистальный отдел концевых щетинок щупика максиллулы Nebalia IV; вид обычный, щетинка песет 5—10 особей. В том же локусе изредка встречаются особи Spinichona horrida.
Р аспр остр анепие. Японское море, о. Путятин, литораль, глуб. 1 м.
Рис. 190. Echinichona regina о Nebalia IV.
3. Род CORONOCHONA Jankowski gen. nov.
Относительно некрупные формы с очень широким, мешковидным, несимметричным телом; левое плечо небольшое, правое необычно крупное, оттянуто далеко в сторону; оба плеча почти горизонтальны. Шейка низкая и широкая, плохо выражена. ПВ непропорционально крупная, растянута в стороны, ширина обычно равна ширине тела. Края ПВ почти параллельны, без складок и вырезок; нет и следа боковых карманов. Форма ПВ треугольная, как у эхинихон. Гипоколлюм дорзальный, образован продолжением стенки сумки. Пелликула ровная, иногда с папиллами и насечками в нижней части. В редких случаях участок между ножкой и краем сумки утолщен и исчерчен.' Края тела без шипов; ПВ с 2 латеральными шипами и с группой маргинальных шипов (16—23 длинных дорзальных, 12—18 мелких вентральных). Ампула очень мелкая, округлая; эндостил короткий, широкий. Ножка низкая, длина ее примерно равна ширине. Сумка очень глубокая, вмещает всего томита; дорзальный край сумки часто разросшийся, пластинчатый. Между стенкой сумки и краем тела лежит толстая прослойка цитоплазмы.
Род отличается от остальных эхинихонид отсутствием стебелька, необычной мешковидной формой тела, утолщением края сумки. ПВ в целом такого же типа, как у Echi-nichona, но несет латеральные и более крупные маргинальные шипы. Вероятно, этопотомок эхинихон, перешедших к планибиозу.
С 1 (типовым) видом С. pectinata, обитающим на максиллуле Nebalia V (Итуруп); род, вероятно, эндемичен для фауны СССР.
1. Coronochona pectinata Jankowski sp. nov. (рис 4, Ж, 3; 9, Д; 192, А—Д).
С признаками рода.
Размеры. Длина особи 45—57 мк, до края гипохона 35—52 мк, до вершины сумки 40 мк, до дна 13—14 мк; L : D=1 : 1; высота эпихона 4.5—7 мк; размеры тела 30—39x45—52 мк, шейки 1.5—2x12—15 мк; длина левого плеча 7—14 мк, правого 25—33 мк; размеры ПВ (от сумки до вершины) 15—18x45—58 мк, латеральных ши
пов 2.5—5x3 мк; длина вентральных шипов 1 мк, дорзальных 3—4 мк, ампулы 3— 4.5 мк, эндостила 3—4.5 мк; размеры ножки 2.5—6x3 — 6 мк, Ala 14—16x8—12 мк, сумки 27—30 Х13 —16.5 мк, томита 25—27X12 —15 мк; высота щитка сумки 7 — 8.5 мк; расстояние между полостью сумки п правым краем тела 7.5 — 9 мк.
Рис. 191. Анактиниды на Nebalia IV. А — Echinichona regina', Б — Dentichona marginata.
Локус и хозяин — поверхность щупика максиллулы Nebalia V; вид обычный, придаток несет 5—10 особей. Встречается совместно с Ctenochona ternipara, в основном в средней и концевой части щупика.
Распространение. О. Итуруп, зал. Одесский, литораль.
Рис. 192. А—Д — Coronochona pectinata с Nebalia V; Е — Ceratochona cimex с Nebalia II; Ж — Armichona gibbosa c Nebalia IV; 3 — Kentrochona nebaliae c Nebalia geoffroyi (no: Doflein, 1897a).
V. Семейство I NVERSOCHONIDAE Jankowski, 1973
Тело сплющено дорзо-вентрально, у большинства родов относительно некрупное, удлинено у примитивных форм с плеопод и укорочено, почти прямоугольное у форм с торакопод. Нет выростов тела и килей в отличие от актинихонид. Плечи узкие у плео-хон, очень широкие, более или менее равные по величине у остальных родов; тело симметрично. Шейка четкая, узкая или умеренно широкая, иногда несколько удлиненная; она редуцирована только у Chonosaurus, ПВ которого как бы втянута в тело. ПВ не коническая, сплющена, растянута в стороны, обычно достигает ширины тела; у высших родов стенки и дно полости утолщены, рот высоко поднят над основанием шейки, ве-стибулюм уменьшен в размерах. Гипохон обычно ниже эпихона, всегда с двумя глубокими продольными складками, участок между которыми вдается в полость ПВ, а иногда и разрастается, образуя щиток. Эпихон часто со щитком; дорзальная стенка ровная, без складок или с небольшими складками. Развиты фактически вентральные, а не дорзальные карманы ПВ. РПА инверсного типа: на эпихоне ресничек нет; зона В перешла на гипохон (на участок, вогнутый внутрь ПВ); зона А разорвана складками гипохона и переместившейся сюда зоной В на две части. Гипоколлюм дорзальный, у плео-хон со всех сторон окружает шейку. Пелликула ровная, без складок и папилл. Исчерченных пластинок экзоскелета нет. Защитный аппарат отсутствует у примитивных Inversochona, хорошо развит у остальных родов; у плеохон развиты гипоколлярные и маргинальные шипы, у остальных — соматические и маргинальные, а часто и базальные. Прикрепление ножкой, расположенной субтерминально (педоморфный признак); семейство включает лишь первичнобесстебельчатые формы. Развита подошва — часть дорзальной стороны тела сплющена, прилегает к субстрату. Ма удлиненный, вытянут у плеохон по оси тела, у остальных родов — поперек тела. Сумка неглубокая, вмещает 1/2—3/4 тела томита. При диминутивном почковании образуется одновременно не более 3 томитов.
Семейство предложено для первичнобесстебельчатых форм с инверсным РПА, субтерминальной ножкой, сплющенными телом и ПВ, с тенденцией к развитию сложных комплексов шипов.
С 5 родами — Pleochona, Inversochona (типовой род), Ceratochona, Kentrochona и Chonosaurus, обитающими на плеоподах и торакоподах 'Nebalia; роды различаются по форме тела, вооружению ПВ и тела. Все роды, кроме плеохон, составляют компактную группу. Семейство в целом, видимо, космополитное: Inversochona и Kentrochona отмечены в Белом море, Адриатике, Англии (Плимут), Калифорнии, Ceratochona и Chonosaurus распространены в дальневосточных морях, найдены на Мурмане.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА
INVERSOCHONIDAE
1 (2). Тело узкое, резко удлинено..............1. Род Pleochona (стр. 334).
2 (1). Тело широкое, низкое, с широкой подошвой.
3 (4). Края тела и ПВ без шипов.............2. Род Inversochona (стр. 336).
4 (3). Имеются шипы по краям тела и ПВ.
5 (6). Дорзальная сторона тела, обращенная к субстрату, несет массивные многочисленные шипы.............,................5. Род Chonosaurus (стр. 345).
6 (5). Дорзальная сторона тела без шипов.
7 (8). ПВ с редкими зубчиками, без базального шипа; тело растянуто по горизонтали .......................................4. Род Ceratochona (стр. 342).
8 (7). ПВ без зубцевидных шипов, с 1—2 базальными шипами эпихона; тело почти квадратное..................................3. Род Kentrochona (стр. 337).
1. Род PLEOCHONA Jankowski, 1973
Крупные формы с удлиненным телом, слабо сплющенным дорзо-вентрально. Шейка узкая, тонкая, очень четко отграничена от тела. ПВ высокая и неширокая, ширина достигает ширины тела; вентральные складки глубокие, тесно сближены, ограничивают высокую и узкую зону, вдающуюся в полость ПВ. Эпихон почти ровный, без складок и цилиатуры, с очень высокими щитковидными краями, несущими длинные зубцевидные шипы. Прекрасно развит гипоколлюм — широкая площадка у основания шейки, вооруженная шипами. В целом развиты два типа шипов — гипоколлярные (2— 4, обычно левее сумки) и дорзальные (2—4 симметричные пары). Стенки ПВ в нижней половине заметно утолщены. Ампула удлиненная; ножка слегка смещена на дорзальную сторону, подошва очень маленькая. Ма угловатый, вытянут по оси тела. Сумка вмещает около половины тела томита.
От всех других ипверсохонид род отличается вытянутой формой тела, .мелкой, слабо выраженной подошвой. Нет тенденции к образованию базальных и соматических шипов. Ппеохоны — единственные сетобионты среди ипверсохонид. Удлиненная форма тела — первичный признак у ипверсохонид, поскольку плеохон можно вывести от Isochona pleonlcola. При переходе от сетобиоза к планибиозу произошли обычные у хонотрих изменения формы тела, в результате чего тело расширено, распластано по субстрату; ножка осталась субтерминальной; появилась широкая подошва.
Рис. 193.4, Б — Isochona pleonicola с Nebalia II; В—Е — Pleochona coronata с Nebalia N.
С 1 (типовым) видом Р. coronata, обитающим на плеоподах Nebalia с о. Итуруп. Не исключено, что к Pleochona примыкает новый род Лёнга (аитеннохона) с антенн Epinebalia sp. из США (Калифорния, Пинос-Пойпт близ бухты Монтерей), имеющий резко удлиненные гипоколлярные и дорзальные шипы. ,
1. Pleochona coronata Jankowski, 1973 (рис. 3, 3; 9, 3; 193, В—Е\ 194).
С признаками рода.
Размеры. Длина особи 69—91 мк, до края гипохона 78—90 мк, до дна сумки 36—41 мк; L : D=3.7 : 1; высота эпихона 4—7 мк; размеры тела 60—71X21—24 мк; шейки 2—3X6.5—9 мк, ПВ (от сумки до вершины) 20—22x28—30 мк, маргинальных шипов 4—6x1.5—2 мк, гипоколлярных 7—10x3—4.5 мк; диам. розетки 4.5—5.5 мк; размеры Ма 15—22x7—9 мк, сумки 16—25x10—13 мк, томита около 36x14 мк.
Локус n хозяин — плеоподы Nebalia V; особи отсутствуют на массивных дисталь-пых и боковых щетинках, запятых у другой расы видом Isochona, и поселяются лишь на тонких боковых щетинках, в основном в их средней и верхней части. Вид обычный, но особи па придатке немногочисленны (порядка 15—20 па нлеоноде).
Распространение. О. Итуруп, зал. Одесский, литораль. Мор и Мацудо (Mohr, 1966; Matsudo a. Mohr, 1968) мельком упоминают о находке Ленгом неопределен-
Рис. 194. Рleochona coronata с Nebalia V.
ного рода с цилиндрическим телом на плеоподах Epinebalia в США; если здесь имеются в виду не торакоподы и если наблюдались не изохоны, то это, может быть, вид Pleochona или близкого рода.
2. Род INVERSOCHONA Jankowski, 1973
Относительно крупные формы с массивным, угловатым, почти квадратным телом, не вытянутым, как у плеохон. Плечи почти равной длины, относительно неширокие — не шире ПВ. Шейка хорошо выражена, широкая и довольно длинная, ПВ не втянута в тело. ПВ гигантская, непропорционально велика, высокая и широкая, достигает ширины тела. Гипохон со слабо развитыми, неглубокими складками и небольшими карманами; эпихон не выше гипохона, иногда разрастается в средней части, образуя небольшой широкий щиток. Пелликула стенок ПВ без продольной исчерченности. Полость ПВ относительно невелика, до половины высоты ПВ занята цитоплазмой. Шипов нет; иногда зазубрен вентральный щиток. Ма массивный, заходит в шейку й ПВ, не вытянут.
Тело в отличие от Pleochona не вытянуто; нет шипов, развитых у всех других ин-версохонид. У Ceratochona тело растянуто в стороны, ПВ с зубчиками.
С 1 (типовым) видом 1. peregra, обитающим иа торакоиодах Nebalia в Белом море. Второй вид рода, с особо широкой ПВ и более вытянутым телом, найден группой Дж. Мора па N. bipes(!) из Плимута (Англия). Форма из Кайгокаса (центральное Чили) отличается от типичных инверсохон щитковидной или шиновидпой формой гииохопа; чилийский вид можно отнести к I ni'ersochona, если главным признаком рода считать отсутствие соматических и базальных шипов.
1. Inversochona peregra Jankowski, 1973 (рис. 4, 77; 10, Б; 51, И; 195, А; 196,. А, Б).
С признаками рода.
Размеры. Длина особи 57—70 мк, до основания шейки 36—39 мк, до дна сумки 13—17 мк; L : D=1.5 : 1; размеры тела 40—46x36—45 мк; длина левого плеча 7— 11 мк, правого 9—12 мк; размеры шейки 3—9X15—16 мк, ПВ (от сумки до вершины) 19—25.5x40—46 мк; высота щитка 4.5—5 мк; расстояние между складками гипохона 6.5—10 мк; длина карманов 15—20 мк; диам. розетки 5—6.5 мк; размеры Ма 20—23Х ХИ—18 мк, сумки 27—32X15—16 мк, томита 33—36x15—18 мк.
Локус и хозяин — дистальные отделы эндо- и экзоподита торакопод Nebalia VI; вид редкий, найдены единичные особи.
Распространение. Белое море, Соловецкие о-ва.
3, Род KENTROCHONA Rompel, 1894
Rompel, 1894 : 618 (-[-Stylochona); Wallengren, 1895 : 2, 44; 1896 : 553 (вероятно, отождествляется с К entro chonop sis multipara и Stylochona nebalina; род. Stylochona сохранен для S. coronata [Heterochona]); D о f 1 e i n, 1896 : 362, 364 (-\-Sty-lochona); 1897a : 619 (N Stylochona); 1897b : 642; 1900 : 2, 37; Waterhouse, 1902 : 187; Calkins, 1910 : 55 (с ошибочной фамилией автора — Rompel); Hamburger u. Buddenbrock, 1911 : 112, 113 (Spirochona sensu lato, part.: род не назван, «5. nebalina» объединяет виды Stylochona, Kentrochona и, вероятно, Kentrochonopsis); Lepp, 1926 : 88 (Spirochona sensu lato, part.); 1965 : 285, 833 (-[-Kentrochonopsis); Schulze a. oth., 1929 : 1725; Kahl, 1933 : 140 (-[-Stylochona [S. nebalina; отнесена одновременно к Spirochona ], вероятно -[-Kentrochonopsis); 1935 : 802 (-[-Kentrochonopsis, -f-Stylochona sensu Kent [Kentrochona nebaliae Doflein= Stylochona nebalina Kent]; род Stylochona сохранен для 5. coronata [Heterochona]); N e a v e, 1939, vol. 2 : 824; Kudo, 1946 : 682 (вероятно -[-Kentrochonopsis); Faure-Fre-miet et Guilcher, 1947 : 112; Mohr, 1948 : 2, 12 (вероятно, -[-«.Kentrochonopsis»); 1959b : 89; 1966 : 536, 541; Guilcher, 1951 : 42 (с ошибочными фамилией автора и датой — Doflein, 1895); Menzies а. М о h г, 1952 : 86 (non Kentrochona sensu Rompel?); Doflein u. Reichenow, 1953 : 1154, 1189 (с ошибочной фамилией автора — Keuten); Hall, 1953 : 412, 413; С о r 1 i s s', 1961 : 136; Mohr' a. oth., 1963a : 227, 228, 232; 1963b : 121; M a t s u d o, 1966 : 364, 367 (-[-Kentrochonopsis); Matsudo a. Mohr 1968 : 281 (вероятный синоним — Kentrochonopsis); Mohr a. M a t s u d o, 1970 (-[-Kentrochonopsis!).
Таксономическая история рода. Под общим названием Kentrochona nebaliae Ромпель описывает разные виды хонотрих: «стоящие» и «лежащие» особи, различающиеся по форме ПВ и обитающие на разных придатках. Описание и рисунки относятся только к последним (с эпи- и экзоподита торакопод), поэтому, хотя вид и сборный, нетрудно установить морфологию типовой расы: это бесстебель-чатая форма с почти квадратным телом, прилегающим к субстрату.Дофлейн считает, однако, что морфология трофонта зависит якобы от места оседания томита; такая «локальная» и «генеративная» изменчивость вида (находка Дофлейном крупных стробил на рачке) и послужила источником путаницы в систематике эндогеммин с Nebalia. По Дофлейну, наблюдается крайняя изменчивость формы тела и ПВ в зависимости от локуса К. nebaliae'. имеются два типа ПВ с рядом переходов между ними. У форм с торакопод ПВ сплющена, с вентральными складками и «коротким стебельком» (ножкой); в основном это типичные К. nebaliae Ромпеля. Формы со щетинок максиллулы — типичные Stylochona Кента, возможно идентичные с S. nebalina, если эпифауна Nebalia на о. Джерси и в Адриатике совпадает. Дофлейн включал обе «экоформы» в один вид вследствие наличия переходов. Поскольку в своих локусах трофонты сохраняют типичные признаки, внешняя среда, по его мнению, непосредственно влияет иа морфологию хонотрих. Дофлейн считал возможной идентификацию вида Кента со своей «ще-тинковой экоформой», а тем самым и с видом К. nebaliae в целом. Ранние авторы (Эрлангер, Валленгрен, Гамбургер) также объединяли эти виды в один — К. nebaliae или Spirochona nebalina; р.од Stylochona они сохраняли для гелиохониды S. coronata. В свою очередь с К. nebaliae отождествлялся и вид Kentrochonopsis multipara Doflein, 1897, до сих пор никем не признанный. Сложно и не вполне понятно положение всех этих форм в определителе Каля: род Kentrochona включает виды К. nebaliae Rompel, 1894 (с торакопод) и К. nebaliae Doflein, 1897 (со щетинок); вид Кента приписан Калом
Рис. 195. А —Inversochona peregra с Nebalia VI; Б—И— Kentrochona .nebaliae с Nebalia geoffroyi (Б—Д — по: Rompel, 1894; Е—И — по: Do-flein, 1897а); К—К. robusta с Nebalia III.
Рис. 196. А, Б — Inversochona peregra с Nebalia VI; В—Д —Kentrochona robusta с Nebalia III; Е—И — Chonosaurus rex c Nebalia V.
к Spirochona, хотя и отмечается, что оы «очень близок к виду Дофлейна» (но Дофлейн изучал в основном форму с торакопод, а не со щетинок максиллулы). Сейчас очевидно, ьто все три отождествлявшихся ранее рода эндогеммин {Stylochona, Kentrochona и Kentrochonopsis) принадлежат к разным эволюционным линиям и семействам и по имеют ни малейшего отношения один к другому.
Диагноз. Относительно некрупные формы с угловатым, ромбическим или прямоугольным телом; плечи относительно неширокие (по сравнению с Ceratochona). Шейка тонкая, слегка вытянута, очень четкая; ПВ не втянута в тело, непропорционально велика, высокая, несколько шире тела. Складки гипохона относительно неглубокие, участок между ними высоко поднят, щитковиден, несет зубцевидные шипы Эпихон высокий, обычно также со щитком. Вооружение: довольно плохо развитые, немногочисленные соматические шипы (1—3 пары), 2 шипа гипохонального щитка, 1—2 массивных базальных шипа ПВ. Нередко исчерчена пелликула стенок ПВ, но не тела. Ножка субтерминальна; имеется широкая подошва. Ма угловатый, заходит в ПВ.
Тело в отличие от Pleochona не вытянуто, имеет широкую подошву, не растянуто в стороны, как у Ceratochona. Эти роды и Kentrochona резко различаются по вооружению ПВ: у цератохон имеются редкие зубчики — выросты стенок ПВ, нет крупных базальных шипов эпихона. От высших инверсохонид {Chonosaurus) род отличается более слабым вооружением: у хонозавра шипы покрывают оба края тела от ПВ до ножки и всю дорзальную сторону тела, обращенную к субстрату; хорошо развит базальный птип.'
С 2 видами — К. nebaliae (типовой вид) и К. robusta, обитающими на торакоподах Nebalia в Адриатике и на Камчатке. Мор неоднократно отмечал находки Kentrochona в США, но едва ли он имел в виду именно эндогеммину типа К. nebaliae Ромпеля. Kentrochona sp. отмечена на плеоподах Epinebalia из бухты Морро (Калифорния)(Меп-zies a. Mohr, 1952), неопределенная Kentrochona — на жабрах, а другой род на плеоподах Е. pugettensis (Mohr, 1966; Matsudo a. Mohr, 1968); все высшие инверсохониды, однако, приурочены к торакоподам, спутать кентрохони Pleochonaневозможно. Наплео-подах (?) Мор поселяет и Stylochona nebalina (с максиллулы).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА KENTROCHONA
1 (2). Эпихон с 2 гигантскими шипами...........................1. К. nebaliae.
2 (1). Эпихон с 1 крупным базальным шипом......................2. К. robusta.
1. Kentrochona nebaliae Rompel, 1894 (рис. 1, Щ; 4, Р, С', 10, Г; 21, 3; 36, Г, К; 48, С—У; 192, 3; 195, Б—И; 197, 1—9, 11—18, 20—30, 33—45', 199, Е—И).
Rompel, 1894 : 618, Taf. XXXIX, Fig. 1—7 {-[-Stylochona sp.); W a 1 1 e n g-r e n, 1895 : 2, 44; 1896 : 553 (вероятно, -[-Stylochona nebalina + Kentrochonopsis multipara)', D of lein, 1896 : 362, Text-Fig. 1—5 {-{-Stylochona sp.); 1897a : 619, Text-Fig. A, С—K; Taf. 45, Fig. 1—4, 9—20; Taf. 46, Fig. 1—26, 28—42, 44, 45 {-{-Stylochona sp., вероятно, идентична c S. nebalina Kent); 1897b : 642; Hamburger u. Buddenbrock, 1911 : 112, 113, Fig. 140, b, c {Spirochona nebalina S. К.; вероятно, -[-Kentrochona nebaliae и Kentrochonopsis multipara)', Lep^i, 1926 : 88 {Spirochona nebalina Kent; вероятно, -[-Kentrochona nebaliae и Kentrochonopsis multipara)', 1965 : 285 {-[-Kentrochonopsis multipara)', Kahl, 1933 : 140, 141, Fig. 26, 7, 8 (упомянуты К. nebaliae Rompel, 1894, K. nebaliae Doflein, 1897 [«очень похожа на Spirochona nebalina Kent, 1889»] и Kentrochonopsis multipara — «очевидно, лишь генеративная форма К. nebaliae Doflein»); 1935 : 802, Fig. 148, 10, 11, 16, 17 (те же синонимы); Kudo, 1946 : 681, 682, fig. 320, с (вероятно, -[-Kentrochonopsis multipara)', Mohr, 1948 : 6 (упомянут «Kentrochonopsis multipara», очевидно отождествляемый c Kentrochona nebaliae)', Doflein u. Reichenow, 1953 : 211, 1189 {K. gemmipara par lapsus на стр. 1189); Hall, 1953 : 412', 413, fig. 7.49, F; M о h r a. oth., 1963a : 232; Matsudo, 1966 : 364, 367 (= Kentrochonopsis multipara)', Matsudo a. Mohr, 1968 : 281 (вероятно, -[-Kentrochonopsis multipara)', Mohr a. Matsudo, 1970 (вероятно, -[-Kentrochonopsis multipara).
Ромпель, как отмечалось, различал две формы хонотрих на Nebalia'. К. nebaliae с торакопод и «.Spirochona» со щетинок максиллулы. Каль приписывает последних виду «К. nebaliae Doflein, 1897», напоминающему «Spirochona nebalina Kent», но правильнее считать, что Дофлейн и Ромпель, не зная о работе Кента, неверно определили формы с максиллулы. Основные ошибки в описании и рисунках кентрохон следующие: 1) длинный стебелек, вложенный в «ножны», у Дофлейна — это ампула, эндостил и ножка; 2) зона мембранелл вдоль края ПВ, отмеченная Ромпелем, — это ряды адесмокинет зоны А; 3) наружная раковинка, как у Lagenophrys, изображенная Холлом, — это лишь светлый шипоносный кортекс. Ромпель показывает слишком четкую границу
Рис. 197. Сборный вид «-Kentrochona nebaliae» с Nebalia geoffroyi (по: Doflein, 1897а). 1—9, 11—18, 20—30, 33—45 — К. nebaliae; 10, 19, 31, 32 — Stylochona nebalina.
22 Заказ .Ns 213
кортекса, Каль рисует контуры тела штрихами, границу эндоплазмы жирной линией; их рисунки производят обманчивое впечатление наличия раковинки.
Тело К. nebaliae слегка вытянутое. Ромпель и Дофлейн изображают ПВ самого различного типа — с ровными краями, со складками на одной или обоих стенках, развитыми в разной степени, с карманами и без них; складки обращены то внутрь, то наружу, в них могут располагаться шипы. Скорее всего К. nebaliae имеет высокую и широкую ПВ с двумя вентральными складками, обращенными внутрь ПВ, и со слабо' выраженными дорзальными складками. Пелликула стенок ПВ не исчерчена, края не зазубрены. Соматические шипы отсутствуют или немногочисленны, располагаются экваториально. Вооружение ПВ плохо изучено; авторы изображают либо ровные края, либо сближенные или редкие зубчики, либо различные шипы: мелкие или крупные, зубцевидные или игольчатые, вентральные или дорзальные. Дорзальные шипы на рисунках Ромпеля слишком велики для маргинальных, продолжаются в «эктоплазме» вплоть до кинет зоны А; это явно базальные шипы, расположенные за стенкой ПВ. Дофлейн рисует эти шипы вложенными в «придаточные воронки» (складки) эпихона; он не нашел два гигантских вентральных шипа, показанные Ромпелем. Лишь иногда, по Дофлейну, гипохон несет 4 мелких зубчика, но они видны лишь у «дегенерирующих» кентрохон. Скорее всего К. nebaliae лишена вентральных шипов: за шипы был принят край складок гипохона.
Размеры. По Ромпелю: длина особи без шипов 40 мк, длина тела 20 мк, шипов 20 мк; ширина тела 13—15 мк, шейки 5 мк, ПВ несколько менее 20 мк, Ма 7—8 мк. По Дофлейну: длина особи от 20—25 до 40—60 мк, ширина от 15—20 до 25—38 мк, толщина 10—15 мк; размеры ПВ 10—15x28—50 мк, Ма 12.5Х 10 мк, стебелька у форм с торакопод 2.5—3.5Х 1—2 мк, с максиллулы 6—15х 1—2 мк. Ошибочные ссылки следующих авторов: длина особи до 80 мк (Ьерщ, 1926), 50 мк (Kahl, 1933), 113 мк; длина стебелька 39—159 мк (Kahl, 1933).
Локус и хозяин — торакоподы Nebalia geoffroyi (N. rostrataV). Хозяевами вида Каль (Kahl, 1933 : 140) называет крабов Ebalia и Portunus, но это ошибка: в диагнозе вида повторены две строчки из диагноза Chilodochona. По Ромпелю, вид заселяет эпи-и экзоподиты торакопод, по Дофлейну — в основном экзоподит, в меньшей степени эпи- и эндоподит. Занят преимущественно дистальный отдел сегментов, у края и на большом удалении от края.
Распространение. Материал Ромпеля (типовая раса) — из аквариума в Праге, рачки из Триеста; материал Дофлейна — из Адриатического моря (Триест, Ровиньо). Возможна находка в Черном море.
2. Kentrochona robusta Jankowski sp. nov. (рис. 9, К; 195, К; 196, В—Д).
Мелкие формы с почти пятиугольным телом, длина которого равна ширине. Шейка шире,’ чем у К. nebaliae. ПВ массивная, чашевидная; участок между складками гипохона высоко поднят, образует защитный щиток с двумя четкими зубцевидными шипами. Эпихон поднят в средней части. Края тела несут 1—2, редко 3 пары зубцевидных шипов, только по экватору; имеется толстый базальный шип, обычно невысоко поднятый над эпихоном. Стенки ПВ исчерчены и зазубрены. Выше Ма лежит опорный обруч.
Размеры. Длина особи 43—52 мк, до края гипохона 38—46 мк (без щитка), до дна сумки 9—10 мк; L : D=1.5 : 1; размеры тела 25—28Х 18—32 мк, шейки 2—4Х Х10—11 мк, ПВ (от сумки до вершины) 18—26 х27—36 мк, соматических шипов 6— 9x3—4 мк, базального шипа 14—19x3 мк; длина левого плеча 5—7 мк, правого 10— 15 мк, щитка гипохона 5.5—7 мк, зубцов гипохона 2.5—4 мк; диам. розетки 4.5 мк; размеры Ма 12—14x5—8 мк, сумки 20x14—16 мк, томита 26—28.5x 13—14 мк.
В отличие от К. nebaliae гипохон исчерчен, несет зубчатый щиток; имеется лишь один базальный шип, а не два симметричных.
Локус и хозяин — дистальные отделы эндо- и экзоподита торакопод Nebalia III; вид редкий, до 6—8 особей на торакоподе.
Распространение. Камчатка, Авачинская губа, глуб. 19 м. .
4. Род CERATOCHONA Jankowski gen, nov.
Мелкие формы с угловатым, низким и очень широким телом, растянутым по горизонтали, всегда более широким, чем ПВ (что редко у ипверсохонид). Шейка низкая, но четко выражена, ПВ не втянута в тело. ПВ низкая, широкая, почти треугольная, также растянута в стороны. Вентральные складки относительно неглубокие. Эпихон без складок и щитков. Стенки ПВ не исчерчены и не зазубрены. Плечи очень широкие, почти равные, тело симметрично. Края тела несут 2—4 пары широких зубцевидных шипов; строгой симметрии вооружения нет. Как правило, вентральная стенка ПВ лишена шипов, дорзальная несет один осевой и 2 боковых зубца или шипа, не гомологичные шипам Kentrochona. Подошва широкая. Ма лентовидный, вытянут вдоль
тела, не заходит в шейку п ПВ. Нет, по-видимому, столь резкого утолщения дна ПВ, как у остальных родов. Контур наружного отверстия ПВ почти прямоугольный.
Тело не вытянуто по осп, как у Pleochona', в отличие от Inversochona вооружено шипами. На дорзальной стороне тела в отличие от Chonosaurus шипов нет. Род близок к Kentrochona, но объединение этих форм нежелательно: они различаются по очертаниям тела и ПВ, по вооружению: у цератохон нет массивных базальных шипов, имеются лишь 3 мелких зубчика — выросты края дорзальной стенки ПВ. Дно ПВ у цератохон не утолщено, рот не поднят так высоко, как у кентрохон; Ма необычный,, лентовидный.
С 2 видами — С. cimex (типовой вид) и С. scandens, обитающими почти на всех сегментах торакопод Nebalia в зонах, никогда не занимаемых другими инверсохонпдами. Найдены в Баренцевом море, на Шикотане и на Камчатке.
Рис. 198. Ceratochona scandens с Nebalia III.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА CERATOCHONA
1 (2). Относительно крупные формы с высоким телом и 3—5 парами соматических шипов .....................................................1. с. cimex.
2 (1). Мелкие формы с низким телом и 1—3 парами соматических шипов . . . . ..............•'....................................... 2. С. scandens.
1. Ceratochona cimex Jankowski sp. nov. (рис. 10, R-, 187, Д—Ж', 192, E).
Относительно крупные формы. Отношение высоты тела к высоте ПВ около 3:1. Края тела несут до 3—5 пар удлиненных соматических шипов (2—4 шипа справа, 3— 5 шипов слева).
Размеры. Длина особи 40—48 мк, до дна сумки 9—11 мк; L : D=1 : 1; размеры тела 30—33 X 43—49.5 мк, шейки 1X10.5—12 мк, ПВ (от сумки до вершины) 13.5—15x36—37.5 мк; длина левого плеча 13—15 мк, правого 14—15 мк, соматических шипов 5—8 мк, дорзальных 6—7 мк; ширина желобка гипохона 4.5—8 мк; диам. розетки 2.5—3 мк; размеры Ма 24—27x4.5—6 мк, сумки 19—22x14—15 мк, томита 27—31X13—14 мк.
С. cimex крупнее, чем С scandens, несет большее число шипов.
Локус и хозяин — внутренние (обращенные к другим сегментам, не дистальные) края почти всех отделов торакопод (коксо-, бази-, эндо-, экзо- и эпйподита) Nebalia II; вид массовый, обычный.
Распространение. О. Шикотан, бухта Анама, литораль.
2. Ceratochona scandens Jankowski )sp. [nov. [(рис. 'А, О, П; 9, ’Г, ff; 32, Е; 149, А—В; 198).
Относительно некрупные формы с низким телом; отношение высоты тела к высоте ПВ около 2:1. Края тела несут до 3 пар соматических шипов, обычно 1—2 шипа справа и 2—3, редко 4 слева.
Размеры. Длина особи 31.5—42 мк, до дна сумки 3—4 мк; L : D=1 : 1; размеры тела 20—29x30—39.5 мк, шейки 1—1.5x8.5—9 мк, ПВ (от сумки до вершины) 11—13 х.29—33 мк; длина левого плеча 6—10 мк, правого 12—17 мк, соматических шипов 6.5—7 мк, дорзальных 3.5—5 мк; ширина желобка гипохона 5—7 мк; диам. розетки 4—5 мк; размеры Ма 21—24x5—6 мк, сумки 14—16х 10—11 мк, томита 22.5Х 11—13 мк.
Вид мельче С. cimex, имеет меньшее число шипов и крупную ПВ.
Локус п хозяева — внутренние края коксо-, бази-, эндо-, экзо- и эпиподита торакопод Nebalia III (основной хозяин) и Nebalia I (дополпительный хозяин). Вид обычный, торакопода в целом может нести до 20—30 особей комменсала.
Рис. 199. А — Chonosaurus sp. с Nebalia IV; Б—Д — Ch. rex С Nebalia V; Е—И — томиты Kentrochona nebaliae (по: Rompel, 1894).
Распространение. Камчатка, Авачинская губа, глуб. 19 м (типовая раса); Баренцево море, о. Кильдин, глуб. 10.5—21 м.
5. Род CHONOSAURUS Jankowski, 1973
Относительно крупные формы с массивным, почти квадратным телом. Шейка редуцирована, ПВ втянута в тело. ПВ массивная, треугольная; гипохон с двумя очень глубокими складками, участок между которыми вдается в полость ПВ, не разрастаясь и не образуя щитка, зубцов, шипов. Эпихон неровный, со слабо выраженными продольными складками или без них; в зоне, противолежащей вентральному желобку,
край эпихона несколько поднят, зазубрен. Вентральные карманы широкие и относительно неглубокие, поскольку дно ПВ резко утолщено, а рот высоко поднят. Плечи широкие, прямые. Прекрасно развит дорзальный гипоколлюм. Края ПВ, особенно вентральный, обычно с продольной исчерченностью и мелкими тупыми зубчиками. Развита очень сложная система шипов, в целом пяти типов: весь край тела от ножки до вершины покрывают соматические шипы, которые укрупняются кверху; гипоколлюм имеет особо удлиненные шипы; эпихон несет длинные зубцы или шипики в зоне, противолежащей желобку; от основания ПВ на дорзальной стороне тела растет гигантский непарный осевой базальный шип; вся дорзальная сторона тела, обращенная к субстрату, покрыта массивными эписоматическими шипами. Прикрепление ножкой и очень
широкой подошвой. Ma несколько вытянут, по пе лентовиден, как у цератохон, часто заходит в ПВ.
В отличие от примитивных Inversochona развита сложнейшая система шипов; тело не вытянуто, как у Pleochona, лишенной соматических и базальных шипов. Тенденция к полимеризации соматических шипов (покрывающих весь край тела, а ие среднюю часть), появление массивных гипоколлярных и необычных эписоматических шипов отличает Chonosaurus от близких родов Ceratochona и Kentrochona.
С 2 видами — Ch. rex (типовой вид) и Ch. galeatus, обитающими на торакоподах Nebalia в Баренцевом и в дальневосточных морях.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА CHONOSAURUS
1 (2). Эпихон с 1 массивным и 2 более мелкими базальными шипами........
.................................................. 1. Ch. galeatus.
2 (1). Эпихон только с 1 массивным базальным шипом...........2. Ch. rex.
1. Chonosaurus galeatus Jankowski sp. nov. (рис. 9, Г; 149, E—К).
Соматические шипы относительно немногочисленны, порядка 5—6 пар. ПВ очень широкая, обычно шире тела; участок эпихона, противолежащий ПВ, разрастается, образуя зазубренный щиток. Правее и левее осевого базального шипа лежат два симметричных базальных шипика.
Размеры. Длина особи 52—72 мк, до вершины сумки 37—44 мк, до дна 10— 14 мк; L : D=1.7 : 1; размеры тела 39—45x36—51 мк, шейки 1—1.5x17—22 мк, ПВ (от сумки до вершины) 20—24X36—54 мк; длина левого плеча 6—8 мк, правого плеча 12—17 мк, щитка 4 мк, соматических шипов 7—16 мк; размеры осевого базального шипа 41—72x4—7 мк, боковых шипов 8—11x2—2.5 мк; диам. розетки 6.5— 7.5 мк; размеры Ма 15—21X 9—13 мк, сумки 20—23X 15—18 мк, томита 29—31X 16— 19 мк.
В отличие от Ch. rex соматические шипы относительно немногочисленны, эпихон несет два дополнительных базальных шипа; маргинальный шип перед осевым отсутствует.
Локус и хозяин — дистальные отделы эндо- и экзоподита торакопод Nebalia I; вид редкий, найдено всего 9 особей.
Распространение. Баренцево море, о. Кильдин, глуб. 10.5—21 м.
2. Chonosaurus rex Jankowski, 1973 (рис. (4, Т; 9, Е; 22, 3; 28, В; 196, Е—И-, 199, Б-Д; 200),
Очень крупные формы с массивным телом, очень широкой подошвой, плоской вентральной и вздутой дорзальной стороной. Шейка почти не выражена. ПВ обычно не шире тела. Гипохон примерно с 7 кинетами в зонах А' и А", с большим числом в зоне В. Края ПВ исчерчены, волнистые. Эпихон неровный, со слабо выраженными складками и зубчатым щитком с небольшим острым осевым маргинальным шипом. Края тела несут 9—10 пар массивных широких шипов, особенно крупных в зоне гипо коллюма. Осевой базальный шип гигантский, с зернистой цитоплазмой; стенки его нередко поперечно исчерчены. Эписомальные шипы можно увидеть лишь на особях, отделенных от субстрата; шипы расположены беспорядочно, крупные шипы чередуются с мелкими интеркалярными. Диминутивные стробилы с двумя томитами.
Размеры. Длина- особи 64—84 мк, до вершины сумки 43—57 мк, до дна 12— 15 мк; L : D=1 : 1; размеры тела 42—60Х 41—61 мк, шейки 1.5—2х 14—19мк, ПВ (от сумки до вершины) 21—30x38—66 мк, соматических шипов 12—20x4—4.5 мк, гипоколлярных до 22 мк, базального 63—90x4.5—6 мк, маргинального 8—15x2—2.5 мк; длина левого плеча 7—10 мк, правого 14—22 мк, щитка 3—7.5 мк; глубина полости ПВ (до рта) 8—9 мк; диам. розетки 6—7.5 мк; размеры Ма 17—21x9—18 мк, сумки 24—26x 16—24 мк, томита 32—37x15—22 мк.
Вид крупнее Ch. galeatus, с большим числом соматических шипов, с маргинальным шипом, без дополнительных базальных шипов.
Локус и хозяин — дистальные отделы эндо- и экзоподита, реже эпиподита торакопод Nebalia V, очень редко на удалении от края. Обычно особи оседают возле щетинок, прислоняясь к ним и включая в свой защитный аппарат. Эндоподит вмещает 4—6 особей, эпиподит 2—3, экзоподит 15—16; обычно же торакопода несет 3—15 особей вида.
Распространение. О. Итуруп, зал. Одесский, литораль (на Nebalia V). Формы типа Ch. rex отмечены на Nebalia IV с литорали о. Путятина (рис. 10, Б; 199, А) и на Nebalia sp. с иловых отмелей лагуны Буссе (Сахалин).
Работа над рукописью настоящей книги была завершена в 1968—1969 гг. В последние годы был опубликован ряд работ, касающихся хонотрих; сведения о Chonotricha были найдены нами и в отдельных более ранних работах, в основном фаунистических или обзорных. Новые виды хонотрих, не вошедшие в данную книгу, описываются в двух статьях автора, цитированных в основном списке литературы (Янковский, 1971, 1973); общее число родов хонотрих сейчас составляет 44, видов — 136. Ниже приведен список дополнительной литературы. Двумя звездочками в нем отмечены работы, цитированные в основном списке литературы (стр. 147—149), но еще не вышедшие или недоступные нам ранее; ниже уточняются их названия.
Геншель Э. 1914. Жизнь пресных вод. М. : 1—390.
Емельяненко П. Г. 1911. Простейшие (Protozoa) аквариума, ч. 3. Любитель природы, 6 (8—9) : 255—270.
Фадеев Н. Н. 1929. Каталог водных животных, найденных в бассейне р. Донца и прилежащих местностях за период работы с 1917 по 1927 г. Труд! Харювськ. тов. доел, природи, т. 52; Роботи секцИ зоол. безхребтових Хари. наук.-доел, ка-тедри зоол., № 1 : 7—32.
Хей син Е. М. и П ол янский Ю.И. 1963. О системе простейших. Материалы научн. конф, по пробл. паразитол., Узбекский научно-исслед. ветер, инет., Самарканд-Тайляк : 106—107.
Янковский А. В. 1972. Комменсологические очерки. 3. Новые роды Chonotricha Exogemmina — симбионты Isopoda, Amphtpoda и Decapoda, Зоол. журн., 51 (11) : 1617—1624.
Янковский А. В. 1973а. Комменсологические очерки. 4. Новые роды Chonotricha Endogemmina — симбионты Leptostraca. Зоол. журн., 52 (1) : 15—24.
Янковский А. В. 19736. Ревизия системы подтипа Ciliophora Doflein, 1901. Зоол. журн., 52 (2) : 165—175.
Andre Е. 1923. Le Lac Lioson et sa faune. Bull. Soc. Vaudoise Sci. Nat., 55 (209) : 22—29.
Bartos E. 1954. Podkmen obrvenky, Ciliophora. In: H r a b e S., Bartos E., F о t t B. et al. Kilo zvireny 6SR. Dfl I (Prvoci, houby, lackovci, cervi, mechovky, mekkysi, korysi). Naklad. 6SAV, Praha : 56—93.
C an e II a M. F. 1964. Contributi alia conoscenza de! Ciiiati, IV. Strutture buccal!, infraciliatura, filogenesi e sistematica dei Ciliofori. Fatti, ipotesi, speculazioni. Ann. Univ. Ferrara, Nuova Serie, Sez. Ill, Biol. Anim., 4 (4) : 119—188.
Corliss J. O. 1960. Comments on the systematics and phylogeny of the Protozoa. Syst. Zool., 8 : 169—190.
Corliss J.O. 1968. The value of ontogenetic data in reconstructing protozoan phylogenies. Trans. Amer. Mier. Soc., 87 (1) : 1—20.
Enaceanu V. ?i В r e z e an u Gh. 1970. Repartitia si componen(.ia florei щ fau-nei Dunarii de la Izvoare la Varsare, I. Fauna. Hidrobiol., 11 : 227—264.
G u e n i n H. A. et F a h r n i J. 1971. La structure fine des noyaux lors du bourgeonne-ment chez Spirochona gemmipara Stein (Cilie Chonotriche). Rev. Suisse Zool., 78 (3) : 556—559.
Henneguy L. F. 1896. Logons sur la cellule. Morphologie et reproduction. Faites au College de France, 1893—1894. Paris : 1—541.
Hentschel E. 1909. Das Leben des Susswassers. Eine gemeinverstandliche Biolo-gie. Munchen : 1—336.
Herrick C. L. 1884. Reports of Society Meetings (Recent proceedings of scientific societies). Minnesota Academy of Natural Sciences. Science, 4 (76) : 73.
Koeppel A. 1919. Kommensalen auf der Flohkrebskieme. Mikrokosmos, 12 (6—7) : 90-92.
К or m os J. 1970. Sejtbimbozas es organizalodas. Veglenyi sejtek fejlodesi organi-zalodasa. MTA Biol. Oszt. Kozlom., 13 : 105—149.
К re pu ska G. 1917. Budapest veglenyei. Else kozlemeny; befejzo kozlemeny. Al-Jattani kozlemenyek, 16(1—2): 86—116, 154—184, 222.
L anessan J.-L. 18S2.Traite de zoologie. Protozoaires. Paris : 1—335.
Lepiji I. 1932. Recherches preliminaires sur les protozoaires des torrents de Sinaia. Publ. Soc. Natur. din Romania, № 10 : 1—53.
Leung Yuk-maan and Mohr J. L. 1966. On the chonotrich ciliates, the rotifer Seison and other animals living on Nebalia in far southern waters. Symposium on Antarctic Oceanography 13—16 Sept. 1966, Section 2, Deep Water. Santiago : 72—73.
**LeVeque J. A. 1947. A taxonomic study of the associates of Llmnoria lignorum (Rathke) with special references to the Protozoa. Master of Arts Thesis, University of Southern California, Biology Department, Los Angeles : 1—52.
**Ma ts udo H. 1967. On the ultrastructure and morphogenesis of a marine chonotri-chous ciliate protozoan, Lobochona prorates. Phil. D. Dissertation, University of Southern California, Biology Department, Los Angeles : 1—190.
Matthes D. und Wenzel F. 1966. Einfiihrung in die Kleinlebewelt : Wimpertiere (Ciliaten). Bau, Lebensweise, Vorkommen, Untersuchung. Stuttgart : 1—111.
** M о h r J. L., Matsudo H. and Leung Yuk-maan. 1970. The ciliate taxon Chonotricha. Oceanogr. and Mar. Biol., Annual Rev., 8: 415—456.
N о b i 1 i R. 1969. Sistematica e filogenesi dei Protozoi Ciliati. Boll. ZooL, 36 : 311—326.
P i t e 1 к a D. 1963. Electron-microscopic structure of Protozoa. International series of monographs on pure and applied biology. Division : Zoology, vol. 13, Oxford—London—New York—Paris : 1—269.
Prenant M. 1935. Legons de Zoologie. Protozoaires. Infusoires Cilies. Actualites Scient. et Industr., 295 : 1—78.
Reichenow E. 1953. I. Kreis : Protozoa, Urthiere. In : Br ohmer P. Fauna von Deutschland. Ein Bestimmungsbuch unserer heimischen Tierwelt. Heidelberg : 1—27.
Reichenow E. 1956. Einzeller, Protozoen. IniLengerken H. von. Das Tierreich, Bd. I. Sammlung Goschen, Bd. 444. Berlin : 1—115.
Reynolds B. D. 1930. Ectoparasitic Protozoa, chapter III. In : H e g n e r R. and Andrews J. Problems and methods of research in protozoology. New York : 11—26.
Rietschel P. und Rohde K. 1971. Die einzelligen Tiere. In : Grzim ek B. Tierleben. Bd. I : 89—137.
Schoch G. 1868. Die mikroskopische Thiere des Supwasser-Aquariums. Fur Freunde des Mikroskopes und der Nattirwissenschaften systematisch dargestellt, I. Buch. Die Urthiere. Leipzig : 1—60.
Sprague V. and Couch J. 1971. An annotated list of protozoan parasites, hyperparasites and commensals of Decapod Crustacea. Journ. Protozool., 18 (3) : 526— 537.
abyssalis, Cavichona 10, 25, 46, 72, 135, 255, 256, 257*, 268, 269*
acanthogammari, Cavichona 10, 24, 25, 46, 72, 86, 111*, 135, 255, 256, 265*, 266*, 273
Actinichona 11, 34, 43, 67, 84, 127, 142, 144, 169, 171*, 179, 289, 290, 292, 295, 299, 301
Actinichonidae 11, 51, 73, 142, 169, 171, 179, 282, 289, 302
altemans, Heliochona 10, 25, 29, 47, 59, 61*, 67*, 75, 78*, 79, ill*, 112, 114, 140, 219, 221, 223, 225*, 226*, 227*, 228
antennaria, Isochona 10, 35*, 37*, 46,
169, 283, 284, 285*
an thus, Serpen tichona 5*, 10, 24, 25, 30, 38, 47, 64*, 71*, 72, 82*, 131, 135, 237*, 260*, 276*, 277*, 278*, 279
anthus, Spirochona 4*, 24, 46, 71, 72, 134, 167, 177, 236*, 278
aranei, Chilodochona 10, 28, 30, 55, 70, 82, 94, 117, 131, 231*, 232, 233*, 234*, 235
armata, Aurichona 5*, 9, 20, 48, 200*, 202
armata, Rhizochona 6*, 11, 35*, 46, 292, 295*
Armichona 11, 34, 54*, 58, 68, 73, 108, 142, 169, 171, 302, 311, 314, 317, 321
Aurichona 9, 20, 38, 45, 48, 65, 69, 141, 168, 170, 175, 179, 200, 201, 202, 203 authus, Spirochona 278
brevis, Spirochona 10, 24, 46, 72, 118*, 135, 176, 239, 243* 245*, 246*, 247*, 249
brevistyla, Cavichona 10, 24, 25, 46, 47, 72, 111*, 116*, 129*, 135, 255, 256, 268, 270*
carcini, Chilodochona 10, 28, 41, 42*, 45, 50, 55, 56*, 57—59, 60*, 62, 75, 82, 87, 110, 111*, 114, 115*, 116, 120*, 124, 138, 147, 231*, 232, 233*, 234
Carinichona 11, 34, 44, 48, 58, 62, 65, 67, 108, 114, 127, 142, 169, 171, 176, 179, 289, 290, 291, 292, 299
carinuri, Cavichona 10, 24, 25, 72, 135, 255, 256, 270, 272, 273*
Cavichona 10, 24, 25, 32, 38, 43, 46, 48, 50, 58, 59, 65, 68, 72, 86, 95, 98, 123,. 126, 132, 134, 135, 142, 168, 170, 176, 238, 243, 244, 246, 254, 255, 256, 276 Ceratochona 12, 34, 67, 73, 75, 94, 142, 169, 171, 334, 336, 340, 342, 343, 346
Chilodochona 3, 10, 13, 27, 28, 32, 43,. 45, 48-51, 54*, 55, 65, 68—70, 85, 87, 95, 110, 113, 135, 140, 141, 144, 147, 161, 167, 168, 170, 172, 176—179,. 181, 228, 230, 232, 233, 342
Chilodochonidae 10, 47, 57, 106, 114, 126, 141, 170, 177, 187, 205, 228
Chilodochonina 177, 228
Chilodochoninae 228
Chonosaurus 12, 34, 47, 48, 65, 67, 73, 94, 142, 143, 169, 171*, 179, 280, 334, 340, 343, 344, 345
Chonotricha 1, 3, 8, 9, 13, 59, 72, 76, 112, 127, 133, 141, 147, 158, 159, 162, 172, 177, 179—183, 185, 186
Chonotrichida 3, 9, 32, 44, 59, 72, 92, 105, 140, 158, 159, 160—162, 167, 170, 171, 177, 178, 181, 182, 185, 186
Chonotrichidae 181
Chonot richidea 159
cimex, Ceratochona 12, 36*, 46, 47, 326*,. 333*, 343
cincinnata, Cavichona 10, 24, 25, 47, 52*, 53, 72, 83*, 135, 168, 255, 256, 257*, 258*, 259*, 260*, 261, 268, 273
coranata, Spirochona 211
coronata, Heterochona 9, 21, 22, 41,. 45, 50, 54, 57, 65, 83*, 119, 124*, 126,. 179, 206, 211, 212*, 214*, 215*, 217*, 219, 304
coronata, Pleochona 6*, 12, 35*, 46, 322, 335*, 336*
coronata, Stylochona 4*, 21, 22, 41, 70, 167, 177, 207, 214, 303, 304, 306, 337"
Coronochona 12, 34, 47, 51, 58, 65, 68, 127, 142, 169, 171, 179, 280, 327, 329, 331 crassa, Cavichona 10, 24, 25, 72, 131, 135,. 255, 256, 259, 267*, 268*
crassa, Isochona 11, 34, 35*, 36*, 46, 47, 280*, 283, 284, 286*, 287
Crassichona 11, 34, 47, 54*, 65, 66, 73,. 75, 84, 91, 108, 114, 142, 144, 169,
1 Названия таксономических единиц выше рода выделены жирным шрифтом, синонимы — курсивом; жирные цифры обозначают страницы с диагностическими; данными; звездочка при цифре указывает страницу с рисунком.
171, 179, 280, 289, 290, 295, 298, 301 crenata, Flectichona 6*, 11, 36*, 46, 67*, 311, 316*
crinita, Heterochona 5*, 9, 22, 45, 136, 137, 206, 207, 209*, 210*, 211, 212*, 244* 247 24R 249
Cristichona 11, 34, 43, 48, 54*, 58, 62, 67, 142, 169, 171, 179, 289, 290, 292 Cryptochona 10, 63, 70, 141, 168, 170, 175, 228, 230, 231, 232
crystalline/., Spirochona 19, 188, 194 crystallina, Vaginicola 10, 21, 45, 179, 207, 211, 219
Ctenochona 12, 34, 51, 58, 65, 68, 73, 119, 123, 142, 143, 169, 171, 176, 179, 280, 302, 319, 321, 323, 325, 326 cuspidata, Actinichona 11, 35*, 46, 295, 296*, 298
Dentichona 11, 34, 43, 63, 68, 73, 127, 142, 169, 171*, 176, 302, 304, 309, 311
Echinichona 12, 34, 44, 47, 54, 58, 62, 63, 65, 68, 73; 84, 108, 127, 142, 169, 171*, 176, 179, 282, 307, 327, 329, 331
Ecliinichonidae 12, 47, 51, 73, 84, 142, 171, 179, 282, 289, 302, 327
ectenolaemus, Oenophorachona 4*, 5*, 9, 22, 30, 39, 57, 69, 79, 91, 94, 119, 194, 195*, 196—198
elegans, Cavichona 5*, 10, 24, 25, 41, 44, 46, 59, 62, 72, 79, 90, 91, 99*, 119, 121, 122*, 123*, 125, 126, 127*, 128, 135, 138, 139, 168, 255, 256, 257*, 260*, 266, 273
elegans, Heliochona 10, 22, 47, 66*, 219, 220, 223, 227*, 228
elegans, Spirochona 4*, 24, 29, 33, 71, 72, 125, 134, 167, 176, 177, 236*, 254, 256, 259, 262, 264, 266, 267, 268, 270, 272, 276
elegantula, Cavichona 10, 24, 25, 53, 72, 86, 135, 246, 255, 256, 262, 268, 273, 274*, 275*, 276
•elegantula, Spirochona 4*, 24, 46, 71, 72, 134, 177, 236*, 251, 273
Eleutherochona 9, 32, 43, 45, 47, 48, 51, 54, 55, 58, 69, 79, 94, 132, 141, 159, 168, 170, 175, 176, 179, 187, 194, 198, 199, 303, 304
Endogemmina 6—8, 10, 47, 73, 83, 140, 142, 160, 169, 171, 176, 178, 179, 186, 279
Eriochona 11, 58, 68, 73, 142, 169, 171, 302, 311, 319, 321, 322
Eurychona 12, 34, 47, 54, 63, 73, 142, 169, 171, 176, 179, 307, 327, 328, 329 exilis, Cavichona 10, 24, 25, 72, 135, 255—257, 266, 267, 270, 271*, 272
exilis, Heterochona 9, 22, 38, 45, 47, 50, 57, 65, 171, 172, 206, 211, 217*, 218 Exogemmina 5, 8, 9, 65, 141, 160, 170, 178, 186, 187
Jilicauda, Flectichona 11, 36*, 46, 311, 314, 316*
Filichona 9, 20, 30, 38, 47, 48, 58, 63, 65, 69, 140, 141, 168, 170, 172, 175, 179, 186, 199—202, 203
Filichonidae 9, 51, 65, 69, 141, 170, 187, 199, 200, 201, 205
Flectichona 11, 34, 47, 58, 63, 68, 73, 142, 169, 171, 302, 304, 311, 316, 319, 321
galeatus, Chonosaurus 12, (35*, 279*, 346 gaucho, Actinichona 7*, 11, 36*, 46, 64*, 74*, 295, 296*, 297*, 298*, 299, 301
gemipara, Spirochona 239
gemmipara, Kentrochona 340
gemmipara, Lagenophrys 239
gemmipara, Spirochona 4*, 5*, 10, 13, 14, 23, 24, 29, 33, 38, 39, 46—49, 52*, 57, 59, 70, 71*, 72, 75, 79, 82*, 84, 87, 89*, 91, 93*, 95, 99*, 100*, 108*, 110, 111*, 114, 115*, 117, 119, 120*, 121, 122*, 123*, 126, 127*, 128, 129*, 130, 131, 133—136, 138-140, 144, 147, 167, 168, 176, 177, 179, 180, 194, 235, 236*, 239, 240*, 241*, 242*, 243*. 244*, 245*, 249, 254, 260*, 262, 268, 273, 275, 276, 303, 305
gemnipara, Spirochona 239, 240
gemnipara, Spirochona 240
gibbosa, Armichona 6*, 11, 36*, 37*, 46, 60*, 61*, 74*, 281*, 314, 316, 317, 318* 333*
glabra, Stylochona 6*, 11, 36*, 46, 74*, 304, 305*, 307, 308*
glacialis, Eriochona 6*, 11, 35*, 46, 321*, 322
globulus, Carinichona 6*, 11, 36*, 46, 47, 60*, 61*, 64*, 74*, 109*, 292, 293*, 294*
globulus, Spirochona 4*, 10, 24, 31, 33, 38, 46, 53, 71, 72, 81*, 122*, 134, 135, 177, 236*, 237*, 239, 240*, 243, 246, 247, 248*, 249*, 250*, 253
gnathopodialis, Spirochona 10, 24, 31, 38, 40*, 46, 47, 72, 135, 237*, 239, 246, 247, 249, 250, 251*
guennerstedti, Chilodochona 233
halophila, Spirochona 4*, 10, 22, 30, 38, 46, 53, 79, 82*, 91, 94, 119, 137, 215, 239, 253*, 254
Heliochona 10, 13, 20—22, 28, 30, 32, 33, 38, 41, 45, 47—49, 51, 53, 57, 58, 62, 63, 65, 68, 70, 79, 85, 107, 112, 113, 124, 125, 133, 137, 140, 141, 167, 168, 170, 172, 176—178, 203, 205—207, 211, 214, 219, 235, 238, 306
Heliochonidae 8, 9, 28, 29, 30, 48, 50, 51, 63, 65, 70, 78, 79, 141, 170, 187, 205, 238
Heterochona 9, 21, 22, 29—32, 38, 40, 41, 45, 48, 49, 53, 54*, 57, 59, 62, 63, 65, 68, 75, 79, 87, 95, 98, 110, 126, 127, 137, 141, 143, 168—171, 175, 176, 178, 183, 205, 206, 208, 219, 238, 239, 303, 304, 337
hexadenta, Armichona 11, 35*, 46, 280*, .316, 317, 318, 319
horrida, Eriochona 6*, 11, 35*, 46, 280*, 321, 322, 325
horrida, Spinichona 6*, 11, 36*, 46, 66*, 67*, 74*, 168, 281*, 309, 310*, 312*, 331
insecta, Armichona 11, 35*, 46, 58, 315, 316, 317*, 318
insolita, Crassichona 6*, 11, 36*, 46, 47, 74*, 109*, 300*, 301
insularum, Lobochona 4*, 9, 20, 45, 69, 91, 94, 131, 138, 139, 188, 189*, 191, 194, 215
inversa, Paraoxychona 6*, 12, 35*, 46, 84, 323*
Inversochona 12, 34, 66, 73, 85, 94, 142, 169, 171, 179, 334, 336, 337, 343, 346
Inversbchonidae 12, 51, 73, 84, 142, 171, 179, 282, 289, 302, 322, 334
Isochona 10, 28, 30, 32, 34, 37, 38, 40, 41, 43, 47, 49, 51, 54, 55, 58, 68, 83, 94, 108, 109, 123, 127, 142, 143, 168— 171, 175, 179, 282, 283, 287, 299, 336
Isochonidae 10, 28, 46, 51, 66, 73, 83, 142, 171, 179, 282, 283, 302
Kentrochona 12, 13, 17, 30, 33, 34, 41, 44, 48—51, 54, 57, 63, 65, 67, 69, 73, 83, 85, 88, 94, 98, 103, 107, 126, 142, 167—169, 171, 172, 177, 178, 238, 299, 301, 303, 305, 306, 334, 337, 340, 342—346
Kentrochonopsis 11, 13, 17, 30, 34, 48, 54, 57, 65, 67, 73, 75, 83, 84, 90, 106, 107, 121, 123, 142, 169, 171, 177, 179, 289, 290, 295, 299, 300, 303, 337, 340
laticollis, Cavichona 10, 24, 25, 38, 46, 52*, 59, 61*, 72, 80*, 111*, 114, 116*, 117, 118*, 135, 240*, 255, 256, 262, 270, 273, 274*
lectthoides, Trichochona 288
lecythoides, Trichochona 4*, 6*, 11, 25, 38, 41, 54, 55, 75, 78, 86, 91, 94, 112, 113, 117, 139, 287, 288*, 289
limnoriae, Lobochona 4*, 5*, 8, 9, 19, 20, .29, 38, 39*, 45, 51, 59, 60*, 61*, 64*, '69*, 78*, 80*, 81*, 94, 131, 137, 138, 188, 189*, 190*, 191*, 192*, 194, 195*, 201, 203
Lobochona 3, 9, 13, 19, 20, 28, 30, 32, 33, 38, 41, 43, 45, 47—49, 51, 53, 54*, 57, 58, 63—65, 68, 69, 73, 75, 79, 82, 85, 91, 95, 100, 110, 121, 126, 131, 137, 140, 141, 143, 144, 162, 168, 170, 172, 173, 175, 177, 179, 187, 188, 194, 198, 238 Lohochonidae 9, 28, 51, 69, 141, 167, 170, 187, 205
marginata, Dentichona 6*, 11, 36*, 37*, 46, 64*, 66*, 122*, 124*, 131, 281*, 311, 313*, 314*, 315*, 324*, 332*
marina, Spirochona 10, 22, 38, 46, 52*, 72, 129*, 239, 253, 254*, 255*
maxillaris, Stylochona 11, 35*, 46, 73, 74*, 304, 307, 308*, 309
microchilus, Chilodochona 4*, 10, 28, 115*, 120*, 124, 177, 232, 235
migratoria, Isochona 6*, 10, 25, 40*, 41, S3*, 89*, 283*, 284
mikrochilus, Chilodochona 235
mirabilis, Toxochona 5*, 9, 22, 40*, 52*, 60*. 69, 78*, 198*, 199*
multilida, Cavichona 10, 24, 25, 59, 63, 64*, 72, ill*, 112, 131, 135, 255—257, 262, 263*, 264*, 265*, 266, 270
multifida, Oxychona 6*, 7*, 11, 36*, 46, 52*, 54, 68, 109*, 319, 320*, 321*, 324*, 325*
multipara, Kentrochona 177, 299
multipara, Kentrochonopsis 4*, 7*, 11, 17, 36*, 46, 91, 109*, 114, 119, 297*, 299, 300, 301, 304, 306, 337, 340
nebaliae, Kentrochona 4*, 7*, 12, 17, 34, 36*, 46, 49, 54, 62, 66*, 73, 76, 91, 93*, 119, 120*, 121, 125, 126, 131, 138, 177, 299—301, 304-306, 333*, 337, 338*, 340, 341*, 342, 345*
nebalii, Spirochona 17, 304
nebalina, Spirochona ill, 300, 304, 337, 340
nebalina, Stylochona 4*, 11, 17, 30, 33, 36*, 46, 177, 214, 303, 304, 305*, 307, 308*, 309, 337, 340, 341*
Oenophorachona 9, 13, 20, 22, 26, 30, 31, 38, 43, 47, 48, 51, 54*, 57, 63, 64, 68, 69, 76, 82, 83, 94, 137, 141, 143, 167, 168, 170, 173, 175, 177, 179, 187, 194, 198, 215
oligocineta, Cavichona 10, 25, 46, 72, 135, 237*, 240*, 255, 256, 261*, 262, 270 273
Oxychona 11, 17, 34, 47, 54, 65, 68, 73, 108, 142, 144, 169, 171, 176, 302, 311, 315, 319, 321
pacifica, Cristichona 6*, 11, 36*, 37*, 46, 59, 60*, 64*, 78*, 81*, 109*, 122*, 281*, 290, 291*
pacifica, Pterochona 7*, 12, 36*, 46, 67*, 68, 74*, 131, 323, 324*, 325*
paguri, Vasichona 5*, 10, 28, 41, 82, 230*, 231*
palinuri, Chilodochona 10, 27, 55, 70, 232, 233, 234*, 235
paradoxa, Filichona 5*, 9, 20, 39*, 45, K9* 90'1* 9П9* 904
Paraoxychona 12, 34, 63, 65, 68, 73, 110, 142, 169, 171, 176, 179, 302, 319, 321, 322
patella, Spirochona 4*, 10, 24, 33, 46, 71, 72, 134, 177, 236*, 246, 254, 259, 266, 273, 275, 276, 278
pectinata, Coronochona 7*, 12, 35*, 46, 331 332 333*
peltifera, Isochona 11, 34, 35*, 46, 83, 283, 284, 285*, 286*
peregra, Heterochona 9, 22, 38, 40*, 41, 45, 46, 65, 172, 206, 211, 216*, 217*, 218
peregra, Inversochona 7*, 12, 36*, 46, 124*, 337, 338*, 339*
Phyllochona 9, 20, 30, 38, 45, 47, 48, 63, 65, 73, 82, 84, 85, 141, 143, 168, 169, 170, 175, 178, 179, 204, 205
Phyllochonidae 9, 51, 65, 69, 141, 170, 187, 203, 204, 205
Pleochona 12, 37, 47, 65, 67, 73, 142, 143, 169, 171*, 334, 335, 336, 340, 343, 346 pleonicola, Isochona 11, 36*, 46, 84, 169 283 287 335*
pontica, Heliochona 10, 21, 29, 45, 67*, 137, 219, 220, 223*, 224*, 225*, 226, 228
prorates, Lobochona 4*, 9, 13, 19, 20, 30, 38, 45, 50, 59, 62, 69, 76, 78*, 79, 84, 86, 91, 94, 96, 101*, 108*, 110, 113, 116, 119, 120*, 122*, 125, 126, 127*, 130, 131, 138. 139, 168, 188, 189*, 191, 192, 194
protecta, Cavichona 10, 24, 25, 28, 63, 64, 72, 80*, 135, 240*, 255—257, 260*, 262*
psychra, Heliochona 4*, 21, 222
psychra, Heterochona 9, 22, 29, 38, 40*, 41, 45, 51, 52, 54, 57, 59, 79, 81*, 91, 136—140, 206, 209*, 211, 212*, 213*, 217____219
Pterochona 12, 34, 44, 47, 58, 68, 73, 108, 123, 127, 142, 169, 171, 176, 302, 319, 323
pusilia, Spirochona 4*, 24, 33, 70—72, 91, 134, 177, 236*, 246, 247, 249
quennerstadtii, Chilodochona 233
quennerstedti, Chilodochona 233, 234
qvennerstedti, Chilodochona 4*, 5*, 10, 27—30, 41, 45, 55, 82, 114, 115*, 116, 124, 177, 181, 229*, 232, 233-235
regina, Echinichona 7*, 12, 36*, 37*, 46, 66*, 74*, 329, 330*, 331*, 332* rex, Chonosaurus 7*, 12, 35*, 46, 67*, 74*, 322, 339*, 344, 345*, 346*
rhabdomorpha, Cavichona 10, 24, 25, 72, 135, 255, 256, 270, 272*
Rhizochona 11, 34, 48, 65, 67, 142, 169, 171, 179, 289, 290, 292, 295
robusta, Kentrochona 12, 35*, 46, 47, 73, 169, 338*, 339*, 340, 342
rotundata, Isochona 10, 34, 36*, 46, 47, 83, 169, 283, 284, 285*
sagitta, Oenophorachona 9, 22, 48, 57, 171, 194, 197*, 198
scandens, Ceratochona 7*, 12, 35*, 46, 47, 81*, 279*, 343*, 344
schentenii, Spirochona 207
scheuteni, Heliochona 207, 210, 212, 221
scheuteni, Spirochona 206, 304
scheutenii, Heliochona 4*, 21, 25, 177, 207, 210, 221, 227, 303
scheutenii, Heterochona 9, 20—22, 29, 38, 40, 41, 45, 50, 53, 54, 57, 59, 67*, 78*, 79, 86, 91, 92, 93*, 99*, 112—114, 115*, 117, 119, 120*, 121, 122*, 127*, 136, 137, 206, 208*, 209*, 210, 211, 213*, 214*, 216—219
scheutenii, Spirochona 20, 21, 22, 206, 211, 221, 306
scheutini, Heliochona 207
Serpentichona 10, 24, 38, 46, 48, 53, 58, 72, 134, 135, 142, 144, 168, 170, 172, 238, 255, 276
sessilis, Heliochona 4*, 5*, 10, 20—22. 29, 38, 44, 45, 53, 66, 78*, 79, 81< 86, 88, 91, 136, 177, 185*, 207, 219, 220*, 221*, 222*, 223*, 225*, 226*, 227, 228
sessilis, Spirochona 207
setaria, Stylochona 11, 36*, 46, 304, 305*, 307, 308*, 309, 329
sheuteni, Spirochona 207
sheutenii, Spirochona 206
simplex, Echinichona 12, 36*, 46, 328*, 329, 331
simplex, Spirochona 4*, 10, 24, 31, 33, 39, 46, 53, 71, 72, 121, 122*, 134, 135, 172, 177, 236*, 237*, 239, 243, 246, 247, 248, 249, 250*, 253
sivertseni, Eleutherochona 5*, 9, 15, 199, 229*, 304
sivertseni, Stylochona 4*, 14, 15, 69, 177, 178, 303, 304
sp., Armichona 280*
sp., Cavichona 24, 25, 79, 83*, 121, 135, 240*
sp., Chilodochona 27, 89*
sp., Chonosaurus 36*, 345*
sp., Cristichona 17
sp., Dentichona 17, 36*
sp., Filichona 20
sp., Flectichona 36*
sp., Heliochona 21, 66
sp., Heterochona 54, 209*, 217
sp., Inversochona 17
sp., Isochona 25, 26, 29, 46, 298
sp., Kentrochona 17, 34, 340
sp., Kentrochonopsis 17, 121
sp., Lobochona 20, 69*, 192*
sp., Oenophorachona 22, 71*
sp., Oxychona 319
sp., Pterochona 17, 325*
sp., Serpentichona 25, 135
sp., Spinichona 17
sp., Spirochona 19, 23, 24, 119, 188, 240’ sp., Stylochona 34, 35*, 127*, 340 sp., Vasichona 27
Spinichona 11, 34, 54, 62, 63, 68, 73, 142, 144, 169, 171, 302, 304, 306, 307, 309, 311
Spirochona 3, 10, 13, 14, 19, 20, 22—24,
26, 30—34, 38, 41-44, 46, 47, 49—51,
53, 58, 62, 68, 70, 72, 75, 78, 85, 86,
90, 95, 103, 106, 124, 126, 132, 134—
137, 140, 141, 143, 159—161, 167— 170, 172, 175—181, 187, 188, 205—207, 211, 219, 221, 238, 239, 246, 254—256, 273, 275, 276, 299, 303—306, 337, 340
Spirochonida 159
Spirochonidae 10, 13, 30, 51, 57, 73, 76, 90, 114, 141, 144, 161, 167/ 170, 177, 187, 205, 235—238
Spirochonina 177, 180, 235, 236
Spirochoninae 236
Spirochona 238
Spirocoma 239
Spirocona 238
Stylochona 11, 13, 17. 32. 34. 44, 46, 54, 63, 68—70, 73, 78, 85, 107, 142, 169, 171, 173, 176—178, 199, 205, 206, 211, 212, 214, 238, 302, 303, 304, 306, 307, 309, 311, 315, 327, 329, 337, 340'
Stylochonidae 11, 19, 33, 47, 51, 73, 84, 142, 169, 171, 177—179, 282, 289, 301, 302, 303
suprema, Oxychona И, 17, 36*, 46, 54, 169, 311, 319, 320*
surgens, Trichochona 11, 25, 46, 54, 55, 140, 287, 288*
tenue, Cavichona 10, 25, 46, 72, 135, 255, 256, 266, 267, 271*, 272
tenue, Lobochona 9, 20, 29, 38, 39*, 45, 64*, 69, 80*, 131, 188, 189, 192*, 193*, 194, 195*
ternipara, Ctenochona 7*, 12, 34, 35*, 46, 326*, 327, 332
tesselata, Cristichona 11, 35*, 46, 59, 60*, 279*, 280*, 290, 291
iintinnabulum, Spirochona 14, 83*, 106, 179 Toxochona 9, 22, 31, 38, 43, 48, 51, 54, 82, 141, 143, 168, 170, 175, 179, 187, 198
Trichochona 11, 13, 25, 26, 29, 30, 38, 40, 41, 44, 46—48, 55, 57, 58, 62, 75, 83—86,
90, 95, 107, 108, 113, 134, 140, 142, 167, 169, 171, 175—179, 215. 282, 283, 287, 289
trifaria, Heterochona 9. 22. 29, 41. 45, 57, 65, 91, 137, 172, 206, 211, 218*, 219
tuba, Spirochona 4*, 10, 24, 46, 71*, 72, 134, 135, 177, 236*, 239, 246, 249, 251, 252*, 253*, 273
tumida, Cryptochona 5*, 10, 27, 231*, 232
urceolata, Oenophorachona 9, 22, 57, 71*, 78*, 123*, 194, 195*,-196*, 197*
Vasichona 10, 45, 63, 70, 73, 94, 141, 143, 144, 168-170, 175, 176, 178, 228, 229, 230, 232, 301
vexillata, Phyllochona 5*, 9, 20, 28, 29, 39*, 203*, 204*, 205
villosa, Stylochona 11, 35*, 46, 304, 305*, 307, 308*, 309
virgata, Cavichona 10, 24, 25, 59, 72, 86, 135, 255, 256, 268, 271*, 272
vitrea, Eurychona 7*, 12', 35*, 36*, 46, 309, 328*, 329
Zvennerstadti, Chilodochona 233
Zvennerstedti, Chilodochona 232
СОДЕРЖАНИЕ
Стр.
Предисловие............................................................ 3
Систематический указатель видов........................................ 9
Введение.............................................................. 13
Краткая история изучения хонотрих.................................. 13
Хозяева хонотрих .................................................. 14
Специфичность к хозяевам .......................................... 28
Локализация ....................................................... 33
Количество особей на хозяине....................................... 44
Морфологический очерк .........‘................................... 47
Размеры, форма тела ............................................ 47
Цитоплазма, сократительные вакуоли.............................. 49
Прикрепление к субстрату........................................ 51
Проблема соматической инфрацилиатуры........................... 59
Покровы тела и защитный аппарат................................. 62
Предротовая воронка............................................. 68
Ротовой аппарат . .............................................. 75
Предротовая цилиатура .......................................... 76
Питание хонотрих ............................................... 86
Ядерный аппарат ................................................ 88
Микронуклеус ................................................. 88
Происхождение и строение гетеромерного макронуклеуса.......... 92
Деление макронуклеуса ........................................ 97
Жизненный цикл .................................................... ЮЗ
Общее описание и терминология.................................. 103
Моногеммическое почкование (на нелиняющих рачках).............: 106
Диминутивное почкование и полигеммия (на линяющих рачках) ... 119
Процесс конъюгации .......................................... 126
Внутривидовая изменчивость признаков.............................. 130
Взаимоотношения хонотрих и хозяев................................. 132
Экология хонотрих . . '........................................... 134
Географическое распространение ................................... 140
Методика изучения хонотрих ....................................... 144
Литература ....................................................... 147
Основные оригинальные работы по Chonotricha .................. 147
Прочая литература ............................................ 149
Систематическая часть ............................................... 158
Отряд Chonotrichida Wallengren, 1895 (номенклатура)............... 158
Диагноз ......................................................... 159
Происхождение хонотрих ........................................... 160
Эволюция хонотрих ............................................... 167
Обзор литературы . ............................................ 167
Данные автора ................................................. 168
Общий взгляд на эволюцию хонотрих.............................. 170
Геологическая история хонотрих и проблема параллельной эволюции 173
Структура отряда ................................................. 176
Положение хонотрих в системе инфузорий............................ 180
Таблица для определения подотрядов отряда Chonotrichida ...... 186
I. Подотряд Ezogemmina Jankowski, 1972 ........................... 186
I. Семейство Lobochonidae Jankowski. 1967 .................. 187
II. Семейство Filichonidae Jankowski fam. nov................. 199
III. Семейство Phyllochonidae Jankowski, 1972 203
JV. Семейство He.liochonidae Jankowski, 1972 ............................. 205
V. Семейство Chilodochonidae Wallengren, 1895 ......................... 228
VI. Семейство Spirochonidae Stein, 1854 ................................ 235
II. Подотряд Endogemmina Jankowski, 1972 .................................... 279
I. Семейство Isochonidae Jankowski, 1973 .............................. 282
II. Семейство Actinichonidae Jankowski fam. nov......................... 289
III. Семейство Stylochonidae Mohr, 1948 ................................. 301
IV. Семейство Echinichonidae Jankowski fam. nov......................... 327
V. Семейство Inversochonidae Jankowski, 1973 .......................... 334
Дополнение ..................................................................... 347
Алфавитный указатель латинских названий хонотрих................................ 349
Анатолий Викторович Янковский
ПОДКЛАСС CHONOTRICHA
(Фауна СССР, Инфузории, том II, вып. 1)
Новая серия № 103
Утверждено к печати Зоологическим институтом Академии наук СССР
Редактор издательства И. А. Храмцова Технический редактор И. М. Кашеварова
Корректоры Г. А. Александрова и О. И. Иващенкова
Сдано в набор 12/Х 1972 г. Подписано к печати 20/11 1973 г. Формат бумаги 7ОХ1О81/М. Бумага № 2. Печ. л. 221/4=31.15 усл. печ. л. Уч.-изд. л. 36.25. Изд. № 3886. Тип. зак. № 213. М-05164. Тираж 1250.
Цена 3 р. 98 к.
Ленинградское отделение издательства «Наука» 199164, Ленинград, Менделеевская линия, д. 1
1-я тип. издательства «Наука» 199034, Ленинград, 9 линия, д. 12