Author: Круглов Ю.В.
Tags: почвоведение почвенные исследования повреждения растений вредители растений болезни растений защита растений биология почвы
ISBN: 5-10-000883-0
Year: 1991
IQ В. КРУГЛОВ
/ИИКРОФАОРк
почвы
И ПЕСТИЦИДЫ
МОСКВА
ВО "АГРОПРОМИЗДАТ
1991
I i , < ' ч ' < . • /.
УДК 631.46:632.95
Редактор Е.П.Жогова
Круглов Ю. В. Микрофлора почвы и пестициды. - М.: Агропромиздат, 1991. -
128 с. - ISBN 5-10-000883-0
' Обобщены сведения о влиянии пестицидов на микрофлору и биохимичес-
кие процессы в почве. Дан анализ воздействия их на бобово-ризобиальный сим-
биоз.' Показана роль микроорганизмов в деградации пестицидов. Рассмотрены
теоретические и практические аспекты оценки и прогнозирования последствий
систематического применения пестицидов.
Для научных работников-фитопатологов, почвоведов, микробиологов, эко-
логов.
Табл. 29. Ил. 32. Библиогр.: 174 назв.
3704040000 - 157
035(01) -91
69-91
ISBN 5-10-000883-0
© Ю. В. Круглов, 1991
введение
Почвенный покров нашей планеты образует ’’особую биогеохими-
ческую оболочку” (Вернадский, 1967), насыщенную живыми организ-
мами и продуктами их метаболизма. Важным компонентом ее являет-
ся микрофлора.
В экологическом плане микрофлора представляет собой часть на-
земной экосистемы (биогеоценоза). Роль ее определяется местом в
потоке энергии и круговороте веществ.
Активное участие микроорганизмов в аккумуляции энергии и
трансформации биогенных элементов обеспечивает жизнедеятельность
других звеньев биоценоза и функционирование экосистемы в целом.
Обладая мощным, разнообразным и лабильным ферментативным
аппаратом, микроорганизмы играют исключительно важную роль в
самоочищении почвы от разнообразных веществ — продуктов произ-
водственной и прежде всего сельскохозяйственной деятельности чело-
века.
Вторая половина XX века характеризуется резким усилением хими-
зации сельского хозяйства. В почву вносятся огромные дозы минераль-
ных удобрений и физиологически активных веществ, к которым сле-
дует отнести средства защиты растений. В настоящее время пестициды
являются одним из важных элементов интенсивных технологий, без
которых невозможно получение высоких и стабильных урожаев прак-
тически ни одной сельскохозяйственной культуры. Экономический
эффект от их применения только в СССР составляет около 7 млрд
руб. в год.
Суммарный объем производства пестицидов в мире достиг в 80-е
гг. 2 млн т и продолжает ежегодно нарастать. Каждый год химически-
ми препаратами обрабатывается от 0,5 до 0,8 млрд га, или 30—100%
сельскохозяйственных угодий. Как правило, пестициды используются
в дозах 0,5—10 кг/га (в последние годы синтезированы препараты но-
вого поколения, действующие в концентрации 10—20 г/га). Во многих
случаях производится многократная обработка полей пестицидами.
Происходит наложение одних веществ на другие при последователь-
ном или одновременном применении фунгицидов, инсектицидов и гер-
бицидов.
Благодаря относительно высокой стабильности пестициды и продук-
ты их трансформации циркулируют в окружающей среде от нескольких
недель до нескольких лет (Мельников и др., 1977). Систематическое
ежегодное их применение приводит к исключительному по своим масш-
табам прецеденту воздействия человека на природные процессы.
Большая часть пестицидов, используемых в сельском хозяйстве,
попадает в почву, которая является своеобразным ’’депо” химических
соединений, местом их взаимодействия с микроорганизмами и основ-
ным источником загрязнения других природных свеп, кормов и про-
3
дуктов питания. Пестициды рассеиваются на огромных площадях и
их невозможно собрать с помощью каких-либо очистных сооружений,
поэтому просчеты в санитарно-гигиенической и экотоксикологической
оценке препаратов особенно опасны, как это можно было видеть на
примере использования алдрина, дилдрина, ДДТ, 2,4,5-Т, ртуть- и мы-
шьяксодержащих веществ.
В настоящей монографии рассматриваются два аспекта взаимодей-
ствия пестицидов и микроорганизмов в почве. 1. Влияние пестицидов7
на микрофлору и биохимические процессы трансформации биогенных
элементов, и в конечном счете на плодородие и фитосанитарное состо-
яние почвы. 2. Трансформация и деградация пестицидов микроорга-
низмами, обусловливающие самоочищение почвы или отравление ее
метаболитами.
Публикации, посвященные воздействию пестицидов на микроор-
ганизмы, в том числе две крупные монографии (Pesticide Microbiol.,
1978; Insecticide microbiol., 1984) носят в основном описательный ха-
рактер. Результаты почвенно-микробиологических исследований проти-
воречивы и часто несопоставимы друг с другом. Фактологический ана-
лиз экспериментального материала, опубликованного за последнее
десятилетие, достаточно хорошо представлен в ряде обзоров (Ме-
ренюк, 1982; Клинцаре, 1983; Берестецкий и др., 1984; Wain-
wright, 19771 1978; Simon-Silvestre, Fournier, 1979; Domsch et al.,
1983; Jagnow, 1984, и др.). Поэтому авторы сочли целесообразным
сосредоточить внимание на методологических принципах почвенно-
микробиологической оценки токсичности пестицидов и основных
закономерностях формирования и жизнедеятельности микрофлоры
при введении в почву химических препаратов. Без выявления этих
закономерностей, без четкого представления о причинно-следственных
связях в реакциях микроорганизмов на обработку почвы мы не сма-
жем правильно оценить последствия применения пестицидов для поч-
венного плодородия, составить прогноз, организовать мониторинг
и разработать рациональные и наиболее безопасные способы защиты
растений.
Не менее острым является вопрос о роли микроорганизмов в про-
цессах самоочищения почвы от пестицидов. Показано, что практически
все препараты, синтезированные до сих пор, подвергаются микробной
трансформации. Однако в большинстве случаев для этого требуется
ряд условий (Головлева, 1979), неодинаковых для разных групп
химических соединений и пока что мало изученных. Но и из того,
что нам известно, ясно, что они далеко не всегда реализуются в почве.
Поэтому, например, ДДТ в лаборатории на искусственных питатель-
* ных средах разлагается микроорганизмами за несколько суток, а в
природных средах циркулирует десятки лет (Головлева и др., 1982;
Мельников и др., 1977). Тезис о том, что комплекс микроорганизмов
легче справляется с пестицидами и доводит процесс их разложения
4
до минеральных продуктов, справедлив лишь для специально подобран-
ного комплекса, функционирующего в оптимальных условиях. При
этом практически не известно, как этот комплекс формируется в почве,
при крайне низких концентрациях пестицидов, в отсутствие или при
незначительной способности их индуцировать синтез соответствующих
ферментов.
Пестициды, попадая в почву, взаимодействуют с органо-минераль-
ным комплексом. При этом изменяется их подвижность, характер
распределения в пространстве и соответственно подверженность микроб-
ному воздействию. Некоторые из них вступают в реакции с гумусовыми
веществами и другими природными соединениями, образуя новые хими-
ческие продукты. Эти реакции катализируются ферментами, проду-
цируемыми микроорганизмами (Bollag, 1983), то есть мы встречаемся
здесь с процессами, которые отсутствуют в чистых культурах на ис-
кусственных питательных средах.
Приступая к обобщению материалов, касающихся взаимодействия
пестицидов и почвенной микрофлоры, автор не претендует на их ис-
черпывающее освещение, а лишь пытается систематизировать результа-
ты собственных исследований и литературные данные. Возможно, раз-
делы книги не равнозначны. Это объясняется разной степенью изучен-
ности обсуждаемых в них вопросов. В частности, почти не исследована
возможность использования микроорганизмов в качестве тест-культур
для оценки и мониторинга загрязнения почв и других природных сред
пестицидами. Автор намеренно отказался от подробного описания
метаболизма пестицидов в культуре микроорганизмов на искусствен-
ных питательных средах. Этой теме посвящено много хороших обзоров
и монографий. Вместе с тем очень мало данных о роли и механизме
микробной трансформации пестицидов в почвенной среде. Поэтому
неизбежными оказались экскурсы в область почвенной микробиологии.
Автор попытался обратить внимание на особенности взаимодействия
микроорганизмов и пестицидов в такой гетерогенной и сложной среде,
как почва, наметить пути их решения.
Надеемся, что книга окажется полезной для специалистов, занима-
ющихся экологическими проблемами применения агрохимикатов и
разработкой рациональных и безопасных способов их использования
в сельском хозяйстве.
ВЛИЯНИЕ ПЕСТИЦИДОВ НА МИКРОФЛОРУ
И БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В ПОЧВЕ
МЕТОДОЛОГИЧЕСКИЕ ПОДХОДЫ К ИЗУЧЕНИЮ ПРОБЛЕМЫ
Микроорганизмы являются основным фактором почвообразо-
вательного процесса и необходимым звеном круговорота веществ
в природе. В соответствии с климатическими условиями, раститель-
ным покровом и физико-химическими свойствами почвы формирует-
ся сообщество микроорганизмов, характерное для данного типа почв.
Оно находится в постоянном развитии, изменяясь во времени и про-
странстве. Происходит перегруппировка микрофлоры, флуктуация
ее численности и биомассы, меняется характер и интенсивность биохи-
мических процессов.
Способность микроорганизмов хорошо сохраняться при неблаго-
приятных условиях и быстро восстанавливать популяцию в благоприят-
ных обусловливает стабильность почвы как биологической системы.
Существенное влияние на микрофлору почвы оказывают различ-
ные агротехнические мероприятия: механические обработки, севообо-
роты, удобрение и химические средства защиты растений (пестициды).
В настоящее время накоплен большой и противоречивый материал
относительно воздействия пестицидов на микроорганизмы и биохи-
мические процессы в почве. Основной причиной противоречий, на наш
взгляд, является отсутствие четкой методологической основы исследо-
ваний. При оценке последствий применения пестицидов мы в данной
работе исходим из положения, что хозяйственная деятельность челове-
ка не должна приводить к негативным последствиям, обусловлива-
ющим снижение качества среды.
В производственном плане качество почвы определяется уровнем
ее плодородия, то есть способностью обеспечивать гарантированный
урожай сельскохозяйственных культур. В экологическом аспекте под
высоким качеством среды понимается возможность устойчивого су-
ществования и развития сложившейся, созданной или преобразован-
ной человеком экосистемы в данном месте; отсутствие в настоящем
и будущем неблагоприятных последствий у любой (или наиболее важ-
ной) популяции, которая находится в этом месте исторически.
Существуют экологические критерии качества окружающей среды:
биологическая продуктивность, оптимальное соотношение видов и
биомассы популяций, находящихся на различных трофических уров-
нях (Израэль, 1984).
Хорошее качество почвы предполагает: высокий уровень биомассы
микроорганизмов в почве; высокую продуктивность микрофлоры;
большое видовое и функциональное разнообразие микроорганизмов;
оптимальное соотношение продуцентов и сапрофитов, обеспечивающее
6
воспроизводство гумуса; высокий уровень развития компенсацион-
ных механизмов системы; высокий уровень микробиологических
процессов самоочищения почвы.
Поддержание достаточного уровня биомассы и биохимической
активности ассоциации почвенных микроорганизмов, а следователь-
но, сохранение состояния гомеостаза почвы как биологической систе-
мы возможно только при условии постоянного притока энергетичес-
кого материала за счет жизнедеятельности основных продуцентов:
высших растений в наземных экосистемах и сельскохозяйственных
культур в агроэкосистемах. Таким образом, качественное состояние
почвы непосредственно зависит от растительного покрова. Поэтому
оценка антропогенного и, в частности, химического воздействия на
микрофлору должна учитывать все компоненты биоценоза.
Сложный характер ответных реакций наземной экосистемы на
введение пестицидов представлен на рисунке 1. Совершенно очевид-
но, что пестициды могут оказывать на микроорганизмы не только
прямое, но и опосредованное действие — через растения и почвенных
животных. Соответственно с этим усложняется оценка, мониторинг
и прогноз последствий применения пестицидов для почвенной биоты.
Рис. 1. Пути воздействия пестицидов на почвенную микрофлору
7
Исключительное значение для оценки и мониторинга токсического
действия пестицидов имеет выбор показателей и методов, характери-
зующих структуру и функциональное состояние почвенной биоты.
Здесь возможны три подхода. Первый, для краткости назовем его
культуральным, основан на оценке воздействия пестицидов на опре-
деленные виды микроорганизмов в чистой культуре. В этом случае
исследуемые вещества вносятся в соответствующие питательные среды
и изучается их влияние на рост и развитие микроорганизмов. Г. В. Ме-
ренюк (1983) подобрал микроорганизмы и разработал системы тес-
тов, на основании которых он предлагает давать ’’агроэкологическую”
оценку пестицидов. Однако для решения агрономических и экологичес-
ких проблем культуральный подход не годится, о чем писал еще
С. Н. Виноградский (1952), по следующим причинам.
1. Имеются большие различия в условиях развития микроорганиз-
мов в почве и на искусственных питательных средах.
2. Популяции отдельных видов микроорганизмов в почве разви-
ваются в ассоциации с другими видами и тесно связаны с ними систе-
мой трофических и хорологических связей, оказывающих существен-
ное влияние на резистентность почвенной биоты к экзогенным
веществам.
3. Естественные популяции микроорганизмов чрезвычайно гете-
рогенны в генетическом отношении и обладают более высоким адап-
тивным потенциалом, чем чистые культуры.
4. Значительная, если не большая часть микроорганизмов находит-
ся в почве в иммобилизованном состоянии. В зависимости от степени
и механизма иммобилизации их чувствительность к пестицидам будет
изменяться, что хорошо показано на примере антибиотиков и тяжелых
металлов (Звягинцев, 1987). Поэтому экстраполяция результатов
исследований с чистыми культурами на почвенную микрофлору явля-
ется не корректной, и метод может быть использован, по-видимому,
только для первичного скриннинга пестицидов в отношении патоген-
ных и симбиотических форм микроорганизмов.
Второй подход, назовем его производственным, при выборе ос-
новных показателей исходит из ’’агрономической ценности” тех или
иных микроорганизмов и биохимических процессов. Он достаточно
условный, поскольку само понятие ’’агрономической ценности” весь-
ма относительно и со временем может изменяться в соответствии с
изменением технологии производства и углублением наших знаний.
Так, минерализация органического вещества — ’’агрономически цен-
ный” процесс, но при условии полного воспроизводства гумуса и вос-
становления структуры почвы. В противном случае рано или поздно
произойдет дегумификация и деградация почвы со всеми вытекаю-
щими для ее плодородия последствиями. Процесс нитрификации яв-
ляется интегральным показателем процессов минерализации азотсо-
держащих веществ и, несомненно, полезен в естественных ландшафтах.
8
Однако в интенсивном земледелии, при использовании высоких доз
минеральных азотных удобрений, с этим процессом связано активное
накопление нитратов в почве и сельскохозяйственной продукции, веду-
щее к токсикозу и возникновению ряда серьезных заболеваний челове-
ка и сельскохозяйственных животных (Лебедев, 1985). Резко возраста-
ют потери азота за счет процессов денитрификации и вымывания, дости-
гая иногда 40 % от внесенных удобрений (Ковда, 1985).
Процесс фиксации атмосферного азота микроорганизмами является
безусловно полезным при любых системах земледелия и в естествен-
ных почвах. В последнем случае только он обеспечивает возврат моле-
кулярного азота в биологический круговорот. Тем не менее чаще всего
при изучении влияния пестицидов на почвенно-микробиологические
процессы этот показатель обходится.
В основе третьего, экологического подхода лежит представление
о микрофлоре почвы как части наземной экосистемы, в которой микро-
организмы развиваются и функционируют в соответствии с экологичес-
кими законами. Роль отдельных микроорганизмов определяется их
местом в потоке энергии и круговороте веществ.
Почвенная микрофлора имеет хорошо развитую пищевую сеть
и мощный компенсационный механизм, основанный на функциональ-
ной взаимозаменяемости одних видов другими. Кроме того, благодаря
лабильному ферментативному аппарату многие виды могут легко пере-
ключаться с одного питательного субстрата на другой, обеспечивая
тем самым стабильность экосистемы. Это существенно усложняет оцен-
ку воздействия на нее различных антропогенных факторов и требует
использование интегральных показателей.
Микроорганизмы занимают различные трофические уровни, но
основной поток энергии идет через сапрофиты. Главная сторона их
деятельности — минерализация и гумификация продуктов зкзоосмоса
и мертвого органического вещества животных и растений, попадающих
в почву, тесно связана с процессами почвообразования и питания рас-
тений.
Все сказанное позволяет сформулировать задачу почвенно-микро-
биологической оценки пестицидов. Она заключается в определении
тех границ (нагрузок, концентраций) их применения, при которых
происходит изменение потока энергии, нарушается круговорот веществ,
ломается структурная и функциональная организация микробоцено-
за. Отсюда и выбор показателей, которые должны занимать ключе-
вое положение в системе функциональных и структурных связей микро-
организмов, имеющих экологическую значимость. Среди них могут
быть крупные таксономические группы микроорганизмов, симбиоти-
ческие системы или такой процесс, как нитрификация, который сум-
марно характеризует минерализацию и трансформацию азотсодержа-
щих соединений вне зависимости от его ’’хозяйственной” оценки и т. д.
В таблице 1 представлены некоторые из этих показателей. Они охваты-
9
1. Почвенно-микробиологические показатели токсичности пестицидов
Экологический, санитарно-гигиенический показатель Основные индикаторные микроорганизмы и процессы Дополнительные признаки
Поток энергии Дыхание почвы (выделение СО,)
Круговорот веществ Азот: нитрификация, азотфиксация Фосфор: минерализация органофосфатов Углерод: выделение СО,, раз- ложение целлюлозы Аммонификация, актив- ность уреазы, протеазы Активность фосфатазы Активность инвертазы, амилазы
Структура биоценоза Сапрофитные бактерии, актиномицеты, грибы, Видовое разнообразие, доминирующие виды,
микроскопические водо- росли, микрофауна. Симбиотические системы: бактериотрофные растения, мико- трофные растения, лишайники виды-индикаторы
Санитарное состояние Патогенные формы микроорганизмов Антибиотический потенци- ал, фунгистазис и т. д.
Способность почвы к Персистентность пестици- Трансформация пестицидов.
самоочищению дов. Кинетика детокси- кации Метаболиты
вают основные параметры экосистемы, включая способность почвы к
самоочищению от патогенных форм микроорганизмов и пестицидов.
Первые три показателя представляют интерес с эколого-агрономической
точки зрения, четвертый и пятый — с санитарно-гигиенической. Исполь-
зуя их, можно составить достаточно четкое представление об измене-
ниях, которые происходят в почвенной биоте под влиянием пестицидов.
При этом, естественно, необходимо иметь количественные критерии для
объективной оценки.
Как известно, в основу токсикологической оценки химических
веществ положен принцип пороговое™: за определенными пределами
концентраций химическое вещество перестает быть ядом и не оказывает
на организм ранее свойственного ему действия (Саноцкий, Уланова,
1978). В настоящее время этот принцип используется в зкотоксико-
логии.
Порог действия токсических веществ на биологическую систему
определяют на основании анализа кривой доза-эффект (Саноцкий,
Уланова, 1975). Многочисленные исследования, проведенные в нашей
10
лаборатории, и литературные данные подтверждают правомерность
такого подхода и для почвенной биоты.
Обобщенные кривые, характеризующие действие возрастающих
доз пестицидов на отдельные почвенно-микробиологические показа-
тели, представлены на рисунке 2.
Как видно, по достижении определенной концентрации пестици-
ды преодолевают физиологическую устойчивость микроорганизмов.
Число последних и активность биохимических процессов в почве сни-
жаются и в конечном счете достигают нулевой отметки. Нередко ма-
лые концентрации некоторых соединений, в частности физиологичес-
ки активных веществ гормонального характера, стимулируют деятель-
ность отдельных групп микроорганизмов и биохимические процессы.
За пороговый уровень принимают концентрации, ниже которых
ответная реакция организма на химические вещества отсутствует. По-
нятие пороговых концентраций или доз весьма относительно, так как
определяемые их значения могут меняться в процессе совершенство-
вания методов анализа, с накоплением и углублением наших знаний
(Израэль, 1984). В силу этого они не могут служить обобщающими
критериями, характеризующими воздействие пестицида на организм.
Для ассоциации почвенных микроорганизмов это тем более спра-
ведливо, что они живут и развиваются в такой гетерогенной и постоян-
но изменяющейся среде, как почва.
В практике санитарно-гигиенических и токсикологических исследо-
ваний в качестве критерия токсичности используют концентрации,
которые снижают численность микроорганизмов или активность биохи-
мических процессов на 25, 50, 75 %. Наиболее репрезентативным и
широко используемым критерием является индекс CKSO (HKS0),
характеризующий концентрации химических веществ, снижающие
численность популяции или активность биохимических процессов на
50%. Опыт показал его приемлемость для первичной оценки воздей-
ствия пестицидов на почвенную биоту.
В таблице 2 представлены результаты такой оценки ряда пести-
цидов. Различия в чувствительности к ним таксономических групп
микроорганизмов говорят об избирательном действии химических
Рис. 2. Влияние возрастающих доз пести-
цидов (отн. ед.) на численность микро-
организмов и активность биохимических
процессов (отн. ед.) в почве (кривая
доза-эффект):
1, 2 — типы ответных реакций микро-
организмов
Дозы пестицида
11
2. Ингибирующее действие пестицидов на биологическую активность дерново-подзолистой
легкосуглиннстой почвы (ИК|0, мг/кг почвы)
Пестицид Дыхание почвы Разложение целлюлозы Нитрифика- ционная способность Азотфик- сирующая активность Численность микроорганизмов
Бактерии Актино- мицеты Грибы Водоросли
Глифосат >100 >100 >100 >100 >100 >100 >100 >100
Атразин >100 >100 >100 >100 >100 100 >100 0,5
Эптам >100 >100 25 >100 — >100 50
Монурон >100 >100 50 >100 >100 >100 >100 0,1
Линурон >100 >100 80 >100 >100 >100 >100 70
Изофос-3 >100 >100 >100 50 >100 >100 >100 27
Рогор >100 >100 5 - >100 >100 >100 >100
Базудин >100 >100 >100 >100 50 30 40 >100
ТМТД >100 40 >100 >100 20 8 6 —
Карбатион 30 30 10 10 >100 20 30 25
Примечание. Знак (-) означает отсутствие данных.
веществ на микрофлору. Водоросли наиболее чувствительны к атра-
зину и монурону, грибы и актиномицеты — к ТМТД, а карбатион в
одинаковой степени подавляет жизнедеятельность водорослей, грибов
и актиномицетов. Аналогичная картина наблюдается и в отношении
ряда биохимических показателей.
Индексы СК50 (или ИК50) позволяют количественно оценить
нагрузку, неблагоприятную для отдельных компонентов почвенной
биоты. Однако используя их, нельзя составить реального представле-
ния о степени опасности или вредоносности пестицидов.
Максимальные концентрации пестицидов в почве заранее заданы
и диктуются производственной необходимостью и санитарно-гигие-
ническими требованиями. Они зависят от физиологической активности
препаратов, цели их использования и типа почвы. Например, карба-
тион рекомендован в дозах 300—800 кг д. в./га, трихлорацетат (ТХА) —
4,5—45, атразин — 1,5—8,0 кг д. в./га, а гербицид глин — всего
0,010-0,015 кг д. в./га.
В связи с этим при оценке вредоносности пестицидов для того
или иного почвенно-микробиологического показателя целесообразно
CKSO приводить в сравнении с производственной концентрацией (ПК).
Это отношение (СК50 или ИК50/ПК) получило наименование ко-
эффициента надежности, или коэффициента безопасности (Kg). По
смыслу Кб близок к индексу широты терапевтического эффекта, ис-
пользуемому в фармакологии для оценки действия лекарственных
веществ, а по существу показывает, во сколько раз полулегальные
дозы пестицидов выше производственных. Применение пестицидов
в сельском хозяйстве, так же как и применение лекарственных ве-
ществ в медицине, представляет определенный риск. В отношении ми-
крофлоры, как одного из основных факторов плодородия почвы, этот
риск тем меньше, чем выше Kg.
Для практической оценки такого риска была предложена ’’шкала
безопасности”, которая позволяет количественно оценить отрица-
тельное влияние пестицида на тот или иной компонент почвенной би-
оты (рис. 3).
На рисунке 4 приведены Kg для некоторых пестицидов, различа-
ющихся химическим составом и механизмом действия.
Глифосат не влияет существенно ни на один из почвенно-микроби-
ологических и биохимических показателей в концентрациях, превыша-
ющих производственные более чем в 100 раз (Kg > 100). Атразин
подавляет развитие микроскопических водорослей (Kg < 0,1). ТМТД
обладает фунгицидным эффектом j(Kg < 3) и подавляет развитие акти-
номицетов (Kg ~ 4). Карбатион блокирует процесс нитрификации
и снижает численность грибов, бактерий, актиномицетов и водорослей
в дозах, во много раз ниже производственных (Kg ~ 0,10).
Таким образом, действие пестицидов на почвенно-микробиологи-
ческие процессы носит избирательный характер. В почве имеются как
13
Рис. 3. ’’Шкала безопасности” пестицидов
для почвенной биоты: Kg — коэффициент
безопасности пестицидов; 1 - отсутствие
ингибирования; 2, 3, 4 - слабая, умерен-
ная и сильная степени ингибирования
соответственно
Рис. 4. Номограммы почвенно-микробиологической оценки отдельных пестицидов:
Микроорганизмы: 1 - бактерии; 2 - микромицеты; 3 - актиномицеты; 4 - мик-
роскопические водоросли. Процессы: 5 — нитрификация; б - разложение целлю-
лозы; 7 - дыхание почвы
чувствительные, так и устойчивые к пестицидам микроорганизмы.
Отсюда можно сделать заключение, что в ассоциации (сообществе)
почвенных микроорганизмов, как и в отдельно взятом организме,
есть свои ’’точки приложения токсического действия пестицидов”,
свои ’’мишени”, которые можно было бы назвать ’’экологическими
мишенями”.
Ассоциация почвенных микроорганизмов является категорией
экологической и функционирует как единое целое благодаря взаимо-
связанным метаболическим превращениям (Мишустин, 1975; Завар-
зин, 1970). Поэтому понятие о ’’мишенях” как нельзя лучше позволя-
ет разобраться в механизме токсического действия пестицидов на микро-
флору и плодородие почвы.
Характер и степень воздействия пестицидов на геохимическую
деятельность ассоциации почвенных микроорганизмов в целом будет
определяться местом, которое занимают микроорганизмы ’’мишени”
в потоке энергии, круговороте веществ и почвообразовательном про-
цессе.
Так, атразин, симазин, прометрин, монурон и ряд других ингиби-
торов фотосинтеза, избирательно подавляя рост водорослей в агро-
экосистемах, где основными продуцентами являются высшие расте-
ния, устойчивые к гербицидам, по-видимому, не будут оказывать за-
метного влияния на почвообразовательный процесс и соответственно
14
на плодородие почвы. Простые расчеты показывают, что приток энер-
гии и синтез органического вещества за счет высших растений в этом
случае в десятки и сотни раз выше, чем за счет водорослей. Вместе
с тем попадание этих гербицидов на ’’примитивные” почвы, покрытые
водорослями и лишайниками, например при переносе воздушными
массами с сельскохозяйственных угодий, может иметь катастрофи-
ческие последствия. Здесь водоросли являются единственными про-
дуцентами Органического вещества. С их гибелью полностью прекра-
щается его синтез и начинается разрушение микроэкосистемы.
Рогор и особенно специфические ингибиторы нитрификации, та-
кие как N-serve и ряд пиридиновых производных, блокируют процес-
сы окисления аммонийного азота до нитратов, вызывая снижение со-
держания окисленных форм азота в почве. Увеличивается отношение
NH4/NO3, уменьшаются потери азота за счет денитрификации, изме-
няются условия азотного питания растений.
При интенсивном применении аммонийных и амидных форм азо-
та, принятом в современном земледелии, такой эффект может рассмат-
риваться как положительный. Ведь именно благодаря ему снижаются
потери азота в почве за счет процессов денитрификации и вымывания
нитратов. Уменьшается загрязнение воздушного и водного бассейнов
его окисленными формами.
Таким образом, отрицательный результат оценки сам по себе еще
не дает права на отказ от применения тех или иных химических средств
защиты растений. Необходим тщательный экологический анализ полу-
ченного материала.
Как уже отмечалось, пестициды обладают различным спектром
действия на почвенную биоту. Некоторые из них, как, например, атра-
зин, подавляют какую-то одну функциональную группу микроорга-
низмов или блокируют какой-то один процесс. Другие, называемые
условно почвенными стерилизаторами, воздействуют на широкий круг
микроорганизмов. В последнем случае пестициды ’’поражают” практи-
чески все живое. Это относится, например, к карбатиону и почти всем
фумигантам. Однако это отнюдь не отрицает концепцию ’’экологичес-
ких мишеней”. Разница между пестицидами узкого и широкого спек-
тра действия заключается в объеме поражения и напоминает, образно
говоря, разницу между поражающим действием прицельной стрель-
бы из винтовки и взрывом артиллерийского снаряда. Пестициды, име-
ющие широкий спектр действия, наносят наибольший ущерб и пред-
ставляют наибольшую опасность для почвенной биоты.
При отсутствии общепринятых и достаточно обоснованных мето-
дов интегральной оценки токсичности пестицидов для почвенной би-
оты, по-видимому, целесообразно выделить наиболее экологически
значимые показатели, такие как процессы фотосинтеза и фиксации
молекулярного азота, жизнедеятельность симбиотических систем, про-
цессы возврата фосфора в биологический круговорот (минерализа-
15
ция органофосфатов и выщелачивание неорганических соединений
фосфора).
Возникает вопрос, насколько важным и универсальным явля-
ется выбор ’’мишени”, сделанный в модельных опытах на одной из
почв.
Априори можно утверждать, что поскольку токсичность пестици-
дов обусловлена их воздействием на функциональный апцарат микро-
организмов, то, очевидно, она будет проявляться в той или иной мере
на любой из почв в оптимальных для жизнедеятельности микроор-
ганизмов условиях.
В таблице 3 представлены результаты оценки воздействия ряда
пестицидов на процесс нитрификации в почвах, имеющих различный
генезис и физико-химические свойства.
3. Ингибирующее действие иестицидов иа процессы нитрификации
в различных типах почв
Пестицид Дерново-подзолистая супесчаная Дерново-подзолистая легкосуглинистая
ИКи Кб ИКи Кб
Атразин >100 >100 >100 >100
Монуроп 10 5 50 25
Эптам 24 12 60 30
* 1ТИОП 3 0,01 10 0,02
Продолжение
Пестицид Чернозем южный карбонатный Чернозем обыкновенный
ик„ Кб ИКЮ Кб
Атразин >100 >100 >100 >100
Монуроп 116 29 119 30
Эптам 149 37 180 45
Карбатион 75 0,15 90 0,18
Примечание. ИКЮ дается в мг/кг почвы.
Как видно, независимо от типа почвы атразин не токсичен для
нитрифицирующих бактерий. Монурон и зптам являются слабыми
ингибиторами нитрификации, карбатион — сильным. Таким образом,
наиболее 'существенное значение во взаимодействии между экзоген-
ным веществом и микроорганизмами имеет химический состав пре-
16
парата и физиологическая устойчивость микроорганизмов к токси-
канту. Тип почвы, ее физико-химические свойства, влияя в той или
иной степени на токсический эффект пестицидов, ни в коей степени
не изменяют природу его воздействия на ассоциацию почвенных микро-
организмов. Как показывают многочисленные исследования, наименее
защищенной от токсического действия пестицидов является микрофло-
ра малогумусных почв, легких по механическому составу.
Таким образом, оценка токсического действия пестицидов на поч-
венную биоту должна складываться из выявления ’’мишени” и после-
дующего экологического анализа ее места и роли в потоке энергии
и круговороте веществ с целью прогнозирования последствия приме-
нения химических средств. Результаты прогноза могут быть использо-
ваны для агроэкологического обоснования мероприятий по защите
растений и регламентации (нормирования) применения пестицидов
в земледелии.
РАСПРЕДЕЛЕНИЕ МИКРООРГАНИЗМОВ
В ОБРАБОТАННОЙ ПЕСТИЦИДАМИ ПОЧВЕ
Как известно, почва гетерогенна и состоит из твердых минераль-
'улных частиц, органо-минеральных агрегатов, пронизанных порами раз-
^Зличной величины, геля, жидкой и газообразной фаз. Микроорганизмы
\ распределяются в ней неравномерно в виде отдельных клеток, неболь-
*гйих групп и микроколоний, которые находятся на твердых поверх-
остях, включены в гель или свободно плавают в почвенном растворе.
Современные пестициды — в основном органические соединения.
Многие из них плохо растворимы в воде. Выпускаются они в виде эмуль-
гирующих концентратов, смачивающихся порошков, дустов, гранул,
капсул. В зависимости от формы препарата, в почву попадают частицы
размером от нескольких микрон до нескольких миллиметров (Мельни-
ков, 1984). Исключение составляют водорастворимые и газообразные
вещества, которые находятся в водной и газовой фазах в молекуляр-
ном состоянии. Таким образом, при любом способе применения боль-
шинство пестицидов распределяется в почве неравномерно в виде от-
дельных частиц, капель и пленок. Это подтверждается рядом данных,
в частности сообщением о зернистой структуре радиоавтографов поч-
венных образцов, обработанных пестицидами, меченными радиоактив-
ными элементами (Grossbard, 1975).
Со временем происходит укрупнение отдельных очагов и более
резкая дифференциация их в пространстве. Последнее объясняется
сорбционным перераспределением пестицидов и аккумуляцией Их
микрофлорой и микрофауной почвы. Способность живого организма
поглощать и накапливать пестициды хорошо известна.
Так, в наших опытах было показано, что коэффициент аккумуля-
17
I в-ТвХвЗч&евйЬ
библиотека
ции гербицида атразина бактериями, грибами и микроскопическими
водорослями составляет от 10 до 400, а концентрация их в биомассе
микроорганизмов может достигать нескольких сот миллиграммов
на 1 кг. Это вовсе не означает, что пестициды, поглощенные микро-
организмами, подвергаются трансформации и детоксикации — происхо-
дит как бы их агрегация и консервация в почве.
Используя стекла обрастания, мы обнаружили интересный фено-
мен формирования почвенной микрофлоры вокруг частиц пестици-
дов (рис. 5); картина напоминала процесс обрастания природных по-
лимеров и композиционных материалов (целлюлозы, хитина, каучу-
ка, лаков и т. д.).
Атразин распределяется в виде частиц и кристаллов размером
от 5 до 50 мкм. Уже на десятый день после заделки стекол в почву
на частицах гербицида появляются отдельные клетки бактерий, чис-
ленность которых со временем увеличивается. Клетки формируются
в более или менее крупные группы, образующие при слиянии микро-
колонии. Спустя несколько месяцев бактерии распределяются плот-
ным слоем по периметру частиц, обволакивая их. Некоторые крис-
таллы гербицида теряют характерную форму. Происходит их деструк-
ция. Частицы атразина могут обрастать различными видами бактерий.
Однако, как правило, на поверхности гербицида развивается моно-
культура, которая первой вступает в контакт и колонизирует его.
Накопление массы бактерий вокруг препарата протекает мед-
ленно и неодинаково для разных частиц, разобщенных в простран-
стве. Так, наряду с кристаллами атразина, обросшими плотным слоем
бактерий, через 4-5 месяцев в почве обнаруживаются почти ’’стериль-
ные” кристаллы. Последнее указывает на специфичность микрофлоры
обрастания гербицида и случайный характер распределения ее в почве.
Актиномицеты на стеклах с атразином встречаются довольно
часто. Гифы их иногда пересекают частицы гербицида, но ни разу не
наблюдалось массового развития этих микроорганизмов вблизи гер-
бицида. Создается впечатление, что они или индифферентны к атрази-
ну, или избегают контакта с ним.
Мицелий грибов обнаруживается редко. Как правило, он прохо-
дит на значительном расстоянии от гербицида, причем нередко наблю-
дается его деструкция и лизис. Лизированный мицелий атакуется бак-
териями.
Таким образом, действие атразина на микроорганизмы почвы
избирательно. Избирательность проявляется в формировании на поверх-
ности кристаллов монокультуры бактерий. Актиномицеты и грибы
как бы ’’отодвигаются” от частиц гербицида. По-видимому, в реакции
мицелиальных форм микроорганизмов существенное значение имеет
отрицательный хемотаксис. Гифы актиномицетов и грибов, достигая
зоны диффузии атразина, прекращают рост в этом направлении и ’’об-
ходят” его стороной.
18
Рис. 5. Формирование микрофлоры на поверхности частиц различных пестицидов
в дерново-подзолистой почве:
I, 2, 3 - атразин соответственно через 10 суток, 2 и 6 месяцев; 4, 5, 6 - линдан
соответственно через 1, 3 и 6 месяцев; 7,8,9 — базудин через 3 суток, 1 и 2 месяца
соответственно
Аналогичная картина наблюдалась на стеклах обрастания в опы-
тах с инсектицидом линданом (у-ГХЦГ).
Гранулы базудина при попадании во влажную почву рассыпались
на мелкие частицы размером 2—40 мкм. Первые 5—10 суток на по-
19
верхности отдельных частиц роста бактерий не наблюдалось. .Вокруг
них образовывалась стерильная зона. Бактерии группировались на
некотором расстоянии от базудина. Актиномицеты и грибы встречались
редко и не вступали в контакт с инсектицидом. При более длитель-
ной инкубации в почве на стеклах с инсектицидом появлялись гифы
актиномицетов. Границы стерильных зон размывались. Кольцо бак-
терий вокруг них смыкалось.
Очень 'сильное действие на микробный пейзаж оказывает сма-
чивающийся порошок тетраметилтиурамдисульфида (ТМТД). Стериль-
ные зоны на стеклах обрастания занимают обширное пространство.
Края их плохо очерчены. Мицелий гриба встречается крайне редко
в виде коротких фрагментов. Актиномицеты развиты плохо и глав-
ным образом на периферии стекол. Бактерии рассеяны в виде одиноч-
ных клеток и небольших групп, что указывает на отсутствие актив-
ного размножения. Отрицательный эффект пестицида проявлялся до-
вольно долго, микропейзаж восстанавливался до контрольного уровня
только через 4—6 месяцев.
Полученный материал отражает определенные закономерности
в формировании микробных пейзажей почвы, обработанной пестицида-
ми. Более детальная картина представляется следующим образом.
Пестициды, плохо растворимые в воде, распределяются в поч-
ве дискретно в виде множества частиц, которые становятся центра-
ми диффузии. От частиц, сколь бы малы они ни были, вещества диф-
фундируют в окружающую среду. По градиенту диффузии концентра-
ция их снижается, в соответствии с этим изменяется и физиологичес-
кое воздействие на почвенные микроорганизмы.
Рассмотрим обобщенную схему ’’возмущающего” действия пес-
тицидов на почвенную микрофлору (рис. 6).
Рис. 6. Схема распределения микро-
организмов по градиенту концен-
трации пестицидов в почве:
а — тотальный стерилизующий эф-
фект пестицида; б - обрастание
частиц пестицида монокультурой
микроорганизмов; С — концентра-
ция пестицида по градиенту диф-
фузии; п,...п4... относительная
численность отдельных видов ми-
кроорганизмов (в % к контролю)
20
Пусть П\, Пг, п3, гц..., на.рисунке 6, а — отдельные виды микро-
организмов, составляющие микрофлору. При попадании в почву хими-
ческий препарат начинает диффундировать в окружающую среду. В
эоне, примыкающей к центру диффузии, он имеет наивысшую концен-
трацию. У таких препаратов, как ТМТД и базудин, деятельность микро-
организмов в этой зоне полностью прекращается. Вокруг частицы пре-
парата образуется стерильная зона. Далее по градиенту диффузии на-
чинают развиваться наиболее устойчивые формы микроорганизмов
(«1), причем на некотором отдалении создаются какие-то оптималь-
ные концентрации, которые стимулируют их развитие.
При дальнейшем снижении концентрации пестицида по мере уда-
ления от центра диффузии наряду с видом nt в почве начинают разви-
ваться все более и более чувствительные виды микроорганизмов, по-
следовательно п2, п3, гц и т. д. Не исключено, что так же, как и в слу-
чае п1; по мере сжжения концентрации пестицида ингибирующий эф-
фект его будет переходить в стимулирующий.
Как видно из рисунка 6, а, при удалении от частицы препарата
будет возрастать не только численность, но и видовой состав микро-
флоры, который в к&йечном счете выравнивается с контролем.
Характерно, что пестициды как физиологически активные ве-
щества при дискретном распределении в почве могут оказывать на
одни и те Же микроорганизмы одновременно как положительное, так
и отрицательное действие, разобщенное в пространстве. Поэтому в
целом эффект пестицидной обработки почвы сводится к пространствен-
ной перегруппировке микроорганизмов.
По градиенту диффузии в направлении от центра к периферии
зоны ингибирования могут чередоваться с зонами более интенсивно-
го развития отдельных видов микроорганизмов. Таким образом, сти-
мулирующий эффект на микрофлору в одной зоне в какой-то степени
компенсирует ингибирующее действие в другой.
Несколько иной тип взаимодействия пестицидов с почвенными
микроорганизмами представлен на рисунке 6, б. В этом случае стери-
льная зона вокруг частиц пестицида отсутствует. Вследствие положи-
тельного хемотаксиса или случайного контакта на поверхности этих
частиц происходит концентрация и размножение какой-то специфичес-
кой микрофлоры, подобно тому, как это происходит на частицах при-
родных или искусственных полимеров.
Многочисленные наблюдения, проведенные во ВНИИ сельскохозяй-
ственной микробиологии, показали, что на частицах гербицида атра-
зина и инсектицида линдана формируется монокультура микроорганиз-
мов, которая первой вступает в контакт и колонизирует их. Это под-
тверждает одну из основных закономерностей сукцессии микрофло-
ры при освоении органического вещества в почве, замеченную еще
Виноградским (1952). Однако и в этом случае менее конкурентные,
индифферентные к пестицидам или более чувствительные к ним микро-
21
организмы располагаются на некотором отдалении от частиц препа-
рата. При этом стимулирующее воздействие последнего на другие виды
микроорганизмов по градиенту диффузии, надо полагать, может про-
являться только в начальный период. В последующем диффундирующий
в почву пестицид будет поглощаться микрофлорой обрастания и лока-
лизоваться в микрозонах. ~-
Таким образом, взаимодействие пестицидов с почвенной микро-
флорой происходит главным образом в микрозонах, то есть имеет ло-
кальный характер. Ни в одном из описанных здесь случаев за предела-
ми этой относительно небольшой зоны, примыкающей к частице пести-
цида, существенных изменений микрофлоры не наблюдается. Следо-
вательно, действие пестицидов на микроорганизмы ограничено какой-
то частью почвы. Отсюда степень их влияния на микробиологические
процессы в целом по почвенному профилю будет зависеть от того,
насколько велика эта часть.
Расчеты показывают, что при дозе пестицида 1 кг/га и массе час-
тиц препарата 10 мкг на 1 см2 обрабатываемой площади приходится
по 1 частице. Если учесть, что пестициды распределяются главным об-
разом в верхнем 5-сантиметровом слое, то одна частица будет приходить-
ся на 5 см3 почвы. На самом деле при поверхностной обработке почвы
пестицидами содержание их с глубиной резко снижается. Поэтому наибо-
лее активный в микробиологическом отношении слой почвы (5—20 см)
содержит лишь какие-то доли того, что попадает на ее поверхность.
Отсюда можно сделать заключение, что даже при идеальном распреде-
лении расстояние между отдельными частицами пестицидов в почве
будет в сотни и тысячи раз превосходить их физические размеры.
Расстояние между микрозонами пестицидов зависит также от типа
почвы, дозы и формы препарата, способа его внесения, размера частиц,
скорости диффузии, взаимодействия с органической и минеральной
частями почвы, подвижности ее водной фазы и т. д. Физико-химичес-
кий аспект многих из этих закономерностей недостаточно изучен и
требует специального анализа.
Из представлений о микрозональном (локальном) характере вза-
имодействия пестицидов и микроорганизмов вытекает, что для получе-
ния стерилизующего эффекта токсиканта, плохо растворимого в воде,
требуется создать такую плотность его микроочагов, которая бы исклю-
чала существование в почве зон, свободных от пестицидов.
Для определения таких нагрузок можно пользоваться кривой ’’до-
за - эффект”, описанной выше.
Значительная часть пестицидов, имеющих достаточно хорошую
растворимость, сорбируется на поверхности твердых частиц и струк-
турных элементов почвы. При использовании производственных доз,
составляющих несколько килограммов на гектар, в условиях ’’нормаль-
ной” для почвы влажности (20-40 %) сорбция пестицида может дости-
гать почти 100% (Calvet et al., 1980). Таким образом, на границе раз-
22
дела твердой и жидкой фаз возникают концентрации, существенно
превышающие концентрации в почвенном растворе, то есть в такой
гетерогенной среде, как почва, даже водорастворимые пестициды бу-
дут распределяться неравномерно, и, следовательно, действие их на
микроорганизмы также будет иметь микрозональный характер.
Следует учитывать, что токсические свойства адсорбированных
почвой химических соединений могут существенно изменяться. Было
показано, например, что антибиотики при адсорбции подавляют толь-
ко адсорбированные клетки бактерий (Звягинцев, 1973), т. е. ареал
их действия ограничен поверхностью почвенных частиц. По-видимому,
не составляют в этом отношении исключение и пестициды. Следовате-
льно, в определенных условиях влажности в почве будут возникать
зоны низких концентраций пестицида или вообще ’’свободные” от
них, где микроорганизмы могут развиваться нормально, не испыты-
вая на себе ’’давления” токсиканта. В условиях неравномерного ми-
крозонального распределения пестицидов микроорганизмы могут
активно уходить из зоны высоких концентраций этих веществ вслед-
ствие отрицательного хемотаксиса, что хорошо показано в модель-
ных опытах на примере других химических соединений.
Микрозональное распределение пестицидов и микроорганизмов,
а также способность последних активно избегать контакта с токси-
ческими веществами, по-видимому, в какой-то степени объясняют
высокую биологическую буферность почвы и низкую эффективность
химических средств защиты растений в борьбе с почвообитающими
фитопатогенами.
Отдельного рассмотрения требуют фумиганты, которые, испаряясь,
распределяются в газообразной и жидкой фазах почвы, сорбируются
на поверхности почвенных частиц, проникают в мелкие поры струк-
турных элементов и диффундируют в органо-минеральный гель. Обла-
дая низкой избирательностью действия, они оказывают стерилизующий
эффект на почвенную биоту, снижая численность микроорганизмов
в десятки и тысячи раз. При этом наиболее чувствительные формы
могут быть надолго ’’выбиты” из микробного ценоза (Поулсон, 1979).
Используемые в относительно высоких дозах (100—200 кг/га), фуми-
ганты радикально воздействуют на биохимические процессы в почве
и требуют наиболее пристального внимания почвенных микробиоло-
гов, особенно в случае крупномасштабного и систематического их при-
менения.
Таким образом, микроскопический анализ показал, что чувстви-
тельность микробиологических процессов к пестицидам обусловли-
вается не только химической природой препарата и физиологической
устойчивостью к нему микроорганизмов, но и неравномерным, дискрет-
ным распределеним его в почве, наличием в ней зон, свободных от
пестицидов.
23
ИЗМЕНЕНИЕ СТРУКТУРЫ ИНДИКАТОРНОЙ ГРУППЫ
МИКРООРГАНИЗМОВ
Концентрация пестицидов в почве не является величиной постоян-
ной. Под влиянием физических, химических и биологических факто-
ров количество их снижается, соответственно меняется характер и
степень воздействия на микроорганизмы, что необходимо учитывать
при агроэкологической оценке токсичности пестицидов.
В нашей лаборатории изучалось действие пестицидов на числен-
ность микроорганизмов и интенсивность некоторых биохимических
процессов в почве. Опыты проводили в биометрах площадью 1,5 м2
на парующих почвах, различающихся по механическому составу и со-
держанию органического вещества. Сорняки удаляли путем ручной
прополки.
В опытах использовали производственные дозы четырех пести-
цидов — зптама, атразина, монурона и карбатиона, относящихся к раз-
личным классам органических соединений.
По предварительной оценке в модельных опытах, зптам являет-
ся слабым ингибитором нитрификации (Kg = 12—45), атразин и мо-
нурон подавляют рост водорослей (Kg < 1), карбатион обладает
фунгицидным и альгицидным эффектом, ингибирует развитие цел-
люлозоразлагающих бактерий, блокирует процессы нитрификации
(Kg < 0,1). Таким образом, токсическое действие гербицидов, ис-
пользуемых в опыте, направлено на различные микроорганизмы, ины-
ми словами, у них разные ’’мишени”.
На рисунке 7 представлена динамика токсического действия изу-
чаемых препаратов на микрофлору дерново-подзолистой супесчаной
почвы. Аналогичные результаты получены на торфянисто-перегной-
ной и дерново-подзолистой тяжелосуглинистой оглеенной почвах.
Рис. 7. Динамика ингибирующего действия пестицидов на микрофлору почвы:
J - бактерии; 2 — грибы; 3 - микроскопические водоросли; t —’время после
обработки, месяцы
24
Атразин и монурон снижали численность водорослей. Карбатион
отрицательно действовал на грибы и водоросли. Эптам (ист на рисун-
ке) практически не влиял ни на один из этих показателей. Отсюда сле-
дует, что в полевых условиях токсическое действие пестицидов наибо-
лее заметно проявляется на индикаторных группах микроорганизмов,
то есть на ’’мишенях”, имеющих коэффициент безопасности ниже еди-
ницы. Это подтверждает правильность выбранных нами методических
подходов к оценке и мониторингу пестицидов.
Независимо от используемого показателя динамика токсическо-
го действия любого из пестицидов на ’’мишени” имела вид U-образной
кривой: после обработки почвы численность чувствительных микро-
организмов резко падала, затем постепенно восстанавливалась, то есть
влияние испытуемых веществ на ’’мишени” имело обратимый харак-
тер. Скорость восстановления численности микроорганизмов-”мишеней”
в почве зависела в значительной степени от персистентности пестицида.
Так, монурон, время детоксикации которого в условиях опыта состав-
ляло более 12 месяцев, подавлял рост водорослей в течение года. Ин-
гибирующий эффект атразина (время разложения 5—6 месяцев) сни-
мался через 3—4 месяца. Карбатион и метилизотиоцианат натрия, обра-
зующийся при гидролизе карбатиона, исчезают через 6—8 недель после
внесения в почву, тогда как численность грибов восстанавливалась
только через 14 недель. Таким образом, отрицательные последствия
применения этого пестицида превосходят по времени его физическое
присутствие в почве.
Обратимый характер токсического действия пестицидов на инди-
каторные группы микроорганизмов обусловлен рядом причин. Во-пер-
вых, неравномерностью распределения препаратов в почве. Имеются
зоны, где они находятся в низких концентрациях, недостаточных для
подавления жизнедеятельности микроорганизмов. Во-вторых, сниже-
нием концентрации пестицидов в почве со временем, их детоксика-
цией. В результате этих процессов возобновляются рост, развитие и
нормальная биохимическая деятельность микроорганизмов. В-треть-
их, генетической гетерогенностью естественной популяции микроор-
ганизмов. Летальные концентрации гербицидов, инсектицидов и фун-
гицидов для различных штаммов одного и того же вида могут разли-
чаться в несколько раз. Все эти причины объясняют высокую буферность
почвы как биологической системы.
Различная чувствительность отдельных видов и штаммов опреде-
ляет изменения в видовой структуре ассоциации почвенных микро-
организмов. В литературе мало данных относительно этих изменений,
что объясняется трудоемкостью учета бактерий, грибов и актиноми-
цетов, сложностью выделения и определения их таксономического
состава.
Для выяснения. некоторых наиболее общих закономерностей
формирования микрофлоры почвы под воздействием пестицидов на-
25
ми в качестве модели были использованы микроскопические водо-
росли. Идентификация их до рода и вида основана главным образом
на морфологических признаках и не представляет больших трудностей.
Это значительно облегчает решение поставленной задачи.
Видовую структуру сообщества водорослей в почве биометров
определяли несколько раз на протяжении вегетационного периода ме-
тодом стекол обрастания. Результаты наблюдений на дерново-подзо-
листой супесчаной почве представлены на рисунке 8.
Через неделю после обработки атразином в почве обнаружено
всего 6 видов водорослей, после обработки монуроном — 4, карба-
тионом — 3 вместо 13 в контроле. В присутствии эптама видовой сос-
тав альгофлоры почвы не менялся. Наиболее чувствительными к пес-
тицидам оказались синезеленые и ряд видов диатомовых водорослей.
Аналогичные результаты были получены на торфянистой и дерно-
во-подзолистой тяжелосуглинистой оглеенной почвах. Некоторая раз-
ница в глубине и скорости протекающих изменений не имеет принци-
пиального значения.
Таким образом, применение альгицидов обедняет видовой состав
водорослей. Снижается частота встречаемости многих из них, значитель-
12 3 Ч 5 В7В ЭЮИШЗ
6
Рис. 8. Изменение видового состава водорослей в дерново-подзолистой супес-
чаной почве под влиянием гербицидов:
1 — Amorphonostoc punktiforme; 2 — Anabaena sp.; 3 — Cylindrospermum sp; 4 —
Phormidium autumnale; 5 — Ph.- cur turn; 6 - Ph. foveolarum; 7 - Chlamydomonas
gloeogama; 8 - Chlorococcum infusionum; 9 - Hormidium flaccidum; 10 - Chlori-
della neglecta; 11 — Hantzschia amphioxys; 12 — Navicula atomus; 13 — Nitzschia pa-
lea; а, б, в — соответственно через 1 неделю, 3 месяца и 1 год после обработки
26
ное число видов вообще ’’выбивается” из альгоценоза. В почве, обра-
ботанной атразином, монуроном и карбатионом, доминирующее положе-
ние занимают один-два наиболее устойчивых вида, которые практичес-
ки целиком обеспечивают продуктивность водорослей как трофичес-
кой группы микропродуцентов. Образуется качественно новое сооб-
щество с низким индексом видового разнообразия, в котором отсут-
ствуют синезеленые водоросли, фиксирующие молекулярный азот.
В течение года после обработки гербицидами таксономический
состав водорослей постепенно восстанавливается. Коэффициент ви-
дового разнообразия приближается к контролю, при этом динамика
видового состава и численности водорослей в почве, обработанной
атразином, монуроном и карбатионом, проявляет одинаковую тенден-
цию. Почва, как биологическая система в целом, стремится к восстанов-
лению структуры биоценоза, обусловленной постоянно действующими
экологическими факторами, и прежде всего ее физико-химическими
свойствами.
Вместе с тем следует подчеркнуть, что Цроцесс восстановления
видового состава альгофлоры протекает очень медленно и далеко не
полностью.
Отрицательные последствия применения пестицидов существен-
но сказываются даже спустя год, когда в верхнем горизонте почвы
они уже не обнаруживаются. В частности, на дерново-подзолистой су-
песчаной почве, обработанной атразином, из состава альгофлоры вы-
пало 2 вида, при обработке монуроном - 4, на торфянистой соответ-
ственно — 1 и 5, на дерново-подзолистой тяжело суглинистой — 4 и 3
(Михайлова, Круглов, 1973).
Приблизительно таким же образом происходит перестройка среди
сапрофитных микроорганизмов, особенно резко выраженная при ис-
пользовании фумигантов (Буткевич, 1956; Поулсон, 1976), протра-
вителей семян, фунгицидов и бактерицидов (Клинцаре, 1983). В этих
случах нередко доминирующее положение надолго занимают 1—2 вида,
причем в сукцессии микроорганизмов после внесения этих веществ
с течением времени происходит смена доминирующих видов (Поул-
сон, 1979).
Таким образом, отдаленные последствия применения пестицидов
характеризуются главным образом ’’выпадением” наиболее чувстви-
тельных видов, при этом для восстановления видового состава микро-
флоры требуется гораздо больше времени, чем для восстановления
ее продуктивности. Отсюда можно сделать заключение, что поток энер-
гии и круговорот веществ в целом обладают более консервативной
реакцией на пестициды вообще, нежели отдельные виды микроорга-
низмов, обеспечивающие эти процессы. Этот консерватизм обусловлен
жизнедеятельностью наиболее устойчивых видов микроорганизмов,
компенсирующих деятельность видов, ’’выбитых” из биоценоза.
Следовательно, устойчивые изменения в видовой структуре инди-
27
каторной группы микроорганизмов (’’мишеней”), ’’выпадение” от-
дельных видов из ассоциации являются первым и наиболее важным
предупредительным сигналом о перегрузке почвы биоцидами.
Реакция на пестициды микроорганизмов, коэффициент безопас-
ности которых выше единицы, носит менее выраженный характер И,
по-видимому, зависит от того, насколько тесно их жизнедеятельность
связана с жизнедеятельностью ’’мишени”.
Так, отрицательное действие карбатиона на микромицеты почвы
влечет за собой интенсивное размножение сапрофитных бактерий, ко-
торые в целом менее чувствительны к ядохимикату. Это, по-видимо-
му, обусловливается устранением грибов как наиболее активных ан-
тагонистов бактерий и появлением в среде энергетического материала
за счет отмирания грибов и водорослей. В то же время уменьшение
численности водорослей в почве под влиянием монурона незначитель-
но влияет на жизнедеятельность сапрофитных грибов и бактерий, поско-
льку роль водорослей как продуцентов в энергетическом балансе окуль-
туренных почв относительно невелика.
Выпадение из микробоценоза синезеленых водорослей ограни-
чивает поступление атмосферного азота в биологический круговорот,
что имеет существенное значение для азотного баланса, например, за-
топляемых почв рисовых полей. Вполне вероятно, что критическим
звеном экосистемы может оказаться какая-то функциональная груп-
па микроорганизмов, например автотрофные тарификаторы, или
всего-навсего один вид, например клубеньковые бактерии. В случае
гибели клубеньковых бактерий произойдет разобщение бобово-ризо-
биального симбиоза. Прекратится фиксация молекулярного азота.
В результате потери азота за счет утраты азотфиксирующей способ-
ности растений могут достигать 200—300 кг/га. Снизится продуктив-
ность бобовых культур в целом. Для получения высоких урожаев по-
требуется дополнительное введение в почву азотных минеральных
удобрений.
Все это еще раз подчеркивает огромную роль индикаторных пока-
зателей (’’мишеней”) для агроэкологической оценки действия пести-
цидов и вообще ксенобиотиков в почве.
Анализируя динамику токсичного эффекта пестицидов, Домш
(Domsch, 1983) выделяет два основных параметра: характеризующий
величину максимальной депрессии микроорганизмов и определяющий
длительность действия препарата. Изучая результаты более 200 опытов,
он обнаружил, что в 89 случаях время действия пестицидов не превы-
шает 30 суток, то есть численность микроорганизмов и активность
биохимических процессов через месяц после обработки почвы при-
ходят в норму. Этот автор считает, что с учетом естественной флукту-
ации микроорганизмов такие изменения допустимы и не представля-
ют опасности для почвенной биоты. Опасность возникает тогда, когда
ингибирующий эффект носит пролонгированный характер. В разви-
28
Рис. 9. Изменение ингибирующего
эффекта и уровня безопасности
пестицидов (по: Domsch, 1983):
А, Б, В - безопасный, допустимый
и критический уровни опасности
пестицидов соответственно
ваемой им концепции почвен-
но-микробиологического мо-
ниторинга делается попытка
увязать интенсивность и вре-
мя ингибирующего эффекта
в единую систему (рис, 9).
На схеме (рис. 9) пред-
ставлены три уровня опасно-
сти пестицидов: незначитель-
ный (безопасный), допусти-
мый и критический. Как видно, линия, отсекающая критический
уровень ингибирующего эффекта, со временем опускается вниз.
Если в течение 30 суток, по мнению Домша, допустимо снижение числен-
ности популяции микроорганизмов на один-два порядка, то через 3—4
месяца критическим становится 60 %-ный уровень ингибирующего эф-
фекта. Соответственно возрастает экологическая значимость этого пока-
зателя. Несмотря на некоторую спорность схемы, она представляет инте-
ресную теоретическую базу для агроэкологической оценки действия хи-
мических препаратов и приобретает особое значение при многолетнем
систематическом их применении.
Описанные ранее методические принципы почвенно-микробиологи-
ческой оценки пестицидов (Круглов, 1979) и предлагаемые Домшем
(Domsch, 1983) критерии можно объединить в целостную систему
почвенно-микробиологического мониторинга последствий применения
химических средств защиты растений. Она будет состоять из первич-
ного скриннинга и выбора ’’мишени”, оценки ее экологической зна-
чимости и анализа критического уровня токсичности пестицида в от-
ношении индикаторного показателя в длительных опытах или при сис-
тематических наблюдениях в биосферных заповедниках. Как нам ка-
жется, для мониторинга нет необходимости исследовать большой ком-
плекс показателей. Достаточно проследить за поведением ’’мишеней”.
МИКРОФЛОРА ПОЧВЫ ПРИ МНОГОКРАТНЫХ
ХИМИЧЕСКИХ ОБРАБОТКАХ
Пестициды широко используются в земледелии и в настоящее вре-
мя становятся постоянно действующим экологическим фактором в
жизни почвенных микроорганизмов. Анализ поведения микрофлоры
29
почвы в этих условиях имеет весьма существенное значение для эколо-
го-агрономической оценки последствий химических обработок.
Как показано в предыдущих разделах, токсическое действие пес-
тицидов наиболее рельефно проявляется на индикаторных группах
микроорганизмов. Поэтому наибольший интерес во всех случаях будет
представлять поведение этих групп.
Рассмотрим результаты наших наблюдений за реакцией почвенных
водорослей в ответ на многолетнюю обработку почвы пестицидами.
В полевом опыте пестициды вносили в производственных дозах
ежегодно в течение 4 лет. Численность и таксономический состав водо-
рослей учитывали в динамике трижды за вегетационный период.
Действие препаратов на альгофлору почвы, имея много общего,
в то же время существенно различается.
Спустя неделю после внесения атразина численность водорослей
резко снижается (рис. 10). Осенью в конце вегетационного периода
она восстанавливается до контрольного уровня. На второй, третий
и четвертый годы соответственно после 2-, 3- и 4-й обработок наблю-
дается аналогичная картина. Многолетняя динамика альгицидного эф-
фекта атразина имеет вид пульсирующей кривой, амплитуда колеба-
ний которой из года в год уменьшается, то есть эффективность гер-
бицида при повторных обработках падает.
Под действием атразина меняется таксономический состав поч-
венной альгофлоры (рис. 11). Наиболее чувствительными из синезе-
леных водорослей оказались Amorphonostoc punctiforme, Anabaena sp.,
Cylindrospermum sp., Phormidium curtum, Chlamydomonas gloeogama,
из диатомовых — Nitzschia palea. Все они надолго выпадают из аль-
гоценоза и не проявляют себя в течение длительного времени. Про-
исходит обеднение видового состава альгофлоры.
Вместе с тем к гербициду быстро адаптируются такие виды, как
Ph. foveolarum, Chlorococcum infusionum, Navicula atomus. Они интен-
сивно развиваются в условиях многократной обработки почвы, зани-
мая ведущее положение в ассоциации водорослей. Наблюдается сме-
на и сужение группы доминирующих видов. На основании этого был
сделан вывод о восстановлении численности водорослей в почве, сис-
тематически обрабатываемой атразином, за счет устойчивых к нему
форм, и образовании качественно нового сообщества, в кото-
ром резко снижена роль азотфиксирующих Cyanophyta из порядка
Nostocales.
Под влиянием однократной обработки монуроном численность
водорослей снижается в несколько раз (см. рис. 10). Продуктивность
их восстанавливается очень медленно. Отрицательное действие герби-
цида существенно сказывается на водорослях даже через год.
При повторных обработках почвы монуроном токсический эф-
фект его возрастает. Во всех почвах, обрабатываемых гербицидом
в течение 4 лет, стабильно удерживается низкий уровень развития во-
30
wo
SO-
25-
12-
Монурон
Рис. 10. Изменение численности водорослей при многолетней систематической
обработке почвы пестицидами: 1, 2,3,4 — годы (кратность) обработок
Контроль
J НирВптион
1 234567В 3WB1213 1 23 ¥ 5 6 7 В 31031213
а 6
В
Рис. 11. Влияние многолетнего систематического применения пестицидов на видо-
вую структуру сообщества водорослей:
1 — Amorphonostoc punctiforme; 2 — Anabaena sp.; 3 — Cylindrospermum sp.; 4 -
Phormidium autumnale; 5 — Ph. curtum; 6 — Ph. foveolanun; 7 - Chlamydomonas
gloeogama; 8 — Chlorococcum mfusionum; 9 - Hormidium flaccidum; 10 - Chlori-
della neglecta; 11 - Hantzschia amphioxys; 12 - Navicula atomus; 13 — Nitzschia pa-
lea. a, S, e - 1, 2,3-й годы обработок соответственно
дорослей, прогрессивно обедняется их видовой состав. Из альгоцено-
за практически полностью выбывают синезеленые водоросли Amorpho-
nostoc punctiforme, Anabaene sp., Cylindrospermum sp., зеленые — Chla-
mydomonas gloeogama, диатомовые — Hantzschia amphioxys, Nitzschia
palea (рис. 11). Таким образом, через 3—4 года под влиянием монуро-
на создается своеобразное сообщество, состоящее из 3—5 видов водо-
рослей, в котором практически полностью отсутствуют представители
Cyanophyta. Доминирующее положение в альгофлоре занимает диатомея
Navicula atomus.
Монурон — высокоперсистентный гербицид, сохраняющий свое
действие более года. Постоянное присутствие его в почве приводит,
с одной стороны, к кумуляции токсического эффекта в ряде поко-
лений чувствительных водорослей и их вымиранию, с другой - к от-
бору и адаптации устойчивых к гербициду видов.
Безусловно, важнейшим отрицательным последствием система-
тического применения монурона, так же как и атразина, является пол-
ное исчезновение из почвы синезеленых водорослей порядка Nosto-
cales, многие из которых фиксируют молекулярный азот (Штина, 1971;
Панкратова, 1973).
В отличие от атразина и монурона карбатион хорошо растворим
в воде и разлагается в почве с образованием метилизотиоцианата и серо-
32
углерода, обладающих фитотоксическим действием. Последние, диф-
фундируя из почвы в окружающую атмосферу, теряют свою токсич-
ность через четыре недели. Следовательно, фактический контакт пести-
цида и продуктов его распада с водорослями был кратковременным.
Альгицидный эффект карбатиона проявляется очень резко. Через
неделю после обработки численность водорослей в почве снижается
в десятки раз. На стеклах обрастания они полностью отсутствуют в
течение месяца, то есть жизнедеятельность водорослей й почве в это
время полностью блокируется. Однако через 3,5 месяца после обра-
ботки численность и видовой состав их в значительной степени вос-
станавливаются .
Под влиянием ежегодных повторных обработок наблюдаются ана-
логичные изменения. Многолетняя динамика токсического эффекта
препарата имеет вид пульсирующей кривой. Восстановление общей
численности водорослей происходит за один вегетационный период.
Вместе с тем с каждым годом возрастает воздействие гербицида на
видовую структуру альгофлоры. Из года в год из почвы исчезают и
не восстанавливаются вновь в течение двух последующих лет такие
виды, как Amorphonostoc punctiforme, Anabaena sp., Cylindrospermum
sp. (см. рис. 11). Ряд видов из категории обильно растущих переходит
в категорию редко встречающихся. Доминирующее положение зани-
мает Ph. foveolarum. Таким образом, сужается комплекс массовых
(обильно развивающихся) форм, соответственно снижается и видовое
богатство альгофлоры. Так, спустя год после 3-летней ежегодной обра-
ботки карбатионом на супесчаной почве наблюдается обильное раз-
витие (> 3 баллов) всего 2 видов вместо 10 в контроле, на тяжело-
суглинистой глееватой — 2 вместо 14 и на торфянистой — 5 вместо
11. Остальные виды встречаются эпизодически и, по-видимому, не иг-
рают существенной роли в накоплении органического вещества.
Таким образом, систематическое многолетнее применение даже
быстроразлагающихся препаратов приводит к весьма существенным
и длительным изменениям в альгоценозе.
Токсическое действие зптама на альгофлору почвы выражено очень
слабо. Многолетнее систематическое применение его не влияло заметно
ни на численность, ни на видовой состав почвенных водорослей. Послед-
нее объясняется отсутствием альгицидного эффекта производственных
доз гербицида. Это еще раз подтверждает тезис о том, что токсический
эффект пестицидов проявляется на микроорганизмах-мишенях, Kg
которых составляет менее единицы.
Как отмечалось, отрицательное действие альгицидов имеет обра-
тимый характер. Степень ингибирующего эффекта и скорость восста-
новления численности водорослей зависят от химического состава
препарата и его стабильности в среде. Пульсирующий характер кри-
вых динамики токсического действия альгицидов при многолетней
обработке обусловлен, .главным образом, снижением их концентра-
33
ции в результате детоксикации и вымывания в нижние горизонты поч-
вы в течение вегетационного периода и последующего возрастания
при очередной обработке в следующий сезон.
На рисунке 12 представлена динамика видового разнообразия аль-
гофлоры за 4 года.
Как видно, многократное использование пестицидов приводит
к постепенному и все возрастающему снижению индекса видового
разнообразия сообщества водорослей за счет полной гибели и выпаде-
ния одних видов и значительного ослабления других.
Анализ таксономической структуры микрофлоры через год после
четырехлетней ежегодной обработки почвы карбатионом (’’мишенью”
для которого являются грибы) подтвердили наблюдения, сделанные
на водорослях. Под влиянием карбатиона снижается общая числен-
ность микромицетов. Ряд видов исчезает из почвы. Соответственно с
этим снижается индекс видового разнообразия и увеличивается индекс
доминирования (табл. 4). Аналогичные изменения микрофлоры под
влиянием длительного систематического применения триазиновых
гербицидов наблюдали М. В. Горленко с соавт. (1969,1980). В их опы-
те происходила рмена доминирующих форм микромицетов, снижалась
частота встречаемости одних видов, исчезали из почвы другие. Появля-
лись новые доминанты, которые ранее занимали скромное место в по-
пуляции микромицетов. Авторы выделили ряд видов, имеющих высо-
кую чувствительность к прометрину.
Таким образом, вследствие систематического многолетнего при-
менения гербицидов в почве фактически формируется новое сообще-
ство, характерной чертой ко-
торого является более низкий
уровень видового разнооб-
разия.
Полученные результаты
иллюстрируют один из наи-
более общих законов эколо-
гии, характеризующих реак-
цию сообщества на стрессы
(Одум, 1975).
Рис. 12. Изменение видового раз-
нообразия почвенных водорослей
при многолетнем систематическом
применении пестицидов:
1 - контроль; 2 - эптам; 3 -
атразин; 4 - карбатион; 5 мо-
нурон
34
4. Последствия четырехлетнего применения карбатион:-
для микрофлоры почвы
Почва, вариант опыта Число зародышей грибов, тыс/г почвы Число видов Индекс домини- рования N Индекс разно- образия S-1 Индекс сходства 2С
А + В
log N
Торфянисто-под- золистая: контроль 450 8 0,54 1,05
карбатион 31 3 0,64 0,58 0,50
Дернов о-подзолис- тая, тяжелосугли- нистая, глееватая: контроль 140 6 0,34 1,52
карбатион 38 2 0,95 0,28 0,57
Примечание. Индексы рассчитаны по Одум (1975).
Как известно, низкий уровень индекса видового разнообразия
указывает на неустойчивость экосистемы. Поэтому, надо полагать,
судьба ее будет зависеть от очень многих факторов, которые трудно
предусмотреть. В частности, в их числе могут быть агротехнические
мероприятия, используемые в земледелии.
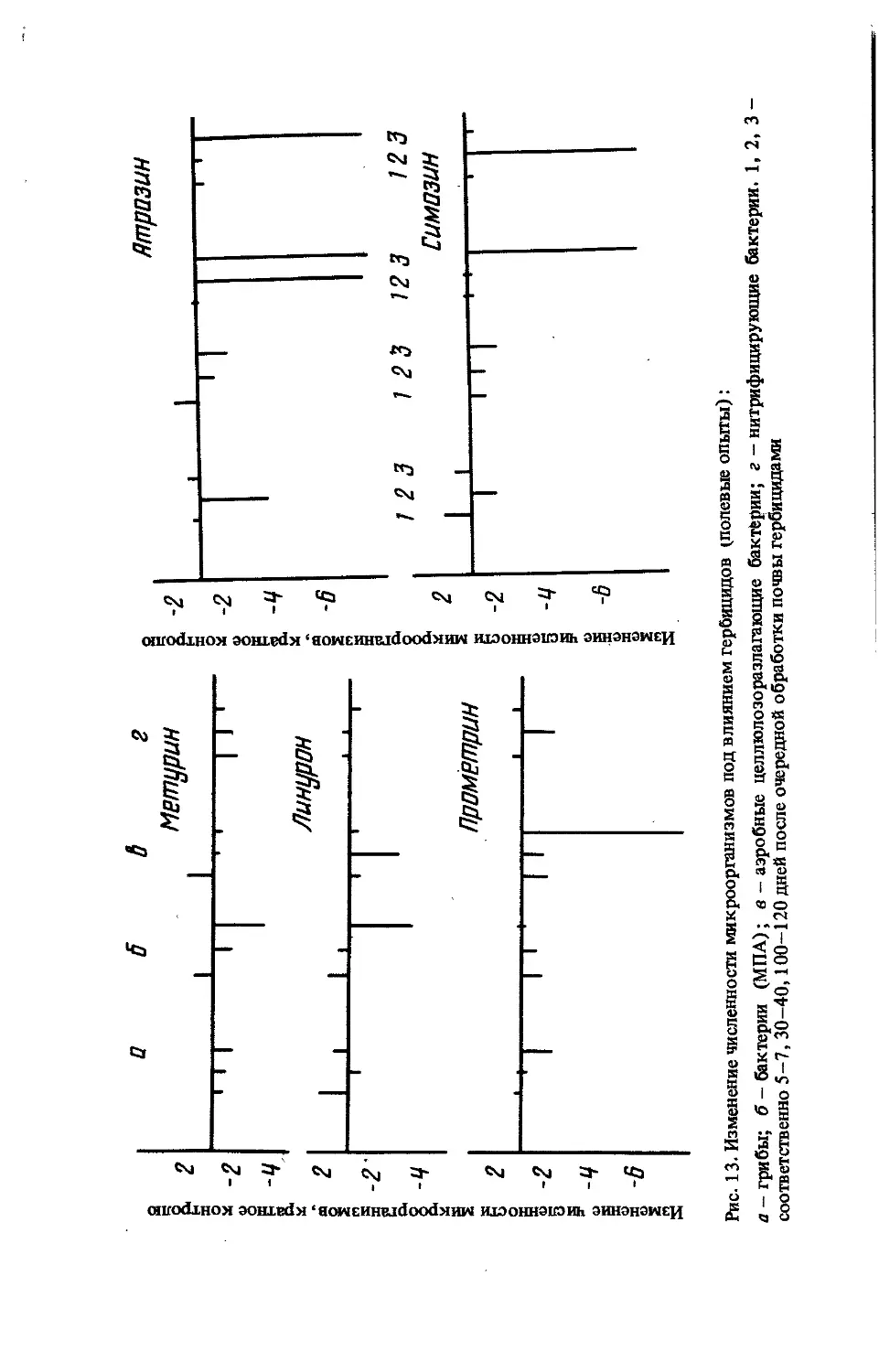
Сильнее всего на микрофлору почвы влияет систематическое приме-
нение персистентных пестицидов, поскольку ассоциация почвенных
микроорганизмов в этом случае находится под постоянным селектив-
ным давлением токсиканта.
Анализ видовой структуры ассоциации почвенных микроорганиз-
мов позволяет судить о степени загрязнения почвы токсическими ве-
ществами и может быть использован для мониторинга. Вместе с тем
высокая чувствительность отдельных видов микроорганизмов к пести-
цидам создает предпосылки для разработки весьма специфичных и прос-
тых микробиологических методов определения химических веществ
в объектах окружающей среды.
ОПОСРЕДОВАННОЕ ДЕЙСТВИЕ ПЕСТИЦИДОВ
НА ПОЧВЕННУЮ МИКРОФЛОРУ
В полевых условиях при анализе почв под культурой растений
нередко наблюдаются изменения тех показателей, которые в лабора-
торных опытах не менялись при внесении того или иного гербицида
в дозах, превышающих производственные в десятки раз. Отсюда про-
тиворечивость данных, особенно тех, которые касаются производных
сим-триазинов и фенилмочевины. Проанализировав 34 работы, Кайзер
35
с соавт. (Kaizer et al., 1971) отметили, что 35(% из них указывают на
отрицательное действие сим-триазинов, в 15 % сообщается о стиму-
лирующем эффекте и в 50 % не обнаружено никакого влияния на бак-
терии. Мы получили сходные соотношения на выборке из 120 работ.
По нашему мнению, противоречия результатов нельзя объяснить
только различием почвенно-климатических условий и методики иссле-
дований. По-видимому, если вещество обладает биоцидным эффектом,
то он должен проявляться в той или иной степени в любых условиях,
на любой почве. В частности, сим-триазины, для которых водоросли
являются индикаторной группой микроорганизмов, ингибируют их
развитие и в красноземах субтропиков, и в черноземах Лесостепи, и
в подзолистых почвах Нечерноземья, и в Австралии, и в США, и в Ве-
ликобритании. В то же время действие этих гербицидов на сапрофит-
ные бактерии и грибы оценивается различными авторами неоднознач-
но даже на подзолах Нечерноземья.
Известно, что с применением гербицидов в большинстве случаев
меняется система механических обработок почвы, соответственно сни-
жается масса сорняков и характер распределения растительных остат-
ков по почвенному профилю. Влияние агроприемов и свежего орга-
нического вещества на формирование микрофлоры и ее жизнедеятель-
ность в общем плане хорошо изучено. Однако при анализе последствий
применения гербицидов и механизма происходящих в почве изменений
эти факторы, как правило, игнорируются. Поэтому в большинстве
случаев все изменения в биологии почвы, обработанной гербицидами,
объясняют токсичностью последних. Так ли это?
Рассмотрим некоторые данные наших опытов, в которых были
использованы гербициды, относящиеся к производным сим-триази-
нов и фенилмочевины — двум классам органических соединений, ши-
роко применяемых в сельском хозяйстве.
Полевые опыты проводились на дерново-подзолистых почвах Ленин-
градской области, занятых культурой картофеля и моркови, в Москов-
ской области на плантациях многолетнего лекарственного растения
диоскореи кавказской, в Узбекской ССР на сероземе светлом, тяжело-
суглинистом староорошаемом под посевом хлопчатника.
Гербициды симазин, атразин, прометрин, которая, метурин, линурон
(два последних используются только за границей) вносили поверхностно
до всходов культур в дозах, рекомендованных производству. Некото-
рые результаты опытов отражены на рисунке 13. Контролем служил
не обработанный гербицидами участок.
Как видно, в полевых условияхпод культурой сельскохозяйственных
растений число микроорганизмов, устойчивых (по данным модельных
опытов) к гербицидам, во всех опытах без исключения отклоняется
от контроля, как правило, в сторону уменьшения. При этом отрица-
тельный эффект препаратов проявляется в разные сроки, что в общем
подтверждает анализ многочисленных литературных данных.
36
S 0 г
МЕГПуриН
Tj—*“т“'-----“ГТ^
Линурпн
-L’-l-ГТ-1-----1 1 I
промвтрин
Рис. 13. Изменение численности микроорганизмов под влиянием гербицидов (полевые опыты):
а - грибы; б-бактерии (МПА); e-аэробные целлюлозоразлагающие бактбрии; г - нитрифицирующие бактерии. 1, 2, 3-
соответственно 5-7, 30-40,100-120 дней после очередной обработки почвы гербицидами
Кривая динамики ингибирующего действия гербицидов не имеет
четко выраженной U-образной формы, как в случае индикаторных
микроорганизмов, чувствительных к этим веществам.
Через 10—14 недель после обработки метурином, атразином и си-
мазином в дерново-подзолистой почве достоверно снижается активность
каталазы, инвертазы и протеазы (табл. 5). Аналогичная тенденция,
хотя и менее выраженная, наблюдалась при использовании которана
на посевах хлопчатника (нет в таблице).
5. Влияние гербицидов ва ферментативную активность
дерново-подзолистой почвы
Вариант Время после обработ- ки, не- дели Катала- за (О,, мл за 5 мин/г почвы) Инверта- за (глю- коза, мг за 24 ч/г почвы) Уреаза (N-аммиака, мкг за 24 ч/г почвы) Протеаза желатино- литическая (ед. за 24 ч/г'почвы)
Контроль 1 1,57 8,45 344 0,91
Метурин 1 1,72 6,36 350 0,73
Контроль 10 0,80 13,18 423 0,91
Метурин 10 0,80 9,21 357 0,73
Контроль 1 19,50 7,63 170 1,75
Симазин 1 25,20 8,76 120 1,79
Атразин 1 18,90 8,38 160 1,74
Контроль 14 8,30 11,65 — 0,35
Симазин 14 4,70 10,04 — 0,05
Атразин 14 4,10 7,60 — 0,01
В чем причина отклонения от контроля численности микроорга-
низмов и активности биохимических процессов в описанных опытах?
Если бы испытуемые гербициды являлись ингибиторами микроорга-
низмов, то их отрицатедьный эффект проявился бы в наибольшей сте-
пени в первые дни после введения в почву, как зто было показано
ранее.
Опытные варианты отличались от контроля только темпом отрас-
тания сорняков. Биомасса сорняков, составляющая в контроле ЗОО-
ТОО' г/м2, под влиянием гербицидов снижалась в 5—10 раз и более.
При механизированной или ручной прополке междурядий в контроль-
ном варианте основная масса сорняков заделывалась в почву или ос-
тавалась на ее поверхности. На участках, обработанных гербицидами,
сорняки гибли в начальные фазы своего развития и фактически не
играли никакой роли в накоплении органического вещества в почве.
Поэтому можно предположить, что снижение численности и биохими-
ческой активности микроорганизмов на этих участках обусловлено
не столько токсичностью гербицидов, сколько более низким уровнем
обеспеченности их органическим веществом — источником энергии и
38
питания. Это подтверждают опыты по влиянию различных способов
прополки на численность микроорганизмов в почве под посевом куку-
рузы (табл, б) • В одном из вариантов (I) после механической пропол-
ки растительные остатки удаляли с поля, в другом (П) заделывали
в верхний 10-сантиметровый слой, в третьем (III) для борьбы с сор-
няками использовали гербицид атразин в дозе 2 кг /га.
Почва дерново-подзолистая, легкосуглинистая, слабокислая (pH
5,6).
Как видно, наиболее высокие показатели биологической активности
были в варианте, где выполотые сорняки заделывали в почву. Через
30—60 суток после начала опыта численность грибов и бактерий здесь
в несколько раз превышала численность микроорганизмов в других
вариантах.
6. Влияние ручной и химической прополок в посевах кукурузы
на микрофлору дериово-подзолистой почьы
Микроорганизмы (на 1 г почвы) Время после обработки атразином, сутки Вариант опыта
I П III
Грибы, тыс. 15 25,5 27,1 27,0
30 44,3 112,0 48,2
60 49,0 198,0 46,5
Бактерии, млн 15 10,8 9,2 15,3
30 13,6 131,0 14,2
60 14,7 79,2 18,8
Аэробные целлюло- 15 13,0 9,0 13,0
зоразлагающие 30 30,0 53,0 21,0
бактерии, тыс. 60 52,0 129,0 40,0
Нитрифицирующие 15 2,9 2,0 2,4
бактерии, тыс. 30 11,0 9,8 10,7
60 11,8 28,0 11,0
Масса сорняков, г/м1 25 342 370 49
54 138 112 4
Сумма 480 482 53
Биогенность почвы, обработанной атразином, была на уровне ’’чис-
того” контроля, в котором растительная масса после прополки уда-
лялась с поля, и значительно ниже, чем во II варианте, где масса сор-
ных растений заделывалась в почву.
Масса сорняков, отрастающих в контроле, составляла в этих опы-
тах около 500 г/м2, что соответствует среднему уровню засоренности
полей. Таким образом, при агротехнических способах борьбы с сорня-
ками в процессе механической обработки в почву заделывается несколько
тонн зеленой массы на гектар, что сопоставимо с количеством запахи-
39
ваемых в почву сидеральных культур, используемых в качестве эффек-
тивных органических удобрений. Влияние этого приема на почвенно-
микробиологические процессы хорошо изучено и не требует коммен-
тариев (Пошон, де Боржак, 1960; Берестецкий и др., 1984).
Чем выше засоренность полей, тем больше растительной массы
поступает в почву при механической прополке, тем сильнее ее воздей-
ствие на почвенно-микробиологические процессы, значительнее раз-
ница между контрольным (агротехнический способ борьбы с сорня-
ками) и гербицидным вариантом опыта. При этом, естественно, резу-
льтаты микробиологического анализа будут очень сильно зависеть
от времени отбора пробы и возделываемой культуры. Последнее свя-
зано не только со специфическим воздействием гербицидов на форми-
рование микрофлоры, сколько с различной технологией выращивания
растений. Например, почва под пропашными культурами подвергает-
ся механической обработке 2—4 и более раз за вегетационный период,
при сплошном посеве (зерновые колосовые, травы и т. д.) обработка
не проводится совсем. Применение гербицидов на пропашных культу-
рах сопровождается сокращением или даже полным исключением ме-
ханических обработок, связанных с уходом за посевами; при сплош-
ном посеве система механических обработок при использовании герби-
цидов практически не меняется.
Хорошо известно, что при заделке зеленой массы растений в поч-
ву численность микроорганизмов и активность биохимических про-
цессов существенно возрастают в первые 60 суток и удерживаются на
высоком уровне достаточно длительное время (Берестецкий и др.,
1984). При этом в процессе разложения растительных остатков наблю-
дается сукцессия микрофлоры, смена зколого-трофических групп
микроорганизмов и перегруппировка ее видового состава. Причем,
поскольку при обработке почвы гербицидами сорняков становится
на порядок меньше, а надземная масса отмирающих растений подсы-
хает и остается в основном на поверхности почвы, характер сукцессии
микрофлоры на растительных остатках и степень ее влияния на микро-
флору почвы в целом будут существенно отличаться от варианта, где
для борьбы с сорняками используются агротехнические способы. Следо-
вательно, в каких-то временных рамках неизбежны различия в соста-
ве зколого-трофических групп, доминирующих видов и в видовом
разнообразии микроорганизмов. Действительно, они отмечены в боль-
шинстве опубликованных экспериментальных работ. Однако степень
этих различий весьма непостоянна по причине, изложенной ранее.
В таблице 7 приведены основные факторы, регулирующие жизне-
деятельность микроорганизмов в почве, и возможные последствия
при замене агротехнических способов борьбы с сорняками химичес-
кими.
Таким образом, действие гербицидов на микрофлору и биохими-
ческие процессы, относительно устойчивые к ним, в полевых услови-
40
7. Изменение микробиологических процессов в почве
в зависимости от способа борьбы с сорняками
Способы борьбы
агротехнические
химические
Изменение микробиоло-
гических показателей
при переходе от агротех-
нических методой к хи-
мическим
Развернутые севооборо-
ты, обеспечивающие вы-
сокую продуктивность
и хорошее фитосанитар-
ное состояние почвы.
Разнокачественный по
годам состав раститель-
ных остатков. Активное
вовлечение в биологи-
ческий круговорот азо-
та и фосфора
Севообороты
Тенденция к сужению
севооборотов н насыще-
нию их основной культу-
рой. Переход на много-
летние бессменные куль-
туры. Однообразный сос-
тав растительных остат-
ков. Односторонний вы-
нос биогенных элемен-
тов из почвы
Снижение численности н
изменение видового соста-
ва микрофлоры. Односто-
роннее Накопление про-
дуктов их метаболизма.
Возрастание фитотоксич-
ности и ухудшение фито-
санитарного состояния
почвы
Механическая обработка почвы
В пропашных ку-
льтурах н много-
летних насажде-
ниях многократная
обработка почвы в тече-
ние вегетационного пе-
риода. Отрастающие сор-
няки заделываются в
почву. Обеспечивается
интенсивная аэрация поч-
вы. Наблюдается ее рас-
пыление
При сплошном
посеве зерновых ко-
лосовых, трав и т. д. ме-
ханическая обработка не
используется. Борьба с
сорняками ведется на
предшественниках и в
процессе основной обра-
ботки
Черный пар.
3-4-кратная механичес-
кая обработка. Интен-
сивное перемешивание н
азрация почвы, распыле-
ние ее. Отрастающие сор-
няки заделываются в
почву
Тенденция к минима-
лнзации механических
обработок. Почва не
перемешивается сов-
сем или перемешивается
в меньшей степени. Сор-
няки отрастают слабо. Их
масса снижается в десят-
ки раз. Погибшие расте-
ния распределяются по
поверхности. Изменяет-
ся водно-воздушный ре-
жим
Механическая обработка
в вегетационный период
не проводится. При испо-
льзовании гербицидов
снижается засоренность
полей. Фитомасса и вод-
но-воздушный режим
такие же, как при агро-
технических способах
Отказ от механической
обработки (химический
пар, нулевая обработка).
Стерня остается на по-
верхности. Сорняки раз-
виваются слабо. Масса
погибших растений под-
сыхает и остается на по-
верхности. Аэрация почвы
ухудшается.
Снижение биогенности н
биохимической активно-
сти почвы. Усиление диф-
ференциации микрофло-
ры по почвенному профи-
лю
Биогенность почвы и
биохимическая активность
существенно не меняются.
Возможна перегруппиров-
ка видового состава в за-
висимости от степени за-
соренности полей
Снижение биогенности н
биохимической активно-
сти почвы. Усиление диф-
ференциации микробиоло-
гических процессов по
почвенному профилю. Пе-
регруппировка микроор-
ганизмов
41
Продолжение
Способы борьбы
агротехнические
химические
Изменение микробиоло-
гических показателей
при переходе от агротех-
нических методов к хи-
мическим
Состав и дозы удобре-
ний, а также сроки их
внесения изменяются по
годам в зависимости от
культуры и севооборота
Минеральные удобрения
Внесение удобрений при
насыщении севооборота
ведущей культурой иосит
более односторонний ха-
рактер. ' Практикуется
применение высоких доз
Перегруппировка микро-
организмов. Изменяется
активность ряда биохими-
ческих процессов (нитри-
фикация, разложение цел-
люлозы) . Снижается эф-
фективность возврата мо-
лекулярного азота в био-
ологический круговорот
ввиду подавления азотфи-
ксирующвй активности
свободноживущих микро-
организмов и симбиоти-
ческих систем
ях в значительной степени имеет опосредованный характер. Измене-
ния, вызываемые пестицидами, не связаны с химическим составом
препарата, то есть являются неспецифичными. Они обусловлены изме-
нением всей технологии возделывания сельскохозяйственных куль-
тур. Глобальное экологическое значение этих изменений, по-видимому,
более четко можно проследить в многолетних стационарных опытах,
где гербициды вносятся в почву систематически в течение нескольких
лет подряд.
ПОСЛЕДСТВИЯ МНОГОЛЕТНЕГО ПРИМЕНЕНИЯ
ПЕСТИЦИДОВ ДЛЯ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ПОЧВЫ
Особый интерес представляет анализ последствий многолетнего
систематического применения гербицидов. Результаты немногочис-
ленных исследований показывают, что длительное применение герби-
цидов приводит к снижению биогенности почвы. Уровень его зависит
от возделываемой культуры и системы земледелия в целом. Можно
отметить, что в условиях севооборотов, а также в посевах зерновых
культур и трав влияние гербицидов менее выражено, чем на пропаш-
ных культурах (картофель, корнеплоды, кукуруза), которые длитель-
ное время выращиваются бессменно. Значительные и глубокие изме-
нения наблюдаются в почве под многолетними насаждениями (сады,
виноградники и т. д.).
42
Реакция наиболее чувствительных индикаторных микроорганиз-
мов на многолетнее применение гербицидов выражена достаточно
резко и рассмотрена нами ранее на примере водорослей и грибов. По-
левые исследования, проведенные сотрудниками ВНИИ сельскохозяй-
ственной микробиологии в различных почвенно-климатических зонах
страны, показали, что в результате трех — девятилетнего применения
гербицидов симазина, атразина и монурона микроскопические водо-
росли практически полностью выбиваются из микробоценоза. Такие
изменения в этом звене почвенной экосистемы равнозначны экологи-
ческой катастрофе.
Дальнейшего глубокого анализа требует поведение в почве, сис-
тематически обрабатываемой гербицидами, сапрофитной микрофло-
ры, для которой производственные дозы этих соединений являются
безвредными (Kg более 10). Рассмотрим несколько примеров.
В наших опытах на плантации многолетнего лекарственного рас-
тения диоскореи кавказской после трехлетней ежегодной обработки
почвы атразином заметно снижалась численность сапрофитных бактерий
и грибов, нитрифицирующих, денитрифицирующих и аэробных целлю-
лозоразлагающих бактерий (табл. 8). Существенно падала активность
ряда ферментов. Снижалась нитрификационная способность почвы,
а также интенсивность минерализации органического вещества, опре-
деляемая по выделению СО2. Каковы же причины столь обширных
изменений в почвенной биоте?
Кд атразина для большинства исследованных показателей выше
100, то есть его токсические концентрации в 100 раз превышают про-
изводственные. Поэтому он не мог оказать прямого ингибирующего
действия на микроорганизмы. Агротехника была одинаковой в опыт-
ном и контрольном (не обработанные гербицидами растения) вариан-
тах. Но в последнем случае проводилась ручная прополка, растения
после которой оставались в борозде. Фитомасса сорняков, по данным
двух контрольных учетов, составляла около 5 т/га, или около 15 т за
3 года. В опытном варианте сорняки отрастали плохо, погибали и высы-
хали на корню. Фитомасса составляла всего несколько десятков ки-
лограммов и распределялась по площади крайне неравномерно.
Как отмечалось ранее, растительные остатки являются основным
источником питания и энергетического материала для сапрофитов поч-
вы. Качественный состав, количество фитомассы и динамика ее поступ-
ления определяют биогенность и динамику микробиологических про-
цессов. Отсюда следует, что основная причина более низкой биологи-
ческой активности почвы в опытном варианте заключалась в худшем
обеспечении микроорганизмов органическим веществом. Кроме того,
с уменьшением объема фитомассы соответственно снижается и поступ-
ление в почву ферментов, что в свою очередь отрицательно влияет на
протекающие в ней биохимические процессы.
После тпехлетней обработки атразином проявляется определен-
43
8. Влияние трехлетней систематической обработки почву атразином
на некоторые показатели ее биологической активности
Крат- ность обра- ботки (годы) Вариант опыта Численность микроорганизмов
Грибы- сапро- фиты (• ю4) Бакте- рии- сапрофиты (• Ю!) Нитри- фикаторы (•10s) Денит- рнфика- торы (• Ю’) Аэроб- ные цел- люлозо- разлага- ющие (-103)
1 Контроль 120 40 10 100 25
Атразин 200 20 1 25 23
2 Контроль 100 30 25 100 10
Атразин 40 20 10 100 1
3 Контроль 40 20 100 250 25
Атразин 3 10 25 100 23
Продолжение
Крат- ность обра- ботки (годы) Активность почвенных ферментов Нитрифика- ционная способность, (N —NO3, мг/100 г почвы) Сухая масса сорных рас- тений, г/м2
Инвер- таза (глюкоза, мг/г почвы) Катала- за (О,, мл/г почвы) Протеаза (аминный азот, мг/г почвы)
1 11,7 43 83 7,6 035 0,0 16,1 5,8 576 0
2 11,7 83 0,55 ’ 28,3 422
3,7 5,7 озо 12,3 7
3 8,9 — 039 24,8 527
3,9 — 0,13 16,1 13
ная тенденция к снижению содержания гумуса. Однако разница между
вариантами опыта не выходит за рамки доверительного интервала.
В стационарном опыте Ленинградского института лесного хозяй-
ства в условиях Ленинградской области симазин и атразин использо-
вали в посадках ели. Гербициды вносили поверхностно в конце мая —
начале июня ежегодно в дозах 5—10 кг/га. Всего за 9 лет в почву по-
ступило около 60 кг препаратов. Механическую обработку междуря-
дий не проводили.
На восьмой и девятый годы применения гербицидов делали микро-
биологические анализы почвы. Как видно из данных таблицы 9, биоген-
ность почвы вследствие систематической обработки гербицидами сни-
44
9. Влияние многолетнего систематического применения симазина и атразина
на микрофлору и агрохимические свойства почвы под посадками ели
Место и время взятия образца Вариант опыта Агрохимические показатели Численность бактерий, тыс/г почвы
углерод органи- ческий, % азот общий, мг/100 г почвы влаго- емкость, % сапро- фиты разла- гающие гуматы кальция денит- рифи- цирую- щие аэробные целлюло- зоразла- гающие анаэроб- ные мас- лянокис- лые Грибы, тыс/г почвы
Междурядье: 30/V Контроль 6,44 490 150 145 1 25,0 1,0 500 242
Гербицида 5,72 445 102 96 6 23 0,1 250 135
13/VII Контроль - - - 4300 14 25,0 0,1 2500 911
Гербициды - - - 3580 360 7,0 0,1 700 170
Гребень: 30/V Контроль 032 178 57 43 — 230 0,07 60 21
Гербицида 0,39 94 49 19 - 0,25 0,01 6 20
13/VII Контроль - - - 5750 - 130 2,40 13 520
Гербицида — - — 1700 - 0,13 0,01 0,13 132
Примечание. (-) - данные отсутствуют.
жается практически по всем исследуемым показателям, за исключе-
нием численности микроорганизмов, разлагающих гуматы кальция.
Следует отметить, что сеянцы ели высаживали на гребень переверну-
того вверх пласта, выпаханного плантажным плугом. Перегнойный
горизонт был сверху прикрыт слоем почвы из иллювиального гори-
зонта. В контроле он слабо за дернён. В варианте с гербицидами расти-
тельность, как правило, отсутствует, поверхность почвы оголена и
частично прикрыта опавшей хвоей. Местами развивается зеленый на-
лет лишайников и синезеленых водорослей рода Phormidium.
В междурядьях контрольного варианта — нетронутая целина. Пе-
регнойно-торфянистый горизонт составляет 5—7 см, сильно задер-
ней, с хорошо развитым травостоем, масса которого при контроль-
ном учете в июле составляла 700—1100 г/м2. В междурядьях опыт-
ного варианта растительный покров развит слабо. Значительная часть
его представлена мхами. Биомасса высших растений (40—80 г/м2)
распределена чрезвычайно неравномерно в виде отдельных куртин.
Все это указывает на глубокие изменения в почве после девятилет-
него ежегодного применения гербицидов. В результате резко меня-
ются условия существования микроорганизмов, количество и качество
энергетического материала, поступающего в почву. Если в контроле
приток свежего органического вещества обеспечивается за счет выс-
ших травянистых растений, то в варианте с гербицидами главным об-
разом за счет опавшей хвои, мхов и некоторых видов синезеленых
водорослей. Это обусловливает относительное снижение численности
сапрофитных грибов и бактерий, использующих легкодоступные ор-
ганические вещества, с одной стороны, и возрастание числа микроор-
ганизмов, разрушающих гуматы, — с другой. Таким образом, происхо-
дят качественные сдвиги: доминирующее положение в сообществе
почвенных микроорганизмов занимает автохтонная группировка, раз-
лагающая почвенный перегной.
Уменьшение количества поступающего в почву органического веще-
ства и интенсивное развитие в ней автохтонной микрофлоры приводят
к ослаблению процессов биосинтеза гумусовых веществ и их разруше-
нию. В результате в почве значительно сокращаются запасы гумуса,
снижается валовое содержание азота и вследствие этого изменяется
ее влагоемкость (см. табл. 9).
Таким образом, результатом длительного систематического приме-
нения атразина и симазина в лесопосадках является значительная пере-
стройка микробного ценоза и изменение характера углеродного пита-
ния гетеротрофных микроорганизмов, не связанные с бактерицидным
или фунгицидным эффектом. Резкие нарушения происходят в альго-
ценозе вследствие высокой чувствительности водорослей к этим герби-
цидам. В почве, обработанной сим-триазинами, было обнаружено все-
го два их вида — Ph. foveolarum и Chlorococcum sp. вместо девяти
в контроле.
46
В Абхазской ACCL в условиях субтропического климата, харак-
теризующегося обильными осадками, высокими температурами и про-
должительным вегетационным периодом, в течение пяти лет испыты-
вали комплекс гербицидов на плантациях мандарин. По данным Само-
ладоса (1971), засоренность плантаций однолетними сорняками в этих
опытах составляла 300-500 растений на 1 м2, многолетними — от 20
до 230. Корневищные злаки занимали от 5 до 25 % площади планта-
ции. Масса надземной части и корневищ превышала 1 кг/м2.
Механические обработки против сорняков оказались недостаточ-
но эффективными. В условиях влажного и теплого климата сорные
растения быстро отрастали. Трех-четырехкратное мотыжение почвы
приводило к ее распылению.
Для химической борьбы с сорняками использовали комплекс сис-
темных и контактных гербицидов. Всего за пять лет было внесено:
монурона - 14,2 кг/га, симазина — 9, атразина — 4, 2,4-Д - 1,2 и рег-
лона (грамоксона) — 42,8 кг/га. Это позволило исключить мотыже-
ние почвы и за пять лет практически избавиться от сорняков.
Почвенно-микробиологические исследования проводили на трех
типах почв в течение нескольких лет.
Данные почвенно-микробиологических и биохимических анализов,
выполненных в конце вегетационного периода после завершения пяти-
летнего цикла обработки почвы, приведены в таблице 10.
В результате пятилетней ежегодной обработки гербицидами биоген-
ность почвы заметно снижается за счет аэробных целлюлоэоразлагающих
нитрифицирующих и денитрифицирующих бактерий. Общая числен-
ность сапрофитных бактерий изменяется незначительно, при том что
в этой группе уменьшается доля спорообразующих форм. Заметно
увеличивается численность Nocardia. Наряду с этим в почве, обраба-
тываемой гербицидами, в несколько раз уменьшается активность уре-
азы и каталазы, падает нитрификационная способность, происходят
определенные сдвиги в агрохимических свойствах. За пять лет содер-
жание гумуса сократилось на 9—18%, а валового азота — на 7—31%
(табл. 11) по сравнению с контролем.
Наблюдается парадоксальное явление - снижение валового со-
держания гумуса и азота происходит при одновременном уменьшении
биогенности почвы и падении ее активности. Используемые в опыте
препараты в химическом отношении относительно инертны и не могут
существенно влиять на деградацию и миграцию гумусовых веществ.
Обратимся к данным, характеризующим накопление растительных
остатков сорняков в почве.
Как уже отмечалось, за год в почву контрольного варианта в про-
цессе механической обработки заделывалось не менее 1 кг сорняков
на 1 м2, или около 10 000 кг/га. Следовательно, за 5 лет на гектар поч-
вы было внесено не менее 50 000 кг органического вещества.
В опытном варианте в результате тотального уничтожения сорня-
47
£ 10. Влияние пятнлетнего ежегодного применения комплекса гербицидов на микрофлору
и активность некоторых ферментов в иочве под культурой мандарина
Почва, вариант опыта Бактерии, тыс/г почвы Активность ферментов
сапрофиты нокар- ДИН нитрифи- цирующие денитри- фицирующие аэробные целлюлозо- разлагаю- щие каталаза (О,, мг/г почвы) уреаза, (N - NH4, мкг/г почвы)
общая споры численность
Подзолистая Контроль* 1050 159 7,0 10,0 250 90 7,0 170 Гербициды* 1470 117 32,1 5,0 60 1 2,1 67 Контроль 1780 311 2,0 8,0 110 10 4,1 126 Гербициды 530 53 41,0 1^6 1 2,0 — Аллювиальная Контроль* 1000 170 - 20,0 25 10 2,2 475 Гербициды* 530 67 - 1,0 6 1 1,9 120 Контроль 3660 530 - 4,0 250 10 2,4 232 Гербициды 920 130 — 1,0 6 1 2,2 16 Желтозем Контроль* 660 139 — 13,0 600 1 7,5 47 Гербициды* 700 63 - 20,0 50 1 4,6 0 Контроль 950 105 - 10,0 50 2 8,2 52 Гербициды 700 72 - 2,0 5 1 6,5 0
Горизонт 0-15 см, в остальных случаях 15-30.
11. Влияние пятилетнего ежегодного применения комплекса
гербицидов на содержание гумуса и азота в почве иод культурой мандарина
Почва, вариант опыта Гумус Азот общий
% % к кон- тролю мг/100 г почвы % к контролю
Подзолистая
Контроль* 4,03 375
Гербициды* 3,53 88 256 69
Контроль 3,26 275
Гербициды 3,00 92 214 78
Аллювиальная
Контроль* 4,36 211
Гербициды* 3,57 82 197 93
Контроль 2,50 196
Гербициды 2,22 89 170 87
Желтозем
Контроль* 4,80 210
Гербициды* 4,25 89 189 90
Контроль 1,82 176
Гербициды 1,66 91 164 93
‘Горизонт 0-15 см, в остальных случаях 15—30.
ков их роль в балансе органического вещества практически сводилась
к нулю. Надо полагать, что в этих условиях почти полностью прекра-
щаются процессы биосинтеза гумуса. Более того, по мере истощения
в почве растительных остатков микроорганизмы, по-видимому, начи-
нают использовать как источник углерода гумусовые вещества. Это
подтверждается изменениями, которые происходят в микробном со-
обществе: относительным снижением споровых форм бактерий и рез-
ким возрастанием численности проактиномицетов рода Nocardia, роль
которых в разложении гумуса хорошо известна (Теппер, 1976). От-
сюда следует, что отрицательный баланс гумуса при многолетней об-
работке почвы гербицидами обусловлен низкими темпами гумусооб-
разования (из-за отсутствия притока свежего органического вещества)
и возрастающей скоростью процесса его деградации. Это в какой-то
степени напоминает картину, складывающуюся в условиях многолет-
него чистого пара, описанную Е. Н. Мишустиным (1975): происходит
перестройка ассоциации почвенных микроорганизмов, ведущая к воз-
растанию роли микрофлоры, разлагающей перегной.
Таким образом, вследствие многократного многолетнего систе-
матического применения гербицидов на посадках многолетних культур
происходит прогрессивное обеднение почвы органическим веществом.
В результате снижается ее биогенность и биохимическая активность.
49
МИКРООРГАНИЗМЫ КАК ИНДИКАТОРЫ ПЕСТИЦИДОВ
Из концепции ’’экологических мишеней” вытекает, что индикатор-
ные группы микроорганизмов являются наиболее чувствительной частно
микробоценоза и представляют главное звено в цепи событий, сле-
дующих после введения в почву пестицидов. Здесь отрицательный эф-
фект проявляется в наибольшей степени и в течение наиболее длитель-
ного времени. Поэтому было бы логично использовать индикаторные
группы для контроля и оценки загрязнения почвы и других объектов
окружающей среды пестицидами. При этом возможны два подхода.
Первый — назовем его условно биоценотическим - базируется на
анализе изменений в почвенной биоте непосредственно в полевых ус-
ловиях. Второй основан на использовании микроорганизмов в качестве
тест-культур для определения содержания химических веществ в поч-
венных образцах в контролируемых условиях лабораторных опытов.
Пока ни тот, ни другой не нашли широкого применения в практике
мониторинга. До настоящего времени значение их для экотоксиколо-
гических исследований недооценивается.
Вместе с тем возможности биологических методов весьма велики,
особенно в тех случаях, когда природа токсиканта неизвестна. Задача
биологических, в том числе микробиологических, методов, как нам
кажется, заключается не столько в точном определении концентрации
вещества, сколько в сигнализации о появлении его в почве в количестве,
нежелательном для экосистемы. В этом плане биологические методы
не исключают, а дополняют химические методы анализа. Рассмотрим
некоторые особенности и возможности использования микробиоло-
гических методов для оценки загрязнения почвы экзогенными веще-
ствами.
БИОЦЕНОТИЧЕСКИЙ ПОДХОД К ОЦЕНКЕ ЗАГРЯЗНЕНИЯ ПОЧВЫ
Биоценотический подход основан на общеэкологических пред-
ставлениях о реакции биотопа на стрессовые ситуации, характеризу-
ющейся выпадением отдельных видов, снижением видового разнооб-
разия и сменой доминанты (Одум, 1975). Многочисленные литератур-
ные данные и примеры, приведенные в предыдущей части книги, под-
тверждают, что микрофлора почвы не является исключением из обще-
го правила.
Как известно, таксономический состав микрофлоры почв естествен-
ных ландшафтов достаточно стабилен. Некоторая флуктуация, обуслов-
ленная сезонными колебаниями температуры, влажности и состояния
растительного покрова, не имеет принципиального значения. На сельско-
50
хозяйственных угодьях значительное влияние на почвенную микро-
флору оказывают механические обработки, севообороты, минераль-
ные и органические удобрения. Тем не менее при сложившейся сис-
теме агротехнических мероприятий в определенных временных рам-
ках в почве складывается более или менее постоянный состав домини-
рующих видов (Берестецкий и др., 1984). Введение в почву пестици-
дов может вызвать существенные его изменения. В крайнем случае,
если химическая нагрузка достаточно высока, отдельные виды микро-
организмов могут вообще исчезать из почвы. Таким образом, сам факт
’’выпадения” тех или иных видов, постоянно присутствующих в ’’нор-
мальной” почве, говорит о появлении в ней соответствующих веществ
и возникновении опасности перегрузки.
Систематические наблюдения за поведением микроскопических
водорослей в ответ на введение в почву атразина (табл. 12), а также
других производных сим-триазинов и фенилмочевины, проведенные
во ВНИИ сельскохозяйственной микробиологии, показали, что чем
выше доза гербицида, тем большее количество видов исчезает из аль-
гоценоза. Аналогичные данные получены В. О. Рудаковым и Ю. Я. Спи-
ридоновым (1979), которые исследовали влияние возрастающих доз
12. Влияние различных концентраций атразина на альгофлору
деряово-подзолистой почвы
Вид водорослей Атразин, мг/кг почвы
0,5 1,0 2,0 4,0 8,0 16,0
Amorphonostoc punctiforme
Anabaena cylindrica
Anabaena variabilis
Heterothrix exilis
Chlorella vulgaris
Cylindrospermum licheniforme
Cylindrospermum museicols
Hormidium nitens
Nitzschia palea
Phormidium autumnale
Phormidium curtum
Phormidium frigidum
Stichococcus minor
Chloridella neglecta
Euglena terricola
Chlamydomonas gloeogama
Hantzschia amphioxys
Pinnularia borealis
Phormidium foveolarum
Chlorococcum mfusionum
Navicula atomus
Примечание. (+) рост водорослей, незаполненная графа -- отсутствие роста.
пиклорама, прометрина, пропазина и бромацила на видовую структуру
почвенных микромицетов. В опытах М. В. Горленко с соавт. (1980) мно-
голетнее использование триазиновых гербицидов приводило к смене
доминирующих видов микромицетов и исчезновению из почвы наиболее
чувствительных из них. Резкие и длительные изменения в видовом сос-
таве грибов происходят при обработке почвы фумигантами (Поулсон,
1979).
Эти примеры достаточно убедительно показывают, что по степени
изменения видового состава микрофлоры почвы можно судить об
уровне загрязнения ее токсическими веществами, причем выпадение
отдельных таксономических групп из микробоценоза характеризует
направленность действия химических соединений (альгицидное, фунги-
цидное, бактерицидное, зооцидное и т. д.).
Использовать эффект элиминирования отдельных видов из био-
ценоза в качестве показателя и критерия загрязненности почвы пести-
цидами или другими экзогенными веществами можно при соблюде-
нии ряда условий. к
1. Необходим контрольный участок, совершенно свободный от
загрязнения экзогенными веществами. В противном случае следует
предварительно изучить структуру микробного сообщества и в после-
дующем вести наблюдения от исходного. Последний прием, по-види-
мому, наиболее приемлем для биосферных заповедников и при мони-
торинге загрязнения почвы в естественных ландшафтах.
2. Индикаторные виды должны быть доминантами или субдоминан-
тами исследуемого сообщества и постоянно присутствовать в ’’нормаль-
ных” почвах.
3. Они должны легко и быстро выявляться и идентифицироваться.
4. Предпочтение следует отдавать прямым методам, позволяющим
наблюдать за поведением индикаторной группы в почве, не снимая
стресса путем высева микроорганизмов на свежие питательные среды.
В настоящее время достаточно хорошо обоснованы и соответствуют
этим требованиям альгологические методы анализа почвы. Для изуче-
ния качественного состава и полуколичественной оценки структуры
альгоценоза при мониторинге очень удобно использовать методику
почвенных пластинок со стеклами обрастания (Михайлова, Круглов,
1973), которая позволяет вести наблюдения непосредственно в поч-
ве. Грибы и особенно бактерии малопригодны для этих целей из-за
сложности их идентификации.
Хорошим показателем состояния экосистемы является индекс
видового разнообразия (Одум, 1975), который отражает снижение
значимости и выпадение отдельных видов из сообщества.
Рисунок 14 иллюстрирует изменение видового разнообразия аль-
гоценоза в присутствии гербицидов атразина и монурона. Степень из-
менений зависит от концентрации препаратов в почве. Аналогичные
закономерности были обнаружены в опытах с другими пестицидами.
52
100
Рис. 14. Изменение индекса видового разнообразия альгофлоры дерново-под-
золистой почвы в зависимости от концентрации гербицидов:
1 - атразин; 2 - монурон
Об уровне загрязнения можно судить по отношению индекса ви-
дового разнообразия исследуемой почвы к индексу видового разнооб-
разия контроля или исходной почвы. Такой подход наиболее эффек-
тивен при мониторинге в биосферных заповедниках или естественных
ландшафтах.
Интересные идеи заложены в методике инициированного сооб-
щества микроорганизмов, предложенной В. С. Гузевым с соавт. (1980,
1984). Суть ее заключается в инициировании развития почвенных мик-
роорганизмов путем локального внесения в почву крахмала с после-
дующим изучением изменения видовой структуры микофлоры под
действием антропогенной нагрузки. Авторы выделяют четыре состоя-
ния системы: гомеостаз, стресс, развитие резистентных форм и реп-
рессию. Выведение системы из состояния гомеостаза означает пере-
грузку почвы химическими веществами экзогенного происхождения.
Наиболее надежным показателем загрязнения среды является раз-
витие резистентных форм и элиминация видов, для которых условия
существования становятся неприемлемыми. В целом эти закономер-
53
ности проявляются в одинаковой степени независимо от природы ток-
сиканта. Однако для выявления относительно низких концентра-
ций пестицидов в почве, по-видимому, следует отбирать индикатор-
ные группы микроорганизмов, которые могут представлять доста-
точно крупные таксономические либо зколого-трофические группы.
В частности, анализ альгофлоры почвы на стеклах обрастания, которую
также можно было бы представить как ’’инициированное сообщество”
фотосинтезирующих микроорганизмов, показал, что под влиянием
сим-триазинов и фенилмочевин стрессовое состояние альгоценоза наб-
людается уже при концентрации этих веществ, составляющей десятые
доли миллиграммов на килограмм почвы. Потеря ряда видов и раз-
витие резистентных форм происходят в диапазоне от 1 до 50 мг/кг.
При более высоких концентрациях водоросли полностью ’’выбрасы-
ваются” из системы. Таким образом, анализируя ’’профиль” видовой
структуры микробного сообщества, можно достаточно точно опреде-
лить уровень и характер загрязнения почвы.
МИКРОБИОЛОГИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕСТИЦИДОВ
И ПРОДУКТОВ ИХ ТРАНСФОРМАЦИИ
Микробиологические методы широко используются для качествен-
ного и количественного анализа ряда органических соединений и физи-
ологически активных веществ, таких как аминокислоты, витамины,
антибиотики и т. д.
Пестициды являются физиологически активными соединениями,
блокирующими жизненно важные функции организма. Поэтому в прин-
ципе для их определения могут быть использованы методические под-
ходы, разработанные для антибиотиков и лекарственных веществ.
Механизм действия пестицидов неодинаков и зависит от химического
состава препарата, что обусловливает индивидуально-групповой под-
ход к выбору тест-культур. Исходя из имеющихся представлений, для
фунгицидов следует искать тест-культуры среди мицелиальных форм
грибов, дрожжей и актиномицетов, для бактерицидов — среди бактерий,
для гербицидов - среди водорослей, для инсектоакарицидов - среди
представителей микро- и мезофауны почвы. Из этого правила могут быть
исключения. Так, М. В. Горленко с соавт. (1969, 1980) сообщили о
высокой чувствительности некоторых видов микромицетов к герби-
цидам - производным сим-триазинов. Д. Бакаливанов (1982) пред-
ложил использовать Asp. niger для определения атразина. В. О. Рудаков и
Ю. Я. Спиридонов (1982) обнаружили сильное ингибирующее действие
бромацила и пиклорама на Mucor sinesis. Инсектицид севин в опытах
Махмуда (Mahmud, 1970) подавлял рост Е. coli при концентрации
0,02 ppm.
Альгологические методы определения гербицидов в почве. Име-
ется достаточно большой опыт применения альгологических методов
54
для поиска микроорганизмов - продуцентов физиологически актив-
ных веществ (Красильников, 1958; Hata, 1962; Jkawa et al., 1969; Му-
ромцев и др., 1974, и др.). Микроскопические водоросли успешно
использовались в скриннинге альгицидов для борьбы с обрастанием
гидротехнических сооружений и цветением хозяйственных водоемов
(Брагинский, 1972). Л. П. Брагинский предложил ряд альгологичес-
ких методов для оценки степени загрязнения водоемов гербицидами.
Однако накопленный в литературе материал касается в основном вод-
ных культур микроскопических водорослей. Практически во всех
случаях альгологический анализ давал качественную или в лучшем
случае полуколичественную оценку содержания фитотоксических ве-
ществ в исследуемом образце.
В конце 60-х - начале 70-х годов был предложен ряд методов ин-
дикации некоторых гербицидов непосредственно в почве (Atkins et al.,
1967; Pilley, Tchan, 1969; Круглов и др., 1968, 1970). В одном
из них (Круглов, 1970) в качестве тест-культуры использовалась Chlo-
rella vulgaris. Водоросли выращивали в жидкой питателыюй среде,
отфильтровывали на диски фильтровальной бумаги, помещали дис-
ки в чашки Петри на поверхность исследуемой почвы, увлажненной
минеральным раствором солей, содержащих биогенные элементы
(N, Р, К). Чашки выставляли в светокамеру на 3 суток, после чего
определяли содержание хлорофилла в водорослях. Интенсивность
ингибирующего эффекта оценивали по отношению —— • 100%,
где Ph — оптическая плотность спиртового экстракта пигментов из
культуры водорослей, выращенных на поверхности исследуемой поч-
вы, Vk - то же из культуры водорослей, выращенных в контроле. Со-
держание гербицида определяли по номограммам, которые строились
на основании опытов с известными его концентрациями. Примеры
таких номограмм приведены на рисунке 15.
Ошибка определения ингибирующего эффекта гербицидов произ-
водных сим-триазинов и фенилмочевины в различных по генезису
и физико-химическим свойствам почвах варьировала в пределах
3,1—10,3 %. Максимальные расхождения результатов повторных опы-
тов были в случаях, когда рост водорослей подавлялся более чем на
80% (ИК80). Оптимальные результаты получались на отрезке кривой,
отражающем 20—80%-ный ингибирующий эффект. В этом случае
наблюдалась почти линейная зависимость между концентрацией и ин-
гибирующим действием гербицида (рис. 15).
Для сравнения следует сказать, что ошибка определений методом
тонкослойной хроматографии гербицидов составляет более 20 %.
Чувствительность альгологического метода зависит от химичес-
кого состава препарата и свойств почвы. Так, ИК50 монурона для
хлореллы в речном песке составляет 0,15 мг/кг, в сильно гумусирован-
55
Концентрация гербицида,
мг/кг пачбы
Рис. 15. Номограммы зависимости альгицидного эффекта гербицидов от их кон-
центрации в дерново-подзолистой почве:
1 — линурон; 2 — арезин; 3 — монурон; 4 - хлоразин; 5 - симазин; 6 — атра-
зин; 7 - прометрин. А — фенилмочевины; Б — сим-триазины
ных почвах — 2—5 и более миллиграммов. На фитотоксические свой-
ства гербицидов определяющее влияние оказывают механический сос-
тав и содержание в ней гумуса (табл. 13).
13. Фитотоксичность гербицида монурона в различных почвах
Почва рн Гумус, % ИК50, мг/кг ИКет хлорелла
хло- релла овес ИКи овес
Торфяно-перегнойная Дерново-подзолистая, 4,0 35,6 10,7 9,6 1,11
тяжелосуглинистая 4,6 3,6 2,7 3,4 0,79
То же Дерново-подзолистая, 5,2 1,7 0,75 1,0 0,75
легкосуглинистая Дерново-подзолистая, 6,0 2,8 1,0 0,7 1,43
супесчаная Чернозем обыкновенный 5,0 U 0,3 0,57 0,58
малогумусный ПР 2,9 13 — —
Речной песок — — 0,15 0,20 0,75
Как показали сравнительные исследования, альгологический метод
по точности и чувствительности не уступает биологическим, в которых
в качестве тест-культур используются высшие растения. В то же время
56
он более удобен, менее трудоемок и занимает меньше времени — все-
го трое суток. Метод может быть успешно применен для решения ряда
практических и теоретических задач. Рассмотрим некоторые из них.
1. Фитотоксикологический анализ остатков гербицидов — произ-
водных сим-триазинов и фенилмочевины в почве.
Известно, что химический анализ, как бы он ни был совершенен,
не дает никакого представления о физиологической активности веществ
в среде, тем более такой сложной, как почва. Поэтому, ориентируясь
только на показатели химического анализа, легко прийти к ошибоч-
ным выводам относительно поведения пестицидов в природных объек-
тах и той опасности, которую они представляют.
Для примера приведем некоторые данные, полученные в нашей
лаборатории. При исследовании динамики разложения гербицида диуро-
на, который ранее применялся в сельском хозяйстве, в почве химичес-
ким методом была обнаружена следующая картина: навоз и раститель-
ные остатки люпина в количестве 2 % от массы почвы значительно
ускоряли разложение гербицида. Время, затраченное на деградацию
50 % диурона, составило в контрольной почве более 12 месяцев, в при-
сутствии растительных остатков люпина — 4,5 месяца, при внесении
свежего коровьего навоза — всего 1,5 месяца. Результаты альгологи-
ческого анализа показали, что в варианте с люпином первые три ме-
сяца происходит не снижение, а нарастание фитотоксического эффек-
та. Более того, фитотоксичность почвы, в которую внесены диурон и
свежие растительные остатки, сохраняется и после того, как в ней пе-
рестают обнаруживаться остатки диурона химическим методом. При-
чина, по-видимому, заключается в токсичности продуктов трансфор-
мации гербицида и синергическом эффекте его с продуктами микроб-
ного разложения растительных остатков. Синергический эффект про-
дуктов метаболизма микроорганизмов и ряда гербицидов отмеча-
ли и другие авторы (Balicka, 1975; Sobieszczanski, 1975, и др.), что ука-
зывает на ординарность этого явления.
В начале 60-х годов фирма ”Сиба-Гейги” (Швейцария) предложи-
ла сельскому хозяйству препарат хлоразин: 2-хлор-4,6-бис(диэтила-
мино)-сим-триаэин. Однако широкого применения он не нашел вслед-
ствие относительно невысокой активности и длительного сохранения
фитотоксичности в почве. В дальнейшем было установлено (Kaufman,
Kearney, 1970), что микробиологическая трансформация его идет по
пути последовательного деалкилирования боковых цепей с образова-
нием хорошо известных гербицидов — триэтазина и симазина. Резуль-
таты альгологического анализа показали, что первый из них в 3, вто-
рой — в 15 раз токсичнее исходного соединения. Отсюда вытекает,
что пролонгирующий фитотоксический эффект хлоразина обуслов-
лен не стабильностью гербицида, а фитотоксичностью его метаболитов.
2. Экспресс-анализ хозяйственной годности почвы, обработанной
производными сим-триазинов и фенилмочевины.
57
Необходимость такой оценки часто возникает при планировании
размещения сельскохозяйственных культур на полях, ранее обрабо-
танных этими гербицидами.
Хорошо известно, что персистентность пестицидов значительно
варьирует в зависимости от метеорологических условий, типа почвы
и культуры растений. Для таких гербицидов, как монурон, атразин,
симазин, эта разница составляет от нескольких месяцев до нескольких
лет.
На практике, как правило, для оценки остаточного количества
гербицидов в почве используется метод химического анализа. Одна-
ко из-за несовершенства способов экстракции и отсутствия достаточ-
ных сведений о характере распределения и подвижности пестицидов
в почве с его помощью не всегда удается определить связанные их фор-
мы. Вместе с тем в последние годы появились сообщения о том, что
некоторые гербициды, образующие комплекс с гуминовыми кисло-
тами, могут сохранять свою фитотоксичность (Кузнецова, Круглов,
1983).
Химические метода не позволяют обнаружить фитотоксичные
метаболиты, которые образуются в процессе трансформации гербици-
дов. Поэтому делаются пробные посевы или ставятся специальные
вегетационные опыты, где в качестве тест-культуры используются
виды и сорта растений, чувствительные к гербицидам. Однако эти
приемы очень трудоемки и занимают, как правило, несколько недель.
Использование в качестве тест-культур микроскопических водорос-
лей позволяет сократить время определения фитотоксичности почвы,
обработанной гербицидами, в 5—8 раз.
Была изучена возможность применения альгологического ме-
тода для определения гербицидов — производных сим-триазинов и
фенилмочевины. Результаты показали, что чувствительность большин-
ства видов растений к атразину значительно ниже чувствительности
хлореллы (рис. 16). Это позволяет рекомендовать альгологический
метод для оценки степени детоксикации и пригодности почвы, ранее
обработанной производными сим-триази-
нами, под посев соответствующей сель-
скохозяйственной культуры (Круглов,
1972).
2
3
ц
5
6
7
т аз as ai
ин50, мг/кг
Рис. 16. Чувствительность к атразину различ-
ных тест-культур, используемых для опре-
деления остаточных количеств гербицида
в почве:
1 - овес; 2 - ячмень; 3 - фасоль; 4 - пше-
ница; 5 — свекла; 6 - клевер; 7 - хлорелла
58
Микроскриннинг фитотоксических веществ — продуктов искус-
ственного синтеза. Быстро оценить фитотоксичность большого коли
чества материала с целью первичного отбора наиболее перспективных
химических соединений гербицидного действия можно с помощью
микроскриннинга, в основу которого положен Метод ’’бумажных дис-
ков” (Круглов, Квятковская, 1972). Методика максимально проста
и заключается в следующем. В агаризованную питательную среду вво-
дят испытуемые вещества в логарифмически возрастающих концен-
трациях (0,01; 0,1; 1,0; 10,0 мг/л). На поверхность агара расклады-
вают диски фильтровальной бумаги с культурой Chlorella vulgaris 157
и инкубируют 3 суток в светокамере при освещенности 4000 лк и тем-
пературе 22—25°С. Интенсивность роста водорослей сравнивают с кон-
тролем. За альгицидные принимают концентрации вещества, которые
полностью подавляют рост водорослей на дисках.
В таблице 14 представлены результаты анализа фитотоксичности
наиболее распространенных гербицидов, широко используемых в сель-
ском хозяйстве ряда стран.
14. Альгологическая оценка фитотоксичности гербицидов
Гербицид Концентрация, мг/л
0,01 0,1 1,0 10,0 50,0
Алифатические карбоновые кислоты ТХА + + + + + Далапон + + + + + Феиоксиалкилкарбововые кислоты 2,4-Д + + + + + 2М-4Х + + + + + 2М-4ХМ + + + + + Карбаматы Беномил + + + + + Тиллам + + + + + Карбин + + + Бетанал + + + Тиокарбаматы Эптам + + + + + Ронит + + + Тандекс + + Карбатион + + Производные фенилмочевины Метурин + + + + Которая + + + Паторан + + + Фенурон + + + Гербан + + Метоксурон + + Майоран + + Теноран + +
59
Продолжение
Гербицид Концентрация, мг/л
ОХИ 0,1 IX) 10Х) 50,0
Гатоин
Линурон
Арезин
Небурон
Монурон
Сим-триазины
Хлоразин
Триэтазин
Симазин
Атразин
Пропазин
Атратон
Прометрин
Гезагард
Бладекс
Семерок
Игран
Прочие
Трефлан
Пропанид
Солан
Примечание. (+) - рост водорослей.
Как видно из таблицы, высокой фитотоксичностью отличаются
производные сим-триазинов и фенилмочевины. Практически отсут-
ствует фитотоксический эффект у производных карбоновых и фено-
ксиалкилкарбоновых кислот; промежуточное положение занимают
карбаматы и тиокарбаматы.
Известно, что карбоновые и феноксиалкилкарбоновые кислоты
эффективно используются в качестве избирательных гербицидов. На-
прашивается вывод, что водоросли не являются универсальным инди-
катором фитотоксичности химических веществ и что альгицидный
эффект последних обусловливается специфическим механизмом дей-
ствия.
Обращает на себя внимание сильное альгицидное действие произ-
водных фенилмочевины и сим-триазинов, которые являются ингиби-
торами фотосинтеза. Практически все гербициды, относящиеся к этим
двум группам соединений, полностью подавляют рост хлореллы при
концентрациях 1—10 мг/л (или >10-6 М). Очевидно, альгологический
метод микроскриннинга может быть наиболее эффективно исполь-
зован для отбора химических соединений — ингибиторов фотосинтеза.
Здесь же следует искать наиболее высокую корреляцию между аль-
гицидным и гербицидным действием веществ.
60
На основании результатов опытов с эталонными гербицидами мы
предложили следующую классификацию фитотоксичности химичес-
ких соединений: ИКМ0,мг/л Оценочный бал Характер действия
<0,1 3 Сильный ингибитор
1,0 2 Умеренный ингибитор
10,0 1 Слабый ингибитор
>10,0 0 Практически не токсичен
При оценке, равной ”0”, вещества считаются практически не ток-
сичными и исключаются из дальнейших испытаний. Соединения, полу-
чившие оценку в 1—3 балла, испытываются более тщательно с помощью
других тестов в порядке возрастания оценочного балла.
Методом микроскриннинга было опробовано более 200 соединений.
Среди них 107 производных фенилмочевины, 40 — сим-триазинов и
по нескольку соединений из групп хлоралькарбаматов, карбаматов,
гуанидинов, диазолидинов.
Из 200 веществ оценку в 1 балл получили 23 соединения, или 11Д %.
Все они относятся к производным фенилмочевины и сим-триазинов.
Отсеялось около 90%. Высокую оценку фитотоксичности (2 балла)
получили два соединения, или 1 % из испытанных веществ. Это 3,4-дих-
лорфенил-А-гидрокси-У-диметилмочевина и 2-метилтио4-изопропилами-
но-6-гидроксиметиламино-сим-триазин. Полулегальные концентрации
(ИК50) для первого составляли 0,7-0,9 мг/л, для второго — 0,4—0,6.
Детальные исследования, проведенные во ВНИИ химических средств
защиты растений (Володарская и др., 1975), показали, что в дозе 2 кг/га
2-метил-4-изопропиламино-6-гидроксиметиламино-сим-триазин уничто-
жает многие сорняки. По своим гербицидным свойствам он превосхо-
дит прометрин. При довсходовом и послевсходовом применении в до-
зе 5 кг/га препарат высоко избирателен по отношению к капусте, сое,
тыкве, просу, моркови и картофелю. Индекс его избирательности для
рассады капусты и томатов более двух. По действию на основные сор-
няки он не уступает семерону, который широко используется в ка-
честве гербицида при посадке капусты. Все зто позволяет сделать заклю-
чение о перспективности его применения для борьбы с сорняками в
посевах ряда овощных культур.
За рубежом разработано несколько модификаций высокопроиз-
водительных автоматических систем для испытания гербицидов и ре-
гуляторов роста растений, основанных на анализе газообмена, роста и
размножения микроскопических водорослей (Арндт и др., 1975; Борне,
Бем, 1975). В зависимости от системы регистрации время испытания
составляет 2—12 ч. Производительность установки достигает нескольких
тысяч образцов в год. В зависимости от поставленной цели опыт можно
прерывать на любой стадии развития культуры, что позволяет существен-
но расширить возможность установки и использовать ее для изучения
первичного механизма действия химикатов на организм.
61
Приведенные примеры убедительно показывают огромные воз-
можности экспресс-микроскриннинга гербицидов с использованием
водорослей.
Основные достоинства альгологического метода микроскриннинга:
1. Простота исполнения. Метод не требует сложного дорогостояще-
го оборудования. Для анализа десяти образцов химических соедине-
ний достаточно 1 м2 площади люминостата (световой комнаты или
площадки в лаборатории), оборудованного лампами ДС-20 или ДС-ЗО,
что вполне доступно для любой химической или биологической лабо-
ратории.
2. Незначительный расход химических соединений. Для оценки
фитотоксичности достаточно иметь 1—5 мг вещества. При усовершен-
ствовании техники эксперимента это количество можно довести до
десятых долей миллиграмма.
3. Высокая производительность тестирования. Эксперимент за-
нимает трое суток и одновременно может проводиться с десятком
и более соединений. Как показал опыт, один лаборант может протести-
ровать 80—100 соединений в месяц.
4. Возможность проведения круглогодичной работы при исполь-
зовании относительно небольших и дешевых светокамер.
5. Высокая воспроизводимость результатов. При многократ-
ном определении фитотоксичности ряда производных фенилмочевин
и сим-триазинов коэффициент вариации составляет не более 20 %.
Как было отмечено, метод может успешно использоваться для от-
бора ингибиторов фотосинтеза. Он имеет самостоятельное значение
для поиска альгицидов. Однако для скриннинга фитотоксических ве-
ществ с иным механизмом действия, по-видимому, более эффектив-
ными являются другие тесты.
Микробиол отческий метод определения фунгицидов. В опытах
с чистыми культурами на искусственных питательных средах выявле-
ны бактерии, грибы и дрожжи, имеющие достаточно высокую чув-
ствительность к различным пестицидам. В таблице 15 перечислены
некоторые из них. Возникла идея использования этих микроорганиз-
мов для определения содержания пестицидов в различных природ-
ных средах. Практическая ее реализация, однако, сводится в основ-
ном к скриннингу бактерицидов, фунгицидов, протравителей с исполь-
зованием в качестве тест-культур микроорганизмов, вызывающих
биоразрушения и заболевания растений. Изучается также действие
химических средств защиты растений, главным образом протравите-
лей, на производственно ценные штаммы микроорганизмов, исполь-
зуемые для инокуляции семян (клубеньковые бактерии, азотобактер,
диазотрофы). Эти исследования в лучшем случае носят полуколичествен-
ный характер. Предложения (Бакаливанов, 1972; Mahmud, 1970, и др.)
использовать микроорганизмы для количественного определения
пестицидов широкой поддержки не получили.
62
15. Токсичность некоторых пестицидов для микроорганизмов
Пестицид Концентра- ция, мг/кг почвы (л пита- тельной среды) Микроорганизм Литературный источник
Хлорпикрин 0,04 Sacch. cerevisiae Tenber, 1966
Метилизотиоцианат ОД
Динитроортокрезол 4,8 St. aureus Меренюк, Тарков, 1972
»» 6,0 R. gracilis
Атразин <5,0 Asp. niger Бакаливанов, 1984
Нитрофенол 10,0 Ps. vulgaris Меренюк, Тарков, 1972
Каптан <0,1 Вас. licheniformis Brison, Denis, 1969
Тирам <0,1 Flavobacterium sp. <<
Набам <0,1
Гранозан <50 Ps. lacticum Клинцаре, 1983
ТМТД <50 Sacr. flava
Меркуран <50
Севин 0,02 E. coli Mahmud, 1970
Пиклорам 0,05 Mucor sinesis Рудаков, Спиридонов, 1982
Бромацил 0,05
Атразин 03
Симазин* 0,01 0,01 0,01 0,01 Penicillium thomii Fusarium solani F. moniliforme F. oxysporum Горленко н др. 1969
Атразин* 0,01 1,0 F. solani P. nigricans
Прометрнн* 0,01 0,1 F. solani F. moniliforme
* Дозы пестицидов даны в кг/га.
В разработанной нами методике определения фунгицидов ТМТД,
каптана в качестве тест-культуры используются дрожжи Saccharomyces
cerevisiae (Круглов и др., 1981). Исследуемые образцы семян или выре-
занные пробочником диски растительной ткани (листья, корнеплоды)
раскладывают в чашки Петри на поверхность агаризованной питатель-
ной среды, засеянной культурой дрожжей, чашки переносят в термо-
стат, инкубируют сутки, затем учитывают ингибирующий эффект по ве-
личине стерильных зон вокруг образца. Для количественной оценки
используют стандартную кривую, которая составляется на основании
опытов с известными концентрациями фунгицидов. В этом случае на
питательную среду раскладывают диски фильтровальной бумаги, про-
питанные ядохимикатами. Чувствительность метода 0,5—1,0 мкг в пробе.
63
Стандартная ошибка не превышает 10%, что говорит об удовлетво-
рительной воспроизводимости результатов. Ниже даны некоторые
примеры использования метода.
1. В хранящихся протравленных семенах пшеницы периодически
определяли содержание фунгицидов. Результаты анализов представле-
ны на рисунке 17. Как видно, ТМТД и каптан сохраняются на семенах
более 17 недель. За это время потери их составляют от 25 до 50%.
Расхождения в содержании препаратов на отдельных зернах не пре-
вышают 15 %, что указывает на хорошее качество протравливания.
2. В вегетационных опытах растения картофеля опрыскивали про-
изводственной дозой каптана и еженедельно определяли его содержа-
ние на листьях. Обнаружено идеальное распределение фунгицида по
листовой поверхности (рис. 18). В сухое лето каптан удерживается
на растении практически весь вегетационный период.
На листьях верхнего яруса он разрушается быстрее, что, по-види-
мому, обусловлено более высоким уровнем солнечной инсоляции.
Фунгицид совсем не обнаруживался в тканях молодых вновь отраста-
ющих листьев. Это позволяет заключить, что он практически не прони-
кает в ткани растений и не передвигается по ним. В то же время оче-
видно, что перезаряжение и возврат заболевания у растений возможны
только за счет листьев, не защищенных фунгицидом.
3. Определяли содержание ТМТД в обработанных препаратом хра-
нящихся корнеплодах моркови, картофеля и свеклы. Послойный (0—2,
2—4, 4—6, 6—8 мм) анализ показал, что на протяжении трех месяцев
ТМТД полностью сохраняется на поверхности корнеплодов, практи-
чески не передвигаясь в ткани растений.
Рис. 17. Динамика детоксикации
каптана (7) и ТМТД (2) на зерне
пшеницы при хранении, по данным
микробиологического метода (тест-
культура Sacch. cerevisiae)
64
7 /V 21 2В 35 42 43 55 53 70
Время после обработки, сутки
Рис. 18. Распределение и динамика деградации каптана на листьях нижнего (1)
и верхнего (2) ярусов растений картофеля по данным микробиологического
метода (тест-культура Sacch. cerevisiae)
Таким образом, микробиологический метод открывает широкие
возможности для изучения стабильности и транслокации фунгицидов.
Он очень чувствителен и позволяет определять ядохимикаты на поверх-
ности отдельного зерна и в образцах тканей растений, масса которых
не превышает нескольких миллиграммов. Метод не требует экстрак-
ции, очистки и концентрации пестицидов, а также сложной аналитичес-
кой техники, что представляет огромное преимущество при зкспресс-
анализе химических соединений.
ДЕЙСТВИЕ ПЕСТИЦИДОВ НА ПРОЦЕССЫ
СИМБИОТИЧЕСКОЙ АЗОТФИКСАЦИИ*
Одним из наиболее важных процессов взаимодействия микроор-
ганизмов с высшим растением является симбиотическая фиксация
атмосферного азота — основного элемента, определяющего величи-
ну и качество урожая. Общее количество молекулярного азота, вовле-
каемого в биологический круговорот симбиотической бобово-ризоби-
альной системой, только в СССР составляет ежегодно 3 млн т. Много-
летний отечественный и зарубежный опыт показывает, что эффектив-
ный бобово-ризобиальный симбиоз — не только залог получения высо-
кого и качественного урожая бобовых культур, а следовательно, и
возможности решения проблемы пищевого белка, но и наиболее эко-
номичный источник пополнения запасов азота в почве. Для использо-
вания дешевого ’’биологического азота” в сельскохозяйственном про-
изводстве многих стран увеличивают посевные площади под бобовы-
ми культурами, а также широко применяют предпосевную обработ-
ку семян препаратами клубеньковых бактерий, получаемых на осно-
ве активных штаммов Rhizobium. Характер и эффективность симби-
отических взаимоотношений бобового растения с клубеньковыми
бактериями зависят от физиолого-биохимического состояния обоих
партнеров, в связи с чем влияние каких-либо факторов на одного иэ
них непременно отражается на продуктивности системы в целом.
Пестициды оказывают разнообразное действие на многие сторо-
ны метаболизма высшего растения и микросимбионта, прямо или кос-
венно связанные с процессом фиксации азота, что обусловливает потен-
циальную их опасность для жизнедеятельности обоих компонентов
системы.
ТОКСИЧНОСТЬ ПРЕПАРАТОВ ДЛЯ КЛУБЕНЬКОВЫХ БАКТЕРИЙ
Токсичность пестицидов для клубеньковых бактерий изучают тра-
диционными методами, оценивая наличие стерильных зон вокруг ага-
ровых блоков либо дисков фильтровальной бумаги, смоченных раство-
рами различных концентраций препаратов, или определяя скорость
размножения бактерий на жидких питательных средах, содержащих
известные дозы пестицидов. Условия проведения опытов, как прави-
ло, далеки от тех, которые складываются в почве на корнях растений.
* Глава написана Л. Н. Пароме некой и Ю. В. Кругловым.
66
Тем не менее подобные исследования позволяют составить общие пред-
ставления о токсичности химических средств защиты растений для
микросимбионта.
Сравнительная оценка различных пестицидов свидетельствует об
уменьшении ингибирующего действия на клубеньковые бактерии в ря-
ду фунгициды > инсектициды > гербициды (Hamed, Salet, 1977).
Показано, что фунгициды в дозах, рекомендуемых для применения,
в большинстве случаев подавляют жизнедеятельность этих микроор-
ганизмов (Hamdi, 1978).
Токсичность препаратов в значительной степени определяется их
химическим составом. Наиболее токсичны ртутьсодержащие фунгици-
ды, применяемые за рубежом для обработки семян бобовых, — аретин,
агрозан и церезан (Bajpai, Tewari, 1978; Tu, 1982; Odeyemi, Ogunledun,
1983), а также фунгициды контактного действия каптан (Graham et al.,
1980), карбатион (Круглов, Пароменская, 1986). Гораздо менее опас-
ны для клубеньковых бактерий фунгициды бенлат (фундазол)
(Bajpai, Tewari, 1978) и бавистин (Bandyopadhyay et al., 1979).
Более чувствительны к фунгицидам клубеньковые бактерии при
выращивании их в жидких культурах (Faizan et al., 1980; Malik, 1980;
Malik, Tesfar, 1983). При действии токсичных концентраций препаратов
изменяется характер их развития — удлиняется лаг-фаза (Garg et al.,
1981), увеличивается продолжительность стационарной фазы роста,
укорачивается экспоненциальная фаза (Abdaila, Suleiman, 1978).
Токсичность фунгицидов для Rhisobium связана со значительны-
ми метаболическими нарушениями в клетках, приводящими к их ги-
бели. В ряде случаев механизм ингибирования Rhizobium аналогичен
таковому у грибов. Так, фунгициды оксикарбоксин, тиофанат инги-
бируют синтез 14С-лейцина, урацила и тимина, а также окисление глю-
козы и сукцината у Rhizobium sp. (Gard et al., 1981).
Значительные нарушения метаболизма в клетках клубеньковых
бактерий вызывают и некоторые инсектициды. Снижение жизнеспособ-
ности клеток R. meliloti в присутствии паратиона сопровождалось из-
менениями соотношения клеточных компонентов — уменьшением
общего содержания поли-d-оксибутирата и экзополисахаридов, повы-
шением содержания белков и фосфолипидов в мембранах бактерий,
а также изменением соотношения в них жирных кислот (Carranza et al.,
1985). Инсектицид альдрин сильно ингибирует окисление рибозы, араби-
нозы и ксилозы у Rhizobium sp. (Guneja, Dogra, 1978). Альдикарб в
концентрациях, подавляющих рост Rhizobium sp., снижал интенсив-
ность дыхания бактерий, вызывал более активное включение 14С-глю-
козы в клетки и изменение распределения 14С в различных ее компо-
нентах (Sekar, Balasubramanian, 1979). Тот же инсектицид сильно подав-
лял синтез ИУК из /.-триптофана у R- japonicum (Balasubramanian,
Nila-Kantan, 1976).
Существенной особенностью ряда пестицидов является увеличе-
67
ние их токсичности при повторных обработках. Установлено, что ма-
лые дозы таких препаратов, как гранозан, севин и каптан, повышают
чувствительность клеток к повторным обработкам и другим антропо-
генным нагрузкам (Башакидзе, Манджгаладзе, 1976; Шварцман, 1976).
Клетки Rhizobium sp., выращенные в присутствии инсектицида аль-
дрина, оказываются более чувствительными к повторному действию
инсектицида, чем бактерии контрольного варианта (Guneja, Dogra,
1978).
Более резистентны клубеньковые бактерии к гербицидам, инги-
бирующие концентрации которых для Rhizobium в большинстве слу-
чаев во много раз превышают производственные дозы. Здесь также
проявляется зависимость токсичности вещества от химического строе-
ния. Галогенопроизводные жирные кислоты (ТХУ и далапон), по дан-
ным ряда авторов, ингибируют различные виды Rhizobium в концентра-
циях от 10 до 5000 мг/л среды (Jensen, 1969; Kaszubiak, 1966; Vinti-
cova et al., 1965; Sud et al., 1973).
Производные феноксиалкилкарбоновых кислот, по мнению боль-
шинства авторов, относительно малотоксичны для клубеньковых бак-
терий. Концентрации их, сдерживающие рост Rhizobium, лежат в интер-
вале от 100 до 300 мг/л питательной среды (Carlyle, Thorpe, 1947; Flet-
cher, 1956; Kaszubiak, 1969; Jensen, 1969), хотя, по данным Джордана
и Гарсиа (Jordan, Garsia, 1969), 2,4-дихлорфеноксимасляная кислота
(2,4-ДМ) угнетала их рост уже при концентрации 10 мг/л.
На высокую чувствительность различных штаммов клубеньковых
бактерий к производным феноксиуксусной кислоты указывала Г. Вин-
тикова с соавт. (Vinticova et al., 1965). По данным О. Е. Аврова (1966),
наиболее токсичным был фалон (2,4-дихлорфеноксиэтилфосфат),
блокирующий рост культуры при концентрации 0,1 %. В ряде работ
отмечали различия в чувствительности видов Rhizobium к феноксиал-
канам. Как правило, медленнорастущие виды более чувствительны
к гербицидам, чем быстрорастущие (Vinticova et al., 1965; Kaszubiak,
1966; Kecskes, 1972).
Из производных фенола на посевах бобовых культур испытыва-
лись ПХФ (пентахлорфенолят натрия) и ДНОК (динитроортокрезол).
По данным О. Е. Аврова (1966), оба препарата снижали численность
клубеньковых бактерий в среде в 2 раза при концентрации их 0,1 %
и полностью блокировали жизнедеятельность Rhizobium при концен-
трации 1 %. В опытах Йенсена (Jensen, 1969) токсичность ДНОК в
жидкой культуре бактерий проявлялась уже при концентрации 20 мг/л.
Из производных сим-триазинов наибольший интерес представ-
ляет гербицид прометрин (2-метилтио-4,6 бис (изопропиламино)
сим-триазин), рекомендованный для борьбы с сорняками в посевах
сои, гороха, люпина, фасоли, вики, чечевицы, кормовых бобов. В опы-
тах ряда авторов при различных методах оценки этот гербицид был
нетоксичен для клубеньковых бактерий в концентрациях, превыша-
68
ющих 500-1000 мг/л среды (Авров, 1966; Kaszubiak, 1966; Ashton,
Crafts, 1981).
По данным О. Е. Аврова (1966), симазин, атразин, пропазин, атра-
тон нетоксичны для R. lupini и R. leguminosarum. Высокую резистент-
ность R. japonicum, R. trifolii, R. leguminosarum к симазину наблюдал
Кашубек (Kaszubiak, 1966). Однако в опытах Гроссбард (Grossbard,
1975) атразин подавлял рост клубеньковых бактерий в концентра-
ции 25 мг/л, а по данным Капусты (Kapusta, Rowenhost, 1973), инги-
бирующая концентрация атразина составляет всего 15 мг/л.
Очень разноречивые результаты получены при оценке токсичес-
кого действия гербицидных производных фенилмочевины. По сообще-
нию Аврова (1966), гербициды фенурон, монурон, небурон в концентра-
ции 1 % не влияли существенно на численность клубеньковых бактерий.
Высокую устойчивость Rhizobium к гербицидам которану, тенорану,
алипуру и афалону отмечал Кашубек (Kaszubiak, 1966). Линурон, по
данным ряда авторов, ингибирует рост различных видов Rhizobium
в концентрациях 7,5—25 мг/л среды (Левина, Карогуйшиева, 1974).
По немногочисленным данным, клубеньковые бактерии высоко-
устойчивы к зптаму, ИФК, хлор-ИФК, рамроду, нитралину, мезорани-
лу, солану.
Относительно мало известно о влиянии гербицидов на физиологи-
ческие процессы в культуре клубеньковых бактерий.
Показано, что 2,4-Д, 2,4,5-Т, метабромурон, монолинурон, линурон
(Huber, 1982), трифлуралин (Affifi, Dowidar, 1973) ингибируют ды-
хание бактерий. Гербицид базамин блокировал окисление глюкозы
и всех интермедиатов цикла трикарбоновых кислот (Balasubramanian,
Palaniappan, 1982). Парик и Сидха (Pareek, Sidhu, 1978) наблюдали
снижение уровня АТФ у бактерий R. trifolii, вызванное разобщением
окислительного фосфорилирования под влиянием 2,4-Д. Установле-
но, что предварительное культивирование R. leguminosarum на средах,
содержащих 250 мг/л 2М-4Х или 2М-4ХМ, приводит к изменению ви-
рулентности бактерий и снижению активности симбиотической сис-
темы при инокуляции семян гороха этой культурой (Пароменская,
1980).
В клетках различных штаммов R. leguminosarum, выращенных
на средах с гербицидом 2М-4ХМ, нетоксичная концентрация гербици-
да (5 мг/л) вызывает увеличение количества поли-0-оксилмасляной
кислоты. Структурную основу цитоплазмы таких клеток составля-
ют злектронно-плотные сферические образования рибосомального
типа, превышающие размеры рибосом обычных клеток и в значитель-
ной степени маскирующие нуклеоид и другие элементы цитоплазмы
(рис. 19). В то же время субтоксичная концентрация гербицида вызы-
вает появление инволюционных форм с нетипичным строением цито-
плазмы, увеличение объема большинства клеток, появление у них вы-
ростов, концентрических мембранных образований, в норме отсутству-
69
Рис. 19. Улэтратонкие срезы клеток
R. leguminosarum, выращенных на средах
с гербицидом 2М-4ХМ (двухсуточная
культура). Увеличение X 30000.
1 - контроль; 2 - 2М-4ХМ, 5 мг/л;
3 - 2М-4ХМ, 250 мг/л;
ющих. В ряде случаев наблюдается почкование клеток, свидетельству-
ющее о местных нарушениях в клеточной стенке бактерий.
Обращает на себя внимание широкий диапазон концентраций пес-
тицидов, токсичных для Rhisobium. Результаты оценки разных авторов
различаются на 1-2 порядка, что, по-видимому, объясняется отсутстви-
ем единой методики исследований и неодинаковой чувствительностью
к пестицидам видов и штаммов бактерий.
Кечкеш (Kecskes, 1972), используя метод диффузии в агар, изу-
чил токсичность 104 гербицидов для 26 штаммов 5 видов Rhizobium.
Почти все гербициды в какой-то степени ингибировали рост того или
иного штамма бактерий, но ни один из них не был токсичен для всех
исследуемых штаммов, то есть в любом случае, с любым гербицидом
выявлялись как чувствительные, так и резистентные формы бак-
терий. Это хорошо подтверждается результатами наших исследова-
ний (табл. 16).
R. leguminosarum (клубеньковые бактерии чечевицы) были более
чувствительны к препаратам фунгицидного и инсектицидного действия,
чем R. trifolii (клубеньковые бактерии донника белого), R. japonicum
(клубеньковые бактерии сои) и Rhizobium sp. (клубеньковые бакте-
рии нута обыкновенного) (Bandyopadhyay et al., 1979). Такая законо-
мерность отмечена также при изучении действия гербицидов — произ-
водных пиколиновой кислоты (Cadahia, 1986).
По данным наших анализов токсичности пестицидов для 224 штам-
мов различных видов Rhizobium, чувствительность клубеньковых бак-
70
16. Токсичность гербицидов по отношению к клубеньковым бактериям
Препарат Число штаммов, % от общего
0* 1-5 6-10 10
Симазин 100 0 0 0
Атразин 96,4 3,6 0 0
Пропазин 89,3 10,7 0 0
Прометрин 63,6 30,9 5,5 0
Хлоразин 56,3 37,5 6,2 0
Триэтазин 63,6 3,6 16,4 16,4
Атратон 9,1 36,4 9,1 45,4
Тордон 97,2 0 0 2,8
Линурон 93,5 3,2 3,1 0
Метурин 69,7 21,2 9,1 0
ТМТД 0 20,6 48,3 31,0
Карбатион 0 0 0 100
* Диаметр стерильных зон вокруг агаровых блоков с гербицидами, мм.
терий в первую очередь определяется химическим строением препарата
и штаммовыми различиями (табл. 17). В случае препаратов, малоток-
сичных для клубеньковых бактерий (прометрин, базагран), межвидо-
вые различия практически не выражены. Резистентность штаммов у
разных видов Rhizobium к более токсичным препаратам варьирует.
Эта вариабельность перекрывает разницу в чувствительности между
отдельными видами. Следует особо отметить высокую токсичность
гербицида дуала для всех исследованных бактерий, а также достаточ-
но большое число штаммов, проявляющих чувствительность к фунда-
золу — фунгициду, считающемуся безопасным для клубеньковых бак-
терий. Эти результаты свидетельствуют о настоятельной необходимости
оценки резистентности к пестицидам штаммов клубеньковых бакте-
рий, используемых для приготовления бактериальных препаратов.
Широкий диапазон чувствительности отдельных штаммов к пести-
цидам, по-видимому, отражает и большие адаптивные возможности
естественной популяции клубеньковых бактерий, чрезвычайно гете-
рогенной в генетическом плане. Действительно, в работе Сценде и
Толнера (Czende, Tolner, 1984) показано, что клубеньковые бактерии,
выделенные из почвы до обработки гербицидами, были более чувстви-
тельны к ним, чем те, которые выделялись спустя 20 лет после систе-
матического их применения. Очевидно, резистентность популяции клу-
беньковых бактерий к гербициду возрастала за счет отбора более ус-
тойчивых фенотипов.
Адаптивные возможности клубеньковых бактерий хорошо пока-
заны на примере тетраметилтиурамдисульфида (ТМТД, тиурам). По-
степенной адаптацией к увеличивающимся концентрациям этого фун-
71
17. Устойчивость различных видов Rhizobium к пестицидам
Вид Число проанализи- рованных штаммов Число чувствительных штаммов (в % от общего) *
фунда- зол 2М-4ХМ 2,4-Д промет- рин дуал базагран
R. trifolii 63 17,4 20,6 19,0 1,6 94,2 5,4
R. meliloti R. leguminosarum с корней: 57 52,6 52,6 49,0 1,8 61,4 5,3
гороха 50 28,0 32,0 32,0 24,0 89,8 8,2
чечевицы 7 28,6 42,8 28,6 0 42,8 0
чины 7 0 14,3 0 14,3 85,8 0
вики 8 37,5 37,5 25,0 10,0 88,8 3,3
кормовых бобов 32 75 9,4 9,4 0 100,0 0
* Определено по ингибированию роста или окрашивания на бобовом агаре, содержащем 0,01 % ТТХ (Пароменская, Круг-
лов, 1985).
гицида получены устойчивые штаммы клубеньковых бактерий лю-
церны, бобов и вигны (Odeyemi, Alexander, 1977; Gupta, Shirkot, 1981) .
Устойчивые к фунгицидам формы бактерий можно также получить
за счет спонтанных мутаций, возникающих при выращивании чувстви-
тельных штаммов Rhizobium в присутствии высоких концентраций
препаратов (Alexander, Odeyemi, 1978,1981). Для повышения резистент-
ности клубеньковых бактерий к коммерческим фунгицидам каптану,
тираму и цинебу успешно применяли ультрафиолетовое облучение
(Hickok, Barber, 1979).
В то же время адаптация клубеньковых бактерий к пестицидам
существенно изменяет их физиолого-биохимическую характеристику.
Адаптация к параквату, в частности, снизила скорость роста и уро-
вень дыхания, но повысила солеустойчивость у R. trifolii (Roslycky,
1985). С развитием устойчивости к севину у различных штам-
мов Rhizobium, выделенных из Lotus comiculatus u Vigna unguicalata,
а также у R. meliloti уменьшается общее количество липидов и фос-
фолипидов и увеличивается содержание гликолипидов (Gupta, Shirkot,
1981). Появление устойчивости к ТМТД приводит к снижению уров-
ня дегидрогеназной активности клубеньковых бактерий, увеличению
общего содержания липидов, фосфолипидов и нейтральных жиров
(Gupta, Shirkot, 1981). Все выделенные каптафол-устойчивые мутанты
R. trifolii характеризовались отсутствием одной и той же плазмиды
и неспособностью образовывать клубеньки на клевере (Ruiz-Sainz et al.,
1984).
Штаммы Rhizobium с приобретенной резистентностью к ТМТД
разрушают фунгицид до нетоксичных соединений (Odeyemi, Alexander,
1977). В то же время способность к разложению гирама отмечена и у
некоторых природных штаммов клубеньковых бактерий, в частности
у R. meliloti (Sirois et al.,1981). Этот фунгицид не является исключением.
Установлено, что клубеньковые бактерии метаболизируют 2,4-дихлор-
феноксимасляную кислоту до 2,4-дихлорфеноксиуксусной и СО2
(Jordan, Garsia, 1969). По нашим данным, R. japonicum разлагает гер-
бициды трефлан и прометрин (Пароменская, 1980).
Известно, что в процессе трансформации гербицидов образуются
разнообразные метаболиты, которые также являются физиологичес-
ки активными веществами. Накапливаясь в окружающей среде, они
воздействуют на живой организм. В последние годы показано, что
эти продукты влияют и на клубеньковые бактерии. Так, Хубер (Huber,
1982) отмечает, что хлорфенолы, являющиеся продуктами трансфор-
мации хлорпроизводных феноксиалкилкарбоновых кислот, сильнее
подавляют дыхание бактерий, чем исходные соединения. По данным
Пошенридера и Хубера (Poschenrieder, Huber, 1983), концентрации
2,4-дихлорфенола, тормозящие реакцию агглютинации R. legumino-
sarum, были в 5 раз, а 2,4,5-трихлорфенолов — в 50 раз ниже, чем кон-
центрации 2,4-Д и 2,4,5-Т соответственно.
73
Таким образом, характер и степень воздействия различных пести-
цидов на клубеньковые бактерии зависят от химического состава пре-
парата, продуктов его трансформации и резистентности отдельных штам-
мов.
ЧУВСТВИТЕЛЬНОСТЬ БОБОВО-РИЗОБИАЛЬНОГО КОМПЛЕКСА
К ХИМИЧЕСКИМ СРЕДСТВАМ ЗАЩИТЫ РАСТЕНИЙ
Характер воздействия фунгицидов - протравителей семян бобо-
вых культур —- на бобово-ризобиальный симбиоз определяется рядом
обстоятельств.
С одной стороны, в результате подавления фитопатогенных микро-
организмов возрастает всхожесть семян, снижается заболеваемость
растений, увеличивается урожай. При этом положительный эффект
в целом зависит от фитосанитарного состояния почвы и семенного
материала. Оздоровительный эффект протравителей в определенных
условиях может оказать положительное действие и на бэбово-ризо-
биальный симбиоз (Moli, Vyas, 1984; Janhri, Agarwal, 1984). С другой
стороны, большинство фунгицидов, как зто было показано выше, ток-
сично для клубеньковых бактерий. Причем, как правило, чем эффектив-
нее защищают фунгициды от возбудителей грибных заболеваний, тем
токсичнее они для Rhizobium (Tu, 1982). Конечный результат определя-
ется весьма неустойчивым равновесием между положительным влия-
нием протравителей на растение, и отрицательным их действием на клу-
беньковые бактерии и инокуляционный процесс.
Согласно литературным данным, протравители не влияют или вли-
яют незначительно на формирование клубеньков за счет спонтанных
клубеньковых бактерий почвы, а урожай растений, как правило, воз-
растает благодаря увеличению всхожести семян и оздоравливающему
действию протравливания. Это, по-видимому, обусловлено локализа-
цией фунгицидов на семенах и пространственным отдалением от них
клубеньковых бактерий, находящихся в почве. При прорастании се-
мян оболочка и семядоли, на которых находится фунгицид, ’’вытал-
киваются” на поверхность, а корешки уходят из зоны действия пре-
парата и быстро заселяются и инфицируются спонтанными клубень-
ковыми бактериями.
При искусственной инокуляции клубеньковые бактерии, находя-
щиеся на семенах, вступают в контакт с фунгицидами и большинство
из них погибает. Степень отрицательного воздействия протравителей
на Rhizobium зависит от химического состава препарата и штамма бак-
терий, а также от длительности их контакта до высева семян. Чем вы-
ше токсичность препарата и дольше контакт, тем больше погибает бак-
терий (рис. 20), тем меньше кйубеньков образуется на корнях расте-
ний. Нередко клубеньки смещаются с центрального корня на боковые.
Вследствие малочисленности бактерий на семенах и постоянного ”дав-
74
Рис. 20. Выживаемость клубень-
ковых бактерий в зависимости
от длительности их контакта с
протравителем (по Клинцаре,
1983):
1 - контроль (без протравли-
вания); 2 - инокуляция сразу
после протравливания гранозаном
пения” фунгицида на штамм-инокулянт снижается его конкурентоспо-
собность (рис. 21). В результате основная масса клубеньков образу-
ется за счет спонтанных клубеньковых бактерий, которые испыты-
вают меньшее воздействие фунгицидов. Эффект инокуляции семян
частично или полностью снимается.
Бактерицидное действие протравителей в почве ослабевает в ре-
зультате адсорбции их на органо-минеральном комплексе (Naumann,
1970). В силу различия адсорбционных возможностей почв различа-
ются и защитные свойства их в отношении клубеньковых бактерий.
Соответственно неодинаковым будет и действие фунгицидов на ино-
куляционный процесс.
Имеется несколько способов снижения отрицательного воздей-
ствия протравителей на бобово-ризобиальный симбиоз.
Рис. 21. Влияние протравителей
на конкурентоспособность различ-
ных штаммов R. trifolii (331 б,
329 б, 348 а):
1 - контроль; 2 - фундазол;
3 - ТМТД
75
1. Разрыв во времени между протравливанием семян и бактериза-
цией як препаратами клубеньковых бактерий. По мнению большинства
специалистов, он должен составлять от 3 до 30 дней и более. В этом
случае токсического эффекта протравителей удается частично или пол-
ностью избежать. Причина этого не совсем ясна, поскольку большинство
протравителей, рекомендуемых для обработки семян бобовых, имеет
достаточно высокую стабильность. По нашим данным, например, ТМТД
и каптан сохраняются на семенах пшеницы, гороха и клевера более
17 месяцев.
2. Немедленная заделка инокулированных семян В почву. В про-
тивном случае титр бактерий падает до нуля через 24 ч (Клинцаре,
1983). Однако в производственных условиях это трудно выполнимо.
Как правило, даже в благоприятных ситуациях от бактеризации до по-
падания семян в почву проходит несколько часов.
3. Дражирование семян фосфоритной мукой, известью и другими
материалами для пространственного разделения ядохимикатов и клу-
беньковых бактерий (Hamdi et al., 1978; Faizan et al., 1980).
4. Использование новых препаративных форм бактерий (жидкие,
гранулированные), которые вводятся непосредственно в почву перед
посевом или одновременно с посевом протравленных семян (Graham
et al., 1980; Stovold, Evans, 1980).
5. Селекция и экспериментальное получение устойчивых к фунги-
цидам штаммов Rhizobium. Показано, что мутанты клубеньковых
бактерий, устойчивые к спергону, тираму, каптану и металаксилу,
переносят дозы фунгицидов, значительно превосходящие производ-
ственные. Их использование увеличивает эффективность инокуля-
ции и активность бобово-ризобиального симбиоза (Odeyemi, Alexander,
1977; Aggarwal, Singlair, 1981; Rennie, 1986). Высокая устойчивость
отселекционированных штаммов позволяет применять их одновре-
менно с протравливанием семян, что существенно упрощает техноло-
гию и решает сразу несколько задач; снимает отрицательное действие
фунгицидов на штамм-инокулянт; повышает его конкурентоспособ-
ность по отношению к спонтанным клубеньковым бактериям вслед-
ствие более высокой чувствительности последних к фунгициду; бло-
кирует развитие фигопатогенных микроорганизмов.
Почвенные фунгициды, такие как производные метилдитиокарба-
миновой кислоты (карбатион, цирам, фербам, марбам и др.), а также
фумиганты относятся к стерилизаторам почвы. Коэффициент их безо-
пасности (Kg) для клубеньковых бактерий составляет от 0,1 до 0,01,
то есть полулегальные концентрации в десятки, сотни раз превосхо-
дят производственные дозы. Рассмотрим реакцию клубеньковых бак-
терий на введение в почву таких агрессивных веществ на примере кар-
батиона.
Карбатион используется как комплексный препарат фунгицид-
ного, нематицидного и гербицидного действия. Производственные до-
76
зы его достаточно велики и составляют от 600 до 1500 л/га. В почве
он быстро разлагается с образованием сероуглерода и метилизотиоциа-
ната. Оба продукта летучи и обладают сильным бактерицидным действи-
ем. В зависимости от метеорологических условий, типа почвы и техно-
логии применения карбатион и продукты его трансформации удержи-
ваются в почве 4—12 недель. Посев производится после этого срока,
поэтому токсичное действие препарата на растениях не проявляется.
В проведенных нами лабораторных, вегетационных и полевых
опытах карбатион в концентрации от 30 до 300 мг/кг практически
полностью подавлял развитие клубеньковых бактерий в почве по край-
ней мере в течение 3 месяцев. При посеве бобовых на такую почву рез-
ко снижалось число инфицированных растений и клубеньков. При кон-
центрации карбатиона свыше 300 мг/кг почвы клубеньки на корнях
растений не образовывались совсем (табл. 18). Таким образом, карба-
тион в дозах ниже производственных практически полностью ’’выби-
вает” клубеньковые бактерии из биоценоза. Однако при посеве в такую
почву инокулированных семян бобово-ризобиальный симбиоз восстанав-
ливается. Происходит интенсивное образование клубеньков, число
которых достигает контрольного уровня (не обработанные карбати-
оном посевы), повышается до контроля урожай зеленой массы рас-
тений.
Интересно, что устранение клубеньковых бактерий из почвы и
отсутствие клубеньков на корнях гороха незначительно сказывается
на продуктивности растений; у растений люпина в этих условиях уро-
жай надземной массы снижается почти в 2,5 раза (см. табл. 18). Это,
очевидно, можно4объяснить достаточным запасом подвижного азота
в почве, неодинаковой эффективностью клубеньковых бактерий, ис-
пользуемых для инокуляции семян гороха и люпина, и различной сим-
биотической активностью двух групп растений.
’’Замещение” популяции спонтанных клубеньковых бактерий (пос-
ле химической стерилизации) на отселекционированные коллекцион-
ные штаммы в случае обеих культур приводит лишь к воссстановле-
нию продуктивности растений до уровня, характерного для растений,
зараженных спонтанными штаммами. Следовательно, вопрос не в эф-
фективности используемых штаммов, а в особенностях физиологии
самих растений. По-видимому, растения гороха предпочитают исполь-
зовать минеральный азот из почвы, тогда как люпин в значительной
степени обеспечивает свои потребности в азоте за счет молекулярной
его формы, то есть речь идет о степени симбиотрофности. Если зто
так, то, по-видимому, горох следует отнести к растениям с низким
уровнем симбиотрофности, а люпин — с высоким. Такая характерис-
тика соответствует принятой в литературе. В большинстве работ горох
расценивается как слабый азотонакопитель. Этим, очевидно, можно
объяснить низкую эффективность препаратов клубеньковых бактерий,
используемых на этой культуре.
77
18. Действие различных доз карбатиона на образование клубеньков
у бобовых растений (вегетационный опыт)
Растение Концентра- ция карбатиона, мг/кг почвы Масса 10 растений, г
без ино- куляции инокули- рованные инокулирован- ные
без инокуля- ции, %
0 86,6 99,4 115
100 83,7 953 114
Горох 300 76,7 92,2 120
900 82,3 98,3 119
0 63,4 65,7 104
100 593 753 127
Люпин 300 23,7 64,6 272
900 28,2 65,3 231
Продолжение
Растение Число растений, Число клубеньков на
с клубеньками, % 10 растений
безнно- иноку- без иноку- инокули-
куляции лированные ляции рованные
100 100 575 507
100 100 522 410
Горох 50 100 38 490
1,7 100 1 460
100 100 60 103
100 100 21 74
Люпин 8 100 2 156
0 100 0 125
Вместе с тем, поскольку карбатион и подобные ему соединения
позволяют добиться практически полного освобождения почвы от клу-
беньковых бактерий, открывается уникальная возможность их исполь-
зования для устранения малоэффективных, но конкурентоспособных
бактерий и замены на высокоэффективные штаммы. Такой прием
был бы экономически оправданным, так как стерилизаторы облада-
ют сильным гербицидным, нематицидным и фунгицидным действием,
то есть являются комплексными препаратами для борьбы с вредите-
лями сельскохозяйственных растений, сорняками и фитопатогенными
грибами.
Токсичность гербицидов для бобово-ризобиального симбиоза,
как правило, оценивают по интенсивности формирования клубеньков
78
на корнях растений. Многие авторы отмечают снижение числа клубень-
ков под действием гербицидов. В опытах Кечкеша из 108 гербицидов
и их сочетаний, использованных на люпине, большинство уменьшало
число клубеньков (Kecskes et al., 1977). В полевых опытах гербициды
линурон и арезин ингибировали образование клубеньков на корнях
люпина (Латыпова, Вагина, 1973), трефлан, прометрин и нитран сни-
жали число клубеньков у сои (Чеботарь, 1978; Baltazar et al., 1979;
Петров, 1981), симазин и алипур уменьшали число клубеньков на кор-
нях люпина (Латыпова, 1968), трибунил ингибировал формирование
клубеньков у фасоли (Malkomes, 1979), базамин — у вигны (Bala-
subramanian, Palaniappan, 1978). Как правило, токсичность препара-
тов определяется химическим строением действующего вещества
и концентрацией его в почве. Наиболее токсичны 5-триазиновые гер-
бициды, в частности симазин, снижающий число клубеньков у люцер-
ны, клевера, сераделлы, гороха при использовании в небольших дозах
(Hauke-Pacewiczowa, 1970), хлорфенолы (Huber, 1982), гербицид фтор-
метурон (Amakiri, Clifford, 1978).
В опытах Флетчера феноксимасляные препараты (2М-4ХМ, 2,4-ДМ)
подавляли образование клубеньков у клевера в гораздо меньшей сте-
пени, чем феноксиуксусные (2,4-Д, 2М-4Х, 2,4,5-Т) (Fletcher et al.,
1956, 1960). Тем не менее в полевых опытах Джордана с соавторами
гербицид 2,4-ДМ снижал образование клубеньков у Lotus comiculatus
(Джордан и др., 1966). В ряде случаев разноречивость результатов
можно объяснить различиями в сроках и способах применения герби-
цидов. Так, внесение трефлана за 5 дней до посева ингибировало об-
разование клубеньков у сои, внесение за 10 дней не влияло на этот
процесс (Baltazar et al., 1979). Обработка почвы атразином перед по-
севом кормовых бобов снижала численность клубеньков на корнях
растений, обработка за 30 дней такого эффекта не оказывала (Salem
et al., 1977). Минимальное влияние 2М-4ХМ на формирование клубень-
ков у растений кормовых бобов и гороха отмечено при раннем сроке
применения гербицида (Пароменская и др., 1976; Butler et al., 1980).
Характер действия гербицидов на процесс образования клубень-
ков зависит и от дозы препарата. Так, производственные дозы трефла-
на и прометрина подавляли образование клубеньков у сои и гороха,
малые концентрации стимулировали этот процесс (Школа, 1970; Чебо-
тарь, 1978; Петров, 1981).
Действие гербицидов на формирование клубеньков определяется
также видом растения. Например, эптам в одних и тех же концентрациях
снижал численность клубеньков у люцерны и красного клевера (Peters,
1979), но практически не влиял на их образование у фасол^ (Deuber,
1978).
Установлена общая закономерность — фитотоксическое действие
гербицидов на бобовое растение сопровождается снижением числа
клубеньков, уменьшением их массы (Круглов, Пароменская, 1972;
79
Bertholet, Clark, 1985), изменением микроструктуры. На рисунке 22
представлены электронно-микроскопические снимки клубеньков
1,5-месячных растений гороха. Контролем служили растения, вырос-
шие на не обработанной гербицидом почве, в опытном варианте в поч-
ву вносили прометрин. Основной объем клубеньков контрольного
варианта занимает бактероидная зона, которая характеризуется хорошо
развитыми растительными клетками, содержащими небольшие вакуоли.
Большинство клеток инфицировано. В клубеньках растений опытного
варианта объем бактероидной зоны существенно сокращается, резко
возрастает число неинфицированных клеток. Большую часть их зани-
мают вакуоли. В инфицированных клетках наряду с нормальными
бактероидами появляются инволюционные формы, происходит дегра-
дация клеток и их распад .
Аналогичная анатомо-морфологическая картина наблюдалась у
клубеньков гороха, обработанного гербицидами 2М-4Х и 2М-4ХМ в фа-
зу 7-8 листьев. Таким образом, одним из результатов отрицательного
действия гербицидов на бобово-ризобиапьный симбиоз является де-
струкция бактероидной ткани и дезорганизация функционального ап-
парата симбиотической фиксации азота'.
Результаты морфологического и цитологического анализа подтвер-
ждаются биохимическими исследованиями. В частности, установлено,
что под влиянием гербицидов — производных феноксиалкилкарбоно-
вых кислот (Круглов и др., 1975), сим-триазинов (Пароменская, 1984),
фенилмочевин (Чеботарь, 1978), ароматических аминов (Круглов
и др., 1984) - снижается активность нитрогеназы, уменьшается со-
держание леггемоглобина в клубеньках, падает азотфиксирующая
способность, снижается урожай растений. В таблице 19 представлены
результаты анализа нитрогеназной активности в клубеньках растений
сои, обработанной производственной дозой гербицидов в полевых
условиях.
Следует отметить, что далеко не всегда подавление гербицидом
процесса азотфиксации сопровождается снижением урожая. В частности,
при обработке почвы в полевых условиях в результате гибели сорняков
и ’’осветления” посевов активизируются процессы фотосинтеза, рас-
ширяется площадь минерального питания, изменяется в лучшую сто-
рону гидротермический режим почвы, что создает более благоприят-
Рис. 22. Микроструктура клубеньков контрольных (7) и опытных (2, 3, 4) рас-
тений гороха (см. текст):
1, 2 - срез клубенька в сканирующем электронном микроскопе (X 3000); 3 -
клетки, наполненные бактероидами (X 17000); 4 — интрацеллюлярные инфек-
ционные нити и вакуоли в клетках клубенька (X 15000). БЗ - бактероидная
зона; ИН — инфекционная нить; В — вакуоль; Б — бактероид; ДБ — дегради-
рованный бактероид
81
19. Влияние гербицидов на нитрогеназную активность
и урожай сои в полевых опытах
Вариант Активность нитрогеназы Урожай зерна, т/га
мкМ С, Н4 на 1 растение % от конт- роля
Предпосевная обработка
почвы гербицидами
Контроль (без гербицидов) 39,4 100 1,87
Трефлан, 1 кг/га* 16,6 ' 42 1,93
Сенкор, 0,3 кг/га 21,8 55 1,57
Базагран, 1,5 кг/га 17,1 43 1,98
Обработка по вегетирующим растениям Дуал, 2,5 кг/га 2,7 7,0 1,36
* Все дозы даны по д. в.
ные условия для растений. Однако, как правило, в этом случае долй
молекулярного азота в балансе азотного питания бобовых существен-
но сокращается. Растения в значительной степени переходят на пита-
ние минеральным азотом почвы. Роль их как азотонакопителей резко
падает. Как видно из таблицы 20, в условиях вегетационного опыта
прометрин в дозе 3,0 мг/кг полностью блокирует фиксацию азота.
Поступление минерального азота на 1 растение фактически не изме7
няется. Очевидно, что системы, обеспечивающие симбиотическую фик-
сацию молекулярного азота, значительно чувствительнее к гербицидам,
чем системы минерального питания растений.
20. Влияние прометрииа иа продуктивность сои
и эффективность использования различных форм азота
Вариант Сырая масса 10 растений, г Азот, мг на 10 растений Активность нитрогеназы, мкМ С, Ц, на 10 растений
минераль- ный молекуляр- ный
Контроль 180 385 1107 327
Прометрин,
1,5 мг/кг почвы 145 391 701 126
Прометрин,
3,0 мг/кг почвы 51 338 0 2
В вегетационных опытах с 15 N было показано, что под влиянием
умеренной дозы прометрина (1,5 мг/кг) нитрогеназная активность
клубеньков снижается почти в 3 раза, активность нитратредуктаэы
возрастает в 2 раза. Соответственно на 42 % увеличивается коэффи-
82
циент поглощения минерального азота из почвы (Круглов, Паромен-
ская, 1986). В результате содержание общего азота в растениях не толь-
ко не снижается, но даже возрастает. Увеличение общего азота в тканях
растений, обработанных гербицидами симазином, линуроном и аре-
зином, отмечала Р. М. Латыпова (1968, 1973) и другие авторы. Одна-
ко, как видно из приведенных примеров, это отнюдь не означает вы-
сокий'уровень симбиотической фиксации молекулярного азота бобо-
выми культурами.
Необходимо подчеркнуть еще одну закономерность, характерную
для многих, если не для всех гербицидов: растения, инокулированные
клубеньковыми бактериями, более чувствительны к гербицидам, чем
растения без клубеньков (рис. 23). Объясняется это рядом причин.
Во-первых, клубеньки синтезируют гормональные вещества, которые
существенно влияют на физиолого-биохимическое состояние растений
(Сабельникова, 1976). Нарушение этой функции в связи с дезинтегра-
цией бактероидной ткани клубенька под влиянием гербицидов может
вызвать накопление фитотоксических веществ и угнетение растений.
Во-вторых, при определенных обстоятельствах не исключена возмож-
ность перехода бактерий к паразитическому образу жизни, что усугу-
бляет отрицательное действие гербицидов на продуктивность растений.
М. В. Федоров (1948) и Виртанен (Virtanen, 1947) допускали возмож-
ность подобного изменения во взаимоотношениях между клубенько-
выми бактериями и бобовыми растениями, например при снижении
потока углеводов в клубеньки. А такие гербициды, как производные
сим-триазинов, фенилмочевины, карбаматы и феноксиалкилкарбо-
новые кислоты, существенно влияют на синтез и распределение моно-
сахаров у растений (Чканников, Соколов, 1973; Audus, 1976). Связь
между изменениями в содержании сахаров, которые происходят под
влиянием гербицидов, и эффективностью бобово-ризобиального сим-
биоза была хорошо прослежена в наших опытах (табл. 21). При дозе
Рис. 23. Чувствительность неинфицированных (7) и инфицированных (2) клубень-
ковыми бактериями растений сои и люпина к трефлану (а) и атразину (б)
83
21. Влияние атразина на эффективность симбиоза
люпина и клубеньковых бактерий
Вариант Содержание моносахаров, % Фиксировано азота, мг на 1 растение Прибавка урожая зеленой массы от инокуляции, % к неинокулированному контролю
Контроль 1,23 33,8 238
Атразин, 0,05 мг/кг почвы 1,14 24,3 173
Атразин, 0,20 мг/кг почвы 0,46 -1,3 -51
Примечание. Вегетационный опыт в песчаной культуре. Интенсивность азот-
фиксации оценивалась разностным методом.
атразина 0,2 мг/кг количество моносахаров в корнях растений снижа-
ется почти в 3 раза, полностью блокируется фиксация молекулярного
азота, в 2 раза по сравнению с неинокулированным контролем умень-
шается продуктивность растений.
Отрицательное действие гербицидов на бобово-ризобиальный сим-
биоз тесно связано с реакцией растения-хозяина на введение ядохими-
катов. Под влиянием гербицидов весьма существенно меняются физио-
лого-биохимические показатели растений. Характер и степень изме-
нений зависят от химического состава препарата, технологии его при-
менения, вида и даже сорта культуры.
Как отмечалось выше, под влиянием многих гербицидов изменя-
ется углеводный обмен, в частности, снижается содержание моноса-
харов в тканях растений. Существенно нарушаются так называемые
вторичные метаболические реакции, и в первую очередь реакции азот-
ного цикла. Установлено, что под действием гербицида хлор-ИФК рез-
ко меняется соотношение между отдельными аминокислотами уже
на стадии прорастания гороха (Янич, 1975): повышается содержание
аммонийного азота, глютаминовой и аспарагиновой кислот. Увеличе-
ние количества дикарбоновыХ кислот и их амидов в клубеньках и
листьях бобовых растений вызывали симазин (Мироненко, 1975),
линурон (Латыпова, 1982), арезин, прометрин и гербан (Лалова, 1975;
Мироненко и др., 1975).
Приведенные данные свидетельствуют о значительных изменениях
в процессах ассимиляции аммонийного азота в растениях под действием
гербицидов. В то же время известна огромная роль аммония и глюта-
мина как регуляторов ферментативных процессов при симбиотичес-
кой азотфиксации, так же как и роль глютаминовой и аспарагиновой
кислот в процессах связывания, резервирования и транспорта аммоний-
ного азота (Кретович, 1980). В присутствии прометрина и ряда других
гербицидов возрастает активность нитратредуктазы и увеличивается
84
поступление нитратов в растения, что отрицательно сказывается на
процессе симбиотической фиксации ввиду конкуренции, существую-
щей между двумя типами азотного питания у бобовых (Rigaud, 1981;
Круглов, Пароменская, 1986).
Важную роль в механизме бобово-ризобиального симбиоза игра-
ют различные эндогенные регуляторы роста индольной, фенольной
и цитокининовой природы, которые синтезируются в клубеньках бо-
бовых (Сабельникова, 1976). Показано, что производные феноксиал-
килкарбоновых кислот и хлорпроизводные алифатические кислоты
сильно влияют на качественный состав, содержание и активность эн-
догенных регуляторов роста (Волынец, 1975; Чканников, Соколов,
1976; Пароменская, 1980); вероятно, это обусловливает их действие
на симбиотические системы. Часто фитотоксический эффект гербици-
дов на инокулированные растения сопровождается уменьшением ко-
личества леггемоглобина в клубеньках, что, в свою очередь, усили-
вает токсическое действие препаратов на процессы симбиотической
фиксации азота (Джордан и др., 1966; Круглов и др., 1975; Balasubra-
manian, 1976).
Однако действие гербицидов на симбиотическую фиксацию азота
через растение — не единственный механизм. В модельных опытах с
интактными клубеньками, отделенными от растения и инкубирован-
ными в растворах различных гербицидов, установлено непосредствен-
ное влияние последних на активность нитрогеназы.
Результаты наших опытов с феноксиалканами, трефланом и про-
метрином (табл. 22) показали, что действие это имеет как стимули-
рующий, так и ингибирующий характер в зависимости от химического
состава и дозы препарата.
22. Влияние гербицидов яа нитрогеназную активность клубеньков,
отделенных от растений
Клубеньки гороха
Клубеньки сои
Вариант
Вариант
Активность
нитрогеназы,
% от контроля
Активность
нитрогеназы,
% от контроля
0,2 г/л 46 Д 1 мг/л 66,0
2М-4Х 2 г/л 6,2 Трефлан 10 мг/л 50,0
ОД г/л 146,0 1 мг/л 7,6
2М-4ХМ 2 г/л 56,0 Прометрин 10 мг/л 3,4
В свете этих данных интересно обратиться к проблеме транслока-
ции гербицидов в бобовых растениях. Показано, что хлорпроизвод-
ные феноксиуксусной кислоты, попадая на листья, быстро передви-
гаются к активно растущим меристематическим тканям, которые пред-
85
ставляют место их ’’конечного действия” (Чканников, Соколов, 1973).
К таким активным меристемам относятся клубеньки в период интен-
сивного роста и формирования бактероидной ткани, поэтому можно
предположить, что гербициды — производные феноксиуксусной кис-
лоты передвигаются и аккумулируются в меристематической ткани
клубеньков.
Вопрос о локализации феноксиалкилкарбоновых кислот в клубень-
ках практически не рассматривался в литературе. В единственной ра-
боте Кулдрейка (Culdreik, 1970) отмечалось, что 2,4,5-трихлорфено-
ксиуксусная кислота, использованная для обработки акации, ’’устрем-
лялась преимущественно в клубеньки”.
Результаты наших исследований по транслокации 14С-2,4-Дв корнях
гороха в основном подтвердили зти наблюдения. Гербицид 2,4-Д пе-
редвигается из листьев в корневую систему, проникает в клубеньки
и аккумулируется здесь. Наиболее интенсивно этот процесс происхо-
дит в растениях, обработанных гербицидом в фазу 7—8 листьев.
Радиометрический анализ экстрактов из корней и клубеньков
растений показал, что уже на 3-и сутки 25 % поступающего в клубе-
ньки 14С представлено в виде свободной 2,4-Д, 7 % — в виде его фе-
нольного метаболита и около 68 % находится в водорастворимой фрак-
ции, не идентифицированной нами. В абсолютных цифрах содержание
свободного 2,4-Д в клубеньках в 40 раз превышало его содержание
в корнях. Это доказывает, что клубеньки являются резервуаром или
одним из важных центров аккумуляции феноксиалканов у растений.
Вместе с тем появление в клубеньках фенолов и других продуктов,
меченных 14С, говорит о наличии в них активного процесса трансфор-
мации 2,4-Д. Один из механизмов этой трансформации — гидролиз
гербицида по эфирной связи, в результате которого накапливаются
хлорофенолы — активные ингибиторы окислительного фосфорилирова-
ния (Чканников, Соколов, 1973).
Аналогичные данные получены в опытах с гербицидом трефланом
на растениях сои. В инокулированных растениях скорость поступле-
ния трефлана в корневую систему возрастала более чем вдвое. В клу-
беньках, кроме трефлана, были обнаружены продукты его трансфор-
мации: 2,6-динитро-4-трифторметил-н-пропиланилин, 2-нитро-4-трифтор-
метил-6-амино-ди-н-пропиланилин, а также следы 2-амино-4-трифтор-
метил-6-нитратаналина. В корнях неинокулированных растений, не име-
ющих клубеньков, эти метаболиты не обнаруживались.
Интенсивные процессы трансформации гербицидов и аккумуля-
ция продуктов их метаболизма в клубеньках сказываются на бобово-
ризобиальном симбиозе. В таблице 23 приведены результаты модель-
ного опыта с клубеньками, отделенными от корней сои в фазу буто-
низации-цветения. Клубеньки инкубировали в растворах трефлана
и продуктов его трансформации. Все соединения сильно ингибировали
86
активность нитрогеназы, причем метаболиты трефлана по токсичности
не уступали исходному соединению.
23. Влияние трефлана и его метаболитов иа активность
нитрогеназы изолированных клубеньков
Вариант Активность нитрогеназы
мкМ С^Ц, % от контроля
200 мг клубеньков
Контроль 527,2 100
Трефлан, 1 мг/л 2,6-динитро-4-трифлорметил-н- 82,2 15,6
пропиланилин, 1 мг/л 75,3 14,3
2-нитро-4-трифторметил-6-амино-ди-н- пропиланилин, 1 мг/л 97.1 18,5
Таким образом, концентрация и трансформация гербицидов в
клубеньках является одним из факторов, определяющих влияние этих
веществ на активность симбиотической фиксации азота.
Как отмечалось ранее, чувствительность различных видов и штам-
мов микроорганизмов к одним и тем же пестицидам существенно раз-
личается. Учитывая широкое применение препаратов клубеньковых
бактерий для искусственной инокуляции бобовых культур, интерес-
но было изучить отношение к пестицидам различных штаммов-симбион-
тов. С этой целью были поставлены вегетационные опыты с песчаной
культурой растений гороха (табл. 24), семена которого инокулировали
штаммами R. leguminosarum, проявившими различную чувствитель-
ность к гербициду прометрину в опытах in vitro на искусственных пита-
тельных средах. Результаты показали, что наиболее устойчивый к про-
метрину штамм (245а) обеспечивал и большую устойчивость к герби-
24. Чувствительность симбиотической азотфиксации к прометриву у
растений гороха, ииокулированных различными штаммами R. leguminosarum
Штамм-ино- кулянт Контроль Прометрин, 0,1 мг/кг почвы
Сухая масса, г/10 растений Актив- ность нитроге- назы, мкМ/1 растение Фикси- рован- ный азот, мг/10 растений Сухая масса, г/10 растений Актив- ность нитро- геназы, мкМ/1 растение Фикси- рован- ный азот, мг/10 растений
245а 4,58 35,0 42,8 4,69 51,6 52,8
250а 5,04 41,2 42,2 4,07 19,4 12,9
2406 4,92 35,2 39,0 4,34 13,6 10,4
87
циду симбиотической системы в целом. Причем если у растений, ино-
кулированных штаммом 245а, эффективность симбиотической фик-
сации азота в присутствии ирометрина возрастала, то в других случаях
она снижалась ио сравнению с контролем в 2-3 раза. Последнее, не-
сомненно, указывает на важную роль индивидуальных свойств штам-
ма в устойчивости бобово-ризобиапьного симбиоза к гербицидам на
различных этапах инфекционного процесса, формирования бактерои-
дной ткани и фиксации молекулярного азота. Все эти вопросы требуют
более детальных исследований.
С другой стороны, хорошо известно, что различные виды и сорта
растений также проявляют неодинаковую чувствительность к пести-
цидам, и обусловлено зто их индивидуальными морфологическими
и физиолого-биохимическими свойствами (Audus, 1976). Вопрос о ,
значении сортовых особенностей бобовых растений для устойчивости р
симбиотической системы к гербицидам малоизучен. Вегетационные v
опыты с шестью сортами растений гороха, инокулированными одним
и тем же штаммом клубеньковых бактерий, проведенные в нашей
лаборатории, дали следующие результаты (рис. 24).
У трех сортов (Местный Вологодский, Московский поздний, Рота)
эффективность симбиотической фиксации азота под давлением про-
метрина возрастала, у трех других заметно снижалась. Особенно чув-
ствительным к гербициду был нитрогеназный комплекс.
Таким образом, устойчивость бобово-ризобиапьного симбиоза к
пестицидам зависит от устойчивости к ним растения-хозяина, чувстви-
тельности микросимбионта и морфофизиологического аппарата симби-
отической фиксации азота, включая проводящие системы, обеспечи-
ЗОО-
ШО-
120-
о
1 г з
§ 300
I R й
О 5 0 c^g-
J100-
§ * "
<£& ВО-
1 2 3
Рис. 24. Чувствительность симбиотической системы различных сортов гороха
к прометрину:
1 — Местный Вологодский; 2 - Московский поздний; 3 - Рота; 4 — Рамонский
77; 5 - Немчиновский 766; 6 - Эра
88
Рис. 25. Схема последовательной оцен-
ки токсичности химических препаратов
для бобово-ризобиального симбиоза
вающие поступление пестицидов в
клубеньки, ферменты нитрогеназ-
ного комплекса, синтез леггемо-
глобина, эндогенные регуляторы
роста и т. д.
Для рационального и безопас-
ного применения химических
средств защиты растений на посе-
вах бобовых необходима предва-
рительная оценка их токсичности
для симбиотической системы.
Пестицид
С этой целью могут быть использованы ’’Методические рекомендации...”
(Пароменская, Круглов, 1985), разработанные во ВНИИ сельскохозяйст-
венной микробиологии. Выбор этапов и методов оценки определяется на-
значением препарата, способом его применения и степенью изученности
(рис. 25). На любом этапе исследований в случае обнаружения токсичес-
кого эффекта пестицид исключается из дальнейшей работы н не рекомен-
дуется для использования под бобовые культуры.
Только оптимальное сочетание резистентного к пестицидам штам-
ма клубеньковых бактерий, сорта бобовой культуры, химического
состава препарата и способа его применения гарантирует получение
высокого урожая и эффективность азотфиксирующей системы в усло-
виях интенсивных технологий выращивания бобовых культур.
ДЕГРАДАЦИЯ ПЕСТИЦИДОВ
Пестициды, попадая в почву, подвергаются трансформации и де-
градации под влиянием физических, химических и биологических факто-
ров.
Вклад микроорганизмов в процессы деградации различными авто-
рами оценивался в 10—70% (Головлева и др., 1982). Такая вариабель-
ность показателей объясняется разнообразием химических соединений,
используемых в качестве пестицидов.
В настоящее время не вызывает сомнения, что все пестициды, при-
меняемые в сельском хозяйстве, могут разлагаться микроорганиз-
мами. Для реализации этого процесса необходимы следующие условия.
1. Наличие микроорганизмов, способных разлагать пестициды. 2. На-
личие условий, необходимых для синтеза ферментов, катализирующих
процессы трансформации пестицидов. 3. Наличие условий, достаточных
для осуществления ферментных реакций трансформации.
При нарушении любого из этих условий микробиологический про-
цесс деградации пестицидов в почве невозможен.
Почва, как биологическая система, насыщена разнообразными
микроорганизмами, которые в совокупности обладают широким на-
бором ферментов, способных трансформировать любое природное
органическое вещество. Численность микроорганизмов существенно
варьирует в зависимости от почвенно-климатический условий, агротех-
нических мероприятий, качества растительного покрова и составляет
от нескольких десятков тысяч до нескольких миллиардов в одном
грамме, биомасса их колеблется от нескольких сот килограммов до
нескольких тонн на 1 гектар и составляет 0,01-0,4% от массы почвы
(Аристовская, 1982). Отсюда следует, что почва обладает огромным
биохимическим потенциалом и способна в течение года перерабаты-
вать десятки тонн органического вещества, попадающего в нее в виде
растительных и животных остатков.
Первым и наиболее простым доказательством наличия микроорга-
низмов, разлагающих пестициды, является более высокая скорость
деградации химических веществ в нестерильной почве по сравнению
со стерильной. Как правило, для процессов микробиологической дегра-
дации характерно наличие более или менее длительной лаг-фазы, в
течение которой происходит адаптация популяции почвенных микро-
организмов к чужеродному химическому соединению.
Из почвы выделены микроорганизмы различных таксономических
групп, способные разлагать пестициды при культивировании их на ис-
кусственных питательных средах. Все они являются хемоорганотро-
фами и выдерживают достаточно высокие концентрации вещества,
превышающие производственные в десятки и сотни раз. Абсолютное
90
большинство из них аэробы или факультативные аэробы. Участие ана-
эробных микроорганизмов в процессах деградации пестицидов почти
не изучено.
В таблице 25 перечислены микроорганизмы, участвующие в транс-
формации основных классов органических соединений, используемых
в качестве пестицидов. При всем разнообразии представленного спис-
ка частота встречаемости отдельных штаммов-деструкторов в почве
25. Микроорганизмы трансформаторы пестицидов
Микроорганизм (род) Фено- ксиал- кан- кар- боно- вые кисло- ты Фенил- моче- вины Фенил- кар- бама- ты Сим- три- азины Фос- фор- орга- ничес- кие кисло- ты ддт Нитро- фено- лы Хло- риро- ванные алифа- тичес- кие кисло- ты
Achromobacter + + +
Acinetobacter +
Aerobacter + +
Agrobacterium + + +
Arthrobacter + + + + + +
Bacillus + + + +
Bacterium + +
Bravibacterium +
Clostridium +
Corinebacterium + + + +
Escherichia +
Flavobacterium + + + + +
Klebsiella + + +
Pseudomonas + + + + + + + +
Rhizobium + + +
Sarcina +
Xanthomonas +
Aspergillus + + + + + +
Ghocladium +
Fusarium + + +
Helminthosporium +
Penicillium + + + + + + +
Rhizoctonia "V. +
Stahibotris +
Thrichoderma + + + + +
Mucor +
Actinomyces + +
Streptomyces + + + + +
Nocardia + + + + + +
Примечание. Наименование микроорганизмов дано по оригиналу (Bank,
1984; Cullimore, 1971; Kaufman, Kearney, 1970; Yasufumi, Shozo, 1986; Головле-
ва, 1985; Круглов, 1976; Керни, Кауфман, 1971).
91
относительно невелика. Адаптация происходит, как правило, очень
медленно. Поэтому для выделения нужных микроорганизмов из поч-
вы обычно используют технику накопительной культуры, перколяторы
и хемостаты, причем период предварительного культивирования часто
растягивается на многие недели и месяцы.
Были предприняты попытки оценить распространенность микро-
организмов-деструкторов пестицидов в почве. Численность микро-
организмов, разлагающих 2,4-Д, по данным одних авторов (Loos
et al., 1979) составляет от 1 до 245 клеток на 1 г почвы, по данным
других (Cullimore, 1981) - около 103, по данным третьих (Fournier,
1980) — 102—104, что соответствует 10“4 — 1 % от общего количества
учтенных бактерий. Кунц и Рибарова (Kune, Rybarova, 1984) оцени-
вают относительную их численность в 5 %. В процессе инкубации поч-
вы и при добавлении глюкозы эта величина возрастает до 55 %. Отме-
чено, что в ризосфере растений число микроорганизмов, разлагающих
феноксиалканы, в, сотни раз выше, чем в парующей почве (Sandmann,
Loos, 1984).
Из этих примеров видно, что относительная численность микро-
организмов, разлагающих пестициды в почве, чрезвычайно вариабель-
на и не коррелирует с общей численностью присутствующих в ней ми-
кроорганизмов.
Замечено, что многократное применение пестицидов приводит
к изменению микробного ценоза почвы в сторону возрастания в ней
относительной доли микроорганизмов, способных разлагать эти веще-
ства. Степень изменения зависит от химического состава препарата
и условий жизнедеятельности микроорганизмов. Так, перестройка
структуры ценоза и адаптация микрофлоры относительно легко про-
исходят в присутствии далапона (2,2-дихлорпропионовая кислота),
2,4-Д(2,4-дихлорфеноксиацетат) (Audus, 1960), карбофурана (0-(2,3-ди-
гидро-2,2-диметилбензофуранил-7)-М-метилкарбамат) (Kaufman et al.,
1985; Wilson et al., 1982) и практически отсутствуют при обработке
почвы симазином [2-хлор-4<6-бис (этиламино) сим-триазин], ГХЦГ
(1,23,4,5,6-гексахлорциклогексан), ДДТ (1,1 -ди (4-хлорфенил) -2,2,2 -
трихлорэтан) и 2,4-5-Т(2,4,5-трихлорфеноксиуксусная кислота).
Прекращение применения пестицидов, как правило, приводит к
быстрому сокращению микрофлоры, разлагающей пестициды, и элими-
нированию этого признака. /
ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ТРАНСФОРМАЦИИ
ПЕСТИЦИДОВ МИКРООРГАНИЗМАМИ
Ценную информацию о биохимических и физиологических меха-
низмах деградации пестицидов в почве дает изучение этого процесса
в культуре микроорганизмов на искусственных питательных средах.
Различают два основных типа трансформации- ксенобиотиков, в
92
том числе пестицидов, микроорганизмами. При первом микроорга-
низмы используют органическое вещество в качестве источника пита-
ния и энергии, за счет этого происходят.рост и деление клеток, накоп-
ление биомассы.
При втором пестициды не могут служить источником питания и
энергии, не могут генерировать деление клеток и соответственно на-
копление биомассы микроорганизмами. Тем не менее они подверга-
ются микробной трансформации. Этот процесс имеет как бы ’’случай-
ный” характер и, как правило, идет в присутствии других органичес-
ких соединений, которые являются источником энергетического ма-
териала или индукторами синтеза соответствующих ферментов.
Кроме того, пестициды могут подвергаться трансформации, всту-
пая в химические реакции с продуктами жизнедеятельности микро-
организмов (аминокислотами, сахарами, белками, фенолами и т. д.).
Большинство пестицидов по структуре и типу химических связей
являются аналогами природных соединений. Поэтому можно предпо-
лагать, что в разнообразной по составу ассоциации почвенных микро-
организмов, использующих в качестве источника энергии органичес-
кое вещество, имеются такие, которые обладают ферментами, способ-
ными атаковать химические соединения. С определенной долей уве-
ренности можно говорить о генетической обусловленности деградации
этих соединений в природных условиях.
Действительно, из почвы и других природных сред были выделены
и отселекционированы микроорганизмы, использующие многие пести-
циды в качестве единственного источника углерода и энергии. Наибо-
лее легко атакуются производные алифатических и арилкарбрновых
кислот, феноксиалканов, фосфорорганические соединения. Сведения
для группы сим-триазинов и фенилмочевины противоречивы.
На начальных этапах деградации органическое вещество, как прави-
ло, с помощью ферментов подготовительного (периферийного) ме-
таболизма превращается в одно из соединений основного (централь-
ного) обмена, которое уже используется в ростовых процессах (Голов-
лева, Головлев, 1980; Карасевич, 1982; Розенгардт, Шерстобитов, 1980;
Johnson, Talbot, 1983). Большинство ферментов подготовительного
метаболизма у микроорганизмов индуцибельно и подвержено репрес-
сии катаболитами (Карасевич, 1982).
Успех микробной трансформации пестицидов определяется мно-
гими факторами, основным из которых является способность хими-
ческого соединения индуцировать синтез ферментов подготовитель-
ного цикла. Эта способность в значительной степени зависит от сход-
ства химической структуры молекулы пестицида и природного анало-
га. Изменение конформации молекулы, характер, положение и число
заместителей в ней резко меняют стабильность химического вещества.
Разложение пестицийа, неспособного индуцировать синтез фер-
ментов, возможно только при наличии в среде индукторов: природ-
93
ных соединений или продуктов искусственного синтеза. Трансформация
пестицида в этих условиях будет носить ’’случайный” характер.
Важным фактором микробной трансформации пестицидов яв-
ляется токсичность многих из них для микроорганизмов. При опре-
деленных концентрациях пестициды ограничивают рост клеток и могут
блокировать активность соответствующих ферментов.
Физиологические особенности роста микроорганизмов на токсичных
субстратах (ядах) подробно рассмотрены в работе Ю. Н. Карасевича
(1982) и заключаются в следующем:
медленный рост клеток вследствие низких концентраций субстра-
та и значительного расхода его на энергию поддержания жизнеспособ-
ности клеток, низкий экономический коэффициент потребления суб-
страта;
наличие так называемой ’’критической концентрации” вещества,
выше которой время генерации микроорганизмов резко возрастает,
соответственно снижается скорость размножения.
растянутая во времени лаг-фаза, которая увеличивается с ростом
концентрации и токсичности субстрата;
узкий интервал между ’’критической концентрацией” и константой
насыщения субстрата, и как следствие, короткая экспоненциальная
фаза;
короткая стационарная фаза и ускоренная, отчетливо выраженная
фаза отмирания.
Все зто в той или иной степени объясняет относительно низкие тем-
пы накопления микроорганизмов-деструкторов в окружающей среде
и высокую персистентность пестицидов.
Вместе с тем следует учитывать, что промежуточные соединения
микробной деградации пестицидов нередко обладают высокой токсич-
ностью и могут ингибировать или полностью блокировать дальней-
шее развитие клеток. По мере их накопления в культуре разложе-
ние и утилизация исходного соединения замедляются и его трансформа-
ция часто носит незавершенный характер. Теоретически процесс разложе-
ния пестицида может возобновиться после детоксикации метаболита
или адаптации и перестройки ферментативного аппарата микроорга-
низмов. Для этого необходимо время. В природных условиях дегра-
дация может продолжиться за счет других видов и штаммов микроор-
ганизмов.
Таким образом, использование пестицидов микроорганизмами
в качестве источника питания и энергии ограничено довольно жестки-
ми рамками.
Токсичность пестицида можно преодолеть путем снижения его
концентрации в среде. Но при этом неминуемо снижается и скорость
его деградации вследствие указанных выше причин.
Чаще всего трансформация пестицидов идет с затратой энергии
и требует дополнительного источника питания. Ферментативные реак-
94
ции трансформации органических соединений, сопряженные с исполь-
зованием дополнительных ростовых субстратов, получили наименование
кометаболизма. Под ростовыми субстратами понимают вещества, обес-
печивающие деление клеток и накопление биомассы микроорганизмов.
Косубстраты (пестициды и т. д) неспособны поддерживать рост и раз-
витие микроорганизмов в отсутствие ростовых субстратов (Скрябин,
Головлева, 1976; Карасевич, 1982; Dalton, Stirling, 1982; Janke, Fritsche,
1985).
В основе кометаболизма лежат различные механизмы, которые
в биохимическом отношении не представляют нечто новое и необыч-
ное и потому этот термин имеет только феноменологический смысл,
объединяющий все явления трансформации неростовых субстратов
(Карасевич, 1982).
Основные свойства субстрата и косубстрата, обеспечивающие сопря-
женность процессов трансформации двух органических веществ при ко-
метаболизме, проанализированы Ю. Н. Карасевичем (1982) и пред-
ставлены ниже:
Субстрат Косубстрат
1. Источник питания и энергии, индуцирует синтез ферментов 2. То же Источник питания, не индуцирует син- тез ферментов Не является источником питания, не
3. То же, не индуцирует синтез ферментов индуцирует синтез ферментов То же, индуцирует синтез ферментов
В первом случае косубстрат в принципе мог бы использоваться
микроорганизмами в качестве ростового субстрата. Однако он не спо-
собен индуцировать необходимые для этого ферменты подготовитель-
ного метаболизма и соответственно обеспечить синтез кофакторов
для преодоления энергетического барьера. При наличии ростового суб-
страта, индуцирующего синтез соответствующих ферментов, косубстрат
утилизируется микроорганизмами почти одновременно с ним. По мере
использования ростового субстрата процесс трансформации косуб-
страта затухает. Полная остановка его зависит от начального уровня
индуцируемых ферментов, синтезированных в присутствии субстрата-
индуктора.
Во втором случае пара субстрат—косубстрат состоит из соединений-
аналогов и является строго специфичной. Косубстрат трансформируется
не полностью. Происходит накопление метаболитов ввиду отсутствия
ферментов, обеспечивающих их последующее превращение.
В третьем случае косубстрат индуцирует ферменты подготовитель-
ного метаболизма. Источником питания и энергии для их биосинтеза
может быть любое органическое соединение (субстрат), утилизируемое
микроорганизмом. Разложение косубстрата имеет незавершенный ха-
рактер вследствие инактивации или отсутствия ферментов, необходимых
для последующей цепи превращений.
95
Для всех описанных случаев характерно, что после утилизации
ростового субстрата ферменты находятся в индуцированном состоянии
и какое-то время могут воздействовать на косубстрат в отсутствие
субстрата. В процессах кометаболизма образуется один или несколь-
ко продуктов, которые не подвергаются дальнейшей трансформации
и накапливаются в культуре. Последнее, по мнению ряда авторов,
обусловлено либо отравлением микробной клетки этими продуктами,
либо отсутствием ферментов, способных осуществлять дальнейшую
трансформацию, либо отсутствием кофакторов и каких-то специфич-
ных условий культивирования (Карасевич, 1982; Janke, Fritsche, 1985),
Для фермента или системы ферментов подготовительного (пери-
ферийного) метаболизма характерна малая субстратная специфичность.
Процессы кометаболизма требуют дополнительных источников энергии
и восстановленных кофакторов.
Таким образом, главная функция органического вещества (росто-
вого субстрата) при кометаболизме заключается в индуцировании
ферментов, генерировании энергии и синтезе восстановленных кофак-
торов, необходимых для поддержания жизнеспособности микробной
клетки и трансформации косубстратов (пестицидов и т. д).
В процессах кометаболизма микроорганизмы используют разно-
образные ростовые субстраты: углеводы, спирты, органические кислоты,
альдегиды, алифатические углеводороды и т. д. Однако не найдено
прямой связи между скоростью роста микроорганизмов на том или
ином ростовом субстрате и интенсивностью трансформации косубстра-
тов в культуре. Более того, как показали Г. К. Скрябин с соавт. (1976),
субстраты, обеспечивающие наилучшие условия роста и развития попу-
ляции микроорганизмов в культуре, зачастую слабо генерируют или
вообще не генерируют процессы кометаболизма. Возможно, зто тот
самый случай, когда ростовой субстрат и косубстрат не способны инду-
цировать ферменты, катализирующие начальные этапы метаболизма
косубстрата. Микроорганизмы просто ”не замечают” его в среде. Это
еще раз подчеркивает разнообразный и сложный характер механизма
кометаболизма.
На рисунке 26 представлена схема функциональной связи между
субстратом (ростовое вещество) и косубстратом (пестициды и т. д).
Как уже отмечалось, в процессе кометаболизма пестицида или
другого органического соединения в чистой культуре микроорганиз-
мов образуются продукты, которые далее не метаболизируются и на-
капливаются в среде. Процесс прерывается на начальных этапах прев-
ращения косубстрата. В условиях смешанной культуры или в ассоци-
ациях микроорганизмов возможно появление новых видов и штаммов,
способных метаболизировать новую пару субстрат—косубстрат, где
в качестве -косубстрата будет выступать продукт метаболизма исход-
ного вещества. Образующиеся в этом случае продукты могут разлага-
ться третьим микроорганизмом и т. д. Можно ожидать, что в резуль-
96
Пестицид
(носубстрат)
Метаболит-1
(косубстрат}
Метаболит-о...
(ростоЬой
субстрат}
Биомасса, н2о,
СП2
и
а
о
Ростобай
субстрат
С02, Н2П, биомасса
РпстоЬой
субстрат
C02,H20, биомасса
a
Рис. 26. Схема функциональной связи ростового субстрата и пестицида в про-
цессах кометаболизма:
а — энергетическое обеспечение жизнедеятельности клетки; б — синтез кофакто-
ров; в - индукция синтеза ферментов
тате цепи кометаболических реакций с участием нескольких типов
микроорганизмов и ростовых субстратов произойдет полное разло-
жение пестицида.
Таким образом, термин кометаболизм может быть использован
только для описания характера трансформации органического вещества
в чистой культуре микроорганизмов. В смешанной культуре, тем более
в ассоциации микроорганизмов в природных условиях, трансформация
таких веществ в конечном счете должна завершаться полной минерали-
97
задней их и включением в биосферный цикл. В этом некоторые авторы
видят гарантию успешного решения проблемы загрязнения окружа-
ющей среды пестицидами и их метаболитами. Однако, как показывают
исследования, необходим сложный градиент условий, который в при-
родных средах реализуется далеко не всегда (Головлева, 1980).
Вопросы метаболизма пестицидов микроорганизмами детально
обсуждены в ряде обзоров и монографий (Barik, 1984; Motosugi, Soda,
1983; Johnson, Taibort, 1983; Скрябин, Головлева, 1976; Головлева,
Головлев, 1980, и др.). Основные типы биохимических реакций транс-
формации суммированы Н. Н. Мельниковым с соавт. (1977) и вклю-
чают окисление, восстановление, гидролиз, дегалогенирование, изоме-
ризацию, образование конъюгатов, полимеризацию.
Не останавливаясь подробно на анализе метаболических путей
превращения пестицидов, обратим внимание на некоторые особенности
их микробной трансформации, существенные с санитарно-гигиеничес-
кой и зкотоксикологической точек зрения.
Во-первых, как правило, трансформация пестицидов в культуре
носит множественный или полифункциональный характер. Так, напри-
мер, при гидролизе 2,4-дихлорфеноксимасляной кислоты (2,4-ДМ)
образуются 2,4-дихлорфенол и масляная кислота, в результате чего
происходит детоксикация гербицида. Продуктом 0-окисления алифати-
ческой цепи 2,4-ДМ является 2,4-дихлорфеиоксиуксусная кислота
(2,4-Д), обладающая более широким спектром фитотоксического
действия. Аналогичные реакции характерны для всех высших фенокси-
алканов (2М-4ХМ, 2,4,5-ТХМ и т. д). Образующаяся из 2,4,5-ТХМ 2,4,5-
трихлорфеноксиуксусная кислота является сильным гербицидом и
длительное время сохраняется в окружающей среде.
Гидролитическое дехлорирование хлоразина ведет к образованию
нефиготоксичного гидроксианалога — гидроксихлоразина, тогда как
при Деалкилировании хлоразин последовательно может превращаться
в триэтазин и симазин, высокостабильные и очень фитотоксичные веще-
ства (Kaufman, Kearney, 1970).
Для производных тиофосфорной кислоты характерно несколько
путей метаболизма, из которых наибольший интерес представляют
два. Первый — окислительная десульфурация, идущая с образованием
окисленных аналогов — оксонов, токсичность которых на 2-3 порядка
выше токсичности исходных тиосоединений. Второй путь — гидролиз
и детоксикация тиофосфатов.
Несколько путей трансформации имеет и гербицид ордрам, широ-
ко используемый на посевах риса. В процессе его деградации образует-
ся ряд высокостабильных кетопроизводных, по токсичности для тепло-
кровных животных значительно превосходящих исходное соединение
(Головлева и др., 1982).
Аналогичным образом в результате реакции циклизации трифлу-
ралина (трефлана) в культуре микроорганизмов образуются и накап-
98
ливаются производные бензимидазола, также физиологически актив-
ные вещества. Многие соединения этой группы являются эффективными
фунгицидами и инсектицидами. В анаэробных условиях происходит
восстановление нитрогрупп в молекуле трефлана и образование его
аминопроизводных, обладающих гербицидным эффектом. В продуктах
трансформации гербицида найдено 28 высокостабильных соединений.
Среди них азо- и азоксибензолы, представляющие опасность для чело-
века, в связи с чем ставится вопрос о нецелесообразности дальнейше-
го использования трефлана в сельском хозяйстве (Мельников и др.,
1977; Golab et al., 1978).
Как видно из приведенных примеров, список которых можно было
бы значительно продолжить, множественный характер микробиологи-
ческой трансформации пестицидов обусловливает накопление различ-
ных промежуточных продуктов деградации, обладающих неодинаковым
физиологическим эффектом. Какие из этих метаболитов будут
образовываться и накапливаться в каждом конкретном случае, зависит
от культуры микроорганизмов, природы субстрата и условий культи-
вирования.
Вторая особенность биохимических процессов трансформации
пестицидов в культуре заключается в том, что при всем многообразии
метаболических путей в конечном счете образуются и накапливаются
определенные ключевые продукты. Для пестицидов, имеющих в своем
составе ароматическое кольцо (арилкарбоновые, арилоксиалкилкар-
боновые кислоты, ароматические углеводороды, фенилмочевины, фе-
нилкарбаматы, фенилтиокарбаматы, ароматические производные фос-
форной кислоты и т. д.), такими ключевыми продуктами являются
производные фенола и бензола. Они относительно долго удержива-
ются в окружающей среде. Многие из них очень токсичны. Стабиль-
ность их зависит от характера и положения заместителя в аромати-
ческом кольце, что достаточно хорошо иллюстрируют данные Алек-
сандера (Alexander, Lustigman, 1966).
26. Скорость деградации производных бензола почвенными микроорганизмами в культуре, сутки (Alexander, Lustigman, 1966)
141 заместитель 2-й заместитель
=СООН =он
орто- мета- пара- орто- мета- пара-
=СООН 28218 =ОН 2 2 111 =СН3 16 2 8 4 16 1 =ОСН3 4 16 2 >64 4 8 =NO2 8 >64 4 4 >64 16
99
Продолжение
1-й заместитель 2-й заместитель
=СООН =он
орто- мета- пара- орто- мета- пара-
=С1 >64 32 >64 16 =NH, 2 64 8 >64 >64 =SO3H >64 >64 >64 32
Отсюда можно сделать заключение, что одновременное или последо-
вательное интенсивное применение фунгицидов, гербицидов и инсекто-
акарицидов, имеющих в молекуле действующего вещества аромати-
ческое кольцо, может привести к загрязнению окружающей среды
их метаболитами в большей степени, чем исходными веществами. Таким
образом, центр внимания в оценке загрязнения почвы смещается с пести-
цидов на их метаболиты.
Производные бензола (фенолы) подвергаются дальнейшей биохи-
мической трансформации одним из двух путей. Первый — гидроксили-
рование, за которым следует ряд окислительных реакций, раскрытие
ароматического кольца и полная его минерализация. Второй включа-
ет реакции полимеризации, катализируемые экстрацеллюлярными
оксидазами (Фонкен, Джонсон, 1976; BoUag et al., 1977; Bollag, 1983).
Характер, скорость и степень полимеризации зависят от исходных про-
дуктов.
Имеется несколько путей трансформации аминопроизводных бен-
зола (анилина). Один из них связан с окислительным дезаминировани-
ем и образованием фенолов, последующая судьба которых описана
выше (Kaufman, 1975). Второй представляет реакцию ацетилирования,
в результате которой образуются ацетанилиды. Реакция обратима:
деацетилирование вновь ведет к накоплению анилинов в среде (Суров-
цева, 1979). Третий путь заключается в последовательном окислении
аминогруппы до гидроксиламина и нитробензола. При определенных
обстоятельствах зта реакция в культуре микроорганизмов также об-
ратима. Четвертый путь представляет собой реакцию конденсации ани-
линов и некоторых продуктов их окисления до азобензолов и других
высокомолекулярных полимеров (Kaufman, 1975; Bartha, 1975).
Нитроароматические соединения, многие из которых обладают
сильным бактерицидным и фунгицидным эффектом, также метаболи-
зируются различными путями. Один из них - отщепление нитрогруппы
с образованием фенилпроизводных соединений и последующая их транс-
формация по схеме, описанной выше. Другой — последовательное вос-
становление нитрогруппы и образование ароматических аминов. Процесс
обратим. Однако в определенных условиях возможна полная дегра-
100
Рис. 27. Схема микробной трансформа-
ции арилпроизводных пестицидов
Нация анилинов или полимериза-
ция их до соответствующих олиго-
меров, о чем сказано выше (Baric,
1984; Dagley, 1978).
Установлено, что оксидазы
катализируют процессы конденса-
ции хлорпроизводных фенолов с
хлорпроизводными анилина. Как
фенолы, так и анилины способны
вступать в аналогичные реакции с
природными соединениями фе-
нольной природы и взаимодейст-
вуют с активными группами гу-
миновых веществ, включаясь в со-
став последних (Bartha, 1977;
ПЕСТИЦИДЫ
со2,н,о
Bollag, 1983). При этом, очевидно,
речь идет о синтезе новых
высокостабильных соединений, длительное время сохраняющихся
в окружающей среде. Некоторые из них теряют токсичность, физиоло-
гический эффект других пока не известен, третьи, подобно азобен-
золам, представляют потенциальную опасность для животных и чело-
века как возможные канцерогены.
Обобщенная схема трансформации пестицидов, в состав молекулы
которых входит ароматическое кольцо, представлена на рисунке 27.
Таким образом, превращение исходного соединения в другие от-
носительно стабильные вещества не снимает вопрос о его токсичности.
Наоборот, в условиях интенсивного систематического применения
пестицидов в сельском хозяйстве потенциальная опасность накопле-
ния такого рода продуктов возрастает. Поэтому правомерной является
постановка вопроса о скриннинге пестицидов не только для выявления
их действия на различные организмы, персистентности и миграции по
пищевым цепям, но и с целью оценки токсичности их метаболитов,
образующихся в конкретных условиях среды (Головлева и др., 1982).
ВЗАИМОДЕЙСТВИЕ МИКРООРГАНИЗМОВ И ПЕСТИЦИДОВ В ПОЧВЕ
Как уже отмечалось, почва является гетерогенной средой и состоит
из твердой, жидкой и газообразной фаз. В силу своей полидисперсности
и агрегированности она имеет сильно развитую поверхность раздела
между твердой и жидкой фазами, что определяет состояние вещества,
распределение микроорганизмов и характер биохимических процессов
в замкнутом ’’поровом пространстве”.
101
Микроорганизмы распределяются свободно в водной фазе почвы,
прикрепляются к поверхности микроагрегатов или включаются в них;
в последнем случае они оказываются зажатыми между коллоидальными
частицами органо-минерального геля, то есть находятся в иммобилизо-
ванном состоянии. В зависимости от характера распределения микро-
организмов существенно меняются их поведение и функциональная
активность. Жизнедеятельность микроорганизмов в почвенном растворе
не отличается от жизнедеятельности стационарной культуры при одина-
ковом химическом составе среды их обитания, осмотическом давлении,
pH, Eh и характере газообмена.
В связи с определенными методическими трудностями численность
микроорганизмов в почвенном растворе изучена крайне недостаточно.
Она сильно зависит от типа почвы и ее влажности. Однако с учетом
емкости поглощения почвы как сорбента и данных по десорбции ми-
кроорганизмов с твердой фазы следует принять ее равной 10—10-4 %
от общей численности почвенных микроорганизмов. Отсюда расчетная
масса не превышает нескольких микрограммов на 1 мл. Грибы и акти-
номицеты, как правило, в почвенном растворе не обнаруживаются.
Водная фаза почвы сосредоточена в пустотах, капиллярах и плен-
ках. Их объем и диаметр неодинаковы, что имеет существенное зна-
чение для жизнедеятельности микроорганизмов. Как было показано
(Звягинцев, 1973), с уменьшением диаметра капилляров существенно
снижается скорость размножения клеток и их ферментативная актив-
ность, сокращаются размеры, в ряде случаев наблюдаются гибель и
лизис. В то же время известно, что даже в хорошо оструктуренных
черноземах превалируют мелкие поры. Отсюда ясно, что микробиоло-
гические процессы превращения органических веществ в водной фазе
почвы при всех равных условиях будут протекать медленнее, чем в
стационарной культуре микроорганизмов, а доля последних в деграда-
ции этих веществ в узких капиллярах сводится к минимуму. Таким
образом, надо признать, что значительная часть (или объем) почвенного
раствора в биохимическом отношении является инертной. Аналогич-
ная картина наблюдается в так называемой пленочной воде. Поэтому
модели микробной трансформации пестицидов, ориентированные на
поведение клеток, свободно плавающих в питательном растворе, не
отражают объективной картины, складывающейся в почве.
Микроорганизмы, находящиеся на поверхности твердых частиц
и агрегатов, удерживаются там ван-дер-ваальсовыми силами и закреп-
ляются по типу ионных, водородных и ковалентных связей (Blanch,
1984; Звягинцев, 1987). Характер и прочность закрепления определя-
ются распределением гидроксильных, карбоксильных, аминных и других
активных групп на поверхности клеточных стенок, свойствами поверх-
ности почвенных частиц и составом почвенного раствора. При благопри-
ятных условиях влажности микроорганизмы размножаются на твердой
102
поверхности, образуя микроколонии. Поэтому распределение их имеет
микрозональный характер.
Прикрепленные клетки при изменении ионной силы раствора, pH,
температуры, электростатического заряда частиц и т. д. могут десор-
бироваться. Адсорбционные связи в микроколониях ослабевают по
мере наслоения размножающихся клеток. Адсорбционная емкость
зависит от типа почвы, вида микроорганизмов, окружающих условий
и составляет в первом приближении 106—109 клеток на 1 г (Звягин-
цев, 1973).
Адсорбция существенно влияет на жизнедеятельность микроорга-
низмов, изменяя скорость их размножения, интенсивность и направлен-
ность физиолого-биохимических процессов.
Одним из важных механизмов иммобилизации клеток является
включение их в матрицу, которая в почве представлена сложным орга-
но-минеральным гелем (Blanch, 1984). Основная масса иммобилизо-
ванных клеток изолирована от почвенного раствора. Пестициды посту-
пают к ним только путем диффузии через слой геля. Соединения, не-
растворимые в воде или имеющие молекулы более крупные, чем раз-
мер пор матрицы, в контакт с микроорганизмами не вступают и ими
не разрушаются. Скорость диффузии водорастворимых соединений,
а следовательно, и скорость биохимических реакций зависят от кон-
центрации их в среде и активности иммобилизованных клеток и фер-
ментов.
Обобщенная формализованная схема распределения микроорга-
низмов, ферментов и пестицидов в почве представлена на рисунке 28.
Таким образом, рассматривая основные закономерности распреде-
ления и жизнедеятельности микроорганизмов в почве, следует отдать
предпочтение тем из них, которые закреплены на поверхности почвенных
частиц.При нормальном и недостаточном увлажнении, наиболее харак-
терном для почв, именно здесь концентрируется основная масса клеток.
Интенсивность и характер их биохимической деятельности опреде-
ляются условиями, которые складываются на границе между твердым
телом (гелем) и жидкостью. Исходя из этих представлений, выбирают
подходы для оценки механизма деградации пестицидов и построения
прогностических моделей их персистентности в почве.
Пестициды, попадая в почву, вступают во взаимодействие с различ-
ными ее компонентами, при этом наибольшее значение имеют глинные
минералы и гумусовые вещества.
Основные механизмы взаимодействия пестицидов с органо-мине-
ральным комплексом почвы суммированы в таблице 27.
Как видно, они разнообразны и зависят от химического состава
препарата. Необходимо подчеркнуть, что для одних и тех же пестици-
дов одновременно может быть задействовано несколько механизмов.
103
I
2
1
Рис. 28. Схема распределения пестицидов, микроорганизмов и внеклеточных
ферментов в почве:
темные фигуры - микроорганизмы; светлые окружности — пестициды; треуголь-
ники — внеклеточные ферменты. 1 - твердая фаза; 2 — жидкая фаза; 3 — гель
Доминирование того или иного из них зависит от типа почвы, содержа-
ния в ней глинных минералов и органического вещества, системы агро-
технических мероприятий. В частности, высокие дозы минеральных
удобрений снижают коэффициент сорбции и увеличивают подвижность
многих пестицидов по почвенному профилю, тогда как компосты и на-
воз, наоборот, ’’связывают” их. Это объясняет трудности анализа пове-
дения и прогноза персистентности пестицидов в почве.
По мнению большинства авторов, основная масса пестицидов, по-
падающих в почву, находится в связанном состоянии и плохо десорби-
руется водой.
Прочность закрепления пестицидов зависит от механизма их вза-
имодействия с органо-минеральным комплексом почвы. С помощью
ван-дер-ваальсовых сил, ионных, водородных связей, электростатичес-
кого притяжения пестициды и их метаболиты извлекаются из чрезвы-
чайно разбавленного почвенного раствора и концентрируются на поверх-
ности твердой фазы. Емкость сорбции увеличивается с увеличением
содержания в почве глины и гумуса.
104
27. Взаимодействие пестицидов с твердой фазой й гумусом почвы
(по: Khan, 1978; Bollag, Loll, 1983;Senesi, Testini, 1983)
Характер взаимодействия Дипири- дилы Сим-триа- зины Фенил- мочевины Полихлор- бифенил Фенокси* алканы
Ионообменные реакции 4- + + +
Водородные связи Ваи-дер-ваальсовые силы Гидрофобные связи + + + 4-
Молекулярное про-
сеивание
Ковалентные связи
Комплексообразо-
вание
Как отмечалось выше, на границе раздела твердой и жидкой фаз
почвы сосредоточена основная масса • микробионтов, поэтому здесь
возникают условия, наиболее благоприятные для контакта пестицидов
с микроорганизмами и ферментами. Однако, как показывает опыт ра-
боты с природными соединениями, характер и скорость процессов
трансформации органических соединений определяются очень мно-
гими факторами. В связи с этим следует рассмотреть основные пути
взаимодействия пестицидов и микроорганизмов на границе раздела
твердой и жидкой фаз.
1. Пестицид концентрируется на поверхности почвенных частиц
и вступает в контакт с закрепленными здесь ферментами и микроор-
ганизмами. Создаются благоприятные условия для его трансформации.
Образно говоря, сорбент выполняет функцию ’’официанта”, подающего
пестицида как источник питания и энергии к ’’столу” микроорга-
низмов.
2. Пестицид обладает токсическими свойствами. При концентрации
на поверхности сорбента ингибирующее воздействие его на жизнедеяте-
льность микроорганизмов возрастает. В результате процесс биохими-
ческой трансформации пестицида тормозится или полностью останав-
ливается.
3. Вследствие разложения пестицида на поверхности сорбента об-
разуются стабильные метаболиты. Сорбент препятствует оттоку их в
почвенный раствор, поэтому они концентрируются на поверхности
почвенных частиц и агрегатов. Возможна катаболическая репрессия.
Накопление токсичного метаболита, например некоторых производ-
ных фенола, бензойной кислоты, нитросоединений и анилина, приводит
к гибели микроорганизмов и прекращению процесса деградации пести-
цида.
4. На поверхности сорбента концентрируются другие органические
105
вещества, конкурирующие за активные центры и тормозящие процесс
трансформации пестицидов.
5. Ростовые субстраты, сорбированные на поверхности почвенных
частиц, могут генерировать процессы трансформации пестицидов
в реакциях кометаболизма.
6. При концентрации и составе катионов на границе раздела твердое
тело—жидкость, неблагоприятных для функционирования ферментных
систем, участвующих в трансформации пестицида, микробной деструк-
ции последнего не происходит.
Как видно, в природных условиях могут складываться ситуации,
которые не возникают или выражены в меньшей степени в гомогенной
среде на искусственных питательных средах. Большинство из них изу-
чены крайне неудовлетворительно и поэтому не поддаются контролю.
В частности, неясным остается вопрос о механизме и роли феномена
кометаболизма в деградации пестицидов в природных средах. По-
жалуй, впервые в экологическом плане он был поставлен в работе
Г. К. Скрябина и Л. А. Головлевой (1976), но до сих пор не получил
более или менее удовлетворительного ответа.
Как отмечалось ранее, в процессе кометаболизма пестицидов микро-
организмы могут использовать в качестве ростового субстрата разно-
образные органические соединения: сахара, спирты, органические кис-
лоты и т. д. Большинство из них обнаружены в почве и постоянно по-
ступают сюда с корневыми выделениями, растительными остатками
и продуктами жизнедеятельности микроорганизмов. Поэтому в почве
имеются объективные условия для процессов кометаболизма пестици-
дов. Однако он не всегда возможен по следующим причинам.
1. Среди почвенных микроорганизмов сравнительно немного видов
и штаммов, способных метаболизировать пестициды. 2. Относитель-
ное содержание ростового субстрата, как правило, в почве невелико.
Он быстро используется микроорганизмами, конкурирующими за источ-
ники питания. Микроорганизмам-трансформаторам пестицидов доста-
ется какая-то небольшая часть его, которая не может в заметной сте-
пени генерировать процесс разрушения пестицида. 3. Микроорганизмы,
способные разлагать пестициды, могут использовать другой более при-
емлемый для них источник углерода и энергии, который не генерирует
процесс кометаболизма. В таком случае их потенциальные возможг ости
не реализуются, пестициды не разлагаются.
Данные исследований микробной деградации пестицидов в почве
не позволяют говорить о высокой эффективности кометаболизма в
природных условиях.
В случае ковалентных связей пестициды и их фрагменты ’’сшива-
ются” химическим мостиком с полимерным субстратом, в качестве
которого выступают гумусовые вещества. При этом пестициды ’’изы-
маются” из почвенного раствора, изменяются их растворимость и стаби-
льность (Bollag, Loll, 1983). Можно предположить, что поскольку свя-
106
занный таким образом пестицид нерастворим в воде, разложение его
будет происходить только при прямом контакте с микроорганизмами
за счет продуцируемых ими экзоферментов. При этом могут воз-
никнуть три ситуации. 1. Разрыв мостика, связывающего пестицид
с субстратом, освобождение и переход пестицида в раствор. В резуль-
тате его токсические свойства ’’регенерируют”. 2. Разрыв мостика и
освобождение модицифированной молекулы пестицида. Соответственно
изменяется его токсикологическая характеристика. 3. Атака микро-
организмов на основной субстрат или функциональные группы пестици-
да, в связи с чем возможно образование новых веществ, токсикологи-
ческие свойства которых трудно предугадать.
Несомненно, зти механизмы деградации и трансформации пести-
цидов отличаются от того, что происходит в чистой культуре микро-
организмов на искусственных питательных средах.
Эффект ’’молекулярного просеивания” имеет значение для отно-
сительно высокомолекулярных соединений, плохорастворимых в воде,
инертных в химическом отношении. ’’Зажатые” между мицеллами гу-
матов, они практически не вступают в контакт с микроорганизмами
и ферментами и консервируются в почве. Освобождение их из этого
’’плена” может произойти в результате деградации гуматов или в случае
структурных изменений полимера, например в процессах заморажи-
вания — оттаивания, пересыхания — увлажнения. Это в какой-то степени
объясняет случаи неожиданного появления пестицидов и ’’ретоксика-
ций” почвы, которые время от времени описываются в литературе.
Химическое взаимодействие характерно для реактивных ксено-
биотиков и наиболее подробно изучено для таких продуктов деграда-
ции пестицидов, как производные фенола и ароматические амины (см.
обзор: Bollag, 1983). Осуществляется оно в основном за счет реакций
окислительной конденсации фенолов и анилинов, которые протекают
спонтанно или катализируются лакказой и фенолоксцдазой, проду-
цируемыми рядом микроорганизмов (Sulfita, Bollag, 1981; Bollag, 1983).
В результате образуются олигомеры различной величины и состава.
Среди продуктов конденсации хлорфенолов найдены дихлорфено-
ксибензохиноны, способные в кислой среде в результате реакции цик-
лизации переходить в диоксин (Minard, Bollag, 1981). Производные
анилина при определенном сочетании образуют азобензолы (Bartha,
1975), стабильность и опасность которых хорошо известны. Менее
знакомы свойства других олигомеров. При реакции с гуматами произ-
водные фенола и анилина могут включаться в состав гумуса. Химическое
строение, токсические свойства и пути трансформации этих веществ пока
неизвестны, поэтому следует с осторожностью, как подчеркивает Боллаг
(Bollag, Loll, 1983), относиться к токсикологической оценке их в при-
родных условиях.
107
РАЗЛОЖЕНИЕ НЕРАСТВОРИМЫХ В ВОДЕ ПЕСТИЦИДОВ
Хорошо известно, что многие пестициды обладают гидрофобными
свойствами и плохо растворимы в воде. Среди них сим-триазины, фенил-
мочевины, углеводороды, многие тиокарбаматы и фосфорорганические
соединения. Попадая в почву, они распределяются в ней дискретно
в виде отдельных частиц и микрокапель. Последние, растекаясь по
поверхности почвенных агрегатов, образуют тончайшие пленки. Этому
процессу способствует периодическое пересыхание и промораживание
почвы. В результате происходит ’’высаживание” пестицидов из почвен-
ного раствора и адгезия на поверхности структурных элементов и мине-
ралов. Возможно закрепление и стабилизация их в почве.
Прямые микроскопические исследования, результаты которых
описаны ранее, показали, что вокруг таких частиц группируется спе-
цифическая микрофлора (рис. 29). Микроорганизмы на твердой по-
верхности пестицидов находятся в активном состоянии, размножаются
и со временем покрывают ее многоклеточным слоем. Создается впе-
чатление, что они разрушают пестицид, образуя водорастворимые про-
дукты, которые диффундируют в почву и используются ими в качестве
источника питания. На стеклах обрастания остается след в виде ра°-
росшейся массы бактерий.
Рис. 29. Деструкция кристаллов атразина бактериями в почве:
1 — 3 дня; 2-1 месяц; 3,4-6 месяцев после внесения атразина в почву
108
В случае жидких нерастворимых в воде нефтепродуктов и других
углеводородов, широко используемых для борьбы с сорняками и вреди-
телями сельского хозяйства, микроорганизмы также распределяются
на границе раздела фаз органического соединения и воды, постепенно
осваивая субстрат (Звягинцев, 1973). По-видимому, поверхность этих
веществ является своеобразной экологической нишей для специфичес-
кой группы микроорганизмов, причем, как показали наши наблюдения,
характер и степень обрастания зависят от конкретных экологических
условий и прежде всего от типа почвы. Дополнительное введение орга-
нического вещества в виде крахмала усиливает степень обрастания
и деструкции углеводородов.
Возможны следующие механизмы разложения нерастворимых в
воде пестицидов.
1. Окисление и гидролиз, протекающие с участием экзоферментов.
Ввиду низкой растворимости и специфического состава пестициды
не способны индуцировать синтез ферментов. Деградация их, вероятно,
катализируется ферментами с широкой субстратной специфичностью
и идет только при наличии дополнительных индукторов и энергетичес-
кого материала.
2. Деградация под действием агрессивных продуктов жизнедеятель-
ности микроорганизмов: органических кислот, углекислого газа, амми-
ака, перекиси водорода. В присутствии фермента каталазы перекись
водорода разлагается с выделением атомарного кислорода, который
является сильным окислителем органических соединений. При выделе-
нии аммиака происходит подщелачивание среды, благоприятствующее
гидролизу (щелочному) многих соединений, в- частности фосфорор-
ганических пестицидов. Образование органических кислот и повышение
концентрации водородных ионов способствуют кислотному гидролизу
пестицидов, к которому склонны некоторые сим-триазины, фосфор-
органические соединения и ряд других веществ.
3. Разложение под действием продуцируемых микроорганизмами
растворителей (спирты, ацетон и т. д.). Локальное воздействие раство-
рителей на поверхность пестицидов способствует переходу их в раствор,
перераспределению в почве и разложению. К сильным продуцентам
растворителей относятся дрожжи, мицелиальные грибы, некоторые
аэробные и анаэробные бактерии.
Следует отметить, что, как правило, для инициирования процесса
деструкции слаборастворимых пестицидов требуется органическое
вещество, в процессе утилизации которого синтезируются соответству-
ющие ферменты, образуются агрессивные вещества и продуцируются
органические растворители. Отсюда, по-видимому, будет понятна пря-
мая связь между содержанием органического вещества в почве и ско-
ростью деградации пестицидов, которая просматривается во многих
работах.
Важно подчеркнуть, что микроорганизмы, продуцируя агрессивные
109
вещества, могут активно разлагать пестициды в отсутствие у них спе-
цифических ферментов. Раскрывается еще одна сторона механизма
микробной деградации пестицидов, которая носит случайный харак-
тер и имеет косвенное отношение к жизнедеятельности микроорганиз-
мов. Вклад этого механизма в процессы самоочищения почвы от ксе-
нобиотиков может иметь огромное значение, но в литературе он прак-
тически не обсуждался и в соответствующие прогностические модели
не закладывался (Soulas, 1982).
В связи с этим интересно обсудить некоторые факты поведения
пестицидов в почвах, удобренных минеральными удобрениями. Из-
вестно, что под влиянием минеральных азотных удобрений изменяется
скорость деградации ряда пестицидов и подвижность их по почвенному
профилю. Характер и степень этих изменений зависят от формы и дозы
удобрений.
В наших опытах восстановленные формы азотных удобрений (сер-
нокислый аммоний, нитрат аммония и мочевина) ускоряли разложе-
ние симазина, атразина, базудина (рис. 30), актеллика. Скорость де-
градации пестицидов была пропорциональна интенсивности процессов
нитрификации. Ингибитор нитрификации N-serve блокировал этот про-
цесс. Очевидно, имеется прямая связь между процессами окисления
аммонийного азота и деградацией пестицидов. Возможно, немалую
роль в ней играет подкисление почвы в процессе нитрификации за счет
накопления NOJ, NO3, SO^- и других анионов. Известно, что атразин,
базудин, актеллик и многие другие пестициды гидролизуются в кислой
среде (Мельников и др;, 1977).
Аналогичные результаты получены при совместном внесении в
почву гербицида атразина и серы. На разных этапах окисления серы
Базудин, % от контроля
Время, после обработки, сутки
Рис. 30. Влияние удобрений на ско-
рость разложения базудина в почве:
1 — контроль; 2 — сернокислый ам-
моний; 3 - мочевина; 4 - аммофос
110
(NH4)2so4
NO3 S04’
Базудин
OCjHg
+ OH-P^
pocA
Рис. 31. Схема деградации пестицидов в процессе окисления восстановленных
соединений азота и серы
происходит образование и накопление сульфоксида, сернистой и серной
кислот. Почва подкисляется, соответственно в несколько раз ускоряет-
ся разложение гербицида.
На рисунке 31 представлена схема участия восстановленных соеди-
нений азота и серы в процессе микробной деградации пестицида.
Вклад в деградацию пестицидов могут также вносить образующиеся
в процессе окисления аммония и серы азотистая и азотная кислоты,
сульфоксид, сернистая и серная кислоты, которые являются довольно
сильными окислителями.
Эти примеры достаточно хорошо иллюстрируют опосредованный
характер воздействия микроорганизмов на пестициды в почве. Причем
примечательно, что активное участие в деструкции химических веществ
принимают автотрофные аэробные бактерии, окисляющие восстанов-
ленные минеральные соединения азота и серы.
Ш
МИКРОБНАЯ ДЕГРАДАЦИЯ ПЕСТИЦИДОВ
ПРИ МНОГОКРАТНОМ ИХ ПРИМЕНЕНИИ
В практическом плане существенным является вопрос о перси-
стентности и эффективности пестицидов при многолетнем и бессменном
их применении на одних и тех же полях. В этих условиях, с одной сто-
роны, возможны опасные последствия для здоровья человека и эко-
системы, с другой — снижение эффективности пестицидов в борьбе
с вредителями, болезнями и сорной растительностью.
В серии модельных опытов было показано, что повторные обработ-
ки почвы пестицидами приводят или к ускорению их деградации, или
к последовательному и все возрастающему их накоплению, или не ока-
зывают никакого влияния на их поведение. Реализация одной из этих
возможностей зависит от химического состава препарата, стабильности
молекулы, периодичности, способа и дозы его внесения, физико-хими-
ческих свойств, температуры и влажности почвы, культуры растений.
К сожалению, многие из перечисленных факторов изучены недостаточно
и наши знания в этой области имеют фрагментарный характер.
Некоторую информацию дали результаты модельных опытов
в условиях интенсивного режима перфузионных систем с фе-
ноксиалкилкарбоновыми кислотами (Audus, 1960), 2Д-дихлор-
пропионовой кислотой (Kaufman, < 1964), хлор-ИФК (Kaufman,
Kearney, 1965) и рядом других гербицидов. Как видно из рисунка
32, повторное многократное внесение 2,4-Д полностью снимало лаг-фазу
в процессе разложения. Скорость деградации гербицида возрастала
в несколько раз. Напрашивается вывод об адаптации, отборе и форми-
ровании в перколяторах с почвой популяции микроорганизмов, разла-
гающих феноксиалкилкарбоновые кислоты.
Феноменальный случай адаптации микроорганизмов к пестицидам
был отмечен Даутоном с сотр- (Daughton, Hsieh, 1977). В его опытах
скорость разложения инсектицида паратиона в смешанной культуре
микроорганизмов достигала 8 г/л в сутки. Вместе с тем в опытах с
симазином, 2,4,5-Т, ГХЦГ формирование популяции микроорганизмов,
разлагающих пестициды, происходило медленно, иногда в течение мно-
гих месяцев. Нередко опыты заканчивались неудачей.
Из анализа литературного материала складывается впечатление,
что ускорение деградации пестицидов от повторной обработки наиболее
четко проявляется в условиях промывного режима, когда они использу-
ются микроорганизмами в качестве источника питания. Это понятно,
поскольку только в таком случае возможно формирование стабильной
ассоциации микроорганизмов, способной разрушать эти соединения.
В полевых условиях при естественной влажности почвы и дискрет-
ном характере распределения пестицидов ускорение их деградации
от повторного внесения менее выражено, и скорость процесса нараста-
112
Рис. 32. Влияние повторных обработок 2,4-Д на скорость разложения гербицида
в модельных опытах (Audus, 1960):
1, 2,3,4 - очередное внесение 2,4-Д
ет постепенно, в течение многих лет. Тем не менее проблема снижения
эффективности препаратов существует и, по-видимому, с годами будет
обостряться.
Так, американскими исследователями отмечено уменьшение
активности эптама и эрадикана в борьбе с сорняками при пов-
торных обработках почвы. Показано, что в почве, ранее обрабо-
танной этими гербицидами, существенно возрастает скорость их
микробной деградации (Obrigawith et al., 1982; Wilson et al., 1982;
Edwards, Kaufman, 1982).
Аналогичные результаты получены при повторных обработках
почвы карбофураном (Felsot et al., 1982).
После 12-летнего ежегодного внесения дифенамида скорость его
деградации возрастала в 40 раз, стерилизация почвенных образцов
у-облучением или автоклавированием полностью снимала этот эффект,
что подтверждает участие микроорганизмов в процессе разложения
пестицидов и нарастание его потенциала при повторных Обработках
(Kaufman et al., 1985).
Таким образом, в результате систематического применения ряда
пестицидов в почве формируется микрофлора, способная их разлагать.
При этом персистентность препаратов снижается, эффективность в бо-
рьбе с сорняками и вредителями сельскохозяйственных культур падает,
приходится снимать их с производства или искать пути повышения
стабильности. ИЗ
Серьезной проблемой является перекрестная адаптация микро-
организмов к структурным аналогам химических соединений. Одус
одним из первых продемонстрировал возможность ее проявления у
микроорганизмов по отношению к пестицидам (Audus, 1960). В его
опытах в почвенной колонке перколятора с культурой микроорганиз-
мов, адаптированных к 2,4-дихлорфеноксиуксусной кислоте, скорость
разложения 2-метил-4-хлорфеноксиуксусной кислоты (2М-4Х) возраста-
ла более чем в 7 раз. В аналогичных опытах микроорганизмы, адапти-
рованные к 2М-4Х, интенсивно разлагали 2,4,5-трихлорфеноксиуксус-
ную кислоту, отличающуюся высокой стабильностью в почве. Предва-
рительная инкубация почвы с 2М-4Х приводила к ускорению процес-
са деградации гербицида 2-метил-4-хлорфеноксимасляной кислоты
(2М-4ХМ).
Сходные результаты были получены Киркленд (Kirkland, Fryer,
1972) и Сюлаш с соавт. (Soulas et al., 1983). Кауфман с corp. (Kaufman,
Blake, 1973) выделил микроорганизмы, разлагающие широкий спектр
гербицидов—производных фенилмочевин, фенилкарбаматов и ацила-
нилидов. В работах Манеке отмечалась групповая адаптация микро-
организмов к фосфорорганическим соединениям (Munnecke, 1976).
В почве, обработанной эптамом, возрастала скорость разложения
тиокарбаматов бутилата и вернолата (Oligawith et al., 1983); в почве,
ранее обработанной карбофураном, существенно ускорялась деграда-
ция ряда гербицидов — производных фенилмочевины, карбаматов и аци-
ланилидов (табл. 28).
Перечисленные факты показывают, что по крайней мере фенокси-
алкилкарбоновые кислоты, производные фенилмочевины, фенилкар-
баматы, ацил анилиды, фосфорорганические соединения вызывают
адаптацию микроорганизмов к нескольким химическим соединениям
28. Разложение ’*С-пестицидов в почве, ранее обработанной
карбофураном (Kaufman et at, 1985)
Пестицид Разложение, % ОТ ИСХОДНОГО
без обработки (контроль) обработано карбофураном
Карбофуран 28,2
Линурон 15,2
Набам , 9,1
Окситихинон 6,1
Пропахлор 6,7
Пропанид 44,5
СДАЛ (N, Ы-диамил-2-
хлорацетамид) 21,9
91,2
23,0
48,5
5,1
15,2
65,3
53,3
114
гомологического ряда. Это ведет к снижению персистентности пести-
цидов в почве, обработанной ранее препаратами с аналогичной структу-
рой. Возрастающая скорость деградации снижает эффективность
химических средств в борьбе с вредителями, болезнями и сорняками
сельскохозяйственных культур. Возникает проблема обеспечения ста-
бильности препаратов. Кауфман (Kaufman et al., 1985) рассматривает
два возможных пути ее решения: а) исключение из ротации пестицидов —
структурных аналогов для устранения возможности перекрестной
япяптяпии; б) введение в препаративные формы ингибиторов фермент-
ных систем, участвующих в деградации пестицидов, что исключит фор-
мирование популяции микроорганизмов, использующих эти вещества
в качестве источника питания. Последний путь является сомнительным
и, как нам кажется, неприемлемым с экологической точки зрения.
Устраняя одни проблемы, он породит новые, связанные с двойным
загрязнением окружающей среды — основным препаратом и ингиби-
тором. Причем последний, очевидно, будет обладать достаточно высокой
стабильностью, так как должен эффективно предупреждать разложение
основного пестицида.
Однако чаще возникают проблемы иного порядка, обусловленные
высокой стабильностью пестицидов, аккумуляцией их в почве и загряз-
нением водного бассейна. По нашим данным, ежегодное четырехлетнее
применение симазина, атразина и монурона на дерново-подзолистой
почве не влияло существенно на скорость деградации гербицидов. Более
того, на третий и четвертый годы их использования возрастала фито-
токсичность нижних горизонтов, что говорит о передвижении и акку-
муляции пестицидов. Аналогичные результаты получены при девятилет-
ней обработке симазином и атразином дерново-торфянистой почвы.
Многолетнее интенсивное применение ДДТ привело к повсеместно-
му накоплению этого инсектицида в почвах. Аналогичные проблемы
связаны с применением ГХЦГ и ряда других пестицидов.
Анализ литературных данных показывает, что наиболее успешно
и относительно быстро микроорганизмы адаптируются к пестицидам
в перфузионных системах, хемостате, почвенной суспензии, на затопля-
емых почвах, а также в случаях, когда концентрация химических ве-
ществ в десятки и сотни раз превышает концентрацию их в производ-
ственных условиях.
В естественной почве при обычной концентрации пестицидов, состав-
ляющей десятые доли микрограммов на грамм, в условиях нормальной
или недостаточной влажности (40—70% от полной влагоемкости)
процесс адаптации растягивается на длительный период или отсутствует
вовсе, как это было показано на примере 2,4,5-Т, ГХЦГ и т. д. Поэтому
нередко на передний план выступают физико-химические факторы
трансформации пестицидов и роль микроорганизмов в процессе само-
очищения почвы сводится на нет.
115
В связи-с этим следует рассмотреть возможности адаптации и фор-
мирования в почве микрофлоры, разлагающей пестициды.
В основе приспособительного механизма утилизации новых необыч-
ных для микроорганизмов химических соединений лежит мутация.
Гипотеза мутационного механизма адаптации предполагает появление
в почве мутантов с этим признаком и последующее размножение их
за счет использования пестицидов в качестве источника углерода и
энергии. Высокая эффективность механизма t в природных условиях
вызывает сомнения по следующим причинам.
1. Низкая частота метаболических (биохимических) мутаций, сос-
тавляющая даже в случае природных соединений 10~7—10-11 (Шлегель,
1972).
2. Низкая концентрация пестицидов — десятые или сотые доли
микрограммов в 1 г почвы. Большинство веществ в таких концентра-
циях не способны генерировать мутационный процесс в заметных коли-
чествах, так как сильные мутагены отсеиваются в процессе скриннинга
и не используются в производстве.
3. Низкий темп размножения микроорганизмов в почве, составля-
ющий в условиях наиболее благоприятной температуры и влажности
в летний период от 2 до 10 генераций в месяц (Аристовская, 1982).
Но если даже допустить, что мутанты, хотя и с низкой частотой,
все же появляются, то надо полагать, что в ассоциации почвенных микро-
организмов они не могут успешно развиваться.
Во-первых, чрезвычайно низкое содержание пестицидов, рассеянных
в почве, практически полностью исключает селективное давление, обес-
печивающее жизнедеятельность и накопление биомассы популяции
биохимических мутантов на соответствующем уровне. Во-вторых, в
почве всегда находятся альтернативные источники питания и энергии,
для утилизации которых у микроорганизмов имеется хорошо разви-
тый ферментный аппарат, приспособленный к конкретным экологи-
ческим условиям. Содержание этих веществ в почве неизмеримо больше,
чем пестицидов. В-третьих, как уже отмечалось, естественные темпы
размножения микроорганизмов в почве чрезвычайно низкие, что также
исключает быстрое нарастание в ней биомассы мутантов. В-четвертых,
в гетерогенных условиях почвы деятельность таких мутантов будет
локализована в микрозонах и вследствие низких темпов размножения
распространение их в почвенном объеме должно происходить крайне
медленно. При отсутствии постоянного притока пестицида в достаточно
высокой концентрации признак адаптивности у мутанта будет быстро
’’элиминировать” и микроорганизмы окажутся ’’выброшенными”
из микробного ценоза. Последнее подтверждается опытом инокуляции
почвы микроорганизмами, разлагающими пестициды (Chatteijec et al.,
1982; Головлева и др., 1986). При введении в почву, содержащую 1 мг/г
2,4,5-Т, Pseudomonas cepacia АС1100 за неделю разлагалось около 95 %
116
гербицида. После этого численность бактерий резко снижалась, падала
относительная скорость процесса деградации. Следует заметить, что
такие результаты удалось получить при концентрации химиката, в
500—1000 раз превышающей ’’нормальную”. Снижение концентрации
до 50 мкг, которая была как минимум в 20—50 раз выше ’’нормы”,
приводило к элиминированию микроорганизма.
В других опытах (Kilbane et al., 1983) для поддержания высокой
скорости деградации 2,4,5-Т, начальная концентрация которого сос-
тавляла 10—20 г/кг, в почву ежедневно в течение 1J5 месяцев вносили
культуру бактерий в количестве 5 107 клеток на 1 г. Близкие по
смыслу данные получены Л. А. Головлевой в опытах с кельтаном (Го-
ловлева и др., 1986).
Известно, что деградация органических соединений, в том числе
ксенобиотиков, контролируется главным образом внехромосоМными
элементами наследственности — плазмидами. Последние способны
конъюгативно переносить эти признаки от клетки к клетке и так же
легко терять их в определенных условиях (Боронин, Скрябин, 1985),
что указывает на неустойчивость признака у микроорганизмов в приро-
де. В связи с этим оптимизм относительно возможности использования
микроорганизмов, полученных генно-инженерными методами, для
деградации пестицидов в почве является необоснованным.
Не менее сложным и также малоизученным является вопрос о
персистентности пестицидов при их совместном применении. По на-
блюдениям ряда авторов, амитрол ингибировал деградацию далапона
(Kaufman, 1966). Динитроо(>токрезол и диносеб снижали скорость
разложения гербицида 2,4-Д (Fournier, 1979; Hurll, 1979). В присут-
ствии монурона и диалата возрастала стабильность линурона в
почве (Poschenrieder, Wallnoter, 1975). Гербициды фенурон, лена-
цил, ИФК и хлор-ИФК ингибировали деструкцию проксифама
(Hamroll et al., 1973). Карбарил блокировал разложение хлор-ИФК.
Хлорфенилкарбамат повышал стабильность пропанида и подавлял
энзиматические реакции азосочетания 3,4-дихлоранилина, в результа-
те чего содержание 3,3,4,4-тетрахлоразобензола в среде снижалось в
2—240 раз (Kaufman, 1975). Фосфорорганические инсектициды паратион
и диазинон ингибировали микробиологические процессы деградации
производных фенилмочевин и фенилкарбаматов (Kaufman, Miller, 1970).
Пентахлорнитробензол подавлял разложение хлор-ИФК (Walker, 1970).
Фунгицид тирам задерживал разрушение прометрина, симазина и моно-
линурона (Wogenbreth; Wallnofer, 1977).
Эти примеры наглядно показывают, насколько важной в экологи-
ческом и хозяйственном плане является проблема совместного приме-
нения пестицидов.
Можно рассматривать две основные причины ингибирующего дей-
ствия одного из пестицидов на микробиологическое разложение другого.
117
Во-первых, биоцидное свойство компонента смеси, обычно фунгицида
или бактерицида, может препятствовать развитию микроорганизмов-
деструкторов. Во-вторых, возможно конкурентное блокирование де-
ятельности адаптивных ферментов, участвующих в деградации пести-
цидов. Известно, например, что метилфеникарбаматы, а также некото-
рые фосфорорганические соединения ингибируют эстеразы и амидазы,
катализирующие процессы трансформации фениламидов (Kaufman,
1975).
ПУТИ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ
МИКРОБИОЛОГИЧЕСКОГО ОЧИЩЕНИЯ
ПОЧВЫ ОТ ПЕСТИЦИДОВ
Химическая защита растений — один из наиболее радикальных
способов борьбы с вредителями, болезнями и сорняками. В настоящее
время ежегодный мировой объем производства пестицидов достигает
2 млн т и по прогнозам специалистов к концу текущего столетия дол-
жен увеличиться в несколько раз. Относительная величина загрязнения
окружающей среды за счет пестицидов, по расчетам Н. Н. Мельникова,
составляет около 1,7%. Эта цифра не кажется незначительной, если
учесть, что используемые вещества обладают исключительно сильным
физиологическим действием. К тому же, они рассеиваются на огром-
ных площадях и, обладая относительно высокой стабильностью, пере-
двигаются по пищевым цепям, аккумулируясь в определенных их
Звеньях до биоцидных концентраций. Поэтому вопросы регулирования
персистентности пестицидов в окружающей-среде имеют чрезвычайно
большое значение.
Поскольку пестициды используются главным образом в земле-
делии, основная масса их попадает в почву. Почва является своеоб-
разным депо и основным местом взаимодействия химических соедине-
ний с микроорганизмами. С зкотоксикологической и санитарно-гиги-
енической точек зрения важно ограничить миграцию пестицидов в дру-
гие объекты окружающей среды. Это диктует необходимость обез-
вреживания их именно в почве.
Как отмечалось выше, при трансформации пестицидов нередко
образуется широкая гамма веществ, отнюдь не безобидных для чело-
века и природы. Именно они являются основным источником загрязне-
ния окружающей среды. Поэтому задача детоксикации пестицидов
смыкается с задачей по обезвреживанию их метаболитов, что значительно
усложняет разработку и организацию природоохранных мероприятий.
Организация природоохранных мероприятий начинается с выбора
пестицида и разработку технологии его применения.
Выбор пестицида подразумевает наличие исчерпывающей информа-
ции о его метаболизме. Микроорганизмы являются наиболее эффектив-
ным инструментом для ее получения. Поэтому одна из важнейших
118
задач микробиологии заключается в изучении процессов биохимической
трансформации пестицидов до широкого внедрения их в производство.
В идеале в практике должны использоваться такие пестициды и
такая технология их применения, которые исключали бы накопление
химических соединений и миграцию их в различные объекты окружа-
ющей среды. Однако в действительности еще нередки случаи, когда
необходимо вмешательство человека в естественные процессы очищения
почвы. Оно может осуществляться несколькими путями.
1. Инокуляция почвы микроорганизмами, способными разрушать
пестициды. В условиях лабораторных и вегетационных опытов была
доказана возможность ускорения деградации пестицидов за счет ино-
куляции микробов-трансформаторов.
Эффективность этого приема иллюстрируют данные таблицы 29.
В цитируемых работах эффективная нагрузка микроба-инокулянта
составляла 107—109 клеток на 1 г почвы, или 0,2-20 т на 1 га. Концен-
трации пестицидов превышали производственные на 2-5 порядков.
При уменьшении их до ’’нормального” уровня снижался титр бактерий-
трансформаторов и прекращалась деградация пестицида. Нагрузка
инокулянта ниже 10s клеток на 1 г почвы была практически неэффек-
тивной.
29. Разложение пестицидов в почвах,
инокулированных микроорганизмами-трансформаторами
Пестицид Микроорганизм Эффективность деградации, % Литературный источник
Кельтан Ps. aeruginosa BS 827 50 Головлева и др., 1980
Полихлор- Serratia marcescens 100 Скурьят и др., 1984
пинен BKM B-10D
2.4,5-Т Ps. cepacia AC 1100 99 Kilbane et al., 1983
2,4,5-Т Ps. cepacia AC 1100 81 Chatteijee et al., 1983
Таким образом, низкие концентрации пестицидов и невысокие
нагрузкй микробов-трансформаторов являются основной причиной
недостаточной эффективности этого приема.
С другой стороны, для разложения ряда пестицидов необходим
сложный градиент условий, трудновоспроизводимый в условиях почв
(Головлева и др., 1980). Учитывая экономическую сторону, следует
признать, что на современном уровне наших знаний реальным явля-
ется применение микробных препаратов для детоксикации пестицидов
на очистных сооружениях, в пунктах хранения и распределения средств
защиты растений на станциях агрохимобслуживания, а также в ава-
рийных ситуациях при высоких концентрациях пестицида, локализу-
емых на относительно небольшой площади.
На затопляемых почвах можно использовать микроорганизмы,
119
иммобилизованные на сорбентах. Эффективность такого приема под-
тверждает опыт нашей лаборатории.
С помощью Asp. niger, иммобилизованного на активированном
угле, удалось полностью очистить воду в условиях лабораторного опыта
от базудина и в 2—3 раза повысить скорость разложения инсектицида.
В этом случае достигаются две цели: быстрое удаление пестицида из
воды (или почвенного раствора) и закрепление его на сорбенте; созда-
ние достаточно высокой концентрации химиката на границе раздела твер-
дой и жидкой фаз и обеспечение контакта с большой массой микроор-
ганизмов на сорбенте.
2. Посев и культивирование на почве, загрязненной ядохимикатами,
высших растений. Растения являются важным фактором формирования
микрофлоры. Численность микроорганизмов в ризосфере значитель-
но выше, чем в окружающей почве. Представлены они главным образом
неспоровыми бактериями рода Pseudomonas, Flavobacterium, Arthro-
bacter, Agrobacterium, среди которых имеются наиболее активные де-
структоры пестицидов. В зоне корневой системы растений складыва-
ются особые условия. В частности, наблюдается постоянный приток
свежего органического вещества за счет корневых выделений, объем
которых достигает 30 и более процентов от общей продуктивности
растений. Эти выделения являются источником энергетического ма-
териала, индукторов и субстратов, необходимых для начальных этапов
трансформации пестицидов. Более того, растения сами способны ак-
кумулировать и разрушать ядохимикаты. Эффективность использова-
ния растений для детоксикации пестицидов в почве достаточно хорошо
обоснована экспериментально.
3. Внесение органических удобрений. Органические удобрения,
являясь важным источником питания и энергетического материала,
значительно обогащают почву микроорганизмами. С производственными
дозами компоста или навоза в 1 г почвы вносится от 0,1 до 1,0 млн
клеток сапрофитных бактерий. Обладая сильной сорбционной способ-
ностью, органические удобрения могут поглощать значительное коли-
чество пестицидов, снижая их токсичность и ограничивая подвижность
по почвенному профилю. При этом органические удобрения и особенно
свежие растительные остатки нередко являются и источником ростовых
субстратов и ферментов, катализирующих процессы трансформации
и детоксикации пестицидов. Применение их повышает почвенное пло-
дородие и хорошо вписывается в систему агротехнических мероприятий.
Поскольку органические удобрения вносятся под растения, то со-
четание этих двух факторов будет давать наилучший эффект в процессах
самоочищения почвы от пестицидов.
4. Внесение минеральных удобрений. Минеральные удобрения в
условиях интенсивного земледелия являются важным звеном в систе-
ме агротехнических мероприятий. Применение их совместно с пестици-
дами меняет персистентность последних, в значительной степени благо-
120
даря стимуляции жизнедеятельности почвенных микроорганизмов.
В частности, микробиологическая трансформация физиологически
кислых удобрений вызывает локальное изменение pH и окислительно-
восстановительного потенциала почвы и, как следствие, ускорение
гидролитического расщепления пестицидов. Поэтому сочетать пестици-
ды и удобрения необходимо с учетом функционирования почвенных
микроорганизмов.
5. Использование природных и неприродных химических соединений
в качестве индукторов ферментных систем, ингибиторов и ростовых
субстратов. Совместное применение или чередование этих соединений
в ряде случае позволит значительно изменить скорость самоочищения
почвы от пестицидов. Так, некоторые фосфорорганические вещества
и карбаматы ингибируют активность ациламидаз и тем самым подав-
ляют процессы детоксикации гербицидов производных фениламидов.
Отсюда следует, что при приготовлении полипрепаратов или при чередо-
вании пестицидов в системе агротехнических мероприятий необходимо
учитывать данные почвенно-микробиологических исследований.
Таким образом, у микробиологов имеются возможности управле-
ния процессами самоочищения почвы от пестицидов, которые необходи-
мо реализовать на практике.
ЛИТЕРАТУРА
Авров О. Е. Действие гербицидов на клубеньковые бактерии и образование
клубеньков у бобовых растений //Докл. ВАСХНИЛ. 1966. № 3. С. 16-19.
Аристовская Т. В. Теоретические аспекты проблемы численности,
биомассы и продуктивности почвенных микроорганизмов //Вопросы численности,
биомассы и продуктивности почвенных микроорганизмов /Под ред. Т. В. Аристов-
ской. Л.: Наука, 1982. С. 7-20.
А р н д т Г., Дрешер Р., Бем Г. Система инфралит-пермопит для ис-
пытания гербицидов и регуляторов роста растений //Механизм действия гербици-
дов и синтетических регуляторов роста растений и их судьба в биосфере. Пущино,
1975. С 193-197.
Бакаливанов Д. Почвенно-микробиологични аспекта на замъреването
с хербициди. София: Земиздат, 1982. 210 с. (бол.).
Бакаливанов Д. Количествено опредепяне на хербипида атразин через
биотестове от Aspergillus niger //Почвознание и агрохимия. 1969. Ч. 4, № 6. С. 111-
115 (бол.).
Биологические основы плодородия почвы /О. А. Берестецкий, Ю. М. Возня-
ковская, Л. М. Доросинский и др. М.: Колос, 1984. 287 с.
Борне Э., Б ё м Г. Автоматический клеточный тест как метод скриннинга
гербицидов и регуляторов роста растений//Механизм действия гербицидов и регу-
ляторов роста растений и их судьба в биосфере. Пущино, 1975. С. 202-215.
Боронин А. М., Скрябин Г. К. Генетические аспекты деградации
бактериями ксенобиотиков //Успехи микробиологии. М.: Наука, 1985. Т. 20.
С. 39-60.
Брагинский Л. П. Пестициды и жизнь водоемов. Киев: Наук, думка,
1972. 227 с.
Буткевич В. В. Стерилизация почвы. М.: Гос. изд-во с.-х. лит., 1950,
119 с.
Вернадский В. И. Биосфера. М.: Мысль, 1967. 376 с.
Виноградский С. Н. Микробиология почвы. М.: Изд-во АН СССР,
19527792 с.
Возбуцкая А. Е. Химия почвы. М.: Высш, шк, 1968.427 с.
Володарская Н. А., Баскаков Ю. А., Мельникова И. А.
и др. Гербицидные свойства А-алкилпщроксиламиновых производных сим-триа-
зина //Агрохимия. 1975. № И. С. 93-98.
Волынец А. П., Пальченко Л. А. Изменение фенольного комплекса
растений при воздействии гербицидов //Тр. X Междунар. симпоз. "Механизм дей-
ствия гербицидов и синтетических регуляторов роста растений”. Пущино, 1975.
С. 97-101.
Воронин А. Д. Основы физики почв. М.: Изд-во МГУ, 1986. 244 с.
Головлева Л. А. Метаболизм и деградации пестицидов и ксенобиотиков
//Агрохимия. 1983. № 6. С. 123-132.
Головлева Л. А. Метаболическая активность псевдомонад, дегради-
рующих ксенобиотики //Генетика и физиология микроорганизмов - перспектив-
ных объектов генной инженерии. Пущино, 1985. С. 10-24.
Головлева Л. А., Головлев Е. Л. Микробиологическая деградация
пестицидов //Успехи микробиологии. М.: Наука, 1980. № 15. С. 137-139.
Головлева Л. А., Перцова Р. Н., Травкин В. М. Условия разло-
жения ДДТ и его аналогов культурой Pseudomonas aeruginosa 640 //Изв. АН СССР.
Сер. биол. 1980. № 2. С. 243-253.
Головлева Л. А., Перцова Р. Н., Травкин В. М. Деградация
кельтана в почве штаммом Р. aeruginosa BS827, содержащим плазмиду р BS3 //Там
же. 1986. №5. С. 747-752.
122
Головлева Л. А. Роль микроорганизмов в разложении пестицидов и
практические задачи охраны окружающей среды //Бюл. ВНИИ с.-х. микробиологии.
. Л., 1979. С. 5-7.
Головлева. Л. А., Финкельштейн 3. И., Перцова Р. Н. Роль
микроорганизмов в разложении пестицидов в окружающей среде //Результаты
научных исследований в практику сельского хозяйства. М.: Наука, 1982. С. 64—73.
Горленко М. В., Лебедева Г. Ф.; Мантуровская Н. В. Произ-
водные триазина и микрофлора почвы //Агрохимия. 1969. № 8. С. 123-128.
Горленко М.В., Лебедева Г. Ф., Чернова Н. И. Воздействие сим-
триазинов на микромицеты в дерново-подзолистой почве //Микология и фитопа-
тология. 1980. Т. 14, № 4. С. 287-293.
Гришина Л. А., Моргун Л. В. Влияние пестицидов на нитрификацион-
ную способность почвы //Агрохимия. 1986. № 8. С. 130-139.
Гузев В. С., Бондаренко Н. Г., Б ы з о в Б. А. и др. Структура ини-
циированного микробного сообщества как интегрального показателя оценки
микробиологического состава почвы //Микробиология. 1980’. Т. 49, выл. 1.
С. 134-141.
Гузев В. С., Левин С. В., Звягинцев Д. Г. Реакция микробной
системы почв на градиент концентрации тяжелых металлов //Микробиология.
1985. Т. 54, вып. 3. С. 414-420.
Заварзин Г. А. К понятию микрофлоры рассеяния в круговороте угле-
рода //Журн. общ. биологии. 1970. Т. 31, № 4. С. 286-393.
Захаренко В. А. Оптимальные экономически обоснованные уровни ис-
пользования пестицидов и минеральных удобрений в земледелии //Журн. Всесо-
юз. хим. о-ва им. Д. И. Менделеева. 1984. Т. 29, № 1. С. 15—21.
Звягинцев Д Г. Почва и микроорганизмы. М.: Изд-во МГУ, 1987. 256 с.
Звягинцев Д. Г. Взаимодействие микроорганизмов с твердыми поверх-
ностями. М.: Изд-во МГУ, 1973.176 с.
Ильичев В. Д., Бочаров Б. В., Г ор л е н к о М. В. Экологические ос-
новы защиты от биоповреждений. М.: Наука, 1985. 262 с.
Карасевич Ю. Н. Основы селекции микроорганизмов, утилизирующих
синтетические органические соединения. М.: Наука, 1982.142 с.
Клинцаре А. А. Пестициды и микрофлора растений. Рига: Зинатне, 1983.
168 с.
К о в д а В. А. Биогеохимия почвенного покрова. М: Наука, 1985. 263 с.
Красильников Н. А. Антагонизм микробов и антибиотические веще-
ства. М.: Сов. наука, 1958.463 с. ,
Круглов Ю. В. Альгологический метод определения атразина в почве
//Изв. АН СССР. Сер. биол. 1970. № 1. С. 144-147.
Круглов Ю. В. Микроскопические водоросли как индикаторы на загряз-
нение почвы гербицидами //Методы изучения н практического использования
водорослей. Киров, 1972. С. 241-251.
Круглов Ю. В. Микрофлора почвы и гербициды //Агрономическая микро-
биология /О. А. Берестецкий, Ю. М. Возняковская, Л. М. Доросинский и др. Л.:
Колос, 1976, С. 204-229.
' Круглов Ю. В. Микробиологическая деградация пестицидов и охрана
природы //Охрана природы и применение химических средств в сельском и лес-
ном хозяйстве /Подред. Э. И. Слепяна. Л., 1981. С. 116-120.
Круглов Ю. В., Квятковская Л. Б. Использование микроскопи-
ческих водорослей для первичных (отборочных) испытаний вновь синтезируемых
гербицидных препаратов //Тез. докл. Всесоюз. конф. ’Тезультаты научно-иссле-
довательских работ по созданию новых пестицидов, внедрению их в производство
и применению в сельском хозяйстве”. М., 1972. С. 51.
Круглов Ю. В., Монейм А. Разложение гербицида атразина почвенны-
ми бактериями //Почвоведение. 1983. № 7. С. 112-114.
123
Круглов Ю. В., Пароменская Л. И., Багияи Л. Г. О действие
гербицидов на бобовые растения //Материалы X Между нар. симпоз. стрЛн-членов
СЭВ "Механизмы действия гербицидов и синтетических регуляторов роста расте-
ний”. Пущино, 1975. С. 41-47.
Круглов Ю. В., Пароменская Л. Н. Симбиотические взаимоотно-
шения бобовых растений с клубеньковыми бактериями при внесении пестицидов
//Докл. ВАСХНИЛ. 1972. № 11. С. 8-10.
Круглов Ю. В., Пароменская Л. Н., Чеботарь Н. И. Влияние
трефлана на симбиоз клубеньковых бактерий и растений сои //Тез. докл. XIV
Междунар. симпоз. "Механизм действия гербицидов и синтетических регуляторов
роста растений”. Уфа, 1984. С. 10-15.
Кру гл о в Ю. В., Пароменская Л. Н. Гербициды и бобово-ризоби-
альный симбиоз //Изв. АН СССР. Сер. биол. 1986. № 2. С. 238-249.
Кузнецова И. А., Круглов Ю. В., Баскаков Ю. А. Трансформа-
ция гербицида метазола чистыми культурами почвенных микроорганизмов //Ми-
кробиология. 1984. Т. 53, вып. 6. С. 1003-1006.
Л а л о в а М. Влияние арезина, прометрииа и играна на азотный обмен в рас-
тениях фасоли //Механизм действия гербицидов. София, 1975. С. 75-82.
Латыпова Р. М., Вагина Н. С. Взаимоотношения желтого кормового
люпина с клубеньковыми бактериями при химической прополке //Сб. науч. тр.
Белорус, с.-х. акад. 1973! Т. 115. С. 129-133.
Латыпова Р. М. Влияние линурона на содержание свободных амино-
кислот в растениях желтого люпина //Материалы Всесоюз. науч.-координац.
совещ. по междунар. программе "Человек и биосфера”. Пущино, 1982. С. 71-76.
Мельников Н. Н., Химия и технология пестицидов. М.: Химия, 1974.
466 с.
Мельников Н. Н., Волков А. И., Короткова О. А. Пестициды
и окружающая среда. М.: Химия, 1977. 240 с.
Меренюк Г. В. Взаимодействие химических загрязнителей окружающей
среды с почвенной микрофлорой //Изв. АН МССР. Сер. биол. и хим. наук. 1982.
№5. С. 17-30.
Меренюк Г. В., Емнова Е. Е., Карлина Н. Н., Ко др ян В. А.
О критериях классификации пестицидов по их антимикробным свойствам //Там
же. 1983. № 3. С. 45-48.
Меренюк Г. В., Тарков М. И. Действие пестицидов на микроорга-
низмы. Кишинев: Штиинца, 1972.98 с.
М и л ь т о П. И. Клубеньковые бактерии и продуктивность бобовых растений
//Наука и техника. Минск, 1982. С. 294.
Мироненко А. В., Д о м а ш В. И., Чехова А. П., Потоцкая А. А.
и др. Влияние гербицидов на обмен азотистых веществ в кормовом люпине //Мате-
риалы X Междунар. симпоз. "Механизм действия гербицидов и синтетических
регуляторов роста растений”. Пущино, 1975. С. 26-30.
Михайлова Е. И., Круглов Ю. В. Влияние некоторых пестицидов
на альгофлору почвы //Почвоведение. 1973. №-8. С. 81-85.
Мишустин Е. Н. Ассоциации почвенных микроорганизмов. М.: Наука,
1975. 108 с.
Мишустин Е. Н., Емцев В. Т. Почвенные азотфиксирующие бактерии
рода Clostridium. М.: Наука, 1974. 251 с.
Мишустин Е. Н., Шильникова В. К. Клубеньковые бактерии и
киокуляционный процесс. М.: Наука, 1973.252 с.
Муромцев Г. С., Зольникова Н. В., Боровков А. В. Использо-
вание хлореллы в качестве тест-объекта при выделении микроорганизмов, обла-
дающих фитотоксической активностью //Докл. ВАСХНИЛ. 1974. № 1. С. 2-3.
Оду м Ю. Основы экологии. М.: Мир, 1975, 740 с.
124
Панкратова Е. М. Фиксация атмосферного азота сине-зелеными водо-
рослями в природных условиях //Ботан. журн. 1973. Т. 58, № 3. С. 360-368.
Пароменская Л. Н. Влияние пестицидов на симбиотические взаимоот-
ношения Rhizobium с бобовыми растениями //Тр. ВНИИ с.-х. микробиологии.
1980. Т. 50. С. 97-111.
Пароменская Л. Н. Механизм действия S-триазинов на симбиотичес-
кую азотфиксацию //Тез. докл. XIV Междунар. симпоз. "Механизм действия гер-
бицидов и синтетических регуляторов роста растений”. Уфа, 1984. С. 40—44.
Пароменская Л. Н., Самошкин В. И., Толкачев Н. 3. Симбиоз
сои с клубеньковыми бактериями при внесении трефлана //Бюл. ВНИИ с.-х. микро-
биологии. 1976. № 32. С. 97-98.
Пароменская Л. Н., Круглов Ю. В. Методические рекомендации
по изучению токсического действия химических средств зашиты растений на эф-
фективность бобово-ризобиального симбиоза. Л., 1985. 21 с.
Петров П. Влияние на трифлуралина върху образуването на грудки
при соята, отглеждана при условията на карбонатни черноземи. //Почвознание
и агрохимия. София. 1981. Т. 16, № 3. С. 72—76 (бол.).
Поулсон Д. С. Влияние обработки биоцидами на почвенные организмы
//Почвенная микробиология. М.: Колос, 1979. С. 237—274.
Пошон Ж., де Боржак Т. Почвенная микробиология. М.: Изд-во
иностр, лит. 1960.560 с.
Разложение гербицидов/Под ред. П. Керни, Д. Кауфман. М.:Мир, 1971. 358 с.
Р и г о Ж. Леггемоглобин и его роль в эффективных клубеньках бобовых
//Физиология растений. 1983. Т. 80. С. 2; 396—403.
Рудаков В. О., Спиридонов Ю. Я. Влияние гербицидов на почвенные
грибы //Микология и фитопатология. 1979. Т. 13, № 6. С. 471—475.
Рудаков В. О., Спиридонов Ю. Я. Грибы - биологические индика-
торы гербицидов в среде //Там же. 1982. Т. 16, № 4. С. 359—360.
Рыбалкина А. В., Кононенко Е. В. Активная микрофлора почв
//Микрофлора почв Европейской части СССР. М.: Изд-во АН СССР, 1957.
С. 174 -257.
Самоладос Т. X. Гербициды в условиях Абхазии. Сухуми: Апашара,
1971.137 с.
Саноцкий И. В., Уланова И. П. Критерии вредности в гигиене и
токсикологии при оценке опасности химических соединений. М.: Медицина, 1978.
328 с.
Скрябин Г. К., Головлева Л. А. Использование микроорганизмов
в органическом синтезе. М.: Наука, 1976. 333 с.
Соколов М. С., Галиулин Р. В. Факторы биоразложения в почве ,
нелетучих пестицидов //Экологические последствия применения агрохимикатов
(пестициды). Пущино, 1982. С. 130-137.
Спиридонов Ю. Я., Спиридонова Г. С. Влияние многолетнего
применения сим-триазииов на биологическую активность почвы //Агрохимия.
1973. №3. С. 122-131.
Суровцева Э. Г., Фунтикова Н. С., Вольнова АН. Роль поч-
венных микроорганизмов в деградации производных фениламидов //Бюл. ВНИИ
с.-х. микробиологии. 1979. № 32. С. 16-19.
Унанянц Т. П. Химизация сельского хозяйства в СССР и за рубежом.
М.: Химия, 1981.192 с.
Фоикен Г., Джонсон Р. Микробиологическое окисление. М.: Мир, '
1976. 239 с.
Чеботарь Н. И. Влияние некоторых гербицидов на взаимоотношения
клубеньковых бактерий с растением сои в условиях северной зоны Молд. ССР
//Бюл. ВНИИ с.-х. микробиологии. 1978. № 2. С. 99-103.
125
Bartha R. Microbial transformations and environmental fate of some pheny-
lamide herbicides //Roczniki Gleboznawcze. 1975. V. 26. N2. P. 17—24.
Bartha R. Pesticide-humus complexes and their role in crop contamination
//Acta microbiol. Acad. Sci. hung. 1977. V. 24. Nl. P. 58-59.
Bertholet I., Clark K. W. Effect of trifluralin and metribuzine on faba
bean growth, development and symbiotic nitrogen fixation //Can. J. Plant Sci. 1985.
V. 65. P. 9-21.
Betts M. F., Morrison J. N. Fall and spring application on trifluralin and
metribuzin in fababeans (Vicia faba) //Weed Sci. 1979. V. 27. P. 691 -695.
Blanch H. W. Immobilized microbial cells //Annu.Reports on fermentation
progress. 1984. V. 7JP. 81-105.
Bollag J. M. Cross-couppling of humus constituents and xenobiotic substances.
Aquatic and terrestrial humic materials.. Michigan, 1983. P. 127—141.
Bollag J. M., Loll M. J. Incorporation of xenobiotics into soil humus //Ex-
perience. 1983. V. 39. P. 1221-1231. , ,
Bjison J., Denis F. Utilisation des bacteries pour la detection de certains
pesticides //Compt. rend. Soc. biol. 1969. V. 163. N6. P. 1426—1427.
С a 1 v e t R., Ter с e. M., A r v i e u J. C. Adsorption des pesticides par les
sols et leurs constituents. III. Caracteristiques de 1’adsorption des pesticides //Ann. agron;
1980. V. 30. N3. P. 239-257.
Carlyle R., Thorpe J. Some effects of ammonium and of 2,4-D on le-
gumes and the Rhizobium bacteria //J. Amer. Soc. Agron. 1947. V. 39. N10. P. 929-
936.
Carranza de S to rani M. M., Rosas S. B., Ghittoni N. E. Effect
of parathion on growth, polysaccharides, lipids and proteins of Rhizobium meliloti //An-
toni van Leewenhoek. 1985. V. 51. N3. P. 249-254.
Cullimore D. R. Interaction between herbicides and soil microorganisms //Res.
Revs. 1971. V. 35. P. 65-80.
Cullimore D. The enumeration of 2,4-D degraders in Saskatchewan soil //Weed
Sci. 1981. V. 29. N4. P. 440-443.
Dalton H., Stirling D. I. Cometabolism //Phil. Trans. Roy. Soc. London.
1982. B. 297. N1084. P. 481-496.
D a u g h t о n C. G., Hsieh D. P. H. Parathion utilization by bacterial symbionts
in a chemostat //Appl. and Environ. Microbiol. 1977. V. 34. N2. P. 175-184.
Domsch К. H., lagnow I., Anderson Jraute-Heidi et al. An
ecological concept for the assessment of side-effects of agrochemicals on soil microor-
ganisms //Residue Revs. 1983. V. 86. P. 65-700.
Edwards D., Kaufman D. EPTC degradation and microbial populations
in Eradicane problem and попргоЫь.л soils //Abstr. 184th Mtg. Amer. Chem. Soc.
Pestic. Chem. Div. 1982. N49.
Fletcher W. W. Effect of hormone herbicides on the growth of Rhizobium
trifolii //Nature. 1956. V. 177. P. 1244.
Fournier J. C. Enumeration of the soil microorganisms able to degrade 2,4-D
by metabolism or co-metabolism //Chemosphere. 1980. V. 9. P. 169—174.
Fryer J., Kirkland D. Field experiments to investigate long-term effects
of repeated application of MCPA, triallate, simazine and linuron: Report after
6 years //Weed Res. 1970. N10. P. 133-158.
Garg F. С., T a u г о P., Mishra M. M„ Grover R. K. Effect of fun-
gicides on growth and on DNA, RNA and protein anabolism of a Rhizomium sp. //Ann.
Microbiol. 1981. Bd. 132. N2. S. 231-239.
Golab T., Althans W., Wooten H. Degradation of trifluralin in soil//
4th Int.‘Congress of Pestic. Chem. Abstr. Volum. Zurich. 1978. P. V. 505.
Grossbard E. The effect of some herbicides on Rhizobium trifolii and its
symbiosis with Trifolium repense with special reference to the role of calcium //Roczn.
gleboznawcze. Warszawa, 1975. T. 26. Z. 2. S. 117-130.
126
Graham P. H., Ocampo G., К u i z L. D., D u g u 1 A. Survival of Rhi-
zobium phaseoh m contact with chemical seed protectants //Agron. J. 1980. V. 2. N4.
P. 625 -627.
Greaves M. P. Problems and progress in the evolution of herbicide safety to
the soil microflora //Weed Research Organization. Seventh report. 1976-1977. Yam-
ton; Oxford: Begbroke Hill, 1978. P. 95—106.
Gupta K. G., S h i г к о t С. К. Development of resistance in slow-growing
rhizobia to l-naphtyl-7V-methyl carbamate (sevin) //Plant and Soil. 1981. V. 60. N3.
P. 399-407.
Hauke-Pacewiczowa T. Influence des residus de la simazine dans le sol
sur la fixation symbiotique de 1’azote par les leguminenses //Action des pesticides et
herbicides sur la microflora et la faunule du sol: Collogue International. Gent. 1970.
V. 35. P. 497.
H a m d i V. Certain environmental factors affecting rhizobia and symbiotic
systems //Zbl. Bacteriol. 1978. Bd. 132. H. 4. S. 350-360.
Ikawa M., Meeker G., Davis R. Use of Chlorella in mycotoxin and phy-
totoxin research //J. Agr. Food Chem. 1969. V. 17. N3. P. 425-429.
Imai Y., Kuwatsuka S. Characteristics of microflora degrading the her-
bicide molinate in soil //J. Pestic. Sci. 1986. V. VII. Nl. P. 57-63.
Insecticide microbiology. Berlin: Springer. 1984. V. 15. 268 p.
Janke D., Fritsche W. Nature and significance of microbial cometabo-
lism of xenobiotics Ц J. Basic Microbiol. 1985. V. 25. N 9. P. 603—619.
Johnson L. M., Talbot H. W. Detoxification of pesticides by microbial
enzymes //Experientia. 1983. V. 39. Nil. P. 1236-1246.
Jones R., GildensG. Introduction of effective N, -fixing rhizobial strains
into the soybean plant by use of fungicide resistance //Agron. J. 1984. V. 76. N4. P. 599-
602.
Jordan D., Garcia M. Interaction between 2,4-DB and the root-nodule
bacteria of Lotus comiculatus //Plant and Soil. 1969. V. 30. N3. P. 360-372.
Juneja S., Dogra R. C. Effect of aldrin of growth and oxidative metabolism
of Rhizobia //J. Appl. Bacteriol. 1978. V. 47.N 1. P. 107-115.
Kadam S. S., Kachave K. G., C h a v a n J. K., Salukne D. K. Effect
of nitrogen, Rhizobium inoculation and simazin on yield and quality of Bengal gramm
//Plant and Soil. 1977. V. 47. Nl. P. 279-281.
Kapusta J., Ronwenhost D. Interaction of selected pesticides and Rhi-
zobium japonicum in pure culture and under field condition //Agron. J. 1973. V. 65.
Nl. P. 112-115.
Kaszubiak H. The effect of herbicides on Rhisobium //Acta microbiol. Polon.
1966.V. 15. P. 357-364.
Kaufman D. D. Microbial degradation of 2,2-dichloropropionic acid in five
soils //Can. J. Microbiol 1964. N10. P. 843-852.
Kaufman D. Microbial degradation of herbicides combination: amitrole and
dalapon //Weeds. 1966. V. 14. N2. P. 130-134.
Kaufman D. Microbial metabolites of aniline-based herbicides //Roczniki
Gleboznawcze. 1975. T. 26. Z. 2. S. 5-15.
Kaufman D., Blake J. Microbial degradation of several acetamide, acy-
lanilide, carbamate, toluidine and urea pesticides //Soil Biol, and Biochem. 1973. N5.
P. 297-308.
Kaufman D. D., Edwards D. F. Pestidde/microbe interaction effects on
persistence of pestiddes in soil // Pestic. Chem.: Hum. Welfare and Environ. Proc. 5th
Int. Congr. Kyoto, 29 Aug. - 4 Sept., 1982, Oxford. 1983. V. 5. P. 177-182.
Kaufman D. D., Kearney P. C. Microbial degradation of isopropylW-
3-chlorophenylcarbamate and 2-chloroethyl-7V-3-chlorophenycarbamate //Appl. Micro-
biol. 1985. N13. P. 443 -446.
127
Kaufman D. D., Kearney P. C. Microbial degradation of s-triazine her-
bicides //Res. Revs. 1970. V. 32. P. 235-265.
Kaufman D. D., Katan J., Edwards D. Microbial adaptation and me-
tabolism of pesticides //Agr. chemicals of the future. BARC Symposium 8.1985. P. 437-
451.
KecskesM. A servey of herbicide sensitivity and resistance of rhizobia //Symp.
Biol. Hung. Budapest, 1972. V. 11. P. 405 -415.
Khan S. U. The interaction of organic matter with pesticides//Soil organic mat-
ter. Amsterdam. 1978. P. 137-171.
Kirkland K., Fryer J. Degradation of several herbicides in soil previously
treated with MCPA //Weed Res. 1972. V. 12. P. 90-95.
Kune F., Rybarova J. Microbial decomposition of 2,4-D in the soil. Some
mechanisms of the effect of available organic substrates //Soil Biol, and Conserv. Biosphe-
re. V. I. Budapest, 1984. P. 193-199.
Mahmoud S. A. Z., Abo E1-C h a r M. R., Z a r i M. M. Interaction between
insecticides and soil. Microbiological assay of sevin and meta-iso-systox using bacteria
as test organisms //Zbl. BacterioL Parasitenk. Infektionskrankn. und Hyg. 1970. Abt.
2. Bd. 124. N7. S. 766-768.
Malik M. А. В., T e s f a i K. Compatibility of Rhizobium japonicum with
commercial pesticides in vitro //Bull. Environ. Contain, and Toxicol. 1983. V. 31. N4.
P. 432-437.
Malkomes H. P. Einfluss von Tribunil und Aresin-Kombi auf Buschbohne
und Dicke Bohne-insbesondere intra Wurzelknollchen-im Gefabversuch //Nachrichtenbl.
Dtsch. Pflanzenschutzdienst (BRD). 1979. Bd. 31. N8. S. 113—115.
Minard K. D., Lin S. I., Bollag J. M. Oligomers and quinones from 2,4-
dichlorphenol//J. Agr. and Food Chem. 1981. V. 29. P. 250-253.
Motosugi K., Soda K. Microbial degradation of synthetic organochlorine
compounds //Experientia. 1983. V. 39. Nil. P. 1214—1220.
Munnecke D. Enzymatic hydrolysis of organophosphate insecticides, a pos-
sible pesticide disposal method //Appl. Environ. MicrobioL 1976. V. 32. Nl. P. 7—13.
Obrigawith T., Wilson R., Martin A. The influence of tempe-
rature, moisture and prior EPTC application on the degradation of EPTC in soils //Weed
Sci. 1982. V. 30. P. 175-181.
Odeyemi O., Alexander M. Resistance of Rhizobium strain to phygon,
spergon and thiram //Appl. Environ. Microbiology. 1977. V. 33. N4. P. 784—790.
Odeyemi O., Alexander M. Use of fungicide-resistant rhizobia for le-
gume inoculation //Soil Biol, and Biochem. 1977. V. 9. N4. P. 247-251.
O’G a r a F., S h a n m a g a n К. P. Regulation of nitrogen fixation by Rhizo-
bia export of fixed N, as NH4 //Biochim. et biophys. acta. 1976. V. 437. N2. P. 313-
321.
P a г e e к R. P., Sidhu B. S. Uncoupling of phosphorylation in Rhizobium
spp. by 2,4-D and Taficide-80 //Ind. J. Microbiol. 1978. V. 18. N2. P. 97-100.
Pesticide Microbiology. Microbiological aspects of pesticide behavior in the en-
vironment. L.: Acad. Press. 1978. 844 p.
Peters E. J., Z b i b а В. M. Effects of herbicides on nitrogen fixation of al-
falfa and red clover //Weed Sci. 1979. V. 27. Nl. P. 18-21.
Pilley A., T c h a n G. Papier disc method for rapid bioassay of phenylurea
herbicides //Biologie du Sol. 1969. N10. P. 23-25.
Poschenrieder G., Huber S. J. Effect of 2,4-D, 2,4,5-T and their main
metabolites on the interaction of Vicia faba agglutinin with Rhizobium leguminosarum
//Pflanzenkrankheiten und Pfianzenschutz. 1983. V. 90. N3. P. 285-290.
Rennie R. S. The effect of seed-applied pesticides of growth and N2 fixation
in pea, lentil and fababean //Canad. J. Plant Set 1985. V. 65. Nl. P. 23-26.
Rennie R. S. Selection for captan tolerance in the Rhizobium phaseoli - Pha-
seolus vulgaris N,-fixing symbiosis //Canad. J. Soil Sci. 1986. V. 66. Nl. P. 143-150.
128
Ries S. R., Chmiel H., Dilley D. R., Fillher P. The increase in
nitratreductase activity and protein content of plant treated with simazin //Proc. nat.
Acad. sci. USA. 1976. V. 58. N2. P. 526.
Rigaud J., Puppo A. Effect of nitrite upon leghemoglobin and interacti-
on with nitrogen fixation //Biochim. et biophys. acta. 1977. V. 497. P. 702—706.
Roslycky E. B. Paraquat-induced changes in selected rhizobia and agrobac-
teria //Canad. J. Soil Sci. 1985. V. 65. N4. P. 667-675.
Ruiz-Sainz G. E., В e r i n g e r G. E., G u t i e r r e z-N a v a г г о A. M.
Effect of the fungicide captafol on the survival and symbiotic properties of Rhizobium
trifolii //J. Appl. Bacteriol. 1984. V. 57. N2. P. 361-364.
Salem S. H., Hamed A. S., L о h d у S a h a d A. T. Effect of some pesti-
cides on the nodulation and nitrogen fixation of infected broad bean plants with root
rot and with deseases //Acta phytopathol. Acad. Sci. Hung. 1977. V. 12. N12. P. 23 -30.
S a n d m a n n E. R. I. C., Loos M. A. Enumeration of 2,4-D degrading mic-
roorganisms in soils and crop plant rhizospheres using indicator media: hign popula-
tions associated with sugar-cane (Saccharum efficinarum) //Chemosphere. 1984. V. 13.
N9. P. 1073-1084.
Sekar T., Balasubramanian A. Influence of a carbamate pesticide
on growth respiration (14C)-carbon metabolism and symbiosis of a Rhizobium sp. //Plant
and Soil. 1979. V. 51. N3. P. 355-361.
S e n e s i N., T e s t i n i C. Physico-chemical investigations of interaction mecha-
nisms between s-triazine herbicides and soil humic acids //Geoderma. 1982. V. 28.
P. 129-146.
Senesi N., Testini C. The environmental fate of herbicides: the role of
humic substances //Environ. Biogeochemistry Ecol. Bull. 1983. V. 35. P. 477-490.
S i m о n-S ilvestre G., Fournier J. C. Effects of pesticides on the soil
microflora //Advances in Agronomy. 1979. V. 31. P. 1 —92.
Singh V. P., Singh R. B., Singh B. D. et al. Toxicity of batachlor to nitrogen-
fixing microorganisms //Beitr. Biol. Pflanz. 1978. Bd. 54. N2. S. 227-237.
Sobieszczanski J. Microorganisms as a factor changing the action of her-
bicides on plants //Roczniki Gleboznawcze. 1975. T. 26. N 2. S. 79—89.
S о u 1 a s G. Mathematical model for microbial degradation of pesticides in the
soil //Soil Biol, and Biochem. 1982. V. 14. N 2. P. 107-115.
Soulas G., Codaccioni P., Fournier J. C. Effect of cross-treatment
on the subsequent breakdown of 2,4-D, MCPA and 2,4,5-T in the soil. Behavior of the
degrading microbial populations //Chemosphere. 1983. V. 12. N7-8. P. 1101-1106.
Stovold J. E., Evans I. Fungicide seed dressings: their effects on emergence
of soybean and nodulation of pea and soybean //Austral. J. Exp. Agr. and Anim. Husban-
dry. 1980. V. 20. N105. P. 497-503.
S u d R. K., Kumar P., Gupta K. On the effects of two herbicides on
micro- and macro-symbiont //Zbl. Bacteriol. Parasitenk. Infektions krankh. und Hyg.
1973. Abt. 2. Bd. 128. N 3/4. S. 423-425.
Szende K., Tolner L. Effect of environmental pollutants (pesticides) on
symbiotic nitrogen fixation, one of the feed back mechanisms in the N2 cycle //Soil
Biol, and Conserv. Biosphere. Budapest, 1984. V. 2. P. 511 —515.
T u С. M. Effects of selected pesticides on Rhizobium meliloti, and on seed germi-
nation and Verticillium wilt pathogenes of alfalfa //Chemosphere. 1982. V. 11. N12.
P. 1195-1201.
T u С. M. Effect of some pesticides on Rhizobium japonicum and the seed ger-
mination and pathogenes of soybean //Chemosphere. 1982. N10. P. 1027-1033.
Vinticova H., S к r d 1 e t a V., S г о g e M. The sensitivity of nodule bac-
teria to several herbicides //Plant Microbes Relationships. Prague. Czechosl. Acad. Sci.
1965. P. 264-268.