Author: Исаев А.С.
Tags: лесное хозяйство лесоводство общая экология биоценология гидробиология биогеография экология лес лесная промышленность российская академия наук издательство наука
ISBN: 5-02-033044-2
Year: 2004
Рассеяные
элементы
в бореальных
лесах
НАУ1Р
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Центр по проблемам экологии и продуктивности лесов
Институт проблем промышленной экологии Севера
Кольского научного центра
Рассеянные
элементы
в бореальных
лесах
Ответственный редактор
академик А.С. Исаев
в
МОСКВА НАУКА 2004
УДК 630.1+574.4
ББК43.4
Р24
Авторы:
В.В. Никонов (введение, 3.5,4.2, 5, 6, 7.3,12), Н.В. Лукина (3.5,4.2, 5, 6,7.3),
B.C. Безель (9,10), Е.А. Вельский (9,10), А.Ю. Беспалова (7.2), А.В. Головченко (7.1),
Т.Т. Горбачева (5), Т.Г. Добровольская (7.1), В.В. Добровольский (2), Н.В. Зукерт (1),
Л.Г. Исаева (8), А.Г. Лапенис (11), И.А. Максимова (7.1), О.Е. Марфенина (7.2),
А.Н. Паникова (7.3), Д.Л. Пинский (4.1), Л.М. Полянская (7.3), Е. Стайннес (5),
А.И. Уткин (1), М.В. Фронтасьева (4.2,6), В.В. Цибульский (3.1-3.4),
И.Ю. Чернов (7.1), М.А. Яценко-Хмелевская (3.1-3.4)
Рецензенты:
доктор биологических наук Л. О. Карпачевский
доктор биологических наук Л.М. Носова
Рассеянные элементы в бореальных лесах / В.В. Никонов, Н.В. Лукина,
B.C. Безель и др.; Отв. ред. А.С. Исаев. - М.: Наука, 2004. 616 с;
ил. ISBN 5-02-033044-2
В монографии впервые сформировано представление о поведении широкого спектра элементов,
характеризующихся низкими концентрациями (0,01%) в биосфере, в бореальных лесных экосистемах.
Генерализована информация о глобальной системе массопотоков рассеянных элементов, рассмотрены их
источники и поведение в атмосфере, сток из атмосферы и взаимодействие с древесным пологом. На
основе многочисленных данных, полученных в полевых условиях и лабораторных экспериментах,
выявлены тенденции миграции и аккумуляции этих элементов в почвах, их поглощения растениями с
атмосферной (лишайники и мохообразные) и почвенной (сосудистые) стратегией питания, дереворазрушающими
грибами, микроорганизмами, мелкими млекопитающими и птицами. Обсуждается влияние воздушного
промышленного загрязнения на биохимические циклы рассеянных элементов. Рассмотрены концепции
биогеохимической селекции организмов и направленной эволюции биосферы, которые позволяют
развивать представление о коэволюции организмов и окружающей среды. Предложены подходы к оценке
миграционной способности рассеянных элементов, сформулированы принципы биогеохимического
мониторинга и коррекции биогеохимических циклов.
Для экологов, почвоведов, географов, биогеохимиков, преподавателей и аспирантов вузов.
По сети АК
ISBN 5-02-033044-2
© Российская академия наук, 2004
© Издательство "Наука"
(художественное оформление), 2004
ОТ РЕДАКТОРА
Всю свою сознательную жизнь исследуя мир северного леса, я не
перестаю удивляться и восхищаться эффективной, а зачастую изощренной
приспособленности этой уникальной экосистемы к суровым условиям
существования. Северные, или бореальные, леса - важнейший производитель
органического вещества и кислорода, стабилизатор климата, безальтернативное
условие существования российского этноса, данный нам свыше
возобновимый природный ресурс. Несмотря на наше бездарное, а порой преступное
хозяйствование, бореальный лес по-прежнему живет, защищает нас от
природных катаклизмов, щедро делится с нами своими богатствами и тайнами,
определяет наш российский менталитет, менталитет народа талантливого,
щедрого, лихого, непредсказуемого.
В течение нескольких тысяч лет бореальный лес сформировался в
гармонично и эффективно функционирующую систему, где все "части" ладно
скроены и хорошо подогнаны. Всего шесть основных лесообразующих
пород отвечают за порядок на огромном евразийском бореальном
пространстве. Для этого в различных климатических и эдафических условиях и на
разных стадиях развития (сукцессиях) они привлекают многообразие
сопутствующих древесных растений, кустарников и кустарничков, трав, мхов и
лишайников, животных и микроорганизмов. Сообщества лесных организмов
принципиально изменяют окружающую природную среду, становящуюся не
только условием, но и следствием их жизни. Они взаимосвязываются с
косным и биокосным миром густо разветвленной и переплетенной сетью
потоков вещества, энергии и информации. В этом бесконечном и неисчерпаемом
круговороте участвуют все природные химические элементы Земли. В
настоящее время мы обладаем существенной информацией о роли и участии в
биогеохимических циклах некоторых из них, тех, концентрации которых
значительны. Это прежде всего углерод - важнейший компонент
продукционного процесса растительного органического вещества, так называемые
биофилы, необходимость которых для успешности жизненных процессов
доказана - это азот, кальций, калий, фосфор и ряд других элементов.
Однако о роли и важности преобладающего числа элементов, концентрации
которых ничтожно малы (< п • 10~2%) и общая масса которых не превышает
0,1% вещества планеты, но которые присутствуют в живом веществе, мы
имеем очень скудные сведения. Между тем они играют незаменимую
биологическую роль, активно участвуя в биогеохимических циклах и вовлекаясь в
состав живого вещества. Это так называемые рассеянные элементы.
Длительное время из-за невысокой чувствительности аналитических методов и
3
отсутствия соответствующих технологий эти элементы зачастую не могли
быть обнаружены и соответствующим образом оценены.
Начиная с XX века промышленное (техногенное) воздействие на боре-
альные леса интенсивно возрастало. Оно обусловило значительные потоки
рассеянных элементов из атмосферы в лесные экосистемы и включение их
в природные биогеохимические циклы. Этот этап формирования бореаль-
ных лесов приобретает качественно иную значимость и привлекает
внимание многочисленной армии ученых разных специальностей. Однако в
подавляющем большинстве работ, посвященных проблеме вовлечения в
биогеохимические циклы многих химических элементов техногенной природы,
обычно лишь констатируются концентрации рассеянных элементов в
отдельных компонентах лесных экосистем, но не раскрывается их значение
для жизненных процессов. Отсюда формируется и устоявшееся
представление о том, что химическое загрязнение биосферы имеет мало общего с
биологией, экологией, лесоведением.
Представляемая коллективная монография, инициатором и основным
автором которой является известный ученый в области лесной экологии,
профессор Вячеслав Васильевич Никонов, - это попытка экосистемного
изучения биогеохимических циклов рассеянных элементов. Основные
положения работы базируются на важнейших методологических аспектах
экологии, игнорирование или вольная трактовка которых может привести к
разноречивым заключениям о современных тенденциях функционирования бо-
реальных лесов. В книге рассмотрен широкий круг проблем, включая
общие представления о бореальных лесах, оценку массопотоков тяжелых
металлов в биосфере, характеристику источников и поведения рассеянных
элементов в атмосфере, твердых и жидких фазах почв, оценку взаимосвязей
между концентрациями рассеянных элементов в лесных экосистемах и
особенностями функционирования растений с атмосферной и корневой
стратегией питания, почвенных микробоценозов, афиллофоровых грибов,
ответственных за разложение древесного опада, мелких млекопитающих и птиц,
анализ миграционной способности рассеянных элементов в биосфере и
коррекции их биогеохимических циклов. Отдельная глава посвящена научному
наследию выдающихся русских ученых П.А. Кропоткина, Р.В. Ризположен-
ского, В.И. Вернадского и В.А. Костицина в области биогеохимической
селекции организмов и направленной эволюции биосферы, которое, как и
популярная гипотеза Геи, позволяет развивать представление о коэволюции
организмов и окружающей среды.
В написании книги участвовал большой международный коллектив
авторов, включая известных ученых, работающих в различных областях
экологии, лесоведения, биогеохимии, почвоведения, зоологии, микробиологии
и использования новых аналитических технологий в экологии из Института
проблем промышленной экологии Севера Кольского НЦ РАН; Центра по
проблемам экологии и продуктивности лесов РАН; Института экологии
животных и растений УрО РАН; Технологического университета (Тронхейм,
Норвегия); кафедры биологии факультета почвоведения МГУ; кафедры
геологии и геохимии ландшафта Московского педагогического
государственного университета; Научно-исследовательского института охраны
атмосферного воздуха (НИИ Атмосфера, Санкт-Петербург); факультета
географии и планирования (Университет Олбани, Нью-Йорк); Института физико-
4
химических и биологических проблем почвоведения РАН; Лаборатории
нейтронной физики Объединенного института ядерных исследований
(г. Дубна Московской обл.). В основу исследований авторами положены
многочисленные оригинальные материалы полевых, стационарных и
экспериментальных исследований, проведенных на территории евразийских
лесов, что придает основательность их научным выводам и оценкам.
Поздравляя авторов с завершением этого капитального труда, выражаю
надежду, что эти материалы внесут весомый вклад в изучение
крупномасштабных процессов, происходящих в бореальных лесах Евразии, и их
воздействия на состояние биосферы в связи с возможными глобальными
изменениями.
Академик А.С. Исаев
ВВЕДЕНИЕ
Биогеохимические циклы элементов или так называемый
биогеохимический круговорот есть способ существования и основа функционирования
биосферы. В условиях ограниченных материальных ресурсов на Земле этот
глобальный процесс обеспечивает воспроизведение сложных
экологических структур, компенсируя их непрерывное разрушение и поддерживая
развитие и эволюцию живого мира. Он определяет миграции всех природных
химических элементов между биосферой и окружающей средой
(литосферой, гидросферой, атмосферой) и использование их для жизненных
процессов, поэтому все известные природные химические элементы в той или иной
степени слагают биосферу Земли. В последние десятилетия получены
многочисленные доказательства предположения В.И. Вернадского (1927, 1967)
о том, что все они обладают определенной биологической ролью.
Значительное число элементов, концентрации которых ничтожно малы
(< п • 10~2%) и общая масса которых не превышает 0,1% вещества планеты,
активно участвуют в биогеохимических циклах и вовлечены в состав
живого вещества (растений, животных, микроорганизмов, человека).
Важность изучения элементов с низкими концентрациями в биосфере
заключается в следующих положениях (Bowen, 1966; Добровольский, 1983;
Кист, 1987; Кабата-Пендиас, Пендиас, 1989 и др.):
• все химические элементы (без исключения) присутствуют в живом
веществе;
• все химические элементы (без исключения) обладают биологической
ролью;
• знания экологической роли и поведения элементов с низкими
концентрациями в биосфере недостаточно полны либо практически отсутствуют;
• деятельность человека чрезвычайно быстро и кардинально нарушила
многие природные процессы, в значительной мере изменяя сложившиеся
представления о роли тех или иных элементов в
структурно-функциональной организации биосферы.
Долгое время, главным образом из-за невысокой чувствительности
аналитических методов и отсутствия соответствующих технологий, элементы,
содержащиеся в природных средах в низких (следовых) количествах, часто
не могли быть обнаружены. Поэтому такие элементы определяли как
"редкие" и "малораспространенные". В действительности имела место не
реальная редкость встречаемости элементов, а их низкая концентрация в
природных средах.
Во второй половине XX века интерес к этим элементам значительно
вырос, представление о них постоянно дополнялось и изменялось. В России
6
широкое распространение получили классификации химических элементов,
в которых выделяются группы макро-, микро- и ультрамикроэлементов
(Виноградов, 1957). Первоначально они отражали исключительно уровень
содержания элемента, но затем акценты стали меняться. В результате эти
группы элементов стали рассматриваться отдельно, обособленно, и в
сознании многих исследователей прочно укоренилось представление о
макроэлементах как элементах, биологическая роль которых в целом известна и
понятна. Термин "микроэлементы" во многих случаях трактовался как
"жизненно необходимые элементы", а под ультрамикроэлементами стали
понимать элементы, не имеющие биологической роли, или "балластные"
(Bowen, 1966; Добровольский, 1983; Кист, 1987; Кабата-Пендиас, Пендиас,
1989, и др.).
В настоящее время термин микроэлемент не имеет строгого
определения. Этот термин, к тому же, по-разному идентифицирует элементы,
слагающие различные природные среды (литосферу, гидросферу, атмосферу и
биосферу), и потому может быть применим как к химическим элементам,
распространенность которых во всех природных средах низка (< п • 10~2%),
так и к тем, что присутствуют в очень малых количествах в одной из
природных сред или только в живом веществе.
В науках об окружающей среде принято несколько определений
понятия микроэлемент (Реймерс, 1990): 1) химический элемент, необходимый
организмам в ничтожных количествах, но определяющий успешность их
развития или безболезненное существование; 2) химический элемент,
содержащийся в растениях и животных в количествах от п • 10"2 до п • 10т6 весовых
процентов и служащий активатором биохимических процессов в организме;
3) любой элемент, находящийся в рассматриваемой среде в количествах
ниже 0,1%. В то же время по мнению А.А. Киста (1987) разграничение
элементов, близких по многим химическим свойствам и входящих в одну
периодическую систему, только по признаку концентрации искусственно. Все
элементы вовлечены в гигантский разветвленный и чрезвычайно сложный
круговорот, определяющий организацию и функционирование биосферы.
Известно, что живое вещество биосферы Земли состоит главным
образом из четырех химических элементов: С, О, Н, N. Кроме того, живые орга-
ниазмы в заметных количествах аккумулируют К, Р, Са, Mg, S, Na, CI, в
биокосных компонентах (почвах, донных отложениях и др.) концентрируются
Si, Al, Fe, Mn, некоторые другие (не более 10-15) элементы. Остальные
природные элементы содержатся в живом веществе и компонентах экосистем,
как правило, в очень незначительных концентрациях. Это позволяет
отнести их к микро- и ультрамикроэлементам (в понимании А.П. Виноградова,
1957). Такое определение, казалось бы, должно учитывать и низкие
концентрации элемента в биосфере, и его безальтернативность для нормального
функционирования любой биосферной ячейки, однако при этом не
принимается во внимание еще одно серьезное обстоятельство - особая форма
существования элемента. Большинство так называемых микро- и
ультрамикроэлементов находится в биосфере в состоянии рассеяния. Это состояние
индуцируется жизнедеятельностью организмов не только из-за низких
концентраций большинства (но не всех!) элементов в сопредельных с
биосферой средах, но и главным образом благодаря их особой роли в биосферных
процессах. Жизнедеятельность организмов является организующим нача-
7
лом биосферы. "В биосфере - подчеркивал В.И. Вернадский (1931), - жизнь
всегда исполняла одновременно разнородные функции", поэтому
применительно к биосфере правильно было бы определить такие элементы как
рассеянные.
Следовательно, рассеянные элементы - это химические элементы,
находящиеся в биосфере в особой форме - состоянии рассеяния,
отличающиеся крайне незначительными концентрациями (< п • 10"2%) и наличие
которых является необходимым условием нормального функционирования
биосферных ячеек - экосистем.
Один из парадоксов современного представления о химическом
составе биосферы заключается в том, что в подавляющем большинстве работ
обычно лишь констатируются концентрации многих рассеянных
элементов в отдельных компонентах экосистем, но не раскрывается их значение
для жизненных процессов в организмах. Отсюда и проистекает
устоявшееся представление о том, что химическое загрязнение биосферы не имеет
ничего общего с биологией и экологией. Считается, что это прикладная
проблема.
Между тем невозможно отрицать факт, что абсолютное большинство
организмов, популяций и сообществ на планете Земля подвержено разному
уровню загрязнения природного или антропогенно обусловленного
генезиса. Методологические просчеты при изучении структурно-функциональной
организации экосистем, подверженных прежде всего техногенному
воздействию, усилили негативное отношение ведущих биологов к загрязнению.
Анализ многочисленных результатов исследования лесных
биогеоценозов и их отдельных компонентов (фитоценозов, зооценозов, микробоцено-
зов, твердых и жидких фаз почв, атмосферных выпадений) в условиях
промышленного загрязнения позволил выделить важнейшие аспекты,
игнорирование или вольная трактовка которых может привести к разноречивым
заключениям о современных тенденциях функционировании этих
биосферных ячеек на значительных территориях:
• Методологические подходы, базирующиеся на аддитивной
интерпретации структурно-функциональной организации лесных биогеоценозов
(свойства отдельных компонентов биогеоценозов переносятся на всю
экологическую систему), недостаточны для оценки их состояния.
• Не учитывается пространственная и временная изменчивость свойств
лесных экосистем (стадия сукцессии, многолетние, годичные и сезонные
флуктуации, парцеллярная и внутрипарцеллярная изменчивость).
Состояние лесных биогеоценозов и их отдельных компонентов оценивают на
основе связей между процессами разной временнбй протяженности. Например,
оцениваются взаимосвязи между концентрациями отдельных элементов,
входящих в состав выбросов, в снеговом покрове одного сезона и
состоянием многолетних древесных растений (деревьев, кустарничков, мхов и
лишайников).
• Преимущественно обсуждаются материалы о поведении элементов,
входящих в состав воздушных выбросов, и зачастую не рассматриваются
таковые для типоморфных элементов (кремний, алюминий, железо),
основных элементов питания, определяющих функционирование организмов (так
называемых биофилов), углерода, не оценивается роль элементов с очень
низкими (< п • 10 -л • \0г%) концентрациями.
8
• Не принимается во внимание соотношение между вкладом внешнего (ал-
логенного) и биогеоценотического (аутогенного) факторов в
функционирование лесных экосистем. Гипертрофируется роль абиогенных факторов.
• Игнорируется роль почвы как биосферного образования и как
неотъемлемого компонента любой наземной экосистемы. Почва
преимущественно рассматривается как субстрат или геологическое образование. Зачастую
сопоставляются почвы и "почвоподобные" образования полностью
разрушенных биогеоценозов, обладающие совершенно иными строением и
свойствами, чем почвы, которые явились основой их генезиса.
• Преобладают лабораторные модельные эксперименты.
В написании книги участвовал большой коллектив авторов, включая
известных ученых в различных областях экологии, лесоведения, биогеохимии,
почвоведения, зоологии, микробиологии и использования новых
аналитических технологий в экологии.
Отдельные разделы работы (главы 1,4-6, 8,12; разделы 3.5,7.3)
выполнены при финансовой поддержке грантов РФФИ (97-04-49991, 00-04-48036,
00-04-48097, 00-04-49073, 00-04-49174, 00-04-55028, 00-05-64620, 03-04-48097,
03-04-48620, 03-04-96169-р2003север), INTAS Ref. No: 01-2213, NWO
047.014.002 и Программы фундаментальных исследований Президиума РАН
"Изменение природной среды и климата. Природные катастрофы".
Авторы считают своим долгом выразить искреннюю признательность
профессору Л.О. Карпачевскому и доктору биологических наук Л.М.
Носовой, высказавшим полезные замечания и советы при рецензировании
рукописи.
Благодарим сотрудников Института проблем промышленной экологии
Севера Кольского научного центра РАН Г.Н. Андрееву, Е.А. Белову,
Е.О. Киселеву, О.И. Денисову, СВ. Сверчкову, выполнивших большой
объем полевых, аналитических и экспериментальных исследований.
Литература
Вернадский В.И. Очерки геохимии. М.; Л., 1927. 368 с.
Вернадский В.И. Биосфера. М.: Мысль, 1967. 348 с.
Виноградов А.П. Геохимия редких и рассеянных элементов в почвах Мира. М.:
Изд-во АН СССР, 1957. 237 с.
Добровольский В.В. География микроэлементов. Глобальное рассеяние. М.:
Мысль, 1983. 272 с.
Кабата-Пендиас А., Пендиас X. Микроэлементы в почвах и растениях. М.:
Мир, 1989. 439 с.
Кист А.А. Феноменология биогеохимии и бионеорганической химии. Ташкент:
Фан, 1987.236 с.
Реймерс Н.Ф. Природопользование. М.: Мысль, 1990. 638 с.
Bowen HJM. Trace elements in biochemistry. N.Y.; London: Academic Press, 1966.
241 p.
Глава 1
БОРЕАЛЬНЫЕ ЛЕСА
1.1. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
О БОРЕАЛЬНЫХ ЛЕСАХ МИРА
Циркумполярный пояс бореальных лесов охватывает большие
территории Евразии и Северной Америки (рис. 1.1). Океанические влияния на
окраинах континентов и палеогеография отдельных регионов в пределах
пояса бореальных лесов более всего сказываются на распространении
криолитозоны ("вечной мерзлоты") и на составе основных лесообразую-
щих пород, т.е. составе лесных фитоценозов, поэтому весь пояс
бореальных лесов целесообразно разделить на шесть лесорастительных
областей. Из них пять в Евразии (см. рис. 1.1,5: 1 - Скандинавская, 2 - Европей-
ско-Уральская, 3 - Западно-Сибирская, 4 - Восточно-Сибирская, 5 -
Дальневосточная) и одна в Северной Америке (6 -
Северо-Американская). Деление бореальных лесов в пределах России на области хорошо
согласуется с лесорастительным и ботанико-географическим
районированием, которое в свою очередь сочетается со схемой лесоэкономическо-
го деления лесного фонда в справочных материалах государственного
учета лесного фонда (ГУЛФ). Для Европейско-Уральской области в
общий пакет бореальных лесов включены и леса, располагающиеся южнее
зоны типичных бореальных (таежных) лесов. На долю последних
(Лесной фонд России..., 1999) приходится лишь 16% от площади покрытых
лесом земель в лесном фонде России.
Распределение площадей и древесных запасов лесонасаждений по
областям бореальных лесов мира показано в табл. 1.11. Использованы данные
учетов ФА О (Forest resources..., 2000), методика которых объединяет
покрытые и непокрытые лесом земли, с включением в запас всех древесных
частей живых и сухостойных деревьев, кустарников, подроста и свежего вале-
жа. По последнему ГУЛФ (Лесной фонд России..., 1999) покрытая лесом
площадь лесного фонда России равна 769,78 млн га, запасы - 81,334 млрд м3.
Для Канады и США также приведены общие площади лесов и их запасы.
Таким образом, Россия и Канада являются главным лесофондодержате-
лями в зоне бореальных лесов. Отсюда и широкий интерес, проявляемый к
лесам этих стран при моделировании природных процессов в связи с
глобальными изменениями климата.
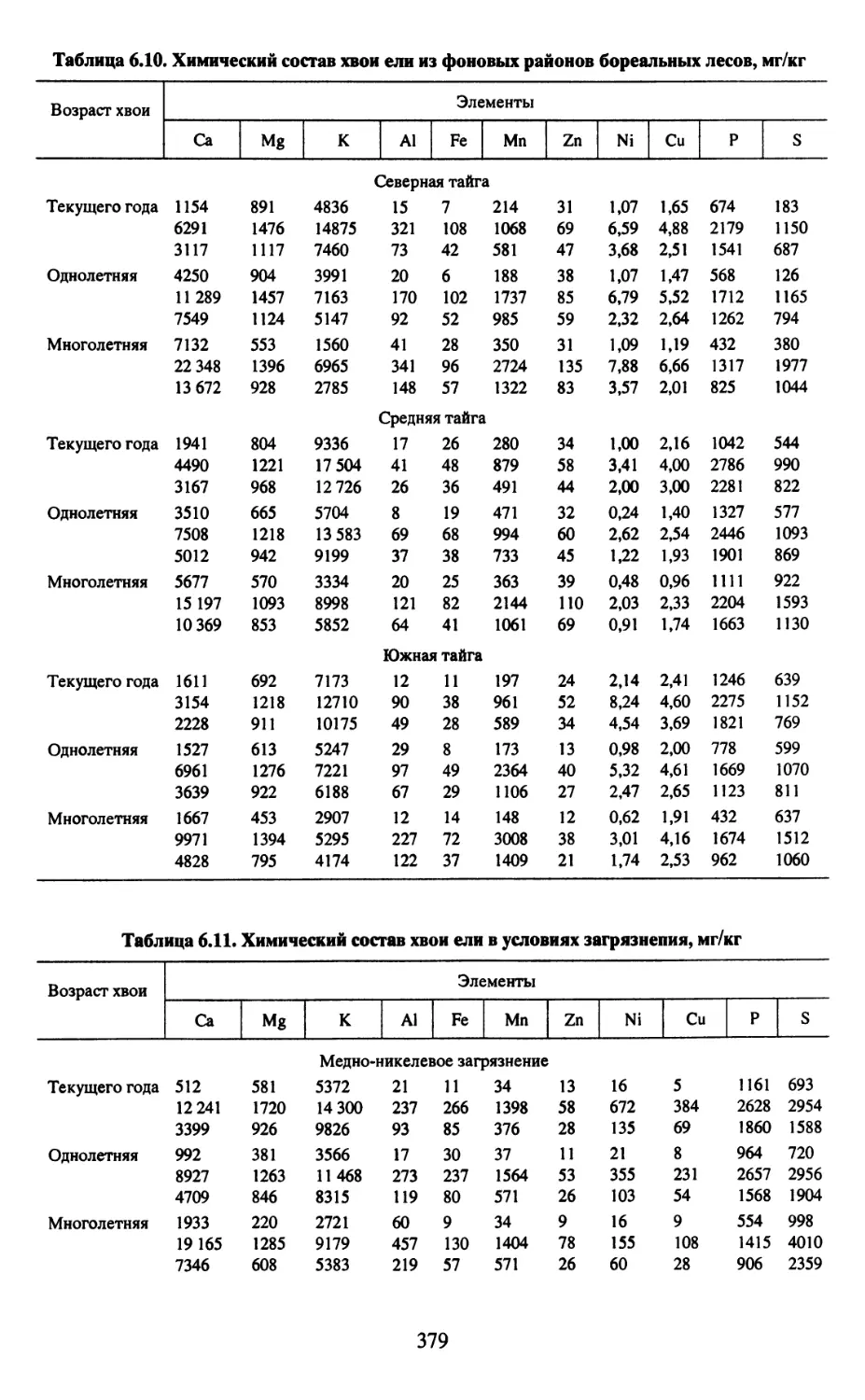
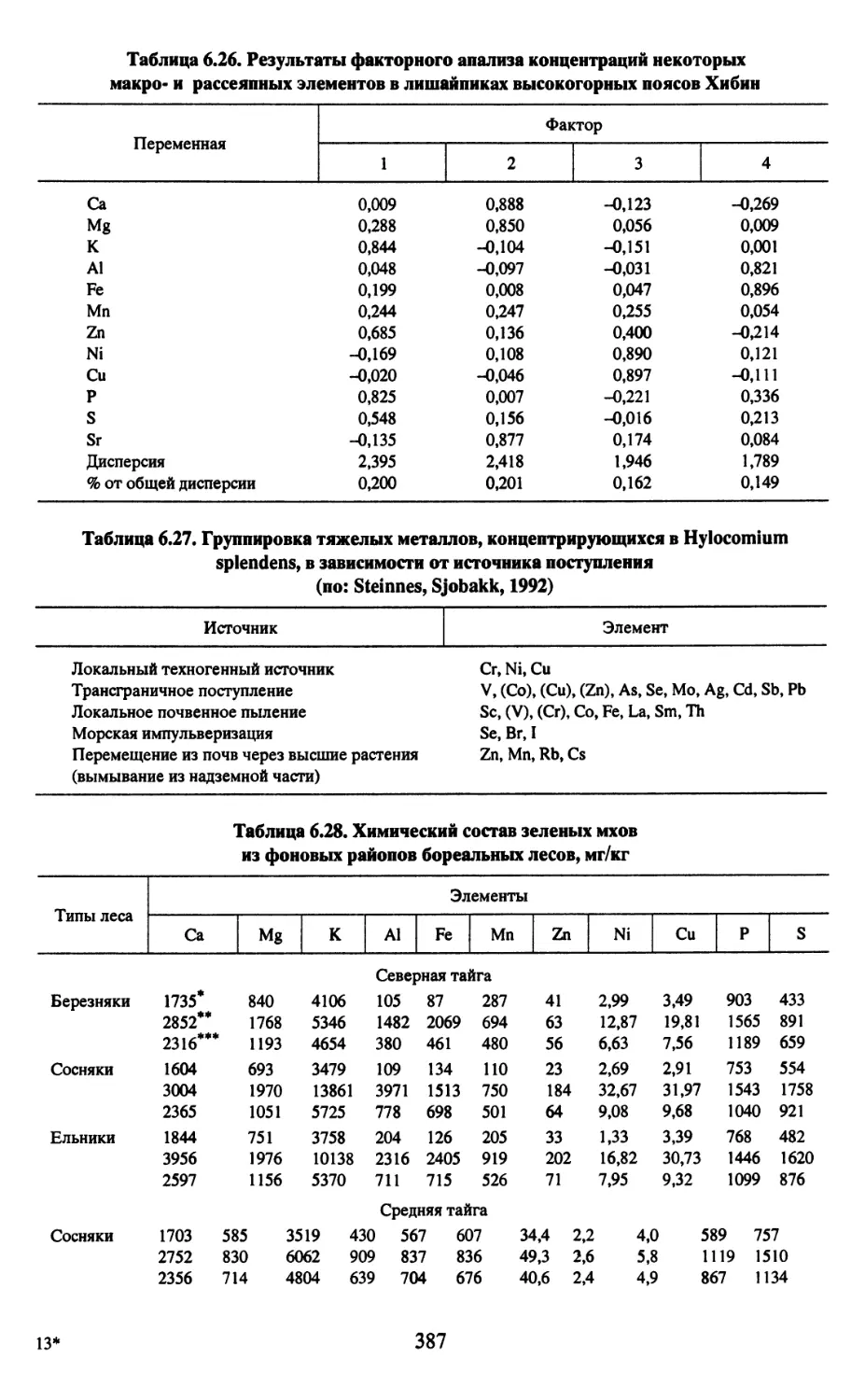
Все таблицы даны в Приложении.
10
Ш-* \ZZ-2 s-з E3-< 0-5
Рис. 1.1. Циркумполярный пояс бореальных лесов в Северной Евразии и Северной
Америке (по: Forest ecosystems..., 1986)
/ - область сплошного распространения вечной мерзлоты; 2 - область островной вечной
мерзлоты; 3 - бореальные леса; 4 - граница между бореальными лесами и тундрой; 5 -
область бореальных лесов (1-6 - см. текст)
11
1.2. РЕСУРСНО-ЭКОЛОГИЧЕСКИЙ ОЧЕРК ЛЕСОВ РОССИИ
Леса России занимают значительную часть Евроазиатского материка и
объединяют более 22% мирового запаса древесины. Они рассматриваются
как один из важнейших компонентов биосферы, оказывающих
разностороннее влияние на природную обстановку планеты. За последние два
столетия площади лесов на территории России существенно сократились,
особенно в южных и центральных районах европейской части страны в связи с
сельскохозяйственным освоением. И хотя в последние 50 лет обезлесивание
в России приостановлено, а доля покрытых лесом площадей даже
несколько увеличилась, качественная структура лесов в экологическом и ресурсном
отношении существенно ухудшилась. Лучшие сосновые, кедровые и еловые
леса, вырубленные на значительных площадях в результате интенсивной
эксплуатации, сменились лиственными насаждениями низкой
продуктивности. Огромные территории лесов, особенно в Сибири и на Дальнем Востоке,
повреждены пожарами и насекомыми. Площади погибших лесов здесь
превышают площади вырубок (Лесной фонд России..., 1999) почти в 8 раз:
24,6 млн га против 3,13 млн га. Для улучшения использования и охраны
лесов необходимы объективные оценки их ресурсной и средообразующей
роли в различных эколого-экономических регионах страны. Такие оценки
дают возможность определить объемы допустимых хозяйственных
воздействий на лесные экосистемы, исключающие их разрушение или потерю
природоохранных функций. Для решения этих задач необходима обширная,
постоянно обновляющаяся информация о лесах, на основе которой должны
вырабатываться оптимальные решения по многоцелевому использованию
лесных ресурсов: промышленных, пищевых, кормовых, лекарственных,
технических.
Лес - глобальный аккумулятор живого вещества (82% фитомассы
растительности России сосредоточено в лесах), главнейший стабилизирующий
элемент природных ландшафтов тайги и умеренной зоны. Лес выполняет
важные экологические и социальные функции. Как объект ведения лесного
хозяйства и основа государственного лесного фонда лес - важнейшее
биосферное достояние России.
Как природная экосистема лес обладает высокой морфологической и
биологической устойчивостью и одновременно непрерывно меняется в
пространстве и времени, находясь под влиянием окружающей среды,
взаимодействуя с ней и меняя ее. Лесу свойственно динамическое равновесие,
устойчивость, выработанная в результате длительного естественного отбора
и эволюции всех его компонентов, особый баланс энергии и вещества. Как
открытая экологическая система лес получает энергию извне, преобразуя
ее в запасы накопленного органического вещества. Лес оказывает
определяющее влияние на водный баланс территорий, гидрологический режим рек
и водоемов. Увеличение лесистости на 10% в равнинной части европейской
России ведет в среднем к увеличению суммы годовых осадков на 10-15 мм.
Водорегулирующая роль леса заключается в уменьшении поверхностного
стока талых и дождевых вод, перевода его в подземный и ослаблении
почвенной эрозии. Велико санитарно-гигиеническое, оздоровительное и
культурно-эстетическое значение лесов. Лес - хранитель биоразнообразия на
всех уровнях.
12
По своему значению (включая экономические, экологические и
социальные функции) леса подразделяются на три группы и на категории
защитное™ Это деление, существующее в России с 1943 г., является основой
ведения хозяйства в лесах страны. Леса I группы (23,0% лесного фонда)
выполняют защитные функции. Они разделены на 20 категорий защитности, из
которых в 13 запрещены промышленные рубки. Леса II группы (7,6%),
находящиеся преимущественно в густо населенных малолесных районах
помимо защитных функций несут и ограниченную ресурсную нагрузку. Леса
III группы, имеющие главным образом эксплуатационное назначение,
составляют 69,4%.
С географической точки зрения, в России выделяются леса бореальные
(таежные), и леса умеренной зоны, леса различных природных зон
(например, леса неморальные, леса пустынь, горные леса и т.д.); по режимам
ведения хозяйства т эксплуатационные и защитные; по степени трансформации
обычно различают девственные природные и антропогенные леса, или, при
ином подходе, коренные и производные; по составу пород - чистые и
смешанные; по жизненным формам деревьев - хвойные и лиственные (в
практике учета лесов это отражается в группах преобладающих пород -
хвойные, твердолиственные и мягколиственные); по выполняемым основным
экологическим функциям - леса водоохранные, защитные,
санитарно-гигиенические и оздоровительные и леса специального целевого назначения
(леса заповедников, национальных и природных парков и др.); по типам
возрастной структуры - одновозрастные, условно разновозрастные,
абсолютно разновозрастные и ступенчато-разновозрастные; по происхождению -
естественные и искусственные (посаженные и посеянные), семенные и
порослевые и т.д.
Одной из важнейших является классификация по преобладающим
породам (или лесным формациям) - леса сосновые, еловые, березовые и др.
Хотя на территории России произрастают около 400 видов древесно-кустарни-
ковых пород, естественно встречающихся в лесах их значительно меньше
(около 300 видов), а леса с преобладанием шести родов деревьев занимают
77,7% всех покрытых лесной растительностью земель. В том числе сосна
(Pinus sp.) занимает 16,0%, ель (Picea sp.) 10,6, лиственница (Larix sp.) 36,6,
пихта (Abies sp.) 2,0%, береза (Betula sp.) 12,9% и осина (Populus tremula) 2,8%.
Типы леса рассматриваются как естественно-исторический базис познания
леса и организации научно обоснованного хозяйства в них. Леса России
произрастают от Субарктики до пустынь юга, от западных до восточных границ
страны. Средняя лесистость России (европейско-уральской и азиатской
частей страны) равна, соответственно, 45,3, 39,1 и 47,4% (все данные здесь и
ниже даны по состоянию на 1 января 1998 г.). В то же время лесистость
Центрально-Черноземного района составляет 6,6%, Поволжского 9,1%, Северо-
Кавказского 10,7%, при минимальной норме лесистости, позволяющей
предотвращать ухудшение природных ландшафтов, порядка 15-20%.
Лесистость основных таежных районов страны повсеместно высока (например,
Иркутская область - 80,4%, Хабаровский край - 68,2%).
Распределение лесов по районам, состав произрастающих в них пород,
их продуктивность определяются зональными (температурный и влажност-
ный градиенты) и секторальными (континентальность) свойствами климата,
а также высотной поясностью в горах, причем нижний пояс в горах обычно
13
соответствует зональным лесам равнин. В зоне арктических и
субарктических пустынь лесов нет. Небольшие лесные массивы (всего 4 млн га)
проникают по долинам рек на Арктическое побережье в европейской части
России, в тундровую зону в Сибири и на Дальнем Востоке. К югу от зональной
тундры на значительных территориях (143 млн га) произрастают предтунд-
ровые леса (леса лесотундры, северотаежные редкостойные леса). В
северной части зоны, безлесные тундры чередуются с зарослями низкорослых
кустарников и редколесий и островами лесов. К югу сомкнутость и
продуктивность лесов возрастают. В европейской части России основные лесообразу-
ющие породы - сосна, ель, березы, в азиатской части - абсолютное
господство лиственницы, покрывающей здесь гигантские территории (38% от
общей покрытой лесом площади).
Основная часть лесов располагается в подзонах средней (461 млн га) и
южной (128 млн га) тайги; здесь находится 76% всех российских лесов. В
европейской части России господствуют еловые и сосновые леса, со
значительными площадями вторичных березняков и осинников. На Урале и в
Западной Сибири темнохвойная тайга образуется сибирской елью, сосной
кедровой сибирской и пихтой. К востоку широко представлены светлохвойные
сосновые леса. Светлохвойные леса из лиственницы (на юге с сосной)
абсолютно господствуют в северной и средней подзонах тайги, особенно к
востоку от Енисея.
Горные территории юга Сибири и Дальнего Востока заняты
преимущественно темнохвойными лесами: из ели сибирской, сосны кедровой
сибирской и пихты на Алтае и Саянах на западе и из ели аянской и нескольких
видов пихт на Сихотэ-Алине. В Приамурье и к югу распространена
уникальная формация кедрово-широколиственных лесов из сосны кедровой,
корейской, аянской ели, пихт и широколиственных пород. Верхние лесные пояса
гор от Забайкалья к востоку и северо-востоку часто занимают каменнобе-
резники, которые выше сменяются зарослями кедрового стланика и пред-
гольцовой травянисто-кустарниковой растительностью.
В европейской части России, Западной Сибири и Красноярском крае, к
югу от таежной зоны, находятся умеренные леса зон смешанных (хвойно-
лиственных) и лиственных лесов, переходящих в лесостепь. Площадь их
относительно невелика, порядка 3-4% лесов страны, однако здесь они
являются важными защитными элементами ландшафтов. Наконец, небольшие
территории (порядка 1-1,5% общей площади лесов) заняты лесными островами
в зонах степи, полупустынь и пустынь. Лесные участки южных зон
представлены преимущественно дубравами на западе и колочными лесами березы и
осины на востоке, а также искусственными противоэрозионными и
почвозащитными насаждениями. Среди последних, на песчаных почвах, обычно
преобладает сосна. В целом, около трех четвертей всех площадей лесов
России произрастают на длительно мерзлых территориях различного типа и
41% лесов отнесено к категории горных лесов.
Площадь лесов России составляет 774,25 млн га (45,3% площади земель
России и около 23% площади сомкнутых лесов Земли), образуя ядро
лесного фонда страны, который также включает не покрытые лесом земли
(127,8 млн га), представленные на 24% гарями и погибшими насаждениями и
на 66% - естественными рединами; около 5% составляют невозобновивши-
еся вырубки, 3% - пустыри и прогалины и 2% представлены несомкнувши-
14
мися лесными культурами (Лесной фонд России..., 1999). Покрытые и не
покрытые лесом земли образуют лесные земли (882,0 млн га), помимо
которых в лесной фонд (1178,6 млн га) включены нелесные земли (296,6 млн га),
представленные землями спецназначения (дороги, поселки лесной охраны,
луга, сенокосы, и т.д.) или неиспользуемыми непродуктивными землями
(болота, пески, крутосклоны и т.д.).
Леса России претерпели значительные изменения в последние три
столетия в связи с изменением землепользования и истощительными рубками.
В европейской части в 1700-1900 гг. леса были сведены на площади около
70 млн га, а лесистость в Центрально-Черноземной зоне уменьшилась с 19
до 10%. Первый полный учет лесов страны датирован 1961 г. За последние
40 лет площадь покрытых лесом земель в стране увеличилась на 79,9 млн га,
что объясняется высокой естественной возобновительной способностью бо-
реальных лесов, существенным снижением горимости в этот период и
значительными площадями искусственных лесов (по состоянию на 1 января
2000 г. учтено 18,3 млн га лесных культур). Вместе с тем в этот период
значительно ухудшилось качество лесов, главным образом в районах
интенсивных лесозаготовок, когда путем концентрированных рубок вырубались
наиболее продуктивные и доступные древостой ценных хвойных пород.
Лесозаготовки сопровождались большими потерями древесины, неиспользованием
древесины лиственных пород, нежелательной сменой пород (Предтундро-
вые леса, 1987; Лесопользование в Российской Федерации..., 1996).
1.3. ПРИРОДНО-СЫРЬЕВАЯ ХАРАКТЕРИСТИКА
ОТДЕЛЬНЫХ ОБЛАСТЕЙ БОРЕАЛЬНЫХ ЛЕСОВ РОССИИ
Большая протяженность пояса бореальных лесов Северной Евразии в
широтном и долготном направлениях, разнообразие орографических и ли-
тологических условий определяют большую гамму почвообразующих пород
и соответственно типов почв. Все это сказывается на дендрологическом
составе лесного покрова, хотя число наиболее распространенных лесообразо-
вателей (основных лесообразующих пород) на родовом уровне не
превышает 15, а на видовом уровне 20-24 древесные породы, причем только у части
их ареалы дифференцированы географически.
На современном состоянии лесов и истории лесообразовательных
процессов отдельных областей бореальных лесов существенно сказалось
влияние человека с его хозяйственной (а порой и бесхозной) деятельностью.
В самой общей форме смену приоритетных направлений в антропогенных
воздействиях можно свести, начиная с наиболее древних времен, к
следующей формуле: охота, сбор плодов и ягод —> укрытие от вражеских племен ->
подсечное земледелие с огневой расчисткой лесов —> заготовка древесины и
торговля лесом на внешнем и внутреннем рынках —»становление и развитие
лесной промышленности с интенсивной механизацией лесозаготовительных
процессов, вступающих в большинстве случаев в противоречие с
сохранением окружающей среды.
Различные регионы России по-разному прошли перечисленные этапы
взаимодействия своего населения (социумов) с лесом. Наиболее
крупномасштабными антропогенными воздействиями в историческое время характе-
15
ризуется Европейско-Уральская область, послужившая в России
колыбелью подсечного земледелия, металлургии на базе древесного угля,
заготовок древесины. На большей части азиатской России леса еще долго
выполняли функции охотничьих угодий, без пагубных для жизни леса последствий
со стороны местного населения. Хотя возникающие от молний лесные
пожары случались и здесь. Особняком стоят районы Центральной Якутии и
Забайкалья, где на лугах и в остепненных светлохвойных лесах издавна
практиковались весенние палы для улучшения травостоев и (в Забайкалье)
кормовой базы диких оленей и косуль.
Исторически наиболее динамичными характеризуются отношения
лесной растительности на контактах с сельскохозяйственными угодьями.
Большое число земельных переделов в России в последние 250-300 лет связано с
разными причинами. Миграция населения, гигантские планы
гидротехнического строительства, распашка целинных земель и т.д. усилили агрессивные
тенденции древесно-кустарниковой растительности в заселении
сельхозугодий, брошенных и временно оставленных без контроля человека. Крупно-
масштабность такого рода демутационных лесообразовательных процессов
свойственна последнему десятилетию, особенно в Нечерноземной зоне, где
мелкие аграрные хозяйства, включая фермерские, не вписались в реформы
рыночных отношений. Сотни тысяч гектаров сформировавшихся и
формирующихся молодняков мягколиственных пород (главным образом березы и
ольхи серой) уже в ближайшие годы могут не только привлечь к себе
внимание и стать крупномасштабной проблемой, но и требуют скорейшего
передела земель между аграрным сектором и лесным хозяйством.
Приступая к краткой комплексной характеристике отдельных областей
бореальных лесов России, укажем, что для обобщений использовали
информацию, содержащуюся во многих картографических материалах и обзорных
публикациях (Предтундровые леса, 1987; Лесопользование в Российской
Федерации..., 1996; Исаченко, Шляпников, 1989); оценки пулов органического
углерода в фитомассе и почвах лесного фонда разных областей бореальных
лесов по подзонам даны на основе авторских разработок (Уткин и др., 2001;
Честных и др., 1999).
Европейско-Уральская область
Общая площадь земель 209,30 • 106 га, общий запас древесины
818,64 • 109 мз (лесной фонд соответственно 1172,32 • 106 га и 813,34 • 109 м*).
Лесистость 45,3%, общая заболоченность 9,1%. Средний состав основных
лесов образующих пород: по площади (в %) - 33,6 - ель; 28,7 - сосна; 24,3 -
береза; 5,3 - осина; 1,3 - дуб низкоствольный; по 0,6 дуб высокоствольный и
ольха; по 0,5 - бук и кедр; 0,4 - пихта; по 0,2 - лиственница и клен; 0,1 -
ясень. По запасу древесины: 32,6 - ель, 28,4 - сосна, 22,5 - береза, 6,9 -
осина, 2,2 - липа, 1,6 - дуб низкоствольный, 1,2 - дуб высокоствольный, 1,0 -
бук, 0,9 - ольха, 0,8 - кедр, 0,7 - пихта, 0,3 - лиственница, 0,2 - клен, 0,1 -
ясень. Соотношение хвойных, твердолиственных и мягколиственных лесо-
образующих пород по площади составляет 64 : 4 : 32, по запасу 79 : 3 : 18.
Европейско-Уральская область находится в зоне атлантического
переноса влажных циклонических воздушных масс, преимущественно в подзонах
северной и средней тайги. Климат здесь мягче по сравнению с азиатской
частью страны. Амплитуда среднемесячных температур самого холодного ме-
16
сяца (января) и самого теплого месяца (июля) во всех трех подзонах
составляет 29-30°; годовая норма осадков - в пределах 620-700 мм, в
вегетационный период - 365-420 мм (табл. 1.2). Поэтому "вечная мерзлота" в лесной
зоне свойственна в большей мере лесотундре и западному макросклону
Уральского хребта. Территория неоднократно подвергалась покровным
оледенениям, два последних из них оставили после себя в средней и южной
таежных подзонах моренные плащи разного геохимического состава
(карбонатная и основная морена). Здесь в отличие от северной тайги с
маломощными покровными отложениями сформировались богатые в лесораститель-
ном отношении почвы. Основной естественный фон лесного покрова - тем-
нохвойные (еловые) леса с примесью сосны, осины, березы, отчасти
лиственницы, в восточной части с островами кедровых (с пихтой) и большей
долей лиственничных лесов.
Плотность Cphytomass покрытых лесом земель составляет в среднем для
подзон (40-60 т С • га-1, с увеличением к югу), для безлесных земель 4,5-
6,5 т С • га-1, с уменьшением к югу. Плотность Csoil для тех же категорий земель
изменяется от 148 до 93 т С • га-1 и от 6,5 до 4,5 т С • га-1 с уменьшением к югу.
Общие запасы органического углерода для территории лесного фонда
Европейско-Уральской области бореальных лесов оцениваются в пределах
145-195 т С • га-1, с лидерством среднетаежной подзоны за счет CsoiI.
На протяжении последних 150 лет леса области оставались главным
центром лесозаготовок страны. Если в дореволюционные годы
заготавливалась на экспорт выборочным способом преимущественно древесина сосны и
дуба, то с 30-х годов XX в. преимущество перешло к ели, тогда как
заготовка мягколиственной древесины во все времена оставалась ограниченной.
Поскольку область по существу находится вне зоны интенсивных
деструктивных воздействий лесных пожаров (площадь гарей в 11 раз меньше
площади вырубок), то анализ крупномасштабных изменений должен быть
ориентирован на вопросы, связанные с промышленными рубками и их
последствиями на экологический и ресурсный потенциал.
Западно-Сибирская область
Общая площадь земель 150,53 • 106 га, лесных земель 95,40 • 106 га,
общий запас древесины 10,96 • 109 м3. Лесного фонда соответственно
150,06 • 106 га, 95,06 • 106 га и 10,93 • 109 и\ Лесистость 37,3%, заболоченность
общая 17,5%. Средний для области состав древостоев (в %): по площади -
35,4 сосна, 22,2 береза, 14,8 кедр, 9,0 лиственница, 6,7 ель, 6,1 осина, 4,4
пихта; по запасу - 29,7 сосна, 21,9 береза, 21,7 кедр, 8,0 осина, 7,5 лиственница,
5,8 ель, 5,3 пихта. Соотношение площадей хвойных, твердолиственных и
мягколиственных пород равно 71:0: 29%.
В ландшафтном отношении территория представляет огромную
низменность со слабым стоком, при наличии "вечной мерзлоты" только в северной
подзоне. На юге низменность обрамлена горными поднятиями. Горы не
контактируют непосредственно с таежными лесами: между ними
располагаются зоны степи и лесостепи. Лесостепь и полоса лиственных лесов
представлена экосистемами березы; лиственница более характерна для горных
районов. Основной фон растительности - темнохвойная (елово-пихтово-кедро-
вая) тайга в комплексе с массивами болот, среди которых преобладают
верховые, часто с большой глубиной торфяной залежи.
17
Область испытывает влияние атлантических циклонов, хотя осадков
здесь выпадает несколько меньше чем в Европейско-Уральской области
(табл. 1.3). Отсутствие вечной мерзлоты на большей части территории
области, переувлажненность почвенного покрова за счет болот ослабляет кон-
тинентальность климата, которая могла бы быть возможной по
атмосферным факторам: амплитуда температур января и июля равна 37-39 °С.
Несколько худшие по сравнению с европейской Россией показатели
температуры и продолжительности теплого периода обусловливают и меньшее
поступление фотосинтетической активной радиации (ФАР) во время
интенсивного функционирования лесных экосистем. Положение равнинных лесов как
бы на своеобразной водно-болотной подушке исключает здесь и высокую
горимость. Исключение составляют сосновые и лиственные леса южной
подзоны. Доля гарей и вырубок почти одинакова. С позиций
крупномасштабных изменений приоритетным деструктивным фактором остаются
рубки леса, хотя из-за потепления зим освоение практикующихся здесь
зимних лесосек часто не реализуется. В последние 40-50 лет среди негативных
антропогенных воздействий на видное место выдвинулась разрушительная
для леса деятельность, связанная с разведкой, добычей и транспортировкой
газа и нефти (Залесов и др., 2002).
По плотности Ctotal безлесных земель Западно-Сибирской области
принадлежит первое место среди других областей бореальных лесов России, в
основном за счет CsoU (см. табл. 1.3). Но эти оценки явно занижены из-за
неполного учета запасов торфа в болотах. Плотность Cphylomass лесных
экосистем находится в общем ряду, свойственным таежным лесам - в среднем
45-50тСпН.
Европейско-Уральскую и Западно-Сибирскую области роднят два
принципиальных природных явления: отсутствие на основных лесных
территориях вечной мерзлоты и обеспеченность осадками при слабой
континентальное™ или вообще ее отсутствии в ряде районов. При разработке
стратегии хозяйственного и природоохранного управления природно-территори-
альными комплексами обе эти области должны быть отделены от двух
восточных областей, где основой лесообразовательных процессов выступают
лесные пожары.
Восточно-Сибирская область
Общая площадь земель 314,51 • 106 га, лесных земель 253,43 га, общий
запас 27,90 • 109 м3. Лесного фонда соответственно 312,30 • 106 га, 251,55 • 106 га
и 27,72 • 109 м3. Лесистость 55,5%, заболоченность общая 6,1%. Средний состав
насаждений: по площади - 41,4 лиственница, 15,7 сосна, 12,6 береза, 10,8 кедр,
4,9 ель, 3,7 пихта, 2,8 осина; по запасу - 37,1 лиственница, 21,3 сосна, 18,0 кедр,
8,6 береза, 5,6 пихта, 5,1 ель, 3,0 осина.
Соотношение площадей хвойных, твердолиственных и мягколиствен-
ных пород - 83 : 0 : 17%. Область относится к типичной для
Средне-Сибирского плоскогорья системе ландшафтов с почти повсеместным залеганием
"вечной мерзлоты", континентальным климатом (амплитуда температур
января и июля 47 °С для северной подзоны и 41 °С для двух других подзон). По
продолжительности теплых периодов, средним температурам, поступлению
ФАР и суммам осадков подзоны средней и южной тайги мало отличаются
18
друг от друга, северная подзона уступает им по тепловому режиму
(табл. 1.4).
В этих условиях лесные пожары становятся как бы природным
фактором, благоприятствуя лесообразовательным процессам лиственницы,
активно заселяющей минерализованные субстраты гарей и слабо зарастающие
травянистой растительностью вырубки. На песчаных почвах, с быстро
оттаивающей весной сезонной мерзлотой, свой очень высокий экологический
потенциал реализует сосна. Для южной подзоны более характерны темно-
хвойные (пихтово-кедровые) леса, аналогичные западно-сибирским, в
котловинах с более континентальными условиями - сосняки. Южно-таежные
ландшафты Красноярского края по многим характеристикам сходны с
прибайкальскими и забайкальскими. Комплексные исследования лесных
экосистем, выполненные Институтом леса им. В.Н. Сукачева по Енисейскому
трансекту (Лесные экосистемы Енисейского меридиана, 2002), как и работы
того же института в других районах Восточно-Сибирской области бореаль-
ных лесов, обеспечивают достаточно полно необходимой экологической,
лесоводственной и лесосырьевой информацией любые проекты и прогнозы,
связанные с динамикой природной среды и лесного фонда. Приоритетными
для анализа крупномасштабных изменений остаются лесные пожары и
промышленные заготовки леса.
Дальневосточная область
Общая площадь земель 504,21 • 106 га, лесных земель 359,46 • 106 га,
общий запас 20,90 • 109 м3; для лесного фонда соответственно 503,43 • 106 га,
358,90 • 106 га и 20,86 • 109 м3. Лесистость 45,9%, заболоченность общая 6,7%.
Средний для области состав древостоев: по площади - 59,3 лиственница,
4,7 береза, 4,6 ель, 4,2 сосна, 3,1 береза каменная, 1,2 кедр, 0,8 дуб
высокоствольный, 0,7 пихта, 0,5 осина, 0,3 дуб низкоствольный, 0,3 липа, 0,2 ольха,
0,1 ясень; по запасу- 61,1 лиственница, 10,7 ель, 5,9 сосна, 3,9 береза, 3,8
береза каменная, 3,2 кедр, 1,6 пихта, 1,2 дуб высокоствольный, по 0,6 липа и
осина, 0,3 дуб низкоствольный, 0,2 ясень, 0,1 ольха. По ландшафтно-образу-
ющей и почвозащитной роли к основным лесообразующим породам
следовало бы отнести и кедровый стланик, экосистемы которого формируют
здесь подгольцовый пояс по всем горным системам, спускаясь местами на
восточном макросклоне гор до морского берега.
По имеющимся оценкам (Уткин, Пряжников, 1999), площадь кедрового
стланика в Дальневосточной области бореальных лесов равна 33,04 • 106 га,
с запасами Ctotal (без учета гумуса в минеральных горизонтах профиля)
877,5 • 106 т С, из них 325,2 • 106 т С в пуле C^^ (Уткин и др., 2001).
Природные условия дальневосточной области очень разнообразны, ибо
территория включает в себя горное меридиальное обрамление вдоль
побережий Охотского и Японского морей, Приморье и Приамурье,
испытывающие воздействие тихоокеанских муссонов, и крайне сухую и малоснежную
территорию равнинной Якутии, изолированную горными системами от
переноса влажных воздушных масс.
Поэтому рассчитанные по подзонам средние показатели биоклимата
здесь достаточно условны и в большой мере зависят от числа метеостанций
в отдельных, контрастных по природным условиям регионах. Усредненные
19
же данные (табл. 1.5) характеризуют район как достаточно
континентальный (амплитуда температур января и июля 42-47 °С, с количеством осадков
и продолжительностью теплого периода в северной и средней подзонах на
уровне Восточно-Сибирской области. Южная подзона по гидротермическим
показателям климата имеет некоторые преимущества за счет утепляющего
влияния прогретого океана в позднелетний-раннеосенний период.
Контрастность орографии, палеогеографии и климата сочетаются с
разнообразием других природных явлений и процессов: почти сплошным
распространением вечной мерзлоты (исключение Приморье и области
Приамурья), постоянным или продолжительным сохранением снежников в горах на
северо-востоке и наледей на юге, вулканической деятельностью на
Камчатке. За счет Якутии, Магаданской области и севера Хабаровского края
господствующей древесной породой остается лиственница (Гмелина на западе
и Каяндера на востоке), свойственная северной и средней тайге, на востоке
обычно в комплексе с кедровым стлаником, а на Камчатке и с березой
каменной. В южной подзоне крупнорегиональными объединениями
выделяются ельники из ели аянской в Приамурье и Приморье, широколиственно-
кедровые и пихтовые леса в Приморье, сосняки в среднем течение Амура.
Все они требуют индивидуальных подходов при оценке возможных
крупномасштабных изменений. В лиственничных лесах, где часто случаются
пожары, нередко разрушительные, послепожарное восстановление лиственницы
в большинстве случаев происходит успешно. Темнохвойные и
широколиственно-кедровые (пихтовые) леса на вырубках и горах восстанавливаются
замедленно, нередко со сменой на мягколиственные породы, и требуют
применения активных хозяйственных мероприятий.
По плотности углерода в пулах Cphytomass и Csoil как покрытых лесом, так
и безлесных земель экосистемы Дальневосточной области бореальных
лесов незначительно отличаются от других частей азиатской России
(табл. 1.3-1.4). Более высокие величины плотности Cphytomass в южной
подзоне обязаны, скорее всего, старовозрастным кедровым лесам, с их большими
запасами древесины. То же выявляется и для южной подзоны
Восточно-Сибирской области.
Приоритетными для области стратегическими направлениями остаются
охрана от пожаров, оптимизация рубок и лесовосстановления в южной
подзоне, максимальная охрана почв от проявления мерзлотных деформаций
(термокарст и др.). Последние тесно связаны с мощностью лесной
подстилки и гумусовых горизонтов, которые при пожарах становятся
первоочередными объектами горения.
1.4. ИЗУЧЕННОСТЬ ЛЕСНОГО ФОНДА
До настоящего времени происходящие в лесах России
крупномасштабные процессы недостаточно изучены, последствия их явно
недооцениваются. Основными причинами такой недооценки являются: слабая изученность
лесов на значительной части территории лесного фонда; несовершенство
используемых методов лесоинвентаризации; отсутствие развитой системы
мониторинга протекающих в лесах крупномасштабных процессов.
Огромная площадь бореальных лесов России и вековая продолжительность
жизненного цикла деревьев обусловливают большую инерционность основных
20
характеристик лесного фонда, сложность оценки происходящих в нем
изменений за относительно короткие промежутки времени между ГУЛФ.
Материалы ГУЛФ, публикуемые с периодичностью один раз в пять лет,
являются основным и практически единственным источником
систематизированной информации о структуре и состоянии лесного фонда России и ее
крупных регионов (Лесной фонд России..., 1995, 1999). Эти учеты традиционно
ориентированы на оценку ресурсного потенциала лесов и обладают
существенными недостатками, затрудняющими сопряженный анализ динамики
структурных характеристик и экологического потенциала лесного фонда.
Данные ГУЛФ содержат неравноценную и разновременную
информацию о лесах. Она базируются на: а) надежных данных лесоустройства,
сочетающего наземные работы с дешифрированием аэрофотоснимков; б)
приближенных данных фотостатистической лесоинвентаризации, основанных
на дешифрировании космических изображений и выборочных
крупномасштабных фотопроб; в) грубых данных аэротаксации, полученных визуально
с самолета около полувека тому назад, а затем частично пройденных
фотостатистической лесоинвентаризацией. К последнему государственному
учету лесов (по состоянию на 01.01.1998) лесоустройством было охвачено
685 млн га (60,7% площади лесного фонда), фотостатистической
инвентаризацией - 335 млн га (30,9%) и аэротаксацией 91 млн га (8,4%) (Гиряев, 1999).
Почти на половине площади лесного фонда (около 500 млн га) данные
лесоинвентаризации имеют давность более 10 лет и нуждаются в существенной
корректировке. К числу недостатков государственных учетов лесов следует
отнести также отсутствие в них материалов информации о породной и
возрастной структуре лесов, не находящихся в ведении государственных
органов лесного хозяйства. Площадь этих лесов на 01.01.98. составляет 5% от
площади лесного фонда.
Регулярные наблюдения за деструктивными воздействиями на леса
природных и антропогенных факторов осуществляются, как правило, только на
активно охраняемой территории, на долю которой приходится около 75%
общей площади лесного фонда страны. Из-за отсутствия инструментальных
методов контроля площадей пожаров, очагов массового размножения
вредных насекомых и болезней леса, а также степени повреждения ими лесной
растительности, данные статистической отчетности государственной лесной
службы для отдельных районов содержат значительные случайные и
систематические ошибки. Существенные погрешности свойственны и данным
статистической отчетности о размерах и структуре лесопользования,
масштабах лесообразовательных процессов на гарях и вырубках. Все это
свидетельствует о насущной необходимости разработки новых методов
инвентаризации лесов, основанных на материалах космических съемок и на
геоинформационных технологиях.
Литература
Гиряев М.Д. Лесоустройство и лесоуправление: Проблемы и перспективы
развития лесоустройства // Тез. докл. Всерос. совещ. по лесоустройству. Новосибирск,
1999. С. 1-31.
Залесов СВ., Крижевских Н.А., Крупинин Н.Я. и др. Деградация и демутация
лесных экосистем в условиях нефтедобычи. Вып. 1. Екатеринбург: Урал. гос. лесо-
техн. ун-т, 2002. 436 с.
21
Зукерт Н.В. Возможные смещения границ растительных зон в Якутии при
изменении климата // Пробл. регион, экологии. 2000. № 4. С. 74-81.
Исаченко Л.Г., Шляпников А.А. Природа мира: Ландшафты. М.: Мысль, 1989.
504 с.
Лесной фонд России: Справочник (по учету на 01.01.1993 г.). М.: Рослесхоз:
ВНИИЦлесресурс, 1995. 280 с.
Лесной фонд России (по данным Государственного учета лесного фонда по
состоянию на 1 января 1998 г.): Справочник. М.: Федер. служба лесн. хоз-ва России:
ВНИИЦлесресурс, 1999. 650 с.
Лесные экосистемы Енисейского меридиана / Ф.И. Плешиков, Е.А. Ваганов,
Э.Ф. Ведрова и др. Новосибирск: Изд-во СО РАН, 2002. 356 с.
Лесопользование в Российской Федерации в 1946-1992 гг. // Сост.: И.В.
Колесников, В.М. Велищанский, Б.Д. Литвиненко и др. М.: Федер. служба лесн. хоз-ва
России, 1996. 313 с.
Предтундровые леса / В.Т. Черновский, П.А. Семенов, В.Ф. Цветков и др. М.:
Агропромиздат, 1987. 168 с.
Уткин А.И., Замолодчиков Д.Г., Честных О.В. и др. Леса России как
резервуар органического углерода биосферы // Лесоведение. 2001. № 5. С. 8-23.
Уткин AM., Пряжников А.А. Фитомасса и углерод экосистем кедрового
стланика России: (Географический аспект) // География и природ, ресурсы. 1999. № 1.
С. 77-84.
Уткин А.И., Пряжников А.А., Карелин Д.В. Запасы углерода и его годичные
потоки в экосистемах кедрового стланика //Лесоведение. 2001. № 4. С. 38-51.
Честных О.В., Замолодчиков Д.Г., Уткин А.И., Коровин Г.Н. Распределение
запасов органического углерода в почвах лесов России // Там же. 1999. № 2.
С. 13-21.
Forest ecosystems in the Alaskan Taiga: A synthesis of structure and function / Ed: Van
Cleve et al. N.Y.: Springer, 1986. 230 p.
Forest resources of Europe, CIS, North America, Australia, Japan and New Zealand...
UN-ECE/FAO contribution to the global forest resources assessment, 2000: Main report.
N.Y.; Geneva: United Nations, 2000. 445 p.
Глава 2
ГЛОБАЛЬНАЯ СИСТЕМА
МАССОПОТОКОВ ТЯЖЕЛЫХ МЕТАЛЛОВ
В БИОСФЕРЕ
Во второй половине XX в. остро обозначилась задача выяснения
закономерностей миграции масс тяжелых металлов в связи с их ведущей ролью в
современных технологиях и большим экологическим значением. Для
решения этой задачи представляются перспективными идеи о циклическом мас-
сообмене химических элементов как о главном факторе поддержания
стационарного состояния биосферы и ее отдельных территориальных звеньев
(Добровольский, 1991).
Процессы циклического массообмена неразрывно связаны с суммарным
геохимическим эффектом жизнедеятельности организмов; некоторые
циклы биогенны непосредственно, другие опосредованно. Характерная черта
циклов массообмена - их незамкнутость, позволяющая избыточным
мигрирующим массам выходить из миграции и аккумулироваться в каком-либо
природном компоненте или продолжить миграцию в системе другого цикла.
Незамкнутость циклов обусловливает замечательное свойство
саморегулирования природных геосистем и вместе с тем обеспечивает направленность
развития всей биосферы под влиянием неуклонно усложняющейся
деятельности живых организмов.
Имеющиеся к настоящему времени данные позволяют в основных
чертах наметить контуры циклического массообмена между фотосинтезирую-
щими органами мировой суши и педосферой, поверхностным слоем
Мирового океана и тропосферой, Мировой сушей и океаном. Структура циклов
весьма сложная; их главным структурным элементом являются
миграционные потоки масс тяжелых металлов, связывающие отдельные природные
компоненты в пространственные динамические системы разных рангов - от
элементарного ландшафта до всей биосферы в целом. Не менее сложны
механизмы, регулирующие наполняемость массопотоков и выводящие
избыточные массы металлов из миграционного потока в депонирующие среды
или препятствующие включению излишних масс в миграционный поток.
Один из наиболее мощных массопотоков тяжелых металлов в биосфере
формируется в процессе захвата металлов из педосферы приростом
растительности Мировой суши. Оценка масс металлов, вовлекаемых в этот мас-
сопоток, связана со значительными трудностями. Первую проблему
составляет определение значения средней концентрации металлов в продукции
23
всей растительности. На первый взгляд само понятие о средней
концентрации вызывает сомнение, учитывая разнообразие видов растений и
колебания концентрации металлов в почвенном покрове. Известно, что даже на
небольшой площади значения концентрации тяжелых металлов в почве столь
непостоянны, что аппроксимируются нормальным, а чаще - логонормаль-
ным гауссовским распределением. Тем не менее, положительный опыт
оперирования средними значениями содержания химических элементов в
геохимии для характеристики крупных природных объектов, как, например,
земной коры и отдельных групп горных пород, дает основание использовать
этот подход применительно к растительности суши и ее годовой продукции.
Анализ обширного массива аналитических данных показал, что
статистически значимые отклонения значений концентрации тяжелых металлов
в почве имеют место лишь на очень небольшой площади геохимических
аномалий и ореолов рассеяния рудных месторождений. Колебания
концентрации металлов в почве в той или иной мере отражаются на их
концентрации в растительности, но существенные отклонения проявляются лишь в
пределах упомянутых геохимических аномалий. Большее значение имеют
небольшие отклонения, проявляющиеся на значительной площади
геохимических провинций, но эти особенности, как правило, не выходят за границы
среднеквадратичного отклонения от кларкового значения, хотя и
отражаются на небольших изменениях модальных значений содержания металлов
в почвенном покрове разных геохимических провинций.
Еще больше факторов влияет на значение средней концентрации
металлов в годовом приросте растительности, поскольку на показатель помимо
колебаний концентрации металлов в почве влияют видовая специфика
растений и временные климатические колебания.
Результаты изучения содержания тяжелых металлов в вегетирующих
органах растений, проведенного автором в разных зональных типах
растительности, позволяют заключить, что фундаментальной особенностью
биогеохимии тяжелых металлов является близкий уровень их концентрации в
общей массе прироста при высокой вариабельности в отдельных растениях.
По-видимому, это обусловлено статистическим нивелированием
индивидуальных значений.
Следует отметить, что различие значений средней концентрации
металлов в зональных типах растительности, как правило, менее значимы, чем
отклонения, вызванные локальными эдафическими факторами, поэтому
биогеохимические аномалии, образованные в растительности на серпентинито-
вых массивах или на выходах полиместеллических руд, встречаются во всех
природных зонах от Арктики до экватора.
Изложенные обстоятельства позволяют в первом приближении
определить ориентировочную концентрацию тяжелых металлов в годовой
продукции растительности континентов (табл. 2.1).
Годовая продукция растительности Мировой суши до ее нарушения
человеком имела значение, близкое к 172 • 109 т сухого вещества (Базилевич,
1993). В результате воздействия человека природная продукция к
настоящему времени сократилась на 25-30%.
В табл. 2.2 приведены оценки масс металлов, ежегодно захватываемые
растительностью до и после воздействия человека. Эти данные
представлены в двух вариантах: в виде общепланетарных показателей и в форме услов-
24
ных модулей, т.е. масс, относимых к единице площади Мировой суши, за
исключением бесплодных пустынь и территорий, покрытых ледниками.
Разумеется, реальные условия разных природных зон вносят весьма
существенные коррективы в эти значения. В силу того, что массы металлов,
захватываемые годовым приростом, изменяются пропорционально
биопродуктивности, сложилась закономерная зональная структура
общепланетарных годовых массопотоков тяжелых металлов. Изменение мигрирующих
масс каждого металла во всем диапазоне природных зон составляет 10 п, а
для отдельных металлов достигает двух математических порядков. Так,
модуль захвата приростом растительности лиственных суббореальных лесов
составляет (в кг/км2 • год): марганца 150, а в постоянно влажных
тропических лесах - свыше 600, цинка, соответственно, 19 и 90; меди 5 и 24;
никеля 1,3 и 6,0; кобальта - 0,3 и 1,5; свинца - 0,8 и 3,7. Подчеркнем, что
изменения средней концентрации тяжелых металлов в растительности такой
закономерности не обнаружено.
Массы металлов, захватываемые в миграционный поток на суше, хотя и
зависят от их содержания в верхнем слое земной коры континентов, не
пропорциональны им. Это указывает на селективность захвата металлов
растительностью. Показателем интенсивности захвата металлов может служить
отношение концентрации металла в сумме зольных элементов,
рассчитанной как средняя статистическая для вегетирующих органов растений суши к
кларку этого металла в гранитном слое земной коры. Значение этого
показателя для большей части металлов больше единицы (см. табл. 2.2), что
также свидетельствует об избирательности их поглощения. Единственный
металл, концентрация которого в сумме зольных элементов почти в 10 раз
ниже кларкового уровня, - железо. По-видимому, это связано с высоким
содержанием этого металла в земной коре, что не способствовало выработке
механизмов его селективного поглощения растениями. Фактор обогащения
Me : Fe в годовом приросте растительности по отношению к гранитному
слою земной коры составляет для свинца 12, для кадмия 35, для меди 53 и
для цинка 85.
Другой мощный и столь же очевидный общепланетарный поток
тяжелых металлов образуется в процессе стока поверхностных вод суши в
систему Мирового океана. Вовлечение масс металлов в водную миграцию и
удаление их за пределы суши имеет очень большое экологическое значение.
Если бы указанные массы не удалялись за пределы суши, то геосистемы
материков вскоре оказались бы перегруженными металлами, что имело бы
тяжелые последствия для живых организмов, которые на протяжении
длительной эволюции адаптированы к определенным уровням концентрации
металлов.
Тяжелые металлы мигрируют в водном стоке в виде растворимых
соединений и в составе взвесей твердых почвенных частиц, при этом
подавляющая часть ежегодно выносимых масс металлов мигрирует с твердым
стоком. Доля водонерастворимых форм железа, марганца, титана,
кобальта, ванадия, хрома, мигрирующих в составе взвесей, составляет более 97%
суммарной массы каждого из выносимых металлов (табл. 2.3). Несколько
меньшую долю составляют массы цинка, меди, никеля. Только в массопо-
токе кадмия доли водорастворимых и водонерастворимых форм примерно
равны.
25
Необходимо особо отметить доминирование масс тяжелых металлов,
переносимых в составе взвесей, так как при изучении водной миграции
химических элементов до сих пор преимущественное внимание уделялось
миграции водорастворимых соединений, причем предполагалось, что водная
миграция элементов происходит в виде простых ионов. Указанное
предположение, вполне справедливое для макрокомпонентов солевого состава
природных вод и таких микрокомпонентов, как йод, бром, стронций, лишь
частично применимо к водной миграции тяжелых металлов.
Водорастворимые формы тяжелых металлов представлены
преимущественно комплексными органическими и неорганическими соединениями,
которые образуются в почве. Нами установлено, что в верхних горизонтах
почв гумидных регионов, в первую очередь подвергающихся промыванию
дождевыми и талыми водами, легкомобилизуемые формы металлов
представлены преимущественно комплексными органическими соединениями
металлов, электронейтральными или имеющими отрицательный заряд. Ка-
тионных форм значительно меньше.
Результаты гель-хроматографического анализа показали, что среди
водорастворимых комплексных соединений металлов выделяются две
фракции: фракция высокомолекулярных соединений с молекулярными массами
от 19 000 до 30 000 и фракция низкомолекулярных соединений со
значениями от 2000 до 4000. Разные металлы распределяются по этим фракциям не
однотипно: так, цинк в основном связан с фракцией низкомолекулярных
соединений, а распределение меди менее определенно, хотя с
высокомолекулярной фракцией связана большая часть этого металла.
По мере усиления аридности ландшафтов значение комплексных
органических соединений в водной миграции металлов уменьшается. В
экстрааридных регионах общая масса водорастворимых соединений тяжелых
металлов сильно (примерно в 10 раз) уменьшается и вместе с тем возрастает
относительное содержание неорганических комплексных соединений
металлов и их простых катионов.
Приведенные данные свидетельствуют, что мобилизация и миграция
масс тяжелых металлов в водорастворимом состоянии регулируется
закономерностями нахождения в растворе разнообразных комплексных
органических и неорганических соединений металлов, а не их простых катионов.
Как отмечено выше, преобладающая часть водного массопотока
металлов обеспечивается миграцией дисперсных почвенных частиц. Последние
играют роль носителей металлов и в том качестве разделяются на две
группы. Первую группу образуют частицы крупнее 2-3 мкм, состоящие из
мелких обломков породообразующих минералов, главным образом кварца.
Содержащиеся в мелкообломочных минералах металлы либо входят в их кри-
сталлохимическую структуру по законам изоморфизма, либо находятся в
неупорядоченном состоянии. Концентрация тяжелых металлов в
мелкообломочных частицах значительно ниже кларков литосферы. По этой
причине сильное увеличение содержания мелкообломочных частиц в речных
взвесях в период половодий способствует некоторому понижению
концентрации тяжелых металлов во взвесях.
Вторая группа состоит из высокодисперсных почвенных частиц
размером от 1-2 мкм и менее. Они представлены глинистыми минералами с
примесью рентгеноаморфных гидроксидов железа-Ш. Концентрация металлов
26
в этих частицах выше, чем в обломочных, благодаря их высокой
адсорбционной способности.
Перемещение масс тяжелых металлов, связанных с взвешенными
частицами, определяется не свойствами металлов, а закономерностями миграции
и свойствами взвешенных почвенных частиц. По причине того, что
концентрации тяжелых металлов в различных гранулометрических компонентах
закономерно различаются, массы металлов в водном стоке не прямо
пропорциональны массе речных взвесей, а также зависят от соотношения
гранулометрических компонентов твердого стока. Ранее отмечена пониженная
концентрация тяжелых металлов в мелкообломочной части речных взвесей
по сравнению с фракцией высокодисперсных частиц.
В то же время распределение тяжелых металлов по фракциям частиц
разных размеров не однотипно.
Металлы, образующие в почве индивидуализированные аккумуляции
(пленки, цемент, конкреции), имеют близкие значения концентрации в
общем веществе почвы и во фракции высокодисперсных частиц. Таковы
железо и марганец. Металлы, вся масса которых рассеяна в веществе почвы,
как, например, цинк и медь, имеют более высокую концентрацию в
высокодисперсной фракции.
Фракционирование высокодисперсных частиц верхних горизонтов
почвы с помощью мембранных фильтров позволило установить, что в
высокодисперсном веществе почвы преобладают частицы крупнее 0,8 мкм. В
меньшем количестве присутствуют коллоидные частицы, проходящие через
мембранный фильтр с отверстиями 0,12 мкм. Содержание фракций частиц
размером 0,80-0,30 и 0,30-0,12 мкм незначительное, обычно в сумме не
превышающее 10-15% от общей массы высокодисперсных частиц. Вместе с тем
концентрация металлов в двух последних высокодисперсных частиц
размером от 0,8 до 2-2,5 мкм. По этой причине распределение концентраций
тяжелых металлов и их масс не совпадает. Небольшая часть массы металлов
находится во фракции 0,8-2,5 мкм, хотя концентрация во фракциях 0,80-0,30
и 0,30-0,12 несколько выше.
В процессе смыва почв и миграции речных взвесей происходит
изменение соотношения фракций. В речных взвесях в период межени содержание
фракции 0,8-2,5 мкм сильно уменьшается и соответственно возрастает
содержание фракций 0,8-0,30; 0,30-0,12 и особенно фракции < 0,12 мкм.
Соответственно в этих фракциях сосредотачивается большая часть массы
переносимых металлов. Во время паводков содержание частиц размером
крупнее 0,8 мкм увеличивается, концентрация во взвесях несколько снижается,
но общая масса выносимых металлов возрастает за счет сильного
увеличения массы твердых взвесей (Добровольский, 1999).
Из приведенных данных следует, что процесс водной миграции масс
тяжелых металлов в водонерастворимой форме не менее сложен, чем
миграция водорастворимых масс. Можно предполагать, что соотношение
многообразных водорастворимых и водонерастворимых форм тяжелых металлов
служит важной частью механизма формирования водного массопотока
тяжелых металлов в биосфере как одного из звеньев системы планетарных
циклов массообмена металлов.
Если для количественной оценки массопотоков тяжелых металлов педо-
сфера-растительность суши и суша-океан имеется сравнительно много
27
фактических данных, то массопоток металлов суша-атмосфера и
океан-атмосфера-суша изучены значительно менее полно. Тем не менее, можно
утверждать, что между поверхностью суши и тропосферой происходит
активный массообмен химических элементов, в том числе тяжелых металлов.
Во второй половине XX в. энергично развернулось изучение геохимии
аэрозолей. Установлено, что ядрами аэрозолей над сушей служат
высокодисперсные частицы почв, рыхлых отложений и вулканических извержений.
Было также обнаружено, что характерной особенностью аэрозольных
частиц является их обогащение тяжелыми металлами. Коэффициент
аэрозольного обогащения (отношение средней концентрации металлов в
аэрозольных частицах к их кларкам литосферы) тяжелых металлов составляет от 10
до 10 п (Добровольский, 1980). Это обогащение происходит в результате
сорбирования пылевыми частицами металлов, которые поступают в
тропосферу в виде газообразных соединений.
Проблема источников газообразных соединений металлов, непрерывно
поступающих в атмосферу, остается открытой. Обнаружено, что тяжелые
металлы содержатся в выделяемых деревьями легколетучих соединениях
(терпенах и изопренах). Таким путем в тропосферу ежегодно поступают
сотни тонн свинца и тысячи тонн цинка (Beaufort et al., 1975). В
субэкваториальных условиях в результате микробиологических процессов метилизации
образуется значительное количество газообразных соединений металлов
типа тетраметил-свинца, метил-ртути и т.п. (Craig, 1980). Большое
количество металлов поступает в тропосферу при лесных пожарах. Значительный
вклад вносят выделения газов при вулканических извержениях.
Длительность нахождения в тропосфере пылевых частиц ("время жизни
аэрозолей") в зависимости от их размеров изменяется от нескольких часов
до 30 суток. Для преобладающих частиц, выполняющих роль носителей
тяжелых металлов, "время жизни" составляет около 7 суток. Следовательно,
циклическая обращаемость пылевых частиц в системе поверхность су-
ши-тропосфера происходит на протяжении года около 50 раз.
Обоснованная оценка масс всех тяжелых металлов, участвующих в
аэрозольной циклической миграции в настоящее время затруднительна. По
нашей ориентировочной оценке масса свинца, поступающая на поверхность
суши с атмосферными осадками и в составе сухих осаждений, составляет от
110 до 330 тыс. т • год-1, масса цинка - около 1-2 млн т • год-1.
В атмосферных осадках и сухих осаждениях в центральных частях
океанов также присутствуют металлы. Расчеты показали, в океанических
осадках имеет место обогащение тяжелыми металлами относительно железа.
Следовательно, с поверхности океана происходит селективное выделение
металлов. Изучение фракционирования химических элементов на границе
раздела океан-тропосфера весьма сложна; по этому поводу высказаны
разные предположения. Наиболее вероятным является предположение о
микробиологическом образовании летучих органических соединений металлов.
Важно иметь в виду, что воздушные массы океанического происхождения
ежегодно переносят на сушу свыше 40 • 1012 т атмосферных осадков, а
вместе с ними значительное количество морских аэрозолей; можно
предполагать, что вместе с ними переносятся десятки и сотни тысяч тонн тяжелых
металлов.
28
Литература
Базилевич Н.И. Биологическая продуктивность экосистем Северной Евразии.
М.: Недра, 1993.
Добровольский В.В. Тяжелые металлы: Загрязнение окружающей среды и
глобальная геохимия //Тяжелые металлы в окружающей среде. М.: Изд-во МГУ, 1980.
С. 3-12.
Добровольский В.В. Глобальные циклы миграции тяжелых металлов //
Развитие идей В.И. Вернадского в геологических науках. М.: Наука, 1991. С. 86-95.
Добровольский В.В. Высокодисперсные частицы почв как фактор массоперо-
носа тяжелых металлов в биосфере // Почвоведение. 1999. № 11. С. 1309-1317.
Beaufort W., BarderJ., Barringer A.R. Heavy metals release from plants into the
atmosphere // Nature. 1975. Vol. 256. P. 35-37.
Craig PJ. Metal cycle and biological methylation // The natural environment and bio-
geochemical cycles. В.: Springer, 1980. P. 169-227.
Dobrovolsky V.V. Biogeochemistry of the world's land. Boca Raton; Ann Arbor; Tokyo;
L., 1994. 362 p.
Глава 3
АТМОСФЕРНЫЕ ВЫПАДЕНИЯ
3.1. ИСТОЧНИКИ И ПОВЕДЕНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ
В АТМОСФЕРЕ
Источники выбросов тяжелых металлов в атмосферу
Поставщиками тяжелых металлов (ТМ) в атмосферу могут быть как
антропогенные, так и природные источники.
Природные источники ТМ. Основными природными источниками
выбросов ТМ в атмосферу являются (Остромогильский, Петрухин, 1984;
Расупа, 1986; Nriagu, 1989; Савенко,1991):
- ветровая эрозия почв и горных пород;
- вулканическая деятельность;
- лесные пожары;
- испарения с поверхности морей и океанов;
- биологические процессы;
- космическая пыль.
Главным природным источником эмиссии Hg в атмосферу является
дегазация почвенного и растительного покровов. Помимо Hg с поверхности
почвы и растительного полога при обычных температурах могут поступать
в атмосферу в виде паров и субмикронных частичек Se, As, Sb, Pb, Zn и
некоторые другие ТМ.
Если раньше пыль рассматривали как основной источник поступления
ТМ в воздух, то в настоящее время многие исследователи отдают
приоритет биологическим процессам (Jaworowski, 1981; Heidam, 1986; Nriagu,
1989). Полагают, что связано с деятельностью организмов от 30 до 50%
поступающих в атмосферу Cd, Си, Mn, Pb, Zn, As и Sb и свыше 50% Se и Мо
(Nriagu, 1989).
К биологическим источникам поступления ТМ в атмосферу относятся,
во-первых, процессы транспирации растений. Ежегодное поступление солей
за счет транспирационных вод составляет 1,2-1,4 тысяч тонн (Бондарев,
1983). Во-вторых, поступление ТМ в атмосферу происходит с пыльцой и
спорами растений, концентрирующих 10-80 мкг/г Ni, 10-50 мкг/г Сг,
10-40 мкг/г Со, 50-350 мкг/г Zn, 10-100 мкг/г Pb, 0,2-1,5 мкг/г Cd,
0,01-0,5 мкг/г (Бондарев, 1983). В третьих, источником поступления ТМ в
атмосферу являются процессы микробиологического метилирования,
приводящие к образованию летучих органических соединений ТМ, эммитирую-
щих из почвы и поверхности водоемов (Бондарев, 1983; Савенко, 1991; Kelly,
30
1997). В настоящее время явления метилирования установлены для Hg, As,
Sn, Pb и Se (Andweres et al., 2000).
В атмосфере количество ТМ, связанных с биологическими прцессами,
вероятно, зависит и от антропогенного загрязнения среды, поскольку чем
больше ТМ поступает в ткани растений, тем выше их концентрация в транс-
пирационных водах и других продуктах выделения. Накопление ТМ в
природных объектах за счет увеличения антропогенных нагрузок также
должно приводить к возрастающему количеству метилированных соединений
ТМ в атмосфере.
Следующим по мощности природным источником поступления ТМ в
атмосферу является вулканическая деятельность, ответственная за
природную эмиссию порядка 50% Cd, 20-40% As, Cr, Cu, Ni, Pb и As (Lambert,
1988; Nriagu, 1989). За счет земной пыли в атмосферу поступает порядка
20-30% Со, Mo, Ni, Pb, Sb и Zn и менее 10% Hg и Se. Роль лесных пожаров
и испарений с поверхности морей и океанов как природных источников
поступления ТМ в воздушную среду значительно ниже, их вклад не
превышает 10%.
Вклад ТМ природного происхождения в суммарное выпадение ТМ на
подстилающую поверхность зависит от уровня индустриального развития
региона, в котором происходит осаждение ТМ: в фоновых районах он
значительно выше, чем в промышленных регионах (табл. 3.1; Яхтин и др.,
1997). Этот вывод подтверждается результатами моделирования переноса
ТМ на большие расстояния (Ryaboshapko et al., 1999). Так, установлено, что
основной вклад в осаждение ртути и кадмия в Арктике вносят именно
природные источники.
Антропогенные источники ТМ. Основными антропогенными
источниками выбросов ТМ в атмосферу являются:
- цветная металлургия;
- первичное и вторичное производство чугуна и стали;
- химическая промышленность;
- сжигание органического топлива;
- автотранспорт;
- горнодобывающая промышленность.
Значительные количества ТМ попадают в атмосферу при производстве
стекла, цемента, хлорной щелочи, при сжигании различных отходов и т.д.
Разные ТМ имеют различные основные источники выбросов в атмосферу.
Например, основным источником Pb является автотранспорт - Pb
выбрасывается в окружающую среду при сжигании этилированного бензина (Sheets
et al., 1997). На долю этого источника приходится почти 70% от всех
антропогенных выбросов свинца в Европе (Berdowski et al., 1997). Основными
источниками Cd, As, Си и Zn является цветная металлургия; Со, Ni, V и Se -
сжигание органического топлива; Hg - цветная металлургия, сжигание
органического топлива и химическая промышленность.
Оценка годового поступления ТМ в атмосферу Европы
свидетельствует, что по абсолютным величинам преобладает Pb. Так, в 1990 г. было
выброшено 40,4 тысяч тонн свинца. За Pb следует Zn (26,1 тыс. т), Ni
(11,5 тыс. т) и Си (5,76 тыс. т) (Berdowski et al., 1997). Количество
выбрасываемых в атмосферу Европы Cd и Hg оценивается в 612 т и 463 т,
соответственно. Однако если оценивать антропогенный поток ТМ в атмосфе-
31
ру относительно запасов рассматриваемых элементов в литосфере, то
первым окажется Cd, а затем в порядке убывания Pb > As > Zn > Ni >
> Со > Se (Бурцева и др., 1986).
Для большинства ТМ антропогенный вклад превышает 60%, а для таких
ТМ, как Pb, Cd, Ni, V, As, Sb и Se, достигает 90-99% от общего количества,
поступающего в атмосферу. Глобальные выбросы ТМ из антропогенных
источников, рассчитанные для 1983 г., приведены в табл. 3.2 (Ryaboshapko,
1999).
Физико-химические свойства тяжелых металлов в атмосфере
Поведение ТМ в атмосфере зависит от физико-химического состояния
этих элементов при поступлении в атмосферу, а также их дальнейших
превращений в воздухе. Наиболее важной характеристикой являются размеры
металлсодержащих частиц, поскольку именно этот параметр определяет
время жизни металлов в атмосфере. Так, крупные частицы не способны
переноситься на значительные расстояния и оседают вследствие гравитации
непосредственно вблизи источника. Они не представляют интереса с точки
зрения глобального и регионального загрязнения окружающей среды.
Напротив, мельчайшие аэрозоли субмикронных размеров или газообразные
соединения ТМ перемещаются на значительные расстояния, загрязняя не
только промышленные, но и фоновые районы планеты.
Помимо размеров металлсодержащих аэрозольных частиц, важную
роль играет степень растворимости ТМ, присутствующих в атмосфере. При
выпадении на подстилающую поверхность ТМ, находящиеся в подвижных,
легкорастворимых формах, активно мигрируют в почвах и быстро
усваиваются организмами, включаясь в биогеохимические циклы.
Существенное влияние на окружающую среду оказывают химические
формы существования ТМ в атмосфере, поскольку они определяют
токсичность ТМ, а также их растворимость в атмосферных осадках. Кроме того,
химические превращения в атмосфере могут приводить к образованию
более токсичных веществ, чем первоначально выбрасываемые, а также
влиять на их сток из атмосферы.
Таким образом, степень воздействия ТМ на окружающую среду во
многом определяется поведением ТМ в атмосфере, начиная с момента их
поступления в атмосферу и кончая осаждением на подстилающую поверхность
земли. В свою очередь, поведение ТМ зависит от их физико-химических
свойств и химических превращений, протекающих в атмосфере.
Аэрозольная и паровая фаза ТМ. До последнего времени считалось,
что основная масса ТМ (за исключением Hg и отчасти Se) существует в
атмосфере только в виде аэрозолей. Поэтому при анализе атмосферного
воздуха на содержание ТМ использовались аэрозольные фильтры, не
задерживающие газообразные и мелкие субмикронные частицы. Однако
результаты последних исследований свидетельствуют, что доля ТМ,
существующих в атмосфере в парообразном состоянии, значительно выше,
чем это предполагалось ранее. (Считается, что аэрозольные частицы
подчиняются газовым законам, когда их размер становится < 0,5-0,1 мкм.
Под паровой фазой понимаются как газообразные соединения ТМ, так и
металлсодержащие аэрозоли субмикронных размеров, ведущие себя
подобно газу.)
32
Необходимо отметить, что результаты исследований, посвященных
изучению субмикронной и газообразной фракций ТМ, малочисленны, что,
вероятно, объясняется сложностью эксперимента и техническими трудностями.
Результаты анализа фазового состояния ТМ в воздухе промышленных
зон различных предприятий показали, что это состояние меняется в
широких пределах и зависит не только от природы элемента, но и от источника
загрязнения (табл. 3.3.). Ни для одного из изученных ТМ доля аэрозоля не
сохранялась постоянно выше 95-99%. Даже для такого малолетучего
элемента, как Со при пирометаллургическом производстве Си доля
парообразной фазы в выбросах превышала 30%. В городском воздухе только для Zn и
Со преобладала аэрозольная составляющая, тогда как для остальных ТМ
вклад паровой фазы колебался от 35 до 75%.
Аналогичные результаты, свидетельствующие о большом вкладе
парообразной составляющей ТМ в атмосфере городской зоны, представлены в
табл. 3.4. Что касается Hg, то она вообще на 90-95% существует в
атмосфере в газообразном виде. В фоновых районах доля ТМ в парообразной
фракции, как правило, выше, чем в городской зоне (см. табл. 3.2). Так, доля
субмикронной фракции РЬ в фоновом районе на 10-15% выше, чем в
городском. То же самое можно отметить и для Cd на основании данных,
полученных в городской зоне и биосферном заповеднике (Миклишанский, Яковлев,
1980; Ровинский, Петрухин, 1985; Бурцева и др., 1986).
Таким образом, данные экспериментов показывают, что определенная
доля ТМ как в урбанизированных, так и в фоновых районах существует в
парообразном состоянии. По значению роли парообразной фракции элементы
можно расположить в следующий ряд:
V < Мп < Сг < Ni < Pb < Cd < Ag < As.
Наибольшая субмикронная составляющая у As, в ряде случаев она
достигает 99%. Ванадий в этой фракции вообще не обнаруживается. Для других
элементов парообразная фракция в одних случаях низка, а в других весьма
высока. Обобщение данных, полученных в различных работах, пока не
позволяет выявить статистически обоснованные связи с природой источников
эмиссии ТМ (на урбанизированной территории) и (или) с общим состоянием
атмосферы. В целом исследования физических процессов, происходящих
при высокотемпературной эмиссии металлов, свидетельствуют, что
первоначально значительная часть ТМ действительно поступает в атмосферу в
виде мельчайших частиц (0,015-0,05 мкм). При контакте с воздухом эти
частицы быстро увеличиваются в размерах, и в пределах короткого времени
большая их часть коагулирует до величины 0,5 мкм, после чего рост
постепенно прекращается (Harrison, Laxen, 1981; Ottar, 1989).
Поведение металлов, эмитирующих в парообразном состоянии, изучено
на примере выбросов извержений вулканов (Миклишанский, Яковлев,
1980). Так, экспериментально установлено преимущественное нахождение в
приземных слоях воздуха As и Sb в парогазовом состоянии вплоть до 8 км от
источника их поступления в атмосферу. Медь, цинк и ртуть вблизи
высокотемпературного источника поступления также характеризуются
существованием летучих форм, которые, однако, являются относительно
неустойчивыми, так как по мере увеличения времени пребывания их в атмосфере
наблюдается отчетливая тенденция к сорбции на поверхности частиц аэрозо-
2. Рассеянные элементы ^
ля. В то же время Fe, Co и Сг находятся в составе газовой компоненты в
виде труднолетучих соединений, которые практически сразу же
конденсируются в атмосфере более холодного воздуха и образуют аэрозольную фазу.
Образование субмикронной фракции аэрозолей происходит при
непосредственном контакте газовой фазы с атмосферным воздухом. Вследствие
высокой концентрации субмикронных частиц в единице объема выброса
протекают интенсивные процессы их коагуляции (для монодисперсного аэрозоля
скорость коагуляции пропорциональна квадрату концентрации). Не
исключено, что химические реакции (образование оксидов, солей и т.д.) и
конденсация водяного пара, происходящие на поверхности частиц, могут
способствовать их росту. В результате этих процессов труднолетучие соединения (Fe,
Со, Сг) оказываются в составе грубодисперсного аэрозоля, в то время как
соединения As, Sb, Cu, Zn и Hg рассеиваются в парообразном состоянии и в
дальнейшем частично сорбируются на поверхности аэрозольных частиц
субмикронных размеров, обладающих наиболее развитой суммарной
поверхностью.
Таким образом, летучие ТМ (Pb, As, Cd, Zn, Cu, Se) входят в состав более
мелких частиц по сравнению с нелетучими (Со, Ni).
Дисперсный состав металлсодержащих аэрозолей. Дисперсный состав
металлсодержащих аэрозолей, поступающих в атмосферу из
антропогенных источников, колеблется в очень широких пределах: от 10 до 20-40 мкм
и более (Jaworowski, 1981). В зависимости от дисперсности аэрозоли можно
разделить на 4 группы (Никомишин, 1985):
1) локальные (грубодисперсные частицы размером более 50 мкм,
осаждающиеся вблизи источника эмиссии);
2) региональные (частицы размером 5-50 мкм, способные переноситься
воздушными массами нижней тропосферы в пределах небольшого региона);
3) континентальные (мелкодисперсные частицы размером 2-5 мкм,
имеющие большое время жизни в атмосфере и обладающие способностью к
дальнему переносу в пределах континента или большого региона);
4) глобальные (частицы размером < 1 мкм, участвующие в глобальном
переносе загрязняющих веществ).
Большинство промышленных процессов (сжигание топлива и твердых
отходов, плавление цветных и черных металлов, обжиг на цементных
заводах), в результате которых происходит выброс ТМ в атмосферу, являются
высокотемпературными (t °C > 1000), при этом, как уже упоминалось,
значительная часть ТМ вследствие их летучести эмиттирует в газообразной или
мелкодисперсной форме.
Так, изучение элементного состава частиц, выбрасываемых в
атмосферу при сжигании угля, показало, что Cd, Pb, Zn, Se, V, Сг и As находятся,
главным образом, в субмикронной фракции вылетающей золы (Bauer,
Andrer, 1988; Coles et al., 1979; Ondov et al., 1979), при этом до 30% Se
улетучивается в газообразной форме (The Atmospheric Emission..., 1999). В
мелкодисперсную фракцию аэрозоля переходят V и Ni при сжигании нефти
(Akiyoshi, Toshio, 1973; Mamane et al., 1986) и Pb при газификации угля
(Davidson et al., 1982). В выбросах, образующихся при сжигании городских
отходов, в мелкодисперсной фракции эмиттируют 80% Pb, 70% Cd, и 50% As
(Candreva, Dams, 1985; Donnelly, 1992). В выбросах металлургических
производств основная масса ТМ содержится в так называемых возгонах, образую-
34
щихся при конденсации пылегазового выброса, содержащего пары ТМ, на
мельчайших частицах субмикронных размеров (Касимов и др., 1988; Старк,
1990). В автомобильных выбросах РЬ входит в состав мелких частиц
(< 0,5 мкм), однако эти аэрозоли в присутствии крупных частиц дорожной и
почвенной пыли быстро коагулируют (Jaworowski et al., 1981).
В целом ТМ наиболее активно конденсируются на мелких частицах,
антропогенные выбросы, как правило, полидисперсны, и механические уносы,
состоящие из более крупных частиц (> 5 мкм), могут также содержать
значительные количества ТМ (особенно в случае металлургических
производств при высоких концентрациях ТМ в исходном сырье).
Естественно, что дисперсный состав выбросов существенно зависит от
эффективности очистного оборудования: чем она выше, тем больше на
выходе доля мелкодисперсных аэрозолей. Кроме того, дисперсный состав
промышленных аэрозолей зависит от расстояния до источника и быстро
трансформируется по мере удаления от него (табл. 3.5). Крупные частицы
быстро удаляются из атмосферы за счет гравитационного осаждения, и
максимум распределения "масса-размер" перемещается в область
высокодисперсных аэрозолей. В фоновых районах до 95% ТМ может ассоциироваться в
атмосфере с аэрозолями с размерами меньше 1 мкм (Пинский, 1988). Летучие
элементы (Pb, As, Cd, Zn, Se, Cu), как правило, входят в состав более мелких
частиц по сравнению с нелетучими (Ni, Co).
Субмикронные частицы аэрозолей ТМ можно отнести к региональным
и даже глобальным загрязнителям атмосферы, способным к переносу на
большие расстояния. Ртуть, в отличие от остальных ТМ, существующих в
атмосфере в основном в аэрозольном виде, на 90-95% эмиттирует в
газообразном состоянии (Pacyna, Munch, 1991), и в атмосфере только порядка
5% Hg связано с аэрозольными частицами.
Плотность аэрозольных частиц. В различных расчетах и измерениях
плотность аэрозольных частиц, содержащих ТМ, обычно считают
постоянной и равной 1-2 г/см3 (Jaworowski, 1981). Однако экспериментальные
данные свидетельствуют о тенденции роста плотности частиц с увеличением их
размеров (Watson et al, 1983; Akigoshi, 1986). Так, согласно (Watson, 1983),
плотность мелкодисперсных аэрозолей составляет 1,7 г/см3, а грубодисперс-
ных 2,6 г/см3. В ряде случаев наблюдаются два максимума распределения.
Например, один из максимумов содержания в аэрозоле Fe, Mn, Zn и Си
приходился на плотность 2,5-2,7 г/см3, другой - на плотность выше 3,3 г/см3
(Akigoshi, 1986). Как правило, более плотные частицы имеют почвенное
происхождение и состоят в основном из оксидов (плотность Si02 равна 2,7 г/см3).
Антропогенные аэрозоли имеют меньшую плотность, но они могут
коагулировать с почвенной пылью (Jaworowski, 1981). В табл. 3.6 приведены
плотности аэрозольных частиц, выбрасываемых в атмосферу в результате
различных производственных процессов (Энергетика и охрана окружающей среды,
1979; Гордон, Пейсахов, 1977; Касимов и др., 1988; Старк, 1990).
Растворимость ТМ, присутствующих в атмосфере. Исследований,
посвященных систематическому изучению растворимых и нерастворимых форм
ТМ в атмосфере и атмосферных осадках, не очень много, однако
имеющиеся экспериментальные данные позволяют оценить тенденцию изменения
растворимости ТМ после их поступления в атмосферу из промышленных
источников.
Изучался характер изменения соотношения растворенных и взвешенных
форм ТМ в снеговом покрове по мере приближения к крупному
промышленному городу (Сает и др., 1990). Практически для всех исследованных
химических элементов на относительно удаленных и сравнительно чистых
территориях в выпадениях из атмосферы преобладают растворимые формы
(табл. 3.7). Около источников выбросов одновременно с увеличением общей
массы выпадающей пыли и степени концентрации в ней ТМ, доля
растворимых форм в снежном покрове резко уменьшается (кроме Cd).
В работе Э.П. Махонько и др. (1980) подробно изучалось влияние
источника промышленных выбросов на соотношение содержания ТМ в
растворимых и нерастворимых формах в атмосферных выпадениях. Были
проанализированы выпадения вокруг металлургических комплексов
Запорожья и Череповца, в районе химических предприятий Усолья-Сибирско-
го и Назаровской ГРЭС (табл. 3.8). Выявлено, что в промышленных
выбросах металлургического комплекса ТМ находятся практически
полностью в нерастворимой форме. По мере удаления от источника доля ТМ в
растворимых формах в выпадениях растет, однако влияние
промышленных выбросов Череповецкого комбината все еще заметно на расстоянии
50-70 км от источника.
В Антарктиде, вдали от каких-либо промышленных источников
поступления ТМ в атмосферу, наблюдается другой крайний случай - ТМ в
выпадениях практически полностью находятся в растворимых формах. В Усть-Вы-
ми и на Южном берегу Крыма, т.е. в сельской местности, наблюдаются
промежуточные значения доли ТМ в растворимых осадками формах.
В работе S.E. Lindberg и R.C. Harris (1983) была исследована
растворимость ТМ не в атмосферных выпадениях, а непосредственно в аэрозолях,
причем наряду с водорастворимой определялась и кислоторастворимая
форма. Показано, что по мере удаления от источника загрязнения
(теплоэлектростанции) - от 250 км до 7 км - за счет возрастания вклада мельчайших
аэрозолей суммарная растворимость Cd увеличивается от 55 до 90%, Мп -
от 55 до 90%, РЬ - от 20 до 50%, Zn - от 50 до 80%.
Растворимость ТМ в промышленных выбросах во многом зависит от
дисперсности промышленного аэрозоля. Действительно, крупные частицы
более труднорастворимы, чем мелкие. Однако, поскольку растворимость
вещества определяется также его химической формой, эта связь иногда
нарушается. Так, в работе (Бурцева и др., 1991) на основании анализа
литературных данных делается вывод, что в выбросах предприятий, сжигающих
городские отходы, а также при сжигании угля на ТЭЦ, ТМ поступают в
атмосферу в составе мелкодисперсной фракции, преимущественно в
водорастворимой форме. С выбросами же цветной металлургии металлы также
поступают в атмосферу в составе мелкодисперсных аэрозолей, однако
главным образом в нерастворимых формах.
Таким образом, по мере удаления от источника доля водорастворимой
фракции ТМ в атмосфере и атмосферных выпадениях увеличивается, что
связано главным образом с увеличением дисперсности атмосферного
аэрозоля. Однако некоторые экспериментальные данные могут противоречить
этому утверждению (Махонько и др., 1980). Так, в сельских районах Англии
доля растворимых примесей в выпадениях составляла 20%, а в
индустриально-промышленной зоне Грейт-Виндзор и в Лондоне повышалась до 25 и
36
31%, соответственно. В центре Берлина доля растворимой примеси в
осадках составляла 51%, а на расстоянии 15 км (г. Далем) и 50 км (г. Мюнцберг)
от него равнялась 64 и 55%, т.е. существенно не изменялась.
Объяснить наблюдаемый характер изменения растворимости ТМ в
атмосфере и в том числе указанные выше противоречия можно следующим
образом. Действительно, форма содержания ТМ в аэрозолях зависит от
расстояния до источника загрязнения. Непосредственно после выброса в
атмосферу ТМ находятся, как правило, в нерастворимых формах. Далее по мере
распространения примеси от промышленного предприятия в первую
очередь оседают наиболее крупные частицы, растворимость которых при
прочих равных условиях меньше растворимости высокодисперсных частиц.
Параллельно с этим процессом происходит разбавление промышленного
аэрозоля "фоновым" воздухом, содержащим атмосферную пыль. Растворимость
атмосферной пыли выше растворимости промышленных выбросов. Это
можно объяснить действием специфических источников ТМ,
выбрасывающих в атмосферу растворимые соединения, например брызги морской воды;
а главное - химическими реакциями, протекающими в атмосфере, в
результате которых постепенно образуются растворимые формы ТМ. Так,
нерастворимые формы ТМ могут переходить в растворимые вследствие
взаимодействия с сильными кислотами, в частности H2S04, содержащимися на
поверхности аэрозоля. Экспериментальные доказательства протекания такого
рода процессов рассмотрены в (Winchester, 1989) на примере почвенных
минеральных аэрозолей. Кроме того, некоторые металлы в атмосфере
участвуют в окислительно-восстановительных реакциях, в результате которых
могут образовываться водорастворимые соединения. Наглядным примером
является Hg, элементарная нерастворимая форма которой вследствие
взаимодействия с диоксидом серы переходит в двухвалентное состояние,
растворимое в воде и легко вымываемое осадками. Поэтому смешивание
промышленного аэрозоля с атмосферной пылью увеличивает долю ТМ в
растворимых формах. Кроме того, по мере "старения" аэрозоля и протекания в нем
различных химических и физических процессов он сам превращается в
атмосферную пыль.
В результате одновременного действия различных источников
поступления ТМ в атмосферу и протекающих процессов удаления ТМ из
атмосферы в ней устанавливается некоторое подвижное равновесие, что приводит к
соотношению содержания ТМ в растворимых и нерастворимых формах,
характерному для фоновых районов. Наконец, в Антарктиде, вдали от
источников загрязнения, в выпадениях наблюдаются в основном растворимые
формы металлов.
В выпадениях, собираемых в городах, наблюдаются как высокие, так и
низкие уровни содержания ТМ в растворимых формах, в зависимости от
происхождения воздушных масс, принесших эти выпадения (локальное или
глобальное происхождение). Этим и можно объяснить некоторое
наблюдаемое противоречие в литературных данных.
Большой интерес представляет также определение доли
водорастворимых форм ТМ в фоновых районах. Выше упоминалось, что вдали от
источников промышленных загрязнений основная часть ТМ существует в
водорастворимых формах. Так, Ф.Я. Ровинским (1987) было установлено, что в
атмосферных осадках фоновых районов водорастворимые формы составля-
37
ют для Со 80%, Сг 80-95%, Си 40-80%, Ni 80%, Sb 60-70%, Se 80-100%,
V 60% и Zn 80-100%.
Результаты определения форм ТМ в аэрозолях приземного слоя
атмосферы и атмосферных осадках показывают, что концентрация металлов в
осадках происходит в процессе облакообразования (Бурцева и др., 1986;
Юшкан, 1991). Аэрозоли ТМ, присутствующие в приземном воздухе в месте
измерения, оказывают крайне малое влияние на степень загрязнения
осадков, определяя главным обрааом потоки сухих выпадений в данном регионе.
Облачные массы, формируясь над импактными зонами в регионах с
высокой плотностью размещения источников загрязнения (европейская часть
России), могут перемещаться на значительные расстояния, соответственно,
в фоновых районах не исключено выпадение осадков с высокой
концентрацией металлов при довольно низком их содержании в приземном воздухе.
Металлы, поступающие на земную поверхность в фоновых районах с
атмосферными осадками и сухими выпадениями, находятся в миграционно
активном состоянии и включаются в биогеохимические циклы.
Обогащение промышленных аэрозолей ТМ. Результаты
многочисленных анализов промышленных выбросов свидетельствуют о значительном
обогащении аэрозолей ТМ по сравнению с земной корой или даже
исходным сырьем (рудой, топливом и т.д.). Например, возгоны, образующиеся
при выплавке металлов, как правило, обогащены ТМ по сравнению с
первоначальной шихтой. В качестве иллюстрации можно сопоставить
содержание ТМ в шихте Усть-Каменогорского свинцово-цинкового комбината и
образующейся при ее плавке пыли (Богатырев, Юрлов, 1989). Как можно
видеть, пыль значительно обогащена такими ТМ, как Pb, Cd и As (табл. 3.9).
Для количественной оценки обогащения частиц тем или иным
элементом обычно используют коэффициенты обогащения (EF) относительно
почвенного аэрозоля, характеризующие степень обогащения аэрозольного
вещества микроэлементами относительно реперного элемента (Fe, или А1 в
случае континентальных аэрозолей, или Na в случае морских аэрозолей)
(Бримблкумб, 1988):
EF(Al)x = (Сх /СА1) воздух
(Сх/См)
где С - концентрация элемента; х - аэрозольные вещества, А1 - репер;
числитель - атмосфера, знаменатель - земная кора или исходное сырье.
Как правило, наиболее четко тенденция к обогащению прослеживается
в случае летучих элементов (Савенко, 1991). Например, максимальные
коэффициенты обогащения для летучей золы углей наблюдаются для таких
легколетучих элементов, как Cd, Sn, As, Se и Мо. Однако в летучей золе,
образующейся при сжигании жидкого топлива, наблюдается наиболее
значительное обогащение менее летучими элементами - Ni и V. В целом летучая
зола нефти характеризуется большим количеством элементов с высокими
коэффициентами обогащения по сравнению с летучей золой углей. Так, для
Со, Ni, V и Мо коэффициенты обогащения находятся в диапазоне 100-1000,
для Zn, Сг, Cd, Pb, Си, As, Se и Sb - от 10 до 100.
В настоящее время предложено несколько возможных механизмов
наблюдаемого обогащения аэрозолей ТМ (Миклишанский и др., 1980; Микли-
шанский, 1981; Бримблкумб, 1988; Sandelin, Backman, 1999). Предполагается,
38
что одной из главных причин обогащения является летучесть этих
элементов при их поступлении в атмосферу из высокотемпературных источников.
Действительно, в процессе сжигания ископаемого топлива, плавления
металлов, вулканической деятельности и т.д. происходит переход в
газообразное состояние многих нелетучих при низких температурах соединений,
которые в процессе охлаждения пылегазовых выбросов конденсируются на
поверхности твердых частичек. При этом самые мелкие аэрозоли,
обладающие максимальной удельной поверхностью, должны быть наиболее сильно
обогащены микроэлементами, что и наблюдается в действительности
(табл. 3.10-3.11; Mamane et al., 1986; Носков и др., 1990; Paode et aL, 1998).
На степень обогащения аэрозольных выбросов тепловых
электростанций, работающих на углях или жидком топливе, большое влияние оказывает
то, в какой форме находятся элементы в исходном топливе. Можно
предположить, что наибольшей летучестью обладают органические формы, которые
полностью разрушаются при горении. Немногочисленные исследования по
этому вопросу свидетельствуют о том, что в углях большинство ТМ, в
частности, Mo, Cu, Hg и As, примерно только на 30-70% связаны с органическими
соединениями (Савенко, 1991), в нефти же металлы в основном существуют в
виде органических соединений (металлпорфиновых хелатов, комплексов тет-
радентатных лигандов, металлоорганических соединений и солей карбоновых
кислот). Возможно, этим и объясняется большая степень обогащения летучей
золы жидкого топлива по сравнению с углями. В работе (Бримблкумб, 1988)
при изучении обогащения аэрозолей в вулканических дымовых шлейфах,
сопоставлены коэффициенты обогащения ряда элементов (относительно А1) с
их температурами кипения, которые действительно, в какой-то степени могут
служить мерой летучести данного ТМ. Как оказалось, между степенью
обогащения и температурой кипения существуют тесные связи.
Помимо вышеуказанного механизма, определенный вклад в обогащение
аэрозолей может вносить явление фракционирования элементов во время
физико-химических процессов конденсации, например испарение водяного
пара, которому подвергаются аэрозоли во время перемешивания в
атмосфере (Ровинский, Петрухин, 1985).
В целом, явление обогащения промышленных выбросов ТМ оказывает
значительное влияние на химический состав аэрозолей, увеличивая в
конечном счете концентрацию металлов в атмосферном воздухе.
3.2. СОЕДИНЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В АТМОСФЕРЕ
Химические формы существования тяжелых металлов в выбросах
и атмосферном воздухе
Химические формы существования ТМ в атмосфере могут оказать
существенное влияние на организмы, поскольку они определяют токсичность
ТМ, а также их растворимость, т.е. доступность для организмов. Так, Сг в
биосфере в трехвалентной форме, поскольку для биологических объектов
неизвестны окислительно-восстановительные процессы, способные
перевести его в состояние со степенью окисления Сг+6 (Хром: Гигиенические
критерии..., 1990). Из промышленных высокотемпературных источников
значительная часть хрома выделяется в наиболее токсичной форме Сг+6, обла-
39
дающей сильными канцерогенными свойствами и характеризующийся
отрицательным воздействием на биоту.
В литературе имеется довольно ограниченная информация о химических
соединениях металлов, поступающих в атмосферу из антропогенных
источников. При высокотемпературных процессах (сжигание угля и отходов,
плавление металлов) происходит, как правило, окисление исходных форм ТМ в
сырье и образование оксидов (табл. 3.12). Так, при минералогическом
анализе летучей золы углей было установлено преобладающее содержание
оксидов и силикатов, причем, вероятно, силикаты являлись первичными
минералами, а оксиды - вторичными, образующимися в процессе сгорания (Са-
венко, 1991). При переработке цинковых кеков в вельц-печах при
восстановительном процессе вначале из шихты выделяются пары металлического
Zn, окисляющегося затем при соприкосновении с кислородом воздуха до
оксида (Старк, 1990). Помимо окисления в горячих парах ТМ могут
взаимодействовать и с другими компонентами газовой фазы, образуя карбонаты, гид-
роксикарбонаты, сульфаты, сульфиды и т.д. (Цинк и кадмий..., 1992).
Например, при определении химического состава седиментационной пыли,
взятой на рабочей площадке свинцово-цинкового комбината, оказалось, что РЬ
и Zn присутствуют в виде оксидов (50,4 и 13,5%, соответственно), металла
(2,3 и 2,6%), сульфатов (0,4 и 0,4%) и сульфидов (1,2 и 2,2%) (Тулупов и др.,
1991). При анализе пылей, отобранных из дымовых труб
металлургического производства, были идентифицированы PbS04, PbO • PbS04, PbO, PbS, Pb,
ZnO, ZnS, CdO (Harrison, Williams, 1983). Основными соединениями Pb, эмит-
тирующими в атмосферу при металлургических процессах, являются PbS04,
PbO • PbS04 (Harrison, Laxen, 1981). Выбросы никелевых предприятий
содержат нерастворимые оксиды никеля NiO^, металлический Ni и растворимые
соли двухвалентного Ni, при этом на долю оксидов приходится до 95% от
общего количества Ni (Wong, Wu, 1991).
В выбросах, содержащих Cd, преобладают элементарный Cd и его
оксиды. Эти соединения считаются наиболее токсичными, также как хлорид
кадмия, обнаруженный в выбросах установок по снижению мусора (Semb,
Расупа, 1988).
Большое значение имеют формы соединений Сг, выделяющиеся в
атмосферу из промышленных источников. Хром в природной среде может
существовать в двух формах - Сг3+ и Сг6*, причем последняя является наиболее
токсичной, ответственной за большинство проблем, связанных с вредным
воздействием хрома на биоту. Считается, что Сг64- попадает в окружающую
среду в основном в результате хозяйственной деятельности человека,
поскольку биологические объекты не способны выработать энергию,
необходимую для окисления Сг3+ в Сг6* (Хром: Гигиенические критерии..., 1990).
В промышленных, высокотемпературных процессах часть элемента может
окисляться до Сг6*. Так, при исследовании химических форм хрома в пыли
плавильных печей при производстве феррохрома оказалось, что примерно
половина общего количества хрома, содержащегося в пыли, являлась
"биодоступной" фракцией, т.е. способной экстрагироваться путем кислотного
(щелочного) выщелачивания. Примерно 40% этой фракции приходилось на
оксиды Сг6-*-, причем большая часть Сг6* концентрировалась на
непосредственно образующихся при плавлении субмикронных частичках, доля
которых от общего числа пылевых частиц составляла 12%. Трехвалентный хром
40
присутствовал как в биодоступной фракции пыли в виде растворимых солей
(таких, как Cr2(S04)3), так и в нерастворимом остатке в виде оксида Сг203
(Сох et al., 1985).
Другие химические формы Сг в атмосферном воздухе практически
неизвестны. Часть его представлена Сг6*, которая, находясь в атмосфере во
взвешенном состоянии, по-видимому, достаточно стабильна. Вероятно,
наиболее важными соединениями Сг в воздухе, как и в случае
большинства ТМ, являются его оксиды Сг203 и Сг03 (Хром: Гигиенические
критерии..., 1990).
Анализ выбросов, содержащих As, свидетельствует о доминировании
его неорганических соединений, при этом наиболее распространенной
формой этого металла является As3+. Пробы воздуха, взятые из плавилен или
непосредственно в выбросах электростанций, работающих на угле,
содержат в основном As3+, существующий как в газообразном, так и аэрозольном
виде. Это очень неблагоприятно для окружающей среды, поскольку
неорганические соединения As+3 являются более токсичными, чем органические.
Содержание органических, метиллированных форм As в выбросах,
по-видимому, очень незначительно. Доля газообразного мышьяка в выбросах при
сжигании твердого топлива колеблется в широких пределах (0,7-52%) и
отчасти зависит от количества твердых частиц в пылегазовом выбросе. Для
объяснения этого поведения As предложен механизм, предполагающий
протекание на поверхности частиц реакции, в результате которой
газообразный As406 образует нелетучие формы, которые затем адсорбируются на
частицах (Germani, Zoller, 1988). В настоящее время считается, что при
сжигании органического топлива в газообразном виде в атмосферу поступает не
более 0,5% As (The Atmospheric Emission..., 1999).
В выбросах металлургических предприятий As также чаще всего
присутствует в своих окисленных формах. Например, обжиговые газы цинковых
заводов часто содержат As203, находящийся в парообразном состоянии.
В выбросах заводов по производству Sb соединения As также представлены
триоксидом с незначительной долей As205 и Sb(As03)2 (Яковлева и др., 1987).
В пыли медных заводов, работающих на вторичном сырье, As на 30%
присутствует в виде As203, до 25% - в элементарной форме и порядка 40% в
виде арсенатов (25% с Zn, 15% с РЬ) (Акылбеков и др., 1989). Кроме того,
выплавка черных и цветных металлов часто сопровождается выделением арси-
на (гидрида мышьяка AsH3) - одного из наиболее токсичных соединений As.
Его образование можно ожидать в любом месте контакта мышьяксодержа-
Щих соединений с различными восстановителями, в качестве которых могут
выступать разные сорта стали и чугуна, цинк и другие ТМ. Будучи летучим,
арсин практически не улавливается пылеулавливающим оборудованием и
бесконтрольно поступает в атмосферу (Струнников и др., 1990).
В атмосфере As находится в основном в виде тонкодисперсных
аэрозолей, которые на 95-100% состоят из неорганических и на 2-5% из
органических соединений. Основным неорганическим соединением As в атмосфере
является легко сублимирующийся оксид As3+ (Гамаюрова, 1993). Из
органических соединений As в атмосферном воздухе были идентифицированы мо-
н°-> ди- и триметиларсиновые кислоты (ММАК, ДМАК, ТМАК).
° табл. 3.13 приведено распределение As между различными химическими
Формами в некоторых фоновых, сельских и промышленных районах Земли
41
(Nakamura, 1990). На основе анализа этих данных, в работе делается вывод,
что ДМАК и ТМАК образуются в результате биометилирования, тогда как
ММАК имеет чисто антропогенное происхождение и поступает в
атмосферу в результате использования пестицидов (Nakamura et al., 1990).
Химические формы существования Se в выбросах и в атмосферном
воздухе изучены недостаточно. Учитывая высокую летучесть Se, можно
предположить, что значительные его количества могут поступать в атмосферу в
газообразном состоянии. Так, отходящие газы цинковых производств
содержат элементарный Se и диоксид Se, находящиеся в парообразном состоянии
(Старк, 1990). В настоящее время считается, что при сжигании твердого
топлива до 15% Se существуют в выбросах в виде газа (The Atmospheric
Emission..., 1999). В атмосфере по разным оценкам доля газообразного Se
составляет от 25 до 60%. Органические соединения Se, вероятно, целиком
содержатся в газообразной форме. Довольно высокое содержание
неорганического Se в газообразной фазе обусловлено относительно высоким
давлением паров Se и химическими реакциями на поверхности аэрозолей с
превращением диоксида Se в Se° (Ross, 1985). Предполагается, что взвешенный
в воздухе Se существует в виде элементарного Se, адсорбированного на
поверхности аэрозолей, нерастворимых селенидных солей и диоксида Se
(Селен. Гигиенические критерии..., 1989).
Одним из основных источников РЬ в атмосферном воздухе, как
известно, являются выхлопы автотранспорта, работающего на алкилированном
топливе, т.е. содержащем в качестве добавок тетраметил- или тетраэтил-
свинец. В автомобильных выбросах РЬ существует в двух формах -
органической и неорганической, причем последняя составляет 70-75% от общего
количества РЬ, поступающего в атмосферу (Harrison, Laxen, 1981). В
автомобильных выхлопах идентифицировано девять различных
неорганических соединений РЬ, представляющих собой смешанные галогениды, при
этом доминирующими являются PbBrCL и ot-PbBrCL • NH4CL. При
поступлении в атмосферу указанные выше соединения РЬ не стабильны и
продолжают подвергаться различным химическим превращениям. Поэтому, хотя
доминирующие в выхлопах соединения PbBrCL и oc-PbBrCL • NH4CL также
в небольших количествах находят в атмосфере, однако преобладающими
соединениями РЬ в воздухе становятся различные сульфаты и в частности
PbS04(NH4)2S04, образующийся при взаимодействии PbBrCL с аэрозолями,
содержащими нейтральные ((NH4)2S04) или кислые (NH4HS04) сульфаты
(Harrison, Laxen, 1981).
Помимо неорганических соединений автомобильные выхлопы содержат
несгоревшие тетраалкильные соединения РЬ. Как уже упоминалось, в
бензины чаще всего добавляют тетраметил- и тетраэтилсвинец. Тетраметилсви-
нец термически более стабилен и химически менее реакционоспособен; из
органических соединений РЬ именно он преобладает в загрязненной
атмосфере (Harrison, Laxen, 1981).
Все химические формы существования Hg в исходном сырье (топливе,
рудах, отходах) способствуют ее эмиссии в газообразной, как правило,
элементарной форме. Например, в углях Hg присутствует главным образом в
виде сульфидов, которые при горении топлива реагируют с кислородом с
образованием элементарной Hg (Hall, Lindqvist, 1990). В отходах
доминирующей формой Hg является оксид, который, будучи термически нестабиль-
42
ным при температурах выше 500 °С, также разлагается на элементарную Hg
и кислород. Преобладающей формой Hg при работе мусоросжигающих
печей является двухвалентная Hg (в основном летучий и легкорастворимый
хлорид Hg) (Karatza et al., 1998; Dvonch et al., 1999), в то время как Hg,
поступающая в атмосферу при сжигании топлива и переработке руд, находится
главным образом в элементарной форме (Munthe, 1991). Соотношения
различных форм Hg, поступающих в атмосферу из антропогенных источников,
приведены в табл. 3.12 и 3.14.
Предполагается, что из антропогенных источников Hg также может
эмитировать в виде метилированных соединений, при этом диметилртуть на
воздухе подвергается быстрой деградации с образованием элементарной Hg
(Slemr, Seiler, 1981). Это предположение, в частности, подтверждается
результатами анализа выхлопных газов автотранспорта, в которых часто
можно обнаружить диметилртуть (Трахтенберг, Коршун, 1990). Однако
вероятно, что основным источником металлорганических соединений Hg в
атмосфере являются процессы биометилирования, протекающие в почвах и
водоемах (Kelly et al., 1997).
Основными соединениями Hg, наиболее часто встречающимися в
атмосфере, являются элементарная ртуть, хлорид ртути, метил(хлорид) ртуть и
диметилртуть. В атмосфере фоновых районов зарегистрировано Hg° -
11-65%, двухвалентной неорганической ртути - 12-25%, метилртути -
21-34% и диметилртути - 1-46% (Петрухин, 1982). В атмосфере над Европой
до 30% Hg находится в форме диметилртути, в то время как над океаном
только 5%, однако результаты измерения содержания диметилртути,
вероятно, слишком завышены (Slemr, Seiler, 1981). Необходимо отметить, что в
литературе имеется довольно большой разброс в данных относительно
соотношения различных химических форм существования Hg в атмосферном
воздухе, однако в настоящее время считается, что ее преобладающей
формой является элементарная Hg, доля которой в атмосфере может доходить
до 80-90% (Lidqvist, Rodhe, 1985). В то же время, некоторое количество Hg
адсорбируется на поверхности аэрозольных частиц и, таким образом,
существует в атмосфере в твердом виде (Olmez et al, 1998).
Помимо Hg способность к образованию металлоорганических
соединений за счет процессов метилирования была установлена для As, Pb, Se и Cd
(Andweres et al., 2000). Учитывая высокую летучесть образующихся при
этом соединений, можно ожидать их интенсивного поступления с
подстилающей поверхности в атмосферу. Действительно, продукты метилирования
этих ТМ были обнаружены в атмосферном воздухе ряда городов Японии
(Hitoshi, 1986). Однако изучение эмиссии органических соединений ТМ,
возникающих в процессе метилирования, практически не проводилось, и эта
область поведения ТМ в окружающей среде является одной из наименее
изученных. Можно только отметить, что по мере дальнейшего загрязнения
почв и водоемов тяжелыми металлами процессы метилирования будут
протекать более интенсивно и, соответственно, доля ТМ, поступающих в атмо-
сферу и таким образом повторно вовлекающихся в геохимический
круговорот, будет возрастать.
43
Химические реакции в атмосфере с участием тяжелых металлов
ТМ поступают в атмосферу в виде оксидов или различных солей.
Естественно, что эти соединения гораздо менее реакционно способны в
воздухе, чем большинство органических загрязнителей. Поэтому основное
взаимодействие ТМ с окружающей средой начинается при их осаждении на
поверхности земли, воды или растительности. Тем не менее, результаты
последних исследований свидетельствуют, что пренебрегать химией ТМ в
атмосфере не следует.
В атмосфере многие ТМ вступают в различные химические реакции,
оказывающие существенное влияние на судьбу не только самих ТМ, но и
других загрязнителей. Одной из наиболее важных функций ТМ в атмосфере
является их каталитическая способность. Ранее уже упоминались, что
некоторые химические превращения с участием ТМ происходят в пылегазовом
выбросе. При сжигании твердого топлива или выплавке металлов диоксид
серы, содержащийся в выбросах, каталитически окисляется на поверхности
мельчайших субмикронных частиц оксида Си и оксида Zn (0,03 мкм) до
H2S04, при этом образующийся аэрозоль гораздо более вредно
воздействует на организмы, чем сама H2S04 (Amdur et al., 1988; Chen et al., 1989).
Аналогичные процессы каталитического окисления диоксида серы в
присутствии ТМ происходят непосредственно в атмосфере (Weschleer et al., 1986;
Conklin, Hoffmann, 1988). Так, они выступают в качестве катализаторов при
окислении четырехвалентной серы, в частности, S02, до шестивалентного
состояния в капельках воды или на влажной поверхности частиц (Durham,
1984; Weschleer, Mandish, Graedel, 1986; Conklin, Hoffmann, 1988a, b; Behra,
Sigg, 1990; Ansari et al., 1997; Cimimo, Toscano, 1998). Диоксид серы,
растворяясь в воде, подвергается гидролизу:
S02 (газ) <-> S02 (раств.),
S02 (раств.) + Н20 <-> HSO3 + Н+ «-> SO^ + 2Н+.
Достаточно сложный механизм каталитического окисления S02 в
водной фазе атмосферного аэрозоля при участии в качестве катализатора
ионов Fe представлен в работе Weschleer et al. (1986):
Fe+з + HSOj <-> FeSO^ + H+,
FeSC>3 + нгО <-> FeHS04 + H+,
FeHS04 + 02 + 2H+ <-> Fe+2 + HSO^ + H202.
В случае Мп, в процессе окисления S+4, вероятно, не происходит
изменения окислительно-восстановительного состояния Мп+2:
03 + HSOJ + Mn+2 -> HSO4 + 02 + Мп+2.
Результаты недавних исследований свидетельствуют, что даже при
низких значениях рН, когда в некаталитических условиях реакция окисления
S02 практически не протекает, присутствие некоторых переходных
металлов и в частности Fe, Mn и Си приводит к возрастанию скорости реакции на
несколько порядков. Этот факт имеет огромное значение, поскольку жид-
44
кофазное окисление S02 является основным механизмом в
биогеохимическом цикле серы в окружающей среде и в процессе увеличения кислотности
атмосферы. Скорость каталитического окисления S02 заметно возрастает
при солнечном освещении (Ansari et al., 1997).
ТМ могут также стимулировать фотоокисление органических и других
соединений, адсорбированных на поверхности частиц (Исидоров и др.,
1992; Hoffman et al., 1994; Carraway, 1994). Значительную роль в
окружающей среде в качестве окислителя играет пероксид водорода. Так, при
рН < 5,0 окисление S02 пероксидом водорода является практически
единственной реакцией образования H2S04 во влажной атмосфере.
Экспериментальные данные свидетельствуют, что в присутствии суспензии оксида
Zn квантовый выход Н202 может быть увеличен до 100% (Hoffman et al.,
1994). Аналогичное возрастание концентрации пероксида водорода
наблюдается также под действием облученных водных суспензий CdS и CdSe
(Carraway et al., 1994).
Благодаря каталитической активности оксидов некоторых ТМ, в
частности оксида Zn, происходит фотокаталитическое окисление ацетата и ряда
других органических соединений, приводящее к их полной минерализации
(Carraway et al., 1994):
СН3СООН + 202 + ZnO + h <r* 2C02 + 2H20 + ZnO + Л.
В работе В.А. Исидорова и др. (1992) при изучении фотостимулирован-
ного окисления различных органических веществ на поверхности
компонентов природного аэрозоля, в частности оксидов цинка, титана,
алюминия и железа, продемонстрирована важность такого рода процессов в
качестве тропосферного стока таких экологически значимых соединений,
как галогенуглеводороды, изопрен и монотерпены, бензол и его гомологи.
Поэтому в настоящее время растворимые фракции ТМ, адсорбированные
на поверхности аэрозолей или в капельках тумана, рассматриваются в
качестве наиболее активных форм в каталитических атмосферных
процессах (Ottar et al., 1989).
Помимо каталитической активности некоторые ТМ, находящиеся в
водной фазе атмосферного аэрозоля, способны принимать участие в
окислительно-восстановительных процессах (Xue et al., 1991). Так, ТМ реагируют с
широким кругом растворенных в атмосферной воде молекул и радикалов.
В ночное время, когда фотохимические превращения прекращаются,
реакции с участием ТМ являются важным источником радикалов в атмосфере
(Weschleer et al., 1986).
Выше уже упоминались химические реакции с участием ТМ,
способствующие их переходу в водорастворимое состояние. Известно, что на
поверхности многих аэрозольных частиц содержатся минеральные кислоты (H2S04,
НС1). Адсорбируясь на таких частицах, ТМ вступают во взаимодействие с
кислотами, образуя хорошо растворимые соли. По мере увеличения
кислотности и окислительного потенциала атмосферы скорость такого рода
реакций будет возрастать, увеличивая подвижность ТМ и в конечном счете
усиливая их токсичное действие на окружающую среду.
Особое значение в атмосферной химии ТМ имеют химические
превращения с участием Hg, поскольку именно они определяют ее
биогеохимические циклы (Ryaboshapko et al., 1998; Fitzgerald et al., 1998). Как извест-
45
но, в атмосфере основная часть Hg находится в элементарной форме,
плохо растворимой в воде. В то же время в осадках (дождевой воде) Hg
существует, как правило, в водорастворимой, двухвалентной форме
(соединениями Hg в дождевой и облачной воде, по-видимому, являются HgCl2 и
CH3HgCl). Таким образом, разумно предположить, что в атмосфере
протекают различные гомогенные и гетерогенные
окислительно-восстановительные процессы, приводящие к изменению валентного состояния Hg и,
соответственно, ее подвижности. Действительно, исследования последних
лет подтвердили, что в атмосферном воздухе Hg принимает участие в
окислительно-восстановительных реакциях, в результате которых может
происходить как окисление элементарной ртути до двухвалентного
состояния, так и восстановление двухвалентной Hg (Iverfeldt, Lindqvist, 1986;
Munthe, McElroy, 1991; Munthe et al., 1991; Munthe, 1991a, b). Такой
окислительно-восстановительный цикл Hg в атмосфере имеет большое
значение, поскольку определяет скорость ее осаждения из атмосферы. Так,
элементарная малорастворимая Hg(O), существующая в газообразной
форме, очень медленно удаляется из атмосферы (по разным оценкам
время жизни ее в атмосфере составляет 0,5-2 года) и способна переноситься
на значительные расстояния от источника эмиссии. В то же время ее
окисленные двухвалентные формы легко растворимы в воде и
быстро,вымываются из атмосферы с осадками (время жизни от нескольких дней до
нескольких недель). Соответственно, можно предположить, что
концентрация растворимых неорганических форм Hg в осадках, а следовательно,
скорость ее осаждения будет определяться соотношением скоростей
окисления и восстановления различных форм (Munthe, 1991a, в).
Основным окислителем Hg в водной фазе атмосферного аэрозоля
является озон (Iverfeldt, Lindqvist, 1986; Munthe, 1991a, в; Munthe, McElroy, 1991),
который способен окислять как элементарную, так и одновалентную Hg.
Предполагается, что при этом протекают следующие реакции:
Hg° + 03 -> HgO + 02,
HgO + 2Н + -» Hg+2 + Н20,
Hg° + Hg+2-> Hg£2,
Hg22 + 03 -> Hg+2 + HgO + 02.
Кроме озона, возможными окислителями атмосферной Hg могут быть
радикалы ОН- и Н02- (Brosset, 1987).
Окисление атмосферной Hg озоном в водной фазе протекает
настолько интенсивно, что можно было бы ожидать обеднения атмосферы
элементарной Hg. Однако в реальности этого не происходит, следовательно, в
воздухе должны протекать какие-то химические процессы,
уравновешивающие быстрое окисление Hg° озоном. Действительно, в водной фазе Hg+2
способна восстанавливаться до элементарной формы растворенным
диоксидом серы со скоростью, сравнимой со скоростью процесса окисления
Hg°, что может препятствовать резкому уменьшению концентрации
элементарной Hg в атмосфере (Munthe, 1991a). Предложен механизм
восстановления двухвалентной Hg диоксидом серы, включающий образование
нестабильного соединения HgS03, при разложении которого образуются
46
ионы одновалентной Hg:
Hg+2 + SOJ2 -» HgS03,
HgS03+ SOJ2 <-» Hg(S03)22#
Hg(so3)22 oHgso3+ so;2^
Hgso3-»Hg+2+ so;-.
Образующиеся в последней реакции SOJ • радикалы быстро вступают в
цепную радикальную реакцию с растворенным кислородом, конечным
продуктом которой является S*4. Одновалентная Hg также быстро
восстанавливается:
Hg+ + HSO; <-> Hgo + SO; • + H+,
Hg+ + Hg+oHgO + Hg2+.
В настоящее время S02 считается основным агентом,
восстанавливающим Hg+2 в атмосфере.
Важным процессом, влияющим на осаждение Hg из атмосферы,
вероятно, является фотохимическое восстановление Hg2+ в водных растворах,
наблюдаемое как в лабораторных, так и в естественных условиях (Brosset,
1987; Munthe, McElroy, 1991; Amyot et al., 1997). Механизм
фотовосстановления двухвалентной Hg в водной фазе до сих пор неясен. Вероятно, фотоин-
дуцированное восстановление Hg должно иметь большое значение в
условиях чистой атмосферы, где вследствие малых концентраций примесей
скорость химических превращений Hg невелика. Таким образом, окислительно-
восстановительные реакции Hg наиболее интенсивно будут протекать в
загрязненной атмосфере, поскольку как S02, так и 03 являются типичными
загрязнителями атмосферного воздуха.
3.3. СТОК ТЯЖЕЛЫХ МЕТАЛЛОВ ИЗ АТМОСФЕРЫ
ТМ могут удаляться из атмосферы путем сухого или мокрого осаждения.
Сухое осаждение
В широком смысле слова под сухим осаждением понимают перенос
загрязняющих веществ из атмосферы на подстилающую поверхность в
отсутствие атмосферных осадков. Процесс сухого осаждения можно разбить на
три этапа (Метеорология и атомная энергия, 1971; Marggrander, Flothman,
1982; Carland, 1982; Rohbock, 1982; Газиев, Соснова,1987; Davidson, Wu, 1988;
Amyot, 1997):
1) перенос загрязнителей через нижние слои атмосферы в квази-лами-
нарный слой (аэродинамический перенос);
2) перенос загрязнителей через квази-ламинарный слой к поверхности
(приграничный перенос);
3) взаимодействие загрязняющих веществ с поверхностью.
47
Аэродинамический перенос загрязняющих веществ происходит под
действием седиментации и турбулентной диффузии. Седиментация (т.е.
осаждение частиц под воздействием силы тяжести) является основным механизмом
удаления грубодисперсных аэрозолей, однако по мере уменьшения их
размеров скорость седиментации падает, и для частиц с диаметром < 1 мкм ею
практически можно пренебречь. Помимо размеров частиц, скорость их
седиментации также зависит от формы и плотности. Для аэрозолей
субмикронных размеров основным механизмом, ответственным за сухое
осаждение, становится турбулентная диффузия. Этот механизм способствует
движению загрязнителей из области высоких в область более низких
концентраций. Когда поверхность является единственным стоком загрязняющего
вещества (как в случае ТМ), концентрация вблизи поверхности всегда будет
ниже и, следовательно, турбулентная диффузия будет вызывать
постоянный поток металлосодержащих аэрозолей по направлению к поверхности
земли (Marggrander, Flothman, 1982).
Под квази-ламинарным понимают слой воздуха, отстоящий от
поверхности на несколько миллиметров и меньше, где эффекты турбулентности
атмосферы минимальны. Перенос загрязнителей через этот слой
осуществляется в основном путем броуновской диффузии и седиментации.
Заключительный этап осаждения загрязняющих веществ происходит,
когда они достигают подстилающей поверхности, при этом свойства самой
поверхности могут оказывать существенное влияние на скорость
осаждения. Например, попадая на гладкую, "нереактивную" поверхность с малой
адсорбирующей способностью частицы могут отскакивать от нее и вновь
поступать в атмосферу. Наоборот, более грубая "реактивная" поверхность
благоприятствует осаждению, увеличивая его скорость. Взаимодействие с
поверхностью включает также повторный вынос загрязняющих веществ в
атмосферу и реэмиссию газов (например, ртути) (Davidson, Wu, 1988).
Под скоростью сухого осаждения (Vd, см/с) понимают величину, равную
Vd = F/C(Z),
где F - плотность потока частиц к поверхности (г/см • с); С - концентрация
загрязнителя (г/см) в воздухе на высоте Z (см).
Основное влияние на скорость сухого осаждения, как уже упоминалось,
оказывают размеры осаждающихся частиц. Зависимости скорости сухого
осаждения от диаметра частиц выявлены в результате как
экспериментальных исследований, так и теоретических расчетов (Marggrander, Flothman,
1982; Carland, 1982; Davidson, Wu, 1988). Оказалось, что частицы с
диаметром в пределах 0,1-1,0 мкм имеют наименьшую скорость сухого осаждения,
при этом самый минимум приходится на диаметр частиц порядка 0,5 мкм.
Существенное возрастание скорости сухого осаждения для частиц с
диаметром > 1-2 мкм связано с их седиментацией, а рост Vd для мельчайших
аэрозолей (d < 0,1) объясняется увеличением интенсивности броуновской
диффузии по мере уменьшения размеров частиц.
Кроме размеров частиц скорость сухого осаждения может зависеть от
многих факторов (плотности частиц, скорости ветра и т.п.) и, в частности, от
гигроскопичности частиц. Так, результаты расчетов СМ. Rojas и др. (1990)
свидетельствуют, что различия в скорости сухого осаждения гидрофобных и
гигроскопичных частиц ТМ могут достигать 32%.
48
Разброс значений скорости сухого осаждения металлосодержащих
частиц достаточно велик, что естественно, поскольку дисперсный состав
аэрозолей меняется в зависимости от профиля источника эмиссии и удаленности
от него, а это, в свою очередь отражается на величине Vd (Carland, 1982;
Rohbock, 1982; Mayer, Ulrich, 1982; Davidson, Wu, 1988; Rojas et al., 1990).
В табл. 3.15 приведены средние значения скорости сухого осаждения ряда
ТМ, а также разброс значений, имеющийся в литературе (Davidson, Wu,
1988). Для большинства ТМ скорость сухого осаждения меньше единицы,
причем более летучие элементы имеют, как правило, меньшую скорость
сухого осаждения.
Мокрое осаждение
Мокрое осаждение, т.е. процесс вымывания загрязняющих веществ
атмосферными осадками, осуществляется с помощью двух механизмов
(Метеорология и атомная энергия, 1971; Barrie, Schemenauer, 1988):
1) внутриоблачного вымывания, основанного на конденсации водяного
пара на аэрозольных частичках;
2) подоблачного вымывания, основанного на захвате аэрозольных
частиц падающими каплями дождя и снежинками.
Когда какое-нибудь тело (например, дождевая капля) проходит через
некоторый объем воздуха, то частицы воздуха расходятся перед ним, увлекая
за собой аэрозоли (Метеорология и атомная энергия, 1971). Однако часть
аэрозолей из-за инерции, электрического притяжения или молекулярной
диффузии пересекает линию тока и сталкивается с дождевыми каплями.
Некоторые частицы при столкновении могут отскочить от капли и затем быть
вновь вовлечены в огибающий ее поток воздуха. Однако какое-то
количество частиц будет захватываться падающими каплями дождя и вымываться из
атмосферы. Наиболее эффективно, таким образом, удаляются
крупнодисперсные аэрозольные частицы, основным процессом вымывания которых
является инерционный захват частиц каплями дождя. По мере уменьшения
размеров частиц до 1 мкм роль инерционного захвата уменьшается и
основным механизмом осаждения на дождевую каплю становится броуновская
диффузия, которая, как известно, является заметной, начиная с размеров
частиц порядка 0,1 мкм, и увеличивается с дальнейшим уменьшением их
размеров. Таким образом, падающие дождевые капли сравнительно хорошо
удаляют пылевые частицы с размерами больше 1 мкм и меньше 0,1 мкм, в
то время как аэрозоли средней дисперсности (0,1-1 мкм) плохо поддаются
вымыванию (Метеорология и атомная энергия, 1971).
Известно, что с уменьшением интенсивности дождя размеры дождевых
капель тоже уменьшаются, при этом сокращается и скорость их падения.
Когда скорость будет сравнима со скоростью восходящих потоков, время
пребывания капли в обтекающем ее потоке аэрозольных частиц возрастает,
что увеличивает число частиц, которые успевают продиффузировать к
поверхности капли. Поэтому слабый дождь будет вымывать загрязняющие
вещества из атмосферы лучше, чем сильный (Метеорология и атомная
энергия, 1971).
Вымывание частиц может происходить не только под действием дождя,
но и при снегопаде. Эффективность очистки при снегопаде меняется в зави-
49
симости от вида снежных кристаллов, их формы, скорости падения,
электрического заряда. Можно ожидать, что при одной и той же интенсивности
осадков мелкие частицы будут с большей эффективностью захватываться
медленно падающими рыхлыми снежинками с их большим поперечным
сечением и, по-видимому, большим электрическим зарядом, чем равными им
по массе водяными капельками. В ряде работ экспериментально
подтверждено, что снег очищает подоблачный слой атмосферы от аэрозольных
частиц лучше, чем дождь (Метеорология и атомная энергия, 1971; Газиев, Сос-
нова, 1987).
Вымывание загрязняющих примесей внутри облака происходит более
интенсивно, чем вымывание в подоблачном слое атмосферы. Основным
механизмом вымывания здесь является конденсация воды на аэрозольных
частичках, что приводит к образованию облачных капель, содержащих
загрязняющие вещества. Такого рода конденсация может происходить на частицах
с диаметром более 0,2 мкм, причем наиболее интенсивно - на
гигроскопичных аэрозолях с большим содержанием растворимых солей. Доля
аэрозольных частиц, включенных в облачную воду, зависит от размера аэрозолей.
Чем меньше размеры металлосодержащих аэрозолей, тем меньше они
будут поглощаться облачной водой во время процессов конденсации. Для
мелкодисперсных аэрозолей с размерами менее 0,1 мкм процесс внутриоблач-
ного вымывания может происходить за счет броуновской диффузии
(Метеорология и атомная энергия, 1971; Barrie, Schemenauer, 1988). Таким
образом, как в случае подоблачного вымывания, наиболее интенсивно
удаляются из атмосферы крупно и мелкодисперсные аэрозоли, в то время как
частицы средней дисперсности обладают наименьшей скоростью внутриоблачно-
го вымывания.
Скорость мокрого осаждения оценивается с помощью константы
вымывания^ равной
SR = С/К,
где С - концентрация вещества в осадках, К - концентрация вещества в
воздухе.
Чем выше константа вымывания, тем более эффективно данное
вещество выводится из атмосферы путем мокрого осаждения.
Константа вымывания рассчитывается на основе экспериментальных
данных, осредненных за определенный период времени (от нескольких
часов до нескольких месяцев). Поэтому разброс значений SR, часто
наблюдаемый в литературных данных, во многом зависит от времени усреднения.
Константы вымывания некоторых металлов, полученные на основе
измерения их концентраций в дождевой воде и воздухе Западной Германии
(Rohbock, 1982), позволяют заключить, что наименее интенсивно удаляются
из атмосферы РЬ и Cd (табл. 3.16).
Экспериментально полученные зависимости константы вымывания от
размеров частиц в большинстве случаев подтверждают теоретические
предположения об уменьшении величины SR с уменьшением диаметра
аэрозолей, хотя в некоторых случаях такого рода зависимость не наблюдалась
(Barrie, Schemenauer, 1988).
Говоря о сухом и мокром осаждении ТМ, мы рассматриваем механизмы
удаления только металлосодержащих аэрозолей. Однако, как известно,
определенная доля ТМ существует в атмосфере в газообразном виде.
50
Процессы осаждения газообразных соединений ТМ в литературе
практически не освещались, за исключением Hg. Основным механизмом
выведения газообразной Hg из атмосферы по современным представлениям
является ее сорбция на аэрозольных частицах и осаждение на подстилающую
поверхность. Атмосферные осадки из подоблачного слоя воздуха удаляют
элементарную, практически не растворимую в воде Hg крайне слабо. Однако
последние исследования свидетельствуют, что Hg может подвергаться на
воздухе процессам окисления до двухвалентного состояния, а затем уже
достаточно эффективно вымываться из атмосферы путем мокрого осаждения
(Lidqvist, Rodhe, 1985; Munthe, 1991a; Dvonch et al., 1999).
Таким образом, основным этапом осаждения газообразных соединений
ТМ является их адсорбция на аэрозольных частицах с последующим
мокрым осаждением. Кроме того, газообразные соединения (например,
хлориды), легко растворимые в облачной воде, могут удаляться из атмосферы
непосредственно, без предварительного осаждения на аэрозольных частицах,
в то время как малорастворимые соединения практически не подвергаются
непосредственному мокрому осаждению. Впрочем, такого рода зависимость
интенсивности мокрого осаждения от растворимости прослеживается и для
аэрозольных частиц: чем больше они растворимы, тем более эффективно
вымываются из атмосферы осадками (Метеорология и атомная энергия,
1971; Barrie, Schemenauer, 1988).
Обобщая имеющиеся в литературе данные о процессах сухого и
мокрого осаждения ТМ, можно сделать вывод, что суммарная скорость удаления
аэрозоля из атмосферы по мере уменьшения размеров частиц примерно до
1 мкм сначала уменьшается (в диапазоне 0,1-1,0 мкм остается
минимальной), а затем, при переходе к еще более мелким (субмикронным) частицам,
снова возрастает.
Соотношение количеств металлсодержащих аэрозолей, поступающих
на подстилающую поверхность земли в результате сухого или мокрого
осаждения, будет зависеть от профиля антропогенного источника, удаленности
от него, эффективности очистного оборудования и, естественно, от
количества осадков. В настоящее время считается, что мокрое осаждение ТМ
доминирует над сухим практически над всей территорией Европы (Alcamo
et al., 1992). Так, непосредственно вблизи источника загрязнения, доля ТМ в
сухих выпадениях, за счет наличия в воздухе грубодисперсных аэрозолей,
может составлять 70-80% от общего количества осаждающихся ТМ
(табл. 3.17) (Pattenden et al., 1982). Однако по мере удаления от источника
эмиссии она уменьшается и уже в сельских районах Евролы составляет
всего 10-30%, т.е. основная масса ТМ поступает на подстилающую поверхность
Европы с атмосферными осадками (Alcamo et al., 1992). Этот вывод вполне
подтверждается результатами исследования поступления цинка и кадмия с
атмосферными осадками в фоновых и техногенных районах (табл. 3.18)
(Цинк и кадмий в окружающей среде, 1992). Вблизи от источника две трети
осаждающихся ТМ поступают на подстилающую поверхность с твердыми
осадками, однако уже на расстоянии 6-10 км от источника только треть и
менее ТМ осаждаются сухим способом. В фоновых же районах поступление
Цинка с жидкими атмосферными осадками в 7-8 раз выше по сравнению с
твердыми, кадмия - выше в 16-160 раз.
51
Перенос тяжелых металлов в атмосфере
Время удержания ТМ в атмосфере. Основной характеристикой,
определяющей поведение ТМ в атмосфере после выброса и, в частности, их
способность перемещаться на большие расстояния, является время их
существования (удерживания) в воздухе.
Время удержания ТМ в атмосфере зависит от суммарной скорости их
мокрого и сухого осаждения, которая, в свою очередь, определяется
метеорологическими условиями и, главное, размерами частиц. Крупнодисперсные
частицы с размерами более 2 мкм осаждаются путем седиментации в
течение примерно нескольких часов. Аналогично быстро, благодаря процессам
диффузии, удаляются из атмосферы мельчайшие частицы (с диаметром
^0,1 мкм). Таким образом, к наиболее долгоживущим можно отнести
металлсодержащие частицы с размерами 0,1-2,0 мкм, причем максимум
времени удерживания в атмосфере приходится примерно на размеры 0,3-0,5 мкм
(Muler, 1982). Термическая диффузия и седиментация, как уже упоминалось,
имеют очень ограниченное значение для аэрозольных частиц таких
размеров, и основным механизмом их удаления из атмосферы является мокрое
осаждение.
Поскольку летучие элементы, как правило, входят в состав более
мелких частиц, чем нелетучие, время удерживания в атмосфере ТМ является
также функцией их летучести. Время удерживания в атмосфере для ТМ
составляет 1-3 суток (Muler, 1982). Эти величины согласуются со многими
значениями, приведенными в литературе, хотя разброс значений часто
достаточно велик (от нескольких часов до месяца) (Брюханов и др., 1988, 1989;
Аналитический обзор загрязнения..., 1989). Например, по мнению
R.M. Harrison и D.N. Laxen, время жизни аэрозолей РЬ в атмосфере
колеблется от 7 до 30 суток, в 9 суток оценивается время удерживания в атмосфере
соединений As (Гамаюрова, 1993). В то же время в работах, посвященных
моделированию переноса ТМ в атмосфере над Европой, время удерживания
Cd и As оценивается в 27 ч, РЬ - в 64 ч (Alcamo et al., 1992).
Время удерживания в атмосфере Hg оценивается различными авторами
от 7 суток до 1,5-2 лет (Брюханов и др., 1989; Munthe, 1991a). Считается, что
наиболее реальные значения составляют для водорастворимых форм Hg и
фракций, связанных с аэрозолями - от нескольких дней до нескольких
недель, для элементарной формы - от нескольких месяцев до года (Lidqvist,
Rodhe, 1985; Munthe, 1991a; Olmez et al., 1998; Elliot, Holey, 1998). Были
проанализированы результаты самолетных измерений концентраций паров Hg
в атмосфере, позволяющие сделать независимые оценки распространения
Hg в атмосфере (Зенкевич, 1992).
Используя модель вертикального переноса Hg в результате
турбулентной диффузии и экспериментальные данные по вертикальному
распределению концентраций Hg, мы рассчитали время жизни Hg в атмосфере
различных регионов бывшего СССР. Среднее время жизни паров Hg в атмосфере
фоновых районов оценивается 46 ± 16 суток, для загрязненных воздушных
масс, перенесенных с Западной Европы, - 16 ± 7 суток, т.е. полученные
значения несколько меньше общепринятых. Однако в любом случае, Hg
является наиболее долгоживущим в атмосфере ТМ и, соответственно, может
распространяться в атмосфере значительно дальше от источника выброса,
чем остальные ТМ.
52
Локальное загрязнение окружающей среды ТМ. Дисперсный состав
металлсодержащих аэрозолей, выбрасываемых промышленными
предприятиями, колеблется в достаточно широких пределах и во многом определяется
эффективностью пыле- и золоулавливающего оборудования. Естественно,
что в случае малоэффективного очистного оборудования или его
отсутствия в атмосферу могут выбрасываться значительные количества крупных
частиц с размерами 2-10 мкм и более.
Такие частицы, попадая в атмосферу, довольно быстро осаждаются
вблизи источника, создавая так называемые техногенные геохимические
аномалии, в которых концентрации ТМ в атмосфере, почвах и других
природных объектах могут достигать очень высоких значений и превышать
фоновые в сотни раз (Gregurek et al., 1997; Яхтин и др., 1997а). Доля локально
осаждающихся ТМ и, соответственно, размеры аномалий, зависят от
профиля антропогенного источника, используемых технологий и сырья,
эффективности пыле-, золоулавливающего оборудования, высоты выброса и т.д.
Например, при высоких дымовых трубах значительная концентрация
выбросов создается в приземном слое атмосферы на расстоянии 10-14 Я, где
Я- высота трубы. Для труб высотой 10-15 м максимальные концентрации
в воздухе образуются в непосредственной близости от источника
(Добровольский, 1983).
В работе J. Alcamo et al. (1992) при моделировании трансграничного
переноса загрязняющих веществ, доля локально осаждающихся ТМ в
Западной Европе оценивается в 5-15% от выброса, однако, по-видимому, эти
значения несколько занижены. Так, измерения, проведенные в районе
медеплавильного завода Садбери (Канада), показали, что при отсутствии природных
осадков из двух труб высотой 194 и 381 м в зоне радиусом 40 км выпадает:
Fe - 15,2; Al - 8,9; Ni - 2,6% и более мелких аэрозолей Pb, Zn и Cd - менее
2%. В дни выпадения осадков доля локально осаждающихся ТМ возрастает
до: Fe - 68, Си - 100, № - 36, Zn - 92, Al - 80, Сг - 14, Cd - 10%. При
выбросе из трубы высотой 93 м в сухие дни доля выпадений в указанной зоне
составляла: Fe - 100, Ni - 29, Al - 58, Pb - 13, Cd - 1%.
Аналогичные исследования были проведены на расстоянии 60-120 км
от нескольких заводов черной и цветной металлургии и
теплоэлектростанций, работающих на каменном угле (Василенко и др., 1986). При этом
оценивалась доля загрязняющих веществ, вовлекаемых в дальний
атмосферный перенос. Оказалось, что локальные выпадения ТМ вокруг
предприятий черной металлургии составляют 15-37%, цветной металлургии -
18-40%, тепловых электростанций - 40-50% от эмиссии
соответствующего металла. Эти данные согласуются с результатами исследований Л.В. Са-
таевой и др. (1990), где доля ТМ (Pb, Zn, Си), осаждающихся на почву в
ближней 10-километровой зоне от металлургических предприятий,
оценивается в 10-30% от их выброса в атмосферу. В то же время при
исследовании снежного покрова на расстоянии 10-15 км от никелевого комбината
было найдено, что поступление никеля составляет 62% от общего объема
выброса.
В табл. 3.19 приведены атмосферные потоки ТМ в зонах влияния
металлургических производств (Яхтин и др., 1997а, б). Как можно видеть, с
увеличением расстояния от источника, количество выпадающих ТМ резко
уменьшается. В целом область интенсивного выпадения пылевых выбросов огра-
53
ничивается расстоянием 40-50 км от металлургических комбинатов, что
подтверждается результатами Т.И. Моисеенко и др. (1998).
Своеобразие антропогенной эмиссии РЬ в результате сжигания
этилированного топлива состоит в том, что выбросы поступают в атмосферу на
высоте всего 0,5 м от поверхности земли, основная их часть (до 80%) оседает в
непосредственной близости от автомобильных дорог (до 200-300 м) и лишь
примерно 20% (мелкодисперсная фракция) переносится на значительные
расстояния. Впрочем, даже эта доля соизмерима с эмиссией РЬ от цветной
металлургии (Бурцева и др., 1991).
Для Hg соответствующие показатели локального осаждения
существенно ниже, чем для остальных ТМ. Например, в обзоре О. Lidqvist, H. Rodhe
(1985) доля локально осаждающейся Hg оценивается в 10, максимум в 20% от
ее эмиссии в атмосферу. В работе Т. Wallin (1976) на примере хлорного
завода показано, что не более 10% ртути оседает на расстоянии 15 км от завода,
в то время как остальное количество уносится на более дальние расстояния
и вносит вклад в глобальный фон. Ю.С. Куклиным и Л.Г. Коробейниковой
(1978) при исследовании снежного покрова вокруг отдельно расположенных
предприятий, выбрасывающих Hg, обнаружено, что годовое выпадение Hg в
радиусе до 15 км составляет около 7% от выбросов предприятия.
Вблизи источника выбросов ТМ, как уже упоминалось, образуются
техногенные аномалии, характеризующиеся высоким содержанием ТМ во всех
природных объектах (воздухе, почвах, водах, растительности и т.д.).
В табл. 3.20 приведены среднесуточные концентрации ТМ в атмосферном
воздухе вблизи некоторых наиболее характерных источников ТМ, а также
коэффициенты концентрации, рассчитанные по отношению к городскому и
региональному фону (Гордон, Пейсахов, 1977). Выявлено, что в центре
аномалии концентрации ТМ в атмосфере могут превышать фоновые
уровни в десятки раз. По мере удаления от источника выбросов, содержание ТМ
в воздухе постепенно убывает, причем пространственное распределение ТМ
в воздухе вокруг различных предприятий имеет характерные особенности.
Выделяются две зоны:
1) ближняя, где происходит резкое убывание концентрации элемента по
мере удаления от источника;
2) дальняя - территория, где градиент значительно меньше и происходит
плавное уменьшение содержания ТМ в воздухе до фоновых.
Первая зона во всех случаях сравнительно небольшая, вторая -
примерно на порядок больше.
Абсолютные размеры зон зависят от характера источника загрязнения.
Для металлургических предприятий и ТЭЦ размеры первой (наиболее
опасной по уровням загрязнения воздуха) зоны - сотни метров, общие размеры
потока достигают 15 км. Даже для небольших предприятий по производству
вторичных цветных металлов параметры аномалий примерно такие же. Для
машиностроительных предприятий зона воздействия ТМ на атмосферный
воздух - сотни метров, для транспорта - десятки метров.
Таким образом, геохимические техногенные аномалии можно разделить
на две основные части:
1) центр, где наблюдаются наиболее высокие концентрации ТМ в
атмосферном воздухе (в основном 0,5 км от предприятий машиностроительного
типа и до 1,5 км для металлургических комбинатов);
54
2) периферийная часть аномалии, где содержание химических элементов
обычно не превышает гигиенических нормативов, но выше фоновых
значений в нескольких раз.
В табл. 3.21 приведены обобщенные данные среднесуточных
наблюдений по содержанию ТМ в воздухе в центре и на периферии аномалий около
некоторых предприятий, а также для сравнения показаны концентрации ТМ
в наиболее чистых районах городов, являющихся по уровню загрязнения
переходными территориями между техногенными аномалиями и
региональными фоновыми значениями. Видно, что в центрах аномалий средние
концентрации Pb, Zn, Ni и Сг в атмосфере значительно (17-63 раза) выше
значений регионального фона, а максимальные выше в сотни раз. На
периферии аномалий коэффициент превышения средних концентраций снижается
до 3-14, но эпизодически возникающие максимальные концентрации для
большинства ТМ выше фоновых значений в 12-33 раза, РЬ - в 127 раз. В
воздухе наиболее чистых районов города средние концентрации в основном
только в три раза выше фоновых, хотя максимальные концентрации
металлов продолжают оставаться чрезвычайно высокими.
Высокое содержание ТМ в воздухе вблизи источников выбросов,
причем часто в грубодисперсной форме, обусловливает мощный поток ТМ на
подстилающую поверхность аномальных участков (Сает и др., 1990). Такое
локальное осаждение ТМ приводит к значительному загрязнению почв и
других природных объектов вблизи промышленных предприятий. При этом
площади рассеяния ТМ в почвах обычно значительно больше, чем в
воздухе (вследствие накапливания ТМ) и могут достигать 30-40 км. Здесь также
можно выделить две зоны. Первая, непосредственно примыкающая к
предприятию, характеризуется очень высоким содержанием ТМ в почвах и
вследствие этого, разрушением исходного природного комплекса
(ландшафта). В ней часто отсутствует растительность, в значительной мере нарушен
почвенный покров, исчезают населявшие его животные и микроорганизмы.
Во второй, более обширной зоне, заметно угнетение, иногда исчезновение
отдельных составных частей биоты. В периферийной части этой зоны
природный комплекс сохраняется без изменений, хотя в почвах и
растительности отмечается повышенное содержание ТМ.
Исследование техногенной аномалии вокруг крупного медно-никелевого
комбината показало, что зона сильного повреждения имеет радиус 3-5 км.
Вторая зона распространяется до 20 км. В первой зоне биота и почва
практически разрушены, ежегодно на поверхность поступает ТМ в несколько сотен
и даже тысяч раз больше по сравнению с глобальным фоном. Концентрация
никеля в почве по направлению от источника к периферии убывает очень
быстро в зависимости близкой к экспоненциальной. На протяжении второй
зоны происходит убывание концентрации, описывающееся линейной
зависимостью, до уровня местного геохимического фона (Добровольский, 1983).
Предприятия меньшей мощности имеют не столь обширные площади
рассеяния ТМ в почвах. На основе изучения геохимических аномалий почв,
образующихся вокруг различных небольших промышленных предприятий,
сделан вывод, что размеры зон неблагоприятного воздействия ТМ (с
высоким и среднем уровнем загрязнения) для металлургии и крупных ТЭЦ
составляют от 5-6 до 10 км; машиностроения - 1,5-2 км; приборостроения - до
0,5 км; автотранспорта - 0,1 км (Сает, 1990).
55
Перенос ТМ на большие расстояния. Определенная часть ТМ,
поступающих в атмосферу из антропогенных источников, локально осаждается
вблизи предприятия, тогда как другая часть может переноситься в
атмосфере на значительные расстояния от источника выброса. В зависимости от
профиля предприятия, эффективности пыле- и золоулавливающего
оборудования и т.д. доля ТМ, вовлекаемых в дальний перенос, колеблется от 50 до
85% (Василенко и др., 1986; Alcamo et al, 1992).
Основным параметром, определяющим расстояние, на которое могут
перемещаться в атмосфере загрязняющие вещества, является время их
удерживания: чем оно больше, тем дальше загрязнители мигрируют от
источника эмиссии. В работе (Alcamo et al., 1990) изучена зависимость расстояния от
времени удерживания ТМ в атмосфере, рассчитанная на основе модели
траекторий Лангмюра. Авторы определяют расстояние, на которое способны
переноситься аэрозольные массы Cd, As, Zn и Pb в Европе.
Учитывая, что время жизни в атмосфере для Cd, As и Zn оценивается
в 27 ч, a Pb - в 64 ч, соответствующие расстояние для Cd, As и Zn
составляют 860-900 км, Pb - 1600-1900 км (Alcamo et al., 1990, 1992), т.е. ТМ скорее
можно отнести к региональным, а не глобальным загрязнителям.
Исключение составляет Hg, продолжительное время удерживание в
атмосфере которой, позволяет ей мигрировать на значительно большие
расстояния от источника эмиссии - 10 тыс. км и более (Ионов, Назаров, 1976).
Именно поэтому Hg в настоящее время рассматривается как глобальный
загрязнитель окружающей среды, способный перемещаться в атмосфере в
пределах полушария (Тяжелые металлы..., 1994).
Способность ТМ переноситься в атмосфере на значительные расстояния
и, соответственно, осаждаться на территориях, удаленных от источника
выброса на сотни и даже тысячи километров, приводит к постепенному
загрязнению ТМ непромышленных районов земли. Так, дальний перенос ТМ
является одним из наиболее важных путей загрязнения арктических
территорий. Последние исследования свидетельствуют, что от 3 до 14% от всей
эмиссии As, Cd, Pb, Zn и V в Евразии осаждается в Арктике ( Pacyna, Ottar,
1985; Pacyna, 1989; Pacyna, 1993). В работах (Виноградова, 1993; 1996а, б,
1997; Виноградова, Егоров, 1996; Виноградова, Пономарева, 2000)
оценивается степень воздействия промышленных регионов Северного полушария
на содержание ТМ в атмосферном аэрозоле в различных частях Российской
Арктики (табл. 3.22). Как видно, свой вклад в антропогенное загрязнение
арктических территорий вносят все основные промышленные регионы
Евразии.
Одним из основных способов изучения переноса загрязнителей на
большие расстояния является математическое моделирование. Современные
расчетные методы позволяют получать достаточно удовлетворительное
соответствие между расчетными и экспериментальными данными (Petersen
et al., 1990; Alcamo et al., 1992; Pacyna et al., 1993; Petersen, 1993; Pankrath, 1993;
Ryaboshapko et al., 1999). Моделирование миграции ТМ в атмосфере
позволяет определять происхождение ТМ, осаждающихся в отдаленных местах, а
также вклад атмосферного переноса в загрязнение ТМ определенных
регионов, например, различных морей, озер, стран и т.д. Например, очень
подробно в Европе изучалось загрязнение ТМ поверхностных вод Северного и
Балтийского морей, при этом проводились не только расчеты, но и долго-
56
временные экспериментальные наблюдения (Petersen et al., 1988; Krell,
Roeckner, 1988; Pacyna, 1992; Pankrath, 1993). Результаты этих исследований
позволяют сделать вывод, что более чем 50% РЬ и Hg и от 30 до 50% As, Cd,
Сг, Си, Ni и Zn поступают в эти моря путем атмосферного переноса (Petersen
et al., 1990; Pankrath, 1993). Как можно видеть из данных, представленных в
табл. 3.23, это десятки и сотни тонн ТМ.
Помимо загрязнения фоновых районов ТМ, существует еще одна
проблема, связанная с возможностью их дальнего переноса в атмосфере:
выбрасываемые в одной стране ТМ, могут легко пересекать границы между
государствами, осаждаясь на территории других стран. Особенно остро эта
проблема стоит в Европе, где сконцентрировано большое количество промыш-
ленно развитых государств, расстояния между которыми не велики.
Поэтому большинство европейских стран являются не только поставщиками ТМ в
воздушную среду, но и сами постоянно страдают от воздействия выбросов
других государств (Ryaboshapko et al., 1999). Например, несмотря на
значительное снижение антропогенных выбросов Hg в Швеции, количество Hg,
осаждающейся в отдаленных районах этой страны не уменьшается в связи с
ее переносом из соседних стран (Meili, 1988).
В работе L. Bozo (1993) продемонстрировано влияние атмосферного
переноса ТМ из ряда европейских государств на осаждение РЬ и Cd на
территорию Венгрии. Из общего количества, осаждающегося РЬ и Cd вклад самой
Венгрии составляет 6-16%, тогда как основная масса ТМ, имеет
"иностранное происхождение".
Аналогичные данные, касающиеся Польши, получены в работе Bartnicki
(1990). Результаты моделирования переноса As и РЬ, выбрасываемых
промышленными предприятиями Польши, свидетельствуют, что около 70%
этих ТМ осаждаются за пределами страны, мигрируя на территорию
соседних государств и Балтийское море. В работе Рябошапко (Ryaboshapko, 1999)
представлены результаты моделирования атмосферного переноса Pb, Cd и
Hg над территорией Европы. Согласно этим результатам, только половина
от общего количества ТМ, выбрасываемых в отдельной европейской
стране, осаждается на ее же территории. Остальная часть выбросов
вовлекается в дальний перенос, загрязняя другие страны и отдаленные регионы
(Арктику). Учитывая вышесказанное, становится ясно, что в регионах с близко
расположенными странами, как в Европе, снижение выбросов ТМ в какой-
либо отдельной стране может не сказаться на уменьшении их потока из
атмосферы. Действительное снижение нагрузки ТМ на окружающую среду
возможно лишь путем совместных усилий близлежащих государств в
области контроля за выбросами ТМ.
3.4. ОБЩИЕ ОСОБЕННОСТИ ПОВЕДЕНИЯ
ТЯЖЕЛЫХ МЕТАЛЛОВ В АТМОСФЕРЕ
Тяжелые металлы существуют в атмосфере как в аэрозольном, так и
парообразном состоянии (в виде газообразных соединений или субмикронных
частиц с размерами менее 0,1-0,5 мкм). Доля ТМ в парообразном состоянии
может колебаться от нескольких процентов до 90% и зависит от природы
элемента, источника выброса и удаленности от него. Доля ТМ в парообраз-
57
ном состоянии, как правило, выше для более летучих элементов (As, Se, Zn,
Pb, Cd, Си) по сравнению с нелетучими (Со, Ni) и увеличивается по мере
удаления от источника.
Металлсодержащие аэрозоли промышленного происхождения обычно
полидисперсны и состоят из возгонов и, так называемого, механического
уноса. Возгоны образуются в результате испарения соединений ТМ при
высокотемпературных процессах и их последующей конденсации по мере
охлаждения пылегазового выброса. Возгонная пыль, как правило, имеет
субмикронные размеры. Кроме того, некоторые высоко летучие металлы могут
эмиттировать в газообразном состоянии. Под механическим уносом
понимают пыль, образующуюся в результате иных, нежели конденсация, процессов
(транспортировка, пересылка, дробление и т.д.). Пыль механического уноса
обычно более крупнодисперсна и имеет размеры порядка 5-10 мкм и более.
Дисперсный состав металлсодержащих аэрозолей быстро меняется по мере
удаления от источника в сторону уменьшения размеров частиц, и в фоновых
районах до 98% ТМ ассоциированы с аэрозолями субмикронных размеров.
Непосредственно после выброса в атмосферу основная часть ТМ
находится в нерастворимом в воде состоянии. Количество ТМ в растворимом
виде зависит от природы элемента, химического состава выбросов и профиля
антропогенного источника. По мере удаления от источника доля ТМ в
растворимых формах увеличивается за счет выпадений крупнодисперсных
частиц и химических реакций, протекающих в атмосфере. В воздухе фоновых
районов основная масса ТМ находится в растворимом виде (50-100%). Доля
водорастворимых форм ТМ в атмосферных осадках выше по сравнению с
аэрозолями. Аэрозольные выбросы ТМ, образующиеся в результате
высокотемпературных процессов, как правило, обогащены ТМ по сравнению с
литосферой и исходным сырьем, при этом, чем меньше размеры частиц, тем
больше коэффициент обогащения.
В выбросах промышленных предприятий и атмосфере основная часть
ТМ содержится либо в виде оксидов, либо в форме различных солей
(хлоридов, сульфатов, сульфидов, карбонатов и т.д.). 90-100% ртути эмиттирует в
атмосферу в газообразном состоянии - в виде элементарной ртути или ее
двухвалентных газообразных соединений (главным образом, хлорида
ртути). 70-75% свинца в автомобильных выхлопах выбрасывается в виде
неорганических соединений, в основном, смешанных галогенидов. Доля металл-
органических соединений ТМ в выбросах и атмосферном воздухе,
по-видимому, невелика. Исключение составляет ртуть, доля метилированных
соединений которой в атмосфере по некоторым данным может достигать 30%.
В атмосфере ТМ могут взаимодействовать с минеральными кислотами,
образуя растворимые соли. Некоторые ТМ (Си, Zn, Mn, Fe) могут выступать
в качестве катализаторов при окислении четырехвалентной серы (S02) до
шестивалентного состояния. Кроме того, ТМ могут стимулировать
фотоокисление некоторых летучих органических соединений (галогенуглеродов,
изопрена и монотерпенов, бензола и его гомологов), адсорбированных на
поверхности аэрозольных частиц. Ртуть в атмосферном воздухе принимает
участие в окислительно-восстановительных реакциях, в результате которых
может происходить как окисление элементарной Hg до двухвалентного
состояния, так и восстановление двухвалентной Hg. Основным окислителем
Hg в атмосфере является озон, восстановителем - диоксид серы.
58
Сток ТМ из атмосферы осуществляется путем сухого и мокрого
осаждения. Суммарная скорость сухого и мокрого осаждения металлосодержащих
аэрозолей из атмосферы по мере уменьшения размеров частиц примерно до
1 мкм сигнала уменьшается, в диапазоне 0,1-1,0 мкм остается минимальной,
а затем при переходе к еще более мелким, субмикронным, частицам снова
возрастает. Соотношение ТМ, поступающих на подстилающую поверхность
в результате сухого и мокрого осаждения, определяется дисперсным
составом выброса. Основным механизмом выведения крупнодисперсных
аэрозолей является седиментация (сухое осаждение). Доля ТМ в сухих выпадениях
вблизи источника выброса за счет наличия грубодисперсных частиц может
достигать 80%, однако по мере удаления от источника она быстро
уменьшается и уже в сельских районах Европы составляет всего 10-30%, т.е.
основная масса ТМ поступает на подстилающую поверхность Европы с
атмосферными осадками. Сток Hg из атмосферы осуществляется главным образом
путем окисления ее элементарной формы до двухвалентного состояния,
хорошо растворимого в воде, и последующего вымывания его атмосферными
осадками.
Время удерживания ТМ в атмосфере оценивается от одного до
нескольких дней, для элементарной формы Hg - от нескольких месяцев до двух лет,
для аэрозольной и растворимых форм двухвалентной Hg - от нескольких
недель до нескольких месяцев. Крупнодисперсные аэрозоли, не уловленные
золо- и пылеулавливающим оборудованием, локально осаждаются вблизи
источника выброса, образуя так называемые, техногенные аномалии. Доля
большинства локально осаждающихся ТМ оценивается в пределах 15-50%
(для Hg - 10-20%) в зависимости от профиля антропогенного источника и
эффективности очистного оборудования. От 50 до 85% поступающих в
атмосферу ТМ вовлекаются в перенос на большие расстояния. По
современным оценкам ТМ являются региональными загрязнителями, способными
перемещаться в атмосфере на несколько тысяч километров от источника
выброса. Исключение составляет ртуть, продолжительное время
удерживания в атмосфере которой соответствует возможности переноса на
расстояние более десяти тысяч километров.
Литература
Акылбеков А.А., Палкина В.И., Эннс И.И., Серба Н.Г. Переработка
конверторных пылей медеплавильных заводов // Малоотходные технологии переработки
полиметаллического сырья. Усть-Каменогорск: ВНИИцветмет, 1989. С. 33-37.
Аналитический обзор загрязнения природной среды тяжелыми металлами в
фоновых районах стран-членов СЭВ (1982-1988 гг.). М.: Гидрометеоиздат, 1989.
87 с.
Богатырев М.Ф., Юрлов BJI. Особенности устройства и эксплуатации
пылеулавливающей установки промышленного агрегата КИВЦЭТ-ЦС // Малоотходные
технологии переработки полиметаллического сырья. Усть-Каменогорск:
ВНИИцветмет, 1989. С. 43-51.
Бондарев JIT. Роль растительности в миграции минеральных веществ в
атмосферу // Природа. 1983. № 3. С. 86-90.
Бримблкумб П. Состав и химия атмосферы. М.: Мир, 1988. 351 с.
Брюханов П.А., Исправникова В.В. Экспериментальная оценка параметров
выведения загрязняющих веществ на подстилающую поверхность на побережье
Финского залива // Загрязнение атмосферы в регионе Балтийского моря: Миграция за-
59
грязняющих веществ и их воздействие на окружающую среду. Л.: Гидрометеоиздат,
1989. С. 49-58.
Брюханов П.А., Исправникова В.В., Королев СМ., Лысак А.В. Исследование
распространения загрязняющих веществ в атмосфере и их поступление на снежный
покров в районе Финского залива // Дальний атмосферный перенос загрязняющих
веществ. М.: Гидрометеоиздат, 1988. С. 136-142.
Бурцева Л.В., Лапенко Л.А., Волошева ГЛ., Васъковский AT. Результаты
изучения субмикронной составляющей тяжелых металлов в атмосферном воздухе //
Мониторинг фонового загрязнения природной среды. Л.: Гидрометеоиздат, 1986.
Вып. 3. С. 125-133.
Бурцева Л.В., Лапенко Л А., Кононов Э., Юшкан Е. Оценка состояния
загрязнения атмосферы фоновых районов СССР тяжелыми металлами // Проблемы
фонового мониторинга состояния природной среды. Л.: Гидрометеоиздат, 1990. Вып. 8.
С. 3-21.
Бурцева Л.В., Лапенко Л.А., Кононов Э.Я. и др. Фоновое содержание свинца,
ртути, мышьяка и кадмия в природных средах // Мониторинг фонового загрязнения
природной среды. Л.: Гидрометеоиздат, 1991. Вып. 7. С. 23-56.
Василенко В.И., Назаров И., Фридман Ш. О некоторых закономерностях
атмосферных выпадений загрязняющих веществ от локальных и площадных
источников // Проблемы фонового мониторинга состояния природной среды. Л.:
Гидрометеоиздат, 1986. Вып. 4. С. 205-211.
Виноградова А.А. Микроэлементы в составе арктического аэрозоля // Изв. АН.
Физика атмосферы и океана. 1993. Т. 29. С. 437-456.
Виноградова АЛ. Атмосферный перенос антропогенных примесей в
центральную часть Российской Арктики // Экол. химия. 1996а. Т. 5, № 1. С. 3-10.
Виноградова АЛ. Элементарный состав атмосферных аэрозолей Российской
Арктики // Изв. АН. Физика атмосферы и океана. 19966. Т. 32, № 4. С. 479-^88.
Виноградова АЛ. Атмосферный перенос пассивных примесей в разные части
Российской Арктики в весеннее время года // Докл. РАН. 1997. Т. 355, № 5.
С. 677-679.
Виноградова АЛ., Егоров ВЛ. О возможностях дальнего атмосферного
переноса загрязнений в Российскую Арктику // Изв. РАН. Физика атмосферы и океана.
1996. Т. 32, № 6. С. 796-802.
Виноградова АЛ.У Пономарева Т.Я. Источники и стоки антропогенных
пассивных примесей в Российской Арктике весной и летом // Там же. 2000. Т. 36, № 3.
С. 357-365.
Газиев Я.И.у Соснова А.К. Физико-математическое моделирование процессов
аэрозольного загрязнения почв промышленными дымовыми выбросами в
атмосферу и продуктами их физико-химических превращений // ТИЭМ. 1987. Вып. 14 (129).
С. 3-15.
Гамаюрова B.C. Мышьяк в экологии и биологии. М.: Наука, 1993. 208 с.
Гордон Г.М., Пейсахов ИЛ. Пылеулавливание и очистка газов в цветной
металлургии. М.: Металлургия, 1977. 456 с.
Добровольский В.В. География микроэлементов: Глобальное рассеяние. М.:
Недра, 1983. 272 с.
Зенкевич В.П. Самолетные исследования переноса ртути в атмосфере //
Актуальные проблемы охраны природы и радиоэкологической безопасности. М.: Наука,
1992. С. 101-105.
Ионов В.А., Назаров ИМ. Перенос ртути в атмосфере // Докл. АН СССР. 1976.
Т. 228, № 2. С. 456-459.
Исидоров В.А., Клокова Е.М., Поваров ВТ. и др. О роли фотостимулирован-
ных гетерогенных процессов в тропосферной химии органических компонент //
Экол. химия. 1992. № 1. С. 65-76.
60
Касимов A.M., Ровенский A.M., Макаров Б.Н. Пылегазовые выбросы при
производстве основных видов ферросплавов. М.: Металлургия, 1988. 110 с.
Куклин Ю.С., Коробейникова Л.Г. Оценка выпадений ртути от отдельного
источника по результатам анализа снега // ТИЭМ. 1978. Вып. 9 (82). С. 26-28.
Кулматов Р.А., Абдуллаев Б., Кист А.А. и др. Содержание и формы
нахождения ТМ в атмосферном воздухе и осадках // Геохимия. 1983. № 10. С. 1447-1452.
Махонько Э.П., Малахов СТ., Блинов Б.К., Неспятина Т.Е. Содержание
тяжелых металлов в растворимых осадками формах в выпадениях в зависимости от
расстояния от источника загрязнения // Миграция загрязняющих веществ в почвах и
сопредельных средах. Л.: Гидрометеоиздат, 1980. С. 53-58.
Метеорология и атомная энергия. Л.: Гидрометеоиздат, 1971. 648 с.
Миклишанский A3., Яковлев Ю.В. Нейтронно-активационный анализ
атмосферных аэрозолей: К вопросу о глобальном загрязнении атмосферы //
Ядерно-физические методы анализа в контроле окружающей среды. Л.: Гидрометеоиздат,
1980. С. 32-52.
Миклишанский А.З., Яковлев Ю.В., Савельев Б.В., Атрашкевич В.В.
Поступление микроэлементов в атмосферу с поверхности воды // Геохимия. 1981. № 6.
С. 927-936.
Миклишанский А.З., Яковлев Ю.В., Савельев Б.В., Зуев А.П. Содержание и
химический состав минеральной фазы в кернах ледникового покрова центральных
районов Антарктиды // Геохимия. 1980. № 2. С. 286-293.
Моисеенко Т.Н., Даувальтер В.А., Родюшкин И.В. Механизмы круговорота
природных и антропогенно привнесенных металлов в поверхностных водах
арктического бассейна // Вод. ресурсы. 1998. Т. 25, № 2. С. 231-243.
Никомишин И.Я., Алексеева Н.Г., Голенецкий СП., Малахов СТ.
Распределения микроэлементов в аэрозольных частицах различных размеров в высокогорном
районе // Ядерно-физические методы анализа в контроле окружающей среды. Л.:
Гидрометеоиздат, 1985. С. 173-179.
Носков А.С., Савинкина М.А., Анищенко Л.Я. Воздействие ТЭС на
окружающую среду и способы снижения наносимого ущерба / АН СССР. Сиб. отд-ние. Ин-т
катализа. Новосибирск, 1990. 184 с.
Остромогильский А.Х., Петрухин В.А. Тяжелые металлы в атмосфере:
Источники поступления и методы оценки их влияния // Мониторинг фонового
загрязнения природной среды. Л.: Гидрометеоиздат, 1984. Вып. 2. С. 56-70.
Петрухин В.А., Бурцева Л.В., Васильковский AT. К вопросу о содержании
ртути в атмосфере фоновых районов // Мониторинг фонового загрязнения природной
среды. Л.: Гидрометеоиздат, 1982. С. 112-120.
Пинский Д.П. Тяжелые металлы и окружающая среда / АН СССР. Ин-т
почвоведения и фотосинтеза. Пущино, 1988. 20 с.
Ровинский Ф.Я. Фоновое содержание микроэлементов в природных средах //
Мониторинг фонового загрязнения природной среды. Л.: Гидрометеоиздат, 1987.
Вып. 4. С. 3-50.
Ровинский Ф.Я., Петрухин В.А. Фоновое содержание металлов в приземном
слое атмосферы // Ядерно-физические методы анализа в контроле окружающей
среды. Л.: Гидрометеоиздат, 1985. С. 8-19.
Савенко B.C. Природные и антропогенные источники загрязнения атмосферы.
М. ВИНИТИ, 1991.212 с.
Сает Ю.Е., Ревич БЛ., Янин Е.П. Геохимия окружающей среды. М.: Недра,
1990. 335 с.
Сатаева Л.В., Мельчаков ЮЛ., Малахов СТ. Анализ пространственного
загрязнения снежного покрова металлами вблизи источников промышленных
выбросов // ТИЭМ. 1990. Вып. 17 (145). С. 22-28.
Селен: Гигиенические критерии состояния окружающей среды. М.: Медицина,
1989. 270 с.
61
Старк СБ. Газоочистные аппараты и установки в металлургическом
производстве. М.: Металлургия, 1990. 400 с.
Струнников СТ., Кушакова Л.Б., Булахова В.И.
Визуально-колориметрический способ обнаружения мышьяковистого водорода. // Технологические аспекты
охраны окружающей среды. Усть-Каменогорск: ВНИИцветмет, 1990. С. 59-65.
Трахтенберг И.М., Коршун МЛ. Ртуть и ее соединения в окружающей среде.
Киев: Высш. шк., 1990. 232 с.
Тулупов П.Е., Малахов СТ., СатаеваЛ.В. Количественные оценки загрязнения
почвы вокруг предприятий цветной металлургии // Загрязнение атмосферы и
почвы. М.: Гидрометеоиздат, 1991. С. 25-39.
Тяжелые металлы. Проект сводного резюме основного доклада Целевой
группы по тяжелым металлам под руководством Чешской Республики.
Исполнительный орган по конвенции о трансграничном загрязнении воздуха на большие
расстояния. М.: Гидрометеоиздат, 1994. 49 с.
Хром: Гигиенические критерии состояния окружающей среды. М.: Медицина,
1990. 168 с.
Цинк и кадмий в окружающей среде. М.: Наука. 1992, 200 с.
Энергетика и охрана окружающей среды. М.: Энергетика. 1979, 352 с.
Юшкан Е.И. Подвижные формы тяжелых металлов в аэрозолях и
атмосферных осадках фонового района // Мониторинг фонового загрязнения природной
среды. Л.: Гидрометеоиздат, 1991. Вып. 7. С. 219-224.
Яковлева Е.Ю., Григорьев Ю.О., Донских Д.К., Пушкарев В.В. Удаление
мышьяка из сурьмяных пылей // Цв. металлургия. 1987. № 7. С. 16-18.
Яхнин Э.Я., Томилина О.В., Деларов ДА. Атмосферные выпадения тяжелых
металлов и их влияние на экологическое состояние почв // Экол. химия. 1997. Т. 6,
№ 4. С. 253-259.
Яхнин Э.Я., Томилина О.В., Тимонина Е.А. и др. Проблемы интерпретации
результатов мониторинга загрязнения снежного покрова (на примере
северо-западного региона) // Там же. 1997. Т. 6, № 1. С. 12-19.
Akigoshi S. Toxic metals in the atmosphere. 1986. 114 p.
Akigoshi S., Toshio H. Vanadium concentration in atmosphere // Environ. Sci. and
Technol. 1973. Vol. 17, N 5. P. 444-448.
Alcamo J., Bartnicki J„ Olendrzynski K. Modelling heavy metals in Europe's
atmosphere: A combined trajectory-climatologic approach // Air pollution modelling and its appli-
cation-VIII. N.Y.; L.: Plenum press, 1990. P. 389-398.
Alcamo J., Bartnicki J., Olendrzynski K„ Pacyna J. Computing heavy metals in Europe's
atmosphere. 1. Model development and testing // Atmos. Environ. A. 1992. Vol. 26, N 18.
P. 3355-3370.
Amdur M.O., Chen L.C., Gulty J. et al. Speciation and pulmonary effects of acidic SO^
formed on the surface of ultrafine zinc oxide aerosols // Ibid. 1988. Vol. 22, N 3. P. 557-560.
Amyot M., Gill G.A., Morel F.M.M. Production and loss of dissolved gaseous mercury in
coastal seawater // Environ. Sci. and Technol. 1997. Vol. 31. P. 3606-3616.
Andweres P., Cullen W.R., Polishchuk E. Arsenic and antimony biomethylation by
Scopulariopsis brevicaulis: Interaction of arsenic and antimony compounds // Ibid. 2000.
Vol. 34. P. 2249-2256.
Ansari A., Peral J., Domenech X., Rodriquez-Clemente R. Oxidation of HSOJ in aque
ous suspension of a-Fe203, a-FeOOH, b-FeOOH and g-FeOOH in the dark and under
illumination // Environ. Pollut. 1997. Vol. 95, N 3. P. 283-288.
Barrie LA., Schemenauer R.S. Wet deposition of heavy metals // Control and fate of
atmospheric trace metals. Dordrecht etc.: Kluwer, 1988. P. 203-231.
Bartnicki J. Long range transport of heavy metals from Poland computed by an eulerian
model // Air pollution modelling and its application-VIII. N.Y.; L.: Plenum press, 1990.
P. 339-348.
62
Bauer C.F., Andrer A.W. Variability of particulate trace element emissions from the
Columbia coal-fired power plant, Portage, Wisconsin // Sci. Total Environ. 1988. Vol. 68.
P. 251-266.
Behra P., Sigg L. Evidence for redox cycling of iron in atmospheric water droplets //
Nature. 1990. Vol. 334. P. 419-421.
Berdowski JJ.M., Baas J., Bloos J.P. et al. The European emission inventory of heavy
metals and persistent organic pollutants for 1990.104 02 672/03 /TNO Inst, of Environ. Sci.,
Energy Res. and Process Innovation. 1997.
Bozo L. Atmospheric concentration and deposition of lead and cadmium over Hungary //
Proceedings of the first workshop on emissions and modelling of atmospheric transport of
persistent organic pollutants and heavy metals. US Environmental Protection Agency, 1993.
P. 423-429 (EMEP/CCC-Rep.; N 7/93).
Brosset C. The behaviour of mercury in the physical environment // Water, Air and Soil
Pollut. 1987. Vol. 34. P. 145-166.
Candreva F., Dams R. Fate of heavy metals released by a municipal incinerator plant //
Metal cycling in the environment. 1985. P. 75-82.
Car land J A. Field measurements of the dry deposition of small particles to grass //
Deposition of atmospheric pollutants. Dordrecht, Reidel.: 1982. P. 9-16.
Carraway E.R., Hoffman A J., Hoffman M.R. Photocatalytic oxidation of organic acids
on quantum-sized semiconductor colloids // Environ. Sci. and Technol. 1994. Vol. 28, N 5.
P. 786-793.
Chen L.C., Peoples S.M., McCarthy J.F., Amdur M.O. Copper oxide aerosols reaction
with S02//Atmos. Environ. 1989. Vol. 23, N 1. P. 149-154.
Cimimo G., Toscano G. Dissolution of trace metals from lava ash: Influence on the
composition of rainwater in the Mount Etna volcanic area // Environ. Pollut. 1998. Vol. 99, N 3.
P. 389-393.
Coles D.G., Ragaini R.C., Ondov J.M. et al. Chemical studies of stack fly ash from a
coal-fired power plant // Environ. Sci. and Technol. 1979. Vol. 13, N 4. P. 455^59.
Conklin M.H., Hoffmann M.R. Metal ion-sulphur (IV) chemistry. 1. Structure and
thermodynamics of transient copper (II) - sulphur (IV) complexes // Ibid. 1988a. Vol. 22, N 8.
P. 883-891.
Conklin M.N., Hoffmann M.R. Metal ion-sulphur (IV) chemistry. 2. Kinetic studies of the
redox-chemistry of copper (II) - sulphur (IV) complexes // Ibid. 1988b. Vol. 22, N 8.
P. 891-898.
Сох Х.В., Linton R.W., Butler F.E. Determination of chromium speciation in
environmental particles. Multi technique study of ferrochrome smelter dust // Ibid. 1985. Vol. 19,
N 4. P. 345-352.
Davidson С J. Characterization of airborne particles at a high coal-gasification pilot
plant // Environ. Monitor. Asses. 1982. Vol. 1, N 4. P. 313-335.
Davidson С J., Wu Y.L. Dry deposition of trace elements // Control and fate of
atmospheric trace metals. Dordrecht etc.: Kluwer, 1988. P. 147-202.
Donnelly J.R. Metal emissions control technologies for waste incineration // Clean
energy from waste and coal. 1992. P. 174-188.
Durham J.L. Acidification of rain by oxidation of dissolved sulphur dioxide and
absorption of nitric acid // Chemistry of particles, fogs and rain. N.Y.; L.: Plenum press, 1984.
P. 197-236.
Dvonch J.T., Graney J.R., Keeler GJ., Stevens R.K. Use of elemental tracers to source
apportion mercury in South Florida precipitation // Environ. Sci. and Technol. 1999. Vol. 33.
P. 4522-4527.
Elliot R.F., Holey M.E. A description on the diet of Lake Michigan coho salmon and
collections for contaminant analysis as part of the 1994-1995 Lake Michigan mass balance
project. Green Bay (WL), 1998. 89 p. (US Fish and Wildlife Service. Rep.; N 98-3).
Fitzgerald W.F., Engstrom D.R., Mason R.P., Nater E.A. The case for atmospheric
mercury contamination in remote areas // Environ. Sci. and Technol. 1998. Vol. 32. P. 1-7.
63
Germani MS., Zoller W.H. Vapor-phase concentrations of arsenic, selenium, bromine,
iodine and mercury in the stack of a coal-fired power plant // Ibid. 1988. Vol. 22, N 9.
P. 1079-1085.
GregurekD., Reimann C, StumpflE.F. Trace elements and precious metals in snow
samples from the immediate vicinity of nickel processing plants, Kola Peninsula, Northwest
Russia // Environ. Pollut. 1997. Vol. 102, N 2/3. P. 221-232.
Hall В., Lindqvist O. Mercury chemistry in simulated flue gases related to waste
incineration conditions // Environ. Sci. and Technol. 199., Vol. 24, N 1. P. 108-111.
Harrison R.M., Laxen D.N. Lead pollution: Causes and control. L.; N.Y.: Chapman and
Hall, 1981. 168 p.
Harrison R.M., Williams C.R. Physico-chemical characterization of atmospheric trace
metal emission from a primary zink-lead smelter // Sci. Total Environ. 1983. Vol. 31.
P. 129-140.
Heidam N.Z. Trace metals in the Arctic aerosols // Adv. Environ. Sci. and Technol. 1986.
Vol. 17. P. 267-293.
Hitoshi M. Heavy metals // Res. Rep. Nat. Inst. Environ. Stud. Jap. 1986. N 102. P. 109.
Hoffman A J., Carraway E.R., Hoffmann M.R. Photocatalytic production of H202 and
organic peroxides on quantum-sized semiconductor colloids // Environ. Sci. and Technol.
1994. Vol. 28, N 5. P. 776-785.
Iverfeldt A., Lindqvist O. Atmospheric oxidation of elemental mercury by ozone in the
aqueous phase//Atmos. Environ. 1986. Vol. 20. P. 1567-1573.
Jaworowski Z„ Bysiek M., Kownacka L. Row of trace metals: Global cycles and
assessment of man's impact // Geochim. et cosmochim. acta. 1981. Vol. 45. P. 2185-2199.
Karatza D.f Lancia A.y Musmarra D. Fly ash capture of mercuric chloride vapors from
exhaust combustion gas // Environ. Sci. and Technol. 1998. Vol. 32. P. 3999-4004.
Kelly СA.y RuddJ.WM., Bodaly R.A. et al. Increases in fluxes of greenhouse gases and
methyl mercury following flooding of an experimental reservoir // Ibid. 1997. Vol. 31.
P. 1334-1344.
Krell U„ Roeckner С Mode simulation of the atmospheric input into the North Sea //
Atmos. Environ. 1988. Vol. 22. P. 375-381.
Lambert G.f Cloarec M.F., Pennisi M. Volcanic output of S02 and trace metals: A new
approach // Geochim. et cosmochim. acta. 198». Vol. 52. P. 39-42.
Lindberg S.E., Harris R.C. Water and acid soluble trace metals in atmospheric particles //
J. Geophys. Res. С 1983. Vol. 88, N 9. P. 5091-5100.
Lindqvist 0., Rodhe H. Atmospheric mercury - a review // Tellus. B. 1985. Vol. 37.
P. 136-159.
Mamane Y., Miller J.L., Dzubay T.G. Characterization of individual fly ash particles
emitted from coal- and oil-fired power plants // Atmos. Environ. 1986. Vol. 20, N 11.
P. 2125-2135.
Marggrander E., Flothman D. Dry deposition of particles: Comparison of published
experimental results with model predictions // Deposition of atmospheric pollutants.
Dordrecht, 1982. P. 23-30.
Mayer R., Ulrich B. Calculation of deposition rates from the flux balance and ecological
effects of atmospheric deposition upon forest ecosystems // Ibid. 1982. P. 195-200.
Meili M. Mercury pollution in Swedish woodland lakes // Air pollution and ecosystems.
1988. P. 940-947.
Muler J. Residence time and deposition of particle bound atmospheric substances //
Deposition of atmospheric pollutants. Dordrecht, 1982. P. 43-52.
Munthe J. The aqueous oxidation of elemental mercury by ozone: The redox cycling of
mercury in the atmosphere. Goteborg, 1991a. 19 p.
Munthe J. The redox cycling of mercury in the atmosphere. Goteborg, 1991b. 55 p.
Munthe J., McElroy WJ. Some aqueous reactions of potential importance in the
atmospheric chemistry of mercury: The redox cycling of mercury in the atmosphere. Goteborg,
1991.10 р.
64
Munthe J, Xiao Z.F., Lindqvist O. The aqueous reduction of divalent mercury by sulfite:
The redox cycling of mercury in the atmosphere. Goteborg, 1991. 12 p.
Nakamura M. Chemical form of arsenic compounds and distribution of their
concentrations in the atmosphere // Appl. Organometal. Chem. 1990. Vol. 4. P. 223-230.
Nriagu J.O. Natural versus anthropogenic emissions of trace metals to the atmosphere //
Control and fate of atmospheric trace metals. Dordrecht: Kluwer, 1989. P. 3-14.
Olmez /., Ames M.R., Gullu G. Canadian and US sources impacting the mercury levels
in fine atmospheric particulate material across New York State // Environ. Sci. and Technol.
1998. Vol. 32. P. 3048-3054.
Ondov J.M., Ragaini R.C., Biermann A.H. Elemental emissions from a coal-fired power
plant: Comparison of venture wet scrubber system with a coal-side electrostatic precipitator //
Ibid. 1979. Vol. 13, N 5. P. 598-607.
Ottar В., Lindberg S.E., Voldner E. et al. Special topics concerning interactions of heavy
metals with environment // Control and fate of atmospheric trace metalls. Dordrecht: Kluwer,
1989. P. 365-372.
Pacyna J.M. Atmospheric trace elements from natural and anthropogenic sources // Adv.
Environ. Sci. and Technol. 1986. Vol. 17. P. 33-52.
Pacyna J.M. The Baltic Sea environmental programme. The topical area study for
atmospheric deposition of pollutants. Final Report N I L U OR 46/92. Norway, 1992. 403 p.
Pacyna J.M. Emissions, atmospheric transport and deposition of heavy metals and
persistent organic pollutants // Proceedings of the first workshop on emissions and modelling of
atmospheric transport of persistent organic pollutants and heavy metals. 1993. P. 45-137 (US
Environ. Protect. Agency. EMEP/CCC-Rep.; N 7/93).
Pacyna J.M., Bartonova A., Cornille P.y Maenhaut W. Modelling of long-range transport
of trace elements: A case study // Atmos. Environ. 1989. Vol. 23, N 1. P. 107-114.
Pacyna J.M., Munch J. Anthropogenic mercury emission in Europe // Water, Air and
Soil Pollut. 1991. Vol. 56. P. 51-61.
Pacyna J.M., Ottar B. Transport and chemical composition of the summer aerosol in the
Norwegian Arctic // Atmos. Environ. 1985. Vol. 19. P. 2109-2120.
Pankrath J. Long-range transport and deposition: Modelling of selected heavy metals //
Proceedings of the first workshop on emission and modelling of atmospheric transport of
persistent organic pollutants and heavy metals. 1993. P. 363-385 (US Environ. Protect. Agency.
EMEP/CCC-Rep.; N 7/93).
Paode R.D., Sofuoglu S.C., Sivadechathep J. et al. Dry deposition fluxes and mass size
distribution of Pb, Cu and Zn measured in Southern Lake Michigan during AEOLOS //
Environ. Sci. and Technol. 1998. Vol. 32. P. 1629-1635.
Pattenden NJ. Trace element measurements in wet and dry deposition and airborne
particulate at an urban site // Deposition of atmospheric pollutants. Dordrecht, 1982. P. 173-184.
Petersen G. Modelling the atmospheric transport and deposition of heavy metals:
A review of results from models applied in Europe // Proceedings of the first workshop on
emission and modeling of atmospheric transport of persistent organic pollutants and heavy
metals. 1993. P. 261-279 (US Environ. Protect. Agency. EMEP/CCC-Rep.; N 7/93).
Petersen G., Schneider В., Eppel D. et al. Modeling the atmospheric transport of trace
metals from Europe to the Norht Sea and the Baltic Sea // Control and fate of atmospheric
trace metals. Dordrecht: Kluwer, 1988. P. 57-84.
Petersen G.t Weber H., Grass! H. Numerical modeling of the atmospheric transport,
chemical transformations and deposition of mercury // Air pollution modelling and its appli-
cation-VIII. N.Y.; L.: Plenum press, 1990. P. 215-224.
Rohbock E. Atmospheric removal of airborne metals by wet and dry deposition //
Deposition of atmospheric pollutants. Dordrecht, 1982. P. 159-171.
Rojas C.M., Otten P.M., Grieken R.E. Dry aerosol deposition over the North Sea
estimated from aircraft measurements // Air pollution modelling and its application-VIII. N.Y.;
L.: Plenum press, 1990. P. 419-425.
3. Рассеянные элементы s*
Ross H.B. An atmospheric selenium budget for the region 30 N to 90 N // Tellus B. 1985.
Vol. 37. P. 78-90.
Ryaboshapko A., Gusev A., Afinogenova 0. et al. Monitoring and modelling of lead,
cadmium and mercury transboundary transport in the atmosphere of Europe. Moscow, 1999.
78 p. (Joint Report of EMEP Centres: MSC-E/CCC. EMEP Rep.; N 3/99).
Ryaboshapko A., Ilyin /., Gusev A., Afinogenova 0. Mercury in the atmosphere of
Europe: Concentrations, deposition patterns, transboundary fluxes. Moscow, 1998. 56 p.
(MSC-East. EMEP-MSC-E Rep.; N 7/98).
Sandelin K., Backman RA. A simple two-reactor method for predicting distribution of
trace elements in combustion systems // Environ. Sci. and Technol. 1999. Vol. 33.
P. 4508-4513.
Semb A., Pacyna J.M. Toxic trace elements and chlorinated hydrocarbons: Sources,
atmospheric transport and deposition / Nordic Council of Ministers. Copenhagen, 1988. 86 p.
Sheets R.W. Airborne lead in the Springfield, Missouri area during a 19-year period
(1975-1993) // Environ. Pollut. 1997. Vol. 96, N 3. P. 155-160.
Slemr F.t Seiler W. Latitudinal distribution of mercury over the Atlantic Ocean // J.
Geophys. Res. 1981. Vol. 86. P. 1159-1166.
The atmospheric emission inventory guidebook. UNECE/EMEP task force on emission
inventories / Ed. G. Mclnnes. 1999. 1134 p.
Wallin T. Deposition of airborne mercury from six Swedish chloralkali plants surveyed
by mass analysis // Environ. Pollut. 1976. Vol. 10, N 12. P. 101-114.
Watson J.G. Heavy metals in the atmosphere // J. Air Pollut. Contr. Assoc. 1983. Vol. 33.
P. 456-461.
Weschleer С J., Mandish ML., Graedel Т.Е. Speciation, photosensitivity and reactions
of transition metal ions in atmospheric droplets // J. Geophys. Res. D. 1986. Vol. 91.
P. 5189-5204.
Winchester J.W. Atmospheric transformations of trace metals: Evidence for aerosol
sulphur association with metals from soil minerals in eastern North America and the potential
for solubilization of aluminium and iron before deposition from the atmosphere // Control and
fate of atmospheric trace metals. Dordrecht etc.: Kluwer, 1989. P. 311-320.
Wong J., Wu T.-G. Speciation of airborne nickel in occupational exposures // Environ.
Sci. and Technol. 1991. Vol. 25, N 2. P. 306-309.
Xue H., Goncalves M.L.S., Reutlinger M. et al. Copper (I) in fog water: Determination
and interactions with sulphite // Ibid. 1991. Vol. 25, N 10. P. 1716-1722.
3-5. ВЗАИМОДЕЙСТВИЕ
АТМОСФЕРНЫХ ВЫПАДЕНИЙ
С ДРЕВЕСНЫМ ПОЛОГОМ
При взаимодействии атмосферных осадков и полога леса наблюдается
изменение кислотности и состава выпадений (Мина, 1967; Ведрова, 1980;
Nihlgard, 1971; Messenger, 1975; Nicholson et al, 1980). Наследуя
геохимическую нагрузку потока в приземной атмосфере, растительный покров
количественно ее увеличивает за счет интенсивного извлечения аэрозолей, а
качественно - внося в него биогенные компоненты: часть катионов и
органические соединения (Елпатьевский, 1993). Из надземных частей растений
вымываются неорганические соединения, которые включают все основные
макро- и микрокомпоненты. В наибольших количествах обычно
высвобождаются калий, кальций, магний и марганец. В составе органических веществ
подкроновых и стволовых вод идентифицированы низкомолекулярные кар-
боновые кислоты, углеводы, полифенолы (Tukey, 1970).
66
Кислотность и состав атмосферных выпадений в лесных экосистемах
характеризуется пространственной (парцеллярной и внутрипарцеллярной) и
временнбй (сезонной и многолетней) изменчивостью. Парцеллярная
изменчивость связана с чередованием различных парцелл в пределах одной
экосистемы, внутрипарцеллярная - с изменчивостью напряженности фитогенно-
го поля эдификатора. В лесных экосистемах кислотность и состав
атмосферных выпадений определяют сильные средообразователи - древесные
растения.
В настоящее время наряду с природными факторами состав
атмосферных выпадений в бореальных лесах определяется воздушным загрязнением,
распространяющимся на значительные расстояния от источников выбросов,
основными компонентами которых являются кислотообразующие вещества
и тяжелые металлы (Ulrich et al., 1980; Лукина, Никонов, 1996). В то же
время многие исследования в условиях воздушного загрязнения не
подкреплены соответствующими материалами об атмосферных нагрузках и их
пространственных и временных вариациях.
Кольский полуостров - наиболее индустриально развитый регион на
Севере. Детальные исследования кислотности и состава атмосферных
выпадений проводили с 1991 по 1997 г. на стационарных мониторинговых
площадях, представляющих сосновые и еловые леса региона в естественных
условиях и в условиях воздушного промышленного загрязнения крупнейшим на
Севере медно-никелевым комбинатом "Североникель". Выбросы поллю-
тантов варьируют по годам, но остаются высокими, и это позволяет
утверждать, что комбинат является одним из самых мощных в Северной Европе
источников воздушного промышленного загрязнения (рис. 3.1).
Объектами исследований послужили ельники кустарничково-зелено-
мошные и сосняки кустарничково-лишайниковые, произрастающие на
подзолистых Al-Fe-гумусовых почвах - зональные и наиболее
распространенные на Кольском полуострове типы еловых и сосновых биогеоценозов
(Мелехов, 1961; Манаков, Никонов, 1981; Чертовской и др., 1987). Главные ле-
сообразующие породы - ель сибирская (Picea obovata Ledeb.) и сосна
обыкновенная (Pinus sylvestris L.).
Результаты исследований динамики органического вещества и
биогеохимических циклов элементов позволили нам (Лукина, Никонов, 1996)
выделить основные типы состояния северо-таежных лесов в индустриально-
развитых регионах: фоновый -> дефолиирующий (стадии начальной,
интенсивной и затухающей дефолиации) —» редколесья -> техногенные пустоши
(табл. 3.24). Принадлежность изучаемых объектов к зеленомошному типу
еловых лесов и лишайниковому типу сосновых лесов подтверждается
геоботаническими описаниями Монче-тундры до начала деятельности комбината
(Боброва, Качурин, 1936) и исследованиями первичной продуктивности и
процессов почвообразования в лесах региона (Манаков, 1961).
На каждой пробной площади было установлено от 10 до 20 осадкопри-
емников, распределенных в подкроновых и межкроновых пространствах.
Образцы атмосферных выпадений с мая по октябрь отбирали ежемесячно,
зимой - в период максимального снегонакопления (начало апреля). В
лаборатории рН вод определяли потенциометрически, затем воды подвергали
фильтрации (фильтр "синяя лента"). Катионы (Al, Fe, Ca, Mg, К, Mn, Zn, Ni,
Си, Na) определяли методами атомно-абсорбционной спектрофотометрии,
о
ЕЙ
sssss
EEEHS
ШИШЕ
взвгЦ
ШЕЕШВШ
Егшшг
ЕШПШЗ
ВИННИ
SHHHHS
ШШЕЕЕШЕЫ.
вшшгз
еннннн
кнннннз
нггггзв
Ш+Ш+J
ншнн
шгш]
ггшгщ
ИЕЗЭЕН5Ш
ввшшга
кшншш;
еннвензеш
5333ЙЭ
ЕННЗ
SUSS
шгш£
КВНЭ
р-
8
ел
00
ON
ON
VO
8
I
ON
ON
О
8
00
00
ON
NO
00
ON
s
ON
CN
00
ON
О
00
ON
00
VO
ON
8
CN
ON
ON
r о©
vo
ON
[ 8
ON
I 8
X*0I4X
j, -0141 '03
a g g <
о о о ,
1 1 1
л
Я
4
Ч
1
S
э с
1 1
Mil
Jrrrrn
J Л
I w
1 Ж
f \шк
ТОП
J Ш$&
> LUIU'U
г шЫ
МИНИН
|^ш
lllllllllll
^^Ш
iiiiiiiiiiiiii
1^^^^
4.
ппнннпш
•k^^^^n
i ■ i
»п со
со
Х'ЭГС
i i i i
>л N «о «о
cs 1-Г о"
[х *пэ *!N
>
1996 1997 1998 1999
ON
2
2
1993
h
см
ON
On
к
On
2
к
ON
1 °^
V
s
Ч ON
1 1~ч
к
J °°
4 °*
О
3
+
S
о
и
"л
К
К
о
а
<и
и
и
S
е
Я
К
ю
S
о
о
U
О
СО
о
о
а
ю
PQ
го
J
s
рН вод - потенциометрически, S04, CI, N03 - методом ионообменной
хроматографии, NH4 и Р - колориметрически. Среднегодовое количество
осадков - 566 мм, в том числе в бесснежный период - 250 мм. Расчет подкроно-
вых выпадений проводили исходя из концентрации элемента
(табл. 3.25-3.28), количества осадков и доли их пропускания древесным
пологом. В бесснежный период доля атмосферных осадков, прошедших через
кроны елей, в фоновых условиях составляла 50%, в дефолиирующих лесах -
56% и редколесьях - 80% от количества осадков в межкроновых
пространствах; через кроны сосны - 92,96 и 99% соответственно. Доля зимних
выпадений под кронами елей составляла 31,49 и 98%, под кронами сосны - 35, 68
и 97% от количества осадков в межкроновых пространствах соответственно.
Рассмотрим особенности взаимодействия атмосферных выпадений с
древесным пологом в северо-таежных лесах индустриально-развитых
регионов.
Состав и свойства атмосферных выпадений
на разных стадиях состояния северо-таежных лесов
Фоновые условия. Продолжительность залегания снегового покрова в
бореальных хвойных лесах охватывает период от ста до двухсот дней в году.
Поэтому значение снегового покрова как аккумулятора атмосферных
выпадений очевидно. На важную роль древесного яруса в формировании
кислотности и химического состава атмосферных осадков зимнего периода в
бореальных лесах указывали многие авторы (Паулюкявичус, 1978; Учватов,
1979; Елпатьевский, 1993). Полагают, что явление вымывания веществ из
полога леса во время оттепелей свидетельствует о выщелачивании
питательных элементов из растительных тканей в период зимнего покоя и
может "усугублять" физиологический стресс при воздействии атмосферного
загрязнения на лесную растительность (Schuepp et al., 1989).
Результаты наших исследований подтверждают предположение о
возможности обогащения подкроновых осадков в еловых лесах в зимнее время.
Об этом свидетельствуют значительные различия в концентрации
элементов в выпадениях под кронами и в межкроновых пространствах (табл. 3.25).
В то же время общее количество веществ, поступающих в подкроновые
пространства, по сравнению с межкроновыми ниже, что обусловлено
меньшим количеством осадков (до 3 раз) в древесных парцеллах (табл. 3.26).
В составе выпадений довольно значительна доля углерода. Из катионов
преобладают NH4, Ca и Na, из анионов минеральных кислот наряду с S04
довольно высока доля О.
Концентрация веществ в зимних выпадениях сосновых лесов
незначительна, а пространственные различия в их составе гораздо менее выражены
по сравнению с выпадениями в еловых лесах. Следует лишь отметить более
высокие концентрации К, Р и NH4 в подкроновых выпадениях, что,
по-видимому, связано с их выщелачиванием из крон в периоды оттепелей (см.
табл. 3.25). Так же как и в еловых лесах, зимой поступление элементов под
кронами ниже, чем в межкроновых пространствах (см. табл. 3.26). Это
связано с относительно низким количеством осадков, поступающих под кроны:
превышение объема межкроновых выпадений над подкроновыми достигает
трех раз.
69
В бесснежный период концентрация веществ в атмосферных
выпадениях заметно увеличивается, что обусловлено активным функционированием
лесного биоценоза (см. табл. 3.27). В составе летних атмосферных
выпадений еловых лесов (как межкроновые, так и древесные парцеллы)
преобладает углерод. Из катионов доминируют NH4 и Са, из анионов минеральных
кислот - S04 (см. табл. 3.28). Полученные материалы демонстрируют роль
ели в формировании кислотности и состава атмосферных выпадений
бесснежного (весенне-летне-осеннего) периода: выпадения еловых парцелл
гораздо кислее и богаче всеми элементами. Различия, как правило,
превышают 10 раз. Более значительное поступление элементов в подкроновые
пространства при меньшем объеме поступающих осадков объясняется
интенсивными обменными процессами на поверхности активно
функционирующей хвои, а также смывом пыли с кроны, которая обладает большой
сорбирующей способностью.
Активизация биологической деятельности обусловливает резкое
увеличение концентраций элементов в осадках и сосновых лесов. Вымывание
элементов из активно функционирующего древесного полога определяет более
высокую кислотность и концентрацию катионов и анионов в летних
выпадениях древесных парцелл (см. табл. 3.27). Однако парцеллярные различия
в концентрации веществ и кислотности выпадений в сосновых лесах
заметно уступают различиям, обнаруженным в еловых лесах. Это
свидетельствует о более выраженной роли ели как эдификатора в преобразовании
кислотности и состава атмосферных выпадений. В составе подкроновых
выпадений преобладает С, из катионов доминируют NH4 и К, из анионов
минеральных кислот - S04. Несмотря на относительно низкий объем осадков,
выпадающий под кронами, общее поступление элементов здесь
значительно выше, чем в межкроновых парцеллах (см. табл. 3.28). Только
поступление N03 под кронами и в межкроновых пространствах сопоставимо, что
связано с их низкими концентрациями в выпадениях древесных парцелл.
Дефолиирующие леса. Концентрации веществ в зимних выпадениях де-
фолиирующих еловых лесов остаются незначительными и сопоставимы с
фоновыми значениями. При этом существенно возрастает концентрация
анионов минеральных кислот - S04 и С1, а также Ni и Си. В этих условиях
сохраняются парцеллярные различия в концентрациях: выпадения
древесных парцелл более концентрированные. Увеличение по сравнению с фоном
поступления элементов питания (К, Р, NH4, Mn и Zn) под древесным пологом
связано как с их выщелачиванием из крон, так и с возрастающим
количеством зимних осадков из-за изреженности крон. Снижение уровня
поступления элементов питания в межкроновых парцеллах соответствует снижению
их концентрации в атмосферных выпадениях.
Парцеллярные различия в общем поступлении элементов
сглаживаются. Это связано с сужением отношения между количеством осадков,
поступающих в межкроновые и подкроновые пространства. Если в фоновых
условиях это отношение достигало 3,0, то в данных условиях оно не
превышает 2,0. Равномерное пространственное распределение запасов снега
обусловлено увеличением изреженности крон, что способствует значительному
накоплению осадков в древесных парцеллах.
Концентрации веществ в зимних выпадениях в сосновых лесах
незначительны и сопоставимы с фоном или даже ниже. При этом по сравнению с
70
фоном поступление таких элементов питания, как К, Na, N, Mn, Zn, под
кронами увеличивается. Следовательно, увеличение их поступления из
атмосферы связано с повышенным количеством зимних осадков под кронами из-
за их дефолиации. Об этом свидетельствует величина отношения между
количеством зимних осадков, выпадающих в межкроновых и подкроновых
пространствах, не превышающая 1,5. Возрастает также поступление поллю-
тантов.
Концентрации веществ в выпадениях бесснежного периода в еловых
лесах обусловлены уровнем загрязнения атмосферного воздуха и степенью
воздействия загрязнения на древесный полог. Кислотность атмосферных
выпадений увеличивается, в составе выпадений резко возрастают
концентрации анионов минеральных кислот (главным образом S04), а также Ni и Си.
Повышенные концентрации Са, Mg и Zn обусловлены выщелачиванием
этих элементов из кроны в результате действия кислых осадков. При этом
концентрации К сопоставимы с фоновыми значениями, а концентрации NH4
и Р даже снижаются, что особенно ярко выражено в древесных парцеллах.
Таким образом, выявляется избирательность в выщелачивании элементов
питания из крон древесных растений в условиях воздушного
промышленного загрязнения. Ткани древесных растений активно обедняются так
называемыми малоподвижными элементами (Са, Mg, Mn и др.), тогда как
интенсивность вымывания способных к ретранслокации внутри дерева элементов (К,
N, Р) снижается.
В сосновых лесах кислотность и состав атмосферных выпадений
древесных парцелл бесснежного периода также обусловлены степенью повреж-
денности крон деревьев. Следует, однако, заметить, что сосна в дефолииру-
ющих лесах трансформирует атмосферные выпадения значительно слабее,
чем ель. По сравнению с фоном значительно возрастает кислотность
осадков (рН межкроновых и подкроновых выпадений 4,5 и 4,1 соответственно),
увеличиваются концентрации кислотообразующих веществ (прежде всего
S04), а также Ni и Си по сравнению с фоном. Относительно высокие
содержания основных катионов связаны с их интенсивным выщелачиванием
более кислыми осадками. К тому же кутикула хвои сосны нарушается (Turunen
et al., 1992), что также способствует активной "утечке" элементов питания.
Как и в дефолиирующих еловых лесах, выявляется избирательность в
выщелачивании элементов питания из кроны сосны. Кроны этой древесной
породы активно обедняются так называемыми малоподвижными элементами
(Са, Mg, Mn и др.), тогда как интенсивность вымывания способных к
ретранслокации внутри дерева элементов (К и Р) сопоставима с фоном и даже
снижается.
Техногенные редколесья. Концентрация веществ в зимних выпадениях в
техногенных еловых редколесьях остаются незначительными и
сопоставимыми с фоновыми условиями и дефолиирующими лесами. При этом
существенно возрастают концентрации анионов минеральных кислот - S04, N03 и
CL а также Ni и Си. Распределение выпадений по площади довольно
равномерное из-за крайней изреженности крон и гибели большинства деревьев.
Концентрация элементов в зимних выпадениях техногенных сосновых
редколесий также остается низкой. Возрастает доля поллютантов, прежде всего
S04, Ni и Си. Состав атмосферных выпадений отличается низкой
пространственной вариабельностью из-за полного разрушения древесного полога.
71
В бесснежный период в техногенных еловых редколесьях изменения,
отмеченные в составе атмосферных выпадений дефолиирующих лесов,
углубляются. Под кронами увеличиваются выпадения загрязняющих веществ:
S04, Ni и Си. Концентрации Ni и Си сопоставимы или превышают
концентрации основных катионов. Выпадения Са, Mg, К, Na, Al, Fe, Mn и Zn в
межкроновых пространствах возрастают. Это может быть связано с
промышленными выбросами, а также и с пылением территории, не покрытой
растительностью (пустоши). Выявляется избирательность в выщелачивании
элементов питания из крон древесных растений в условиях воздушного
промышленного загрязнения. Сохраняются присущие дефолиирующим лесам
тенденции селективного выщелачивания из тканей древесных растений так
называемых малоподвижных элементов (Са, Mg, Mn и др.), тогда как
интенсивность вымывания способных к ретранслокации внутри дерева элементов
(К, N, Р) заметно ниже, чем в фоновых условиях. Парцеллярные различия в
поступлении элементов практически отсутствуют в связи с сильным
повреждением и разрушением древесного яруса.
В техногенных сосновых редколесьях изменения в составе атмосферных
выпадений, отмеченные в дефолиирующих лесах, сохраняются. По
сравнению с фоном возрастает кислотность атмосферных выпадений бесснежного
периода как под кронами, так и в межкроновых пространствах.
Увеличивается поступление не только поллютантов, но и элементов питания, что
связано с их более интенсивным вымыванием из крон кислыми осадками.
Сохраняются парцеллярные различия, выявленные в фоновых условиях:
количество элементов, поступающих в подкроновые пространства, значительно
выше.
Общие особенности состава и свойств атмосферных выпадений
при взаимодействии с древесным пологом
Зимние выпадения приурочены к периоду биологического покоя.
Несмотря на низкую минерализацию, снеговые осадки аккумулируют
значительные количества кислотообразующих агентов и катионов благодаря их
большому количеству (более 300 мм), выпадающему в течение длительного
периода (более 200 дней). Этому периоду свойственны оттепели с
выщелачиванием веществ из древесного полога, что обусловливает некоторое
пространственное перераспределение атмосферных выпадений.
Наиболее ярко выраженные результаты взаимодействия атмосферных
выпадений и древесного полога наблюдаются в бесснежный период,
особенно в сезон вегетации. Известны три основных механизма формирования
химического состава атмосферных выпадений, контактирующих с древесным
пологом: а) смыв пыли, выделений из растений, экскрементов насекомых и
беспозвоночных; б) выщелачивание элементов из растений; в) поглощение
элементов растительным пологом - "внекорневая подкормка" (Карпачев-
ский, 1981). При этом большая часть металлов (прежде всего Al, Fe, Cu, Ni,
Сг и др.), поступающая из атмосферы, не включается в растительные ткани,
а осаждается на поверхности листьев, ветвей, стволов, затем смывается
атмосферными осадками.
В этот период осуществляются глубокие преобразования атмосферных
выпадений, обусловленные активным функционированием биоценоза. Бла-
72
годаря функционированию надземной части (кроны и стволы) и
обитающих в ней и на ней организмов деревья обогащают атмосферные осадки
многими элементами и органическим веществом. Если в межкроновых
пространствах (парцеллах) атмосферные выпадения носят главным образом
атмогенный характер, т.е. состав и кислотность выпадений определяют
атмосферные осадки, то в подкроновых пространствах (древесных
парцеллах) они приобретают ярко выраженный биогенный (аутогенный)
характер. Это обусловлено тем, что помимо элементов, выпадающих из
атмосферы, состав подкроновых выпадений определяют вещества,
образованные в результате жизнедеятельности самих древесных растений, а также
других растительных и животных организмов, обитающих на деревьях.
Биогенный фактор определяет высокую кислотность подкроновых
атмосферных выпадений в вегетационный сезон. Поступление органических веществ
под кроны ели за вегетационный период может превышать 10 г/и2 (в
пересчете на углерод).
Характер преобразования атмосферных выпадений двумя
доминирующими в бореальных хвойных лесах древесными породами - елью сибирской
и сосной обыкновенной, сходен: осадки, прошедшие сквозь полог этих
деревьев, становятся более кислыми и концентрированными. Однако степень
преобразования осадков различна - более глубокую трансформацию
осуществляет ель. Прежде всего это касается кислотности выпадений в
бесснежный период: выпадения под еловым пологом значительно кислее, чем под
сосновым: значения рН варьируют от 3,5 до 5,2 и от 4,2 до 6,0
соответственно. Низкие значения рН свидетельствуют о высокой толерантности таких
чувствительных растительных организмов, как лишайники и зеленые мхи,
произрастающих под кронами хвойных деревьев, к высокой кислотности
окружающей среды. Выпадения протонов (Н+) под еловым пологом достигают
0,3 кмоль/га, тогда как под сосновым не превышают 0,07 кмоль/га. В
межкроновых пространствах эти различия менее выражены: 0,08 и 0,05 кмоль/га
соответственно.
Одновременно под кронами деревьев резко увеличивается поток
элементов питания, способствуя формированию благоприятного питательного
режима, прежде всего для растений, получающих элементы питания из
атмосферы - лишайников и моховидных.
В условиях воздушного промышленного загрязнения бореальные леса
выступают как трансформатор нисходящих атмосферных техногенных
потоков. Кислотность и состав атмосферных выпадений в этом случае
контролируются двумя дополнительными факторами - уровнем загрязнения
атмосферы и степенью поврежденности древесного полога. Атмо-биогенный
характер атмосферных выпадений в бореальных лесах в условиях воздушного
промышленного загрязнения дополняется техногенной составляющей.
Кислотность атмосферных выпадений резко возрастает, в их составе
значительно повышаются концентрации S04, Ni и Си. Выпадения Н+ и S04
увеличиваются до 5 раз, достигая максимальных значений в древесных парцеллах
(особенно под елью), выпадения Ni и Си - в 50-100 раз. Максимальные значения
также отмечаются под кронами хвойных деревьев, отличающихся высокой
сорбирующей способностью. Поэтому рост выпадений Ni и Си в древесных
парцеллах главным образом связан со смывом их соединений с поверхности
хвои. Повышенные концентрации основных катионов обусловлены выще-
73
лачиванием этих элементов из кроны в результате действия кислых осадков.
Кутикула хвои деревьев нарушается, что способствует активной "утечке"
катионов.
На функционирование бореальных лесов в данных условиях
существенно воздействует избирательность в выщелачивании элементов питания из
крон древесных растений атмосферными осадками. Деревья обедняются так
называемыми малоподвижными элементами (Са, Mg, Mn и др.) из-за их
интенсивного выноса из тканей древесных растений и корнеобитаемого слоя
почв. В то же время не происходит обеднения крон деревьев так
называемыми подвижными, способными к ретранслокации внутри деревьев
элементами (К, N, Р).
В условиях воздушного промышленного загрязнения благодаря
наличию древесного полога нижние ярусы растительности, почвы древесных
парцелл и сами деревья подвергаются более мощному техногенному
воздействию, чем растительность и почвы межкроновых парцелл.
Традиционно атмосферные нагрузки в бореальной зоне оцениваются для открытых
территорий. Отмеченное явление вызывает необходимость пересмотра
традиционных представлений о техногенной атмосферной нагрузке на бо-
реальные леса и глубине изменений в бореальных экосистемах,
подверженных воздушному промышленному загрязнению с учетом
пространственной структуры.
Литература
Боброва Л.И., Качурин М.Х. Очерк растительности Мончетундры //
Материалы по растительности центральной и западной частей Кольского полуострова. М;
Л., 1936. С. 95-121.
Ведрова Э.Ф. Влияние сосновых насаждений на свойства почв. Новосибирск:
Наука, 1980. 95 с.
Елпатьевский П.В. Геохимия миграционных потоков в природных и природно-
техногенных геосистемах. М.: Наука, 1993. 253 с.
КарпачевскийЛ.О. Лес и лесные почвы. М.: Лесная пром-сть, 1981. 262 с.
Лукина Н.В., Никонов В.В. Биогеохимические циклы в лесах Севера в
условиях аэротехногенного загрязнения: В 2 ч. Апатиты: КНЦ РАН, 1996. Ч. 1. 213 с;
4.2.192 с.
Манаков К.Н. Поглощение растительностью минеральных элементов и
азота из почвы в лесах Кольского полуострова // Почвоведение. 1961. № 8.
Манаков К.Н., Никонов В.В. Биологический круговорот минеральных
элементов и почвообразование в ельниках Крайнего Севера. Л.: Наука, 1981. 196 с.
Мелехов И.С. Особенности лесов Кольского полуострова и пути их изучения //
Леса Кольского полуострова и их возобновление. М.: Изд-во АН СССР, 1961.
С. 5-18.
Мина В.Н. Влияние осадков стекающих по стволам деревьев на почву //
Почвоведение. 1967. № 10. С. 44-48.
Паулюкявичус Г.Б. Оценка роли леса в экологической оптимизации холмистых
ландшафтов Литвы. Вильнюс: Изд-во АН ЛитССР, 1978. 182 с.
Учватов В.П. Трансформация состава природных вод в ландшафте и
почвообразование. Пущино: ОНТИ НЦБИ АН СССР, 1979. 28 с.
Чертовской ВТ., Семенов Б А., Цветков В.Ф. и др. Предтундровые леса М.:
Агропромиздат, 1987. 168 с.
74
Messenger AS. Climate, time and organisms in relation to podzol development in
Michigan stands. II. Relationships between chemical element concentrations in nature tree
foliage and upper humic horizon // Soil Sci. Soc. Amer. Proc. 1975. Vol. 39. P. 698-702.
Nicholson I. A., Cape N., Fowler D. et al. Effects of a Scots pine (Pinus sylvestris L.)
canopy in the chemical composition and deposition pattern of precipitation // Ecological
impact of acid precipitation / Ed. D. Drablos and A. Tollan Oslo, 1980. P. 148-149 (SNSF-
project.)
Nihlgard B. Pedological influence of spruce planted on former beech forest soils in
Scania, South Sweden // Oikos. 1971. Vol. 22. P. 195-207.
Schuepp P., Comtois P., Schemenauer R. Studies on pollution-induced nutrient stress and
redaction in pollen viability in high-levitation forests // Air pollution and forest decline: proc.
14th Intern, meet spec, air pollut. eff. forest ecosyst. Int. Union Forest Res. Organ. Project
Group P2.05, Interlaces 2-8 Oct., 1988. Birmensdorf, 1989. Vol. 2. P. 520-522.
Tukey H.B. The leaching of substances from plants // Annu. Rev. Plant Physiol. 1970.
Vol. 21. P. 305-324.
Turunen M., Huttunen S.t Back J., Koponen J. et al. Needle damage in the Scots pines of
Lapland and the Kola Peninsula // Symp. on the state of the environmental monitoring in
Northern Fennoscandia and the Kola Peninsula. Rovaniemi: Arctic Centre Univ. of Lapland,
1992. P. 235-239.
Ulrich B.f Mayer R.T., Khanna P.K. Chemical changes due to acid precipitation in a loess
derived soil in Central Europe // Soil Sci. 1980. № 130. P. 193-199.
Глава 4
ПОЧВЫ
Важность изучения роли в почвообразовании элементов,
характеризующихся низкими и ультранизкими концентрациями в биосфере, заключается
в следующих положениях: а) все элементы (без исключения) присутствуют
в живом веществе; б) все элементы (без исключения) обладают
биологической ролью; в) в результате деятельности человека в ряде случаев
произошло стирание границ между макро- и микроэлементами.
В настоящее время техногенное выпадение рассеянных элементов в
так называемых условно фоновых районах на поверхность почвы
колеблется в пределах 1-200 г/(га • год), но может достигать 5 кг/(га • год) для РЬ,
2-5 кг/(га • год) для Ni и Си, 1,1 кг/(га • год) для Zn (Глазовская, 1988). Вынос
этих элементов за пределы почв не превышает 10% от поступления.
Продолжительность их пребывания в почве, как правило, превышает
продолжительность жизни нескольких поколений растительных организмов - до
1000 лет и более.
Почвы могут быть отнесены к загрязненным, если (Глазовская, 1999):
1) уровень первичной продуктивности снижается по сравнению с
"нормой";
2) в органах и тканях растительных организмов с корневой стратегией
питания накапливаются соединения элементов в количествах, нарушающих
жизненные функции;
3) в почвенной биоте не сохраняется средообразующий генофонд,
поддерживающий устойчивость почвы как биокосного тела.
Аккумуляция рассеянных элементов происходит в результате
образования солей с органическими кислотами, адсорбции ионов на поверхности
органических коллоидных систем или образования органоминеральных
комплексов. Ионы рассеянных элементов могут адсорбироваться на
поверхности минеральных частиц, проникать в межплоскостные
пространства глинных минералов или изоморфно замещать ионы других элементов в
кристаллической решетке. Различаются и преобладающие формы
соединений рассеянных элементов в почвах. В случае геохимических аномалий
соединения элементов представлены в основном сульфидами, сульфатами
и карбонатами, в случае аэротехногенного загрязнения - оксидами и
металлической формой. В почвах, подверженных техногенному
загрязнению, накапливаются не только так называемые приоритетные, но и
сопутствующие в рудах и других вспомогательных веществах (топливо, флюсы
и др.) рассеянные элементы.
76
В данной главе рассматриваются следующие проблемы: 1) формы
рассеянных элементов в почвах; 2) закономерности трансформации соединений
рассеянных элементов в почвах (общие закономерности и трансформация
соединений металлов техногенной природы); 3) концентрации и внутрипро-
фильное распределение рассеянных элементов в подзолах (в фоновых
условиях и в условиях воздушного загрязнения выбросами медно-никелевого и
апатито-нефелинового производства).
4.1. КОНЦЕНТРАЦИИ И ФОРМЫ
РАССЕЯННЫХ ЭЛЕМЕНТОВ В ПОЧВАХ
Содержание и формы нахождения тяжелых металлов в почвах
определяются различными факторами: а) составом почвообразующих пород;
б) масштабами и химическим составом техногенных эмиссий; в)
содержанием и формами нахождения тяжелых металлов в глобальных природных и
техногенных потоках; г) условиями миграции и трансформации первичных
соединений тяжелых металлов в почвах, включая соединения техногенной
природы (факторами почвообразования); д) свойствами почв.
Для почв бореальной зоны в целом концентрации и формы тяжелых
металлов определяются главным образом составом и свойствами
почвообразующих пород и генезисом почв. Это связано с тем, что средняя плотность
населения в этой зоне весьма незначительна. Оно сконцентрировано
преимущественно в европейской части страны в крупных городах и промышленных
центрах.
Основная масса соединений тяжелых металлов, выбрасываемая в
окружающую среду промышленными предприятиями, концентрируется в почвах
в непосредственной близости от источников загрязнения.
Высокодисперсные частицы с медианным размером <0,05 мкм, поступающие в атмосферу
после фильтров тонкой очистки, вовлекаются в глобальные потоки и
переносятся на большие расстояния в форме высокодисперсных аэрозолей (гл. 3;
Гудима, Шейн, 1975; Остромогильский, Петрухин, 1984). В настоящее время
количество As, Cd, Mn, Pb, Zn, Hg, Mo, Sb, выбрасываемых в атмосферу из
техногенных источников, сопоставимо или превосходит количество
металлов, поступающих в результате природных процессов (Добродеев, 1978; Мо-
тузова, 1999).
Несмотря на то, что концентрация тяжелых металлов в аэрозолях
быстро растет с уменьшением медианного диаметра частиц, общий уровень
загрязнения почв за счет глобального переноса, по-видимому, крайне
незначителен, так как плотность частиц, содержащих ТМ, в глобальных природных
и техногенных потоках достаточно низка (Добровольский, 1983).
Формы рассеянных элементов
К бореальным относятся почвы лесотундровой, северотаежной и сред-
нетаежной зоны - всего около 20% общей территории бывшего СССР.
Важнейшие почвенные типы представлены мерзлотно-таежными, глеево-подзо-
листыми и подзолистыми, глеево-таежными, таежно-болотными и таежно-
пойменными почвами с разнообразными химическими признаками
(Почвоведение, 1988; Природно-сельскохозяйственное районирование... 1985).
77
Почвообразующие породы, составляющие минералогическую основу
бореальных почв, весьма разнообразны. Основная их масса в северной
части бореального пояса представлена моренными, флювиогляциальными, со-
лифлюкционными и делювиально-солифлюкционными отложениями,
преимущественно легкого механического состава; в южной части - покровными,
лёссовидными, карбонатными и бескарбонатными средними и тяжелыми
суглинками.
Для почвообразующих пород легкого механического состава
характерно повышенное содержание слабо выветрелых первичных минералов.
В почвообразующих породах среднего и тяжелого механического состава
большое значение для состояния тяжелых металлов имеют вторичные и
глинные минералы.
Важными факторами, влияющими на содержание, распределение и
формы тяжелых металлов в бореальных почвах, является их переувлажненность,
во многих случаях слабокислая и кислая реакция среды, а также явления,
связанные с периодическим промерзанием и протаиванием почв. Эти факторы в
целом увеличивают подвижность большинства тяжелых металлов и
возможность их перераспределения между эффективными фазами почв.
Среднее содержание некоторых тяжелых металлов во флювиогляциаль-
ных и древнеаллювиальных песках составляет (в мг/кг): РЬ - 4, Мп - 476,
Си - 19,5; Zn - 30,6. Среднее содержание свинца в моренных суглинках
составляет около 6, в покровных тяжелых суглинках - 13, в лёссовидных
суглинках - 15, в сильно подзолистых почвах Карелии - около 6 мг/кг (Тойкка,
Потахина, 1980). Как следует из представленных данных общее содержание
тяжелых металлов в почвообразующих породах в целом сопоставимы или
несколько ниже средних значений для почв в целом. В сильно подзолистых
почвах Карелии наблюдаются более низкие концентрации некоторых
тяжелых металлов (Тойкка, Потахина, 1980).
Первичные минералы. Тяжелые металлы, входящие в состав первичных
минералов, по-видимому, являются наиболее консервативными, хотя и
неустойчивыми в условиях почвообразования соединениями (табл. 4.1). По
мнению Д.М. Шоу (1969) и Г.В. Мотузовой (1999), в первичных минералах
тяжелые металлы находятся в трех формах: 1) изоморфные примеси (большая
часть тяжелых металлов); 2) ионы, защемленные в дефектах структуры или
адсорбированные на поверхности минерала; 3) входящие в состав
акцессорных минералов.
Возможность изоморфного замещения структурных катионов
катионами тяжелых металлов и прочность их закрепления в этих позициях
определяется физико-химическими свойствами последних: радиусом, строением
внешних электронных оболочек, величиной заряда, потенциалом
ионизации, электроотрицательностью и др. (Лебедев, 1969). В частности, в
структуре первичных минералов возможны следующие изоморфные замещения с
участием тяжелых металлов (Тоусон, 1961; Шоу, 1969; Беус и др., 1976):
Шпинели: Mg-Fe-Mn-Zn-Ni-Co; Al-Fe-Mn; Cr-Ti-V;
Оливин: Mg-Fe-Mn-Zn-Ni-Cr;
Гранат: Ca-Mg-Fe-Mn; Al-Fe-Mn;
Эпидот: Al-Fe-Mn; Cr-Ti-V;
Турмалин: Mg-Fe-Mn-Zn-Ni-Cr; Al-Fe-Mn; Cr-Ti-V;
78
Гиперстены: Mg-Fe-Mn-Zn-Ni-Cr;
Амфиболы: Al-Mg-Mn;
Роговые обманки: Ca-Mg-Fe-Mn;
Магнетит: Ti-Mn-Cr-Co-Al-Zn-Mo-Cu-Ga.
По способности накапливать тяжелые металлы силикаты образуют
следующие ряды (Шоу, 1969; Мотузова, 1999):
Си - биотит > гранат > плагиоклаз > гиперстен > оливин;
Мп - гиперстен > оливин > плагиоклаз.
Акцессорные минералы (апатит, циркон, ильменит, титаномагнетит,
рутил, сульфиды) наиболее сильно обогащены тяжелыми металлами, но их
содержание в почвообразующих породах крайне невелико, так же как и
собственных минералов некоторых тяжелых металлов.
В процессе выветривания первичных минералов переход тяжелых
металлов, адсорбированных поверхностью минерала, в раствор обусловлен
процессами десорбции. Металлы, содержащиеся внутри кристаллической
решетки в форме изоморфных или механических примесей (включая
акцессорные минералы) переходят в раствор только после разрушения
кристаллической решетки. Устойчивость отдельных минералов к выветриванию и
очередность высвобождения отдельных элементов из кристаллической
решетки минералов при ее разрушении представлены в табл. 4.1 и 4.2.
Вторичные минералы. Аккумуляция тяжелых металлов в глинных
минералах в форме изоморфных и механических примесей весьма велика.
В частности, в октаэдрических слоях двухслойных минералов (каолинита,
диккита, галуазита, метагалуазита, гинзбургита и др.) ионы А13+ могут быть
замещены Cu2+, Cr3+, Ni2+; в трехслойных минералах (монтмориллоните, бей-
деллите, нантроните) - Ni2+, Zn2+, Cu2+, Co2+; в группе гидрослюд
(вермикулит, гидробиотит) - Mn2+, Cr3+, V3+; в четырехслойных минералах (группа
хлорита) - Сг3+, Мп2+; в бруситовом слое Mg2+ часто замещается Ni2+, Fe2+ и
Мп2+. Изоморфное замещение более характерно для минералов 2:1 типа,
чем для 1:1 типа (Соколова, 1985).
Важным механизмом иммобилизации тяжелых металлов глинными
минералами является ионообменная адсорбция на поверхности. Это связано,
прежде всего, с их высокой дисперсностью и связанной с этим значительной
удельной поверхностью и обменной емкостью (табл. 4.3). Особенно
значительны эти показатели для трехслойных и смешаннослойных минералов,
которые обладают лабильной кристаллической решеткой.
Трансформация соединений рассеянных элементов
Общие закономерности. Поступающие в почву из природных и
антропогенных источников первичные соединения тяжелых металлов являются
термодинамически неустойчивыми, поскольку почвенные условия существенно
отличаются от условий их формирования. В результате все эти соединения
с той или иной скоростью трансформируются в более устойчивые формы.
Процессы, вызывающие трансформацию первичных соединений тяжелых
металлов в почвах, носят универсальный характер и реализуются во всех
типах почв с определенным своеобразием, обусловленным конкретными
условиями существования той или иной цочвы (рис. 4.1).
79
ПОЧВА
Транслокация
в растения
Поглощение-
выделение
Почвенная
биота
Миграция с грунтовыми водами
Карбонатное
равновесие
Почвенный
раствор
Осаждение-
растворение
Осадки
малорастворимых
солей
Растворение,
десорбция
Почвенный
воздух
Ионный обмен,
адсорбция
Поллютанты
Почвенный
поглощающий
комплекс
Рис. 4.1. Схема трансформации соединений тяжелых металлов в почве
Важнейшим этапом трансформации соединений тяжелых металлов в
почвах является переход металлов из твердой фазы в жидкую. В силу
термодинамической неустойчивости первичных соединений тяжелых металлов
эта стадия трансформации в большинстве случаев является необратимой.
Далее свободные тяжелые металлы в почвенном растворе вступают в
обратимые взаимодействие с неорганическими и органическими компонентами
почвенного раствора за счет процессов гидролиза, гидратации и ассоциации
(комплексообразования). Свободные и образовавшиеся ассоциированные
формы металлов взаимодействуют с другими эффективными фазами почв,
включая микроорганизмы, мезофауну и корневые системы растений,
вступая, таким образом, в биогеохимический круговорот.
Процессы, определяющие взаимодействие тяжелых металлов с
эффективными фазами почв, хорошо изучены в смежных областях знаний: это
прежде всего ионный обмен и адсорбция, осаждение-растворение. В почвах
эти процессы сильно осложнены гетерогенным составом поверхности
частиц почвенного поглощающего комплекса и полиионностью протекающих
процессов. Значительно хуже изучены механизмы поступления тяжелых
металлов в живые организмы и в частности в корневую систему растений.
Здесь до настоящего времени приходится пользоваться эмпирическими
соотношениями, описывающими транслокацию металлов из раствора в
растения или микроорганизмы.
Соединения техногенной природы. Состав пыли предприятия по
производству свинца и цинка представлен в табл. 4.4. Основная масса тяжелых
металлов в техногенных выбросах находится в форме оксидов. Причем в ряду
80
Pb -» Zn -» Cd существенно увеличивается доля растворимых в воде форм и
уменьшается доля металла, содержащегося в нерастворимом осадке. К
этому следует добавить, что по мере удаления от источника загрязнения в
составе техногенных выбросов в целом повышается содержание растворимых
форм элементов (Ковнацкий и др., 1989). Таким образом, соединения
тяжелых металлов в техногенных выбросах гораздо менее устойчивы по
сравнению с естественными формами и вступают в биогеохимический круговорот
примерно в 100 раз быстрее последних (Patterson, 1965).
Особенности нахождения тяжелых металлов в бореальных почвах
обусловлены, прежде всего характером почвообразовательного процесса и
появлением компонентов, присущих только почвам: специфическому и
неспецифическому органическому веществу, а также некоторым минеральным и ор-
ганоминеральным соединениям, образующимся в результате деятельности
живых организмов. Последние играют чрезвычайно важную роль в
трансформации соединений тяжелых металлов в почвах (Ковалевский, 1984).
Из табл. 4.3 следует, что специфическое органическое вещество почв
(гуминовые и фульвокислоты), да и гумус в целом имеют довольно большую
обменную емкость и потому их вклад в иммобилизацию тяжелых металлов
за счет процессов ионообменной адсорбции весьма значителен. Вместе с тем
следует иметь в виду, что емкость катионного обмена почвы не является
аддитивной величиной, складывающейся из величин емкости катионного
обмена отдельных компонентов (Пинский, 1997).
Поскольку концентрации тяжелых металлов в почвах очень
незначительны, они занимают лишь малую часть емкости катионного обмена.
В этих условиях более важную роль в иммобилизации тяжелых металлов
играет сродство обменных центров почвенного поглощающего комплекса к
тяжелым металлам, которое определяется энергией взаимодействия
адсорбирующихся катионов с поверхностными функциональными группами.
Иммобилизация тяжелых металлов за счет ионообменной адсорбции
частицами почвенного поглощающего комплекса особенно важна в случае
загрязнения почв соединениями тяжелых металлов из источников, удаленных от
исследуемой территории.
Почвенный поглощающий комплекс является полифункциональным об-
менником, на поверхности которого располагаются группы с широким
спектром кислотно-основных свойств - от сильнокислотных до сильноосновных
(Пинский, 1997). По-видимому, распределение поверхностных
функциональных групп с различными свойствами на поверхности почвенной
частицы носит кластерный характер. Поэтому ряды сродства каждого такого
кластера к ионам тяжелых металлов отличаются (Мархол, 1985):
- для участков поверхности с сильнокислотными свойствами:
Ва2+ > Pb** > Sr2+ > Ni2+ = Cu2+ > QP+ > С02+ > Zn2+ > Mn2+ > Ве2+ > Hg2+;
- для участков поверхности со среднекислотными свойствами:
РЬ2+ > Си2+ > Zn2+ > Cd2+ >Mn2+ > Со2+ > Ni2+;
- для участков поверхности со слабокислотными свойствами:
Си2+ > Со2+ > Ni2+ > Са2+ (при рН около 7,0).
Это означает, что связывание тяжелых металлов различными частями
поверхности почвенных частиц происходит неодинаково. При малых кон-
81
центрациях тяжелых металлов в почвенном поглощающем комплексе
заполняются центры, наиболее интенсивно взаимодействующие с ними. По
мере увеличения степени заполнения почвенного поглощающего
комплекса в процесс ионообменной адсорбции включаются центры с более
низким относительным сродством к данным катионам. Таким образом,
прочность удерживания металла поверхностью почвенных частиц зависит не
только от свойств иона металла и средних показателей свойств
поверхности, но и от степени заполнения поверхности этими металлами (уровня
загрязнения почв).
Изменение положения катионов в рядах сродства обусловлено тем, что
катионы тяжелых металлов по-разному взаимодействуют с
поверхностными функциональными группами. Неспецифическая адсорбция обусловлена
силами электростатического взаимодействия, скорректированными
деформацией сольватных оболочек, образующихся вокруг катионов и
обменных центров. Энергия такого взаимодействия незначительна и не
превышает 10 ккал/моль (40 кДж/моль), чаще всего 2-3 ккал/моль. Она
характерна для функциональных групп с сильно- и среднекислотными
функциями. Специфическая адсорбция характеризуется значительно
более сильными взаимодействиями электростатического и
координационного типа. Она более избирательна по отношению к катионам и характерна
для групп слабокислотного и основного типа. При этом из обменных
позиций в раствор вытесняются протоны, подкисляющие почву (Пинский,
1997; Понизовский и др., 1999).
Экспериментальные методы изучения форм нахождения ТМ в почвах
чаще всего основаны на селективной экстракции катионов ТМ, связанных
либо с определенными компонентами почв, либо существенно
различающихся по прочности связи с почвенными частицами. Следует отметить, что
формы нахождения ТМ в почвах, идентифицируемые с помощью методов
последовательных селективных экстракций, весьма условны, поскольку
отсутствуют идеально селективные экстрагенты. Кроме того, по мере
продвижения по любой схеме последовательных селективных экстракций
накапливается систематическая ошибка, обусловленная влиянием предшествующих
экстракций на состояние металла в почве.
Для выявления этого факта был произведен анализ форм кадмия,
свинца и цинка в лугово-карбонатной почве с использованием методов Миллера
(Miller et al., 1986) и Суна и Бейтса (Soon, Bates 1982). В первом случае
идентифицировали водорастворимую, неспецифически адсорбированную,
специфически адсорбированную, кислоторастворимую, связанную с
органическим веществом, оксидами Fe и Мп формы; во втором - подвижную,
комплексную и кислоторастворимую формы.
Сравнительный анализ показал, что сумма водорастворимой и
неспецифически адсорбированной форм металлов, извлекаемых по методу
Миллера, соответствует подвижным формам, экстрагируемым по методу Суна и
Бейтса. Сумма специфически адсорбированных, связанных с органическим
веществом и кислоторастворимых форм, извлекаемых по методу Миллера
соответствует комплексной форме, экстрагируемой по методу Суна и
Бейтса. В принципе эти соотношения довольно хорошо согласуются с
представлениями о характере взаимодействия катионов металлов с компонентами
почв при образовании той или иной формы нахождения металла в почве.
82
Рассмотрим некоторые экспериментальные оценки состояния тяжелых
металлов в почвах, полученные с применением методов последовательных
селективных экстракций.
В работе (Химия тяжелых металлов..., 1985) представлены данные по
изучению форм цинка и кадмия в некоторых почвах, подверженных
техногенному загрязнению и искусственно загрязненных пылью, взятой с
фильтров тонкой очистки свинцового завода после инкубации в течение года
(табл. 4.5). В работе использовали следующую схему анализа форм:
обменная (1н Ca(N03)2) -> связанная с органическим веществом (1н Ca(N03)2
после 30% Н202) -» связанная с оксидами Fe (CH3COOH + NH2OH) ->
остаточная. Отдельно определялась водорастворимая форма.
Анализируя данные табл. 4.5, можно отметить ряд особенностей:
- содержание форм Zn и Cd в почвах, загрязненных выбросами
свинцового завода, в естественных условиях и в модельных экспериментах
различается незначительно,
- цинк и кадмий существенно различаются между собой по формам
нахождения в почвах: цинк концентрируется в основном в форме связанной с
оксидами железа, кадмий - в обменной форме;
- почвы подзолистого ряда в целом аккумулируют тяжелые металлы в
более лабильных формах по сравнению с черноземом.
Различный характер взаимодействия Си и Zn с почвами и связанные с
этим различные формы их аккумуляции отмечены в работе Т.В. Пампуры и
др. (1993) при использовании метода последовательных селективных
экстракций Тессиера и др. (Tessier et al., 1979) для оценки перераспределения Zn
и Си в черноземе.
Состояние металлов в исходной незагрязненной почве:
Zn: карбонаты < органическое вещество < обменная форма < оксиды Fe
и Мп < остаточная форма;
Си: оксиды Fe и Мп < органическое вещество <^ остаточная форма.
Состояние металлов при среднем уровне загрязнения (^ 200 мг/кг):
Zn: органическое вещество < остаточная форма = карбонаты <
обменная форма < оксиды Fe и Мп
Си: обменная форма < карбонаты < оксиды Fe и Мп < остаточная
форма < органическое вещество.
Состояние металлов при высоком уровне загрязнения (> 400 мг/кг):
Zn: органическое вещество в остаточная форма < карбонаты < оксиды
Fe и Мп < обменная форма.
Си: обменная форма < карбонаты < остаточная форма < органическое
вещество < оксиды Fe и Мп.
В дерново-карбонатной почве, подверженной комплексному
загрязнению выбросами предприятий черной металлургии и химической
промышленности, основная масса цинка аккумулирована в остаточной фракции.
Значительно меньшие количества металла связаны с органическим
веществом. Содержание цинка в форме, связанной с оксидами Fe и Мп,
карбонатами и находящейся в обменном состоянии, невелико и в сумме не
превышает 15%.
Итак, состояние тяжелых металлов в бореальных почвах зависит от
свойств элементов, состава и свойств почв и почвообразующих пород.
Основная масса тяжелых металлов в незагрязненных почвах находится в соста-
83
ве первичных и вторичных минералов в форме изоморфных примесей и
механических включений, образующихся в процессе формирования этих
минералов, jto наиболее консервативные формы нахождения тяжелых
металлов в почвах.
Техногенные соединения тяжелых металлов относительно быстро
переходят в более устойчивые формы характерные для почв бореального пояса,
при этом перераспределение тяжелых металлов между различными
компонентами почв зависит от свойств металла. Например, Cd и Zn в
значительной степени аккумулируются в неспецифически и специфически
адсорбированных формах, Си и РЬ в виде комплексных соединений с органическим
веществом и в остаточной фракции. В целом трансформация техногенных
соединении тяжелых металлов в почвах бореального пояса приводит к
увеличению лабильных форм металлов.
Литература
Недра^^б4" ГрабовскаяЛИ- Тихонова Н.В. Геохимия окружающей среды. М.:
Войткевич Г В Кокин А.В., Мирошниченко А.Е., Прохоров ВТ. Справочник
по геохимии. М.: Недра, 1990.
Глазовская М.А. Проблемы и методы оценки эколого-геохимической устойчи-
№мГс\\™т°Т0 ПОКрова к техногенным воздействиям // Почвоведение,
хл WHf ШейнЯ.П. Краткий справочник по металлургии цветных
металлов. М.: Металлургия, 1975. 535 с
Мысль^вТт"" ВВ Ге0Графия микроэлементов: Глобальное рассеяние. М.:
Wm^U С ?8^2ХНОГеНе3 ~ Мощная геохимическая сила биосферы // Приро-
Загрязняющие вещества в окружающей среде / Ред. А. Моцик и Д.Л. Пинский.
Пущино; Братислава, 1991. 195 с.
ра шГпГс"" АЛ' Биогеохимические поиски рудных месторождений. М.: Нед-
Ковнацкий Е.Ф Сурнин В.А., Казначевский И.В. и др. Некоторые особенности
загрязнения атмосферного воздуха промышленного города с развитой цветной
металлургией // Мшрация загрязняющих веществ в почвах и сопредельных средах. Л.:
Гидрометеоиздат, 1989. Т. 5. С. 128-133
XHMrofl969B И Ионн°-атомные радиусы и их значение для геохимии и химии. Л.:
С 90^92ДГ°Л М' И°НОобменники в аналитической химиию М.: Мир, 1985. Т. 1.
1999МГб6Ус°вй ГВ С°еДИНения микроэлементов в почвах. М.: Эдиториал УРСС,
Остромогильский А.Х., Петрухин В.А. Тяжелые металлы в атмосфере:
Источники поступления и методы оценки их влияния // Мониторинг фонового
загрязнения природных сред. Л.: Гидрометеоиздат, 1984. Вып. 2. С. 56-78.
и™ 1ГТура ТВ' "инскийДЛ., Остроумов В.Е. и др. Экспериментальное
изучение буфер«ости чернозема при загрязнении медью и цинком // Почвоведение. 1993.
рвунина .и., Малахов С.Г. Подвижность металлов, выпавших в почву в
составе выоросов промышленных предприятий // Миграция загрязняющих веществ в
почвах и сопредельных средах. Л.: Гидрометеоиздат, 1989. С. 171-179.
Пинский ДЛ. Ионообменные процессы в почвах. Пущино, 1997. 166 с.
да.
84
Понизовский А.А., Студеникина Т.А., Мироненко Е.В. Поглощение ионов
меди (II) почвой и влияние на него органических компонентов почвенных растворов //
Почвоведение. 1999. № 7. С. 850-859.
Почвоведение. М.: Высш. шк., 1988. Ч. 1: Почва и почвообразование. 400 с;
Ч. 2: Типы почв, их география и использование. 368 с.
Природно-сельскохозяйственное районирование земельного фонда СССР:
Атлас СССР. М.: ГУГК, 1985. 75 с.
Тойкка МЛ.у ПотахинаЛ.Н. Содержание тяжелых металлов в почвах и
растительном покрове в районе г. Петрозаводска // Тяжелые металлы в окружающей
среде. М.: Изд-во МГУ, 1980. С. 51-54.
Toy сон Л.В. Геохимия редких элементов в гранитоидах. М.: Изд-во АН СССР,
1961.
Химия тяжелых металлов, мышьяка и молибдена в почвах. М.: Изд-во МГУ,
1985. 206 с.
Шоу ДМ. Геохимия микроэлементов кристаллических пород. Л.: Недра, 1969.
Miller W.P., Martens D.C., Zelezny L.W. Effect of sequence in extraction of trace metals
from soils // Soil Sci. Soc. Amer. J. 1986. Vol. 50, N 3. P. 598-601.
Mitchell R.L. Trace elements: Chemistry of soil. N.Y., 1955. 127 p.
Patterson C.C. Contaminated and natural lead environ of man // Arch. Environ Health.
1965. N11. P. 179-188.
Soon Y.K., Bates Т.Е. Chemical pools of cadmium, nickel and zinc in polluted soils and
some preliminary identifications of their availability to plants // J. Soil Sci. 1982. Vol. 33.
P. 477-488.
Tessier A., Campbell P.G.G., Bisson M. Sequential extraction procedure for the specia-
tion of particulate trace elements // Anal. Chem. 1979, Vol. 51, N 7. P. 844-851.
4.2. Рассеянные элементы в Al-Fe-гумусовых подзолах
Al-Fe-гумусовые подзолы, доминирующие в наземных экосистемах
холодных гумидных областей, характеризуются фоновыми, длительными по
времени (тысячи лет) почвенными процессами, обусловившими генезис
маломощного и резко дифференцированного по строению и свойствам
почвенного профиля (Никонов, 1987; Никонов, Переверзев, 1989; Таргульян,
1971). Современный этап подзолистого Al-Fe-гумусового почвообразования
связан с активным антропогенным воздействием, вызвавшим
одновременное протекание фоновых и новых, непродолжительных по времени (годы-
десятки лет) техногенно обусловленных процессов. Эти процессы связаны,
прежде всего, с аэротехногенным загрязнением почв и проявляются на
значительных по площади территориях в результате: а) сжигания ископаемого
топлива; б) выбросов предприятий горнопромышленного комплекса; в)
выбросов химической промышленности; д) выбросов автотранспорта; е)
сжигания отходов. Они инициируют воздушную миграцию и поступление в
наземные экосистемы прежде всего рассеянных элементов и
кислотообразующих агентов (соединений серы и азота), следствием чего является
преобразование химического состава и свойств почв (Глазовская, 1988;
Добровольский, 1983; Ильин, 1991; Кабата-Пендиас, Пендиас, 1989; Bowen, 1966).
Ликвидация последствий техногенного загрязнения почв с ограничением
распространения токсичных для биоты соединений элементов объединяется
понятием "самоочищения". В действительности о "самоочищении" можно
говорить лишь по отношению к почвам, загрязненным токсическими
органическими соединениями, подвергающимися минерализации (пестицидами,
85
детергентами, полициклическими углеводородами и т.д.). В отношении
минеральных загрязняющих соединений переход их в иммобильное состояние
(и как результат накопление в почвах) нельзя оценивать как самоочищение.
Это - техногенное консервирование (Глазовская, 1999). Масшабы такого
консервирования и последствия его для биоты еще не оценены.
Различия между почвами геохимических аномалий и техногенно-загряз-
ненными выражаются в статусе элементов. В первом случае их аккумуляция
в почвах характеризуется элювиальной кривой, во втором - элементы
преимущественно концентрируются в верхнем гумусовом горизонте
(Глазовская, 1999).
Материалы, характеризующие особенности внутрипрофильного
распределения широкого спектра тяжелых металлов в подзолах в фоновых
условиях, а также при интенсивном техногенном загрязнении, немногочисленны,
однако они необходимы для трактовки современных процессов
подзолообразования.
В данном разделе рассматриваются закономерности аккумуляции и
внутрипрофильного распределения рассеянных элементов в Al-Fe-гумусовых
подзолах в фоновых условиях и при загрязнении выбросами медно-никеле-
вого и апатито-нефелинового производства на Кольском полуострове.
Фоновые условия
Объектами исследования послужили Al-Fe-гумусовые подзолы ельника
кустарничково-зеленомошного, развивающиеся на несортированной зава-
луненной морене, и почвы сосняка лишайникового, сформированные на
сортированных четвертичных отложениях. Эти типы лесных экосистем
доминируют на Кольском полуострове. Подробная характеристика объектов
исследования представлена в наших работах (Лукина, Никонов, 1996;
Никонов, 1987; Никонов, Лукина, 1994). Следует отметить, что оба типа
объектов развиваются в условиях фонового регионального загрязнения.
В основных генетических горизонтах (О, Е, В и С) почв определяли
валовые концентрации рассеянных элементов, объединенных в
соответствии с их положением в периодической системе и атомным номером
(табл. 4.6). Химический состав различных генетических горизонтов почв
и почвообразующей породы сопоставляли с помощью широко
применяемого в геохимии коэффициента обогащения (КО), или "enrichment factor"
(EF) (Глазовская, 1988; Добровольский, 1983; Кабата-Пендиас, Пендиас,
1989; Перельман, 1989). Этот показатель рассчитывается как отношение
концентрации рассеянного элемента в почвенном горизонте к его
содержанию в породе.
Определение рассеянных элементов проводили методом эпитеплового
нейтронного активационного анализа на импульсном быстром реакторе
ИБР-2 мощностью 2 Мвт Лаборатории нейтронной физики им. И.М.
Франка Объединенного института ядерных исследований в Дубне (Frontasyeva,
Steinnes, 1995; Nazarov et al., 1995). Образцы и аттестованные стандарты
МАГАТЭ (донные отложения SDM, SL-5, SL-7) облучали с помощью пнев-
мотранспортной установки РЕГАТА в канале облучения с кадмиевым
экраном при плотности потока эпитепловых и быстрых нейтронов
(0.23 ± 0.03) • 1012 и (1.4 ± 0.16) • 1012, соответственно.
86
Рассмотрим особенности аккумуляции и внутрипрофильного
распределения рассеянных элементов по группам и подгруппам Периодической
системы.
Элементы подгруппы 1а представлены щелочными металлами Rb и Cs
(табл. 4.6). Хорошо известно, что эти элементы легко вступают в
химические реакции благодаря одному электрону на внешнем энергетическом
уровне. При этом Cs более активен, чем Rb. В кислой окислительной среде,
которая характерна для Al-Fe-гумусовых подзолов, Rb и Cs сравнительно
легко высвобождаются из первичных минералов при выветривании.
Рубидий. Концентрация металла находится в пределах 30-50 мг/кг, что
в целом соответствует содержанию Rb в почвах на ледниковых
отложениях и моренах (Кабата-Пендиас, Пендиас, 1989; Lin et al, 1996).
Распределение Rb в минеральной части почвенного профиля довольно равномерное,
органогенный горизонт содержит минимальные количества 9-16 мг/кг
(рис. 4.2). В Al-Fe-гумусовых подзолах для этого металла, по-видимому,
отсутствуют барьеры в силу его миграционной активности, высокой
степенью участия в химических реакциях и легкого высвобождения из
первичных минералов.
Цезий. Известно, что химические и геохимические характеристики Cs
сходны с Rb. Однако концентрация этого элемента значительно ниже - в
пределах п • 10"1 мг/кг. Основываясь на имеющихся данных,
характеризующих содержание Cs в почвах легкого песчаного гранулометрического
состава, следует заключить, что исследованные почвы бедны этим
металлом. Распределение Cs, также как и Rb, по почвенному профилю
характеризуется элювиальной кривой, что свидетельствует о прогрессивном
обеднении почвенного профиля в процессе почвообразования (рис. 4.2).
Элементы подгруппы lb представлены Си и благородными металлами
Ag и Аи (табл. 4.6). Полагают, что между поведением этих металлов в
геохимических процессах наблюдается устойчивая корреляция
(Кабата-Пендиас, Пендиас, 1989).
Медь входит в состав первичных минералов (главным образом,
сульфиды), которые легко выветриваются в кислой среде. Этот элемент
принадлежит к группе переходных металлов, обладающих широкой вариацией
свойств, прежде всего способностью к комплексообразованию и окислению.
Активное взаимодействие этого элемента с органическими и минеральными
компонентами (комплексообразование, адсорбция, соосаждение)
препятствует его высокой подвижности в пределах почвенного профиля.
Медь - ярко выраженный биофил, растения активно поглощают
соединения этого элемента, концентрируя в наземных органах, а затем возвращая
с опадом. Валовое содержание меди в минеральных и особенно в
органогенных горизонтах варьирует. Согласно нашим данным содержание меди
достигает 60 мг/кг в почвообразующих породах и может не превышать 4 мг/кг
в органогенных горизонтах. Согласно данным Л.В. Алещукина (1972) и
В.О. Таргульяна (1971) содержание меди составляет в среднем 40 мг/кг в
минеральных горизонтах и 60 мг/кг - в органической части профиля. Для
сравнения, концентрации Си в подзолах иллювиально-железистых Канады на
порядок ниже (Lin et al., 1996).
На Кольском полуострове при незначительном воздушном
промышленном загрязнении распределение данного металла по профилю подзолов но-
87
& li
5
8-
^
8-
<N
,°т*
1»
1*
0
° 1 1 1
О О О
ев ^
C3Q
1 1
о о
СО Tt
мг/кг
400
) 200
i
с
со
i/
i i
5 О О
^н ГЯ
30-
~s
мг/кг
Is
со -
!3"
о Н
с
1 1 1 1
э о о о о
i-н CN СО "^
мг/кг
0,6 0,9
) 0,3
с
ее
и
1 ^^Г
1 1 1
Э О О О
—< CN СО
1
/кг
§
£
CN
00
о
*■
О
О -1
с
,--°
,#
/*—г^
1 1 1 к
э о о о о
*ч CN СО тГ
мг/кг
40 60
i i !
8-
С
£
F^,
I
■ ■It
5 О О О О
^н CS CO rt
1Ю *внидХ1гj
мг/кг
со
со -
1Л _
с
Э © О
30-
i
мг/кг
) 10 20 30
> '
О
i i i i
э о о о о
^н CN СП rf
мг/кг
) 5 10
*
* _
1 — i i i
о о о
О *-н СМ
и
1 1
СП Tt
fa 00 -1
3
VO -
^ -
CN -
а е
■ III
э о о о о
^ CN СП 4t
г/кг
о _
о .
CN
С
ф ш
ф _S
I I
> о о
»-н CN
1 1
О О
СП Tf
мг/кг
300
§"
§-
Й с
р\
1 1 1
э о о о
1-н CN СП
1
3
мг/кг
и
120
■ 1
о .
VO
С
ф
ф
ф
о^~~+^
it
»/
i i
z> о о
^ CN
*%%*о
1 1
о о
СП ^
Рп
) 0,5
•
с
1 D
л^~~ фф*
# ш
i I i
5 О О О
^ CS СП
ко 'внидХкj
■■■"1
Та мг/кг
0 0,4 0,8
1 Л 1 1 1 1
.--О""*
Р"
1
1
1
О • •
■ ill
5 О р О О
1-н CN СП Tt
го 'внидХиj
Рис. 4.3. Внутрипрофильное распределение никеля
и меди в подзолах условно-фоновых районов
Кольского полуострова
сит элювиальный характер (рис. 4.3). Такие
территории на Кольском полуострове
незначительны и были обнаружены нами в
Лапландском заповеднике, а также в
национальном парке "Кутса". Сходный тип
распределения обнаруживается на территории Финской
Лапландии, которую относят к самому
"чистому" уголку Северной Европы, и в Северной
Норвегии (Reinmann et al, 1998). Однако уже
при низком (фоновом) уровне
аэротехногенного загрязнения обнаруживается
аккумулятивный характер распределения меди с максимумом в органогенном горизонте,
что обусловлено формированием комплексов с органическим веществом
(см. рис. 4.2).
Серебро легко высвобождается при выветривании и активно
взаимодействует с гумусовыми веществами. Уровень содержания Ag
(п • 10~1-п • 10~2 мг/кг) в целом соответствует природному диапазону (Smith,
Carson, 1977; Кабата-Пендиас, Пендиас, 1989). Для почв характерно
биоаккумулятивное накопление металла в подстилке, что что связано с биофиль-
ной природой этого элемента (см. рис. 4.2).
Золото. Этот металл отличается самыми низкими концентрациями из
всех определявшихся рассеянных элементов (п • 10~3 мг/кг). При сравнении с
другими почвами (Кабата-Пендиас, Пендиас, 1989) содержание золота в
подзолах Кольского полуострова приближается к верхнему уровню
природного диапазона. Максимальная концентрация этого металла, также как и
серебра, отмечается в подстилке (рис. 4.2), что, по-видимому, связано с
селективным поглощением элемента лесными растениями и закреплением его после
разложения опада в виде органо-металлических соединений (Boyle,
Alexander, Aslin, 1975).
Элементы подгруппы Па - Sr и Ва - входят в число щелочноземельных
элементов (см. табл. 4.6). В геохимических процессах их поведение сходно с
Са и Mg.
Стронций легко мобилизуется при выветривании в кислой
окислительной среде. Почвы, развитые на ледниковых отложениях, характеризуются
широким диапазоном колебаний содержания этого элемента - 15-570 мг/кг
(Кабата-Пендиас, Пендиас, 1989). В условиях гумидного климата Sr активно
выносится за пределы почв. Исследованные почвы довольно богаты Sr и
сопоставимы с иллювиально-железистыми подзолами Канады (Lin et al., 1996),
концентрация Sr составляет п • 102 мг/кг. Распределение Sr по почвенному
профилю носит элювиальный характер, что может быть обусловлено его
активной мобилизацией в наиболее активной части профиля (кислая
окислительная среда) и выносом за пределы профиля нисходящими почвенными
растворами в условиях гумидного режима (см. рис. 4.2).
Барий, высвобождающийся при выветривании первичных минералов,
малоподвижен. Концентрация этого элемента в подзолах и песчаных почвах
мг/кг
0 20 40 60 80
П J
и ■
а10"
S 20-
VO
и 30-
40-1
iiii
> t
<> V
ъ V
^т- А « 1
V 141 -v - - - ^Ц
90
находится в широких пределах от 180 до 780 мг/кг (Кабата-Пендиас, Пенди-
ас, 1989). В исследованных почвах концентрация Ва близка содержанию Sr
(п • 102 мг/кг). Сходно и распределение этих металлов по почвенному
профилю: минимальное содержание в органогенном горизонте и довольно
равномерное распределение в минеральной части (см. рис. 4.2).
Подгруппа lib включает два металла: Zn и Cd. Эти элементы
относительно подвижны в природной среде. Чаще всего они присутствуют в виде
двухвалентных катионов и обнаруживают большое сродство к
органическим соединениям (см. табл. 4.6).
Цинк. Содержание Zn в подзолах и других песчаных почвах может
существенно различаться: от 4 до 220 мг/кг. Подвижность Zn, как и Си,
контролируют процессы комплексообразования, адсорбции и соосаждения. В
кислой среде адсорбция Zn2+ связана с катионным обменом. При рН < 7
адсорбция Zn2+ ослабляется, что приводит к мобилизации и выщелачиванию Zn
(Кабата-Пендиас, Пендиас, 1989). Поэтому в подзолистых почвах
выявляется выраженное обеднение профиля этим элементом. Органическое
вещество способно связывать Zn в устойчивые формы, что обусловливает
накопление элемента в органогенных горизонтах. В исследованных почвах
концентрация этого металла составляет п • 101 мг/кг. В кислых окислительных
условиях Zn довольно подвижен и может активно выноситься за пределы
профиля. Профильное распределение этого металла свидетельствует о
биоаккумулятивном характере накопления - аккумуляции в подстилке (см.
рис. 4.2). Это может быть вызвано селективным поглощением растениями и
закреплением в органо-минеральных комплексах после разложения
растительного опада или природным аэральным привносом этого элемента -
атмосферное выпадение Zn сопоставимо с размерами его выноса за пределы
профиля (Никонов, Лукина, 1994).
Элементы подгруппы ШЬ представлены Sc, а также элементами двух
малоизученных семейств: лантаноидами или редкоземельными элементами
(La, Се, Nd, Sm, Eu, Gd, Tb, Yb, Lu) и актиноидами (Th и U) (см. табл. 4.6).
Скандий. Наименьшие концентрации Sc установлены в легких песчаных
почвах: в подзолах Польши пределы колебаний содержания элемента от 0,8
до 3,5 мг/кг (Кабата-Пендиас, Пендиас, 1989), в почвах США на ледниковых
отложениях и моренах - 5-15 мг/кг (Smith, Carson, 1977). Исследованные
почвы довольно богаты Sc (n • 10° -п • 101 мг/кг), что, по-видимому,
является региональной особенностью (см. табл. 4.6). Распределение элемента по
почвенному профилю характеризуется элювиальной кривой (см. рис. 4.2).
Особенно обеднен Sc горизонт подстилки, что позволяет сделать вывод о
низкой потребности лесной растительности в элементе и отсутствии
биогеохимических барьеров.
Лантаноиды (La, Се, Nd, Sm, Eu, Gd, Tb, Yb, Lu) присутствуют в горных
породах и почвах в соединениях с зарядом 3+. Как правило, содержание
лантаноидов убывает с возрастанием атомной массы, и элементы с четными
атомными номерами имеют большую распространенность, чем следующие
за ними элементы с нечетными атомными номерами (хондритовое
соотношение). Это находит подтверждение для всех генетических горизонтов
исследованных почв. Лантаноиды по концентрации в этих почвах
разделяются на две группы: концентрация п • 10° мг/кг - La, Се, Nd; п • 1(Н мг/кг - Sm,
Eu, Gd, Tb, Yb, Lu. Такие различия в первую очередь определяются исход-
91
ным содержанием этих элементов в почвообразующих породах. Эти
концентрации на порядок ниже, чем в подзолах иллювиально-железистых южного
Квебека (Lin et al., 1996). Все перечисленные элементы повторяют
особенности распределения по почвенному профилю, присущие Sc (см. рис. 4.2).
Актиноиды. Это семейство элементов в естественных условиях
представлено Th и U. В процессе выветривания минералов эти элементы легко
мобилизуются, образуя комплексные неорганические и органические
соединения. Гумусовые кислоты способны повышать растворимость актиноидов
(Кабата-Пендиас, Пендиас, 1989). Уран (в виде U02) обладает большей
растворимостью, чем Th4+, и потому более активно выщелачивается. В
исследованных почвах актиноиды (Th и U) характеризуются низкими
концентрациями: в диапазоне п • КГ1 мг/кг. В целом концентрации Th несколько выше,
чем U, особенно в нижней части почвенного профиля. Распределение
актиноидов по почвенному профилю характеризуется закономерностями,
присущими Sc и лантаноидам (см. рис. 4.2).
Элементы IV подгруппы представлены Sn (подгруппа IVa) и Zr и Hf
(подгруппа IVb) (см. табл. 4.6).
Олово в природных условиях проявляет себя как халькофильный
элемент. Он способен к образованию комплексов с органическими
соединениями. Немногочисленные данные позволяют заключить о способности Sn к
аккумуляции в верхнем органогенном горизонте, где концентрации этого
элемента составляют 10-35 мг/кг, снижаясь в верхней части минерального
профиля до 6-7 мг/кг.
Элементы подгруппы IVb, как полагают (Кабата-Пендиас, Пендиас,
1989), по концентрации в литосфере и биосфере близки семейству
редкоземельных элементов.
Цирконий распространен в земной коре незначительно: в пределах
20-500 мг/кг, для песчаных почв Белоруссии интервал содержания Zr
колеблется в пределах от 90 до 160 мг/кг (Лукашев, Петухова, 1974). В почвах
является слабо подвижным, поскольку самый распространенный минерал
циркон Zr - устойчив к выветриванию даже в кислых подзолистых почвах
(Steinnes, Njastad, 1995). Исследованные почвы довольно богаты этим
элементом. Концентрации Zr в минеральных горизонтах составляют
п • 102 мг/кг, в подстилке - на порядок ниже. Распределение Zr в
минеральной части профиля принципиально отличается от распределения выше
рассмотренных элементов (см. рис. 4.2). Максимальные концентрации этого
элемента приурочены к элювиальному горизонту А2 и постепенно
снижаются с глубиной. Этот факт подтверждает известный вывод об
устойчивости минералов, содержащих Zr, к выветриванию и возможность
использования этого элемента в качестве реперного при генетических интерпретациях.
По мнению D. Hutton (1977) для анализа генезиса почв наиболее
предпочтительно соотношение Ti : Zr. Низкие концентрации Zr в подстилках могут
быть связаны с его ограниченным потреблением растениями.
Гафний, близкий по геохимическим свойствам к Zr, еще менее
распространен в земной коре: в горных породах - предел колебаний его
концентраций составляет 0,1-10 мг/кг, в подзолах иллювиально-железистых
Южного Квебека (Канада) - от 10 до 14 мг/кг (Lin et al., 1996). Концентрация
этого элемента в исследованных почвах значительно ниже, чем Zr:
я • 10° мг/кг - для минеральных горизонтов и п • 1(Н мг/кг - для подстилки.
92
Однако закономерности его распределения по почвенному профилю, в том
числе и относительное обогащение горизонта Е, сохраняются (см. рис. 4.2).
Вероятно, это связано со сходными геохимическими свойствами
элементов, в том числе их включением в состав устойчивых к выветриванию
минералов.
Элементы подгруппы Va представлены As (единичные данные) и Sb (см.
табл. 4.6).
Сурьма характеризуется высокой подвижностью в окружающей среде.
Среднее содержание Sb в земной коре не превышает 1 мг/кг, для подзолов
иллювиально-железистых Южного Квебека (Канада) оно колеблется в
пределах от 2 до 5 мг/кг (Lin et al., 1996), для песчаных почв Онтарио,
использующихся в сельском хозяйстве, значительно ниже: 0,05-1,3 мг/кг (Frank et al.,
1979). В исследованных почвах, формирующихся в условиях фонового
регионального загрязнения, концентрация этого элемента довольно низкая:
п • 10'2 мг/кг - для минеральных почвенных горизонтов и резко возрастает в
подстилке. Аккумулятивный характер распределения с максимумом в
органогенном горизонте свидетельствует о фоновом загрязнении (см. рис. 4.2).
Известно, что ионы Sb активно фиксируются гумусом (Кабата-Пендиас,
Пендиас, 1989), что, по-видимому, и наблюдается в органогенных
горизонтах исследованных почв.
Мышьяк. Основываясь на наших результатах и данных для почв из
других регионов (Кабата-Пендиас, Пендиас, 1989) следует заключить, что этот
элемент может накапливаться в органогенных горизонтах при фоновом
уровне загрязнения. Концентрации As в органогенных горизонтах
исследованных почв достигают 24 мг/кг.
Подгруппа Vb представлена V и Та (см. табл. 4.6).
Содержание ванадия в подзолистых Al-Fe-гумусовых почвах
определяется его концентрацией в почвообразующей породе, поскольку для
Скандинавии этот элемент характеризуется низкой биоаккумулятивной
активностью: соотношение концентраций V в горизонтах О и С находится в
пределах 0,1-0,4 (Steinnes, Njastad, 1995). В исследованных почвах концентрации
этого элемента достигали в породе 50 мг/кг, тогда как в органогенных
горизонтах были менее 10 мг/кг. Ванадию свойственен элювиальный характер
внутрипрофильного распределения (рис. 4.2).
Тантал является геохимически малоподвижным элементом, что
обусловлено его плохой растворимостью. В исследованных почвах он
характеризуется низкими концентрациями (п • 10"1-и • 10~2 мг/кг) и элювиальным
характером распределения по профилю (см. рис. 4.2). В подзолах иллювиально-
железистых Квебека содержание этого элемента значительно выше: может
превышать 2 мг/кг (Lin et al., 1996). Наиболее обеднены этим элементом
подстилки, что указывает на отсутствие биогеохимических барьеров для Та.
Элементы VI группы представлены Se (подгруппа Via), Сг, Mo, W
(подгруппа VIb) (см. табл. 4.6).
Хром. Исследованные почвы богаты этим элементом. В почвообразую-
щих породах концентрация Сг достигает п • 102 мг/кг, и, по-видимому, это
основная причина высокого содержания элемента в почвах. Привлекает
внимание элювиально-иллювиальное распределение Сг по профилю в условиях
фонового регионального загрязнения (см. рис. 4.2). Это становится
объяснимым, если иметь в виду, что в природе значительная часть соединений эле-
93
мента обладает валентностью +3 и что геохимические свойства и ионный
радиус Сг+3 очень близки ионам Fe+3 и АГ3 (как раз эти элементы проявляют
элювиально-иллювиальный характер распределения в исследованных
почвах), а также тот факт, что при рН > 5,5 Cr*3 почти полностью выпадает в
осадок (этот диапазон кислотности свойствен верхней части иллювиальных
горизонтов В подзолистых Al-Fe-гумусовых почв).
Элемент VII подгруппы - Вг относится к галогенам (см. табл. 4.6). Соли
этого элемента легко растворимы. Поэтому Вг известен как активно
выщелачивающийся из почв элемент. Концентрация этого элемента в
исследованных почвах находится в диапазоне п • 10гх мг/кг. На основе имеющихся
данных выявляется бимодальный характер распределения Вг по профилю с
максимумами накопления в органогенных и иллювиальных горизонтах.
Объяснением такого характера распределения могут быть установленные
тесные связи между Вг и С в почвах различных типов и поверхностных
отложениях (Кабата-Пендиас, Пендиас, 1989). Распределение Вг весьма сходно
с Ag. Вероятно, это неслучайно, поскольку наиболее распространенным
природным минералом является AgBr.
Группа VIII представлена Со, Ni и 1г (см. табл. 4.6). Со и Ni близки
между собой по геохимическим свойствам и атомным радиусам. Fe, не являясь
рассеянным элементом в почвах и горных породах, играет определяющую
роль в поведении Со, Ni и некоторых других рассеянных элементов.
Кобальт. Почвы наследуют содержание Со от материнских пород.
В геохимических циклах Со тесно связан с Fe и Мп. В природных условиях
этот элемент встречается главным образом в двух состояниях окисления:
Со2+ и Со3+. При выветривании в окислительной кислой среде Со
относительно подвижен, но может сорбироваться оксидами Fe и Мп. Органические
хелаты Со известны как легко подвижные и активно мигрирующие по
почвенному профилю. Исследованные почвы концентрируют в почвообразую-
щей породе до 10 мг/кг этого металла. В процессе почвообразования
почвенный профиль, особенно его верхняя часть (Н и Е) обедняются Со (до
2-3 мг/кг) (см. рис. 4.2).
Никель, как и Си, входит в состав первичных минералов, которые легко
выветриваются в кислой окислительной среде. Этот металл обнаруживает
способность к абсорбции органическим веществом. Поэтому в верхних
почвенных горизонтах он может присутствовать преимущественно в
органически связанных формах, прежде всего как легко растворимые хелаты.
Валовое содержание Ni в исследованных почвах довольно высокое: оно
составляет 10-60 мг/кг в минеральном профиле и достигает 80 мг/кг в органогенных
горизонтах (Алещукин, 1972; Никонов и др., 1993). Эти данные на порядок
превышают концентрации Ni в подзолах иллювиально-железистых Канады
(Lin et al., 1996).
В почвах, формирующихся на территориях, где воздушное
промышленное загрязнение очень незначительно (Лапландский заповедник,
национальный парк Кутса, Финская Лапландия, Северная Норвегия), распределение
никеля по профилю носит элювиальный характер (см. рис. 4.3).
Особенностью распределения Ni по профилю исследованных почв, формирующихся в
условиях фонового регионального загрязнения, является аккумулятивный
характер распределения с максимумом в органогенном горизонте (см.
рис. 4.2).
94
Общие особенности формирования химического состава Al-Fe-гумусо-
вых подзолов. Анализ полученных материалов уместно предварить кратким
изложением сложившихся представлений об участии макроэлементов
(концентрации > 1 г/кг) в формировании химического состава рассматриваемых
почв: Na, К, Mg, Ca, А1, С, Si, Ti, N, Р, Mn, Fe, многие из которых называют
типоморфными для ландшафтов холодных гумидных областей (Глазовская,
1988; Перельман, 1989).
В табл. 4.7 представлены коэффициенты обеднения-обогащения (КО)
для макроэлементов. Как и следовало ожидать, сопоставление подстилки и
почвообразующей породы (отношение О/С) указывает на обогащенность
органогенного горизонта С, N, Р (иногда, Мп). Особенно впечатляет
относительная аккумуляция С и N - КО может превышать 200. Величины КО для
других горизонтов свидетельствуют о высокой обогащенности этими
элементами всего почвенного профиля.
Как показано в многочисленных работах по подзолообразованию,
для горизонта Е характерна обогащенность Si. Особенностью
формирования химического состава горизонта В является выраженная обогащенность
Fe, что тесно связано с распределением С. Алюминий проявляет сходные, но
слабо выраженные тенденции.
Полученные материалы свидетельствуют также о том, что профиль
Al-Fe-гумусовых подзолов в процессе почвообразования обедняется
щелочными (Na, К) и щелочноземельными металлами (Ca, Mg), а также Ti.
Подзолы иллювиально-железистые Канады (Lin et al., 1996) обогащены
Cd, Rb, Sb, но обеднены Ca, Cu, Ni по сравнению с почвообразующей
породой. Однако в данном случае сопоставлялись слои 0-20 см и подстилающей
породы, поэтому сложно делать заключения о внутрипрофильном
распределении.
Наши данные (табл. 4.8) позволяет говорить об обогащенности
подстилки Ag и Аи в подзолах Кольского полуострова, что, вероятно, связано с био-
фильным характером этих элементов. Максимум в органогенном горизонте
обнаруживается и для Вг.
Остальными исследованными элементами подстилка обеднена,
особенно щелочными элементами Rb, Cs, лантаноидами и актиноидами. Следует
также подчеркнуть, что в почвах, формирующихся на территориях,
практически не подверженных воздушному промышленному загрязнению, для
меди и никеля также характерен элювиальный тип внутрипрофильного
распределения (см. рис. 4.3).
Сопоставление химического состава минерального горизонта Е с
почвообразующей породой показывает тенденции преобразования почвенной
минеральной массы в результате различной устойчивости минералов,
концентрирующих определенные элементы, к выветриванию. В данном наиболее
преобразованном почвообразованием горизонте активно аккумулируются
Zr и Hf, что, вероятно, вызвано устойчивостью минералов,
концентрирующих эти элементы, к выветриванию. Этот горизонт значительно
обедняется лантаноидами, актиноидами, Та, Сг, Со.
Для иллювиального горизонта характерны следующие тенденции:
- обогащение Ag, Au, Br, Сг и Со, вероятно, в силу тесной связи с
иллювиальным гумусом (об этом свидетельствуют кривые внутрипрофильного
распределения перечисленных элементов, охарактеризованные выше);
95
- обогащение Zr и Hf, которое определяется устойчивостью к
выветриванию минералов, их содержащих.
Остальными элементами в процессе почвообразования порода
обедняется, на что указывает величина КО.
Таким образом, в подзолах, формирующихся на наиболее удаленных от
источников воздушного промышленного загрязнения территориях, можно
идентифицировать следующие типы внутрипрофильного распределения для
рассматриваемого ряда элементов:
- насыщенный тип - профиль насыщен С и N;
- биофильный (органогенно-аккумулятивный) тип с максимумом в
органогенном горизонте - характерен для Р, Ag, Au, иногда для Мп;
- минерально-аккумулятивный - для Si, Zr, Hf;
- иллювиально-элювиальный - для Fe и А1;
- бимодальный с максимумами в органогенном и иллювиальном
горизонтах характерен для С, N, Au, Ag, Br;
- элювиальный - для Са, Mg, К, Na и для большей части рассеянных
элементов.
В условиях даже очень незначительного регионального загрязнения
(объекты исследований могут быть удалены от источников загрязнения на
расстояния, превышающие 100 км) рассеянные элементы, входящие в
состав выбросов, демонстрируют органогенно-аккумулятивный тип
распределения. К таким элементам на Кольском полуострове, а также в Северной
Норвегии относятся Ni, Cu,Cr, Zn, Co, Sb, V, Se, Pb, As.
Можно предположить, что обогащение органогенного горизонта
соединениями рассеянных элементов может происходить и в природных условиях,
например, в случае пыления минеральных горизонтов при их обнажении
(при вывале деревьев), а также при морской импульверизации.
Поскольку соединения тяжелых металлов мигрируют по почвенному
профилю с органическим веществом, для некоторых из них в условиях
регионального фона может наблюдаться бимодальный тип внутрипрофильного
распределения, например, для Сг, Со.
Воздушное загрязнение
Медно-никелевое производство. В настоящее время имеется большое
количество данных о воздействии воздушных выбросов медно-никелевого
производства на концентрацию тяжелых металлов в Al-Fe-гумусовых
подзолах. Впервые детальная характеристика распределения и поведения
никеля, меди, некоторых других тяжелых металлов в этих почвах была
представлена в работах В.В. Добровольского и сотрудников его коллектива (Але-
щукин, 1972; Добровольский, 1972, 1983; Добровольский и др., 1997).
В.В. Добровольский (1983) подчеркивал важную роль коренных пород в
формировании химического состава четвертичных отложений, предложив
классификацию рассеянных элементов в комплексах кристаллических
пород Кольского полуострова.
Представленные в табл. 4.9 материалы позволяют говорить о важности
и необходимости учета особенностей состава почвообразующих пород при
анализе материалов, характеризующих концентрацию рассеянных
элементов в почвах региона. Однако аналитические технологии, использовавшиеся
96
в то время, не позволяли корректно оценить концентрации многих
рассеянных элементов. Кроме того, большинство последующих публикаций по этой
проблеме касались главным образом так называемых "приоритетных пол-
лютантов": соединений Ni, Си, Со. Данные о валовых концентрациях многих
рассеянных элементов (Rb, Cs, Ag, Au, Sc, лантаноиды, актиноиды, Sn, Zr,
Hf, As, Sb, V, Та, Se, Mo, W, Br, платиноиды) в основных генетических
горизонтах Al-Fe-гумусовых подзолов до настоящего времени оставались
единичными либо отсутствовали.
Целью данного раздела является оценка уровней концентрации и
особенностей внутрипрофильного распределения широкого спектра
рассеянных элементов в подзолах, формирующихся при интенсивном загрязнении
выбросами медно-никелевого производства и развивающихся в условиях
варьирующего литогенного фона.
Наземные экосистемы Кольского полуострова более 60 лет
испытывают воздействие двух самых больших на Севере Европы медно-никелевых
комбинатов: "Североникель" (центральная часть полуострова -
Мончегорский градиент) и "Печенганикель" (северо-западная окраина на границе с
Норвегией - Никельский градиент).
Объектами исследований Мончегорского и Никельского градиентов
послужили почвы сосняков лишайниковых, произрастающих вдоль
юго-западного и южного направлений от комбинатов, соответственно. Подробная
характеристика объектов исследования представлена в наших работах
(Лукина, Никонов, 1996; Никонов и др., 1993, 1997). В табл. 4.10 приведены
материалы, характеризующие атмосферные выпадения некоторых рассеянных
элементов в условно-фоновых районах Северной Фенноскандии и в зонах
воздушного промышленного загрязнения медно-никелевыми комбинатами.
Выпадения Ni, Си, Со вблизи комбинатов могут превышать фоновые
значения в 1000 раз и более. Остальные определявшиеся элементы, которые
могут поступать в результате воздушного загрязнения или пыления
эродированных поверхностей (например, Sr), выпадают также в заметных
количествах. Атмосферные нагрузки на экосистемы Мончегорского градиента
значительно выше, чем Никельского. Это связано с преимущественным
использованием на комбинате "Североникель" норильской руды, которая
богаче местной рассеянными элементами, а также с особенностями
производства, что обусловливает относительно низкие выбросы комбинатом
"Печенганикель" Ni, Си, Со, но высокие - Сг (Chekushin et al., 1994).
При проведении исследований мы руководствовались следующими
принципами и подходами (Лукина, Никонов, 1996; Никонов и др., 1993):
Принцип однотипности объектов исследования. Согласно этому
принципу корректное сопоставление параметров, обусловленных разным уровнем
воздействия средообразующего фактора, возможно только для почв
экосистем сходного типа структурно-функциональной организации.
Градиентный подход позволяет выявлять взаимодействия между
степенью и результатом воздействия средообразующего фактора на процессы
почвообразования.
Результаты наших многолетних исследований позволяют утверждать,
что в лесных экосистемах на Al-Fe-гумусовых подзолах биогеохимический
круговорот осуществляется главным образом в системе
фитоценоз-подстилка (Никонов, 1987). В этом случае градиентный подход является эффектив-
4. Рассеянные элементы от
ным приемом при поисках связей между уровнем загрязнения атмосферы и
концентрацией рассеянных элементов в верхних органогенных горизонтах
почв.
При рассмотрении концентрации рассеянных элементов в почвах,
формирующихся не только при разных уровнях воздушного промышленного
загрязнения, но и в условиях варьирующего литогенного фона, градиентный
подход нуждается в дополнении другими методами, позволяющими учесть
влияние литогенного (аутогенного) фактора, определяющего природное
обогащение четвертичных отложений рассеянными элементами коренных
пород.
Мончегорский и Никельский градиенты пересекают равнинную
территорию и участки, прилегающие к горным массивам, слагаемые
различающимися по химическому составу горными породами (Чуна- и Монче-тундры,
Хибины и др.). Основным источником рассеянных элементов в
четвертичных отложениях Кольского полуострова являются коренные породы
(Добровольский, 1972). Моренные отложения, сплошным чехлом покрывающие
территорию, на участках горных массивов могут прерываться или
обогащаться примесями коренных пород. Доля тех или иных коренных пород в
составе четвертичных отложений определяет размеры аккумуляции
рассеянных элементов в почвах.
Для характеристики внутрипрофильного распределения элементов
использовали коэффициенты обогащения (КО), метод расчета которых
приведен ранее. Для идентификации почв, развивающихся в условиях
изменяющегося литогенного фона, использовали дискриминантный анализ,
предоставляющий возможность выявлять различия между двумя и более группами
объектов по многим переменным одновременно.
В основных генетических горизонтах (<9, Е, В и С) почв определяли
валовые концентрации 36 рассеянных элементов (Rb, Cs, Cu, Ag, Au, Sr, Ba, Zn,
Cd, Sc, La, Се, Nd, Sm, Eu, Gd, Tb, Yb, Lu, Th, U, Sn, Zr, Hf, As, Sb, V, Та, Se,
Cr, Mo, W, Co, Ni, Br, It), объединенных в соответствии с их положением в
периодической системе. Образцы из каждого генетического горизонта на
каждом объекте исследований отбирали в 3-4-кратной повторности. Анализ
проводили, как правило, во всех отобранных образцах. Определение
рассеянных элементов проводили методом эпитеплового нейтронного активаци-
онного анализа, описанным выше.
Полученные материалы, представленные в табл. 4.11, позволяют
заключить, что при приближении к медно-никелевым комбинатам "Северони-
кель" и "Печенганикель" происходит значительное обогащение как
органогенных, так и минеральных горизонтов почв многими определявшимися
рассеянными элементами. С одной стороны, наблюдается существенное
возрастание концентраций элементов, входящих в состав выбросов (среди них Ni,
Си, Со, Сг Sr, Sb, It) особенно в верхних органогенных горизонтах почв. В
органогенных горизонтах также возрастают концентрации Ag, Au, Ba,
характеризующихся органогенно-акумулятивным типом распределения в
природных условиях и входящих в состав выбросов. С другой стороны, в почвах
достоверно возрастают концентрации элементов, не являющихся
компонентами выбросов: Sc, лантаноидов, актиноидов, Zr, Hf, Та.
Концентрации рассеянных элементов в исследуемых почвах
определяются литогенным, биогенным и техногенным факторами. Влияние биоген-
98
мг/кг Си
2500-1
2000 J ш R2 = 0,933
1500-
1000-
500-
0-
\ #
•V
^""^ Щ т т
6 15 30 45 60 75
Расстояние, км
]
0,06п
0,04-
0,02-
0-
кг/кг Аи
у R2 = 0,841
\
•\.
^ *■—s
и ' II 1 1 1
0 15 30 45 60 75
Расстояние, км
мг
51
4-
3-
2-
1-
0-
/кг
0
15
R2 = 0,941
■ i i
30 45 60
Расстояние, км
Se
i
75
мг
200н
150-
100-
50-
п
/^ Со
• R2 = 0,959
• • т
Ui 1 1 i - i — 1
0 15 30 45 60 75
Расстояние, км
мг/ki
2,5 -1
2-
1,5-
1-
0,5-
П-
С
f R2 = 0,941
V^_^
t—•—§
i i i i
) 15 30 45 60
Расстояние, км
Sb
75
мг/кг
Ni
3000
2000-|
1000
0
R2 = 0,794
0 15 30 45 60 75
Расстояние, км
мг/кг
0,03 п й
R2 = 0,718
0 15 30 45 60 75
Расстояние, км
Рис. 4.4. Взаимосвязи между концентрацией рассеянных элементов в верхнем
органогенном горизонте почв и расстоянием до источника загрязнения (Мончегорский
градиент)
4*
99
ного фактора на процессы почвообразования на объектах исследования
сопоставимо, поскольку все они представлены лесными экосистемами
сходной структурно-функциональной организации - сосняками
лишайникового типа. Литогенный фактор, определяющий уровни концентраций
рассеянных элементов, наследуемые почвой от почвообразующих пород,
существенно варьирует, что обусловлено долей примеси щелочных,
основных и ультраосновных пород вдоль градиентов. При приближении к
источникам выбросов возрастает уровень воздушного промышленного
загрязнения, который варьирует в зависимости от используемой руды и
специфики технологии.
Попытаемся продемонстрировать значение техногенного (аллогенного)
и литогенного (аутогенного) факторов в концентрации и внутрипрофиль-
ном распределении рассеянных элементов в подзолистых Al-Fe-гумусовых
подзолах.
Мончегорский градиент. В окрестностях комбината "Североникель"
обнаруживается увеличение концентраций многих рассматриваемых
рассеянных элементов по сравнению с фоном (рис. 4.4). Однако для одних
элементов основным фактором, определяющим возрастание концентраций,
является литогенный, а для других - воздушное промышленное загрязнение.
Использование дискриминантного анализа для характеристики
материалов, касающихся химического состава только минеральных почвенных
горизонтов, позволяет продемонстрировать исходную неоднородность почво-
образующей породы (рис. 4.5). На основе содержания рассеянных элементов
в минеральном профиле выделены три группы почв: а) почвы,
сформированные на сортированных моренных отложениях (фон и 48 км); б) почвы
36 км, состав которых определяет близость Хибин; в) почвы вблизи
Мончегорска, состав которых определяет близость Чуна-тундр (8 и 10 км от
источника выбросов). Уровень концентраций рассеянных элементов в
почвообразующих породах определяет различия между химическим составом
минеральных горизонтов почв 8 и 10 км.
Различия в концентрациях актиноидов, лантаноидов и скандия во всех
почвенных горизонтах между объектами у источника загрязнения и в
фоновых условиях значительны, достигают 2-3 раз. При этом коэффициенты
обогащения, рассчитанные как отношения между концентрациями
элементов в горизонтах почв и почвообразующей породе, часто ниже, чем в
фоновых условиях. Это свидетельствует о более ярко выраженном выносе этих
элементов из почв в условиях загрязнения.
Концентрации Rb и Cs в органогенных горизонтах почв у источника
загрязнения увеличиваются, а в минеральных снижаются, либо не изменяются
по сравнению с фоном. Коэффициент обогащения (КО) органогенных
горизонтов рубидием увеличивается в двое, тогда как минеральных варьирует,
не обнаруживая четких тенденций (табл. 4.12). Можно предположить, что
увеличение концентраций рубидия и цезия в органогенных горизонтах
обусловлено пылением обнаженных минеральных горизонтов.
Концентрации Ва и особенно Sr увеличиваются по сравнению с
фоновыми значениями только в органогенных горизонтах (до 2-8 раз), но не в
минеральных. Основным фактором, определяющим эти различия, особенно
для стронция, является воздушное промышленное загрязнение, о чем
свидетельствует значительное возрастание коэффициентов обогащения по отно-
100
200
150
100
504
мг/кг
1
Rb
Л2 = 0,767
I Г^
0 10 20 30 40 50
Расстояние, км
]
1,5,
0,5-
0-1
(
г/кг
1
) 10
Л2 = 0,826
—^ _
20 30 40
Расстояние, км
Sr
—а
=ж1
50
-I 1 1 1 1
0 10 20 30 40 50
Расстояние, км
мг/кг
800 т
600?
400 \
200 4#^
л
С
)
■
10
Ва
Л2 = 0,840
•
щ #
1 1 1 1
20 30 40 50
Расстояние, км
200-1
150 1
1001
50J
л J
т/кг
>
1
L.
U т г—
0 10
Л2 = 0,960
_—а
20 30 40
Расстояние, км
La
а
50
R2 = 0,961
Се
20 30 40 50
Расстояние, км
2,5
2
1,5
1
0,5
мг/кг
ТЬ
I
Л2 = 0,923
0 10 20 30 40 50
Расстояние, км
мг/кг
Ей
12п
9
6
3
0
R2 = 0,740
L-^r
0 10 20 30 40 50
Расстояние, км
мг/кг
20-1
15 1
101
51
ftj
\
Ui 1—
0 10
Л2 = 0,945
—^i г '" i1
20 30 40
Расстояние, км
Sm
50
0 10 20 30 40 50
Расстояние, км
Рис. 4.5. Распределение почв Мончегорского градиента (минеральный профиль) в
координатах двух дискриминантных функций на основе состава рассеянных
элементов
101
шению к почвообразующей породе для органогенных горизонтов у
источника загрязнения. Об этом же свидетельствуют данные В.А. Чекушина и др.
(Chekushin et al., 1994). Другой причиной увеличения концентраций этих двух
элементов может быть пыление минеральных горизонтов.
Концентрации № и Си в органогенных горизонтах почв увеличиваются
по сравнению с фоном до 30 раз, а в минеральных - только до 5 раз. При
этом коэффициенты обогащения для органогенных горизонтов возрастают
до 20 раз, практически не изменяясь для минеральных. На основании
изложенного выше следует заключить, что основным фактором, определяющим
варьирование концентраций этих металлов в почвах, является воздушное
загрязнение, несмотря на то, что у источника загрязнения литогенный фактор
вносит вклад, хотя и гораздо менее значительный.
Концентрации Со в органогенных горизонтах почв увеличиваются по
сравнению с фоном в 20-30 раз, а в минеральных - в 6-9 раз. При этом
коэффициенты обогащения для органогенных горизонтов возрастают только
в 4 раза, а для минеральных не изменяются. Следовательно, значительный
вклад в варьирование концентраций кобальта вносят как литогенный
фактор, так и воздушное промышленное загрязнения.
Различия в КО для Ni, Си и Со, вероятно, связаны с их разной
способностью к комплексообразованию с органическим веществом.
Концентрации Сг по сравнению с фоном в органогенных горизонтах
возрастают до 14 раз, при этом коэффициенты обогащения для этого
горизонта в условиях загрязнения увеличиваются только до 3 раз. Из этого следует,
что различия в концентрации этого элемента в почвах в значительной
степени определяет литогенный фактор.
Концентрации Sb в органогенных и минеральных горизонтах
увеличиваются по сравнению с фоном почти в 3 раза. Можно заключить, что
возрастание концентрации этого элемента у источника выбросов связано как с
воздушным загрязнением, так и с литогенным фактором.
Концентрации Zn в органогенных горизонтах сопоставимы с фоновыми
значениями. В минеральных горизонтах почв концентрации данного
элемента у источника загрязнения несколько повышены (1,5-2 раза). При этом
коэффициенты обогащения по сравнению с почвообразующей породой для
органогенного горизонта снижаются, а для минеральных сопоставимы с
фоновыми. Известно, что Zn в отличие от Си приурочен к фракциям
низкомолекулярных органических соединений, что может объяснять его высокую
подвижность (Добровольский и др., 1997), которая увеличивается при
возрастании кислотности среды, что приводит к относительному обеднению
соединениями этого элемента в органогенных горизонтах. Возрастание его
концентраций у источника загрязнения в минеральных горизонтах
обусловлено обогащением почвообразующей породы.
Концентрации Мп увеличиваются по сравнению с фоном во всех
почвенных горизонтах, однако в минеральных горизонтах это увеличение
выражено гораздо ярче. При этом коэффициент обогащения по отношению к поч-
вобразующей породе для минеральных горизонтов практически не
изменяется, а для органогенных - снижается. Можно предположить, что,
увеличение кислотности среды приводит к возрастанию мобильности марганца, как
и цинка, что объясняет относительное обеднение соединениями этого
элемента органогенных горизонтов почв.
102
Концентрации Ag и Au в органогенных горизонтах значительно
возрастают у источника загрязнения. Для минеральных горизонтов наши данные
единичны, однако согласно данным, полученным в других работах
(Reinmann et al., 1998), эти два элемента входят в состав загрязняющих
веществ и почвообразующих пород у источника загрязнения. Поэтому можно
заключить, что оба фактора, как аутогенный, так и аллогенный, играют
роль в аккумуляции этих элементов в органогенных горизонтах почв.
Концентрации Zr и Hf в органогенных горизонтах у источника
загрязнения увеличиваются по сравнению с фоном в 2-3 раза. При этом в
минеральных горизонтах концентрации этих двух элементов достигают
максимальных значений на пробной площади, расположенной на самом близком
расстоянии от Хибинского горного массива. Повышенные концентрации этих
элементов в органогенных горизонтах почв у источника загрязнения
объясняются пылением обнаженных элювиальных горизонтов.
Таким образом, роль аутогенного (литогенного) фактора в
формировании .состава исследуемых почв и в условиях воздушного промышленного
загрязнения остается существенной.
Следует заключить, что типы внутрипрофильного распределения
рассеянных элементов для Al-Fe-гумусовых подзолов сохраняются при
различных техногенных нагрузках и изменяющемся литогенном фоне для многих
элементов. Исключение составляют Ni, Cu, Co, Sb, Sr, которые в условиях
воздушного промышленного загрязнения медно-никелевым производством
демонстрируют органогенно-аккумулятивный тип распределения, тогда как
в фоновых условиях их внутрипрофильное распределение носило
элювиальный характер. Роль органогенных горизонтов как биогеохимических
барьеров для указанных элементов сохраняется даже при значительном
воздушном загрязнении
Для Zn обнаруживается обратная картина:
органогенно-аккумулятивный тип распределения этого элемента, отмечаемый в условиях
регионального фона, меняется в условиях загрязнения на элювиальный. Для марганца
наблюдаются сходные тенденции изменений. Элювиальный тип
распределения для лантаноидов становится более выраженным, что обусловлено
возрастанием подвижности соединений этих элементов.
Никельский градиент. Вблизи комбината "Печенганикель", так же как и
комбината "Североникель", обнаруживаются тенденции обогащения почв
многими рассеянными элементами (табл. 4.13). Так, концентрации
лантаноидов и актиноидов при приближении к источнику загрязнения
увеличиваются во всех горизонтах почв. При этом коэффициенты обогащения либо
сопоставимы с фоном, либо даже ниже (табл. 4.14). Это позволяет заключить,
что увеличение концентраций данных элементов связано с
провинциальными особенностями химического состава почв вблизи комбината, а не с
промышленными выбросами.
Увеличение концентраций Rb и Cs в органогенных горизонтах почв
можно объяснить пылением минеральных горизонтов.Тенденция
увеличения концентрации Ва и Sr по сравнению с фоновыми значениями наиболее
ярко выражена в органогенных горизонтах (до 2,5 раз). Основным
фактором, определяющим эти различия, для стронция является воздушное
промышленное загрязнение, о чем свидетельствует возрастание
коэффициентов обогащения по отношению к почвообразующей породе для органоген-
103
ных горизонтов у источника загрязнения, тогда как для минеральных
горизонтов данные тенденции не выражены. Для бария увеличение
концентраций может объясняться в основном литогенным фактором, поскольку КО
для органогенных горизонтов, так же как и для минеральных, практически
сопоставимы с фоновыми значениями.
Концентрации Ni, Си и Со в органогенных горизонтах почв
увеличиваются по сравнению с фоном менее значительно, чем на Мончегорском
градиенте (до 2-4 раз), а в минеральных горизонтах концентрации по всему
градиенту сопоставимы. КО для органогенных горизонтов возрастают не
более, чем в 3 раза, практически не изменяясь для минеральных. Основным
фактором, определяющим варьирование концентраций этих металлов в
почвах, является воздушное загрязнение.
Концентрации хрома по сравнению с фоном в органогенных горизонтах
возрастают до 2 раз, оставаясь сопоставимыми в минеральных.
Коэффициент обогащения для органогенного горизонта у источника выбросов
возрастает не более, чем в 1,5 раза, а для минеральных не изменяется. Из этого
следует, что различия в концентрации хрома в почвах определяет воздушное
загрязнение.
Концентрации Sb в органогенных горизонтах почв увеличивается не
более, чем в 2 раза, а в минеральных в 2,5 раза. Можно заключить, что
концентрации этого элемента в почвах у источника выбросов связано, главным
образом, с литогенным фактором.
Концентрации Zn в органогенных горизонтах сопоставимы с фоновыми
значениями. В минеральных горизонтах почв концентрации данного
элемента у источника загрязнения несколько повышены (в 1,5-1,7 раза). При
этом КО для органогенного горизонта снижаются, а для минеральных
сопоставимы с фоновыми. Следовательно, изменения в концентрации цинка на
Никельском и Мончегорском градиентах носят сходный характер.
Обнаруживаются лишь тенденции увеличения концентрации Ag в
органогенных горизонтах у источника загрязнения, концентрации Аи
сопоставимы по всему градиенту.
Концентрации циркония и гафния в органогенных горизонтах у
источника загрязнения увеличиваются по сравнению с фоном в 2-3 раза. При этом
в минеральных горизонтах концентрации этих двух элементов либо
сопоставимы с фоном, либо ниже фоновых значений. Следовательно, повышенные
концентрации этих элементов в органогенных горизонтах почв у источника
загрязнения объясняются пылением обнаженных элювиальных горизонтов.
Таким образом, сопоставление Al-Fe-гумусовых подзолов,
подверженных медно-никелевому загрязнению, позволяет заключить, что типы внут-
рипрофильного распределения рассеянных элементов сохраняются для
многих элементов при различных техногенных нагрузках и изменяющемся ли-
тогенном фоне. Исключение составляют никель, медь, кобальт и сурьма,
которые в условиях этого типа загрязнения демонстрируют органогенно-ак-
кумулятивный тип распределения, тогда как в фоновых условиях их внутри-
профильное распределение носило элювиальный характер. Так же как и на
Мончегорском градиенте, происходит обеднение органогенного горизонта
цинком. В то же время сохраняются тенденции обеднения этих почв
лантаноидами, актиноидами, щелочными и щелочноземельными элементами,
свойственные почвам фоновых территорий.
104
Апатитонефелиновое производство. Необходимость получения высоких
и стабильных урожаев обусловила активное использование минеральных
удобрений для регулирования питательного режима почв. Руды, из которых
производятся фосфорные удобрения (апатиты, фосфориты и др.) содержат,
как правило, помимо важнейшего элемента питания - фосфора, в
значительных количествах другие элементы. Так, для пород Хибинского горного
массива, где добываются апатито-нефелиновые руды, характерны
ассоциации рассеянных элементов, в которых преобладают Sr, лантаноиды, Zr, Nb;
постоянно и часто обнаруживаются Ва, Y, Та, Th, V, Cu, Ga; эпизодически
встречаются Li, Au, Zn, Hf, Be (Горбунов и др., 1981). Основными
компонентами выбросов при производстве апатитового концентрата являются
продукты флотации, поступающие в экосистемы воздушным путем в результате
пыления производимого концентрата и отходов, складируемых в хвостохра-
нилищах (Приймак и др., 1998). Следствием этих процессов является
изменение химического состава и свойств почв. Фосфорные удобрения
используются практически повсеместно в сельском и лесном хозяйствах, а также при
проведении рекультивационных работ. Поэтому весьма актуально выявить
тенденции миграции и аккумуляции рассеянных элементов, концентрации
которых в природных условиях не превышают лг • 101 мг/кг.
Биогеохимические циклы этих элементов остаются малоизученными.
Целью этого раздела является рассмотрение тенденций накопления и
внутрипрофильного распределения рассеянных элементов в AI-Fe-гумусо-
вых подзолах в условиях воздушного промышленного загрязнения
выбросами апатито-нефелинового производства.
Объектами исследований послужили AI-Fe-гумусовые подзолы
ельников кустарничково-зеленомошных, формирующихся вдоль юго-западного
градиента на расстоянии 0,5,2,18 и 48 км от апатито-нефелиновой фабрики
(АНОФ-2) комбината "Апатит" и ее хвостохранилища в губе Белой
оз. Имандра. Фабрика производит апатитовый концентрат начиная с 1963 г.
В табл. 4.15 приведены материалы, характеризующие атмосферные
выпадения некоторых рассеянных элементов в условно-фоновых районах
Северной Фенноскандии и в зонах воздушного промышленного загрязнения
апатито-нефелиновым производством. Особенно велики выпадения Sr,
превышающие фоновые значения более чем в 70 раз, и V - более чем в 15 раз.
Относительно высокие уровни выпадений Ni и Си связаны с близостью мед-
но-никелевого комбината. Однако эти материалы не характеризуют
выпадения редкоземельных элементов. Между тем апатитовый концентрат и
отходы флотации весьма богаты этими элементами. Так, концентрации Sc и
редкоземельных элементов в апатитовом концентрате составляют (в мг/кг):
Sc-0,14; Y-235; La-1890; Се-1920; Sm-170; Eu-60; Tb-9, Yb-12, Lu-1 (Волох
и др., 1989; Горбунов и др., 1991), что значительно (в 30-100 раз и более)
превышает их содержание в почвообразующих породах AI-Fe-гумусовых
подзолов Кольского полуострова, развитых на моренных отложениях (Никонов
и др., 1997).
В основных генетических горизонтах (О, Е, В и Q почв определяли
валовые концентрации 33 рассеянных элементов (Rb, Cs, Ag, Au, Sr, Ba, Zn, Cd,
Sc, La, Ce, Nd, Sm, Eu, Gd, Tb, Yb, Th, U, Zr, Hf, As, Sb, V, Та, Se, Cr, Mo, W,
Co, Ni, Br, lr), объединенных в соответствии с их положением в
периодической системе (табл. 4.16). В отличие от территории, подверженной загрязне-
105
нию медно-никелевого производства (Никонов и др., 1993), визуальных
признаков нарушений не фиксируется даже на расстоянии ближе 1 км от
источника, за исключением сильной запыленности поверхностей растений и почв.
Вблизи фабрики и хвостохранилища (почвы 0,5 и 2 км) органогенный
горизонт О морфологически разделяется на два подгоризонта. Эти различия
определяются интенсивным накоплением пыли в его верхней части, и потому
подгоризонты 01 и 02 анализировали отдельно.
Определение рассеянных элементов проводили методом эпитеплового
нейтронного активационного анализа, описанным выше.
Одним из методов, позволяющих выявить основные факторы,
определяющие состав почв в условиях изменяющегося литогенного фона и
различных техногенных нагрузок, является факторный анализ (Харман, 1972).
Коэффициенты обогащения, рассчитанные для почвенных горизонтов на
объектах исследования, и типы внутрипрофильного распределения
сопоставляли с этими характеристиками, полученными для фоновых объектов.
Для сравнения концентраций элементов между различными
генетическими горизонтами и в каждом генетическом горизонте, а также для
сопоставления коэффициентов обогащения на различных объектах
исследования, использовали однофакторный дисперсионный анализ. Различия
считали достоверными при р < 0,05.
Полученные материалы, представленные в таблице 4.16, позволяют
заключить, что при приближении к источнику загрязнения происходит
значительное обогащение как органогенных, так и минеральных горизонтов почв
всеми определявшимися рассеянными элементами. Объекты исследования
представлены лесными экосистемами сходной структурно-функциональной
организации - ельниками кустарничково-зеленомошными, поэтому влияние
биогенного фактора на процессы почвообразования сопоставимо.
Следовательно, концентрации рассеянных элементов в почвенных горизонтах
определяется соотношением вкладов литогенного и техногенного факторов.
Факторный анализ всех материалов демонстрирует высокую степень
"сжатия" информации (табл. 4.17). Три фактора объясняют более 80%
дисперсии. С фактором 1 (более 56% дисперсии) связаны элементы, которые в
данных условиях характеризуются аккумулятивным типом
внутрипрофильного распределения с максимумом концентраций в верхней части
органогенных горизонтов. На это указывают величины коэффициентов обогащения
(КО), достигающие 10 (табл. 4.18). В природных условиях эти элементы
демонстрировали либо элювиальный (среди них Rb, Cs, Sr, лантаноиды,
актиноиды, Та), либо минерально-аккумулятивный (среди них Zr, Hf) типы
распределения, и только для Zn отмечались тенденции аккумулятивного
накопления (Никонов и др., 1997). Следовательно, в условиях воздушного
промышленного загрязнения выбросами апатитового производства эти
элементы приобретают органогенно-аккумулятивный (техногенно-аккумулятив-
ный) тип внутрипрофильного распределения. Их концентрации в верхней
части органогенных горизонтов могут быть выше природных значений на
два порядка.
Максимальные концентрации перечисленных элементов фиксируются на
расстоянии 1-2 км от источника, резко снижаясь при удалении от него
(рис. 4.6.), что можно объяснить большими размерами активно
осаждающихся частиц (2-8 мкм и более), содержащих редкоземельные элементов, актино-
106
мг/кг
г
1-
л
(
1
v__
) 10
Л2 = 0,942
- t
* i i i
20 30 40
Расстояние, км
и
=л_
50
600^ Zr
450Н
300^
150Н
п J
i R2 = 0,715
^-t__ .
ит 1 "1 1 1 —1
0 10 20 30 40 50
Расстояние, км J
2(^/КГ
15
10-
5-
он
(
I R2 = 0,883
^— а
1 1 »i т- г—
) 10 20 30 40
Расстояние, км
Та
—А
—*1
50
мг/кг
15>
10{
51
V
*-
*н—
0
Л2 = 0,693
■— •
i w\ \
10 20 30
Расстояние, км
Hf
§
40 50
Л2 = 0,681
10 20 30 4^
Расстояние, км
1о"
—J
50
Рис. 4.6. Взаимосвязи между концентрацией рассеянных элементов в верхнем
органогенном горизонте почв и расстоянием до источника загрязнения (апатито-нефе-
линовое производство)
100ш
75 1
50 J ^
25
&d__J!SL
I
S I
I
1 Ed
РЗ
»!
Sr Sc La
GO 0,03-2 MKM
Ce
Sm Eu
H 2-8 mkm
Th
As Sb
■ >8mkm
Cr
Рис. 4.7. Распределение рассеянных элементов по размерам несущих частиц в
атмосферных выпадениях
107
иды и другие поллютанты апатитового производства (рис. 4.7). Такая
зависимость концентрации поллютантов в верхних горизонтах почв от расстояния
до источника загрязнения является закономерной. Необычно высокие
концентрации рассеянных элементов в органогенных горизонтах, особенно тех,
которые характеризуются элювиальным типом распределения в природных
условиях, можно объяснить резким снижением кислотности почв, что
обусловливает снижение их миграционной активности (табл. 4.19). Так, в условиях
загрязнения величина рННг0 органогенных горизонтов исследованных
почв возросла по сравнению с фоном на 3 единицы (от 3,9 до 6,9).
С фактором 2 (вклад в дисперсию 14%) наиболее тесной корреляцией
характеризуются элементы, распределение которых, как и в природных
условиях, относится к элювиальному типу (Sc и Сг). Возрастание концентраций
этих элементов в почвенных горизонтах при приближении к источнику
загрязнения обусловлено главным образом литогенным фактором, о чем
свидетельствуют сопоставимые с фоном КО. Следует заметить, что в
природных условиях скандий и лантаноиды характеризуются сходным поведением.
Различия в данном случае могут объясняться тем, что содержание скандия в
концентрате значительно (2-5 порядков) ниже, чем лантаноидов.
Концентрации Ва, для которого корреляционные связи с факторами 1 и 2
сопоставимы, определяются как воздушным загрязнением, так и исходным составом
почвообразующих пород.
С фактором 3, объясняющим около 10% дисперсии, связаны элементы,
часто характеризующиеся в природных условиях элювиальным типом
распределения - Со, Ni, Sb. Увеличение КО, рассчитанных для этих элементов
в органогенных горизонтах, и органогено-аккумулятивный тип внутрипоч-
венного распределения обусловлены влиянием выбросов медно-никелевого
производства (комбината "Североникель").
Таким образом, факторы 1 и 3, объясняющие 67% общей дисперсии,
характеризуют воздушное загрязнение верхних органогенных горизонтов
почв выбросами апатитового и медно-никелевого производств. Тип внутри-
профильного распределения элементов, связанных с этими факторами,
объясняется техногенным воздействием. Фактор 2, объясняющий всего 14%
дисперсии, характеризует влияние литогенного фона на распределение
рассеянных элементов
Общие тенденции аккумуляции
и внутрипрофильного распределения рассеянных элементов
Любой тип почв и отдельные почвенные горизонты этих почв обладают
определенным, присущим только этим объектам химическим составом.
Аккумуляцию и внутрипрофильное распределение элементов в этом случае
можно представить как определенную траекторию трансформации состава
почвообразующей породы в процессе почвообразования. Для описания
такого процесса Уодингтоном (Арманд, 1986) был предложен термин "креод",
который в нашем случае будет означать последовательную смену состояний
почвы через качественную химическую трансформацию почвообразующей
породы в результате функционирования всей экосистемы. В лесных
экосистемах, развивающихся в условиях холодных гумидных областей на полими-
ктовых песчаных отложениях, эквифиналом (т.е. одним и тем же результа-
108
том почвообразования) является формирование почвенного профиля с
определенным набором почвенных горизонтов О-Е-В-ВС-С и
соответствующим им химическим составом. Следовательно, в отсутствие внешних
нарушающих процессов и явлений аккумуляция и внутрипрофильное
распределение рассеянных элементов в Al-Fe-гумусовых подзолах являются
направленными и предсказуемыми.
В соответствии с анализом поведения и распределения по профилю этих
почв "структурных" (макро-) и микроэлементов, сделанным выше, а также
основываясь на многочисленных материалах других авторов, можно
заключить, что в процессе подзолистого Al-Fe-гумусового почвообразования
происходят существенные изменения химического состава исходной почвообра-
зующей породы.
Эквифинальность этого процесса определяется:
- тотальной обогащенностью благодаря жизнедеятельности организмов
всего почвенного профиля С и N - элементами, которые являются микро- и
ультрамикроэлементами для литосферы (насыщенный тип распределения);
- концентрацией некоторых элементов, проявляющих себя как биофилы,
в верхнем органогенном горизонте - подстилке благодаря их активному
поглощению организмами Ag, Au, Zn, Ba (органогенно-аккумулятивный тип);
- селективной обогащенностью минерального профиля некоторыми
элементами в силу устойчивости минералов, их содержащих, к
выветриванию (Si, Zr, Hf) (минерально-аккумулятивный тип);
- обедненностью профиля значительной частью элементов в результате
процессов выветривания и почвообразования (Na, К, Rb, Cs, Mg, Ca, Sr, В а,
Sc, La, Се, Nd, Sm, Eu, Cd, Tb, Yb, Th, U, Ti, Та, Ni, Си, Сг, Со) (элювиальный
тип);
- элювиально-иллювиальным распределением по минеральному
почвенному профилю отдельных элементов, тесно связанным с распределением
органического вещества (Fe, (Al), Ag, Au,, Br, Cr).
Предлагаемая классификация элементов и типов их внутрипрофильного
распределения, безусловно, нуждается в дополнении (в нее не включены
некоторые, характеризующиеся низкими концентрациями в биосфере,
элементы) и корректировке. Необходимы уточнения содержания и тенденций
внутрипрофильного распределения некоторых элементов, для которых
представлены единичные данные.
Воздействие сильного внешнего (аллогенного) фактора может заметно
изменять тенденции аккумуляции и внутрипрофильного распределения
рассеянных элементов в Al-Fe-гумусовых подзолах. Таким фактором является
воздушное промышленное загрязнение, которое способствует поступлению в
экосистемы значительного количества различных рассеянных элементов из
атмосферы. Если в природных условиях значительная доля соединений
рассеянных элементов, поступающих из атмосферы, обусловлена биологическими
процессами, то в условиях промышленного загрязнения преобладают
соединения техногенного происхождения. Результатом воздушного
промышленного загрязнения является значительное обогащение верхних органогенных
горизонтов почв рассеянными элементами, входящими в состав выбросов.
При атмосферном загрязнении медно-никелевым производством
особенно высокими уровнями аккумуляции отличаются Си, Ni, Co. Тип
внутрипрофильного распределения данных элементов можно охарактеризовать
109
как техногенно-аккумулятивный. Этот же тип распределения характеризует
накопление и других элементов (Ag, Au), идентифицированных нами как
поллютанты, а в природных условиях характеризующихся биогенно-акку-
мулятивным распределением. Роль органогенных горизонтов как
биогеохимических барьеров для указанных элементов сохраняется даже при
значительном воздушном загрязнении вплоть до формирования техногенных
пустошей. Благодаря эффективному функционированию органогенных
горизонтов как биогеохимических барьеров на пути нисходящей миграции
соединений этих рассеянных элементов уровень их концентрации в
минеральных горизонтах почв обусловлен главным образом литогенным фактором.
Поэтому увеличение их концентраций в минеральном профиле почв вблизи
источников загрязнения связано с их повышенными концентрациями в
основных и ультраосновных породах.
Для цинка и марганца в условиях воздушного загрязнения медно-никеле-
вым производством наблюдается обратная тенденция: если в фоновых
условиях тип их распределения по профилю зачастую можно охарактеризовать
как биогенно-аккумулятивный, то в условиях загрязнения он приобретают
черты элювиального распределения. Это обусловлено мобилизацией
соединений цинка и марганца в условиях кислой среды и активными обменными
реакциями в почвенном поглощающем комплексе, насыщенном катионами
металлов-поллютантов.
Для лантаноидов в условиях воздушного загрязнения медно-никелевым
производством отмечается интенсификация процессов элювиирования.
В условиях воздушного загрязнения медно-никелевого производства
выделенный нами элювиальный тип внутрипрофильного распределения для
Rb, Cs, Sc, La, Ce, Nd, Sm, Eu, Cd, Tb, Yb, Th, U, Та, Сг в Al-Fe-гумусовых
подзолах сохраняется при различных техногенных нагрузках и изменяющемся
литогенном фоне. Тенденции изменения концентраций этих элементов, как
в органогенных, так и минеральных горизонтах почв при приближении к
источникам загрязнения, расположенных в местах концентрации основных и
ультраосновных пород, связаны главным образом с литогенным фактором.
Воздушное загрязнение выбросами апатитового производства приводит
к значительному обогащению верхних органогенных горизонтов
Al-Fe-гумусовых подзолов рассеянных элементов, большинство из которых
характеризуется в природных условиях ярко выраженным элювиальным типом
внутрипрофильного распределения (среди них лантаноиды и актиноиды).
Литература
АлещукинЛ.В. Геохимия меди, никеля и железа в почвах Мурманского
Заполярья // Материалы к геохимии ландшафтов Кольского полуострова. М.: МГПИ, 1972.
С. 69-94.
Арманд АД. Устойчивость геосистем. М.: Наука, 1986. С. 14-23.
Виноградов А.П. Геохимия редких и рассеянных элементов в почвах Мира. М.:
Изд-во АН СССР, 1957. 237 с.
Волох А.А., Горбунов А.В., Гундорина С.Ф. и т.д. Производство фосфорных
минеральных удобрений как источник загрязнения окружающей среды
редкоземельными элементами. Дубна, 1989. 10 с. (Препр. ОИЯИ; Р 14-89-101).
Глазовская М А. Геохимия природных и техногенных ландшафтов СССР. М.:
Высш. шк., 1988. 328 с.
ПО
Горбунов А.В., Онищенко Т.П., Гундорина С.Ф., Фронтасьева М.В.
Воздействие производства фосфорных удобрений на окружающую среду. Дубна, 1991. 22 с.
(Препринт ОИЯИ. Р 14-91-478).
Добровольский В.В. География микроэлементов: Глобальное рассеяние. М.:
Мысль, 1983. 272 с.
Добровольский В.В. Минералогия и ландшафтно-геохимическая
характеристика четвертичных отложений Кольского полуострова Заполярья // Материалы к
геохимии ландшафтов Кольского полуострова. М.: МГПИ, 1972. С. 3-68.
Добровольский В.В., АлещукинЛ.В., Филатова Е.В., Чупахина Р.П.
Миграционные формы тяжелых металлов почвы как фактор формирований массопотоков
металлов // Тяжелые металлы в окружающей среде. Пущино: ОНТИ НЦБИ, 1997.
С. 5-14.
Ильин В.Б. Тяжелые металлы в системе почва-растения. Новосибирск: Наука,
1991. 151 с.
Кабата-Пендиас А., Пендиас X. Микроэлементы в почвах и растениях. М.: Мир,
1989. 439 с.
Кист А.А. Феноменология биогеохимии и бионеорганической химии. Ташкент:
Фан, 1987. 236 с.
Ковальский А.А., Андрианова Г.А. Микроэлементы в почвах СССР. М.: Наука,
1970. 178 с.
Ковда В.А. Биогеохимия почвенного покрова. М.: Наука, 1985. 263 с.
Ковда В.А., Якушевская И.В., Тюрюканов АЛ. Микроэлементы в почвах
Советского Союза. М.: Изд-во МГУ, 1959. 66 с.
Лукашев К.И., Петухова Н.И. Микроэлементы в ландшафтах Белорусской
ССР // Почвоведение. 1974. № 8. С. 47-53.
Лукина Н.В., Никонов В.В. Биогеохимические циклы в лесах Севера в
условиях аэротехногенного загрязнения: В 2 ч. Апатиты: КНЦ РАН, 1996. Ч. 1. 213 с; Ч. 2.
192 с.
Микроэлементы в почвах СССР / Под ред. Н.Г. Зырина и Г.Д. Белициной. М.:
Изд-во МГУ, 1981.252 с.
Никонов В.В. Почвообразование на северном пределе сосновых биогеоценозов.
Л.: Наука, 1987. 142 с.
Никонов В.В., Лукина Н.В. Биогеохимические функции лесов на северном
пределе распространения. Апатиты: КНЦ РАН, 1994. 315 с.
Никонов В.В., Лукина Н.В.,ДеромД. и др. Миграция и аккумуляция соединений
никеля и меди в Al-Fe-гумусовых подзолистых почвах сосновых лесов в условиях
аэротехногенного загрязнения // Почвоведение. 1993. № 11. С. 40-53.
Никонов В.В.t Лукина Н.В., Фронтасьева М.В. Рассеянные элементы в AI-Fe-
гумусовом подзолообразовательном процессе // Там же. 1997. № 12.
Никонов В.В., Переверзев В.Н. Почвообразование в Кольской Субарктике. Л.:
Наука, 1989. 168 с.
Орлов Д.С. Химия почв. М.: Изд-во МГУ, 1985. 376 с.
Перельман А.И. Геохимия. М.: Высш. шк., 1989. 528 с.
Таргулъян В.О. Почвообразование и выветривание в холодных гумидных
областях. М.: Наука, 1971. 268 с.
Харман Г. Современный факторный анализ. М.: Статистика, 1972. 485 с.
Цветкова Г.А. Медико-географическая характеристика Мурманской области
на ландшафтно-геохимической основе // Материалы к геохимии ландшафтов
Кольского полуострова. М.: МГПИ, 1972. С. 105-116.
Яценко-Хмелевская М.А., Цибульский В.В., Миляев В.Б. Миграция тяжелых
металлов в атмосфере // Журн. экол. химии. 1994. № 3. С. 3-15.
Bowen HJ.M. Trace elements in biochemistry. N.Y.; L.: Acad, press, 1966. 241 p.
Boyle R.W., Alexander W.M., Aslin G.E.M. Some observations on the solubility of gold
// Geol. Survey. Canada. Pap. 1975. N 75. P. 24.
Ill
Chekushin VA.t Bogatyrev I.V., De Caritat P. et al. Annual atmospheric deposition of
17 elements in eight catchments of the Barents region // Kola Project - international report:
Catchment study, 1994. Apatity, 1996. P. 79-99. (NGU Rep.; 96.08).
Frank R., Stonefield K.I., Suda P. Metals in agricultural soils of Ontario // Canad. J. Soil
Sci. 1979. Vol. 59. P. 99-106.
Frontasyeva M.V., Steinnes E. Epithermal neutron activation analysis of mosses used to
monitor heavy metal deposition around an iron smelter complex // Analyst. 1995. Vol. 120.
N 5. P. 1437-1440.
Hendrshot W.H., Courchesne F., Schemenauer RS. Soil acidification along a
topographic gradient on Roundtop Mountain, Quebec, Canada // Water, Air and Soil Pollut. 1992.
Vol. 61. P. 235-242.
Hutton J.T. Titanium and zirconium minerals // Minerals in soil environments / Ed.
J.B. Dixon, S.B. Weed. Madison, (Wis.), 1977. P. 673.
Lakin H.W., Dawidson D.F. The relation of the geochemistry of selenium to its
occurrence in soil // Selenium in biomedicine. Westport (Conn.), 1967. P. 27.
Lin Z.Q., Bender shot W.H., Kennedy G.G. et al. Total elements in forest soils affected
by acid deposition in southern Quebec // Canad. J. Soil Sci. 1996. Vol. 76. P. 165-171.
Lin Z.Q., Schuepp P.H., Schemenauer R.S., Kennedy G.G. Trace metal contamination on
balsam fir [Abies balsamea (L.) Mill.] foliage in southern Quebec // Water, Air and Soil
Pollut. 1995. Vol. 81. P. 175-191.
Nazarov V.M., Frontasyeva M.V., Peresedov V.F. et al. Resonance neutrons for
determination of elemental content of moss, lichen and pine needles in atmospheric deposition
monitoring // J. Radioanal. and Nucl. Chem. 1995. Vol. 192. N 2. P. 229-238.
Norrish K. The geochemistry and mineralogy of trace elements // Trace elements in soil-
plant-animal systems. / Ed. D.D. Nikolas and A.R. Egan. N.Y., 1975. P. 55-71.
Reimann C, Ayr as M., Chekushin V. et al. Environmental geochemical atlas of the
Central Barents region. Trondheim: Grytting, 1998. 745 p.
Shacklette H.T., Boerngen J.G. Element concentration in soils and other materials in the
conterminous, United States // US Geol. Surv. Prof. Pap. 1984. N 1270.
Smith l.C.t Carson B.L. Trace elements in the environment. Ann Arbor. 1977 .
Vol. 1.394 p.; Vol. 2. 469 p.
Smith I.C., Carson B.L. Trace elements in the environment. Ann Arbor, 1978. Vol. 3.
405 p.
Steinnes E., Njastad O, Enrichment of metals in the organic surface layer of natural soil:
identification of contributions from different sources // Analyst. 1995. Vol. 120, N 5.
P. 1479-1483.
Haddington CM. Organisers and genes. Cambridge: Cambridge Univ. press, 1940.
160 p.
Глава 5
ПОЧВЕННЫЕ ВОДЫ
Современная трактовка генезиса почвенного покрова не может быть
корректной и всеобъемлющей без информации как об элементах,
преобладающих в составе почв (так называемые типоморфные элементы), так и об
элементах, концентрации которых незначительны или ничтожно малы, но
которые являются необходимым условием успешного функционирования
организмов и развития почвы как особого биосферного образования и как
неотъемлемого компонента любой наземной экосистемы. Параметры
химического состава твердых фаз почв являются консервативными
характеристиками почв. Состав почвенных вод отражает динамические почвенные
признаки, позволяя оценивать современные процессы почвообразования.
Металлы, включая рассеянные элементы, могут быть представлены в
природных водах в различных, варьирующих в зависимости от размера,
заряда и плотности атома, физико-химических формах. В холодных гумидных
областях важную биогеохимическую и педогенную роль играют
водорастворимые органические вещества (Карпухин и др., 1993; Кауричев,
Фролова, 1965; Пономарева, 1964; Яшин, Кауричев, 1992; Van Hees et al., 2000). Они
связываются с различными лигандами, от простых ионов до крупных
молекул, а также участвуют в формировании коллоидов. Металлы могут быть
адсорбированы на органических или неорганических частицах и включены
в состав этих частиц (Spivakov et al., 1994). Образование органоминеральных
соединений - характерная и неотъемлемая черта почвообразования,
оказывающая существенное влияние на формирование состава и свойств
почвенных вод как наиболее активной части почвы. Металлы мигрируют в
почвенном профиле преимущественно в комплексах со специфическими и
неспецифическими органическими кислотами.
Почвенные воды как любой водный раствор представляет собой
дисперсную (раздробленную) систему. В зависимости от размера компонентов,
их слагающих, почвенные воды как системы формируются грубодисперсны-
ми (взвеси), коллоидными (золи) и истинно растворенными фракциями (Ев-
стратова, 1990). Соотношение этих фракций в почвенных водах является
одним из основных факторов, контролирующих миграционную активность и
доступность элементов для растительных организмов, а также способность
почв к их аккумуляции, мобилизации и перераспределению в пределах
почвенного профиля.
В настоящее время не существует ясного представления о степени
дисперсности компонентов вод почв бореальных лесов и в частности Al-Fe-ry-
113
мусовых подзолов. Анализ литературы, касающейся теории подзолообразо-
вательного процесса, показывает, что переносу частиц в
коллоидно-дисперсном состоянии отводится существенная роль в почвообразовании.
Согласно коллоидно-химической концепции подзолообразовательного
процесса К.К. Гедройца (1935) в почвах, развивающихся в условиях холодного гу-
мидного режима, почвенные воды выносят из поверхностных горизонтов
высокодисперсные растворы гумуса, кремнекислоту и гидраты полуторных
окислов, которые осаждаются в иллювиальном горизонте, как под
влиянием повышенной концентрации электролитов, так и в результате взаимной
коагуляции противоположно заряженных коллоидов.
Ионы металлов взаимодействуют с почвенной матрицей посредством
ионного обмена, сорбции, комплексообразования, осаждения и соосаждения
и формирования органо-металлических соединений (Leece et al., 2000).
Экспериментально доказано, что присутствие высоковалентных ионов
металлов способствует ассоциации мономеров фульвокислот в водном растворе
вследствие комплексообразования (Варшал, 1973; Варшал и др., 1975, 1993).
Насыщение функциональных групп фульвокислот ионами металлов
способствует заметному увеличению значений молекулярных масс, ослаблению их
миграционной и химической активности и появлению ассоциатов с новыми
свойствами, характерными для коллоидных систем и высокомолекулярных
соединений (Яшин, Кауричев, 1992).
В наших предыдущих работах уже обсуждались материалы по валовым
концентрациям типоморфных и некоторых рассеянных элементов в
почвенных водах (Никонов и др., 1993, 1997, 1999; Лукина, Никонов, 1996, 1998).
Были показаны закономерности внутрипрофильной и парцеллярной
изменчивости состава вод: как правило, концентрации элементов снижались с
глубиной и были ниже в водах межкроновых парцелл, по сравнению с
древесными (Лукина, Никонов, 1998; Лукина и др., 2002, 2003).
Влияние аэротехногенного загрязнения на валовые концентрации и
степень дисперсности соединений элементов в водах Al-Fe-гумусовых подзолов
в настоящее время является актуальной проблемой, поскольку доступность
для живых организмов ионов металлов и их токсичность зависит от формы
соединений металла. Только мобильные фракции могут быть токсичными
(Carlson-Ekvall, Morison, 1997).
В данной главе обсуждаются результаты изучения валовых
концентраций 52 элементов (Li, Na, К, Rb, Cs, Be, Mg, Ca, Sr, Ba, Y, La, Ce, Pr, Nd, Sm,
Eu, Gd, Dy, Er, Yb, Th, U, Ti, Zr, V, Nb, Cr, Mo, W, Mn, Fe, Co, Ni, Cu, Ag, Zn,
Cd, B, Al, Ga, Tl, C, Si, Sn, Pb, P, As, Sb, Bi, S, Br) в природных условиях и в
условиях воздушного промышленного загрязнения медно-никелевым
производством. Концентрации 27 элементов в водах подзолов определены
впервые. Особое внимание уделяется миграционным формам 21 элемента (Li,
Na, К, Rb, Mg, Ca, Sr, Ba, Nd, Zr, V, Cr, Mn, Co, Ni, Zn, Al, C, Si, Sb, S), что
также не обсуждалось ранее.
Объектами исследования послужили Al-Fe-гумусовые подзолы
ельников кустарничково-зеленомошных - широко распространенный тип лесных
экосистем в Северной Скандинавии. Пробные площади располагаются на
фоновой территории (на расстоянии 200 км от источника выбросов) и на
территории, загрязненной промышленными выбросами комбината "Севе-
роникель". Последние представляют собой различные стадии деградацион-
114
ной сукцессии лесных экосистем: интенсивной дефолиации, затухающей
дефолиации и техногенного редколесья (100, 30 и 7 км от комбината
соответственно) (Лукина и др., 2003).
Концентрации элементов в атмосферных выпадениях представлены в
табл. 5.1 и 5.2. Изменчивость концентраций элементов в атмосферных
выпадениях в лесу, главным образом определяются влиянием двух факторов:
средообразователем - елью (аутогенный фактор) и воздушным
промышленным загрязнением (аллогенный фактор).
В фоновых условиях концентрации всех определявшихся элементов в
выпадениях под кроной были значительно выше, чем в межкроновых
пространствах. Это связано со смывом соединений элементов с поверхности и
вымыванием их из растительных клеток (Tukey, 1970; Смит, 1985). В
межкроновых выпадениях концентрации многих определявшихся элементов
были ниже пределов обнаружения.
В условиях загрязнения закономерности в пространственной
изменчивости концентраций элементов в атмосферных выпадениях, определяемые де-
ревом-средообразователем, сохраняются. Вместе с тем обнаруживается
увеличение концентраций никеля, меди, кобальта, хрома, кадмия, мышьяка,
сурьмы, висмута, ванадия, молибдена и вольфрама при приближении к
источнику загрязнения. В наибольшей степени возрастают концентрации
никеля, меди и кобальта - в 100-300 раз, тогда как концентрации всех других
элементов увеличиваются в разы. Это объясняется тем, что никель, медь и
кобальт являются компонентами крупных частиц эмиссий и большая их
часть выпадает у источника загрязнения в процессе седиментации.
Максимальные концентрации всех поллютантов обнаруживаются в стволовых
водах: разница в концентрациях элементов в межкроновых выпадениях и
стволовых водах у источника загрязнения составляет десятки раз.
Ранее нами были обнаружены тенденции увеличения цинка и марганца в
снеговых выпадениях в межкроновых пространствах (Никонов, Лукина,
2000), что объяснялось тем, что эти элементы также являются
компонентами эмиссий. В летних выпадениях для цинка обнаруживается тенденция
возрастания концентраций в межкроновых атмосферных выпадениях при
приближении к источнику выбросов. В кроновых водах эти изменения не
выражены, что, вероятно, связано с уменьшением поверхности хвои из-за
дефолиации и снижением содержания цинка в хвое (Лукина, Никонов, 1998).
Концентрация марганца в кроновых водах значительно снижается, что также
обусловлено существенным снижением концентрации этого элемента в хвое
и дефолиацией ели (Лукина, Никонов, 1998). В межкроновых выпадениях
выраженные тенденции в изменении концентрации этого элемента не
наблюдаются.
Концентрации лантаноидов, актиноидов, циркония и титана не
изменяются при приближении к комбинату, как в стволовых и кроновых водах, так
и в водах межкроновых пространств.
Тип используемых лизиметров для изучения почвенных вод -
гравитационный с ненарушенным почвенным монолитом конструкции Джона Дерома
(Лукина, Никонов, 1996). Основные характеристики: диаметр воронки - 20
см; мощность дренажного слоя - 15 см; состав дренажа - полиэтиленовая
крошка диаметром 3-5 мм; приемники фильтрата - полиэтиленовые
бутыли, объемом 2,0 л (рис. 5.1). Учет объема фильтрата проводили в полевых
115
Поверхность почвы
Трубка для отвода воды
Пластмассовая
воронка
Пластмассовая
бутыль
Рис, 5.1. Устройство гравитационного лизиметра
условиях сразу после отбора, измерение влажности и температуры почвы не
проводится.
На каждой мониторинговой площади установлено по 12
гравитационных лизиметров под тремя почвенными горизонтами (О, В, ВС) с учетом
парцеллярной структуры - в подкроновых и межкроновых пространствах.
Перед установкой лизиметра специальным буром (d = 30 см) извлекали
ненарушенный почвенный монолит с необходимой глубины, затем буром
меньшего диаметра делали углубление для приемной бутыли. После
установки лизиметра почвенный монолит аккуратно возвращали на место.
Просочившиеся воды отбирали с помощью вакуум-насоса, используя
нейлоновую трубку, выходящую на поверхность.
Химический состав почвенных вод характеризуется на основе
сопоставления пяти периодов года: 1) зимне-весеннего - между началом
формирования снежного покрова и началом вегетации (октябрь-май); 2) начала
периода вегетации (июнь); 3) середины периода вегетации (июль); 4) конца
периода вегетации (август); 5) осеннего - между концом вегетации и началом
формирования снежного покрова (сентябрь).
Кислотность и концентрации Са, Mg, К, Na, NHj, Al, Fe, Mn, Zn, Ni, Cu,
SO4", NO3, C1-, P характеризовали на основе данных 1999 и 2000 годов.
Металлы определялись методом атомно-абсорбционной спектрофотометрии;
сульфаты, нитраты и хлориды - методом ионообменной хроматографии;
фосфор и аммоний - колориметрически, углерод - на основе перманганат-
ной или бихроматной окисляемости (табл. 5.3).
Валовые концентрации и фракционный состав широкого спектра
рассеянных элементов (Li, Rb, Cs, Be, Sr, Ba, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Dy, Er,
Yb, Th, U, Ti, Zr, V, Nb, Cr, Mo, W, Co, Ni, Cu, Ag, Zn, Cd, B, Ga, Tl, Si, Sn, Pb,
As, Sb, Bi, Br) определяли в образцах вод из органогенного (О) и иллювиаль-
116
ного (В) горизонтов, отобранных в июне и июле 2000 г. методом масс-спек-
трометрии с индуктивно-связанной плазмой (Plasma Quard, VG, England) в
Институте проблем технологии микроэлектроники и особочистых
материалов РАН (Черноголовка Московской обл.).
Для изучения степени дисперсности (молекулярно-массового
распределения) использовали метод мембранного разделения с использованием
мембран фирмы Millipore (материал смесь ацетата и нитрата целлюлозы).
Указанный метод широко применяется для изучения фракционного состава
поверхностных и сточных вод (Spivakov et al., 1994; Burba et al., 1995, 1998;
Wennrich et al., 1995), но практически не используется для почвенных
исследований, вероятно, в связи с установившейся традицией применять для этих
целей метод гель-проникающей хроматографии (Орлов и др., 1971;
Карпухин, Фокин, 1977; Яшин и др., 1993).
Для разделения взвешенной и растворенной фракций широко
применяется метод фильтрования. Для этого традиционно используется фильтр с
размерами пор 0,45 мкм. Границы между различными фракциями
установить довольно сложно. Мы руководствовались схематичной
классификацией, основанной на микрофильтрации, ультрафильтрации и диализе (Brock,
1983). Термином взвешенная частица определяли компоненты с размерами
>0,45 мкм, термином коллоид - в пределах от 1 нм до 0,45 мкм и термином
истинный раствор - ионы и молекулы <1 нм (Buffle et al., 1992). В
упомянутой классификации установлено соответствие между размерами частиц и
молекулярной массой (см. также табл. 5.4):
Фракционирование почвенных вод проводили методами
ультрафильтрации исходной пробы через мембрану 0,45 мкм фирмы Millipore с
последующим диализом полученного фильтрата в дисподиализаторах Spectra /
Рог производства Spectrum laboratories Inc. (США). Дисподиализатор
представляет собой мембранную тубу с определенной номинально отсекаемой
молекулярной массой, герметично укрепленную в пластиковых зажимах.
Процесс диализа проводили в мультидиализаторе EZ-1 производства той
же фирмы. Мультидиализатор представляет собой емкость объемом 4,0 л
(внешний сосуд) с каруселью, на которой укрепляются дисподиализаторы.
Вращение карусели осуществляется с помощью реверсивного двигателя.
В ходе диализа происходит многократная смена воды в емкости.
Перечисленные особенности технологии позволили значительно снизить время
диализа.
Базовыми для последующих расчетов послужили характеристики
исходного раствора (1), фракции <0,45 мкм (2) и фракции диализата 0,45 мкм
-1 нм (3). Долю взвешенной формы оценивали по разности концентраций
между первой и второй фракциями [(1)-(2)]; долю истинно растворенной
фракции - по разности концентраций между двумя последними фракциями
К2НЗ)].
Валовые концентрации определявшихся элементов в почвенных водах
представлены в табл. 5.5-5.9. Фракционный состав минеральных
компонентов почвенных вод во многом определяется типом связи в
соединениях, обусловленным положением элемента в Периодической системе.
Поэтому целесообразно дать сравнительную характеристику
определявшимся элементам по основным и побочным группам этой системы. Ряд
элементов, для которых определялся фракционный состав, достоверно диаг-
117
ft. U6 ffl
E
о
U
ЬАаАаЛАлалалал\а1 ■"' '■■' ■*■■■■ 14 H 1>А«А»А* *'*'* *> A»J ■■■!■■ ■■■I1
кдох-хдох-хдоэ■■■■■■■■■■■■ ич "5 РА*:»:»:':":»:»:':*:*:»:":-!■■■■■■■■■■■
ft'iViViyiViYiYiYilll ■■ ■■ ■■ i| ^ K«a«awa»j»a»>:j ».■ ■■ ■
fe'?Jh'h'^Jh'Wh'№'
'■■^а"*Л"аЛ""^"'^"аЛ*,П|«*П|"*Ла1
I'.'A'A'A'A'A'J
|улуХуа-.-.-,
Z
Е
>/a:va^:>/->.:ww
■■? *■■■■■■* .■■■■
EvM«Miibiki5r,itibiiibl ьо JAMA'A-Ai■■■■■■■■-■■■■■■■■■■Ч
со
Ьу,>,:>/,>г:ад>л>Лч^1£т
1,.|.,.,.,»,.',.|.'.,.,,,.,'.'.'.Г ■■'"■■ ■ ■■' ШИ ■ ■■ -fh lv.V<VAVA4\V.4',rr^4P»4HrPir»4fl • •-<
laXaXaXvXaXaXaX4PliPlIiP-«P1l«P13 СО fc^!A^*!!;^^ СО
z
*
о
U
>
N 3
*
•о
Z
со
со
ыздццаца
Ё
■ЬЧЬЧЬ'Ь-и'ЬЧЬ'Ь'Ьд
IvXJ« ■■■■■■■■■■■■■■■■■■■■■■ ■■!
!:•:•:•:•:•:•:•> ■■■•■■■■■•■■•■■■■■• .J
1у.*ХаХа1уХАХаА11" ,■» .■■ .■■■ „■■ ,d
•ХуХХуХуХФ" ■■■■■■■■■■ ■■■■ч
1...... '''"'J— -f -- -- -- fl
H*^^^^■a^^^^^ga^!a!f■^^^ё^^^''!'■^^
я
K^iffiff^
{!a!a!a!a?a!a?a!a!a!a!*?a№!A!A!АИАКАЦ* > J
'ffl*№KYtVri*^tVt iYfiYiYi*t*i*«*3 ■ ■ ■ Д
ШуХуЕуК'ХХКуЬ ■%■■■■!■■■■■
е.у.у.у.у.у.у/.у!: ■ ■■ ■ ,
ЬаАААа.А.АА^Ла«АААААЛАААЛАЛ*ЛА»АААЛД
bYi4YiYtYi%Y*iYiYriY>YrriYi4VtVt*iJ
и
со
crj
и
2
£
M
Z
fliWWWaWWWft:
N■■■■■■■■■■■■■■■■■■■■■■■■■■■H
^:;;:;::;;y:;::;;;;;:;:^M
и
<
!■ ■■ ■■ ■■'■■ ■■ ■ ■ ■■■■■■! ц^
Ь|..1..1..1.11..1..1.ШП1[П -y^
■■■■У1%1'щ1%1У1аа»ДРИДР VJ
fcvXvXvlM ■■■■■■■■■■■■■■■■■■ H
Г•*'-';~-*r~ ".""**."* ~". "" ""
KyXvXvXyXvXi ■ ■■ ■ ■■ • ■■ • ■■ щ
fttViVtlrtVtVtYfiff■ И■ mm.p•' m[
ВхУЙ-Х'ХУХ'Х-^^
YiYi*iYriYiYiyiVriV|Vi*i*w Ma ■ ■■ И
»■_■ ■_'■■_ ■■'■■_■■' "'flVllBJllll
i i 1 ' 1—
t§ О О О О О
64 00 VO Tf CM
с*
и
£
£
Z
*
3
# s s Q s °
•<t ra
118
tststsstststsKtas
2
wawtsBwtasas
fcKWi&'!«:•;•;•&■■ ***** ■■■ *■* '■да
гХФХДОХ'ХФХъ ■?■■?■■?■■%■■■ ЧЛ
flit tit 11 ijt 11 т т и Г mf mfT if «C ■■ Д1
ШЙШШ
«««««в:
Sffiffiffit««w:
||ЧУГ|*1*1)|У1*Дп^иИИДиНД^НДИ
t■ »»MJ# "■ '** "" ■* "" '"^*"" "Я
Е'ХФХг fii!iii,S,?i,fi,i,i4
ffiffiffi-
bv.'ffly.y.*.
йВВЕИгл
Кугау;у;уКу#гЛтЛиЛ'ЛиЛ1 со
tX*X^Xtt'X*X*X<*X'XttfrH»»_J -Я
|А*.Д.мiijIf.1.*А*А'*А*А*А^А*А1 А*А ■ ■ i
IXtttt*XttttyXW*>X*X»XJ|X IiF'
1>УУУ|У|У|У|У|*^У«У»У'У|*,*||*,*|*,1* " "
I
6
>
я
СО
Х>
СО
СО
U
5
со
и
I1
л
2
00 S "<fr CN
119
§
РШЗ£5Й£
ьу.у.уХ«Ь" *"* "и* "" "'
f.у.у.уд»—.—■—»—. J
глулуЬ »■ ■■« ■■■«■■■
О
U
ss±aia43:
N
§
1шЮдЭДЭД
fevW
i «■ id ■ м !■ и яЬ wid
ШКД;3;зд
со
Х>
со
1шш^-*-Н
PWif-4-ДЗД
b^tiiiws^
щщшттН
ттттщ
feffi«F4
|^»^ч
I—I—I—I-
PQ
ее
U
с*
W
fay-*-Т *■' ■^■■■*1
у.У.У/Жи у ну ■■ bJ
■С iWftrftrTLftfW
РШйеёз
£ ИаЩА^ g
iiBMWWWftff
(шшейт^х- Ц44мЦ
о
и
>
Й
z
Я
^GffiffiffiffltW
Ы&»?АШ
!=щ^ш^И
ЯгЯЗВЯЗВ'.
X)
со
со
3 to:AC;>;>--;i-;^
JuTLiTUTljnTT.» ■
■СХИЛ LI I U I Lj 1T1 ■ ■
-rmPfTTfTlfTTi
ed
PQ
Mw;?*M
гаааавгспа
Ии^ш&а-.!
j i..,, i ;
iaa
Штвяя*
ШФЩШУА
о о о о о о
О ОО \С ^- (N
се
U
ЬХ)
S
м
л
г
*»—i—i—1—ь
о о о о о о
О 00 VO rt (Ч
Ш&&":1':Г':":1!1
Н^^ДЙя
ШШ±й:й:
шмш
с р^ша
M^ftAWHi:
О
U
Ff^P^^vl < а
Е*^г*?Г';!*?г*;г*;г*;Д
(иуяязЦ
со Еу1у$1*&Г^Г1£Г?гГ*гГ«1
Ь«А:.КГ;ГИ,:|И,ГЯ
j^kt:^:^ri
ШЙ^М
ШВД:Ч^
Lvlv.vlv.yiyiyM ■ ■■'■■■ "1
СуХуХуХу> Mi ■ %■■■■■ J
шттщ
■а
со
Х>
со
ас
о
X
X
0)
н
о
(U
Я"
о
а
с
и
а>
Он
се
С
X
X
о
<D
СО
<L>
а
«
0Q
О
Н
К
О
ел
5
Он
о
со
и
<
се
PQ
се
U
X)
Ь4
л
г
я
Я
<D
U
о
к
се
и
а
о
х
и
о
«
со
со
о
со
СО
в
8
^ i—i—i—i—i—+•
о о о о о о
О 00 ЧО Tj- CN
3 I
я ^
X «п
я- a
* S я
<я s S
.•До
ej dS
i8 §
120
HWWWr
ttSiSSS.
i..m ■ m ii я т Ш m ijtphH
r'Mlllll Д fl Щ1ШШ
№№№№№№::■
!'.*■*■■■ «hi ■■*■■■
*
CO
CO
fA«A»A- ■ ■■- ■ ■-■ ™^
fc'x'xfc ■■■■■■■■■■■ •■■И
F,v"Ti ■■■■■■ ■■, irM
KvXvXvXV ■■■■■■ *■■ Ha
Г- • • • f' - -r- ■ —г ■—"— "^
»—r
i—r
CO
U
ад
*
X)
с*
[;:;::1,Л.Л-Л--".-ЛаЫ со [хОДЛ-Л^-Л-*^
С
N
о
U
п
n
^■■■^■■■■ьии"1и"и^"ИЧ1
bWAWJi "■■■■<!■ шЦШЕшА О
ts
Ei" ■■■■■■■■■■■ ■■ ИНН 43 цаЩ" ■■"■■■■■■■■
■■■■■■■■■■■■■■■■рдЫ J2J т***Т ■■■ ^ ■■■■■■ ■■
fflaaaffliw
N
■ ■■■■p«»jp Д 111 1ЦШ
р:Х:ХлХ::!Х:»Л«Л»ЛД <
№№№№№№№
Ыаддяди::-
CO
Ь!-:!-:!НааВйДйД -2 pSfrfrfrfr
rfflvjr *■ ■ y> ■ sffjfM
ix*x*x*:|i> ■■■■■■■■■■ iW
клхлх*:с ■■■■■■■■■ «40
CO
и
со
се
и
kvXvX'TJ*"I"^I*"t"Д >^*
Ьх«х*х1.УЛ>Л>Л>ЛлД Z
LW.V.W.g ■!■■*■■■ ■■■Д О
E" ■■■■■■ ■■■■■■ ■■■■■■ J 33
;■■■■■■■■;■■;■■■■■^ц 2Г
[SJ }r.V.W.V.Um. ■■■■■■ *■■ Д ^
СО К|Х|Х|Х?*^"^"^"^Ш1
^ tYiYiYiYl ■!■■ f ■■ 1 ■■ *■■ «И
ВЗИК-
1'.'.» А !■ !■'!■ М ifa М 1^ ■ 1И^
II1111 I If ■ ' ■■ ■■ ■■ ' ■■
tvX»X*l■ i"i"S"bi1
tyXvIvtl/.l^l"".!^
tA№rt»№rf ■■■ rt ■■■*■■ я гз
ЬХ'ХтХ'ХЬ яямяяматм шяш <«
CO
x>
CO
CO
f.WAj*.,*■■ii,'»ь„миру ^
со к-т^д ■ у яш ■■■■>■ с
Е*Х*Х*Х4 Ч ■■■■*■■■■■■ ■
fc.W.'JW.l ^ ■'" ■** *яш »ЯЩЛ *S*
tvX'Xv!*! Чи«»в» •■■■■■ «Я <>,
ftVtVi'tVwT—'?■ '■■■'Ч1Ш ^ rtYiWtYtVtYtYrVb'Г"ТМ № ^
^■■■■■■■■■■■■■■■■аГШД! CvX-^aiiiiii'ii'ii'iM'i
со
и
>■■■,■■■■■■■■■■■■■,■■/■ ^-* ^■■■^■■■■■■■■^■■■«■■■J ^^
h'X»>!:<^:C'X<'X'X<<'X'X':j 1j
8S§?8°
$ 1—1—1—1—r
SO О О О О
00 ЧО Tj- С*
i—1—1—r
000000
О 0O vo Tf П
ft* u
On u
121
Ьх-ХуГ ■■Ч'Чр '■■'■■fl
1У.У.'.У.УД. ■— _- _
MA*A+A*A* " 9Я ■■'■■'■■
Ку!уМу>1"ш ■"■■?■■ ^ш ■'
ЕУ.У.У.'.*.ааи_а»«га«".аИ.а)
.VAy^VAVyVAy^AVAvA
iy;y.*i ■■■■■■■■■■■■■■■■
ffflyff'a'VV'a^aMJ
1*амлуау^уау^уауауа
1%у.у,.у.у.;.у.у.;.*.у.у.у.
нищим Гц Щ111Ц111
> ■ % ИД■■■>■■■ м^—ДМ
)вф^>>.в|
Му!уЩуЬ ■%■■■■?■■ d
I*ХуХvXfca ■■a"?a""a«*J
^УАУЛУЯ.И1".«И'Я^.Ш«1
^.:.v:vi v.v. v.v. ■ ■■■■■■■
^хЗДхУХ^
пУГГмааВ^аЯ^ми^аа" а а" ЛИ
ЕХу&ХуХу&у^^
Z
о
*s
■х-
>
■х-
Й
го
ш
te
b
::^Г-ш>-вшР-"Щ4Ий
•.%•! ■■■■■■■■ ИМТ^ТГШГ
Ш14-4-ЛНМ|
я! li-v-v-iaa
ввавегел*:
р
2
-
и
>
"■Х-
Й
:S
й
со
X)
со
со
и
PQ
со
ев
U
S
*
CCJ
ti>i,i<it<,VAlJAlAlJ.VA<Al«'L l
^i—i—i—i—i-
8
О О О О О
ОО Ю Tt М
teti*№tf*ttttt:
JMMHMHH
■■'■■Ппцгагаппппп
[а ■_ -.« — п- м ^М Ж Ж М'М
JUM IJ И ■ IPTJPWHHHtHafH
l*4aZBDIDIQIIa3QalDalDaQa^3aDaD
ЫДД Д Л1Я ТаГЯГяГМЯД1Д
CO
x>
CO
CO
|....Wf«r-.- - —r__ --M ni la
cd
PQ
< ИИ^ВД < 1ШШ<
rtfltT|tltai, ■ ,■ ■; HTM -1 ».УАУАУАУ» j ■ - » _ «П
Р»=Н б «ttWW^u
Ь'уАуауау! ■" и ■■ и ""ПУН
ащаая:
iffii* ■■■■■■■■■■• ■'■■ ■ ■ J
УтУ1> ■ %■'■■,'■ ■ % "'■ 1
!iAW»vAva^v^vaVA^wJ
;ХуХуХ<У|*Х'ХуХ*УуГ,%
^г
1 Г
Ьу:>'УА%уА1->.«^«Щ
ty>xi-y;^';itfii"M'ifl
р.'.у.ул»л«гвдь f—■-,-■-,
Р|УЛ>УГ|УА "a fr a ■
Ьулт у ^уХуХ*.у.у.*.у.
С ЬДОЛдолЬ ■■■*■■■■■■■■ С
8НТТТГнТн*П-ГТТ-'
СЧХЧГЧХЧГл-С.
о
и
>
Й
§
juamImjjH -■ !■ _J -4J
КуХуХуМ ■■■■■■■■■■■■
со
со
ГГГЛУГГГГГГ iV iBI Д ЩДЦШ w
ЫуЩуИуР1 IP1У а>*Л /5
КуХ»ХлХаГ«и*■■*■■ ^О СО
ЬУ|Уifi*i*■*iVA аа■аи■аа■ ДИ нн
^W)
1Шф#фн t emssdi
з
«
55
1л%«АуАу.улуАуА«И ■ ■■ "Q а»«
СуХуХуХуХуХуХ4"%"1 rv* ►*
с.....уау.у.у;уау.у^ —■ J № *-,
fcy;y!';y!yt,H"*"","1H"
ЫуХ^ХуХуХ^"" ■■■■■■
Суа».?.v.wАЧуА. ■'."■■
Li.yAlAVA^AWX'AVJ'A'AJ '
jXyX;XyXrffl*X;XyX;*Xyfl
о x ю ^ (S
i 1 1 f
CO
^
^
О 00 ЧО Tf CS
122
р»»%;н11 ашщ ■■■*■■■■■ *■■ *-*
fJAMJJ.MJ.MJl * 1Д " -I1" -1'
?:*?:;?:;?:«????1"!г-",г-в>г-
tYtV^YiViVtVli f ■■ ■ м 1 ■!
iX#X#X»X«X»XL ■ •■ ■ *■ ■ "\'
['тУтУуУтУтУтТ. fr ■% ■ '- ■ Т.
MA*A*A*f'"" '"' '■■'■■
яммвад'.-
I
со
О
и
>
й
тз
2
й"
P>%»j«x<%>;rii,?ii*i,t*iy| ^
i^xb^^ д
pAWAV..Afflft,.Jl -г ■ ДМ {J
|».у.улу.уя'_1 _. Jraffj ^
bx»xw<»;t№X>'iwMiff'i л
ihiiiiiii'ii »—пг*М JM О
Е:::::::::;:::::;::х::Т-"<г-«"Г.",'1 ГЧ
КЧУЛУ.У.У. «1ч I ■■ МЧ 1« LJ
1-&хЧу&уЩу!ухТ S* Т
IxyXyXyxttyXyELj^ii
Рх*х«х»х»й»х*1Ч*^"^"'11
*
>
й
■о
Й"
Hwx»;»! ■ hi ■ ■! ■ ■■ ■>■■ ■■< й
со Ejaasggygggl со ^::;::;::;::;:g::;;
*
х>
со
^илщпфщ й щяршщ 7 штШЩ я
ИИ»;»-
со
*
ел
и
K»X#X#XeI" ""^
1уХуХуХуХуХ«р %'■ % Н
rXwXvXvXvX,l"*«"^4
Fx^xyffiffiflrV
i;x;x«X«ftiX»X«?>p j «pi IhW
^Л'ЛУ.'Л»Л'ЛУ^Г.1Г^ИИ
«ЙЦЦаия»
иащяж-.".■.■.■;.
|у.у.у.у.уг*Ху.у.у.*^" ■- ■
I
.mavamAm.mAm.mJjauJ
У.у.у.у.
fri'&K^&xl
CO
CO
и
f
£
£
1хуХ&у:у:у:уХу.р '■ w и *3J
^.y.w.y.yjy.y.vl -» ■ -Д ^
JmJJjLmJ.M.MJI ■- ■ ■-IM ■'! ^
гХаХ%<*Х<*Х<ф?в"*ЦпШ CO
Ьу.уАулулм H_ ■ ■„ k mjimi и
КуХуХуХу>#Л«^"*101 СО
(ИУНУИЧУ^УГ^* ■'■"■] J
1мам1мл»Лма».4"и ■*■ —
EXv&xwx^xt ■ ii ■ ь ■ 1
|"ЛУЛ»АУАУ».Г. ««Ч, ti*li ■
со
ш::::::':^аац и
3
Е%у«%у»у.у1,ж»,*1»та1
Гу.у.*.у.«:ч, .,, ,ащ
тж-ы
fa'X'XyХу> !■*!■" !l * !И »-•
К*Х«Х»Х»>1""ъ"Л"^1"та СО
КvXуX*L ■■-■■-■'
ГУ.*.*»*!*'*" ■'Г ИГ ■!
>->-
ввяияий;.-:-
!•:•:•:%%vt ■*■■■«■■■■*•■■
|у.уХу>- ■ ■:?■- ■»■■«■■
a j
^i—i—i—i—I-
!l Г
tttttttKy^yXK ■ ^ ■ ^
^у>^Ху;у:?ЯЛи^^
fa#X<vXvXyXi"^" "^" %1
^У^У^УЙТ^^'Г'^'^
X)
04
♦X'X'XWX'XC'X'X^L ■ ■■
^ fay!*!y!*!y!y!ya> ■■■ ■'flUO ^
^^ с vX*X*X*X*X*!*3" ■■ ■ ■ JQPQ4 **
2
ку^Ау'ГуЙуХуХ»*" ■*■■■■
rtVtWfУtWtУ ifД ' *p * '■
^д'аЧ'А'АОамЛ'А'А^А'Л'н #ri ЬЛМЛ'А'А^А'А'ЛУА'.ЧУАУ
8 о о о о о
00 Ю Tf M
^1г
1 Г
>
со
X)
со
и
2
о о о о о
X
8
оо \о tj- (S
123
ностируется только в грубодисперсной фракции (взвесях) вод, тогда как в
коллоидной фракции их содержание находится ниже предела
обнаружения. В этих случаях было невозможно выделить истинно растворенную и
коллоидную фракции. Такие элементы на рисунках 5.2-5.7 помечены
звездочкой.
5.1. ПРИРОДНЫЕ ОСОБЕННОСТИ
Валовые концентрации элементов в почвенных водах из
органогенного и иллювиального горизонтов в древесных и межкроновых парцеллах
представлены в табл. 5.5-5.6, фракционный состав элементов в этих водах
на рис. 5.3-5.4, химический состав вод в табл. 5.4. Следует отметить, что
относительно высокими валовыми концентрациями в подстилочных
водах помимо С характеризуются К, Са, S, Na, Mg, Si, P, Mn, Fe, Al, Zn.
Одновременно обращают на себя внимание большие различия в
концентрации отдельных элементов, достигающие семи порядков - от п • 105 до
п • 10~2 мкг/л.
Подгруппа I A, Li, Na, К, Rb, Cs. В твердых фазах Al-Fe-гумусовых
подзолов элементы данной подгруппы характеризуются элювиальным типом
внутрипрофильного распределения (Никонов и др., 1997). Обеднение
профиля по сравнению с почвообразующей породой может объясняться
высокой миграционной способностью соединений этих элементов, что
обусловливает их интенсивный вынос за пределы почвенного профиля или
поглощение растениями, а также отсутствие ярко выраженных биогеохимических
барьеров в почвенном профиле.
В этой подгруппе в водах из органогенных горизонтов элементов
доминирует калий, концентрации которого достигают 4 мг/л, концентрация
натрия ниже в 5-6 раз, а рубидия - на два порядка ниже, чем калия. Самыми
низкими концентрациями характеризуются литий и цезий (<1 мкг/л).
Концентрации калия, натрия и рубидия отличается выраженной
парцеллярной и внутрипрофильной изменчивостью: максимальные концентрации
этих элементов отмечаются в водах древесных парцелл из органогенных
горизонтов.
Истинно растворенная фракция является доминирующей формой
миграции лития, калия и рубидия. В то же время натрий в водах из органогенного
горизонта древесных парцелл представлен равными долями истинно
растворенной и коллоидной фракций, а в водах из иллювиального горизонта этих
парцелл доминируют коллоиды (до 80%). В водах органогенного горизонта
межкроновых парцелл истинно растворенная фракция натрия не
обнаружена, преобладает доля коллоидов (достигает 70%). В водах древесных
парцелл доля высокодисперсных фракций калия, рубидия и натрия выше, чем в
водах межкроновых пространств.
Подгруппа II A. Be, Mg, Са, Sr, Ba. Так же как элементы подгруппы IA,
элементы подгруппы ПА характеризуются элювиальным типом
распределения в твердых фазах Al-Fe-гумусовых подзолов (Никонов и др., 1997). В
составе почвенных вод доминирует кальций, концентрации которого
варьируют в пределах от 0,5 до 2,8 мг/л. Концентрации магния в Ъ-4 раза, бария и
стронция на два порядка и бериллия на 3-4 порядка ниже, чем кальция.
124
Наличие сильных средообразователей (деревьев) обусловливает четко
выраженные парцеллярные особенности в концентрации данных элементов
в составе вод: по сравнению с водами межкроновых пространств,
концентрации кальция и магния в водах из органогенных горизонтов древесных
парцелл выше в 5 раз, а концентрации бария и стронция - в 3 раза. Независимо
от парцеллярной приуроченности концентрации данных элементов в водах
из почвенного профиля ниже, чем из органогенных горизонтов, что
свидетельствует о наличии биогеохимических барьеров, прежде всего
биологического поглощения.
В отличие от элементов IA подгруппы, для данных элементов
обнаружена высокая доля коллоидов (50-90%). Выявляются тенденции увеличения
доли коллоидной фракции с возрастанием атомного веса элемента. Также
как и для элементов предыдущей подгруппы обнаруживается парцеллярная
изменчивость фракционного состава кальция, стронция и бария. Истинно
растворенные фракции этих элементов в водах из органогенных горизонтов
почв древесных парцелл выше, чем межкроновых.
Подгруппа III A. La, Се, Pr, Nd, Sm, Th. В твердых фазах Al-Fe-гумусовых
подзолов элементы данной подгруппы характеризуются элювиальным типом
внутрипрофильного распределения (Никонов и др., 1997), что можно
объяснить их незначительным биологическим поглощением и высокой
кислотностью почв, повышающей миграционную активность данных элементов.
Среди элементов данной подгруппы в почвенных водах доминируют
лантан и церий. В подстилочных водах их концентрации варьируют в пределах
0,2-1,8 и 0,4-0,8 мкг/л соответственно. Концентрации неодима, празеодима
и самария на 1-2 порядка ниже, чем лантана и церия. Концентрации других
лантаноидов и иттрия ниже предела обнаружения. Концентрации тория и
урана в подстилочных водах сопоставимы с концентрациями празеодима.
Как видно на примере неодима, основная часть лантаноидов из
органогенных горизонтов мигрирует в форме коллоидов (до 75%) и взвесей, из
иллювиальных горизонтов помимо коллоидов около 20% приходится на
фракцию истинных растворов.
Подгруппа IV A. Ti, Zr. В твердых фазах Al-Fe гумусовых подзолов
цирконий, так же как и кремний, характеризуется минерально-аккумулятивным
типом внутрипрофильного распределения (Никонов и др., 1997).
Максимальные концентрации этого элемента обнаруживаются в верхней части
минерального профиля (элювиальные горизонты) благодаря его
относительному обогащению данным элементом, который является компонентом
стабильных минералов (бадделеита и циркона).
Концентрация титана в подстилочных водах на порядок выше, чем
циркония и составляет 6,5 мкг/л. В процессе миграции вод вниз по почвенному
профилю концентрации данных элементов снижались. Соединения
циркония в водах из органогенных горизонтов мигрируют преимущественно в
форме взвесей (>60%) и коллоидов.
Подгруппа V А. V. В твердых фазах Al-Fe-гумусовых подзолов ванадий
характеризуется элювиальным типом внутрипочвенного распределения
(Никонов и др., 1997). Этот элемент отличается низким уровнем
биоаккумуляции: отношение концентрации данного элемента в подстилках и почвооб-
разующей породе подзолов Норвегии варьировало от 0,1 до 0,4 (Steinnes,
Njastad, 1995).
125
Концентрация ванадия в подстилочных водах древесных парцелл
достигает 2 мкг/л и снижается в процессе внутрипрофильной миграции. Основной
формой миграции ванадия из органогенных горизонтов являются коллоиды
(80%).
Подгруппа VI A. Cr, Mo, W. В твердых фазах Al-Fe-гумусовых подзолов
хром и молибден, так же как железо и алюминий, характеризуются
элювиально-иллювиальным типом внутрипрофильного распределения (Никонов и
др., 1997). Геохимическое сходство наиболее распространенного в природе
Сг3+ с Fe3+ и также факт, что Сг3+ осаждается при рН > 5,5 (характерно для
верхней части иллювиальных горизонтов Al-Fe-гумусовых подзолов), могут
объяснять иллювиальный максимум для хрома. Иллювиальный максимум
молибдена можно объяснить тем, что молибден связывается оксидами
железа (Кабата-Пендиас, Пендиас, 1989).
В подстилочных водах концентрация молибдена на порядок выше, чем
вольфрама, и варьирует от 0,1 до 1,1 мкг/л.
Подгруппа VII А. Мп. Концентрация марганца в подстилочных водах
колеблется в пределах от 60 до 450 мкг/л. В водах древесных парцелл
концентрация марганца значительно выше (в 7-8 раз), чем в водах межкроновых
пространств, и резко снижается в процессе внутрипрофильной миграции.
В водах органогенных горизонтов древесных парцелл доли истинно
растворенной и коллоидной фракций этого металла сопоставимы, в
межкроновых парцеллах добавляется доля взвесей, которая может достигать 15%.
Такие же тенденции в распределении разных фракций соединений марганца
характерны для вод из иллювиального горизонта.
Подгруппа VIII. Fe, Co, Ni. В твердых фазах Al-Fe-гумусовых подзолов
железо характеризуется элювиально-иллювиальным типом
внутрипрофильного распределения с ярко выраженным максимумом в иллювиальном
горизонте, где осаждаются Al-Fe-комплексы с органическим веществом
(Пономарева, 1964). Для никеля и кобальта в этих же почвах обнаружен
элювиальный тип внутрипрофильного распределения.
Среди элементов данной триады железо доминирует в почвенных водах,
концентрация этого элемента варьирует от 30 до 310 мкг/л. Концентрации
никеля и кобальта на 1-3 порядка ниже, чем железа. Концентрации всех
трех элементов в водах древесных парцелл значительно выше, чем в водах
межкроновых пространств и снижаются в процессе внутрипрофильной
миграции.
Результаты многих исследований демонстрируют, что железо
формирует внутрисферные комплексы с фульвокислотами, характеризующиеся
высокой стабильностью в кислой и слабокислой среде. Поэтому можно
предположить доминирование коллоидной фракции железа в водах
Al-Fe-гумусовых подзолов.
Согласно полученным нами результатам, практически все соединения
кобальта и никеля мигрируют в водах Al-Fe-гумусовых подзолов в форме
коллоидов, что связано с высоким содержанием в почвенных водах
органических лигандов и слабым конкурирующим влиянием более активных
акцепторов в связи с их относительно низкими концентрациями. В водах из
почвенного профиля высокая доля коллоидной фракции может
объясняться минеральными и органоминеральными коллоидами (с оксидами железа и
марганца).
126
Подгруппа I В. Си, Ag. В данной подгруппе элементов по концентрации
в почвенных водах преобладает медь (от 8 до 75 мкг/л), концентрации
серебра ниже на порядок и более. С глубиной концентрация меди снижается.
Серебро в твердых фазах подзолов характеризуется
биоаккумулятивным типом внутрипрофильного распределения с максимумом в
органогенных горизонтах (Никонов и др., 1997), что, вероятно, обусловлено
способностью этого элемента к формированию комплексов с органическим
веществом. Для меди в подзолах Кольского полуострова на фоновых территориях
обнаруживается элювиальный внутрипрофильный тип распределения.
Подгруппа II В, Zn, Od. В твердых фазах Al-Fe-гумусовых подзолов цинк
характеризуется биоаккумулятивным типом внутрипрофильного
распределения (Никонов и др., 1997). Концентрации цинка в подстилочных водах
варьировали от 28 до 63 мкг/л, концентрации кадмия на 1-2 порядка ниже, чем
цинка. Отчетливые парцеллярные различия для цинка не обнаружены.
Большая часть цинка в почвенных водах, особенно из органогенного
горизонта, мигрирует в коллоидной форме. В водах из иллювиального
горизонта коллоидную фракцию дополняют взвеси, доля которых достигает
30%.
Подгруппа III В, В, А1. Доминирующим в составе вод элементом данной
подгруппы является алюминий, концентрация которого в водах из
органогенных горизонтов изменяется от 0,1 до 0,5 мг/л. Для алюминия характерно
элювиально-иллювиальное распределение по минеральному профилю
Al-Fe-гумусовых подзолов, тесно связанное с распределением
органического вещества.
Доминирующая доля коллоидной фракции алюминия в подстилочных
водах подтверждает представление о том, что данный элемент мигрирует в
почвенных водах в комплексах с органическим веществом. В водах из
иллювиального горизонта древесных парцелл доля истинно растворенной
фракции алюминия достигает 40%, что можно объяснить снижением
концентрации органического вещества, и одновременно возрастает доля взвесей
(35%). Согласно результатам исследований Ван Хииса с соавт. (Van Hees et
al., 2000) неорганическая фракция алюминия в растворах из иллювиального
горизонта подзолов варьирует от 7 до 16%.
Подгруппа IV В. С, Si, Sn, Pb. Почвенные воды бореальных лесов
характеризуются высокой концентрацией углерода. В водах из органогенного
горизонта почв исследованных ельников концентрация углерода
варьировала от 24 до 93 мг/л. В процессе миграции вниз по профилю почвенные воды
значительно обеднялись органическим веществом. Наряду с внутрипро-
фильными наблюдаются пространственные (парцеллярные),
обусловленные влиянием дерева, различия в концентрации углерода: в водах древесных
парцелл концентрация углерода значительно выше, чем в водах
межкроновых пространств.
В зависимости от парцеллы варьирует и фракционный состав
органического вещества. В водах межкроновых парцелл доминирует коллоидная
фракция, истинно растворенная фракция не идентифицируется. В водах из
органогенных горизонтов древесных парцелл истинно растворенная
фракция возрастает (до 40%). При этом коллоидная фракция остается
доминирующей: в подстилочных водах она составляет 60%, а в водах из
иллювиального горизонта - 80%.
127
Кремний характеризуется селективным накоплением в твердых фазах
верхней части минерального профиля подзолов в силу устойчивости
минералов, его содержащих, к выветриванию (Никонов и др., 1997).
Концентрации кремния в подстилочных водах варьируют от 0,1 до 1,3 мг/л,
концентрация свинца на 3-4 порядка ниже, чем кремния. Концентрация олова в
почвенных водах ниже предела обнаружения.
Концентрации кремния и свинца в почвенных водах характеризуются
парцеллярной изменчивостью: в водах древесных парцелл их
концентрации выше, чем межкроновых. Для этих элементов также обнаруживается
внутрипрофильная изменчивость: концентрация сЬинца в водах из
почвенного профиля значительно ниже, чем в подстилочных водах.
Концентрация кремния, напротив, в водах из почвенного профиля была значительно
выше, что свидетельствует о десиликации Al-Fe-гумусовых подзолов
(Никонов, 1987).
Доля истинно растворенной фракции кремния в подстилочных водах
составляет 50-60%, но при этом в подкроновых пространствах остальная часть
приходится на коллоиды, а в межкроновых - на взвеси. В водах из
иллювиального горизонта доля истинно растворенной фракции снижается до 35% и
доминирует взвешенная фракция. Эти материалы подтверждают
представление о десиликации профиля Al-Fe-гумусовых подзолов.
Подгруппа V В. Р, As, Sb, Bi. Для элементов данной подгруппы
обнаружены разные типы внутрипрофильного распределения (Никонов и др.,
1997): для фосфора - бимодальный с максимумами в органогенном и
иллювиальном горизонтах, что обусловлено миграцией соединений этого
элемента с органическим веществом; для мышьяка и сурьмы - аккумулятивный,
что может быть обусловлено региональным загрязнением. Мышьяк и
сурьмы образуют комплексные соединения с гумусом почвы (Кабата-Пендиас,
Пендиас, 1989), что объясняет их аккумуляцию в верхнем органогенном
горизонте.
Концентрация фосфора варьирует от 0,2 до 0,4 мг/л. Среди других
определявшихся элементов самой высокой концентрацией в подстилочных водах
отличается мышьяк (до 2 мкг/л), концентрации сурьмы и висмута на два
порядка ниже, чем мышьяка. Проявляется ярко выраженная
пространственная вариабельность в концентрации элементов данной подгруппы в
почвенных водах. В отношении фосфора обнаруживается парцеллярная
изменчивость: концентрации этих элементов в водах древесных парцелл
значительно выше, чем в межкроновых пространствах, что было показано нами ранее
(Лукина, Никонов, 1998).
Фракционный состав почвенных вод определен только для сурьмы.
Доминирующая форма миграции этого элемента из органогенных
горизонтов - коллоидная фракция.
Подгруппа VI В. S. Концентрация серы варьирует в подстилочных водах
от 0,6 до 1,7 мг/л. В водах древесных парцелл концентрации этого элемента
значительно выше, чем в водах межкроновых пространств. В то же время по
сравнению с подстилочными водами, концентрация соединений серы в водах
из минерального профиля в 2-3 раза выше.
Согласно полученным данным 70-80% соединений серы находится в
почвенных водах в форме коллоидов.
128
Общие особенности состава и свойств
вод Al-Fe-гумусовых подзолов северо-таежных лесов
В составе вод подзолов преобладает органическое вещество,
концентрации углерода достигают п • 105 мкг/л. Остальные определявшиеся элементы
могут быть объединены по их концентрационным характеристикам (мкг/л)
в подстилочных водах в шесть групп: 1) (п • 103) К, Са, S; 2) (п • 102) Na, Mg,
Si, P, Mn, Fe, Al; 3) (n • 100 Rb, Cu, Sr, Ba, B, Zn, Ni, Pb, Ti, Cr; 4) (n • 10°) Zr,
As, La, Sn, V, Ag; 5) (n • 10-0 Be, Cs, W, Co, Ce, Li, Sb, Bi, Th, Nd, Cd; 6) (n • 10-0
U, Sm, Pr.
Древесные растения определяют пространственное (горизонтальное и
вертикальное) варьирование не только валовой концентрации
органического вещества и минеральных элементов в почвенных водах, что отмечалось
ранее (Лукина, Никонов, 1998), но и их миграционных форм. Как правило,
валовые концентрации элементов в водах древесных парцелл выше, чем
межкроновых.
В подстилочных водах древесных парцелл истинно растворенная
фракция органического вещества составляла 40%, тогда как в водах
межкроновых парцелл она практически не идентифицировалась. Какими же
соединениями эта фракция может быть представлена? Низкомолекулярные
органические кислоты (лимонная, шикимовая, щавелевая, фумаровая, муравьиная,
уксусная, яблочная, молочная и др.) идентифицируются в тонкодисперсных
фракциях вод Al-Fe-гумусовых подзолов в диапазоне 1-1100 мкмМ (Van Hees
et al, 2000). Согласно нашим расчетам, доля лимонной кислоты, обычно
представленная в водах подзолов в высоких концентрациях (15-250 мкмМ)
(Van Hees et al., 2000), не превышала 0,4% от общей концентрации углерода.
В составе хвои, основного компонента активной части опада в
древесных парцеллах, доминирует целлюлоза и другие углеводы (до 60%), доля
таннина и лигнина - 15 и 6% соответственно (Орлов, 1992). Основа
структуры лигнина - гидрофобная часть (фенилпропановое кольцо). К тому же
лигнин легко вступает в реакции полимеризации и поликонденсации, что
объясняет его низкую степень растворимости. Таннины, будучи комплексными
эфирами, также характеризуются слабой растворимостью. Целлюлоза как
соединение углеводного характера подвергается микробиологической
деструкции в наибольшей степени, поэтому можно утверждать, что истинно
растворенная фракция органического вещества в водах подзолов представлена
главным образом углеводами. Также следует заметить, что углеводы, как и
низкомолекулярные кислоты, поступают под кроны деревьев со
стволовыми и кроновыми водами.
Таким образом, значительная доля высокодисперсных компонентов
(истинно растворенной фракции) органического вещества в водах древесных
парцелл обусловлена поступлением низкомолекулярных органических
соединений с опадом хвои и стволовыми и кроновыми водами. Важным
фактором, определяющим долю истинно растворенной фракции органического
вещества, является активность микроорганизмов, зависящая от энергии
химических связей органических соединений растительных организмов.
Микроорганизмы способны к деструкции лигнина при использовании энергии
других, легкогидролизуемых источников энергии, таких, как углеводы
(Ibrahima et al., 1995). В органогенных горизонтах Al-Fe-гумусовых подзолов
под кронами деревьев биомасса и численность микроорганизмов оказалась
5. Рассеянные элементы л лл
ниже, чем в межкроновых пространствах (Никонов и др., 2001), что также
может быть причиной высокой доли истинно растворенной фракции
органического вещества в водах древесных парцелл.
Результаты исследований подтверждают важную биогеохимическую и
педогенную роль водорастворимых органических веществ. Данные
свидетельствуют, что преобладающей миграционной формой многих
определявшихся элементов (Na, Mg, Al, S, Ca, Mn, Co, Ni, Zn, As, Sr, Zr, Sb, Ba, Nd)
являются коллоиды, что свидетельствует о преимущественной миграции этих
элементов в составе органических соединений.
Алюминий формирует с гумусовыми кислотами комплексные соли,
металл в которых находится в анионной части молекулы (Орлов, 1992).
Цинк образует многочисленные соединения различной прочности.
Наиболее распространены комплексы, образованные по типу донорно-акцеп-
торной связи одновременно с атомами кислорода и азота. При избытке
органических лигандов степень закомплексованности цинка может возрастать
до 85-97% от валового содержания растворенных форм, это главным
образом комплексы с фульвокислотами (Линник, Набиванец, 1986).
Известно, что в природных водах марганец чаще находится в степени
окисления Мп2+ (растворенная часть) и Мп4+ (в основном в виде взвеси)
(Линник, Набиванец, 1986). В интервале рН 3,0-8,0 марганец практически
полностью представлен катионными формами (преимущественно, в виде гидрати-
рованных ионов Мп2+). Комплексообразование марганца с органическими
лигандами не является доминирующим. Комплексы Мп(Н) с веществами
гумусовой природы характеризуются как непрочные. Однако установлено, что
марганец способен к образованию внешнесферных комплексов с
фульвокислотами, менее прочных, чем внутрисферные комплексы железа и меди.
Никель в водах подзолов может быть представлен соединениями с
органическим веществом, преимущественно легко растворимыми хелатами.
Кобальт в кислой окислительной среде относительно подвижен, но может
быть адсорбирован оксидами железа и марганца. Органические хелаты
кобальта мобильны и активно мигрируют в пределах почвенного профиля.
Способность кобальта и никеля к комплексообразованию слабее, чем
железа, поскольку с возрастанием заряда ядра атомов наблюдается уменьшение
числа непарных электронов в d-подуровне, что обусловливает снижение в
целом химической активности и в частности комплексообразующей
способности.
Наличие вакантных d-орбиталей, большой размер иона и его высокий
заряд, вероятно, обусловливают высокое сродство лантаноидов и
актиноидов к органическому веществу.
Относительно высокая доля коллоидов для элементов подгруппы ПА -
магния, кальция, стронция и бария (50-90%) может объясняться
интенсивным биологическим поглощением истинно растворенной фракции и
неполной деструкцией растительных тканей. Органические коллоиды почвы
могут формироваться как гумусовыми частицами, так и клеточными
оболочками растений, клетками микроорганизмов, макромолекулами белковых
веществ типа ферментов. Кальций входит в состав производных пектина и
фитина, магний является структурным компонентом порфириновых
соединений, в частности хлорофилла. Возможно, данные структуры могут также
формировать миграционноспособные почвенные коллоиды.
130
Высокая доля коллоидной фракции сульфатов свидетельствует о
преимущественной миграции серы в органических соединениях. При этом
сопоставление результатов анализов валовых концентраций серы в водах
подзолов, полученных методом масс-спектрометрии, с результатами определения
сульфат-ионов методом ионообменной хроматографии, свидетельствует об
абсолютном преобладании сульфатной формы серы. По-видимому, причину
полученных результатов следует искать либо в особенностях
взаимодействия сульфат-ионов с почвенными коллоидами, либо в аналитических
тонкостях процесса диализа. В нашем случае за границу разделения истинной и
коллоидной фракции была принята номинально отсекаемая масса 100
Дальтон. Молекулярная масса сульфат-иона близка к данной величине (96
Дальтон), поэтому мономерные формы в принципе должны беспрепятственно
проникать сквозь мембрану.
Согласно теории образования ионных пар сульфат-ион имеет большой
размер в силу тетраэдрического расположения связей (Рэмсден, 1989). В
большом анионе электроны находятся дальше от ядра и в меньшей степени
испытывают его воздействие, чем в малом анионе, поэтому большой анион легче
поляризуется. Если катион мал, а анион велик, то катион может поляризовать
анион, и анион будет частично делить свое электронное облако с катионом,
поэтому связь приобретает частичный ковалентный характер. Следствием
этого может являться образование ионных пар в растворе, что повышает
молекулярную массу и снижает лабильность сульфатных соединений.
В качестве другой возможной причины может быть влияние
концентрационной поляризации, связанной с повышением концентрации
растворенного вещества у поверхности мембраны вследствие избирательного отвода
растворителя через поры этой мембраны. Этот фактор признается одним из
основных, влияющих на скорость и селективность мембранных процессов
(Brock, 1983). Принимая во внимание преобладание органического вещества
в составе вод, можно предположить, что его концентрация у внутренней
поверхности мембраны дисподиализатора является причиной создания
отрицательного заряда, а это будет способствовать снижению лабильности
отрицательно заряженных сульфат-ионов вследствие отталкивания от поверхности
мембраны.
Наконец, причиной возможного доминирования сульфатной формы
соединений серы в почвенных водах может быть полярная безобменная
адсорбция сульфат-ионов на органических коллоидах, когда ион, одинаковый
по знаку заряда с коллоидом (анион в случае отрицательных коллоидов),
внедряется в потенциал-определяющий слой, а второй ион в равновесии с
ним - в компенсирующий слой (Орлов, 1992).
Исключение составляют элементы подгруппы IA литий, калий и
рубидий, преимущественно мигрирующие в форме истинных растворов (гидрати-
рованные ионы). Литий, натрий, калий, рубидий и цезий относятся к группе
типичных ^-элементов. Эти элементы являются щелочными металлами, для
которых характерны соединения преимущественно с ионным типом связи.
Одно из важных свойств элементов подгруппы IA - слабо выраженная
склонность к комплексообразованию. Комплексные соединения с ионом
щелочного металла в качестве комплексообразователя малоустойчивы
(известны лишь для лития и натрия), поэтому они присутствуют в почвенных
водах главным образом в виде свободных (гидратированных) ионов.
Однако весьма многочисленны комплексные производные, у которых
ионы щелочного металла располагаются во внешней сфере. Многие из
подобных комплексов могут отличаться устойчивостью (Некрасов, 1973).
Формирование коллоидов, особенно натрием, позволяет предположить
образование комплексных производных, ионы щелочного металла которых
располагаются во внешней сфере; ядро такой мицеллы можно упрощенно
представить как агрегат комплексных кислот типа H3[Al(RCOO)6].
Высокая доля высокодисперсных компонентов элементов подгрупп I A
и IIА в водах древесных парцелл, так же как и для органического углерода,
может быть обусловлена поступлением соединений этих элементов с опа-
дом хвои и стволовыми и кроновыми водами, а также относительно низкой
биомассой микроорганизмов в водах древесных парцелл.
Высокая доля высокодисперсных компонентов отмечается для кремния.
Согласно существующим представлениям, в разбавленных растворах, где
концентрация кремния не превышает 140 мг/л, обнаруживаются
мономерные формы кремниевой кислоты (Орлов, 1992). Уголини и Далгрен (Ugolini,
Dahlgren, 1987) обнаружили, что весь кремний в водах подзолов находится в
лабильной форме. Согласно результатам исследований Ван Хииса с
соавторами (Van Hees et al., 2000), кремний в почвенных растворах подзолов
представлен в основном в низкомолекулярных соединениях, возможно в форме
кремниевой кислоты. Результаты наших исследований также указывают на
высокую долю низкомолекулярных соединений (до 60%) этого элемента.
Наличие в бореальных экосистемах сильного эдификатора - дерева
обусловливает парцеллярные различия в дисперсности мигрирующих
соединений. Тем самым подтверждено представление о необходимости изучения
почвообразовании в лесных экосистемах с учетом их пространственной
(парцеллярной) структуры. В водах древесных парцелл доля
высокодисперсных фракций выше, чем в межкроновых парцеллах.
Метод мембранного разделения для изучения миграционных форм
элементов в почвенных водах имеет несомненные преимущества перед другими
методами, традиционно применяемыми в почвоведении: а) быстроту
определения; б) отсутствие необходимости в калибровке; в) исключение влияния
на состав пробы разного рода реактивов; г) снижение до минимума
адсорбционных процессов на материале мембраны.
5.2. ВОЗДУШНОЕ ПРОМЫШЛЕННОЕ ЗАГРЯЗНЕНИЕ
В процессе развития любой биосферной ячейки (экосистемы,
биогеоценоза) происходят сукцессии, т.е. последовательные смены биоценозов,
преемственно возникающих на одной и той же территории под влиянием
природных факторов. Почва является неотъемлемым компонентом любой
наземной экосистемы или биогеоценоза (БГЦ) и проходит все этапы развития.
Антропогенные нарушения или природные катаклизмы могут остановить
или изменить тенденции аутогенной сукцессии. Так, интенсивное развитие
промышленного производства вызывает поступление больших количеств
кислотообразующих агентов (прежде всего, соединений азота и серы) и
других поллютантов (включая тяжелые металлы) в атмосферу и последующее
их выпадение на подстилающую поверхность, что приводит к существенным
132
изменениям структурно-функциональной организации лесных БГЦ. Вокруг
медно-никелевых комбинатов - основных загрязнителей природной среды
на Севере России - идентифицируются четыре основных типа состояния
лесных БГЦ: фоновый —> дефолиирующий (стадии начальной, интенсивной
и затухающей дефолиации) —> техногенные редколесья —> техногенные
пустоши (Лукина, Никонов, 1998). По сути дела это процесс деградационной
(техногенной) сукцессии, т.е. направленного изменения
структурно-функциональной организации БГЦ. В процессе техногенной сукцессии происходит
изменение свойств почв и почвенных вод (Лукина и др., 2003).
Рассмотрим влияние выбросов комбината "Североникель" - самого
мощного в Северной Европе источника выбросов загрязняющих веществ в
атмосферу, на валовые концентрации и фракционный состав типоморфных
и рассеянных элементов в водах подзолов - широко распространенного в бо-
реальной зоне типа почв. Валовые концентрации элементов в почвенных
водах из органогенного и иллювиального горизонтов в древесных и
межкроновых парцеллах представлены в табл. 5.7-5.8, фракционный состав
элементов в этих водах на рис. 5.5-5.8, химический состав вод в табл. 5.4.
Подгруппа I A. Li, Na, К, Rb, Cs. На всех стадиях деградационой
сукцессии закономерности пространственной вариабельности в
концентрации элементов данной подгруппы, обнаруженные в фоновых условиях,
сохранялись, за исключением техногенного редколесья. В водах из
органогенных горизонтов почв древесных парцелл максимальное превышение
фоновых концентраций данных элементов обнаруживается на стадии
интенсификации дефолиации. Доля натрия в истинном растворе выше, чем
в фоновых условиях (около 80%). На стадиях затухающей дефолиации и
техногенного редколесья концентрации натрия, лития и цезия были ниже,
чем на предыдущей стадии, но оставались выше фоновых, тогда как
концентрации калия и рубидия были значительно ниже фоновых значений.
Доля истинно растворенной фракции рубидия и особенно калия
снижалась (<40% для калия).
В водах из почвенного профиля изменения в концентрациях элементов
данной подгруппы в процессе деградационной сукцессии были сходными с
изменениями в водах из органогенного горизонта. На стадии
интенсификации дефолиации доля истинно растворенной фракции калия и рубидия
значительно снижалась, а натрия увеличивалась (>80%). На стадии затухающей
дефолиации истинно растворенная фракция калия не идентифицируется, а
рубидия снижается до 50%. В то же время доля калия и рубидия в коллоидах
и взвесях увеличивается. На стадии техногенного редколесья истинно
растворенная фракция калия была также ниже (40%), а натрия выше фоновых
значений (60%).
В водах из органогенных горизонтов почв межкроновых парцелл
концентрации калия и рубидия на всех стадиях деградации ниже фоновых
значений, тогда как концентрации натрия, лития и цезия, напротив, выше
фоновых, за исключением цезия на стадии техногенного редколесья. На стадии
интенсификации дефолиации доля истинно растворенной фракции калия не
идентифицируется, тогда как доля этой фракции для натрия значительно
возрастает (до 40%). На стадии затухающей дефолиации истинно
растворенная фракция идентифицируется только для рубидия (менее 40%),
доминирующей фракцией калия и натрия являются коллоиды. На стадии техногенно-
133
го редколесья доля истинно растворенной фракции калия и рубидия была
выше, чем на предыдущей стадии сукцессии.
Изменения в распределении перечисленных металлов по фракциям в
водах из почвенного профиля, вызванные действием воздушного
промышленного загрязнения, сопоставимы с изменениями в водах из органогенного
горизонта.
Причинами вариации концентраций данных элементов в почвенных
водах и распределения их по фракциям являются поступление их соединений с
опадом, биологическое поглощение, антагонизм между элементами и
реакции в почвенном поглощающем комплексе. На стадии интенсификации
дефолиации повышенные концентрации элементов в водах связаны с
увеличением количества опада и активными обменными процессами в почвах.
Повышенная концентрация калия в водах из иллювиального горизонта
древесных парцелл, превышающая концентрацию данного элемента в водах из
органогенных горизонтов, может быть обусловлена его высвобождением из
межпакетных пространств глинистых минералов, которые подвергаются
деструкции из-за высокой кислотности (Соколова, 1980).
На следующих стадиях техногенной сукцессии (затухающей дефолиации
и техногенного редколесья) снижение концентраций калия и рубидия и их
истинно растворенной фракции, вероятно, обусловлено уменьшением
количества опада (Лукина, Никонов, 1996), ингибированием жизнедеятельности
микроорганизмов (Никонов и др., 2001) и их активным поглощением
растениями (Лукина и др., 1999). Повышенные концентрации калия в растениях,
подверженных воздушному загрязнению отмечались и другими авторами
(Lobersli, Steinnes, 1988). Возможно, из-за проявления антагонизма
интенсивное поглощение растениями калия и рубидия может приводить к снижению
активности поглощения натрия и цезия, концентрации* которых в почвенных
водах возрастают.
Подгруппа II A. Be, Mg, Ca, Sr, Ba. Также как и для элементов
предыдущей подгруппы, на всех стадиях деградационной сукцессии закономерности
пространственной вариабельности в концентрациях данных элементов в
почвенных водах сохраняется. В водах из органогенных горизонтов почв
древесных парцелл максимальное превышение фоновых концентраций
наблюдается на стадии интенсификации дефолиации. На следующих стадиях,
затухающей дефолиации и техногенного редколесья, концентрации кальция, магния и
стронция снижаются по сравнению с предыдущей стадией, но остаются
сопоставимыми с фоновыми значениями или даже превышают их. В процессе
сукцессии истинно растворенные фракции кальция и магния снижаются.
Истинно растворенная фракция бария и стронция увеличивалась на стадии
интенсификации дефолиации и была сопоставима с фоном на других стадиях.
В водах из всего профиля изменения в концентрациях элементов данной
подгруппы, обусловленные действием воздушного загрязнения, сходны с
изменениями в водах из органогенных горизонтов. На стадиях
интенсификации дефолиации и затухающей дефолиации истинно растворенная фракция
кальция, магния, бария и стронция оказалась ниже фоновых значений, на
стадии техногенного редколесья данные фракции элементов сопоставимы с
фоном.
В водах из органогенного горизонта почв межкроновых пространств на
всех стадиях деградации концентрации элементов данной подгруппы превы-
134
шали фоновые значения. Доля истинно растворенной фракции магния была
ниже, а бария и стронция выше фонового уровня на стадиях деградации.
Снижение доли истинно растворенной фракции кальция можно отметить
только на стадии интенсификации дефолиации. По сравнению с водами из
органогенных горизонтов в водах из почвенного профиля концентрации
всех элементов данной подгруппы значительно снижались. Концентрации
кальция, магния и стронция достигали максимальных значений в
техногенном редколесье. Концентрации бария и бериллия увеличивались в процессе
сукцессии. Истинно растворенная фракция кальция, магния, бария и
стронция на всех стадиях сукцессии была значительно выше, чем в водах из
органогенного горизонта.
Концентрации элементов данной подгруппы и их распределение между
фракциями в почвенных водах зависят от количества опада,
биологического поглощения и антагонизма между элементами.
Максимальные концентрации элементов в водах древесных парцелл на
стадии интенсификации дефолиации можно объяснить большим
количеством опада и выщелачиванием элементов из растительных остатков, а также
вытеснением основных катионов из почвенного поглощающего комплекса
протонами. Снижение доли истинно растворенной фракции кальция и
магния в водах на данной стадии, вероятно, связано с более интенсивным
поглощением елью. Истинно растворенная фракция бария и стронция здесь,
напротив, увеличивается, по-видимому, из-за проявления антагонизма между
этими элементами, с одной стороны, и кальцием и магнием, в природных
условиях активно поглощаемых растениями, с другой. Возможно также, что
на данной стадии наблюдается антагонизм между кальцием и магнием, с
одной стороны, и калием, концентрации которого в растениях снижаются, с
другой. Причиной повышенных концентраций элементов данной подгруппы
в водах на стадиях затухающей дефолиации и техногенного редколесья
может быть вытеснение основных катионов из почвенного поглощающего
комплекса протонами и снижение активности биологического поглощения.
Доля коллоидной фракции элементов на данных стадиях деградации
увеличивается, тогда как доля этих элементов в истинном растворе снижается,
что объясняется снижением количества свежего опада.
Подгруппа III A. Sc, Y, лантаноиды (La, Се, Pr, Nd, Sm, Eu, Gd, Tb, Dy,
Yb, Lu), актиноиды (Th, U). В подстилочных водах и водах из всего
профиля древесных парцелл концентрация лантаноидов на стадиях
интенсификации и затухания дефолиации была значительно выше фоновых, тогда как на
стадии редколесья снижалась по сравнению с фоном. Сходные тенденции
обнаруживаются для урана, тогда как концентрация тория сопоставима с
фоновыми значениями на всех стадиях сукцессии.
Распределение концентраций лантаноидов между фракциями
рассмотрим на примере неодима. В подстилочных водах и в водах из всего профиля
на стадии интенсификации дефолиации возрастала истинно растворенная
фракция неодима (до 10 и 20% соответственно). На стадии затухающей
дефолиации и техногенного редколесья увеличивается фракция коллоидов.
В подстилочных водах межкроновых пространств концентрации
лантаноидов и тория были выше фоновых значений на всех стадиях деградации,
за исключением лантана в водах редколесья. Увеличение истинно
растворенной фракции неодима обнаруживается на стадии затухающей дефолиа-
135
ции (20%). На стадии редколесья основная форма миграции неодима -
коллоиды. В водах из почвенного профиля дефолиирующих лесов истинно
растворенная фракция неодима была высокой, особенно на стадии затухающей
дефолиации (до 80%).
Увеличение концентрации лантаноиодов и актиноидов в почвенных
водах древесных парцелл дефолиирующих лесов и на всех стадиях деградации
в водах межкроновых парцелл, вероятно, обусловлено увеличением
количества опада и интенсивными обменными процессами в почве. Увеличение
истинно растворенной фракции неодима в дефолиирующих лесах может быть
связано с увеличением количества свежего опада и возрастанием
кислотности.
Высокая истинно растворенная фракция неодима в водах из почвенного
профиля в дефолиирующих лесах может быть обусловлена миграцией с
подстилочными водами и повышенной кислотностью почв и почвенных вод.
Подгруппа IV A. Ti, Zr. В подстилочных водах древесных парцелл
максимальные концентрации циркония и титана обнаружены в
дефолиирующих лесах, что можно объяснить большим количеством опада. В процессе
деградационной сукцессии доля взвесей циркония, как и кремния,
увеличивается.
Подгруппа V А. V. Ванадий является компонентом выбросов комбината,
что объясняет увеличение его концентрации в почвенных водах в процессе
деградационной сукцессии. На всех стадиях деградации концентрация этого
элемента в почвенных водах выше фоновых значений. В подстилочных
водах доминирующей формой миграции остаются коллоиды, однако доля
ванадия в истинно растворенном состоянии значительно возрастает (до 40%).
Можно предположить, что коллоидная фракция представлена катионной
формой V, характеризующейся высоким сродством к органическому
веществу. По мере повышения степени окисления устойчивость катионных
комплексов ванадия понижается, а анионных - повышается (Зубович, 1989).
Истинно растворенная фракция V на всех стадиях деградации, вероятно,
относится к анионной форме.
Подгруппа VI А, Сг, Mo, W. Концентрации хрома, молибдена и
вольфрама в почвенных водах древесных парцелл увеличивается с уменьшением
расстояния до источника загрязнения. В водах межкроновых пространств
ярко выраженные изменения в уровне концентраций, обусловленные
аэротехногенным загрязнением, обнаруживались только для вольфрама:
концентрация этого элемента достигала максимума на стадии редколесья.
Подгруппа VII А. Мп. В подстилочных водах древесных парцелл
максимальные концентрации марганца обнаруживаются на стадии
интенсификации дефолиации, на стадии затухающей дефолиации концентрация этого
элемента была сопоставима с фоновыми значениями, а на стадии
редколесья - ниже фонового уровня. В водах из минеральных горизонтов
максимальные концентрации также выявляются на стадии интенсификации
дефолиации, на стадиях затухающей дефолиации и редколесья концентрации
снижаются по сравнению с предыдущей стадией, но остаются выше
фоновых значений. Распределение между фракциями сопоставимо с фоном.
В природных водах марганец чаще всего находится в степени окисления
+2 (растворенная часть) и +4 (в основном в виде взвеси). В интервале
рН 3,0-8,0 марганец практически полностью представлен катионными фор-
136
мами (преимущественно, в виде гидратированных ионов Мп2+) (Линник, На-
биванец, 1986). В этих условиях комплексообразование марганца с
органическими лигандами не является доминирующим процессом. Комплексы
Мп(П) с веществами гумусовой природы характеризуются как непрочные.
Однако установлено, что марганец способен к образованию внешнесфер-
ных комплексов с фульвокислотами, менее прочных, чем внутрисферные
комплексы железа и меди. Указанные обстоятельства, по всей видимости, и
обусловливают распределение соединений данного элемента между истинно
растворенной и коллоидной фракциями, характерное практически для всех
исследованных образцов почвенных вод.
Вариации в концентрации марганца в почвенных водах с максимумом на
стадии интенсификации дефолиации и минимумом на стадии редколесья
связаны с количеством опада и интенсивностью обменных процессов в почве.
Подгруппа VIII. Fe, Co, Ni. Концентрации железа характеризуются
максимальными значениями в водах из минеральных горизонтов обеих парцелл
и в подстилочных водах межкроновых парцелл на стадии интенсификации
дефолиации. В подстилочных водах древесных парцелл концентрации
железа были сопоставимы с фоновыми значениями на всех стадиях деградации.
Результаты многих исследований демонстрируют, что железо формирует
внутрисферные комплексы с фульвокислотами, характеризующиеся
высокой стабильностью в кислой и слабокислой средах (Орлов, 1992).
Концентрации никеля и кобальта в почвенных водах древесных и
межкроновых парцелл увеличиваются при приближении к источнику выбросов.
На стадиях деградационной сукцессии увеличивается доля истинно
растворенной фракции никеля и кобальта (до 40% на стадии редколесья) и также
возрастает доля фракции взвесей.
В водах из почвенного профиля коллоидная фракция представлена
минеральными и оргаяоминеральными коллоидами (с оксидами железа и
марганца). На всех стадиях сукцессии от 30 до 50% соединений никеля и
кобальта мигрировали в истинно растворенном состоянии, что может объясняться
повышенной кислотностью почв и почвенных вод. Высокая истинно
растворенная фракция в водах у источника загрязнения может объясняться
уменьшением содержания органического вещества.
Подгруппа I В, Си, Ag. Полагают, что медь связывается главным
образом с органическим веществом и практически не связывается с
минеральными фракциями твердых фаз почв (Temminghoff et al., 1994). Влияние
различных компонентов почвенного поглощающего комплекса на
ионообменную адсорбцию катионов зависит не только от состава и свойств почв,
но и от свойств самих катионов и их содержания в почвах (Пинский, 1997).
Согласно результатам исследования Т. Пампуры с соавт. (1993) при низкой
концентрации меди в почвах большая ее часть связана с органическим
веществом, при повышенной концентрации меди в почве значительное ее
количество специфически связывается с органическим веществом и
оксидами железа и марганца с образованием внешнесферных комплексных
соединений.
Концентрация меди в водах исследованных Al-Fe-гумусовых подзолов
увеличивается при приближении к источнику выбросов и в водах древесных
парцелл как в фоновых условиях, так и на стадиях деградационной
сукцессии, была значительно выше, чем в водах межкроновых пространств. Кон-
137
центрация серебра в водах значительно варьировала, минимальные
значения отмечались на стадии редколесья, максимальные - на стадии
интенсификации дефолиации в межкроновых пространствах и затухающей
дефолиации в древесных парцеллах. Увеличение концентраций серебра в водах де-
фолиирующих лесов и их уменьшение у источника загрязнения может быть
связано с вариациями в количестве опада.
Подгруппа II В. Zn, Cd. Макро- и микроэлементы в почвах,
загрязненных кадмием, медью, свинцом и цинком, могут иметь различный уровень
растворимости, и почвенные растворы могут содержать эти металлы в
различных химических формах: свободные двухвалентные катионы,
неорганические комплексы и органические комплексы (Holm et al., 1995). Согласно
результатам исследований Т. Пампуры с соавт. (1993) при низких
концентрациях цинка в почвенном поглощающем комплексе (<400 мг/кг) большая
его часть была адсорбирована почвой неспецифически и связывалась с
оксидами железа и марганца. С увеличением концентрации цинка, его
основная часть переходит в обменную форму.
Концентрация цинка в подстилочных водах древесных парцелл
исследованных ельников превышала фоновые значения на всех стадиях деградации,
максимальное превышение обнаруживалось на стадии интенсификации
дефолиации, где возрастает истинно растворенная фракция этого элемента.
Концентрации кадмия также превышали фоновые значения на всех стадиях
деградации. В водах из всего профиля концентрации цинка и кадмия также
увеличивались на всех стадиях деградации. Доли истинно растворенной
фракции цинка в этих водах достигали максимума на стадии редколесья
(40%).
Концентрации цинка в подстилочных водах межкроновых пространств
превышали фоновые значения на всех стадиях деградационной сукцессии,
концентрация кадмия была выше фоновой только на последней стадии.
Истинно растворенная фракция цинка увеличивалась на стадии редколесья,
доля взвесей была выше в дефолиирующих лесах. В водах из всего профиля
концентрации цинка и кадмия увеличивались на всех стадиях
деградационной сукцессии. Истинно растворенная фракция цинка в этих водах
достигала максимума на стадии редколесья (>30%), максимальные значения
взвешенной фракции наблюдались на стадии интенсификации дефолиации (до
80%).
Повышенные концентрации цинка в почвенных водах на стадии
интенсификации дефолиации связаны с увеличением количества опада и
активными обменными процессами в почве. Высокая доля коллоидной фракции
цинка объясняется относительно высоким сродством этого элемента к
органическому веществу. Возможными причинами увеличения концентрации
цинка и его истинно растворенной фракции на стадии редколесья являются
поступление соединений цинка из атмосферы, загрязненной выбросами,
снижение содержания органического вещества и ингибирование его
биологического поглощения.
Кадмий также является одним из компонентов выбросов, что объясняет
увеличение его концентраций на всех стадиях деградации.
Подгруппа III В. В, Al, TL На всех стадиях деградации в подстилочных
водах древесных парцелл концентрации алюминия и таллия превышали
фоновые значения. Концентрации алюминия характеризовались максималь-
138
ными значениями на стадиях интенсификации дефолиации и техногенного
редколесья. Концентрации бора превышали фоновый уровень на стадиях
интенсификации дефолиации и затухающей дефолиации. Истинно
растворенная фракция алюминия в подстилочных водах в процессе сукцессии
достигала 30%.
В водах из почвенного профиля возрастала концентрация алюминия,
концентрация таллия превышала фоновые значения на всех стадиях
деградации, а бора - только на стадии интенсификации дефолиации. В отношении
распределения концентраций алюминия между фракциями следует обратить
особое внимание на значительное возрастание доли алюминия во взвесях (до
60%) на стадии интенсификации дефолиации, не сопровождаемое
соответствующим увеличением взвешенной фракции органического вещества. Доля
истинно растворенной фракции алюминия достигала максимума на стадии
затухающей дефолиации (до 50%).
В подстилочных водах межкроновых пространств на всех стадиях де-
градационной сукцессии концентрации алюминия и таллия превышали
фоновые значения. Так же как в водах древесных парцелл, концентрации
алюминия характеризуются двумя максимумами: на стадии интенсификации
дефолиации и техногенного редколесья. Концентрация бора снижалась на
стадиях затухающей дефолиации и редколесья. Изменения в распределении
концентрации алюминия между фракциями, обусловленные воздушным
загрязнением, сопоставимы с изменениями, описанными для вод древесных
парцелл, за исключением стадии затухающей дефолиации, где истинно
растворенная фракция алюминия не обнаруживается.
В водах из почвенного профиля концентрация алюминия увеличивалась
в процессе деградационной сукцессии, концентрации бора и таллия были
ниже пределов обнаружения. Так же как и в водах древесных парцелл,
высокая доля алюминия во взвесях (более 90%) и в истинном растворе (70%)
была обнаружена на стадиях интенсификации и затухания дефолиации
соответственно.
Причинами вариации концентраций элементов данной подгруппы и их
распределения между фракциями в почвенных водах являются изменения в
количестве опада, реакции в почвенном поглощающем комплексе, степень
растворимости соединений элементов в почвах, обусловленная
кислотностью почв и почвенных вод.
Увеличение концентрации алюминия и его истинно растворенной
фракции в подстилочных водах на стадии интенсификации дефолиации может
быть обусловлено возрастанием количества свежего опада и гидролизом
аккумулятивных форм гумуса. На данной стадии истинно растворенная
фракция представлена, вероятно, комплексами алюминия с
низкомолекулярными органическими кислотами. Возможной причиной увеличения истинно
растворенной фракции алюминия может быть снижение интенсивности
поглощения растениями из-за активного поглощения ими кальция и магния
(проявление антагонизма). Второй пик увеличения концентрации алюминия
в подстилочных водах техногенного редколесья связан с растворением
неорганических компонентов, аккумулирующихся в органогенных горизонтах
из-за пыления территорий, не покрытых растительностью, и органическим
веществом (техногенные пустоши). Повышенная истинно растворенная
фракция алюминия в подстилочных водах на стадии затухающей дефолиа-
139
ции и техногенного редколесья обусловлена, вероятно, растворением алю-
моорганических и неорганических соединений из-за высокой кислотности
почв и почвенных вод.
Повышенная концентрация бора в водах на стадии интенсификации и
затухания дефолиации может быть связана с увеличением количества опада.
На стадии интенсификации дефолиации увеличение взвешенной
фракции алюминия в водах минерального профиля, как в древесных парцеллах,
так и межкроновых пространствах, не сопровождаемое соответствующим
увеличением взвешенной фракции органического вещества, может быть
связано с увеличением содержания неорганических аморфных соединений в
минеральных горизонтах. Согласно Джексону (Jackson, 1963), повышенная
кислотность снижает стабильность гидроксидов алюминия и приводит к
повышению растворимости обменных форм алюминия. Согласно нашим
данным на стадии интенсификации дефолиации происходит значительное
снижение концентрации обменного алюминия и, напротив, увеличение
концентрации доступного для растений (ацетат аммония, рН = 4,65) соединений
этого металла (Лукина, Никонов, 1996; Лукина и др., 2002). По сравнению с
фоновыми значениями концентрация обменного алюминия снижается в
3-4 раза, а доступного увеличивается в 2-3 раза (табл. 5.8). При этом
концентрация алюминия, экстрагируемого оксалатом аммония (аморфный
алюминий), в иллювиальных горизонтах подзолов также возрастала.
Пратт с соавт. (Pratt, Blair, 1961) и Макклин с соавторами (Mclean et al.,
1965) обнаружили, что ацетатом аммония (рН = 4,80) экстрагируется не
только доступные для растений соединения алюминия, но и свежеосажден-
ные аморфные гидроксиды этого элемента. Обнаружено, что в диапазоне
рН 4-6 аморфные гидроксиды алюминия могут формироваться в
межпакетных пространствах трехслойных силикатов с лабильной решеткой в
процессе гидролиза, полимеризации и фиксации Al3+ (Jackson, 1959,1963; Rich, 1960;
Carstea, 1968).
Можно также предположить, что на стадии интенсификации дефолиации,
характеризующейся повышенной концентрацией фульвокислот,
мигрирующих из органогенных горизонтов, наблюдается растворение имоголита в
иллювиальных горизонтах. Известно, что фульвокислоты способны
растворять протоимоголит при молярном соотношении СООН: А1 > 8 (Farmer, 1979).
Подгруппа IV В. С, Si, Sn. Валовая концентрация органического
углерода достигала максимальных значений на стадии интенсификации
дефолиации, где фиксировалось максимальное содержание общего количества
кислотообразующих веществ (Лукина и др., 2003). Возрастание концентрации
органического вещества на данной стадии может быть связано с
увеличением концентрации фульвокислот, что объясняется гидролизом
аккумулятивных форм гумуса при каталитическом действии минеральных кислот
(серная кислота). Это предположение подтверждается значительным
снижением отношения Срк : Сфк в органогенных горизонтах почв на данной стадии
сукцессии (Лукина, Никонов, 1996). К тому же причиной интенсивного
формирования грубого кислого гумуса и низкомолекулярных алифатических и
ароматических кислот на этой стадии может быть повышенное количество
свежего опада.
Пониженная концентрация органического вещества в почвенных водах на
стадии затухающей дефолиации и техногенного редколесья, объясняющая
140
снижение общего количества кислотообразующих веществ, несмотря на
интенсивное их поступление из атмосферы (Лукина и др., 2003), обусловлена
незначительным количеством опада и фитомассы (Лукина, Никонов, 1993).
В процессе техногенной сукцессии в почвенных водах древесных
парцелл происходит увеличение доли коллоидной и взвешенной фракций
органического вещества, тогда как доля истинно растворенной фракции
органических соединений в составе вод из органогенного горизонта снижается.
Причины снижения доли истинно растворенной фракции различны на
разных стадиях сукцессии.
Стадия интенсификации дефолиации характеризуется дефолиацией ели
и отмиранием зеленых мхов (Лукина, Никонов, 1996). Концентрация
углерода истинно растворенной фракции сопоставима с фоном, тогда как общая
концентрация органического вещества превышала фоновые значения.
Причиной сопоставимых концентраций органического вещества в истинно
растворенной фракции при снижении численности и биомассы
микроорганизмов (Никонов и др., 2001), особенно грибов, являющихся основными
деструкторами органического вещества в подзолах, может быть увеличение
количества растительного опада - источника водорастворимых
низкомолекулярных органических соединений. Повышенная доля коллоидной фракции
органического вещества связана с высокой концентрацией фульвокислот,
обусловленной гидролизом аккумулятивных форм гумуса, и увеличением массы
свежего опада.
На следующих стадиях сукцессии возможными причинами снижения
общей концентрации органического вещества и его растворенной фракции
могут быть уменьшение количества свежего опада (Лукина, Никонов, 1993).
Доминирующей фракцией органического вещества на данной стадии
остаются коллоиды, повышенная доля взвесей обусловлена усилением
интенсивности внутрипочвенного выветривания.
В водах из органогенных горизонтов почв межкроновых пространств
наблюдается иная картина в распределении органического вещества по
фракциям. Истинно растворенная фракция органического вещества
обнаруживается лишь на последней стадии деградации, где активность микробио-
ты значительно снижается, но, в отличие от древесных парцелл,
поступление опада растительных остатков продолжается, поскольку доминирующим
растением здесь является устойчивая к загрязнению вороника (Empetrum
hermaphroditum).
На всех стадиях деградационной сукцессии в водах древесных и
межкроновых парцелл наблюдается увеличение доли органического вещества во
взвесях (до 50%). Данная фракция представлена взвешенными частицами
разных размеров, превышающих 0,45 мкм, включая грубодисперсную
фракцию опада. Диаметр пор песчаных почв колеблется в пределах от 10-1 до
10-2 мм (Пономарева, 1964), благодаря чему частицы довольно крупных
размеров способны подвергаться внутрипочвенной миграции.
Максимальное превышение фоновых концентраций кремния и олова в
подстилочных водах древесных парцелл обнаруживается на стадиях
интенсификации и затухания дефолиации. На стадии редколесья концентрация
кремния сопоставима с фоновыми значениями. В процессе деградационной
сукцессии истинно растворенная и коллоидная фракции кремния
снижаются, тогда как доля взвесей, напротив, возрастает до 90%.
141
В водах из почвенного профиля максимальное превышение фоновых
концентраций кремния отмечается на стадии интенсификации дефолиации,
на следующих стадиях деградации концентрация этого элемента снижается,
оставаясь выше фоновых значений.
Концентрация кремния в подстилочных водах межкроновых
пространств превышала фоновые значения на стадиях интенсификации
дефолиации и техногенного редколесья. Так же как и в водах древесных парцелл,
наблюдается ярко выраженное увеличение доли кремния во взвесях (до 90%).
В водах из почвенного профиля концентрация кремния на всех стадиях
сукцессии сопоставима с концентрацией в водах древесных парцелл,
доминирующая форма миграции - взвеси.
Повышенные концентрации кремния в подстилочных водах, особенно
на стадиях интенсификации и затухания дефолиации, по-видимому,
обусловлены выщелачиванием из растительных остатков.
Повышенные концентрации кремния и увеличение его взвешенной
фракции в водах из минерального профиля на всех стадиях сукцессии
свидетельствуют об усилении процессов внутрипочвенного выветривания. На
стадии интенсификации дефолиации, характеризующейся наиболее
интенсивным выносом органических кислот из органогенного горизонта,
наблюдается резкое увеличение концентрации во взвешенном состоянии не
только кремния, но и алюминия, особенно ярко выраженное в древесных
парцеллах, что можно рассматривать как один из признаков растворения
минералов.
Подгруппа V В. N, P, As, Sb. В подстилочных водах древесных парцелл
концентрация аммония на стадии интенсификации дефолиации значительно
превышала фоновые значения, тогда как на последующих стадиях его
концентрация была ниже фоновой. Концентрации нитратов оставались
сопоставимыми с фоновыми, и только в техногенных редколесьях снижались.
Концентрация фосфора снижалась, тогда как концентрации мышьяка и
сурьмы, напротив, увеличивались в подстилочных водах в процессе деграда-
ционной сукцессии. Истинно растворенная фракция сурьмы в водах дефоли-
ирующих лесов была выше фоновых значений (около 30%), доля коллоидов
снижается до 50%. В техногенном редколесье доминирующей формой
миграции сурьмы снова становятся коллоиды. На стадиях затухающей
дефолиации и техногенного редколесья мышьяк в этих водах представлен
преимущественно истинно растворенной фракцией (около 70-100%).
В водах из минерального профиля тенденции изменения концентрации
аммония и фосфора в процессе деградационной сукцессии совпадали с
тенденциями, отмеченными для подстилочных вод. Концентрации нитратов
превышали фоновые значения только на стадии техногенного редколесья.
Концентрация сурьмы значительно увеличивалась на стадиях затухающей
дефолиации и редколесья. Причем в дефолиирующих лесах значительно
возрастает доля сурьмы, так же как и многих других элементов, во взвесях,
а в техногенном редколесье резко увеличивается ее истинно растворенная
фракция (до 40%). Концентрации мышьяка во фракциях были ниже
пределов обнаружения.
В подстилочных водах межкроновых пространств концентрации
аммония достигали максимальных значений на стадии интенсификации
дефолиации, а на следующих стадиях опускались ниже фоновых значений. На всех
142
стадиях деградации концентрации нитратов сопоставимы с фоновыми,
тогда как концентрации фосфора были ниже фоновых значений.
Концентрации мышьяка и сурьмы увеличивались на стадиях затухающей дефолиации
и редколесья. При этом концентрации мышьяка значительны в истинно
растворенной фракции (на стадии затухания дефолиации до 50-60%), тогда как
доминирующей формой миграции сурьмы становятся взвеси (до 60%) В
водах из минерального профиля концентрации нитратов и сурьмы превышали
фоновые значения на стадии редколесья.
Изменения в концентрации аммония и фосфора, обусловленные
воздушным загрязнением, связаны главным образом с вариациями в концентрации
органического вещества.
Было бы необоснованным предполагать, что в состав истинно
растворенных фракций входят только минеральные соединений фосфора,
например ортофосфаты, а в состав коллоидной фракции - исключительно
высокомолекулярные органические соединения данного элемента. Известно,
что значительная часть фосфора входит состав гуминовых и фульвокис-
лот, относящихся к фракции относительно высокомолекулярных, но в
составе органической части почвы фосфор представлен также и фосфолипи-
дами, нуклеиновыми кислотами, фосфопротеинами, фосфорилированны-
ми карбоновыми кислотами (Орлов, 1992), которые могут иметь и
достаточно низкие молекулярные массы. В свою очередь, для ортофосфорной
кислоты характерно образование конденсированных структур, часть орто-
фосфатов может быть связана с органическим веществом через катион-
ные мостики (железо и алюминий). Поэтому в силу достаточно высоких
молекулярных масс эти соединения будут идентифицированы как
коллоидная фракция.
Высокая концентрация нитратов в водах из минерального профиля в
техногенном редколесье, вероятно, обусловлено вытеснением из
почвенного поглощающего комплекса этих мобильных анионов сульфатами.
Увеличение концентраций в водах мышьяка и сурьмы связано с тем, что эти
элементы являются компонентами выбросов. Повышенная истинно
растворенная фракция этих металлов в почвенных водах у источника загрязнения
можно объяснить снижением содержания органического вещества.
Подгруппа VI В, S. В подстилочных водах древесных парцелл
максимальное превышение фоновых концентраций соединений серы
обнаруживается на стадии интенсификации дефолиации. Коллоидная форма этого
элемента остается доминирующей формой миграции на всех стадиях сукцессии.
В водах из минерального профиля максимальная концентрация
соединений серы также наблюдается на стадии интенсификации дефолиации, на
следующих стадиях концентрации снижаются, оставаясь значительно выше
фоновых. На стадиях деградационной сукцессии, в отличие от фона,
концентрации соединений серы в водах из минерального профиля значительно (до
2 раз) ниже, чем в подстилочных.
Соединения серы - основной (по доле в составе) компонент выбросов,
что объясняет их повышенные концентрации в почвенных водах на всех
стадиях деградации. Максимальное превышение фоновых концентраций на
стадии интенсификации дефолиации может объясняться вымыванием
соединений серы с поверхности хвои ели, где они осаждаются в форме
аэрозолей и выщелачиванием из растительных остатков на поверхности почвы. На
143
следующих стадиях деградации поверхность хвои снижается из-за
произошедшей уже дефолиации, а также уменьшается количество опада.
В почвенных водах межкроновых пространств концентрации серы и
сульфатов увеличиваются в процессе деградационной сукцессии.
Коллоидная форма миграции также остается доминирующей на всех стадиях.
В отличие от фона на всех стадиях деградации отмечены тенденции вну-
трипрофильного снижения интенсивности нисходящей мигарции:
концентрация серы в водах из минерального профиля была ниже, чем в
подстилочных водах (до 1,5 раза).
Нами установлено, что в условиях загрязнения концентрации
экстрагируемой серы (ацетат аммония, рН 4,65) в твердых фазах подповерхностных
горизонтов в 3-4 раза выше фоновых, тогда как в органогенных горизонтах
они сопоставимы с фоновыми значениями (Лукина, Никонов, 1996, 1998).
Согласно существующим представлениям, важная роль в сорбции
сульфатов в почвах принадлежит гидроксидам алюминия и железа, поверхность
коллоидных частиц которых положительно заряжена (Singh, Brydon, 1970).
Как было показано выше, концентрация аморфного алюминия в
минеральных горизонтах подзолов в условиях загрязнения возрастает. Также
увеличивается концентрация аморфного железа (Кислотные осадки и лесные
почвы, 1999). Повышенная кислотность почвенных вод может приводить к
увеличению положительного заряда минеральной части профиля,
благодаря чему создается более сильный барьер на пути внутрипрофильной
миграции соединений серы.
Показано, что в присутствии сульфатов гидроксиды алюминия выходят
из межпакетных пространств трехслойных минералов и связываются
сульфатами с формированием новой кристаллической фазы - базалюминита
(Singh, Brydon, 1970). Сульфаты могут также связываться с другими слабо-
растворимыми соединениями, такими как алюминит и джурбанит (Global
biogeochemical cycle..., 1983).
Высокая доля коллоидной фракции сульфатов свидетельствует о
преимущественной миграции серы в органических соединениях. При этом
сопоставление результатов анализов валовых концентраций серы в водах
подзолов, полученных методом масс-спектрометрии, с результатами определения
сульфат-ионов методом ионообменной хроматографии, свидетельствует об
абсолютном преобладании сульфатной формы серы. По-видимому, причину
полученных результатов следует искать либо в особенностях
взаимодействия сульфат-ионов с почвенными коллоидами, либо в аналитических
тонкостях процесса диализа, что обсуждалось нами ранее для фоновых условий.
Состав и свойства вод Al-Fe-гумусовых подзолов северотаежных лесов
в условиях воздушного промышленного загрязнения
Валовые концентрации. Воздушное промышленное загрязнение
существенно изменяет концентрации в почвенных водах не только поллютантов,
но и других элементов.
Концентрации компонентов выбросов Ni, Си, Со, V, Cr, As, Mo, Cd, Sb и
W в водах древесных и межкроновых парцелл увеличивались в процессе
техногенной сукцессии, что хорошо отражают линейные тренды, и достигали
максимальных значений вблизи источника загрязнения. Концентрация S, ос-
144
новного поллютанта, увеличивалась так же линейно только в водах
межкроновых пространств, тогда как в водах древесных парцелл максимальные
концентрации соединений этого элемента обнаруживаются на стадии
интенсификации дефолиации. Следовательно, на всех этапах техногенной
сукцессии деревья продолжали выполнение своей эдификаторной роли.
Изменения в концентрации органического вещества, металлов и
неметаллов, в водах древесных парцелл, обусловленные действием
аэротехногенного загрязнения, носят нелинейный по отношению к источнику загрязнения
характер. Как правило, максимальные концентрации обнаруживаются на
стадии интенсификации дефолиации. Значительное возрастание
концентрации углерода и анионов органических кислот в водах на данной стадии может
быть связано с гидролизом аккумулятивных форм гумуса при
каталитическом эффекте минеральных кислот, а также с увеличением количества
свежего опада. Концентрации Li, Na, К, Rb, Cs, Be, Mg, Ca, Sr, Ba, N-NH4, S, CI,
Zn, Y, лантаноидов, Mn, Al, Fe также характеризовались выраженным
максимумом на стадии интенсификации дефолиации, что обусловлено
увеличением количества опада, повышенной растворимостью соединений элементов и
интенсивными обменными процессами в почве. На стадиях затухающей
дефолиации и техногенного редколесья концентрации некоторых элементов
(Ca, Sr Na, Li, S, CI, Zn) в водах резко снижаются по сравнению с предыдущей
стадией, но остаются значительно выше фоновых значений. Концентрации
других элементов (К, Rb, Cs, Mg, С, N-NH4, N-N03) в водах на стадии
затухающей дефолиации сопоставимы с фоновыми значениями, а на стадии реко-
лесья - ниже фонового уровня. Причинами уменьшения концентрации
элементов являются значительное обеднение органогенного горизонта
мобильными соединениями этих элементов из-за их интенсивного выщелачивания, а
также и снижение продуктивности фитоценоза и количества опада.
В водах межкроновых пространств концентрации некоторых
элементов (S, CI, Ca, Mg, Sr, Ba, Mn, Zn, лантаноидов) на стадиях деградационной
сукцессии были, как правило, выше фоновых, тогда как концентрации
других элементов (К, Rb) значительно снижались. Концентрации С, Fe, N-NH4,
также как и в водах древесных парцелл, достигали максимальных значений
на стадии интенсификации дефолиации.
Барьерные функции. В дефолиирующих лесах, так же как и в фоновых
условиях, концентрации многих элементов снижались в процессе внутрипро-
фильной миграции, что свидетельствует о существовании биогеохимических
барьеров (биологическое поглощение, органическое вещество, оксиды и
гидроксиды железа, марганца, алюминия). Однако эти барьеры для железа,
алюминия, кремния и углерода в дефолиирующих лесах оказались
значительно слабее, особенно на стадии интенсификации дефолиации. Так, в
фоновых условиях отношения между концентрациями Fe, Al, Si и С в
подстилочных водах и в водах из всего профиля составляли соответственно 6,0; 3,5;
0,6 и 5, а на стадии интенсификации дефолиации они снижались до 2; 1,3; 0,3
и 3 соответственно. Причиной ослабления барьеров внутрипрофильной
миграции органического вещества является, вероятно, гидролиз
аккумулятивных форм гумуса, приводящий к увеличению концентраций фульвокислот с
относительно низкой молекулярной массой. Железо и алюминий мигрируют
в комплексах с фульвокислотами. Дополнительной причиной интенсивной
миграции органического вещества является ингибирование жизнедеятель-
145
ности микроорганизмов, что приводит к ослаблению поглощения основных
источников их питания - углеводов, входящих в состав органического
вещества почвенных вод. Снижение отношений между концентрацией А1 и Si в
подстилочных водах и в водах из всего профиля может быть растворение
минералов в иллювиальных горизонтах.
Барьеры на пути внутрипрофильной миграции элементов питания
(N-NH4, К, Са, Mg, Zn, Rb, Sr, Ba), поллютантов (S, Ni, Cu, Co, Cd) и
лантаноидов в дефолиирующих лесах были, напротив, более ярко выражены, чем в
фоновых условиях.
Для таких питательных элементов, как Са и Mg на стадии
интенсификации дефолиации и для N, К и Rb на стадии затухающей дефолиации,
барьером может являться активное избирательное поглощение растениями.
Особый интерес представляет поведение сульфатов, особенно в водах
древесных парцелл: если в фоновых условиях соотношение между их
концентрациями в подстилочных водах и в водах из всего профиля колебалось
от 0,5 до 1,0, то в дефолиирующих лесах это отношение возрастает до 2,4.
Отсутствие ярко выраженных барьеров внутрипрофильной миграции
соединений серы в фоновых условиях может объясняться блокированием
органическим обменных позиций на поверхности гидроксидов или формированием
комплексов органического вещества с AISOJ (Singh, Johnson, 1986). Ярко
выраженные барьеры в минеральных горизонтах почв, подверженных
загрязнению, можно объяснить увеличением концентраций аморфных
соединений Fe и особенно А1 в минеральной части профиля, а также
формированием новых кристаллических фаз, таких, как базалюминит, алюминит и
джурбанит. Аморфные гироксиды алюминия также могут эффективно
адсорбировать фосфаты, но в условиях загрязнения мы не наблюдаем этого
явления, вероятно, из-за конкурирующего влияния сульфатов.
Барьерами на пути внутрипрофильной миграции тяжелых металлов
(поллютантов и лантаноидов) в почвах дефолиирующих лесов, вероятно,
являются органическое вещество и сульфаты, концентрации которых в
минеральных горизонтах увеличиваются (Лукина, Никонов, 1996). Также
причиной снижения миграционной активности тяжелых металлов может быть
насыщенность функциональных групп фульвокислот ионами этих металлов,
что приводит к увеличению молекулярной массы, снижению их способности
к миграции и формированию ассоциатов. Однако, с другой стороны,
необходимо заметить, что высокий уровень кислотности почв и почвенных вод
является неблагоприятным фактором для формирования таких ассоциатов.
В техногенных редколесьях биогеохимические барьеры на пути
внутрипрофильной миграции многих элементов были значительно слабее, чем в
фоновых условиях и в дефолиирующих лесах. Это связано с разрушением
растительного покрова, ингибированием жизнедеятельности
микроорганизмов снижением концентрации органического вещества и разрушением
почвенного профиля. Концентрации нитратов в водах из всего профиля
значительно выше, чем в в подстилочных. Можно предположить, что нитраты
могут замещаться в почвенном поглощающем комплексе иллювиальных
горизонтов сульфатами.
Фракционный состав. В процессе деградационной сукцессии
распределение концентраций элементов между фракциями с частицами различных
размеров в почвенных водах значительно изменяется.
146
Уменьшение истинно растворенной фракции углерода в подстилочных
водах древесных парцелл и, напротив, ее увеличение в водах межкроновых
пространств связаны с варьированием количества опада и ингибированием
жизнедеятельности микроорганизмов. Истинно растворенная фракция
щелочных (К, Rb) и щелочно-земельных (Са, Mg) элементов снижалась, что
может быть обусловлено их активным поглощением растениями на стадиях
интенсификации и затухания дефолиации и уменьшением количества опада на
стадиях затухающей дефолиации и техногенного редколесья. Истинно
растворенная фракция поллютантов Ni, Co, As, Sb, V значительно возрастала,
особенно на стадии редколесья. Причинами увеличения данной фракции
поллютантов могут быть повышенная кислотность почв и почвенных вод и
снижение концентрации органического вещества. Обнаруживаются тесные
отрицательные корреляции между уровнем рН и концентрациями Ni, Co, As, Sb,
V в подстилочных водах (г = -0,749; г = -0,693; г = -0,723; г = -0,521; г = -0,767
соответственно). Возрастание истинно растворенной фракции А1 в водах
может быть обусловлено их высокой кислотностью, Обнаруживались тесные
отрицательные корреляции между концентрацией алюминия в истинном
растворе в почвенных водах и уровнем рН (г = -0,750 - для подстилочных водах
и г = -0,596 - для вод из всего профиля) Увеличение взвешенной фракции А1
и Si в водах из всего профиля на стадии интенсификации дефолиации может
быть связано с растворением минералов, обусловленным действием высокой
концентрации фульвокислот, мигрирующих из органогенного горизонта.
Возрастание взвешенной фракции Ъг свидетельствует об усилении
выветривания исходных минералов почвообразующих пород.
Литература
Варшал Г.М. Фракционирование, количественное определение и изучение
некоторых основных компонентов растворенных органических веществ природных
вод // Гидрохим. материалы. 1973. Т. 49. С. 143-151.
Варшал Г.М., Велюханова Т.К., Кощеева И.Я. Геохимическая роль гумусовых
кислот в миграции элементов // Гуминовые вещества в биосфере. М.: Наука, 1993.
С. 97-117.
Варшал Г.М.у Инцкирвелли Л.Н., Сироткина И.С. и др. Об ассоциации
фульвокислот в водных растворах // Геохимия. 1975. № 10. С. 1581-1584.
Возбуцкая А.Е. Химия почв. М.: Высш. шк., 1964. 130 с.
Гедройц К.К. Химический анализ почвы // Избр. соч. М.: Сельхозгиз, 1935. Т. 2.
С. 11-439.
Евстратова К.И. Физическая и коллоидная химия. М.: Высш. шк., 1990. 253 с.
Кабата-Пендиас А., ПендиасХ. Микроэлементы в почвах и растениях. М.: Мир,
1989. 439 с.
Карпухин А.И., Фокин Ф.Д. Применение гелевой хроматографии для изучения
фульвокислот и железофульватных соединений // Особенности почвенных
процессов дерново-подзолистых почв. М.: ТСХА, 1977. С. 102-114.
Карпухин А.И., Яшин И.М., Черников В.А. Формирование и миграция
комплексов водорастворимых органических веществ с ионами тяжелых металлов в
таежных ландшафтах Европейского Севера // Изв. ТСХА. 1993. Вып. 2. С. 99-126.
Кауричев И.С., Фролова Л.Н. Водорастворимые органические вещества
индивидуальной природы в лесных подстилках // Докл. ТСХА. 1965. Вып. 115, ч. 2.
147
Кислотные осадки и лесные почвы / Под ред. В.В. Никонова и Г.Н. Копцик.
Апатиты: КНЦ РАН, 1999. 320 с.
Кнорре Д.Г., Мызина С Д. Биологическая химия. М.: Высш. шк., 2000. 479 с.
Линник П.Н., Набиванец Б.И. Формы миграции металлов в пресных
поверхностных водах. Л.: Гидрометеоиздат, 1986. 271 с.
Лукина Н.В., Горбачева Т.Т., Никонов В.В., Лукина М.А. Пространственная
изменчивость кислотности Al-Fe-гумусовых подзолов // Почвоведение. 2002. № 2.
С. 163-176.
Лукина Н.В., Горбачева Т.Т., Никонов В.В., Лукина М.А. Пространственная
изменчивость кислотности почв в процессе техногенной сукцессии лесных
биогеоценозов // Там же. 2003. № 1. С. 32-45.
Лукина Н.В., Никонов В.В. Состояние еловых биогеоценозов Севера в
условиях техногенного загрязнения. Апатиты: КНЦ РАН, 1993. 134 с.
Лукина Н.В., Никонов В.В. Биогеохимические циклы в лесах Севера в
условиях аэротехногенного загрязнения: В 2 ч. Апатиты: КНЦ РАН, 1996. Ч. 1.213 с; Ч. 2.
192 с.
Лукина Н.В., Никонов В.В. Питательный режим лесов северной тайги:
Природные и техногенные аспекты. Апатиты: КНЦ РАН, 1998. 316 с.
Некрасов В.В. Основы общей химии. М.: Химия, 1973. Т. 1. 656 с.
Никонов В.В. Почвообразование на северном пределе сосновых биогеоценозов.
Л.: Наука, 1987. 142 с.
Никонов В.В., Лукина Н.В. Влияние ели и сосны на кислотность и состав
атмосферных выпадений в северо-таежных лесах индустриально-развитого региона //
Экология. 2000. Т. 31. № 2. С. 82-90.
Никонов В.В., Лукина Н.В.,ДеромД. и др. Миграция и аккумуляция соединений
никеля и меди в Al-Fe-гумусовых подзолистых почвах сосновых лесов в условиях
аэротехногенного загрязнения // Почвоведение. 1993. № 11. С. 40-53.
Никонов В.В., Лукина Н.В., Полянская Л.М., Паникова А.Н. Особенности
распространения микроорганизмов в Al-Fe-гумусовых подзолах северо-таежных
еловых лесов: природные и техногенные аспекты // Микробиология. 2001. Т. 70, № 3.
С. 374-383.
Никонов В.В., Лукина Н.В., Фронтасьева М.В. Рассеянные элементы в Al-Fe-
гумусовом подзолообразовательном процессе // Почвоведение. 1997. № 11.
С. 1319-1331.
Никонов В.В., Лукина Н.В., Фронтасьева М.В. Рассеянные элементы в
подзолистых Al-Fe-гумусовых почвах в условиях воздушного загрязнения медно-никеле-
вым производством и изменяющегося литогенного фона // Там же. 1999а. № 3.
С. 370-382.
Никонов В.В.t Лукина Н.В., Фронтасьева М.В. Рассеянные элементы в Al-Fe-
гумусовых подзолистых почвах в условиях воздушного загрязнения апатито-нефе-
линовым производством // Там же. 19996. № 12. С. 1492-1501.
Орлов Д.С. Химия почв. М.: Изд-во МГУ, 1992. 400 с.
Орлов Д.С., Аммосова Я.М., Глебова Г.И. и др. Молекулярные веса, размеры и
конфигурация частиц гумусовых кислот // Почвоведение. 1971. № 11. С. 43-58.
Пампура Т.В., Пинский ДЛ.У Остроумов В.Е. и др. Экспериментальное
изучение буферное™ чернозема при загрязнении медью и цинком // Там же. 1993. № 2.
С. 104-110.
Пинский ДЛ. Ионообменные процессы в почвах. Пущино: Пущин. НЦ РАН,
1997. 166 с.
Пономарева В.В. Теория подзолообразовательного процесса (биохимические
аспекты). М.; Л.: Наука, 1964. 380 с.
Рэмсден Э.Н. Начала современной химии. Л.: Химия, 1989. 784 с.
Смит У.Х. Лес и атмосфера. М.: Прогресс, 1985. 430 с.
148
Таргульян В.О. Почвообразование и выветривание в холодных гумидных
областях. М: Наука, 1971. 268 с.
Фокин Ф.Д., Аргунова В.А., Кауричев И.С., Яшин ИМ. Состав органического
вещества и состояние полуторных окислов и фосфатов в водах, дренирующих
подзолистые почвы // Изв.ТСХА. 1973. Вып. 2. С. 99-105.
Фридрихсберг Д.А. Курс коллоидной химии. М.: Химия, 1974. 352 с.
Яшин ИМ., Кауричев И.С. Педогенные функции водорастворимых
органических веществ в таежных ландшафтах // Почвоведение. 1992. № 10. С. 49-61.
Яшин ИМ., Нмадзуру И., Шесшаков Е.И. Особенности формирования
водорастворимых органических веществ в подзолистых почвах и их роль в абиогенной
миграции типоморфных элементов // Изв. ТСХА. 1993. Вып. 3. С. 126-142.
Benes P., Gjessing E.T., Steinnes E. Inter actions between humus and Xr ace elements in
fresh water //Water Res. 1976. Vol. 10. P. 711-716.
Brock T.D. Membr filtration: A user's guide and reference manual. Madison: Publ. of
Sci. Techn. 1983. 73 p.
Buffle J., Ferret D., Newnam M. Environmental particles. Vol. 1. Boca Raton (Fla.):
Lewis, 1992. P. 172-230.
Burba P., Aster В., Nifanteva T. et al. Membrane filtration studies of aquatic humic
substances and their metal species: a Concise overview // Talanta. 1998. Vol. 45.
P. 977-988.
Burba P., Shkinev V., SpivakovB.Ya. On-line fractionation and characterization of
aquatic humic substances by means of sequential-stage ultrafiltration // Fresenius J. Anal. Chem.
1995. Vol. 351. P. 74-82.
Carlson -Ekvall C.E.A., Morison GM. Metal partitioning and toxicity in sewage sludge
// Environ. Technol. 1997. Vol. 18. P. 489-497.
Carstea D.D. Formation of hydroxy Al and Fe-interlayer in montmorillonite and ver-
miculite: influence of particle size and temperature // Clays and Clay Miner. 1968. Vol. 16,
N3. P. 231-238.
Evans LJ., Manley E.P. Podzol development in Northeastern Ontario: Mineralogy and
elemental redistribution // Sci. Geol. Mem. 1983. N 73. P. 85-93.
Farmer V.C. Possible roles of a mobile hydroxyaluminium orthosilicate complex (pro-
toimogolite) and other hydroxyaluminium and hydroxy-iron species in podzolization //
Migrations organo-minerales dans les sols temperes, Nancy, 24-28 Sept. 1979. P., 1981.
P. 275-279. (Colloq. Intern. CNRS; N 303).
Frimmel F.H. // Progress in hydrogeochemistry. В.: Springer, 1992. P. 24-28.
Frimmel F.H., Abbt-Braun G. II Humic substances in the aquatic and terrestrial
environment. В.: Springer, 1991. P. 37-46.
Global biogeochemical cycle of sulphur and influence on it of anthropogeneous activity.
Moscow, 1983. 420 p.
Holm P.E., Christensen Т.Н., Tjell J.C., McGrath S.P. Speciation of cadmium and zinc
with application to soil solutions // Environ. Qual. 1995. Vol. 24. P. 183-190.
Hongve D., Baann J., Becher G., homo S. II Environ. Intern. 1996. Vol. 22. P. 489.
Ibrahima A., Jofere R., Gillon D. Changes in litter during the initial leaching phase: an
experiment on the leaf litter of Mediterranean species // Soil Biol, and Biochem. 1995.
Vol. 27, N7. P. 931-939.
Jackson ML. Frequency distribution of clay minerals in major great soil group as
related to the factors of soil formation // Proc. Nat. conf. clay and clay minerals. P. 133-143.
Jackson ML. Aluminium bonding in soils: a unifying principle in soil acience // Soil Sci.
Soc. Amer. Proc. 1963. Vol. 27, N 1. P. 1-10.
KilduffJ., Weber WJ., Jr. // Environ. Sci. and Technol. 1992. Vol. 26. P. 569.
Leece D.R., Low G.K.-C, Warne M. St J. et al. Opportunities for expanded use of soil,
plant and water analysis in environmental management // Commun. Soil Sci. Plant Anal.
2000. Vol. 31, N 11/14. P. 2185-2200.
149
McLean E.O., Reicopky D.C., Lashmann С. Al in soil: Interrelationships of organic
matter, liming, and extractable Al with "permanent" charge 9KC1 and pH-dependent cation
exchange capacity of surface soil // Soil Sci. Soc. Amer. Proc. 1965. Vol. 29. P. 374-378.
Mykkelbost T.C., Vogt R.D., Seip H.M. Organic carbon fractionation applied to lake and
soil water at the HUMEX site // Environ. Intern. 1995. Vol. 21. N 6. P. 849-859.
Pratt P.F., Blair F.L. A comparison of the reagents for extraction of aluminium from
soils // Soil Sci. 1961. Vol. 91. P. 3-17.
Rich CI. Aluminium in interlayers of vermiculate // Soil Sci. Soc. Amer. Proc. 1960.
Vol. 24. P. 41-52.
Singh B.R., Abrahamsen G., Stuanes A. Effect of simulated acid rain on sulphate
movement in acid forest soils // Soil Sci. Soc. Amer. J. 1980. Vol. 44. P. 75-80.
Singh B.R., Johnson D.W. Sulfate content and adsorption in soils of two forest
watersheds in Southern Norway // Water, Air and Soil Pollut. 1986. Vol. 31. P. 847-856.
Singh S.S., Brydon J.E. Activity of aluminium hydroxy sulphate and the stability of
hydroxy aluminium interlayers in montmorillonite // Canad. J. Soil Sci. 1970. Vol. 50, N 6.
P. 219-225.
Smith U.Ch. Forest and atmosphere. Moscow: Progress, 1985. 430 p.
Spivakov В., Shkinev V., Geckeler K. Separation and preconcentration of trace elements
and their physico-chemical forms in aqueous media using inert solid membranes // Pure and
Appl. Chem. 1994. Vol. 66, N 3. P. 631-640.
Steinnes E., Njastad O. Enrichment of metals in the organic surface layer of natural soil:
identification of contributions from different sources // Analyst. 1995. Vol. 120, N 5.
P. 1479-1483.
Swift R.S. II Humic substances II: In search of structure. Chichester: Wiley, 1989.
P. 450-466.
Temminghoff EJ.M., Van der Zee, Keizer M.G. The influence of pH on the desorption
and speciation of sandy soil // Soil Sci. 1994. Vol. 158. P. 395-408.
Thurman E.M., Wershaw R.L., Malcolm R.L., Pinckney DJ. // Org. Geochem. 1982.
Vol. 4. P. 27.
Tukey H.B. The leaching of substances from plants // Annu. Rev. Plant Physiol. 1970.
Vol. 21. P. 305-324.
Ugolini FC, Dahlgren R.A. The mechanisms of podzolization as revealed by soil
solution studies // Podzols and podzolization / Assoc, frangaise pour Г etude du sol. INRA. P.,
1987. P. 185-203.
Van Hees P.A.W., Lundstrom U.S., Giesler R. Low molecular weight organic acids and
their Al-complexes in soil solution-composition, distribution and seasonal variation in three
podzolized soils // Geoderma. 2000. Vol. 94. P. 173-200.
Wennrich R., Mattusch J., Morgenstern P. et al. Size and phase fractionation of water
components by membrane filtration // Fresenius J. Anal. Chem. 1995. Vol. 359. P. 161-166.
Глава 6
РАСТЕНИЯ
Живой организм взаимодействует с окружающей средой. Отношения
между "спросом" живых организмов в химических элементах и
"предложением" окружающей их среды редко бывают адекватными.
Наиболее фундаментальная характеристика биологической роли
химических элементов - содержание их в живом веществе. Эта особенность
организмов нуждается в развитии посредством расширения представлений о:
а) формах нахождения рассеянных элементов; б) "депо" рассеянных
элементов, градиентов концентраций и барьеров; в) ответных реакциях организмов
на изменение элементного состава внешней среды; г) сдвиге элементного
состава организмов в аномальном и патологическом состоянии; е)
биологической необходимости и незаменимости рассеянных элементов (включая
условия угнетения и нарушения функций организмов при недостатке
элементов и их восстановление при введении); ж) стимулирующем, токсическом,
канцерогенном, мутагенном и других воздействиях рассеянных элементов на
жизнедеятельность организмов.
Общеизвестно, что в биосфере и экосистемах химический состав
организмов тесно связан с химическим составом среды обитания.
Экстремальные значения по отношению к рассеянным элементам можно определить
как элементно-дефицитные или элементно-избыточные. Вероятно,
широкое разнообразие химического состава природной среды обусловливает
такое же разнообразие состава живого вещества, и проблема "нормы" или
"фона" всегда остра.
Химический состав растений - генетически запрограммированная и
константная величина (Ильин, 1985). Постоянную потребность в том или ином
элементе растение должно удовлетворять за счет окружающей среды.
Полагают, что все химические элементы, существующие в природе так или
иначе участвуют в жизненных процессах. Это представление основано на
многочисленных данных об исключительном разнообразии геохимических
ситуаций, в которых произрастают растения, большой пластичности
живого вещества и возможности неординарных реакций и соединений, в которых
могут участвовать элементы (Виноградов, 1952; Кист, 1987; Bowen, 1966; и
др.). Однако имеется мнение, что растения поглощают из почвы как
нужные, так и ненужные элементы и не всякий элемент в их составе -
необходимый (Арнон, 1962).
По мнению В.Б. Ильина (1985) химический состав растений определяют
два ведущих фактора: генетический и экологический. Их долевое участие
151
меняется в зависимости от обстоятельств. При соответствующей
геохимической обстановке растение осуществляет генотипическую программу
поглощения и использования элементов в метаболических процессах.
Экологический фактор нарушает запрограммированные тенденции, способствуя
избыточному поступлению тех или иных элементов в растения и их накоплению
в количествах, превышающих нормальное содержание.
Представление о биофильности элемента по отношению к растениям
можно составить на основании их сепарации в морской воде, где
предположительно зародилась жизнь (Эгами, 1980; Ильин, 1985). В соответствии с
этим представлением в группу с наибольшей концентрацией (> 106 мг/кг)
входят основные элементы-биофилы: Н, О > Na, CI > Mg >S>K>C>N.
Элементы с концентрациями в пределах ШМО2 мг/кг (Вг > В > Si, Sr > F > Li
> P > Rb > I, Ba) могут быть отнесены в группу биоэлементов
специализированных органов. Элементы с концентрацией 102—10° мг/кг (Mo, Zn, Al, V, Fe
> Ni, Ti, U, Си, Сг > Mn, Cs, Se, Sb > Co, W) могут рассматриваться как
катализаторы. Элементы с концентрацией < 10° мг/кг, по мнению Ф. Эгами
(1980) не связаны с биологическими системами.
Освоение организмами суши с менее благоприятными условиями питания
не привели к кардинальным изменениям в химическом составе живого
вещества. Наземные организмы попытались приспособиться к изменившейся
окружающей среде, создавая механизмы нахождения и селективного
извлечения элементов питания из лито- и атмосферы, и способствовали
формированию особого биосферного тела - почвы. Поиск способов самообеспечения
элементами для участия в метаболических реакциях благоприятствовал
сохранению изначально сложившегося химического состава, но
приспособление к особенностям геохимической обстановки вызывало его изменения.
Формирование химического состава растений происходило в
конкретной геохимической обстановке. При высоком содержании рассеянных
элементов в окружающей среде в растении мог проявляться компенсаторный
механизм, обеспечивающий закрепление избыточного элемента в
метаболическом обмене и обусловливающий появление мутаций. В.Б. Ильин
(1985) обращает внимание на то обстоятельство, что, согласно
исследованиям Н.И. Вавилова (1987), центрами видообразования были территории
многих горных стран, где часто к поверхности подходят рудные тела и
встречаются обширные ореолы рассеяния металлов. Это, в свою очередь,
вносило разнообразие в химический состав растений и аккумуляцию
рассеянных элементов.
В целом содержание рассеянных элементов в растениях фоновых
территорий характеризуется широким диапазоном колебаний. Величина
диапазона колебаний определяется особенностями растений и условиями
окружающей среды (свойствами почв и атмосферным поступлением элементов).
6.1. ПРИРОДНЫЕ ОСОБЕННОСТИ
Данные о распространении рассеянных элементов в живых организмах
противоречивы. Следует отметить (Ильин, 1985,1991; Кист, 1987): 1)
концентрация рассеянных элементов закономерно уменьшается с увеличением их
атомного номера (заряда, относительной атомной массы); 2) несмотря на раз-
152
витие новых аналитических технологий, практически отсутствуют данные об
аккумуляции организмами платиноидов, редкоземельных элементов
(лантаноидов), ниобия, рения, таллия, висмута и некоторых других элементов.
Важное методологическое значение в исследованиях биологической
роли химических элементов играет определение критериев их биологической
незаменимости. Наиболее известны и приняты критерии Э.Андервуда
(1962):
1) рост или стимуляция жизнедеятельности при увеличении в питании
одного единственного элемента;
2) признаки недостаточности при исключении одного элемента из
рациона, полноценного во всех других отношениях, причем они исчезают при
введении дефицитного элемента;
3) корреляция между низким содержанием элемента и состоянием
недостаточности.
Для растений в список жизненно важных включены элементы,
встречающиеся в концентрациях > 1(И% (Арнон, 1962), при более низких
концентрациях доказать жизненную необходимость элементов с учетом критериев
Андервуда не удается. Отсутствие четкости в определении жизненно
необходимых элементов стала основной причиной отрицания многими
исследователями биологической роли химических элементов, составляющих
значительную часть периодической системы, особенно ультрамикроэлементов.
По мнению А. Киста (1987) необходимость так называемых
ультрамикроэлементов может проявляться не вследствие отсутствия элемента, а в
результате нарушения механизмов вовлечения элемента в нормальные
обменные процессы.
Биологическая избирательность позволяет растениям контролировать
химический состав в определенных пределах. Химический состав живых
организмов непостоянен, и его вариации тем больше, чем меньше
концентрация изучаемого элемента и чем больше степень неоднородности
исследуемой выборки (Кист, 1987; Кабата-Пендиас, Пендиас, 1989). При этом
вариации состава отдельного организма тем больше, чем ниже по эволюционной
лестнице стоит организм. Прямую связь химического состава организмов и
окружающей среды можно предполагать только на начальной стадии
развития биосферы. По мере развития организмов эта зависимость становилась
более сложной и нелинейной.
Поскольку химический состав организмов чрезвычайно непостоянен и
неоднороден, требуются сведения о химическом составе достаточно
генерализованных систем: биосфера в целом, отдельные классы и виды
организмов и др.
В целом существуют положительные линейные зависимости между
составами живых организмов и почв, морской воды и литосферы. Эти
зависимости указывают на увеличение концентрации элементов в организмах при
увеличении их содержания в окружающей среде и могут свидетельствовать
о возможной линейной (или близкой к линейной) связи состава организмов
и окружающей среды. Для выявления этих закономерностей используют
коэффициенты биологического поглощения (накопления) (Перельман, 1975).
Сопоставление максимальных концентраций элементов в растениях со
средним содержанием (кратность накопления) позволило установить, что
кратность накопления также возрастает с уменьшением среднего содержания
153
элементов в растениях (Ткалич, 1969). Это явление иллюстрирует большую
толерантность растений к изменению концентрации в них незначительно
распространенных элементов (Кист, 1987). С увеличением концентрации
элемента коэффициент накопления резко уменьшается. Вероятно,
интенсифицируются гомеостатические процессы, защищающие организм от
существенных изменений его состава.
Таким образом, в организмах, адаптированных к условиям обитания, в
силу многообразия механизмов гомеостаза коэффициент накопления
элементов зависит от их среднего содержания. Это, очевидно, не противоречит
сведениям об организмах, способных избирательно накапливать
определенные элементы, существовать в условиях аномально измененной
питательной среды и т.д., поскольку имеются указания на возможность генетически
детерминированной устойчивости к повышенным концентрациям
элементов и даже создания (воспитания) организмов, способных как переносить
повышенные химические нагрузки, так и утилизовать различные элементы.
На самом деле такие связи чаще всего менее четкие и более сложные.
Так, применительно к наземным растениям это объясняется тем, что сама
почва является продуктом жизнедеятельности растений и естественные
вариации состава обеих сред маскируют эффект концентрирования. Кроме
того, наземные растения, особенно высшие, в силу эволюционной продвинуто-
сти обладают специализированными механизмами утилизации элементов
питания. В то же время при сопоставлении состава растений и почвенных
растворов линейные зависимости выражены довольно отчетливо (Bowen,
1966; Кист, 1987; Лукина, 1996; Лукина, Никонов, 1996, 1998). По мнению
А.А.Киста (1987) реальные связи могут быть более или менее
замаскированными глобальной закономерностью падения концентрации
(распространенности) элемента с увеличением его атомного номера (относительной
атомной массы).
Растения выступают по отношению к рассеянным элементам и как
пассивный рецептор (поглощая элементы из воздуха и почвы), и как живая
система, способная контролировать поступление и удаление элементов
посредством метаболических реакций.
Химическим элементам в целом свойственны такие процессы и явления
поведения в растении, как: а) поглощение и распределение; б) концентрации
и формы нахождения; в) метаболические процессы; г) дефицитность и
токсичность; д) взаимодействие.
Основными источниками химических элементов для растений являются
почва и атмосфера.
Для нормального роста и развития растениям требуется
сбалансированное минеральное питание. Минеральные вещества в растениях могут играть
роль структурных компонентов растительных тканей, катализаторов
различных реакций, регуляторов осмотического давления, компонентов
буферных систем и регуляторов проницаемости мембран (Крамер, Козловский,
1983).
Минеральные вещества поглощаются из почвы вместе с водой и
транспортируются в восходящем направлении преимущественно по ксилеме.
Соотношение отдельных химических элементов в ксилемном соке и в почве
значительно различается. Из этого следует, что поглощение минеральных
веществ клетками корня - процесс избирательный. Минеральные вещества
154
обычно накапливаются в тех клетках, где в них возникает потребность.
Такая избирательность регулируется как мембранами, которые окружают
протопласт, вакуоль и клеточные органеллы, так и находящимися в них
ионными насосами, действующими за счет метаболической энергии (Гэлстон и
др., 1983). Следовательно, количественно-качественные особенности
элементного химического состава различных тканей и частей растений имеют
свое функциональное обоснование.
Поглощение минеральных веществ через корни включает: а)
передвижение ионов из почвы к поверхности корней; б) накопление в клетках
корней; в) движение из них в ксилему; г) выделение в ксилемный сок, с которым
они перемещаются в листья с транспирационным током (Крамер,
Козловский, 1983). Поглощение ионов осуществляет в основном молодая часть
корня. Движение ионов в почве к корням происходит путем диффузии и
массового перетекания в направлении к поверхности корней интенсивно транс-
пирирующих растений. Движение элементов из почвы внутрь корня
происходит через клеточные стенки. Основным барьером для ионов в молодых
корнях является эндодерма, так как пояски Каспари на ее радиальных
стенках делают корни относительно непроницаемыми для воды и растворенных
в ней веществ. Поясок Каспари состоит из одного слоя клеток, в оболочке
которых имеется субериновая перемычка, перекрывающая ионам путь по
апопласту (свободному пространству) и направляющая их в симпласт
(протопласты соседних клеток, соединенных плазмодесмами), где происходит
избирательное поглощение клеточными мембранами.
По свободному пространству ионы движутся неизбирательно,
необратимо и независимо от метаболизма. Поглощение солей растительными
клетками избирательно и зависит от метаболитической активности.
Поглощение ионов клетками во многом зависит от избирательно действующего
механизма активного транспорта. Согласно теории переносчиков,
объясняющей активный транспорт через клеточные мембраны, ионы образуют на
наружной поверхности мембран соединения с особыми молекулами,
получившими названия переносчиков, почти такие же, как ферменты, где они
вступают во временные соединения с молекулами субстратов. Образовавшийся
комплекс может перемещаться через мембраны, непроницаемые для ионов.
На внутренней стороне мембран ионы отделяются от переносчиков и
передвигаются в вакуоль и другие части внутреннего пространства клетки (Либ-
берт, 1976). Избирательность транспорта ионов контролируется различной
способностью переносчиков образовывать комплексы с разными ионами.
В ксилему таким образом попадают преимущественно физиологически
важные химические элементы в благоприятных для растений пропорциях.
Балластные и избыточные ионы задерживаются корнями (Либберт, 1976;
Крамер, Козловский, 1983; Ильин, 1985). В листьях ионы переходят из апо-
пласта в симпласт, т.е. происходит очередное избирательное поглощение
элементов через клеточную мембрану. Наряду с активным транспортом
через мембрану происходит и пассивный. Эти два вида транспорта могут
наблюдаться на разных участках мембраны.
Некоторые ионы могут влиять на поглощение и транспорт других
ионов. Например, повышенные концентрации рубидия (Rb+) во внешнем
растворе снижают поглощение калия и наоборот. Сходные явления
наблюдаются и для следующих пар элементов: калий-кальций, калий-магний, желе-
155
зо-марганец и др. Таким образом, эти элементы действуют как взаимные
антагонисты. Вероятно, определенные группы ионов "конкурируют" за
специфические участки находящегося в мембране переносчика (Гэлстон и др.,
1983; Крамер, Козловский, 1983; и др.).
Элементы минерального питания находятся в растении в различных
состояниях: в растворе, в адсорбированном вид В нормальных условиях в
составе биополимеров сосредоточена основная часть минеральных элементов.
В растении элементы могут находиться в мобильной (ионной) и связанной
формах. Например, азот и сера находятся в основном в связанной форме (в
биополимерах), тогда как калий и натрий - в виде ионов (Ильин, 1985).
В результате метаболического обмена возможен переход элементов из
связанного состояния в менее закрепленное. Вероятно, это явление и лежит
в основе реутилизации элементов-биофилов, переброски из зоны с
неактивной жизнедеятельностью в зону роста. С этой точки зрения подвижными
элементами являются азот, фосфор, калий, натрий, магний, сера, а
малоподвижными - кальций, железо, марганец, цинк, медь и др. (Сабинин, 1971;
Ильин, 1985).
Благодаря довольно полной разобщенности флоэмного и ксилемного
тока веществ генотипические пропорции химических элементов наиболее
тщательно поддерживаются в репродуктивных органах, что, по мнению
В.Б. Ильина (1985), является эволюционным приспособлением для защиты
проростка-гетеротрофа от излишних минеральных компонентов и
косвенным способом передачи информации о видовых особенностях элементного
химического состава.
Все организмы в процессе длительной эволюции в условиях
окружающей среды сложного химического состава выработали механизмы
активного селективного извлечения необходимых элементов и выведения за
пределы организма и экосистемы токсичных избытков. Эти процессы - основа го-
меостаза.
Поглощение рассеянных элементов корнями растений может быть
пассивным (неметаболическим) и активным (метаболическим). Пассивное
поглощение происходит путем диффузии ионов из внешнего раствора в
эндодерму корней. При активном поглощении необходимы затраты энергии
метаболических процессов и оно направлено против химических градиентов.
В поглощении микроэлементов корнями растений участвует несколько
процессов: а) катионный обмен между почвой и корневой системой; б) перенос
внутри клеток хелатообразующим веществом или другим носителем; в)
действие ризосферы.
Содержание подвижных соединений элементов в почвах определяют
реакция среды, окислительно-восстановительные условия,
гранулометрический состав и состав гумуса. Подвижность многих рассеянных элементов,
прежде всего тяжелых металлов, резко уменьшается при переходе от
кислого интервала в щелочной. Поэтому в растениях на нейтральных или
слабощелочных почвах низкое содержание тяжелых металлов будет
определяться в первую очередь пониженной их растворимостью, способствуя тем
самым их концентрированию из-за заторможенного в условиях
микроэлементного дефицита продукционного процесса.
Ионы многих металлов (среди которых широко представлены тяжелые
металлы) представляют собой сильные комплексообразователи и в биоло-
156
гических средах могут присоединять нейтральные молекулы, образуя более
сложные комплексные соединения. Ион металла, как правило
положительно заряженный, является центральным ионом комплекса, а вокруг него в
непосредственной близости координировано несколько положительно
заряженных ионов или нейтральных молекул, которые называют лигандами.
Они формируют внутреннюю координационную оболочку, или сферу.
Часть ионов может притягиваться к центральному иону за пределами
внутренней сферы, образуя внешнюю сферу. Общее число лигандов, входящих в
состав сферы, называют координационным числом. В качестве лигандов,
участвующих в формировании металлоорганических соединений, могут
быть самые различные органические и неорганические соединения или
ионы, имеющиеся в биологических средах. Степень сродства металла и этих
соединений при образовании комплексов выражают в виде логарифмов
констант связывания. Особую роль в образовании комплексных соединений
металлов с органическими молекулами играет хелатный эффект, когда лиганд
имеет две группы или более, способные к комплексообразованию. Многие
биологически активные соединения в организмах, содержащие тяжелые
металлы, построены по этому типу (Трахтенберг и др., 1987).
Растения довольно легко поглощают ионы, хелаты и комплексные
соединения тяжелых металлов из почвенных растворов. Главный путь
поступления тяжелых металлов из почвы - их абсорбция корнями. В системе
растение-почва действует следующая генерализованная схема процессов
поглощения элементов, которое: а) происходит при низких концентрациях в
растворе; б) зависит от концентрации в растворе; в) определяется видом
растения и стадией развития; г) зависит от температуры,
окислительно-восстановительного потенциала, кислотности и аэрации почв; д) осуществляется
избирательно; е) происходит (для некоторых ионов) в направлении,
противоположном градиенту их концентрации в почве.
Поглощение тяжелых металлов ассимилирующими органами (фолиар-
ное) происходит двумя путями:
1. Неметаболическое проникновение через кутикулу (основной путь фо-
лиарного поглощения);
2. Поглощение в результате метаболических процессов. Эта группа
процессов ответственна за перенос ионов через плазматические мембраны и в
протоплазму клеток;
Для оценки обогащенности растений может быть использован
коэффициент обогащенности (Коб). Этот коэффициент представляет собой
отношение содержания исследуемого (сравниваемого, Сх) и опорного (Коп)
элементов в исследуемой системе по отношению концентраций тех же элементов в
системе, играющей роль исходной (Соп) и опорной (KJ (Кист, 1987):
об~ Г V '
Высокие значения коэффициентов обогащенности для некоторых
элементов в растениях являются доводом в пользу существенной роли аэраль-
ного питания в формировании химического состава растений (Немерюк,
1964; Голенецкий, 1983; Голенецкий и др., 1981; Яценко-Хмелевская,
Цибульский, Миляев, 1994), причем большое значение имеют аэрозольные и
парогазовые фазы. В формировании парогазовой и аэрозольной фаз боль-
157
шое значение могут иметь и сами растения. Экстремально высокими
значениями коэффициента аэральной обогащенности характеризуются
компоненты экосистемы (растения, почвы и др.), обладающие развитой
поверхностью, значительными сорбционными способностями и в максимальной
степени контактирующие с атмосферой.
Перенос тяжелых металлов в высших растениях зависит от
деятельности сосудистых тканей (флоэмы и ксилемы) и связан с интенсивностью
транспирации. Для переноса тяжелых металлов наиболее важны хелатооб-
разующие лиганды. Подвижность тяжелых металлов в растительных тканях
определяют рН, окислительно-восстановительный потенциал, конкуренция
между элементами, гидролиз, полимеризация, образование нерастворимых
солей, вид растения, фаза развития. Накопление и иммобилизация тяжелых
металлов в корнях растений - обычное явление, особенно при достаточном
поступлении.
Многочисленные результаты исследований и экспериментов по
поглощению тяжелых металлов растениями позволяют утверждать, что наиболее
достоверные методы установления доступности тяжелых металлов в
почвах - методы выявления взаимосвязей между концентрацией тяжелых
металлов в почвенных растворах (а не в твердой фазе) и в растениях.
Несмотря на успехи аналитической химии имеются единичные данные о
природных особенностях распространенности в наземных экосистемах
редкоземельных элементов (лантаноидов). Так, Бернд Маркерт и Цанг Де Ли
(Markert, Zhang De Li, 1991) определяли методом ICP-AES (атомно-эмиссион-
ной спектрометрии с индуктивно связанной плазмой) редкоземельные
элементы (La, Се, Рг, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Y) в различных
видах растений (Betula alba, Pinus sylvestris, Vaccinium vitis-idaea, V. myrtillus,
Deschampsia fiexuosa, Polytrichum sp., Sphagnum sp.) и различных почвенных
горизонтах лесных экосистем северо-западной Германии. Природные
концентрации лантаноидов в растениях представлены в табл. 6.1. Соотношение
этих элементов в системе растение-почва было в пределах 0,04-0,09.
Цанг с соавторами (Zhang et al., 1997) использовали этот же метод для
определения редкоземельных элементов (лантаноидов), а также скандия
(Sc) и иттрия (Y) в аборигенных лесных растениях, почвах и горных породах
о-ва Шикоку (Япония). Выявлено, что растения обладают определенной
емкостью для аккумуляции редкоземельных элементов, которая зависит от
жизненной формы растений и изменяется в соответствии с содержанием
редкоземельных элементов в почвах. Наиболее высокой концентрацией
редкоземельных элементов выделялся Phytolacca L., представитель
семейства Phytolaccaceae.
В целом оказалось, что растения характеризуются низким уровнем
аккумуляции редкоземельных элементов и потому являются эффективным
барьером против их перемещения по пищевым сетям в экосистемах.
Травянистые растения аккумулируют редкоземельных элементов больше, чем
древесные, листопадные больше, чем вечнозеленые, устойчивые к
загрязнению металлами больше, чем неустойчивые. Не установлены тесные связи
между концентрацией редкоземельных элементов и возрастом
ассимилирующих органов.
Цанг с соавт. (Zhang et al.; 1997) утверждают, что содержание
редкоземельных элементов в растениях связано с их концентрациями в почвах,
158
Бернд Маркерт и Цанг Де Ли (Markert, Zhang de Li, 1991) применительно к
таежным растениям отрицают такие связи.
Внутри растения тяжелые металлы распределяются неравномерно: в
наибольшем количестве они аккумулируются в подземных и
ассимилирующих органах, в наименьшем - в органах запасных ассимилятов и семенах.
Это обусловлено несколькими причинами, прежде всего аттагирующей
способностью органа и локальным накоплением в результате перехода в
малоподвижную форму.
Перераспределение поглощенных растениями элементов в почвенном
профиле может происходить в связи с пространственным несовпадением зон
поглощения и высвобождения, т.е. вертикальной асимметрией зон фитопог-
лощения и возврата элементов (Фокин, 1999). Так, в лесных экосистемах
наиболее интенсивные биогеохимические циклы протекают в системе
фитоценоз (биоценоз) <± подстилка (Никонов, Лукина, 1994). В то же время
установлено, что цинк, кадмий, ртуть и цезий, поступившие в наземные
органы растений в форме водорастворимых солей, на 40-80% могут
включаться в метаболизм и перераспределяться по растению. От 25 до 90% от
общего количества поглощенного растением элемента переходит из наземных
органов в состав корней, до 15% 137Cs спустя 7 суток обнаруживалось в
составе корневых выделений. В ряде случаев повышенное проникновение
некоторых тяжелых металлов в почву на значительную глубину при наличии
сильных биогеохимических барьеров для нисходящей внутрипрофильной
миграции можно объяснить действием именно этого механизма (Фокин,
1999).
Токсичность и толерантность
Известно, что при недостаточном поступлении некоторых элементов
жизнедеятельность организмов угнетается. В определенном интервале организм
развивается нормально, а при избыточном поступлении химических элементов
вновь наблюдается угнетение процессов жизнедеятельности, и, наконец, при
очень больших концентрациях элементов организм гибнет. Все эти процессы
попытался проиллюстрировать Бовен (Воwen, 1960) (рис. 6.1, а). В это
представление А.А. Кистом (1987) внесены изменения на основе учения о биотиках
(Венчиков, 1962), рассматривающего химические элементы при определенных
концентрациях как неспецифические стимуляторы. Асимметрия кривой на
рис. 6.1, б отражает способность организмов лучше "справляться" с избытком
химических элементов, чем с его недостатком. Вначале концентрация
элемента в организме растет с увеличением его концентрации во внешней среде. По
достижении определенных уровней рост концентрации в организме
замедляется в результате включения защитных механизмов, и организм стремится
утилизовать все меньшую долю поступающего элемента. Впоследствии
наблюдается либо незначительный дальнейший рост концентрации, либо его
прекращение и сохранение постоянства, либо новое резкое, но кратковременное
увеличение концентрации. Во всех этих случаях отмечаются выраженные
физиологические нарушения и, наконец, гибель организма.
Метаболические нарушения в растениях вызываются главным образом
избытком микроэлементов. Возможные типы реакций представлены в
табл. 6.2.
159
.1
L
2
3
4
5
6
6'
\l
7
1
^_
^
Уровень поступления
Рис, 6.1. Две возможные схемы описания влияния изменения уровня поступления
химического элемента на организм (по: Кист, 1987)
а - традиционная схема: 1 - нет роста; 2 - существенный дефицит; 3 - угнетенный дефицит;
4 - оптимальный интервал; 5 - избыточное потребление; 6 - токсичность; 7 - летальность;
б - измененная схема: 1 - летальный дефицит; 2 - парабиотический дефицит; 3 -
патологический дефицит; 4 - оптимальное поступление; 5 - неспецифическая стимуляция; 6 -
патологический избыток; 6 - парабиотический избыток; 7 - летальный избыток
Ряды тяжелых металлов по степени токсичности для растений хорошо
коррелируют со следующими факторами: а) электропроводностью
двухвалентных ионов; б) растворимостью сульфатов; в) устойчивостью хелатов;
г) биологической доступностью.
Толерантность к тяжелым металлам проявляют, как правило, либо
виды растений, способные произрастать в областях с сильным загрязнением,
либо отдельные растения, способные выжить при более высоких
концентрациях элементов по сравнению с другими.
Может наблюдаться как высокоспецифичная, так и групповая
толерантность к тяжелым металлам. Известны семейства высших растений, виды
которых обнаруживают толерантность к микроэлементам: Caryophyllaceae
(гвоздичные), Cruciferae (крестоцветные), Сурегасеае (осоковые), Роасеае
(злаковые), Leguminosae (бобовые).
Выделены внешние факторы, определяющие толерантность растений к
тяжелым металлам: 1) низкая растворимость; 2) низкая подвижность
катионов в окружающей корни среде; 3) антагонистические взаимодействия
металлов.
Истинная толерантность растений к действию тяжелых металлов не
представляет собой единый механизм, а включает несколько метаболиче-
160
ских процессов (Кабата-Пендиас, Пендиас, 1989; Барсукова, 1997): 1)
селективное поглощение ионов; 2) пониженную проницаемость мембран или
другие различия в их структуре и функциях; 3) иммобилизацию ионов в
корнях, листьях и семенах; 4) удаление ионов из метаболических процессов
путем отложения (образования запасов) в фиксированных и (или)
нерастворимых формах в различных органах и органеллах; 5) изменение
характера метаболизма; 6) адаптацию к замещению физиологически важного
элемента токсичным в энзиме; 7) удаление токсичных ионов из растений
при вымывании через листья, соковыделении, сбрасывании листьев и
выделении через корни.
Выявление пороговых концентраций химических элементов, выше или
ниже которых проявляются определенные биологические эффекты на
целом организме, приобретает большое значение (Ковальский, Андрианова,
1970). Пороговые концентрации имеют видовую и индивидуальную
специфику. В процессе приспособления к геохимической среде организмы
вырабатывают физиологические механизмы регулирования функций. Это
следующие системы: а) депонирования; б) выделительные; в) барьерные; г)
распределения между органами и тканями; д) синтеза биологически активных
соединений. Однако существуют пределы концентраций химических
элементов, с которыми не могут справиться регулирующие системы.
Несмотря на высокое разнообразие геохимических ситуаций на Земле
сравнительно немного территорий с острой нехваткой или токсичным
избытком химических элементов для растений в почвах. Ведущая роль при
этом принадлежит подвижным формам рассеянных элементов. Обычно
выявляются тесные зависимости между содержанием подвижных форм
элементов в корнеобитаемом слое почв и аккумуляцией их в растительных
тканях.
При значительных концентрациях рассеянных элементов в среде
обитания возможна глубокая трансформация структуры растительного покрова:
его основу составляют толерантные виды. По мнению А.П. Виноградова
(1957) на почвах геохимических аномалий возможно произрастание двух
групп растений: 1) концентрирующих рассеянные элементы в силу их
повышенного содержания в почве; 2) поглощающих большое их количество
вследствие генетически закрепленной потребности.
В природных растительных сообществах наибольшую толерантность к
избытку рассеянных элементов проявили лишайники, что объясняется
особенностями морфологического строения (возможностью задерживать
большое количество пылеватых частиц) и низким уровнем метаболизма. Среди
высших растений эти свойства проявляют представители однодольных
(Кабата-Пендиас, Пендиас, 1989).
Защитными механизмами неспецифической природы в растениях,
позволяющими утилизовать избыток рассеянных элементов, прежде всего
тяжелых металлов, являются: а) адсорбция избыточных ионов на стенках
клеток; б) перекачка ионов в вакуоли; в) перевод тяжелых металлов в органо-
минеральные комплексы.
Выявлены и систематизированы следующие внешние и внутренние
защитные приспособления растений к высоким концентрациям тяжелых
металлов в почвах (табл. 6.3). Выявленные взаимосвязи между химическим
составом живых организмов и окружающей среды, а также многочисленные
6. Рассеянные элементы л ^л
данные состава организмов позволяют заключить, что толерантность
организмов к изменению физиологических состояний и химического состава
окружающей среды зависит от среднего содержания элемента в организме,
которое, в свою очередь, является функцией положения элемента в
периодической системе (Кист, 1987). Утвердилось представление о росте токсичности
металлов с увеличением их относительной атомной массы. Показано также,
что способность организмов адаптироваться к изменению содержания
химических элементов в окружающей среде тем выше, чем большими
вариациями по отношению к этим элементам характеризуется внешняя среда.
Известно, что вариации рассеянных элементов существенно больше,
чем макроэлементов, поэтому в относительном выражении такие
элементы, как калий и натрий, будут существенно более токсичны, чем ртуть,
мышьяк, сурьма и др., поскольку в первом случае достаточно сотых и
тысячных долей элемента от природного содержания в организме, тогда как во
втором требуется сто-тысячекратное превышение над естественной
концентрацией.
На основе таких представлений о взаимосвязях химического состава
организмов и окружающей среды А.А. Кист (1987) сформулировал
концепцию концентрационных интервалов. Основные положения этой концепции
заключаются в следующем.
Широко известно, что в нормальных (фоновых) физиологических и
биогеохимических условиях содержание элемента в окружающей среде и в
организмах в целом колеблется в пределах средних значений. Это могут быть
природные вариации: короткопериодические, суточные, сезонные,
возрастные и т.д., а также вариации, вызванные внешними воздействиями. Общим
в этой закономерности является увеличение интервалов варьирования с
уменьшением средней концентрации элемента, степени однородности
выборки и степени организованности объекта. Таким образом, каждая
экосистема и ее отдельные компоненты характеризуются определенными
концентрационными интервалами и эти колебаниями не связаны с какими-либо
серьезными нарушениями.
Несколько большим интервалом колебаний химического состава
характеризуются экосистемы и их компоненты при патологических состояниях
организмов, экстремальных внешних воздействиях, в том числе
экстремальных изменениях биогеохимической обстановки. И, наконец, существует еще
один интервал, включающий оба предыдущих и ограниченный линией
летальных кратностей концентраций элементов в организмах и окружающей
среде, с одной стороны, и летальным дефицитом, с другой.
Таким образом, для любой экосистемы и организмов, входящих в ее
состав, возможны по меньшей мере три концентрационных интервала.
Интервал нормальных концентраций включает вариации состава
окружающей среды и физиологические вариации состава организмов, не
вызывающие патологических состояний. В пределах этого интервала нормально
функционируют гомеостатические процессы.
Интервал патологических концентраций включает вариации,
связанные с патологическими состояниями. Это стрессовый интервал или
предельная нагрузка для нормальных гомеостатических процессов.
Интервал парабиотических концентраций - интервал вариаций
состава при критических патологических процессах в организмах или критиче-
162
ского избытка или недостатка элемента (элементов) во внешней среде.
Достижение этого интервала вызывает гибель отдельных организмов или
всего биоценоза и трансформацию или деградацию экосистемы.
В идеальном случае границы интервалов (в предположении их
симметричности относительно линии средних значений) можно выразить так:
lgA = ±£(A-lgC),
где К- степень организованности организмов (совершенства, однородности
выборки); А - способ выражения концентрации элемента (элементов): А =
2 при выражении концентрации в весовых %; А = 1 - в долях от единицы; А
= 6 - в мг/кг.
Из рассмотренной концепции следует, что организмы существенно более
толерантны к изменению содержания во внешней и (или) внутренней среде
микро- и ультрамикроэлементов (рассеянных элементов) и исключительно
чувствительны к изменению содержания конституционных или
макроэлементов, причем толерантность уменьшается с увеличением степени
организованности организмов и экосистем. Это отражает увеличение специфичности
роли химических элементов и степени совершенства гомеостатических
механизмов по мере эволюции организмов к изменению окружающей среды.
Таким образом, четко разделить рассеянные элементы на токсичные и
жизненно необходимые невозможно, поскольку соответствующие эффекты в
известной степени зависят от дозы (Ильин, 1985,1991; Смоляр, 1989).
Расхождение в оценке физиологической значимости рассеянных элементов отражает
современное состояние наших знаний. Если присутствие тяжелых металлов в
биосферных процессах обосновано, то будет правильнее говорить не о
токсичных элементах, а о токсичных для организмов (растений) концентрациях.
Взаимодействие элементов, синергизм и антагонизм
Дефицит и избыток химических элементов оказывают влияние на
стабильность химического состава организмов. На основании ряда
исследований выявлено, что взаимодействия между макро- и рассеянными
элементами в системе почва-растение характеризуются как антагонистическими, так
и синергетическими эффектами (табл. 6.4). Вместе с тем характер этих
взаимодействий между элементами в большинстве случаев оказался
непостоянным. Поскольку оценить этот процесс количественно достаточно сложно,
В.Б. Ильин (1991) предполагает, что если содержание элемента в почве не
превышает токсическую норму, отклонения концентраций остальных
элементов в растениях от нормы будут несущественными.
По мнению А. Киста (1987) рассмотрение синергизма и антагонизма
целесообразно в интервале только нормальных концентраций. Автор
полагает, что в условиях отсутствия резкого изменения окружающей среды
выявляются следующие тенденции "чистого", или "физиологического",
синергизма или антагонизма элементов в биосфере.
Малые подгруппы. Крайние элементы малых подгрупп следует считать
внутригрушювыми антагонистами, а средние - индеферентными. Первые
элементы малых групп можно разделить на две категории, между
которыми могут быть антагонистические отношения. Элементами первой группы
являются скандий, марганец, железо, никель, кобальт; второй - титан,
возможно, ванадий, хром, медь, цинк.
Большие подгруппы. Явления синергизма или антагонизма внутри
больших подгрупп характеризуются антагонизмом элементов, лежащих на
разных плечах параболы распространенности. Для первой подгруппы в
качестве синергистов выступают литий и натрий; антагонистичны этим элементам
калий, рубидий, цезий.
Явления синергизма или антагонизма между большими группами
прослеживаются достаточно четко. Возможно считать синергетичными
элементы I, III, V, VII групп, антагонистичные элементам II, IV, VI групп.
Синергетичными оказываются элементы с нечетным числом неспаренных
электронов для нечетных групп (1 для первой, 1 для третьей, 3 для пятой, 1
для седьмой) и с четным или равным 0 числом таких электронов для четных
подгрупп (0 для второй, 2 для четвертой, 2 для шестой). Такое поведение по
мнению Киста (1987) можно объяснить способностью элементов с
нечетными числами неспаренных электронов образовывать друг с другом прочные
соединения.
С точки зрения строения электронных оболочек предположительно си-
нергистами будут I, II, IV, V и VI малые подгруппы и I, III, V, VII большие
подгруппы. Они же будут антагонистичны элементам остальных подгрупп.
Взаимодействие между элементами в химическом составе растений
может быть антагонистическим или синергическим, и его несбалансированные
реакции могут служить причиной химических стрессов. Антагонизм
возникает, когда совместное действие двух или более элементов меньше суммы
действия элементов, синергизм - когда совместное действие больше. Эти
взаимодействия можно связать со способностью одного элемента ингибиро-
вать или стимулировать поглощение других элементов растениями. Эти
реакции могут происходить в среде, окружающей корни растений, на
поверхности мембран и внутри клеток.
Кальций, фосфор, магний - главные антагонистические элементы в
отношении поглощения и метаболизма рассеянных элементов. Среди
рассеянных элементов наибольшее число антагонистических реакций наблюдалось
для железа, марганца, меди, цинка, что, по-видимому, связано с их ключевой
ролью в физиологии растений. Антагонистические отношения к этим
элементам чаще всего проявляют хром, молибден, селен.
Синергическое взаимодействие между рассеянными элементами
(тяжелыми металлами) обычно не наблюдается.
По степени накопления химических элементов все растения могут быть
разделены на неадаптированные и адаптированные (Петрунина, 1974).
Первые не переносят повышения концентрации в окружающей среде, вторые,
напротив, приспособлены к этому. Адаптированные растения, в свою
очередь, подразделены на две группы: растения, концентрирующие элементы в
надземных органах, и растения, их не концентрирующие. Растения,
концентрирующие химические элементы, могут быть привычными и
непривычными концентраторами. Привычные концентраторы всегда содержат
повышенное количество определенных элементов, даже если окружающая среда
бедна ими. Непривычные концентраторы обогащены элементами только
тогда, когда их много в этой среде.
Таким образом, неадаптированные растения обладают
незначительными защитными возможностями при избыточности химических элементов в
окружающей среде. Адаптированные растения, напротив, имеют достаточ-
164
но сильные защитные барьеры, располагающиеся преимущественно в
подземной части (у растений, не концентрирующих элемент) или в наземных
органах (у растений, концентрирующих элемент). При этом под
концентрацией элемента в растении (органе, ткани или клетке) подразумевается его
поступление против градиента концентрации, требующее затраты энергии.
Процесс же повышенного содержания избыточных в окружающей среде
элементов в растении (органе, ткани или клетке) корректнее рассматривать
как пассивное выравнивание концентраций между средой обитания и
растениями (Ильин, 1985).
6.2. ВОЗДУШНОЕ ЗАГРЯЗНЕНИЕ
Вокруг индустриальных предприятий (горнометаллургические,
горнодобывающие, нефтеперегонные), крупных городов, дорожных магистралей, в
устьях рек и по берегам морей и океанов возникают техногенные аномалии
рассеянных элементов. Они могут быть разделены на литохимические
(почвы, породы, строения), гидрогеохимические (воды), атмогеохимические
(атмосфера), биогеохимические (организмы). Совокупность техногенных
аномалий загрязнения вызывают нарушения и разрушения природных и
искусственных экосистем, заболевания человека, поскольку концентрации
многие рассеянные элементы в экосистемах отдельных регионов
приближаются к токсичному уровню.
Техногенную миграцию определяют две группы процессов (Перельман,
1989). Первая группа унаследована от биосферы: биологический
круговорот, круговорот воды, рассеяние элементов в результате импульверзации,
вулканических извержений и др. Вторая группа находится в резком
противоречии с природными условиями. Это - металлическое состояние некоторых
элементов (Fe, Ni, Cr, Cu, V и др.), не соответствующее физико-химическим
условиям земной коры, производство химических соединений,
отсутствующих в биосфере, производство атомной энергии, радиоактивных изотопов,
сверхчистых веществ.
Загрязнение атмосферы происходит как в результате природных
процессов (эоловая пыль, вулканические извержения, испарение с поверхности
воды, транспирация растениями и др.), так и антропогенной деятельности
(сжигание горючих ископаемых, выплавка металлов, использование
удобрений и ядохимикатов в сельском хозяйстве и др.).
Основные источники техногенных загрязнений почв рассеянными
элементами: а) теплоэлектростанции (сжигание ископаемого топлива и
золоотвалы); б) металлургические комбинаты по добыче и переработке
руд тяжелых металлов; в) автомобильный транспорт; г) минеральные
удобрения и химические средства защиты от вредителей и болезней в
сельском хозяйстве.
Главными характеристиками загрязнения атмосферы рассеянными
элементами являются следующие: 1) промышленные выбросы в атмосферу,
рассеивающиеся на значительных территориях и переносящиеся на
значительные расстояния. Размеры зоны рассеяния определяются концентрацией
твердых частиц в выбросах и высотой заводских труб; 2) биоаккумуляция в
организмах (прежде всего в растениях) без видимых повреждений; 3) воздей-
165
ствие на живые ткани путем нарушения метаболических процессов; 4)
устойчивость к детоксикации при метаболизме, следствием чего является
вхождение рассеянных элементов в пищевые цепи.
Реальность загрязнения биосферы соединениями рассеянных элементов
обусловлена прежде всего их устойчивостью во внешней среде,
растворимостью в атмосферных осадках, способностью к сорбции почвой, зелеными
насаждениями, донными отложениями, что в совокупности и приводит к
постепенному накоплению в среде обитания человека. Согласно прогнозам и
оценкам в будущем рассеянные элементы могут стать более опасными
загрязнителями, чем отходы атомных электростанций и органические
вещества, и выйти на первое место или, в крайнем случае, разделить его с
пестицидами (Ревич, 2001).
К тяжелым металлам относятся свыше 50 химических элементов с
относительной плотностью более 5 г/см3. Техногенное воздействие, существенно
изменившее природные биогеохимические циклы, повсеместно
сопровождается полиэлементной химизацией (металлизацией) в цепи: источники
выбросов (выбросы, отходы, стоки) -> транспортирующие (атмосфера,
гидросфера) и депонирующие (почва, донные отложения) среды —> экосистемы —>
организмы.
Многочисленные данные свидетельствуют о формировании
техногенных биогеохимических провинций, загрязненных тяжелыми металлами,
вокруг предприятий по их добыче и переработке при высокотемпературных
технологических процессах (металлургии, обжиге цементного сырья и др.),
однако значительно больше металлов поступает в биосферу с выбросами от
теплоэнергетических установок (прежде всего, сжигание углей). Эти
предприятия обусловливают общепланетарный процесс обогащения биосферы
тяжелыми металлами (Трахтенберг и др., 1987).
В связи с ростом экологических исследований большое значение
получили классификации элементов по степени токсичности, прежде всего
приоритетных загрязнителей. В 1973 г. к приоритетным загрязнителям
относились свинец, кадмий и ртуть, в 1980 г. к ним были добавлены медь, олово,
ванадий, хром, молибден, марганец, кобальт, никель, сурьма, мышьяк и селен.
Разработана и более детальная классификация загрязнителей (табл. 6.5).
Бовен (Bowen, 1966) полагает, что каждый элемент, скорость добычи
которого превысит в 10 раз его скорость в природных биогеохимических
циклах, следует рассматривать как потенциальный загрязнитель. В таком
случае в настоящее время для биосферы опасны серебро, золото, кадмий, хром,
ртуть, мараганец, свинец, сурьма, олово, теллур, вольфрам и цинк.
Поглощение элементов
Загрязнение растений рассеянными элементами происходит при
техногенном воздействии за счет поверхностного загрязнения, а также фолиарно-
го и почвенного поглощения. При длительном воздушном загрязнении
оценка поступления рассеянных элементов в растения осложняется аддитивным
влиянием большого и постоянно увеличивающегося запаса этих элементов
в корнеобитаемом слое почвы. При избытке многих рассеянных элементов
в почвах могут проявляться признаки угнетения растений. На загрязненных
территориях накопление рассеянных элементов в растениях зависит от запа-
166
сов доступных соединений и защитных возможностей растительного
организма.
Загрязнение растений рассеянными элементами делится на внешнее
(оседание на поверхности надземных органов) и внутреннее (поступление в
ткани главным образом через корни).
Корневая система препятствует поступлению в растения избытка
рассеянных элементов (Ильин, 1991). В.Б. Ильин (1991) предполагает, что
способность корневой системы растений задерживать избыточные ионы
обусловлена совокупным действием морфологических структур и химических
реакций неспецифической природы, к которым относится поясок Каспари,
обменная емкость корней, многочисленные органические соединения,
формирующие с рассеянными элементами малоподвижные соединения, вакуо-
лярные депо. Они способствуют или механической задержке рассеянных
элементов, или их адсорбции на стенках клеток, или уменьшению их
подвижности, или изоляции.
Различия в насыщении вегетативных и репродуктивных (плодов)
органов растений могут быть обусловлены тем обстоятельством, что
репродуктивная фаза наступает относительно поздно и плоды меньше по времени,
чем вегетативные органы, подвергаются воздействию избыточной
концентрации.
У. Эрнст (Ernst, 1976) выделяет два пути приспособления растения к
высоким концентрациям рассеянных элементов: 1) использование защитных
механизмов для предотвращения накопления этих элементов; 2)
инактивация поступивших в растение элементов, их вывод в менее поражаемые
части, изменение метаболических путей.
В условиях воздушного промышленного загрязнения загрязняются
также поверхности надземных частей растений в результате оседания
загрязнителей. Важную роль в закреплении рассеянных элементов на листьях,
стеблях и других надземных частях играют гутационные выделения (Аржанова,
Елпатьевский, 1990; Елпатьевский, 1993). Полагают, что внешнее
загрязнение менее опасно для растений, чем то, которое осуществляется через
корни, однако внешнее загрязнение может вызывать сокращение притока
солнечной энергии к фотосинтезирующим клеткам, закупорку устьиц, "ожоги"
и другие нарушения, вызываемые кислотообразующими компонентами.
В условиях воздушного загрязнения значительное ускорение
нисходящего перемещения рассеянных элементов может происходить благодаря их
фолиарному поглощению, перераспределению по растению и поступлению
на различную глубину в составе корневых выделений и корневого опада
(Фокин, 1999).
6.3. ПОГЛОЩЕНИЕ ЭЛЕМЕНТОВ
РАСТЕНИЯМИ СЕВЕРОТАЕЖНЫХ ЛЕСОВ
(ПРИРОДНЫЕ И ТЕХНОГЕННЫЕ АСПЕКТЫ)
В бореальных лесах представлены растения двух типов стратегий
питания: 1) поглощающие элементы питания из почв - древесные растения,
кустарнички, травянистые; 2) поглощающие элементы питания из атмосферы -
мохообразные и лишайники. Благодаря функционированию мохообразных
167
и лишайников атмосфера как источник питания используется всем лесным
сообществом, поскольку при разложении опада этих растений элементы
питания, поглощаемые из атмосферы, становятся доступными для растений,
поглощающих элементы питания из почвы. Элементы, вымываемые из
полога древесных растений, используются растениями с атмосферной
стратегией питания. Особую роль в питании растений с корневой стратегией
питания играют органогенные горизонты, способные аккумулировать и
длительное время сохранять наиболее доступные для растений соединения
элементов (Лукина, Никонов, 1998).
Минеральному питанию бореальных растений посвящено множество
работ, однако большая часть проведенных исследований касаются главным
образом макроэлементов и лишь незначительного количества рассеянных
элементов, важная роль которых в питании растений в настоящее время
доказана.
Цель данного раздела - охарактеризовать концентрации широкого ряда
макро- и рассеянных элементов в доминирующих в бореальных лесах
растениях с почвенной (деревья, кустарнички и травянистые растения) и
атмосферной (лишайники и зеленые мхи) стратегией питания в природных
условиях и при техногенном загрязнении.
Объектами исследования послужили хвоя разного возраста сосны и ели,
листья березы, кустарничков черники, брусники и вороники, надземные
части луговика извилистого, а также лишайники рода Cladina и зеленые мхи
Pleurozium schreberi и Hylocomium splendens. Образцы растений отобраны в
условно-фоновых территориях северной (Кольский полуостров), средней
(Карелия, заповедник "Кивач") и южной (Валдай, Валдайский
национальный парк) тайги, на территориях, подверженных медно-никелевому (зоны
воздействия медно-никелевых комбинатов "Североникель" и "Печенгани-
кель") и апатитонефелиновому (зона воздействия ОАО "Апатит")
загрязнению.
В перечисленных растениях определяли концентрации Са, Mg, К, Al, Fe,
Mn, Zn, Ni, Си, S, Sr, P. Химический анализ проводили в Институте проблем
промышленной экологии Севера КНЦ РАН: металлы (Са, Mg, К, Al, Fe, Mn,
Си, Ni, Zn) определяли методом атомно-абсорбционной спектрометрии
после мокрого озоления в концентрированной HN03, P и S - колориметрически.
Образцы перед анализом не отмывали.
Кроме того, в ряде образцов хвои сосны и ели методом эпитеплового
нейтронного активационного анализа на быстром импульсном реакторе
ИБР-2 мощностью 2 Мвт Лаборатории нейтронной физики им. И.М.
Франка Объединенного института ядерных исследований в Дубне анализировали
широкий ряд рассеянных элементов (Sr, Ba, Ti, Rb, Се, La, V, Nd, Cr, Br, As,
Se, Gd, I, Sm, Mo , Cd, Lu, W, Th, Dy, Cs, Sc, Та, Ag, Yb, Eu, Hf, Sb, U, Tb, In,
Hg, Au) (Frontasyeva, Steinnes, 1995; Nazarov et al., 1995). Образцы и
аттестованные стандарты МАГАТЭ облучали с помощью пневмотранспортной
установки РЕГАТА в канале облучения с кадмиевым экраном при плотности
потока эпитепловых и быстрых нейтронов (0,23±0,03) • 1012 и
(1,4±0,16) • 1012, соответственно.
Определение широко ряда рассеянных элементов (Rb, Pb, Cd, Cr, Co, V,
As, Ba, Sr, Sb, Bi, Tl, U, Th, Be, Li, Cs, Mo, Y, La), в растительных тканях хвои
сосны, листьев кустарничков, луговике извилистом и зеленых мхах проводи-
168
ли также методом масс-спектрометрии с индуктивно-связанной плазмой в
Технологическом университете г. Трондхейм, Норвегия (Stennes et al., 2000).
Результаты этих исследований в условиях медно-никелевого загрязнения в
приграничных районах России и Норвегии обсуждены нами подробно ранее.
В этой главе мы не приводим все полученные материалы, а ограничиваемся
общими представлениями.
Растения с почвенной стратегией питания
Сосна (Pinus sylvestris. L.). Макроэлементы. В соответствии с
химическим составом ассимилирующих органов сосну следует отнести к
низкозольным кали-кальцефилам. Концентрация кальция в хвое может достигать 14,
а калия - 12 г/кг. Концентрации элементов в хвое сосны закономерно
изменяются при ее старении (Malkonen, 1974; Митрофанов, 1977; Raitio, 1987;
Helmisaari, 1992; Лукина, Никонов, 1996). Концентрации подвижных
элементов (азот, фосфор, калий и магний) с возрастом хвои снижаются, а
малоподвижных (кальций, алюминий, железо, марганец) возрастают (табл. 6.6).
Следует заметить, что хвоя сосны из северной тайги значительно богаче (р <
0,001) кальцием, а хвоя текущего года и однолетняя - магнием (р
изменяется от 0,04 до < 0,001), по сравнению с хвоей соответствующих возрастных
классов сосны из средней и южной тайги. Эти различия можно объяснить
тем, что почвообразующие породы Кольского полуострова содержат
больше кальция и магния (Манаков, Никонов, 1981; Казимиров, Морозова, 1973).
Не выраженные различия по содержанию магния в хвое сосны последних
лет жизни между регионами, вероятно, обусловлены различиями в
количестве возрастных классов. Поскольку в северной тайге количество
возрастных классов хвои сосны больше, в последнем возрастном классе хвои
концентрация магния снижается до уровня, сопоставимого с соснами из средней
и южной тайги из-за его активной ретранслокации в более молодую хвою.
В условиях загрязнения кислотообразующими агентами и тяжелыми
металлами в хвое сосны последних лет жизни обнаруживается достоверное
снижение концентрации кальция, несмотря на заметно более высокое
содержание этого элемента в почвообразующих породах вблизи комбинатов
(табл. 6.7; Лукина, Никонов, 1996, 1998). Эти тенденции связаны с
замещением кальция протонами, ионами алюминия и тяжелых металлов в
почвенном поглощающем комплексе органогенного горизонта и его
выщелачиванием из хвои кислыми осадками. При более детальном рассмотрении
многочисленных данных на различных расстояниях от источников выбросов нами
было показано достоверное увеличение концентраций фосфора, калия и
азота в хвое сосны у источников загрязнения (Лукина, Никонов, 1996; 1998).
Эта закономерность может быть связана с постоянным опаданием хвои, а не
только в природные фенологические сроки, и постоянной ретранслокацией
подвижных элементов из опадающей хвои в оставшуюся живую.
Рассеянные элементы. Рассеянные элементы накапливаются в хвое
сосны в широком диапазоне концентраций, минимальные концентрации
характерны для лантаноидов, актиноидов, тантала и золота - сотые и тысячные
доли мг/кг (табл. 6.8, 6.9). Для рассеянных элементов, так же как и для
макроэлементов, обнаруживаются закономерные тенденции в изменении
концентраций в ассимилирующих органах по мере их старения.
169
В условиях загрязнения с возрастом в хвое сосны накапливаются многие
микро- и ультрамикроэлементы: литий, алюминий, ванадий, хром, марганец,
железо, кобальт, мышьяк, стронций, иттрий, сурьма, теллур, лантан, свинец,
висмут, уран. Известно, что с возрастом обычно накапливаются элементы,
характеризующиеся низкой степенью подвижности, например такие, как
кальций, марганец, стронций. Однако при загрязнении причиной
накопления микроэлементов - поллютантов с возрастом может быть также
осаждение содержащих их частиц на поверхности хвои.
В хвое сосны у источника загрязнения происходит аккумуляция
элементов, содержащихся в крупных частицах выбросов - железа, кобальта,
никеля и меди. Наблюдается также накопление элементов, высвобождающихся
главным образом в летучей форме в связи с высокотемпературными
процессами и содержащихся в аэрозолях: селен, теллур, мышьяк, молибден,
сурьма, висмут (Steinnes et al, 2000). Источниками последних является медно-ни-
келевый комбинат, кроме того, их концентрация в атмосфере может
увеличиваться в результате сжигания угля в процессе деятельности других видов
производства на территории Никеля и Заполярного. Загрязнение
соединениями свинца связано с активным использованием автотранспорта. В хвое
также увеличивается концентрация ванадия, хрома, таллия и кадмия,
входящих в состав выбросов. Концентрации лития, бериллия, бора и алюминия
существенно не изменялись.
Концентрации рубидия, стронция, цезия, марганца, цинка и бария
снижались, что можно объяснить вытеснением катионов этих металлов ионами
водорода, алюминия, никеля и меди и выносом их из корнеобитаемого
пространства.
Увеличение в хвое сосны концентраций лантана и иттрия в условиях
загрязнения, вероятно, связано с увеличением концентрации данных
элементов в почвообразующих породах (см. главу 4).
Ель сибирская (Picea obovata Ledeb.). Макроэлементы накапливаются
в хвое в разных количествах - от десятков тысяч до сотен мг/кг
(табл. 6.10). Так же как и в хвое сосны, в хвое ели по мере старения
наблюдается снижение содержания подвижных элементов, таких, как N, Р, К, а
также Mg, относящегося к элементам средней подвижности.
Одновременно ткани хвои обогащаются Са, Al, Fe, Mn, которые обычно не реутилизи-
руются. Хвоя ели из северной тайги значительно (р < 0,001) богаче
кальцием и беднее калием, чем хвоя соответствующих возрастных классов сосны
из средней и южной тайги. Повышенные содержания кальция в хвое ели
Кольского полуострова можно объяснить высоким содержанием этого
элемента в почвообразующих породах. Содержание калия в
почвообразующих породах всех трех объектов исследования оказались
сопоставимыми. Поэтому относительно низкие концентрации калия в хвое ели
Кольского полуострова можно объяснить известным антагонизмом между
кальцием и калием при поглощении их елью.
В условиях воздушного загрязнения медно-никелевого производства
наблюдаются значительные изменения в поглощении элементов питания
елью, что отражает состав ассимилирующих органов (табл. 6.11).
Концентрации кальция и магния снижаются (р <^ 0,001) в однолетней и многолетней
хвое, что связано с обеднением основаниями органогенного горизонта
почв - основного источника питания бореальных растений в результате вы-
170
теснения основных катионов из почвенного поглощающего комплекса
протонами и ионами алюминия. Концентрации наиболее подвижных элементов
калия и фосфора, напротив, возрастают (р < 0,001), несмотря на снижение
концентрации доступных для растений соединений этих элементов в почвах,
что отмечалось нами ранее (Лукина, Никонов, 1996, 1998). Данная
тенденция также отмечалась нами для такого подвижного элемента как азот.
Загрязнение апатитонефелиновым производством обусловливает
увеличение концентрации фосфора, калия, серы и алюминия в хвое ели всех
возрастных классов (табл. 6.11). Концентрация магния в многолетней хвое
снижается.
Обогащение хвои ели калием и алюминием и ее обеднение магнием
можно объяснить проявлением антагонизма между элементами (К-А1,
K-Mg), так как верхние горизонты почв обогащаются соединениями всех
этих элементов (см. главу 4).
Рассеянные элементы. Так же как и для макроэлементов, для
некоторых рассеянных элементов обнаруживаются закономерные изменения в их
концентрации по мере старения ассимилирующих органов (см.
табл. 6.10-11). С увеличением возрастного класса хвои происходит
достоверное снижение концентрации Rb и Cs, тогда как концентрации Sr, Ba, Вг,
Sb, La, напротив, возрастали. Для остальных элементов (As, Se, Ag, Sm, Та,
Au, Th) характерно относительно равномерное распределение по
возрастным классам.
Воздушное загрязнение медно-никелевого произвосдтва вызывало
значительное возрастание концентраций поллютантов никеля, меди, железа
кобальта, хрома, мышьяка, молибдена, сурьмы и селена в хвое ели.
Концентрации марганца и цинка, напротив, снижались (р < 0,001), что отмечалось и
при обсуждении результатов других подобных исследований (Lobersli,
Steinnes, 1988: Лянгузова, 1991; Лукина, Никонов, 1992). Увеличение (р<0,05)
концентраций алюминия в хвое ели обусловлено возрастанием его
подвижности в почве (Лукина, Никонов, 1996). Снижение концентраций марганца и
цинка можно объяснить вытеснением катионов этих металлов ионами
водорода, алюминия, никеля и меди и выносом их из корнеобитаемого
пространства.
Загрязнение апатитонефелиновым производством способствовало
существенному обогащению хвои ели всех возрастных классов лантаноидами
и актиноидами (табл. 6.12). В однолетней хвое ели также увеличивалась
концентрация стронция и бария. Данные изменения в составе хвои
соответствуют изменениям, происходящим в почвах (см. главу 4).
Береза пушистая (Betula pubescens). Макроэлементы.
Ассимилирующие органы березы выделяются относительно высоким содержанием
минеральных элементов, достигающим 5,2 % на сухое вещество (табл. 6.13;
Никонов, Лукина, 1994). Концентрация азота может достигать 3,2% на сухое
вещество, из зольных элементов преобладают калий и кальций. От других
исследованных растений бореальных лесов береза отличается высоким
содержанием фосфора.
Наши данные по химическому составу листьев березы, свидетельствуют
о том, что береза, произрастающая в березовых лесах в сухих
местообитаниях на подзолах, аккумулирует достоверно меньше магния и калия и
больше алюминия, железа и марганца по сравнению с березой, растущей в полу-
171
мг/кг
1200
Рис. 6.2. Концентрации Mg, К, Al, Fe, Mn в листьях березы и Zn листьях черники,
растущих на сухих (S - южный градиент) и влажных (N - северный и W - южный
градиенты) местоположениях на территориях с минимальным уровнем загрязнения
гидроморфных и гидроморфных условиях на торфянисто-подзолистых и
торфянисто-глеевых почвах (рис. 6.2).
В условиях медно-никелевого загрязнения в листьях березы наблюдается
возрастание концентрации серы. Тенденции снижения концентрации
кальция и марганца при усреднении всех полученных на загрязненной территории
данных не выражены, однако при более детальном рассмотрении
обнаруживается значительное снижение концентраций кальция и марганца в березе
березовых лесов, произрастающих на подзолах, бедных основаниями вблизи
Заполярного (рис. 6.3). Данные тенденции не выражены на почвах, богатых
основаниями, однако это не дает оснований утверждать, что береза в данных
условиях при воздушном загрязнении не обеднялась кальцием и марганцем,
поскольку мы проводим сравнение с так называемыми фоновыми
объектами, почвы на которых изначально могли быть беднее основаниями.
Рассеянные элементы. В наименьших количествах из микроэлементов
накапливается уран, сурьма, висмут, теллур (тысячные доли мг/кг). Береза
концентрирует значительные количества цинка и кадмия (Steinnes et al.,
2000).
При аэротехногенном загрязнении медно-никелевого производства
наблюдаются сходные с хвойными изменения в концентрации микро- и
ультрамикроэлементов в ассимилирующих органах. Происходит аккумуляция
172
Mn
Рис. 6.3. Концентрации Са и Мп в листьях березы вдоль северного градиента и К в
листьях черники вдоль северного (слева), южного (в центре) и западного (справа)
градиентов
поллютантов, содержащихся как в крупных частицах выбросов (железо,
кобальт, никель, медь), так и в аэрозолях (селен, теллур, мышьяк, молибден,
сурьма, висмут). Увеличивается концентрация ванадия, хрома, таллия,
кадмия и цинка, входящих в состав выбросов. Наблюдается возрастание
концентрации бора и алюминия.
Увеличение концентраций иттрия и лантана может быть обусловлено
повышенным содержанием данных элементов в почвообразующих породах.
Черника (Vaccinium myrtillus L.). Макроэлементы. Характерными
особенностями видов рода Vaccinium является высокое содержание кальция
(табл. 6.14). Эти растения относятся к типичным кальцифагам (Ingestad,
1973). Способность к активному поглощению кальция, вероятно, является
адаптивной реакцией, поскольку обычно виды рода Vaccinium произрастают
на почвах с очень низкой доступностью этого элемента. Многие
исследователи указывают на интенсивную аккумуляцию Мп видами рода Vaccinium
(Левина, 1960; Манаков, 1961; Раменская, 1974; Парибок, 1983). По мнению
Т.А. Парибок (1983), сравнительно большое накопление Мп кустарничками
в подзоне северной тайги связано с его большой доступностью в условиях
кислой реакции почв.
Полученные нами данные подтверждают, что черника и брусника
хвойных лесов северной, средней и южной тайги, также лесотундры (березовые
леса) аккумулируют значительно количество кальция и марганца (см.
173
табл. 6.14-6.15). Кроме того, в чернике следует отметить высокое по
сравнению с брусникой содержание калия и магния. При этом черника и
брусника сосновых и еловых лесах северной тайги аккумулирует значительно
меньше (р < 0,05) магния, чем в хвойных лесах средней и южной тайги. Эти
различия не объясняются различиями в составе почв, поскольку почвы
Кольского полуострова (северная тайга) содержат больше магния.
В условиях загрязнения в листьях черники сосновых и еловых лесов
обнаруживается достоверное (р < 0,05) увеличение концентраций калия и
алюминия, а в еловых лесах также наблюдается снижение концентраций
кальция (табл. 6.15). В березовых лесах тенденции изменения
концентраций кальция, магния, калия и алюминия при усреднении всех полученных
на загрязненной территории данных выражены слабо, однако при более
детальном рассмотрении данных было показано увеличение концентраций
калия в чернике, произрастающей вблизи источников загрязнения (см.
рис. 6.2, 6.3). Черника аккумулирует в листьях заметно больше меди,
никеля, железа и кобальта по сравнению с брусникой. Возможно, это
обусловлено высокой физиологической активностью растущих тканей листа, что
связано с повышенной активностью ферментов, в состав которых входят
микроэлементы.
Рассеянные элементы. Из рассеянных элементов черника аккумулирует
значительное количество мышьяка, которого в ней содержится в 2-7 раза
больше, чем в других видах растений бореальных лесов (Steinnes et al, 2000).
Для черники характерно также относительно высокое содержание теллура
и бора. В условиях загрязнения в листьях черники наблюдается
значительное увеличение концентраций железа, никеля, меди, кобальта, мышьяка,
сурьмы, теллура, свинца и висмута, тогда как концентрации стронция, цезия,
бария снижаются.
Брусника (Vaccinium vitis-idaea L.). Рассеянные элементы. По
сравнению с черникой, брусника отличается низким уровнем концентрации многих
элементов. В листьях брусники, как и в листьях черники, при
аэротехногенном загрязнении выбросами медно-никелевых комбинатов наблюдается
снижение концентраций марганца, цинка, цезия, стронция (табл. 6.16-6.17;
Steinnes et al, 2000). Концентрации никеля, меди, железа, кобальта, сурьмы,
свинца, висмута, напротив, увеличиваются.
Вороника (Empetrum hermaphroditum). Вороника, так же как виды
рода Vaccinium, может быть отнесена к кальцифагам. Листья этого
кустарничка характеризуются также высокими концентрациями железа и низкими -
марганца по сравнению с кустарничками рода Vaccinium (табл. 6.18). При
техногенном загрязнении наблюдается снижение (р < 0,05) концентраций
кальция, магния, марганца, цезия в фотосинтезирующих органах вороники,
тогда как концентрации серы, никеля, меди, железа, алюминия, кобальта,
сурьмы, свинца, висмута, ванадия, хрома, кадмия, теллура, таллия и свинца
возрастают (табл. 6.19; Steinnes et al, 2000).
Луговик извилистый (Deschampsia flexuosa). Луговик извилистый
отличается сравнительно высокой зольностью - 3-3,5% сухого вещества
(Никонов, Лукина, 1994). Из минеральных элементов преобладают калий и
фосфор (табл. 6.20). От других растений, как древесных, так и кустарничков,
луговик отличается низким содержанием кальция и алюминия и высоким -
калия. Концентрации лития, бора, ванадия, железа, кобальта, иттрия, сурьмы,
174
свинца в луговике ниже, чем в других растениях бореальных лесов (Steinnes
et al., 2000).
В условиях загрязнения (Мончегорский градиент) наблюдается
значительное увеличение концентраций поллютантов в фотосинтезирующих
органах: серы - до 1,5 раза, никеля и меди - до 23 раз, железа - до 3 раз по
сравнению с фоновыми условиями (Лукина, Никонов, 1998). При этом также
увеличиваются концентрации алюминия и снижаются (р < 0,05)
концентрации кальция, магния, марганца и цинка (табл. 6.21). Сходные тенденции в
отношении поллютантов наблюдаются в окрестностях комбината "Печен-
ганикель". Обнаруживается снижение концентрации стронция и цезия и
увеличение концентрации никеля, меди, железа, кобальта, сурьмы, свинца,
висмута, кадмия, теллура и свинца (Steinnes et al., 2000).
Растения с атмосферной стратегией питания
Лишайники. Лишайник с биологической точки зрения - это трактуемый
в широком смысле симбиоз двух (или более) генетически обособленных
организмов, основанный на метаболических потребностях одного из них (Го-
лубкова, 1993; Бязров, 2002). Лишайник включает в себя микобионт (гриб),
фитобионт (зеленую водоросль или цианобактерию), слоевище и продукты
метаболизма партнеров. В этой симбиотической ассоциации гриб,
по-видимому, паразитирует либо на зеленой водоросли, либо на цианобактерии
(сине-зеленой водоросли), либо на водоросли и цианобактерии вместе. Эукари-
отическая водоросль и прокариотическая цианобактерия являются фото-
синтезирующими организмами и служат для гриба источником углеводов.
Лишайники разделяют в соответствие с их субстратной специализацией.
Выделяют (Бязров, 2002): 1) эпилиты, т.е. обитающие на выходах горных
пород; 2) эпигеиды, т.е. растущие на почве или грунте; 3) эпифиты, т.е.
растущие на живых органах растений; 4) эпифитореликвиты, т.е. растущие на
мертвом органическом субстрате; 5) эврисубстратные, т.е. обитающие на
разных субстратах.
У сосудистых растений поглощение из почвы воды и питательных
веществ осуществляет корневая система. Поскольку у лишайников корни
отсутствуют, постольку их функционирование в определяющей степени
зависит от снабжения элементами минерального питания, заключенными в
атмосферных выпадениях, взамен почвенных запасов, эксплуатируемых
сосудистыми растениями (Nieboer et al, 1978). Незначительная часть
минеральных элементов питания может поступать из почвы. Экспериментально
показано, что талломы лишайников рода Cladina способны поглощать
минеральные элементы через мертвую часть подециев (Барашкова, 1963,
Нифонтова и др., 1979). Поскольку атмосферные источники минеральных
веществ по сравнению с почвой относительно скудны, решающими для
функционирования лишайников являются механизмы концентрирования
элементов из атмосферы. Атмосферная стратегия питания, свойственная
лишайникам, обусловила их использование как биомониторов для оценки
региональных атмосферных нагрузок и миграции атмосферных
загрязнителей (Puckett, 1988). Были получены свидетельства толерантности ряда видов
лишайников к высоким концентрациям металлов (Викторов, 1960), а также
их способности синтеза чужеродных питательных веществ, которые не мог-
175
ли бы иным образом попасть в экосистему, и включения в
биогеохимические циклы (Бязров, 1970, 2002).
Зольность лишайников, как правило, ниже, чем других растений.
Однако сведения о накоплении лишайниками минеральных элементов в
количествах, намного превышающих их содержание в субстрате, не дают повода
для сомнений в их возможности аккумулировать в своих телах эти
количества (Бязров, 2002). Известен факт, что концентрация меди в лишайниках на
диорите почти в 90 раз превышала этот показатель для субстрата (Nash,
1996). Методом рентгеновского дифракционного анализа была
подтверждена биогенная природа накопления зольных элементов в эпигейном
лишайнике Parmelia chlorochroa, что связано прежде всего с синтезом оксалата
кальция, а не с загрязнением растения частицами почвы (Erdman et al., 1977).
О возможности лишайников концентрировать элементы с низкими
концентрациями (микроэлементы, рассеянные элементы) имеются
противоположные мнения. Лоунамаа (Lounamaa, 1956) утверждает, что концентрация
большинства микроэлементов в лишайниках выше, чем у мохообразных,
папоротников, хвойных, кустарников и трав. Однако есть сведения о низком
содержании всех микроэлементов в лишайниках Запдного Таймыра (Ван-
штейн, 1982) или слоевищах Cladina stellaris из северных районов Канады
(Doyle et al., 1973).
Двумя основными источниками поступления элементов в лишайники
являются атмосферные выпадения и субстрат. Атмосферные выпадения
подразделяются на жидкие (дождь, снег, туман, роса) и сухие (седиментация
аэрозолей и пыли). Как источники минеральных элементов для лишайников
очень важны туман и роса, в которых концентрация этих элементов может
быть существенно выше, чем в дождевых и снеговых водах. Также велика
роль пыли. Выявлена тесная положительная корреляция между
количеством металлов в золе эпилитных, эпифитных и эпигейных лишайников, с
одной стороны, и содержанием их в сухом остатке атмосферных осадков, с
другой.
Эпигейные и эпилитные лишайники тесно контактируют с литосферны-
ми источниками минеральных элементов. Концентрация минеральных
элементов в них может довольно точно отражать геохимические особенности
ареала лишайников (Erdman, Gough, 1977). В то же время лишайники
способны избирательно поглощать те или иные элементы из окружающей среды,
регулируя их концентрацию. Так, представители рода Cladina,
произрастающие в одном регионе на сфагновых торфах, бедных железом, и на
минеральных почвах, богатых железом, имели одинаковый уровень концентрации
этого элемента в слоевищах (Lounamaa, 1965). Выявлено также, что
лишайники, развивающиеся на бедных микроэлементами субстратах,
характеризуются более высоким коэффициентом биологической миграции этих
элементов, чем те, кторые растут на богатых ими субстратах (Торбанов, Хаджиата-
насов, 1973).
Эпифитные, эпигейные и эпилитные лишайники подвержены влиянию
переносимой ветром пыли, источником большей части которой являются
незакрепленные поверхности почвы. Эти почвенные частицы могут легко
внедряться в межклеточное пространство. Растворимые соединения их
являются потенциальным источником элементов минерального питания, но
процесс растворения медленный, и большинство элементов из этих частиц, ве-
176
роятно, остаются недоступными для растений (Бязров, 2002). Имеются лишь
косвенные свидетельства взаимосвязей между составом субстратов и
химическим составом лишайников: а) избирательность некторых видов по
отношению к субстрату (Lounamaa, 1965; Salisbury et al., 1968; Локинская, 1970;
Brodo, 1973; Purvis, Halls, 1996), толерантность к высоким концентрациям
металлов в субстрате (Lange, Ziegler, 1963; Brown, Slingsby, 1972; Alstrup,
Hansen, 1977; Garty, 1993, 2000), большие различия между видами в
способности их к накоплению металлов (Бобрицкая, 1950; Локинская, 1970;
Tomassini et al., 19764 Garty, 1993).
Лишайники наряду с отсутствием корневой системы не имеют на
поверхности слоевищ восковой кутикулы, свойственной листьям сосудистых
растений, хотя большинство лишайников имеют верхний коровой слой из плотно
переплетенных грибных гиф. Как следствие, обмен элементов у
лишайников осуществляется через всю поверхность их талломов (Бязров, 2002).
Основными механизмами поглощения лишайниками минеральных элементов
из окружающей среды являются обмен ионов, внутриклеточное
поглощение и улавливание взвешенных в атмосфере частиц.
Талломы лишайников имеют значительное по объему межклеточное
пространство, достигающее 18% (Collins, Farrar, 1978; Nieboer et al, 1978).
Свободное проникновение в слоевище богатых микроэлементами частиц
может быть одной из главных причин высокого их содержания, особенно в
условиях воздушного промышленного загрязнения (табл. 6.22).
Лишайники - самые низкозольные представители растительного мира в
бореальных лесах. Зольность их обычно не превышает 1% на сухое
вещество (Никонов, Лукина, 1994). В них наряду с азотом и калием активно
накапливается кремний.
Анализ химического состава лишайников бореальных лесов
показывает, что по концентрациям основных макроэлементов-биофилов (Са, Mg, К,
Р, S) лишайники сосновых лесов северной, средней и южной тайги
сопоставимы (табл. 6.23), что свидетельствует об относительном консерватизме
химического состава этих организмов в пределах бореальной зоны в условиях
широкого спектра климатических и эдафических условий. Тренд
увеличения концентраций при продвижении с юга на север характерен для А1 и Fe,
что указывает либо на возрастание концентраций этих типоморфных для
бореальных ландшафтов элементов в природной среде, либо (что более
вероятно) на увеличение их подвижности. Кроме того, в северо-таежных лесах
Кольского полуострова значительно возрастают концентрации Ni и Си, что
обусловлено загрязнением территории региона выбросами медно-никелево-
го производства.
Сопоставление химического состава лишайников сосновых лесов
Кольского полуострова условно-фоновых районов и подверженных воздействию
медно-никелевого загрязнения показывает, что эти организмы заметно
обогащаются поллютантами (Fe, Ni, Си) и одновременно обедняются кальцием
и марганцем (табл. 6.24). Последний факт подтверждает наше
представление об изменении химического состава растений северо-таежных лесов,
подверженных воздушному загрязнению кислотообразующими агентами и
тяжелыми металлами (Лукина, Никонов, 1996, 1998).
Химический состав лишайников Хибинского горного массива
существенно дополнен большим рядом рассеянных элементов (Sr, Ba, Ti, Rb, Ce, La,
177
V, Nd, Cr, Br, As, Se, Gd, I, Sm, Mo , Cd, Lu, W, Th, Dy, Cs, Sc, Та, Ag, Yb, Eu,
Hf, Sb, U, Tb, In, Hg, Au) (табл. 6.25). Выявляется, что аккумуляция
элементов с низкими концентрациями (> 100 мг/кг) может колебаться в широких
пределах. Наибольшими концентрациями рассеянных элементов в
лишайниках характеризуются Sr, Ba, Ti (n • 101 мг/кг), тогда как аккумуляция Au
может составлять всего 0,0004 мг/кг. Следовательно, различия в способности
лишайников концентрировать те или иные природные химические
элементы, достигает 9 порядков - от п • 105 (характерно азоту) до п • 10-4 мкг/л.
Факторный анализ матрицы элементов, включающей макроэлементы и
рассеянные элементы (табл. 6.26), позволил добиться высокой степени
"сжатия" информации (общий вклад в дисперсию составляет 70%).
Выявлено четыре основных фактора, определяющих химический состав
лишайников Хибинского горного массива. Три из них антропогенного характера
(факторы 1, 2 и 4; общий вклад в дисперсию 58%) и один характеризует
биологические особенности лишайников (фактор 3).
Первый фактор может быть идентифицирован как влияние апатито-не-
фелинового производства. С ним наиболее тесно связаны лантаноиды La,
Се, Nd, Sm, Eu, Tb, Dy, Yb, Lu (r = 0,6-0,9). Второй фактор обусловлен
воздействием медно-никелевого производства. С этим фактором тесно связаны
поллютанты этого производства Ni, Cu, As, Se (r = 0,92, 0,79,0,89, 0,66,
соответственно). Третий фактор характеризует природную изменчивость
химического состава лишайников. Наиболее тесными положительными связями
с этим фактором отличается биофил К (г=0,64) и отрицательными Са (г=-
0,83) и Sr (г = -0,81). Фактор четыре коррелирует с Al, Fe и Mg (r = 0,76, 0,74
и 0,77 соответственно) и может быть идентифицирован как вклад пыления
эродированных почв и обнажений коренных пород.
Зеленые мхи. Мохообразные, или бриофиты, широко распространены в
бореальных лесах. Эти растения сближает с лишайниками сравнительно
небольшие размеры и многолетний цикл развития. Тело мохообразных
представлено слоевищем, либо прижатым к субстрату (антоцеротовые и
печеночники), либо восходящим кверху стеблем с листьями (листостебельные).
Так же как и лишайники, мохообразные лишены корней, однако имеют
ризоиды.
Ниже речь пойдет о широко представленных в моховом ярусе
суходольных бореальных лесов зеленых мхах Pleurozium schreberi и Hylocomium splen-
dens. Эти мохообразные - относительно высокозольные растения - 2,3-2,7%
сухого вещества (Никонов, Лукина, 1994). В минеральном составе зеленых
мхов преобладают азот, калий и кальций. Таким образом, зеленые мхи
определяют азотно-калиево-кальциевый тип биогеохимического круговорота.
В настоящее время зеленые мхи наряду с лишайниками широко
используются для мониторинга атмосферных выпадений металлов.
Преимущественно атмосферная стратегия питания, свойственная мохообразным,
обусловила их использование как биомониторов для оценки региональных
атмосферных нагрузок и миграции атмосферных загрязнителей. В связи с тем,
что годичный прирост у зеленых мхов Pleurozium schreberi и Hylocomium
splendens легче идентифицируется по сравнению с лишайниками, им и
отдается предпочтение перед последними при оценке атмосферных нагрузок.
Минеральное питание бриофиты получают главным образом из
атмосферных выпадений. Зеленые мхи тесно контактируют с литосферными ис-
178
точниками минеральных элементов. Они способны поглощать некоторую
часть элементов из субстрата, на котором произрастают (минерального или
органического). Концентрация минеральных элементов в них может
довольно точно отражать геохимические особенности ареала этих растений. В
то же время мхи, как и лишайники, способны избирательно поглощать те
или иные элементы из окружающей среды, регулируя их концентрацию.
Так, степень сорбции и удержания микроэлементов в тканях Hylocomium
splendens позволили расположить их следующим образом: Си, Pb > Ni > Со >
Zn, Mn, Cd (Ruhling, Tyler, 1970).
Эти же исследователи (Ruhling, Tyler, 1970; Ruhling, 1994) установили,
что на поверхности мохообразных может происходить катионный обмен:
основные катионы, входящие в состав зеленых мхов, могут обмениваться на
катионы тяжелых металлов, т.е. мхи действуют подобно искусственным ио-
нообменникам. Они продемонстрировали возможность использования
зеленых мхов для картирования атмосферных выпадений ряда металлов.
Позднее данные методы нашли применение в широкомасштабных
исследованиях в скандинавских странах (Steinnes, 1977; Ruhling, 1994; Kubin, 1990).
Таким образом, основными механизмами поглощения зелеными мхами
минеральных элементов из окружающей среды являются улавливание
взвешенных в атмосфере частиц с обменом ионов и внутриклеточным
поглощением как у лишайников, а также поглощение минеральных элементов из
субстратов с помощью ризоидов.
Распространение химических элементов в биосфере может
осуществляться как в в результате природных биогеохимических циклов (морская
импульверизация, внутриэкосистемные циклы почва-растение и т.п.), так и
в результате антропогенной деятельности (выбросы загрязняющих веществ
от металлургических комбинатов, трансграничные переносы и др.). Так,
исследование воздушных миграционных потоков 26 тяжелых металлов (от
локальных источников, трансграничные переносы и природные циклы в
наземных экосистемах) для территории Норвегии, с использованием в
качестве биомонитора зеленых мхов (Hylocomium splendens) позволили Э. Стайн-
несу (Steinnes, 1992) идентифицировать вклады от неатмосферных
источников: почвенная пыль после ветровалов древесных растений и
выщелачивание из высших растений. Эти материалы послужили основой для
объединения тяжелых металлов, концентрирующихся в Hylocomium splendens, в
соответствии с источником поступления в экосистему из атмосферы (табл. 6.27).
Перечень источников поступления элементов следует дополнить
селективной (избирательной) аккумуляцией элементов живыми организмами,
поскольку мохообразные контролируют поглощение и закрепление
элементов в своих тканях.
Анализ концентраций Са, Mg, Al, Fe, Mn, Zn, Ni, Си, Р, S в зеленых мхах
Pleurozium schreberi и Hylocomium splendens еловых лесов на
условно-фоновых территориях северной (березняки лесотундровые, сосновые и еловые
леса Кольского полуострова), средней (сосновые и еловые леса Карелии,
заповедник "Кивач") и южной (сосновые и еловые леса Валдая, Валдайский
национальный парк) тайги показывает выраженный тренд увеличения
общей аккумуляции определявшихся элементов в мохообразных бореальных
лесов при продвижении с севера на юг (табл. 6.28) в основном за счет
кальция, калия, фосфора и серы. В то же время тренд увеличения концентраций
179
в обратном направлении (при продвижении с юга на север), так и же как для
лишайников, характерен для А1 и Fe, указывая либо на возрастание
концентраций этих типоморфных для бореальных ландшафтов элементов в
природной среде, либо (что более вероятно) на увеличение их подвижности. Кроме
того, в мохообразных еловых лесов Кольского полуострова значительно
возрастают концентрации Ni и Си, что обусловлено аэротехногенным
загрязнением территории региона выбросами медно-никелевого производства.
Сопоставление мохообразных сосновых лесов бореальной зоны
позволяет заключить следующее. Если в условиях северной тайги их способность
аккумулировать перечисленные элементы сопоставима со мхами из еловых
лесов региона, то в более южных регионах (средняя и южная тайга)
мохообразные сосновых лесов заметно уступают этим организмам,
произрастающим в еловых лесах.
Для Кольского полуострова характерны многочисленные комбинации
природных факторов и антропогенного воздействия, которые могут
существенно повлиять на поступление различных элементов в лесные экосистемы
и их поглощение зелеными мхами: а) большой литологический спектр
горных пород (от щелочных интрузий до разнообразных осадочных пород);
б) сочетание малопродуктивных лесотундровых березняков и северо-таеж-
ных хвойных лесов; в) сочетание экосистем, близких по организации
девственным, и экосистем, испытывающих очень высокие (по мировым
масштабам) уровни атмосферного загрязнения тяжелыми металлами и
кислотообразующими агентами.
Сопоставление химического состава мохообразных из разных типов
лесов леса в пределах одного региона северной тайги (березовые, сосновые и
еловые леса) позволяет утверждать, что эти растения довольно
информативно отражают региональный фон, включая высокие концентрации
никеля и меди в атмосферных выпадениях. Мохообразные из березовых лесов
меньше накапливают калия, железа и алюминия, по сравнению с северо-та-
ежными хвойными лесами.
Воздействие антропогенного фактора (прежде всего воздушное
промышленное загрязнение) обусловливает резкое возрастание аккумуляции
большинства определявшихся элементов. Наиболее важные источники их
поступления в экосистему из атмосферы - продукты глубокой переработки
минерального сырья и пыление открытых поверхностей в результате
добычи рудных материалов. Сопоставление химического состава мохообразных
лесов Кольского полуострова условно-фоновых районов и подверженных
воздействию медно-никелевого и железорудного загрязнения показывает,
что эти организмы заметно обогащаются, прежде всего, поллютантами (Fe,
Ni, Си), а также кальцием и алюминием и одновременно обедняются цинком
(табл. 6.29). Последний факт подтверждает наше представление об
изменении химического состава растений северотаежных лесов, подверженных
воздушному загрязнению кислотообразующими агентами и тяжелыми
металлами. Возможно, цинк может селективно выщелачиваться из
растительных тканей в результате воздействия кислотообразующих агентов и
тяжелых металлов, как это свойственно ассимилирующим органам ели и сосны
(Лукина, Никонов, 1996, 1998).
Вывод об увеличении аккумуляции большинства элементов в условиях
воздушного промышленного загрязнения подтверждают результаты
180
(табл. 6.30) определения в составе мохообразных большого спектра
рассеянных элементов (Rb, Pb, Cd, Сг, Со, V, As, Ba, Sr, Sb, Bi, Tl, U, Th, Be, Li, Cs,
Mo, Y, La). Так, по нашим данным и данным Рейнмана с соавт. (Reimann et
al., 1998) в зоне воздействия медно-никелевых комбинатов не выявлена
заметная аккумуляция мохообразными только лантана, марганца, рубидия,
теллура и цинка. Некоторые из этих элементов (марганец, цинк, возможно,
рубидий) могут селективно выщелачиваться из растительных тканей в
результате воздействия кислотообразующих агентов и тяжелых металлов, как
это свойственно ассимилирующим органам ели и сосны (Лукина, Никонов,
1996, 1998). В то же время заметное возрастание концентраций серебра,
мышьяка, висмута, кадмия, кобальта, хрома, меди, железа, молибдена,
никеля, сурьмы и селена вызвано медно-никелевым производством, тогда как
повышенная аккумуляция алюминия, бария, кальция, магния, скандия и
кремния может быть связана с пылением открытых поверхностей.
6А СРАВНИТЕЛЬНАЯ ОЦЕНКА
ПОГЛОЩЕНИЯ ЭЛЕМЕНТОВ
РАСТЕНИЯМИ БОРЕАЛЬНЫХ ЛЕСОВ
Химический состав растений обусловлен наличием элементов их
слагающих в окружающей среде и избирательностью и интенсивностью их
поглощения. Для выявления закономерности связи состава внешней и внутренней
сред предложены коэффициенты биологического поглощения (КБП) как
отношение концентрации элемента в организме к его концентрации в
окружающей среде (Перельман, 1989). Для сравнительной оценки мы
использовали коэффициент биологического поглощения, рассчитанный как
отношение концентрации элемента в ассимилирующих органах растений к его
концентрации в органогенном горизонте почв (экстрагирование
концентрированной азотной кислотой, этот же растворитель испльзовался и для
растений), являющемся основным источником питания бореальных растений.
Высшие растения поглощают необходимые им элементы из почвы и
отличаются по способности аккумулировать макро- и микроэлементы, о чем
свидетельствуют различия в коэффициентах биологического поглощения.
Самым высоким коэффициентом биологического поглощения
характеризуются бор и марганец (табл. 6.31), коэффициенты поглощения, рассчитанные
для этих элементов, выше, чем для макроэлементов. Также высокий
уровень поглощения отличает рубидий. Низкая степень аккумуляции
свойственна железу, иттрию, лантану, свинцу, висмуту, торию и урану (КБП, как
правило, < 0,1).
Высшие растения поглощают необходимые им элементы из почвы и
отличаются по способности аккумулировать макро- и микроэлементы, о чем
свиедетельствуют различия в коэффициентах поглощения. Из
исследованных высших растений наиболее ярко выраженной концентрационной
способностью отличаются береза, листья которой аккумулируют многие
элементы в максимальных количествах (см. табл. 6.13, 6.32). Наименьшей
концентрацией микро- и ультрамикроэлементов, а также кальция, магния и
натрия отличается луговик извилистый, характеризующийся при этом
высокой концентрацией азота и калия (см. табл. 6.20).
181
Отличительной особенностью сосны является высокий уровень
накопления алюминия, таллия и натрия. При этом сосна отличается от всех
других исследуемых растений очень низким содержанием бария в
ассимилирующих органах (Steinnes et aL, 2000). Ель интенсивно аккумулирует
кальций и стронций в ассимилирующих органах, особенно в хвое старших
возрастных групп. Береза является концентратором фосфора, цинка и
кадмия, а также листья березы аккумулируют довольно много стронция и
бария. Существуют определенные закономерности в аккумуляции
элементов в хвое по мере её старения: с возрастом в хвое накапливаются
малоподвижные элементы кальция, марганец, алюминий, железо, стронций,
а в условиях атмосферного загрязнения также широком рядом
рассеянных элементов, входящих в состав выбросов, либо высвобождаемых при
пылении обнаженных минеральных горизонтов. В процессе старения хвоя
обедняется подвижными элементами азотом, фосфором, калием,
рубидием, цезием.
Характерными особенностями видов рода Vaccinium является высокое
содержание кальция и марганца. Брусника и черника отличаются также
относительно высоким уровнем аккумуляции серы и бария.
В условиях аэротехногенного загрязнения медно-никелевым
производством содержание одних элементов возрастает, других - снижается,
содержание ряда элементов не изменяется. Элементы, входящие в состав
выбросов, отличаются по интенсивности их накопления растениями. Так, селен,
теллур, мышьяк, молибден, сурьма, висмут и свинец характеризуются очень
высокими уровнями концентраций в растениях (Steinnes et aL, 2000).
Источниками выбросов их соединений в атмосферу являются медно-никелевые
комбинаты, также они могут высвобождаться в процессе сжигания угля,
повышенное содержание свинца обусловлено использованием бензина. Эти
элементы, преимущественно высвобождаемые в летучей форме в связи с
высокотемпературными процессами, обнаруживаются в мелких
аэрозольных частицах и поэтому распространяются на значительные расстояния от
источников выбросов. Маленькими размерами частиц обусловлена ярко
выраженная фиксация этих элементов на поверхности листовых пластинок и
высокий уровень их аккумуляции в растениях.
В отличие от предыдущей группы железо, кобальт, никель и медь
ассоциируются с крупными частицами выбросов, они выпадают
преимущественно вблизи комбинатов и не отличаются высокой степенью фиксации
листовой поверхностью.
Ванадий, сера, хром, цинк и таллий также входят в состав выбросов, но
накопление их растениями не столь значительны, как элементов двух
предыдущих групп.
Довольно часто алюминий демонстрирует высокое содержание в
растениях при воздушном загрязнении медно-никелевым производством. Это
можно объяснить повышенной подвижностью соединений этого элемента в
почвах при подкислении.
Вариации в концентрации лития, бериллия, бора, лантаноидов и
актиноидов объясняются в значительной степени их содержанием в почвообразую-
щих породах.
Концентрации кальция, магния, рубидия, стронция, цезия, марганца,
цинка и бария часто снижаются в растениях в условиях медно-никелевого
182
производства, что может быть связано с вытеснением их катионов из
почвенного поглощающего комплекса протонами и ионами алюминия и
тяжелых металлов и выносом из корнеобитаемой зоны. В некоторых случаях не
проявляющиеся тенденции снижения концентраций кальция и магния
обусловлены высоким содержанием этих элементов в почвообразующих
породах около источников выбросов, тогда как сравнение проводится с так
называемыми фоновыми участками, где содержание оснований в породах могло
быть изначально существенно ниже.
В сосудистых растениях (ель, сосна) часто наблюдается увеличение
концентраций подвижных элементов - азота, калия и фосфора при снижении
доступных соединений этих элементов в органогенных горизонтах почв. Это
может быть связано с опаданием хвои не только в природные
фенологические сроки и постоянной ретранслокацией подвижных элементов из
опадающей хвои в оставшуюся живую.
При загрязнении отходами апатитонефелинового производства
растения обогащаются фосфором, калием, серой, алюминием, лантаноидами,
актиноидами, стронцием. Концентрация магния в многолетней хвое
снижается. Обеднение хвои магнием при обогащении этим элементом органогенных
горизонтов можно объяснить проявлением антагонизма между элементами
(K-Al, K-Mg).
Растения с атмосферной стратегией питания (лишайники и зеленые мхи)
демонстрируют большие возможности в аккумуляции макро- и рассеянных
элементов в пределах бореальной зоны, при этом лишайники из всех боре-
альных растений характеризуются самыми низкими концентрациями
элементов в фоновых условиях. Различия в способности растений с
атмосферной стратегией питания концентрировать те или иные природные
химические элементы при варьировании их концентраций в окружающей среде
достигает 9 порядков - от п • 105 до п • 1(Н мкг/кг. Наибольшими
концентрациями в растениях с атмосферной стратегией питания, так же как и в
сосудистых растениях, характеризуются биофилы азот, кальций, калий, магний,
фосфор, сера, марганец, а также типоморфные для северо-таежных
ландшафтов элементы алюминий и железо.
Анализ химического состава лишайников в условно-фоновых условиях
свидетельствует об относительном консерватизме химического состава этих
организмов в пределах бореальной зоны независимо от климатических и
эдафических условий, а также типа леса. Для мохообразных еловых лесов
характерен тренд увеличения общей аккумуляции элементов в при
продвижении от северной к южной тайге в основном за счет кальция, калия,
фосфора и серы, в сосновых лесах такие тенденции не выявлены.
Растения с атмосферной стратегией питания из северной тайги Фенно-
скандии характеризуются повышенной аккумуляцией AI и Fe, что
указывает либо на возрастание концентраций этих типоморфных для бореальных
ландшафтов элементов в природной среде, либо (что более вероятно) на
увеличение их подвижности.
Воздушное промышленное загрязнение обусловливает резкое
возрастание уровня аккумуляции большинства элементов в лишайниках и
мохообразных. Наиболее важные источники их поступления в экосистему из
атмосферы - продукты глубокой переработки минерального сырья и пыление
открытых поверхностей в результате добычи рудных материалов. Химиче-
183
скии состав растений с атмосферной стратегией питания информативен для
характеристики регионального загрязнения (например, загрязнение
территории Кольского полуострова никелем и медью).
Некоторые элементы в условиях воздушного промышленного
загрязнения (марганец, цинк, возможно, рубидий) селективно выщелачиваются из
растительных тканей лишайников и мохообразных, как это свойственно
ассимилирующим органам ели и сосны.
Литература
Лндервуд Э. Микроэлементы у животных // Микроэлементы. М.: Изд-во
иностр. лит., 1962. С. 50-60.
Аржанова B.C., Елпатъевский П.В. Геохимия ландшафтов и техногенез. М.:
Наука, 1990. 194 с.
Арнон Д. Роль микроэлементов в питании растений, в частности в фотосинтезе
и усвоении азота // Микроэлементы. М.: Изд-во иностр. лит., 1962. С. 9-49.
Барашкова Э.А. Питание кладонии оленьей через мертвую часть подециев //
Ботан. журн. 1963. Т. 48, № 4. С. 588-591.
Барсукова B.C. Физиолого-генетические аспекты устойчивости растений к
тяжелым металлам. Новосибирск, 1997. 63 с.
Боорицкая М.А. Методика зольного анализа растений. М.: Всесоюз. о-во
почвоведов, 1958. 49 с.
Ьязров Л.Г. Эпифитные лишайниковые синузии в лесных биогеоценозах
подзоны широколиственных лесов. Автореф. дис. - канд. биол. наук. Л., 1970. 26 с.
БязровЛ.Г. Лишайники в экологическом мониторинге. М.: Научный мир, 2002.
336 с.
1лот!Т°б **'**' НРоисх°ждение и география культурных растений. Л.: Наука,
1987. 438 с.
Ваинштейн Е.А. Некоторые вопросы физиологии лишайников. III.
Минеральное питание // Ботан. журн., 1982. Т. 67, № 5. С. 561-571.
Венчиков АЛ. Биотики. М.: Медгиз, 1962. 234 с.
Викторов СВ. Лишайники пустыни Устюрт и их связь с некторыми
свойствами почвы и горных пород // Вопросы индикационной геоботаники. М., I960.
С. 53—56.
Виноградов АЛ. Геохимия редких и рассеянных элементов в почвах. М.: Изд-
во АН СССР, 1957. 238 с.
1оленецкии СП. Пути формирования микроэлементного состава природных
сред. М.: Гидрометеоиздат, 1983. 6 с.
Голенецкий СП., Жигаловская Т.Н., Голенецкая СИ. Роль атмосферных
выпадении в формировании элементного состава почв и растений // Почвоведение. 1981.
1 олуокова Н.С К вопросу о происхождении и путях эволюции лишайникового
гИ^!Й™ Новости систематики низших растений. СПб.: Наука, 1993. Т. 29.
540 ГэЛСтОН А' Дэвис П> Сэттер Р. Жизнь зеленого растения. М.: Мир, 1983.
Елпатъевский П.В. Геохимия миграционных потоков в природных и природно-
техногенных геосистемах. М.: Наука, 1993. 252 с.
Ильин В.Б. Элементный химический состав растений. М.: Наука, 1985. 129 с.
Ильин В.Б. Тяжелые металлы в системе почва-растения. Новосибирск: Наука,
ояо, тл'Пендиас А., ПендиасX. Микроэлементы в почвах и растениях. М.: Мир,
184
Казимиров Н.И., Морозова P.M. Биологический круговорот веществ в
ельниках Карелии. Л.: Наука, 1973. 174 с.
Кист АЛ. Феноменология биогеохимии и бионеорганической химии. Ташкент:
Фан, 1987. 236 с.
Ковальский В.В. Геохимическая экология. М.: Наука, 1974. 299 с.
Крамер П., Козловский Т. Физиология древесных растений. М.: Гослесбумиз-
дат, 1963. 628 с.
Левина В.И. Определение массы ежегодного опада в двух типах сосновых лесов
на Кольском полуострове // Ботан. журн. 1960. № 3. С. 418-423.
Либберт Э. Физиология растений. М.: Мир, 1976. 580 с.
Локинская МЛ. Некоторые данные о составе зольных элементов в лишайниках
рода Cladonia северо-востока Сибири // Водоросли и грибы Сибири и Дальнего
Востока. Новосибирск: Наука, 1979. Ч. 1. С. 230-232.
Лукина Н.В.у Никонов В.В. Биогеохимические циклы в лесах Севера в
условиях аэротехногенного загрязнения: В 2 ч. Апатиты: КНЦ РАН, 1996. Ч. 1.213 с; Ч. 2.
192 с.
Лукина Н.В., Никонов В.В. Питательный режим лесов северной тайги:
природные и техногенные аспекты. Апатиты: КНЦ РАН, 1998. 316 с.
Лянгузова И .А., Чертов ОТ. Химический состав растений при атмосферном и
почвенном загрязнении // Лесные экосистемы и атмосферное загрязнение. Л.:
Наука, 1990. С. 75-86.
Манаков К.Н. Поглощение растительностью минеральных элементов и азота
из почвы в лесах Кольского полуострова // Почвоведение. 1961. № 8. С. 34-41.
Манаков КН., Никонов В.В. Биологический круговорот минеральных
элементов и почвообразование в ельниках Крайнего Севера. Л.: Наука, 1981. 196 с.
Митрофанов Д.П. Химический состав лесных растений Сибири. Новосибирск:
Наука, 1977. 120 с.
Немерюк Г.Е. Миграция солей в атмосферу при транспирации // Фзиология
растений. 1970. Т. 18, вып. 4. С. 673-679.
Никонов В.В., Лукина Н.В. Биогеохимические функции лесов на северном
пределе распространения. Апатиты: КНЦ РАН, 1994. 315 с.
Нифонтова М.Г., Лебедева А.В., Куликов Н.В. Накопление Sr-90 и Cs-137
живыми и мертвыми лишайниками // Экология. 1979. № 1. С. 94-97.
Парибок Т.А. Загрязнение растений металлами и его эколого-физиологические
последствия: Обзор // Растения в экстремальных условиях минерального питания.
Л.: Наука, 1983. С. 82-99.
Перельман AM. Геохимия ландшафта. 2-е изд. М.: Высш. шк., 1975. 340 с.
Петрунина Н.С. Морфо-анатомические особенности растений,
произрастающих на почвах, обогащенных тяжелыми металлами // Теоретические вопросы фи-
тоиндикации. Л.: Наука, 1971. С. 142-148.
Раменская МЛ. Микроэлементы в растениях Крайнего Севера. Л.: Наука, 1974.
158 с.
Ратнер Е.П. Пути приспособления растениях к условиям питания катионами в
почве // Проблемы ботаники. М.; Л.: Изд-во АН СССР, 1950. Вып. 1. С. 427-448.
Ревич Б.А. Загрязнение окружающей среды и здоровье населения. Введение в
экологическую эпидемиологию. М.: МНЭПУ, 2001. 72 с.
Сабинин А.Д. Физиологические основы питания растений. М.: Изд-во АН
СССР, 1955. 512 с.
Ткалин СМ. Некоторые общие закономерности содержания химических
элементов в золе растений // Биогеохимические поиски рудных месторождений. Улан-
Удэ: СО АН СССР, 1969. С. 83-90.
Трахтенберг И.М., Тимофиевская Л.А., Квятковская И.Я. Методы изучения
хронического действия химических и биологических загрязнителей. Рига: Зинатне,
1987. 170 с.
185
Фокин А.Д. Роль растений в перераспределении веществ по почвенному
профилю // Почвоведение. 1999. № 1. С. 109-116.
Яценко-Хмелевская М.А., Цибульский В.В., Миляев В.Б. Миграция тяжелых
металлов в атмосфере // Журн. экол. химии. 1994. № 3. С. 3-15.
Alstrup V., Hansen ES. Three species of lichens tolerant of high concentrations of
copper // Oikos. 1977. Vol. 2. N 2. P. 290-293.
Bowen HJ.M. Trace elements in biogeochemistry. N. Y.; L.: Acad, press, 1966. 241 p.
Brodo I.M. Substrate ecology // The lichens / Ed. V. Ahmadjian, M.E. Hale. N.Y.; L:
Acad, press, 1973. P. 401-441.
Brown D.H., Slingsby D.R. The cellular location of lead and potassium in the lichen
Cladonia rangiforms (L.) Hoffm. // New Phytologist. 1972. Vol. 71. P. 297-305.
Collins C.R., Farrar J.F. Structural resistances to mass transfer in the lichen Xanthoria
parietina // Ibid. 1978. Vol. 81. P. 71-83.
Doyle P., Fletcher W.K., Brink V.C. Trace element content of soils and plants from the
Selwyn Mountains, Yukon and Northern Territories // Canad. J. Bot. 1973. Vol. 54, N 3.
P. 421-427.
Erdman J A., Gough L.P. Variation in the element content of Parmelia chlorochroa from
the Powder River Basin of Wyoming and Montana // Borilogist. 1977. Vol. 80, N 2.
P. 292-303.
Erdman J A., Gough L.P., White R.W. Calcium oxalate as source of high ash yields in
terricolous lichen Parmelia chlorochroa // Ibid. 1977. Vol. 80, N 2. P. 334-339.
Ernst W.H.O. Sampling of plant material for chemical analysis // Sci. Total Environ.
1995. Vol. 176, N 1/3. P. 15-24.
Frontasyeva M.V., Steinnes E. Epithermal neutron activation: Analysis of masses used to
monitor heavy metal deposition around an iron smelter complex // Analyst. 1995. Vol. 120,
N 5. P. 1437-1440.
Garty J. Environment and elemental content of lichens // Trace elements - their
distribution and effects in the environment / Ed. B. Markert, K. Friese. N.Y.: Elsevier, 2000.
P. 245-276.
Helmisaari Я.-5. Spatial and age-related variation in nutrient concentrations of Pinus
sylvestris needles // Silva Fenn. 1992. Vol. 26, N 3. P. 145-153.
Ingestad T. Mineral nutrient requirements of Vaccinium vitis-idaea and Vaccinium myr-
tillus // Physiol, plant. 1973. N 29. P. 239-246.
Kubin E. A survey of element concentrations in the epiphytic lichen Hypogymnia
physodes in Finland in 1985-86 // Acidification in Finland. В.: Springer, 1990. P. 421-446.
Lange J.L., Ziegler H. Der Schwermetallgehalt von Flechten aus dem Acarosporetum
sinopicae auf Erzschlackenhalden des Harzes. I. Eisen und Kupfer // Mitt. Florist-soziol.
Arbeitsgemainschaft. N.F. 1963. Bd. 10. S. 156-183.
Lobersli E. N., Steinnes E. Metal uptake in plants from a birch forest area near a copper
smelter in Norway// Water, Air and Soil Pollut. 1988. Vol. 37. P. 25-39.
Lounamaa J. Trace elements in plants growing wild on different rocks in Finland.
A semi-quantitative spectrograph^ servey // Ann. Bot. Soc. Zool. Bot. Fenn. "Vanamo".
1956. Vol. 39, N 4. P. 1-196.
Malkonen E. Annual primary production and nutrient cycle in some Scots pine stands //
Commun. Inst. Forest. Fenn. 1974. N 84. 87 p.
Markert В., Zhang De Li. Inorganic chemical investigations in the forest biosphere
reserve near Kalinin, USSR. II. The distribution of lanthanide elements in the vegetation
cover // Vegetatio. 1991. Vol. 97. P. 57-62.
Nash Т.Н. (ed.). Lichen biology. Cambridge: Cambridge Univ. press, 1996. 303 p.
Nazarov V.M., Frontasyeva M.V., Peresedov V.F. et al. Resonance neutrons for
determination of elemental content of moss, lichen and pine needles in atmospheric deposition
monitoring //J. Radioanal. and Nucl. Chem. 1995. Vol. 192. N 2. P. 229-238.
Nieboer E., Richardson D.H.S., Tomassini F.D. Mineral uptake and release by lichens:
An overview // Briologist. 1978. Vol. 81, N 2. P. 226-246.
186
Puckett К J. Bryophytes and lichens as monitors of metal deposition // Lichens,
bryophytes and air quality / Ed. Т.Н. Nash, V. Wirth. В.; Stuttgart, 1988. P. 231-267.
Purvis O.W., Halls С A review of lichens in metal-enriched environments //
Lichenologist. 1996. Vol. 28, N 6. P. 571-601.
Raitio H. The significance of the number of needle year classes in interpreting needle
analysis results // Silva Fenn. 1987. Vol. 21, N 1. P. 11-16.
Reimann C, Ayras M., Chekushin V. et al. Environmental geochemical atlas of the
Central Barents region. Trondheim: Grytting, 1998. 745 p.
Ruhling A. (ed.). Atmospheric heavy metal deposition in Europe - estimations based on
moss analysis. Nord, 1994. 9, 38 p.
Ruhling A., Tyler G. An ecological approach to the lead problem // Bot. Notis. 1968.
Vol. 122. P. 248-342.
Ruhling A., Tyler G. Sorption and retention of heavy metals in the woodland moss
Hylocomium splendens // Oikos. 1970. Vol. 21. P. 92-97.
Salisbury F.B., Spomer G.G., Sobral M. et al. Analysis of an alpine environment // Bot.
Gaz., 1968. Vol. 129. P. 16-32.
Steinnes E. Atmospheric deposition of trace elements in Norway studied by means of
moss analysis. Kjeller, 1977. 29 p. (Rep. Ubst, fir Atinebergul В KR-154).
Steinnes E., Sjobakk Т.Е. Heavy metals in the soil-plant system in South Varanger //
Effects of air pollutants on terrestrial ecosystems in the border area between Russia and
Norway. Oslo: State Pollution Control Authority, 1992. P. 86-92.
Steinnes E., Lukina N., Nikonov V. et al. A gradient study of 34 elements in the
vicinity of a copper-nickel smelter in the Kola Peninsula // Environ. Monit. and Assess. 2000.
Vol. 60. P. 71-88.
Tomassini F.D., Puckett KJ.t Nieboer E. et al. Determination of Cu, Fe, Ni and S by X-
ray fluorescence in lichen from the Mackenzie Valley, Northwest Territories, and the
Sudbury District, Ontario // Canad. J. Bot. 1976. Vol. 54, N 14. P. 1591-1603.
Zhang S., Shau X., Van X., Zhang H. The determination of rare earth elements in soils by
inductively coupled plasma mass spectrometry // Atom. Spectrosc. 1997. Vol. 18.
P. 140-144.
Глава 7
МИКРООРГАНИЗМЫ
7.1. МИКРОБНЫЕ СООБЩЕСТВА
ЛЕСНЫХ БИОГЕОЦЕНОЗОВ
Лесные биогеоценозы отличаются огромной поверхностью фитомассы
и четкой дифференциацией разных вертикальных слоев по их
функциональным свойствам. Факультативным признаком лесного растительного
сообщества является ярусность, поскольку оно образовано контрастными по
высоте жизненными формами. Поэтому в ботанике и лесоводстве
традиционно выделяют древесный, кустарниковый, травяно-кустарничковый и мохо-
во-лишайниковый ярусы.
Выраженная вертикальная градиентность гидротермического и
светового режимов, концентрации кислорода и углекислого газа обусловила
разделение этих биосферных ячеек на уровне экосистем на биогеоценотические
горизонты или биогоризонты, различающиеся по своим функциям (Уткин,
1975). В лесных биогеоценозах представлены следующие биогеогоризонты
(Карпачевский, 1981):
- фотосинтетический деревьев, подразделяющийся по интенсивности
фотосинтеза на подгоризонты самого верхнего слоя крон деревьев и
аккумулятивного слоя деревьев, т.е. стволовой аккумуляции;
- фотосинтетический подлеска, объединяющий ярусы мохово-лишайни-
ковый, травяно-кустарничковый и кустарниковый (включая подрост), в
котором также можно выделить подгоризонты, связанные с этими ярусами;
- аккумуляции мертвого органического вещества (лесная подстилка),
подразделяющаяся на слои L (опада), F (ферментации) и Я (гумусообразова-
ния) в зависимости от степени разложения опада;
- гумусоаккумулятивный минеральный (включает верхние гумусирован-
ные почвенные горизонты), для которых характерны максимальное
заселение корнями, животными и микроорганизмами, наиболее высокое
содержание элементов питания.
Одновременно развивается и другое представление о вертикальной
структуре лесных биогеоценозов, согласно которому каждый ярус или горизонт
анализируется с точки зрения среды жизни для обитающих там организмов.
При этом в любом типе биогеоценоза можно выделить надземный (филло-
плана), наземный (подстилка) и почвенный (минеральные горизонты почв)
ярусы (Арнольди К., Арнольди Л., 1963). Положение животного организма
в вертикальной структуре биогеоценоза тесно связано с его эколого-физио-
188
логическими особенностями, позволяющими ему обитать в определенном
ярусе (Гиляров, 1968; Чернов, 1975).
Почвенные микробиологи в отличие от фитоценологов и зоологов, до
последнего времени отдавали предпочтение почвенному ярусу, из которого
брали для анализа в основном верхние горизонты почвы. Такое явление
объясняется длительным развитием почвенной микробиологии в отрыве от
экологии. Биогеоценологический подход требует изучения микробных
сообществ всех ярусов экосистемы, а не только почвенного.
Для наземных экосистем основным фактором, определяющим
вертикальное распределение микроорганизмов, является характер субстрата,
обеспечивающего определенный тип питания микробиоты. Так, в
надземном ярусе (филлоплане) - это прижизненные выделения растений,
представляющие собой водорастворимые органические соединения (сахара,
органические кислоты, аминокислоты). В лесных подстилках это различные
полимеры: крахмал, целлюлоза, ксиланы, лигнин, содержащиеся в растительном
спаде; в почве - гумусовые вещества, минеральные компоненты. В то же
время для вертикальной стратификации микробных сообществ наземных
биогеоценозов температура, освещенность и даже кислород не имеют
такого значения, как для водных экосистем.
Анализ распределения дрожжей и грибов в наземных биогеоценозах
разных природных зон (Мирчинк, Бабьева, 1981; Бабьева, 1984; Мирчинк,
1988) показал, что в каждом из типов биогеоценозов можно построить ряды
эукариотных микроорганизмов в системе: растения-подстилки-почвы,
различающиеся как по численности, так и по таксономическому составу. При
изучении эпифитно-сапротрофного комплекса бактерий в пределах
вертикальной структуры некоторых типов наземных биогеоценозов были
установлены закономерности в организации бактериальных сообществ,
подтверждающие на прокариотном уровне общебиологические законы: а)
вертикальную дифференциацию природных сообществ; б) одновременное
сочетание дискретности и непрерывности, выраженные в теории континуализ-
ма; в) корреляцию между местоположением организма в вертикальной
структуре биогеоценоза, его функциями и типом экологической стратегии
(Звягинцев и др., 1991,1993).
Численность микроорганизмов по ярусам биогеоценоза
Численность микроорганизмов значительно колеблется в пределах
вертикальной структуры биогеоценозов, но в каждом типе биогеоценоза
выделяется свой ярус с максимальной концентрацией микроорганизмов
(Бабьева, 1984; Звягинцев и др., 1991).
В лесных экосистемах при переходе от надземного яруса (филлоплана
растений) к наземному (подстилка) наблюдается резкое увеличение
численности почти всех групп микроорганизмов (рис. 7.1). Если для дрожжей и
грибов это увеличение составляет около порядка, то для бактерий оно может
измеряться 2-3 порядками (табл. 7.1). В этом специфическом биогеогори-
зонте происходит ежегодное пополнение органическим веществом за счет
хвои, шишек, веточек, листьев деревьев и кустарников, цветков, семян и
ягод лесных растений, остатков животных и продуктов их
жизнедеятельности. В отличие от почвенных горизонтов подстилка динамична: ее мощность
189
1
2
Надземный
Наземный О
А1
Почвенный
А2
Рис. 7.1. Схема распределения численности микроорганизмов по ярусам лесных
биогеоценозов
1 - бактерии, дрожжи, грибы; 2 - актиномицеты; О - подстилка, А1 и А2 - почвенные
горизонты. Заштрихованы ярусы с максимальной концентрацией микроорганизмов
указанных групп
и запасы (масса) резко изменяются в течение года и по годам (Карпачевский.
1981). В этом наиболее подвижном биогеоценотическом горизонте
наблюдаются и наибольшие сезонные колебания численности микроорганизмов.
Самые высокие показатели соответствуют влажным и часто холодным
периодам года (весна, зима) и приходятся большей частью на верхний слой
подстилки (табл. 7.2, 7.3).
При переходе к почвенному ярусу наблюдается снижение плотности
популяций как бактерий, так и эукариотных микроорганизмов - грибов и
дрожжей, причем численность этих групп может падать на 1-2 порядка.
Распределение прокариотных мицелиальных микроорганизмов - акти-
номицетов - характеризуется постепенным, довольно плавным увеличением
численности от верхнего к нижним слоям подстилки и далее к почвенным
горизонтам. Максимум численности актиномицетов приходится на верхний
гумусированный горизонт. Почва является тем природным субстратом, из
которого актиномицеты выделяются в наибольшем количестве и
разнообразии, составляя четвертую часть по численности от всех бактерий,
выделяемых из почвы на синтетические питательные среды. Однако
представители некоторых родов актиномицетов (Streptoverticillum, Micromonospord)
обнаруживаются в подстилке в значительно большем количестве, чем в почве.
Так, например, для стрептовертициллов число КОЕ/г субстрата на порядок
выше в слое подстилки (F + Н), чем в горизонте А1 (табл. 7.4).
Распределение микроорганизмов в пределах почвенного профиля имеет
общий для всех групп биоты характер: снижение плотности популяций с
глубиной. Так, уже в подзолистых горизонтах численность как прокариотных,
так и эукариотных микроорганизмов на порядок ниже, чем в вышележащих
горизонтах.
Таким образом, в лесных биогеоценозах при переходе от надземного
яруса к наземному прослеживается увеличение плотности заселения
субстрата всеми микроскопическими обитателями. В почвенном ярусе
происходит довольно резкое снижение численности всех групп микроорганизмов,
кроме актиномицетов.
Следовательно, ярусом с максимальной концентрацией жизни
микроскопических существ, главной сферой их активной жизнедеятельности в бо-
реальном поясе являются лесные подстилки. В этом же ярусе
сосредоточено
ны и разнообразные группировки мелких членистоногих (Чернова, 1989) и
простейших (Гельцер, 1982, 1984). В лесных подстилках значительно выше
и ферментативная активность по сравнению с почвенными горизонтами
(Щербакова, 1983).
Таксономические, функциональные и экологические группировки
микроорганизмов в разных ярусах биогеоценоза
По вертикали биогеоценоза меняется не только степень насыщенности
биотопов разными группами микроорганизмов, но и их таксономический
состав, экологические функции, тип стратегии. Прежде чем переходить к
описанию конкретных группировок биоты, хотелось бы уточнить некоторые
понятия и термины, употребляемые далее.
Консортивный подход, применяемый для изучения взаимоотношений
растений с гетеротрофными организмами, предполагает наличие
центрального ядра (детерминанта консорции), т.е. автотрофного растения и
связанных с ним трофически или топически организмов (консортов). Конеорты
образуют ряд концентров. В состав консортов первого концентра входят
биотрофы (организмы, использующие живые органы автотрофйых
растений), сапротрофы, использующие отмершие органы растений, и эккрисо-
трофы, потребляющие прижизненные выделения растений (Работнов,
1978). Микроорганизмы входят в состав каждой из перечисленных групп
консортов.
Биотрофные консорты, которые представлены фитопатогенными
микроорганизмами и различными симбионтными формами (микориза,
клубеньковые бактерии, франкии) нами не будут рассматриваться. Эккрисотроф-
ные консорты - это обитатели филлопланы и ризопланы, которые не
только трофически, но и топически связаны с растением и поэтому именуются
эпифитными организмами. Сапротрофные консорты - основные редуценты
растительных остатков, для которых главными местообитаниями являются
подстилка и верхние почвенные горизонты.
Такая классификация консортов, конечно, условна, так как один и тот
же организм способен менять как экотоп, в котором он обитает, так и тип
питания. Так, типичные обитатели филлосферы - псевдомонады,
питающиеся прижизненными выделениями растений (эккрисотрофы), попадая с опа-
дом в подстилку, начинают использовать отмершие растительные остатки,
т.е. становятся сапротрофами. Эти же организмы в почвенном ярусе
способны использовать даже сложные гумусовые вещества. Аналогичные
примеры существуют среди эукариотных микроорганизмов - дрожжей и грибов;
типичные эпифитные черные дрожжи Aureobasidium pullulans, гриб
Cladosporium, попадая в подстилку с опадающими листьями, продолжают
развиваться в новом субстрате как сапротрофы, но меняют жизненную
форму при смене местообитания. Нельзя ставить знак равенства между
терминами эпифитный и эккрисотрофный, так как обитающие на поверхности
растения микроорганизмы питаются не только прижизненными
выделениями растений: они используют отмирающие корни и листья растений,
разрушают воска кутикулы, т.е. могут вести "сапротрофный образ жизни".
Если требуется подчеркнуть приуроченность микроорганизмов к
определенному ярусу или биотопу, то возможно употребление таких терминов,
191
как фитобионты - связанные с живыми растениями (надземный ярус), са-
пробионты - связанные с мертвыми растительными остатками (обитатели
наземного яруса или "подстилочные сапротрофы") и педобионты -
почвенные обитатели, приспособленные к существованию в минеральной части
почвы и почти не встречающиеся в других субстратах.
Такое деление также весьма условно. В почвенном ярусе расположены
корни деревьев и трав, туда попадают и переносятся различными
животными свежие растительные остатки, там обитают различные беспозвоночные
животные, в кишечнике которых живут микроорганизмы симбионты, и все
они - обитатели почвенного яруса, которые могут принадлежать к разным
трофическим и топическим группировкам в зависимости от их локализации
в почве. Однако, как правило, под педобионтами подразумевают организмы,
характерные для минеральных горизонтов, которые встречаются лишь в
почве, либо их численность значительно выше в почве, чем в других
субстратах.
Вопрос о функциональных группах микроорганизмов является
традиционно дискуссионным в микробиологии. Существовавшие в течение
длительного времени понятия зимогенная и автохтонная группы, введенные
С.Н. Виноградским и обозначавшие первоначально связь первой группы с
растениями, а второй - с почвами, были впоследствии расширены и
изменили смысловую нагрузку. Г.А. Заварзин (1970) показал, что свойства,
которые приписывали автохтонной и зимогенной группировкам, несовместимы
и, следовательно, микроорганизмы, обладающие одновременно этими
свойствами, существовать не могут. Было предложено считать обе группы
почвенными в противовес аллохтонной группировке. Вместо понятий
автохтонная - зимогенная было предложено выделить две группы: гидролити-
ки и микрофлора рассеяния. Последний термин было предложено заменить
на диссипотрофы (Васильева, Заварзин, 1995). Первые способны к
биосинтезу внеклеточных гидролаз и являются первичными разлагателями
растительного опада, вторые - функционируют за счет усвоения мономеров из
рассеянного состояния. Существуют и другие термины, объединенные в
пары по их диаметрально противоположному отношению к концентрации
используемого субстрата: евтрофы-олиготрофы (Кузнецов, 1974), копио-
трофы-олиготрофы (Poindexter, 1981). Первые требуют для роста высокие
концентрации субстрата, вторые - способны расти на мономерах,
довольствуясь низкими концентрациями питательных веществ в среде. Как правило,
олиготрофов относят к микрофлоре рассеяния. В 1986 г. была предложена
функциональная микробная триада "гидролитики-копиотрофы-олиготро-
фы" (Гузев, Иванов, 1986). При этом под гидролитиками предполагается
функциональная группа в формулировке Г.А. Заварзина, под копиотрофа-
ми - группа микроорганизмов, характеризующихся высокой скоростью
потребления мономеров при их высокой концентрации в окружающей среде,
под олиготрофами - группа микроорганизмов, имеющих систему
активного транспорта мономерных соединений внутрь клетки при их низкой
концентрации в окружающей среде.
Учение об экологических стратегиях организмов, привнесенное в
микробиологию из фитоценологии, позволило с иной стороны подойти к
функциональным группам микроорганизмов (Звягинцев, 1987; Кожевин и др.,
1980; Паников, 1986). Тип экологической стратегии определяется, прежде
192
всего, особенностями кинетики роста микробной популяции, которые
генетически закрепились в ходе эволюции и проявляются даже при
выращивании микроорганизмов на искусственных питательных средах в чистых
культурах. ^-Стратеги приурочены к более или менее стабильным условиям
среды, представлены равновесными популяциями, скорость их роста и
отмирания регулируются плотностью, они приспособлены к условиям острой
конкуренции с другими организмами. Обнаруживаются ^-стратеги на поздних
стадиях сукцессии в климаксном микробном сообществе. К этой группе
можно отнести медленно растущие, иногда с трудом культивируемые на
искусственных питательных средах микроорганизмы, входящие по другим
классификационным схемам в группы автохтонной микрофлоры или
микрофлоры рассеяния. ^-Стратеги имеются среди разных групп
микроорганизмов: бактерий (коринеподобные, нокардии, стебельковые и почкующиеся
бактерии), дрожжей (липомицеты), мицелиальных грибов (олиготрофные
виды, обитающие в минеральных горизонтах почвы).
r-Стратеги обычно занимают нестабильные местообитания,
характеризуются нестабильными (оппортунистическими) популяциями с резкими
колебаниями плотности. Они активно заселяют новые неосвоенные
местообитания, где им не грозит конкуренция со стороны других
микроорганизмов. Биологический смысл г-стратегии - максимализация скорости роста,
создание за короткий срок высокой численности популяции и быстрый
захват ресурсов, которые появились в результате тех или иных нарушений
стационарного трофического режима. В сукцессионном ряду г-стратеги
связаны с пионерными стадиями, так как, будучи слабыми конкурентами,
вытесняются из климаксного сообщества ^-стратегами. К этой группе
относится большинство микроорганизмов, которые легко культивируются
на питательных средах, они соответствуют зимогенной микрофлоре.
Типичными примерами r-стратегов могут служить энтеробактерии,
псевдомонады, флавобактерии, клубеньковые бактерии, эрвинии, многие
дрожжи и сахаролитические грибы.
/-Стратеги флуктуируют около нижнего предела численности, т.е.
находятся как бы на грани вымирания, но выживают благодаря способности
образовывать покоящиеся структуры (споры, цисты, склероции) или
существовать в экстремальных экотопических условиях (термофилы, психрофилы,
галофилы и др.). Примерами типичных /-стратегов могут служить бациллы,
клостридии, галофильные и термофильные архебактерии, актиномицеты,
большинство видов грибов.
Разные типы стратегий сформировались под действием разных типов
отбора: r-отбора (по скорости размножения, отбора эксплуатации), £-отбо-
ра (отбора насыщения в условиях полной занятости экологических ниш,
когда скорость размножения уже не играет решающей роли) и /-отбора
(отбора в неблагоприятных условиях).
Следует отметить, что проявление той или иной стратегии не является
абсолютно закрепленным свойством популяции, так как каждый организм в
той или иной степени способен противостоять конкуренции,
восстанавливаться после нарушений и переживать стрессы. Чтобы решить вопрос о
стратегиях, надо расположить все микроорганизмы в пространстве rlk-кон-
тинуума. Такой континуум может быть развернут во времени для любой
трофической группы.
7. Рассеянные элементы
193
Несмотря на то, что не существует жесткого однозначного соответствия
типа стратегии приуроченности организмов к определенному субстрату или
экологической группе, корреляция между этими параметрами явно имеется.
Так, было отмечено сходство двух типов стратегии (г и к) со стереотипами
поведения зимогенной и автохтонной микрофлор соответственно
(Звягинцев и др., 1984; Gerson, Chet, 1981). Функционально-стратегические ряды (с
учетом трех типов стратегий) микроорганизмов - аналоги рядов, созданных
фитоценологами (Миркин, 1985), были предложены B.C. Гузевым и
П.И. Ивановым (1986):
Гидролитики Копиотрофы Олиготрофы
/-стратеги r-стратеги ^-стратеги
Патиены Эксплеренты Виоленты
В настоящем разделе используются предложенные этими авторами
ряды при характеристике экологических группировок, типичных для каждого
яруса.
Основные группы микроорганизмов
Бактерии. В надземном ярусе лесов бактерии обнаруживаются на
поверхности листьев и трав, на коре и шишках, цветках и плодах, в почвах и
семенах, т.е. на всех органах растений. Распределение микроорганизмов по
поверхности различных органов носит ярко выраженный микрозональный
характер. Существенной экологической особенностью эпифитных бактерий
является их способность развиваться в прикрепленном состоянии благодаря
адсорбции. При этом в механизме адсорбции значительную роль играют
слизистые выделения как бактерий, так и растений. Защитную роль от
световых лучей выполняют каротиноидные пигменты, образуемые
большинством эпифитных бактерий и составляющие всю гамму
желто-оранжево-красных тонов.
Сведения о таксономическом составе бактерий филлопланы отрывочны
и противоречивы. Большинство названий в перечне родов и видов бактерий,
обнаруживаемых на растениях, приводится на основании идентификации
культур по устаревшему определению Н.А. Красильникова. Многие роды
бактерий, например Bacterium, Pseudobacterium, Achromobacter, в настоящее
время уже упразднены; большие изменения произошли в систематике но-
кардио- и коринеподобных бактерий, но несмотря на это всю эту группу
относят по традиции к сборному устаревшему понятию - микобактерии. Если
составить перечень родов и видов бактерий, обнаруженных разными
исследователями в филлоплане растений, то он займет несколько страниц.
Однако, как уже указывалось ранее, он не соответствует (в большинстве
случаев) принятым в настоящее время названиям таксонов.
Общепризнанным считается доминирование на поверхности растений
грамотрицательных бактерий, среди которых значительную долю
составляют представители родов Pseudomonas, Xanthomonas, Erwinia, Flavobacterium.
В качестве минорных компонентов постоянно обнаруживаются коринепо-
добные бактерии родов Rhodococcus, Micrococcus, Curtobacterium. В
филлоплане практически не встречаются спорообразующие бактерии и мицели-
альные актиномицеты.
194
По кинетическим параметрам роста бактерии филлосферы относятся к
популяциям, характеризующимся низкой инерционностью, высокими
скоростями роста и быстрым отмиранием клеток при прекращении
поступления питательных веществ, слабой конкурентной способностью, что
позволяет отнести их к г-стратегам.
Протеобактерии являются доминирующей группировкой и в подстилке,
особенно в ее верхнем слое L, куда они попадают с опадом и отпадом
листьев и трав. В этом ярусе они переходят с эккрисотрофного на сапротрофный
образ жизни, используя водорастворимые мономеры, содержащиеся в
растительных остатках, и начиная тем самым процесс деструкции
растительных остатков. Набор таксонов в подстилке (в ее верхнем слое) тот же, что и
в филлоплане (табл. 7.5).
В нижних слоях подстилки (F и Н) появляются спорообразующие
бактерии (Bacillus), цитофаги и миксобактерии; увеличивается доля стрептомице-
тов и целлюломонад. Все они принадлежат к функциональной группе гидро-
литиков, а по типу экологической стратегии являются /- и ^-стратегами.
Известно, что миксобактерии, цитофаги и целлюломонады способны
разрушать целлюлозу, бациллы - крахмал и пектин, стрептомицеты - хитин.
Таким образом, в нижних слоях подстилки происходит более глубокая
переработка растительных остатков, в результате которой расщепляются
сложные полимеры. Хотя основную функцию по деструкции растительных
остатков в лесных биогеоценозах играют грибы, нахождение бактерий-гидро-
литиков в значительных количествах в тех биотопах, где идет активная
переработка растительного опада, позволяет говорить об их активном участии
в этих процессах. В целом подстилка является тем биотопом, где
сосредоточено максимальное разнообразие бактерий, осуществляющих самые
разнообразные функции. Здесь есть и копиотрофы, и гидролитики и олиготрофы,
представленные разными родами (рис. 7.2). Подстилку можно
рассматривать как экотон - переход между четко различающимися сообществами,
богатый видами, так как он включает представителей этих обоих сообществ
(фитопланы и почвы) и формы, свойственные самому экотону (подстилке);
а вертикальное градиентное сообщество микроорганизмов как экоклин - по
аналогии с фитоценозами (Пианка, 1981).
При переходе от наземного к почвенному ярусу уменьшается не только
численность бактерий, но и их таксономическое разнообразие. В сапро-
трофном комплексе бактерий остаются главным образом стрептомицеты
(их доля увеличивается), родококки, бациллы, появляются нокардии и кау-
лобактер. Типичными обитателями почвенного яруса, не обнаруживаемыми
в других субстратах, являются такие олиготрофы, как Pedomicrobium,
Melallogenium, Seliberia, Gallionella. Эти организмы образуют в профиле
почв мощные разрастания и создают обогащенные окисным железом и
марганцем очаги и прослойки (Аристовская, 1965). Часто они развиваются на
поверхности грибных гиф. Однако все перечисленные выше организмы -
олиготрофы - не выделяются обычными методами посева из разведений на
общепринятые питательные среды. Это же относится и к другой группе
специфических олиготрофных бактерий - простекобактерий, включающих
уникальные по морфологии роды (Васильева, 1984). Все эти бактерии
способны расти при низких концентрациях питательных веществ, усваивая их
из рассеянного состояния, т.е. принадлежат к микрофлоре рассеяния. Они
7*
195
а бвгд еж з
Рис. 12. Распределение доминирующих родов бактерий эпифитно-сапротрофного
комплекса (процентное содержание) по ярусам лесного биогеоценоза
1 - филлоярус; 2, 3 - подстилка, горизонты L и F + Н; 4-6 - почвенные горизонты: А1,
А2, В; роды: а - Aquaspirillum, б - Flavobacterium, в - Erwinia, г - Methylobacterium, д -
Rhodococcus, е - порядок Myxobacterales, ж - Cytophaga, з - Bacillus; сумма всех
представленных на рисунке родов в каждом из ярусов составляет 100%
характеризуются экономным обменом, приспособлены к условиям
конкуренции с другими организмами, обнаруживаются на поздних стадиях
сукцессии, что позволяет отнести их к ^-стратегам. К этой же экологической
группе относятся и представители коринеподобных бактерий - артробактер и
родококки. Однако артробактер - типичный обитатель большинства почв -
не обнаруживается в лесных подзолистых почвах.
Следует сказать, что почва является исключительно сложным и
гетерогенным местообитанием. Благодаря своим многочисленным микролокусам,
где создаются самые разнообразные условия для обитания
микроорганизмов, часто с диаметрально противоположными потребностями (корни трав
и деревьев, гифы грибов, кусочки растительных остатков, экскременты
почвенных животных, минеральные и гумусовые частицы), почва является
уникальным природным банком, где размножаются или просто хранятся в
покоящемся состоянии многочисленные виды микроорганизмов. Считается,
что из почвы можно выделить любой нужный организм, применив особые
методы, а, следовательно, по степени разнообразия форм на первом месте
среди других биотопов и ярусов следует поместить почву, а не подстилку.
Однако при использовании обычных традиционных методов посева из
разведений на общепринятые питательные среды наибольшее количество
бактериальных таксонов выделяется все же из подстилки.
Таким образом, по вертикальной структуре лесного биогеоценоза
меняется как таксономическая структура бактериального комплекса, так и
принадлежность к определенным функциональным группам и типам
экологических стратегий. Смена таксономического состава бактерий происходит
путем последовательного обогащения каждого из горизонтов новыми
формами с сохранением таксонов, характерных для вышележащих горизонтов.
Так, в подстилке при сохранении бактерий, типичных для филлопланы,
появляются бациллы и стрептомицеты, которые становятся доминирующими
в почвенном ярусе. По вертикали лесного биогеоценоза наблюдается
природный континуум бактериальных сообществ, создаваемый теми
таксонами, которые ассоциированы с живыми растениями или растительными
остатками и практически обнаруживаются во всех ярусах. Это эккрисотрофы,
196
переходящие в сапротрофный ярус, представленные псевдомонадами, фла-
вобактериями, энтеробактериями. Они же обнаруживаются в почвенном
ярусе в ризоплане растений и кишечнике почвенных беспозвоночных. На их
фоне происходит смена групп бактерий, осуществляющих поэтапно
процессы разложения растительных остатков. Доминирующие на определенной
стадии сукцессии бактериальные таксоны (ярусные доминанты) позволяют
говорить о стратификации бактериальных сообществ в вертикальной
структуре биогеоценоза.
Смена трофических групп по вертикали биогеоценоза отражает
процесс сукцессии при разложении растительных остатков от протеобактерий
и бацилл к актиномицетам, нокардиям и облигатным олиготрофам - факт,
установленный в модельных опытах (Мишустин, Тимофеева, 1944;
Козловская, 1976). В соответствии со сменой трофических групп меняется и
тип стратегии. Следует отметить, однако, что подобное разделение очень
условно и отражает лишь тенденцию к смене эккрисотрофов (г-стратегов)
на растениях олиготрофами (^-стратегами) - в почвенных горизонтах. При
этом мы условно выделяем в таком сложном биокосном теле, как почва,
качественно иной по сравнению с вышележащими биогеоценотическими
горизонтами субстрат - минеральный компонент почв. Именно в этом
субстрате способны обитать олиготрофные бактерии, живущие по принципу
"пост-голодание". Однако это не означает, что каждому из компонентов
биогеоценоза должна строго соответствовать только одна группа
микроорганизмов со специфическими функциями и типом стратегии. Так, в
подстилке, где зарегистрированы максимальная численность и максимальное
разнообразие бактерий эпифитно-сапротрофного комплекса,
одновременно функционируют и копиотрофы, и гидролитики, и олиготрофы. В
почвенном ярусе, благодаря наличию множественных мезо- и микролокусов,
также обнаруживаются представители всех эколого-функциональных
группировок. Переработка поступающих в почву растительных остатков,
представленных преимущественно растительным опадом, происходит в
подстилке и почве при участии гетеротрофных микроорганизмов и
почвенных беспозвоночных животных. В составе лесного опада присутствуют
разнообразные соединения: самым распространенным компонентом
является целлюлоза (40-60%), меньшую долю составляют ксилан (около 20%),
лигнин, легко гидролизуемые белки и углеводы. Конечные продукты
разложения полимеров - простые сахара, а также аминокислоты,
органические кислоты и спирты.
Участие тех или иных микроорганизмов в разложении различных
материалов определяется их физиологическими свойствами, особенностями
ферментных систем, наличием внеклеточных гидролаз. Обладая широким
спектром ферментов, представители разных бактериальных таксонов
принимают участие во всех этапах разложения органического вещества,
осуществляя самые разнообразные функции. Группа грамотрицательных бактерий,
представленная родами Pseudomonas, Erwinia, Enterobacter, Flavobacterium,
питающихся в филлосфере прижизненными выделениями растений, в
подстилке начинает процесс деструкции отмерших растительных остатков. Они
используют легкодоступные водорастворимые вещества (сахара,
органические кислоты, спирты). Родококки, обнаруживаемые как на растениях, так
и в подстилке, участвуют в разложении полимеров. Они ассимилируют ор-
197
ганические кислоты, ароматические соединения, образуемые гидролитика-
ми в качестве промежуточных продуктов распада полимеров. Бактерии-гид-
ролитики в большом количестве обнаруживаются в тех компонентах
биогеоценоза, где идут активные процессы деструкции растительных остатков:
подстилке, дернине, верхних почвенных горизонтах. Они представлены ми-
ксобактериями, цитофагами, из коринеподобных бактерий - целлюломона-
дами и промикромоноспорами, актиномицетами. Эти группы бактерий
участвуют не только в разрушении таких труднодоступных полимеров, как
целлюлоза, лигнин, хитин, но способны к продуцированию литических
ферментов, разрушающих клеточные стенки бактерий и грибов, т.е. они
перерабатывают и микробную биомассу. Спорообразующие бактерии рода Bacillus
встречаются по всему почвенному профилю. Способность бацилл
образовывать споры, в виде которых они способны переживать любое стрессовое
воздействие, позволяет им обитать в любых почвенных микрозонах и давать
вспышку роста при поступлении органического вещества в почву.
Спорообразующие бактерии могут вызывать гидролиз различных полимеров:
пектина, крахмала, лигнина, хитина, а также лизировать клеточные стенки
дрожжей и грибов.
К заключительным стадиям разложения органических веществ
приурочены специфические олиготрофные бактерии - группа почкующихся и про-
стекобактерий, а также олиготрофные представители коринеподобных
бактерий - артробактер и родококки. Главная функция этих представителей
"микрофлоры рассеяния" - улавливание из рассеянного состояния
низкомолекулярных продуктов распада полимеров.
Важной экологической функцией бактерий в лесных биогеоценозах
является участие в превращениях азота. Обладая ферментами протеазой и
уреазой, бактерии разнообразных таксономических групп участвуют в
аммонификации органических веществ подстилки и почвы, однако большая
часть освободившихся азотистых веществ сразу же ассимилируются
растениями, другими микроорганизмами или включается в состав почвенного
поглощающего комплекса.
Прямое измерение выявило высокий уровень потенциальной
активности гетеротрофной нитрификации в почве хвойных лесов. Восстановленные
соединения азота окисляют представители гетеротрофных
микроорганизмов: Achromobacter, Arthrobacter, Bacillus, Pseudomonas, Corynebacterium,
Proteus, Mycobacterium, Alcaligenes, Nocardia, Streptomyces (Alexander, 1965).
К гетеротрофной нитрификации способны многие широко
распространенные в почвах денитрифицирующие бактерии, однако денитрификация в
кислых почвах не достигает значительных величин, она протекает в
основном в минеральных горизонтах и заканчивается на стадии образования
закиси азота.
Азотфиксация в лесных биогеоценозах осуществляется широким
кругом бактерий. Поскольку растения с эндосимбионтами на корнях
достаточно редки в этих экосистемах, большую роль в накоплении азота играют сво-
бодноживущие азотфиксаторы (Умаров, 1986). Спутниками бактерий в
таких ассоциациях часто бывают эукариотные организмы. В лесных биогено-
ценозах подходящим энергетическим материалом для осуществления
процесса азотфиксации может служить подстилка, обильно заселенная
грибами. Максимальное количество активных азотфиксирующих ассоциаций вы-
198
делилось из нижних слоев подстилки и гумусового горизонта, где идут
активные процессы деструкции органического вещества, минимальное - из
минеральных горизонтов. У всех изученных ассоциаций нитрогеназная
активность была выше, чем активность чистых культур. При изучении азот-
фиксации в почвах и подстилках ельника и березняка ацетиленовым
методом показано, что в подстилке интенсивность азотфиксации закономерно
увеличивалась от верхних к нижним слоям, достигая максимума в слое Н,
невысок был этот показатель в минеральном горизонте почвы. Высокий
уровень азотфиксации в нижних слоях подстилки свидетельствует о
сопряженности процессов азотфиксации и деструкции органического вещества
почвенными микроорганизмами (Умаров, Кононков, 1983).
Актиномицеты. Актиномицеты (порядок Actinomycetales) составляют
весьма обширную группу грамположительных бактерий, в пределах
которой можно обнаружить разнообразные случаи перехода от достаточно
простой клеточной дифференциации к более сложной. Понятие актиномицеты
собирательное, оно объединяет мицелиальные и амицелиальные
организмы. Следует заметить, что если генетический (и, возможно,
филогенетический) "вес" такого признака, как образование мицелия, подвергается в
настоящее время пересмотру, то внимание к экологической его значимости
лишь усиливается (Калакуцкий, Шарая, 1990). Мицелиальная организация
актиномицетов обусловливает схожесть экологических стратегий этих про-
кариотических организмов с эукариотическими мицелиальными
организмами - грибами.
В надземном ярусе на поверхности листьев бука, березы, клена,
лиственницы, лещины, ивы обнаруживаются представители рода Actinoplanes,
численность которых достигает 106 КОЕ/г исследуемого материала.
Можно предполагать, что обнаруживаемые на поверхности растений
актиномицеты (артробактерии, коринебактерии, микобактерии, стрептомице-
ты, нокардии, микромоноспоры и актинопланы) могут попадать сюда с
семян, с частичками пыли, каплями дождя, токами воздуха. Последнее
наиболее вероятно, поскольку многие актиномицеты формируют гидрофобный
воздушный мицелий, фрагментирующийся на споры. Находясь в воздухе,
споры актиномицетов приобретают электрический заряд, который
способствует адсорбции клеток гидрофобной поверхностью растений.
Деструкция органического вещества, в которой принимают участие
популяции актиномицетов наряду с популяциями других микроорганизмов в
лесных биогеоценозах, начинается с лесной подстилки. Актиномицеты
являются постоянными компонентами микробоценозов подстилки хвойного
леса (рис. 7.3). Особенно характерны темноокрашенные представители
стрептомицетов, принадлежащих к секции Cinereus и серии Chromogenes (За-
прометова и др., 1975). Бурый пигмент актиномицетов имеет меланиновую
природу (Зенова, 1965), подобен гуминовым кислотам почвы и, очевидно,
играет немаловажную роль в процессе почвообразования. Постоянное
обнаружение меланинообразующих стрептомицетов в лесной подстилке
свидетельствует об активном участии этих организмов как в деструкции
органических веществ, так и гумусировании верхнего горизонта почвы.
Сообщалось, что после деградации меченого С-лигнина в почве при участии
актиномицетов значительное количество метки было обнаружено во фракции гу-
миновых кислот (Калакуцкий, Шарая, 1990).
199
а б в г д
Рис. 7.3. Распределение представителей разных родов актиномицетов (процентное
содержание) по ярусам лесного биогеноценоза
1 - филлоярус; 2, 3 - подстилка, горизонты L и F + Н; 4 - горизонт А1; рода: а -
Streptomyces, б - Streptoverticillium, в - Streptosporangium, г - Micromonospora, д - Nocardia; род
Strepotmyces составляет 90% от всех актиномицетов во всех ярусах; на долю остальных родов
приходится 10%
Актиномицеты участвуют в разложении хвои во всех слоях подстилки. В
осенних образцах значительный удельный вес начинают приобретать кроме
белых и серых окрашенные формы стрептомицетов (табл. 7.6).
Активизация актиномицетного населения отмечена в нижних слоях F и Н подстилки,
что хорошо увязывается со способностью стрептомицетов разлагать
труднодоступные для других микроорганизмов органические вещества,
концентрирующихся здесь.
Для характеристики структуры актиномицетного комплекса применяют
количественные критерии, отражающие соотношение видов в комплексе
(Зенова, Кураков, 1988): пространственную и временную частоту
встречаемости видов, индекс разнообразия комплексов, коэффициент Серенсена,
позволяющие сравнивать между собой комплексы актиномицетов,
формирующиеся в различных экологических условиях. Использование показателей
пространственной и временной частоты встречаемости дает возможность
дифференцировать виды актиномицетов на типичные (доминантные, часто
и редко встречающиеся) и случайные. С помощью перечисленных
показателей можно характеризовать пространственно-функциональное
распределение актиномицетов по вертикальным ярусам лесного биогеоценоза
(рис. 7.4).
При относительно небольших различиях в динамике численности
таксономический состав комплекса актиномицетов разных ярусов лесного
биогеоценоза (подстилки и почвы), если его рассматривать во времени,
существенно различается, о чем свидетельствуют прежде всего величины индекса
разнообразия.
Небольшие и относительно постоянные значения индекса разнообразия в
лесной подстилке существенно возрастают в почвенных горизонтах, достигая
в июне максимума в верхних гумусированных горизонтах и снижаясь с
глубиной. Более высокие значения индекса разнообразия актиномицетов в почве
по сравнению с подстилкой свидетельствуют о большей зрелости почвы.
Структура комплекса актиномицетов определяется спектром их
таксономического состава и является следствием смены видов в процессе сукцес-
200
Индекс Шеннона
1
Lo
F + Hh
А1А2
А2
1" ■-!? А
/\ ч
/ \ »•-...
к *к ""•••-
Пч ^V
^ ч.
N ч^
^ \
4 \
Г 1 V
чд
/
/
/
/
' i
1 /
' /
*/
г ' /
\/
У*
1 ° А
1—
***..>
'"•«.#
'''•:и
3
/
■*'
2
у'
у'*
"щ
\
к
/
/
Рис. 7.4. Разнообразие комплекса актиномицетов в разных биогеоценотических
ярусах в течение года
1 - май, 2 - июнь, 3 - сентябрь
сии. Доминируют в слоях подстилки и горизонтах почвы елового леса
представители рода Streptomyces секции Cinereus серии Achromogenes. Лесная
подстилка, особенно ее верхний горизонт - L, характеризуется
ограниченным набором видов актиномицетов, здесь нет типичных частых видов,
частота встречаемости большинства видов менее 30%. Спектр типичных
частых и редких видов, как и весь набор актиномицетных видов комплекса,
значительно расширяется в почвенных горизонтах. Так, в слое подстилки L
комплекс актиномицетов представлен только стрептомицетами, причем
виды всего лишь трех секций и серий являются типичными - Cinereus и
Achromogenes, Albus и Albus, Helvolo-Flavus и Helvolus. Виды других секций
стрептомицетов являются случайными или отсутствуют вовсе. В слоях F и Н
в комплексе актиномицетов, выделяемых на казеин-глицериновом агаре,
кроме стрептомицетов, обнаруживаются представители Micromonospora саг-
bonacea; спектр типичных видов стрептомицетов расширяется по сравнению
с верхним слоем L. В верхних гумусированных горизонтах почвы спектр
типичных видов стрептомицетов дополняется представителями семи секций и
серий рода Streptomyces (представители рода Micromonospora становятся
типичными видами).
Можно предполагать, что виды стрептомицетов Streptomyces griseofus-
cus, S. antibioticus, S. nigrifaciens, S. fiimosus, принадлежащие к секции и серии
Cinereus Achromogenes, доминирующие в лесной подстилке и почве (Звягин-
201
цев и др., 1987), принимают участие в разложении органического вещества
лесной почвы, где средоопределяющими факторами являются наличие
подстилки, небольшое содержание гумуса, низкие значения рН.
Кроме доминирующих форм актиномицетов, представленных в лесном
биогеоценозе стрептомицетами, отмечено присутствие и других родов
порядка Actinomycetales, по численности на 1-3 порядка уступающих
доминирующим формам стрептомицетов. К ним относятся представители стрепто-
вертициллов и микромоноспор, наиболее частые в слоях F и Н подстилки;
стрептоспорангии, тяготеющие к верхним гумусированным минеральным
горизонтам, нокардии, выявляемые и в подстилке, и в почве (см. табл. 7.4).
Таким образом, для каждого яруса можно выделить особый специфический
комплекс актиномицетов.
Подобно другим группам микроорганизмов и по аналогии с животным
населением местообитание актиномицетов (положение их в вертикальном
континууме) коррелирует с их функциями, местом в сукцессии, типом
экологической стратегии. В филлоплане растений доминируют копиотрофы,
питающиеся простыми водорастворимыми соединениями, выделяемыми
растениями (углеводы, спирты, органические кислоты). Очевидно, актино-
планы, постоянно выделяемые с поверхности растений, приспособлены к
условиям существования в филлоплане растений и выдерживают здесь
конкуренцию с немицелиальными бактериями - эккрисотрофами. В лесной
подстилке, особенно в ее нижнем слое, и в почве, где активно идут процессы
деструкции органического вещества опада, доминируют гидролитики,
осуществляющие разложение сложных полимеров. Среди актиномицетов это
нокардии, микромоноспоры, стрептомицеты, стрептовертициллы,
стрептоспорангии, организмы, относящиеся к /- или /хгипам стратегий. Функции
актиномицетов в лесных биогеоценозах определяются прежде всего их
способностью к выделению экзогидролаз и использованию труднодоступных
субстратов. Широко известна, например, активизация актиномицетов в
природных и близких к ним условиях при внесении в почву крахмала, хитина,
кератина. Способность ряда актиномицетов к росту на лигнине и гуматах
демонстрировалась неоднократно (Калакуцкий, Зенова, 1984).
Потенциальная способность к разрушению труднодоступных
растительных полимеров (прежде всего целлюлозы) определяется наличием
соответствующих ферментов и их комплексов у актиномицетов родов Streptomyces,
Thermomonospora, Micromonospora, Cellulomonas и многих других. В
лабораторных условиях показано, что стрептомицеты проявляют большую
активность в разрушении лигноцеллюлоз трав, чем древесных растений, у разных
видов стрептомицетов могут функционировать различные механизмы
деградации лигнина. Актиномицеты ведут процесс разложения в
физиологических условиях, отличных от тех, в которых он ведется грибами-лигнино-
литиками. В гумусовом горизонте лесной почвы актиномицеты участвуют в
разложении капролитов беспозвоночных. При изучении гумусового
горизонта мулеподобного типа почвы рендзины методом прямого микроскопи-
рования обнаружено большое количество капролитов беспозвоночных,
плотно заселенных разрастаниями актиномицетов (Szabo et al., 1964).
В органоминеральном горизонте почвы актиномицеты (стрептомицеты
и нокардии) принимают участие в разложении гумусовых веществ (Аристов-
ская, 1980; Теппер, 1976). В минеральных горизонтах почвы актиномицеты
202
осуществляют наряду с другими микроорганизмами разложение минералов
и участвуют в биогенных процессах минералообразования (Аристовская,
1980).
Мицелиальные грибы. На поверхности живых растений как
древесных, так и травянистых существует специфический комплекс микроми-
цетов, представленный эпифитами, патогенами и сапротрофами (Мир-
чинк, 1988).
Мицелиальные грибы - эпифиты, обитающие на поверхности листьев и
хвои древесных пород, представлены обычно небольшим разнообразием
видов и по численности значительно уступают дрожжевым грибам и
бактериям. Мицелиальные грибы представлены среди эпифитов древесных пород
тремя-четырьмя видами (Кузнецова, 1973). Наиболее типичны среди
эпифитов на многих хвойных и лиственных породах деревьев бореальных лесов,
темноцветные дейтеромицеты семейства Dematiaceae родов Alternaria,
Cladosporium и Epicoccum, но особенно широко представлены там
мицелиальные грибы рода Aureobasidium, имеющие дрожжевую стадию. Часто на
поверхности хвои ели они являются единственными ее обитателями. Состав
видов микромицетов на листьях березы более разнообразен. Кроме
Aureobasidium pullulans, Alternaria alternata, Cladosporium herbarum, но со
значительно более низкой встречаемостью, присутствуют Fusarium
sporotrichiella, Botrytis cinerea, Acremonium roseum, Gliocladium catenulatum,
Trichoderma koningii (Озерская, Мирчинк, 1981; Мирчинк, 1988).
Для собственно эпифитных грибов характерна малая специализация по
отношению к различным породам деревьев. Преимущественно их
объединяет устойчивость к интенсивному облучению, обусловленная наличием в
мицелии этих грибов меланинов, которые служат защитой от облучения на
поверхности растений. Эти грибы характеризуются также способностью к
быстрому прорастанию спор при низкой влажности. На травянистых
растениях эпифиты также мало специализированы и преимущественно
представлены темноцветными дейтеромицетами, такими как Cladosporium herbarum,
Epicoccum nigrum, Alternaria alternata, и сумчатыми Leptosphaeria microsporica,
L. nigricans, часто им сопутствует Aureobasidium pullulans (Запрометова,
Мирчинк, 1979; Мирчинк, Демкина, 1977).
При попадании свежих листьев и хвои на подстилку на них какое-то
время сохраняются грибы, присущие только поверхности листьев и хвои, но
затем они постепенно вытесняются типичными подстилочными
сапротрофами (Parkinson, 1981). В результате временной смены видов происходит и
различное распределение грибов в пространстве по слоям подстилки (рис 7 5,
табл. 7.7). Смену видов на лесной подстилке лиственных пород в
соответствии с делением ее на слои можно представить следующим образом: сразу
после опадения листьев на растительном опаде, т.е. в слое L, еще некоторое
время (до 6 месяцев) продолжают развиваться грибы эпифиты, среди
которых преобладают Aureobasidium pullulans, Cladosporium herbarum, Epicoccum
nigrum, многие из которых обладают пектинолитической активностью,
осуществляя разложение пектина межклеточных пространств. Через шесть
месяцев, т.е. в слое F (ферментации), появляются в большом количестве
Mycogone nigra, Humicola grisea, Apospheria pulviscula, грибы родов
Trichoderma, Fusarium, Penicillium (P. frequentans, P. thomii) - активные гидро-
литики, разлагающие целлюлозу, которые могут развиваться параллельно с
203
а б в г д е ж
1
2
3
4
5
6
7
Рис. 7.5. Распределение типичных родов грибов (процентное содержание) по ярусам
лесного биогеоценоза
1 - филлоярус; 2-4 - подстилка, слои L, F, Н, 5-7 - почвенные горизонты Al, A2, В;
виды: а - Aureobasidium pullulans, б - Cladosporium herbarum, в - Thysanophora penicilloides, г -
Chrysosporium sulfureum, д - Verticillium terrestre, e - Mortierella ramanniana, ж - Penicillium
dahlias
быстрорастущими копиотрофами ("сахарными грибами"),
представленными мукоровыми. Последние снова сменяются медленно растущими целлю-
лолитиками, грибами рода Chaetomium, а затем лигнинразрушающими
грибами - подстилочными сапротрофами, представленными преимущественно
базидиальными грибами родов Collybia, Marasmius, Mycena и др. с сильно
развитым в подстилке мицелием (Частухин, Николаевская, 1969; Dickinson,
Pugh, 1974; Kendrick, Burges, 1962). Типичными для этого слоя подстилки в
хвойных лесах являются грибы родов Phialophora, Thysanophora, Mucor,
Trichoderma (Озерская, Мирчинк, 1981).
Кроме того, к основным разлагателям того или иного субстрата на всех
стадиях разложения подключаются грибы с высокой экономичностью
обмена, довольствующиеся малым содержанием доступных Сахаров и
своеобразными кинетическими параметрами, грибы олиготрофы или так называемая
"микрофлора рассеяния". Это преимущественно Mortierella ramanniana,
Mucor hiemalis, Mucor plumbeus (Заварзин, 1970; Кочкина и др., 1978;
Мирчинк, Бабьева, 1981).
Своеобразный организм, который может быть обнаружен на всех
стадиях разложения подстилки хвойных и лиственных лесов - Aposphaeria pulvis-
cula имеет низкую скорость роста в широком диапазоне концентраций
Сахаров без выраженного максимума.
При помощи специальной методики прямого накопления удалось
выделить из подстилки буковых и еловых горных лесов Карпат значительное
число родов гифомицетов в дополнение к вышеназванным в том числе два
новых - Spadicesporium и Harmoniella (Борисова, 1988). В верхних слоях
подстилки, как это отмечалось и ранее, преобладали темноцветные гифомицеты. В
подстилке буковых лесов - род Spadicesporium, а также Drechlera, Stachybotrys,
ниже они дополняются родами Verticillium, Dactylella, Papulaspora,
Endophragmium. Для верхних слоев подстилки еловых лесов характерны
Thysanophora, Trichoderma, а также Hormiactella, Verticicladium, Dactylella, в
нижних слоях к ним присоединяются Oidiodenron, Endophragmia, Gliocladium.
204
В основном смена видов по слоям подстилки и почвы идет путем
обогащения каждого последующего слоя формами из вышележащего слоя, хотя
многие из форм, поступающих из верхних слоев, могут оказаться в
нижележащих в неактивном состоянии в виде спор и начнут развиваться только при
поступлении дополнительного органического вещества. Многие виды
грибов различных слоев подстилки, переходя в верхние горизонты почвы, тем
самым дополняют набор видов, типичных для почвы, которые вследствие
этого характеризуются большим богатством и разнообразием.
Набор видов, который можно выделить из почвы, очень разнообразен.
В зависимости от числа взятых проб можно выделить несколько сотен
видов, поскольку помимо собственно почвенных в нее попадают споры из
подстилки, с поверхности растений, из воздуха. Однако комплекс постоянно
встречающихся типичных видов для определенной почвы ограничивается
обычно 15-20 видами, разными для разных почв. В подзолистых почвах
ельника с наибольшей частотой встречаются виды: Chrysosporium pannorum,
Cladosporium herbarum, Mortierella ramanniana, Trichoderma alba, Thysanophora
penicilloides.
Таким образом, вертикальное распределение мицелиальных грибов
характеризуется нарастанием числа видов в ряду: поверхность растений -
подстилка - почва (Кураков, 2001). Однако численность грибных зародышей и
биомасса их грибного мицелия достигают максимальных значений в
подстилке и значительно снижаются в почве (рис. 7.6). Из этого следует, что
подстилка лесного биогеоценоза является именно тем субстратом, в
котором происходит основная активная деятельность грибов. В почве при
большем их видовом разнообразии многие грибы находятся, видимо, в
неактивном состоянии, преимущественно в виде спор, составляя так называемый
общий микробный пул почвы. Максимальное количество грибных зародышей
находится в верхних гумусированных горизонтах почвы, с глубиной
снижаются как численность, так и разнообразие видов грибов.
Что касается корневой зоны растений, то непосредственно на
поверхности корней (ризоплана) и внутри корня (грибы-микоризообразователи) из-
за высокой специализации грибов достаточно высокой численности видовое
разнообразие их невелико. В ризосфере численность и разнообразие грибов
значительно возрастает.
Грибы осуществляют почти полную минерализацию листьев и хвои, а
также древесины и представляют собой основных агентов разложения опа-
да в лесах, разлагая его лигноцеллюлозный комплекс. Многие грибы, в
первую очередь высшие базидиальные, обладают всем комплексом целлюлоли-
тических ферментов и осуществляют многоступенчатый процесс
разложения целлюлозы до конечных продуктов в подстилке. Грибам подстилки
принадлежит значительная роль в разложении гемицеллюлоз - ксилана, араба-
на и др., а также пектиновых веществ, образующих межклеточное
вещество растительных клеток. В частности, высокой пектинолитической
активностью обладают грибы Aureobasidium pullulans, виды Cladosporium,
Alternaria, Aposphaeria. Кроме того, грибам подстилки принадлежит
уникальная роль в разложении лигнина до конечных продуктов с разрушением
ароматического кольца. Этот процесс осуществляют только базидиальные дре-
воразрушающие грибы - Coriolus versicolor, Fomes fomentarius и
подстилочные сапротрофы - виды Mycena, Marasmius. Многие несовершенные грибы
205
Индекс Шеннона Численность, КОЕ/г
2.2 2.6 3.0 100 500 900
Рис. 7.6. Изменение разнообразия (I) и численности (II) грибов-микромицетов по
ярусам лесного биогеоценоза, в течение года
1 - весна, 2 - лето, 3 - осень, 4 - зима
осуществляют отдельные стадии разложения лигнина. Обладая активными
полифенолоксидазами, они производят превращение продуктов распада
лигнина в виде различных фенольных соединений в хиноны. Такие
процессы осуществляют грибы Cladosporium herbarum, Idriella lunata, Trichoderma
koningii, T. harzianum и др. В то же время среди грибов подстилки есть виды,
появляющиеся на ранних стадиях ее разложения, использующие
легкодоступные сахара, характеризующиеся высокими скоростями роста при
высоких концентрациях субстрата, т.е. копиотрофы, которых достаточно
условно можно отнести к r-стратегам. Это некоторые виды Mucor, Rhizopus,
Absidia. Кроме того, на всех стадиях разложения подстилки
обнаруживаются грибы, как это было сказано выше, с высокой экономичностью обмена,
характеризующиеся своеобразными кинетическими параметрами,
медленнорастущие, однако имеющие максимальную скорость роста при низких
концентрациях субстрата, т.е. грибы олиготрофы или так называемая
микрофлора рассеяния. Это в первую очередь Mortierella ramanniana, Mucor
hiemalis, Aposphaeria pulviscula.
В целом можно сказать, что большинство грибов подстилки отличается
полифункциональностью, т.е. одни и те же виды могут осуществлять
разнообразные процессы (Кураков, 2001).
Дрожжевые грибы. С одноклеточной организацией дрожжевых грибов
сопряжены и многие их физиологические особенности, в частности
сравнительно узкий спектр усваиваемых соединений, отсутствие мощных
гидролитических систем, часто встречающаяся способность к неэффективному
метаболизму за счет спиртового брожения. В целом дрожжи в наибольшей
степени соответствуют понятию сахаролитические грибы. В природе
дрожжи особенно многочисленны в местообитаниях с повышенным
содержанием Сахаров. В лесных биогеоценозах наиболее изученными из них являются
цветочный нектар, весенние истечения флоэмного сока деревьев, буровая
мука в ходах жуков-ксилофагов, сочные сахаристые плоды, разлагающиеся
плодовые тела грибов, кишечный тракт многих беспозвоночных-фитофагов
206
и т.п. В таких местообитаниях численность дрожжей может достигать 100%
грибной биомассы. При этом характерно доминирование дрожжей аскоми-
цетового аффинитета, классифицируемых в порядке Saccharomycetales.
Однако распространение дрожжей не ограничивается только
подобными локусами. С той или иной вероятностью их можно выделить из любых
биогеоценотических ярусов: живых и мертвых частей растений, из
растительных остатков и лесных подстилок, из верхних и более глубоких
горизонтов почв. Численность дрожжей в таких местообитаниях существенно
ниже, чем в высокосахаристых локусах, и обычно не превышает 105 КОЕ/г.
Дрожжи представлены здесь в основном видами базидиомицетового
аффинитета, причем очень характерно доминирование эврибионтных видов, не
связанных строго с определенными типами местообитаний. В их
распределении по биогеоценотическим ярусам прослеживаются определенные
закономерности, которые исследованы достаточно подробно (Бабьева и др.,
1973,1999).
Живые листья и неодревесневшие ветви сосудистых растений, а также
живые части мхов для развития большинства видов дрожжей являются
наиболее благоприятным субстратом. На них были отмечены максимальные
значения численности и разнообразия дрожжевых грибов (до 105 КОЕ/г).
Всего в образцах этих субстратов обнаруживается более 70% от общего
числа видов, обитающих в лесных биогеоценозах. Наиболее часто на живых
листьях встречаются представители родов Rhodotorula, Sporobolomyces,
Cryptococcus, Bullera. Доминируют виды Sporobolomyces roseus
(встречаемость около 80%), Cryptococcus laurentii (70%), Rhodotorula fujisanensis (40%),
R. minuta (20%), R. mucilaginosa (20%).
Численность дрожжевых грибов в филлоплане зависит как от
таксономической принадлежности растений, так и от их экологических
особенностей. Наиболее достоверные различия наблюдаются при сравнении эпифит-
ных дрожжевых сообществ, формирующихся на листьях растений различных
экологических групп. На поверхности еловой хвои и на листьях ксерофитов
(например, Vaccinium) численность и разнообразие дрожжевых грибов
достоверно ниже, чем на листьях мезофитных травянистых растений и лиственных
деревьев. Максимальные значения численности отмечены на поверхности
гигрофитных растений, таких, как Oxalis acetosella, и живых частях
приземных мхов. По всей видимости, снижение численности эпифитных дрожжей на
листьях ксерофитных растений связано с наличием более толстой кутикулы,
ограничивающей выделение экссудатов, которые являются основным
источником питания эпифитных дрожжей. Среди живых надземных частей
растений наименее заселены дрожжами одревесневающие части растений, в
частности молодые ветви кустарничков и деревьев, что также можно объяснить
более низкой экссудацией, по сравнению с листьями.
Дрожжи обильны и на мертвых частях растений, особенно на сухих, но
находящихся на корню листьях и ветвях сосудистых растений, а также
мертвых частях мхов. Принципиальное отличие этих субстратов от живых
частей растений - отсутствие прижизненных экссудатов с относительно
высокой концентрацией легкодоступных соединений, поэтому для сахаролитиче-
ских дрожжей мертвые части растений служат менее благоприятной средой
обитания, что проявляется в особенностях формирующихся на них
дрожжевых сообществ. Общее обилие (в среднем 104 КОЕ/г) и разнообразие дрож-
207
жей здесь несколько ниже, чем на живых листьях. Наиболее часто на сухих
листьях встречаются Cryptococcus albidus, С. laurentii, Sporobolomyces roseus,
т.е. те же обычные эпифитные дрожжи, которые доминируют и на живых
частях растений. В то же время, на мертвых частях обнаруживаются
типичные сапротрофные и педобионтные виды, такие, как Trichosporon pullulans и
Cryptococcus terricola.
Дрожжевое население свежего растительного опада (опавших листьев и
мелких ветвей, сохраняющих основные черты анатомического строения) по
численности и таксономической структуре также не сильно отличается от
группировок на мертвых надземных частях растений. Численность
дрожжевых грибов здесь колеблется в пределах от 103 до 105 КОЕ/г и в среднем не
ниже, чем на сухих листьях. Однако видовое разнообразие дрожжей здесь
заметно меньше. Так же как и на надземных частях растений, наиболее
обильны эврибионтные дрожжи Cryptococcus albidus и С. laurentii, которые
обнаруживаются примерно в 70% образцов. В то же время в опаде заметно
ниже встречаемость типичного эпифитного вида Sporobolomyces roseus,
очень редко встречаются пигментированные виды рода Rhodotorula, а также
аскоспоровые дрожжи из родов Debaryomyces, Metschnikowia, Pichia и ана-
морфные аскомицетовые дрожжи Candida spp., которые достаточно
обычны на надземных, особенно живых частях растений.
В нижних слоях подстилки: ферментации (F) и гумусообразования (Я),
характер дрожжевого населения существенно меняется. Средняя
численность дрожжей в этих слоях подстилки составляет всего 103 КОЕ/г.
Таксономическая структура дрожжевого населения подстилки существенно
отличается от надземных частей растений. Хотя доминируют здесь те же
типичные эврибионты Cryptococcus albidus и С. laurentii, в качестве субдоминантов
выступают виды Trichosporon pullulans и Cystofilobasidium capitatum, которые
очень редко обнаруживаются на листьях растений и в свежих растительных
остатках. Достаточно часто обнаруживается типично почвенный вид
Cryptococcus terricola.
Характеристики структуры дрожжевых группировок, формирующихся
в подповерхностных, и особенно в более глубоких слоях исследованных
почв, говорят о том, что почва - наименее благоприятная среда обитания
для дрожжевых грибов. Средняя численность дрожжей непосредственно под
подстилкой составляет около 103 КОЕ/г. Во всех типах почв количество
дрожжей резко убывает вниз по профилю, и на глубине более 15 см обычно
находится на пределе чувствительности метода посева (102 КОЕ/г). В
отличие от растительных субстратов, дрожжи в отдельных почвенных образцах
удается обнаружить далеко не всегда, в среднем их встречаемость в
органогенных горизонтах составляет около 70%, а в иллювиальном горизонте не
превышает 50%. На глубине более 20-25 см дрожжевые грибы практически
не обнаруживаются при посевах на сусло-агар.
Среди дрожжей, выделяемых из лесных почв обнаружены типичные са-
пробионты (Cystofilobasidium capitatum, Trichosporon pullulans), а также
характерные эпифитные виды (Cryptococcus laurentii, Sporobolomyces roseus,
Rhodotorula glutinis, R. mucilaginosa). Интересной особенностью верхних
почвенных горизонтов является постоянное присутствие аскомицетовых
дрожжей, в основном анаморфных, близких к родам Pichia, Debaryomyces,
Hanseniaspora.
208
Особенно интересный вопрос - существование автохтонных почвенных
дрожжей, т.е. тех, которые проводят в почве весь жизненный цикл и для
которых минеральные горизонты почв являются наиболее естественным
местообитанием (Бабьева, 1976; Бабьева и др., 1978). Липомицеты -
единственные дрожжи, которые пока можно с достаточной уверенностью относить к
автохтонным почвенным дрожжам, представляют собой достаточно
специфическую филогенетическую линию аскомицетовых грибов и настолько
отличаются от остальных дрожжей по своим экофизиологическим преферен-
думам, что не учитываются обычными методами посева на сахаросодержа-
щие среды, включая сусло-агар. Что касается других видов дрожжей, то
среди них нет ни одного, который бы подобно липомицетам выделялся
исключительно из почв и не встречался бы на растениях и растительных остатках.
Тем не менее, у трех анаморфных видов базидиомицетового аффинитета,
относящихся к роду Cryptococcus, встречаемость в органогенных и
минеральных горизонтах почв достоверно выше, чем в других типах субстратов.
Это виды С. podzolicus, С. terreus и С. terricola. Интересно, что для всех этих
видов характерны те же микроморфологические черты, что и для липоми-
цетов, а именно интенсивное накопление в шаровидных клетках
внутриклеточных липидов в виде крупных глобул при росте на богатых средах,
образование мощных полисахаридных капсул. Исходя из всех этих особенностей
морфологии и распространения мы объединяем эти виды вместе с
представителями рода Lipomyces в экоморфологическую группу педобионтных
дрожжей.
Таким образом, в распределении дрожжевых сообществ по элементам
вертикальной структуры биогеоценоза прослеживаются определенные
закономерности. Для дрожжей, как для типичных представителей сахаролити-
ческих организмов, важнейшим фактором является концентрация
легкодоступных питательных веществ, которая закономерно снижается в простран-
ственно-сукцессионном ряду: живые растения - подстилка - почва. Поэтому
для дрожжевых грибов растительные субстраты в ходе разложения
становятся все более экстремальной средой обитания. Это проявляется и в
особенностях структуры дрожжевых сообществ.
Прежде всего, обращает на себя внимание монотонное убывание общего
обилия дрожжей от 104-105 КОЕ/г на живых растениях до 102 КОЕ/г в
почвенных горизонтах (рис. 7.7). По стадиям пространственно-сукцессионного
ряда закономерно изменяются также все параметры видового разнообразия
дрожжевых сообществ. Снижается среднее количество видов, которое
удается обнаружить в отдельном образце субстрата (от пяти-шести видов в
образцах зеленых частей растений до двух в минеральных почвенных горизонтах).
Все более выраженным становится доминирование одного вида.
Для каждой стадии пространственно-сукцессионного ряда характерен
свой набор видов, которые могут быть обнаружены в качестве
доминирующих в отдельной дрожжевой группировке (табл. 7.8). На надземных
частях растений преобладают виды с выраженными адаптивными
признаками эпифитов (наличие каротиноидного пигмента, полисахаридных капсул,
активно отстреливающихся баллистоспор). Для разлагающихся
растительных остатков наиболее типичны дрожжеподобные грибы, которые
характеризуются наличием развитого истинного мицелия, более высокой
гидролазной активностью, способностью разлагать ксилан, другие геми-
209
Среднее число видов Численность, КОБ/г
в образце (логарифмы)
2 3 4 5 3 4 5
Живые части
растений
Мертвые части
растений
Подстилка
Горизонт А
Горизонт В
Рис. 7.7. Изменение общей численности и видового разнообразия дрожжевых
группировок в пространственно-сукцессионном ряду
целлюлозы, пектины, фенольные соединения. Наконец, в минеральных
горизонтах почв преобладают типичные педобионты, для которых
характерно отсутствие пигментации, накопление внутриклеточных липидов,
образование капсул.
Таким образом, пространственно-сукцессионный ряд следует
рассматривать как важнейший экологический градиент в организации дрожжевого
населения лесных биогеоценозов, в котором существенно меняются все
основные параметры дрожжевых сообществ.
В целом дрожжи являются важным, хотя и не доминирующим,
компонентом микробного населения лесных биогеоценозов и выполняют в них
разнообразные функции, которые можно свести к следующим:
- "подбирание" прижизненных выделений растений и "запуск" сукцессии
при разложении растительных остатков (многие фитобионтные виды типа
Cryptococcus laurentii и Sporobolomyces roseus);
- гидролиз растительных полимеров типа крахмала или пектина на
начальных стадиях деструкции растительных остатков в верхних слоях почвы
(сапробионтные дрожжеподобные грибы, такие, как Trichosporon pullulans и
Cystofilobasidium capitatum);
- по-видимому, улавливание остаточных легкодоступных веществ в
минеральных горизонтах почв со способностью переживать неблагоприятные
условия за счет капсул и внутриклеточных запасных веществ (педобионт-
ные виды Lipomyces spp., Cryptococcus terricola);
- эксплерентное освоение локусов с высоким содержанием
легкодоступных источников питания, прежде всего Сахаров (сахаробионты, к которым
относится большинство аскомицетовых дрожжей из порядка
Saccharomycetales).
■ i i I i
210
Мониторинг бактериальных сообществ почв лесного заповедника
На территории Центрально-Лесного государственного биосферного
заповедника представлены ненарушенные лесные биогеоценозы южной части
бореальной зоны. В этих биогеоценозах сформировался почвенный покров,
составные части которого (почвы) приурочены к определенным элементам
рельефа, почвообразующим породам и типам леса, различаются степенью
дифференциации профиля на генетические горизонты, наличием и
характером преобразования элювиальной по илу толщи, морфологией
диагностических горизонтов и рядом химических показателей (Головченко и др., 1995;
Терехова и др., 1999). Ниже представлены результаты шестилетнего
мониторинга за динамикой структуры бактериальных сообществ.
Из различных субстратов были выделены бактерии, отнесенные к семи
таксономическим группам: спириллы, миксобактерии, цитофаги, группа
грамотрицательных бактерий, включающая роды Flavobacterium,
Pseudomonas и Xanthomonas, коринеподобные бактерии, бациллы и стрепто-
мицеты. Анализ распределения бактерий по элементам вертикальной
структуры ельника черничного и ельника неморального подтвердил
установленные ранее для других типов леса закономерности в пространственном
размещении микробных сообществ (Звягинцев и др., 1991, 1993).
Различия между бактериальными комплексами вертикально-ярусных
элементов экосистемы проявились при анализе вероятности доминирования
различных таксономических групп. Этот показатель определяли как
отношение образцов, в которых данная таксономическая группа составляет
более 30% от общей численности бактерий, к общему количеству
проанализированных образцов. Прежде всего обращает на себя внимание частое
доминирование бактерий-гидробионтов, представленных спириллами, во всех
элементах вертикально-ярусной структуры ельников. Частота
доминирования других групп бактерий зависела от характера субстрата. На растениях в
круг потенциальных доминантов входили коринеподобные бактерии и гра-
мотрицательные бактерии родов Flavobacterium, Pseudomonas и Xanthomonas.
В подстилках более значимой группировкой наряду со спириллами
становились скользящие бактерии. В почвенном ярусе содоминантами спирилл
были бациллы и стрептомицеты. Спектр стрептомицетов в подстилках и в
почвах был представлен секциями и сериями, характерными для лесных
биогеоценозов таежной зоны (Зенова и др., 1996).
В результате идентификации основных бактериальных доминантов
было установлено, что среди спорообразующих бактерий, представленых
пятью видами, доминируют факультативно-анаэробные виды - Bacillus circu-
lans и В. cereus. Видовой спектр бактерий рода Cytophaga (6 видов) также
включал редкий для представителей этого рода факультативно-анаэробный
вид Cytophaga succinicans.
Использование сукцессионного подхода для анализа бактериального
разнообразия позволило выявить более широкий спектр бактериальных
таксонов в исследуемых почвах (Алехина и др., 1997). Так, в буроземе помимо
выше указанных групп были выявлены на разных этапах сукцессии азоспи-
риллы и факультативно-анаэробные протеобактерии семейств
Enterobacteriaceae и Vibrionaceae, среди актинобактерий - Promicromonospora
и Micromonospora. Была обнаружена также приуроченность микромоноспо-
ровых актиномицетов в большей степени к белоподзолистой почве, чем к
211
бурозему, что связано с адаптацией этих прокариот (гидрофильность спор и
микроаэрофильность мицелия) к избытку влаги в белоподзолистой почве
(Зенова, Звягинцев, 1997).
Информационное разнообразие бактерий (индекс Шеннона) было
максимальным в подстилках обоих типов почв, особенно в слое F
(ферментации). Однако спектр потенциальных доминантов был шире в буроземе
(Алехина и др., 1997; Головченко и др., 1995).
Различия между почвами были выявлены и при сравнении
бактериальных комплексов почвенных горизонтов, что связано, как указывалось
раннее, с особенностями строения их органопрофиля. Так, бактериальное
разнообразие в почвенном ярусе бурозема было выше, чем в белоподзолистой
почве, благодаря наличию следующего за подстилкой гумусированного
горизонта, который содержит больший спектр бактериальных таксонов, чем
белоподзолистая почва, подстилку которой сменяет обедненный
подзолистый горизонт.
Иллювиальные горизонты почв отличались по родовому составу кори-
неподобных бактерий, являющихся характерными их обитателями. В
буроземе коринеподобные бактерии более разнообразны. Они были
представлены артробактером, родококками и микрококками, причем доля артробакте-
ра составляла 87%. В белоподзолистой почве артробактер отсутствовал, его
заменяли желтопигментированные, неидентифицированные нами до рода
коринеподобные бактерии, которые составляли примерно равные доли с
другими представителями актинобактерий.
Мониторинг за сезонной и годовой динамикой структуры
бактериальных комплексов позволил оценить (с помощью факторного дисперсионного
анализа) влияние различных факторов на показатели численности и
разнообразия выявляемых бактериальных группировок. Оценивали влияние
следующих факторов: тип почвы, тип субстрата (тип горизонта) и погодные
условия года исследования. Выявлено достоверное (при уровне значимости
0.90) влияние типа субстрата на численность бактерий сапротрофного
комплекса. Плотность бактериальных популяций постепенно убывает от
подстилок к иллювиальным горизонтам, на этом фоне как сезонные, так и
годовые колебания численности весьма незначительны.
На таксономический состав бактериальных комплексов достоверное
влияние оказывало (в порядке убывания степени влияния) количество
выпавших осадков, тип субстрата и тип почвы. Индекс Шеннона,
характеризующий информационное разнообразие сообщества, был самым низким во
всех биогеоценотических горизонтах бурозема и белоподзолистой почвы в
год с наименьшим количеством выпавших осадков. В этом же году
проявились и наиболее четкие различия по индексу Шеннона как между типами
почв, так и между горизонтами. В более "влажные" годы при более высоких
общих показателях разнообразия эти различия были сглажены (Головченко
и др., 1995).
Влажность определяла и характер распределения бактерий по ярусам.
В те сроки анализа, когда почвы были насыщены водой почти до ее водо-
вместимости, наблюдалось континуальное распределение бактерий в
пределах всей полуметровой толщи, включая подстилки. В более засушливые
периоды, когда влажность почвы была меньше, чем общая (наименьшая)
влагоемкость, наблюдали дискретный тип распределения бактериальных
212
таксонов, т.е. регистрировали четкие различия между составом и
соотношением родов в бактериальных сообществах подстилочного и почвенного
ярусов. При этом в подстилке доминировали скользящие бактерии (цито-
фаги и миксобактерии), а в почвенных горизонтах - бациллы и коринепо-
добные бактерии.
В зависимости от влажности года принципиально изменялась структура
бактериального комплекса в белоподзолистой почве. При высокой
влажности доминировали спириллы - типичные гидробионты, при более низкой
влажности - миксобактерии, при этом в 10 раз увеличивается доля бацилл.
При дальнейшем высушивании почвы в лабораторных условиях (на воздухе)
продолжает увеличиваться доля бацилл до 40%, т.е. эта группа становится
доминирующей, одновременно возрастает содержание коринеподобных
бактерий и стрептомицетов. Аналогичную картину увеличения
относительного обилия актинобактерий и бацилл наблюдали в процессе лабораторного
высушивания дерново-глеевой почвы (Алехина, Добровольская, 1999).
Такая структура бактериального комплекса не свойственна исследуемым
почвам при анализе их в естественном состоянии без предварительного
высушивания образцов. В то же время в подзолистых песчаных почвах Окского
заповедника Рязанской области (из-за легкого механического состава и
большей прогреваемости почв) наблюдается иногда такая же картина в
соотношении бактериальных группировок, как и при искусственном высушивании
почвенных образцов: доминирование бактерий актиномицетной линии и
бацилл, т.е. форм, устойчивых к высушиванию (Добровольская и др., 1995).
Все это свидетельствует о том, что исследуемые нами почвы находятся
постоянно, независимо от сезона и года, в условиях сильного переувлажнения,
поэтому таксономическая структура бактериального комплекса,
определяемая прежде всего влажностью, незначительно меняется в зависимости от
сезона и типа почвы (Головченко и др., 2000).
* * *
Анализ распределения микроорганизмов по компонентам вертикальной
структуры лесных биогеоценозов позволил выявить общие закономерности
в пространственном размещении и организации микробных сообществ:
- изменение численности и таксономической структуры всех групп
микроорганизмов по ярусам биогеоценоза;
- максимальная концентрация биоты в лесных подстилках;
- отражение в стратификации подстилок этапов сукцессии, связанных с
конвейерной переработкой растительного опада микроорганизмами;
- корреляция между местоположением микроорганизмов в
вертикальной структуре биогеоценоза, их функциями, местом в сукцессии, типом
экологической стратегии.
Все эти закономерности подтверждают, что общебиологические законы
вертикальной дифференциации природных сообществ распространяются и
на микроорганизмы.
Рассмотренные нами группы биоты составляют основной сапротроф-
ный блок, осуществляющий совместно с почвенными животными
биогенную деструкцию органического вещества в лесных биотах. Ферменты,
выделяемые микроорганизмами, столь разнообразны, что позволяют
осуществлять деструкцию всех сложных полимеров, входящих в состав раститель-
213
ных и животных остатков - лигнина, целлюлозы, гемицеллюлозы, хитина,
пектиновых веществ, крахмала и др.
Основная деятельность микроорганизмов по переработке растительного
опада приурочена к наземному (лесная подстилка) и почвенному
(примыкающий к ней верхний гумусированный горизонт) биогеоценотическим
горизонтам. В этих горизонтах максимально концентрируются все группы
микроорганизмов, теснейшим образом связанные в единые детритные пищевые
цепи. Причем стратификация этих горизонтов является отражением
конвейерной переработки растительного опада и соответствует определенным
стадиям сукцессии. В верхнем слое подстилки, состоящем из почти ненарушенных
листьев, трав, хвои, мхов происходит использование водорастворимых
мономеров, вымываемых из опада либо образующихся в результате расщепления
сложных растительных полимеров. Здесь же происходит разложение белков,
пектиновых веществ, крахмала. Эти процессы осуществляются бактериями и
дрожжевыми грибами (копиотрофами, r-стратегами), попадающими в
подстилку из надземного яруса. Это эпифиты, переходящие в сапротрофный
ярус: псевдомонады, эрвинии, дрожжеподобный гриб Aureobasidium pullulans,
криптококки, спороболомицеты, а также "сахарные грибы" - мукоровые,
представители родов Talaromyces, Emericellopsis (сумчатые грибы), родов
Cephalosporium, Penicillium, Fusarium (несовершенные грибы).
В ферментационном слое подстилки начинается расщепление одного из
главных полимеров, входящих в состав стенок растительных клеток -
целлюлозы. Оно осуществляется прежде всего грибами-целлюлолитиками. Это
сумчатые грибы (роды Chaetomium, Talaromyces), дейтеромицеты (роды
Trichoderma, Alternaria, Cladosporium), из дрожжей - Cystofilobasidium capita-
turn. В деструкции целлюлозы участвуют также стрептомицеты и бактерии,
представленные как аэробными, так и анаэробными формами. Это миксо-
бактерии из подпорядка Sporanginae, целлюломонады, клостридии. Все эти
организмы - типичные гидролитики, способные к синтезу комплекса цел-
люлазных ферментов. Это /-стратеги, образующие различные покоящиеся
формы для выживания - споры, конидии, цисты.
В нижнем слое подстилки Н гидролизуется один из самых
труднодоступных полимеров - лигнин. Его деструкцию осуществляют в основном базиди-
альные грибы родов Collybia, Marasmius, Mycena и др., а также некоторые
виды стрептомицетов. Промежуточные продукты распада лигнина -
различные фенольные соединения типа ванилиновой и оксибензойной кислот,
сиреневого альдегида и др. используются, такими бактериями, как родокок-
кус, псевдомонас, азотобактер.
В верхних гумусированных горизонтах почв, где сосредоточено
множество мицелиальных эукариотных микроорганизмов, клеточные стенки
которых инкрустированы хитином, сконцентрированы актиномицеты -
организмы, образующие внеклеточные хитиназы, способные разрушать
клеточные стенки грибов. Среди одноклеточных бактерий такой способностью
обладают очень немногие представители. Как продуценты хитиназ известны
лишь некоторые виды бацилл и цитофагов. Здесь же осуществляется
деструкция и гумусовых веществ под воздействием стрептомицетов, микромоно-
спор, нокардий, псевдомонад.
На гифах грибов поселяются типичные олиготрофные бактерии -
Metallogenium, Hyphomicrobium, это А>стратеги, относящиеся к микрофлоре
214
рассеяния. Они медленно растут и с трудом культивируются на
искусственных питательных средах. В качестве источников питания они извлекают из
рассеянного состояния различные мономеры, освобождающиеся в процессе
разложения полимеров гидролитиками. В почвенном ярусе
обнаруживаются олиготрофы и среди дрожжей - Lipomyces, и среди грибов - Mortierella
ramanniana, Penicillium dahliae.
Итак, при переходе от одного биогеоценотического горизонта к
другому наблюдается изменение типа субстрата. Как результат конвейерной
переработки растительного опада микроорганизмами эти изменения
определяют ход сукцессии.
Сукцессионные ряды микроорганизмов, наблюдаемые по вертикальной
структуре лесных биогеоценозов, соответствуют таковым, полученным в
модельных опытах по разложению растительных остатков. Для бактерий
эти ряды соответствуют сменам следующих группировок: псевдомонады -
бациллы - актиномицеты - олиготрофные бактерии. Для грибов: сахарные
грибы - целлюлолитики - лигнинразрушающие.
Кроме вертикальных градиентных сообществ микроорганизмов
наблюдается континуум тех группировок, которые являются характерными, но
часто минорными компонентами, обнаруживаемыми в каждом ярусе
биогеоценоза. Это псевдомонады и родококки среди бактерий, "сахарные грибы"
Мисог или Rhizopus или олиготрофные грибы - например Mortierella
ramanniana.
Таким образом, процесс разложения растительных остатков
осуществляется в результате сложной многообразной и многоступенчатой
деятельности комплекса редуцентов, состоящего из грибов, бактерий, почвенных
животных, тесно связанных между собой. Рассуждения об экологической
значимости одних организмов и малой значимости других не имеют смысла.
"Важна та суммарная роль, которая выполняется всем комплексом
почвенных организмов в процессах круговорота веществ и энергии" (Гиляров,
1968).
Литература
Алехина Л.К,, Добровольская ТТ. Динамика структуры бактериальных
комплексов дерново-глеевой почвы в процессе ее высушивания // Почвоведение. 1999.
№9. С. 1140-1143.
Алехина Л.К., Невская Д.В., Добровольская ТТ.У Звягинцев Д.Г. Бактериальное
разнообразие в лесных почвах (Сукцессионный анализ) // Микробиология, 1997.
Т. 66, № 4. С. 558-562.
Арисшовская Т.В. Микробиология подзолистых почв. М.; Л.: Наука, 1965,183 с.
Аристовская Т.В. Микробиология процессов почвообразования. Л.: Наука,
1980.186 с.
Арнолъди К.В., Арнолъди Л.В. О биоценозе как одном из основных понятий
экологии, его структуре и объеме // Зоол. журн. 1963. Т. 42. С. 161.
Бабъева И.П. Почвенные дрожжи - экология и география // Проблемы и
методы биологической диагностики и индикации почв. М.: Наука, 1976. С. 71-90.
Бабъева И.П. Дрожжи в биогеоценозах разных природных зон // Почвенные
организмы как компоненты биогеоценозов. М.: Наука, 1984. С. 131-141.
Бабъева И.П., Голубев В.И., Картинцев А.В. Дрожжи в структуре лесных и
луговых биогеоценозов // Вестн. МГУ. Сер. биология, почвоведение, 1973. № 6.
С. 67-73.
215
Бабъева И.П., Горин С.Е., Марченко А.И. Липомицеты - автохтонные
почвенные дрожжи // Биол. науки. 1978. № 1. С. 108-112.
Бабъева И.П., Картинцева А.А., Максимова И.А., Чернов И.Ю. Дрожжевые
грибы в ельниках Центрального лесного государственного биосферного
заповедника // Вестн. МГУ. Сер. 17. Почвоведение. 1999. № 4. С. 45-49.
Борисова В.Р. Гифомицеты лесной подстилки в различных экосистемах. Киев:
Наук, думка, 1988. 250 с.
Васильева Л.В. Олиготрофы как компонент биогеоценоза // Почвенные
организмы как компоненты биогеоценоза. М: Наука, 1984. С. 81.
Васильева Л.В., Заварзин ГА. Диссипотрофы в микробном сообществе.
Микробиология. 1995. Т. 64, № 2. С. 239-244.
Гелъцер ЮТ Простейшие (Protozoa) как компонент биоты почв таежной зоны //
Микроорганизмы как компонент биогеоценоза. Материалы Всесоюз. симпоз.
Алма-Ата, 1982. С. 9.
Гелъцер ЮТ. Почвенные простейшие естественных биогеоценозов и агроцено-
зов // Почвенные организмы как компоненты биогеоценоза. М.: Наука, 1984. С. 185.
Гиляров М.С. Почвенный ярус биогеоценозов суши // Успехи соврем, биологии.
1968. Т. 66. С. 121.
Головченко А.В., Добровольская ТТ. Численность и структура микробных
комплексов в контрастных почвах мезоморфного ряда ельников южной тайги //
Вестн. МГУ. Сер. 17, Почвоведение. 1995. № 3. С. 57-64.
Головченко А.В., Добровольская ТТ., Максимова И.А. и др. Структура и
функции микробных сообществ почв южной тайги // Микробиология. 2000. Т. 69, № 4.
С. 453-464.
Головченко А.В., Добровольская ТТ., Чернов И.Ю. Структура бактериальных
комплексов в заповедных ельниках // Почвоведение. 1995. № 9. С. 1121-1124.
Гузев B.C., Иванов П.И. Функциональная структура зимогенной части
микробной системы почв // Изв. АН СССР. Сер. биол. 1986. № 5. С. 739-746.
Добровольская ТТ., Меньших Т.Б., Чернов И.Ю. и др. Бактерии
гидролитического комплекса в лесных гидроморфных почвах // Почвоведение. 2000. № 10.
С. 1242-1246.
Добровольская ТТ., Павлова О.С, Полянская Л.М., Звягинцев ДТ.
Бактериальные комплексы лесных биогеоценозов Окского заповедника: пространственная
структура и таксономическое разнообразие // Микробиология. 1995. Т. 64, № 6.
С. 829-833.
Заварзин ТА. К понятию микрофлоры рассеяния в круговороте углерода //
Журн. общ. биологии. 1970. № 4. С. 386.
Запрометова К.М., Зенова Г.М., Сорокина Л.Е. Закономерности развития
почвенных микроорганизмов. Л.: Наука, 1975. 231 с.
Запрометова К.М., Мирчинк ТТ. Пигменты темноокрашенных грибов и их
экологическая роль // Микробные метаболиты. М.: Изд-во МГУ. 1979. С. 193-209.
Звягинцев ДТ. Почва и микроорганизмы. М.: Изд-во МГУ, 1987. 256 с.
Звягинцев ДТ., Бабъева И.П., Добровольская ТТ. и др. Вертикально-ярусная
организация микробных сообществ лесных биогеоценозов // Микробиология, 1993.
Т. 62, № 1.С. 5-36.
Звягинцев ДТ, Добровольская ТТ9ЛысакЛ.В. Вертикальный континуум
бактериальных сообществ в наземных биогеоценозах // Журн. общ. биологии. 1991.
Т. 52. С. 162-171.
Звягинцев ДТ., Зенова Г.М., Сорокина Л.Е. Сравнительная характеристика
комплексов почвенных актиномицетов лесного и агроценоза // Вестн. МГУ. Сер. 17,
Почвоведение. 1987. № 4. С. 20-23.
Звягинцев ДТ, Кочкина ТА., Кожевин П.А. Новые подходы к изучению сук-
цессий микроорганизмов в почве // Почвенные организмы как компоненты
биогеоценоза. М.: Наука, 1984. С. 81-102.
216
Зенова ГМ. Меланоидные пигменты актиномицетов // Микробиология. 1965.
Т. 34, № 2. С. 278-283
Зенова Г.М., Грачева Т.А., Манучарова Н.А., Звягинцев Д.Г Актиномицетные
сообщества лесных экосистем // Почвоведение. 1996. № 2. С. 1347-1351.
Зенова ГМ., Звягинцев Д.Г. Экологический статус актиномицетов рода
Micromonospora // Там же. 1997. № 3. С. 376-383.
Зенова ГМ., Кураков А.В. Методы определения структуры комплексов
почвенных актиномицетов и грибов. М.: Изд-во МГУ, 1988. 54 с.
Калакуцкий Л.В., Зенова ГМ. Экология актиномицетов // Успехи
микробиологии, 1984. Т. 19. С. 203-223.
Калакуцкий Л.В., Шарая Л.С. Актиномицеты и растения // Там же. 1990. Т. 24.
С. 26-65.
Карпачевский Л.О. Лес и лесные почвы. М.: Лес. пром-сть, 1981. 262 с.
Кожевин П.А., Кочкина ГА., Ягодина ТТ., Звягинцев Д.Г. О критериях
микробной сукцессии в почве // Микробиология. 1980. Т. 49, № 2. С. 335-341.
Козловская Л.С. Роль беспозвоночных в трансформации органического
вещества болотных почв. Л.: Наука, 1976. 211 с.
Кочкина Г.А., Мирчинк ТТ., Кожевин П.А., Звягинцев Д.Г. Особенности
радиальной скорости роста грибов в связи с их экологией // Микробиология. 1978. Т. 47,
№ 5. С. 964-965.
Кузнецов СИ. Развитие идеи С.Н. Виноградского в области экологической
микробиологии // XI чтения имени С.Н. Виноградского. М.: Наука, 1974. С. 5.
Кузнецова Т.Г. Микрофлора растений и почв. Новосибирск: Наука, 1973. 55 с.
Кураков А.В. Методы выделения и характеристики структуры комплексов
микроскопических грибов наземных экосистем: Учеб.-метод. пособие. М.: МАКС
пресс, 2001. 92 с.
Миркин Б.М. Теоретические основы современной фитоценологии. М.: Наука,
1985. 136 с.
Мирчинк Т.Г. Почвенные грибы как компонент биогеоценоза //
Микроорганизмы как компонент биогеоценоза. М.: Наука, 1984. С. 114-130.
Мирчинк Т.Г Почвенная микология. М.: Изд-во МГУ, 1988. 220 с.
Мирчинк Т.Г, Бабъева И.П. Грибы, образующие мицелий, и дрожжи в
природных экосистемах // Журн. общ. биологии. 1981. Т. 42, № 3. С. 390-398.
Мирчинк Т.Г, Демкина Т.С. Экология темноокрашенных грибов подстилки.
Вестн. МГУ. Сер. 17, Почвоведение. 1977. № 2. С. 59-64
Мишустин Е.Н., Тимофеева А.Г. Смена микрофлоры при процессе разложения
органических остатков в связи с развитием в почве Вас. mycoides // Микробиология.
1944. Т. 13. С. 272.
Озерская СМ., Мирчинк Т.Т. Смена видов грибов - микромицетов по мере
разложения березового опада // Микология и фитопатология. 1981. Т. 15, № 2.
С. 97-101.
Паников Н.С Особенности кинетики микробного метаболизма в природных
средах // Экологическая роль микробных метаболитов. М.: Изд-во МГУ, 1986.
С. 140.
Пианка Э. Эволюционная экология. М.: Мир, 1981. 399 с.
Работное ТА. Фитоценология. М.: Изд-во МГУ, 1978. 383 с.
Tennep E.3. Микроорганизмы рода Nocardia и разложение гумуса. М.: Наука,
1976. 197 с.
Терехова В.А., Трофимов С.Я., Семенова ТА., Дорофеева Е.И. Структурно-
функциональные особенности микобиоты в связи с динамикой органического
вещества в ненарушенных почвах южной тайги // Почвоведение. 1999. № 4. С. 461-467.
Трофимов С.Я., Строганова М.Н. Особенности почвообразования на
дренированных склонах в ненарушенных биогеоценозах южной тайги // Вестн. МГУ. Сер.
17, Почвоведение. 1991. № 3. С. 8-16.
217
Умаров ММ. Ассоциативная азотфиксация. М.: Изд-во МГУ, 1986. 131с.
Умаров ММ., Кононков Ф.П. Азотфиксация в подстилке хвойных
биогеоценозов подзоны южной тайги // Роль подстилки в лесных биогеоценозах: Тез. докл. Все-
союз. совещ. Красноярск, 1983. С. 197.
Уткин А.И. О показателях лесных биогеоценозов // Бюл. МОИП. Отд. биол.
1975. Т. 80. С. 121.
Частухин В.Я., Николаевская МЛ. Биологический распад и ресинтез
органических веществ в природе. Л.: Наука, 1969. 323 с.
Чернов Ю.И. Природная зональность и животный мир суши. М.: Мысль, 1975.
222 с.
Чернова НМ. Ценотическая организация и функции населения микроартро-
под лесной подстилки // Механизмы биотической деструкции органических
веществ в почве: VII чтения памяти акад. В.Н. Сукачева. М.: Наука, 1989.
С. 5.
Щербакова ТА. Ферментативная активность почв и трансформация
органического вещества. Минск: Наука и техника, 1983. 220 с.
Alexander M. Nitrification soil nitrogen / Ed W.V. Bartholomew, F. Dark. Madison:
Amer. Soc. Agronomy, 1965. P. 309.
Dickinson C.H., Pugh J.Y.F. (Ed.) Biology of plant litter decomposition. L.; N.Y.: Acad,
press, 1974. Vol. 2. 450 p.
Gerson U., Chet I. Are allochtonous soil microorganism r- and K-selected? // Rev. Ecol.
Biol. Soil. 1981. Vol. 48. P. 285.
Kendrick W.B., Burges A. Biological aspects of the decay of Pinus sylvestris leaf litter //
Nowa Hedwigia Ztschr. Kryptogamenkd. 1962. N 4. P. 313.
Lussenhop J. Mechanisms of microarthropod-microbial interactions in soil // Adv. in
Ecol. Res. 1992. Vol. 23. P. 53-65.
Parkinson D. Ecology of soil fungi // Biology of conidial fungi // Ed. G.T. Cole,
B. Kendrick.
N.Y. etc.: Acad, press, 1981. P. 277-294.
PoindexterJ. The caulobacters // Microbiol. Rev. 1981. Vol. 54. P. 123-179.
Szabo I.M., Marton M., Partai G. II Proc. Intern, working meeting on soil micromor-
phology. Amsterdam, 1964. P. 12.
7.2 ПОЧВЕННЫЕ МИКРОБНЫЕ
СООБЩЕСТВА БОРЕАЛЬНЫХ ЛЕСОВ
В УСЛОВИЯХ ПРОМЫШЛЕННОГО
ЗАГРЯЗНЕНИЯ ТЯЖЕЛЫМИ МЕТАЛЛАМИ
Общие представления о функционировании
почвенных микробных сообществ
Биогеоценотическое значение почвенных микроорганизмов в бореаль-
ных лесах заключается в их активном участии в биогеохимических циклах
элементов, деструкции и синтезе органических веществ (в частности, гуми-
новой природы). Основными характеристиками, определяющими их биогео-
ценотические функции, являются численность, продуктивность (биомасса и
продукция) и активность. Все эти показатели можно измерять как для
почвенной микробиоты в целом, так и для отдельных функциональных и
таксономических групп микроорганизмов, однако эти представления
существенно зависят от методов, применяемых для изучения структуры и функции
микробных сообществ.
218
Известно, что состав и состояние микроорганизмов в почве
характеризуется большой пространственной и временной вариабельностью. Это
определяется свойствами самой почвы - особой среды обитания микроорганизмов
(Звягинцев, 1987), условиями окружающей среды (особенно температурой и
влажностью) в момент отбора почвенных образцов и используемым методом
исследования. В связи с вышеназванными причинами имеются и
определенные сложности в сопоставлении данных, полученных разными авторами.
Распределение микроорганизмов по профилю почв бореальных лесов
изучено достаточно хорошо. Подобные исследования проводились в основ-,
ном методом посева на твердые питательные среды. Несмотря на то, что
этот метод дает возможность изолировать и изучать только часть
микроорганизмов, населяющих почву, он позволяет описать общие тенденции
горизонтального и вертикального распределения микроорганизмов. Выявлено,
что тенденции изменения видовой структуры вниз по профилю схожи с
изменением состава микроорганизмов в процессе сукцессии при разложении
растительного опада в хвойных и лиственных лесах. Изменение
таксономического состава микробного сообщества происходит в результате
последовательного обогащения каждого нижележащего горизонта новыми
формами микроорганизмов иногда с сохранением форм, типичных для
вышележащего горизонта. В ходе общей сукцессии микроорганизмов при разложении
растительных остатков вслед за обильным развитием грибов происходит
развитие комплекса почвенных бактерий и актиномицетов (Persson et al.,
1980; Звягинцев и др., 1984; Kjoller, Struwe, 1989) (рис. 7.8).
Поскольку продуктивность (биомасса и продукция) и численность
микроорганизмов в почвах является информативными биогеоценотическими
параметрами, были апробированы многочисленные методы их оценки в
почвах бореальных лесов. Наиболее консервативный подход к такой
оценке - метод подсчета колоний при посеве на твердые питательные среды.
Использование этого метода показало, что на питательных средах из почв
лесных биогеоценозов выделяется большее число колониеобразующих единиц,
чем из почв более южных экосистем (Мишустин, 1954).
Методы прямого счета позволяют более полно учитывать микробную
биомассу почвы. Для мицелиальных организмов методами прямого счета
можно раздельно учитывать длину мицелия и число спор, тогда как
чашечный метод учитывает число колониеобразующих единиц - спор и
фрагментов мицелия (Методы..., 1991). Для оценки микробной биомассы в почве
могут быть использованы фумигационный метод (Jenkinson, Powlson, 1976) и
метод субстрат-индуцированного дыхания (Anderson, Domsh, 1975). По
мнению некоторых авторов изменения в грибных популяциях лесной почвы
могут быть зафиксированы путем измерения содержания эргостеролов. Для
характеристики микробиологической активности почв используют
определение эмиссии почвой двуокиси углерода и измерение ферментативной
активности почв. За последнее время широкое распространение получил
метод "Биолог" (Garland, Mils, 1991), а также его специальная модификация
для почвенной микробиологии система "Эколог" (Горленко, 2001),
позволяющие изучать разнообразие функциональных групп микроорганизмов.
Использование прямых методов существенно увеличивает показатели
численности определяемых микроорганизмов. Так, количество бактерий
почв северотаежных лесов, учитываемых прямым методом, в тысячи и де-
219
lgtf
9,9
9,7
t\ с
9,5
9,3
9,1
lgc
2,8
2,4
t
2,0*
1,6
1,2
/\ 3
/ \
2
1
hb\
2,9
2,7
1 С
--^.2,5
2,3
2,1
о
14
21 Сутки
Рис. 7.8, Ход сукцессии бактерий (1), актиномицетов (2) и грибов (3) в
дерново-подзолистой почве (Звягинцев и др., 1984)
а - численность бактерий (число клеток на 1 г почвы), Ь - длина мицелия грибов (м/г
почвы), с - длина мицелия актиномицетов (м/г почвы)
сятки тысяч раз превышает их количество, полученное методом посева на
питательные среды, для почв южной тайги диапазон этих различий
снижается, составляя, как правило, сотни, реже тысячи раз.
Биомасса бактерий в органогенном горизонте северных лесных почв по
оценкам разных авторов составляет порядка 0,5-0,8 мг на грамм почвы
(Евдокимова, Мозгова, 2001; Полянская и др., 2001). При этом численность
бактерий в корнеобитаемых горизонтах подзолов соснового леса составляет
около 0,7-3,5 млрд клеток на грамм почвы, биомасса бактерий актиноми-
цетной линии может составлять около 1,5% от биомассы всех
присутствующих в почве микроорганизмов и порядка 20-30% от общей биомассы
бактерий (Полянская, 1996). Причем мицелий актиномицетов составляет около
10-20% от общей биомассы актиномицетов в почве, а остальная часть
представлена спорами (Звягинцев, Зенова, 2001). Длина мицелия актиномицетов
в корнеобитаемых горизонтах подзолов составляет от 50 до 200 м на грамм
почвы (Полянская и др., 2001). Численность актиномицетов по оценкам
чашечным методом в органогенных горизонтах хвойного леса составляет от
500 до 1,3 х 106 колониеобразующих единиц на грамм почвы. Число коло-
ниеобразующих единиц бактерий, выделяемых из лесных почв,
максимально при рН, близких к нейтральному, и уменьшается по мере снижения рН
(Kjoller, Struwe, 1994). Более южные почвы под смешанными лесами
характеризуются большей численностью бактерий, чем почвы хвойных лесов.
Численность актиномицетов, выделяемых из почвы также возрастает с
севера на юг (Мишустин, 1981; Звягинцев, Зенова, 2001).
Важной характеристикой функционирования микробных сообществ
являются размеры живой биомассы и ее доля от общей микробной биомассы
в почве. Не все методы прямого счета позволяют проводить такое
разделение. Использование различных красителей при изучении микробной
биомассы методом люминесцентной микроскопии может давать определенное
представление о соотношении живой и мертвой биомассы. С помощью
метода радиоактивной метки (Baath, 1988) можно оценивать содержание мета-
болитически активного мицелия в почве. По оценкам с помощью этого ме-
220
тода содержание активного мицелия в "кислой лесной почве" в 2,5^4 раза
меньше, чем при прямом счете с применением диацетата флуоресцеина
(Baath, 1988; Soderstrom, 1979).
Ключевую роль в разложении растительных остатков в лесных
экосистемах играют грибы. Грибная биомасса составляет основную часть
микробной биомассы лесных почв. Особенно велика доля грибной биомассы в
верхних органогенных горизонтах. При подсчете методом люминесцентной
микроскопии в верхних корнеобитаемых горизонтах подзолов доля грибов
составляет свыше 90% от общей микробной биомассы. Лишь к концу
вегетационного периода в нижней части корнеобитаемого пространства их доля
может снижаться до 65-70% (Полянская и др., 2001). По данным Г.А.
Евдокимовой и Н.П. Мозговой (2001) грибная биомасса в верхнем органогенном
горизонте почв под хвойным лесом превышает бактериальную в среднем в
4 раза. В минеральных горизонтах грибная биомасса приближается к
бактериальной. В нижних минеральных горизонтах бактериальная биомасса
может даже превосходить грибную.
По результатам исследований многих авторов, использовавших метод суб-
страт-индуцированного дыхания, в почвах бореальных лесов доля грибной
биомассы от общей микробной составляет от 60 до 80% (Anderson, Domsh,
1975, 1978). В процессе микробной сукцессии соотношение грибной и
бактериальной биомассы уменьшается (Neely et al., 1991; Kjoller, Struwe, 1989).
По данным метода прямого счета средняя длина грибных гиф в почве бо-
реального леса колеблется от сотен до тысяч метров мицелия на грамм
почвы (Kjoller, Struwe, 1994). Имеются сведения, что в хвойных лесах более
низкая общая биомасса микроорганизмов и длина грибного мицелия
характерна для почв сосновых лесов по сравнению с еловыми. Это может быть
связано с относительной засушливостью местоположения сосновых
биоценозов и их более низкой биологической продуктивностью. По данным Г.А.
Евдокимовой средняя длина грибного мицелия в органогенном горизонте
сосняка составляет порядка 100 м на грамм почвы, ельника - порядка 1700. В
весенне-летний период содержание мицелия в подстилке елового леса
может доходить до 4000 м на грамм почвы (Евдокимова, Мозгова, 2001).
Длина грибного мицелия в почвах под сосняками может составлять 1100 м на
грамм почвы (Полянская и др., 2001).
Доля живых грибных гиф от общего содержания мицелия в почве
обычно подвержена сильным колебаниям (Ingham et al., 1989). В летний период
этот показатель заметно возрастает. По мнению Д. Фракланда (Frakland,
1975) в лесных почвах Великобритании около 15-37% грибного мицелия от
его общего содержания является потенциально активным. По оценкам с
помощью метода радиоактивной метки содержание метаболитически
активного мицелия колеблется в приделах 20-120 м/г сухой почвы в
подстилочном горизонте и 0,6-1,6 м/г сухой почвы в элювиальном горизонте в кислых
лесных почвах Швеции (Baath, 1988). Использование метода
люминесцентной микроскопии с использованием диацетата флуоресцеина дает в
2,5-4,0 раза большие значения этого показателя (Soderstrom, 1979).
В лесных экосистемах наблюдается резкое увеличение численности и
биомассы микроорганизмов при переходе от надземного яруса (филлосфера
растений) к наземному (подстилка). Лесная подстилка является горизонтом
максимального накопления биомассы и наибольшей активности почвенных
221
микроорганизмов. При продвижении вниз по профилю наблюдается
снижение биомассы и активности почвенных микроорганизмов. Количество
бактерий, грибов и дрожжей может падать на 1-2 порядка при переходе от
органических горизонтов к минеральным.
Почвенные микроорганизмы и тяжелые металлы
Загрязнение природной среды обусловливает нарушение естественного
функционирования наземных экосистем и, следовательно, изменению
состава, структуры и функционирования почвенного микробоценоза как
неотъемлемого компонента. Считается, почвенные микроорганизмы являются
сравнительно устойчивыми к загрязнению организмами (Cervantes,
Gutierrezcorona, 1994; Евдокимова, 1995; White et al., 1997). Устойчивость
микробной клетки к высоким концентрациям тяжелых металлов обеспечивает
разнообразие защитных механизмов. Основные среди них следующие:
1. Поддержание постоянной относительно низкой концентрации
тяжелых металлов в клетке благодаря
• снижению проницаемости мембраны и избирательному поглощению
ионов из внешней среды;
• активному удалению тяжелых металлов из клетки.
2. Аккумуляция тяжелых металлов в клетке в нетоксичной или
малотоксичной форме:
• биосорбция на поверхности клетки;
• активное метаболическое поглощение и внутриклеточная
аккумуляция;
• компартментация во внутриклеточных структурах (например,
вакуолях);
• накопление в форме нетоксичных соединений (связанных с тиолами,
металлотионеинами и пр.).
3. Снижение токсичности тяжелых металлов во внешней среде
благодаря их связыванию экзометаболитами.
Эти механизмы выполняют свою защитную функцию лишь до
определенного уровня содержания тяжелых металлов. При достижении так
называемой пороговой концентрации происходит их нарушение защитных
механизмов, что обусловливает, в свою очередь, качественные изменения в
структуре и функционировании микробного сообщества почвы.
Полагают, что микроорганизмы, обладающие устойчивостью к
повышенным дозам тяжелых металлов, исходно присутствуют во всех почвах
(Bader et al., 1999; Jordan, LeChevalier, 1975). В то же время в длительно
загрязняемых тяжелыми металлами почвах доля устойчивых
микроорганизмов возрастает (Amir, Pineau, 1998; Baath, 1989; Doelman, Haanstra, 1979; Giller
et al., 1998; Kelly et al., 1999; Olson, Thornton, 1982). Микроорганизмы,
изолированные из загрязненных местообитаний, часто лучше растут на средах,
содержащих металлы в повышенных количествах, и иногда их рост можно
стимулировать, повышая содержание металлов в среде (Doelman, Haanstra,
1979; Olson, Thornton, 1982).
Показано, что устойчивость микробного сообщества почвы меняется в
течение некоторого времени после внесения тяжелых металлов (Kelly et al.,
1999). В почве, однократно обработанной раствором, содержащим тяжелые
222
металлы, устойчивость микробного сообщества не только отличалась от
исходной, но и продолжала возрастать в течение определенного времени
после обработки. Устойчивость оценивали по числу колониеобразующих
единиц микроорганизмов, изолирующихся на питательные среды с аномально
высоким содержанием тяжелых металлов.
Возрастание толерантности микробного сообщества при загрязнении
может происходить двумя путями (Doelman, Haanstra, 1979; Giller et al., 1998).
1. Отбор микроорганизмов, исходно более устойчивых к тяжелым
металлам, чем остальная часть микробной популяции и их доминирование при
загрязнении.
2. Развитие микроорганизмов с генетически закрепленной
устойчивостью к тяжелым металлам.
Первый тип повышения устойчивости описывает адаптацию
микробного сообщества, в первую очередь, при однократном воздействии тяжелых
металлов на почву (такое имеет место в основном в лабораторном
эксперименте, когда в почвенный образец разово вносится большое количество
загрязняющих веществ). Развитие толерантности по второму пути характерно
для постепенной адаптации микроорганизмов при постоянном попадании
загрязняющих веществ в почву, когда под воздействием стресса меняется
генетическая структура микробного сообщества (такое обычно имеет место в
природе в условиях длительного загрязнения).
После воздействия тяжелых металлов происходит отбор наиболее
устойчивых микроорганизмов и изменение в составе почвенного микробного
сообщества. Существуют различные аспекты оценки нарушения
микробного сообщества в результате загрязнения. Чаще всего в качестве показателя
нарушений используют изменение микробной биомассы.
Продуктивность почвенных микроорганизмов. Небольшое увеличение
содержания металлов обычно ведет к некоторой стимуляции роста
микроорганизмов и возрастанию микробной биомассы, однако дальнейшее
повышение концентрации металлов в среде оказывает негативное воздействие на
микроорганизмы, и их биомасса в почве уменьшается (Fliessbach et al, 1994).
В полевых экспериментах при длительном загрязнении почвы тяжелыми
металлами наблюдается снижение общей микробной биомассы (Марфенина,
1991; Полянская и др., 2001; Никонов и др., 2001; Baath, 1989; Marfenina,
Grygorev, 1992; Fliessbach et al., 1994; Giller et al., 1998; Kelly et al., 1999).
Лабораторные эксперименты показывают, что однократное воздействие
раствором, содержащим тяжелые металлы, на почвенный образец ведет к
значительному снижению микробной биомассы на начальных этапах
эксперимента. Биомасса может снизиться более чем на 50% по сравнению с
контрольным образцом, однако впоследствии этот показатель восстанавливается и
может значимо не отличаться от контроля (Kelly et al., 1999) (рис. 7.9).
При загрязнении почвы тяжелыми металлами возрастает доля мертвой
массы микроорганизмов от ее общего количества. Число жизнеспособных
микроорганизмов может сократиться на 90% после однократной обработки
почвы тяжелыми металлами, однако спустя некоторое время этот
показатель может частично восстановиться. Отмечено, что загрязнение влияет
также на скорость размножения микроорганизмов, в частности при
загрязнении изменяется время, необходимое популяции для достижения
максимальной плотности. При загрязнении может не наблюдаться взрывного ро-
223
■ Контроль ■ Zn
III. I~l. I 1.11.
15 45 90 200 420
Сутки
Рис. 7.9. Изменение микробной биомассы после обработки почвы ZnS04 (6538 мг/кг
сухой почвы) (Kelly et al., 1999)
ста на начальных этапах развития популяции, в других случаях активный
рост популяции в загрязненных почвах наблюдается позже, чем в контроле
(Kelly etal., 1999).
Воздействие высоких доз тяжелых металлов может вызывать изменение
морфологической структуры почвенных грибов: мицелий становится более
тонким, начинает усиленно ветвиться (Евдокимова, 1995; Amir, Pineau, 1998;
Gardeatorresdey et al., 1997).
В целом, микробную биомассу трудно расценивать как очень
чувствительный показатель загрязнения почвы тяжелыми металлами. После
некоторого периода времени, требующегося для адаптации микробного
сообщества к повышенным дозам тяжелых металлов, чувствительная часть
популяции отмирает или ингибируется и находится в неактивном состоянии, более
толерантные микроорганизмы становятся доминантами микробиоценоза,
однако изменения в общей микробной биомассе могут практически не
отражать этого.
Активность микробных сообществ. Другим показателем оценки
воздействия загрязнения тяжелыми металлами на микроорганизмы является
активность микробного сообщества. Существуют различные методы ее
оценки, включающие измерения скорости минерализации почвенного
органического вещества или внесенных в почву органических веществ,
интенсивности почвенного дыхания (выделения С02 почвой), активности различных
ферментов (целлюлазы, дегидрогеназы, инвертазы и пр.), интенсивности
нитрификации, фиксации азота и других процессов, осуществляемых
микроорганизмами в почве.
Сравнительный анализ ряда показателей при определении реакции на
загрязнение свинцом (в интервале 125-2000 мг/кг РЬ на сухое вещество)
дерново-подзолистой почвы выявил, что перспективными для индикации
такого загрязнения являются: определение активности азотфиксации,
дегидрогеназы, выделения двуокиси углерода, денитрификации, уреазы, численности
свободноживущих и олиготрофных бактерий (Звягинцев и др., 1997).
Измерение интенсивности азотфиксации хорошо применимо для оценки
активности определенных групп микроорганизмов, осуществляющих этот
процесс в почве. Скорость минерализации азотсодержащих соединений дает
224
0,25
| 0,2
g
5 0,15
и
а од
0,05
более общую картину и является достаточно чувствительным тестом на
загрязнение почвы тяжелыми металлами в полевых и лабораторных условиях.
Во многих работах отмечается сокращение общей активности
почвенных микроорганизмов в загрязненных тяжелыми металлами почвах (Giller et
al., 1998; Kelly et al., 1999). Активность почвенных ферментов может падать
более, чем на 90 % от исходного уровня (Kelly et al., 1999), однако различные
ферменты обладают неодинаковой чувствительностью к тяжелым
металлам, и их активность сильно зависит от многих других свойств, помимо
содержания металлов (температура, влажность почвенного образца,
содержание в нем органического вещества, величина рН почвенного раствора и пр.).
В связи с этим такие показатели имеют ограниченное применение для
индикации реакции микробного сообщества на загрязнение.
Интенсивность почвенного дыхания является более селективным тестом
состояния микробного сообщества, хотя различные почвенные свойства
также оказывают на него влияние (Dumestre et al., 1999; Kelly et al., 1999).
Было предложено использовать длительность лаг-периода,
предшествующего началу минерализации органического вещества, как показатель
реакции микробного сообщества на загрязнение (Dumestre et al., 1999; Nordgren et
al., 1985). Показано, что величина этого показателя хорошо коррелирует с
концентрацией тяжелых металлов в почвенном растворе, особенно четко
такие корреляции прослеживаются для почв лесных биогеоценозов.
Применение этого показателя дает сопоставимые результаты и при однократном,
и при длительном загрязнении (Giller et al., 1998).
В загрязненных тяжелыми металлами почвах отмечено подавление
минерализации лесной подстилки. Различия в скоростях разложения
органического вещества между фоновой и загрязненной почвой увеличивались с
возрастанием времени загрязнения. В течение первых нескольких недель
загрязнения воздействия на интенсивность разложения подстилки не
отмечалось, однако после утилизации легкодоступных органических соединений
наблюдается снижение скорости минерализации. Был сделан вывод, что
загрязнение в большей мере влияет на скорость разложения нерастворимого
органического вещества, чем на минерализацию легкодоступных
органических соединений. Поэтому воздействие загрязнения более заметно
проявляется на поздних стадиях разложения лесной подстилки (Baath, 1989), однако
микроорганизмы в фоновых и загрязненных почвах могут утилизировать
различные органические субстраты, и это также может повлиять на
интенсивность почвенного дыхания. Это особенно относится к длительно
загрязняемым территориям, где изменяется состав растительности и,
соответственно, состав опада по сравнению с фоновой зоной.
Предполагается, что более корректным показателем активности
почвенного микробного сообщества является интенсивность разложения
внесенного в почву органического субстрата. Такой подход позволяет избежать
неясностей, связанных с измерением скорости минерализации почвенного
органического вещества, не зная, какие именно его компоненты
разлагаются и будут ли они одинаковыми в фоновых почвах и при различных уровнях
загрязнения. Несмотря на зависимость интенсивности почвенного дыхания
от вида и количества добавляемого субстрата и времени проведения
измерений, этот метод дает более четкие корреляции с содержанием тяжелых
металлов в почве. Ограничения, которые накладывает этот метод, связаны с
8. Рассеянные элементы
225
2000
3000
4000
Zn, мкг/г почвы
7000
Рис. 7.10. Изменение значения эмиссии С02 почвой, выраженной на единицу
микробной биомассы, при различных уровнях загрязнения (Barajas-Aceves et al., 1999)
тем, что получаемые результаты описывают состояние не всего
микробного сообщества почвы, а определенной трофической группировки, в
зависимости от добавляемого субстрата (Giller et al., 1998).
Интенсивность почвенного дыхания не всегда четко коррелирует с
содержанием тяжелых металлов в почвенном растворе. Этот метод лучше
всего применим для кислых лесных почв (Baath, 1989), но даже и для них
имеются противоречивые данные. Разные исследователи получали и снижение
(Dumestre et al, 1999), и возрастание (Barajas-Aceves et al., 1999)
интенсивности почвенного дыхания в результате загрязнения почвы тяжелыми
металлами. В большинстве работ показано отсутствие влияния небольших доз
тяжелых металлов на эмиссию С02 почвой и ингибирование почвенного
дыхания при длительном загрязнении (Baath, 1989).
Комбинирование измерений микробной биомассы и активности
является более адекватной оценкой состояния почвенного микробного
сообщества при загрязнении. Показано, что интенсивность почвенного
дыхания, выраженная на единицу микробной биомассы, является достаточно
адекватным тестом на загрязнение тяжелыми металлами. Значение этого
показателя возрастает при загрязнении и положительно коррелирует с
содержанием тяжелых металлов в почве (Barajas-Aceves et al., 1999)
(рис. 7.10). Такая корреляция свидетельствует о расширении соотношения
углерода, выделяемого в виде С02 и встраиваемого в биомассу, при
повышенных дозах тяжелых металлов. Это означает, что в загрязненных
почвах микроорганизмы имеют более низкий экономический коэффициент,
что приводит к увеличению эмиссии количества С02 на единицу
утилизируемого субстрата.
Численность почвенных микроорганизмов. Численность всех групп
почвенных микроорганизмов (водорослей, грибов, дрожжей, бактерий,
актиномицетов) обычно снижается при высоких уровнях загрязнения.
Максимальное снижение численности характерно для верхних органогенных
горизонтов, где концентрируется большая часть тяжелых металлов
(Jordan, LeChevalier, 1975). Несмотря на то, что адаптационные процессы
происходят у всех групп почвенных микроорганизмов (Amir, Pineau, 1998),
степень резистентности различается для разных групп. Причем толерант-
226
ность конкретного вида во многом определяется тем, из какого
местообитания он был выделен (Doelman, Haanstra, 1979; Duxbury, Bicknell, 1983;
Olson, Thornton, 1982).
Состав и структура микробных сообществ. Воздействие тяжелых
металлов на почвенные микроорганизмы обусловливает изменение
таксономического состава и таксономической структуры микробного сообщества.
Основной тенденцией в реакции почвенного микробиоты на повышение
содержания тяжелых металлов в среде является сокращение числа видов,
выделяемых из почвы. Это происходит благодаря элиминации чувствительных к
загрязнению видов. Структура микробного сообщества изменяется в сторону
"концентрации доминирования", т.е. присутствия небольшого числа
доминантных видов и снижения присутствия видов с низкой частотой
встречаемости (Марфенина, 1991; Лебедева, Канивец, 1991; Евдокимова, 1995). Состав
доминантных видов микроорганизмов на загрязненных территориях также
может существенно отличаться от фоновых почв (Jordan, LeChevalier, 1975;
Марфенина, 1991).
Некоторые авторы считают актиномицеты чувствительной частью
почвенного сообщества к загрязнению (Jordan, LeChevalier, 1975). Другие
бактерии менее чувствительны и могут адаптироваться к достаточно высокому
содержанию металлов в среде. При загрязнении происходит отбор наиболее
толерантных видов бактерий. Грам-отрицательные бактерии считаются
более устойчивыми к загрязнению, чем грам-положительные (Baath, 1989;
Doelman, Haanstra, 1979; Duxbury, Bicknell, 1983). Из общего числа
бактериальных штаммов, изолированных из загрязненной почвы, 74% составляли
грам-отрицательные, 19% - коринеформные, 5% - бациллы (Doelman,
Haanstra, 1979).
По данным многих исследований грибы сравнительно устойчивая часть
почвенного микробного сообщества к загрязнению (Jordan, LeChevalier,
1975; Doelman, Haanstra, 1979), однако длительное загрязнение ведет и к
изменению таксономической структуры почвенных микромицетов. Изучение
изменений в составе микроскопических грибов при загрязнении почвы
тяжелыми металлами (Си, Zn, Pb) в Южной Швеции показало, что реакция
грибного сообщества более чувствительна, чем такие показатели как
грибная биомасса и дыхание почвы (Nordgren et al., 1985).
Большая часть микроскопических грибов, типичных для лесной
почвы, при загрязнении не выделяется. В длительно загрязняемых почвах
грибные комплексы могут быть представлены несколькими видами родов
Penicillium и Trichoderma (Евдокимова, 1995; Baath, 1989). В то же время
при загрязнении в составе почвенного грибного комплекса могут
появиться виды, нетипичные для лесной зоны. Как негативные последствия
изменения грибных сообществ в результате загрязнения среди них могут
активно развиваться фитопатогенные и токсинообразующие грибы
(Марфенина, 1991; Кураков и др., 2000; Nordgren et al., 1985), а также показана
возможность увеличения присутствия видов потенциально патогенных
для человека, что выявляется как в почвах, так и в приземных слоях
воздуха (Марфенина, 1999).
Установлены некоторые виды грибов, которые ведут себя как
сравнительно чувствительные или резистентные к некоторым тяжелым металлам.
Например, для дерново-подзолистых почв наиболее чувствительный вид к
8*
227
загрязнению тяжелыми металлами (ртутью, кадмием, свинцом) является
Mortierella ramanniana. А сравнительно устойчивы к действию свинца Mucor
hiemalis, Penicillium funiculosum, а к кадмию Aspergillus niger, Paecilomyce
lilacinus, Penicillium funiculosum (Марфенина, 1994).
Получен ряд объяснений причин "поведения" популяций грибов в
условиях загрязнения тяжелыми металлами, связанный с изменением их
жизненных циклов. Задержка прорастания спор грибов - фунгистатический
эффект - часто вызывается разнообразными антропогенными факторами, и
проявляется у чувствительных к этим воздействиям грибов, встречаемость
которых в антропогенно нарушенных условиях, как правило, уменьшается.
Напротив, для видов грибов, выделение которых увеличивается под
влиянием определенных антропогенных факторов, может наблюдаться
уменьшение лаг-периода, и прорастание наступает быстрее. Такое ускорение
прорастания спор чаще отмечается у резистентных видов в условиях низких
уровней воздействия (Марфенина, 1999).
Одна из наиболее четко прослеживаемых реакций на антропогенные
воздействия у почвенных грибов - изменение уровня прорастания спор.
Снижение уровня прорастания по сравнению с контролем обычно
регистрируется в почвах для видов, выделяемых как чувствительные к воздействию,
например у гриба Mortierella ramanniana при загрязнении дерново-подзолистых
почв кадмием. Напротив, увеличение уровня прорастания спор обычно
наблюдается для грибов, которые проявляют себя как устойчивые к
определенным факторам, например Penicillium funiculosum при загрязнении
дерново-подзолистых почв свинцом. Это особенно заметно при низких и средних
уровнях воздействия (Марфенина и др., 1989).
Многочисленные исследования были проведены для выявления
количественных зависимостей состояния микробного сообщества от концентрации
тяжелых металлов в почвенном растворе (Baath, 1989). Были изучены
различные почвы, содержащие тяжелые металлы в различных концентрациях
и соотношениях. Эти исследования выявили большую вариабельность
получаемых результатов. Значения обеих концентраций менялись в 100-1000 раз
в различных исследованиях и в большой степени перекрывались (рис. 7.11).
Такая вариабельность может объясняться следующими причинами:
1) различные методы оценки содержания токсичных соединений
металлов в почве;
2) сравнение результатов длительного загрязнения (полевые
исследования) и однократной обработки почвы раствором, содержащим тяжелые
металлы (лабораторные эксперименты).
В первом случае микробиота существует при постоянно
увеличивающемся содержании тяжелых металлов в среде и в момент исследования
микробное сообщество почвы уже адаптировано к стрессу. Когда
микроорганизмы впервые оказываются под воздействием стресса, им требуется время
для адаптации. Сразу после обработки почвы тяжелыми металлами
происходят существенные изменения в микробном сообществе, однако спустя
некоторое время исходные свойства могут частично или полностью
восстановиться. В результате данные многих исследований несопоставимы, а часто
противоречат друг другу.
По этой причине в настоящее время установлены лишь тенденции
изменения почвенного микробного сообщества в результате загрязнения тяже-
228
Zn О"
Pb
Ni •-
Hg
Cu *"
cr 0-
Cd
-S-t—I—•«—I •
t-^J 1 %-. Q-
i—I 1—1ч)—ol • o-
—°~• r
I • •! ti—I
8 .till—i
7 8 II.. M-t
1 10 100 1000 10000
Количество металлов, добавляемых к почве (мкг/г)
Рис. 7.11. Влияние обработки тяжелыми металлами на интенсивность почвенного
дыхания в лабораторных исследованиях
лыми металлами. Результаты большинства исследований сложно
представить в виде конкретных количественных зависимостей состояния
микробного сообщества от концентрации тяжелых металлов в почвенном растворе.
Полученные материалы позволяют заключать лишь об общих
качественных закономерностях, отражающих направление реакции микробного
сообщества на такой стресс.
Литература
Горленко М.В. Функциональное биоразнообразие почвенных
микроорганизмов: подходы к оценке/ Перспективы развития почвенной биологии. М.: МАКС
пресс, 2001. С. 228-234.
Евдокимова ГА. Эколого-микробиологические основы охраны почв Крайнего
Севера. Апатиты, 1995. 342 с.
Евдокимова ГЛ., Мозгова Н.П. Микроорганизмы тундровых и лесных
подзолов Кольского Севера. Апатиты: КНЦ РАН, 2001. 184 с.
Звягинцев ЦТ. Почва и микрорганизмы. М.: Изд-во МГУ, 1987. 256 с.
Звягинцев Д.Г., Зенова Г.М. Экология актиномицетов. М.: ГЕОС, 2001. 256 с.
Звягинцев Д.Г., Конкина ГЛ., Кожевин U.A. Новые подходы к изучению сук-
цессий микроорганизмов в почве // Почвенные организмы как компоненты
биогеоценоза. М.: Наука, 1984. С. 81-103.
Звягинцев Д.Г, Кураков А.В., Умаров М.М., Филип 3. Микробиологические и
биохимические показатели загрязнения свинцом дерново-подзолистой почвы //
Почвоведение. 1997. № 9. С. 1124-1131.
Кураков А.В.f Звягинцев Д.Г., Филип 3. Изменение комплекса гетеротрофных
микроорганизмов при загрязнении дерново-подзолистой почвы свинцом // Там же.
2000. № 12. С. 1448-1456.
Лебедева Е.В., Канивец Т.В. Микромицеты почв, подверженных влиянию
горнометаллургического комбината // Микология и фитопатология. 1991. Т. 25, № 2.
С 111-116.
Марфенина О.Е. Микробиологические аспекты охраны почв. М.: Изд-во МГУ,
1991.118 с.
229
Марфенина О.Е. Микологический почвенный мониторинг; возможности и
перспективы // Почвоведение. 1994. № 1. С. 75-80.
Марфенина О.Е. Антропогенные изменения комплексов микроскопических
грибов в почвах: Дис.... д-ра. биол. наук. М., 1999. 294 с.
Марфенина О.Е., Попова Л.В., Макарова Н.А. Прорастание спор
микроскопических грибов как показатель антропогенного воздействия на почву // Вестн. МГУ.
Сер. 17, Почвоведение. 1989. № 4. С. 64-68.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева. М.:
Изд-во МГУ, 1991.303 с.
Мишустин Е.Н. Закон зональности и учение о микробных ассоциациях почвы
//Успехи соврем, микробиологии. 1954. Т. 37. С. 127-154.
Мишустин Е.Н. Эколого-географическая изменчивость почвенных бактерий.
М.: Наука, 1981.109 с.
Никонов В.В., Лукина Н.В., Полянская Л.М., Паникова А.Н. Особенности
распространения микроорганизмов в Al-Fe-гумусовых подзолах северо-таежных
еловых лесов: природные и техногенные аспекты // Микробиология. 2001. Т. 70, № 3.
С. 374-383.
Полянская Л.М. Микробная сукцессия в почве. Автореф. дис.... д-ра. биол.
наук. М., 1996. 96 с.
Полянская Л.М. у Никонов В.В..Лукина Н.В. и др. Микроорганизмы в
Al-Fe-гумусовых подзолах сосняков лишайниковых в условиях аэротехногенного
загрязнения // Почвоведение. 2001. № 2. С. 215-226.
Amir H., Pineau R. Effects of metals on the germination and growth of fungal isolates
from New Caledonian ultramafic soils // Soil Biol, and Biochem. 1998. Vol. 30.
P. 2043-2054.
Anderson J.P.E., Domsh K.H. A physiological method for the quantitative measurement
of microbial biomass in soils // Ibid. 1978. Vol. 10. P. 215-221.
Anderson J.P.E., Domsh K.H. Measurement of bacterial and fungal contributions to
respiration of selected agricultural and forest soils // Canad J. Microbiol. 1975. Vol. 21.
P. 314-322.
Baath E. Autoradiographic determination of metabolically-active fungal hyphae in
forest soil // Soil Biol, and Biochem. 1988. Vol. 20. P. 123-125.
Baath E. Effects of heavy metals in soil on microbial processes and populations: A
review // Water, Air and Soil Pollut. 1989. Vol. 47. P. 335-379.
Bader J.L., Gonzales G., Goodel P.C. et al. Chromium-resistant bacterial populations
from a site heavily contaminated with hexavalent chromium // Ibid. 1999. Vol. 109.
P. 263-276.
Barajas-Aceves M., Grace C, Ansorena J. et al. Soil microbial biomass and organic С in
a gradient of zinc concentrations in soils around a mine spoil tip // Soil Biol, and Biochem.
1999. Vol. 31. P. 867-876.
Cervantes C, Gutierrezcorona F. Copper resistance mechanisms in bacteria and fungi //
FEMS Microbiol. Rev. 1994. Vol. 4. P. 121-137.
Doelman P., Haanstra L. Effects of lead on the soil bacterial microflora // Soil Biol, and
Biochem. 1979. Vol. 11. P. 487-491.
Dumestre A., Sauve S., McBride M. et al. Copper speciation and microbial activity in
long-term contaminated soils // Arch. Environ. Contam. and Toxicol. 1999. Vol. 36.
P. 124-131.
Duxbury Т., BicknellA. Metal-tolerant bacterial populations from natural and
metal-polluted soils // Soil Biol, and Biochem. 1983. Vol. 15. P. 243-250.
Fliessbach A., Martens R., Reber H.H. Soil microbial biomass and microbial activity in
soils treated with heavy metal contaminated sewage sludge // Ibid. 1994. Vol. 26.
P. 1201-1205.
FranklandJ.C. Estimation of live fungal biomass // Ibid. 1975. Vol. 7. P. 339-340.
230
Gardeatorresdey J.L., Canoaguilera I., Webb R., Guiterrezcorona F. Enhanced copper
adsorption and morphological alterations of cells of copper stressed Mucor rouxii // Environ.
Toxicol, and Chem. 1997. Vol. 16. P. 435-441.
Garland J.L., Mills A.L. Classification and characterization of heterotrophic microbial
communities on the basis of patterns of community-level sole-carbon-source utilization //
Appl. and Environ. Microbiol. 1991. Vol. 57. P. 2351-2359.
GillerK.E., Witter E., McGrath S.P. Toxicity of metals to microorganisms and microbial
processes in agricultural soils: A review // Soil Biol, and Biochem. 1998. Vol. 30.
P. 1389-1414.
Ingham E.R., Coleman D.C., Moore J.C. An analysis of food-web structure and function
in a shortgrass prairie, a mountain meadow, and a lodgepole pine forest // Biol, and Fertility
Soils. 1989. Vol. 8. P. 29-37.
Jenkinson D.S., Powlson D.S. The effect of biocidal treatments on the metabolism in soil:
A method for measuring soil biomass // Soil Biol, and Biochem. 1976. Vol. 8. P. 209-213.
Jordan MJ., LeChevalier M.P. Effects of zinc smelter on forest soil microflora // Canad.
J. Microbiol. 1975. Vol. 21. P. 1855-1865.
Kelly J J., Haggblom M., Tate R.L., III. Changes in soil microbial communities resulting
from one time application of zinc: A laboratory microcosm study // Soil Biol, and Biochem.
1999. Vol. 31. P. 1455-1465.
KjollerA., Struwe S. Microfungi and bacteria as decomposers of organic matter in soil //
Opera bot. 1989. N 100. P. 147-152.
Kjoller A., Struwe S. Analysis of fungal communities on decomposing beech letter //
Beyond the biomass / Ed. K. Ritz et al. Chichester etc.: Brit. Soc. of Soil Sci. Wiley-Sayce
PubL, 1994. P. 191-199.
Marfenina O.E., Grigoryev A.M. Mycological monitoring of acid precipitation in some
coniferous ecosystems at Kola Peninsula // Effects of air pollutants on terrestrial ecosystems
in the borger areae between Russia and Norway: Proc. from the first symp. Svanik, 1992.
P. 171-176.
Neely C, Beare M.H., Hargrove W.L., Coleman D.C. Relationships between fungal and
bacterial substrate-induced respiration, biomass and plant residue decomposition // Soil Biol,
and Biochem. 1991. Vol. 23. P. 947-954.
Nordgren A., Baath E., Soderstrom B. Soil microfungi in an area polluted by heavy
metals // Canad. J. Bot. 1985. Vol. 63, N 3. P. 448-455.
Olson B.H., Thornton I. The resistance patterns to metals of bacterial populations in
contaminated land // J. Soil Sci. 1982. Vol. 33. P. 271-277.
Persson Т., Baath E., Clarholm M. et al. Trophic structure, biomass dynamics and
carbon metabolism of soil organisms in a Scots pine forests // Structure and function of Northern
coniferous forests: An ecosystem study. Stockholm, 1980. P. 419-459. (Ecol. Bull. Vol. 32).
Soderstrom B.E. Seasonal fluctuations of active fungal biomass in the horizons of a pod-
zolized pine forest soil in Central Sweden // Soil Biol, and Biochem. 1979. Vol. 11.
P. 149-154.
White C, Sayer J.A., Gadd G.M. Microbial solubilization and immobilization of toxic
metals: Key biogeochemical processes for treatment of contamination // FEMS Microbiol.
Rev. 1997. Vol. 20. P. 503-516.
7.3. МИКРООРГАНИЗМЫ AI-Fe-ГУМУСОВЫХ ПОДЗОЛОВ
(ПРИРОДНЫЕ И ТЕХНОГЕННЫЕ АСПЕКТЫ)
Функционирование населяющих лесную почву гетеротрофных
микроорганизмов тесным образом связано с растительностью, поставляющей через
опад и корневые выделения органическое вещество - основной источник их
питания. В бореальных лесах основное количество мертвого органического
231
вещества поступает в виде надземного опада. Традиционное представление
о пространственном размещении и организации микробных сообществ
лесных экосистем определяется: а) доминированием грибов; б) максимальной
концентрацией микроорганизмов в верхних органогенных горизонтах
(лесных подстилках); в) отражением в стратификации подстилок этапов
сукцессии микробиоты, связанных с конвейерной переработкой опада и остатков
организмов; г) корреляцией между местоположением микроорганизмов, их
функциями, сукцессионным циклом и типом жизненной стратегии (Ари-
стовская, 1980; Звягинцев и др., 1998, 1999; Полянская, 1996).
Использование для оценки численности и массы микроорганизмов новых
аналитических технологий (в частности, прямого метода люминесцентной
микроскопии) позволило внести коррективы в данное представление (Полянская,
1996). Установлено, что внутрипрофильная концентрация микробиоты в
корнеобитаемой сфере почв бореальных лесов более равномерная, чем
считалось ранее, благодаря высокой представленности микромицетов в
минеральных горизонтах. Вместе с тем данная концепция нуждается в развитии
и подтверждении основных положений для почв различного
таксономического уровня и экосистем разных типов как в природных условиях, так и при
антропогенезе.
В настоящее время важным фактором, определяющим
функционирование лесных экосистем, является воздушное промышленное загрязнение
кислотообразующими веществами и тяжелыми металлами (Кислотные осадки
и лесные почвы, 1999; Лукина, Никонов, 1996, 1998). В различных частях
ареала распространения бореальных лесов наблюдаются тенденции
возрастания кислотности и загрязненности почв, что может существенно нарушать
состав, внутрипрофильное распределение и продуктивность почвенной
микробиоты.
В этом разделе рассматриваются природные и техногенные аспекты
распространения микроорганизмов в Al-Fe-гумусовых подзолах
северотаежных лесов на основе анализа пространственных (внутрипрофильных и
парцеллярных) и сезонных особенностей численности и биомассы
различных групп микробиоты. Результаты наших исследований показали, что
тенденции этих особенностей в еловых и сосновых экосистемах сходные.
Различия могут быть только количественные. Ниже представлены материалы,
характеризующие пространственные и сезонные особенности численности
и биомассы почвенных микроорганизмов ельника кустарничково-зелено-
мошного (Никонов и др., 2001). При обобщениях эти данные дополняются
материалами, характеризующими почвенные микроорганизмы сосняков ку-
старничково-лишайниковых (Полянская и др., 2001).
На северной границе ареала бореальных лесов распространены ельники
кустарничково-зеленомошные, занимающие на Кольском полуострове
более 80% площади еловых лесов (Манаков, Никонов, 1981). Эти
растительные сообщества характеризуются древостоем, слагаемым елью (80%) и
березой (20%), хорошо развитым кустарничковым ярусом (преимущественно
Empetrum hermaphroditum, Vaccinium myrtillus, V. vitis-idaea) и мощным
сплошным покровом из зеленых мхов (Pleurozium schereberi и Hylocomium
splendens). Под ними на несортированных четвертичных отложениях
легкого гранулометрического состава развиваются Al-Fe-гумусовые подзолы с
профилем типа О-Е-В-ВС-С. Специфика динамики органического вещества
232
в этих БГЦ определяется наличием эдификатора - ели, важной ролью
мохового покрова и значительным количеством мертвого органического
вещества на поверхности почвы: запас фитомассы - 70-100 т/га, первичная
продукция - 2-4 т/га, запас подстилки - 39-41 т/га (Никонов, 1985).
При проведении исследований мы руководствовались: а) принципом
пространственной гетерогенности свойств лесных экосистем, который
предполагает изучение параметров функционирования наземных экосистем на
основе их отдельных структурных частей - парцелл; б) принципом
временной гетерогенности свойств лесных экосистем, указывающим на ярко
выраженную сезонную вариабельность свойств бореальных экосистем; в)
принципом однотипности объектов исследования, согласно которому
корректное сопоставление параметров, обусловленных разным уровнем
воздействия средообразующего фактора, возможно только для экосистем сходного
типа структурно-функциональной организации или одного состояния
(Лукина, Никонов, 1996, 1998).
Исследования проводили в естественных условиях и в условиях
воздушного промышленного загрязнения крупнейшим на Севере медно-никелевым
комбинатом "Североникель" - одним из самых мощных в Северной Европе
источником воздушного промышленного загрязнения. Различная
интенсивность влияния техногенного фактора обусловливает стадии трансформации
коренных ельников кустарничково-зеленомошных: ельники зеленомошно-
кустарничковые -> ельники злаково-кустарничковые —> вороничные
еловые редколесья. Ингибирование продуцирования и интенсификация
отмирания растительности вызывают уменьшение запаса живой фитомассы и
накопление мертвого органического вещества. Доминирующие
чувствительные к загрязнению виды (ель, зеленые мхи, черника), большая часть
которых безвозвратно выпадает из сообществ, заменяются устойчивыми
(вороника, злаки), образуются микрогруппировки из устойчивых видов (Лукина,
Никонов, 1993).
Для фоновых условий характерны два парцеллы: еловая и кустарничко-
во-зеленомошная. На стадии дефолиирующих ельников, для которой
свойственно выпадение зеленых мхов и активная дефолиация ели, выделяются
три парцеллы: еловая, злаково-кустарничковая и злаковая. Для
техногенного елового редколесья, где происходит полное разрушение исходной
экосистемы, характерны еловая, вороничная и злаковая парцеллы, а также
пространства, не покрытые растительностью - пустоши.
В основных типах парцелл закладывали почвенные разрезы. Образцы
почв отбирали в начале (июнь) и конце (сентябрь) вегетационного периода
из основных генетических горизонтов Al-Fe-гумусовых подзолов: О, Е, В,
ВС. Горизонт подстилки расчленяли на слои FH и Н. Детальная
характеристика морфолого-генетических свойств и питательного режима
Al-Fe-гумусовых подзолов дана нами ранее (Лукина, Никонов, 1998; Никонов, 1979;
Никонов, Лукина, 1994). Для определения доступных для растений
соединений элементов образцы почв экстрагировали 1М CH3COONH4 (pH = 4,65)
(Зырин, Стоилов, 1964, 1965; Halonen et al., 1983). Для органогенных
горизонтов использовали соотношения почвы и вытеснителя как 1:25, для
минеральных - 1:10. Содержание катионов определяли методом атомно-абсорб-
ционной спектрофотометрии, содержание серы, N03 и NH4 и фосфора -
колориметрически.
233
Изучение концентраций элементов питания в почвенных водах
проводили с использованием 12 гравитационных лизиметров в каждом типе
состояний экосистем из-под трех почвенных горизонтов (О, Bhfa, ВС) с учетом
парцеллярной структуры БГЦ (Лукина, Никонов, 1998). Катионы (алюминий,
железо, кальций, магний, калий, марганец, цинк, никель, медь) определяли
методом атомно-абсорбционной спектрофотометрии; S04, N03 - методом
ионообменной хроматографии, NH4 и Р - колориметрически; углерод - на
основе бихроматной окисляемости.
Предварительную обработку образцов почв для
микробиологического анализа проводили ультразвуковым диспергированием на
низкочастотном диспергаторе УЗДН-1 (22 кГц, 0,44 А, 2 мин). Общее количество
микроорганизмов определяли с помощью метода люминесцентной
микроскопии. Препараты для подсчета бактерий и мицелия актиномицетов
окрашивали акридином оранжевым, для учета спор и мицелия грибов -
калькофлуором белым. Определяли численность микроорганизмов и их
биомассу. Для численности бактерий среднее квадратическое отклонение
8(п-1) не превышало 5%, для мицелия и спор грибов, а также актиноми-
цетного мицелия - 10%. Удельная масса (плотность) микроорганизмов
принималась равной 1 г/см3, а содержание воды в клетках - 80%.
Биомасса одной бактериальной клетки объемом 0,1 мкм составляет 2 • 10~14 г на
сухое вещество, 1 м мицелия актиномицетов диаметром 0,5 мкм -
3,9 • 10-8 г. С учетом замеренного диаметра спор и мицелия грибов
вычисляли их биомассу по формуле (для спор - 0,0836 г3 • 10-11 г, для мицелия -
0,628 г2 • 1(Н г) (Полянская, 1996).
Бактерии и актиномицеты. В фоновых условиях микроорганизмы про-
кариотного комплекса сосредоточены в верхних горизонтах Al-Fe-гумусо-
вых подзолов: органогенном (подстилке) и верхнем минеральном
(подзолистом). Максимальная численность бактерий достигает 2 • 109 клеток/г,
длина мицелия актиномицетов может превышать 200 м/г (табл. 7.9). В нижних
корнеобитаемых горизонтах эти показатели заметно снижаются.
Парцеллярные и сезонные особенности выражены нечетко, следует отметить лишь
заметное увеличение длины мицелия актиномицетов в древесных парцеллах
к концу вегетационного сезона. Выявленные особенности свойственны
биомассе бактерий и актиномицетов (табл. 6.10), различия заключаются в том,
что масса бактерий на порядок выше массы мицелия актиномицетов
(0,01-0,04 и 0,002-0,008 мг/г соответственно). Обращает на себя внимание
сопоставимость концентраций как бактерий, так и актиномицетов в
органогенных и верхних минеральных (Е) горизонтах.
В условиях воздушного промышленного загрязнения численность и
биомасса прокариот заметно увеличиваются (табл. 7.11-7.14). Эти тенденции
особенно выражены в почвах техногенного елового редколесья, где
численность бактерий может достигать 6 • 109 клеток/г или в 3 раза превышать
фоновые значения. Сходные изменения отмечены в почвах древесных (еловых)
парцелл. Особенности внутрипрофильного распределения бактерий
сохраняются и в условиях загрязнения, более того численность бактерий в
нижней части корнеобитаемого слоя, как правило, превышает 0,5 • 109
клеток/г - это больше, чем в фоновых условиях.
Длина и биомасса мицелия актиномицетов также увеличиваются в
условиях загрязнения, но эти тенденции не столь выражены, как это прису-
234
ще бактериям. Содержание актиномицетов в почвах фоновых и дефолии-
рующих лесов в целом сопоставимо, заметные изменения наблюдаются в
условиях техногенного елового редколесья. Здесь длина мицелия
актиномицетов в злаковых парцеллах может достигать 300 м/г.
Межпарцеллярные и внутрипрофильные различия свидетельствуют о наиболее
благоприятных условиях для актиномицетов в верхних органогенных горизонтах
почв злаковых и отчасти древесных парцелл. Даже в поверхностном
горизонте почв пустошей (пространств без растительного покрова)
концентрация бактерий и актиномицетов значительно выше, чем в остальной
почвенной толще.
Грибы (мицелий и споры). Внутрипрофильные, парцеллярные и
сезонные особенности распределения микромицетов в Al-Fe-гумусовых
подзолах ельников кустарничково-зеленомошных имеют много общего с
микроорганизмами прокариотного комплекса. Однако выявляются и
заметные различия. В фоновых условиях длина мицелия грибов
значительно превышает длину мицелия актиномицетов, достигая почти 1400 м/г,
количество спор - 11 спор/г, биомасса мицелия и спор грибов - 8,7 и 0,3 мг/г
соответственно (см. табл. 7.9, 7.10). Нижние корнеобитаемые горизонты
8 и ВС заметно уступают верхним, различия могут достигать 10 раз и
более. Для микромицетов довольно четко выражены сезонные различия,
указывающие на заметное увеличение численности и массы мицелия и
спор к концу вегетационного периода. Внутрипрофильное распределение
характеризуется преимущественной аккумуляцией этой группы
микроорганизмов в верхней части профиля, охватывающей органогенный (О) и
элювиальный (Е) горизонты (мощность этого слоя колеблется в пределах
от 10 до 15 см).
Воздушное промышленное загрязнение однозначно негативно
воздействует на микромицеты (табл. 7.11-7.14). Длина мицелия, количество спор и
биомасса грибов тесно связана с уровнем загрязнения. Так, если биомасса
мицелия грибов в почвах древесных парцелл фоновых условий достигает
9 мг/г, то в почвах дефолиирующих лесов она не превышает 3 мг/г, а в
почвах елового редколесья едва достигает 1,2 мг/г. Такие же тенденции
выявлены в почвах межкроновых кустарничково-зеленомошных парцелл, в
условиях загрязнения трансформирующихся в злаково-кустарничковые.
Особенно низкими концентрациями этой группы микроорганизмов
характеризуются почвы, лишенные растительности - пустоши. Здесь общая биомасса
микромицетов не превышает 0,8 мг/г.
Особенностью внутрипрофильного распределения мицелия и спор
грибов в условиях загрязнения является включение в почвенное пространство,
в котором концентрируются микроорганизмы этой группы, также
горизонта В. Таким образом, этот почвенный слой достигает 25-30 см. Следует
отметить всплеск численности спор грибов в почвах дефолиирующих лесов,
отражающий негативные изменения в сообществах почвенных
микромицетов, подверженных загрязнению. Наконец, и для мицелия, и для спор грибов
характерна тенденция снижения длины, численности и массы к концу
вегетационного сезона.
235
Общие особенности распространения микроорганизмов
в Al-Fe-гумусовых подзолах северо-таежных лесов
Природные условия. В гетеротрофных микробоценозах
Al-Fe-гумусовых подзолов, слагаемых прокариотами (бактериями и актиномицетами) и
микромицетами, грибы - полноправный эдификатор. Пространственные
(парцеллярные и внутрипрофильные) и сезонные характеристики
численности и биомассы микроорганизмов в почвах ельников кустарничково-зелено-
мошных свидетельствуют об абсолютном доминировании грибов (см.
табл. 7.9, 7.10). На это указывает соотношение размеров биомассы
отдельных жизненных форм: на долю микромицетов приходится подавляющая
часть микробной массы - более 97%, из которых более 90% - мицелий. В
целом данный факт подтверждает представление об организации микробного
пула почв бореальных лесов, в котором микромицеты способны
осуществлять почти полную минерализацию лигниноцеллюлозного комплекса
(Полянская, 1996). Длина мицелия актиномицетов на порядок меньше, чем у
грибов, а биомасса - на три порядка и более. Биомасса бактерий также
значительно ниже, чем грибов.
Внутрипочвенная концентрация микроорганизмов Al-Fe-гумусовых
подзолов наблюдается в небольшом по протяженности (10-15 см), резко
дифференцированном по морфологии и свойствам корнеобитаемом
пространстве, охватывающем надземную (подстилочную) и верхнюю часть подземной
сферы почвенного яруса экосистемы. Эту область корнеобитаемого
пространства мы определили как зону жизненного оптимума почвенных
гетеротрофных микроорганизмов, однако следует учитывать и тот факт, что не
вся микробная биомасса пребывает здесь в активном состоянии,
значительная ее часть может находиться в анабиозе (Звягинцев и др., 1998, 1999;
Полянская, 1996).
Жизнедеятельность почвенных микроорганизмов, как и любых других
организмов, определяется границами жизненного пространства, в которых
сочетаются возможности окружающей среды в удовлетворении
потребностей организмов и способности организмов использовать эти возможности.
Кратко охарактеризуем гидротермический и питательный режимы, в
значительной мере обусловливающие функционирование гетеротрофной микро-
биоты.
Наиболее благоприятный температурный режим в Al-Fe-гумусовых
подзолах северотаежных лесов складывается в слое 0-15 см, где независимо
от метеорологических условий года в вегетационный период фиксируются
активные температуры (>10 °С). Водный режим этого слоя изменчив: в
начале вегетационного сезона этот слой, как правило, иссушен в связи с
отсутствием атмосферных осадков и активной транспирацией растений, во
второй половине сезона благоприятен для организмов, обитающих в почве
(Семко, 1982).
Зона жизненного оптимума гетеротрофных микроорганизмов Al-Fe-
гумусовых подзолов отличается высокой кислотностью, обусловленной
формированием большого количества веществ кислой природы в
результате функционирования биоценозов северотаежных лесов. Ниже по профилю
почв кислотность заметно снижается. Высокая кислотность - это,
по-видимому, условие существования и следствие жизнедеятельности конкретных
236
микробных сообществ. Ацидофильный характер микробиоты Al-Fe-гумусо-
вых подзолов, прежде всего микромицетов, следует рассматривать как
адаптацию почвенных микробоценозов к бореальным экосистемам.
Функционирование гетеротрофных организмов тесно связано с
наличием питательного субстрата - источника энергии и пищи. Для почвенных
микроорганизмов этот субстрат слагается: а) растительным опадом
(надземным и подземным), б) корневыми выделениями, в) отмирающей биомассой
животных и микроорганизмов, г) энергией и пищей, концентрирующейся в
твердых фазах почв, д) энергией и пищей, концентрирующейся в почвенных
водах.
В бореальных лесах преобладает надземный опад, и растительные
остатки преимущественно накапливаются на поверхности почвы.
Аккумуляция органического вещества и элементов питания также приурочена к
надземным органогенным горизонтам (табл. 7.15), поэтому не случайно
традиционное представление о внутрипочвенном распределении микробиоты в
бореальных лесах предполагает максимальную концентрацию
микроорганизмов в верхних органогенных горизонтах (лесных подстилках) и резкое
снижение в минеральном корнеобитаемом слое почв.
Представленные результаты исследований не свидетельствуют о резком
снижении численности и биомассы микроорганизмов Al-Fe-гумусовых
подзолов при переходе от наземной (подстилочной) к подземной сфере
почвенного яруса. Так, тенденции снижения численности и биомассы
микроорганизмов в почвах межкроновых (кустарничково-зеленомошных) парцелл
фиксируются только в горизонте В, тогда как в подзолистом горизонте эти
показатели сопоставимы с нижней частью органогенного горизонта. В
древесных (еловых) парцеллах выраженное снижение общей биомассы
микроорганизмов с глубиной наблюдается также начиная с иллювиального
горизонта. При этом, особенно в конце вегетационного периода, максимум
численности и биомассы микроорганизмов отмечается в верхнем горизонте
подстилки (слое FH). Эти тенденции обусловлены главным образом внутрипро-
фильным распределением грибов. Достоверные парцеллярные различия
также можно отметить лишь в верхней части органогенного горизонта:
биомасса микроорганизмов за счет грибного мицелия значительно выше в
еловой парцелле.
Что может обусловливать практически сопоставимую биомассу
микроорганизмов в богатых органическим веществом и элементами питания
органогенных горизонтах и соседствующих с ними минеральных горизонтах,
отличающихся низкими концентрациями органического вещества и биогенов
в твердых фазах? Возможным объяснением этого явления может быть
постоянное поступление в минеральные горизонты подстилочных вод,
богатых углеродом и водорастворимыми соединениями биогенов, наиболее
доступных для микроорганизмов (табл. 7.16). Активная нисходящая миграция
этих веществ в подземное корнеобитаемое пространство, обусловленная гу-
мидным режимом и легким гранулометрическим составом, способствует
формированию благоприятной для микроорганизмов питательной среды на
фоне благоприятных гидротермических условий.
Ориентируясь на объемную массу наземной и подземной сфер зоны
жизненного оптимума микробоценозов Al-Fe-гумусовых подзолов, следовало
бы заключить, что основная масса микроорганизмов приурочена к мине-
237
ральным корнеобитаемым горизонтам. Но для такого вывода является
обязательным выполнение, по меньшей мере, двух условий. Во-первых,
разделение микробиоты на живую и мертвую части. Во-вторых, доказательство
равномерного распределения почвенной микробиоты в пределах подземной
сферы зоны жизненного оптимума. Имеются экспериментально
подтвержденные данные (Звягинцев и др., 1999), что в минеральных почвенных
горизонтах микроорганизмы распределены неравномерно, наряду с зонами
активности довольно значительные пространства лишены микробной жизни.
Антибиотическое действие споровых (лишайников и мхов), может инги-
бировать активность микроорганизмов в надземной почвенной сфере
северотаежных лесов. В почвах межкроновых (кустарничково-зеленомошных)
парцелл максимальная плотность населения микроорганизмов смещена к
нижней части зоны жизненного оптимума, что, возможно, связано с
угнетением грибной микрофлоры метаболитами зеленых мхов непосредственно
под ними. Почвы древесных (еловых) парцелл, где зеленые мхи, как
правило, угнетены, характеризуются максимумом концентрации
микроорганизмов в верхней части органогенного горизонта.
Только для зоны жизненного оптимума характерны довольно четко
выраженные сезонные различия в численности и биомассе микробиоты:
благоприятный гидротермический и питательный режимы способствуют
резкому возрастанию массы микромицетов в конце вегетационного
периода. В древесных парцеллах наибольшие показатели численности и
биомассы микроорганизмов фиксируются в зоне жизненного оптимума в
конце вегетационного сезона. Увеличение концентрации микроорганизмов
может быть обусловлено поступлением свежего растительного опада и
миграцией в глубь профиля водорастворимого органического вещества и
элементов питания с почвенными водами. Развитию микрофлоры к концу
вегетации могут благоприятствовать более комфортные
гидротермические условия: повышение температуры и влажности верхних корнеобита-
емых горизонтов (Семко, 1982).
Воздушное промышленное загрязнение. Воздушное промышленное
загрязнение приводит к значительным нарушениям функционирования
всей экосистемы. Эти нарушения характеризуются (Лукина, Никонов,
1996,1998): а) значительным поступлением кислотообразующих агентов и
тяжелых металлов из атмосферы; б) возрастанием количества
растительного опада из-за дефолиации хвойных деревьев и гибели чувствительных
видов (зеленых мхов); в) обогащением опада и подстилки тяжелыми
металлами и обеднением элементами питания; г) замещением катионов
элементов питания в почвенном поглощающем комплексе "кислыми
катионами" и их выносом; е) увеличением содержания обменного алюминия.
Анализ этих нарушений позволяет заключить, что качество питательного
субстрата для микроорганизмов существенно изменяется. По нашему мнению,
следует принимать во внимание содержание как токсичных соединений
элементов, например тяжелых металлов (Евдокимова, 1995), так и
органического вещества и элементов питания.
Специфика нарушения качества субстрата для микроорганизмов в
древесных (еловых) парцеллах определяется интенсивными потоками
кислотообразующих веществ и тяжелых металлов в подкроновые пространства,
обусловливающими выщелачивание основных катионов из опада и органо-
238
Начало вегетационного сезона
мг/г
о0 1 2 1
V/
5
8 10
i15
Ч 20
^ 25
30
■Ч. f' 1
*. ** У
^_j^j*d
р—~"7 ^
* v;-""
- fy
. \А
\/ \
/ ^
4L а
35
V 1 "~ "tr* — J • " ■ а• • • J
Конец вегетационного сезона
мг/г
Л0 2 4 6 8 10
и
5
8 10
S 15
1
д ■ р " "^-* ' 1
* tf^~~
i w
г ш
£ 20 А 4Э
я
Ь 25
30
35*
>v
It
^
o(
5
§ io
8
1 15
* *,
С 20
25
>
A
4
•
f\:
' If
/;1
40
зо L
1 2
■ i
^
*^*^
мг/г
3
i
Л0 1
0
5
Ъ ю
ed
J 15
£
Я
^ 20
25
30
i
. F/ ^
* ^'^
iJT
> r
' :P
ill
mii
мг/г
2|
■
мг/г
o° l 2
и
5
я 10
a 15
5
v| 20
6*
t* 25
30
35
ТЗИЗ-'Д '
^v
**.
- f ..>
i ..•••
j.-*"'
- a-*''* i
мг/г
0 12 3
5
8 10
2 15
s „
|20
й 25
30
35
1 *.-'■*&* '
3**
F
..•'''
•*' '
/
: /
- У
Рис. 7Л2. Внутрипочвенное, парцеллярное и сезонное распределение общей
биомассы микроорганизмов в условиях загрязнения
1 - фон, 2 - дефолиирующий ельник; 3 - редколесье
239
генных горизонтов почв, обогащение подстилки медью, никелем,
алюминием и обеднение доступными соединениями углерода, магния, калия,
фосфора, азота (нитратами). Сходные тенденции наблюдаются в почвах кустар-
ничковых парцелл. Сопоставимое с фоном содержание кальция в почвах
подкроновых и межкроновых парцелл обусловлено его высоким
содержанием в опадающих не только в фенологические сроки хвое и листьях кустар-
ничков-кальцифагов (брусники, черники).
При низком уровне загрязнения (дефолиирующие леса) в начале
вегетации биомасса и численность грибного мицелия органогенных и
минеральных горизонтов почв древесных парцелл сопоставима с фоном (см.
табл. 7.11, 7.12; рис. 7.12). Дренирование почвенного профиля снеговыми
водами обусловливает его частичную "очистку" от токсичных соединений
никеля и меди, способствуя относительно благоприятным для
микроорганизмов условиям (рис. 7.13). Известно, что подвижные соединения этих
металлов могут быть токсичными, прежде всего для грибов (Baath, 1989;
Nordgren et al., 1986). В конце вегетации биомасса и численность грибного
мицелия в почвах этих парцелл значительно ниже, чем в фоне. Это резкое
снижение может быть обусловлено значительным возрастанием
содержания подвижных соединений тяжелых металлов и алюминия к концу
вегетации, как в твердых фазах почв, так и в почвенных водах. При накоплении
токсичных для эукариот химических соединений происходит перестройка
микробного комплекса, так как бактерии-гидролитики оказываются более
конкурентоспособными, чем в фоновых условиях, и занимают новые
экологические ниши.
В почвах с относительно устойчивыми к загрязнению растительными
группировками (межкроновые парцеллы, злаково-кустарничковые
сообщества) в начале вегетационного периода внутрипрофильное распределение
численности и массы микроорганизмов соответствует фону, однако в конце
сезона эти показатели значительно уступают фоновым, вероятно, по тем же
причинам, что и в почвах древесных парцелл.
Уже в этих условиях прокариоты и эукариоты проявляют разную
устойчивость к загрязнению. Биомасса и численность бактерий и актиномицетов,
в отличие от грибов, характеризуется выраженными тенденциями к
увеличению в условиях загрязнения (рис. 7.14). Последнее обстоятельство может
быть связано со способностью прокариот (прежде всего бактерий), гораздо
более разнообразных по своим физиологическим характеристикам, нежели
грибы, развивать специфические группы, устойчивые к атмосферному и
почвенному загрязнению. Сходные тенденции были обнаружены при
изучении воздействия воздушных выбросов медного комбината Харьявалта
(Финляндия) на почвенную микрофлору, когда с возрастанием концентрации
меди в почве соотношение грибной и бактериальной биомассы сужалось (Fritze
etal., 1996,2000).
Таким образом, в условиях загрязнения организация микробных
комплексов Al-Fe-гумусовых подзолов выражается в увеличении значимости про-
катриотных форм. Микромицеты оказываются наиболее чувствительной к
загрязнению группой почвенных микроорганизмов. Причинами снижения
биомассы и численности грибного мицелия к концу вегетации является как
"ухудшение" качества субстрата (обогащение соединениями тяжелых
металлов и обеднение элементами питания) (см. табл. 7.7; 7.8), так и наруше-
240
Подстилочные воды
мкгэкв/л
400
Ni
зоо |- |
200 h №
I
100
о
1.
-Я. -И. -И
Июнь Июль Август Сентябрь
ГШ Ш2 05
мкгэкв/л
400 г
Си
300 к
200 U
0
Л
100 I- |}
Ея
jttiTTKNL
JlTTja,
Июнь Июль Август Сентябрь
Воды корнеобитаемого пространства (0-20 см)
мкгэкв/л
100 г
Ni
80
60
40
20
0
^_н_
1—1 -
I
NN NN NN _Кч
Июнь Июль Август Сентябрь
мкгэкв/л
35 г
Си
30
25
20
15
10
5
0
Ш
-1:======
Е
§а ^~
Щ ви
Июнь Июль Август Сентябрь
мг/л
12 р
10 Г
8 Г
4Г
2Г
0
Нп 1
II 1
н'иТШ^т!
О
IRsI 1 HIlU—. I
Са Mg NH4 N03 Р
Рис. 7.13. Концентрация элементов питания, Ni и Си в почвенных водах
органогенного горизонта корнеобитаемого слоя в начале и конце вегетационного периода в
различных парцеллах и типах состояния
1 - фон, 2 - дефолиирующий ельник, 3 - редколесье
ние сроков поступления растительного опада (поступает не в природные
фенологические сроки, а на протяжении всего периода вегетации),
вызывающее "сбои" сукцессионных циклов.
В загрязненных почвах наблюдается увеличение доли спор в биомассе
грибов, т.е. споруляция в ходе техногенной сукцессии наступает раньше, чем
в контроле. В то же время показано, что высокие концентрации металлов
могут ограничивать процесс спорообразования у почвенных грибов (Amir,
Pineau, 1998).
241
о 20
S 15
?10
\о 5
Зеленомошно-кустарничковая
парцелла
TTTll ml
т^Шт^яты
Н Е
Ш П2 Ш5
0
Г6
0
Еловая парцелла
вггпЕ
н. итР . гагН . Л1 ,1
Н Е В ВС
Рис. 7.14. Соотношение биомасс грибов и бактерий в различных парцеллах,
почвенных горизонтах и типах состояния
Н - органогенный горизонт; Е - элювиальный горизонт; В - иллювиальный горизонт;
ВС - переходный горизонт; 1 - фон, 2 - дефолиирующий ельник, 3 - редколесье
Показатель оси ординат (Бб : Бг) • 100 - соотношение биомасс бактерий и грибов,
умноженное на 100
В техногенных редколесьях изменения в функционировании
биогеоценоза, отмеченные в дефолиирующих лесах, углубляются. Наблюдается
снижение концентрации грибного мицелия в техногенных редколесьях по
сравнению с фоном, что может быть связано с углублением процесса изменения
качества субстрата: уменьшением количества свежих растительных
остатков, органического вещества, элементов питания и увеличением
концентраций токсичных соединений тяжелых металлов. Это обусловливает снижение
численности и биомассы грибного мицелия во всем почвенном профиле к
концу вегетации.
Литература
Аристовская Т.В. Микробиология процессов почвообразования. Л.: Наука,
1980. 187 с.
Евдокимова ГЛ. Эколого-микробиологические основы охраны почв Крайнего
Севера. Апатиты: КНЦ РАН, 1995. 272 с.
Звягинцев Д.Г., Добровольская ТТ., Бабъева И.П. и др.
Структурно-функциональная организация микробных сообществ наземных экосистем // Экология и
почвы. Пущино: ОНТИ ПНЦ РАН, 1998. Т. 2. С. 34-83.
Звягинцев Д.Г., Добровольская ТТ., Бабъева И.П. и др. Роль микроорганизмов
в биогеоценотических функциях почв // Структурно-функциональная роль почвы в
биосфере. М.: ГЕОС, 1999. С. 113-121.
Зырин Н.Г., Стоилов ГЛ. Использование метода проростков для определения
подвижности микроэлементов в почвах и оценки химических методов // Агрохимия.
1964, № 7.
Зырин Н.Г., Стоилов ГЛ. Еще раз о возможности использования метода
проростков для определения подвижности микроэлементов в почвах // Там же. 1965.
Коб.
Кислотные осадки и лесные почвы / Под ред. В.В. Никонова и Г.Н. Копцик.
Апатиты: КНЦ РАН, 1999. 320 с.
Лукина Н.В.> Никонов В.В. Состояние еловых биогеоценозов Севера в
условиях техногенного загрязнения. Апатиты: КНЦ РАН, 1993. 134 с.
Лукина Н.В., Никонов В.В. Биогеохимические циклы в лесах Севера в
условиях аэротехногенного загрязнения. В 2-х ч. Апатиты: Изд. Кольского научного
центра РАН, 1996. Ч. 1. 213 с; Ч. 2. 192 с.
242
Лукина Н.В., Никонов В.В. Питательный режим северотаежных лесов:
природные и техногенные аспекты. Апатиты: Изд. КНЦ РАН, 1998. 315 с.
Манаков К.Н., Никонов В.В. Биологический круговорот минеральных
элементов и почвообразование в ельниках Крайнего Севера. Л.: Наука, 1981. 196 с.
Никонов В.В. Особенности почвообразования в северотаежных еловых
биогеоценозах // Почвоведение, 1979. № 9. С. 20-31.
Никонов В.В. Общие особенности первичной продуктивности и
биогеохимических циклов на Крайнем Севере (на примере Кольского полуострова) //
Сообщества Крайнего Севера и человек. М: Наука, 1985. С. 79-90.
Никонов В.В..Лукина Н.В. Биогеохимические функции лесов на северном
пределе распространения. Апатиты: Изд. КНЦ РАН, 1994. 315 с.
Никонов В.В., Лукина Н.В., Полянская Л.М., Паникова А.Н. Особенности
распространения микроорганизмов в Al-Fe-гумусовых подзолах северотаежных
еловых лесов: Природные и техногенные аспекты // Микробиология. 2001. Т. 70, № 3.
С. 374-383.
Полянская Л.М. Микробная сукцессия в почве // Дисс. ... д-ра биол. наук, М.,
1996. 96 с.
Полянская Л.М., Никонов В.В. .Лукина Н.В. и др. Микроорганизмы
Al-Fe-гумусовых подзолов сосняков лишайниковых в условиях аэротехногенного загрязнения
// Почвоведение. 2001. № 2. С. 190-200.
Семко А.П. Гидротермический режим почв лесной зоны Кольского
полуострова. Апатиты: Изд-во Кол. Фил. АН СССР, 1982.142 с.
Baath E. Effects of heavy metals in soil on microbial processes and population // Water,
Air and Soil Pollution, 1989. Vol. 47. P. 335-379.
Fritze H„ Pennanen Т., HaimiJ. et al. Effects of heavy metals on soil microflora // Forest
condition in a changing environment - the Finnish case. Dordrecht: Kluwer (Forestry Sci.
Vol. 65). 2000. P. 260-265.
Fritze #., Vanhala P., Pietikainen A. and Malkonen E. Vitality fertilization of Scots pine
stands growing along a gradient of heavy metal pollution: short-term effects on microbial bio-
mass and respiration rate oh the humus layer // Fresenius' J. Anal. Chem. 1996. Vol. 354.
P. 750-755.
Halonen O., Tulkki H., Derome J. Nutrient analysis methods // Metsantutkimuslaitoksen
tiedonantoja, 1983. Vol. 121. P. 1-28.
Nordgren A., Kauri Т., Baath E., Soderstrom B. Soil microbial activity, myceliar length
and physiological groups of bacteria in heavy metal polluted area // Environ. Pollut. A. 1986.
Vol. 41. P. 89-100.
Глава 8
ДЕРЕВОРАЗРУШАЮЩИЕ ГРИБЫ
Функционирование леса как сложной экосистемы определяется
взаимодействием составляющих эту систему различных групп организмов. В
лесных сообществах микобиота представлена разнообразными группами
грибов, выполняющих функцию разложения основного по массе опада
древесины. Этот процесс осуществляется сумчатыми, несовершенными и
базидиальными грибами. Ксилотрофные базидиомицеты и в первую
очередь афиллофоровые грибы являются наиболее важным компонентом
ксилофильных сообществ лесных экосистем, их значение определяется
ведущей ролью в разложении древесной массы (Бондарцев, 1953; Частухин,
1952; Рипачек, 1967; Частухин, Николаевская, 1969; Степанова, Мухин,
1979; Мухин, 1981, 1993). Кроме того, многие виды патогенны для живых
деревьев и их массовое развитие может существенно повлиять на
состояние древостоев. Структурно-функциональная организация бореальных
лесов предопределяет видовой состав, развитие и распространение
находящихся в консортивных отношениях с ними микро- и макромицетов,
характер этих отношений.
8Л. АФИЛЛОФОРОВЫЕ ГРИБЫ -
ИНДИКАТОРЫ СОСТОЯНИЯ БОРЕАЛЬНЫ X ЛЕСОВ
Естественные, ненарушенные бореальные леса - резерваты природного
разнообразия биоты. Наибольшее видовое разнообразие дереворазрушаю-
щих грибов характерно для мало нарушенных хозяйственной деятельностью
лесных фитоценозов, что в значительной степени связано с наличием здесь
большого количества бурелома и валежа - субстрата для развития этих
грибов. Исследования в данном направлении получают развитие в последние
годы в различных регионах России. Например, детально исследован видовой
состав и структура комплексов афиллофоровых грибов в условно коренных
сосновых и еловых лесах особо охраняемых территорий Карелии (Бондар-
цева, Свищ, 1993; Бондарцева и др., 1996; Лосицкая, 1999; Лосицкая и др.,
2001).
Анатомическое строение базидиом афиллофоровых грибов и условия их
обитания. Анатомическое строение базидиом связано с условиями
существования дереворазрушающих грибов (Бондарцева, 1963, 1983). Выявлено, что
гигрофилы имеют преимущественно мономитическое строение с тонкостен-
244
ными генеративными гифами, мезофилы - димитическое с относительно
параллельным расположением гиф, ксерофилы - тримитическое и мономити-
ческое с толстостенными гифами. Такие признаки, как форма базидиом,
консистенция ткани и тип гифальной системы предположительно способствуют
выживанию вида и связаны с его адаптацией к экологическим
характеристикам среды обитания. В бореальной зоне отмечается преобладание однолетних
резупинантных форм с мономитическим типом строения базидиом.
Афиллофоровые грибы как индикаторы состояния лесных экосистем.
Исследованиями отечественных и зарубежных микологов последних лет
показана перспективность использования редуцентов древесины для оценки
состояния лесных экосистем (Научные основы..., 1992; Стороженко, 1994;
Исаева, 1998; Лосицкая и др., 2001). Установлено, что наибольшее видовое
разнообразие дереворазрушающих грибов характерно для старовозрастных
малонарушенных лесов, что в значительной степени связано с наличием
здесь субстрата для этих грибов.
В странах Северной Европы (Швеции, Финляндии, Норвегии) при
выявлении старых и девственных сосновых и еловых лесов широко
используются в качестве видов-индикаторов трутовые грибы Polyporaceae s.l. (Kotiranta,
Niemela, 1996).
Афиллофоровые грибы и гидротермические условия. Процесс
жизнедеятельности грибов, их рост, развитие и активность в значительной мере
зависят от условий окружающей среды и прежде всего от влажности,
температуры, кислотности, обеспеченности кислородом, освещенности.
Важнейшее значение при этом имеет определенное сочетание отдельных факторов
и продолжительность их воздействия. Влажность и температура в наземных
экосистемах являются одними из существенных экологических факторов
(Одум, 1986).
Большинство грибов лучше развивается при высокой влажности
субстрата и окружающей среды. Отношение к этому фактору определяется
принадлежностью гриба к той или иной экологической группе.
Оптимальное развитие грибов наблюдается при влажности субстрата 60-130% (Бон-
дарцев, 1953; Давыдкина, 1974; Klein, 1978). Влажность воздуха в
значительной мере определяет процессы формирования базидиом, образование спор и
спороношение (Федоров, Стайченко, 1970; Пармасто, 1955, 1978). По
отношению к влажности выделяют три группы дереворазрушающих грибов:
гигрофилы требуют постоянной высокой влажности субстрата, отчасти и
воздуха; мезофилы обычно развиваются на толстых валежных стволах, пнях, а
также на древесине живых деревьев с более постоянным содержанием
влаги; ксерофилы - развиваются в условиях непостоянной, недостаточной
влажности (Пармасто, 1955; Бондарцева, 1965).
Установлено, что девственные разновозрастные еловые леса типичных
для северной тайги свежих и влажных условий роста имеют большие
уровни поражения дереворазрушающими грибами. По мере улучшения условий
роста и сокращения возрастного ряда древостоя уровни поражения их гни-
левыми болезнями снижаются (Стороженко, 1998).
Ксилотрофные базидиомицеты способны к определенному
регулированию влажности древесины, частично за счет высокой влагоемкости и водо-
поглощающей способности плодовых тел грибов. Некоторые
исследователи предполагают, что часть поглощаемой дереворазрушающими грибами
245
влаги может идти на увлажнение субстрата (Бондарцев, 1953; Любарский,
Васильева, 1975).
Как и влажность, температура окружающей среды оказывает большое
влияние на рост, размножение и физиологическую активность грибов.
Мицелий ксилотрофных базидиомицетов способен к росту в диапазоне температур
от 0 до 46 °С, с оптимумом 20-30 °С (Бондарцев, 1953; Рипачек, 1967; Давыд-
кина, 1974; Любарский, Васильева, 1975; Бойко, 1979; Яковлев и др., 2000),
сохраняет жизнеспособность даже в пределах 50-100 °С (Бондарцев, 1953;
Яковлев и др., 2000; Klein, 1978). Большое значение имеет температура среды и для
прорастания спор гриба (Бондарцев, 1953; Пармасто, 1955; Негруцкий, 1962).
Приуроченность афиллофоровых грибов к древесным породам. В
природных условиях субстратная или трофическая специализация
ксилотрофных базидиомицетов проявляется в их преимущественной приуроченности к
древесине определенных видов древесных пород (Мухин, 1993; Ставишенко,
1998; Лосицкая, 1999). Установлено, что субстрат является основным
фактором, определяющим присутствие и смену видов афиллофоровых грибов в
конкретном биоценозе (Бондарцева, 1965).
Показано, что имеется определенная приуроченность к типам леса не
только в зависимости от состава пород-хозяев, но также и от
микроклиматических условий: например, в ксерофильном типе леса в низинках, во
влажных условиях могут встречаться гигрофильные виды (Бондарцева, 1963).
8.2. АФИЛЛОФОРОВЫЕ ГРИБЫ
И ПРОМЫШЛЕННОЕ ЗАГРЯЗНЕНИЕ
В настоящее время промышленные выбросы являются одним из самых
распространенных антропогенных факторов, влияющих на состояние
лесных экосистем. В условиях техногенного воздействия на лесные экосистемы
происходит деградация микобиоты, что, в свою очередь, может привести к
нарушению внутриэкосистемных и глобальных биогеохимических циклов в
результате увеличения времени консервации биофильных элементов в
древесном опаде и отпаде (Tyler, 1982). Воздушное промышленное загрязнение
воздействует как на структуру и функции лесного биоценоза в целом, так и
на отдельные его составляющие (растения, животные, микроорганизмы).
Обзор отечественных и зарубежных работ о неоднозначной реакции
отдельных видов дереворазрушающих грибов и эколого-трофических групп
грибов на антропогенное воздействие в различных формах его проявления
сделан П.В. Гордиенко и М.В. Горленко (1987). Рассмотрим некоторые
аспекты этого воздействия.
Распространение и численность афиллофоровых грибов. Установлено,
что по мере накопления в биоценозах поллютантов и продолжительности их
экспозиции происходят изменения распространенности и численности
патогенных видов. В лесах, подверженных постоянному атмосферному
загрязнению, постепенно развивается необратимая деградационная сукцессия древо-
стоев, и патогенные организмы приобретают в этом процессе значительное
участие (Мозолевская и др., 1987; Юпина, 1988; Морозова, 1994).
При разных формах и уровнях воздействия антропогенных факторов
проявляется общая тенденция - сокращение видового состава афиллофоро-
246
вых грибов с одновременным увеличением численности одних и тех же
немногих видов, происходит смена доминантов (Бондарцева, Свищ, 1991; Ло-
сицкая, Бондарцева, 1999; Брындина, 1998, 2000).
В импактной зоне дереворазрушающие грибы предпочитают заселять
валежные стволы, нежели сухостой и пни (Брындина, 1998). По
исследованиям СП. Арефьева (1996) в этих условиях уменьшается встречаемость
стволовых паразитов гипоарктического комплекса Phellinus igniarius (L.: Fr.)
Quel., Inonotus obliquus (Pers.: Fr.) Pil. и увеличивается численность рудераль-
но-раневых видов Cerrena unicolor (Bull.: Fr.) Мшт., Stereum hirsutum (Fr.)
S.F. Gray, Trametes ochracea (Pers.) Gilb. et Ryvarden, Trametes versicolor (L.: Fr.)
Pil., Bjerkandera adusta (Willd.: Fr.) P. Karst. и др.
В буферной зоне видовое богатство дереворазрушающих грибов
сохраняется на уровне фона, но происходит смена доминирующих видов
(Брындина, 2000).
Исследованиями выявлено, что характер воздействия промышленных
выбросов различен в зависимости от удаленности источника загрязнения и
концентрации поллютанта в воздухе. Гживач и Важны (Grzywacz, Wazny,
1973) установили максимальную плотность некоторых дереворазрушающих
грибов при концентрации S02: 1,2 мг/м3 - для Armillariella mellea (Fr.) P.
Karst., 0,5 мг/м3 - для Heterobasidion annosum (Fr.) Bref., 0,8 мг/м3 - для
Phellinus pini (Brot.: Fr.) A. Ames.
Высокие дозы сернистого газа и его производных вызывают
токсический эффект, а низкие стимулируют физиологические процеесы (Grzywacz,
Wazny, 1973). Пределы токсических и стимулирующих концентраций пол-
лютантов в одних и тех же условиях варьируют у различных видов грибов:
например, содержание в среде 1 мг/м3 S02 ингибирует рост Heterobasidion
annosum, а для Schizophyllum commune Fr. концентрации от 0,1 до 1,0 мг/м3
стимулируют рост и плодоношение.
Таким образом, продолжающееся загрязнение природной среды может
привести к утрате грибного генофонда, так как сокращение естественных
местообитаний обусловит безвозвратную потерю ряда чувствительных
видов (Бондарцева, Свищ, 1991; Kotiranta, Niemela, 1996).
Чувствительность афиллофоровых грибов к загрязнению. На
повышенное загрязнение среды разные виды макромицетов реагируют по-разному.
Одни виды малочувствительны к промышленному загрязнению, другие
активизируют рост, распространение и "вредоностность" (Grzywacz, Wazny,
1973; Минкевич и др., 1982; Юпина и др., 1986; Селиванов и др., 1994;
Максимова, 2000, и др.).
В результате промышленного загрязнения активизируются виды:
Trichaptum abietinum (Dicks.: Fr.) Ryvarden, Schizophyllum commune Fr.,
Phellinus pini (Brot.: Fr.) A. Ames, Melampsoridium betulinum (Fr.) Kleb., Nectria
cinnabarina (Tode: Fr.) Fr., Puccinia graminis Pers. (Grzywacz, Wazny, 1973;
Benben, Sierota, 1977; Domanski, 1978, и др.). В импактной зоне свою
деятельность активизируют Gloeophyllum sepiarium (Wulfen: Fr.) P. Karst., G.
abietinum (Fr.) P. Karst., Cerrena unicolor, Trametes versicolor, Stereum hirsutum,
Schizophyllum commune (Брындина, 2000).
Установлено, что виды, обитающие на коре деревьев (Hysterium pulicare
Pers.: Fr., Diatrype distiformis (Hoffm.: Fr.) Fr., Diplocarpon rosae Wolf) весьма
чувствительны к промышленному загрязнению, тогда как виды рода
247
vjtcicuni, uaeaaim quercina (L.) Fr., Xylodon versiporus (Pers.) Bond. (Grzywacz,
Wazny, 1973; Benben, Sierota, 1976,1977; Domanski, 1978, и др.) проявляют
устойчивость.
Грибы как биоиндикаторы загрязнения. В настоящее время установлена
возможность использования дереворазрушающих грибов как
биоиндикаторов загрязнения воздуха промышленными выбросами, своим
распространением указывающих на патологическое состояние лесных экосистем (Хансо,
1987; Шевченко, 1987; Юпина, Калимуллина, 1987; Вишневская, 1988; Васи-
ляускас, 1991; Арефьев, 1996). Важными параметрами при оценке состояния
природных и подверженных загрязнению лесных экосистем являются
видовое разнообразие и встречаемость отдельных (индикаторных) видов афил-
лофоровых грибов (Бондарцева и др., 2001).
В качестве биоиндикаторов антропогенного воздействия могут служить
дереворазрушающие грибы, способные поражать растущие деревья через
открытые раны (Василяускас, 1991). При биоиндикации могут быть
полезны стойкие комплексы немногих видов, формирующиеся под влиянием
промышленных выбросов (Бондарцева и др., 1994).
Дереворазрушающие грибы и тяжелые металлы. Грибы способны
накапливать тяжелые металлы из субстрата, выводя тем самым их из
биогеохимических циклов, поэтому они могут использоваться как биоиндикаторы
загрязнения лесных экосистем тяжелыми металлами. Большинство ксило-
трофных грибов обладают низкой аккумулирующей способностью, хотя
есть исключения из этого правила. Аккумуляция тяжелых металлов в
плодовых телах варьирует в широких пределах. Так, макромицеты вблизи
источников промышленных выбросов аккумулируют более высокое
количество тяжелых металлов (Pb, Zn, Cd, Си), чем из "чистых" местообитаний
(Горбунова, Терехова, 1995). На 1 г сухой массы плодовых тел Armillaria
lutea и Mycena ammoniaca может накапливаться до 6 мг РЬ, 640 мкг Zn,
230 мкг Cd и Си. Кроме того, представители разных экологических групп
различаются по способности концентрировать тяжелые металлы (Lodenius
et al., 1981). Среди макромицетов концентраторами тяжелых металлов
могут быть ксилотрофы и подстилочные сапротрофы, доля которых в
условиях загрязнения увеличивается (Петров, 1992; Селиванов и др., 1992).
Исследованиями Тилера (Tyler, 1980) выявлено, что частота
встречаемости отдельных металлов в карпофорах 130 видов базидиомицетов
приближается к нормальному распределению. Накопление тяжелых металлов в
плодовых телах дереворазрушающих грибов варьирует в широких пределах.
Установлено, что Cd, Pb, Си активно накапливаются дереворазрушающими
грибами, особенно многолетними плодовыми телами Phellinus robustus
(P. Karst.) Bourd. et Galz. (Второва, Гордиенко, 2001). В карпофорах Fomes
fomentarius (L.: Fr.) Gill., Piptoporus betulinus (Bull.: Fr.) P. Karst., Trametes
versicolor (L.: Fr.) Pilat, Inonotus radiatus (Sow. : Fr.) P. Karst. обнаружено
накопление Co, в меньшей степени Cd, Fe, Zn, Cu, Mg, Na. Однако строгой
зависимости между концентрацией металлов в плодовых телах и соответствующих
древесных субстратах не установлено (Tyler, 1982). Данные о содержании
Си, Pb, Cd и Zn в дереворазрушающих грибах на расстоянии 800 м от
металлургического комбината по направлению ветра приводят Энке М. с соавт.
(Enke et al., 1977). В карпофорах грибов эти металлы варьируют в
следующих пределах: Zn - 120-170, Си - 145-180, РЬ - 51-178, Cd - < 0,2-36 мг/кг.
248
В однолетних базидиомах Fomes fomentarius и Fomitopsis pinicola (Fr.)
P. Karst. аккумулируется больше свинца и никеля, чем в многолетних (Юпи-
на и др., 1986).
По отношению к железу Armillariella mellea является
микроконцентратором, т.е. содержит металл в близких или несколько больших концентрациях,
чем субстрат. Pleurotus ostreatus избирательно накапливает кадмий, если даже
его концентрация в субстрате ниже предела обнаружения. Этот ксилотроф
способен также накапливать и медь. Для индикации загрязнения среды медью
целесообразно использовать Armillaria mellea (Поддубный и др., 1998).
Содержание тяжелых металлов отличается у представителей некоторых
экологических групп грибов. Например, концентрация ртути и свинца
почти в 6 раз, а кадмия в 25 раз выше у подстилочных сапротрофов, чем у ми-
коризообразователей и дереворазрушающих грибов (Lodenius et al., 1981).
Тяжелые металлы оказывают токсическое воздействие на грибы. При
выращивании на средах с солями тяжелых металлов (Hg, As, Ni, Cd, Zn, Pb,
Си) у ряда макромицетов (Lentinus edodes, Pleurotus membraneus, Flammulina
velutipes) происходит подавление роста и развития мицелия, изменение
морфологии спор, ингибирование целлюлазы, активизация аскорбат-оксидазы
и снижение урожайности (Shi Qiao-qin et al., 1991). Снижение радиального
роста колоний и нарушение ориентации гиф в присутствии свыше 100 мкМ
Cd отмечено в культурах базидиомицета Schizophyllum (Lilly et al., 1992).
Такое разнообразное проявление действия тяжелых металлов объясняется их
воздействием сразу на множество функций живой клетки грибов, влияя на
весь ее метаболизм, и в частности на метаболизм нуклеиновых кислот и
белка (Горбунова, Терехова, 1995).
Общим ответом грибных организмов на присутствие токсичных
соединений металлов является синтез специфических связывающих металлы
белков - металлотионеинов, небольших (8-10 кДа) полипептид, богатых цисте-
ином, которые связывают такие металлы, как Си, Zn, Cd и Hg (Горбунова,
Терехова, 1995). Ионы Си, например, могут активно сорбироваться
меланином мицелия, что снижает их токсическое действие (Жданова, Василевская,
1988; Gadd, Rome, 1988).
8.3. АФИЛЛОФОРОВЫЕ ГРИБЫ СЕВЕРО-ТАЕЖНЫХ ЛЕСОВ
В УСЛОВИЯХ ВОЗДУШНОГО ЗАГРЯЗНЕНИЯ
МЕДНО-НИКЕЛЕВОГО ПРОИЗВОДСТВА
Рассмотрим поведение афиллофоровых грибов в условиях загрязнения
тяжелыми металлами на примере северотаежных лесов Кольского
полуострова, подверженных воздействию выбросов медно-никелевого
производства. Первые сведения по афиллофоровым грибам этого региона приводятся
в работе СИ. Ванина (1927), в дальнейшем исследованиям подвергались в
основном фитопатогенные грибы (Ванин, 1926, 1927; Lind, 1934; Траншель,
1936; Kari, 1936; Гутнер, Хохряков, 1940; Неофитова, 1951; 1958; Ратвийр,
1967; Крутов, 1979; Nanfeldt, 1981; Иванов, 1998; Каратыгин, 1995, 1999, и
др.). Отдельные находки афиллофороидных грибов приводятся в работах
Э.Х. Пармасто (1967), В.К. Неофитовой (1972), Л.В. Михайловского (1975),
И.В. Каратыгина с соавт. (1998, 1999).
249
Стационарное изучение грибной флоры на Кольском полуострове
начато с образованием Лапландского биосферного и Кандалакшского
государственных заповедников. При исследовании микофлоры заповедных островов
Кандалакшского залива было собрано 289 видов базидиомицетов, из них
50 видов из 28 родов порядка Aphyllophorales (Пыстина и др., 1969). С
1950-х годов микофлору Лапландского заповедника исследует Н.М.
Пушкина (1961), список собранных ею грибов включает 19 видов афиллофоровых
грибов. В конце 1980-х годов проведена инвентаризация микофлоры
Лапландского заповедника (Берлина, 1988, 1991). По данным Н.Г. Берлиной
порядок Aphyllophorales включает 28 видов из 21 рода (Исаева, Берлина,
1992; Берлина, 2001, 2002).
Наиболее полным обзором по грибам Мурманской области до
последнего времени остается работа В.И. Шубина и В.И. Крутова (1979), в которой
приводится список около 80 видов афиллофоровых грибов.
В настоящее время согласно литературным данным и нашим сборам
афиллофороидные грибы Мурманской области насчитывают примерно
100 видов, из них ксилотрофы составляют 65%, сапротрофы почвенные и
гумусовые - 27%; грибы микоризообразователи - 8%.
При оценке природных и подверженных антропогенному воздействию
лесных экосистем наиболее важными параметрами являются видовое
разнообразие и встречаемость отдельных (индикаторных) видов афиллофоровых
грибов.
Объектом исследований являются афиллофоровые ксилотрофные бази-
диомицеты старовозрастных и подверженных воздушному загрязнению
еловых и сосновых экосистем. Сбор образцов проводили преимущественно
маршрутным методом, а также на постоянных пробных площадях в
соответствии с общепринятыми правилами сбора и хранения образцов (Гербарное
дело, 1995). На основании полевых наблюдений в картотеку заносили
сведения о встречаемости видов. При исследовании влияния промышленного
загрязнения на видовой состав трутовых грибов использовали постоянные
пробные площади Лапландского биосферного заповедника, расположенные
на различном удалении от комбината "Североникель".
Идентификацию собранного материала проводили в лаборатории
наземных экосистем ИППЭС КНЦ РАН с использованием микроскопа и
определителей (Давыдкина, 1980; Бондарцева, Пармасто, 1986; Бондарцева,
1998; Ryvarden, Gilbertson, 1993; Nordic Macromycetes, 1997).
Природные условия. Древостой на объектах исследования
сформированы главным образом сосной (Pinus sylvestris L.), елью (Picea obovata
Ledeb.) и березой (Betula pubescens Ehrh.). На основе рекогносцировочных
маршрутов и визуальных оценок обследованы типичные и редкие участки
коренных (отчасти условно-коренных) сосновых и еловых сообществ:
ельник чернично-вороничный - Piceetum empetroso-myrtillosum subass. typ-
icum, ельник лишайниковый - Piceetum cladinosum subass. typicum, ельник
травяный - Piceetum herbosum, сосняк чернично-вороничный - Pinetum
empetroso-myrtillosum, сосняк кустарничково-лишайниково-зеленомош-
ный - Pinetum hylocomioso-cladinosum, сосняк лишайниковый - Pinetum
cladinosum.
В результате исследований, проведенных в 1999-2000 гг. в
старовозрастных лесах был выявлен 41 вид ксилотрофных афиллофоровых грибов из
250
28 родов, 7 семейств: Poriaceae (23), Hymenochaetacea (7), Polyporaceae (3),
Corticiaciae (4), Stereaceae (2), Peniophoraceae (1), Hericiaceae (1). Три рода
(Trichaptum, Trametes, Phellinus) содержат по 3-5 видов, 25 родов (89%)
представлены 1-2 видами (табл. 8.1). Большая часть исследованных видов (56%)
является представителями семейства Poriaceae.
Субстратом для афиллофоровых грибов являются живые, усыхающие и
сухостойные, валежные, буреломные и ветровальные стволы и пни
различных древесно-кустарниковых пород. Так, на ели обнаружено 11 видов, на
сосне - 6, на березе - 25, на рябине - 1, на осине - 1 (см. табл. 8.1). Среди 16
видов, приуроченных исключительно к хвойным породам, 75% отмечено
только на одной породе (11 видов - на ели, 1 - на сосне). Немного больше видов
(88%) из 25, найденных только на лиственных породах, зарегистрировано в
старовозрастных еловых и сосновых лесах на одной породе (22 вида - на
березе). В сосняках на лиственных деревьях обнаружено от 57 до 64%
афиллофоровых грибов, в ельниках - от 43 до 58%.
Видовое разнообразие афиллофоровых грибов в старовозрастных лесах
по типам леса представлено в табл. 8.2. В целом еловые леса отличаются от
сосновых как большим видовым разнообразием ксилотрофных базидиоми-
цетов, так и большим разнообразием форм базидиом (табл. 8.3).
Наибольшее богатство видов характерно для ельников травяного (30 видов) и зеле-
номошно-кустарничкового (26 видов), что составляет, соответственно, 73%
и 63% от общего числа видов, отмеченных в старовозрастных лесах. Это
определяется тем, что данные типы леса отличаются от других более высокой
степенью увлажнения. В этих типах леса обнаружено также и большее
количество видов-индикаторов, характеризующих старовозрастные и
девственные леса (табл. 8.4). Лишайниковые типы лесов не отличаются
богатством видов, так как исторически сформировались на площадях, вышедших
из-под пожаров. Кроме того, исследованные сосновые и еловые
старовозрастные леса сходных типов сопоставимы по видовому составу ксилотрофов.
Среди встреченных видов афиллофоровых грибов семь являются
индикаторами старовозрастных еловых лесов: Amylocistis lapponica (Romell)
Singer, Laurilia sulcata (Burt) Pouzar, Phlebia centrifuga P.Karst., Fomitopsis rosea
(Alb. Et Schwein.: Fr.) Karst., Onnia leporina (Fr.) Jahn, Phellinus chrysoloma (Fr.)
Donk, Phellinus nigrolimitatus (Lomell) Bourdot et Galzin и три вида -
индикаторами старовозрастных сосновых лесов: Dichomitus squalens (Karst.) Reid,
Phellinus pini (Brot.: Fr.) A. Ames, Gloeophyllum protractum (Fr.) Imazeki
(Kotiranta, Niemala, 1996). Один вид - Hericium coralloides (Scop.: Fr.) Pers. -
внесен в Красную книгу РСФСР и Мурманской области.
Таким образом, старовозрастные еловые и сосновые леса северной
тайги отличаются богатством и разнообразием афиллофоровых грибов, где
создаются устойчивые комплексы видов, которые могут быть индикаторами
их возраста и состояния.
Воздушное промышленное загрязнение. В условиях промышленного
загрязнения видовой состав афиллофоровых грибов изучали в еловых лесах
(Piceetum myrtillosum, P. empetroso-myrtillosum и Р. fruticuloso-hylocomiosum)
вдоль юго-западного градиента от комбината Североникель. Выявлено
22 вида дереворазрушающих грибов (табл. 8.5), относящихся к пяти
семействам: Poriaceae (64%), Hymenochaetaceae (18%), Polyporaceae (4%),
Corticiaceae (5%), Stereaceae (9%).
251
Реакция дереворазрушающих грибов на воздушное промышленное
загрязнение не однозначна. Численность и видовой состав изучаемых грибов
характеризуется отрицательной зависимостью от уровня загрязнения, чем
ниже уровень, тем выше численность и разнообразнее видовой состав (см.
табл. 8.5).
В природных условиях для микоценозов характерно примерно
одинаковое соотношение всех типов гифальной системы (табл. 8.6). В дефолиирую-
щих лесах выражены тенденции снижения доли грибов с мономитическим
типом строения. В разрушающихся еловых экосистемах (техногенное
редколесье) встречаются виды только с димитической и тримитической
гифальной системой. Вывод о том, что грибы с мономитическим типом
строения базидиомы наиболее чувствительны к изменениям среды,
подтверждает результаты других микологов (Лосицкая, Бондарцева, 1999; Лосицкая и
ДР., 1999).
Анализируя видовой состав афиллофоровых грибов по форме базидиом,
можно сказать, что наиболее устойчивыми к воздушному промышленному
загрязнению оказались сидячие, а наиболее чувствительными -
распростертые формы базидиом.
Виды-индикаторы состояния лесных экосистем отмечены в условиях
фона (Onnia leporina, Gloeophillum protraktum, Amylocistis lapponica, Phellinus
chrysoloma, Phellinus nigrolimitatus, Phlebia centrifuga), а также в условиях
различной степени дефолиации от одного до четырех видов по мере удаления
от источника загрязнения.
Многолетние исследования ксилотрофов северо-таежных ельников кус-
тарничково-зеленомошных, подверженных воздушному промышленному
загрязнению (период с 1979 по 1993 г.), позволили охарактеризовать
временную динамику их видового состава в процессе техногенно
обусловленной сукцессии: фон -> дефолиирующие леса -> техногенные редколесья
(табл. 8.7).
В начале 1980-х годов на стационарах, характеризующих нарушенные
(дефолиирующие) леса, по сравнению с фоновыми объектами отмечена
активность как паразитных (Phellinus igniarius и Inonotus obliquus), так и сапротро-
фитных (Fomes fomentarius, Piptoporus betulinus) видов. Первоначально (стадия
начальной дефолиации) к активным паразитам добавлялся инонотус
скошенный - чага (Inonotus obliquus) и сапротрофы валежных стволов и пней
(Trichaptum abietinum, Trichaptum fusco violaceus). Затем (стадия интенсивной
дефолиации) количество ксилотрофов пополнялся патогенами: ложным
трутовиком (Phellinus igniarius), который поражает только живые деревья, и
полупаразитом - березовой губкой (Piptoporus betulinus). To есть, ослабление
древостоев еловых лесов процессом дефолиации способствует
распространению паразитных видов (Piptoporus betulinus, Phellinus igniarius, Ininotus
obliquus), поражающих живые или ослабленные деревья (увеличение видового
состава достигает 48%). На стадии разрушенных лесов (техногенные
редколесья) происходило резкое снижение видового богатства: из дереворазрушите-
лей отмечено только два вида (Fomes fomentarius и Fomitopsis pinicola),
которые имеют димитическую и тримитическую гифальную систему. Виды с мо-
номитической системой появляются лишь на стадии дефолиации.
В 1990-е годы на стадии начальной дефолиации видовой состав
ксилотрофов не изменился. В то же время количество деревьев, пораженных на-
252
стоящим березовым трутовиком (Fomes fomentarius) заметно увеличилось.
На стадии интенсивной дефолиации опасные патогены представлены уже
тремя видами (Phellinus igniarius, Inonotus obliquus, Piptoporus betulinus), к
которым добавляются ксилотрофы Gloeophyllum sepiarium (заборный
трутовик) и Phellinus chrysoloma (еловая губка) - индикатор старовозрастных
лесов (Kotiranta, Niemela, 1996). Одновременно активизировались настоящий
(Fomes fomentarius) и ложный (Phellinus igniarius) трутовики. На стадии
разрушенных лесов (техногенные редколесья) появляется березовая губка
(Piptoporus betulinus).
Таким образом, в процессе деградации дефолиирующих лесов в них
заметно уменьшается встречаемость стволовых паразитов (Phellinus igniarius,
Ininotus obliquus, Phellinus chrysoloma) - до 25% от общего количества дере-
воразрушающих грибов.
С усилением техногенного воздействия происходит сокращение
видового состава афиллофоровых грибов с одновременным увеличением
численности одних и тех же немногих видов (Fomes fomentarius и Fomitopsis pinico-
1а), устойчивых к загрязнению (см. табл. 8.7), поэтому пораженность
древесных пород дереворазрушающими грибами по мере удаления от источника
загрязнения снижается.
Выявлено, что субстрат - важнейшее условие распространения и
видового разнообразия афиллофоровых грибов. В северотаежных ельниках кус-
тарничково-зеленомошных отмечены в основном узкоспециализированные
виды, связанные с одной породой. По мере появления подходящего
субстрата, происходит поражение грибами березы, либо ели. При этом
пораженность березы дереворазрушающими грибами выше, чем ели (табл. 8.8).
8.4. ОБЩИЕ ОСОБЕННОСТИ АФИЛЛОФОРОВЫХ ГРИБОВ
СЕВЕРОТАЕЖНЫХ ЛЕСОВ
Разнообразные и устойчивые комплексы афиллофоровых грибов
старовозрастных хвойных лесов северной тайги обусловливают постоянное
разрушение древесины опада и отпада. Тем самым они выполняют важную
биогеохимическую функцию: способствуют возвращению в биогеохимические
циклы элементов, аккумулирующихся в многолетних органах древесных
растений и потому на длительное время исключенных из этих природных циклов.
Субстратная специализация ксилотрофных базидиомицетов проявляется
в их преимущественной приуроченности к древесине определенных видов
древесных пород. Наибольшее количество видов грибов приурочено к
древесине березы (24 вида), для других доминирующих в северо-таежных лесах
древесных пород ели и сосны количество видов значительно меньше (16 и
6 видов соответственно). Одни виды обладают видовой специализацией
породы-хозяина, другие могут использовать различный древесный субстрат.
Большинство ксилотрофных грибов обладают незначительной
способностью аккумулировать тяжелые металлы. Доступность соединений
тяжелых металлов для грибов определяется кислотностью субстрата.
В условиях изменяющейся природной среды, обусловленной воздушным
промышленным загрязнением, проявляются специфичность и
универсальность ответных реакций афиллофоровых грибов.
253
Универсальность ответа обусловлена тем, что на воздействие разных
загрязняющих веществ реагируют одни и те же регуляторные системы мико-
биоты. Сходство ответных реакций наиболее отчетливо проявляется в
смене доминантов афиллофоровых грибов, сокращении их видового состава с
безвозвратным выпадением отдельных видов. Поэтому загрязнение среды
может привести к утрате грибного генофонда бореальных лесов.
Специфичность ответных реакций афиллофоровых грибов
выражается в неоднозначной реакции разных видов. Наименее устойчивыми
видами являются индикаторы малонарушенных лесных экосистем (Onnia lepo-
rina, Gloeophillum protraktum, Amylocistis lapponica, Phellinus chrysoloma,
Phlebia centrifuga, Dichomitus squalens), наиболее устойчивыми - Fomitopsis
pinicola, Fomes fomentarius, Gloeophyllum sepiarium. Специфичность
ответных реакций определяется также типом гифальной системы. Виды с мо-
номитической гифальной системой наиболее чувствительны к
загрязнению окружающей среды, поэтому в этих условиях происходит заметное
увеличение доли видов с тримитическим и димитическим типами
гифальной системы.
Литература
Арефьев СП. Трансформация микобиоты в импакт-зонах городов Тюменского
Севера и ее использование в биоиндикации // Освоение Севера и проблемы
рекультивации. Тез. докл. III Междунар. конф. Сыктывкар, 1996. С. 8-9.
Берлина Н.Г. Инвентаризация грибов. Отчет по теме № 3, 4 за 1987-1988 гг.
1988. 30 с. (Рукопись Лапландского государственного биосферного заповедника).
Берлина Н.Г. Инвентаризация грибов. Отчет за 1986-1990 гг. 1991. 73 с.
(Рукопись Лапландского государственного биосферного заповедника).
Берлина Н.Г. Некоторые редкие виды микофлоры Лапландского заповедника //
Микология и криптограммная ботаника: Тр. Междунар. конф. СПб., 2000. С. 69-70.
Берлина Н.Г. К микофлоре Лапландского заповедника // Современная
микология в России: I съезд микологов России: Тез. докл. М., 2002. С. 101-102.
Бойко М.И. Влияние температуры и кислотности среды на рост штаммов гриба
Fomitopsis pinicola (Fr.) P. Karst. // Микология и фитопатология. 1979. Т. 19, № 2.
С. 141-146.
Бондарцев А.С. Трутовые грибы Европейской части СССР и Кавказа. М.; Л.:
Изд-во АН СССР, 1953. 1106 с.
Бондарцева М.А. Обзор порядка Aphyllophorales Ленинградской области: Дис. ...
канд. биол. наук. Л., 1963. 447 с.
Бондарцева М.А. Факторы, влияющие на распространение афиллофоровых
грибов по типам леса // Проблемы изучения грибов и лишайников. Тарту, 1965.
С. 23-28.
Бондарцева М.А. Система трутовых грибов (Polyporaceae s. lato) и принципы их
классификации: Дис.... д-ра биол. наук. Л., 1983. 558 с.
Бондарцева М.А. Определитель грибов России: Порядок афиллофоровые.
Вып. 2. СПб.: Наука, 1998. 390 с.
Бондарцева М.А., Крутое В.И., Лосщкая В.М. Афиллофоровые грибы
сосновых древостоев промышленной зоны г. Костомукши // Биоэкологические аспекты
мониторинга лесных экосистем Северо-Запада России. Петрозаводск: Карел, науч.
центр РАН, 2001. С. 224-232.
Бондарцева М.А., Крутое В.И.,Лосицкая В.М., Кивиниеми С.Н. Комплексы де-
реворазрушающих грибов хвойных древостоев заповедника "Кивач" (Русская
Карелия) и биосферного заповедника "Северная Карелия" (Юго-Восточная Финляндия)
254
// Проблемы антропогенной трансформации лесных биогеоценозов Карелии.
Петрозаводск, 1996. С. 121-139.
Бондарцева М.А.,Лосщкая В.М., Свищ Л.Г. Влияние антропогенного фактора
на распространение афиллофоровых грибов // Проблемы лесной фитопатологии и
микологии: Тез. докл. Всерос. конф. М., 1994. С. 10-11.
Бондарцева М.А., Пармасто Э.Х. Семейства гименохетовые, лахнокладиевые,
кониофоровые, щелелистниковые Л.: Наука, 1986. 192 с. (Определитель грибов
СССР: Порядок афиллофоровые; Вып. 1).
Бондарцева М.А., Свищ Л.Г. Изменение видового состава трутовых грибов в
условиях антропогенного воздействия // Проблемы лесопатологического
мониторинга в таежных лесах Европейской части СССР. Тез. докл. Петрозаводск, 1991.
С. 9-11.
Бондарцева М.А., Свищ Л.Г. Афиллофоровые грибы пробных площадей
заповедника "Кивач" // Новости систематики низших растений. 1993. Т. 29. С. 37-42.
Брындина Е.В. Реакция сообществ ксилотрофных базидиомицетов на
техногенную нагрузку // Современные проблемы популяционной, исторической и
прикладной экологии: Матер, конф. Екатеринбург, 1998. 280 с.
Брындина Е.В. Действие выбросов медеплавильного завода на сообщества
ксилотрофных базидиомицетов южной тайги // Сиб. экол. журн. 2000. № 6. С. 679-683.
Ванин И.И. Список галлов, собранных в Карело-Мурманском крае //
Материалы по микологии и фитопатологии. 1926. № 1.
Ванин СИ. К микологической флоре Мурмана // Защита растений от
вредителей. 1927. Т. 4, № 4/5. С. 770-772.
Василяускас Р.А. Дереворазрушающие грибы как биоиндикаторы
антропогенного воздействия лесных биогеоценозов Литвы // Проблемы лесопатологического
мониторинга в таежных лесах Европейской части СССР: Тез. докл. Петрозаводск,
1991. С. 15-17.
Вишневская И.Г. Грибные болезни ельников рекреационных лесов хвойно-ши-
роколиственной зоны и обоснование мероприятий по профилактике и борьбе с
ними: Автореф. дис.... канд. биол.наук. Л.,1988. 17 с.
Второва В.Н., Гордиенко П.В. Оценка состояния лесопарковых экосистем по
химическому составу растений и дереворазрушающих грибов // Современные
проблемы биоиндикации и биомониторинга: Тез. докл. Сыктывкар, 2001. С. 30-31.
Гербарное дело: Справочное руководство / Под ред. Д. Бридсон и Л. Формана.
Рус. изд., М., 1995. 24 с.
Горбунова Е.А., Терехова В.А. Тяжелые металлы как фактор стресса для
грибов: Проявление их действия на клеточном и организменном уровнях // Микология
и фитопатология. 1995. Т. 29, № 4. С. 63-67.
Гордиенко П.В., Горленко М.В. Антропогенное воздействие на развитие
грибных болезней леса // Там же. 1987. Т. 21, № 4. С. 377-387.
Гутнер Л.С., Хохряков М.К. Материалы по болезням культурных растений
Кольского полуострова // Вестн. защиты растений. 1940. № 1/2.
Давыдкина Т.А. Стереумовые грибы Советского Союза. Л.: Наука, 1980. 143 с.
Давыдкина Т.А. Влияние некоторых факторов культивирования на развитие
видов рода Stereum Pers. ex F. Gray s. lato // Микология и фитопатология. 1974. Т. 8,
№4. С. 301-306.
Жданова Н.Н., Василевская А.И. Меланинсодержащие грибы в экстремальных
условиях. Киев: Наук, думка, 1988. 196 с.
Иванов СМ. Грибные болезни пятихвойных сосен, интродуцированных на
Кольском полуострове // Микология и фитопатология. 1998. Т. 32, № 6. С. 72-77.
Исаева Л Т. Некоторые итоги многолетнего мониторинга лесов Лапландского
заповедника // Антропогенное воздействие на природу севера и его экологические
последствия. Тез. докл. Апатиты, 1998. С. 223-224.
255
Исаева Л.Г., Берлина Н.Г. К флоре и экологии афиллофоровых грибов
Лапландского заповедника // Экология и плодоношение макромицетов-симбиотро-
фов древесных растений: Тез. докл. Всесоюз. совещ. Петрозаводск, 1992.
С. 33-34.
Каратыгин И.В. Головневые грибы (порядок Ustilaginales) Российской
Арктики // Микология и фитопатология. 1995. Т. 29, № 1. С. 30-35.
Каратыгин И.В. Паразитные грибы тундрового и гольцового поясов
Хибинских гор // Новости систематики низших растений. 1999. Т. 33. С. 82-87.
Каратыгин И.В., Нездойминого ЭЛ., Новожилов Ю.К., Журбенко М.П.
Результаты исследования микофлоры арктических субтундр и тундр Кольского
полуострова // Проблемы ботаники на рубеже XX и XXI вв.: Тез. докл., представл. к
X съезду Рус. ботан. о-ва. СПб., 1998. Т. 2. С. 11.
Каратыгин И.В., Нездойминого ЭЛ., Новожилов Ю.К., Журбенко М.П. Грибы
Российской Арктики. СПб.: СПб. гос. хим.-фармацевт. акад., 1999. 212 с.
Крутое В.И. О паразитной микофлоре искусственных фитоценозов сосны на
вырубках Карельской АССР и Мурманской области // Микология и фитопатология.
1979. Т. 13, № 4. С. 68-70.
Лосщкая В.М. Афиллофоровые грибы республики Карели;: Автореф. дис. ...
канд. биол. наук. СПб.: 1999. 22 с.
Лосщкая В.М. Кониофоровые грибы республики Карелия // Микология и
криптограммная ботаника: Тр. Междунар. конф. СПб., 2000. С. 184-187.
Лосщкая В.М., Бондарцева М.А. Влияние Костомукшского
горно-обогатительного комбината на биоразнообразие афиллофоровых грибов // Биологические
основы изучения и охраны животного и растительного мира, почвенного покрова
Восточной Фенноскандии: Тез. докл. Петрозаводск, 1999. С. 203-204.
Лосщкая В.М., Бондарцева М.А., Крутое В.И. Афиллофоровые грибы как
индикаторы состояния сосновых древостоев промышленной зоны города Костомукши
(Карелия) // Микология и фитопатология. 1999. Т. 33, № 5. С. 331-337.
Лосщкая В.М., Бондарцева М.А., Крутое В.И. Видовое разнообразие
афиллофоровых грибов на разных стадиях сукцессии естественных лесов заповедника "Ки-
вач" // Биоэкологические аспекты мониторинга лесных экосистем северо-запада
России. Петрозаводск: Карел, науч. центр РАН, 2001. С. 82-99.
Любарский Л.В., Васильева Л.Н. Дереворазрушающие грибы Дальнего
Востока. Новосибирск: Наука, 1975. 164 с.
Максимова ТА. Паразитические грибы на некоторых древесных и
кустарниковых породах в окрестностях г. Абакана // Проблемы изучения растительного
покрова Сибири: Тез. докл. II Рос. конф., посвящ. 150-летию со дня рождения П.Н.
Крылова. Томск, 2000. С. 80.
Минкевин И.И., Чернышева Н.К., Маслова Л.А. Реакция грибов - ксилофагов
на загрязнение среды фторсодержащими соединениями // Экология и биология
низших растений: Тез. докл. Всесоюз. симпоз. микологов и лихенологов. Минск, 1982.
С. 102.
Михайловский Л.В. Макромицеты (порядок Agaricales) Хибинского горного
массива: // Автореф. дис. ... канд. биол. наук. Л., 1975. 23 с.
Мозолевская Е.Г., Соколова Э.С., Шарапа Т.В., Писарева С.Д. Влияние промвы-
бросов на насекомых и патогенную микофлору // Охрана лесных экосистем и
рациональное использование лесных ресурсов: Тез. докл. Всесоюз. науч.-техн. конф. М.,
1987. Секция 1.С. 26.
Морозова Т.И. Грибные болезни в лесах, ослабленных атмосферным
загрязнением // Проблемы лесной фитопатологии и микологии. Тез. докл. М., 1994. С. 43-45.
Мухин В.А. Роль базидиальных дереворазрушающих грибов в лесных
биогеоценозах//Лесоведение. 1981. № 1. С. 46-53.
Мухин В.А. Биота ксилотрофных базидиомицетов Западно-Сибирской
равнины. Екатеринбург: Наука, 1993. 231 с.
256
Научные основы устойчивости лесов к дереворазрушающим грибам / В.Г. Сто-
роженко, В.А. Бондарцева, В.А. Соловьев, В.И. Кругов. М: Наука, 1992. 221 с.
Негруцкий С.Ф. Роль температуры в развитии грибов Fomitopsis annosa (Fr.)
Karst. // Ботанич. журн. 1962. Т. 47, № 3. С. 416-418.
Неофитова В.К. Болезни растений Мурманской области и меры борьбы с
ними. Мурманск, 1951.
Неофитова В.К. Болезни декоративных растений для Крайнего Севера СССР.
М.: Изд-во АН СССР, 1958.
Неофитова В.К. Обзор микофлоры Хибинских гор // Флора и растительность
Мурманской области. Л.: Наука, 1972. С. 62-72.
Одум Ю. Экология: В 2 т. М.: Мир, 1986. Т. 1. 328 с; Т. 2. 376 с.
Пармасто Э.Х. Трутовые грибы Эстонской ССР: Автореф. дис. ... канд. биол.
наук. Тарту, 1955. 23 с.
Пармасто Э.Х. Трутовые грибы севера Советского Союза // Микология и
фитопатология. 1967. Т. 1, № 4. С. 280-286.
Пармасто Э.Х. Распространение афиллофоровых грибов базидиоспорами. 2.
Биология распространения Polyporus squamosus (Polyporaceae) // Изв. АН ЭССР.
1978. Т. 27, № 2. С. 141-149.
Петров А.Н. Макромицеты-симбиотрофы в зоне действия аэропромвыбросов
// Экология и плодоношение макромицетов-симбиотрофов древесных растений:
Тез. докл. Петрозаводск, 1992. С. 47^4-8.
Поддубный А.В., Христофорова Н.К., КовековдоваЛД. Макромицеты как
индикаторы загрязнения среды тяжелыми металлами // Микология и фитопатология.
1998. Т. 32, №6. С. 47-51.
Пушкина Н.М. Видовой состав и особенности плодоношения шляпочных грибов.
1961. 70 с. (Рукопись Лапландского государственного биосферного заповедника).
Пыстина К.А., Павлова Т.В., Шестакова Ю.С. К микофлоре заповедных
островов Кандалакшского залива // Тр. Кандалакш. гос. заповедника. 1969. Вып. 7.
С. 190-226.
Ратвийр А.Г. Предварительный обзор экзобазидиальных грибов в СССР //
Микология и фитопатология. 1967. Т. 1, № 6. С. 450-453.
Рипачек В. Биология дереворазрушающих грибов. М.: Лесн. пром-сть, 1967.
276 с.
Селиванов И.А.У Шкараба Е.М., Мехоношин Л.Е. Реакции грибов на
техногенное загрязнение в природных лесах Перми // Проблемы лесной фитопатологии и
микологии. М., 1994. С. 71-72.
Селиванов И.А., Шкараба Е.М., Мехоношин Л.Е., Переведенцева Л.Г. Реакция
шляпочных грибов на загрязнение окружающей среды // Экология и плодоношение
макромицетов-симбиотрофов древесных растений: Тез. докл. Петрозаводск, 1992.
С. 54-55.
Ставишенко И.В. Ксилотрофные макромицеты Среднетаежного Приобья //
Автореф. дис. ... канд. биол. наук. Екатеринбург, 1998. 22 с.
Степанова Н.Т., Мухин В.А. Основы экологии дереворазрушающих грибов. М.:
Наука, 1979. 100 с.
Стороженко В.Г. Формирующая и деструктивная функции
дереворазрушающих грибов в лесных биогеоценозах // Проблемы лесной фитопатологии и
микологии: Тез. докл. М., 1994. С. 83-84.
Стороженко В.Г. Структура и пораженность дереворазрушающими грибами
разновозрастных ельников северной тайги //Лесоведение. 1998. № 1. С. 42-^49.
Траншель В.Г. Материалы к флоре грибов Мурманского округа. Киров, 1936.
24 с. (Рукопись ПАБСИ).
Федоров Н.И., Стайченко Н.И. Динамика споруляции корневой губки в БССР
// Микология и фитопатология. 1970. Т. 4, № 5. С. 454-458.
9. Рассеянные элементы
257
Хансо М.Э. Rhizosphaera alkhoffi Bub. (Coelomucetes, Sphaeropsidalles) как
индикатор загрязнения воздушной среды в ельниках Эстонии // Охрана лесных экосистем
и рациональное использование лесных ресурсов: Тез. докл. Всесоюз. науч.-техн.
конф. М., 1987. Секция 1. С. 32.
Частухин В.Я. Распад растительных остатков и роль грибов в процессе
почвообразования // Агробиология. 1952. № 4. С. 12-25.
Частухин В.Я., Николаевская МЛ. Биологический распад и ресинтез
органических веществ в природе. Л.: Наука, 1969. 324 с.
Шевченко СВ. Возможность использования фитопатогенных грибов в
биоиндикации загрязнения среды // Охрана лесных экосистем и рациональное
использование лесных ресурсов: Тез. докл. Всесоюз. науч.-техн. конф. М., 1987. Секция 1.
С. 32-33.
Шубин В.И., Крутое В.И. Грибы Карелии и Мурманской области: (Эколого-си-
стематический список). Л.: Наука, 1979.107 с.
Юпина ГЛ. Дереворазрушающие грибы антропогенных территорий //
Изучение грибов в биогеоценозах: Тез. докл. Свердловск, 1988. С. 158.
Юпина ГЛ., Калимуллина СМ. К использованию дереворазрушающих грибов
как биоиндикаторов загрязнения лесных экосистем // Тез. докл. Всесоюз. науч.-
техн. конф. "Охрана лесных экосистем и рациональное использование лесных
ресурсов". М., 1987. Секция 1. С. 33-34.
Юпина ГЛ., Калимуллина С.Н., Ольшевская Е.Е. К использованию
дереворазрушающих грибов в качестве биоиндикаторов тяжелых металлов // Микология и
фитопатология. 1986. Т. 20, № 6. С. 478-480.
Яковлев А.Ю., Боровский Г.Б., Пензина ТЛ. и др. Влияние отрицательных
температур на рост мицелия и жизнеспособность плодовых тел некоторых высших кси-
лотрофных базидиомицетов // Микология и фитопатология. 2000. Т. 34, № 6.
С. 56-61.
Benben К., Sierota Z. Grzyby pasozytnicze na aparacie asymilacyjnym drzew i krzew6w
wok6y Zakladdw Azotowych w PuHawach. // Sylwan. 1976. R. 120, N 10. S. 21-26.
Benben K., Sierota Z. Z badari nad wystepowaniem grzybdw na terenach objetych dzi-
ayaniem emisji przemysyowych Zaklad6w Azotowych w Puyawach // Prace Inst.
Badawczego LeSn. 1977. N 531/536. S. 22-59.
Domanski S. Grzyby powodujace choroby korzeni w drzewostanach objetych oddziay-
waniem emisji przemysyowych w G6rno£laskim i Krakowskim okregu przemysyowym //
Phytopathol. Pol., 1978. N 3. S. 167-172.
Enke M., Matschiner H., Ashtzehn M.-K. Schwermetallanreicherungen in Pilzen //
Mykol. Mitteilungsbl. 1977. Jg. 21, N 1. S. 7-12.
Gadd G.V., Rome L. Biosorption of copper by fungal melanin // Appl. Microbiol, and
Biotechnol. 1988. Vol. 29, N 6. P. 610-617.
Grzywacz A., Wazny J. The impact of industrial air pollutants on the occurrence of
several important pathogenic fungi of forest trees in Poland // Europ. J. Forest Pathol. 1973.
Vol. 3, N 3. P. 129-141.
Kari L.T. Mikromyceten aus Finnisch-Lappland // Ann. Bot. Soc. Zool.-Bot. Fenn.
"Vanamo". 1936. Vol. 8, N 3. P. 1-24.
Klein W. Holzzerstorung durch pilze // Wald und Holzarb. 1978. N 294. S. 27-32.
Kotiranta #., Niemela T. Uhandlaiset kaavat Suomessa. Helsinki, 1996. P. 163-169.
Lilly W.W., Wallweber GJ., Lukefahr ТА. Cadmium absorption and its effects on growth
and mycelial morphology of the basidiomycete fungus, Schizophyllum commune //
Microbios. 1992. Vol. 72, N 292/293. P. 227-237.
Lind J. Studies on the geographical distribution of arctic circumpolar micromycetes //
Kgl. Dan. Videns. Selsk. Biol. Medd. 1934. Bd. 11, N 2. S. 1-30.
Lodenius M., Kuusi Т., Laaksovirta K. et al. Lead, cadmium and mercury contents of
fungal in Mikkeli, SE Finland // Ann. bot. fenn. 1981. Vol. 18, N 2. P. 183-186.
258
Nannfeldt J A. Exobasidium, a taxonomic reassessment applied to the European species
// Symb. Bot. Uppsal. 1981. Vol. 23, N 2. P. 1-72.
Nordic macromycetes. Vol. 3. Heterobasidion, Aphyllophoroid and Gasteromycetoid
Basidiomycetes. Helsinki, 1977. 444 p.
Ryvarden L., Gilbertson R. European Polyporus. Pt 1. Abortiporus - Lindtneria. Oslo:
Fungiflora, 1993. 507 p.
Shi Qiao-qin, Lin Lin, Chen Zhe-chao et al. A study on accumulation of the heavy
metals and their effect on growth and metabolism inmushrooms // Acta mycol. sin. 1991.Vol. 10,
N4. P. 301-311.
Tyler P. Metals in sporophores of Basidiomycetes // Trans. Brit. Mycol. Soc. 1980.
Vol. 74, N 1. P. 41-49.
Tyler G. Metal accumulation by wood-decaying fungi // Chemosphere. 1982. Vol. 11,
N11. P. 1141-1146.
Глава 9
МЕЛКИЕ МЛЕКОПИТАЮЩИЕ
Мелкие млекопитающие в бореальных экосистемах выполняют
несколько биогеохимических функций.
Транспортная функция. Мелкие млекопитающие являются важным
звеном в биогеохимических циклах микроэлементов, обеспечивая
транспорт последних от почвы и растительности к высшим трофическим
уровням. Большинство видов мелких млекопитающих являются фитофагами,
на долю которых приходится потребление более 35% первичной
продукции. С другой стороны, эти виды выступают в качестве вторичных
продуцентов, обеспечивая пищевые потребности животных высших
трофических уровней.
Распределительная функция. Будучи эвритопными подвижными консу-
ментами, мелкие млекопитающие "усредняют" информацию об
аккумуляции микроэлементов, включая загрязнение, на территориях площадью от
нескольких до десятков гектаров, нивелируя тем самым "мозаичность"
распределения поллютантов.
Индикаторная функция. Физиологическая, анатомическая,
биохимическая и трофическая близость этих видов млекопитающих человеку
позволяет рассматривать их в качестве объекта биоиндикации состояния среды для
оценки экологического риска.
Многочисленные исследования химического состава органов и тканей
мелких млекопитающих, выявили видовую специфичность аккумуляции
микроэлементов. Эти различия, например, проявляются по мере увеличения
содержания тяжелых металлов в окружающей среде (Getz et al., 1977; Муха-
чева, Безель 1995). В то же время очевидно, что эти уровни аккумуляции
зависят от экологии вида и прежде всего от состава пищевых рационов. Так,
полевки рода Microtus (чаще всего серая и пашенная) являются типичными
зеленоядными зверьками. В придорожных экосистемах у этих животных
наблюдаются более высокие концентрации свинца, чем у типичных
зерноядных видов (например, у лесных мышей (Jefferies, French, 1972)). Полевки
рода Clethrionomus (чаще всего рыжая и красная полевки), обладающие
смешанным рационом, включающим веточный корм и частично насекомых, по
данным тех же авторов, имеют промежуточные уровни аккумуляции
тяжелых металлов в органах и тканях.
Другие авторы (Smith, Rongstad, 1982) при сопоставлении участков с
повышенными уровнями некоторых тяжелых металлов (цинк, медь, кадмий,
свинец, ртуть, мышьяк и др.) и контрольных выявили противоположные
260
тенденции. Так, пенсильванская полевка аккумулирует в своих органах и
тканях более низкие содержания этих элементов, чем хомячки,
потребляющие, кроме растительности, беспозвоночных. Наши исследования
показали, что концентрации свинца и цинка у красных и рыжих полевок в
фоновых условиях (экосистемы южной тайги) превышают таковые у серых
(Безель и др., 1984, 1985, 1986). В то же время Роберте и Джонсон (Roberts,
Johnson, 1978) наблюдали сопоставимые концентрации свинца у рыжих и
пашенных полевок, обитающих на отвалах шахт. Лесные мыши в этих
условиях аккумулировали в своем теле несколько меньшие концентрации
тяжелых металлов.
Казалось бы, роль рационов можно установить при сравнении
фитофагов (разные виды полевок и мышей) с типичными насекомоядными видами
(бурозубки), однако и в этом случае мы не имеем четкой закономерности.
Бурозубки накапливают меньшие количества свинца, чем полевки и лесные
мыши (Roberts, Johnson, 1978). С другой стороны, по данным Хантера и со-
авт. (Hunter et al., 1987) зеленоядные пашенные полевки, зерноядные лесные
мыши и насекомоядные бурозубки в условиях совместного обитания
показали различия в аккумуляции меди и кадмия. В рационах бурозубки
обыкновенной содержится в три раза больше меди и в 12 раз больше кадмия, чем у
пашенной полевки. Меньше всего металлов с пищей потребляла лесная
мышь. В то же время не выявлены достоверные различия для этих групп
животных или даже получены обратные тенденции для мелких
млекопитающих, обитающих вдоль дорог (Getz et al., 1977). Отсутствие четкой
зависимости, вероятно, связано с особенностями экологии бурозубок, рационы
которых характеризуются высокой пластичностью и значительно варьируют
по составу потребляемого корма.
Для выяснения специфики аккумуляции свинца в органах мелких
млекопитающих мы проанализировали материалы ряда авторов (Getz et al., 1977;
Jefferies, French, 1972; Quarles et al., 1974; Roberts, Johnson, 1978; Roberts et al.,
1978; Williamson, Evans, 1972). Поскольку в этих работах речь идет о
различных уровнях тяжелых металлов во внешней среде, то средние концентрации
свинца в теле зверьков были выражены относительно его содержания у
полевок рода Microtus, в каждом случае принятого равным 1,0 (Безель и др.,
1986). Согласно этим данным, нет основания говорить о каком-либо
избирательном накоплении свинца полевками рода Clethrionomys и даже
бурозубками. Лишь у мышей рода Apodemus, являющихся типичными зерноядными
животными, концентрация свинца в теле животных была на 40% ниже
(рис. 9.1). Полученные данные хорошо согласуются с концентрациями
свинца в разных органах растений, которые потреблялись животными:
концентрации этого элемента в плодах и зернах были ниже, чем в стеблях и листьях.
Некоторые авторы отмечают, что, кроме рационов, причиной видовых
отличий могут быть особенности экологии животных, особенно размер
стаций обитания и роющая деятельность (Jefferies, French, 1972; Roberts et al.,
1978).
Положение мелких грызунов в трофических цепях как первичных кон-
сументов придает особое значение установлению функциональной
зависимости - аккумуляция тяжелых металлов в организмах животных как
функция их концентрации в растительности. С этой целью мы привели к
единым единицам размерности концентраций весь известный нам материал по
261
5
i
£
i
нтра
Si
9
О
M
i,^
1
0,8
0,6
0,4
0,2
0
к
jj
^Ш
■
////////у
Ш
Шк
ш
Microtus Clethrionomys Apodemus Sorex
Рис, 9.1. Видовая специфика аккумуляции свинца мелкими млекопитающими
б
# R2 = 0,307
л=16
150 200 250
U 50
1 40
| зо
1 20
а
\й 10
(
в
у/
yS R2 = 0,783
1 ' ' i i 1
) 50 100 150 200 250 1
Растения, мг/кг
8г
6
4
2
0
R2 = 0,768
л = 9
12
Растения, мг/кг
18
Рис. 9.2. Взаимосвязи между концентрацией свинца в растениях и аккумуляцией в
животных
а - красная полевка (Безель и др., 1984, 1985); б - лесная мышь (Roberts, Johnson, 1978);
в - пашенная полевка (Roberts et al., 1978); г - рыжая полевка (Мухачева, Безель, 1995)
накоплению свинца в организмах мелких грызунов, обитающих в условиях
техногенного загрязнения и на контрольных участках. Данные
охватывают значительный диапазон концентраций элемента в растительности от
1до 1000 мкг/г и широкие пределы возможной его аккумуляции в органах
и тканях животных (от 0,5 до 100 мкг/г). Высокие концентрации свинца в
растительности отражают максимальное токсическое загрязнение среды,
когда численность природных популяций мелких млекопитающих мала, а
262
их роль в функционировании таких экосистем сведена к минимуму.
Отметим в этой связи, что близкие фоновым уровни свинца в растительности от
1,0 до 10,0 мкг/г представлены наименьшим числом данных.
Представленные на рис. 9.2 данные показывают, что несмотря на разброс приводимых
значений концентраций можно говорить о тесной положительной
зависимости аккумуляции свинца в организмах животных от его концентрации в
растительности.
Сведений о других тяжелых металлах значительно меньше. Однако и в
этом случае анализ данных по аккумуляции металлов мелкими
млекопитающими выявил тесную положительную зависимость концентрации цинка в
организмах животных (рыжие полевки) и от его концентрации в
растительности, а также между аккумуляцией кадмия в печени и его концентрацией в
рационах (Безель, 1987; Мухачева, Безель, 1995).
Несмотря на самый общий характер приводимых зависимостей более
детальное изучение этих закономерностей позволяет отметить специфику
накопления тяжелых металлов различными функционально-возрастными
группами животных в природных популяциях. Прежде всего, выявлены
различия в аккумуляции цинка и меди, с одной стороны, и свинца, кадмия,
ртути, с другой. Показано, что при возрастании концентрации меди в рационе
до 9 раз практически не увеличивается аккумуляция этого металла в
организмах перезимовавших рыжих полевок (Мухачева, Безель, 1995). Сходные
тенденции характерны поведению цинка. Следует предположить наличие
физиологического барьера поглощения на уровне кишечно-желудочного
тракта, обеспечивающего внутренний гомеостаз этих металлов. По нашим
оценкам, концентрации этих металлов в кормовых рационах, достигающие
в среднем 135-230 мкг/г на сухое вещество для цинка и 60-115 мкг/г на сухое
вещество для меди, не столь значительны, чтобы преодолеть этот барьер и
вызвать заметное повышение аккумуляции элементов в тканях животных
(Мухачева, Безель, 1995).
Иначе обстоит дело с тяжелыми металлами из другой группы.
Увеличение концентрации свинца и кадмия в рационах полевок приводит к
существенному повышению их уровней в тканях (табл. 9.1). Отсутствие
фиксируемых физиологических барьеров по отношению к этим металлам
обусловливает свободное поступление через стенку кишечно-желудочного тракта и
объясняет повышенные их уровни в тканях животных.
Поскольку обменные процессы, прежде всего энергетические, у мелких
млекопитающих обеспечиваются за счет пищевых рационов, то и
поступление тяжелых металлов в организмы зверьков должно коррелировать с
уровнем энергетических затрат. С этих позиций обнаруженные повышенные
уровни свинца в скелете самок всех возрастных групп, вероятно, отражают
их общие, более высокие энергетические затраты, связанные с участием в
размножении. Аналогичные повышенные уровни свинца в скелете и кадмия
в печени самок рыжих и красных полевок показаны рядом авторов (Безель,
1987; Quarles et al., 1974). Отмечена также повышенная аккумуляция
железа, марганца, никеля самками азиатской мыши (Литвинчук, 1984).
Возможно, что более низкая интенсивность аккумуляции перечисленных
элементов, отмеченная для самцов, объясняется еще и спецификой их
территориального поведения. В отличие от самок, ведущих преимущественно оседлый
образ жизни, особенно в период беременности и выкармливания потомства,
263
самцы активно перемещаются по территории. Это значит, что в выборках
животных, отловленных на загрязненных территориях, могут
присутствовать самцы-мигранты со смежных менее загрязненных участков. Это,
естественно, снижает средние концентрации элемента в выборках самцов.
В условиях хронического загрязнения тяжелые металлы имеют
тенденцию накапливаться с возрастом в органах-депо (Безель, 1987; Maljkovic,
Kostial, 1985; Cook et al., 1990; Pankakoski et al., 1992). Данные по накоплению
тяжелых металлов в органах рыжих полевок из экосистем южной тайги,
иллюстрирующие это положение, представлены в табл. 9.1. Логично ожидать,
что максимальные уровни тяжелых металлов будут обнаружены в органах
и тканях перезимовавших полевок (особенно это касается свинца в
метаболически инертном скелете). Повышенные концентрации тяжелых металлов
можно ожидать и в организмах половозрелых сеголеток,
характеризующихся более высоким по сравнению с неполовозрелыми прибылыми особями
уровнем энергетических затрат.
Нам представляется важным, что основной экотоксикологический
эффект, связанный с накоплением свинца в скелете, обусловлен не столько
различиями в концентрациях этого элемента на фоновой территории,
сколько динамикой его накопления в градиенте техногенной нагрузки. Так у
перезимовавших зверьков содержание свинца в скелете при увеличении
уровня техногенного загрязнения возрастает более чем в 5 раз, у половозрелых
прибылых особей - в 2,9 раза, у неполовозрелых животных - в 2,6 раза (см.
табл. 9.1).
Аналогичная картина в градиенте техногенной нагрузки отмечена и у
кадмия, накапливающегося в печени. У сеголеток (половозрелых и
неполовозрелых), обитающих на загрязненных участках, отмечены сходные
концентрации этого элемента, которые в 3,2-3,3 раза больше, чем у
половозрелых прибылых особей фоновых территорий. У перезимовавших животных
также отмечено почти шестикратное увеличение аккумуляция кадмия.
Таким образом, возрастание концентрации тяжелых металлов в среде
обитания, прежде всего в растительности, неизбежно ведет к повышению их
аккумуляции в органах и тканях консументов первого порядка
(млекопитающих). Наличие множества трудно учитываемых абиотических и
биотических факторов природной среды в сочетании с неоднозначностью
применяемых методик исследований в значительной мере затрудняют анализ
экологических закономерностей влияния таких факторов, как состав пищевых
рационов, видовой половой и возрастной специфики аккумуляции тяжелых
металлов зверьками различных популяционных группировок.
9.1. ТЕХНОГЕННОЕ ЗАГРЯЗНЕНИЕ
И СОСТОЯНИЕ ПОПУЛЯЦИЙ
МЕЛКИХ МЛЕКОПИТАЮЩИХ
В условиях загрязнения среды обитания тяжелыми металлами в
организмах мелких млекопитающих не определяют еще состояние и судьбу их
популяций. В настоящее время лабораторные животные (мыши, крысы)
являются наиболее изученными биологическими объектами с точки зрения
влияния на млекопитающих разнообразных токсических веществ, однако много-
264
численные данные свидетельствуют, что в природных популяциях при
техногенном загрязнении среды редко удается обнаружить те признаки
поражения организмов, которые надежно диагностируются в виварных или
лабораторных токсикологических экспериментах. Очевидно, что
жизнеспособность природных популяций не исчерпывается адаптационными
возможностями отдельного организма, решающую роль в обеспечении судьбы
популяции играют популяционные механизмы, обеспечивающие стабильность
и нормальное их функционирование при техногенном химическом
загрязнении среды.
Одним из важнейших процессов, определяющим состояние природных
популяций мелких млекопитающих в условиях техногенного загрязнения,
является воспроизводство обилия их населения.
Репродуктивные потери
Репродуктивные потери в популяциях мелких млекопитающих
иллюстрируются на примере рыжих полевок, обитающих на загрязненных
территориях южной тайги (Безель, Мухачева, 1995; Мухачева, Безель, 1995; Безель
и др., 1998). Данные получены в период 1989-1999 гг. при изучении
репродуктивных возможностей мелких млекопитающих в градиенте воздушного
промышленного загрязнения тяжелыми металлами лесных экосистем
Среднего Урала.
Рассмотрен полный цикл воспроизводства, включающий три этапа:
1) оогенез, в процессе которого в яичниках животных из первичных ооцитов
формируется зрелая яйцеклетка; 2) пренатальный период (эмбриогенез);
3) постнатальный период, включающий развитие сеголеток от рождения до
момента полового созревания и участия в размножении. Полученные
данные представлены в виде единого репродуктивного процесса,
объединяющего клеточно-тканевые, организменные и популяционные этапы. На
каждом из этапов рассмотрен ряд последовательных стадий, на которых
механизмы элиминации (атрезия фолликул, эмбриональные потери, гибель
молодняка, неполное участие зверьков в размножении) исключают из
процесса дальнейшего развития часть репродуктивного материала.
Проведенный анализ показал, что максимальные потери (более 98%)
происходят в оогенезе, причем эти процессы не обусловлены техногенным
загрязнением среды: потери на фоновой и загрязненной территориях
сопоставимы. Более резистентны стадии эмбриогенеза, в течение которых
репродуктивные потери не превышают 20%. При этом общие эмбриональные
потери, выраженные через отношение разности между средним числом
желтых тел беременности и живых эмбрионов к числу желтых тел, более чем в
два раза выше на фоновой, чем на наиболее загрязненной территориях.
Подобная повышенная плодовитость мышевидных грызунов в условиях
химического и радиационного стресса отмечается и другими авторами (Тестов,
1993; Рождественская, 1999) и может рассматриваться в качестве одного из
механизмов популяционной адаптации.
Поскольку установлено, что на техногенно загрязненных территориях в
организмах животных фиксируются более высокие концентрации тяжелых
металлов, то трудно ожидать, что это обстоятельство может способствовать
прямому снижению эмбриональных потерь. Очевидно, что их меньшая ве-
265
личина в условиях техногенного загрязнения вызвана не реакцией организ-
менного уровня, а связана с популяционными механизмами компенсации, в
результате которых в популяциях сохраняются наиболее плодовитые самки.
Оказалось, что максимально высокими потерями на загрязненных
участках характеризуется периоды постнатальной жизни зверьков. По нашим
данным потери сеголеток до момента их вступления в размножение при
высоком уровне загрязнения тяжелыми металлами достигает 80%, на фоновых
территориях составляет не более 43%.
Таким образом, лишь малая часть первичных фолликул завершает
процесс онтогенеза и, будучи оплодотворенной, успешно проходит стадии
внутриутробного развития. Еще меньшая часть может реализоваться среди
новорожденных и принять участие в размножении. На всем протяжении цикла
от однослойных фолликул (потенциально максимальное количество
потомков) до размножающихся самок репродуктивный потенциал снижается на
фоновой территории в 900 раз, на загрязненной - в 1900 раз.
Сравнивая ход репродуктивных потерь на фоновом и импактном
участках, отметим, что роль загрязнения тяжелыми металлами на этапах оогене-
за и внутриутробного развития выражена слабо, что свидетельствует о
незначительном токсическом действии поллютантов на организм самок.
В наибольшей степени различия в репродуктивных потерях
проявляются на этапе онтогенеза, прямо связанном с качеством местообитаний.
Результатом деградации природной среды (прежде всего фитоценозов)
является снижение количества участков, пригодных для обитания зверьков.
Именно поэтому этапы постнатального развития сеголеток и их участие в
размножении наиболее резко реагируют на загрязнение. Повышенная
элиминация из популяции сеголеток компенсируется более полным участием
выживших в размножении. Аналогичные данные приводят СИ. Исаев и
А.Д. Покаржевский (1978), показавшие, что при радиационном загрязнении
происходит своеобразное "омоложение" популяции лесной мыши, и в
размножение вступают более молодые и плодовитые особи. При этом
жизнеспособность природных популяций мелких млекопитающих в условиях
химического техногенного загрязнения среды определяется тем, в какой мере
им удается компенсировать обусловленные токсическим влиянием
повышенные потери репродуктивного цикла.
Наши оценки показывают, что 100 самок, дважды в течение сезона
участвуя в размножении, потенциально могут дать на фоновой территории
274 прибылых самок, на загрязненных участках то же количество самок в
силу более активного участия в размножении и несколько большей
плодовитости дадут 433 прибылых зверьков. Основываясь на опубликованных
ранее данных (Безель и др., 1998), можно оценить судьбу сеголеток в обоих
случаях. В табл. 9.2 приведен примерный расчет возможности
воспроизводства численности в каждой из локальных популяционных группировок.
Оказалось, что весенняя численность полевок следующего года на импактной
территории будет более чем в два раза ниже фоновой.
Таким образом, при всей условности полученного результата следует,
что поддержание стабильной численности в условиях техногенного
загрязнения тяжелыми металлами невозможно, если исключить пополнение
локальных популяционных группировок на загрязненных участках
мигрантами со смежных территорий.
266
Динамика численности
Влияние техногенного загрязнения на процессы воспроизводства в
природных популяциях неизбежно отражается на динамике численности этих
видов. Кроме того, процесс токсической пессимизации среды обитания
может существенно модифицировать естественный ход этих процессов. Таким
образом, реакция популяции мелких млекопитающих на токсический
фактор обусловлена, с одной стороны, уровнем техногенного загрязнения
(содержание тяжелых металлов в пищевых рационах); с другой - изменением
экологической емкости среды обитания. В первом случае речь может идти
о прямом токсическом влиянии на животных, реализуемом через различие
концентраций тяжелых металлов в организмах животных разных
функциональных групп (половозрелые и неполовозрелые сеголетки,
перезимовавшие особи). В силу их различной толерантности к поллютантам возможно
изменение полово-возрастной структуры популяции и связанное с этим
изменение динамики численности. Во втором случае, мы имеем в виду
состояние подверженных техногенной деградации фитоценозов, опосредованно
влияющих на динамику численности через наличие мест для укрытия,
обилие кормов и т.д. (деградационная сукцессия).
На различных фазах динамики численности, когда решающим является
вклад в общее обилие зверьков различных функциональных группировок,
при техногенном загрязнении закономерно должна меняться и доля
"пораженных" животных (Безель, Оленев, 1989). Выше мы отмечали, что
токсическое поражение связано с нарушением репродуктивных функций, в этом
случае доля таких особей отражает дифференцированное снижение
плодовитости различных функциональных группировок и соответствующее
уменьшение их вклада в общее обилие популяции.
На фазе максимальной численности поражение популяции мелких
млекопитающих может быть обусловлено главным образом токсическим
воздействием на перезимовавших и неполовозрелых зверьков. Высокий
процент "пораженных" среди этих групп животных приводит к тому, что в зиму
до весны следующего года остается меньшая часть популяции. Это
снижение весенней численности компенсирует предшествующий высокий уровень
обилия. Подобное явление на фазе максимума выступает в качестве
дополнительного механизма снижения избыточного количества зверьков. На
фазе спада численности наибольший вклад в общее поражение популяции
вносят половозрелые сеголетки. Выход популяции из депрессии в этом случае
определяется сохранностью к осени полноценных молодых зверьков,
которые после зимовки могут обеспечить подъем численности.
Согласно данным Л.Е. Лукьяновой и О.А. Лукьянова (1998) амплитуда
общего обилия рыжих полевок между максимумом и минимумом ее
численности на техногенно загрязненных территориях достигает десятикратной
величины при восьмикратном изменении этого показателя в контроле. Если
же в качестве характеристики динамики численности принять частное
обилие как меру относительной численности зверьков только на заселенных,
максимально пригодных к обитанию участках, то указанные различия
имеют обратный характер. На загрязненных участках частное обилие
изменяется меньше, чем на незагрязненных.
Можно рассматривать также показатели заселенности (процент
ловушек, попавших на участки заселенные животными) и агрегированность на-
267
селения (отношение частного обилия к заселенности территории). В
табл. 9.3 приведены значения этих показателей на различных фазах
динамики численности рыжих полевок на загрязненных и фоновых участках,
иллюстрирующих различие в реакции населения полевок. Следует обратить
внимание, что амплитуды изменения всех рассмотренных показателей на
различных фазах динамики численности населения деградированных
территорий могут изменяться в 8-10 раз (кроме частного обилия). Аналогичным
образом Г.Д. Катаев и соавт. (Kataev et al., 1994) отмечают, что в условиях
воздушного промышленного загрязнения динамика численности мелких
млекопитающих (рыжая, красная, красно-серая полевки) утрачивает
периодичность и при интенсивной техногенной нагрузке может быть отнесена к
разорванному типу, характерному для нестабильных временных поселений
транзитных зверьков.
Таким образом, в условиях техногенного химического загрязнения боре-
альных экосистем потоки тяжелых металлов через популяцию мелких
млекопитающих в силу особенностей ее эколого-функциональной структуры
способны воздействовать на ведущие демографические параметры
(плодовитость и выживаемость зверьков) и через них - на ее возрастную
структуру и динамику численности. Выраженность такого корректирующего
воздействия качественно и количественно зависит от специфики конкретного
поллютанта и уровня пессимизации среды обитания.
9.2. ТЕХНОГЕННОЕ ЗАГРЯЗНЕНИЕ
И СТРУКТУРА ПОПУЛЯЦИЙ
МЕЛКИХ МЛЕКОПИТАЮЩИХ
Пространственная неоднородность территории является важнейшим
фактором, определяющим устойчивое существование популяции. Эколого-
климатические факторы, проявляя свою прерывистость в пространственно-
временных масштабах, формируют некоторую экологическую мозаику
среды обитания природных популяций животных и растительных ценопопуля-
ций. На эту естественную мозаичность природных биоценозов
накладывается неоднородность полей загрязнения, вызванная спецификой воздушных
потоков, особенностями рельефа местности и другими географическими
параметрами территории. Независимое сочетание природных и техногенных
факторов имеет следствием не просто различие в уровнях накопления
токсических веществ в отдельных элементах биоценозов, но и связанную с этим
различную меру их деградации, создавая тем самым мозаичную по условиям
существования среду обитания живых организмов.
Поскольку расселение или ненаправленное пространственное
перемещение особей на определенных этапах жизненного цикла является
важнейшим свойством биологических систем надорганизменного ранга, то именно
миграционные процессы играют важную роль в популяционной адаптации к
действию токсических факторов (Бигон и др., 1989; Шилова, 1999;
Лукьянов, 1999).
Воздушное промышленное загрязнение лесных экосистем Среднего
Урала, так же как и других районов бореальной зоны, ведет к уменьшению
плотности, полноты и запасов древостоя, снижению сомкнутости крон и
268
плотности подроста, увеличению доли сухостоя, замещению лесных видов
травянистых растений луговыми и эксплерентами и т.д. (Ахметшина, Хан-
темирова, 1994). В процессе деградационной (техногенной) сукцессии
отмечено уменьшение емкости местообитаний мелких млекопитающих,
сокращение кормовых и защитных ресурсов. Как уже отмечали, пессимиза-
ция среды обитания существенно модифицирует естественный ход
динамики численности изученных видов. Адаптация природных популяций к тех-
ногенно трансформированной среде реализуется за счет адаптивной
перестройки поло-возрастной структуры популяции. Повышенная доля в
популяции мигрирующих особей на загрязненных территориях может
рассматриваться как адаптация, компенсирующая повышенную гибель животных
на этих участках.
В табл. 9.4 приведена характеристика обилия оседлых и мигрирующих
особей в различной степени техногенно нарушенных местообитаниях.
Данные получены в исходных и частично деградированных пихтово-еловых
лесах методом многосуточного безвозвратного изъятия животных линиями
ловушек Геро (Лукьянов, 1988,1991; Щипанов, 1990). Следует отметить
резкое увеличение доли мигрирующих особей по мере увеличения техногенной
нагрузки.
Таким образом, динамика численности в популяциях мелких
млекопитающих на загрязненных территориях существенно отличается от фоновых
условий. В естественных условиях нарастание обилия происходит за счет
как пространственной экспансии, так и локального уплотнения населения.
На техногенно загрязненных территориях большое значение играет
пространственная миграция. При этом обилие особей в сохранившихся
благоприятных местообитаниях поддерживается на постоянном уровне
(Лукьянова, Лукьянов, 1998). Даже частичное токсическое воздействие на основные
стации обитания, где сохраняется ядро популяции, должно приводить к
значительному опустошению смежных территорий, в том числе и тех,
техногенное загрязнение которых незначительно или отсутствует (Безель и др.,
1994). Наиболее серьезные последствия с точки зрения снижения
численности популяции следует ожидать в случае совпадения полей техногенного
загрязнения и зон преимущественного обитания зверьков. Иначе говоря, в
зависимости от пространственного размещения стаций преимущественного
обитания и полей максимального загрязнения последствия могут выходить
за границы территории прямого токсического воздействия, оказывая
значительное негативное влияние на смежные зоны.
Отметим еще одно обстоятельство, связанное с техногенной
деградацией природной среды. На загрязненных участках в отличие от фоновых
обилие мелких млекопитающих не может достигать значительной
плотности. В техногенно нарушенных экосистемах по этой причине сведена к
минимуму роль зависящих от плотности населения механизмов,
ограничивающих плодовитость самок. Именно это обстоятельство может
объяснить отмеченные выше меньшие эмбриональные потери у рыжей
полевки на загрязненных территориях (Безель, Мухачева, 1995). На этих
территориях невозможно достижение таких численностей, которые мы
регистрируем на фоне и которые ограничивали бы на этих территориях
плодовитость зверьков.
269
9.3. ТЕХНОГЕННОЕ ЗАГРЯЗНЕНИЕ
И ВИДОВОЕ РАЗНООБРАЗИЕ
СООБЩЕСТВ МЕЛКИХ МЛЕКОПИТАЮЩИХ
Сообщества мелких млекопитающих формируются в ходе
естественного эволюционного процесса в конкретных условиях физико-географической
среды и могут быть характеризованы долевым участием видов,
позволяющим сообществу наиболее полно использовать ресурс среды (Лукьянова,
Лукьянов, 1998). Загрязнение последней оказывает, как правило,
воздействие прежде всего через видоспецифическую элиминацию из сообщества
наиболее чувствительных к поллютанту видов, а также опосредованное
влияние через изменение качественных и количественных характеристик
местообитаний.
Если в первом случае следует ожидать сокращение видового
разнообразия, то во втором - в силу возросшего разнообразия и мозаичности среды
возможна трансформация сообщества в сторону увеличения его видового
разнообразия. При этом в результате совокупного влияния (прямого и
опосредованного) токсической нагрузки на исходное видовое сообщество
возможно снижение роли доминирующих видов и возрастание обилия редких
видов, т.е. к увеличение видового разнообразия и выровненность видового
состава.
Техногенное загрязнение среды влияет на видовой состав и обилие
мелких млекопитающих (Лукьянова, Лукьянов, 1998; Лукьянов и др.,
1994). В условиях южной тайги значительный вклад в эти изменения
вносит опосредованное влияние химического загрязнения через деградацию
темнохвойных лесов - основной лесообразующей формации. Изменениям
подвержены как видовой состав мелких млекопитающих, так и их долевое
участие в обилии видов. Роль доминирующего по численности вида -
рыжей полевки - существенно снижается, его место занимают сателлитные
виды - приверженцы антропогенных ландшафтов. Различие в видовом
составе населения мелких млекопитающих при высоком уровне загрязнения
тяжелыми металлами обусловлено исчезновением типичного
представителя хвойных коренных лесов естественных ненарушенных ландшафтов
Среднего Урала - красно-серой полевки (CI. rufocanus) и появлением
таких типичных представителей антропогенного ландшафта, как полевая
мышь и обыкновенная полевка (Лукьянов и др., 1994; Герасимов, Мухаче-
ва, 1994; рис. 9.3).
Возросшая деградация природной среды по градиенту техногенной
нагрузки обусловливает не просто увеличение разнообразия местообитаний,
благодаря чему создаются условия для большего видового разнообразия.
Одновременно по мере снижения общего обилия населения мелких
млекопитающих может происходить упрощение видового состава их сообществ,
как это отмечено для сообществ мелких млекопитающих экосистем
северной тайги Кольского полуострова, подверженных воздушному
промышленному загрязнению комбинатом "Североникель" (Kataev et al., 1994). При
сравнении с заповедными (фоновыми) территориями отмечается
закономерное снижение видового состава сообщества этих видов по мере
увеличения техногенной нагрузки. Выпадение видов мелких млекопитающих из им-
пактных сообществ обусловлено прежде всего деградацией кормовых ре-
270
100
("V_ Виды в порядке убывающего обилия
КД Л... ^N^Q
""А Д--Д О
-J I I I I I I I I I I I
1 2 3 4 5 6 7 8 9 10 11 12 13
••—А фон —О— загрязнение
Рис. 9.3. Участие видов в сообществах мелких млекопитающих на техногенно
загрязненных и фоновых территориях (в %)
Загрязненная территория: 1 - Clethrionomys glareolus, 2 - CI. rutilus, 3 - Apodemus sylvati-
cus, 4 - Sorex caecutiens, 5 - S. araneus, 6 - Microtus oeconomus, 7 - Ap. agrarius, 8 - M. agrestis,
9 - M. arvalis, 10 - Neomus fodiens, 11 - Sicista betulina, 12 - Sorex minutus, 13 - S. isodon
Фоновая территория: 1 - Clethrionomys glareolus, 2 - Sorex araneus, 3 - CI. rufocanus, 4 -
Sorex caecutiens, 5 - S. isodon, 6 - CI. rutilus, 7 - Microtus oeconomus, 8 - Apodemus sylvaticus, 9 -
Sorex minutus, 10 - M. agrestis
сурсов (эпифитных лишайников и зеленых мхов) для рыжей и красной
полевок, а также почвенных беспозвоночных для бурозубок. Вместе с тем эти
данные свидетельствуют о более высокой мобильности и большей
способности к структурным перестройкам сообществ мелких млекопитающих в
зонах оптимального обитания (умеренные широты) и потенциальной их
нестабильностью в пессимальных условиях границы ареала (экстремальные
условия Заполярья).
Литература
Ахметшина Г.Н., Хантемирова Е.В. Высшая растительность // Воробей-
чик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование
техногенных загрязнений наземных экосистем. Екатеринбург, 1994. С. 149-159.
Безелъ B.C. Популяционная экотоксикология млекопитающих. М.: Наука, 1987.
129 с.
Безелъ B.C., Баженов А.В., Мокроносов А.А., Садыков О.Ф. Мышевидные
грызуны как возможный индикатор уровней свинца в природных экосистемах/ /
Проблемы экологического мониторинга и моделирования экосистем. Л.: Гидрометеоиз-
дат, 1985. Вып. VII. С. 27-35.
Безелъ B.C., Вельский Е.А., Муханева СВ. К проблеме вариабельности
показателей воспроизводства в популяциях животных при токсическом загрязнении среды
обитания // Экология. 1998. № 3. С. 217-223.
Безелъ B.C., Большаков В.Н., Воробейник ЕЛ. Популяционная
экотоксикология. М.: Наука. 1994. 80 с.
Безелъ B.C., Муханева СВ. Характер репродуктивных потерь в популяциях
рыжей полевки при токсическом загрязнении среды // Докл. РАН. 1995. Т. 345, № 1.
С. 135-137.
Безелъ B.C., Оленев Г.В. Внутрипопуляционная структура грызунов в условиях
техногенного загрязнения среды обитания // Экология. 1989. № 3. С. 40-45.
10
1
п 1
271
Безель B.C., Попов Б.В., Садыков О.Ф. Мелкие млекопитающие в системе
регионального экологического мониторинга // Техногенные элементы и животный
организм (плевые наблюдения и эксперимент). Свердловск: УНЦ АН СССР, 1986.
С. 3-13.
Безель B.C., Садыков О.Ф., Тестов Б.В., Мокроносов А.А. Накопление свинца
мышевидными грызунами в природных популяциях // Экология, 1984. № 6. С. 25-31.
Бигон М., Харпер Дж., Таунсенд К. Экология. Особи. Популяции. Сообщества.
М: Мир. 1989. 667 с.
Герасимов А.А., Муханева СВ. // Экологическое нормирование техногенных
загрязнений наземных экосистем. Екатеринбург: Наука, 1994. С. 205.
Исаев СИ., Покаржевский А.Д. Рост и половое размножение лесных мышей
при повышенном содержании Sr-90 в биоценозе // Экология. 1978. № 3. С. 64-68.
Литвинчук Н.К. Некоторые данные по накоплению тяжелых металлов в
организмах азиатской мыши // Влияние промышленных предприятий на окружающую
среду. Пущино. 1984. С. 117-118.
Лукьянов О .А. Оценка демографических параметров популяций мелких
млекопитающих методом безвозвратного изъятия // Экология, 1988. № 1. С. 47-55.
Лукьянов О.А. Изучение плотности оседлых и потока мигрирующих особей в
популяциях мелких млекопитающих методом безвозвратного изъятия // Там же.
1991. №6. С. 36-47.
Лукьянов О.А. Экологические связи расселения в популяциях мелких
млекопитающих // Журнал, общ. биологии. 1999. Т. 60, № 2. С. 162-174.
Лукьянова Л.Е., Лукьянов О.А. Реакция сообществ и популяций мелких
млекопитающих на техногенное воздействие. 1. Популяции // Успехи соврем, биологии.
1998. Т. 118. Вып. 6. С. 693-706.
Лукьянова Л.Е., Лукьянов О.А., Пястолова О.А. Трансформация сообществ
мелких млекопитающих под воздействием техногенных факторов // Экология. 1994.
J* 3. С. 69-76.
Лукьянова Л.Е., Пястолова О.А., Лукьянов О.А., Микшевич Н.В. Изучение
популяций мелких млекопитающих в условиях техногенного воздействия // Экология.
1990. № 2. С. 53-61.
Муханева СВ., Безель B.C. Уровни токсических элементов и функциональная
структура популяций мелких млекопитающих в условиях техногенного загрязнения
(на примере рыжей полевки) // Экология. 1995. № 3. С. 237-240.
Мухачева СВ., Лукьянов О.А. Миграционная подвижность населения рыжей
полевки в градиенте техногенных факторов // Там же. 1997. № 1. С. 34-39.
Рождественская А.С Размножение европейской рыжей полевки при
загрязнении среды радиоцезием в Белоруссии / Биоиндикация радиоактивных загрязнений
М.: Наука, 1999. С. 226-231.
Тестов Б.В. Влияние радиоактивного загрязнения на популяции мышевидных
грызунов: Автореф. дис.... д-ра биол. наук. Екатеринбург, 1993. 35 с.
Шилова С.А. Популяционная организация млекопитающих в условиях
антропогенного воздействия // Успехи соврем, биологии. 1999. Т. 119, № 5. С. 487-503.
Щипаное Н.А. Оценка плотности населения оседлых и величины потока
нетерриториальных мелких млекопитающих при учетах с безвозвратным изъятием // Зо-
ол. журн. 1990. Т. 69, № 5. С. 113-123.
Beardsley A., Vagg M.J., Bekett P., Sausom B. Use of the field vole for monitoring
potentially harmful elements in the environment // Environ. Pollut. 1978. Vol. 16, N 1. P. 65-71.
Bull K.R., Roberts R.D., Inskip M.J., Goodman G.T. Mercury concentration in soil, grass,
eathworms and small mammals near an industrial emission source // Ibid. 1977. Vol. 12, N 2.
P. 135-140.
Cook J.A., Andrews S.M., Johnson M.S. The accumulation of lead, zinc, cadmium and
fluoride in the wood mous // Ibid. 1990. Vol. 51, N 1/2. P. 55-63.
272
Getz L.L.,Verner L., Prather M. Lead concentrations in small mammals // Ibid. 1977.
Vol. 13, N2. P. 151-157.
Hunter, Johnson MS.f Thompson DJ. Ecotoxicology of copper and cadmium in a
contaminated grassland ecosystem. III. Small mammals // J. Appl. Ecol. 1987. Vol. 24, N 2.
P. 601-614.
Jefferies J.D., French M.C. Lead concentration in small mammals trapped on roadside
verges and fiels sites // Environ. Pollut. 1972. Vol. 172, N 3. P. 147-156.
Kataev G.D., Seumela J., Palokangas P. // Oecologia, 1994. Vol. 97. P. 491.
Maljkovic Т., Kostial K. The influence of age on metal toxicity // Heavy Metal Environ.
Intern, conf., Athens, Sept. 1985. Edinburgh, 1985. Vol. 2. P. 193.
Mieran G., Favare B.E. Lead poisoning in roadside population of deermice // Environ.
Pollut. 1975. Vol. 8. P. 15-21.
Pankakoski E., Koivisto /., Hyvarinen H. Reduced developmental stability as an
indicator of heavy pollution in the common shrew Sorex araneus // Acta zool. fenn. 1992. N 191.
P. 137-144.
Quarles H.D., Hanawalt R.B., Odum W.E. Lead in small mammals, plants and soil at
varying distances from a nighway // J. Appl. Ecol. 1974. Vol. 11. P. 937-949.
Roberts R.D., Johnson MS. Dispersal of heavy metals from abandoned mine workings
and their transference though terrestrial food chains // Environ. Pollut. 1978. Vol. 16, N 4.
P. 239-310.
Roberts R.P., Johnson MS., Button M. Lead concentration of small mammals from
abandoned metalliferous mines // Ibid. 1978. Vol. 15, N 1. P. 61-69.
Sharma R.f Shupe J.L. Lead, cadmium and arsenic residues in animal tissues in relation
to those in their surrounding habitat // Sci. Total Environ. 1977. Vol. 7, N 1. P. 22-30.
Smith GJ.t Rongstad 0. Small mammal heavy metal concentrations from mined and
control sites // Environ. Pollut. 1982. Vol. 28, N 2. P. 121-134.
Welsh W.R., DickDL. Lead levels in roadside invertebrates and small mammals // Ibid.
1975. Vol. 8. P. 15-21.
Williamson P.f Evans P.R. Lead levels in roadside invertebrates and small mammals //
Bull. Environ. Contam. and Toxicol. 1972. Vol. 8. P. 280-288.
Глава 10
ПТИЦЫ
Птицы способны регулировать численность беспозвоночных и мелких
млекопитающих в наземных экосистемах благодаря интенсивному обмену
веществ и большому количеству потребляемого корма, высокой
подвижности и способности концентрироваться в местах с высокой плотностью своих
жертв (Иноземцев, 1978). Они активно распространяют семена растений.
Водоплавающие, околоводные, куриные и другие группы птиц составляют
основную базу любительской и промысловой охоты.
Использование птиц в мониторинге состояния природной среды имеет
давние традиции. Способность накапливать тяжелые металлы в организме
дала основание использовать птиц и их органы в качестве биоиндикаторов
загрязнения среды. Для оценки техногенного воздействия используют
показатели разных структурно-функциональных уровней (Биоиндикация
загрязнений..., 1988). Многие из них неспецифичны по отношению к различным
стрессорам и представляют собой ответы не только на прямое, но и на
опосредованное воздействие, обусловленное изменениями биотопов, их
защитных, кормовых и иных свойств. Лишь в случаях с высокотоксичными пол-
лютантами (соединения некоторых тяжелых металлов) удается установить
причинно-следственную связь между конкретным токсикантом и эффектом
поражения.
Важную информацию о характере антропогенного воздействия на
экосистемы дают параметры населения птиц в целом. Для изучения эффектов
воздействия токсических выбросов на птиц на популяционном уровне в
качестве модельных объектов наиболее удобны воробьиные-дуплогнездники:
мухоловка-пеструшка (Ficedula hypoleuca), большая синица (Parus major),
московка (Parus ater), горихвостка (Phoenicians phoenicurus), а также
мохноногий сыч (Aegolius funereus) (Hornfeldt, Nyholm, 1996).
10.1. АККУМУЛЯЦИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ПТИЦАХ
Химические свойства элементов определяют форму их аккумуляции в
организме, особенности метаболизма и органы преимущественного
накопления. Многие элементы концентрируются в органах выведения: печени и
почках (Си, Cd, Pb, Hg, Co, Mn, As). Ряд остеотропных металлов
накапливается в костной ткани (Pb, Zn, Al, Mn). Органо-минеральные соединения
ртути депонируются в жировой ткани, мозге и в мышцах (метил- и диметил-
274
ртуть). В перьевом покрове накапливаются Zn, Cr, Cu, Ni, Hg (Лебедева,
1999; Scheuhammer, 1987).
Накопление тяжелых металлов в организме птиц подвержено
географической изменчивости, оно зависит от концентрации в окружающей среде,
вида, пола и возраста особей, территориальных связей и ряда других
факторов. Известно, что микроэлементный состав специфичен у птиц, обитающих
в разных географических точках, даже в местностях с естественно низкими
уровнями тяжелых металлов. Это позволяет использовать спектры
химических элементов в качестве маркеров географических популяций птиц
(Лебедева, 1999).
У птиц, обитающих на загрязненных территориях, содержание тяжелых
металлов в организме коррелирует с их концентрацией во внешней среде.
Это показано, в частности, для мухоловки-пеструшки, синиц рода Parus
(Вельский и др., 19956; Sawicka-Kapusta et al., 1986; Nyholm, 1994, 1995;
Nyholm et al., 1995), полевых воробьев (Pinowska, 1981), мохноногого сыча
(Hornfeldt, Nyholm, 1996), серой куропатки (Wojcik, 1980) и других видов.
Концентрация свинца в скелете взрослых диких птиц, превышающая
5 мкг/г, свидетельствует о загрязненности среды их обитания этим металлом
(Scheuhammer, 1987).
Закономерности накопления тяжелых металлов в организме зависят от
их химических свойств и физиологической роли. Выявлены положительные
корреляции между концентрациями свинца, кадмия, ртути, мышьяка, а
также в ряде случаев меди в окружающей среде и в организме (Wojcik, 1980;
Nyholm, 1994, 1995; Вельский и др., 1995а; Sawicka-Kapusta et al., 1986;
Dmowski, Karolewski, 1979, и др.). В то же время тесные связи между
концентрациями цинка, железа в организме птиц и окружающей среде
отсутствуют, что, вероятно, связано с гомеостатическими механизмами (Sawicka-
Kapusta et al., 1986; Nyholm, 1994, 1995).
Видовая специфика накопления тяжелых металлов в тканях и органах
птиц определяется структурой рациона, определяемой положением вида в
трофической цепи, способом и местом кормодобывания, особенностями
метаболизма. Так, концентрация Cd у растительноядных птиц на 1-2
порядка выше, чем у хищных и всеядных. Из растительноядных наиболее
высокие концентрации Cd отмечены у глухаря (почки - 43 мкг/г, печень -
4,4 мкг/г на сырое вещество) и лебедя-шипуна (почки - 42 мкг/г, печень -
12 мкг/г) (Frank, 1986). Концентрации мышьяка в организме хищных и
рыбоядных птиц выше по сравнению с фитофагами, полифагами и энтомо-
фагами (Лебедева, 1999). Накопление свинца в скелете интенсивнее
протекает у мелких видов по сравнению с крупными, у наземных по сравнению
с водными (Лебедева, 1999). Вместе с тем для многих тяжелых металлов не
выявлено тесной зависимости их накопления от трофического уровня,
занимаемого видом.
Специфика аккумуляции тяжелых металлов разными видами птиц
обусловливается видовыми особенностями поступления их с кормом. Так, при
совместном обитании в одних и тех же биотопах, подверженных
воздействию выбросов медеплавильных заводов, содержание тяжелых металлов в
рационе мухоловки-пеструшки в 1,4-3 раза больше, чем у большой синицы
(Вельский и др., 1995а; Eeva, Lehikoinen, 1996). Концентрации свинца у
растительноядных уток значительно выше, чем у других водоплавающих, что
275
связано с особенностями их питания. Растительноядные утки,
нуждающиеся в гастролитах больше, чем плотоядные виды, чаще заглатывают
свинцовую дробь.
Физиологические особенности обусловливают половую специфику
аккумуляции тяжелых металлов в организме и чувствительности к их
токсическому действию. Накопление свинца выше у самок сизого голубя и
американской пустельги по сравнению с самцами (Hutton, Goodman, 1980; Drash et
al., 1987; Pattee, 1984). Это связано с более выраженной аккумуляцией Са и
других остеотропных элементов в организме самок перед яйцекладкой. Для
неостеотропных элементов половая специфика накопления не выражена
(вяхирь, кваква, чайка-хохотунья, утиные), либо противоположна у разных
видов. Так, у самок американской черной утки концентрация кадмия в
печени ниже, чем у самцов, а у кряквы и морской чернети наблюдается обратное
(Пушкарь и др., 1991). В перьях воротничкового рябчика Bonasa umbellus не
выявлены зависимости накопления Си, Ni и Fe от пола и возраста птиц (Rose,
Parker, 1982).
Особенности метаболизма определяют и возрастную специфику
накопления тяжелых металлов в организме птиц. В период интенсивного роста
тела и минерализации скелета происходит быстрое накопление металлов в
организме молодых птиц. С возрастом размеры поступления и выведения
элементов из организма приходят к равновесию. Таким образом, в целом
исходно низкие концентрации тяжелых металлов, присущие организму
птенцов, с возрастом увеличиваются. Наиболее ярко это выражено для
остеотропных элементов, депо которых скелет, окончательно формируется
и насыщается минеральными веществами лишь у взрослых особей.
Увеличение с возрастом концентраций РЬ и Cd в перьях отмечено у сорок, но в
оперении молодых выше уровни Zn, Cu, Fe (Kooiker, 1986). Результаты
исследований в Норвегии показывают, что Cd в печени и почках молодых
белых куропаток быстро накапливается в течение первой зимы, а затем,
после достижения порогового уровня, его аккумуляция прекращается
(Pedersen, Myklebust, 1991).
Для некоторых тяжелых металлов выявлены сублетальные и летальные
концентрации в организме птиц. Токсический уровень РЬ в крови лебедей-
шипунов определяют в 40 мг/100 мл, при превышении этого уровня
развивается свинцовое отравление (Sears, 1989). Летальные концентрации РЬ в
печени гусеобразных оценивают в > 20,5 мкг/г на сухое вещество (Zwank et al.,
1985). Диагностической для отравления свинцом домашних животных
считается концентрация свинца в корковом веществе почек 25 мкг/г на сухое
вещество (National research council, 1980, цит. по: Beyer et al., 1985).
Концентрации Cd 100-200 мкг/г на сухое вещество почек вызывают структурные
нарушения этого органа птиц (Nicholson et al., 1983). Летальные уровни свинца у
молодых птиц ниже, чем у взрослых (CTHalloran et al., 1988).
Концентрации тяжелых металлов в яйцах птиц коррелируют с их
содержанием в организме самок, однако количество металлов, поступающих в
яйца из организма самки, значительно ниже их аккумуляции в печени и
почках. Это же отмечено нами и для большой синицы в окрестностях Средне-
уральского медеплавильного завода. При увеличении содержания свинца в
рационе птиц импактной зоны по сравнению с фоновой в 5,6 раз
концентрация этого элемента в скорлупе повышается лишь в 1,2 раза, для меди, соот-
276
ветственно, в 6,5 и 2 раза. Очевидно, существуют физиологические
механизмы, ограничивающие поступление тяжелых металлов в репродуктивные
органы (Вельский и др., 1995а; Sawicka-Kapusta et al., 1986).
10.2. ТЕХНОГЕННОЕ ЗАГРЯЗНЕНИЕ
И РЕПРОДУКТИВНЫЕ ПОКАЗАТЕЛИ ПТИЦ
Сроки размножения. Большое значение для эффективности
воспроизводства у птиц имеют сроки размножения. Рано прилетающие птицы имеют
преимущество при выборе гнездовых территорий и мест для устройства
гнезда. Основная часть взрослых птиц прилетает на места гнездования
раньше молодых. Как правило, максимальная продуктивность размножения
свойственна рано гнездящимся парам.
Определяющее значение для сроков размножения птиц имеют сроки
весенних фенологических явлений. Нарушенные территории раньше
освобождаются от снега, так как разреженный древостой в меньшей степени
экранирует солнечные лучи, а снег, содержащий осевшую из выбросов пыль,
тает быстрее. По нашим наблюдениям, развитие растений весной в
окрестностях заводов опережает их развитие на фоновой территории.
Раннее прохождение весенних фенологических явлений могло бы
способствовать более ранним срокам размножения птиц в окрестностях
предприятий. Однако этого не происходит. По нашим наблюдениям на Среднем
Урале, а также данным Т. Eeva (1996), мухоловки-пеструшки на
загрязненных территориях приступают к размножению позже, чем на фоновых. Для
мохноногого сыча, обитающего в окрестностях металлургического завода,
характерно более позднее начало гнездования и более раннее его
окончание, что приводит к сокращению всего сезона размножения у этого вида
(Hornfeldt, Nyholm, 1996). Напротив, большие синицы приступают к
размножению на загрязненных территориях раньше, чем в ненарушенных
местообитаниях. Особи этого вида, зимовавшие возле жилья человека, при
расселении весной на гнездовые участки в первую очередь занимают ближайшие
окрестности населенных пунктов (Eeva, 1996).
Размер кладки. Размер кладки отражает максимально возможное
количество потомков на размножающуюся пару птиц, которое не всегда
реализуется из-за смертности эмбрионов в период инкубации яиц и птенцов в
период их выкармливания. Загрязнение среды обитания, в том числе
тяжелыми металлами, для многих видов может приводить к снижению этого
показателя. Наиболее ярко это явление прослеживается у мухоловки-пеструшки
(табл. 10.1). Для данного вида уменьшение плодовитости в градиенте
загрязнения на Среднем Урале составило 33% (Вельский и др., 1995а), в
Скандинавии - 11-13% (Eeva, Lehikoinen, 1995; Nyholm, 1995). Причинами снижения
размера кладки в условиях загрязнения могут быть физиологические сдвиги
у самок вследствие интоксикации, изменения в обилии и качестве корма,
трансформация возрастного состава размножающихся птиц либо сдвиги
сроков размножения.
Размеры яиц определяют запас питательных веществ, расходуемых на
развитие эмбриона. У многих видов от величины яйца прямо зависит успеш-
277
ность вылупления, жизнеспособность птенцов и темпы их роста (Мянд, 1988;
Schifferli, 1973; Jrvinen, Ylimaunu, 1984). Ряд авторов отмечает, что величина
яиц не является показателем, специфичным по отношению к концентрации
тяжелых металлов, а отражает общее неблагополучие условий как в
естественных, так и техногенно трансформированных экосистемах (Мянд, 1988;
Венгеров, 1991). Комплекс внешних условий определяет физиологическое
состояние самок, а через них и размеры откладываемых яиц (Potti, 1993).
Таким образом, техногенное загрязнение воздействует на размеры яиц
двояко: непосредственное воздействие на организм высоких концентраций
тяжелых металлов дополняется опосредованным - через изменение
местообитаний.
По мере увеличения концентрации в среде тяжелых металлов отмечено
уменьшение среднего объема яиц дуплогнездников: у большой синицы - на
8,6%, у московки - на 4,3%, у мухоловки-пеструшки - на 3-8% по сравнению
с контролем (Вельский и др., 1995а; Eeva, Lehikoinen, 1995). Наряду с
уменьшением среднего объема яиц на загрязненных территориях увеличивается доля
мелких яиц: в 2 раза и более по сравнению с контролем (Вельский, 1997).
Одна из важных оологических характеристик - толщина скорлупы.
Скорлупа выполняет механическую и барьерную функции, служит депо
кальция для эмбриона, через поры скорлупы происходит газообмен.
Нарушение метаболизма кальция у размножающихся самок в условиях подкисле-
ния окружающей среды, а также комплексного воздействия тяжелых
металлов и S02, приводит к появлению дефектных яиц. Поверхность скорлупы
таких яиц более шероховатая, а структура кристаллов кальцита более грубая,
чем в норме. Аномальная пористость скорлупы приводит к
преждевременному высыханию содержимого яйца и гибели эмбрионов (Nyholm, Myhrberg,
1977; Nyholm, 1981; 1995; Eeva, Lehikoinen, 1995). Доля кладок
мухоловки-пеструшки с дефектами скорлупы вблизи металлургического завода может
достигать 32% при отсутствии таковых в контроле (Nyholm, 1995).
Наряду с изменением структуры скорлупы у некоторых видов
отмечается ее утончение: у мухоловки-пеструшки - на 17% от фонового уровня (Eeva,
Lehikoinen, 1995). Эта величина соответствует порогу (16-18%), за которым
у птиц наблюдается снижение вылупляемости и в итоге сокращение
плотности популяций (Newton, 1979).
Успешность инкубации. Этот показатель определяется как отношение
количества вылупившихся птенцов к количеству насиживавшихся яиц. В
условиях техногенного загрязнения эффективность инкубации характеризует
как влияние поллютантов на качество формируемых яиц и поведение
родителей при их инкубации, так и токсичность поллютантов по отношению к
гаметам, процессу оплодотворения и развивающимся эмбрионам.
Успешность инкубации у птиц снижается с ростом загрязненности
территории. Негативные эффекты в наибольшей степени проявляются у
мухоловки-пеструшки. В естественных условиях этот показатель, как правило,
не опускается ниже 90% (Вельский и др., 1995; Nyholm, 1995; Eeva,
Lehikoinen, 1995). Вблизи медеплавильных заводов успешность инкубации у
мухоловки-пеструшки составила 5-61%, у большой синицы 70-80%
(Вельский и др., 1995а; Eeva, Lehikoinen, 1995).
Загрязнение среды тяжелыми металлами, по-видимому, не оказывает
влияния на фертильность родительских пар у птиц. Так, доля неоплодотво-
278
ренных яиц у мухоловки-пеструшки не зависела от расстояния до источника
выбросов тяжелых металлов и S02 и составляла около 1,5% (Nyholm, 1995;
Eeva, Lehikoinen, 1995).
Часть эмбрионов гибнет из-за преждевременного высыхания
содержимого в яйцах с аномально пористой скорлупой. Вместе с тем часть
эмбрионов элиминируется вследствие нарушения собственно процессов развития.
Так, отход яиц на стадии инкубации в кладках с нормальной скорлупой
увеличивался в градиенте техногенной нагрузки от 5 до 11% (Nyholm, 1995).
Успешность выкармливания. Успешность выкармливания
представляет собой долю птенцов, покинувших гнездо, от количества вылупившихся.
На процесс выкармливания птенцов на загрязненной территории
оказывают влияние два противоположно направленных фактора. С одной
стороны, результативность инкубации и выкармливания птенцов в гнезде
определяется прямым воздействием загрязнителей на взрослых птиц и их
потомство. С другой стороны, уменьшение числа птенцов в гнезде на
загрязненной территории ведет к увеличению количества корма, приходящегося
на каждого птенца, что должно повышать эффективность выкармливания.
Таким образом, рассматриваемый показатель отражает некоторый
интегральный эффект.
У мухоловки-пеструшки эффективность выкармливания в условиях
загрязнения снижалась в 1,4 раза по сравнению с контролем (табл. 10.1),
несмотря на то, что количество вылупившихся птенцов на гнездо у этого вида
на фоновой территории примерно в 2 раза больше (Вельский и др., 19956).
В непосредственной близости от медеплавильного завода эффективность
выкармливания у мухоловки-пеструшки составила 20% при 70-80% в
контроле, у большой синицы - 30% и 60-80%, соответственно (Eeva, Lehikoinen,
1996).
Повышенная смертность птенцов в зонах сильного загрязнения,
несомненно, связана с высокими концентрациями тяжелых металлов,
поступающих в организм птенцов в период их выкармливания. Это подтвердили
опыты с заменой яиц в гнездах импактной территории, привезенных с фонового
участка, и наоборот (Nyholm, 1998).
Очевидно, снижение эффективности выкармливания в зоне
максимального загрязнения тяжелыми металлами объясняется несколькими
причинами. Одна из важнейших причин - нарушение физиологических процессов у
птенцов вследствие интоксикации. Средняя масса печени и головного мозга,
концентрация гемоглобина в крови и другие гематологические показатели у
птенцов мухоловки-пеструшки в зоне воздействия металлургического
завода оказалась достоверно меньше, чем в контроле (Nyholm, 1995, 1998).
Кроме того, у мухоловки-пеструшки, обитающей на загрязненных
территориях, отмечены нарушения процессов формирования скелета:
размягчение костей конечностей и их переломы (Вельский и др., 19956; Eeva,
Lehikoinen, 1996). На расстоянии 1 км от завода доля выводков с дефектами
скелета конечностей у птенцов достигала 27% (Eeva, Lehikoinen, 1996). Такие
птенцы, как правило, не выживают. В основе физиологических аномалий
лежат нарушения процессов кальцификации скелета вследствие снижения
поступления кальция с пищей (Eeva, Lehikoinen, 1996; Nyholm, 1995).
Нарушение физиологических процессов в организме, столь явно
выраженное у части птенцов, у другой их части приводит к снижению темпов ин-
279
R2 = 0,378
n = 29
ев
В
Pb, мкг/г
Рис. 10.1. Взаимосвязь между массой слетков большой синицы и концентрацией
свинца в их скелете
50 г
3 40
9 зо
10
о
-А Л-**
..♦• -..О
.А'
Масса, г
12
15
18
Рис. 10.2. Распределение массы слетков мухоловки-пеструшки в зависимости от
уровня загрязнения
дивидуального развития. У мухоловки-пеструшки и большой синицы
отмечено замедление скорости роста птенцов в зоне максимального загрязнения
(Eeva, Lehikoinen, 1996), у слетков мухоловки-пеструшки, большой синицы и
московки - снижение массы тела и степени развития оперения по сравнению
с контролем (Вельский и др., 19956; Вельский, 1997).
У мухоловки-пеструшки, обитающей на загрязненных территориях,
отмечается большая птенцовая смертность. Ослабленные и отставшие в
развитии птенцы подвергаются элиминации в гнезде. Тем самым
локальные группировки птиц загрязненных территорий уже на раннем этапе
"очищаются" от неполноценных особей. Для выживших птенцов это
явление благоприятно, так как воздействие поллютантов здесь, по-видимому,
компенсируется увеличением количества корма, приходящегося на
каждого птенца.
Часть ослабленных птенцов все же доживает до вылета из гнезда,
однако их шансы на выживание проблематичны. Доля таких птенцов в средних
и крупных выводках в импактной зоне достоверно выше, чем в контроле: у
280
мухоловки-пеструшки, соответственно, 31,3±1,6% и 10,6+1,7% (рис. ЮЛ), а у
большой синицы 21,3±4,3% и 7,4±3,6% (Вельский, 1997).
Наблюдаемое снижение массы тела птенцов на загрязненных
территориях, на наш взгляд, обусловлено действием накапливаемых в организме
тяжелых металлов. Нами отмечена высокая отрицательная зависимость
между содержанием металлов в скелете и массой птенцов большой синицы
перед вылетом из гнезда (рис. 10.2; Вельский и др., 19956).
Успешность размножения. Успешность размножения представляет
собой долю (в %) покинувших гнездо птенцов от количества отложенных яиц
и характеризует эффективность инкубации и выкармливания птенцов.
Техногенное загрязнение среды обитания тяжелыми металлами способно
приводить к уменьшению успешности размножения птиц (Гилязов, Катаев,
1990; Вельский и др., 19956). Выявлено достоверное снижение этого
показателя в градиенте нагрузки у всех дуплогнездников: для
мухоловки-пеструшки - в 2 раза (см. табл. 10.1), для большой синицы - в 1,5 раза, для
московки - в 1,3 раза. Один из факторов, влияющий на успешность размножения,
оставление самками незаконченных кладок. Их доля последовательно
возрастает с увеличением концентрации тяжелых металлов в среде. Если из
расчетов исключить брошенные кладки, то и в этом случае снижение
успешности размножения у мухоловки-пеструшки в импактной зоне останется
достоверным (Вельский и др., 19956).
Аналогичный показатель - выживание птенцов и эмбрионов (в кладках,
где вылупилось не менее одного птенца) - у мохноногого сыча Aegolius
funereus в Швеции, несмотря на сильную межгодовую изменчивость, во все
годы наблюдений вблизи завода был меньше, чем в контроле (Hornfeldt,
Nyholm, 1996). По мнению авторов, решающую роль в этом сыграло не
непосредственное воздействие высоких концентраций тяжелых металлов на
организм птиц, а опосредованное - через снижение численности мелких
млекопитающих, составляющих рацион сыча.
Еще один пример опосредованного воздействия загрязнения
окружающей среды тяжелыми металлами на воспроизводство птиц - изменение
защитных свойств биотопа. Воздействие хищников на открытогнездящиеся
виды зависит во многом от степени укрытости их гнезд. Сильное
повреждение листвы деревьев и кустарников промышленным воздушным
загрязнением проявляется в преждевременном опадании листвы в самый разгар
гнездового сезона. Это способно приводить к демаскировке и массовому
разорению хищниками гнезд, расположенных в древесно-кустарниковом ярусе
(Поленц, Вельский, 1991).
Количество слетков на гнездо. Для оценки процессов воспроизводства в
группировках птиц используют среднее количество слетков на
размножавшуюся пару, включая неуспешные гнезда (Паевский, 1985). Это
показатель - важный демографический параметр, так как позволяет определить
способность той или иной группировки птиц воспроизводить себя, либо
вносить полноценный вклад в воспроизводство всей популяции вида.
Как и вышеописанные репродуктивные параметры, количество слетков
на гнездо уменьшается в окрестностях металлургических заводов. Это
отмечено для мухоловки-пеструшки, большой синицы и мохноногого сыча в
Скандинавии (Eeva, 1996; Hornfeldt, Nyholm, 1996). Снижение этого
показателя в градиенте нагрузки на Среднем Урале составило для мухоловки-пест-
281
рушки - 3,2 раза (см. табл. ЮЛ), для большой синицы - 2 раза, для
московки - 1,6 раза. Количество слетков на гнездо у мухоловки-пеструшки (а
также, вероятно, и у большой синицы) явно недостаточно для воспроизводства
их группировок в зоне максимального загрязнения.
Таким образом, разные локальные группировки птиц вносят
неодинаковый вклад в воспроизводство видовых популяций. Группировки,
испытывающие достаточно высокую нагрузку поллютантов, не воспроизводят себя и
существуют за счет притока особей извне. По образному выражению
Н.В. Лебедевой с соавторами (1996), техногенно нарушенные территории
становятся "черной дырой" для популяций птиц.
Динамика смертности потомства в гнездовой период. Анализ
репродуктивных показателей мухоловки-пеструшки (см. табл. 10.1) дает
возможность оценить смертность потомства на разных стадиях процесса
воспроизводства. Представление репродуктивного цикла в виде единой
последовательности этапов позволяет выделить стадии, характеризующиеся
наибольшими потерями.
Смертность на стадии завершения кладок (доля брошенных кладок) на
загрязненной территории составляет 23% при 1% в контроле. Потери на
стадии формирования и откладки яиц были определены нами как отношение
среднего размера кладки в конкретной зоне загрязнения к максимально
возможному размеру кладки в ненарушенных местообитаниях (9 яиц). Они
составили 51% в импактной зоне и 27% - в контроле. Отход на стадии
инкубации равен 33% и 10%, на стадии выкармливания птенцов - 32 и 5%,
соответственно.
Анализ динамики смертности потомства в естественных условиях
показывает, что небольшая ее величина, обусловленная оставлением самками
незаконченных кладок, резко возрастает на стадии формирования и
откладки яиц. Затем интенсивность гибели снижается с каждой стадией примерно
вдвое, и достигает минимума на стадии выкармливания птенцов.
На техногенно нарушенных территориях интенсивность смертности в
значительной мере выравнивается за счет увеличения потерь на поздних
стадиях гнездового периода. С каждой стадией развития увеличивается
разрыв между зонами загрязнения в численности выживающей части когорты
молодых особей. Так, у мухоловки-пеструшки до вылета из гнезда
доживает в 3,2 раза меньше птенцов, чем в контроле.
10.3. ТЯЖЕЛЫЕ МЕТАЛЛЫ И РАЗНООБРАЗИЕ ПТИЦ
Усиление антропогеннного воздействия для многих видов (исключая
экологически пластичные, склонные к синантропизации) приводит к
снижению численности, а порой и к полному исчезновению. В условиях
регистрируемых ныне уровней загрязнения среды вряд ли можно говорить о
непосредственном воздействии поллютантов как причине исчезновения
отдельных видов и преобразования сообществ птиц. Скорее имеет место
опосредованное воздействие - через трансформацию местообитаний, в частности,
фитоценозов. Далеко не всегда воздействие поллютантов приводит к
однозначному ухудшению показателей населения птиц. Поскольку в результате
техногенной трансформации биоценозов изменяются не только абиотиче-
282
ские параметры среды, но и биотические взаимоотношения, отдельные
виды могут получать преимущества за счет других. Таким образом, в условиях
загрязнения имеет место как снижение тех или иных показателей
биоразнообразия, так и их увеличение, либо реакции могут не проявляться. Многое
зависит также от величины нагрузки и конкретных
природно-климатических особенностей местообитания. Высокая буферная емкость биоценоза и
отсутствие резких колебаний естественных факторов смягчают влияние
загрязнения. Напротив, совместное воздействие экстремальных факторов
естественной природы и техногенеза демонстрирует синергический эффект.
Закономерности антропогенной динамики населения птиц бореальных
лесов были исследованы в следующих регионах:
- в горных хвойных (ель, пихта) лесах Центральной Европы: Северной
Чехии в горах Крконоше (Flousek, 1989; Lemberk, 1989) и в Крушных горах
(Stastny, BejCek, 1983); в Судетах (Польша) (Gramsz, 1993) и в Рудных горах
(Германия) (Muckel, 1992). Эти леса испытывают сильное воздействие
промышленных районов стран Западной и Центральной Европы;
- на Среднем Урале (подзона южной тайги) в окрестностях Средне-
уральского медеплавильного завода (г. Ревда Свердловской области)
(Вельский и др., 1994; Вельский, Ляхов, 1996);
- на Кольском полуострове (подзона северной тайги) в окрестностях
комбината "Североникель" (Гилязов, Катаев, 1990).
Видовой состав
Основные закономерности техногенной динамики населения птиц
совпадают во всех изученных регионах. С усилением техногенного воздействия
уменьшается количество видов птиц (см. рис. ЮЛ). Очевидно, существует
синергический эффект воздействия техногенного загрязнения и
климатических факторов. В более суровых климатических условиях северной тайги
относительное количество видов в градиенте техногенной нагрузки
сокращается в 2,9 раза, в южной тайге - в 1,7 раза, в горных лесах Центральной
Европы с более мягким климатом - в 1,3 раза.
Видовое разнообразие сообществ птиц определяется в первую очередь
характеристиками фитоценоза: его структурой (MacArthur R., McArthur J.,
1961; Cody, 1981), видовым составом (Rotenberry, 1985, и др.), состоянием
кормовой базы, наличием подходящих условий для гнездования.
По мере усиления техногенной нагрузки на коренные таежные фитоце-
нозы происходит нарушение их горизонтальной структуры вследствие
выпадения отдельных деревьев или групп деревьев и образования брешей в
сплошном древостое. Увеличивается мозаичность местообитаний и
создаются условия для проникновения в экосистемы видов птиц открытых
биотопов (овсянки, трясогузковые и др.).
При высоком уровне техногенного загрязнения отмирание деревьев
приобретает массовый характер. Местами хвойные породы замещаются
лиственными (береза, осина). Уменьшение проективного покрытия древесного
яруса и улучшение освещенности благоприятствует успешному росту
представителей травяно-кустарничкового яруса (Ахметшина, Хантемирова,
1994). В этих условиях происходит коренная перестройка сообществ птиц.
Увеличение открытости местообитаний способствует заселению террито-
283
рии кустарниковыми и наземногнездящимися видами и снижению доли
типично лесных видов. Доля типично лесных видов в сообществах птиц
экосистем южной тайги уменьшается с 71% в контроле до 53% вблизи завода
(Вельский и др., 1994; Вельский, Ляхов, 1996), в северной тайге с 67 до 38%,
соответственно (Гилязов, Катаев, 1990). В экосистемах северной тайги доля
видов птиц открытых местообитаний (лесотундры и тундры) возрастает с
18% в контроле до 50% в импактной зоне (Гилязов, Катаев, 1990).
Общее и частное обилие
Общая плотность населения птиц определяется емкостью
местообитаний. Ухудшение основных продукционных параметров фитоценозов и
упрощение их структуры в градиенте техногенной нагрузки свидетельствуют об
уменьшении экологической емкости экосистем (Ахметшина, Хантемирова,
1994). Этим обусловлено уменьшение плотности гнездового населения птиц
экосистем южной тайги Урала и горных лесов Центральной Европы почти
в 2 раза (Вельский и др., 1994; Вельский, Ляхов, 1996; Flousek, 1989; см.
рис. 10.2). Как и в случае с общим количеством видов, наиболее резкое
снижение отмечено в экосистемах северной тайги - почти в 8 раз (Гилязов,
Катаев, 1990), что подтверждает роль взаимодействия экстремальных
природных и техногенных факторов.
В соответствии с преобразованием видового состава сообществ птиц им-
пактных территорий в пользу видов открытых биотопов уменьшается
плотность типично таежных видов. В экосистемах еловых и смешанных горных
лесов Центральной Европы эти тенденции характерны для популяций
корольков, дроздов, московки, крапивника, зяблика (Flousek, 1989; Stastny,
BejCek, 1983); в экосистемах южной тайги-для популяций дроздов
(белобровик, певчий, рябинник), мухоловки-пеструшки, буроголовой гаички,
снегиря, чижа, клеста-еловика, зеленого конька (Вельский и др., 1994; Вельский,
Ляхов, 1996); в экосистемах северной тайги - для популяций белобровика,
певчего дрозда, обыкновенной горихвостки, мухоловки-пеструшки, серого-
ловой гаички, лесного конька, веснички, снижающих плотность в 2 раза и
более уже при среднем уровне загрязнения (Гилязов, Катаев, 1990; Gilyazov,
1993). Общая закономерность для экосистем бореальных лесов - с
усилением техногенной нагрузки происходит снижение плотности или полное
исчезновение крупных лесных видов (тетеревиных, сов, ряда дневных хищников,
голубей).
Среди причин снижения плотности названных видов следует назвать
сокращение кормовой базы для специализированных видов, отсутствие мест
для устройства гнезд (дуплогнездники), возможное увеличение фактора
беспокойства вблизи источника выбросов, обычно расположенного в черте
населенного пункта (тетеревиные). Сокращение плотности сов и дневных
хищников связано с уменьшением обилия мышевидных грызунов в
градиенте техногенной нагрузки (Гилязов, Катаев, 1990). Уменьшение обилия
почвенной мезофауны (Воробейчик и др., 1994) обусловливает снижение
плотности популяций дроздов, в рационе которых значительную часть
составляют обитатели лесной подстилки. С обеднением травяно-кустарничкового
яруса, по-видимому, связано уменьшение плотности снегиря,
использующего в корм также семена растений. Снижение плотности популяций клестов
284
(экосистемы южной тайги), чижа, буроголовой гаички, московки, в корме
которых важную роль играют семена хвойных, вероятно, связано с
уменьшением семеношения этих пород в условиях загрязнения. В то же время в
экосистемах северной тайги другой стенофаг - чечетка - поддерживает
достаточно высокое обилие на техногенно нарушенных территориях
благодаря сохранению плодоношения кормового растения - березы (Гилязов,
Катаев, 1990).
Плотность экологически пластичных видов, многие из которых
гнездятся на кустарниках, подросте, земле (лесная завирушка, зарянка, чечевица, в
южной тайге также садовая камышевка, пеночки и славки) слабо зависит от
загрязнения. Увеличение техногенной нагрузки благоприятствует лишь си-
нантропным врановым (сорока, серая ворона), в то время как плотность
менее пластичных видов (ворона и сойки) сокращается.
Разреживание древостоя приводит к увеличению обилия видов птиц
открытых биотопов, строящих гнезда на земле, либо в полостях грунта. Так, в
горно-лесных экосистемах Центральной Европы усиление техногенной
нагрузки вызывает увеличение плотности популяций лесного, лугового и
горного коньков, лугового чекана, горихвостки-чернушки, белозобого дрозда
(Flousek, 1989); в экосистемах южной тайги - популяций овсянки
обыкновенной, белой трясогузки и лесного конька (Вельский и др., 1994; Вельский,
Ляхов, 1996); в экосистемах северной тайги - популяций лугового конька,
обыкновенной каменки, овсянки-крошки (Гилязов, Катаев, 1990; Gilyazov,
1993). Увеличение обилия этих видов на техногенно нарушенных
территориях, тем не менее, не компенсирует выпадение типично лесных видов. В
результате техногенное загрязнение обусловливает снижение общей
плотности населения птиц.
Дуплогнездники, прежде всего воробьиные, служат удобным объектом
для мониторинга изменений окружающей среды (Muckel, 1992). В число
основных видов, заселяющих искусственные гнездовья в таежной зоне,
входят многие синицы рода Parus, мухоловка-пеструшка, обыкновенная
горихвостка. Развеска гнездовий позволяет создать искусственно высокую
плотность этих видов. При этом воздействие на птиц всех внешних
факторов сохраняется.
Оказалось, что даже при избытке гнездовий плотность дуплогнездников
достоверно уменьшается с ростом техногенной нагрузки. Это отмечено для
экосистем еловых лесов Рудных гор в Германии (Muckel, 1992), темнохвой-
ных лесов Среднего Урала (Вельский и др., 1994; Вельский, Ляхов, 1996),
северной тайги Кольского полуострова (Гилязов, Катаев, 1990; Gilyazov,
1993). Следовательно, техногенно нарушенные местообитания становятся
пессимальными для дуплогнездников (мухоловки-пеструшки и московки)
как вследствие недостатка мест для сооружения гнезд, так и в результате
нарушения фитоценоза, изменения обилия и качества корма и т.д.
Вместе с тем различные виды дуплогнездников по-разному реагируют
на техногенную трансформацию местообитаний. Так, в окрестностях
медеплавильного завода на Среднем Урале плотность большой синицы
несколько увеличивается с ростом нагрузки, а московки уменьшается почти в 3 раза
(табл. 10.2). Наиболее сильно снижается плотность мухоловки-пеструшки -
более чем в 6 раз. Деградация биотопов благоприятствовала лишь
горихвостке, плотность которой возросла почти в 12 раз.
285
Реакции разных видов хорошо объясняются их экологическими
особенностями. Московка связана в своем распространении с елью, на которой она
собирает корм: мелких беспозвоночных в теплое время года, а также
семена зимой. Сокращение доли ели в древостое приводит и к уменьшению
обилия этого вида птиц. Мухоловка-пеструшка предпочитает спелые и
средневозрастные древостой, так как только в них она может найти
потенциальные места для сооружения гнезд. В лесных массивах на загрязненных
территориях увеличивается площадь, занятая редколесьем и молодняками,
которых этот вид избегает. Определенную роль играет, по-видимому, ухудшение
кормовой базы в деградированных местообитаниях. Небольшое повышение
плотности большой синицы вблизи завода может объясняться определенной
синантропностью этого вида. Обыкновенная горихвостка предпочитает
осветленные участки леса с угнетенным травяно-кустарниковым ярусом, в
том числе нарушенные человеком (гари, вырубки, окрестности жилья
человека). Деградация фитоценозов в импактных зонах явно благоприятствует
ее распространению.
С ростом загрязнения увеличивается нестабильность населения дуплог-
нездников, о чем свидетельствует увеличение изменчивости плотности этой
группы видов по годам (коэффициент вариации в табл. 10.2). Население
мухоловки-пеструшки, большой синицы и московки наиболее изменчиво в
нарушенных биотопах. Напротив, стабильность населения горихвостки
максимальна в деградированных биотопах, по-видимому, оптимальных для этого
вида (Вельский, Ляхов, 1996).
Структура населения птиц
Структура населения птиц изменяется в градиенте техногенной нагрузки
в соответствии с изменениями биотопов. Доля лесных видов падает, а доля
видов открытых и кустарниковых биотопов увеличивается. При высоком
уровне деградации фитоценозов происходит смена доминантов.
В экосистемах темнохвойных лесов Среднего Урала почти независимо
от уровня загрязнения в населении птиц доминирует зяблик (12-18% от
общей плотности). Состав субдоминантов более показателен. На фоновой
территории в эту группу входят, как правило, типично лесные виды:
мухоловка-пеструшка (8-10%), пухляк (8%), а также зарянка (7%), чечевица (8%). В
импактной зоне субдоминанты представлены в основном видами открытых
и кустарниковых биотопов: зеленая пеночка (10-13%), лесной конек
(6-12%), овсянка обыкновенная (10%), чечевица (5-9%), пеночки: весничка
(5-16%), теньковка (5-7%), а также горихвостка (3-8%), предпочитающая
участки с угнетенным травяным покровом (Вельский и др., 1994; Вельский,
Ляхов, 1996).
В горно-лесных экосистемах Центральной Европы на всех стадиях
деградации фитоценоза в сообществе птиц также доминирует зяблик
(30-38%). Субдоминантов слабонарушенных лесных массивов - славку-чер-
ноголовку (7-8%) и желтоголового королька (6%) - в сильно загрязненных
местообитаниях сменяют зарянка (6-9%), лесной конек (8-10%) и лесная
завирушка (7%) (Flousek, 1989).
В экосистемах северной тайги структура сообщества птиц значительно
отличается от таковой более южных районов, что связано с особенностями
286
географического распространения ряда видов. В ненарушенных
экосистемах доминирует вьюрок (23%), субдоминанты: весничка (18%), белая
трясогузка (13%) и чечетка (12%). В условиях сильного техногенного загрязнения
доминантами становятся чечетка и полевой конек (по 18%), в субдоминанты
выходит обыкновенная каменка (10%). Свою роль в сообществе сохраняют
весничка (16%) и белая трясогузка (10%) (Gilyazov, 1993).
Таким образом, техногенное загрязнение приводит к сокращению
видового богатства, изменению структуры орнитокомплексов, уменьшению
плотности и снижению стабильности гнездового населения птиц. Реакция на
загрязнение разных видов неодинакова и связана с их экологической
спецификой.
Литература
Ахметшина Г.Н., Хантемирова Е.В. Высшая растительность // Воробей-
чик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование
техногенных загрязнений наземных экосистем. - Екатеринбург: Наука, 1994. С. 149-159.
Вельский ЕЛ. Изменчивость морфологических характеристик потомства дуп-
логнездников в градиенте техногенного загрязнения среды обитания // Проблемы
изучения биоразнообразия на популяционном и экосистемном уровне: Материалы
конф. Екатеринбург, 1997. С. 24-34.
Вельский Е.А., Безелъ B.C., Ляхов А.Г. Характеристика репродуктивных
показателей птиц-дуплогнездников в условиях техногенного загрязнения // Экология.
1995а. № 2. С. 146-152.
Вельский Е.А., Безелъ B.C., Поленц Э.А. Ранние стадии гнездового периода
птиц-дуплогнездников в условиях техногенного загрязнения // Там же. 19956. № 1.
С. 46-52.
Вельский Е.А., Ляхов А.Г. Некоторые особенности реакции населения
лесных птиц на выбросы медеплавильного завода // Проблемы общей и прикладной
экологии. Материалы молодежной конф. Екатеринбург: Екатеринбург, 1996.
С. 18-24.
Вельский Е.А., Ляхов А.Г., Поленц Э.А. Население птиц // Воробейчик Е.Л.,
Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных
загрязнений экосистем. Екатеринбург: Наука, 1994. С. 193-204.
Биоиндикация загрязнений наземных экосистем / Под ред. Р. Шуберта. М.: Мир,
1988. 348 с.
Венгеров П.Д. Эколого-зооморфологическая оценка состояния популяций птиц
в трансформированных экосистемах: Автореф. дис. ... канд. биол. наук. М., 1991.
24 с.
Воробейчик ЕЛ., Садыков О.Ф., Фарафонтов М.Г. Экологическое
нормирование техногенных загрязнений экосистем. Екатеринбург: Наука, 1994. 280 с.
Гилязов А.С, Катаев Г.Д. Опыт зооиндикации промышленных загрязнений в
условиях Кольского Севера // Антропогенные воздействия на природу
заповедников. М., 1990. С. 5-25.
Иноземцев А.А. Роль насекомоядных птиц в лесных биоценозах. Л.: Изд-во
ЛГУ, 1978. 264 с.
Лебедева Н.С. Экотоксикология и биогеохимия географических популяций
птиц. М.: Наука, 1999. 199 с.
Лебедева Н.С, Рябцев И.А., Белоглазое М.В. Популяционная радиоэкология
птиц // Успехи соврем, биологии. 1996. № 4. С. 432-446.
Мянд Р. Внутрипопуляционная изменчивость птичьих яиц. Таллинн: Валгус,
1988. 195 с.
Паевский В.А. Демография птиц. Л.: Наука, 1985. 285 с.
287
Поленц З.А., Вельский Е.А. О влиянии техногенного загрязнения на
репродуктивные показатели птиц // Очерки по экологической диагностике. Свердловск,
1991. С. 68-74.
Пушкарь И.Г., Борисова ТА., Воронова Л Д., Денисова А.В. Загрязнение
кадмием фауны экосистем (по мировым данным) // Мониторинг фонового загрязнения
природных сред. Л., 1991. Вып. 7. С. 100-111.
Beyer W.N., Pattee O.H., Sileo L. et al. Metal contamination in wildlife living near two
zinc smelters // Environ. Pollut. A. 1985. Vol. 38. P. 63-86.
Cody ML. Habitat selection in birds: The roles of vegetation structure, competition and
productivity//Bioscience. 1981. Vol. 31. P. 107-113.
Dmowski K., Karolewski MA. Cumulation of zinc, cadmium and lead in invertebrates
and in some vertebrates according to the degree of an area contamination // Ekol. pol. 1979.
Vol. 27, N 2. P. 333-349.
Drasch GA., Walser D., Kosters J. The urban pigeon (Columba livia, Forma urbana)
biomonitor for the lead burden of the environment // Environ. Monit. and Assess. 1987.
Vol. 9, N 3. P. 223-232.
Eeva T. Direct and indirect effects of air pollution on two hole-nesting bird species //
Ann. univ. Turkuensis. Ser. AII. 1996. Vol. 83.
Eeva Т., Lehikoinen E. Egg shell quality, clutch size and hatching success of the great tit
(Parus major) and the pied flycatcher (Ficedula hypoleuca) in an air pollution gradient //
Oecologia. 1995. Vol. 102. P. 312-323.
Eeva Т., Lehikoinen E. Growth and mortality of nestling great tits (Parus major) and pied
flycatchers (Ficedula hypoleuca) in a heavy metal pollution gradient // Ibid. 1996. Vol. 108.
P. 631-639.
Flousek J. Impact of industrial emissions on bird populations breeding in mountain
spruce forests in Central Europe // Ann. zool. fenn. 1989. Vol. 26, N 3. P. 255-263.
Frank A. In search of biomonitors for cadmium: cadmium content of wild Swedish fauna
during 1973-1976 // Sci. Total Environ. 1986. Vol. 57. P. 57-65.
Gilyazov A.S. Air pollution impact on the bird communities of the Lapland biosphere
reserve // Aerial pollution in Kola Peninsula: Proceedings of the International Workshop,
April 14-16, 1992, StPetersburg. Apatity, 1993. P. 383-390.
Gramsz B. Badania ilosciowe ptakow w zdegradowanych lasach swierkowych Sudetow
Zachodnich // Not. Ornitol. 1993. Vol. 34, N 3/4. P. 319-331.
Hornfeldt В., Nyholm N.E.I. Breeding performance of Tengmalm's owl in a heavy metal
pollution gradient//J. Appl. Ecol. 1996. Vol. 33. P. 377-386.
Hutton M., Goodman G.T. Metal contamination of feral pigeons Columba livia from the
London area. I. Tissue accumulation of lead, cadmium and zinc // Environ. Pollut. 1980.
Vol. 22, N 3. P. 207-217.
Jarvinen A., Ylimaunu J. Significance of egg size on the growth of nestling pied
flycatchers Ficedula hypoleuca // Ann. zool. fenn. 1984. Vol. 21, N 3. P. 213-216.
Kooiker G. Schwermetalle in Federn von Elstern (Pica pica) // J. Ornithol. 1986. Bd. 127,
N 1. S. 25-36.
Lemberk V. Srovnavani ornitocenoz smrkovych lesu Krkonos podle stupne poskozeni
imisemi // Opera corcontica. 1989. N 26. P. 131-143.
McArthur R.H., MacArthur J.W. On bird species diversity // Ecology. 1961. Vol. 42.
P. 594-598.
Muckel R. Haufigkeitsveranderungen holenbrutender Singvogel des Fichtenwaldes
wahrend des "Waldsterbens" im Westerngebirge // Zool. Jb. Syst. 1992. Bd. 119. S. 437-493.
Newton I. Population ecology of raptors. Berkhamstead: Poyser, 1979.
Nicholson J.K., Kendall M.D., Osborn D. Cadmium and mercury nephrotoxicity //
Nature. 1983. Vol. 304, N 5927. P. 633-635.
Nyholm N.E.I. Evidence of involvement of aluminium in causation of defective
formation of eggshells and of impaired breeding in wild passerine birds // Environ. Res. 1981.
Vol. 26. P. 363-371.
288
Nyholm N.E.I. Heavy metals tissue levels, impact on breeding and nestling development
in natural populations of pied flycatcher (Aves) in the pollution gradient from a smelter //
Ecotoxicology of soil organisms. Lewis, 1994. P. 373-382.
Nyholm N.E.I. Influence of heavy metal exposure during different phases of the
ontogeny on the development of pied flycatchers, Ficedula hypoleuca, in natural populations // Arch.
Environ. Contam. and Toxicol. 1998. Vol. 35. P. 632-637.
Nyholm N.E.I. Monitoring of terrestrial environmental metal pollution by means of free-
living insectivorous birds // Ann. chim. 1995. Vol. 85. P. 343-351.
Nyholm N.E.L, Myhrberg H.E. Severe eggshell defects and impaired reproductive
capacity in small passerines in Swedish Lapland // Oikos. 1977. Vol. 29, N 2. P. 336-341.
O'Halloran /., Myers AA.t Duggan P.F. Lead poisoning in swans and sources of
contamination in Ireland // J. Zool. 1988. Vol. 216, N 2. P. 211-223.
Pattee ОЛ. Eggshell thickness and reproduction in American kestrels exposed to
chronic dietary lead // Arch. Environ. Contam. and Toxicol. 1984. Vol. 13, N 1. P. 29-34.
Pedersen H.C., Myklebust J. Age-dependent accumulation of cadmium in Norwejian
willow ptarmigan (Lagopus 1. lagopus) // Trans. 20th Congr. Intern. Union Game Biol.,
Godollo, Aug. 21-26, 1991. Godollo, 1991. Pt 2. P. 477-482.
Pinowska В., Krasnicki K., Pinowski /. Estimation of the degree of contamination of
granivorous birds with heavy metals in agricultural and industrial landscape // Ekol. pol.
198L Vol. 29, N1. P. 137-149.
Potti /. Environmental, ontogenetic and genetic variation in egg size of pied flycatcher //
Canad. J. Zool. 1993. Vol. 71, N 8. P. 1534-1542.
Rose G.A., Parker G.H. Effects of smelter emissions on metal levels in the plumage of
ruffed grouse near Sudbury, Ontario, Canada // Ibid. 1982. Vol. 60, N 11. P. 2659-2667.
Rotenberry J.T. The role of habitat in avian community composition: Physiognomy or
floristics // Oecologia. 1985. Vol. 67. P. 213-217.
Sawicka-Kapusta K., Kozlowski J., Sokolowska 7. Heavy metals in tits from polluted
forests in southern Poland // Environ. Pollut. A). 1986. Vol. 42. P. 297-310.
Scheuhammer AM. The chronic toxicity of aluminium, cadmium, mercury, and lead in
birds: A review // Environ. Pollut. 1987. Vol. 46, N 2. P. 263-295.
Schifferli L. The effect of egg weight on the subsequent growth of nestling great tits
Parus major//Ibis. 1973. N 115. P. 549-558.
Sears J. A review of lead poisoning among the River Thames mute swan Cygnus olor
population // Wildfowl. 1989. N 40. P. 151-152.
Stastny K., Bejcek V. Bird communities of spruce forests affected by industrial emissions
in the Krusne hory (Ore Mountains) // Bird census work and atlas studies / Ed. K. Taylor et
al; BTO Tring. 1983. P. 243-253.
Wojcik W. Estimation of contamination of small game by heavy metals in the region of
copper works // Ekol. pol. 1980. Vol. 28, N 4. P. 601-614.
Zwank PJ., Wright V.L.y Shealy P.M., Newsom J.D. Lead toxicosis in waterfowl on two
major wintering areas in Louisiana // Wildlife Soc. Bull. 1985. Vol. 13, N 1. P. 17-26.
10. Рассеянные элементы
Глава 11
ПРИНЦИП БИОГЕОХИМИЧЕСКОЙ
СЕЛЕКЦИИ ОРГАНИЗМОВ
И НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ БИОСФЕРЫ
Одной из основных парадигм современной теории биологической
эволюции является генетическое единство всех живых организмов,
произошедших от одного общего предка (Lovelock, 1988). Некоторые ученые идут
гораздо дальше в своих обобщениях и предполагают, что пронизывающие всю
биосферу потоки энергии и вещества объединяют метаболизм отдельных
организмов в единую сеть планетарного масштаба под названием Гея (Gaia)
по имени древнегреческой богини Земли. Таким образом, согласно этой
популярной теории единый предок современных организмов не исчез, а всего
лишь эволюционировал в более сложный сверхорганизм - современную
биосферу.
В конце XIX и начале XX веков четыре русских ученых П.А. Кропоткин,
Р.В. Ризположенский, В.И. Вернадский и В.А. Костицин выдвинули
несколько взаимосвязанных концепций о характере и направленности
коэволюции организмов и окружающей среды. Поскольку на протяжении
большей части XX столетия между Россией и остальным миром существовали
политические, языковые и культурные барьеры, многие из этих концепций
до сих пор остаются неизвестными западной науке.
Как популярная в современной науке гипотеза Геи, так и
систематизированные нами результаты исследований и размышлений русских ученых
позволяют развивать представление о коэволюции организмов и окружающей
среды, обусловливающей направленность эволюции организмов в сторону
создания более благоприятной среды их обитания. Вместе с тем имеются
принципиальные отличия "русского" представления о направленной
эволюции биосферы от гипотезы Геи.
11.1. ГИПОТЕЗА ГЕИ
В настоящее время существуют две основные точки зрения на роль Геи
в изменении окружающей среды. Согласно первой Гея способна изменять
окружающую среду в направлении, благоприятном для большинства
организмов (гипотеза "сильной Геи"), согласно второй Гея способна лишь
поддерживать необходимые условия для существования жизни (гипотеза гомео-
стаза, или "слабой Геи") (Kirchner, 1991).
290
"Слабая Гея"
С помощью простой эвристической модели Эндрю Уотсон и Джеймс Ла-
влок (Watson, Lovelock, 1983) показали, как воображаемая биосфера, "Мир
маргариток" ("Daisyworld"), двухвидовое сообщество, состоящее из белых
маргариток с высоким альбедо (коэффициент отражения) и темных - с
низким альбедо, откликается на изменение в яркости свечения солнца. В
соответствии с их моделью численность темных маргариток падает, а белых -
растет с увеличением яркости свечения солнца. В результате этих
изменений температура в "Мире маргариток" стабилизируется благодаря
увеличению планетарного альбедо. По мнению Дж. Лавлока этот пример должен
продемонстрировать главное свойство Геи: способность к регулированию
окружающей среды и удерживанию ее в границах условий, благоприятных
для большинства организмов.
Хотя моделирование окружающей среды и является широко
распространенным научным приемом^ основные уравнения простых
математических моделей зачастую отражают лишь субъективное мнение математика, а
не объективную реальность. Например, модель "Мир маргариток" не
учитывает возможную адаптацию темных маргариток к более высокой
температуре, эволюцию маргариток серого или других оттенков и т.д., поэтому
такие математические упражнения не могут служить доказательством
теории Геи.
"Сильная Гея"
Гипотеза сильной Геи опирается на весьма интригующую аксиому.
В этой гипотезе организмы и окружающая их среда эволюционировали в
современное относительно стабильное состояние не в силу случайного
стечения обстоятельств, а благодаря направленному действию самих организмов.
Иными словами, сильная Гея способна изменять окружающую среду в
направлении, благоприятном для большинства организмов. Хотя и трудно
найти простое объяснение этому явлению, факт существования такой
эволюции находит подтверждение во многих палеогеографических и
биогеохимических исследованиях (Volk, 1998).
Например, хорошо известно, что на протяжении геологического
времени как сообщества организмов, так и их отдельные представители
становились сложнее и разнообразнее в основном благодаря тому, что со временем
увеличивалась неоднородность живой и неживой природы. Или как
сформулировал эту мысль Хаггет: "Как гео-, так и биоразнообразие среды
постоянно возрастали в процессе эволюции..." (Huggett, 1999, с, 299). Вполне
понятно, что в некоторых случаях именно живые организмы играли ведущую
роль в увеличении геологического разнообразия, особенно те, которые
после смерти служили материалом для образования различных осадочных
горных пород (например, известняка). Однако невозможно доказать, что эти
специфические изменения производились организмами "намеренно", чтобы
сделать условия внешней среды более благоприятными для своего
потомства или каких-то других видов.
Идея взаимных изменений у живого вещества и окружающей среды
похожа на концепцию биологической коэволюции, сформулированную
Паулем Эрлихом и Питером Равеном (Ehrlich, Raven, 1965). Эти исследователи
ю*
291
определили коэволюцию как процесс взаимных эволюционных изменений у
взаимодействующих видов. Они заметили, что родственные виды бабочек
питаются на родственных растениях. Причиной этих взаимоотношений мог
послужить тот факт, что некоторые насекомые приспособились к токсинам,
которые продуцируются растениями в защитных целях, поэтому вполне
вероятно, что выжил только тот вид бабочек, который адаптировался к
токсинам того или иного растения.
Позднее экономист-эколог Р. Норгаард (Norgaard, 1981, 1984)
распространил концепцию коэволюции на развитие социоэкологических систем.
По Норгаарду, качество окружающей среды ухудшается с ростом
технического прогресса, что в свою очередь вызывает снижение урожайности и в
конечном счете заставляет общество менять свое поведение по отношению
к среде обитания. Говоря о низкой экономической продуктивности
тропических дождевых лесов Амазонии, Норгард (Norgaard, 1981) отметил одну
принципиальную разницу между искусственными и естественными
экосистемами. Метаболизм естественных экосистем эффективнее, чем агроэко-
систем, которые нуждаются в постоянной помощи извне в виде орошения (в
периоды, когда величина суммарного испарения превышает количество
выпадающих осадков) и внесения удобрений, чтобы компенсировать потерю
питательных веществ из почвы из-за орошения и отчуждения с урожаем
сельскохозяйственных культур. Однако эти проблемы могли бы быть
решены, если бы социальная и экологическая системы в Амазонии развивались
по пути коэволюции, приводя как к изменению поведения человека, так и
направленной человеком адаптации агроэкосистем (Norgaard, 1981).
В последнем примере очевидной причиной коэволюции являлся
человек. В более общем случае коэволюции организмов и окружающей среды
движущие силы не так очевидны. Трудно понять, достигла ли биосфера
своего современного состояния в основном за счет случайных внешних
параметров, таких, как яркость солнечного свечения, вулканическая активность,
столкновение с астероидами, или благодаря тому, что сами организмы
избирали только определенные пути своего развития?
Если организмы играли пассивную роль по отношению к окружающей
среде, то поиск движущей силы коэволюции следует продолжить среди
внешних факторов (вулканы, астероиды, космическое излучение и т.д.). С
другой стороны, если организмы следовали определенными, доминантными,
путями своего развития, - механизм коэволюции надо искать внутри
сложной сети взаимоотношений между отдельными организмами и окружающей
их средой. Ответ на этот вопрос имеет большое значение для нашего
понимания возможного долгопериодного отклика биосферы на современные
возмущения окружающей среды, включая и возможные антропогенные
изменения климата. Если организмы биосферы действительно следуют
только определенному вектору развития, то биосфера в целом должна бы иметь
значительный потенциал устойчивости на длительном масштабе времени.
Такое заключение ни в коей мере не должно умалять беспокойство
экологов о возможном уроне, наносимом биосфере человеком в короткие
интервалы времени. Вместе с тем понимание естественных долгопериодных
тенденций развития биосферы может пригодиться для решения прикладных
задач и лучшего понимания последствий экологического менеджмента и
крупномасштабных геоинженерных проектов.
292
11.2. ПРИНЦИП БИОГЕОХИМИЧЕСКОЙ
СЕЛЕКЦИИ ОРГАНИЗМОВ
В настоящем разделе рассмотрим представление о взаимодействии
организмов и окружающей среды Через призму результатов исследований,
выполненных русскими учеными П.А. Кропоткиным, Р.В. Ризположенским,
В.И. Вернадским и В.А. Костициным. Имеет смысл построить дискуссию о
развитии концепций направленной коэволюции в российской науке,
соблюдая ее хронологический порядок, чтобы стала яснее интеллектуальная связь
между результатами этих и других сходных исследований.
Взаимопомощь организмов - фактор их эволюции
Работы ПА. Кропоткина [1842-1921 гг.] - известного
естествоиспытателя и географа, а также одного из основателей анархистской идеологии,
по биологической эволюции достигли своей кульминации после
опубликования Томасом Хаксли (Huxley, 1888) книги "Борьба за существование в
человеческом обществе". С точки зрения Кропоткина Хаксли и другие
социальные дарвинисты не придавали должного значения механизму
возможного выживания благодаря взаимопомощи и сосуществованию.
Кропоткин придерживался представления, что в биосфере выживали зачастую
те индивидуумы или виды, которые оказывали взаимопомощь друг другу
для общей выгоды. В своей книге "Взаимопомощь как фактор эволюции"
(Kropotkin, [Г902] 1972) ученый сделал главный вывод: "Взаимопомощь -
такой же закон природы, как и взаимная вражда". Здесь слова "закон
природы" следует интерпретировать с точки зрения метода научной дедукции,
который Кропоткин применял в своих естественнонаучных и
социологических исследованиях. По Кропоткину, научная дедукция состоит из трех
ступеней: (а) наблюдение и сбор данных, (б) формулирование гипотезы и
(в) проверка этой гипотезы на других данных и наблюдениях (Ударцев,
1989). На последней ступени этой последовательности гипотеза должна
становиться законом природы (Кропоткин, 1920). Однако при такой
интерпретации законов природы не ясно, какой уровень накопления данных
делает гипотезу законом.
Рассматривая примеры взаимопомощи между отдельными животными и
группами животных в локальном и региональном масштабе, Кропоткин
возводит случаи их социального поведения на уровень закона природы
(Kropotkin, [1902] 1972). Он приводит пример пространственного
распределения численности волков и лошадей на Русской равнине, где волки
самоорганизуются для охоты в отдельные компактные группы, а лошади - в
замкнутые круги для защиты себя и жеребят при угрозе атаки волков. В других
примерах описывается поведение насекомых (например, сообществ
муравьев и пчел, а также взаимопомощь среди некоторых видов жуков) и случаи
общественного поведения птиц. В общем Кропоткин считал, что
социальное поведение помогаеп1_организмам лучше приспосабливаться к
окружающей среде. Однажды приобретенная, такая адаптация может передаваться
от одного поколения организмов к другому.
Позднее Кропоткин собрал дополнительные доказательства в
поддержку теории взаимопомощи и наследственной адаптации. В периодиче-
293
ском издании "Девятнадцатый век" он опубликовал серию работ на эти
темы, включая взаимодействие окружающей среды с растениями и
животными, наследование приобретенных характеристик и наследственные
изменения у растений и животных (Campbell, Livingstone, 1983). По мнению
Кэмпбелла и Ливингстона, в этих работах представлены убедительные
доказательства того, что географический и анархический гуманизм
Кропоткина имеет глубокие корни в его естественнонаучных исследованиях и
особенно в неоламаркистских взглядах на эволюцию. Последнее заметно,
например, в его заключениях о том, что растения и животные напрямую
подвергались модификациям со стороны окружающей их среды, и что любая
такая модификация затем наследовалась их потомством (Campbell,
Livingstone, 1983).
Неоламаркизм Кропоткина был тесно связан с концепцией
дарвиновского естественного отбора. Причиной такого эволюционного дуализма была
вера Кропоткина в то, что взаимопомощь является наиболее энергетически
эффективным приспособлением организмов к окружающей среде. Поэтому
с его точки зрения, те организмы,, что приобрели или унаследовали навык
социального поведения, в то же время получили эволюционное
преимущество перед другими организмами.
Еще одной интересной особенностью теории Кропоткина (1920)
является его видение эволюции как продукта "микросил", которые работают как
независимо, так и в тесной связи друг с другом. Он ([1902] 1972) использовал
термин "микросилы" для описания взаимодействия между отдельными
видами организмов. Примером такого взаимодействия, обусловленного тем же
принципом взаимопомощи, служат жуки-могильщики Necrophorus, которые
используют разлагающиеся трупы мелких животных как инкубаторы для
отложенных ими яиц. Чтобы обеспечить безопасные условия для яиц, жуки
Necrophorus разыскивают трупы мышей и птиц, которые можно было бы
закопать в грунт. Однако ни один жук не сможет проделать эту работу в
одиночку. Поэтому первый жук, найдя труп животного, приводит несколько
других жуков на место и с их помощью закапывает этот труп, или они
вместе перетаскивают его на другое место с более мягким грунтом, где затраты
энергии на выполнение работы будут наименьшими.
Эти и другие наблюдения привели Кропоткина (Kropotkin, [1902] 1972,
с. 81) к формулировке основного принципа направленной эволюции: "В
великой борьбе за жизнь для достижения ее наибольшей полноты и
насыщенности при наименьших затратах энергии естественный отбор
постоянно ищет пути, на которых можно максимально избежать конкуренции*.
В этой фразе Кропоткин сделал важное обобщение о направленности
эволюции в сторону наименьших затратах энергии организмами. Говоря о
естественном стремлении организмов или групп организмов к состоянию с
наименьшими затратами энергии, Кропоткин имел в виду прежде всего
энергетические преимущества взаимопомощи как фактора выживания
перед конкуренцией.
В России у Кропоткина было много последователей, которые пытались
применять его теорию взаимопомощи в социальных науках. Р.В. Ризполо-
женский был одним из немногих, кто пытался развить идеи Кропоткина в
естественных науках.
294
Взаимопомощь организмов в совместном "приготовлении пищи"
Согласно Р.В. Ризположенскому [1847-1918 гг.] новатору в области
географии почв, основной причиной взаимопомощи среди организмов является
выгода от совместного участия в процессе питания, когда одни организмы
усваивают доступную только им пищу, одновременно трансформируя ее в
пищу, доступную другим организмам (например, отношения между автотро-
фами и гетеротрофами и т.д.).
В 1892 г. он сформулировал оригинальную концепцию "почвы" как
границы между миром неорганизованной природы (хаосом) и миром
организованным или миром порядка (Ризположенский, 1892). Мир порядка - это
живые организмы, а мир хаоса - неживая среда, которая включает атмосферу,
гидросферу и литосферу. Согласно Ризположенскому при взаимодействии
мира хаоса с миром порядка образуется три основные почвенные
формации: (1) почвы на границе между миром живых организмов и литосферой -
твердые почвы; (2) почвы на границе между миром живых организмов и
гидросферой - жидкие почвы; (3) почвы на границе между миром живых
организмов и атмосферой - газообразные почвы.
В мире почв Ризположенского их свойства изменяются живыми
организмами во время поиска питательных ресурсов в воздухе, воде и горных
породах. В этом процессе одни организмы ненамеренно перемешивают
различные среды и производят отходы, которые в свою очередь могут служить
пищей для других организмов. Следовательно, утилизируя пищевые ресурсы,
любое растение или животное непроизвольно участвует в создании пищи
для другого живого организма. По Ризположенскому, такая взаимопомощь
в "приготовлении пищи" друг для друга никогда не прерывается. Живые
организмы работают совместно, объединяясь в более или менее
дружественные группы и ассоциации, причем одна ассоциация незамедлительно
заменит собой другую в случае, если первая истощила все имевшиеся в ее
распоряжении ресурсы. Вторая ассоциация будет лучше приспособлена для
данного типа почвы и климата и сможет продолжить работу, начатую первой
ассоциацией (Ризположенский, 1897). Непрерывная работа по созданию
биогенного вещества постепенно преобразует границу между миром
организмов и миром хаоса (например, изверженная геологическая порода) в
"окружающую среду более благоприятную для развития жизни в целом".
Поскольку Ризположенский рассматривал почву как место контакта живых
организмов с гидросферой, атмосферой и литосферой, можно понять, что
приведенная цитата есть определение концепции направленной эволюции всей
биосферы Земли, т.е. концепции, подобной гипотезе сильной Геи.
Эволюция почвы через развитие отношений отходы-пища,
соответствует взгляду Кропоткина на взаимопомощь как фактор эволюции.
Действительно, способность организма занимать свое место в экосистеме в самом
конце существующей пищевой цепи сохраняет ему энергию. Такой
организм не тратит, например, энергию на борьбу за ресурсы питания и может
мирно сосуществовать с другими видами сообщества, находящимися на
более низких уровнях питания. Поэтому с появлением в результате эволюции
новых видов, способных занять места в конце пищевой цепи, у всей системы
появляется тенденция к усложнению из-за расширения сети питания и
лучшего приспособления всех видов организмов через удовлетворение нужд
каждого индивидума.
295
В то же время Ризположенский (1897) указывает, что в коротких
временных интервалах свойства почвы могут развиваться как в направлении,
благоприятном для организмов, так и вызывая уменьшение численности и
даже гибель данного вида организмов. В качестве примера он приводит
лесные почвы. Из-за выщелачивания органического вещества и разрушения
почвенной структуры корнеобитаемый слой почвы становится плотным,
непроницаемым для корней. В результате такой трансформации лесные
почвы превращаются в болотные или солонцы, а лесная растительность с
глубокой корневой системой исчезает. Однако со временем открытые и
обезлесенные пространства зарастают травами и кустарниками с маломощной
корневой системой и заселяется новыми видами землеройных животных.
В результате денудации и биотурбации со временем, эти почвы может опять
пригодными для заселения лесной растительностью. Данная
последовательность событий отражает процесс вторичной суксессии, где биотурбация
способствует восстановлению продуктивности почвы. Ризположенский
приводит этот пример одновременно и независимо от Евгения Уорминга, который
ввел понятие суксессии (Odum, 1996).
Многие взгляды Ризположенского не нашли поддержки у его коллег.
Его резко критиковали за противоречивый характер теорий, переоценку
роли биотурбации в почвообразующих процессах и "бесполезную для
практики" классификацию почв (Сибирцев [1892] 1953). Однако, как нам кажется,
видимое противоречие во взглядах Ризположенского на эволюцию почвы в
коротком и длинном интервалах времени можно разрешить, если
обратиться к теории внутренней неустойчивости биогеохимических циклов,
предложенной В.А. Костициным через двадцать лет после смерти
Ризположенского. Но сначала нам следует обратиться к научному наследию коллеги и
учителя Костицына - В.И. Вернадского, который развил идеи Кропоткина,
Ризположенского и других исследователей в фундаментальное учение о
биосфере.
Первый и второй биогеохимические принципы
Многочисленные исследователи, включая Лавлока (Lovelock, 1988),
Маргулиса и Сагана (Margulis, Sagan 1997), признают приоритет В.И.
Вернадского [1863-1945 гг.] в открытии многих важных функций биосферы
Земли и доказательстве того, что современные атмосфера и гидросфера
образовались в результате деятельности живых организмов. Некоторые из них,
например, Марк и Диана МакМенамин (McMenamin, 1994), ссылаются на
Вернадского как на русский источник гипотезы Геи.
Некоторое сходство между учением Вернадского о биосфере и
гипотезой Геи очевидно, например, из холистического взгляда Вернадского на
природу, особенно из его концепции живого вещества как совокупности всех
живых организмов. Однако этот взгляд простирается и на магматические
породы, ювенильные воды или летучие продукты вулканических
извержений, которые составляют по Вернадскому (Vernadsky, [1926] 1998) другую
интегрированную характеристику: косную материю. В более поздних
работах в дополнение к живому веществу и косной материи Вернадский вводит
новую часть биосферы - биокосную материю (Vernadsky, ([1931a] 1993).
Хотя Вернадский никогда не ссылался на Ризположенского, его биокосная ма-
296
терия весьма похожа на "почву" Ризположенского, представляющую среду,
образованную из косной материи в результате деятельности живых
организмов. Так, биокосная материя представлена, например, почвами суши,
донными морскими отложениями, поверхностным слоем воды мирового океана и
любыми другими средами со свойствами, существенно измененными или все
еще находящимися под влиянием живых организмов. Многочисленные
потоки вещества и энергии между живым, косным и биокосным веществами
объединяют отдельные части в единое целое, в сложную систему, или
"механизм" биосферы (Vernadsky, Вернадский [1926] 1998).
Еще одной чертой, общей для учения Вернадского о биосфере и
гипотезы Геи, является идея направленной эволюции. Возможно, наиболее важной
работой Вернадского по научному обоснованию идеи направленной
эволюции можно считать его лекцию, озаглавленную "Изучение феномена жизни
и новая физика" (Vernadsky, [1931a] I993), в которой он представил два
основных биогеохимических принципа.
Первый принцип биогеохимии Вернадского "Биогенная миграция
химических элементов в биосфере стремится к максимальному своему проявле-
нию" (Vernadsky, [1931a] 1993, с. 348) вытекает из ранней концепции
"давления жизни" (Vernadsky, [1926] 1998), которая основывается на наблюдениях
за различными видами организмов в современной биосфере, где
размножение живых организмов ограничено лишь несколькими внешними "силами".
Размножение организмов замедляется при низких температурах и
ослабевает или исчезает совсем в отсутствие пищи, газа для дыхания или
пространства для новорожденных организмов. Во всех других случаях жизнь стремится
к максимально возможной экспансии, которая схожа с адиабатическим
расширением газов. "Давление водяного пара и давление жизни аналогичны"
(Vernadsky, [1926] 1998, с. 67).
Концепция давления жизни схожа с вышеуказанным принципом
наибольшей полноты и интенсивности жизни Кропоткина. Вернадский
(Vernadsky, [19316] 1993, с. 348) развил этот принцип глубже, введя понятие
"биологический фактор времени". Согласно Вернадскому биологическая
продуктивность даже при оптимальных условиях не может возрастать
бесконечно, она ограничена биологическим фактором времени, или конечной
максимальной скоростью деления клетки. Некоторые организмы
(например, бактерии) подвержены регулярному клеточному делению, которое
можно использовать как меру "биологического времени" и которое
Вернадский ввел в дополнение к понятию о геологическом и условном времени.
При неограниченном биологическом факторе времени биогенная миграция
химических элементов увеличивается в пределах пороговых величин других
лимитирующих факторов.
Ктпрпй принцип биогеохимии Вернадского гласит, что в процессе эво-
люции выживают те виды, кбтирые Спосооны увеличивать круговорот
биогенной миграции химических элементов в биосфере (Vernadsky, [1931a]
1993). Этот принцип также схож со взглядами Кропоткина на
дарвиновский принцип высокой приспособляемости организмов к условиям
внешней среды, хотя Вернадский и не уточняет, какой механизм
приспособляемости энергетически более выгоден - конкуренция или взаимопомощь.
Напротив, Вернадский сравнивает организмы по степени их участия в
биогенной миграции химических элементов. Вне контекста других работ Вер-
297
надского формулировка второго биогеохимического принципа может
показаться не совсем ясной. Так, не ясно, каким образом одни виды смогли
сделать такой вклад в биогенную миграцию химических элементов, что
они получили преимущество перед другими видами, которые такого
вклада сделать не смогли?
Позднее Вернадский сформулировал новый принцип, согласно
которому эволюция видов в течение геологического времени должна идти в
направлении, увеличивающем проявление биогенной миграции атомов в
биосфере (Vernadsky [1940] 1987). Под "биогенной миграцией атомов" Вернадский,
очевидно, имел в виду вовлечение различных химических элементов в
биогеохимические циклы. Поэтому эволюция видов должна идти в направлении
ускорения биогенной миграции химических элементов, которое может быть
достигнуто только через увеличение биологической продуктивности. Таким
образом, последняя концепция представляет собой еще одну формулировку
второго биогеохимического принципа.
Формулируя второй биогеохимический принцип, Вернадский не
приводит доказательств и не открывает подробных дискуссий, характерных для
его работ. Возможно, он думал, что этот принцип является самоочевидным
выводом из его предыдущих трудов и поэтому не нуждается в обосновании.
В своем обобщении взглядов Вернадского на механизм глобальных
биогеохимических циклов элементов Маргулис и Саган (Margulis, Sagan, 1997)
утверждают, что его подход всегда основывается на интеграции очень
специфических локальных процессов. Так, глобальные потоки фосфора
включают, например, чайку, переносящую фосфор из океана на сушу. Суслик,
роющий свою норку, вносит вклад в поток органического углерода в почве,
а миграция северных оленей из тайги в тундру - обмен химических
элементов между различными географическими зонами и т.д. Другими словами,
глобальные биогеохимические циклы, по Вернадскому, состоят из
локальных специфических процессов (сходных с "микросилами" Кропоткина).
Каждый из таких микроциклов вносит свой конкретный вклад в глобальные
биогеохимические циклы, ускорение которых создает, в свою очередь,
более благоприятную для жизни среду. Но опять же, Вернадский не дает
ясного ответа на вопрос, почему умение ускорить биогеохимические циклы
обеспечивает организмам или их популяциям эволюционное преимущество
по отношению к другим организмам?
Внутренняя нестабильность биогеохимических циклов
В.А. Костицин [1886-1963 гг.] долго и плодотворно работал в области
математической биологии и других областей прикладной математики. По
словам самого ученого, главным направлением его работ была "атака"
проблемы биологической эволюции. Костицин (Kostizin, 1939) считал, что
концепции эволюции можно дать количественное определение как "процесса,
направленного от более вероятного состояния к отличному от него менее
вероятному состоянию, или процесса, направленного против возрастания
энтропии". Он утверждал, что возрастание энтропии является всеобщей
тенденцией, а ее уменьшение - локальным явлением очень низкой
вероятности. "Всеобщие тенденции будут несомненно направлены к более
вероятному состоянию, если это состояние уже не было достигнуто ранее... Ло-
298
кальные тенденции могут быть восходящими или нисходящими и
несомненно первые менее вероятны, чем вторые. Хотя их вероятность еще не равна
нулю..." (Kostizin, 1939). Иными словами, эволкшиялредставлялась Кости-
цыну как^резвычайно редкий феномен, в высшей степени локализованный
в пространстве и во времени.
Костицын олестяще показал, как математическое моделирование может
использоваться для изучения этого маловероятного процесса биологической
эволюции. В сложной системе дифференциальных уравнений, которая
может быть использована для описания глобальных биогеохимических циклов,
всегда существует вероятность того, что параметры этой системы будут
сдвигаться в направлении, противоположном равновесному состоянию
(Kostizin, [1935] 1978). В применении к конкретным циклам химических
элементов отклонение системы от равновесия должно приводить к изменениям
концентраций этих элементов во внешней среде. В первой из известных
публикаций о применении математических методов для решения
биогеохимических проблем "Эволюция атмосферы: Круговорот органического вещества,
периоды оледенений" (Kostizin, [1935] 1978) Костицин показывает, что связь
организмов с биокосной материей поддается описанию нелинейными
дифференциальными уравнениями такого же типа, что были применены Лотка для
описания взаимодействия между хищниками и их жертвами.
Костицин нашел удачный метод исследования устойчивости уравнений,
описывающих более сложные системы объединенных циклов кислорода,
углерода и азота. В результате этого исследования им были определены
условия, необходимые для возникновения автоколебаний в химическом
составе атмосферы, океана и почвы. Диапазон этих условий оказался достаточно
широким, из чего Костицин сделал вывод о закономерности периодических
и квазипериодических изменений в биогеохимических циклах важнейших
элементов питания (Kostizin, [1935] 1978).
Такое понимание природы биогеохимических циклов отличается от
детерминистических взглядов Кропоткина и Вернадского. В самом деле, Кро-
поткин и Вернадский считали, что выживаемость организмов зависит от их
поведения, в то время как Костицин считал, что организм и окружающая
среда, по крайней мере в течение какого-то промежутка времени, могут
подвергаться случайным изменениям, зачастую направленным в сторону от
равновесного состояния.^Отгнако мнение коститтина сгишятгяет со взгляттом
Ризположенского в том, что в течение коротких промежутков времени
организмы могут видоизменять окружающую среду в сторону создания
условий как благоприятных, так и губительных для их существования.
Костицин (Kostizin, [1935] 1978) также показал, что появление новых,
хорошо адаптированных к внешней среде организмов необязательно
оказывается выгодным для всего сообщества и даже может явиться причиной
уменьшения их численности или вымирания, однако при возрастании
общего количества видов ввод в систему нового вида чаще заканчивается
усилением стабильности системы (Kostizin, [1935] 1978). Последнее можно
отнести за счет увеличения разнообразия в сети питания и увеличения
возможных ниш обитания, доступных для нового типа организмов. Поэтому с
математической точки зрения Костицына, идея Кропоткина о взаимопомощи
является не строгим правилом, а скорее аттрактором, к которому
устремляется система по мере увеличения ее сложности и разнообразия.
299
Вместе с тем Костицын понимал, что устойчивое развитие посредством
редких и маловероятных событий возможно лишь в системе с хорошей
"памятью". По его мнению, механизмом такой памяти могло бы служить
избирательное накопление незначительных случайных генетических мутаций
внутри "бактериальной плазмы" (Kostizin, ([1939] 1978, с. 435). Похожий
подход можно найти в работах Вольтерра (Volterra, [1938] 1978), изданных
почти одновременно с работами Костицина.
Систематизация представлений русских ученых
о биогеохимической селекции организмов
В этом разделе нами предпринята попытка синтезировать взгляды
четырех русских ученых таким образом, чтобы показать, являются ли их
научные идеи актуальными до сих пор или имеют лишь историческое значение.
В таблице 11.1 показаны возможные связи между интеллектуальными
вкладами каждого из них в развитие теории направленной эволюции
биосферы. Не следует рассматривать эту схему в качестве амбициозной
попытки суммировать научное наследие Кропоткина, Ризположенского,
Вернадского и Костицина в нескольких колонках одной таблицы. Напротив, целью
этой таблицы является систематизация последовательности представлений
о принципе биогеохимической селекции организмов и направленной
эволюции биосферы. Выделяются три ключевых проблемы:
1) взаимопомощь,
2) взаимосвязь между организмами и окружающей средой,
3) механизм направленной эволюции.
Связи 1А-»1В—»1D демонстрируют развитие идеи о взаимопомощи в
трудах Кропоткина, Ризположенского и Костицина. Вклад Вернадского в
эту теорию не был прямым. В его работах биосфера предстает биотой или
пространством, занимаемым живыми организмами, дополненной биогенной
миграцией элементов, которая функционально объединяет живое вещество
и косную материю в единую систему. Другими словами, Вернадский
органично вводит концепции Кропоткина (окружающая среда как фактор
изменения в живых организмах) и Ризположенского (организмы как фактор
изменения окружающей среды) в учение о едином биогеохимическом
механизме обратной связи между живым веществом и косной материей (связь
2А -> 2В -> 1С).
Другая связь в этой таблице показывает формализацию Костициным
учения Вернадского о биосфере через систему нелинейных
дифференциальных уравнений, схожих с теми, которые использовали Лотка и Вольтерра
для описания динамики численности популяций (1С —» 2D).
Связи ЗА —> ЗВ —> ЗС характеризуют трансформацию взглядов
Кропоткина, Ризположенского и Вернадского на направленную эволюцию. Кости-
цин (Kostizin, [1936] 1978), принимавший участие в обсуждении возможной
направленности эволюции видов, не сформулировал особого закона или
принципа направленной эволюции. В то же время его идеи об очевидной
тенденции к симбиозу в эволюции сложных систем и внутренней
нестабильности биогенной миграции элементов, как и идея о случайной природе
генетических мутаций и передаче информации о приобретенных или
унаследованных признаках через "бактериальную плазму" (пункт 3D), могут оказать-
300
ся очень важными в нашем поиске возможной движущей силы
направленной эволюции.
Действительно, если биогенная миграция элементов внутренне
нестабильна, организмы должны испытывать постоянный стресс,
обусловленный, например, динамикой содержания питательных веществ, изменением
химического состава атмосферы и гидросферы. В настоящее время
считается, что изменения концентрации биогенных элементов в воде океанов и
вызванные ими изменения продуктивности морской биоты приводили в
прошлом к существенным колебаниям атмосферной концентрации С02 и
"парникового эффекта" атмосферы (Вербицкий, Лапенис 1987; Лапенис 1989).
Таким образом, климатическая изменчивость в прошлом могла быть либо
вызвана либо существенно усилена внутренней нестабильностью
биогеохимических циклов питательных элементов и связанного с этими циклами
круговорота углерода. Поэтому наряду со стрессом, который испытывали
организмы при изменениях концентрации питательных веществ в окружающей
среде, они подвергались и периодическому стрессу из-за изменений климата,
вызванных той же внутренней нестабильностью биогеохимических циклов.
Известно, что во время подобных стрессов гены, которые находились в
угнетенном состоянии, могут стать частью видового фенотипа (Rutherford,
Lindquist, 1998). Поэтому пока окружающая среда оказывает стресс на био-
ту, последняя постоянно производит новые виды, обладающие широким
спектром свойств.
Внешние факторы, такие как вулканические извержения или
столкновение Земли с астероидами, несомненно вызывают такой же или даже
больший стресс у организмов, как биогеохимический или климатический
факторы. Однако последние постоянны по своему действию, а внешние
возмущения большой силы довольно редки. Полагают, что после наиболее
существенных столкновений Земли с астероидами, имевших место за последние
полмиллиарда лет, вымерло до 80% земных видов организмов (Rampino,
Huggerty, 1995). Несмотря на эти драматические изменения в биосфере,
после каждого из таких возмущений живое вещество восстанавливалось до
того уровня биологической продуктивности и сложности, который оно имело
до возмущения или даже превышало его (Rampino, Huggerty, 1995). Таким
образом, очевидно, что механизм направленной эволюции действовал и в
относительно спокойные геологические периоды, поэтому логично искать
данный механизм внутри самой биосферы, а не за ее пределами.
Такой поиск осложняется фактом случайной природы генетических
мутаций. Очевидно, что не все мутации могут приводить к изменению
биогеохимических циклов. Некоторые генетические изменения могут не иметь
эффекта или даже замедлить эти циклы, поэтому сами по себе генетические
мутации, вызванные внутренними или внешними факторами, не могут дать
объяснения постоянному движению биосферы в сторону увеличения
продуктивности и усложнения ее организации.
Возможный ответ на вопрос о причинах направленного развития
биосферы вопреки случайным мутациям организмов можно найти с помощью
концепции Вернадского о биогеохимической селекции организмов. По
Вернадскому, устойчивость развития биосферы поддерживается именно этим
биосферным механизмом, который ускоряет обмен массы и энергии между
биотой и окружающей средой. Не так важно, каким путем организмы доби-
301
лись интенсификации биогеохимических циклов. Например, генетические
мутации могут привести к таким изменениям в анатомии морской чайки, что
у нее разовьется способность нырять на большую глубину, приносить
больше пищи на берег и в результате позволит вырастить более здоровое
потомство. В то же время, другие птицы таких изменений могут не приобрести и,
как результат, проиграть в эволюционном соревновании.
Безусловно, естественный отбор, основанный на каком-либо критерии,
может работать, только если он обеспечивает организмы особым
преимуществом над другими видами, поэтому вначале необходимо убедиться в том,
что данный механизм действительно обеспечивает организмы каким-либо
эволюционным преимуществом. Только после этого мы сможем сказать,
что этот особый биогеохимический критерий селекции имеет какое-либо
значение для эволюции видов.
С нашей точки зрения второй биогеохимический принцип Вернадского
предполагает наличие, по крайней мере, двух эволюционных преимуществ:
1) ускорение биогеохимических циклов элементов уменьшает
зависимость организмов от внешних источников питательных веществ;
2) интенсификация биогеохимических циклов элементов обычно
приводит к накоплению доступных питательных веществ в благоприятных для
организмов соотношениях.
Используя терминологию Вернадского, можно сказать, что первое
преимущество происходит из того факта, что доставка питательных веществ от
косной материи к живому веществу обычно осуществляется через среду
биокосного вещества. Если контакт между организмом и косной материей
неизбежен (например, контакт между растительностью и продуктами
недавнего вулканического извержения), то за короткий период времени живое
вещество образует слой отходов, который со временем трансформируется в
почву, другое биокосное образование или пищу для других организмов.
Почва или другое бжжосное тело динамически разъединит живое вещество и
косную материю, что энергетически выгодно для организмов.
Действительно, органическое вещество почвы может разложиться до исходных
составляющих, включая элементы питания, с меньшими энергетическими
затратами, чем потребовало бы добывание этих питательных веществ через
процессы выветривания горных пород (Ross, 1987). Поэтому группы
организмов, способные ускорять разложение биокосного вещества, в меньшей
степени зависят от внешних источников питательных веществ. Так, в случае
снижения скорости выветривания горных пород из-за снижения содержания
двуокиси углерода в атмосфере или глобального похолодания, сообщества
организмов, способные ускорять круговорот питательных веществ, могут
стабилизировать свою продуктивность, а продуктивность сообществ, где
интенсификация биогенной миграции невозможна и напрямую зависит от
скорости выветривания горных пород, должна снизиться.
При неизменных условиях окружающей среды эволюция новых видов
организмов, способных ускорить циклы питательных веществ, приведет к
большему обособлению живого вещества от косной материи и, таким
образом, к увеличению их продуктивности и меньшей зависимости от
возможных изменений внешних условий.
Другим преимуществом эффективных циклов питательных веществ
является лучшее сохранение этих соединений в соотношениях, благопри-
302
ятных для живого вещества. Чем меньше интервал времени для
разложения органики, тем меньше шансы для диссипации веществ в окружающей
среде. Почвенные организмы не знают, конечно, что ускоренное
разложение органического вещества благотворно влияет на растения. Растения, в
свою очередь, просто осуществляют биогенную миграцию в
соотношениях, необходимых для следующего цикла метаболизма (Volk, 1998).
Биогенная миграция химических элементов идет быстрее в длинных детритовых
звеньях трофической сети, в которых организмы могут более эффективно
делиться между собой необходимыми им питательными веществами.
Циклы этих питательных веществ во всей системе ускоряются "по мере того
как развиваются новые формы жизни, которые заполняют экологические
ниши, имеющиеся в разновидностях детрита с различной степенью
деградации" (Volk, 1998, с. 187). Поэтому эволюция новых видов, которые могут
сосуществовать с остальной частью сообщества, должна быть связана с
интенсификацией биогеохимических циклов и увеличением разнообразия
трофических цепей.
Подводя итоги вышесказанному об этих двух типах эволюционного
преимущества, можно сделать вывод, что более быстрая биогенная миграция
элементов способствует организмам (а) уменьшить их чувствительность к
изменению внешних факторов и (б) приблизить химический состав
окружающей среды к составу самих организмов, делая, таким образом,
окружающую среду во многих случаях более "дружелюбной" по отношению к
большинству видов организмов. Из этого правила необходимо исключить
интоксикацию продуктами распада в замкнутых системах, где привнос нового
вещества ограничен, а потребности в элементах питания превосходят скорость
деградации токсикантов,
* * *
В конце XIX - начале XX века четыре русских ученых П.А. Кропоткин,
Р.В. Ризположенский, В.А. Вернадский и В.А. Костицин выдвинули
несколько взаимосвязанных концепций о характере и направленности
коэволюции организмов и окружающей среды.
П.А. Кропоткин считал, что взаимопомощь среди животных есть
фактор их эволюции, когда выживают те виды, которые владеют лучшими
социальными навыками. По Кропоткину, победа взаимопомощи- над враждой
направляет эволюцию в сторону энергетически эффективного состояния,
при котором организмы могут сосуществовать друг с другом,.избегая
конкуренции настолько, насколько это возможно.
Р.В. Ризположенский сделал попытку объяснить концепцию
Кропоткина о взаимопомощи участием организмов в совместном "приготовлении
пищи". Развитие этой концепции привело Ризположенского к теории
эволюции почвы, близкой гипотезе Геи. Однако по Ризположенскому, "почва"
вряд ли является сверхорганизмом, который может пожертвовать частью
себя для пользы оставшейся части.
В.И. Вернадский объединил концепции Кропоткина, Ризположенского и
других в единую теорию биогеохимических циклов и сформулировал
принцип естественного отбора организмов, способных ускорять биогенную
миграцию элементов. Биосфера Вернадского постоянно стремится достичь
максимального уровня продуктивности, однако эта эволюция ограничена био-
303
логическим фактором времени и рядом других физических и химических
факторов.
В.А. Костицин развил теорию Вернадского дальше, введя случайные
изменения в биосфере, возникающие из-за внутренней нестабильности
биогеохимических циклов, и продвижение против увеличения энтропии
системы за счет ее памяти, поддерживаемой аккумуляцией генетических мутаций
в "бактериальной плазме".
Комбинирование второго биогеохимического принципа Вернадского,
концепции Костицина о внутренней нестабильности биогеохимических
циклов и некоторых современных концепций о взаимосвязи стрессов в
окружающей среде и генетических мутаций приводит к формулировке механизма
биогеохимической селекции организмов, который можно представить
тремя основными элементами:
1. Внутренняя нестабильность биогеохимических циклов вызывает
стресс у организмов посредством постоянного изменения состава
атмосферы, гидросферы и верхней части литосферы почвы или посредством
связанных с этой нестабильностью изменений климата;
2. Биогеохимический и климатический стрессы вызывают генетические
мутации организмов. Некоторые генетические мутации могут ускорять
биогенную миграцию, другие не оказывают влияния вообще, или замедляют ее.
Однако виды организмов, способные ускорять биогенную миграцию,
обладают эволюционным преимуществом перед другими видами, поэтому
вероятность их выживания выше;
3. Внедрение видов, способных ускорить биогенную миграцию
элементов и увеличить продуктивность системы в целом, в детритовое звено
трофических цепей способствует проявлению взаимопомощи как фактора
выживания. Отсюда биосфера направленно эволюционирует в сторону
увеличения продуктивности, возрастания сложности и социабильности.
Согласно гипотезе JTeH направленность эволюционного процесса
проистекает из стремления самой биосферы^как единснго^ организма достичь
состояния гoмeoc?aзaГДaннoe^oбъжйeниe,, выходит за рамки собственно
науки и основывается на романтическом видении природы, отражающем
взгляд сверху с позиций сверхорганизма. В противоположность гипотезе
Геи принцип биогеохимической селекции организмов раскрывает механизм
зарождения и интеграции направленных эволюционных импульсов снизу
вверх: от локального масштаба, где происходит взаимодействие отдельного
организма с элементами окружающей среды, до масштаба экосистемы и
далее до уровня всей биосферы.
Естественное стремление биосферы эволюционировать в сторону
увеличения продуктивности, сложности и социабельности, можно
интерпретировать как стремление к созданию более благоприятных условий для всей
совокупности^?анизмбв' Таким образом, можно прийти к выводу, что
обсуждаемый принцип 'биогеохимической селекции близок к гипотезе
"сильной Геи". Вместе с тем сходство^то только внешнее, и мы не можем его
распространить на доказательную базу этих двух подходов. Механизм
биогеохимической селекции основан на проверяемых научных принципах, в то
время как гипотеза Геи остается только гипотезой, которую наследие русских
ученых как не опровергает, так и не подтверждает.
304
Литература
Вербицкий М.Я., Лапенис А.Г. Ледниковые периоды, углекислый газ и баланс
кальция в океане // Изв. АН СССР. Сер. географ. 1987. С. 16-24.
Кропоткин П. А. Современная наука и анархия. М.: Прогресс, 1990. 64 с.
Лапенис А.Г. Биодинамический механизм изменения концентрации углекислого
газа в атмосфере // Изв. АН СССР. Сер. геогр. 1989. № 6. С. 794-799
Ризположенский Р.В. Естественная история Казанской губернии. Почвы
Казанской губернии // Тр. Ассоц. естествоиспытателей при Казан, ун-те. 1892. Т. 24.
С. 6-24.
Ризположенский Р.В. Восток Европейской России. Казань: Казан, ун-т, 1897.
Сибирцев Н.М. Мой ответ Ризположенскому // Изб. тр. Сибирцева. М.: Сельхоз-
гиз, 1953. 203-207.
Ударцев СЕ. Кропоткин: Из истории политической и правовой мысли. М.:
Юрид. лит., 1989. 142 с.
Campbell J A., Livingstone D.N. Neo-Lamarckism and the development of geography in
the United States and Great Britain //Trans. Inst, of Brit. Geogr. 1983. Vol. 8. P. 267-294.
Ehrlich P.R., Raven P.H. Butterflies and plants: A study in coevolution // Evolution.
1965. Vol. 18. P. 586-608.
Huggett RJ. Ecosphere, biosphere, or Gai#? What to call the global ecosystem // Global
Ecol. and Biogeogr. 1999. N 1. P. 425-431.
Huxley Т.Н. The struggle for existence in human society. 1888. Cited at
http://alephO.clarku.edu/huxley/CE9/Str.html.
Kirchner J.W. The Gaia hypotheses: Are they testable? Are they useful? // Scientists on
Gaia / Ed. by S.H. Schneider and P.J. Boston. Cambridge (Mass.); L.: MIT press, 1991.
P. 38-46.
Kostitzin VA. Evolution of the atmsophere: Organic calculations, glacial periods
(1935) // The golden age of theoretical ecology, 1930-1940. N.Y.: Springer, 1978a.
p. 443-484.
Kostitzin VA. 1936. General differential equations for the problem of natural selection
(1936) // Ibid. 1978b. P. 424-429.
Kostitzin VA. Mathematical biology. Chap. 15. Evolution (1939) // Ibid. 1978c.
p. 414-438.
Kropotkin PA. Mutual aid: A factor of evolution (1902) / Ed. P. Avrich. N.Y.: N.Y.,
Univ. press, 1972.
Lovelock J.E. The ages of Gaia: A biography of our living Earth. N.T.: Norton, 1988.
Margulis L.f Sagan D. Microcosmos: Four billion years of microbial evolution. L.: Univ.
of Calif, press, 1997.
McMenamin MAS., McMenamin D.L.S. Hypersea: Life on land. N.Y.: Columbia Univ.
press, 1994.
NorgaardR. Sociosystem and ecosystem coevolution in the Amazon // J. Environ. Econ.
and Manag. 1981. Vol. 8. P. 238-254.
Norgaard R. Revolutionary development potential // Land Econ. 1984. Vol. 60.
P. 160-173.
Odum E.P. Ecology: A bridge between science and society; Sunderland: Sinauer,
1996.
Rampino M.R., Haggerty BM. Mass extinctions and periodicity // Science. 1995.
Vol. 269. P. 617-619.
Ross ShAM. Energetics of soil processes // Energetics of physical environment / Ed.
K.J. Gregory. Chichester; N.Y.: Wiley, 1987. P. 119-143.
Rutherford S., Lindquist S. Hsp90 as a capacitor for morphological evolution // Nature.
1998. Vol. 396. P. 336-342.
Vernadsky V.I. The biosphere (1926). Engl, transl. / Ed. M.A.S. McMenamin and
L. Margulis. N.Y.: Nevramont, 1998.
305
Vernadsky V.I. Izuchenie yavlenii zhizni i novaya physika = Study of phenomenon of life
and new physics (1931a) // Discoveries and destinies: Chronicle of Russian scientific thought
in persons, documents, illustrations. Moscow: Sovremennik, 1993. P. 355-393.
Vernadsky V.I. Vremya = The Time: Unfinished draft (1931b) // Ibid. 1993. P. 348-355.
Vernadsky V.I. Khimicheskoe stroenie biosphery Zemli i ее okruzheniya = Chemical
composition of Earth's biosphere and environment (1940) // Khimicheskoe stroenie
biosphery Zemli i ее okruzheniya. 2nd ed. Moscow: Nauka, 1987.
Volk T. Gaia's body: Towards a physiology of Earth. N.Y.: Springer, 1998.
Volterra V. The general equations of biological strife in the case of historical actions
(1938) // The golden age of theoretical ecology, 1930-1940. N.Y.: Springer, 1978.
P. 264-274.
Watson A J., Lovelock J.E. Biological homeostasis of the global environment: The
parable of Daisyworld // Tellus B. 1983. Vol. 35. P. 284-289.
Глава 12
МИГРАЦИОННАЯ СПОСОБНОСТЬ
ЭЛЕМЕНТОВ В БИОСФЕРЕ
И КОРРЕКЦИЯ ИХ БИОГЕОХИМИЧЕСКИХ
ЦИКЛОВ
12.1. О ПРЕДЕЛАХ УСТОЙЧИВОСТИ БИОСФЕРЫ
К ТЕХНОГЕННОМУ ЗАГРЯЗНЕНИЮ
Активная техногенная (промышленн«Г&) деятельность человека
позволяет заключить, что загрязненность биосферы некоторыми химическими
элементами, прежде всего тяжелыми металлами, еще долгое время будет либо
сохраняться, либо даже расти. Добываемые элементы неизбежно будут
перераспределяться и рассеиваться в биосфере. Человек может только
регулировать эти процессы. Прогнозы чаще всего строятся неутешительные,
они предвещают вымирание организмов и разрушение экосистем в
результате химического загрязнения биосферы. В этой связи большое значение
приобретает корректная оценка ответных реакций биосферы и ее
элементарных ячеек - экосистем и определение критических нагрузок.
Основываясь на глобальных биосферных функциях почвы,
способствующих обеспечению в конечном итоге жизни на Земле (Добровольский,
Никитин, 1990), для оценки состояния биосферы предложен подход,
базирующийся на величине отношения техногенного выброса металла к его
содержанию в гумусовой оболочке (Бондарев, 1976). Этот показатель позволяет
в первом приближении оценить логичный и вероятный конечный этап -
рассеяние добываемых металлов в биосфере.
А.А. Кист (1987), используя закон роста толерантности и концепцию
концентрационных интервалов, предпринял попытку оценить, насколько
загрязненная биосфера будет пригодна для жизни. В его модели было
использовано предположение, что увеличение содержания химических элементов
в гумусовой оболочке будет пропорционально их концентрации в организме
млекопитающих. Рассмотрены нормальный, патологический, парабиотиче-
ский и летальный уровни концентрационных интервалов (см. главу 6).
Выявлено, что при таком подходе кроме известных приоритетных
загрязнителей - мышьяка (As), свинца (РЬ), ртути (Hg) и сурьмы (Sb), к
токсичным уровням приближаются концентрации олова (Sn), цинка (Zn), никеля
(№), серебра (Ag), молибдена (Мо) и урана (U). В то же время даже при
локальном интенсивном загрязнении биосферы не достигаются уровни пато-
307
логических концентраций, а среднебиосферные уровни будут находиться в
пределах естественных вариаций или незначительно превысят их.
Предлагаемая модель позволяет нетрадиционно оценить
приоритетность неорганических загрязнителей и токсичность химических элементов с
учетом толерантности живого вещества к изменению концентраций
отдельных элементов и масштабов возможной загрязненности биосферы.
Какие причины столь неожиданного заключения:
- практически невозможно равномерное обогащение гумусового слоя
почв химическими элементами;
- химические элементы, поступающие в почву, частично будут
переходить в трудно доступные или недоступные для биоты формы соединений;
- существует довольно тесная положительная зависимость между
концентрацией химических элементов в почве и коэффициентом их
биологического поглощения;
- содержание многих элементов в растениях, особенно в аномальных
биогеохимических условиях, может варьировать в исключительно широких
пределах, что указывает на вероятность существования и развития растений
в условиях биосферы на уровне сравнительно жесткой модели. Для
большинства химических элементов отношения максимально обнаруженных
концентраций в растениях к их среднему содержанию превышают кратность
увеличения содержания элементов в загрязненном гумусовом слое;
элементы попадают в организм животных и человека не
непосредственно, и человеческий организм может оказаться защищенным
многочисленными гомеостатическими барьерами организмов, составляющих
питательные цепи;
в процессе загрязнения биосферы усилятся процессы привыкания:
известно, что эти процессы могут возникать в сравнительно короткое время -
продолжительности жизни одной генерации популяции (Ковальский, 1974);
с повышением концентрации элементов в продуктах питания должна
уменьшится степень их утилизации.
Перечисленные эффекты, по мнению А. А. Киста (1987) могут привести к
суммарному уменьшению кратности усвоения элементов организмом
животных и человека, по меньшей мере, в 5-10 раз, что не позволяет
прогнозировать химическое состояние биосферы, исключающее существование
человека как вида. Однако этот прогноз имеет определенные недостатки: 1) основан
на приближенных предпосылках; 2) отражает глобальный и
крупномасштабный региональный уровень, но не учитывает локальное загрязнение или
отравление отдельных организмов; 3) не учитывает в полной мере
канцерогенное, мутагенное, терратогенное и другие негативные воздействия химических
элементов, проявляющиеся в течение длительного времени.
12.2. О ПРИГОДНЫХ АНАЛИТИЧЕСКИХ ТЕХНОЛОГИЯХ
И ИНФОРМАТИВНОСТИ АНАЛИТИЧЕСКИХ РЕЗУЛЬТАТОВ
Повышенный интерес к тяжелым металлам в биосфере вызван как
осознанием их важной роли в биосферных процессах, так и появлением нового
поколения аналитических технологий. Качественные изменения
представлений о биологической роли этих элементов связаны с бурным развитием и
308
активным внедрением в экологию следующих методов химического
анализа: атомно-абсорбционной спектрометрии, атомно-эмиссионной
спектрометрии с индуктивно сопряженной плазмой, полярографии, нейтронно-ак-
тивационного анализа. Учитывая сложность химического анализа живых
организмов и биокосных природных тел, а также недостаточные
возможности перечисленных анализов для определения отдельных тяжелых
металлов, необходима верификация методов и корректность их использования.
Детальное изучение содержания тяжелых металлов с помощью ней-
тронно-активационного анализа в подзолистых почвах с различным
содержанием органического вещества позволило выявить возможности этого
анализа (Naeumann et al., 1993): а) наиболее пригоден нейтронно-активаци-
онный анализ для определения концентраций Sc, Cr, Mn, Fe, Co, Zn, Br, Sb,
Cs, Ва, лантаноидов, Hf, Th, U; б) удовлетворительные результаты были
получены при определении V, As, Se, Rb, Sr, I, Та, Au; в) для Zr, Mo, Ag, Hg
возможности нейтронно-активационного анализа ограничены; г) для Ti, Ni, Cd
результаты определений были неудовлетворительны.
Временные (возрастные, сезонные, месячные, суточные и более ко-
роткопериодические, а также апериодические) и пространственные (в
пределах почвенного горизонта, профиля в целом и биогеоценоза; одного
органа или ткани и в целом для организма) вариации являются одной из
причин противоречий многочисленных да^жых и затрудняют составление
сводок распространенности химических элементов в отдельных экосистемах и
биосфере в целом. Анализ публикаций, посвященных распространению
тяжелых металлов в наземных экосистемах, показывает, что довольно часто
нарушается принцип однотипности объектов исследования. Зачастую
сопоставляются экосистемы разных типов, сравниваются естественные
почвы и "почвоподобные" образования полностью разрушенных экосистемы
и т.д. Так, для характеристики химического состава маломощных почв
горных областей и выявления различий используются почвенные образцы,
отобранные во всех условий с глубины 0-30 см. В то же время известно,
что почвенный слой такой глубины охватывает, как правило, несколько
генетических горизонтов, имеющих принципиально различный генезис и
химический состав. Кроме того, с увеличением высоты над уровнем моря
представленность этих горизонтов в образце будет изменяться. И даже
самое блестящее аналитическое исполнение не позволит сделать
корректные заключения о концентрациях тяжелых металлов и тенденциях их
изменений с изменением экологических условий, поскольку сопоставляются
разнотипные объекты.
Для повышения информативности аналитических результатов
распространения рассеянных элементов в биосфере можно воспользоваться
следующими советами Киста (1987):
1. Получение добавочной информации о поведении элементов в
различных средах (компонентах экосистем) достигается сопоставлением
концентраций элементов - членов одной подгруппы периодической системы;
2. Для описания взаимосвязей между элементами более корректно
выявление парных корреляций, тогда как расчет уравнений регрессий и
коэффициентов множественной корреляции в силу многообразия и
разнонаправленное™ процессов, ответственных за формирование элементного состава
организмов и окружающей их среды не всегда приводит к однозначным вы-
309
водам. Для этого могут быть использованы феноменологические модели
распространенности химических элементов;
3. Аппарат многофакторного анализа, основанный на максимизации
описательных функций, в большей степени отвечает специфике
феноменологического подхода при оценке поведения химических элементов в
различных средах (компонентах экосистем);
4. Детализация информации при оценке поведения химических
элементов в различных средах (компонентах экосистем) возможна при выделении
различных форм существования элементов (с помощью различных
вытяжек, мембранной фильтрации, ультраэлектронной микроскопии и др.).
12.3. ФИТОИНДИКАЦИЯ ЗАГРЯЗНЕНИЯ БИОСФЕРЫ
Фитоиндикация элементов - это наблюдение за распространенностью
этих элементов в природной среде на основании данных, полученных при
помощи растительных организмов как живущих в данный момент, так и
живших ранее (Markert, 1993; Кабата-Пендиас, 2001). Содержание одного и
того же элемента в составе растений одновременно отражает и
физиологическую потребность в минеральном питании, и влияние окружающей среды
(почвы, атмосферы, природных вод и др.), поэтому в последние годы
растения активно используются для оценки химического загрязнения биосферы.
Чаще всего в качестве фитоиндикаторов используются лишайники и
мохообразные, а также грибы (для изучения легколетучих элементов: ртути,
селена, радионуклидов), органы и части деревьев (листья, хвоя, кора,
древесина), некоторые травянистые растения. Наилучшим фитоиндикатором
является чувствительное растение, способное аккумулировать поллютант, но
не гипераккумулятор. Полагают, что наиболее важная информация по фи-
тоиндикации может быть получена при помощи многофункционального
анализа, включающего помимо ассимилирующих органов и корней, также
почву.
Растение, приемлемое в качестве индикатора, должно иметь следующие
свойства (Кабата-Пендиас, Пендиас, 2001):
- подходящую скорость накопления элементов;
- токситолерантность к накапливаемому элементу;
- представленность в экосистеме;
- широкую географическую распространенность;
- легкость индентификации и сбора;
- отсутствие сезонных различий в доступности и применимости;
- наличие тесных связей между аккумуляцией и поступлением в
окружающую среду.
Изучение концентраций элементов в растениях позволяет: 1) оценить
современное состояние биосферы; 2) оценить толерантность растений к
изменению химического состава биосферы; 3) создать базы данных,
характеризующие современный этап формирования химического состава
растительности; 4) выявить аккумуляторные и индикаторные свойства
систематических групп и жизненных форм растений.
Концентрация элементов в составе тканей высших растений
обусловлена преимущественно эдафическими условиями произрастания и спецификой
310
видового состава, для лишайников и мохообразных она определяется
главным образом качеством (загрязненностью) воздуха (атмосферных
выпадений). Лишайники и мохообразные обладают уникальными
аккумуляторными функциями и индикаторными свойствами, захватывая и удерживая всей
поверхностью тела воздушные и водные мигранты. Они являются наиболее
чувствительными биоиндикаторами состояния окружающей среды
благодаря отсутствию кутикулы, неразвитости корневой системы.
Заключения и выводы о химическом загрязнении биосферы теми или
другими элементами строятся на предположении, что основным критерием
оценки "нормы" содержания этих элементов в составе живых организмов
является удовлетворительное функционирование (рост и развитие) и
адекватная реакция биоты на изменение состояния окружающей среды,
обеспеченное сбалансированностью концентраций.
Так, данные химического состава растений-биоиндикаторов (Кабата-
Пендиас, Пендиас, 1989; Markert, 1993, 1994; Markert, Zhang De Li, 1991; Zhang
et al., 1997) позволяют заключить, что распределение лантаноидов в
биосфере характеризуется следующими особенностями: а) элементы с четным
атомным номером содержатся в больших количествах, чем с нечетным; б)
концентрации этих элементов в растительных тканях обратно пропорциональны
атомному номеру; в) выявлены тесные взаимосвязи между содержанием
лантаноидов в материнских породах и концентрацией их в растениях.
Основываясь на представлении, что в условиях техногенеза все поллю-
танты поступают в наземные экосистемЫглавным образом из атмосферы
(результат промышленного воздушного загрязнения), Б. Маркерт (Markert,
1993, 1994; Markert, Zhang De Li, 1991) заключил, что в экосистемах
Западной Европы миграция этих элементов протекает более активно, чем в
Восточной Европе, и отражает более высокий уровень загрязнения.
В.Н. Второва и Б. Макерт (1995), сопоставляя химический состав одних
и тех же видов растений лесных экосистем разных частей Европы, приходят
к выводу, что его вариабельность связана не с биологическими
особенностями состава видов или физиологическими потребностями растений, а с
чувствительностью видов к состоянию окружающей среды. При этом высшие
растения проявили значительно меньшие индикаторные признаки и
свойства по сравнению с лишайниками и мохообразными.
Тяжелые металлы с наибольшей амплитудой колебаний концентраций в
составе органов растений принято считать наиболее чувствительными к
состоянию окружающей среды и рекомендовать их в качестве элементов,
пригодных для мониторинга, а соответствующие виды растений - как
биомониторы (Гудериан, 1979; Биоиндикация..., 1988; Markert, 1993, 1994; Второва,
Маркерт, 1995; и др.).
Ведущая роль биологического фактора в формировании химического
состава растений и разная чувствительность растительных организмов к
состоянию окружающей среды позволяют использовать содержание
химических элементов в составе одних видов в качестве пассивных биоиндикаторов
(преимущественно высшие растения), других видов - активных
(преимущественно мохообразные и лишайники) биоиндикаторов (Markert, 1993, 1994;
Markert, Zhang, 1991).
Анализ химического состава листьев широко распространенного в боре-
альных лесах кустарничка - брусники (Vaccinium vitis-idaea L.) в пределах
311
ареала на территории Европы позволил В.Н. Второвой и Б. Макерту (1995),
выявить следующие особенности: а) состав проявляет высокое сходство
концентраций элементов в различных частях ареала; б) концентрации Сг,
Mo, Pb, W, Fe, V, La, Sc, Sm характеризуются синхронными изменениями;
в) причины высоких концентраций Сг, Mo, Pb, W скорее всего обусловлены
спецификой местообитания, аккумуляция лантаноидов - исключительно
атмосферным поступлением.
В лесных экосистемах Севера зеленые мхи Pleurozium schreberi и
Hylocomium splendens являются доминирующими видами растительных
сообществ. В настоящее время зеленые мхи широко используются для
мониторинга атмосферных выпадений металлов, поскольку у них отсутствует
корневая система и их состояние зависит от выпадения питательных
элементов, главным образом из атмосферы, за исключением тех незначительных
количеств металлов, которые поступают из почвы при пылении не
покрытых растительностью территорий. Рухлинг и Тилер (Ruhling, Tyler, 1970)
изучали поглощение различных тяжелых металлов в Hylocomium splendens -
широко распространенном в Скандинавии лесном виде мохообразных. Они
установили, что на поверхности этих растений может происходить катион-
ный обмен: основные катионы, входящие в состав зеленых мхов, могут
обмениваться на катионы тяжелых металлов, т.е. мхи действуют подобно
искусственным ионообменникам. Эти авторы продемонстрировали
возможность использования зеленых мхов для картирования атмосферных
выпадений ряда металлов. Позднее данные методы нашли применение в
территориальных оценках состояния природной среды (Steinnes, 1977; Ruhling, 1994;
Kubin, 1990).
Распространение тяжелых металлов в биосфере может
осуществляться как в результате антропогенной деятельности (выбросы загрязняющих
веществ от металлургических комбинатов, трансграничные переносы и
др.), так и в результате природных биогеохимических циклов (морская
импульверизация, внутриэкосистемные циклы почва-растение и т.п.).
Исследование миграционных воздушных потоков 26 тяжелых металлов
(от локальных источников, трансграничные переносы и природные
циклы в наземных экосистемах) для территории Норвегии, с использованием
в качестве биомонитора зеленых мхов (Hylocomium splendens) позволили
Э. Стайннесу и др. (Steinnes et al., 1992) идентифицировать вклады от
неатмосферных источников: почвенная пыль после ветровалов древесных
растений и выщелачивание из высших растений. Эти материалы
послужили основой для объединения тяжелых металлов, концентрирующихся в
Hylocomium splendens, в соответствии с источником поступления в
экосистему из атмосферы (табл. 12.1).
В этой связи интересным является сопоставление химического состава
зеленых мхов, произрастающих в различных экологических условиях
(сосновые и еловые леса). Зеленые мхи из еловых лесов характеризуются не
только более высокими концентрациями основных элементов питания (Са,
Mg, К, Мп, Р), а также и рассеянных элементов - Ni и Си (Никонов и др.,
2001). Вероятно, это обусловлено более высокой емкостью биологического
круговорота в ельниках по сравнению с сосняками.
312
12.4. КОРРЕКЦИЯ ПРИРОДНЫХ
БИОГЕОХИМИЧЕСКИХ ЦИКЛОВ
В УСЛОВИЯХ ТЕХНОГЕНЕЗА
Техногенез обусловил качественное изменение роли химических
элементов, исходно содержащихся в биосфере в низких, следовых количествах
(прежде всего тяжелых металлов) и вызвал активизацию исследований их
поведения, переоценку роли в функционировании экосистем и протекании
биогеохимических циклов. В более широкой постановке данная проблема
может рассматриваться как разработка подходов к управлению биосферой,
т.е. создание такой биогеохимической обстановки, которая обеспечила бы
оптимальные условия для жизни. Этой цели может служить коррекция
природных биогеохимических циклов в условиях техногенеза.
Решение проблемы нуждается в методологическом и методическом
обосновании. Кратко рассмотрим некоторые разработки, посвященные
данной проблеме: 1) концепция рефугиума (Литовка, Федоров, 1998); 2)
подходы к коррекции планетарного биогеохимического круговорота (Воробьев,
1998; Пучков, Воробьев, 1999); 3) хеморемедиация (иммобилизация мигра-
ционно-активных соединений отходов горнопромышленного производства)
(Зосин и др., 1991; Приймак и др., 1998); 4) фиторемедиация (Banuelos, Ajwa,
1999; Prasad, Hagemeyer, 1999; Rrasad, 2001); 5) экоремедиация (оптимизация
питательного режима лесных экосистем в условиях воздушного
промышленного загрязнения) (Лукина, Никонов, 1996, 1998).
Концепция рефугиума. Для существующих в настоящее время
общественных форм производства характерно экологически нерентабельное
потребление и перераспределение материальных ресурсов, обусловливающее
прогрессирующее истощение природно-ресурсного потенциала и детерио-
рацию (ухудшение) природной среды. В рамках этих представлений
биосфера - неограниченный источник материальных ресурсов и
самоочищающаяся среда.
Основанием к подобному заключению является господствующая
парадигма антропоцентризма, одним из основополагающих принципов которой
является принцип запаздывающего отражения. Применительно к
биогеохимическим циклам этот принцип ориентирует на борьбу с последствиями
техногенных нарушений, а не на ликвидацию их причин. Так, очистные
сооружения ориентированы на самоочищающуюся способность природной
среды, но хорошо известно, что значительная часть загрязняющих веществ,
прежде всего ксенобиотики, не способны к растворению, разбавлению или
быстрому разложению.
В то же время, согласно гипотезе Геи и принципу биогеохимической
селекции организмов (см. главу 11) отдельные организмы и популяции не
только сами приспосабливаются к абиотической среде, но и своей
совместной деятельностью в экосистемах приспосабливают геохимическую
среду к своим биологическим потребностям. Таким образом, сообщества
организмов и их среда обитания развиваются как единое целое. Если
природопользование представить как форму экологически рациональной
эксплуатации ресурсов биосферы и увязать с перечисленными
представлениями, то принципиально возможно создание локальной среды обита-
313
ния организмов (рефугиума) со свойствами, не противоречащими
принципам самоорганизации биосферных ячеек - экосистем (Литовка, Федоров,
1998). Напомним, что в классической формулировке рефугиум -
сформированная естественным путем или искусственным образом среда, в
которой организмы выживают или переживают неблагоприятный для них
этап геологического периода.
Развитие человечества вплоть до настоящего времени характеризуется
как экстенсивный этап природопользования. Для него свойственно
единство и противоречие двух аспектов: 1) экологического аспекта
природопользования - пассивного осознания необходимого перехода на стадию
сбалансированных отношений в условиях внутреннего антагонизма природно-антро-
погенных систем; 2) экономического аспекта природопользования -
активное невосприятие необходимости перестройки экономики в соответствии с
природным базисом жизнеобеспеченности.
Концепция рефугиума способствует в рамках отдельных регионов
(геосистем) нахождению допустимых условий модифицируемости элементов
биосферы, включая биогеохимический круговорот, или обоснованию
приемов построения искусственных (синтезированных) сред, формы
самоорганизации в которых соответствовали бы способам сосуществования экосистем.
Подходы к коррекции планетарного биогеохимического круговорота.
Техногенез в рамках глобального биогеохимического круговорота
представляет собой экспоненциально возрастающий во времени поток качественно
новых соединений элементов, обусловленных деятельностью человека. Так,
несмотря на выраженные в последние годы тенденции к ограничению
негативного воздействия на биосферу (модернизация технологии, увеличение
степени очистки сбросов и выбросов и др.), кардинального улучшения
состояния природной среды не наблюдается. Это объясняется энтропийными
процессами рассеивания сконцентрированного человеком вещества в
биосфере.
Во второй половине XX века природные биогеохимические циклы
многих элементов по объему, скорости и интенсивности миграции стали
уступать техногенным. Только за счет сжигания угля в энергетических
установках в окружающую среду поступает ртути (Hg) в 8700, мышьяка (As) в 125,
урана (U) в 60, кадмия (Cd) в 40, бериллия (Be) и циркония (Zr) в 10, олова
(Sn) и ванадия (V) в 4 раза больше, чем вовлекается в природные
биогеохимические циклы.
Один из путей коррекции планетарных биогеохимических циклов -
упорядочить соотношение долей природных и техногенно-обусловленных
элементов. Основным направлением такой стратегии коррекции планетарного
биогеохимического круговорота (Воробьев, 1998; Пучков, Воробьев, 1999)
может быть количественный и качественный учет элементов, поступающих
в биогеохимический круговорот, и формирование оптимальных их
соотношений. Зная параметры природных биогеохимических циклов и
техногенных потоков различных элементов, можно прогнозировать количество и
формы вещества, необходимые для полного осуществления современного
биогеохимического круговорота. Другими словами, нужно устранить
дисбаланс элементов в планетарном биогеохимическом круговороте с учетом
ландшафтно-геохимических особенностей территории, обусловливающих
различную величину вовлекаемых элементов.
314
Подобный дифференцированный подход к геохимическому
ранжированию различных территорий в сочетании с параметрами биогеохимического
круговорота, формами вступающих в реакцию элементов и образующихся
соединений позволяет теоретически обосновать подходы к коррекции
современных биогеохимических циклов. При подобных расчетах
целесообразно разделить химические элементы на дефицитные и избыточные.
Дефицитными называются элементы, добавление подвижных форм
которых ускоряет биогеохимический круговорот и повышает его емкость (О,
N, Р, К, Са, Mg, J, Mo, Zn, Mn и др.). В большинстве случаев недостает
именно подвижных форм, в то время как общее (валовое) содержание элемента
может быть достаточно велико. Преодоление дефицитности возможно либо
добавлением извне недостающих элементов, либо повышением
подвижности инертной части.
Избыточными называются элементы, удаление которых из биосферы
ускоряет биогеохимический круговорот и повышает его емкость (CI, S, Na,
Си, Ni, Fe, F и др.).
В настоящее время при зарегулировании соьременного
биогеохимического круговорота можно ограничиться только коррекцией объемов
ведущих элементов атмосферы (прежде всего кислорода и углерода), которые
определяют поведение всех других элементов.
В природных биогеохимических циклах участвует в основном
атмосферный кислород. Его образование в свободном состоянии происходит,
главным образом, в результате фотосинтеза, а потребление - в процессах
дыхания, окисления и других химичео^х преобразованиях. Запасы свободного
кислорода Земли оцениваются в 1,18 • 1015 т. Время полного оборота
кислорода составляет около 2500 лет. В настоящее время свободный кислород
образуется со скоростью 1,55 • 109 т/год, а расходуется со скоростью
2,16 • 109 т/год. Таким образом, расход кислорода больше его поступления в
атмосферу от природных источников, и потому необходимо восполнять
исходное содержание этого элемента. Таким источником компенсации может
быть углекислый кальций (СаСОэ) осадочных пород, кислород которого
высвобождается в незначительных количествах в результате вулканической
деятельности.
Другим важным элементом является углерод. В биогеохимические
циклы ежегодно вовлекается 12% от 1,3 • 1012 т содержащегося в
атмосфере углекислого газа. Время оборота атмосферного углерода около 8 лет, и
потому биогеохимические циклы этого элемента более "чувствительны" к
внешним воздействиям. С середины XIX века поступление углерода в
атмосферу резко усилилось за счет сжигания ископаемого топлива,
поскольку в атмосфере остается более 50% промышленных выбросов.
Восстановление сбалансированного круговорота углерода также возможно
искусственным путем.
Важным регулирующим фактором глобального биогеохимического
круговорота является величина необходимой энергии. Солнечная радиация
и тепло земных недр индуцирует природные биогеохимические циклы
элементов. Имеющееся в настоящее время техногенное повышение
температуры атмосферы может послужить дополнительным источником энергии для
корректировки круговорота. Одновременно будет решена проблема
нивелирования техногенного теплового воздействия на биосферу.
315
Хеморемедиация (иммобилизация миграционно-активных соединений
отходов горнопромышленного производства). Значительное количество
газообразных, жидких и твердых отходов горнопромышленного производства
(выбросы, стоки и дезинтегрированные минеральные отходы) благодаря
активной миграционной способности активно включается в природные
биогеохимические циклы и вызывает региональные и глобальные нарушения
биосферы. Другим возможным путем коррекции биогеохимических циклов
различных элементов (включая тяжелые металлы) в этом случае является
резкое снижение подвижности этих соединений, перевод их в иммобильное
состояние, безопасное для живых организмов. Данный результат может
быть достигнут выполнением следующих процедур повышения
геохимической инертности отходов и придания им свойств локальных коренных
горных пород перед их размещением в природной среде (Зосин и др., 1991):
1) отвердевание, снижение растворимости и повышение сорбционной
активности поверхности твердых дезинтегрированных отходов; 2) конвертация
пылегазовых выбросов и сточных вод в твердотелые геохимически
инертные соединения; 3) использование в процессах кондиционирования отходов
технологии твердеющих минеральных дисперсий.
В основу концепции технологии твердеющих минеральных дисперсий
положен принцип термодинамического равновесия системы "отходы горно-
перерабатывающего производства ±£ иммобилизатор отходов ±£
вмещающая порода". Этот принцип направлен на придание размещаемым в
природной среде миграционнно-активным отходам состояния геохимической
инертности. Реализация этого принципа возможна благодаря:
- химической неустойчивости дисперсной фазы, представленной
природными минералами или продуктами техногенеза (алюмосиликатами,
силикатами, оксидами, гидроксидами);
- коагуляционно-конденсационному каркасу, образующемуся в процессе
твердения дисперсии и обеспечивающему прочность и геохимическую
инертность твердого тела;
- наличию многозарядных катионов с малыми ионными радиусами для
адсорбционного концентрирования анионов;
- наличию гидратной воды и/или анионов SiO^", PO4", SO*" для
адсорбционного концентрирования катионов;
- корректировке состава и свойств синтезируемого твердого тела
(введению поверхностно-активных веществ, перемешиванию и др.).
Возможность реализации этого подхода к коррекции биогеохимических
циклов показана на примере медно-никелевого и апатитонефелинового
производств (Зосин и др., 1991; Приймак и др., 1998). Технология твердеющих
минеральных дисперсий позволяет получать адсорбционно-активные
твердотелые соединения из отходов горно-перерабатывающего производства и
минерального сырья, "геохимически инертные" по отношению к природной
среде, в которой они размещаются.
Фиторемедиация. Какие виды загрязнителей и в каких объемах могут
быть устранены или нейтрализованы с помощью растений? Этот вопрос
имеет не только академическое значение, но также имеет отношение к
формированию основных принципов управления устойчивым развитием.
Фиторемедиация - использование растений для устранения или
уничтожения опасного загрязнения окружающей среды, прежде всего почвы и во-
316
ФИТОРЕМЕДИАЦИЯ ПОЧВ
Фитостабилизация
Фитоиммобилизация
Фитоэкстракция
Фитотранспирация
Фитодеградация
ТМ, М, Г, Р, О
ТМ,М,Р
тм,м,г,р,о
тм,м,г,о
о
Рис. 12.1. Поллютанты, подлежащие фиторемедиации (по: Prasad, 2001)
ТМ - тяжелые металлы, М - металлоиды, Г - галогениды, P - радионуклиды; О -
органические вещества
ды (Prasad, Hagemeyer, 1999; Prasad, 2001). Это понятие возникло как
жизнеспособная коммерческая технология для устранения воздействия
разнообразных загрязнителей в различных условиях природной среды. Так,
биоконцентрация тяжелых металлов^растениями - хорошо установленный
факт, и в настоящее время большое число высших растений может быть
использовано для различных методов снижения загрязнения тяжелыми
металлами.
Обязательные составные части фиторемедиации, используемые для
загрязненных почв, и поллютанты (загрязнители), подлежащие той или
другой разновидности этого приема, показаны на рис. 12.1. Список растений,
предложенный для фиторемедиации загрязненных почв, представлен в
таблице 12.2.
Различные методы снижения доступности рассеянных элементов,
концентрирующихся в почве, для растений основываются на сорбировании,
осаждении и связывании в почвенном поглощающем комплексе этих
элементов, разбавлении поступающих растворов и увеличении величины рН почвы
(снижении кислотности). Альтернативой этим методам может
рассматриваться использование устойчивых к рассеянным элементам видов растений,
способных к гипераккумуляции этих элементов в своих органах и тканях.
Этот метод предполагает успешное выращивание растений -
гипераккумуляторов тех или иных рассеянных элементов, способных поглощать те или
иные потенциальные поллютанты из почвы и закреплять их в своих
органах. Однако мало известно о механизмах гипераккумуляции специфических
рассеянных элементов различными видами растений.
Метод фиторемедиации изучали в течение восьми лет сотрудники
исследовательской лаборатории водного хозяйства, центральная Калифорния, на
почвах, перенасыщенных селеном (Banuelos, Ajwa, 1999). В этом регионе
317
растворение концентрирующих селен осаждений в связи со стратегией
размещения системы дренажных вод привело к высоким концентрациям этого
элемента в поверхностных водах и эффекту токсикоза водоплавающих
птиц, посещающих местный национальный парк. В ходе проведения
экспериментов была установлена способность различных видов растений к
аккумуляции селена на разных типах почв и при различных концентрациях рас-
сенных элементов и разной засоленности. Донные осадки, отобранные в Ке-
стерсонском Резервуаре, не только содержали высокие концентрации
селена (в пределах 40 мг/кг), но также высокие уровни других рассеянных
элементов. Исследования, проведенные лабораторией водного хозяйства,
показали, что Brassica narus и Festuca arundincae (высокая овсяница),
используемые для фиторемедиации бора и селена, аккумулируют различные уровни
рассеянных элементов, зависящих от вида растения. Поскольку
большинство растений одинаково активно поглощают селенаты и сульфаты ( SeO^" и
SC>4~), которые близки по химическим свойствам, Brassica narus наряду с
высокими концентрациями серы также аккумулирует высокие
концентрации селена. Другие виды растений (например, виды астрагала) способны
аккумулировать высокие концентрации селена (> 1000 мг/кг) в природных
условиях. Большая часть селена в природных растениях - аккумуляторах
этого элемента - находится в водорастворимых небелковых соединениях, тогда
как селен в растениях с низкими природными концентрациями находится в
форме протеин-связанного селенометионина.
В связи с аккумуляцией селена растениями была оценена их способность
эмитировать (испарять, выделять в процессе транспирации) селен, когда они
произрастают на богатых этим элементом почвах. Биологическое
эмитирование селена является очень заманчивым компонентом фиторемедиации,
потому что в результате этого процесса селен удаляется немедленно и с
минимальным уроном для природной среды. В этом случае селен
метилируется растениями или растительно-микробными ассоциациями с последующим
продуцированием летучих, относительно нетоксичных форм селена
(например, диметилселенида). Однако для того чтобы выявить, действительно ли
растения используют участие почвенной микробиоты для минерализации
комплексов нерастворимых соединений селена в растворимые формы,
перед тем как селен может быть адсорбирован или эмитирован, необходимы
дополнительные исследования.
Экоремедиация (оптимизация питательного режима лесных экосистем в
условиях воздушного промышленного загрязнения). Определение уровня
обеспеченности тех или иных организмов и сообществ элементами питания
нуждается в решении трех главных задач: 1) определении потребности
организмов и сообществ; 2) выявлении возможностей окружающей среды в
удовлетворении потребностей организмов и их сообществ; 3) оценке
способностей организмов и их сообществ использовать возможности окружающей
среды для удовлетворения своих потребностей. Для поддержания своего
существования живое должно вносить в среду своими действиями потребный
ему порядок, то есть проецировать в круговорот среды системные
особенности собственного обмена веществ (Туровский, Туровская, 1993). Способы
удовлетворения потребностей организмов и сообществ, входящих в состав
тех или иных биогеоценозов (экосистем) и биосферы в целом, в элементах
318
питания можно определить, используя понятие питательного режима
(Лукина, Никонов, 1998).
Под питательным режимом понимается сочетание возможностей
окружающей среды в удовлетворении потребностей организмов и их сообществ
в элементах питания и способности организмов и сообществ использовать
эти возможности, трансформируя среду обитания и тем самым создавая
условия жизни.
Таким образом, в формировании питательного режима участвуют
сообщества живых организмов и окружающая их среда - компоненты,
взаимосвязанные и взаимовлияющие друг на друга и необходимые для
поддержания жизни в той ее форме, которая существует на Земле, при ведущей роли
живого вещества.
Восстановительные сукцессии (противоположные деградационным) в
бореальных лесах в условиях постоянного воздушного промышленного
загрязнения и, как результат, стабилизация природных биогеохимических
циклов невозможны без участия человека. Размеры материальных и
энергетических субсидий должны определяться стадией деградационной
(техногенной) сукцессии.
На стадии дефолиирующих лесов основной задачей стабилизации
природных биогеохимических циклов является поддержание лесной
растительности, нарушенной воздушным промышленным загрязнением, в
стабильном состоянии. Питательный режим этих лесов существенно
изменяется, что является одной из наиболее важных причин их угнетения. Лесные
растения, произрастающие в дефолиирующих лесах, интенсивно
аккумулируют подвижные элементы (азот, фосфор, калий) и поллютанты (серу,
тяжелые металлы), тогда как интенсивность поглощения кальция, магния,
марганца и цинка снижается. Эти тенденции обусловлены изменением
условий питания лесных растении: 1) изменением состава атмосферных
выпадений как среды "на входе" в экосистему и как источника питания
растений; 2) снижением эффективности использования атмосферной
составляющей питательного режима во внутриэкосистемных циклах в результате
выпадения из сообществ лишайников и мохообразных, которые способны
концентрировать элементы питания из атмосферы и постепенно
передавать их растениям с корневой стратегией питания при разложении; 3)
интенсивным поступлением поллютантов, в том числе и кислотообразующих
веществ, из атмосферы; 4) увеличением кислотности почв и обеднением
органогенных горизонтов почв основными элементами питания и их
обогащение поллютантами; 5) выщелачиванием элементов питания из
растений кислыми осадками.
Эффективный способ оптимизации биогеохимических циклов
элементов в дефолиирующих хвойных лесах - внесение удобрений (мелиорантов),
содержащих недостающие элементы питания или способствующих
возрастанию их подвижности в почве. Внесение извести и плавленых магниевых
фосфатов, отличающихся пролонгированным действием, даже в
незначительных количествах оптимизирует нарушенные биогеохимические циклы
элементов, способствуя: а) снижению обменной и актуальной кислотности;
б) преодолению дисбаланса в поглощении элементов питания древесными
растениями: активному поглощению недостающих элементов питания
(кальций, магний, марганец, цинк) и снижению уровня аккумуляции азота,
319
калия и фосфора, концентрации которых в хвое деревьев, подвергающихся
воздушному загрязнению, обычно возрастают.
Наличие эдификатора - дерева - обусловливает пространственную
гетерогенность биогеохимических циклов в лесных экосистемах и парцеллярные
различия в их реакции на регулирование питательного режима. Возрастающие
потоки кислотообразующих веществ в условиях воздушного промышленного
загрязнения в подкроновые пространства и активное поглощение элементов
питания древесными растениями интесифицируют биогеохимические циклы,
обусловливая снижение их запасов в органогенных горизонтах почв этих
пространств по сравнению с межкроновыми. Это вызывает необходимость
внесения повышенных доз мелиорантов в подкроновые пространства.
Литература
Биоиндикация загрязнений наземных экосистем / Под ред. Р. Шуберта. М.: Мир,
1988. 350 с.
Бондарев ЛТ, Ландшафты, металлы, человек. М: Мысль, 1976. 71 с.
Воробьев А.Е. Корректирование планетарного биогеохимического
круговорота // Новое в экологии и безопасности жизнедеятельности: Докл. III Всерос. конф.
СПб., 1998. Т. 3. С. 71-78.
Bmopoea B.H., Маркет Б, Мультиэлементный анализ растений лесных
экосистем Восточной Европы // Изв. РАН. Сер. биол. 1995. № 4. С. 447-454.
Горшков ВТ. Экологическая устойчивость и локальная адаптация: допустимые
пределы антропогенного возмущения Л.: ЛИЯФ, 1991. 35 с.
Гудериан Р. Загрязнение воздушной среды. М.: Мир, 1979. 200 с.
Добровольский Г.В., Никитин Е.Д. Функции почв в биосфере и экосистемах.
М.: Наука, 1990. 258 с.
ЗосинАЛ., Приймак Т.Н., Кошкина Л.Б., Мартынова Т.Ф. Адсорбционно-ак-
тивные материалы для промышленной экологии. Апатиты: КНЦ РАН, 1991. 112 с.
Кабата-Пендиас А. Фитоиндикация как инструмент для изучения окружающей
среды // Сиб. экол. журн. 2001. № 2. С. 125-130.
Кабата-Пендиас А., Пендиас X. Микроэлементы в почвах и растениях. М.:
Мир, 1989. 439 с.
Кист А.А. Феноменология биогеохимии и бионеорганической химии. Ташкент:
Фан, 1987. 236 с.
Ковальский В.В. Геохимическая экология. М.: Наука, 1974. 299 с.
Литовка О.П., Федоров ММ. Парадигма рефугиума в формировании общей
теории природопользования // Новое в экологии и безопасности
жизнедеятельности: Докл. III Всерос. конф. СПб., 1998. Т. 2. С. 487-495.
Лукина U.В., Никонов В.В. Биогеохимические циклы в лесах Севера в
условиях аэротехногенного загрязнения: В 2 ч. Апатиты: КНЦ РАН, 1996. Ч. 1. 213 с; Ч. 2.
192 с.
Лукина Н.В.У Никонов В.В. Питательный режим лесов северной тайги:
природные и техногенные аспекты. Апатиты: КНЦ РАН, 1998. 316 с.
Маркет B.t Bmopoea B.H. Кадастры концентраций химических элементов
растений лесных экосистем Восточной Европы // Изв. РАН. Сер. биол. 1995. № 5.
С. 545-553.
Никонов В.В..Лукина Н.В., Смирнова Е.В., Исаева Л.Г. Влияние ели и сосны на
формирование первичной продуктивности нижними ярусами хвойных лесов
Кольского полуострова // Ботан. журн. 2002. Т. 87, № 8. С. 112-124.
Приймак Т.Н., Зосин А.И, Федоренко Ю.В. Экологические аспекты процессов
геохимической трансформации хвостов обогащения апатито-нефелиновых руд
Хибинского месторождения. Апатиты: КНЦ РАН, 1998. 51 с.
320
Пучков Л А., Воробьев А.Е. Роль горнопромышленного комплекса в эволюции
биосферы Земли // Зеленый мир. 1999. № 3. С 11-12.
Туровской М.В., Туровская СВ. Концепция В.И. Вернадского и перспективы
эволюционной теории // Вопр. философии* 1993. № 6. С. 88-104.
Banuelos G.S., Ajwa НА. Trace elements in soils and plants: An overview // J. Environ.
Sci. Health. A. 1999. Vol. 34, N 4. P. 951-974.
Kubin E. A survey of element concentrations in the epiphytic lichen Hypogymnia
physodes in Finland in 1985-86 // Acidification in Finland. В.: Springer, 1990. P. 421^*46.
Markert B. (ed.). Plants as biomonitors. Weinheim: VCH Pub!., 1993.640 p.
Markert B. (ed.). Environmental sampling for trace analysis. Weinheim: VCH publ,
1994.524 р.
Markert B.r Zhang De Li. Inorganic chemical investigations in the forest biosphere
reserve near Kalinin, USSR. II. The distribution of lanthamde elements in the vegetation
cover // Vegetatio. 1991. N 97. P. 57-62.
Naewnann R., Steinnes E., Guinn VJ\ Feasibility of instrumental neutron activation
analysis for trace element studies in natural soils // J. RadioanaL and NucL Cham. 1993.
Vol. 168, P. 61-68.
Prasad MJ4.V. Phytoremediatiom of metal polluted ecosystems: CofmnerdaKzationi in
the millennium // Актуальные вопросы экологической физиологии растений в XXI в.
Сыктывкар: Коми НЦ УрО РАН, 2001. С. 11-12.
Prasad MJV.K, Hagerneier J. (edX Heavy metal stress in plants. В.: Spriner, 1999.
401 p.
Ruhling A. (ed.). Atmospheric heavy metal deposition in Europe - estimatk»*s based on
moss analysis. Nord, 1994. 9, 38 p.
Ruhling A., Tyler G. Sorption and retention of heavy metals m tire woodlamd imoss
Hylocomium splendens // Qikos. 1970. VoL 21. P. 92-97.
Steinnes E. Atmospheric deposition of trace elements in Norway stofied by means of
moss analysis. Kjeller, 1977. 29 p. (Rep. Inst fear Atomeraergi; N KR-154).
Steinnes E.r Rambak J.P., Hannsen J.E. Large-scafe multi-etement survey of atmospheric
deposition using naturally growing moss as Ьмишмайог // Chemospftere. 1992.. Vol 35.
P. 735-752.
Zhang S., Shau X., Van X., Zhang #. The determioatioo of rare earth etemerrts in soils by
inductively coupled plasma mass spectrometry // Atom. Spectrosc. 1997. VoL 18>.
P. 140-144.
11. Рассеянные элементы
ПРИЛОЖЕНИЕ
Таблица 1.1. Площади и древесные запасы бореальных лесов мира
(по: Forest resources..., 2000)
Показатель
Размерность
Регион
РФ
Другие
страны
СНГ
Страны
Балтии
Северная
Европа
Канада
США
Всего
Площадь
лесов
106i
%
Древесные за- 109 м3
пасы
%
886,5
51,7
85,5
55,0
47,3
2,8
4,0
2,6
7,2
0,4
1,2
0,8
65,2
3,8
5,6
3,6
416,1 291,2
24.3
29,4
18,9
17,0
29,6
19,1
1713,5
100
155,3
100
Таблица 1.2. Характеристика подзон Евровейско-Уральской части бореальных лесов России
Показатель
Северная подзона
Средняя подзона
Южная подзона
Широта границы (в
направлении запад-восток)
северная
южная
Площадь земель
лесного фонда, млн га %
покрытых лесом
не покрытых лесом и
нелесных (вместе)
Лесистостьу %
Осадки, мм
за год
за период с t° >5 °С
Средняя t°C
годовая
января
июля
Период с t °C, число
дней
>0°С
>5°С
>10°С
Сумма ФАР (МДж) за
период
>0°С
>5°С
>10°С
68°-66° с.ш.
62°-64°с.ш.
53,58(39,1%)
21,25(52,2%)
71
665
365
-0,8
-14,6
14,6
175
129
78
1336
1073
706
62°-64°с.ш.
60° с.ш.
24,82(18,1%)
8,54(21,0%)
74
695
417
1,5
-12,6
16,5
197
152
105
1505
1271
941
60° с.ш.
56°-57° с.ш. (для лесной
зоны)
58,55(42,8%)
10,94(26,8%)
84
622
413
4,2
-10,8
19,2
224
181
139
1824
1611
1328
322
Таблица 1.2 (окончание)
Показатель
Северная подзона
Средняя подзона
Южная подзона
Вечная мерзлота
Господствующие типы
почв
Лесообразующие
породы
основные
сопутствующие
раннесукцессионные
пойменные
Органический углерод
на землях лесного фонда
по пулам, 106тС
<Womass ПОКРЫТЫХ
лесом земель
Сплошная вдоль
Полярного круга,
южнее - островная
Подзолы (разных
типов), глеевые,
торфянистые, торфяники
Ель, береза, сосна
Осина, ольха серая
Сосна, береза
Ивы, ольха
2162
Cphytomass безлесных
земель
Cphytomass общий
Csoil покрытых лесом
земель
С^п безлесных
земель
Садп общий
4otal
Плотность углерода в
пулах, т С • га"1
покрытые лесом
земли
Cphytomass
Csoil
4otal
не покрытые лесом и
нелесные земли
(вместе)
^-phytomass
^"soil
*-total
134
2296
7921
3966
11887
14183
40,4
147,8
188,2
6,3
186,7
193,0
На севере чаще
островами, почти
сплошная в приуральской
полосе
Подзолистые,
глеевые, торфянисто-
подзолистые
Ель, сосна
Лиственница, кедр,
пихта
Береза, осина
Ивы
1135
39
1174
2295
1322
3617
4791
45,7
92,5
138,2
4,6
154,8
159,4
Отсутствует
Дерново-подзолистые,
бурые, серые лесные
Ель, сосна, дуб,
лиственница
Кедр, береза, пихта,
липа, осина, ольха
(черная и серая)
Береза, осина, липа,
ольха серая
Ивы, тополь, вяз
3486
56
3542
6190
1509
7699
18 940
59,5
105,7
165,3
5,1
138,0
143,1
Примечание. Здесь и в табл. 1.3-1.5:1) информация о границах подзон, распространении
вечной мерзлоты, основных типах почв заимствована из работ: Предтундровые леса, 1987;
Лесопользование в Российской Федерации, 1996; Исаченко, Шляпников, 1989; 2) сведения о Cphytomass и
Csoil являются авторскими разработками (Уткин и др., 2001; Честных и др., 1999). Для болот оценка
CSOii только до глубины 1 м; 3) распределение площадей лесного фонда по категориям земель дано по
материалам ГУЛФ по состоянию на 01.01.93 г. (Лесной фонд России..., 1995); лесистость и
заболоченность - только для территории лесного фонда; 4) климатические параметры рассчитаны на
основе базы данных, характеризующей 2296 метеорологических станций (Зукерт, 2000).
И*
323
Таблица 13. Характеристика подзон Западно-Сибирского района бореальных лесов России
Показатель
Широта границы (в
направлении запад-восток)
северная
южная
Площадь земель
лесного фонда, млн га %
покрытых лесом
не покрытых лесом и
нежесных (вместе)
Лесистость, %
Осадки, мм
за год
за периоде
температурой >5°С
Средняя температура,
°С
годовая
января
июля
Период с t °С число дней
>0°С
>5*С
>10<С
Сумма ФАР (МДж) за
период
yQ°C
>5*С
>т*е
Вечная мерзлота
Годоодстауншянетяпы
почв
Лесообразующие
породы
Основные
Сопутствуюище
Раннесунцесснотше
Поименные
Органический углерод
на землях лесного фонда
по пулам, IG^tC
<^у1отшШМ1К|ШГГШС
лесом земель
С^у1отшйезлоош^
земель
^hytomass Общий
С^оп покрытых лесом
земель
Qou безлесных
земель
Qoil общий
Qotal
Северная подзона
66° сап.
62° ели.
17,04(21,6%)
16,07(27,5%)
52
556
307
-5,4
-234
153
146
из
72
1161
945
643
В северной части, на
юге - островами
Поверяностно-
глееиые, подзолы,
торфяпнетме
Ляствелница
сибирская, ель сибирская,
сосна
Кедр, береза
Береза
Ивы
571
104
675
3046
2940
JTroD
6661
Средняя подзона
62° ш.
59°c.iil
30^8(39,0%)
25,40(43,6%)
55
580
382
-2J0
-20,4
15,9
175
136
93
1446
1184
845
Отсутствует
Глеевые,
торфянистые,
торфяники, подзолы
Ель, кедр, пихта, сосна
Береза, осина
Береза, сосна
Ивы, тополь
1472
143
1615
4398
4994
9392
11007
Южная подзона
59° с.ш.
56° с.ш.
31,04(39,4%)
16,83(28,9%)
65
548
348
-03
-19,2
18,2
187
154
118
1537
1337
1077
Отсутствует
Дерново-лодэолистые,
глеевые, торфянистые,
серые лесные
Сосна, ель, кедр
Пихта, лиственница
сибирская
Береза, осина
Ивы, тополь
1618
83
1701
4811
3742
8553
10 254
324
Таблица 1.3 (окончание)
Показатель
Северная подзона
Средняя подзона
Южная подзона
Плотность углерода в
пулах, т С га"1
Покрытые лесом земли
(-phytomass
Qoil
Qotal
Не покрытые лесом и
нелесные земли (вместе)
*~phytomass
Qoil
ЧоЫ
33,5
178,7
212,2
6.5
183,0
189,5
48,0
143,4
191,4
5.6
196,6
202,3
52,1
155,0
207,1
4,9
206.4
211.3
Таблица 1.4. Характеристика подзон Восточно-Сибирского района бореальных лесов России
Показатель
Широта границы (в
направлении запад-восток)
северная
южная
Площадь земель
лесного фонда, млн га (%)
покрытых лесом
не покрытых лесом и
нелесных (вместе)
Лесистость, %
Заболоченность, %
Осадки, мм
за год
За период с
температурой >5 °С
Средняя температура,
°С
годовая
января
июля
Период с
температурами, число дней
>0°С
>5°С
>10°С
Сумма ФАР (МДж) за
период
>0°С
>5°С
>10°С
Вечная мерзлота
Господствующие типы
почв
Северная подзона
71°-72° с.ш.
58°-53° с.ш.
42,18 (19,4%)
46,09 (57,7%)
48
515
281
-8,0
-31,4
15.7
142
111
73
1129
925
640
Повсеместно
(сложная)
Подзолы, таежно-
глеевые, торфяно-
болотные
Средняя подзона
58°-53° с.ш.
58°-60° с.ш.
93,86(43,1%)
21,34(26,7%)
82
473
335
-3.3
-24,2
17,1
170
135
95
1440
1200
889
Подзолы,
подзолистые,
торфяно-подзолисто -
глеевые, торфяно-
болотные
Южная подзона
58°-60° с.ш.
50°-48° с.ш.
81,52(37,5%)
12.42(15,6%)
77
472
340
-3.3
-24,5
16,6
171
135
93
1422
1179
863
Островная
Дерново-подзолистые,
серые лесные, торфяно-
болотные, подбуры
таежные, дерново-
карбонатные
325
Таблица 1.4 (окончание)
Показатель
Лесообразующие
породы
Основные
Сопутствующие
Раннесукцессионные
Пойменные
Органический углерод
на землях лесного фонда
по пулам, 106 т С
^Лукичам ПОКРЫТЫХ
лесом земель
ЯрНуюшш» безлесных
земель
Qphyiomass Общий
Csoi] покрытых лесом
земель
Cioi] безлесных земель
C^oji общий
Qotal
Плотность углерода в
пулах, т С га"1
Покрытые лесом земли
Sphytonuss
Си
Qotal
Безлесные земли
Srtiytomass
Qotal
Северная подзона
Лиственница
(сибирская, Гмелина)
Ель, кедр, береза
Лиственница, береза
Ивы
1263
293
1556
8694
8528
17 222
18 778
29,9
206,1
236,0
6,4
185,0
191,4
Средняя подзона
Лиственница Гмелина,
сосна, ель
Кедр, пихта, береза
Лиственница, береза
Ивы, тополь
4201
109
4310
13 933
3556
17 489
21799
44,8
148,4
193,2
5,1
166,6
171,7
Южная подзона
Пихта, кедр, ель; в
Приангарье - сосна,
лиственница
Береза, осина
Осина, береза
Тополь, черемуха, ивы
5140
57
5197
12 580
2182
14 762
19 959
63,1
154,3
217,4
4,6
175,7
180,3
Таблица 1.5. Характеристика подзон Дальневосточного района бореальных лесов России
Показатель
Широта границы (в
направлении запад-восток)
северная
южная
Площадь земель
лесного фонда, млн.га (%)
покрытых лесом
не покрытых лесом и
нелесных (вместе)
Лесистость, %
Заболоченность, %
Осадки, мм
за год
За период с
температурой >5 °С
Средняя температура,
°С
годовая
января
июля
Северная подзона
104,43(38,2%)
168,96(75,2%)
38
400
216
-11,1
-35,6
13,8
Средняя подзона
132,70(48,5%)
47,75(21,2%)
74
525
355
-6,2
-31,5
16,6
Южная подзона
36,60(13,4%)
7,90(3,5%)
82
674
539
0,7
-23,7
18,9
326
Таблица 1.5 (окончание)
Показатель
Период с
температурами, число
дней
>0°С
>5°С
>10°С
Сумма ФАР (МДж) за
период
>0°С
>5°С
>10°С
Вечная мерзлота
Господствующие типы
почв
Лесообразующие
породы
Основные
Сопутствующие
Раннесукцессионные
Пойменные
Органический углерод
на землях лесного фонда
по пулам, 10бтС
Cphytomass ПОКРЫТЫХ
лесом земель
Cphytomass безлесных
земель
^hytomass <>бЩИЙ
Qoii покрытых лесом
земель
СдеН безлесных земель
Сил общий
Qotal
Плотность углерода в
пулах, т С га"1
Покрытые лесом земли
Ц)ЬуЮтавв
Qoil
4otal
Безлесные земли
ЦрЬуюта*»
Cgoil
Qotal
Северная подзона
135
104
62
1048
842
536
Сплошная
Подбуры таежные,
торфянисто-пере-
гнойно-глеевые, пере-
гнойно-карбонатные
Лиственница Гмелина
(на западе) и Каяндера
(на востоке), кедровый
стланик
Ель, береза
Лиственница
Ива, тополь
2563
819
3342
16 520
26 241
42761
46103
24,2
158,2
182,4
4,9
155,3
160,2
Средняя подзона
160
129
90
1259
1049
769
Дерново-таежные,
дерново-подзолистые,
палевые типичные
подбуры таежные
Лиственница (Гмелина
и Каяндера), береза
каменная, ель аянская
Сосна, кедр, пихта
сибирская
Лиственница, береза
Чозения, тополь, ивы
5476
257
5733
17 063
7764
24 827
30 560
41,3
128,6
169,9
5,4
162,6
168,0
Южная подзона
192
159
120
1480
1266
994
В северной полосе
островная, местами
сплошная
Бурые таежные,
дерново-подзолистые, тор-
фяно-болотные,
подзолы, торфянисто- и тор-
фяно-болотные
Ель аянская, пихты,
береза каменная, кедр
корейский (на юге)
Клены, липа, дуб
монгольский и др. (на юге)
Преимущественно
лиственные породы
Тополь, ольха
волосистая, ясень, ильм и др.
1865
43
1908
7084
1422
8506
18 920
51,0
193,6
244,6
5,4
179,9
185,3
327
Таблица 2.1. Концентрация рассеянных элементов
в ежегодном приросте растительности суши
Элемент
Средняя концентрация, мг/г
в золе
в сухой фитомассе
в живой фитомассе
Мп 4100,0 205,0 82,0
Zn 700,0 35,0 14,0
St 650,0 32,5 13,0
Ti 600,0 30,0 12,0
Си 160,0 8,0 3,2
Zr 150,0 7,5 3,0
Ni 40,0 2,0 0,8
Сг 35,0 1,8 0,7
V 30,0 1,5 0,6
Pb 25,0 1,25 0,5
Co 10,0 0,5 0,2
Sn 5,0 0,25 0,10
Ga 1,0 0,05 0,02
Таблица 2.2. Ежегодный захват тяжелых металлов растительностью континентов и
интенсивность биологического поглощения металлов на суше
Металл
Захват годовым приростом растительности
на всей площади суши
(за исключением
ледников и пустынь), тыс. т
на 1 км2, кг
Показатель
интенсивности захвата
Fe
Мп
Zn
Си
Ni
Сг
V
РЬ
Со
Cd
Hg
34 000(26 000)
41400(31050)
5160(3870)
1376(1032)
344 (258)
309 (232)
258 (193)
215(161)
86(64)
8,6 ((6,4)
2,06(1,54)
290(220)
345 (259)
43 (32)
11,5(8,6)
2,87 (2,0)
2,58(1,93)
2,15(1,61)
1,79(1,34)
0,72 (0,54)
0,072 (0,054)
0,017(0,013)
0,1
6,9
11,8
2,3
1,5
1,0
1,5
1,4
4,4
7,6
Таблица 2.3. Водная миграция масс нерастворимых форм тяжелых металлов
Металл
Суммарный годовой
массопоток металла,
1 • 106 т/год
Масса нерастворимых
форм в годовом массо-
потоке, 1 • 106 т/год
Доля нерастворимых
форм в суммарном
годовом массопотоке
металла, %
Fe
Мп
Zn
V
Сг
РЬ
Си
Ni
Са
Ga
Cd
75,6
20,9
6,68
3,53
2,50
2,87
1,83
1,70
0,350
0,344
0,022
75,4
20,5
5,86
3,48
2,46
2,83
1,52
1,38
0,340
0,340
0,013
99,7
98,1
87,7
98,6
98,4
98,6
83,1
81,2
97,1
98,8
59,1
328
Таблица 3.1. Вклад природной составляющей при атмосферном выпадении ТМ, %
Регион
лемент
РЬ
Cd
Zn
Си
Ni
Cr
Со
V
Фоновые районы
северовосточной Скандинавии
30-50
10-20
30-50
30-50
30-50
-
До 100
До 100
Южные районы
Финляндии]
я северо-запад
10
5
10
20-30
20-30
80
80
20-30
России
Страны Восточной и
Центральной Европы
1-2
1-2
5
10-15
10-15
—
-
-
Таблица 3.2. Глобальные выбросы ТМ из антропогенных источников, 1983 г.
Источник
Интенсивность выбросов, кг/год
РЬ
Cd
Hg
Сжигание органического топлива 2,7-18,4 0,2-1,1 0,7-3,5
Сжигание древесины 1,2-3,0 0,06-0,18 0,06-0,3
Металлургические процессы 31,1-83,8 2,7-8,2 0,05-0,2
Сжигание отходов 1,6-3,1 0,06-1,4 0,2-2,2
Транспорт 248,0
Другие виды производственной деятельности 4,0-19,6 0,08-0,8
Усредненное значение 332 7,6 3,6
Диапазон колебаний 289-376 3,1-12,0 0,9-6,2
Таблица 33. Концентрации ТМ в аэрозольном (A3) и парообразном состоянии вблизи
различных источников выбросов, нг/м3
Фракция
Cd
Со
As
Se
Сг
Zn
Производство тугоплавких материалов
Аэрозольная
Паровая
Доля A3, %
Аэрозольная
Паровая
Доля A3, %
Аэрозольная
Паровая
Доля A3, %
Аэрозольная
Паровая
Доля A3, %
Аэрозольная
Паровая
Доля A3, %
160
100
61,5
2300
1000
69,7
22440
1100
95,3
3120
110
96,9
176
100
63,8
3226 11
5 3
99,9 78,5
Производство цинка
16 15 037
0,8 190
95,0 99,8
Производство кадмия
100 320
1,5 200
98,5 34,1
Производство меди
54 650
26 80
67,5 89,0
Городской воздух
32 63
1,2 50
97,0 55,8
95
20
82,6
82
100
45,0
31
30
50,8
58
60
49,2
19
38
33,8
143
24
85,6
154
250
38,4
120
47
71,8
350
50
87,5
12
32,7
26,8
300
100
75,0
202 430
130
99,9
11 160
700
94,1
18 470
500
97,4
7150
50
99,3
329
Таблица 3.4. Относительное содержание ТМ в парообразном состоянии
в городской зоне и фоновом районе, %
Элемент
Район
РЬ
Cd
As
Ag
Сг
Ni
Mn
Бурцева, 1986
Городской
33
54
94
-
-
-
-
Фоновый
46
-
-
69
33
38
23
Миклишанский, Яковлев, 1980
Городской
36
44
_
_
—
-
Фоновый
_
_
_
20±
3±4
Ровинский, Петрухин, 1985
Городской
65
86±9
«.
_
_
-
Фоновый
58
.
_
75
_
-
Таблица 3.5. Диаметр аэрозолей, содержащих ТМ, в атмосфере различных районов,
мкм (Расупа, 1991)
Элемент
Промышленные выбросы
(медеплавильный завод)
РЬ
Cd
Си
Ре
Мл
Zn
Ni
0,7-1,9
0,7-5,3
4,4-9,0
9,0
4,2-5,0
0,8-6,6
9
Место отбора проб
Промышленные районы
0,3-1,0
0,9-3,2
0,5-5,8
1,2-9,5
0,8-4,2
0,5-1,7
1,0-9
Фоновые районы
0,25-0,9
0,3-0,7
0,4-0,9
0,7-4
0,8-4
0,4-0,8
0,6
Таблица 3.6. Плотности антропогенных аэрозольных частиц, г/см3
Источник выброса
Плотность
Пыль, образующаяся на металлургических предприятиях
Летучая зола, образующаяся при сжигании
углей
твердых бытовых отходов
2,7-3,1
1,9-2,9
2,6-3,8
Таблица 3.7. Соотношение растворенных и взвешенных форм ТМ в атмосферных
выпадениях, %
Районы исследования
Среднесуточные
выпадения пыли,
КГ/КМ2
Соотношение раствор/твердая взвесь
Сг
Zn
РЬ
Cd
Неурбанизированная территория
(50 км от источника выбросов)
Пригородная зона и окраины города
(10 км)
Завод цветных металлов
Крупная промышленная зона
(18) (10) (40) (25)
В скобках указан коэффициент концентрации химических элементов по отношению к
содержанию в фоновых условиях.
17
80
140
480
77
0)*
36
(0,5)
3,5
(100)
11
79
0)
17
(2,5)
13
(20)
9
82
0)
18
(6,0)
12
(160)
2
95
(1)
81
(2,2)
90
(22)
48
330
Таблица 3.8. Доля ТМ в растворимых формах в суммарных выпадениях и осадках, %
Район отбора проб
Антарктида
Южный берег Крыма
Усть-Вымь
Череповец
Усолье-Сибирское
Назаровская ГРЭС
Расстояние от
источника загрязнения, км
55-77
10-50
2-10
0-2
10-15
5-10
0-5
15-25
10-15
5-10
0-5
Вид
выпадений
Суммарные
выпадения
Осадки
it
Суммарные
выпадения
Тоже
м
Си
100
51
66
15
13
6,2
2,5
33
32
16
75
74
50
47
Ni
100
38
35
17
11
3,1
1.4
77
63
35
13
5,0
4,7
1.1
Pb
100
40
4,2
5,2
8,1
4,8
0,1
93
76
48
62
62
62
45
Таблица 3.9. Содержание ТМ в шихте свинцово-цинкового комбината
и образующейся при ее плавке пыли, %
Металл
Pb
Zn
Си
Cd
As
Шихта
Пыль
39,3 52,2
7,4 7,7
2,7 1,3
0,04 1,61
0,36 1,51
Таблица 3.10. Содержание свинца в различных фракциях золы углей
Размеры фракции, мкм
Содержание Pb, г/т
>40 90
30-40 300
20-30 430
15-20 520
Размеры фракции, мкм
Содержание Pb, т/т
10-15 430
5-10 820
<5 970
Таблица 3.11. Коэффициенты обогащения ТМ в летучей золе углей
(относительно содержания алюминия в земной коре)
Элемент
As
Se
Sb
Fe
Mn
V
Летучая зола
ПО
490
110
0,9
0,2
47
Субмикронная фракция
360
1900
150
0,7
0,3
92
Почва
4,1
71
-
1.1
1.0
27
331
Таблица 3.12. Основные соединения ТМ, эмиттирующие из антропогенных источников
Процесс
As
Cd
Pb
Hg
Сжигание угля
Сжигание мусора
Производство
цветных металлов
Производство чугуна
и стали
Химическая
промышленность
Автомобильные
выхлопы
As0, As203, As2S3, Cd°, CdO, CdS
As0, As203, Cd°, CdO, CdC12
As2Cl3,
As203 CdO, CdS
CdO
PbCl2,PbO,PbS,
Pb°
Pb°, PbO, РЬС1г
PbO, PbS04
РЮ
PbBrCl,
а-2РЬВгС1 •
NH4CI
75% Hg°
20% Hg+2
5% аэрозолей
20% Hg°
75% Hg+2
5% аэрозолей
90% Hg°
10% Hg+2
45% Hg°
45% Hg+2
10% аэрозолей
Таблица 3.13. Распределение мышьяка между различными химическими формами, %
Место отбора проб
Неорганический As
ММАК
ДМАК
ТМАК
о. Оаху
Токио
Fremante-Showa st.
Бермуды
Иокогама
96,1
89,1
95,8
92,0
98,8
-
2,2
-
1,5
0,2
1,3
2,6
4,2
2,3
0,1
2,6
6,1
-
4,2
0,9
Таблица 3.14. Относительный вклад разных форм Hg в выбросах
(Ryaboshapko et al., 1999), %
Источник
Форма существования Hg
Элементарная
Газообразная
окисленная
В виде частиц
Сжигание угля
Сжигание жидкого топлива
Производство цемента
цветных металлов
чугуна и стали
каустической соды
Захоронение отходов
Другое
42
2
11
6
5
14
1
19
66
3
4
2
2
И
5
7
68
3
6
3
2
0
8
10
Таблица 3.15. Скорости сухого осаждения ТМ, см/с
Элемент Среднее значение Интервал
Элемент Среднее значение
Интервал
As
Cd
Со
Сг
Си
Hg
0,19
0,56
1,20
1,25
0,81
0,48
0,18-0,19
0,04-2,2
1,0-1,4
1,0-1,5
0,08-1,6
0,31-0,64
Мп
Ni
Pb
Se
Zn
1,21
1,0
0,32
0,1
0,34
0,27-6,4
-
0,005-1,3
-
0,05-0,66
332
Таблица 3.16. Константы вымывания некоторых ТМ
Элемент
Константа вымывания
Элемент
Константа вымывания
РЬ
Cd
Мп
140
400
1500
Си
Са
1200
1800
Таблица 3.17. Скорости сухого и мокрого осаждения ТМ (мм/с), а также их соотношение,
в крупном промышленном центре Англии
Элемент
As
Cd
Cr
Со
Си
РЬ
Мп
Ni
Se
V
Zn
Скорость
дения,
Ул
сухого осаж-
1,9
-
15
14
14
4,6
4,3
10
1,0
4,6
2,0
Скорость
дения,
К
мокрого осаж-
1,3
4,3
4,8
5,7
19
2,9
3,6
10
1,2
5,3
4,6
VJV»
1,5
-
3,1
2,5
0,73
1,6
1,2
1,0
0,86
0,86
0,44
Таблица 3.18. Выпадение цинка и кадмия с атмосферными осадками
в фоновых и техногенных районах, мг/м2 в год
Район
Жидкие осадки
Zn
Cd
Пыль, г/м2
в месяц
Твердые осадки
Zn
Cd
Фоновый
Угледобывающий
Черная металлургия
ТЭЦ
Машиностроительная
промышленность
Примечание. Минимальнее значения приведены для периферийных участков в районе
антропогенного воздействия в 6-10 км от источника выбросов, максимальные - вблизи источника.
42
(30-50)
20-110
39-230
33-150
34-240
0,2
(0,1-0,3)
0,14-0,5
0,36-1,1
0,22-0,66
0,24-0,77
0,5-0,7
1,5-10
1,5-15
1-20
1,5-10
5,7
(3,5-9,1)
14,7-158,4
18,7-448,2
4,5-399,2
17,6-236,4
0,002
0,0001-0,0005
0,03-0,087
0,006-0,25
0,003-0,36
0,005-0,174
Таблица 3.19. Атмосферный поток ТМ вблизи металлургических производств, мг • м-2 • год"1
Источник, регион
Атмосферный поток
Медно-никелевое производство (Кольский полуостров)
Расстояние от источника, км 5 10 25
Ni 845 506 66,3
Си 494 198 49,4
Со 53,8 16,5 4,47
Переработка свинцового концентрата (Дальний Восток)
Расстояние от источника, км 0,5 1,5 8
РЬ 1353 220 85
Zn 220 63,4 14,1
Cd 8,5 1,66 0,23
50
4,7
3,3
0,19
333
ft
В
2
с*>
§
S
£
Я
2
>
в
;
1 с
l
с
с
5
о. о
и
0,0
UU
о
и
а, о
о
0,0
«- о 1
и
8
с
L>
с
5.
0
*
ч
VO NcOOh «О
»-* Г» СО ГЯ 00 ^ Г-
STf ON "«fr 00 V0
о о о о о о о
<ч ~* «п ~ ~ t^ *-«
о* о <э<э<э~ о"
»-* ~ 00 СЧ »-• Г-»
<Ч ^-ЮСП^н ,-.
о
о
о
«о лют <s
со qqo о
о о о о о
со **1 «Я
= S $£3S 3
о* о оооо о
I
Is
я I
2
е
U
с*
ГО
£
Я
z
Ifi
■
;
t
(
*
*
8"
^
*
и
^
*
if-
в-
=г
5
*
J
г
<
D
СО \л СО *-ш VD
\© w — w Г^ w —
- °°- S Й 8 S 8
о О о S о В о
■&
о
£
8.
Б
К
Я*
=• &•
.— СО ^ ON
Я <^ ч-ч ^ #^ч *"" —
СЧ ч^ UO s—' СО >-• «—•
£ m £j со р; Tt £$
_ 05 «ПО
«-■ s^ 00 s«/ UO n—' »—»
8$ -8 s. 8 ч
S n 5 о S о
s
CO w У0 w ~
g м g й g i
о Зов о Jf
к «
к о
!*
Ж ed
§1
е* со
8.S
о
•в-
2 S 2
3 s ^
§ ^x
о ^ м
s vo
u о
334
Таблица 3.22. Относительные вклады промышленных регионоввантропогенное
загрязнение атмосферы Российской Арктики ТМ (в %)
ТМ
Пункт
наблюдения
Источник
Суммарный вклад
Максимальный
вклад
Источник
максимального вклада
As
Ni
Sb
Pb
V
Zn
Cd
Cd
Mn,Cr
Земля Франца
Иосифа
Северная Земля
Земля Франца
Иосифа
Северная Земля
Земля Франца
Иосифа
Северная Земля
Земля Франца
Иосифа
Северная Земля
Земля Франца
Иосифа
Северная Земля
Земля Франца
Иосифа
Северная Земля
Земля Франца
Иосифа
Северная Земля
Земля Франца;
Иосифа
Северная Земля
Сев. Европа, Кольский
п-ов, Норильск
Тоже
»
»
»
»
Сев. Европа, Зап.
Европа, Кольский п-ов
Сев. Европа, Урал,
Норильск
Сев. Европа, Зап.
Европа, Урал
Сев. Европа, Урал,
Норильск
Сев. Европа, Кузбасс
Тоже
»,
»
Сев, Европа, Зап.
Европа, Кольский п-ов
Сев Европа, Вост.
Европа, Урал
72
67
80
80
62
59
63
54
67
61
64
64
68
60
61
50
29
42
37
51
33
35
41
26
44
30
44
37
37
27
36
24
Кольский п-ов
Норильск
Кольский п-ов
Норильск
Кольский п-ов
Норильск
Северная Европа
»
»
»
»
Кузбасс
Северная Европа
Кузбасс
Северная Европа
Кузбасс
335
Таблица 3.23. Количество ТМ, осаждающихся из атмосферы в Северное и Балтийское моря,
т/год (данные за 1985 г.)
Регион
As
Cd
Zn
Pb
Северное море
Балтийское море
61
98
14
18
920
650
2400
1400
Hg
10
12
Таблица 3.24. Таксационная характеристика древостоев
Тип состояния
Возраст,
лет
Фон
Дефолиирую-
Редколесье
Фон
Дефолиирую-
щий
Редколесье
Состав
Число стволов,
шт./га
сухие
Средний
диаметр,
см
Средняя
высота, м
Ельники кустарничково-зеленомошные
>160 8Е2Б 1293 73 13,7
>160 9Е1Б 480 200 19,1
>160 5Е5Б 150 590 10,2
Сосняки кустарничково-лишайниковые
>140 ЮС 1184 42 15,6
60-80 ЮС 5233 100 4,9
60-80 ЮС
3750
1275
4,8
8,1
11J
6,2
11,7
4,7
4,4
' Отношение массы текущего года к общей массе хвои (Лукина, Никонов, 1996).
Коэффициент
дефолиации*
0,1-0,2
0,2-0,3
0,3-0,45
0,2-0,25
0,25-0,45
0,35-0,60
336
и
§
о
со
<ч о ~ — «- о
5.
. . , .СО СО Tt
СО ON Г- <N CO CN
8 О
СО* ~-*
1,39
0,99
со
со
1,69
1.14
~
1,37
5.
1,06
1.21
-
1,22
1,52
«о
1,22
1,32
3
Я Я
о о
§1
о" о
8.8.
О О
?? 8
2 2
Я Я.
о о
СО О
2 3
о" о*
О 00
В. 5
ON CN
SCO
О
о" <э
.. см
Я Я
о о
Я Я
о о
00 ON
В 3
о о
Г» ON
о* о*
О «П
CN ON
я 8
о о
«о о
3 о
о" о
8.8.
о о
8 8
о" о*
8
О О О О
S.S.
о о
II
3 3
о* о
§1
о о
V© 00
я я
о о
о о
о" о"
2
00
о о
о о
tS 5»
Tf СО
о* о"
^ t^ 00 ^
~ ©* сГ о"
ON
00
о
,_ч
«о
о
00
<<t
о
тГ
CN
О
О
о" о"
X ч
я
е.*
о о
о о о о о о
«П Tf 00 00 VO ON
о" о* о" о" о" о*
In со
о* о*
о о
со со
о о
0,019
0,014
0,29
0,31
$ $
0,018
0,020
0,28
0,29
£8
*ч *- ^ СО
CN ~
Я Я
о о
3S.
о о
X
s.s.
о о
Я Я.
ON Г*
Я Я
о о
1Л «-> °°
я я vA
О О CN
СО
~ ~ ё
II
о
«
II
I
со
337
со
о
2
<*
кл
242 134
339 298
501 270
320 390
CM ~
^ ON
Ч* СО
wo г-
см г-
г-* wo
я
NO VO ЧО Tf VO VO
со on со см оо г*^
CM CM СМ СО W0 СМ
^ SO 00 VO Tt Tf
о
I
VO CO ON Tf CO ^t
WO CO CO CO t-^ 00
»- wo см со со со
1-й ^ WO CO WO Г-
— VO C\ 00 VO --
^ CO CM CO Tf Tf
Ov Tt О ~ vo ~
•^■oo — wo со см
^ со со со ю m
CN CO CN CN CM CO
CO
О CM
_
—« vo
r- vo
CM »-
4
о -
CO CM
vo oo
3 3 о см см ПЧ vo on
OO 00 *-« rfcM О О CN CM — —
^ Г- VO W0
— CO Г- CO CN —
CN WO CO WO WO 00
»- ~ CM 1— — СЛ
4> CN WO ^00 VOW0 "2 CN CO Tf Tf VO VO
о
On (J
t> ^ JQ О J^^^Tt-vocMQevOO
^f»-i VO i—i CT\ i—i ^ ON VO ON 00 ON
wo со vqo cmwo vftOCM^cMoo
TfCM CMCO Tfrf ^t^TfCMQOO
«-•CM —^ i-< CM i—i «^^_H_*.fN»-'
- SJ IS ? Sf4 on, wo — o> 1- on
"^ WO 0© CO ^ CM CO WO 4fr *— CO. П
8$ S8 8 S
CM 00 Г-»
00 VO Tf W0 «ПО
00 *-* С** ***" i-H 1-й
WO *— Tf Tt ON
CNTt VO VO VO VO « ^ ^ Ш 00 VO
1
s
§
•e-
Pi
в
к
§
•e-
338
о
z
о
4
3
4
SS
в
>s
e
з
I
e
в
i
I
2
м
ее
i
I
В
В
О
Я"
в
ч
я
ее
Z
ад
4,21
2,13
23,90
0,71
0,12
0,08
0,08
0,69
0,19
ые леса
0,54
и
о
«о
3,27
6,80
0,61
0,68
2,09
0,07
о
о
0,00
0,01
0,01
0,04
0,02
0,80
0,31
0,42
~ -о
4,81
23,8
0,17
3,99
Фон
9
о
г-
<м
0,01
5,10
Os OS
— о
Г- 00
Г- SO
о" о"
42,95
7,80
0,40
0,05
СМ 00
Г- —
о" о*
о о
0,10
0,03
*-н СП
•л я.
о о
00 Г*
о о
5? =
о" о
VO СП
rj- Os
сп ю
°\ Ч
СП О"
VO *П
so"4 о*
г- г*-
VO <N
г- см
•"г Ч
СП —
0,41
0,10
— о
СП ^f
Дефолииру-
ющий
6,11
1,68
СМ Г-
Я ^
~ о
28,98
14,53
0,06
0,08
СП «-«
СП SO
см" о"
^ so
Г» «О
«-" ©
•^ «о
-. я.
о о
0,09
0,03
0,35
0,09
0,29
0,11
2,41
1,64
8 g
см" о"
И*1
89*1
о" о"
ч °°*
сп ~
5 ч
»П СП
<м ~
О О
СП Г»
Г-; Os
сп сп
Редколесье
Сосновые леса
0,90
0,36
2,68
0,06
0,33
0,49
11*1
0,03
0,007
0,003
0,004
0,024
0,003
0,025
0,049
0,005
0,04
0,08
1,50
0,41
1,07
0,14
0,52
н.о.
0,022
4,97
Фон
0,03
0,04
0,84
0,14
0,17
€0*0
0,11
н.о.
0,004
5,59
OS 00
—< СП
0,50
0,76
сп «о
сп «о
u-Г см"
0,04
0,02
0,074
0,010
0,050
0,006
0,025
0,021
0,042
0,012
0,06
0,03
0,10
0,03
00 Tf
Г^ Os
—" о
Os «-*
VO СП
о" о"
Os СП
00 СМ
-©" о
*2
о о
2 3
см" о"
о о
X* X*
00 ЧЧ
gs
о о
4,12
4,49
Дефолииру-
ющий
00 OS
SO so
CN О"
1,00
0,82
11,18
6,25
0,06
0,03
0,509
0,203
0,376
0,145
0,035
0,024
0,047
0,013
0,13
0,08
0,13
0,08
2,09
0,73
1,00
0,37
00 Г-
г- см
о" о"
0,38
0,16
оо сп
—* о"
о о
X* X
0,138
0,079
4,00
4,16
Редколесье
339
t
i
Я
Ш
i
I
!
f
£
О
3
£
2
*
VO CO «—i 00 (S О
CN «О 00 rf (S fl
« О 00 О £ CO
8 £ 2 £ 8 2
on cn о oN F^ vo
<s m vo *-< lo со
N 00 CN On
CO О О 0\ «Q
CO CN CM On t О
On Tf CO
VO 00 Г» 00 00 VO
*■* r« cn со r- «n
VO CN — VO CN —
ON
00
«o
о
00
CO
VO
о
r^
CO
s
«Л
CN
i
CN
8
CO
§
2;
cn
00
-
о
00
CN
«O
CO
«n
CN
5t
00
Ю
VO
~ ~ vo ^ со -*
О ^t CN CO
~ CO »- 00 CN 1-"
vo ~* oo
00 CO Г* 00 — 00
~- i-H — CN On CO
VO VO VO «O On VO
леса
Еловые
a
00
VO
О
CO
VO
8
^
О
«О
§
cn
00
r-
a
s
я
VO
о
«о
«о
00
00
CN
со
CO
CN
СО
*-*
s
00
CN
00
ч*
о
^г
Я
00
CN
О
5
00
4t
CN
леса
Сосновые
OS
00
345
5
00
о
о
CN
Ю
СО
ТГ
Я
R
■*
2
00
00
со
CN
00
Г*
CN О
СО CN
CN Q
СО CN
О СО
CN 00
Ю ~*
On
rt СО
CN ON
00 1-" On ~ CO CN
"«я c^ oo Si 22
~ CN CS VO »-н ~
^ CO ^-00 On 00
CN "^ CN «O — VO
CN *- CO «П ©
CO 00 — CO On "^
О
U
в
8 S S8 S $
•n о о о
On С- On «O VO «—'
CN VO ^ Tt со ^
-ч CN WO — CO »—
S3 33 3 3
s
£
I
I
til
&
я
x
о
■в»
Й & &
340
Таблица 4.1. Ряды относительной устойчивости породообразующих минералов
(Войткевич и др., 1990)
Устойчивость
Породообразующие минералы
Акцессорные минералы
Весьма
неустойчивые
Неустойчивые
Устойчивые
Весьма устойчивые
Основные плагиоклазы, биотит, гипс,
ангидрит, сидерит, галит, сильвин
Средние плагиоклазы, пироксены,
амфиболы, кальцит, доломит
Мусковит, ортоклаз, микроклин,
кислые плагиоклазы
Кварц, лимонит, глинистые минералы
Марказит, пирит, пирротин, оливин,
фельшпатоиды, сульфаты
Апатит, барит, гематит, андалузит,
ставролит, силлиманит, дистен
Монацит, эпидот, титанит, флюорит,
магнетит
Циркон, турмалин, рутил, топаз,
шпинель, анатаз
Таблица 4.2. Распределение микроэлементов по способности высвобождаться
при выветривании изверженных пород (Mitchel, 1955)
Минерал
Порядок высвобождения микроэлементов
Оливин
Роговые обманки
Авгит
Биотит
Апатит
Анортит, андезит
Олигоклаз, альбит
Гранат
Ортоклаз
Мусковит
Титанит
Ильменит
Магнетит
Турмалин
Циркон
Ni, Co, Mn, Li, Zn, Cu, Mo
Ni, Co, Mn, Li, Sc, V, Zn, Си, Ga
Ni, Co, Mn, Li, Sc, V, Zn, Pb, Си, Ga
B, Pb, Ba, Ni, Co, Sc, Li, Mn, V, Zn, Си, Ga
Редкоземельные элементы, Rb, Cr
Sc, Си, Ga, Mn
Cu,Ga
Mn, Cr, Ga
Pb, Ba, Sr, Ga, Си
F,Pb,Ba,Sr,Ga,V
Редкоземельные элементы, V, Sr
Co, Ni, Cr, V
Zn,Co,Ni,Cr,V
Li,F,Ga,B
Hf
Таблица 4.3. Значения емкости катионного обмена различных компонентов почв
Компонент почвы
Емкость катионного обмена, мг/100 г Литературный источник
Монтмориллонит
Вермикулит
Каолинит
Хлорит
Мусковит
Иллит
Галлуазит
Аллофаны
Цеолиты природные
Смектиты
Гидроксиды Fe и А1 (рН 8)
Коагели (mSi02 • nR203)
Гуминовые кислоты
Фульвокислоты
Гумус в целом
80-150
100-150
3-15
10-40
10-50
10-40
5-50
50-100
100-300
55-120
0,5-1,0
16-95
500-900
до 700
41-300
Гримм, 1959
Орлов, 1985
Soil Chemistry, 1976
Маттсон, 1934
Александрова, 1934
Орлов, 1985
341
Таблица 4.4. Состав пыли предприятия по производству свинца и цинка
(по данным Первуниной и Малахова, 1989)
Соединения
Свинец
Цинк
Кадмий
Общее количество, мг/г 510 120 18,8
Растворимые в воде, % - 5 43
Оксиды, % 85 76 53
Сульфиды, % 12 17 4
Нерастворимый осадок 3 2-
Таблица 4.5. Содержание различных форм цинка и кадмия в почвах загрязненных
выбросами свинцового завода (по: Химия..., 1985)
Почва
Формы металлов, % от общего содержания
обменная
связанная с
органическим
веществом
связанная с
оксидами
железа
остаточная
Водорастворимая, мкг/мл
Цинк
Чернозем 15,6 19,4 50,0 15,0 0,29
Чернозем (пыль) 17,2 19,8 52,1 10,9 0,33
Дерново-подзолистая 21,6 31,7 41,2 5,5 2,70
(пыль)
Кадмий
Чернозем 76,2 9,5 16,2 -1,9 0,002
Чернозем (пыль) 56,1 4,7 24,7 3,6 0,090
Дерново-подзолистая 83,7 2,8 15,3 -1,9 0,070
(пыль)
Таблица 4.6. Концентрации и диапазон колебаний рассеянных элементов в подзолах
Кольского полуострова (региональный фон), мг/кг
Элемент
группа
FH
Е
Горизонт
В
С
11,4(9,0-13,8)*
10,2(4,3-16,0)**
0,32(0,28-0,37)
0,32(0,19-0,46)
77 (70-83)
105(80-130)
111(88-134)
134(88-180)
1,3(1,1-1,6)
1,6(0,5-2,4)
2,0(1,6-2,3)
2,5(1,7-3,3)
7,0(3,4-10,5)
5,7 (4,7-6,6)
45 (39-51)
41
0,45 (0,41-0,50)
0,76 (0,72-0,80)
203 (182-224)
310
323 (254-392)
415(410-420)
3,9(3,7-4,1)
6,7 (6,4-45,9)
3,3(1,1-5,4)
2,6(2,0-3,10)
3,5 (2,9-4,1)
7,0 (6,7-7,2)
45 (39-52)
33
0,69 (0,61-0,78)
0,81 (0,79-0,83)
233 (223-243)
260 (250-270)
323,5 (287-360)
280 (260-300)
7 (4,6-9,4)
9,3 (8,5-10,0)
6,5
4,5 (3,9-5,0)
6,0 (5,6-6,4)
11,7(9,4-14,0)
54
34(27-41)
0,83
0,89 (0,88-0,90)
310
300 (280-320)
327
310(280-340)
3,84
10,0(8,9-11,0)
4,8
5,5 (3,4-7,5)
8,4
13,5 (10,0-17,0)
Rb la
Cs
Sr На
Ba
Sc Ша
La
Се
342
Таблица 4.6 (окончание)
Элемент
Sm
Ей
ТЬ
Yb
Th
и
Zf
Hf
V
Та
Ст
Fe
Со
Ni
Ag
Au
Zn
_****
Sb
Br
Под-
груп-
па
IVa
Va
Via
VIII
lb
lib
IV
Vb
Vllb
FH
0,42(0,27-0,58)
0,33 (0,25-0,41)
0,11(0,08-0,15)
0,08(0,04-0,11)
0,05 (0,04-0,06)
0,05 (0,03-0,07)
0,16 (0,09-0,23)
0,11(0,08-0,15)
0,28 (0,27-0,29)
0,34(0,27-0,41)
0,13(0,11-0,14)
0,19 (0,13-0,24)
26(23-29)
35 (21^9)
0,58 (0,50-0,67)
0,99(0,40-1,60)
22 (20-24)
11(9-14)
0,07 (0,06-0,08)
0,12(0,06-0,18)
14(11-18)
18(7-30)
4,44 (3,40-5,48)***
4,35 (2,00-6,70)
3,9 (2,52-5,2)
4,4 (4,1-4,6)
70(60-81)
0,18(0,22-0,132)
0,52 (0,34-0,70)
0,005 (0,003-0,008)
0,005 (0,004-0,006)
48 (41-54)
33 (22-44)
44,0(42,3-45,6)
47,1 (41,5-52,6)
0,47 (0,44-0,50)
0,50(0,49-0,50)
9,0(8,1-9,9)
5,5 (4,5-6,4)
Горизонт
E
0,60(0,56-0,64)
0,87 (0,83-0,91)
0,22(0,18-0,27)
0,29 (0,28-0,30)
0,10(0,09-0,11)
0,15(0,14-0,16)
0,22(0,17-0,28)
0,54 (0,33-0,75)
0,34 (0,21-0,47)
0,66 (0,59-0,73)
0,29 (0,22-0,35)
0,48 (0,42-0,54)
158(109-206)
260(250-270)
4,62 (3,40-5,80)
6,55 (6,5-6,6)
27 (26-28)
20(16-20)
0,06(0,05-0,06)
0,42 (0,40-0,43)
53(51-55)
69(68-69)
7,97 (7,20-8,73)
13;00
3,6 (3,2-3,9)
5,5 (5,4-5,5)
47 (25-68)
0,08(0,04-0,12)
0,09 (0,085-0,089)
0,002 (0,002-0,003)
0,001
13(11-15)
25 (22-28)
0,25 (0,2-0,3)
0,9
0,09
0,04(0,03-0,04)
1,0(0,8-1,2)
1,4(0,9-1,8)
В
0,95 (0,91-0,99)
0,31 (0,26-0,37)
0,34 (0,33-0,35)
0,21 (0,16-0,25)
0,24(0,19-0,29)
0,16(0,10-0,21)
0,92(0,6-1,2)
1,40(1,20-1,60)
1,65(1,60-1,70)
0,70(0,68-0,72)
0,49(0,47-0,51)
146(140-151)
160(140-180)
4,08 (3,73-4,43)
4,25 (4,00-4,50)
19(18-20)
18
0,12
0,51 (0,47-0,55)
70(61-79)
120(110-130)
18,00(13,50-22,50)
26,50(23,00-30,00)
6,6 (5,0-8,3)
9,5 (9-10)
44 (39-48)
0,25 (0,22-0,28)
0,90(0,009-1,7)
0,004 (0,003-0,004)
28(25-31)
23 (14-32)
0,65 (0,4-0,9)
2
0,09(0v04-0,13)
0,04(0,03-0,05)
5,4 (4,2-6,7)
17,5(14-21)
Здесь и в табл. 4.7,4.8: сосновые леса; еловые леса; Fer/кг; С-
С
0,59
2,15(1,10-3,20)
0,39
0,30
0,12
0,31 (0,20-0,41)
0,46
1,18(0,86-1,50)
1,5
2,25(1,60-2,90)
0,82(0,44-1,20)
28,5
110(81-140)
2,06
3,70 (3,50-3,90)
37 (24-50)
0,12
0,67 (0,41-0,93)
55
103(96-110)
14,6
25,00 (24,00-26,00)
5,3
9,5 (9,2-9,8)
42
0,12
0,13
0,003
0ДЮ2
32
47
0,2
0,33 (0i30-0,35)
0,02
0,06 (0,03-0,09)
6,2
10,2(9,3-11)
% на сухое вещество.
343
Таблица 4.7. Коэффициенты обогащения для макроэлементов
(рассчитаны на основе данных из работ: Манаков, Никонов, 1981; Никонов, 1987)
А1
0,1
0,3
0,8
0,8
1,0
1,1
1,0
1,0
Fe
0,2
0,3
0,7
0,5
1,4
1,8
1,0
1,0
Р
1,7
2,2
0,2
0,1
1,0
1,3
0,9
0,9
Са
0,2
0,4
0,8
0,7
0,9
1,0
0,9
0,9
Mg
0,1
0,3
0,4
0,5
0,9
0,8
1,0
1,0
Мп
0,8
1,2
0,8
1,0
1,0
1,4
1,0
1,6
К
0,2
0,3
0,9
0,9
0,9
0,8
1,0
0,9
344
FH/C
Е/С
В/С
ВС/С
208*
260*'
3,3
1,8
10,8
6,1
2,1
1,0
112
69
2,5
2,2
11,5
3.5
2,5
1.3
0,1
0,4
1,1
1,1
0,9
0,9
1.0
1.0
N
А
е
со
б
2
ю
й
0,28
0,90
0,19
со
О
г-
со
0,27
0,32
0,15
о
о
VO
2,19
5,43
0,23
00
о
CN
00
1,77
2,35
0,29
VO
О
3
со
ON
5,02
0,93
со
О
Р
1,15
1,45
0,73
00
г-
о
ON
о о о о ~ о
о" о4
о о
?2 8§
о" о ~ о
СО CN
00 тГ
о" о"
5!%
о о
CN -м
о" о"
NO 8
—" о
Г- 00
о о
Tf СО
со П-
о о
CN СО
О О
On Г*
О О
п Ц.
О NO
~ о
о* ~
00 CN
ON СО
~, ON
-< О
g s
Г- 00
©* о"
00 ON
о о
00 ON
о" о
£
со
N
и
тГ
»п
о
VO
о
со
о
00
00
о
за
8
s s
of of
8 8
ss.
а
8 22
о о"
Я
о
<ч
OI
3
«о
CN
«—I
Г^
Г-
CN
"0
OI
СО
00 СО ~
г* «о со
~ о о" о —*
ON NO V">
о о -
г-
VO
*—'
»о
г*
см
О NO
~ v>
— о
сз
о
«-*
о г-
о о о о
«О <S СО
«-* \П *П CN
о о' о о" —*
VO Я
О -
S 8
£
00
345
Таблица 4.9. Классификация рассеянных элементов в комплексах кристаллических пород
Кольского полуострова зоны воздействия комбината "Североникель"
(по: Добровольский, 1972)
Породы, массив
Преобладающие
Постоянно и часто
обнаруживающиеся
Эпизодически
обнаруживающиеся
Основные и ультраос- Ni, Си, Со, Сг Ti, Mn, Ga, Sr, Zr, Be Ba, Zn, Mo, Sn, Y, Ag,
новные породы, Монче- Au, Se, Те, Bi, Pt (?), Pd
тундры (?)
Нефелиновые сиениты, Ti, Zr, Sr, TR, Nb Mn, Та, Th, V, Cu, Ga, Y, Mo, Zn, Hf, Li, Be, Au
Хибины Ba, Pb
Таблица 4.10. Атмосферные выпадения рассеянных элементов в условно-фоновых районах и
загрязненных Кольского полуострова, г/га • год (по: Chekushin et al.,1994)
Элемент,
атомный
номер
Си, 29
Sr,38
Zn,30
Cd,48
As, 33
Sb,51
V,23
Cr,24
Mo, 42
Co, 27
Ni,28
Группа,
подгруппа
IB
HA
IIB
VA
VB
VIB
VIII
Фон
6,26
2,13
28,2
0,35
1,56
1,87
2,40
2,15
0,46
0,32
2,20
Мончегорский градиент
10 км
4940
53,5
119,7
3,8
37,4
6,8
193,0
52,4
10,9
538,1
8450
25 км
494
18,0
109,6
1,1
13,4
2,1
27,8
11.1
3,4
44,7
663
Никельский
градиент
(Заполярный)
2270
30,0
123,5
2,3
27,4
5.2
24,6
87,6
0,8
165,1
5060
Таблица 4.11. Концентрации и диапазон колебаний рассеянных элементов в подзолах
Кольского полуострова в условиях медно-никелевого загрязнения
(Мончегорский градиент), мг/кг
Элемент
Подгруппа
О
Горизонт
Е
В
С
48 км
Rb
Cs
Sr
Ba
Sc
La
Ce
Nd
Sm
Eu
Tb
la
Ila
Ilia
4,6(7,0-2,2)
0,35 (0,29-0,40)
69 (59-79,0)
86(43-128)
0,8(1,0-0,6)
2,9 (2,0-4,7)
5,8 (4,2-7,4)
7,7
0,26
0,08
0,04 (0,03-0,05)
44,8 (43,0-46,6)
0,34(0,37-0,31)
246 (226-266)
310(275-345)
3,0 (2,7-3,3)
3,2(1,8-45)
3,7 (2,6-4,8)
5,5 (4,5-6,4)
0,51 (0,44-0,57)
0,16
0,09(0,07-0,11)
54,8(38,6-71,0)
0,66(0,72-0,59)
262(250-274)
331 (309-353)
6,6 (5,3-7,8)
5,0 (4,3-5,7)
12,5(9,0-16,0)
4,2
1,05(0,88-1,21)
0,30
0,19(0,10-0,27)
48,5
0,52
265
354
4,8
10,2
14,5
10,1
1,47
0,29
0,17
346
Таблица 4.11 (продолжение)
Элемент
Yb
Lu
Th
и
Zr
Hf
As
Та
Сг
Mn
Fe
Co
Ni
Ir
Cu
Ag
Au
Zn
С
Sb
Br
Rb
Cs
St
Ba
Sc
La
Ce
Nd
Sm
Eu
Tb
Yb
Lu
Th
U
Zr
Hf
As
Та
Подгруппа
IVa
Vb
Va
Via
Vila
VIII
VIII
lb
lib
IV
Vb
Vllb
la
Ila
IIIA
IVa
IVa
Vb
Va
0
0,12(0,09-0,14)
0,14
0,31 (0,22-0,40)
0,19(0,12-0,25)
16 (8-24)
0,55 (0,40-0,70)
2,40(2,90-1,90)
0,03 (0,02-0,03)
9
266(232-299)
11838(12064-11612)
6
164(134-193)
65 (61-69)
0,38 (0,23-0,52)
0,009
75 (74-76)
45,4 (52,1-38,7)
0,65 (0,70-0,59)
10,6(8,2-13,0)
8,1(4,5-11,8)
0,17(0,15-0,19)
63 (52-75)
54 (46-^4)
0,7 (0,6-0,8)
3,6 (2,9-4,4)
7,5 (6,7-9,2)
2,9(1,6-4,2)
0,44 (0,35-0,55)
0,10(0,09-0,11)
0,04 (0,03-0,05)
0,08 (0,05-0,12)
0,12
0,32 (0,27-0,37)
0,17 (0,12-0,21)
15 (8-20)
0,37 (0,30-0,40)
2,55 (2,10-3,00)
0,05 (0,03-0,08)
Горизонт
E
0,21 (0,21-0,21)
-
0,56(0,41-0,71)
0,30 (0,28-0,32)
167(154-180)
4,20(4,50-3,90)
-
0,05 (0,04-0,05)
35 (33-36)
249 (188-309)
36202(30487-41917)
3(2-4)
41 (36-46)
27(23-31)
0,19 (0,07-0,31)
0,002
22 (14-29)
0,7 (0,7-0,7)
0,04 (0,03-0,04)
1,0(0,6-1,3)
36 km
22,7 (26,6-16,8)
0,16(0,09-0,21)
257(177-309)
315(250-360)
6,0(4,6-7,1)
2,8 (2,4-3,6)
6,8(5,6-9,1)
9,2(4,1-12,5)
0,84(0,70-1,08)
0,21 (0,19-0,25)
0,16(0,12-0,21)
0,46(0,16-0,70)
-
0,58 (0,47-0,69)
0,40(0,32-0,49)
389 (288-466)
7,93 (6,20-9,20)
0,50
0,16 (0,12-0,22)
В
0,40(0,22-0,58)
-
2,30 (2,06-2,54)
0,47 (0,41-0,52)
168(72-264)
4,15 (2,60-5,70)
0,60
0,09
111(97-124)
330(286-373)
42087(40123-44051)
6(3-8)
47 (43-51)
29(26-31)
0,11
0,003 (0,002-0,005)
39(26-51)
1,2(1,6-0,7)
0,05 (0,04-0,05)
5,2 (4,5-5,9)
24,6 (26,5-23,0)
0,45(0,37-0,51)
238(200-260)
314,0(284-332)
9,3(8,6-10,3)
6,0 (4,6-7,6)
16,1 (14,6-18,7)
12,0 (10,0-14,0)
1,48(1,43-1,56)
0,28 (0,23-0,32)
0,23 (0,22-0,25)
0,50 (0,42-0,62)
0,55
1,79(1,50-2,11)
0,44 (0,36-0,48)
236(220-258)
5,27 (4,90-5,90)
-ж
0,17(0,13-0,20)
С
0,29
-
1,75
0,61
138
3,80
-
0,07
62
298
27600
5
34
14
0,10
0,004
33
0,2
0,04
2,4
54,0
0,34
304
428
9,4
12,5
36,6
14,3
0,50
0,30
0,30
0,60
-
2,42
0,61
237
5,0
-
0,12
347
Таблица 4.11 (продолжение)
Элемент
Сг
Мп
Fe
Со
Ni
1г
Си
Ag
Аи
Zn
С
Sb
Вг
Rb
Cs
Sr
Ва
Sc
La
Се
Nd
Sm
Ей
Tb
Yb
Lu
Th
U
Zr
Hf
As
Та
Сг
Mn
Fe
Co
Ni
Ir
Си
Ag
Подгруппа
Via
Vila
VIII
la
Ha
Vb
VHb
la
Ha
Ilia
Ilia
IVa
Vb
Va
Via
Vila
VIII
lb
О
9 (8-10)
270 (140-424)
6735(5610-8155)
9 (7-10)
318(143-464)
0,002(0,001-0,002)
143 (57-205)
0,20(0,17-0,23)
0,009(0,008-0,013)
60(55-68)
36,7 (22,2-45,9)
0,60(0,57-0,66)
11,2(11,1-11,2)
9,9
0,37 (0,27-0,46)
320(177-463)
211(151-270)
7,2 (5,7-8,7)
4,5 (3,8-5,2)
4,9 (3,3-^,4)
9,7
0,76(0,44-1,08)
0,24(0,23-0,24)
0,25 (0,13-0,36)
0,57 (0,56-0,58)
0,09 (0,08-0,09)
0,50(0,49-0,50)
-
99
1,85(1,50-2,20)
-
0,13
102(73-130)
480(390-569)
54723(49265-60181)
80(46-114)
2025(1274-2775)
0,019(0,010-0,028)
1050(587-1512)
1,27(0,95-1,58)
Горизонт
E
90(67-104)
412 (389-444)
40654,0(35739-47810)
6(4-8)
50(36-54)
-
24(13-38)
0,45 (0,43-0,47)
0,003 (0,002-0,003)
22(20-23)
0,3 (0,3)
0,06(0,03-0,09)
0,9(0,6-1,4)
10 км
17,8(18,6-17,0)
0,31
210(209-210)
280(220-340)
17,0(15,6-18,3)
6,3 (6,9-5,7)
12,0(14,0-10,0)
6,2
1,48
0,47 (0,38-0,55)
0,42(0,25-0,58)
0,84
0,18
0,99(0,78-1,20)
0,45
146(87-204)
4,70(4,30-5,10)
1,80
0,18(0,14-0,21)
235 (220-250)
1008(931-1085)
93751(82311-105190)
24 (24-23)
124(113-134)
-
50(49-50)
0,94
В
120(88-138)
476 (453-494)
55135,0(50119-61073)
10(8-12)
64(52-86)
0,006
31 (23-36)
0,12(0,04-0,25)
0,004(0,002-0,005)
50(33-83)
1,1 (0,7-1,7)
0,06 (0,06)
10,5(9,3-12,0)
24,2
0,71
-
288(261-314)
22,3(23,0-21,6)
16,1 (13,2-19,0)
-
1,38(0,36-2,40)
0,78 (0,73-0,82)
0,26(0,25-0,27)
1,05
0,48 (0,47-0,49)
1,59(1,53-1,65)
-
-
4,40(3,30-5,50)
-
3,20(0,93-5,46)
271(226-316)
978(975-981)
109643 (99241-120044)
30(32-28)
132
-
59
-
С
105
474
36200
14
45
-
31
0,43
0,002
37
0,2
0,03
4,6
27,3
-
272
270
20,2
12,6
30,2
-
1,64
0,64
0,47
1,32
0,13
3,20
-
-
3,00
-
-
300
830
73400
30
118
-
52
-
348
Таблица 4.11 (окончание)
Элемент
Аи
Zn
С
Sb
Вг
Rb
Cs
Sr
Ва
Sc
и
Се
Nd
Sm
Ей
Tb
Yb
Lu
Th
U
Zr
Hf
As
Та
Cr
Mn
Fe
Co
Ni
Ir
Си
Ag
Au
Zn
С
Sb
Br
Подгруппа
lib
IVb
Vb
VHb
lb
lib
IHb
IVb
Vb
Va
Via
Vila
VIII
lb
lb
lib
IVb
Vb
Vllb
О
0,040(0,023-0,057)
90(68-111)
22,5(21,0-23,9)
1,41 (1,20-1,61)
32,5
13,4(13,3-13,5)
0,51
415 (293-537)
169(144-194)
10,5(7,7-13,2)
5,4
133(8,3-18,3)
-
1,44(0,65-2,22)
0,40(034-0,45)
0,10(0,05-0,14)
0,96-
0,11-
038-
—
1,55(1,40-1,70)
-
236(1,65-3,07)
210(143-276)
854(652-1056)
71296(51859-90732)
120(94-146)
1483(514-2451)
0,021 (0,017-0,025)
975 (192-1758)
1,04(0,76-1,31)
0,056(0,056)
70(67-73)
U (1,2)
1,81 (1,69-1,92)
-
Горизонт
E
0,006
71(53-90)
1,1 (0,7-1,5)
0,07
13
8км
19,3(18,2-20,4)
-
132
222(163-270)
20,4(19,5-21,0)
6,2 (4,4-8,0)
14,3(103-21,7)
-
1,33(0,63-2,01)
0,53 (0,38-0,68)
0,94(0,19-2,38)
130-
0,26(0,17-0,33)
2,40(2,30-230)
69
3,13 (23ОЧ40)
-
2,36(0,82-3,90)
321 (252-400)
1032(977-1140)
83687 (76581-89625)
31(29-32)
204(182-217)
-
95 (71-141)
-
-
70(55-80)
13(13)
0,14(0,06-0,21)
-
В
-
86(72-100)
1,4
0,11
—
15,8(10,0-19,5)
-
162
214(200-225)
21,9(20,8-23,0)
7,4(6,0-8,7)
16,1 (14,7-17,0)
19,0(19,0)
0,88(0,24-1,32)
0,58 (0,52-0,61)
0,55(0,15-1,25)
0,79(0,66-1,00)
0,19(0,18-0,20)
2,04(1,20-2,48)
128(121-137)
2,47(1,90-3,00)
-
4,04(2,61-6,30)
354(264-422)
1094(831-1598)
86120(83458-88391)
32 (28-36)
218(193-247)
0,027 (0,017-0,036)
75 (64-84)
-
-
79(75-87)
0,8 (0,8)
0,69(0,60-0,77)
-
С
-
73
0,2
-
—
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
936
83800
-
163
-
62
-
-
71
-
-
-
349
Й
О СП CS
On, тГ ©^
О «О «Л
On СП СП
*— CN On
0,12
00
1,21
СП
СП
838
о" ~ ~
СП Tf Tt
»-* СЧ Г-
v> —■ о
—' СП «О
о о — ооо ооо
ОО \П rt
~- Г- VO
о о" о4
§
CS 00
Г* СП
о" ~<
w t о
тГ VO 00
<э о" о"
СП 00 О
Г*» ON VO
о" о" о"
СП СП 00
-« »о г»
ооо"
CN 00 «О
Ю 0О 1Л
о" о" о"
3
00 «П СП
(S «О О
о о* ~
со
*-* О СЧ
^ q. «n.
О ~ -и
ООО О — <N
ч* Оч 00
о* о* о"
00 —« Tf
00 00 «О
о" о" о"
СП «Ч —«
00 ^ h
о о" о*
§
ооо ооо
чо О сп
— Tf «О
о" о" о"
3; г-* сп
Ч ^ Т
ооо
Л
ооо о о
ю о t
сп ю сп
о" о" о"
сп On оо
ч ч «г
ооо
Г*» СП NO
^ VO СП
о" о" —*
О V© ON
о" о" о"
»п о о^
о" «-^ ~*
CQ
^ 00 Tt
м оо а
о ож о
3 8
^- ооо
ооо ооо ооо
00 h О
-г о. Я.
—. О О
СП On
■а ч .
-< о о
8
и
а ю t
СП »П 00
о" о" о*
Ю Ш VO
VO ЧО CN
о" о* ~
о г- ~
»П Tfr СП
о" о ~
~ Tt Tf
CM 00 00
о* о*4 о"
8 СМ СП
ON ~
о" о" -J
•О CN VO
и rf t
о* о* о"
П" Г- »П
о* о" о
Ой PQ
$ 2Т ю
О Ш CQ
О ц? со
Ошв
350
со
й
3
<
Z
3
U
8
О
в
23,5
220
1,90
1,08
2,74
1,68
S
4,50
1,25
0,78
0,67
1,65
-
о
4,25
3,25
1,31
2,33
1,15
1,04
о
со
4,42
16,1
227
2,29 2,28
3,75
4,64
4,81
8
0,40
0,88
3,50
0,46 0,65
1,90
1,93
1,21
§
2,17
со
5,75
0,79 1,17
о
2,04
1,38
о
2,43
20,1
184
4,06 1,61
0,47
4,61
7,07
г
0,20
2,00
1,50
1,22 0,59
1,05
0,78
1,12
Ъ
2,29
1,89
5,50
1,52 1,35
0,27
1,01
CS
з
?
112
1,23
20,18
17,16
5
5,50
0,98
0,95
1,05
00
7,00
г»
со
31*1
8
54,00
0,96
18,75
12,56
8
7,50
0,96
1,83
1,73
CS
о
4,00
1,09
1,45
1,85
Г"»
о
ОО^ ^ © -« ООО (SO- Ч ри г-
ЕВ
а
О «о «о
Ю On Щ
** <э ~
CS On CS
СО — CS
^* со «о
о" ~ ~
0,89
0,15
VO
со
0,83
0,56
3
1,11
1,78
OS
CS
0,57
0,09
?
0,87
0,86
со
со
1,00
1,14
CS
Ч
0,58
0,34
13*1
0,78
00
0,90
1,03
0,70
1,24
1,07
1,32
1,18
о о — о о —
= 8
CS Г-
VO <П
о* —
s
О Ш 00
$ & ffl
ууу У у у
О w да О ш со
351
Таблица 4.13. Концентрации и диапазон колебаний рассеянных элементов в подзолах
Кольского полуострова в условиях медно-никелевого загрязнения
(Никельский градиент), мг/кг
Элемент
Rb
Cs
Sr
Ва
Sc
La
Се
Sm
Eu
Gd
Tb
Yb
Lu
Th
U
Zr
Hf
Та
Se
Cr
Co
Ni
Cu
Ag
Au
Zn
Sb
Br
Rb
Cs
Sr
Ba
Sc
La
Ce
Sm
Eu
Gd
Tb
Yb
Lu
Th
U
Zr
Подгруппа
la
Ila
Ilia
IVa
Va
VIb
Via
VIII
lb
lb
lib
Vb
VHb
la
Ha
Ilia
IVa
О
13,4(12,2-14,5)
0,26(0,23-0,29)
199(152-270)
225 (202-243)
4^ (2,8-6,0)
6,8 (5,3-8,3)
17,1 (16,8-17,7)
1,1 (0,9-13)
0,26(0,25-0,26)
7,05 (4,10-10,0)
0,14(0,12-0,15)
0,27(0,11-0,51)
0,34(0,15-0,49)
1,36(1,24-1,46)
0,39(0,33-0,47)
101 (52-136)
1,92(1,40-2,20)
0,06(0,05-0,09)
0,76(045-0,97)
34(28-44)
63 (4,7-7,2)
235 (167-345)
128(128)
0,231 (0231)
0,0085 (0,0I03~,0114)
65 (46-84)
0,47(039-0,61)
28,0(24,3-30,9)
7,4(6,0-10,0)
0,22(0,14-036)
130(96-171)
102 (69-136)
1,8(1,3-2,7)
2,7(1,4-49)
11,1(7,6-14,6)
03(03-0,8)
0,10(0,10)
830(5,00-13,60)
0,08(0,05-0,11)
032(0,l&-0,60)
037(0,37)
1,02(0,37-2,08)
0,15(0,09-0,19)
82(51-140)
Горизонт
E
34 km
21,9(19,2-23,0)
0,17 (0,16-0,18)
402(386-418)
451 (380-524)
83 (7,8-9,0)
15,2(11,8-20,7)
50,2(40,2-56,9)
2,7(2,3-3,1)
0,50(0,46-033)
18,60(13,70-25,10)
0,37(035-039)
0,90(0,85-0,92)
0,89(0,78-1,06)
530(3,01-6,96)
0,63(0,51-0,82)
520(504-530)
6,82(1,02-11,0)
1,40(1,40)
1,40(1,40)
53 (53-54)
63(5,9-7,5)
38 (33-49)
18 (14-25)
0,726(0,598-0,853)
0,0031 (0,0015-0,0046)
42(37-47)
0,20(0,08-0,41)
4,6(4,2-5,0)
15 km
153 (13,8-16,8)
0,11(0,09-0,14)
254(240-270)
299(280-320)
7,7 (5,4-8,8)
12,0(9,4-15,5)
323(23,3-43,6)
1,7(13-2,2)
0,26(0,23-03)
11,33(5,40-17,70)
0,26(0,21-036)
035(0,4*-O,63)
1,04(0,73-135)
4^9(230-6,62)
035(0,47-0,69)
395(296-574)
В
20,0(19,0-21,4)
037(0,18-0,65)
367(314-416)
359(268-^40)
8,7 (6,9-10,3)
17,6(13,8-20,7)
41,6(38,8-44,1)
2,2(1,2-3,1)
037 (035-0,60)
26,73(13,80-40,80)
0,41 (0,39-0,43)
031 (0,78-0,87)
0,90(0,11-1,44)
3,85 (3,43-4,10)
0,84(0,82-1,07)
293 (192-353)
0,14(0,12-0,16)
1,68(136-1,80)
1,68(136-1,80)
68(66-70)
8,0(6,4-9,2)
43 (31-52)
26 (17-34)
0,068(0,068)
0,0044 (0,0042-0,0046)
52(4-77)
0,30(0,11-0,60)
19,0(15,2-253)
15,6(103-213)
0,21 (0,14-0,28)
235 (145-340)
234 (176-292)
9,1 (5,1-12,4)
15,9(5,6-28,7)
43,4(10,3-77,6)
23(1,2-4,3)
032(0,26-038)
21,35(18,40-2430)
0,34(0,21-0,48)
0,96(0,63-1,56)
1,16(037-131)
539(1,24-10,80)
0,62(0,31-0,98)
300(163-458)
С
23,8
0,14
473
310
12,0
16,3
61,2
-
0,87
11,10
озз
0,94
-
4,62
-
416
0,16
1,27
1,27
69
10,4
37
19
0,557
-
68
0,10
-
17,2
0,18
337
280
8,7
11,5
40,6
2,4
0,56
10,40
036
0,78
0,78
4,00
0,48
252
352
Таблица 4.13 (продолжение)
Элемент
Подгруппа
О
Горизонт
Е
В
С
Hf
Та
Se
Сг
Со
Ni
Си
Ag
Аи
Zit
Sb
Br
Va
VIb
Via
VIH
VIII
lb
lib
Vb
Vllb
1,46(0,9^-2,40)
0,06(0,04-0,10)
1,12(0,56-1,72)
18(11-29)
6,5 (4,8-7,5)
253 (193-374)
120(82-157)
0,313(0,297-0328)
0,0041 (0,0024-0,00058)
49 (43-55)
0,80(0,21-1,90)
19,9 (15,8-24,0)
7,76(5,68-11,00)
0,21 (0,14-0,31)
1,62(0,93-230)
49 (39-65)
6,6(4,8-8,1)
27(22-30)
22 (9^-34)
0,011 (0,011)
0,0014 (0,0014)
33 (29-37)
0,09(0,06-0,12)
1,9(1,8^2,1)
5,64 (3,10-8,70)
0,17 (0,10-Ю ,23)
1,60(0,82-2,02)
62(39-83)
8,9 (5,8-И т
42(25-54)
21 (19^-23)
-
0,0022(0,0016-0,0030)
54(54)
0ДЗ (0,09-03)
1'9,0(15Д-253)
4,07
0,20
-
59
8,5
44
20
0,590
0,0020
58
0,14
7.4
9км
19r7 (ISyCKZO^)
0,21 (0r16-0,25)
277 (230-326)
325 (310-343)
8,0(7,5-8,4)
6,8 (2,1-10,8)
31,8(15,0-484»
2,9(1,0-53)
0,42(0,32-0,60)
12,73 (6,30-23,00)
0,28 (0,24-0,33)
0,79 (0,66-0,95)
0,95 (0,95)
3,96(1,98-5,25)
0,39 (0,28r-0,49)
254(224-290)
5,45(4,65-6,68)
0,18(0,14-0,23)
0,98(0,90-1,05)
51(48-53)
7,8 (7,0-8,9)
39 (2Ф49)
26 (19-33)
0,00& (0,006-0,010)
0,0066(0,0066)
28(25-31)
0,45 (0,13-0;77)
2,1 (1,8-2,4)
18,5(13,0-24,0)
0,28 (0,23-033)
241(170-310)
241(164-321)
8,7(4,042,2)
6,3(5,9^,7>
20v5 (19,3-22,3)
2;l (1^-2,7)
0,59(0,26-0,91)
12,50(12,50)
0,52 (0,40-0,63)
088(0,48-1,13)
-
Г,61 (1,18-1,86)
0,36 (0,36)
165(135-194)
3,13(2,52-3,60)
0,11(0,08-0,13)
0,62 (0,62)
68 (64-71)
Щ0 (8,3-11,6)
51 (51-51)
34(33-35)
0,108(0,045-0,170)
0,0029 (0,0029)
53 (36-70)
055 (0*21-1,02)
11,2(8,2-14,2)
17,0
0,21
260
240
10,9
10,5
32,4
2,2
0,31
27,20
0,46
из
0,71
3,10
0,36
166
3,20
0,12
1,18
66
9,9
52
27
0,592
-
79
0,10
2,4
7km
Rb la 18,7(14,4-23,0) 20,1(17,0-23,1) 21,1(19,7-22,4) 23,0
Cs 0,41 (0,36-0,46) 0,27 (013H>;4©) 0,33 (0,32-0,33) 0,23
Sr Ila 266(212-320) 336(296-37$) 328(286-370) 410
Ba 251(163-338) 364(334-394) 333(320-345)) 373
Rb
Cs
Sr
Ba
Sc
La
Ce
Sm
Eu
Gd
Tb
Yb
Lu
Th
U
Zr
Hf
Та
Se
Cr
Co
Ni
Си
Ag
An
Zn
Sb
Br
la
Ila
Ilia
IVa
Va
VIb
Via
VIII
lb
lib
Vb
Vllb
5,8 (3,5-8,0)
0,25 (0,19-0,30)
235 (73-341)
81(46-108)
1,6(1,0-1,9)
2,5(1,0-3,3)
7,8 (4,3-9,8)
0,4(0,2-0,6)
0,07 (0,07)
7,33 (4,80-12,00)
0,07 (0,03-0,10)
0,22(0,15-0,34)
0,22 (0,22)
0,69 (0,39-0,88)
0,20(0,17-0,23)
70(33-137)
0,74(0,71-0,78)
0,04(0,03-0,04)
1,16(1,09-1,77)
54(31-86)
8,9(4,6-12,2)
473 (392-554)
313(321-394)
0,159(0,143-0,175)
0,0060(0,0026-0,0087)
44(40-47)
0,66 (0,39-0,82)
23,0(14,6-27,4)
12. Рассеянные элементы
353
Таблица 4.13 (окончание)
Элемент
Sc
La
Се
Sm
Eu
Gd
Tb
Yb
Lu
Th
U
Zr
Hf
Та
Se
Cr
Co
Ni
Cu
Ag
Au
Zn
Sb
Br
Подгруппа
Ilia
IVa
Va
VIb
Via
VIII
lb
lib
Vb
VHb
О
3,3(1,1-5,4)
9,5(7,2-11,8)
24,0(19,4-28,5)
2,1 (1,5-2,7)
0,51 (0,49-0,53)
3,55 (3,40-3,70)
0,35(0,16-0,53)
0,65 (0,43-0,86)
0,35 (0,35)
2,50(2,30-2,70)
0,47 (0,41-0,52)
203(94-311)
4,48 (2,67-6,28)
0,12(0,08-0,15)
1,55(1,55)
75 (61-89)
13,4(7,6-19,2)
509(465-553)
475 (371-579)
0,482(0,482)
0,0045 (0,0024-0,0065)
64(55-73)
0,91 (0,60-1,21)
11,6(7,8-15,4)
Горизонт
E
9,8 (8,7-10,8)
15,7(10,0-21,3)
46,5(32,0-61,0)
2,9 (2,3-3,4)
0,38 (0,38)
23,50(15,40-31,60)
0,35 (0,33-0,36)
0,81 (0,72-0,90)
0,92(0,92)
2,12 (0,94-3,30)
0,46(0,38-0,54)
334(330-338)
5,55 (4,50-6,60)
0,13(0,12-0,13)
-
61(58-63)
5,5 (4,5-6,4)
35 (35)
13 (10-15)
-
0,0050(0,0039-0,0061)
52(23-81)
0,51 (0,23-0,79)
1,2(1,1-1,3)
В
11,8(10,9-12,6)
16,7(12,6-20,8)
41,1 (33,0-49,1)
4,0(3,5-4,4)
0,42 (0,40-0,44)
8,45 (7,90-9,00)
0,44(0,43-0,45)
0,63 (0,63)
0,64(0,64)
3,80(2,62-4,97)
0,57(0,51-0,62)
277 (260-294)
4,75 (4,80-4,70)
0,14(0,13-0,14)
-
78(75-81)
11,3(10,4-12,1)
58(54-61)
26 (24-28)
-
0,0030(0,0026-0,0033)
70 (64-76)
0,59(0,26-0,91)
7,1 (5,9-8,2)
С
12,0
28,5
90,0
5,6
0,67
52,00
0,60
1,28
-
13,0
1,21
506
8,17
0,26
-
93
10,1
47
20
-
0,0026
114
0,24
2,0
354
OS ON
CN 1—
О —
со
00
о
VO
<N
О
Г-
о
'—'
ю
со
—
<N
<N
О
00
сч
—
СМ
Ю
О
ON vo
О О
ON
<N
О
On Ш VO »-« О со
CN On 00 t Г» N
о" о" о" о" о" -J о
О О 00 О СО On
СМ Г- Г- V> VO Tf
" о" о" о о" о*
8
©о© ©©© ©©
I
В
X
Об
а
е
V©
е
•в-
л
е
з
X
"2
О
Щ
Ё
со
3 00 — CM On «О
VO Tf 00 © ©
©" — см* ©~ ~ Ы
г- г- vo г* «о vo
CM Tf Tfr © Tf —
©~ ©" ©* ©* ©" ©*
On r- vo оо vp r- cotton vo г^ со
M Ш VO - ^ Ю СМ СО 00 Г-U-NVO
©" ©" ©" ©~ ©~ ©* ©" —* ~ ©" ©" ©"
On CM <£ О О «О 0О — —
<—| Г*- © CM CO On СО «О f-
о" ©* ~ о* ~> ©* ©" ©* ©*"
2
0,28
0,82
0,42
0,93
0,36
0,69
0,68
1,08
0,72
0,27
0,24
0,21
0,80
1,04
0,88
1,07
1,38
1,05
0,24
0,24
0,14
0,98
0,65
0,73
0,63
0,60
0,80
Г* CM VO
СМ Ю тТ
©" о" ©"
СО Ю On
СО Ш Ш
©" о4 ©*
г- ^ оо
СМ 00 On
©* ©~ ©*
ев
0Q
COVOVO ЧОГ^тГ TfvO© f- 00 On
Г-Tt— CO©00 COCO© VO ON 00
#t «t * «t * «ч «t * * #>**•*
о ~- — © — © © ~ ~ ©©©
(S Ю 00
4 oo ^
© © ©
© г- со
ON © ON
©* —> ©*
JO
ОС
I
votj-ti: tj- »-*■ on onqco oo«n —
00 CM VO NVO - f* © CO r-^Tj-
+. Ф* 0* *. •« *h #.»*#. » *. *
*-*-CN — © — ^^H^H ^ _ ^
V© CM Tfr COOi— CO CO v© — f«* CM
Ю On 00 t ON ON CO — © 00 00 ON
©" ©* ©" ©~ ©" ©* ©" — ~ ©* ©* ©*
О щ со Ошв О w со О щ со
з
о
Й
00 VO Г- Г^- Г- ©
VO CM «О Tf 00 vO
CM © CM ON © Tf
© CN CO
oo vo щ
«O © CO
CO [^ Г* Tt M N
Г- ON ON t^ VO VO
Tfr »— CM «O © —
© r- ©
VO rf ю
VO rf Ю
VO
ON
©
<N
VO
©
vo
r-
©
«o
00
©
r-
«o
©
Tf
ON
©
VO
m
©
VO
со
©
r^
VO
©
£ 5
vo vo —
Ю Tf VO
©* ©" O*
00 00 »0 w-s ^ ^,
n On © © J. On CN - » ч^ гч
VO" ©" -f «П ~ ~ ~ © ~: Д CT ~
Tf CO Tf
Г- ON —
vo vo JQ со ©
rt\ ro ^ vo CO
ч*2ю vo©»n ©Tfop So^^i
CO©»— C-vOOn — Г- ON °4r-<S
ЧО — — Ю©© On©© 20 —
©©© ©©— ©©— ^-©~
О 00 On ^-C0«0 CNr-cO О Ш t
•ОГ-On СП 00 О 00Г-© M VO 00
#.«.»• **№* •»#**• #»#*.^
©©© ©©— ©©— ©©©
9*
О IT) «O »— f- CN
CO © 00 CO Tf ON
© — © © — ©
Tl- 00 CM
т> Tf Ю
© © ©
© © © © — -*
© — © © —
со © oo
CN (^ ON
©* —* ©"
© — © © © ©
,_»
CO
©
Ю
•—
о
CO
«—
vo
•o
©
r^
©
"■
8
^^
00
CO
©
00
CO
©
r-
ТГ
©
d Sj «
Ууу ky^i ^y^
О ш со О ш со О ш со
12*
355
Таблица 4,15. Атмосферные выпадения рассеянных элементов в условно-фоновых и в
условиях воздушного загрязнения анатито-нефелнновым производством на Кольском
полуострове, г/га * год (по: Chekushin et aL, 1994)
Элемент, атомный
номер
Группа, подгруппа
Фон
Апатитский градиент
Си, 29
Srf38
2л, 30
Cd,4«
As, 33
Sb,51
V,23
Or, 24
Mo, 42
•Co, 27
Ni,28
lb
Ha
lib
Va
Vb
Vlb
vra
6,26
2,13
28,2
0,35
1,56
1,87
2,40
2,15
0,46
0,32
2,20
32,8
153,32
52,8
0,49
5,04
1,38
30,90
5,92
0,69
1,89
46,8
356
34,0
0,89
[280-320]
[280-340]
82
со со
оо*
8 S
О ^ N н О Л О О © ~-
1 J. О » t <*! <Ч °°. Ч Ч I «П. Q. «О Ч. .1 <*»
э S rr г^ г*, о о о ^ о £
s^|q^
' «О
со
vq -* со, со, ^ CN оо и f4. Ч f, vq g
-*«О^Г-СМ©©*-«СМ© ^* СО О COO *- —
«О ^
On 00
В
2
в 4!
S
I
2
I
О
= ,
о
в
о —
СО «в.
СО О
§8
as
СМ
«О On О О —«
СО CM СМ Г- U0
о ~
4r^/-sCOCO»-'SOSDTfQ
«П. *. оС Ч ~ о о о ~ о 2 *"
w _^ oocoN-/«ns-'N-'N-'N-'>-/4-' О ^ ^ I ^ v-/ "-" on*i
О wwwr^w©^-TfrCMV">ON e Ю ^ О — О "* WsO
3 со «1 «П. -Г vq Я со Я on sq Ч g <n 3 S «о g pC uo S
см см o\^^m<-ooo«o ^-ча- о ono — — on r-
2 2 3 2?
li
II
в и
Ii
I
e
ь*
i
S r* « Я ^ i- vq О
^ © CO ^t CN SO CM Г-
OOCM^UOSOTf S Ю О o^
l ©*©*©* о" ©* о см so* о* см о
Ю ^ <Л"Л
я$ _ л a = s
00 00
3§§2
_ - - 00
тГ О О О
.. < vl О* О* О* О*
со о П «^ ■О. П Р. °. Я.
СО »— CMUOCOOOOO
— "Ч-
rt CM
??
R2
4(0,
9(0,
со »—
О О
s
^-v 7
On 00
тГ со
J о
со О
о
«о
49-0
о
о
•о
о
00
*-ч
9
/—ч SO
СО О
1$
2^см
SO ^
СО О
о
2
00
*■*
ч тя
*\ Чсо
«О TJ- СМ
I
5
Д sS Я
> £
> > >
д
Ой U
(25йЛ6§1а^^эй15>!2б
62
357
?3.gg
8Ш
cn «o
«о л о
Ч о ^
~ -* со
П "1 °°- 2 °°» Ч «? Ч 2 —*
_^^^ © es-csvos^c*, cp
—< © СО СО Tf «»-t'-«OO^W«- <S«0 О COO — CN — ON
t
О со ^
*§§
J T <o
SgS83
CN <N Tt" CN О
AS-4»
' p" of © 8
1*3 "
S й Я
CO O"
v©
;©;
Оч С* <N -TOO - °°. «П. П ^ ^ 4
«SCO <N — — <N — — ©©© — ©
iU _? лл as I * ». 00 ^* * •> J*». ». » ^»
. § 2 ?
о 9 2^2
О ^ CN T О Т Q
- S oo 0 q, «o S^
^. г* 3» <*> сч © «o
О vo О — CN — vo
о — о
t*3
©„
NO
c*» vo со r* ^ о Ф
CN Г*- NO VO S4 Г» О
?5fS3
a T ^ * ^ ч <ч — — 7 T т т т ■* Г t ~ °°. °°.
s3§3 м
со о со ^t
• Os § Я
i <N Г"; VO^ Ч\
<N Г* СО — 00 — © © © © © СОР* О
00 %
CN О
CN Ш VO
►2 £ я
2 ££
> > >
(Зй<2ЙйЛб§113{2^{5эЙяЙ>^бЙа2
358
8.SS
Q. Q. Q. ^ О SO
oo V t>T q Sn v5
-- ^ en ю oj о
ff 4 4 4 I i 5
MON?^h«m-NOOhNO -< «О О t^O CN SO — —
CN О
q cs (
8 ©*!
SO
5*
ы 2 3 - § * ^ §■ i? 2 s
© ©©oo7©4»nr*-i©©P
» <Ч П ^ in^^.i со so T
in oe vo in ю 0\ es«0 «D w On л О ©С
°. 4 <*l Hn14. 8 ©. °. со 54. й so г-* so
w«nqinqwnoos©»n»noN л«о «о w on
ч m -< со so* 9. 4 <*1 Hnf4. 8 ©. ©. со <*•
^■^-.^Ы — cnoo^cs© —• со © m©
Ы
t
q cs _ _
r*» ^v © ©
CN © © CO
© A *T I
^Г СО О О
3$P2r.
CM © <N «<t 4f
m m - ^-< © s© © *- © <^ © I I
~ ©* ©" ~ ~ ©* « oo" ©* .1 ^ "1 П,о
1Л N ft 1Л 1Л 1Л 1Л \Л S/ ft ._ s—' ^-^ qL
ГМ "^ «М
00 * * *■■"
w »o w
CN w ©. _ "О N О Ю 1Л «Л
^см-го^сососм^^оо
<*! П Г* - Г*
00 © Tt f-» f-m ^- 00
I
I
* q;©^^ qq^i4^^ Sq © S © §
« <N П S S л 00 Cf © 4 °0 П ~. <4 ^ ~. <4 -. ^ -
<S-rCO00 fJCjl VCCO WOO *? 7 ° 7 7 7 P *?
~" °°. S S •? J осГ Tf so <Ч Ч <Ч ^, и. 1 ч ^ t °l ^ J rf "?
<s о Я Я i 4 S n S cs о d — ~ 2r © © JL © »I "i 2 J.
- Я. Я Й «о °° со" oo со °°. Ч «Ч ^ 3. - Sqei-q0 Ч К oo
<N*-CNCN^fr»OCM^tCNCN©©©*-«*- ~ <S © rt ~ Г* Г* — CO
© CO
—* OS
22
^s;
«ma
«348
© ^ ^ Г «n.
^r со cs ^i p*
q. q.
il
a
©p.
— © CO <S »П CO CO
4
Q S ^
sococoo©^^-© r-*o © <s©
ill
CO SO
©•
©
9
s g g «a g «J. i 2
.. so
On »П
CM —
О
Я S
Ё ^
> > >
£бй3йй.3<32!(3ё<2еэйв<8>(2б(йа2
359
О СП
s?Ss g
СП
w
•О »-•
so P*„<
СП О <
о о о
Я "^ ^
см о о о
?. 8 S § 2 R s %
2 ~ »
S^OCMiOi-.'-hOsO СИ rt CM CM
4^<±<±см7сЬ^(пс±>?76©
* ** S S °Р о К о "1 *1 Ч "а °\ °V о <Ч °. ^ Ч S 1 -Г г
i 8 см 8 оо S ^ ^ сп о о - см о ^ rt о Д - g оо см (
о w
»-* «о
Tt so
3 "г °. °-
СМ СП SO СП СП О О
so «о °i h. n °i 8, n 2§ n ^8 о 5 21 ю
socncnoocMTt»^ см so о socm см — cmtj-
О On л ^
о о ож
CM
'8?
u->
i О
^2 21®222 522225
R $ о, о cs so oC Ч см «о ч «- сп £
СПЮ «Л СМСМЮСПСП^ОСМТГ^ CM
CM «О СП — CM
~ о" см" ^ ~
сп О
о
«о
290-3
о
см
СП
О О
— о
см см
(20,0-
(15,0-
8-20)
*г "i ~
О Г» ON
см — —
ы
!'
§
ее
' о о о оР оо Son __ о «Я
К in <* г-" <ЧЧ П °°. «Я оч Э °°. 1
-гснснсМООтСМ© ^ ~ ""*
о
сп
О
о
3
S
«л о о
^ см Ч
51
— 3 5
|*"° 8 <i = ^
s§
О О О О О
СП Г-; ~ CN ©^
1ГТс56 = о\ 3 £ г! 2 2 J <i
© Q *Т -^ W OsOO^tOOCM ©СМ
l#"v i^s r^. __. |»»^ , ял v#S #ч.» /"""ч #4.1 v4> /~\ #v| f»^ /"^
о
Os
8
,:2
r> oo
cm"
so см о cm Tt о
So 2^
SO О CM
о ~£
^ OO*" OS
en —« сп
? § I s s
— CM ^ SO ^
VO©©©©www©
Г^^СП^'-'Г^СМ'^" — СП Ю
i
с
й £
ев S -—
> > >
0)
2бй5ЙйЛб§<1й{2?^эЙхЙ>^0£а2
360
Таблица 4.17. Результаты факторного анализа распределения рассеянных элементов
в Al-Fe-гумусовых подзолах в условиях воздушного загрязнения апатито-нефелиновым
производством
Переменная
Rb
Cs
Ag
Sr
Ba
Zn
Sc
La
Ce
Nd
Sm
Eu
Tb
Yb
Th
U
Zr
Hf
Sb
V
Та
Cr
Br
Co
Ni
Дисперсия
% от общей дисперсии
Фактор 1
0,946*
0,831*
0,295
0,98*
0,601
0,704*
0,03
0,941*
0,979*
0,933*
0,981*
0,972*
0,979*
0,658
0,913*
0,896*
0,715*
0,642
0,144
0,825*
0,982*
0,022
-0,174
0,528
0,04
14,040
56,2
Фактор 2
0,096
-0,006
0,316
-0,006
0,564
0,265
0,931*
-0,073
-0,036
-0,04
0,069
-0,05
0,129
0,402
0,299
0,159
0,193
0,399
-0,54
0,181
0,035
0,929*
0,348
0,159
-0,356
3,388
13,6
Фактор 3
-0,224
0,205
0,13
-0,069
-0,421
0,235
-0,089
0,085
0,135
0,134
0,129
-0,028
0,064
0,139
0,096
0,056
-0,48
-0,519
0,687
-0,045
-0,024
-0,105
0,272
0,750*
0,718*
2,590
10,4
* Значимы при р < 0,01.
361
о-
(2
Й
X)
в
S
*
а:
i
•^
чпп
1— »-* о
СО 00 W0
- о о
Ч Ч п
о о о
^t Р^ СМ
о" о" ~"
Ч Я, со,
Г"* СМ 14
Г- ~ 00
см ~ ©"
оо о vo
~ см" о
5 Zf 2*
wo ^ ©
см р- -Г
Ч П ^
СМ О О
г» см wo
см" ~ о
00 ON WO
—" о" о"
оо, ч vq
со" ~ о"
3 °. °1
2 rf о
СО ^- О
vq со, оо,
со" см" о"
п ч ^
W0 ~ О
Os CM, ^
wo" о о"
со so г*»
о" о" о"
SSZJ
wo, со, со„
Г^ 00 СО
rf ^Г ,-Г
vo о см
о - о
1 ~г ^
СО СМ О
00, ~ СМ,
со" ~Г ,-Г
01/С
02/С
Е/С
6*0
00
о"
©„
см*
ч
00
о"
ч
о
-1
-
q
""'
2
щ*
~
2
vq
ON,
о
^Г
OS
о"
о"
q
On
о
СО„
СМ
q
о
^т
"■*
q
§
Ч
vq,
•4 О
2
изз
32
2
ч
о
2
2
vq
о
см.
*■"•
р»„
о
г-„
о
2км
0,2 0,8
•Я
СО
cJ
q.
со
2
-1
о"
-i
р^
о
vq
~*
Ч
о
vq.
vq,
О
5
3
§
"1
""'
00
о"
ч
о
о
q.
-.
00,
wo.
ее
со
о"
S-
3
00
о"
ч
о
см
^
о
О О
362
2
см
о
г*
о
р}
г*
о
см
Ч
2
_
^
W0
о"
Ч
о
о
2
2
q
о
2
§
2
о.
о.
2
р*
о
р*>
о"
°°.
о
g
6*0
OS,
О
2
q,
wo
г*
о"
00
о"
vq
о
Os,
О
q
^*
Os
О
р-
о"
00
о"
00
о"
00
о
2
р^
о"
2
2
э
00
о"
Os
о
тГ
О
„—
•"*
Os
о"
£
7,1
5
со
о"
о"
о
О
wo
о"
2
см
о"
см
о"
о"
см
о"
3 s
22
fH СО
о"
о"
со
о"
см
о"
со
о"
о"
"г
о
см
о
р^
о"
fmm
""
ч
о
см
о"
8
1.1
2
о"
2
2
2
00
о
Ч
1,4
00
О"
00
о
q
-
00,
см.
з
П<4
wo
о"
2
г*„
о
VO
о"
2
«П.
о
р^
о"
о
со
о"
Р-
о"
wo
о"
~Г
2
q
о
рг
о
q
~
S
Ч
о
2
р^
О
Os,
О
00
о"
о
о.
ч
о
00
о"
©„
wo
о"
©„
q.
vo
о"
^,
•~
_*
"
£
СМ V© 00
-" о" о"
wo vq, о
о о —
П -- ^
о о —
СМ Р"» СМ
о о" -"
см vo оо
о" о" о"
р. «а <ч
— о о
со, vq, sq
оо" о" о
СО 00 —
о" —" *-*
п ч ч
о см ~
см vo vo
о" о" о"
<ч «я ^
о о о
-г п °°.
о о о
^ <Ч «П. °°.
| о о о
5 см о —
о —" *-"
CM Tt VO
о" о" о"
WO, q, P-;
о о о
^- W0 Os
о" о" о
Ю W0 00
о о о
— г» Оч
о о" о"
«^ п «п.
о о о
Ч П. «V
О 1-< О
•<t О Os
О -Г о
О Г» Os
V о" vo"
Ч °\ Os
о о о
СО СМ О
о" ^г ^г
ш
Таблица 4.19. Кислотность (рНн2о) различных горизонтов почв Апатитского градиента
Горизонт
01 (л = 6)
02 (л = 6)
Е(л = 6)
В (л = 6)
С(л = 6)
Горизонт
0(л = 6)
Е2(л = 6)
В(л = 6)
С(л = 6)
Минимш
0,5 км
6,77* 6,92**
5,77 5,97
5,01 5,14
5,15 5,65
5,49 6,00
18км
3,64 3,82
3,91 4,30
4,37 4,77
4,67 5,20
7,03***
6,09
5,41
5,94
6,25
3,97
4,68
5,17
5,66
4,18
4,12
4,33
5,20
4,93
3,70
4,24
4,93
Н.о.
** ***
1ьные, средние, максимальные значения.
Примечание. Н.о. - не определяли.
2 км
4,70
4,43
4,44
5,47
5,38
Фон
3,90
4,38
5,17
Н.о.
5,04
4,66
4,61
5,69
5,80
4,05
4,52
5,44
Н.о.
Таблица 5.1. Характеристика атмосферных выпадений в еловых лесах
в бесснежный период, мг/л (Лукина, Никонов, 1998)
Стадия деградацион-
ной сукцессии**
Фон
ид
зд
Р
рН
4,67*
5,58
3,99
5,10
3,51
4,20
3,73
3,97
С
47,5
9,4
23,8
2,7
35,0
1,8
18,1
4,4
Са
1,88
0,27
4,81
0,40
7,77
1,42
3,47
1,86
Mg
0,45
0,13
1,20
0,09
1,67
0,27
0,97
0,47
К
5,27
0,78
6,80
0,42
6,61
0,54
1,68
1,11
Ni
0,003
0,004
0,08
0,009
0,48
0,06
1,71
0,56
Си
0,007
0,016
0,12
0,019
0,72
0,18
2,33
0,61
S04
9,90
1,04
23,90
2,09
42,95
7,80
28,98
14,53
Здесь и в табл. 5.4, 5.6-5.8 стадии сукцессии: ИД- интенсификации дефолиации; ЗД-
затухающей дефолиации: Р - редколесье.
** Над чертой - под кронами; под чертой - между кронами.
363
I
е
с*
«о
&
Си
Г
Фон
О
^
^
*
б
О
*
*
*
*
*
*
*
*
о
*
*
*
*
Предел
обнаружения
|
i
0
>
V V
{ «П О й S О О О О О О о О ^ Ч
V VVVVVV V
ON £
Ч© ^
. о О S
со rt
% 5 S *г g о о Й Sc 2 о S S о о о о о о £ о ч *i
v v vvvvvv v
^ f£ <<* vq «- On Гг 00 <N
1 oo »o о vj,«,ww ~. on
ooooooCCo^
V V
?• У У Г. os . « .
о »-* ^t
"°. vo N M ^. ^. Г^ - 00 t^ п. - -
тГ О M t t4 С
Г- Ю ~* vO ^- О
On pC Г- «О
„ . _ 5 <» » Й ^ <N °°
ООООГ^О — O^tON
S|855^SoSrlooi-OaOOOOOOOOOOrf
'5
'CdCCCCCCCCCC-
V VVVVVVVVVV
P. 8 fc 5412 I S SS-o 8 So 8 S., о о о cto ^o
© cs ю -* © С — со со — СооСооССС»пС<ч^-
V V V V V V V
S^r-nVOii^^t^^t^^^'-^ OOONTtOO
Г0--ЮООЛ^«^О«н OOOOcOOfNO^CS
©. К £ ^ *- - 2 $ 8 © «ч •о. <ч -. ч п о - ч ^ ~ «я ч
<ЧГ^—'^©ОГО—' — СО©
»-©©©©ON© — ©VOO»
о 2 ; q З.о 8 $^t о 3 j о о о о о о о о о ч
V V VVVVVVVVVV
9*'
„ о О 3 » 3 ^ О S S О О о О О О О О О ъ
V V VV VVVVVV
Ч. <N CO Tt
о ■ —- ■
в 18 -. s о
ч «л «л о . а
1— см *- г* о С
rtfooooCC3oCNO(sC^o
V V
00r*00500VO00CS<N^TfCO^©Tf
^^©©©©©„©©CN — 00 © ON СЧ
©* ©* ©" ©* ©"
со 0 м rj 2
О — — © © © u-> ~ © ©~ ©~ ©" ©~ ©~ ©~ ©" ©" ~
364
о © о ^ «> s g Я .*о2ооо8о^йояоооч
vv vVVVv v\7vv
VVV VVV
^ * 3 ? а 3 - °- о °i о* J2 п о ч «п о с*г ч п 5 о вч о п
V V V V
°-~9®©vSR:3; оо ^ «я 2 & - £ ^. \о ю =: £ 8 ч s <ч ^
vo ^ «*l So S vg к «Я S сГаГ S <*l ^* °°« тг оо 8 °V ^ оо о ^ сп °°
С г-° on ^ <^г5 Я О оо О О О 2 О О О О pj О О О г-
v - С * о оо - о ^оС^ССоСССС^С^ю
eiS 9 Suisse voK^5;og30«sScoo|ooovo
V VV VVVVV
^.S^^g^ ?*.^8n8 n § § ? S 8 £ n 5 -;
Tf-0^(S\0-H(N —«4tCO~©CO©*-*-»nc4©^»o»-*VOVO
MP *2 ЙР S ^ 9 SP8 -.8 ^S.§ й?2 I О $£=,
V
O^OoOOO®gOO^OjOjOOOOSOOO^
V V VVV VVV V V VVVV VVV
OooOnO 3 ooo^o?o?2ooo2ooon
2§ойэ csS ^SggjS-oS^ggoloo^oo
C^C^oo-io t^oc4cooTrC<^^-Vot-r^CCt*-r^
V V V VVV
365
00 Tf CO
SON ^ VO
Tfr CM ~
O О* О О'
00 (S OO "
1^» CN Ю ^,
01 О О О
сГ о о" о"
•— 00 «О
88S8
о о" о" о"
Tf CM V0 —
о о о о
д\ со «о ио
8S88
о о о" о
53 JQ £
8.8.8
О О О
00 Ol Ol V0
01 OI 00 Ol
ON VO Ol CM
о о* о" о
«О On СЧл —^
so* vo* vo* oC
V0 00 СО i—
О (Ч 00 00
On О «П СО
VO — СО СМ
0,434
0,061
0,092
0,101
V0, СО, Г*; CN
vo* of з* on
СО V0 тГ —-
On ^т *—' »-*
<s r^ Tt см
0,065
0,291
0,056
0,031
tJ; CM ©ж ~
со vo* vo vo*
СО Tt — —«
О ^t VO
00 ON CO
см см — m
00 On vp —
CO CO Q CM
01 © © »-
о" о" о" о"
On VO WO
О rf ^- _Г
ON СМ -^ ^
vo
СО VO ц-\ СО
CM CM V «-
00 Tj- Г- VO
CO f- — CM
о о о. о.
о о о о
0\ *П С*\ ч?
©" vo* о г-*
ON
00 тГ CM VO
00 — On VO
00 CM VO
о о 3
о о о
СМ О 00
Tf ~Г СМ*
8
28
3
VO —
Г- Г^ V0 СМ
чо 1— со *-
Ol СО СМ •—
tj- со см vo
^ »п г- см
ъ ~г Ч о
О CM On Tt
3
со
i
о
&
5
«о
^ r- з: ^
"l Ч Ч г-Г
о см
~ СО ^- On
СО V0 ~- ^t
О О СО Os
2 vo
со уо см ^ vo
О О со SO _Г
- О" О* ~ т*
со
g- о
CM ON СО
^ СО On
00 Tf СО
^* Р- СО
^ °1 О
*-. о ^*
со со ^t vo
00 СМ Г^ Г»
о"
I
,-Г^Г » o--wo
.-.«-:
— Tt
о со см ,^-
<*1 *> § _ -1
— V0 — «~ О ^ On (S »-
ё
со
vq, *q sq, оо.
On 00 jOO On
.sq. On, Tf Ol,
со" of ^ of
^ ON SO 00
2*" со
°1 см* "I Я.
Q Ol wm 00 Г-
S
3 ем оо г^ оо,
tt On CM СО Г-
О -ч NO CO VO
оа
^см ^ «—. **»
^- NO — rfO
СО VO СМ «—
ГМ ~- 00 V0
о
£ ч
ю
О vo
оо* OV оо
«-■ \о —
2 ^
со vo On со
о
X
о
а
*
и
03
+
аэ со оо о
со см vo
о о* of
«5 rf ^ О- Г-
<D rf VO*" О Of
Ol
CN CO •- f* ►- ^-<
5,0
CO
vo
00
0,5
со
r*-
1-^
CO
uo
vo
о
r-
s
00
On
s
n>
корн
=
0
CQ
00
CM
CO
Ol
о
Ol
r-
CM
Tf
vo
о
TO
ON
Ol
OJ
Ol
00
*-*
4
uo
m
CO
00
r*
CM
vq, on^ q vq,
« со* of —"
g °i ^ о см
* CO О ^ CM
Я *- Г- — —
•- со
CM «О ^ 00
— — v© г-»
О 00 ^ CM On
PQ СО *- ТО VO
СО ON Г^
«О О СО
о* о ^
VO
VO СМ Г^-
-. <Ч vd
О О со
+
+
о
•в-
о
9
0Q
СО U0 СМ
О* О* rf
°Ч ^ °Ч
«п о со"
. ЧО
со тГ
Ol ON
SS
^ Л _^ «-Ч
«—' СО ^—* Q
— — t*- SO
00 Г-
VO On ч— —
CM CM SO On
г^ см t*» r*«
28
125
— — CM
SI
vo
(S M CM
«О Г^ On
«Ч Г-* Of ОС
со о rf r-
CO — CO CN
00 О »—
**l К ON К
On V0 CM I-*
CO О ^Г P*
of vo" о rt
1— CM ^ Ol
^ 00* ON O*
*-i V0 1— Tf
vo г- о vo
O* ^f ^* of
~- CN CO CO
r« оо о о-
vq, о, vo^ vo,
Tt* Tt" со* со*
ON VO CM VO
4, 00^ On^ On^
^ CO CO CO
ON 00 CM *-»
"1 ^X °^ ^
V-T ГГ Tt* Tt*
oo, vq r^ 5
VO* rt* ^t* Tj*
со vq т^ »n
V-Г ^* Tf Tf*
о ttn
•9" S со Oi
о ««
•Э S со Ou
О S CO Oh
•в* S со ou
о сз* t(
в S CO Ou
S со o-
366
Таблица 5.4. Размеры частиц и их молекулярно-массовое распределение в природных водах
(по: Spivakov et al., 1994)
Размер
Молекулярная
масса, Дальтон
Фракция
Природные органические и
неорганические составные части
<1нм
1 нм-0,45 мкм
0,45-10 мкм
сЮ2
КЯ-Ю7
107-1010
Растворимая
(истинный раствор)
Макромолекулы
(коллоиды)
Взвеси
Простые соединения: гидратированные
неорганические или органические ионы,
комплексы, молекулы
Полигидрокомплексы, полисиликаты,
фульвокислоты, кислоты жирного ряда,
гидроксиды металлов, глинистые
минералы, гумусовые кислоты, белки, вирусы
(от 0,1 до 0,2 мкм)
Неорганические минеральные частицы,
органические частицы, водоросли,
бактерии
Таблица 5.5. Валовые концентрации элементов в почвенных водах из органогенного и
иллювиального горизонтов в древесных (К) и межкроновых (М) парцеллах, мкг/л
Элемент
Подгруппа
Предел
обнаружения (ПО)
Органогенный горизонт
М
Иллювиальный
горизонт
Li, 3
Na, И
К, 19
Rb,37
Cs,55
Be, 4
Mg, 12
Ca,20
Sr,38
Ba,56
La, 57
Ce,58
Pr,59
Nd,60
Sm,62
Th,90
Ti,22
IA
Ha
IIIA
IVA
0,2
0,2
10
10
171
203
0,2
0,04
0,03
0,1
0,06
0,06
9
9
12
10
03
0,3
03
0,2
0,02
0,02
0,02
0,05
0,02
0,02
0,03
0,04
0,03
0,05
0,02
0,01
2
1
0,28
0,40**
507
478
3924
3819
19,8
21,9
0,49
<no
<no
<no
766
860
2794
3395
14,7
17,2
27,1
34
1,8
0,33
0,8
0,5
0,056
0,07
0,22
0,17
0,068
<no
0,053
0,12
<no
6,5
0,36
0,26
443
134
2336
1284
14,2
9,1
0,5
<no
<no
<no
186
223
495
675
5Д
5,4
И,4
15,4
1,6
0,19
0,5
0,41
0,049
0,066
<no
0,17
<no
<no
<no
<no
<no
6,5
0,32
<no
609
428
2693
4926
11,4
12,2
<no
<no
0,1
<no
678
405
2131
1831
12,4
9,8
55,9
20,2
0,37
0,64
0,54
1,2
0,087
0,15
0,21
0,59
<no
0,12
<no
<no
<no
2,9
367
Таблица 5.5 (окончание)
' Элемент
Zr,40
V,23
Сг,24
Mo, 42
W,74
Mn,25
Fe,26
Co, 27
Ni,28
Cu,29
Ag,47
Zn,30
Cd,48
B,5
Al,13
C,6
Si, 14
Sn,50
Pb,82
P,15
As, 33
Sb,51
Bi,83
S,16
Подгруппа
VA
VIA
VIIA
VIII
IB
ИВ
ШВ
IVB
VB
VIB
Предел
обнаружения (ПО)
0,2
0,2
1
2
2
2
0,2
0,1
0,09
0,01
2
0,5
10
6
0,08
0,2
1
1
3
2
0,08
0,07
2
2
0,07
0,08
5
3
5
5
41
42
0,2
0,2
0,2
0,02
68
79
0,9
1
0,05
0,06
0,07
0,02
62
54
Органогенный горизонт
К
0,68
<ПО
2,1
<ПО
<ПО
<по
1,1
0,42
0,71
<ПО
449
315
314
255,
0,29
<ПО
12,2
3,4
74,7
58,4
1.4
<ПО
42,1
52,2
0,42
0,86
13,8
13
181
414
17 080
47 060
237
674
<ПО
1,5
7,6
5,4
337
350
<ПО
<ПО
0,1
0,1
<ПО
0,11
1364
1666
Примечание. Верхняя строчка - июнь; нижняя - июль.
М
1.2
<ПО
<ПО
<ПО
3,3
<по
0,5
<по
<по
<по
65,6
61,9
105
204
0,2
<ПО
5,2
1,5
12
12,6
1,7
<ПО
27,7
63,2
2,2
1.4
25,3
2,8
173
531
29 900
25 300
224
203
<ПО
1,2
<ПО
7,3
209
<ПО
1,8
<ПО
0,07
0,1
<ПО
0,038
616
640
Иллювиальный
горизонт
К
<ПО
<ПО
<ПО
<ПО
<ПО
<ПО
0,32
<ПО
0,12
<ПО
74,7
12,9
32,4
132
0,16
<ПО
4,2
1,2
25
8
<ПО
<по
134
27,2
0,12
0,35
9,2
9,9
288
698
21800
29 000
414
804
<ПО
0,69
2,8
2,2
<ПО
<по
<по
<по
<по
<по
3455
2368
368
Таблица 5.6. Валовые концентрации элементов в почвенных водах из органогенных
горизонтов в древесных и межкроновых парцеллах на разных стадиях деградационной
сукцессии, мкг/л
Элемент
Предел
обнаружения
(ПО)
Древесные
ид
зд
Р
Межкроновые
ид
зд
Р
Li
Na
К
Rb
Cs
Be
Mg
Ca
Sr
Ba
Y
La
Ce
Pr
Nd
Sm
Eu
Gd
Dy
0,2
0,2
10
10
171
203
0,20
0,04
0,03
0,1
0,06
0,06
9
9
12
10
0,3
0,3
0,3
0,2
0,1
0,1
0,02
0,02
0,02
0,05
0,02
0,02
0,03
0,04
0,03
0,05
0,03
0,04
0,05
0,06
0,03
0,06
6,5
3,8
4811
2016
5499
10064
28,9
30,0
3,21
0,19
0,47
<no
2981
1445
10508
5176
73,1
37,8
50,6
41,3
0,38
<no
9,20
0,32
2,10
0,68
0,210
0,091
0,76
0,38
0,17
<no
0,08
<no
0,10
<no
0,054
<no
2,0
1,0
3686
1654
2576
2248
14,1
10,2
2,9
<no
0,14
<no
921
496
4826
2908
37,1
20,2
61,1
30,9
0,32
<no
5,60
0,24
1,40
0,65
0,12
0,13
0,37
0,28
0,038
<no
<no
<no
0,12
<no
0,045
<no
0,63
0,54
2566
1078
1496
2248
4,4
7,1
0,59
<no
<no
<no
801
558
2710
2325
25,5
25,0
23,8
20,6
0,14
<no
0,47
0,17
0,58
0,51
0,073
0,086
0,26
0,23
0,055
<no
0,033
<no
<no
<no
<no
<no
3,0
0,64
711
411
456
1035
0,62
1,8
0,59
<no
0,10
<no
166
381
598
951
6,5
7,8
9,6
9,3
<no
<no
2,80
0,24
0,86
0,45
0,059
0,036
0,20
0,22
0,050
<no
<no
<no
<no
<no
<no
<no
0,42
0,33
505
483
605
892
1,2
1,7
3,6
<no
<no
<no
235
327
1196
1687
13,0
15,6
38,7
54,3
<no
<no
7,50
0,36
0,85
0,66
0,065
0,070
0,19
0,25
0,10
<no
<no
<no
<no
<no
<no
<no
0,63
0,48
528
529
1451
1142
6,8
4,6
0,12
<no
0,083
<no
1129
1013
3947
3539
39,4
35,0
67,3
51,7
0,18
<no
1,00
0,61
ill
0,8
0,150
0,083
0,39
0,26
0,08
<no
<no
<no
<no
<no
<no
<no
369
Таблица 5.6 (продолжение)
Элемент
Предел
обнаружения
(ПО)
Древесные
ид
зд
Р
Межкроновые
ид
зд
Р
Ег
Yb
Th
и
Ti
Zr
V
Nb
Cr
Mo
W
Mn
Fe
Co
Ni
CU
Ag
Zn
Cd
В
0,03
0,02
0,04
0,04
0,02
0,01
0,01
0,03
2
1
02
02
2
01
01
2
2
02
01
0,09
0,01
2,0
05
10
6
0,08
0,20
1
1
2
2
0,08
0,07
_2
2
007
0,08
5
3
0,17
<no
0,31.
<no
0,059
0,070
0,072
<no
<no
5,0
1,2
<no
8,0
7,2
0,23
<DL
3,3
<no
0,72
0,45
0,36
0,54
1278
861
283
204
3,6
1,8
64,8
43,1
45,9
80,1
<no
123
92,2
4,90
0,94
38,8
22,6
<no
<no
<no
<no
0,038
0,052
0,084
<no
10,4
9,2
1,8
<no
5,6
6,7
<no
<no
10,1
5,1
1,1
Q69
1,10
528
346
295
333
24,8
6,6
372
159,7
450
248,1
8,9
<no
83,1
72,5
13,6
2,9
43,8
25,8
<no
<no
<no
<no
0,058
0,050
<no
<no
<no
6,3
<no
<no
16,3
15,3
<no
<no
7,7
2Д
2,1
2,7
3,1
56,7
41,3
208
290
31,8
21,6
931
816
1439
785
<ПО
<по
94,6
86,6
6,8
3,3
12,5
13,3
<ПО
<ПО
<ПО
<ПО
0,028
0,016
0,069
<ПО
<ПО
4,3
<по
<по
2,8
<по
<по
<по
2,5
<по
0,36
<по
Q15
<по
47,6
102
148
167
0,32
<по
12,5
3*6
87,1
11,8
6,9
<ПО
45,6
22,1
1,6
07
25,2
<ПО
<по
<по
<по
<по
0,035
<по
<по
<по
4,1
6,0
0,45
<по
<по
<по
<по
<по
<по
<по
0,65
<по
0,14
0,33
381
621
130
233
3,1
2,4
31,4
36,3
22,1
24,4
2,2
<ПО
29,8
48,9
2,4
1,5
10,4
4,40
<ПО
<по
<по
<по
0,048
0,024
<по
<по
<по
4,0
0,64
<ПО
Ъ1
4,3
<по
<по
3,4
<по
0,39
<ПО
0,70
0,39
206
201
232
211
72,3
49,9
1514
1609
730
461
0,14
<ПО
938
228
7,7
6,5
8,1
7,0
370
Таблица 5.6 (окончание)
Элемент
Предел
обнаружения
(ПО)
Древесные
ид
зд
Р
Межкроновые
ид
зд
Р
А1
Ga
Т1
С
Si
Sn
Pb
Р
As
Sb
Bi
S
Br
«
5
5
0,09
0,20
0,02
0,03
41
42
0,2
0,2
0,2
0,02
68
79
0,9
1,0
0,05
0,06
0,07
0,02
62
54
21
18
Июнь, июль;
869
557
0,81
<DL
0,068
<DL
56600
14020
542
546
1,20
0,26
139
2,8
313
800
4,0
8,1
0,40
0,41
<no
0,047
11873
7623
32,2
<no
ПО - предел
619
546
<ПО
<по
0,200
0,069
29500
41500
682
1254
<ПО
1,5
240
7,9
195
199
21,2
24,8
0,51
0,44
<ПО
0,12
9117
6432
<ПО
<ПО
обнаружения.
750
639
<ПО
<ПО
0,13
0,54
13390
23300
275
919
<ПО
1,2
7,9
6,4
137
204
41,4
43,6
0,62
0,45
<по
0,16
7740
6991
<по
<ПО
163
345
<по
<по
<по
<по
20100
29400
481
627
<по
0,61
39,0
3,2
368
<ПО
<ПО
<ПО
<ПО
0,082
<ПО
0,027
1004
1150
<ПО
<ПО
178
578
<по
<по
0,180
0,088
34600
46100
190
1127
<по
1,8
64,3
8,8
<по
<по
4,6
3,0
0,17
0,15
<по
0,092
1073
1897
<по
<по
682
768
<ПО
<ПО
0,200
0,086
30950
7710
505
1219
<ПО
1,1
4,4
4,5
189
<ПО
19,7
12,1
0,46
0,21
<ПО
0,063
10027
9549
<ПО
<по
Таблица 5.7. Валовые концентрации элементов в почвенных водах из почвенного профиля в
древесных и межкроновых парцеллах на разных стадиях деградационной сукцессии, мкг/л
Элемент
Предел
обнаружения
(ПО)
Древесные
ид
зд
Р
Межкроновые
ид
зд
Р
Li
Na
К
0,2
0,2
10
10
171
203
4,60*
0,85**
5816
611
930
1178
1.1
14
581
1409
743
321
0,91
1,20
808
907
960
1035
0,70
но
978
но
477
<ПО
0,86
но
853
но
555
<ПО
1,0
но
1016
но
1064
<ПО
371
Таблица 5.7 (продолжение)
Элемент
Предел
обнаружения
(ПО)
Древесные
ид
зд
Р
Межкроновые
ид
зд
Р
Rb
Cs
Be
Mg
Ca
Sr
Ba
Y
La
Ce
Pr
Nd
Sm
Eu
Gd
Dy
Ho
Th
U
Ti
0,20
0,04
0,03
0,1
0,06
0,06
9
12
10
0,3
0,3
0,3
0,2
0,1
0,1
0,02
0,02
0,02
0,05
0,02
0,02
0,03
0,04
0,03
0,05
0,03
0,04
0,05
0,06
0,03
0,06
0,01
0,01
0,02
0,01
0,01
0,03
2
1
2,9
3,4
0,64
<no
0,22
<no
3711
367
6471
851
50,8
7,2
58,4
11,5
0,43
<no
Ю
0,35
1,30
0,61
0,180
0,075
0,57
0,33
0,044
<no
0,052
<no
0,076
<no
0,11
<DL
0,034
<DL
<no
<no
0,036
<no
<no
3,2
2,20
0,36
0,059
<no
0,19
<no
232
455
1558
2128
14,1
16,9
25,3
38,8
0,16
<no
0,74
0,25
0,96
0,56
0,120
0,087
0,42
0,38
0,12
0,11
<no
<no
0,10
<no
<no
<no
<no
<no
0,039
0,016
0,023
<no
<no
4,6
2,6
3,3
0,49
<no
0,081
<no
798
922
2503
2730
27,8
31,0
59,0
62,5
<no
<no
0,15
0,48
0,13
0,25
<no
<no
0,076
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
<no
2,5
0,41
HO
0,059
HO
<no
HO
335
HO
1148
HO
9,3
HO
23,3
HO
<no
HO
0,51
HO
0,53
HO
0,051
HO
0,15
HO
0,055
HO
<no
HO
<no
HO
<no
HO
<no
HO
<no
HO
<no
HO
<no
HO
hi
HO
0,047
HO
0,13
HO
221
HO
432
HO
7,9
HO
55,0
HO
0,78
HO
4,3
HO
2,6
HO
0,39
HO
0,87
HO
0,13
HO
0,064
HO
0,15
ND
0,086
ND
<no
HO
<no
HO
<no
HO
<no
HO
2Л
HO
0,52
HO
0,11
HO
1063
HO
6140
HO
39,0
HO
167
HO
<no
HO
0,19
HO
0,19
HO
0,028
HO
0,059
HO
<no
HO
<no
HO
<no
HO
<DL
ND
<no
HO
<no
HO
<no
HO
<no
HO
372
Элемент
Предел
обнаружения
(ПО)
ид
Габлица 5.7 (продолжение)
Древесные
зд
Р
ид
Иежкроновые
зд
Р
Zr
V
Mo
W
Mn
Fe
Co
Ni
Cu
Ag
Zn
Cd
В
Al
Tl
С
Si
Sn
Pb
P
0,2
0,2
2
0,2
0,1
0,09
0,01
2,0
0,5
10
6
0,08
0,20
I
1
3
2
0,08
0,07
1_
2
0,07
0,08
5
3
5
5
0,02
0,03
41
42
0,2
0,2
0,2
0,02
68
79
<no
<no
<no
<no
<no
0,24
<no
<no
369
140
<no
108
2,60
0,44
22,1
4,8
6,6
7,9
<no
<no
29,9
31,9
0,35
0,54
14,4
3,7
502
630
0,045
<no
14800
13900
2098
1672
<no
0,58
0,28
3,50
2J6
<DL
0,27
<no
<no
<no
0,26
<no
0,13
0,23
92,9
132
46,3
223
4,7
4,7
68,5
108
49,5
27,7
0,11
<no
33,5
56,7
0,23
0,60
<DL
14,8
1050
2225
0,018
0,056
8300
12400
1021
878
<no
1,4
1,3
4,1
<no
<no
<no
<no
2,0
<no
<no
0,28
<no
<no
47,6
62,5
<no
95,4
28,5
24,9
889
1015
419
428
<no
<no
119
174
3,6
2,9
7,4
10,0
1109
1030
0,10
<no
11090
10900
1464
2099
<no
0,96
1,4
3,3
<no
<no
<no
HO
<no
HO
0,34
HO
<DL
HO
7,9
HO
14,7
HO
0,34
HO
6Д
HO
36,1
ND
0,37
HO
178
HO
<no
HO
<no
HO
169
HO
<no
HO
17800
HO
1842
HO
<no
HO
4,3
HO
<no
HO
<no
HO
<no
HO
<no
HO
<no
HO
24,9
HO
<no
HO
3,1
HO
18,2
HO
11,0
ND
<no
HO
14,8
HO
<no
HO
<no
HO
534
HO
<no
HO
11050
HO
1412
HO
<no
HO
0,41
HO
<no
HO
<no
HO
<no
HO
<no
HO
<no
HO
168
HO
17,9
HO
50,4
HO
1174
HO
15,6
ND
<no
HO
100
HO
0,42
HO
<no
HO
2135
HO
<no
HO
9790
HO
1719
HO
<no
HO
0,43
HO
<no
HO
373
Таблица 5.7 (окончание)
Элемент
Предел
обнаружения
(ПО)
Древесные
ид
зд
Р
Межкроновые
ид
зд
Р
Sb
Bi
0,05
0,06
0,07
0,02
62
54
<по
<по
<по
0,027
10311
2671
0,25
<ПО
<ПО
0,066
3368
5811
0,10
0,14
<ПО
0,040
4341
5048
<по
но
<ПО
но
1657
но
<ПО
но
<ПО
но
2216
но
0,057
но
<ПО
но
4519
но
' июнь, июль; ПО - предел обнаружения; но - не определяли.
Таблица 5.8. Аморфный, доступный для растений и обменный алюминий в иллювиальном
горизонте Al-Fe-гумусовых подзолов на разных стадиях деградационной сукцессии
Стадия
деградации
Древесные парцеллы
Аморфный
(оксалат
аммония), г/кг
Доступный
(ацетат
аммония), г/кг
Обменный
(калий
хлористый),
мгэкв/100г
Межкроновые парцеллы
Аморфный
(оксалат
аммония), г/кг
Доступный
(ацетат
аммония), г/кг
Обменный
(калий
хлористый),
мгэкв/ЮОг
ф
ид
зд
р
6,46
19,5
16,0
30,8
1,22
4,25
2,33
3,70
2,78
0,81
1,88
1,63
7,58
14,3
12,0
32,4
1,57
3,82
2,83
2,52
1,99
1,35
1,63
1,77
Таблица 6.1. Природные концентрации лантаноидов в растениях, мг/кг сухого вещества
(по: Markert, Zhang De Li, 1991)
Элемент,
порядковый
номер
La, 57
Се, 58
Рг,59
Nd,60
Sm,62
Концентрация
0,15-0,25
0,25-0,55
0,03-0,06
0,1-0,25
0,02-0,04
Элемент,
порядковый
номер
Ей, 63
Gd,64
Tb,65
Dy,66
Но, 67
Концентрация
0,005-0,015
0,030-0,060
0,005-0,015
0,025-0,05
0,005-0,015
Элемент,
порядковый
номер
Ег,68
Тт,69
Yb,70
Lu,71
Y.39
Концентрация
0,015-0,030
0,0025-0,005
0,015-0,030
0,0025-0,005
0,15-0,25
Таблица 6.2. Типы реакций, связанные с токсичным действием избытка элементов
(по: Кабата-Пендиас, Пендиас, 1989)
Микроэлементы в избытке
Тип реакции
Ag, Au, Br, Cd, Cu, F, Hg, I, Pb, U
Ag,Hg,Pb
As,Sb,Se,Te,W,F
Al, Be, Sc, Y, Zr, лантаноиды,
тяжелые металлы
Cs, Li, Rb, Se, Sr
As,B,Br,Se,Te,W
Изменение проницаемости клеточных мембран
Реакция тиольных групп с катионами
Конкуренция с жизненно важными катионами
Большое сродство к фосфатным группам и
активным центрам в АДФ и АТФ
Замещение жизненно важных ионов (главным
образом, макрокатионов)
Захват в молекулах позиций, занимаемых
жизненно важными группами
374
Таблица 6.3. Внутренние и внешние защитные приспособления растений к высоким
концентрациям тяжелых металлов (по Antonovics et al., 1971; Ильин, 1991)
Защитные приспособления
Внешние
Внутренние
1. Элемент находится в
нерастворимой в воде форме, при
наличии хорошо
растворимой формы осуществляется
быстрое разбавление
концентрации за счет
окружающей среды.
2. Количество свободно
диффундирующих ионов
элемента мало по сравнению с его
валовым содержанием.
3. Недостаточная подвижность
рассеянных элементов при
определенных условиях
1. Избирательное поглощение ионов.
2. Ограничение влияния ионов элемента на метаболизм путем их
переноса в вакуоль.
3. Ограничение влияния ионов металла на метаболизм путем их
перекачки из клетки.
4. Ограничение влияния ионов металла на метаболизм путем их
перевода в безвредную форму.
5. Экскреция - вывод элемента в "орган хранения".
6. Увеличение потребности ферментных систем в ионах металла.
7. Альтернативные метаболические реакции.
8. Увеличение концентрации метаболитов, которые
противодействуют ингибитору.
9. Увеличение концентрации ингибирующего фермента.
10. Сокращение потребности в продуктах ингибируемой системы.
11. Образование изоферментов с меньшим сродством к ингибитору
или увеличенным относительным сродством к субстрату.
12. Изменение в протоплазме с сохранением функций фермента
даже при замене физиологически нужных элементов токсичными.
Таблица 6.4. Влияние избытка микроэлемента в среде обитания
на содержание элементов в растении (по: Ильин, 1991)
Элемент в
растении
N
Р
К
Mg
Са
S
Na
Fe
Mn
В
Zn
Си
Mo
Al
Элемент в среде обитания
Fe
1
т
т <->
1
1
1
Мп
т
Т <-»
т *+
<-»
Т 1
т
1
1
т
в
*-*
Т «->
т
т
Т А
т
т
Zn
г
Т 1
Т 1
т
Си
Т 1
т
4
т
Т 1
т
Мо
т
т
т
Т 1
1
т
А1
Т 1
Обозначения: t - концентрация увеличивается; 1 - концентрация уменьшается; <-> - отсутствие
изменений.
375
Таблица 6.5. Классификация загрязнителей биосферы (по: Bowen, 1966)
Потенциальное загрязнение
Химический элемент
Очень интенсивное
Интенсивное
Умеренное
Слабое
Ag, Au, Cd, Cr, Cu, Hg, Pb, Sb, Sn, Ti, Zn
Ba, Bi, Ca, Fe, Mn, Mo, P, Ti, V
Al, As, B, Br, Be, CI, Co, F, Ge, K, Li, Na, Ni, Rb, V, W
Ga, I, La, Mg, Nb, Si, Sr, Та, Zr
Таблица 6.6. Химический состав хвои сосны из фоновых районов бореальных лесов, мг/кг
Возраст
хвои
Текущего года
Однолетняя
Многолетняя
Текущего года
Однолетняя
Многолетняя
Текущего года
Однолетняя
Многолетняя
Здесь
Са
1450*
3677**
2406***
1933
5247
3329
3189
14135
6282
1060
1909
1407
1753
3249
2567
2537
6216
3924
1417
2158
1867
2714
5653
4346
2550
5266
4407
и в табл.
Mg
802
1764
1274
641
1608
1180
374
1268
786
870
1238
1094
788
1326
1056
540
1298
773
717
935
829
631
882
788
592
959
774
6.7,6.10,
К
5571
12640
8421
2680
6112
4359
2786
5218
3863
6571
10417
8025
3346
7273
4937
2589
6132
3842
4545
7826
6327
3266
6198
4554
3491
6070
4462
6.11,6.13-
А1
Элементы
Fe
Mn
Северная тайга
100
410
239
139
624
311
159
1041
494
18
69
32
38
179
70
38
169
93
220
766
430
474
1704
1092
425
3048
1269
Средняя тайга
140
248
189
157
387
290
146
557
354
34
48
41
57
84
70
83
116
96
430
930
719
816
2120
1351
1151
2645
1896
Южная тайга
126
248
189
244
455
334
233
447
352
20
31
26
33
51
42
35
63
45
555
1022
774
1554
2227
1898
1528
2938
1891
Zn
27
61
43
27
79
50
27
81
56
26
40
35
30
66
46
28
81
56
28
35
31
45
61
51
45
59
50
-6.21: минимум, максимум,
Ni
0,72
7,90
3,26
0,78
8,02
2,52
0,36
6,40
2,48
1,78
4,43
2,98
0,48
2,84
1,39
0,25
1,97
1,09
1,71
4,25
2,88
0,49
2,23
1,32
0,50
2,05
1,34
Си
2,34
5,68
4,08
1,53
7,31
3,04
1,37
4,03
2,69
3,01
5,63
4,04
2,11
6,60
3,04
1,88
4,64
2,52
3,50
5,92
4,50
2,36
3,71
3,21
2,46
3,84
3,27
***
среднее.
Р
1362
2087
1627
879
1518
1119
771
1862
968
1428
1727
1542
956
1304
1136
815
1271
1045
1322
1744
1495
1023
1318
1189
979
1443
1215
S
586
1365
892
434
1129
773
465
1686
816
585
1091
804
283
992
771
562
862
745
324
782
415
337
491
395
339
585
410
376
Таблица 6.7. Химический состав хвои сосны в условиях медно-никелевого загрязнения, мг/кг
Возраст
хвои
Текущего года
Однолетняя
Многолетняя
Текущего года
Однолетняя
Многолетняя
а
664*
8708**
2690***
1207
8557
3872
914
9353
4728
1169
3086
1867
2097
5799
3295
2779
6803
4495
Mg
243
2018
1051
243
1892
1028
382
1806
845
721
1526
1013
709
1641
1055
384
4480
917
К
А1
Элементы
Fe
Mn
Zn
Ni
Комбинат "Североникель" (Мончегорск)
2371
12383
6990
2270
8270
4985
474
12783
3797
107
525
242
160
674
324
107
986
366
3
768
147
40
701
172
42
428
138
23
995
287
42
1424
563
135
1750
789
4
71
24
3
67
26
5
115
33
Комбинат "Печенганикель" (Никель)
4217
8287
6117
2835
4810
3567
1739
4003
2842
60
348
183
102
608
292
104
648
298
36
441
158
111
632
302
133
608
295
95
471
300
161
888
536
188
1267
737
19
45
30
16
78
35
14
82
35
7
1160
149
9
1303
182
11
912
95
7,30
36,31
17,73
10,21
40,82
21,78
9,02
42,51
17,64
Cu
4
709
102
11
864
112
12
734
47
4,78
18,88
10,65
6,79
28,97
14,82
6,44
29,43
13,05
P
1142
2945
1827
943
1450
1185
233
1200
959
1475
2667
1916
949
1480
1105
846
1330
1000
S
702
1962
1341
961
1848
1325
607
1747
977
1002
1647
1276
821
1782
1204
833
1939
1121
Таблица 6.8. Концентрация рассеянных элементов в хвое сосны текущего года в условиях
фона, медно-никелевого (Мончегорск) и железо-перерабатывающего
(Ковдор) производств, мг/кг
Элемент
Rb
Sr
Ва
Sc
Со
Se
Br
Ag
Sb
Cs
La
Ce
Sm
Eu
Gd
Tb
Та
W
Au
Th
30,3*
7,3
2,2
0,019
0,260
0,087
2,6
0,016
0,009
0,245
0,025
0,292
0,002
0,026
0,920
0,002
0,001
0,218
0,002
0,005
Фон
59,2**
10,7
5,8
0,308
0,740
0,172
8,6
0,033
0,040
1,190
0,062
0,292
0,004
0,039
0,920
0,002
0,003
1,770
0,006
0,007
41,3***
9,0
4,0
0,135
0,511
0,119
4,8
0,024
0,024
0,592
0,041
0,292
0,003
0,032
0,920
0,002
0,002
0,833
0,004
0,006
20,4
3,0
1,3
0,005
0,450
0,043
1,2
0,018
0,023
0,011
0,074
0,093
0,004
0,001
0,010
0,001
0,001
HO
0,001
0,003
Мончегорск
61,5
30,7
15,8
0,355
31,400
2,120
9,8
0,502
8,800
0,450
0,855
0,950
0,013
0,188
0,427
0,003
0,048
HO
0,010
0,022
34,0
19,2
7,0
0,101
7,469
0,634
3,3
0,167
0,616
0,128
0,241
0,594
0,009
0,036
0,248
0,002
0,013
HO
0,005
0,013
41,8
7,6
4,3
0,002
0,150
0,006
1,6
0,009
0,009
0,627
0,065
0,001
0,002
0,001
0,001
0,002
0,001
1,240
0,001
0,006
Ковдор
110,0
23,0
22,1
0,494
2,060
0,193
8,4
0,053
0,113
2,190
0,116
0,112
0,012
0,034
0,047
0,007
0,062
9,510
0,009
0,013
73,0
14,9
9,6
0,082
0,460
0,107
5,9
0,034
0,047
0,911
0,087
0,057
0,006
0,010
0,024
0,004
0,016
3,335
0,003
0,009
377
£2
I
§
s
I
I
2
к^я
CM CO
<s C; » см *-л ю со f^
со о ^ *-* -** см >n *-
00 »П CM SO Tf
S S 3 5 3
о" о о о о
"О « VO М О
Ы о> vo v© г^
00 О О •-» ~£ О 1л
"■"i v-i *■< ► о тз> •о
<* о о о — о ~
см£
CM VO
I v© ел g\ со g о см
. _ .. ; Ч ю 9. Р. Я. о q Ч °* 1
vo^»-cnr*^ooooo«noo
§22 о*
о о
^ О Г* 00 СО
VO СО
СО СМ Г»
' О О О* со" 00* О" О О" О" О"
г rog^s^^i^?
\о оо о\
S £ §0 8 з о.
тГОООГ^О'-О
ю «о «о «о
•or» см г- г- vo
£" СО ^ Г- *- Ov СО Ю СМ ^ СО Q v© Г- f-
С£ г» v© см vp см «— см —» ^- см со v© о *- «n ^ £
Ч 9 ^ ~„ <% q so «о q о. q с; q. см q о — ©- q £ q
^-oco^-ocscoooooooor»ooo — о — о
I
i
к
к
I
I
I
CO
q 8 \q v8 R
О vO ^* -" CO*
VOVO Г- CM Ю ^ Ю _ «O
^ооооог^ооо — о—«о
sisg
^ ^ ^ ~« S !2 SS
^CNCOOOOOOO'-Q.q
OO — OOOCMV0OOOOOV0OOO00
§2
CN
CM
CO
~ г» см *-
VO VO Ю — On CM
* _» __» + + #*
о см со r* «o
«-ч CO «O ON CO #si
- Q о 0- о Я
OOCMOO^^^tOOOOOCMOOO^-OCMO
I
«—oo P» 00 СЛ CM v© см СЛ v© «Л «о о о ел
00 00 CO ^ IO 00 O^Q^^-COCOvpOVOC^ooCO
n; 3. см! c* o> wo„ q см 5. q q. q q W* ~ £; ~ ^ q g q
00«000»-сО»ООООООсЛООО-"ОСМО
2
в
I
1
2
S. 8. 8. x R 4. «i °t 88.8.8. S. £ 8.8.5. %. ©. § 8.
OO^OOO^CMOOOOOCMOOO00O*-O
CM Г* CM
Г» CO VO — CO VO
^ Ож ооя смж смж 0 тг -г
о о о сГо'в осГ 2
о" о* о* о
OS 00 ^" О
оо Я S Й S
о см Я. 9 9 Ч
X — О О О 00
о2
I
е
I
Г» •— 00
00 «О J ОЛ VO
о о о 5 5 х
о i> JJ £[ 8. q 8. о -• 9 8, § 3„ о Я о
~ v© ~ © © О О SCMOOOOvOCM S
смемем f°g vocoo
9 <§. П Ч 5. о Ч ^ о 8. о Р о £ П 8- о со о S о
О О О О О XCOVO ХО ВО ХСМОО = — ХСМ X
I
й
£306>-2M^SaPD(SS6>-J3a5OKE2
378
Таблица 6.10. Химический состав хвои ели из фоновых районов бореальных лесов, мг/кг
Возраст хвои
Текущего года
Однолетняя
Многолетняя
Текущего года
Однолетняя
Многолетняя
Текущего года
Однолетняя
Многолетняя
Са
1154
6291
3117
4250
11289
7549
7132
22 348
13 672
1941
4490
3167
3510
7508
5012
5677
15 197
10 369
1611
3154
2228
1527
6961
3639
1667
9971
4828
Mg
891
1476
1117
904
1457
1124
553
1396
928
804
1221
968
665
1218
942
570
1093
853
692
1218
911
613
1276
922
453
1394
795
К
А1
Элементы
Fe
Мп
Северная тайга
4836
14875
7460
3991
7163
5147
1560
6965
2785
9336
17 504
12 726
5704
13 583
9199
3334
8998
5852
7173
12710
10175
5247
7221
6188
2907
5295
4174
15
321
73
20
170
92
41
341
148
7
108
42
6
102
52
28
96
57
214
1068
581
188
1737
985
350
2724
1322
Средняя тайга
17
41
26
8
69
37
20
121
64
26
48
36
19
68
38
25
82
41
Южная тайга
12
90
49
29
97
67
12
227
122
11
38
28
8
49
29
14
72
37
280
879
491
471
994
733
363
2144
1061
197
961
589
173
2364
1106
148
3008
1409
Zn
31
69
47
38
85
59
31
135
83
34
58
44
32
60
45
39
ПО
69
24
52
34
13
40
27
12
38
21
Ni
1,07
6,59
3,68
1,07
6,79
2,32
1,09
7,88
3,57
1,00
3,41
2,00
0,24
2,62
1,22
0,48
2,03
0,91
2,14
8,24
4,54
0,98
5,32
2,47
0,62
3,01
1,74
Си
1,65
4,88
2,51
1,47
5,52
2,64
1,19
6,66
2,01
2,16
4,00
3,00
1,40
2,54
1,93
0,96
2,33
1,74
2,41
4,60
3,69
2,00
4,61
2,65
1,91
4,16
2,53
Р
674
2179
1541
568
1712
1262
432
1317
825
1042
2786
2281
1327
2446
1901
1111
2204
1663
1246
2275
1821
778
1669
1123
432
1674
962
S
183
1150
687
126
1165
794
380
1977
1044
544
990
822
577
1093
869
922
1593
ИЗО
639
1152
769
599
1070
811
637
1512
1060
Таблица 6.11. Химический состав хвои ели в условиях загрязнения, мг/кг
Возраст хвои
Текущего года
Однолетняя
Многолетняя
Са
512
12 241
3399
992
8927
4709
1933
19 165
7346
Mg
581
1720
926
381
1263
846
220
1285
608
К
Медно-и
5372
14 300
9826
3566
11468
8315
2721
9179
5383
А1
[икелес
21
237
93
17
273
119
60
457
219
Элементы
Fe
юе заг
11
266
85
30
237
80
9
130
57
Мп
эязнение
34
1398
376
37
1564
571
34
1404
571
Zn
13
58
28
11
53
26
9
78
26
Ni
16
672
135
21
355
103
16
155
60
Си
5
384
69
8
231
54
9
108
28
Р
1161
2628
1860
964
2657
1568
554
1415
906
S
693
2954
1588
720
2956
1904
998
4010
2359
379
Таблица 6.11 (окончание)
Возраст хвои
_-—
Текущего года
Однолетняя
Многолетняя
Са
3222
4864
3983
6384
9392
7658
9181
13 483
11315
Mg
К
А1
Элементы
Fe
Мп
Zn
Апатито-нефелиновое загрязнение
845
982
920
745
1193
872
358
1060
615
8967
12 967
10 662
7089
9797
8195
5189
6320
5715
141
450
300
166
415
327
145
816
552
127
625
355
122
402
284
30
791
455
191
438
332
422
720
585
250
1051
787
43
68
53
57
83
69
42
98
71 '
Ni
8,41
17,04
11,90
7,99
18,13
12,50
9,05
18,03
12,65
Си
3,85
5,93
4,87
3,59
5,88
4,85
5,86
17,19
8,81
Р
1935
2389
2138
1711
2146
1899
729
1675
1231
S
664
1095
884
1032
1835
1400
855
2663
1662
Таблица 6.12. Концентрация рассеянных элементов в хвое ели разных лет в условиях фона и
апатитонефелинового производства, мг/кг
Элемент
Rb
St
Ва
Sc
Сг
Со
As
Вг
Мо
Ag
Cd
Sb
Cs
La
Се
Ga
Nd
Sm
Eu
Gd
Tb
Yb
Hf
Та
W
Au
Th
U
Rb
St
Ba
Sc
10*
22
20
0,02
3,4
0,18
0,031
1,40
0,024
HO
0,046
0,01
0,06
0,00
HO
0,68
2,40
0,01
HO
HO
HO
HO
HO
0,00
0,15
0,0005
0,006
HO
6
20
21
HO
Фон
Хвоя
17**
43
38
0,02
3,4
0,28
0,075
2,20
0,024
но
0,460
0,01
0,14
0,08
но
0,68
2,40
0,02
но
но
но
но
но
. 0,00
0,22
0,0008
0,007
но
текущего года
15***
33
29
0,02
3,4
0,23
0,057
1,67
0,024
но
0,235
0,01
0,10
0,03
но
0,68
2,40
0,01
но
но
но
но
но
0,00
0,18
0,0007
0,007
но
Хвоя первого года
11
60
48
но
8
40
38
но
10
27
14
0,04
1,0
0,21
0,036
1,20
0,098
0,025
0,065
0,01
0,03
0,03
0,42
3,70
0,04
0,09
0,01
но
0,00
но
0,04
0,01
0,06
0,0006
0,018
0,005
6
11
35
0,02
Загрязнение
26
56
30
0,14
1,0
0,62
0,260
2,70
0,098
0,038
0,091
0,01
0,11
1,50
2,10
3,70
8,00
0,55
0,01
но
0,02
но
0,04
0,02
0,32
0,0140
0,089
0,022
14
83
66
0,04
19
41
25
0,08
1,0
0,36
0,093
1,82
0,098
0,032
0,078
0,01
0,06
0,46
1,02
3,70
4,02
0,25
0,01
но
0,01
но
0,04
0,01
0,12
0,0050
0,041
0,011
9
63
51
0,03
380
Таблица 6.12 (окончание)
Элемент
Сг
Со
As
Вг
Мо
Ag
Cd
Sb
Cs
La
Се
Ga
Nd
Sm
Eu
Gd
Tb
Yb
Hf
Та
W
Au
Th
U
HO
0,20
0,036
1,50
0,040
0,051
0,160
0,01
0,05
0,00
HO
HO
HO
0,01
HO
0,19
HO
HO
HO
0,00
0,18
0,0005
0,003
HO
Фон
HO
0,30
0,067
2,10
0,040
0,058
0,160
0,04
0,09
0,10
HO
HO
HO
0,02
HO
0,19
HO
HO
HO
0,00
0,85
0,0008
0,005
HO
HO
0,25
0,056
1,73
0,040
0,055
0,160
0,02
0,06
0,05
HO
HO
HO
0,01
HO
0,19
HO
HO
HO
0,00
0,48
0,0007
0,004
HO
1,5
0,23
0,095
1,10
0,110
0,009
0,170
0,02
0,03
0,12
0,51
1,70
0,94
0,08
0,01
HO
0,00
0,02
0,04
0,01
0,12
0,0007
0,016
0,005
Загрязнение
U5
0,42
0,670
3,30
0,720
0,027
6,600
0,10
0,12
1,40
2,80
7,00
2,10
0,59
0,07
HO
0,01
0,02
0,04
0,02
0,35
0,0093
0,083
0,031
1,5
0,33
0,369
1,70
0,353
0,018
3,385
0,05
0,06
0,64
1,53
3,08
1,52
0,27
0,04
HO
0,01
0,02
0,04
0,01
0,20
0,0024
0,049
0,018
Многолетняя хвоя
Rb
Sr
Ba
Sc
Cr
Co
As
Br
Mo
Ag
Cd
Sb
Cs
La
Ce
Ga
Nd
Sm
Eu
Gd
Tb
Yb
Hf
Та
W
Au
Th
U
5
28
20
0,01
0,8
0,19
0,060
1,50
0,037
0,049
0,650
0,02
0,03
0,00
но
1,00
но
0,01
но
0,05
но
но
0,03
0,00
0,17
0,0006
но
но
6
75
54
0,01
4,7
0,33
0,100
230
0,037
0,049
0,650
0,07
0,05
0,13
но
7,70
но
0,01
но
0,05
но
но
0,03
0,00
0,20
0,0011
но
но
6
46
35
0,01
2,7
0,27
0,077
1,80
0,037
0,049
0,650
0,04
0,04
0,06
но
4,35
но
0,01
но
0,05
но
но
0,03
0,00
0,18
0,0008
но
но
5
73
32
0,03
но
0,40
0,100
1,60
0,400
0,034
0,530
0,04
0,03
0,13
1,40
1,80
но
0,22
но
но
0,01
0,06
0,02
0,01
0,08
0,0018
0,035
0,010
10
81
35
0,03
но
0,52
0,750
2,80
0,400
0,034
0,530
0,06
0,03
0,45
2,10
1,80
но
0,22
но
но
0,01
0,06
0,02
0,03
0,18
0,0019
0,066
0,023
8
77
34
0,03
но
0,46
0,425
2,20
0,400
0,034
0,530
0,05
0,03
0,29
1,75
1,80
но
0,22
но
но
0,01
0,06
0,02
0,02
0,13
0,0019
0,051
0,017
381
Таблица 6.13. Химический состав листьев березы, мг/кг
Регион
Лесотундра
Лесотундра
Са
5160
8798
6530
3396
10 527
6064
Mg
2352
3796
3141
1830
3996
2822
К
5599
10621
7457
Элементы
А1
Fe
Мп
Фон
21 66 415
58 168 1273
33 100 766
Zn
85
323
174
Медно-никелевое загрязнение
4062
13 098
7390
21 84 146
302 769 2013
64 251 778
70
344
154
Ni
8,55
18,48
14,26
18,52
121,36
54,27
Си
5,22
9,33
7,40
6,61
49,55
20,83
Р
1652
2313
1933
1259
3256
2114
S
835
1872
1356
731
4304
1829
Таблица 6.14. Химический состав листьев черники
из фоновых районов бореальных лесов, мг/кг
Регион
Северная
тайга
Средняя
тайга
Южная
тайга
Северная
тайга
Средняя
тайга
Южная
тайга
Лусо-
тундра
Са
6874
8653
7893
8553
12 887
10 661
8369
12 866
10 544
8942
14 093
11685
9593
11769
10877
11352
14 277
12 443
6461
10 578
8615
Mg
1223
2218
1741
1987
2921
2516
1760
2440
2082
1530
2062
1795
2554
3124
2813
2317
3001
2651
1676
3238
2376
К
5939
8527
6848
3711 \
6822
5183
4659
7065
6176
4939
9923
7492
7886
14997
11697
9381
12326
10905
4951
10730
7339
А1
<
76
122
105
112
147
136
153
219
187
59
353
226
253
349
292
246
422
327
Бер<
111
221
142
Fe
^основы
17
43
28
57
68
61
66
81
74
Еловые
78
82
80
118
350
229
104
148
121
?зовое р<
39
151
72
Элементы
Мп
елеса
360
4542
2538
3309
4981
4075
4323
6087
5194
леса
694
4483
2903
3559
5928
4459
5392
7181
6256
*дколесь
1186
3372
1900
Zn
10
21
14
12,0
14,4
13,0
15,5
22,4
18,0
12
42
31
15,8
22,5
19,0
18,9
21,0
20,2
е
7
32
15
Ni
5,19
6,49
5,79
1,8
4,4
3,0
3,4
4,8
4,1
5,0
9,9
8,2
1,3
3,2
2,5
3,6
5,3
4,2
5,71
11,44
7,40
Си
6,48
8,85
7,27
5,3
6,6
6,0
5,8
8,7
6,9
5,9
10,3
8,2
2,5
10,5
8,5
8,8
12,5
11,1
5,61
11,29
8,27
Р
897
1754
1340
1102
1359
1199
1101
1448
1273
147
1327
884
1336
2053
1755
1244
1495
1378
1071
2358
1632
S
702
2469
1703
1166
2242
1663
1481
2173
1728
1392
1991
1693
1750
4410
2811
1565
2490
2128
1206
1864
1455
382
Таблица 6.15. Химический состав листьев брусники
из фоновых районов бореальных лесов, мг/кг
Регион
Северная
тайга
Средняя
тайга
Южная
тайга
Северная
тайга
Средняя
тайга
Южная
тайга
Са
5497
8889
7654
4158
7872
6121
2932
9665
5541
4999
8393
6433
4880
8285
6309
3509
6550
5490
Mg
844
1937
1375
1234
3382
1738
1096
2539
1523
1021
1467
1240
1476
1923
1661
1239
2112
1610
К
2759
5034
3811
3890
9987
5425
2249
10724
4446
3736
9204
6325
4172
7651
5593
3514
5437
4440
А1
Fe
Элементы
Мп
Сосновые леса
96
245
145
104
258
181
69
229
145
69
228
140
185
322
250
17
202
127
13
133
39
28
ИЗ
61
16
48
32
Еловые
12
52
22
63
224
141
2
52
35
1306
2795
1908
1442
2744
2098
1187
4877
2857
леса
1055
2615
1917
1750
2863
2290
1180
2865
1898
Zn
21
43
34
20,8
31,1
25,3
15,4
45,6
28,6
15
36
28
25,1
37,7
31,4
15,6
57,2
30,1
Ni
1,9
8,5
4,9
0,7
1,6
1,1
1,1
2,2
1,7
1,90
5,62
4,29
0,7
2,8
1,3
0,8
2,4
1,6
Си
4,2
6,8
4,9
2,8
5,3
3,9
2,7
4,3
3,2
3,33
5,21
4,28
3,5
4,5
3,8
0,9
4,7
3,8
Р
620
1008
733
469
1198
848
635
1236
913
735
1037
824
843
1511
1065
462
1103
841
S
860
1566
1276
1141
2426
1724
941
2136
1546
650
3345
2488
1148
2896
1908
1110
2429
1864
Таблица 6.16. Химический состав листьев черники в условиях медно-никелевого
загрязнения, мг/кг
Регион
Элементы
Са
Mg
А1
Fe
Mn
Zn
Ni
Cu
Северная
тайга
Северная
тайга
Северная
тайга
Сосновые леса (комбинат "Североникель", Мончегорск)
5051 800 3620 94 20 477 6 20,99 11,84 752 1387
14 751 3021 14318 429 335 5337 31 854,26 757,23 1739 4433
9013 1669 9826 193 98 2309 12 188,19 139,86 1338 2024
Сосновые леса (комбинат "Печенганикель", Никель)
7701 2196 4153 69 35 1492 10 7,7 9,4
10 233 3502 8923 231 202 4217 15 36,0 32,0
8911 2460 7014 134 106 2851 12 17,1 14,4
Еловые леса (комбинат "Североникель", Мончегорск)
6061 1127 5890 177 39 1241 5 20,00 9,95 1242 980
9855 2676 17 370 630 477 5053 38 587,43 781,72 1810 3728
7945 1607 9814 326 150 2694 21 218,06 214,85 1498 2252
383
Таблица 6.17. Химический состав листьев брусники в условиях медно-никелевого
загрязнения, мг/кг
Регион
Элементы
Са
Mg
Al Fe
Mn
Zn
Ni
Cu
Сосновые леса (комбинат "Североникель", Мончегорск)
Северная тайга 5064 870 4577 71 17 527 5 18,41 6,37 588 839
9145 1804 9303 215 81 2507 22 260,99 147,89 919 3127
6790 1295 6449 139 37 1250 13 68,23 27,20 753 1499
Сосновые леса (комбинат "Печенганикель", Никель)
Северная тайга 3798 909 2242 44 33 811 5 7,6 6,3
6166 1899 5066 231 207 2331 16 28,0 13,3
5282 1272 3928 125 85 1674 11 13,1 9,0
Еловые леса (комбинат "Североникель", Мончегорск)
Северная тайга 4040 926 4202 77 12 418 7 12,21 5,75 368 896
11669 2448 8814 242 80 3443 31 177,22 94,17 1091 4095
6555 1512 6303 134 38 1576 15 59,26 23,41 777 1585
Таблица 6.18. Химический состав листьев вороники
Регион
Са
Северная тайга 4719
12 877
7799
Северная тайга 4497
9097
6335
Таблиц]
Регион
Са
изфс
Mg
1295
2429
1788
1839
2300
2103
16.19.51
ме
Mg
НОВЫХ ]
К
1522
7399
4631
3774
12 108
7085
[имичес
ДНО-НИК
К
>айонов северной тайги, мг/кг
Элементы
А1
Fe
Mn
Сосновые леса
41 56 123
268 335 1306
137 156 772
Еловые леса
29 30 511
209 136 2385
94 82 1098
кий состав листьев i
[елевого загрязнени
Элемент
А1
Fe
Mn
Zn
13
35
20
12
39
24
ворони
я, мг/к
ы
Zn
Ni
7,0
16,4
11,5
4,84
19,24
1135
Си
5,2
9,3
7,3
5,44
19,55
9,73
ки в условиях
г
Ni
Си
Р
531
1283
916
749
1619
1163
Р
S
587
1858
984
842
2999
1759
S
Сосновые леса (комбинат "Североникель", Мончегорск)
Северная тайга 3860 919 3531 24 35 60 5 20,4 9,5 430 370
11337 2050 9646 572 895 951 41 1635,8 965,9 1300 2397
6880 1272 5991 243 343 298 15 427,6 276,7 739 1228
Сосновые леса (комбинат "Печенганикель", Никель)
Северная тайга 4823 1205 2642 47 127 277 4 16,5 9,0
7783 1856 5534 307 674 659 12 50,2 40,8
5867 1564 4192 168 341 483 8 31,2 21,0
Еловые леса (комбинат "Североникель", Мончегорск)
Северная тайга 2922 485 3702 27 34 70 3 17,6 9,3 432 510
10417 2595 15 837 751 1242 991 33 1717,4 1528,4 1758 2645
5732 1221 6955 197 314 376 14 324,0 236,3 850 1192
384
Таблиц» 6.20. Химический состав луговика извилистого
из фоновых районов северной тайги, мг/кг
Ельники
Са
1965
4227
3045
Mg
487
881
749
К
10283
13680
11984
А1
71
212
121
Элементы
Fe
Мп
44 429
186 1151
93 822
Zn
33
57
46
Ni
6,0
1U
ял
Си
4,0
11,4
1Л
Р
1383
1931
1694
S
997
1674
1374
Северная
тайга
Таблица 6Л1. Химический состав луговика извилистого
в условиях медою-янкелевого загрязнения, мг/кг
Регион
Северная
тайга
Элементы
Са
а
409*
Mg
>сновые
354
К
леса (ко*
3245
АК
ибинат
350
Fe*
"Север
886
Mm
юникель
87
Zra
Ni
.", Мончегорск)
20 642,2
Си
338,5
Р
823
5
677
965 599» 5052 766» ЮТ 229 46 2739,0» 974,8 1050 965
629*** 490 39611 617 1239 146 33 Г470;0 697,4 949 867
Сосновые леса (комбинат "Печенганикель", Никель)
1241 585 9793 22 52 164 6 10,2 64 732
Северная
тайга
2110
1723
763
3701
1449
1114 15047 152 385 6Гб
823 11688 71 187 Ш
Еловые леса (комбинат "Североникель"
389 5089 84 137 134
869 11762 636 1573 792
537 8206 318 683 377
73 38,5
18 20,5
Мончегорск)
16 132,3
46 1074,5
33 532,2
31,6
1*7
52,0
535,4
269,7
1733
1155
775
1390'
1082
632
2172
1369
Таблица 6.22. Сопоставление концентраций некоторые! микроэлементов^ в лишайниках
из фоновых и промышденно развитых регионов» мг/кг (по: Nash,. 1996; Бязреву 2000)
Элемент
Се
и
As
Ni
V
Zn
Си
Hg
Pb
Фон
0,18-0,89
0,5-1,0
0,06-2,21
1,7-5,5
0,17-9,7
10-30
0,7-5,0
0,009-0,101
0,4-9,2
Воздушное
промышленное загрязнение
2,2-7,2
3,0-151
128-1140
8-312
150-578
1000-25000
15-25Q
0,4O-Oi87
111-270
Источник загрязнение
Электростанции
Рудник
Плавление золота
Плавка: никеля
Древесная пульпа для бумаги
Плавка цинка
Плавка никеля;
Хлорночцелочной завод
Городской автомобильный транспорт
13. Рассеянные элементы
385
Таблица 6.2Э. Химический состав лишайников из фоновых районов бореальных лесов, мг/кг
Типы леса
Березняки
Сосняки
Ельники
Сосняки
Сосняки
Са
147*
695**
387***
44
968
385
176
616
335
244
450
361
464
1116
706
Mg
191
552
350
106
1422
332
171
270
220
208
352
278
177
285
243
К
969
1514
1292
706
6468
1551
1288
1568
1448
1251
2331
1729
1311
2069
1720
А1
Элементы
Fe
Мп
Северная тайга
124
967
466
90
1017
354
101
426
295
76
1197
545
80
1715
415
74
493
277
8
108
35
И
296
51
11
263
122
Средняя тайга
138
269
207
146
351
248
17
65
38
Южная тайга
117
231
142
36
152
83
44
151
91
Zn
15
25
20
8
44
19
13
23
18
13,9
29,6
18,6
17,6
40,6
26,1
Ni
2,4
14,8
8,0
1,3
16,9
5,7
2,6
9,9
5,4
0,6
3,0
1,4
0,7
1,3
1,0
Си
1,7
10,8
5,8
и
10,3
4,4
2,3
8,4
5,7
1,1
2,3
1,6
1,1
1,6
1,3
Р
356
529
461
106
739
339
396
727
529
320
674
465
277
593
433
S
254
456
350
551
551
551
373
428
395
211
727
460
290
649
439
Таблица 6.24. Химический состав лишайников сосновых лесов в условиях медно-никелевого
загрязнения (комбинат "Печенганикель", Никель), мг/кг
Элементы
Са
Mg
А1
Fe
Mn
Zn
Ni
Cu
46'
137*M
80***
402
686
500
1101
2478
1539
263
693
485
751
1350
1226
17
101
36
18
50
27
58,86
81,93
73,91
47,30
169,38
84,40
Таблица 6.25. Концентрация рассеянных элементов в лишайниках Хибин, мг/кг
Элемент
Минимум
Максимум
Среднее
Элемент
Минимум
Максимум
Среднее
Rb
Cs
Sr
Ва
Sc
La
Се
Nd
Sm
Eu
Gd
Tb
Dy
Yb
Lu
Th
U
2,3
0,05
9,1
4,0
0,027
1,3
1,6
0,5
0,123
0,018
0,129
0,009
0,004
0,024
0,054
0,043
0,017
11,2
0,24
286,3
54,4
0,328
19,8
16,0
9,6
1,022
0,272
1,605
0,133
0,526
0,266
0,383
0,764
0,156
5,6
0,12
42,5
12,5
0,107
4,5
4,8
2,2
0,303
0,083
0,488
0,036
0,136
0,089
0,175
0,153
0,063
Ti
Hf
V
Та
Cr
Mo
W
Ag
Au
Cd
Hg
In
As
Sb
Se
Br
I
2,5
0,02
0,82
0,014
0,500
0,043
0,060
0,024
0,001
0,044
0,005
0,003
0,323
0,035
0,209
0,55
0,20
26,9
0,21
10,74
0,206
2,677
2,300
0,785
0,225
0,014
0,636
0,121
0,085
1,600
0,228
1,017
1,43
0,66
10,3
0,08
2,48
0,103
1,213
0,302
0,156
0,097
0,002
0,284
0,021
0,034
0,783
0,076
0,553
0,92
0,40
386
Таблица 6.26. Результаты факторного анализа концентраций некоторых
макро- и рассеянных элементов в лишайниках высокогорных поясов Хибин
Переменная
Фактор
1
2
3
4
Са
Mg
К
А1
Fe
Мп
Zn
Ni
Си
Р
S
Sr
Дисперсия
% от общей дисперсии
0,009
0,288
0,844
0,048
0,199
0,244
0,685
-0,169
-О,020
0,825
0,548
-0,135
2,395
0,200
0,888
0,850
-0,104
-0,097
0,008
0,247
0,136
0,108
-0,046
0,007
0,156
0,877
2,418
0,201
-0,123
0,056
-0,151
-0,031
0,047
0,255
0,400
0,890
0,897
-0,221
-0,016
0,174
1,946
0,162
-0,269
0,009
0,001
0,821
0,896
0,054
-0,214
0,121
-0,111
0,336
0,213
0,084
1,789
0,149
Таблица 6.27. Группировка тяжелых металлов, концентрирующихся в Hylocomium
splendens, в зависимости от источника поступления
(по: Steinnes, Sjobakk, 1992)
Источник
Элемент
Локальный техногенный источник
Трансграничное поступление
Локальное почвенное пыление
Морская импульверизация
Перемещение из почв через высшие растения
(вымывание из надземной части)
Сг, Ni, Си
V, (Со), (Си), (Zn), As, Se, Mo, Ag, Cd, Sb, Pb
Sc, (V), (Cr), Co, Fe, La, Sm, Th
Se, Br, I
Zn, Mn, Rb, Cs
Типы леса
Таблица 6.28. Химический состав зеленых мхов
из фоновых районов бореальных лесов, мг/кг
Са
Элементы
Mg
К
А1
Fe
Мп
Zn
Ni
Си
Р
S
Березняки
Сосняки
Ельники
Сосняки
1735*
2852**
840
1768
2316*** 1193
1604
3004
2365
1844
3956
2597
1703
2752
2356
693
1970
1051
751
1976
1156
585
830
714
4106
5346
4654
3479
13861
5725
3758
10138
5370
Северная тайга
105
1482
380
109
3971
778
204
2316
711
87
2069
461
134
1513
698
126
2405
715
287
694
480
110
750
501
205
919
526
Средняя тайга
3519 430 567 607
6062 909 837 836
4804 639 704 676
41
63
56
23
184
64
33
202
71
34,4
49,3
40,6
2,99
12,87
6,63
2,69
32,67
9,08
1,33
16,82
7,95
2,2 4,С
2,6 5,8
2,4 4,5
3,49
19,81
7,56
2,91
31,97
9,68
3,39
30,73
9,32
)
903 433
1565 891
1189 659
753 554
1543 1758
1040 921
768 482
1446 1620
1099 876
589 757
1119 1510
867 1134
13*
387
Таблица 6,28 (окончание)
Типы леса
Ельники
Сосняки
Ельники
Са
1703
3733
2590
2308
3941
3130
2992
4075
3326
Mg
585
1409
972
529
931
730
853
1221
1053
К
3519
8941
6493
4070
7341
5688
7439
10641
9058
А1
374
909
567
Элементы
Fe
302
837
600
Мп
132
836
504
Южная тайга
284
458
353
314
455
368
69
226
146
224
367
269
191
390
301
501
1574
896
Zn
34,4
56,7
43,1
38,9
89,1
58,5
42,1
46,0
43,8
Ni
2,2
3,5
2,7
U
1,9
и
W
2,4
1,9
Си
3,6
7,2
5.3
3,3
4,9
4,4
4,4
7,0
5,8
Р
589
1759
1182
483
1120
820
1333
1948
1690
S
757
1969
1208
806
1309
1041
1218
1963
1617
Таблица 439+
г разному тияу загря
и, мг/кг
Тип загрязнения
Медно-никелевое
(Мончегорск)
Медно-нике левое
(Никель)
Железорудное
(Кавдор)
Са
1694
9814
5101
1667
6085
3835
1725
7047
4886
Mg
402
2437
1250
734
2S97
1660
747
3573
1861
AI
387
3546
1439
467
1904
1257
341
1087
Элементы
Fe
392
16516
3958
904
5820
3729
420
4040
2691
Mo
320
1005
642
279
1188
636
213
539
373
Zn
20
41
30
26
51
38
23
57
32
Ni
22
765
196
8
491
174
4
27
15
Си
15
859
191
28
345
117
6
28
15
388
тг <Ч -. » 4 <n "l гм * ©. П -1 -. <Ч о Ч 4 ~« П -.
CNP-Oen — — ©СПСПООООООООООСЧ
a
о
X
r
О О ^ Os
oo ci <Ч °1 <Ч - «П. Tt en *-* .
л « о «o « «n - m vo © —
Ф л О Ф - oo en «n "*t Os —-
©Г*СЧ — m©00Os — Os©
OOOOOOOOrf
s
^ СП © 00. '
M <П (S <- ф tn 1Л CS ^ - Ю
О. О О. ©. О О — -l О — (N
— еП©СЧО<Ч© — — ©©©©©©©О©©©
^ OS «О Ч© СП
ч " ri о\ о °. 'Ч °. ч *".
1Л)Щ<- «S^-OOOOOOOOOOO
«о о
— *- г-* on e>i»-'r*oor^osoo^-mcncn
(N 00 О — — 00 CM
©©©о©©©©©©—
OQ
8.
с
CO
i
I
i1
о
X
о
а
00 s© СП —
Oscn©CN©C4©<4
St-. — ©фспепооспоог*
ooooo — oo — cs
•> r. + * * »■ - » - »• •«
ooooooooooo
CN Os
СП NO — 00 — Ю — «OCSOsVO — VO
os П -• П П <4 ~. t- ч -i ^ ~ ©. - о. 4 en - «n oo.
— OsO»OtJ-VO — CSCSOOOOOOOOOO —
г- елГ <Ч <sf -* -* *4 ^ cn 4 4 4 ~ <4 <4 S
cs О cs en t^ Os
g 2
«N — © — — — P-
«oovcoooo — — © — -<t
00 О
^ <S envp — — oo en ir> чо v© v© «n
«о о г- os cn — уф о c5 ©. o^ ©_ o. — — ©„ — »n
OsNOOCSOenO — 00OOOOOOOOOOO
J CN 4
00 c*"l*1r*^r",i04.c4cN
HhONONON
*-* о* o" o* o" o" ©* ©* ©* ©* o* ©*
X
i
Stto en cnosvo? — уоюю оомм
^ 0* <n «> os. ож r^ _ ^ - 6; <s * ~ <ч <ч Ч гг <Ч <Ч
<S — OCNOTfOeneNOOOOOOOOOO —
* S 5 8
о ч ©. гг «о. <ч -. en p. © о. я. ©• p. я. -.©.,.
— TfOCSOCSO — VOOOOOOOOOOOO
s.
.=*
в
Д
S£3u6><s<J5«aF3^<S3(3l>-J3
389
Таблица 6.31. Коэффициенты биологического поглощения для доминирующих растений
Элемент
РЬ
Cd
Си
Zn
Сг
Ni
Со
Fe
Мп
V
Ва
Sr
А1
Sb
Bi
и
Th
Li
Rb
Cs
Mg
Ca
Y
La
В
Ga
Se
Hg
P
CI
Те
Береза
0,011
0,38
0,63
5,38
0,06
0,35
0,16
0,01
12,60
0,02
2,09
3,06
0,01
0,06
0,018
0,007
но
0,06
4,49
0,27
1,54
4,20
0,002
0,006
10,50
0,015
0,00
0,00
10,23
0,00
0,29
Черника
0,008
но
0,33
0,28
0,46
0,37
0,10
0,07
25,83
0,13
2,60
0,62
0,07
0,15
0,023
0,033
0,014
0,10
2,15
0,48
1,30
4,73
0,023
0,017
13,47
0,026
но
0,10
2,69
8,63
0,26
Брусника
0,005
но
0,40
1,00
0,06
0,21
0,06
0,01
26,11
0,02
2,06
1,10
0,04
0,09
0,009
0,002
но
0,04
1,42
0,71
0,86
5,59
0,002
0,003
7,86
0,007
5,33
0,24
3,98
1,00
0,05
Вороника
0,016
но
0,40
0,56
0,12
0,61
0,09
0,01
4,33
0,03
1,30
0,98
0,02
0,09
0,063
0,007
но
0,14
3,78
0,25
1,25
5,45
0,004
0,005
16,71
0,007
но
0,16
3,23
1,02
0,00
Луговик
0,000
но
0,34
0,68
0,10
0,17
0,04
но
8,94
0,02
0,62
0,65
0,00
но
0,009
0,002
но
но
4,04
0,64
0,62
0,99
0,001
0,003
5,14
0,030
5,87
но
7,44
но
0,21
Хвоя сосны, возрастные i
Текущая
0,002
0,17
0,46
1,48
0,04
0,32
0,07
но
4,10
0,01
0,22
0,49
0,04
но
0,027
-0,001
но
но
6,47
1,72
0,76
1,54
0,001
-0,001
9,50
но
но
но
7,09
1,02
0,00
1 год
0,010
0,17
0,37
1,55
0,07
0,25
0,12
0,01
7,24
0,02
0,39
0,94
0,10
0,13
0,018
0,002
но
но
4,95
0,45
0,70
2,76
0,003
0,005
6,86
0,007
но
0,16
3,77
0,94
0,00
2 год
0,022
0,13
0,55
1,45
0,12
0,37
0,19
0,02
7,62
0,03
0,43
1,05
0,10
0,11
0,036
0,007
но
0,10
3,57
0,24
0,54
3,25
0,005
0,007
6,86
0,007
но
0,16
3,16
0,97
0,45
слассы
Згод
0,024
0,12
0,45
1,23
0,10
0,25
0,13
0,01
6,24
0,03
0,48
0,93
0,07
0,09
0,027
0,013
но
но
2,99
0,19
0,34
2,57
0,006
0,007
6,00
но
но
0,16
2,46
0,99
0,00
Таблица 6.32. Различия в уровне концентрации элементов
между различными видами сосудистых растений лесов северной тайги
(по: Steinnes et at, 2000)
Элемент
Ранжирование растений* по уровням
концентрации элементов
Элемент
Ранжирование растений* по
уровням концентрации элементов
В Vm > Bp, Vv, Eh > Df Ni
Na Ps3 > Bp, PsO, Vm, Vv, Eh, Df Cu
Mg Bp, Vm > Vv, Eh > Ps, Df Zn
Al Ps,Vm,Vv,Eh>Bp>Df Rb
P Bp>Vm,Df,PsO>Vv,Eh>Ps3 Sr
S Vm, Vv > Bp, PsO > Vv, Eh > Ps3 Cd
Ca Bp,Vm,Vv,Eh>Ps3>PsO,Df Ba
Mn Vm > Vv > Bp > Ps, Eh, Df Pb
Fe Bp, Ps3, Vm; Eh > PsO, Vv > Df
*
Vm - Vaccinium myrtillus; Bp - Betula pubescens; Vv -
hermaphroditum; Df - Deschampsia flexuosa; Ps -Pinus sylvestris (O
Bp, Vm, Eh > Ps > Vv, Df
Vm > Bp, Ps, Eh > Vv > Df
Bp > Ps, Vv > Vm, Eh, Df
PsO > Bp, Vm, Eh, Df > Ps3, Vv
Bp > Ps3, Vv, Eh > PsO, Vm, Df
Bp > Ps > Vm, Vv, Eh, Df
Bp, Vm, Vv > Eh > Df, Ps3 > PsO
Ps3 > Bp, Vm, Eh > Vv > PsO, Df
Vacinium vitis-idaea; Eh- Empetrum
- текущая хвоя; З - многолетняя хвоя).
390
Таблица 7.1. Распределение микроорганизмов по ярусам лесных биогеоценозов
Ярус
Надземный
(филлоплана)
Наземный
(подстилка)
Почвенный
Горизонт,
слой
L
F + H
А1
А2
Численность микроорганизмов
млн/г
Бактерии
0,1-2
50-3000
1-100
0,5-1,0
0,1
Актиномицеты
0,1-0,2
0,1-0,5
0,4-1,0
0,7-2,0
тыс/г
Дрожжи
10-20
50-3400
30-4000
10-300
1-200
Грибы
5-140
300-1500
200-900
50-100
4-80
Таблица 7.2. Сезонная динамика численности бактерий (млн/г) в лесной подстилке ельника
волосистоосокового (Чашниково Московской обл.)
Слой
подстилки
L
F+H
Май
3000
45
Июнь
150
87
Июль
47
Сентябрь
38
115
Октябрь
157
22
Ноябрь
390
2
Таблица 7.3. Численность дрожжей в лесных подстилках и почвах в разные сезоны годы
(тыс/г) (Московская обл., Нарофоминский район)
Тип леса
Горизонт,
слой
Май
Июнь
Октябрь
Декабрь
Февраль
Апрель
Березняк
Ельник
L
F+H
А1
А2
F+H
А1
А2
1010
-
270
105
5000
208
195
94
442
78
52
907
178
57
50
31
12
-
2100
10
1
3400
4370
185
20
2500
130
И
1710
-
147
65
40
34
7
2210
840
181
230
3300
300
76
391
Таблица 7.4. Численность представителей разных родов актиномицетов в дерново-
подзолистой почве (тыс. КОЕ/г субстрата)
Горизонт,
глубина, см
Сгрептомицеты
Стрептовер-
тициллы
Стрепгоспо-
рангии
Микромоно-
споры
Нокардии
L,0-2
F+H, 2-3
А1.3-12
3001150
8001350
13001600
2,010,9
40+25
2,511,1
6,313,1
1218,3
31118,2
10,512,7
2619,6
8,112,7
1017,3
813,9
1217,2
Таблица 7.5. Доминирующие роды бактерий в разных ярусах лесного биогеоценоза
Ярус
Растения и их
части, горизонт
Таксон
Функционально-
трофические группы
Надземный
(филлоплана)
Наземный
(подстилка)
Почвенный
Кора ели, шишки, хвоя Myxobacterales,
Листья деревьев и
кустарников
Травы, злаки, осоки
L
F+H
А1
Rhodococcus
Flavobacterium,
Micrococcus, Rhodococcus
Erwinia,
Methylobacterium,
Clavihacter,
Curtobaclerium
Cellulomonas, Cytophaga,
nop. Myxobacterales
Bacillus, Streptomyces,
Rhodococcus,
Cellulomonas, nop.
Myxobacterales
Streptomyces, Bacillus,
Nocardia, Rhodococcus,
группа почкующихся и
стебельковых
олиготрофных бактерий
Экриссотрофы,
копиотрофы
Подстилочные
сапротрофы
Гидролитики
Педобионты-
сапротрофы,
гидролитики,
олиготрофы
Таблица 7.6. Пространственная и временная частоты встречаемости видов актиномицетов в
разных биогеоценотических горизонтах лесного биогеоценоза (%)
Секция
Серия
Слои подстилки и горизонты почвы
F+H
А1
А1А2
А2
Cinereus
Streptomyces
Achrormgenes
Chromogenes
Chrysomallus
Violaceus
50
90
5
20
-
5
15
50
75
_8^
15
8
50
-
50
75
20
100
20
60
-
50
90
20
90
10
50
-
50
75
10
75
5
20
-
392
Таблица 7.6 (окончание)
Секция
Серия
Albus Albus
Albocoloratus
Helvolo-Flavus Helvolus
Roseus Fradiae
Слои подстилки и горизонты почвы
L
20
100
10
20
20
45
-
Micromonospora
-
-
F+H
40
100
-
15
30
-
5
15
Примечание. Над чертой - пространственная, под чертой -
мости;"-" - виды не встречаются.
А1
40
100
20
60
20
60
12.
20
10
75
А1А2
50
100
11
75
15
75
-
80
А2
30
75
20
75
20
75
-
20
75
временная частота встречав-
Таблица 7.7. Типичные виды грибов в разных ярусах ельника волосисто-осокового
Ярус
Субстрат,
слой, горизонт
Вид
Функционально-трофические
группы
Надземный
(хвоя)
Наземный
(подстилка)
F+H
Почвенный
А1
А2
Aueobasidium pullulans
Cladosporium herbarum
Aueobasidium pullulans
Aposphaeria pulviscula
Cladosporium herbarum
Trichoderma hamatum
Aueobasidium pullulans
Cladosporium herbarum
Chrysosporium sulfureum
Penicillium frequentans
P. cyclopium
Trichoderma koningii
Verticillium terrestre
Chrysosporium sulfureum
Mortierella ramanniana
Verticillium terrestre
Penicillium dahime
P. frequentans
P. simplicissimum
Trichoderma koningi
Chrysosporium sulfureum
Mortierella ramanniana
Penicillium dahliae
P. frequentans
Verticillium terrestre
Эккрисотрофы, копиотрофы
Подстилочные сапротрофы,
гидролитики
Педобионты, олиготрофы
393
Таблица 7.8. Вероятности доминирования видов дрожжей (доля образцов,
в которых вид был обнаружен в качестве преобладающего, от общего количества
проанализированных образцов данного субстрата, %) на различных стадиях
пространственно-сукцессионного ряда
Вид
С. albidus
С. laurentii
R. glutinis
М. pulcherrima
S.roseus
M. reukaufii
Candida spp.
L. scottii
C. luteolus
R. fujisanensis
С capitatum
T. pullulans
C. terricola
C. podzolicus
Живые части
37
21
8
6
5
3
3
10
3
4
Мертвые
части
44
18
15
7
8
8
Подстилка
51
13
4
4
15
9
4
Верхние
горизонты
10
20
60
10
Нижние
горизонты
81
19
Таблица 7.9. Численность микроорганизмов в почвах различных парцелл ельников
кустарничково-зеленомошных (фон)
Горизонт,
глубина, см
Бактерии, млрд/г
Мицелий
актиномицетов, м/г
Мицелий грибов,
м/г
Споры грибов,
спор/г
FH,0-3
Н,3-6
Е,6-12
В, 12-22
ВС, 22-35
FH,0-4
Н,4-10
Е, 10-15
В, 15-25
ВС, 25-40
1,5/но*
1,5/2,0
1,7/0,7
1,2/0,7
0,8/0,5
0,6/1,8
2,0/1,4
2,1/0,7
0,8/0,4
0,7/0,2
Примечание. Здесь и
Кустарничково-зеленомошная
в табл.
144/но
96/109
120/87
80/83
48/54
Еловая
90/170
148/205
140/145
80/54
34/25
7.10-7.13 числитель-
259/но
989/1473
1104/1104
347/336
91/125
763/3533
869/1392
221/1373
160/672
80/107
2,5/но
3,7/6,7
3,8/6,2
3,2/3,5
2,5/2,4
5,3/11,0
2,5/4,8
3,2/4,3
1,8/3,4
1,8/1,4
начало вегетационного периода
Таблица 7.10. Биомасса микроорганизмов в почвах различных парцелл ельников
кустарничково-зеленомошных (фон), мг/г
Горизонт,
глубина, см
Бактерии
Мицелий
актиномицетов
Мицелий
грибов
Споры грибов
Итого
FH,0-3
Н,3-6
Е,6-12
В,12-22
ВС, 22-35
0,03/но
0,03/0,04
0,03/0,01
0,03/0,01
0,02/0,01
Кустарничково-зеленомошная
0,006/но 0,52/но
0,004/0,004 2,10/3,60
0,005/0,003 2,12/2,70
0,003/0,003 0,46/0,65
0,002/0,002 0,15/0,29
0,03/но
0,06/0,13
0,05/0,09
0,04/0,05
0,04/0,03
0,59/но
2,19/3,77
2,21/2,81
0,53/0,72
0,21/0,33
394
Таблица 7.10 (окончание)
Горизонт
Бактерии
Мицелий актино-
мицетов
Мицелий
грибов
Споры грибов
Итого
FH,0-4
Н.4-10
Е, 10-15
В, 15-25
ВС, 25-40
0,01/0,04
0,04/0,03
0,04/0,01
0,02/0,01
0,02/0,00
Еловая
0,004/0,006
0,006/0,008
0,006/0,006
0,003/0,002
0,002/0,001
1,73/8,65
1,58/2,76
0,45Д,26
0,49/0,93
0,25/0,28
0,09/0,25
0,05/0,10
0,04/0,06
0,03/0,05
0,03/0,02
1,84/8,94
1,68/2,90
0,54/2,34
0,54/0,99
0,30/0,30
Таблица 7.11. Численность микроорганизмов в почвах различных парцелл ельников
злаково-кустарничковых (дефолиирующие леса)
Горизонт,
глубина, см
Od,0-2
Н.2-7
Е, 7-14
В, 14-30
ВС, 30-45
FH,0-3
Н,3-9
Е,9-18
В, 18-25
ВС, 25-38
Od,0-2
Н,2-4
Е, 4-11
В, 11-25
ВС, 25-40
Бактерии, млрд/г
Мицелий
актиномицетов, м/г
Мицелий грибов,
м/г
Злаково-кустарничковая
1,3/но
3,0/1,8
1,3/1,9
1,0/1,0
0,9/0,7
1,6/1,9
2,3/1,5
1,5/0,8
1,4/0,5
0,7/0,3
3,1/3,7
3,2/2,7
2,2/1,4
0,9/1,3
0,4/1,0
122/но
144/135
119/135
112/97
19/58
Еловая
160/155
140/126
116/93
96у70
39/50
Злаковая
158/193
173/122
130/97
83/112
58/58
125/но
1104/1080
979/25
331/22
230/60
538/1421
802/1181
1910/984
355/740
407/154
442/1113
394/892
542/700
451/434
504/504
Споры грибов,
спор/г
1,9/но
4,3/12,5
3,8/44,5
2,7/37,4
2,4/15,8
5,3/8,6
5,8/4,8
4,3/4,8
3,5/2,9
1,4/2,9
4,8/12,0
3,2/16,3
2,4/16,8
2,9/26,4
1,6/31,2
Таблица 7.12. Биомасса микроорганизмов в почвах различных парцелл ельников злаково-
кустарничковых (дефолиирующие), мг/г
Горизонт
Бактерии
Мицелий
актиномицетов
Мицелий
грибов
Споры грибов
Итого
Злаково-кустарничковая
Od,0-2
Н,2-7
Е, 7-14
В, 14-30
ВС, 30-45
АО
АО
А2
В
ВС
0,03/но
0,09/0,04
0,03/0,04
0,02/0,02
0,02/0,01
0,03/0,04
0,05/0,03
0,03/0,02
0,03/0,01
0,01/0,01
0,005/но
0,011/0,006
0,005/0,005
0,004/0,004
0,001/0,002
Еловая
0,006/0,006
0,005/0,005
0,005/0,004
0,004/0,003
0,002/0,002
0,24/но
2,01/1,81
1,57/0,65
0,47/0,55
0,32/0,18
0,86/2,98
1,63/2,30
1,81/1,75
0,54/1,33
0,63/0,35
0,07/но
0,13/0,14
0,05/0,03
0,04/0,02
0,04/0,02
0,11/0,18
0,08/0,10
0,06/0,05
0,03/0,03
0,05/0,03
0,34/но
2,24/1,99
1,65/0,72
0,53/0,59
0,38/0,38
1,01/3,20
1,77/2,44
1,91/1,82
0,60/1,37
0,70/0,39
395
Таблица 7.12 (окончание)
Горизонт
Бактерии
Мицелий
актиномицетов
Мицелий
грибов
Споры грибов
Итого
Od,0-2
Н,2-4
Е,4-11
В, 11-25
ВС, 25-40
0,06/0,07
0,06/0,05
0,04/0,03
0,02/0,02
0,01/0,02
Злаковая
0,006/0,008
0,007/0,005
0,005/0,004
0,003/0,004
0,002/0,002
0,95/2,14
0,72/1,90
1,04/1,20
0,50/0,84
0,53/0,18
0,14/0,24
0,07/0,26
0,06/0,24
0,04/0,35
0,02/0,36
1,16/2,46
0,86/2,22
1,15/1,47
0,56/1,22
0,56/0,56
Таблица 7.13. Численность микроорганизмов в почвах различных
парцелл техногенного елового редколесья
Горизонт,
глубина, см
Od,0-5
Н,5-8
Е,8-10
В, 10-17
ВС, 17-35
FH.0-5
Е,5-7
В, 7-18
ВС, 18-35
Od,0-2
Н,2-5
Е.5-7
В, 7-15
ВС, 15-30
0-2
2-5
5-15
15-30
Бактерии, млрд/г
Злаке
2,0/но
3,2/1,3
1,5/1,3
1,0/1,0
0,7/0,9
4,2/2,0
1,2/0,9
0,9/0,3
0,7/0,1
5,9/2,0
2,0/1,5
1,7/1,5
0,9/1,3
0,5/1,0
2,5/0,9
0,9/0,9
0,7/0,3
0,8/0,2
Мицелий
актиномицетов, м/г
Мицелий грибов,
м/г
эво-кустарничковая парцелла
81/но
110/189
154/186
99/150
52/143
Еловая парцелла
112/135
173/109
92/73
54/58
Злаковая парцелла
289/199
112/127
141/154
54/116
44/102
Пустошь
173/116
87/131
71/58
77/25
197/но
221/469
360/365
322/100
173/45
528/264
667/283
446/77
134/37
706/1253
302/710
517/603
566/206
110/189
360/432
586/192
349/94
235/13
Споры грибов,
спор/г
4,0/но
2,9/6,2
2,5/4,3
3,0/3,0
1,3/2,0
7,7/3,8
2,9/5,7
2,9/1,9
1,9/2,4
6,7/8,6
3,0/5,8
4,8/5,8
2,1/4,3
2,1/2,8
3,8/9,1
2,9/4,3
3,7/3,0
3,4/1,7
Таблица 7.14. Биомасса микроорганизмов в почвах различных
парцелл техногенного елового редколесья, мг/г
Горизонт
Бактерии
Мицелий
актиномицетов
Мицелий
грибов
Споры грибов
Итого
СМ, 0-5
Н,5-8
А2,8-10
В, 10-17
ВС, 17-35
0,04/но
0,06/0,03
0,03/0,03
0,02/0,02
0,01/0,02
Злаково-кустарничковая парцелла
0,003/но 0,52/но
0,004/0,007 0,48/1,50
0,006/0,007 0,51/1,02
0,004/0,006 0,52/0,35
0,002/0,006 0,15/0,10
0,11/но
0,04/0,16
0,04/0,08
0,07/0,06
0,02/0,03
0,67/но
0,59/1,69
0,59/1,13
0,61/0,49
0,19/0,15
396
Таблица 7.14 (окончание)
Горизонт
FH,0-5
Е,5-7
В, 7-18
ВС, 18-35
Od,0-2
Н.2-5
Е,5-7
В, 7-15
ВС, 15-30
0-2
2-5
5-15
15-30
Бактерии
0,08/0,04
0,02/0,02
0,02/0,01
0,01/0,00
0,12/0,04
0,04/0,03
0,03/0,03
0,02/0,03
0,01/0,02
0,05/0,02
0,02/0,02
0,02/0,01
0,02/0,00
Мицелий
актиномицетов
Мицелий
грибов
Еловая парцелла
0,004/0,005
0,007/0,004
0,004/0,003
0,002/0,002
0,96/0,45
1,23/0,58
1,12/0,12
0,29/0,06
Злаковая парцелла
0,010/0,008
0,008/0,005
0,006/0,006
0,002/0,004
0,002/0,004
1,14/2,40
0,61/1,50
1,05/1,50
1,35/0,40
0,14/0,35
Пустошь
0,007/0,005
0,003/0,005
0,003/0,002
0,003/0,001
0,69/0,96
0,62/0,37
0,56/0,24
0,35/0,02
Споры грибов
0,10/0,38
0,03/0,05
0,07/0,02
0,05/0,02
0,12/0,23
0,10/0,09
0,20/0,10
0,06/0,08
0,01/0,05
0,06/0,41
0,01/0,09
0,04/0,08
0,06/0,02
Итого
1,15/0,88
1,29/0,65
1,21/0,15
0,36/0,09
1,39/2,68
0,76/1,62
1,27/1,64
1,43/0,51
0,16/0,42
0,81/1,39
0,65/0,48
0,62/0,33
0,43/0,05
Таблица 7.15. Содержание подвижных соединений элементов
(1М CH3COONH4, рН = 4,65) в почвах по типам состояния экосистем, мг/кг
Парцелла,
выборка
КЗ (/i = 26)
(я = 2)
(/i = 26)
Е (л = 47)
(л = 3)
(/1 = 40)
Зл (я = 8)
(/i = 6)
(я = 6)
Е (л = 8)
(/1=10)
(/1=10)
Зл-К(л = 26)
(/1 = 9)
(/1 = 9)
П (л = 5)
(л = 3)
(п = 3)
Е (л = 8)
(/1 = 3)
(л = 3)
Горизонт
О
Е
В
О
Е
В
О
Е
В
О
Е
В
О
Е
В
О
Е
В
О
Е
В
Са
459
17
74
2815
491
122
1876
69
67
1639
52
59
2054
34
33
Тех
1414
81
60
883
107
133
Mg
Ф01
155
4
16
462
5
20
Дефолиир
211
13
13
181
9
10
290
9
6
ногенное
159
13
10
131
13
9
К
i
70
13
27
1081
12
34
>ующий
702
49
37
574
27
30
593
42
18
редколесье
225
20
20
269
30
31
Р
19
1,0
16
247
2,0
19
78
9,7
13
71
8,8
19
77
5,8
15
25
5,5
6
30
4,0
6
S
55
3
38
153
6
48
104
9
59
117
12
58
113
10
59
138
22
102
172
32
109
Ni
0,7
0,01
0,6
4,0
0,3
0,6
242
7,3
5,0
141
8
8,3
145
2,4
1,6
586
31
17
587
55
35
Си
0,2
0,01
0,6
4,4
0,11
1,1
255
3,3
2,1
331
12
10
109
0,4
0,5
655
4,8
3,2
1205
31
9
397
Таблица 7.15 (окончание)
Парцелла,
выборка
Горизонт
Са
Mg
Ni
Си
Зл-К (л = 5)
(я-3)
(я-3)
Зл (л = 3)
(я-3)
(я-3)
О
Е
В
О
Е
В
2546
203
128
1995
130
117
296
19
19
336
23
14
306
33
30
438
46
41
46
2,5
4
54
3,9
6
140
24
108
135
29
130
640
2,9
7,0
633
27
мошная
(л-3) В 117 14 41 6 130 16
Примечание. Здесь и в табл. 7.16 обозначения парцелл: КЗ - кустарничково
ная; Е - еловая; Зл-К - злаково-кустарничковая; Зл - злаковая; П - пустошь.
404
20
0,7
200
4,5
1,6
-зелено-
Таблица 7.16. Состав лизиметрических вод по типам состояния экосистем,
парцеллам и горизонтам, мкгэкв/л
Парцелла
КЗ (л = 26)
КЗ (я-12)
Е(л-11)
Е(л = 27)
Зл-К (л-21)
Зл-К (л =13)
Е(л = 24)
Е(и«34)
Зл(л-15)
Зл(л=15)
Зл-К (л -14)
Зл-К(л = 23)
Е (л -17)
Е(л = 22)
Зл(л-10)
Зл(л = 24)
П(л-15)
П(л-18)
*РиС-
Горизонт
О
В
О
В
О
В
О
В
О
В
о
в
о
в
о
в
о
в
в мг/л.
РН
4,06
5,55
4,24
4,89
4,14
4,87
3,76
437
4,26
4,88
4,14
4,59
3,63
4,61
4,75
4,76
4,11
4,88
Са
116
47
576
268
147
128
435
305
71
96
331
223
287
204
132
166
341
251
Mg
65
30
201
128
75
63
202
140
31
42
Тех
136
81
126
99
57
64
96
85
К
56
15
329
138
Дефол
132
43
214
148
28
48
ногенн
97
32
136
47
140
76
20
24
NH4
Фон
243
43
540
124
ИИруЮ!
229
31
301
91
93
57
ое ред!
112
51
115
97
219
108
168
93
А1
80
20
111
76
ций
63
46
93
142
53
51
содесы
66
98
146
85
51
71
86
48
Ni
0,6
0,2
3,9
0,9
1,8
1,6
14,2
5,7
13
1Д>
44
26
55
44
19,5
21
56
15
Си
0,6
0,3
3,6
0,5
1,0
0,6
9,9
1,9
0,7
0,3
17
0,9
74
15
5,1
1,5
8,1
0,9
Р*
0,29
0,02
2,29
0,05
0,84
0,05
0,57
ОД 5
0,08
0,02
0,11
0,01
0,21
0,02
0,46
0,03
0,19
0,01
S04
82
84
748
535
232
174
1000
669
120
171
662
340
846
466
272
313
527
276
N03
9
2
51
14
24
4
67
26
3
5
39
189
31
65
141
211
131
228
С*
55,2
31,5
74,2
28,8
61,8
18,5
40,0
28,3
37,1
25,0
45,0
223
48,6
30,7
27,6
61,3
41,8
24,1
398
Таблица 8.1. Список видов афиллофоровых грибов старовозрастных северотаежных лесов
Вид
Семейство
Субстрат*
Amylocistis lapponica (Romell) Singer*
Cerrena unicolor (Bull.: Fr.) Murrill
Climacocystis borealis (Fr.) Kotl. et Pouzar
Daedaleopsis septentrionalis (P.Karst) Niemela*
Datronia stereoides (Fr.: Fr.) Ryvarden
Dichomitus squalens (Karst.) Reid*
Fomes fomentarius (L.: Fr.) Fr.
Fomitopsis pinicola (Sw.: Fr.) Karst.
F. rosea (Alb. Et Schwein.:Fr.) Karst.*
Gloeophyllum protractum (Fr.) Imazeki*
Gl. sepiarium (Wulfen: Fr.) Karst.
Gloeoporus dichrous (Fr.:Fr.) Bres.
Hapalopilus nidulans (Fr.) P. Karst
Heterobazidion annosum (Fr.) Bref.
Lenzites betulina (Fr.) Fr.
Pycnoporus cinnabarinus (Jacg.: Fr.) P. Karst.
Trametes hirsuta (Wulfen: Fr.) Pildt
Tr. ochracea (Pers.) Gilb. et Ryvarden
Tr. pubescens (Schumach.: Fr.) Pilit
Tr. versicolor (L.:Fr.) PiWt
Trichaptum abietinum (Dicks.: Fr.) Ryvarden
T. biforme (Fr. in Klotzsch) Ryvarden
T. fusco-violaceum (Ehrenb.: Fr.) Ryvarden
Inonotus obliquus (Pers.: Fr.) Pilat
Onnia leporina (Fr.) Jahn*
Phellinus chrysoloma(Fr.) Donk*
Ph. pini (Brot: Fr.> A. Ames*
Ph. nigrolimkatus (LomeS) Bourdot et Galzin*
Ph. igniarius (L.: Fr.)QucL
Ph. tremulae (Bondartsev) Bondartsev et Borisov
Chondrostereum purpureum (Fr.) Pouzar
Laurilia sulcata (Burt) Pouzar*
Phlebta centrifuga P.Karst*
Ph. tremellosa (Schrad.rFr.) Nakasone, Burds.
Piptoporus betulinus (Bull.:Fr.)P. Karst.
Polyporus ciliatus Fr.
P. brumalis Pers.: Fr.
Poriaceae
Hymenochaetaceae
Corticiaceae
Polyporaceae
E
Б
E
Б
Б
E
Б
Е,С,Б
E
E,C
E
Б
Б
E
Б
Б,Р
Б
Б
Б
Б
Е
Б
С,Е
Б
Е,С
Е
С
Е
Б
О
Б
Е
Е
Б
Б
Б
Б
Stereum hirsutum (Willd.: Fr.) Grey Stereaceae Б
St. sanguinolentum (Alb. et Schwein : Fr.) Fr. С, Е
Peniophora laurentii Lund in Lund, Nsnnf. Coniophoraceae Б
Hericium coralloides (Scop.: Fr.) Pers. Hericiaceae Б
Примечание:
* Здесь и в табл. 8.2 и 8.5 - виды-индикаторы старовозрастных лесов (Kotiranta, NiemelS, 1996).
** Здесь и в табл. 8.4: Е - ель, С - сосна, Б - береза, О - осина, Р - рябина.
399
Таблица 8.2. Видовой состав афиллофоровых грибов старовозрастных лесов
Вид
Тип леса*
Amylocistis lapponica (Romell) Singer*
Cerrena unicolor (Bull.: Fr.) Murrill
Climacocystis borealis (Fr.) Kotl. et Pouzar
Daedaleopsis septentrionalis (P.Karst) Niemela
Datronia stereoides (Fr.: Fr.) Ryvarden
Dichomitus squalens (Karst.) Reid*
Fomes fomentarius (L.: Fr.) Fr.
Fomitopsis pinicola (Sw.: Fr.) Karst.
F. rosea (Alb. Et Schwein.:Fr.) Karst.*
Gloeophyllum protractum (Fr.) Imazeki*
Gl. sepiarium (Wulfen: Fr.) Karst.
Gloeoporus dichrous (Fr.:Fr.) Bres.
Hapalopilus nidulans (Fr.) P. Karst
Heterobazidion annosum (Fr.) Bref.
Lenzites betulina (Fr.) Fr.
Pycnoporus cinnabarinus (Jacg.: Fr.) P. Karst.
Trametes hirsuta (Wulfen: Fr.) Pildt
Tr. ochracea (Pers.) Gilb. et Ryvarden
Tr. pubescens (Schumach.: Fr.) Pildt
Tr. versicolor (L.:Fr.) Pildt
Trichaptum abietinum (Dicks.: Fr.) Ryvarden
T. biforme (Fr. in Klotzsch) Ryvarden
T. fusco-violaceum (Ehrenb.: Fr.) Ryvarden
Inonotus obliquus (Pers.: Fr.) Pilat
Onnia leporina (Fr.) Jahn*
Phellinus chrysoloma (Fr.) Donk*
Ph. pini (Brot.: Fr.) A. Ames*
Ph. nigrolimitatus (Lomell) Bourdot et Galzin*
Ph. igniarius (L.: Fr.) Quel.
Ph. tremulae (Bondartsev) Bondartsev et Borisov
Chondrostereum purpureum (Fr.) Pouzar
Laurilia sulcata (Burt) Pouzar*
Phlebia centrifuga P.Karst*
Ph. tremellosa (Schrad.:Fr.) Nakasone, Burds.
Piptoporus betulinus (Bull.:Fr.) P. Karst.
Polyporus ciliatus Fr.
P. brumalis Pers.: Fr.
Stereum hirsutum (Willd.: Fr.) Grey
St. sanguinolentum (Alb. et Schwein : Fr.) Fr.
Peniophora laurentii Lund in Lund, Nsnnf.
Hericium coralloides (Scop.: Fr.) Pers.
Всего:
+ + +
+ + + +
+ +
+ +
+
+
+ + + + + +
+ + + + + +
+ +
+ + + +
+ + + +
+ +
+ + + +
+
+
+ +
+ +
+
+ + + +
+
+
+
+
+
+
+
+
+
+
+ +
+ +
+ + +
+
+
+
+ +
17 7 14 26 7
+
30
Здесь и в таблицах 8.3, 8.4:1 - сосняк чернично-лишайниково-зеленомошный; 2 - сосняк
лишайниковый; 3 - сосняк чернично-зеленомошный; 4 - ельник кустарничково-зеленомошный; 5 - ельник
лишайниковый; 6 - ельник травяный (приручьевой).
400
Таблица 8.3. Распределение афиллофоровых грибов старовозрастных лесов
по форме и анатомическому строению базидиом
Форма
базидиомы
Тип
гифальной
системы
Признак
Сидячая
С ножкой
Распростерто-отогнутая
Распростертая
Всего
Мономитическая
Димитическая
Тримитическая
/
10(59)
4(23)
3(18)
17
6(35)
6(35)
5(30)
2
Тип
3
леса
4
5
Количество видов (%)
5(71)
2(29)
7
1(14)
3(43)
3(43)
11(79)
3(21)
14
4(29)
4(29)
6(42)
17(65)
3(12)
4(15)
2(8)
26
7(27)
11(42)
8(31)
6(86)
1(14)
7
1(14)
4(57)
2(29)
6
18(60)
2(6)
5(17)
5(17)
30
10(34)
11(38)
8(28)
Таблица 8.4. Распределение дереворазрушающих и индикаторных видов по типам леса
Тип леса
/
С,Е
Б
2
С,Е
Б
3
С,Е
Б
4
Е
Б
5
Е
Б
6
Е
Б
10
Грибы-индикаторы
2 6
Грибы-дереворазрушители
5 8 11 14
14 15
Таблица 8.5. Список видов афиллофоровых грибов в условиях загрязнения
Вид
Расстояние от источника загрязнения, км
25
28
31
100
Amylocistis lapponica (Romell) Singer*
Cerrena unicolor (Bull.: Fr.) Murrill
Climacocystis borealis (Fr.) Kotl. et Pouzar
Daedaleopsis septentrionalis (P.Karst) Niemela
Dichomitus squalens (Karst.) Reid*
Fomes fomentarius (L.: Fr.) Fr.
Fomitopsis rosea (Alb. Et Schwein.:Fr.) Karst.*
Fomitopsis pinicola (Sw.: Fr.) Karst.
Gloeophyllum protractum (Fr.) Imazeki*
Gloeophyllum sepiarium (Wulfen: Fr.) Karst.
Inonotus obliquus (Pers.: Fr.) Pilat
Onnia leporina (Fr.) H. Jahn*
Phellinus chrysoloma (Fr.) Donk*
Phellinus nigrolimitatus (Lomell) Bourdot et Galzin*
Phellinus igniarius (L.: Fr.) Quel.
Phlebia centrifuga P.Karst.*
Piptoporus betulinus (Bull.:Fr.) P. Karst.
+ + +
+ +
+ +
+ +
+
+ + + +
+
+ + + +
+ +
+ + + +
+ +
+ + +
+ + +
+ +
+ + + +
+ +
+ + + +
401
Таблица 8.5 (окончание)
Вид
Расстояние от источника загрязнения, км
25
28
31
100
Stereum sanguinolentum (Alb. et Schwein : Fr.) Fr.
Stereum hirsutum (Willd.: Fr.) Grey
Trametes ochracea (Pers.) Gilb. et Ry varden
Trametes. pubescens (Schumach.: Fr.) Pilat
Trichaptum abietinum (Dicks.: Fr.) Ryvarden
Trichaptum. fusco-violaceum (Ehrenb.: Fr.) Ryvarden
Всего:
+
+
12
+
+
+
17
+
+
+
+
+
+
23
Таблица 8.6. Распределение дереворазрушающих грибов по форме и анатомическому
строению базидиом в условиях воздушного загрязнения
Признак
Расстояние от источника загрязнения, км
7
25
28
31
100
Количество видов (%)
Форма базидиомы Распростерто-отогнутая
Гифальная система
5 (42) 4 (23) 5 (23)
Распростертая
С ножкой
Сидячая
Всего
Мономитическая
Димитическая
Тримитическая
0
0
3(100)
3
0
2(67)
1(33)
0
0
8(100)
8
2(25)
3(37)
3(38)
0
0
7(58)
12
3(25)
8(67)
1(8)
1(6)
Кб)
11(65)
17
5(30)
7(41)
5(29)
1(5)
1(4)
15(68)
22
7(32)
9(41)
6(27)
Таблица 8.7. Временная динамика видового богатства дереворазрушающих грибов
в еловых лесах, подверженных воздушному загрязнению, но этажам наблюдении
Вид
Расстояние от комбината, км
3,5
1*
2
8
/
2
15
/
2
25
/
2
30
/
2
Более 50
/
2
Fomes fomentarius
Fomitopsis pinicola
Fomitopsis rosea
Gloeophyllum sepiarium
Phellinus igniarius
Phellinus chrysoloma
Piptoporus betulinus
Inonotus obliquus
Trichaptum abietinum
Trichaptum fusco-violaceus
* Здесь и в табл. 8.8 этапы
+ + + + +
+ + + + +
+
+ +
наблюдений: этап / - 1979-1983
+
+
+
+
+
+
+
+
+
+
+
гг.; этап 2
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
-1991-1993 гг.
+
+
+
+
+
+
+
+
+
+
+
+
+
+
402
Таблица 8.8. Количество деревьев (по породам), пораженных дереворазрушающими грибами
в еловых лесах, подверженных воздушному загрязнению, по этапам наблюдений (/, 2),
% нарастающим итогом
Вид
Порода
Расстояние от комбината, км
3,5
1
2
8
/
2
15
1
2
25
1
2
30
/
2
>50
/
2
Fomes
fomentarius
Fomitopsis
pinicola
F. rosea
Gloeophyllum
sepianum
Phellinus
ignianus
Ph. chryso-
loma
Piptoporus
betulinus
Inonotus
obliquus
Trichaptum
abietinum
T. fusco-
violaceus
Береза
Ель
"
,.
Береза
Ель
Береза
и
Ель
„
1,4
7,1
07
09
1,4
5,7
07
09
07
09
08
3,1
3,0
4,0
2,8
10,3
4,2
5,8
5,0
26,5
01
01
07
3,8
1,1
6,0
5,9
26,5
0,5
07
0,8
4,3
1,1
6,0
01
05
2,0
7,3
01
02
1,7
6,2
03
1,1
0,2
09
0,1
02
3,1
12,1
09
1,2
05
0,6
1,9
7,6
0,4
05
07
2,7
02
09
0,3
0,4
3,8
20,7
02
03
01
01
1,0
5,6
05
2,6
0,1
03
0,2
03
03
03
5,3
20,7
04
04
1,3
6,4
01
03
02
1,2
Q2
03
03
0,3
0,2
09
01
01
08
3,5
01
04
1,2
5,5
01
01
1,9
8,6
0,3
0,4
0,1
05
01
0,4
Таблица 9.1. Аккумуляция свинца в скелете, кадмия в печени и почках рыжих полевок,
мкг/г (по: Мухачева, Безель, 1995)
РЬ, скелет
Cd, печень
Cd, почки
ПЗ
ПС
НС
ПЗ
ПС
НС
ПЗ
ПС
НС
12,73±1,44(37)
20,27±3,11(30)
19,48±1,53(146)
1,6810,19(41)
1,97±0,49(26)
1,25±0,12(125)
10,8810,90(24)
7,2011,33(10)
3,0610,27 (85)
42,7015,07 (39)
48,0314,02 (36)
36,9212,14(99)
6,2511,13(18)
6,2511,10(39)
7,6410,49 (63)
35,9713,28 (37)
34,0416,26 (9)
22,8612,17 (64)
66,0017,50(20)
57,9315,47 (36)
50,7816,12(27)
9,6312,22 (8)
6,7011,62(15)
6,0910,96(15)
55,6919,52(9)
22,6413,11(11)
24,3413,54(14)
* ПЗ - перезимовавшие особи; ПС
В скобках - объем выборки.
- половозрелые сеголетки; НС - неполовозрелые сеголетки.
403
<
PQ
К
CQ
X
и
о
X
о
*
о
I
со
£
CU
1.
2
II
I
£
2
£2
£
рга
О
<
0)
X
0)
S
м
X
U
ЬСЯ
&
ров
Р Ё
8. I
"8 5
В се
а х
II
CQ ш
8. »
g g
§1
I
406
Таблица 12.1. Группировка тяжелых металлов, концентрирующихся в Hylocomium splendens,
в зависимости от источника поступления (по: Steinnes et al., 1992)
Источник
Элемент
Локальный техногенный источник
Трансграничное поступление
Локальное почвенное пыление
Морская импульверизация
Перемещение из почв через высшие растения
(вымывание из надземной части)
Cr, Ni, Си
V, (Со), (Си), (Zn), As, Se, Mo, Ag, Cd, Sb, Pb
Sc, (V), (Cr), Co, Fe, La, Sm, Th
Se, Br, I
Zn, Mn, Rb, Cs
Таблица 12.2. Растения, предложенные для фиторемедиации загрязненных почв
(по: Prasad, 2001)
Процесс фиторемедиации
Перечень растений
Гипераккумуляция металлов
Ликвидация радионуклидов
Фитотранспирация
Brassica juncea, Cannabis savita, Cardamonopsis
hallerii, Ceratophyllum demersum, Eucalyptus sp.,
Eichhornia crassipes, Armoracia rustica, Datura
innoxia, Armeria maritime, Azolla pinnata, Salix sp.,
Tamarix, Thlaspi sp.,
Brassica canola, Kochia scoparia, Phaseolus acutifolius
Typha sp.
ОГЛАВЛЕНИЕ
ОТ РЕДАКТОРА. A.M. Исаев 3
ВВЕДЕНИЕ. В.В. Никонов 6
Глава 1. БОРЕАЛЬНЫЕ ЛЕСА. А.И. Уткин, Н.В. Зукерт 10
1.1. Общие представления о бореальных лесах мира 10
1.2. Ресурсно-экологический очерк лесов России 12
1.3. Природно-сырьевая характеристика отдельных областей бореальных
лесов России 15
Европейско-Уральская область 16
Западно-Сибирская область 17
Восточно-Сибирская область 18
Дальневосточная область 19
1.4. Изученность лесного фонда 20
Глава 2. ГЛОБАЛЬНАЯ СИСТЕМА МАССОПОТОКОВ ТЯЖЕЛЫХ
МЕТАЛЛОВ В БИОСФЕРЕ. В.В. Добровольский 23
Глава 3. АТМОСФЕРНЫЕ ВЫПАДЕНИЯ 30
3.1. Источники и поведение тяжелых металлов в атмосфере. В.В.
Цибульский, МЛ. Яценко-Хмелевская 30
Источники выборосов тяжелых металлов в атмосферу 30
Физико-химические свойства тяжелых металлов в атмосфере 32
3.2. Соединения тяжелых металлов в атмосфере. В.В. Цибульский, М.А.
Яценко-Хмелевская 39
Химические формы существования тяжелых металлов в выбросах и
атмосферном воздухе 39
Химические реакции в атмосфере с участием тяжелых металлов 44
3.3. Сток тяжелых металлов из атмосферы. В.В. Цибульский, М.А. Яценко-
Хмелевская 47
Сухое осаждение 47
Мокрое осаждение 49
Перенос тяжелых металлов в атмосфере 52
3.4. Общие особенности поведения тяжелых металлов в атмосфере. В.В.
Цибульский, М.А. Яценко-Хмелевская 57
3.5. Взаимодействие атмосферных выпадений с древесным пологом. В.В.
Никонов, Н.В.Лукина 66
Состав и свойства атмосферных выпадений на разных стадиях состояния
северо-таежных лесов 69
Общие особенности состава и свойства атмосферных выпадений при
взаимодействии с древесным пологом 72
Глава 4. ПОЧВЫ 76
4.1. Концентрации и формы рассеянных элементов в почвах. ДЛ. Пинский ... 77
Формы рассеянных элементов 77
Трансформация соединений рассеянных элементов 79
408
4.2. Рассеянные элементы в Al-Fe-гумусовых подзолах. В.В. Никонов,
Н.В.Лукина, М.В. Фронтасъева 85
Фоновые условия 86
Воздушное загрязнение 96
Общие тенденции аккумуляции и внутрипрофильного распределения
рассеянных элементов 108
Глава 5. ПОЧВЕННЫЕ ВОДЫ. Н.В. Лукина, Т.Т. Горбачева, В.В. Никонов,
Е. Стайннес 113
5.1. Природные особенности 124
Общие особенности состава и свойств вод Al-Fe-гумусовых подзолов се-
веро-таежных лесов 129
5.2. Воздушное промышленное загрязнение 132
Состав и свойства вод Al-Fe-гумусовых подзолов северо-таежных лесов
в условиях воздушного промышленного загрязнения 144
Глава 6. РАСТЕНИЯ. В.В. Никонов, Н.В. Лукина, М.В. Фронтасъева 151
6.1. Природные особенности 152
Токсичность и толерантность 159
Взаимодействие элементов, синергизм и антагонизм 163
6.2. Воздушное загрязнение 165
Поглощение элементов 166
6.3. Поглощение элементов растениями северо-таежных лесов (природные и
техногенные аспекты) 167
Растения с почвенной стратегией питания 169
Растения с атмосферной стратегией питания 175
6.4. Сравнительная оценка поглощения элементов растениями бореальных
лесов 181
Глава 7. МИКРООРГАНИЗМЫ 188
7.1. Микробные сообщества лесных биогеоценозов. Т.Г. Добровольская,
А.В. Головненко, И.А. Максимова, И.Ю. Чернов 188
Численность микроорганизмов по ярусам биогеоценоза 189
Таксономические, функциональные и экологические группировки
микроорганизмов в разных ярусах биогеоценоза 191
Основные группы микроорганизмов 194
Мониторинг бактериальных сообществ почв лесного заповедника 211
7.2. Почвенные микробные сообщества бореальных лесов в условиях
промышленного загрязнения тяжелыми металлами. О.Е. Марфенина, А.Ю.
Беспалова 218
Общие представления о функционировании почвенных микробных
сообществ 218
Почвенные микроорганизмы и тяжелые металлы 222
7.3. Микроорганизмы Al-Fe-гумусовых подзолов (природные и техногенные
аспекты). Л.М. Полянская, В.В. Никонов, Н.В. Лукина, А.Н. Паникова 231
Общие особенности распространения микроорганизмов в
Al-Fe-гумусовых подзолах северо-таежных лесов 236
Глава 8. ДЕРЕВОРАЗРУШАЮЩИЕ ГРИБЫ. Л.Г. Исаева 244
8.1. Афиллофоровые грибы - индикаторы состояния бореальных лесов 244
8.2. Афиллофоровые грибы и промышленное загрязнение 246
8.3. Афиллофоровые грибы северо-таежных лесов в условиях воздушного
загрязнения медно-никелевого производства 249
8.4. Общие особенности афиллофоровых грибов северо-таежных лесов 253
409
Глава 9. МЕЛКИЕ МЛЕКОПИТАЮЩИЕ. B.C. Безелъ, Е.А. Вельский 260
9.1. Техногенное загрязнение и состояние популяций мелких
млекопитающих 264
Репродуктивные потери 265
Динамика численности 267
9.2. Техногенное загрязнение и структура популяций мелких млекопитающих 268
9.3. Техногенное загрязнение и видовое разнообразие сообществ мелких
млекопитающих 270
Глава 10. ПТИЦЫ. ЕЛ. Вельский, B.C. Безель 274
10.1. Аккумуляция тяжелых металлов в птицах 274
10.2. Техногенное загрязнение и репродуктивные показатели птиц 277
10.3. Тяжелые металлы и разнообразие птиц 282
Видовой состав 283
Общее и частное обилие 284
Структура населения птиц 286
Глава 11. ПРИНЦИП БИОГЕОХИМИЧЕСКОЙ СЕЛЕКЦИИ
ОРГАНИЗМОВ И НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ БИОСФЕРЫ. А.Г. Лапенис 290
11.1. Гипотеза Геи 290
"Слабая Гея" 291
"Сильная Гея" 291
11.2. Принцип биогеохимической селекции организмов 293
Взаимопомощь организмов - фактор их эволюции 293
Взаимопомощь организмов в совместном "приготовлении пищи" 295
Первый и второй биогеохимические принципы 296
Внутренняя нестабильность биогеохимических циклов 298
Систематизация представлений русских ученых о принципе
биогеохимической селекции организмов 300
Глава 12. МИГРАЦИОННАЯ СПОСОБНОСТЬ ЭЛЕМЕНТОВ В
БИОСФЕРЕ И КОРРЕКЦИЯ ИХ БИОГЕОХИМИЧЕСКИХ ЦИКЛОВ.
В.В. Никонов 307
12.1. О пределах устойчивости биосферы к техногенному загрязнению 307
12.2. О пригодных аналитических технологиях и информативности
аналитических результатов 308
12.3. Фитоиндикация загрязнения биосферы 310
12.4. Коррекция природных биогеохимических циклов в условиях техногенеза 313
ПРИЛОЖЕНИЕ 322
Научное издание
РАССЕЯННЫЕ ЭЛЕМЕНТЫ
В БОРЕАЛЬНЫХ ЛЕСАХ
Утверждено к печати
Ученым советом
Центра по проблемам экологии
и продуктивности лесов
Российской академии наук
Зав. редакцией НА. Степанова
Редактор ГМ. Орлова
Художник Ю.И. Духовская
Художественный редактор В.Ю. Яковлев
Технический редактор О.В. Аредова
Корректоры А.Б. Васильев,
Р.В. Молоканова, Т.И. Шеповалова
Подписано к печати 18.11.2003
Формат 70x100 1/16. Гарнитура Тайме
Печать офсетная
Усл.печ.л. 33,8. Усл.кр.-отт. 34,3. Уч.-издл. 34,6
Тираж 330 экз. Тип. зак. 4781
Издательство "Наука"
117997 Москва, Профсоюзая ул., 90
E-mail: secret@naukaran.ru
Internet: www.naukaran.ru
Санкт-Петербургская типография "Наука"
199034 Санкт-Петербург, 9-я линия, 12