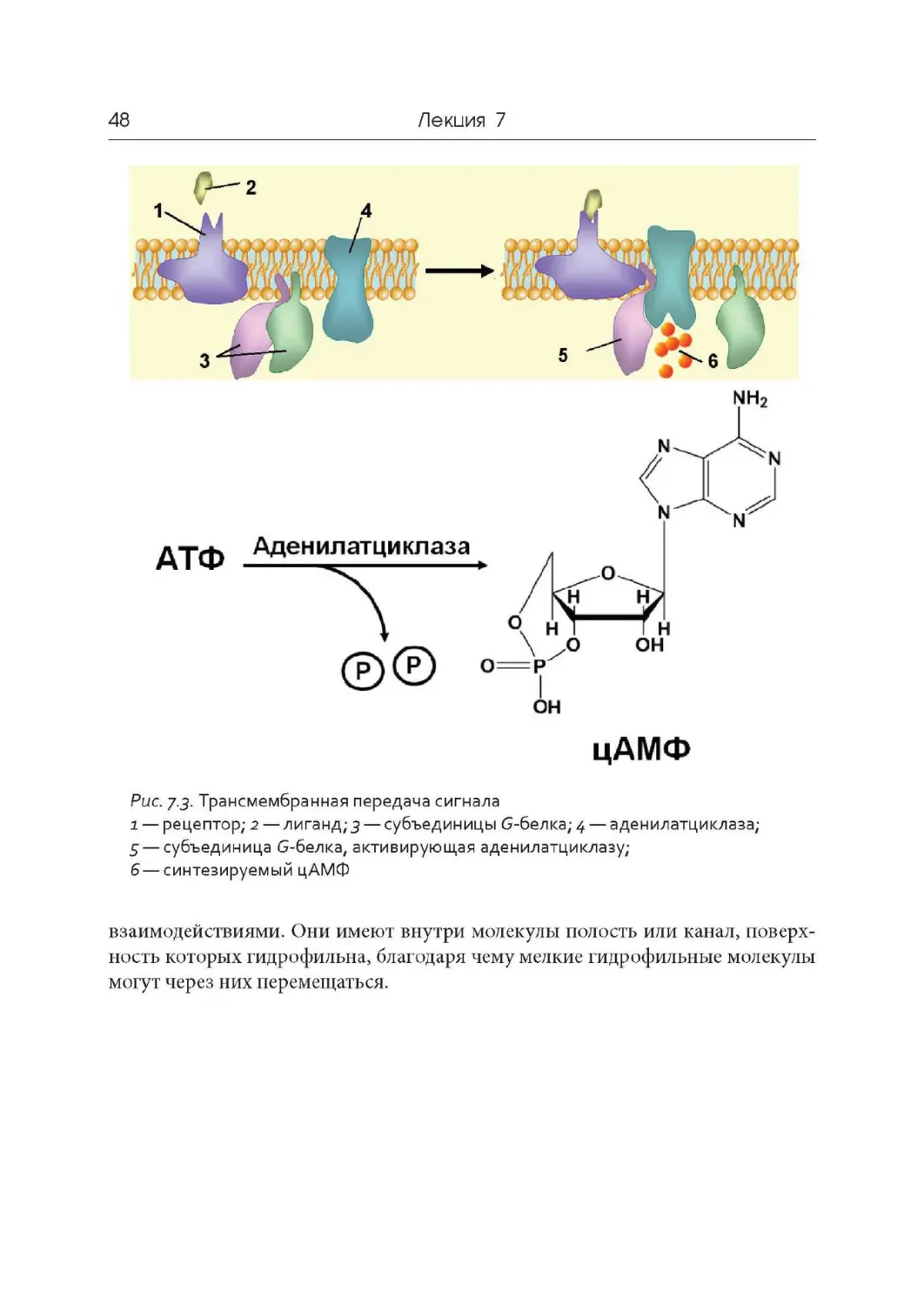
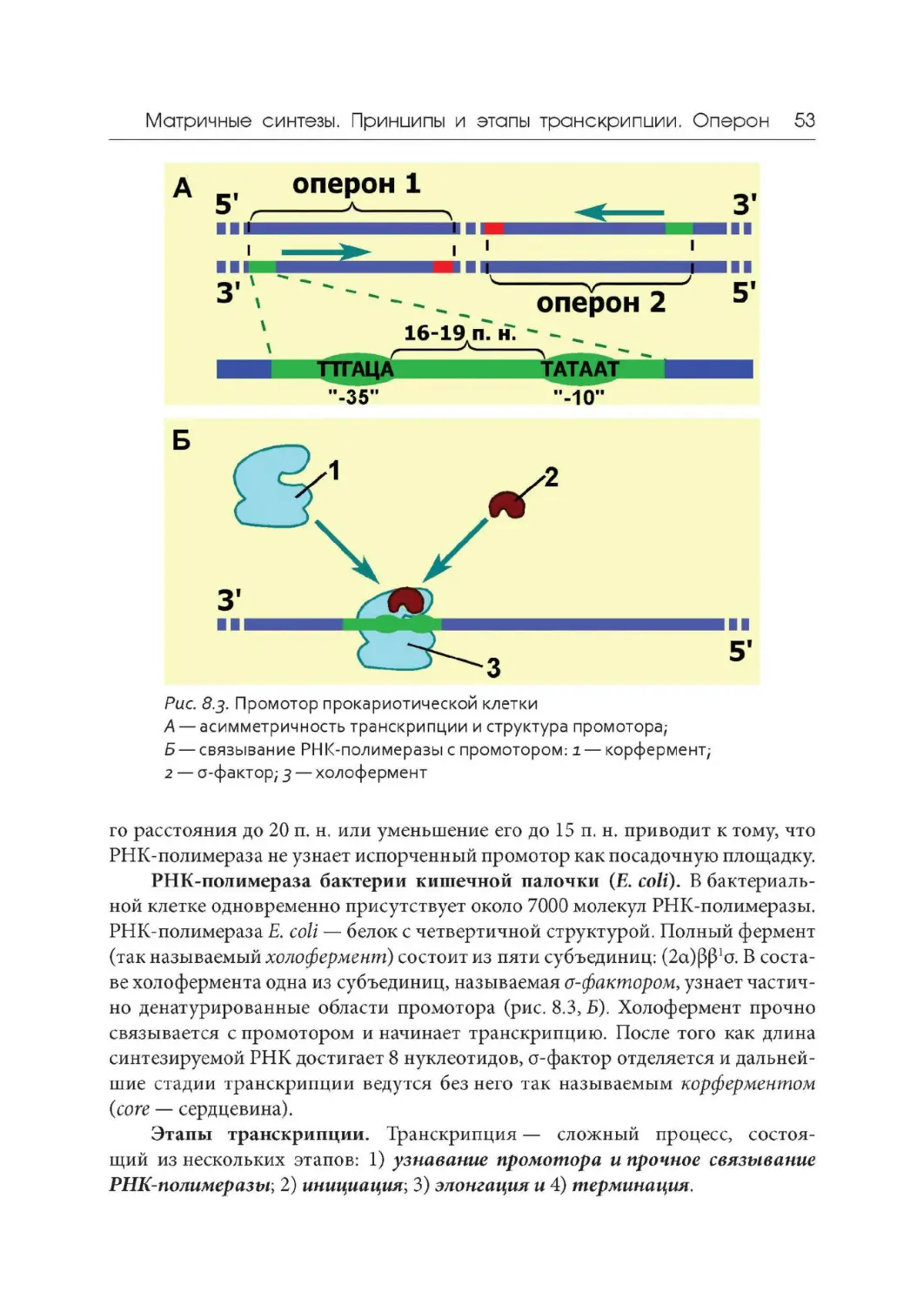
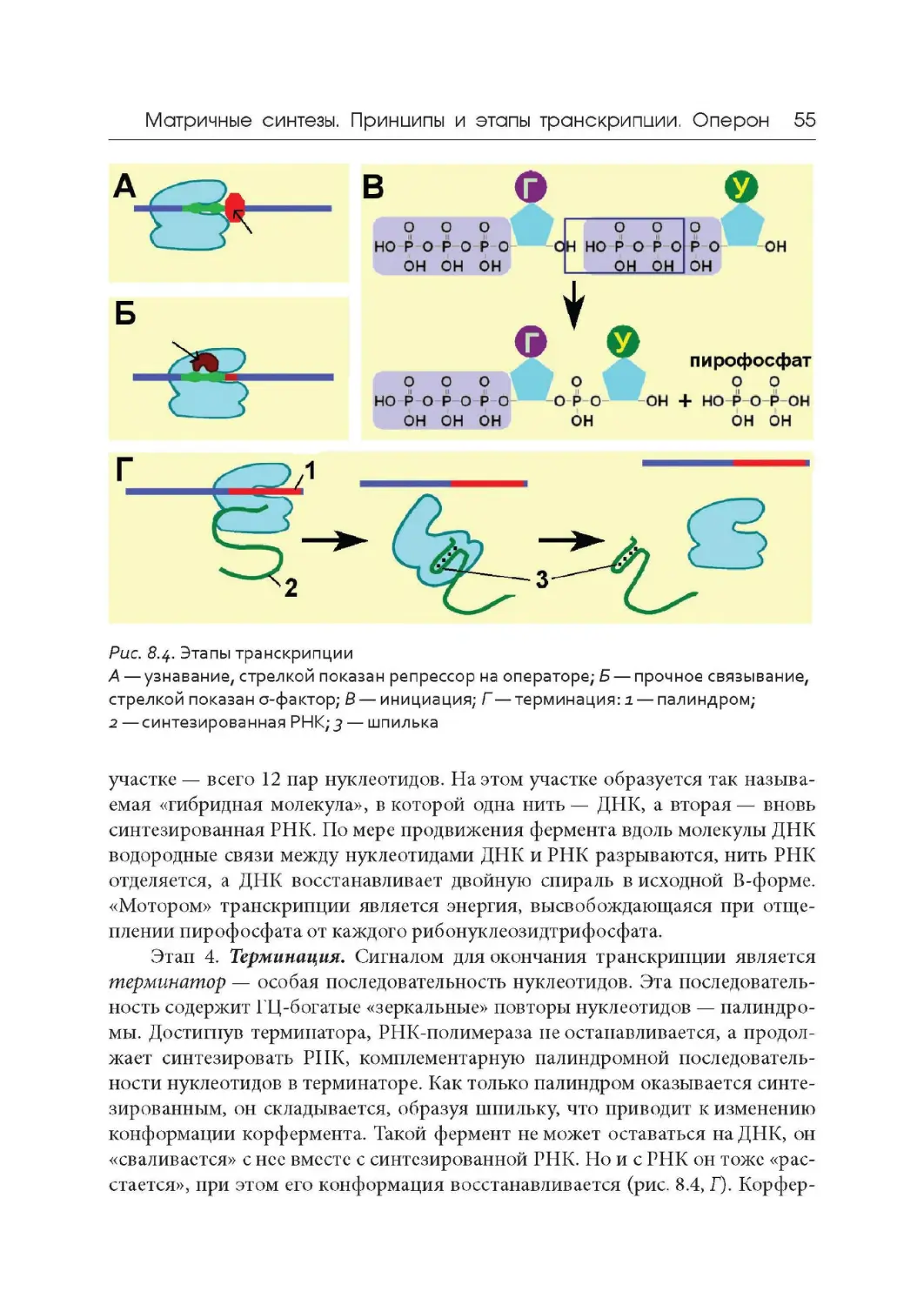
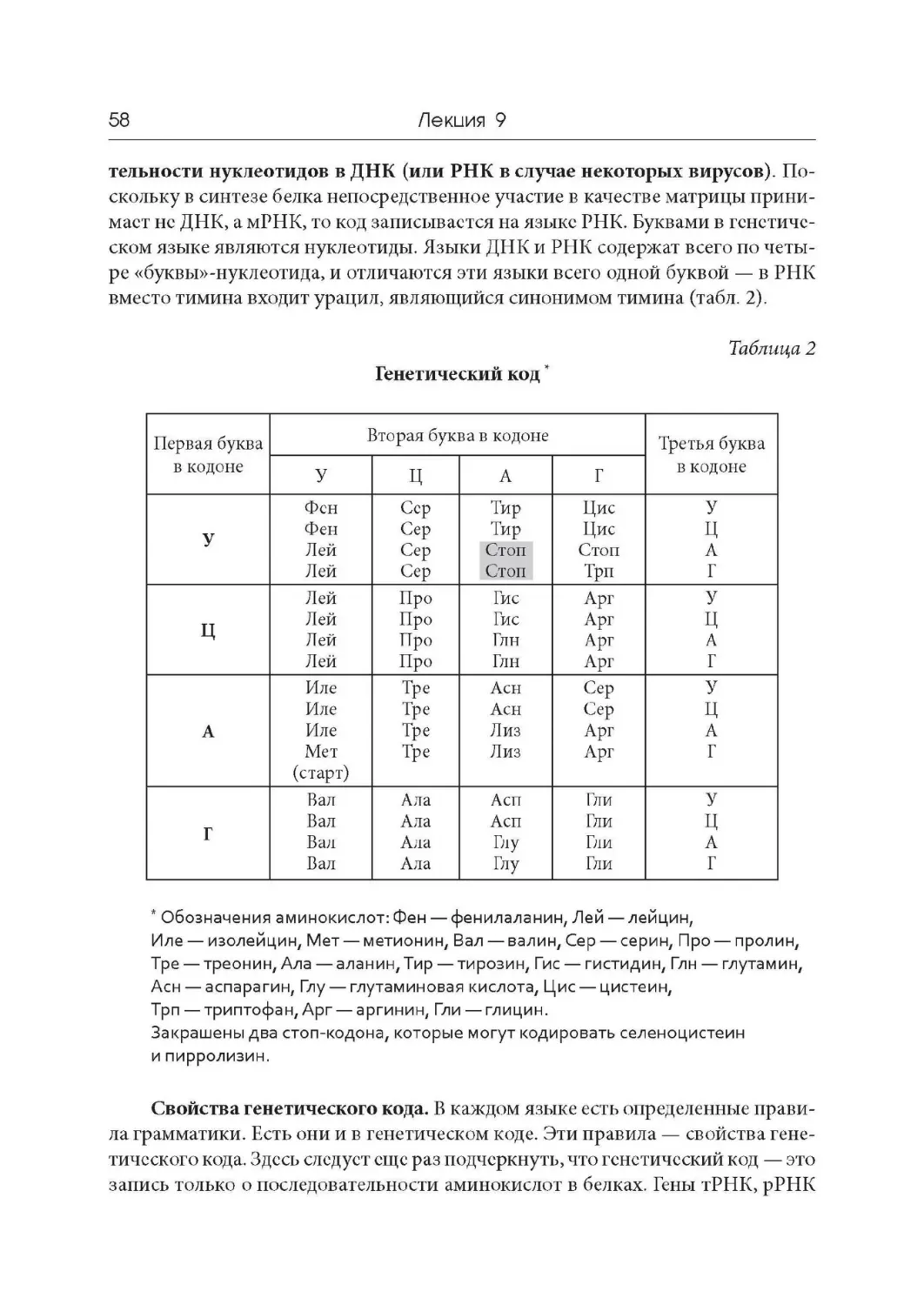
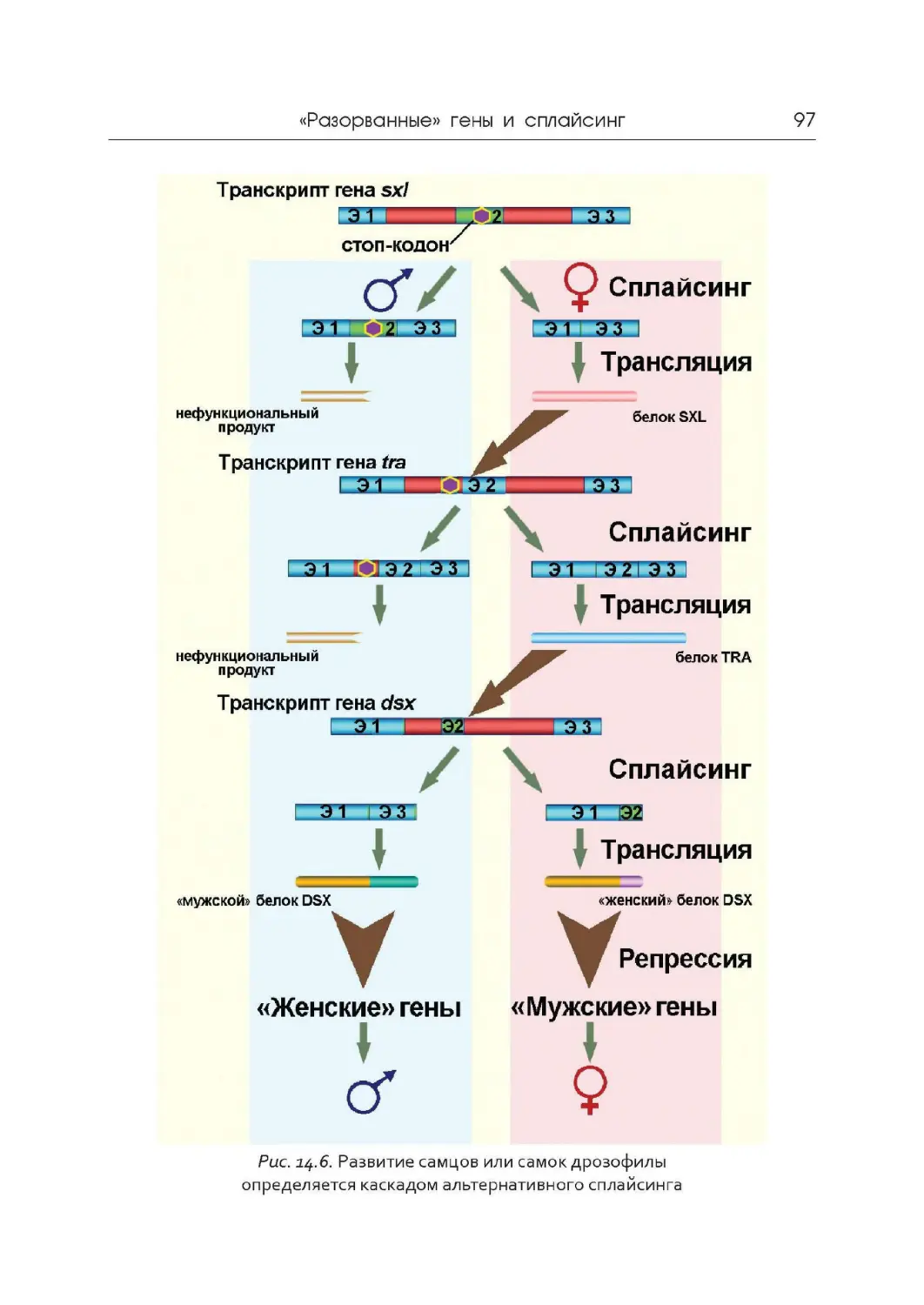
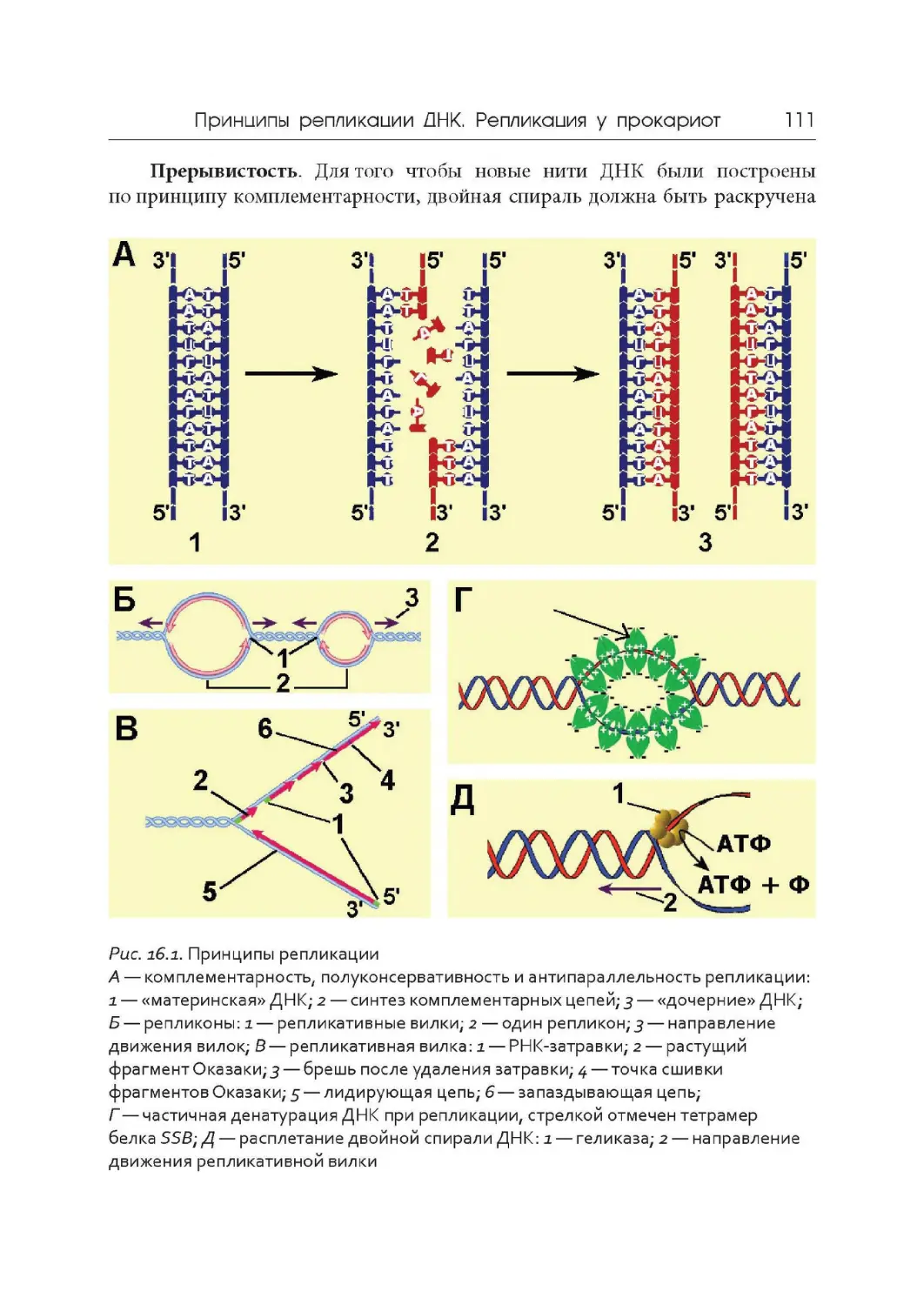
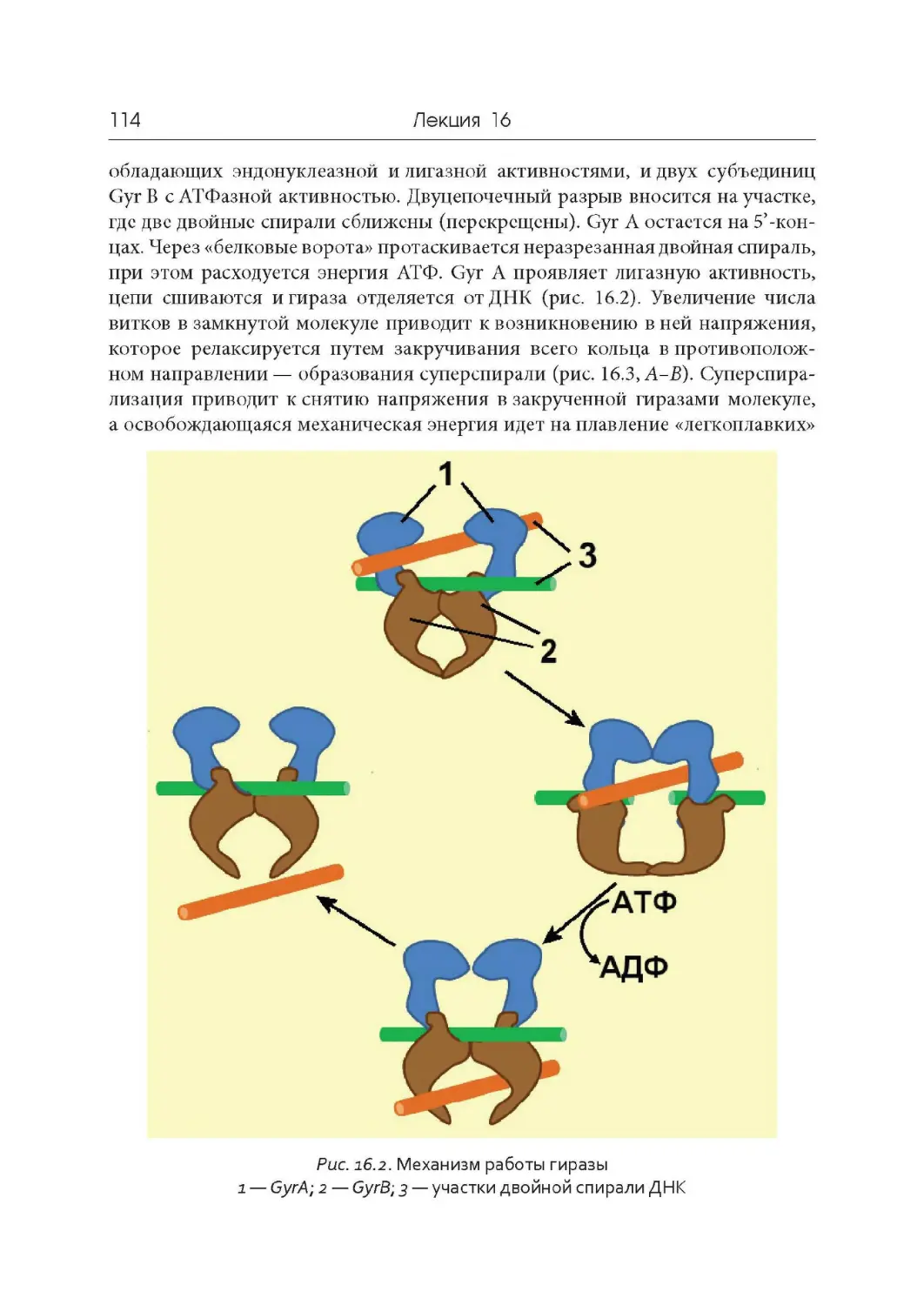
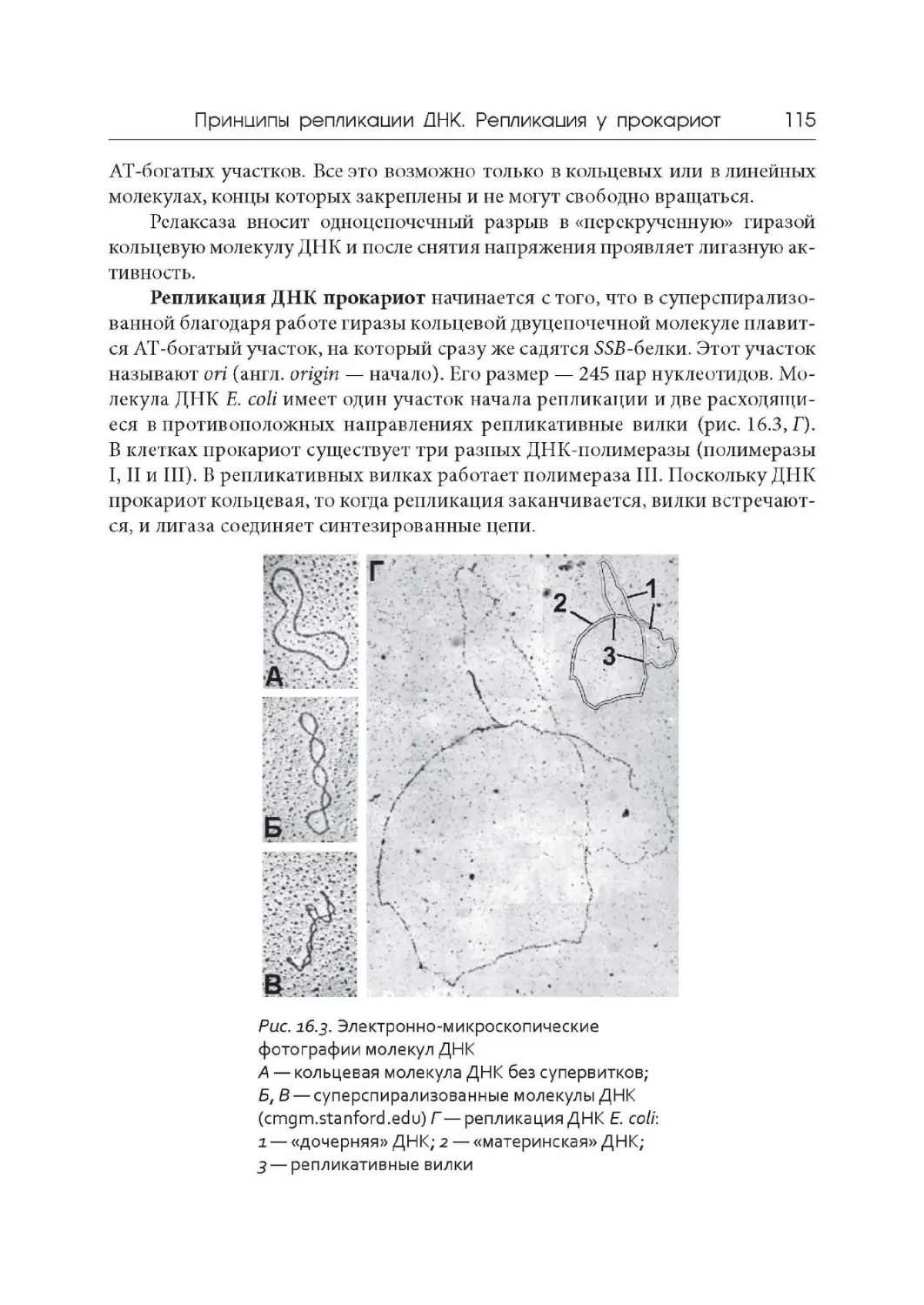
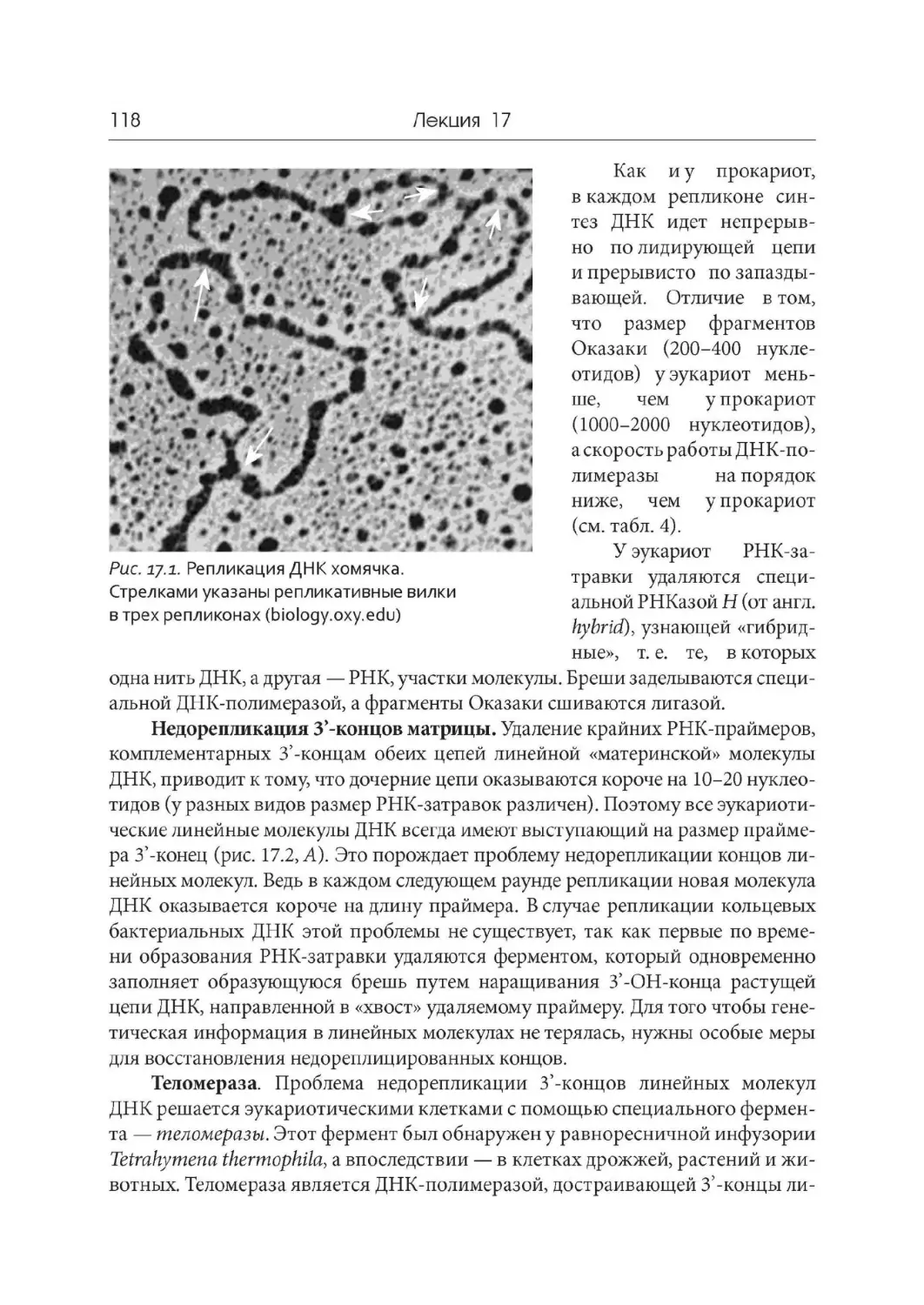
Author: Дымшиц Г.М. Саблина О.В.
Tags: материальные основы жизни биохимия молекулярная биология биофизика биология
ISBN: 978-5-4437-0704-4
Year: 2017
Text
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет естественных наук
Кафедра молекулярной биологии
Специализированный учебно-научный центр НГУ
Кафедра естественных наук
Г.М . Дымшии, О. В. Саблина
25 ИЛЛЮСТРИРОВАННЫХ ЛЕШИЙ
ПО МОЛЕКУЛЯРНОЙ БИОЛОГИИ
Учебное пособие
Новосибирск
2017
УДК 577.2 (075.8)
ББК 28.070
Д 888
Рецензент
д-р хим , наук, доцент Д . М . Грайфер
Дымшиц, Г. М .
25 иллюстрированных лекций по молекулярной биологии : учеб,
пособие / Г. М . Дымшиц, О. В. Саблина ; Новосиб. гос. ун-т. —
Новоси-
бирск : ИПЦ НГУ, 2017.
Д 888
178 с.
ISBN 978-5-4437-0704-4
Пособие представляет собой развернутое изложение истории воз-
никновения и развития молекулярной биологии, а также ее основных
разделов , связанных с хранением, воспроизведением и реализацией ге-
нетической информации; рассмотрены основные молекулярно-генети-
ческие процессы: репликация, транскрипция, трансляция и репарация.
Значительное внимание уделено регуляции экспрессии генов , организа-
ции и эволюции геномов.
Предназначено для студентов биологов и медиков 2-го курса НГУ,
слушающих общий курс «Молекулярная биология» , а также биохимиков
и биофизиков 4-го курса, для которых этот курс является специальным;
может быть полезно студентам биологических и медицинских факульте-
тов университетов, учителям и старшеклассникам.
УДК 577.2 (075.8)
ББК 28.070
Ш Новосибирский государственный
университет, 2017
© Г. М. Дымшиц, О. В. Саблина, 2017
ISBN 978-5 -4437-0704-4
Оглавление
Лекция 1. Определение предмета и история молекулярной
биологии. Доказательства генетической роли
нуклеиновых кислот
Лекция 2. Строение и функции нуклеиновых кислот
Лекция 3. Аминокислоты. Первичная и вторичная структура белков..
Лекция 4. Третичная и четвертичная структура белков.
Денатурация и фолдинг
Лекция 5. Функции белков. Ферменты. Иммуноглобулины. Гормоны.
Рецепторы
Лекция 6. Структурная, транспортная и другие функции белков
Лекция 7. Биологические мембраны
Лекция 8. Матричные синтезы. Принципы и этапы транскрипции.
Оперон
Лекция 9. Генетический код
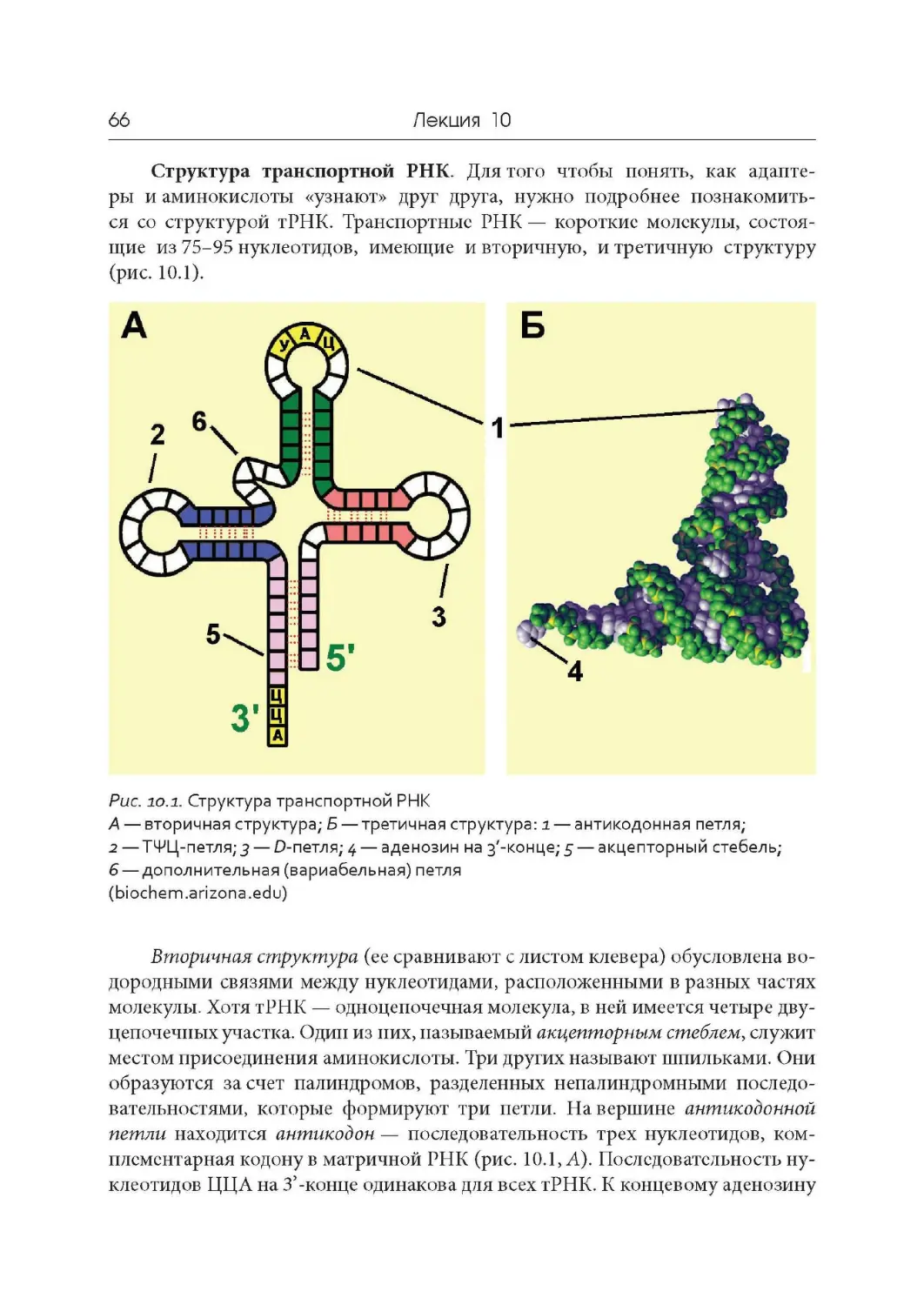
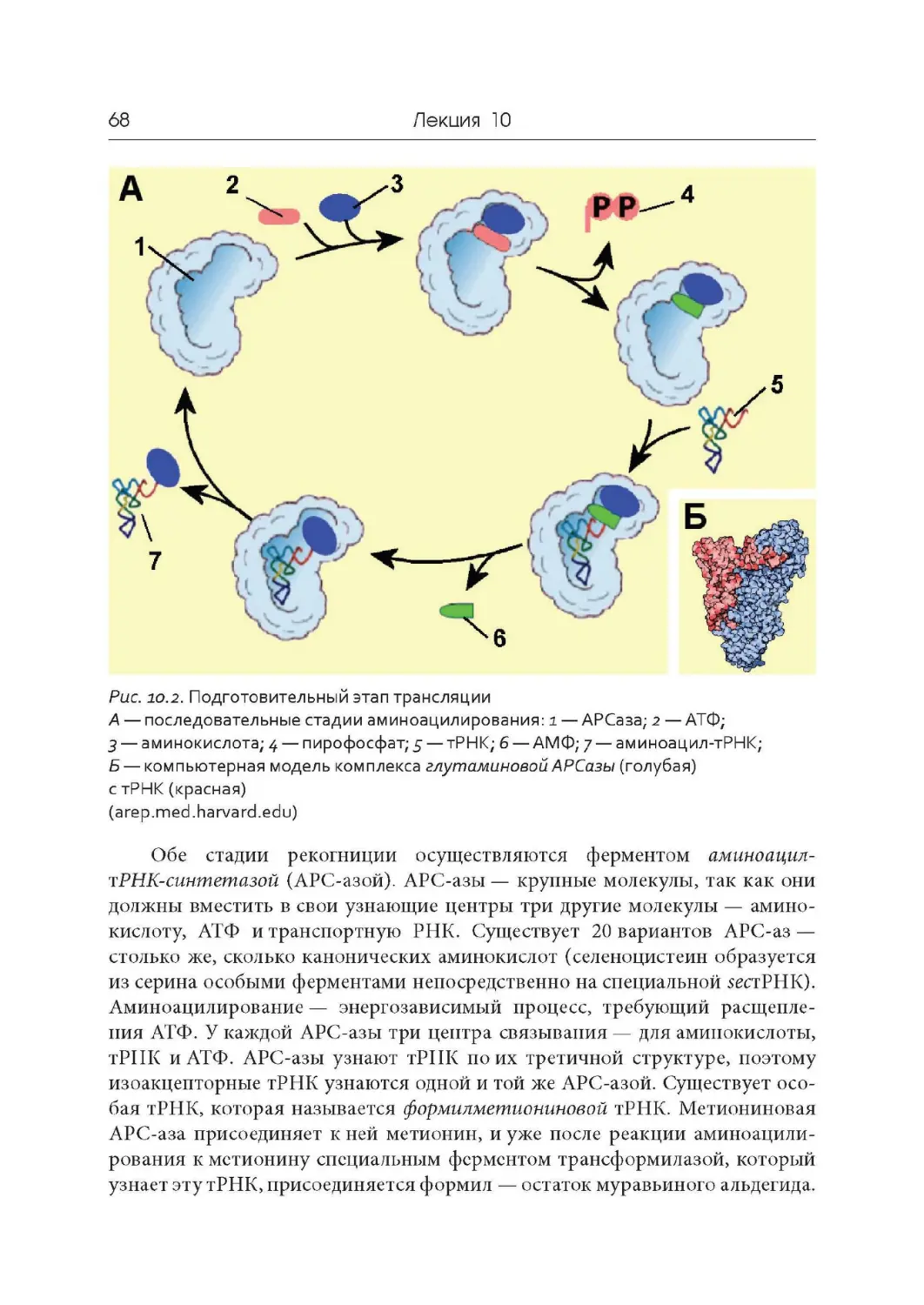
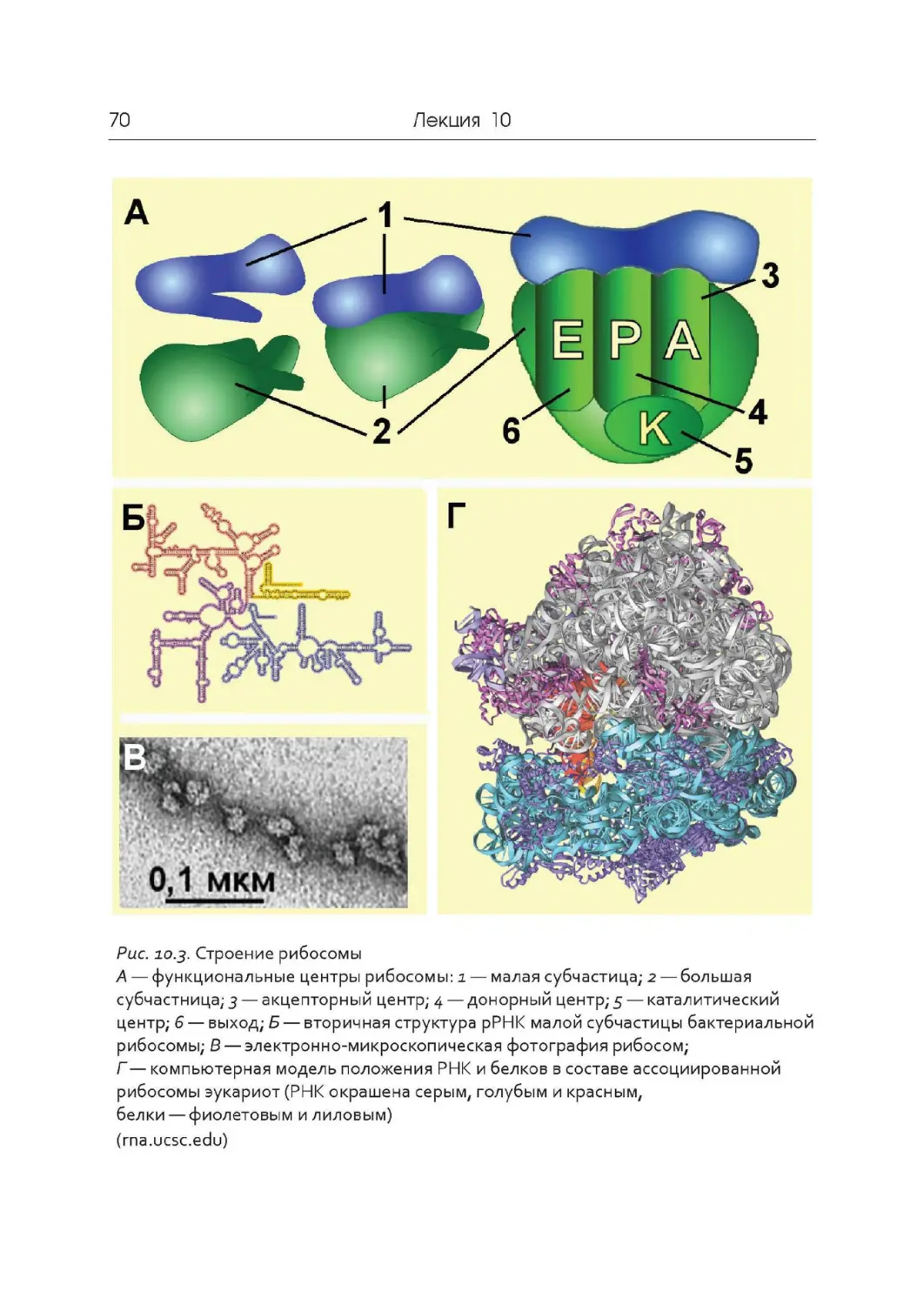
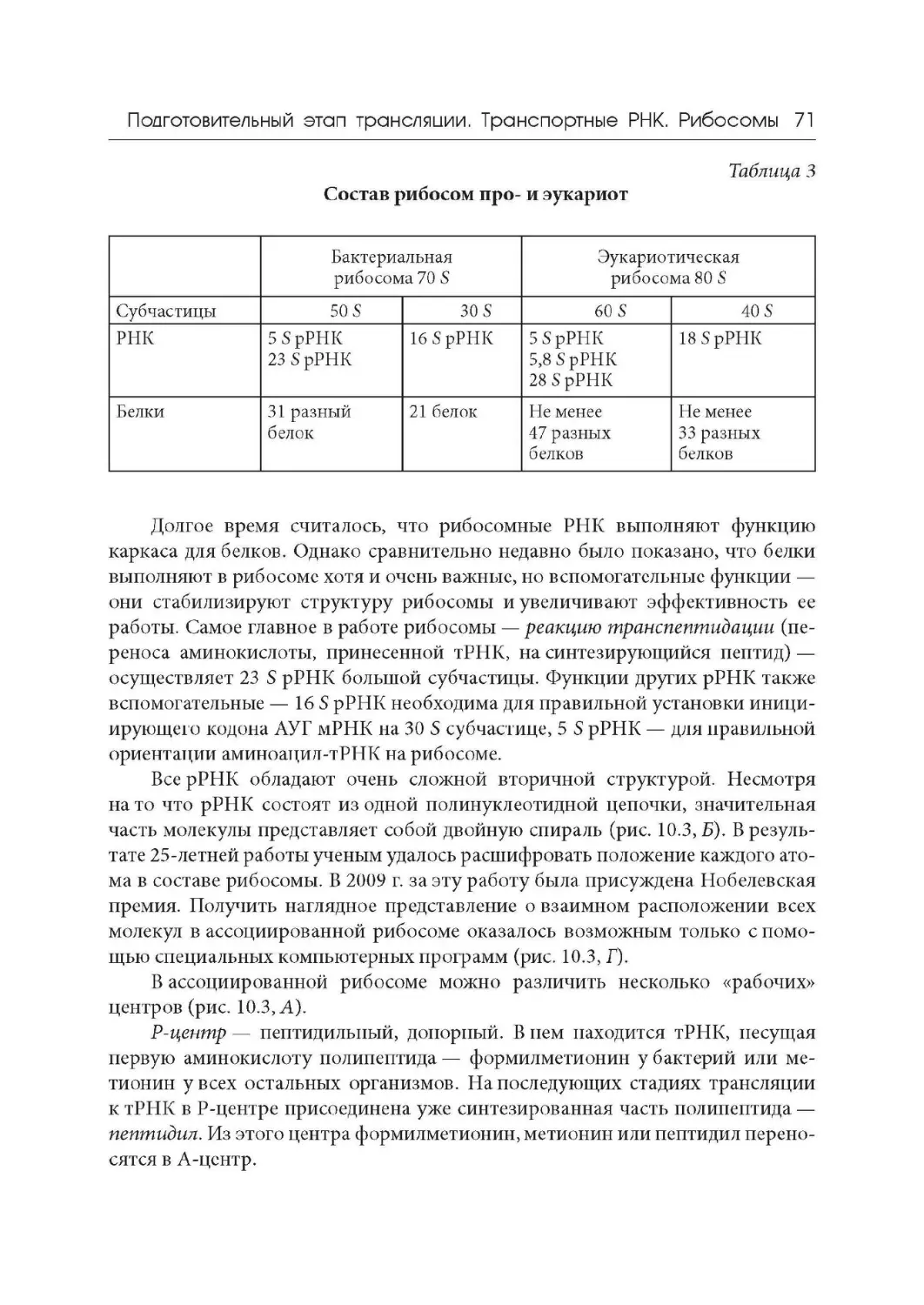
Лекция 10. Подготовительный этап трансляции. Транспортные РНК.
Рибосомы
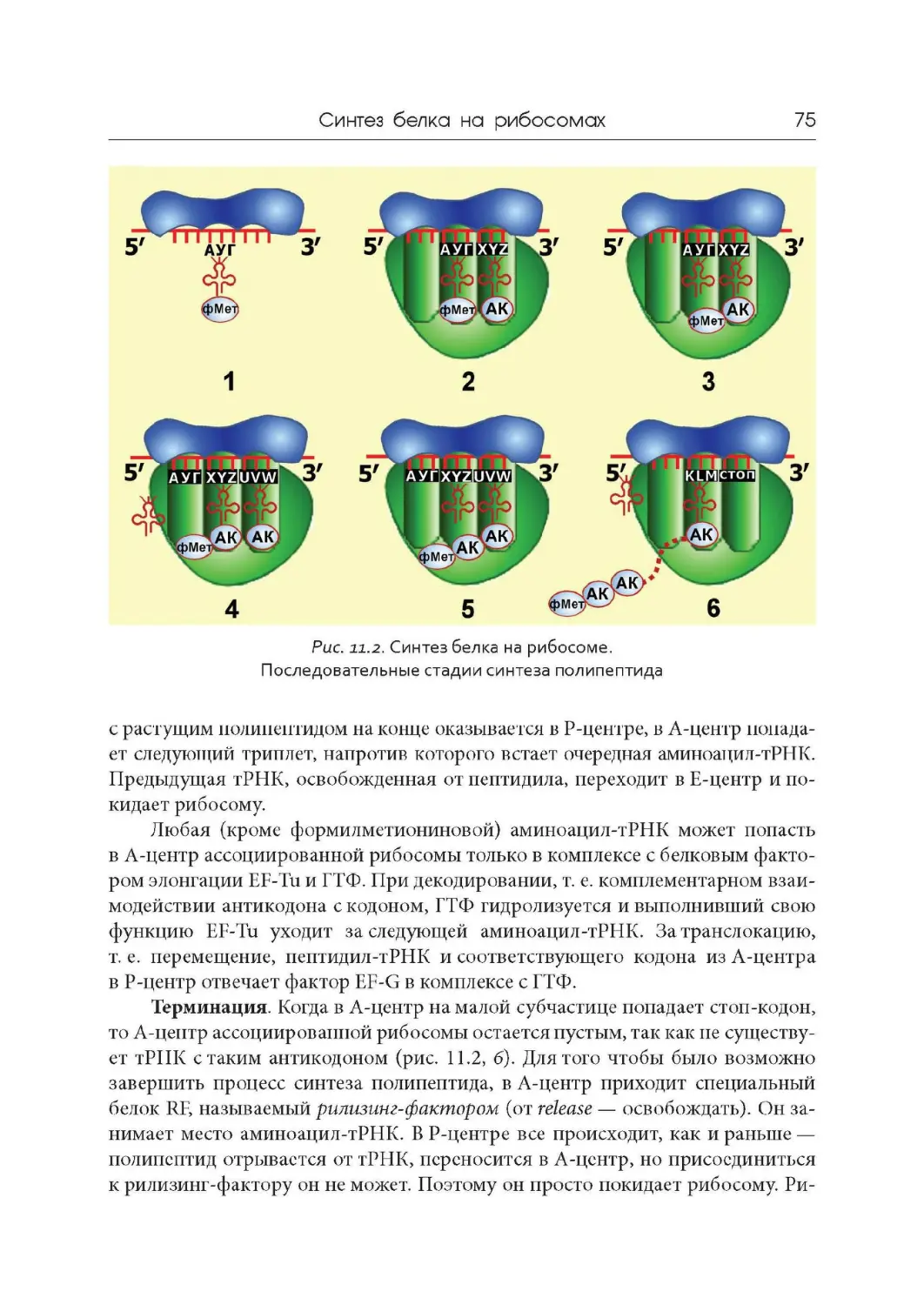
Лекция 11. Синтез белка на рибосомах
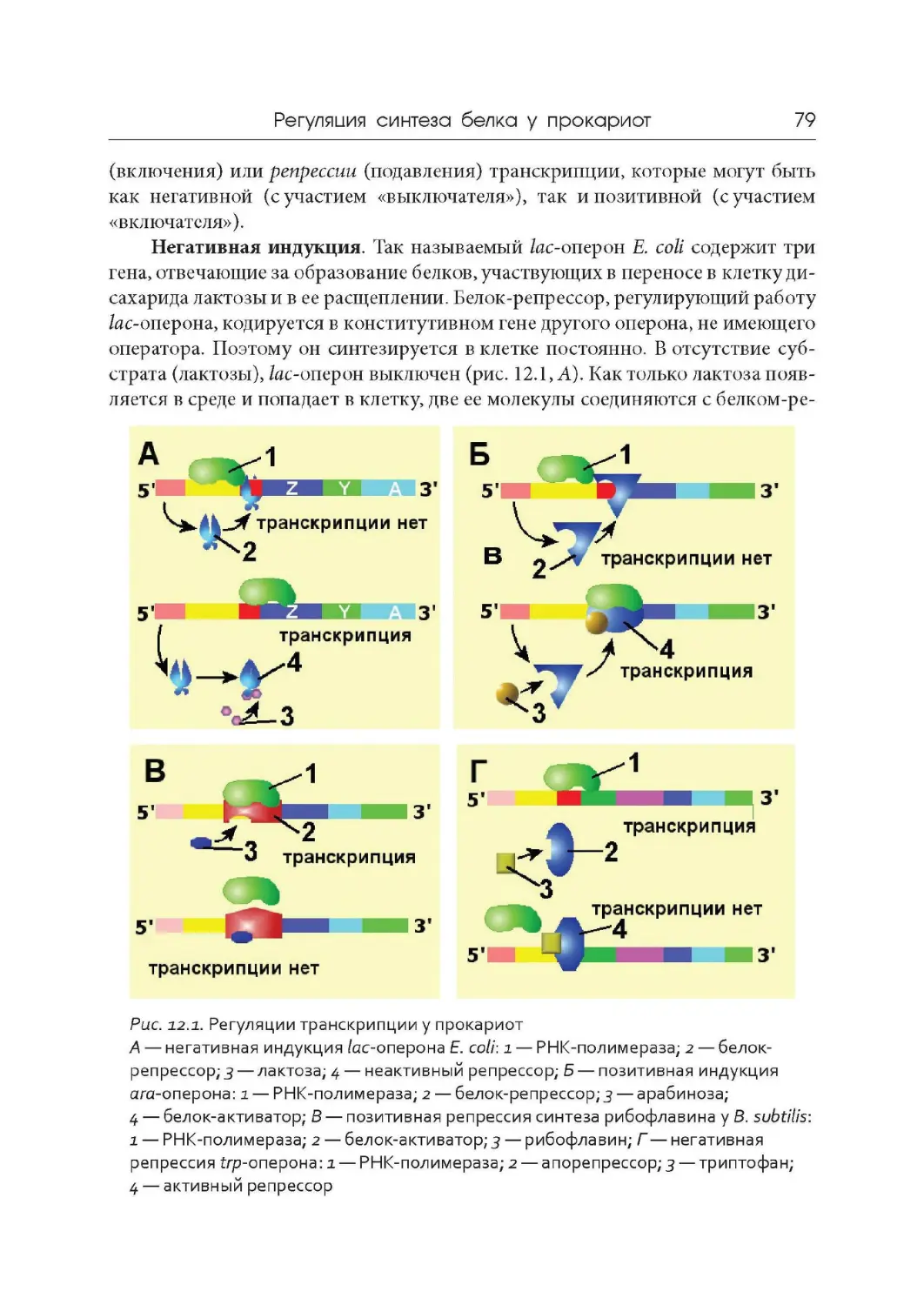
Лекция 12. Регуляция синтеза белка у прокариот
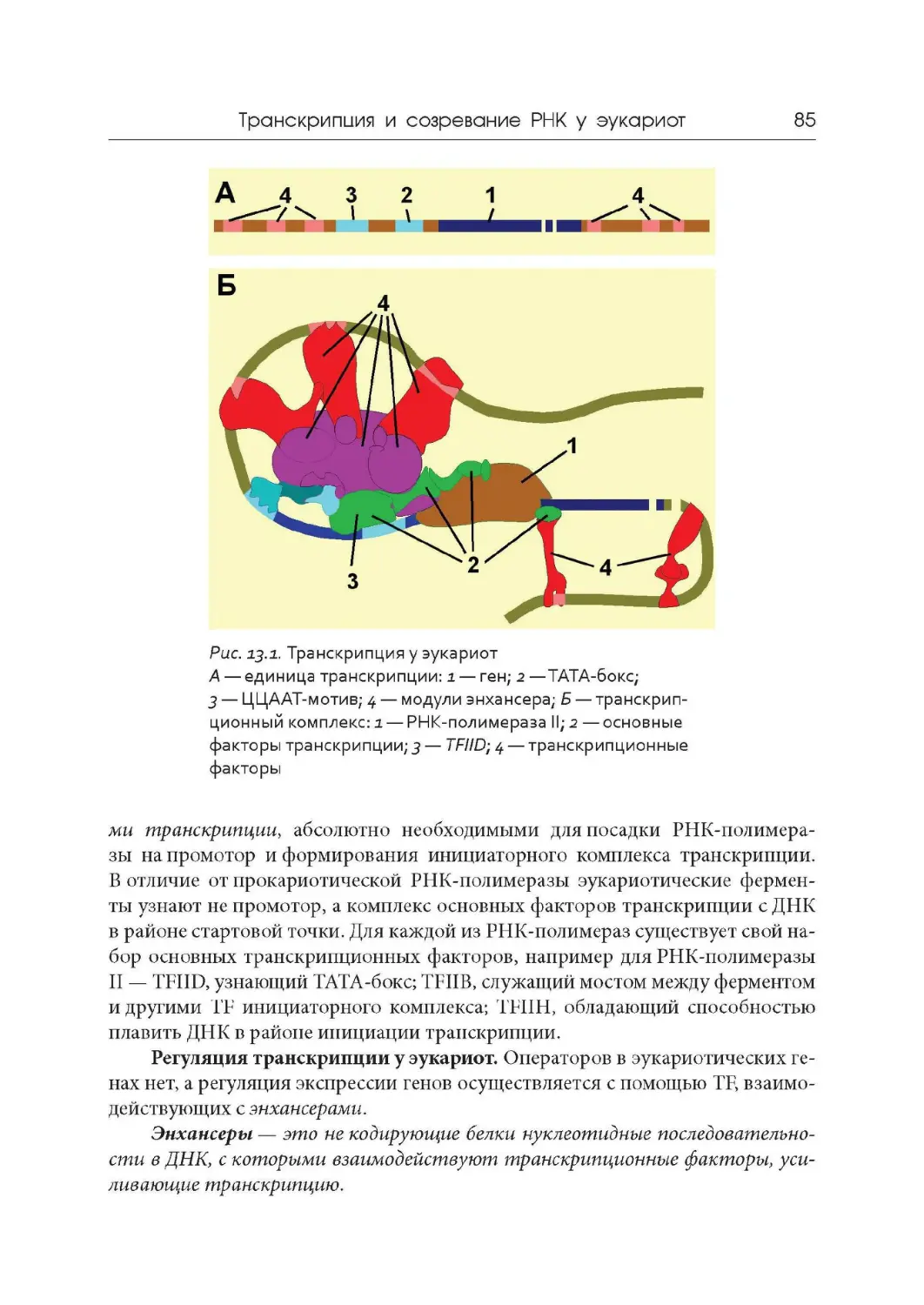
Лекция 13. Транскрипция и созревание РНК у эукариот
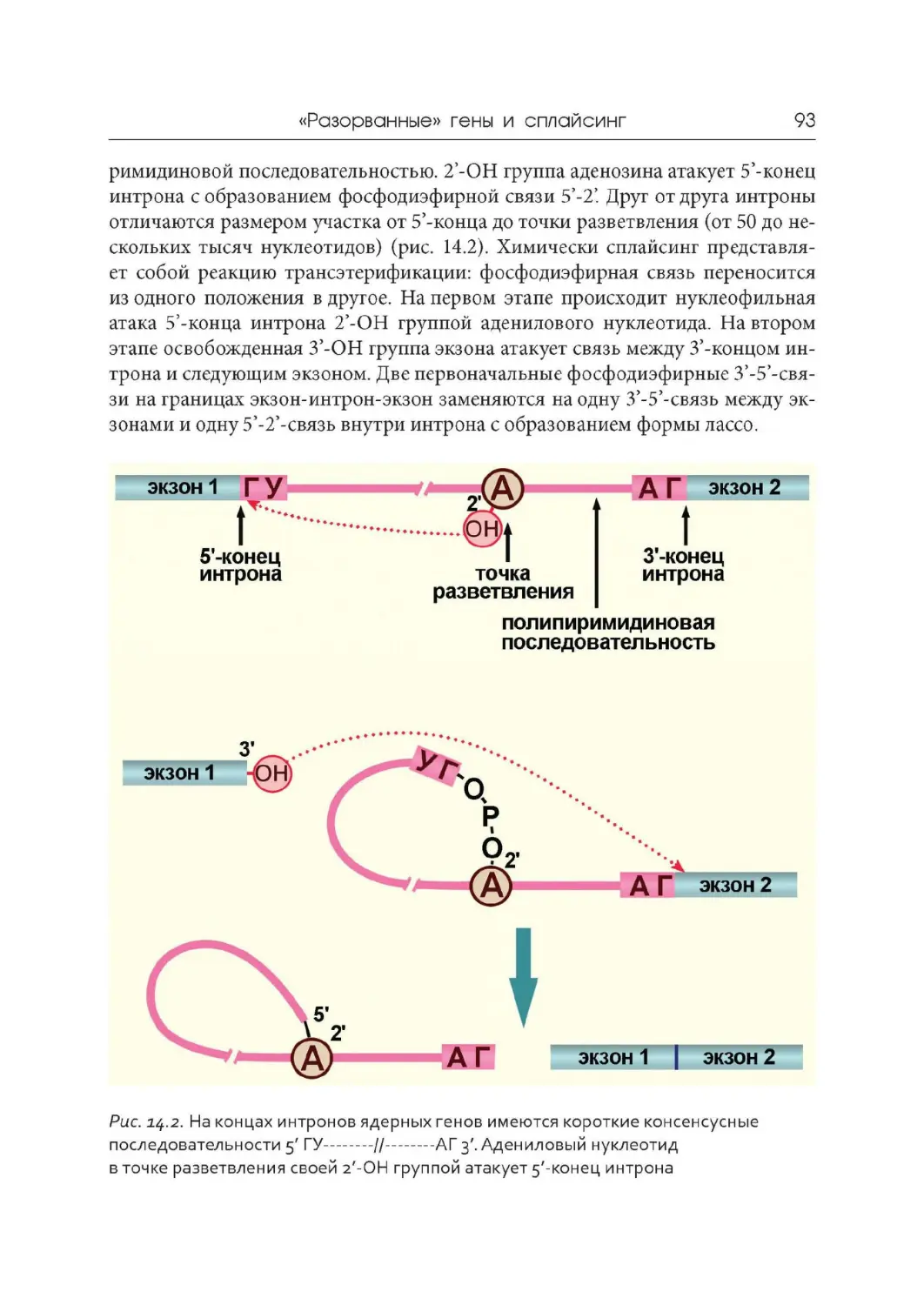
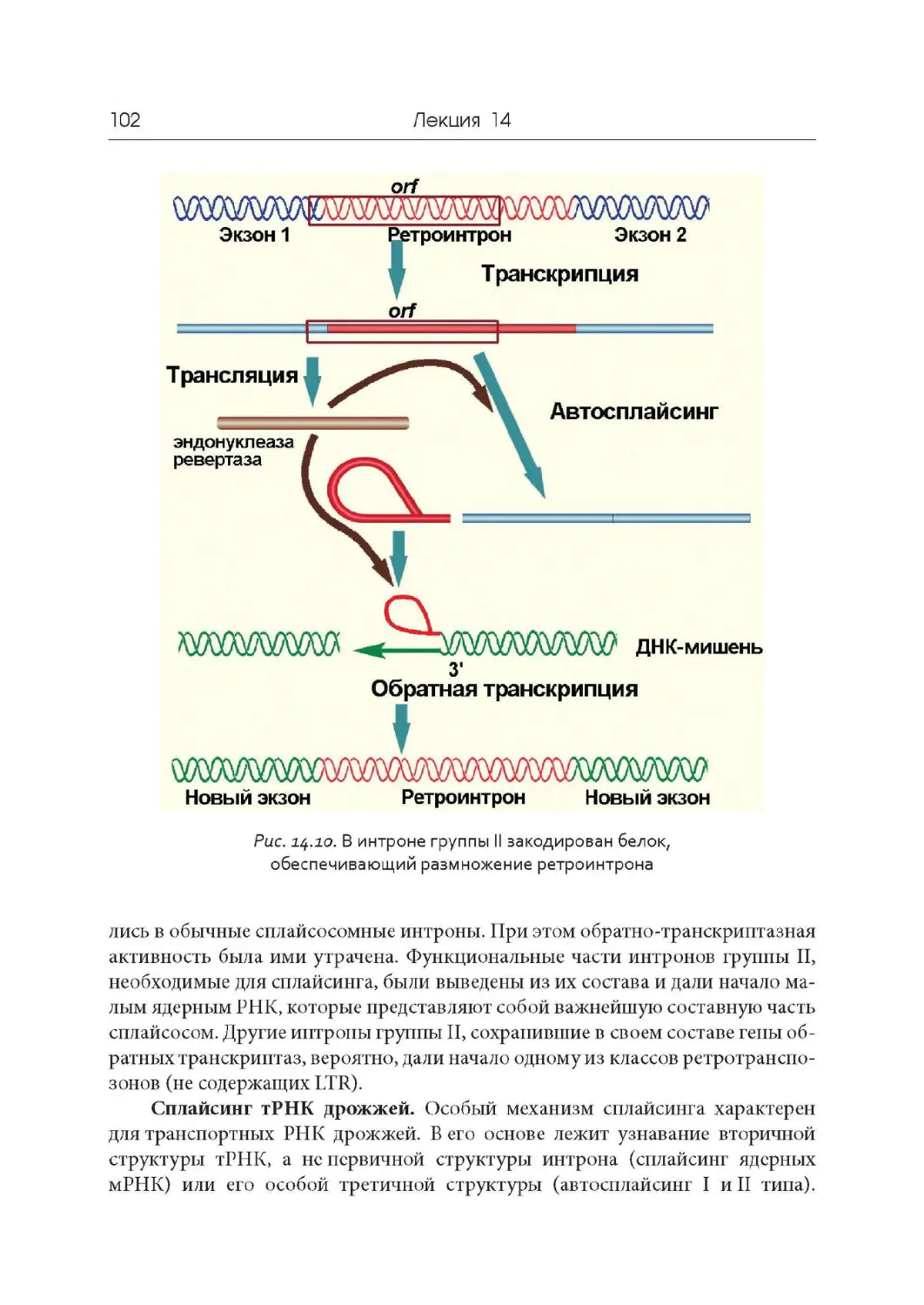
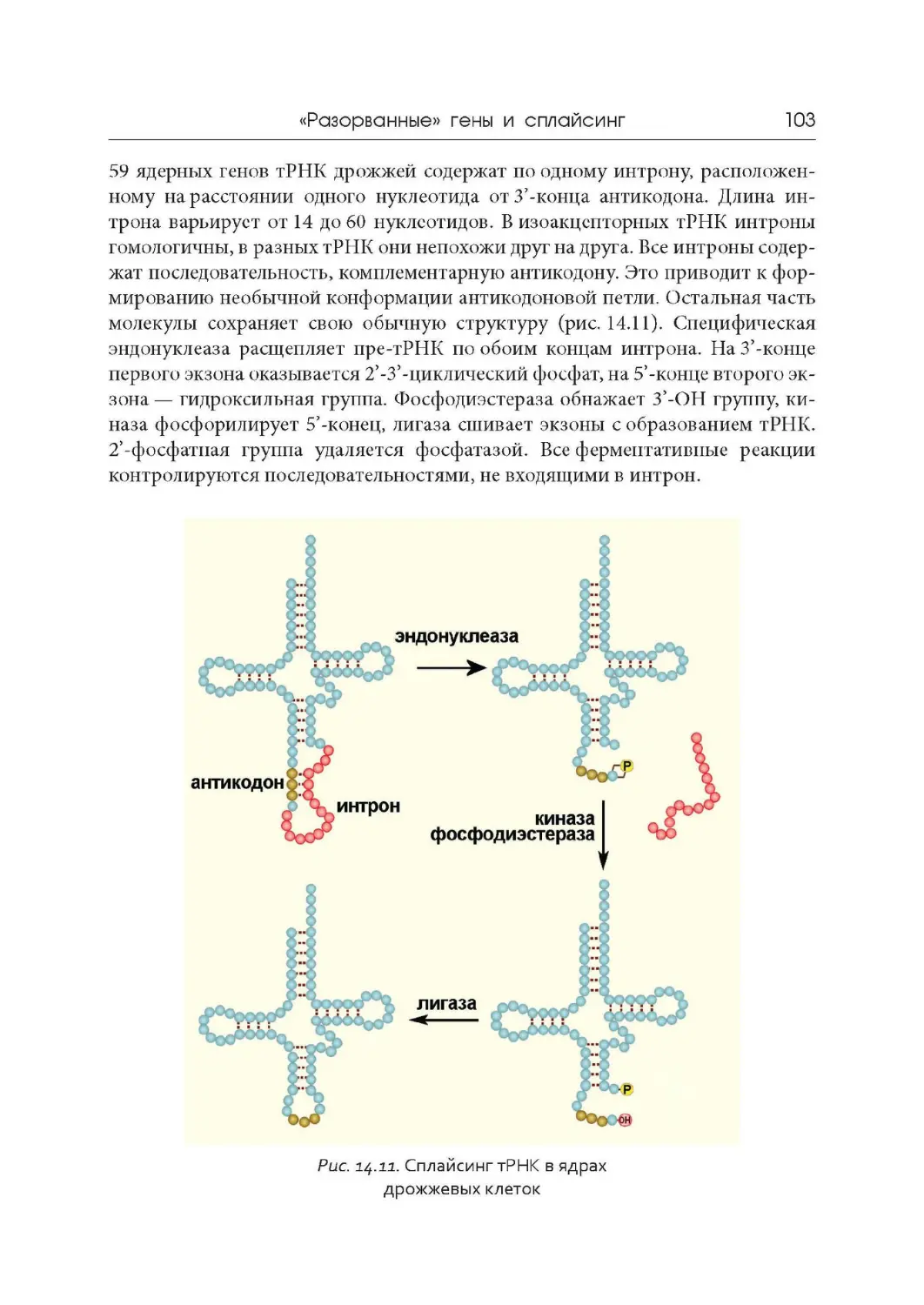
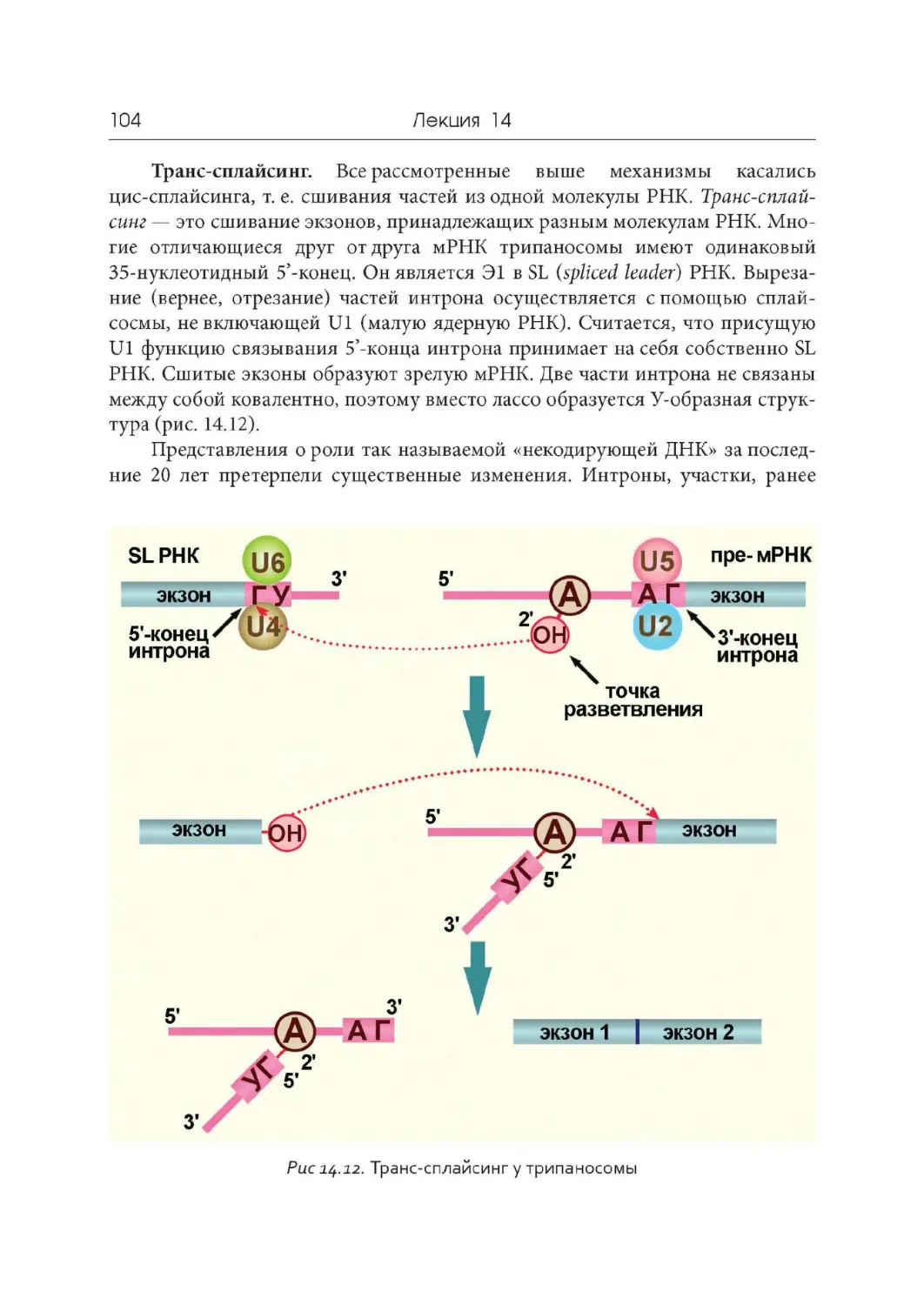
Лекция 14. « Разорванные» гены и сплайсинг
Лекция 15. Регуляторная роль РНК
Лекция 16. Принципы репликации ДНК. Репликация у прокариот
Лекция 17. Особенности репликации ДНК у эукариот
Лекция 18. Репарация ДНК
Лекция 19. Геномы вирусов, прокариот и эукариот
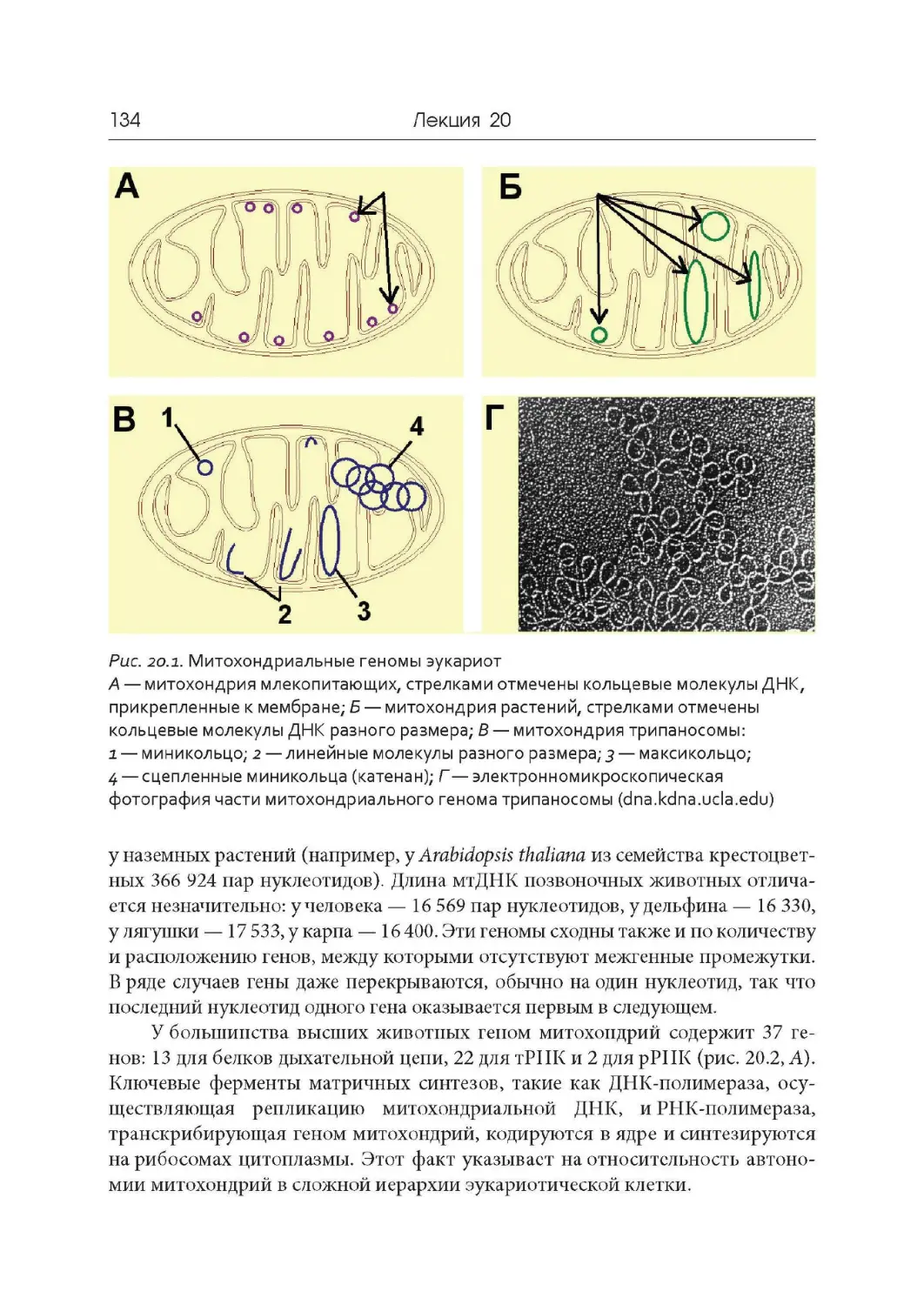
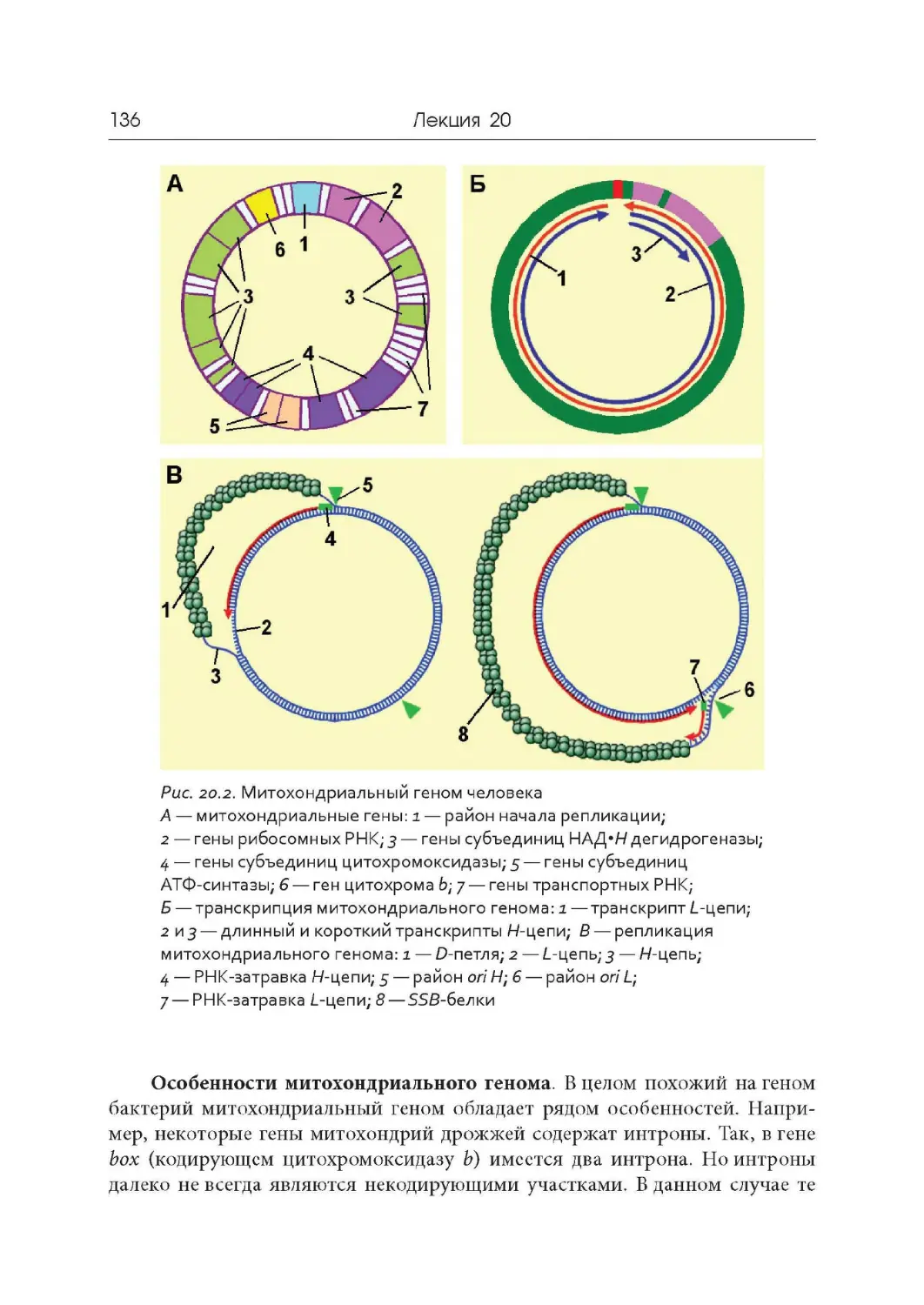
Лекция 20. Геном митохондрий и хлоропластов
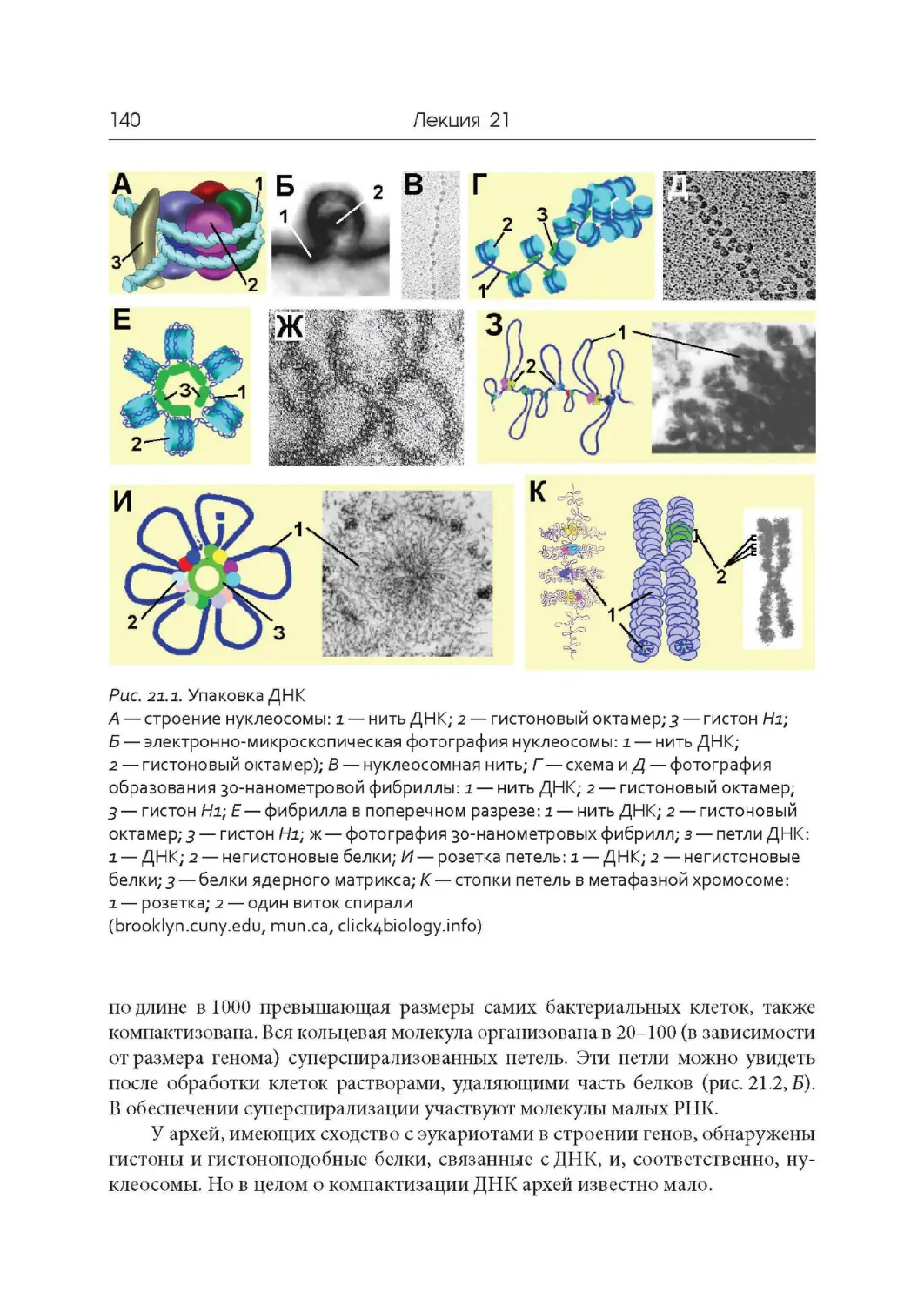
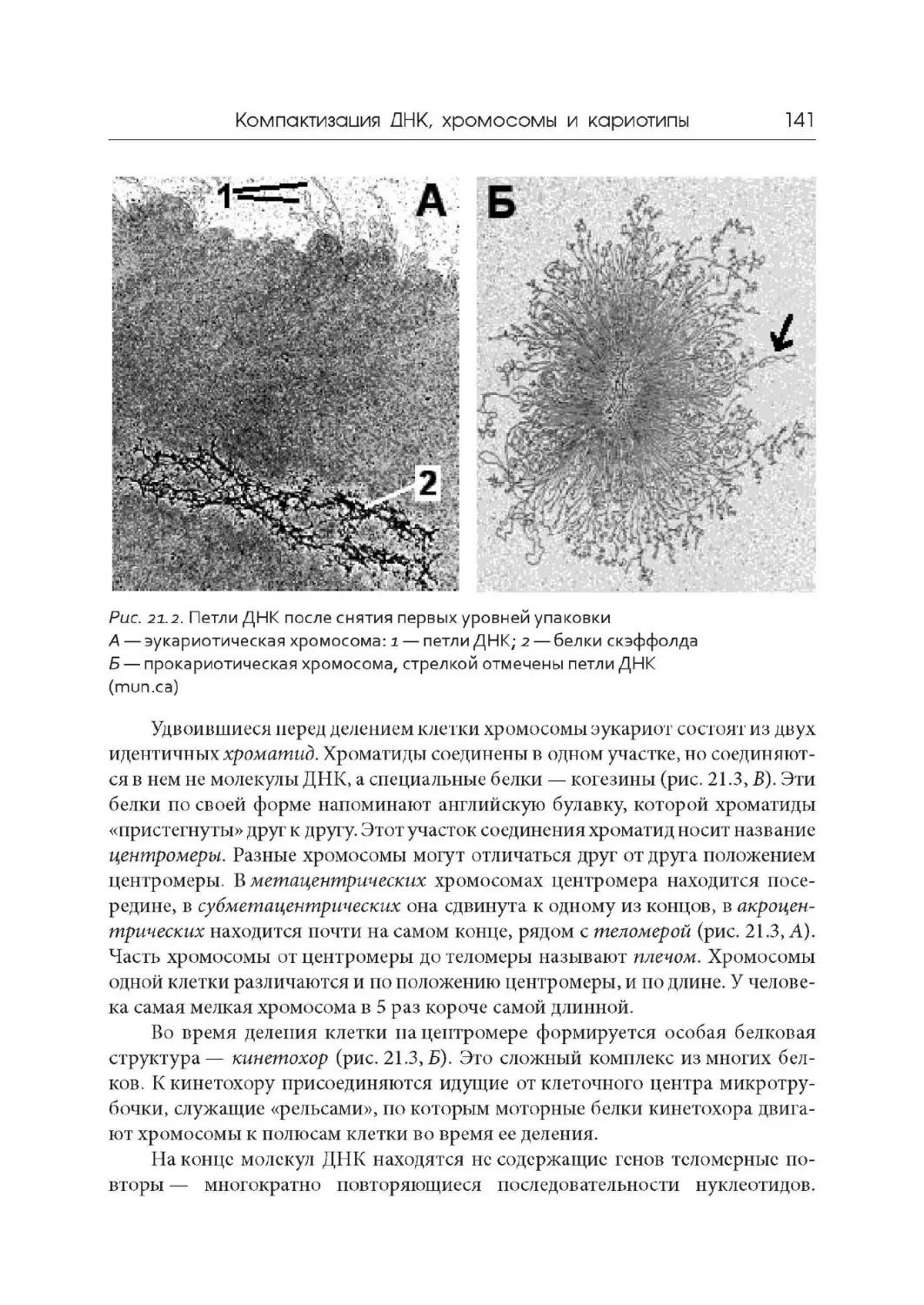
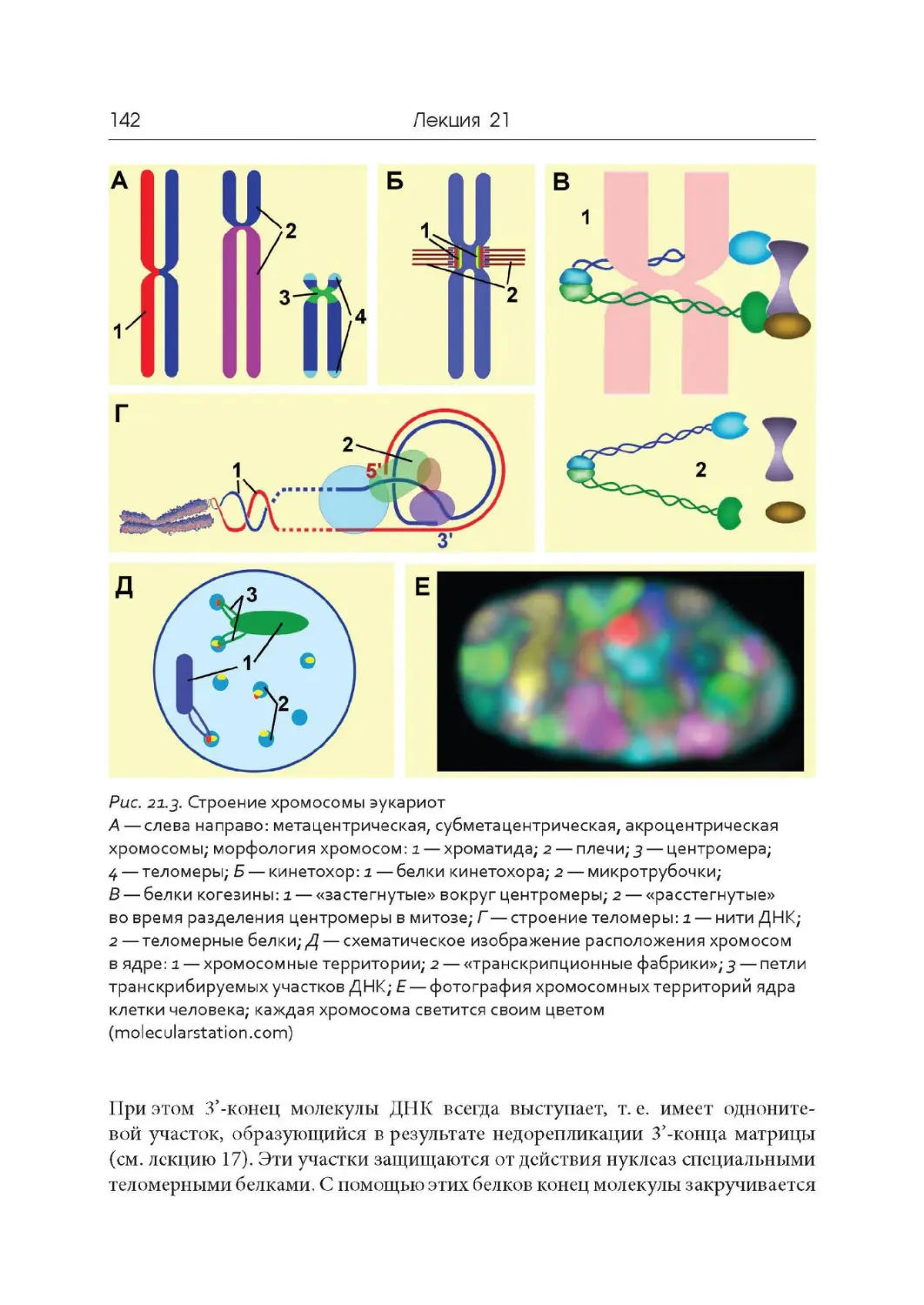
Лекция 21. Компактизация ДНК, хромосомы и кариотипы
Лекция 22. Дифференциальная активность генов
Лекция 23. Мобильные генетические элементы. Псевдогены.
Эволюция геномов
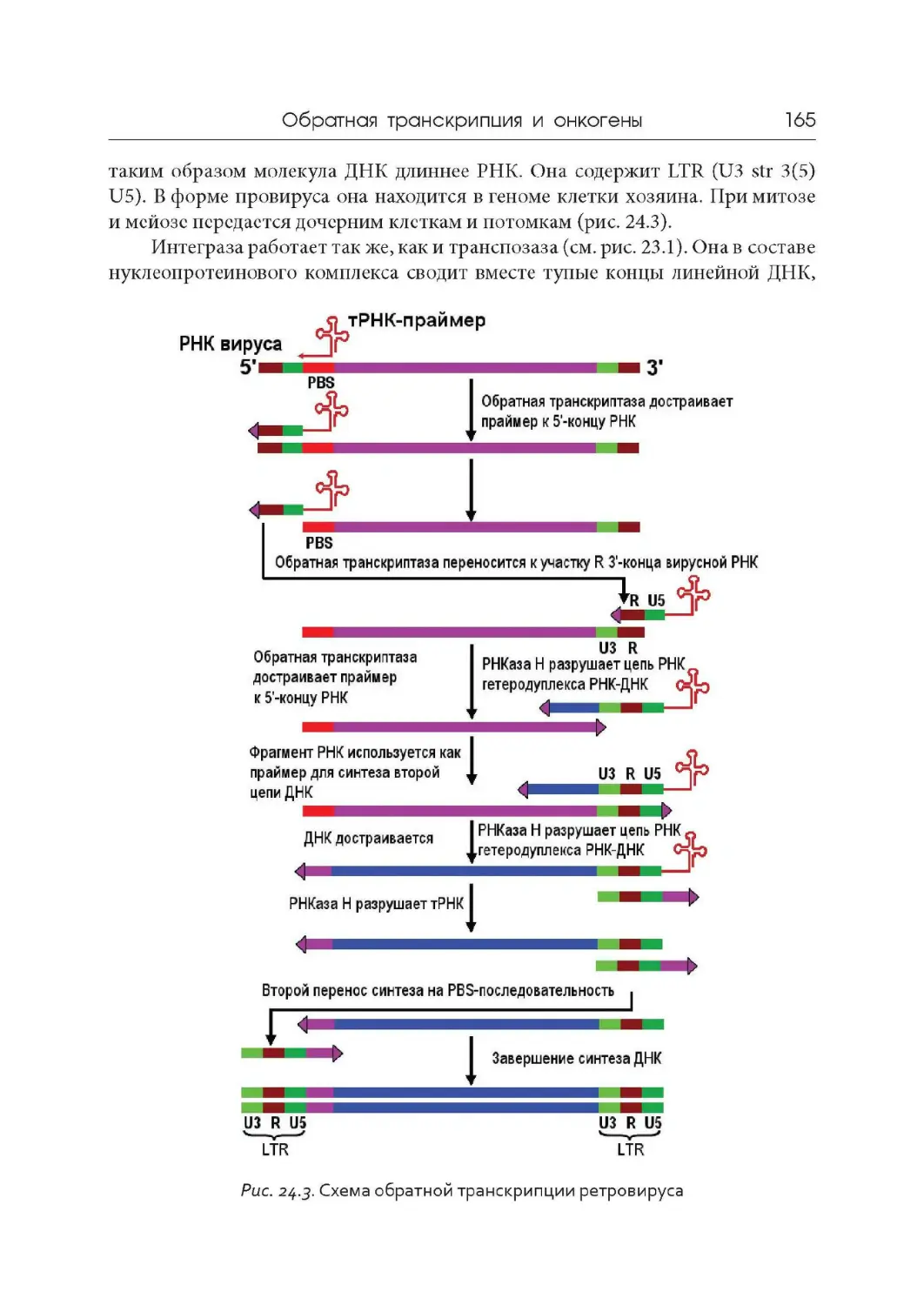
Лекция 24. Обратная транскрипция и онкогены
Лекция 25. Современные представления о происхождении жизни
.4
.9
17
22
30
37
44
49
57
65
73
78
84
91
106
.. 110
117
121
126
133
.. 138
146
152
163
.. 168
4
ЛЕКиИЯ 1
Опрелеление предмета и история молекулярной
биологии, Доказательства генетической роли
нуклеиновых кислот
Определение предмета молекулярной биологии. Термин «молекулярная
биология» принадлежит английскому физику Фрэнсису Крику, которому на-
доело в ответ на вопрос о его профессии объявлять себя смесью кристалло-
графа, биохимика, биофизика и генетика. После атомной бомбардировки Хи-
росимы и Нагасаки в 1945 г. началось бегство ученых из физики, а в 1947 г. Но-
белевский лауреат физик Эрвин Шредингер написал книгу «Что такое жизнь
сточки зрения физики?» , которая стала путеводной звездой для физиков
и математиков. Именно приход аналитических умов в биологию, до той поры
в значительной степени описательную науку, открыл горизонты познания
тончайших и в то же время надежных молекулярных механизмов , лежащих
в основе функционирования клеток и вирусов, органов и тканей, организмов
и экосистем.
Молекулярная биология — это наука о механизмах хранения, воспроизве-
дения, передачи и реализации генетической информации; о структуре и функ-
циях нерегулярных биополимеров — нуклеиновых кислот и белков.
Основные этапы развития молекулярной биологии
Романтический период (детство)
В 1935-1944 гг. Макс Дельбрюк и Сальвадор Лурия (Нобелевская премия
1969 года) занимались изучением репродукции фагов и вирусов, представ-
ляющих собой субмолекулярные комплексы нуклеиновых кислот и белков.
В 1940 г. Джордж Бидл и Эдвард Татум ( Нобелевская премия 1958 года) сфор-
мулировали гипотезу «Один ген — один фермент». Однако тогда еще нс знали,
что такое ген в физико-химическом плане.
Определение предмета и история молекулярной биологии. ..
5
Второй романтический период (отрочество)
В 1944-1953 гг. была доказана генетическая роль ДНК. В 1953 г. появи-
лась модель двойной спирали ДНК, за которую ее создатели Джеймс Уотсон
и Френсис Крик, а также кристаллограф Морис Уилкинс в 1962 году были удо-
стоены Нобелевской премии.
Догматический период (юность)
В 1953-1962 гг. была доказана генетическая роль РНК. Сформулирована
центральная догма молекулярной биологии: перенос генетической информа-
ции идет в направлении ДНК -> РНК белок. В 1962 г. была закончена рас-
шифровка генетического кода.
Академический период (зрелость)
С 1962 г. по настоящее время; с 1974 года выделяют генно- инженерный
подпериод.
Основные открытия и фундаментальные исследования
1944 г. Доказательство генетической роли ДНК. Освальд Эйвери, Колин
Мак -Леод , Маклин Мак -Карти.
1948 г. Открытие явления транспозиции и мобильных генетических эле-
ментов. Барбара Мак - Клинток (Нобелевская премии 1983 года).
1953 г. Установление структуры ДНК . Джеймс Уотсон, Френсис Крик.
Кристаллограф Розалинда Франклин (1920-1958) не дожила до присуждения
Нобелевской премии в 1962 г.
1961 г. Открытие генетической регуляции синтеза ферментов. Андре
Львов, Франсуа Жакоб, Жак Моно (Нобелевская премия 1965 года).
1962 г. Расшифровка генетического кода. Маршалл Нирнберг, Генрих
Маттеи, Северо Очоа, Гобинд Корана, Роберт Холли (Нобелевская премия
1968 года ).
1967 г. Синтез in vitro биологически активной ДНК. Артур Корнберг (Но-
белевкая премия 1959 года за исследование механизма биосинтеза нуклеино-
вых кислот).
1970 г. Химический синтез гена. Гобинд Корана.
1970 г. Открытие фермента обратная транскриптаза и явления обрат-
ной транскрипции. Говард Темин, Дэвид Балтимор, Репато Дульбеко (Нобелев-
ская премия 1975 года).
1970-1990 гг. Открытие ключевых регуляторов клеточного цикла. Леланд
Хартвил, Тимоти Хант, Пол Нерс (Нобелевская премия 2001 года).
1970-2000 гг. Фундаментальное исследование молекулярных основ транс-
крипции у эукариот. Роджер Корнберг (Нобелевская премия 2006 года).
6
Лекиия 1
1973 г. Создание аналитического метода установления последовательно-
сти в ДНК. Фредерик Сенгер (Нобелевская премия 1980 года).
1974 г. Открытие рестриктаз. Гамильтон Смит, Даниэль Натане, Вернер
Арбер (Нобелевская премия 1978 года).
1974-1980 гг. Фундаментальные исследования биохимических свойств ну-
клеиновых кислот, в особенности рекомбинантных ДНК. Пол Берг (Нобелев-
ская премия 1980 года).
1974-1996 г. Открытия в области генетического регулирования развития
органов и механизмов апоптоза. Сидни Бреннер, Роберт Хорвиц, Джон Сал-
стон (Нобелеская премия 2003 года).
1975-2005 гг. Фундаментальные исследования структуры и функции ри-
босом. Вепкатрамап Рамакришпап, Томас Стейц, Ада Йопат (Нобелевская пре-
мия 2009 года).
1978 г. Открытие прерывистой структуры гена и явления сплайсинга.
Филипп Шарп, Ричард Робертс (Нобелевская премия 1993 года ).
1980-2010 гг. Фундаментальные исследования репарации ДНК. Томас Лин-
дал, Пол Модрич, Азиз Санджар (Нобелевская премия 2015 года).
1982 г. Открытие каталитической активности РНК и явления автос-
плайсинга. Томас Чек (Нобелевская премия 1989 года).
1982 г. Открытие прионов и нового биологического принципа инфекции.
Стэнли Прузинер (Нобелевская премия 1997 года).
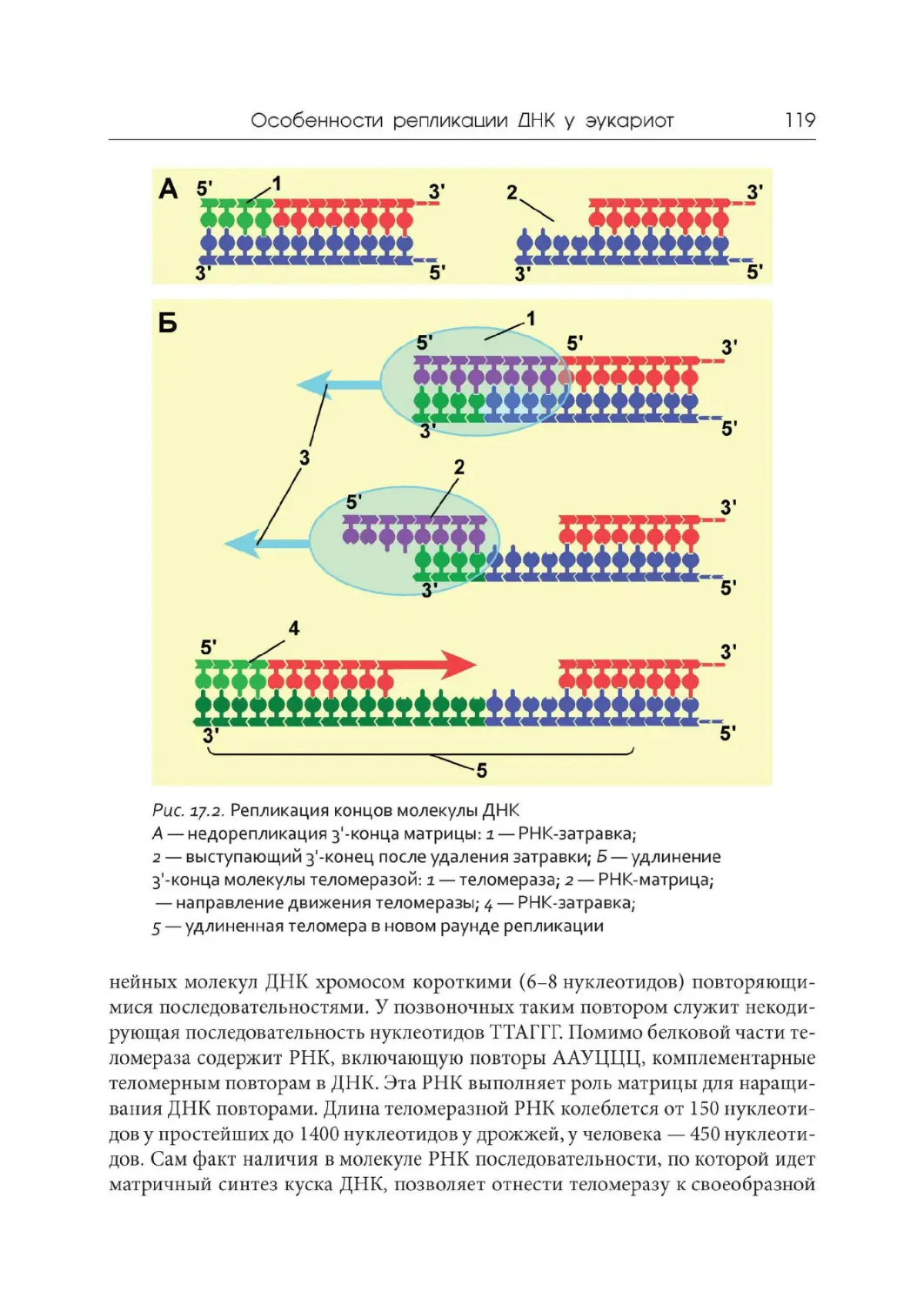
1984 г. Открытие защитных механизмов хромосом от концевой недоре-
пликации (предсказанных в 1971 году Алексеем Оловниковым) с помощью те-
ломер и теломеразы. Кэрол Грейдер, Элизабет Блэкберн, Джек Шостак (Нобе-
левская премия 2009 года).
1987 г. Создание метода полимеразной цепной реакции (ПЦР). Кери Мул-
лис (Нобелевская премия 1993 года).
1998 г. Открытие явления РНК-интерференции. Эндрю Файер и Крейг
Мелло (Нобелевская премия 2006 года).
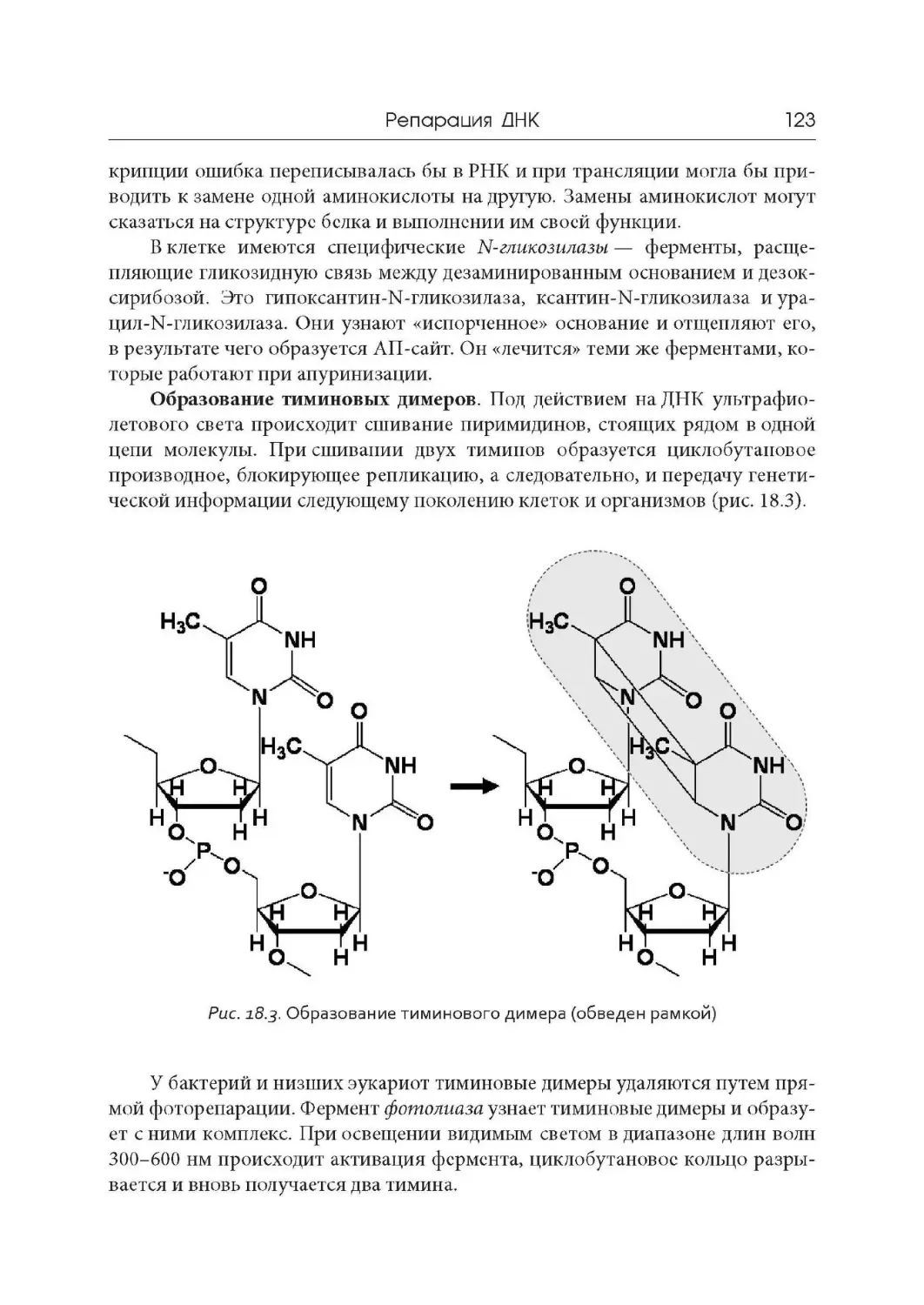
Доказательства генетической роли нуклеиновых кислот. Дезоксирибону-
клеиновая кислота (ДНК) была открыта швейцарским химиком Фридрихом
Мишером в 1868 г. Он выделил из погибших клеток, содержавшихся в гное,
вещество, которое назвал нуклеином. Затем, когда Мишер определил, что это
вещество является кислотой, его назвали нуклеиновой кислотой. Функции
этого вещества долгое время были неизвестны.
В 1928 г. английский врач Фредерик Гриффит открыл явление транфор-
мации. Гриффит работал с пневмококками — бактериями, вызывающими
пневмонию. Он брал два штамма пневмококков: с капсулой и без капсулы.
Капсульные бактерии при заражении мышей вызывали у них заболевание
и гибель, бсскапсульныс заболевания нс вызывали, т. с. были непатогенны-
ми. При введении мышам смеси убитых нагреванием (и, следовательно, по-
Определение предмета и история молекулярной биологии . . .
7
вирулентность)
пневмококков
терявших
капсульных
и живых бескапсульных не-
вирулентных бактерий, жи -
вотные погибали в результа -
те размножения капсульных
вирулентных форм (рис. 1.1).
Другими словами, свойство
образовывать капсулу и спо-
собность вызывать заболева-
ние передавалось от убитых
бактерий к живым. Обнару-
женное явление Гриффит на -
звал трансформацией.
Трансформация — это
приобретение одним орга-
низмом некоторых призна -
ков другого организма за счет
захвата части его генетиче -
ской информации.
В 1944 г.
этот
экс-
перимент был повторен
О. Эйвери,
К. Мак -Леодом
и М. Мак- Карти
торыми
модификациями.
Они к культуре бескапсуль-
ных пневмококков добав-
ляли белки, полисахари-
ды или ДНК, выделенные
из капсульных бактерий. Оказалось, что трансформацию вызывала только
ДНК, а белки и полисахариды таким эффектом не обладали. Так была выявле-
на генетическая роль ДНК.
В 1952 г. Альфред Херши и Марта Чейз доказали, что ДНК содержит ин -
формацию и о строении белков, и о собственном воспроизведении. Они рабо-
тали с бактериофагами (или просто фагами ’) кишечной палочки.
Кишечная палочка (£. coli) — бактерия, обитающая в кишечнике тепло-
кровных животных . Поскольку большинство ее штаммов безвредно для че-
ловека, ее широко используют в молекулярно-биологических исследованиях .
Опыт Херши и Чейз состоял в том, что фаги, у которых белковая оболочка была
с неко-
Рис. 1.1. Трансформация бактерий
1 — бескапсульные непатогенные бактерии;
2 — капсульные патогенные бактерии;
3 — убитые капсульные бактерии
'
Фаги — это вирусы, размножающиеся в бактериях .
8
Лекиия 1
мечена радиоактивной серой 35S, а ДНК — радиоактивным фосфором 32
Р, ин-
кубировали с бактериями. Затем бактерии промывали и определяли, какие ра-
диоактивные изотопы они содержат. Оказалось, что бактерии содержали толь-
ко 32
Р и не содержали 33S. В смывных же водах оказалась только ”S, а меченый
фосфор не обнаруживался. Следовательно, внутрь попадала только ДНК. Через
несколько минут из бактерии выходили десятки полноценных фагов, содержа-
щих и белковую оболочку, и ДНК. Отсюда следовал однозначный вывод о том,
что именно ДНК выполняет генетическую функцию — несет информацию как
о создании новых копий ДНК, так и о синтезе фаговых белков.
В 1957 г. Хейнц Френкель-Ко-
Штамм 1
Штамм 2
нрат показал, что носителем ге-
нетической информации может
служить не только ДНК, но и РНК.
Он работал с вирусом табачной
мозаики (ВТМ). В атом вирусе со-
держится РНК, а не ДНК. Было из-
вестно, что разные штаммы вируса
вызывают разную картину пора-
жения листьев табака. X. Френ-
кель -Конрат разделил вирусы,
принадлежавшие разным штам-
мам, на белок и РНК, а затем по-
менял их составные части: к РНК
вирусов одного штамма добавил
белок другого штамма. Вирусные
частицы обладают свойством са-
мосборки — в такой смеси из мо-
лекул РНК и белка самопроизволь-
но собираются вирусные частицы.
После смены белковой оболочки
Ж ш§-
I
^lmrrrmrrnrnv-
РНК 1
/ Капсид 2
|
|PfA\ Инфицирование
РНК 1
Капсид 1
«Переодетые» вирусы вызывали
картину поражения, характерную
для того штамма, чья РНК была
покрыта чужим белком (рис. 1.2)
На сегодняшний день существуют сотни тысяч доказательств генетиче-
ской роли нуклеиновых кислот, но эти три являются классическими.
Рис. 1.2 . Доказательство
генетической роли РНК
9
ЛЕКиИЯ 2
Строение и функиии нуклеиновых кислот
Для функционирования клеток и организмов необходимы не только «ма-
териалы и инструменты» (белки) , но и «чертежи», и «инструкции по изготов-
лению и использованию», т. е. информация о строении белков. Белки не спо-
собны к хранению и передаче информации. « Информационными молекула-
ми» являются нуклеиновые кислоты : дезоксирибонуклеиновая кислота (Д1 Ж )
и рибонуклеиновая кислота (РНК). Они представляют собой нерегулярные
полимеры, мономерами которых являются нуклеотиды.
Нуклеотидами называют сложные органические молекулы, состоящие
из остатков трех более простых молекул: пятиуглеродного сахара ( рибозы
или дезоксирибозы ) , азотистого основания (гетероциклического азотсо-
держащего соединения) и фосфорной кислоты. Азотистые основания яв-
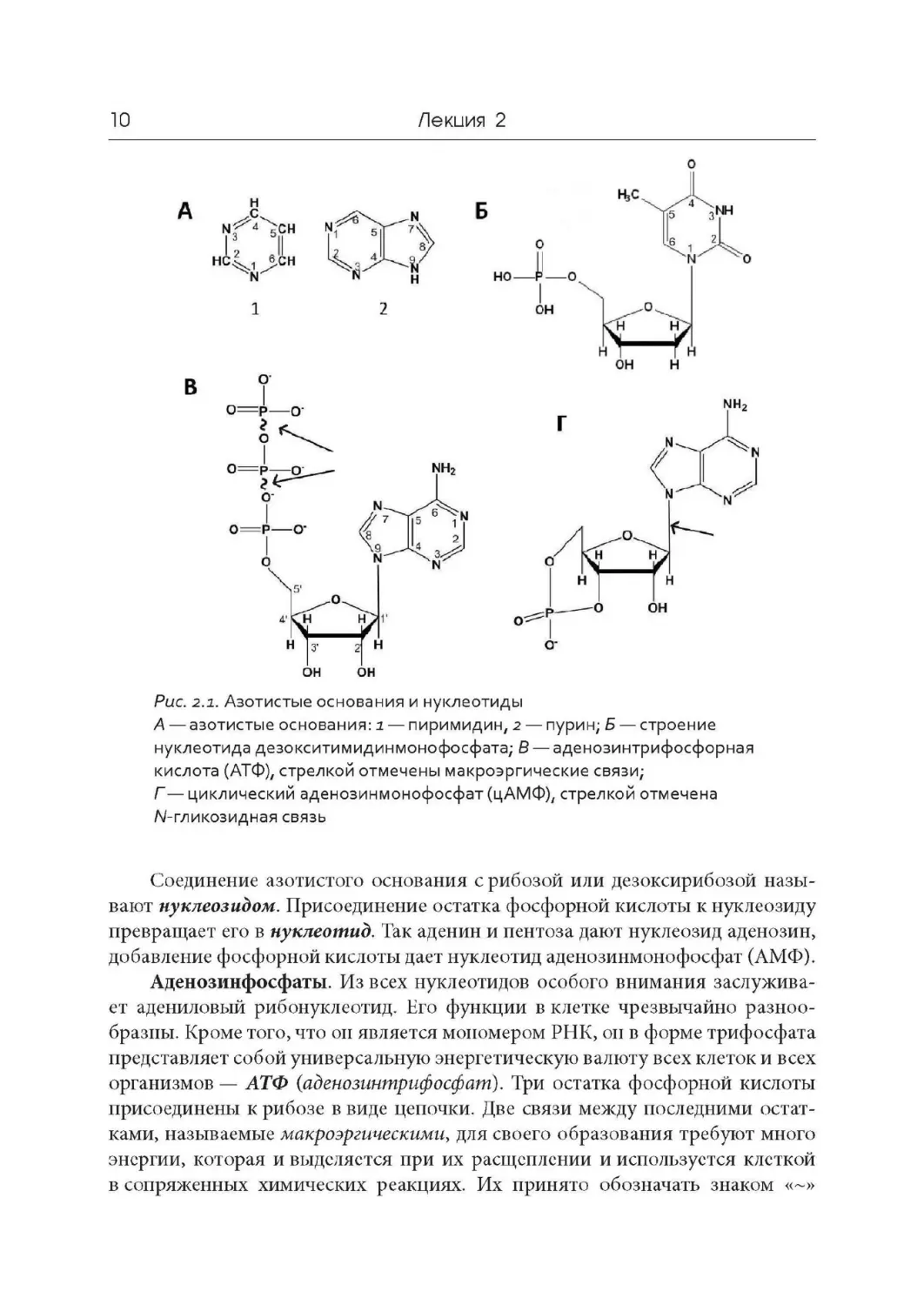
ляются производными либо пурина, либо пиримидина (рис. 2.1, А ). Так как
и сахара, и азотистые основания могут существовать отдельно друг от дру-
га и для каждого из них есть общепринятая нумерация атомов в молекуле,
то в составе нуклеотида атомы сахара обозначаются цифрами со штрихом.
В нуклеотиде пиримидиновое азотистое основание присоединено к сахару
в положении 1- Т, пуриновое в положении 9- Т, а остаток фосфорной кислоты
находится в 5’-положении пентозы (рис. 2.1, Б ). Азотистых оснований суще-
ствует довольно много, так как у разных атомов гетероциклов могут быть
разные заместители , но в состав нуклеиновых кислот в основном входят
только пять из них : аденин, гуанин, тимин и цитозин в состав ДНК; аденин,
гуанин, урацил и цитозин в состав РНК. Сокращенно их принято обозначать
начальными буквами: А, Г, Т, Ц , У. А и Г — пурины, Т, Ц и У — пиримидины.
Связь между азотистым основанием и пентозой называют N-гликозидной
(рис. 2.1, Г). В некоторых случаях в состав нуклеиновых кислот могут вхо-
дить так называемые минорные ( редкие, неглавные) основания, отличающие-
ся наличием или отсутствием определенных групп. Больше всего минорных
оснований находится в транспортных РНК.
10
Лекиия 2
н
А
Тf 4>
H
г
нсЧ>сн
^
1
о
В
0=Р О'
Рис. 2.1. Азотистые основания и нуклеотиды
А — азотистые основания : i — пиримидин, 2 — пурин; Б — строение
нуклеотида дезокситимидинмонофосфата; В — аденозинтрифосфорная
кислота (АТФ), стрелкой отмечены макроэргические связи;
Г — циклический аденозинмонофосфат (цАМФ), стрелкой отмечена
/V- гликозидная связь
Соединение азотистого основания с рибозой или дезоксирибозой назы-
вают нуклеозиЬом. Присоединение остатка фосфорной кислоты к нуклеозиду
превращает его в нуклеотид. Так аденин и пентоза дают нуклеозид аденозин,
добавление фосфорной кислоты дает нуклеотид аденозинмонофосфат (АМФ).
Аденозинфосфаты. Из всех нуклеотидов особого внимания заслужива-
ет адениловый рибонуклеотид. Нго функции в клетке чрезвычайно разноо-
бразны. Кроме того, что он является мономером РНК, он в форме трифосфата
представляет собой универсальную энергетическую валюту всех клеток и всех
организмов — АТФ ( аденозинтрифосфат) . Три остатка фосфорной кислоты
присоединены к рибозе в виде цепочки. Две связи между последними остат-
ками, называемые макроэргическими, для своего образования требуют много
энергии, которая и выделяется при их расщеплении и используется клеткой
в сопряженных химических реакциях . Их принято обозначать знаком « ~»
Строение и функиии нуклеиновых кислот
11
(рис. 2.1, В ). В некоторых случаях в роли аккумулятора энергии может высту-
пать ГТФ — гуанозинтрифосфат.
Адснозинмонофосфат также является очень важным соединением. Оста-
ток фосфорной кислоты в его составе может вступать в еще одну связь с остат-
ком рибозы — в положении 3’, образуя так называемый циклический аденозин -
монофосфат (цАМФ) (рис. 2.1, Г). Эта молекула является одним из основных
внутриклеточных переносчиков сигналов.
Производными аденозинфосфатов являются некоторые коферменты .
Например, важнейшими коферментами, участвующими в окислительно-вос-
становительных реакциях в клетке, являются динуклеотиды, обозначаемые
аббревиатурами НАД, НАДФ, ФАД. В них одним нуклеотидом обязательно
является адепозипфосфат. В качестве азотистого основания второго нуклео-
тида выступают витамины группы В: никотинамид, флавин.
Первичная структура нуклеиновых кислот. Нуклеиновые кислоты —
очень длинные молекулы. Их цепочки могут насчитывать десятки миллионов
мономеров. При этом все мономеры соединены друг с другом только одним
способом — З’-гидроксильная группа одного нуклеотида соединена эфирной
связью с остатком фосфорной кислоты, находящейся в 5’-положении соседне-
го нуклеотида. Такое соединение можно рассматривать как диэфир фосфор-
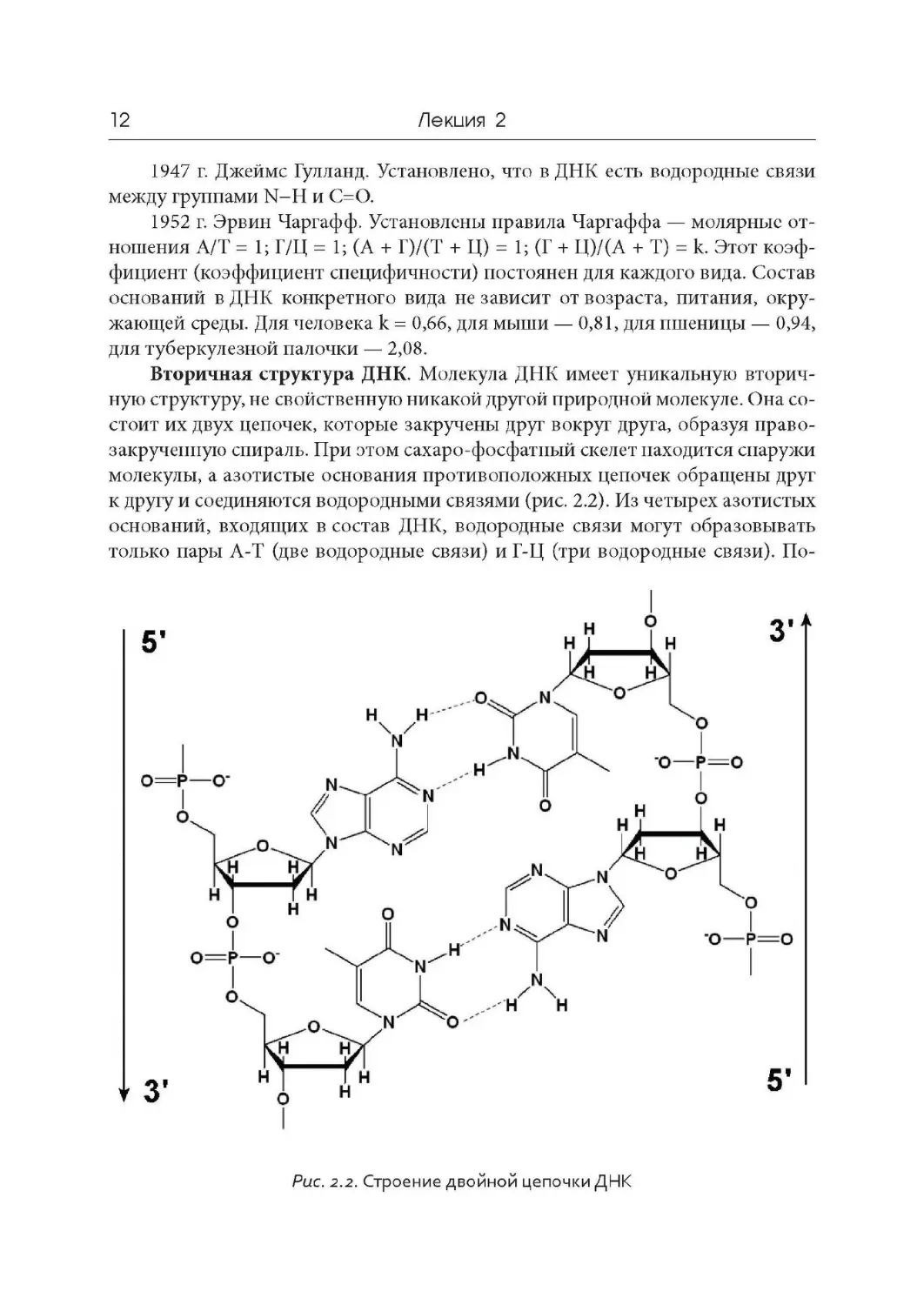
ной кислоты, поэтому связь называют 3’- 5’-фосфодиэфирной (рис. 2.2). В ре-
зультате нуклеиновая кислота всегда на З’- конце имеет гидроксильную группу,
а на 5’-конце — остаток фосфорной кислоты. ДНК бактерий, некоторых ви-
русов , а также клеточных органоидов (митохондрий и хлоропластов) концов
не имеют, так как они ковалентно замкнуты и представляют собой кольцо.
В соединении нуклеотидов одной цепи азотистые основания участия
не принимают. Поэтому основу молекулы составляет так называемый саха-
ро-фосфатный остов (скелет) , имеющий регулярную структуру. Нерегуляр-
ность всей молекуле придает чередование азотистых оснований.
Хронология открытий, подготовивших создание Уотсоном и Криком
модели двойной спирали ДНК:
1868 г. Фридрих Мишер. Обнаружение нуклеина. Современное назва-
ние — хроматин.
1889 г. Рихард Альтман. Разделение нуклеина на нуклеиновую кислоту
и белок. Введение термина «нуклеиновая кислота».
1900 г. Описание азотистых оснований химиками.
1909 г. Фашель Левин. Обнаружение в нуклеиновых кислотах фосфорной
кислоты и рибозы.
1930 г. Фашель Левин. Обнаружение дезоксирибозы.
1938 г. Уильям Астбюри, Флорин Белл. С помощью рентгено-структурно-
го анализа установлено расстояние между уложенными стопками азотистыми
основаниями в ДНК — 0 ,34 нм.
12
Лекиия 2
1947 г. Джеймс Гулланд. Установлено, что в ДНК есть водородные связи
между группами N-H и С=0.
1952 г. Эрвин Чаргафф. Установлены правила Чаргаффа — молярные от-
ношенияА/Т=I;1/11. 1;(А+Г)/(Т+Ц)=1;(Г+Ц)/(А+Т)=к.Этоткоэф-
фициент (коэффициент специфичности) постоянен для каждого вида. Состав
оснований в ДНК конкретного вида не зависит от возраста, питания, окру-
жающей среды. Для человека к = 0 ,66, для мыши — 0,81, для пшеницы — 0 ,94,
для туберкулезной палочки — 2,08.
Вторичная структура ДНК. Молекула ДНК имеет уникальную вторич-
ную структуру, не свойственную никакой другой природной молекуле. Она со-
стоит их двух цепочек, которые закручены друг вокруг друга, образуя право-
закручеппую спираль. При этом сахаро-фосфатный скелет находится снаружи
молекулы, а азотистые основания противоположных цепочек обращены друг
к другу и соединяются водородными связями (рис. 2.2). Из четырех азотистых
оснований, входящих в состав ДНК, водородные связи могут образовывать
только пары А-Т (две водородные связи) и Г-Ц (три водородные связи). По-
Рис. 2.2. Строение двойной цепочки ДНК
Строение и функиии нуклеиновых кислот
13
этому последовательность нуклеотидов в одной из цепочек ДНК однозначно
определяет последовательность нуклеотидов во второй цепочке. Такие пары
нуклеотидов называются комплементарными (взаимодополнитсльными).
В каждую комплементарную пару входит один пурин (А или Г) и один пири-
мидин (Т или Ц). Строение и пространственная организация нуклеотидов
такова, что водородные связи могут образоваться только в том случае, когда
цепочки одной молекулы расположены антмпараллелъно — против З’- конца
одной цепочки всегда находится 5’-конец другой. Таким образом, принципами
строения ДНК являются 1) нерегулярность; 2) двуцепочечноеть; 3) компле-
ментарностъ; 4) антипараллельность.
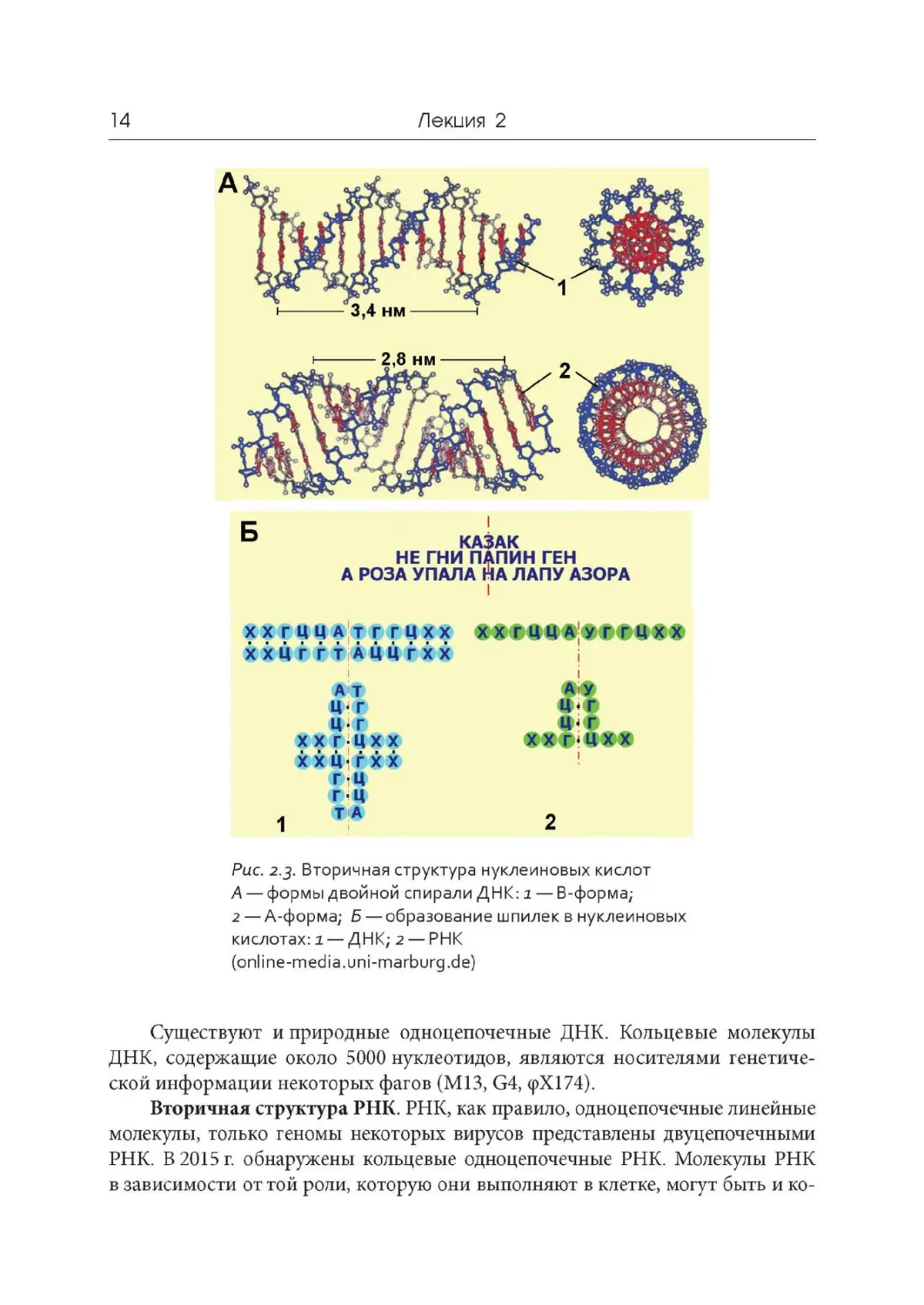
Существуют несколько форм двойной спирали ДНК (рис. 2.3, А ). В основ-
ной В- форме па один виток приходится 10 комплементарных пар, шаг спира-
ли составляет 3,4 нм. Плоскости азотистых оснований перпендикулярны оси
спирали, образуя как бы ступеньки винтовой лестницы. Соседние комплемен-
тарные пары повернуты друг относительно друга на 36°. Диаметр спирали со-
ставляет 2 нм. В A-форме на один виток приходится 11 пар нуклеотидов, а пло-
скости азотистых оснований отклонены от нормали к оси спирали на 20°. По-
этому в A-форме молекула ДНК имеет внутреннюю пустоту диаметром 0,5 нм.
Шаг спирали при этом составляет 2,8 нм. A -форму принимают участки ДНК,
контактирующие с ферментом, синтезирующим РНК (РНК-полимеразой).
В отличие от правозакрученных А- и В-форм Z -форма
спираль. На один ее оборот приходится 12 пар нуклеотидов, диаметр 1,8 нм.
Сахарофосфатный остов имеет зигзагообразную форму (отсюда и название
Z-форма). Чаще всего Z-форму принимают чередующиеся ГД пары. Фрагмен-
ты Z-ДНК играют роль (пока неизвестно, какую именно) в регуляции экспрес-
сии генов.
Кроме изменения формы спирали, ДНК может денатурировать (т. е.
терять нормальную, нативную , структуру) в результате разрыва водород-
ных связей. При повышении температуры до 90 °С ДНК становится одноце-
почечной. Эта денатурация обратима, так как при понижении температуры
двуцепочечноеть восстанавливается. Но восстановиться она может только
с соблюдением принципов комплементарности и антипараллельности. Когда
в растворе находится большое количество разных по длине молекул ДНК, по-
иск комплементарной цепочки может занять много времени. Такие молекулы
левозакрученная
могут месяцами оставаться одпоцепочечпыми.
Так как азотистые основания в паре А-Т образуют две водородные связи,
три, то те участки ДНК, в которых пар А-Т -болыпе (так на-
авпареГ-Ц
зываемые А-Т-богатые участки), чем в среднем в данной молекуле, денатури-
руют при более низкой температуре, чем Г-Ц -богатые участки. Протяженные
А-Т
- богатыс участки нередко бывают частично денатурированными в нор-
мальных физиологических условиях .
14
Лекция 2
КАЗАК
НЕ ГНИ ПАПИН ГЕН
А РОЗА УПАЛА НА ЛАПУ АЗОРА
I
ХХГЦЦАТГгцхх
XXЦГГТАЦЦГХХ •
нтмим
Ау
АТ
ц-г
Ц'г
Ц'г
ц-г
ХХГ'ЦХХ
XXгцхх
ХХЦ'ГХХ
гЦ
пц
ТА
2
1
Рис. 2.3
. Вторичная структура нуклеиновых кислот
А — формы двойной спирали ДНК : i — В
-
форма;
2 — A -форма; б — образование шпилек в нуклеиновых
кислотах: 2 — ДНК ;2 — РНК
(online -media.uni -marburg .de)
Существуют и природные одноцепочечные ДНК. Кольцевые молекулы
ДНК, содержащие около 5000 нуклеотидов, являются носителями генетиче-
ской информации некоторых фагов (М13, G4, <рХ174).
Вторичная структура РНК. РНК, как правило, одноцепочечные линейные
молекулы, только геномы некоторых вирусов представлены двуцепочечными
РНК. В 2015 г. обнаружены кольцевые одноцепочечные РНК. Молекулы РНК
в зависимости от той роли, которую они выполняют в клетке, могут быть и ко-
Строение и функиии нуклеиновых кислот
15
роткими, всего 22-24 нуклеотида, и очень длинными, но они никогда не дости-
гают такой длины, как ДНК. Несмотря на то что РНК представляют собой одну
полинуклсотидную цепочку, значительная часть молекулы может быть двуце-
почечной. Такие двуцепочечные области образуются за счет того, что в разных
местах молекулы существуют взаимно комплементарные антипараллельно на-
правленные участки — гак называемые палиндромы (в языке так называют «зер-
кальные» слова или фразы, которые одинаково читаются как слева направо, так
и справа налево). Отличие палиндромов в нуклеиновых кислотах от тех , что есть
в русском языке, в том, что в «зеркале» отражаются не те нуклеотиды, которые
стоят «перед зеркалом», а комплементарные им. Такие палиндромы в РНК могут
образовывать двуцепочечные участки, так называемые шпильки (рис. 2.3, Б).
Третичная структура. Если о третичной структуре ДНК обычно не гово-
рят (можно считать ее третичной структурой линейную или кольцевую форму
молекулы) , то молекулы РНК могут обладать очень сложной пространствен-
ной конформацией. Она зависит от того, какую именно функцию в клетке вы-
полняет данная молекула.
Функции нуклеиновых кислот. Как уже было сказано, нуклеиновые кис-
лоты — « информационные» молекулы. Все их функции связаны с хранением,
воспроизведением , передачей и реализацией информации обо всех сторонах
жизнедеятельности.
Главным «хранителем» является ДНК. Поэтому ее основная функция —
хранение генетической информации. Эта функция обеспечивается благода-
ря существованию генетического кода . У некоторых вирусов, не содержащих
ДНК, функцию хранения генетической информации выполняет геномная РНК
(гРНК). Геномные РНК содержат, например, вирус гриппа, вирус гепатита С, ви-
рус иммунодефицита человека, некоторые онкогенные вирусы (онкорнавирусы).
Вторая функция — воспроизведение и передача генетической информа-
ции в ряду поколений клеток и организмов. С самого начала существования
жизни на Земле генетическая информация передается не прерываясь. Содер-
жание и количество информации, конечно, меняется, но каждый живой орга-
низм связан с самым ранним предком всего живого астрономически большим
числом поколений, передача информации между которыми не прерывается
вот уже почти 4 миллиарда лет. Эта функция обеспечивается процессом вос-
произведения нуклеиновых кислот — репликацией.
Третья функция — реализация генетической информации в виде белков,
а также любых других соединений (полинуклеотидов, полисахаридов, липидов,
аминокислот, нуклеотидов и т. д .) , образующихся с помощью белков-фермен-
тов. Эта функция обеспечивается процессами транскрипции и трансляции.
Функции РНК весьма разнообразны, но все они связаны с реализацией
генетической информации. Матричная или информационная РНК (мРНК
или иРНК) выполняет важнейшую функцию — именно она является матри-
16
Лекиия 2
цей для синтеза белков. Молекулы мРНК являются комплементарной копией
участка ДНК, в котором записана информация о последовательности амино-
кислот в полипептиде. Транспортные РНК (тРНК) служат адаптерами («пе-
реводчиками») в ходе трансляции — принося аминокислоты к месту синтеза
белка, они выстраивают их в точном соответствии с последовательностью
нуклеотидов в мРНК (и соответствующем участке ДНК). Рибосомные РНК
(рРНК) составляют структурную основу рибосом — органоидов, синтезирую-
щих белки. Помимо этого они принимают участие и в подготовке трансляции,
помогая рибосоме занять правильное положение на молекуле мРНК, и в самом
процессе образования пептидной связи в синтезирующемся белке. Огромное
разнообразие различных регуляторных РНК участвуют в регуляции актив-
ности генов, работающих практически во всех процессах жизнедеятельности
организмов. Так, малые ядерные РНК (ч/ РПК ) входят в состав сплайсосом —
рибонуклеопротеидных комплексов, участвующих в сплайсинге . Сплайсинг —
это процесс вырезания копий интронов из мРНК и сшивания копий экзонов.
Малые интерферирующие РНК (siPHK) защищают клетки растений (и других
организмов, у которых нет иммунологической системы) от вирусов. И , нако-
нец, рибозимы — молекулы РНК, обладающие ферментативной активностью,
выполняют каталитическую функцию.
17
ЛЕШИЯ 3
Аминокислоты. Первичная и вторичная структура белков
В состав живого входят самые различные органические соединения,
но основные биополимеры , без которых жизнь на Земле невозможна,
белки и нуклеиновые кислоты. Белки являются « строительным материалом»
и « инструментами», осуществляющими процессы жизнедеятельности. Огром-
ное, практически бесконечное разнообразие белков позволяет им справляться
почти со всеми функциями живого. Пожалуй, только к хранению и передаче
наследственной информации они не способны.
Белки — это линейные
нерегулярные полимеры, мо -
номерами которых являют-
ся аминокислоты .
Аминокислотами
зываются органические со-
единения , в состав которых
входят две функциональные
группы: карбоксильная груп-
па и аминогруппа. Группи-
ровка, в которой к одному
атому углерода присоедине -
ны и карбоксильная, и ами-
ногруппа ( a- положение), на -
зывается пептидной группой
(рис. 3.1, А ). В природе обна -
ружено около 200 аминокис-
лот, из них
в большинстве
организмов встречается око-
ло 60, но в состав белков вхо-
дит только 22 аминокислоты
(одна из них , пролин, по хи-
это
А
Н
jH2N с-соон
Пептидная
I
группа
иа-
R
Плоскость симметрии
Б
NH2
NH2
С:с
нн/
R
R
/
ноос
соон
Рис. 3.1
. Аминокислота
А — общая формула; Б — оптические изомеры
18
Лекиия 3
мической структуре является не амино- , а иминокислотой ). Различаются
они R-группой ( радикалом).
Вес аминокислоты , за исключением глицина, существуют в виде двух
оптических изомеров. Эти изомеры идентичны по своим химическим свой-
ствам, их различие состоит в том, что они отклоняют плоскость поляризо-
ванного света в противоположные стороны. Таким свойством обладают
молекулы, у которых все четыре валентности одного атома углерода заняты
разными замещающими группами ( рис. 3.1 , Б ). Все аминокислоты, которые
включаются в белки, являются левовращающими стереоизомерами, у ко-
торых аминогруппа находится в a -положении (в пролине в а -положении
находится иминогруппа). Помимо L-аминокислот в организме есть D -ами -
покислоты , не включающиеся в белки, и аминокислоты с другим (не а -) по-
ложением аминогруппы. В некоторых белках , например в светящемся белке
светлячка, есть D -аминокислоты, но они не включаются в полимерную мо-
лекулу во время синтеза полипептида на рибосоме, а образуются под дей -
ствием фермента из L-аминокислот в результате химической модификации
в готовой молекуле белка.
По способности взаимодействовать с водой (или полярности) при физио-
логических значениях pH (~ 7) все аминокислоты можно разделить на четыре
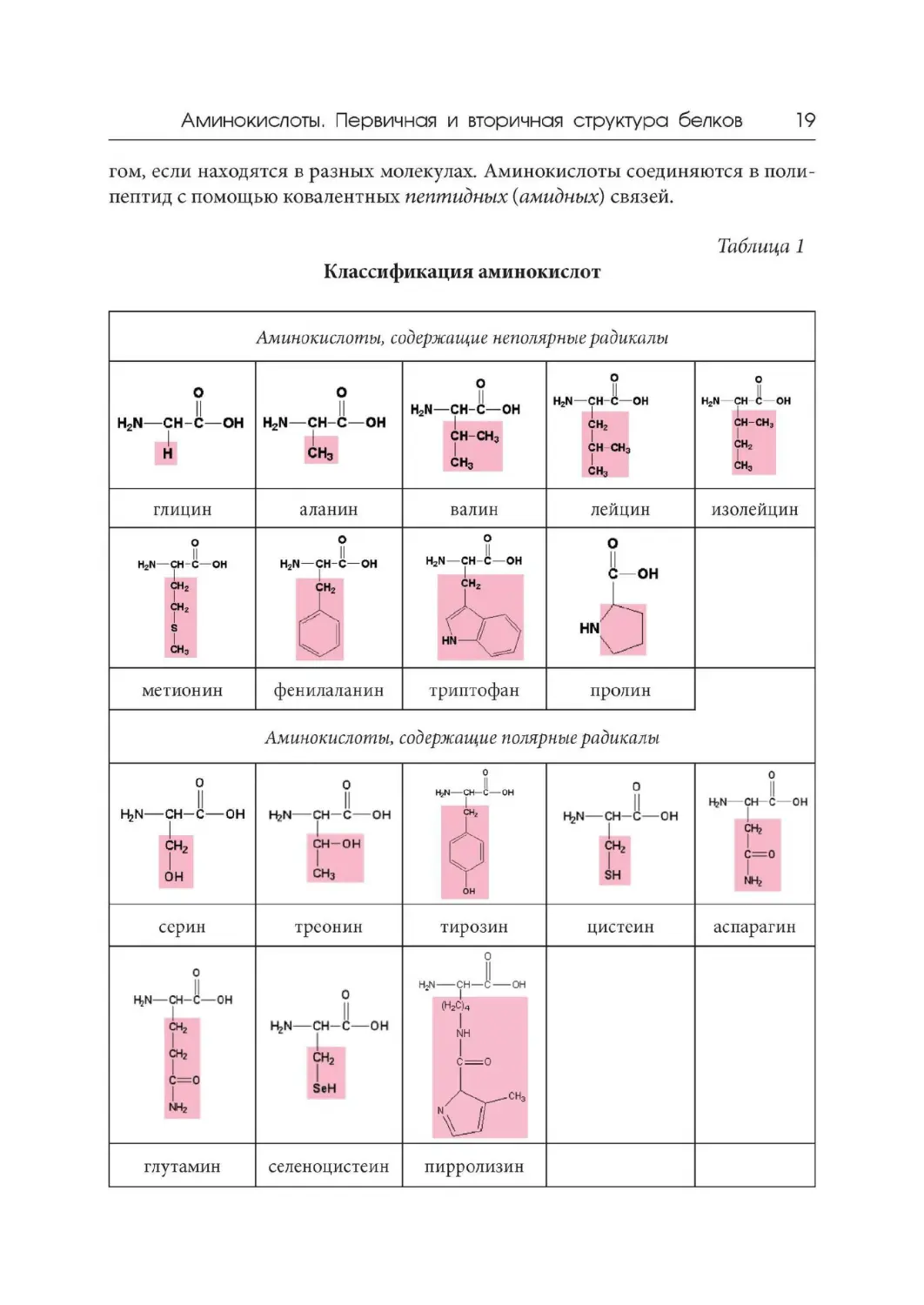
класса в зависимости от свойств R-групп (табл. 1).
1. Аминокислоты, содержащие неполярные (гидрофобные) радикалы. Это
алифатические аланин, валин , лейцин и изолейцин; содержащий серу метио-
нин; ароматические фенилаланин и триптофан; наиболее просто устроенный
глицин и иминокислота пролин.
2. Аминокислоты с полярными незаряженными радикалами, способны-
ми образовывать водородные связи с водой. Это содержащие гидроксильную
группу серин, треонин и тирозин; содержащий сульфгидрильную группу ци-
стеин; содержащие амидную группу аспарагин и глутамин. В эту же группу
входят две неканонические, т. е . не имеющие смысловых кодонов в таблице ге-
нетического кода, аминокислоты: селеноцистеин и пирролизин.
3. Аминокислоты с отрицательно заряженными (кислыми ) R-группами.
Это содержащие вторую карбоксильную группу аспарагиновая и глутамино-
вая кислоты.
4. Аминокислоты с положительно заряженными R-группами. Это лизин,
несущий вторую аминогруппу в е-положепии алифатической цепи, аргинин
с гуанидиновой группой и гистидин, имеющий имидазольную группу.
Первичная структура белка. Белки представляют собой цепочку сое-
диненных друг с другом аминокислот. Такое соединение возможно потому,
что аминокислоты обладают двумя функциональными группами: кислотной
и основной. Эти группы в одной молекуле аминокислоты нс могут взаимодей-
ствовать между собой из-за жесткости ее структуры, но реагируют друг с дру-
Аминокислоты. Первичная и вторичная структура белков
19
том, если находятся в разных молекулах . Аминокислоты соединяются в поли -
пептид с помощью ковалентных пептидных (амидных) связей.
Таблица 1
Классификация аминокислот
Аминокислоты, содержащие неполярные радикалы
о
О
О
О
H2N сн-с
—
он
H,N
-
СН-С ОН
I
сн-сн3
H2N A=-A >=
СН- СНз
H2N—СН-С
—
ОН
сн2
1
сн2
СН СН3
н
1
сн3
СН3
сн3
лейцин
изолейцин
глицин
аланин
валин
о
о
H2N —сн-с
—он
H2N сн-с — он
сн2
I
сн2
I
а
СНз
фенилаланин
триптофан
метионин
пролин
Аминокислотысодержащие полярные радикалы
о
H2N—сн-с
—
он
сн-он
сн3
серин
треонин
тирозин
цистеин
аспарагин
о
HjN — сн-с
—
он
сн?
Iсн?
1
с=о
глутамин
селеноцистеин
пирролизин
20
Лекиия 3
Окончание табл. 1
Аминокислоты, содержащие заряженные радикалы
о
о
И-он
о
О
о
H2N — сн-с
—
он
HjN—СН-
^
N—СН-С —ОН
H2N сн-с
—
он
H2N сн-с
—
он
сн2
СН2
СНг
сн.
I
сн2
СН2
/ч
Г
с=о
*HN
с—О
I
сн2
NH
О-
6-
NH3
+
аспарагиновая
кислота
глутаминовая
кислота
лизин
аргинин
гистидин
Цепочка расположенных в определенной последовательности ами-
нокислотных остатков в полипептиде, представляет собой первичную
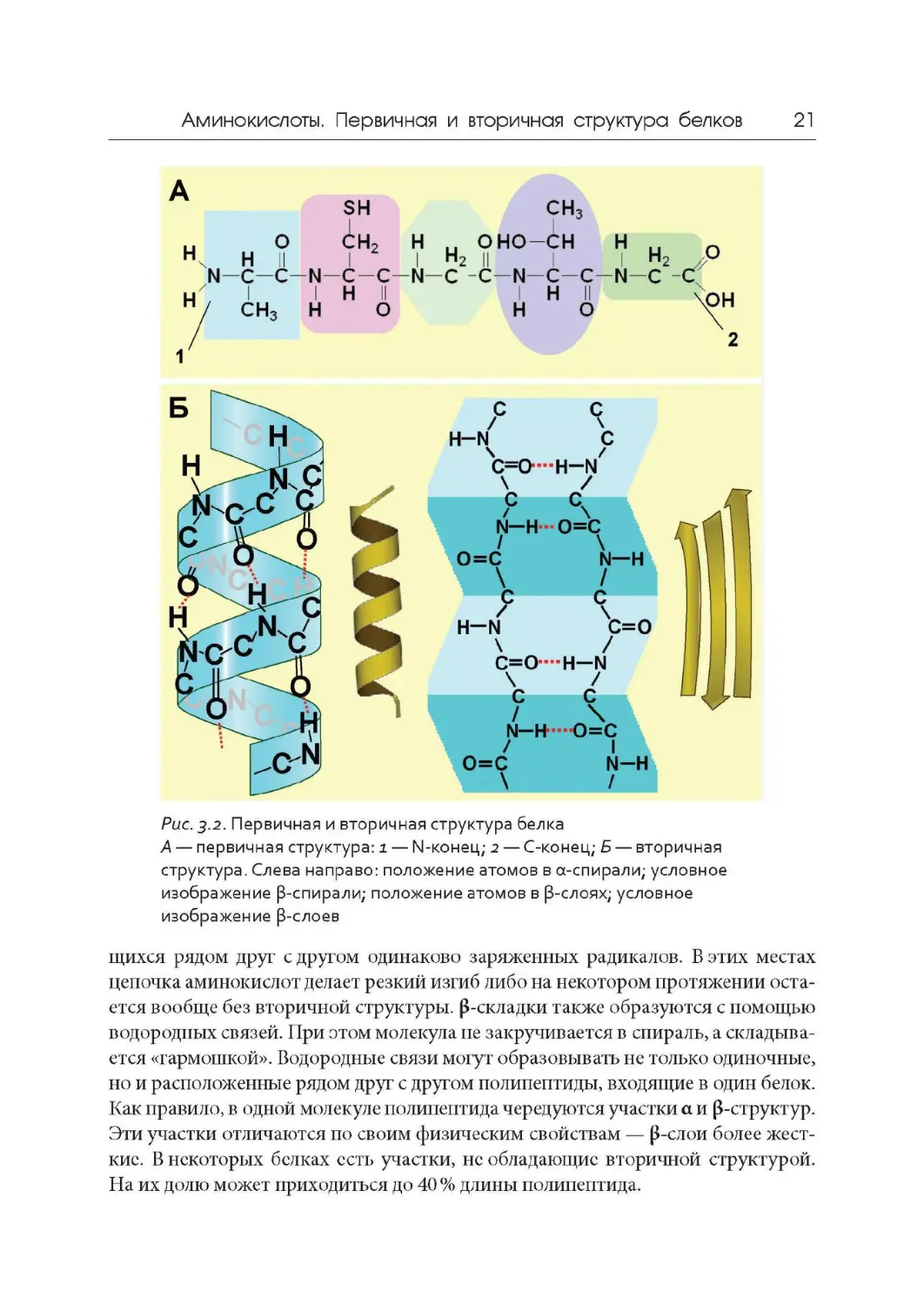
структуру белка (рис. 3.2, А).
Подавляющее большинство природных белков являются нерегулярными
полимерами. Регулярные белки с закономерным чередованием аминокислот
встречаются крайне редко. Это всегда структурные белки, представляющие со-
бой очень длинные прочные нити. Примером является белок шелка фиброин.
Это полимер, в котором регулярно повторяется шестерка аминокислот Гли-
Ала-Гли-Ала- Гли-Сер. Почти регулярную первичную структуру имеет колла-
ген — структурный белок соединительной ткани кожи, хрящей и сухожилий.
Благодаря нерегулярности разнообразие возможных белков практически бес-
конечно. Например, у трипептида, состоящего из трех разных аминокислот,
возможно 3! = б различных первичных структур. У олигопептида, состоящего
из двадцати разных аминокислот, разнообразие первичных структур 20!, это
= 2х 1018. Разнообразие первичных структур среднего по размеру белка (при-
мерно 500 аминокислот ) составляет уже = 20500 вариантов (если все аминокис-
лоты представлены в эквимолярных соотношениях ).
Вторичная структура белка может быть регулярной а-спиралью или не-
регулярными (3-складками (рис. 3.2, Б). В а-спирали карбонильная группа -С=0
одного аминокислотного остатка образует водородную связь с группой -NH дру-
гого аминокислотного остатка, находящегося через четыре мономера от него.
На один виток а-спирали приходится 3,6 аминокислотных остатков. Период
идентичности составляет пять витков, включающих 18 аминокислотных остат -
ков. В определенных случаях регулярность спирали нарушается. Как правило,
это происходит в местах расположения иминокислоты пролина либо находя-
Аминокислоты. Первичная и вторичная структура белков
21
СН3
оно-сн
Н2 II
-
с-с
-
с
с
/
\
с
Н—N
\
/
С=0 -H-N
/
\
А
С
с
\
/
МП
N—Н 0=С
/
\
о=с
N—Н
\
/
/
С
С
\
с=о
H-N
/
\
С=0— H
-
N
ици
\
/
\
с
/
N-H 0=С
/
I
о=с
\
N—Н
/
Рис. 3.2
.
Первичная и вторичная структура белка
А — первичная структура : i — N -конец; 2 — С -конец; Б — вторичная
структура . Слева направо : положение атомов в а-спирали; условное
изображение [3-спирали; положение атомов в [3-слоях ; условное
изображение [3-слоев
щихся рядом друг с другом одинаково заряженных радикалов. В этих местах
цепочка аминокислот делает резкий изгиб либо на некотором протяжении оста-
ется вообще без вторичной структуры. (3-складки также образуются с помощью
водородных связей. При этом молекула не закручивается в спираль, а складыва-
ется «гармошкой». Водородные связи могут образовывать не только одиночные,
но и расположенные рядом друг' с другом полипептиды, входящие в один белок.
Как правило, в одной молекуле полипептида чередуются участки а и (3-структур.
Эти участки отличаются по своим физическим свойствам — (3-слои более жест-
кие. В некоторых белках есть участки, нс обладающие вторичной структурой.
На их долю может приходиться до 40 % длины полипептида.
22
ЛЕКиИЯ 4
Третичная и четвертичная структура белков,
Ленатураиия и фоллинг
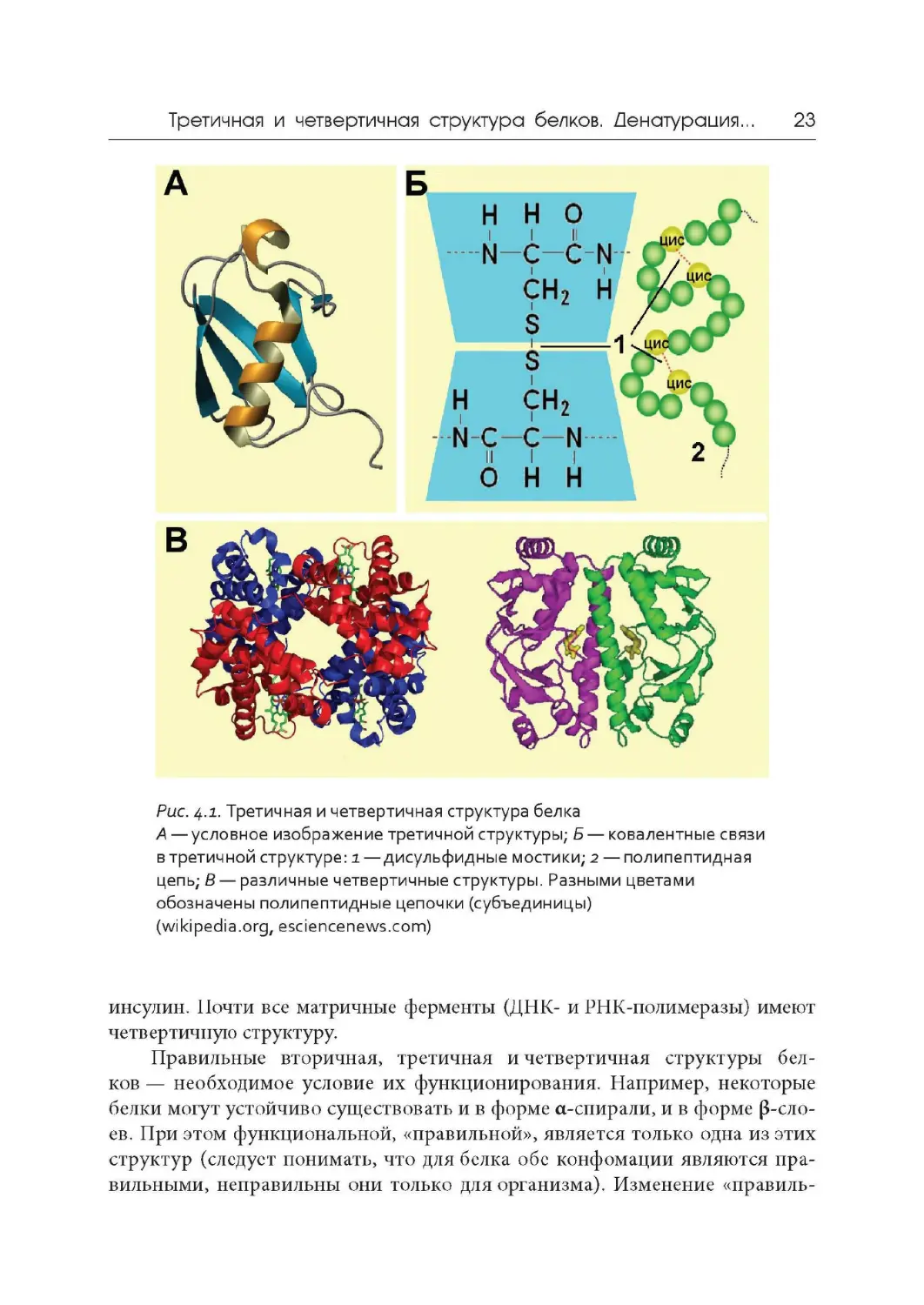
Третичная структура белка — это пространственная конформация
полипептида, имеющего вторичную структуру, обусловленная взаимодей-
ствиями между радикалами аминокислот (рис. 4.1, А ).
Существует четыре типа взаимодействий между радикалами.
L Ковалентные связи между остатками двух цистеинов — так называе-
мые дисульфидные мостики (рис. 4.1, Б ) .
2. Ионные (электростатические) взаимодействия между противоположно
заряженными радикалами аминокислотных остатков. Например, положительно
заряженная е-аминогруппа лизина (-N1 L ' ) притягивается отрицательно заряжен-
ной карбоксильной группой (-СОО ) глутаминовой или аспарагиновой кислоты.
3. Водородные связи образуют все аминокислотные радикалы, имеющие
гидроксильные, амидные или карбоксильные группы.
4. Гидрофобные взаимодействия возникают между неполярными радика-
лами в водной среде. Выталкиваемые из воды гидрофобные радикалы амино-
кислот, стремясь занять наименьший объем , формируют гидрофобное «ядро»,
внутри которого вода отсутствует. В результате молекула приобретает слож-
ную пространственную конформацию, только сохраняя которую белок может
выполнять свою биологическую функцию.
В образовании третичной структуры гидрофобные взаимодействия яв-
ляются определяющими в силу своей неизбирательности и многочисленно-
сти. Из 22 аминокислот 9 содержат гидрофобные радикалы, каждый из кото-
рых может взаимодействовать с любым из них . Гидрофобное ядро образуется
в водной среде у большинства белков.
Четвертичная структура белка — это объединение двух или большего
числа полипептидных цепей, имеющих третичную структуру, для выпол-
нения общей функции (рис. 4.1, В). Четвертичную структуру поддерживают
водородные, электростатические и дисульфидные связи. Четвертичной струк-
турой обладает около 5 % белков , в том числе гемоглобин, иммуноглобулины,
Третичная и четвертичная структура белков. Денатурация.. .
23
Б
ннО
I
I
N-C
-
C-N
-
н сн2
I
-
N-C
-
C-N
1
I
Онн
Рис. 4.1
. Третичная и четвертичная структура белка
А — условное изображение третичной структуры; Б — ковалентные связи
в третичной структуре: i — дисульфидные мостики; 2 — полипептидная
цепь; В — различные четвертичные структуры. Разными цветами
обозначены полипептидные цепочки (субъединицы)
(wikipedia.org, esciencenews.com)
инсулин. Почти все матричные ферменты (ДНК- и РНК-полимеразы) имеют
четвертичную структуру.
Правильные вторичная, третичная и четвертичная структуры бел-
ков — необходимое условие их функционирования. Например, некоторые
белки могут устойчиво существовать и в форме а-спирали, и в форме (}-сло-
ев. При этом функциональной, «правильной» , является только одна из этих
структур (следует понимать, что для белка обе конфомации являются пра-
вильными, неправильны они только для организма). Изменение «правиль-
24
Лекиия 4
ной» формы существенно меняет свойства белков , что может привести к за-
болеванию. Такие заболевания известны: скрепи овец, « коровье бешенство»,
у людей болезнь Крсйцфсльда — Якоба, фатальная семейная бессонница,
болезнь куру, связанная с ритуальным каннибализмом в некоторых стра-
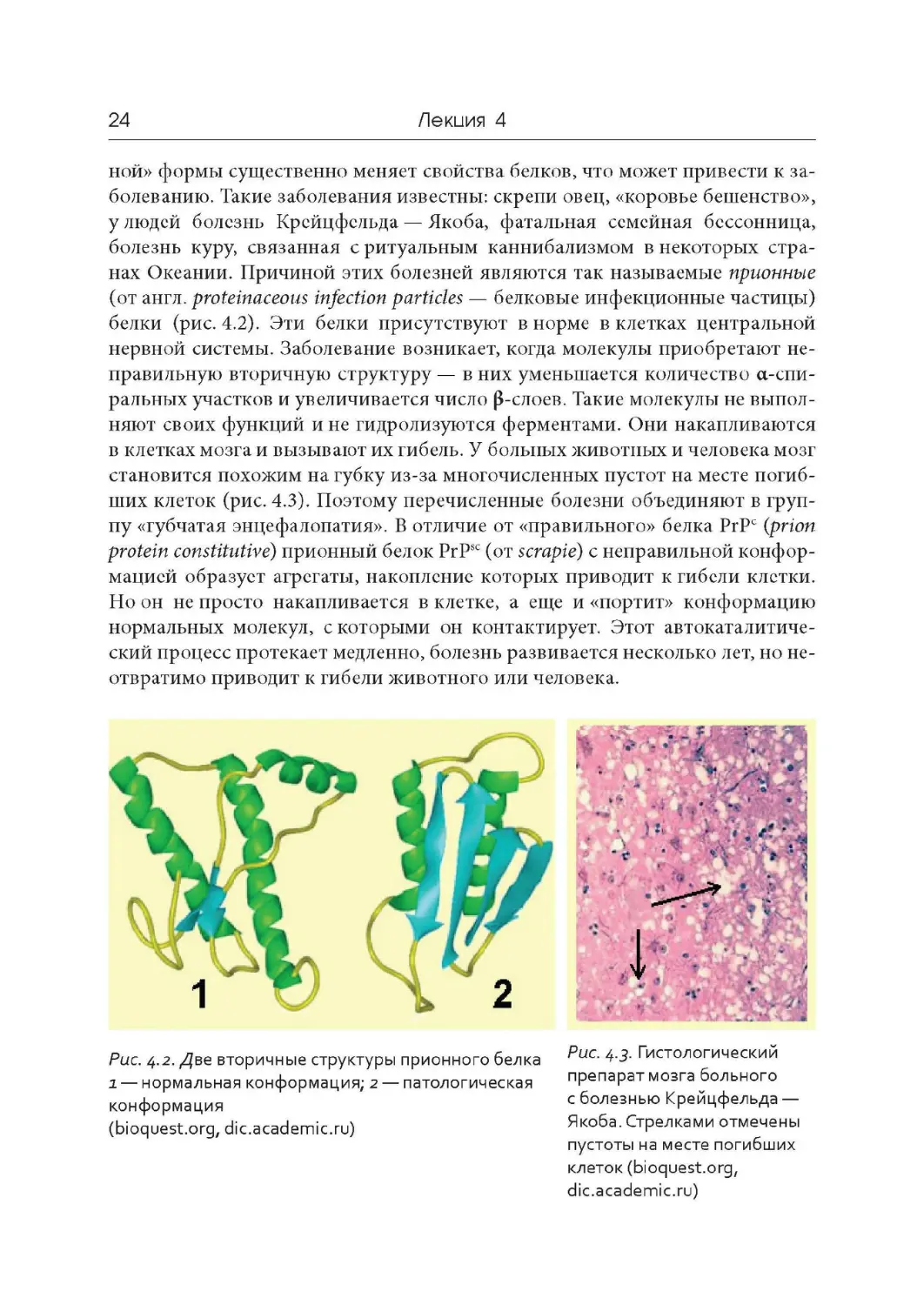
нах Океании. Причиной этих болезней являются так называемые прионные
(от англ , proteinaceous infection particles — белковые инфекционные частицы)
белки (рис. 4.2). Эти белки присутствуют в норме в клетках центральной
нервной системы. Заболевание возникает, когда молекулы приобретают не -
правильную вторичную структуру — в них уменьшается количество а-спи-
ральных участков и увеличивается число (3-слоев. Такие молекулы не выпол-
няют своих функций и не гидролизуются ферментами. Они накапливаются
в клетках мозга и вызывают их гибель. У больных животных и человека мозг
становится похожим на губку из- за многочисленных пустот на месте погиб-
ших клеток (рис. 4.3). Поэтому перечисленные болезни объединяют в груп-
пу «губчатая энцефалопатия». В отличие от «правильного» белка PrPc ( prion
protein constitutive) прионный белок PrPsc ( от scrapie) с неправильной конфор-
мацией образует агрегаты, накопление которых приводит к гибели клетки.
Но он не просто накапливается в клетке, а еще и «портит» конформацию
нормальных молекул, с которыми он контактирует. Этот автокаталитиче-
ский процесс протекает медленно, болезнь развивается несколько лет, но не -
отвратимо приводит к гибели животного или человека.
итачм
4
%-У
>я.
I
*
1
к
•1
>*
Рис. 4.3
.
Гистологический
препарат мозга больного
с болезнью Крейцфельда —
Якоба. Стрелками отмечены
пустоты на месте погибших
клеток (bioquest.org,
dic.academic.ru)
Рис. 4.2
. Две вторичные структуры прионного белка
1 — нормальная конформация; 2 — патологическая
конформация
(bioquest.org, dic.academic.ru)
Третичная и четвертичная структура белков. Денатурация.. .
25
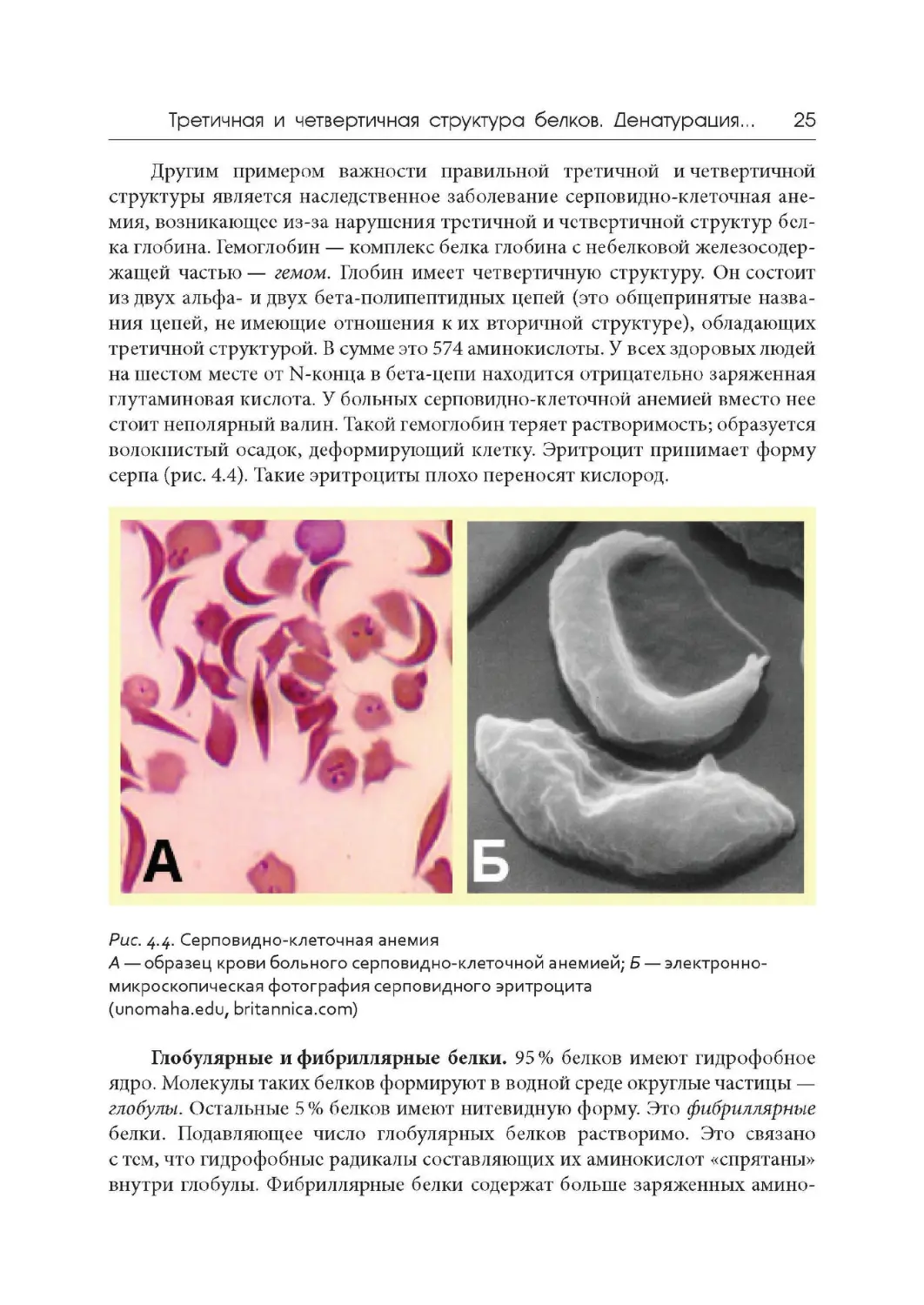
Другим примером важности правильной третичной и четвертичной
структуры является наследственное заболевание серповидно-клеточная ане-
мия, возникающее из-за нарушения третичной и четвертичной структур бел-
ка глобина. Гемоглобин — комплекс белка глобина с небелковой железосодер-
жащей частью — гемом . Глобин имеет четвертичную структуру. Он состоит
из двух альфа- и двух бета-полипептидных цепей (это общепринятые назва -
ния цепей, не имеющие отношения к их вторичной структуре), обладающих
третичной структурой. В сумме это 574 аминокислоты. У всех здоровых людей
на шестом месте от N-конца в бета-цепи находится отрицательно заряженная
глутаминовая кислота. У больных серповидно-клеточной анемией вместо нее
стоит неполярный валин. Такой гемоглобин теряет растворимость; образуется
волокнистый осадок, деформирующий клетку. Эритроцит принимает форму
серпа (рис. 4.4). Такие эритроциты плохо переносят кислород,
V-
)0
Рис. 4
,
4. Серповидно-клеточная анемия
А — образец крови больного серповидно-клеточной анемией; Б — электронно-
микроскопическая фотография серповидного эритроцита
(unomaha.edu, britannica.com)
Глобулярные и фибриллярные белки. 95 % белков имеют гидрофобное
ядро. Молекулы таких белков формируют в водной среде округлые частицы —
глобулы. Остальные 5 % белков имеют нитевидную форму. Это фибриллярные
белки. Подавляющее число глобулярных белков растворимо. Это связано
с тем, что гидрофобные радикалы составляющих их аминокислот «спрятаны»
внутри глобулы. Фибриллярные белки содержат больше заряженных амино-
26
Лекиия 4
кислот, чем глобулярные. Отдельные полипептидные цепи этих белков раство-
римы, а их комплексы неполярны и нерастворимы. Примерами таких белков
могут служить а-ксратины (на их долю приходится почти весь сухой вес волос,
шерсти, рогов , копыт, ногтей, перьев) , коллаген (белок кожи, сухожилий , хря-
щей), фиброин (белок шелка).
Денатурация и ренатурация. Большинство межрадикальных взаимодей-
ствий, поддерживающих пространственную конформацию белковых молекул,
легко нарушаются при изменении внешних условий. При повышении темпе-
ратуры, например, разрываются водородные связи, усиливающееся броунов-
ское движение нарушает компактность гидрофобных ядер. Изменение ионной
силы раствора может нарушить электростатические взаимодействия. Такие
воздействия приводят к денатурации — нарушению нативной (природной,
« правильной») третичной и четвертичной структуры белковых молекул, что
обычно сопровождается потерей функциональной активности. Денатурация
может быть обратимой, когда при нормализации условий происходит восста -
новление нативной структуры, и необратимой. Необратимость денатурации
часто связана с образованием «незаконных » мсжмолскулярных связей. При-
мером необратимо денатурированного белка является белок сваренного кури-
ного яйца, он теряет прозрачность и растворимость.
Фолдинг — сворачивание полипептида в нативную третичную струк-
туру; является необходимым условием функционирования белка. Синтезиру-
емые в клетке полипептидные цепи представляют собой полностью разверну-
тые молекулы. Для того чтобы белок приобрел присущие ему функциональ-
ные свойства, цепь должна определенным образом свернуться в пространстве.
Для третичной структуры каждого белка характерно определенное сочетание
элементов вторичной структуры: а -спиралей, (3-слоев, а также гибких участ-
ков — петель.
Процесс сворачивания протекает в несколько стадий (рис. 4.5, А). Снача-
ла быстро образуется вторичная структура — участки а -спиралей и |3-слоев.
Способность того или иного участка молекулы сложиться в а -спираль, (3-слой
или в петлю зависит от последовательности аминокислот в молекуле. Затем
также очень быстро образуются отдельные элементы третичной структуры.
Следующая стадия — медленное образование специфической простран-
ственной конформации (главным образом за счет гидрофобных взаимодей-
ствий). Так как гидрофобные взаимодействия неспецифичпы, па этом этапе
возможны ошибки. Это связано с тем, что могут «склеиться» гидрофобные
участки разных молекул, т. е. произойдет неспецифическая агрегация. Функ-
циональный белок при этом не образуется. Чтобы предотвратить это неже-
лательное событие, в клетке существуют специальные белки, называемые
молекулярными шаперонами и шаперонинами (английское слово chaperone
близко по смыслу к слову «гувернантка» , «наставница» , « дуэнья» ). Шапероны
Третичная и четвертичная структура белков . Ленатураиия.
27
Рис. 4.5
.
Посттрансляционная судьба белков в клетке
А — последовательные стадии сворачивания полипептида, Б — шапероны
и шаперонины: i — мРНК ; 2 — рибосома; 3 — синтезируемый полипептид;
4 — шапероны;5 — шаперонин, меняющий конформацию; 6 — полипептид,
покидающий шаперонин; S — компьютерная модель шаперонина;
Г — изменение внутреннего пространства шаперонина в ходе работы
(upload.wikimedia. org, sciencedaily. com)
начинают взаимодействовать с синтезируемым белком еще до его схождения
с рибосомы. Они связываются с полностью или частично развернутой молеку-
лой белка и удерживают ее, экранируя гидрофобные группы и предохраняя ее
от неспецифической агрегации. Они переносят развернутую молекулу в нуж-
ное место (например, в митохондрии или хлоропласты), помогают ей пройти
сквозь мембрану органоида. В цитоплазме шапероны создают условия для эф-
фективного правильного сворачивания (рис. 4.5, Б ) , передавая ее другому бел-
ку-помощнику — шаперонину.
Шаперонины, в отличие от относительно просто устроенных шаперонов,
представляют собой сложные белки, состоящие из большого числа субъеди-
ниц. Они похожи на стаканчик с полостью внутри (рис. 4.5, В ). В эту полость
помещается принесенная шаперонами полипептидная цепь, после чего «ста-
канчик» закрывается «крышечкой». Попавшая внутрь шаперонина молекула
оказывается полностью изолированной и получает возможность без помех
осуществить стадию медленного сворачивания. Субъединицы шаперонина,
получая энергию от А4’Ф, периодически меняют свою конформацию, как бы
28
Лекиия 4
«встряхивая» содержимое «стаканчика» (рис. 4.5, Г), чем способствуют более
быстрому протеканию этой стадии. Когда белок приобретает нативную струк-
туру, «крышечка» открывается и готовая молекула покидает шаперонин.
Шапероны и шаперонины не только «воспитывают » только что синтези-
рованные молекулы белка, но и «чинят » белки, третичная структура которых
почему-либо нарушилась. Часто нарушение третичной структуры белка про-
исходит в стрессовых для клетки ситуациях , например, из-за повышения тем-
пературы. При этом резко усиливается синтез шаперонов. Впервые они и были
обнаружены при так называемом «тепловом шоке» клеток, поэтому их часто
называют «белками теплового шока».
В результате теплового шока или других воздействий — свободных ради-
калов , активных форм кислорода, окисляющих дисульфидпые мостики, — мо-
гут возникать «незаконные сшивки» , когда дисульфидные мостики восстанав-
ливаются, но в неправильных местах . Такие нарушения третичной структуры
могут исправляться с помощью специального внутриклеточного антиокси-
данта — трипептида глутатиона. Две молекулы глутатиона восстанавливают
тиольные группы, « забирая» у них дисульфидный мостик. Получившийся
димер глутатиона восстанавливается специальным ферментом глутатионре-
дуктазой. Глутатион — трипептид, состоящий из трех аминокислот (глута-
миновой кислоты, цистеина и глицина), причем глутаминовая (дикарбоновая)
кислота присоединена к цистеину необычной у-пептидной связью (рис. 4.6).
Глутатион присутствует во всех живых организмах и выполняет важнейшую
функцию внутриклеточного антиоксиданта, расщепляя «незаконные» дисуль-
фидные мостики, образовавшиеся в результате окисления сульфгидрильных
групп и «сшившие» молекулы белков. Он участвует также в обезвреживании
свободных радикалов, пероксидов и других токсических веществ.
Цис
Оон
V
о
о
|«рУ
сн- -сн2
—
СН2
—
С N—СН-С N—СН-С
0нсн2
он
NH2
нн
Гли
Глу
SH
Рис . 4.6
. Трипептид глутатион
Третичная и четвертичная структура белков. Денатурация.. .
29
Несмотря на деятельность шаперонов и шаперонинов, в клетке регулярно
возникают «испорченные» белковые молекулы, исправить которые шаперони-
нам нс удастся. Кроме того, многие белки, особенно регуляторные, выполнив
свою функцию, становятся ненужными. Такие молекулы должны быть уничто-
жены. Для этого существуют специальные ферменты, разрушающие белки, —
протеазы. Но как клетке удается разрушить только определенные белковые
молекулы, не затронув все остальные? Для этого существую! специальные
механизмы. К молекуле, предназначенной для уничтожения, присоединяется
специальная «метка» — цепочка, состоящая из нескольких молекул небольшо-
го (76 аминокислот ) белка убиквитина. Его концевая карбоксильная группа
присоединяется к е-аминогруппе лизина в «приговоренном» белке. Ученые
назвали это событие «поцелуем смерти» . Помеченный белок попадает в проте-
асому — белковый «стаканчик», похожий на шаперонин, но предназначенный
не для исправления, а для уничтожения молекулы. В протеасоме белок расще-
пляется на аминокислоты , которые могут быть использованы для построения
новых белков.
30
ЛЕКиИЯ 5
Фуншии белков, Ферменты. Иммуноглобулины.
Гормоны. Реиепторы
Белком называют отдельный полипептид или агрегат нескольких поли-
пептидов, выполняющий биологическую функцию. Полипетид (понятие хи-
мическое) представляет собой одну полимерную цепочку, состоящую из ами-
нокислот. Белок (понятие биологическое) может представлять собой как от-
дельную молекулу полипептида, так и объединение нескольких полипептидов.
Например, иммуноглобулин (антитело) — молекула, состоящая из четырех
полипептидных цепей, которые по отдельности белками не являются; белок
только их функциональный агрегат. Многие ферменты состоят из несколь-
ких субъединиц — отдельных полипептидов. Белки, в силу своего огромного
разнообразия, способны выполнять самые различные функции в клетке и в
организме. Эти функции можно разделить на следующие группы: 1) каталити-
ческая, 2) защитная, 3) регуляторная, 4) рецепторная, 5) структурная, 6) функ-
ция трансформации энергии, 7) транспортная, 8) питательная, 9) буферная,
10) энергетическая, 11) другие, например, участие в фолдинге.
Каталитическая функция белков. В клетках и организмах протекает
огромное количество химических реакций, очень многие из которых в фи-
зиологических условиях могут идти только в присутствии катализаторов.
Но даже и те реакции, которые в принципе могут протекать самопроизвольно,
в клетке также идут с помощью катализаторов — ферментов. Практически все
ферменты являются белками. Лишь некоторые биологические катализаторы,
рибозимы, представляют собой молекулы РНК. Ферменты отличаются от не-
органических катализаторов, используемых в химии, следующими важными
свойствами: 1) очень высокой эффективностью, 2) строгой специфичноеTM,
3) узким оптимумом условий среды и 4) способностью к регуляции. Как и не-
органические катализаторы, ферменты понижают энергию активации реа-
гирующих веществ, только, как правило, гораздо сильнее. Например, реак-
цию разложения пероксида водорода до кислорода и воды платина ускоряет
в 220 000 раз, а фермент каталаза — в 93 000 000 000 раз! Но те реакции, кото-
Функиии белков. Ферменты. Иммуноглобулины. Гормоны. . .
31
рые невозможны термодинамически, ферменты катализировать не могут. Не-
органические катализаторы могут ускорять самые разные реакции, тогда как
в клетке для каждой реакции существует свой фермент. Это делает возможным
одновременное протекание множества разных реакций внутри одной клет-
ки. Как правило, фермент «узнает» свои субстраты (вещества, участвующие
в данной реакции) по пространственной конформации. С этим связано такое
качество большинства ферментов , как узкие пределы условий среды (темпера-
тура, ионная сила раствора, pH), в которых ферменты могут работать — ведь
изменение именно этих параметров вызывает денатурацию белков. Денатура-
ция, представляющая собой изменение пространственной структуры молеку-
лы, лишает белок функциональной активности.
Как работают ферменты? Молекула фермента обязательно имеет один
или несколько активных центров , с которыми связываются молекулы суб-
стратов. Некоторые ферменты, катализирующие реакции, для которых нужна
энергия, имеют и центр связывания АТФ. Как правило, ферменты осущест-
вляют акт катализа за счет изменения своей конформации. Например, если
фермент должен осуществить соединение двух субстратов в один продукт ,
он должен связать эти субстраты с образованием фермент-субстратного
комплекса (рис. 5.1, Л ). Сам акт связывания меняет конформацию фермента
и его активных центров за счет взаимодействий с субстратами (электростати-
ческих , гидрофобных — в зависимости от конкретной реакции). В результате
этого молекулы субстратов оказываются, во-первых , повернутыми друг к дру-
гу так, как они должны быть расположены в продукте, а во-вторых , несколько
деформированными, причем именно таким образом, чтобы усилить реакци-
онную способность взаимодействующих групп. Это может быть, например,
оттягивание на себя отрицательно заряженными аминокислотами активного
центра протона гидроксильной группы субстрата, что облегчает его перенос
на другую молекулу. Такая «целенаправленная деятельность» ферментов обе-
спечивает их очень высокую эффективность. Некоторые ферменты для своей
работы нуждаются в небелковых молекулах -помощниках , называемых кофер-
ментами .
В отличие от ферментов коферменты выходят из реакции в измененном
виде (например, НАД А НАД-Н). К своему первоначальному состоянию они
возвращаются через сопряженные реакции. Нередко коферменты служат пе-
реносчиками различных групп атомов (например, остатков кислот ). Многие
коферменты являются производными витаминов, например, в состав НАД
входит никотиновая кислота (витамин Р). Витамин В входит в состав ТПФ —
тиаминпирофосфата, кофермента декарбоксилазы пировиноградной кислоты.
При дефиците Вх развивается тяжелое заболевание бери -бери.
Важнейшим свойством ферментов является возможность регулирова-
ния их работы. Нередко ферменты синтезируются клеткой «про запас» в виде
32
Лекиия 5
CV- Ч1С
KffigCC
2
^
pof
PO"
-
Puc. £
.i. Каталитическая функция белков
Д — механизм работы фермента : i — молекулы субстратов; 2 — молекула фермента
с двумя активными центрами; j — фермент-субстратный комплекс; 4 — продукт
реакции; Б — аллостерическая регуляция фермента: i — субстрат; 2 — активный
центр;з — аллостерический центр; 4 — лиганд;5 — «закрытый» активный центр;
В — регуляция фермента с помощью ассоциации-диссоциации субъединиц:
2 — регуляторная субъединица; 2 — неактивная каталитическая субъединица;
3— субстрат; 4 — лиганд регуляторной субъединицы;5 — активная каталитическая
субъединица; Г— конкурентное ингибирование фермента: i — субстрат;
2 — конкурирующая молекула ингибитора; Д —фосфорилирование фермента :
1 — неактивный фермент; 2 — активный фосфорилированный фермент
неактивных проферментов. Обычно активация профермента происходит
в результате отщепления части его полипептидной цепочки, что приводит
к раскрытию активного центра. Так протеолитический фермент химотрипсин
секретируется из поджелудочной железы в тонкий кишечник в виде неактив-
ного химотрипсиногена. Под действием другого протеолитического фермен-
та — трипсина — в двенадцатиперстной кишке из химотрипсиногена выреза-
ется два дипептида и образуется активный химотрипсин, состоящий из трех
полипептидных цепей, связанных двумя дисульфидными мостиками. Если ак -
тивация протеолитических ферментов происходит преждевременно, в самой
поджелудочной железе, то развивается острый панкреатит.
Функиии белков. Ферменты. Иммуноглобулины. Гормоны. . .
33
Аллостерическая регуляция осуществляется за счет изменения конформа-
ции фермента в результате присоединения специальной молекулы -регулятора,
называемой лигандом (лаг. ligeo — связываю) к аллостерическому центру. Ли-
ганды могут быть активаторами фермента, «открывающими» активный центр,
или подавителями, «закрывающими» его (рис. 5.1, Б ). Некоторые сложные
ферменты содержат отдельные каталитические и регуляторные субъединицы.
Активация может осуществляться в результате объединения субъединиц, или,
наоборот, диссоциации. Отсоединение активной каталитической субъедини-
цы, в свою очередь, может стимулироваться аллостерически (рис. 5.1, В ). Так
как работа фермента осуществляется за счет изменения его третичной струк -
туры, то молекулы, имеющие такую же форму, как молекула (или даже часть
молекулы) субстрата, связавшись с активным центром фермента, лишает его
активности. Такой способ «выключения» фермента называется конкурентным
ингибированием (рис. 5.1 , Г). Этот механизм лежит в основе действия некото-
рых лекарств. Одним из распространенных способов регуляции активности
ферментов является фосфорилирование. Присоединение заряженного остатка
фосфорной кислоты изменяет конформацию фермента, открывая его актив-
ный центр (рис. 5.1, Д). Таким образом, активный центр фермента — это его
« рабочий орган», самая важная часть молекулы. Действие многих ядов (циа-
нидов , соединений ртути, мышьяка, фосфорорганических соединений) связа-
но с тем, что они необратимо связываются с активными центрами ферментов
(это так и называют — отравление активного центра), делая невозможными
основные процессы жизнедеятельности.
В зависимости от катализируемых реакций ферменты делятся на шесть
основных классов:
1. Оксидоредуктазы переносят электроны или атомы водорода при био-
логическом окислении.
2. Трансферазы переносят группы атомов. К ним относятся все матричные
ферменты: ДНК-полимеразы и РНК-полимеразы.
3. Тидролазы переносят функциональные группы на молекулы воды.
Пептидазы (или протеазы) гидролизуют белки, нуклеазы гидролизуют нукле-
иновые кислоты.
4. Лиазы присоединяют группы к двойной связи или способствуют обра-
зованию двойной связи путем негидролитического удаления групп.
5. Изомеразы переносят группы внутри молекулы с образованием изо-
мерных форм.
6. Лигазы образуют связи С-С, С-S, С-О и C-N в реакциях конденсации,
сопряженных с расщеплением АТФ.
Защитная функция белков. Специальные белки иммунной системы
позвоночных животных защищают их от чужеродных агентов — бактерий
и вирусов, крупных экзогенных молекул, называемых антигенами . Антитела,
34
Лекция 5
A
Б
,ll
3
I]t
и0II
в
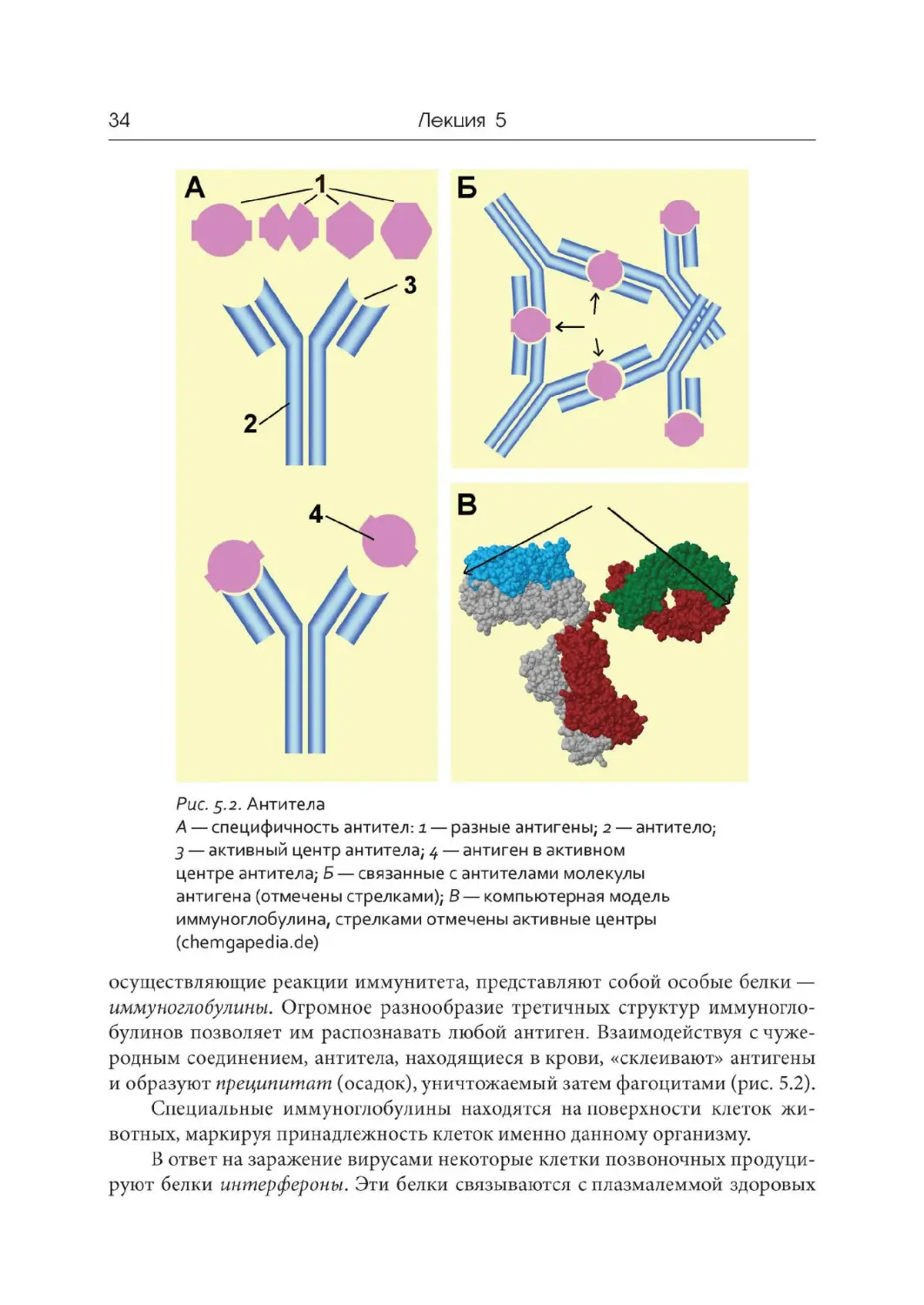
Рис. 5.2
. Антитела
А — специфичность антител: i — разные антигены; 2 — антитело;
3 — активный центр антитела; 4 — антиген в активном
центре антитела; Б — связанные с антителами молекулы
антигена (отмечены стрелками); В — компьютерная модель
иммуноглобулина, стрелками отмечены активные центры
(chemgapedia.de)
осуществляющие реакции иммунитета, представляют собой особые белки —
иммуноглобулины. Огромное разнообразие третичных структур иммуногло-
булинов позволяет им распознавать любой антиген. Взаимодействуя с чуже-
родным соединением, антитела, находящиеся в крови, « склеивают» антигены
и образуют преципитат (осадок), уничтожаемый затем фагоцитами ( рис. 5.2).
Специальные иммуноглобулины находятся на поверхности клеток жи-
вотных , маркируя принадлежность клеток именно данному организму.
В ответ на заражение вирусами некоторые клетки позвоночных продуци-
руют белки интерфероны. Эти белки связываются с плазмалеммой здоровых
Функиии белков. Ферменты. Иммуноглобулины. Гормоны. . .
35
клеток и стимулируют образование специальных ферментов, способных раз-
рушить вирусные мРНК.
Другой тип защитной реакции организма, осуществляемый белками —
выработка токсинов, которые некоторыми животными используются как бел-
ковые яды для защиты от врагов.
Регуляторная функция. Для таких сложных систем, как клетки и орга-
низмы, четкая регуляция всех происходящих в них процессов — необходимое
условие жизнедеятельности. Регуляторные системы действуют и на внутрикле-
точном, и на тканевом, и на организменном уровнях . Регуляторные молекулы
очень разнообразны по своей химической природе. Среди них значительную
часть составляют регуляторные белки.
Внутри клетки белки- репрессоры и белки-активаторы транскрипции
играют ключевую роль в регуляции действия генов (см. лекцию 12). На орга-
низменном уровне регуляторами являются гормоны. Многие гормоны явля-
ются белками. Например, инсулин , гормон поджелудочной железы, регулиру-
ет переход глюкозы через клеточную мембрану. При недостаточной секреции
инсулина у млекопитающих развивается тяжелое заболевание — сахарный
диабет. Белком является соматогпропин — гормон роста млекопитающих ,
образующийся в передней доле гипофиза. Там же образуется и адренокорти-
котропный гормон (АКТГ). Он действует на кору надпочечников, регулируя
образование небелковых стероидных гормонов.
Рецепторная функция. Эта функция белков очень тесно связана с преды-
дущей. Для того чтобы адекватно реагировать на изменения внешней среды,
клетка или организм должны получать сигналы. Такими сигналами могут быть
гормоны или нейромедиаторы, запахи, свет и т. д. Чтобы реагировать на эти
сигналы, их нужно воспринять. Для этого клетки имеют рецепторы — белко-
вые молекулы (нередко ковалентно связанные с полисахаридами) , реагирую-
щие на определенный стимул — сигнальную молекулу (лиганд) или квант све-
та. Сигнальные молекулы и рецептор подходят друг к друг)'
, как ключ к замку.
Связывание молекулы лиганда изменяет конформацию рецептора. При этом
рецептор, как правило, приобретает ферментативную активность, в результа-
те чего в клетке запускается каскад биохимических реакций, т. е. осуществля-
ется реагирование на стимул.
В мозге человека образуются очень короткие белки
нейропептиды эн-
дорфины и энкефалины , состоящие из пяти аминокислотных остатков. Они
служат для поддержания нормального функционирования центральной нерв-
ной системы. Энкефалины повышают чувствительность к раздражителям,
приводят организм в состояние «боевой готовности». Эндорфины, наоборот,
понижают чувствительность к раздражителям, вызывают расслабление, ощу-
щение счастья. Сходство пространственной формы эндорфинов с экзогенны-
ми опием и морфием, приводит к тому, что эти наркотики прочно связыва-
36
Лекиия 5
ются с рецепторами нейропептидов, что вызывает ощущение довольства. Но,
поскольку синтез таких биологически активных веществ в организме очень
строго лимитируется, занятость рецепторов приводит к тому, что нсйропспти-
ды перестают синтезироваться. После разрушения молекулы наркотика отсут-
ствие энкефалинов и эндорфинов (которые были названы эндогенными опио-
идами) приводит к «ломке» , когда человеку очень плохо, организму требуется
наличие лигандов для рецепторов. Рецептор ведь не различает, что за лиганд
с ним соединен — нейропептид или наркотик. Так возникает наркотическая
зависимость, а нарушение регуляции работы центральной нервной системы
очень быстро разрушает организм и приводит его к гибели.
37
ЛЕКиИЯ 6
Структурная, транспортная и другие функиии белков
Структурная функция белков. Белки входят в состав всех без исклю-
чения клеточных органелл, как мембранных , так и немембранных . О белках
в биологических мембранах подробно будет рассказано в следующей лекции.
Белки немембранных органелл будут рассмотрены в лекциях , посвященных
структуре и функциям рибосом и хромосом.
Белки являются главной структурной частью опорных и покровных тка-
ней животных . Белки соединительной ткани составляют строму — структур-
ную основу различных органов. Как правило, это фибриллярные белки. По-
липептидные цепочки располагаются бок о бок и скрепляются электростати-
ческими взаимодействиями, водородными связями и / или дисульфидными
мостиками . В результате образуются очень прочные нити, видимые в световой
микроскоп или даже невооруженным глазом. Так, человеческий волос состоит
из «трехжильных канатов», каждый из которых скручен из цепочек богатого
цистеином а кератина. Цепочки скреплены друг с другом дисульфидными
мостиками. Из а-кератина состоят не только волосы, но и ногти, рога, копыта,
иглы ежа, рог носорога, панцирь черепахи. Белок шелка фиброин производят
пауки и некоторые насекомые. Он состоит из множества вытянутых и антипа -
раллельно уложенных цепей ф-кератина , скрепленных водородными связями.
Отсутствие ковалентных дисульфидных мостиков между цепями обеспечива-
ет большую по сравнению с а -кератином гибкость фиброина. По этой же при-
чине шелк практически нерастяжим в отличие от шерсти, которую при тепло-
вой обработке можно растянуть в два раза.
Сплетения a-цепей белка коллагена в тройной спирали (рис. 6.1) в пе-
ресчете на единицу площади поперечного сечения имеют большую прочность,
чем стальная проволока. Коллагеновые «канаты» образуют хрящи, сухожилия,
костный матрикс.
Благодаря наличию реакционноспособных групп в радикалах аминокис-
лот построенные из них белки обладают способностью соединяться с другими
самыми разными молекулами. Такие сложные белки называют протеидами.
38
Лекиия 6
А
Б
|У
V.
Рис. 6.1.Строение коллагена
А — схема тройной спирали; Б — волокна коллагена
(сканирующий электронный микроскоп)
В зависимости от того, с какой молекулой соединен белок, различают глико-
протеиды, липопротеиды, хромопротеиды.
Гликопротеиды — соединение белковых молекул с поли- или олигосахари-
дами. Многие мембранные белки-рецепторы представляют собой гликопроте-
иды. Белки заякоривают рецептор в мембране, а олигосахаридная часть моле-
кулы формирует распознающий центр рецептора. Разнообразие связей между
моносахаридными остатками, наличие а- и (3-изомеров сахаров, существование
разветвленных олигосахаридных молекул позволяет олигосахаридам форми-
ровать самые разнообразные пространственные формы. Узнавание рецептора
и лиганда происходит благодаря тому, что их пространственные конформации
подходят друг к другу, как ключ к замку. Часто такие рецепторы представляют
собой «опознавательные знаки» клеток, принадлежащих определенной ткани
организма. Их узнавание обеспечивает также сцепление клеток друг с другом
при формировании органа. Гликопротсидами являются и молекулы, определяю-
щие группу крови человека; они встроены в плазмалемму эритроцитов.
Структурная, транспортная и другие функции белков
39
Особую группу гликопротеидов представляют протеогликаны, состав-
ляющие структурную основу соединительной ткани, хрящей, роговицы глаза
(рис. 6.2, А ). В протеогликанах к фибриллярной белковой молекуле ковалент -
но присоединено множество олигосахаридных цепей. Олигосахариды, благо-
даря своей высокой гидрофильности, связывают большое количество молекул
воды. Это придает эластичность хрящу, гелеобразную консистенцию межкле-
точному веществу в тканях организма, упругость и прозрачность роговице.
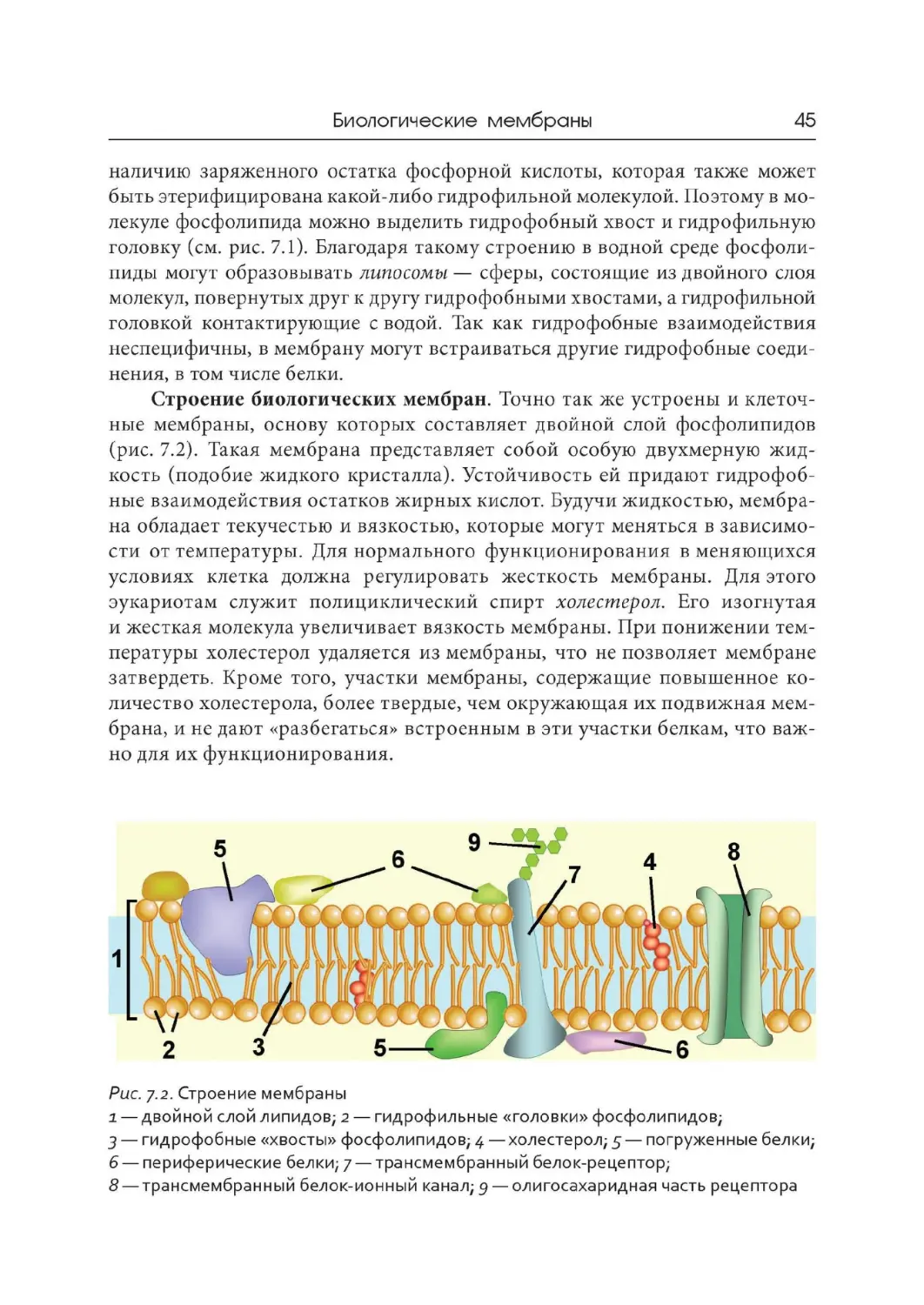
Рис. 6.2. Сложные белки
А — строение протеогликанов хряща (слева) и роговицы глаза (справа):
1— цепочки олигосахаридов; 2 — белковая часть молекулы; б — липопротеин:
1— липиды; 2 — аполипопротеин; В — строение хромопротеидов гемоглобина
(слева) и хлорофиллсодержащего белка (в середине):i— гем; 2 — субъединица
глобина; з — белковая часть молекулы; 4 — хлорофилл; 5 — атом магния
в порфириновом кольце
(ks.uiuc. edu, di.uq. edu. au, commons.wikimedia.org)
Липопротеиды — сложные белки, состоящие из белковой и липидной ча-
стей. Липопротеиды входят во все клеточные мембраны. Особый класс липо-
протеидов — молекулы, транспортирующие липиды в крови. В кровь липиды
поступают из пищи или синтезируются в организме. В свободном виде липиды
переноситься кровью не могут, так как в водной среде в результате гидрофоб-
ных взаимодействий они слипаются, что может привести к закупорке кровенос-
ных сосудов и смерти. Поэтому транспортировка липидов происходит в виде
40
Лекиия 6
липопротеидов — соединений липидов с белковыми молекулами, которые но-
сят название аполипопротеинов (рис. 6.2, Б ). В составе такой частицы липидная
часть покрыта белковой «оболочкой», гидрофобные аминокислотные радикалы
которой обращены к липиду, а гидрофильные — наружу. В результате гидро-
фобные взаимодействия между разными молекулами липидов оказываются
невозможными, и частицы безопасно транспортируются кровью. Различают
несколько групп таких транспортных липопротеидов, главными из которых
являются липопротеиды высокой плотности и липопротеиды низкой плотно-
сти . Плотность их зависит от соотношения белок / липид. Чем больше белковая
часть, тем выше плотность липопротеида, так как липиды — легкие молекулы,
их плотность меньше плотности воды. Липопротеиды низкой плотности, в ко-
торых белка мало, при высокой концентрации их в крови могут все-таки прили-
пать к стенкам кровеносных сосудов, что приводит к развитию атеросклероза
и повышает риск инфаркта или инсульта. С возрастом в клетках печени умень-
шается количество специальных рецепторов для липопротеидов низкой плот-
ности, которые «вылавливают» их из крови, чтобы разрушить. Поэтому и риск
развития атеросклероза у человека с возрастом увеличивается.
Хромопротеиды (рис. 6.2, В — это белки, содержащие так называемые
хромофорные группы (греч. cromoc — цвет и (рорео — несу). Хромофорные
группы избирательно поглощают свет определенной длины волны, поэтому
они придают окраску белку. В качестве хромофорной группы наиболее часто
встречаются сложные гетероциклические молекулы — порфирины. Самыми
известными являются хлорофилл, содержащий атом магния, и содержащий
атом железа гем. Гем входит в состав гемоглобина и цитохромов — важнейших
участников процессов энергетического обмена.
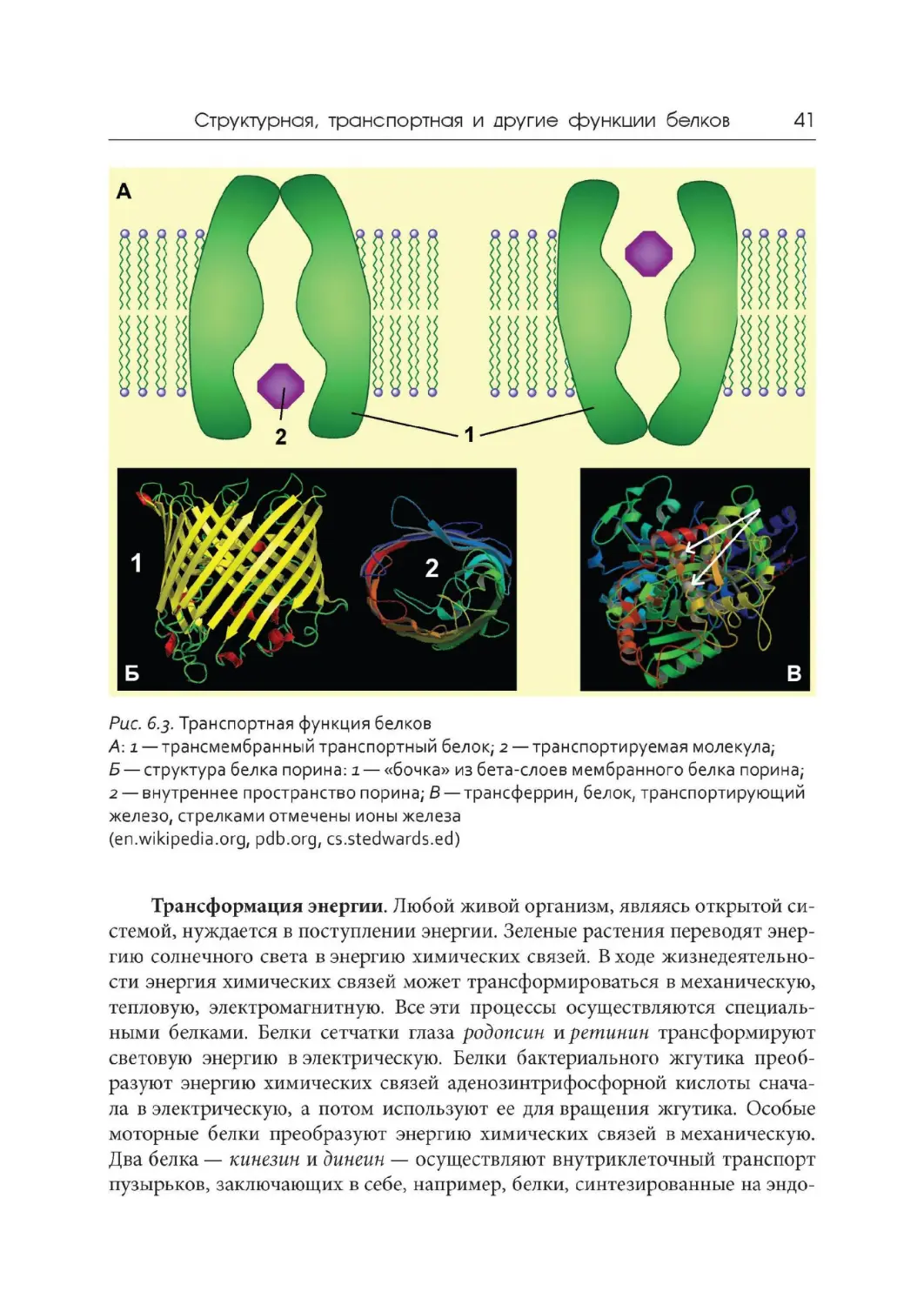
Транспортная функция белков. В многоклеточных организмах для по-
ступления определенных веществ в те клетки, которые в них нуждаются, про-
стой диффузии недостаточно, да она и не всегда возможна. Активный перенос
веществ осуществляется специальными транспортными белками. Многочис-
мембранные белки — переносят полярные соединения
так и против градиента концентрации. Такие белки
ленные пермеазы
через мембрану как по,
осуществляют свою функцию за счет изменения конформации (рис. 6.3, А).
Специальные белки образуют постоянные каналы в плазмалемме для посту-
пления воды. В клеточной стенке бактерий особый белок порин формиру-
ет « трубы» , стенки которых образованы бета-слоями молекулы (рис. 6.3, Б ).
В кровеносном русле белок гемоглобин (в составе эритроцитов ) переносит
кислород и углекислый газ. Другие белки переносят некоторые вещества,
нужные клеткам, но токсичные для организма. К таким веществам относятся
ионы железа и меди, которые входят в состав ферментов, но в свободном виде
нс должны находиться в крови. Так, белок трансферрин (рис. 6.3, В ) осущест-
вляет транспорт железа в плазме крови.
Структурная, транспортная и другие функиии белков
41
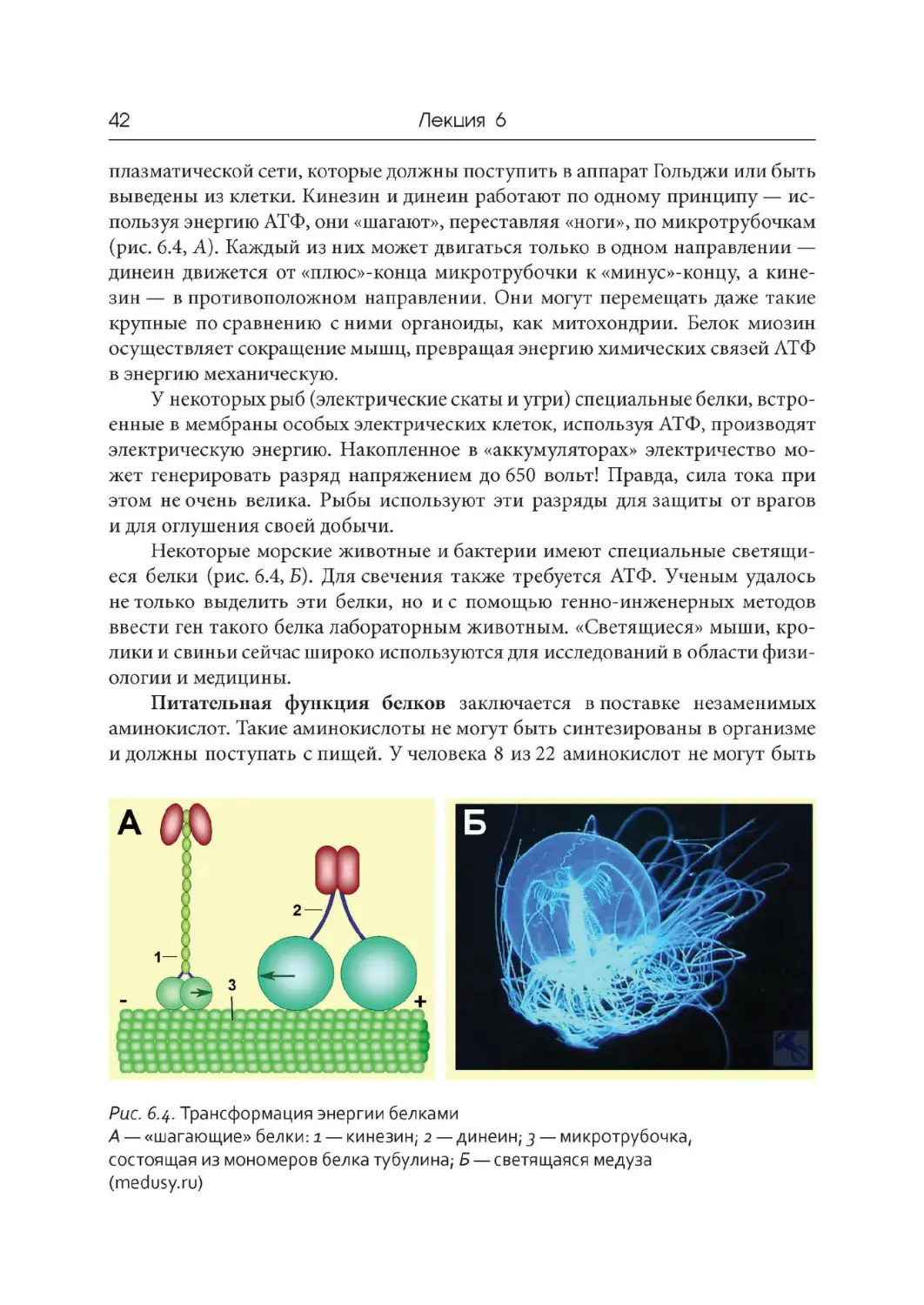
Рис. 6.3
. Транспортная функция белков
А. 1 — трансмембранный транспортный белок, 2 — транспортируемая молекула,
Б — структура белка порина:i— «бочка» из бета -слоев мембранного белка порина;
2 — внутреннее пространство порина; В — трансферрин, белок, транспортирующий
железо, стрелками отмечены ионы железа
(en.wikipedia.org, pdb.org, cs.stedwards.ed)
Трансформация энергии. Любой живой организм, являясь открытой си -
стемой, нуждается в поступлении энергии. Зеленые растения переводят энер-
гию солнечного света в энергию химических связей. В ходе жизнедеятельно-
сти энергия химических связей .может трансформироваться в механическую,
тепловую, электромагнитную. Все эти процессы осуществляются специаль-
ными белками. Белки сетчатки глаза родопсин претинин трансформируют
световую энергию в электрическую. Белки бактериального жгутика преоб-
разуют энергию химических связей аденозинтрифосфорной кислоты снача-
ла в электрическую, а потом используют ее для вращения жгутика. Особые
моторные белки преобразуют энергию химических связей в механическую.
Два белка — кинезин и динеин — осуществляют внутриклеточный транспорт
пузырьков, заключающих в себе, например, белки, синтезированные на эндо-
42
Лекиия 6
плазматической сети, которые должны поступить в аппарат Гольджи или быть
выведены из клетки. Кинезин и динеин работают по одному принципу — ис-
пользуя энергию АТФ, они «шагают », переставляя «ноги », по микротрубочкам
(рис. 6.4, А). Каждый из них может двигаться только в одном направлении —
динеин движется от «плюс» -конца микротрубочки к «минус »-концу, а кине-
зин — в противоположном направлении. Они могут перемещать даже такие
крупные по сравнению с ними органоиды, как митохондрии. Белок миозин
осуществляет сокращение мышц, превращая энергию химических связей АТФ
в энергию механическую.
У некоторых рыб (электрические скаты и угри) специальные белки, встро-
енные в мембраны особых электрических клеток, используя АТФ, производят
электрическую энергию. Накопленное в «аккумуляторах » электричество мо-
жет генерировать разряд напряжением до 650 вольт! Правда, сила тока при
этом не очень велика. Рыбы используют эти разряды для защиты от врагов
и для оглушения своей добычи.
Некоторые морские животные и бактерии имеют специальные светящи-
еся белки (рис. 6.4, Б ). Для свечения также требуется АТФ. Ученым удалось
не только выделить эти белки, но и с помощью генно- инженерных методов
ввести ген такого белка лабораторным животным. « Светящиеся» мыши, кро-
лики и свиньи сейчас широко используются для исследований в области физи-
ологии и медицины.
Питательная функция белков заключается в поставке незаменимых
аминокислот. Такие аминокислоты не могут быть синтезированы в организме
и должны поступать с пищей. У человека 8 из 22 аминокислот не могут быть
Рис. 6.4
. Трансформация энергии белками
А—
« шагающие» белки : i — кинезин; 2 — динеин; JJ — микротрубочка,
состоящая из мономеров белка тубулина; Б — светящаяся медуза
( medusy. ru )
Структурная, транспортная и другие функиии белков
43
синтезированы в клетках организма. Для разных видов животных и грибов
незаменимыми могут быть разные аминокислоты. С питательной функци-
ей тесно связана функция запасания аминокислот для развития зародышей
и вскармливания младенцев. Аминокислоты им нужны для построения новых
полипептидов, а запасать их выгоднее в виде белков. Например, казеин (белок
молока), овальбумин (яичный белок) , глиадин (белок зерен пшеницы) разла-
гаются клетками зародыша (или детеныша млекопитающего) до аминокислот,
из которых потом строятся собственные белки.
Энергетическая функция для белков не является основной, но, тем
не менее, белки могут использоваться и для получения энергии. Заменимые
аминокислоты, которые могут быть синтезированы в клетке из продуктов рас-
щепления углеводов и липидов, в клетках животных обычно дезаминируются,
а потом поступают в процессы энергетического обмена. Для хищников, в ра-
ционе которых мало углеводов , энергетическая роль белков значительна.
Буферная функция белков. Любой белок является амфотерным поли-
электролитом. В силу этого белки способны стабилизировать pH. В разных
участках клетки протекают разные реакции, которые требуют определенных
значений pH. Различные белки могут поддерживать такую разницу pH в раз-
ных частях клетки, обеспечивая этим условия для одновременного протека-
ния разнообразных реакций.
Другие функции белков. Некоторые способы использования белков
трудно классифицировать. Например, некоторые животные вырабатывают
белковые токсины не только для защиты, но и для нападения. Яды змей, пчел,
других ядовитых животных содержат различные вещества, в том числе и фер-
менты, разрушающие биополимеры организма жертвы. Из змеиного яда такие
ферменты получают для использования в исследовательских работах и для ле-
чения некоторых заболеваний.
44
ЛЕКиИЯ 7
Биологические мембраны
Строение фосфолипидов. Многие белки
могут эффективно выполнять свои функции
только тогда, когда они закреплены в мембра -
не. Мембраны (от лат. membrane — кожица,
оболочка, перепонка) — абсолютно необходи-
мый компонент живых систем. Основой всех
биологических мембран являются макромо-
лекулы фосфолипидов. Фосфолипиды пред-
ставляют собой сложные эфиры трехатомного
спирта глицерола и кислот — одной молекулы
фосфорной кислоты и двух молекул высших
карбоновых кислот (рис. 7.1). Эти карбоновые
кислоты часто называют жирными кислотами.
Это алифатические одноосновные кислоты,
содержащие более четырех атомов углерода.
В клетках чаще всего встречаются жирные
кислоты, содержащие 16-20 атомов углерода.
Обычно в молекуле фосфолипида один оста-
ток жирной кислоты является насыщенным,
а другой содержит двойную связь. Это позво-
ляет липиду оставаться жидким при физиоло-
гических условиях , так как наличие двойных
связей существенно понижает температуру
плавления жирных кислот. Молекулы фос-
фолипидов амфифильны , т. е. включают ги -
дрофильную и гидрофобную части. Длинные
углеводородные «хвосты» жирных кислот ги -
дрофобны , глицсрол — гидрофильное соеди -
нение. Гидрофильность усиливается благодаря
>=@ о
I
н,с
сн,
—
сн.
Рис. 7.1
. Строение молекулы
фосфолипида лецитина
2 — гидрофобный «хвост»
(остатки пальмитиновой
и олеиновой кислот);
2 — остаток глицерола;
3 — остаток холина;
4 — гидрофильная «головка»
Биологические мембраны
45
наличию заряженного остатка фосфорной кислоты, которая также может
быть этерифицирована какой- либо гидрофильной молекулой. Поэтому в мо-
лекуле фосфолипида можно выделить гидрофобный хвост и гидрофильную
головку (см. рис. 7.1). Благодаря такому строению в водной среде фосфоли-
пиды могут образовывать липосомы — сферы, состоящие из двойного слоя
молекул, повернутых друг к другу гидрофобными хвостами, а гидрофильной
головкой контактирующие с водой. Так как гидрофобные взаимодействия
неспецифичны, в мембрану могут встраиваться другие гидрофобные соеди-
нения, в том числе белки.
Строение биологических .мембран. Точно так же устроены и клеточ -
ные мембраны, основу которых составляет двойной слой фосфолипидов
(рис. 7.2). Такая мембрана представляет собой особую двухмерную жид -
кость ( подобие жидкого кристалла ). Устойчивость ей придают гидрофоб-
ные взаимодействия остатков жирных кислот. Будучи жидкостью, мембра-
на обладает текучестью и вязкостью, которые могут меняться в зависимо-
сти от температуры. Для нормального функционирования в меняющихся
условиях клетка должна регулировать жесткость мембраны. Для этого
эукариотам служит полициклический спирт холестерол. Его изогнутая
и жесткая молекула увеличивает вязкость мембраны. При понижении тем-
пературы холестерол удаляется из мембраны, что не позволяет мембране
затвердеть. Кроме того, участки мембраны, содержащие повышенное ко-
личество холестерола, более твердые, чем окружающая их подвижная мем-
брана, и нс дают « разбегаться» встроенным в эти участки белкам, что важ-
но для их функционирования.
9
5
8
6
4
,7
>
1
ЧМ*!
3
5
б
2
Рис. у .2 . Строение мембраны
1— двойной слой липидов; 2 — гидрофильные «головки» фосфолипидов;
3 — гидрофобные «хвосты» фосфолипидов; 4 — холестерол;5 — погруженные белки;
6 — периферические белки; 7 — трансмембранный белок-рецептор;
8 — трансмембранный белок- ионный канал; 9 — олигосахаридная часть рецептора
46
Лекиия 7
Мембранные белки. Эукариотические клетки содержат много мембран —
это не только плазмалемма, но и мембраны органоидов. Принцип их устрой-
ства один и тот же, но свойства различаются. Это обусловлено не только раз-
ницей в составе липидов, но, в первую очередь, теми белками, которые встро-
ены в эти мембраны. Все связанные с мембранами белки можно разделить
на три группы: трансмембранные белки, пронизывающие мембрану насквозь;
погруженные белки, расположенные в гидрофобном слое и «выглядывающие»
на ту или другую поверхность мембраны; периферические белки, находящиеся
только на каждой поверхности мембраны и не проникающие в гидрофобный
слой. Периферические белки обычно присоединяются к поверхности мембра -
ны электростатически.
Все трапемембранные и погруженные белки закреплены в мембране
благодаря тому, что гидрофобные радикалы аминокислот у них не спрята-
ны внутрь белковой глобулы, а наоборот, располагаются на поверхности той
части молекулы, которая находится внутри мембраны. Поэтому «выпасть»
из мембраны белок не может. В некоторых мембранах клеточных органоидов
(например, митохондрий) белков оказывается по массе больше, чем липидов,
но тем не менее их мембраны остаются целыми. Участки молекул белков, вы -
ступающие за поверхность мембраны, гидрофильны.
Функции мембран. Функции клеточных мембран разнообразны. Так
плазмалемма (плазматическая мембрана) защищает цитоплазму от физиче-
ских и химических повреждений, делает возможным контакт и взаимодей-
ствие клеток в тканях и органах , избирательно обеспечивае т транспорт в клет-
ку питательных веществ и выведение конечных продуктов обмена. На мем-
бранах таких органоидов, как хлоропласты и митохондрии, протекают многие
реакции энергетического обмена. В клетке одновременно идет огромное коли-
чество химических реакций, не всегда совместимых друг с другом (например,
требующих разных значений pH). Мембраны органоидов осуществляют ком-
партментализацию — разделение клетки на отдельные участки (компартмен-
ты ) , отграниченные друг от друга.
Ферментативные конвейеры. В клетке в основном осуществляются
не отдельные биохимические реакции, а довольно длинные цепи последо-
вательных превращений того или иного вещества. Для успешного функци-
онирования клетки необходимо, чтобы эти реакции следовали одна за дру-
гой в правильной последовательности, а реагирующим веществам не при -
ходилось бы «искать» друг друга по всему объему. В таких случаях эти
последовательные реакции осуществляются ферментами , закрепленными
на мембране в нужной последовательности. Каждый фермент катализи-
рует свою реакцию и « передает» продукт реакции следующему ферменту,
который располагается рядом . Чтобы молекулы ферментов нс «уплыли»
в жидкой мембране, они находятся в так называемых липидных рафтах
Биологические мембраны
47
(англ, raft — плот ). Это более толстые и твердые участки мембраны, в кото-
рых находятся молекулы липидов, не содержащие ненасыщенных жирных
кислот и богатые холсстсролом. В стабилизации ферментативного конвей -
ера принимают участие и периферические белки , ограничивающие погру-
женные белки - ферменты с боков.
Электронно-транспортные цепи. Особой разновидностью фермента-
тивных конвейеров являются электронно-транспортные цепи хлоропластов
и митохондрий. Они представляют собой цепь окислителей, в которой каж-
дый последующий компонент является более сильным окислителем, чем пре-
дыдущий. Благодаря этому они отбирают друг у друга высокоэнергетические
электроны. В митохондриях это электроны коферментов НАД- И и ФАД -Н
электроны хлорофилла, возбужденные квантами света.
2’
в хлоропластах
Энергия, которую электроны теряют при прохождении по электронно-транс-
портной цепи, используется для синтеза АТФ или восстановления некоторых
коферментов. Работа электронно-транспортных цепей сопровождается пере-
качиванием протонов на одну сторону мембраны, например, в межмембран-
нос пространство митохондрий или во внутритилакоиднос пространство
хлоропластов. Так как мембрана для протонов непроницаема, между ее сторо-
нами возникает разность электрических потенциалов, что делает возможным
использование клетками электрического (ионного) тока.
Трансмембранная передача сигнала. Другим примером конвейера
мембранных белков является система трансмембранной передачи сигнала.
В нее входят рецепторный белок , имеющий активный центр для улавлива-
ния какого-либо сигнала из внешней для клетки среды (например, для свя-
зывания молекулы гормона) , так называемый G-белок и фермент аденилат-
циклаза , который синтезирует универсальный внутриклеточный перено-
счик сигналов цАМФ (циклический аденозинмонофосфаг ). G -белок — это
погруженный в мембрану белок с четвертичной структурой, одна субъе-
диница которого может отсоединяться. Присоединение молекулы гормо-
на к активному центру рецептора меняет его конформацию. За счет этого
рецептор взаимодействует с G -белком. Отделившаяся в результате этого
взаимодействия субъединица перемещается к аденилатциклазе и активи -
рует ее. Аденилатциклаза начинает продуцировать цАМФ, который запу-
скает каскад реакций внутри клетки (рис. 7.3). При этом молекула гормона
или другого сигнального вещества не попадает внутрь клетки, а передается
только сигнал.
Мембранный транспорт. Благодаря своему строению мембрана непро-
ницаема для очень многих веществ: воды , ионов, крупных молекул. Так как
клетке необходимо поступление извне одних веществ и выведение других ,
существуют многочисленные мембранные транспортные белки
ионные каналы. Эти белки также удерживаются в мембране гидрофобными
пермеазы ,
48
Лекиия 7
Аденилатциклаза
АТФ
цАМФ
Рис. 7.3
.
Трансмембранная передача сигнала
1— рецептор; 2 — лиганд;3 — субъединицы G-белка; 4 — аденилатциклаза;
5 — субъединица G-белка, активирующая аденилатциклазу;
6 — синтезируемый цАМФ
взаимодействиями. Они имеют внутри молекулы полость или канал, поверх -
ность которых гидрофильна, благодаря чему мелкие гидрофильные молекулы
могут через них перемещаться.
49
ЛЕКиИЯ 8
Матричные синтезы. Приниипы и этапы
транскришии. Оперон
Матричные синтезы. Матричный синтез — свойственный только живому
способ создания биополимеров путем последовательного присоединения моно-
меров в соответствии с образцом, матрицей. Так как мономеры (разные нуклео-
тиды или отличающиеся радикалами аминокислоты) по способности образовы-
вать фосфодиэфирные или пептидные связи не отличаются друг от друга, пра-
вильность их последовательности может гарантироваться только «побуквен-
ным чтением» матрицы и «записью прочитанного» в новой молекуле. Основных
матричных синтезов в природе три: репликация (синтез ДНК по матрице ДНК),
транскрипция (синтез РНК по матрице ДНК) и трансляция (синтез белка по ма-
трице мРНК). Некоторые вирусы способны к еще двум разновидностям матрич-
ных синтезов — репликации РНК (синтез РНК по матрице РНК) и обратной
транскрипции (синтез ДНК по матрице РНК). На матричном принципе основан
и процесс репарации — исправления ошибок в молекуле ДНК.
Главным принципом всех матричных синтезов является комплементар-
ностъ — однозначное соответствие последовательностей мономеров вновь
синтезируемой и матричной молекул. Во всех случаях комплементарность
обеспечивается образованием водородных связей между азотистыми основа-
ниями А-Т, Г-Ц в ДНК и A-У, Г-Ц в РНК или гибридах ДНК-РНК. Этот прин-
цип следует из принципа строения двойной спирали ДНК; оттуда же следует
и второй принцип — антипараллельность. Эти два принципа выполняются
для всех видов матричных синтезов. Третий принцип обусловлен не строением
нуклеиновых кислот, а особенностями работы ферментов, которые осущест-
вляют эти процессы. Все полимеразы нуклеиновых кислот (РПК-полимера-
зы, ДНК-полимеразы, РНК-репликазы, обратные транскриптазы, репаразы),
передвигаясь в процессе работы по матричной молекуле, могут осуществлять
это только в одном направлении — от З’- конца к 5’- концу матрицы. Этот
принцип матричных синтезов называется униполярность. Синтезируемые
цепи ДНК или РНК всегда растут в направлении 5’эЗ’. В случае трансляции
50
Лекиия 8
термин «униполярность» не употребляют, хотя осуществляющие синтез белка
рибосомы также движутся только в одном направлении, но в противополож-
ном — от 5’- конца к З’- концу матричной РНК. Синтезируемый при этом белок
растет от N-конца к С-концу.
Принципы транскрипции. Начальным этапом процесса реализации
генетической информации, хранящейся в ДНК, является транскрипция
(англ , transcription — переписывание) — синтез всех видов РНК по матрице
ДНК, осуществляемый ферментами — ДНК-зависимыми РНК-полимеразами.
У прокариот синтез всех видов РНК осуществляется одним и тем же
ферментом. У эукариот ферментов несколько: три ядерные РНК-полимера -
зы, митохондриальные РНК-полимеразы, хлоропластные РНК-полимеразы.
Субстратами для РНК-полимераз служат рибопуклеотиды. Для соединения их
в цепочку 3’-5’-фосфодиэфирными связями нужна энергия. Она запасается за-
ранее, путем активирования нуклеотидов. Процесс активирования заключает-
ся в том, что с помощью универсального переносчика энергии, АТФ (которая
и сама является активированным рибонуклеотидом) , остальные рибонуклео-
тиды фосфорилируются, превращаясь в рибонуклсозид -трифосфаты с двумя
макроэргическими связями (рис. 8.1). Весь процесс транскрипции осущест-
вляется за счет энергии, выделяющейся при отщеплении пирофосфата Р,074 —
от активированных нуклеотидов.
Транскрипция происходит в соответствии с общими принципами ма-
тричных синтезов. Но у нее есть и своя особенность. Она связана с тем, что мо-
лекула ДНК, служащая матрицей для транскрипции, двуцепочечна, а РНК —
одноцепочечная молекула. Это означает, что матрицей для нее может служить
только одна из цепей ДНК, причем не любая, а строго определенная, ведь нити
ДНК не идентичны друг другу, а комплементарны, т. е . последовательности
нуклеотидов в них разные (хотя они и находятся в однозначном соответствии
друг с другом). Поэтому в любом участке ДР1К, по которому синтезируется
РНК, одна нить будет транскрибируемой , а другая — нетраскрибируемой ( ко-
дирующей ). Отсюда следует еще один принцип, свойственный только процессу
транскрипции — асимметричность.
Таким образом, процесс транскрипции осуществляется в соответ-
ствии со следующими принципами: 1 ) комплементарностъ; 2) антипарал-
лельность; 3) униполярность; 4 ) асимметричность.
Понятие об опероне. Процессы транскрипции у прокариот и эукариот
имеют свои особенности. С 60-х гг. XX века основным объектом для изуче-
ния транскрипции были прокариоты , а особенности транскрипции у эука-
риот были изучены позднее. Мы также сначала рассмотрим этот процесс
у бактерий , а потом отметим его особенности у эукариотических организ-
мов. У прокариот единицей транскрипции является оперон — участок ДНК,
с которого считывается одна молекула РНК (рис. 8.2, А ). В начале каждого
50
Лекиия 8
термин «униполярность» не употребляют, хотя осуществляющие синтез белка
рибосомы также движутся только в одном направлении, но в противополож-
ном — от 5’- конца к З’- концу матричной РНК. Синтезируемый при этом белок
растет от N-конца к С-концу.
Принципы транскрипции. Начальным этапом процесса реализации
генетической информации, хранящейся в ДНК, является транскрипция
(англ , transcription — переписывание) — синтез всех видов РНК по матрице
ДНК, осуществляемый ферментами — ДНК-зависимыми РНК-полимеразами.
У прокариот синтез всех видов РНК осуществляется одним и тем же
ферментом. У эукариот ферментов несколько: три ядерные РНК-полимера -
зы, митохондриальные РНК-полимеразы, хлоропластные РНК-полимеразы.
Субстратами для РНК-полимераз служат рибопуклеотиды. Для соединения их
в цепочку 3’-5’-фосфодиэфирными связями нужна энергия. Она запасается за-
ранее, путем активирования нуклеотидов. Процесс активирования заключает-
ся в том, что с помощью универсального переносчика энергии, АТФ (которая
и сама является активированным рибонуклеотидом) , остальные рибонуклео-
тиды фосфорилируются, превращаясь в рибонуклсозид -трифосфаты с двумя
макроэргическими связями (рис. 8.1). Весь процесс транскрипции осущест-
вляется за счет энергии, выделяющейся при отщеплении пирофосфата Р,074 —
от активированных нуклеотидов.
Транскрипция происходит в соответствии с общими принципами ма-
тричных синтезов. Но у нее есть и своя особенность. Она связана с тем, что мо-
лекула ДНК, служащая матрицей для транскрипции, двуцепочечна, а РНК —
одноцепочечная молекула. Это означает, что матрицей для нее может служить
только одна из цепей ДНК, причем не любая, а строго определенная, ведь нити
ДНК не идентичны друг другу, а комплементарны, т. е . последовательности
нуклеотидов в них разные (хотя они и находятся в однозначном соответствии
друг с другом). Поэтому в любом участке ДР1К, по которому синтезируется
РНК, одна нить будет транскрибируемой , а другая — нетраскрибируемой ( ко-
дирующей ). Отсюда следует еще один принцип, свойственный только процессу
транскрипции — асимметричность.
Таким образом, процесс транскрипции осуществляется в соответ-
ствии со следующими принципами: 1 ) комплементарностъ; 2) антипарал-
лельность; 3) униполярность; 4 ) асимметричность.
Понятие об опероне. Процессы транскрипции у прокариот и эукариот
имеют свои особенности. С 60-х гг. XX века основным объектом для изуче-
ния транскрипции были прокариоты , а особенности транскрипции у эука-
риот были изучены позднее. Мы также сначала рассмотрим этот процесс
у бактерий , а потом отметим его особенности у эукариотических организ-
мов. У прокариот единицей транскрипции является оперон — участок ДНК,
с которого считывается одна молекула РНК (рис. 8.2, А ). В начале каждого
52
Лекиия 8
особая последовательность нуклеотидов
оперона находится промотор
ДНК, узнаваемая РНК-полимеразой как «посадочная площадка» . Синтез
специфической РНК может начаться только с промотора. В конце каждого
оперона находится терминатор — особая последовательность нуклеотидов
ДНК, узнаваемая РНК-полимеразой как сигнал к завершению транскрипции.
Перед терминатором располагаются структурные гены , или цистроны —
последовательности нуклеотидов ДНК, кодирующие один полипептид (или
белок, не имеющий четвертичной структуры). Цистроны, не кодирующие
белки, служат матрицами для тРНК, pPPIK или sPIIK (один цистрон — одна
молекула РНК ). В большинстве случаев в оперон объединяются цистроны,
в которых кодируются разные белки, принимающие участие в одной цепи
биохимических реакций. Существуют моно-, олиго- и полицистропные опе -
роны. Между промотором и цистронами может находиться оператор — ре-
гуляторный участок оперона, особая последовательность нуклеотидов ДНК,
узнаваемая белком- репрессором. Когда на операторе находится белок - репрес-
сор , транскрипция не идет, так как он мешает продвижению РНК-полимера-
зы. Когда белка- репрессора на операторе нет, РНК-полимсраза может дви-
гаться по молекуле ДНК, и транскрипция идет (рис. 8.2, Б ) . Оператор может
перекрываться с промотором или даже полностью быть вложенным в про-
мотор. Если на таком операторе сидит белок- репрессор, то посадка РНК-по-
лимеразы на промотор невозможна. Опероны, не содержащие оператора,
транскрибируются постоянно. Их называют конститутивными в отличие
от регулируемых , в которых оператор имеется.
Процесс транскрипции асимметричен — в пределах одного оперона
транскрибируется только одна из цепей ДНК. В одной молекуле ДНК оперонов
много, и они могут быть разнонаправленными (рис. 8.3, А ). Таким образом,
транскрибируются обе цепи ДНК, но в каждом отдельном опероне — только
одна из них . Поскольку РНК-полимераза может двигаться по цепи ДНК толь-
ко в направлении 3’->5’, положение промотора и терминатора в опероне одно-
значно определяют, какая именно из цепей ДНК будет транскрибироваться.
Структура прокариотического промотора. РНК-полимераза узнает про-
мотор, покрывая 40-60 пар нуклеотидов. В промоторе находятся два АТ-бо-
гатых участка. Как мы знаем, АТ-богатые участки ДНК, имеющие меньше
водородных связей, чем участки, содержащие ГЦ-пары, денатурируют легче.
Поэтому в этих АТ-богатых участках комплементарные цепи ДНК слегка от-
ходят друг от друга на протяжении 4-6 нуклеотидных пар. РПК-полимераза
узнает именно эти «неровности на дороге» (см. рис. 8.3, А). Центры этих участ-
ков находятся в положениях -10 и -35 нуклеотидов от начала синтеза РНК.
Для правильного узнавания промотора РНК-полимеразой принципиально
важным является расстояние между этими расплавленными участками. Оно
колеблется от 16 до 19 п. н. (пар нуклеотидов). Искусственное увеличение это-
Матричные синтезы . Принципы и этапы транскрипиии . Оперон 53
оперон 1
Л
А
3'
I
'
5'
оперон 2
П.Н,
А
ТАТААТ
-
10"
5'
3
Рис. 8.3
.
Промотор прокариотической клетки
А — асимметричность транскрипции и структура промотора;
Б — связывание РНК-полимеразы с промотором: i — корфермент;
2 — о -фактор;з — холофермент
го расстояния до 20 п. н . или уменьшение его до 15 п . н. приводит к тому, что
РНК- полимераза не узнает испорченный промотор как посадочную площадку.
РНК-полимераза бактерии кишечной палочки ( Е. coli ) . В бактериаль-
ной клетке одновременно присутствует около 7000 молекул РНК-полимеразы.
РНК- полимераза Е. coli — белок с четвертичной структурой . Полный фермент
(так называемый холофермент) состоит из пяти субъединиц: (2а)(3(3 ' а. В соста-
ве холофермента одна из субъединиц, называемая а-фактором, узнает частич -
но денатурированные области промотора (рис. 8.3, Б ). Холофермент прочно
связывается с промотором и начинает транскрипцию. После того как длина
синтезируемой РНК достигает 8 нуклеотидов, a -фактор отделяется и дальней-
шие стадии транскрипции ведутся без него так называемым корферментом
Оcore — сердцевина).
Этапы транскрипции. Транскрипция — сложный процесс, состоя-
щий из нескольких этапов: 1) узнавание промотора и прочное связывание
РНК-полимеразы, 2) инициация; 3) элонгация и 4) терминация.
54
Лекиия 8
Этап 1. Узнавание. Как мы знаем, транскрибируется не вся молекула ДНК,
а ее определенный участок. Фермент РНК-полимераза должен узнать, с какого
места должен начинаться синтез РНК и где он должен закончиться. Молекула
корфермента обладает определенным сродством к ДНК, поэтому она способна
присоединиться к ДНК-матрице практически в любом месте и «ехать» по ней, но
для начала специфической транскрипции она должна найти промотор и проч-
но с ним связаться. Присоединение ст-фактора ккорферменту в 10 тыс. раз
уменьшает сродство РНК-полимеразы к случайному участку ДНК и в 1000 раз
увеличивает сродство холофермента к промотору (сама по себе н-субъедини-
ца с ДНК не связывается). Холофермент узнает промотор по «неровностям
на дороге» — частично денатурированным участкам, независимо оттого, на-
ходится ли белок-репрессор па операторе, расположенном за промотором, или
нет (рис. 8.4, А, Б ). Если на операторе, перекрывающимся с промотором, есть
репрессор, то фермент не может прочно связаться с промотором. Если репрес-
сора нет, то РНК-полимераза начинает движение в направлении терминатора.
При этом в каталитическом центре инициации транскрипции (находящемся
в |3-субъсдиницс) оказывается первый транскрибируемый нуклеотид оперона
(его обозначают «+1»). Образовавшийся комплекс «открывается» — нити ДНК
отодвигаются друг от друга. Образуется транскрипционный «глазок» , в котором
нуклеотиды транскрибируемой цепи ДНК становятся доступными для спарива-
ния с мономерами — активированными нуклеотидами.
Этап 2. Инициация заключается в образовании первой фосфодиэфирной
связи между первым и последующим нуклеотидом. Синтез РНК всегда начи-
нается с пуринового нуклеотида ( АТФ или ГТФ). Он так и остается в виде три-
фосфата. Последующие нуклеотиды присоединяются к З’ -ОН-группе преды-
дущего с отщеплением остатков пирофосфорной кислоты (рис. 8.4, В ). Выде-
ляющаяся при этом энергия макроэргической связи используется для работы
PBIK-полимеразы и ее передвижения по ДНК. После инициации и полимери-
зации восьми нуклеотидов РНК ст-фактор покидает корфермент.
Этап 3. Элонгация — продолжение транскрипции, последовательное нара-
щивание цепи РНК. Присоединение каждого следующего нуклеотида сопрово-
ждается отщеплением пирофосфата. Скорость элонгации составляет пример-
но 40-50 нуклеотидов в секунду.
Для комплементарного синтеза РНК необходим разрыв водородных свя-
зей в ДНК. Работающая РНК-полимераза (корфермент) покрывает примерно
40 пар нуклеотидов (четыре витка спирали ДНК). Па участке такой длины
расплетения двойной спирали не происходит, но зато РНК-полимераза пере-
водит ДНК изБ-формы вА -форму. BA-форме двойная спираль имеет вну-
треннюю полость диаметром 0,5 нм (см. рис. 2.3). Такое положение азотистых
оснований облегчает образование комплементарных пар оснований в ходе
транскрипции. Водородные связи в ДНК при этом разрываются на небольшом
Матричные синтезы. Приниипы и этапы транскрипции, Оперон 55
О
А
В
ООО
НОРОРОРо
ононон
ооо
-
ОННОРОРОР
ОНОН01
Б
о о пирофосфат
Оо
-
ОН + НО-Р
-
О-Р
-
ОН
ОН он
ООО
HOPOPOPO
ононон
о
-
ОРо
он
Рис. 8 .4
, Этапы транскрипции
А — узнавание, стрелкой показан репрессор на операторе; Б — прочное связывание,
стрелкой показан о-фактор; В — инициация; Г— терминация: i — палиндром;
2 — синтезированная PHK; j— шпилька
участке — всего 12 пар нуклеотидов. На этом участке образуется так называ-
емая «гибридная молекула» , в которой одна нить — ДНК, а вторая — вновь
синтезированная РНК. По мере продвижения фермента вдоль молекулы ДНК
водородные связи между нуклеотидами ДНК и PPIK разрываются, нить PPIK
отделяется, а ДНК восстанавливает двойную спираль в исходной В-форме.
« Мотором» транскрипции является энергия, высвобождающаяся при отще-
плении пирофосфата от каждого рибонуклеозидтрифосфата.
Этап 4. Терминация. Сигналом для окончания транскрипции является
терминатор — особая последовательность нуклеотидов. Эта последователь-
ность содержит ГЦ-богатые «зеркальные» повторы нуклеотидов — палиндро-
мы. Достигнув терминатора, РНК-полимераза не останавливается, а продол-
жает синтезировать РНК, комплементарную палиндромной последователь-
ности нуклеотидов в терминаторе. Как только палиндром оказывается синте-
зированным, он складывается, образуя шпильку, что приводит к изменению
конформации корфермента. Такой фермент не может оставаться на ДНК, он
« сваливается» с нес вместе с синтезированной РНК. Но и с РНК он тоже «рас-
стается» , при этом его конформация восстанавливается (рис. 8.4, Г). Корфер-
56
Лекиия 8
мент соединяется с ст-фактором, образуя холофермент, готовый к синтезу но-
вой молекулы РНК.
В некоторых опсронах в терминаторе хотя и имеется палиндром, но
не ГЦ-богатый, и за образующейся в РНК шпилькой не следует легко отделя-
емая от ДНК олиго-У-последовательность. В этом случае происходит р-зави-
симая терминация. Обладающий АТФазной активностью р-белок движется
по РНК с такой же скоростью, с какой корфермент перемещается по ДНК. Тер-
минальная шпилька в РНК затормаживает РНК-полимеразу и р-белок догоня-
ет корфермент. При этом комплекс отваливается от ДНК, а a-фактор замещает
р-белок с образованием холофермента, готового к транскрипции очередного
оперона.
57
ЛЕКиИЯ 9
Генетический кол
Генетическая информация. В предыдущих лекциях мы говорили о хране-
нии и реализации генетической информации. А что же такое генетическая ин-
формация? В XX веке стало ясно, что кроме двух фундаментальных составляю-
щих Вселенной (материи и энергии) есть и третья — информация. Поэтому и не
существует одного всеобъемлющего определения информации, как нет опре-
деления материи и энергии. В разных контекстах этот термин можно опреде-
лять по-разному. Например, информацию можно определить как совокупность
сведений, зафиксированных на материальном носителе, где эти данные сохра-
няются и могут распространяться во времени и пространстве. Генетическая
информация в широком смысле этого слова представляет собой передаваемую
по наследству совокупность данных обо всех сторонах жизнедеятельности —
составе, строении, функционировании, развитии и взаимодействии, составля-
ющих живую систему молекул, клеток, органов, организмов. Это может быть
информация о первичной структуре белков или о том, какая сторона яйцеклет-
ки станет головой или хвостом зародыша, о том, станет ли клетка печеночной
или нервной, сможет ли организм прожить много лет или его жизнь ограничена
несколькими часами и так далее. Любая информация для сохранения и переда-
чи должна быть записана. Генетическая информация не является исключением.
Разная генетическая информация записывается по-разному: с помощью стро-
ения определенных молекул или с помощью распределения молекул в клетке,
органе или организме. Но в основе всех разновидностей генетической инфор-
мации и способов ее записи, хранения и передачи лежит информация о строе-
нии белков. Нередко только ее и называют генетической информацией, хотя это
не вполне верно. По несомненно, что именно информация о последовательно-
сти аминокислот в белках — наиболее общая и объемлющая все без исключения
стороны функционирования живых систем. Тот язык, которым записана эта ин-
формация, называется генетическим кодом.
Таким образом, генетический код — это система записи ( язык ) инфор-
мации о последовательности аминокислот в белках с помощью последова-
58
Лекиия 9
тельности нуклеотидов в ДНК (или РНК в случае некоторых вирусов). По-
скольку в синтезе белка непосредственное участие в качестве матрицы прини-
мает нс ДНК, а мРНК, то код записывается на языке РНК. Буквами в генетиче-
ском языке являются нуклеотиды. Языки ДНК и РНК содержат всего по четы-
ре «буквы» -нуклеотида, и отличаются эти языки всего одной буквой — в РНК
вместо тимина входит урацил, являющийся синонимом тимина (табл. 2).
Таблица 2
Генетический код *
Вторая буква в кодоне
Первая буква
в кодоне
Третья буква
в кодоне
У
ц
А
Г
Тир
Тир
Стоп
Стоп
Фен
Фен
Лей
Лей
Сер
Цис
Цис
Стоп
Трп
У
Сер
ц
У
Сер
А
Сер
Г
Лей
Лей
Лей
Лей
Про
Гис
Apr
У
Про
Гис
Apr
ц
ц
Про
Глн
Глн
Apr
А
Про
Apr
Г
Тре
Иле
Иле
Иле
Мет
(старт)
Сер
У
Асн
Асн
Лиз
Лиз
Тре
Сер
ц
Тре
Apr
А
А
Тре
Apr
Г
Вал
Вал
Вал
Вал
Ала
Ала
Ала
Ала
Гли
У
Асп
Асп
Гли
Ц
Г
Глу
Гли
А
Глу
Гли
Г
* Обозначения аминокислот: Фен — фенилаланин, Лей — лейцин,
Иле — изолейцин, Мет — метионин, Вал — валин, Сер — серин, Про — пролин,
Тре — треонин, Ала — аланин,Тир — тирозин, Гис — гистидин, Глн — глутамин,
Асн — аспарагин, Глу — глутаминовая кислота, Цис — цистеин,
Трп — триптофан,Apr — аргинин, Гли — глицин.
Закрашены два стоп-кодона, которые могут кодировать селеноцистеин
и пирролизин.
Свойства генетического кода. В каждом языке есть определенные прави-
ла грамматики. Есть они и в генетическом коде. Эти правила — свойства гене-
тического кода. Здесь следует еще раз подчеркнуть, что генетический код — это
запись только о последовательности аминокислот в белках . Гены тРНК, рРНК
Генетический код
59
и лРТ IK белки не кодируют. В них генетическая информация тоже записана
последовательностью нуклеотидов, но грамматика там другая. В ДНК (и РНК)
есть много других «записей»: сигналы начала транскрипции (промоторы) и сс
завершения (терминаторы) , сигналы начала репликации, сигналы различных
модификаций ДНК и РНК и многие другие. Это — другие языки (хотя и с теми
же буквами) с другими правилами, которые до сих пор еще не полностью рас-
шифрованы. В этой лекции мы рассмотрим правила грамматики только гене-
тического кода. Основных свойств кода восемь.
1. Триплетность. В 1954 году, через год после создания модели двойной
спирали ДНК, физик Георгий Гамов предположил, что любая аминокислота
в белке кодируется трехбуквенным «словом» — тройкой нуклеотидов. Это
предположение было сделано па « арифметической основе» . Аминокислоту
не может кодировать один нуклеотид, так как в белки включается двадцать
аминокислот (в настоящее время известно, что их 22), а нуклеотидов всего
четыре. Двух нуклеотидов для кодирования одной аминокислоты тоже недо-
статочно, так как таким способом можно закодировать лишь 16 аминокислот.
Минимальный размер «слова» в генетическом языке — три нуклеотида, так
как число сочетаний и перестановок из 4 по 3 (с повторением элементов) рав-
но 64. Такая последовательность из трех нуклеотидов , кодирующая одну ами-
нокислоту, называется триплетом или кодоном.
2. Однозначность. Основным свойством любого кода является одно-
значность. Ведь если один и тот же знак или слово имеют разные значения,
то закодировать что -либо будет очень сложно. В случае генетического кода
это означает, что каждый триплет кодирует лишь одну аминокислоту (или
является « знаком препинания»). Однако, как мы знаем, в языке бывают омо-
нимы — слова с одинаковым произношением и написанием, но разным значе-
нием. В искусственных языках (например, языках программирования) этого
не допускают, а в генетическом коде, как оказалось, это возможно. Примером
является кодон АУГ. У прокариот этот кодон, если именно с него начинается
синтез белка (« заглавная буква») , кодирует аминокислоту формилметионин
(метионин, к которому присоединен остаток муравьиной кислоты — формил).
Этот же кодон, находящийся в любом другом месте гена, кодирует метионин.
Однако есть и более поразительные исключения из правила однозначности.
В конце XX в. было обнаружено, что кроме канонических двадцати аминокис-
лот, некоторые белки включают в себя аминокислоты селеноцистеин и пирро-
лизин. Возник вопрос: а как же они кодируются, ведь для них кодонов «не хва-
тает», для всех 64 возможных кодонов значения давно известны. Оказалось,
что они кодируются триплетами УГА (селеноцистеин) и УАГ (пирролизин),
которые, как правило, являются стоп-кодонами, т. е . обозначают конец синте-
за белка. Но как клетка отличает, когда окончить трансляцию, а когда продол-
жить, вставив одну из этих аминокислот? Оказалось, что она это делает так же,
60
Лекиия 9
как и мы различаем омонимы в русском языке — по контексту. Ведь для того
чтобы отличить, например, лук-оружие от лука-растения нам нужен окружа-
ющий текст ( «натягивать тетиву лука» или « сажать лук»). Для клетки знаком
того, что данный кодон означает аминокислоту, а не «точку», является особая
последовательность нуклеотидов в нетранслируемом участке мРНК, содержа-
щая палиндром. В готовой мРНК эта область образует шпильку, которая «объ-
ясняет» клеточному аппарату синтеза белка, как именно надо понимать этот
кодон.
3. ВырожЬенность . Поскольку в белки включаются 22 аминокислоты,
а кодонов 64, оказывается, что большинство аминокислот может кодироваться
не одним, а несколькими кодонами. Только двум аминокислотам — метионину
и триптофану — соответствует по одному кодону. Другие аминокислоты могут
быть обозначены двумя, тремя, четырьмя и даже шестью кодонами. Такое свой-
ство, когда одной аминокислоте соответствует более одного обозначения в язы-
ке, называется вырожденностъю. В большинстве случаев кодоны одной амино-
кислоты различаются лишь одним третьим нуклеотидом. Три кодона никакой
аминокислоты нс кодируют, они являются «знаками препинания», обозначаю-
щими конец синтеза белка. Это кодоны УАА, УАГ и УГА, называемые стоп-сиг-
налами . В определенном контексте триплеты УАГ и УГА кодируют включение
в белок неканонических аминокислот селеноцистеина и пирролизина.
4. Наличие межгенных знаков препинания. Ген — это участок ДЫК, коди-
рующий одну полипептидную цепь или одну молекулу тРНК, рРНК или sPHK.
В конце каждого гена, кодирующего полипептид, находится, по меньшей мере,
один из трех терминирующих кодонов, или стоп-сигналов: УАА , УАГ, УГА. Они
являются сигналами окончания синтеза белка на рибосоме. Условно к знакам
препинания относится и триплет ЛУГ — первый кодон в транслируемой части
гена. Кодируя формилметионин у прокариот или метионин у эукариот, он вы-
полняет функцию «заглавной буквы в предложении».
5. Компактность , или отсутствие внутригенных знаков препинания.
Внутри гена каждый нуклеотид входит в состав триплета, кодирующего ами-
нокислоту. Из-за того что между кодонами внутри гена нет знаков препина-
ния, возможны так называемые мутации «сдвига рамки считывания». Они
возникают в случае выпадения или вставки одного или двух нуклеотидов. Та-
кие мутации приводят к полному изменению первичной структуры синтези-
руемого полипептида. При выпадении или вставке трех нуклеотидов (или ко-
личества нуклеотидов, кратного трем) сдвига рамки не происходит. При этом
в полипептиде выпадает или появляется одна аминокислота, но остальные
аминокислоты остаются неизменными. Поэтому вставка или удаление одного
нуклеотида в начальной части гена приводят к порче всего гена. В зависимо-
сти от того, с какого нуклеотида начинается дешифровка одной и той же по-
следовательности, возможно несколько рамок считывания, внутри которых
Генетический код
61
5'
3'
Ц |У|Ц А|Г|Ц Г|У|У А|Ц [Ц АЩ
Лейцин Серин Валин Треонин
5'
3'
F(0 "(3 C<0F)"0F
Серин Аланин Лейцин Пролин
5'
3'
)C)0|3(C #| |& &| |&
Глутамин
Тирозин
Аргинин
Гистидин
Рис. g .i . Рамки считывания
«тексты» различны (рис. 9.1 ). При этом одна и та же нуклеотидная последова-
тельность может кодировать три совершенно различные последовательности
аминокислот.
6. Универсальность. Генетический код един для всех живущих на Земле
существ. У всех существующих видов одни и те же триплеты кодируют оди-
наковые аминокислоты. Однако как и в человеческих языках существуют
диалекты, так и значения некоторых триплетов у разных организмов могут
несколько отличаться. Например, у одной из инфузорий кодон УГА кодирует
цистеин (или селеноцистеин) , тогда как у подавляющего большинства осталь-
ных организмов это стоп -кодон. У всех эукариот от универсального кода отли-
чается и код митохондрий. Отличия касаются значений одного-двух кодонов.
Так в митохондриях коров кодон АУА кодирует метионин, а в универсальном
изолейцип, а кодон УГА, являющийся терминирующим в упиверсаль-
коде
ном коде, в митохондриях определяет включение в белок триптофана. Генети-
ческий код митохондрий коровы и некоторых других млекопитающих являет-
ся «идеальным». Договорились называть идеальным код, в котором выполня-
ется правило вырожденноеTM квазидублетного кода. Оно гласит: «Если в двух
триплетах два первых нуклеотида совпадают, а третьи принадлежат к одному
классу (оба пурины или оба пиримидины) , то они кодируют одну и ту же ами-
62
Лекиия 9
нокислоту». Например, АГУ и АГЦ кодируют серин, а АГА и АГГ — аргинин.
Аргинин кодируется еще четырьмя кодонами ЦГУ, ЦГЦ, ЦГА и ЦГГ в соответ-
ствии с правилом.
Можно сказать, что митохондрии разных видов говорят на разных язы-
ках , но никогда — на языке клетки, в которой они находятся. По-видимому,
это позволяет им сохранять в клетке некоторую самостоятельность — они
размножаются в интерфазе между делениями клетки.
7. Помехоустойчивость. Мы знаем, что все белки могут выполнять свои
функции только тогда, когда они имеют определенную пространственную
конформацию — третичную и / или четвертичную структуру. Эти структу-
ры зависят от связей между радикалами аминокислот, входящих в этот белок.
По радикалам все аминокислоты молено разделить па четыре класса: неполяр-
ные, способные к гидрофобным взаимодействиям; полярные, образующие
водородные связи с водой; отрицательно заряженные и положительно заря-
женные, способные к электростатическим взаимодействиям. Если в результа-
те замены нуклеотида в ДНК в белке произойдет замена одной аминокислоты
на другую, принадлежащую к тому же классу, то структура белка, как правило,
меняется незначительно, что может вообще не сказаться на выполнении функ-
ции. Замены нуклеотидов, не приводящие к смене класса кодируемой амино-
кислоты, называют консервативными. Замена нуклеотида, приводящая к сме-
не класса кодируемой аминокислоты (называемая радикальной ) , сказывается
на третичной структуре белка и, как следствие, на выполнении его биологиче-
ской функции.
В каждом триплете может произойти девять однократных замен. Общее
количество возможных замен нуклеотидов в триплетах , кодирующих 20 кано-
нических аминокислот, оказывается 61 • 9 = 549. Из них 134 замены из-за вы
-
рожденноеTM кода не меняют кодируемую аминокислоту; 230 замен не меняют
класс кодируемой аминокислоты; 162 замены являются радикальными, т. е при-
водят к смене класса аминокислоты; 23 замены превращают смысловой триплет
в стоп-кодон. Таким образом, отношение числа консервативных замен к числу
радикальных будет (134 + 230) : 162 = 2,25. Эта цифра — показатель помехо-
устойчивости генетического кода. Она означает, что большая часть замен ну-
клеотидов не сказывается на третичной и четвертичной структуре белка и его
функции (помехоустойчивость современных компьютеров оценивается в 1,5).
8. Неперекрываемость . В 1956 г. Г. Гамов предлолсил вариант перекры-
вающегося кода, в котором каждый нуклеотид, начиная с третьего в гене,
входит в состав трех кодонов. Достоинством перекрывающегося кода явля-
ется сверхкомпактность и меньшая зависимость структуры белка от вставки
или удаления нуклеотида. Но у перекрывающегося кода есть и существенные
недостатки: большая зависимость структуры белка от замены нуклеотида
и ограничение на соседей. Последнее означает, что такой способ кодирования
Генетический код
63
очень сильно уменьшает возможное разнообразие белков. Например, кодон
ГГЦ обозначает аминокислоту глицин. В перекрывающемся коде следующий
кодон будет ГЦХ. Независимо от того, какой нуклеотид обозначает буква X ,
это будет аланин. Другими словами, если кодоны перекрываются, то после
глицина не может стоять никакая аминокислота, кроме аланина. Следующая
аминокислота тоже не может быть любой — в зависимости от того, какой ну-
клеотид обозначен буквой X , это будет одна из пяти аминокислот (а не из 20,
как в неперекрывающемся коде). Это означает, что перекрывающимся кодом
невозможно закодировать любую последовательность аминокислот. Когда
в 1962 г. генетический код был расшифрован, оказалось, что он является непе-
рекрывающимся, т. е. каждый нуклеотид входит в состав лишь одного кодона.
В 1976 г. была секвепирована ДНК фага (рХ174. Было известно, что ДНК
фага кодирует девять белков. Для шести из них были определены гены, рас-
полагающиеся друг за другом. Выяснилось, что у этого фага некоторые гены
частично или полностью перекрываются. Ген В полностью находится внутри
гена А, а ген Е полностью находится внутри гена D . Их инициирующие ко-
доны появляются в результате сдвига рамки считывания на один нуклеотид.
Инициирующий кодон гена J перекрывается с терминирующим кодоном гена
D в результате сдвига рамки считывания на два нуклеотида (рис. 9.2).
В митохондриях ряда видов последний нуклеотид одного гена является
первым нуклеотидом соседнего гена. Другими словами, гены иногда могут
перекрываться. Но в пределах одного гена перекрывания кодонов никогда
не бывает. У подавляю-
щего большинства про-
и эукариот не перекры -
ваются и сами гены.
Информационная
емкость ДНК. В наш век
суперкомпьютеров труд-
но удивить кого-либо
объемами хранимой ин-
формации. Попробуем
оценить объем инфор-
мации в ДНК. На Зем -
ле живет ~ 7 млрд чело-
век. У каждого человека
~ 25 тыс. генов. У всех лю-
дей ~18 • 1013 генов или
-
36-10
2
16
пар нуклеоти-
дов, которые составляют
~ 1017 кодонов. Единицей
Рис. 9 .2
.
Перекрывание генов в геноме фага (pXij4
1 — неперекрывающиеся гены;
2 — перекрывание генов
64
Лекиия 9
генетической информации в ДНК является кодон. На долю последовательно-
стей нуклеотидов, кодирующих белки , у человека приходится не более 1,5 %
ДНК. Значит, объем информации о белках в ДНК человека составляет око-
ло одного петабайта (1015 байт). Такой объем информации вполне достижим
для современных компьютеров. Какой физический объем займут разные но-
сители такого количества информации? Средняя книжная страница содержит
25 • 102 знаков. ДНК 7 • 109 сперматозоидов (содержащих информацию о 7 мил-
лиардах живущих на Земле людей) содержит информацию, равную по объему
примерно 4 -1013 книжных страниц или 13,5 миллионов DVD. 7 • 109 спермато-
зоидов — это примерно 1 мл. Их ДНК занимает менее половины миллилитра,
а вся кодирующая белки часть ДНК — в 100 раз меньше. Не случайно сейчас
ученые стремятся создать носители информации для суперкомпьютеров буду-
щего на основе синтетических ДНК-подобных молекул.
65
ЛЕКиИЯ 10
Подготовительный этап трансляиии ,
Транспортные РНК , Рибосомы
Адаптерный принцип трансляции. Как мы знаем, все признаки любого
организма , все стороны его функционирования определяются белками, вхо-
дящими в его состав. И та генетическая информация, о которой мы говорили
в предыдущем параграфе, предназначена для того, чтобы эти белки синтези-
ровать. Осуществляется это в ходе трансляции — синтеза белка по матрице
мРНК, Трансляция — это перевод генетической информации с языка нуклеоти-
дов на язык аминокислот, осуществляемый в ходе синтеза белка. Поскольку ну-
клеотиды, из которых состоит матричная РНК, и аминокислоты, составляющие
белки, — это разные по своим химическим свойствам молекулы, то матричный
принцип в ходе трансляции не может осуществляться за счет комплементарно-
сти мономеров. Трансляция отличается от остальных матричных синтезов тем,
что она идет с помощью адаптеров — своего рода переходников, которые и осу-
ществляют перевод последовательности нуклеотидов в последовательность ами-
нокислот. Этими переходниками служат транспортные РНК. Принцип их дей-
ствия заключается в том, что на одном конце конструкции, состоящей из тРНК
и аминокислотного остатка находится антикодон — триплет, комплементарный
одному из кодонов в мРНК, а на другом — та аминокислота, которая кодируется
именно этим кодоном. В результате тРНК, спаривающиеся своими антикодона-
ми с кодонами, выстраиваются в том порядке, в котором кодоны расположены
в мРНК (и, соответственно, в ДНК, с которой эта РНК была считана). И в этом
же порядке, естественно, выстраиваются аминокислоты. Соединение этих ами-
нокислот пептидными связями и дает полипептид с закодированной последо-
вательностью аминокислот. Таким образом, и в ходе трансляции выполняется
принцип комплементарноеTM, но, в отличие от синтеза нуклеиновых кислот,
через посредство адаптера — тРНК. Для того чтобы полипептид был построен
в точном соответствии с записью в мРНК, каждая транспортная РНК должна
быть безошибочно узнана и к ней присоединена «своя» аминокислота. Именно
это и составляет суть подготовительного этапа трансляции ( рекогниции).
66
Лекиия 10
Структура транспортной РНК. Для того чтобы понять, как адапте-
ры и аминокислоты «узнают» друг друга, нужно подробнее познакомить-
ся со структурой тРНК. Транспортные РНК — короткие молекулы, состоя-
щие из 75-95 нуклеотидов, имеющие и вторичную, и третичную структуру
(рис. 10.1).
А
О
Ц
3'м
А
Рис. юл. Структура транспортной РНК
А — вторичная структура; Б — третичная структура: i — антикодонная петля;
2 — ТТЦ-петля;з — D-петля; 4 — аденозин на з'- конце;5 — акцепторный стебель;
б — дополнительная (вариабельная) петля
(biochem.arizona .edu)
Вторичная структура (ее сравнивают с листом клевера) обусловлена во-
дородными связями между нуклеотидами , расположенными в разных частях
молекулы. Хотя тРНК — одноцепочечная молекула, в ней имеется четыре дву-
цепочечных участка. Один из них , называемый акцепторным стеблем, служит
местом присоединения аминокислоты. Три других называют шпильками. Они
образуются за счет палиндромов, разделенных непалиндромными последо-
вательностями, которые формируют три петли. На вершине антикодонной
петли находится антикодон — последовательность трех нуклеотидов, ком-
плементарная кодону в матричной РНК (рис. 10.1, А). Последовательность ну-
клеотидов ЦЦА на З’-конце одинакова для всех тРНК. К концевому аденозину
Подготовительный этап трансляиии. Транспортные РНК , Рибосомы 67
(А) присоединяется та аминокислота, которую переносит эта транспортная
РНК. В состав транспортных РНК входят несколько минорных нуклеотидов.
В так называемой ТЧ' Ц - петле находятся тимин (Т), обычно нс встречающийся
в РНК, и псевдоуридин (обозначается греческой буквой '1') , который отличает-
ся от уридина тем, что в нем урацил присоединен к рибозе С-гликозидной свя-
зью (в уридине связь N-гликозидная). В D -петле находится дигидроуридин.
Наличие этих минорных нуклеотидов необходимо для безошибочного узна-
вания ферментами, присоединяющими к тРНК аминокислоту, и для защиты
от действия рибонуклеаз. Рибонуклеазы не опознают молекулы, содержащие
необычные нуклеотиды, поэтому в отличие от мРНК транспортные РНК яв-
ляются долгоживущими. Между шпилькой с ТЧ'Ц - петлей и антикодоновой
шпилькой находится вариабельный район, включающий от 4 до 16 нуклеоти-
дов (рис. 10.1, А).
При образовании третичной структуры D - и Т'КЦ-петли складываются
и вся молекула изгибается, образуя третичную структуру, в проекции на пло-
скость похожую на латинскую букву L (рис. 10.1, Б). Всего может существовать
нс менее 61 разных (различающихся антикодонами) тРНК — столько, сколь-
ко существует кодирующих триплетов. У прокариот есть еще и специальная
формилметиониновая тРНК с таким же антикодоном, как и метиониновая.
Они различаются последовательностью нуклеотидов на 5’- конце и в D -петле.
Разнообразие третичных структур тРНК значительно меньше — 20 (по коли-
честву канонических аминокислот). Имеющие разные антикодоны, компле-
ментарные кодонам, кодирующим одну и ту же аминокислоту, тРНК имеют
одинаковую третичную структуру. Такие тРНК называются изоакцепторны-
ми . К ним присоединяется одна и та же аминокислота.
Рекогниция. Для того чтобы трансляция могла начаться, аминокислоты
должны быть узнаны своими тРНК и присоединены к ним. Это происходит
во время подготовительного этапа трансляции. Он называется рекогницией
( recognition — узнавание). Суть рекогниции заключается в образовании ко-
валентной связи между тРНК и соответствующей аминокислотой (рис. 10.2).
Рекогниция состоит из двух стадий. Первая стадия — активирование амино-
кислоты. Активирование представляет собой химическую реакцию присоеди-
нения аминокислоты к аденозину в составе АМФ:
аминокислота + АТФ -> аминоациладепилат + пирофосфат.
Вторая стадия рекогниции — аминоацилирование — заключается в пере-
носе аминокислоты с аминоациладенилата на аденозин на З’- конце тРНК:
аминоациладснилат + тРНК -> аминоацил -тРНК + АМФ.
68
Лекиия 10
Рис . 10.2 . Подготовительный этап трансляции
А — последовательные стадии аминоацилирования: 2 — АРСаза; 2 — АТФ;
3 — аминокислота; 4 — пирофосфат; 5 — тРНК ; 6 — АМФ; 7 — аминоацил-тРНК ;
6 — компьютерная модель комплекса глутаминовой АРСазы (голубая)
с тРНК (красная)
(arep.med.harvard.edu)
Обе стадии рекогниции осуществляются ферментом аминоацил-
тРНК-синтетазой (АРС-азой). АРС-азы — крупные молекулы, так как они
должны вместить в свои узнающие центры три другие молекулы — амино-
кислоту, АТФ и транспортную РНК. Существует 20 вариантов АРС-аз
—
столько же, сколько канонических аминокислот ( селеноцистеин образуется
из серина особыми ферментами непосредственно на специальной secrPHK).
Аминоацилирование — энергозависимый процесс, требующий расщепле-
ния АТФ. У каждой АРС-азы три центра связывания — для аминокислоты,
тРНК и АТФ. АРС-азы узнают тРНК по их третичной структуре, поэтому
изоакцепторные тРНК узнаются одной и той же АРС-азой. Существует осо-
бая тРНК, которая называется формилметиониновой тРНК. Метиониновая
АРС-аза присоединяет к ней метионин, и уже после реакции аминоацили -
рования к метионину специальным ферментом трансформилазой, который
узнает эту тРНК, присоединяется формил — остаток муравьиного альдегида.
Подготовительный этап трансляиии. Транспортные РНК , Рибосомы 69
Именно с формилметионина начинается синтез любого полипептида у бак -
терий. Таким образом, кодон АУГ играет роль заглавной буквы в кодирую-
щем полипептид участке мРНК, а формилмстионин — первой буквы в этом
полипептиде.
Каждая тРНК используется в качестве переносчика аминокислоты много-
кратно. Освободившуюся в ходе синтеза белка на рибосоме от аминокислоты
гРНК АРСаза снова связывает с такой же аминокислотой.
Структура рибосом. Собственно трансляция — синтез полипептидов
происходит на рибосомах . Рибосомы — немембранные клеточные орга-
неллы, самые мелкие, но при этом едва ли не самые сложные (рис. 10.3, В ).
Каждая рибосома состоит из двух субчастиц (большой и малой), отличаю-
щихся и рибосомпыми РНК, и белками , образующими комплексы с рРНК
(рис. 10.3 , А ). Пока рибосома не занята синтезом полипептида, она диссо-
циирована, субчастицы не агрегированы. Синтез белков осуществляют ас-
социированные рибосомы; для ассоциации субчастиц необходимы компен-
сирующие отрицательные заряды рибосомных РНК ионы Mg2+
в количестве
до 2000 на одну рибосому.
В клетке Е. coli содержится около 103—5
-
103 рибосом. Рибосомы бактерий
имеют размеры 21 х 29 нм. Для частиц такого размера принято указывать так
называемый коэффициент седиментации (константу Сведберга), обозна-
чаемый буквой S. Он зависит от молекулярной массы и от формы частицы
(широкая и плоская частица осаждается при центрифугировании медленнее,
чем компактная такой же массы ). Поэтому константа седиментации ассоци-
ированной рибосомы не равна сумме констант седиментации ее субчастиц.
Она меньше из-за компактной формы ассоциированной рибосомы. Рибосо-
мы бактерий обозначают как 70 S рибосомы. В цитоплазме эукариотических
клеток находятся 80 S рибосомы, они крупнее (22 х 32 нм) и сложнее бактери-
альных (табл. 3). Полуавтономные органоиды эукариот — митохондрии и хло-
ропласта — имеют собственный аппарат белкового синтеза и, следовательно,
собственные рибосомы. Самые мелкие рибосомы находятся в митохондриях
животных — 55 S. Рибосомы митохондрий грибов имеют промежуточные раз-
меры — 75 S . В хлоропластах высших растений рибосомы такие же, как у бак-
терий — 70 S,
В состав рибосом входят молекулы рибосомных РНК и рибосомные бел-
ки (табл. 3). Сложность структуры рибосом объясняется тем, что подавляю-
щее большинство составляющих их молекул присутствует в одном экземпля-
ре. Например, в бактериальной рибосоме только один из 31 белка большой
субчастицы присутствует в количестве четырех копий.
70
Лекиия 10
Рис. 10.3
. Строение рибосомы
А — функциональные центры рибосомы: 2 — малая субчастица; 2 — большая
субчастница;3 — акцепторный центр; 4 — донорный центр;5 — каталитический
центр; 6 — выход;Б — вторичная структура рРНК малой субчастицы бактериальной
рибосомы; В — электронно-микроскопическая фотография рибосом;
Г — компьютерная модель положения РНК и белков в составе ассоциированной
рибосомы эукариот (РНК окрашена серым, голубым и красным,
белки — фиолетовым и лиловым)
(rna.ucsc.edu)
Подготовительный этап трансляиии. Транспортные РНК , Рибосомы 71
Таблица 3
Состав рибосом про- и эукариот
Бактериальная
рибосома 70 S
Эукариотическая
рибосома 80 S
Субчастицы
50S
30S
60S
40S
РНК
5SрРНК
23 S рРНК
16 SpPHK 5 S рРНК
5,8 S рРНК
28 S рРНК
18 S рРНК
21 белок
Белки
Не менее
47 разных
белков
Не менее
33 разных
белков
31 разный
белок
Долгое время считалось, что рибосомные РНК выполняют функцию
каркаса для белков. Однако сравнительно недавно было показано, что белки
выполняют в рибосоме хотя и очень важные, но вспомогательные функции —
они стабилизируют структуру рибосомы и увеличивают эффективность ее
работы. Самое главное в работе рибосомы — реакцию транспептидации (пе-
реноса аминокислоты, принесенной тРНК, на синтезирующийся пептид) —
осуществляет 23 S рРНК большой субчастицы. Функции других рРНК также
вспомогательные — 16 S рРНК необходима для правильной установки иници-
ирующего кодона АУГ мРНК на 30 S субчастице, 5 S pPPIK — для правильной
ориентации аминоацил-тРНК на рибосоме.
Все рРНК обладают очень сложной вторичной структурой. Несмотря
на то что рРНК состоят из одной полинуклеотидной цепочки, значительная
часть молекулы представляет собой двойную спираль (рис. 10.3, Б ). В резуль-
тате 25-летней работы ученым удалось расшифровать положение каждого ато-
ма в составе рибосомы. В 2009 г. за эту работу была присуждена Нобелевская
премия. Получить наглядное представление о взаимном расположении всех
молекул в ассоциированной рибосоме оказалось возможным только с помо-
щью специальных компьютерных программ (рис. 10.3, Г).
В ассоциированной рибосоме можно различить несколько « рабочих »
центров (рис. 10.3, А ).
Р-центр — пептидильпый, донорный. В нем находится тРНК, несущая
первую аминокислоту полипептида — формилметионин у бактерий или ме-
тионин у всех остальных организмов. На последующих стадиях трансляции
к тРНК в P-центре присоединена уже синтезированная часть полипептида —
пептидил . Из этого центра формилметионин , метионин или пептидил перено-
сятся в А-цснтр.
72
Лекиия 10
A-центр — аминоацильный, акцепторный. В этот центр рибосомы посту-
пают очередные аминоацил- тРНК. В этом центре происходит акцептирование
формилмстионина, метионина или пептидила.
Е-центр — выход ( exit ). Из этого участка тРНК, освободившаяся после
передачи пептидила из P-центра в A-центр, покидает рибосому
К-центр — каталитический. В нем происходит главное событие транс-
ляции — образование очередной пептидной связи. К -центр формируется
23 S рРНК большой субчастицы рибосомы. Он катализирует перенос пепти-
дила из состава пептидил- тРНК на поступившую в A-центр очередную ами-
ноацил- тРНК. При этом образуется еще одна пептидная связь и пептидил уд-
линяется на одно звено.
73
ЛЕКиИЯ 11
Синтез белка на рибосомах
После завершения подготовительного этапа начинается собственно
трансляция — синтез белка на рибосоме. Этот процесс невозможен без несу-
щих генетическую информацию мРНК, поставляющих материал для постро-
ения полипептида аминоацил-тРНК и управляющих каждым этапом транс-
ляции белковых факторов. Как и в других матричных синтезах , в трансляции
выделяют три этапа: инициацию, элонгацию и терминацию.
Инициация трансляции у прокариот. Для того чтобы полипепептид
был синтезирован правильно, считывание должно начаться со строго опре-
деленного кодона в «РНК. У бактерий каждый цистроп начинается с так
называемой лидерной последовательности . Она является нетранслируемой,
так как не кодирует аминокислот, и нужна для того, чтобы рибосома мог-
ла узнать инициирующий кодон АУГ. Эта последовательность может быть
разного размера (до 160 нукл.) и разной первичной структуры, но обяза-
тельно содержит так называемую полипуриновую последовательность
Шайна — Дальгарно ( обычно это шесть нуклеотидов АГГАГГ). Этот участок
мРНК комплементарен участку, находящемуся на З’ - конце 16 S рРНК малой
субчастицы рибосомы. Спаривание этих участков позволяет точно устано-
вить малую субчастицу рибосомы относительно кодона АУГ (рис. 11.1). Этот
кодон находится на расстоянии 3-10 нуклеотидов от последовательности
Шайна — Дальгарно. Первым этапом трансляции и является образование
комплекса малой субчастицы с мРНК.
Взаимодействие 16 S рРНК малой субчастицы и последовательности
Шайна — Дальгарно приводит к тому, что кодон АУГ оказывается в Р-цептре,
а следующий кодон — в A-центре малой субчастицы рибосомы. По пока нет
большой субчастицы, попасть в рибосому (точнее, в малую субчастицу) может
только формилметионин-тРНК. Ее антикодон образует водородные связи с ко-
доном АУГ. Второй кодон мРНК также находится в малой субчастице, но вход
в А-цснтр закрыт белковым фактором инициации IF1, тРНК с аминокисло-
той туда попасть не может. В результате образуется инициаторный комплекс:
74
Лекиия 11
1
5'
3'
УЦЦУЦЦ
2
АГГАГГ
5'
Рис. 11.1. Последовательность Шайна — Дальгарно
1 — 16 S рРНК малой субчастиицы; 2 — лидерная последовательность мРНК
30 S субчастица рибосомы + мРНК + формилметиониновая тРНК-формилме-
тионин (рис. 11.2, 1 ) . Только после этого происходит ассоциация рибосомы,
т. е. присоединение большой субчастицы. При этом конформация 16 S рРНК
изменяется, и связь между ней и последовательностью Шайна — Дальгарно
нарушается. Это необходимо для того, чтобы рибосома могла передвигаться
по мРНК. Белковый фактор инициации IF2 в комплексе с ГТФ обеспечива -
ет взаимодействие нагруженной формилметионином тРНК (и никакой дру-
гой) с инициирующим кодоном АУГ. За узнавание и правильную установку
на 30 S субчастице инициирующего кодона отвечает фактор IP3, который по-
кидает рибосому в момент ассоциации субчастиц.
Элонгация. После того как формилметионин -тРНК заняла свое место
и присоединилась большая субчастица, A -центр ассоциированной рибосо-
мы оказывается доступным для аминоацил - тРНК. Туда входит та несущая
аминокислоту тРНК, антикодон которой соответствует кодону, следующему
за АУГ (рис. 11.2, 2). Рибосома начинает работать: формилметионин в ре-
зультате действия каталитического центра рибосомы отрывается от тРНК,
переносится в A-центр и присоединяется к аминокислоте, связанной с тРНК,
находящейся в A-центре (рис. 11.2, 3). В P-центре остается «пустая» формил -
метиониновая тРНК.
После образования пептидной связи рибосома передвигается по мРНК
на один кодон. В результате пустая формилметиониновая тРНК переходит
из Р -центра в I.
-центр и затем покидает рибосому (рис. 11.2, 4 ) . Второй кодой
мРНК вместе с тРНК, к которой теперь уже присоединен дипептид, переходит
в P-центр, а A-центр освобождается. В нем оказывается третий кодон, к кото-
рому подходит следующая аминоацил-тРНК с соответствующим антикодоном.
Теперь в P-центре отрывается дипептид, переносится в A-центр и соединяется
с третьей аминоацил -тРНК (рис. 11.2, 5). Удлинение полипсптидной цепочки
так и происходит — рибосома передвигается на один кодон, пептидил- тРНК
Синтез белка на рибосомах
75
Рис. 11.2 . Синтез белка на рибосоме .
Последовательные стадии синтеза полипептида
с растущим полипептидом на конце оказывается в Р-центре, в A-центр попада-
ет следующий триплет, напротив которого встает очередная аминоацил-тРНК.
Предыдущая тРНК, освобожденная от пептидила, переходит в Е-центр и по-
кидает рибосому.
Любая (кроме формилметиониновой) аминоацил-тРНК может попасть
в A-центр ассоциированной рибосомы только в комплексе с белковым факто-
ром элонгации EF-Tu и ГТФ. При декодировании, т. е. комплементарном взаи-
модействии антикодона с кодоном, ГТФ гидролизуется и выполнивший свою
функцию Ер-Ти уходит за следующей аминоацил -тРНК. За транслокацию,
т. е. перемещение, пептидил-тРНК и соответствующего кодона из А -центра
в P-центр отвечает фактор EF-G в комплексе с ГТФ.
Терминация. Когда в A-центр на малой субчастице попадает стоп-кодон,
то А центр ассоциированной рибосомы остается пустым, так как не существу-
ет тРПК с таким антикодоном (рис. 1 Е 2, б). Для того чтобы было возможно
завершить процесс синтеза полипептида, в A-центр приходит специальный
белок RF, называемый рилизинг-фактором (от release — освобождать). Он за-
нимает место аминоацил-тРНК. В P-центре все происходит, как и раньше —
полипептид отрывается от тРНК, переносится в А-цснтр, но присоединиться
к рилизинг -фактору он не может. Поэтому он просто покидает рибосому. Ри-
76
Лекиия 11
босома диссоциирует, и малая субчастица снова соединяется с лидерной по-
следовательностью в этой же молекуле мРНК (если она полицистронна) или
в другой мРНК.
Все синтезируемые полипептиды бактерий (и митохондрий эукариот)
HaN-конце несут формилметионин. Из всех полипептидов, синтезирован-
ных бактериальной клеткой, 80 % начинается с метионина, который образу-
ется в результате отщепления формильного радикала от формилметионина.
От 20 % полипептидов отщепляется и метионин.
Инициация трансляции у эукариот. Этапы элонгации и терминации
трансляции у про- и эукариот проходят практически одинаково. Несколько
отличаются лишь белковые факторы , управляющие процессом синтеза белка
па этих этапах . Инициация же у эукариот значительно усложнена по сравне-
нию с прокариотами. Связано это в первую очередь с тем, что в ядре клетки
образуются про-мРНК, которые «созревают» до мРНК путем модификации
5’-конца (100 % молекул), наращиванием полиА-«хвоста » на З’-конце (более
95 % молекул) и сплайсинга (более 85 % молекул мРНК). (О деталях созрева-
ния, или процессинга, будет рассказано в лекциях 13 и 14.) Все зрелые мРНК
на 5’-конце имеют специфическую структуру, называемую кэпом (от англ.
cap — колпачок, шапочка). С кэпом связывается белковый фактор инициации
трансляции е1Б4Е и обеспечивает образование комплекса мРНК с 40 S субча-
стицей рибосомы в цитоплазме клетки (рис. 11.3). 40 S субчастица движется
вдоль мРНК, сканируя ее, до встречи с инициирующим кодоном АУГ. В от-
личие от полицистронных прокариотических мРНК эукариот моноцистрон-
ны и в нетранслируемом районе не содержат последовательности Шайна —
Дальгарно. С инициирующим кодоном спаривается особая тРНК, несущая
метионин, которая поступает на 40 S субчастицу в виде тройного комплекса
РАВР РАВР
АААААААААА
мРНК
Рис. 11. j . Инциация трансляции у эукариот
Синтез белка на рибосомах
77
с eIF2 и ГТФ. На последней стадии инициации белковый фактор eIF5 в ком-
плексе с ГТФ обеспечивает ассоциацию субчастиц с образованием 80 S рибо-
сомы, на которой и начинается синтез полипептида.
Если на З’-конце мРНК имеется полиА-хвост (аэто более 95 % всехмРНК),
то он по мере наращивания покрывается полиА -связывающим белком РАВР
(от англ. polyA binding protein ). К этому белку имеет сродство фактор e!F4G,
который ускоряет образование иницииторного комплекса копированного
5’-конца тРНК с 40 S субчастицей. С каждым актом трансляции полиА-хвост
укорачивается: существует корреляция между длиной хвоста и числом иници-
ированных синтезов идентичных полипептидных молекул. Не полиаденили-
рованные мРНК транслируются лишь один раз.
78
ЛЕКиИЯ 12
Регуляиия синтеза белка у прокариот
Как мы уже знаем, все процессы жизнедеятельности любого организ-
ма определяются тем, какие белки, когда и в каком количестве производятся
клетками. Все эти параметры постоянно меняются в зависимости от потреб-
ностей организма. Это означает, что все процессы, связанные с синтезом бел-
ков , должны регулироваться. Они и регулируются, причем на разных уровнях :
на уровне транскрипции, на уровне трансляции, на уровне посттрансляцион-
ной модификации и разрушения белков. Регуляторные системы клетки очень
сложны и разнообразны. Мы познакомимся только с некоторыми.
Регуляция синтеза белка у прокариот. У бактерий гены разных фермен-
тов, участвующих в одной цепи биохимических реакций, объединены в один
оперон, имеющий один промотор. Многие гены являются конститутивными;
они экспрессируются, т. е. транскрибируются и транслируются, постоянно.
Например, у бактерии Е. coli ферменты метаболизма глюкозы кодируются ге-
нами, находящимися в нескольких постоянно транскрибируемых оперонах .
Однако количество мРНК, считанных с разных оперонов, может быть раз-
личным. Это зависит от « силы» промоторов. К одним промоторам сродство
РНК-полимеразы может быть большим, чем к другим , с ними за единицу вре-
мени связывается и начинает транскрипцию большее количество молекул хо-
лофермента.
Большая часть прокариотических генов объединена в регулируемых опе-
ронах . Бактериям необходимо быстро отвечать на изменения в окружающей
среде. Их выживаемость зависит от способности переключать метаболизм
с одного субстрата на другой, поскольку в условиях их обитания поступление
питательных веществ может постоянно меняться. Бактерии не синтезируют
ферменты того или иного метаболического пути в отсутствие соответствую-
щего субстрата, но способны в любое время быстро начать их синтезировать,
если субстрат появится. Наиболее экономично регулировать синтез фер-
ментов в самом начале пути — во время процесса считывания информации
с ДНК, т. е. транскрипции. Работа оперонов регулируется путем индукции
Регуляиия синтеза белка у прокариот
79
(включения) или репрессии (подавления) транскрипции, которые могут быть
как негативной (с участием «выключателя») , так и позитивной (с участием
« включателя» ).
Негативная индукция. Так называемый /яс-оперон Е. coli содержит три
гена, отвечающие за образование белков, участвующих в переносе в клетку ди-
сахарида лактозы и в ее расщеплении. Белок-репрессор, регулирующий работу
/яс-оперона, кодируется в конститутивном гене другого оперона, не имеющего
оператора. Поэтому он синтезируется в клетке постоянно. В отсутствие суб-
страта (лактозы), /яс-оперон выключен (рис. 12.1, А). Как только лактозапояв-
ляется в среде и попадает в клетку, две ее молекулы соединяются с белком-ре-
А
1
3'
5'
_
jf транскрипции
«
*\2
нет
транскрипции нет
5’
транскрипция
транскрипция
^
_
3
3’
транскрипция
транскрипция
транскрипции нет
4
3'
транскрипции нет
Рис. 12.1. Регуляции транскрипции у прокариот
А — негативная индукция /ас-оперона Е . coli: i — РНК
-
полимераза; 2 — белок-
репрессор;з — лактоза, 4 — неактивный репрессор; Б — позитивная индукция
ara-оперона : 2 — РНК
-
полимераза; 2 — белок-репрессор;3 — арабиноза;
4 — белок-активатор; В — позитивная репрессия синтеза рибофлавина у В. subtilis :
1—РНК
-полимераза; 2 — белок-активатор;3 — рибофлавин; Г — негативная
репрессия frp-оперона : i — РНК
-
полимераза; 2 — а порепрессор;3 — триптофан;
4 — активный репрессор
80
Лекиия 12
прессором, изменяют его конформацию, и он отсоединяется от оператора. Тут
же начинается транскрипция lac-оперона и трансляция мРНК. Одним из об-
разующихся белков является пермеаза, избирательно переносящая лактозу
в клетку через плазмалемму, два других белка — ферменты, расщепляющие
лактозу на глюкозу и галактозу, а затем превращающие галактозу в конечный
продукт. Когда вся лактоза переработана, очередная порция репрессора, сво-
бодного от лактозы, выключает lac-оперон. Эта схема регуляции называется
негативной, потому что контролирующим транскрипцию элементом является
негативный фактор, «выключатель» — белок-репрессор. Индукция происхо-
дит при потере сродства белка- репрессора к оператору.
Позитивная индукция. Другой оперон кишечной палочки, содержащий
три цистропа, кодирующие ферменты, расщепляющие сахар арабипозу, регу-
лируется с помощью позитивной индукции (рис. 12.1, Б). В отсутствие араби-
нозы ягд -оперон не работает, так как белок -репрессор связан с оператором.
Взаимодействие попавшей в клетку арабинозы с белком -репрессором превра -
щает его в активатор, облегчающий посадку РНК-полимеразы на промотор.
Эта схема регуляции называется позитивной индукцией, поскольку контроли-
рующий элемент — белок- активатор — «включает» работу оперона.
Более сложный вариант позитивной индукции наблюдается при регуля-
ции рассмотренного выше lac-оперона. Функцию активатора выполняет ком-
плекс белка САР (catabolite activator protein ) с цАМФ. Количество цАМФ об-
ратно пропорционально количеству глюкозы в клетке. При дефиците глюкозы
активатор ускоряет посадку холофермента на промотор /ас-он срои а в 50 раз.
Глюкоза, образующаяся при расщеплении лактозы, снижает концентрацию
цАМФ и тем самым понижает степень активирования /ас-оперона, но не вы-
ключает его. Лишь отсутствие в клетке лактозы приводит к прекращению
транскрипции по схеме негативной индукции: белок -репрессор перекрывает
дорогу РНК-полимеразе.
Позитивная репрессия. Третий тип регуляции — позитивную репрессию —
рассмотрим на примере регуляции транскрипции оперона синтеза рибофлави-
на у другой бактерии — Bacilus subtilis. В опероне содержатся гены ферментов,
участвующих в синтезе рибофлавина. Позитивная репрессия так называется
потому, что в ней участвует белок-активатор, а сама регуляция заключается
в его инактивации. Она противоположна позитивной индукции. Существует бе-
лок -активатор, обеспечивающий посадку РНК-полимеразы на промотор. Обыч-
но оперон открыт, так как рибофлавин нужен постоянно. По синтезироваться
его должно столько молекул, сколько в данный момент нужно клетке. Лишняя
молекула рибофлавина взаимодействует с белком-активатором, и он теряет спо-
собность ускорять посадку РНК-полимеразы на промотор (рис. 12.1, В).
Негативная репрессия используется клетками Е. coli для регуляции ра-
боты оперона, отвечающего за синтез аминокислоты триптофана. Негативная
Регуляиия синтеза белка у прокариот
81
репрессия так называется потому, что есть бедок- репрессор, а сама регуляция
заключается в «выключении» работающего оперона. В этом опероне имеет -
ся пять цистронов, которые кодируют ферменты последовательной цепи ре-
акций синтеза триптофана. Обычно оперон включен. Белок- репрессор есть,
но он неактивен, так как находится в форме так называемого апорепрессора.
В этой форме он не способен садиться на оператор. Клетке нужно опреде-
ленное количество молекул триптофана. Лишняя молекула взаимодействует
с апорепрессором. Он меняет конформацию, связывается с оператором, вло-
женным в промотор, и не позволяет холоферменту узнать промотор и начать
синтез мРНК (рис. 12.1 , Г).
Аттенуация. Для экономии пластических и энергетических ресурсов
клетки транскрипция trp-оперона может быть прервана как только концен-
трация триптофана достигает уровня, позволяющего синтезировать так на-
зываемый лидерный пептид. Этот 14-членный пептид содержит два остатка
триптофана (что намного больше содержания триптофана в среднем белке).
Он закодирован в участке 1 лидерной области, содержащей еще три участка,
способные спариваться. Участок 2 комплементарен участкам 1 и 3, участок
3 комплементарен участкам 2 и 4 (рис. 12.2). Когда РНК-полимераза уже синте-
зировала участок 1,по нему начинает двигаться рибосома, и если из-за отсут-
ствия триптофана образование лидерного пептида невозможно, то она застре-
вает на этом участке. Образовавшиеся за это время участки 2 и 3 спариваются,
что исключает возможность образования шпильки 3-4 , которая способна оста-
новить движение корфермента. Эту ГЦ-богатую шпильку, за которой следует
олигоУ-последовательность, называют аттенуатором (ослабителем). Атте-
нуация (прерывание транскрипции) происходит в том случае, когда рибосома,
синтезирующая лидерный пептид при достаточной концентрации триптофа-
на, сдвигается на участок 2 и мешает ему спариваться с участком 3. Шпилька
Рис. 12.2 . Аттенуация trp-оперона Е. coli
А — лидерная последовательность; Б — продолжение синтеза РНК;
В — прерывание синтеза РНК
82
Лекиия 12
3-4 образуется и терминирует транскрипцию. Лидерный пептид не выполняет
никакой биологической функции, важен сам факт его образования. Это сигнал
к выключению триптофанового оперона.
Аттенуация используется для регуляции экспрессии многих генов и опе-
ронов как у Е. coli , так и других организмов. Работа некоторых оперонов ре-
гулируется исключительно с помощью аттенуации. Так например, his-оперон
содержит девять цистронов, кодирующих ферменты биохимической цепи
синтеза аминокислоты гистидина. Если образование 15-членного лидерного
пептида, содержащего шесть гистидинов, возможно, то корфермент сходит
с дистанции, не доходя до первого цистрона, прекращая синтез РНК. 15-член-
ный пептид, обуславливающий абортивную транскрипцию фенилаланиново-
го оперона, содержит семь фенилаланинов.
Одновременная транскрипция и трансляция. В отличие от эукариот,
у которых транскрипция происходит в ядре, а трансляция — в цитоплазме,
у прокариот оба процесса происходят в одном и том же месте. Как уже говори-
лось, прокариоты должны оперативно реагировать на любые изменения окру-
жающей среды , в первую очередь на появление или исчезновение тех или иных
питательных веществ. Поэтому когда определенный оперон включается, т. е.
начинается транскрипция, клетка не ждет, пока молекула мРНК будет полно-
стью синтезирована, а начинает трансляцию сразу же, как только размер син-
тезированного участка РНК будет достаточен для посадки рибосомы. По мере
продвижения РНК-полимеразы по ДНК и удлинения молекулы мРНК рибосо-
ма также продвигается, освобождая 5’-конец молекулы, куда может сесть но-
вая рибосома . Чем дальше продвигается полимераза по оперону, тем длиннее
оказывается молекула РНК, тем больше на ней ведущих трансляцию рибосом.
Такая структура
сом напей называется полисомой . Каждый оперон одновременно транскри-
бируется несколькими РНК-полимеразами. Из каждой молекулы корфермен-
та «свисает» полисома , которая тем длиннее, чем дальше от промотора про-
двинулась РНК-полимераза (рис. 12.3).
Для того чтобы синтез белка прекратился, когда потребность в нем ми -
нует, прекращения транскрипции недостаточно, должна быть ликвидиро-
вана матрица мРНК, чтобы рибосомы не имели возможности продолжать
трансляцию. Другими словами, мРНК должна не только синтезироваться
в клетке, по и разрушаться — ведь без баланса процессов синтеза и разруше-
ния молекул невозможна тонкая регулировка процессов жизнедеятельности.
Разрушение РНК происходит в результате действия РНКазы, фермента, « от-
кусывающего» по одному нуклеотиду с 5’- конца. Пока конец занят рибосо-
мой, мРНК недоступна для действия этого фермента, но если не происходит
посадки новой рибосомы на освободившийся конец, он начинает разрушать-
ся РНКазой.
мРНК и много (иногда несколько десятков) рибо-
нить
Регуляиия синтеза белка у прокариот
83
В результате ока-
зывается, что неред-
ко РНК-полимсраза
еще не дошла до тер-
минатора в опероне,
рибосомы еще не за-
кончили синтез зако-
дированного
в гене
белка, а части мРНК,
соответствующей на-
чалу гена, уже нет. Это
позволяет синтезиро-
вать столько молекул белка, сколько нужно клетке, не тратя ресурсы на про-
изводство лишних молекул. Таким образом, транскрипция, трансляция и раз-
рушение мРНК у прокариот не разобщены во времени и пространстве. Это
и позволяет им быстро реагировать на изменяющиеся условия среды.
А
,
'V
Рис. 12.3
. Одновременная транскрипция
и трансляция в бактериальной клетке
1— ДНК ;2 — полисомы
(изображение с сайта users.rcn.com)
84
ЛЕКиИЯ 13
Транскрипиия и созревание РНК у эукариот
Особенности транскрипции у эукариот. В отличие от прокариот, у кото-
рых все виды РНК синтезируются одной и той же РНК-полимеразой, эукарио-
ты имеют в ядре три разные полимеразы , специализирующиеся на синтезе раз-
личных видов РНК. РНК-полимераза I синтезирует все рРНК (кроме 5 S рРНК);
РНК-полимераза II — все мРНК и некоторые sPHK; РНК-полимераза III все
тРНК, 5 S рРНК и некоторые sPHK. PPIK -полимеразы различаются количе-
ством субъединиц, их аминокислотным составом и зависимостью от катионов
магния и марганца. Для РНК-полимераз I и III оптимальное для работы соот-
ношение [Mn2+] / [Mg2+] = 2. Для РНК-полимеразы II [Mn2+] / [Mg2+] = 5. Наи-
более яркое различие — чувствительность к а -аманитину (токсину бледной
поганки). Он полностью подавляет работу РНК-полимеразы II в концентра-
ции 10 8 М и РНК-полимеразы III ( в концентрации КИМ), РНК -полимераза
I нечувствительна к этому токсину.
Помимо ядерных РНК-полимераз у эукариот есть еще РНК-полимеразы
хлоропластов и митохондрий. Они кодируются в ядре, а не в соответствующих
органеллах . В органеллах образуются свои тРНК, рРНК и рибосомные белки.
У эукариот в клеточном ядре единицей транскрипции является отдель-
ный ген (в митохондриях гены организованы в опероны, как у прокариот).
Гены эукариот не имеют операторов. Промоторы у них организованы по-дру-
гому, не так, как у прокариот. Перед генами на расстоянии 25 пар нуклеотидов
до первого транскрибируемого нуклеотида (стартовой точки +1) находится
последовательность ГАГА, так называемый ТАТА-бокс. Его позиция определя-
ет точку инициации транскрипции. На расстоянии 75 и 125 пар нуклеотидов
располагаются ЦЦААТ-мотивы , которые не являются абсолютно необходи-
мыми , но присутствуют в промоторах большинства генов (рис. 13.1 , А). Такой
большой участок ДНК РНК-полимеразой не покрывается, поэтому установка
полимеразы осуществляется с помощью специальных белков — транскрип-
ционных факторов ( TF). И ТАТА-бокс и ЦЦААТ-мотивы опознаются своими
белками, которые взаимодействуют друг с другом и с основными фактора-
Транскрипиия и созревание РНК у эукариот
85
Рис. 13.1
. Транскрипция у эукариот
А — единица транскрипции:i— ген; 2 — ТАТА -бокс;
3 — ЦЦААТ-мотив; 4 — модули энхансера; Б — транскрип-
ционный комплекс : i — РНК
-
полимераза II; 2 — основные
факторы транскрипции;3 — TF//D; 4 — транскрипционные
факторы
ми транскрипции , абсолютно необходимыми для посадки РНК-полимера-
зы на промотор и формирования инициаторного комплекса транскрипции.
В отличие от прокариотической РНК-полимеразы эукариотические фермен-
ты узнают не промотор, а комплекс основных факторов транскрипции с ДНК
в районе стартовой точки. Для каждой из РНК-полимераз существует свой на-
бор основных транскрипционных факторов, например для РНК-полимеразы
II — TFIID, узнающий ТАТА-бокс; TFIIB, служащий мостом между ферментом
и другими TF инициаторного комплекса; TFIIH, обладающий способностью
плавить ДНК в районе инициации транскрипции.
Регуляция транскрипции у эукариот. Операторов в эукариотических ге-
нах нет, а регуляция экспрессии генов осуществляется с помощью ТЕ взаимо-
действующих с энхансерами.
Энхансеры — это не кодирующие белки нуклеотидные последовательно-
сти в ДНК , с которыми взаимодействуют транскрипционные факторы, уси-
ливающие транскрипцию.
86
Лекиия 13
Энхансеры не представляют собой непрерывных Последовательностей
нуклеотидов. Существуют так называемые модули — отдельные части энхансе-
ров. Одинаковые модули могут встречаться в разных энхансерах , но для каж-
дого энхансера набор модулей уникален. Модули — это короткие последова-
тельности, не более двух витков спирали (20 п. н.) , которые могут находиться
перед, за и даже внутри гена (рис. 13.1, А ). Отдельные модули могут распола-
гаться на расстоянии нескольких тысяч пар нуклеотидов от регулируемого
гена. С каждым модулем связывается свой ТГ. Транскрипционные факторы
имеют сродство друг к другу и к основным белковым факторам транскрипции.
Сближаясь при изгибании ДНК, они активируют инициаторный комплекс
(рис. 13.1, Б). Инициаторный комплекс — это агрегат РНК-полимеразы с ос-
новными белковыми факторами транскрипции. Инициация транскрипции —
это начало синтеза РНК полимеразой в результате множества белок-белко-
вых взаимодействий между транскрипционными факторами, связавшимися
с промотором и модулями энхансера.
Некоторые ТБ, называемые рецепторами стероидных гормонов, синтези-
руются на рибосомах в цитоплазме клетки , а войти в ядро и выступить в каче-
стве активаторов могут только в комплексе с гормоном. Стероидные гормоны
беспрепятственно попадают в клетку через плазмалемму. Так, например, жен-
ский половой гормон эстрадиол активирует экспрессию группы генов, «мол-
чащих » у мужчин. Мужской половой гормон тестостерон включает другие
гены, в том числе и те, в которых закодированы TF, необходимые для активи-
рования транскрипции генов, непосредственно гормонами не регулируемых .
Другие ТР образуются или активируются только в клетках -мишенях белковых
гормонов (не способных пройти в клетку), действующих , например, через аде-
нилат -циклазную систему. Разные гормоны активируют экспрессию различ-
ных генов через посредников, среди которых ключевыми являются транскрип-
ционные факторы.
Кроме энхансеров существуют и сайленсеры — ослабители. Это нукле-
отидные последовательности, с которыми связываются белки -репрессоры,
которые не активируют, а подавляют образование инициаторного комплекса
транскрипции.
Образование рибосом у эукариот. В некоторых случаях описанных спо-
собов регуляции синтеза белка оказывается недостаточно. Например, эукари-
отической клетке нужно огромггое количество рибосом — сотгги тысяч, а ино-
гда и миллионы. Даже самая интенсивная транскрипция одного гена не может
обеспечить такого количества молекул рРНК. Поэтому в данном случае ис-
пользуется другой «метод» — увеличение количества одинаковых генов в од-
ной клетке. Гены рибосомных РНК присутствуют в количестве от 10 до 10s ко-
пий в клетках разных видов эукариот. Например, у человека в каждой клетке
находится около 200 копий генов, в которых закодированы рРНК. Все рибо-
Транскрипиия и созревание РНК у эукариот
87
сомные гены (кроме генов 5 S рибосомной РНК) расположены группами один
за другим , а эти группы, называемые кластерами, многократно повторяются
в хромосомах . В световой микроскоп можно видеть ядрышки — места синтеза
рибосомных РНК и образования субчастиц рибосом (рис. 13.2, А). Ядрышки
представляют собой сближенные кластеры рибосомных генов , находящиеся
в разных хромосомах . Плотная структура ядрышек образована большим ко-
личеством продуктов рибосомных генов — рРНК и готовых субчастиц рибо-
сом. Ядрышек в клетке может быть одно или несколько. Группа расположен-
ных рядом генов рРНК называется ядрышковым организатором.
На электронно- микроскопи -
ческих
фотографиях
транскри-
бирующихся генов рибосомной
РНК видна картина, напомина-
ющая « рождественскую елочку»
(рис. 13.2, Б). « Ствол елочки» —
это молекула ДНК. РНК-полиме-
раза движется от «верхушки елоч-
ки» к ее основанию. Каждая «вет-
ка елочки» — это одна молекула
транскрипта, синтезируемая одной
РНК-полимеразой. Чем дальше
от «вершины», тем длиннее «вет-
ка». На « ветках » «висят» рибосо-
мные белки. Для рибосомных бел -
ков существуют свои гены. Синте-
зируемые на них мРНК поступают
на готовые рибосомы в цитоплаз-
му, где синтезируются рибосом-
ные белки для новых рибосом. Эти
вновь синтезированные рибосом-
ные белки поступают в ядро и « за-
путываясь в ветвях елки», соеди-
няются с образующейся рРНК. Так
формируются рибосомные субча-
стицы. Одновременно в эукарио-
тическом ядре находятся тысячи
субчастиц рибосом.
Процессинг у эукариот. Изменения, происходящие с РНК после транс-
крипции, такие как разрезание эндонуклеазами, модификации 5’- и З’-кон-
цов, сплайсинг и редактирование называют процессингом или « созреванием»
РНК. Процессинг рибосомных РНК у эукариот принципиально не отличается
Рис. 13.2
. Транскрипция генов рРНК
А — клетка в световом микроскопе:
1 — ядро; 2 — ядрышко;
Б — электронно-микроскопическая
фотография: 1— ДНК ; 2 — транскрипты
РНК ;з — рибосомные белки; 4 — начало
транскрипции;5 — конец транскрипции
(изображение с сайтов cell-wars.blogspot .
com, stonybrookmedicalcenter.org)
88
Лекиия 13
от такового у прокариот и заключается в том, что из первичного транскрип-
та — гигантской молекулы так называемой 45 S про-рРНК — ферменты (эндо-
и экзонуклсазы) «выкраивают» зрелые молекулы рРНК. Рибосомныс белки,
поступающие в ядро, соединяются с рРНК, входящей в состав еще только ра-
стущего первичного транскрипта, а разрезание его происходит после того, как
транскрипция закончится.
Процессинг мРНК у эукариот очень сложен и состоит из нескольких
этапов — кепирования, полиаденилирования, сплайсинга и редактирования.
Все стадии процессинга мРНК проходят в РНП -частицах (рибонуклеопро-
теидных комплексах ). По мере синтеза про-мРНК , она сразу же образует
комплексы с ядерными белками — информоферами . Поэтому мРНК никогда
не бывает свободной от белков. На всем пути следования от ДНК, по кото-
рой она синтезируется, до завершения трансляции на рибосоме мРНК защи-
щена от нуклеаз. Кроме того, белки придают ей необходимую конформацию.
И в ядерные, и в цитоплазматические комплексы (информосомы) мРНК с бел-
ками входят так называемые малые РНК — sPHK (от англ , small — маленький).
В составе информосом мРНК может жить от нескольких минут до нескольких
дней , не подвергаясь действию нуклеаз.
Кепирование . Кепирование означает «надевание шапочки». Шапочка
(англ , cap ) представляет собой метилированный ГТФ, присоединенный в не-
обычной позиции 5’-5’ и две метилированные рибозы в первых двух нуклео-
тидах мРНК. Кепируются мРНК еще до завершения транскрипции. По мере
образования про-мРНК (еще до 30-го нуклеотида), к 5’-концу, несущему пу-
ринтрифосфат, присоединяется гуанин, после чего происходит метилиро-
вание (рис. 13.3, Л). Кепируются все матричные РНК, синтезируемые в ядре
Б
/2
1
ААУААА
ононон
II
I3'
5'
рOPор-о
—
ГТ;У/:Т:Т:1 ГППТИ 11
5'
3'
А
снэ
Рис. 13.3
. Процессинг мРНК у эукариот
А — кепирование; Б — полнаденилирование: i — сигнал полиаденилирования;
2 — место разрезания эндонуклеазой
Транскрипиия и созревание РНК у эукариот
89
клетки. « Шапочка» защищает 5’
-конец мРНК от действия экзонуклеаз (фер-
ментов, отщепляющих по одному нуклеотиду от конца нуклеиновых кислот)
и помогает взаимодействию мРНК с рибосомой. За счет се узнавания cap-свя-
зывающими белками происходит правильная установка мРНК на рибосоме.
У прокариот за это отвечает последовательность Шайна — Дальгарно, кото-
рой у эукариот нет.
Полиаденилирование . В большинстве генов эукариот в конце гена нахо-
дится так называемый сигнал полиаЬенилирования. В транскрибированной
с гена мРНК он представляет собой последовательность нуклеотидов ААУА-
АА. Когда синтез про-мРНК завершен, то на расстоянии примерно 20 нуклео-
тидов в направлении к З’-концу от последовательности 5’-ААУААА -3’ проис-
ходит разрезание молекулы специфической эндонуклеазой (ферментом, разре-
зающим молекулы нуклеиновых кислот на части) и к новому З’-концу без ис-
пользования матрицы присоединяется от 30 до 300 адениловых нуклеотидов
(рис. 13.3, Б ) . Делает это полиА -синтетаза безматрично.
Каждый вид мРНК имеет «поли-А хвост » определенной длины. Он защи-
щает З’- консц от гидролиза, так как покрыт полиА-связывающими белками
(РАВР). В значительной степени время жизни мРНК коррелирует с длиной
полиА-хвоста. Полиаденилируется более 95 % мРНК. Матричные РНК неко-
торых генов не полиаденилируются. Такие мРНК живут несколько минут, на-
пример, гистоновые мРНК, тогда как полиаденилированные — несколько ча-
сов или даже дней.
Сплайсинг — вырезание копий интронов и сшивание копий экзонов будез
рассмотрен в следующей лекции.
Редактирование . Редактирование — это изменение генетической инфор-
мации на уровне мРНК. Открыто это явление было при изучении экспрессии
генов трипаносомы.
Трипаносома — одноклеточный паразит, вызывающий тяжелые, часто
смертельные заболевания человека и животных . У трипаносом сложный путь
индивидульного развития, включающий смену хозяев — теплокровных (мле-
копитающих и птиц) и насекомых . В клетке трипаносомы есть митохондрии
и ферменты окислительного фосфорилирования. Один из ключевых фермен-
тов этого процесса — цитохромоксидаза. Это белок с четвертичной структу-
рой, состоящий из трех разных субъединиц. Когда трипаносома живет в те-
плокровных млекопитающих , ей достаточно молекул АТФ, образующихся
в процессе гликолиза. При этом синтезируются только две субъединицы ци-
тохромоксидазы, и фермент не работает. Насекомые-переносчики, промежу-
точные хозяева трипаносомы, холоднокровны, поэтому трипаносома нужда-
ется в окислительном фосфорилировании для получения большого количе-
ства молекул АТФ. Следовательно, когда трипаносома находится в организме
насекомого, у нее синтезируются все три субъединицы фермента. В геноме
90
Лекиия 13
трипаносомы есть только два гена для двух разных субъединиц. В мРНК одно-
го из них происходит разрезание и встраивание четырех уридинов ( на неболь-
шом расстоянии друг от друга, но не подряд) (рис. 13.4). Происходит сдвиг
рамки считывания, и отредактированная мРНК кодирует совершенно другой,
новый полипептид — третью субъединицу цитохромоксидазы.
••••(ГУА)С
~
ГАГ
~
ХААЦX
'
TjyF'
XГУА )•••
нередактированная мРНК
последовател ьность
аминокислот
вал
глу
асн
леи
вал
Редактирование
....( # %"03 00F
^
FC3# 3C0 )...
""""
(3C0 X ГАВХ
~
г 1у|У1 ХАЙА
~
ХЦЦуX
ггу )• • • • редактированная мРНК
последовательность
аминокислот
вал
асп
иле
про
гли
вал
Рис. 13.4
.
Редактирование мРНК у трипаносомы
Еще несколько лет назад редактирование мРНК считалось «экзотикой »,
свойственной только трипаносомам. Сейчас установлено, что редактирова-
ние широко распространено среди эукариот. Редактирование осуществляется
не только с помощью вставки уридина. Встречается и вырезание отдельных
нуклеотидов, а также их химическая модификация. Например, дезаминиро-
вание цитозина превращает его в урацил, а дезаминирование аденина дает
гипоксантин, способный образовывать комплементарную пару не с тимином,
а с цитозином. Так, в печени человека кодон
2153 в гене аполипопротеина
ЦАА кодирует глутамин. А в клетках тонкого кишечника при дезаминирова-
нии цитозина возникает терминирующий кодон УАА и образуется укорочен-
ная копия этого белка.
Редактируются не только мРНК, но и некоторые транспортные, рибосом-
ные и регуляторные малые РНК.
91
ЛЕКиИЯ 14
«Разорванные» гены и сплайсинг
После того как была установлена и доказана генетическая роль ДНК,
определения гена менялись несколько раз. Первоначальное определение «один
ген — один признак» оказалось слишком расплывчатым и, в общем случае,
неверным, так как за развитие одного признака может отвечать несколько ге-
нов, а один ген может оказывать влияние на развитие нескольких разных при-
знаков. Определение «один ген — один фермент» также оказалось неточным,
так как очень многие ферменты — белки с четвертичной структурой, и поэ-
тому являются продуктом нескольких разных генов. А после нахождения не-
транслируемых генов, таких как гены транспортных или рибосомных РНК,
а также открытия альтернативного сплайсинга матричных РНК, определение
« один ген — одна полипептидная цепь» также устарело. Ген можно определить
как участок ДНК, по которому образуется функциональная молекула РНК
( .м , р , от, s). Пре-мРНК может подвергаться альтернативному сплайсингу и ре-
дактированию, благодаря чему возможно образование нескольких разных по-
липептидных цепей, закодированных в одном гене.
Почти все бактериальные гены колинеарны белковому продукту. По-
давляющее большинство генов высших эукариот « разорвано». Они состоят
из чередующихся участков, «кодирующих » (экзонов ) и «некодирующих » (ни-
тронов). Поскольку в ряде случаев интроны (или их части) оказывались «ко-
дирующими» , а экзоны «некодирующими», то правильнее называть экзонами
те участки ДНК, копии которых составляют зрелую РНК, а интронами — те
внутренние районы гена, копии которых удаляются из первичного транс-
крипга и отсутствуют в зрелой РНК. Вырезание из пре-РНК копий интропов
(в дальнейшем для простоты — интронов ) и сшивания копий экзонов (в даль-
нейшем для простоты — экзонов) происходит на одном из этапов созревания
РНК, названном сплайсингом (англ , splicing — сращивание канатов без узлов)
(рис. 14.1). Этот процесс был открыт в 1977 г. Ф. Шарпом и Дж. Робертсом
(MIT, Массачусетский Технологический Институт, США) при работе с адено-
вирусом человека. Несколько разных мРНК содержали три одинаковых экзона
92
Лекиия 14
и четвертый, пришитый к ним в результате альтернативного сплайсинга; все
они считывались с одного гена аденовируса и служили матрицами для синтеза
разных белков.
Ген
Интрон 2 Экзон 3
Экзон 1 Интрон 1 Экзон 2
AY
\ Транскрипция
пре- мРНК Экзон 1
Экзон 2
Интрон 2 Экзон 3
Инт[
\ Сплайсинг
мРНК
Экзон Т Экзон 2 Экзон 3
I Трансляция
Белок
Рис. 14.1
. При созревании мРНК интроны вырезаются, а экзоны сшиваются
Большая часть эукариотических генов, кодирующих белки, содержит хотя
бы один интрон. У человека средний ген, имеющий размер 27 • 103 пар нуклео-
тидов, содержит 8 интронов со средней длиной 1500 пар нуклеотидов. Однако
некоторые гены, например, гены гистонов, гены отдельных трансмембранных
рецепторов, интронов не содержат. У млекопитающих таких генов 6 %, у пло-
довой мушки — 17 %, а у низших эукариот, таких как дрожжи, — 95 %. У низ-
ших всего несколько генов, кодирующих рибосомные и транспортные РНК,
содержат по одному интрону.
« Разорванными» могут быть все классы ядерных генов: кодирующие бел-
ки, кодирующие рРНК, кодирующие тРНК. Интроны найдены также в мито-
хондриальных генах низших эукариот, в генах хлоропластов и некоторых бак-
териофагов. Большая часть генов архей содержит интроны. В последнее время
выявлено несколько «разорванных » генов у эубактерий.
Химия сплайсинга. У человека и других высших организмов в ядерных
генах , кодирующих белки, интроны на своих 5’-концах имеют динуклеотид ГУ,
наЗ’-концах — АГ. На расстоянии 18-40 нуклеотидов от З’- конца находится
« точка разветвления» — адениловый нуклеотид. Он отделен от АГ полипи-
«Разорванные» гены и сплайсинг
93
римидиновой последовательностью. 2
’- ОН группа аденозина атакует 5’- конец
интрона с образованием фосфодиэфирной связи 5’-2’. Друг от друга интроны
отличаются размером участка от 5’- конца до точки разветвления (от 50 до не-
скольких тысяч нуклеотидов) (рис. 14.2). Химически сплайсинг представля-
ет собой реакцию трансэтерификации: фосфодиэфирная связь переносится
из одного положения в другое. На первом этапе происходит нуклеофильная
атака 5’- конца интрона 2’- ОН группой аденилового нуклеотида. На втором
этапе освобожденная З’-ОН группа экзона атакует связь между З’- концом ин-
трона и следующим экзоном. Две первоначальные фосфодиэфирные 3’-5’-свя-
зи на границах экзон- интрон-экзон заменяются на одну 3’- 5’- связь между эк-
зонами и одну 5’- 2
’- связь внутри интрона с образованием формы лассо .
%0;
экзон 1 ГУ
АГ экзон2
Г
t
*•.
о
1 З'-конец
интрона
5'-конец
интрона
точка
разветвления
полипиримидиновая
последовательность
экзон 1
АГ экзон2
экзон 1 | экзон 2
Рис. 24.2
. На концах интронов ядерных генов имеются короткие консенсусные
последовательности 5' ГУ
//
АГ 3'. Адениловый нуклеотид
в точке разветвления своей 2'- 0 Н группой атакует 5'- конец интрона
94
Лекция 14
По существу сплайсинг — это две последовательные реакции трансэтери-
фикации в РНК, проходящие автокаталитически либо при помощи или фер-
ментов, или рибонуклеопротеидных комплексов — сплайсосом.
Альтернативный сплайсинг. Альтернативный сплайсинг — образование
нескольких разных зрелых РНК из одинаковых пре- РНК за счет исключения не-
которых экзонов и / или оставления частей интронов. У высших организмов
первичный РНК-транскрипт может подвергаться альтернативному сплайсин-
гу. При этом в определенных случаях могут удаляться и некоторые из экзонов
вместе с интронами, а некоторые интроны или их части оставаться в зрелой
мРНК и служить матрицей для синтеза полипептидной цепи (рис. 14.3). В ре-
зультате по одному гену может образоваться несколько разных мРНК, по ко -
торым синтезируются разные белки. Именно альтернативным сплайсингом
объясняется тот факт, что у человека синтезируется не менее 105 разных типов
белков, кодируемых всего -20- 103 генами. Из всех генов человека, содержащих
интроны более 75 % служат матрицами для синтеза пре-мРНК, подвергаемых
альтернативному сплайсингу.
Альтернативный
экзон
Альтернативный
экзон
1
Экзон *1
Экзон 2
i
;
;
Экзон 1
L
:
Экзон 1 Экзон 2
2
Экзон ТТ Экзон 2
Г
‘
I
Экзон 3
Экзон 1
Экзон 3
ЭКЗОН 2
i
|.
j
Экзон 1 Экзон 2 Экзон 3
3
Г
'
!
Г
1
Экзон 1 Т Экзон 2 Экзон 3
Экзон 1
ЭКЗОН 2
ЭКЗОН О
;
J
!
i
Экзон 1 ГЭкзон 2 Г
"
Экзон ЗГ
4
'
1
>>
Г
Экзон 1 Экзон 2 Экзон 3
Г
'
!
Экзон 1
Экзон Z
Экзон 3
Экзон 11
Экзон 2 Экзон 3
Альтернативный
экзон 1
|
;
J
Альтернативный
j экзон1!
5
‘
1
Экзон 1
Экзон 2
Экзон Т
Экзон 2
i
ji
i
Экзон 1
Альтернативный
экзон 2
Экзон 2
Альтернативный
экзон 2
Рис. 14.3
. Альтернативный сплайсинг
1 — с оставлением или вырезанием экзона; 2 — с оставлением или вырезанием
интрона; з — с распознаванием разных з'- концов в интроне; 4 — с распознаванием
разныхз'-концов в интроне; 5 — с взаимоисключающим оставлением экзонов
В результате альтернативного сплайсинга по каждому гену высших эу-
кариот может образовываться в среднем три разных мРНК, а по некоторым
генам — даже несколько тысяч. Так по гену SZo, экспрессирующемся в волоско-
«Разорванные» гены и сплайсинг
95
вых клетках внутреннего уха человека, теоретически возможно образование
более 30 000 разных мРНК (в настоящее время обнаружено около 500 из них ).
Ген содержит 35 экзонов, 8 из которых альтернативны. Разные формы белка Slo
определяют различия в частоте звуков, воспринимаемых клетками.
Механизм сплайсинга ядерных мРНК. Известно несколько разных меха-
низмов сплайсинга. Наиболее сложным из них является сплайсинг мРНК ядер-
ных генов высших эукариот. Он осуществляется сплайсосомой — рибонуклео-
протеидным комплексом, включающим пять малых ядерных РНК (Ul , U2, U4,
U5, U6) и более 100 белков. Некоторые белки напрямую участвуют в сплайсин-
ге, большая их часть играет структурную роль и необходима для сборки ма -
лых ядерных рибонуклеопротеидных комплексов и их взаимодействий между
собой и с пре-мРНК.
Описано несколько десятков белковых комплексов, называемых SR-бел-
ками (сплайсинг -регулирующими) , которые различны в разных тканях , а так-
же в одной ткани на разных этапах развития организма. Эти богатые серином
и аргинином белки связываются с определенными нуклеотидными последова-
тельностями внутри экзонов и сигнализируют о вырезании или сохранении
конкретного экзона в мРНК (рис. 14.4). Если они связываются с экзонным
энхансером сплайсинга (ESE), то на 5’-конце соседнего интрона начинается
формирование сплайсосомы (рис. 14.5). Если же другие SR-белки связываются
с экзонным супрессором сплайсинга (ESS), тогда блокируется присоединение
малых РНК сплайсосомы к фланкирующим интронам, что приводит к выреза-
нию этого экзона вместе с интронами.
SR
^
ESE
т
ESSs
Экзон 1
U1
Интрон 2
Экзон 3
U2
*
мРНК
т
Экзон 1
Экзон 3
Рис. 14.4
. Маркировка экзонов, входящих в зрелую мРНК ,
и экзонов, вырезаемых вместе с фланкирующими интронами
После взаимодействия SR-белков с ESE в экзоне концы фланкирующих
его интронов спариваются с малыми РНК. 5’-консц интрона сближается
с точкой разветвления и 2’-ОН группа аденилового нуклеотида оказывается
96
Лекиия 14
интрон
экзон
экзон
зплайсо-
сома
белки
I
мРНК
экзон
экзон
экзон
Рис. 14.5
. Образование сплайсосом
в такой конформационной позиции, что с неизбежностью атакует границу
экзон -интрон. Приближенный З’-конец интрона атакуется З’-ОН группой эк -
зона. Сшивание экзонов происходит с точностью до одного нуклеотида, что
принципиально важно — при синтезе полипептидов не должно происходить
сдвига рамки считывания.
Определение пола у дрозофилы каскадом альтернативного сплай-
синга. Первый ген в этом каскаде — sxl ( sex- lethal). Он одинаков у самцов
(X:А =0,5)исамок(X:А =1)исостоитизтрех экзоновидвух интронов
(рис. 14.6). У самцов в зрелой мРНК содержатся все три экзона, в Э2 имеется
терминирующий кодон, на котором заканчивается образование белкового
продукта, не обладающего функциональной активностью. У самок же Э2 вы -
резается вместе с фланкирующими его нитронами. По мРНК, содержащей
Э1 и ЭЗ образуется белок SXL, который обеспечивает у самок вырезание
И1 из транскрипта гена tra (transformer). У самцов в мРНК сохраняется часть
И1, в которой имеется терминирующий кодон. В результате у самцов не об -
«Разорванные» гены и сплайсинг
97
Транскрипт гена sxl
*
2
Э1
Э3
7
стоп-кодон
сГ/
Сплайсинг
Э1 эз
Трансляция
нефункциональный
продукт
белок SXL
Транскрипт гена tra
Э1
э3
Сплайсинг
МЭ'
2IЭ'З
Э1
IЭ1 ГЭ2IЭ3I
Трансляция
*
нефункциональный
продукт
белок TRA
Транскрипт гена dsx
Э1
Э2
Э3
Сплайсинг
Э1 Э3
Трансляция
«женский» белок DSX
«мужской» белок DSX
YРепрессия
«Мужские» гены
«Женские» гены
*
9
сГ
Рис . 24.6
, Развитие самцов или самок дрозофилы
определяется каскадом альтернативного сплайсинга
98
Лекиия 14
разуется белок TRA, который синтезируется только у самок и вовлекается
в альтернативный сплайсинг мРНК гена dsx ( double sex ). TRA взаимодейству-
ет с белком SR и обеспечивает его посадку на ESE в Э2 транскрипта гена dsx ,
что приводит к оставлению Э2 в зрелой мРНК самок. У самцов Э2 выреза-
ется вместе с фланкирующими его нитронами; по Э1 и ЭЗ образуется «муж-
ской» белок DSX, который репрессирует «женские» гены, в результате чего
развитие идет по мужскому типу. « Женский» белок DSX репрессирует «муж-
ские» гены , и развитие идет по женскому типу.
Автосплайсинг — процесс вырезания интронов из пре-РНК без участия
белков. Каталитической активностью обладают особые третичные структуры
самих интронов.
Автосплайсинг I типа . Особый механизм сплайсинга, так называемый
автосплайсинг, был открыт Томасом Чеком (США) в 1982 г. Он работал с ин-
фузорией Tetrachymena thermophyla. У нее образуется 35 S пре- рРНК длиной
6400 нуклеотидов. Из этой пре-рРНК вырезается внутренний участок дли-
ной в 414 нуклеотидов, два экзона сшиваются с образованием 26 S pPEIK
(рис. 14.7). Оказалось, что это происходит без какого-либо участия белков.
Эта пре - рРНК обладает особой третичной структурой, с чем и связана ее ка-
талитическая активность.
Вырезание интрона и сшивание экзонов осуществляется в ходе реакций
трансэтерификации. В самом интроне имеется несколько «шпилек», образу-
ющих третичную структуру — «карман», в который попадает ГТФ, ГДФ, ГМФ
или гуанозин, З’- гидроксильная группа гуанозина атакует 5’-конец интрона,
что приводит к нуклеофильному расщеплению молекулы РНК. Освобожден-
ная З’-ОН группа первого экзона реагирует с фосфатной группой на Заграни-
це интрона и второго экзона. Экзоны сшиваются, а вырезанный линейный ин-
трон претерпевает две последовательные реакции внутримолекулярной тран-
сэтерификации, которые сопровождаются гидролизом, приводящим к отще-
плению сначала 15, а затем 4 нуклеотидов. Образование L-19IVS (англ, linear
intervening sequence — линейная интронная последовательность минус 19 ну-
клеотидов ) — демонстрация каталитической потенции самого интрона.
Так впервые было показано, что каталитической активностью обладают
не только белки, но и РНК. Молекулы РНК с такой активностью назвали рибо-
зимами по аналогии с белковыми ферментами , которые называют также энзи-
мами. К настоящему времени описано несколько сотен рибозимов.
Автосплайсинг II типа . В 1986 г. в митохондриях дрожжей были от-
крыты интроны, также подвергавшиеся автосплайсингу, но в ходе процесса,
отличавшегося от описанного Т. Чеком. Эти интроны, названные нитронами
группы II, оказались сходными с ретротранспозонами (см. лекцию 23). В на-
стоящее время показано, что такие интроны довольно широко распростране-
ны в митохондриях низших эукариот, в пластидах растений и у эубактерий.
«Разорванные» гены и сплайсинг
99
Расщепление эндонуклеазой Автосплайсинг
УУУУУУУ
т"" »
I
I~г
У
5’
3'
пре-рРНК
Экзон 1
Экзон 2
Экзон 1
Экзон 1
L-19 IVS
Экзон 1 Экзон 2
Рис. 14.7
. Образование рибосомных РНК у инфузории.
Автосплайснгом i типа выбрасывается интрон из 26 S рРНК
В митохондриях дрожжей вырезание нитронов и сшивание экзонов до-
стигается двумя разными путями: автосплайсингом II типа и сплайсингом,
катализируемым ферментом матуразой. В ходе собственно автосплайсинга
II типа атаку 5’- конца нитрона осуществляет одна из множества 2’-гидрок-
сильных групп самого интрона. В третичной структуре интрона аденозин,
находящийся в одной из шести шпилек (ближайшей к З’-концу), сближается
100
Лекиия 14
страницей экзон-интрон. После образования 5’- 2’-фосфодиэфирной связи
З’-ОН группа экзона атакует границу интрона со следующим экзоном. Экзо-
ны сшиваются, выброшенный интрон имеет форму лассо (рис. 14.8). Такая же
картина наблюдается при сплайсинге мРНК ядерных генов, но там это осу-
ществляется сплайсосомой, а не автокаталитически.
Другой способ удаления интронов в митохондриях дрожжей осуществля-
ется специальными ферментами — матуразами , Как оказалось, они кодиру-
ются в самих интронах (вернее, часть белка кодируется экзонами , а часть —
прилежащими участками интронов) генов, мРНК которых подвергается
Интрон
Каталитический
центр
Экзон 1
Экзон 2
Экзон 1
Экзон 2
Экзон 1
Экзон 2
Экзон 1 Экзон 2
Рис. 14.8
. Интрон, выброшенный автосплайсингом II типа, имеет форму лассо
«Разорванные» гены и сплайсинг
101
сплайсингу (рис. 14.9). Синтезированный фермент осуществляет сплайсинг,
вырезая интрон и тем самым уничтожая собственную матрицу. Это предот-
вращает синтез лишних молекул фермента.
Альтернативные сайты сплайсинга
/ч
Транскрипт гена box
Э1
И1
И2
Э2
ЭЗ
Автосплайсинг II типа
мРНК матуразыЧ . *
Э2
Э1
ЭЗ
Трансляция
Сплайсинг
Матураза
мРНК гена цитохромоксидазы b
Э1
Э2
ЭЗ
Рис. 14.9
. Матураза — фермент сплайсинга в митохондриях дрожжей —
кодируется экзонами и вырезаемыми ею интронами
Ретроинтроны. Интроны группы II фактически являются ретротранс-
позонами , поэтому их еще называют ретроинтронами. Как и другие ретро-
элементы, ретроинтроны кодируют белок, обладающий ревертазной (обрат-
но-транскриптазной) активностью. В открытой рамке считывания кодируется
белок IEP (intron-encoded protein ). После трансляции этот белок вступает во
взаимодействие с той частью мРНК, которая является рибозимом, и помогает
ей принять правильную конформацию. Активированный рибозим осущест-
вляет автосплайсинг и вырезается из РЫК. Обладающий ревертазной актив-
ностью белок IEP обеспечивает синтез ДНК по матрице РНК вырезанного
интрона и встраивание этой ДНК в подходящее место. В результате в геноме
появляется новая копия интроны группы II (рис. 14.10). В большинстве случа-
ев бактерии содержат единичные экземпляры ретроингронов, поэтому их дол-
го не могли обнаружить и считали, что у эубактерий вообще нет сплайсинга.
Недавно обнаружено, что термофильная цианобактерия Thermosynechococcus
elongatus содержит 28 интронов группы II, из которых 17 лишены гена iep , но
тем не менее размножаются с помощью «чужого» белка IEP.
Предполагается, что древние эукариоты « заразились» интронами груп-
пы II от своих симбионтов-бактсрий, которые стали предками митохондрий.
В ядерных геномах эукарио т интроны группы II размножились и преврати-
102
Лекиия 14
orf
Экзон 1
Экзон 2
троинтрон
Транскрипция
orf
Трансляция
Автосплайсинг
эндонуклеаза
ревертаза
штош
ДНК-мишень
Обратная транскрипция
¥
жтш
тшшт
Новый экзон
Ретроинтрон
Новый экзон
Рис. ц .10. В интроне группы II закодирован белок,
обеспечивающий размножение ретроинтрона
лись в обычные сплайсосомные интроны. При этом обратно-транскриптазная
активность была ими утрачена. Функциональные части интронов группы II,
необходимые для сплайсинга, были выведены из их состава и дали начало ма-
лым ядерным РЫК, которые представляют собой важнейшую составную часть
сплайсосом. Другие интроны группы II , сохранившие в своем составе гены об-
ратных транскриптаз, вероятно, дали начало одному из классов ретротранспо-
зонов (не содержащих LTR).
Сплайсинг тРНК дрожжей. Особый механизм сплайсинга характерен
для транспортных РЫК дрожжей. В его основе лежит узнавание вторичной
структуры тРНК, а нс первичной структуры интрона (сплайсинг ядерных
мРНК) или его особой третичной структуры (автосплайсинг I и II типа).
«Разорванные» гены и сплайсинг
103
59 ядерных генов тРНК дрожжей содержат по одному интрону, расположен-
ному на расстоянии одного нуклеотида от З’- конца антикодона. Длина ни-
трона варьирует от 14 до 60 нуклеотидов. В изоакцепторных тРНК интроны
гомологичны, в разных тРНК они непохожи друг на друга. Все интроны содер-
жат последовательность, комплементарную антикодону. Это приводит к фор-
мированию необычной конформации антикодоновой петли. Остальная часть
молекулы сохраняет свою обычную структуру (рис. 14.11). Специфическая
эндонуклеаза расщепляет пре-тРНК по обоим концам интрона. На З’- конце
первого экзона оказывается 2’-3’- циклический фосфат, на 5’-конце второго эк-
зона — гидроксильная группа. Фосфодиэстераза обнажает З’-ОН группу, ки-
наза фосфорилирует 5’-конец, лигаза сшивает экзоны с образованием тРНК.
2’-фосфатпая группа удаляется фосфатазой. Все ферментативные реакции
контролируются последовательностями , не входящими в интрон.
эндонуклеаза
>
антикодон
интрон
киназа
фосфодиэстераза
лигаза
Рис. 14.11
. Сплайсинг тРНК в ядрах
дрожжевых клеток
104
Лекиия 14
Транс-сплайсинг. Все рассмотренные выше механизмы касались
цис-сплайсинга, т. е. сшивания частей из одной молекулы РНК. Транс-сплай-
синг — это сшивание экзонов, принадлежащих разным молекулам РНК. Мно-
гие отличающиеся друг от друга мРНК трипаносомы имеют одинаковый
35-нуклеотидный 5’- конец. Он является Э1 в SL ( spliced leader ) РНК. Выреза-
ние (вернее, отрезание) частей интрона осуществляется с помощью сплай-
сосмы, не включающей Ш ( малую ядерную РНК). Считается, что присущую
U1 функцию связывания 5’- конца интрона принимает на себя собственно SL
РНК. Сшитые экзоны образуют зрелую мРНК. Две части интрона не связаны
между собой ковалентно, поэтому вместо лассо образуется У-образная струк-
тура (рис. 14.12).
Представления о роли так называемой «некодирующей ДНК» за послед-
ние 20 лет претерпели существенные изменения. Интроны, участки, ранее
пре- мРНК
Г экзон
З'-конец
интрона
SL РНК
иб
3'
5'
А
экзон
/ 114
U2\
2'
5'-конец
интрона
О
\ точка
разветвления
Ч
5'
он
Д Г экзон
экзон
3'
5'
АГ
экзон 1 | экзон 2
Рис 14.12
. Транс - сплайсинг у трипаносомы
«Разорванные» гены и сплайсинг
105
считавшиеся «мусорной ДНК», оказались существенной частью молекуляр-
ных механизмов реализации генетической информации. Так, около половины
известных микроРНК (miPHK) млекопитающих , участвующих в регуляции
экспрессии генов, кодируется в интронах генов белков. Стало ясно, что сплай-
синг — явление, свойственное всем группам организмов, включая прокариот,
которым до недавнего времени отказывали в наличии этого процесса. Иссле-
дования показывают, что интроны, ретротранспозоны и ретровирусы фило-
генетически связаны друг с другом и являются неотъемлемой частью единого
живого мира.
Особенно велико значение интронов и сплайсинга для высших эукариот.
Известно, что увеличение количества генов в геноме ограничивается резким
усложнением систем регуляции. Возникновение альтернативного сплайсинга
позволило обойти это ограничение путем увеличения разнообразия белков
без увеличения количества генов. Это значительно расширило эволюционные
возможности многоклеточных эукариот, позволив создать новые уровни регу-
ляции экспрессии генов.
106
ЛЕКиИЯ 15
Регуляторная роль РНК
В течение примерно полувека считалось, что РНК в клетке играет только
подсобную роль посредника между ДНК и белком. Однако результаты, полу-
ченные исследователями на рубеже тысячелетий, показали, что РНК — одно
из самых главных «действующих лиц» в клетке. Она не только переносит ин-
формацию от ДНК к белку, но и непосредственно участвует в сто синтезе. Кро-
ме того, как оказалось, существуют особые РНК-регуляторы разных сторон
жизни клетки.
РНК-переключатели. В 2002 г. была открыта регуляция транскрипции
у прокариот без участия белков-репрессоров или активаторов. Она осущест-
вляется с помощью особых участков уже транскрибированной мРНК — так
называемых РНК- переключшпелей (рис. 15.1 , А , Б ). В ДНК эти участки находят-
ся в транскрибируемой, но не транслируемой области оперона, перед началом
кодирующей области, т. е. в лидерной последовательности. Другими словами,
они транскрибируются первыми. В этой области оперона находятся неболь-
шие палиндромные последовательности, чередующиеся с непалиндромными.
В результате, как только этот участок ДНК будет транскрибирован, еще дале-
ко не законченная молекула РНК может приобрести третичную структуру со
шпильками и одноцепочечными петлями. В третичной структуре переключа-
теля, уникальной для каждого регулируемого таким способом оперона, есть ре-
цепторный участок. Пространственная форма этого участка такова, что к ней,
как ключ к замку, подходит молекула того вещества, которое является продук-
том кодируемого этим опероном фермента. Связывание лиганда с рецептором
и позволяет переключателю принять такую конформацию, что продолжение
синтеза РНК становится невозможным. Таким образом, если продукта про-
изведено достаточно для нужд клетки, лишняя молекула свяжется с рецепто-
ром, переключатель изменит конформацию, и транскрипция закончится, едва
успев начаться. К настоящему времени открыты не только «РНК-выключате-
ли» , но и «РНК-включатсли». Изменение конформации « РНК-включатслсй»
позволяет транскрипции успешно идти до конца. Лигандом в таком случае
Регуляторная роль РНК
107
Рис. 15.1
. Регуляторные РНК
А—РНК
-
переключатель в синтезируемой РНК : i — работающая РНК -полимераза;
2 — шпилька;
^
— изменение конформации РНК -переключателя, связанного
с лигандом; 4 — измененная конформация РНК -полимеразы; б — компьютерная
модель переключателя, связанного с лигандом (отмечен стрелкой);
В — блокирование трансляции с помощью микроРНК : i — Dicer ; 2 — микроРНК ;
3 — мРНК -мишень; Г — нарушение дифференцировки лепестков у петунии (слева)
и львиного зева (справа) в результате мутации гена микроРНК :!— нормальный
цветок петунии; 2 — нормальный цветок львиного зева;3, 4 — мутантные цветки
этих растений;,/} — подавление действия гена малыми интерферирующими РНК :
1 — Dicer; 2 — дцРНК ;з — siPHK; 4 — геликаза;5 — нуклеаза;
6 — разрезание мРНК -мишени
(sbio.info, biology-blog.com)
может являться ее субстрат, для обработки которого и нужен фермент, коди-
руемый данным геном.
Как оказалось, такой способ регулирования транскрипции широко распро-
странен в природе. Сейчас он найден у представителей всех надцарств живой
не только у бактерий, по и у архей, и у эукариот. Исследователи
природы
считают, что это, возможно, самый древний из способов регуляции активно-
сти генов, возникший еще в «РНК-мире» , на стадии « добелковой» жизни.
МикроРНК. То, что в клетке есть молекулы РНК малого размера, было из-
вестно давно. Однако на них долго не обращали внимания, считая их «облом-
ками» более длинных молекул. Потом было обнаружено, что некоторые малые
РНК (sPITK) участвуют в процессинге информационных и рибосомных РНК.
108
Лекиия 15
Но в самом конце XX в. неожиданно выяснилось, что такие РНК могут вы-
ключать работу некоторых генов. Сначала короткие регуляторные РНК (дли-
ной всего в 22 нуклеотида) были обнаружены у круглого червя С. elegans. Они
контролировали правильное чередование личиночных стадий развития этого
организма. Довольно долго считали это редким случаем, исключением , прису-
щим именно этим червям. Но в начале XXI в. обнаружилось, что такой способ
остановки действия генов, без участия белков, а только с помощью коротких
молекул РНК, распространен в живой природе очень широко, Такие РНК, по-
лучившие название микроРНК (miPHK), обнаружены у растений, дрозофилы,
человека. Недавно их обнаружили и у одноклеточных организмов. Сейчас
известны сотни видов микроРНК. Правда, функции известны только для не-
которых из них , но эти функции чрезвычайно важны. МикроРНК участвуют
в регуляции формирования осей тела и дифференцировке тканей в эмбрио-
генезе животных (и человека), направляют развитие нервной системы у рыб,
а также дифференцировку некоторых органов у растений. Так, мутация по од-
ному из генов микроРНК приводит к тому, что у растений-мутантов вместо
лепестков образуются тычинки (рис. 15.1 , Г). У дрозофилы блокирование дей-
ствия некоторых микроРНК приводит к гибели развивающихся эмбрионов.
Недавно было показано, что нарушение работы некоторых микроРНК может
приводить к развитию рака и некоторых других заболеваний человека.
МикроРНК обычно транскрибируются в виде предшественника длиной
около 70 нуклеотидов, представляющего собой шпильку с несколькими од-
ноцепочечными участками. Нередко район гена, кодирующий этот предше-
ственник , расположен в одном из интронов регулируемого гена. Специальный
фермент, носящий название Dicer (англ, « нарезающий кусочками» ), вырезает
из транскрипта участок длиной около двух десятков нуклеотидов. Получивша-
яся микроРНК почти полностью ( за исключением очень маленького кусочка)
комплементарна участку информационной РНК, считываемой с того гена, ко-
торый нужно выключить. МикроРНК спаривается с мРНК, тем самым блоки-
руя трансляцию (рис. 15.1, В).
Интерферирующие малые РНК. Одним из главных событий конца XX в.
в молекулярной биологии стало открытие так называемых малых интерфериру-
ющих РНК (siPHK). Оказалось, что это маленькие двуцепочечные РНК (дцРНК),
которые могут полностью блокировать действие гена, копией части которого
они являются. Обычно в клетках пет дцРНК, по если она там появится по ка-
кой-либо причине, в действие вступают особые ферменты. Если молекула
дцРНК длинная, то уже знакомый нам фермент Dicer нарезает ее кусочками
длиной 20-23 нуклеотида. Эти кусочки и являются siPHK. Затем к ним при-
соединяются два фермента: геликаза и нуклеаза. Геликаза — фермент, раскру-
чивающий двойную спираль и отделяющий комплементарные цепочки друг
от друга, а нуклеаза расщепляет нуклеиновые кислоты. После того как гелика-
Регуляторная роль РНК
109
за разделит siPTIK , одна из цепочек окажется связанной с нуклеазой. Этот ком-
плекс присоединяется к комплементарному участку мРНК так, как это делают
и регуляторные микроРНК. Нуклсаза, находящаяся в составе этого комплекса,
разрезает мРНК, в результате чего трансляция ее оказывается невозможной.
Р1етрудно видеть, что механизм действия интерферерующих РНК очень похож
на действие микроРНК, только в данном случае действие более «радикаль-
но» — это не блокирование трансляции, а уничтожение мРНК (рис. 15.1, Д).
Искусственное введение небольших двуцепочечных РНК-копий участка
определенного гена сейчас широко используется исследователями для «при-
цельного» выключения именно этого гена. Однако откуда же берутся в клетке
дцРНК в естественных условиях ? Ведь наличие специального ферментатив-
ного комплекса в клетке указывает на его востребованность. Оказалось, что
интерферирующие РНК эффективно защищают клетки растений и насеко-
мых от вирусов — ведь у этих организмов нет антител и иммунитета в том
виде, в каком он присущ позвоночным. Большинство вирусов растений и на -
секомых содержат именно РНК, а не ДНК. Правда, далеко не у всех вирусов
РНК является двуцепочечной. Однако недавно было показано, что у растений
и грибов белковый комплекс, распознающий чужеродную РНК, может вклю-
чать и РНК- зависимую РНК-полимеразу. Одноцепочечная РНК при этом до-
страивается до двуцепочечной, которую Dicer затем нарезает кусочками.
В клетках позвоночных животных с помощью этого механизма могут унич-
тожаться дефектные молекулы РНК или молекулы, ставшие ненужными. Пока
неизвестно, как клетка различает те РНК, которые нужно достроить и уничто-
жить, от молекул РНК , необходимых в данное время.
Длинные регуляторные РНК. Использование новых современных методов
изучения генома позволило ученым обнаружить у эукариот несколько сотен
генов, кодирующих не белки и не те РНК, которые ранее уже были извест-
ны (рРНК, тРНК, шг
'
РНК, sil’IIK ), а длинные регуляторные РНК. Этот новый
класс РНК назвали йисРНК (англ , large intervening non-coding RNAs, большие
промежуточные некодирующие РНК). Гены этих РНК оказались очень консер-
вативными, т. е . мало меняющимися в ходе эволюции. Это указывает то, что
функции их жизненно важны, поэтому большинство мутаций в них отмета-
ются отбором. Точная функция и механизм действия большинства /шсРПК
пока неизвестны, однако было показано, что они участвуют в регуляции самых
клеточного деления, образования гамет, диффе-
разпых процессов в клетке
ренцировки стволовых клеток, репарации ДНК, транспорта веществ из ци-
топлазмы в ядро, уничтожения дефектных или ставших ненужными клеток.
Они участвуют в работе иммунной системы, росте мышц, функционировании
нервной системы. Для некоторых йясРНК детали функционирования извест-
ны более подробно.
no
ЛЕКиИЯ 16
Приниипы репликаиии ДНК , Репликаиия у прокариот
Преемственность генетического материала в поколениях клеток и организ-
мов обеспечивается процессом репликации — удвоения молекул ДНК с помо-
щью фермента ДНК-полимеразы. В результате этого сложного процесса, осу-
ществляемого комплексом десятков ферментов и белков, не обладающих катали-
тической активностью, необходимых для придания полинуклсотидным цепям
нужной конформации, образуются две идентичные двойные спирали ДНК. Ре-
пликация происходит в клетке перед делением, поэтому каждая дочерняя клетка
получает точно такие же молекулы ДНК, какие имела материнская клетка.
Как и все матричные синтезы (лекция 8), процесс репликации ДНК осно-
ван на принципах комплементарности, антипараллельности и униполярно-
сти (рис. 16.1 , А ). Это означает, что 1) каждая из двух цепей «материнской»
молекулы ДНК служит матрицей для синтеза дополняющей ее, т. е . компле-
ментарной, «дочерней» цепи; 2) синтезируемая дочерняя цепь ориентирована
антипараллельно матричной (напротив З’- конца матричной цепи находится
5’-конец дочерней); 3) передвижение ДНК-полимераз — ферментов, синтези-
рующих новые нити ДНК, возможно лишь в одном направлении — от З’-кон-
цов к 5’-концам матричных цепей. При этом синтез комплементарных нитей
всегда ведется в направлении 5’->3’.
Кроме этих общих принципов, для репликации характерны и другие, свя-
занные с уникальностью строения молекул ДНК.
Полуконсервативность. В ходе репликации двойная спираль ДНК разде-
ляется на отдельные цепочки, каждая из которых служит матрицей для по-
строения повой, «дочерней» цепи. В результате репликации образуются две
идентичные двойные дочерние спирали, в каждой из которых одна из цепей —
сохраненная (« законсервированная» ) материнская, та, которая представляла
собой половину материнской молекулы. Вторые цепи дочерних молекул —
новые, синтезированные из дезоксирибонуклеотидов заново по принципу
комплементарности к нитям материнской ДНК. Новые молекулы ДНК ничем
не отличаются друг от друга и от материнской двойной спирали (рис. 16.1, А ).
Пршшпы репликации ДНК , Репликация у прокариот
111
Прерывистость. Для того чтобы новые нити ДНК были построены
по принципу комплементарности, двойная спираль должна быть раскручена
Рис. 16.1. Принципы репликации
А — комплементарность, полуконсервативность и антипараллельность репликации:
1 — «материнская» ДНК ; 2 — синтез комплементарных цепей;з — «дочерние» ДНК ;
Б — репликоны: 2 — репликативные вилки; 2 — один репликон;з — направление
движения вилок; В — репликативная вилка : i — РНК
-
затравки; 2 — растущий
фрагмент Оказаки;з — брешь после удаления затравки; 4 — точка сшивки
фрагментов Оказаки; 5 — лидирующая цепь;6 — запаздывающая цепь;
Г — частичная денатурация ДНК при репликации, стрелкой отмечен тетрамер
белка SSS; Д — расплетание двойной спирали ДНК : i — геликаза; 2 — направление
движения репликативной вилки
112
Лекиия 16
и между родительскими цепями должны отсутствовать водородные связи.
Только в этом случае ДНК-полимеразы способны двигаться по материнским
нитям и использовать их в качестве матрицы для безошибочного синтеза до-
черних цепей. Длина каждой молекулы ДНК любой клетки очень велика, она
превышает размеры самой клетки во много раз. Например, длина каждой
из 46 молекул ДНК человека составляет примерно от 2 до 10 сантиметров,
в них содержится от 5 до почти 30 миллионов витков спирали! Раскрутить
столько витков от начала до конца невозможно. И репликация самой короткой
двухсантиметровой молекулы от одного конца до другого длилась бы почти
две недели. Полное раскручивание спиралей, состоящих из многих миллионов
пар нуклеотидов, сопряжено со столь значительным количеством вращений
и такими энергетическими затратами, которые невозможны в условиях клет-
ки. Поэтому репликация начинается одновременно в нескольких местах мо-
лекулы ДНК. Участок между двумя точками, в которых начинается синтез до-
черних цепей, называется репликоном (рис. 16.1, Б ). В эукариотической клетке
в каждой молекуле ДНК в зависимости от размеров имеются сотни и даже ты-
сячи рспликонов. Рспликоны в одной молекуле активируются по расписанию,
заданному генетической программой.
В каждом репликоне можно видеть репликативную вилку — ту часть мо-
лекулы ДНК, которая под действием специальных ферментов уже расплелась.
Каждая нить в вилке служит матрицей для синтеза комплементарной дочер-
ней цепи. Именно в репликативной вилке работает ферментативный ком-
плекс, обеспечивающий репликацию ДНК. В ходе репликации вилка переме-
щается вдоль материнской молекулы , при этом расплетаются новые участки
ДНК. Так как ДНК-полимеразы могут двигаться лишь в одном направлении
вдоль матричных нитей, а нити ориентированы антипараллельно, то в каждой
вилке одновременно ведут синтез два по-разному организованных реплика-
тивных ферментативных комплекса. Одна дочерняя цепь (лидирующая) рас-
тет непрерывно, а другая (отстающая) — в виде фрагментов длиной в несколь-
ко сотен нуклеотидов , названных в честь открывшего их японского ученого
фрагментами Оказаки (рис. 16.1, В ) . После действия ферментов, изменяющих
структуру фрагментов, они сшиваются ДНК- лигазой , образуя непрерывную
цепь. Такой механизм синтеза дочерних цепей ДНК фрагментами называют
прерывистым.
Потребность в затравке. Все существующие ДНК-полимеразы не спо-
собны начинать синтез ни лидирующей цепи, ни фрагментов Оказаки отста-
ющей цепи. Они могут лишь наращивать уже имеющуюся полинуклеотидную
нить, последовательно присоединяя дезоксирибонуклеотиды к ее З’ -ОН -кон-
цу. Откуда же берется начальный 5’- концевой участок растущей цепи ? Его
синтезирует особая форма РНК-полимсразы, называемая ДНК- праймазой
(от англ , primer — затравка ). Размер рибонуклеотидной затравки невелик
Принципы репликации ДНК , Репликация у прокариот
113
(< 20 нуклеотидов ) в сравнении с размером цепи ДНК, образуемой ДНК-по-
лимеразой. Выполнивший свою функцию праймер (РНК- затравка ) удаляет-
ся специальным ферментом, а образованная при этом брешь заделывается
ДНК-полимеразой, использующей в качестве затравки З’- ОН -конец соседне-
го фрагмента Оказаки.
Белки, участвующие в репликации. Кроме уже упомянутых ДНК-по-
лимеразы, праймазы и лигазы в сложном процессе репликации участвуют
и другие белки. Во время репликации обе нити молекулы ДНК должны быть
в одноцепочечном состоянии , чтобы служить матрицами для синтеза до-
черних цепей. Это значит, что двуцепочечную ДНК нужно частично денату-
рировать ( часто говорят « расплавить») и удерживать нити от спаривания .
Это делается с помощью специальных белков — SSB -белков, геликаз и гираз .
SSB-белки (англ , single strand binding — связывающиеся с одной нитью) или
белки Альбертса, обнаруженные в 1968 г., снижают температуру плавления
ДНК на 20-40 °С. SSB-белки представляют собой тетрамеры — объедине-
ние четырех субъединиц. Они содержат кластер положительно заряженных
аминокислотных остатков , благодаря чему связываются с ДНК, являющей-
ся полианионом, электростатически. Эти белки имеют повышенное срод -
ство к одноцепочечной ДНК, С двуцепочечной ДНК, не имеющей расплав -
ленных участков , белок не связывается. Но если есть одноцепочечная ДНК,
то белки легко садятся на нее и выпрямляют ее, мешая восстановлению
двойной спирали. Когда в ДНК образуется расплавленный участок , белок
покрывает его сплошным слоем. Молекулы белка, сидящие на комплемен -
тарных цепях , не дают им схлопнуться, так как имеют мощный суммарный
отрицательный заряд (рис. 16.1 , Г). Участие SSB в репликации абсолютно
необходимо. Они не только удерживают матричные цепи ДНК в реплика-
тивной вилке в одноцепочечном состоянии, но и защищают одноцепочеч -
ную ДНК от действия нуклеаз. Кроме того, они избирательно стимулируют
работу ДНК-полимеразы.
Геликазы — это ферменты, денатурирующие ДНК. Геликаза, сидя на од-
ной из цепей ДНК, продвигается вперед, нарушая при этом водородные свя-
зи и разделяя цепочки ДНК (рис. 16.1, Д ) , Для движения по двойной спирали
ДНК и разрушения водородных связей она использует энергию АТФ. Гелика-
за не может начать плавление нативной ДНК, в которой нет одноцепочечных
участков, так как ей нужна посадочная площадка — небольшой район, где
цепи ДНК отошли друг от друга. Откуда берется такая площадка в нативной
ДНК? Эта проблема решается с помощью топоизомераз.
Топоизомеразы — это ферменты, изменяющие топологию ДНК. Они
меняют число зацеплений одной цепи за другую. Все топоизомеразы делятся
на два класса: релаксазы , уменьшающие число зацеплений, и гиразы, увеличи-
вающие число зацеплений. Гираза Е. coli состоит из двух субъединиц Gyr А,
114
Лекиия 16
обладающих эндонуклеазной и лигазнбй активностями, и двух субъединиц
Gyr В сАТФазной активностью. Двуцепочечный разрыв вносится на участке,
где две двойные спирали сближены (перекрещены). Gyr А остается на 5’-кон-
цах . Через «белковые ворота» протаскивается неразрезанная двойная спираль,
при этом расходуется энергия АТФ. Gyr А проявляет лигазную активность,
цепи сшиваются игираза отделяется от ДНК (рис. 16.2). Увеличение числа
витков в замкнутой молекуле приводит к возникновению в ней напряжения,
которое релаксируется путем закручивания всего кольца в противополож-
ном направлении — образования суперспирали (рис. 16.3, A-В ). Суперспира -
лизация приводит к снятию напряжения в закрученной гиразами молекуле,
а освобождающаяся механическая энергия идет на плавление «легкоплавких »
Рис. i6.2 . Механизм работы гиразы
2 — СугА; 2 — GyrB; 3 — участки двойной спирали ДНК
Принципы репликации ДНК , Репликация у прокариот
115
АТ-богатых участков. Все это возможно только в кольцевых или в линейных
молекулах , концы которых закреплены и не могут свободно вращаться.
Рслаксаза вносит одноцепочечный разрыв в «перекрученную» гиразой
кольцевую молекулу ДНК и после снятия напряжения проявляет лигазную ак -
тивность.
Репликация ДНК прокариот начинается с того, что в суперсгшрализо-
ванной благодаря работе гиразы кольцевой двуцепочечной молекуле плавит-
ся АТ-богатый участок, на который сразу же садятся SSB-белки. Этот участок
называют ori (англ, origin — начало). Его размер — 245 пар нуклеотидов. Мо-
лекула ДНК Е. coli имеет один участок начала репликации и две расходящи -
еся в противоположных направлениях репликативные вилки (рис. 16.3, Г).
В клетках прокариот существует три разных ДНК-полимеразы (полимеразы
I , II и III) . В репликативных вилках работает полимераза III . Поскольку ДНК
прокариот кольцевая, то когда репликация заканчивается, вилки встречают-
ся, и лигаза соединяет синтезированные цепи.
шш-
V.-
,
'•
А
шт'
/;
" 0:-
Б•О ц
Р •и:-
»
ши
'
ВV
Рис. 16.3
. Электронно -микроскопические
фотографии молекул ДНК
А — кольцевая молекула ДНК без супервитков;
6, В — суперспирализованные молекулы ДНК
(cmgm.stanford.edu) Г — репликация ДНК Е. coli:
1 — «дочерняя» ДНК ; 2 — «материнская» ДНК ;
3 — репликативные вилки
116
Лекиия 16
В настоящее время популярна модель « тромбона» (рис. 16.4), согласно ко-
торой ДНК-полимераза III образует асимметричный димер и одновременно
ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запазды-
вающей цепи. Удаление РНК-затравок и заделывание образующихся при этом
брешей берет на себя ДНК-полимераза I. Фрагменты Оказаки сшиваются ли-
газой.
Рис. i 6.4
. Модель «тромбона» репликации ДНК Е. Coli
1 — гираза; 2 — геликаза;з — димер ДНК -полимеразы III; 4 — праймаза;
5—РНК
-
праймер;6 — 55 В; 7 — фрагмент Оказаки, 8 — лидирующая цепь,
9 — запаздывающая цепь; го — ДНК -полимераза I;и — лигаза
117
ЛЕКиИЯ 17
Особенности репликаиии ДНК у эукариот
Репликация у эукариот имеет некоторые особенности. Во-первых , ДНК
эукариот во много раз длиннее ДНК прокариот, а ДНК-полимеразы работают
на порядок медленнее, чем прокариотические. Кажется, что репликация у эу-
кариот должна занимать гораздо больше времени. Но это нс так. Дело в том,
что кольцевая молекула ДНК прокариот представляет собой один репликон.
В линейной ДНК эукариот репликонов много. У них в каждой молекуле ДНК
не один, как у прокариот, а много районов ori и репликативных вилок, в кото-
рых синтез идет одновременно (рис. 17.1, табл. 4). Во-вторых , ДНК эукариот ли-
нейная, т. е. не замкнута в кольцо, а мы знаем, что для посадки геликазы на ДНК
требуется плавление участка ori. У эукариот линейные молекулы ДНК в ядрах
с помощью специальных белков во многих местах прикреплены к внутренней
ядерной мембране. Этим достигается топологическая замкнутость участков мо-
лекулы, без чего невозможно образование супервитков. В каждом отдельном
участке ДНК между местами прикрепления есть свой ori. Участок ДНК между
двумя ori — это отдельный репликон. Следовательно, каждая эукариотическая
хромосома является молирепликоном. За счет этого время репликации ДНК
Е. соН и человека соизмеримо, хотя в клетке человека ДНК в 1000 раз больше.
Таблица 4
Характеристики репликонов у про- и эукариот
Количество
репликопов
Средний размер репликона,
тыс. пар нуклеотидов
Скорость движения реплика -
тивной вилки, п. и. / мин
Организм
Е. соИ
1
4 200
50 000
Дрожжи
500
40
3 600
Дрозофила
3 500
40
2 600
Лягушка
15 000
200
500
Мышь
25 000
150
2 200
Бобы
35 000
300
2 200
118
Лекция 17
Как и у прокариот,
в каждом репликоне син-
тез ДНК идет непрерыв-
но по лидирующей цепи
и прерывисто по запазды -
вающей. Отличие в том,
что размер фрагментов
Оказаки (200-400 нукле-
отидов) у эукариот мень-
у прокариот
( 1000-2000 нуклеотидов),
а скорость работы ДНК-по-
на порядок
у прокариот
чем
ше,
лимеразы
ниже, чем
(см. табл. 4).
У эукариот РНК-за
-
травки удаляются специ-
альной РНКазой Н (от англ.
hybrid ), узнающей «гибрид-
ные», т. е. те, в которых
одна нить ДНК, а другая — РНК, участки молекулы. Бреши заделываются специ-
альной ДНК-полимеразой, а фрагменты Оказаки сшиваются лигазой.
Недорепликация З’-концов матрицы. Удаление крайних РНК-праймеров,
комплементарных З’- концам обеих цепей линейной «материнской» молекулы
ДНК, приводит к тому, что дочерние цепи оказываются короче на 10-20 нуклео-
тидов (у разных видов размер РНК-затравок различен). Поэтому все эукариоти-
ческие линейные молекулы ДНК всегда имеют выступающий на размер прайме-
ра З’- конец (рис. 17.2, А ). Это порождает проблему недорепликации концов ли-
нейных молекул. Ведь в каждом следующем раунде репликации новая молекула
ДНК оказывается короче на длину праймера. В случае репликации кольцевых
бактериальных ДНК этой проблемы не существует, так как первые по време-
ни образования РНК-затравки удаляются ферментом, который одновременно
заполняет образующуюся брешь путем наращивания З’-ОН-конца растущей
цепи ДНК, направленной в «хвост» удаляемому праймеру. Для того чтобы гене-
тическая информация в линейных молекулах не терялась, нужны особые меры
для восстановления недореплицированных концов.
Теломераза. Проблема недорепликации З’- концов линейных молекул
ДНК решается эукариотическими клетками с помощью специального фермен -
та — теломеразы. Этот фермент был обнаружен у равноресничной инфузории
Tetrahymena thermophila, а впоследствии — в клетках дрожжей, растений и жи-
вотных . Теломераза является ДНК-полимеразой, достраивающей З’ - концы ли-
;'>*
*
*., •
•
•
Рис. 17.1
. Репликация ДНК хомячка.
Стрелками указаны репликативные вилки
в трех репликонах (biology.oxy.edu)
Особенности репликаиии ДНК у эукариот
119
/
2
7ЧШ
3'
3'
5
Рис. ij.2 . Репликация концов молекулы ДНК
А — недорепликация з' - конца матрицы: i — РНК-затравка;
2 — выступающий з' - конец после удаления затравки; Б — удлинение
З' - конца молекулы теломеразой: i — теломераза; 2 — РНК- матрица;
—
направление движения теломеразы; 4 — РНК-затравка;
5 — удлиненная теломера в новом раунде репликации
нейных молекул ДНК хромосом короткими (6-8 нуклеотидов ) повторяющи -
мися последовательностями. У позвоночных таким повтором служит некоди -
рующая последовательность нуклеотидов ТТАГГГ. Помимо белковой части те-
ломераза содержит РНК, включающую повторы ААУЦЦЦ, комплементарные
теломерным повторам в ДНК. Эта РНК выполняет роль матрицы для наращи-
вания ДНК повторами. Длина теломеразной РНК колеблется от 150 нуклеоти-
дов у простейших до 1400 нуклеотидов у дрожжей, у человека — 450 нуклеоти -
дов. Сам факт наличия в молекуле РНК последовательности, по которой идет
матричный синтез куска ДНК, позволяет отнести теломеразу к своеобразной
120
Лекиия 17
обратной транскриптазе, т. е . ферменту, способному вести синтез ДНК по ма-
трице РНК.
Как уже было сказано, все линейные молекулы ДНК имеют выступающие
однонитевые З’-концы материнских цепей (оверхенги ). Они -то и узнаются те-
ломеразой, которая последовательно наращивает материнские цепи, исполь-
зуя их З’-ОН-концы в качестве затравок, а РНК, входящую в состав фермента,
в качестве матрицы. Образующиеся длинные одноцепочечные концы, в свою
очередь, служат матрицами для синтеза дочерних цепей по традиционному
репликативному механизму.
Как это происходит? Сначала выступающий конец ДНК, содержащий тело-
мерные повторы, комплементарно связывается с матричным участком теломе-
разпой РНК, затем теломераза наращивает ДНК, используя в качестве затравки
ее З’-ОН-конец, а в качестве матрицы — РНК, входящую в состав фермента. По-
сле этого происходит перемещение удлиненной ДНК относительно фермента.
Следом снова идет удлинение и очередное перемещение. Таким образом, тело-
мераза наращивает и без того выступающий конец ДНК. Новый раунд реплика-
ции начнется с нового конца, который теперь намного дальше прежнего начала
репликации (рис. 17.2, Б ). Поэтому то, что было недореплицировано раньше, до-
реплицируется. Но «ступенька» на конце молекулы все равно останется.
В результате образуются специализированные концевые структуры хромо-
сом — теломеры. Они состоят из многократно повторенных коротких последо-
вательностей ДНК и специфических белков. Поскольку теломерные последова-
тельности нуклеотидов не являются кодирующими, они выступают в роли бу-
ферной зоны как защита от проблемы концевой репликации. Укорочение ДНК
в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст
теломеры, но не приводит к утрате смысловых последовательностей — генов
и регуляторов их экспрессии. Таким образом, репликация обеспечивает переда-
чу всего генетического материала в поколениях клеток и организмов.
Теломераза работает с полной актиностью только в эмбриональных клет-
ках и предшественниках яйцеклеток и сперматозоидов. В разных стволовых
клетках различна и активность теломеразы.
В дифференцированных соматических клетках высших эукариот теломера-
за не работает. Лишь в раковых клетках обнаружена активность этого фермента,
что и служит одной из причин злокачественной трансформации. Характерной
чертой раковых клеток является неконтролируемое и нерегулируемое деление.
Старение и смерть — нормальные биологические функции организмов,
размножающихся половым путем. С возрастом в организме накапливаются
мутации, которые передаются потомкам. Множественность механизмов ста-
рения (выключение теломеразы — лишь один из них ) страхует вид от « засоре-
ния» особями, способными к размножению и несущими испорченную генети-
ческую информацию.
121
ЛЕКиИЯ 18
Репараиия ДНК
Молекулы ДНК — единственные макромолекулы, в самой структуре ко-
торых заложена способность к устранению повреждений и восстановлению
исходной формы . Осуществляется это с помощью особого процесса — репа-
рации . Комплементарность цепей в двойной спирали позволяет исправить
повреждение, возникшее в одной из цепей, по матрице другой цепи. Если же
повреждения возникают одновременно в одном месте обеих цепей, то такие
дефекты не исправляются и могут быть причиной гибели клетки. К счастью,
такие повреждения чрезвычайно редки.
Апуринизация. Наиболее частым повреждением ДНК является апури -
низация — потеря пуриновых оснований. Она может происходить спонтан-
но. В каждой соматической клетке человека теряется за сутки около 5000 аде-
нинов и гуанинов, а при повышении температуры при заболевании это коли-
чество увеличивается до 10000. Происходит это при разрыве N-гликозидной
связи между пурином и дезоксирибозой. В сто раз реже из ДНК выщепляют-
ся пиримидины.
После отщепления азотистого основания в цепи образуется АП - сайт
(апуриновый или апиримидиновый участок ) . Специфическая репараци-
онная эндонуклеаза расщепляет сахарофосфатный остов в АП -сайте с об-
разованием З’- гидроксильного и 5’- фосфатного концов. Начиная с 5’- фос-
фатного конца, экзонуклеаза отщепляет дезоксирибофосфат, у которого
нет азотистого основания, и еще 2-3 нуклеотида. Образующаяся брешь
в 3-4 нуклеотида заделывается специальной репарационной ДНК-поли -
меразой, которая использует З’- гидроксильпый конец в качестве затравки.
В заключение лигаза сшивает концы, и цепь оказывается восстановленной
(рис. 18.1). Если бы АП -сайт сохранялся , то после репликации одна из до-
черних цепей ДНК была бы короче на один нуклеотид, а после второй ре-
пликации появилась бы молекула, лишенная одной комплементарной пары.
Это изменило бы весь смысл генетической информации , закодированной
в поврежденном гене.
122
Лекиия 18
ыччы
НИЦ! 1 pffl-o
-l3ф-eJ4kl-»l
I
I
ll
3'l Is*
3'"
I5'
l5.
h’
3'
3'
Puc. 18.1. Репарация ДНК при апуринизации
i — апуринизация; 2 — АП-сайт; 3 — вырезание поврежденного участка;
4 — заполнение бреши
Дезаминирование. Под действием химических веществ, попадающих
в клетку из окружающей среды, таких как алкилирующие агенты (азотистые
соединения, нитрозомочсвина), при изменении pH в ядре клетки, увеличе-
нии температуры может происходить дезаминирование азотистых оснований
в составе ДНК.
В результате дезаминирования аде-
нин превращается в гипоксантин, кото-
рый образует две водородные связи с ци-
тозином. Поэтому во время репликации
вместо тимина, который был напротив
аденина, включится цитозин, что приве-
дет к замене комплементарной пары ну-
клеотидов АТ на другую комплементар-
ную пару ГЦ. Дезаминирование гуанина
превращает его в ксантин, образующий
водородные связи с тимином, а при де-
заминировании цитозина образуется
урацил. В обоих случаях после реплика-
ции пара нуклеотидов ГЦ окажется заме-
ненной на пару АТ (рис. 18.2). Тимин —
единственное основание в ДНК, которое
не может быть дезаминировано. Если бы
дезаминированные основания сохраня-
лись в ДНК, то через две репликации вме-
сто пары АТ стояла бы пара ГЦ; на месте
пары ГЦ появилась бы пара АТ, а пара ЦГ’
была бы заменена на пару ТА. При транс-
Аденин
Гипоксантин
Цитозин
Урацил
Ксантин
Гуанин
Рис. 18.2 . Изменения азотистых
оснований ДНК
при дезаминировании
Репарация ДНК
123
крипции ошибка переписывалась бы в РНК и при трансляции могла бы при-
водить к замене одной аминокислоты на другую. Замены аминокислот могут
сказаться на структуре белка и выполнении им своей функции.
В клетке имеются специфические N- гликозилазы — ферменты, расще-
пляющие гликозидную связь между дезаминированным основанием и дезок-
сирибозой. Это гипоксантин- М - гликозилаза, ксантии- N -гл икози;iаза и ура-
цил-М -гликозилаза. Они узнают «испорченное» основание и отщепляют его,
в результате чего образуется АП-сайт. Он « лечится» теми же ферментами, ко-
торые работают при апуринизации.
Образование тиминовых димеров. Под действием на ДНК ультрафио-
летового света происходит сшивание пиримидинов, стоящих рядом в одной
цепи молекулы. При сшивании двух тиминов образуется циклобутаповое
производное, блокирующее репликацию, а следовательно, и передачу генети-
ческой информации следующему поколению клеток и организмов (рис. 18.3).
Рис. 18.3
. Образование тиминового димера (обведен рамкой)
У бактерий и низших эукариот тиминовые димеры удаляются путем пря-
мой фоторепарации. Фермент фотолиаза узнает тиминовые димеры и образу-
ет с ними комплекс. При освещении видимым светом в диапазоне длин волн
300-600 нм происходит активация фермента, циклобутановос кольцо разры-
вается и вновь получается два тимина.
124
Лекиия 18
И дезаминированные основания, и тиминовые димеры кроме того могут
удаляться с помощью эксцизионной репарации. Специфические эндонуклеазы
производят одноцепочечные разрезы (инцизии). Затем происходит удаление
(эксцизия) нескольких нуклеотидов и заделывание бреши. У Е. coli заделыва-
нием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же лик-
видирует одноцепочечные разрывы, возникающие при действии ионизирую-
2
А
3
3':
5'
/ СН3
СН3
I
1
Б
MutL
MutH MutS
C\
5'
СН3
СН3
I
В
MutL
MutH MutS
5':
3':
ен,
СН3
I
|-
Метилаза
СН3 ДНК-полимераза
Гираза
СН3
3':
5'
СН3
сн3
Рис. 18.4
. Распознавание «неправильного» нуклеотида
в дочерней цепи ДНК
А — мисматч (ошибка спаривания): i — родительская
метилированная цепь; 2 — дочерняя неметилированная
цепь;з — неспаренный нуклеотид; Б — разрезание дочерней
цепи; В — удаление части дочерней цепи с неспаренным
нуклеотидом; Г — заделывание бреши и метилирование
дочерней цепи
Репарация ДНК
125
щей радиации. У Е. coif зксцизионная репарация осуществляется мультифер-
ментным комплексом, включающим белки uvrA, uvrB, uvrC ( ultraviolet repair ) ,
которые узнают поврежденный участок и вносят 5’ - и З’- разрывы с разных
сторон от него, uvrD -геликазу, которая отсоединяет вырезанный олигомер
(12 нуклеотидов), используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог та-
кого мультиферментного комплекса. У млекопитающих по меньшей мере де-
вять разных генов кодируют ферменты эксцизионной репарации. Мутация
в одном из них , нарушающая процесс репарации, является причиной тяжелой
наследственной болезни человека — пигментной ксеродермы. Люди, страда-
ющие этим заболеванием , очень чувствительны к ультрафиолетовому свету.
Даже при слабом воздействии солнечных лучей у них развиваются различные
повреждения кожи , в том числе и разные формы рака.
Под действием ионизирующей радиации или рентгеновских лучей в ДНК
возникают одноцепочечные и двуцепочечные разрывы сахарофосфатного ске-
лета. Азотистые основания при этом могут оставаться неповрежденными. Од-
ноцепочечные разрывы сшиваются лигазой, а двуцепочечные могут привести
к фрагментации хромосом и даже к гибели клетки.
Репарационная система должна четко различать обе цепи (родительскую
и дочернюю) , чтобы удалить мутированное основание из вновь синтезиро-
ванной цепи и исправить ошибку. Как же осуществляется распознавание це-
пей? В ДНК Е. соН в последовательности 5’ - ГАТЦ-3’ аденин всегда метилиро-
ван ферментом Dam-метилазой. Метилированные основания не нарушаю!
спаривания цепей ДНК. В течение какого- то времени родительская цепь бу-
дет метилирована, а дочерняя нет. Белок Mut S узнает нарушение в спирали,
Mut Н, связанный с Mut S при участии Mut L, находит неметилированную
последовательность 5’- ГАТЦ-3’ на одной из цепей дуплекса и разрывает цепь
в этом месте. Место разрыва может быть удалено от места ошибки на ты-
сячи оснований. Затем при совместном действии геликазы и экзонуклеазы
удаляется участок цепи от разрыва до места ошибки, а ДНК-полимераза
I застраивает брешь и лигаза сшивает концы. Для исправления одного ос-
нования бывает необходима замена тысяч оснований ( рис. 18.4). У эукариот
имеется подобная система. У человека известны белки, аналогичные белкам
Mut S и Mut L Е . colt. Мутации в генах этих белков сопровождаются увеличе-
нием риска канцерогенеза.
126
ЛЕК 1_1ИЯ 19
Геномы вирусов, прокариот и эукариот
Термин «геном» был предложен Г. Винклером в 1920 г. для описания сово-
купности генов, заключенных в гаплоидном наборе хромосом одного биологи-
ческого вида. В настоящее время термином «геном» обозначают совокупность
молекул ДНК (не только генов) гаплоидного набора хромосом , которые заклю-
чены в отдельной клетке зародышевой линии многоклеточного организма или
в одной прокариотической клетке.
Геномы вирусов. Самые разнообразные геномы имеют вирусы. Они
могут быть представлены как ДНК, так и РНК. Молекулы могут быть одно-
цепочечными и двуцепочечными, линейными и кольцевыми. Количество ге-
нов — от 3 (фаг Qb) до 1 120 (самый крупный из известных в настоящее время
вирусов — мегавирус) , что в три раза больше, чем у некоторых бактерий. Со-
ответственно, и размер генома у вирусов может находиться в диапазоне от ме-
нее 2000 нуклеотидов до > 2,5 -106 пар нуклеотидов. Геномы вирусов очень ком-
пактны, как правило, у них нет участков ДНК или РНК, не кодирующих белок.
Для некоторых вирусов бактерий (фагов) показано перекрывание генов, когда
один и тот же участок ДНК входит в состав двух генов. За счет сдвига рамки
считывания кодируемые ими белки оказываются разными (но в пределах од-
ного гена кодоны не перекрываются!).
Сейчас к вирусам относят и самые маленькие инфекционные агенты —
так называемые вироиды. Вироиды — это патогены растений, которые состоят
из короткого фрагмента (несколько сотен нуклеотидов) кольцевой одноцепо-
чечной РНК, не покрытой белковой оболочкой, характерной для вирусов. Са-
мый маленький вироид scRNA имеет длину всего 220 нуклеотидов. Этого недо-
статочно даже для одного гена. Вироиды и не имеют собственных генов, но их
РНК обладает свойствами рибозима: она способна к самоудвоению без участия
белков. Для репликации РНК они используют клеточные нуклеотиды. Посколь-
ку у вироидов нет оболочки, они не способны к существованию вне клетки.
Разнообразие видов и форм вирусных нуклеиновых кислот определяет
и разнообразие способов их репликации. Бактериофаг Т4 имеет одну двухце-
Геномы вирусов, прокариот и эукариот
127
почечную линейную молекулу ДНК, состоящую из 160 х 103 пар нуклеотидов.
В ней закодировано более 150 различных белков , в том числе более 30 белков,
участвующих в репликации фаговой ДНК. Обезьяний вирус SV40 имеет двух -
цепочечную кольцевую ДНК. У вируса оспы две комплементарные цепи ли-
нейной ДНК на обоих концах соединены ковалентной фосфодиэфирной свя-
зью. Этот вирус — один из самых крупных известных вирусов — содержит бо-
лее 240 генов. Репликация у вирусов с двухцепочечной ДНК принципиально
не отличается от репликации бактериальной или эукариотической ДНК.
Паразитирующие в бактериальных клетках Е. coli фаги М13 и фХ174 име-
ют кольцевую одноцепочечную ДНК. R зараженной клетке бактериальные
ферменты репликации синтезируют комплементарную цепь, которая служит
матрицей для образования новых фаговых ДНК. Они соединяются с фаговы-
ми белками, также синтезированными бактериальными ферментами, и новые
фаги покидают клетку-хозяина.
Многие вирусы растений содержат одну линейную молекулу РНК, напри-
мер первый из описанных вирусов — вирус табачной мозаики (ВТМ).
Репликация РНК вируса табачной мозаики осуществляется ферментом,
называемым РНК-зависимой РНК- полимеразой , закодированной в геноме ви-
руса. Сначала этот фермент строит комплементарную цепь РНК, так называ-
емую минус-цепъ (она не кодирует белки в отличие от вирусной РНК, которая
кодирует белки и называется плюс -цепъю ) , а затем по ней, как по матрице, син-
тезирует множество вирусных РНК.
У вирусов с так называемым « негативным » геномом, к которым отно-
сится вирус гриппа, инфицирующая РНК является минус-цепью и не коди-
рует белков. Только комплементарная ей плюс-цепь РНК, синтезирующаяся
в зараженных вирусом клетках , несет информацию о создании новых вирус-
ных частиц. Она же служит матрицей для образования большого количества
вирусных минус-цепей РНК. Поскольку необходимой для этого фермента
РНК- зависимой РНК-полимеразы в клетках нет, вирус «приносит» ее с собой.
Молекула фермента, присоединенная к его геномной РНК, вместе с ней осво-
бождается из капсида и начинает репликацию РНК.
Две одинаковые одноцепочечные молекулы РНК внутри икосаэдрического
белкового капсида содержат некоторые онкогенные (опухолеродные) вирусы.
Они имеют еще и внешнюю оболочку, состоящую из двойного липидного слоя
плазматической мембраны клетки-хозяина, а также гликопротеидов вирусно-
го происхождения. Такое же строение имеет вирус иммунодефицита человека
(ВИЧ), вызывающий синдром приобретенного иммунного дефицита (СПИД).
Из онкогенных вирусов первым был открыт вирус саркомы Рауса (ВСР),
вызывающий злокачественные опухоли у кур. Изучение механизма трансфор-
мации клетки, т. с. превращение из нормальной в раковую, привело в 1970 г.
американских ученых Говарда Тёмина и Дэвида Балтимора к открытию явле-
128
Лекиия 19
ния обратной транскрипции. ВСР содержит фермент, называемый обратной
транскриптазой. Он представляет собой ДНК-полимеразу, которая сначала
синтезирует цепь ДНК, используя в качестве матрицы одну из идентичных
молекул вирусной РНК, а затем вторую, комплементарную цепь ДНК. В ре-
зультате образуется двухцепочечная ДНК. Она может встроиться в хромосому
клетки-хозяина.
Такой процесс встраивания вирусной ДНК в хромосомную ДНК хозяи-
на называют интеграцией . Вирусный геном в форме интегрированной ДНК,
синтезированной на проникшей в клетку вирусной РНК с помощью обратной
транскриптазы, называют провирусом. Провирус становится частью генети-
ческого материала клетки , реплицируется вместе с клеточной ДНК и при де-
лении передается дочерним клеткам. В скрытой (латентной) форме провирус
может пребывать бесконечно долго, переходя от родителей к потомкам через
сперматозоид или яйцеклетку.
РНК-содержащие вирусы, являющиеся первопричиной злокачественного
перерождения, относятся к ретровирусами (от лат. retro — возврат назад) из-за
того, что обратная транскрипция — необходимый этап в их жизненном цикле.
К ретровирусам относится и возбудитель СПИДа. Он внедряется в Т-лим-
фоциты — центральные клетки иммунной системы, — так как на их поверх -
ности есть рецепторы, способные связываться с белками внешней оболочки
ВИЧ. Иммунная система человека утрачивает свои защитные свойства и ока-
зывается не в состоянии противостоять возбудителям различных болезней.
ВИЧ передается при половом контакте, через зараженную кровь (совместное
пользование загрязненными иглами для введения наркотиков, переливание
непроверенной крови, случайный контакт медицинских работников с кровью
больного), от матери к плоду во время беременности или новорожденному
при родах . Средняя продолжительность жизни инфицированного человека
без лечения составляет 7-10 лет.
В 1975 г. У Фирсом из Гентского университета (Бельгия) была определена
первичная структура генома фага MS2. Это плюсРНК, в которой закодирова-
но три полипептида: белок А (нужный по одной молекуле на каждую фаговую
частицу), С-белок оболочки (нужный в количестве 180 молекул на каждый
фаг) и полипептид S (одна из субъединиц РНК-зависимой РНК-полимеразы).
РНК-полимераза синтезирует комплементарную ей минус-цепь РНК, а затем
по пей, как по матрице, сотни плюс-цепей РНК. Как же регулируется образо-
вание столь разного количества белка по одной матрице? Каждый ген пред-
ставлен множеством шпилек и очертанием напоминает цветок, а весь геном —
букет, в котором доступной для посадки рибосомы является только лидерная
последовательность перед геном С. По мере продвижения рибосомы по гену
С расплетается лидер перед геном S и начинается синтез полипептида S. К это-
му времени первая молекула белка С уже синтезирована; она имеет высокое
Геномы вирусов, прокариот и эукариот
129
сродство к лидеру и инициирующему кодону гена S, по которому полипептид
образуется лишь один раз. Полипептид S ассоциирует стремя хозяйскими
белками — факторами элонгации трансляции EF-TU и EF-TS и рибосомным
белком S1 с образованием активного фермента РНК- зависимой РНК- полиме-
разы. Как только синтез минус-цепи РНК начинается, расплетается лидер гена
А, спаренный с З’- нетранслируемой областью гена S и начинается синтез белка
А. Он образуется в количестве одной молекулы, так как лидер гена А вновь
« прячется» в шпильку и становится недоступным для посадки рибосомы.
К этому времени С-белок оболочки, наработанный в количестве 180 молекул,
покрывает вновь образованную плюс-РНК. Таким образом, сбалансированное
количество разных белков регулируется самой структурой генома (рис. 19.1).
/1
\ГенС /*
II
I'I
2
Ген А
Ген S
33’
5' СП
129
23 393 33
1182
1638
171
Рис. ад.2. Геном фага М5 г
1 — лидерные последовательности; 2 — нетранслируемая область .
Цифрами обозначено количество нуклеотидов в соответствующих участках
Геномы большинства прокариот представлены двуцепочечной кольцевой
ДНК, прикрепленной к плазмалемме. Размеры прокариотических геномов —
от 140 тыс. до 10 млн пар нуклеотидов, количество генов — от 190 у самых мел-
ких бактерий (микоплазм ) до более 4000. Кроме основной молекулы ДНК бакте-
рии могут содержать одну или несколько необязательных небольших кольцевых
молекул — плазмид. Обычно плазмиды несут один или несколько генов, обе-
спечивающих устойчивость к различным факторам внешней среды: антибиоти-
кам, солям тяжелых металлов. Геномы прокариот очень компактны, межгенные
промежутки у них сведены до лидерных последовательностей; всего менее 15 %
нуклеотидных последовательностей ДНК не кодирует РНК и белки.
Геномы эукариот самые большие и сложные. Даже у самых простых эука-
риот, дрожжей, геном значительно больше прокариотического — 12 млн пар
нуклеотидов, около 6000 генов. У подавляющего большинства эукариот геном
состоит из нескольких линейных молекул ДНК, соединенных со специальны-
ми белками — хромосом.
Можно было бы ожидать, что количество ДНК и генов будет увеличивать-
ся с усложнением организации живых существ. Однако это не так. Конечно,
у человека геном (3,2 -109 пар нуклеотидов ) значительно больше, чем у дрож-
жей или у дрозофилы. Но рекордсменом по размеру генома среди животных
является довольно примитивная двоякодышащая рыба мраморный протоп-
130
Лекиия 19
тер ( Protopteru.; aethiopicus ) , геном которой содержит 132-109 пар нуклеотидов.
Внутри некоторых классов (рептилии, птицы, млекопитающие) диапазон раз-
меров геномов мал, а внутри других (рыбы, амфибии) достигает двух и даже
грех порядков. Столь же велико разнообразие размеров геномов цветковых
растений. Самый большой геном имеет растение вороний глаз японский —
149-109 пар нуклеотидов. Это явление (отсутствие корреляции между эволю-
ционной продвинутостью организма и количеством ДНК в его клетках ) но-
сит название С -параЬокса (латинской буквой С обозначают количество ДНК
в гаплоидной клетке). При этом количество генов у большинства эукариоти-
ческих организмов около 20 000. Например, в геноме человека насчитывают
около 23 000 генов, а у крошечного червя нематоды С. elegans лишь немногим
19 000. Наибольшее количество генов
31 000
меньше
номе примитивного плантонного рачка дафнии.
Все гены, входящие в геном, делят на две группы. Одна часть работает во
всех клетках . Это гены, кодирующие белки рибосом, гистоны, структурные
белки мембран и цитоскелета, ферменты, участвующие в биосинтезе биопо-
лимеров или в расщеплении веществ в реакциях энергетического обмена. Их
называют генами «домашнего хозяйства». К ним относят и нетранслируемые
гены транспортных и рибосомных РНК. Остальные гены, являющиеся тка-
неспецифичными, транскрибируются и транслируются лишь ограниченное
время и (или) не во всех клетках многоклеточного организма. Продукты этих
генов нужны не только производящей их клетке, но и всему организму. Они
производятся дифференцированными клетками, выполняющими функции,
свойственные той или иной ткани. Так, ген инсулина работает лишь в произ-
водящих гормон клетках поджелудочной железы, а ген гормона роста — толь-
ко в клетках гипофиза.
Когда определили размеры и структуру геномов эукариот, возникло поня-
тие избыточности эукариотического генома. Действительно, на один ген Е. coli
приходится в среднем около 1000 пар нуклеотидов, а у млекопитающих — око-
ло 160 000 пар нуклеотидов. Почему это происходит? Во-первых , гены эукари-
от значительно больше прокариотических за счет наличия интронов и протя-
женных регуляторных областей. Во-вторых , некоторые гены в геноме много-
кратно повторяются. Так, у млекопитающих имеется несколько сотен одина-
ковых генов рибосомных РНК, а у амфибий их несколько тысяч. В -третьих ,
в геномах эукариот присутствуют нефункциональные копии нормальных ге-
нов — так называемые псевдогены. Псевдогены не способны к кодированию
и реализации полезной информации из-за изменений в их структуре, как пра-
вило, заключающихся в утрате важных фрагментов, например, промоторов.
В-четвертых , в геномах эукариот много некодирующих последовательностей,
значительная часть которых представляет собой обязательные структуры хро-
содержится в ге-
мосом, отсутствующие у прокариот, такие как центромеры и теломеры, ме-
Геномы вирусов, прокариот и эукариот
131
жгенные промежутки. Наконец, у эукариот значительно больше мобильных
генетических элементов, чем у прокариот ( см. лекцию 23). В результате 6е-
лок-кодирующие части генов в геномах млекопитающих напоминают острова
в океане некодирующих последовательностей (рис. 19.2).
Хромосома длиной 1,5 - 108 п. н., ~1200 генов
А
0,5 % хромосомы содержит ~6 генов
1 ген, состоящий из ~105п. н.
Кодирующая белок часть гена , ~1300 п. н .
Рис. ig.2 . Структура генома эукариот
А — организация генов в хромосоме: i — регуляторная область
гена; 2 — экзон; з — интрон; Б — состав генома человека:
1 — белок-кодирующая часть генома; 2 — некодирующая ДНК;
3 — псевдогены; 4 — повторенные последовательности;
5— мобильные генетические элементы в составе повторенных
последовательностей
Своеобразен геном представителей третьего домена ( кроме бактерий
и эукариот) живых существ — архей. Хотя, как и у других прокариот, у архей
геном представлен одной кольцевой молекулой ДНК, гены у них , как и у эука-
риот, имеют интроны. Структура промотора у них также ближе к эукариотам,
чем к прокариотам. Исходя из этого, именно архей считаются эволюционны-
ми предшественниками эукариот.
132
Лекиия 19
Геном человека. В каждой соматической (неполовой) клетке человека,
имеющей ядро, содержится 46 хромосом — диплоидный (двойной) набор. Га-
плоидный набор состоит из 23 хромосом. Результатом 15-лстнсй работы меж-
дународной программы « Геном человека», завершенной в 2003 г., стало опре-
деление последовательности всех 3,2 -109 пар нуклеотидов, образующих геном.
У человека почти в пять раз больше генов, чем у кишечной палочки, а весь его
геном больше генома Е. coli почти в 700 раз. При сравнении с эукариотической
дрозофилой (плодовой мушкой) цифры также различаются существенно: у че-
ловека в 1,5 раз больше генов, а весь геном в 25 раз больше генома дрозофи-
лы. Даже у позвоночного — рыбы фугу — геном меньше человеческого почти
в 10 раз при практически одинаковом количестве генов. Большинство генов
рыбы и человека если не совсем одинаковы, то очень похожи: у них сходная
последовательность белок-кодирующей части генов, одинаковое количество
экзонов. Отличаются они размерами интронов. Главное отличие генома фугу
от геномов других позвоночных — очень небольшое количество и протяжен-
ность различных некодирующих последовательностей — межгенных проме-
жутков, мобильных генетических элементов и др. Из 3,2 х 109 пар нуклеотидов
генома человека только 25 % занято белок -кодирующими генами, а собственно
кодирующие белок последовательности (экзоны) составляют всего 1,5 % гено-
ма. Что же представляют собой остальные 75 % генома человека (рис. 19.2, Б) ?
В основном эта часть генома занята так называемыми повторенными после-
довательностями. Они представляют собой многократно повторяющиеся
участки ДНК с одинаковой первичной структурой. Примерно 2 % генома че-
ловека составляют высокоповторенные (более 1 ( Г раз) последовательности,
составленные повторяющимся блоком длиной в 171 п. н. Эти повторы нахо-
дятся в центромерных участ ках каждой хромосомы. С этими участками свя-
зываются специальные белки, составляющие кинетохор. На концах хромосом
находятся теломерные повторы. Эти повторенные последовательности генов
не содержат.
Умеренно повторенные (менее 105 раз) последовательности включают
блоки генов «домашнего хозяйства», продукты которых клеткам нужны по-
стоянно в большом количестве (гены гистонов, рРНК, тРНК, белков цитоске-
лета). Требуемое количество этих продуктов один даже очень активно транс-
крибируемый и транслируемый ген обеспечить не может.
Не менее 50 % генома человека занимают псевдогепы и мобильные гене-
тические элементы ( МГЭ), которые иногда называют «прыгающими генами».
О них будет подробнее рассказано в лекции 23.
133
ЛЕКиИЯ 20
Геном митохондрий и хлоропластов
У всех эукариот генетическая информация содержится не только в хро-
мосомах клеточного ядра, но и в митохондриях и пластидах — самовоспроиз-
водящихся полуавтономных органеллах клетки, имеющих собственный геном.
Геном митохондрий. В то время как ядерный геном представляет собой
совокупность линейных молекул ДНК гаплоидного набора хромосом, мито-
хондриальные геномы больше похожи на геномы прокариот. У высших жи-
вотных они представляют собой одну или несколько кольцевых молекул ДНК
(мтДНК), прикрепленных к внутренней мембране митохондрий (рис. 20.1 , А ).
У растений такие кольцевые ДНК (их всегда несколько) могут быть разных
размеров. Большие кольца образованы объединенными малыми (рис. 20.1, Б ).
Митохондрии некоторых видов растений наряду с кольцевыми содержат и ли-
нейные молекулы ДНК. Крупные клетки простейших обычно содержат одну
большую митохондрию с огромным количеством колец ДНК самого разного
размера (огромных макси-колец и маленьких мини-колец), которые к тому
же продеты друг в друга (рис. 20.1, В , Г). Такие цепи колец (катенаны) обычно
образуются при репликации кольцевых молекул, но у прокариот специальные
ферменты их расцепляют, так как у них дочерние клетки после деления долж-
ны получить по одной неповрежденной молекуле.
В матриксе митохондрий, поскольку там есть ДНК, есть и собственный
аппарат белкового синтеза. Собственные рибосомы митохондрий по многим
характеристикам отличаются от эукариотических рибосом, которые находят-
ся в цитоплазме тех же самых клеток. Но большая часть белков, составляющих
структурные и функциональные компоненты митохондрий, кодируется ядер-
ным геномом, синтезируется на рибосомах эндоплазматической сети и транс-
портируется в митохондрии. На рибосомах же митохондрий образуется не бо-
лее 5% от всех белков, входящих в их состав.
Размер генома митохондрий разных организмов колеблется от менее 6 тыс.
пар нуклеотидов у малярийного плазмодия (в нем, помимо двух генов рРНК, со-
держится только три гена, кодирующих белки) до сотен тысяч пар нуклеотидов
134
Лекиия 20
Рис. 20.1. Митохондриальные геномы эукариот
А — митохондрия млекопитающих, стрелками отмечены кольцевые молекулы ДНК ,
прикрепленные к мембране;Б — митохондрия растений, стрелками отмечены
кольцевые молекулы ДНК разного размера; В — митохондрия трипаносомы:
2 — миникольцо; 2 — линейные молекулы разного размера; j — максикольцо;
4 — сцепленные миникольца (катенан); Г — электронномикроскопическая
фотография части митохондриального генома трипаносомы (dna .kdna.ucla .edu)
у наземных растений (например, у Arabidopsis thaliana из семейства крестоцвет-
ных 366 924 пар нуклеотидов). Длина мтДНК позвоночных животных отлича -
ется незначительно: у человека — 16 569 пар нуклеотидов, у дельфина
у лягушки — 17 533, у карпа — 16 400. Эти геномы сходны также и по количеству
и расположению генов, между которыми отсутствуют межгенные промежутки.
В ряде случаев гены даже перекрываются, обычно на один нуклеотид, гак что
последний нуклеотид одного гена оказывается первым в следующем.
У большинства высших животных геном митохондрий содержит 37 ге-
нов: 13 для белков дыхательной цепи, 22 для тРПК и 2 для рРПК (рис. 20.2, А).
Ключевые ферменты матричных синтезов , такие как ДНК-полимераза, осу-
ществляющая репликацию митохондриальной ДНК, и РНК-полимераза,
транскрибирующая геном митохондрий, кодируются в ядре и синтезируются
на рибосомах цитоплазмы. Этот факт указывает на относительность автоно-
мии митохондрий в сложной иерархии эукариотической клетки.
16 330,
Геном митохондрий и хлороплсютов
135
Все мтДНК, в отдичие от ядерных и прокариотических ДНК, не метили-
руются. Известно, что метилирование — один из механизмов программируе-
мой инактивации генов (см. лекцию 22). По-видимому, это связано с тем , что
митохондриальные гены не нужно выключать, так как они кодируют белки
и РНК, которые необходимы для выполнения основной функции митохон-
дрий — производства АТФ.
Репликация ДНК митохондрий млекопитающих (рис. 20.2, В ). У боль-
шинства животных комплементарные цепи в мтДНК значительно различаются
по удельной плотности, поскольку имеют неодинаковое содержание «тяжелых »
пуриновых и «легких » пиримидиновых нуклеотидов. Цепи так и называют-
ся — Н (англ, heavy — тяжелая) и L (англ, light — легкая) цепь. В начале реплика-
ции молекулы мтДНК образуется так называемая D-петля (от англ, displacement
loop — петля смещения). Эта структура, видимая в электронный микроскоп,
состоит из двуцепочечного и одноцепочечного участков. Одноцепочечный уча-
сток — это отодвинутая часть Н-цепи. Двуцепочечный участок образован частью
L-цепи и комплементарным ей вновь синтезированным фрагментом ДНК длиной
450-650 (в зависимости от вида организма) нуклеотидов, имеющим на 5’-кон-
це рибонуклеотидную затравку. Этот конец соответствует точке начала синтеза
Н-цепи ( ori Н). Синтез L-цепи начинается лишь тогда, когда дочерняя Н-цепь до-
ходит до точки ori L. Это обусловлено тем, что область инициации репликации
L-цепи доступна для ферментов синтеза ДНК лишь в одноцепочечном состоянии,
а это имеет место только при расплетании двойной спирали при синтезе Н-цепи.
Таким образом , в отличие от ядерной ДНК, митохондриальная ДНК реплициру-
ется непрерывно по обеим цепям, но со значительным сдвигом во времени и в
пространстве, так как участки ori в цепях далеко отодвинуты друг от друга.
Транскрипция мтДНК (рис. 20.2, Б ). В отличие от ядерного генома мито-
хондриальный геном очень компактен. В нем мало межгенных некодирующих
областей. Это делает возможным транскрипцию полигенных РНК с каждой
цепи мтДНК. Поэтому каждая из цепей мтДНК млекопитающих , представля-
ющая собой полигенную структуру, транскрибируется с образованием одной
молекулы РНК, начинающейся в районе ori Н . Помимо этих двух длинных
молекул РНК, комплементарных Н - и L-цепям, образуются и более корот-
кие транскрипты Н-цепи, начинающиеся в той же точке и заканчивающиеся
наЗ’-конце гена 16 S рРНК. Этих коротких транскриптов в десять раз боль-
ше, чем длинных . В результате процессинга ( «созревания» ) из них образуются
12 S рРПК и 16 S pPI IK, идущие на формирование митохондриальных рибосом,
а также фенилаланиновая тРНК и валиновая тРНК. Из длинных транскриптов
вырезаются остальные тРНК и образуются транслируемые иРНК, которые по-
лиаденилируются по З’-концам. Но 5’- концы этих иРНК не кепируются, что
необычно для эукариот. Сплайсинга обычно нс происходит, поскольку боль-
шинство митохондриальных генов млекопитающих не содержит нитронов.
136
Лекиия 20
Рис. 20.2 . Митохондриальный геном человека
А — митохондриальные гены : i — район начала репликации;
2 — гены рибосомных РНК; з — гены субъединиц НАД * Н дегидрогеназы;
4 — гены субъединиц цитохромоксидазы; 5 — гены субъединиц
АТФ-синтазы; 6 — ген цитохрома Ь; 7 — гены транспортных РНК;
Б — транскрипция митохондриального генома : i — транскрипт /.
-
цепи;
2 из — длинный и короткий транскрипты Н-цепи; В — репликация
митохондриального генома : i — D
-
петля; 2 — /.
-
цепь;з—/
-
/- цепь;
4 — РНК-затравка Н-цепи; 5 — район ori Н; 6 — район ori Ц
7 — РНК-затравка /.
-
цепи; 8 — SSS
-
белки
Особенности митохондриального генома. В целом похожий на геном
бактерий митохондриальный геном обладает рядом особенностей. Напри-
мер, некоторые гены митохондрий дрожжей содержат интроны. Так , в гене
box (кодирующем цитохромоксидазу b) имеется два нитрона. Но интроны
далеко не всегда являются некодирующими участками. В данном случае те
Геном митохондрий и хлороплсютов
137
участки ДНК, которые представляют собой интроны для гена цитохромокси-
дазы Ь , для гена матуразы — фермента, участвующего в сплайсинге, играют
роль экзонов. Из первичного РНК-транскрипта вырезается копия большей
части первого интрона, причем происходит это автокаталитически, без уча-
стия каких -либо белков (пример автосплайсинга) . Оставшаяся РНК служит
матрицей для образования матуразы. Часть аминокислотной последователь-
ности матуразы закодирована в оставшихся копиях интронов. Матураза
вырезает их , разрушая свою собственную мРНК, копии экзонов сшиваются,
и образуется мРНК для цитохромоксидазы Ъ. Открытие этого феномена за-
ставило пересмотреть представление об нитронах , как о «ничего не кодиру-
ющих последовательностях ».
Генетический код митохондрий млекопитающих несколько отличает -
ся от универсального значениями нескольких кодонов. Возможно, этим ми-
тохондрии «охраняют свою независимость», ведь митохондриальная мРНК
не может быть прочитана цитоплазматическими рибосомами.
Геном хлоропластов. Так же как и митохондрии, хлоропласты обладают
собственным геномом. ДНК хлоропластов кольцевая. Один хлоропласт обыч-
но содержит несколько десятков копий генома. В настоящее время расшиф-
рованы хлоропластные геномы многих растений: кукурузы, табака, риса и др.
В геномах хлоропластов содержится около 120 генов. Это гены всех рРНК,
тРНК, рибосомных белков, часть генов, кодирующих белки фотосистем и элек-
тронно-транспортной цепи. При этом, как и в митохондриях , значительная
часть белков или их субъединиц кодируется ядерным геномом.
Хлоропласты значительно сильнее, чем митохондрии, похожи на своих
прокариотических предков. Например, часть генов хлоропластного генома
объединена в опероны, имеющие одинаковые с прокариотами промоторы,
терминаторы, некоторые регулирующие элементы, трансляция у них начина-
ется не с метионина, а с формилметионина, как у бактерий. Но вместе с тем
геному хлоропластов свойственны и некоторые общие с эукариотиами черты.
Так, в некоторых хлоропластных генах имеются интроны, есть не свойствен-
ный прокариотам процесс редактирования РНК.
138
ЛЕКиИЯ 21
Компактизаиия ДНК , хромосомы и кариотипы
Как мы видели, геномы даже самых мелких прокариот содержат миллио-
ны пар нуклеотидов. Хотя размер одной нуклеотидной пары составляет всего
0,34 нм, длина геномной ДНК кишечной палочки составит 1,6 мм при длине
самой бактерии 1-6 мкм. У эукариот геномы значительно больше. Суммарная
длина всех 46 молекул ДНК человека составляет около 2 м, а у некоторых ли-
лейных — более 10 м! Каким же образом эти громадные молекулы умещаются
в ядре диаметром менее 10 мкм? Для этого ДНК должна быть плотно упако-
вана, при этом она не должна запутываться, и любой ее участок должен быть
доступен для ферментов и транскрипционных факторов. Кроме того, молеку-
лы ДНК такой длины не могут существовать сами по себе — они просто разо-
рвутся под действием собственной тяжести. Поэтому ДНК никогда не бывает
свободной от белков. Кроме ферментов и разнообразных регуляторных бел-
ков , это специальные упаковочные белки, обеспечивающие компактизацию
(упаковку) ДНК в ядре клетки. Такой комплекс ДНК с упаковочными белками
называют хроматином, а одна молекула ДНК в комплексе с белками называет-
ся хромосомой .
Существует четыре уровня упаковки ДНК. Два первых уровня комггакти-
зации эукариотического генома обеспечиваются белками, которые называют-
ся гистонами .
Гистоны — основные белки. Все они обогащены лизином и аргинином —
аминокислотами с положительно заряженными радикалами. Благодаря этому
они электростатически взаимодействуют с ДНК, являющейся полианионом.
Выделяют пять видов гистонов, обозначаемых HI , Н2А, Н2В , НЗ и Н 4. Синте-
зируется их очень много — 60 млн молекул каждой фракции на клетку.
Все гистоны, кроме HI , чрезвычайно консервативны в эволюционном
отношении (у коровы и клевера гистоны Н2А отличаются всего одной амино-
кислотой!). Это значит, что эти белки выполняют важную функцию, которая
у всех эукариот обеспечивается одинаково. Практически любая мутация в ги-
стоновых генах детальна.
Компактизаиия ЛИК , хромосомы и кариотипы
139
Н 1 — очень вариабельная фракция. Этот гистон различен не только у ви-
дов , но даже у одного организма, в зависимости от стадий онтогенеза.
На первом уровне компактизации двойная спираль ДНК с диаметром 2 нм
как на катушку наматывается на белковый комплекс, содержащий 8 молекул
гистонов — гистоновые октамеры (рис. 21.1, А , Б ). Образуется структура, напо-
минающая бусы на нитке, диаметром 11 нм (рис. 21.1, В). В состав сердцевины
каждой такой бусины — нуклеосомы — входит по две одинаковых молекулы че-
тырех разных гистонов (Н2А, Н2В , НЗ и Н4 ). Они образуют кор (сердцевину)
нуклеосомы. На кор наматывается ДНК — 1,75 левых витка спирали. Устье этих
витков замыкается молекулой гистона Н 1. Непосредственно с октамером кон-
тактирует 145 пар нуклеотидов, и 20-40 пар нуклеотидов остается между нукле-
осомпыми корами. Нуклеосомная нить короче неупакованной молекулы ДНК
в 7 раз. Молекула диаметром 2 нм упаковывается в нить диаметром 11 нм.
На втором уровне компактизации нуклеосомы сближаются с помощью
гистона Н1 . Образуется фибрилла с диаметром 30 нм (рис. 21.1 , Г- Ж ) , а общая
длина уменьшается еще в 6-10 раз.
На третьем уровне упаковки формируются петли , содержащие
от 20 до 80 тыс. пар нуклеотидов (рис. 21.1, 3). Петли «подвешиваются» на ядер-
ных белках , образующих так называемый «скэффолд» (англ, scaffold
ра). В «устье» каждой петли находятся белки, которые узнают определенные
нуклеотидные последовательности и при этом имеют сродство друг к другу.
Типичная хромосома млекопитающих может содержать до 2500 петель. Как
правило, петли сунерспирализованы. Частично расправляются те пет ли, в ко-
торых расположены активно транскрибирующиеся в данный момент гены.
Негистоновые белки и гистоны вместе с ДНК образуют хроматин, видимый
лишь в электронный микроскоп. Среди негистоновых белков хроматина есть
не только белки, участвующие в упаковке ДНК, но и ферменты, осуществляю-
щие транскрипцию, репликацию и репарацию.
Перед делением клетки молекулы ДНК удваиваются, и в них возникает
четвертый уровень упаковки , за счет чего хромосома утолщается и становит -
ся видимой в световой микроскоп. На этом уровне упаковки структура, полу-
чившаяся на предыдущем уровне, свертывается в спираль, образуя розетки
(рис. 21.1, Я). Затем розетки петель складываются в стопки, которые можно
видеть в световой микроскоп (рис. 21.1, К ) . В целом «укорочение» ДНК дости-
гает 104. Если из такой компактизоваипой хромосомы удалить гистоны, белки
скэффолда будут продолжать скреплять петли ДНК, но сами петли при этом
расправятся и окружат «скелет» хромосомы плотным облаком, во много раз
большим, чем метафазная хромосома. Это наглядно показывает, как плотно
упакована ДНК в хромосомах (рис. 21.2, А).
У бактерий гистонов нет, но ДНК связана с положительно заряженными по-
лиаминами и ионами Mg2+
. Поэтому у бактерий нет нуклеосом. Однако их ДНК,
опо-
140
Лекиия 21
\£J:
Рис. 21.1. Упаковка ДНК
А — строение нуклеосомы: 1 — нить ДНК ; 2 — гистоновый окта мер;з — гистон Hi ;
Б — электронно-микроскопическая фотография нуклеосомы: i — нить ДНК ;
2 — гистоновый октамер); В — нуклеосомная нить; Г — схема и Д — фотография
образования зо-нанометровой фибриллы: i — нить ДНК ; 2 — гистоновый октамер;
3 — гистон Hi ; Е — фибрилла в поперечном разрезе:i— нить ДНК; 2 — гистоновый
октамер; з — гистон Hi ; ж — фотография 30-нанометровых фибрилл; з — петли ДНК:
1 — ДНК; 2 — негистоновые белки; И — розетка петель :i— ДНК; 2 — негистоновые
белки; з — белки ядерного матрикса; К — стопки петель в метафазной хромосоме:
1 — розетка; 2 — один виток спирали
(brooklyn.cuny.edu, mun.ca, ciick 4biology.info)
подлине в 1000 превышающая размеры самих бактериальных клеток, также
компактизовапа. Вся кольцевая молекула организована в 20-100 (в зависимости
от размера генома) суперспирализованных петель. Эти петли можно увидеть
после обработки клеток растворами, удаляющими часть белков (рис. 21.2, Б).
В обеспечении суперспирализации участвуют молекулы малых РНК.
У архей, имеющих сходство с эукариотами в строении генов, обнаружены
гистоны и гистоноподобные белки, связанные с ДНК, и, соответственно, ну-
клеосомы. Но в целом о компактизации ДНК архей известно мало.
Компактизаиия ЛИК , хромосомы и кариотипы
141
Рис. 21.2 . Петли ДНК после снятия первых уровней упаковки
А — эукариотическая хромосома: i — петли ДНК ; 2 — белки скэффолда
Б — прокариотическая хромосома, стрелкой отмечены петли ДНК
(mun.ca)
Удвоившиеся перед делением клетки хромосомы эукариот состоят из двух
идентичных хроматид. Хроматиды соединены в одном участке, но соединяют-
ся в нем не молекулы ДНК, а специальные белки — когезины (рис. 21.3, Б). Эти
белки по своей форме напоминают английскую булавку, которой хроматиды
« пристегнуты» друг к другу. Этот участок соединения хроматид носит название
центромеры. Разные хромосомы могут отличаться друг от друга положением
центромеры. В тетацентрических хромосомах центромера находится посе-
редине, в субметацентрических она сдвинута к одному из концов , в акроцен-
трических находится почти на самом конце, рядом с теломерой (рис. 21.3, А).
Часть хромосомы от центромеры до теломеры называют плечом. Хромосомы
одной клетки различаются и по положению центромеры, и по длине. У челове-
ка самая мелкая хромосома в 5 раз короче самой длинной.
Во время деления клетки па центромере формируется особая белковая
структура — кинетохор (рис. 21.3, Б). Это сложный комплекс из многих бел-
ков. К кинетохору присоединяются идущие от клеточного центра микротру-
бочки, служащие «рельсами», по которым моторные белки кинетохора двига-
ют хромосомы к полюсам клетки во время ее деления.
На конце молекул ДНК находятся нс содержащие генов тсломсриыс по-
вторы — многократно повторяющиеся последовательности нуклеотидов.
142
Лекиия 21
А
В
Г
2
*
I
3'
Е
Рис. 21.2 Строение хромосомы эукариот
А — слева направо: метацентрическая, субметацентрическая, акроцентрическая
хромосомы; морфология хромосом : i — хроматида; 2 — плечи;з — центромера;
4 — теломеры; Б — кинетохор: i — белки кинетохора; 2 — микротрубочки;
В — белки когезины: г — «застегнутые» вокруг центромеры; 2 — «расстегнутые»
во время разделения центромеры в митозе;Г — строение теломеры: i — нити ДНК ;
2 — теломерные белки;,Д — схематическое изображение расположения хромосом
в ядре : 1 — хромосомные территории; 2 — «транскрипционные фа6рики»;з — петли
транскрибируемых участков ДНК ; Е — фотография хромосомных территорий ядра
клетки человека; каждая хромосома светится своим цветом
(molecularstation.com)
При этом З’-конец молекулы ДНК всегда выступает, т. е. имеет одноните-
вой участок, образующийся в результате недорепликации З’-конца матрицы
(см. лекцию 17). Эти участки защищаются от действия нуклсаз специальными
теломерными белками. С помощью этих белков конец молекулы закручивается
Компактизаиия ЛИК , хромосомы и кариотипы
143
в кольцо (рис. 21.3, Г). Самый кончик при этом образует триплекс — тройную
нить. Теломеры защищают кодирующие последовательности ДНК — гены —
от разрушения ферментами.
В неделящихся клетках , когда нет последнего уровня компактизации, ДНК
не просто заполняет внутреннее пространство ядра — хромосомы занимают
в ядре определенную компактную территорию. Предполагается, что те части
хромосомы, где находятся неработающие гены или вообще нет генов, спрятаны
внутрь этой хромосомной территории, а активно транскрибирующиеся районы
декомпактизуются и в виде петель находятся в относительно свободных местах
(рис. 21.3, Д, Е). При этом теломеры и некоторые другие участки хромосом закре-
плены на внутренней мембране ядерной оболочки, а области хромосом, обычно
соответствующие границам петель ДНК (третий уровень компактизации) , за-
креплены на так называемом ядерном скелете. Определение белков, входящих
в его состав, показало, что там находятся ферменты: ДНК-полимераза, топоизо-
мераза, РНК-полимераза и некоторые другие. По современным представлениям
в ходе репликации и транскрипции не они движутся по ДНК, а, наоборот, нить
ДНК протягивается через закрепленные на ядерном матриксе ферменты. Эти
участки ядра назвали «транскрипционными фабриками» , именно туда и протя-
гиваются петли активно считываемой ДНК.
Полный упорядоченный набор хромосом клетки на стадии метафазы ми-
тоза называют кариотипом (греч. Kctpiov — ядро, тиле > с; — форма). Количество
хромосом и их морфология в пределах одного кариотипа постоянны. У организ-
мов, размножающихся половым путем, соматические клетки обычно содержа!
два набора хромосом: один, полученный от отца, другой — от матери. Поэтому
количество хромосом в кариотипе принято обозначать символом 2п (табл. 5).
Кариотипы разных видов организмов могут различаться по числу, размерам
и форме хромосом и служат своеобразным паспортом вида. Организмы разных
видов могут иметь одинаковое число хромосом, однако полностью идентичные
кариотипы встречаются весьма редко и только у близких видов.
Таблица 5
Числа хромосом (2п) некоторых организмов
Вид
Вид
2п
2п
32
38
дрожжи
кошка
собака
2
78
лошадиная аскарида
дрозофила
8
84
носорог
48
46
окунь
человек
36
16
лягушка
лук
бобы
78
12
курица
40
20
кукуруза
мышь
барабинский хомячок
20
14
горох
144
Лекиия 21
В некоторых случаях хромосомы одного кариотипа трудно отличить друг
от друга по внешнему виду. На рис. 21.4 приведены фотографии кариотипа чело-
века. Хромосомы 6-12 и Х-хромосома, хромосомы 13-15, хромосомы 19-20,
хромосомы 21-22 и Y-хромосома образуют группы, внутри которых отличить
гомологичные хромосомы от негомологичных очень трудно, а иногда и невоз-
можно. В этих случаях помогают специально разработанные методы дифферен-
циальной окраски хромосом. Обработка препаратов хромосом с помощью про-
теолитического фермента трипсина приводит к удалению части хромосомных
белков, в результате окраска хромосом становится полосатой. Распределение
и толщина полос строго постоянны. Это позволяет не только «различать в лицо»
хромосомы одного вида, но и сравнивать между собой хромосомы, принадлежа-
МUи МИ 11!
*
il8I.
1
2
3
4-5
1
2
3
4
5
XY
Шшшшш НII3!кilва
6-Х
-
12
6
7
8
9101112
ISНSeИ32
17 18
АММА U Л5ЛА
13-15
*ЯЛИ
-
19-го-
16
17 18
131415
Ч21
19 20
16
М
ккАА*
-
21-22
-
Y-
21
22
Рис. 21.4
. Кариотип человека : слева — обычная окраска;
справа — дифференциальная окраска
Ошч
И*
*
шо
чшо
чшо
ИШ#1!
2
13
15
Рис. 21.5
. Сравнение трех хромосом человека (ч)
с хромосомами шимпанзе (ш) и орангутана (о)
Компактизаиия ЛИК , хромосомы и кариотипы
145
щие разным видам, определять их родственные связи, различать близкие виды.
Дело в том, что рисунок « волосатости» определяется генетическим содержимым
данного участка хромосомы и сохраняется при перестройках хромосом.
Кариотипы разных видов млекопитающих обычно сильно различаются
между собой, но, поскольку предок у всех млекопитающих общий, то и хромосо-
мы их между собой тоже «родственники». В ходе эволюции кариотипы подвер-
гались многочисленным перестройкам, при этом менялось взаимное располо-
жение разных участков хромосом. Но отдельные участки хромосом (а у близких
видов и целые хромосомы) сохранили взаимное расположение и генов и рисун-
ков окраски. На рис. 21.5 приведены фотографии хромосом
2,13и15чело-
века в сравнении с соответствующими хромосомами близких видов: шимпанзе
и орангутана. Видно, что хромосоме 2 человека соответствуют по две соединен-
ных в области центромеры хромосомы обезьян. При этом общий рисунок окра-
ски у них одинаков. Остальные две хромосомы одинаковы у всех грех видов.
146
ЛЕКиИЯ 22
Лифференииальная активность генов
Дифференциальная активность генов. После того как судьба клетки
определена в процессе детерминации, она дифференцируется: приобретает
специфичные признаки, характерные для той или иной ткани. У млекопита -
ющих или птиц насчитывается около 300 типов клеток. Они отличаются друг
от друг а нс только размерами или формой, но и тем, что в них синтезируются
разные мРНК и белки. Другими словами, в дифференцированных клетках раз-
ных типов наблюдается дифференциальная активность генов — транскрип-
ция и трансляция разных участков ДНК с разной генетической информацией.
Ни в одной клетке многоклеточного организма ни при каких условиях не счи-
тывается информация со всех генов, которые в ней имеются. Большая часть ге-
нов в любой клетке не работает. Например, в клетках мозга человека работае ]
15 % генов, а в клетках печени — не более 5 %, как ив поджелудочной железе,
и в селезенке. В одной и той же клетке в ходе индивидуального развития опре-
деленный ген в нужное время может «включаться» или «выключаться». Вклю-
чаются гены, как мы видели, с помощью транскрипционных факторов. А каким
же образом происходит «выключение» генов? Таких механизмов несколько —
регуляция с помощью транскрипционных факторов, регуляция с помощью ми-
кроРНК, ремоделирование (преобразование) хроматина , метилирование ДНК.
Предполагается, что микроРНК (см. лекцию 15) осуществляют тонкую
« подгонку» активности генов. К 2009 г. для человека было идентифицирова-
но более 400 микроРНК, регулирующих действие не менее 10 000 генов (одна
miPHK может иметь несколько «мишеней»). Использование компьютерных
программ позволило предсказать, что в геноме человека должно быть не менее
1000 генов микроРНК.
Ремоделирование хроматина. Одним из способов выключения генов яв-
ляется ремоделирование (перестройка структуры) хроматина. Самым первым
уровнем компактизации ДНК в клетке является наматывание нити ДНК на ги-
стоновый октамер — образование нуклсосомы (см. лекцию 21). Образующие
сердцевину нуклеосомы гистоны имеют выступающие за пределы нуклеосо-
Дифференциальная активность генов
147
мы N -концы. Эти белковые «хвосты » могут подвергаться химической моди-
фикации, например ацетилированию ( рис. 22.1, А). Присоединение кислотных
остатков нейтрализует избыточный заряд положительно заряженных концов
гистонов и ослабляет взаимодействие ДНК с нуклеосомным кором. Нуклеосо-
мы, в которых гистоны ацетилированы, представляют собой транскрипцион-
но активную ДНК, так называемый эухроматин.
Для выключения генов специальные ферменты деацетилируют гистоны.
Гистоновые «хвосты» метилируются, а затем к ним присоединяются спсциаль-
А
-VV
*
1
1
Гг
Рис. 22.1. Дифференциальная активность генов
А — модификация гистонов в хроматине: г — ацетилированные гистоны
в эухроматине; 2 — метилированные гистоны в гетерохроматине; з — белок HPi ,
связывающийся с метилированными гистонами и блокирующий транскрипцию;
Б — электронно-микроскопическая фотография хроматина :i— эухроматин;
2 — гетерохроматин; В — метилирование ДНК при геномном импринтинге:
1— ГЦ-островок в районе промотора; 2 — метилирование цитозина в паре ГЦ;
Г — половой хроматин, стрелкой отмечена инактивированная Х-хромосома
в женской клетке
(cellbiol.ru, mun . ca)
148
Лекиия 22
ные белки ( НР1). Это вызывает компактизацию хроматина, в котором ДНК ста-
новится недоступной для РНК-полимеразы. Это так называемый гетерохрома-
тин — хроматин, гены в котором неактивны. На фотографиях гстсрохроматин
выглядит более темным, чем эухроматин (рис. 22.1, Б ). Гетерохроматизация при-
водит в одновременному выключению протяженных участков ДНК.
Метилирование ДНК. Существуют и способы выключения меньших
участков, содержащих один или несколько близко расположенных генов. Од-
ним из широко распространенных у позвоночных животных механизмов ре-
прессии (подавления активности) генов является метилирование азотистых
оснований в ДНК. Метилирование (присоединение радикала -СН3 к цитозину;
у некоторых организмов метилируется аденин) представляет собой такую хи-
мическую модификацию молекулы ДНК, которая не нарушает смысла содер-
жащейся в ней генетической информации. Специальный фермент присоеди-
няет метальный радикал к цитозину, причем происходит это в участках ДНК,
в которых в каждой из цепей в направлении 5’ -3’ после цитозина расположен
гуанин (так называемый мотив 5’- ЦГ-3’)
-
«Одинокие» цитозины, а также ци-
тозины , стоящие перед гуанином (мотив 5’- ГЦ-3’) нс метилируются. Особые
белки, участвующие в регуляции транскрипции генов (обычно это белки, осу-
ществляющие репрессию), связываются только с метилированными цитози-
нами. При этом другие регуляторные белки (обычно участвующие в актива-
ции транскрипции) теряют способность связываться с участком ДНК после
того, как в нем произошло метилирование.
В промоторных районах
большинства генов эукариот находятся
ГЦ -островки — участки ДНК с повышенным содержанием мотива З’- ПГ-З’.
В зависимости оттого, в клетках какой ткани находится данный ген, ЦГ-о -
стровки в его промоторе могут быть либо метилированы, либо свободны от ме-
тальных групп. Метилированные промоторы ДНК недоступны для РНК-поли-
меразы. В результате гены, находящиеся за метилированными промоторами,
оказываются выключенными (рис. 22.1, В). Таким образом, метилирование
ЦГ-островков наряду с другими факторами участвует в определении, какие
гены должны работать в данной ткани, а какие должны «молчать».
Очень важно, что метилирование не нарушает комплементарности цито-
зина и гуанина и не препятствует репликации ДНК. Специальный фермент уз-
нает «полуметилированную» (образовавшуюся в результате полуконсерватив-
пой репликации ДНК, в которой старая цепочка метилирована , а новая — пет)
и метилирует вновь синтезированную нить ДНК. Поэтому репрессированное
состояние гена, характерное для разных типов клеток и тканей, сохраняется
в ряду клеточных поколений.
Метилирование ДНК широко распространено у прокариот и эукариот,
а также их вирусов. Функции метилирования нс ограничиваются специфич-
ной регуляцией транскрипции генов в разных тканях . Метилирование исполь-
Дифференииальная активность генов
149
зуется клетками для защиты от транскрипции чужеродных последовательно-
стей ДНК (например, провирусов, мобильных генетических элементов), регу-
ляции репликации. Нарушения состояния метилирования генов могут приво-
дить к различным заболеваниям, в том числе и к раку.
Геномный импринтинг. Метилирование ГЦ-островков лежит в основе
явления, называемого геномным импринтингом (от англ , imprint — отпечаток).
Все организмы, размножающиеся половым путем, получают одну из гомоло-
гичных хромосом от отца, другую от матери. Эти хромосомы в течение всей
жизни индивидуума несут отпечаток своего отцовского или материнского
происхождения, так как оказалось, что некоторые гены метилированы по- раз-
ному в яйцеклетках и в сперматозоидах . И только при образовании гамет эти
отпечатки стираются, а взамен образуются новые отпечатки. Это и попят-
но — в гаметах должны работать совсем другие гены. Новое метилирование
происходит в разное время для разных генов: одни гены метилируются на ста-
дии дробления зиготы, другие оказываются метилированными уже в зрелых
гаметах . В результате яйцеклетка (как и сперматозоид) получает все хромосо-
мы с материнским (или отцовским) отпечатком, несмотря на то, что примерно
половина хромосом происходит от бабушки, а половина от дедушки. Другими
словами, отпечатки бабушек и дедушек не сохраняются. Эти отпечатки пред-
ставляют собой «рисунок метилирования» — в мужских и женских гаметах он
разный. Это означает, что из пары аллельных генов гетерозиготы проявится
не доминантный, а тот, который получен, например, от матери (если репрес-
сирован ген в сперматозоиде, а в яйцеклетке он работает) или от отца (если
репрессирован ген в яйцеклетке). У человека известно несколько наследствен-
ных заболеваний, вызываемых рецессивными мутациями генов, находящихся
в импринтируемых районах хромосом. Важно отметить, что геномному им-
принтингу подвергаются только некоторые гены (у человека около 150 генов).
Как правило, это гены, работающие во время эмбрионального развития. Боль-
шинство же генов не импринтируется, и в клетках работают оба их аллеля.
Инактивация Х-хромосомы. Из курса генетики известно, что одна
из Х-хромосом женского пола у млекопитающих инактивируется, чем достигает-
ся равенство «дозы гена» в мужских и женских клетках . Это явление тоже можно
отнести к дифференциальной активности генов. Эта инактивация происходит
на ранних стадиях эмбриогенеза. Плотно упакованная Х-хромосома недоступна
для РНК-полимеразы (за исключением небольших , так называемых псевдоауто-
сомных районов, для которых имеются гомологичные участки в Y-хромосоме).
В некоторых клетках на стадии интерфазы она видна в микроскоп (рис. 22.1, Г).
В инактивации Х-хромосомы участвует специальный ген XIST. С этого гена
считывается linkPHK (см. лекцию 15), не кодирующая никакого белка. Эта РНК
в комплексе со специальными белками связывается с той из Х-хромосом, в кото-
рой этот ген работает, и инактивирует ее. На вторую хромосому эта РНК «пере-
150
Лекиия 22
браться» не может. В клетках существует специальный механизм, подсчитыва-
ющий Х-хромосомы. У человека известно несколько врожденных заболеваний,
обусловленных особыми мутациями — наличием лишних Х-хромосом. В таких
случаях инактивации подвергаются все «лишние» Х-хромосомы. Только одна
Х-хромосома, в которой ген XIST не работает, остается транскрипционно ак-
тивной. Инактивация Х-хромоеомы происходит у многоклеточного эмбриона,
причем в каждой клетке хромосома для инактивации «выбирается» случайно.
Только поэтому у женщин не проявляются такие сцепленные с Х-хромосомой
заболевания, как, например, гемофилия — ведь в половине клеток организма
инактивирована мутантная хромосома. Половины здоровых клеток достаточно
для того, чтобы болезнь не проявилась.
Иммуноглобулиновые гены у млекопитающих. У высших животных
в ходе онтогенеза могут происходить весьма сложные перестройки генома.
Наиболее сложными являются изменения генома, происходящие при форми-
ровании генов антител, осуществляющих иммунитет.
Антитела представляют собой белки иммуноглобулины с четвертичной
структурой. Молекула антитела состоит из двух коротких и двух длинных
полипептидных цепей, связанных друг с другом дисульфидными мостиками.
Все цепи имеют константную и вариабельную части. Вариабельные (изменя-
ющиеся) части отличаются друг от друга и первичной, и третичной структу-
рой. Вариабельные участки образуют активный центр антитела, который вза-
имодействует с антигеном (рис. 22.2, А ). Именно пространственная структура
этой части молекул создает необычайное разнообразие антител. Оно может
достигать нескольких миллионов отличающихся друг от друга белковых мо-
лекул. Как же достигается такое разнообразие? Ведь геном млекопитающих
содержит всего около 23 000 генов.
Гены иммуноглобулинов устроены особым образом. Они имеют преры-
вистую структуру: отдельные участки лежат на некотором расстоянии друг
от друга. Кроме того, вариабельная часть молекулы кодируется двумя или тре-
мя (у разных классов иммуноглобулинов) типами последовательностей, каж-
дый их которых состоит из нескольких блоков , отличающихся друг от друга.
Другими словами, в кроветворных клетках , как и во всех клетках организма,
иммуноглобулиновых генов нет, а есть только «заготовки» — отдельные бло-
ки, из которых в процессе дифференцировки собираются работающие гены
(рис. 22.2, Б ). В период эмбрионального развития организма при размноже-
нии клеток-предшественниц лимфоцитов происходит так называемый генный
сплайсинг — выборочная репликация этих генов, при которой пропускаются
некоторые из блоков. В результате получается набор клеток, отличающихся
друг от друга набором блоков, формирующих функционирующие гены легких
и тяжелых цепей иммуноглобулинов. Для каждой из цепей возможно более
тысячи вариантов сочетания блоков. Поскольку гены для легкой и тяжелой
Дифференииальная активность генов
151
Б
,2
.3
1
4
от * козсипам
—
н нэоо ооооао
*
t
I
5
6
ашхмш*
'
t
7
\
-ш
8
I
1f
\
I9
11
10
А
Рис. 22.2 . Иммуноглобулиновые гены млекопитающих
А — строение антитела млекопитающих : i
—
константная часть тяжелой цепи;
2 — вариабельная часть тяжелой цепи;з — константная часть легкой цепи;
4 — вариабельная часть легкой цепи;5 — активный центр; Б — формирование
разнообразия генов антител : 1
—
участки генов вариабельной части тяжелых
цепей; 2 — участки генов константной части тяжелых цепей;3 — участки генов
вариабельной части легких цепей; 4 — участок генов константной части легких
цепей;5 — реорганизация ДНК; 6 — повторная реорганизация ДНК;7— выборочная
транскрипция; 8 — сплайсинг;g — трансляция; ю — тяжелая цепь;и — легкая цепь
цепей «собираются» независимо друг от друга, число сочетаний блоков в од-
ной молекуле превышает несколько миллионов. Но на этом еще не исчерпы-
ваются возможности изменения структуры иммуноглобулина. Дело в том, что
в участках ДНК, кодирующих вариабельные части молекулы в клетках -пред-
шественницах лимфоцитов, повышена частота мутаций. Мутационный про-
цесс создает дополнительный источник увеличения разнообразия структуры
антител. Кроме того, лимфоцит с уже «готовыми» собранными генами может
синтезировать несколько различных антител, так как выбор блоков осущест-
вляется и на стадии транскрипции и сплайсинга мРНК. Поэтому для каждого
поступающего в организм антигена находится лимфоцит, синтезирующий ан-
титело, подходящее по своей пространственной структуре к этому антигену,
даже если организм с этим антигеном раньше не встречался.
152
ЛЕКиИЯ 23
Мобильные генетические элементы. Псевдогены.
Эволюиия геномов
Значительную часть геномов составляют мобильные генетические эле-
менты (иногда называемые «прыгающими генами» ) и псевдогены. Мобильные
генетические элементы (или транспозоны ) представляют собой небольшие
участки ДНК, способные перемещаться по геному, встраиваясь в разные его
участки. Они были открыты в конце 40-х гг. XX в. американским генетиком
Барбарой Мак -Клинток, описавшей мозаичность окраски зерен у кукурузы,
не объяснимую законами Менделя и мутационной теорией. Она предполо-
жила, что некоторые гены могут менять свое местоположение в геноме. Это
было первое исследование, показавшее, что геном динамичен. Вначале к ее от-
крытию отнеслись скептически, а через 35 лет присудили за него Нобелевскую
премию. Сейчас МГЭ обнаружены у всех живых организмов: и у бактерий, и у
архей, и у всех эукариот. В настоящее время в обширную группу подвижных
элементов гецома, кроме собственно МГЭ, включают плазмиды и вирусы.
Долгое время их считали « генетическим мусором» или геномными па-
разитами. Но несмотря на то что некоторые из них , действительно, можно на-
звать паразитами, они играют важную роль в обеспечении некоторых функ-
ций организма и в эволюции.
Все МГЭ делят на два класса: ДНК-траспозоны и более многочисленные
ретроэлементы (рис. 23.1). Их различают по механизмам, которые они ис-
пользуют для перемещения по геному.
Самые простые ДНК-транспозоны — IS-элементы ( insertion sequences ).
Их размер чаще всего составляет около 700-1500 п. п. На концах они содержат
инвертированные (палиндромные) повторы (~20 п. н.) (рис. 23.1). IS-элементы
содержат только один ген — ген транспозазы, фермента, обеспечивающего пере-
мещение IS-элемента по геному. Этот ген, находясь в составе транспозона в ДНК
клетки, транскрибируется и транслируется клеточными ферментами и рибосо-
мами. Синтезированные молекулы фермента обладают сродством к коротким
инвертированным (палиндромным) повторам, фланкирующим ген транспозазы.
Мобильные генетические элементы. Псевдогены. ..
153
Рис. 2J.1. Мобильные генетические элементы:
А — ДНК -транспозоны: / — /S- элемент: i — ген транспозазы; 2 — промотор;
3 — терминатор; 4 — инвертированные повторы. II — Гл- элемент: 1— структурные
гены; 2 — /S- элементы; Б — ретроэлементы: i — вирусная частица;
2 — ретровирусная геномная РНК и обратная транскриптаза;3 — ДНК -копия
вирусного генома; 4 — провирус
Две молекулы транспозазы, присоединенные к фланкирующим повторам,
сворачивают участок, содержащий ген, в петлю. Затем транспозазы разрезают
ДНК по краям гена и сшивают получившиеся концы хозяйской ДНК, вырезав
свой ген. Концы вырезанного гена удерживаются молекулами фермента. Затем
димер транспозазы, найдя в другом участке ДНК подходящий сайт, присое-
диняется к нему, разрезает хозяйскую ДНК с образованием « липких концов»
и пришивает к ним концы своего гена. Затем клеточные ферменты заделывают
оставшиеся одноцепочечные бреши. В результате сайт встраивания оказыва-
ется дуплицированным. Так происходит интеграция вырезанного фрагмента
в новое место (рис. 23.2). Этот механизм перемещения называется «вырезать
и вставить» ( cut and paste ) . Распознаваемые трапспозазой последователыю-
сти-мишени очень невелики (обычно 5-10 нуклеотидов) , поэтому в геноме
всегда найдется такое место, где случайно содержится именно эта последова-
тельность. Если транспозон в дальнейшем переместится в другое место гено-
ма, то на прежнем месте сохранится дупликация сайта-мишени. В некоторых
случаях , если перемещение элемента происходит во время репликации кле-
точной ДНК, возможна ситуация, когда место расположения элемента уже ре-
154
Лекиия 23
Ген транспозазы
1
1
>
Транскрипция
Трансляция
2
2
Разрезание
мишени
Встраивание
^
Заделывание брешей
Рис. 23.2
.
Перемещение /S-элемента
1— инвертированные повторы; 2 — мономеры транспозазы;
3 — сайт узнавания на молекуле ДНК -мишени
плицировалось, а место встраивания — еще нет. Тогда вырезание может про-
изойти только из одной копий ДНК, а в другой копии транспозон останется.
Успевшая встроиться в новое место копия удвоится, и в результате количество
встроенных копий увеличится. Такой механизм перемещения носит название
«копировать и вставить» ( copy and paste ).
Ги -транспозоны содержатся в геномах как прокариот, так и эукариот.
Помимо гена транспозазы в них находится один или несколько структурных
генов (рис. 23.1, Л , II ). Транспозоны прокариот чаще всего содержат так на-
зываемые гены лекарственной устойчивости. Эти гены кодируют ферменты,
расщепляющие антибиотики. Количество копий транспозона в клетках бак-
Мобильные генетические элементы. Псевдогены. ..
155
терий возрастает при наличии в среде антибиотика, ген устойчивости к ко-
торому кодируется в данном транспозоне. Существуют транспозоны, не со-
держащие гена транспозазы. Такие транспозоны в начале и в конце содержат
IS-элементы, за счет транспозазы которых они и перемещаются. Транспозо-
ны эукариот могут содержать гены, кодирующие белки, облегчающие пере-
мещение по геному (например, особые ДНК-связывающие белки ). Актив-
но перемещающиеся транспозоны обнаружены у многих растений , а также
у животных от беспозвоночных до амфибий. В геноме человека также обна-
ружены ДНК-транспозоны, однако они неактивны, так как в них накопилось
много мутаций. Полагают, что геномы млекопитающих вообще не содержат
активных ДНК-транспозонов.
К классу ДНК-трапспозонов прокариот относят плазмиды. Плазмида —
это маленькая кольцевая молекулы ДНК у бактерий. Она меньше геномной
ДНК в тысячи раз. Плазмиды способны к автономной репликации, независи-
мой от репликации основной молекулы ДНК. Они так же, как и основной ге-
ном , могут включать транспозоны. Некоторые плазмиды, содержащие опреде-
ленные транспозоны, способны встраиваться (интегрироваться) в геномную
ДНК. Такие плазмиды называют эписомами.
После перехода из основной ДНК в плазмиду транспозон может попасть
с ней в другую бактерию, придавая новому хозяину ранее отсутствовавшую
лекарственную устойчивость. Кроме того, при вырезании транспозона из ге -
номной бактериальной ДНК могут захватываться участки генома одной
бактерии, которые вместе с транспозоном переносятся в другую бактерию.
Плазмиды и эписомоподобные факторы есть и у некоторых эукариот, напри -
мер, у дрожжей.
Некоторые вирусы животных и фаги прокариот фактически тоже являют-
ся мобильными элементами. ДНК так называемых умеренных фагов (вирусов
бактерий, не вызывающих их гибели) может встраиваться в бактериальный
геном, размножаться вместе с бактерией, а затем вырезаться, упаковывать-
ся в белковую оболочку и в виде фаговых частиц заражать другие бактерии.
Например, А -фаг может захватывать часть генетической информации одной
бактерии и переносить ее в другую. Некоторые ДНК-содержащие вирусы жи-
вотных также могут находиться в геноме клетки хозяина в форме провируса
на протяжении нескольких поколений, а потом начать перемещаться.
В некоторых случаях мобильные генетические элементы прокариот могут
передаваться ими эукариотическим клеткам. Например, почвенная бактерия
Agrobacterium tumefaciens вызывает развитие так называемых корончатых гал-
лов у растений , передавая им свою плазмиду, которая встраивается в ДНК за-
раженной растительной клетки.
Ретроэлементы. Значительно более многочисленны и разнообразны ре-
троэлементы (от лат. retro — прежде, обратно) эукариот. Все их объединяет
156
Лекиия 23
общая черта — использование обратной транскрипции (см, лекцию 24). Ак-
тивные (не «испорченные» мутациями) ретроэлементы обычно содержат
гены ферментов обратной транскриптазы (иногда се называют ревертазой)
и интегразы, необходимой для встраивания в геном синтезированной копии.
Образующаяся в результате транскрипции РНК служит матрицей для синтеза
ревертазы и интегразы. Затем ревертаза осуществляет обратную транскрип-
цию этой РНК, а интеграза встраивает полученную ДНК в геном клетки. В ре-
зультате в геноме оказывается новая копия элемента, при этом старая остается
на месте. Поэтому в отличие от ДНК-транспозонов ретроэлементы активно
размножаются в геноме. Из- за этого значительную долю геномов большинства
эукариот составляют копии ретроэлементов. Например, у млекопитающих
около 20 % геномов занимают так называемые LINE1 ( Long Interspersed Nuclear
Elements) — длинные диспергированные ядерные элементы. К счастью (ведь
геном не может увеличиваться бесконечно) , значительная часть их неактивна
из-за накопившихся мутаций.
Другую группу ретроэлементов составляют ретровирусы. Ретровирусами
называют такие вирусы, для которых обратная транскрипция является обя-
зательным этапом в жизненном цикле. Они отличаются от ретроэлементов
тем, что содержат также гены, кодирующие белки вирусной оболочки. Их ге-
номные РНК, попав в клетку, так же как и ретроэяементы, служат матрица-
ми для синтеза ДНК. На обоих концах этой двухцепочечной ДНК находятся
LTR — длинные концевые повторы нуклеотидов (long terminal repeat ) , которые
нужны для встраивания этой ДНК в геном клетки. Образующаяся в результа-
те обратной транскрипции ДНК встраивается в геном клетки хозяина с помо-
щью фермента интегразы. Этих ферментов в клетке нет, поэтому вирусы при-
носят их с собой. Встроенную ДНК называют провирусом (рис. 23.1, Б ).
К ретровирусам относится вирус иммунодефицита человека, вызываю-
щий СПИД и так называемые онкорнавирусы ( см. лекцию 24). Близкое род-
ство ретротранспозонов и ретровирусов не вызывает сомнений. Пока еще
не вполне ясно, кто от кого произошел. Ученые склоняются к мысли, что
ретровирусы произошли от ретротранспозонов в результате приобретения
генов белков оболочки. Однако, по-видимому, возможен и обратный про-
цесс — деградация вируса. На это указывает присутствие в геноме человека
и других животных множества так называемых эндогенных ретровирусов —
встроенных вирусных геномов. Если ретровирусу удается проникнуть в по-
ловые клетки, он сможет передаваться по наследству. Такие ретровирусы,
встроившиеся когда-то в геном половых клеток и устойчиво передающиеся
от родителей к потомкам, и называют эндогенными ретровирусами. Если
в череде поколений возникает мутация, портящая один из генов вируса, то
он теряет способность вызывать инфекционный процесс. Отбором такие
мутации не отсеиваются, и накопление мутаций приводит к постепенной
Мобильные генетические элементы. Псевдогены. ..
157
деградации вируса. Если в результате мутации будет испорчен ген, кодирую-
щий белок вирусной оболочки, а гены ревертазы и интегразы останутся це-
лыми, такой провирус превратится в ретротранспозон. Его дальнейшая де-
градация может привести к тому, что останутся только одни LTR — длинные
концевые повторы. Эти повторы могут содержать промотор, сигнал поли-
аденилирования и различные регуляторные последовательности, влияющие
на уровень транскрипции. Эти « беспризорные» регуляторные участки могут
быть использованы клетками для создания новых генов.
Особую группу составляют ретроэлементы прокариот (а также митохон-
дрий и пластид эукариот ) — так называемыеретроинтроны. Эти элементы со-
держат только один ген белка, обладающего активностью обратной транскрип-
тазы и эндонуклеазы. Кроме того, РЕ1К этого элемента обладает рибозимпой
активностью, благодаря которой осуществляется самосплайсинг — вырезание
интрона из пре-мРНК, считанной с этого гена. В результате трансляции MPEIK
синтезируется фермент. Его эндонуклеазная активность позволяет создать
разрыв в клеточной ДЫК. Вырезанный интрон встраивается в этот разрыв,
а ревертазный активный центр белка синтезирует ДНКовую копию интрона.
Подробнее о ретроинтронах было рассказано в лекции 14.
Псевдогены. Этим термином обозначают нефункциональные «испор-
ченные» гены. Чтобы такие гены в геноме вообще существовали, необходи-
мо предварительное удвоение гена с тем, чтобы нормальная, неиспорченная,
версия гена в геноме была и выполняла свою функцию. Известно два типа
псевдогенов: процессированные и непроцессированные. Процессированные об-
разуются с помощью ретровирусов или ретротранспозонов. Это происходит
в том случае, когда транскрибированная с обычного гена мРНК, подвергша-
яся сплайсингу, случайно оказывается матрицей для обратной транскрипта-
зы и интегразы. Получившаяся ДНК-копия матричной РНК будет при этом
встроена в геном. Но эта копия не будет содержать интронов, характерных
для клеточного гена , и , самое главное, не будет содержать промотора , который
не транскрибируется и поэтому отсутствует в мРНК. Так получи тся псевдоген:
он содержит все кодирующие белок участки, но не может считываться, так как
не имеет промотора. Непроцессированные псевдогены — результат удвоения
сегмента ДНК, содержащего этот ген. Если в одной копии гена произойдет му-
тация, делающая невозможным нормальное функционирование гена, то это
и будет псевдогеп. Организм при этом не пострадает, так как нормально рабо-
тающая копия гена у него останется. В геноме человека содержится не менее
30 000 псевдогенов — больше, чем нормальных генов.
Эволюция геномов. Эволюция — развитие живой природы от мель-
чайших предшественников прокариот до современных млекопитающих —
сопровождалась увеличением размеров генома. Однако если мы сравним
размеры геномов разных организмов, то увидим, что очень большие гено-
158
Лекиия 23
мы имеют простейшие. А геномы пресмыкающихся, птиц и млекопитающих
имеют весьма скромные размеры и варьируют очень мало. Другими слова-
ми, между размерами генома и сложностью организма нет корреляции. Этот
факт рхзвестен под названием С -парадокса (С — количество ДНК в гаплоид-
ной клетке).
Однако если мы сравним количество генов у организмов разной сложно-
сти, то увидим, что все-таки генов у человека в 5 раз больше, чем у кишечной
палочки и в 1,2 раза больше, чем у почвенной нематоды Caenorhabditis elegans.
В целом в ходе эволюции число генов в геномах увеличивалось, хотя у боль-
тттртнетва животных их количество примерно одинаково (около 20 000).
Откуда же берутся новые гены? В 1970 г. Сусумо Оно предположил (сей-
час это считается доказанным), что основным способом увеличения числа ге-
нов у эукариот является геномная дупликация с последующим накоплением
мутаций в одной из копий гена. Естественный отбор этому не препятствует,
так как старый ген сохраняет свою функцию, PI мутации не ашжают жизне-
способности организма.
В эволюционной истории позвоночных было, по крайней мерс, два ра-
унда полногеномной дупликации. Кроме того, значительная часть геномов
высших животных и растений является результатом сегментных дупликаций
(т. е. удвоения отдельных частей генома — целых хромосом 8;@! их участ-
ков). Удвоение генов создает возможность постепенного накопления мута-
ций и создания новых генов без нарушения работы старых . Образующиеся
при этом псевдогены сохраняются в геноме просто потому, что не существу-
ет активного механизма их удаления. Поскольку они ни для чего не ртужны,
то и не подвержены действию отбора. По этой причине в них накапливаются
мутации. Но иногда случается, что псевдоген может дать начало новому гену.
Если псевдоген непроцессированный, то произошедшая в нем новая мутация
может восстановить активность этого гена также с изменением функции, т. е.
с возникновением нового гена. Возникшие таким образом новые гены будут
мало отличаться от старых . Предполагают, что таким образом возникли так
называемые семейства генов. Многие гены человека повторены в геноме от не-
скольких единиц до нескольких сотен раз и образуют мупьтигенные семей-
ства. Эти гены обычно сгруппированы в определенных районах одной либо
нескольких хромосом. Во многих мультигенных семействах наряду с функцио-
нально активными генами содержатся псевдогены. Примерами мультигенных
семейств могут служить гены рибосомных , транспортных и ядерных малых
РНК, гены глобинов, тубулинов, миоглобина, актина, гены обонятельных ре-
цепторов и многих других .
Мобильные генетические элементы (МГЭ) и эволюция. Масштабное
изучение геномов прокариот в течение нескольких последних десятилетий
показало, что в отличие от эукариотических их геномы очень пластичны. Это
Мобильные генетические элементы. Псевдогены. ..
159
связано с широчайшим распространением так называемого горизонтального
переноса генетической информации — переноса генов между весьма отдален-
ными видами бактерий. Так как у прокариот нет полового процесса, многооб-
разные способы горизонтального переноса генов для них являются возможно-
стью осуществления рекомбинации. Рекомбинация необходима для преодоле-
ния последствий так называемого храповика Меллера — необратимого увели-
чения количества вредных мутаций в популяциях организмов , неспособных
к половому размножению. В отсутствие генетической рекомбинации такие
популяции неизбежно вымирают. Переносчиками генов у прокариот служат
все виды мобильных генетических элементов: транспозоны, ретроэлементы,
плазмиды, умеренные фаги.
У эукариот транспозиции МГЭ, как правило, происходят редко. Однако
они могут в определенных условиях (ухудшение условий обитания, слишком
близко родственное скрещивание) учащаться.
Перемещающиеся МГЭ часто оставляют «следы своего присутствия» —
часть нуклеотидных последовательностей — на месте, откуда они удалились.
Иногда, наоборот, они «прихватывают» часть клеточной генетической инфор-
мации, перенося ее на новое место или даже в клетки другого организма.
Встраиваясь в гены, мобильные элементы могут приводить к наруше-
нию их функций из-за нарушения кодирующей части. Их бесконтрольное пе-
ремещение может нанести существенный вред организму. Но оказалось, что
клетки эукариот могут целенаправленно регулировать активность своих МГЭ.
Во многих случаях их последовательности в составе 1 енома могут быть ме-
тилированы. В других случаях уничтожаются считанные с них РНК. Напри-
мер, у дрозофилы во время образования половых клеток начинают работать
гены особых малых (24-29 нуклеотидов) регуляторных РНК, так называемых
p/ PI 1К, и образующих с ними комплекс специальных белков PiwL Действуют
они аналогично интерферирующим РНК (см. лекцию 15). Последовательно-
сти нуклеотидов рг
'
РНК, комплементарные участкам разных МГЭ, узнают
РНК, считанные с мобильных элементов, а находящиеся в комплексе с ними
Ргич-белки уничтожают молекулы РНК. Белки этого семейства есть и у млеко-
питающих (они называются MIWI и Ml1,1 ); они тоже синтезируются во время
гаметогенеза и образуют комплексы с рг'РНК.
Однако мобильные элементы могут не только нести вред, но и играть суще-
ственную роль в эволюции. Дело в том, что они содержат самые разные регуля-
торные участки: промоторы, терминаторы, сигналы сплайсинга, энхансеры. По-
следствия появления этих участков там, где их раньше не было, может привести
к усилению или ослаблению активности генов, изменению их регуляции. Так,
было установлено, что у предка человека произошло встраивание ретровирус-
ного энхансера перед геном, кодирующим фермент пролиндсгидрогсназу. Этот
ген работает в нейронах некоторых отделов головного мозга, участвуя в синтезе
160
Лекиия 23
одного из важнейших нейромедиаторов глутамата. У шимпанзе, ближайшего
родственника человека, этой вставки нет. В результате активность этого важно-
го гена у человека существенно выше, чем у шимпанзе. Возможно, это событие
было одним из шагов, приведших к «поумнению» человека.
Мы знаем, что в геномах много LTR — повторов , оставшихся от исчез-
нувших ретротранспозонов и содержащих промотор. Если при перемещении
по геному такой сохранивший активность промотор пристроится к процес-
сированному псевдогену, тот может начать работать. Если за время его суще-
ствования в нем произошли мутации, новый ген будет отличаться от первона-
чального гена не только отсутствием нитронов, но и тем, что будет кодировать
отличающийся белок. Другими словами, возникнет новый ген.
Весьма важным является то, что перемещение МГЭ может привести к воз-
никновению новых экзонов и, как следствие, к возникновению новых белков
в результате альтернативного сплайсинга. Недавно было показано, что некото-
рые экзоны определенных генов человека возникли в результате размножения
в геноме так называемых Alu-повторов. А /м-повторы являются процессиро-
ванными пссвдогснами 7SL-PHK
—
одной из клеточных регуляторных РНК.
В геноме человека их более миллиона, и они продолжают размножаться. По-
давляющее большинство этих повторов неактивно, но некоторые продолжают
транскрибироваться (в них есть внутренний промотор). Особенно активно
они транскрибируются в клетках головного мозга. Ученые считают, что если
вслед за встраиванием А/и-повтора в интрон какого-либо гена произойдет му-
тация, в результате которой появится новый сайт сплайсинга, возникнет но-
вый экзон, а значит, появится новый белок . Такое событие может играть суще-
ственную роль в эволюции, ведь в отличие от мутации, прекращающей синтез
« старого» белка, альтернативный сплайсинг добавляет новый белок, не затра-
гивая синтез старого.
Другим путем создания новых генов является возникновение новых ком-
бинаций уже существовавших экзонов. Это может быть результатом переме-
щения транспозонов, «прихвативших » с собой часть генетического материала.
В результате появятся разные гены, содержащие одинаковые экзоны, и , соот-
ветственно, белки, содержащие одинаковые домены, но выполняющие разные
функции. В ходе эволюции эукариот такое происходило неоднократно.
Важным может быть не только приобретение новых экзонов, но и новых
нитронов. Оказалось, что с увеличением размера генома в ходе эволюции эу-
кариот интроны демонстрируют тенденцию к увеличению, причем экзоны
остаются довольно короткими. У мух и червей средний интрон (приблизи-
тельно 150 п. н .) по размеру практически равен экзону. У позвоночных разме-
ры нитронов могут достигать десятков тысяч пар нуклеотидов. Предполагают,
что длина интронов может играть определенную роль в регуляции экспрессии
содержащих их генов , которая значительно сложнее у человека, чем, напри-
Мобильные генетические элементы. Псевдогены. ..
161
мер, у рыбы. Размер и число интронов в геноме человека в расчете на один ген
больше, чем у любого другого животного.
Предполагается, что интроны были приобретены прокариотами на са-
мых ранних стадиях развития жизни при внедрении мобильных ретроэлемен-
тов. Впоследствии эти ретроинтроны оказались в эукариотических клетках
в составе геномов митохондрий и пластид. У высших эукариот в результате
известного процесса переноса митохондриальных генов в ядро интроны ока-
зались и в ядерном геноме. При этом ими была утрачена способность к коди-
рованию обратной транскриптазы и эндонуклеазы. Функциональные участки,
которые необходимы для сплайсинга, были перемещены в другие места генома
и дали начало малым ядерным РНК, которые составляют основу сплайсосом.
Геномный анализ показал, что ретроинтроны могли быть эволюционными
предшественниками ретротранспозонов, не содержащих LTR (длинных кон-
цевых повторов нуклеотидов) LINE-эдементов.
В настоящее время перемещение мобильных генетических элементов счи-
тают одним из видов мутаций. Исследования показали, что многие давно из-
вестные и хорошо изученные генные мутации у дрозофилы, мыши и других
организмов в действительности представляют собой результат встраивания
мобильных генетических элементов, а не замены или выпадения пар нукле-
отидов. Другими словами, перемещения МГЭ являются важным источником
наследственной изменчивости.
Показано, что подвижность мобильных генетических элементов может
резко усиливаться при различных неблагоприятных условиях — изменении
температурного режима, действии ядовитых веществ , при близкородствен-
ных скрещиваниях (резком уменьшении численности популяции). Благода-
ря этому мобильные генетические элементы могут играть роль «передатчи -
ка» сигнала геному организма о существенном изменении внешних условий.
Следствием перемещения МГЭ, таким образом, становится значительное
увеличение изменчивости, являющейся, как известно, материалом для эво-
люции, причем происходит это увеличние именно тогда, когда в нем возни-
кает необходимость.
В 2009 г. группой исследователей было доказано, что во время эмбрио-
нального развития человека в определенных участках (и только в них !) фор-
мирующегося мозга на короткое время резко усиливается перемещение ре-
тротрапспозопа LINE-1. Оказалось, что в предшественниках нейронов ДНК
этого элемента деметилирована, поэтому они активны. Результатом этого яв-
ляется генетическое разнообразие клеток головного мозга, расширяющее его
возможности. Можно предположить, что в случае, если изменение окажется
вредным, такие клетки погибнут. Ничего страшного в этом нет, так как ней-
ронов закладывается больше, чем нужно, и гибель некоторой их части — нор-
мальное явление, всегда имеющее место в ходе эмбрионального развития.
162
Лекиия 23
«Молекулярное одомашнивание». Еще одним механизмом возникнове-
ния новых генов является так называемое « молекулярное одомашнивание». Не-
которые ферменты или другие белки, свойственные вирусам или транспозо-
нам, обычным клеткам не свойственны. Однако иногда клеткам удается «при-
ручить» какой-нибудь транспозон, сделав его собственным геном с опреде-
ленной функцией. Это явление и назвали « молекулярным одомашниванием».
Ученым удалось установить, что такие крайне редкие, но чрезвычайно важные
события действительно имели место в ходе эволюции. Несколько «приручен-
ных » генов оболочечных белков эндогенных ретровирусов человека работают,
например, в плаценте. Эти белки (синтицины) осуществляют слияние клеток
для образования синцитиотрофобласта (наружного слоя плаценты) , а также
предотвращают повреждение плода иммунной системой матери.
« Прирученные» гены транспозаз дали начало генам так называемых
RAG-белков, которые создают разнообразие генов антител путем вырезания
и перекомбинирования фрагментов геномной ДНК. Растения, приручив гены
транспозаз, используют их для другой цели
го дня. От рстротранспозона происходит и клеточный фермент теломераза,
а дрозофила, у которой нет гена теломеразы, для удлинения теломер использу-
ет разные ретротранспозоны.
Таким образом, перемещение и размножение мобильных генетических
важный процесс, создающий генетическое разнообразие, кото-
рое служит материалом для эволюции.
слежения за длиной светово-
элементов
163
ЛЕКиИЯ 24
Обратная транскрипиия и онкогены
Обратная транскрипция — это синтез ДНК по матрице РНК. Обратную
транскрипцию описали в 1970 г. Темин, Балтимор, Дульбеко, работавшие с ви-
русом саркомы Рауса (ВСР), вызывающим саркому у кур. Это онкорнавирус
(oncoRNA), который относится к ретровирусам .
Ретровирусы — это РНК-содсржащис вирусы , в жизненный цикл кото-
рых входит стадия образования ДНК обратной транскриптазой и внедрение
ее в геном клетки хозяина в форме провируса. Предпочтительного места вне-
дрения провируса в геном нет,
В состав ретровируса входит две идентичные молекулы РНК. На 5’- конце
имеется Сар, на З’-конце — полиА-хвост. Фермент обратную транскриптазу
вирус «носит» с собой. Поверх белкового капсида имеется мембранная обо-
лочка, заимствованная у клетки -хозяина плазмалемма, инкрустированная ви-
русными белками (рис. 24.1).
Большинство ретровирусов не наносит какого-либо вреда клетке, в кото-
рую они внедрились. Но некоторые из них в ходе эволюции приобрели спо-
собность вызывать злокачественную трансформацию клеток. К таким онко-
генным ретровирусам относятся вирус иммунодефицита человека и вирус
саркомы Рауса.
Геном онкогенного ретровируса содержит четыре гена: gag — белок ну-
к лсоида, pol — обратная транскриптаза, env — белок оболочки, one — онкоген,
ответственный за злокачественную трансформацию клетки. Эти гены (кроме
гена one) транскрибируются и транслируются в виде одной молекулы поли-
протеина, который затем разрезается вирусной протеазой па отдельные белки.
Служебными последовательностями в геноме ВСР являются короткие конце-
вые повторы (short terminal repeat ), обозначаемые str5 и str3; уникальные после-
довательности U5 и U3 (U5 — 80 н., U3 — 200 н.); участок связывания затравки
PBS ( primer binding site ) (рис. 24.2).
Участок PBS комплементарен З’-концу тРНК, которая связывается с ним
и служит затравкой для синтеза ДНК. Синтезируется небольшой кусок ДНК.
164
Лекиия 24
Обратная транскриптаза, обладая еще и активностью РНКазы Н, удаляет РНК
в гибриде с ДНК, а за счет идентичности str 3 и str5 этот одноцепочечный уча-
сток ДНК взаимодействует с З’- концом второй молекулы РНК, которая служит
матрицей для продолжения синтеза цепи ДНК. Затем РНК-матрица уничтожа-
ется и по образовавшейся цепи ДНК строится комплементарная. Созданная
Рис. 24.1
. Схема строения вируса саркомы Рауса
1— РНК ; 2 — обратная транскриптаза;3 — интеграза;
4 — белковый капсид;5 — матрикс; 6 — мембранная
оболочка, 7 — трансмембранные белки
вирусного происхождения
str5 PBS
pol
из
one
U5 gag
str3
polyA
env
Puc. 24.2
. Структура генома SCP: gag — белок капсида, матрикса и нуклеокапсид
(укладка димера РНК ); pol — протеаза, обратная транскриптаза и интеграза; env —
трансмембранный белок оболочки; one — онкоген; strg и stn, — короткий концевой
повтор; Ug и U3 — уникальные последовательности; PBS — участок связывания
затравки
Обратная транскрипция и онкогены
165
таким образом молекула ДНК длиннее РНК. Она содержит LTR (U3 str 3(5)
U5). В форме провируса она находится в геноме клетки хозяина. При митозе
и мсйозс передастся дочерним клеткам и потомкам (рис. 24.3).
Интеграза работает так же, как и транспозаза (см. рис. 23.1). Она в составе
нуклеопротеинового комплекса сводит вместе тупые концы линейной ДНК,
тРНК-праймер
J3
РНК вируса
5'
3’
1Обратная транскриптаза достраивает
праймер к 5’-концу РНК
I
PBS
Обратная транскриптаза переносится к участку R З’-конца вирусной РНК
изR
РНКаза Н разрушает цепь РНК
гетеродуплекса РНК -ДНК о
Обратная транскриптаза
достраивает праймер
к 5 -концу РНК
Фрагмент РНК используется как
праймер для синтеза второй
цепи ДНК
РНКаза Н разрушает цепь РНК ,
-
ч
гетеродуплекса РНК -ДНК
ДНК достраивается
3
РНКаза Н разрушает тРНК
Второй перенос синтеза на PBS-последовательность
I
п
IЗавершение синтеза ДНК
U3RU5
U3RU5
LTR
LTR
Рис. 24.3
. Схема обратной транскрипции ретровируса
166
Лекиия 24
а затем, удаляя по два нуклеотида с каждого З’-конца, превращает двуцепочеч-
ные концы в усеченные с 5’-выступом. Сайты-мишени выбираются интегра-
зой случайно. Она вносит двуцепочечный надрез со смещением, 5’-концы на-
дрезов ДНК мишени ковалентно присоединяются к усеченным З’ -концам ДНК
ретровируса. Заполнением одноцепочечных участков занимаются клеточные
ферменты репарации. В ходе этой реакции 5’-концевые выступы ДНК ретро-
вируса удаляются. В результате провирус оказывается окаймленным прямыми
повторами 4-6 пар нуклеотидов специфично для каждого вируса. При дей-
ствии на клетку канцерогенов , неблагоприятных условий (стресс, радиация)
провирус транскрибируется, образуются вирусные белки, в том числе и те, ко-
торые приводят к злокачественной трансформации клетки.
Большинство изученных вирусных онкогенов кодируют протеипкипазу,
фермент, который фосфорилирует белки. Как правило, это тирозиновая про-
теинкиназа. В клетке есть собственные протеинкиназы, в том числе и тирози-
новая, но гораздо более активны сериновая и треониновая. Гены, кодирующие
клеточные протеинкиназы, обозначают опс _, вирусные — one . One — клеточ-
ные гены, работающие в дифференцированных клетках . One , имеют интроны,
онс не имеют. Если у клетки ген one кодирует сериновую или треониновую
протеинкиназу, то внесение oncv добавляет тирозиновую протеинкиназу. Фос-
форилирование тирозина там, где этого быть не должно, нарушает нормаль-
ное функционирование многих белков. В первую очередь это касается белков,
присутствующих в клетке в большом количестве. Это белки цитоскелета (на-
рушение адгезии) , мембранные белки (нарушение контактного торможения),
гистоны (нарушение регуляции , компактизации, облегчение репликации
ДНК). Если же у клетки есть своя собственная тирозиновая протеинкиназа,
то сказывается дозовый эффект кодирующего ее гена и количество фермента
увеличивается, что приводит к тем же последствиям.
Большинство ученых считает наиболее вероятным происхождение ретро-
вирусов от мобильных ретроэлементов. Известно, что ретроэлементы в ходе
транскрипции нередко «прихватывают» и транскрипт клеточного гена, кото-
рый расположен рядом с местом встраивания элемента. Некоторые из таких
захваченных генов способствовали возникновению капсида, что привело
к превращению ретроэлемента в ретровирус. Онкогенные свойства ретрови-
русы приобрели в результате внедрения в непосредственной близости от one
генов. В дальнейшем one , захваченный вирусом, в ходе эволюции изменился
и превратился в one .
Одним из путей активации one является такая перестройка генома, в ре-
зультате которой рядом с онкогеном появляется новый регуляторный эле-
мент, обеспечивающий его более активную транскрипцию. Другой путь —
структурная мутация в протоонкогснс, т. с. нормальном клеточном гене,
способном превратиться в онкоген. Существуют также и антионкогены, или
Обратная транскрипция и онкогены
167
гены-супрессоры опухолей, подавление активности которых приводит к раз-
витию опухолей.
Природа белковых продуктов онкогенов и антионкогенов чрезвычайно
разнообразна. К онкогенам относят некоторые гены белков — факторов роста,
а также гены рецепторов факторов роста. Перепроизводство факторов роста
или нарушение структуры их рецепторов может привести к более частому де-
лению клеток. Изменения в генах , кодирующих белки — передатчики сигна-
лов от рецепторов к ядру клетки , в основном протеинкиназы различной спец-
ифичности, — а также изменения экспрессии генов, ответственных за белко-
вые факторы транскрипции, могут превратить нормальную клетку в раковую.
Подавление активности генов, ответственных зароет и размножение кле-
ток, осуществляется белковыми продуктами генов — супрессоров опухолей.
Так, ключевая роль в разрешении на переход из одной фазы клеточного цик-
ла в другую принадлежит белкам — циклинам. Только находясь в комплексе
сциклинами, циклинзависимые протеинкиназы способны фосфорилировать
белки мишени, необходимые для перехода в следующую фазу клеточного цикла.
Специальные белки сканируют ДНК перед репликацией на предмет выяв-
ления нерепарированных повреждений. Если ДНК не проходит тест, то вклю-
чаются системы реализации « запрограммированной смерти» — апоптоза, в ре-
зультате чего разрушаются жизненно важные структуры клетки, в том числе
хромосомы и цитоскелет. Апоптоз определяется большим числом генов, цен-
тральное место среди которых занимает ген, кодирующий белок с молекуляр-
ным весом 53 кДа, — ген р53. Этот ген поврежден в 50 % всех опухолей человека.
Когда он выведен из строя, клетки с поврежденной (мутантной) ДНК перестают
выбраковываться и в них происходит накопление новых мутаций, которые мо-
гут затрагивать как протоонкогены, гак и гены-супрессоры опухолей.
Как видно и сказанного выше, рак возникает из-за нарушения регуляции
важнейших процессов жизнедеятельности клетки — роста, размножения, кон-
троля состояния ДНК. Нарушения в регуляторных системах могут возникать
как из-за мутаций генов, так и изменения работы регуляторных механизмов.
Так, сейчас установлено, что развитию рака способствует изменение экспрес-
сии генов регуляторных микроРНК. Сами гены при этом остаются неповре-
жденными.
Как правило, рак развивается у людей пожилого и старого возраста. Это
связано с тем, что повреждения возникают случайно и вероятность накопле-
ния в клетке нужного для злокачественного превращения набора измененных
генов увеличивается с годами.
168
ЛЕКиИЯ 25
Современные представления о происхождении жизни
Описанные в предыдущих лекциях многообразие и сложность молекуляр-
ных процессов, составляющих основу существования и функционирования
живой природы, неизбежно приводят к вопросу о том, как эта сложность мог-
ла возникнуть. Биогенез (возникновение живых систем) должен был включать,
по крайней мере, четыре необходимых этапа: 1) абиогенез — синтез малых орга-
нических молекул (аминокислот, нуклеотидов, липидов, сахаров); 2) образова-
ние биополимеров (полипептидов, РНК, ДНК); 3) возникновение самовоспро-
изведения (наследственности, генетического кода); 4) образование пробион-
—
дискретных структур, явившихся предшественниками настоящих клеток.
Первая научная гипотеза о происхождении жизни принадлежит извест-
ному отечественному биохимику А. И . Опарину. В 1924 г» он предположил, что
при мощных электрических разрядах в земной атмосфере, которая 4-4,5 млрд
лет назад состояла из аммиака, метана, углекислого газа и паров воды, могли
возникнуть простейшие органические соединения, в частности аминокисло-
ты, которые полимери зова лисъ в белки. Коацерваты — белковые сгусгки, обра-
зующиеся в растворах , — Опарин считал предшественниками клеток. В 1929 г.
британский ученый Дж. Холдейн независимо выдвинул гипотезу абиогенного
происхождения жизни. В отличие от Опарина, он считал , что первичным со-
бытием было возникновение не белка, а неких гипотетических макромолекул,
способных к самовоспроизведению (роль ДНК в наследственности была уста-
новлена только в 1944 г.) .
Абиогенный синтез органических веществ (первый этап биогенеза) доста-
точно хорошо исследован и воспроизведен в лабораторных условиях . В 1955 г.
американский исследователь С. Миллер, пропуская электрические разряды
напряжением до 60 000 вольт через смесь СН4
,NH
3
, Н, и паров Н,0 поддавле-
нием в несколько паскалей при температуре 80 °С, получил простейшие жир-
ные кислоты, уксусную и муравьиную кислоты, пять аминокислот и другие
органические соединения. В некоторых опыта Миллера реакции протекали
в колбах , содержавших кроме «атмосферы» еще и «вулканические газы»: циа-
тов
Современные представления о происхождении жизни
169
ниды и оксиды углерода. Проведенное в 2008 г. после появления новых , более
чувствительных методов анализа повторное исследование сохраненного со-
держимого этих колб показало, что там были не 5 (как в «атмосферном» опы -
те), а 22 аминокислоты , несколько аминов, альдегиды, кетоны. Возможность
синтеза пептидов в реакциях конденсации при нагревании сухих смесей ами -
нокислот также экспериментально доказана. Получение сахаров из формаль-
дегида (реакция Бутлерова) хорошо известно. В институте катализа СО РАН
было показано, что в присутствии фосфатов в реакции Бутлерова преимуще-
ственно получается рибоза. Наличие цианидов в реакционной смеси позволи -
ло последователям Миллера получить аденин . Однако оставалось серьезное
препятствие — абиогенно довольно легко синтезировался только аденин, а пи -
римидины не синтезировались совсем. Кроме того, оказалась невозможной
реакция гликозилирования пиримидинов — они отказывались соединяться
с сахарами для образования нуклеозидов.
Но в 2009 г. это препятствие удалось обойти — британский химик Дж. Са-
зерленд с сотрудниками нашли способ синтезировать цитидин не из рибозы
и цитозина, а из более простых органических молекул, которые абиогенно
получаются довольно просто. Эти молекулы — цианоацетилен, цианамид,
гликольальдегид, глицеральдегид — в обязательном присутствии неорганиче-
ского фосфата в результате 13 промежуточных реакций давали сразу активи -
рованный нуклеотид — рибоцитидин-2’,3’
-
циклофосфат (рис. 25.1). При этом
получалось довольно много побочных продуктов, хотя выход нуклеотида был
достаточно высок — около 40 %. Однако облучение смеси в течение трех дней
ультрафиолетом привело к распаду всех примесей, а также к дезаминирова -
нию части рибоцитидин-циклофосфата и превращению его в уридин -цикло-
фосфат. В 2016 г. мюнхенскому химику Т. Карреллу с коллегами удалось, слегка
модифицировав эти условия (добавив муравьиную кислоту и формамид), по-
лучить и пуриновые рибонуклеотиды.
NH2
Он
о
с
НС
OH+HC
-
C-CN+ Д
оо-
+ H2N-C=N + HCL
о
Н2С
о6
XО О'
Рибоуридин-2' -3' -фосфат
Цианоацетилен
Цианамид
ОН
СН2ОН
Фосфат
Гликольальдегид
Рис. 25.1
. Абиогенный синтез рибонуклеотидов
Таким образом , осуществимость первого этапа биогенеза подтверждена
экспериментально и сомнений не вызывает. Однако другое предположение
Опарина о том, что предшественниками первых клеток были коацерваты,
170
Лекиия 25
большинством ученых не принимается. В настоящее время ясно, что белок
не мог быть первой « живой» молекулой, так как белки неспособны к самовос-
произведению. Для получения одинаковых молекул белка необходима матри-
ца — ген. Но носитель генетической информации, ДНК, не может быть синте-
зирован без фермента, белка. Белок сам по себе не мог создать ДНК-матрицу
для собственного кодирования — известно, что генетическая информация
от белка к ДНК не передается. Оказывается неразрешимым вопрос: что было
раньше — ДНК или белок ?
В 1968 г, американский ученый Карл Вёзе высказал предположение о том,
что первым биополимером была РНК, которая в первых живых системах вы-
полняла все функции хранения, воспроизведения и реализации генетической
информации, а также составляла основу их структуры.
То, что первыми «живыми» нуклеотидами были рибонуклеотиды, в на-
стоящее время у ученых никаких сомнений не вызывает. В современных про-
цессах , протекающих в живых организмах , сохранилось много «молекулярных
живых ископаемых » — следов древней жизни. Именно аденозинрибофосфат
выполняет множество самых различных функций помимо того, что он являет -
ся мономером РНК. Это и участие в процессах энергетического обмена (при-
чем это не только АТФ, но и НАД, НАДФ, ФАД и один из самых широко рас-
пространенных коферментов — КоА), и универсальный внутриклеточный пе-
реносчик сигналов — циклический АМФ, и непосредственное осуществление
синтеза белков. Ведь именно к концевому аденозину транспортных РНК при-
соединяются аминокислоты, и именно 23S РНК большой субчастицы рибосо-
мы осуществляет реакцию транспептидации (образование пептидной связи ).
И даже функционирование и самовоспроизведение ДНК не может обойтись
без РНК — это и РНК-праймер в репликации и теломераза. Огромное количе-
ство некодирующих РНК участвует в регуляции практически всех процессов
в живой клетке.
Могла ли из рибонуклеотидов абиогенно образоваться РНК? Активиро-
ванные нуклеотиды легко соединяются с себе подобными, образуя ди -, три-,
тетрануклеотиды. В Институте белка РАН было показано, что в растворе та-
кие короткие олигонуклеотиды способны удлиняться без участия ферментов,
путем хорошо известной химикам реакции трансэтерификации. Среди корот-
ких олигонуклеотидов легко могут находиться частично комплементарные мо-
лекулы. Хотя они слишком малы для образования стабильной двойной цепоч-
ки, однако на короткое время могут стабилизировать взаимное расположение
двух олигонуклеотидов для облегчения протекания реакции трансэтерифика-
ции. Иными словами, олигорибонуклеотиды могут быть получены абиогенно
неферментативным путем без участия других молекул.
Главное затруднение состоит в том, что абиогенно (без матрицы) синтези-
руется рацемическая смесь молекул, химическая рекомбинация коротких оли-
Современные представления о происхождении жизни
171
гонуклеотидов также не зависит от хиральности мономеров. Но матричные
синтезы, необходимые для самовоспроизведения живых систем, невозможны
из рацемической смеси мономеров ( из- за разного направления связей у энан-
тиомеров ). В принципе преимущественный синтез одного из энантиомеров
возможен при использовании хиральных катализаторов, однако подавляющее
большинство их являются органическими молекулами, в основном фермента-
ми. Понятно, что до появления жизни их еще не было. Другой возможностью
является твердофазный катализ — отбор одного из энантиомеров на твердой
поверхности, обладающей хиральностью.
Дж. Бернал предположил, что такой неорганической матрицей мог-
ли быть глины — алюмосиликаты. Глины обладают микрокристаллической
структурой, в которой микрокристаллы представляют собой плоские та-
блички, сложенные стопками. Рост этих микрокристаллов происходит только
по двум поверхностям — плоскостям табличек. Такие стопки легко расщепля -
ются по этим же плоскостям и каждая часть, имеющая такую форму и такие
же плоскости, служит затравкой для нового роста. Это типичный автокатали-
тический процесс, результатом которого является самовоспроизведение ми-
крокристаллов. Такие глины хорошо известны — это, например, каолиниты
или монтмориллонит, который сейчас рассматривается как основной претен-
дент на роль «глиняных генов» (рис. 25.2). Таким образом, глиняный «авто-
каталитический цикл» оказывается «полезным » для эволюции органических
молекул. Глина тоже «получает выгоду» — органические молекулы, осаждаясь
на микрокристаллах и проникая между их слоями, существенно облегчают
расщепление их стопок, тем самым убыстряя их «размножение». Глина же, яв -
ляясь катализатором ( каталитические свойства алюмосиликатов хорошо из-
вестны), ускоряет синтез олигонуклеотидов.
В 2004 г. были предложены другие кандидаты на роль матриц — поли-
ароматические углеводороды ( ПАУ). Полиароматические углеводороды до-
статочно широко распространены во Вселенной и, скорее всего, были и на
Расщепление
Рис. 2$.2 . « Глиняные гены»
А — самовоспроизведение микрокристаллов глины: i — микрокристалл;
2 — грани, по которым происходит рост и расщепление микрокристалла;
6 — электронно-микроскопическая фотография микрокристалла
172
Лекиия 25
ранней Земли. ПАУ обычно плохо растворимы в воде, но ультрафиолетовое
излучение, которого на Земле было достаточно, могло способствовать окси-
гснированию молекул. Наличие гидроксильных групп делало ПАУ более рас-
творимыми в воде,
ПАУ самопроизвольно складываются в стопки в результате стэкинг-вза-
имодействий ароматических молекул. Гидроксильные группы таких оксиге-
нированных углеводородов могут взаимодействовать с другими молекула-
ми. При этом должно преобладать специфическое связывание с такими же
плоскими молекулами, например, с пиримидиновыми и пуриновыми азоти-
стыми основаниями. Эти основания также содержат ароматические кольца
и выстраиваются в аналогичные стэки. Авторы этой гипотезы предположили,
что после присоединения азотистых оснований к ПАУ-кольцам с помощью
водородных связей основания могли соединяться друг с другом олигомера-
ми формальдегида. Впоследствии эти олигомеры формальдегида могли быть
заменены рибозой. Открытие возможности абиогенного синтеза сразу акти-
вированных нуклеотидов делает ненужными гипотетические олигомеры фор-
мальдегида. По-видимому, к углеводородным стэкам могли присоединяться
сразу и рибо-2’-3’- циклофосфаты. При повышении кислотности окружающей
среды, например, в результате вулканических извержений, связь азотистых ос-
нований и ПАУ могла быть нарушена. Предполагается, что отсоединившиеся
от ПАУ-матрицы цепочки РНК могли формировать стабильные и частично
двухцепочечные структуры, похожие на рибозимы. В пользу предположения
об участии ПАУ в возникновении РНК говорит тот факт, что расстояние меж-
ду азотистыми основаниями в нуклеиновых кислотах в точности соответству-
ет расстоянию между молекулами ПАУ в стэках — 0 ,34 нм.
Следующей необходимой стадией возникновения жизни является воз-
никновение кодирования — связи между нуклеиновыми кислотами и син-
тезом белков. Этот вопрос является самым сложным, пока что у ученых есть
только несколько самых общих гипотез. Одной из самых продуманных и име-
ющих хотя бы минимальное экспериментальное обоснование является гипо-
теза московского ученого А. Альтштейна, предполагающая одновременное
возникновение нуклеиновой кислоты и синтеза белка. Альтштейн предполо-
жил, что кроме коротких олигонуклеотидов могли возникать и соединения
нуклеотидов с аминокислотами — аминоацил -нуклеотидилаты. Химически
это такие же сложные эфиры, как и олигонуклеотиды. В растворе, там, где
существовал целый набор разнообразных динуклеотидов и аминоацилнукле-
отидилатов должны были возникать временные ассоциации таких молекул.
Эти ассоциации, хотя и непрочные, но не вполне случайные — определенные
аминокислоты предпочитают определенные динуклеотиды. Это предпочтение
определяется физико-химическими взаимодействиями. Такие комплексы су-
ществуют некоторое время. Поскольку это всего три нуклеотида (еще не пол-
Современные представления о происхождении жизни
173
ностъю связанные химически!), то среди их разнообразия непременно долж-
ны встречаться взаимно комплементарные тройки. Образование водородных
связей между ними повышало стабильность всей конструкции. Это давало
время для образования фосфодиэфирной связи между нуклеотидами (фак-
тически это катализ). Получался «проген» — тройка нуклеотидов со «своей»
аминокислотой. Они могли легко диссоциировать на одноцепочечные фраг-
менты (три нуклеотида слишком мало для удержания двуцепочечности). На-
личие частично комплементарных олигонуклеотидов, как мы уже говорили,
может удерживать рядом друг с другом разные аминоацил -нуклеотидилаты.
Находящиеся друг рядом с другом аминокислоты могли образовывать пептид-
ную связь. Так получался дипептид, связанный стройкой нуклеотидов. Сре-
ди всех возможных наборов дипептидов должны были встретить те, которые
катализировали образование фосфодиэфирной связи между тринуклеотида-
ми. Дальнейшая эволюция этого процесса могла привести к возникновению
фермента РНК-зависимой РНК-полимеразы. Сейчас установлено, что именно
этот фермент является самым древним из всех нам известных . Еще одним под-
тверждением того, что такой ход событий мог иметь место, является наличие
живого «молекулярного ископаемого» — кофермента А. Он имеет как раз та-
кую химическую структуру — рибонуклеотид, соединенный с дипептидом.
Нетрудно заметить, что эта гипотеза предполагает относительную одновре-
менность возникновения нуклеиновой кислоты, кодирования и трансляции.
Кроме того, она естественным образом объясняет возникновение сразу три-
плетного квазидублетного кода.
Сейчас ученые не сомневаются, что именно на основе РНК существовал
самодостаточный РНК-мир. РНК, обладая всеми теми же матричными и ге-
нетическими функциями, что и ДНК, способна также к выполнению ряда
функций, присущих белкам, включая катализ химических реакций. Однако
белки выполняют каталитическую и некоторые другие функции эффектив-
нее, чем РНК, поэтому в ходе эволюции эти функции и были «переданы» бел-
кам. При этом возникает вопрос о том, как возникла трансляциия, в частно-
сти, такая сложная структура как рибосома. Канадские биохимики К. Боков
и С. Стейнберг провели подробный анализ вторичной структуры 23S рРНК
Е, coli. Они предположили, что проторибосома была маленьким рибозимом.
Для проверки этой гипотезы они подразделили структуру молекулы на 60 не-
больших блоков и попытались выяснить, мощно ли некоторые блоки убрать,
не нарушая целостности оставшейся молекулы. Оказалось, что последователь-
ное изъятие блоков в определенном порядке не нарушает строение остающей-
ся части. В результате такого моделирования остался очень небольшой участок
рРНК, который представляет собой пептидил-трансферазный центр рибосо-
мы (рис. 25.3). Этот участок сравнили с рибозимом, полученным искусствен-
но методом «эволюции в пробирке» и способным катализировать соединение
174
Лекиия 25
аминокислот,
соединенных
с тРНК, в небольшие пептиды.
Структура этого рибозима ока-
залась очень близкой к полу-
ченной авторами теоретически.
Проторибосома
скорее
всего работала не слишком
специфично, но в ходе эволю-
ции к ней могли присоединять-
ся небольшие блоки РНК , кото-
рые не нарушали работу актив-
ного центра, по способствовали
ее
«усовершенствованию» —
повышали стабильность струк-
туры, помогали правильной
ориентации аминоацил -тРНК,
увеличивали специфичность.
Что это были за блоки
РНК? Американские иссле-
дователи предположили, что
это были последовательности
нуклеотидов
не случайные,
а содержащие генетическую
информацию. Эту гипотезу они
мето-
Рис. 2S -3
-
Участок 23S рРНК Е. coli,
содержащий пептидил-трансферазный
центр — «проторибосому»
(выделен голубым цветом)
проверили с помощью
Дов биоинформатики. После-
довательности нуклеотидов всех рРНК Е. coli (23S, 16S и 5S рРНК) они пере-
вели в комплементарную форму и сравнили с последовательностями генов,
кодирующих тРНК, рибосомные белки, а также некоторые ферменты, необ-
ходимые для самовоспроизведения (полимераз, лигаз и некоторых других ).
Они обнаружили, что в рибосомных РНК закодированы последовательности
тРНК для всех 20 аминокислот, некоторые рибосомные белки, активные цен-
тры ферментов АРСаз, РНК-полимераз, лигаз, фосфатаз. Конечно, совпадение
нуклеотидных последовательностей было неполным — на 50-70 %, но следу-
ет иметь в виду, что со времени возникновения проторибосом до настоящего
времени прошло почти 4 млрд лет, а после того, как хранение генетической
информации было возложено на ДНК, последовательности в рРНК перестали
быть кодирующими и накопили мутации.
Гипотетические живые системы, бывшие предшественниками клеток, уче-
ные назвали пробионтами — предшественниками современного живого мира.
Обязательным условием образования и сколько-нибудь длительного существо-
Современные представления о происхождении жизни
175
вания пробионтов была компартментализация — отграничение их от окру-
жающей среды. Она необходима и для того, чтобы обеспечить достаточную
концентрацию мономеров и избежать «убегания» синтезированных биополи-
меров, и для защиты от конку-
ренции. Полупроницаемая мем-
брана — оптимальный вариант,
который позволяет проникать
необходимым для поддержа-
ния циклов молекулам. Она же
создает эволюционные преиму-
щества, снижая конкуренцию
с другими потребителями отих
же субстратов. Такая мембрана
не обязательно должна состо-
ять именно из фосфолипидов,
это могут быть просто жирные
кислоты с достаточной длиной
углеводородного хвоста.
Американским ученым под руководством нобелевского лауреата Дж. Шо-
стака удалось создать модель протоклетки-пробионта. Ее мембрана состояла
из декановой кислоты с декановым спиртом и глицериновым моноэфиром де-
кановой кислоты. Активированные имидазолом нуклеотиды (рис. 25.4) хоро-
шо проходили через модельную мембрану (нуклеозид-трифосфаты из- за боль-
шого отрицательного заряда не могут проходить сквозь любые липидные мем-
браны). В конце концов , ученым удалось создать искусственные протоклетки,
способные поддерживать синтез РНК в отсутствие ферментов и даже рибо-
зимов. Для этого необходимы ионы Mg2+
в высокой концентрации. Их разру-
шительное для липидной мембраны действие удалось нейтрализовать добав-
лением цитрата . Но Шостак с коллегами предположили, что предотвращать
вредное действие магния с сохранением его каталитической активности мог
не цитрат, а короткие пептиды, содержавшие аспарагиновую кислоту (в совре-
менных ферментах РНК-полимеразах ионы магния в активном центре окру-
жены тремя остатками аспарагиновой кислоты). Абиогенный синтез аспара-
гиновой кислоты был показан в опытах С. Миллера.
Однако некоторые ученые сомневаются в том, что первые клетки с ли -
пидной мембраной могли быть построены на основе только РНК. Дело в том,
что РНК — довольно непрочная молекула, поэтому ее молекулы в РНК-мире
должны были быть короткими, не более нескольких сотен нуклеотидов. Это
означает, что кодировать достаточное для самой простой клетки количество
генетической информации должны были многочисленные разные молекулы
РНК, причем каждая из них должна была присутствовать во всех протоклет-
о
N
^N Р—О
\=/
-
он
он
Рис. 25.4
. Рибонуклеотид,
активированный имидазолом
176
Лекиия 25
ках . Это маловероятно при отсутствии сложного аппарата воспроизведе-
ния генетической информации. Уже довольно давно существует предполо-
жение, что первичными ячейками зарождения жизни были микрополости
в минеральных отложениях в окрестностях океанических гидротермальных
источников или гейзеров. Сульфиды железа или цинка стенок ячеек могли
служить катализаторами, а сами стенки при своем возникновении, скорее
всего, были не твердыми, а гелеобразными , т. е . полупроницаемыми. Эта ги -
потеза никак не отвергает гипотезы протоклеток с липидными мембранами.
Эти мембраны могли образовываться и в минеральных ячейках , а образуе-
мые ими пузырьки могли покидать ячейки, служа « расселительной стадией»
пробионтов.
Крайне маловероятно, что каждый такой пробиопт мог в полной мере
осуществлять все метаболические и информационные процессы, поэтому
пробионты должны были быть разными. При этом наверняка среди них была
широко распространена рекомбинация, т. е. обмен молекулами (или частями
молекул) РНК. Механизмы защиты собственного генетического материала
от чужеродной информации возникли позже. Поэтому в каждом конкретном
месте обитания (теплой луже, окрестности черного курильщика и т. п.) сре-
ди пробионтов должна была существовать широкая кооперация. Способные
к кооперации и рекомбинации пробионты представляли собой своеобразную
« первобытную коммуну», в которой разные члены осуществляли разные мета-
болические пути, а продукты поступали в более или менее общее пользование.
Другими словами, жизнь должна была возникать сразу в виде экосистемы!
Компьютерное моделирование показывает, что в таких условиях неизбежно
должны были появиться «паразиты», которые использовали продукты дея-
тельности «честных коммунаров» , сами ничего не производя. Предполагается,
что именно так могли возникнуть вирусы.
Однако те «коммуны» , в которых паразиты возникли, для того, чтобы вы-
жить, должны были защищаться. По-видимому, такими средствами защиты ста-
ли рестрикция (расщепление РНК вируса) и РНК-интерференция. Этот древний
способ защиты от вирусов растения сохранили до настоящего времени. Так на-
чалась «гонка вооружений» между пробионтами (а потом и клетками) и вируса-
ми, которая продолжается до сегодняшнего дня. Считается, что именно вирусы
для защиты от рестриктаз «изобрели» ДНК. По-видимому, сначала была моди-
фицирована рибоза. Отсутствие одной из гидроксильных групп сделало моле-
кулу неузнаваемой для клеточных рестриктаз. Возникла так называемая У-Д1IK,
т. е. ДНК, содержащая не тимин, а урацил. Несколько таких бактериофагов, со-
держащих У-ДНК, существует и в настоящее время. Затем модификация была
продолжена — урацил был метилирован, получился тимин. Такие содержащие
ДНК вирусы, если они были умеренными (а какая-то часть из них определенно
таковой была), могли, попадая в протоклетку и оставаясь там на некоторое вре-
Современные представления о происхождении жизни
177
мя, передать клетке часть своей ДНК. Сначала получились протоклетки химер-
ные, содержавшие в качестве генетического материала и РНК, и ДНК, впослед-
ствии вся геномная РНК была заменена на ДНК, а РНК сохранила за собой роль
«дирижера» в синтезе белков. Полностью РНКовые пробионты не выдержали
конкуренции с ДНКовыми именно из-за большей стабильности ДНК в слабо-
щелочных условиях .
Получившиеся ДНКовые протоклетки входе эволюции дали начало
предку всех клеток, которые существуют в настоящее время. Он получил имя
LUCA — ( Last Universal Common Ancestor — последний универсальный общий
предок ). Иногда эту аббревиатуру расшифровывают как Last Universal Cell
Ancestor — последний общий предок клеток, что, скорее всего, более верно,
так как LUCA дал начало всем клеткам, существующим сейчас па Земле, —
и бактериям, и эукариотам.