Author: Скулачёв В.П. Богачев А.В. Каспаринский Ф.О.
Tags: материальные основы жизни биохимия молекулярная биология биофизика общая биофизика мембранная биоэнергетика преобразование энергии фосфорилирование жизнедеятельность организма мембранные формы
ISBN: 978-5-211-05871-2
Year: 2010
В.П. Скулачев
А.В. Богачев
Ф.О. Каспаринский
МЕМБРАННАЯ
БИОЭНЕРГЕТИКА
Допущено Учебно-методическим объединением
по классическому университетскому образованию
в качестве учебного пособия для студентов,
обучающихся по специальности 020210 «Биоинженерия
и Биоинформатика»
Издательство
Московского университета
2010
УДК 577.23
ББК 28.071
С46
Скулачев В.П., Богачев А.В., Каспаринский Ф.О.
С46 Мембранная биоэнергетика: Учебное пособие. — М.: Издательство
Московского университета, 2010. — 368 с.
ISBN 978-5-211-05871-2
В книге изложены основные сведения о механизмах преобразования энергии в
живых организмах. Рассмотрены системы субстратного, фото- и окислительного фос-
форилирования, поставляющие всю энергию, необходимую для жизнедеятельности
организмов. Описаны пути генерации мембранных форм энергии, а также их исполь-
зования для синтеза АТР, аккумуляции химических веществ в клетках и органеллах,
подвижности бактерий, образования тепла в целях терморегуляции и т.д. В заключение
рассмотрены пути практического применения биоэнергетики для отмены программы
старения организма.
Для студентов и аспирантов биологических факультетов университетов, а также
для специалистов в области биоэнергетики, биохимии, биофизики, фармакологии,
физиологии и микробиологии.
Ключевые слова: аденозинтрифосфат, дыхательная цепь, биоэнергетика, мембранный
потенциал, мембранный транспорт, подвижность бактерий, программа старения, термогенез,
фосфорилирование окислительное, фотосинтез.
УДК 577.23
ББК 28.071
Skulachev V.P., Bogachev A.V., Kasparinsky F.O.
Membrane bioenergetics: Textbook. M.: Moscow University Press,
2010. - 368 p.
ISBN 978-5-211-05871-2
This book describes mechanisms of energy conservation in living organisms. The systems
of photo- and oxidative phosphorylation are described, processes which produce all energy
needed for all vital functions of a living cell. Also the pathways of generation of membrane-
dependent energy forms are described as well as their use as the driving force for ATP
synthesis, substrates accumulation in cells and organelles, bacterial motility, heat production
for thermoregulation, etc. In conclusion, possible ways for cancelling the senescence program
of an organism are considered.
The book is suitable for undergraduate and graduate students of biological departments of
universities, as well as for specialists in bioenergetics, biochemistry, biophysics, pharmacology,
physiology, and microbiology.
Key words: adenosine triphosphate, bacterial motility, bioenergetics, membrane potential,
membrane transporters, oxidative phosphorylation, photosynthesis, respiratory chain, senescence
program, thermogenesis.
© Скулачев В.П., Богачев A.B., Каспаринский Ф.О., 2010
© ООО «МАСТЕР-МУЛЬТИ МЕД ИА», иллюстрации, 2010
ISBN 978-5-211-05871-2 © Издательство Московского университета, 2010
ПРЕДИСЛОВИЕ
Энергия и жизнь — явления объективной реальности, субъективные по-
нятия и просто слова нашего языка. Философы спорят о сущности этих
понятий уже более двух тысяч лет. Веками ученые пытаются всесторонне
охарактеризовать их. Десятки лет рекламная индустрия успешно использует
положительную эмоциональную окраску этих слов, чтобы привлечь внимание
потребителей. А миллионы людей, ежедневно употребляя слова «энергия» и
«жизнь», довольствуются иллюзией интуитивного понимания их смысла.
В чем же секрет такой популярности? Рискнем предположить, что эво-
люция человеческого языка определялась преуспеванием индивидуумов,
способных привлечь внимание к понятиям, наиболее важным для самого
существования общества и отдельных его представителей. Преимущества
цивилизации позволяют современным людям избегать множества проблем,
с которыми сталкивались обитатели дикой природы. Это создает условия
для изменения системы приоритетов. Казалось бы, сегодня «энергия и
жизнь» далеко не самое главное для отдельного человека или человеческого
сообщества. Закодированная в звуковом ряде языка эмоциональная притя-
гательность может быть низведена до уровня исторической вехи на пути по-
знания людьми окружающей природы и самих себя. Действительно, огром-
ный прогресс в понимании молекулярных механизмов энергообеспечения,
достигнутый с 1961 по 1995 г., мог породить иллюзию, что в биоэнергетике
все или почти все уже открыто и следующим поколениям биологов лучше
выбирать какое-нибудь другое направление исследований.
Но вот наступил 1996 г. Появились первые публикации о совершенно
новой роли митохондрий, энергопреобразующих органелл клеток живот-
ных, растений и грибов в самой судьбе этих клеток. Митохондрии оказа-
лись в самом центре событий, приводящих к запрограммированной смерти
клетки. Они не только обеспечивают энергией этот процесс (что заставляет
по-новому взглянуть на проблему «энергия и смерть», ранее рассматриваю-
щуюся в основном применительно к ядерному оружию), но служат мощ-
нейшими умножителями смертоносных сигналов. Актуальным стал вопрос
о роли митохондрий в запрограммированной ликвидации участков тканей,
органов и даже целых организмов. Это открытие сразу вызвало значительный
рост публикаций по митохондриям. Ежегодно таких статей в первую декаду
XXI в. было по крайней мере в два с половиной раза больше, если сравни-
вать с публикациями по годам в последнее десятилетие века ушедшего.
Книга, предлагаемая вниманию читателя, претендует на роль учебни-
ка по современной биоэнергетике. Большая ее часть — курс лекций по
6
ПРЕДИСЛОВИЕ
этому предмету, читаемый одним из авторов студентам МГУ в течение бо-
лее чем сорока последних лет. В курс вошли фундаментальные сведения
о молекулярных механизмах аккумуляции энергии, о ее использовании в
мембранах митохондрий, хлоропластов и бактерий. В предыдущем учебни-
ке по биоэнергетике, написанном лектором, эта тема тоже освещалась, но
в предлагаемой книге отражен ряд новых ее аспектов, таких, как эволю-
ция биоэнергетических механизмов, токсикология и физиология активных
форм кислорода, их роль в явлениях запрограммированной смерти и ряд
других. Часть сведений, не включенных в курс, который читается только в
течение одного семестра, помещена в раздел «Приложения».
Наглядные материалы по курсу «Биоэнергетика» ежегодно совершен-
ствуются и дополняются. Полные наборы иллюстраций и видеолекции
публикуются в сети Интернет по адресу: http://www.master-multimedia.ru/
lectures/vps/. Мы надеемся, что знакомство с этими материалами в извест-
ной мере заменит читателю прямое общение с лектором и позволит твор-
чески усвоить материал, без чего невозможно формирование личности бу-
дущего ученого.
Часть первая
ПРИНЦИПЫ БИОЭНЕРГЕТИКИ
ГЛАВА ПЕРВАЯ
ВВЕДЕНИЕ
1.1. Определение понятия «биоэнергетика»
и некоторые вехи ее истории
Что связывает энергию и жизнь? В начале XX в. Дж. Холдейн (J. Haldane)
определил жизнь как способ существования самовоспроизводящихся структур
за счет притока энергии извне. Такой же точки зрения придерживался наш
известный биолог Б.М. Медников. Как следует из формулировки, способ-
ность к энергообеспечению является одним из двух основных свойств жизни.
Однако каким образом энергия позволяет жизни существовать? Мы по-
стараемся ответить на этот вопрос, по возможности не прибегая к помощи
сложных формул.
Прежде всего определим тему нашего курса. Биоэнергетика {биологиче-
ская энергетика) есть совокупность процессов преобразования энергии внешних
ресурсов в биологически полезную работу живых систем, а также раздел био-
логии, изучающий эти процессы.
У истоков биоэнергетики — рассуждения античных мыслителей о при-
роде брожения и о роли воздуха в процессах использования пищи живыми
организмами. Леонардо да Винчи одним из первых (начало XVI в.) сравнил
питание животных с горением свечи. Эта идея была развита голландским
естествоиспытателем Йоханнесом Баптиста ван Гельмонтом в 1648 г. в опы-
тах с растениями. До начала XX в. основным содержанием биоэнергети-
ки являлось изучение суммарных балансов процессов энергообеспечения
живых организмов (дыхания, брожения), а также воздействия различных
условий (переход от покоя к работе, изменение окружающей температуры)
на энергетический баланс организма. Быстрое развитие биохимии в первую
половину XX в. способствовало формированию представлений о превраще-
ниях энергии в живых клетках. Ключевую роль здесь сыграли работы наших
замечательных соотечественников В.А. Энгельгардта и В.А. Белицера, от-
крывших фосфорилирующее дыхание. Однако до формулирования П. Мит-
челом принципа устройства ключевых механизмов трансформации энергии
в живых клетках биоэнергетика еще не существовала как отдельная наука.
У каждой из современных отраслей науки есть свой год рождения.
Так, отсчет времени молекулярной генетики начался с публикации жур-
8
ЧАСТЬ I. Принципы биоэнергетики
Рисунок 1.1. Король Швеции Карл XVI
Густав (справа) вручает П. Митчелу
Нобелевскую премию (1978)
Рисунок 1.2. А. Сент-Дьерди
налом «Nature» в марте 1956 г. статьи
Дж. Уотсона и Ф. Крика о спиральных
структурах ДНК, встречающихся у ви-
русов. Биоэнергетика тоже имеет свою
точку отсчета, и это тоже публикация
в «Nature», но другого нобелевского
лауреата — Питера Митчела (рис. 1.1).
В 1961 г. он напечатал статью, где
предложил свое объяснение механиз-
ма дыхательного и фотосинтетического
фосфорилирования (хемиосмотическую
гипотезу). А само слово «биоэнергети-
ка» было впервые использовано пятью
годами раньше, в 1956, нобелевским
лауреатом А. Сент-Дьерди (рис. 1.2),
который дал такое название написан-
ной им небольшой брошюре. Это очень
странная книжка, изданная на излете
карьеры автора, где он позволил себе
безудержно фантазировать по поводу
того, что такое живое существо. Почти
все мысли, в ней высказанные, не под-
твердились. А вот слово, вынесенное
на титульный лист, вошло в обиход как
название новой науки.
В 1968 г. в Полиньяно а Маре, ма-
леньком городке на юге Италии, состо-
ялась конференция по окислительному
фосфорилированию, на одном из засе-
даний которой специально обсуждался
вопрос, как назвать новую отрасль био-
логии, посвященную выяснению моле-
кулярных механизмов энергообеспече-
ния живых существ. Одному из авторов
этой книги (В.П.С.) посчастливилось
участвовать в этой конференции. Его
английский язык в то время оставлял желать лучшего и, если доходило
до выражения собственного мнения, то получалось это как-то очень уж
прямолинейно... Когда начали обсуждать, как ему показалось, громоздкие
и неблагозвучные названия, он встал и сказал, что организовал недавно в
Московском университете отдел биоэнергетики, и потому предлагает на-
звать этим именем новую науку. В перерыве один из участников конферен-
ции, Карел Ван Дам из Голландии, пожурил В.П. Скулачева за столь резкое
выражение своей позиции в присутствии таких корифеев, как Г. Кребс,
Л. Эрнстер, Э. Слейтер, но удивительным образом дискуссия привела к
тому, что название было принято. Не прошло и нескольких лет, как появи-
лись журналы по биоэнергетике, конференции по биоэнергетике, между-
Глава 1. Введение
9
народная организация биоэнергетиков со своими отделениями в разных
странах. К сожалению, впоследствии экстрасенсы решили узурпировать
новый термин. В.П. Скулачев пытался как мог протестовать, выступая в
широкой печати и по телевидению, но потерпел фиаско: в настоящее время
существуют два понятия — «биоэнергетика научная» и «биоэнергетика па-
ранаучная». Это началось у нас в России, а потом перекинулось за рубеж.
В результате в последнем издании Британской энциклопедии уже есть оба
значения слова «биоэнергетика». Язык как океан: стихия, с которой нельзя
бороться в одиночку...
Выделившаяся в отдельную науку биоэнергетика быстро завоевала «ме-
сто под солнцем». В 1978 г. получил Нобелевскую премию за свою гипо-
тезу ее основатель П. Митчел. В 1988 г. нобелевскими лауреатами стали
X. Михель, Й. Дейзенхофер и Р. Хубер, преуспевшие в рентгеноструктур-
ном анализе комплекса фотосинтетических реакционных центров. В 1997 г.
П.Д. Бойер и Дж. Уокер удостоились такой же премии за исследование про-
тонной ATP-синтазы, а вместе с ними и И.-Х. Скоу — за открытие Na+,K+-
АТРазы. В 2003 г. нобелевскими лауреатами стали П. Агре и Р. МакКиннон,
описавшие с атомным разрешением структуру аквапорина и калиевого ка-
нала. По-видимому, ждет своей премии открытие Г. Кремером, Д.Д. Нью-
мейером и К. Уангом центральной роли митохондрий в запрограммирован-
ной смерти клетки. В последнее десятилетие число публикаций на эту тему
растет по экспоненте.
1.2. Биоэнергетика в системе биологических наук
Классификацию биологических наук можно представить в виде зда-
ния, восемь этажей которого соответствуют уровням сложности организа-
ции живой материи (рис. 1.3). Самый
верхний этаж — исследование биосфе-
ры (более высокие этажи пока только
проектируются, поскольку неизвестно,
есть ли жизнь за пределами нашей пла-
неты). Спускаясь с этажа на этаж, ис-
следователь продвигается от общего к
частному. Второй этаж сверху — эколо-
гия. Эта наука изучает сообщества от-
дельных организмов, которые образуют
экосистемы, формирующие биосферу.
Этажом ниже концентрируется группа
наук, которые можно объединить под
одним названием — «биология видов».
Это классические описательные науки
биологического профиля, такие, как
зоология, ботаника, микология, микро-
биология и вирусология. Они позволя-
ют систематизировать представления о
БИОЛОГИЧЕСКИЕ
ФУНКЦИИ
Рисунок 1.3. «Здание биологии»: класси-
фикация биологических наук
(по В.П. Скулачеву)
10
ЧАСТЬ I. Принципы биоэнергетики
видах и популяциях на основании эталонных образцов или статистического
анализа совокупности фенотипических признаков.
Популяции состоят из индивидов. Их изучением занимаются на четвер-
том этаже, если считать сверху. Анатомия и физиология позволяют охаракте-
ризовать соответственно строение и функции как целостного индивида, так
и его тканей. Ткани состоят из клеток, и можно изучать биологические яв-
ления на этом субтканевом уровне — клеточная биология (5-й этаж сверху).
Следующий уровень упрощения — субклеточная биология, объектами кото-
рой являются органеллы и надмолекулярные комплексы. Здесь объединены
работы по исследованию структуры и функций плазмалеммы, цитозоля,
клеточного ядра, митохондрий, эндоплазматического ретикулума, лизосом,
пероксисом, хлоропластов и некоторых других внутриклеточных органелл.
Седьмой этаж сверху исключительно важен: это молекулярная биология.
Предметом молекулярной биологии являются те индивидуальные моле-
кулы, из которых состоят живые существа, прежде всего макромолекулы.
Именно на этом этаже происходит переход к количественному описанию
биологических объектов. Биология молекул хотя и очень сложная, но уже
точная наука, претендующая на тот уровень точности, который характерен
для химии и физики. Непременным условием здесь является сохранение
нативности исследуемых молекул и их комплексов: они должны быть «жи-
выми», т.е. нативными, а не денатурированными, и продолжать во время
эксперимента выполнение своей биологической функции. На самом ниж-
нем этаже (8-й сверху) это требование уже может не соблюдаться. Биоорга-
ническая химия исследует структуру и физико-химические свойства чистых
индивидуальных макромолекул, а также их компонентов и низкомолеку-
лярных соединений, присутствующих в организме. Некоторые из таких
соединений являются неорганическими, однако малочисленность объектов
исследования не дает оснований для выделения бионеорганической химии
в отдельный «этаж».
Классификация биологических наук не ограничивается уровнями
сложности. Тот или иной биологический объект может исследовать био-
лог, химик, физик или математик. Каждый из них обладает совершенно
разными методологическими подходами и философией исследования. Иногда
даже сами выводы исследователя кардинальным образом зависят от того, в
каком методологическом «подъезде» «здания биологии» он трудился. Для
математика важно выяснить, какими математическими формулами опи-
сывается исследуемый объект. Биофизик, исследующий протекание реакций
во времени, хочет наблюдать за ними с высоким разрешением на протя-
жении всего диапазона времен*. Для химика главное — чистота молекул и
гомогенность системы. Биолог не будет в большинстве случаев стремиться к
фемтосекундному разрешению, математической точности или химической
чистоте. Биолога интересует поведение (регуляция, рождение и смерть) жи-
* Следует отметить, что в этом направлении весьма преуспевающей оказалась отече-
ственная биофизика: например, в Институте физико-химической биологии им. А.Н. Бело-
зерского МГУ к настоящему моменту достигнуто максимальное предельное разрешение в
исследовании кинетики процессов, существующих в природе (2 х 10-15 сек).
Глава 1. Введение
11
вой системы, а также ее история — филогенез и онтогенез. Авторы этой
книги по образованию биологи, и поэтому книга в значительной степени
отражает биологический подход.
Есть еще один критерий для классификации исследований в биологии,
когда в основу положены те биологические функции, которые выполняют ис-
следуемые системы. Существуют четыре основные функции биологических
объектов. Одна из них — генетическая, т.е. передача свойств организма по
наследству. Наука, изучающая эту функцию, называется генетикой. Энерго-
обеспечение — другое необходимое условие существования живой системы,
и этим занимается биоэнергетика. Есть такая функция, как превращение
одних веществ в другие. То, из чего мы состоим, — это в основном совсем
не те вещества, которые можно найти в окружающей среде. Большинство из
них мы для себя сделали сами. Поэтому превращение веществ может быть
расценено как специальная биологическая функция. С учетом соблюдения
языковых норм можно назвать ее метаболикой. Это неологизм. В принципе,
здесь речь идет о биохимии в прежнем понимании данной науки. Однако
биохимия родила в свое время науки, занимающие в здании биологии три
последних этажа: субклеточную биологию, молекулярную биологию и био-
органическую химию. В то же время биохимию можно понимать как раздел
биологии, в котором используется химический подход. И, наконец, сенсо-
рика. Это тоже неологизм, которым, по аналогии с тремя предыдущими,
можно определить науку о восприятии и обработке сигналов, поступающих
из внутренней или из внешней среды живой системы, а также способность
адекватно реагировать на такие сигналы.
Следует подчеркнуть, что функциональный подход венчает собой изу-
чение любой биологической системы. В конце концов нам не так уж важ-
но, какая конкретная молекула занимается своим делом, и уж совсем не
важно, каким образом мы ее открыли — как биологи, химики, физики или
математики. Важно, что именно делает молекула и как ее функция вписы-
вается в общую схему жизнедеятельности исследуемого объекта. Эти четыре
функциональные науки — цель биологии. Там, где мы решили задачу в ее
функциональном аспекте, можно поставить точку и идти дальше. Вопрос в
том, куда идти. Пушкинское «Куда ж нам плыть?..»
Возьмем на себя смелость утверждать, что человек, изучив живой мир и
себя как один из его компонентов, основной будет считать задачу создания
новых существ и усовершенствования своей собственной природы. Раньше
подобные аспекты относились к области фантастики, хотя селекция рас-
тений и животных существовала испокон веков. Люди отчасти преуспели в
создании ряда новых пород животных и сортов растений. Однако процесс
этот был крайне медленным, а успех случайным, так как селекцией за-
нималась скорее специальная отрасль производства, чем фундаментальная
наука. Углубление наших знаний по всем трем координатам, изображен-
ным на рис. 1.3, открыло возможность создания по плану, придуманному
исследователем, новых биологических молекул, новых процессов, а затем
и новых, невиданных прежде существ. Вопросы такого рода решаются на-
укой, получившей название «биоинженерия». В систему, представленную на
рис. 1.3, биоинженерия не вписывается, так как «жильцы» «здания биоло-
12
ЧАСТЬ I. Принципы биоэнергетики
гии» пытаются познать живое существо, возникшее в результате эволюции,
а биоинженерия — это попытка самим создать новое живое существо или
его компонент. Это принципиально иной, новаторский подход, и такой
подход — будущее биологии, сколько бы мы ни обсуждали, правомерно
ли создание новых биологических объектов, этично ли это и чем может
грозить человечеству в будущем. Биологи уже вступили на этот путь, и не
очень понятно, почему разгораются такие страсти вокруг биоинженерии.
Ведь селекция — это тоже попытка создать новое, доселе не известное су-
щество, а ведь никто селекционеров не осуждает. С другой стороны, в био-
инженерных исследованиях нужна большая осторожность. Ошибка здесь
дорого может стоить человечеству. Например, вполне реально создание су-
перпатогенных бактерий, которые смогут одновременно вызывать симпто-
мы чумы, холеры, сибирской язвы и т.п. С такими патогенами невозможно
будет бороться современными антибиотиками. Подобный монстр может
получиться случайно или специально быть создан террористами для того,
чтобы угрожать населению Земли. Об этом чрезвычайно опасном аспекте
биоинженерных исследований надо помнить, но не для того, чтобы вообще
запретить биоинженерию, а для того, чтобы подобные исследования нахо-
дились под жестким общественным и государственным контролем.
1.3. Законы биоэнергетики
На сегодня биоэнергетика достигла такого прогресса в своем развитии,
что мы уже можем сформулировать основные ее законы.
1-й закон биоэнергетики. Живая клетка избегает прямой утилизации энер-
гии внешних ресурсов при совершении полезной работы. Сначала она трансфор-
мирует эту энергию в конвертируемую форму АТР, Дрн< или ДцКа+ и исполь-
зует ее затем в различных энергоемких процессах (ур. 1). Апеллируя к нашей
повседневной жизни, можно сказать, что клетка предпочитает бартеру де-
нежное обращение.
Энергетические ресурсы -э АТР, Дцн+ или ApNa+ работа (1.1)
Рисунок 1.4. Ф. Липман
Впервые этот принцип был выдвинут еще в
1941 г. Ф. Липманом (рис. 1.4), который тогда знал
о существовании только одной биологической «ва-
люты» — АТР. Действительно, АТР — абсолютно
универсальный признак жизни: нет живой клетки,
где бы не было АТР. Но оказалось, что существу-
ют еще две биологических «валюты». Это разности
электрохимических потенциалов ионов Н+ и Na+
(ДЦН. и AjlNaO-
Дцн+ может существовать в двух формах: (1)
электрической и (2) химической. Первая — это
трансмембранная разность электрических потенци-
Рисунок 1.5. Две формы протонного потенциала между отсеками, разделенными мембраной:
градиент электрического поля (АТ, А) и градиент кислотности (АрН, Б). Вероятное направление
протонного тока указано пунктирной стрелкой
алов (ДТ), вторая — трансмембранная разность концентраций ионов водо-
рода (ДрН). Рис. 1.5 иллюстрирует эти два понятия.
Если между двумя отсеками, разделенными мембраной, существует раз-
ность электрических потенциалов, образованная, например, электрической
батареей, то энергетически выгодным оказывается перемещение ионов Н+
из отсека, заряженного положительно, в отрицательно заряженный отсек
(рис. 1.5Л). Другой способ достичь той же цели — закислить содержимое
левого отсека относительно правого, добавив, например, в левый отсек со-
ляную кислоту. В этом случае протонный ток слева направо также будет ид-
ти «под гору», но движущей силой окажется уже не Д*Р, а ДрН (рис. 1.5 Б).
Потенциальная энергия, накопленная в виде Д*Р или ДрН, может быть
утилизирована полезным образом, если поместить в мембрану устройство,
сопрягающее перенос протона «под гору» с совершением какой-либо по-
лезной работы.
Энергия, накопленная в форме Дцн, может быть рассчитана по уравне-
нию (1.2):
[Н+Ъ
Дйн*=/7Д'Г + ЛТ1п^—(1.2)
|Н Jh
где Д*Р — трансмембранная разность электрических потенциалов, R — газо-
вая постоянная, Т — абсолютная температура, F — число Фарадея, [Н+]ри
[Н+]„ — молярные концентрации ионов Н+ в соответственно положительно
заряженном (или более кислом) и в отрицательно заряженном (или более
щелочном) отсеках.
Дцн+ вычисляется в единицах джоуль х моль-1. Для перевода величины
Дцн+ в вольты это значение необходимо разделить на число Фарадея. Полу-
ченное частное П. Митчел предложил называть протон-движущей силой (по
14
ЧАСТЬ I. Принципы биоэнергетики
аналогии с электродвижущей силой) и обозначил ее символом Ар. Величина
Ар может быть рассчитана для 25 °C по уравнению (1.3):
Ар = Дрн7^= - 0,06-АрН. (1.3)
Знак вычитания между АТ и АрН обусловлен тем, что pH — отрицатель-
ный логарифм концентрации водородных ионов. Применительно к рис. 1.5
это обстоятельство иллюстрируется фактом, что Дцн+ будет тем больше, чем
выше положительный заряд и чем ниже pH в левом отсеке.
Согласно уравнению (1.3) АрН, равная 1, эквивалентна АТ, равной
0,06 В, или 60 мВ. Та же величина, выраженная в килоджоулях х моль-1,
будет равна 5,7 (1,37 ккал х моль-1).
Аналогичные уравнения можно применить также и к натриевой энер-
гетике. В этом случае в уравнение (1.3) вместо Дцн+надо подставить ДцНа+,
а вместо Ар — «натрий-движущую силу», которую можно обозначить как As
(от лат. sodium)'.
As = ApNa+/F= AT — 0,06-ApNa. (1.4)
На рис. 1.6 приведена схема энергетики живых клеток, которые исполь-
зуют Дцн+ в качестве мембранной формы конвертируемой энергии. Согласно
схеме свет или энергия субстратов дыхания могут утилизироваться фермента-
ми фотосинтетической или дыхательной редокс-цепей или бактериородопси-
ном. В результате образуется Дцн+, которая затем используется для соверше-
ния работы, в частности для синтеза АТР. Субстратное фосфорилирование
служит альтернативным механизмом образования АТР, который не требует
Дцн+. Такое фосфорилирование наблюдается в цепи реакций гликолиза и при
окислительном декарбоксилировании а-кетоглутаровой кислоты.
Дцн+-зависимое образование АТР — главный, но не единственный про-
цесс трансформации Дцн+ в химическую работу. К тому же типу энерге-
тических превращений относятся синтез неорганического пирофосфата, а
также перенос восстановительных эквивалентов в направлении более от-
рицательных редокс-потенциалов (таковы обратный перенос электронов в
дыхательной цепи и трансгидрогеназная реакция).
Зависящий от ДЦН+ транспорт через мембрану различных форм веществ
в сторону большей их концентрации представляет собой трансформацию
энергии по типу Дцн+ —> осмотическая работа, а вращение бактериального
жгутика за счет энергии Дцн+ служит примером превращения Дцн+ -> ме-
ханическая работа. Образование теплоты митохондриями животных в ответ
на понижение окружающей температуры описывается превращениями типа
ДЦН+ теплота.
Для немембранных частей клетки также описаны все перечисленные
выше типы энергетических превращений. Здесь они поддерживаются энер-
гией АТР или других высокоэнергетических соединений.
Существуют системы, специализированные на стабилизации (забуфе-
ривании) уровней Дцн+ и АТР. Для Дцн+ эту роль играют градиенты Na+ и
К+, для АТР — креатинфосфат.
Глава 1. Введение
15
У некоторых бактерий вместо ДЦН+ образуется ApNa+. Источником энер-
гии могут служить дыхание или неокислительное декарбоксилирование
карбоновых кислот. Образованная ДцМа+ используется для производства
химической, осмотической и механической работы. Буфером ДЦМа+ может
служить К+/Н+-градиент (рис. 1.6Б).
Наиболее сложный характер носит энергетика клетки животного. Фак-
тически здесь в ходу три различные энергетические «валюты»: ДЦН+ в ми-
тохондриях, ДЦМа+ на внешней клеточной мембране и АТР в прочих частях
клетки.
Субстраты
дыхания + О2
или карбоновые
кислоты
Свет или
субстраты
дыхания + О2
ДрК / ApNa
Механическая
работа
Электрическая
работа
Теплота
Химическая
работа
Осмотическая
работа
ДТР » * Креатинфосфат /
креатин
Углеводы,
а - кетоглутаровая
кислота
Осмотическая
работа
дМн* «—
Химическая
работа
механическая
работа
Механическая
работа
Углеводы.
а - кетоглутаровая
кислота
Энергетические
ресурсы
Энергетические
ресурсы
Рисунок 1.6. Схема энергетики
клетки, использующей Ацн+ и
АТР (А) или AfNa+ и АТР (Б) в
качестве конвертируемых форм
энергии. (В) Взаимопревраще-
ние трех конвертируемых форм
энергии
16
ЧАСТЬ I. Принципы биоэнергетики
Возвращаясь к первому закону биоэнергетики, нужно сказать, что три
его компонента (АТР, Дцн+, ДрКа+) неравнозначны. АТР — непременный
компонент, а два остальных взаимозаменяемы, и вследствие этого у неко-
торых организмов может присутствовать либо тот, либо другой компонент.
Но один из них должен быть обязательно. Следствием этого является 2-й
закон.
2-й закон биоэнергетики. Любая живая клетка располагает хотя бы дву-
мя формами конвертируемой энергии — АТР и Дцн+ или ДЦНа+. Продолжая
аналогию с денежным обращением, у клетки в кошельке всегда есть и банк-
ноты, и кредитная карточка.
3-й закон биоэнергетики предполагает взаимопревращение трех конвер-
тируемых форм запасенной энергии. Вот почему клетка может удовлетво-
рить все свои энергетические потребности, если есть возможность получить
хотя бы одну из трех конвертируемых форм энергии за счет внешних энергети-
ческих ресурсов (рис. 1.61?). Иными словами, клетке все равно, как распла-
чиваться за совершенную работу — банкнотами или кредитной карточкой.
Описаны клетки, использующие только какой-то один тип энергети-
ческих ресурсов. Одни из них живут за счет дыхания или фотосинтеза и
образуют только Дцн+, у них нет гликолиза, поэтому нет возможности пря-
мого синтеза АТР. У других, наоборот, единственным источником энергии
служит гликолиз, образующий АТР без посредничества Дцн+. У некоторых
бактерий нет ни гликолиза, ни дыхания, ни фотосинтеза — они накаплива-
ют ДцНа+ за счет протекания одной из реакций декарбоксилирования, а из
ДцНа+ делают и АТР, и Дцн+.
Мы обычно не осознаем масштаб событий, сопровождающих энергоо-
беспечение нашего организма. Вот некоторые цифры. Человек за день по-
требляет в среднем около 140 л кислорода и синтезирует около 40 кг АТР,
для чего нужно перекачать через мембраны митохондрий порядка 0,5 кг
протонов. При этом генераторы Дцн+ поддерживают напряженность элек-
трического поля на митохондриальной мембране в сотни кВ/см.
В науке, которой посвящен наш курс, есть еще много белых пятен. До
сих пор не ясны молекулярные механизмы большинства взаимопревраще-
ний различных форм энергии. Более того, не факт, что схемы, приведенные
на рис. 1.6, описывают все типы биологической трансформации энергии.
В них, например, отсутствует образование света. Свет является не только
источником энергии. Любое живое существо высвечивает фотоны, обра-
зующиеся при свободно-радикальных реакциях, которые всегда протекают
в клетке. Неясно, что это — только побочный продукт таких реакций или
же клетки как-то используют свет в качестве сигнала.
Ярчайшая иллюстрация глубины нашего незнания — история с откры-
тием роли митохондрий в запрограммированной смерти клетки — апоптозе.
В самом конце XX в. выяснилось, что в межмембранном пространстве ми-
тохондрий спрятаны «белки смерти», которые запускают апоптоз, выйдя из
митохондрий в цитозоль. Таким образом, митохондрии не только электро-
станции клетки, но и органеллы, определяющие самую ее судьбу. А про-
Глава 1. Введение
17
стейший из цитохромов — цитохром с, которым занималось множество
биоэнергетиков, начиная с открывшего его в 1925 г. Д. Кейлина, — оказал-
ся мощным инструментом клеточного самоубийства, причем это совершен-
но другая функция данного белка, не имеющая никакого отношения к его
функции переносчика электронов.
1.4. Эволюция биоэнергетических механизмов
Как возникли в процессе эволюции те три конвертируемых формы
энергии, о которых шла речь в предыдущем разделе? Искать ответа на этот
вопрос — задача неблагодарная. Прямого опыта здесь не поставишь, а от
палеонтологов удается добиться основанного лишь на косвенных данных
мнения, что какие-то следы жизнедеятельности цианобактерий есть в древ-
нейших из дошедших до нас осадочных породах возрастом порядка 3,5 млрд
лет. И все же без обсуждения этой проблемы нам не обойтись. Нельзя по-
нять устройство современных живых систем, не представив себе хотя бы в
общих чертах прошлое системы, т.е. происхождение и эволюцию. Ниже мы
изложим свою гипотезу происхождения биоэнергетических механизмов.
1.4.1. Аденозинтрифосфат
Почему эволюция остановила свой выбор на этом веществе? Рассмо-
трим каждую из трех составных частей АТР. Первая — трифосфатный оста-
ток, где собственно и запасена энергия АТР. Итак, почему АТР? Известно,
что если третий атом фосфора заменить на ближайший ему по свойствам
атом мышьяка, то образовавшийся ADP-арсенат быстро распадается уже
при комнатной температуре и нейтральном pH. Атом мышьяка чуть больше
атома фосфора, и этого оказывается достаточно, чтобы облегчить его ата-
ку молекулами воды. К тому же во внешней среде мышьяка значительно
меньше, чем фосфора, так что искать мышьяк живому существу было бы по
меньшей мере утомительно.
Среди биологов бытует миф об АТР как уникальной биологической
форме энергии, поскольку это вещество имеет высокоэнергетические (или
«макроэргические») связи. Строго говоря, к высокоэнергетическим соедине-
ниям можно отнести АТР и все вещества, способные образовывать АТР в
ферментативных реакциях переноса групп. Изменение свободной энергии
при гидролизе таких соединений всегда не меньше, чем таковое для адено-
зинтрифосфата, т.е. около 10 ккал х моль-1 (в физиологических условиях;
в стандартных условиях эта величина составляет около 7 ккал х моль-1).
Следует подчеркнуть, что термин «высокоэнергетические соединения»
имеет скорее биологический, чем химический смысл. Эту мысль можно
пояснить следующим примером. Креатинфосфат служит высокоэнергети-
ческим соединением у позвоночных, располагающих ферментом креатин-
фосфокиназой, катализирующим обратимый перенос фосфорила между
АТР и креатином. В то же время у некоторых беспозвоночных, где роль
буфера для АТР играет аргининфосфат, а креатинфосфокиназа отсутствует,
18
ЧАСТЬ I. Принципы биоэнергетики
креатинфосфат уже не высокоэнергетическое соединение, если следовать
определению, данному выше.
Ошибочное представление, что пирофосфатные связи в АТР какие-
то особенные, породило следующее заблуждение — энергия непременно
должна выделяться при гидролизе АТР. В действительности оказалось, что
во многих случаях энергия выделяется не при гидролизе этой связи, а при
сорбции АТР на белке. Если АТР особым образом «распять» в активном цен-
тре белка, то часто он (АТР) теряет «макроэргичность», и потом уже нельзя
из этого распятого АТР сделать нормальный, свободный, «макроэргиче-
ский» АТР, поскольку энергия АТР инвестирована в напряженную кон-
формацию белковой молекулы. В таких случаях свободный АТР можно по-
лучить, лишь денатурировав белок. В норме же конформационная энергия
белка используется для совершения определенной работы, а последующий
гидролиз АТР нужен для получения конечных продуктов реакции (ADP и
фосфата), отщепление которых от белка освобождает место для посадки на
белок следующей молекулы АТР. Деэнергизация АТР при сорбции на белке
не удивительна, поскольку свободный АТР имеет мало общего со связан-
ным АТР, который взаимодействует сразу со многими функциональными
группами в активном центре фермента. В результате этих взаимодействий
электронные плотности в связанном АТР могут быть распределены совер-
шенно иначе, чем в свободном.
Следующая проблема: почему АТР? Это не простой вопрос, так как уже
ADP является макроэргом. Существует фермент аденилаткиназа, который
может из двух ADP сделать АТР и АМР. Стандартная цена энергии пиро-
фосфатной связи в терминальном фосфате ADP близка к таковой у АТР.
Казалось бы, всю энергетику клетки можно построить на гидролизе ADP
до АМР. И тем не менее эволюцией был выбран более сложный АТР, а не
более простой ADP. Объяснение этому парадоксу следует искать в том об-
стоятельстве, что существуют два пути гидролиза АТР.
АТР + Н2О -> ADP + Pi5 (1.5)
АТР + Н2О -> ADP + PPj. (1.6)
Гидролиз терминального фосфата в АТР происходит в тех случаях,
когда эндэргонический процесс, движимый расщеплением АТР, требу-
ет энергии либо меньшей или равной 10 ккал х моль-1, либо много большей
10 ккал х моль-1. (В этих случаях существует особый механизм, позволяю-
щий использовать энергию многих молекул АТР для совершения одного
функционального акта, к примеру актомиозин.)
В реакциях, когда потребность в энергии лишь несколько больше
10 ккал х моль-1, АТР гидролизуется до АМР и неорганического пирофос-
фата. In vivo в клетке выход энергии при гидролизе АТР до АМР и РР> на
4—5 ккал х моль-1 превосходит таковой при его гидролизе до ADP и Р4. Это
обусловлено значительно более низкой концентрацией неорганического
пирофосфата по сравнению с неорганическим фосфатом, образующимся
вследствие необратимого гидролиза PPj пирофосфатазой.
Глава 1. Введение
19
Таким образом, использование в качестве конвертируемой «валюты»
аденозин/и/шфосфата, а не аденозиндифосфата сообщает дополнительную
гибкость биологической системе энергообеспечения.
1.4.2. Гипотеза об адениновом фотосинтезе
Но, пожалуй, самый интригующий вопрос, почему носителем высо-
коэнергетических фосфатов оказался аденозин, т.е. почему ЛТР? Все ска-
занное выше об АТР верно и для неорганического трифосфата. Далее мы
попытамся продемонстрировать, что сегодня аденозин в АТР — не более
чем родимое пятно эволюции.
Есть разные идеи о том, что послужило источником энергии при про-
исхождении жизни на Земле или в космосе. Некоторые считают, что это
была энергия электрических разрядов при грозах, другие — что термальная
энергия, третьи — энергия окисления древних осадочных пород. Нам ка-
жется, однако, что становление жизни было настолько длительным и му-
чительным процессом, что первичным энергетическим ресурсом должно
было быть нечто не ограниченное какими бы то ни было земными обстоя-
тельствами. Есть только один такой источник энергии, который и сегодня
служит первичным энергетическим ресурсом жизни на Земле, — свет Солн-
ца. У солнечного света есть видимая и ультрафиолетовая составляющие.
Считается, что во времена происхождения жизни ультрафиолет свободно
проходил сквозь атмосферу и достигал поверхности первичного океана, по-
скольку кислорода было еще слишком мало, чтобы образовать непрони-
цаемый для ультрафиолета озоновый слой. Окрашенных веществ, т.е. тех,
которые поглощают видимый свет, очень мало, а вот ультрафиолетовый
свет поглощают практически все вещества. Кванты такого света могли раз-
вязать множество химических реакций простых веществ, имевшихся в пер-
вичном океане и атмосфере древнейшей Земли. Американский биохимик
С. Понамперума поставил такие опыты. Он запаял стерильный раствор си-
нильной кислоты в ампулу и затем облучил его ультрафиолетовым светом.
Оказалось, что в результате облучения в растворе образовался аденин и
другие азотистые основания.
Как показал Понамперума, в тех же условиях под действием ультра-
фиолета синтезировался аденозин, а если в ампулу был добавлен помимо
синильной кислоты еще и этилметафосфат, то также AMP, ADP, АТР и
аденозинтетрафосфат, причем превращение ADP в АТР шло с достаточно
хорошим выходом, гораздо большим, чем синтез АМР и аденозина или
АДР из АМР.
Моделируя атмосферу древнейшей Земли, К. Саган пришел к выводу о
существовании в ней «окна» в области 240—290 нм, прозрачного для ультра-
фиолетового света, поскольку основные простые компоненты этой атмо-
сферы (Н2О, СН4, NH3, СО2, СО и HCN) поглощают свет короче 240 нм,
а формальдегид, также входивший, как полагают, в ее состав, имеет мак-
симум поглощения длиннее 290 нм. Именно в этом «окне» располагаются
спектральные максимумы пуринов и пиримидинов.
20
ЧАСТЬ I. Принципы биоэнергетики
К. Саган и С. Понамперума приводят следующие доводы в пользу того,
что в качестве антенны для ультрафиолетового света аденин имеет преиму-
щества по сравнению с другими пуринами и пиримидинами: (1) наиболь-
шее поглощение света в спектральном «окне», о котором шла речь выше;
(2) наибольшая устойчивость к разрушительному действию ультрафиоле-
тового света и (3) большая продолжительность возбужденного состояния,
возникающего в ответ на поглощение ультрафиолетового кванта.
Расчеты Л.А. Блюменфельда и М.И. Темкина привлекли наше внима-
ние к тому, что величины изменения свободной энергии при нарушении
ароматической структуры аденина близки к энергии реакции синтеза АТР
из ADP и неорганического фосфата.
Приняв во внимание все названные выше обстоятельства, мы предло-
жили следующий механизм фосфорилирования за счет ультрафиолетового
света в первичных живых клетках.
1) Адениновая часть ADP поглощает ультрафиолетовый квант, что пе-
реводит ее в возбужденное состояние с нарушенной системой двойных свя-
зей. При этом аминогруппа аденина, соответствующая в обычном состоя-
нии ароматической, приобретает свойства алифатической, что облегчает ее
атаку атомом фосфора неогранического фосфата*.
2) Возбужденный аденин ADP фосфорилируется, давая изомер АТР,
третий фосфорил которого находится при аминогруппе аденина.
3) Фосфорил переносится с аденина на конечный (второй) фосфат ADP.
Такой перенос облегчен тем, что расстояние между шестичленным циклом
в аденине и вторым фосфатом в ADP в точности равно размеру еще одного
(третьего) фосфатного остатка (на это обстоятельство обратил внимание
еще А. Сент-Дьерди). Перенос фосфорила с адениновой «головы» нукле-
отида на фосфатный «хвост» должен сопровождаться его стабилизацией,
поскольку весьма лабильный фосфоамид заменяется на менее лабильный
фосфоангидрид (рис. 1.7).
Стадии (2) и (3) гипотетичны и призваны объяснить механизм синтеза
АТР под действием ультрафиолета в опытах Понамперумы.
Известно, что аденин и реже другие пурины или пиримидины входят в
состав ключевых коферментов и простетических групп ферментов, таких,
как никотинамидадениндинуклеотид (NAD+), никотинамидадениндину-
клеотидфосфат (NADP+), флавинадениндинуклеотид (FAD), кофермент А
(СоА), тиаминопирофосфат (производное витамина ВО, витамин В12. Все
эти соединения, как правило, построены по одному и тому же принципу.
Они содержат (1) ту или иную функциональную группу, непосредственно
участвующую в катализе, (2) пурин или (реже) пиримидин и (3) гибкую
связку, позволяющую сблизить две другие части молекулы. Особенно на-
глядно устройство динуклеотидов: в них плоские остатки никотинамида
(в NAD+ и NADP+) или изоаллоксазина (в FAD) лежат на таком же плоском
остатке аденина. Продемонстрирован перенос энергии от остатка аденина
к остатку никотинамида или изоаллоксазина в ответ на поглощение адени-
* Другая возможность: фосфат присоединяется к N! аденина, а не к его аминогруппе.
Например, описаны природные соединения NAD+ с рибозой в положении N,.
Глава 1. Введение
21
ном ультрафиолетового кванта. Резон-
но предположить, что исходно аденин,
возбуждаясь ультрафиолетовым светом,
передавал энергию на функциональную
группу кофермента, который использо-
вал эту энергию для проведения энер-
гоемких химических реакций (напри-
мер, восстановления простых веществ
среды до более сложных соединений
первичной клетки).
В дальнейшем не слишком специ-
фичный и нерегулируемый катализ,
осуществляемый низкомолекуляр-
ными коферментами, был вытеснен
процессами с участием высокомоле-
кулярных катализаторов-ферментов,
отличающихся огромной избиратель-
ностью в отношении субстратов и
возможностью регулировать катализ.
По-видимому, первыми ферментами
были рибонуклеиновые кислоты — по-
О—Р—о-p—он
। ।
он он
ADP
лимеры, составленные из мономеров-
нуклеотидов. Можно полагать, что аде-
ниновый фотосинтез катализировался
комплексами РНК с магниевыми соля-
ми ADP и фосфата. При этом РНК мог-
ла бы выполнять также роль антенны,
собирающей ультрафиолетовый свет и
передающей возбуждение на ADP.
Два свойства РНК предопредели-
ли, по-видимому, дальнейшую эво-
люцию — способность этой молекулы
создавать свою копию (реплицировать-
ся) и способность двух разных РНК
обмениваться участками своих нуклео-
Рисунок 1.7. Схема «аденинового фото-
синтеза» — предполагаемого первичного
механизма запасания энергии в живой
клетке. Квант ультрафиолетового света
поглощается адениновой частью аде-
нозиндифосфата (АТР), переводя ее в
возбужденное состояние. Возбуждение
облегчает присоединение неорганическо-
го фосфата (Pz) к аминогруппе аденина.
В результате образуется PADP, изомер
аденозинтрифосфоата (АТР), где третий
фосфат присоединен не к пирофосфат-
ному «хвосту», а к адениновой «голове»
ADP. Затем происходит перенос фосфата
от «головы» к «хвосту» с образованием
обычного АТР
тидных последовательностей (рекомбинация). А.С. Спирин предположил,
что когда-то первичный океан представлял собой гигантский реактор, в ко-
тором «варилось» бесчисленное множество непрерывно рекомбинирующих
молекул РНК (эдакий Солярис Станислава Лема). Трудно даже представить
себе все разнообразие вариантов РНК, возникавшее в такой системе.
Надо сказать, что еще и сегодня в определенных (хотя и весьма не-
многочисленных) случаях биохимические реакции могут катализироваться
рибонуклеиновыми кислотами (так называемыми рибозимами). Наиболее
важной из них является рибосома, катализирующая синтез белков благо-
даря участию функциональных групп, прежде всего рибосомальных РНК,
в то время как группы, принадлежащие белкам, играют в общем-то вспомо-
гательную роль. Однако несомненно, что каталитические функции совре-
22
ЧАСТЬ I. Принципы биоэнергетики
менных организмов, как правило, осуществляются белками, обладающими
гораздо большим, чем РНК, разнообразием химических группировок и их
сочетаний.
Кодирование структуры белков первоначально осуществлялось, по-
видимому, все теми же рибонуклеиновыми кислотами. Затем функция ко-
дирования была передана более стабильным дезоксирибонуклеиновым кис-
лотам (ДНК) (отсутствие спиртовой группы в дезоксирибозе стабилизирует
сложноэфирную связь в ДНК).
Другим важнейшим изобретением биологической эволюции стали жи-
ры и жироподобные вещества, прежде всего фосфолипиды. Замечательной
особенностью фосфолипидов является их способность самопроизвольно,
без какой-либо помощи извне образовывать тончайшую пленку, непрони-
цаемую для гидрофильных веществ, таких, как нуклеотиды-коферменты,
РНК, ДНК, белки и углеводы. Эта пленка (мембрана) представляет собой
бислой, образованный двумя рядами молекул фосфолипидов, соприкасаю-
щихся своими гидрофобными (углеводородными) «хвостами». При этом ги-
дрофильные «головы» (фосфатные остатки) фосфолипидов оказываются на
двух противоположных поверхностях мембраны. Толщина такой мембраны
порядка 50 ангстрем.
С образованием мембран стало возможным говорить о первичной жи-
вой клетке, содержимое которой было отделено от внешней среды достаточ-
но надежным барьером. Появление клетки как обособленного мельчайшего
пузырька могло бы сыграть роль в защите от неблагоприятных эффектов
ультрафиолетового облучения.
1.4.3. Запасные энергетические ресурсы и гликолиз
Ультрафиолетовый свет — обоюдоострое оружие. Он хорош тем, что
способен инициировать разнообразные химические реакции, среди кото-
рых могут быть полезные, как, например, фосфорилирование адениновой
аминогруппы ADP. Но в то же время (и по той же причине!) ультрафиолето-
вый свет опасен: он может разрушить уже синтезированные молекулы жи-
вой клетки. Одним из способов уменьшить «ультрафиолетовую опасность»
могли стать запасные вещества — энергетические ресурсы, образуемые на
свету, чтобы затем использоваться в темноте. Ультрафиолетовый свет, до-
стигающий поверхности океана, не может проникать на сколько-нибудь
значительную глубину из-за мутности и наличия растворенных веществ,
поглощающих ультрафиолетовые кванты. Фактически только очень тонкий
поверхностный слой подвергается бомбардировке этими квантами. Данное
обстоятельство позволяет предположить следующий механизм энергообе-
спечения первичных живых клеток. Под действием движения слоев жид-
кости в океане клетки постоянно циркулировали между тонкой верхней
пленкой воды, доступной для ультрафиолетового света, и более глубокими
слоями, которых он не достигал. При этом вблизи поверхности происходил
синтез АТР, использовавшегося для образования резервных соединений,
которые затем расщеплялись на глубине, поддерживая ресинтез АТР из
Глава 1. Введение
23
Рисунок 1.8. Энергетика первичной живой клетки,
основанная на «адениновом фотосинтезе». Предпо-
лагается, что ультрафиолетовые кванты, достигая
поверхности первичного океана, использовались
клеткой для синтеза АТР, который запускал синтез
углеводородов (гликонеогенез). Клетка, увлекаемая
потоком океанской воды с поверхности на не-
которую глубину, оказывалась недосягаемой для
ультрафиолетового облучения. Здесь происходило
расщепление накопленных углеводов (гликолиз),
сопряженное с синтезом АТР, который использо-
вался для совершения клеткой различных типов
полезной работы
Атмосфера
ADP и Р15 образовавшихся при эндергонических процессах жизнедеятель-
ности. В результате короткие экспозиции на ультрафиолетовом свету чере-
довались с гораздо более длительными периодами, где ультрафиолетовой
опасности уже не было (рис. 1.8). Кроме того резервные вещества помогали
клеткам пережить ночь.
Хорошими кандидатами на роль энергетического резерва первичных
клеток могли бы быть неорганические пиро- и полифосфаты. Они и сегод-
ня играют эту роль у некоторых видов живых существ. Например, в клетках
грибов полифосфаты образуются из АТР в условиях избытка энергетиче-
ских ресурсов и расщепляются, давая АТР, при дефиците источников энер-
гии. Однако в подавляющем большинстве дошедших до нас организмов
функцию легко мобилизуемого энергетического резерва выполняют не по-
лифосфаты, а углеводы. Их синтез за счет энергии АТР (гликонеогенез)
представляет собой длинную последовательность реакций, намного более
сложную, чем синтез полифосфатов из АТР. Преимущество углеводов перед
полифосфатами состоит в том, что в них запасена не только энергия, но и
«строительный материал». Расщепление углеводов (гликолиз) дает, помимо
АТР, различные карбоновые кислоты, такие, как пировиноградная кислота,
которая может использоваться клеткой при биосинтезе самых разнообраз-
ных соединений.
Описаны два основных типа гликолиза. В одном случае (спиртовое бро-
жение) конечными продуктами расщепления углеводов оказываются этило-
вый спирт и углекислый газ — вещества, легко проникающие через мем-
брану клетки. Это обстоятельство имеет как преимущества (нет проблемы
переполнения клетки конечными продуктами гликолиза), так и недостатки
(трудно вернуться назад, к углеводу, если конечные продукты уже вышли из
клетки и разбавились в океане внешней среды).
Указанный недостаток отсутствует во втором, на сегодня гораздо более
распространенном типе гликолиза, когда конечным продуктом оказывается
24
ЧАСТЬ I. Принципы биоэнергетики
молочная или какая-либо другая карбоновая кислота. Молочная кислота
не проникает через мембрану, не покидает пределы клетки и потому может
быть использована клеткой для ресинтеза углеводов, когда возникает такая
возможность. Неудачно лишь то, что молекулы молочной кислоты, обра-
зуясь, диссоциируют с образованием ионов лактата и водорода. Послед-
ние тоже не могут пройти через мембрану, остаются в клетке и закисляют
ее содержимое. Закисление, если его не предотвратить, приведет к гибели
клетки из-за кислотной денатурации белков. Возможное решение этой про-
блемы будет описано в следующем разделе.
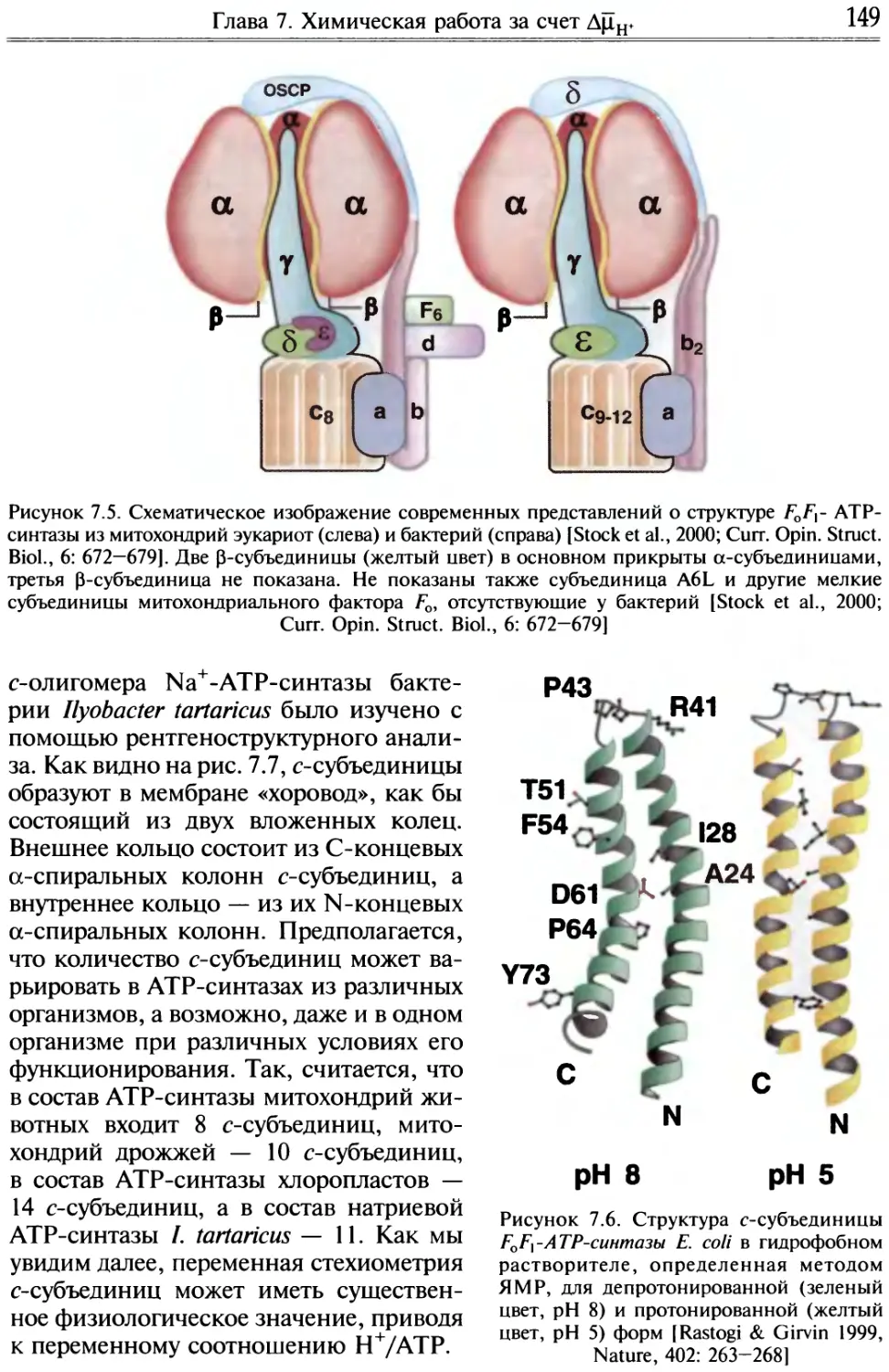
1.4.4. Протонные каналы и FT-АТРаза как способы предотврати
закисление клетки при гликолизе
Проблема проникновения через клеточную мембрану веществ, которые
сами по себе не могут сквозь нее пройти, у современных клеток решается
с помощью встроенных в мембрану белков-переносчиков. В частности, из-
вестны белки-переносчики ионов Н+. Так называемый фактор Fo — белок,
входящий в состав Н+-АТР-синтазы, — действует как переносчик Н+ или
протонный канал.
Можно предположить, что у первичных гликолизирующих клеток фак-
тор Fo функционировал в отсутствие фактора Ft, второго (каталитическо-
го) компонента Н+-АТР-синтазы, разрешая ионам Н+, образующимся при
гликолизе, покинуть пределы клетки. Так предотвращалось закисление
&
Гликолиз —>1Н+ ———-- Н4
Рисунок 1.9. Как первичная клетка мог-
ла избавиться от ионов Н+, образуемых
гликолизом? А — облегченная диффузия
ионов Н+ посредством белка (фактора Fo),
образующего Непроводящий путь сквозь
клеточную мембрану; Б — комплекс
факторов Fo и Fx (Н+-АТРаза), активно
откачивающий из клетки ионы Н+ за счет
гидролиза АТР
внутриклеточной среды, которая ока-
зывалась в равновесии по ионам Н+ с
внеклеточной средой. Ограничениями
гликолиза в такой ситуации стали за-
кисление внеклеточной среды и гене-
рация мембранного потенциала (АТ) за
счет диффузии иона Н+ изнутри клетки
наружу, т.е. в клетке возникал избыток
отрицательных зарядов (интересно, что
все без исключения дошедшие до нас
живые клетки имеют АТ со знаком
«минус» внутри).
Ослабить действие этих ограниче-
ний можно было, достроив белок — пе-
реносчик ионов Н+ (фактор Fo) — дру-
гим белком, называемым фактором Fx,
способным использовать энергию АТР
для активной откачки из клетки ионов
Н+ через фактор Fo. Известно, что Н+-
АТР-синтаза (комплекс факторов Fo и
F]), действуя в обратном направлении,
способна катализировать вместо синте-
за АТР гидролиз АТР, сопряженный с
Глава 1. Введение
25
откачкой ионов Н+. Этот процесс носит название Н+-АТРазной реакции
(рис. 1.9). Можно полагать, что с образованием Н+-АТРазы завершилось
формирование первичной клетки, использовавшей ультрафиолетовый свет
в качестве источника энергии для жизнедеятельности.
1.4.5. Бактериородопсиновый фотосинтез —
первичный механизм использования видимого света
С течением времени все меньше ультрафиолетовых квантов достигало
поверхности Земли. Причиной было образование озонового слоя атмосфе-
ры в условиях повышения в ней концентрации кислорода. Первоначально
кислород образовывался, по-видимому, вследствие фотолиза паров воды
под действием того же ультрафиолетового облучения. Чтобы выжить в но-
вых условиях, древние клетки должны были переключиться с ультрафиоле-
тового света на какой-либо иной источник энергии, все еще доступный для
них в новых условиях. Таким источником стал, вероятно, видимый свет.
Возможен и другой сценарий эволюции. Возникновение фотосинтеза,
использующего видимый свет, произошло еще до помутнения атмосферы,
а именно при проникновении жизни в более глубокие уровни океана, ли-
шенные ультрафиолетового света. Замена опасного ультрафиолетового из-
лучения на безопасный видимый свет могла бы стать тем признаком, кото-
рый лег в основу естественного отбора на данном этапе эволюции. В рамках
этой концепции создание озонового слоя имеет биогенную природу, явив-
шись результатом фотолиза воды системой хлорофилльного фотосинтеза
зеленых бактерий и цианобактерий.
Новый фотосинтез должен был, как и прежде, образовывать АТР, ко-
торый к тому времени уже прочно занял место в центре метаболической
карты как «конвертируемая энергетическая валюта» клетки. Однако аденин
уже не мог играть роль улавливающей свет антенны, так как его максимум
поглощения находится в ультрафиолетовой, а не в видимой области спектра.
До нас дошли два типа фотосинтетических устройств, использующих види-
мый свет. Антенной в одном из них служит хлорофилл, в другом — произ-
водное витамина А, ретиналь, соединенный с особым белком, названным
бактериородопсином. Хлорофилл обнаружен у зеленых растений и почти у
всех фотосинтезирующих бактерий. Исключение составляют группа соле- и
теплоустойчивых архей и некоторые бактерии, содержащие бактериородоп-
син. Тем не менее именно бактериородопсин выглядит как эволюционно
первичный механизм запасания клеткой энергии видимого света.
Бактериородопсин — светозависимый протонный насос. Он способен
активно откачивать ионы Н+ из клетки за счет энергии видимого света,
поглощенного ретиналевой частью его молекулы. В результате световая
энергия превращается в Дцн+. Ионы Н+, откачанные бактериородопсином,
могут вернуться в клетку через комплекс факторов Fo и F{ таким образом,
что энергия, освобождающаяся при движении протонов «под гору», исполь-
зуется для синтеза АТР. Нетрудно представить себе, как возник фотосинтез
АТР, катализируемый бактериородопсином и комплексом 7%/^. С появле-
26
ЧАСТЬ I. Принципы биоэнергетики
Рисунок 1.10. Бактериородопсиновый фотосинтез. Ионы Н+ откачиваются из клетки бакте-
риородопсином — белком, содержащим ретиналь в качестве хромофора, т.е. группировки,
поглощающей видимый свет. Ионы Н+ возвращаются в клетку, двигаясь «под гору» через
Н+-АТРазный комплекс FoFi. При этом оказывается, что Н+-АТРаза катализирует обратную
реакцию, т.е. синтез АТР, а не его гидролиз
нием бактериородопсина клетка научилась создавать ДЦН+ за счет видимого
света, а эта Ацн+, образовавшись, просто развернула вспять Н+-АТРазную
реакцию, существовавшую ранее в качестве механизма откачки из клетки
гликолитических ионов Н+. Так комплекс FOFX мог превратиться из АТРазы
в ATP-синтазу (рис. 1.10).
Устройство бактериородопсина намного проще системы хлорофилль-
ного фотосинтеза. Белковая часть бактериородопсина представляет собой
одну полипептидную цепь средней длины, которая не содержит других
коферментов и простетических групп, кроме ретиналя. Бактериородопсин
чрезвычайно устойчив: без потери активности его можно кипятить в ав-
токлаве при +130 °C, изменять содержание NaCl в омывающем мембрану
растворе от нуля до насыщения, в широких пределах изменять pH этого
раствора. Более того, можно удалить выступающие из мембраны концевые
участки полипептидной цепи и даже расщепить эту цепь в одном месте по-
середине без ущерба для активности насоса. В то же время эффективность
бактериородопсина как преобразователя энергии сравнительно низка: всего
20% энергии светового кванта превращается в ДЦН+. При этом на один по-
глощенный квант через мембрану переносится лишь один ион Н+.
1.4.6. Хлорофилльный фотосинтез
Хлорофилльный фотосинтез отличается от бактериородопсинового
большей эффективностью использования светового кванта. Он устроен
таким образом, что либо на каждый квант переносится через мембрану
не один, а два иона Н+, либо помимо транспорта Н+ происходит запаса-
ние энергии в форме углеводов, синтезируемых из СО2 и Н2О. Вот поче-
Глава 1. Введение
27
му бактериородопсиновый фотосинтез был в ходе эволюции вытеснен с
авансцены.
Хлорофилльный фотосинтез катализируется ферментной системой,
включающей несколько белков. Квант света поглощается хлорофиллом,
молекула которого, перейдя в возбужденное состояние, передает один из
своих электронов в фотосинтетическую цепь переноса электронов. Эта цепь
представляет собой последовательность окислительно-восстановительных
ферментов и коферментов, находящихся во внутренней мембране бактерий
или хлоропластов растений, где локализованы также белки, связанные с
хлорофиллом. Компоненты цепи содержат, как правило, ионы металлов с
переменной валентностью (железа, меди или марганца). При этом железо
может входить в состав гема (в таком случае белки называются цитохро-
мами). Большую роль играют также негемовые железопротеиды, где ион
железа связан с белком через серу цистеина или (реже) азот гистидина. По-
мимо ионов металлов, роль переносчиков электронов играют производные
хинонов, такие, как убихинон, пластохинон и витамины группы К (здесь и
далее структурные формулы различных простетических групп и кофакторов
ферментов электрон-транспортных цепей см. в Приложении 2).
Перенос по цепи электрона, отнятого от возбужденного хлорофилла,
завершается по-разному — в зависимости от типа фотосинтеза.
У пурпурных бактерий (рис. 1.11) электрон с возбужденного светом
хлорофилла переносится на другую сторону мембраны, где присоединяется
к хинону (CoQ). Восстановленный CoQ присоединяет протоны, образуя
CoQH2. Последний диффундирует на другую сторону мембраны, чтобы вер-
нуть хлорофиллу его электрон. При этом протоны CoQH2 освобождаются в
воду в виде ионов Н+, оказавшихся снаружи клетки. Процесс завершается
возвращением ионов Н+ в клетку через Н+-АТР-синтазу, образующую при
этом АТР.
Рисунок 1.11. Хлорофилльный фотосинтез пурпурных бактерий
Упрощенный вариант. Объяснения в тексте
28
ЧАСТЬ I. Принципы биоэнергетики
Рисунок 1.12. Хлорофилльный фотосинтез цианобактерии глеобактер.
I
Упрощенный вариант. Объяснение в тексте. НСОН — компонент глюкозы
Следующим шагом в эволюции фотосинтеза стали, по-видимому, циа-
нобактерии типа глеобактера. В этом случае хлорофилл восстанавливает при
участии особых ферментов внутриклеточную углекислоту, превращая ее в
глюкозу. При этом поглощаются Н+ ионы из цитозоля. Что касается восста-
новителя фотоокисленного хлорофилла, то им оказывается внеклеточная
вода, расщепляющаяся до О2 и Н+. Обратный поток Н+ внутрь клетки через
FoFi сопряжен с генерацией АТР (рис. 1.12). Таким образом, фотосинтез
цианобактерий параллельно с образованием АТР дает углевод — главное
резервное вещество современных живых клеток. Нет сомнений, что циано-
бактерия является эволюционным предшественником хлоропластов — ор-
ганелл зеленых растений, энергетика которых устроена в основном по той
же схеме, что показана на рис. 1.12.
1.4.7. Дыхательный механизм энергообеспечения
Побочным продуктом фотосинтеза у цианобактерий и растений слу-
жит молекулярный кислород. Нарастание его концентрации в атмосфере
привело к появлению ферментов, убирающих этот сильный окислитель,
опасный для жизнедеятельности. Вероятно, первой функцией ферментов,
восстанавливающих О2 до Н2О, было снижение внутриклеточной концен-
трации кислорода. Однако в дальнейшем аэробные бактерии научились из-
влекать пользу из этого процесса, создав дыхательную цепь электронного
транспорта, сопряженного с откачкой ионов Н+.
Дыхательная цепь представляет собой механизм окисления суб-
стратов дыхания, получающихся, например, из глюкозы, образованной
организмами-фотосинтетиками. По существу, ферменты дыхательной це-
пи выполняют функции, противоположные тем, которые осуществляются
при фотосинтезе цианобактерий и хлоропластов. При дыхании происходит
Глава 1. Введение
29
Рисунок 1.13. Механизм дыхательного фосфорилирования в аэробных бактериях и митохондриях.
Упрощенный вариант. Объяснение в тексте
не синтез, а окисление органических веществ. В результате происходит не
окисление Н2О до О2, а восстановление О2 до воды. Что касается синтеза
АТР, то он, как и во всех прочих случаях, сопряжен с переносом Н+ «под
гору» (рис. 1.13).
Подобно тому, как хлоропласты произошли от цианобактерий, мито-
хондрии животных, растений и грибов ведут свое происхождение от аэроб-
ных бактерий. Поэтому неудивительно, что митохондриальная дыхатель-
ная цепь описывается той же принципиальной схемой, что изображена на
рис. 1.13.
Завершающим аккордом в создании современной картины энергетики
жизни стала, по-видимому, замена Н+ на Na+ в ряде биоэнергетических
устройств. Натрий имеет два преимущества перед протоном. Во-первых,
он гораздо более массовый (в океане 5х10-1 М Na+ против 1* 10-7 М Н+).
Во-вторых, мембраны более проницаемы для Н+, чем для Na+. Протонак-
цепторные группы мембранных белков повышают ее Непроводимость, че-
го не происходит в случае с Na+. Создать мембрану, непроницаемую для
протона, очень сложно, для Na+ — гораздо проще. Особенно неудобен ион
Н+ как сопрягающий ион в щелочной среде, где его концентрация осо-
бенно низка. Неудобен он и для жизни при высокой температуре, посколь-
ку с ростом температуры Непроводимость мембран увеличивается гораздо
сильнее, чем №+-проводимость. Базируясь на известном принципе, испо-
ведуемом энзимологами, — «белок может все», нетрудно себе представить
некий белок, который откачивает ионы Na+ наружу за счет использования
того или иного энергетического источника, и другой белок, разрешающий
иону Na+ войти в клетку параллельно с синтезом АТР или совершением
какой-либо другой работы. Так могли бы возникнуть «натриевые» мембра-
ны, использующие Na+, а не Н+ в качестве сопрягающего иона. Примером
«натриевых» мембран могут быть, во-первых, мембраны некоторых мор-
ских бактерий, имеющих Na+-транспортирующую дыхательную цепь (или
30
ЧАСТЬ I. Принципы биоэнергетики
№+-декарбоксилазу) и №+-АТР-синтазу, и, во-вторых, внешняя мембра-
на животной клетки с ее №+/К+-АТРазой и №+-зависимыми белками —
транспортерами различных веществ.
Следующим этапом эволюции может оказаться возникновение «каль-
циевой» энергетики. Ионы Са2+ у большинства организмов выполняют
две функции: структурную (входят в состав скелетов) и регуляторную (об-
ратимо меняют свойства множества компонентов внеклеточной и вну-
триклеточной среды). Разнообразные системы транспорта ионов кальция
(Са2+-АТРазы, Ь1а+/Са2+-обменники, электрогенные ионные каналы) при-
сутствуют в мембранах всех основных органелл клетки (плазмалеммы, сар-
коплазматического ретикулума, эндоплазматического ретикулума, аппарата
Гольджи и митохондрий). Часть энергопродукции животной клетки всег-
да расходуется на обеспечение Са2+-потоков, регулирующих такие важные
процессы, как передача нервного импульса и внутриклеточное проведение
гормональных сигналов, инициация сокращения мышц и регулирование
клеточного роста, стимуляция анаэробного и аэробного катаболизма, экзо-
цитоз в секреторных клетках и формирование межмембранных контактов,
контроль клеточного старения и смерти и др. Данные одного из авторов
(Ф.О. Каспаринского) этой книги, полученные в 1992—2002 гг. при работе
с изолированными митохондриями печени крысы, дают основания пола-
гать, что рассеяние трансмембранных градиентов ионов кальция могло
бы обеспечивать «аварийное» восстановление ДЧ' на мембранах клетки в
условиях дефицита источников свободной энергии, при ингибировании
работы Ацн+-генераторов метаболическими ядами и в прочих экстремаль-
ных условиях. Современные данные о пространственной организации тес-
ных контактов между потенциал-зависимыми Са2+-каналами плазмалеммы,
эндоплазматическим ретикулумом и митохондриями позволяют выдвинуть
гипотезу о возможности организации адресной доставки свободной энергии
кальциевого градиента в любой клеточный компартмент.
Часть вторая
ГЕНЕРАТОРЫ
ПРОТОННОГО ПОТЕНЦИАЛА
ГЛАВА ВТОРАЯ
ХЛОРОФИЛЛЬНЫЕ ГЕНЕРАТОРЫ
ПРОТОННОГО ПОТЕНЦИАЛА
Генераторы Лцн* — это основные преобразователи энергии внешних ре-
сурсов в утилизируемую форму. Для начала рассмотрим светозависимые
(фотосинтетические) генераторы. Во-первых, они представляют собой, как
мы думаем, исторически первый механизм образования протонного потен-
циала за счет энергии внешних ресурсов. Во-вторых, и по сей день фото-
синтез играет ключевую роль в энергообеспечении биосферы, состоящей в
основном из организмов-фотосинтетиков и органотрофов, потребляющих
прямо или косвенно продукты фотосинтеза — органические вещества и
кислород. Оксигенный фотосинтез, т.е. тот, который образует кислород,
присущ зеленым растениям и цианобактериям. Именно он обеспечивает
кислородом планету. Можно указать точные географические координаты
тех областей Земли, которые за это отвечают. Большая часть кислорода на
Земле образуется у нас в стране — в таежных лесах Сибири. Меньший вклад
дает Канада, где тоже есть леса умеренной полосы, прежде всего хвойные.
Что же касается знаменитых тропических лесов (африканских джунглей и
южноамериканской сельвы), а также Мирового океана, то их вклад незна-
чителен просто потому, что там, в отличие от лесов умеренной полосы, есть
огромное количество гетеротрофных бактерий, поглощающих тот самый
кислород, который выделяют фотосинтетики. По сути дела Сибирь — это
легкие планеты. Вот почему если загубить сибирские леса, то аэробной жизни
на Земле придет конец.
Есть еще одно, чисто техническое, но немаловажное обстоятельство,
заставляющее нас начать изложение материала с фотосинтеза. Этот процесс
запускается квантом света, что делает возможным применение современ-
ных физических приборов для анализа его механизма. Например, исполь-
зуя сверхбыстрый лазер, вы можете подать вспышку света длительностью
2 х 10-14 сек, чтобы изучить кинетику и механизм первичных процессов
запасания энергии света.
32
ЧАСТЬ II. Генераторы протонного потенциала
2.1. Светозависимая циклическая редокс-цепь
пурпурных бактерий
Рисунок 2.1. А.А. Красновский
Мы начнем не с того самого главного (оксигенного) фотосинтеза, о
котором шла речь только что, а с более примитивных фотосинтетических
механизмов, описанных у фототрофных бактерий, уже упоминавшихся в
первой лекции. Фотосинтетический аппарат пурпурных бактерий локали-
зован во внутренней, т.е. цитоплазматической, мембране и хроматофорах —
пузырьках, отпочковывающихся от этой мембраны.
По определению биологическая мембрана — это липидно-белковая пленка
толщиной от 50 до 70 ангстрем. По существу — это липидный бислой, в
котором плавают пронизывающие его насквозь трансмембранные белки.
Другие белки прикрепляются к поверхности
бислоя. Как правило, в веществах мембраны
преобладают белки, хотя бывают мембраны,
где липидов больше, чем белков. Липидным
компонентом биомембран обычно служат фос-
фолипиды, реже сульфо- и гликолипиды.
Ключевую роль в фотосинтезе у пурпур-
ных бактерий играет бактериохлорофилл,
одно из производных хлорофилла (см. При-
ложение 2). Во второй половине 1940-х гг.
А.А. Красновский (рис. 2.1) открыл реакции
фотоиндуцированного окисления и восстанов-
ления хлорофилла, что положило начало по-
ниманию механизма действия фотосинтетиче-
ского аппарата.
Известно, что поглощение кванта света
видимого диапазона молекулой хромофора
вызывает переход электрона с основной орбитали (So) на одну из синглет-
ных (S/, S2* ...) или триплетную (Т) возбужденную орбиталь (рис. 2.2). При
этом энергия кванта света тратится на перевод электрона на более удален-
ную от ядра орбиталь. Так как электрон на возбужденной орбитали связан
с ядром относительно слабо, то его довольно легко оторвать от молекулы
хромофора, находящейся в возбужденном состоянии, т.е. эта молекула ста-
новится хорошим восстановителем. В то же время на основной орбитали
после поглощения кванта света образуется «вакансия» для одного электрона
(«дырка»). Эта «дырка» обладает большим сродством к электрону, т.е. явля-
ется хорошим окислителем.
Время жизни молекулы хромофора в возбужденном состоянии (особен-
но в синглетном) крайне мало. Неизбежно происходит возврат электрона
с возбужденной на основную орбиталь. При прямом возврате электрона с
возбужденной на основную орбиталь энергия поглощенного кванта света
теряется либо в виде тепла, либо в виде высвеченного кванта (флуоресцен-
ция или фосфоресценция). Однако фотосинтезирующие организмы научи-
лись использовать эффект перехода хромофора в возбужденное состояние
Глава 2. Хлорофилльные генераторы протонного потенциала
33
Рисунок 2.2. Простейшая схема электронных переходов при поглощении
хромофором кванта света
для запасания энергии hv в удобной для клетки форме. Так, если за время
жизни возбужденного состояния удастся перенести электрон с возбужден-
ной орбитали на какой-то акцептор А, а вакансию на основной орбитали
хромофора заполнить с какого-то донора Y, то часть энергии кванта света
может быть запасена в виде разности окислительно-восстановительных по-
тенциалов веществ X и Y при условии, если редокс потенциал пары У^кис/
Квосст. положительней потенциала пары Аокис/Авосст. Более того, если данную
окислительно-восстановительную реакцию организовать таким образом, что-
бы электрон с Y на X переносился поперек мембраны, то еще какая-то часть
энергии светового кванта может быть запасена также и в форме Дцн+.
При альтернативном варианте фотосинтеза электрон с возбужденной
орбитали можно вернуть именно на основную орбиталь, но не напрямую,
а заставив его сначала пересечь мембрану, что приведет к генерации Дцн+.
Именно так обстоит дело у пурпурных бактерий.
2.1.1. Основные компоненты редокс-цепи и принцип их действия
Свет поглощается магний-порфирином бактериохлорофилла, связанным
с особым белком (этот комплекс называется светособирающей антенной).
или дополнительными пигментами — каротиноидами, локализованными в
той же мембране и передающими энергию возбуждения на бактериохлоро-
филл антенн. Следует отметить, что у ацидофильных бактерий ион Mg2+
в бактериохлорофилле заменен на Zn2+, чтобы избежать вытеснения Mg2+
34
ЧАСТЬ II. Генераторы протонного потенциала
LH-I
Рисунок 2.3. (А, Б) Структура комплекса реакционного центра (RC) и антенны I (LH-I) пурпур-
ных бактерий. Бактериохлорофиллы показаны в виде ромбов (бактериохлорофиллы антенны 1
показаны зеленым цветом; (БХл)2 (обозначен как РА) и мономеры бактериохлорофилла (ВА и
Вв) реакционного центра — соответственно красным и синим цветом). Цветными стержнями
показаны ос-спиральные участки L- (желтым), М- (красным) и Н-субъединиц (серым цветом)
реакционного центра, а также белков антенны I (синим и розовым цветом). (В) Структурная
организация комплекса реакционного центра, антенны 1 и антенны II у пурпурных бактерий.
Показан полипептидный остов белков и молекулы бактериохлорофилла [Hu et al. 1998, PNAS,
95: 5935-5941]
ионами Н+ из комплекса с порфирином, как это происходит в кислой сре-
де. Возбуждение мигрирует по молекулам антенного бактериохлорофилла,
пока не достигнет «специальной пары» — димера бактериохлорофилла, свя-
занного с другими белками в комплекс фотосинтетических реакционных цен-
тров (рис. 2.3).
Этот комплекс содержит, помимо димера, две молекулы мономерного
бактериохлорофилла, две молекулы бактериофеофитина (аналога бактери-
охлорофилла, где ион Mg2+ заменен на два Н+) и две молекулы убихинона
(CoQ)*. Количество комплексов реакционных центров обычно во много раз
меньше, чем антенного бактериохлорофилла.
Возбужденный димер бактериохлорофилла отдает электрон убихинону.
Этот процесс ориентирован поперек мембраны и протекает в направлении
ее цитоплазматической стороны. Он включает ряд промежуточных этапов,
на которых происходит последовательное восстановление и окисление мо-
номера бактериохлорофилла, бактериофеофитина и связанных мена(уби)-
хинонов. На схеме циклической редокс-цепи (рис. 2.4) эти этапы соответ-
ствуют реакциям 1—4.
Для восстановления CoQ должен присоединять два электрона и два
протона (рис. 2.5). При этом один из электронов поставляется реакцион-
Иногда одна молекула убихинона заменена на менахинон (MQ); см. Приложение 2.
Глава 2. Хлорофилльные генераторы протонного потенциала
35
2Н+
Цитоплазма ।
ё
( е
CoQ Ьн
>5
CoQH2
Бфео
ё 12
БХл
13
(БХл)2
> е
CoQ
11
CoQ <
FeSm*—
_7CoQH2
9
ё
2H+
Периплазма или
внутренний объем хроматофора
Рисунок 2.4. Циклическая редокс-цепь пурпурной фотосинтезирующей бактерии Rhodospirillum
rubrum\ (БХл)2 и БХл — димер и мономер бактериохлорофиллов реакционного центра; БФео —
бактериофеофитин; QA и QB — две молекулы убихинона, связанного с белками реакционного
центра; Ьни bL — высоко- и низкопотенциальные гемы цитохрома b; FeSin — негемовый же-
лезопротеин; q и с2 - соответствующие цитохромы
ным центром, а другой — гемом Ьи цитохрома Ь*. Приняв электроны, CoQ
присоединяет и протоны, которые черпаются из ближайшей водной фазы
(на рис. 2.4 — над мембраной, т.е. в цитозоле; образование CoQH2 описы-
вается реакцией 5 на рис. 2.4 и более подробно — на рис. 2.5).
Образовавшись, CoQH2 перемещается в направлении противополож-
ной (периплазматической) стороны мембраны (рис. 2.4, реакция 6). Вбли-
зи этой поверхности мембраны CoQH2 окисляется в семихинонную форму
(реакция 7) посредством негемового железосульфопротеина, обозначаемого
FeSni. При окислении CoQH2 теряет два протона, которые затем переносят-
ся в периплазму или внутрь хроматофора (рис. 2.4).
Электрон, перешедший с CoQH2 на FeSHI, используется в конечном
итоге для восстановления димера бактериохлорофилла, окисленного на
* Цитохромами называются гем-содержащие белки, катализирующие окислительно-
восстановительные реакции (см. Приложение 2). Цитохромы, имеющие идентичные
гемы, но разные белковые части, обычно обозначают одной и той же буквой, но разными
цифровыми индексами.
36
ЧАСТЬ II. Генераторы протонного потенциала
Хинон (Q)
Анион гидрохинона (QH~)
Гидрохинон (QH2)
Рисунок 2.5. Этапы преврашения хинона в гидрохинон
первом этапе цикла. В переносе электрона от FeSln к (БХл)^ (реакции
8—10) участвуют цитохромы типа с (у Rh. rubrum это цитохромы сх и с2).
CoQ*-, получающийся из CoQH2 при потере одного электрона и двух
протонов, восстанавливает гем bL (реакция 11). Гем bL передает электрон
предварительно окисленному гему Ьн (реакция 12). Цикл завершается диф-
фузией CoQ к верхней поверхности мембраны (реакция 13).
Общим итогом процесса оказывается генерация Дцн+ вследствие перено-
са через мембрану двух ионов Н* на каждый поглощенный фотон.
(БХл)2-«-БХл
Среднеточечный редокс-потенциал (Em),
-1,о - (БХл)2^БХл
0.0 - (870нм)
I
БФео
re&lpkFeS,
FeSB
FAD
l$AD
(БХл)2
bL
CoQ Ьн
С, FeS
H,S-»-FMN
840нм)
*(БХл)2
Рисунок 2.6. Редокс-потенциалы переносчиков электронов, участвующих в фотосинтетических
системах пурпурных бактерий (Л) и зеленых серных бактерий (Б). Объяснения см. соответственно
в разделах 2.1.1 и 2.2
Глава 2. Хлорофилльные генераторы протонного потенциала
37
Энергетика цикла «оплачивается» фотонами, поглощенными бактериох-
лорофиллом. Последний, перейдя в возбужденное состояние под действием
света, резко изменяет свой редокс-потенциал, который становится около
-950 мВ (сравни с +440 мВ в невозбужденном состоянии). Все дальней-
шие реакции переноса электронов протекают с выделением энергии, бу-
дучи направленными в сторону более положительных редокс-потенциалов
(рис. 2.6Л).
Белки, катализирующие циклический перенос электронов, удается раз-
делить на два комплекса: комплекс реакционных центров и Ьсх-комплекс.
2.1.2. Комплекс реакционных центров
Белковый состав. Комплекс реакционных центров из Rhodospirillum
rubrum состоит из трех белковых субъединиц’, так называемой тяжелой (Я),
средней (Л/) и легкой (Z), присутствующих в соотношении 1:1:1.
Комплекс реакционных центров Blastochloris (прежнее название
Rhodopseudomonas) viridis содержит кроме Н-, М- и Z-субъединиц еще и
прочно связанный цитохром, имеющий четыре гема С-типа. Молекулярные
массы этого цитохрома, Н-, М- и Z-субъединиц, полученные посредством
электрофореза с додецил сульфатом натрия, оказались, соответственно,
38, 35, 28 и 24 кДа, что и позволило назвать нецитохромные субъедини-
цы «high» (Н), «medium» (М) и «low» (L). Однако сделанное впоследствии
определение первичной структуры дало величины 40,5; 28,3; 35,9 и 30,6 кДа
(336, 258, 323 и 273 аминокислотных остатка), что явно не соответствует
принятой ранее номенклатуре. Тем не менее старые названия субъединиц
по-прежнему используются в литературе.
Построение профиля гидрофобности аминокислотной последователь-
ности Л/-субъединицы показало, что белок содержит пять очень гидро-
фобных сегментов, составленных примерно из 20 аминокислот. Каждый
из этих сегментов образует трансмембранную а-спираль. Это заключение
было подтверждено данными рентгеноструктурного анализа комплекса ре-
акционных центров из Blastochloris viridis (X. Михель, Й. Дайзенхофер и
Р. Хубер. Нобелевская премия по химии за 1988 г., рис. 2.7). Авторам уда-
лось получить кристаллы диаметром 0,5—1 мм путем высаливания комплек-
Рисунок 2.7. X. Михель, Й. Дайзенхофер и Р. Хубер
38
ЧАСТЬ И. Генераторы протонного потенциала
са реакционных центров сульфатом аммония из белкового раствора, содер-
жащего детергент.
Рентгеноструктурное исследование кристаллов позволило впервые уви-
деть трехмерную структуру мембранного преобразователя энергии с разре-
шением 0,3 нм. Выяснилось, что комплекс длиной 13 нм состоит из двух
периферических доменов (один из которых — четырехгемовый цитохром с,
а другой — //-субъединица) и центральной части, образованной главным
образом М- и £-субъединицами. Оказалось, что М- и £-субъединицы несут
бактериохлорофиллы и бактериофеофитины ft-типа, хиноны и атом неге-
мового железа, связанного с имидазолами четырех гистидинов белка. Сопо-
ставление рентгеноструктурных данных с результатами, полученными ранее
другими методами, позволяет утверждать, что цитохром с локализован на
периплазматической стороне мембраны, Я-субъединица — в основном на
цитоплазматической ее стороне, а М- и £-субъединицы интегрированы в
гидрофобный слой мембраны.
На рентгеноструктурном изображении комплекса реакционных центров
удается выявить одиннадцать трансмембранных а-спиральных колонн, на-
правленных перпендикулярно к плоскости мембраны и параллельно длин-
ной оси комплекса. Колонны локализованы в средней (мембранной) его
части. Н-субъединица имеет только одну а-спиральную колонну, в то время
как М- и L-субъединицы, подобные друг другу по аминокислотным после-
довательностям и пространственным структурам, содержат по пять таких
колонн, расположенных симметрично относительно продольной оси ком-
плекса (рис. 2.8).
Единственная гидрофобная а-спираль Я-субъединицы служит как бы
якорем, прикрепляющим этот гидрофильный полипептид к мембране. Что
касается другой периферической субъединицы — четырехгемового цитох-
рома с, то она удерживается на мембране взаимодействием с остальны-
ми субъединицами, а также двумя жирными ацилами, ковалентно связан-
ными с глицерином, который образует тиоэфирную связь с SH-группой
N-концевого остатка цистеина этого цитохрома (рис. 2.9).
При рассмотрении упаковки полипептидных цепей субъединиц Я, М
и £ в мембране обращает на себя внимание полное отсутствие заряжен-
ных аминокислот (рис. 2. ЮЛ) и почти полное отсутствие связанной воды
(рис. 2.10£) в трансмембранных а-спиральных колоннах. Такие аминокис-
лоты и вода сосредоточены на поверхностях мембраны, причем на внешней
поверхности больше отрицательно заряженных аминокислот, а на внутрен-
ней — положительно заряженных. Это наводит на мысль, что упаковка по-
липептидов в мембране достигается за счет электрофореза определенных
белковых доменов под действием АТ (в условиях энергизации мембраны
внутренний объем бактерии заряжен отрицательно).
Кристаллизация мембранных белков представляет собой чрезвычайно
сложную задачу. Успех опытов по кристаллизации комплекса реакцион-
ных центров из BL viridis стал, вероятно, следствием того, что централь-
ная гидрофобная часть этого комплекса (А/- и £-субъединицы) экраниро-
вана гидрофильными полипептидами — четырехгемовым цитохромом с и
Я-субъединицей.
Глава 2. Хлорофилльные генераторы протонного потенциала
39
Рисунок 2.8. Структура белковых субъединиц
реакционного центра Blastochloris viridis’. I, II,
III и IV — тетрагемовый цитохром с, L-, М- и
Я-субъединицы по данным рентгенострук-
турного анализа; V — общий вид комплекса
реакционного центра; VI — расположение
ос-спиральных колонн (вид сверху, А, В, С,
D, Е — пять трансмембранных ос-спиральных
колонн субъединиц М и L). Заштрихована
область, где расположены хромофоры. Все
колонны несколько наклонены по отношению
к плоскости мембраны — на 38° (колонны D)
и < 25° (прочие колонны). При этом колонны
сближаются у цитоплазматической стороны
мембраны и расходятся вблизи периплазма-
тической ее стороны. На рисунке VI пред-
ставлен срез, прошедший предположительно
через середину гидрофобного слоя мембраны
[Deisenhofer et al. 1984, J. Mol. BioL, 180:
385-398]
Расположение редокс-групп. Наиболее важным результатом рентге-
ноструктурного анализа реакционных центров Blastochloris viridis явилось
выяснение расположения окислительно-восстановительных простетических
групп. На рис. 2.11 результаты этого анализа представлены таким образом,
чтобы были видны только простетичские группы. Четыре гема цитохрома с
40
ЧАСТЬ II. Генераторы протонного потенциала
Рисунок 2.9. Гидрофобный
«якорь» тетрагемового ци-
тохрома с Blastochloris viridis’.
остатки жирных кислот, свя-
занные через глицерин с
SH-группой N-концевого
цистеина белка
Рисунок 2.10. Структура реакционных центров Blastochloris
viridis. А — остатки заряженных аминокислот в этом комплексе.
Положительно заряженные аминокислоты показаны оранже-
вым цветом, а отрицательно заряженные — голубым. Б — Мо-
лекулы связанной воды в комплексе реакционных центров В1.
viridis. Видно, что в центральной части комплекса, погруженной
в мембрану, нет ни заряженных аминокислотных остатков, ни
воды, что должно резко уменьшать диэлектрическую посто-
янную и рассеивание энергии при переносе электронов через
мембрану в этой области комплекса [Deisenhofer et al. 1984, J.
Mol. Biol., 180: 385-398]
располагаются друг за другом над димером бактериохлорофилла. Расстоя-
ние между атомами железа двух соседних гемов колеблется от 1,4 до 1,6 нм.
Атом железа гема, ближайшего к (БХл)2, находится на расстоянии 2,1 нм от
ионов магния, входящих в состав (БХл)2. Димер ориентирован параллель-
но длинной оси комплекса реакционного центра. Он как бы зажат между
а-спиральными колоннами £>, принадлежащими субъединицам MwL (соот-
ветственно DM и Л£). Каждая их этих колонн несет остаток гистидина, ими-
дазольная группа которого служит аксиальным лигандом для Mg2+ в (БХл)2.
Два мономерных бактериохлорофилла закреплены несколько ниже
димера под углом ~ 70° к последнему. Расстояние между ионами Mg2+ в
(БХл)2 и БХл равно 1,3 нм. Лигандами Mg2+ в БХл служат имидазолы остат-
ков гистидина, входящих в состав связок между колоннами См и DM или
CL и Dl. Мономеры бактериохлорофилла находятся в контакте с бакте-
риофеофитинами (БФео). Расстояния и углы равны соответственно 1,1 нм
и 64°. Фитольные остатки участвуют в образовании такого контакта. На
1,8 нм ниже той из молекул БФео, которая связана с £-субъединицей,
видна молекула менахинона, лежащая на остатке Тгр-252 Л/-субъединицы.
Симметричное место под другой молекулой БФео, по всей вероятности,
Глава 2. Хлорофилльные генераторы протонного потенциала
41
предназначено для хиноновой головки
Со 2, который менее прочно связан с
комплексом реакционных центров (от-
мывается в процессе выделения и кри-
сталлизации комплекса). Этот CoQ мог
бы расположиться на остатке РЛе-216
L-субъединицы.
На полпути между менахиноном и
местом связывания CoQ находится атом
негемового железа. Он связан с белком
иначе, чем в FeS-протеинах. Четыре ли-
ганда железа были идентифицированы
как имидазольные группы гистидино-
вых остатков колонн DM, Ем, DL и EL.
Связки между колоннами Ам и Вм.
См и DM, Al и Bl, Cl и Dl, а также че-
тыре из пяти первых (от N-конца) ами-
нокислотных остатков в субъединице
Н участвуют в образовании контакта с
тетрагемовым цитохромом с. Туг-1Л62
располагается между (БХл)2 и ближай-
шим к нему гемом. Предполагают,
что он может участвовать в переносе
электронов с этого гема на окислен-
ный (БХл)2. В транспорте протонов из
цитоплазмы к CoQ*- может участвовать
Glu-НГП, который имеет доступ в по-
лость, где предположительно находится
CoQ. Удаление //-субъединицы, несу-
Рисунок 2.11. Расположение простети-
ческих групп в комплексе реакционных
центров из Bl. viridis по данным рентге-
ноструктурного анализа. Видны четыре
гема (сверху, над мембраной), димер
бактериохлорофилла, два мономера бак-
териохлорофилла, два бактериофеофетина,
менахинон (MQ) и негемовое железо (Fe)
[Deisenhofer et al. 1984, J. Mol. Biol., 180:
385-398]
щей этот остаток, резко нарушает функцию CoQ в реакционном центре.
Согласно данным, полученным оптическими методами, (БХл)2 за-
креплен перпендикулярно к плоскости цитоплазматической мембраны В1.
viridis. Вот почему представляется весьма вероятным, что длинная ось ком-
плекса реакционного центра расположена поперек мембраны. Расстояние
между атомами Mg в (БХл)2 и менахиноном равно приблизительно 3,0 нм,
так что электрон, перенесенный от (БХл)2 к менахинону, должен пересечь
большую часть гидрофобного барьера мембраны.
В целом система, составленная из бактериохлорофилла, бактериофео-
фитина и хинонов, выглядит как два параллельных пути переноса электро-
нов. Можно было бы предположить, что один электрон, восстанавлива-
ющий CoQ до CoQ*-, транспортируется правой ветвью, т.е. через MQ, а
другой электрон, необходимый для восстановления CoQ*-, поставляется ле-
вой ветвью, т.е. без участия MQ. Однако опыты показали, что один из путей
(левый) вообще не участвует в переносе электронов на CoQ. Рассматривая
возможную функцию этого пути, следует иметь в виду, что неподалеку от
мономера БХл левой ветви располагается молекула каротиноида, на который
«стекает» возбуждение с (БХл)2, если тот не успел окислиться правой ветвью
42
ЧАСТЬ II. Генераторы протонного потенциала
Рисунок 2.12. Расположение хромофорных ком-
понентов комплекса реакционных центров В1.
viridis (схема В.А. Шувалова и А.А. Асадова, по-
стулированная в 1979 г. на основании оптических
наблюдений)
и перешел из синглетного в бо-
лее долго живущее триплетное
состояние. Что касается воз-
бужденного состояния кароти-
ноида, то оно рассеивается в
виде тепла или путем эмиссии
светового кванта большей дли-
ны волны (флуоресценции).
Если все же кислород успе-
вает атаковать возбужденный
каротиноид, он окисляется и
уходит из комплекса реакцион-
ных центров, чтобы замениться
другой (интактной) молекулой
каротиноида. Таким образом,
каротиноид как бы жертвует
собой, спасая (БХл)2, БХл или
БФео, окисление которых по-
влекло бы необратимую инак-
тивацию всего комплекса.
В конце этого раздела следует отметить, что данные рентгенострук-
турного анализа фактически подтвердили схему расположения хромофоров
(рис. 2.12), постулированную В.А. Шуваловым и А.А. Асадовым (1979) на
основании оптических наблюдений.
Последовательность реакций переноса электронов. После выяснения
пространственного расположения редокс-групп в комплексе реакционных
центров можно считать доказанной следующую цепь реакций переноса
электронов, включенных между бактериохлорофиллом и CoQ:
(БХл)2 —(БХл)2* -> БХл БФео (2А -> (2в, (2.1)
где применительно к BL viridis QK — это MQ, а Св — Со (2-
Именно такая последовательность событий была постулирована на
основании данных по спектральным изменениям бактериохлорофиллов и
бактериофеофитина в ответ на пикосекундную вспышку лазера. Было по-
казано, что вызванное вспышкой окисление (БХл)2 сопровождается вос-
становлением БХл и БФео. Все эти процессы завершаются в течение 20 пс.
Следующий этап — восстановление менахинона посредством БФео — про-
исходит с tx/1 около 230 пс, a tx/1 восстановления (БХл)^ до (БХл)2 (в случае
Blastochloris viridis) оказывается величиной порядка 270 нс (рис. 2.13).
Принципиальным моментом является то обстоятельство, что редокс-
потенциал димера бактериохлорофилла в невозбужденном состоянии
(+440 мВ) резко сдвинут в положительную область по сравнению с потен-
циалом мономера (около —900 мВ). Это различие нивелируется при воз-
буждении димера. Его потенциал оказывается порядка —950 мВ, т.е. даже
несколько отрицательнее, чем у невозбужденного мономера, и тем более
чем у невозбужденного бактериофеофитина (около —750 мВ).
Глава 2. Хлорофилльные генераторы протонного потенциала
43
Изучение реакционных центров В1.
viridis. проведенное одним из авторов
этой книги (В.П.С.) и сотрудниками,
показало, что донором электронов для
восстановления (БХл)^ служит гем че-
тырехгемового цитохрома с, характе-
ризующийся a-максимумом поглоще-
ния при 559 нм и редокс-потенциалом
+380 мВ. Можно предположить, что
этот гем располагается непосредствен-
но над (БХл)2 в комплексе реакционных
центров. Гем559 в свою очередь полу-
чает электрон от другого гема (погло-
щение при 556 нм, редокс-потенциал
+310 мВ), а тот — от водорастворимого
цитохрома с2. Роль еще двух гемов ци-
тохрома с (редокс-потенциалы +30 мВ
и —50 мВ) остается неясной.
Чрезвычайно высокая скорость
первичных процессов фотосинтетиче-
ского переноса электронов заслуживает
специального обсуждения. Названные
процессы представляют собой самые
быстрые химические реакции среди всех
известных в биологии. По-видимому,
благодаря столь высоким скоростям
удается предотвратить энергетически
Рисунок 2.13. Быстрая кинетика измене-
ний поглощения света (ДА) модифици-
рованными комплексами реакционных
центров Rhodobacter sphaeroides без одной
из двух молекул мономера бактериохлоро-
филла (БХлм). Снижение А930 — переход
БХл2 в возбужденное состояние. Снижение
А875 — образование (БХл)2+. Снижение
А805 — восстановление (БХл)ь. Снижение
А755 — восстановление БФео. Возбужде-
ние достигалось вспышкой лазера (t1/2 =
0,2 пс). Начальное возрастание поглоще-
ния при 775 нм обусловлено переходом
(БХл)2 в (БХл)2* [Матвеец и др. 1986, ДАН
СССР, 292: 724-728].
более выгодный обратный транспорт электронов по фотосинтетической це-
пи (так как скорость прямого переноса электрона примерно в 100 раз пре-
вышает скорость обратного процесса), а также и окисление возбужденного
бактериохлорофилла кислородом.
У Bl. viridis анион-радикал MQe_ — первый промежуточный продукт,
время жизни которого сравнимо с таковым для интермедиатов большин-
ства ферментативных процессов. Окисление MQe" связанным CoQ протека-
ет примерно за 0,1 мс. Поэтому MQ часто называют первичным акцептором
электронов. В некоторых бактериях эту роль играет не MQ, a CoQ. В таких
случаях каждый комплекс реакционных центров содержит две молекулы
CoQ: первичный акцептор Со(?А и вторичный акцептор CoQB.
Перенос электронов между двумя хинонами облегчается присутствием
негемового железа. При этом оно не окисляется и не восстанавливается,
все время находясь в форме Fe2+. Показано, что Мп2+ вполне успешно за-
меняет Fe2+.
Одна из точек зрения на механизм переноса электронов комплексом
реакционных центров состояла в том, что Со(2я служит конечным продук-
том процесса, катализируемого комплексом:
Qa + Qb Qa + Q в -
(2.2)
ЧАСТЬ II. Генераторы протонного потенциала
Другая, более вероятная возможность сводится к тому, что не только QB,
но и Qb восстанавливается посредством QA (см. уравнение 2.3). В пользу
этого варианта свидетельствует тот факт, что Qb~ в отличие от QB и QBH2
очень прочно связан с £-субъединицей комплекса реакционных центров.
Двухэлектронное восстановление CoQB сопровождается присоединени-
ем двух протонов:
Qa + Qb + 2Н+ -> 0А + 0вН2. (2.3)
Механизм генерации Ацн+. Поскольку цитохром с2 и хинон локализованы
на противоположных сторонах мембраны, перенос восстановительных экви-
валентов происходит через мембрану в направлении ее цитоплазматической
поверхности. Если от цитохрома с2 к хинону переносится электрон, то ци-
топлазма должна заряжаться отрицательно относительно периплазмы или
внутреннего объема хроматофора.
Это предположение подтверждено целым рядом опытов, где измеря-
ли генерацию АТ реакционными центрами. С этой целью в нашей группе
Л.А. Драчевым, А.Д. Кауленом и А.Ю. Семеновым был разработан метод,
позволяющий измерять непосредственно вольтметром генерацию АТ фермен-
тами, встроенными в протеолипосомы. Термин «протеолипосома» был пред-
ложен одним из авторов (В.П.С.) в 1973 г. для обозначения замкнутых мем-
бранных пузырьков, образованных самосборкой из фосфолипидов и белков.
В обсуждаемых опытах протеолипосомы сорбировали на одной из поверхностей
коллодиевой пленки, пропитанной раствором фосфолипидов в декане.
Как показали эксперименты, сорбция протеолипосом происходит та-
ким образом, что содержащийся внутри них раствор не перемешивается с
наружным раствором. По-видимому, при сорбции на той стороне протео-
липосомы, которая контактирует с пленкой, мембрана растворяется пропи-
тывающим пленку деканом, а на другой ее стороне — сохраняется, отделяя
омывающий пленку раствор от раствора внутри протеолипосом.
Генерация АТ на мембране сорбированных протеолипосом может быть
зарегистрирована двумя электродами, которые помещены по обе стороны
коллоидной пленки и соединены с вольтметром. Временное разрешение
такой системы составляет 50 нс, что значительно короче времени одно-
кратного срабатывания любого Дцн+-генератора. Вот почему этим методом
удается следить не только за валовым процессом генерации АТ, но и за
его отдельными этапами. Иными словами, можно регистрировать переме-
щение заряда (например, электрона или протона) внутри молекулы белка-
генератора.
На рис. 2.14 дана общая схема изучения Дцн+-генерирующих белков
клетки, включающая их очистку и самосборку и завершающаяся прямым
измерением преобразования ими световой или химический энергии в элек-
трическую форму.
Наш метод позволил измерить генерацию АТ реакционными центра-
ми в нано- или микросекундной шкалах. Оказалось, что основной вклад в
генерацию АТ вносит процесс, продолжительность которого больше, чем
50 нс (разрешение измерительной аппаратуры). В цепи событий, происхо-
Глава 2. Хлорофилльные генераторы протонного потенциала
45
Рисунок 2.14. Схема очистки и само-
сборки генераторов Ацн+ и прямого
измерения их активности
дящих в реакционных центрах, столь быстрые реакции локализованы между
(БХл)2 и Qa. Сопоставив это наблюдение с данными по трансмембранно-
му расположению редокс-групп реакционных центров, можно заключить,
что перенос электронов от (БХл)2 к QA имеет электрогенный характер, т.е.
движение электрона поперек мембраны электрически не компенсировано
перемещением какого-либо другого заряда.
Г.-В. Триссл и сотрудники измерили электрический ответ клеток В1.
viridis с еще большим временным разрешением, используя разработанный
ими же метод светового градиента. Измерение АТ этим косвенным мето-
дом дает величины хотя и заниженные (примерно на два порядка), но с
разрешением 40 пс. Были выявлены две электрогенные фазы (tj < 40 пс и
т2 = 125 пс) примерно одинаковой амплитуды. Первая фаза соответствовала
восстановлению БФео посредством (БХл)2, а вторая — окислению БФео
менахиноном.
Помимо быстрых электрогенных стадий мы выявили три более мед-
ленные стадии. Одна из них возникла при добавлении CoQ10 в декановый
раствор фосфолипидов, используемый для пропитки коллодиевой пленки.
Амплитуда этой стадии составила около 5% от общей АТ, генерируемой
на вспышку лазера, а полувремя — около 400 мкс, что несколько медлен-
ней, чем скорость восстановления QB. Эффект оказался чувствительным
к о-фенантролину, тормозящему восстановление QB. На основании этих
данных было сделано заключение, что обнаруженная электрогенная ста-
дия связана с восстановлением QB. По-видимому, декан экстрагирует QB из
мембраны хроматофоров или протеолипосом, прикрепленных к пропитан-
ной этим углеводородом коллодиевой пленке, а добавление CoQl0 предот-
вращает этот эффект.
Возможны два различных механизма медленной электрогенной стадии,
требующей CoQ10. (1) Перенос электронов с QA на QB имеет электрогенный
характер. (2) Существует Непроводящий путь от поверхности мембраны к
QB; ионы Н+ движутся по этому пути к восстановленному аниону QB и про-
тонируют его с образованием QH2.
46
ЧАСТЬ II. Генераторы протонного потенциала
Чтобы сделать выбор между этими вариантами, исследовали эффект
двух последовательных лазерных вспышек длительностью 30 нс. Если ве-
рен первый вариант, обе вспышки должны вызывать появление медленной
электрогенной стадии. В альтернативном случае такая стадия будет воз-
никать только при второй вспышке, так как Со0 в , образующийся в ре-
зультате однократного срабатывания реакционного центра под действием
первой вспышки, не протонируется при физиологических значениях pH.
Протонирование происходит после присоединения второго электрона, для
чего необходима вторая вспышка.
Как показали опыты (рис. 2.15), только вторая вспышка дает медлен-
ную электрогенную стадию. Это означает справедливость второго вариан-
та, предполагающего перенос Н+ из воды к месту локализации QB внутри
комплекса реакционных центров. Допустив постоянство диэлектрических
свойств гидрофобного барьера мембраны по всей ее толщине, можно опре-
делить, какую часть этого барьера проходит Н+. Так как медленная стадия
составляет 5% от всего электрического ответа, обусловленного трансмем-
бранным переносом зарядов, можно было бы принять, что протон перено-
сится на 1/20 часть толщины мембраны. Дальнейшее исследование, однако,
показало, что реальная ситуация не столь проста (об этом речь пойдет не-
сколько позже).
Для оценки вклада четырехгемового цитохрома с были использованы
условия, при которых два гема цитохрома с (с556 и с559) восстановлены. CoQ
не добавляли, чтобы избежать появления электрогенных стадий, сопрово-
ждающих протонирование CoQ2-. Оказалось, что вспышка лазера, вызыва-
ющая фотоокисление (БХл)2, приводит к временному окислению этих гемов
Рисунок 2.15. Генерация Д'? комплексами реакционных центров Bl. viridis в ответ на две по-
следовательные 15-наносекундные вспышки лазера, произведенные с интервалом 0,5 с. Момент
вспышки показан вертикальной стрелкой. Видно, что только вторая вспышка вызывает появ-
ление «медленной» (микросекундной) электрогенной стадии (Л). На рис. Б эта стадия показана
при большем разрешении, где пунктирная и сплошная линии означают соответственно первую
и вторую вспышку. CoQ10 был добавлен в раствор для пропитки пленки. Редокс-потенциал
среды +240 мВ [Dracheva et al. 1988. Eur. J. Biochem. 113: 213-218]
Глава 2. Хлорофилльные генераторы протонного потенциала
47
Рисунок 2.16. Генерация Д+ комплексами реакционных центров Bl. viridis'. роль высокопотенци-
альных гемов цитохрома с. Измерение проводилось при редокс-потенциале среды +220 мВ (два
высокопотенциальных гема тетрагемового цитохрома с восстановлены, а два низкопотенциаль-
ных — окислены), +380 мВ (50% степени восстановленности одного из высокопотенциальных
гемов) и при +440 мВ (все четыре гема окислены). Справа (Б) дана часть рис. А более крупным
планом [Dracheva et al. 1988, Eur. J. Biochem, 113: 213-218]
(t1/2 около 300 нс для ге-
ма с559 и 3 мкс для гема
с556). Окисление гемов
сопровождается генера-
цией ДТ, которая также
носит двухфазный ха-
рактер. Кинетика каж-
дой из фаз соответству-
ет кинетике окисления
гемов. Вклады быстрой
и медленной цитохром-
ных электрогенных фаз
в общую ДТ оказались
соответственно 15 и 5%
(рис. 2.16).
На рис. 2.17 при-
ведена схема, иллю-
стрирующая структур-
но-функциональные
характеристики реак-
ционных центров В1.
viridis. Расстояния меж-
ду редокс-группами со-
Рисунок 2.17. Механизм электрогенных стадий
5%ДКР,Г Змкс*
16% ДЧИД 0,Змкс <
37% ДЧ/,Т^40пс <
Й<у
37% ДТ.Т 125ПС'
5%ДТ,Т 400МКС
Н
в комплексе реакционных центров BL viridis
48
ЧАСТЬ II. Генераторы протонного потенциала
ответствуют данным рентгеноструктурного анализа. Интересно, что пере-
нос Н+ от цитоплазматической поверхности мембраны к CoQ дает всего
лишь 5% от общего АТ: то ли путь протона (из воды к CoQ) короче, чем
путь электрона (от цитохрома с к CoQ), то ли Н+ переносится через менее
гидрофобную часть комплекса. Вероятнее всего, играют роль оба фактора.
Подобная ситуация, по-видимому, имеет место на тех этапах, где перено-
сится электрон.
Расстояния между QA и (БХл)2, (БХл)2 и с559, с559 и с556 по оси, верти-
кальной к плоскости мембраны, равны соответственно 2,9, 2,1 и 1,2 нм.
Если бы вклад каждой из этих стадий в общий электрогенез определялся
только расстоянием между редокс-группами, то вклады относились бы как
1:0,7:0,4. В действительности они относятся как 1:0,2:0,07. Это означает, что
вклад тем больше, чем глубже данный этап переноса электрона погружен
в мембрану. Такая закономерность становится понятной, если учесть, что
величина диэлектрической постоянной в мембране должна возрастать по
мере приближения к водной фазе.
Когда П. Митчел в 1960-е гг. сформулировал хемиосмотическую гипо-
тезу, он предположил, что электрон, двигаясь от цитохрома с к CoQ через
бактериохлорофилл, пересекает гидрофобный барьер мембраны (электрон-
транспортная «полупетля»). Это предположение, в то время чисто умозри-
тельное, сегодня прямо доказано. Единственный новый момент, выявлен-
ный в результате экспериментальной проверки гипотезы, состоит в том, что
существует небольшая, но измеримая электрогенная стадия, обусловленная
не переносом электрона, а встречным движением протона, необходимого
для образования CoQH2 из CoQ.
2.1.3. CoQ-цитохром с-редуктаза
CoQ-цитохром с-редуктаза (комплекс Ьсх) была открыта и детально
изучена при исследовании дыхательной цепи митохондрий. Информация
относительно молекулярных свойств компонентов этого комплекса у пур-
пурных фотосинтезирующих бактерий более ограниченна, однако все, что
известно, в значительной степени напоминает митохондриальную систему.
Поэтому в данном разделе мы лишь вкратце рассмотрим структуру бакте-
риального комплекса Ьсъ так как более подробно этот Дцн+-генератор будет
разбираться ниже.
Комплекс Ьс} включает один цитохром Ь, содержащий два гема: низко-
потенциальный bL (синоним — Z>566, по «-максимуму спектра поглощения) и
высокопотенциальный Ьн (или £560); один негемовый железо-серный центр
(FeSIH); один цитохром с и несколько бесцветных белковых субъединиц раз-
ной молекулярной массы, не имеющих простетических групп. CoQH2 и ци-
тохром с2 служат соответственно восстановителем и окислителем комплекса
Ьс{. Цитохром с2 — водорастворимый цитохром, подобный цитохрому с.
В реконструированных системах митохондриальный цитохром с успешно
заменяет цитохром с2. Редокс-потенциалы компонентов комплекса пред-
ставлены на рис. 2.6.
Глава 2. Хлорофилльные генераторы протонного потенциала
49
CoQ-цитохром с-редуктаза представляет собой самый медленный компо-
нент фотосинтетической редокс-цепи. Максимальная скорость его работы in
situ обычно не превышает 10 мс.
По аналогии с митохондриями можно предположить, что генерация
АЦН+ этой системы отчасти обусловлена переносом электронов поперек
мембраны от гема bL к Ьн, как показано на рис. 2.4. Этот процесс направ-
лен в сторону цитоплазматической поверхности бактериальной мембраны.
Установлено, что электрон, перемещаясь от гема bL к гему Ьн, пересекает
35-40% толщины мембраны. Можно полагать, что остальную часть пути
проходят протоны, двигаясь в направлении, противоположном электрону
(см. рис. 2.4).
Остается неясным: CoQ, Coff~ либо они оба служат акцепторами элек-
тронов для Ьн- Если такую роль выполняет только какой-то один из этих
двух компонентов, то образование полностью восстановленной формы уби-
гидрохинона (CoQH^ должно включать реакцию дисмутации (2CbQ*“ + 2/Л
<-> CoQ + CoQH^. Другим источником электронов для восстановления CoQ
до CoQH2 служит комплекс реакционных центров. Для устойчивой работы
системы необходимо, чтобы из каждых двух молекул CoQ, восстановленных
до CoQH2, одна образовывалась за счет переноса электронов с реакционных
центров, а другая — с гема Ьн. В любом случае ионы водорода, необходи-
мые наряду с электронами для превращения CoQ в CoQH2, черпаются из
цитоплазмы.
Образовавшись, CoQH2 пересекает большую часть гидрофобного барье-
ра мембраны, чтобы окислиться железосульфопротеином. В результате об-
разуется CoQ*, восстановленный FeSH] и 2Н+. Затем ионы Н+ переносятся
через оставшуюся часть гидрофобного барьера, чтобы оказаться в пери-
плазме или внутреннем пространстве хроматофора. В случае Rh. rubrum и
Rhodobacter sphaeroides перенос электрона с FeSHI на (БХл)2 через цитохромы
Cj и с2 завершает цикл, как показано на рис. 2.4. У BL viridis четырехгемовый
цитохром с включен в перенос электронов от цитохрома с2 к (БХл)^.
Последовательность процессов, катализируемых CoQ-цитохром с-ре-
дуктазой (рис. 2.4), по существу представляет собой конкретный вариант
Q-цикла, постулированного П. Митчелом в 1975 г. Ключевое положение
этой схемы: пути каждого из двух электронов, приходящих на CoQ или ухо-
дящих с CoQH2, оказываются различными. Сегодня это твердо доказано, по
крайней мере для окисления CoQH2. Установлено, что роль CoQHi-оксидазы
играет FeSUh a CoQ*, образующийся из CoQH2, окисляется затем гемом bL
цитохрома Ь. Существует чисто химическая предпосылка того, что CoQH2 и
Со(Т~ окисляются разными ферментами: редокс-потенциалы гидрохинона
и семихинона существенно различны.
По мнению ряда авторов, связывание CoQH2 и FeSin происходит таким
образом, что гидрохиноловая «головка» оказывается вблизи некоторой поло-
жительно заряженной группировки (предположительно Fe3+). Это вызывает
сдвиг рК гидрохинола в кислую сторону, что облегчает его депротонирова-
ние. Потеряв протон, CoQH2 превращается в CoQH", который и окисляется
посредством FeSni. Депротонирование необходимо для окисления CoQH2,
50
ЧАСТЬ П. Генераторы протонного потенциала
так как редокс-потенциал пары CoQH2/CoQH2*+ выше +850 мВ, а пары
CoQH"/CoQH* около +190 мВ, что отрицательнее, чем у FeSIH.
В митохондриях перенос электронов с убихинола на FeSin и далее че-
рез цитохром Ci на цитохром с катализируется III комплексом дыхатель-
ной цепи, известным также как комплекс Ьс}, или убихинол-цитохром
с-оксидоредуктаза. Этот комплекс найден у целого ряда бактерий и во мно-
гих отношениях сходен с пластохинол-пластоцианин-оксидоредуктазой ти-
лакоидов (комплексом bf). Окислительно-восстановительные группы ком-
плекса bey включают железо-серный [2Fe—2S] кластер, находящийся в белке
Риске (Rieske), 2 гема /ьтипа, находящихся на отдельном полипептиде, и
гем цитохрома сх. Железо-серный кластер [2Fe—2S] белка Риске присоеди-
нен к полипептиду связями одного из атомов железа с двумя остатками
цистеина, а другого — с двумя остатками гистидина. Полипептидная цепь
с железо-серным кластером внутри глобулярной структуры заякорена в
мембране гидрофобной N-концевой спиралью и выдается над липидным
бислоем в водную фазу, положительно заряжающуюся в процессе работы
комплекса III.
Цитохром Ci имеет сходный с белком Риске глобулярный домен и гидро-
фобный якорь, отличающийся размещением на С-конце белка. Субъединица
цитохрома b имеет 8 трансмембранных а-спиралей. Четыре консервативных
гистидиновых остатка располагаются попарно на каждой из двух спиралей
таким образом, чтобы служить аксиальными лигандами для гемов.
2.1.4. Пути использования Дцн+, образованной циклической редокс-цепью
В хроматофорах протонный потенциал, образованный циклической
редокс-цепью, может использоваться для совершения четырех видов хими-
ческой работы. Среди них: 1) образование АТР из ADP и неорганического
фосфата посредством Н+-АТР-синтазы; 2) образование неорганического пиро-
фосфата из двух молекул фосфата под действием Н+-пирофосфат-синтазы;
3) катализируемый NADH-CoQ-редуктазой обратный перенос восстанови-
тельных эквивалентов от доноров водорода с редокс-потенциалов около ну-
ля к NAD+; 4) восстановление NADP+ посредством NADH под действием
трансгидрогеназы.
NADH-CoQ-редуктаза представляет собой первый из трех Дцн+-генера-
торов, включенных в дыхательную цепь. Действуя в обратном направлении
(CoQH2 -> NAD+), этот фермент в хроматофорах становится потребителем
Дцн+, образуемой фотосинтетической редокс-цепью. Он делает возможным
восстановление NAD+ (редокс-потенциал —320 мВ) за счет таких доноров
водорода, как H2S (редокс-потенциал около 0). Образующийся NADH за-
тем используется в восстановительных биосинтезах.
Один из путей использования NADH — восстановление NADP+ в
трансгидрогеназной реакции. Фермент трансгидрогеназа служит потребите-
лем Дцн+. Он локализован, в частности, в мембране хроматофоров. Транс-
гидрогеназа, потребляя Дцн+, резко увеличивает редокс-потенциал пары
NADPH/NADP+, что благоприятствует тем восстановительным синтезам,
где используется NADPH в качестве донора водорода.
Глава 2. Хлорофилльные генераторы протонного потенциала
51
Рисунок 2.18. Пути трансформа-
ции энергии света в цитоплазма-
тической мембране пурпурных
фотосинтезирующих бактерий
(1—9). В хроматофорах тех же
бактерий действует упрощенная
схема, где отсутствуют пути 4, 5
и, по-видимому, 3
АТР
Транспорт
метаболитов
Вращение
флагеллы
нос ё через
NADH-KoQ-pe-
\дуктазу
г Восстановление
NADP* транс-
гидрогеназой
|Ll[q}« ° * Градиенты Na+/K‘
В темноте NADH-CoQ-редуктаза может действовать в прямом направ-
лении (NADH —> CoQ), генерируя Ацн+. Образуемый CoQH2 окисляется
комплексом Ьсх с восстановлением цитохрома с2. Последний восстанавли-
вает цитохром о, который переносит электроны на О2 и образует Дцн+. Та-
ким образом, пурпурные фотосинтезирующие бактерии располагают дыха-
тельной цепью с тремя Ацн+-генераторами.
В цитоплазматической мембране фотосинтезирующих бактерий суще-
ствует целый ряд дополнительных потребителей Ацн+, отсутствующих в хро-
матофорах. Среди них: 1) Н+-моторы, вращающие бактериальные флагеллы;
2) Н+, метаболит-симпортеры, обеспечивающие накопление метаболитов в
бактериальной клетке; 3) системы транспорта Na+ и К+, ответственные за
поддержание асимметричного распределения этих катионов между клеткой
и средой. Градиенты ионов Na+ и К+ действуют как Ацн+-буфер. Аналогич-
ную роль может, по-видимому, играть и пирофосфат.
Общая схема превращения энергии света в различные типы работы мем-
браны пурпурных фотосинтезирующих бактерий приведена на рис. 2.18.
2.2. Нециклическая светозависимая редокс-цепь
зеленых серных бактерий
В предыдущем разделе было упомянуто, что пурпурные фотосинтези-
рующие бактерии могут восстанавливать NAD+ посредством H2S за счет
энергии света, которая предварительно превращена в Ацн+ циклической
редокс-цепью. Зелеными фотосинтезирующими бактериями-анаэробами ис-
52
ЧАСТЬ II. Генераторы протонного потенциала
пользуется другой механизм. Он устроен таким образом, что свет одновремен-
но вызывает а) генерацию Дцн+ и б) восстановление NAD+ сероводородом.
Это простейший вариант так называемой нециклической фотосинтети-
ческой редокс-цепи. Схема обсуждаемого механизма приведена на рис. 2.19.
Комплекс реакционных центров в данном случае подобен комплексу фо-
тосистемы 1 хлоропластов и цианобактерий (см. ниже, раздел 2.3.2). Он
составлен из димера бактериохлорофилла, двух мономеров бактериохло-
рофилла, витамина К| (филлохинона) и трех FeS-кластеров (FeSx, FeSA и
FeSB), включенных последовательно в редокс-цепь. Акцептором электро-
нов комплекса служит водорастворимый железо-серный белок ферредок-
син (Fd), расположенный на цитоплазматической поверхности мембраны.
От Fd электроны переносятся на флавопротеид, простетической группой
которого, по-видимому, служит FAD, и далее на NAD+.
Фотоокисленный (БХл)^ восстанавливается донорным сегментом
редокс-цепи, берущей начало от H2S. Этот участок содержит флавопротеин
с FMN в качестве простетической группы, менахинон и два цитохрома.
Редокс-потенциалы основных компонентов цепи зеленых бактерий были
указаны выше (см. рис. 2.6).
Показана светозависимая генерация АТ мембранными фрагментами
зеленых бактерий, сорбированных на плоской фосфолипидной мембране.
Природа этого эффекта объясняется, как и в случае других хлорофилл -
содержащих Ацн+-генераторов, переносом электронов поперек мембра-
ны. Перенос электронов, показанный на рис. 2.19, должен приводить к
освобождению ионов водорода во внешнюю среду из-за окисления H2S до
элементарной серы электрон-донорным сегментом редокс-цепи, который
Рисунок 2.19. Нециклическая фотосинтетическая редокс-цепь зеленых серных бактерий.
Объяснения в тексте
Глава 2. Хлорофилльные генераторы протонного потенциала
53
расположен вблизи внешней поверхности цитоплазматической мембраны.
На противоположной (внутренней) стороне мембраны должно происходить
поглощение ионов Н+, так как NAD+ восстанавливается бактериохлоро-
филльной системой, транспортирующей электроны, но не протоны. Чтобы
образовать NADH из NAD+, присоединение двух электронов должно со-
провождаться присоединением одного протона.
Итак, на внешней поверхности мембраны зеленой бактерии происходит
следующий процесс:
H2S -> S + 2Н+ + 2ё, (2.4)
в то время как события, происходящие на внутренней стороне мембраны.
описываются как:
NAD+ + Н+ + 2ё -> NADH. (2.5)
Таким образом, схема переноса электронов у зеленых серных бактерий
предполагает, что и генерация Дцн+, и восстановление NAD+ осуществляются
одной и той же светозависимой редокс-цепью.
Следует отметить, что схема, представленная на рис. 2.19, применима
лишь к анаэробным зеленым серным бактериям. В то же время извест-
но, что зеленые несерные бактерии типа Chloroflexus. относящиеся к фа-
культативным аэробам, имеют циклическую редокс-пепь, напоминающую
редокс-цепь пурпурных бактерий.
2.3. Нециклическая светозависимая редокс-цепь
хлоропластов и цианобактерий
Нециклическая светозависимая редокс-цепь цианобактерий и хлоро-
пластов до известной степени аналогична цепи зеленых бактерий. В обоих
случаях свет используется для генерации ДЦН+ и восстановления NAD(P)+
посредством донора электронов с более положительным, чем у NAD(P)+,
редокс-потенциалом. Главное от-
личие цианобактерий и хлоропла-
стов от зеленых бактерий в том,
что донором электронов для пер-
вых служит не сероводород, а во-
да. Разность редокс-потенциалов
между NAD(P)+ и Н2О составляет
около 1,2 В, что намного больше,
чем разность потенциалов между
NAD+ и H2S, используемых зеле-
ными бактериями (0,3 В). Поэто-
му транспорт одного электрона
по редокс-цепи хлоропластов
(цианобактерий) сопряжен с по-
глощением двух фотонов, а не
одного, как у зеленых бактерий.
Рисунок 2.20. Структура хлоропласта
54
ЧАСТЬ II. Генераторы протонного потенциала
Строма 4Н+
хлоропласта
2ё 2ё V
pqa-*pqb7^7~-">
2PQ Ьн 2PQH2
2е
ФеО
2е
2е
ХлП
2ё
2е 2PQ
(XnII)2 <- 2PQ.
z CPB-*Z^
2PQH2
Н2О 2Н++1/2О2
4Н
1,5
-1,0
-0,5
(ХлП);?
/чХлИфео
8.
0,5
Н2О
680 нм
NADP+ NADPH
fadh2
2Н
Fd
FeSe
|2ё
FeSA
|2ё
FeSx
|2ё
К
I 2е
ХлГ
|2ё
Хл1
700 нм
FeS э-- о— Р*л1)2
Fesk£e ,2е„ #_
Внутренний объём
тилакоида
(Хл1)2
ЬйЧ?
О Х.лГк О
C»K1 V
FeSx _
UFbSaQ
FeSe
. ?tFtl*FAD*NADP
PQa9 Ъ1 '
PQb4 Ьн * '
4 PQ
feST
Пц*(Хл1)2
Ьи
©
m
Е
ш
ф
ф
0
1,0
О
(Хл11)2
Рисунок 2.21. Нециклическая светозависимая редокс-цепь хлоропластов (по Бланкеншипу и
Принсу): СРВ — система расщепления воды; Z — остаток тирозина в одном из белков фотоси-
стемы 2; (ХлП)2 — димер хлорофилла фотосистемы 2, PQA и PQB — пластохиноны, связанные с
фотосистемой 2; PQ — свободный пластохинон; bHubL — высоко- и низкопотенциальные гемы
цитохрома bb\f— цитохром/; Пц — пластоцианин; (Хл1)2 — димер хлорофилла фотосистемы I;
Kj — витамин Ki; FeSx — первичный стабильный акцептор электронов фотосистемы 1; FeSA,
FeSB — два железосерных кластера, прочно связанные с фотосистемой 1; Fd — ферредоксин.
А — рисунок составлен с учетом расположения редокс-центров в мембране тилакоида. Б —
переносчики восстановительных эквивалентов расположены в соответствии с их редокс-
потенциалами; пунктиром показан перенос электронов от ферредоксина к ^/'-комплексу,
циклизующий фоторедокс-цепь
Глава 2. Хлорофилльные генераторы протонного потенциала
55
В растительных клетках фотосинтетическая редокс-цепь локализована
во внутрихлоропластных мембранах, в основном в тилакоидах — замкнутых
сплющенных мембранных пузырьках, собранных в пачки (граны) (рис. 2.20).
Тилакоиды обнаружены также у многих цианобактерий.
2.3.1. Принцип действия
На рис. 2.21 показана светозависимая редокс-цепь в тилакоидной мем-
бране хлоропластов. Цепь содержит два типа реакционных центров (они на-
зываются фотосистемами 1 и 2), а также несколько ферментов, катализирую-
щих темновые реакции окисления воды, Q-цикла и восстановления NADP+.
Процесс начинается поглощением фотона хлорофиллом антенны. Воз-
буждение мигрирует от хлорофилла антенны к хлорофиллу одной из фото-
систем. Если это димер хлорофилла фотосистемы 2 (максимум поглощения
при 680 нм), он окисляется мономером хлорофилла II, после чего элек-
трон оказывается на феофитине. От феофитина электрон переносится на
связанный пластохинон (PQA). Затем электрон достигает другой молекулы
связанного пластохинона (PQ^). Как и в бактериальном фотосинтезе, этот
процесс катализируется негемовым железом, связанным с четырьмя имида-
золами гистидинов белка. Катион-радикал окисленного димера хлорофил-
ла (Хл11);+ принимает электрон от одного из тирозинов белка, который,
в свою очередь, восстанавливается электроном, отнятым у молекулы Н2О
посредством довольно сложной марганец-содержащей системы расщепления
воды (СРВ). При расщеплении воды наряду с электронами образуется мо-
лекулярный кислород и протоны. Последние высвобождаются в раствор
внутри тилакоидов. Восстановленный PQ окисляется Р0Я2-пластохинон-
редуктазой, или комплексом brf (это хлоропластный аналог комплекса Ьсх).
Комплекс b(f включает трехгемовый цитохром b (гемы bL, Ьн и с,-), FeS и
цитохром/, который функционально аналогичен цитохрому сх.
Комплекс bj катализирует Q-цикл, подобный тому, который описан у
пурпурных бактерий и митохондрий. В результате перенос одного электро-
на с PQ на цитохром f оказывается сопряженным с транслокацией одного
заряда через мембрану тилакоида, поглощением двух Н+ из стромы и вы-
свобождением двух Н+ во внутритилакоидное пространство. Поглощение
протонов происходит на внешней поверхности мембраны тилакоида, их вы-
деление — на внутренней.
От цитохрома f электрон движется к медь-содержащему белку пласто-
цианину (ПЦ). который восстанавливает катион-радикал димера хлоро-
филла фотосистемы 1 (максимум поглощения этого хлорофилла — 700 нм).
(Хл!)^ образуется при окислении возбужденного (Хл1)2*. Электрон, отнятый
от (Хл1)2*, переносится через мономеры хлорофилла (Хл1 и Хл1') и витамин
Kj (филлохинон) на железосерный центр FeSx, играющий роль первичного
стабильного акцептора электронов в фотосистеме 1.
На следующих этапах электрон транспортируется на другие железосер-
ные кластеры (FeSB, FeSA, ферредоксин) и далее на флавопротеин, содер-
жащий FAD в качестве простетической группы. От FAD восстановительные
эквиваленты поступают на NADP+. Образованный в результате NADPH
56
ЧАСТЬ II. Генераторы протонного потенциала
окисляется водорастворимой системой ферментов, восстанавливающих СО2
до сахара.
Согласно схеме, представленной на рис. 2.21, эффективность нецикли-
ческой редокс-цепи хлоропластов и цианобактерий должна составлять 6Н+
на 4hv, что соответствует отношению Н+/ё, равному 1,5 (имеется в виду от-
ношение количества протонов, перенесенных через мембрану, к количеству
электронов, прошедших весь путь от Н2О до СО2). Таким образом, редокс-
цепь тилакоидов содержит три l^^-генератора: фотосистему 1, фотоси-
стему 2 и комплекс bj.
Рисунок 2.22. Полипептидный остов фотоси-
стемы 1 из хлоропластов гороха. Четыре белка
антенны (Lhca 1—4) показаны зеленым. Крас-
ным даны элементы структуры хлоропластной
фотосистемы 1, отличные от фотосистемы 1
цианобактерий, а серым — совпадающие у хло-
ропластов и цианобактерий. Железо-серные
кластеры FeSx, FeSA и FeSB, имеющие состав
Fe4S4, показаны как черные (Fe) и синие (S)
жирные точки. А — вид сверху со стороны
стромы хлоропласта. Указаны субъединицы F,
G, Н и К. Б — вид сбоку со стороны белков
антенны. N-концевые домены субъединиц F
и D, специфичные для хлоропластов, указа-
ны красным. Рентгеноструктурный анализ
Нельсона и Бен-Шема [Nelson & Ben-Shem
2004, Nature Reviews Molecular Cell Biology 5:
971-982]
2.3.2. Фотосистема 1
Фотосистема 1 из хлоропластов
включает 14 различных полипепти-
дов. Два из них с молекулярными
массами 83,2 и 82,5 гомологичны
друг другу (45% идентичности ами-
нокислотных последовательностей).
Остальные субъединицы гораздо
мельче.
(Хл1)2, Хл1, ХлГ, витамин Kq
(филлохинон) и FeSx связаны с
крупными субъединицами, a FeSA и
FeSB — с одной из мелких гидро-
фобных субъединиц. В отличие от
фотосистемы 1 цианобактерий, в
хлоропластную фотосистему 1 ин-
тегрированы четыре белка, несущие
хлорофиллы антенны (Lhca 1—4).
Если посмотреть на мембрану ти-
лакоида сверху, то окажется, что
антенные белки формируют полу-
кольцо вокруг остальных субъеди-
ниц, образующих комплекс реак-
ционных центров фотосистемы 1
(рис. 2.22). Перенос энергии воз-
буждения от хлорофиллов антенны
на (Хл1)2 чрезвычайно эффективен:
почти каждый квант света, погло-
щенный антенной, вызывает окис-
ление (Хл1)2. С внутренней стороны
мембраны тилакоида расположен
поверхностный медь-содержащий
белок пластоцианин (см. ниже),
входящий в состав фотосистемы 1,
а с внешней — другой поверхност-
ный белок ферредоксин (11 кДа).
Глава 2. Хлорофилльные генераторы протонного потенциала
57
Последний содержит [Fe—S]-кластер и слу-
жит переносчиком электронов с фотосисте-
мы 1 на флавопротеин, восстанавливающий
NADP+ (34 кДа).
Комплексы реакционных центров фо-
тосистемы 1 в мембране тилакоидов циано-
бактерий образуют тримеры. В хлоропластах
высших растений фотосистема 1 находится
в мономерной форме. Как тримеры циа-
нобактерий, так и мономеры хлоропластов
были очищены, закристаллизованы и под-
вергнуты рентгено-структурному анализу.
Результаты такого анализа применительно к
хлоропластам показаны на рис. 2.22 и 2.23.
Как видно на рис. 2.23, существуют две ветви
переноса электронов через (Хл1)2* на FeSx,
каждая из которых содержит одни и те же
редокс-группы (Хл1, Хл!' и витамин К^. Обе
ветви способны к переносу электронов, но
одна делает это в десять раз быстрее другой.
Первичный светоиндуцированный ре-
докс-процесс, происходящий в фотосистеме
1, — перенос электрона от (Хл1)2* (редокс-
потенциал —1,2 В) к Хл! (редокс-потенциал
около —1 В). Затем электрон попадает на
• • FeSB
# FeSA
Я8 FeSx
Си (Пц)
Рис. 2.23. Расположение просте-
тических групп в фотосистеме 1
хлоропластов по данным рентгено-
структурного анализа (по Нельсону
и Бен-Шему) [Nelson & Ben-Shem
2004, Nature Reviews Molecular Cell
Biology 5: 971-982]
Хл!' и далее на витамин К] (редокс-потенциал —0,8 В). Следующий пере-
носчик электронов — FeSx (—0,7 В). Он представляет собой кластер, со-
держащий четыре иона железа и четыре иона сульфида. Кроме этого ком-
понента в фотосистеме 1 находят еще два кластера [4Fe—4S], а именно
FeSA и FeSB. Их редокс-потенциалы равны соответственно —0,58 и —0,53 В.
Последовательность реакций в этой части редокс-цепи следующая: FeSx
FeSA -» FeSB. Последний компонент служит восстановителем ферредокси-
на, водорастворимого белка, содержащего кластер [2Fe—2S].
Другой водорастворимый переносчик электронов играет роль восстано-
вителя фотоокисленного (Хл1)2+. Это медь-содержащий белок пластоцианин.
В первичной структуре пластоцианина обнаружена гомология с субъедини-
цей II цитохромоксидазы — конечного фермента дыхательной цепи, содер-
жащего медь и железо (см. ниже, раздел 4.4).
Восстановителем пластоцианина является цитохром /, принадлежащий
комплексу bj. Этот комплекс осуществляет перенос электронов от фото-
системы 2 к фотосистеме 1 (см. ниже, раздел 2.3.3).
Существует альтернативный способ функционирования фотосинтетиче-
ской редокс-цепи в хлоропластах — циклический перенос электронов с участи-
ем фотосистемы 1 и комплекса bj\ но без фотосистемы 2. Такой механизм
in vitro можно продемонстрировать, блокируя фотосистему 2 диуроном и
добавив какой-либо искусственный переносчик электронов. В определен-
ных условиях циклический перенос электронов можно наблюдать и in vivo.
58
ЧАСТЬ И. Генераторы протонного потенциала
В этом случае восстановительные эквиваленты каким-то неизвестным еще
образом транспортируются от ферредоксина не к NADP+, а назад к (Хл1)2+.
В этом процессе принимают участие пластохинон и комплекс b<f Предпо-
лагают, что ферредоксин восстанавливает PQ, так что фотосистема 2 ста-
новится ненужной для регенерации (Хл1)2 из (Хл!)^. Подобный механизм
аналогичен циклической светозависимой редокс-цепи пурпурных бактерий,
образующей Дцн+ без фотолиза воды и восстановления NADP+.
Нет сомнений, что фотосистема 1 способна генерировать Дцн+. Показа-
но, что пластоцианин, восстанавливающий фотосистему 1, расположен на
внутренней стороне мембраны тилакоида, а ферредоксин и ферредоксин-
NADP+-peдyктaзa, окисляющие фотосистему 1, обращены наружу. Поэтому
транспорт электронов через фотосистему 1 должен быть направлен поперек
мембраны. Комплекс фотосистемы 1 был встроен в протеолипосомы, ко-
торые на свету генерировали АрН. Чтобы включить циклический перенос
электронов, в инкубационную среду добавили искусственный переносчик
электронов феназинметасульфат и донор электронов аскорбат. Включение
очищенной Н+-АТР-синтазы в те же протеолипосомы давало систему, ката-
лизирующую фотофосфорилирование.
Механизм генерации Дцн+ фотосистемой 1, по всей вероятности, по-
добен таковому в бактериальных реакционных центрах. Наносекундная
вспышка лазера вызывает генерацию ДТ с т < 100 нс, что много быстрее
всех процессов, происходящих в фотосистеме 1, кроме переноса электронов
на этапе (Хл!)* FeSx- Эта ДТ составляет большую часть электрогенного
ответа, так что все прочие этапы переноса электронов в фотосистеме 1 мо-
гут внести лишь сравнительно малый вклад в трансформацию энергии на
этом участке фотосинтетической редокс-цепи.
2.3.2. Фотосистема 2
Фотосистема 2 в зависимости от объекта и метода очистки состоит
из полипептидов около 30 различных типов, часть которых кодируется
ядерной, а часть — хлоропластной ДНК. Фотосистема 2 образует димеры.
Структура фотосистемы 2 и расположение редокс-центров по данным рент-
геноструктурного анализа показаны на рис. 2.24.
Хлорофиллы фотосистемы 2 (как и фотосистемы 7) относятся к группе
хлорофиллов а и имеют a-полосу поглощения при 680 нм (в фотосистеме 1 при
700 нм). В состав фотосистемы 2 входят субъединицы D1 и D2 массой 39,5
и 39 кДа, похожие на М и £-субъединицы комплекса реакционных центров
пурпурных бактерий. Подобно этим субъединицам, они ответственны за
связывание (Хл11)2, двух Хл11, двух феофитинов, первичного и вторично-
го хинонов (в этом случае PQA и PQb), негемового железа, связанного с
четырьмя гистидинами, а также двух хлорофиллов антенны (Xnz). 39-кДа-
субъединица специфически связывает гербициды.
Характерной чертой фотосистемы 2 является наличие 12 очень малень-
ких субъединиц (3—5 кДа). Субъединицы 9,5 и 4,5 кДа образуют цитохром
типа b с максимумом a-пика при 559 нм (цитохром Z>559). Каждая из на-
Глава 2. Хлорофилльные генераторы протонного потенциала
59
Рисунок 2.24. Структура фотосистемы 2. А — вид сбоку димера фотосистемы 2: субъединицы D1
и D2 показаны темно-синим цветом, хлорофилл-связываюшие белки антенны СР43 и СР47 —
красным цветом, цитохром Ь559 — светло-синим цветом, периферические субъединицы — оран-
жевым и желтым цветом, остальные субъединицы — розовым цветом. Б — пространственное
расположение простетических групп фотосистемы 2: хлорофиллы показаны темно-зеленым
цветом, марганцевый кластер — светло-синим цветом, гемы и негемовое железо — красным
цветом, хиноны — фиолетовым цветом. Стрелками указан путь переноса электронов [Nelson
& Ben-Shem 2004, Nature Reviews Molecular Cell Biology 5: 971—982]
званных субъединиц содержит остаток гистидина, имидазол которого об-
разует координационную связь с гемом. Роль цитохрома Ь559 остается невы-
ясненной. То же относится к цитохрому типа с (c55Q), расположенному на
внутренней (обращенной во внутритилакоидное пространство тилакоида)
стороне мембраны (этот цитохром есть у цианобактерий и отсутствует в
хлоропластах). Что касается цитохрома Ь559, то он находится ближе к проти-
воположной стороне мембраны.
Отличительной чертой фотосистемы 2 является очень высокий редокс-
потенциал основного состояния димера хлорофилла, т.е. пары (Хл11)2/(ХлП)2+.
60
ЧАСТЬ II. Генераторы протонного потенциала
Он равен +1,1 В. Вот почему (Хл11)2 может служить акцептором электро-
нов для воды (редокс-потенциал пары Н2О/О2 при нейтральном pH равен
+0,82 В). В то же время редокс-потенциал возбужденного (Хл11)2* находится
в отрицательной области (менее —0,6 В).
Первичный стабильный акцептор электронов является пластохиноном
(PQA). Еще одна молекула связанного хинона (PQb) участвует в дальнейшем
переносе электронов по фотосинтетической редокс-цепи. Как и у пурпур-
ных бактерий, этот этап ускоряется негемовым железом, хелированным че-
тырьмя гистидинами, и блокируется о-фенантролином.
Первичным донором электронов для (Хл11)2+ служит один из остатков
тирозина белка. Он восстанавливает (Хл11)2+ за время порядка 50—500 нс.
В качестве восстановителя радикала тирозина, возникающего при окис-
лении этой аминокислоты посредством (Хл11)2+, используется специфиче-
ская система расщепления воды (СРВ). Она действует таким образом, что
расщепление двух молекул воды приводит к восстановлению четырех моле-
кул (Хл11);+, образованию одной молекулы О2 и четырех ионов Н+.
СРВ состоит из четырех полипептидов, один из которых содержит че-
тыре иона Мп2+. Последние принимают непосредственное участие в пере-
носе электронов от воды к радикалу тирозина.
Механизм генерации ДЦН+ фотосистемой 2 может быть описан по ана-
логии с уже рассмотренным выше комплексом центров пурпурных бакте-
рий. Здесь также происходит трансмембранный светозависимый перенос
электронов от возбужденного димера хлорофилла к QA, расположенному по
другую сторону гидрофобного барьера, причем функционирует только одна
из двух цепей, содержащих ХлП и феофитин.
2.3.3. Комплекс brf
В хлоропластах и цианобактериях система реакций Q-цикла катализиру-
ется комплексом b<f. Комплекс содержит четыре более крупных (18—32 кДа)
и четыре более мелких субъединицы. Из крупных три снабжены редокс-
центрами. Это цитохром f (32 кДа), трехгемовый цитохром Ь6 (23 кДа) и FeS-
белок (20 кДа). Четвертая крупная субъединица (18 кДа) прямо не участвует
в переносе электронов. Комплекс образует димер массой 217 кДа. Цитохром
Z>6 уникален, так как содержит два гема b и гем с, (рис. 2.25). Оба гема b в
цитохроме Ьь характеризуются спектральным a-максимумом при 563 нм. Они
отличаются по редокс-потенциалам. Гемы bL и Ьн имеют среднеточечные по-
тенциалы (Ет) соответственно —30 и +150 мВ. В хлоропластном цитохроме
Z>6 гем Ci ковалентно связан только с одним цистеином, а не с двумя, как во
всех прочих цитохромах типа с. Другая отличительная черта гема с, — от-
сутствие аксиальных лигандов, представленных функциональными группами
белка. Гем с,- расположен рядом с гемом Ьн, как бы экранируя его от PQ.
Вероятно, PQ может служить одним из аксиальных лигандов гема с,-. Можно
предположить, что такая конфигурация PQ-редуктазного центра комплекса
облегчает двухэлектронное восстановление PQ за счет электронов гемов ct
и Ьн и уменьшает время жизни семихинонной формы пластохинона (PQ*-),
опасной своей способностью превращать О2 в О2~. Опасность такого пре-
Глава 2. Хлорофилльные генераторы протонного потенциала
61
9
©
©А
*4
©
ф Fe2Sz
ф f
Рис. 2.25. Редокс-центры димера комплекса b<f из хлоропластов зеленой водоросли Chlamydomonas
reinhardtii. А — атомы железа гемов с„ Ьн и bL цитохрома b, Fe2S2 кластера белка FeSm и ци-
тохрома f Б — окружение гемов с, и bh. Зеленым показаны потенциальный аксиальный лиганд
железа гема с, (по-видимому, пластохинон) и две молекулы воды, связанные вблизи гемов с, и
Ьн (по Д. Стрёбелю и др.)
62
ЧАСТЬ И. Генераторы протонного потенциала
Рисунок 2.26. Трансмембранное располо-
жение двух гемов (выделены вертикаль-
ными жирными линиями) цитохрома Ь6.
Верхний и нижний гемы — соответственно
bLnbH, показана возможная стабилизация
отрицательно заряженных (—) пропионат-
ных групп гемов наиболее консервативны-
ми аргининовыми остатками (+)
вращения особенно велика в клетках с
оксигенным фотосинтезом, где высока
внутриклеточная концентрация О2 (она
не может быть ниже концентрации О2 в
растворе, находящемся в равновесии с
воздушной средой).
Сравнение аминокислотной по-
следовательности цитохрома Ь6 из хло-
ропластов шпината и цитохромов b
из митохондрий животных, растений
и грибов выявило сходство в первых
(считая от TV-конца) 200 остатках. В то
же время существует и явное различие,
состоящее в том, что цитохром Ь6 го-
раздо короче (211 остатков), чем мито-
хондриальные цитохромы b (330—385
остатков). При этом обнаруживается
гомология между субъединицей 18 кДа
комплекса b<f и остатками 260—353 ми-
тохондриального цитохрома Ь. Поэтому
можно полагать, что некая функция,
присущая С-концевой части митохон-
дриального цитохрома Ь, в хлоропластах
выполняется субъединицей 18 кДа.
Цитохром Ьь содержит пять остат-
ков гистидина, из них четыре участвуют
в координировании гемов bL и Ьн. Эти
остатки в положениях 82, 96, 283 и 198
(в митохондриальном цитохроме b —
197) полностью консервативны, т.е. встречаются как в цитохроме Z>6, так
и во всех цитохромах b митохондрий из разных царств живых организмов.
Все четыре гистидина, упомянутые выше, всегда локализованы в гидро-
фобных сегментах полипептидной цепи. Именно они принимают участие
в связывании гемов bL и Ьн. играя роль аксиальных лигандов и определяя
расположение гемов перпендикулярно поверхности мембраны. Каждый гем
b содержит два отрицательно заряженных остатка пропионата. Эти группы
находятся напротив консервативных остатков аргинина, заряженных по-
ложительно (рис. 2.26).
Расстояние между краями гемов, согласно модели, равно 1,2 нм, а между
атомами железа — 2,0 нм. Следовательно, электрон, чтобы переместиться с гема
bL на гем Ьн, должен пересечь около половины гидрофобного слоя мембраны.
Партнером цитохрома Z>6 в реакции окисления PQH2 служит железо-
серный белок комплекса b<f, который функционально аналогичен компо-
ненту FeSin дыхательной цепи. FeSin содержит два атома Fe и два атома S.
Следующий переносчик электронов — цитохром / Последовательность из
285 аминокислот, образующих цитохром /, содержит фрагмент Cys-X-Y-
Cys-His, характерный для места ковалентного связывания гемов в цитохро-
Глава 2. Хлорофилльные генераторы протонного потенциала
63
мах типа с. Он расположен в области 21—25 от N-конца. His-25 и Lys-145
или Lys-222 служат лигандами железа, входящего в гем. Гем локализован
в большом N-концевом домене (остатки 1—250), экспонированном в во-
дное пространство внутри тилакоида. Остатки 251—270 имеют выражен-
ный гидрофобный характер и образуют а-спиральную колонну, которая,
пересекая мембрану, играет роль «якоря». Остальные 15 аминокислот от
С-конца локализованы на внешней поверхности тилакоидной мембраны и
могут быть удалены протеазами. Участок 190—249 богат кислыми аминокис-
лотами, обращенными внутрь тилакоида. Они участвуют, как полагают, во
взаимодействии с кластером основных аминокислот цитохрома Z>6. Десять
консервативных основных аминокислот на отрезке 58—154, вероятно, уча-
ствуют в связывании следующего переносчика электронов — пластоциани-
на. Спектр цитохрома f имеет a-максимум при 555 нм. Редокс-потенциал
этого цитохрома равен +365 мВ.
Средний диаметр комплекса b<f составляет величину порядка 8,5 нм.
В природной мембране комплекс существует в виде димера.
Следует отметить, что комплекс b<f — медленное и наиболее уязвимое зве-
но фотосинтетической редокс-цепи. Вход в Q-цикл от фотосистемы 2 бло-
кируется мощным гербицидом дихлорфенилдиметилтиомочевиной (диуро-
ном). Определенные этапы Q-цикла чувствительны к дибромтимохинону и
N-оксиду 2-гептил-4-оксихинолина. Последние два яда тормозят 0-цикл
также в митохондриях и бактериях.
Ингибиторный анализ редокс-цепи тилакоидов осложняется существо-
ванием путей переноса электронов, альтернативных главной нециклической
цепи. Это циклический перенос электронов вокруг фотосистемы 1 (а также,
возможно, и фотосистемы 2).
Рисунок 2.27. Три генератора Дцн+ в мембране тилакоида цианобактерий (по Куризу и др.).
Чтобы упростить картину, белки, связанные с поверхностью мембраны, т.е. пластоцианин (Пц),
ферредоксин (Fd) и ферредоксин-^АБР+-редуктаза (FNR), вынесены в водные пространства
внутри или снаружи тилакоида
64
ЧАСТЬ II. Генераторы протонного потенциала
На рис. 2.27 показаны три генератора АЦН+ оксигенного фотосинтеза.
Данные получены в результате рентгеноструктурного анализа фотосистем 1
и 2 и комплекса b<f цианобактерий. Аналогично выглядит система оксиген-
ного фотосинтеза хлоропластов.
2.3.4. Судьба Ацн+, образованной фотосинтетической
редокс-цепъю хлоропластов
Тилакоиды хлоропластов выполняют лишь две функции — восстановление
NADP+ и синтез АТР, опосредованный образованием и использованием ДЦН+.
При этом энергия АЦН+ количественно превращается в энергию АТР по-
средством Н+-АТР-синтазы.
Для тилакоидов нет необходимости совершать осмотическую работу по
транспорту метаболитов, поскольку внутритилакоидное водное простран-
ство является, по существу, «энзиматически пустым». Единственный зна-
чительный процесс, происходящий на внутренней поверхности тилакоид-
ной мембраны, — фотолиз воды с образованием молекулярного кислорода.
Мембрана не может быть барьером ни для субстрата этой реакции (Н2О),
ни для ее продукта (О2). Что касается превращения ADP и Р, в АТР, а также
NADP+ в NADPH, то оба эти процесса локализованы на внешней поверх-
ности тилакоида.
Обратный перенос электронов против градиента редокс-потенциала в
тилакоидах отсутствует, поскольку проблему генерации «восстановительной
силы» они решают, образуя NADPH нециклической цепью. В хлоропластах
не описано таких потребителей ДЦН+, как Н+-моторы, вращающие флагеллы
бактерий.
Фотосистема II Комплекс b6f Фотосистема I
АТР
Рисунок 2.28. Превращение энергии в мембранах тилакоидов
Глава 2. Хлорофилльные генераторы протонного потенциала
65
Коль скоро в тилакоидах есть только одна Ацн+-зависимая функция, от-
падает необходимость стабилизировать Ацн+ в той степени, как это обычно
происходит у бактерий. Тем не менее тилакоиды располагают возможно-
стью забуферить до известной степени уровень Ацн+. Дело в том, что их
мембрана проницаема для ионов СГ, К+ и Mg2+. Транспорт этих ионов
по электрическому градиенту, образуемому АЦн+-генераторами, приводит к
превращению АТ в АрН. Поскольку в форме АрН можно запасти намного
больше энергии, чем в АТ, переход АТ -э> АрН повышает общее количество
«мембранной» энергии в системе. Такой эффект может стабилизировать
скорость синтеза АТР хлоропластами в условиях колебаний освещенности,
что часто происходит в природных условиях. Общий план энергетики тила-
коида представлен на рис. 2.28.
Последний существенный момент, который следует отметить при рас-
смотрении энергетики хлоропластов, состоит в том, что Н+-АТР-синтаза
может отсутствовать в тех областях, где мембраны двух соседних тилакои-
дов тесно прилегают друг к другу. Такой эффект возникает при условии,
что тилакоиды находятся в ненабухшем состоянии, т.е. имеют дисковидную
форму. В этом случае между тилакоидами остается лишь очень узкая щель.
Показано, что в данном состоянии молекулы Н+-АТР-синтазы сконцентри-
рованы на самых краях диска, обращенных в сторону хлоропласта, и (глав-
ным образом) в мембранах ламелл, далеко выступающих из гран в строму.
Ламеллы представляют собой, в сущности, продолжение некоторых из ти-
лакоидов. Ламеллы содержат фотосистему 1, в то время как в тилакоидах
есть обе фотосистемы. Создается впечатление, что ламеллы специализиро-
ваны на синтезе АТР, сопряженном с циклическим переносом электронов
вокруг фотосистемы 1, и не способны к фотолизу воды и восстановлению
NADP+ (эти два процесса протекают в тилакоидах). Чтобы образовать АТР,
генерируемая тилакоидом Дцн+ должна быть передана вдоль мембраны в
ламеллу, где локализована большая часть молекул Н+-АТР-синтазы.
Если тилакоиды находятся в набухшем состоянии, то молекулы Н+-
АТР-синтазы диффундируют из ламелл в тилакоиды и равномерно распре-
деляются по всей системе внутрихлоропластных мембран.
Все эти соображения могут быть отнесены и к тилакоидам цианобак-
терий, являющихся эволюционными предшественниками хлоропластов.
В этом случае необходимо лишь дополнить схему на рис. 2.27 дыхательной
цепью, которая у цианобактерий находится в той же тилакоидной мембра-
не, что и фотосинтетическая редокс-цепь (у растений дыхательная цепь
вынесена в митохондрии). Взаимодействие дыхательной и фотосинтетиче-
ской цепей, обслуживаемых на средних участках одними и теми же ком-
понентами Q-цикла, будет рассмотрено в одной из последующих глав (см.
разд. 4.3).
ГЛАВА ТРЕТЬЯ
ОРГАНОТРОФНАЯ ЭНЕРГЕТИКА
/ у^нная глава нашей книги будет посвящена краткому обзору метаболизма
гетеротрофных организмов, причем в основном той его части, в ходе которой
происходит обеспечение клетки необходимой энергией. Преполагается, что
читатель уже хорошо знаком с общим курсом биохимии. Основной материал
этой главы будет изложен в очень краткой форме, лишь иллюстрирующей
биоэнергетическое описание метаболических процессов.
3.1. Субстраты органотрофной энергетики
Органические вещества являются источниками энергии (субстратами)
для подавляющего большинства гетеротрофных организмов. При окисле-
нии субстратов кислородом выделяется большое количество энергии, кото-
рая может быть преобразована в удобную для клетки форму (в частности, в
АТР). Что за субстраты используются в этих процессах? В первую очередь
это углеводы, жиры и белки.
Полисахариды, жиры и особенно белки исключительно разнообразны,
так что организму приходится иметь дело со многими тысячами различных
соединений. На первом этапе метаболизма этих субстратов происходит их
деполимеризация, т.е. расщепление полимеров и сложных соединений до
отдельных мономеров. Углеводы на этом этапе расщепляются до моносаха-
ридов (основных моносахаридов меньше десяти). При расщеплении жиров
получаются глицерин и жирные кислоты (которых тоже около 10). При рас-
щеплении белков образуется 20 различных аминокислот. В целом из тысяч
биополимеров пиши получается ограниченный набор (нескольких десят-
ков) веществ — мономеров (см. рис. 3.1). Таким образом, уже на первом
этапе метаболизма происходит значительная унификация используемых
субстратов.
3.2. Краткий обзор метаболизма сахаров
На втором этапе происходит дальнейшая унификация соединений для
их последующего окисления молекулярным кислородом. Рассмотрим этот
процесс на примере наиболее распространенного сахара — глюкозы. При
Глава 3. Органотрофная энергетика
67
Жиры----
Углеводы
Белки
---► глицерин,_жирные кислоты
моносахариды-—►фга \
аминокислоты
2Н
2Н
Гистидин
Пролин
Глутамин
Аргинин
Оксипролин
Серин
Цистеин
Треонин
Глицин
*;---*АТР
ФГК г
, J Треонин I
/ ТЛизин Г
Триптофан -►Аланин-*^ Пируват..
I Лактат4
\2Н
Оксало-\>
ацетат ""Х
Леицин
Изолейцин
Метионин
Валин
Фумарат
Сукцинат
2Н
GTP С02
СО2
Ct -Кетоглутарат
Ацетил'
СоА
со2
2Н
Цитрат
2Н
2Н
. Изоцитрат
I • Z п
CoQ
V
FMN
Глутамат
Цит.Ь
-♦АТР
Цит.с
Цит.
1/2О2-^П
Н2О
Рисунок 3.1. Схема унификации «топлива» (восстановительных эквивалентов) при органотроф-
ной энергетике. Зеленым показаны пути переноса атомов водорода, красным — реакции синтеза
АТР (GTP), черным — метаболические пути унификации «топлива», широкими стрелками —
перенос электронов по дыхательной цепи
68
ЧАСТЬ II. Генераторы протонного потенциала
ГЛИКОЛИЗ
но.. Глюкоза
Пируват о I \
2 ^JL 2 2 - -
* ^^чон 2 Й *
он
^ОАТП^ Я
но»
Пируваткиназа)
2 н°х он
Фосфоенолпируват
9 ЕнолазаJ
АТР
он Фруктозо-
J -6-фосфат
2-Фосфо- но-
°и он -6-фосфат **
( 2 Фосфоглюкоизомера j
но
(з Фосфофруктокиназ Л Фосфоглице
ADP
S З-Фосфо- но.
ADP
глицерат 2
он о
Фруктозо-1 6-бисфосфат
2ADP
2 но, .<*
2АТР
7 Фосфоглицераткиназа
4 Альдолаза
Глицеральдегид- * хон
3-фосфат Диокси- \
ацетонфосфат \
Триозофосфат изомер»
Глицеральдегид- но^ он /
-3-фосфат 0*P>o**V
ОН
1,3-Бисфосфоглицерат
2NADH
ГпицеральдегидфосфатА
дегидрогеназа J
он он
~....* Глицеральдегид-З-фосфат
Рисунок 3.2. Основные пути метаболизма глюкозы: А — гликолиз, Б — цикл Кребса
окислении глюкозы кислородом выделяется очень большое количество
энергии (2850 кДж/моль), которую необходимо преобразовать в удобную
для клетки форму (АТР):
С6Н12О6 + 6О2 -> 6СО2 + 6Н2О. (3.1)
Как следует из уравнения 3.1, для полного окисления одной молекулы
гексозы от нее необходимо отнять 24 электрона и перенести их на шесть
молекул О2. Конечно же, это невозможно сделать за один этап, поэтому
данное окисление происходит в несколько последовательных этапов, объ-
единенных в те или иные метаболические пути. При переносе электро-
нов на кислород выделяется большое количество энергии. Ее запасание
в виде АТР является сложным процессом, требующим функционирования
ферментных комплексов дыхательной цепи. Чтобы попасть в дыхательную
цепь, электроны отнимаются от мономеров и переносятся на молекулы
специфических кофакторов — никотинамидадениндинуклеотида (NAD+)*
или (реже) убихинона (CoQ). Образованные в ходе этих реакций NADH и
CoQH2 окисляются комплексами дыхательной цепи, а затем уже молеку-
лярным кислородом. Таким образом, с точки зрения биоэнергетика, основ-
* Обычно перенос электронов с органических субстратов на NAD+ не связан с за-
пасанием энергии, поэтому данный процесс может быть осуществлен за счет действия
довольно просто устроенных ферментов.
Глава 3. Органотрофная энергетика
69
Рисунок 3.3. Г. Кребс
ним итогом начальных этапов метаболизма глю-
козы и других соединений является окисление
этих веществ и унификация полученных вос-
становительных эквивалентов в виде всего лишь
двух соединений, а именно NADH и CoQH2.
Посмотрим, как протекает этот процесс, ес-
ли мы имеем дело с глюкозой. Чаще всего окис-
ление глюкозы происходит за счет последова-
тельного функционирования гликолиза и цикла
Кребса (схему этих метаболических путей см. на
рис. 3.2).
Вначале глюкоза фосфорилируется за счет
АТР с образованием глюкозо-6-фосфата. Как
было указано выше, основной функцией метабо-
лизма сахаров является обеспечение клетки энер-
гией. Однако, как видно, уже на первой стадии
гликолиза клетка затрачивает энергию, кото-
рая идет на образование сложноэфирной связи
между сахаром и остатком фосфорной кислоты. При этом большая часть
энергии расщепляемого АТР рассеивается в виде тепла, что делает данный
процесс необратимым. Последнее должно обеспечить надежную регуляцию
гликолиза. Чаще всего контроль над протеканием какого-то метаболиче-
ского пути осуществляется за счет регуляции его первой реакции. Очевид-
но, что такая регуляция упростится, если регулируемый процесс необратим.
По-видимому, в первой реакции гликолиза клетка за счет энергии АТР обе-
спечивает необратимую активацию молекулы глюкозы и, таким образом,
создает благоприятные условия для тщательного контроля над этим мета-
болическим путем. В то же время затрат АТР нет, если субстратом служит
не глюкоза, а гликоген, так как источником фосфорила при образовании
глюкозофосфата является неорганический фосфат (реакция фосфоролиза
гликогена катализируется ферментом гликогенфосфорилазой). В этом слу-
чае присоединение фосфата к сахару происходит за счет энергии связей
между остатками глюкозы в гликогене.
Далее глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат.
Фруктозо-6-фосфат снова фосфорилируется за счет АТР с образованием
фруктозе-1,6-дифосфата, т.е. в третьей реакции гликолиза снова происходит
трата энергии. Скорее всего, это опять же необходимо для регуляции дан-
ного метаболического пути, потому в особенности, что глюкозо-6-фосфат
помимо гликолиза может еще вовлекаться в пентозофосфатный путь или
потребляться для синтеза гликогена и других углеводов. Неудивительно, что
именно за счет стадий, катализируемых гексокиназой и фосфофруктокина-
зой, осуществляется основной контроль над протеканием гликолиза. Одна-
ко за это приходится платить, рассеивая большую часть энергии гидролиза
двух молекул АТР.
В ходе следующей стадии фруктозе-1,6-дифосфат расщепляется на
3-фосфоглицериновый альдегид и диоксиацетонфосфат. Фосфоглицерино-
вый альдегид, а через него и диоксиацетонфосфат далее в ходе нескольких
70
ЧАСТЬ II. Генераторы протонного потенциала
реакций (ниже мы рассмотрим их более подробно) окисляются с образова-
нием двух молекул 3-фосфоглицериновой кислоты. На этом этапе проис-
ходит первая окислительная стадия в цепи метаболизма глюкозы. В резуль-
тате от каждой из двух частей исходной молекулы сахара отнимаются по два
электрона, которые переносятся на две молекулы NAD+. Фосфоглицерино-
вая кислота превращается в фосфоэнолпируват и, далее, в пируват.
Пируват подвергается окислительному декарбоксилированию с образо-
ванием ацетил-СоА. При этом по два электрона с каждой молекулы пиру-
вата переносятся на NAD+.
Далее в ходе протекания цикла Кребса ацетил-СоА конденсируется с
щавелевоуксусной кислотой в лимонную кислоту. Из лимонной кислоты
образуется изолимонная кислота, которая при последующем окислитель-
ном декарбоксилировании (сопровождающемся переносом электронов на
NAD+) превращается в а-кетоглутаровую кислоту, а-Кетоглутарат снова
подвергается окислительному декарбоксилированию (опять-таки с перено-
сом электронов на NAD+) и в две стадии превращается в янтарную кислоту.
Янтарная кислота окисляется до фумаровой кислоты. Однако окислительно-
восстановительный потенциал пары сукцинат / фумарат (+30 мВ) зна-
чительно положительней потенциала пары NADH/NAD+ (—320 мВ), и в
этом случае электроны с органического субстрата переносятся не на NAD+,
а на переносчик электронов с более положительным редокс-потенциалом,
а именно убихинон (CoQ).
Фумаровая кислота подвергается гидратированию с образованием
яблочной кислоты, окисляющейся (с переносом электронов на NAD+) до
щавелевоуксусной кислоты, которая готова к реакции конденсации со сле-
дующей молекулой ацетил-СоА.
Таким образом, в ходе гликолиза и цикла Кребса происходит полное
окисление молекулы глюкозы до углекислого газа, а отнятые от субстрата
электроны используются для образования NADH и убихинола (CoQH2):
С6Н12О6 + 10NAD+ + 2CoQ + 6Н2О ->
->6СО2 + 2CoQH2 + 10NADH +10Н+. (3.2)
NADH и CoQH2 могут быть далее окислены молекулярным кислородом за
счет активности дыхательной цепи:
10NADH +10Н+ + 2CoQH2 + 6О2 -> 10NAD+ + 2CoQ + 12Н2О. (3.3)
Как мы увидим далее, именно при окислении NADH и убихинола кис-
лородом (т.е. при протекании реакции 3.3) выделяется большая часть энер-
гии реакции 3.1. Однако и реакция 3.2 также является экзергоничной. Хотя
количество выделяющейся здесь энергии и не очень велико, но и она может
быть частично запасена в виде АТР. Рассмотрим, в чем состоит механизм
этого преобразования энергии, называемого субстратным фосфорилирова-
нием, на примере окисления 3-фосфоглицеринового альдегида (ФГА) до
3-фосфоглицериновой кислоты (ФГК) в цепи реакций гликолиза.
Глава 3. Органотрофная энергетика
71
3-3. Механизм субстратного фосфорилирования
Окислительно-восстановительный потенциал пары ФГА/ФГК (—550 мВ)
значительно отрицательней потенциала пары NADH/NAD+ (—320 мВ), поэ-
тому при переносе электронов от ФГА на NAD+ выделяется большое коли-
чество энергии (43 кДж/моль), достаточное для обеспечения синтеза одной
молекулы АТР из ADP и Pj. Для этого нужно лишь сопрячь протекание этой
экзергонической реакции с реакцией фосфорилирования ADP неоргани-
ческим фосфатом. Однако, с точки зрения химии, такое сопряжение двух
реакций (энергодающей и энергопотребляющей) крайне непростая задача.
Посмотрим, какие механизмы были выработаны природой для реализации
данного сопряжения.
В клетке сопряженное с синтезом АТР окисление ФГА до ФГК осу-
ществляется за счет работы двух ферментов — глицеральдегид-фосфатде-
гидрогеназы и фосфоглицераткиназы. Последовательность событий изобра-
жена на рис. 3.4, и ее можно разделить на три этапа.
1) Вначале дегидрогеназа глицеральдегидфосфата связывает ФГА и об-
разует с ним ковалентную связь за счет взаимодействия SH-группы соб-
ственного остатка цистеина с альдегидной группировкой ФГА (таким об-
разом, образуется так называемый тиополуацеталь). Важно отметить, что
данная реакция обратима, т.е. на нее не нужно затрачивать энергию. В ре-
зультате первого этапа без затраты энергии молекула субстрата присоединя-
ется к реакционно-способной группировке.
Рисунок 3.4. Механизм синтеза АТР при гликолитическом окислении глицеральдегид-3-фосфата.
Макроэргические связи выделены красным
72
ЧАСТЬ II. Генераторы протонного потенциала
Рисунок 3.5. Схема окислительного декарбоксилирования пирувата и а-кето глутарата
2) На втором этапе происходит энергетически выгодное окисление аль-
дегидной группы до карбоксильной группы за счет переноса двух электро-
нов на молекулу NAD+. Однако так как в реакцию вступает тиополуаце-
тальное производное альдегидной группы, то в результате образуется не
карбоксильная группа, а ее тиоэфир. При этом свободная энергия окисле-
ния ФГА не рассеивается в виде тепла, а запасается в виде напряженной
тиоэфирной связи. В результате второго этапа за счет окисления субстрата
(а именно — за счет окисления его углеродного атома, связанного с реакцион-
ной группировкой) значительно повышается энергия разрыва связи между ним
и реакционной группировкой.
3) На третьем этапе производится фосфоролиз тиоэфирной связи с об-
разованием фосфоангидрида карбоксильной группы субстрата. При этом
происходит регенерация исходного фермента с сохранением энергии тио-
эфирной связи в виде фосфоангидридной связи. Далее этот фосфатный
остаток, характеризующийся высокой энергией разрыва связи, легко может
быть перенесен на молекулу ADP с образованием АТР (последняя реакция
катализируется уже следующим ферментом — фосфоглицераткиназой). Та-
ким образом, в ходе третьего этапа энергия разрыва связи между окисленным
субстратом и реакционной группировкой запасается в форме А ТР.
Данный тип механизма запасания энергии получил название фосфори-
лирования на уровне субстрата или субстратного фосфорилирования. Кро-
ме описанной выше реакции механизм субстратного фосфорилирования
используется и на некоторых других этапах гликолиза и цикла Кребса, а
именно при превращении 3-фосфоглицерата в пируват, а также при окис-
Глава 3. Органотрофная энергетика
73
лительном декарбоксилировании пирувата и а-кетоглутарата. Во всех этих
случаях (с небольшими вариациями) также возможно применить описан-
ную выше схему событий.
При окислительном декарбоксилировании пирувата и а-кетоглутарата
(см. рис. 3.5) на первом этапе в качестве реакционной группировки высту-
пает кофактор тиаминпирофосфат, на этой стадии также происходит декар-
боксилирование субстрата. Далее полуальдегидная форма субстрата при ее
переносе на окисленную форму липоевой кислоты окисляется в ацильную
с образованием уже хорошо нам знакомой тиоэфирной связи. На третьей
стадии происходит перенос ацетильной (или сукцинильной) группы с ли-
поевой кислоты на SH-группировку СоА. Далее следует фосфоролиз тио-
эфирной связи с образованием ацетилфосфата (или сукцинилфосфата) и
перенос фосфатной группировки на молекулу ADP (или GDP). Следует от-
метить, что у большинства организмов (за исключением некоторых бакте-
рий) энергия тиоэфирной связи ацетил-S-CoA не используется для синтеза
АТР, а применяется либо для запуска первой реакции цикла Кребса, либо
для осуществления разнообразных синтезов в анаболических процессах.
Пожалуй, наиболее просто устроен механизм запасания энергии при
гликолитическом превращении 2-фосфоглицерата в пируват. Здесь нет не-
обходимости в присоединении к субстрату какой-либо реакционной груп-
пировки, так как 2-фосфоглицерат уже несет на себе остаток фосфорной
кислоты (тот самый фосфат, который был перенесен на сахар в ходе гексо-
киназной или фосфофруктокиназной реакции). Таким образом, для синте-
за АТР необходимо всего лишь каким-то образом дестабилизировать фос-
фоэфирную связь в 2-фосфоглицерате, т.е. повысить потенциал переноса
этой фосфатной группировки. Такую функцию выполняет энолаза, катали-
зирующая отнятие воды от 2-фосфоглицерата с образованием фосфоэнол-
пирувата. При гидролизе фосфоэнолпирувата образуется энольная форма
пирувата, которая за счет кето-энольной таутомерии сразу же превращается
в кето-форму пировиноградной кислоты. Данное обстоятельство значитель-
но повышает энергию разрыва фосфоэфирной связи, так что ее оказывается
более чем достаточно для переноса фосфатного остатка на молекулу ADP
(последняя реакция катализируется следующим ферментом гликолиза —
пируваткиназой).
Казалось бы, механизм субстратного фосфорилирования в данном слу-
чае принципиально отличается от описанных выше реакций, так как при
образовании фосфоэнолпирувата отсутствует стадия окисления субстрата.
Однако дегидратацию 2-фосфоглицерата также можно рассматривать как
окислительно-восстановительную реакцию. Только в данном случае элек-
троны перераспределяются не между молекулой субстрата и молекулой
редокс-активного кофактора, а внутримолекулярно, т.е. между различными
атомами одной и той же молекулы субстрата (в данном случае за счет окис-
ления второго атома углерода 2-фосфоглицерата происходит восстановление
его третьего атома углерода). Такое энергетически выгодное диспропорцио-
нирование различных атомов углерода и является источником энергии для
синтеза АТР в ходе превращения 2-фосфоглицерата в пируват.
74
ЧАСТЬ II. Генераторы протонного потенциала
Итак, мы рассмотрели основные метаболические реакции, сопровожда-
ющиеся синтезом АТР за счет субстратного фосфорилирования. В качестве
основного достоинства данного механизма запасания энергии можно отме-
тить его относительную простоту, а стало быть, и надежность этого процес-
са. Как мы увидим далее, механизм окислительного фосфорилирования (т.е.
синтеза АТР за счет энергии окисления субстратов дыхания молекулярным
кислородом) значительно сложнее. Почему же субстратное фосфорилиро-
вание не получило более широкого распространения? Или, иными слова-
ми, в чем же недостатки механизма субстратного фосфорилирования?
Во-первых, энергию окисления далеко не каждого соединения можно
с помощью данного механизма запасти в виде АТР. По чисто химическим
причинам это, по-видимому, удается сделать лишь с ограниченным набо-
ром довольно реакционно-способных веществ (прежде всего с альдегидами
и кетонами). Еще один недостаток заключается в строгой стехиометрии
данного процесса запасания энергии: на каждую молекулу окисленного
субстрата может быть синтезирована ровно одна молекула АТР. Это жест-
кое соотношение накладывает определенные ограничения на применение
данного механизма и снижает его эффективность. Ведь если энергия окис-
ления субстрата намного превышает энергию гидролиза АТР, то весь этот
избыток будет потерян в виде тепла. А если энергия окисления субстрата
меньше энергии гидролиза АТР, то энергию этой реакции вообще нельзя
запасти с помощью механизма субстратного фосфорилирования. Как мы
увидим далее, механизм окислительного фосфорилирования в дыхательных
и фотосинтетических цепях переноса электронов лишен этих недостатков
и поэтому играет более важную роль в обеспечении клетки необходимой
энергией.
3.4. Брожение
Несмотря на то что в ходе гликолиза на каждую потребленную мо-
лекулу глюкозы синтезируются лишь две молекулы АТР, для некоторых
организмов этот метаболический путь является единственным источником
энергии для жизнедеятельности клетки. К таким организмам прежде всего
относятся различные бактерии и низшие эукариоты, растущие в анаэроб-
ных условиях. Из-за отсутствия кислорода и других акцепторов электронов
эти организмы не могут осуществлять дыхательное фосфорилирование и
вынуждены довольствоваться лишь небольшим количеством энергии, за-
пасающейся при субстратном фосфорилировании. Такой тип метаболизма
принято называть брожением.
Выше были изложены основные реакции метаболизма сахаров. Однако
этого недостаточно для понимания различных типов брожения. Как видно
на рис. 3.2Д в ходе гликолиза на каждую метаболизированную глюкозу
образуются две молекулы NADH. У аэробных организмов NADH впослед-
ствии окисляется кислородом, и, таким образом, осуществляется регене-
рация NAD+, необходимого для протекания гликолиза (да еще при этом
запасается большое количество энергии). Но этот путь регенерации NAD+
Глава 3. Органотрофная энергетика
75
совершенно недоступен для анаэробных организмов. Необходимо было най-
ти какой-то другой акцептор электронов для осуществления данного про-
цесса. Таким акцептором электронов могут служить различные молекулы
продуктов гликолиза или цикла Кребса. Таким образом, основным ограни-
чением различных типов брожения и пригодных для них субстратов являет-
ся необходимость соблюдения строгого окислительно-восстановительного
баланса реакций. Иными словами, в ходе реакций брожения количество
образованных молекул NADH должно быть в точности равно количеству
молекул NAD+, полученных при восстановлении конечных продуктов ме-
таболизма.
В качестве основного примера рассмотрим наиболее простой тип бро-
жения — молочнокислое брожение. Данный тип брожения прежде всего ха-
рактерен для различных молочнокислых бактерий, а также используется в
скелетных мышцах животных при кратковременной, но интенсивной фи-
зической нагрузке. В ходе этого метаболического пути глюкоза вовлекается
в гликолиз, и из нее образуются две молекулы пировиноградной кислоты.
В ходе гликолиза образуются также две молекулы АТР (они и являются
единственным источником энергии для молочнокислых бактерий) и две
молекулы NADH, которые необходимо окислить для дальнейшего протека-
ния реакций гликолиза. При молочнокислом брожении окисление NADH
достигается за счет восстановления пирувата до молочной кислоты. Таким
образом, суммарная схема молочнокислого брожения выглядит следующим
образом (см. рис. 3.6). Из этой схемы видно также, насколько важно со-
блюдение полного окислительно-восстановительного баланса брожения.
При использовании более восстановленного по сравнению с глюкозой со-
единения (например, сорбитола) или бо-
лее окисленного соединения (например,
глюконовой кислоты) уже невозможно со-
блюсти этот баланс. Поэтому такие столь
похожие на глюкозу соединения, как сор-
битол или глюконат, не являются сбражи-
ваемыми субстратами для молочнокислых
бактерий.
Попробуем ответить на вопрос, откуда
же берется энергия для синтеза АТР в хо-
де молочнокислого брожения. Дело здесь
в том, что в молекуле глюкозы все атомы
углерода находятся в средней степени вос-
становленное™ (содержат при себе либо
гидроксильную, либо карбонильную груп-
пировку). При этом восстановление одних
атомов углерода глюкозы за счет окисле-
ния других ее углеродных атомов являет-
ся энергетически выгодным. Именно это
и происходит при молочнокислом броже-
нии. Как видно на рис. 3.6, распределение
атомов углерода по степени восстановлен-
Глюкоза Гликоген
(С)6П
Гексозофосфат
С6
Триозофосфат
Сз
* Триозофосфат
С3
NAD
Рисунок 3.6. Схема молочнокислого
брожения
76
ЧАСТЬ И. Генераторы протонного потенциала
ности в молекуле лактата уже совсем иное, чем в глюкозе: произошло окис-
ление первого углеродного атома за счет восстановления третьего атома
углерода.
Итак, в ходе молочнокислого брожения зарабатывается 2 молекулы
АТР на одну потребленную молекулу глюкозы. Подобная стехиометрия на-
блюдается и в хорошо известном спиртовом брожении. А можно ли как-то
увеличить энергетический выход брожения? Оказывается, это возможно,
нужно лишь увеличить диспропорционирование электронов между различ-
ными атомами углерода в продуктах брожения. Рассмотрим это на примере
смешанного брожения энтеробактерий. Будем описывать этот тип броже-
ния, опираясь на наши знания о различных путях метаболизма глюкозы.
Как было сказано выше, в ходе гликолиза на каждую метаболизированную
глюкозу образуются две молекулы пирувата, а также 2 молекулы NADH
и 2 АТР. Было бы крайне соблазнительно не восстанавливать пируват до
лактата (как в молочнокислом брожении), а получить из него ацетил~СоА
и, далее, ацетат и АТР (как было описано выше при изложении механизма
окислительного декарбоксилирования пирувата). При этом мы бы получили
4 молекулы АТР на каждую потребленную глюкозу. Однако в данном случае
у нас бы не осталось возможности окислить 2 молекулы NADH, получен-
ные при гликолизе. Более того, при работе пируватдегидрогеназного ком-
плекса образуются еще две допол-
нительные молекулы NADH, что
делает невозможным соблюдение
окислительно-восстановительного
баланса брожения. Поэтому эн-
теробактерии пошли несколь-
ко иным путем. При брожении
вместо пируватдегидрогеназного
комплекса они используют дру-
гой фермент — пируват-формиат-
лиазу (см. рис. 3.7). Данный фермент из пирувата образует ацетил~СоА и
формиат, или муравьиную кислоту (а не ацетил-Со А, СО2 и NADH, как
делает это пируватдегидрогеназный комплекс). Таким образом, с этим фер-
ментом уменьшается количество образованных молекул NADH, однако
образуется в качестве продукта брожения очень токсичное соединение —
формиат*. Далее судьба двух образованных (из одной глюкозы) молекул
ацетил-СоА различна. Одна из них подвергается фосфоролизу с последую-
щим образованием АТР и ацетата. Другая молекула ацетил-СоА дважды
восстанавливается за счет NADH (происходит полное окисление образо-
ванного в ходе гликолиза NADH) с получением этанола и свободного СоА.
Таким образом, на одну молекулу глюкозы в ходе описанного выше про-
цесса может быть синтезировано не две, а три молекулы АТР.
А как бы выглядело идеальное (с точки зрения энергетического выхода)
брожение? Очевидно, происходило бы максимально возможное диспропор-
Рисунок 3.7. Схема пируват-формиат-лиазной
реакции
* С помощью формиатдегидрогеназного комплекса муравьиная кислота может быть
преобразована в безопасные углекислый газ и водород (НСООН СО2 + Н2).
Глава 3. Органотрофная энергетика
77
ционирование электронов между различными атомами углерода в продук-
тах брожения, т.е. следующий процесс:
С6Н12О6 -> зсо2 + зсн4.
(3.4)
Некоторые сообщества микроорганизмов способны осуществить эту
реакцию (метаногенез), однако механизм запасания энергии при метано-
генезе довольно сложен. Он будет вкратце описан в главах, посвященных
дыхательным цепям бактерий, а также натриевой энергетике.
3.5. Карнозин
Основной недостаток брожения — очень низкий энергетический выход
данного типа метаболизма. Из этого следует, что для обеспечения клетки
необходимой энергией нужно потреблять очень большое количество сбра-
живаемых субстратов, что приведет к значительному накоплению продуктов
брожения, многие из которых могут быть токсичными. Даже такие соедине-
ния, как молочная, уксусная, янтарная, пропионовая и масляная кислоты,
накапливаясь в больших количествах, угнетают жизнедеятельность клетки,
так как эти продукты брожения, являясь кисло-
тами, сильно понижают внутриклеточный pH.
Данное обстоятельство может иметь особое
значение при интенсивной работе скелетных
мышц. В этих условиях в мышцах кончается
кислород и накапливается большое количество
молочной кислоты, что ведет к закислению ци-
топлазмы и инактивации всех мышечных фер-
ментов. Посмотрим, как организм решает эту
проблему. Речь пойдет о дипептидах, содержа-
щихся в мышцах. История о пептидах — занима-
тельная глава биохимии. Пептиды — регуляторы
разнообразных процессов в нашем организме.
Они являются важнейшим компонентом нашего
тела. Сейчас мало кто уже помнит, что первый
пептид был открыт в России точно на рубеже
XIX и XX вв. — в 1900 г. — Владимиром Сер-
геевичем Гулевичем. Это вещество, являющееся
Р-аланил-гистидином (рис. 3.9), было названо
карнозином. У карнозина есть аналог, у кото-
рого в гетероцикле гистидина водород замещен
на метильную группу (р-аланил-метилгистидин,
или ансерин). Эти два вещества находятся во
многих мышцах в очень больших количествах.
Их общая концентрация в цитоплазме иногда
достигает 50 миллимолей на литр.
В самом начале XX в., за 30 лет до откры-
тия АТР, многие метаболиты не были известны,
Рисунок 3.9. Карнозин
(протонированная форма)
78
ЧАСТЬ II. Генераторы протонного потенциала
Рисунок 3.10. С.Е. Северин
и каждый год открывались все новые и новые
вещества биологического происхождения. Шли
годы, большинство веществ обретало свое место
на метаболической карте, а функции карнози-
на и ансерина оставались неизвестными. И ког-
да Гулевич уже завершал свой жизненный путь,
он завешал своему любимому ученику Сергею
Евгеньевичу Северину выяснить функцию этих
веществ. С.Е. Северин остался верен заветам
своего учителя: он положил жизнь на то, чтобы
открыть физиологическую роль карнозина и ан-
серина. И действительно, в 1952 г., через много
лет после смерти Гулевича, функция мышечных
дипептидов была выяснена его учеником. Однако
функция эта оказалась столь простой и, по мне-
нию С.Е. Северина, примитивной, что он просто
не поверил своим глазам. И дальше, до конца
своей долгой жизни (С.Е. Северин прожил более 90 лет), он продолжал ис-
кать ответ на уже исследованный вопрос, какое значение для жизнедеятель-
ности имеют карнозин и ансерин. А опыт, который в дальнейшем вошел в
физиологию как «феномен Северина», состоял вот в чем. Изолированная
мышца лягушки возбуждалась электродами и начинала сокращаться. Спу-
стя некоторое время наступало утомление — и сокращения прекращались.
Однако когда в среду, которая омывала эту мышцу, добавили карнозин,
оказалось, что она может работать часами без всякого утомления. Это был
крайне яркий эффект. Сотрудники С.Е. Северина упорно разбирались, что
же произошло в мышцах, измеряли самые разные параметры, и оказалось,
что в основном все без изменений, кроме одного: в присутствии карнозина
мышца в состоянии накапливать колоссальные количества лактата. Отсю-
да простое объяснение: по-видимому, карнозин связывает образующиеся
при гликолизе протоны. Еще в 1939 г. Бэйт-Смит определил значения рКа
азотов имидазола гистидинового остатка в мышечных дипептидах. Оказа-
лось, что рКа карнозина равно 6,95, а ансерина — 7,05, т.е. эти вещества
обладают pH-буферными свойствами как раз при физиологических значе-
ниях pH. Таким образом, конечными продуктами гликолиза в анаэробной
мышце являются лактат и протонированный карнозин. Протонированный
карнозин — вещь безобидная, и поэтому мышца способна работать, пока
не будут запротонированы все молекулы карнозина и ансерина. Бэйт-Смит
предсказал, что, может быть, функция этих веществ заключается лишь в
том, чтобы забуферить pH в нейтральной области. С.Е. Северин не согла-
сился с такой интерпретацией его результатов, считая буферную функцию
слишком простой и даже какой-то убогой. Казалось бы, по сравнению с
функциями АТР, NADH, коэнзима А эта функция не выдерживает сравне-
ния по значимости.
А дальше произошло следующее. Наблюдение Сергея Евгеньевича бы-
ло напечатано по-русски, оно не получило резонанса, сам автор не придал
Глава 3. Органотрофная энергетика
79
значения открытому им эффекту. Он очень любил этот свой опыт, рас-
сказывал о нем студентам на лекциях, но вновь и вновь пытался найти
какие-то другие, альтернативные функции карнозина. Может быть, кар-
нозин действует на нервно-мышечную передачу? Или фосфорилируется, и
фосфорилированный карнозин используется в мышцах как макроэрг? Или
он как-то влияет на митохондрии? Оказывалось, что почти в каждом слу-
чае карнозин как-то себя проявлял... Такого яркого эффекта, который был
описан в 1952 г., Сергей Евгеньевич уже никогда больше не увидел, но об-
наруживались какие-то небольшие воздействия карнозина, и всегда в хоро-
шую сторону. Это стимулировало интерес исследователя, он перебрал шаг
за шагом почти весь обмен веществ, внедряя туда карнозин. К концу сво-
ей жизни С.Е. Северин стал одним из самых разносторонне образованных
биохимиков мира. Большинство биохимиков России училось у него, прямо
или косвенно. А через 30 лет после открытия феномена Северина его опыт
был повторен за рубежом с использованием ТРИС-буфера вместо карнози-
на. Было описано колоссальное увеличение работоспособности мышц под
действием этого вещества, и тут уж его объяснили буферным эффектом без
всяких ссылок на С.Е. Северина.
Карнозин метаболически инертен, что является важным его свойством
как специализированного pH-буфера. Карнозин может без проблем прото-
нироваться и депротонироваться, что никак не скажется на ходе различных
метаболических процессов. Важно и то, что карнозин — это не простой
дипептид. В его состав входит необычная р-аминокислота. По-видимому,
это еще один способ сделать данное вещество более инертным, в том числе
вывести его из-под контроля обычных пептидаз.
Другое важнейшее свойство карнозина — он подвижный pH-буфер, что
облегчает выравнивание pH во всей огромной мышечной клетке. В то же
время гистидиновые остатки белков, также вносящие вклад в забуферива-
ние pH в нейтральной области, малоподвижны или вовсе неподвижны, как,
например, актин и миозин. Как показал расчет, неподвижные рН-буферы
лишь усугубляют опасность локального закисления участков клетки. Кроме
того, протонирование белков почти всегда сказывается на их биологиче-
ской функции (вспомним, что практически все ферменты имеют выражен-
ный pH-оптимум).
В итоге оказалось, что pH-буферная функция карнозина не единствен-
ная. В частности, карнозин является прекрасным хелатором ионов меди и
железа, а это отнюдь не безразлично для клетки, поскольку эти катионы —
мощные катализаторы превращения перекиси водорода в радикал ОН*,
сильнейший метаболический яд (см. главу XV). Оказалось также, что кар-
нозин — наш защитник от повреждающего действия альдегидов на белки и
ДНК. По-видимому, при больших концентрациях именно карнозин спасает
нас от отравления формальдегидом, а также другими альдегидами. Альде-
гиды, конечно же, портят карнозин, но он «дешевый» — это всего лишь
дипептид. Оказалось, что карнозин каким-то образом защищает клетку и
от накопления амилоидных фрагментов, а также от неправильных белок-
80
ЧАСТЬ II. Генераторы протонного потенциала
белковых взаимодействий и т.д. Однако все эти функции — дополнитель-
ные, так как не объясняют, почему природа выбрала дипептиды, которые
стоят насмерть на рубеже pH = 7, и почему в больших концентрациях они
встречаются только в мышцах.
На этом мы завершим небольшое отступление от сугубо биоэнергети-
ческих вопросов и перейдем к описанию механизма работы дыхательной
цепи.
ГЛАВА ЧЕТВЕРТАЯ
ДЫХАТЕЛЬНАЯ ЦЕПЬ
Термин «дыхательная цепь» означает последовательность реакций, ответ-
ственных за перенос атомов водорода или электронов от субстратов дыхания
к молекулярному кислороду.
Различают два типа дыхательных цепей: со-
пряженные с трансформацией энергии и не со-
пряженные с ней. Биологическое значение ды-
хания первого типа стало ясным благодаря
работам В.А. Энгельгардта, открывшего в начале
1930-х гг. дыхательное фосфорилирование. Что
касается дыхания второго типа, то первые указа-
ния на его активную роль были получены почти
на 30 лет позже. Концепция, предполагающая,
что несопряженное дыхание может быть биоло-
гически полезным, была сформулирована одним
из авторов этой книги в 1960 г.
Данная глава будет посвящена описанию
сопряженной с трансформацией энергии дыха-
тельной цепи митохондрий и аналогичным ей
дыхательным цепям бактерий. В клетках эука-
риот дыхание, сопряженное с трансформацией
энергии, локализовано во внутренней мембране
Рисунок 4.1. В.А. Энгельгардт
митохондрий. У дышащих бактерий тот же процесс обнаруживается в цито-
плазматической мембране, мезосомах или тилакоидах.
4.1. Принцип действия
Как было изложено в разделах, посвященных фотосинтезу, основным
источником энергии для жизни на Земле является энергия солнечного света.
Такие автотрофные организмы, как цианобактерии и растения, используют
энергию квантов света для осуществления двух одновременно протекающих
процессов, а именно — для запасания энергии в виде Дцн+ (с последующим
ее преобразованием в форму АТР) и для разложения воды и переноса полу-
ченных электронов на NADP+. В ходе последнего процесса также запасает-
ся значительное количество энергии, но уже в виде разности окислительно-
82
ЧАСТЬ И. Генераторы протонного потенциала
восстановительных потенциалов, так как потенциал пары NADP+/NADPH
(Eq = -320 мВ) значительно более отрицателен по сравнению с парой О2/
Н2О (£0'= +820 мВ).
Образованные в ходе фотосинтеза АТР и NADPH используются для
процессов фиксации углекислого газа. Во время этих реакций образуются
углеводы, а далее жиры, аминокислоты, нуклеотиды, т.е. весь необходимый
материал для построения клетки.
Гетеротрофные организмы обычно не способны напрямую использо-
вать энергию света, и поэтому основным доступным для них источником
является энергия, накопленная растениями в виде разности окислительно-
восстановительных потенциалов. Значит, гетеротрофные организмы в пер-
вом приближении просто обращают реакции фотосинтеза. Сначала они
(как было описано в главе III) при протекании реакций гликолиза и цикла
Кребса окисляют углеродные атомы углеводов, жирных кислот и амино-
кислот до СО2, а полученные таким образом электроны используют для
образования NADH. Далее NADH окисляется молекулярным кислородом
с образованием воды. Как было сказано выше, NADH-оксидазная реакция
характеризуется очень большим количеством свободной энергии (порядка
1,1 электрон-вольта при переносе одного электрона с NADH на кислород),
которая может быть запасена дыхательной цепью в виде Дцн+. Величина
протон-движущей силы на биологических мембранах обычно составляет
около 200 мВ, так как при больших величинах электрического потенциала
возможен пробой липидного бислоя и утрата запасенной энергии. Таким об-
разом, нетрудно подсчитать, что для запасания энергии NADH-оксидазной
реакции перенос каждого электрона с NADH на кислород должен быть со-
пряжен с транслокацией не менее пяти протонов через мембрану, а полный
процесс, т.е. восстановление молекулы кислорода до воды, должен сопро-
вождаться трансмембранным переносом 20 протонов*. В то же время труд-
но себе представить фермент, способный переносить через мембрану сразу
20 протонов в ходе одного каталитического акта.
По-видимому, необходимость такой высокой стехиометрии Н+/О2 за-
ставила природу пойти иным путем: NADH-оксидазная реакция была раз-
бита на несколько этапов (в митохондриях животных таких этапов три).
Сначала два электрона с NADH переносятся на убихинон NADH-CoQ-
редуктазой (комплексом I), затем полученный убихинол окисляется ци-
тохромом с посредством СоРН2-цитохром с-редуктазы (комплекса Ьсх, или
комплекса III), и в завершение восстановленный цитохром с окисляется
молекулярным кислородом под действием цитохром с-оксидазы (комплек-
са IV). Активность всех этих трех ферментных комплексов сопряжена с
генерацией мембранного потенциала.
Как видно на рис. 4.2, разница окислительно-восстановительных по-
тенциалов между субстратами и продуктами реакции в случае с комплек-
сом I равна -380 мВ, в случае с комплексом III -190 мВ, для комплекса IV
* Если пользоваться электротехнической терминологией, то можно сравнить работу
дыхательной цепи с функционированием понижающего трансформатора.
Глава 4. Дыхательная цепь
83
NADH (-320 мВ)
|гн+/ё
CoQ (+60 мВ)
|1Н*/ё
цитохром с (+250 мВ)
2Н+/ё
О2 (+820 мВ)
Рисунок 4.2. Схема переноса
электронов и генерации Дцн+
вдыхательной цепи митохон-
дрий высших животных
—570 мВ*. Принимая значение мембранного по-
тенциала равным приблизительно 200 мВ, легко
подсчитать, что комплексы I, III и IV при транс-
порте одного электрона могут соответственно пе-
реносить 2, 1 и 2—3 Н+. Экспериментальным пу-
тем было установлено, что комплекс I переносит
2 Н+/ё, комплекс III — 1 Н+/ё, а комплекс IV —
2 Н+/ё.
При сопоставлении потенциалов и стехиоме-
трии Н+/ё становится очевидным, что комплек-
сы 1 и III практически всю энергию перепада
окислительно-восстановительных потенциалов
запасают в виде Дцн+. В то же время перепад
энергии на последнем участке гораздо больше,
чем на предыдущих, а стехиометрия Н+/ё для ци-
тохромоксидазы такая же, как и в случае с ком-
плексом I (два Н+ на один ё). Таким образом, значительная часть энергии
на последней стадии рассеивается в виде тепла, и она, в отличие от реак-
ций, происходящих на остальных стадиях, имеет необратимый характер.
Благодаря большому энергетическому перепаду последняя стадия как бы
тянет за собой все сопряженные реакции дыхательной цепи, а с ними и весь
аэробный метаболизм клетки.
Как показано на рис. 4.3Л, последовательность реакций дыхатель-
ной цепи начинается окислением NADH. В процессе участвует несколько
редокс-центров NADH-CoQ-редуктазного комплекса: FMN и группа [Fe—S]
кластеров. NADH-CoQ-редуктаза восстанавливает CoQ. Полученный CoQH2
окисляется системой Q-цикла, включающей [Fe—S] кластер комплекса III
(Fe—Sni Риске), цитохром сх и два гема цитохрома b (высокопотенциальный
Ьн и низкопотенциальный bL). Непосредственным акцептором электронов
для CoQH2 служит Fe—Sin. От Fe—Sin электроны поступают на цитохром сх
и далее на цитохром с. Последний используется как восстановитель конеч-
ного фермента дыхательной цепи — цитохромоксидазы, имеющей в своем
составе два гема (а и а3) и три атома меди. Цитохромоксидаза восстанавли-
вает кислород до воды.
Процесс окисления NADH кислородом сопряжен с переносом 10 про-
тонов из митохондриального матрикса (у бактерий — из цитоплазмы) в
межмембранное пространство митохондрий (у грамотрипательных бакте-
рий — в периплазму, а у грамположительных — во внешнюю среду). Об-
разованный мембранный потенциал далее расходуется на синтез АТР при
помощи так называемого комплекса V (протонной ATP-синтазы) либо на
совершение некоторых других типов полезной работы.
* Важно отметить, что в тексте и на рис. 4.2 приведены значения стандартных
окислительно-восстановительных потенциалов (Ео'). В клетке из-за разницы в концентра-
циях соответствующих окисленной и восстановленной форм редокс-соединений значения
их окислительно-восстановительных потенциалов могут существенно отличаться от Ео'.
84
ЧАСТЬ II. Генераторы протонного потенциала
Комплекс I
“ -700-1
О Комплекс III
Комплекс IV
Q ч 0Q
и «о <?
Рисунок 4.3. А — митохондриальная дыхательная цепь. АН2 — субстрат дыхания, восстанавли-
вающий NAD+ Перенос электронов показан черными стрелками, а трансмембранный перенос
протонов — синими стрелками. Ингибиторы даны красным. Б — значения среднеточечных
потенциалов различных переносчиков электронов дыхательной цепи митохондрий
Глава 4. Дыхательная цепь
85
Описанное выше многокомпонентное
устройство дыхательной цепи, помимо обе-
спечения высокой стехиометрии Н+/О?5 име-
ет еще ряд дополнительных преимуществ.
Прежде всего это придает ей известную гиб-
кость в использовании субстратов с разными
окислительно-восстановительными потенциа-
лами. Восстановительные эквиваленты могут
поступать в дыхательную цепь на различных ее
уровнях в зависимости от редокс-потенциала
окисляемого субстрата. Если этот потенциал
оказывается меньше, равен или лишь немногим
больше —320 мВ (редокс-потенциал пары NADH/
NAD+), то в окислении такого субстрата может
участвовать вся дыхательная цепь. Именно так
окисляется большинство субстратов дыхания.
Если редокс-потенциал субстратов ОКИС- Рисунок 4.4. А.Л. Ленинджер
ления намного отрицательней такового пары
NADH/NAD+, то, как описано в предыдущей главе, в систему переноса
электронов может быть включен специальный механизм накопления энер-
гии еще до дыхательной цепи. Такого типа реакции относят к разряду про-
цессов трансформации энергии на уровне субстрата, или субстратного фос-
форилирования (см. выше, разд. 3.3).
Если редокс-потенциал субстрата значительно более положительный,
чем у пары NAD+/NADH, то восстановительные эквиваленты с такого суб-
’ -------а-кг / сукц, пир / ац.СоА -0,7
_______ФГА / ФГК -0,55
’°’5 “ _______формиат / СО2, Н2/ 2Н + -0,4
' -------NAD(P)H / NAD(P)+, Op О2 -0,3
-------MQH / MQ, RQH J RQ -0,06
m°’° ’ < ---^z-^сукц / фум, H S / S +0,03
* CoQH2/ CoQ +0,05 J 2
-------c2+/c3+ +0,25
*-------*------NH /NO "NO, /NO" +0,4
0,5- 2
_______Fe+/Fe3+ +0,77
3 HO / O, +0,82
2 2
HO/OH’+H+ +1,35
2
Рисунок 4.5. Шкала окислительно-восстановительных потенциалов различных соединений,
имеющих отношение к функционированию дыхательной цепи
86
ЧАСТЬ И. Генераторы протонного потенциала
страта переносятся на средний или конечный участок дыхательной цепи. Так
окисляется один из субстратов цикла Кребса — сукцинат (редокс-потенциал
+30 мВ), а также ацил-СоА — субстрат первой оксидоредукции в систе-
ме р-окисления жирных кислот. И сукцинат, и ацил-СоА-дегидрогеназы
подают электроны в дыхательную цепь, минуя комплекс I, т.е. переносят
электроны сразу на убихинон.
В очень редких случаях редокс-потенциал окисляемого субстрата бо-
лее положителен, чем даже у CoQ. Тогда восстановительные эквиваленты
входят в цепь на уровне цитохрома с, так что только цитохромоксидазный
Дцн+-генератор участвует в трансформации энергии. Примером может слу-
жить окисление аскорбиновой кислоты у животных или окисление мета-
нола, ионов Fe2+ или нитрита у различных бактерий. На рис. 4.5 приведе-
ны окислительно-восстановительные потенциалы некоторых компонентов,
имеющих отношение к дыхательной цепи (потенциалы полувосстановления
(Eq) представлены в вольтах и измерены при pH 7,0).
4.2. NADH-CoQ-редуктаза
Как было описано выше, NADH-CoQ-редуктаза (комплекс I) катали-
зирует перенос электронов с NADH на хинон, и эта реакция сопряжена с
транслокацией четырех протонов через мембрану. Данный ферментатив-
ный комплекс является начальным этапом работы дыхательной цепи. К со-
жалению, комплекс I — наименее изученный компонент этой цепи. Очень
сложное строение комплекса I (огромное количество субъединиц и редокс-
кофакторов), его чрезвычайная лабильность при выделении и отсутствие
данных с высоким разрешением о трехмерной структуре полного комплекса
крайне затрудняют изучение этого фермента.
4.2.1. Белковый состав комплекса I
По субъединичному составу комплекс I является наиболее сложным ком-
понентом дыхательной цепи. Сегодня считается, что у млекопитающих дан-
ный фермент состоит из 45 разных полипептидов, каждый из которых имеется
в одном экземпляре. Общая масса комплекса оказывается порядка 980 кДа.
Комплекс I из митохондрий низших эукариот, по-видимому, устроен
несколько проще. Но и он состоит не менее чем из 30 субъединиц (так, для
комплекса I дрожжей Yarrowia lipolytica на сегодняшний день идентифици-
ровано 37 субъединиц).
В то же время дыхательные цепи многих бактерий содержат комплекс I
(в этом случае используют также название NDH-1), состоящий всего из
14 субъединиц*. При этом такой упрощенный фермент с весом всего в
530 кДа успешно выполняет свою главную функцию: он переносит два
* У энтеробактерий NDH-1 состоит из 13 субъединиц, но не за счет отсутствия одного
из основных полипептидов, а за счет слияния генов двух субъединиц (пиоС и nuoD) в
один удлиненный ген (mwoCD).
Глава 4. Дыхательная цепь
87
Рисунок 4.6. Пространственная организация комплек-
са I из бактерии Escherichia coli (желтым цветом — пе-
риферический домен и синим — мембранный домен)
и комплекса I из митохондрий гриба Neurospora crassa
(голубая штриховка) [Guenebaut et al., 1998, J. Mol.
Biol., 276: 105-112]
МАТРИКС
5HM
МЕМБРАНА
МЕЖМЕМБРАННОЕ ПРОСТРАНСТВО
электрона с NADH на хинон, и этот процесс сопряжен с транслокацией 4-х
протонов через мембрану. Вот почему 14-субъединичный бактериальный
фермент считается минимальной формой комплекса I. Субъединицы бакте-
риального комплекса I весьма консервативны, поскольку их аналоги при-
сутствуют во всех известных на сегодняшний день Н+-транслоцирующих
\АВН:хинон-оксидоредуктазах. Далее для простоты изложения мы будем
рассматривать структуру и функции комплекса I в основном на примере
более простого бактериального фермента. При этом остается неясным сле-
дующий вопрос: если аналоги 14 основных (бактериальных) субъединиц
достаточны для функционирования комплекса I, то в чем же заключается
роль остальных субъединиц (их тридцать одна) митохондриального фер-
мента? Считается, что, скорее всего, они могут принимать какое-то участие
в процессе сборки комплекса I и регуляции его активности. Здесь уместно
отметить, что наличие дополнительных субъединиц характерно и для других
ферментов дыхательной цепи митохондрий, если сравнить с их бактериаль-
ными аналогами.
14 генов, кодирующих субъединицы комплекса I, в геномах большин-
ства прокариот объединены в один оперон. Данные гены чаще всего на-
зывают пио (от NADH: ubiquinone oxidoreductase) в алфавитном порядке
в соответствии с их последовательностью в опероне (эта последователь-
ность генов в иио-опероне является консервативной для разных бактерий).
Семь из этих белков (NuoA, Н, J, К, L, М, N) исключительно гидрофобны.
Они являются интегральными мембранными полипептидами и в сумме,
по-видимому, образуют 54 трансмембранные ос-спирали. Остальные семь
субъединиц относительно гидрофильны и крепятся к мембране в основном
за счет белок-белковых взаимодействий с гидрофобными субъединицами.
В случае с комплексом I эукариот аналоги семи гидрофобных бактериаль-
ных субъединиц кодируются в митохондриальном геноме и синтезируются
митохондриальными рибосомами. Остальные 37 субъединиц кодируются в
ядре, синтезируются в цитоплазме и оказываются в митохондриях лишь по-
сле транспортировки через две митохондриальные мембраны*.
* Хотелось бы отметить, что эта закономерность (т.е. то, что митохондриальный
геном содержит лишь гены наиболее гидрофобных субъединиц) характерна и для других
компонентов дыхательной цепи. По-видимому, транспорт столь гидрофобных полипепти-
дов через цитоплазму и внешнюю мембрану митохондрий крайне затруднен. Вот почему
соответствующие гены были оставлены в геноме митохондрий, а не перенесены вместе
подавляющим большинством генов других митохондриальных белков в ядро. Так можно
объяснить сохранение генома у этой уникальной органеллы
88
ЧАСТЬ II. Генераторы протонного потенциала
Как было сказано выше, на сегодняшний день еще не удалось провести
рентгеноструктурный анализ полного комплекса I и, следовательно, опре-
делить его трехмерную структуру с атомным разрешением. Однако общая
конфигурация этого комплекса была установлена с помощью электронной
микроскопии. Было показано, что комплекс I имеет L-образную форму
с двумя доменами, расположенными под прямым углом друг к другу (см.
рис. 4.6). Один из доменов расположен в мембране, а второй, перифери-
ческий домен выступает из нее в матрикс митохондрий (или цитоплазму
бактерий) приблизительно на 150 А. Именно в периферическом домене
расположено большинство редокс-центров фермента.
4.2.2. Кофакторный состав комплекса I
Уже на ранних этапах изучения комплекса I было установлено, что в
качестве редокс-кофакторов этот фермент содержит нековалентно связан-
ный FMN и ряд [Fe—S] кластеров. С помощью ЭПР-спектроскопии бы-
ло определено, что [Fe—S] кластеров в ферменте по крайней мере пять.
Два из них (Nla и Nib) являются кластерами [2Fe—2S] типа, а остальные
(N2, N3 и N4) — [4Fe—4S] типа. Однако при анализе аминокислотной по-
следовательности субъединиц комплекса I выяснилось, что этот фермент
теоретически может нести на себе до 8 [Fe—S] кластеров (см. табл. 4.1).
По-видимому, именно эта цифра соответствует действительности, но ЭПР-
сигналы от некоторых кластеров оказываются крайне уширенными из-за
сильных диполь-дипольных взаимодействий между собой и поэтому не мо-
гут быть идентифицированы с помощью ЭПР-спектроскопии (например, к
таким кластерам относятся два [4Fe—4S] центра N6a и N6b в субъединице
Nuol). Недавно методом рентгеноструктурного анализа гидрофильной ча-
сти комплекса было прямо продемонстрировано, что в состав комплекса I
входят 8 [Fe—S] кластеров (см. ниже, рис. 4.9). В комплексе I присутству-
ет также прочно связанный убихинон, который, по-видимому, тоже может
функционировать в качестве редокс-кофактора этого белка.
4.2.3. Субфрагменты комплекса I
При обработке хаотропными агентами комплекс I удается разделить на
три составные части (субфрагменты). Один из них, названный флавопро-
теином (FP), содержит две субъединицы этого белка и включает по крайней
мере два [Fe—S] кластера (Nla и N3), FMN, а также NADH-связывающий
участок. FP способен окислять NADH искусственными гидрофильными
акцепторами электронов (например, феррицианидом), но не природными
гидрофобными убихинонами.
Второй субфрагмент комплекса I, названный железопротеидом (IP),
несет в своем составе пять субъединиц и содержит несколько [Fe—S] кла-
стеров. Этот фрагмент полностью лишен ферментативных активностей.
В сумме FP и IP образуют периферический домен комплекса I.
Третий субфрагмент (гидрофобный субкомплекс, или HP) включает
семь субъединиц комплекса I и, так же как и IP, не проявляет фермента-
Глава 4. Дыхательная цепь
89
Таблица 4.1. Свойства 14 субъединиц бактериального комплекса 1
Субъединица Принадлежность к субкомплексам Молекулярный вес, кДа Связывание простетических групп
NuoA HP 19
NuoB IP 28 [4Fe—4S] (N2)
NuoC IP 25
NuoD IP 65
NuoE FP 18 [2Fe—2S] (Nla)
NuoF FP 45 NADH, FMN, [4Fe-4S] (N3)
NuoG HP 90 [4Fe-4S] (N4), [4Fe~4S] (N5), [2Fe-2S] (Nib)
NuoH HP 32
Nuol IP 23 [4Fe-4S] (N6a), [4Fe-4S] (N6b)
NuoJ IP 23
NuoK HP 10
NuoL HP 45
NuoM HP 40
NuoN HP 38
тивной активности. Важно отметить, что HP не содержит флавина и [Fe—S]
кластеров, и, таким образом, все известные редокс-кофакторы комплекса I
(за исключением хинона) расположены в периферическом домене этого
белка.
Разделение комплекса I на субфрагменты помимо задачи изучения то-
пологии этого фермента имеет также некоторое значение для понимания
эволюционного происхождения столь сложного белка. По-видимому, такой
исключительно большой и сложный ферментативный комплекс мог быть
сконструирован в ходе эволюции лишь за счет комбинирования и объеди-
нения в одно целое частей различных предсуществующих ферментов. При
сравнении первичных последовательностей субъединиц комплекса I с дру-
гими известными белками выяснилось, что основная часть субфрагмен-
та IP ведет свое происхождение от водорастворимой [Ni-FeJ-гидрогеназы,
катализирующей перенос электронов на ионы Н+ с образованием моле-
кулярного водорода. Мембранная часть комплекса I (HP) имеет сходство
с мультисубъединичным комплексом Мгр алкалофильных бацилл, пред-
положительно являющимся Ка+(К+)/Н+-антипортером. Объединение этих
двух ферментативных модулей, по-видимому, позволило создать белок, со-
прягающий перенос электронов от [Fe—S] кластеров на хинон с трансмем-
бранным транспортом протонов. Третья часть комплекса I — FP — играет
роль адаптера и обеспечивает субстратную специфичность этого фермента
по отношению к донору электронов. Интересно отметить, что у ряда про-
кариот есть ферменты, гомологичные комплексу I, которые, однако, вместо
субфрагмента FP содержат другие, негомологичные NuoE и NuoF субъе-
90
ЧАСТЬ II. Генераторы протонного потенциала
диницы. Такая замена привела к изменению субстратной специфичности.
Например, есть основания полагать, что у некоторых архей подобный фер-
ментативный комплекс окисляет не NADH, а особый кофактор — F42oH2;
у цианобактерий и хлоропластов — NADPH, а у бактерии Helicobacter pylori
(способной вызывать у человека язву желудка) — ферредоксин.
4.2.4. Ингибиторы комплекса I
На сегодняшний день описано огромное количество ингибиторов ком-
плекса I. Весь этот широкий спектр соединений можно разделить на две груп-
пы по месту их действия: практически все известные ингибиторы комплекса I
препятствуют взаимодействию фермента либо с NADH, либо с хиноном.
К наиболее известным ингибиторам NADH-дегидрогеназного участ-
ка фермента относятся реин и ADP-рибоза, а к ингибиторам хинон-
редуктазного участка — ротенон, пирицидин А, амитал, капсаицин и мно-
гие другие.
Места связывания ингибиторов хинон-редуктазного участка находятся
между железо-серным кластером N2 и CoQ. Прежде всего это структурные
аналоги CoQ, а также многие гидрофобные соединения, которые вытесня-
ют жирный изопреноидный «хвост» CoQ из участка его связывания в ком-
плексе I. Некоторые гидрофобные ингибиторы имитируют хиноновую «го-
ловку» CoQ. Одним из первых обнаруженных ингибиторов был амитал из
класса барбитуратов. Вскоре было установлено, что диапазон его эффектив-
ных концентраций находится в миллимолярной области и ингибиторный
эффект обусловлен неспецифическими гидрофобными взаимодействиями с
ферментом. Противоядием по отношению к амиталу является водораствори-
мый витамин К3, который способен шунтировать перенос восстановитель-
ных эквивалентов через участок фермента, чувствительный к барбитуратам.
Использование обходного пути ухудшает эффективность работы комплек-
са, однако позволяет избежать фатальных последствий при избытке барби-
Рисунок 4.7. Б. Чанс
туратов. Очень интересный опыт был поставлен
Б. Чансом и его коллегами, которые исследова-
ли митохондрии из мышц девочки, страдавшей
сильной мышечной слабостью. Ребенок не мог
передвигаться без инвалидной коляски. Сначала
Чанс проанализировал влияние физической на-
грузки на уровень креатинфосфата в мышцах.
Оказалось, что креатинфосфат быстро снижается
на фоне мышечной активности, а при отдыхе па-
тологически медленно восстанавливается. С точ-
ки зрения биоэнергетика, самым простым объ-
яснением такого эффекта могло быть понижение
скорости образования АТР в сравнении с нормой.
Для проверки этого предположения была сделана
биопсия мышц, выделены митохондрии миоци-
тов и проанализирована активность комплексов
дыхательной цепи. В результате было обнаружено
Глава 4. Дыхательная цепь
91
сильное ингибирование переноса электронов между I и III комплексами
дыхательной цепи. После введения витамина К3 (в смеси с аскорбиновой
кислотой) произошло чудесное исцеление пациентки: уже через час девочка
почувствовала возвращение сил и встала с инвалидной коляски. Хотя для
поддержания нормальной мышечной активности было необходимо возоб-
новлять инъекции витамина К3 через каждые шесть часов, девочка расста-
лась с инвалидной коляской, поступила в колледж и успешно закончила
его, вышла замуж и смогла прожить полноценную жизнь.
Самым популярным среди биоэнергетиков ингибитором комплекса I
можно считать ротенон, известный еще под названием «рыбий яд», по-
скольку это соединение использовали для того, чтобы избавиться от «сор-
ной» рыбы в водоеме, прежде чем заселить его промысловыми видами рыб.
Необходимо уточнить, что для прочих животных ротенон — такой же яд,
как и для рыб. Другим интересным примером ингибиторов комплекса I яв-
ляется капсаицин. Именно это соединение придает жгучий вкус красному
перцу. Капсаицин ингибирует комплекс I лишь при относительно высоких
концентрациях, однако к данному веществу чувствительны все известные
представители этого класса ферментов. Таким образом, капсаицин часто
используется для идентификации комплекса I в дыхательных цепях раз-
личных организмов. Важно отметить, что многие детергенты (в том числе
и широко используемые в быту) являются мощными ингибиторами ком-
плекса I и поэтому далеко небезопасны. Например, подобным действием
обладают додецилсульфат и Тритон Х-100.
4.2.5. Возможные механизмы генерации Дцн+ комплексом I
Прежде чем подойти к описанию возможных механизмов генерации
протонного потенциала комплексом I, остановимся вкратце на том, как
вообще окислительно-восстановительные реакции могут быть сопряжены с
транслокацией протонов через мембрану.
В электрон-транспортных цепях возможны два принципиально разных
способа генерации Дцн+. Первый из них основан на переносе через мембра-
ну восстановительных эквивалентов в форме электронов. При этом пере-
носчиками служат такие редокс-кофакторы и простетические группы, как
хлорофиллы, цитохромы, [Fe—S] кластеры, ионы меди, витамин К! и т.д.
Этот механизм был предложен П. Митчелом и получил название «Митчело-
вой петли». Как видно на рис. 4.8Л, в ходе функционирования такой петли
с внутренней стороны мембраны (в случае митохондрий — со стороны, об-
ращенной в матрикс) поглощается два протона, на внешней стороне мем-
браны выделяются два протона, а через всю толщу мембраны переносятся
два электрона в сторону матрикса митохондрий. Этот процесс эквивалентен
переносу двух ионов Н+ из матрикса во внешнюю среду, хотя нетрудно за-
метить, что в данном случае такого непосредственного трансмембранного
переноса протонов не происходит. Данный механизм с неизбежностью под-
разумевает стехиометрию Н+/ё при генерации Дцн+ равную 1. Именно по
такой схеме происходит образование протонного потенциала в описанных
92
ЧАСТЬ И. Генераторы протонного потенциала
Митчелова петля
© 2Н'
Межмембранное
пространство
АН;
2е
X
2е
у 2 6
АН;
2е
Матрикс
>0)
5 s
Протонная помпа
Межмембранное
пространство
Рисунок 4.8. Схема генерации транс-
мембранного протонного потенциала по
механизму Митчеловой петли (Л) или
протонной помпы (Б)
А + 2Н Матрикс В + 2Н ВН2
£
в главе II фотосинтетических электрон-
транспортных цепях.
Второй возможный механизм ге-
нерации Дцн+ был выдвинут С. Папой
(S. Papa) и, независимо от него, од-
ним из авторов этой книги (В.П.С.).
Он получил название «протонной
помпы». В данном случае энергия
окислительно-восстановительных ре-
акций должна быть сопряжена с кон-
формационными изменениями в белке
и изменением значений рК различ-
ных протон-акцепторных групп. За
счет этого происходит непосредствен-
ный трансмембранный перенос ионов
Н+ (рис. 4.85). Такой процесс уже не
должен иметь жесткой стехиометрии
Н+/ё = 1. Количество «помпирован-
ных» протонов теоретически может
быть различным. Более того, в данном
случае Н+ может быть заменен каким-
либо другим ионом, например ионом
натрия.
Попробуем теперь рассмотреть, ка-
ким образом генерируется протонный
потенциал в случае с комплексом I.
Сначала многие исследователи предполагали, что данный фермент может
функционировать по механизму Митчеловой петли. Высказывались гипоте-
зы, что FMN или хиноны этого белка переносят через мембрану атомы во-
дорода, а многочисленные [Fe—S] кластеры формируют трансмембранный
путь транспорта электронов. Однако существуют очень серьезные трудности
в реализации таких механизмов. Прежде всего напомним, что стехиометрия
Н+/ё для комплекса I равна 2, т.е. необходимо обеспечить функционирова-
ние сразу двух Митчеловых петель во время работы этого фермента. Более
того, как мы уже отмечали выше, оказалось, что практически все кофакто-
ры комплекса I (кроме хинонов) расположены в периферическом домене
этого фермента, т.е. вынесены на значительное расстояние из мембраны.
Поэтому они вряд ли способны осуществить трансмембранный перенос
атомов водорода или электронов.
Таким образом, наиболее вероятно, что комплекс I генерирует протон-
ный потенциал по механизму протонной помпы. Однако остается неясным,
каким образом протоны переносятся через мембрану и как их транспорт со-
пряжен с катализируемыми комплексом I редокс-реакциями. Можно лишь
предполагать, какие именно этапы переноса электронов в комплексе I мог-
ли быть сопряжены с транслокацией протонов. Для этого важно отметить,
что значения Ет' для FMN и большинства [Fe—S] кластеров находятся в
13,5(12,3) FMN
^10,9 (7,6)
N1a2w<r9,'4i- 14,2(11,0)
N3 ** N1b
13,9(10,7) & 24,2(20,5)N7
N5 Л12,2'(8,5)
|16,9 (14,0)
N6a 12,2(9,4)
N6b ^14,2(10,5)
N2
Рисунок 4.9. (Л) Трехмерная структура периферического домена комплекса I из Т. thermophilus.
Красно-оранжевым цветом указано расположение [Fe—S] кластеров. Стрелкой указан карман в
структуре белка, являющийся, по-видимому, местом связывания убихинона. (Б) Расположение
[Fe-S] кластеров в комплексе I из Т. thermophilus. Расстояние между центрами кластеров, а
также (в скобках) между их краями указано в ангстремах [Sazanov & Hinchliffe 2006, Science
311: 1430-1436]
диапазоне от —370 до —240 мВ, т.е. не очень отличаются от потенциала
пары NAD+/NADH. И лишь среднеточечный потенциал [Fe—S] кластера
N2 более положителен (в зависимости от объекта исследования от —20 до
-150 мВ).
Совсем недавно в группе Л. Сазанова методом рентгеноструктурного
анализа была определена трехмерная структура периферического домена
комплекса I из термофильной бактерии Thermus thermophilus (рис. 4.9Л).
В этой работе удалось надежно продемонстрировать количество [Fe—S] кла-
стеров и их взаимное расположение в белке (рис. 4.9Ь). Восемь основных
железо-серных кластеров* образуют в периферическом домене электрон-
проводящую цепь, вытянутую вдоль всего белкового комплекса. Место
связывания FMN расположено между кластерами Nla и N3. Приняв во
внимание эти данные, можно было бы предположить следующую последо-
вательность переноса электронов в этом белке.
Сначала NADH передает два электрона на FMN. Далее с FMNH2
дважды происходит перенос одного электрона по цепочке, построенной из
изопотенциальных [Fe—S] кластеров (N3, Nib, N5, N4, N6a и N6b). Здесь
* Комплекс I из Т. thermophilus по сравнению с другими гомологичными белками
этого семейства содержит дополнительный [4Fe—4S] кластер (N7). Однако этот кофактор
не является консервативным и, по-видимому, не принимает участия в переносе электро-
нов от NADH к хинону, а играет какую-то другую роль.
94
ЧАСТЬ II. Генераторы протонного потенциала
важно отметить роль флавина в процессе окисления NADH. Как извест-
но, NADH является переносчиком гидрид-иона (Н-), т.е. он может быть
донором двух (и только двух!) электронов. В то же время [Fe—S] кластер
обычно может принять на себя только один электрон. А вот особенностью
флавинов является то, что они могут выступать в качестве как двух-, так и
одноэлектронных переносчиков (в последнем случае с образованием фла-
восемихинонной формы). Таким образом, флавин в комплексе I (а также
и во многих других белках) выступает в роли адаптера между двух- и одно-
электронными редокс-кофакторами. На сегодняшний день еще непонятна
роль кластера Nla. По-видимому, этот кофактор не входит в электрон-
транспортную цепь, так как он расположен «выше» места связывания фла-
вина и имеет более отрицательный, чем флавин, редокс-потенциал. Кла-
стер Nla, скорее всего, необходим для временного окисления семихинона
FMN, если этот кофактор по каким-то причинам не может отдать второй
электрон в электрон-проводящий путь тотчас после первого электрона. Это
должно значительно уменьшить время жизни флавосемихинона и, стало
быть, скорость генерации активных форм кислорода комплексом I, так как
(1) флавосемихинон очень легко восстанавливает О2 до О*- и (2) FMN, на-
ходясь в NADH-связываюшем участке комплекса I, должен быть доступен
для такой маленькой молекулы, как О2.
Из-за того, что между NADH и изопотенциальной группой [Fe—S]
кластеров нет значительного перепада редокс-потенциалов, считается, что
перенос электронов от NADH до N6b не сопровождается генерацией Дцн..
А вот при переносе электрона от N6b на N2, а также от N2 на хинон вы-
свобождается достаточное количество энергии для трансмембранного пере-
носа протона. Вот почему полагают, что именно эти реакции могут быть
сопряжены с генерацией протонного потенциала. Важно отметить, что в
отличие от большинства других [Fe—S] кластеров среднеточечный потен-
циал кластера N2 является pH-зависимым (сдвигается на 60 мВ при изме-
нении значений pH на одну единицу). Это означает, что его восстановле-
ние сопровождается протонированием, а окисление — депротонированием
какого-то аминокислотного остатка. Если этот остаток находится внутри
трансмембранного протон-проводящего пути, то перенос электрона через
кластер N2 мог бы сопровождаться генерацией протонного потенциала.
4.3. СорН2-цитохром с-редуктаза
NADH-CoQ-Редуктаза восстанавливает CoQ, который в свою очередь
передает электроны на следующий сегмент дыхательной цепи, называе-
мый CoQH2-utumoxpoM с-редуктазой (комплекс Ьсь или комплекс III). Ком-
плекс III переносит электроны с хинола на цитохром с, и данная реакция
сопряжена с генерацией АЦН+ со стехиометрией, равной 1 Н+/ё.
Глава 4. Дыхательная цепь
4.3.1. Структурные аспекты Ьс^комплекса
В настоящее время удалось получить кристаллы Со9Н2-цитохром
с-редуктаз из митохондрий быка, курицы и дрожжей, а также определить
трехмерную структуру этого белка с разрешением в 2,3 А. Определение трех-
мерной структуры с хорошей степенью разрешения значительно упростило
изучение этого фермента, и, в отличие от описанного выше комплекса I,
нам уже, по-видимому, известны основные аспекты функционирования
bci-комплекса.
Полипептидный состав комплекса III из митохондрии сердца быка при-
веден в табл. 4.2. Комплекс III дыхательной цепи является гомодимерным
мультисубъединичным ферментом. Каждый из мономеров Ьс{-комплекса
содержит три каталитические субъединицы, несущие на себе четыре редокс-
центра: это низко- и высокопотенциальные гемы bL и Ьн, связанные с ци-
тохромом Ь; негемовый железосерный кластер [2Fe—2S] типа, включенный
в соответствующий апопротеин (FeSni, или белок Риске; другое название
«фактор Слейтера»); и гем С, присоединенный к апопротеину цитохрома сх.
Наряду с переносчиками восстановительных эквивалентов в состав
CoQH2-nnToxpoM с-редуктазы митохондрий входят еще восемь полипепти-
дов, лишенных простетических групп. Один из них (субъединица VI) связы-
вает CoQ. Он состоит из 110 аминокислотных остатков и содержит большое
количество (около 50%) а-спиральных участков. Существуют данные, что
субъединица X связывается с цитохромом и облегчает его взаимодействие
с цитохромом с. В этой субъединице 27% всех аминокислотных остатков со-
ставляют глутамат и глутамин, причем вблизи N-конца расположен кластер
из восьми следующих друг за другом остатков глутамата. По всей вероятно-
сти, именно этот отрицательно заряженный участок белка взаимодействует
с цитохромом с, который содержит много положительно заряженных ами-
нокислотных остатков. Самые крупные субъединицы I и II — так называе-
Таблица 4.2. Субъединицы комплекса Ьсх из митохондрий сердца быка
Субъединица Молекулярная масса, кДа Название Функция
I 49,5 Сердцевинный белок I Неизвестна
II 47,0 Сердцевинный белок II Неизвестна
III 44,0 Цитохром b Связывает гемы bL и Ьн
IV 28,0 ЦИТОХРОМ С) Связывает гем ct
V 21,5 Белок Риске Связывает [2Fe—2S] кластер
VI 13,5 Qin-белок Связывает CoQ
VII 9,5 — Неизвестна
VIII 9,0 — Неизвестна
IX 8,0 — Неизвестна
X 7,0 — Связывает цитохром с
XI 6,5 — Связывает белок Риске
96
ЧАСТЬ II. Генераторы протонного потенциала
мые сердцевинные белки (core proteins). Это неудачное название было при-
думано в те годы, когда еще ничего не было известно о пространственной
структуре комплекса III. Ошибочное представление об этих белках как о
центрах структурной организации Ьс{-комплекса подтверждалось, казалось
бы, тем, что они крупнее других субъединиц комплекса и в их составе нет
редокс-групп. Впоследствии оказалось, что эти белки занимают в ферменте
периферическое положение. Самая маленькая субъединица комплекса III
(XI) участвует в связывании белка Риске. Что касается других полипепти-
дов, не имеющих редокс-центров, их функции остаются неясными.
Лишь один белок из 11 полипептидов, входящих в состав Ьсх-комплекса
эукариот, а именно цитохром 6, кодируется в митохондриальном геноме.
Гены остальных белков находятся в клеточном ядре.
Интересно отметить, что дыхательная цепь многих бактерий также
содержит фермент, гомологичный Ьсх-комплексу эукариот. Однако как и
бактериальные Н+-транслоцирующие NADH:xинoн-oкcидopeдyктaзы, Ьсг
комплексы прокариот устроены значительно проще своих митохондриаль-
ных аналогов. Эти ферменты состоят всего лишь из трех полипептидов,
гомологичных трем каталитическим субъединицам митохондриального
комплекса III (цитохрому Ь, цитохрому сх и белку Риске).
Как было изложено ранее (см. разд. 2.3.3), в хлоропластах растений
функционирует очень близкий аналог Ьс{-комплекса — bj-комплекс. Он
принимает участие в работе фотосинтетической электрон-транспортной це-
пи, где его основная роль заключается в передаче электронов от фотосисте-
мы II на фотосистему I. По своей структуре и механизму функционирования
66/'-комплекс является практически полным аналогом митохондриального
комплекса III. Однако интересно отметить, что /^-комплекс содержит ряд
дополнительных кофакторов. Наиболее интересным отличием является то,
что в его состав входят не два, а три гема. Дополнительный гем, названный
ch расположен рядом с гемом Ьи. Его функции на сегодняшний день неиз-
вестны.
4.3.2. Рентгеноструктурный анализ III комплекса
На рис. 4.10 приведены результаты рентгеноструктурного анализа ком-
плекса III. Более узкая часть этого фермента пронизывает мембрану, а более
широкие его части выступают в матрикс митохондрий и в межмембранное
пространство. Центральный гидрофобный домен Ьс{-комплекса сформиро-
ван восемью трансмембранными а-спиралями цитохрома Ь. В трехмерном
пространстве а-спирали могут образовать «хоровод», в котором поблизости
оказываются трансмембранные участки с удаленными порядковыми номе-
рами. К примеру, оказалось, что соседом 2-го а-спирального столба явля-
ется 5-й (см. рис. 4.10), причем каждая из этих а-спиралей содержит пару
остатков гистидина. Данные остатки служат для перекрестного хелатирова-
ния двух гемов. Расстояние между атомами железа гемов bL и Ьн равно 21 А
(что составляет около половины от толщины мембраны). Существует и до-
полнительный способ крепления каждого гема к белку при помощи связи
Глава 4. Дыхательная цепь
97
МЕЖМЕМБРАННОЕ
ПРОСТРАНСТВО
МАТРИКС
Рисунок 4.10. Трехмерная структура дрожжевого комплекса 111. А — гомодимерный комплекс,
состоящий из каталитических субъединиц цитохрома b (голубой цвет), белка Риске (зеленый
цвет) и цитохрома q (желтый цвет) с соответствующими простетическими группами (черный
цвет), а также из восьми дополнительных субъединиц, шесть из которых показаны отдель-
ными цветами: сердцевинный белок 1 (фиолетовый), сердцевинный белок II (сине-зеленый),
субъединица VI (синий), VII (красный), VIII (розовый) и IX (серый). Б — каталитические
субъединицы одного мономера. QP и QN — места связывания хинона в комплексе III [Hunte et
al., 2003, FEBS Lett., 545: 39-46]
между карбоксильными группами пропионатных остатков гема и протони-
рованными аминогруппами лизиновых остатков полипептида.
Цитохром С\ и белок Риске связаны с мембраной за счет одиночных
трансмембранных спиралей, а их каталитические домены обращены в меж-
мембранное пространство митохондрий. При этом «сердцевинные белки»
находятся в широкой части фермента со стороны
матрикса митохондрий. Как уже было отмечено
выше, комплекс III является гомодимером. Рент-
геноструктурный анализ выявил удивительную
особенность такой пространственной организа-
ции. Оказалось, что [Fe—S] кластер белка Риске
прилегает к телу соседнего мономера и обслу-
живает именно его электрон-переносящие пути.
Выяснилось также, что каталитический домен
[Fe—S] белка обладает очень высокой подвижно-
стью. В зависимости от степени восстановленно-
сти /х^-комплекса он может занимать два разных
положения — либо рядом с гемом bL, либо ря-
дом с гемом сР Таким образом, [Fe—S] кластер
белка Риске мог бы функционировать в качестве
мобильного переносчика электронов между хи-
нолом и цитохромом Ср Эта уникальная особен-
Рисунок 4.11. Э.К. Слейтер
98
ЧАСТЬ И. Генераторы протонного потенциала
ность каталитического домена [Fe—S] белка понадобится нам далее при
описании механизма функционирования Ьсх -комплекса.
С помощью рентгеноструктурного анализа удалось также выявить два
места связывания CoQ в Ьс{-комплексе. Они получили название центров Р
и N, так как находятся на разных границах гидрофобного слоя мембраны
с ее положительно (positive) и отрицательно (negative) заряженных сторон
соответственно. Другое название — центры о (out) и i (in).
о уГем с.
54,7A t
/ Л 30,3 А
FeS
Рисунок 4.12. Расположение простетических групп в гомодимерной форме комплекса III.
Группы левого мономера обозначены (*)
На схеме (см. рис. 4.12) представлены расстояния между электрон-
транспортыми центрами комплекса III. Видно, что, исходя из расстояний,
кроме переноса электронов внутри определенного мономера возможен так-
же обмен электронами между мономерами внутри гомодимера.
4.3.3. Функциональная модель комплекса III
Схема функционирования митохондриальной СоРН2-цитохром с-ре-
дуктазы была приведена выше (см. рис. 4.3). Интересно отметить, что ме-
ханизм генерации протонного потенциала этим ферментом был предска-
зан П. Митчелом еще в 1975 г. В настоящее время эта элегантная схема
полностью подтверждена как разнообразными структурными данными, так
и многими биофизическими экспериментами. Еще раз напомним, что клю-
чевой постулат этой схемы, названной Q-циклом, состоит в том, что пути
каждого из двух электронов, уходящих с CoQH2, оказываются различными.
Сегодня это предположение твердо доказано. Установлено, что окисление
хинола происходит в центре Р, при этом два протона высвобождаются в
межмембранное пространство митохондрий. В ходе окисления хинола пер-
Глава 4. Дыхательная цепь
99
вый электрон переносится на [Fe—S] кластер белка Риске, а второй элек-
трон передается на низкопотенциальный гем Z>L цитохрома Ь. Дальнейшая
судьба этих электронов оказывается различной. Электрон с [Fe—S] кластера
переносится на цитохром сн далее — на цитохром с и цитохром с-оксидазу.
В то же время электрон с гема Ьх переносится на высокопотенциальный гем
йн и далее используется для восстановления молекулы хинона в центре N с
образованием семихинона. При окислении в центре Р второй молекулы хи-
нола еще два протона высвобождаются в межмембранное пространство ми-
тохондрий, образуется еще одна молекула восстановленного цитохрома с,
а убисемихинон в центре N восстанавливается до хинола. Для образования
хинола в ценре N два протона захватываются из матрикса митохондрий.
Образованный в центре N хинол отсоединяется от фермента и диффунди-
рует на другую сторону мембраны, чтобы снова окислиться в центре Р.
Перенос электрона от центра N к цитохрому с происходит вдоль мем-
браны, поэтому этот процесс не приводит к запасанию энергии. А вот пере-
нос электрона от центра Р к центру N является трансмембранным, что
ведет к генерации электрического потенциала. Таким образом, генерация
протонного потенциала комплексом III происходит с использованием ме-
ханизма Митчеловой петли.
Редокс-потенциалы переносчиков электронов, присутствующих в
CoQH2-nnTOxpoM с-редуктазе, хорошо согласуются со схемой 0-цикла. Для
гемов bL и Ьн они равны соответственно —40 и +40 мВ, для [Fe—S] кластера
+280, а для цитохромов сх и с — соответственно +220 и +250 мВ. Важно, что
редокс-потенциал гема Ьн заметно положительней, чем редокс-потенциал
гема bL, так что перенос электронов с bL на Ьн должен сопровождаться вы-
свобождением энергии. Эта энергия запасается в виде AH', поскольку ок-
сидоредукция bH^> bL направлена поперек мембраны. Перенос электронов
от [Fe—S] Риске к цитохрому сх и далее к с вдоль мембраны происходит без
существенных изменений редокс-потенциала и, следовательно, без выделе-
ния энергии.
Суммарная реакция реакция комплекса III может быть записана в сле-
дующем виде:
2CoQH2 + 2цит. с(ох) + CoQ + 2H+in ->
-> 2CoQ + 2цит. c(red) +CoQH2+ 4H+out + 2q. (4.1)
Или после сокращения:
CoQH2 + 2цит. с(ох) + 2H+in -> CoQ + 2цит. c(red) + 4H+out + 2q. (4.2)
Таким образом, перенос двух электронов с убихинола на цитохром с со-
провождается захватом двух протонов из матрикса митохондрий, выбросом
четырех протонов в межмембранное пространство и переносом двух заря-
дов (обозначено в уравнениях 4.1 и 4.2 как q) через всю толщину липидного
бислоя. В первом приближении данный процесс эквивалентен генерации
протонного потенциала со стехиометрией 1 Н+/ё. Небольшое отличие от
истинной стехиометрии 1 Н+/ё заключается в различном количестве прото-
нов, поглощенных из матрикса митохондрий и выделенных в межмембран-
100
ЧАСТЬ II. Генераторы протонного потенциала
ное пространство. Эта разница обусловлена тем, что цитохром с, в отличие
от убихинола, является переносчиком электронов, а не молекул водорода.
Как вы увидите далее, это расхождение в количестве протонов будет впо-
следствии «исправлено» при работе цитохромоксидазы.
Для функционирования Ьсх-комплекса важно, чтобы пути переноса двух
электронов при окислении хинола были разными. При перевосстановлении
гемов цитохрома b возможно, что и второй электрон из центра Р уйдет
на цитохром с, потому что этот процесс термодинамически более выгоден
по сравнению с восстановлением гема bL. По-видимому, описанная выше
мобильность каталитического домена белка Риске позволяет предотвратить
этот процесс, так как отошедший от центра Р FeS кластер уже просто сте-
рически не способен перенести также и второй электрон.
Свойства митохондриальной СоРН2-цитохром с-редуктазы во многом
сходны с таковыми гомологичных ферментных комплексов в фотосинте-
тических редокс-цепях хроматофоров пурпурных бактерий и тилакоидов
цианобактерий или хлоропластов. Показана даже взаимозаменяемость ком-
плексов Ьс{ митохондрий и хроматофоров. Комплекс Ьс{ из митохондрий
млекопитающего был реконструирован в протеолипосомах с комплексом
фотосинтетических реакционных центров из хроматофоров пурпурной бак-
терии Rhodobacter sphaeroides. Полученная «химера» катализировала цикли-
ческий фотоперенос электронов, сопряженный с транслокацией Н+ через
мембрану протеолипосомы.
Описана уникальная природная система, где одна и та же Р0Н2-цитохром
с-редуктаза участвует в темноте в дыхательной цепи, а на свету — в фото-
синтетической. Это мембрана тилакоидов цианобактерий. При освещении
пластохинон, комплекс b<f, цитохром с и пластоцианин обеспечивают связь
фотосистем 1 и 2. В темное время суток те же компоненты принимают
участие в дыхательной цепи между NADH-пластохинон-редуктазой и ци-
тохромоксидазой.
4.3.4. Ингибиторы комплекса III
Сегодня известно довольно большое количество ингибиторов ЬсГ
комплекса с различным механизмом действия, что значительно облегчило
процесс изучения этого фермента. Токсические антибиотики антимицин А
и поликруазин препятствуют связыванию хинона в центре N. Миксотиа-
зол и мупидин ингибируют окисление хинола в центре Р. По-видимому,
железо-серный кластер Риске как таковой является мишенью для ионов
Zn2+ и британского антилюизита (Р-меркаптопропанола). Стигмателлин бло-
кирует путь электронов от железо-серного кластера Риске к цитохрому с{.
4.4. Цитохром с-оксидаза
Цитохромоксидаза катализирует окисление цитохрома с молекулярным
кислородом. Эта реакция сопряжена с генерацией ДЦН+ со стехиометрией
2Н+/ё.
Глава 4. Дыхательная цепь
101
4.4.1. Цитохром с
Связующим звеном при передаче восстановительных эквивалентов от
III к IV комплексу служит цитохром с, который локализован в межмем-
бранном пространстве митохондрий. Этот водорастворимый белок с мо-
лекулярной массой 12 кДа состоит всего из 104 аминокислотных остатков.
Пространственная структура цитохрома с была установлена на основании
результатов рентгеноструктурного анализа с разрешением 1,5 А (рис. 4.13).
На протяжении многих лет казалось, что об этом переносчике электронов
известно все. Тем поразительнее было открытие, совершенное в середине
последнего десятилетия XX в. Оказалось, что цитохром с является одним из
«белков смерти», участвующих в самоубийстве клетки (апоптозе). Об этом
мы расскажем в одной из последних глав (глава XV), а сейчас уделим осо-
бое внимание канонической функции цитохрома с.
Большую роль в функционировании цитохрома с играют остатки His-18
и Met-80, которые являются аксиальными лигандами атома железа в геме и
своими координационными связями закрепляют
гем с двух разных сторон. Как у всех подобных
цитохромов, мезогем типа «С» ковалентно присо-
единен к сульфгидрильным группам цистеиновых
остатков белка (Cys-14 и Cys-17). Это отличает
цитохромы типа с от цитохромов других типов (а,
b, d, ои др.), где гемы связаны нековалентно. Вы-
сказывалось предположение, что прочная связь
гема С с апоцитохромами обусловлена тем, что
подавляющее большинство цитохромов с-типа
расположено на внешней стороне мембраны ми-
тохондрий или бактерии. Нековалентно связан-
ный гем мог бы диссоциировать и разбавиться
цитозолем (у митохондрий) или периплазмой, а
затем и внешней средой (у бактерий).
Пространственная структура цитохрома с на-
поминает варежку, удерживающую гем, который
доходит почти до поверхности белка. На концах
«варежки» находится венчик из положительно
заряженных аминокислотных остатков: Lys-13,
Lys-72, Lys-79 и Lys-86. Лизиновые остатки служат
для прикрепления цитохрома с к своим партне-
рам — цитохрому с, и цитохромокси лазе. К при-
меру, у цитохромоксидазы есть три отрицательно
заряженных аминокислоты, которые, подобно
магнитному замку, обеспечивают электростатиче-
ское притяжение цитохрома с и его фиксацию в
правильном положении. Окисление и восстанов-
ление цитохрома с не сопровождаются значитель-
ными изменениями его конформации.
Рисунок 4.13. Простран-
ственные структуры цитох-
ромов с из митохондрий
мышц тунца (Л) и бактерии
Paracoccus denitrificans (Я), а
также цитохрома с2 из бакте-
рии Rhodospirillum rubrum (Б).
Красным показан гем
102
ЧАСТЬ II. Генераторы протонного потенциала
Аминокислотная последовательность цитохрома с была установлена за-
долго до начала попыток его рентгеноструктурного анализа. Исключитель-
ная стабильность, небольшие размеры и относительная простота очистки
цитохрома с оказались предпосылками для быстрого накопления информа-
ции о структуре этого белка у разных организмов. Сопоставляя аминокис-
лотные последовательности цитохромов с, выделенных из разных источни-
ков, геносистематики начали строить свои первые эволюционные деревья.
Теперь известно, что у человека и шимпанзе первичная структура цитохрома
с одинакова. При сопоставлении с человеческим цитохромом с у макаки-
резуса обнаруживается одна аминокислотная замена, у лошади — 12 замен,
у курицы —13, у тунца — 21, у пшеницы — 35, а у гриба нейроспоры — 44.
4.4.2. Комплекс IV (цитохром с-оксидаза)
Цитохромоксидаза обладает молекулярной массой около 200 кДа. У эу-
кариот комплекс IV состоит из 13 прдипептидов. Первые три из них гидро-
фобны, кодируются митохондриальным геномом и считаются основными
каталитическими субъединицами фермента. Данные SDS-электрофореза
отчасти не совпадают с принятой нумерацией субъединиц: I (57 кДа), II
(26 кДа), III (30 кДа). Следует отметить, что цитохромоксидазы бактерий
обычно состоят всего из трех субъединиц, гомологичных трем гидрофоб-
ным субъединицам комплекса IV эукариот. Остальные субъединицы цитох-
ромоксидазы эукариот невелики: их молекулярные массы варьируют от 17
до 5 кДа.
Цитохромоксидаза митохондрий содержит четыре редокс-кофактора:
два гема A-типа (а и а3) и два редокс-центра, содержащих атомы меди (СиА
и Сив). В дополнение к ним комплекс IV включает также несколько редокс-
инертных ионов металлов — Mg2+, Zn2+, а в ряде случаев также еще и Са2+
или Na+. Функции этих ионов в составе оксидазы пока неизвестны. Все
редокс-кофакторы цитохромоксидазы локализованы на субъединицах I и II.
СиА находится на субъединице II, на этой субъединице расположено также
место связывания цитохрома с (на второй субъединице есть упомянутое
выше кольцо из отрицательно заряженных аминокислот: это Asp-136, Asp-
187 и Glu-227; все они участвуют в присоединении цитохрома с к комплек-
су IV). Субъединица I содержит остальные редокс-центры фермента: гем а,
гем а3, а также Сив. Гем а3 и медь Сив в цитохромоксидазе расположены
очень близко друг к другу (на расстоянии в 4,5 А между атомами металлов),
образуя так называемый гем-медный биядерный центр. Этот центр служит
местом связывания молекулы О2 и ее восстановления. Третья каталитиче-
ская субъединица не несет редокс-кофакторов, и ее функции на настоящий
день неизвестны. Более того, в случае с бактерией Р. denitrificans потеря
субъединицы III при выделении цитохромоксидазы, по-видимому, не ска-
зывается на функциональных свойствах этого белка.
Рассмотрим редокс-кофакторы цитохромоксидазы подробнее. Центр
Сив представляет собой ион меди, присоединенный к белку координаци-
Глава 4. Дыхательная цепь
103
онными связями с тремя остатками гистидина (через атомы азота имида-
зольного кольца). Этот ион может находиться в двух состояниях валентно-
сти: + 1 и +2. Таким образом, Сив функционирует в качестве переносчика
одного электрона. Центр СиА состоит из двух атомов меди, расположенных
очень близко друг к другу. Однако центр СиА, так же как и Сив, является
переносчиком только одного электрона (Cu2+Cu1+ <-> Cu2+Cu2+).
Кроме атомов меди цитохромоксидаза митохондрий содержит два ге-
ма: а и а3. Прежде чем перейти к описанию этих кофакторов, остановимся
вкратце на общих свойствах гемов. Ионы железа в комплексных соединени-
ях (к каким относятся и гемы) могут образовывать шесть координационных
связей с лигандами. В цитохромах четыре координационные связи с желе-
зом обеспечиваются 4 атомами азота порфиринового кольца (см. приложе-
ние 2), и эти связи располагаются в плоскости данного кольца. Две остав-
шиеся связи предоставляются, как правило, аминокислотными остатками
белка (чаще всего в такой роли выступает гистидин, реже — метионин).
Такие лиганды называют аксиальными, и их связи с железом находятся
по разные стороны порфиринового кольца и перпендикулярны ему. Гемы,
где у железа реализованы все шесть координационных связей, называются
низкоспиновыми (так как они имеют равновесную электронную конфигура-
цию, соответствующую нижнему энергетическому уровню с минимальным
спином s = ‘/2)- Такие гемы обычно функционируют в роли простых пере-
носчиков электрона, к ним относятся все описанные в предыдущих главах
цитохромы, а также гем а цитохромоксидазы. В то же время у некоторых
гемов, например у гема я3, один из аксиальных лигандов отсутствует. Та-
кие гемы имеют спин s=5/2 и называются высокоспиновыми. Если в среде
присутствуют небольшие нуклеофильные соединения (например, О2, NO,
СО, H2S, CN- и т.п.), то они могут связаться с высокоспиновым гемом,
выступая в качестве его второго аксиального лиганда. В случае с кислоро-
дом такая связь может сопровождаться переносом электрона от гема к О2,
и, таким образом, будет осуществляться кислород-редуктазная активность.
Итак, высокоспиновые гемы могут функционировать не только как пере-
носчики электрона, но и как место связывания небольших лигандов (на-
пример, кислорода в миоглобине и гемоглобине или NO в гуанилатциклазе)
либо как место их восстановления (например, восстановление кислорода в
цитохромоксидазе или NO в NO-редуктазе).
4.4.3. Рентгеноструктурный анализ комплекса IV
Рентгеноструктурный анализ кристаллов цитохромоксидазы был прове-
ден параллельно двумя группами исследователей: в Японии (в группе С. Йо-
шикавы) на комплексе IV из сердца быка и в Германии (под руководством
нобелевского лауреата X. Михеля) на ферменте из бактерии Р. denitrificans.
В результате этих исследований была определена трехмерная структура ци-
тохромоксидазы с высоким разрешением (на настоящий момент — 2,3 А).
Важно отметить, что в случае с ферментами из эу- и прокариот структура
104
ЧАСТЬ II. Генераторы протонного потенциала
Рисунок 4.14. Структура двух основных
субъединиц цитохром с-оксидазы из Р.
denitrificans. Субъединица I показана зеленым
цветом, субъединица II — фиолетовым, гем
а — красным, гем а3 — черным; атомы меди
представлены в виде светло-синих сфер,
атомы железа — розовых сфер, а молекулы
воды — темно-синих мелких сфер [Oster-
meieretal., 1997 PNAS, 94: 10547-10553]
Рисунок 4.15. Схема строения К- и D-кана-
лов в бычьей цитохром с-оксидазе. Мелкие
светло-синие сферы — молекулы воды
основных каталитических субъединиц
оказалась практически идентичной. Как
видно на рис. 4.14, цитохромоксидаза
почти полностью погружена в мембра-
ну и в поперечном сечении напоминает
собой трапецию. Единственной частью
белка, вынесенной из толщи мембра-
ны (в межмембранное пространство),
оказывается медь-связывающий домен
субъединицы II. Этот домен несет на
себе центр СиА и закреплен в мембра-
не за счет гарпуноподобной структуры,
состоящей из двух гидрофобных транс-
мембранных а-спиралей. Субъедини-
ца I образует 12 трансмембранных спи-
ралей, а субъединица III — семь. Как
было сказано выше, субъединица 1 не-
сет на себе три кофактора — гемы л,
а3 и медь Сив. Как видно на рис. 4.14
и рис. 4.15, эти центры расположены
примерно на одной линии, параллель-
ной плоскости мембраны (сами гемы
перпендикулярны мембране), находясь
ближе к ее внешней поверхности (на
расстоянии 15 А от этой поверхности).
Рентгеноструктурный анализ выявил
любопытную особенность строения
биядерного центра цитохромоксидазы.
Оказалось, что один из остатков ги-
стидина, служащих лигандами меди
CuB (His-240), образует ковалентную
связь с фенольной группой близле-
жащего остатка тирозина (Туг-244).
Впоследствии выяснилось, что данная
ковалентная связь образуется авто-
каталитически при работе фермента.
Такой тип посттрансляционной мо-
дификации белка крайне необычен и
найден пока только в оксидазах.
Анализ трехмерной структуры
комплекса IV позволил также выявить
два возможных канала для транспорта
протонов из матрикса митохондрий к
биядерному центру (см. рис. 4.15). Эти
пути состоят из консервативных остат-
Глава 4. Дыхательная цепь
105
ков полярных аминокислот и прочно связанных молекул воды. По назва-
ниям аминокислот, расположенных во входной части этих путей, они были
названы К- и D-каналами (соответственно остатки Lys-354 и Asp-124). В то
же время трехмерная структура не позволяет четко выявить пути переноса
протонов от биядерного центра к межмембранному пространству. Однако
эта часть белка не столь гидрофобна, расстояние от биядерного центра до
внешней поверхности мембраны составляет всего 15 А, и, возможно, для
переноса протона здесь нет необходимости в организации специального
канала.
4.4.3. Путь переноса электронов
в комплексе IV
На схеме (4.3) представлена последовательность переноса электрона в
цитохромоксидазе. Вначале электрон от цитохрома с переходит на двумед-
ный центр Си^. Впоследствии электрон переносится от Си^ к гему а и далее
к биядерному гем-медному центру [б73-Си5)], на котором происходит вос-
становление О2:
Цитохром с-э Сил -> гем а [гем ^3 Сид] —°2-—4--—> 2Н2О. (4.3)
Однако такая простая схема (4.3) недостаточна для описания процесса
переноса электронов в цитохромоксидазе. Напомним, что для восстановле-
ния молекулы О2 до воды необходимы четыре электрона, тогда как цитох-
ром с является переносчиком лишь одного ~ё. Значит, требуется специаль-
ный механизм для накопления электронов на оксидазе и восстановления
О2 без образования свободных радикалов. Посмотрим, каким образом это
происходит (см. рис. 4.16).
I. Окисление первой молекулы цитохрома с приводит к переносу элек-
трона с него на Си^ и далее к перераспределению электрона между центра-
ми а, а3 и Сив. При этом фермент переходит из окисленной формы (О) в
1-электронно-восстановленную форму (Е). Эта форма (Е) еще не способ-
на связать кислород. Точная локализация первого электрона на ферменте
еще неизвестна; мы для простоты изложения будем считать, что биядерный
центр фермента находится при этом в состоянии (Fe3+ Cu1+).
II. Окисление второй молекулы цитохрома с запускает целую последо-
вательность событий:
1) оба электрона (с цитохрома с и с гема а) могут перейти на биядерный
центр и восстановить его (состояние биядерного центра Fe2+ Cu1+, данная
форма фермента получила название R).
2) Перенос двух электронов на биядерный центр приводит к тому, что
он получает способность связать кислород. Таким образом форма R пере-
ходит в форму А (состояние биядерного центра Fe2+—О2 Си1+).
3) Связывание кислорода сопровождается переносом на него электро-
нов с цитохромоксидазы. Вначале предполагали, что на этой стадии проис-
ходит двухэлектронное восстановление О2 с образованием перекисного мо-
106
ЧАСТЬ II. Генераторы протонного потенциала
2Н++ё
[Fe4=O Си2+], У F
Н2О
[Fe3+Cu2+], У •
о<.
Н2О
2Н++ё
[Fe4=O 'OH-Cu
Е lFe3+Cu1+I,y
R [Fe+Cu1+1,У
[Fe"-O2 Си1*], У °2
Рисунок 4.16. Схема процесса восстановления молекулярного кислорода в биядерном центре
цитохром с-оксидазы. Y — предположительно тирозин-244 субъединицы 1
стика между атомами железа и меди биядерного центра (Fe3+—О—О—Си2+).
Эта форма получила название перекисной, или формы Р. Однако впослед-
ствии выяснилось, что уже на этой стадии происходит четырехэлектронное
восстановление кислорода (хотя все равно за этой формой в силу истори-
ческих причин закрепилось название Р). Конечно же, возникает вопрос,
каким образом может осуществиться четырехэлектронное восстановление
О2, когда на ферменте до этого было всего 2 электрона? Оказалось, что
один дополнительный электрон берется с железа гема а3, при этом оно
переходит в очень необычное феррильное состояние Fe4+. Второй дополни-
тельный электрон (и, по-видимому, протон) поступает с остатка какой-то
близрасположенной ароматической аминокислоты с образованием из не-
го соответствующей радикальной формы (V)*. Кроме того, поглощается
один ион Н+, а медь оказывается связанной с анионом гидроксила. Таким
образом, на сегодняшний день считается, что форма Р цитохромоксидазы
представляет собой следующее состояние: Y’ Fe4+=O -HO-Cu2+. Следует от-
метить, что редокс-потенциалы пар Y*/Y и Fe4+/Fe3+ крайне высоки (> +0,7
В).
Итак, восстановление кислорода до воды происходит уже на этой ста-
дии. В дальнейшем нужно лишь вернуть фермент в исходное состояние, что
и происходит при окислении следующих двух молекул цитохрома с.
III. При окислении третьей молекулы цитохрома с электрон с него пе-
реносится на радикал, а также происходит захват еще одного протона из
водной фазы. При этом происходит образование феррильной (F) формы
фермента (Fe4+ = О Си2+) и первой молекулы Н2О.
* Считается, что радикальная форма V образуется из остатка Туг-244. Образование
такого необычного и крайне реакционно-способного радикала, по-видимому, и приво-
дит к формированию описанной выше ковалентной связи между Туг-244 и близлежащим
His-240. Данная ковалентная связь, возможно, впоследствии позволяет стабилизировать
радикальную форму и избежать дальнейшего повреждения белка.
Глава 4. Дыхательная цепь
107
IV. Окисление четвертой молекулы цитохрома с приводит к образова-
нию второй молекулы Н2О и регенерации исходной окисленной (О) формы
фермента (Fe3+ Cu2+), т.е. замыкается каталитический цикл цитохромокси-
дазы.
4.4.4. Механизм генерации Дцн+ цитохром с-оксидазой
Как уже было сказано выше, цитохромоксидаза генерирует Д|1Н+ со сте-
хиометрией 2 Н+/ё. При описании предыдущих компонентов дыхательной
цепи мы постулировали существование двух принципиально разных меха-
низмов генерации протонного потенциала — Митчеловой петли и протон-
ной помпы. При функционировании цитохромоксидазы реализуются сразу
оба эти механизма.
1) Митчелова петля
Транспорт электронов от цитохрома с на биядерный центр сопрово-
ждается переносом отрицательного заряда (электрона) от межмембранного
пространства вглубь мембраны на расстояние порядка */3 ее толщины (см.
рис. 4.14). В то же время для восстановления кислорода до воды необходимы
протоны. Для обеспечения этого процесса происходит транспорт протонов
через К- или D-каналы, т.е. перенос положительных зарядов от матрикса к
биядерному центру. В сумме двух этих процессов
осуществляется генерация Дцн+ со стехиометрией
1 Н+/ё.
2) Протонная помпа
Еще в 1977 г. М. Викстремом было показа-
но, что окисление цитохрома с комплексом IV
сопровождается закислением межмембранного
пространства митохондрий, чего не должно быть
в случае с Митчеловой петлей. Таким образом,
было продемонстрировано, что в дополнение к
механизму петли цитохромоксидаза генерирует
Дцн+ еще и как протонная помпа с суммарной
эффективностью этого процесса, равной 2 Н+/ё.
Несмотря на значительный прогресс в изуче-
нии данного явления, механизм «помпирования»
протонов цитохромоксидазой еще неизвестен.
На сегодняшний день существует несколько ин- Рисунок 4 ,7 м Викстрём
тересных теоретических моделей этого процес-
са. Однако их изложение выходит за рамки данной книги. Здесь мы лишь
вкратце расскажем о том, каким образом помпирование протонов связано с
протеканием каталитического цикла цитохромоксидазы.
При рассмотрении энергетики каталитического цикла цитохромокси-
дазы выяснилось, что реакции О—>Е и Е—>R характеризуются небольшим
изменением свободной энергии. Этой энергии едва хватает для генерации
Д\|/ при переносе электрона от Си^ до а3. А вот переходы Р—>F и F—>О
108
ЧАСТЬ II. Генераторы протонного потенциала
(восстановление таких крайне высокопотенциальных соединений, как Y*
и Fe4+) сопровождается большим выделением энергии. Поэтому первона-
чально предполагалось, что переходы О—>Е и Е—>R не сопряжены с пом-
пированием протонов, а вот при реакциях Р—>F и F—>О происходит транс-
мембранный перенос Н+ с удвоенной стехиометрией. Однако впоследствии
выяснилось, что перенос каждого из четырех электронов от цитохрома с на
цитохромоксидазу сопряжен с помпированием одного протона. Понимание
механизма этих реакций требует дальнейших исследований.
4.5. Ингибиторы цитохромоксидазы
Как уже было упомянуто выше, высокоспиновые гемы могут связывать
небольшие нуклеофильные соединения, такие, как СО, NO, CN“, H2S, N3“.
Присоединение этих лигандов переводит высокоспиновый гем в низкоспи-
новое состояние и препятствует его взаимодействию с таким относительно
слабым лигандом, как О2. Поэтому все эти соединения являются мощны-
ми ингибиторами цитохромоксидазы. Важно отметить, что многие из таких
ингибиторов, появляясь во внешней среде, действуют как сильные отрав-
ляющие вещества.
ГЛАВА ПЯТАЯ
СТРОЕНИЕ ДЫХАТЕЛЬНЫХ ЦЕПЕЙ ПРОКАРИОТ,
А ТАКЖЕ МИТОХОНДРИЙ ПРОСТЕЙШИХ,
РАСТЕНИЙ И ГРИБОВ
В предыдущей главе мы рассмотрели строение дыхательной цепи мито-
хондрий высших животных. Эта цепь характеризуется довольно высокой
эффективностью запасания энергии (высоким значением коэффициента
Н+/О2), а также тем, что путь переноса электронов от NADH к кислороду
носит линейный характер. В то же время строение дыхательных цепей бак-
терий и архей, а также митохондрий простейших, растений и грибов имеет
ряд существенных отличий от электрон-транспортной цепи митохондрий
животных. К основным отличительным особенностям этих цепей можно
отнести следующие:
1) Каждый из трех участков дыхательной цепи может осуществляться
не одним ферментом (соответственно комплексами 1, III и IV), как в слу-
чае митохондрий животных, а несколькими альтернативными ферментами
с различными функциональными свойствами.
2) Некоторые участки дыхательной цепи могут быть «шунтированы» за
счет транспорта электронов через альтернативные ферменты с понижен-
ным коэффициентом Н+/ё или вовсе без сопряжения с трансмембранным
переносом протонов.
3) Некоторые ферменты дыхательных цепей бактерий используют ион
натрия вместо протона в качестве первичного сопрягающего иона (на этой
особенности бактерий мы остановимся более подробно в главах XII—XIV).
4) Бактерии также способны использовать значительно более широкий
набор соединений как в качестве доноров, так и акцепторов электронов
для дыхательной цепи. Например, многие микроорганизмы, помимо кис-
лорода, могут также восстанавливать такие вещества, как NO3“, NO2, NO,
N2O, различные органические S-оксиды и N-оксиды, фумарат и т.п. Наряду
с NADH, сукцинатом, жирными кислотами и глицерофосфатом бактери-
альные дыхательные цепи могут непосредственно окислять молекулярный
водород, формиат, малат, лактат, глюкозу, некоторые аминокислоты, Fe2+,
NO2", S2O32" и т.п.
5) Состав дыхательной цепи может варьироваться в зависимости от
условий роста, а в случае с многоклеточными организмами он может быть
также и тканеспецифичным.
Эти различия, по-видимому, связаны с разными условиями функцио-
нирования дыхательной цепи митохондрий животных по сравнению с ды-
110
ЧАСТЬ II. Генераторы протонного потенциала
хательными цепями бактерий и митохондрий простейших, грибов и рас-
тений. Митохондрии животных функционируют при постоянных условиях
внешней для них среды, т.е. цитозоля этих клеток. В то же время условия
функционирования митохондрий простейших, растений и одноклеточных
грибов и в особенности условия роста бактерий могут претерпевать зна-
чительные изменения за относительно короткие промежутки времени. Вот
почему строение дыхательных цепей этих организмов имеет более сложный
характер и может значительно изменяться в зависимости от внешних усло-
вий. Такого рода электрон-транспортные цепи обычно отличаются мень-
шей эффективностью запасания энергии (меньшим значением коэффици-
ента Н+/О2) по сравнению с дыхательной цепью митохондрий животных.
По-видимому, основным фактором отбора при эволюции этих электрон-
транспортных цепей была не эффективность запасания энергии (как у ми-
тохондрий животных), а надежность работы и способность адаптироваться
к меняющимся в неблагоприятную сторону условиям внешней среды.
5.1. Дыхательная цепь митохондрий простейших,
растений и грибов
Электрон-транспортные цепи митохондрий этих организмов содержат
все те же ферментативные комплексы, которые функционируют в митохон-
дриях животных, т.е. NADH-CoQ-редуктазу, СоОН2-цитохром с-редуктазу и
цитохром с-оксидазу. Комплексы I, III и IV митохондрий простейших, рас-
тений и грибов демонстрируют высокое сходство со своими гомологами из
митохондрий животных, отличаясь от них лишь несколько иным набором
пиерицидин МЕЖМЕМБРАННОЕ ПРОСТРАНСТВО
4Н+
2Н+
Ротенон
Амитал
4Н
NADH NAD
Са;
NDex
2CoQ
2Н
CoQ
bL
NDjn
4H+ 2H
2H+ 2H
NADH
2H+
NAD*
2Си
Миксотиазол ® ?3 Си
CoQ
CoQH
Г* Анти-
. мицинA
2e
CoQH.
Тндм,ИН
FeS,N2
FeS,N6b
FeS,N6a
FeS,N5
FeS,N4
FeS,N1b
FjeS,N3r
2e
Рейн
У он
NADH
FMH
CoQ
CoQH.
CoQ
2H
2H
АН
т
Азиды
KCN
СО
2H
МАТРИКС
Рисунок 5.1. Схема строения дыхательной цепи митохондрий простейших, растений и грибов
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 111
дополнительных субъединиц. В то же время митохондрии этих организмов
содержат ряд ферментов, отсутствующих в митохондриях животных. Схема
строения дыхательной цепи митохондрий простейших, растений и грибов
представлена на рис. 5.1. Как видно, NADH матрикса этих митохондрий
может окисляться не только комплексом I, но и дополнительным альтер-
нативным ферментом — NDin. Этот периферический мембранный белок
устроен значительно проще комплекса I. Он состоит только из одного по-
липептида (с молекулярной массой 40—50 кДа) и содержит всего один ко-
фактор (FAD). Ферментативная активность NDin, в отличие от комплекса 1,
не сопряжена с транслокацией протонов через мембрану, т.е. вся энергия
NADH:y6HXHHOH-oKcwiopeflyKTa3Hoft реакции при работе NDin теряется в
виде тепла.
Митохондрии животных не способны к прямому окислению цито-
плазматического NADH. Для осуществления этого процесса они исполь-
зуют различные челночные схемы (они будут подробно описаны далее в
разд. 11.1). В то же время митохондрии простейших, растений и грибов в
присутствии ионов Са2+ окисляют внемитохондриальный NADH (а ино-
гда и NADPH) с довольно высокими скоростями. Данный процесс осу-
ществляется за счет функционирования в этих митохондриях еще одной
NADH:yбиxинoн-oкcидopeдyктaзы — NDex. Этот фермент по первичной
последовательности и основным свойствам похож на NDin. Однако в его
аминокислотной последовательности содержится другой адрес, направляю-
щий этот белок не в матрикс, а в межмембранное пространство митохон-
дрий. Таким образом, NDex прикреплен не к внутренней, а к внешней по-
верхности внутренней митохондриальной мембраны и поэтому окисляет не
внутримитохондриальный, а цитоплазматический NADH. Как и в случае
NDin, активность NDex не сопряжена с генерацией Дцн+. В отличие от NDin,
первичная последовательность NDex содержит участки, ответственные за
связывание ионов Са2+.
Таким образом, в дыхательной цепи митохондрий простейших, расте-
ний и грибов первый пункт сопряжения может быть шунтирован за счет
работы двух несопряженных ферментов — NDin и NDex.
В ранних исследованиях митохондрий растений было установлено, что
эти органеллы, в отличие от митохондрий животных, могут осуществлять
цианид-устойчивое потребление кислорода. Позднее выяснилось, что дан-
ная активность связана с присутствием в митохондриях простейших, рас-
тений и грибов особого фермента — альтернативной цианрезистентной
терминальной оксидазы (АОХ)*. Этот белок состоит всего из одного поли-
пептида с молекулярной массой около 40 кДа. Как и NDin, альтернативная
оксидаза является периферическим мембранным белком (т.е. не содержит
трансмембранных а-спиралей) и прикреплена к внутренней стороне вну-
тренней мембраны митохондрий. Гены, кодирующие все альтернативные
* Недавно альтернативная терминальная оксидаза была обнаружена у некоторых
круглых и кольчатых червей, у моллюсков и даже у низших хордовых, т.е. АОХ, по-
видимому, может функционировать и в митохондриях отдельных представителей царства
животных.
112
ЧАСТЬ II. Генераторы протонного потенциала
ферменты дыхательной цепи митохондрий (АОХ, NDin и NDex), расположе-
ны в ядерном геноме.
Первичная последовательность АОХ имеет сходство с последователь-
ностями различных монооксигеназ, и, как и эти ферменты, альтернативная
оксидаза содержит лишь два атома негемового железа в качестве редокс-
кофакторов. Эти атомы образуют биядерный центр (наподобие гем-медного
биядерного центра комплекса IV), который, по-видимому, и является ме-
стом восстановления О2. АОХ отличается от комплекса IV целым рядом
других важных особенностей. Так, донором электронов для альтернатив-
ной оксидазы является не цитохром с, а непосредственно убихинол (т.е.
АОХ является не цитохром с-оксидазой, а хинолоксидазой). Далее, работа
альтернативной оксидазы не сопряжена с трансмембранной транслокацией
протонов. Таким образом, как и в случае NDin и NDex, вся энергия ката-
лизируемой АОХ реакции выделяется в виде тепла. Следовательно, функ-
ционирование АОХ приводит к шунтированию второго и третьего пунктов
сопряжения дыхательной цепи.
Важно отметить, что активность альтернативной оксидазы находится
под контролем целого ряда параметров клеточного метаболизма. Прежде
всего высокая активность АОХ растений наблюдается лишь в присутствии
различных а-кетокислот, таких, как пируват или а-кетоглутарат. Кроме
того, активность АОХ в значительной степени зависит от уровня восста-
новленное™ CoQ. В отличие от Ьс}-комплекса, активность альтернативной
оксидазы наблюдается лишь при очень высоком соотношении CoQH2/CoQ.
Таким образом, при работе АОХ используется лишь избыток убихинола,
который в силу каких-либо обстоятельств не может быть окислен за счет
активности «канонической» дыхательной цепи.
Итак, митохондрии простейших, растений и грибов наряду с обычной
«сопряженной» дыхательной цепью (аналогичной дыхательной цепи ми-
тохондрий животных) содержат альтернативную, полностью не сопряжен-
ную электрон-транспортную цепь, пересекающуюся с «канонической» це-
пью лишь на уровне убихинона. В чем же состоит физиологический смысл
функционирования альтернативной дыхательной цепи, ведь ее активность
не приводит к запасанию энергии, а лишь к ее рассеиванию в виде тепла?
Одна из возможностей состоит в том, что такая несопряженная цепь ис-
пользуется для теплопродукции (например, в соцветиях термогенных рас-
тений, о чем пойдет речь далее при описании механизмов термогенеза).
Однако альтернативная дыхательная цепь присутствует не только в термо-
генных, но и в других растениях, а также у многих простейших и грибов.
Важно отметить, что отсутствие трансмембранной транслокации протонов
позволяет несопряженным ферментам избежать лимитирования скорости
переноса электронов генерируемым протонным потенциалом, т.е. эффекта
дыхательного контроля. Поэтому возможно, что несопряженная альтерна-
тивная ветвь дыхательной цепи применяется для ускорения дыхания, а это,
в свою очередь, может быть использовано не только для теплопродукции,
но и для понижения внутриклеточной концентрации кислорода, регуляции
метаболических потоков, понижения продукции активных форм кислорода
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... ИЗ
или каких-либо других функций. Тем не менее сегодня приходится при-
знать, что физиологическая роль несопряженной дыхательной цепи еще до
конца не определена.
5.2. Строение дыхательных цепей прокариот
Дыхательные цепи бактерий крайне многообразны, и довольно трудно
привести в качестве показательного примера электрон-транспортную цепь
какого-нибудь одного микроорганизма. Поэтому мы вкратце остановим-
ся на дыхательных ферментах нескольких наиболее изученных бактерий и
опишем основные принципы их функционирования.
5.2.1. Дыхательная цепь Paracoccus denitrificans
Р. denitrificans относится к а-протеобактериям и является наиболее
близким «родственником» митохондрий среди свободно-живущих микро-
организмов. Строение его дыхательной цепи имеет много общего с мито-
хондриями, что сделало эту бактерию излюбленной моделью для изучения
окислительного фосфорилирования. Р. denitrificans содержит белки, гомо-
логичные комплексам I, III и IV митохондрий, т.е. Н+-транслоцирующую
NADH-CoQ-редуктазу, Zjcj-комплекс и цитохром с-оксидазу гш3-типа. Эти
комплексы Р. denitrificans отличаются от своих митохондриальных аналогов
лишь значительно меньшим количеством субъединиц. Однако в отличие
от митохондрий восстановление кислорода у Р. denitrificans может осущест-
вляться не только «канонической» оксидазой яя3-типа, но и двумя допол-
нительными ферментами — цитохром с-оксидазой с/>/>3-типа и хинолок-
сидазой />я3-типа (см. схему на рис. 5.2). Оба эти фермента гомологичны
яя3-оксидазе, они имеют в своем составе гем-медный биядерный центр и
являются протонными помпами (соотношение Н+/ё для них равно 2). Од-
: Nap
I------------1 ; (нитрат-
| Гидрогеназа | ! редуктаза)
NADH-
CoQ-редуктаза
CoQ
Сукцинат-
дегидрогеназа
Метанол- и метиламин-
дегидрогеназы + связанные! Гцйто'хром'ё-1
редокс-белки \ [^ероксидаза!
_ | сЬЬ3-оксидаза |
—»| аа3-оксидаза|
; Нитрит-
; редуктаза!
: Цит. с550 или;
псевдоазурин ;
Убихинол-
цит. с-оксидо-
редуктаза Цит. С,
Ьа3-оксидаза
Nar
(нитрат-редуктаза)
'552
। NO-редуктаза
| Н2О-редуктаза|
Рисунок 5.2. Схема строения дыхательной цепи почвенной бактерии Р. denitrificans.
Объяснения в тексте
114
ЧАСТЬ II. Генераторы протонного потенциала
нако у этих ферментов есть ряд особенностей, отличающих их от оксида-
зы яяз-типа. Так, бяз-оксидаза окисляет не цитохром с, а непосредственно
убихинол. Таким образом, при ее функционировании шунтируется второй
пункт сопряжения дыхательной цепи. Структура этой оксидазы сходна со
структурой фермента яя3-типа — за тем лишь исключением, что в составе
Ьа3 отсутствует редокс-кофактор СиА, а его роль, по-видимому, выполняет
молекула субстрата — хинола.
Цитохром с-оксидаза с^3-типа хотя и катализирует ту же реакцию,
что и фермент яя3-типа (т.е. является Н+-транслоцирующей цитохром
с-оксидазой), однако ее первичная последовательность имеет лишь отда-
ленное сходство с последовательностями «канонических» оксидаз. В то же
время оксидаза с/>/>3-типа гомологична NO-редуктазам, т.е. одному из фер-
ментов анаэробного переноса электронов. Это обстоятельство указывает на
возможные пути эволюционного происхождения ферментов аэробного об-
мена.
Р. denitrificans является почвенной бактерией, и основной экологиче-
ской нишей этого микроорганизма, по-видимому, служат происходящие в
почве процессы денитрификации, т.е. восстановление окисленных форм
азота до N2. Этот процесс является важным этапом круговорота азота в
природе и, к сожалению, приводит к истощению почвенных источников
связанного азота. Денитрификация может быть описана следующей цепоч-
кой превращений:
NO3“ -> NOf -> NO -> N2O -> N2. (5.1)
В дыхательной цепи Р. denitrificans присутствуют ферменты, катали-
зирующие все реакции данного процесса. Первый этап денитрификации
(восстановление нитрата до нитрита) осуществляется двумя разными ни-
тратредуктазами (Nap и Nar, см. рис. 5.2). Белок Nar является мембранным
ферментом и включает в свой состав необычный кофактор, содержащий атом
молибдена. Донором электронов для Nar является хинол. Данный фермент
является генератором АЦН+ с использованием механизма Митчеловой петли
со стехиометрией 1 Н+/ё. Вторая нитратредуктаза (Nap) расположена в пе-
риплазме, и активность этого фермента не сопряжена с образованием про-
тонного потенциала. Три следующие стадии денитрификации осуществля-
ются соответственно нитритредуктазой, NO-редуктазой и N^-редуктазой.
Донором электронов для этих ферментов служит цитохром с. Активности
нитритредуктазы, NO-редуктазы и N^-редуктазы не сопряжены с образо-
ванием АЦН+. Однако, окисляя цитохром с, данные ферменты делают воз-
можной генерацию протонного потенциала в анаэробных условиях на пер-
вых двух пунктах сопряжения дыхательной цепи (т.е. комплексами I и III).
Таким образом, эти ферменты вносят косвенный вклад в увеличение эф-
фективности использования энергии при анаэробном росте Р. denitrificans.
В целом процесс денитрификации может служить примером анаэробного
переноса электронов, т.е. использования бактериями других, отличных от
О2 терминальных акцепторов электронов для дыхательной цепи.
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 115
н+/е'=О н+/е‘=1
Рисунок 5.3. Схема строения дыхательной
цепи и генерации мембранного потенциа-
ла у энтеробактерии Е. coli
5.2.2. Дыхательная цепь Escherichia coli
Аэробная дыхательная цепь Е. coli значительно упрощена по сравнению
с электрон-транспортной цепью митохондрий (рис. 5.3). Она не содержит
Ьс{-комплекса и каких-либо цитохромов типа с, т.е. в ней функционируют
лишь два пункта сопряжения ^АОНгхинон-оксидоредуктазный и хино-
локсидазный). Окисление NADH в ды-
хательной цепи Е. coli осуществляют два
разных фермента. Один из них (NDH-1)
является гомологом митохондриального
комплекса I*. Ферментативная актив-
ность NDH-1 сопряжена с генераци-
ей ДЦН+. В то же время в дыхательной
цепи Е. coli присутствует альтерна-
тивная NADH:xинoн-oкcидopeдyктaзa
(NDH-2). Этот белок и по первичной
последовательности, и по основным своим свойствам близок к NDin ми-
тохондрий растений. NDH-2 состоит из одного полипептида, содержит
один редокс-кофактор (FAD), и активность этого фермента не сопряжена с
трансмембранной транслокацией протонов.
Хинол, образованный посредством NDH-1 и NDH-2, окисляется в ды-
хательной цепи Е. coli за счет активности двух альтернативных терминаль-
ных оксидаз — хинолоксидазы to-типа и хинолоксидазы to-типа. Фермент
to-типа является основной оксидазой дыхательной цепи Е. coli при росте
клеток этого микроорганизма в микроаэробных условиях (т.е. при низкой
концентрации О2), тогда как to-оксидаза превалирует при обычной концен-
трации О2 в среде роста. Хинол-оксидаза to-типа состоит из трех субъеди-
ниц и содержит три редокс-кофактора: медь Сив и два гема — низкоспи-
новый гем В и высокоспиновый гем О. Гем О и Сив образуют биядерный
центр, служащий, как и в других гем-медных оксидазах, местом связывания
и восстановления кислорода. Несмотря на то что to-оксидаза является хи-
нолоксидазой, ее первичная последовательность и особенно ее трехмерная
структура очень похожи на цитохром с-оксидазу яяз-типа. Неудивительно,
что to-оксидаза является протонной помпой и генерирует АЦН. со стехио-
метрией 2 Н+/ё (см. схему на рис. 5.4Л).
В то же время вторая терминальная оксидаза Е. coli (цитохром bd) явля-
ется необычным ферментом. Этот белок не гомологичен ни оксидазам с гем-
медным биядерным центром (митохондриальным цитохром с-оксидазам и
сходным бактериальным ферментам), ни цианид-резистентным оксидазам
с железо-железным биядерным центром (альтернативным оксидазам мито-
хондрий растений, простейших и грибов, а также сходным ферментам из
некоторых бактерий и хлоропластов растений). Таким образом, хинолокси-
даза to-типа является представителем третьего класса терминальных окси-
даз. Данный фермент из Е. coli состоит из двух субъединиц и имеет в своем
* Свойства этого белка были подробно описаны в предыдущей главе.
116
ЧАСТЬ II. Генераторы протонного потенциала
А
Ьо-оксидаза
bd-оксидаза
1/2О2
©
Рисунок 5.4. Схема функционирования терминальных оксидаз £о-типа (/I) и М-типа (Б) у
энтеробактерии Е. coli
составе три простетические группы: низкоспиновый гем Z>558 и два высоко-
спиновых гема — гем Z>595 и хлориновый гем d. Высокоспиновые гемы Z>595
и d расположены в белке очень близко друг к другу, и они, по-видимому,
формируют гем-гемный биядерный центр наподобие гем-медного или
железо-железного биядерных центров остальных оксидаз*.
Предполагается, что простетические группы М-оксидазы расположены
в гидрофобной части белка параллельно плоскости мембраны и ближе к
ее периплазматической поверхности (рис. 5.45). По-видимому, электроны
с хинола вначале переносятся на гем Z>558, а далее — на биядерный центр,
где и происходит восстановление кислорода. Оксидаза М-типа не являет-
ся протонной помпой, и данный фермент генерирует ДЦН+ лишь по меха-
низму Митчеловой петли. Образующиеся при окислении хинола протоны
высвобождаются в периплазму, в то время как протоны, необходимые для
образования воды, захватываются из цитоплазмы. Этот процесс приводит к
формированию протонного потенциала со стехиометрией Н+/ё = 1. Инте-
ресно отметить, что из-за расположения электрон-транспортного пути па-
раллельно поверхности мембраны электрический мембранный потенциал в
данном случае образуется не за счет трансмембранного переноса электронов
(как, например, в фотосинтетических реакционных центрах), а практически
полностью за счет транспорта двух протонов с разных сторон мембраны.
Итак, в дыхательной цепи Е. coli присутствуют как ферменты, гомоло-
гичные белкам дыхательной цепи митохондрий животных (NDH-1 и хинол-
оксидаза 6о-типа), так и ферменты либо с пониженной эффективностью за-
пасания энергии (М-оксидаза), либо вовсе не сопряженные с транслокацией
протонов (NDH-2). Снова возникает вопрос, в чем же состоит физиологи-
ческий смысл функционирования альтернативных ферментов дыхательной
цепи? Однозначного ответа на настоящий момент нет, но можно полагать,
* Подобное устройство кислород-редуктазных центров является интересным при-
мером конвергенции при независимом эволюционном происхождении различных типов
терминальных оксидаз.
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 117
что у Е. coli низкий к.п.д. дыхания компенсируется большей устойчивостью
данной бактерии к ядовитым веществам. Дело в том, что комплексы [II и
особенно I наиболее подвержены ингибиторному действию гидрофобных
ксенобиотиков. Для Е. coli такие вещества не токсичны по тем причинам,
что комплекс I можно шунтировать посредством NDH-2, а комплекса III
нет вовсе. Этот пример иллюстрирует некий общий биологический прин-
цип, когда эффективность биологической системы приносится в жертву ее
большей устойчивости. Чуть ниже мы проиллюстрируем это обстоятельство
на другом примере — энергетике азотофиксирующей бактерии Azotobacter
vinelandii.
Клетки Е. coli могут расти как в аэробных, так и в анаэробных услови-
ях. В отсутствии кислорода у кишечной палочки индуцируются дополни-
тельные ферменты дыхательной цепи, способные использовать некоторые
отличные от О2 акцепторы электронов. Так, клетки Е. coli могут восстанав-
ливать NO3“ до NO2“. Эта активность осуществляется нитратредуктазой —
ферментом, сходным с описанной выше нитратредуктазой Р. denitrificans.
Он генерирует ДЦН+ со стехиометрией Н+/ё = 1. Наряду с нитратом, Е.
coli может восстанавливать различные органические N-оксиды (например,
триметил-N-оксид) до соответствующих аминов или различные органиче-
ские S-оксиды (например, диметилсульфоксид) до соответствующих суль-
фидов. Кроме того, клетки Е. coli в анаэробных условиях способны вос-
станавливать фумарат до сукцината за счет окисления хинола*. Все эти
реакции не сопряжены с трансмембранным переносом протонов, однако,
окисляя хинол, данные ферменты делают возможной генерацию протонно-
го потенциала в анаэробных условиях при восстановлении хинона в первом
пункте сопряжения дыхательной цепи.
Восстановление фумарата до сукцината встречает определенные слож-
ности, если использовать убихинон в качестве переносчика электронов от
NDH-1 к фумаратредуктазе. Ео' пары убихинон / убихинол (+60 мВ) более
положителен, чем у пары фумарат / сукцинат (+30 мВ), что не может не за-
труднять протекание фумаратредуктазной реакции. Поэтому при анаэроб-
ном росте у Е. coli происходит замена убихинона на менахинон (витамин
К). Ео' пары менахинон / менахинол составляет —80 мВ, что обеспечивает
достаточную движущую силу для процесса восстановления фумарата. Это
обстоятельство делает также наш симбионт Е. coli потенциальным источни-
ком витамина К для человеческого организма.
5.2.3. Восстановление фумарата в митохондриях аскариды
Многие бактерии способны использовать фумарат в качестве конечного
акцептора электронов. Однако существует пример, когда подобный меха-
низм применяется и в митохондриях животного. Речь идет об имаго аска-
риды — гельминта, паразитирующего в анаэробных участках кишечника
* Этот процесс катализируется хинол-фумаратредуктазным комплексом, который
подобен (но не идентичен) сукцинат-CoQ редуктазному комплексу (другие названия:
сукцинатдегидрогеназа и комплекс II).
118
ЧАСТЬ II. Генераторы протонного потенциала
оксалоацетат малат; малат -* фумарат -у* сукцинат
(2Н 2Н/
V-----> NADH---------Дцн+
Рисунок 5.5. Схема дисмутации малата в митохондриях аскариды
млекопитающих. Для биологов оказалось сюрпризом, что клетки аскариды
содержат большое количество митохондрий: аскарида живет в анаэробных
участках кишечника, и митохондрии с их дыхательной цепью им вроде бы
не нужны. Исследование показало, что в митохондриях аскариды актив-
ность конечных участков дыхательной цепи действительно очень низка, но
ее начальный сегмент весьма активен. Ферменты цикла Кребса, ответствен-
ные за превращение трикарбоновых кислот, отсутствуют, в то время как
ферменты, метаболизирующие дикарбоновые кислоты, имеются в большом
количестве. Впоследствии выяснилось, что запасание энергии митохондри-
ями аскариды обусловлено восстановлением фумарата. Как сам фумарат,
так и атомы водорода, необходимые для его восстановления, образуются за
счет дисмутации малата (рис. 5.5). Источником малата служит цепь реакций
гликолиза, образующая пируват из глюкозы. Малат может быть получен из
пирувата путем его карбоксилирования.
Перенос восстановительных эквивалентов от NADH к хинону катали-
зируется комплексом I. На этом этапе происходит запасание энергии в виде
АЦН+. Образованный хинол окисляется фумаратредуктазой. Интересно от-
метить, что в митохондриях имаго аскариды, как и в анаэробной дыхатель-
ной цепи Е. coli, также происходит замена убихинона на его аналог с более
отрицательным редокс-потенциалом. Однако в данном случае используется
не менахинон, а еще одно производное хинона — родохинон (см. Прило-
жение 2).
Личинки аскариды, живущие в аэробных условиях (в крови), распола-
гают митохондриями с обычной дыхательной цепью и полным набором
ферментов цикла Кребса.
5.2.4. Дыхательная цепь Azotobacter vinelandii
A. vinelandii является почвенной азотфиксирующей бактерией (т.е. бак-
терией, способной осуществлять восстановление молекулярного азота до
ионов аммония). Большинство азотфиксирующих бактерий не могут асси-
милировать N2 в условиях высокого содержания кислорода в окружающей
среде, так как нитрогеназный комплекс, ответственный за восстановление
азота, необратимо инактивируется при взаимодействии с О2. A. vinelandii
является исключением из этого правила: этот микроорганизм способен эф-
фективно фиксировать молекулярный азот даже при высоких концентра-
циях О2 в среде роста. Однако нитрогеназный комплекс A. vinelandii так же
чувствителен к кислороду, как и у других бактерий. Таким образом, должен
существовать какой-то специальный механизм, позволяющий A. vinelandii
защищать нитрогеназу от инактивации кислородом.
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 119
Н+/е=2 н7е=3
н7е=0 н+/е=1
низкий [кислород],
ассимиляция NH3
высокий [кислород],
фиксация N2
Рисунок 5.6. Схема строения дыхательной цепи и генерации мембранного потенциала у почвен-
ной азотфиксирующей бактерии A. vinelandii [Bertsova et al., 2001; J. Bacteriol., 183: 6869—6874]
В 1969 г. Дальтон и Постгейт выдвинули гипотезу, объясняющую спо-
собность Azotobacter к фиксации N2 даже при высоких концентрациях кис-
лорода. Они предположили, что клетки A. vinelandii за счет значительного
увеличения скорости дыхания снижают концентрацию О2 в цитоплазме до
такого низкого уровня, при котором нитрогеназа уже не инактивируется.
Действительно, было установлено, что при высоких концентрациях кисло-
рода клетки A. vinelandii имеют такие большие скорости дыхания, которые
оказываются максимальными среди всех исследованных бактерий. Какие
же особенности дыхательной цепи A. vinelandii позволяют этой бактерии
дышать так быстро и, таким образом, осуществлять механизм «дыхательной
защиты» нитрогеназного комплекса?
Как видно из схемы, представленной на рис. 5.6, дыхательная цепь А.
vinelandii в основном состоит из уже хорошо знакомых нам компонентов —
двух NADH:xинoн-oкcидopeдyктaз (NDH-1 и NDH-2), Ьс{-комплекса и по
крайней мере двух терминальных оксидаз (цитохром с-оксидазы с/>63-типа
и хинолоксидазы М-типа)*. Как видно из этой схемы, при росте в условиях
низкой концентрации кислорода и избытка связанного азота дыхательная
цепь A. vinelandii преимущественно состоит из ферментов с высокой эф-
фективностью сопряжения, а именно: NDH-1, taq-комплекса и цитохром
с-оксидазы с6/>з-типа. Общая эффективность генерации протонного потен-
циала при этом составляет, как и у митохондрий, 5 Н+/ё. В то же время
в условиях повышенной аэрации и особенно в условиях дефицита связан-
ного азота дыхание катализируется в основном несопряженными фермен-
тами или ферментами с пониженной эффективностью запасания энергии,
а именно: NDH-2 и хинолоксидазой М-типа. Суммарная эффективность
сопряжения для такой цепи составляет всего лишь 1 Н+/ё. Таким образом,
индукция этих ферментов приводит к пятикратному снижению эффектив-
ности генерации протонного потенциала полной дыхательной цепью.
Такая низкая эффективность приводит к тому, что при необходимости
осуществления дыхательной защиты нитрогеназного комплекса активность
электрон-транспортной цепи A. vinelandii не лимитируется генерируемым
протонным потенциалом. Кроме того, NDH-2 и хинолоксидаза М-типа
имеют очень высокие значения удельной активности. Так, в случае NDH-2
из Е. coli удельная активность этого фермента как минимум на 2—3 порядка
выше, чем активность NDH-1. Очевидно, такая высокая активность NDH-2
* Свойства всех этих ферментов были подробно изложены в разделах, посвященных
дыхательным цепям Е. coli и Р. denitrificans.
120
ЧАСТЬ II. Генераторы протонного потенциала
и хинолоксидазы М-типа связана прежде всего с отсутствием активности
протонных помп у этих ферментов. За кинетические преимущества дыха-
тельной цепи, состоящей из NDH-2 и хинолоксидазы М-типа, A. vinelandii
вынужден «платить» очень низкой эффективностью запасания энергии при
дыхании, что приводит к крайне низкому к.п.д. (прирост биомассы, норми-
рованный на количество потребленных субстратов), характерному для это-
го микроорганизма при росте в условиях высокой аэрации и в отсутствии
связанного азота.
5.2.5. Окисление дыхательными цепями бактерий субстратов
с положительным редокс-потенциалом
Примером энергетики такого типа служит бактерия Thiobacillus
ferrooxidans. В качестве единственного энергетического ресурса Th.ferrooxidans
может использовать ион закисного железа (Fe2+), который она окисляет до
иона окисного железа (Fe3+) кислородом воздуха. Редокс-потенциал пары
Fe2+/Fe3+ равен +770 мВ. Редокс-потенциал пары Н2О/О2 при нейтральном
pH оказывается равным +820 мВ. Таким образом, разность потенциалов
между окислителем и восстановителем составляет мизерную величину по-
рядка 50 мВ, что недостаточно для генерации Дцн+, необходимой для об-
разования АТР посредством Н+-АТР-синтазы (около 180 мВ).
Решение этого вопроса было найдено, когда приняли во внимание за-
висимость редокс-потенциала пары Н2О/О2 от pH. Так как ионы водоро-
да участвуют в образовании воды из О2 (О2 + 4е + 4Н+ 2Н2О), этот
редокс-потенциал становится более положительным по мере закисления
среды, которое сдвигает вправо равновесие реакции восстановления кис-
лорода. Количественно этот сдвиг равен 60 мВ на единицу pH. Таким
образом, например, при pH = 3 редокс-потенциал пары Н2О/О2 будет
820 мВ + (4 х 60 мВ) = 1060 мВ. Это на 290 мВ положительнее, чем редокс-
потенциал пары Fe2+/Fe3+, который не зависит от pH, ибо в окислении
закисного железа ионы Н+ не участвуют. Такая разность потенциалов уже
вполне достаточна, чтобы синтезировать АТР. Вот почему железобактерии
живут только при кислых значениях pH (оптимум pH для Th. ferrooxidans
находится между 3 и 1).
Синтез АТР — лишь одна из проблем, которые приходится решать Th.
ferrooxidans. Другая проблема — как использовать донор электронов с поло-
жительным редокс-потенциалом для обеспечения биосинтезов восстанови-
тельными эквивалентами. Th.ferrooxidans — хемолитотрофная бактерия. Она
может образовывать все свои компоненты из СО2, Н2О, NH3 и минеральных
солей. Чтобы достичь этого, необходим какой-то механизм восстановления
NAD(P)+ посредством Fe2+. Такое восстановление требует затрат энергии,
так как значение редокс-потенциала для пары NAD+/NADH (—320 мВ) го-
раздо отрицательнее, чем значение потенциала пары Fe2+/Fe3+.
Чтобы преодолеть подобное затруднение, бактерия использует обрат-
ный перенос электронов в средних и начальных сегментах дыхательной це-
пи. Этот термодинамически невыгодный транспорт электронов от высокого
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 121
Рисунок 5.7. Схема окисления Fe2+ дыхательной цепью Th. ferrooxidans
редокс-потенциала к низкому осуществляется за счет энергии АЦН+, обра-
зуемой в конечном сегменте дыхательной цепи.
Схема энергообеспечения железобактерий предполагает, что электро-
ны, отобранные от Fe2+, поступают в цитохромоксидазную систему, кото-
рая переносит электроны на кислород сопряженно с генерацией Дцн+. Об-
разуемый протонный потенциал затем используется не только для синтеза
АТР, но и для обеспечения всех прочих видов работы, присущих бактери-
альной мембране. Кроме того, Дрн- утилизируется, чтобы развернуть вспять
СоОН2-цитохром с-редуктазную и НАДН-СоО-редуктазную реакции, кото-
рые из ДЦн+-генераторов становятся потребителями ДЦН+ (рис. 5.7).
Опыты, проведенные с двумя видами железобактерии М.И.Х. Алимом
и сотрудниками, а в нашей группе Г. В. Тихоновой, показали, что Fe2+ дей-
ствительно может восстанавливать NAD+ посредством обратного переноса
электронов, который поддерживается энергией, продуцируемой в конечном
сегменте дыхательной цепи. В соответствии с этой схемой было также уста-
новлено, что Th. ferrooxidans содержит огромные количества цитохромов с
и цитохромоксидазы, в то время как компоненты среднего и начального
сегментов цепи представлены в гораздо меньших количествах. Такая гипер-
трофия цитохромоксидазной системы объясняет исключительно высокую
скорость потребления кислорода на 1 мг белка, которая оказалась в семь раз
выше, чем у митохондрии сердца быка. Этот факт становится вполне понят-
ным, если учесть, что железобактерии располагают только одним АЦН+-гене-
ратором, поставляющим необходимую энергию для всех функций клетки.
Fe2+ не единственный донор электронов с положительным редокс-
потенциалом, утилизируемый бактериями рода Thiobacillus. Они способны
окислять также тиосульфат в сульфат через цитохром с и цитохромоксидазу:
S2O32" + 2О2 + Н2О -> 2SO42" + 2Н+. (5.2)
Процесс сопряжен с синтезом АТР, причем разобщители-протонофоры
блокируют этот синтез. Ситуация, аналогичная таковой у Thiobacillus, на-
блюдается также в случае Nitrobacter, окисляющего нитрит. Электроны,
отобранные у нитрита, который превращается в нитрат (редокс-потенциал
+420 мВ), переносятся на цитохромоксидазу, а затем на О2. Этот процесс по-
ставляет энергию для синтеза АТР и переноса электронов от NO2“ к NAD+.
5.2.6. Дыхательная цепь цианобактерий
Дыхательная цепь цианобактерий имеет уникальное строение. Основ-
ной особенностью цианобактерий является то, что в тилакоидных мем-
бранах этих организмов одновременно функционируют две электрон-
122
ЧАСТЬ II. Генераторы протонного потенциала
транспортные цепи — фотосинтетическая и дыхательная. Более того, эти
две цепи имеют несколько общих компонентов, а именно — Ьс{-комплекс,
пластохинон и цитохром с6 (или пластоцианин). Дыхательная цепь циано-
бактерий состоит из уже хорошо известных нам белков: нескольких NAD(P)
Нгхинон-оксидоредуктаз NDH-1* и NDH-2 типа, Ьс{-комплекса и цитохром
с-оксидазы яя3-типа. Наряду с «каноническим» комплексом IV, некоторые
цианобактерии также содержат хинолоксидазу М-типа или альтернативную
цианид-резистентную оксидазу. Важно отметить, что единственным хино-
ном дыхательной цепи цианобактерий является пластохинон.
Фотосинтетическая и дыхательная цепи в клетках цианобактерий име-
ют несколько разную локализацию. Компоненты дыхательной цепи рас-
положены как в цитоплазматической, так и в тилакоидной мембранах, в то
время как фотосинтетическая цепь функционирует только в тилакоидной
мембране.
5.2.7. Дыхательная цепь хлоропластов
Поглощение кислорода хлоропластами (хлородыхание) было описа-
но более 40 лет назад. Однако молекулярные основы этого процесса были
установлены лишь в самое последнее время. Оказалось, что хлоропласты
могут содержать отдельные компоненты дыхательной цепи, сходные с та-
ковыми у цианобактерий. Было установлено, что мембраны хлоропластов
некоторых (но далеко не всех) растений содержат NAD(P)H:wiacToxnHOH
оксидоредуктазу NDH-1 типа. Там же, возможно, присутствуют и NAD(P)
Н:пластохинон-оксидоредуктазы типа NDH-2. Более того, в этих органеллах
была обнаружена и оксидаза, гомологичная цианид-резистентной оксидазе
цианобактерий**. Таким образом, в хлоропластах может функционировать
дыхательная цепь, состоящая из хинон-редуктазного и хинол-оксидазного
участков.
Активность дыхательной цепи хлоропластов невелика, и перенос элек-
тронов по ней составляет менее 1% от переноса электронов по фотосинтети-
ческой цепи. Считается, что основной ролью этой дыхательной цепи являет-
ся не обеспечение хлоропластов энергией, а участие в регуляции активности
фотосинтетической цепи. Так, активность дыхательной цепи в хлоропластах
может влиять на уровень восстановленное™ пластохинона, а одновременное
функционирование фотосистемы I и NDH-1 (NDH-2) может приводить к
циклическому переносу электронов вокруг этой фотосистемы.
В то же время функционирование дыхательной цепи в других пласти-
дах, отличных от хлоропластов (например, в этиопластах), может быть важ-
но и с точки зрения их энергообеспечения за счет дыхания, так как в этих
случаях NDH-1 может оказываться единственным энергопреобразующим
ферментом данных органелл.
* Как было упомянуто в предыдущей главе, NDH-1 цианобактерий содержит
необычный FP-фрагмент, и этот белок, по-видимому, является NADPH:miacTOXHHOH-
оксидоредуктазой.
** Интересно отметить, что цианрезистентная оксидаза хлоропластов более похожа
на АОХ цианобактерий, нежели на АОХ митохондрий тех же растений.
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 123
5.3. Эдектрон-транспортная цепь
метаногенных архей
Как было упомянуто в главе 3, при анаэробных условиях бактерии спо-
собны обеспечивать себя энергией за счет процессов брожения. При этом
глюкоза может сбраживаться до ацетата, СО2 и Н2 (5.3), реже — до лактата,
этанола, сукцината, пропионата, формиата и т.п.
Глюкоза + 2Н2О -> 2СН3СООН + 2СО2 + 4Н2, (5.3)
\(j' = — 216 кДж/моль.
Эта реакция сопровождается выделением энергии, которая в ходе бро-
жения может быть запасена в виде АТР, как правило, с использованием
механизма субстратного фосфорилирования. Однако продукты сбражива-
ния глюкозы еще потенциально содержат достаточно большое количество
утилизируемой энергии. Энергетически максимально выгодным был бы
следующий процесс:
Глюкоза -> ЗСО2 + ЗСН4, (5.4)
AG0' = —418 кДж/моль.
Однако сегодня не известен ни один микроорганизм, способный осу-
ществлять реакцию (5.4). Тем не менее данный процесс активно реализуется
во многих анаэробных нишах земной биосферы, но он осуществляется не
каким-нибудь одним организмом, а целыми бактериальными сообщества-
ми, где каждый из участников специализируется на проведении отдельных
стадий расщепления глюкозы до углекислого газа и метана. Вначале глюко-
за сбраживается бактериями и некоторыми одноклеточными эукариотами
до таких соединений, как ацетат, этанол, формиат, СО2, Н2 и т.п. Далее эти
соединения метаногенами преобразуются в метан.
Необходимо отметить, что метаногенез играет исключительно важную
роль в круговороте углерода в земной биосфере. Считается, что в ходе ме-
таногенеза образуется более 109 тонн метана в год. Большая часть этого
газа впоследствии попадает в аэробные слои Земли, где метан может быть
окислен молекулярным кислородом в клетках различных метилотрофных
бактерий (этот процесс также очень важен для биосферы, так как СН4 явля-
ется мощным парниковым газом). Небольшая часть образованного метана
накапливается в подземных месторождениях. Именно она интенсивно ис-
пользуется человеком в качестве одного из основных видов топлива.
Метаногены могут осуществлять следующие основные виды реакций:
4Н2 + СО2 -> СН4 + 2Н2О, (5.5)
AG0' = —131 кДж/моль;
124
ЧАСТЬ II. Генераторы протонного потенциала
СН3ОН + Н2 -> СН4 + Н2О, (5.6)
= —113 кДж/моль.
Иными словами, метаногены способны восстанавливать молекулярным
водородом одноуглеродные соединения с образованием метана и воды.
Кроме того, метаногены могут метаболизировать некоторые продукты
брожения бактерий без использования Н2:
СНзСООН -> СН4 + СО2, (5.7)
\(л' = —36 кДж/моль;
4НСООН -> СН4 + ЗСО2 + 2Н2О, (5.8)
Дб^' = -145 кДж/моль;
4СН3ОН -4 ЗСН4 + СО2 + 2Н2О, (5.9)
А б0' = -107 кДж/моль.
При этом происходит энергетически выгодное диспропорционирование
либо различных атомов углерода в С2-соединениях (так, один из С-атомов
ацетата может окислиться до СО2 за счет восстановления второго атома
до СН4), либо различных молекул С j-соединений (одна молекула метанола
может окислиться до СО2 за счет восстановления трех других молекул ме-
танола до метана).
Метаногены являются высокоспециализированными организмами и
способны использовать в качестве субстратов для роста лишь ограниченное
число субстратов: ацетат, Н2, СО2 и некоторые Сj-соединения (формиат,
метанол, метиламин и метилтиолы). Все известные на сегодняшний день
метаногены относятся к царству архей, и, как мы увидим далее, они обла-
дают уникальным набором ферментов и кофакторов, практически не встре-
чающихся в хорошо уже известных нам бактериях и эукариотах.
Энергия, выделяющаяся в ходе реакций 5.5—5.9, может быть запасена
метаногенными бактериями в виде АТР. Однако, в отличие от реакций бро-
жения, АТР в данном случае синтезируется не за счет реакций субстратного
фосфорилирования, а при использовании Дрн* или ApNa+ в качестве интер-
медиата. Значит, как и в случае с дыхательным фосфорилированием, внача-
ле за счет энергии некоторых реакций метаногенеза происходит трансмем-
бранный перенос ионов Н+ (Na+). Далее протонный (натриевый) потенциал
может быть потрачен для осуществления синтеза АТР за счет активности
А1>А,-АТР-синтазы — архейского аналога ГоГ,-АТР-синтазы бактерий и эу-
кариот (см. ниже, разд. 7.1).
Рассмотрим вкратце, каким образом энергия реакций метаногенеза за-
пасается в виде Дцн+ (или ApNa+). Реакции метаногенеза можно условно
разделить на два этапа — на «окислительную» и «восстановительную» фазы
этого процесса.
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 125
5.3.1. Окислительная фаза метаногенеза
Данная стадия заключается в переносе электронов с уникального кофак-
тора метаногенов HS-СоМ на атом углерода с образованием окисленного
СоМ и молекулы метана. Кофермент М (СоМ, 2-меркаптоэтансульфонат)
содержит реакционную сульфгидрильную группу, и этот кофактор на на-
чальных стадиях окислительной фазы окисляется до метил-S-CoM (рис. 5.8).
СН3СОО^ [СО]
^СН3-Н4МРТ
6 [ Н ]+СО2 ^CH3-S-CoM
X"
Рисунок 5.8. Пути образования СН3—S—СоМ из ацетата, СО2 и некоторых восстановленных С!
соединений (СН3—X), таких, как метанол, метилтиол и метиламин
В случае использования метанола, метиламина и метилтиолов происходит
прямой перенос метильной группы на СоМ. При росте на ацетате или СО2
образование СН3—СоМ осуществляется в несколько стадий. В частности,
метильная группа вначале переносится на особый кофактор Н4МРТ (тетра-
гидрометаноптерин). Далее метильная группа с СН3—Н4МРТ переносится
на СоМ:
СН3-Н4МРТ + HS-CoM -> Н4МРТ + CH3-S-CoM. (5.10)
Эта экзергоничная реакция сопряжена с трансмембранной транслока-
цией ионов натрия, т.е. выделяющаяся в ходе данной реакции энергия мо-
жет быть запасена в виде ApNa+ (эта реакция будет более подробно описана
в разд. 12.3). Таким образом, в окислительной части метаногенеза при ис-
пользовании ацетата или СО2 (но не метанола, метиламина и метилтиолов)
присутствует реакция, сопряженная с запасанием энергии*.
Далее СН3—S—СоМ взаимодействует еще с одним специфическим ко-
фактором метаногенов, содержащим -SH группировку, — коферментом В
(меркаптогептаноил-треонинфосфатом):
CH3-S-CoM + HS-CoB -> СН4 + CoM-S-S-CoB. (5.11)
В ходе этой реакции происходит высвобождение метана и образова-
ние гетеродисульфида СоМ—S—S—СоВ. Реакция 5.11 сопровождается зна-
чительным выделением энергии. Однако, насколько известно, эта реакция
не сопряжена ни с образованием Дцн+ (ApNa+), ни с синтезом АТР. В то же
* Однако следует отметить, что на начальных этапах метаногенеза для активации
молекул СН3СООН и СО2 используется соответственно энергия гидролиза АТР и энергия
трансмембранного натриевого потенциала. Таким образом, окислительная часть метано-
генеза в целом не приводит к запасанию энергии.
126
ЧАСТЬ II. Генераторы протонного потенциала
время высвобождающаяся на этой стадии энергия может быть фактором,
сдвигающим в сторону образования продуктов равновесие последующих
эндэргонических стадий восстановительной части метаногенеза.
5.3.2. Восстановительная фаза метаногенеза
Восстановительная фаза метаногенеза заключается в окислении раз-
личных субстратов, сопряженном с восстановлением гетеродисульфида до
СоМ—SH + СоВ—SH. Эти реакции реализуются несколькими мембран-
ными ферментами, организованными в своеобразную энергозапасающую
электрон-транспортную цепь, где гетеродисульфид играет роль конечного
акцептора электронов. В качестве первичного донора электронов для этой
цепи может использоваться либо молекулярный водород (если метаногены
осуществляют реакции 5.5-5.6), либо восстановленная форма специфиче-
ского кофактора архей — F420* (при осуществлении реакций 5.8—5.9).
Рассмотрим, каким образом может запасаться энергия при восстанов-
лении гетеродисульфида молекулярным водородом. Данная реакция осу-
ществляется в две стадии. Вначале особый фермент — Р420-независимая
гидрогеназа — окисляет Н2 и переносит электроны на липофильный ко-
фактор архей метанофеназин (МР), являющийся функциональным (но не
структурным) аналогом хинонов дыхательных цепей бактерий и эукариот.
Гидрогеназа состоит из трех субъединиц, содержащих два гема В, железо-
серный кластер и особую простетическую группу, состоящую из негемового
железа и атома никеля. Как видно на рис. 5.9, на центре [NiFe] происходит
окисление Н2, далее электроны через [Fe—SJ-кластер переносятся на ци-
тохром Ь, где происходит восстановление метанофеназина. Образующиеся
при окислении Н2 протоны выделяются во внешнюю среду, а при образо-
вании МРН2 из МР протоны поглощаются из цитоплазмы. Таким образом,
гидрогеназа генерирует протонный потенциал со стехиометрией 1 Н+/ё по
механизму Митчеловой пе!ли.
Образованной МРН2 может быть окислен следующим ферментом
электрон-транспортной цепи метаногенов — гетеродисульфидредуктазой.
Этот фермент состоит из двух субъединиц и содержит два [Fe—S]-кластера
и два гема В (редокс-потенциалы гемов в случае с Methanosarcina barkeri со-
ставляют — 180 и —23 мВ). На цитохромной субъединице гетеродисульфид-
редуктазы происходит окисление МРН2. При этом протоны выделяются во
внешнюю среду, а электроны трансмембранно переносятся через гемы В на
[Fe—S]-кластеры и далее — на гетеродисульфид с образованием СоМ—SH и
CoB-SH. В ходе последней реакции происходит поглощение двух протонов
из цитоплазмы. Таким образом, гетеродисульфидредуктаза, как и гидроге-
наза, генерирует протонный потенциал по механизму Митчеловой петли со
стехиометрией 1 Н+/ё. В ходе этих двух стадий энергия Н2:гетеродисульфид-
оксидоредуктазной реакции запасается в виде ДЦН+.
Если метаногены используют для роста различные С!-соединения в от-
сутствие Н2 (т.е. если они осуществляют реакции 5.8—5.9), в этом случае
F42o является производным дезазофлавина.
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий простейших... 127
ЦИТОПЛАЗМАТИЧЕСКАЯ
МЕМБРАНА
Рисунок 5.9. Пример электрон-транспортной цепи метаногенных архей
основным донором электронов для электрон-транспортной цепи служит
восстановленная форма кофактора F420 (Eq = —360 мВ). У архей F420 служит
гидрофильным переносчиком гидрид-иона. Данный кофактор восстанавли-
вается при окислении С!-соединений* и окисляется электрон-транспортной
цепью. Таким образом, у метаногенов F420 оказывается функциональным
аналогом NAD+.
Окисление восстановленного F420 катализируется Р420Н2-метанофеназин-
оксидоредуктазой. Как показано в предыдущей главе, этот фермент гомо-
логичен комплексу I дыхательной цепи митохондрий и его активность (как
и активность комплекса I) сопряжена с трансмембранной транслокацией
ионов Н+. Затем образованный МРН2 (как и в случае использования Н2)
окисляется гетеродисульфидредуктазой.
Итак, реакции восстановительной фазы метаногенеза сопряжены с гене-
рацией ДЦН+. Образованный в ходе реакций протонный потенциал может быть
далее использован для синтеза АТР за счет активности АоАх-АТР-синтазы.
Эти реакции являются основным источником энергии для жизнедеятельности
метаногенных архей.
* F420H2 может образовываться и при окислении Н2 за счет активности Р420-зависимой
гидрогеназы.
ГЛАВА ШЕСТАЯ
БАКТЕРИОРОДОПСИН
6.1. Принцип действия
В 1971 г. Д. Остерхельт и В. Стокениус открыли в мембранах экстремаль-
но галофильной археи Halobacterium salinarium (первоначально эта архея
была ошибочно определена как Н. halobium) новый ретиналь-содержащий
белок — бактериородопсин. В дальнейшем было продемонстрировано, что
он позволяет клеткам этого микроорганизма преобразовывать энергию
солнечного света в Дцн+, т.е. функционирует как светозависимая Н*-помпа.
А.А. Ясайтисом в нашей лаборатории было доказано, что Дцн+, генерируемый
бактериородопсином на мембране Н. salinarium. может поддерживать синтез
АТР. За последующие годы был достигнут большой прогресс в определении
механизма светоиндуцированного трансмембранного переноса протона по-
средством бактериородопсина.
Бактериородопсин обладает целым набором особых свойств, которые
в значительной мере облегчают его изучение. Это удобные спектральные
свойства данного белка в видимой области; возможность запуска трансмем-
бранного переноса протона лазерной вспышкой; способность бактериоро-
Рисунок 6.1. Д. Остерхельт (слева) и В. Стокениус (справа)
Рисунок 6.2. А.А. Ясайтис
Глава 6. Бактериородопсин
129
допсина образовывать как двумерные кристаллы в пурпурных бляшках, так
и трехмерные кристаллы в искусственной кубической фазе липидов; воз-
можность использования метода сайт-специфического мутагенеза; неболь-
шой размер и исключительная стабильность белка в широчайшем диапазо-
не концентраций органических растворителей, значений pH, температуры,
давления и многое другое. На сегодня бактериородопсин является наиболее
изученной протонной помпой, а полная идентификация механизма работы
этого белка должна способствовать определению механизмов функциони-
рования и других протон-переносящих ферментов.
Бактериородопсин представляет собой одиночный полипептид с мас-
сой 26 кДа, что значительно меньше, чем у всех других известных Дцн+-ге-
нераторов. Обычно молекулы бактериородопсина in vivo образуют тримеры
(однако и в мономерной форме этот белок может работать как протонный
насос). Бактериородопсин локализован в специальных областях цитоплаз-
матической мембраны Н. salinarium — так называемых пурпурных бляшках,
достигающих 0,5 мкм в диаметре. Пурпурные бляшки практически насыще-
ны бактериородопсином, этот белок составляет около 75% вещества данной
мембраны (остальное — фосфо- и сульфолипиды, а также каротиноиды).
Бактериородопсин характеризуется регулярной (кристаллической) упаков-
кой в мембране пурпурных бляшек. Других белков в этих бляшках нет,
так что данные мембранные образования представляют собой своеобразные
двумерные кристаллы бактериородопсина.
Такие процессы, как межмолекулярный перенос окислительно-
восстановительных эквивалентов или гидролиз ковалентных макроэргиче-
ских связей, протекающие в других Дцн+-генераторах, в бактериородопсине
не обнаружены.
Согласно современной точке зрения, механизм действия бактериородоп-
сина состоит в следующем. Поглощение фотона остатком ретиналя, кова-
лентно связанным в молекуле бактериородопсина посредством альдиминной
связи с е-аминогруппой остатка лизина, вызывает изомеризацию ретина-
ля по типу «полностью транс -» 13-цис» (рис. 6.3). Этот процесс сопрово-
ждается очень резким «кислым сдвигом» рКа иминного азота Шиффова
основания, который в темновой форме бактериородопсина протонирован.
Полностью трансизомер
Рисунок 6.3. Светозависимая
«полностью транс -> 13-цис»
изомеризация остатка ретиналя
в бактериородопсине
13-Цисизомер
белок
130
ЧАСТЬ II. Генераторы протонного потенциала
В результате Шиффово основание депротонируется, и высвобождающийся
протон выделяется в водную фазу снаружи бактериальной клетки. Затем
рКа Шиффова основания сдвигается к исходному значению, т.е. сродство
основания к протонам вновь возрастает. В результате Шиффово основание
протонируется, причем для этой цели используется Н+, поступающий из-
нутри клетки. Далее ретиналь возвращается в свою исходную конформацию
(переход «VS-цис -> полностью транс»). Таким образом, вызванное светом
циклическое превращение бактериородопсина оказывается сопряженным с
транспортом иона Н+ через цитоплазматическую мембрану Н. salinarium.
6.2. Структура бактериородопсина
Бактериородопсин оказался хронологически первым ДЦн+-генератором,
для которого удалось выяснить первичную структуру. Это было сделано
Ю.А. Овчинниковым, Н.Г. Абдулаевым и сотрудниками (1978), а позднее
Х.Г. Кораной и его коллегами (1979). Оказалось, что белок состоит из 248
аминокислотных остатков, образующих семь гидрофобных последовательно-
стей (по 24—28 аминокислот каждая), чередующихся с более короткими ги-
дрофильными участками. Кроме того, на С-конце молекулы белка находит-
ся гидрофильная последовательность, включающая около 20 аминокислот.
В 1975 г. Р. Хендерсон и П. Ануин опубликовали пространственную
модель бактериородопсина с разрешением порядка 7 А (впоследствии раз-
решение этого метода было увеличено до ~3 А). Данные авторы использо-
вали уникальное свойство бактериородопсина образовывать in vivo двумер-
ные кристаллы в пурпурных бляшках. Используя электронный микроскоп
и метод анализа дифракции электронов, авторы получили изображения
бактериородопсина, приведенные на рис. 6.6АБ. Оказалось, что полипеп-
тидная цепь бактериородопсина семь раз пересекает мембрану, формируя
семь а-спиральных колонн (обозначенных буквами алфавита от Л до G), о5-
Рисунок 6.4. Ю.А. Овчинников (слева) и Х.Г. Корана (справа)
Рисунок 6.5. Р. Хендерсон
Рисунок 6.6. Пространственная организация бактериородопсина. А — карта распределения
электронной плотности в пурпурной бляшке (проекция на плоскость мембраны); одна из молекул
бактериородопсина обведена пунктиром, ячейка двумерного кристалла — сплошной линией;
Б — вид сбоку модели одной молекулы бактериородопсина, реконструированной на основе
карт распределения электронной плотности; В — вероятное расположение семи а-спиральных
колонн в молекуле бактериородопсина
разованных в основном гидрофобными аминокислотами. Каждая из колонн
высотой порядка 3,5 нм. На рис. 6.6Б отсутствуют гидрофильные вставки,
связывающие гидрофобные колонны, так как разрешение метода слишком
низко, чтобы их увидеть. N- и С-концы полипептидной цепи бактерио-
родопсина находятся по разные стороны цитоплазматической мембраны:
N-конец обращен наружу, а С-конец — внутрь клетки.
Впоследствии трехмерная структура бактериородопсина была опреде-
лена и методом рентгеноструктурного анализа (с разрешением до ~ 1,4 А).
Эта более детальная структура белка позволила выявить некоторые важные
132
ЧАСТЬ II. Генераторы протонного потенциала
ЦИТОЗОЛЬ
внешняя
среда
Рисунок 6.7. Структура бактериородопсина с указанием основных функциональных аминокис-
лотных остатков [Lanyi 2004, Annu. Rev. Physiol. 66: 665—688]. Wat^ (зеленый шарик в центре
мембраны) — молекула связанной воды в области Asp-85 и Asp-212
элементы, указывающие на возможный механизм работы бактериородопси-
на. Было установлено, что остаток ретиналя в молекуле бактериородопсина
связан с £ys-216, локализованным в колонне G. Шиффово основание на-
ходится в сердцевинной гидрофобной части белка (см. рис. 6.7), чуть ближ|
к внешней поверхности мембраны. Вблизи Шиффова основания находятся
два остатка аспарагиновой кислоты — Asp-85 и Asp-212. Остаток аспартата
Asp-85 связан с внешней средой протон-переносящим путем, состоящим
из остатков Лд^-82, Glu-194 и G/w-204, а также 7—8 прочносвязанных моле-
кул воды. Таким образом, депротонирование Шиффова основания во время
фотоцикла бактериородопсина может приводить к выбросу образующегося
протона во внеклеточную среду. В то же время в бактериородопсине между
Шиффовым основанием и цитоплазматической поверхностью мембраны
почти нет остатков полярных аминокислот. В этой части белка расположен
лишь один остаток аспартата — Asp-96. Однако расстояния от цитоплазма-
тической поверхности мембраны к Asp-96 и далее от Asp-96 до Шиффова
основания (10—12 А) слишком велики для прямого переноса протонов. Та-
Глава 6. Бактериородопсин
133
ким образом, для осуществления репротонирования Шиффова основания
во время фотоцикла должны происходить значительные конформационные
изменения, приводящие к образованию узкой обводненной щели, веду-
щей из цитоплазмы к А$р-96 и дальше к Шиффову основанию. Некоторые
структурные особенности бактериородопсина указывают на вероятный ме-
ханизм таких перестроек. Так, колонны В, С и У7 имеют изгибы за счет при-
сутствия в этих а-спиралях остатков пролина. Колонна G также обладает
мобильным структурным элементом. Ход а-спирали в этой колонне с цито-
плазматической стороны прерван одним витком я-спирали («я-выступом»).
Этот элемент образуется за счет того, что карбонильные атомы кислорода
в пептидной группировке остатков Ala-215 и Lys-216 образуют водородные
связи не с атомами водорода последующих пептидных группировок (как в
а-спиралях), а с молекулами воды. Таким образом, в этом элементе воз-
можен я <-> а переход, вероятно приводящий к значительным структурным
изменениям в цитоплазматической части бактериородопсина и к осущест-
влению репротонирования Шиффова основания.
6.3. Фотоцикл, бактериородопсина
Поглощение фотона бактериородопсином вызывает ряд превращений,
замкнутых в цикл (рис. 6.8). Каждое из них может быть прослежено по
характерному спектральному сдвигу. Уже в 1971 г. Д. Остерхельт и В. Сто-
кениус описали ключевой интермедиат бактериородопсинового фотоцик-
ла, поглощающий свет при гораздо более короткой длине волны (412 нм),
чем исходная форма бактериородопсина bR (568 нм). Поскольку этот спек-
тральный сдвиг подобен переходу родопсин метародопсин II {Mil) в
зрительном родопсине, коротковолновый интермедиат бактериородопсина
был назван Мт. В последующих работах были выявлены два интермедиата
между 6Т?568 и Мц2 в фотоцикле. Они
были обозначены буквами алфавита,
предшествующими М. Образование
Л/4|2 стали описывать следующей
схемой: Z>/?568 Кт
^550 -> Мц2-
Превращение М4!2 в bR в темновой
фазе фотоцикла также включает два
промежуточных продукта (Мцг -»
Мбо -> ^640 -> ^568). В дальнейшем
при анализе кинетики образования
и распада формы М4]2 выяснилось,
что на этой стадии фотоцикла об-
разуется несколько разных интерме-
диатов со сходными спектральными
свойствами (названных Mz4|2 Мп4п и
Мш4Q5), что привело к дальнейшему
усложнению схемы фотопревраще-
ний бактериородопсина (рис. 6.8).
Рисунок 6.8. Схема фотоцикла бактериородоп-
сина с указанием основных его стадий
134
ЧАСТЬ II. Генераторы протонного потенциала
Хранение бактериородопсина в темноте приводит в минутной шкале
времени к так называемой темновой адаптации. При этом бактериородоп-
син превращается в новый компонент, поглошаюший свет при 548 нм и
содержащий 13-4<мс ретиналь. Темно-адаптированный />Я548 неактивен как
протонный насос, но освещение вызывает быстрый переход 6Я548 ЬКЖ
(световая адаптация) в обычную активную форму бактериородопсина.
6.4. Светозависимый транспорт протонов
бактериородопсином
Прогресс в понимании функциональной активности бактериородопси-
на связан прежде всего с разработкой быстрых спектральных и электро-
метрических методов, а также с использованием очень коротких вспышек
лазера для запуска фотоцикла этого белка. Спектральные измерения в мак-
симумах интермедиатов фотоцикла позволяют следить за образованием и
распадом последних. Чувствительные pH-индикаторы дают возможность
наблюдать выделение и поглощение ионов Н+ молекулами бактериоро-
допсина, одновременно запущенными вспышкой света. Прямое измерение
смещений зарядов в бактериородопсине, сорбированном на коллодиевой
пленке, дает информацию о переносе Н+ или каких-либо иных заряженных
компонентов внутри молекулы этого ДЦН+-генератора.
Л.А. Драчевым и А.Д. Кауденом были измерены следующие три пара-
метра: 1) образование и распад Л/4)2 (по изменению поглощения света при
412 нм); 2) изменение pH в среде (по поглощению света pH-индикатором —
р-нитрофенолом) и 3) генерация и разрядка АТ, обусловленная смещением
зарядов в бактериородопсине (по показаниям вольтметра, соединенного с
двумя электродами, погруженными в растворы электролита по обе стороны
коллодиевой пленки). Одновременное однократное срабатывание молекул
бактериородопсина вызывали вспышкой лазера (Z|/2 вспышки 15 нс). При
измерениях сдвигов pH и поглощения при 412 нм использовали суспензию
пурпурных бляшек. Для измерения АТ
стороны на коллодиевом фильтре.
Рисунок 6.9. А.Д. Каулен (слева) и Л.А. Драчев
те же бляшки сорбировали с одной
Как показали измерения, ки-
нетика образования и распада М412
совпадает соответственно с выде-
лением и поглощением бляшками
Н+. Поскольку процессы образо-
вания Л/4|2 и выделения Н+ оказа-
лись намного быстрее (Z|/2 около
250 мкс), чем распад Л/4)2 и погло-
щение Н+ (Г|/2 порядка 30 мс), то
их можно было легко соотнести с
двумя основными электрогенными
процессами, наблюдавшимися в
системе бляшки-коллодиевая плен-
ка (приведенные выше величины
Глава 6. Бактериородопсин
135
/1/2 относятся к /°=5°С). Образование Л/412 и выброс Н+ коррелировали с
электрогенной фазой, развивающейся в микросекундной временной шка-
ле. Соответственно распад М412 и поглощение Н+ коррелировали со второй
(миллисекундной) электрогенной фазой. Соотношение амплитуд микро- и
миллисекундных фаз генерации АТ оказалось равным 1:4. Микро- и мил-
лисекундные электрогенные стадии имеют направление, соответствующее
переносу положительных зарядов от цитоплазматической к внешней по-
верхности мембраны.
В дальнейшем была описана цепочка молекулярных событий, приводя-
щая к светозависимой трансмембранной транслокации протона. Это удалось
осуществить при анализе различных мутантных форм бактериородопсина с
замененными отдельными аминокислотными остатками. Наиболее важные
данные были получены, когда удалось определить с хорошим разрешением
трехмерную структуру не только исходной формы бактериородопсина bR54%,
но и некоторых интермедиатов его фотоцикла. Попробуем вкратце опи-
сать последовательность событий при трансмембранном переносе протонов
этим белком.
В бактериородопсине можно выделить три протон-донорные (протон-
акцепторные) группы, являющиеся ключевыми участниками этого процес-
са. Это азот Шиффова основания и два остатка аспартата — А$р-85 и А$р-96
(находящиеся соответственно с внешней и с цитоплазматической стороны
от Шиффова основания, см. рис. 6.7). В исходной форме 6А548 атом азота
Шиффова основания находится в протонированной форме (рКа этой груп-
пы > 12), /lsp-85 — депротонирован (рКа = 2,5), a Asp-96 — протонирован
(рКа = 10). Остаток ретиналя в исходной форме bR54% находится в виде
полностью транс изомера.
При поглощении света бактериородопсином происходят следующие
основные события:
1. Переход bR570 К590
За счет энергии светового кванта остаток ретиналя в бактериородоп-
сине изомеризуется из полностъю-транс в 13-цис. В растворе подобная
фотоизомеризация ретиналя приводит к значительному изменению фор-
мы этой молекулы, которая становится более изогнутой по сравнению
с полностью транс изомером. Однако на первой стадии фотоцикла бак-
териородопсина изогнутая конформация 13-цис ретиналя не может быть
реализована из-за структурных ограничений, накладываемых на эту про-
стетическую группу ретиналь-связывающим центром белка. Поэтому в
интермедиате остаток 13-4<мс ретиналя находится в так называемой
«скрученной» конформации. Таким образом, на первой стадии фотоцикла
энергия поглощенного кванта света запасается в виде напряженной кон-
формации остатка ретиналя*.
* Спектроскопия с субпикосекундным разрешением позволила выявить два пред-
шественника Я590 в фотоцикле бактериородопсина, а именно «истинно первичный» ин-
термедиат /4й0 и следующий сразу за ним J62s, образующийся из 1480 за 700 фемтосекунд
(7 х 10’13 сек).
136
ЧАСТЬ II. Генераторы протонного потенциала
2. Переход К590 -> L550
На следующей стадии остаток 13-цис ретиналя переходит из напряжен-
ной конформации в релаксированную изогнутую конформацию. Это проис-
ходит за счет того, что остаток скрученного ретиналя «расталкивает» амино-
кислотные остатки белка и переводит молекулу бактериородопсина в новую
напряженную конформацию (т.е. на этой стадии происходит передача энер-
гии от ретиналя к белку) с измененным центром, связывающим ретиналь.
3. Переход L550 —> М412
В новой конформации белка Шиффово основание и /15/7-85 из-за еще
неизвестных причин изменяют свои протон-донорные (акцепторные) свой-
ства таким образом, что их рКа смещаются приблизительно к 8. Это приво-
дит к переносу протона с Шиффова основания на /15/7-85.
4. Переход М!412 —> М412И
На этой стадии осуществляется депротонирование остатка G/w-204 на
внешней поверхности бактериородопсина, и, таким образом, осуществляет-
ся выброс протона во внешнюю среду.
5. Переход М412И —> М4051И
Далее в молекуле бактериородопсина происходят значительные кон-
формационные изменения. Здесь, по-видимому, меняется структура мо-
бильных элементов а-спиралей этого белка (см. выше) и происходит обра-
зование щели между колоннами бактериородопсина в цитоплазматической
его части. За счет этих изменений вода проникает в пространство между
/15р-96 и Шиффовым основанием, что облегчает перенос протона между
этими двумя группами.
6. Переход М405"' -> N560
Изменение окружения остатка аспартата /15/7-96 приводит к сдвигу его
рКа до значения ~7. Следствие этого — перенос протона от Asp-96 к Шиф-
фову основанию. Таким образом, на данной стадии происходит репротони-
рование простетической группы бактериородопсина.
7. Переход N560 -> О640
На данной стадии происходит обратная изомеризация 13-цис ретиналя
в энергетически более выгодное состояние полностъю-транс. На этой ста-
дии осуществляется также репротонирование остатка /15/7-96 за счет захвата
протона из цитоплазмы и закрывается щель на цитоплазматической сторо-
не бактериородопсина.
8. Переход О640 -> bR568
На последней стадии происходит перенос протона от /15/7-85 на С/м-204
и, таким образом, завершается фотоцикл бактериородопсина.
Глава 6. Бактериородопсин
137
В итоге поглощение одного кванта света молекулой бактериородопсина
приводит к переносу одного протона через мембрану. Необходимо отме-
тить, что, несмотря на значительный прогресс в определении механизма
транслокации протона бактериородопсином, некоторые ключевые реакции
этого процесса еше остаются невыясненными. Пожалуй, наиболее важным
неясным моментом является определение природы молекулярной «зашел-
ки», переключающей доступность Шиффова основания от внешнего к вну-
треннему (цитоплазматическому) протон-переносящему пути. Все еще не
известен ответ на вопрос, почему репротонирование Шиффова основания
осуществляется за счет переноса протона от ?lsp-96, а не за счет простого
возврата Н+ от /ivp-85.
6.5. Другие ретинадь-содержащие бедки
6.5.1. Галородопсин
При исследовании Н. salinarium было установлено, что мембраны этого
микроорганизма в дополнение к бактериородопсину содержат еще одну све-
тозависимую ионную помпу — галородопсин. Галородопсин (йЛ) представ-
ляет собой ретиналь-содержащий белок, транспортирующий ионы С1“ из
среды в клетку Н. salinarium за счет энергии света. Это мембранный белок
с молекулярной массой 27 кДа, т.е. того же порядка, что и у бактериоро-
допсина. Включение галородопсина в протеолипосомы позволяет получить
пузырьки, способные к светозависимому транспорту ионов хлора. Будучи
сорбированными на плоской мембране, протеолипосомы генерируют фото-
ток, обусловленный электрогенным транспортом ионов С1”. В мембране
Н. salinarium галородопсин локализован вне пурпурных бляшек, и его со-
держание в клетке примерно в 100 раз меньше по сравнению с бактерио-
родопсином.
По аминокислотным последовательностям эти два ретиналь-содержащих
белка различаются примерно на 70%; наибольшее сходство наблюдается в
составе а-спиральных колонн, число которых в галородопсине, как и в
бактериородопсине, равно семи. Как и в бактериородопсине, остаток ре-
тиналя присоединен к галородопсину с помощью альдиминной связи с
е-аминогруппой остатка лизина.
Трехмерная структура галородопсина была определена с помощью
рентгеноструктурного анализа, и она оказалась очень близкой к структуре
бактериородопсина. Наиболее важным отличием галородопсина является
то, что этот белок не содержит в своем гидрофобном ядре остатков заря-
женных аминокислот, соответствующих ключевым остаткам аспартата (Asp-
85 и Asp-96) бактериородопсина.
Фотоцикл галородопсина в общих чертах сходен с фотоциклом бакте-
риородопсина и в качестве первого этапа включает в себя изомеризацию
полностъю-транс ретиналя в 13-цис изомер. Однако в процессе всего фото-
цикла галородопсина Шиффово основание постоянно остается в протони-
рованном состоянии.
138
ЧАСТЬ П. Генераторы протонного потенциала
Механизм действия галородопсина совершенно неясен. Основываясь
на трехмерной структуре этого белка, можно сказать, что в темновой форме
галородопсина ион С1” связан вблизи положительно заряженного протони-
рованного Шиффова основания (приблизительно в том месте, где в бактери-
ородопсине расположен остаток ?lsp-85). Возможно, что светоиндуцируемая
изомеризация остатка ретиналя вызывает перемещение Шиффова основа-
ния вместе с электростатически связанным с ним ионом С1“ от входного к
выходному С1 “-проводящему пути. Следует отметить, что в галородопсине
(так же как и в бактериородопсине) между Шиффовым основанием и ци-
топлазматической поверхностью мембраны почти нет остатков полярных
аминокислот. Таким образом, в цитоплазматической части галородопсина
во время фотоцикла должны происходить значительные конформацион-
ные изменения, приводящие к образованию щели, постулированной и для
структуры некоторых интермедиатов фотоцикла бактериородопсина.
Тем не менее до сих пор непонятно, каким образом два белка со сход-
ными структурами и свойствами (бактериородопсин и галородопсин) об-
ладают специфичностью к столь разным ионам (каковыми являются Н+ и
С1“), да еще при поглощении света переносят их в противоположных на-
правлениях.
Биологическая функция галородопсина состоит прежде всего в том, чтобы
возвращать в клетку ионы С1“, электрофоретически удаляемые из цито-
плазмы, которая заряжена отрицательно относительно внешней среды бла-
годаря работе ДЦн+-генераторов (бактериородопсина и дыхательной цепи).
Определенная утечка С1“ неизбежна, если учесть, что ДТ на мембране гало-
фильных архей достигает 200 мВ, а концентрация С1“ в цитоплазме очень
высока (до 4 М).
Галородопсин ответственен за возврат меньшей части теряемых клет-
кой ионов хлора. Большая их часть возвращается посредством С1“, Н+-сим-
портера, локализованного в той же мембране. Обе эти системы могут также
обеспечивать увеличение количества ионов С1“ при возрастании объема
клетки перед делением.
Интересно отметить, что другая галофильная архея Natronomonas
pharaonis не содержит бактериородопсина, и галородопсин является един-
ственной светозависимой ионной помпой этого организма. Таким образом,
по-видимому, галородопсин может использоваться не только для возврата
ионов хлора в цитоплазму, но и для запасания энергии света в виде ДЦС1-.
Скорее всего, в дальнейшем трансмембранный потенциал ионов хлора
конвертируется в ДЦН+ за счет активности описанного выше С1“,Н+-сим-
портера.
6.5.2. Распространенность бактериородопсина и его аналогов
у различных живых организмов
Присутствие бактериородопсина (галородопсина) в мембране некото-
рых галофильных архей позволяет им использовать солнечный свет в каче-
стве источника энергии. На настоящий момент у живых организмов извест-
ны два принципиально разных способа запасать энергию квантов света в
Глава 6. Бактериородопсин
139
виде Ацн+: это различные типы хлорофиллсодержащих фотосистем и бакте-
риородопсин (галородопсин). Поглощение света хлорофилл-содержащими
фотосистемами цианобактерий и растений приводит к разделению заря-
дов и к дальнейшему трансмембранному переносу электронов от субстра-
та с положительным редокс-потенциалом к продукту с отрицательным
редокс-потенциалом. При этом энергия квантов света запасается как в виде
АЦН+ (с эффективностью 1,5 H+/Av), так и в виде разности окислительно-
восстановительных потенциалов субстрата и продукта этой реакции. В то
же время при поглощении кванта света бактериородопсином данный белок
просто переносит через мембрану протоны (с эффективностью 1 H+/hv). Та-
ким образом, бактериородопсин характеризуется меньшей эффективностью
преобразования энергии по сравнению с хлорофилл-содержащими фотоси-
стемами растительного типа*, и при работе данного белка энергия квантов
света запасается только в виде АЦН+. Известно, что для автотрофного типа
метаболизма (прежде всего для фиксации углекислого газа) необходима не
только энергия в виде АТР (ДЦН+), но и источник восстановительных эк-
вивалентов с отрицательным редокс-потенциалом — NAD(P)H. Следова-
тельно, функционирование бактериородопсина само по себе не способно
обеспечить автотрофный тип метаболизма. Так, клетки Н. salinarium не спо-
собны фиксировать СО2 и нуждаются в органических субстратах.
Поэтому долгое время считалось, что в ходе эволюции бактериородоп-
син проиграл конкурентный отбор хлорофиллсодержащим фотосистемам
и остался лишь в качестве реликта у представителей наиболее древних ор-
ганизмов, сохранившихся только в экстремальных нишах Земной биосфе-
ры, — Н. salinarium и близкородственных ему видов галофильных архей.
Однако недавно было установлено, что ген сходного бактериородопсину
белка присутствует и у каких-то некультивируемых морских протеобакте-
рий. При экспрессии этого гена в клетках Е. coli в присутствии ретиналя
синтезировался белок (названный протеородопсином), способный к све-
тозависимой трансмембранной транслокации протонов. И оказалось, что
белки семейства бактериородопсина распространены намного более широ-
ко, чем считалось ранее, и, возможно, играют более существенную роль в
биосфере Земли.
Однако если даже считать, что ретиналь-содержащие белки как пре-
образователи энергии света у большинства организмов проиграли конку-
рентный отбор в ходе эволюции, то все равно они нашли несколько иное,
но важное применение: такие белки используются как рецепторы света и в
этом качестве очень широко распространены среди живых организмов. Рас-
смотрим вкратце некоторые сенсорные ретиналь-содержашие белки.
* Хлорофиллсодержащие фотосистемы также обладают лучшими светопоглощающими
свойствами, особенно с учетом функционирования светособирающих антенн, отсутствую-
щих в случае работы бактериородопсина (правда, совсем недавно было обнаружено, что
гомолог бактериородопсина из бактерии Salinibacter ruber содержит в своем составе молекулу
каротиноида, выполняющую, пусть и примитивно, функцию светособирающей антенны)
В любом случае, хлорофиллсодержащие белки не только более эффективно преобразуют
энергию света, но и намного эффективнее ее улавливают.
140
ЧАСТЬ II. Генераторы протонного потенциала
6.5.3. Сенсорный родопсин и фобородопсин
Галофильные археи воспринимают красный свет как аттрактантный
сигнал, а синий — как репеллентный.
При низких интенсивностях света аттрактантное и репеллентное его
действие обеспечивается двумя ретиналь-содержащими пигментами, на-
званными сенсорным родопсином (sR) и фобородопсином (pR). Эти белки-
рецепторы демонстрируют определенное сходство с бактериородопсином.
Так, sR и pR содержат семь трансмембранных колонн. Остаток ретиналя
связан в них посредством альдиминной связи с е-аминогруппой остатка
лизина колонны G.
Сенсорный родопсин имеет максимум поглощения при 590 нм, кото-
рый сдвигается к 370 нм под действием света, вызывающего переход полно-
стью транс ретиналя в 13-цис ретиналь. Освещение 5/?370 вызывает реге-
нерацию формы sR59Q. В темноте это превращение также происходит, но
требует около 1 с, что примерно в 100 раз медленнее, чем аналогичный
процесс в бактериородопсине и галородопсине. По-видимому, образование
долгоживущего продукта необходимо для того, чтобы включить цепь собы-
тий, приводящих к усилению аттрактантного сигнала.
Как показали опыты, слабый длинноволновый свет сенсибилизирует
клетки Н. salinarium к репеллентному действию коротковолнового света.
Этот эффект был объяснен в рамках предположения о том, что sR^, полу-
чающийся из 5А590, служит сенсором репеллентного (синего) света.
Дальнейшие исследования показали, что галофильные археи располага-
ют четвертым ретиналь-содержащим белком, не идентичным bR, hRn sR и
участвующим, наряду с sR, в осуществлении репеллентного эффекта корот-
коволнового света. Его спектральный максимум располагается при 480 нм.
Пигмент, названный фобородопсином (pR), при освещении превращается
в интермедиаты с максимумами при 450 и 360 нм. Последний живет около
0,5 с. Вероятно, он и посылает репеллентный сигнал в систему таксиса.
Интересно, что все четыре ретиналь-содержащих белка Н. salinarium ис-
пользуют один и тот же первичный светозависимый механизм — полностью
транс —> 13-цис изомеризацию ретиналя.
Концентрация и локализация sR и, по-видимому, pR в мембране подоб-
ны таковым для hR: это минорные компоненты, находящиеся в тех областях
мембраны, где нет бактериородопсина. Как показали расчеты, сенсорные
родопсины должны быть связаны с какой-то мощной системой усиления
сигнала, поскольку для аттрактантного эффекта достаточно всего 20 кван-
тов света, а для репеллентного и того меньше — 1—2 кванта.
Удивительным образом оказалось, что у Н. salinarium аттрактантное
действие красного света обеспечивается не только сенсорным родопсином
sR, но и обычным бактериородопсином. В лаборатории одного из авторов
(В.П.С.) этого учебника К. Льюисом было показано, что при большой ин-
тенсивности красного света его аттрактантный эффект в основном обуслов-
лен протон-транспортной активностью бактериородопсина. Ингибирование
не зависящих от света ДЦн+-генераторов (дыхания цианидом, Н+-АТРазы
Глава 6. Бактериородопсин
141
ДЦКД) резко увеличивает ответ галофильных архей на интенсивный крас-
ный свет. По данным, полученным в той же лаборатории С. И. Бибиковым,
этот эффект отсутствует у штамма, лишенного бактериородопсина, но на-
блюдается у содержащих бактериородопсин штаммов, лишенных sR и pR.
Механизм данного явления состоит, по всей вероятности, в следующем:
на свету бактериородопсин образует ДЦН+, а повышение ДЦН+ регистриру-
ется клеткой посредством «протометра» — особой сенсорной системы, из-
меряющей протонный потенциал. Предполагается, что протометр посылает
аттрактантный сигнал Н+-моторам жгутиков, если ДЦН+ растет. Таким об-
разом, бактериородопсин, не являясь специализированным фотосенсором,
тем не менее участвует в восприятии света как аттрактантного стимула,
когда интенсивность света достаточно велика, чтобы привести в действие
большое количество молекул бактериородопсина и тем самым повлиять на
уровень ДЦН+. Существенно, что в этих условиях, т.е. на сильном свету, из-
мерение света посредством sR оказывается неудобным из-за слишком высо-
кой чувствительности sR. Иными словами, у прокариот бактериородопсин
и сенсорный родопсин играют ту же роль, что соответственно колбочки
(зрение на сильном свету) и палочки (сумеречное зрение) в нашем глазу.
6.5.4. Родопсин животных
Родопсин животных, или зрительный родопсин, открытый за сто лет до
бактериального, служит светочувствительным пигментом фоторецепторных
клеток глаза. Он ответственен за поглощение световых квантов и включе-
ние системы обработки светового сигнала.
Родопсин быка содержит 348 аминокислотных остатков, что на сто
остатков больше, чем у бактериородопсина. Аминокислотная последова-
тельность этого белка, расшифрованная Ю.А. Овчинниковым и сотрудни-
ками, резко отличаясь от таковой бактериородопсина, тем не менее хорошо
подходит для формирования структуры с семью а-спиральными колоннами,
пронизывающими мембрану. Семь гидрофобных последовательностей той
же протяженности, что и в бактериородопсине, связаны гидрофильными
последовательностями разной длины. Дополнительные сто аминокислот,
упомянутые выше, локализованы в более длинных, чем у бактериородоп-
сина, концевых последовательностях, а также в связках между колоннами.
Особенно велика петля между пятой и шестой колоннами.
Кроме «семиколонной» организации мембранной части белка, родоп-
сины архей и животных имеют целый ряд общих структурных особенно-
стей. В частности, в обоих случаях ретиналь присоединен к белку через
е-аминогруппу остатка лизина (у бактериородопсина это Zys-216, а у ро-
допсина животных — £ys-296), локализованного в ближайшей к С-концу
седьмой (G) а-спирали, а Шиффово основание в темноте протонировано.
Животный родопсин, подобно бактерио- и галородопсину, оказался спо-
собным к генерации ДТ за счет энергии света.
Первые этапы фотоцикла в двух родопсинах также похожи. В обоих
случаях были описаны следующие последовательные спектральные сдвиги:
142
ЧАСТЬ II. Генераторы протонного потенциала
1) очень быстрый (пикосекунды) длинноволновый сдвиг; 2) его обращение
в микросекундной шкале и 3) более медленный сдвиг в коротковолновую
область спектра. Как в бактериальном, так и в животном родопсинах про-
исходит светозависимая изомеризация ретиналя, однако вместо «полностью
транс 13-4<мс» изомеризации, описанной у галофильных архей, в случае
зрительного пигмента наблюдается переход из 11 -цис в полностью транс
форму.
Функциональные различия пигментов животных и архей связаны глав-
ным образом с судьбой коротковолнового интермедиата (соответственно
МП и М412).
1. Образование этого интермедиата, в обоих случаях сопровождающее-
ся депротонированием Шиффова основания, приводит к выделению Н+ в
воду бактериальным (но не животным) родопсином.
2. В случае животного родопсина интермедиат МП «живет» несколько
минут. Время жизни бактериородопсинового М4П измеряется миллисекун-
дами.
3. МП не может спонтанно превращаться в исходную форму родопсина.
Он распадается на свободный полностью транс ретиналь и опсин, который
требует 11-цис ретиналя, чтобы регенерировать родопсин.
4. Родопсин, превратившись в МП, приобретает способность специфи-
чески взаимодействовать с другим белком, названным трансдуцином.
Такое взаимодействие приводит к замене GDP, связанного с трансду-
цином, на GTP, что вызывает следующие процессы. Комплекс трансдуцин-
GTP активирует фосфодиэстеразу, расщепляющую cGMP. В результате
снижается концентрация cGMP и закрываются №+-каналы плазматиче-
ской мембраны, требующие cGMP в качестве активатора. Закрытие каналов
повышает сопротивление этой мембраны, что в свою очередь ведет к повы-
шению ДТ. Последняя постоянно генерируется Na+/K+-ATPa3oft плазмати-
ческой мембраны фоторецепторных клеток.
При работе этой системы происходит умножение светового сигнала:
1) одна молекула долгоживущего интермедиата Л///способна заменить GDP
на GTP в сотнях молекул трансдуцина; 2) одна молекула активного тройно-
го комплекса фосфодиэстераза-трансдуцин-GTP успевает расщепить сотни
молекул cGMP, пока связанный GTP не гидролизуется до GDP и фосфата,
что приведет к распаду комплекса. Приняв во внимание эти обстоятельства,
можно объяснить, каким образом клетке палочки удается отвечать возбуж-
дением на такую минимальную порцию световой энергии, как одиночный
фотон.
Однако усиление сигнала становится ненужным и даже вредным, когда
световой сигнал содержит не один, а, например, миллион фотонов. В этом
случае более адекватной была бы система, линейно отвечающая на изме-
нение светового потока. Следует отметить, что электрический потенциал,
генерируемый родопсином в плазматической мембране колбочек, оказы-
вается того же направления, что и генерируемый Na+/K4-ATPa3oft (знак
«минус» внутри клетки). Это означает, что способность родопсина образо-
Глава 6. Бактериородопсин
143
вывать ЛЧ7 под действием света, в принципе, может быть использована для
восприятия внезапного и резкого увеличения освещенности, причем это
будет гораздо более быстрый ответ, чем при использовании громоздкой си-
стемы усиления светового сигнала в палочках при низких интенсивностях
света. Другая его особенность в том, что ответ на сильный свет будет само-
произвольно исчезать во времени, так как родопсин — фотоэлектрический
генератор однократного действия: поглощение им кванта ведет к отщепле-
нию остатка ретиналя, и для регенерации исходной формы белка требуется
вновь присоединить к нему 11 -цис ретиналь.
Часть третья
ПОТРЕБИТЕЛИ Дцн
ГЛАВА СЕДЬМАЯ
ХИМИЧЕСКАЯ РАБОТА ЗА СЧЕТ ДЦН
Описано пять ферментных систем, которые можно рассматривать в каче-
стве потребителей ДЦН+, совершающих химическую работу: Н+-АТР-синтаза;
Н+-пирофосфат-синтаза; Н+-трансгидрогеназа; обратная NADH-CoQ-редук-
таза; обратная СоОН2-цитохром с-редуктаза.
В первых двух случаях энергия утилизируется для образования макро-
эргической фосфоангидридной связи (синтеза АТР из ADP и Р, или РР, из
Pi), в трех других — для переноса восстановительных эквивалентов про-
тив градиента редокс-потенциала. Среди всех этих систем особенно важ-
ной представляется Н+-АТР-синтаза, ответственная за взаимопревращение
основных «конвертируемых валют» живой клетки — мембранной (АЦН+) и
водорастворимой (АТР). Вот почему на сегодня Н+-АТР-синтаза относится
к числу наиболее интенсивно изучаемых ферментов.
7.1. Н+-АТР-синтаза
ЕС-АТР-синтаза — фермент, катализирующий обратимое фосфорилиро-
вание ADP неорганическим фосфатом за счет энергии ДЦН+. Обнаружен в ми-
тохондриях, хлоропластах, дышаших и фотосинтезирующих бактериях.
Как будет подробно описано в конце данной главы, во многих анаэроб-
ных бактериях, таких, как, например, Lactococcus casei или Enterococcus hirae,
очень похожий фермент осуществляет обратный процесс (АТР -э ADP + Р, +
+ АЦН+)- Эта функция рассматриваемой системы, единственная у L. casei и
Е. hirae, играет подчиненную роль у аэробных и фотосинтезирующих кле-
ток или органелл.
7.1.1. Субъединичное строение ЕГ-АТР-синтазы
Несмотря на значительное разнообразие встречающихся в живых ор-
ганизмах первичных генераторов ДЦН+ (см. предыдущие главы), Н+-АТР-
синтазные комплексы, выделенные из разных источников, имеют весьма
сходное строение. Каждый из них может быть разделен на два субкомплекса,
Глава 7. Химическая работа за счет Дцн*
145
один из которых отвечает за трансмембранный транспорт протонов (Fo), а
другой — за синтез или гидролиз АТР (Fx)*.
Для Н+-АТР-синтазы Е. coli известен субъединичный состав, амино-
кислотная последовательность и структура оперона. У этой бактерии фак-
тор Fx состоит из пяти типов субъединиц (а—е), а фактор Fo — из трех
(а—с) (табл. 7.1) в следующей стехиометрии: За : Зр : у : 5 : е : а : 2Ь : Юс**.
Молекулярные массы fj, Fo и комплекса FOFX оказались для Е. coli равными
соответственно 381, ~ 145 и ~525 кДа.
Комплекс FOFX Е. coli кодируется одним опероном (ипс, или atp). Его
размер около 7 тыс. пар нуклеотидов. Порядок генов соответствует транс-
ляции матричной РНК, кодирующей субъединицы /, а, Ь, с, 5, а, у, Р и е, где
символом I обозначен гипотетический белок с неизвестными функциями,
который отсутствует в очищенном FOFX.
Митохондриальная EF-ATP-синтаза также состоит из субкомплекса Fx
(шесть типов основных субъединиц), субкомплекса Fo (три типа основных
субъединиц) и еще нескольких дополнительных субъединиц. При этом фак-
тор Fx содержит субъединицы За, Зр, у, 5, е и белок OSCP. Крупные субъе-
диницы (а и Р) очень напоминают таковые Е. coli. Так, в Р-субъединицах
фактора Fx из митохондрий сердца быка, дрожжей, Е. со И и хлоропластов
содержание консервативных последовательностей составляет около 70%.
Подобная ситуация наблюдается и в случае а-субъединицы.
Таблица 7.1. Субъединичный состав Н+-АТР-синтазы Е. coli
Комплекс Е. coli Субъедини- ца Е. coli Аналог субъединицы в митохондриях Молекуляр- ная масса, кДа Количество аминокислотных остатков Количество субъединиц на один
Fl а а 55,0 513 3
Р Р 50,0 459 3
Y Y 31,5 287 1
8 OSCP 19,5 177 1
E 8 И E 15,0 138 1
Fo а а 30,0 271 1
b b 17,0 156 2
с с 8,0 79 10
Сравнение остальных субъединиц факторов Fx из Е. coli и митохондрий
животных показало, что субъединицы у у этих организмов похожи, а 5 и
8 — отличны (см. также рис. 7.5). В первом приближении митохондриаль-
* Кроме ATP-синтаз /^-типа в живых организмах встречаются также весьма сход-
ные с ними ATP-синтазы (АТРазы) VoVr и А^-типа, описанию которых мы посвятим
последние разделы данной главы.
** Количество входящих в фактор Fo субъединиц типа с будет подробно рассмотрено
далее.
146
ЧАСТЬ III. Потребители Дцн+
ные субъединицы 8 и е в сумме соответствуют е-субъединиие Е. coli. Мито-
хондриальный фактор F] содержит дополнительный полипептид, так назы-
ваемый белок, обусловливающий чувствительность к олигомицину (oligo ту с in
sensitivity conferring protein, или OSCP). Этот компонент в основном гомоло-
гичен 5-субъединице Е. coli, но имеет несколько большую молекулярную
массу (21 кДа по сравнению с 19,3 кДа 5-субъединицы Е. coli), содержит
гидрофобный участок вблизи N-концевой последовательности и несколько
протяженных отрезков, гомологичных не 5-, а Л-субъединице Е. coli.
Фактор Ео из митохондрий животных имеет строение, сходное с Е. coli,
и его основными субъединицами являются полипептиды а, b и с. Однако
субъединица b из митохондрий животных несколько видоизменена по срав-
нению с бактериями, и в состав фактора Ео животных входит, по-видимому,
лишь один полипептид типа Ь, а не два. На сегодняшний день принята
следующая стехиометрия основных субъединиц в ATP-синтазе животных —
За : 3f} : у : 5 : е : OSCP : а : b : 8с.
В /Л-ATP-синтазе митохондрий находят несколько дополнительных по-
липептидов, которые отсутствуют у бактерий. Это субъединица A6L факто-
ра Го; фактор Г6 (9 кДа); белковый ингибитор фактора Е\ с массой 9,5 кДа,
субъединица d с массой 18,5 кДа, которая наряду с F6 и OSCP необходима
для правильного связывания Fx с Го, и некоторые другие субъединицы.
У животных и дрожжей все субъединицы фактора Е\ закодированы в
ядерном геноме и синтезируются в цитоплазме. Среди компонентов факто-
ра Fo дрожжей митохондриальным геномом кодируются субъединицы а, с и
A6L. Все прочие субъединицы имеют соответствующие гены в ядре. В гено-
Рисунок 7.1. Структура каталитической
части Н+-АТР-синтазы\ изолированный
фактор Г| из митохондрий сердца быка
(негативный контраст); электронно-
микроскопические фотографии 379 про-
екций пяти основных типов суммированы
с использованием системы анализа изо-
бражений
ме митохондрий животных присутству-
ют два перекрывающихся гена, коди-
рующих субъединицы а и A6L фактора
Го; все остальные субъединицы (в том
числе и с) кодируются в ядре.
Субъединичный состав Н -АТР-
синтазы хлоропластов, обозначаемой
CF0CF}, в основном подобен таковым
бактерий. Фактор Fx имеет субъединич-
ный состав За : Зр : у : 5 : е. При этом
е-субъединица представляет собой по-
липептид бактериального типа. В то же
время фактор CFO содержит не три, а
четыре типа основных субъединиц — а,
Ь, Ь' нс (субъединица Ь' является близ-
ким гомологом субъединицы Ь) в пред-
полагаемой стехиометрии — а : b : Ь' :
14с. Отметим, что в состав СГ0 входит
не гомодимер субъединиц Ь, а гетеро-
димер из двух разных (но довольно по-
хожих) субъединиц b и /Л
Глава 7. Химическая работа за счет Дцн+
147
7.1.2. Трехмерная структура и расположение в мембране
Н+-А TP-синтазный комплекс так велик, что выдается в воду на довольно
большое расстояние с одной стороны мембраны. Выступающая часть, которая
представляет собой фактор Fx, обращена в цитоплазму бактерий, матрикс
митохондрии или строму хлоропласта.
Негативное окрашивание вывернутых субмитохондриальных пузырьков
выявляет грибовидные выросты диаметром около 9 нм, располагающиеся по
всей поверхности мембраны. Как показал Э. Ракер, выросты исчезают по-
сле сильного механического перемешивания суспензий пузырьков в раство-
ре, содержащем этилендиаминтетраацетат (ЭДТА) — комплексон на ионы
Mg2+. Этот процесс сопровождается потерей способности пузырьков син-
тезировать и расщеплять АТР, а также появлением в растворе сферических
частиц диаметром 9 нм, обладающих АТРазной активностью. Реконструк-
ция сферических частиц с мембраной пузырьков возвращает последним
ATP-синтазную и АТРазную активности. Из этих наблюдений Э. Ракер за-
ключил, что выступы представляют собой каталитическую часть Н+-АТР-
синтазы, т.е. фактор Fx. После отшепления фактора Fx в мембране остается
часть Н+-АТР-синтазы, ответственная за перенос ионов Н+ (фактор Fo), что
приводит к значительному увеличению протонной проводимости этой мем-
браны. Результаты компьютерного анализа электронных микрофотографий
фактора Fx суммированы на рис. 7.1. Фронтальная проекция фактора Fx
имеет диаметр порядка 10 нм.
Рисунок 7.2. Э. Ракер
Рисунок 7.3. Дж. Уокер
148
ЧАСТЬ HL Потребители Дцн+
Рисунок 7.4. Структура основной части
фактора F] митохондриальной Н+-АТР-
синтазы. Различные субъединицы выделе-
ны следующими цветами: а — красный,
Р — желтый, у — синий, 8 — зеленый,
е — фиолетовый [Stock et al., 2000; Curr.
Opin. Struct. Biol., 6: 672-679]
В настоящий момент трехмерная
структура основной части митохондри-
ального фактора Fx определена с вы-
соким разрешением (2,4 А) методом
рентгеноструктурного анализа. Эта
работа была удостоена Нобелевской
премии в 1997 г. (Дж. Уокер, рис. 7.3).
Как видно на рис. 7.4, большая часть
Fx построена из субъединиц а, р и у в
стехиометрии 3:3:1. Эти субъединицы
образуют сферическую глобулу. Цен-
тральная часть этой глобулы состоит
из очень длинных а-спиральных участ-
ков у-субъединицы, вокруг которой,
попеременно чередуясь, расположены
субъединицы аир (это расположение
часто сравнивают с положением до-
лек в апельсине). Важно отметить, что
у-субъединица в центре глобулы за-
нимает несколько асимметричное по-
ложение, по-разному взаимодействуя
с различными субъединицами аир.
Субъединица у значительно выступа-
ет за пределы 3а:3|}-глобулы с одной
из ее сторон. Эта выступающая часть
у-субъединицы вместе с субъединица-
ми 5 и с образует «стержень» фактора
Fx, связывающий его с фактором Fo.
Интересно отметить: а- и р-субъединицы содержат в своем составе по
одному центру для связывания нуклеотидов. Нуклеотид-связывающий до-
мен обнаружен также и в составе у-субъединицы. Однако при физиоло-
гических условиях этот домен, по-видимому, не способен к связыванию
нуклеотидов и выполняет чисто структурную роль.
О трехмерной структуре остальной части ATP-синтазы имеются лишь
косвенные сведения, полученные с помощью дифракции электронов, ЯМР
и за счет анализа первичных последовательностей субъединиц и различных
возможностей их кросс-сшивок в составе FOF}-комплекса. Комплекс FOF{
схематично изображен на рис. 7.5.
Трехмерная структура с-субъединицы Е. coli в гидрофобном растворителе
была определена методом ЯМР. Эта субъединица состоит из двух трансмем-
бранных а-спиральных колонн, соединенных между собой с цитоплазмати-
ческой стороны мембраны петлей из полярных аминокислотных остатков
(см. рис. 7.6). С-концевая а-спиральная колонна содержит в своем составе
(где-то на уровне середины гидрофобного слоя мембраны) консервативный
остаток аспартата (Asp-61), играющий ключевую роль в процессе трансмем-
бранного транспорта протонов. В составе фактора Fo присутствует олиго-
мер, состоящий из 8—14 субъединиц типа с. Совсем недавно строение этого
Глава 7. Химическая работа за счет Дцн+
149
Рисунок 7.5. Схематическое изображение современных представлений о структуре FoFr АТР-
синтазы из митохондрий эукариот (слева) и бактерий (справа) [Stock et al., 2000; Curr. Opin. Struct.
Biol., 6: 672—679]. Две р-субъединипы (желтый цвет) в основном прикрыты а-субъединицами,
третья р-субъединица не показана. Не показаны также субъединица A6L и другие мелкие
субъединицы митохондриального фактора Fo, отсутствующие у бактерий [Stock et al., 2000;
Curr. Opin. Struct. Biol., 6: 672—679]
с-олигомера 1Ча+-АТР-синтазы бакте-
рии Ilyobacter tartaricus было изучено с
помощью рентгеноструктурного анали-
за. Как видно на рис. 7.7, с-субъединицы
образуют в мембране «хоровод», как бы
состоящий из двух вложенных колец.
Внешнее кольцо состоит из С-концевых
ос-спиральных колонн с-субъединиц, а
внутреннее кольцо — из их N-концевых
ос-спиральных колонн. Предполагается,
что количество с-субъединиц может ва-
рьировать в ATP-синтазах из различных
организмов, а возможно, даже и в одном
организме при различных условиях его
функционирования. Так, считается, что
в состав ATP-синтазы митохондрий жи-
вотных входит 8 с-субъединиц, мито-
хондрий дрожжей — 10 с-субъединиц,
в состав ATP-синтазы хлоропластов —
14 с-субъединиц, а в состав натриевой
ATP-синтазы I. tartaricus — 11. Как мы
увидим далее, переменная стехиометрия
с-субъединиц может иметь существен-
ное физиологическое значение, приводя
к переменному соотношению Н+/АТР.
pH 8 pH 5
Рисунок 7.6. Структура с-субъединицы
РоР\-АТР-синтазы Е. coli в гидрофобном
растворителе, определенная методом
ЯМР, для депротонированной (зеленый
цвет, pH 8) и протонированной (желтый
цвет, pH 5) форм [Rastogi & Girvin 1999,
Nature, 402: 263-268]
150
ЧАСТЬ III. Потребители Дцн+
Рисунок 7.7. Структура с-олигомера натриевой АТР-синтазы /. tartaricus. (А) вид перпендикулярно
мембране, (Б) вид параллельно плоскости мембраны. Разные с-субъединицы указаны разным
цветом. Синие сферы — связанные ионы натрия [Meier et al., 2005; Science, 308: 659—662]
Как видно на рис. 7.8, в составе FOF\-комплекса олигомер с-субъединиц
соединен с фактором F\ посредством стержня АТР-синтазы. Важно от-
метить, что стержень занимает асимметричное положение относительно
с-олигомера, взаимодействуя с
(а)
8
3
о<
3
Рисунок 7.8. Стереоизображение Frc10 комплекса
из митохондрий S. cerevisiae. Вид сбоку (а) и вид
снизу (Ь). Справа внизу изображены схемы с указа-
нием расположения субъединиц [Stock et al., 2000;
Curr. Opin. Struct. Biol., 6: 672—679]
полярными петлями лишь шести
из его субъединиц.
О структуре остальных субъ-
единиц фактора Fo сегодня из-
вестно крайне мало. Исходя из
анализа первичных последова-
тельностей, предполагают, что
^-субъединица гидрофобна и об-
разует пять «-спиральных транс-
мембранных столбов, в которых
имеется несколько консерва-
тивных остатков заряженных
аминокислот (в случае с Е. coli
это Arg-210, His-245, Glu-196 и
Glu-219). Не исключено, что эти
остатки участвуют в формирова-
нии трансмембранного протон-
переносящего пути, образуемого
за счет взаимодействия субъеди-
ниц а и с.
Субъединица b более гидро-
фильна и в случае с Е. coli пере-
секает мембрану, по-видимому,
только один раз. Основная
функция этой субъединицы,
Глава 7. Химическая работа за счет Дцн+
151
скорее всего, заключается в формировании так называемой периферической
ножки, также связывающей факторы Fo и Fx (см. рис. 7.5). Предполагается,
что у Е. coli в состав периферической ножки наряду с двумя 6-субъединицами
входит также 5-субъединица. В митохондриальной ATP-синтазе перифери-
ческая ножка сформирована, по-видимому, из субъединиц 6, OSCP, d и F6
в стехиометрии 1:1:1:1.
7.1.3. Гидролиз АТР изолированным фактором f2
Фактор будучи отделен от мембранного сектора Н+-АТР-синтазы,
сохраняет способность гидролизовать АТР до ADP и фосфата. Реакция про-
текает с очень большой скоростью и утрачивает чувствительность к олиго-
мицину, диэтилстильбестролу и низким концентрациям ДЦКД, отличаясь в
этом отношении от АТРазной активности нативного комплекса FOFX.
Показано, что гидролиз АТР фактором Fx происходит путем прямой
атаки молекулой воды ангидридной связи АТР. Этот процесс протекает
без образования ковалентных интермедиатов. Об этом свидетельствуют как
данные опытов по изотопному обмену, так и тот факт, что гидролиз АТР
фактором Fx устойчив к ванадату, гидроксиламину и другим реагентам на
ацил фосфат.
Как было отмечено в предыдущем разделе, установлено, что в факторе
Fx присутствуют шесть потенциальных нуклеотид-связывающих центров: по
одному на каждую а- и р-субъединицу*. Из биохимических экспериментов
известно, что Fx может связывать шесть молекул адениннуклеотидов. Од-
нако лишь центры на р-субъединицах обменивают связанные и свободные
нуклеотиды со скоростями, сопоставимыми со временем оборота данного
фермента. Исходя из этого считается, что в факторе Fx лишь три центра на
р-субъединицах выполняют каталитические функции, в то время как ну-
клеотидные центры на сх-субъединицах выполняют структурную роль (свя-
зывают между собой а- и Р-субъединицы), а также, возможно, участвуют в
регуляции активности АТР-синтазы.
Удивительной особенностью фактора Fx является то, что три катали-
тических центра этого фермента обладают различной аффинностью к ну-
клеотидам. Один из центров («Т-центр», от английского tight) обладает
исключительно высоким сродством к АТР или к ADP + Р, с константой
связывания для них в диапазоне от 10“12 до 10-8 М. Два других центра
(«L-» и «О-» центры, от loose и open соответственно) связывают нуклеотиды
лишь при высокой их концентрации (К, = 10“6—10“3 М) и, по-видимому,
обладают различной избирательностью по отношению к АТР и ADP (см.
рис. 7.9). Различие каталитических центров фактора Fx связано с разны-
ми конформационными состояниями, в которых находятся различные а- и
р-субъединицы этого белка. По-видимому, это обусловлено асимметрич-
* Необходимо отметить, что на самом деле все нуклеотид-связывающие центры рас-
положены в области контактов а- и Р-субъединиц. Однако для простоты изложения мы
будем полностью приписывать эти центры тем субъединицам, большее число аминокис-
лотных остатков которых вовлечено в формирование соответствующих центров.
152
ЧАСТЬ III. Потребители Дцн+
Рисунок 7.9. Схема каталитических сай-
тов FoFpATP-синтазы. Сайт L связы-
вает субстраты ATP-синтазной реакции
(ADP + Pi). Сайт Т обладает очень вы-
соким сродством к АТР или ADP + Р, и
катализирует их энергонезависимое взаи-
мопревращение. В сайте О происходит вы-
свобождение синтезированного АТР (или
связывается АТР при его гидролизе)
Рисунок 7.10. А.Д. Виноградов
ным расположением у-субъединицы
внутри 3а:3р-глобулы.
При низкой концентрации мече-
ного АТР, т.е. в условиях, когда запол-
няется только один центр связывания
нуклеотидов (Т-центр), гидролиз АТР32
фактором F\ идет очень медленно (так
называемый одноцентровьй катализ).
При добавлении к этой смеси избыт-
ка немеченого АТР происходит свя-
зывание «холодного» АТР в L-центре,
что вызывает многократное ускорение
реакции гидролиза АТР32, обусловлен-
ного увеличением скорости высвобож-
дения продуктов АТРазной реакции
(ADP и Pj32) из Т-центра. Таким об-
разом, при связывании второй моле-
кулы АТР в L-центре Т-центр меняет
сродство к нуклеотидам и переходит в
состояние О (другими словами, между
различными центрами фактора Fx на-
блюдается отрицательная кооператив-
ность в связывании нуклеотидов, но
положительная кооперативность в осу-
ществлении катализа). По-видимому,
гидролиз АТР сопровождается после-
довательным изменением конформа-
ции нуклеотид-связывающих центров:
О-»Т—>L... Так, в ходе катализа все
три центра проходят через идентич-
ные конформационные состояния, но
в любое фиксированное время все три
центра находятся в разных конформа-
циях. Было выдвинуто предположение,
что подобный механизм гидролиза АТР
фактором Fx может быть достигнут при
последовательном изменении положе-
ния у-субъединицы относительно раз-
ных а- и р-субъединиц; например, при
ее вращении внутри 3сх:3р-глобулы.
Гидролиз АТР FOFX-комплексом
находится под регуляторным контро-
лем различных параметров энергети-
ческого статуса клетки. Как показали
А.Д. Виноградов и сотрудники, гидро-
лиз АТР изолированным митохондри-
альным фактором Fx сильно тормозится
Глава 7. Химическая работа за счет Ацн+
153
одним из продуктов реакции — ADP. Этот эффект значительно усиливается
в присутствии азида и предотвращается в присутствии сульфита. Установ-
лено, что для удаления ADP из ингибированного фактора находящегося
в составе мембранного FQF}-комплекса, требуется Ацн+. Это означает, что
торможение посредством ADP может развиваться только в том случае, если
ДЦН+ снижен, т.е. именно тогда, когда есть опасность исчерпания фонда АТР
в клетке за счет обращения Н+-АТР-синтазной реакции. В митохондриях
ту же функцию, что и ADP, может выполнять особый полипептид — бел-
ковый ингибитор. Подобно ADP, белковый ингибитор подавляет АТРазную
активность изолированного фактора Fx, а также комплекса FOF} в мембране
в условиях, когда Дцн+ снижен.
7.1.4. Синтез связанного АТР изолированным фактором Ft
В 1982 г. Р. Фелдмэн и Д. Сигмэн показали, что очищенный фактор CF},
полученный из хлоропластов, может синтезировать АТР из прочно связанного
ADP в ответ на добавление в раствор неорганического фосфата. Синтези-
рованный АТР оставался связанным с CFX и мог быть переведен в раствор
только путем денатурации фермента. Позднее появились данные о синтезе
связанного АТР из ADP и Р19 добавленных к раствору митохондриального
фактора Fj.
Теоретический расчет, сделанный в лаборатории одного из авторов,
показывает, что константа равновесия
гидролиза АТР в Т-центре фактора Fx
не превышает 100 и по всей вероят-
ности близка к единице. Это означает,
что синтез связанного АТР в Т-центре
требует гораздо меньше энергии, чем
синтез свободного АТР в растворе (или,
другими словами, сродство Т-центра к
АТР значительно выше, чем к ADP +
Pi). Дело в том, что электронная струк-
тура ангидридной связи в связанном
АТР сильно отличается от свободного
АТР из-за взаимодействия с группами
белка (см. рис. 7.12). Можно предпо-
ложить, что (как это было впервые от-
мечено П.Д. Бойером в 1973 г.) при
синтезе АТР энергия Ацн+ тратится
не на стадии синтеза фосфоангидрид-
ной связи, а на стадии высвобождения
АТР из каталитического центра. Соот-
ветственно при гидролизе АТР энергия
выделяется не при разрыве фосфоанги-
дридной связи, а при связывании АТР
с Т-центром.
Рисунок 7.11. П. Бойер
154
ЧАСТЬ III. Потребители Ацн+
Рисунок 7.12. Структура ADP и Р, в активном центре фактора Fh Цифры у пунктирных пря-
мых — расстояние в А
7.1.5. Проведение протонов через фактор Fo
Удаление фактора из тилакоидов, хроматофоров, суббактериальных
или субмитохондриальных пузырьков приводит к появлению протонной
проводимости через фактор Fo. Протеолипосомы с фактором Fo также ха-
рактеризуются высокой проводимостью для протонов. Эффект снимается
добавлением специфического блокатора Fo дициклогексилкарбодиимида
(ДЦКД). Реконструкция фактора Fo с фактором F} также подавляет утечку
протонов.
В опытах с бактериями показано, что мутация по любой из трех субъе-
диниц фактора Fo приводит к потере его способности проводить протоны.
По-видимому, основную роль в транспорте протонов играют субъединицы
а и с, и трансмембранный протон-переносящий путь формируется в ме-
сте контакта этих субъединиц. В с-субъединицах фактора Fo из различных
организмов содержится остаток аспартата или глутамата, абсолютно необ-
ходимый для переноса протонов (для Е. coli это Аур-61). Он располагается
на расстоянии 1,8 нм от поверхности мембраны, т.е. примерно в середине
гидрофобного барьера. Его замена на Asn или Gin полностью прекраща-
ет как транспорт Н+, так и синтез АТР за счет Ацн+. Трансмембранные
а-спиральные колонны субъединицы а также содержат несколько консер-
вативных остатков заряженных аминокислот (Arg-210, His-245, Glu-196
и Glu-219). Предполагается, что эти остатки участвуют в формировании
протон-проводящего пути.
Глава 7. Химическая работа за счет Дцн+
155
Н+
Рисунок 7.13. Схема возможного меха-
низма транспорта протонов фактором Fo.
Субъединицы а и с показаны соответ-
ственно зеленым и желтым цветом [Junge
et al., 2001; FEBS Lett., 504: 152-160]
Характерной чертой фактора Fo является его чувствительность к ДЦКД.
ДЦКД является ковалентным модификатором карбоксильных групп в их
протонированной форме, и при низких его концентрациях он избирательно
присоединяется к Л$р-61 с-субъединиц ATP-синтазы. Данная модификация
Аур-61 полностью ингибирует Непроводящую функцию Fo. Интересно от-
метить, что для полной инактивации фермента, по-видимому, достаточно
модифицировать лишь один с-полипептид из олигомера этих субъединиц.
Митохондриальный фактор Fo наряду с ДЦКД также ингибируется оли-
гомицином. Выделены мутанты дрожжей, у которых Непроводимость через
Fo резистентна к этому антибиотику. Ответственными за резистентность
оказались два локуса в субъединице а. Оба они консервативны у человека
и мыши. В то же время в я-субъединице Е. coli обнаружен только один из
консервативных локусов, что согласу-
ется с наблюдением о слабом эффекте
олигомицина на ATP-синтазу этой бак-
терии.
Фактор Fo вряд ли представляет со-
бой просто пору, так как зависимость
скорости переноса Н+ через Го имеет
сложную форму с оптимумом при pH
7—9. Эти данные указывают на наличие
нескольких мест связывания иона Н+.
Таких мест в факторе Fo, по-видимому,
два, и они расположены с разных сто-
рон мембраны. Наибольшие значения
Непроводимости были получены для
фактора Го хлоропластов и фотосинте-
зирующих бактерий: -6000 Н+ в секун-
ду на один Го при ДТ = 100 мВ. Однако
даже эта величина, вероятно, слишком низка для Н+-проводящего механиз-
ма типа канала.
Для объяснения перечисленных выше структурных особенностей Го,
кинетических характеристик транспорта протонов этим фактором, а так-
же его инактивации под действием ДЦКД была предложена модель функ-
ционирования фактора Го, представленная на рис. 7.13. Данная модель
основана на постулировании существования в факторе Fo двух протонных
полуканалов с разных сторон мембраны. Перенос протонов между этими
полуканалами происходит параллельно поверхности мембраны за счет пере-
носа протонированного остатка аспартата (глутамата) субъединицы с. Такое
движение карбоксильной группы может быть достигнуто за счет вращения
с-олигомера относительно субъединицы а. При этом данная карбоксиль-
ная группа должна депротонироваться при взаимодействии с субъединицей
а и протонироваться при выходе из этого контакта. Таким образом, при
функционировании рассматриваемого механизма транспорт протонов через
фактор Fq должен быть сопряжен с вращением с-олигомера.
156
ЧАСТЬ III. Потребители Дцн.
7.1.6. Возможный механизм преобразования энергии
-АТР-синтазой
Основные принципы функционирования АТР-синтазы уже были нами
вкратце описаны в предыдущих разделах этой главы. Прежде всего, по-
видимому, ADP и фосфат, связанные с фактором F}, могут образовать свя-
занный АТР без какого-либо притока энергии извне, а энергия требуется для
освобождения связанного АТР из активного центра фактора в воду.
То, что освобождение АТР, связанного фактором действительно
поддерживается энергией ДЦН+, показано в опытах, когда изучали торможе-
ние АТРазы субмитохондриальных пузырьков негидролизуемым аналогом
АТР — 5-аденилилимидодифосфатом (AMPPNP). Короткая предынкубация
пузырьков с AMPPNP в среде с сукцинатом в аэробных условиях полно-
стью снимала торможение АТРазной активности, если ее измеряли в при-
сутствии разобщителя, добавленного после сукцината. Если же разобщитель
был добавлен в среду с субмитохондриальными пузырьками до сукцината,
то в этом случае торможение сохранялось. Именно такого эффекта можно
было ожидать, если ДЦН+, генерируемая при окислении сукцината, удаляет
AMPPNP из каталитического центра.
Встает вопрос, каким же образом энергия ДЦН+ может быть потрачена
для изменения сродства каталитических центров АТР-синтазы к нуклеоти-
дам? Напомним, что транспорт протонов осуществляется в факторе Fo, в
то время как нуклеотид-связывающие центры расположены в факторе Fx.
Таким образом, для совершения химической работы энергия протонного
потенциала должна передаться в белке на большое расстояние. Для осу-
ществления данного сопряжения природой был изобретен очень необыч-
ный механизм, напоминающий функционирование электромотора. Энергия
протонного потенциала вначале преобразуется в механическую энергию (во
вращение ротора FOF{-АТР-синтазы), которая затем тратится на соверше-
ние химической работы (изменения сродства каталитических центров АТР-
синтазы к нуклеотидам), что в итоге приводит к ДЦн+-зависимому синтезу
АТР. Рассмотрим более подробно, как устроено подобное сопряжение.
Как было отмечено выше, у-субъединица в центре 3а:3р-глобулы зани-
мает асимметричное положение, по-разному взаимодействуя с различными
субъединицами аир. Это, по-видимому, приводит к различию свойств трех
(Т, О и L) каталитических центров АТР-синтазы. Так как гидролиз АТР
сопровождается последовательным изменением конформации нуклеотид-
связывающих центров, было бы логично предположить, что гидролиз АТР
может быть сопряжен с вращением у-субъединицы внутри 3а:3р-глобулы.
Эта гипотеза (выдвинута впервые П.Д. Бойером, за что он был удостоен
Нобелевской премии по химии в 1997 г.) была впоследствии подтверждена
серией очень изящных прямых экспериментов. Так, например, японским
исследователем М. Йошидой был выделен упрощенный вариант бактери-
ального фактора F15 состоящий лишь из трех субъединиц (а, р и у) в стехио-
метрии 3а:3р:у. Предварительно молекулярно-генетическими методами из
этих субъединиц были удалены все остатки цистеина, а один остаток этой
аминокислоты был искусственно внесен в домен у-субъединицы, образую-
Глава 7. Химическая работа за счет Ацн+
157
Рисунок 7.14. Схема эксперимента
по визуализации вращения у-субъ-
единицы фактора Fi при катализе им
гидролиза АТР. Субъединицы фактора
Fi выделены следующими цветами:
а — розовый, р — оранжевый, у —
зеленый (по М. Йошида)
Актиновый
ФИЛАМЕНТ
Остаток,
цистеина
Биотин
Стрептавидин
Биотин
СТЕКЛО, ПОКРЫТОЕ
НИКЕЛЕМ
щий стержень ATP-синтазы. Кроме того, к N-концу р-субъединицы была
добавлена последовательность из шести остатков гистидина, связывающая с
высоким сродством ионы никеля. Далее, как показано на рис. 7.14, данный
белок был прикреплен за эту полигистидиновую «ручку» к предметному
стеклу, покрытому ионами никеля, а к единственному остатку цистеина на
у-субъединице с использованием биотин-связывающего белка стрептави-
дина был пришит очень длинный актиновый филамент, несущий флуорес-
центную метку (остатки флуоресцеина). При добавлении к такому препара-
ту субстратов АТРазной реакции можно было наблюдать под микроскопом
вращение флуоресцирующего актинового филамента в направлении против
часовой стрелки. Полный поворот на 360° складывался из трех шаговых
движений с поворотом на 120°. Вращение наблюдалось только в присут-
ствии АТР и Mg2+ и было чувствительно к ингибиторам АТРазной реакции.
Так было прямо показано, что при функционировании фактора F} энергия
гидролиза АТР может быть преобразована в механическую энергию враще-
ния у-субъединицы.
В то же время в составе полного FOF}-комплекса у-субъединица взаи-
модействует не только с 3а:3р-глобулой, но и с олигомером с-субъединиц.
При этом стержень занимает, как уже отмечалось, асимметричное положе-
ние относительно с-олигомера, взаимодействуя с полярными петлями лишь
шести из этих субъединиц. Есть указания на то, что транспорт протонов
через фактор Fo сопряжен с вращением с-олигомера, а значит, и с вра-
щением связанного с ним стержня. Таким образом, посредством враща-
тельного механизма транспорт протонов может быть сопряжен с синтезом
(или гидролизом) АТР этим ферментом. При этом олигомер с-субъединиц
фактора Fo вместе с субъединицами у и е*, образующими стержень фактора
* В случае с ферментом бактериального типа, в митохондриальном ферменте в состав
стержня входят субъединицы у, 5 и е.
158
ЧАСТЬ III. Потребители Дцн+
FH формируют ротор этого мотора, в то время как остальные субъедини-
цы служат статором (см. рис. 7.5). Если исходить из этой гипотезы, станет
понятна роль периферической ножки, связывающей также факторы Fo и
По-видимому, эта дополнительная связь между двумя факторами необхо-
дима, чтобы прикрепить 3а:3р-глобулы к мембранной части фермента и не
допустить вращения 3а:3р-глобулы вместе со стержнем.
Следует подчеркнуть, что многие вопросы функционирования FoFr
АТР-синтазы еще очень далеки от разрешения. Прежде всего, неизвестно,
каким образом транспорт протонов в факторе Fo сопряжен с вращением
олигомера с-субъединиц. Предполагается, что в данном процессе ключевую
роль может играть электростатическое притяжение депротонированного
аниона Asp-61 на субъединице с (т.е. роторе) и катиона одного из положи-
тельно заряженных остатков аминокислот субъединицы а (т.е. статора).
7.1.7. Стехиометрия FT/АТР
Твердо установлено, что для синтеза одной молекулы АТР необходимо
перенести через мембрану более одного протона. Такое заключение базиру-
ется на данных по измерению Ацн+ и концентраций АТР, ADP и фосфата.
Общепринято, что при физиологических концентрациях субстратов и про-
дуктов АТР-синтазы образование АТР «стоит» не менее 44 кДж х моль-1
(10,5 ккал х моль-1). Эта величина соответствует Ацн+, равной 455 мВ при
условии, что стехиометрия Н+/АТР = 1. Указанное значение Ацн+ как ми-
нимум вдвое больше измеренного экспериментально, и если предположить,
что рассматриваемое соотношение выражается целым числом, то минималь-
ная стехиометрия РГ/АТР может быть равна двум.
Экспериментальное определение стехиометрии Н+/АТР в основном ба-
зируется на измерении так называемого от-
ношения P/О на митохондриях при окислении
ими различных дыхательных субстратов. Это
отношение представляет собой количество
синтезированного АТР (или эстерифициро-
ванного фосфата), нормированное на коли-
чество потребленного кислорода (АТР/О или
P/О). Критерий P/О был предложен в 1939 г.
В.А. Белицером и Е.Т. Цыбаковой. Для ми-
тохондрий животных, окисляющих NAD+-
зависимые субстраты или сукцинат, экспе-
риментально измеренные величины P/О, как
правило, оказываются соответственно около
2,7 и 1,6. Так как при окислении NADH и
сукцината ферменты дыхательной цепи пере-
носят через мембрану соответственно 10 и 6
Н+ (см. главу IV), то, исходя из измеренных
величин P/О, можно определить количество
протонов, потребляемых АТР-синтазой для
синтеза одной молекулы АТР. Легко подсчи-
Рисунок 7.15. В.А. Белицер
Глава 7. Химическая работа за счет Ацн+
159
тать, что стехиометрия Н+/АТР в этом случае будет приблизительно рав-
на 4. Однако необходимо учесть, что в митохондриях, фосфорилирующих
внешний (внемитохондриальный) ADP внешним фосфатом, ДЦН+ потребля-
ется не только ATP-синтазой, но также и АТР4“/АОР3“-антипортером и
Н2РО4-,Н+-симпортером. В результате обмен внешних ADP и фосфата на
внутренний АТР сопровождается импортом в митохондрию одного иона Н+.
Таким образом, стехиометрия Н+/АТР собственно комплекса FOFX должна
составлять 4—1=3.
Если верна гипотеза о вращательном механизме функционирования
этого фермента, то поворот ротора FOFX на 360° должен сопровождаться
синтезом трех молекул АТР (так как в данном ферменте присутствуют три
каталитических нуклеотид-связывающих центра). С другой стороны, по-
ворот ротора митохондриального FOF{ на 360° должен приводить к транс-
мембранному переносу восьми протонов (так как в случае с митохондриями
животных в состав с-олигомера входят 8 с-субъединиц). Таким образом,
структурные данные указывают на то, что стехиометрия Н+/АТР для АТР-
синтазы из митохондрий животных должна быть равна 8/3 = 2,7, что до-
вольно хорошо согласуется с экспериментальными данными. Этот пример
иллюстрирует и важность такого параметра, как количество субъединиц,
входящих в состав с-олигомера. Действительно, стехиометрия с-субъединиц
должна иметь исключительно важное физиологическое значение, так как
она определяет такой существенный параметр клетки, как отношение
Н+/АТР. Как было указано ранее, в состав ATP-синтазы хлоропластов вхо-
дят, по-видимому, 14 с-субъединиц*, а в состав натриевой ATP-синтазы I.
tartaricus — 11. Таким образом, различные организмы, исходя из особенно-
стей своего метаболизма, могут варьировать такой исключительно важный
параметр, как «обменный курс» двух энергетических валют клетки — Дцн+
и АТР.
Интересно отметить, что, если исходить из механистических представ-
лений о стехиометрии Н+/АТР (признать, что она должна выражаться це-
лым числом), можно ожидать, что количество с-субъединиц в ферменте
должно быть кратно трем. Однако практически во всех исследованных слу-
чаях наблюдается нарушение 1:3-симметрии, что должно приводить к дроб-
ным величинам отношения Н+/АТР.
7.2. Н+-АТРазы — вторичные Дцн+-генераторы
В данном разделе мы рассмотрим функционирование различных АТРаз
в качестве генераторов протонного потенциала. Наиболее распространен-
ные Ацн+-генераторы используют энергию света или дыхания, чтобы об-
* Эти данные хорошо согласуются с экспериментально измеренной стехиометри-
ей Н+/АТР для ATP-синтазы хлоропластов. У растений фотофосфорилирование ADP
происходит на внешней стороне мембраны тилакоидов. Полученный АТР используется
преимущественно в строме хлоропласта при синтезе глюкозы. В этом процессе портеры
не участвуют, а соотношение Н+/АТР приблизительно равно четырем протонам на одну
молекулу АТР.
160
ЧАСТЬ III. Потребители А|1н*
Глюкоза
Ферменты гликолиза
АТР
Н+-АТРаза
АМн
Н+-метаболит-симпортеры
Аккумуляция
метаболитов
Рисунок 7.16. Схема одного из путей преоб-
разования энергии у анаэробных бактерий,
синтезирующих АТР исключительно с помо-
щью субстратного фосфорилирования
механической (вращение жгутика) работы.
Кроме роли Н+-АТРаз в совершении осмотической или механической
работы, следует отметить еще одну их функцию, а именно регуляцию вну-
триклеточного pH.
Формально любой фермент, способный генерировать ДЦН+ за счет энер-
гии АТР, может рассматриваться как Н+-АТРаза. Выше мы уже отмечали,
что Н+-АТР-синтаза, обычно используемая для образования АТР за счет
энергии ДЦН+, обладает Н+-АТРазной активностью, т.е. может гидролизо-
вать АТР и создавать ДЦН+. По этой причине данный фермент часто назы-
вают Н+-АТРазой. Однако, по нашему мнению, более уместно употреблять
название «Н^-АТ Раза» только в тех случаях, когда основной биологической
функцией фермента служит гидролиз, а не синтез АТР. Введя такое огра-
ничение, к Н+-АТРазам можно будет отнести несколько типов ферментов
разовать протонный потенциал.
АТР не участвует в этом процессе.
Однако иногда путь от использова-
ния энергетических ресурсов к ДЦН+
оказывается более сложным: энер-
гия сначала превращается в АТР и
лишь затем используется для гене-
рации ДЦН+ посредством Н+-АТРаз.
Последние могут быть объединены
термином «вторичные ^^-генера-
торы».
Как правило, Н+-АТРазы оказы-
ваются необходимыми, когда ни свет,
ни энергия дыхания не доступны для
мембраны, совершающей некоторую
работу, связанную с расходом ДЦН+.
Примером такой системы могут быть
анаэробные бактерии, получающие
энергию исключительно с помощью
субстратного фосфорилирования (бро-
жения). У таких бактерий АТР, об-
разованный ферментами гликолиза,
может утилизироваться Н+-АТРазой,
находящейся в цитоплазматиче-
ской мембране. ДЦН+, генерируемая
Н+-АТРазой, используется для со-
вершения осмотической (аккумуля-
ции метаболитов при участии Н+,
метаболит-симпортеров, рис. 7.16) и
(относящихся к классам FOFX, и FiF2), отличающихся по структуре и
механизму действия, но имеющих общую функцию (см. табл. 7.2). Рассмо-
трим эти типы ферментов более подробно.
Глава 7. Химическая работа за счет Ацн+
161
Таблица 7.2. Вторичные Дцн+-генераторы
Фермент Локализация Механизм Функции, поддерживаемые образованной ДЦН+
Н+-АТРаза Цитоплазматическая мембрана облигатно-анаэробных бактерий FOF\ и Ио И, Накопление веществ и регуляция pH в клетке
- х - Внешняя мембрана растений и грибов Е& То же
- х - Тонопласт растений и грибов Ио И, Накопление веществ и регуляция pH в вакуо- ли
- X - Внешняя мембрана клеток не- которых животных ЕхЕ2 и Ио И, Секреция Н+; накопле- ние веществ в клетке
- X - Мембраны секреторных пузырь- ков, эндосом, лизосом, аппарата Гольджи; мембрана эндоплазма- тического ретикулума иои( Накопление веществ и регуляция pH во внутриклеточных пу- зырьках
Н+-АТР- синтаза (об- ращенная) Цитоплазматическая мембрана дышащих или фотосинтезирую- щих бактерий FOFX Накопление вешеств и регуляция pH в клетке, вращение флагелл при отсутствии О2 и света
- х - Внутренняя мембрана митохон- дрий FOF, Транспорт веществ в митохондрии при от- сутствии О2
Н+/К+- АТРаза Внешняя мембрана клеток эпи- телия желудка е,е2 Секреция Н+
7.2.1 Н^-АТРазы Р^-типа
Данные Н+-АТРазы функционируют в цитоплазматической мембране
большинства анаэробных бактерий. Как по набору входящих в их состав
субъединиц, так и по своим структурным и функциональным свойствам
они очень близки к описанным выше Н+-АТР-синтазам /^-типа. Более
того, в мембранах, содержащих Н+-АТР-синтазу, возможна генерация АЦН+
за счет гидролиза АТР вследствие обращения реакции, катализируемой этим
ферментом. Такой эффект наблюдается, например, у некоторых бактерий,
использующих как энергию дыхания или света, так и энергию гликолиза.
Н+-АТРазы могут быть легко разделены на два субкомплекса: протон-
проводящий фактор Го и каталитический фактор Fx. Гидролиз АТР фермен-
тами этого типа чувствителен к азиду, ДЦКД, ауровертину и некоторым
другим ингибиторам Н+-АТР-синтаз. Катализируемая Н+-АТРазами реак-
162
ЧАСТЬ III. Потребители Ацн+
ция обратима. Так, эти ферменты способны осуществлять синтез АТР за
счет энергии АТ, искусственно созданной при выходе из бактерий ионов
К+ в присутствии валиномицина.
К наиболее изученным представителям этого класса ферментов можно
отнести Н+-АТРазы таких анаэробных бактерий, как Lactobacillus easel и
Enterococcus hirae.
АТРазы РоИ-типа состоят из
С,а 5
В а
А А Р Р
7.2.2. Н^-АТРазы V0V1-muna
Н+-АТРазы ИоИ-типа очень близки к описанным выше Н+-АТР-
синтазам (Н+-АТРазам) /^-типа, однако отличаются от них целым ря-
дом структурных и функциональных свойств, что позволяет выделить их
в особый класс данных ферментов. Примером фермента Ио^-типа может
быть Н+-АТРаза тонопласта — мембраны, ограничивающей вакуоли кле-
ток растений и грибов. К этому же типу Н+-АТРаз относятся ферменты,
обнаруженные в различных мембранных органеллах эукариот, таких, как
секреторные пузырьки, эндосомы, лизосомы и мембраны аппарата Голь-
джи. Н+-АТРазы Ро^-типа иногда также функционируют в плазмалемме
некоторых эукариотических клеток, а также в цитоплазматической мембра-
не небольшого количества облигатно анаэробных прокариот (например, у
некоторых клостридий).
двух субкомплексов, один из которых в
составе полного фермента отвечает за
трансмембранный транспорт протонов
(Ио), а другой — за гидролиз АТР (Kj).
Однако, в отличие от ATP-синтаз FOF\-
типа, при диссоциации АТРаз Ио Kj-типа
субкомплексы и V\ теряют способ-
ность к осуществлению своих частных
активностей.
В случае вакуолярной К0К]-АТРазы
состоит из восьми субъединиц (А—Н).
Субъединицы А и В несут в своем со-
ставе нуклеотид-связывающие центры*
и образуют ЗА:ЗВ-глобулу наподобие
За: 30-глобулы ATP-синтаз FOF} -типа.
Субъединицы С, Е, F и Н (в стехио-
метрии 1:1:1:1) образуют, по-видимому,
стержень фермента РЗ^-типа, тогда
как субъединицы D и G (в стехиоме-
трии ID: 2G) — периферическую нож-
ку (рис. 7.17)**.
Фактор Ио состоит из пяти субъединиц af d, с, с' и с". Субъединицы
с, с' и с" гомологичны друг другу. Они демонстрируют значительное сход-
Е O,2G У g 2Ь
F d
а с с с
с с с" а
Рисунок 7.17. Сравнительное изображе-
ние структуры АТРаз Ио^-типа (слева) и
Го/7!-типа (справа) [Lolkema et al., 2003;
J. Bioenerg. Biomembr., 35: 323—335]
* Каталитические центры находятся только в субъединицах А.
** По последним данным таких ножек в Ио^-АТРазе две.
Глава 7. Химическая работа за счет Дцн+
163
ство с субъединицей с ATP-синтаз ГоГгтипа. Однако субъединицы с и с'
фактора Ио в два раза больше субъединицы с фактора Fo, представляя со-
бой дуплицированный вариант этой субъединицы. Они содержат в своем
составе не 2, а 4 трансмембранные а-спирали. Что касается субъединицы
с", то она приблизительно в 2,5 раза больше субъединицы с фактора Fo и
содержит в своем составе 5 трансмембранных колонн. Существенно, что
во всех с-субъединицах фактора Ио сохранилось лишь по одному консер-
вативному остатку глутамата (аспартата). Ранее считалось, что с-олигомер
фактора Ио содержит приблизительно такое же количество трансмембран-
ных а-спиралей, как и с-олигомер фактора Fo. Если это так, то из-за умень-
шенного в два раз количества активных карбоксильных групп Р^-АТРаза
должна обладать в два раза более низкой стехиометрией Н+/АТР по срав-
нению с ферментом FoFi-™na. Выдвигалось предположение, что за счет
дупликаций и слияний с-субъединиц с потерей одного из остатков карбок-
силата природой был получен фермент, характеризующийся пониженной
стехиометрией Н+/АТР и потому более приспособленный для осуществле-
ния Н+-АТР-синтазной реакции в обратном направлении, т.е. функцио-
нирующий in vivo исключительно в качестве Н+-АТРазы. Однако совсем
недавно с помощью рентгеноструктурного анализа было показано, что на-
триевая Ео^-АТРаза из Enterococcus hirae содержит олигомер, состоящий
из 10 с-субъединиц, т.е. соотношение Na+/ATP для этого фермента должно
быть таким же, как соотношение Н+/АТР у Н+-АТР-синтазы Е. coli.
Транспорт Н+ и АТРазная активность ферментов Ко И)-типа подавляются
уникальным набором ингибиторов, включающим нитрат, N-этилмалеимид,
триалкил-олово и высокие концентрации ДЦКД. Олигомицин и ДЦКД в
низких концентрациях (ингибиторы Н+-АТР-синтазы ЕоЕ)-типа) не влияют
на Н+-АТРазу тонопласта.
7.2.3. FE-АТРазы Е^-типа
Н+-АТРазы Е1Е2-типа представляют собой очень длинный полипептид
(порядка 100 кДа), которому может сопутствовать меньшая субъединица,
имеющая скорее регулярные, чем каталитические функции. Реакция начи-
нается с фосфорилирования одного из остатков аспартата большой субъе-
диницы, что вызывает ее конформационный переход, обозначаемый ЕХ-^Е2.
Этот переход сопровождается снижением свободной энергии гидролиза
фосфориласпартата. Последующее дефосфорилирование фермента регене-
рирует исходную форму ЕР Описанный механизм подобен такому Na+/K+-
АТРазы и Са2+-АТРазы (см. разд. 12.5.2). Е)Е2-АТРазы описаны для внеш-
них клеточных мембран растений и грибов. Такая же структура обнаружена
у Н+/К+-АТРазы эпителия желудка.
Активность Е1Е2-АТРаз чувствительна к ванадату, гидроксиламину и
диэтилстильбэстролу, но устойчива к основным ингибиторам АТРаз ЕОЕХ- и
Р0Р1-типа (олигомицину, азиду, нитрату и т.д.).
164
ЧАСТЬ III. Потребители Дцн+
Рисунок 7.18. Схема работы
Н+-АТРазы Е]Е2-типа. Н* и
Н+о — соответственно ионы
Н+ внутри и снаружи клетки
7.2.3.1. РГ-АТРаза внешней клеточной мембраны растений и грибов
Во внешней клеточной мембране растений и грибов (плазмалемме) на-
ходится фермент, откачивающий ионы Н+ из клетки за счет энергии АТР.
Транспорт Н+ носит электрогенный характер. Н+-АТРаза, о которой идет
речь, относится к Е^-типу. В процессе реакции возникает аспартилфос-
фатный интермедиат, чувствительный к ванадату и гидроксиламину. Инги-
биторами служат также диэтилстильбэстрол и ДЦКД.
Очистка Н+-АТРазы показала, что это одиночный полипептид с массой
несколько больше 100 кДа. Его содержание во внешней мембране достигает
15% от общего количества белка.
Механизм реакции Н+-АТРазы внешней мембраны, по-видимому, ана-
логичен таковому других ЕхЕ2-АТРаз (см. разд. 12.5.2, рис. 7.18). Н+-АТРазы
из мембран грибов и растений были реконструированы в протеолипосомы.
В этой системе была показана обратимость гидролиза АТР, когда ДЧ7, ис-
кусственно созданная диффузией К+, использовалась для синтеза АТР.
Определенный биологический смысл имеет то обстоятельство, что Н+-
АТРаза внешней мембраны характеризуется оптимумом pH между 6 и 7.
При pH выше 7,0 активность фермента резко падает. Создается впечатле-
ние, что Н+-АТРаза, откачивая ионы Н+ из цитоплазмы, используется клет-
кой, чтобы предотвратить закисление внутриклеточного объема. Вероятно,
регуляция внутреннего pH есть одна из функций Н+-АТРазы плазмалеммы.
В то же время очевидна и другая функция этого фермента: образуемая им
Дцн+ используется для концентрирования в клетке различных веществ, кото-
рые транспортируются туда вместе с протонами (см. главу 9).
7.2.3.2. РГ/1С-АТРаза слизистой желудка
Особая АТРаза, образующая Дцн+, была обнаружена во внешней мембра-
не клеток слизистой желудка. Фермент осуществляет электронейтральный
обмен внутриклеточного Н+ на внешний К+, тем самым закисляя среду в
желудке. Он был назван ЕЕ /К: -АТРазой. Н+/К+-АТРаза очищена и рекон-
струирована в протеолипосомы.
Глава 7. Химическая работа за счет Дцн+
165
Рисунок 7.19. Схема работы
/Л/А^-АТРазы
Установлено, что ЕС/К*-АТРаза принадлежит к ЕхЕ2-типу, фермент со-
держит полипептид массой около 100 кДа. Гидролитическая реакция про-
текает с образованием фосфорилированного интермедиата. Активность
тормозится ванадатом и гидроксиламином. В то же время структуре Н+/К+-
АТРазы присуща специфическая особенность. Этот фермент, по-видимому,
построен из трех подобных, но не идентичных субъединиц с молекулярны-
ми массами порядка 100 кДа.
Механизм работы ЕС/К*-АТРазы состоит в следующем. Комплекс К+ и
фермента в Ех-конформации связывает АТР и Н+ на цитоплазматической
поверхности плазмалеммы, окружающей клетку слизистого эпителия же-
лудка. При этом К+ высвобождается в цитоплазму. В тройном комплексе
(£]• АТР» Н+) фосфорил с АТР переносится на одну из карбоксильных групп
фермента. В результате образуется интермедиат H+ Ei~P. Затем происходит
конформационный переход (Е} —>£2), сопровождающийся переброской ио-
на Н+ через гидрофобный барьер мембраны. Полученный комплекс Н+£2-Р
не способен фосфорилировать ADP. Замена Н+, связанного с £2-Р, на вне-
клеточный К+ приводит к выделению Н+, который оказывается в просвете
желудка. Кроме того, связывание иона К+ вызывает гидролиз £2-Р. Следую-
щий за этим переход £2->£j завершает цикл (см. рис. 7.19). Аналогичный
фермент был также описан и в эпителии толстой кишки.
7.2.4. Соотношение функций tC-АТРаз
Н+-АТРазы обычно выполняют две основные функции: энергизацию
мембраны и создание нужного pH в одном из двух отсеков, разделенных
мембраной.
У анаэробных бактерий, живущих за счет гликолиза, гликолитический
АТРгидролизуется ЕС-АТРазой, чтобы образовать Дцн+ и затем использовать
ее при аккумуляции веществ среды внутрь клетки.
В то же время нельзя не учитывать роль Н+-АТРазы, откачивающей
ионы Н+ из клетки, в борьбе с закислением цитоплазмы, тенденция к кото-
рому всегда существует в бактериях-анаэробах, сбраживающих нейтральные
сахара до кислых конечных продуктов. Последняя функция присуща также
166
ЧАСТЬ III. Потребители А|1Н+
и Н+-АТРазе плазмалеммы растений и грибов, которая активируется при
падении цитоплазматического pH ниже 7,0. По-видимому, при кислых pH
не генерация Дцн+ для совершения осмотической работы, а откачка про-
тонов становится ведущей функцией этой Н*-АТРазы.
Функцией группы Н+-АТРаз животных тканей является закисление сре-
ды внутри пузырька. Именно это происходит в лизосомах, эндосомах и,
может быть в аппарате Гольджи и эндоплазматическом ретикулуме. В этих
случаях АТ, генерируемая Н*-АТРазой, превращается в АрН посредством
электрофоретической аккумуляции какого-либо аниона, например СГ. В ли-
зосомах закисление внутренней среды создает оптимальный pH для работы
литических ферментов. По сути дела, лизосомальные ферменты не активны
при нейтральных pH, типичных для цитозоля. В результате компоненты ци-
тозоля не могут быть переварены каким-либо лизосомальным ферментом,
если он выйдет из лизосомы. Вероятно, кислый pH необходим также для
работы эндосом и некоторых других цитоплазматических включений, рас-
полагающих Н+-АТРазами.
Иную роль играют Н+-АТРазы плазматических мембран некоторых ти-
пов клеток в почках и эпителии мочевого пузыря. Они участвуют в транс-
клеточном переносе кислотных эквивалентов. Для выполнения этой функции
также необходим переход АЧ7 -э АрН. В случае Н+/К+ -АТРазы слизистой
желудка, тоже специализированной на функции транспорта кислотных эк-
вивалентов, проблема решается за счет электронейтрального эквивалентно-
го обмена Н+ на К+.
По-видимому, эта АТРаза переносит только один ион Н+ на каждую
молекулу АТР, что открывает возможность создания очень больших (со-
гласно термодинамическим расчетам — до 7 единиц pH) градиентов кон-
центрации водородных ионов между цитоплазмой и внеклеточной средой.
В хромаффинных гранулах и некоторых других секреторных пузырьках
^^-генерирующая функция Н*-АТРазы является ведущей, так как аккуму-
ляция секретируемых веществ поддерживается энергией протонного потен-
циала.
В заключение хотелось бы отметить, что в большинстве эукариотиче-
ских клеток одновременно функционируют Н*-АТРазы (Н*-АТР-синтазы)
всех трех вышеперечисленных типов. Так, в митохондриях и хлоропластах
присутствуют /^-Н^-АТР-синтазы, в остальных мембранных органеллах
клетки — К0И]-Н+-АТРазы, тогда как в плазмалемме функционирует АТРаза
EjE2-™na.
7.3. Н+-Пирофосфат-синтаза (Н+-Пирофосфатаза)
Как описано в разд. 1.4.1, при необходимости затратить большее коли-
чества энергии, чем может быть получено при гидролизе АТР до ADP и Рь
в ходе различных метаболических процессов (таких, как синтез ДНК, РНК,
полипептидов, при активации жирных кислот, глюкозы и т.д.) происходит
гидролиз АТР до АМР и пирофосфата (РР,):
Глава 7. Химическая работа за счет Дцн+
167
синтез РНК. (NMP)n + NTP -> (NMP)n+1 + РР.;
синтез ДНК (dNMP)n + dNTP -> (dNMP)n+1 + РР.;
синтез белков', аминокислота 4- тРНК -» аминоацил-тРНК 4- РР,;
синтез гликогена и крахмала', глюкозо-1-фосфат 4- АТР -»
-» ADP-глюкоза 4- РР,;
активация жирных кислот'. R—СООН 4- HS-CoA 4- АТР ->
-> R-CO-S-CoA + АМР + PPj.
Образованный в ходе этих реакций пирофосфат в клетках большинства
организмов необратимо гидролизуется растворимой пирофосфатазой'.
PPi +Н2О -> 2Pj.
Эта реакция необходима для того, чтобы удерживать концентрацию пи-
рофосфата на очень низком уровне и тем самым «тянуть за собой» АТР-за-
висимые биосинтезы, сопровождающиеся образованием PPj.
Однако существуют исключения из правила, согласно которому пиро-
фосфат немедленно расщепляется растворимой пирофосфатазой. В клетках
растений и некоторых микроорганизмов растворимая пирофосфатаза либо
отсутствует, либо ее активность находится на крайне низком уровне. В этих
случаях стационарная концентрация пирофосфата в цитоплазме может быть
довольно высока (так, у высших растений цитоплазматическая концентра-
ция PPj приблизительно равна 0,3 мМ), и энергия гидролиза PPj может быть
потрачена на совершение какой-нибудь работы.
Действительно оказалось, что в тонопласте растительных вакуолей со-
держится особый фермент — мембраносвязанная Н+-транслоцирующая
пирофосфатаза, катализирующая сопряженный с гидролизом пирофосфата
трансмембранный перенос протонов. Между вакуолью и цитозолем суще-
ствуют значительные градиенты pH, ионов и метаболитов. Основным фер-
ментом, создающим AjiH+ как движущую силу для этого транспорта веществ
в сторону большей их концентрации, является Н+-АТРаза Р^-типа. Одна-
ко наряду с данным ферментом в тонопласте растений действует еще один
протонный насос — Н+-пирофосфатаза. Более того, в некоторых тканях
растений активность этого фермента может быть существенно выше актив-
ности V-АТРазы.
Очень похожий фермент был также обнаружен у некоторых прокари-
от (как у бактерий, так и у архей). Еще в 1966 г. М. Балчевски и сотруд-
ники описали образование неорганического пирофосфата хроматофорами
Rhodospirillum rubrum под действием света. Позднее было найдено, что в
темноте пирофосфат, подобно АТР, энергизует мембрану хроматофоров.
В хроматофорах был также показан протонный контроль пирофосфатазной
активности, которая возрастала в восемь раз при рассеивании Дцн+. Опыты в
группе одного из авторов (В.П.С.) показали, что гидролиз пирофосфата гене-
рирует ДЧ7 на мембране хроматофоров, а также протеолипосом, содержащих
168
ЧАСТЬ III. Потребители Дцн+
Рисунок 7.20. М. Балчевски
очищенную пирофосфатазу Rh. rubrum. Таким об-
разом, мембраносвязанная Н+-транслонируюшая
пирофосфатаза (Н+-пирофосфат-синтаза) ката-
лизирует обратимое взаимопревращение энергии
между Дцн+ и пирофосфатом.
Казалось бы, функция Н+-пирофосфат-син-
тазы в клетках Rh. rubrum должна была состоять в
синтезе пирофосфата за счет энергии света (или
дыхания) либо в генерации Дцн+ за счет гидроли-
за пирофосфата. Однако в первом случае не ясна
дальнейшая судьба образованного пирофосфата,
который, в отличие от АТР, отнюдь не являет-
ся универсальным источником энергии в клет-
ке. Скорее всего, у Rh. rubrum пирофосфат играет
роль энергетического буфера по отношению к
Дцн+ и АТР (эта функция будет подробно рас-
смотрена нами в разд. 11.3). В любом случае Н+-
пирофосфат-синтаза Rh. rubrum должна обладать
важной биологической функцией. Ее активность в хроматофорах довольно
высока, составляя 12—15% по отношению к активности Н+-АТР-синтазы.
Первичная последовательность Н+-пирофосфатазы была определена
как для большого количества растений, так и для различных прокариот.
Несмотря на то что Н+-пирофосфат-синтаза катализирует очень сходную
реакцию по сравнению с Н+-АТР-синтазой (Дцн+-зависимое образование
фосфоангидридной связи), эти два фермента не обладают сколь-нибудь за-
метной гомологией по отношению друг к другу. Более того, в отличие от
Н+-АТРазы Н+-пирофосфатаза является относительно простым белком. Во
всех исследованных случаях данный фермент состоит всего из одного поли-
пептида с молекулярной массой около 70 кДа (хотя предполагается, что in
vivo Н+-пирофосфатаза функционирует в виде гомодимера). Данный поли-
пептид является исключительно гидрофобным, он содержит в своем составе
14—16 потенциальных а-спиральных трансмембранных колонн, соединен-
ных очень короткими гидрофильными последовательностями.
Мембраносвязанная Н+-пирофосфатаза не имеет также высокой гомо-
логии и с растворимыми пирофосфатазами. Определенное сходство между
этими двумя ферментами наблюдается лишь в области гидрофильной петли
между V и VI трасмембранными колоннами Н+-пирофосфатазы, являю-
щейся, по-видимому, местом связывания MgPPj.
Н+-пирофосфатаза проявляет свою активность лишь в присутствии ио-
нов магния (большинству этих ферментов требуются также и ионы калия).
Известен набор ингибиторов, подавляющих данную пирофосфатазную ак-
тивность. Это Са2+, фторид, имидодифосфат, N-этилмалеимид и антибио-
тик Дио-9. Олигомицин не влияет на фермент. ДЦКД снижает активность
пирофосфатазы в хроматофорах и подавляет генерацию AH' этим фермен-
том в составе протеолипосом.
Механизм действия фермента и его молекулярные свойства остаются
неясными. Данный белок на сегодняшний день является, пожалуй, найме-
Глава 7. Химическая работа за счет Д|1н+
169
нее изученной протонной помпой. Не найдено фосфорилированных интер-
медиатов Н+-пирофосфатазной реакции. Предполагается, что стехиометрия
H+/PPi Для этого фермента равна всего 1 (хотя цифры 0,5 и 2 также рассма-
триваются в литературе). Столь низкая (по сравнению с Н+-АТР-синтазой)
стехиометрия объясняется, по-видимому, тем, что внутриклеточная [PJ
много больше [PPJ, тогда как внутриклеточная [ADP] много меньше [АТР].
Это означает, что для синтеза пирофосфата в реальных условиях (например,
в бактериальной клетке) требуется значительно меньше энергии, чем для
синтеза АТР. Действительно, у мембран из анаэробной бактерии Syntrophus
gentianae был показан чувствительный к протонофорам синтез АТР за счет
энергии гидролиза пирофосфата, а также синтез РР, за счет энергии гидро-
лиза АТР. При этом для синтеза одной молекулы АТР было необходимо
провести гидролиз приблизительно трех молекул пирофосфата, а для син-
теза трех молекул пирофосфата оказалось достаточно гидролизовать одну
молекулу АТР. Такая низкая стехиометрия H+/PPi для Н+-пирофосфат-
синтазы, по-видимому, и объясняет относительно простое устройство этого
фермента по сравнению со столь сложным белковым комплексом, каковым
является Го£|-АТР-синтаза с ее стехиометрией Н+/АТР=2,7 (см. выше).
7.4. Н+-Трансгидрогеназа
NAD(H) и NADP(H) являются основными переносчиками восстанови-
тельных эквивалентов в цитоплазме клеток большинства живых организ-
мов. Структурно эти два кофактора отличаются между собой всего лишь на
один фосфатный остаток. Однако из-за этого небольшого отличия NAD(H)
и NADP(H) в клетке метаболически изолированы друг от друга и выпол-
няют различные функции. За редкими исключениями, NAD+ используется
для окисления субстратов в реакциях катаболизма, тогда как NADPH ча-
ще всего применяется для восстановительных процессов в ходе анаболиче-
ских реакций. Поэтому в клетке NADP(H) обычно находится в сильно вос-
становленном состоянии ([NADP+]«[NADPH]), тогда как NAD(H) более
окислен ([NAD+]>[NADH]).
Основным источником NADPH в клетках являются такие реакции, как
окисление глюкозы в пентозофосфатном пути или окисление изоцитрата
NADP+-3aBHCHMoft изоцитратдегидрогеназой в цикле Кребса. Однако на-
ряду с этими процессами возможен и прямой перенос гидрид-иона (Н-) от
NADH к NADP+ (уравнение 7.1), катализируемый ферментами, называе-
мыми трансгидрогеназами:
NADH + NADP+ « NAD+ + NADPH. (7.1)
Такого рода ферментативная активность впервые была описана в 1952 г.
С. Коловиком, Н. Капланом и др. Так как NADP(H) находится в восста-
новленном состоянии, a NAD(H) значительно окислен, то восстановление
NADP+ за счет окисления NADH возможно лишь при дополнительном ис-
пользовании какого-нибудь источника энергии. В 1963 г. Л. Даниэльсон и
Л. Эрнстер обнаружили, что энергизация субмитохондриальных пузырьков
170
ЧАСТЬ III. Потребители Дцн+
Рисунок 7.21. Л. Эрнстер
резко сдвигает равновесие реакции (7.1) вправо — в
сторону образования NADPH. В результате соот-
ношение
[NADPH ] [NAD+]
[NADP+][NADH]
оказывается порядка 500. В неэнергизованном со-
стоянии это соотношение близко к единице, что
вполне понятно, поскольку стандартные редокс-
потенциалы пар NADH/NAD+ и NADPH/NADP*
практически равны.
В 1966 г. П. Митчел постулировал, что транс-
гидрогеназа представляет собой дополнительный
пункт энергетического сопряжения в дыхательной
цепи. Предполагалась, что окисление NADPH
посредством NAD+ (прямая реакция) генерирует
Дцн+ того же направления, что и дыхание, а об-
ратный процесс потребляет Дцн+, образуемую дыханием.
Опыты, проведенные Е.А. Либерманом с сотрудниками и группой одно-
го из авторов (В.П.С.), подтвердили эти предположения. Было установлено,
что вывернутые субмитохондриальные пузырьки, хроматофоры Rh. rubrum
и протеолипосомы с очищенной трансгидрогеназой генерируют ДЧ7 («+»
внутри пузырька) при окислении NADPH посредством NAD+. Окисление
NADH посредством NADP+ также образовывало ДЧ7, но внутри был знак
«—». Как та, так и другая ДЧ7 исчезали при уравнивании концентраций суб-
стратов и продуктов реакции. Генерируемые ДЧ7 оказались линейной функ-
, [NADPH ] [NAD+]
циеи соотношения In----------------.
[NADP ] [NADH]
Таким образом, трансгидрогеназа в вывернутых субмитохондриальных
пузырьках и хроматофорах катализирует следующий процесс:
NADP+ + NADH + иН+внут » NADPH + NAD+ + иН+нар.
Если дыхательные или фотосинтетические генераторы образуют Дцн+,
благоприятную для выхода Н+внут, то реакция сдвигается влево. Считается,
что при одном обороте трансгидрогеназы через мембрану переносится один
протон, т.е. стехиометрия Н“/Н+ = 1.
Сдвиг равновесия трансгидрогеназной реакции при энергизации есть
прямое следствие энергетических соотношений трансгидрогеназы и других
Дцн+-генераторов дыхательной цепи. Свободная энергия процесса превра-
щения субстрата S в продукт Р может быть рассчитана как
ДС = ДС0 + ЛГ1п—
[Р]’
где Д(70 — изменение свободной энергии при [5] = [Р]. Во всех Дцн.-гене-
раторах, за исключением трансгидрогеназы, Д(70 достаточно велика — по-
Глава 7. Химическая работа за счет Д|1н+
171
рядка 30—45 кДж х моль-1. И только в трансгидрогеназной реакции Д<70
близка к 0. Поэтому данный фермент не может составить конкуренции
дыхательной цепи или АТРазе в качестве генератора Дцн+, если только про-
изведение [NADPH]x[NAD+] не окажется на несколько порядков выше, чем
[NADP+]x[NADH], что вряд ли может произойти в реальных условиях.
Мембраносвязанная Н+-трансгидрогеназа обнаружена во внутренней
мембране митохондрий многих эукариот (прежде всего у высших живот-
ных), а также в цитоплазматической мембране подавляющего большинства
бактерий*. Митохондриальный фермент состоит всего из одного полипеп-
тида с молекулярной массой ~120 кДа, однако in vivo трансгидрогеназа
функционирует в виде гомодимера. В белке обнаруживаются три домена —
di, dll и dill. Фрагмент di является типичным нуклеотид-связывающим
доменом (устроенным по типу «складки Россманна») и специфически свя-
зывает NAD+ и NADH. Эта специфичность достигается за счет образова-
ния водородной связи между консервативным остатком аспартата домена
di и 2'-ОН группой остатка рибозы NAD(H). Фрагмент dill также являет-
ся нуклеотид-связывающим доменом Россманновского типа, однако этот
фрагмент способен связывать только NADP+ и NADPH. В данном случае
специфичность достигается за счет взаимодействия консервативных остат-
ков лизина, аргинина и серина домена dill с остатком фосфата в молекуле
NADP(H). Фрагмент dll является весьма гидрофобным полипептидом. Он
практически полностью погружен в мембрану. Предполагается, что dll по-
строен в зависимости от объекта из 12—14 трансмембранных а-спиральных
столбов, соединенных между собой очень короткими гидрофильными пет-
лями. По-видимому, домены di и dill катализируют перенос гидрид-иона
между NADH и NADP+, тогда как фрагмент dll осуществляет сопряженный
с предыдущей реакцией трансмембранный перенос протона.
Бактериальные Н+-трансгидрогеназы имеют очень сходное строение по
сравнению с митохондриальным ферментом. Однако эти ферменты состоят
не из одного длинного полипептида, а из его фрагментов, т.е. из двух (как
в случае Е. coli) или трех (как в случае Rh. rubrum) более коротких белков,
образующих описанные выше домены di, dll и dill.
С помощью генетических и биохимических методов домены di и dill
могут быть выделены в чистом виде. Показано, что эти фрагменты самопро-
извольно образуют между собой прочный комплекс (для этого комплекса
установлена трехмерная структура). Данный dLdIII-комплекс способен свя-
зывать нуклеотиды и катализировать быстрый перенос гидрид-иона между
ними. При этой реакции происходит прямой стереоспецифический перенос
Н- между положением А никотинамидного кольца NADH и положением В
такового NADP+. Существенным моментом трансгидрогеназного механиз-
ма является то обстоятельство, что в данном случае не происходит изотоп-
ный обмен между переносимым гидрид-ионом и протонами среды. Таким
образом, протоны, транспортируемые полным ферментом через мембрану, не
* Наряду с мембраносвязанной трансгидрогеназой в клетках может присутствовать и
растворимая трансгидрогеназа, катализирующая энергонезависимый перенос гидрид-иона
от NADPH к NAD+. Этот фермент мы не будем рассматривать в данной книге.
172
ЧАСТЬ III. Потребители Дцн*
идентичны тем протонам, которые переносятся от одного никотинамидного
нуклеотида к другому в виде гидрид-иона при трансгидрогеназной реакции.
Направление трансгидрогеназной реакции в dl:dlII-комплексе в сторо-
ну образования NADPH, по-видимому, достигается за счет того, что срод-
ство dill к NADPH значительно превышает сродство этого фрагмента к
NADP+ (а сродство di к NADH значительно ниже сродства этого фрагмента
к NAD+). Однако в стационарных условиях трансгидрогеназная активность
dl dlll-комплекса крайне низка из-за очень медленного высвобождения
продуктов реакции из нуклеотид-связывающих центров. Все это свидетель-
ствует о том, что энергия протонного потенциала в Н+-трансгидрогеназе
тратится не для осуществления самой реакции переноса гидрид-иона, а для
изменения сродства фермента к продуктам реакции.
Таким образом, наблюдается интересная аналогия в работе Н+-транс-
гидрогеназы и описанной выше Н+-АТР-синтазы. Оба фермента катализи-
руют две сопряженные реакции (химическую реакцию и трансмембранный
транспорт протонов), пространственно разнесенные в белке довольно да-
леко друг от друга. Стало быть, для сопряжения этих реакций должен су-
ществовать механизм передачи энергии между различными частями белка
за счет конформационных изменений, и энергия Ацн+ в обоих ферментах
тратится не на осуществление катализируемых ими химических реакций, а
на изменение сродства этих белков к продуктам реакции.
Механизм транспорта протонов Н+-трансгидрогеназой и способ сопря-
жения этой реакции с изменением сродства этого фермента к нуклеотидам
пока еще неизвестны.
Безусловно, главная физиологи-
ческая функция -трансгидрогеназы
состоит в поддержании высокого
соотношения [NADPH]/[NADP+],
что стимулирует восстановительные
синтезы. Последние включают, как
правило, один или несколько этапов,
на которых происходит окисление
NADPH. Фактически энергия, вы-
рабатываемая дыхательной или фото-
синтетической редокс-цепью в виде
Дцн+, становится при посредничестве
трансгидрогеназы дополнительной
движущей силой восстановительных
биосинтезов (см. рис. 7.22).
Такой эффект имеет место в мито-
хондриях и в подавляющем большин-
стве бактерий, у которых отсутствует
нециклическая фотоцепь. В хлоро-
пластах, а также цианобактериях про-
блема поддержания высокого соотно-
шения [NADPH]/[NADP+] решается
Свет, дыхание
-Генераторы
Л!-1н
Н+-Трансгидрогеназа
NADPH
Восстановительные
синтезы
Рисунок 7.22. Преобразование энергии при
участии Н+-трансгидрогеназы
Глава 7. Химическая работа за счет Дцн+
173
восстановлением NADP+ в качестве конечного акцептора электронов фо-
тосинтетической редокс-цепи. Неудивительно, что Н+-трансгидрогеназа в
хлоропластах отсутствует.
Митохондриальная Н+-трансгидрогеназа, возможно, осуществляет еще
одну функцию. Известно, что в митохондриях мышечных тканей животных
окисление изоцитрата может катализироваться двумя типами ферментов:
NAD+- и NADP+-3aBHCHMbiMH изоцитратдегидрогеназами. Одновременная
работа этих двух дегидрогеназ и Н+-трансгидрогеназы может приводить
к функционированию футильного цикла, рассеивающего энергию ДЦН+.
С другой стороны, существование такого цикла теоретически позволяет ре-
гулировать работу цикла Кребса величиной мембранного потенциала.
7.5. Другие системы обратного переноса
восстановительных эквивалентов
В некоторых случаях трансгидрогеназа оказывается включенной после-
довательно с системой обратного переноса восстановительных эквивалентов
дыхательной цепью. По-видимому, эта ситуация имеет место в хроматофо-
рах Rh. rubrum, окисляющих субстраты с редокс-потенциалом около нуля
(серу, S2- и т.д.). На свету ДЦН+, образующаяся циклической фотоцепью,
может использоваться, во-первых, для обращения NADH-CoQ-редуктазы,
т.е. для восстановления NAD+ серой или сульфидом, и, во-вторых, для
окисления образующегося NADH посредством NADP+ в трансгидрогеназ-
ной реакции.
Известны примеры, когда обратный перенос восстановительных эквива-
лентов оказывается одним из основных потребителей ДЦН+ в клетке. Таковы
бактерии, использующие субстраты с положительным редокс-потенциалом
в качестве единственного источника энергии и восстановительной силы.
Как было отмечено выше (см. разд. 5.2.5), Thiobacillus ferrooxidans окисля-
ет Fe2+ в Fe3+ (Е° = + 0,77 В) кислородом и строит все компоненты сво-
ей клетки из СО2, Н2О и NH3. Чтобы сделать это, необходимо обратить
вспять не только NADH-CoQ-редуктазную реакцию, но и СорН2-цитохром
с-редуктазную реакцию.
Обратный перенос электронов, по-видимому, не нужен хлоропластам и
имеет ограниченное (скорее всего, регуляторное) значение для митохондрий.
ГЛАВА ВОСЬМАЯ
МЕХАНИЧЕСКАЯ РАБОТА ЗА СЧЕТ Дц[[(:
ДВИЖЕНИЕ БАКТЕРИЙ
D течение длительного времени молекулярный механизм механической
работы живых организмов ассоциировали исключительно с АТРазами ак-
томиозинового типа. Было доказано, что актомиозин-подобные АТРазы
ответственны не только за мышечное сокращение, но и за подвижность
сперматозоидов, некоторых растений, грибов и простейших, а также за дви-
жение определенных внутриклеточных структур. В частности, АТР-зависимый
механизм приводит в движение флагеллы, или жгутики, эукариотических
клеток.
Когда стало ясно, что движение бактерий обусловлено вращением фла-
гелл, простейшая трактовка механизма этого эффекта, казалось, состоя-
ла в предположении об ATP-зависимом характере и этого типа механи-
ческой работы. Однако все попытки обнаружить связанную с вращением
АТРазную активность прокариотических флагелл были тщетными*. Кроме
того выяснилось, что структуры про- и эукариотических флагелл совер-
шенно различны. Принципиально другим оказался и механизм движения
бактерий, использующий вместо АТР энергию ДЦН+ (в ряде случаев ДЦКа+;
см. разд. 13.2).
Интересно отметить, что живые организмы, в отличие от технических
устройств нашей цивилизации, практически не используют принцип рабо-
ты колеса для совершения механической работы. Пожалуй, единственным
исключением из этого правила является флагелла бактерий. Показано, что
филамент совершает не биение, а именно вращательное движение вдоль
своей длинной оси. Так как филамент обычно представляет собой левую
спираль, полярная флагелла, расположенная сзади, толкает клетку при вра-
щении против часовой стрелки. Вращение по часовой стрелке тянет клетку
в противоположную сторону, и она движется флагеллой вперед.
Известны бактерии, имеющие не одну полярную флагеллу, а много
флагелл, расположенных латерально (например, Е. coli). Вращение флагелл
Е. coli против часовой стрелки приводит к тому, что все они как бы спле-
таются в жгут, вращение которого обусловливает поступательное движение
клетки. При вращении по часовой стрелке жгут расплетается, флагеллы
* Небольшая АТРазная активность флагелл все же была недавно обнаружена, од-
нако она необходима для сборки этих органелл, но не для осуществления движения как
такового.
Глава 8. Механическая работа за счет Дцн+: движение бактерий 175
вращаются независимо одна от другой, и клетка останавливается (вернее,
начинает совершать кратковременные хаотические движения в разных на-
правлениях).
8.1. ДЦН+ вращает ротор фдагедлярного мотора
Еще в 1956 г. П. Митчел отметил принципиальную возможность того,
что ионный градиент может вызвать движение бактерий. Им было выска-
зано предположение, что бактериальная флагелла является своеобразным
«реактивным двигателем», представляя собой гигантский ионный канал.
Эта конкретная схема была оставлена после расчета, показавшего ее неэф-
фективность. Тем не менее общая идея локомоции, поддерживаемой энер-
гией ионного градиента, получила экспериментальное подтверждение.
В 1974 г. Дж. Адлер и его коллеги наблюдали движение мутанта Е. coli,
лишенного способности к окислительному фосфорилированию. Мутант
был подвижен в условиях активного дыхания, хотя оно не могло быть со-
пряжено с синтезом АТР из-за мутации в ATP-синтазе (уровень АТР под-
держивался гликолизом). Более того, сильное уменьшение концентрации
АТР в клетке не снижало скорости движения мутанта. Клетки обездвижи-
вались лишь при добавлении разобщителя.
В 1975 г. работами одного из авторов этого учебника (В.П.С.) и его
сотрудника К. Льюиса было подтверждено наблюдение Дж. Адлера, хотя
исследования производили на бактерии Rhodospirillum rubrum, весьма отда-
ленной от Е. coil по своему систематическому положению. Как оказалось,
и в этом случае скорость движения не коррелирует с уровнем АТР. В то же
время наблюдалась хорошая корреляция движения с величиной мембран-
ного потенциала, образуемого фотосинтетической редокс-цепью. На основе
этих данных было сделано заключение, что движение Rh. rubrum поддержи-
вается энергией ДЦН+, а не АТР. В дальнейшем в группе автора и двух других
лабораториях было показано, что бактерии, неподвижные в условиях, когда
генерация ДЦН+ естественным путем была невозможна, приобретали под-
вижность на несколько минут вновь, если на их мембране искусственно
создавали ДТ или ДрН.
У Bacillus subtilis подвижность появлялась при ДЦН- около 30 мВ; ско-
рость движения возрастала при повышении ДЦН+ до 60 мВ. Дальнейший
рост Дцн+ не влиял на эту скорость. У Е. coli также был обнаружен порог,
ниже которого бактерии оставались неподвижными. Однако возрастание
скорости движения наблюдалось вплоть до величин Дцн+ порядка 200 мВ.
Максимальные скорости движения у разных видов различаются. Наиболь-
шая величина (140 мкм/с) получена для Bdellovibrio bacteriovorus. Другие
бактерии движутся, как правило, со скоростью 20—40 мкм/с. Скорость вра-
щения флагеллы у Е. coli обычно колеблется в пределах 10—50 оборотов/с,
достигая 300 оборотов/с в условиях, когда эта органелла вращается прак-
тически без нагрузки. У некоторых бактерий скорость вращения флагеллы
может достигать 1700 оборотов/с.
176
ЧАСТЬ III. Потребители Дцн+
Важная особенность флагеллярного мотора — его способность вращать
флагеллу как по часовой стрелке, так и против нее при неизменной направ-
ленности ДЦН+. Переключение с одного направления вращения на другое
контролируется системой таксиса. Добавление репеллента вызывает смену
направления вращения: флагелла, вращавшаяся против часовой стрелки,
начинает вращаться по часовой стрелке.
Одним из параметров, измеряемых системой таксиса, служит АЦН+. Та-
ким образом, ДЦН+ оказывается не только движущей силой, но и регуля-
тором направления вращения ротора. Этот факт существенно осложняет
изучение механизма работы флагеллярного мотора. Преодолеть сложности
удалось двумя различными путями.
В работах Г. Берга и сотрудников был исследован подвижный мутант
стрептококка, дефектный по системе таксиса. Оказалось, что в этом слу-
чае изменение направления АЦН+, искусственно создаваемой на мембра-
не мутанта, приводит к изменению направления вращения флагеллы. Этот
эффект служит сильным доводом в пользу концепции, рассматривающей
ДЦН+ в качестве той формы энергии, которая непосредственно потребляется
флагеллярным мотором. Крайне маловероятно, чтобы АЦН+ обратного зна-
ка вызывала вращение в противоположную сторону, если бы между ДЦН.
и мотором был бы какой-либо интермедиат типа высокоэнергетического
соединения.
Другой подход был применен М. Эйзенбахом и Дж. Адлером. Авторы
получили «тени» клеток Е. coli и Salmonella typhimurium, сохраняющие обо-
лочку и флагеллы, но лишенные цитоплазмы. «Тени» прикрепляли к сте-
клу, покрытому антителами к флагеллину. В результате приклеенная к сте-
клу флагелла вместе со своим ротором оказывалась прочно закрепленной.
В этих условиях включение мотора приводило к вращению статора, а с ним
и «тени» бактериальной клетки, висящей на флагелле. Используя такую
модель, лишенную цитоплазматической системы таксиса, авторы нашли,
что как дыхание, так и искусственно созданная Ацн+ естественного направ-
ления поддерживают вращение против часовой стрелки. К сожалению, ис-
кусственно созданная АЦН+ обратного знака вращения не вызывала, что, по
мнению авторов, было следствием необратимого повреждения мотора.
8.2. Структура флагеллярного мотора бактерий
Флагелла бактерий представляет собой одну из наиболее сложно устро-
енных органелл прокариотических клеток. Она состоит более чем из 20 раз-
личных белков, входящих в ее состав в стехиометрии от нескольких штук до
>10 000 копий на один комплекс. Для сборки и регуляции этой органеллы
требуется активность еще более чем тридцати дополнительных белков.
Типичная флагелла бактерии состоит из филамента, расположенного
снаружи клетки, и базального тела, закрепленного в клеточной стенке. Фи-
ламент представляет собой, как правило, жесткую левую спираль в несколь-
ко микрометров длиной (иногда до 20 мкм) и около 20 нм в диаметре. Он
Глава 8. Механическая работа за счет Дцн+: движение бактерий
177
построен из многих тысяч мономеров единственного белка флагеллина*,
молекулярная масса которого у разных видов колеблется от 25 до 60 кДа.
Флагеллин (FliC**) является исключительно структурным белком, ника-
кой ферментативной активности обнаружить у него не удалось. Молекулы
флагеллина в филаменте упакованы таким образом, что получается полая
трубка. Сборка филамента происходит за счет последовательного присоеди-
нения мономеров флагеллина с дистального его конца, находящегося на
очень большом удалении от клетки. Считается, что молекулы флагеллина
доставляются к дистальному концу филамента как раз по внутренней по-
лости этой структуры, что позволяет избежать значительных потерь это-
го белка за счет его диффузии во внешнюю среду. Трубка филамента на
дальнем от клетки конце «закрыта» специальным белком — FliD (другое
название — НАР2), который препятствует реполимеризации мономеров
флагеллина и их диффузии во внешнюю среду. Движущей силой процесса
транспорта флагеллина служит гидролиз АТР особой АТРазой, составлен-
ной из 6 субъединиц Flil и одной субъединицы FliH (см. ниже). Интересно,
что аминокислотная последовательность Flil гомологична а-субъединице
FoFi-ATP-синтазы, а 6 субъединиц этого белка образуют структуру, напо-
минающую 3а:3р-глобулу фактора F{ ATP-синтазного комплекса. Кроме
того, субъединица FliH гомологична Ь- и 5-субъединицам FOF\ АТР-синтаз
(по-видимому, являясь структурным гомологом периферической ножки ком-
плекса F0Fi), что предполагает использование вращательного механизма
при транспорте флагеллина (см. разд. 7.1).
Филамент обычно крепится к базальному телу особой изогнутой струк-
турой, называемой крюком. Это трубка несколько большего диаметра, чем
филамент. Крюк состоит из большого количества копий единственного
белка — FlgE, присоединенного к филаменту посредством двух дополни-
тельных белков — FlgL и FlgK (НАР1 и НАРЗ). Базальное тело состоит из
стержня (построенного из белков FlgB, FlgC, FlgF и FlgG), сочлененного с
крюком, и четырех (иногда двух) дисков, как бы насаженных на стержень.
Диаметр стержня от 8 до 12 нм, дисков — 18—33 нм (рис. 8.1).
Базальное тело латеральных флагелл грамотрицателъных бактерий со-
стоит из четырех дисков. Вначале предполагали, что в состав флагеллы вхо-
дят диски L, Р, М и S. Однако впоследствии выяснилось, что диски М и 5
построены из разных доменов одного и того же белка FliF, т.е. они пред-
ставляют один диск, получивший название MS. Впоследствии при более
мягком выделении базального тела удалось выявить еще один входящий в
эту структуру дополнительный диск, расположенный с цитоплазматической
стороны мембраны и получивший название диска С (рис. 8.1 Б). Сегодня
принято считать, что в состав базального тела латеральных флагелл грамот-
* У некоторых бактерий в состав филамента входят несколько различных изоформ
флагеллина. Физиологический смысл использования этих изоформ на настоящий момент
неизвестен.
** Здесь и далее номенклатура белков флагеллы приведена на примере той, которая
используется применительно к бактерии S. typhimurium.
178
ЧАСТЬ III. Потребители Д|1н.
В
Крюк
L - диск
Р - диск
Стержень
MS - диск
Рисунок 8.1. А — структура базального тела бактериальных флагелл (на примере Е. coli). Б —
электронная микрофотография жгутика Е. coli. Стрелками указаны (слева направо) базальное
тело, крюк и филамент. Масштаб — 50 нм [Метлина 2001, Усп. биол. химии, 41: 229—282].
В — электронная микрофотография базального тела жгутика Е. coli [Berg 2000, Phil. Trans. R.
Soc. bond. B. 491—501]
Глава 8. Механическая работа за счет Дцн+: движение бактерий
179
рицателъных бактерий входят четыре диска — L, Р, MS и С, Базальное тело
флагелл грамположительных бактерий содержит всего два диска — MS и С.
Диск L расположен во внешней мембране и построен из нескольких
копий единственного липопротеина FlgH. Диск Р находится под диском L
и состоит из белка Figi. MS’диск погружен в цитоплазматическую мембрану
и, как было сказано выше, состоит из белка FliF. Функции этих дисков на
сегодняшний день неизвестны. Диск С расположен в цитоплазме, он состо-
ит из белков FlhA, F1HB, FliH, FliJ, Flil, FliN, FliG, FliM, FliO, FliP, FliQ и
FliR. Белки FliN, FliG и FliM ответственны, по меньшей мере, за переклю-
чение направления вращения жгутика (см. далее), а белки FlhA, F1HB, FliH,
FliJ, Flil, FliO, FliP, FliQ и FliR — за трансмембранный транспорт белков
флагеллы при ее сборке (см. выше).
Иногда в бактериальной мембране удается различить особые белковые
структуры, окружающие базальное тело. Их нет в препаратах очищенных
базальных тел. Эти структуры построены из интегральных мембранных
белков MotA и MotB. В белке MotB присутствует одна трансмембранная
а-спираль, расположенная на его N-концевом участке, а основная часть
этого белка находится в периплазме. На С-концевом участке MotB распола-
гается пептидоглюкан-связывающий домен. Предполагают, что этот белок
прочно связан с бактериальной клеточной стенкой. Это позволяет считать
его элементом статора флагеллярного мотора, так как статор такой круп-
ной органеллы, способной генерировать очень большой крутящий момент
(-4000 пикоНьютон нанометров), должен быть прочно закреплен на един-
ственной жесткой структуре бактерии — на ее клеточной стенке.
В белке MotA имеются четыре трансмембранные а-спирали, остальная
(большая) его часть расположена в цитоплазме. Показано, что MotA и MotB
образуют между собой прочный комплекс. Известно также, что комплекс
MotA—MotB может взаимодействовать с С-концевым доменом белка FliG,
входящего в состав С-диска. Количество комплексов MotA—MotB, входя-
щих в состав одной флагеллы, пока точно не установлено. Структурные
исследования флагелл различных бактерий дают стехиометрию от 10 до 16
MotAB-комплексов на одну органеллу, тогда как функциональное изучение
этого мотора предсказывает существование в нем 8 генераторов вращатель-
ного момента.
Мутации в трансмембранных участках белков MotA и MotB приводят к
потере Ацн+-зависимого вращения флагеллы. Считается, что MotA и MotB
ответственны за осуществление трансмембранного транспорта протонов и
являются компонентами «статора», в то время как базальное тело и фи-
ламент — «роторная часть» флагеллярного мотора. Последнее заключение
сделано на основании изучения последствий генетических сшивок между
собой различных белковых компонент флагеллы. Так как удалось полу-
чить функционально активные флагеллы со слитыми белками FliF—FliG и
FliM—FliN, то сделано заключение, что MS- и С-диски являются компо-
нентами ротора этой органеллы.
180
ЧАСТЬ III. Потребители Ацн+
8.3. Возможный механизм Н+-мотора
В группе Г. Берга были исследованы интактные клетки стрептококка,
приклеенные флагеллами к стеклу. Искусственную АТ создавали за счет
диффузионного потенциала К+, а искусственную АрН — подкислением или
подщелачиванием инкубационной среды. Важнейший результат, получен-
ный авторами, состоит в том, что скорость вращения флагеллярного мотора,
работающего без нагрузки, практически не зависит от температуры в иссле-
дованном интервале — от 38 до 4°С.
По всей вероятности, работа мотора происходит без каких-либо кон-
формационных изменений образующих его белков или других событий, со-
путствующих ферментативному катализу, который всегда сильно тормозится
при таком значительном снижении температуры. Другой факт, отличающий
мотор от ферментов-переносчиков ионов Н+, — отсутствие существенного
изотопного эффекта при замене Н2О на D2O.
Механизм работы флагеллы все еще неизвестен. В 1978 г. К. Льюисом и
одним из авторов этой книги (В.П.С.) был предложен механизм устройства
протонного мотора бактерий, изображенный на рис. 8.2. Согласно совре-
менной интерпретации этой схемы функциональной частью бактериально-
го мотора являются диски MS и С (ротор) и MotAB-комплексы (статор),
поскольку это единственные компоненты флагеллы, локализованные в ци-
топлазматической мембране, несущей ДЦН+, или поблизости от этой мем-
браны.
Предполагают, что в статоре находятся два протонных «колодца», каж-
дый из которых пересекает лишь часть толщины мембраны. На дне вход-
ного «колодца» должна быть расположена протон-акпепторная группа X,
Стержень
Наружная сторона
Цитоплазма-
тическая
мембрана
Внутренняя сторона
М-Диск
Рисунок 8.2. Возможное устройство протонного мотора бактерий
[Glagolev, Skulachev, Nature 1978, 272: 280—282]. Объяснения в тексте
Глава 8. Механическая работа за счет Дцн+: движение бактерий 181
принадлежащая ротору, т.е. MS- или С-диску. Появление положительного
заряда на X при его протонировании вызывает кулоновское притяжение
этой группы к другой протон-акцепторной группе Y~ (например, ионизи-
рованной карбоксильной группе дикарбоновой аминокислоты, принадле-
жащей белку статора). Притяжение приводит к вращению ротора и сбли-
жению JTH и К. Перенос протона от к К и далее в цитоплазму по
выходному «колодцу» завершает цикл. Теперь другой ион Н+ из периплаз-
мы может протонировать следующую группу Л, занявшую место на дне
входного «колодца».
Наилучшим кандидатом на роль группы Y статора является консерва-
тивный остаток аспартата единственной трансмембранной а-спирали белка
MotB (Asp32 в случае с Е. coli). Мутации по этой аминокислоте приводят
к полной потере ДЦн+-зависимого вращения флагеллы. В то же время на
настоящий день не удается найти хорошего кандидата на роль группы X ро-
тора. Так, в белках FliG, FliM и FliN отсутствуют консервативные остатки
положительно-заряженных аминокислот, а мутации по заряженным амино-
кислотным остаткам в С-концевом домене белка FliG (домене, взаимодей-
ствующем с MotAB-комплексом; см. выше) не приводят к потере функцио-
нальной активности флагеллы.
У приведенной выше схемы есть и ряд других проблем, ожидающих
своего решения. Например, данная модель предполагает, что на периферии
MS- или С-диска расположена длинная цепь групп X, так что один оборот
ротора сопровождается переносом большого числа протонов из периплазмы
в цитоплазму. По расчету Г. Берга, один оборот ротора требует переноса око-
ло 1200 ионов Н+ через мембрану в цитоплазму. В рамках схемы, показанной
на рис. 8.2, это означает, что число групп X на роторе должно быть порядка
1200/л, где п — количество MotAB-комплексов, входящих в состав флагеллы,
т.е. число групп X должно быть довольно большим (-150), что не так просто
себе представить исходя из известной структуры базального тела.
В любом случае диск С представляется лучшим, чем MS, кандидатом
на носителя группы X. В таком варианте удается избежать прямого кон-
такта ротора и статора в цитоплазматической мембране и разрыва мно-
жества белок-белковых связей в гидрофобном электроизолирующем слое
мембраны при работе ротора. Этот механизм легче представить себе, по-
стулировав, что взаимодействие ротора и статора вынесено в цитозоль, а в
мембране происходит только перенос ионов Н+, вызывающий изменение
пространственного положения той части Н+-канала, которая находится в
обводненной части системы. Тогда вращение ротора могло бы происходить в
фосфолипидной части мембраны без контакта с теми участками статора, ко-
торые погружены в мембрану. В любых других случаях возникает проблема
повышения пассивной утечки Н+ через мембрану в местах контактов ротора
и статора.
Как уже отмечалось выше, во флагеллярном моторе предусмотрено пе-
реключение направления вращения ротора при неизменном знаке Дцн+. Эту
функцию в данной органелле выполняет С-диск, состоящий из белков FliG,
FliM и FliN. Данное устройство должно обладать способностью менять по-
182
ЧАСТЬ III. Потребители Дцн+
ложение протонных «колодцев» относительно ротора таким образом, чтобы
в одном положении перенос протонов вращал ротор по часовой стрелке, а
в другом — против.
Движение протонов по «колодцам» является, видимо, чисто физиче-
ским процессом, судя по тому факту, что работа мотора не зависит от тем-
пературы. Это может быть диффузия ионов Н+ или Н3О+ по обводненной
поре, или миграция Н+ вдоль цепочки молекул связанной воды, либо эста-
фета по закрепленным в белке протон-акцепторным группам, не требую-
щая конформационных изменений белковой молекулы.
8.4. ДЦн+-зависимая подвижность прокариот,
не содержащих флагелл,
а также внутриклеточных органелл эукариот
Наряду с движением за счет функционирования флагеллярного мотора,
многие бактерии способны и к другим типам подвижности. Механизмы
этих альтернативных способов движения на сегодняшний день еще очень
мало изучены, однако очевидно, что в природе реализуется несколько раз-
личных способов такого движения.
Эксперименты, проведенные И.И. Севериной и одним из авторов дан-
ной книги (В.П.С.), показали, что скользящее движение трихомов многокле-
точных цианобактерий Phormidium uncinatum по поверхности подложки под-
держивается энергией ДЦН+, а не АТР. Такое заключение было сделано на
основании ингибиторного анализа скольжения, когда энергия поставлялась
фотоцепью, дыханием или гликолизом. В тех же опытах было продемон-
стрировано движение трихомов при создании искусственных ДТ или ДрН в
присутствии ДЦКД, блокировавшего образование АТР за счет Дцн+.
Ph. uncinatum не содержит флагелл. Предполагают, что их движение
некоторым образом связано с фибриллами, локализованными под внеш-
ней мембраной трихома. Если это действительно так, то фибриллы должны
быть соединены с несущей ДЦН+ цитоплазматической мембраной клеток,
образующих трихом.
В то же время скользящее движение тканевых паразитов животных (ми-
коплазм) и растений (спироплазм), вероятно, не зависит от ДЦН+. У этих
бактерий отсутствуют не только флагеллы, но и клеточная стенка, так что
они отделены от среды одной только цитоплазматической мембраной. Дви-
жение паразитов оказалось устойчивым к протонофору (1 мМ динитрофе-
нолу). Скольжение Spiroplasma полностью подавлялось ингибиторами гли-
колиза и ДЦКД. Вопрос о движущей силе процесса скольжения остается
открытым. Им мог бы быть либо АТР, либо ДЦКа+, либо какой-нибудь дру-
гой ионный градиент.
Интересное наблюдение было опубликовано Дж. Уотербери и сотруд-
никами, которые изучали движение мелких одноклеточных цианобактерий
рода Synechococcus, обнаруженных в Атлантическом океане. Эти бактерии
плывут сквозь объем жидкости со скоростью порядка 25 мкм х с-1. По дан-
ным световой микроскопии движение клетки Synechococcus напоминает та-
Глава 8. Механическая работа за счет Дцн+: движение бактерий
183
ковое флагеллярных бактерий. Однако электронная микроскопия не обна-
ружила у них флагелл.
Подобный механизм, видимо, лежит в основе вращательного движения
хлоропластов харовых водорослей. Вращение хлоропластов было открыто в
1838 г. французом Донне, который изучал капли протоплазмы, выдавлен-
ной из клетки водоросли Chara. Это явление впоследствии было забыто и
«открыто» еще несколько раз. Е.Х. Моценок в группе одного из авторов
(В.П.С.) повторила эксперимент Донне, чтобы выявить источник энергии
для вращения хлоропластов. В опытах использовали нителлу из оз. Байкал.
Оказалось, что хлоропласты могут часами вращаться в капле протоплазмы.
Скорость вращения колебалась в пределах один оборот за 2—3 с. Изредка
направление вращения менялось на противоположное. Период времени, в
течение которого направление вращения оставалось неизменным, в отдель-
ных случаях достигал 1 ч. Вращение хлоропластов удалось наблюдать также
и в интактных клетках водоросли. В некоторых случаях один или несколько
хлоропластов отрывались от неподвижного мультислоя хлоропластов, рас-
положенного под цитоплазматической мембраной водоросли. Уносимые
током цитозоля, они медленно вращались с той же скоростью, что и в вы-
деленных каплях протоплазмы.
Был проведен ингибиторный анализ вращения хлоропластов. Для срав-
нения смотрели действие тех же ингибиторов на циклоз — движение про-
топлазмы, поддерживаемое энергией АТР. Полученные данные показали,
что вращение хлоропластов на свету устойчиво, а в темноте чувствительно
к ДЦКД. Включение света немедленно запускало вращение хлоропластов,
остановленное в темноте посредством ДЦКД. Вращение тормозилось иона-
ми аммония, рассеивающими ДрН — главную составляющую Дцн+ в хло-
ропластах. Если концентрация NH4+ была не слишком велика, торможение
удавалось преодолеть, повысив интенсивность света. Ингибиторами враще-
ния оказались также разобщители-протонофоры. Цитохалазин В, блоки-
рующий ATP-зависимые движения в клетке, не влиял на вращения хлоро-
пластов, но полностью останавливал циклоз. Все эти соотношения можно
объяснить, если принять, что вращение хлоропластов поддерживается Дцн+.
Как и в описанных выше опытах с Synechococcus, электронная микроскопия
не позволила выявить каких-либо образований типа флагелл, прикреплен-
ных к оболочке хлоропласта.
Принимая во внимание вероятное происхождение хлоропластов от
цианобактерий, можно предположить, что вращение хлоропластов поддер-
живается тем же неизвестным пока механизмом, который лежит в основе
движения Synechococcus. Поскольку хлоропласты и Synechococcus лишены
наружных флагелл, приходится думать о каком-либо другом механизме
движения. Этот механизм мог бы приводить в движение цитозоль в узких
щелях между хлоропластами, иммобилизованными в мультислое, ускоряя
транспорт синтезируемого в хлоропластах сахара. Циклоз также призван
выполнять подобную функцию, но его роль ограничивается свободным
пространством цитоплазмы, находящимся между мультислоем хлоропла-
стов и тонопластом.
184
ЧАСТЬ III. Потребители Дцн+
8.5. Подвижные симбионты эукариот и прокариот
Обзор Дцн+-зависимой подвижности был бы неполным без упомина-
ния редких, но весьма впечатляющих случаев, когда неподвижная эука-
риотическая клетка использует подвижные бактерии-симбионты для целей
локомоции. Так движется, в частности, Mixotricha paradoxa — крупное про-
стейшее из класса флагеллат, обнаруженное в кишечнике термита. Как бы-
ло показано Л.Р. Кливлендом, движение этого простейшего обеспечивается
координированным волнообразным движением мембран многих тысяч спирохет,
покрывающих большую часть тела миксотрихи. Интересно, что миксотриха
имеет четыре собственных флагеллы, которые, однако, она использует не
для движения, а для какой-то иной, пока неизвестной цели (может быть,
в качестве водителя ритма, синхронизирующего работу спирохет). Такая
синхронизация могла бы, например, производиться прикосновением фла-
геллы к спирохете, вызывающим (через систему восприятия тактильных
сигналов) реверсию ее протонных моторов. Если это действительно так, то
миксотриха погоняет своих спирохет флагеллой, как бичом, — красивое, но
пока бездоказательное предположение.
Еще один пример подобного рода был описан С.Л. Таммом, изучавшим
другой вид простейшего — девесковиниду, также относящуюся к флагелла-
там и обитающую в кишечнике термитов. Как и миксотриха, девесковинида
использует для движения не собственные флагеллы, а бактерии-симбионты.
На поверхности простейшего в специальных выемках, образуемых мем-
браной хозяина, располагаются тысячи палочковидных перитрихиальных
бактерий. Все флагеллы этих бактерий локализованы на той части бакте-
риальной клетки, которая обращена во внешнюю среду. Вращение флагелл
хозяина удается выключить амфотерицином В или нистатином, для дей-
ствия которых необходим холестерин, имеющийся у этого простейшего,
но отсутствующий у бактерий. Жгутики бактерий продолжают вращаться
в присутствии этих антибиотиков, что обеспечивает подвижность простей-
шего, несмотря на неподвижность его собственных флагелл. В то же время
разобщители-протонофоры, шунтирующие мембрану бактерий, парализуют
девесковиниду.
Как миксотриха, так и девесковинида совершают активное скользя-
щее движение по поверхности подложки. Скорость скольжения достигает
150 мкм/с, что намного превосходит скорость скольжения прокариот, на-
пример цианобактерий (порядка 10 мкм/с). Складывается впечатление, что
локомоторная система этих простейших — достаточно эффективный спо-
соб движения. Размер клетки миксотрихи составляет порядка 0,1 мм, де-
весковиниды — 0,5 мм. Есть подвижные цианобактерии, трихомы которых
достигают длины около 1 мм.
Не описано случаев, чтобы Дцн+ использовалась для движения орга-
низмов большего размера. Более крупные живые объекты, чтобы двигаться,
всегда применяют АТРазные системы актомиозинового типа.
Трудно себе представить устройство, в котором бактериальная флагелла
длиной не более 20 мкм нашла бы себе применение, чтобы перемещать в
Глава 8. Механическая работа за счет Дцн+: движение бактерий
185
пространстве организм, построенный из множества крупных эукариотиче-
ских клеток. Однако изучая актомиозиновый механизм, конечно важней-
ший для животных и человека, необходимо иметь в виду, что миниатюрные
формы жизни выбрали совсем другой способ обеспечения подвижности.
С этой целью они используют вращающийся диск, так что первое изобрете-
ние колеса не следует приписывать человеку. Диск — элемент более слож-
ной конструкции, базального тела, служащего молекулярным прототипом
нашего электромотора, опять-таки, оказывается, изобретенного задолго до
нас. Ось мотора соединена с жестким филаментом, играющим роль винта
моторной лодки.
Такой или несколько видоизмененный механизм применяется не толь-
ко, чтобы плыть, но и чтобы скользить по поверхности, как движутся три-
хомы цианобактерий и некоторые простейшие. Последние вступали с этой
целью в эктосимбиоз с бактериями. Неудивительно, что такая попытка ока-
залась эволюционным тупиком. Как в свое время возражал Сталину Буха-
рин, пытаясь защитить крестьян от коллективизации: «Из лодок не постро-
ишь корабля!».
ГЛАВА ДЕВЯТАЯ
ОСМОТИЧЕСКАЯ РАБОТА ЗА СЧЕТ Дцн+
9.1. Определение и классификация
Термин «осмотическая работа» в его широком смысле относится к любо-
му процессу трансмембранного переноса вещества в сторону большей его
концентрации. Такой перенос сопровождается появлением осмотического
дисбаланса между двумя разделенными мембраной объемами, поскольку по
крайней мере в одном из них существенно меняется концентрация транс-
портируемого вещества.
Вообще говоря, образование градиентов ионов специфическими ион-
ными насосами, такими, как Дцн+-генераторы, ион-транспортные АТРазы
и т.п., должно быть отнесено к осмотической работе. Однако такого рода
устройства принято исключать из рассмотрения в данном контексте. Вместо
этого главное внимание уделяют транспорту метаболитов, осуществляемому
посредством энергии Дцн+, ДцКа+, АТР или фосфоенолпирувата (ФЕП). Ни-
же будет рассмотрена Дцн+-зависимая осмотическая работа.
В митохондриях все энергозависимые виды транспорта веществ под-
держиваются энергией Дцн+. В плазмалемме и тонопласте растений и гри-
бов большинство процессов такого типа также происходит за счет Дцн+.
Однако в плазмалемме животной клетки гораздо более типичны ДцКа+-зави-
симые транспортные системы, хотя в некоторых особых случаях движущей
силой осмотической работы служит Дцн+. Для бактерий описаны примеры
всех перечисленных выше движущих сил, хотя Дцн+ и АТР используются
наиболее часто. У морских и галофильных микроорганизмов вместо Дцн+
применяется ДцКа+. У Е. coli среди 16 систем транспорта аминокислот 8
переносчиков утилизируют АТР, 4 переносчика — Дцн+, одна — ДцКа+ и
три системы как Дцн+, так и ДцКа+ (табл. 9.1). Та же бактерия накапливает
глюкозу за счет энергии ФЕП, лактозу — за счет Дцн+.
Дцн+-зависимая аккумуляция в отсеке, заряженном отрицательно (на-
пример, в матриксе митохондрии или в цитоплазме бактерии), описывается
уравнением 9.1:
RT 1п^внут = -(и + Z) • F • Д'? - nRT 1п[Я ]внуг, (9.1)
[Янар [Я+]нар
где п — число ионов Н+, переносимых в симпорте с одной молекулой суб-
страта (5), a Z — величина заряда субстрата.
Глава 9. Осмотическая работа за счет Дцн+
187
Таблица 9.1. Системы аккумуляции аминокислот
в клетках Е. coli
№ системы Аминокислоты Движущая сила транспорта
1 Ala, Gly Дцн^
2 Thr, Ser Дцн-
3 Leu, lie, Vai АТР
4 Leu, lie, Vai АТР
5 Leu, lie, Vai ДЦн-
6 Leu, He, Vai ДЙн-
7 Phe, Tyr, Trp ДЙн-
8 Pro ДРН+, APNa+
9 Lys, Arg, От АТР
10 Arg АТР
11 Gin АТР
12 Gin АТР
13 Gin ДЦН+, APNa+
14 Gin АЙН\ APNa-
15 Cys АТР
16 Cys АТР
9.2. ДТ как движущая сида
Если транспортная система осуществляет аккумуляцию катиона силь-
ного основания внутри положительно заряженного отсека (или откачивает
анион сильной кислоты из этого отсека), единственной движущей силой про-
цесса может быть электрическая составляющая протонного потенциала (ДТ).
В этом случае равновесное соотношение концентраций транспортируемого
катиона по ту и другую стороны мембраны описывается уравнением 9.2:
T?r iiJC7 -*внуг =-Z F Ay (9 2)
[CZ+]Hap ’ 1 }
Пользуясь уравнением Нернста, легко подсчитать, что создание деся-
тикратного градиента одновалентного катиона С+ при температуре порядка
25°С требует АТ около 60 мВ.
Такое простое электрофоретическое поведение системы ионного транс-
порта показано, например, для переноса ионов К+ в присутствии антибио-
тика валиномицина. Подобный механизм ответственен также за перенос
Са2+ в митохондрии (рис. 9.1, система 7). Однако в этом случае коэффици-
ент Z равен двум, так что для создания десятикратного градиента оказыва-
ется достаточным АТ = 30 мВ.
188
ЧАСТЬ III. Потребители Дцн+
Отсек 1 - Отсек 2
(более Меморана (более
положительный отрицательный
и кислый) и щелочной)
Са2*------г——► Са2+
AV
СН2СОО" CHjCOO"
6н2СОО" £^=-7—6н2СОО"
2Н+— АрН""* 2Н+
Са2* , __Са2‘
2Н+—' АрН 2Н+
Лактоза д Лактоза
Н+^ДрН^^- н+
R-NH3+^______5 R-NH3+
2Н+ -*^2ДрН 2Н+
Рисунок 9.1. Примеры Дцн+-зависимых
транспортных систем: 7 — электрофо-
ретический унипорт катиона сильного
основания (Са2+) в отрицательно за-
ряженный отсек; 2 — ДрН-зависимый
симпорт протонов и аниона слабой
кислоты (сукцината) в щелочной от-
сек; 3 — антипорт катиона сильного
основания (Са2+) и протонов по АрН;
4 — симпорт нейтрального соединения
(лактозы) и протонов по ДЧ7 и ДрН,
вклады которых равнозначны; 5 —
антипорт катиона слабого основания
(RNH3+) и протонов (вклад ДрН вдвое
превышает таковой ДЧ7)
Как валиномицин, так и митохон-
дриальный унипортер ионов Са2+ реша-
ют сравнительно простую задачу. Они
«узнают» ион, подлежащий транспорту,
и облегчают его диффузию через гидро-
фобный слой мембраны. Для превраще-
ния энергии АТ в ионный градиент здесь
не требуется каких-либо специальных
устройств, поскольку весь процесс сво-
дится к электрофорезу — движению иона
в электрическом поле.
Более сложные механизмы ис-
пользуются, по-видимому, при акку-
муляции К+ клетками Е. coli. Как было
установлено В. Эпстайном и сотрудни-
ками, здесь существуют по крайней ме-
ре две системы импорта К+, а именно:
К+-транспортирующая система (TrkA)
и К+-АТРаза (Хф-система). TrkA дей-
ствует при обычных концентрациях К+
в среде, в то время как К+-АТРаза ин-
дуцируется резким снижением [К+]нар.
Система TrkA использует энергию Дцн+
и аллостерически активируется АТР.
По-видимому, TrkA представляет собой
К+,Н+-симпортер. Нет сомнения, что
К+-АТРаза утилизирует АТР, однако и
ДТ участвует в ее энергообеспечении,
так как этот фермент катализирует уни-
порт ионов К+, т.е. переносит катион из
положительно заряженного отсека в от-
сек, заряженный отрицательно. Подоб-
ный механизм, вероятно, ответственен за
50 000-кратную аккумуляцию ионов К+
в клетках Methanobacterium thermoautotrophicum при росте на малокалиевой
среде.
У Е. coli ионы К+ необходимы для поддержания осмотического давле-
ния клетки. На повышение осмолярности среды Е. coli отвечает поглощением
ионов К* через TrkA(Kdp)-систему. Увеличение К+внуг устраняет осмотиче-
ский дисбаланс между цитоплазмой и гипертонической средой. Неудиви-
тельно, что резкое снижение осмотического давления среды ведет к выходу
ионов К+ из клетки. Однако этот выход происходит с участием уже иного
механизма — за счет функционирования механочувствительных каналов
MscL и MscS, образующих в мембране при гипоосмотическом шоке боль-
шие поры, которые обеспечивают пассивный выход из клетки ионов и мо-
лекул небольшого размера.
Глава 9. Осмотическая работа за счет Дцн+
189
Простой процесс электрофореза может, по-видимому, объяснить дви-
жущие силы трансмембранных потоков и некоторых анионов. В тилакоидах
ион С1“ движется во внутренний отсек, заряжающийся положительно бла-
годаря работе фотоцепи. В митохондриях выход аниона АТР также проис-
ходит электрофоретически. Однако здесь эта система усложняется тем, что
происходит антипорт ATP4-BHyr/ADP3-Hap (подробнее см. разд. 9.7.2)
9.3. ДрН как движущая сида
Электрофоретический транспорт ионов приводит к тому, что катио-
ны и анионы аккумулируются соответственно в отрицательно и положи-
тельно заряженных отсеках. Однако очевидно, что разделение веществ на
катионы и анионы вряд ли может быть той целью, ради которой живая
клетка тратит энергию на осмотическую работу. Один из путей, помогаю-
щих обойти ограничение простого электрофореза, состоит в превращении
ДУ-составляющей протонного потенциала в ДрН. Известно, что ДТ есть
первичная форма Дцн+, поскольку электрическая емкость мембраны значи-
тельно меньше, чем pH-буферная емкость разделенных мембраной раство-
ров. Для превращения Д'Р в ДрН необходим электрофоретический поток
ионов, разряжающий трансмембранную разность потенциалов. Если ДТ =
О, то уравнение 9.1 упрощается следующим образом:
[^]внуг = п [Н ]внут
[*Янар [Н+]нар
В простейшем случае слабая кислота или слабое основание аккуму-
лируется соответственно в более щелочном или более кислом отсеке. Для
аккумуляции достаточны два условия: мембрана должна быть проницаема
для нейтральной формы кислоты (основания) и непроницаема для их за-
ряженной формы. Если выполняются оба эти требования, то происходят
простые события, описываемые уравнениями 9.4 и 9.5:
АНнар -> АНвнут, (9.4)
АНвнуг + ОН” -> А“внут+ Н2Овнуг. (9.5)
Потребляемые щелочные эквиваленты пополняются Дцн+-генератора-
ми, откачивающими ионы Н+, например, из матрикса митохондрий.
Именно таким способом энергизованные митохондрии накапливают
ацетат. Поскольку протонированная форма уксусной кислоты (СН3СООН)
представляет собой небольшую нейтральную молекулу, она проходит сквозь
мембрану без всяких переносчиков по градиенту pH и аккумулируется в
матриксе в форме непроникающего ацетат-иона (СН3СОО~), нейтрализуя
избыток ионов ОН- в этой части органеллы.
Аналогичный механизм, действующий в противоположном направле-
нии, вызывает выход аммиака:
(NH3)BHyr -э (NH3)Hap,
(9.6)
190
ЧАСТЬ III. Потребители A|iH.
(NH3)BHyT + Н+нар -э (NH4+)Hap. (9.7)
Если слабое основание или слабая кислота нерастворимы в липиде,
требуются соответствующие переносчики, специфичные к незаряженной
форме основания (кислоты). Примером такого механизма может быть ми-
тохондриальный переносчик сукцината, связывающий сукцинат2- (“ООС-
СН2-СН2-СОО-) на наружной поверхности внутренней мембраны и перено-
сящий его с двумя Н+нар в матрикс. В целом процесс эквивалентен переносу
недиссоциированной формы янтарной кислоты (НООС-СН2-СН2-СООН),
концентрация которой в нейтральном растворе очень низка (см. выше,
рис. 9.1, система 2).
Итак, наличие вторичной формы протонного потенциала (ДрН) позво-
ляет вовлечь в процессы транспорта слабые кислоты и основания таким
образом, что направление их движение противоположно. Как и в случае
электрофореза катионов и анионов, разнонаправленный перенос слабых
кислот и оснований не может решить всех задач, стоящих перед транс-
портными системами клетки или органеллы. Например, бактерия, судя по
направленности Дцн+, должна накапливать катионы и слабые кислоты и
выбрасывать в среду анионы и слабые основания. Очевидно, что во многих
случаях направление движения вещества должно быть иным.
Для катионов сильных оснований проблема может быть решена пу-
тем использования катион/Н+-антипортеров. Например, в митохондриях
и некоторых бактериях кроме электрофоретической системы аккумуляции
ионов Са2+ есть электронейтралъный Са2+/2/Л-антипортер, откачивающий
Са2+ из матрикса или бактериальной цитоплазмы с использованием ДрН
(рис. 9.1, система 3).
Таким образом, митохондрии и бактерии могут не только аккумулиро-
вать ионы Са2+, но и активно выбрасывать эти ионы в среду. Ясно, что две
названные системы должны действовать попеременно, иначе взаимодействие
Са2+-унипортера и Са2+/2Н+-антипортера приведет к рассеянию энергии
Дцн-
Подобным образом анионы сильных кислот могут накапливаться в ма-
триксе за счет ДрН, если они симпортируются с ионами Н4. Так устроен,
в частности, механизм накопления фосфата в митохондриях и бактериях.
Нейтральная форма фосфорной кислоты (Н3РО4) практически отсутствует
при физиологических значениях pH. Анионы фосфата должны откачивать-
ся из митохондрий (бактерий), двигаясь по ДТ. Тем не менее фосфат не
только не откачивается, а, напротив, накапливается митохондриями и бак-
териями под действием Н2РО4-,Н+-симпортера.
9.4. Общая Дцн+ как движущая сида
Иногда движущей силой транспорта оказываются обе составляющие про-
тонного потенциала: ДТ и ДрН. Это наблюдается, например, при переносе
веществ, не обладающих ни зарядом, ни кислотно-основными свойствами.
Такие соединения могут переноситься вместе с протоном или обмениваться
Глава 9. Осмотическая работа за счет Дцн+
191
на протон, используя энергию общей Дцн+. Так, аккумуляция лактозы бак-
териями осуществляется посредством лактоза, Н+-симпортера (см. рис. 9.1,
система 4\ подробнее см. разд. 9.7.1). Вакуоли корнеплодов сахарной све-
клы накапливают сахарозу при помощи (сахароза / Н+)-антипортера. При-
чиной, по которой в данном случае используется антипортер, а не симпор-
тер, является то обстоятельство, что Дцн+ на мембране вакуоли направлена
в другую сторону по сравнению с бактериальной мембраной.
Д*Р и ДрН одинаково эффективны в качестве движущей силы при работе
лактоза, Н+-симпортера и сахароза / Н+-антипортера. В подобных системах
повышение стехиометрии Н+ / вещество увеличивает градиент вещества,
возникающий в результате транспортного процесса. В других случаях повы-
шение стехиометрии определяет направление транспорта. Примером тому
служит аккумуляция положительно заряженных катехоламинов (RNH3+) в
хромаффинных гранулах коры надпочечников. Здесь находится Н+-АТРаза,
накачивающая ионы Н+ в гранулы, в результате чего их внутренний объем
заряжается положительно и закисляется (см. разд. 7.2). Аккумуляция RNH3+
обусловлена (ВМН3+/2Н+)-антипортером (рис. 9.1, система 5). Тем самым
перенос одного RNH3+ внутрь гранул сопровождается переносом двух про-
тонов и одного положительного заряда в противоположных направлениях.
Эти данные означают, что энергетически равные по величине ДТ и
ДрН будут вносить разный вклад в обеспечение процесса транспорта: ДрН
окажется вдвое более эффективной, чем ДТ той же величины (см. уравне-
ние 9.1). В то же время в системах типа TrkA (см. разд. 9.2), когда катион
(К+) симпортируется с Н+, вклад ДТ должен быть вдвое больше, чем у ДрН,
коль скоро транспорт одного иона К+ связан с переносом двух зарядов и
одного Н+.
В силу обратимости транспортных процессов градиент метаболитов,
образуемых внутри клетки, а затем выделяющихся в среду Дцн+-зависимой
транспортной системой, может, в принципе, использоваться как источник
энергии для генерации Дцн+.
Например, в анаэробных Enterococcus hirae образование лактата в ре-
зультате гликолиза приводит к возникновению градиента этого конечно-
го продукта между цитоплазмой и средой ([лактат] внуг > [лактат] нар). Выход
лактата из клетки катализируется (лактат, иН+)-симпортером, где п = 2 при
низких значениях [лактат]нар и [Н+]нар. Коэффициент п понижается до 1,
когда уровни лактата и Н+ в среде возрастают. Это означает, что совместное
действие гликолиза и симпортера защелачивает цитоплазму и заряжает ее
отрицательно, если концентрации лактата и Н+ снаружи клетки низки:
глюкоза -э- 2(лактат“)внут 4- 2Н+внуг (9.8)
2(лактат )ВНуТ 4~4Н ВНут > (лактат )нар 4~ 4Н нар. (9.9)
Аккумуляция лактата и Н+ в среде модифицирует этот механизм таким
образом, что количества лактата и ионов Н+, выходящих из клетки, уравно-
вешиваются и, следовательно, генерация Дцн+ прекращается. Подобная ре-
гуляция предотвращает накопление в клетке избытка молочной кислоты.
192
ЧАСТЬ III. Потребители Дцн*
9.5. Дцн+-зависимые транспортные каскады
ЦИТОЗОЛЬ МАТРИКС
Рисунок 9.2. Транспортный каскад внутренней
митохондриальной мембраны. Дыхательная
цепь (7) откачивает ионы Н+ из матрикса;
(Н2РО4’,Н+)-симпортер (2) и (ATP^/ADP3-)-
антипортер (5) переносят фосфат и ADP в
матрикс в обмен на АТР; (НРО^/малат2-)-
антипортер (4) катализирует выход малата;
(малат2-/иитрат3- + Н+)-антипортер (5) вы-
зывает накопление в матриксе цитрата
Описано несколько систем, в которых Дцн+ используется для создания
градиента определенного компонента (Sj), а этот градиент затем утилизиру-
ется для транспорта другого вещества (S2).
В бактериях роль Sj часто выполняют ионы Na+. В этом случае энер-
гия Дцн. потребляется при откачке Na+ из клетки посредством электроней-
трального Naь/Н+-антипортера или электрогенного Ка+/иН+-антипортера.
Образованная ApNa используется для
аккумуляции различных метаболи-
тов при помощи (Na+, метабол ит)-
симпортеров. Этот вид осмотической
работы оказывается основным у ал-
калофильных, галофильных и многих
морских микроорганизмов.
В митохондриях многоступенча-
тый Дцн+-зависимый каскад описан
при исследовании механизмов пере-
носа фосфата и интермедиатов цик-
ла Кребса. Процессом, запускающим
каскад, служит образование АТ дыха-
тельной цепью. Затем АТ превраща-
ется в ДрН посредством электрофоре-
тического обмена АТР4-внут / ADP3-Hap
(а также унипорта Са2+, К+ и т.д.).
Полученная ДрН используется для
создания Др (фосфат) при помощи
симпорта Н2РО4- и Н+, направлен-
ного снаружи внутрь митохондрии.
Др (фосфат) утилизируется для нако-
пления малата при помощи НРО42/
малат2--антипортера (тот же перенос-
чик транспортирует некоторые другие
дикарбоновые кислоты). Последний
этап каскада — импорт митохондриями цитрата. Процесс осуществляется
переносчиком, обменивающим малат2- на цитрат3- и Н+ (рис. 9.2).
Вся эта сложная система открывает возможность создания целой иерар-
хии регулирующих воздействий на метаболизм митохондрий.
9.6. Карнитин как пример трансмембранного переносчика
химической группировки
В некоторых случаях через мембрану переносится не вся молекула транспорти-
руемого вещества, а только ее часть. Примером может служить транспорт остат-
ков жирных кислот (жирных ацилов), опосредованный участием карнитина.
Глава 9. Осмотическая работа за счет Ацн+
193
Рисунок 9.3. Карнитин и ацил карнитины в депротонированной (цвиттерионной)
и протонированной (катионной) формах. R — остаток жирной кислоты (ацил)
Исследования карнитина имеют длинную историю, поучительную
для всех, кто занимается проблемой транспорта метаболитов. Карнитин
(рис. 9.3) был открыт в 1905 г. в России В. Гулевичем и Р. Кримбергом. В то
время биохимические журналы пестрели сообщениями о новых веществах
биологического происхождения, поэтому описание еще одного органиче-
ского соединения в мышцах вряд ли было оценено по достоинству.
В 1930-е гг., когда прогресс в понимании биологических функций низ-
комолекулярных соединений был особенно впечатляющим, структурное
подобие карнитина и холина стимулировало ряд исследований, однако ни-
какой метаболической функции карнитина обнаружить не удалось.
В 1940-х гг. весьма популярными были работы по поиску новых вита-
минов, и здесь наконец-то был достигнут первый успех в изучении роли
карнитина. Оказалось, что он служит одним из ростовых факторов для муч-
ного червя Tenebrio molitor. Авторы, обнаружившие этот эффект, назвали
карнитин витамином Вт (Гот Tenebrio). Позднее было установлено, что в
условиях дефицита по карнитину и голодания черви умирают «жирными»,
будучи не в состоянии утилизировать свои жировые запасы.
К несчастью для исследователей карнитина, все попытки показать ви-
таминную функцию этого вещества на объектах иных, чем мучной червь,
дали отрицательный результат. Работа по витамину Бт оказалась не в со-
стоянии стимулировать интерес к функции карнитина просто потому, что
человечество, не заинтересованное в процветании мучных червей, было не
слишком озабоченно витаминностью их пищи. К середине века, когда пода-
вляющее большинство низкомолекулярных компонентов клетки уже нашло
свое место на метаболической карте, функция карнитина все еще остава-
лась неясной. В 1955 г., т.е. ровно полвека спустя после открытия карни-
тина, С. Фридман и Г. Френкель выяснили, что карнитин обратимо ацети-
лируется посредством ацетил-СоА. Ацетил-СоА занимает ключевое место в
метаболизме, так что можно было надеяться, что ацетил карнитин служит
интермедиатом переноса ацетильных остатков с ацетил-СоА на какой-либо
акцептор. Ничего подобного, однако, не оказалось. Единственной реакцией
утилизации ацетилкарнитина осталось его превращение обратно в карни-
194
ЧАСТЬ III. Потребители Ацн+
тин с ацетилированием свободного СоА. То же верно и для ацилкарнитина,
второго представителя соединений этого типа, который вместо ацетила со-
держит ацильный остаток жирной кислоты. Складывалось впечатление, что
ацилирование карнитина представляет собой метаболический тупик.
В том же 1955 г. И. Фритц отметил стимулирующее действие карнити-
на на окисление жирных кислот гомогенатом печени. Подобный эффект
представлялся довольно неожиданным для вещества, стоящего в стороне от
главных путей метаболизма, так что наблюдение Фритца в течение некото-
рого времени оставалось необъясненным.
В 1960-е гг., когда начались обширные работы по биомембранам, эф-
фект Фритца попал в поле зрения. Обнаружилось, что он как-то связан с ми-
тохондриями. Фритц выдвинул гипотезу об участии карнитина в транспорте
жирных кислот через митохондриальную мембрану. Эта мысль получила
подтверждение, когда выяснились следующие два факта. Во-первых, кар-
нитинацилтрансфераза, катализирующая перенос ацильной группы между
СоА и карнитином, локализована на обеих сторонах внутренней мембраны
митохондрий. Во-вторых, ацилкарнитин (но не ацил-СоА) способен про-
никать через митохондриальные мембраны. На основе названных наблюде-
ний была сформулирована схема участия карнитина (Сп) как переносчика
жирных ацилов, суммированная уравнениями 9.10—9.12:
Ацил-СоАнар + Спнар-> ацил-Спнар +СоА, (9.10)
Ацил-Спнар-> ацил-Спвнут, (9.11)
АЦИЛ СпВнут“НТ ТИЛ ^^^^внут* (9.12)
Два вопроса оставались неясными в рамках данной концепции. 1) По-
чему такая гидрофильная молекула, как карнитин, была отобрана эволюци-
ей в качестве переносчика жирных ацилов? 2) Какова судьба Спвнут? (Сам
по себе он не может выйти из митохондрий, так как внутренняя мембрана,
как было показано, непроницаема для карнитина.)
Обе проблемы были решены в 1970-е гг. Для биоэнергетиков этот пе-
риод ознаменовался борьбой вокруг хемиосмотической гипотезы Питера
Митчела, завершившейся его триумфом. В частности, было найдено, что
любой процесс аккумуляции ионов или метаболитов в митохондриях под-
держивается энергией Дцн+. Вот почему в 1970 г. один из авторов этой
книги (В.П.С.) предположил, что роль карнитина как-то связана с исполь-
зованием протонного потенциала. Так как жирные кислоты представляют
собой гидрофобные анионы, они могли бы откачиваться из митохондрий
под действием АТ. Протонированные формы жирных кислот способны вхо-
дить обратно в митохондрии, двигаясь по АрН. Циркуляция жирных кислот
в мембране митохондрий должна приводить к рассеянию Ацьг (разобщению
процессов дыхания и аккумуляции энергии). В то же время ни карнитин,
ни ацилкарнитин не могут быть анионами. В депротонированной форме
они представляют собой цвиттерионы (суммарный заряд равен нулю), а в
протонированной — катионы. При этом цвиттерионные формы более ги-
дрофильны. Эти данные позволяют предположить, что жирные кислоты,
Глава 9. Осмотическая работа за счет Дцн+
195
соединяясь с карнитином, утрачивают свою разобщающую активность и
приобретают способность накапливаться внутри митохондрий, где проис-
ходит их р-окисление. Транспорт в целом может быть описан симпортом
жирных ацилов и ионов Н+ в митохондриальный матрикс под действием
общей Дцн+:
Ацил-Спнар + Н+нар-> ацил-Сп-Н+нар, (9.13)
Ацил-Сп-Н+нар-> ацил-Cn-Н+внут, (9.14)
Ацил-Сп-Н+внут -> ацил-Спвнут + Н+внут. (9.15)
В соответствии с предсказанием этой схемы, Д.О. Левицкий обнару-
жил в нашей лаборатории, что рассеяние Дцн+ в митохондриях разобщите-
лем резко тормозит окисление пальмитоилкарнитина, добавленного после
разобщителя. В то же время разобщитель стимулирует окисление, будучи
добавленным через 3 мин после пальмитоилкарнитина. По-видимому, ко-
личества пальмитоилкарнитина, накопленного энергизованными митохон-
дриями за три минуты инкубации, было достаточно для активного дыхания
в течение всего периода полярографического опыта.
Так был получен ответ на вопрос, почему карнитин был выбран в каче-
стве переносчика жирных ацилов. Зная функцию карнитина, можно лишь
поражаться целесообразности устройства этой небольшой молекулы. Все
три функциональные группы карнитина необходимы для выполнения им его
роли: гидроксильная группа нужна для соединения с жирным ацилом, кар-
боксильная — для обратимого связывания протона, четвертичный азот —
для сообщения молекуле переносчика положительного заряда.
Представленная концепция оставляет без ответа второй из вопросов,
поставленных выше: что происходит с карнитином, освободившимся вну-
три митохондрии в реакции с СоАвнут? Эта проблема была решена в 1976 г.
С. Панде и Р. Парвином и, независимо от них, Р. Рамсеем и П. Таббосом,
обнаружившими стехиометричный карнитин / ацилкарнитин-антипорт
между инкубационной смесью и митохондрией.
Общая схема транспорта внемитохондриальных ацилов жирных кис-
лот в матрикс представлена на рис. 9.4. Процесс начинается во внешней
митохондриальной мембране, где локализована ацил-СоА-синтаза — фер-
мент, эстерифицирующий СоА свободными жирными кислотами за счет
энергии АТР (реакция 7). В межмембранном пространстве или на внешней
поверхности внутренней мембраны ацил-СоА атакуется внешней карнити-
нацилтрансферазой, в результате чего жирный ацил переносится с СоА на
карнитин (реакция 2). Образующийся ацил карнитин протонируется иона-
ми Н+нар. ФОНД Н+нар пополняется дыхательными Дцн+-генераторами, отка-
чивающими протоны из матрикса в межмембранное пространство (реакции
3 и 4). Протонированный ацилкарнитин пересекает внутреннюю мембрану,
двигаясь под действием общей Дцн+ (реакция 5), и депротонируется в ма-
триксе (реакция 6). Там ацилкарнитин ацилирует внутримитохондриальный
СоА под действием внутренней ацилкарнитинтрансферазы (реакция 7). Вы-
196
ЧАСТЬ III. Потребители Дцн+
МИТОХОНДРИЯ
Внешняя
мембрана
ЦИТОЗОЛЬ
Межмембранное
пространство
Внутренняя
мембрана
МАТРИКС
Рисунок 9.4. Карнитин-зависимый транспорт ацилов жирных кислот в матрикс митохондрий: 1 —
ацил-СоА-синтаза, 2 — внешняя карнитинацилтрансфераза, 3 — Дцн+-генераторы дыхательной
цепи, 4 — протонирование карбоксильной группы ацил карнитина, 5 — Дцн+-зависимый вход
ацилкарнитина, 6 — депротонирование карбоксильной группы ацилкарнитина, 7 — внутренняя
карнитинацилтрансфераза, 8 — карнитин-ацилкарнитин-антипортер
свобождающийся при этом карнитин обменивается с внешним ацилкарни-
тином посредством карнитин / ацилкарнитин-антипортера (реакция 8).
Интересной чертой этой системы является то, что уровень карнитина в
матриксе регулирует распределение потока ацилкарнитина в митохондрию
между Дцн+-зависимым (т.е. связанным с энергетическими затратами) пу-
тем 5 и энергонезависимым антипортом 8. Вероятно, Дцн+-зависимый путь
преобладает в тот момент, когда жирные кислоты начинают окисляться,
сменяя другие субстраты дыхания. В этих условиях концентрация свобод-
ного карнитина в матриксе еще слишком мала, чтобы насытить антипортер,
имеющий довольно низкое сродство к карнитину (Кт около 1 мМ). На дан-
ной стадии затрата Дцн+ оправданна, поскольку это форсирует накопление
жирных кислот в митохондриях и тем самым способствует переводу мито-
хондрий на окисление жирных кислот. Массированное поступление ацил-
карнитина в матрикс с последующей утилизацией жирных ацилов в системе
р-окисления приводит к накоплению карнитина в матриксе митохондрий в
количествах, достаточных для активации антипортера. Теперь система мо-
жет обойтись без затраты Дцн+ на транспорт жирных ацилов, так как работа
антипортера сама по себе не требует протонного потенциала.
Приведенную выше логику нельзя применить к ацетилкарнитину, ко-
торый слишком гидрофилен для проникающего катиона. Было постулиро-
вано, что главная функция ацетилкарнитина состоит в забуферивании уровня
ацетил-Со А подобно тому, как креатинфосфат забуферивает уровень АТР.
Это не исключает также и электрофоретического накопления протониро-
ванного ацетил-Cn в митохондриях, если допустить существование особого
белка-переносчика такого катиона. Кстати сказать, переносчик очень не
помешал бы и транспорту протонированного ацил-Cn, концентрация кото-
рого и проникающая способность при нейтральном pH для искусственных
мембран очень малы.
Глава 9. Осмотическая работа за счет Дцн+
197
9.7. Некоторые примеры Дцн+-зависимых
белков-переносчиков
Образование концентрационных градиентов того или иного вещества
за счет энергии Дцн+, в принципе, может происходить и без специально-
го энергопреобразующего устройства. Как уже упоминалось выше, ацетат
должен накапливаться в митохондриях, а аммиак — откачиваться во вне-
митохондриальное пространство под действием ДрН без всяких перенос-
чиков просто потому, что мембрана проницаема для СН3СООН и NH3.
В такой ситуации включение переносчика может лишь ускорить процесс
транспорта. Однако переносчик оказывается совершенно необходимым, ес-
ли транспортируемое вещество или химическая группировка сами по себе
не могут двигаться через мембрану в нужном направлении. Живая клетка
всегда стремится избежать спонтанных событий, предпочитая иметь дело с
процессами, катализируемыми белками. В этом случае может быть получена
высокая специфичность в отношении субстрата и регулируемая в широких
пределах скорость реакции. Данный принцип применим и к Дцн+-зависи-
мой осмотической работе. Огромное большинство транспортных механизмов
обслуживается специальными белками-переносчиками.
В некоторых случаях переносчик может быть устроен достаточно про-
сто, как, например, карнитин. Такие антибиотики-пептиды, как грамицидин,
образующий канал, проницаемый для К+, Na+ и Н+, калиевый унипортер
валиномицин, К+/Н+-антипортер — нигерицин, №+/Н+-антипортер — монен-
син также выглядят сравнительно простыми веществами рядом с белковы-
ми молекулами. Однако следует помнить, что и карнитин, и антибиотики-
ионофоры выполняют, в общем-то, примитивные функции.
В случае карнитина — это включение процесса транспорта, кото-
рый затем, набрав необходимый темп, переходит на другие «рельсы», где
уже безусловно требуется белок-переносчик (карнитин / ацилкарнитин-
антипортер). Что касается антибиотиков, то их роль, по всей видимости,
сводится к повреждению мембраны клеток конкурирующих видов. Если
функция переносчика более сложна, то это всегда белок.
Белки-переносчики — это трансмембранные полипептиды, которым при
их работе иногда «ассистируют» периферические или водорастворимые бел-
ки. Здесь уместно вспомнить хорошо изученную систему транспорта ами-
нокислот в Е. coli (см. табл. 9.1). Показано, что транспортные белки 1, 2,
5, 7, 8 и 14 действуют без водорастворимых белков-помощников. Другие
системы, перечисленные в той же таблице, используют растворимые белки.
В случаях 3, 4 и 6 такие белки играют роль буферов, стабилизирующих уро-
вень соответствующих аминокислот в периплазме. Они обратимо связыва-
ют аминокислоты, которые поступают из внешней среды, и высвобождают
аминокислоты, когда концентрация последних в периплазме падает из-за
активности белков-переносчиков, локализованных в цитоплазматической
мембране. Благодаря этим эффектам стабилизируется скорость импорта
аминокислот в цитоплазму.
198
ЧАСТЬ III. Потребители Дцн+
Иная ситуация описана для систем 9 и 10. Здесь белки-помощники не-
обходимы для транспорта как такового. Связав аминокислоту в периплаз-
ме, белок-помощник образует комплекс с одним из интегральных белков
цитоплазматической мембраны, который играет роль собственно перенос-
чика. Белок-помощник в системах 9 и 10 обусловливает специфическое
сродство переносчика к транспортируемому веществу. Ниже будут рас-
смотрены две Дцн+-зависимые транспортные системы, исследованные до-
статочно детально.
9.7.1. (Лактоза,Н*)-симпортер из Е. coli
(Лактоза,Н+)-симпортер из Е. coli — наиболее изученный переносчик
бактериального происхождения. Он был открыт в 1955 г. Ж. Коэном и
Г. Рикенбергом. Спустя восемь лет П. Митчел предположил, что лактоза
симпортируется с протоном под действием Дцн+. В 1970 г. И. Уэст показал,
что поглощение лактозы клетками Е. coli действительно сопровождается
поглощением ионов Н+. В то же время было выяснено, что продуктом гена
lacY является какой-то мембранный белок. В 1978 г. Р. Титер и сотрудники
клонировали ген 1ас\, что позволило выяснить аминокислотную последова-
тельность симпортера, амплифицировать ген и синтезировать белок in vitro.
В 1980 г. очищенный симпортер был встроен в протеолипосомы.
В опытах с интактными бактериями, вывернутыми суббактериальны-
ми пузырьками и протеолипосомами было продемонстрировано, что пере-
нос лактозы сторону ее более низкой концентрации приводит к появлению
Дцн+. При этом положительно заряжался и закислялся тот отсек, где кон-
центрация лактозы была ниже. Образуемая Дцн+ тормозила перенос лакто-
зы, а разобщители-протонофоры снимали это торможение.
В то же время транспорт лактозы в сторону большей концентрации
за счет энергии ДЦН+, образуемой дыханием, тормозился разобщителями.
Первоначально этот эффект был показан на интактных клетках кишечной
палочки, а затем и на протеолипосомах, содержавших симпортер и цитох-
ром Ьо из Е. coli.
(Лактоза, Н+)-симпортер на протяжении многих лет является клас-
сической моделью для изучения механизма функционирования белков-
переносчиков. Это очень гидрофобный белок с массой 46,5 кДа, состоя-
щий из 417 аминокислотных остатков. В ходе исследований было получено
огромное количество мутантных форм данного фермента и подробно ис-
следованы последствия таких замен. Удивительной особенностью (лакто-
за, Н+)-симпортера является то, что лишь 6 его аминокислотных остатков
оказались абсолютно незаменимыми. Для одной из таких мутантных форм
(Cysl54Gly) белка совсем недавно были получены кристаллы, что позволи-
ло определить трехмерную структуру этого переносчика с высокой степе-
нью разрешения.
Как видно на рис. 9.5, (лактоза, Н+)-симпортер образует 12 трансмем-
бранных а-спиральных столбов. Структура этих спиралей необычным об-
разом искривлена, что приводит к оригинальной «воронкообразной» форме
белка. В структуре этого симпортера наблюдается очень большая гидро-
Глава 9. Осмотическая работа за счет Ацн+
199
Рисунок 9.5. Структура (лактоза, Н+)-симпортера (LacY) из Е. coli в комплексе с аналогом суб-
страта (показан черным цветом) [Abramson et al., 2003, FEBS Lett., 555: 96—101]. A — вид сбоку
(параллельно поверхности мембраны). Б — вид сверху (со стороны цитоплазмы)
фильная полость, на дне которой (где-то на уровне середины липидного
бислоя) расположены места связывания лактозы и протона.
Как было сказано выше, трехмерную структуру удалось определить
лишь для мутанта (лактоза, Н+)-симпортера Cysl54Gly. Данная мутантная
форма как бы «заморожена» в одной из возможных конформаций этого
белка, что и обеспечило успех при ее кристаллизации. Однако ранее было
установлено, что во время переноса лактозы (лактоза, Н+)-симпортер пре-
терпевает значительные конформационные перестройки, сопровождающи-
еся изменением доступности к воде различных аминокислотных остатков с
разных сторон мембраны. Это указывает на то, что гидрофильная полость
со связанной лактозой может быть открыта в зависимости от конформа-
ционного состояния белка либо в сторону цитоплазмы (конформация, в
которой всегда находится мутант Cysl54Gly), либо в сторону периплазмы
(рис. 9.6). На основе этих данных была предложена модель переноса лакто-
зы через мембрану, изображенная на рис. 9.7.
ПЕРИПЛАЗМА
Рисунок 9.6. Структурные изменения в (лакто-
за, Н^)-симпортере между открытой внутрь (А)
и открытой наружу (Б) конформациями этого
белка. Аналог субстрата показан черным цветом
[Abramson et al., 2003, FEBS Lett., 555: 96-101]
ПЕРИПЛАЗМА МЕМБРАНА ЦИТОПЛАЗМА
В
ЦИТОПЛАЗМА
ПЕРИПЛАЗМА
Рисунок 9.7. Механизм действия (лактоза,
Н+)-симпортера: 1—6 — последовательность
стадий процесса; СН и С- — протонированн-
ная и депротонированная формы симпортера,
L — лактоза
200
ЧАСТЬ III. Потребители Ацн+
9.7.2. Митохондриальный ATP/ADP-антипортер
Среди митохондриальных транспортных систем наиболее изученным
считается ATP/ADP-антипортер (синонимы: адениннуклеотидтранслоказа,
переносчик адениннуклеотидов). Антипортер осуществляет обмен одной
молекулы ADP на одну молекулу АТР между вне-
и внутримитохондриальными пространствами.
Как было показано М. Клингенбергом и Г. Рот-
тенбергом, катализируемое антипортером пере-
распределение АТР и ADP зависит от величины
АТ. Валиномицин, разряжая АТ, уравнивает со-
отношение адениннуклеотидов снаружи и вну-
три митохондрий и меняет кинетику антипорта,
в то время как нигерицин, снимающий АрН, не
влияет на указанные параметры. Все эти фак-
ты свидетельствуют об электрогенном характере
обмена ATP/ADP. В отличие от подавляющего
большинства других нуклеотид-связывающих
белков, ATP/ADP-антипортер присоединяет не
магниевые комплексы АТР и ADP, а только их
свободные формы. Так как в отсутствие магния
АТР при нейтральном pH несет на один отрица-
Рисунок 9.8. м. Клингенберг тельный заряд больше, чем ADP, и направление
АТ в митохондриях благоприятствует выбросу
анионов, авторы заключили, что АТРвнут4 обмениваются на ADPHap3-. Этот
вывод был подтвержден в опытах с протеолипосомами.
Число оборота антипортера довольно мало (около 25 в 1 с). В то же
время количество молекул антипортера в мембране очень велико: оно со-
ставляет от 5 до 12% от общего белка внутренней мембраны.
Специфическими ингибиторами антипортера служат глюкозиды атрак-
тилат и карбоксиатрактилат, а также бонгкрековая кислота.
Антипортер необходим для откачки из митохондрий в цитоплазму того
АТР, который образуется при окислительном фосфорилировании. Электро-
форетический характер антипорта нуклеотидов через мембрану энергизо-
ванных митохондрий облегчает выход АТР из митохондрий и вход в них
ADP. Кроме того, повышается цена энергии гидролиза АТР в цитозоле из-
за роста отношения ATP/ADP в этом отсеке клетки. Последнее сдвигает все
ATP-зависимые процессы в сторону использования АТР. Значит, появляет-
ся возможность совершить дополнительную работу.
Если окислительное фосфорилирование выключено, например анаэро-
биозом, то тот же самый механизм антипорта предотвращает истощение
гликолитического АТР посредством Н+-АТР-синтазы, действующей в об-
ратном (АТРазном) направлении. Чтобы войти в митохондрию, внешний
АТР должен двигаться против поля, создаваемого Н+-АТРазной реакцией.
Интересно сравнить субстратную специфичность ATP/ADP-антипортера
и Н+-АТР-синтазы. Первый взаимодействует только с адениннуклеотидами,
вторая также и с гуаниннуклеотидами. Поэтому GTP, образованный внутри
Глава 9. Осмотическая работа за счет Ацн+
201
митохондрий при окислительном фосфорилировании GDP, в отличие от
АТР, не может быть немедленно откачан антипортером в цитозоль. Сначала
требуется передать фосфорил с GTP на ADP посредством нуклеозиддифос-
фаткиназы, и лишь затем полученный АТР подлежит обмену на цитоплаз-
матический ADP. Это относится и к субстратному фосфорилированию при
окислительном декарбоксилировании а-кетоглутарата, при котором обра-
зуется GTP. Данная субстратная специфичность антипортера замедляет ис-
пользование GTPBHyT внемитохондриальными потребителями энергии, что
должно способствовать протеканию в митохондриях синтеза белка, поддер-
живаемого энергией GTP.
Структура и механизм работы ATP/ADP-антипортера
ATP/ADP-антипортер — гидрофобный мембранный белок с массой
32 кДа, состоящий (в случае с ферментом из быка) из 297 аминокислотных
остатков. Анализ первичной последовательности этого фермента показы-
вает, что он состоит из трех повторяющихся последовательностей, каждая
из которых представляет собой две гидрофобные а-спирали, соединенные
протяженной гидрофильной петлей (т.е. в полном белке присутствуют 6
трансмембранных а-спиралей). Гомологичные повторы в структуре этого
переносчика указывают на то, что он, по-видимому, возник в ходе эволю-
ции за счет трипликации какого-то гена-предшественника. In vivo данный
антипортер функционирует в виде гомодимера.
Недавно трехмерная структура ATP/ADP-антипортера была установле-
на с помощью рентгеноструктурного анализа. Как видно на рис. 9.9, шесть
трансмембранных столбов этого белка образуют в липидном бислое доста-
точно компактную структуру. Все эти а-спирали значительно наклонены по
отношению к направлению, перпендикулярному поверхности мембраны.
Каждая вторая а-спираль где-то на уровне середины бислоя имеет острый
излом за счет присутствия в этом месте остатков пролина. Как и в случае
пермеазы лактозы, в структуре
ATP/ADP-антипортера имеется
очень большая гидрофильная во-
ронка (рис. 9.10). Она «выстла-
на» изнутри остатками положи-
тельно заряженных аминокислот
(Arg79, Argl04, Argl37, Arg234,
Arg235 и Arg279; а также Lys22,
Lys32, Lys91, Lys95 и Lysl06),
которые, по-видимому, обеспе-
чивают узнавание, освобождение
от магния и связывание АТР4- и
ADP3-. Место связывания этих
нуклеотидов расположено на са-
мом дне этой положительно за-
ряженной полости (т.е. где-то
на уровне середины липидного
Рисунок 9.9. Трехмерная структура ATP/ADP-
антипортера [Pebay-Peyroula et al., 2003, Nature,
426: 39-44]
202
ЧАСТЬ III. Потребители Ацн
Рисунок 9.10. Заряд поверхности ATP/ADP-антипортера (вид со стороны межмембранного про-
странства). Положительные и отрицательные заряды указаны соответственно синим и красным
цветом [Pebay-Peyroula et al., 2003, Nature, 426: 39—44]
бислоя). В этом месте молекулы белка есть необычная последовательность
(Arg234Arg235Arg236 Met237Met238Met239), что служит характерной особенностью
первичной структуры ATP/ADP-антипортеров, не встречающейся в других
переносчиках.
По-видимому, механизм обмена нуклеотидов ATP/ADP-антипортером
сходен с механизмом работы описанного выше (лактоза, Н+)-симпортера.
Этот механизм мог бы заключаться в значительных конформационных пе-
рестройках белка во время работы, приводящих к открытию гидрофильной
полости либо в сторону матрикса (причем данная форма белка должна иметь
повышенное сродство к АТР), либо в сторону межмембранного простран-
ства (с одновременным понижением сродства к АТР и увеличением аффин-
ности к ADP). Важно отметить, что ATP/ADP-антипортер, по-видимому,
обменивает нуклеотиды лишь в форме гомодимера. Таким образом, возмож-
ный механизм работы этого белка заключается в кооперативной смене кон-
формаций мономеров, находящихся в димере в таких состояниях, когда их
гидрофильные карманы открыты на противоположные стороны мембраны.
ATP/ADP-антипорт может происходить не только на внутренней мем-
бране митохондрий, но и в некоторых других ситуациях. Указание в пользу
присутствия ATP/ADP-антипортера в хлоропластах было впервые получено
Дж. Уолдегиоргисом и сотрудниками. Обмен нуклеотидов в хлоропластах
оказался чувствительным к бонгкрековой кислоте, но устойчив к карбок-
сиатрактилату. Доказано, что антипортер пластид функционирует в обрат-
ном направлении по сравнению с митохондриями, т.е. он обменивает АТР
цитоплазмы на ADP органеллы, что обеспечивает жизнедеятельность хло-
ропластов в темноте.
Особая система переноса адениннуклеотидов обнаружена в цитоплаз-
матической мембране бактерии Rickettsia prowazekii, внутриклеточного па-
Глава 9. Осмотическая работа за счет Дцн+
203
разита эукариот, вызывающего эпидемический тиф и являющегося ближай-
шим из всех изученных на сегодняшний день бактерий «родственником»
митохондрий. Этот микроорганизм располагает дыхательной цепью и с ее
помощью поддерживает ДЦН+ на своей мембране. Однако АТР, образуемый
клеткой хозяина, также может служить энергетическим ресурсом для R.
prowazekii за счет присутствия в этом микроорганизме особого ATP/ADP-
антипортера. Данный белок обеспечивает вход АТР в бактерию и выход
из нее ADP, т.е. транспорт нуклеотидов имеет направленность процесса,
противоположную таковому в митохондриях. Это объясняет, почему, не-
смотря на эволюционную близость R, prowazekii и митохондрий, ATP/ADP-
антипортер этой бактерии намного более схож с антипортером хлоропласт-
ного типа, нежели со своим митохондриальным аналогом.
Импорт АТР был обнаружен также у Bdellovibrio bacteriovorus. Эта мел-
кая бактерия — рекордсмен по скорости движения среди прокариот. Плывя
очень быстро, Bd. bacteriovorus убивает другие микроорганизмы, сталкиваясь
с ними и пробивая их клеточную стенку. Оказавшись внутри клетки, Bd.
bacteriovorus поглощает АТР своей жертвы.
9.8. Родь Дцн+ в транспорте макромолекул
Одна из наиболее интригующих проблем мембранологии и биоэнерге-
тики состоит в том, каким образом биологические макромолекулы, а имен-
но белки и нуклеиновые кислоты, переносятся через гидрофобный барьер
сопрягающих мембран, непроницаемый для такой небольшой частицы, как
ион Н+.
Твердо установлено, что в этих случаях процессы транспорта макромо-
лекул происходят без нарушения целостности мембраны, поскольку найде-
но, что они обеспечиваются энергией Дцн+ или одной из ее составляющих.
Скорость транспорта некоторых макромолекул очень высока.
Если обсуждать транспорт белков через сопрягающие мембраны, то
здесь наиболее изучены две модели: импорт в митохондрии (хлоропласты)
белков, синтезируемых в цитозоле, и экспорт из бактериальной цитоплазмы
белков, предназначающихся для периплазмы и внешней мембраны.
С проблемой транспорта белков тесно связан вопрос о механизме
встраивания в мембрану вновь синтезированных трансмембранных белков.
Чтобы расположиться нужным образом в липидном бислое, определенные
домены этих белков должны пересечь гидрофобный барьер.
9.8.1. Транспорт митохондриальных белков.
Биогенез митохондрий
Подавляющее большинство (не менее 98%) белков митохондрии ко-
дируется ядерным геномом. Это означает, что белки, как правило, синте-
зируются в цитоплазме, а затем каким-то образом доставляются в соответ-
ствующий отсек митохондрии (в матрикс, в межмембранное пространство,
во внешнюю или во внутреннюю мембрану).
204
ЧАСТЬ III. Потребители Дцн+
Чаще всего импортируемые в митохондрии белки синтезируются в ци-
топлазме в виде несколько более крупных предшественников, содержащих
добавочную аминокислотную последовательность с N-конца полипептид -
ной цепи. Эта последовательность является «адресом», направляющим бе-
лок в митохондрии. Она называется лидерной последовательностью и чаше
всего состоит из 10—30 аминокислотных остатков, способных образовы-
вать амфипатическую а-спираль. Половина поверхности этой спирали ги-
дрофобна, тогда как вторая половина гидрофильна и положительно заря-
жена за счет того, что обычно обогащена остатками лизина и аргинина.
Достигнув места назначения, белок-предшественник становится объектом
действия специфического протеолитического фермента — лидер-пептидазы.
Лишившись лидера, предшественник превращается в зрелый белок.
В некоторых случаях импортируемые в митохондрии белки не содержат
лидерной последовательности. Это продемонстрировано, в частности, для
многих переносчиков внутренней митохондриальной мембраны (например,
для ATP/ADP-антипортера) и для всех белков внешней митохондриальной
мембраны (например, для порина). Информация, необходимая для направ-
ления таких белков в митохондрии, заключена где-то внутри их первичной
последовательности. Несмотря на то что у имеющих внутренний адрес ми-
тохондриальных белков размер зрелого белка такой же, как и у соответству-
ющего белка-предшественника, белок-предшественник все же имеет иную
конформацию, нежели зрелый белок.
Во многих случаях показано, что митохондриальные белки могут синте-
зироваться на свободных полисомах. Транспорт этих белков обеспечивается
необходимой энергией на каких-то посттрансляционных этапах.
Рассмотрим транспорт митохондриальных белков на примере матрикс -
ного митохондриального фермента, обладающего лидерной последователь-
ностью. Прежде всего такой белок должен проникнуть через внешнюю мем-
брану этих органелл. Данный процесс обеспечивается ТОМ-комплексом (от
английского «translocase of the outer mitochondrial membrane»), состоящим из
семи различных полипептидов. Рецепторные субъединицы ТОМ-комплекса
(Тот20, Тот22 и Тот70) связывают лидерную последовательность, после
этого белок-предшественник проникает через внешнюю мембрану с помо-
щью белка Тот40, образующего в ней крупную пору.
Транспорт белков через внутреннюю мембрану осуществляется TIM-
комплексом («translocase of the inner mitochondrial membrane»), состоящим
из трех различных субъединиц: Tim50, Tim23 и Tim 17. Вначале лидерная
последовательность связывается в межмембранном пространстве с Tim50,
и далее эта последовательность проникает сквозь внутреннюю мембрану
через канал, образуемый субъединицей Tim23. Последний процесс проис-
ходит за счет электрофоретического переноса положительно заряженных
аминокислотных остатков лидера, т.е. осуществляется за счет энергии АТ.
Отсутствие АТ на внутренней мембране митохондрий полностью предот-
вращает транспорт матриксных митохондриальных белков.
Попав в матрикс, лидерная последовательность связывается с шаперо-
ном mtHsp70, выполняющим в комплексе с дополнительными белками сра-
Глава 9. Осмотическая работа за счет Дцн+
205
зу две функции. Этот шаперон за счет энергии гидролиза АТР «затаскивает»
в матрикс оставшуюся часть белка-предшественника, а затем обеспечивает
правильную сборку зрелого митохондриального белка.
Таким образом, для транспорта белков в матрикс митохондрии необ-
ходима энергия как в виде ДТ, так и в виде АТР. В то же время при транс-
порте белков из цитоплазмы во внутреннюю мембрану митохондрий ис-
пользуется лишь энергия ДТ.
Существует очень мало данных о встраивании во внутреннюю мембра-
ну тех белков, которые кодируются митохондриальным геномом и синтези-
руются в матриксе митохондрий. К белкам этого типа относится небольшое
количество очень гидрофобных полипептидов — 7 субъединиц NADH-
CoQ-редуктазы, 1 субъединица СоОН2-цитохром с-редуктазы, 3 субъеди-
ницы цитохромоксидазы и 2 субъединицы Н+-АТР-синтазы*. Все они об-
разуются сразу в зрелой форме и встраиваются в мембрану специальным
комплексом, отличным от TIM-комплекса. Механизм данного процесса в
настоящее время остается неизвестным.
Важный вывод из изложенных выше данных состоит в том, что ми-
тохондрия не может образоваться самосборкой из составляющих ее компо-
нентов. Она происходит только от другой митохондрии подобно тому, как
клетка происходит от клетки. Необходимым условием для биогенеза ми-
тохондрий служит наличие ДТ на ее внутренней мембране. Поскольку ни
один из ферментов, образующих ДТ, не может быть синтезирован самой
митохондрией, вся популяция этих органелл в клетке обречена на гибель,
когда митохондрии потеряют свой последний ДТ-образующий фермент, да-
же если в цитозоле будет избыток всех белков-предшественников.
Вот почему дрожжи, оказавшись в анаэробных условиях, сохраняют
замкнутые мембранные пузырьки («промитохондрии»), которые не содер-
жат дыхательной цепи, но способны к генерации ДТ посредством обраще-
ния Н+-АТР-синтазы, присутствующей там, хотя и в малом количестве.
9.8.2. Транспорт бактериальных белков
Белки бактерий, локализованные в периплазме или внешней мембране,
должны пересечь внутреннюю мембрану, чтобы прибыть по назначению.
Кроме того известно, что бактерии экскретируют некоторые ферменты во
внешнюю среду. Все эти процессы напоминают импорт белков митохонд-
риями и требуют наличия ДТ на внутренней бактериальной мембране.
В обоих случаях транспортируемый полипептид содержит дополнительную
сигнальную последовательность. Эта последовательность расположена на
N-конце транспортируемого белка и представляет собой один или несколь-
ко положительно заряженных аминокислотных остатков, после которых
следуют гидрофобные остатки, способные к образованию трансмембранной
а-спирали. После осуществления транспортировки белка сигнальная по-
следовательность может быть удалена с помощью специальной пептидазы.
Эти данные приведены для митохондрий высших животных.
206
ЧАСТЬ III. Потребители Ацн+
Необходимость энергизации мембраны специально исследовали при-
менительно к периплазматическим белкам, связывающим лейцин, изолей-
цин, валин и мальтозу, а также к р-лактамазе и некоторым белкам внешней
мембраны. Во всех этих случаях была показана абсолютная зависимость
транспорта белков от наличия АТ на внутренней бактериальной мембране.
9.8.3. Роль АЦН+ в транспорте белков и их укладке в мембране
Оказывается, что во многих случаях АТ необходима для правильного
встраивания белка в мембрану. По-видимому, простейшим примером тако-
го рода явления может быть АТ-зависимое образование каналов в плоской
фосфолипидной мембране при добавлении пептидного антибиотика аламе-
тицина. В этом случае АТ необходима для электрофоретического переме-
щения заряженных групп аламетицина в мембране.
Асиалогликопротеиновый рецептор из печени и мелиттин, активное
начало пчелиного яда, встраиваются в плоскую мембрану, только если на
нее подано напряжение более 20 мВ. Мелиттин — короткий полипептид
(26 аминокислотных остатков), так что нетрудно представить механизм
АТ-зависимого встраивания в мембрану, включающий трансмембранный
электрофорез определенных участков этой молекулы.
Присутствие АТ на липидном бислое позволяет не только обеспечить
энергией процесс встраивания белков, но и придать векторный характер
этому процессу, т.е. осуществить функциональную асимметричность био-
логических мембран. Существует правило, что положительно заряженные
домены мембранного белка локализуются на отрицательно заряженной сто-
роне мембраны, а отрицательно заряженные домены — на противоположной,
положительно заряженной стороне мембраны.
9.8.4. Транспорт бактериальной ДНК
Нет сомнений, что должен существовать особый молекулярный ме-
ханизм, транспортирующий ДНК через мембрану бактериальной клетки.
Этот процесс может быть исключительно быстрым. Так, скорость пере-
носа ДНК при инфицировании бактерии фагом Т4 достигает 3 х 103 ну-
клеотидных остатков в 1 с, т.е. один нуклеотид за 330 мкс. Перенос ДНК
при конъюгации и генетической трансформации происходит несколько
медленней: соответственно 600 и 55 нуклеотидных остатков в 1 с, что все
равно больше, чем скорость переноса нуклеотидов ATP/ADP-антипортером
(25 нуклеотидов/с). Транспорт ДНК часто сопровождается переносом осо-
бых «пилотных» белков. Это означает, что мембрану пересекают большие
молекулярные массы. В некоторых случаях ДНК переносится в виде двой-
ной спирали.
Роль АЦрр и АТР в транспорте ДНК была изучена Л.Л. Гринюсом и
его сотрудниками. Установлено, в частности, что истощение фонда внутри-
клеточного АТР при инкубации с арсенатом не тормозит ни генетической
трансформации, ни способности бактерий инфицироваться фагом Т4. С дру-
Глава 9. Осмотическая работа за счет Дцн+
гой стороны, конъюгация тормозилась арсенатом. При этом оказалось, что
ДЦН+ необходима во всех трех случаях транспорта ДНК. В частности, это
было показано для трансформации В. subtilis, инфицирования Е. coli фагом
Т4 и конъюгации.
Позднее эти наблюдения были подтверждены в других лабораториях.
Так, Б. Бремер и сотрудники выяснили, что вызывающий трансформацию
перенос ДНК в клетки В. subtilis или Haemophilus influenzae зависит от ДЦН+,
причем эффективны и ДТ, и ДрН. Б. Лабедан и сотрудники подтвердили,
что ДЦН+ необходим для инфицирования фагом Т4, но, по их мнению, дей-
ствующим компонентом служит ДЧ7, а ДрН не эффективен. Группе Б. Ла-
бедана не удалось показать необходимость ДЦН+ для инфицирования фагом
Т5. Транспорт ДНК фага X в Е. coli также оказался энергонезависимым
процессом.
Складывается впечатление, что бактерии располагают различными ме-
ханизмами переноса фаговой ДНК через мембрану.
В процессах, когда ДЦН+ необходима, она может служить либо движу-
щей силой транспорта, либо его регулятором, определяющим, например,
правильную ориентацию транспортируемой ДНК или ДНК-белкового ком-
плекса.
ГЛАВА ДЕСЯТАЯ
Дцн+ КАК ИСТОЧНИК ЭНЕРГИИ
ДЛЯ ОБРАЗОВАНИЯ ТЕПЛОТЫ
10.1. Три способа превращения метаболической энергии
в теплоту
Некоторые живые организмы (прежде всего млекопитающие и птицы)
способны к поддержанию значительного градиента температуры между своим
телом и окружающей средой. Этот процесс требует затраты очень большого
количества энергии. Понятно, что в любых нефотосинтезирующих тканях
основным первичным источником энергии для термогенеза может быть
только окисление дыхательных субстратов молекулярным кислородом, так
как только при этих реакциях выделяется достаточное ее количество.
В живой клетке теплота может выделяться тремя основными способами:
1) при гидролизе АТР, синтезированного за счет окислительного фосфори-
лирования (дыхание АЦН+ АТР—> тепло); 2) при рассеивании протон-
ного потенциала, образованного протон-транслоцирующими ферментами
дыхательной цепи (дыхание ДЦН+ тепло); 3) при окислении субстра-
тов дыхания ферментами, не сопряженными с запасанием энергии (дыха-
ние -> тепло). В механизмах первого типа участвует дыхание, сопряженное с
фосфорилированием, в то время как во втором и третьем случаях — дыхание,
соответственно разобщенное или первично не сопряженное с запасанием энер-
гии. Чтобы отличить последние два механизма от систем первого типа, где
путь от субстрата дыхания к выделению теплоты весьма сложен и требует
образования и утилизации АТР, удобно использовать понятие «свободное
окисление», объединяющее как разобщенные, так и первично не сопряжен-
ные дыхательные системы. У разных организмов для теплопродукции могут
применяться различные из перечисленных выше типы механизмов термо-
генеза, а также всевозможные их комбинации.
Тот факт, что дыхательные системы как-то вовлечены в терморегуля-
цию, был выяснен в ранних физиологических исследованиях, показавших
сильное увеличение поглощения кислорода млекопитающими и птицами,
помещенными в холодные условия. Обычно такое усиление дыхания (до-
стигающее 2,5 раз) происходит без пропорционального увеличения основ-
ных функций организма. Создалось впечатление, что на холоде физиологи-
ческие функции осуществляются менее эффективно: чтобы совершить одну
и ту же работу, в холодных условиях необходимо потребить больше пищи
и кислорода, а значит, выделить больше теплоты. Возможно и другое объ-
Глава 10. Дцн+ как источник энергии для образования теплоты
209
яснение данного эффекта: при охлаждении эффективность функций как
таковых остается неизменной, а усилившиеся дыхание и теплопродукция
обусловлены активацией каких-то специализированных механизмов обра-
зования теплоты. Второе объяснение выглядит более рациональным, по-
скольку оно соответствует задаче, решаемой терморегуляторной системой
организма, — сделать физиологические функции независимыми от темпе-
ратуры окружающей среды.
10.2. Терморегуляторная активация свободного дыхания
у животных
10.2.1. Бурый жир
В организме млекопитающих содержится особая ткань — бурый жир,
специализирующаяся на выработке добавочной теплоты при снижении
окружающей температуры. Бурый жир составляет не более 1—2% массы
тела. Тем не менее стимуляция этой ткани симпатической нервной систе-
мой при охлаждении животных, предварительно адаптированных к холоду,
повышает теплопродукцию бурого жира в такой степени, что она может
достигать одной трети всей дополнительно образованной в организме те-
плоты. В этих условиях бурый жир способен выделять до 400 Вт теплоты
на 1 кг массы, что на несколько порядков больше обычной термогенной
способности тканей млекопитающих (человек в состоянии покоя образует
около 1 Вт теплоты на 1 кг массы).
В организме бурый жир сосредоточен в верхней части спины, ближе к
шее. Он окружает кровеносные сосуды, питающие кровью мозг. Вот почему
теплопродукция в буром жире может иметь огромное значение для выжи-
вания организма на холоде. Эта ткань наиболее развита у новорожденных,
и ее удельное содержание в организме быстро снижается с возрастом жи-
вотного.
Первые научные публикации о буром жире датируются XVII в., но лишь
недавно была понята его функция. В 1959 г. Б. Йоханссон написал пер-
вый подробный обзор о метаболизме бурого жира. Основываясь на скудной
фактической информации тех лет и некоторых предварительных данных, он
выдвинул гипотезу, что бурый жир может некоторым образом участвовать в
терморегуляции. Благодаря последующим работам Р.Э. Смита и ряда других
исследователей стало ясно, что основной физиологической функцией бу-
рого жира является образование дополнительной теплоты в условиях, когда
теплоотдача организма значительно возрастает.
Своим цветом бурый жир обязан митохондриям, содержащимся в огром-
ных количествах в клетках этой ткани. Митохондрии бурого жира оказались
хорошо оснащенными именно для образования теплоты. Содержание ды-
хательных ферментов в них намного превышает таковое Н+-АТР-синтазы.
Но, пожалуй, важнее всего то, что в их внутренней мембране содержится
особый разобщающий белок UCP (от uncoupling protein), также называемый
термогенином.
210
ЧАСТЬ III. Потребители Д|1н.
сАМР
ЦИТОЗОЛЬ Протеин- ©
Триглицериды
жировой капли
НоО
га
н
О
Жирная кислота глицерин
Жирный ацил-СоА
Ь-АТР*ч1
^ADP+рД
Пируват
g
га
х
Z
а:
0s
га
х
га
*
Внутренняя
митохондриальная
мембрана
н°*
Жирный
ацил-СоА
Пируват
со
МАТРИКС
С
ф
Рисунок 10.1. Индуцированный холодом термогенез в митохондриях бурого жира. Знаками +
и — обозначены соответственно стимуляция и торможение
Глава 10. Дцн+ как источник энергии для образования теплоты
211
Термогенин экспрессируется исключительно в буром жире и составля-
ет до 15% общего белка митохондрий этой ткани. UCP способен вызывать
разобщение окислительного фосфорилирования, таким образом рассеивая
всю энергию протонного потенциала в виде тепла (термогенез с использо-
ванием механизма: дыхание -> АЦН+ -> тепло). Молекулярная масса UCP
равна 33,2 кДа. Этот белок состоит из трех повторяющихся последователь-
ностей, каждая из которых включает две трансмембранные а-спирали, сое-
диненные между собой протяженной гидрофильной петлей. Считается, что
UCP функционирует в виде гомодимера. Аминокислотная последователь-
ность термогенина напоминает таковую ATP/ADP-антипортера и некото-
рых других анионных переносчиков митохондрий (глутамат / аспартатного
антипортера и переносчика дикарбоксилатов).
Функционирование UCP регулируется на нескольких уровнях. Так, при
охлаждении животного происходит резкое увеличение транскрипции гена
этого белка (значительное увеличение содержания соответствующей мРНК
в клетках бурого жира наблюдается уже через 15 мин после начала охлаж-
дения). Регулируется также и ферментативная активность UCP. Различные
пуриновые нуклеотиды (GDP, ADP, GTP и АТР) ингибируют протонную
проницаемость митохондрий из бурого жира, тогда как свободные жирные
кислоты в микромолярной концентрации необходимы для повышения этой
проницаемости.
Эксперименты, проведенные на животных in vivo, ткани бурого жира
in situ, адипоцитах и митохондриях in vitro, позволили выявить следующую
цепь событий, включенных в термогенный ответ этой ткани на понижение
температуры среды.
1. Холодовые рецепторы кожи активируются и посылают сигнал в мозг,
а именно — в терморегуляторный центр гипоталамуса.
2. Из гипоталамуса сигнал поступает в бурую жировую ткань через сим-
патические нейроны. Из нервных окончаний в пространство между адипо-
цитами выделяется норадреналин.
3. Норадреналин связывается с p-адренорецепторами, локализованны-
ми на внешней стороне плазматической мембраны клеток бурого жира (это
и все дальнейшие события проиллюстрированы на рис. 10.1).
4. р-Адренорецепторы, связав норадреналин, активируют аденилатци-
клазу. Синергистом норадреналина служит глюкагон, а антагонистом — ин-
сулин. Каждый гормон действует через свой рецептор.
5. Аденилатциклаза образует сАМР из АТР.
6. сАМР включает протеинкиназный каскад, приводящий к активации
липазы.
7. Липаза расщепляет содержащиеся в жировых каплях триацилглице-
риды до жирных кислот и глицерина.
8. Образованные таким путем жирные кислоты выполняют две функ-
ции: они служат субстратами дыхания и одновременно вторичными (вну-
триклеточными) медиаторами гормонального сигнала. Как субстраты жир-
ные кислоты претерпевают обычный цикл катаболитических превращений.
Они активируются во внешней мембране митохондрий, давая ацил-СоА.
Полученные жирные ацилы транспортируются посредством карнитино-
212
ЧАСТЬ III. Потребители Ацн+
вой системы в митохондриальный матрикс, где под действием ферментов
р-окисления расщепляются, давая СО2 и атомы Н.
9. Атомы Н, поставляемые в дыхательную цепь при р-окислении жир-
ных кислот и окислении в цикле Кребса ацетильных групп, переносятся к
О2, что сопряжено с образованием протонного потенциала дыхательными
АЦн+-генераторами. В результате ионы водорода откачиваются из матрикса
в межмембранное пространство митохондрий.
10. Ионы Н+ возвращаются в матрикс за счет функционирования UCP,
связавшего жирные кислоты (сигнальная функция жирных кислот). Этот
завершающий этап сопровождается выделением теплоты.
В настоящее время предложены два альтернативных гипотетических
механизма разобщающего действия UCP.
Согласно одному из них, связывание жирных кислот с этим белком
приводит к открытию в нем канала, способного к осуществлению транс-
мембранного переноса Н+.
Второй механизм, предложенный одним из авторов данной книги
(В.П.С.), состоит в том, что термогенин является переносчиком анионной
формы свободных жирных кислот. Облегчение трансмембранного пере-
мещения анионов (RCOO-) может иметь принципиальное значение для
разобщенного действия жирных кислот, поскольку их анионные формы
задерживаются на поверхности раздела мембрана / вода, ориентируясь кар-
боксильной группой в сторону воды, а жирным «хвостом» — в сторону
липида. Поэтому, несмотря на то что липидный бислой хорошо проницаем
для нейтральных (протонированных) жирных кислот (RCOOH), мембраны
очень плохо проводят их анионные формы. Из-за этого сами по себе жир-
ные кислоты не являются протонофорами. Однако если UCP может пере-
носить RCOO-, то это обстоятельство должно резко повысить эффектив-
ность жирных кислот как разобщителей.
Перенос RCOO- UCP и ATP/ADP-антипортером мог бы осуществлять-
ся при помощи взаимодействия этого аниона с положительно заряженными
Arg и Lys в нижней части воронки этих белков (см. выше рис. 9.10). Чтобы
пересечь гидрофобный барьер мембраны, RCOO- достаточно было бы об-
ратимо связаться с Arg234, 235 или 236, которые находятся в части белка,
образующей дно воронки.
Другая весьма важная характеристика разобщения жирными кислотами
состоит в том, что здесь не требуется специального механизма для пре-
кращения разобщающего эффекта. Разобщение исчезает само по себе, как
только скорость поступления жирных кислот в митохондрии станет меньше
скорости их окисления. Именно такие соотношения возникают при повы-
шении окружающей температуры, когда отключаются холодовые рецепторы
кожи, а с ними прекращается действие регуляторного каскада, обеспечива-
ющего образование жирных кислот из триацилглицеридов. С прекращени-
ем подачи жирных кислот в митохондрию их запас быстро исчерпывается
мощной системой р-окисления. В итоге уровень жирных кислот падает и
разобщение, вызванное жирными кислотами, исчезает.
Интересно, что не только охлаждение, но и, по крайней мере, еще три
состояния организма, связанные с повышением поглощения кислорода и
Глава 10. Дцн+ как источник энергии для образования теплоты 213
выделения тепла, сопровождаются разобщением в бурой жировой ткани.
Одно из таких состояний — появление на свет новорожденного. При родах
молодой организм из комфортных изотермических условий внезапно по-
падает в гипотермическую окружающую среду. Эта проблема значительно
осложняется небольшими размерами новорожденного (т.е. высоким со-
отношением поверхность / объем), что значительно увеличивает потери
тепла. Показано, что бурый жир играет ключевую роль в термоадаптации
детенышей млекопитающих при родах. Приведенные выше данные объяс-
няют, почему эта ткань наиболее развита у новорожденных и ее удельное
содержание в организме постепенно снижается с возрастом параллельно
увеличению размера тела и понижению соотношения поверхность / объем.
Еще одним примером функционирования бурого жира является про-
буждение животного от зимней спячки. Показано, что бурый жир не атро-
фируется у зимоспящих животных, адаптированных к термонейтральным
условиям. Холодовая акклиматизация повышает количество термогенина
в митохондриях бурого жира зимоспящих животных, но не в такой степе-
ни, как, например, у крыс или кроликов. Пробуждение хомяков от спячки
сопровождается разобщением, которое, по-видимому, особенно важно для
разогрева крови, притекающей к мозгу. Из-за локализации бурого жира в
области сосудов, идущих к голове, теплопродукция в этой ткани прежде
всего вызывает повышение температуры мозга, который переходит в актив-
ное состояние сразу же вслед за разогревом бурого жира.
Другая модель — термогенез, обусловленный избыточным потреблением
пищи. Н. Ротуел и М. Сток поставили следующий опыт. Взрослым кры-
сам скармливали «ресторанную диету», т.е. разнообразную и вкусную пищу.
Потребление животными этой пищи оказалось на 80% больше, чем в кон-
трольной группе, получавшей обычный корм. При этом масса животных за
три недели увеличилась только на 27%. Измерение газообмена показало,
что хорошо питавшиеся крысы потребляли на 25% больше кислорода, чем в
контроле. Эта надбавка исчезала после введения животным пропанолола —
антагониста норадреналина. Масса бурого жира за те же три недели опыта
возросла более чем втрое; в митохондриях увеличилось количество UCP.
Оказалось также, что мутация, вызывающая ожирение, сопровождается
снижением уровня UCP у
мышей.
Роль UCP в термо-
адаптации была недавно
прямо подтверждена с по-
мощью молекулярно-гене-
тических подходов. Б. Кэн-
нон и Я. Недергардом была
получена линия мышей с
нокаутированным геном
UCP. Оказалось, что эти
мыши чувствительны к по-
Рисунок 10.2. Б. Кэннон (слева) и Я. Недергард (справа)
нижению температуры.
214
ЧАСТЬ П1. Потребители Дцн+
10.2.2. Скелетные мышцы
Как описано выше, бурый жир является специализированной тканью
млекопитающих, ответственной за термоадаптацию при понижении темпе-
ратуры. Однако удельный вес этой ткани относительно невелик (особенно
у взрослых животных с большой массой тела), и ее активность не может
объяснить большей части дополнительного термогенеза, наблюдаемого при
охлаждении животных. Важно отметить, что такие теплокровные живот-
ные, как птицы, вообще не содержат бурого жира. Сказанное означает, что
другие ткани теплокровных животных и прежде всего те ткани, которые
богаты митохондриями и обладают значительным удельным весом в орга-
низме (например, скелетные мышцы), также должны принимать участие
в теплопродукции при охлаждении. В то же время известно, что ген UCP
экспрессируется исключительно в буром жире. Поэтому механизм тепло-
продукции в других тканях теплокровных животных может отличаться от
механизма термогенеза в буром жире.
Один из механизмов термогенеза скелетных мышц нам хорошо изве-
стен по собственному опыту — это мышечная дрожь при охлаждении ор-
ганизма. Она поддерживается, как любое сокращение мышцы, гидроли-
зом цитоплазматического АТР. Регенерация последнего происходит за счет
транспорта АТР из митохондрий ATP/ADP-антипортером. В митохондриях
АТР образуется Н+-АТР-синтазой, которая потребляет Дцн+, генерируемую
дыхательной цепью (т.е. осуществляется термогенез по типу дыхание ->
ДЦН+ АТР тепло).
Однако также известно и то, что этот путь термоадаптации использу-
ется лишь при краткосрочном охлаждении. Вероятно, данный механизм —
слишком длинный и медленный, чтобы резко увеличить продукцию тепло-
ты в условиях внезапного понижения температуры среды. Кроме того он
связан с сильной активацией мышечного сокращения, т.е. со специфиче-
ской функцией данной ткани (потребление кислорода организмом при рез-
ком охлаждении приближается к таковому при тяжелой мышечной работе).
Таким образом, главный принцип терморегуляции — сделать функции не-
зависимыми от температуры — в данном случае остается нереализованным
применительно к самой массовой ткани организма, мышечной. Вот почему
мышечная дрожь уменьшается по мере адаптации к холоду. Можно предпо-
ложить, что при длительном охлаждении в мышцах активируется какой-то
дополнительный механизм образования тепла.
Интересно, что роль митохондрий в термогенезе была впервые дока-
зана именно на скелетных мышцах животных. Работы по исследованию
действия кратковременного охлаждения животного на митохондрии были
начаты в 1960 г. одним из авторов книги (В.П.С.) совместно с С.П. Масло-
вым в лаборатории С.Е. Северина. Опыты проводили на голубях, которых
предварительно остригали, чтобы исключить физическую терморегуляцию.
Клетку с животным помещали в холодильник на —20 °C и включали венти-
лятор. Голубь, впервые помещенный в эти жестокие условия, выдерживал
15—20 мин, после чего наступало резкое снижение температуры тела. Одна-
Глава 10. Дцн+ как источник энергии для образования теплоты 215
ко при повторном охлаждении, которому подвергали голубя на следующий
день, животное лишь несколько снижало температуру своего тела, после че-
го она стабилизировалась, и голубь мог выдерживать охлаждение часами.
Изучение митохондрий, выделенных из грудной мышцы голубя, охлаж-
давшегося впервые, показало снижение коэффициента P/О в 1,6 раза по
сравнению с неохлаждавшимися животными. Второе охлаждение вызывало
снижение P/О в шесть раз, т.е. наступало почти полное разобщение дыха-
ния и фосфорилирования.
Дальнейшее исследование этого эффекта показало, что степень разоб-
щения достигает максимума уже через 15 мин после повторного помещения
животного на холод. Разобщение мышечных митохондрий было продемон-
стрировано не только у птиц, но и у млекопитающих (мышей).
Было показано также, что концентрация высокоэнергетических соеди-
нений возрастает при первом охлаждении и падает при втором. Этот факт
по меньшей мере свидетельствовал о том, что мышцы некоторым образом
вовлечены в исследуемый терморегуляторный ответ. Измерение дыхания in
vivo выявило его стимуляцию как при первом, так и при повторном охлажде-
нии животного. В первом случае стимуляция сменялась прогрессирующим
торможением дыхания, в то время как во втором случае торможения не на-
ступало. Именно таких соотношений можно было ожидать, если животное,
охлаждаясь впервые, не успевало в должной степени разобщить дыхание
и фосфорилирование и избыточное потребление кислорода приводило к
избыточному синтезу АТР и торможению дыхательной цепи по механизму
протонного контроля. При повторном действии холода происходило силь-
ное разобщение, предотвращавшее накопление АТР и исчерпание ADP, так
что состояние дыхательного контроля не наступало. Но если эта логика
верна, то введение животному искусственного разобщителя-протонофора
при первом охлаждении могло бы спасти организм от скоропостижной хо-
лодовой смерти. Опыты, поставленные С.П. Масловым, подтвердили это
предсказание. Инъекция 2,4-динитрофенола, являющегося токсичным для
животных, тем не менее значительно увеличивала продолжительность жиз-
ни мышей, впервые подвергнутых охлаждению, на холоде.
В других опытах было показано, что дыхание интактной мышцы диа-
фрагмы крысы активируется при повторном охлаждении животных. Одно-
временно снижается степень стимуляции дыхания ткани динитрофенолом.
Эффект, подобный охлаждению, мог быть вызван инъекцией животному
норадреналина. Как выявило дальнейшее исследование, концентрация
жирных кислот значительно возрастает в мышцах животных, подвергнутых
повторному воздействию холода. Было получено несколько независимых
свидетельств роли свободных жирных кислот в качестве медиаторов термо-
регуляторного разобщения в мышцах.
1. Связывание жирных кислот при промывании митохондрий раство-
ром предварительно обезжиренного сывороточного альбумина повышало
P/О в митохондриях из мышц охлажденных животных.
2. Фракция жирных кислот, выделенная из мышц охлажденных жи-
вотных и добавленная к митохондриям контрольных животных, вызывала
разобщение.
216
ЧАСТЬ III. Потребители Дцн+
3. Пальмитиновая кислота в концентрации всего 1 х 10”5 М заметно
стимулировала дыхание мышечных митохондрий в состоянии дыхательного
контроля.
Таким образом, в мышцах, как и в буром жире, жирные кислоты служат
медиаторами терморегуляторного разобщения в митохондриях. Однако, как
было сказано выше, мышечные митохондрии не содержат специального
разобщающего белка UCP. Как же в этом случае реализуется разобщающее
действие жирных кислот?
В нашей группе Е.Н. Моховой было установлено, что разобщение мы-
шечных митохондрий низкими концентрациями жирных кислот подавля-
ется 5 х 10"7 М карбоксиатрактилатом, специфическим ингибитором АТР/
ADP-антипортера. ADP, добавленный как с олигомицином, так и без него,
также уменьшал стимуляцию дыхания малыми дозами пальмитата. С другой
стороны, жирные кислоты тормозили ATP/ADP-антипорт. На основе этих
данных был сделан вывод, что разобщение мышечных митохондрий жир-
ными кислотами в их физиологической концентрации опосредуется АТР/
ADP-антипортером. Следует еще раз отметить, что UCP во многом подобен
по аминокислотной последовательности и доменному строению ATP/ADP-
антипортеру. Перенос Н+ UCP также активируется жирными кислотами и
тормозится пуриновыми нуклеотидами (см. выше). Поэтому можно пола-
гать, что как в мышцах, так и в буром жире жирные кислоты служат медиа-
торами терморегуляторного разобщения в митохондриях, однако в первом
случае мишенью жирных кислот оказывается ATP/ADP-антипортер, а во
втором — специальный белок, по-видимому представляющий собой особую
модификацию антипортера*.
То обстоятельство, что жирные кислоты не только повышают прово-
димость внутренней мембраны митохондрий для Н+, но и конкурируют
с адениннуклеотидами за ATP/ADP-антипортер, должно страховать клетку
от истощения фонда внемитохондриального АТР в условиях разобщения,
когда Н+-АТР-синтаза начинает действовать в обратном (гидролитическом)
направлении. Истощение АТР, помимо всего прочего, могло бы блокиро-
вать окисление жирных кислот, служащих не только регулятором сопряже-
ния, но и основным субстратом дыхания на холоде. Как отмечалось выше,
активация жирных кислот путем их соединения с СоА за счет энергии АТР
происходит во внешней мембране митохондрий.
Изучение разобщения митохондрий в тканях, отличных от бурого жира,
в недавнее время получило довольно неожиданное продолжение. Выясни-
лось, что геном млекопитающих, наряду с геном термогенина (UCP), также
содержит еще четыре дополнительных гена, близких его гомологов. Про-
дукты этих генов получили названия разобщающих белков UCP2, UCP3,
UCP4 и UCP5, а термогенин теперь в современной литературе именуется
как UCP1. Более того, разобщающие белки были обнаружены у болыиин-
* В рамках этой гипотезы UCP представляет собой монофункциональный вариант
ATP/ADP-антипортера, утратившего основную (нуклеотид-транспортную) функцию и
специализирующегося на дополнительной функции — разобщении жирными кислотами
посредством транспорта их анионов.
Глава 10. Дцн+ как источник энергии для образования теплоты
217
ства исследованных животных (как теплокровных, так и холоднокровных)
и даже у многих растений. Существуют указания на то, что какие-то UCP,
возможно, функционируют также у грибов и у простейших. Столь широкое
распространение этих белков, по-видимому, предполагает какую-то фунда-
ментальную роль UCP в метаболизме всех эукариот.
Экспрессия генов новых разобщающих белков млекопитающих ткане-
специфична. UCP2 экспрессируется во многих тканях, UCP3 — в буром
жире и скелетных мышцах, тогда как UCP4 и UCP5 специфичны для мозга.
Открытие целого семейства UCP у млекопитающих навело многих иссле-
дователей на мысль, что основной функцией этих белков является осущест-
вление теплопродукции в иных, чем бурый жир, тканях. Это заключение
подтверждалось наблюдением увеличения экспрессии генов UCP2 и UCP3
в ответ на охлаждение животного (удивительно, но подобная индукция
холодом также характерна и для некоторых растительных UCP). Однако
впоследствии было установлено, что индукция разобщающих белков на-
блюдается не только при охлаждении, но и во многих других условиях, в
том числе и в тех, которым никак не может способствовать уменьшение эф-
фективности запасания энергии (например, при голодании). Скорее всего,
повышенная экспрессия генов разобщающих белков коррелирует не с тем-
пературными условиями, а с ускорением в организме метаболизма жиров.
Более того, оказалось, что мутантные мыши с нокаутированными ге-
нами различных альтернативных разобщающих белков (UCP2—UCP5) не
демонстрируют каких-либо отличий в адаптации к холоду по сравнению с
контрольными мышами. Таким образом, на сегодняшний день считается,
что если UCP2—UCP5 и участвуют в разобщении митохондрий при холодо-
вом стрессе, то их роль в этом процессе относительно невелика. Ф. Гольей
и одним из авторов этой книги (В.П.С.) было высказано предположение,
что новые UCP служат переносчиками анионов перекисей жирных кислот
и ответственны за откачку этих опасных соединений из внутреннего во
внешний полумембранный слой внутренней мембраны митохондрий. Так
можно было бы объяснить многочисленные указания на роль новых UCP
в антиоксидантной защите митохондрий, а также тот факт, что их коли-
чество очень невелико по сравнению с таковым UCP1 (точно так же, как
количество перекисей жирных кислот всегда гораздо меньше количества
интактных жирных кислот).
10.3. Терморегуляторная активация свободного окисления
у растений
Согласно широко распространенной догме терморегуляция представля-
ет собой функцию, присущую только высшим млекопитающим и птицам.
Однако природа не столь догматична, как ее исследователи, и иногда пре-
подносит им свои сюрпризы. Проблема лишь в том, что люди зачастую
склонны игнорировать подобные подарки.
В 1778 г. Ж.-Б. Ламарк обратил внимание на то, что температура в
основании распустившегося цветка лилии рода Arum заметно выше, чем в
218
ЧАСТЬ III. Потребители Дцн+
других частях того же растения. Позднее было установлено, что феномен
существенного разогревания цветка (соцветия) встречается у многих видов,
входящих в различные семейства примитивных цветковых растений, та-
ких, как Araceae, Nelumbonaceae, Nymphaeaceae, Aristolochiaceae, Агесасеае,
Cyclanthaceae, Annonaceae, Magnoliales и Cycadaceae. Гиперпродукция тепла
длится в течение 12—48 ч, что необходимо для испарения имитирующих
гнилостный запах пахучих веществ (обычно аминов или индолов), при-
влекающих насекомых-опылителей. Теплопродукция делает процесс цве-
тения независимым от температуры окружающей среды. При этом разница
температур между цветком и воздухом может достигать 35 °C, а величина
удельной теплопродукции — 1000 Вт на 1 кг ткани (см. рис. 10.3).
Все эти наблюдения побудили многих исследователей усиленно изу-
чать термогенез растений. Еще в 1851 г. Гарэ показал хорошее соответствие
между потреблением кислорода и продукцией теплоты в цветах ароидной
лилии. Впоследствии выяснилось, что снижение окружающей температуры
приводит к сильной активации дыхания (традиционно считали, что такой
эффект — прерогатива теплокровных животных). Например, снижение тем-
пературы среды с +15 до +5 °C ускоряет в 3,5 раза скорость дыхания цвет-
ков восточной капусты. Цветение термогенных растений сопровождается
исключительно мощным усилением дыхания (настолько мощным, что оно
получило название «метаболического взрыва»). Максимальная скорость ды-
хания достигает 40 мл О2хг-1 хч"1, что является исключением в мире рас-
тений и близко к наивысшим скоростям дыхания животных тканей. Каким
10 15 20 25 30 (°C)
Рисунок 10.3. Стадии цветения термогенного растения Symplocarpus renifolius (А—В). Г — фото-
графия стадии В в инфракрасном диапазоне. Д, Ей Ж— увеличенное изображение фотографий
Б, В и Г. Шкала температуры для фото Г и Ж показана справа внизу, масштаб 1 см [Onda et
al., 2008, Plant Physiol., 146: 636-645]
Глава 10. Др,н+ как источник энергии для образования теплоты
219
же образом в термогенных растениях происходит преобразование энергии
окисления дыхательных субстратов в тепло?
Как было изложено в разд. 5.1, дыхательная цепь растительных мито-
хондрий, в отличие от митохондрий животных, содержит ферменты аль-
тернативного пути окисления, не сопряженного с запасанием энергии. Это
две несопряженные NADHixhhoh оксидоредуктазы (NDin и NDex, окисляю-
щие соответственно митохондриальный и цитоплазматический NADH) и
несопряженная цианрезистентная хинолоксидаза (АОХ). Данное отличие
позволяет растениям использовать путь прямого преобразования энергии
окисления дыхательных субстратов в тепло, минуя промежуточные стадии
образования протонного потенциала или АТР.
Одним из авторов этой книги (А.В.Б.) было установлено, что мито-
хондрии термогенных растений перед цветением имеют обычное дыхание,
чувствительное к цианиду, миксотиазолу и ротенону, и эта дыхательная
активность сопряжена с фосфорилированием (коэффициент P/О для окис-
ления малата составляет порядка 2,7). Однако в день цветения дыхание со-
цветия разобщается и утрачивает чувствительность к вышеперечисленным
ингибиторам.
Было также установлено, что митохондрии соцветий термогенных рас-
тений характеризуются исключительно высоким содержанием NDin, NDex и
АОХ, активность которых не сопряжена с генерацией протонного потенциа-
ла. Вклад же сопряженных митохондриальных ферментов (комплексов I, III
и IV) в общий процесс дыхания в этих соцветиях не превышает 5%. Таким
образом, в этих митохондриях за счет активности NDin и NDex шунтирован
первый пункт сопряжения, а за счет активности АОХ шунтируются также
второй и третий пункты сопряжения (рис. 10.4). Так реализуется механизм
прямого превращения энергии дыхания в тепло.
NADH » Комплекс I _ ЬсЛ —► с -► аа3— (X запасание
2 энергии
NADH » NDjn ! ! ! ! » CoQ^.
NADH t NDex » АОХ O2 Теплопродукция
Рисунок 10.4. Схема дыхательной цепи митохондрий термогенных растений.
Превалирующие при термогенезе пути переноса электронов выделены жирными стрелками
Это означает, что механизмы теплопродукции у растений и теплокров-
ных животных принципиально различны. В чем же состоит причина этих
различий? По-видимому, еще на начальных этапах эволюции животных
ферменты альтернативного несопряженного пути дыхания были утеряны,
поэтому при последующем возникновении теплокровности они были вы-
нуждены использовать такие более сложные пути термогенеза, как рассеи-
вание энергии, уже запасенной в виде протонного потенциала или АТР.
Часть четвертая
ВЗАИМОСВЯЗЬ И РЕГУЛЯЦИЯ
ГЕНЕРАТОРОВ И ПОТРЕБИТЕЛЕЙ
ПРОТОННОГО ПОТЕНЦИАЛА
ГЛАВА ОДИННАДЦАТАЯ
РЕГУЛЯЦИЯ, ТРАНСПОРТ И СТАБИЛИЗАЦИЯ
ПРОТОННОГО ПОТЕНЦИАЛА
11.1. Регуляция Дцн+
Ферменты, образующие и потребляющие Дцн+, могут контролироваться,
подобно другим энзиматическим системам, всем набором регулирующих
воздействий, которым располагают клетка и организм. Ряд примеров такого
рода регуляции был описан в предыдущих главах этой книги. В данной гла-
ве будут обсуждаться особые механизмы, специально изобретенные живой
природой, чтобы регулировать Дцн+. Некоторые аспекты этой проблемы уже
рассмотрены в предыдущей главе применительно к функции свободного окис-
ления в терморегуляции. В следующем разделе будет показано, что процессы
свободного окисления, часто в комбинации с сопряженным окислением,
имеют гораздо более широкое значение, чем образование теплоты.
11.1.1. Альтернативные функции дыхания
Когда в 1932 г. К. Окунуки описал цианид- и СО-устойчивое дыхание
пыльцы одного из лилейных, это произошло почти одновременно с откры-
тием В.А. Энгельгардтом (1930) фосфорилирующего дыхания в эритроцитах
птиц. Поэтому неудивительно, что Окунуки не уточнил, сопряжен ли с
фосфорилированием открытый им новый путь окисления.
Огромный успех направления исследований, начало которым положил
В.А. Энгельгардт, привело, как это часто бывает, к появлению догмы, пере-
оценивавшей роль фосфорилирующего окисления. Биологически полезным
стали считать только то дыхание, которое сопряжено с образованием АТР.
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
221
Если кто-либо обнаруживал дыхание, не связанное с фосфорилированием,
это наблюдение списывали на счет артефакта in vitro или патологии in vivo,
В 1958 г. этой догме была противопоставлена противоположная точка
зрения, согласно которой клеточное дыхание in vivo в норме происходит
не только сопряженно с запасанием энергии, но и без такого сопряжения
(этот второй тип дыхания был назван свободным). Было высказано предпо-
ложение, что свободное дыхание участвует в терморегуляторном образовании
теплоты, в образовании или разрушении метаболитов, детоксикации ксено-
биотиков и даже (косвенно) в запасании энергии.
Чтобы подтвердить эту гипотезу, мы исследовали образование теплоты
в организме теплокровных, подвергнутых воздействию холода. Как уже от-
мечалось выше, оказалось, что свободное окисление действительно активи-
руется в скелетных мышцах. Впоследствии подобный эффект был описан
другими исследователями в буром жире и цветах некоторых растений.
Что касается неэнергетических функций свободного окисления, то
наиболее наглядным примером могут служить системы, обеспечиваю-
щие разрушение конечных продуктов метаболизма и токсичных веществ-
ксенобиотиков.
В 1962 г. один из авторов данной книги (В.П.С.) и его сотрудники
обнаружили, что коэффициент P/О при окислении лактата кислородом
в мышцах оказывается значительно ниже, чем при использовании других
субстратов дыхания, окисляющихся через NAD+.
Позднее было показано, что окисление лактата в митохондриях дрож-
жей идет в обход начальных и средних участков фосфорилирующей дыха-
тельной цепи. В обходном пути свободного окисления участвует цитохром
Ьъ заключенный в межмембранном пространстве, а также цитохромокси-
даза. NAD+ не нужен для окисления лактата дрожжевыми митохондриями.
По данным А. Ф. Броди и сотрудников, клетки Mycobacterium phlei окисля-
ют лактат быстрее, чем другие субстраты, но без фосфорилирования.
Впечатляющий прогресс был достигнут при изучении систем свободно-
го окисления, ответственных за детоксикацию ксенобиотиков. В мембране
эндоплазматического ретикулума клеток печени были обнаружены особые
дыхательные цепи, включающие цитохром Р-450 в качестве конечной окси-
дазы и NADPH-цитохром Р-450-редуктазу или NADH-цитохром Ь5-редуктазу
и цитохром Ь5. Эти цепи участвуют в окислении множества ксенобиотиков.
Образующие их ферменты находятся в клетке в большом количестве. На-
пример, концентрация цитохрома Р-450 в определенных условиях может
превышать таковую любого другого цитохрома в печени.
Свободное дыхание, катализируемое цитохромом Р-450, участвует не
только в деструктивных, но и в некоторых конструктивных процессах, ко-
торые обычно локализованы в эндоплазматическом ретикулуме. Однако,
пожалуй, наиболее демонстративный пример — это митохондрии коры над-
почечника. Показано, что начальный и конечный этапы образования стеро-
идных гормонов (кортизона и альдостерона) осуществляются двумя видами
цитохрома Р-450, находящимися во внутренней мембране этих митохон-
дрий. Там же существует особая редокс-цепь, восстанавливающая цитох-
222 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
ром Р-450. Она окисляет внутримитохондриальный NADPH посредством
NADPH-адренодоксин-редуктазы — флавопротеина, содержащего FAD.
Последний восстанавливает адренодоксин — негемовый железопротеин,
служащий донором электронов для митохондриального цитохрома Р-450.
Все эти окислительные реакции не сопряжены с генерацией Дцн+, которая
образуется обычной фосфорилирующей дыхательной цепью, локализован-
ной в той же самой мембране.
Интересный пример мощной активации свободного дыхания описан в
лейкоцитах, атакующих бактериальную клетку. В этом случае особые вну-
триклеточные пузырьки сливаются с внешней клеточной мембраной лей-
коцита. Такой эффект имеет следствием вспышку свободного дыхания, в
котором участвует цепь окисления NADPH, включающая флавопротеины и
самоокисляющийся цитохром типа Ь. Цитохром b катализирует одноэлек-
тронное восстановление О2 до супероксидного радикала О2 , который реа-
гирует с СГ под действием миелопероксидазы с образованием радикальной
формы хлора. Последняя, будучи чрезвычайно токсичной, убивает бактерии.
Существенно, что NADPH окисляется флавином на внутренней поверх-
ности плазматической мембраны лейкоцита, а кислород восстанавливается
цитохромом b на внешней ее поверхности. Поэтому ядовитый продукт об-
разуется снаружи лейкоцита, что уменьшает вероятность его повреждения.
Нетрудно объяснить, почему перечисленные выше процессы поглоще-
ния кислорода не сопряжены с генерацией Дцн+. Энергетическое сопряже-
ние неизбежно усложнило бы выполнение деструктивных или конструк-
тивных функций всеми этими ферментными системами, которые имеют
жизненно важное значение для организма.
Итак, мы рассмотрели четыре главные функции окислительных процессов:
1) запасание энергии в утилизируемой форме (Дцн+), 2) рассеивание энер-
гии в виде теплоты, 3) образование полезных соединений и 4) расщепление
вредных веществ. Можно было бы думать, что первая из перечисленных
функций непосредственно обеспечивается сопряженным, а три другие —
свободным дыханием. Однако такой взгляд слишком упрошает реальную
ситуацию.
Сопряженное дыхание участвует в некоторых случаях в осуществлении
функций 2—4. Так, мышечная дрожь при первом охлаждении животного в
качестве механизма срочной теплопродукции требует образования Дцн+, а
затем и АТР, используемого актомиозином в качестве субстрата. Ясно так-
же, что большинство конструктивных процессов нуждается в энергии АТР,
образуемого сопряженным дыханием. Что касается деструктивных реакций,
то они, как правило, обходятся без АТР, хотя и здесь есть ряд важных ис-
ключений. Достаточно вспомнить цикл синтеза мочевины из аммиака, ис-
пользующий энергию АТР.
На первый взгляд, свободное дыхание по определению не может уча-
ствовать в запасании энергии. Парадоксально, что существуют случаи, ког-
да это не так.
Известно, что начальный участок сопряженной дыхательной цепи — са-
мый медленный и наиболее уязвимый. Широкий круг гидрофобных ксенобио-
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
223
тиков блокирует дыхание именно в этом пункте цепи. Шунтировав затор-
моженное место цепи свободным окислением, можно вновь активировать
дыхательный синтез АТР, хотя, конечно, со сниженным КПД. Такой эф-
фект особенно актуален для митохондрий в печени — органе, специализи-
рующемся на аккумуляции гидрофобных ксенобиотиков с целью их после-
дующего разрушения при помощи микросомального цитохрома Р-450.
Шунтирование заторможенной NADH-CoQ-редуктазы может дости-
гаться десорбцией цитохрома с в межмембранное пространство или до-
бавлением витамина К3 (менадиона) либо викасола, которые активируют
дикумарол-чувствительную ДТ-диафоразу. Не ясно, однако, стимулируется
ли эта система, описанная in vitro, гидрофобными ксенобиотиками при ин-
токсикации in vivo. В то же время показано, что искусственное введение
менадиона оказывает выраженный благоприятный терапевтический эффект
при наследственном нарушении среднего участка дыхательной цепи (под-
робнее см. разд. 4.2.4).
11.1.2. Регуляция потоков восстановительных эквивалентов
между цитозолем и митохондриями
Если два пути окисления — свободный и энергетически сопряжен-
ный — сосуществуют в одной и той же клетке, возникает проблема, как
предотвратить утилизацию всех восстановительных эквивалентов по тому из
них, который термодинамически более выгоден. Без сомнения, простран-
ственное разграничение (компартментализация) метаболических процессов
играет ведущую роль в решении этой проблемы. Например, дегидрогеназы
основных субстратов локализованы в матриксе, так что восстановительные
эквиваленты, питающие дыхательную цепь, образуются непосредственно
внутри митохондрий и потому сами по себе недоступны для внешних си-
стем свободного окисления. Кроме того во внутренней митохондриальной
мембране содержится несколько Ацн+-зависимых переносчиков, ответствен-
ных за аккумуляцию в матриксе тех субстратов, чьи дегидрогеназы имеются
не только в митохондриях, но и в цитозоле. Если же дегидрогеназа данного
субстрата локализована исключительно в цитозоле, то используются осо-
бые челночные механизмы, переносящие восстановительные эквиваленты
из цитозоля в матрикс.
На рис. 11.1 показан малат-аспартат-глутаматныи челнок. Действие
этой системы приводит к окислению внемитохондриального NADH по-
средством NAD+ матрикса. В процессе участвуют два фермента, локали-
зованные по обе стороны внутренней мембраны митохондрий, а именно
малатде гидрогеназа и аспартат: глутамат-аминотрансфераза. Кроме того
необходимы два переносчика: антипортер дикарбоновых кислот и глута-
мат / аспартат-антипортер. Последний использует энергию АЦН+, так как
он катализирует обмен аспартат / (глутамат-+Н+). В результате перенос
гидрид-иона от NADHHap к NAD+BHyT оказывается сопряженным с переме-
щением одного иона Н+ из цитозоля в матрикс под действием Ацн+.
224 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
Внутренняя
мембрана
митохондрии
ЦИТОЗОЛЬ
МАТРИКС
Рисунок 11.1. Челночная система для окисления цитозольного NAD+ митохондриальной дыха-
тельной цепью: NADHHap восстанавливает оксалоацетат (ОА) посредством обращения реакции,
катализируемой цитозольной малатдегидрогеназой (/). Образованный таким путем малат (Mai)
переносится в матрикс в обмен на а-кетоглутарат (a-KG) при участии антипортера дикарбок-
силатов (2). В матриксе малат восстанавливает NAD+ митохондриальной малатдегидрогеназой
(5). Полученный оксалоацетат переаминируется с глутаматом, давая аспартат и а-кето глутарат
(4). Внутренний аспартат обменивается на внешние глутамат и Н+ при помощи аспартат- /
(глутамат“+Н+)-антипортера с использованием энергии ДЦН. (5). Внешний аспартат переами-
нируется с внешним а-кетоглутаратом, регенерируя внешний оксалоацетат (6). Дцн+, потре-
бляемая в реакции (5), возобновляется дыхательной цепью (7), которая окисляет гидрид-ион,
отщепленный от NADHBHyT
Другой челночный механизм использует две глицерофосфатдегидроге-
назы: цитозольную, зависящую от NAD+, и митохондриальную, восстанав-
ливающую CoQ без участия NAD+. Челночные системы тканеспецифичны.
Например, малатный челнок очень активен в печени, но отсутствует в серд-
це, где митохондрии лишены дикарбоксилатного антипортера. Глицерофос-
фатный челнок резко активизируется тироидными гормонами.
Другим примером пространственного разделения окислительного об-
мена могут быть пероксисомы. Эти органеллы окружены мембраной, на-
поминающей по проницаемости внешнюю митохондриальную мембрану.
Она непроницаема для белков, но легко пропускает низкомолекулярные
вещества. Поглощение кислорода пероксисомами обусловлено действием
уратоксидазы, оксидазы D-аминокислот и оксидазы a-кетокислот. Окси-
дазы пероксисом не конкурируют с ферментами сопряженного дыхания
митохондрий, поскольку субстраты этих оксидаз окисляются без участия
NAD(P)+ и дыхательной цепи. Токсический продукт реакции — перекись
водорода — немедленно разлагается внутри пероксисом каталазой, самым
массовым белком этих органелл.
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
225
11.1.3. Взаимопревращение ДТ и АрН
Без сомнения, взаимопревращения ДТ и АрН могут иметь регуляторное
значение. Такого типа эффект должен влиять на соотношение ДТ- и ДрН-
зависимых транспортных систем, количество энергии, запасенной мембра-
ной, и значение pH по крайней мере с одной стороны мембраны.
Чтобы превратить ДТ в АрН, достаточно электрофоретически перене-
сти через мембрану любой ион, кроме Н\ В митохондриях есть только один
крупномасштабный процесс такого рода — АТР4-внут/АВР3_нар-антипорт,
питающий Н+-АТР-синтазу одним из ее субстратов. Однако в условиях,
когда митохондрии синтезируют АТР, этот антипорт всегда сопровождается
ДрН-зависимым стехиометрическим симпортом Н2РО4- и Н+, который по-
ставляет в митохондрию фосфат — второй субстрат реакции образования
АТР. В результате, как правило, митохондрия поддерживает Дцн+ в основ-
ном в форме ДТ. Тем не менее иногда ДТ снижается, а ДрН возрастает.
Такой эффект наблюдал, в частности, Р. Кауппинен, измерявший ДТ и ДрН
в митохондриях перфузированного сердца in situ.
Л.Б. Чен и сотрудники окрашивали метилродамином митохондрии кле-
ток в культуре ткани. Катион метилродамина электрофоретически накапли-
вается в митохондриях и потому прокрашивает только те из них, которые
имеют ДТ, но не ДрН. Был описан случай, когда из двух соседних клеток,
не отличающихся по морфологии, только в одной митохондрии накапли-
вали метилродамин. Добавление нигерицина, превращающего ДрН в ДТ
путем обмена Н+ на К+, вызывало окрашивание митохондрий также и во
второй клетке. Существует ряд данных, что митохондрии располагают соб-
ственным К+/Н+-антипортером, который обычно находится в латентной
форме.
Одним из факторов, вызывающих переход ДТ в ДрН, может быть уни-
порт Са2+ в митохондрии. Однако этот процесс, как правило, имеет огра-
ниченное значение из-за очень низкого (IO-7—10“6 М) уровня Са2+ в цито-
золе. Что касается К+, концентрация которого в цитозоле составляет около
0,1 М, его массовый унипорт в митохондрии должен быть запрещен, так
как распределение К+ по ДТ привело бы к накоплению КОН в матриксе.
Импорт fC служит, по-видимому, главным механизмом превращения ДТ в
ДрН у бактерий, существующих при гораздо более низкой концентрации К+
снаружи, чем у митохондрий. В хлоропластах Дцн+ находится в основном в
форме ДрН из-за высокой проницаемости мембраны тилакоидов для СГ,
К+ и Mg2+.
11.1.4. Отношение системы контроля Дцн+ к основным регуляторным
механизмам эукариот
В организмах эукариот надклеточные регуляторы, например гормоны,
передают свои команды при помощи внутриклеточных медиаторов, назы-
ваемых вторичными посредниками. Среди них наиболее часто используются
Са2+, циклические нуклеотиды, и продукты расщепления фосфатидилино-
226 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
зитдифосфата: трифосфоинозит и диацилглицерин. В последнее время био-
химики все большее внимание уделяют такому регулятору с множествен-
ным действием, как ион Н+.
Иногда в качестве вторичных посредников действуют метаболиты, ре-
гулирующие пути своего собственного превращения в клетке. Подобная
ситуация была описана при рассмотрении терморегуляторного разобще-
ния (см. разд. 10.2.1). Жирные кислоты выступают не только как субстраты
окисления, но и как разобщители этого окисления и ингибиторы АТР/
ADP-антипортера. Описан еще один регуляторный эффект жирных кислот.
Оказалось, что они вызывают десорбцию гексокиназы, связанной с внешней
мембраной митохондрий. Это может облегчить жирным кислотам конку-
ренцию с глюкозой за АТР в реакциях образования ацил-СоА и глюкозо-
6-фосфата. Оба эти процесса могут происходить на поверхности внешней
митохондриальной мембраны. Жирные кислоты, сорбируясь на мембране,
повышают отрицательный заряд, что приводит к разрушению комплекса
гексокиназы с ее рецептором. Роль последнего выполняет порин.
Что касается «классических» вторичных посредников, то применительно
к митохондриям особенно тщательно изучены ионы Са2+. Накапливаясь в
митохондриях, они превращают АТ в АрН. Кроме того они активируют фос-
фолипазу А2. Последняя образует жирные кислоты, вызывающие все те эф-
фекты, о которых шла речь выше. Другой продукт действия фосфолипазы —
лизофосфолипиды — также влияет на некоторые параметры митохондрий.
сАМР может, по-видимому, воздействовать на функции митохондрий
не только через жирные кислоты, но и более прямо. На внешней сторо-
не внутренней мембраны митохондрий дрожжей находится белок массой
45 кДа с очень высоким сродством к сАМР (Kd = 10-9 М). Можно предпо-
ложить, что этот белок служит специфическим рецептором, ответственным
за описанное ранее действие сАМР, добавленного к клеткам дрожжей, —
стимуляцию синтеза митохондриями субъединиц I— III цитохромоксидазы
и ускорение дыхания.
Нет сомнений, что ион Н+ также может быть использован в качестве
вторичного посредника. Совершенно очевидно, что pH-регуляция очень
важна при работе Н+-АТРазы внешней мембраны клеток растений и гри-
бов. Как было показано в разд. 7.2.3.1, этот фермент начинает активно
откачивать ионы Н* из цитоплазмы во внешнюю среду, если возрастает
внутриклеточная концентрация Н+. Действие растительных гормонов аук-
синов, по всей вероятности, связано с закислением цитоплазмы, вызываю-
щим активацию Н+-АТРазы и, как следствие, повышение AH' на внешней
мембране клетки.
11.1.5. Контроль Ацн+ у бактерий
Как уже отмечалось, многие бактерии располагают параллельными
электрон-транспортными путями, одни из которых сопряжены с накоплени-
ем энергии, а другие нет. Кроме того, свободное и сопряженное окисления
могут быть последовательно включены в одну и ту же дыхательную цепь.
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
227
Интересный пример механизма, поддерживающего высокую Дцн+ по
принципу саморегуляции, был выявлен в опытах с подвижными бактерия-
ми. Выяснилось, что искусственно вызванные изменения Дцн+ восприни-
маются бактерией как сигнал, регулирующий ее движение. Так, добавка
разобщителя или исчерпание кислорода служат репеллентным сигналом,
вызывающим изменение направления движения бактерии. Соответственно
добавление О2 оказывается аттрактантным стимулом, благоприятным для
линейного движения. Отмечено, что влияние кислорода на поведение бак-
терий (аэротаксис) проявляется лишь в тех случаях, когда концентрация О2
в среде влияет на Дцн+.
Простейшее объяснение этих данных в том, что бактерия располагает
устройством, которое измеряет Дрн- и посылает соответствующий сигнал
флагеллярному мотору, регулируя таким способом направление вращения
жгутика: направление изменяется на противоположное, если Дцн+ снижа-
ется, и сохраняется неизменным, если она растет. В результате клетка дви-
жется туда, где она может поддерживать более высокую Дцн+. Гипотетиче-
ский механизм подобного типа, названный одним из авторов этой книги
(В.П.С.) протометром, позволяет интегрировать множество благоприятных
и неблагоприятных воздействий, отражающихся на энергетическом состоя-
нии мембран. Недавно функционирование протометра было прямо проде-
монстрировано в системе таксиса Н. salinarium (см. выше, разд. 6.5.3).
Описан механизм, согласующий работу двух фотосистем в хлоропластах
и тем самым оптимизирующий продукцию Дцн+ и NADPH. Если фотоси-
стема II работает слишком быстро, это приводит к восстановлению редокс-
переносчика (предположительно PQ), расположенного между двумя фото-
системами. Такой эффект некоторым способом активирует протеинкиназу,
фосфорилирующую белок, который несет на себе хлорофилл антенны.
Названный белок в его нефосфорилированном состоянии локализуется в
основном в тилакоидах, упакованных в граны. Фосфорилирование увели-
чивает отрицательный заряд белков антенны, которые диффундируют из
тилакоидов в мембраны стромы, где в основном локализована фотосисте-
ма I. В итоге фотосистема I получает больше хлорофилла антенны, а следо-
вательно, и больше фотонов, чем фотосистема II. Активация фотосистемы 1
вызывает окисление PQH2, а значит, и торможение протеинкиназы. Непре-
рывно действующая протеинфосфатаза дефосфорилирует белок антенны и
прекращает его дальнейшую утечку из тилакоидов в ламеллы стромы.
11.2. Транспорт энергии вдоль мембран в форме Дцн+
11.2.1. Общие положения
Обычно мембраны рассматривают как структуры, отделяющие цито-
плазму от окружающей среды или один отсек клетки от другого. Без сомне-
ния, такое свойство присуще любой биологической мембране. Однако ясно
также, что разделительная функция всегда имеет следствием и определен-
228 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
ные интегративные эффекты. Например, цитоплазматическая мембрана не
только отграничивает цитоплазму от внеклеточной среды, но и объединяет
разнообразные внутриклеточные компоненты в единую систему.
Как должно быть ясно из всего предыдущего изложения, Ацн+, подобно
АТР, служит конвертируемой энергетической «валютой» многих бактерий,
растений, грибов, митохондрий и хлоропластов. В главах 12—14 будет пока-
зано, что роль мембранной формы энергии в цитоплазматической мембра-
не ряда бактерий и во внешней мембране животной клетки играет ApNa+.
Обязательное свойство любой «валюты» — ее транспортабельность. Как
Ацн+, так и ApNa+ отвечают этому требованию. В частности, представляется
вполне очевидным, что и АТ-, и АрН-составляющие протонного потен-
циала, возникнув на той или иной точке мембранной структуры, немед-
ленно распространяются по мембране во все стороны. Так как среды по
обе стороны мембраны представляют собой водные растворы электролитов,
электропроводность их очень высока. В то же время электропроводность
самой мембраны очень низка. Это означает, что АТ, образованная данным
Ар н+-генератором, не может избежать быстрой иррадиации по всей поверх-
ности мембраны. То же относится и к АрН в связи с высокой скоростью
диффузии Н+ в воде и большой концентрацией подвижных рН-буферов,
еще более увеличивающих эту скорость. Эти факты означают, что Ацн+,
образованная Ацн+-генератором в определенной области мембраны, может
передаваться вдоль мембраны и превращаться в работу в другой области
той же мембраны. Основываясь на приведенных выше соображениях, один
из авторов этой книги (В.П.С.) выдвинул в 1969 г. концепцию, согласно
которой сопрягающие мембраны могут играть роль электрического кабеля,
действующего в пределах клетки или даже на надклеточном уровне. Ниже бу-
дут рассмотрены эта и ряд других интегрирующих функций биологических
мембран.
11.2.2. Перенос Ацн+, образуемой светозависимыми
^^-генераторами, вдоль мембран галобактерий
и хлоропластов
Как было показано в разд. 6.1, перенос Ацн+ вдоль мембраны дол-
жен быть обязательным этапом утилизации световой энергии бактериями
Н. salinarium. У этих микроорганизмов более 50% площади цитоплазмати-
ческой мембраны может быть занято пурпурными бляшками диаметром до
0,5 мкм. Ацн+, образуемая бактериородопсином, должна использоваться по-
требителями протон-движущей силы в областях той же мембраны, иных, чем
пурпурные бляшки, поскольку других белков, кроме бактериородопсина, в
бляшках нет.
По меньшей мере два процесса транспорта энергии вдоль мембран
существуют в хлоропластах и цианобактериях. Хорошо известно, что
фотоны в основном поглощаются хлорофиллом антенны. Затем энергия
электронного возбуждения мигрирует в плоскости мембраны между мо-
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала 229
лекулами хлорофилла антенны, пока не достигнет хлорофилла реакцион-
ного центра.
Перенос энергии вдоль мембраны хлоропласта, но уже в форме Дцн+, дол-
жен иметь место, когда Дцн+, поставляемая фотосистемой II (которая ло-
кализована в тилакоидах), используется для синтеза АТР /Л-АТР-синтазой,
сосредоточенной в ламеллах стромы хлоропласта.
11.2.3. Трансклеточный перенос энергии в трихомах цианобактерий
В галобактериях и хлоропластах передача энергии осуществляется на
расстояния не более 1 мкм. В то же время транспорт ДТ может быть эф-
фективным на расстояние порядка 1 мм, как это показал сделанный нами
расчет потерь, сопровождающих такую передачу энергии (потери рассчиты-
вали по уравнению электрического кабеля).
Первый пример передачи Дцн+ на столь большое расстояние был описан
И.И. Севериной в группе одного из авторов при изучении трихомов нит-
чатых цианобактерий Phormidium uncinatum. Трихом цианобактерий пред-
ставляет длинную цепочку соединенных друг с другом клеток. Число клеток
может достигать тысячи, а длина трихома — нескольких миллиметров. Су-
ществуют данные, что клетки, объединенные в трихом, могут быть связаны
друг с другом микроплазмадесмами — короткими и очень тонкими трубоч-
ками, пересекающими межклеточное пространство. Если микроплазмадес-
мы имеют высокую электропроводность, то ДТ, образованная, например,
вблизи одного конца трихома, может передаваться вдоль трихома вплоть до
его противоположного конца и там совершать полезную работу. И.И. Севе-
риной было установлено, что освещение около 5% трихома сфокусированным
пучком света вызывает генерацию ДТ, распространяющуюся по всей длине
трихома. Амплитуда и кинетика распространения ДТ соответствовали та-
ковым, рассчитанным на основании предположения о кабельных свойствах
трихома.
Вывод о кабельных свойствах трихомов цианобактерий можно экстра-
полировать на ткани растений, в которых клетки соединены между собой
плазмадесмами, хорошо проницаемыми для ионов, в том числе для Н+.
Возможное значение трансклеточной передачи Дцн+ для растительных орга-
низмов — интересный предмет будущих исследований.
11.2.4. Структура и свойства нитчатых митохондрий
и митохондриального ретикулума
Догма о мелких митохондриях. В переводе с греческого митохондрия
означает нить-зерно. Это название было предложено цитологами, использо-
вавшими световой микроскоп. Первые исследователи митохондрий всегда
подчеркивали, что данные органеллы существуют в двух основных формах:
нитчатой и сферической (или эллипсоидной).
С введением электронной микроскопии и техники тонких срезов по-
добное мнение изменилось: нитчатые митохондрии стали рассматривать
230 ЧАСТЬ IV Взаимосвязь и регуляция генераторов и потребителей протонного...
как весьма редкое исключение, в то время как сферическая форма была
признана канонической. Подобное изменение взгляда на митохондрии ока-
залось следствием того обстоятельства, что микроскопист, рассматриваю-
щий одиночную электронную микрофотографию, по существу имеет дело
с двумерным изображением клетки. На одиночном срезе и клубок ниток
можно ошибочно принять за россыпь мелких зерен. Истинная картина воз-
никает только при реконструкции структуры по многим серийным срезам,
прошедшим строго параллельно друг другу.
Догма о размере и форме митохондрий приобрела особую популяр-
ность среди молодого поколения биохимиков, никогда не видевших толком
митохондрии в световой микроскоп. Чтобы наблюдать митохондрии этим
старым способом, нужна известная сноровка, поскольку митохондрии на-
ходятся на грани разрешающей способности световой микроскопии. Проще
было поверить на слово электронным микроскопистам, развившим новый
физический метод с несравнимо большим разрешением.
Ясно, что передача Дцн+, ограниченная отдельной мелкой митохондри-
ей сферической формы, не может служить механизмом транспорта энергии
в масштабах клетки. Но если все же старые морфологии были правы, по-
мещая «мшпос» на первое место в названии этих органелл, и митохондрии
обычно (или хотя бы иногда) имеют вид длинных нитей, то их функция в
качестве внутриклеточного протонного кабеля представляется вполне ре-
альной.
Гигантские митохондрии и Reticulum mitochondriale. Три методических
подхода поколебали догму о мелких митохондриях: 1) реконструкция трех-
мерной структуры клетки по сериям тонких срезов; 2) высоковольтная
электронная микроскопия, позволившая увеличить толщину исследуемого
препарата, и 3) окрашивание митохондрий флуоресцирующими проникаю-
щими катионами, что сделало возможным возврат к прижизненному изуче-
нию клетки под световым микроскопом.
Метод серийных срезов был применен прежде всего в работах на одно-
клеточных эукариотах. Уже самые первые исследования этих объектов вы-
Рисунок 11.2. Единая митохондриальная сеть в клетке жгутикового Polytomella agilis\ А — срез
через клетку (микрофотография может быть ошибочно интерпретирована как свидетельство
того, что в клетке находится много мелких митохондрий); Б и В — вид спереди и сбоку модели
единой митохондриальной системы Р. agilis, реконструированной по серийным срезам
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
231
явили очень крупный размер и сложное строение митохондрии. Например,
М. Бертон и Дж. Мур, работая с Polytomella agilis, обнаружили в клетке этого
простейшего из группы жгутиковых всего одну (!) митохондрию, выгля-
девшую как перфорированная сфера, располагающаяся сразу под внешней
клеточной мембраной. Цитоплазма и ядро лежали внутри этой сферы, «как
в авоське» (рис. 11.2).
Одиночная гигантская митохондрия была описана в клетках некоторых
дрожжей, а также хлореллы и других одноклеточных водорослей. Несколько
очень крупных сетчатых митохондрий, иногда объединяющихся в одну, бы-
ло обнаружено у хламидомонад, эвглены, трипаносом и некоторых грибов.
Нитевидные митохондрии длиной около 10 мкм найдены в экзокринных
клетках поджелудочной железы. Сперматозоиды содержат цепь длинных
митохондрий, состыкованных конец в конец. В печени выявлены два ти-
па митохондрий: мелкие сферические и крупные разветвленные. Подоб-
ная картина наблюдается в клетках асцитного рака и у водоросли Polytoma
papillatum. В последнем случае было проанализировано 228 параллельных
срезов через клетку водоросли. Оказалось, что клетка содержит 246 отдель-
ных мелких сферических митохондрий, две крупные и разветвленные и еще
одну очень большую, образующую полый перфорированный шар.
Одним из наиболее интересных объектов для изучения возможных ме-
ханизмов передачи энергии являются клетки мышечной ткани. Многоядер-
ные клетки мышц (мышечные волокна) достигают огромных размеров. Их
энергетические потребности чрезвычайно высоки. В тяжело работающей
мышце должны возникать градиенты кислорода и субстратов между пери-
ферией и сердцевиной клетки, что ограничивает объем выполняемой рабо-
ты. Передача ДцНч от краев мышечной клетки к ее центру могла бы решить
проблему. Но для этого мышечные митохондрии должны быть очень вели-
ки по размеру.
В летательных мышцах насекомых обнаружены митохондрии, имеющие
вид пластин, которые тянутся от края к центру клетки. Их длина около
10 мкм, т.е. того же порядка, что и радиус мышечного волокна.
Первые указания на то, что в мышцах высших животных митохондрии
могут достигать значительных размеров, были получены в 1960-е гг. Г.Д. Бу-
бенцером и Ж.Ф. Готье при исследовании одиночных срезов. В нашей груп-
пе Л.Е. Бакеева и Ю.С. Ченцов предприняли систематическое исследование
серийных срезов мышцы диафрагмы крысы и установили, что митохондрии
в этой ткани имеют вид сети, пронизывающей мышечное волокно в изо-
тропной области вблизи Z-дисков. Сети связаны между собой колоннами,
расположенными параллельно миофибриллам. Кроме того имеются ветви,
связывающие сети с митохондриальными кластерами по краям мышечного
волокна (рис. 11.3). Вся эта система, названная одним из авторов этой кни-
ги (В.П.С.) митохондриальным ретикулумом {Reticulum mitochondriale), харак-
терна для диафрагмы взрослых животных. Ее нет в диафрагме крысиных
эмбрионов и новорожденных крысят.
Иногда составляющие ретикулум митохондриальные филаменты об-
разуют, соприкасаясь, особые контактные зоны. Эта структура, открытая
Л.Е. Бакеевой и сотрудниками при исследовании мышцы диафрагмы, за-
232 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
тем была детально изучена в той же группе на примере сердечной мышцы,
где митохондриальные контакты особенно многочисленны. Оказалось, что
митохондрии в этой ткани также образуют трехмерную систему, но вместо
сети из тонких ветвящихся трубчатых митохондриальных тяжей, описанных
в мышце диафрагмы и скелетных мышцах, в сердце содержится множество
толстых эллиптической формы митохондрий с малым количеством отрост-
ков; все они связаны друг с другом контактами (рис. 11.4).
Зона контакта представляет собой диск диаметром от 0,1 до 1 мкм.
В этой зоне как мембраны, так и межмембранное пространство характери-
зуются повышенной электронной плотностью. Две внешние мембраны кон-
тактирующих митохондрий максимально сближены друг с другом подобно
тому, как это происходит в плотных контактах внешних клеточных мембран
(рис. 11.4). Каждая митохондрия связана с соседними несколькими такими
контактами. В сердце трехдневного крысенка контакты отсутствуют.
Еще более сложная контактная структура обнаружена в зоне нексуса
(межклеточного щелевого контакта). Иногда можно видеть, что митохон-
дрии, локализованные в двух соседних кардиомиоцитах, плотно прилегают
к внешней клеточной мембране в области щелевого контакта. В результате
образуется шестимембранный контакт, составленный из двух клеточных и
четырех митохондриальных мембран.
Нитчатые митохондрии. Если изучаемый объект имеет не столь высокую
электронную плотность, как мышечное волокно, истинные форма и размер
митохондрий без труда могут быть выявлены посредством высоковольтной
электронной микроскопии. Такого рода исследования обнаружили длин-
ные нитевидные митохондрии в клетках самых различных типов.
Однако указанный метод имеет два существенных ограничения. Во-
первых, он не позволяет наблюдать митохондриальные контакты. Поэтому
не удается ответить на вопрос, что является объектом наблюдения — одна
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
233
Рисунок 11.3. Митохондриальный ретикулум в мышцах диафрагмы двухмесячной крысы. А —
продольный срез, Б — поперечный срез через изотропную область. В—Д — реконструкция
митохондрий мышц диафрагмы (В — вид сбоку, Г — вид сверху, Д — вид сбоку) [Bakeeva et al.,
1981, Eur. J. Cell Biol., 25: 175-181]
234 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
Рисунок 11.4. Продольный срез кардио-
миоцита. Стрелками показаны митохон-
дриальные контакты [Bakeeva et al., 1981,
Eur. J. Cell Biol., 25: 175-181]
Рисунок 11.5. Фибробласт человека: окра-
ска этилродамином [Драчев, Зоров 1986,
ДАН СССР, 287: 1237-1238]
протяженная митохондрия или множество органелл, связанных друг с дру-
гом контактами. Во-вторых, подобно любой другой методике, использую-
щей электронный микроскоп, при высоковольтной микроскопии исследо-
ватель имеет дело с фиксированным материалом, что не позволяет прямо
следить за функционированием митохондрий. Чтобы преодолеть послед-
нее затруднение, мы решили вернуться к световому микроскопу. Работая
этим методом в проходящем свете, в принципе, можно увидеть митохон-
дрии в живой клетке, но тонкие митохондриальные филаменты и сети часто
ускользают от наблюдения из-за низкого разрешения этого метода. Такого
рода ограничение снимается, если работать не с поглощением, а с эмиссией
света. Когда эмиссия достаточно интенсивна, источник света можно уви-
деть в темноте, даже если его не удается наблюдать как тело, задерживаю-
щее свет (поэтому звезды на небе видны только ночью).
Исследования, проведенные Л.Б. Ченом и сотрудниками в США и
Д.Б. Зоровым в лаборатории В.П. Скулачева, показали, что производные
флуоресцирующего проникающего катиона родамина специфически накаплива-
ются в митохондриях. Было также установлено, что митохондрии в живой
клетке достаточно часто представляют собой филаменты длиной в десят-
ки микрометров (рис. 11.5). Иногда митохондриальные филаменты имеют
такую большую протяженность, что могут связывать периферию и центр
клетки или даже пересекать клетку от края до края вдоль длинной ее оси.
В ряде типов клеток был выявлен митохондриальный ретикулум. Типичный
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала 235
вариант состоит в том, что в клетке сосуществуют две популяции митохон-
дрий — длинные нитчатые и мелкие овальные.
Применение прижизненной флуориметрии митохондрий подтвердило
отрывочные наблюдения, которые были сделаны ранее традиционными
методами, свидетельствовавшими, что обратимый переход нить-зерно есть
универсальное свойство этих органелл. Демонстративный пример такого
рода был описан Л. Фойсснером, который показал превращение митохон-
дрий нителлы в филаменты длиной до 30 мкм при торможении фотосинтеза
диуроном или снижением интенсивности света, а также при блокировании
дыхательной цепи в среднем или конечном сегментах. В то же время тормо-
жение NADH-CoQ-редуктазы ротеноном или снятие ДЦН+ динитрофенолом
не влияли на размер митохондрий. Удлинение митохондрий предотвраща-
лось при торможении синтеза белка. Примечательно, что только некоторые
митохондрии (не более 20% от их общего числа) превращались в нити, как
если бы они несли какую-то дополнительную функцию, отличную от той,
которая может быть выполнена мелкими митохондриями.
Случай другого рода был описан К. Танакой и сотрудниками, заметив-
шими, что при вхождении клеток дрожжей Candida albicans в стадию поч-
кования отдельные митохондрии объединяются в одну гигантскую, которая
фрагментируется при митозе. Затем (перед цитокинезом) вновь образуется
гигантская митохондрия, впоследствии разделяющаяся на две части.
Образование митохондриальных филаментов в клетках дрожжей
Endomyces magnusii, выращиваемых в гипоксических условиях, было отме-
чено М.Н. Мейселем и сотрудниками еще в 1964 г.
Митохондрия как внутриклеточный протонный кабель. Результаты, изло-
женные в предыдущем разделе, свидетельствуют о том, что многие клетки
эукариот располагают очень длинными митохондриями, иногда объединен-
ными в сеть. Протяженные митохондрии часто сосуществуют с популяцией
мелких митохондрий, традиционно считающихся типичным примером ми-
тохондриальных структур.
Если нитчатая митохондрия представляет собой континуум как внеш-
ней, так и внутренней мембраны, то ДЦН+ должна распространяться по всей
ее длине. Если же эта нить составлена из многих мелких митохондрий или
митопластов, состыкованных конец в конец, то возможны два варианта:
1) митохондриальный филамент подобен трихому цианобактерий, у которых
все его составляющие (клетки) соединены друг с другом микроплазмадес-
мами, имеющими высокую электропроводность (см. разд. 11.2.3); 2) между
двумя соседними митохондриями нет электрического контакта.
В предыдущем разделе уже был описан межмитохондриальный кон-
такт — особая структура, локализованная на стыках двух митохондрий.
Проблема в том, чтобы установить, проводящий ли это контакт, подоб-
но микроплазмадесмам цианобактерий либо щелевым контактам внешних
мембран животных клеток, или же, напротив, его сопротивление так же вы-
соко, как и в других участках внутренней мембраны митохондрий. С точки
зрения предполагаемых кабельных свойств длинных митохондрий первый
случай идентичен митохондриальному континууму. Во втором случае при-
236 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
ходится предполагать, что обмен энергией между соседними митохондрия-
ми обеспечивается не диффузией протонов, а диффузией АТР, перемещаю-
щегося через область контактов.
Очевидное предсказание гипотезы, рассматривающей нитевидную
митохондрию в качестве кабеля, состоит в том, что локальное поврежде-
ние такой митохондрии в любой точке должно вызывать деполяризацию
мембраны по всей ее длине. Это предсказание получило свое прямое под-
тверждение: в группе автора (В.П.С.) В.А. Драчевым был сконструирован
специальный прибор, состоящий из лазера и флуоресцентного микроскопа.
Используя это устройство, Д.Б. Зоров облучил одиночный митохондриаль-
ный филамент в клетке культуры фибробластов человека, прокрашенной
этилродамином. Облучение производили сфокусированным пучком лазера,
так что диаметр светового пятна был соизмерим с поперечником фила-
мента. Облучение привело к исчезновению свечения родамина по всей длине
(40 мкм) филамента^ существенно, что при этом другие митохондриальные
филаменты в той же клетке сохраняли свою флуоресценцию. Следователь-
но, наблюдаемый эффект нельзя объяснить неспецифическим повреждени-
ем всей клетки лазером. Фазовоконтрастная и электронная микроскопия
не выявила заметных повреждений в структуре облученной лазером и пре-
кратившей светиться митохондрии.
Аналогичное исследование было проведено на кардиомиоцитах. Об-
лучение одиночной митохондрии вызывало тушение кластера, состояще-
го из многих митохондрий. Электронное микроскопирование обнаружило,
что погасшие митохондрии связаны с облученной межмитохондриальными
контактами. Что касается митохондрий, сохранивших флуоресценцию, то
здесь контактов с облученной органеллой найти не удалось.
Простейшее объяснение всех этих данных состоит в следующем. В кар-
диомиоците содержится несколько независимых митохондриальных кла-
стеров, образованных многими митохондриями (грозди митохондрий, или
Streptio mitochondriale). Митохондрии, формирующие гроздь, соединены друг
с другом митохондриальными контактами. Эти контакты характеризуются
высокой электропроводностью.
Гигантские митохондрии как пути транспорта веществ. Не только Н+
(рис. 11.7), но и другие ионы, метаболиты и т.п. могли бы транспорти-
роваться по нитчатым митохондриям. Например, любое вещество, кон-
центрирующееся в матриксе, будет переноситься по митохондриально-
му филаменту, как по трубопроводу. В частности, ионы Са2+, попавшие
из межклеточного пространства в приграничный слой цитозоля, должны
сначала аккумулироваться посредством АТ-зависимого Са2+-унипортера в
окончаниях митохондриальных филаментов, а затем диффундировать по
матриксу к противоположным концам этих филаментов, расположенным в
центральных участках клетки. Если предположить, что в этих последних ак-
тивирован Са2+/Н+-антипортер, то нитевидные митохондрии одним своим
концом могли бы поглощать ионы Са2+ на периферии клетки, а другим —
выделять их в глубинных ее частях. Подобную логику можно применить к
любому компоненту, способному обратимо аккумулироваться в митохон-
дриальном матриксе.
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
237
Рисунок 11.6. В.А. Драчев (слева) и Д.Б. Зоров (справа)
Другой вариант использования протяженных митохондрий состоит в
переносе жирорастворимых веществ. На первый взгляд, транспорт веществ
по мембранам должен происходить медленнее, чем по водной фазе клетки.
Бытует мнение, что вязкость мембраны гораздо выше, чем вязкость цито-
плазмы, а следовательно, для любого вещества, растворимого и в воде, и в
липиде, водный путь предпочтительнее.
Однако цитозоль и митохондриальный матрикс — это не водные рас-
творы низкомолекулярных веществ, а, скорее, коллоидные растворы, к тому
же пересеченные нерастворимыми структурами — мембранами и компонен-
тами цитоскелета. Как показал опыт, когда измеряли движение низкомо-
лекулярного спин-меченого соединения с коэффициентом распределения
в системе липид / вода, близким к 1, в клетках самых различных типов
это соединение предпочтительно движется не по воде, а по липиду. Такое
предпочтение должно быть еще более выражено, если коэффициент рас-
пределения вещества в пользу липида, как это имеет место, например, для
жирных кислот и их эфиров с карнитином или СоА. В частности, мембран-
ный путь был постулирован для ацил-СоА (М. Сампером и Дж. Тройбле).
Ацилкарнитин, по-видимому, приспособлен для выполнения этой функции
даже лучше, чем ацил-СоА, так как по массе он значительно меньше.
Интересная проблема — транспорт молекулярного кислорода по мембра-
нам. Можно указать по крайней мере четыре обстоятельства, благоприят-
ствующие транспорту О2 по внутренней мембране митохондрий.
1. Растворимость О2 в липиде примерно в пять раз выше, чем в воде.
2. Цитохромоксидаза — главный фермент, поглощающий кислород, —
локализована во внутренней мембране. Она имеет очень высокое сродство
к кислороду (Кт цитохромоксидазы гораздо ниже концентрации О2 в воде,
уравновешенной с воздушной фазой), что может способствовать образова-
238 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
СП
2Е
2
О2
ан2
A J
~Н+—
Н+
н+<
т-О2
АН
Н+
Н2О
А
Рисунок 11.7. Схема транспорта энергии в форме Дрн. по митохондриальной сети
скелетных мышц
АКТОМИОЗИНОВЫЕ
ФИЛАМЕНТЫ
Н2О
А
МИТОХОНДРИАЛЬНЫЙ
ФИЛАМЕНТ ^АТР
S-ADP
................. *’’ Р/
внутри м иофибрилл я рн ые \
митохондрии
нию локальных областей низкой концентрации О2 во внутренней митохон-
дриальной мембране.
3. Скорость диффузии О2 в углеводородах в 10—100 раз выше, чем это
следует из данных по макровязкости; ее величина оказывается того же по-
рядка, что и величина скорости диффузии О2 в воде. Она резко замедляется
холестерином, которого, как известно, нет во внутренней мембране мито-
хондрий.
4. В таких тканях, как мышечная, внутренняя митохондриальная мем-
брана составляет большую часть мембранного материала клетки.
Однако даже в сердечной мышце, где митохондрий особенно много,
митохондриальные мембраны занимают малую часть общего объема клет-
ки. Поэтому необходимы дальнейшие исследования, чтобы решить, какой
путь транспорта кислорода является главным: по мембранам или через ци-
тозоль.
Интересная проблема — перенос электронов вдоль мембран. Этот процесс
локализован, по-видимому, в эндоплазматическом ретикулуме и внешней
митохондриальной мембране, где он обеспечивается NADH-цитохром Ь5-
редуктазой (флавопротеином Фп5) и цитохромом Ь5. Названная система
найдена в печени, почках, мозге и некоторых других тканях. Как Фп5, так
и цитохром Ь5 состоят из двух неравных частей: большей гидрофильной,
содержащей флавин или гем, и меньшей гидрофобной, требующейся для
заякоривания белка в мембране. Подобно челноку, Фп5 и цитохром Ь5 могут
перемещаться по поверхности мембраны, встречая сравнительно неболь-
шое сопротивление.
Поскольку редокс-потенциал Фп5 близок к редокс-потенциалу восста-
новителя (NADH), этот флавопротеин, двигаясь вдоль мембран, может вы-
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
239
равнивать градиенты редокс-потенциалов в области —0,3 В в различных ча-
стях клетки. Цитохром Ь5 способен выполнять ту же функцию, но на уровне
редокс-потенциалов, близких к нулю.
Еще одна функция цитохрома Ь5 была обнаружена автором этой книги
(В.П.С.) совместно с А.И. Арчаковым. Установлено, что пузырьки эндо-
плазматического ретикулума или митохондрии печени способны восста-
навливать цитохром Ь5 протеолипосом, не содержащими других белков,
кроме этого цитохрома. В качестве восстановителя использовали NADH.
Поскольку эффект не снижался многократными промываниями эндоплаз-
матического ретикулума, был сделан вывод, что Фп5, или цитохром Ь5, или
они оба могут катализировать межмембранный перенос электронов без по-
мощи каких-либо водорастворимых посредников.
Дальнейшие опыты показали, что данное свойство присуще только ци-
тохрому Ь$. Пузырьки эндоплазматического ретикулума обрабатывали прона-
зой при 4°С, что приводило к разрушению цитохрома Ь5. При этом активность
Фп5 сохранялась на вполне измеримом уровне. Такие пузырьки полностью
утрачивали способность к межмембранному переносу электронов.
Интересное наблюдение было сделано С. Грингат и М. Роузмэном, ис-
следовавшими количество цитохрома Ь5 в протеолипосомах, диаметр кото-
рых варьировал в 1,5 раза (от 21 до 35 нм). Выяснилось, что содержание ци-
тохрома Ь5 на мг липида было по крайней мере в 20 раз больше в пузырьках
меньшего диаметра. Это означает, что цитохром Ь5 может накапливаться в
изогнутых участках мембраны, например в концах митохондриальных фи-
ламентов.
На рис. 11.8 представлен возможный механизм переноса электронов че-
рез шель между двумя соседними митохондриальными филаментами. Пред-
полагается, что молекулы цитохрома Ь5 диффундируют в плоскости мем-
браны вдоль филаментов посредством броуновского движения, сканируя
мембрану в поисках окислителя. В области, где два соседних мембранных
тяжа находятся на расстоянии не более удвоенного диаметра гидрофиль-
ной головки цитохрома Z>5, цитохром более восстановленного филамента
передает электрон цитохрому более окисленного филамента. Эта реакция
облегчается вследствие концентрирования цитохромов Ь5 в изогнутых окон-
чаниях филаментов, что может быть частным случаем сформулированного
авторами более общего принципа о «таксисе» мембранных ферментов к их
субстратам.
11.3. Дцн+-Буферы
11.3.1. Градиенты Na+ и К* как ЛрИ+-буфер у бактерий
Если протонный потенциал действительно играет роль конвертируемой
«валюты», то количество энергетических эквивалентов, накопленных в виде
Дцн+, должно быть достаточно велико, чтобы гасить, забуферивать колеба-
ния скоростей Дцн+-образующих и Дцн+-потребляющих процессов.
240 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
Зная электрическую емкость и площадь мембраны, например бактери-
альной клетки, можно рассчитать, сколько ионов водорода будет откачано
из цитоплазмы бактерии при образовании Ацн+ порядка 250 мВ (верхний
предел Дцн+, поддерживаемой в энергизованных условиях). Если принять
емкость за 1 мкф х см-2, то получается количество Н+, равное всего 1 мкмоль
х г белка-1, что соизмеримо с содержанием мембранных ферментов. Чтобы
запасти энергию Дцн+ в «субстратных» количествах, необходимо разрядить
мембрану потоком любых ионов, за исключением Н+. При этом снижение
АТ будет сопровождаться переносом новых порций ионов Н+ до тех пор,
пока АрН не возрастет до величины, эквивалентной 250 мВ. рН-Буферная
емкость цитоплазмы примерно на два порядка превышает электрическую
емкость цитоплазматической мембраны, так что порция энергии, нако-
пленной в АрН, оказывается гораздо большей, чем в АТ.
Дальнейшее увеличение количества «мембранной» энергии может быть
достигнуто, если образованная таким способом АрН затем используется,
например, катион/Н+-антипортером, заменяющим АрН на Ар(катион).
Включение такого антипортера, обменивающего внутренний Na+ на внеш-
ний Н+, по существу равносильно увеличению концентрации рН-буфера,
как это впервые было отмечено П. Митчелом еще в 1968 г. При этом Мит-
чел игнорировал роль другого массового одновалентного катиона, а именно
К+. По его мнению, накопление К+ под действием АТ есть нежелательный,
хотя и неизбежный побочный эффект.
В 1978 г. один из авторов этой книги (В.П.С.) предположил, что вход Л*
используется бактериальной клеткой с целью превращения АТ в АрН и АрК.
Образуемая АрК забуферивает АТ. Что касается АрН, то она утилизируется
№+/Н+-антипортером для образования ApNa. В результате ApNa оказыва-
ется буфером АрН. Согласно этой концепции бактерия аккумулирует и
выбрасывает Na+ в условиях избытка энергетических ресурсов. Энергетиче-
ский дефицит меняет направление ионных потоков: снижается АТ, и К+
начинает выходить из клетки, двигаясь по градиенту своей концентрации;
следовательно, снижение АрН приводит к входу Na+ (рис. 11.9).
Рисунок 11.8. Перенос электронов с конца одного мембранного тяжа на начало
другого тяжа посредством цитохрома Ь5\ стрелками показан электронный транспорт
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
241
БАКТЕРИАЛЬНАЯ
ЦИТОПЛАЗМАТИЧЕСКАЯ
МЕМБРАНА
Рисунок 11.9. ДЦн+-Зависимое образо-
вание градиентов Na+ и К+ на цитоплаз-
матической мембране бактерий. Ион Н4
откачивается из клетки Дцн+-генераторами
(7). Образованная при этом Д*Р вызывает
электрофоретический вход ионов К+ (2),
который разряжает ДЧ\ превращая ее в
ДрН. №+/Н+-антипортер откачивает Na4
из клетки за счет ДрН (J). Снижение ДЧ7
и ДрН обращает ионные потоки, которые
некоторое время поддерживают ДЧ7 и ДрН
в отсутствие внешних энергетических
ресурсов
Гипотеза ДЦн+-буфера позволила
объяснить ряд наблюдений, относя-
щихся к энергетике бактерий. В част-
ности, было известно, что К+ может
электрофоретически накапливаться в
бактериальных клетках. Что же касает-
ся №+/Н+-антипорта, то он был опи-
сан в 1974 г. И. Уэстом и П. Митчелом
у Е. coli. Впоследствии его наличие бы-
ло продемонстрировано у многих видов
бактерий.
Взаимодействие ДТ-зависимого им-
порта К+ и ДрН-зависимого экспорта
Na+, в принципе, удовлетворяет тре-
бованиям, предъявляемым к Дцн+-бу-
феру. Na+ — наиболее массовый кати-
он. Его концентрация в морской воде
около 0,5 М. Поэтому клетка, откачи-
вая Na+ из цитоплазмы, может легко
создать большой градиент ионов Na+.
Концентрация [К+]нар обычно гораздо
ниже, чем [Na+]Hap, так что большая
величина ДрК может быть получена за
счет аккумуляции К+ внутри клетки.
В то же время [К+]нар не столь мала,
чтобы затруднить поиск этого катиона
во внешней среде. Ведь К+ — второй
по массовости катион морской воды.
Замена внутриклеточного Na+ на К+
вряд ли должна сильно сказаться на
метаболизме и структуре клетки, по-
скольку свойства этих ионов во многом
подобны, тем более что ни К+, ни Na+
прямо не участвуют в биохимических
реакциях.
Опыты по проверке гипотезы о Дцн+-буфере, проведенные в нашей
группе И.И. Броуном, показали, что бактерии действительно образуют Na+/
К*-градиенты при избытке энергии и используют их для совершения полезной
работы при нехватке энергетических ресурсов. Наиболее существенны сле-
дующие наблюдения.
1. Предобразованные градиенты ионов Na+ и К+ после исчерпания
энергетических ресурсов клетки могут поддерживать такую Дцн+-зависимую
функцию, как движение галофильной археи Halobacterium salinarium, мор-
ской бактерии Vibrio harveyi, а также Е. coli. У пресноводной Phormidium
uncinatum был эффективен градиент К+, но не Na+.
2. Градиенты Na+ и К+ стабилизируют уровень ДТ и АТР в условиях
энергетического дефицита.
242 ЧАСТЬ IV. Взаимосвязь и регуляция генераторов и потребителей протонного...
3. Емкость Na+/K+-6y(J)epa прямо пропорциональна концентрации со-
ли в среде обитания бактерий, снижаясь в ряду Н. salinarium > К harveyi >
Е. coli > Ph. uncinatum. Градиенты Na+ и К+ у Н. salinarium, предынкубиро-
ванной на свету, все еще поддерживают движение прокариот спустя более
чем 8 ч после прекращения освещения и исчерпания О2. Это означает,
что галофильная архея в течение дня способна вложить в Na+/K+-градиент
столь значительную порцию энергии, что ее хватает практически на всю
ночь.
Взаимодействие К+-унипорта и Ка+/Н+-антипорта — простейший, но
не единственно возможный механизм стабилизации ДЦН+ градиентами од-
новалентных катионов. У некоторых бактерий, по крайней мере в щелоч-
ной среде, имеет место электрогенный (Na+/ntP)-антипорт. Кроме того,
накопление К+ может катализироваться К/-импортером. В подобных
случаях ApNa стабилизирует не только АрН, но и (в меньшей степени) АТ.
Соответственно АрК стабилизирует и АТ, и АрН, причем эффект более вы-
ражен в отношении АТ.
Вероятно, стабилизация ДЦН+ необходима прежде всего в мембранах,
располагающих сразу многими путями образования и использования ДЦН+.
Такова, например, цитоплазматическая мембрана дышащих или фотосинте-
зирующих бактерий, где имеются дыхательные (фотосинтетические) Дцн+-ге-
нераторы, Н+-АТР-синтаза, Др^-зависимые переносчики и Н+-моторы.
В то же время у анаэробных неподвижных бактерий, живущих гликоли-
зом, проблемы стабилизации ДЦН+ может и не быть. В их цитоплазматиче-
ской мембране содержится только один тип Дцн+-генераторов (Н+-АТРаза,
использующая гликолитический АТР) и один тип потребителей Дрн+
(Н+,метаболит-симпортеры). В этой группе микроорганизмов можно найти
представителей, у которых содержание Na+ внутри клетки оказывается вы-
ше, чем снаружи. Та же логика справедлива применительно к внутрикле-
точным пузырькам и органеллам, специализированным на Ацн+-зависимом
синтезе АТР (хроматофоры бактерий-фотосинтетиков, митохондрии и хло-
ропласты). Они используют упрошенные варианты механизма стабилиза-
ции ДЦН+.
11.3.2. Другие системы стабилизации АЦН+
Обычно биологическая мембрана делит некий объем на две неравные
части. Поэтому активный транспорт ионов Н+ через мембрану изменяет pH
главным образом (или даже исключительно) в меньшем отсеке. Если в этом
отсеке нет ферментов, то механизм стабилизации ДЦН+ может быть упрощен
таким образом, что его натриевый компонент попросту отсутствует. Наи-
более демонстративный пример — тилакоиды хлоропластов.
Здесь ионы Н+, транспортируемые через мембрану, высвобождаются
во внутритилакоидное пространство, представляющее собой очень узкую
щель, размеры поперечника которой имеют тот же порядок, что и толщина
мембраны. В этой щели практически нет ферментов, поэтому нет риска,
что закисление внутритилакоидного пространства инактивирует какой-
либо ферментативный процесс. Как было показано выше (см. разд. 2.3.4),
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала
243
стабилизация Дцн+ происходит за счет перехода Д*Р -> ДрН, сопровождаю-
щего перенос К+, Mg2+ и С1“ через мембрану тилакоидов. Поскольку вну-
тритилакоидное пространство очень мало по сравнению с объемом стромы
хлоропласта, ДрН образуется почти исключительно за счет закисления сре-
ды внутри тилакоида, pH которой может быть на три единицы ниже, чем
в строме.
Некоторая стабилизация Дцн+ необходима хлоропласту из-за колеба-
ний интенсивности света, всегда происходящих в естественных условиях.
Вероятно, по этой причине хлоропласт превращает Д'? в ДрН. Та же про-
блема существует и в бактериальных хроматофорах; у Rhodospirillum rubrum
она может быть решена посредством -пирофосфат-синтазы. Этот весь-
ма активный фермент использует Дцн+, чтобы образовать пирофосфат из
фосфата. Путей утилизации пирофосфата, соизмеримых по скорости с Н+-
пирофосфат-синтазой, для этой бактерии описано не было. Один из авто-
ров этой книги (В.П.С.) предположил, что главный путь превращения пи-
рофосфата у Rh, rubrum — его гидролиз с образованием Дцн+ при обращении
Н+-пирофосфат-синтазной реакции. Синтез АТР есть основная функция
хроматофоров. Существенно, что пирофосфат стабилизирует Дцн. на уров-
не, достаточном для синтеза АТР (см. разд. 7.3).
Вероятно, внешняя мембрана клеток высших растений стабилизирует
Дцн+ тем же путем, что и тилакоиды. Протоны, откачиваемые из клетки
Н+-АТР-синтазой, оказываются в узком межклеточном пространстве, где
pH может быть на две единицы ниже, чем в цитоплазме.
У пресноводных цианобактерий ApNa «правильного» направления не
может быть образована из-за низкой [Na+]Hap. Здесь емкость ДЦн+-буфера
невелика, поскольку используется только одна его составляющая — АрК.
Для митохондрий проблема Дцн+-буфера стоит не так остро, как для
бактерий и хлоропластов, поскольку уровень дыхательных субстратов ко-
леблется, как правило, в меньшей степени, чем уровень света. Поэтому
неудивительно, что Дцн+ в митохондриях представлена главным образом в
виде ДЖ Среди возможных претендентов на роль Дцн+-буфера здесь можно
назвать унипорт К+, а в тканях с сильно меняющейся активностью, типа
мышечной, — объединение митохондрий в митохондриальный ретикулум.
Часть пятая
НАТРИЕВЫЙ МИР
Прогресс биоэнергетических исследований в конце XX в. стимулировал
интерес к ионам натрия. Оказалась поколебленной догма о Н+ как о един-
ственном сопрягающем ионе. Выяснили, что роль Na+ не ограничивается
его функцией в системе Дцн+-буферов и у некоторых живых организмов Na+
прямо вовлечен в превращения энергии, заменяя собой протоны в этих реакциях.
Значительное таксономическое разнообразие видов, использующих Na+, а
не Н+ в качестве первичного сопрягающего иона, указывает на всеобщее
распространение вновь открытого типа мембранной энергетики. Возникает
впечатление, что наряду с миром живых существ, чья энергетика базируется
на циркуляции протонов, существует достаточно обширная область, которую
можно было бы назвать «натриевым миром».
ГЛАВА ДВЕНАДЦАТАЯ
ГЕНЕРАТОРЫ AjINa+
12.1. Декарбоксилазы, транспортирующие Na+
В 1980 г. П. Димрот сообщил об открытии первичного ApNa+-генератора,
откачивающего Na+ из цитоплазмы бактериальной клетки без участия Дцн+
или АТР. Было показано, что энтеробактерия Klebsiella aerogenes, растущая в
анаэробных условиях, декарбоксилирует оксалоацетат в пируват и СО2 только
в присутствии ионов натрия, и декарбоксилирование сопряжено с переносом
Na+ из клетки во внешнюю среду против концентрационного градиента:
НООС-СН2-СО-СООН + nNa+BHyT ->
-» СН3-СО-СООН + СО2 + «Na+Hap, (12.1)
где п, вероятнее всего, равно двум.
Указанный процесс показан как в интактных клетках, так и в выверну-
тых субклеточных пузырьках, а также в протеолипосомах. Реакция, катали-
зируемая биотиновым ферментом, локализованным в цитоплазматической
мембране, протекает в два этапа: 1) перенос карбоксила с оксалоацетата на
биотиновую простетическую группу и 2) высвобождение СО2 из карбок-
силированного биотина с регенерацией исходной формы фермента. Для
второго этапа требуется Na+. При транспорте Na+ внутренний объем вывер-
Глава 12. Генераторы ApNa+
245
Оксалоацетат-
Рисунок 12.1. Схема сбраживания цитрата у К. aerogenes и К. pneumonia. Объяснения в тексте
нутых субклеточных пузырьков заряжается положительно, что свидетель-
ствует об электрогенном характере этого процесса. АТ и ApNa были равны
65 и 50 мВ, т.е. общая ApNa+ составляла 115 мВ.
Оксалоацетатдекарбоксилаза К. aerogenes состоит из а-, ₽- и у-субъединиц
с молекулярными массами соответственно 65, 34 и 12 кДа. а-Субъединица —
периферический белок, в то время как ₽- и у-субъединицы — интеграль-
ные мембранные белки, переходящие в раствор только в присутствии де-
тергента. Биотин ковалентно связан с консервативным остатком лизина
а-субъединицы.
Функционирование у Na+-транспортирующей декарбоксилазы К. aero-
genes позволяет этой бактерии сбраживать такой необычный для анаэроб-
ного роста субстрат, как цитрат (рис. 12.1). Вначале цитрат захватывается
клеткой с помощью Na+-зависимого переносчика этого аниона (CitS). Далее
цитрат разлагается цитрат-лиазой (CL) на оксалоацетат и ацетат. Оксалоа-
цетат декарбоксилируется с образованием пирувата соответствующей де-
карбоксилазой, откачивающей Na+ из клетки, т.е. энергия этой реакции
запасается в виде ApNa+. Пируват под действием пируват-формиат-лиазы
(PFL) превращается в ацетил-СоА с высвобождением формиата. Энер-
гия разрыва тиоэфирной связи ацетил-СоА может быть запасена в виде
АТР, этот процесс осуществляют ферменты фосфотрансацетилаза (РТА) и
ацетат-киназа (АК). Токсичный для клетки формиат разлагается на СО2
и Н2 под действием формиатдегидрогеназы (FHL), электроны с Н2 перено-
сятся на NAD(P)+ гидрогеназой. Таким образом, в ходе данного брожения с
помощью субстратного фосфорилирования образуется 1 моль АТР на моль
потребленного субстрата, а также некоторое количество энергии дополни-
тельно запасается в виде ApNa+. ApNa-Составляющая натриевого потенциа-
ла может быть использована для транспорта цитрата и других метаболитов,
246
ЧАСТЬ V. Натриевый мир
a A*P, по-видимому, утилизируется Н+-АТР-синтазой для синтеза добавоч-
ного количества АТР.
Дальнейшие исследования показали, что К. aerogenes — не единствен-
ный микроорганизм, располагающий Na+-транспортирующей декарбок-
силазой. На сегодняшний день у разных бактерий описано четыре класса
данных ферментов, использующих для декарбоксилирования различные
субстраты.
1) №+-транспортирующая оксалоацетатдекарбоксилаза обнаружена у та-
ких энтеробактерий, как К. aerogenes, К. pneumoniae и Salmonella typhimurium.
2) У микроорганизмов Acidaminococcus fermentans, Peptococcus aerogenes,
Clostridium symbiosum и Fusobacterium nucleatum присутствует Na+-TpaHC-
портирующая глутаконил-СоА декарбоксилаза, которая декарбоксилирует
глутаконил-СоА (интермедиат сбраживания глутамата до ацетата и бутира-
та) в кротонил-СоА сопряженно с транспортом Na+.
3) У строго анаэробной бактерии Veillonella alcalescens, превращающей
лактат в ацетат и пропионат, и у Propionigenium modestum, утилизирующей
сукцинат с образованием пропионата, декарбоксилирование метилмалонил-
СоА в пропионил-СоА также поддерживает транспорт Na+. Перед декар-
боксилированием сукцинат превращается в метилмалонил-СоА, декарбок-
силирование которого, собственно, и сопряжено с переносом Na+.
4) У бактерии Malonomonas rubra описана №+-транспортирующая де-
карбоксилаза малоната, образующая из этого соединения ацетат и СО2.
При чтении бактериальных геномов было обнаружено, что гены, гомо-
логичные известным генам Na+-транспортирующих декарбоксилаз, присут-
ствуют у большого количества бактерий и архей. Субстратную специфич-
ность этих предполагаемых Na+-транспортирующих ферментов предстоит
выяснить в будущих исследованиях.
12.2. Ыа+-транспортирующая
ЫАВН:хинон-оксидоредуктаза
В 1977 г. Т. Унемото с соавторами показали, что NADH-оксидазная ре-
акция, катализируемая суббактериальными частицами из Vibrio alginolyticus
и V costicola, специфически стимулируется ионами натрия. Другие катионы
были неэффективны. В тех же условиях NADH-оксидазная реакция дыха-
тельной цепи Е. coli не требовала Na+ для достижения максимальной ак-
тивности. Дальнейшие исследования той же группы ученых выявили, что
№+-зависимая стадия дыхательной цепи вибрионов локализована между
NADH-дегидрогеназой и убихиноном, в то время как цитохромный сегмент
цепи активен и без Na+.
Более того, оказалось, что ^^-зависимость окисления NADH у
V alginolyticus связана не с какой-либо аллостерической регуляцией
NADH:xинoн-oкcидopeдyктaзы, а с тем, что активность этого фермента со-
пряжена с трансмембранной транслокацией ионов натрия. В 1982 г. X. То-
куда и Т. Унемото продемонстрировали сопряженный с дыханием экспорт
Na+ из клеток V alginolyticus. Затем авторам удалось выделить Na+-транс-
Глава 12. Генераторы A|LiNa+
247
портирующую NADH:xuHOH-OKCudopedyKma3y (Na+—NQR) и встроить ее в ли-
посомы. Окисление NADH протеолипосомами сопровождалось накоплени-
ем в них ионов Na+. Исключение Na+ из состава среды инкубации в 15 раз
тормозило скорость окисления NADH. Был сделан вывод, что NADHixhhoh-
оксидоредуктаза V. alginolyticus является первичной натриевой помпой.
12.2.1. Первичная структура субъединиц Na+-транслоцирующей
NADH:xuHOH-OKCudopedyKma3bi
В 1994 г. В группах Т. Унемото и П. Рича была определена после-
довательность оперона, кодирующего Na+—NQR. Этот оперон содержит
шесть генов (nqrA—F), соответствующих шести субъединицам, формирую-
щим Na+—NQR комплекс. Три субъединицы (NqrB, NqrD и NqrE) очень
гидрофобны, в то время как остальные три — относительно гидрофильны
(см. табл. 12.1). Субъединица NqrF оказалась гомологичной многим белкам,
осуществляющим окислительно-восстановительные реакции. С-концевой
домен этой субъединицы сходен с некоторыми ферредоксин^АОР+-
оксидоредуктазами. В его первичной структуре содержатся участки, от-
ветственные за связывание NADH и FAD. N-концевой домен NqrF
гомологичен ферредоксинам, содержащим [2Fe—2S] кластер. Его после-
Таблица 12.1. Физико-химические свойства субъединиц Na+-NQR на примере
фермента из И harveyi и их возможная роль при осуществлении ферментативной
активности
Субъединица Na+-NQR Молекулярная масса, кДа Предполагаемое коли- чество трансмембран- ных а-спиралей Связывание кофакторов и возможная роль в ферментативной активности
NqrA 48,4 0 ?
NqrB 45,4 8 Ковалентно связанный остаток FMN, возможно, формирует хинон-редуктазный центр фер- мента
NqrC 27,5 1-2 Ковалентно связанный остаток FMN
NqrD 22,7 6 Возможно, участвует в транс- мембранной транслокации ионов натрия
NqrE 21,5 6 Возможно, участвует в транс- мембранной транслокации ионов натрия
NqrF 45,2 1 Место связывания NADH, со- держит нековалентно связанный FAD и [2Fe~2S] кластер. От- ветственна за осуществление NADH-дегидрогеназной актив- ности
248
ЧАСТЬ V. Натриевый мир
довательность включает четыре консервативных остатка цистеина, прини-
мающих участие в формировании этого железо-серного кластера. Таким
образом, NqrF представляет собой полипептид, объединяющий в своем со-
ставе NADH:фeppeдoкcин-oкcидopeдyктaзy и ферредоксин. Остальные пять
субъединиц Na+—NQR (NqrA—Е) не обладают сколь-нибудь существен-
ной гомологией по отношению к другим белкам с известными функция-
ми. Важно отметить, что Na+—NQR полностью отлична как от ферментов
класса протон-транслоцирующих NADH:xинoн-oкcидopeдyктaз (NDH-1
или Комплекс I), так и от ферментов класса несопряженных NADHixhhoh-
оксидоредуктаз (NDH-2). Таким образом, белки типа Na+—NQR составля-
ют третий класс NADH:xинoн-oкcидopeдyктaз дыхательных цепей, который
возник в ходе эволюции независимо от двух других классов этих ферментов.
Интересно отметить, что гены, гомологичные nqrN—F из И alginolyticus,
впоследствии были обнаружены в геномах многих бактерий. Таким образом,
Na+—NQR широко распространен среди прокариот, в частности, этот белок
содержится и у различных патогенных микроорганизмов, таких, как И chol-
егае, К. pneumoniae, Haemophilus influenzae, Neisseria gonorrhoeae, Neisseria men-
ingitidis, Yersinia pestis, Pseudomonas aeruginosa, Porphyromonas gingivalis и т.д.
12.2.2. Простетические группы NcY-NQR
В 1986 г. Токуда и Унемото выделили Na+—NQR из И alginolyticus и по-
казали, что она содержит лишь флавины в качестве кофакторов, а именно —
один нековалентно связанный FAD и один нековалентно связанный FMN.
Однако при анализе первичных структур субъединиц Na+—NQR было уста-
новлено, что лишь в одной из них (в субъединице NqrF) присутствует мотив
для нековалентного связывания флавина. Более того, X. Д. Пфеннингер-Ли
и П. Димрот показали, что в очищенном препарате Na+—NQR содержится
лишь один нековалентно связанный флавин, а именно — FAD. Позднее дан-
ное противоречие в результатах было разрешено. Оказалось, что Na+—NQR
наряду с нековалентно связанным FAD содержит дополнительно еще две мо-
лекулы FMN, ковалентно связанные с субъединицами NqrB и NqrC. В обоих
случаях остатки FMN присоединены к остаткам треонина субъединиц по-
средством фосфоэфирной связи*. Ковалентный тип связи флавина с белком
подразумевает какой-то другой, отличный от классического мотив первичной
структуры флавин-содержащего домена, а также невозможность использова-
ния обычно применяемой методики экстракции для его обнаружения.
Изучение флавиновых кофакторов Na+—NQR получило неожиданное
продолжение в самое последнее время. В группе Б. Баркуэры было показа-
но, что данный белок наряду с FAD и FMN содержит также и нековалентно
связанный рибофлавин. Рибофлавин обычно используется живыми орга-
низмами лишь как предшественник для синтеза FAD и FMN, и, за исклю-
чением Na+—NQR, неизвестны случаи его функционирования в качестве
редокс-активной простетической группы фермента. Согласно последним
* Такой тип ковалентной связи флавина с белком является уникальным и, кроме
Na+—NQR, не встречается в других изученных ферментах.
Глава 12. Генераторы A|LtNa+
249
данным наряду с флавинами Na+—NQR содержит также [2Fe—2S] кластер и
молекулу прочно связанного убихинона-8. Таким образом, сегодня принято
считать, что Na+~NQR в качестве кофакторов содержит нековалентно свя-
занный FAD, два ковалентно связанных остатка FMN, рибофлавин, [2Fe—2S]
кластер и убихинон-8.
При функционировании in vivo Na+—NQR окисляет NADH и пере-
носит два электрона на молекулу убихинона с образованием убихинола.
Данная окислительно-восстановительная реакция сопряжена с векторным
переносом двух ионов натрия через мембрану, т.е. соотношение Na+/e
для Na+—NQR равно 1. Значит, эффективность запасания энергии Na+-
транслоцирующими NADH:xинoн-oкcидopeдyктaзaми в грубом приближе-
нии в два раза меньше по сравнению Н+-транслоцирующими NADH:xhhoh-
оксидоредуктазами, когда стехиометрия Н+/ё равна 2:
NADH + Н+Внут + CoQ + 2Na+BHyT -> NAD+ + CoQH2 + 2Na+Hap. (12.2)
Так как ионы натрия являются обязательными участниками катали-
зируемой Na+—NQR реакции, ее скорость зависит от концентрации Na+ и
данный процесс практически полностью отсутствует в средах, истощенных
по этому иону. При физиологических значениях ионной силы Км для ионов
натрия у Na+—NQR из различных вибрионов находятся в миллимолярной
области концентраций. Na+—NQR абсолютно специфична по отношению к
Na+. Все другие исследованные ионы не способны вызывать подобного ак-
тивирующего действия на реакцию 12.2. Na+—NQR даже в отсутствие ионов
натрия не способна к транслокации протонов.
Транспорт натрия ферментом сопровождается генерацией трансмем-
бранного электрического потенциала (ДТ). Показано, что протоны, вы-
свобождающиеся при окислении NADH, выделяются в цитоплазму, а
протоны, необходимые для образования убихинола, также поглощаются с
цитоплазматической стороны мембраны (см. реакцию 12.2). Таким обра-
зом, Na+—NQR является первичной электрогенной натриевой помпой и не
катализирует №+,Н+-обмена.
Na+—NQR имеет pH-оптимум между 8,0 и 9,0. Она специфически тор-
мозится ионами Ag\ а также очень низкими концентрациями N-окиси
2-гептил-4-окси-хинолина (HQNO) и антибиотика корормицина.
Механизм генерации натриевого потенциала при работе Na+—NQR еще
не известен. Однако уже установлена стадия каталитического цикла это-
го фермента, специфически активирующаяся ионами натрия. По данным
А.В. Богачева и М.И. Верховского, это перенос электронов от FAD к кова-
лентно связанным остаткам FMN.
12.3. Ыа+-транспортирующий метилтрансферазный
комплекс метаногенных архей
Как было изложено в разделе 5.3, метаногенные археи обладают уни-
кальным набором мембранных белков, способных к запасанию энергии при
протекании реакций анаэробного образования СН4. Еще на ранних этапах
250
ЧАСТЬ V. Натриевый мир
исследования метаногенеза было отмечено, что метаногенным археям не-
обходимо присутствие в среде роста ионов натрия (более 1 мМ). Позднее
удалось выяснить, что Na+ специфически активирует окислительную фазу
метаногенеза.
При восстановлении метаногенами разнообразных одноуглеродных со-
единений молекулярным водородом с образованием метана и воды актива-
ция натрием наблюдается лишь для таких субстратов, как формальдегид+Н2
или СО2+Н2, но не при восстановлении водородом метанола (см. разд. 5.3.1).
При анализе этих данных было установлено, что одной из натрий-зависимых
стадий метаногенеза является перенос метильной группы с метил-тетрагидро-
метаноптерина (СН3—Н4МРТ) на 2-тиоэтансульфонат (СоМ):
СН3-Н4МРТ + СоМ -» Н4МРТ + СН3—СоМ
А б9’ = —30 кДж/моль. (12.3)
Эта реакция катализируется мембранным Na+-транспортирующим ме-
тилтрансферазным комплексом, и свободная энергия данной экзергоничной
реакции запасается в виде ApNa+. Метилтрансферазный комплекс состоит
из 8 разных субъединиц (MtrA—Н), являющихся продуктами восьми генов
оперона mtr\—Н. Данный белок содержит 5-оксибензимидазолилкобаламин
(кобаламин — кофактор, содержащий атом кобальта, см. Приложение 2) в
качестве простетической группы, связанной с субъединицей MtrA. В хо-
де метилтрансферазной реакции метильная группа с СН3—Н4МРТ вначале
переносится на кобаламин:
СН3—Н4МРТ + кобаламин(Со+1) Н4МРТ + СН3-кобаламин(Со+3). (12.4)
Далее метильная группа с метилкобаламина переносится на СоМ:
СН3-кобаламин(Со+3) + СоМ кобаламин(Со+1) + СН3—СоМ. (12.5)
Именно последняя реакция специфически активируется Na+ и сопря-
жена с трансмембранным электрогенным транспортом этих ионов. Счита-
ется, что на каждую перенесенную метильную группу фермент транслоци-
рует через мембрану 2 Na+. Механизм генерации натриевого потенциала
метилтрансферазным комплексом еще не известен.
12.4. Ыа+-транспортирующая
формидметанофурандегидрогеназа метаногенных архей
Второй натрий-зависимой стадией окислительной фазы метаногене-
за является окисление формилметанофурана (формил-MFR*) до метано-
фурана (MFR) и углекислого газа, катализируемое формилметанофуран-
дегидрогеназой:
* Метанофуран (MFR) является уникальным коферментом метаногенных архей,
играющим ключевую роль в реакциях фиксации и восстановления СО2, а также в реакциях
окисления органических молекул, сопровождающихся выделением СО2. Редокс-потенциал
пары формил-МРК/МРК+СО2 составляет —530 мВ.
Глава 12. Генераторы ApNa+
251
формил-MFR -> СО2 + MFR + 2Н
А б9' = —16 кДж/моль. (12.6)
В настоящий момент неизвестно, какой из переносчиков восстанови-
тельных эквивалентов выполняет роль акцептора электронов для этой реак-
ции. Формилметанофурандегидрогеназа является электрогенной натриевой
помпой и на каждую образованную молекулу СО2 переносит через мембра-
ну 2—3 иона Na+.
Окисление формил-MFR происходит в качестве одной из стадий при
превращении формиата или метанола в метан и углекислый газ:
4НСООН -> СН4 + ЗСО2 + 2Н2О, (12.7)
4СН3ОН -> ЗСН4 + СО2 + 2Н2О. (12.8)
В разных метаногенных бактериях могут функционировать формилме-
танофурандегидрогеназы, относящиеся к двум различным типам, а имен-
но ферменты, содержащие молибден или вольфрам. Все они являются
мультисубъединичными железосерными белками. Наряду с [Fe—S] кла-
стерами они содержат особую простетическую группу — молибдоптерин-
гуанидиндинуклеотид (или вольфрамоптерин гуанидиндинуклеотид). Ме-
ханизм работы формилметанофурандегидрогеназ на настоящий момент
неизвестен, и, пожалуй, этот фермент является наиболее загадочным био-
энергетическим компонентом метаногенных архей.
12.5. Вторичные АЦКа+-генераторы: Ыа+-транспортирующие
АТРазы и Ыа+-пирофосфатаза
12.5.1. Бактериальные Na-АТРазы
В 1982 г. Д. Хифнер и Ф. Харольд представили убедительные свидетель-
ства существования Na+-транспортирующей АТРазы у анаэробной бактерии
Enterococcus hirae (в то время этот микроорганизм именовался Streptococcus
faecalis). Было показано, что добавка Na+ к вывернутым субклеточным пу-
зырькам из Е. hirae стимулирует их АТРазную активность. Радиоактивный
Na+ накапливался в пузырьках сопряженно с гидролизом АТР.
В дальнейшем выяснилось, что при росте Е. hirae в обычных услови-
ях (при нейтральных значениях pH и при невысоких концентрациях ио-
нов натрия) в ней функционирует в основном «каноническая» Н+-транс-
лоцирующая АТРаза FoFi-THna. Однако при повышении концентрации Na+
в среде роста, а также при щелочных значениях pH или при росте в при-
сутствии протонофоров у Е. hirae превалирует альтернативный фермент —
Na+-транспортирующая АТРаза VoVj-™na.
Данный фермент, как и другие АТРазы V-типа, устойчив к действию
азида и ванадата, но чувствителен к нитрату и N-этилмалеимиду. Актив-
ность этого белка специфически активируется ионами натрия (с двумя ка-
жущимися Км, равными 20 мкм и 4 мМ), из других катионов лишь ионы
252
ЧАСТЬ V. Натриевый мир
лития обладают подобным действием (с Км равными 60 мкм и 3,5 мМ)*.
Подобно Ыа+-транспортирующей NADH:xинoн-oкcидopeдyктaзe V. al-
ginolyticus. Na+-ATPa3a Е. hirae наиболее активна в щелочной среде (pH
8,0—9,0). Как было отмечено в разд. 7.2.2, гидролиз одной молекулы АТР
Ыа+-транспортирующей АТРазой Е. hirae должен быть сопряжен с транс-
мембранным транспортом 3,3 ионов натрия.
Скорее всего, биологическая функция Na+-ATPa3bi Е. hirae состоит в
энергизации мембраны этой гликолизирующей бактерии в условиях, когда
невозможно использовать обычную цепь реакций, приводящих к накопле-
нию метаболитов и к совершению других типов мембранной работы (см.
реакцию 12.9):
Глюкоза -» АТР -> Ацн+ -» мембранная работа. (12.9)
При отсутствии Дцн+ реализуется альтернативный механизм:
Глюкоза -> АТР ApNa+ мембранная работа, (12.10)
где второй и третий этапы катализируются соответственно №+-АТРазой и
№+-зависимыми транспортерами.
12.5.2. Na+/K*-ATPa3a и Na+-ATPa3a животных
Na+/K*-АТРаза была описана Й.-Х. Скоу в 1957 г. Сорок лет спустя это
открытие было отмечено Нобелевской премией по химии. Фермент лока-
лизован во внешней мембране животной клетки. Он ответствен за генерацию
AT, ApNa и АрК на этой мембране. Такой эффект достигается путем обмена
2К+нар на 3Na+BHyT, сопряженного с гидролизом одной молекулы АТР. Na+/
К+-АТРаза состоит из двух субъединиц (а и р) с молекулярными массами
соответственно 100 и 40 кДа. По данным Ю.А. Овчинникова, Н.Н. Модя-
нова и сотрудников, полученным посредством электронного микроскопи-
рования двухмерных кристаллов фермента (разрешение 2 нм), вертикаль-
ный размер ap-протомера составляет около 10 нм, что существенно больше
толщины липидного бислоя.
р-Субъединица содержит короткий цитоплазматический (N-концевой)
участок, одну трансмембранную а-спираль и большой гликозилированный
экстраклеточный домен. а-Субъединица содержит 10 трансмембранных
ос-спиралей. По данным, полученным в опытах с химической модификаци-
ей и антителами, почти две трети ос-субъединицы находятся вне мембраны,
причем цитоплазматический домен втрое больше того, который выступает
снаружи клетки. ос-Субъединица сужается в своей центральной части, по-
груженной в мембрану.
Na+/K+ATPa3a может быть встроена в протеолипосомы, способные к
ATP-зависимому антипорту Na+ и К+. Как показал метод травления за-
* Интересно отметить, что Li+ хотя и способен транспортироваться АТРазой Е. hirae,
однако, в отличие от Na+, повышение концентрации ионов лития в среде роста не вы-
зывает увеличения экспрессии генов этого фермента.
Глава 12. Генераторы A|iNa+
253
Na внут
Е^АТР------—► + ADP
Е,Р--->Е2Р
К нар
Е2Р-----—► Е2+ Н3РО4
Е2—Е,
Рисунок 12.2. Механизм функциони-
мороженных образцов, протеолипосомы
содержат частицы размером 9—12 нм, что
примерно соответствует размеру комплек-
са со стехиометрией а2р2.
N-концевой домен а-субъединицы
обращен в цитоплазму. Карбоксильная
группа одного из остатков аспартата, ло-
кализованного в этом домене и входяще-
го в консервативную последовательность
DKTGT, фосфорилируется посредством
АТР при образовании фосфофермента в
процессе АТРазной реакции.
Механизм Na+/K+-ATPa3bi описывается в рамках общей схемы работы
Е^-АТРаз (рис. 12.2). Согласно этой схеме ионы Na+BHyT необходимы для
фосфорилирования фермента. Фосфофермент претерпевает конформаци-
онное изменение (Ej -> Е2) и распадается на Е2 и фосфат в присутствии
ионов калия (К+нар). Затем Е2 релаксирует в Еь Состояние Е2Р фиксирует-
ся оуабаином. Наблюдается положительная кооперативность в связывании
3Na+ и 2К+.
Rb+, Cs+, NH4+, Tl+, Li+ и Na+ могут, хотя и в разной степени, заменять
ион К+. Что касается иона Na+, то его роль более специфична. Среди пере-
численных катионов только Li+ может быть использован вместо Na+, при-
чем в этом случае скорость гидролиза АТР снижена, а сродство фермента к
Li+ гораздо меньше, чем к Na+. Интересно, что Na+ можно заменить ионом
водорода, причем Н+ имеет по крайней мере на два порядка большее срод-
ство к Na+/K+-ATPa3e, чем Na+. Тот факт, что фермент в физиологических
условиях переносит Na+, а не Н+, обусловлен гораздо большей концентра-
цией Na+, чем Н+ в цитоплазме. Однако в более кислых средах (pH 5,7)
удается наблюдать Н+/К+-антипорт и АТРазную активность без Na+.
Другая Na+-транспортирующая АТРаза была описана Ф. Провербио и
коллегами в эпителии тонкого кишечника и проксимальных почечных ка-
нальцах. Она отличается от Ма^/К+-АТРазы прежде всего тем, что К+ не
нужен для активности, а оуабаин не влияет на фермент.
12.5.3. Na+-пирофосфатаза
Какописано в разд. 7.3, в клетках растений и некоторых микроорганизмов
содержится особый фермент — мембраносвязанная Н+-транслоцирующая
пирофосфатаза, катализирующая сопряженный с гидролизом пирофосфа-
та трансмембранный перенос протонов. Однако совсем недавно сотруд-
ник нашего института А.А. Байков и его коллеги из университета г. Турку
Р. Лахти, А. Малонен и Г. Белогуров выяснили, что мембраносвязанные
пирофосфатазы архей Methanosarcina mazei и Moorella the г то асе tic а, а также
термофильной бактерии Thermotoga maritima используют в качестве сопряга-
254
ЧАСТЬ V. Натриевый мир
Рисунок 12.3. Р. Лахти, А. Малонен, Г. Белогуров и А.А. Байков (слева направо)
ющего иона Na+, а не Н+. Эти пирофосфатазы похожи на обычные мембра-
носвязанные Н+-транслоцирующие пирофосфатазы и отличаются от них
лишь измененной субстратной специфичностью. Каталитическая актив-
ность мембраносвязанных пирофосфатаз из Methanosarcina mazei, Moorella
thermoacetica и Thermotoga maritima проявляется лишь в присутствии Na+, и
данная активность сопряжена с электрогенной трансмембранной трансло-
кацией этого иона.
ГЛАВА ТРИНАДЦАТАЯ
УТИЛИЗАЦИЯ AjINa+, ОБРАЗУЕМОЙ
ПЕРВИЧНЫМИ A[lNa-ГЕНЕРАТОРАМИ
13.1. Осмотическая работа, поддерживаемая ApNa+
13.1.1. (Na+,Mema6oAum)-cuMnopmepbi
У алкалотолерантной Vibrio alginolyticus, располагающей Na+-NADH:xnHOH-
оксидоредуктазой, обнаружены (№\метаболит)-симпортеры, ответственные
за аккумуляцию 19 аминокислот и сахарозы.
Показано также, что накопление К+ в клетках V. alginolyticus при ще-
лочных pH поддерживается энергией AH', генерируемой Na+—NQR.
№+-зависимое накопление метаболитов в алкалофильных бациллах
было описано в ряде сообщений. Однако остается неясным, как эти алка-
лофилы образуют ApNa+.
Нейтрофильные бактерии, живущие при низких или умеренных кон-
центрациях NaCl, обычно используют Н+, а не Na+ в качестве симпор-
тируемого иона (см. разд. 9.7). Однако известны и исключения из этого
правила. Так, пролин транспортируется вместе с Na+ в клетки Mycobacterium
phlei, Salmonella typhimurium и E. coli.
Интересный «дуалистический» механизм импорта метаболита описан у
Е. coli. Оказалось, что эта бактерия использует альтернативно Н+ или Na+ в
качестве сопрягающего катиона при аккумуляции мелибиозы. Поглощение
цитрата бактериями Klebsiella pneumoniae осуществляется переносчиком,
обеспечивающим симпорт цитрата3-, 2Na+ и 2Н+. Это означает, что движу-
щей силой процесса должны быть АЧ\ ApNa и АрН.
А. Броди и сотрудникам удалось выделить (№+,пролин)-симпортер из
М. phlei, который оказался белком массой в 20 кДа. Очищенный симпор-
тер был реконструирован с фосфолипидами. Полученные протеолипосомы
транспортировали пролин за счет АЧ*, образованной диффузией ионов К+.
Аккумуляция пролина тормозилась ионофорами, снижавшими АЧ\ а также
сульфгидрильными реагентами.
Описана частичная очистка и реконструкция (№+,аспартат)-симпортера
из галофильной Halobacterium halobium. Вообще морские и галофильные ми-
кроорганизмы, подобно алкалофилъным, обычно используют Na+, а не Н* как
импортируемый ион. Это верно также и для внешней мембраны клеток
высших животных, омываемой раствором с высокой концентрацией NaCl.
Данное обстоятельство — еще одно свидетельство справедливости мнения
256
ЧАСТЬ V. Натриевый мир
о том, что кровь — «частичка океана в нашем теле». Генератором ApNa+ на
плазмалемме животных клеток служит Na+/K+-ATPa3a (в некоторых слу-
чаях также и Na+-ATPa3a). Образованная ApNa+ утилизируется различны-
ми переносчиками, транспортирующими в клетку аминокислоты, сахара,
жирные кислоты и другие соединения. Ряд (№+,метаболит)-симпортеров
выделен и встроен в протеолипосомы.
Некоторые животные клетки содержат Н+-АТРазу во внешней мембране
(см. разд. 7.2). В этих клетках также найдены (Н+,метаболит)-симпортеры.
13.1.2. Ионы Na+ и регуляция внутриклеточного pH
Бактерии весьма успешно решают проблему гомеостаза внутриклеточ-
ного pH. Как было показано в группе Р.М. Макнаба, у Е. coli этот гомео-
стаз наблюдается при рНнар 5,5—9,0. В указанном интервале рНнар величина
рНвнут описывается уравнением:
рНвнут = 7,6 + 0,1(рНнар - 7,6), (13.1)
так что значения рНвнут при рНнар 5,5 и 9,5 равны соответственно 7,4 и 7,8.
При понижении рНнар закисление цитоплазмы может быть предотвра-
щено посредством импорта разменивающего образуемую Дцн+-генера-
тором AH' на ДрН нужного направления (цитоплазма шелочнее внешней
среды) (рис. 13.1 Л).
При нейтральном рНнар единственная задача — вернуть в цитоплаз-
му ионы Н+, теряемые клеткой из-за работы Дцн+-генераторов. Проблема
может быть решена посредством электронейтрального №+/Н+-антипорта
(рис. 13.1 Б).
Электронейтральный Ка+/Н+-антипорт эффективен в поддержании рН-
гомеостаза только при условии, что рНнар < рНвнут. Механизмы закисления
цитоплазмы оказываются иными, если рНнар выше, чем рНвнут. Бактерия
сталкивается с этой проблемой, когда среда роста становится щелочной.
Теперь электронейтральный №+/Н+-антипортер уже не может обеспечи-
вать вход Н+ в клетку, так как градиенты pH и pNa неблагоприятны для
такого процесса. Один из способов предотвратить защелачивание цито-
плазмы при высоком рНнар — сделать №+/Н+-антипортер электрогенным
(например, обмен одного иона Na+ на два иона Н+). Если при этом Д^Р,
образуемая Дцн+-генератором, достаточно высока, чтобы перекрыть небла-
гоприятное действие ДрН и ApNa, то взаимодействие Дцн+-генератора и
Na+ /2 ЕЕ-антипортера будет поддерживать рНвнут< рНнар (рис. 13.1В).
Альтернативная возможность показана на рис. 13.1 Г. Здесь первичный
ДцКа+-генератор заряжает мембрану, а ЕЕ -унипортер облегчает электрофо-
рез ионов Н+ под действием образованной ДЧ*.
Ионы Na+ участвуют также в pH-гомеостазе животных и растительных
клеток. Для животных твердо установлено, что именно №+/Н+-антипор-
тер ответственен за постоянство внутриклеточного pH. У растений Na+/
Н+-антипорт происходит как во внешней мембране клетки, так и в тоно-
пласте.
Глава 13. Утилизация A|iNa., образуемой первичными Дцн»-генераторами
257
[НТ]„ар = [НТ]внут
Рисунок 13.1. Возможные механизмы стабилизации pH в цитоплазме бактерий. А —
рНнар < рНвнуъ АЦн+-генератор выбрасывает ионы Н+ из клетки и образует Д'? (реакция 7).
Эта Д'? разряжается потоком К+ в клетку (реакция 2), так что образуется ДрН нужного знака
(цитоплазма защелачивается); Б — рННдр = рНВнуъ потеря клеткой ионов Н+ из-за работы
АЦн+-генераторов (реакция 7) компенсируется входом Н+Ндр в обмен на Na+BHyT (реакция 2);
В, Г — рННАР > рНвнуъ В — Н+-помпа откачивает Н+ из цитоплазмы, генерируя Д'? (реак-
ция 7). Эта Д'? используется Na+, 2 Н+-анти портером, обменивающим один Na+BHyj на два Н+НАР
(реакция 2); Г — первичная Na+-noMna заряжает мембрану, откачивая Na+ во внешнюю среду
(реакция 7). Унипорт Н+ в клетку разряжает Д'? и подкисляет цитоплазму (реакция 2)
[Н+]„ар< [Н*]енут
258
ЧАСТЬ V. Натриевый мир
13.2. Механическая работа
Существует по крайней мере один пример, когда механическая работа
совершается за счет ApNa+, образуемой первичным Na+-HacocoM. Как было
показано в нашей группе П.А. Дибровым, движение И alginolyticus (1) на-
блюдается только в присутствии Na+; (2) может поддерживаться искусствен-
но созданной ApNa (но не АрН), причем моненсин снимает этот эффект;
(3) происходит, хотя и со сниженной скоростью, в присутствии высокой
концентрации протонофора. В 100 раз меньшая концентрация протонофора
полностью подавляет движение, если добавить моненсин. При отсутствии
ХКФ моненсин лишь слегка снижает скорость движения, поддерживаемого
дыханием. Было сделано заключение, что флагеллярный мотор V. alginolyticus
использует энергию ApNa+, а не Дцн+.
Движение вибрионов в морской воде осуществляется за счет функци-
онирования единственной гигантской полярной флагеллы (см. рис. 13.2).
Этот натриевый мотор может вращаться с частотой до 1700 оборотов в се-
кунду и двигать клетку со скоростью, достигающей 60 мкм/с. Структура
базального тела в общих чертах сходна с таковой у обычных латеральных
Независимых флагелл (см. главу 8). Как и следовало ожидать, основные
отличия Na^-зависимого мотора от своих Недвижимых аналогов прихо-
дятся на элементы статора этих органелл. Белки MotA и MotB натриевых
флагелл значительно отличаются по своей первичной структуре от соответ-
ствующих субъединиц протонных моторов. Более того, статор натриевого
мотора содержит также два дополнительных белка MotX и MotY, отсут-
ствующих в случае с Н+-флагеллами. Интересно отметить, что замена у
вибрионов собственных белков MotA, MotB, MotX и MotY на белки MotA
и MotB Е. coli приводит к изменению специфичности мотора: в этом случае
для своего вращения он уже использует энергию протонного, а не натрие-
вого градиента.
Недавно было продемонстрировано, что при выращивании в жидких
средах V. alginolyticus движется за счет работы единственной полярной на-
триевой флагеллы (как было описано выше). Однако при росте в очень
вязких средах клетки И alginolyticus экспрессируют добавочные флагеллы
меньшего размера, которые расположены латерально, т.е. по всей поверхно-
сти бактерии. Оказалось, что вращение латеральных флагелл V. alginolyticus
Рисунок 13.2. Полярная флагелла
V. parahaemolyticus
поддерживается энергией не натрие-
вого, а протонного потенциала. Таким
образом, эта бактерия для совершения
механической работы в зависимости
от условий роста может использовать
энергию как ApNa+, так и Дрн+.
Натриевое движение было описа-
но и для других морских вибрионов, в
частности для V. cholerae. Известно, что
И. cholerae образует токсин, вызываю-
Глава 13. Утилизация ApNa+, образуемой первичными Ацн+-генераторами
259
щий выброс соли из тканей в кишечник. Возможно, эта соль необходима
И cholerae для №+-энергетики этого вибриона.
Na^-зависимое движение показано также у алкалофильных бацилл:
Bacillus sp. YN-\ и Вас. pseudofirmus. На Вас. sp. YN-1, изученной более де-
тально, показано, что Na+ необходим для движения, которое лишь частич-
но тормозится протонофором. Продемонстрировано также, что ApNa и АЧ\
генерируемые энзиматически, эквивалентны друг другу в качестве источни-
ков энергии для движения.
13.3. Химическая работа
Еще в 1966 г. И. Глин и П. Гаррахан доказали принципиальную воз-
можность того, что ApNa (вместе с АрК) способна повернуть вспять реак-
цию гидролиза АТР, катализируемую ион-транспортной АТРазой. Авторы
описали синтез АТР эритроцитами в условиях, когда [Na+]BHyT > [Na+]Hap и
[К+]внут < [К+]нар- Однако такая реакция вряд ли происходит in vivo из-за
противоположной направленности ионных градиентов.
13.3.1. Ар^а+-3ависимый синтез АТР у анаэробных бактерий
Некоторые указания на превращение энергии ApNa+ -» АТР в естествен-
ных условиях были получены П. Димротом и его коллегами, изучавшими
Propionigenium modestum — строго анаэробную бактерию, описанную в 1982 г.
Б. Шинком и Н. Пфенигом. Единственным источником полезной энергии
для Р. modestum служит декарбоксилирование сукцината в пропионат:
“ООС-СН2-СН2-СОО" + Н2О -> СН3-СН2-СОО_ + НСОз"
Аб^’ = —21 кДж/моль. (13.2)
Энергетический выход этой реакции примерно вдвое ниже, чем цена
энергии синтеза АТР из ADP и фосфата при физиологических условиях*.
Ясно, что механизмы субстратного фосфорилирования не могут быть ис-
пользованы Р. modestum, так как все они предполагают образование одной
молекулы АТР на одну молекулу утилизированного субстрата. Решением
проблемы могла бы быть генерация Ацн+ или ApNa+ при декарбоксилирова-
нии сукцината, если предположить, что на каждый декарбоксилированный
сукцинат из клетки откачивается лН+ или «Na+, а синтез одной молекулы
АТР сопряжен с переносом 2иН+ (2«Na+) назад в клетку.
По данным П. Димрота и сотрудников декарбоксилирование метил-
малонил-СоА (интермедиата превращения сукцината в пропионат) сопря-
жено с откачкой ионов Na+ из цитоплазмы Р. modestum (см. разд. 12.1),
и это декарбоксилирование в субклеточных пузырьках Р. modestum может
поддерживать синтез АТР. Образованная при декарбоксилировании ApNa+
используется для синтеза АТР путем обращения Na+-ATPa3bi, которая была
* Это послужило поводом для Б. Шинка и Н. Пфенига дать видовое название вновь
открытому микробу modestum, т.е. умеренный (в смысле энергетических потребностей).
260
ЧАСТЬ V. Натриевый мир
обнаружена в больших количествах в мембране Р. modestum (рис. 13.3). Эта
Na+-ATPa3a как по субъединичному составу, так и по чувствительности к
ингибиторам похожа на обычные АТРазы Fo^-типа, отличаясь от них лишь
измененной субстратной специфичностью. При нейтральных и слабоще-
лочных значениях pH АТРазная активность фермента из Р. modestum со-
пряжена с транслокацией ионов натрия через мембрану, однако при низких
значениях pH и при отсутствии ионов Na+ фермент способен транспорти-
ровать и протоны. Еще предстоит выяснить, как один и тот же фермент в
разных условиях способен к транслокации столь непохожих ионов, как Na+
и Н+.
Кроме ионов натрия и протонов, АТРаза Р. modestum способна также
транспортировать и Li+, однако с намного меньшим сродством к этому ио-
ну. В соответствии с предсказаниями ионная специфичность Na+-АТРазы
определяется фактором Fo. Так, химерный фермент, включающий Fx из Р.
modestum и FQ из Е. coli, демонстрирует свойства типичного Н+-насоса.
Кроме Р. modestum, №+-АТР-синтазы описаны у таких бактерий, как
Acetobacterium woodii и Ilyobacter tartaricus. Вообще, эти ферменты, по-
видимому, довольно широко распространены среди микроорганизмов
(в частности, у метаногенных архей).
13.3.2. Потребители ApNa+, совершающие химическую работу
у метаногенных архей
Как описано выше, два фермента метаногенных архей — метилтранс-
феразный комплекс и формилметанофурандегидрогеназа — являются пер-
вичными натриевыми помпами. Однако в некоторых условиях эти фермен-
ты способны катализировать обратные реакции, т.е. использовать энергию
ApNa+ для совершения химической работы (для переноса метильной группы
с метил-СоМ на Н4МРТ и для восстановления СО2 до формил-MFR).
2сн2-соо~
сн2-соо’
2СН3-СН2-СОО“
k 2СН2-СОО" _
СН2-СОО“ “
2СН3-СН2-СОО’
ADP+Pi
2 СН2-СОО~ г 2 СН3-СН-СОО
СН2-СО-СоА СО-СоА
- 2СН3-СН2-СО-СоА*--------
2СО2
Рисунок 13.3. Предполагаемый механизм энергообеспечения анаэробной бактерии Р. modestum:
сукцинат входит в клетку, где превращается в сукцинил-СоА посредством переацилирования с
пропионил-СоА. Из сукцинил-СоА образуется метилмалонил-СоА. Последний декарбоксилиру-
ется до пропионил-СоА и СО2, что сопряжено с выбросом из клетки ионов Na+. Эти ионы Na+
возвращаются в цитоплазму через №+-АТР-синтазу, образующую АТР из ADP и фосфата
Глава 13. Утилизация Л|1КгГ, образуемой первичными Ацн+-генераторами 261
При таких метаногенных процессах, как:
СН3СООН СН4 + СО2, (13.3)
СО2 + 4Н2 -» СН4 + 2Н2О, (13.4)
Н2СО + ЗН2 -> СН4 + 2Н2О. (13.5)
Na^-транспортирующий метилтрансферазный комплекс функционирует в
качестве генератора натриевого потенциала, однако при диспропорциони-
ровании молекул метанола в метан и углекислый газ:
4СН3ОН ЗСН4 + СО2 + 2Н2О (13.6)
тот же фермент катализирует обратную реакцию и выступает в качестве по-
требителя ApNa+.
№+-транспортирующая формилметанофурандегидрогеназа функцио-
нирует в качестве генератора натриевого потенциала при превращениях
формиата или метанола в метан и углекислый газ:
4НСООН -> СН4 + ЗСО2 + 2Н2О, (13.7)
4СН3ОН ЗСН4 + СО2 + 2Н2О. (13.8)
Однако при восстановлении углекислого газа до метана молекулярным
водородом:
СО2 + 4Н2 СН4 + 2Н2О (13.9)
этот фермент является уже потребителем ApNa+.
Важно отметить, что в тех метаногенных процессах, где один из двух
натрий-зависимых ферментов выступает в роли потребителя натриевого по-
тенциала, второй натрий-транспортируюший фермент обязательно являет-
ся натриевой помпой и, таким образом, обеспечивает генерацию ApNa+ для
совершения химической работы.
ГЛАВА ЧЕТЫРНАДЦАТАЯ
СООТНОШЕНИЕ ПРОТОННОГО И НАТРИЕВЫХ
МИРОВ
14.1. Как часто используется Ыа+-цикл
живыми клетками?
Рисунок 14.1 иллюстрирует тот факт, что ДЦН+ обычного направления может
эффективно использоваться только при кислых или нейтральных значениях
pH внешней среды.
В этих условиях откачка протонов из цитоплазмы поддерживает AH'
и АрН «правильного» знака, т.е. благоприятного для входа Н+ обратно в
клетку.
При щелочных значениях pH тот же процесс генерирует «правильную»
АТ на фоне обратной АрН. Концентрация ионов Н+ в клетке алкалофилов
должна поддерживаться на более высоком уровне, чем снаружи, чтобы из-
бежать щелочной инактивации внутриклеточных ферментов. В результате
ион Н+, откачанный из цитоплазмы, не может произвести полезной ра-
боты, так как, возвращаясь назад в клетку, он движется по AH', но против
АрН. Замена сопрягающего иона (Н+ на Na+) может решить проблему, как
это оказалось в случае Vibrio alginolyticus. Другие алкалотолерантные и алка-
лофильные бактерии также, по-видимому, могут энергизовать цитоплазма-
тическую мембрану без участия протонного потенциала.
Мутант Enterococcus hirae. лишенный Н+-АТРазы, а также дикий штамм
того же микроба, выращенный в присутствии протонофора, могут служить
примерами, когда развитие натриевой энергетики не связано с жизнью в
щелочной среде (см. разд. 12.5.1). Это же имеет место у некоторых анаэро-
бов, а также у Salmonella typhimurium, использующих Ма+-транспортирующие
декарбоксилазы. Например, Propionigenium modestum растет при pH 6,5—8,4 с
оптимумом между 7,1 и 7,7.
Интересно, что отдельные компоненты №+-цикла можно найти у тако-
го нейтрофила, как Е. coli, которая накапливает определенные метаболиты
в симпорте с Na+. Этот способ совершения осмотической работы является
основным для многих морских и галофильных бактерий, а также для внеш-
ней мембраны животных клеток (см. разд. 13.1). Здесь также очевидно, что
использование натриевой энергетики обусловлено причинами иными, чем
приспособление к щелочным условиям среды.
Глава 14. Соотношение протонного и натриевых миров
263
Энергия
Ацидофилы
ЛЙн+ =-zApH
Энергия
Нейтрофилы
АЙН+ =A'P-zApH
© Работа
Энергия
Рисунок 14.1. Роль дцн+ при различных значениях pH среды обитания бактерий: Дцн* может
эффективно использоваться ацидо- и нейтрофилами, но не алкалофилами, где электрический
потенциал и градиент Н+ направлены в противоположные стороны
Алкалофилы
дйн+ = О
14.2. Возможные эволюционные отношения между
протонным и натриевым мирами
Можно предположить, что эволюционно первичным сопрягающим ио-
ном был Н+. Нетрудно представить, как примитивная живая клетка могла
бы «изобрести» Дцн+-генератор, устроенный по типу редокс-петли Митчела.
Механизм редокс-петли предполагает, что некий акцептор атомов водоро-
да (например, хинон Q) восстанавливается донором электронов (например,
цитохромом Fe2+). Если такой процесс протекает вблизи одной из поверх-
264
ЧАСТЬ V. Натриевый мир
ностей мембраны (допустим, левой), ионы водорода должны поглощаться
из воды, омывающей эту поверхность:
Q + 2Fe2\eB + 2 Н+лев-> QH2+2Ре3+лев. (14.1)
Образованный QH2 диффундирует в сторону своей меньшей концентра-
ции к противоположной стороне мембраны и там окисляется акцептором
электронов, например другим цитохромом Fe3+. В результате ионы водорода
высвобождаются в воду справа от мембраны:
QH2 + Fe3+npaB Q + 2Fe2+npaB + 2Н+прав. (14.2)
Эти две реакции и диффузия QH2 образуют «полупетлю», переносящую
атомы водорода. Другая «полупетля» представляет собой перенос электро-
нов через мембрану, направленный справа налево (см. также рис. 4.8).
Тот факт, что редокс-петля образует разность электрохимических по-
тенциалов ионов водорода, есть прямое и неизбежное следствие химизма
окислительной реакции, поставляющей энергию. Схема редокс-петли бы-
ла однозначно доказана для фотосинтетических редокс-центров пурпурных
бактерий, а также для фотосистем I и II хлоропластов и цианобактерий
(см. главу 2). Редокс-циклы, включенные в механизмы генерации ДЦН+ ды-
хательной цепью, можно рассматривать как усложненный вариант редокс-
петли.
В то же время существуют ДЦн+-генераторы, использующие энергию без
участия системы Н+/ё-антипорта. Таковы, в частности, трансгидрогеназа
(см. разд. 7.4) и бактериородопсин (см. главу 6). В этих случаях поставляю-
щий энергию процесс сопряжен с генерацией ДЦН+ не прямо, как в редокс-
петле, а каким-то иным, более изощренным способом (см. также рис. 4.8).
Системы такого типа уже не предполагают с неизбежностью участие Н+ в
качестве сопрягающего иона. Поэтому неудивительно, что непрямые ме-
ханизмы сопряжения используются для транспорта и других ионов. Так,
бактериородопсин переносит Н+, а близкий к нему по пространственной и
первичной структуре галородопсин транспортирует СГ (см. разд. 6.5.1).
Генераторы натриевого потенциала с очевидностью попадают в разряд
непрямых преобразователей энергии и потому могут рассматриваться как
эволюционно более поздние изобретения природы,
В тех случаях, когда поглощение и выделение ионов Н+ уже не есть
следствие химизма процесса, замена Н+ на Na+ имеет известные преимуще-
ства.
1. Как уже указывалось, это сообщает клетке устойчивость к средам с
низкой [Н+].
2. Проводимость липидной мембраны для Н+ по крайней мере в 106 раз выше,
чем для Na+. Эта величина окажется еще большей, если липидный бислой
содержит включения белков, располагающих протон-акцепторными груп-
пами, которые могут облегчить эстафетный механизм Непроводимости.
В то же время [Н+] в среде обычно в ~106 раз ниже, чем [Na+]. Соотношение
этих двух параметров может приводить к тому, что клетка легче удерживает
градиент Na+, чем Н+. По-видимому, названное соотношение становится
неблагоприятным для №+-энергетики только у экстремальных галофилов,
Глава 14. Соотношение протонного и натриевых миров
265
живущих в насыщенном растворе NaCl. Возможно, именно по этой причи-
не они используют Н+, а не Na+ в качестве первичного сопрягающего иона,
несмотря на высокую [Na+] нар.
3. Последний и, может быть, самый важный момент состоит в том,
что внутриклеточные ферменты гораздо чувствительней к изменению кон-
центрации Н+, чем Na+, особенно если снижение [Na+]BHyT компенсируется
повышением [К+]внут. Поэтому клетка, откачивающая из цитоплазмы Na+,
выглядит биологически более совершенной, чем та, которая откачивает Н+.
В такой клетке рНвнут становится независимым от скорости мембранных
процессов преобразования энергии, и, в свою очередь, эти процессы пере-
стают контролироваться цитоплазматическим pH.
Следуя подобной логике, можно понять, почему такая эволюционно
молодая мембрана наиболее прогрессивного царства живых существ, как
плазмалемма животной клетки, использует Na+ в качестве сопрягающего
иона.
Как уже отмечалось, слишком высокая [Na+]Hap может оказаться не-
благоприятной для натриевой энергетики. Однако [Na+]Hap не должна быть
и слишком низкой, иначе не удастся создать Na1-градиент нужного на-
правления, т.е. [Na+]BHyT < [Na+]Hap. Это требование выполняется как для
клеток животных, так и для микроорганизмов, за исключением пресновод-
ных (V. alginolyticus и Р. modestum, служащие наиболее яркими примерами
натриевой энергетики, найдены в море).
Чтобы выявить таксономические связи между живыми существами, ис-
пользующими Н+ или Na+ в качестве сопрягающих ионов, был проведен
поиск генов, кодирующих Н+ и №+-зависимыс ферменты, среди большого
числа прочитанных на сегодняшний день бактериальных геномов. Широ-
кое распределение видов, использующих ДцКа+, среди разнообразных так-
сономических групп указывает, что №+-цикл был «открыт» бактериями
достаточно давно. Б. Розен даже предположил, что натриевая энергетика
появилась до протонной, которая пришла на смену №+-циклу, когда бак-
терии поднялись из моря в реки, т.е. перешли из соленой воды в пре-
сную, характеризующуюся низкой [Na+]. Эту гипотезу (ее недавно поддер-
жал А. Мулкиджанян) трудно исключить, как и многие другие построения
эволюционистов. Однако соображения, изложенные в начале настоящего
раздела, делают, как нам кажется, более вероятной альтернативную точку
зрения: первичным сопрягающим ионов был Н\
Если принять, что сначала возникла протонная энергетика, можно
представить возможный путь становления натриевого цикла. Первым эта-
пом могло быть использование градиентов Na+ и К+ как Дцн+-буферов
(см. разд. 13.1). Следующей стадией эволюции стало, по-видимому, пря-
мое использование ДцКа+, образованной совместным действием Дцн+-ге-
нератора и №+/Н+-антипортсра, для совершения осмотической работы
(Ка+,метаболит)-симпортерами. Создание №+-цикла завершилось с появ-
лением первичных ДцКа+-генераторов, не требующих Дцн+ для образования
натриевого потенциала.
266
ЧАСТЬ V. Натриевый мир
Большинство этих событий произошло, вероятно, на достаточно ран-
них этапах эволюции жизни, так что теперь отдельные компоненты Na+-
цикла обнаруживаются в самых различных таксонах: Vibrio, Propionigenum,
Salmonella, Clostridium, Streptococcus, в метанобразующих археях и, наконец,
в животных клетках. Возможно, даже «классическая» Е. coli имеет пред-
ставителей натриевого мира среди своих далеких предков, иначе трудно
понять, почему эта бактерия накапливает некоторые метаболиты за счет
14.3. Превращение энергии в биомембранах
без участия Н+ и Na+
Рассматривая соотношение протонного и натриевого миров, уместно
задаться вопросом, нет ли и еще одного (третьего) мира, где ни Н+, ни Na+
не участвуют в энергетическом сопряжении. Сегодня ответ на этот вопрос
однозначен и отрицателен.
Сказанное не означает, что среди всего многообразия процессов пре-
вращения энергии в мембранах нельзя найти такие, которые обходятся без
Н+ и Na+. Однако все это исключительные случаи, не складывающиеся в
единую энергетическую систему, подобную протонной или натриевой энер-
гетике.
Рассмотрим, например, биоэнергетические функции ионов К\ Как уже
отмечалось в разделе 11.3.1, у бактерий АрК может возникать за счет А^-
составляющей протонного (или натриевого) потенциала, образуемого ДЦН+
(ДЦКа+)-генераторами. Если Е. coli растет в среде с очень низким содержа-
нием К+, то индуцируется К+-АТРаза ЕхЕ2-типа (система Kdp), аккумули-
рующая в клетке ионы К+ за счет энергий АТР. Функции образуемой АрК
ограничены стабилизацией AH', внутреннего pH и осмотического давления.
В животных тканях К+-градиент, как правило, образуется Na+/K+-
АТРазой. Роль К+ в этом случае сводится к функции противоиона для Na+,
который откачивается из клетки с целью образования ДЦКа+ — конвертируе-
мой «валюты» внешней мембраны животной клетки.
В разделе 7.2.3.2 была рассмотрена К+/Н+-АТРаза эпителия слизистой
желудка высших животных. Здесь К+ служит противоионом для Н+, отка-
чиваемого из клетки для подкисления желудочного сока.
В эпителии некоторых насекомых электрогенная К+-АТРаза катализи-
рует транспорт массовых количеств К+ от базальной к апикальной стороне
эпителиальной клетки. Этот процесс важен для движения жидкости через
эпителий. К+-АТРаза насекомых, в отличие от Na+/K+-ATPa3bi и К+/Н+-
АТРазы, откачивает К+ из клетки. Она локализована в апикальной области
плазматической мембраны. К+-АТРаза образует грибовидные выросты раз-
мером около 10 нм, внешне напоминающие фактор F{. Ее активность устой-
чива к оуабаину и специфически тормозится инсектицидом 5-эндотоксином
из Bacillus thuringiensis.
Глава 13. Утилизация A|iNa+, образуемой первичными Дцн+-генераторами 267
В эпителии кишечника одного из червей К+-АТРаза откачивает К+ из
клетки, создавая Д% которая используется для удаления ионов Н+ из про-
света кишечника. В результате pH в кишечнике поддерживается на уровне
10—11. ДЦК+ или одна из ее составляющих, по-видимому, служит движу-
щей силой аккумуляции аминокислот в клетках эпителия посредством (К+,
аминокислота)-симпортера.
В мембране эндоплазматического ретикулума и внешней клеточной
мембране животных (а также в цитоплазматической мембране бактерий)
имеется Са2*-АТРаза ЕхЕ2-типа, которая переносит Са2+ из цитозоля в про-
свет ретикулума или в межклеточное пространство. Нет прямых свидетельств
тому, что образуемая ДЦса2’ может использоваться для совершения полезной
работы. По всей вероятности, единственной функцией Са2+-АТРазы служит
регуляция [Са2+] в цитозоле.
Известно несколько примеров транспорта анионов, независимого от
ДЦН+ и AjLLNa+. В разделе 6.5.1 был рассмотрен один из них — галородопсин,
транспортирующий ионы СГ в клетки Н. salinarium за счет энергии света.
Эта помпа возвращает в клетку ионы СГ, которые постоянно ею теряются
электрофоретически, перемещаясь через мембрану в направлении изнутри
наружу. У моллюска Aplysia californica подобная функция выполняется СГ-
АТРазой, локализованной во внешней клеточной мембране. Фермент чув-
ствителен к ванадату.
Солончаковое растение Limonium vulgaris выделяет соль на поверхность
листьев посредством особой железы, состоящей из клеток, во внешней мем-
бране которых обнаружена СГ-АТРаза. Предполагают, что этот фермент
электрогенно откачивают ионы С Г из клетки, а образуемая Д'? (внутри
клетки знак «+») используется для электрофоретического переноса ионов
Na+ вслед за С Г.
Некоторые вещества аккумулируются бактериями за счет энергии АТР
или фосфоенолпирувата. Наиболее разработанным примером такого рода
является фосфоенолпируваттрансферазная система, катализирующая одно-
временно два процесса — фосфорилирование глюкозы фосфоенолпирува-
том и аккумуляцию этого сахара в виде глюкозо-6-фосфата некоторыми
бактериями. При этом разность в величинах свободной энергии фосфо-
енолпирувата и глюкозо-6-фосфата используется для создания большого
градиента сахара между клеткой и средой.
В заключение следует подчеркнуть, что все перечисленные выше си-
стемы представляют собой особые механизмы, совершающие осмотическую
работу. Огромное большинство процессов концентрирования веществ под-
держивается энергией ДЦН+ или ДЦКа+. Что же касается мембранной работы
химического и механического типов, то здесь во всех без исключения опи-
санных случаях движущей силой служит либо протонный или натриевый
потенциал, либо АТР.
Часть шестая
ОПЫТ ПРАКТИЧЕСКОГО ПРИМЕНЕНИЯ
БИОЭНЕРГЕТИКИ: АКТИВНЫЕ ФОРМЫ
кислорода и возможные пути
ОТМЕНЫ ПРОГРАММЫ СТАРЕНИЯ
ОРГАНИЗМА
И терпентин на что-нибудь полезен.
Козьма Прутков
В этой части нашей книги мы предпримем попытку применить изложенные
выше сведения об энергетике биологических мембран к решению в общем-
то прикладной проблемы. Однако это один из тех практических вопросов,
которые имеют общечеловеческое значение и потому перестают быть просто
прикладными. Речь пойдет о возможности отмены старения людей.
Вот основные пункты нашей концепции.
1) Старение живых организмов — последний этап реализации програм-
мы онтогенетического развития.
2) Старение — один из механизмов, ускоряющих биологическую эволю-
цию. Небольшие благоприятные признаки, не существенные для сильного
молодого организма, могут оказываться жизненно важными (и потому стать
объектом естественного отбора) у организмов, ослабленных старением.
3) Человек давно уже не полагается на черепаший темп своей эволю-
ции. Он не приспосабливается к окружающей среде, а сам приспосабливает
ее для своих целей. Поэтому применительно к человеку старение (как лю-
бой другой механизм эволюции) есть атавизм, который надо попытаться
отменить ввиду его очевидной вредности для нашего организма.
4) Увеличение уровня активных форм кислорода (АФК) внутри мито-
хондрий есть один из необходимых этапов на пути реализации программы
старения. АФК вызывают запрограммированную смерть клеток, которых в
результате с возрастом становится все меньше и меньше в жизненно важ-
ных органах и тканях. Это ведет к ослаблению отдельных функций организ-
ма и, как следствие, к старческим болезням и смерти.
5) Программу старения можно прервать, почистив от избытка АФК «са-
мое грязное место в клетке» — внутренность митохондрий. Для достижения
такого эффекта следует нагрузить митохондрии катионными производными
антиоксидантов многократного действия, свободно проникающими через
митохондриальную мембрану и потому электрофоретически накапливаю-
щимися внутри митохондрий, заряженных отрицательно. Такими антиок-
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 269
сидантами могут быть вещества, составленные из природных хинонов и
«молекул-электровозов» — синтетических катионов, заряд которых сильно
делокализован по их гидрофобной молекуле.
До недавнего времени уже самый первый пункт концепции, изложен-
ной выше, представлялся абсолютно диссидентским подавляющему боль-
шинству геронтологов. Однако в последние несколько лет ситуация начала
быстро меняться, так что в конце 2005 г. нам даже удалось опубликовать
в таком престижном и респектабельном журнале, как Nature, статью под
названием «Запрограммированное альтруистическое старение»*. В том же
году мы начали обширный инвестиционный проект по практическому ис-
пользованию проникающих катионных антиоксидантов, финансировав-
шийся О.В. Дерипаской. «Сверхзадачей» проекта была заявлена попытка
отменить программу старения.
ГЛАВА ПЯТНАДЦАТАЯ
ПРЕДПОСЫЛКИ ПРОЕКТА
ПО АНТИОКСИДАНТАМ,
АДРЕСОВАННЫМ В МИТОХОНДРИИ
15.1. Природа АФК и пути их образования в клетке
Почти весь кислород, поглощаемый живыми организмами, превращается в
такое безобидное вещество, как вода. Это происходит в результате реакции
молекулы О2 с 4ё и 4Н+. Однако небольшая доля поглощенного О2, обычно
не превышающая 1—2%, дает вместо воды анион супероксида (одноэлек-
тронное восстановление О2 до радикала О^-) или Н2О2 (двухэлектронное
восстановление О2). Этот, казалось бы, незначительный в общем балансе
дыхания процесс играет важнейшую роль в регуляции физиологических
функций организма и даже его судьбе. Дело в том, что анион супероксида
и Н2О2 могут превращаться в АФК, а именно в радикалы пергидроксила
(НО2’) или ОН*, а также пероксинитрит (ONOO), способный давать *ONOO,
синглетный кислород (’О2) или все тот же ОН* (рис. 15.1). В свою очередь
АФК атакуют самые различные компоненты клетки, включая ДНК, РНК,
белки и липиды. Некоторые из АФК настолько агрессивны как окислители,
что даже небольшой их доли в общем потреблении кислорода хватает для
проявления вредоносного действия, последствия которого могут оказаться
* Longo V.D., Mitteldorf J., Skulachev V.P. Programmed and altruistic ageing // Nature
Review Genetics. 2005. № 6. P. 866—872.
270 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
ЧЕТЫРЕХЭЛЕКТРОННОЕ ВОССТАНОВЛЕНИЕ
КИСЛОРОДА ДО ВОДЫ
О2 + 4ё + 4Н+—► 2Н2О
ВОССТАНОВЛЕНИЕ
КИСЛОРОДА С ОБРАЗОВАНИЕМ
АКТИВНЫХ ФОРМ КИСЛОРОДА (АФК)
01400“
анион
пероксинитрита
е е е
о2—о- —оГ—орт- о’
анион анион анион
супероксида пероксида оксена
но; н2о2
радикал
пергидроксила
Н2О НО'
радикал
гидроксила
Рисунок 15.1. Пути восстановления кис-
лорода в организме. Четырехэлектронное
восстановление О2 до Н2О происходит в
мембранах митохондрий или бактерий и
обычно сопряжено с переносом внутри-
митохондриальных (внутрибактериальных)
ионов Н+ наружу митохондрии (бактерии).
Одноэлектронное восстановление О2 дает
анион супероксида, который при кислых
pH протонируется, а при нейтральных вос-
станавливается до О22-(в реакции дисму-
тации 2О2 О22- + О2) или соединяется
с NO", давая анион пероксинитрита. О22-
протонируется в Н2О2 или восстанавлива-
ется до О23-, который затем превращается
в Н2О и радикал ОН*
трагическими для митохондрии, клетки и даже для организма в целом.
Ведь если 1% от тех 400 л О2, которые поглощает в день взрослый человек
среднего веса, пойдут на образование не воды, а АФК, то это будет означать
продукцию 4 л супероксида в день. Нетрудно представить себе последствия,
если учесть, что такой продукт дальнейшего превращения супероксида, как
радикал гидроксила, может соперничать по токсичности с «хлоркой», при-
меняемой при дезинфекции.
Первоначально считалось, что образование АФК — неизбежная «рас-
плата» за аэробный образ жизни, поскольку мелкие, незаряженные и до-
вольно гидрофобные молекулы О2, свободно проникающие через мембраны
и даже накапливающиеся в них, чисто химически (неферментативно) могут
окислять редокс-группы белков, способные к одноэлектронному восстанов-
лению кислорода. К таким группам относят полувосстановленные (семихи-
нонные) формы убихинона, пластохинона, менахинона, флавинов, а также
[Fe—SJ-кластеры негемовых железопротеидов с редокс-потенциалами, близ-
кими к таковому пары супероксид / кислород*. Однако многочисленные
публикации последних лет убедительно свидетельствуют о том, что если да-
же АФК и служат побочными продуктами метаболизма, то тем не менее их
образование и уборка тщательно контролируются организмом. В результате
концентрация АФК в организме может варьировать на порядки в результате
действия специальных регулирующих систем.
* Стандартный потенциал пары О2 /О2 около —0,3 В. Реальный потенциал хотя и
несколько положительнее из-за превышения [О2] над [О2 ], все еще располагается в от-
рицательной области шкалы редокс-потенциалов.
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 271
В случае наиболее мощных генераторов АФК, таких, как комплексы I и
III (а также комплекс II, дегидрогеназы дигидролипоата и цитохрома Р450),
образование О* выглядит как «преждевременная утечка» электронов, кото-
рые вместо переноса по дыхательной цепи (или применительно к цитохро-
му Р450 — участия в оксигенации субстрата) захватываются кислородом в
процессе его одноэлектронного восстановления. Ввиду колоссальных объ-
емов кислорода, поглощаемых дыхательной цепью, даже очень небольшая
их «утечка» должна привести к образованию таких количеств АФК, которые
значительно больше тех, что генерируются ферментами, специализирован-
ными на восстановлении О2 до О* или Н2О2, т.е. моноаминооксидазой
внешней митохондриальной мембраны, NAD PH-оксидазой плазмалеммы,
оксидазами пероксисом, ксантиноксидазой и некоторыми другими фер-
ментными системами (табл. 15.1). Большему вкладу дыхательной цепи в
общую генерацию АФК организмом соответствует и значительное количе-
ственное преобладание ферментов этой цепи над другими оксидазами и
оксигеназами. Ферменты дыхательной цепи — один из основных компо-
нентов внутренней мембраны митохондрий, общая площадь которой в ор-
ганизме человека равна примерно 14 тыс. м2. Прямые измерения распре-
деления АФК в разных участках живой клетки показали, что, например,
вспышка образования АФК при самоубийстве дрожжевой клетки первона-
чально происходит в ее митохондриях (см. ниже рис. 15.9Л).
15.2. Как живые системы защищаются от АФК?
15.2.1. Вещества-антиоксиданты
Традиционно в качестве защиты от АФК рассматривают прежде все-
го вещества-антиоксиданты, убирающие ядовитые формы кислорода. Ре-
зультат взаимодействия АФК и антиоксидантов состоит в том, что АФК
инактивируются, а антиоксиданты, как правило, портятся, теряя свои за-
щитные свойства. Антиоксидант гибнет, как бы прикрывая собой другие,
более важные биомолекулы, такие, как ДНК, РНК, белки, фосфолипиды и
т.п. Иногда возможна регенерация окисленного антиоксиданта в исходную
активную форму.
Антиоксиданты принято делить на водорастворимые, действующие
в гидрофильных областях клетки (аскорбиновая кислота, SH-глутатион,
цистеин и др.), и жирорастворимые, призванные защищать мембранные
структуры (CoQ, пластохинон, витамины A, D, Е и К). Например, CoQH2
может восстанавливать свободнорадикальные формы липидов, окисляясь в
CoQ*-. Полученный CoQ*- регенерирует в исходный CoQH2, восстанавли-
ваясь комплексом I, II или III.
15.2.2. Снижение внутриклеточной концентрации кислорода
В последнее время все больше внимания уделяется биологическим ме-
ханизмам защиты от АФК, снижающим продукцию активных форм кисло-
рода в клетке, а не убирающим уже образовавшиеся АФК.
272 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
Таблица 15.1. Генераторы АФК в живой клетке
Фермент Тип АФК Чем является образование АФК? Предполагаемый вклад в общую продукцию АФК организмом Локализация
Комплекс I °7 Результатом утечки ~ё на О2 Наибольший Внутренняя часть вну- тренней мембраны мито- хондрий
Комплекс III о;- « Довольно большой Внешняя часть внутрен- ней мембраны митохон- дрий
Комплекс II о;- « Малый Внутренняя часть вну- тренней мембраны мито- хондрий
Дегидрогеназа дигидролипоата °7 « « Матрикс митохондрий
Цитохром Р450 °7 « « Эндоплазматический ретикулум печени, внутренняя мембрана митохондрий печени и коры надпочечника
NADPH- оксидаза 07 Одним из основных про- дуктов реак- ции « Внешняя мембрана клетки
Моноаминок- сидаза Н2О2 « « Внешняя мембрана ми- тохондрии
Оксидазы мо- чевой кислоты, D- и L-амино- кислот Н2О2 « « Пероксисома
Ксантинокси- даза °7- Н2О2 « « Молоко; цитозоль клетки
Все аэробные организмы располагают глубокоэшелонированной систе-
мой защиты от АФК путем предотвращения самой их генерации. Простей-
шим приемом служит снижение внутриклеточной концентрации кислорода.
Дело в том, что цитохромоксидаза и другие терминальные оксидазы, вос-
станавливающие О2 до Н2О, сохраняют максимальную активность вплоть
до концентрации кислорода, составляющей всего несколько процентов от
той, которая имеется в воде при нормальном давлении кислорода в воздухе.
В то же время скорость восстановления О2 до О* в митохондриях линейно
зависит от [О2] во всем диапазоне концентраций кислорода. Вот почему
снижение в 10—20 раз уровня [О2] внутри клетки ведет к резкому тормо-
жение продукции О*- без существенного торможения цитохромоксидазной
реакции, а значит, и без уменьшения скорости дыхания и сопряженного
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 273
Рисунок 15.2. Ферментативное (четырехэлектрон-
ное) и неферментативное (одноэлектронное)
восстановление О2 как функция от концентра-
ции кислорода [О2]. Концентрация О2, обеспе-
чивающая полумаксимальную скорость фермен-
тативного восстановления (О2 -» Н2О), считается
равной Зх 10-7М. Принято также, что скорость
неферментативного восстановления (О2 -> О* )
линейно повышается с ростом концентрации О2.
Скорость поглощения О2 при уровне О2, соот-
ветствующем атмосферному давлению кислоро-
да (0,22 мМ), взята за 100%. При этом следует
помнить, что абсолютная скорость поглощения
О2, принятая за 100% для реакции О2 Н2О,
обычно по крайней мере на два порядка больше,
чем для реакции О2 О2 [Skulachev, Quart. Rev.
Biophys., 1996, 29: 169-202]
с ним синтеза АТР. И действительно, измерения [О2] в тканях животных
показали, что эта величина примерно на порядок ниже, чем в воде, насы-
щенной воздухом, т.е. лежит в области В на рис. 15.2. Эта область выгодно
отличается как от области А (где [О2] слишком мала для поддержания вы-
сокой скорости цитохромоксидазной реакции), так и от области С (где по-
вышение [О2] приводит к развязыванию одноэлектронного восстановления
кислорода без какого-либо выигрыша для цитохромоксидазы).
В любой ткани, кроме легких, [О2] поддерживается на уровне суще-
ственно более низком, чем в равновесии с воздухом, только потому, что в
покое скорость доставки О2 от легких к другим органам специально удер-
живается в области значений, весьма далеких от максимально возможных.
Эта скорость резко возрастает при переходе от покоя к интенсивной работе.
Улучшается вентиляция легких, усиливается работа сердца, растет скорость
кровотока, расширяются кровеносные сосуды. Параллельно повышается
потребление кислорода цитохромоксидазой из-за появления свободного
ADP (см. выше, разд. 7.1). Но и в новых условиях соотношение скоростей
потребления кислорода в тканях и его доставки оказываются отрегулиро-
ванными таким образом, что [О2] в клетках не увеличивается выше 10%
от насыщения на воздухе. При этом организм отслеживает концентрацию
АФК в крови с помощью особых сенсоров, которые вызывают сужение со-
судов в ответ на рост [О^-].
Стратегия, описанная выше, невозможна для одноклеточных. Так, даже
азотобактер, имеющий рекордную среди живых существ скорость дыхания
(см. разд. 5.2.4), не в состоянии, как показал наш расчет, существенно пони-
зить внутриклеточную [О2] из-за слишком короткой дистанции между цито-
золем бактериальной клетки и средой: поглощение О2 цитохромоксидазой
тотчас компенсируется потоком О2 извне. Здесь на помощь приходит по-
лисахаридная «шуба», окружающая клетку азотобактера. «Шуба» исключает
конвекцию жидкости, омывающей непосредственно бактериальную стенку,
что резко замедляет движение О2 из среды к бактерии. Проблема защиты
от кислорода стоит для азотобактера особенно остро в средах, не содержа-
274 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
щих солей аммония. В этом случае азотобактеру, чтобы выжить, приходится
восстанавливать молекулярный азот до аммиака, чем занимается специ-
альный фермент — нитрогеназа. Последняя чрезвычайно чувствительна
к О2, даже следы которого ее быстро инактивируют. Неудивительно, что
именно в условиях фиксации N2 азотобактер включает особую упрощенную
дыхательную цепь, поглощающую кислород гораздо быстрее, чем делает
это «каноническая» цепь, составленная из комплексов I, III и IV. Простая
цепь, получившая название цепи дыхательной защиты, состоит всего из двух
ферментов: 1) несопряженной NADH-дегидрогеназы II с ее единственным
редокс-центром (FAD), которая восстанавливает CoQ посредством NADH,
и 2) b d-хинол оксидазы, окисляющей полученный CoQH2 кислородом. Эта
вторая реакция генерирует Арн+ с эффективностью Н+/ё = 1, т.е. вдвое
меньшей, чем у комплекса IV (см. разд. 5.2.4). В итоге цепь дыхательной
защиты транспортирует всего 2Н+ на каждую молекулу окисляемого NADH
вместо 10Н+ в случае «канонической» цепи. Следовательно, азотобактеру в
условиях дыхательной защиты приходится окислять в 5 раз больше NADH,
чтобы получить столько же АТР, сколько синтезирует обычная дыхательная
цепь (см. рис. 5.6).
Иной путь защиты от кислорода из-
брала бактерия Е. coli. Как было пока-
зано в нашей лаборатории Е.О. Будре-
не, эти бактерии в ответ на появление
в среде Н2О2 собираются в кластеры,
каждый из которых состоит из тысяч от-
дельных клеток. Сигналом к движению
бактерий навстречу друг другу служит
градиент аттрактанта — аспарагиновой
кислоты, которую они начинают выде-
лять в среду при добавлении перекиси
водорода. В результате на чашке с по-
лужидким агаром образуется множество
скоплений (кластеров) бактериальных
клеток, каждое из которых состоит из
большого количества отдельных бакте-
рий. Кластеры могут образовывать пра-
вильные структуры различной формы
(рис. 15.3), по-видимому отражающие
неравномерное распределение аспартата
в агаре. Можно полагать, что внешние
слои бактерий в кластере поглощают
кислород, тем самым понижая его кон-
центрацию в глубинных слоях кластера.
В результате бактерии во внешних сло-
ях жертвуют собой, прикрывая тех, кто
оказался внутри кластера.
В известном смысле аналогичная
стратегия применяется в очень крупных
Рисунок 15.3. Кластеры, образованные
скоплениями клеток Е. coli на чашках Пе-
три с полужидким агаром. Каждая светлая
точка — кластер, состоящий из множества
бактерий (по Е.О. Будрене)
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 275
мышечных клетках. Здесь митохондрии скапливаются непосредственно под
внешней клеточной мембраной (сарколеммой). От этих скоплений вглубь
клетки уходят длинные митохондриальные тяжи, связывающие субсарко-
леммальные митохондрии с межфибриллярными, локализованными внутри
мышечного волокна, т.е. между пучками актомиозиновых нитей. Предпо-
лагается, что кислород, поступающий в мышечную клетку, потребляется
субсарколеммальнымимитохондриями, дыхательная цепь которых образует
Ацн+. Образованная Ацн+ передается затем по митохондриальным тяжам к
межфибриллярным митохондриям, которые делают АТР за счет энергии,
поступающей туда в виде Ацн+ (см. рис. 11.7).
15.2.3. Уменьшение генерации АФК дыхательной цепью
Мягкое разобщение служит, по-видимому, одним из механизмов, сни-
жающих продукцию АФК комплексами I и III. Как было показано в нашей
лаборатории А. А. Старковым и соавторами, генерация перекиси водорода
изолированными митохондриями сердца, окисляющими сукцинат, очень
сильно зависит от величины разности электрических потенциалов (Д'?)
на митохондриальной мембране (рис. 15.4). В тех же опытах было уста-
новлено, что ингибитор комплекса I ротенон тормозит образование Н2О2
на 80%, ингибитор комплекса III миксотиазол — на 15%, а разобщитель-
Рисунок 15.4. Пороговая зависимость образования перекиси водорода окисляющими сукцинат
митохондриями от величины мембранного потенциала (Д'Р). Мембранный потенциал снижали:
1) разобщителем SF6847, стимулирующим дыхание путем повышения Непроводимости мито-
хондриальной мембраны (черные квадраты); 2) малонатом, тормозящим поступление электро-
нов в дыхательную цепь (красные квадраты), или 3) аденозиндифосфатом, стимулирующим
дыхание посредством включения механизма синтеза АТР (зеленый треугольник) [Korshunov et
al., FEBS Lett., 1997, 416: 15-18]
276 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
сукцинат
Рисунок 15.5. Два места образо-
вания АФК в дыхательной цепи
митохондрий
протонофор — на 95%. Эти результаты по-
зволили заключить, что 80% Н2О2 образуется
путем энергозависимого обратного перено-
са электронов комплексом I от сукцината
(редокс-потенциал пары фумарат / сукци-
нат +0,03 В) к О2 (редокс-потенциал пары
О2/ О*~ -0,3 В). Еще 15% от общего количе-
ства перекиси водорода возникает в Q-цикле
при реакции семихинонной формы убихи-
нона (CoQ*-) с О2 в условиях дыхательно-
го контроля, когда высокая АТ блокирует
перенос электронов от гема bL к гему Лн и
тем самым предотвращает окисление CoQ*-
посредством гема bL (см. разд. 4.3).
Как тот, так и другой механизмы, со-
гласно рис. 15.5, выключались, если АТ не-
сколько снижалась разобщителем, ингиби-
тором сукцинатдегидрогеназы малонатом
или включением процесса окислительного
фосфорилирования добавкой ADP. Есть
основания полагать, что такого рода снижение AT in vivo может быть вы-
звано небольшим («мягким») разобщением дыхания и фосфорилирования
жирными кислотами. Такое разобщение может опосредоваться ATP/ADP-
антипортером, аспартат / глутамат-антипортером а также некоторыми дру-
гими митохондриальными переносчиками анионов, транспортирующими
не только анионы своих специфических субстратов (нуклеотидов, амино-
кислот и т.д.), но и анионы жирных кислот (см. разд. 10.2.2).
Инактивация аконитазы супероксидом может быть следующей линией
обороны митохондрий от АФК. Показано, что супероксид вызывает окис-
ление одного из четырех ионов негемового железа, имеющихся в акони-
тазе — ферменте, катализирующем первую реакцию цикла Кребса. Такое
окисление ведет к потере этого иона и обратимо инактивирует фермент.
Неактивная аконитаза реактивируется, связывая ион Fe2+. Выключение
аконитазы супероксидом блокирует цикл Кребса в самом его начале. По-
скольку именно цикл Кребса служит главным поставщиком электронов при
дыхании, его блокада опустошает дыхательную цепь. Все ее электронные
переносчики переходят в окисленную форму и уже не могут восстанавли-
вать О2 ни до Н2О, ни до О^-. В итоге тормозится генерация О^-, первичного
предшественника митохондриальных АФК.
Торможение аконитазы имеет еще одно следствие: в клетке накаплива-
ется цитрат — субстрат этого фермента. Цитрат — трехзарядный анион, об-
разующий комплексы с Fe2+ и Fe3+. Комплекс цитрат3--Fe2+ способен к са-
моокислению посредством О2, превращаясь в еще более прочный комплекс
цитрат3--Ее3+. Поэтому в аэробных условиях накопление цитрата должно
способствовать уменьшению концентрации ионов Fe2+, которые служат
наилучшим донором электронов для восстановления иона пероксида (О22-),
завершающегося образованием радикала ОН* — наиболее опасной формы
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 277
Рисунок 15.6. Торможение аконитазы по-
средством АФК и некоторые последствия
этого события. Объяснения в тексте
Н2О
8 самоокисление 1 7 накопление
ионов Fe2+ цитрата
Мито-
хондрия
. 2 ингиби- з ингибирование 4
АФК—► рование —► —
аконитазы цикла Кребса
окисление
переносчиков
дыхательной
цепи
дестабил изация
митохондриальной
Митоптоз
АФК (см. выше, рис. 15.1). Таким образом, выключив аконитазу, митохон-
дрия достигает, во-первых, уменьшения образования О* и, стало быть, всех
АФК, служащих производными супероксида, и, во-вторых, торможения ге-
нерации ОН* (рис. 15.6).
15.2.4. Митоптоз
Митоптоз (или самоубийство митохондрий) под действием АФК —
последний эшелон защиты клетки от тех митохондрий, которые образуют
слишком много АФК.
Митоптоз, включаемый активными формами кислорода, может осу-
ществляться несколькими способами. Один из них — открытие пор во
внутренней митохондриальной мембране. Наиболее вероятный сценарий
278 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
этого события состоит в следующем. АФК окисляют обращенные в сто-
рону матрикса SH-группы ATP/ADP-антипортера (или какого-то другого
митохондриального переносчика анионов), что приводит к вскрытию того
участка антипортера, который образует барьер между обводненной «ворон-
кой» антипортера и противоположной поверхностью мембраны (см. выше
рис. 9.9—9.10). Так образуется довольно крупная пора, проницаемая для ве-
ществ с массой менее 1,5 кДа, что приводит к рассеянию Ацн+ и всех гради-
ентов низкомолекулярных компонентов между матриксом и межмембран-
ным пространством митохондрии. Такая митохондрия неизбежно «пойдет
ко дну», как корабль с открытыми кингстонами. Гибель митохондрии, от-
крывшей поры, будет вызвана не только выходом NAD+, NADP+ и других
кофакторов, необходимых для нормального функционирования органеллы,
но и из-за прекращения такого важнейшего репаративного процесса, как
замена старых, испорченных белков новыми, активными. Один из этапов
импорта белков-предшественников из цитозоля в митохондрию (а таких
белков насчитывается около шести сотен), как правило, осуществляется
электрофоретически: положительно заряженная «лидерная» последователь-
ность белка под действием АТ движется в сторону отрицательно заряжен-
ного матрикса). Этот процесс оказывается невозможным при открытых
порах, когда АТ равен нулю. Даже те 13—15 белков, которые кодируются
митохондриальной ДНК, не могут быть правильно уложены в мембране,
так как здесь также требуется АТ.
Еше одно следствие избыточной продукции АФК в митохондрии, — по
существу, гибельное для органеллы, — состоит в том, что АФК инактиви-
руют аконитазу, в норме связанную с митохондриальной ДНК. Инактива-
ция понижает сродство аконитазы к ДНК. В результате ДНК обнажается
и становится беззащитной к повреждающему действию АФК и других не-
благоприятных воздействий. Дело в том, что митохондрия лишена гисто-
нов, выполняющих защитную функцию применительно к ядерной ДНК, а
аконитаза, по данным Р. Бутова, служит одним из белков, выполняющих
функцию гистонов в митохондриях.
Следует подчеркнуть, что открытие пор и окисление аконитазы суть
прямые следствия повышения уровня АФК в митохондриях. Оба эти собы-
тия не требуют каких-либо внемитохондриальных факторов и осуществля-
ются теми АФК, которые образовались внутри данной митохондрии. Ска-
занное означает, что мы имеем здесь дело с самоубийством митохондрии,
не справившейся с задачей поддержания своих АФК на безопасном уровне.
Подобное явление, названное нами митоптозом, представляет собой ме-
ханизм очистки митохондриальной популяции от митохондрий, ставших
опасными для клетки из-за ускорения генерации (или замедления уборки)
активных форм кислорода. Появление таких аномальных органелл может
быть, например, следствием мутаций в митохондриальной ДНК.
«Трупы» погибших митохондрий обычно убираются посредством авто-
фагии. В этом процессе ключевую роль играют автофагосомы — органеллы,
окруженные, наподобие митохондрий, двумя мембранами, но их внутрен-
няя мембрана, в отличие от митохондриальной, не образует впячиваний
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 279
(крист). Автофагосомы могут быть специфичными к поглощаемым ими
органеллам. Различают митофагию (уборку митохондрий) и пероксифагию
(уборку пероксисом). Органеллы, попавшие внутрь автофагосомы, частич-
но перевариваются, после чего автофагосома сливается с лизосомой, где
процесс переваривания завершается*.
Митоптоз должен быть полезен для клетки, пока он представляет со-
бой «очистку стада от немногих паршивых овец». Хуже, если эпидемия су-
перпродукции АФК охватила всю митохондриальную популяцию клетки
или хотя бы большую ее часть. Тогда гибнущие митохондрии увлекают с
собой в небытие и саму клетку. Это происходит не только потому, что в
подавляющем большинстве типов нормальных клеток, в отличие от рако-
вых, гликолиз слишком слаб, чтобы эффективно заменить дыхание в каче-
стве источника энергии, а также не потому, что помимо выполнения чи-
сто энергетических функций митохондрии играют жизненно важную роль
в обмене веществ. Смерть клетки при массовой дисфункции митохондрий
наступит намного раньше, чем в ней кончится АТР или какие-то метабо-
литы, образуемые митохондриями. В этом случае мы имеем дело с частным
проявление действия особого биологического закона:
Живые организмы стремятся избежать спонтанных, нерегулируемых про-
цессов. Они делают все возможное, чтобы поставить все происходящие в них
события под контроль.
Наиболее драматичное среди этих событий — смерть. Поэтому неуди-
вительно, что клетка стремится контролировать собственную гибель, пред-
почитая покончить с собой еще до того, как нарушения ее структуры и
функций достигнут уровня, несовместимого с жизнью. Как говаривал один
из героев Мольера, незадачливый лекарь мсье Байс: «Лучше умереть по
всем правилам, чем выздороветь вопреки этим правилам».
Нетрудно представить, какие преимущества дает организму такая стра-
тегия. Агония клетки, гибнущей «не по правилам», могла бы нарушить ра-
боту клеток-соседей, а если речь идет, например, о клетках, вырабатываю-
щих какие-либо регуляторные факторы, то и всего организма. Последствия
могут быть еще более трагичными, если агонизировавшая клетка все-таки
выживет. В процессе агонии, вызванной, например, избытком АФК, клетка
вряд ли может гарантировать надежную защиту своей ДНК от АФК. В ре-
* Механизм митоптоза, описанный выше, является, по всей вероятности, не един-
ственным способом, каким клетки избавляются от «неправильных» митохондрий. Недав-
но Б.В. Черняком, К.Г. Лямзаевым и др. в нашей группе было обнаружено, что клетка
способна собирать такие митохондрии вблизи ядра, окружать мембраной и выбрасывать
полученное таким образом «митоптическое тельце», содержащее множество митохондрий,
во внеклеточное пространство. Такого рода эффект возникал при культивации раковых
клеток линии HeLa в присутствии разобщителя и ингибитора дыхательной цепи, т.е.
агентов, превращающих митохондрии из продуцентов АТР в потребители. Так раковые
клетки, располагающие мощным гликолизом, предотвращали расщепление митохондрия-
ми гликолитического АТР. Можно предположить, что созревание эритроцитов и клеток
хрусталика глаза, сопровождающееся исчезновением митохондрий, происходит способом,
описанным выше. Это объяснило бы, почему превращение эпителиальных клеток в клетки
хрусталика происходит даже тогда, когда выключена автофагия.
280 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
зультате выжившая клетка может оказаться безнадежным мутантом, опас-
ным для организма. Таковы, по-видимому, раковые клетки. Поэтому неслу-
чайно апоптоз как форма запрограммированной клеточной смерти служит
одним из основных барьеров на пути злокачественного перерождения.
15.2.5. Апоптоз
Запрограммированная смерть клетки и, в частности, апоптоз, вызван-
ный активными формами кислорода, в силу причин, изложенных выше,
может рассматриваться как следующая линия защиты от АФК.
Термин «апоптоз» заимствован у древнеримского ученого и врача Гале-
на. Гален обратил внимание на то, что сломанная ветка уходит в зиму, не
сбросив листья, которые жухнут, но не опадают. Поэтому листопад — это
активный процесс, а не гибель листьев от холода, как считалось до Галена.
У римлян научным языком был греческий, и свое наблюдение Гален опре-
делил как «апоптозис» (от греческих слов «апис» — лист и «птозис» — опа-
дание). Когда в 1972 г. Дж.Ф. Керр и сотрудники предположили, что смерть
клетки во многих случаях запрограммирована ее геномом, то это явление
было обозначено как «apoptosis» (по-русски — «апоптоз»). В 2002 г. Нобе-
левская премия по физиологии и медицине была присуждена Х.Р. Хорвицу,
Дж.Э. Салстону и С. Бреннеру за открытие генов, управляющих онтогене-
зом, среди которых оказались и гены запрограммированной смерти кле-
ток.
Апоптоз представляет собой длинную цепь событий, в которых, как
правило, митохондрии играют центральную роль. Одним из индукторов
апоптоза служат АФК. При этом роль АФК состоит главным образом в
том, что они нарушают барьерную функцию внешней митохондриальной
мембраны и позволяют выйти в цитозоль митохондриальным белкам, ло-
кализованным в межмембранном пространстве. Некоторые из этих белков
обладают способностью индуцировать апоптоз. К ним относятся, как это
ни неожиданно, цитохром с, а также apoptosis-inducing factor (AIF), белок
smac, протеаза omi и эндонуклеаза G. Каждый из названных выше белков
по-своему стимулирует апоптоз. Так, AIF, открытый в начале 1996 г. па-
рижским биологом Г. Кремером, отправляется, выйдя из митохондрий, в
клеточное ядро, где связывается с ДНК. В этом, по-видимому, участвуют
28 положительно заряженных аминокислотных остатков AIF, вынесенных
на поверхность белковой глобулы и связывающихся с анионами фосфатных
остатков ДНК. В результате ДНК теряет нативную конформацию и стано-
вится объектом нуклеаз. Одна из них (эндонуклеаза G) также приходит из
митохондрий и вызывает межнуклеосомные разрывы ДНК. У некоторых
животных AIF комплексуется с эндонуклеазой G, повышая ее активность.
В том же 1996 г., но на несколько месяцев позже Г. Кремера, К. Уанг и
сотрудники (и независимо от него в начале 1997 г. Д.Д. Ньюмейер) в США
показали, что давно известный биоэнергетикам цитохром с имеет, наряду с
дыхательной, также и другую, зловещую функцию — запускает целый ка-
скад процессов, приводящих к запрограммированной гибели клетки. Выйдя
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 281
из митохондрий, цитохром с связывается с белком, названным «фактором,
активирующим апоптическую протеазу» (apoptosis protease activating factor
1, или Apaf-1). Полученный комплекс присоединяет АТР (лучше dATP) и
превращается в частицу, названную апоптосомой. Апоптосома сорбирует
на своей поверхности несколько молекул белка, известного как прокаспа-
за 9. Сблизившись, молекулы прокаспазы 9 активируют друг друга (пере-
ход прокаспаза 9 каспаза 9). Активные каспазы 9 атакуют прокаспазу 3
и отщепляют часть ее полипептидной цепи, в результате чего получается
активная каспаза 3. Объектом действия этой протеазы оказывается целая
группа внутриклеточных белков. Все они занимают ключевые позиции на
метаболической карте или играют важнейшую роль в структурной органи-
зации клетки. Одним из результатов всех этих событий становится межну-
клеосомное расщепление ядерной ДНК.
Роль smac и omi, двух других проапоптозных белков, также освобож-
дающихся, подобно цитохрому с, AIF и эндонуклеазе G, из митохондрий в
цитозоль, состоит в дополнительной активации каскада, запускаемого ци-
тохромом с.
Существуют, по меньшей мере, еще два пути индукции апоптоза по-
средством АФК. Один из них — модификация порина, белка внешней мито-
хондриальной мембраны. В норме этот белок образует поры, проницаемые
только для низкомолекулярных веществ. Однако под действием суперок-
сида молекулы порина объединяются в олигомеры, пропускающие также и
более крупные молекулы белков. Этот эффект, по-видимому, усиливается
белком Вах. В результате белки межмембранника выходят в цитозоль, при-
чем этот процесс уже не требует открытия пор во внутренней мембране.
Еще один путь от АФК к внешней мембране митохондрии опосредован
протеинкиназой JNK. Этот фермент фосфорилирует Вах, чем вызывает его
активацию. Кроме того, JNK фосфорилирует и при этом инактивирует бел-
ки Вс1-2 и Bcl-XL, ингибирющие Вах. Остается неизвестным, каким имен-
но образом АФК активируют протеинкиназу JNK.
На рис. 15.7 показаны все три пути запуска апоптоза при помощи АФК.
Однако было бы ошибочным думать, что схема, представленная на рисун-
ке, исчерпывает все варианты индукции запрограммированной смерти под
действием АФК. Дело в том, что помимо апоптоза существует еще один тип
программ, смертоносных для клетки, — некроз.
15.2.6. Некроз
Традиционно некроз противопоставляют апоптозу. Считалось, что не-
кроз, в отличие от апоптоза, не запрограммирован, представляя собой смерть
клетки в условиях, несовместимых с жизнью. Ошибочность этого утверж-
дения стала очевидной, когда выяснилось, что некроз, подобно апоптозу,
требует энергии в виде АТР и участия определенных ферментов*.
* При полном истощении АТР клетка гибнет неким способом, признаки которого
отличаются от таковых как апоптоза, так и некроза (так называемая энергетическая ка-
тастрофа).
282 ЧАСТЬ IV Опыт практического применения биоэнергетики: активные формы...
АФК-------------» JNK
I ""Х
ATP/ADP-антипортер X \
I \
пора во \
внутренней мембране \
митохондрий
I
набухание матрикса
митохондрий
I
разрыв внешней
мебмраны порин ~
митохондрий митохондрий
выход белков вс1-2?
из межмембранника Bcl-XL
митохондрий в цитозоль
Рисунок 15.7. Как АФК могут активировать апоптоз?
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 283
По-видимому, на ранних этапах апоптоз и некроз могут использовать
одни и те же механизмы. В случае АФК — это окисление SH-групп АТР/
ADP-антипортера и, как следствие, открытие поры во внутренней мембра-
не митохондрий. Существует и альтернативный путь запускаемого АФК не-
кроза — через JNK. Принципиальное отличие некроза от апоптоза состоит
в том, что только при некрозе происходит разрушение внешней мембраны
клетки, так что внутриклеточное содержимое выплескивается во внекле-
точное пространство. При апоптозе сохраняются барьерные свойства внеш-
ней клеточной мембраны, а гибель клетки сопровождается уменьшением
ее объема без появления внутриклеточных макромолекул в межклеточнике.
При апоптозе клетка как бы не афиширует акт своего самоубийства, в то
время как некроз можно сравнить с самосожжением на людной площади.
Апоптозная клетка не привлекает к себе внимания других клеток за исклю-
чением могильщиков-макрофагов, которые узнают ее по появлению фос-
фатидилсерина в наружном слое фосфолипидов внешней мембраны (сигнал
«съешь меня!»). Напротив, некрозная клетка, лопнув, освобождает в окру-
жающую среду множество веществ, отсутствующих там в норме и провоци-
рующих образование цитокинов другими клетками. В итоге возникает очаг
воспаления. Не случайно, что одно и то же воздействие может вызывать
как апоптоз, так и некроз в зависимости от силы этого воздействия. Так,
в наших опытах на раковых клетках линии HeLa обнаружилось, что трех-
кратное снижение уровня внутриклеточного АТР в течение трех часов вос-
принимается клеткой как сигнал к апоптозу, а в течение пяти часов — уже к
некрозу. Создается впечатление, что клетка-самоубийца выбирает апоптоз,
если причиной смерти оказываются какие-то преходящие обстоятельства, и
некроз, если речь идет о более опасных факторах, действующих в течение
более длительного времени. Девизом апоптозной клетки могло бы быть:
«Я не справилась и потому ухожу, не прощаясь», а некрозной: «Смотрите!
Грядет катастрофа, смертельно опасная не только для меня, но и для всех
нас!»
15.2.7. Феноптоз
Митоптоз как запрограммированная самоликвидация неправильно
функционирующих митохондрий может быть механизмом митохондриаль-
ной селекции, посредством которой «вредные» митохондрии выбраковыва-
ются из внутриклеточной популяции этих органелл. Соответственно апоп-
тоз и некроз выполняют ту же роль применительно к популяции клеток в
ткани (клеточная селекция). В этой связи закономерен вопрос: действует ли
данный принцип также и на уровне организма, т.е. существуют ли способы
самоликвидации индивида, функционирующего ошибочно, с точки зрения
семьи, сообщества или популяции индивидов?
Гипотетический механизм самоликвидации организма мы назвали феноп-
тозом по аналогии с апо- и митоптозами. Феноптозные механизмы могли
бы предохранять сообщество организмов от появления зловещих монстров,
способных разрушать это сообщество или даже всю популяцию, подобно
284 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
тому, как апоптоз предохраняет ткань от злокачественного перерождения,
выбраковывая раковые клетки.
В случае феноптоза, как и апоптоза, речь может идти о поддержании
стабильности («чистоты») генома. Применительно к сложным организмам,
отдельные виды которых существуют сотни тысяч и даже миллионы лет,
стабильность генома есть главный гарант сохранения видовой индивидуаль-
ности. Поэтому было бы неудивительным, если бы организмы, не справив-
шиеся с проблемами защиты или своевременной репарации своих геномов,
выбраковывались путем включения каких-то механизмов феноптоза, т.е.
биохимического самоубийства.
К явлениям феноптоза могут быть отнесены многочисленные примеры
запрограммированной смерти бактерий и одноклеточных эукариот. В дан-
ном случае самоликвидация клетки есть не что иное, как самоубийство
организма, коль скоро этот организм — одноклеточное существо.
Интересен ответ бактерий на повреждение их ДНК. Степень поврежде-
ния отслеживается специальным белком, индуцирующим сначала фермен-
ты репарации ДНК, а если они не справляются — арест деления клетки.
Если и в этом случае повреждение сохраняется, то активируется фермент
автолизин, расщепляющий вещества клеточной стенки, — и бактерия гиб-
нет. Аналогичный механизм описан и у дрожжей. Если повреждение ДНК,
о котором идет речь, вызвано АФК, то механизм феноптоза, описанный
выше, можно рассматривать как способ защиты популяции одноклеточных
от ядовитых форм кислорода.
В.Н. Манских и, независимо от него, А.В. Лихтенштейном была вы-
двинута гипотеза, что рак есть не что иное, как феноптозная программа,
очищающая популяцию от особей с нестабильным геномом. Одной из при-
чин, вызывающих такую нестабильность, могут быть АФК.
Завершая рассмотрение механизмов эшелонированной защиты живых
систем от АФК (табл. 15.2), мы сформулировали на этом примере некото-
рую общебиологическую закономерность, которую можно было бы назвать
Самурайским законом биологии: «Лучше умереть, чем ошибиться». В бо-
лее развернутой форме закон звучит так: сложные биологические системы
(от митохондрий до организма) располагают механизмами самоуничтожения.
Эти механизмы включаются в тех случаях, когда данная система оказывает-
ся опасной или даже просто ненужной для систем, занимающих более высокое
положение в биологической иерархии.
Таблица 15.2. Рубежи эшелонированной зашиты живых систем от АФК
1) Антиоксиданты.
2) Уменьшение концентрации О2 в клетке.
3) Уменьшение продукции АФК дыхательной цепью вследствие (а) мягкого
разобщения и (б) блокады цикла Кребса на уровне аконитазы.
4) Выбраковка митохондрий, образующих избыток АФК (митоптоз).
5) Выбраковка клеток, образующих избыток АФК (апоптоз и некроз).
6) Выбраковка организмов, не справившихся с защитой ДНК от АФК
(феноптоз).
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 285
15.3. Биологические функции АФК
По-видимому, исходно АФК были для живых существ только ядом, а
первичная функция дыхания состояла в превращении потенциально ядови-
того О2 в безвредную воду. Однако с течением времени организм не толь-
ко научился жить в присутствии небольших количеств АФК, неизбежно
образовывавшихся при одноэлектронном восстановлении кислорода дыха-
тельными ферментами и коферментами, но и начал использовать в своих
целях саму ядовитость АФК. Так АФК стали «биологическим оружием», при-
меняемым живой клеткой для борьбы с патогенами, а затем и «самурайским
мечом», которым пользуются митохондрии, клетки и, по-видимому, орга-
низмы, чтобы свести счеты с жизнью.
Наилучшим примером применения клеткой АФК как биологического
оружия может служить NADPH-оксидаза внешней клеточной мембраны.
Данная оксидаза окисляет NADPH на внутренней стороне этой мембраны.
Электроны, отнятые от NADPH, переносятся посредством флавина и осо-
бого цитохрома b на противоположную (внешнюю) сторону мембраны, что-
бы восстановить О2 до О^-. Полученный таким образом супероксид выде-
ляется во внеклеточную среду, чтобы превратиться там в более агрессивные
формы АФК, убивающие бактерии. Что касается АФК, образуемых внутри
клетки (прежде всего в митохондриях), то именно они являются мощными
стимуляторами апоптоза и некроза у млекопитающих и феноптоза у одно-
клеточных. Так, Ф.Ф. Севериным и сотрудниками нашей группы было по-
казано, что смерть дрожжей, вызываемая дрожжевым феромоном, требует
генерации АФК в митохондриях гибнущих клеток (рис. 15.8/4). Другой при-
мер — апоптоз раковых клеток (карциномы HeLa), вызванный цитокинами
(фактором некроза опухолей, или TNF, рис. 15.85). Поражает размах из-
менений концентрации АФК: если в норме при использовании данного ме-
тода их практически не видно и картина напоминает знаменитый «Черный
квадрат» Казимира Малевича, то в условиях индукции феноптоза или апоп-
тоза клетки, прокрашенные на АФК, светятся, как фонари. Недаром в этих
случаях говорят о «взрывном» характере образования АФК. Интересно, что
антиоксиданты блокируют феноптоз у дрожжей, но не апоптоз клеток HeLa
при добавлении к ним избытка TNF. Анализ этих соотношений в нашей
группе Б.В. Черняком и сотрудниками показал, что АФК, будучи необяза-
тельными для самоубийства конкретной клетки под действием TNF, служат
как бы «черной меткой» — смертоносным сигналом (индуктором апопто-
за) — для других клеток, не получивших TNF. Посредником в межклеточ-
ной передаче апоптозного сигнала оказалась перекись водорода.
Такого рода эффект мог бы участвовать в защите ткани от вирусной
инфекции, когда зараженная клетка не только сама уходит в апоптоз, но
и стимулирует самоубийство соседних клеток — наиболее вероятных по-
тенциальных реципиентов вируса. В результате вокруг зараженной клетки
образуется мертвая зона, что блокирует дальнейшее распространение ви-
русной инфекции. Образование таких зон было прямо продемонстрировано
на линии табака, сверхчувствительной к вирусу табачной мозаики. В норме
коллективный апоптоз применяется для ликвидации участков ткани и це-
286 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
Митотрекер АФК
Контроль
TNF
Рисунок 15.8. . Генерация АФК в процессе феноптоза дрожжей (А) и апоптоза клеток HeLa (кар-
циномы эпителия шейки матки человека) в культуре (Б). А — ответ дрожжей на амиодарон, вклю-
чающий феромонный каскад феноптоза на одном из ранних его этапов. Видна колокализация
митохондрий (окраска митотрекером оранжевым) и АФК (окраска дихлордигидрофлуоресцин-
диацетатом, DCF) в клетках № 1-3 |Poznyakovsky el al., J. Cell Biol. 2005, 168: 257-269]. Б —
ответ клеток HeLa на добавление фактора некроза опухолей (TNF). Верхний ряд — световая
микроскопия; нижний ряд — световая флуоресцентная микроскопия (окраска DCF) |Shchepina
et al., Oncogene 2002, 2k 8149-8157]
лых органов в процессе онтогенетического развития организмов. Нагляд-
ный пример был описан при исследовании механизма исчезновения хвоста
у головастика. Известно, что этот процесс запускается тироидными гормо-
нами. Он может быть изучен на отрезанных хвостах, помещенных в среду
определенного состава. Оказалось, что добавление тироксина в этом случае
резко повышает продукцию NO и уровень АФК, в частности перекиси во-
дорода. Последняя вызывает массовую гибель (апоптоз) клеток хвоста, раз-
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 287
мер которого уменьшается в часовой шкале. Это явление можно определить
как органоптоз, вызываемый активными формами кислорода.
Описаны случаи, когда АФК служат сигнальными молекулами с не столь
мрачными функциями, как «черная метка». Это относится прежде всего
к роли активных форм кислорода в мобилизации систем защиты от са-
мих этих форм. Так, увеличение продукции супероксида воспринимается
специальными рецепторами, запускающими процесс сужения сосудов, что
уменьшает аэрацию тканей, снижает концентрацию О2 в клетке и, стало
быть, скорость образования супероксида (см. выше, рис. 15.2). Внутри
клеток уменьшение [О2] тормозит гидроксилирование транскрипционно-
го фактора HIF-1. В результате, во-первых, предотвращается инактивация
HIF-1 и, во-вторых, тормозится его расщепление в протеосомах. В свою
очередь, повышение активности и количества HIF-1 стимулирует работу
ряда генов, кодирующих ферменты антиоксидантной защиты. Тем самым
клетка страхуется от парадоксального эффекта, когда гипоксия вызывает
окислительный стресс. Механизм этого стресса может состоять в закис-
лении ткани за счет активации гликолиза при торможении дыхания ввиду
нехватки О2. Закисление ведет к протонированию О^- с образованием го-
раздо более агрессивного НО2*. Кроме того, гипоксия и особенно аноксия
способствуют восстановлению ионов Fe3+ до Fe2+, запускающего реакцию
Фентона (Н2О2 ОН*, см. рис. 15.1). Оба эти эффекта не так опасны до
тех пор, пока отсутствует кислород. Однако реоксигенация («кислородный
удар») после гипоксии немедленно приводит к образованию НО2* и ОН* со
всеми вытекающими отсюда последствиями.
Не исключено, что та же логика объясняет, почему АФК стимулируют
ангиогенез — прорастание в ткани новых сосудов. Нехватка О2 провоцирует
циклические переходы «гипоксия — реоксигенация» и вызывает повышение
уровня АФК по механизмам, описанным выше. В свою очередь, возраста-
ние АФК воспринимается как стимул для мобилизации антигипоксических
мер и, в частности, ангиогенеза.
К сказанному следует добавить, что небольшие концентрации АФК спо-
собствуют пролиферации клеток. Причина такого эффекта остается на се-
годня во многом загадочной, хотя уже ясно, что АФК увеличивает уровень
циклинов — регуляторных белков, необходимых для осуществления клеточ-
ного цикла.
Суммируя все сказанное в этом разделе, мы можем заключить, что АФК
не только зло, но и необходимый компонент нормальной жизнедеятельно-
сти. Показательно наблюдение Н.И. Гольштейна, продемонстрировавшего,
что дыхание воздухом, полностью освобожденным от отрицательных аэрои-
онов (т.е. от О^-), губительно для животных: мыши умирают через 18 дней,
а крысы — через 23 дня.
288 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
15.4. Старение как медленный феноптоз, вызываемый
повышением уровня АФК
15.4.1. Определение понятия «старение»
и краткая история проблемы
Старение организма можно определить как согласованное ослабление с
возрастом жизненных функций, приводящее к постепенному увеличению риска
смерти.
Ключевой вопрос в том, что является причиной такого ослабления
функций. Вот уже более ста лет в биологии соперничают две точки зрения
на эту проблему — оптимистическая и пессимистическая. Первая пред-
полагает, что старение есть конечный этап нашей онтогенетической про-
граммы и поэтому может быть отменено путем выключения данного этапа.
Вторая рассматривает старение как неизбежный результат функционирова-
ния сложной живой системы: накопления ошибок и повреждений в состав-
ляющих их биомолекулах, истощения «жизненной силы», функционирова-
ния некоторых генов, которые в молодости были полезными, а с возрастом
стали вредными и т.д.
Совершенно очевидно, что если справедлива пессимистическая гипо-
теза, то попытки борьбы со старением людей обречены на неудачу: все мы
в конце концов должны сломаться, как старый автомобиль. Один из кори-
феев геронтологии XX в. А. Комфорт как-то заметил, что трудно поверить,
чтобы лошадь и телега старели одинаково. Тем не менее подавляющее боль-
шинство геронтологов до сих пор не разделяют мнение о том, что старение
запрограммировано. И лишь совсем недавно были получены факты, прямо
свидетельствующие в пользу оптимистической концепции и позволяющие
понять, почему в процессе биологической эволюции могли возникнуть ак-
тивирующиеся с возрастом биохимические механизмы ослабления жизнен-
ных функций.
Первым, кто указал на возможность запрограммированной смерти ор-
ганизма, был Альфред Рассел Уоллес, вошедший в историю с тем, что одно-
временно с Дарвином сформулировал идею естественного отбора. Вот что
писал Уоллес в одном из своих писем на рубеже 1860—1870-х гг.: «Родите-
ли, произведя достаточное количество потомства, становятся помехой для
этого потомства, конкурируя с ним за пищу. Естественный отбор выбра-
ковывает родителей и во многих случаях дает преимущество тем расам,
представители которых умирают почти сразу же после того, как произвели
потомство». Позднее (в 1881 г.) этот принцип был независимо выдвинут и
детально развит другим великим биологом — Августом Вейсманом: «От-
работанные индивиды не только бесполезны, но даже и вредны, занимая
место тех, кто дееспособны... Я рассматриваю смерть не как первичную не-
обходимость, но как нечто приобретенное вторично в качестве адаптации»
(выделено авторами).
Вейсман был немедленно обвинен современниками в антидарвинизме,
хотя сам Дарвин прекрасно отдавал себе отчет в ограниченности своей ги-
потезы (эволюция происходит только в тех направлениях, которые благо-
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 289
приятны для индивида), когда речь шла о половом подборе и групповой
адаптации. Вот что писал Дарвин в своей второй знаменитой книге «Проис-
хождение человека»: «Не подлежит сомнению, что сообщество организмов,
включающее много членов, всегда готовых прийти на помощь друг другу и
пожертвовать собой ради общего дела, одержит победу над большинством
других сообществ, и это будет естественным отбором».
Сегодня критики Вейсмана обычно цитируют П.Б. Медавара, предпо-
ложившего, что старение, даже если оно полезно для популяции, не могло
возникнуть как механизм, выработанный эволюцией. Медавар утверждал,
что в природных условиях подавляющее большинство организмов умирает
еще до того, как они постарели. Сегодня ошибочность этого утверждения
уже совершенно очевидна. Старение начинается задолго до того, как оно
может стать непосредственным поводом для смерти индивида. В то же время
оно может опосредованно способствовать этой смерти. Так, прогрессирую-
щее с возрастом ослабление организма безусловно повышает вероятность
его смерти при атаке хищниками, патогенами и т.п. Недавно А. Лойсон с
коллегами и, независимо от них, Р. Бондурянский и К. Брассил прямо по-
казали, что в естественных условиях как долгоживущие млекопитающие,
так и короткоживущие насекомые страдают от старения. Такой результат
неудивителен, если учесть, что, например, снижение с возрастом мышеч-
ной силы начинается сравнительно рано — в период завершения роста ор-
ганизма, а старение иммунной системы — еще раньше (у человека — между
10 и 15 годами жизни).
Гипотеза о том, что смерть может быть следствием реализации некой
записанной в геноме программы, была впервые прямо доказана на уров-
не клеток (мы имеем в виду апоптоз и некроз). В самое последнее время
пришло понимание того, что явления запрограммированной смерти про-
слеживаются на суб- и надклеточных уровнях: были открыты митоптоз,
коллективный апоптоз, органоптоз и феноптоз (см. выше).
Среди явлений феноптоза важно различать случаи запрограммирован-
ной смерти индивида, зависящие и не зависящие от стадий жизненного
цикла организма. К последним можно отнести, например, альтруистиче-
скую гибель индивида (одно- или многоклеточного), зараженного патоге-
ном. Таким образом может предотвращаться распространение инфекции в
популяции. Подобные явления, молекулярный механизм которых уже хо-
рошо изучен на бактериях, могут рассматриваться как прецедент самого
существования запрограммированной смерти на уровне организма и био-
логического смысла такого явления. Однако в аспекте проблемы старения
интереснее случаи, когда запрограммированная смерть приурочена к опре-
деленному этапу индивидуальной истории жизни существа.
15.4.2. Феноптоз организмов, размножающихся однократно
Как было впервые отмечено Уоллесом, у подобных видов организм
устроен таким образом, что само это устройство предопределяет гибель жи-
вого существа вскоре после размножения. Например, имаго поденки живет
всего пару дней, потому что не может есть: у нее нет функционирующего
290 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
рта, а кишечник заполнен воздухом. У одного из видов клеща потомки
выводятся внутри тела матери и прогрызают себе путь на волю, тем са-
мым убивая мать. У некоторых кальмаров самец гибнет тотчас после того,
как перенесет свой сперматофор под кожу самке. Самка одного из видов
осьминога полностью теряет аппетит и гибнет с голоду после того, как
маленькие осьминоги вылупятся из кладки яиц, которые она отложила и
затем ревностно охраняла. Трагического для самки события не произойдет,
если у нее удалить обе так называемые оптические железы. Такая операция
вчетверо продлевает жизнь животного.
Семяизвержение у самца богомола становится возможным только по-
сле того, как его обезглавит самка в конце полового акта. А самцы австра-
лийской сумчатой мыши гибнут через две недели после гона под действием
избытка собственных феромонов (ср. с феноптозом дрожжей, вызванным
феромоном, о котором уже шла речь выше).
Поразительные наблюдения были сделаны при изучении лососей. Ти-
хоокеанский лосось Oncorhynchus keta (кета) умирает вскоре после того, как
вымечет икру. Смерть наступает в результате ускоренного старения (про-
герии), развивающегося, когда рыба покидает океан и плывет по реке к ее
верховьям. Традиционное объяснение этого явления состояло в том, что
животное тратит слишком много энергии, двигаясь долгое время против
течения. Однако эта точка зрения оказалась ошибочной, потому что, во-
первых, старение и смерть не наступают, если у лосося удалить гонады
или надпочечники, и, во-вторых, прогерия развивается даже в тех случаях,
когда рыба нерестится в верховьях совсем коротких речек со слабым тече-
нием. Сравнили две популяции тихоокеанского лосося, одна из которых
нерестилась в верховьях Амура (реки, длина которой свыше двух тысяч
км), а другая на Сахалине, в маленьком ручейке длиной всего в 200 метров.
В обоих случаях нерестящаяся рыба имела все признаки преждевременно-
го старения, приводившего к смерти. По-видимому, сигналом к развитию
старения служил переход из морской воды в пресную. В данном случае био-
логический смысл самоубийства состоит в том, что трупы отнерестившихся
рыб служат отличной пищей для речных беспозвоночных, которые в свою
очередь поедаются мальками лососей.
В какой мере закономерности ускоренного старения лосося примени-
мы к медленному старению других животных? С.Н. Аустад считает, что эти
два явления совершенно различны по своей природе и механизму: прогерия
есть программа, а медленное старение — накопление случайных ошибок.
Однако такому взгляду противоречит тот очевидный факт, что прогерии ло-
сося сопутствует множество признаков, присущих обычному процессу ста-
рения: остеопороз, снижение иммунной защиты, опухоли, утончение кожи,
уменьшение числа мышечных клеток (саркопения) и т.д. Недавно в мозгу
нерестящегося лосося обнаружили пептиды амилоидных бляшек, которые
возникают у пожилых людей, страдающих болезнью Альцгеймера.
Одна из функций явлений феноптоза, описанных выше, состоит в уве-
личении разнообразия потомства. Реализация феноптозной программы у
осьминожихи приводит к тому, что она размножается только раз в жизни.
Поэтому среди произошедших от нее осьминогов не будет младших или
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 291
старших братьев и сестер. Это значит,
что в прямом родстве друг с другом
будет состоять только клон осьмино-
гов, произошедший из яиц одной и
той же кладки.
Иной смысл имеет феноптоз бам-
бука. Бамбуковая рощица размножа-
ется вегетативно в течение 15—20 лет,
после чего переходит на половое раз-
множение, зацветает, образует семена
и тотчас засыхает в самый разгар лета.
Так растения-родители освобождают
жизненное пространство растениям-
потомкам (рис. 15.9).
Рисунок 15.9. Феноптоз бамбука. Ботаниче-
ский сад в Гетеборге, начало июля
15.4.3. Старение — медленный феноптоз?
Приняв, что старение запрограммировано, нам прежде всего придется
ответить на следующие два вопроса: (1) каков возможный биологический
смысл старения как медленного угасания биологических функций и (2) как
можно себе представить такой механизм программы старения, который не
будет выбраковываться естественным отбором? Ведь потерявшие его и по-
тому не стареющие мутантные организмы должны, казалось бы, иметь нео-
споримые преимущества перед стареющими.
Отвечая на первый из этих вопросов, можно предположить, что мед-
ленный процесс старения служит одним из механизмов, необходимых для
успешной эволюции. Давайте рассмотрим следующий умозрительный экс-
перимент. Два молодых зайца, — один поумней, другой поглупей, — встре-
тив лису, имеют практически равные шансы удрать от врага просто потому,
что бегают гораздо быстрей лисы. Однако с возрастом умный заяц получит
преимущество перед глупым, и это преимущество может оказаться решаю-
щим, когда скорости бега зайцев снизятся из-за старения до скорости бега
лисы. Теперь у умного зайца, который, увидев лису, тотчас пустится наутек,
будет гораздо больше шансов спастись, чем у глупого, который замешкает-
ся, а значит, только умный будет продолжать плодить зайчат. В результате
заячья популяция поумнеет.
Существенно, что молодая (т.е. более многочисленная и интенсивнее
размножающаяся) часть популяции не будет участвовать в таком экспери-
менте, служа гарантией стабильности всего того, что уже достигнуто эволю-
цией. В то же время стареющая часть популяции может себе позволить не-
сколько изменить генотип, инициировав отбор какого-то нового свойства.
Если это свойство окажется действительно полезным, то оно будет закре-
плено в потомстве. Если же у нового признака окажутся неблагоприятные
побочные эффекты, потенциально разрушительные для вида, признак не
пройдет сито отбора, а сам эксперимент вряд ли будет иметь серьезные по-
следствия для вида, поскольку старых особей не так уж много, размножа-
ются они не так активно и вскоре просто вымрут.
292 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
Описанный выше благоприятный для эволюции эффект старения пред-
полагает, что мозг стареет не быстрее, чем мышцы, и мышечная сила осла-
бевает, когда еще возможно размножение. Эти условия, по-видимому, вы-
полняются, по крайней мере если речь идет о людях. У человека первые
признаки атрофии мышц заметны уже в возрасте около 25 лет. В начале
этот процесс развивается медленно. В наше время значительное уменьше-
ние мышечной силы начинается в 50-летнем возрасте у шведских мужчин
и в 40-летнем у мужчин Саудовской Аравии. С другой стороны, в начале
XIX в. снижение того же параметра было заметно уже у 25-летних (исследо-
вали бельгийских мужчин). Такая динамика легко объясняется улучшением
уровня жизни за последние два века. В любом случае, как отмечает Т. Голд-
смит, «из-за того, что даже небольшое ухудшение вызывает статистически
значимое увеличение смертности, следует ожидать, что эволюционный эф-
фект старения у диких животных начинается в сравнительно молодом воз-
расте».
В известных пределах укорочение жизни может благоприятно сказаться
на темпе эволюции благодаря сопутствующему этому процессу ускорению
смены поколений. Вот почему оказывается выгодным отрегулировать «рео-
стат», определяющий скорость реализации программы старения, на более
короткую жизнь, если внешние условия ухудшились. И наоборот, прорвав-
шись на новые рубежи, т.е. лучше приспособившись к внешним условиям,
популяция может позволить себе снизить темп эволюции, другими слова-
ми — увеличить продолжительность жизни. Так произошло с позвоночны-
ми, когда им удалось завоевать воздушный океан: птицы и летучие мыши
живут в несколько раз дольше, чем наземные млекопитающие того же раз-
мера. При этом интенсивность метаболизма у птиц в 2,5 раза больше, чем у
наземных млекопитающих того же веса. Продолжительность жизни летучей
мыши в 17 раз больше, чем у похожей на нее по размеру землеройки, пита-
ющейся, как и летучая мышь, насекомыми. Среди птиц есть такие, возраст
которых достигает 100 и даже более лет, причем у долгожителей не удается
обнаружить каких-либо признаков старения. Что касается наземных по-
звоночных, то и среди них максимальную продолжительность жизни имеют
те, у которых практически нет врагов. Таковы гигантские черепахи. Одна
из них, помеченная еще Дарвином, живет до сих пор, получая корм из рук
служителей зоопарка. Дело в том, что вес панциря долгожителя оказался
слишком большим для мышечного аппарата животного, которое потеряло
подвижность и в дикой природе было бы обречено на смерть от жажды. Не
описано признаков старения у гренландского кита. Максимальная продол-
жительность жизни этого животного — более двух веков. Примерно столько
же может жить алеутский ерш — северный вид очень крупного морского
окуня. Интересно, что среди видов этого рода хищных рыб есть и коротко-
живущие (максимальная продолжительность жизни не более 12 лет). Можно
полагать, что короткоживущие виды обитают в менее благоприятных усло-
виях конкурентной борьбы с другими видами, чем долгоживущие. В любом
случае уже то, что виды одного рода могут в 20 раз отличаться по продол-
жительности жизни, указывает на наличие программы старения, которое
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 293
у таких видов вряд ли можно объяснить простым накоплением случайных
ошибок. Скорее, виды, лучше приспособившиеся к среде, могут позволить
себе отключить программу старения и эволюционировать медленнее.
Замечательный пример, иллюстрирующий наличие программы старе-
ния, имеющей какой-то весьма важный биологический смысл, продемон-
стрировали недавние работы на мелких африканских рыбках рода зубастого
карпика Nothobranchius. Оказалось, что продолжительность жизни отдель-
ных видов этого рода варьирует в пять раз в зависимости от того, где обита-
ет данный вид в дикой природе. Так, N. furzeri из пересыхающих водоемов
в Зимбабве живет всего 3 месяца, что соответствует периоду дождей в этой
стране. N. rachovii и N. kuhntae из Мозамбика, где выпадает вчетверо больше
осадков, живут 9,5 месяцев, a N. guentheri из Занзибара (влажный климат
с двумя дождливыми сезонами) — более 16 месяцев. У рыбок самого ко-
роткоживущего вида N. furzeri рост и половое созревание завершаются за
месяц, после чего самки многократно нерестятся в течение оставшихся двух
месяцев, пока водоем не пересохнет. Из икры, благополучно пережившей
засуху, на следующий год вылупятся мальки. Поразительно, что за два по-
следних месяца жизни рыбка успевает состариться, демонстрируя весь набор
старческих признаков (замедление движений, потеря «исследовательского»
поведения в открытом пространстве, остеопороз (горбатость), накопление
липофузциновых гранул в печени, резкое увеличение р-галактозидазной ак-
тивности в фибробластах кожи и т.д.). У более долгоживущих видов того
же рода завершение роста и половое созревание наступает гораздо позднее.
Следовательно, позже начинают увеличиваться и биомаркеры старения.
Существенно, что указанные различия сохраняются при аквариумном со-
держании животных, т.е. предопределены генетически и уже не зависят от
сиюминутных условий существования. Создается впечатление, что рыбки
короткоживущего вида стремятся успеть постареть за тот короткий период
жизни, который им отпущен на воле. Важно также, что программа старения
имеет сходные проявления у самых отдаленных классов позвоночных —
рыб и млекопитающих. Этот консерватизм — безусловное свидетельство
древности данной программы.
Интересный эксперимент был поставлен самой природой в верховьях
рек Оропучо и Ярра (Тринидад). Как обнаружил Д.Н. Резник с коллегами,
верховья рек, о которых идет речь, отрезаны от их низовий порогами, не-
преодолимыми для хищных рыб (прежде всего щук), питающихся гуппи.
В результате оказалось, что гуппи в верховьях рек живут практически без
своего главного врага, а гуппи в низовьях непрерывно испытывают опас-
ность быть съеденными щукой. Исследователи отловили гуппи из рек вы-
ше и ниже по течению относительно водопадов и стали размножать их
в аквариумах, где никаких врагов не было. Оказалось, что рыбки второй
аквариумной генерации, ранее сосуществовавшие со щуками, (1) живут до
35% дольше, причем исключительно за счет увеличения репродуктивного
периода жизни, (2) размножаются вдвое быстрее и (3) почти в полтора раза
быстрее стартуют в ответ на появление опасности (совсем как умный заяц
в приведенном выше примере с лисой). Нетрудно понять, что первые два
294 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
параметра увеличивают плодовитость стаи в условиях постоянных потерь в
численности из-за атак хищников, а третий уменьшает такие потери. В це-
лом приведенные данные противоречат одному из ключевых постулатов
классической геронтологии — увеличить плодовитость можно лишь за счет
сокращения продолжительности жизни*.
Анализируя результаты этого природного эксперимента, трудно избе-
жать заключения, что плодовитость и продолжительность жизни регулиру-
ются как бы двумя реостатами, иногда по-разному реагирующими на изме-
нение условий внешней среды. Такая регуляция используется популяцией
не только для того, чтобы выжить, но и для изменения темпа своей эволю-
ции: в плохих условиях эволюция ускоряется путем увеличения плодовито-
сти, а значит, и разнообразия потомков. Параллельно может сокращаться
продолжительность жизни под действием как давления внешней среды, так
и внутренних факторов организма. Причем дело здесь не в том, что вся
жизненная сила особи уходит на производство потомства и ее не хватает на
собственное долгожительство, как полагают Т. Кирквуд и С.Н. Аустад. Если
бы оказались правы эти авторы, результаты, полученные Резником, были
бы просто необъяснимы.
В известных пределах сокращение продолжительности жизни может
благоприятно сказаться на темпе эволюции благодаря ускорению смены
поколений, сопутствующему этому процессу. Вот почему оказывается вы-
годным отрегулировать «реостат», определяющий скорость реализации
программы старения, на более короткую жизнь, если внешние условия
ухудшились. Прорвавшись на новые рубежи, т.е. лучше приспособившись
к внешним условиям, популяция может себе позволить снижение темпа
эволюции. Случай с гуппи, сброшенными водопадом, так сказать, прямо
в щучью пасть, — особый. Когда популяция оказалась перед угрозой не-
медленного уничтожения, ей, чтобы выжить, пришлось задействовать все
имеющиеся ресурсы, увеличив и плодовитость, и продолжительность ре-
продуктивного периода жизни.
15.4.4. Мутации, продлевающие жизнь
Если существует генетическая программа старения, то должны быть му-
тации, продлевающие жизнь. У одного из аскомицетов, мицелиевого гриба
Podospora anserina, мутация в одной из субъединиц цитохромоксидазы бло-
кирует активность этого фермента, что индуцирует альтернативную оксида-
зу, окисляющую CoQH2 кислородом без выделения АФК. Это приводит, во-
первых, к резкому снижению уровня АФК и, во-вторых, к переключению с
полового размножения на вегетативное в результате действия какого-то еще
неизвестного механизма. Такое переключение сопровождается исчезнове-
нием морфологических признаков старения и более чем двадцатикратным
* Д.Н. Резник был настолько уверен в том, что продолжительность жизни «в аду»
должна быть гораздо короче, чем «в раю», что, затевая свой многолетний проект, имел
неосторожность предсказать в печати именно такой результат. В последней свой работе
Резник с коллегами уже не цитируют своих ошибочных предсказаний.
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 295
продлением жизни (с 25 дней до многих
месяцев). Подобный результат достига-
ется и другими мутациями (или добав-
лением соответствующих ингибиторов),
инактивирующими главную дыхатель-
ную цепь митохондрий (рис. 15.10), а
также блокированием гена, кодирую-
щего динамин-подобный белок. Этот
белок необходим для одной из ранних
стадий апоптоза, опосредованного ми-
тохондриями, а именно фрагментации
протяженных митохондрий на мелкие.
В последнем случае удалось проследить
не только резкое замедление той ста-
дии жизни гриба, которая сопровожда-
ется суперпродукцией АФК, но и явное
CT^yPIED<S)IUlQMOI NKCTAIF>eO®DQ||Ne
NADH NADH
Рисунок 15.10. Дыхательные цепи подо-
споры дикого типа (слева) и ее долгожи-
вущего мутанта (справа)
уменьшение его чувствительности к апоптогенному действию Н2О2. Следу-
ет подчеркнуть, что переключение программы, предполагающей короткую
продолжительность жизни, на долгожительство может быть достигнуто и
без мутаций или ингибирования дыхательной цепи, а именно выращивани-
ем подоспоры в жидкой среде.
С. Хекими и сотрудники добились увеличения в 5,5 раза продолжитель-
ности жизни нематоды Caenorhabditis elegans. Это происходило в результате
мутации в генах инсулинового рецептора Daf-2 и фермента, катализирую-
щего конечный этап биосинтеза CoQ. С. Кэньон и ее коллеги достигли
еще большего (в семь раз) эффекта, выключив синтез Daf-2 и белков, от-
ветственных за половое размножение. При этом не было отмечено никаких
отличий в жизнедеятельности животных-долгожителей.
Дж. Пеличчи с сотрудниками обнаружили, что мутант мышей по гену
белка p66shc живет на 30% дольше, а полученные из таких животных фи-
бробласты не отвечают на перекись водорода включением программы апоп-
тоза*. Следующая цепь событий была выявлена у мышей дикого типа:
АФК повреждение ДНК р53 стабилизация p66shc [p66shc]T
комплекс цитохрома с и p66shc О2 —> открытие пор во внутренней
митохондриальной мембране апоптоз.
Наиболее интересно для нас комплексообразование p66shc и цитохрома
с, которое, по-видимому, придает этому цитохрому способность реагиро-
вать с О2, образуя супероксид.
In vivo нокаут гена p66shc вызывает понижение степени окислительного
повреждения как митохондриальной, так и ядерной ДНК в легких, печени,
селезенке, коже, скелетных мышцах и почках, но не в мозге и сердце. Это
коррелирует с содержанием «белка старения» в различных органах, которое
* Ср. с данными Т. Кирквуда и его сотрудников, показавших существование поло-
жительной корреляции между продолжительностью жизни различных млекопитающих и
устойчивостью их фибробластов к окислительному стрессу.
296 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
оказалось наиболее низким в мозге и сердце, т.е. в органах, стареющих, как
правило, в последнюю очередь.
В 1971 г. российский геронтолог В.М. Дильман постулировал, что ста-
рение находится под гормональным контролем, причем инсулин играет
роль фактора, стимулирующего старение. Позже эта мысль получила под-
тверждение в работах на эукариотах самого различного таксономического
положения. Как установил М. Блюхер с соавторами, нокаут инсулинового
рецептора в адипоцитах продлевает жизнь мышей на 18%. Независимо от
него, М. Хольценбергер с коллегами показали, что мыши, гетерозиготные
по рецептору инсулин-подобного фактора первого, живут на 26% дольше,
чем дикий тип. Эффект сопровождается понижением [p66shc] на 50%. Сре-
ди других участников системы, сокращающей жизнь мышей, были иден-
тифицированы белок Ras и Akt/PKB — протеинкиназа, фосфорилирующая
белки по серину и треонину.
Указания на сокращение продолжительности жизни инсулин-подобными
факторами были получены также на мухах и нематодах. У С. elegans мутация
в гене daf-2 удлиняет жизнь в 2—3 раза. У тех же животных, как выясни-
лось, NAD+-3aBHCHMa4 деацетилаза гистонов (белок SIR2.1) подавляет один
из инсулиновых регуляторных каскадов и увеличивает продолжительность
жизни. Повышение дозы гена sir2 у дрожжей продлевает им жизнь. В. Лон-
го и его сотрудники отмечали 2—3-кратное повышение продолжительности
жизни дрожжей путем делеции генов Ras2 и аналога гена Akt.
Существуют многочисленные свидетельства того, что повреждение
митохондриальной ДНК специфически участвует в регуляторном каскаде,
который обусловливает старение как дрожжей, так и животных. Совсем
недавно это положение было прямо подтверждено в элегантных опытах,
выполненных в лабораториях Н.-Г. Ларшона, Т.А. Проллы и Г. Зассенхауза.
Исследователи нашли, что экспрессия мутантной митохондриальной ДНК-
полимеразы, сохранившей способность синтезировать ДНК, но утратившей
возможность корректировать ошибки при этом синтезе, ведет к сильному
увеличению частоты мутаций митохондриальной ДНК, особенно в области
цитохрома Ь, значительному сокращению продолжительности жизни и по-
явлению многих типичных признаков старения. Группе Зассенхауза, модифи-
цировавшей ДНК-полимеразу только в сердечной мышце, удалось предот-
вратить эффект мутации, введя животному циклоспорин А, ингибитор пор
во внутренней мембране митохондрий.
15.4.5. АФК и старение
Полвека тому назад Д. Хармэн в США и вслед за ним Н.М. Эммануэль
в России выдвинули предположение, что старение есть результат повреж-
дения биополимеров (в первую очередь ДНК) посредством АФК. С тех пор
было обнаружено множество свидетельств в пользу справедливости этого
постулата, причем создалось впечатление, что первичной мишенью АФК
при старении служит ДНК митохондрий.
Уже нет сомнений, что с возрастом баланс систем генерации и обез-
вреживания АФК сдвигается таким образом, что возрастает как уровень
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 297
Рисунок 15.11. Д. Хармэн (слева) и Н.М. Эммануэль (справа)
АФК, так и степень повреждений, вызываемых АФК. Подобная ситуация
приводит к тому, что постепенно увеличивается число клеток, ушедших
в апоптоз. Погибшие клетки не заменяются в полной мере новыми, и в
результате уменьшается общее количество клеток в тех или иных органах и
тканях. Последнее ведет к снижению жизненных функций — основному
признаку старения организма. Главная беда старения не в том, что каждая
наша клетка работает все хуже, а в том, что клеток этих становится все
меньше и меньше. Типичный пример — старческая саркопения, т.е. умень-
шение числа клеток в скелетных мышцах*.
По данным некоторых исследователей, генерация Н2О2 митохондриями
различных тканей птиц существенно ниже, чем млекопитающих того же ве-
са. По данным группы С.Н. Аустада подобные различия наблюдаются также
и между летающими и наземными млекопитающими — летучей мышью и
землеройкой.
В лабораториях Р.С. Сохала, Г. Бархи и М. Бранда было независи-
мо показано, что продолжительность жизни теплокровных тем короче, чем
выше скорость генерации АФК при обратном переносе электронов через
комплекс I митохондриальной дыхательной цепи. Такой корреляции не на-
блюдалось, если измеряли генерацию АФК при прямом переносе электро-
нов через тот же участок цепи. Особенно обстоятельной оказалась работа
* Интересно, что эта особенность механизма старения была подмечена еще древни-
ми греками, приписывавшими богу врачевания Асклепию (у римлян он стал Эскулапом)
мысль о том, что «старение есть повреждение всего тела при полной неповрежденное™
его частей». Сказанное не означает, что в конце концов «части» организма не приходят в
негодность, но это терминальная стадия, наступающая гораздо позже того момента, когда
включилась программа старения.
298 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
группы М. Бранда, исследовавшей 12 видов различных млекопитающих (от
мыши до бабуина и коровы) и птиц (от перепелки до голубя). 11 видов
отлично легли на прямую, описывающую продолжительность жизни как
обратную функцию от скорости генерации АФК. И только один вид ока-
зался явным исключением из правила. Это был так называемый голый зем-
лекоп — африканский грызун размером с мышь, живший почти в 10 раз
дольше мыши, но образовывавший АФК быстрее, чем мышь. Однако это
тот случай, когда исключение лишь подтверждает правило. Дело в том, что
голый землекоп оказался единственным нестареющим существом в иссле-
дованной выборке видов.
15.4.6. Голый землекоп
Голый землекоп, по-английски naked mole-rat, латинское название
Heterocephalus glaber (Rodentia: Bathyergidae). — вид мелких грызунов, про-
должительность жизни которых в лабораторных условиях достигает 28 лет.
Многие заболевания, такие, как рак, атеросклероз, иммунодефициты, а
также некоторые виды боли у этих животных не обнаружены. Они живут
большими сообществами, состоящими из 200—300 «солдат», «царицы» и не-
скольких ее сексуальных партнеров. Только «царица» и ее «мужья» при-
нимают участие в размножении. В лабораторных условиях голые землеко-
пы умирают в возрасте 25—28 лет по неизвестным причинам. Уровень их
смертности не зависит от возраста, как будто программа старения у этих
животных отсутствует. Отключение программы происходит, по-видимому,
на этапах, следующих за образованием АФК, так как уровень образования
АФК при обратном переносе электронов и степень окисленности биопо-
лимеров у этих животных выше, чем у мышей. Приведенные наблюдения
неудивительны, если учесть, что активности супероксиддисмутазы и ката-
лазы у этих двух видов — одного порядка величины, а активность третьего
антиоксидантного фермента, глутатионпероксидазы, у голого землекопа в
70 раз ниже, чем у мыши. Ключ к пониманию этой парадоксальной си-
туации дает наблюдение, показавшее, что клетки голого землекопа чрез-
вычайно устойчивы к апоптозу, вызванному Н2О2. Этим голый землекоп
напоминает долгоживущих мышей с мутациями в генах, кодирующих белок
p66shc, фермент, участвующий в синтезе CoQ (mClkl), или киназу фактора
эдонгации-2. Их клетки резистентны и к апоптозу, вызванному перекисью
водорода или другим прооксидантом — менадионом.
Возможный механизм исчезновения функции, ставшей ненужной в
процессе эволюции голого землекопа, был недавно описан Парк и др. Бы-
ло установлено, что у этих грызунов отсутствует небольшой 11-членный
пептид, который называется субстанцией Р и участвует у других животных
в передаче некоторых видов болевых сигналов (в частности, болевого ответа
на капсаицин). Капсаицин, как и некоторые другие индукторы боли, не вы-
зывает поведенческого ответа на боль у голого землекопа. Чувствительность
к капсаицину можно восстановить, если ввести ДНК, кодирующую суб-
станцию Р, в ногу животного. Такая процедура не сказывается на чувстви-
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 299
тельности к боли других ног. Вполне возможно, что «царица» голых земле-
копов и ее «мужья» в природе не сталкиваются с внешними источниками
боли. В таком случае мутация, нарушающая процесс передачи сигнала от
болевых рецепторов кожи, будет нейтральной и избежит элиминации в про-
цессе естественного отбора. Аналогичным образом могла быть отключена
и программа старения, которая, согласно нашей гипотезе, дает эволюцион-
ные преимущества под давлением естественного отбора лишь при наличии
врагов. А у царицы, единственной особи, приносящей потомство и, стало
быть, участвующей в эволюционном процессе, врагов практически нет. От
них ее защищают жизнь в обширных подземных лабиринтах, охраняемых
армией многочисленных солдат, которые в естественных условиях живут
не более 3 лет и гибнут в борьбе со змеями, заползающими в их норы.
Похоже, что «реостатом», регулирующим продолжительность жизни, слу-
жит скорость образования АФК внутри митохондрий. Такой вывод хорошо
согласуется с цитированными выше данными Н.Г. Ларшсона и других о
прогерии, вызываемой нескорректированными ошибками при синтезе ми-
тохондриальной ДНК.
Итак, можно полагать, что реализация программы старения включает
запрограммированное в геноме усиление образования АФК митохондрия-
ми. Губительный эффект АФК может также усиливаться с возрастом за-
программированным ослаблением систем защиты от АФК в митохондриях
и других частях клетки. Наблюдения в пользу такого сценария развития
событий при старении можно найти в геронтологической литературе.
Возникает вопрос, почему в эволюции именно АФК были выбраны
в качестве инструмента старения? Нет сомнений, что АФК все еще пред-
ставляют проблему для современных аэробных форм жизни. Быть может,
именно поэтому старение как специализированный механизм эволюции
устроено таким образом, чтобы способствовать усовершенствованию анти-
оксидантной системы организма. В известном смысле АФК действуют на-
подобие лисы в приведенном выше примере улучшения заячьей породы,
но отбор идет не на лучший интеллект, а на лучшую систему защиты от
кислорода. Это обстоятельство является прямым следствием участия АФК
в осуществлении программ самоликвидации митохондрий, клеток, органов
и организмов.
Что же запускает программу старения? Нет сомнений, что такой запуск
происходит сравнительно рано, скорее всего, в момент прекращения роста
организма или даже еще раньше — при завершении полового созревания.
Простейший вариант состоит в том, что «хронометр», отсчитывающий годы
и дающий сигнал на прекращение роста, не только выключает программу
роста, но и запускает программу старения. Характерно, что такие неста-
реющие животные-долгожители, как жемчужница, щука, крупные крабы,
черепахи и киты, растут всю жизнь.
Следующий вопрос — где находится «хронометр» и что он собой пред-
ставляет? Если годы наш организм отсчитывает тем же способом, что и дни,
то «хронометр» старения надо искать в супрахиазматическом ядре гипота-
ламуса, которое ответственно за поддержание суточного ритма млекопи-
тающих. У птиц ту же функцию исполняет эпифиз. Эта железа играет роль
300 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
«Хронометр»
I1
Повышение уровня АФК
в митохондриях
I2
Превышение скорости апоптоза
над скоростью пролиферации
I3
Уменьшение количества
клеток в органах
I4
Ослабление
функций органов
Рисунок 15.12. Гипотетическая схема за-
программированного старения организма
(см. ст. В.П. Скулачева: Рос. хим. журнал.
2009. № 53. С. 125-140)
в суточном ритме и у млекопитающих,
но здесь ее работа запускается супра-
хиазматическим ядром.
В клетках супрахиазматического
ядра выявлены периодические био-
химические реакции, имеющие след-
ствием появление циклов возбуждения
и торможения этих клеток в суточном
ритме. Эти циклы передаются нейро-
нами в эпифиз, отвечающий на дан-
ный стимул колебаниями продукции
гормона мелатонина, который выде-
ляется клетками эпифиза и с кровью
переносится во все органы и ткани.
Суточные колебания мелатонина в
крови суть медиатор суточного ритма
функционирования организма. Мела-
тонин — сам по себе антиоксидант и,
что еще важнее, индуктор синтеза мно-
гих белков антиоксидантных каскадов.
Интересно, что амплитуда суточных
колебаний концентрации мелатонина
в крови резко снижается при старении, причем это снижение служит, по-
видимому, самым ранним признаком старения, проявляясь у людей с семи-
летнего возраста.
В целом гипотетическую программу старения организма млекопитаю-
щих можно представить себе следующим образом (рис. 15.12).
15.4.7. Парадокс белка р53
Как прервать программу старения человека, если она действительно
существует? Можно было бы нокаутировать гены, в которых эта программа
записана, но как их найти и как избежать возможных неблагоприятных по-
следствий такого вмешательства? Показателен пример с белком р53. Л. До-
нехауэр и его сотрудники обнаружили, что мутация, повышающая актив-
ность белка р53, приводит к исключению рака из списка причин смертности
животных. Поскольку обычно почти каждая вторая старая мышь умирает от
рака, можно было бы ожидать, что исследуемая мутация значительно уве-
личит мышиную продолжительность жизни. К вящему изумлению исследо-
вателей жизнь мутантов, вместо того чтобы удлиниться, в действительности
сократилась на 20%. Впоследствии И. Гарсия-Као с коллегами, также полу-
чившие активацию р53, но, по-видимому, не столь значительную, как До-
нехауэр, наблюдали уменьшение случаев злокачественных опухолей с 45 до
17%, но не обнаружили статистически достоверного изменения продолжи-
тельности жизни. Этот результат, в общем-то, согласуется с данными До-
нехауэра, поскольку столь заметное снижение частоты заболеваний раком
должно было бы продлить жизнь, чего в действительности не наблюдалось.
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 301
Недавно Г. Скрэйбл и его сотрудники активировали р53 еще одним, веро-
ятно, наиболее эффективным способом, так что продолжительность жизни
мышей снизилась втрое.
Белок р53 известен как «страж генома». Он ответственен за стимуля-
цию репарации ДНК, арест клеточного цикла и апоптоз в ответ на увели-
чивающуюся степень повреждения ДНК. Кроме того, как ясно из опытов
Донехауэра и других, р53 стимулирует старение. Сказанное означает, что
мутанты, утратившие ген р53, которые, казалось бы, должны победить в
процессе естественного отбора как «вечно молодые», в действительности
проигрывают из-за появления брешей в эшелонированной системе защиты
генома и, стало быть, антираковой защите. В полном соответствии с этой
логикой мутанты без р53 жили гораздо меньше, чем дикий тип, погибая
исключительно от рака. Простейшее объяснение прогерического эффекта
р53 состоит в следующем. По-видимому, этот белок выбраковывает клетки
с нарушениями в геноме, но выполняет такую функцию слишком рьяно.
В итоге от апоптоза гибнут не только клетки, вступившие на путь малиг-
низации, но также и те, что могли бы еще жить и жить без всякого зло-
качественного перерождения. Как прямое следствие этого обстоятельства
старение стимулируется на стадии 2 (см. схему, приведенную выше).
Итак, сегодня мы могли бы ответить на вопрос, так мучивший Вейсма-
на много лет назад: «Не может быть никаких сомнений, что высшие орга-
низмы устроены таким образом, что содержат в себе семена смерти. Вопрос
лишь в том, как они, эти семена, могли возникнуть».
15.4.8. Снижение митохондриальных АФК
как возможный способ торможения программы старения
Очевиден один из подходов к тому, чтобы прервать программу старения.
Если необходимым этапом такой программы служит появление с возрастом
избытка АФК в митохондриях, давайте уберем этот избыток. На первый
взгляд, подобный эффект могли иметь природные вещества-антиоксиданты,
такие, например, как витамин Е, накапливающийся в мембранах. Однако
никому не удавалось радикально замедлить старение людей и животных
такими антиоксидантами. По-видимому, попытка отменить старение (как
и любую другую биологическую программу) наталкивается на противодей-
ствие организма, упорно пытающегося эту программу выполнить. Так, ока-
залось, что повышение потребления витамина Е ведет к индукции в печени
особой формы цитохрома Р450, который разрушает избыток витамина Е,
поступающего в организм. Вот почему в качестве инструмента для отмены
программы старения лучше использовать синтетические антиоксиданты,
причем специфически адресованные в митохондрии, коль скоро их мише-
нью должны быть, прежде всего, внутримитохондриальные АФК. Вопрос
состоит в том, как адресовать антиоксидант в митохондрии.
В конце 1960-х гг. нами совместно с группой Е.А. Либермана были опи-
саны гидрофобные катионы и анионы, заряд которых сильно делокализован
(«размазан») по достаточно большой органической молекуле. Впоследствии
302 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
американский биоэнергетик Д. Грин назвал по-
добные вещества ионами Скулачева (Sk+ и Sk“).
В силу своей низкой гидратации (диполи воды
не могут образовать «водную шубу» вокруг иона,
если его заряд делокализован) Sk+ и Sk~ легко
проникают через мембраны, распределяясь меж-
ду двумя разделенными мембраной отсеками в
соответствии с законом Нернста (10-кратный
градиент концентрации иона на каждые 60 мВ
АТ). Ввиду логарифмической зависимости ион-
ного градиента от АТ, митохондрия, имеющая
АТ = 180 мВ (внутри знак минус), способна
поддерживать 1000-кратный градиент Sk+. В ка-
честве примера проникающих ионов мы иссле-
довали катион тетрафенилфосфония и анион
тетрафенилбора. Позже С.Е. Северин, Л.С. Ягу-
жинский и один из авторов этой книги (В.П.С.)
выдвинули предположение, что ионы типа Sk+
могут быть «молекулами-электровозами»: если необходимо доставить не-
которое вещество X в митохондрии, достаточно присоединить к нему Sk+.
Такое предположение основывалось на том, что матрикс митохондрий —
это единственное ограниченное мембраной пространство внутри клетки,
заряженное отрицательно относительно цитозоля.
Подобная логика была использована нами для объяснения роли ка-
тионной группы карнитина в транспорте в митохондрии остатков жирных
кислот, а затем М. Мерфи и Р. Смитом — для конструирования антиокси-
дантов, адресованных в митохондрии. В большинстве работ Мерфи исполь-
зовалось вещество под названинем MitoQ, где в качестве антиоксиданта был
выбран убихинон, а в качестве Sk+ — катион децилтрифенилфосфония.
Мы подтвердили способность микромолярных концентраций MitoQ
накапливаться в митохондриях и защищать их от окислительного стрес-
са. Однако, как показал в нашей группе М.Ю. Высоких, даже небольшая
передозировка этого вещества ведет к изменению знака эффекта: MitoQ
становится мощным прооксидантом, катализируя генерацию Н2О2 мито-
хондриями с рекордной скоростью (того же порядка, что скорость дыхания
митохондрий в отсутствие ADP). Такие же наблюдения были сделаны и в
трех других лабораториях, в том числе и в группе Мерфи.
ГЛАВА шестнадцатая
ПРОЕКТ ПО АНТИОКСИДАНТАМ,
АДРЕСОВАННЫМ В МИТОХОНДРИИ
16.1. SkQ тормозит программу старения
Когда стало очевидным, что MitoQ вряд ли является реальным кандидатом
на роль антиоксиданта, адресованного в митохондрии с целью затормозить
программу старения, мы обратились к пластохинону — переносчику элек-
тронов, действующему вместо убихинона в фотосинтетических электрон-
транспорных цепях хлоропластов растений и цианобактерий. В процессе
эволюции возможной причиной замены убихинона, участвующего в ды-
хательной цепи митохондрий, на пластохинон в хлоропластной фото цепи
той же растительной клетки могли быть именно лучшие антиоксидантные
свойства пластохинона по сравнению с убихиноном, описанные В.А. Рогин-
ским в химических опытах на модельных системах. Фактически образующий
кислород хлоропласт всегда находится в условиях гораздо более сильного
окислительного стресса по сравнению с митохондриями, поглощающими этот
кислород. Пластохинон в отличие от убихинона имеет метильные группы
вместо метоксильных, а метильная группа убихинона заменена на водород
(рис. 16.1). Оказалось, что такие замены резко повышают антиоксидантную
активность полученного соединения в биологических системах. Если для
Катион тетрафенилфосфония
SkQ1 — митохондриально-адресованный антиоксидант
Рисунок 16.1. Структурные формулы тетрафенилфосфония и антиоксиданта SkQl
304 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
[Хинон], М
актив-
Рисунок 16.2. Прооксидантная (верхняя панель) и антиоксидантная (нижняя панель)
ности SkQ и его аналогов на выделенных митохондриях. Прооксидантную активность измеряли
по ускорению образования митохондриями Н2О2. Антиоксидантную активность измеряли по
торможению накопления малонового диальдегида в митохондриях. Отрезки прямых под осью
абсцисс показывают размер «окна» между концентрациями, при которых соответствующие
производные хинонов вызывают 20% анти- и 20% прооксидантный эффекты [Skulachev et al.,
Biochim. Biophys. Acta 2009, 1787: 437—461]
Глава 16. Проект по антиоксидантам, адресованным в митохондрии 305
MitoQ концентрации, вызывающие анти- и прооксидантные эффекты, раз-
личаются менее, чем вдвое (300 и 500 нМ), то для пластохинонового произ-
водного децилтрифенил фосфония, названного SkQl, это различие возросло
до 400 раз (2 и 800 нМ, см. рис. 16.2).
С получением этого результата стало ясно, что в наших руках оказал-
ся уникальный по своей эффективности антиоксидант, действие которого
специфически направлено на митохондрии и не осложнено побочным про-
оксидантным действием.
В связи с этим следует указать, что наши работы по SkQ финансиро-
вались в 2003—2005 гг. в основном благотворительным фондом «Паритет»
(позже «Вольное дело») О.В. Дерипаски, а с 2005 по 2008 г. — им же, но
теперь в рамках инвестиционного проекта. В 2008 г. Дерипаска прервал
финансирование проекта в связи с кризисом. В течение семи очень трудных
месяцев проект поддерживался управляющей компанией В. В. Перехватова
«Иконтри». С мая 2009 г. финансирование взяла на себя компания «Исток»
А.В. Чикунова. В сентябре 2010 г. к финансовой поддержке проекта при-
соединилась госкорпорация Роснано (генеральный директор А.Б. Чубайс).
Все это время гарантом «непотопляемости» проекта служила наша Alma
Mater — МГУ и ее ректор В.А. Садовничий, председатель наблюдательного
совета проекта (научным руководителем является один из авторов книги —
В.П. Скулачев, а его заместителями — сотрудники МГУ М.В. Скулачев и
Б.В. Черняк). За годы, прошедшие с начала проекта, был проведен ши-
рокий круг экспериментов — от синтеза новых веществ до их испытаний
in vivo на различных живых организмах. Экспериментальные данные, по-
лученные в этих исследованиях, изложены в 10 статьях, опубликованных
в 2007—2010 журналами «Биохимия», J. Membr. Biol., FEBS Lett., Biochim.
Biophys. Acta, Aging и Proc. Natl. Acad. Sci. USA. Результаты «мегапроекта»,
в котором были задействованы сотрудники Института физико-химической
биологии им А.Н. Белозерского и ряда факультетов МГУ, а также более 30
других исследовательских институтов в России, Швеции и США, можно
суммировать следующим образом.
Прежде всего была выполнена работа, которую можно определить как
нанобиоинженерию: синтезировали серию небольших (размером около
2 нм) «молекул-электровозов», конъюгированных с различными хинона-
ми. В этих веществах в качестве Sk+ использовали децил- или амилтрифе-
нилфосфоний (соответственно SkQl и SkQ5), децилродамин 19 (SkQRl),
децил метил карнитин (SkQ2), децилтрибутиламмоний (SkQ4), а также ана-
логичные производные метилпластохинона (SkQ3), убихинона (MitoQ),
дезметоксиубихинона (DMQ) и ряд других (Г.А. Коршунова и сотр.). На
искусственной бислойной фосфолипидной мембране (БЛМ) оценена про-
никающая способность этих веществ, которая уменьшалась в ряду: SkQRl >
SkQl, SkQ3, MitoQ > SkQ5 > SkQ4 (И.И. Северина, Ю.Н. Антоненко и
сотр.). Антиоксидантные свойства, проверенные в водных растворах, на
БЛМ, липосомах, мицеллах линолевой кислоты и митохондриях, оказались
следующими: SkQRl, SkQl > SkQ3, DMQ > MitoQ. В противоположном
порядке изменялись прооксидантные свойства исследованных соединений,
которые оказались максимальными у MitoQ (М.Ю. Высоких, Э.К. Рууге,
306 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
Mito-YFP SkQRl наложение
Рисунок 16.3. Совпадение локализации SkQRl (флуоресцентное производное SkQ) и флуорес-
цирующего белка медузы YFP, содержащего пептид с митохондриальным адресом 8-й субъеди-
ницы цитохромоксидазы. Клетки HeLa трансфецировали плазмидой, кодирующей Mito-YFP,
и инкубировали с 100 нМ SkQRl в течение 15 мин. [Skulachev et al., Biochim. Biophys. Acta
2009, 1787: 437-461]
Ю.Н. Антоненко, B.A. Рогинский и сотр.). Исходя из этих данных для даль-
нейших опытов были выбраны SkQl и его флуоресцирующее производное с
большей проникающей способностью — SkQRl.
На сердечных митохондриях in vitro было показано, что SkQl может
восстанавливаться дыхательной цепью, т.е. служить возобновляемым антиок-
сидантом многократного действия. Местом восстановления оказался гем Z>H
комплекса III, расположенный вблизи внутренней поверхности внутренней
мембраны митохондрий (то место, которое атакуется антимицином, см. вы-
ше, рис. 4.3Л; М.Ю. Высоких и сотр.).
Используя SkQRl, мы выяснили, что вещества класса SkQ, добавлен-
ные к клеточной культуре, избирательно накапливаются в митохондриях
(Б.В. Черняк и сотр., рис. 16.3). Далее оказалось, что исследованные ве-
щества тормозят апоптоз клеток HeLa и фибробластов человека, вызван-
ный Н2О2 (активность: SkQRl > SkQl > MitoQ; рис. 16.4). Некроз, инду-
цированный АФК, также был чувствителен к SkQ (Б. В. Черняк и сотр.).
На грибе Podospora anserine, рачке Ceriodaphnia affinis, дрозофиле, зубастом
карпике Nothobranchius furzeri и мышах SkQl увеличивал медианную про-
должительность жизни (на мышах — до двух раз; рис. 16.5; М.Ю. Высо-
ких, О.Ф. Филенко, Е.Г. Пасюкова, К.А. Шидловский и В.Н. Анисимов).
Во всех случаях SkQl особенно эффективно уменьшал смертность на ран-
них стадиях старения (первые 20% смертей), но слабо влиял на макси-
Рисунок 16.4. Взаимодействие SkQl, SkQRl и MitoQ с человеческими клетками в культуре.
А — кинетика накопления SkQRl в клетках HeLa и его выхода из клеток. В начальный момент
времени к клеткам добавляли 50 нМ SkQRl. Там, где указано, добавлен разобщитель (10 мкМ
FCCP). Накопление и выход SkQRl измеряли флуориметрически с помощью проточного цито-
метра. Б — предынкубация фибробластов человека в течение 7 дней с 20 нМ SkQl предотвращает
апоптоз, вызванный Н2О2. Апоптозные клетки подсчитывали через 24 ч после добавки Н2О2.
Добавки: 1 мкМ FCCP, 400 мкМ Н2О2. В — SkQl и SkQRl предотвращают Н2О2-зависимый
апоптоз человеческих фибробластов более эффективно, чем MitoQ. Условия как в Б. Г — SkQl
(20 нМ, 7 дней) предотвращает накопление Н2О2 в клетках HeLa, обработанных внешним
Н2О2 (200 мкм, 45 мин). Клетки окрашивали 4 мкм DCF в течение 15 мин и анализировали
с помощью проточного цитометра. Д — SkQRl, SkQl и MitoQ предотвращают фрагментацию
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
307
и
*
ш
§
Г
1
митохондрий, вызванную Н2О2. Фибробласты человека предынкубировали с SkQRl, SkQl или
MitoQ в течение 2 ч и затем обрабатывали 400 мкМ Н2О2 в течение 3 ч. Е — SkQl предотвращает
некроз, вызванный фотодинамической обработкой клеток HeLa, окрашенных митотрекером
красным. Клетки освещали 15 мин зеленым светом (545 нм) так, что освещенность состав-
ляла 34,8 Дж/см2. Некроз измеряли через 5 ч после освещения. Клетки обрабатывали 1 мкМ
SkQl, смесью 1 мкМ тетрафен ил фосфония (ТРР) и 1 мкМ децилпластохинона (DPQ), 20 мМ
N-ацетилцистеина (NAC) или 1 мМ тролокса за 1 ч до освещения [Skulachev et al., Biochim.
Biophys. Acta 2009, 1787: 437-461]
308 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
10(М
л 75-
8
ЗЕ 50-
in
S
*25-
3
m
о+
0
—БЕЗ SkQ1
0,5 нмоль 8кО1/кг х день
—5 нмоль 8кО1/кг х ДЕНЬ
—*—50 нмоль 8кО1/кг х день
100 200 300 400 500 600 700 800 900 1000
Возраст, дни
Рисунок 16.5. SkQl увеличива-
ет продолжительность жизни
мышей SHR. На рисунке
суммированы данные двух
экспериментов на 200 самках.
В каждом опыте анализиро-
вали 4 группы мышей по 25
животных в каждой группе
[Skulachev et al., Biochim.
Biophys. Acta 2009, 1787: 437-
461]
мальную продолжительность жизни (последние 10% смертей). В результате
наблюдалась ректангуляризация (увеличение наклона) кривых смертности.
На мышах, содержавшихся в нестерильном виварии, SkQl, добавленный в
питьевую воду (0,5—5 нмоль/кг в день), резко уменьшал смертность от ин-
фекционных заболеваний, но слабо влиял на смертность от рака на поздних
возрастах (В.Н. Анисимов и сотр.). На мышах и крысах было показано,
что SkQl замедляет развитие таких признаков старения, как инволюция
тимуса* и фолликулярной области селезенки, уменьшение соотношения
лимфоцитов и нейтрофилов в крови, остеопороз, горбатость, катаракта,
ретинопатия, глаукома, облысение, поседение, исчезновение астральных
циклов у самок и полового влечения у самцов, гипотермия, оцепенение и
т.д. (Н.Г. Колосова, В.Н. Анисимов, Н.И. Дризе, А.Г. Рязанов, Б. Кэннон
и сотр.; рис. 16.6, 16.7). На фибробластах, изолированных из мышей, полу-
чавших или не получавших SkQ в течение всей жизни, было показано, что
SkQl предотвращает появление с возрастом р-гликозидазной активности и
фосфорилирование гистона Н2АХ. На этой же модели удалось наблюдать
возрастное увеличение спонтанного апоптоза и его стимуляцию добавлен-
ной перекисью водорода, причем эти эффекты полностью снимались SkQl
(И.М. Спивак, В.М. Михельсон и сотр.). Существенно, что SkQl не полно-
стью прекращал апоптоз, а лишь предотвращал его трехкратное усиление у
старых мышей. Именно такого результата можно было ожидать, исходя из
нашей схемы старения организма (см. выше, рис. 15.12).
В ряде случаев удалось наблюдать, как SkQ тормозит развитие уско-
ренного старения (прогерии). Это было показано на крысах OXYS, стра-
дающих от постоянного окислительного стресса, где прием SkQl с пищей
(250 нмоль/кг) не только предотвращал (и даже обращал) ранние катаракту
* Исчезновение тимуса с возрастом — один из наиболее демонстративных приме-
ров запрограммированности старения. Этот эффект, конечно же, не может объяснить-
ся накоплением каких-то ошибок в стареющем организме. Несомненно, инволюция
тимуса — органа, образующего Т-лимфоциты, одного из центральных типов клеток
иммунной системы организма, — ведет к ослаблению иммунитета. Данные изменения
усугубляются протекающей параллельно инволюцией фолликул селезенки, где образуются
B-лимфоциты — другой важнейший тип иммунных клеток. Оба эти явления тормозятся
(но не отменяются полностью) посредством SkQl. Так, по данным Л.А. Обуховой, объем
тимуса у 14-месячных крыс составил 27 ± 7 мм3 в контроле и 44,5 ± 5 мм3, если животные
получали SkQ. У 2-месячных крыс этот параметр был равен 180 ± 20 мм3.
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
309
и ретинопатию, но и препятствовал на-
коплению в тканях окисленных липидов
и белков (Н.Г. Колосова, Р.А. Зиновкин
и сотр.). В случае катаракты и дистро-
фии сетчатки удалось показать, что глаз-
ные капли 2,5 • 10-7М SkQl вылечивают
уже развившееся заболевание за 1,5 мес.
Оказалось также, что подобная терапия
эффективна в отношении катаракты у
обычных крыс линии Вистар. Что каса-
ется дистрофии сетчатки, то крысы ли-
нии Вистар редко доживают до нее, так
что пришлось сменить объект исследова-
ния. Как показала работа, проведенная
сотрудниками Ветеринарной Академии
им. К.И. Скрябина Е.П. Копенкиным и
Л.Ф. Сотниковой, капли SkQl помогают
при ретинопатиях у собак, кошек и ло-
шадей. Всего SkQl получало 271 живот-
ное, причем для всех традиционные спо-
собы лечения оказались неэффективны.
Особенно яркий положительный эффект
был обнаружен при врожденной диспла-
зии сетчатки (радикальное улучшение в
67% случаев) и при ее вторичной деге-
нерации (54%). При прогрессирующей
дегенерации сетчатки SkQl был менее
эффективен (29%). В 89 случаях нашими
пациентами оказались недавно ослеп-
шие животные. В 67 случаях они прозре-
ли после курса капель 2,5 • 10-7М SkQl в
Рисунок 16.6. Мыши SHR в возрасте 630
дней, получавшие 0,5 нмоль SkQl/кг в
день (вверху) и не получавшие препара-
та (внизу). Видны признаки старения у
мыши без SkQl (горбатость, отсутствие
вибрисс, облысение на щеках, плеши
на боку). У мыши, получавшей SkQl,
эти признаки отсутствуют [Skulachev et
al., Biochim. Biophys. Acta 2009, 1787:
437-461]
течение двух-шести недель.
Эти положительные результаты контрастируют с неудачей сотрудников
группы Мерфи, пытавшихся лечить посредством MitoQ врожденные рети-
нопатии мышей. По-видимому, все дело в том, что эффективные концен-
трации MitoQ, вызывающие антиоксидантное действие, находятся слиш-
ком близко от таковых, вызывающих прооксидантный эффект. На другую
возможность указывают авторы статьи: может быть, исследованные ретино-
патии принципиально не лечатся антиоксидантами.
В завершение этой серии исследований мы обратились к глазным болез-
ням животных, вызванным искусственно, а именно к экспериментальным
увеиту (И.И. Сенин и сотрудники) и глаукоме (В.П. Еричев и сотрудни-
ки). Обе эти болезни, как известно, связаны с сильнейшим окислительным
стрессом, и в обоих случаях капли SkQl оказывали лечебный эффект. Осо-
бенно показательны оказались опыты с увеитом. Это аутоиммунное заболе-
вание вызывали иммунизацией кроликов арестином — белком фоторецеп-
торных клеток. Болезнь приводила к слепоте, после чего в один глаз капали
310 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
Рисунок 16.7. SkQl предотвращает развитие катаракты
и ретинопатии у крыс OXYS. Электроретинограммы
трех крыс возрастом (1) 3 месяца (красный), (2) 24
месяца без SkQl (черный) и (3) 24 месяца с 250 нмоль
SkQl/кг х день (зеленый) [Skulachev et al., Biochim.
Biophys. Acta 2009, 1787: 437-461]
2,5 10-7 M SkQl четырежды в
день. Спустя несколько дней
животные начинали видеть,
но только тем глазом, который
получал SkQl. Та же процедура
предотвращала развитие увеи-
та, если капли давали в период
иммунизации. При этом успех
достигался в 100% случаев как
при предотвращении увеита,
так и при лечении уже развив-
шегося заболевания.
Возвращаясь к прогерии у
крыс OXYS, отметим, что на
этой модели SkQl предотвра-
щал уменьшение с возрастом
количества клеток тимуса и
первичных фолликул селе-
зенки, ответственных за обра-
зование соответственно Т- и В-лимфофитов, играющих ключевые роли в
работе иммунной системы (опыты Л.А. Обуховой, Н.Г. Колосовой и сотр.).
При прогерии, вызванной облучением, SkQl снимал такой эффект старения,
как поседение (в опытах использовали черных мышей; А.Г. Рязанов, США).
Чрезвычайно интересными оказались результаты, полученные на мутант-
ных мышах, где прогерию вызывали заменой 257-го аспартата на аланин в
корректорском домене митохондриальной ДНК-полимеразы у (эти мутанты
уже обсуждались выше в связи с ролью митохондрий в старении организма).
Введение таким мутантам SkQl с питьем вызвало увеличение продолжитель-
ности жизни и, что еще более важно, продлило период молодости: мыши
с SkQl умирали без целого букета старческих болезней, которые наблюда-
лись у погибающих мутантов, не получавших SkQl: остеопороза (горбато-
сти), облысения на щеках и на теле, оцепенения, снижения температуры
тела, исчезновения эстральных циклов и т.д. Эффект SkQl на смертность от
инфекционных заболеваний в этих опытах не исследовался, так как мыши
содержались в стерильных условиях (Б. Кэннон и сотр., Швеция).
Как показали дальнейшие опыты, введение животному SkQl или SkQRl
резко снижает неблагоприятный эффект ишемии и последующей реперфу-
зии на ритм сердца, уменьшает зоны инфаркта миокарда и инсульта го-
ловного мозга. Оба эти препарата предотвращали гибель крыс, у которых
была удалена одна почка, а другую подвергли 90-минутной ишемии (груп-
пы В.И. Капелько и Д.Б. Зорова; рис. 16.8). На р53-/~ мышах SkQl или не-
адресованный антиоксидант N-ацетилцистеин (NAC) тормозили развитие
лимфом, снижали уровень АФК в селезенке и продлевали жизнь, причем
SkQl достаточно было вводить в количестве 5 нмоль/кг в день. Для тако-
го эффекта требовалось 6 ммоль NAC/кг в день, т.е. в 1,2 млн раз больше,
чем SkQl (группа Б.П. Копнина). Еще меньшие количества SkQl оказались
активны при борьбе с сердечной аритмией крыс и при увеличении про-
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
311
Рисунок 16.8. Выживание крыс
с одной почкой, подвергнутых
90-минутной ишемии с после-
дующей реперфузией. SkQl или
SkQRl были инъецированы вну-
трибрюшинно за сутки до ишемии
[Skulachev et al., Biochim. Biophys.
Acta 2009, 1787: 437-461]
100
o
О
s
Ф
CO
20-
80-
60<
40-
SkQ1, 1 мкмоль/кг
SkQRl, 1 мкмоль/кг
SkQl, 0,1 мкмоль/кг
SkQ1, 0,005 мкмоль/кг
без SkQ
*
m
01 । । । « । । । । । । ।
0 2 4 6 8 10 12 14
Дни после ишемии
должительности жизни мышей: 0,05 и 0,5 нмоль (что соответствует 0,025 и
0,25 нг) на кг веса животного в день. Эффективность столь малых количеств
SkQ объясняется несколькими обстоятельствами.
(1) SkQl электрофоретически накапливается в цитозоле клеток при-
мерно в 10-кратном избытке по сравнению с концентрацией снаружи клет-
ки. Это происходит под действием разности электрических потенциалов на
внешней клеточной мембране (Д\|/ около 60 мВ).
(2) Еще более значительное (тысячекратное) накопление имеет место в
митохондриях (Д\|/ порядка 180 мВ).
(3) Коэффициент распределения в системе октанол / вода для SkQl
оказался около 13 000. Поэтому концентрация SkQl во внутреннем полу-
мембранном слое внутренней мембраны митохондрий должна быть в 10 х
103х 1,3 х 104 = 1,3 х 108 раз больше, чем во внеклеточном пространстве.
Что касается механизма антиоксидантного действия SkQ, то он может
быть двояким. Во-первых, SkQH2, накапливаясь во внутреннем полумем-
бранном слое митохондриальной мембраны, способен гасить пероксильные
радикалы полиненасыщенных жирных кислот (LO2*) фосфолипидов, нахо-
дящихся в этом слое (прежде всего кардиолипина). Тогда ЬО2* превраща-
ется в перекись жирной кислоты (LOOH), и прерывается цепная реакция
окислительного повреждения липидов митохондрий:
LO2* + SkQH2 -> LOOH + SkQH’. (16.1)
Полученный SkQH’ восстанавливается цитохромом /?н комплекса III
дыхательной цепи вблизи внутренней поверхности мембраны с регенераци-
ей исходного SkQH2:
SkQH’ + цитохром />н2+ + Н+ -> SkQH2 + цитохром />н3+.
Что касается остатка перекиси жирной кислоты (LOOH), то он отще-
пляется от кардиолипина и переносится из внутреннего во внешний полу-
мембранный слой в виде аниона перекиси жирной кислоты с последующим
расщеплением при участии цитохрома с или особой глютатионпероксида-
зы, способной использовать перекиси липидов в качестве субстратов. При
312 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
этом роль переносчиков могли бы играть либо минорные разобщающие
белки (UCP2, UCP3, UCP4 или UCP5, см. выше разд. 10.2.2), либо все тот
же SkQ(H2). Как недавно было показано в нашей группе И.И. Севериной,
Ф.Ф. Севериным, Ю.Н. Антоненко, М.Ю. Высоких и сотр., SkQ и его ана-
лог, не содержащий пластохинона (С12ТРР), могут служить переносчиками
анионов жирных кислот в искусственных и митохондриальных мембранах.
Эта дополнительная активность SkQ позволяет рассматривать его как разоб-
щитель, адресованный в митохондрии. Замечательно, что SkQ, в отличие от
классических протонофоров типа динитрофенола, должен действовать как
«мягкий» разобщитель. Сбрасывая Д\|/, SkQ предотвращает свое собствен-
ное накопление в митохондриях, и потому максимальный протонофорный
эффект можно ожидать только при высоких значениях Ду. Именно такое
«мягкое» разобщение является оптимальным механизмом, предотвращаю-
щим генерацию АФК митохондриями: небольшое снижение Ду резко тор-
мозит образование АФК, но не препятствует синтезу АТР. Наши данные
можно сопоставить с недавними результатами В.И. Падалко и А. Ковалтов-
ски о продлении жизни дрозофил и мышей и предотвращении окисления
биополимеров при старении малыми дозами разобщителя динитрофенола.
В табл. 16.1 суммированы наши результаты, полученные при исследова-
нии воздействия SkQl и SkQRl на животных in vivo. Как видно из таблицы,
26 различных признаков старения отступают под действием SkQ, что по-
зволяет определить наши вещества как мощные геропротекторы.
Подытоживая сказанное выше, мы можем заключить, что соединения
класса SkQ представляют собой наиболее активные из известных геропро-
текторов, снижающих смертность на ранних и средних этапах старения и
предотвращающих появление большой группы старческих дефектов. Ины-
ми словами, SkQ способен продлить молодость экспериментальных живот-
ных*. В какой мере подобный эффект возможен, если речь пойдет о людях,
должны показать клинические испытания SkQl, которые уже начались.
* Говоря о продлении молодости, мы хотели бы подчеркнуть, что отмена программы
старения как ослабления с возрастом основных жизненных функций еще не означает для
индивида личного бессмертия. Если рассматривать программу старения как биологический
механизм, ускоряющий эволюцию, то вряд ли увеличение максимальной продолжитель-
ности жизни должно быть непременным следствием отмены такой программы. Вклад
долгожителей-«аксакалов» в общую продуктивность популяции невелик из-за их мало-
численности. Более того, с возрастом могут накапливаться повреждения генома не только
под действием запрограммированного повышения уровня АФК, но и по другим причинам,
действие которых продолжается всю жизнь. Это обстоятельство особенно опасно для самок:
ДНК их яйцеклеток должно сохраниться интактным на протяжении всей жизни особи.
Поэтому неудивительно, что начиная с некоего возраста самки теряют способность к раз-
множению. Наступает менопауза, которая особенно продолжительна у людей и китов, но
есть даже у мушки дрозофилы. Не случайно на ранних и средних стадиях старения вклад
в смертность соответствующей программы велик, а ее отмена посредством SkQ заметно
повышает продолжительность жизни. Однако с возрастом появляются другие причины
смерти, как правило не зависящие от программы старения и, стало быть, не отменяемые
SkQ. Среди этих причин главной служит рак, который тоже является феноптозной про-
граммой, но иной функциональной направленности: в этом случае речь, по-видимому,
идет о выбраковке индивидов, допустивших перегрузку генома ошибками.
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
313
Таблица 16.1. SkQ тормозит осуществление программы старения животных (медлен-
ного феноптоза) и гибели животных после кризиса (острого феноптоза)
Результат Виды Тип воздействия
1 Увеличение средней продол- жительности жизни Гриб Podospora anserina Добавление SkQl к среде роста
2 Увеличение средней продол- жительности жизни Ракообразное Ceriodaphnia afflnis Добавление SkQl к аквари- умной воде в течение всей жизни
3 Увеличение средней продол- жительности жизни Насекомое Drosophila melanogaster Добавление SkQl к пище в течение всей жизни
4 Увеличение средней и макси- мальной продолжительности жизни Рыба Nothobranchius furzeri Добавление SkQl к аквари- умной воде в течение всей жизни
5 Увеличение средней продол- жительности жизни Мыши Прием SkQl с питьевой во- дой в течение всей жизни
6 Увеличение средней и макси- мальной продолжительности жизни «Мутаторные» мыши Прием SkQl с питьевой во- дой в течение всей жизни
7 Увеличение средней и макси- мальной продолжительности жизни р53-/“ мыши или бестимус- ные мыши с привитой цер- викальной кар- циномой шейки матки SiHa Прием SkQl с пищей в течение всей жизни
8 Снижение уровня пероксидов в крови Крысы Ежедневное вливание рас- твора SkQl в защечные мешочки в течение 14 дней
9 Снижение в крови количества 8-окси-2’-дезоксигуанозина Крысы Ежедневное вливание рас- твора SkQl в защечные мешочки в течение 14 дней
10 Уменьшение хромосомных аббераций Крысы Ежедневное вливание рас- твора SkQl в защечные мешочки в течение 14 дней
11 Уменьшение перекисного окисления липидов и карбо- нилирования белков Крысы линии OXYS Прием SkQl с пищей в течение всей жизни
12 Предотвращение уменьшения уровня кардиолипина «Мутаторные» мыши Прием SkQl с питьевой во- дой в течение всей жизни
13 Предотвращение уменьшения соотношения в кардиолипине ненасыщенных и насыщен- ных жирных кислот «Мутаторные» мыши Прием SkQl с питьевой во- дой в течение всей жизни
314 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
Продолжение табл. 16.1
Результат Виды Тип воздействия
14 Предотвращение возраст- зависимого апоптоза фибро- бластов, вызванного окисли- тельным стрессом Мыши Прием SkQl с питьевой во- дой в течение всей жизни
15 Предотвращение возраст- зависимого увеличения р-га- лактозидазы в фибробластах Мыши Прием SkQl с питьевой во- дой в течение всей жизни
16 Предотвращение возраст- зависимого увеличения фосфорилирования гистона Н2АХ в фибробластах Мыши Прием SkQl с питьевой во- дой в течение всей жизни
17 Предотвращение возраст- зависимого миелоидного сдвига формулы крови Мыши Прием SkQl с питьевой во- дой в течение всей жизни
18 Замедление возраст- зависимого повреждения гематопоэтической системы Мыши Прием SkQl с питьевой во- дой в течение всей жизни
19 Снижение смертности от инфекций Мыши Прием SkQl с питьевой во- дой в течение всей жизни
20 Замедление возраст- зависимой инволюции тимуса и фолликулов селезенки у крыс OXYS Крысы линии OXYS Прием SkQl с пищей в течение всей жизни
21 Замедление возраст- зависимого остеопороза Крысы линии OXYS Прием SkQl с пищей в течение всей жизни
22 Предотвращение возраст- зависимого лордокифоза Мыши Прием SkQl с питьевой во- дой в течение всей жизни
23 Предотвращение возраст- зависимого снижения скоро- сти заживления ран Крысы Прием SkQl с питьевой во- дой в течение всей жизни
24 Предотвращение возраст- зависимого исчезновения эстральных циклов у самок Мыши Прием SkQl с питьевой во- дой в течение всей жизни
25 Предотвращение снижения половой мотивации у самцов Крысы линии OXYS Прием SkQl с пищей в течение всей жизни
26 Предотвращение возраст- зависимых изменений в по- ведении Крысы Прием SkQl с питьевой во- дой в течение всей жизни
27 Предотвращение возраст- зависимого облысения и потери усов Мыши Прием SkQl с питьевой во- дой в течение всей жизни
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
315
Окончание табл. 16.1
Результат Виды Тип воздействия
28 Предотвращение развития возраст-зависимой катаракты и ретинопатий Крысы линии OXYS Прием SkQl с пищей в течение всей жизни
29 Обращение развития возраст- зависимой катаракты и рети- нопатий Крысы линии OXYS Прием SkQl с пищей либо закапывание SkQl в глаза в течение 1,5 месяцев
30 Обращение развития возраст- зависимых ретинопатий Собаки, кошки, лошади Закапывание SkQl в глаза в течение 1—3 месяцев
31 Предотвращение поседения после у-радиации Черные мыши Прием SkQl с питьевой водой в течение 1 месяца
32 Предотвращение гибели по- сле почечной ишемии Крысы с одной почкой Однократная инъекция SkQl или SkQRl за день до ишемии
33 Частичная нормализация со- держания в крови креатини- на, диуреза и резорбции Са2+ после почечной ишемии Крысы с одной почкой Однократная инъекция SkQl или SkQRl за день до ишемии
34 Нормализация работы почек при рамбдомиолизе Крысы Инъекция SkQRl через 1, 12, 24 и 36 часов после ин- дукции рамбдомиолиза
35 Уменьшение зоны поврежде- ния головного мозга и пре- дотвращение локомоторной дисфункции после ишемии Крысы Однократная инъекция SkQRl до индукции ишемии мозга
36 Уменьшение зоны поврежде- ния сердца после ишемии Крысы Прием SkQl с питьевой водой в течение 2—3 недель до индукции ишемии
37 Снижение аритмии после индукции ишемии сердца Крысы Прием SkQl с питьевой водой в течение 2—3 недель до индукции ишемии
38 Предотвращение или обра- щение развития эксперимен- тального увеита Кролики Закапывание SkQl в глаза в течение 1—2 месяцев
39 Частичное предотвращение экспериментальной глаукомы Кролики Закапывание SkQl в глаза в течение 1—2 месяцев
40 Предотвращение эксперимен- тального артрита Крысы Добавление SkQl в пищу с момента индукции заболе- вания
316 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
16.2. Сравнение эффектов SkQ и временного ограничения
питания
Лучшим доказательством справедливости гипотезы о программе старе-
ния была бы успешная попытка ее отменить. Есть основания полагать, что
такая попытка впервые дала положительный результат еще в 1934 г., когда
К.М. МакКей и сотрудники сообщили об увеличении продолжительности
жизни крыс посредством некоторого ограничения их питания. Это ограни-
чение, введенное на ранних этапах жизни, вначале приводило к задержке
роста животных. Затем ограничение питания снималось, животные быстро
увеличивались в размерах до нормы, но жили на 70% (самцы) и 48% (сам-
ки) дольше, чем те, что всю жизнь получали пищу ad libitum. Среди при-
чин смерти резко уменьшался вклад легочных болезней, а также некоторых
опухолей. Авторы отмечали, что животные-долгожители выглядели провор-
ными и молодыми независимо от возраста. При этом их пульс снижался
до 340 ударов в минуту, что было примерно на 100 ударов ниже контроля.
В дальнейшем благоприятное действие некоторого ограничения питания
на продолжительность жизни было продемонстрировано на самых разных
видах эукариот: от дрожжей до макак-резусов и людей. С появлением ги-
потезы Хармэна о роли АФК в старении все эти эффекты принято было
объяснять уменьшением объема пищи, окисленной кислородом, а значит,
и снижением сопутствующей продукции АФК и вызываемого ими повреж-
дающего действия. Несостоятельность такого допущения была ясна еще из
ранних работ по ограничению питания, когда в той же группе МакКея и
др., выяснилось, что теплопродукция на кг веса тела в опытной когорте
крыс была даже выше, чем в контроле. Дальнейшие исследования прямо
опровергли общепринятую точку зрения.
Во-первых, выяснилось, что для дрозофилы достаточно двух дней жиз-
ни впроголодь, чтобы превратить ее в «долгожителя» в той же степени,
как если бы муха была ограничена в питании в течение всей своей жизни.
Далее оказалось, что не только избыток пищи, но даже сам ее запах сни-
жают геропротекторный эффект ограничения питания дрозофилы. Все эти
обстоятельства — вряд ли специфика дрозофилы. На мышах-альбиносах
Т.Б. Робертсон и др. еще в 1934 г. обнаружили, что пост в течение 2-х дней
в неделю вполне достаточен для продления жизни на 50—60%. Наблюдая
мышей, К.Дж. Карр и др. убедились, что способность к деторождению,
исчезавшая к концу первого года жизни животных при неограниченном
кормлении, сохранялась по крайней мере до 21-го месяца жизни, если мы-
ши были ограничены в пище в первые 11—15 месяцев, а затем получали ее
ad libitum. По данным чешских авторов (Е. Стучликовой и др.) крысы, мы-
ши и золотистые хомячки, ограниченные на 50% в питании в течение 2-х
лет, жили на 20% дольше, чем в контроле. Ограничение в течение одного
только первого года жизни давало эффект на 40—60%, а в течение только
второго года — на 30—40%.
Как показали дальнейшие исследования, в эффект ограничения пита-
ния вносят вклад как углеводный, так и белковый его компоненты. При
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
317
этом за действие белков отвечает одна-единственная аминокислота, а имен-
но метионин. Метионин относится к группе аминокислот, названных не-
заменимыми, так как они не могут синтезироваться в организме млекопи-
тающего, всецело зависящего от их поступления с пищей. Оказалось, что
не только продление жизни, но и уменьшение генерации АФК митохон-
дриями и окислительного повреждения митохондриальной ДНК имитиру-
ется диетой, где белок заменяли смесью аминокислот, из которой исключен
метионин. Интересно, что ограничение питания никак не сказывается на
окислении ядерной ДНК, которого можно было бы ожидать, если исходить
из принятой гипотезы о старении как неспецифическом возрастном по-
вреждении биополимеров клетки посредством АФК и его предотвращении
при снижении калорийности питания.
По нашему мнению, ограничение питания воспринимается организ-
мом как весьма тревожный сигнал о нехватке пищи. Даже частичное го-
лодание, как известно, влечет за собой уменьшение плодовитости. А это,
в свою очередь, ставит под вопрос само существование популяции. Чтобы
хотя бы частично воспрепятствовать такому повороту событий, достаточ-
но отменить программу старения, продлив тем самым продолжительность
репродуктивного периода индивида, т.е. увеличив общее количество его
потомства. Иными словами, действие ограничения питания на продолжи-
тельность жизни лишь косвенно связано с АФК, представляя чисто регуля-
торный эффект. Это прежде всего биология, а не химия. Вот почему такие
явно сигнальные эффекты, как кратковременный пост (или, наоборот, за-
пах пищи), а не только нехватка (или избыток) пищи в течение всей жизни
оказывают мощное влияние на параметры жизненного цикла. Не случайно
временное ограничение питания (пост) лучше, чем постоянное. Сигнал мо-
жет быть подан за сравнительно короткий срок, а вообще-то длительный
период жизни впроголодь сам по себе ничего хорошего организму принести
не может*. Обжорство свойственно скорее некоторым людям, чем живот-
ным, которые не склонны наедаться впрок, если пищи всегда вдоволь.
Сигнальный характер эффекта ограничения питания хорошо объясняет
опыты с метионином. По-видимому, организм определяет количество до-
ступной пищи и прежде всего незаменимых аминокислот, нужных для био-
синтеза его белков, отслеживая количество одной из них — метионина.
Существенно, что ограничение питания не только увеличивает сред-
нюю продолжительность жизни, но продлевает молодость, как уже было от-
мечено первооткрывателем этого явления МакКеем. Отступают старческие
недуги, и само поведение и даже внешний вид старых животных становится
неотличимым от поведения и внешности молодых. Показательна только
что опубликованная работа группы Р. Уэйнбраха с приматами. Двадцати-
летний опыт на 76 макаках убедил, что длительное ограничение питания на
30% (в опыт были взяты уже взрослые животные в возрасте от 7 до 14 лет)
* Возможно, религиозные посты — это способ продления жизни путем кратковре-
менных периодов ограничения питания. Известно, что верующие люди, как правило,
живут дольше атеистов.
318 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
приводит к 1) резкому уменьшению зависящей от возраста смертности (за
30 лет 20% против 50% у животных в контроле, которые получали пищу ad
libitum), 2) исчезновению из списка причин смерти диабета, 3) уменьшению
вдвое частоты смертей от рака (у макак это в основном аденокарцинома
кишечника), 4) уменьшению частоты смертей от сердечно-сосудистых за-
болеваний, 5) снижению остеопороза, 6) предотвращению развития таких
старческих признаков, как саркопения, уменьшение массы серого вещества
головного мозга, облысение, поседение и ряд других. К 30 годам оставшие-
ся в живых контрольные макаки в 80% случаев демонстрировали какие-
либо признаки старения, в то время как в опытной группе они наблюдались
лишь у 20% животных.
Опыт на обезьянах еще далеко не закончен, поэтому мы не можем
ничего сказать о действии ограничения питания на максимальную продол-
жительность жизни приматов. Однако в случае с грызунами такие данные
имеются. Они свидетельствуют, что у мышей, крыс и хомячков медианная
(50% умерших) продолжительность жизни увеличивается гораздо сильнее,
чем максимальная. Наиболее простое объяснение механизма этого явле-
ния — отмена (или значительное торможение) программы старения. При
этом могут замедляться и другие онтогенетические программы, прежде все-
го рост организма. Это происходит при достаточно сильном и продолжи-
тельном голодании. Однако более умеренное ограничение питания может
удлинять жизнь и без задержки роста.
Есть много общего между эффектами ограничения питания и SkQ. Как в
том, так и в другом случае происходит ректангулизация кривых смертности,
резко уменьшается ранняя смертность, а средняя продолжительность жизни
увеличивается намного больше, чем максимальная. Их эффект не столько
в продлении жизни как таковой, сколько в продлении здоровой, молодой
жизни. Оба воздействия эффективны применительно к живым существам,
очень сильно различающимся по своему систематическому положению
(ограничение питания — на дрожжах, насекомых, млекопитающих, SkQ —
на мицелиевом грибе, ракообразном, насекомом, рыбе и млекопитающих).
Действие как того, так и другого носит ярко выраженный плеотропный
характер, т.е. на них отвечает сразу множество физиологических систем
организма, причем в большинстве случаев это одни и те же системы. Отсту-
пают болезни сердечно-сосудистой системы, остеопороз, нарушения зри-
тельного аппарата, некоторые типы рака, нет поседения и выпадения волос,
старческой депрессии. Противоречивые данные получены по саркопении и
иммунным ответам при ограничении питания. Ряд авторов указывает на то,
что это воздействие ослабляет как мышечную систему, так и иммунитет*.
С другой стороны, Р. Уэйнбрах и сотр. отмечают отсутствие саркопении у
обезьян, а МакКей и сотр. — устойчивость к легочным заболеваниям у крыс,
* Как отмечает Дж. Фернандес и сотр., ограничение питания, особенно в молодом
возрасте, уменьшает выделение интерлейкинов макрофагами в ответ на бактериальные
полисахариды. Это в свою очередь снижает устойчивость животных к сепсису и перито-
ниту. По данным Э.М. Гарднер, частичное голодание уменьшает устойчивость животных
к вирусу гриппа.
Глава 16. Проект по антиоксидантам, адресованным в митохондрии 319
посаженных на ограниченную диету (ср. с резким уменьшением смертности
от инфекционных болезней и торможением возраст-зависимой инволюции
тимуса и фолликулярных отделов селезенки у крыс под действием SkQ).
В то же время противоположным оказалось действие ограничения питания
и SkQ на заживление ран: жизнь впроголодь тормозила, a SkQl, напротив,
стимулировал заживление. Ограничение питания снижало температуру тела
и замедляло рост животного, чего не наблюдалось с SkQ. Все это свидетель-
ствует против такой тривиальной трактовки наших данных, как допущение,
что SkQl уменьшает потребление животным пищи, например снижая аппе-
тит. Прямые измерения потребления пищи мышами, получавшими SkQl,
показали, что SkQl не влияет на этот параметр.
В ухудшении ряда жизненных показателей при ограничении питания
нет ничего удивительного. Как уже отмечалось выше, животные не склон-
ны переедать, даже когда их не ограничивают в пище. Обычно они съеда-
ют столько, сколько требует их организм. Поэтому длительное снижение
питания ведет к тем или иным нарушениям жизнедеятельности. Понятно
также, что такие нарушения будут тем вероятней, чем длительнее голо-
дание. Как уже отмечалось выше, геропротекторный эффект ограничения
питания вовсе не требует долгого и непрерывного голодания. Отсюда и
противоречивость данных по действию ограничения питания на продол-
жительность жизни и состояние организма. Там, где ограничение питания
было не слишком большим и не слишком долгим, преобладали благоприят-
ные эффекты, а там, где геронтологи перебарщивали с этим ограничением,
возникали неблагоприятные побочные последствия. Так, принято считать,
что длительное ограничение питания снижает частоту эстральных циклов
(иногда вплоть до их полного исчезновения), но еще в 1949 г. К.Дж. Карр
и сотр. показали, что временное ограничение с последующим его снятием,
наоборот, продляет циклы и способствует их сохранению вплоть до глубо-
кой старости. Напомним, что подобное продление наблюдается и в случае
с SkQ. В принципе нет никакой необходимости голодать всю жизнь, если
голодание есть сигнал к продлению жизни путем отмены программы старе-
ния. Однако существует опасность, что слишком короткое, слишком слабое
или запоздалое ограничение питания приведет лишь к частичному тормо-
жению программы и геронтологический эффект окажется небольшим. Та-
кой опасности, по-видимому, нет с SkQl, который действует на старение
в столь малых концентрациях, что каких-либо неблагоприятных эффектов
пока что обнаружено не было.
Еще одно серьезное ограничение надо иметь в виду, рассматривая не-
доедание как геропротектор для человека. Ведь если это ограничение —
сигнал опасности голодной смерти, то ответом организма должно быть не
только увеличение продолжительности жизни, призванное компенсировать
уменьшение рождаемости в голодные годы. Весьма вероятны и другие от-
веты, причем какие-то их них могут оказаться далеко не столь привле-
кательными, как продление здоровой жизни. Замечено, например, что в
состоянии недоедания мышь, попав в «беличье колесо», не хочет покидать
его, пробегая за ночь от 6 до 8 км (при нормальном питании это расстояние
320 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
всегда меньше 1 км). Подобный эффект уже никак нельзя объяснить ис-
тощением и мышечной слабостью при голодании. Скорее, налицо еще один
ответ на сигнал голода: крайняя обеспокоенность, попытка сканировать
как можно большее пространство в поисках пищи. Перефразируя повесть
Стругацких «Понедельник начинается в субботу», здесь мы имеем дело с
мышью, «не удовлетворенной желудочно». Если бы подобный эффект был
присущ SkQ, мы заметили бы, что животные, получавшие SkQ, поглощали
больше пищи, чего в действительности не наблюдалось. Создается впечат-
ление, что введение SkQ — более «чистый» способ отменить программу ста-
рения, не отягощенный нежелательными побочными эффектами.
16.3. От «человека разумного» к «человеку разумному
и освободившемуся»
Существует по меньшей мере еще один аспект, в котором ограничение
питания вряд ли сможет заменить собой SkQ. Материал, рассмотренный вы-
ше, свидетельствует, что SkQl — весьма перспективный агент для создания
нового поколения лекарств, действующих на процессы старения, — анти-
оксидантов, специфически адресованных в митохондрии. При этом очевид-
но, что действие SkQ не ограничивается его геропротекторным эффектом
(см. табл. 16.1, п. 1—30). Опыты по сердечной аритмии, инфарктам сердца
и почек, инсульту и ряд других были поставлены на молодых животных
(см. табл. 16.1, п. 32—40). Можно, конечно, предположить, что SkQ просто
«чистит самое грязное место в клетке», следствием чего оказывается некий
неспецифический благоприятный эффект на самые различные аспекты ее
жизнедеятельности. Однако такое объяснение вряд ли справедливо. В этом
случае остается неясным, почему в процессе своей эволюции растения, син-
тезирующие в отдельности пластохинон и проникающий катион берберин,
не создали их комбинации, способной почистить от АФК внутренность
растительных митохондрий, подвергающихся «кислородной опасности» в
большей степени, чем животные митохондрии, из-за насыщенности цито-
золя кислородом, образуемым хлоропластами.
Альтернативная возможность состоит в том, что прием, используемый
для запуска старения как медленного феноптоза, применяется также и в
некоторых других смертоносных программах, вызывающих быстрый, или
острый, феноптоз. Здесь мы приходим к фундаментальному вопросу био-
логии: как вообще могут существовать генетические программы, контрпро-
дуктивные для индивида? Ч. Дарвин, А.Р. Уоллес и А. Вейсман еще в XIX в.
предположили, что смерть особи может быть альтруистичной, т.е. полезной
для семьи или сообщества. В 1964 г. У.Д. Гамильтон опубликовал серию из
двух статей под названием «Генетическая эволюция социального поведе-
ния». А в 1976 г. вышла в свет книга Р. Докинза «Эгоистичный ген», где ав-
тор развил и популяризировал мысль Гамильтона, заключив, что «основной
единицей отбора служит не индивид, а ген». По существу, здесь речь идет
Глава 16. Проект по антиоксидантам, адресованным в митохондрии 321
уже не о благополучии сообщества, а о диктатуре генома, единственной
самовоспроизводящейся биологической структуры, сохранение, развитие и
экспансия которой приобрела в процессе эволюции приоритетное значение
по сравнению с благополучием индивида или группы индивидов. Организм
в рамках этой концепции — лишь устройство, машина, обеспечивающая
интересы генома. Некоторое время тому назад мы сформулировали прин-
цип, названный самурайским законом биологии: «лучше умереть, чем оши-
биться». В сочетании с концепцией о диктатуре генома этот закон означает,
что любое критическое состояние организма, когда он уже не гарантирует
сохранность своего генома и в случае выздоровления может произвести по-
томство с измененным геномом, может стать сигналом к самоликвидации
организма, т.е. быстрому феноптозу.
Представляется вполне возможным, что механизм быстрого феноптоза,
как и механизм медленного феноптоза (старения), использует в качестве
интермедиата на ранних этапах процесса внутримитохондриальные АФК.
Если это допущение справедливо, то благоприятное действие SkQ не толь-
ко при старении, но и при самых разнообразных острых патологиях как
молодых, так и старых организмов могло бы объясняться нейтрализацией
этих АФК.
Не исключено, что SkQ может послужить оружием в «восстании ма-
шин» — попытке Homo sapiens покончить с тиранией генома и отменить те
из диктуемых геномом программ, которые выгодны для эволюции генома,
но невыгодны для индивида. Отмена их символизировала бы превращение
человека в Homo sapiens liberatus (по-латыни liberatus — освободившийся),
что могло бы стать величайшим достижением медицины XXI в.
Авторы благодарят свои семьи за терпение и поддержку, которые облег-
чали работу над материалами книги во время отпусков на протяжении не-
скольких лет. Общий графический стиль создан Ф.О. Каспаринским. Ори-
гинальные иллюстрации принадлежат ООО «МАСТЕР-МУЛЬТИМЕДИА»
(www.master-multimedia.ru).
322 ЧАСТЬ IV. Опыт практического применения биоэнергетики: активные формы...
В.А. Садовничий, председатель
наблюдательного совета проекта,
руководитель математической группы
М.В. Скулачев, заместитель научного
руководителя проекта
И.И. Северина, лидер группы БЛМ
Б.В. Черняк, заместитель научного
руководителя проекта, лидер группы
клеточной биологии
Рисунок 16.9 (часть 1). Участники проекта по антиоксидантам, адресованным в митохондрии
Глава 16. Проект по антиоксидантам, адресованным в митохондрии
323
Ф.Ф. Северин, лидер группы
биоэнергетики дрожжей
Л.С. Ягужинский, лидер группы
митохондриологии
В.Н. Анисимов, лидер группы
геронтологии млекопитающих
Н.Г. Колосова, лидер группы изучения
прогерии
Рисунок 16.9 (часть 2). Участники проекта по антиоксидантам, адресованным в митохондрии
Приложения
ПРИЛОЖЕНИЕ 1
ЭНЕРГИЯ, РАБОТА
И ЗАКОНЫ ТЕРМОДИНАМИКИ
Энергия (от греч. energeia — действие, деятельность) в обобщенном пони-
мании — это свойство материальной системы, характеризующее возможность
производить изменения в окружающем мире (работу). Величина этой работы
(W) возрастает по мере приумножения общего количества материи в системе,
увеличения неравномерности распределения частиц материи в пространстве
и усиления их движения. Физические процессы взаимодействия частиц
материи в системе сопровождаются взаимной трансформацией различных
видов энергии (механической, тепловой, электромагнитной, гравитацион-
ной, ядерной, химической). Каким образом жизнь обеспечивается энергией?
Законы термодинамики позволяют получить количественный ответ на этот
вопрос, не прибегая к помощи мистики. Превращения энергии в живых
самовоспроизводящихся материальных системах (организмах) подчиняются
законам термодинамики. Примечательно, что первое начало термодинамики
(закон сохранения и превращения энергии) было исходно сформулировано
в 1841 г. немецким физиком и врачом Ю.Р. Майером в результате изучения
энергетических процессов в организме человека, а потом стало широко при-
меняться к системам технической энергетики.
Термодинамика исследует три типа систем: изолированные, закрытые и
открытые. Гипотетические изолированные (адиабатические) системы пол-
ностью автономны, их граница не допускает обмена материей, энергией и
информацией с окружающей средой. Закрытые системы материально само-
достаточны, но энергетически и информационно открыты. Иными слова-
ми, через границы закрытых систем происходит обмен энергией и инфор-
мацией, но не материей. Многие неживые системы технической энергетики
устроены именно таким образом. Живые организмы — открытые системы,
постоянно обменивающиеся с внешней средой веществом, энергией и ин-
формацией. Иными словами, энергообмен организмов с окружающей сре-
дой может осуществляться как непосредственно, так и вместе с потоками
материи.
В качестве меры энергии, переходящей от одного тела к другому, в
термодинамике используется понятие количества теплоты (0. Энергия,
полученная системой, расходуется на совершение работы над внешними
ПРИЛОЖЕНИЕ 1. Энергия, работа и законы термодинамики
325
телами и окружающей средой, а также на переходы между альтернативными
состояниями компонентов системы. Изменение количества работы термо-
динамической системы (A W) может быть вычислено как произведение дав-
ления (Р) на бесконечно малое приращение объема (А И):
АРГ= РАИ
Количество возможных состояний термодинамической системы харак-
теризует энтропия (5), которая часто ассоциируется с мерой беспорядка.
Понятие энтропии (от греч. entropia — поворот, превращение), введенное
в 1865 г. немецким физиком Р. Клаузиусом, теперь широко используется в
физике, химии, биологии и теории информации. Связь между изменением
общих количеств теплоты и энтропии при обратимых процессах описыва-
ется уравнением:
AQ = ГА5,
где Т — абсолютная температура.
Второе начало термодинамики, сформулированное в 1851 г. англий-
ским физиком У. Томсоном (лордом Кельвином), помогает прогнозировать
возможность совершения работы над внешними телами, связывая направ-
ление переноса энергии (теплоты) и информации через границу системы
с понятием энтропии. Обратимые процессы в изолированных системах не
приводят ни к росту энтропии, ни к осуществлению полезной работы. Не-
обходимые для совершения работы неравновесные превращения в изоли-
рованных системах неразрывно связаны с приближением к состоянию тер-
модинамического равновесия, при котором энтропия максимальна. После
достижения равновесия полезная работа в изолированных системах уже не
может осуществляться. Энтропия в закрытых и открытых системах возрас-
тает при совершении ими работы над внешними телами и в результате по-
лучения информации извне. Рост количества возможных альтернативных
состояний системы уменьшает вероятность ее пребывания в работоспособ-
ной (нативной) конформации, что снижает эффективность ее работы. Опыт
использования закрытых систем технической энергетики показывает, что их
приходится регулярно реставрировать. Живые системы стремятся сами ми-
нимизировать рост собственной энтропии, ведущей к гибельному для них
равновесному состоянию. Они поддерживают достигнутую в ходе эволюции
стационарную организованность своих составляющих за счет увеличении
энтропии окружающей среды. Существование стационарных состояний от-
крытых систем, соответствующих минимальному производству энтропии,
было теоретически обосновано будущим лауреатом Нобелевской премии
по химии И.Р. Пригожиным, который в 1947 г. доказал основополагающую
теорему термодинамики неравновесных процессов.
Очевидно, что сложность термодинамических описаний систем возрас-
тает при уменьшении степени их изоляции. Простые уравнения класси-
ческой равновесной термодинамики не могут быть непосредственно при-
менены к открытым системам, поскольку поток материи через их границы
препятствует установлению истинного равновесия. Однако живые организ-
мы можно рассматривать как совокупность взаимодействующих подсистем
326
ПРИЛОЖЕНИЯ
(органов, тканей, клеток, органелл, молекул), что позволяет облегчить по-
нимание сути энергетических процессов. В большинстве случаев отдельные
реакции между компонентами подсистемы можно рассматривать как закры-
тые системы и применять к ним уравнения равновесной термодинамики.
Из этих уравнений следует, что для любой системы потенциальная способ-
ность совершать работу определяется степенью отклонения ее компонентов
от состояния равновесия. Чтобы использовать на практике приблизитель-
ные количественные оценки поведения открытых систем, следует понять
природу равновесного состояния для конкретной химической реакции и
оценить смещение равновесия реальной реакции относительно состояния
равновесия, предсказанного уравнениями классической равновесной тер-
модинамики. Именно это отклонение от равновесия определяет количе-
ственную способность реакции производить полезную работу. Кроме того,
математический аппарат равновесной термодинамики можно эффективно
использовать для выявления «невозможных» реакций. Самопроизвольно
(без притока энергии в систему извне) могут протекать только процессы,
приводящие к росту энтропии и уменьшению запаса энергии.
Термодинамические потенциалы
Согласно второму началу термодинамики, не вся энергия системы яв-
ляется «полезной», т.е. может быть использована для осуществления рабо-
ты. Для оценки количества полезной энергии в 1878 г. американский физик
и математик Дж.У. Гиббс разработал теорию «фундаментальных функций»,
которые характеризовали состояние термодинамической системы в зави-
симости от ее основных свойств: числа частиц (7V), объема (И), давления
(Р), температуры (7), энтропии (5) и химического потенциала компонентов
(//). В настоящее время «фундаментальные функции» известны как «термо-
динамические потенциалы». Последний термин, предложенный в 1884 г.
французским философом-физиком П. Дюгемом, вытеснил первоначаль-
ный благодаря более точному соответствию сути дела. Потенциал (от лат.
potentia — сила) — источники, возможности, средства, запасы, которые мо-
гут быть использованы для решения какой-либо задачи, достижения опре-
деленной цели. Разные термодинамические потенциалы оптимизированы
для облегчения характеристики систем с различными наборами постоянных
и переменных свойств (макроскопических параметров):
• внутренняя энергия (U), функция энтропии (5) и объема (У);
• энтальпия (Н), функция энтропии (5) и давления (Р);
• свободная энергия Гельмгольца (7), функция температуры (7) и объема
(И;
• потенциал Гиббса (G), функция температуры (7) и давления (Р);
• потенциал Ландау, или большой термодинамический потенциал (Q),
функция температуры (7), объема (И) и химического потенциала пере-
носимых частиц (//).
Внутренняя энергия системы (U) — полная энергия этой системы за
вычетом кинетической энергии системы как целого (энергии движения в
окружающей среде) и потенциальной энергии системы во внешнем поле
ПРИЛОЖЕНИЕ 1. Энергия, работа и законы термодинамики
327
сил (при взаимодействии с другими системами). В применении к биоэнер-
гетике внутренняя энергия складывается из кинетической энергии хаоти-
ческого движения молекул, потенциальной энергии взаимодействия между
ними и внутримолекулярной энергии. В соответствии с первым началом
термодинамики полная энергия системы равна разнице между количеством
теплоты (0, переданным системе, и максимально полной работой (ИО, со-
вершенной над внешними телами и окружающей средой:
U= Q- W.
Для идеализированных процессов, состоящих из непрерывно следую-
щих друг за другом состояний равновесия, изменения (А) внутренней энер-
гии системы с постоянным количеством частиц при совершении работы
описываются уравнением:
\U= 5Q-bW= T\S- PW.
Для характеристики количества теплоты, переданной системе для со-
вершения работы, применяется термодинамический потенциал Я, или эн-
тальпия (от греч. enthalpd — нагреваю), изменения которой связаны с вну-
тренней энергией системы следующим образом:
\Н= \U+ \(PV) = T\S- PW + PW + V\P= TbS+ V\P.
При постоянном давлении изменение энтальпии равно количеству
теплоты, переданной системе для совершения полезной работы, поэтому
энтальпию часто называют тепловой функцией, или теплосодержанием.
Энтальпией системы удобно пользоваться в тех случаях, когда в качестве
независимых переменных, определяющих состояние системы, выбирают
давление Р и температуру Т. При исследовании биологических систем те-
плосодержание можно определить непосредственными калориметрически-
ми измерениями теплового эффекта реакции:
-АЯ = AQ.
Второе начало термодинамики запрещает полное превращение внутрен-
ней энергии в работу, поскольку часть внутренней энергии неизбежно рас-
ходуется на увеличение энтропии (5). Доля полной энергии, которая может
быть израсходована системой для совершения максимально полной работы
над внешней средой и находящимися в ней телами (системами), называ-
ется свободной энергией Гельмгольца (f)? или изохорно-изотермическим
потенциалом:
\F=\U-\{TS)= T\S- PW- T\S-S\T= - PW-S\T.
Из этого уравнения следует, что свободная энергия Гельмгольца убы-
вает при возрастании объема и температуры. Однако часть полной работы
расходуется на бесполезное изменение внешней среды вследствие вариаций
объема системы.
Работа системы над внешними телами, не приводящая к изменению
внешней среды, называется полезной работой. Максимально полезная рабо-
328
ПРИЛОЖЕНИЯ
та системы численно равна уменьшению энергии Гиббса (<7), или изобарно-
изотермического потенциала, который вычисляется следующим образом:
AG = АН — A{TS) = AU + A(PV) - A(TS) =
= TAS + VAP — TAS — SAT = VAP — SAT.
Согласно уравнению, энергия Гиббса уменьшается с ростом темпера-
туры, но увеличивается с ростом давления в системе. Для характеристики
физических процессов используется свободная энергия Гельмгольца, а для
химических и физико-химических — потенциал Гиббса. Разность потенци-
алов Гельмгольца и Гиббса характеризует количество энергии, затраченной
системой на непродуктивное изменение внешней среды:
AF— AG= — PAV- VAP.
Следует подчеркнуть, что в биологической литературе потенциал Гиб-
бса часто называется «свободной энергией Гиббса» или просто «свободной
энергией», что может привести к смешению с потенциалом Гельмгольца.
В приложении к биологическим системам разницей между этими потен-
циалами часто пренебрегают, поскольку при большинстве биохимических
превращений изменения объема незначительны.
Биохимические реакции протекают при постоянном давлении и тем-
пературе, значит, формулу для вычисления изменений потенциала Гиббса
можно упростить следующим образом:
Д(7 = АН — TAS.
Характер изменения энергии Гиббса позволяет судить о принципиаль-
ной возможности осуществления процесса. При AG < 0 процесс может про-
текать самопроизвольно, если ему не препятствуют кинетические факторы.
К примеру, отрицательная величина изменения энергии Гиббса не препят-
ствует переносу электронов с молекулы NADH на кислород без каких-нибудь
посредников. Однако молекула NADH в одной реакции отдает 2 электрона,
а молекула кислорода способна принять только один. В результате само-
произвольное окисление NADH кислородом запрещено из-за несоответ-
ствия правилу четности Шеффера, которое требует совпадения количества
отданных и принятых в одной реакции электронов. Молекулы-посредники,
способные принимать и отдавать разные количества электронов, помогают
обойти кинетические ограничения термодинамически разрешенных про-
цессов. Если AG = 0, то система находится в состоянии химического равно-
весия и валовые превращения компонентов системы не происходят. Осу-
ществление процесса, характеризующегося AG > 0, возможно только при
поступлении энергии извне. К примеру, образование глюкозы из воды и
углекислого газа в процессе фотосинтеза сопряжено с увеличением энергии
Гиббса и осуществляется за счет поступления в систему энергии квантов
света. Определить изменение энергии Гиббса для биохимических реакций
можно несколькими способами: из константы равновесия реакции, величин
стандартных окислительно-восстановительных потенциалов, калориметри-
ческим определением теплового эффекта реакции, а также путем суммиро-
ПРИЛОЖЕНИЕ 1. Энергия, работа и законы термодинамики
329
вания известных из таблиц стандартных величин Д//о и ГД50 образования
компонентов реакции из соответствующих простых элементов.
Термодинамические потенциалы, описывающие гомогенные системы
без переноса частиц (растворы), проще потенциалов для расчета энергетики
содержащих мембраны гетерогенных систем. Если энергетические процес-
сы в системе сопряжены с переносом материи (частиц) через ее границу
(мембрану) во внешнюю среду (другую систему), все уравнения термоди-
намических потенциалов дополняются слагаемым (+pA7V), количественно
равным изменению энергии Гиббса в системе за счет добавления в нее
количества молекул N с химическим потенциалом ц.
Химический потенциал (//) компонента равен энергии, которую необ-
ходимо затратить для того, чтобы добавить в систему бесконечно малое
молярное количество этого компонента (одну частицу). Иными словами,
химический потенциал — это удельный потенциал Гиббса (на одну частицу
или 1 моль молекул, если под N подразумевается не количество частиц, а
число молей молекул):
// = &G/&N.
Оценка химических потенциалов помогает охарактеризовать реакции,
связанные с перераспределением частиц (молекул) между фазами или от-
секами, разделенными мембраной. Частицы могут самопроизвольно пере-
мещаться из отсека (фазы) с более высоким химическим потенциалом в от-
сек (фазу) с более низким химическим потенциалом. Это понижает общую
свободную энергию системы и приближает ее к равновесию, при котором
химические потенциалы частиц в обоих отсеках (фазах) равны. Следует об-
ратить внимание на исторически сложившееся различие в понимании тер-
мина «градиент» у специалистов из разных областей науки. Под термином
«градиент» (от лат. gradiens — шагающий) биохимики часто подразумевают
направление уменьшения концентрации частиц, тогда как математики и фи-
зики имеют в виду направление возрастания некоторой величины, значение
которой меняется от одной точки пространства к другой.
Если частицы, перемещающиеся через границу раздела фаз, имеют
электрический заряд (например, ионы), возникают условия для появления
трансмембранной разности электрических потенциалов (ДТ). Для оценки
вероятного перераспределения ионов применяется электрохимический по-
тенциал (/7), о котором было рассказано подробно в разделе «Законы био-
энергетики».
Для статистического ансамбля состояний системы с переменным коли-
чеством (N) частиц и равновесным химическим потенциалом может быть
определен «большой термодинамический потенциал», или потенциал Лан-
дау (Q), который связывает свободную энергию Гельмгольца с химическим
потенциалом:
Q = А — juN = — PV,
AQ = — S\T — PW — №ци.
330
ПРИЛОЖЕНИЯ
Свободная энергия Гиббса и обмен веществ
в биологических системах
Откуда живые организмы получают свободную энергию Гиббса? По-
скольку биологическая эволюция была направлена на увеличение не столь-
ко эффективности, сколько надежности систем энергообеспечения, живые
системы не используют атомные, тепловые и механические источники
энергии. Для совершения работы в организмах применяется энергия хими-
ческих реакций, света и ионных градиентов.
Внешние ресурсы поглощаются организмами и вовлекаются в обмен
веществ (метаболизм). Конструктивная ветвь метаболизма (анаболизм, или
ассимиляция) объединяет реакции синтеза органических полимеров (белки,
углеводы, липиды, нуклеиновые кислоты), которые входят в состав орга-
низма. Источником углерода у автотрофов является углекислый газ, а у
гетеротрофов — органические вещества. Органические полимеры в ходе
подготовительных реакций энергетической ветви метаболизма (катаболизм,
или диссимиляция) расщепляются до низкомолекулярных соединений (мо-
номеров), которые в дальнейшем оказываются субстратами анаболических
реакций. Экзергонические реакции катаболизма сопровождаются освобож-
дением энергии Гиббса, запас которой используется для осуществления
термодинамически невыгодных реакций анаболизма. В подавляющем боль-
шинстве случаев запасание энергии Гиббса связано с переходом одного или
двух электронов от вещества-донора к веществу-акцептору, отличающемуся
более высоким сродством к электрону; при этом исходно восстановленный
донор окисляется, а окисленный акцептор — восстанавливается. Первич-
ными донорами электронов у литотрофов служат неорганические соедине-
ния (соединения серы, двухвалентное железо, аммиак и его соли, нитриты,
водород и угарный газ), а у органотрофов — органические вещества (белки,
углеводы, липиды и продукты их частичного расщепления). Акцептором
электронов у аэробных организмов является кислород, а у анаэробных —
нитраты, нитриты, сульфаты, углекислый газ и некоторые органические
вещества.
Для количественной оценки сродства веществ к электронам служит
шкала стандартных окислительно-восстановительных (редокс) потенциалов,
исчисляемых в вольтах (В). Доноры имеют более отрицательный редокс-
потенциал, чем акцепторы. Значения редокс-потенциалов низкомолекуляр-
ных веществ, участвующих в биоэнергетических превращениях, находятся в
пределах от —0,7 В (а-кетоглутарат / сукцинат) до +0,8 В (кислород / Н2О).
Законы термодинамики допускают возможность использования для по-
лучения и последующего запасания энергии любой донорно-акцепторной
пары, обеспечивающей разницу редокс-потенциалов не менее 0,2 В. Такая
разность потенциалов позволяет конвертировать свободную энергию раз-
нообразных ресурсов в унифицированную форму аденозинтрифосфорной
кислоты, или АТР (см. главу VII), применяемую для совершения разных
видов работы. Обсуждаемое количественное ограничение отражает кванто-
вый принцип передачи свободной энергии в биологических системах.
ПРИЛОЖЕНИЕ 1. Энергия, работа и законы термодинамики
331
Ассимиляционная сила и ее источники
Электроны, полученные от доноров с высоким восстановительным по-
тенциалом, могут быть использованы для связывания молекул в ходе анабо-
лических реакций. Такие электроны часто называются восстановительными
эквивалентами. Совокупность восстановительных эквивалентов и свобод-
ной энергии Гиббса, полученная в ходе катаболических реакций, называ-
ется ассимиляционной силой. Каковы источники ассимиляционной силы для
биологических систем?
Жизнедеятельность хемотрофов зависит от наличия в окружающей сре-
де сильных неорганических или органических восстановителей. Фототрофы
восстанавливают молекулы собственных акцепторов (см. главу II) электро-
нами, полученными от слабых восстановителей за счет энергии квантов
света. Борьба за энергетические ресурсы могла быть движущей силой эво-
люционного процесса при освоении новых экологических ниш. Распре-
деление внешних источников углерода и ассимиляционной силы между
организмами привело к появлению восьми вариантов биоэнергетики. Хе-
мотрофной биоэнергетикой (см. главу V) пользуются хемоорганоавтотрофы
(некоторые метилотрофные прокариоты); хемоорганогетеротрофы (боль-
шинство прокариот и две группы эукариот: животные и грибы); хемолито-
автотрофы и хемолитогетеротрофы (многие прокариоты). Светозависимую
энергетику (см. главы II и VI) применяют фотоорганоавтотрофы и фото-
органогетеротрофы (прокариоты), фотолитоавтотрофы (растительные эука-
риоты) и фотолитогетеротрофы (прокариоты). В экологических системах
продукты жизнедеятельности одних организмов могут являться ресурсами
для других. Следствием донорно-акцепторных взаимодействий в биосфере
и ее биогеоценозах является биогенная миграция химических элементов.
К примеру, фотолитоавтотрофные цианобактерии и растения, потребляя
углекислый газ и воду, производят глюкозу и кислород, которые преобра-
зуются аэробными хемоорганогетеротрофами снова в углекислый газ и во-
ду. Лишь 5—20% энергии Гиббса аккумулируются в образованной биомассе
гетеротрофов, а остальная часть рассеивается в виде тепла и расходуется на
поддержание жизнедеятельности. Фотолитоавтотрофы, являющиеся основ-
ными продуцентами биомассы в большинстве экосистем, используют около
1 % доступной световой энергии для анаболизма.
Транспорт ассимиляционной силы
У многоклеточных гетеротрофов подготовительные реакции катаболиз-
ма происходят, в основном, в полостях пищеварительной системы и в за-
пасающих тканях, а окислительные — в клетках. Доноры и акцепторы элек-
тронов поступают в организм многоклеточных сквозь поверхность тела или
через специальные структуры (устьица растений, жабры, пищеварительный
тракт и легкие животных), после чего переносятся к клеткам при помощи
проводящих систем (ситовидные трубки, трахеиды и трахеи растений; кро-
веносная система животных), а также через межклетники и полости тела.
Эффективность транспорта акцепторов к местам их использования часто
332
ПРИЛОЖЕНИЯ
увеличивается за счет дыхательных пигментов (гемоглобин и др.) и специ-
альных клеток-переносчиков (эритроциты).
Внутриклеточными посредниками между донорами и акцепторами яв-
ляются белковые ферменты класса оксидоредуктаз. Для перемещения вос-
становительных эквивалентов оксидоредуктазы используют вещества не-
белковой природы (кофакторы и простетические группы): никотиновые и
флавиновые нуклеотиды, хиноны, металло-порфирины и железо-серные
кластеры. Элементы электрон-транспортных цепей располагаются в поряд-
ке возрастания сродства к электрону, что помогает снизить активационный
барьер суммарной оксидоредуктазной реакции. Перенос восстановитель-
ных эквивалентов в растворах осуществляют никотинамидные кофермен-
ты, структура которых препятствует их прямому окислению кислородом.
В катаболических превращениях в основном участвует NAD+, а в реакциях
анаболизма — его фосфорилированный аналог NADP+. Окисление доно-
ров или восстановление акцепторов часто сопровождается освобождением
или соответственно присоединением 1-2 ионов водорода (Н+). Участие Н+
в этих превращениях позволяет увеличивать разницу редокс-потенциалов
донорно-акцепторной пары, изменяя кислотность среды в направлении,
определяемом уравнением В. Нернста и законом действующих масс.
Свободная энергия Гиббса может накапливаться и передаваться в фор-
ме ионных градиентов (см. главы 9 и 11), а также в молекулах веществ, со-
держащих группы с высоким потенциалом переноса, которые В.А. Энгель-
гардт в 1945 г. назвал «макроэргами». Наиболее известной молекулой такого
рода является АТР, водорастворимая «энергетическая валюта» клетки (см.
главу 7). В физиологических условиях структура АТР обеспечивает сочета-
ние высокого потенциала переноса каждой из двух концевых фосфориль-
ных групп на молекулу акцептора (термодинамическую нестабильность) с
кинетической устойчивостью (при температуре тела и нейтральном pH АТР
самопроизвольно не гидролизуется). Показано, что АТР расходуется при
совершении разнообразных видов работы: химической (биосинтезы), элек-
трической (создание разности электрических потенциалов на биомембра-
нах), осмотической (образование градиентов концентраций незаряженных
веществ) и механической (сокращение актомиозиновых комплексов мышц).
Свободная энергия Гиббса, запасенная в потенциале переноса групп АТР
(фосфорильный потенциал), при помощи специальных ферментов (нуклео-
зидди- и монофосфаткиназ) может перераспределяться между различны-
ми нуклеозидтри- и дифосфатами, обеспечивая протекание специфических
биосинтезов. Фосфорильный потенциал у большинства животных стабили-
зируется посредством равновесной реакции обратимого переноса фосфори-
ла на креатин. У некоторых ракообразных буфером фосфорильных групп
является фосфоаргинин, а у грибов — полифосфаты.
Помимо «водорастворимой валюты», клетки всегда располагают хотя
бы одной, а часто двумя «мембранными валютами» — трансмембранны-
ми разностями электрохимических потенциалов ионов Н+ и Na+ (соответ-
ственно ДДн+ и A/zNa+).
ПРИЛОЖЕНИЕ 1. Энергия, работа и законы термодинамики
333
Хранение ассимиляционной силы
Для долговременного хранения ассимиляционной силы используются
полимеры углеводов (крахмал у растений, гликоген у животных и грибов),
липиды (масла у бактерий, растений и грибов, жиры у животных), белки
(вителлин ооцитов и др.) и полифосфаты (у некоторых бактерий и грибов).
Углеводы отличаются высокой скоростью мобилизации, а липиды — наи-
большей энергоемкостью. Резервные углеводы у растений размещаются в
запасающих органах (клубни и др.), а у животных — в печени, мышцах,
мозге и некоторых других тканях. Специальная жировая ткань у живот-
ных служит местом депонирования липидов. Доступность акцепторов для
клеток хемогетеротрофов часто является ограничивающим экологическим
фактором. Поэтому такой акцептор электронов, как О2, у аэробных жи-
вотных может аккумулироваться специальным дыхательным пигментом
мышц (миоглобином). Периоды ограниченной доступности внешних ре-
сурсов некоторые организмы могут пережидать в состоянии анабиоза или
спячки (гибернации). Определенные биологические ассимиляционные за-
пасы могут использоваться технической энергетикой. Полагают, что масла
ископаемых диатомовых водорослей послужили источником для образова-
ния нефти; целлюлоза древних плаунов и хвощей превратилась в черный и
бурый каменный уголь, а деятельность архей-метаногенов способствовала
возникновению запасов природного газа.
ПРИЛОЖЕНИЕ 2
СТРУКТУРНЫЕ ФОРМУЛЫ РАЗЛИЧНЫХ
ПРОСТЕТИЧЕСКИХ ГРУПП И КОФАКТОРОВ
ФЕРМЕНТОВ ЭЛЕКТРОН-ТРАНСПОРТНЫХ ЦЕПЕЙ
Рисунок 1. Структурные формулы различных гемов, входящих в состав основных ферментов
электрон-транспортных цепей
ПРИЛОЖЕНИЕ 2 Структурные формулы различных простетических групп.. 335
Бактериохлорофилл а
Бактериофеофетин а
Рисунок 2. Хлорофиллы фотосинтетических электрон-транспортных цепей прокариот и рас-
тений
336
ПРИЛОЖЕНИЯ
Убихинон (CoQ)
Пластохинон (PQ)
он R
Менахинон (MQ) Родохинон (RQ)
Рисунок 3. Производные хинона, участву-
ющие в ферментативных окислительно-
восстановительных процессах: число
изопреновых остатков (п) варьирует у
разных видов от 6 до 10; уби- и менахи-
ноны найдены в мембранах бактерий и
митохондрий, пластохинон — в мембранах
тилакоидов хлоропластов и цианобакте-
рий, родохинон — в дыхательной цепи
митохондрий имаго аскариды
Рисунок 5. Структурные формулы рибоф-
лавина, FMN и FAD, а также механизм их
двухэлектронного восстановления
FAD (FMN)
FADH2 (FMNH2)
он R
Рисунок 4. Структурные формулы никотинамидных
кофакторов В NAD(H) R является гидроксильной
группой, а в NADP(H) — фосфатной
Рисунок 6. Основные железосерные кластеры
FeS-протеинов: [Fe—SJ-центр, [2Fe—2S]- и
[4Fe—4S]-кластеры (сверху вниз). Кластер,
содержащий один атом Fe (показан красным),
был описан в различных рубредоксинах и
родственных им белках. Однако, как правило,
атомов железа больше — два. три. четыре и
т.д. В рубредоксине все атомы серы принад-
лежат остаткам цистеина белка (показаны
серым). В остальных кластерах в образовании
комплекса наряду с остатками цистеина уча-
ствуют также атомы серы в форме сульфида
(S2-, показаны желтым)
ПРИЛОЖЕНИЕ 2. Структурные формулы различных простетических групп... 337
Рисунок 7. Структурные формулы тиаминпирофосфата (1),
дигидролипоевой кислоты (2) и кофермента А (3)
Рисунок 8. Кобаламин
(витамин Bi2)
Рисунок 9 Тетрагидрофолат и тетрагидрометаноптерин
(метаногенные археи)
Рисунок 10. Структурные формулы метил-кофермента М,
кофермента В и CoM-S-S-CoB гетеродисульфида (метано-
генные археи)
338
ПРИЛОЖЕНИЯ
МЕТАНОФЕНАЗИН
R=
Рисунок 11 Структурные формулы различных вариантов кофермента F420
(метаногенные археи)
Формил-MFR
ДИГИДРОМЕТАНОФЕНАЗИН
Рисунок 12. Метанофеназин и дигидрометанофе-
назин метаногенных архей
Карбокси-MFR
Рисунок 13. Структурные формулы мета-
нофурана (MFR). формил-метанофурана
и карбокси-метанофурана (метаноген-
ные археи)
ПРИЛОЖЕНИЕ 3
ПРИРОДНЫЙ ВОЗОБНОВЛЯЕМЫЙ АНТИОКСИДАНТ,
АДРЕСОВАННЫЙ В МИТОХОНДРИИ
В последней главе нашей книги речь шла о том, что SkQl — искусствен-
ный антиоксидант многократного действия, адресованный во внутреннюю
митохондриальную мембрану. В 2008 г. появилось сообщение Б. Моосмана и
сотр. о естественном возобновляемом антиоксиданте, локализованном в той
же мембране. Поразительно, что ради достижения этой цели митохондрии
пошли на изменение своего генетического кода. Как показали авторы ци-
тированной работы, белки, кодируемые митохондриальной ДНК, у многих
видов эукариот содержат гораздо больше метионина, чем их аналоги у других
видов эукариот. Оказалось также, что у видов, бедных метионином, эта ами-
нокислота кодируется в митохондриях одним кодоном (AUG), а у богатых
метионином — не только AUG, но также еще AUA (у бедных метионином
AUA — один из трех кодонов изолейцина). Как правило, кодон AUA кодирует
метионин вместо изолейцина, когда речь идет о видах с высоким аэробным
обменом (позвоночные, насекомые, ракообразные, круглые черви), в то
время как у видов с низким аэробным обменом (иглокожие, губки, плоские
ленточные черви, книдарии) AUA кодирует в митохондриях изолейцин точ-
но так же, как это имеет место в случае с белками, кодируемыми ядерной
ДНК. Замечательное разнообразие демонстрируют грибы. Среди группы
Saccharomycotina одни (в частности, Saccharomyces cerevisiae) используют AUA
для кодирования метионина, а другие — изолейцина (к последним относятся
также Schizosaccharomyces pombe).
Существенно, что как изолейцины, так и метионины, кодируемые
AUA, обычно расположены на поверхности белков внутренней мембраны
митохондрий, причем часть из них обращена в сторону интерфазы мембра-
на / вода, а часть находится в сердцевине мембраны, т.е. в ее гидрофобной
области. Демонстративен следующий пример. По количеству поверхност-
ных метионинов в митохондриальном цитохроме b пчела Melipona bicolor
в десять раз превосходит морскую звезду Florometra serratissima (33 остатка
против 3). В результате у насекомого вся молекула цитохрома b прямо-таки
покрыта снаружи метионинами (рис. 1).
По мнению Б. Моосмана и его коллег, ключ к пониманию подобной
ситуации дает антиоксидантная активность метионина. Это единственная
аминокислота, способная реагировать практически со всеми природными
АФК, включая даже сравнительно инертную Н2О2. При этом АФК обезвре-
живаются, а метионин превращается в стабильный и безобидный метио-
Морская звезда
Ftoromatra serratissima
ВИД СБОКУ
ВИД СВЕРХУ
Пчела
МеИропа bicolor
Рисунок 1. Остатки метионина (показаны красным) в цитохроме b из митохондрий мор-
ской звезды (Florometra serratissima) и пчелы (Melipona bicolor) [Bender et al., PNAS 2008, 105:
16496-16501]
нинсульфоксид (ср. с другой серосодержащей аминокислотой — цистеином,
которая тоже реагирует с АФК, но образует при этом весьма агрессивный
радикал*). Кроме того, очень важно, что метионинсульфоксид способен
регенерировать в исходный метионин, восстанавливаясь электронами ды-
хательной цепи:
NADPH тиоредоксинредуктаза тиоредоксин
метионинсульфоксидредуктаза метионин.
Таким образом, метионин белков, кодируемых митохондриальной ДНК,
оказывается аналогом SkQl, будучи возобновляемым антиоксидантом, ло-
кализованным во внутренней мембране митохондрий (рис. 2). Существен-
но, что добавочные метионины, появляющиеся в результате изменения ге-
нетического кода в митохондриях, располагаются на периферии белковой
молекулы, встречая АФК на пути к активным центрам ключевых белков
окислительного фосфорилирования. Подобное расположение метионинов
обусловлено тем, что ранее те же места занимали остатки такой гидрофоб-
ной аминокислоты, как изолейцин. Белки, о которых идет речь, встроены в
мембрану, как кирпичи в стену, а поверхностные гидрофобные аминокис-
лоты цементируют их связи с партнерами внутри мембраны.
Совсем недавно антиоксидантная роль метиониновых остатков в белках
была подтверждена Луо и Левиным в опытах на Е. coli. Бактерии росли на
среде со смесью аминокислот, в которой метионин был заменен на нор-
лейцин. Поскольку система биосинтеза белков Е. coli может использовать
норлейцин вместо метионина, со временем в среде роста накапливалось
все больше клеток с белками, в которых метионин заменен на норлейцин.
Когда процент подобных замен достиг 40, клетки отмыли от свободного
* Неудивительно, что существует обратная корреляция между продолжительностью жиз-
ни организма и количеством остатков цистеина в белках, кодируемых в митохондриях.
ПРИЛОЖЕНИЕ 3 Природный возобновляемый антиоксидант, адресованный... 341
Искусственная защита
митохондрий
от АФК при помощи SkQ
Природная защита
митохондрий
от АФК при помощи метионина
Рисунок 2. SkQ и метионин как возобновляемые антиоксиданты, защищающие митохондрии
от АФК. АФК — активные формы кислорода, НФК — неактивные формы кислорода, SkQH2 —
восстановленная форма SkQ, SkQ*- — анион-радикал SkQ, Z>H2+ — восстановленный цитохром
Ьи, Ьиу+ — окисленный цитохром Ьи, метионин и метионин-сульфоксид — соответствующие
аминокислотные остатки в белках, кодируемых митохондриальной ДНК, Тгхв — восстановлен-
ный тиоредоксин, Тгхо — окисленный тиоредоксин. Показано, что дыхание регенерирует />н2+
и Тгхв, восстанавливая />н3+ и Тгхо
норлейцина и добавили метионин. В результате количество свободного ме-
тионина и S-аденозилметионина в клетках Е. coli нормализовалось, а ко-
личество метионина в белках осталось сниженным. Как выяснилось, такие
клетки оказались гораздо чувствительней, чем в норме, к токсическому дей-
ствию Н2О2.
При всем сходстве в антиоксидантном действии белковых метионинов
и SkQl между ними есть и существеннейшее отличие, касающееся при-
менимости двух этих механизмов для терапии старения. Не вмешиваясь
в геном митохондрий, мы не можем искусственно усилить метиониновую
систему, увеличив количество метионина в митохондриальных белках. В то
же время не составляет труда варьировать силу воздействия SkQl, просто
меняя его количество, вводимое в организм пациента. Существенно также,
что метионин — самая токсичная из аминокислот, избыток которой в диете
ведет к множеству патологических последствий для организма.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автофагия 278, 279
Аденилатциклаза 211
Аденозиндифосфат (ADP) 17, 18
— ингибирование ГоГгАТРазы 152, 153
Аденозинмонофосфат (АМР) 18
Аденозинмонофосфат циклический
(сАМР) 211,226
Аденозинтрифосфат (АТР) 12, 17, 18
Аденозинтрифосфатаза (АТРаза) 159, 160
- Са2+ 267
- СГ 267
- Н+ 159 - 164
— — в анаэробных бактериях 160
— — в плазмалемме клеток 162
— — классификация 160, 161
— — типа Е]Е2 163
— — типа FOF\ 161, 162
-----типа VOV, 162, 163
- К+ 164, 165, 188
- Na+ 251-253
- Na+/K+ 30, 252, 253
Аденозинтрифосфатсинтаза
(АТР-синтаза)
— в хлоропластах 146
- механизм 151 — 158
— митохондриальная 145, 146
— отношение Н+/АТР 158, 159
— субъединичный состав 145, 146
— трехмерная структура 147—151
- Na+ 259, 260
- Е. coli 145
Аконитаза 68, 276—278, 284
Аксиальный лиганд 40, 50, 60-62, 101
— определение 103
Активные формы кислорода (АФК)
268-288, 294-301, 306, 310, 312, 316,
317, 320, 321, 339-341
Алкалофилы 89, 192, 255, 259, 262, 263
Альтернативная (цианидрезистентная)
оксидаза (АОХ) 111, 112, 115, 122
Альцгеймера болезнь 290
Аминокислот транспорт 187, 255, 256
Антенна светособирающая 20, 21, 25, 33,
34, 55, 56, 58, 59, 139, 227-229
Антимицин 100, 306
Антипортер
- ATP/ADP 200-204,206,211,212,214,
216, 276, 278, 283
- глутамат/аспартат 211,223,276
— дикарбоксилатов 211,223,224
— карнитин/ацилкарнитин 195—197
— сахароза/Н+ 191
- К+/Н+ 89, 197, 225, 253
- Na+/H+ 192, 197, 240-242, 256
- НРО42/малат2’ 192
Апоптоз 16, 101, 280-286, 289, 295, 297,
298, 301, 306, 308, 314
Арсенат 17, 206, 207
Аскарида 117, 118
Аскорбат 58, 86, 91, 271
Атрактилат 200
Аттрактанты 140, 141, 227, 274
Ацетил-СоА 70, 193, 196, 245
Ацетил фосфат 73
Ацидофилы 33, 256
Бактериородопсин
— аминокислотная последовательность
130
— в аттрактантном эффекте света 140,
141
- генерация АЦН+ 129,130,134-137
- двумерные кристаллы 129
- квантовый выход 139
- конформационные изменения 133,
136
— принцип функционирования 129,
130
— сдвиг рК Шиффова основания 129,
130
— темновая адаптация 134
- трехмерная структура 130-133
— фотоцикл 133
— электрогенные стадии 134, 135
Бактериофеофетин 34, 35, 38, 41, 42
Бактериохлорофилл 32-36, 38-43, 48,
52
- димер 34,35,39,41,42,52
Белок
— ингибитор F| 153
— протеинкиназы 211, 227, 281, 296,
298
- Риске 50, 83, 95-97, 99, 100
— транспорт через мембрану 203—206
- р53 295, 300, 301, 310, 313
- p66shc 295, 296, 298
Бислойная мембрана 305
Биотин 157, 244, 245
Предметный указатель
343
Биоэнергетика
— определение 7
— отношение к другим биологическим
наукам 9—12
— эволюционные аспекты 17—30
Биядерный центр 102, 104—107, 112,
113, 115, 116
Бонгрековая кислота 200, 202
Британский антилюизит 100
Брожение 7, 74-77, 123, 124, 160, 245
Бурый жир 209-214, 216, 217, 221
Буферы Дцн+ 14, 51, 64, 168, 239-244,
265
Валиномицин 162, 187, 188, 197, 200
Ванадат 151, 163, 164, 251, 267
Витамин А 25,271
Витамин В, 20
Витамин В12 20, 250
Витамин Е 271, 301
Витамин К, 27, 52, 54-57, 91, 117, 271
Витамин К3 27, 90, 91, 117, 223, 271
Вольфрам 251
Высокоэнергетическое соединение, опре-
деление 17—18
Галородопсин 137—141, 264, 267
Галофилы 128, 138-142, 187, 192, 241,
255, 262, 264
Гексокиназа 69, 226
Гем
— высокоспиновый 103, 108, 115
— низкоспиновый 103, 116
— хлориновый 116
- Ьн 35, 36, 48, 49, 54, 55, 60-62, 83,
95, 96, 99, 276, 306, 311, 341
- bL 35, 36, 48, 49, 54, 55, 60-62, 83,
95-97, 99, 100, 276
Гемоглобин 103, 332
Генератор Дцн+
— вторичный 159—161
— первичный 31 — 141
- соотношение Н+/ё 55, 83, 91, 92, 94,
99, 100, 115-117, 119
2-Гептил-4-оксихинолин-ТЧ-оксид
(HQNO) 249
Гидрогеназа 89, 126, 127, 245
Гидроксиламин 153, 163, 164
Гипоксия 235, 287
Глаукома 308, 310, 315
Гликолиз 14, 16, 22-24, 26, 68-76, 78,
82, 118, 160, 161, 165, 175, 182, 191,
200, 242, 252, 279, 287
Глицеральдегид-фосфатдегидрогеназа
(ГАФД) 68,71,223
Глицерин 38, 40, 66, 211
Глутатион 271
Глюкоза 28, 66, 68-70, 74-76, 109, 118,
123, 159, 166, 169, 186, 191, 226, 252,
267, 331
Грамицидин D 197
Гуанилатциклаза 103
Гуанозиндифосфат (GDP) 73, 142, 201,
211
Гуанозинмонофосфат циклический
(cGMP) 142
Гуанозинтрифосфат (GTP) 67, 142, 200,
201, 211
Движение
— бактерий 174-181
— простейших 174, 184, 185
— сперматозоидов 174
Девесковинида 184, 185
Дезоксирибонуклеиновая кислота (ДНК)
8, 22, 58, 79, 166, 206, 207, 269, 271,
278-281, 284, 295, 296, 299, 301, 310,
312, 317, 339-341
Декарбоксилаза
— глутаконил-СоА 246
—метилмалонил-СоА 246, 259
—№+-зависимая 244—246
—оксалоацетата 244, 245
2,4-р-Динитрофенол 182, 215, 235, 312
ТЧ,М-Дициклогексилкарбодиимид (ДЦКД)
141, 151, 154, 155, 161, 163, 164, 168,
182, 183
Диурон 57, 235
Диэтил стильбестрол 151
Дыхательный контроль 112, 215, 216,
276
Дыхательная цепь 81—122
Железа двухвалентного ион как донор
электронов 120, 121
Жирные кислоты
— как терморегуляторные разобщители
211, 212, 215, 216
— ковалентное связывание с белком 38,
40
— р-окисление 86, 195, 196, 212
— транспорт 192—196, 212
Жирный ацилкарнитин 193—197
Жирный ацил-СоА 86, 194, 195, 211,
226, 237
344
Предметный указатель
Зеленые фотосинтезирующие бактерии
51-54
Зимняя спячка 213
Калий-транспортирующая система 188
Кальция ион
— аккумуляция в митохондриях 30,187,
188, 190, 192, 225, 236
— активация фосфолипазы А2 226
— как вторичный посредник 111, 225,
226
Капсаицин 90, 91, 298, 299
Карбоксиатрактилат 200, 202, 216
Кардиолипин 311, 313
Карнитин 192-197, 211, 237, 302, 305
Карнозин 77—79
Каротиноиды 33, 41, 42, 129, 139
Каспаза 281
Каталаза 224
а-Кетоглутарат 14, 70, 72, 73, 112, 201,
224, 330
а-Кетоглутаратде гидрогеназа 68, 72
Кобаламин, см. витамин В!2 250
Комплекс I
— бактериальный 87, 89, 90
— в митохондриях 86
— генерация Дцн+ 92—94
— перенос электронов 93, 94
- редокс-центры 88
— соотношение Н+/ё 83, 92
— субъединичный состав 86, 87
- трехмерная структура 87, 93
Комплекс II см. Сукцинатде гидрогеназа
Комплекс III (CoQН2:цитохром с редук-
таза)
— в бактериальной фото-редокс цепи
48-50
— в дыхательной цепи 94—100
- редокс-центры 98, 99
— субъединичный состав 95, 96
— трехмерная структура 96—98
Комплекс IV См. Цитохромоксидаза
Комплекс Ьсх См. Комплекс III
Комплекс bj 60—63
Комплекс фотосинтетических реакцион-
ных центров (бактериальный)
— генерация Дцн+ 44—48
— последовательность переноса электро-
нов 42—44
- расположение редокс-групп 38-42
— субъединичный состав 37, 38
- трехмерная структура 38—41
Кофермент А (СоА) 20, 86, 167, 193-196,
211, 260
Кофермент В (СоВ) 125, 126
Кофермент F420 90, 126, 127
Кофермент Q (CoQ)
— в дыхательной цепи 82, 83
— в комплексе фотосинтетических реак-
ционных центров 27, 34
Кофермент М (СоМ) 125, 126, 250, 260
Креатинфосфат 14, 17, 18, 90, 197, 332
Ксенобиотики 117, 221-223
Р-Лактамаза 206
Лактат 24, 76, 78, 82, 109, 123, 191, 221,
246
Лидер-пептидаза 204
Лизосома 10, 161, 162, 166, 279
Лизофосфолипиды 226
Липаза 211,226
Липоевая кислота 72, 73
Липопротеины 38, 40, 179
Липосома 247, 305
Липофильные (проникающие) ионы 230,
234, 268, 269, 302, 320
Малат 68, 109, 118, 192, 219, 224
Малат-аспартат-глутаматный челнок
223, 224
Малатде гидрогеназа 68, 223, 224
Медь 27, 55-57, 79, 82, 91, 102-107,
112-115
Мелатонин 300
Мелибиоза 255
Менадион, см. витамин К3
Менахинон (MQ) 42, 40-42, 45, 52, 117,
118, 270
Метан 123-125, 250, 251, 261, 333
Метаногенез 77, 123-127, 249-251, 260,
261, 333
Метанофеназин 126, 127
Метанофуран 250, 251, 260, 261
Метионин 103, 317, 339-341
Метиламин 124, 125
Метилмалонил-СоА 246, 259
Миксотиазол 100, 219, 275
Митоптоз 277—280, 284, 290
Митохондриальный ретикулум 229, 231,
233, 234, 243
Митохондрия
- биогенез 205
— внешняя мембрана 87, 195, 203, 204,
211, 216, 224, 226, 232, 238, 271, 280,
281
Предметный указатель
345
— внутренняя мембрана 81, 111, 171,
190, 192, 194, 195, 200, 202-205, 209,
216, 217, 221, 223, 226, 235, 237, 238,
271, 272, 277, 278, 283, 295, 296, 306,
311
— гигантская 230—232
- контакт 231, 232, 234-236
- латеральный транспорт 235—239
— нитчатая 232—235
— окраска родамином 225, 234, 236
- транспорт Са2+ 30,187,188,190,192,
225, 236
— форма 229—235
- эволюционное происхождение 203
Молибден 114, 251
Моненсин 258
Муцидин 100
Мягкое разобщение 276, 284, 312
Надпочечник 191, 272, 290
Негемовое железо
— в альтернативной оксидазе 112
— в комплексе реакционных центров
41
— в фотосистеме II 58—60
Негемовые железосерные белки
— в комплексе 1 88, 89
— в нециклической фото-редокс цепи
52
— в комплексе III 36, 50,
— в фотосистеме I 57
Некроз 281,283-286,289,306,307
Нигерицин 197, 200, 225
Никотинамидадениндинуклеотид
(NAD(H)) 20, 50-53, 68-71, 74-76,
78, 81-83, 85-90, 93, 94, 109, 111,
115, 118, 120, 121, 127, 158, 169-173,
219, 221, 223, 224, 239, 246, 247, 249,
274, 278, 328, 332
Никотинамидадениндинуклеотидфосфат
(NADP(H)) 20,50,55-58,63-65,81,
82, 90, 111, 122, 169-173, 221, 222, 227,
247, 271, 272, 278, 285, 332
Нистатин 184
Нитрат
— ингибитор У0У|-АТРазы 163
— как окислитель редокс-цепи 114,117,
121, 330
- редуктаза 114, 117
Нитрит 86,114,121,330
Норадреналин 211, 213, 215
Нуклеозиддифосфаткиназа 201, 332
Обратный перенос электронов 120,
121, 173
Ожирение 213
Оксалоацетат 68, 70, 224, 244—246
Олигомицин 144, 155, 163, 168, 216
Органоптоз 287, 289
Осмотическая работа, определение 186
Остеопороз 290, 293, 308, 310, 314, 318
Отношение Р/О 158, 159
Оуабаин 253, 266
Пальмитоилкарнитин 195
Пероксисома 10, 224, 271, 272, 279
Пептидоглюкан 159
Пиерицидин 90
Пирофосфат неорганический (PPj) 14,
18, 51, 144, 166-169
Пирофосфат-синтаза (пирофосфатаза)
18, 50, 166-169, 243, 253
Пируват 68, 70, 72, 73, 75, 76, 112, 118,
244, 245
Пируватдегидрогеназный комплекс 68,
72, 76
Пируват-формиат-лиаза 76, 245
Плазмадесма 229, 235
Плазмалемма 10, 30, 162—166, 186, 256,
265, 271
Пластохинон (PQ) 27, 54, 55, 57, 60, 61,
100, 122, 270, 271, 303, 305, 320
Пластоцианин 54, 56-58, 63, 100, 122
Плотный контакт 232
Прогерия 290, 299, 301, 308, 310
Пропионат 77, 123, 246, 259
Пропионил-СоА 246, 260
Протеинфосфатаза 227
Протеолипосома 44, 45, 58, 100, 137, 154,
164, 167, 168, 170, 198, 200, 239, 244,
247, 252, 255, 256
Протометр 141, 227
Протон-движущая сила (Др) 13, 14
Протонная помпа 92, 107, 113, 115, 116,
120, 128, 129, 168
Протонофор 121, 169, 182-184, 198, 212,
215, 251, 258, 259, 262, 276, 312
Пурпурные бляшки 129—131, 134, 137,
228
Пурпурные фотосинтезирующие бактерии
27, 32-36, 51, 53, 55, 58, 60, 100, 264
Разность pH (ДрН)
— забуферивание 240—242
- определение 12, 13
346
Предметный указатель
Разность электрических потенциалов
(A\g)
— в распределении мембранных белков
— определение 12, 13
— превращение в АрН 240—242
Разность электрохимических потенциалов
ионов Н+ (Дцн+)
— забуферивание 14, 239—243
— как конвертируемая энергетическая
валюта 12—14
— определение 12, 13
- перенос 227—239
Разность электрохимических потенциалов
ионов Na+ (ApNa+) 12, 14—16, 244
Разобщение терморегуляторное
— в буром жире 209—214
— в мышцах 214—217
Разобщитель См. Протонофор
Регуляция pH в цитоплазме 161, 164,
226, 256, 257
Редокс-петля (петля Митчела) 48, 91, 92,
99, 107, 114, 116, 126, 263, 264
Репелленты 140, 176, 227
Ретиналь 25, 26, 128-130, 134-143
Рибозим 21
Рибонуклеиновая кислота (РНК) 21, 22,
145, 166, 167, 211, 269, 271
Рибофлавин 248, 249
Родамин 225, 234, 236, 305
Родопсин
— аминокислотная последовательность
141
— генерация Д\|/ 142, 143
— каскад cGMP 142
- расположение в мембране 141
— фотоцикл 142
Родохинон 118
Ротенон 90, 91, 219, 235, 275
Саркопения 290, 297, 318
Свободное дыхание 81, 208—219, 221—
223, 226
Секреторные пузырьки 161, 162, 166
Сенсорный родопсин 140, 141
Симпортер
— Лактат, Н+ 191
- Лактоза, Н+ 191, 198, 199, 202
- СГ, Н+ 138
- Н2РО4", Н+ 192
- К+, Н+ 188, 242
- Н+, метаболит 186, 187
— Na+, метаболит 255, 256
Система расщепления воды хлоропластов
и цианобактерий 54, 55, 60
Скулачева ионы 302
Соотношение Н+/ё 55, 83, 91, 92, 94, 99,
100, 115-117, 119
Соотношение Н+/АТР 149, 158, 159,
163, 169
Сопрягающий ион 13, 29, 109, 244, 255,
263-265
Сперматозоид 174, 231
Специальная пара бактериохлорофилла,
См. бактериохлорофилла димер
Старение 268, 269, 288-321
Стероидные гормоны 221
Субклеточные бактериальные пузырьки
154, 198, 244, 246, 251, 259
Субмитохондриальные пузырьки 147,
154, 156, 169, 170
Сукцинат 68, 70, 77, 86, 109, 117, 123,
156, 158, 188, 190, 246, 259, 260, 275,
276, 330
Сукцинатдегидрогеназа 68, 117,276
Сукцинил-СоА 260
Сульфит 153
Супрахиазматическое ядро 300
Таксис бактериальный 140, 176, 227
Термогенез сократительный 214, 222
Термогенин (UCP1) 209, 211, 213, 216
Терморегуляция 208—217, 221
Термофилы 93, 253
Тетрагидрометаноптерин (МРТ) 125,
250, 260
Тетрафенилборат 302
Тетрафенилфосфоний 302, 303, 305,
307
Тиаминпирофосфат 20, 73
Тилакоид 50, 53-56, 58, 63-65, 81, 100,
121, 122, 154, 159, 189, 225, 227, 229,
242, 243
Тимуса инволюция 308, 314, 319
Тиосульфат 121
Тироидные гормоны 224, 286
Тонопласт 161-163, 167, 183, 186
Трансгидрогеназа 50, 144, 169—173,
264
Трансдуцин 142
Убихинон см. Кофермент Q
Увеит 310, 315
Унипорт К+
— в бактериях 188, 225, 242
— в митохондриях 192, 243
Предметный указатель
347
Фактор некроза опухоли (TNF) 285, 286
Фактор Fo
— определение 144, 145
— проводимость для Н+ 154, 155
- расположение в мембране 147
— субъединичный состав 145, 146
— трехмерная структура 149, 150
— чувствительность к олигомицину
155
- эффект ДЦКД 154,155
Фактор Fi
— гидролиз АТР 151—153
— ингибирование ADP 153
- каталитические центры 151
— одноцентровый гидролиз АТР 152
— определение 144, 145
— отделение от мембраны 147
— связывание нуклеотидов 148, 151
— синтез связанного АТР 153
— субъединичный состав 145, 146
- трехмерная структура 148, 159
Фактор F6 146, 151
Феназинметосульфат 58
о-Фенантролин 45, 60
Феноптоз 283-291, 312, 313, 320, 321
Фентона реакция 287
Феофитин 55, 58, 60
Ферредоксин 54—58, 63, 90, 247, 248
Феррицианид 88
Флавинадениндинуклеотид (FAD) 20, 52,
55, 111, 115, 222, 247-249, 274
Флавинмононуклеотид (FMN) 52, 83,
88, 89, 92-94, 247-249
Флагелла
— бактериальная 14, 51, 64, 141, 160,
161, 174-184, 227, 258
— эукариотическая 174, 184
Флагеллин 176, 177
Фобородопсин 140
Формиат 76, 109, 122, 124, 245, 251,
261
Формиатдегидрогеназа 245
Фосфатидилинозит 225
З-Фосфоглицеральдегид 68, 71
2-Фосфоглицерат 68—73
Фосфодиэстераза 142
Фосфолипаза 226
Фосфоенолпируват 68, 70, 73, 186, 267
Фосфотрансферазная система 267
Фоторецептор 140—142, 310
Фото-редокс цепь
— нециклическая 33, 51—60
— — в зеленых серных бактериях 51—53
— — в хлоропластах и цианобактериях
53-60
— циклическая 33—50, 57, 58
— - в пурпурных бактериях 33—50
— — в хлоропластах и цианобактериях
57, 58
Фотосистема I
— локализация в ламеллах стромы 65
— механизм генерации Дцн+ 58
— механизм переноса электронов 57
— субъединичный состав 55
— трехмерная структура 56, 57
Фотосистема II
— локализация в тилакоиде 65
— механизм генерации Дцн+ 60
— механизм переноса электронов 59, 60
— субъединичный состав 58
— трехмерная структура 59
Фототаксис 140, 141
Фотофосфорилирование 58, 159
Фторид 168
Фумарат 68, 70, 109, 116-118, 276
Фумаратредуктаза 68, 117, 118
Хемиосмотическая теория 8, 48, 194
Хинолоксидаза
— £я3-типа 113, 114
- to-типа 115, 116
- to-типа 115, 116, 119, 120, 122, 274
Хинон 27, 35
Хлорида транспорт 64, 138, 267
ди-Хлорокарбонилцианидфенилгидразон
(ХКФ) 258
Хлоропласт
— вращение 183
— забуферивание Дцн+ 64, 65
- структура 53
— фото-редокс цепь 53—63
Хлорофилл 25, 27, 28, 32, 55, 56, 58-60,
91, 139, 227-229
— димер 54, 55, 58—60
Холестерин 184, 238
Хроматофор 32, 36, 44, 45, 49-51, 100,
154, 167-170, 173, 242, 243
Хромаффинные гранулы 166, 191
Цианид 19, 103, 108, 141, 219, 220
Цианобактерии 17, 25, 28, 29, 31, 52,
53, 55, 56, 58, 60, 63, 65, 81, 90, 100,
121, 122, 139, 182-185, 228, 229, 235,
243, 303
348
Предметный указатель
Цикл Кребса 68-70, 72, 73, 75, 82, 86,
118, 169, 173, 192, 212, 276, 284
Циклоз 183
Цинк 33, 100, 102
Цитохром
— определение 36, 103
— тетрагемовый с-типа 37, 39—41, 47
- b 35, 36, 48, 49, 50, 55, 61, 62, 83, 96,
97, 99, 100, 285, 296, 339
- Ь5 221, 238-240
- />559 58, 59
- с 17,36,38,39,41,43,46,48,49,58,
82, 83, 86, 94, 95, 99-108, 112-115, 121,
223, 280, 281, 295, 311
- с, 36, 49, 50, 55, 83, 95-97, 99, 101
- f 54, 55, 57, 60, 62, 63
- Р-450 221-223, 271, 272, 301
Цитохромоксидаза
— механизм генерации ДЦН+ 107, 108
— соотношение Н+/ё 107
— субъединичный состав 102
— последовательность переноса электро-
нов 105-107
— редокс-центры 102, 103
— трехмерная структура 103—105
— дд3-типа 102—108, 122
- с/>/>3-типа 113, 114, 119
Цитрат 68, 70, 169, 192, 245, 255, 276
Черная мембрана см. Мембрана, плоский
бислой
Электронный парамагнитный резонанс
(ЭПР) 88
Эндоплазматический ретикулум 10, 30,
161, 166, 221, 238, 239, 267, 272
Эндосома 161, 162, 166
N-этилмалеимид 163, 168, 251
Ядро 10, 58, 87, 96, 112, 146, 203, 231,
279, 280
Ядерный магнитный резонанс (ЯМР)
148, 149
Na+-движущая сила (Ал) 14
№+/К+-градиент как буфер ДЦН+ 239-
242
\а+-мотор 258, 259
№+-цикл 262—266
Q-цикл 49, 55, 60, 63, 65, 83, 98, 99,
276
ИМЕННОЙ УКАЗАТЕЛЬ
Абдулаев Н.Г. 130
Агре П. (Agre Р.) 9
Адлер Дж. (Adler J.) 175, 176
Алим М.И.Х. (Aleem M.I.H.) 121
Анисимов В.Н. 306, 308, 323
Антоненко Ю.Н. 305,306, 312
Ануин П.Н. (Unwin P.N.) 130
Арчаков А.И. 239
Асадов А.А. 42
Аустад С.Н. (Austad S.N.) 290, 294, 297
Байков А.А. 253, 254
Бакеева Л.Е. 231
Балчевски М. (Baltscheffsky М.) 167, 168
Баркуэра Б. (Barquera В.) 248
Барха Г. (Baija G.) 297
Белицер В.Н. 7, 158
Берг Г.К. (Berg Н.С.) 176, 180, 181
Бертон М. (Burton М.) 231
Берцова Ю.В. 119
Бибиков С.И. 141
Блюменфельд Л.А. 20
Богачев А.В. 249
Бойер П.Д. (Boyer P.D.) 9, 153, 156
Бондурянский Р. 289
Бранд М.Д. (Brand M.D.) 297, 298
Брассил К. (Brussil С.) 289
Бремер Б. (Bremer В.) 207
Бреннер С. (Brenner S.) 280
Броди А.Ф. (Brodie A.F.) 221, 255
Броун И.И. 241
Бубенцер Г.Д. (Bubenzer H.J.) 231
Будрене Е.О. 274
Бэйт-Смит Е.К. (Bate-Smith Е.С.) 78
Ван Дам К. (Van Dam К.) 8
Вейсман A. (Weismann А.) 288, 289, 320
Верховский М.И. 249
Викстрём М. (Wiksrom М.) 107
Виноградов А.Д. 152
Винчи Леонардо да (Vinci Leonardo da) 7
Высоких М.Ю. 302, 305, 306, 312
Гален К. (Galenus) 280
Гарднер Э.М. (Gardner Е.М.) 318
Гаррахан П. (Garrahan Р.) 259
Гарсия-Као И. (Garsia-Kao I.) 300
Гельмонт И.Б. ван (Helmont J.B. van) 7
Глин И. (Glynn I.) 159
Голдсмит Т. (Goldsmith Т.) 292
Гольштейн Н.И. 287
Голья Ф. (Goglia F.) 217
Грин Д. (Green D.) 302
Грингат С. (Greengut S.) 239
Гринюс Л.Л. 206
Гулевич В.С. 77, 78, 193
Дайзенхофер Й. (Deisenhofer J.) 37
Дальтон X. (Dalton Н.) 119
Даниэльсон Л. (Danielson L.) 169
Дарвин Ч. (Darwin C.R.) 288, 289, 292,
320
Дейзенхофер Й. (Deisenhofer J.) 9
Дерипаска О.В. 269, 305
Дибров П.А. 258
Дильман В.М. 296
Димрот П. (Dimroth Р.) 244, 248, 259
Докинз Р. (Dowkins R.) 320
Донехауэр Л. (Donehower L.) 301
Драчев В.А. 234, 236, 237
Драчев Л.А. 44, 134
Дризе Н.И. 308
Еричев В.П. 310
Зассенхауз Г. (Zassenhaus Н.Р.) 296
Зиновкин Р.А. 309
Зоров Д.Б. 234, 236, 237, 310
Йоханссон Б. (Johansson В.) 209
Йошида М. (Yoshida М.) 156, 157
Йошикава С. (Yoshikawa S.) 103
Капелько В.И. 310
Каплан Н. (Kaplan N.) 169
Карр К.Дж. (Carr C.J.) 316, 319
Каспаринский Ф.О. 30, 321
Каулен А.Д. 44, 134
Кауппинен Р. (Kauppinen R.) 225
Кейлин Д. (Keilin D.) 17
Керр Дж.Ф. (Kerr J.F.) 280
Кирквуд Т. (Kirkwood T.B.L.) 294, 295
Кливленд Л.Р. (Cleveland L.R.) 184
Клингенберг М. (Klingenberg М.) 200
Коловик С. (Colowick S.) 169
Колосова Н.Г. 308-310, 323
Комфорт A. (Comfort А.) 288
350
Именной указатель
Копенкин Е.П. 309
Копнин Б.П. 310
Корана Х.Г. (Khorana H.G.) 130, 132
Коршунова Г.А. 305
Коэн Ж.Н. (Cohen G.N.) 198
Красновский А.А. 32
Кребс Г.А. (Krebs Н.А.) 8, 69
Кремер Г. (Kroemer G.) 9, 280
Крик Ф. (Crick F.) 8
Кримберг Р. 193
Кэннон Б. (Cannon В.) 213, 308, 310
Кэньон С. (Kenyon С.) 295
Лабедан Б. (Labedan В.) 207
Ламарк Ж.-Б. (Lamarck J.-B.) 217
ЛаниЯ.К. (Lanyi J.K.) 132
Ларшсон Н.-Г. (Larsson N.G.) 296
Либерман Е.А. 170, 302
Лихтенштейн А.В. 284
Липман Ф. (Lipmann F.) 12
Лойсон A. (Loyson А.) 289
Лонго В. (Longo V.D.) 269
Льюис К. (Lewis К.) 140, 175, 180
Лямзаев К. Г. 279
Маккей К. М. (МсСау С.М.) 316, 318
Маккиннон Р. (MacKinnon R.) 9
Макнаб Р.М. (Macnab R.M.) 256
Манских В.Н. 284
Маслов С.П. 215
Медавар П.Б. (Medawar Р.В.) 289
Медников Б.М. 7
Мейсель М.Н. 235
Мерфи М. (Murphy М.Р.) 302, 309
Метлина А.Л. 178
Митчел П. (Mitchell Р.) 8, 9, 13, 48, 49, 91,
98, 170, 175, 194, 198, 240, 241
Михель X. (Michel Н.) 9, 37
Михельсон В.М. 308
Моосман Б. (Moosmann В.) 339
Мохова Е.Н. 216
Моценок Е.Х. 183
Мулкиджанян А. 265
Мур Дж. (Moore J.) 231
Ньюмейер Д.Д. (Newmeyer D.D.) 9, 280
Обухова Л.А. 308, 310
Овчинников Ю.А. 130, 132, 141, 252
Окунуки К. (Okunuki К.) 220
Остерхельт Д. (Oesterhelt D.) 128, 133
Панде С. (Pande S.) 195
Папа С. (Papa S.) 92
Парвин Р. (Parvin R.) 195
Пасюкова Е.Г. 306
Пеличчи Дж. (Pelicci P.G.) 295
Перехватов В. В. 305
Понамперума С. (Ponamperuma S.) 19,
20
Постгейт Дж. Р. (Postgate J.R.) 119
Провербио Ф. (Proverbio F.) 253
П ролла Т.А. (Prolla Т.А.) 296
Пфениг Н. (Pfennig N.) 259
Пфеннингер-Ли (Pfenninger-Li X.D.)
248
Ракер Э. (Racker Е.) 147
Рамсей Р. (Ramsay R.) 195
Резник Д.Н. 293, 294
Рикенберг Г.В. (Rickenberg H.V.) 198
Рич П.Р. (Rich P.R.) 247
Робертсон Т.Б. (Robertson Т.В.) 316
Рогинский В.А. 306
Розен Б. (Rosen В.) 265
Роттенберг Г. (Rottenberg Н.) 200
Ротуел Н. (Rothwell N.) 213
Роузмэн М. (Roseman М.) 239
Рууге Э.К. 305
Рязанов А.Г. 308, 310
Саган К. (Sagan С.) 19, 20
Садовничий В.А. 305, 322
Сазанов Л.А. 93
Салстон Дж.Э. (Sulston J.E.) 280
Сампер М. (Sumper М.) 237
Северин С.Е. 78, 79, 214, 302
Северин Ф.Ф. 285, 312, 323
Северина И.И. 182, 229, 305, 312, 322
Семенов А.Ю. 44
Сенин И.И. 310
Сент-Дьерди A. (Szent-Gyorgyi А.) 8, 20
Сигмэн Д. (Sigman D.) 153
Скоу Й.-Х. (Skou J.-Ch.) 9, 252
Скрэйбл Г. (Skrable G.) 301
Скулачев В.П. 8, 9, 234, 300, 305
Скулачев М.В. 305, 322
Слейтер Э. (Slater Е.С.) 8, 97
Смит Р. (Smith R.A.) 209, 302
Сотникова Л.Ф. 309
Сохал Р. (Sohal R.) 297
Спивак И.М. 308
Спирин А.С. 21
Именной указатель
351
Старков А.А. 275
Сток М. (Stock М.) 148-150, 213
Стокениус В. (Stoeckenius W.) 128
Стучликова Е. (Stuchlikova Е.) 316
Таббс П. (Tubbs Р.) 195
Тамм С.Л. (Tamm S.L.) 184
Танака К. (Tanaka К.) 235
Темкин М.И. 20
Титер Р.М. (Teather R.M.) 198
Тихонова Г.В. 121
Токуда X. (Tokuda Н.) 246, 248
Триссл Г.-В. (Trissl H.-W.) 45
Тройбле Дж. (Trauble Н.) 237
Уанг Кс. (Wang X.) 9, 280
Унемото Т. (Unemoto Т.) 246—248
Уокер Дж. (Walker J.) 9, 147, 148
Уолдегиоргис Дж. (Woldegiorgis G.) 202
Уоллес А.Р. (Wallace A.R.) 288, 289, 320
Уотербери Дж. (Waterbury J.) 182
Уотсон Дж. (Watson J.) 8
Уэйндрах Р. (Weindruch R.) 317, 318
Уэст И. (West 1.) 198, 241
Фелдмэн Р. (Feldman R.) 153
Фернандес Дж. (Fernandes J.) 318
Филенко О.Ф. 306
Фойсснер Л. (Foissner L.) 235
Фритц И.Б. (Fritz 1.В.) 194
Хармэн Д. (Harman D.) 296, 297, 316
Харольд Ф. (Harold F.M.) 251
Хекими С. (Hekimi S.) 295
Хендерсон Р. (Henderson R.) 130, 132,
Хифнер Д. (Heefner D.) 251
Холдейн Дж. (Haldane J.) 7
Хольценбергер М. (Holzenberger М.)
296
Хорвиц Х.Р. (Horvitz H.R.) 280
Хубер Р. (Huber R.) 9, 37
Цибакова Е.Т. 158
Чанс Б. (Chance В.) 90
Чен Л.Б. (Chen L.B.) 225, 234
Ченцов Ю.С. 231
Черняк Б.В. 279, 285, 305, 306, 322
Чикунов А.В. 305
Шидловский К.А. 306
Шинк Б. (Schink В.) 259
Шувалов В.А. 42
Эйзенбах М. (Eisenbach М.) 176
Эммануэль Н.М. 296, 297
Энгельгардт В.А. 7, 81, 220
Эпстайн В. (Epstein W.) 188
Эрнстер Л. (Ernster L.) 8, 169, 170
Юнге В. (Junge W.) 155
Ягужинский Л.С. 302, 323
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ ОРГАНИЗМОВ
Acetobacterium woodii 260
Acidaminococcusfermentans 246
Aplysia californica 267
Arum sp. 217
Azotobacter vinelandii 117-120, 273, 274
Bacillus pseudofirmus 259
Bacillus sp. YN-\ 259
Bacillus thuringiensis 266
Bacillus subtilis 175, 207
Bdellovibrio bacteriovorus 175, 203
Blastochloris (Rhodopseudomonas) viridis
37-49
Caenorhabditis elegans 295, 296
Candida albicans 235
Ceriodaphnia affinis 306, 313
Chara sp. 183
Chloroflexus sp. 53
Chlamydomonas reinhardtii 61
Clostridium symbiosum 246
Endomyces magnusii 235
Enterococcus hirae 144,162, 163, 191,251,
252, 262
Escherichia coli 87, 115-119, 139, 145,
146, 148, 150, 151, 154, 155, 163, 171,
174-176, 178, 181, 186-188, 197-199,
207, 241, 242, 246, 255, 258, 262, 266,
274, 340, 341
Haemophilus influenzae 207, 248
Halobacterium halobium 255
Halobacterium salinarium 128-130, 137,
139, 140, 227, 228, 241, 242, 267
Helicobacter pylori 90
Heterocephalus glaber 298
Homo sapiens 321
Florometra serratissima 339, 340
Fusobacterium nucleatum 246
Ilyobacter tartaricus 149, 150, 159, 260
Klebsiella aerogenes 244-246
Klebsiella pneumoniae 246, 248, 255
Lactococcus casei 144,162
Limonium vulgaris 267
Malonomonas rubra 246
Melipona bicolor 339, 340
Methanobacterium thermoautotrophicum
188
Methanosarcina barkeri 126
Methanosarcina mazei 253
Mixotricha paradoxa 184
Moorella thermoacetica 253, 254
Mycobacterium phlei 221, 255
Natronomonas pharaonis 13 8
Neisseria gonorrhoeae 248
Neisseria meningitidis 248
Nitrobacter sp. 121
Nitella sp. 183,235
Neurospora crassa 87
Nothobranchius furzeri 293, 306, 313
Nothobranchius guentheri 293
Nothobranchius kuhntae 293
Nothobranchius rachovii 293
Oncorhynchus keta 290
Paracoccus denitrificans 102-104,113,114,
117, 119
Peptococcus aerogenes 246
Phormidium uncinatum 182, 229, 241, 242
Podospora anserina 294, 306, 313
Polytomella agilis 230, 231
Polytoma papillatum 231
Porphyromonas gingivalis 248
Propionigenium modestum 246, 259, 260,
262, 265
Pseudomonas aeruginosa 248
Rhodospirillum rubrum 35-37,49,101,167,
168, 170, 171, 173, 175, 243
Rickettsiaprowazekii 202, 203
Saccharomyces cerevisiae 95,97, 145, 146,
149, 150, 155, 205, 221, 226, 231, 271,
284-286, 290, 296, 316, 318, 340
Salinibacter ruber 13 9
Указатель латинских названий организмов
353
Salmonella typhimurium 176, 177, 255, 262
Schizosaccharomyces pombe 339
Spiroplasma sp. 182
Symplocarpus renifolius 218
Synechococcus sp. 181-183
Syntrophus gentianae 169
Tenebrio molitor 193
Thermotoga maritima 253, 254
Thermus thermophilus 93
Thiobacillus ferrooxidans 120, 121, 173
Veillonella alcalescens 246
Vibrio alginolyticus 246-248, 255, 258, 262,
265
Vibrio cholerae 248, 258, 259
Vibrio costicola 246
Vibrio harveyi 241, 242, 247
Vibrio parahaemolyticus 258
Yarrowia lipolytica 86
Yersinia pestis 248
СПИСОК СОКРАЩЕНИЙ
АФК БЛМ БХл (БХл)2 (БХл)2* (БХл)з+ БФео пц Хл (Хл)2 (Хл)2* (Хл1)Г Фео ЭПР ЯМР — активные формы кислорода — бислойная фосфолипидная мембрана — бактериохлорофилл — димер бактериохлорофилла — возбужденный димер бактериохлорофилла — катион-радикал димера бактериохлорофилла — бактериофеофетин, капсаицин — 8-метил^-ванилл ил-6-ноне нам ид — пластоцианин — хлорофилл — димер хлорофилла — возбужденный хлорофилл — катион-радикал хлорофилла — феофетин — электронный парамагнитный резонанс — ядерный магнитный резонанс
АМР ADP АОХ АТР сАМР СССР CoQ CoQH2 CoQH* CoQ*- dNADH Em FAD FMN Fd GDP GTP HQNO H+/e — аденозин-5'-монофосфат — аденозин-5'-дифосфат — альтернативная цианрезистентная оксидаза — аденозин-5'-трифосфат — циклический аденозин-3',5'-монофосфат — м-хлоркарбонилцианид фенилгидразон — убихинон — убихинол — нейтральный убисемихинон — анионный убисемихинон — восстановленный никотинамид гипоксантин динуклеотид — среднеточечный окислительно-восстановительный потенциал — флавинадениндинуклеотид — флавинмононуклеотид — ферредоксин — гуанозин-5'-дифосфат — гуанозин-5'-трифосфат — 2-гептил-4-гидроксихинолин N-оксид — нормированное на количество электронов количество протонов, перенесенных через мембрану ферментом дыхательной цепи
MitoQ MQ NAD+ NADH NADP+ — 10-(6'-убихинонил)децилтрифенилфосфоний — менахинон — никотинамидадениндинуклеотид — восстановленный никотинамидадениндинуклеотид — никотинамидадениндинуклеотидфосфат
NADPH — восстановленный никотинамидадениндинуклеотидфосфат
Na+-NQR — Na+-транслоцирующая \АВН:хинон-оксидоредуктаза
Na+/e — нормированное на количество электронов количество ионов натрия, перенесенных через мембрану ферментом дыхательной цепи
NDex — внешняя NADH:xинoн-oкcидopeдyктaзa митохондрий растений
Список сокращений
355
NDH-1 — бактериальная Н+-транслоцирующая NADHixhhoh оксидоредуктаза, гомолог митохондриального комплекса I
NDH-2 NDin — бактериальная несопряженная NADHixhhoh оксидоредуктаза — внутренняя несопряженная NADH:xинoн-oкcидopeдyктaзa митохондрий растений
Pi PQ PQH2 PQ- PPi SkQ — неорганический фосфат — пластохинон — пластохинол — анионный пластосемихинон — пирофосфат — производное пластохинона, соединенное с делокализованным катионом посредством децильного или амильного линкера
SkQl SkQRl Ay ДЦн- — 10-(6'-пластохинонил)децилтрифенилфосфоний — 10-(6'-пластохинонил)децилродамин 19 — трансмембранная разность электрических потенциалов — трансмембранная разность электрохимических потенциалов ионов водо- рода
ДЙ№- — трансмембранная разность электрохимических потенциалов ионов на- трия
ДрН — трансмембранная разность значений pH
ОГЛАВЛЕНИЕ
Предисловие........................................................... 5
Часть I. Принципы биоэнергетики
Глава 1. Введение..................................................... 7
1.1. Определение понятия «Биоэнергетика» и некоторые вехи ее истории. 7
1.2. Биоэнергетика в системе биологических наук....................... 9
1.3. Законы биоэнергетики............................................ 12
1.4. Эволюция биоэнергетических механизмов........................... 17
1.4.1. Аденозинтрифосфат.......................................... 17
1.4.2. Гипотеза об адениновом фотосинтезе......................... 19
1.4.3. Запасные энергетические ресурсы и гликолиз................. 22
1.4.4. Протонные каналы и Н+-АТРаза как способы предотвратить
закисление клетки при гликолизе................................... 24
1.4.5. Бактериородопсиновый фотосинтез — первичный механизм
использования видимого света...................................... 25
1.4.6. Хлорофилльный фотосинтез................................... 26
1.4.7. Дыхательный механизм энергообеспечения..................... 28
Часть II. Генераторы протонного потенциала
Глава 2. Хлорофилльные генераторы протонного потенциала ............. 31
2.1. Светозависимая циклическая редокс-цепь пурпурных бактерий....... 32
2.1.1. Основные компоненты редокс-цепи и принцип их действия...... 33
2.1.2. Комплекс реакционных центров............................... 37
2.1.3. CoQ-цитохром с-редуктаза................................... 48
2.1.4. Пути использования ДЦН+, образованной циклической редокс-цепью 50
2.2. Нециклическая светозависимая редокс-цепь зеленых серных бактерий .... 51
2.3. Нециклическая светозависимая редокс-цепь хлоропластов и цианобактерий 53
2.3.1. Принцип действия........................................... 55
2.3.2. Фотосистема 1.............................................. 56
2.3.2. Фотосистема 2.............................................. 58
2.3.3. Комплекс b<f............................................... 60
2.3.4. Судьба АЦН+, образованной фотосинтетической редокс-цепью хлоропластов64
Оглавление 357
Глава 3. Органотрофная энергетика..................................... 66
3.1. Субстраты органотрофной энергетики............................... 66
3.2. Краткий обзор метаболизма сахаров................................ 66
3.3. Механизм субстратного фосфорилирования .......................... 71
3.4. Брожение......................................................... 74
3.5. Карнозин......................................................... 77
Глава 4. Дыхательная цепь ............................................ 81
4.1. Принцип действия................................................. 81
4.2. NADH-CoQ-редуктаза............................................... 86
4.2.1. Белковый состав комплекса I ................................ 86
4.2.2. Кофакторный состав комплекса I ............................. 88
4.2.3. Субфрагменты комплекса I ................................... 88
4.2.4. Ингибиторы комплекса I ..................................... 90
4.2.5. Возможные механизмы генерации ДЦН+ комплексом I ............ 91
4.3. СоОН2-цитохром с-редуктаза....................................... 94
4.3.1. Структурные аспекты Ьсх-комплекса .......................... 95
4.3.2. Рентгеноструктурный анализ III комплекса ................... 96
4.3.3. Функциональная модель комплекса III ........................ 98
4.3.4. Ингибиторы комплекса III .................................. 100
4.4. Цитохром с-оксидаза............................................. 100
4.4.1. Цитохром с ................................................ 101
4.4.2. Комплекс IV (цитохром с-оксидаза) ......................... 102
4.4.3. Рентгеноструктурный анализ комплекса IV.................... 103
4.4.3. Путь переноса электронов в комплексе IV ................... 105
4.4.4. Механизм генерации ДЦН+ цитохром с-оксидазой .............. 107
4.5. Ингибиторы цитохромоксидазы .................................... 108
Глава 5. Строение дыхательных цепей прокариот, а также митохондрий
простейших, растений и грибов .................................... 109
5.1. Дыхательная цепь митохондрий простейших, растений и грибов...... НО
5.2. Строение дыхательных цепей прокариот ........................... 113
5.2.1. Дыхательная цепь Paracoccus denitrificans.................. 113
5.2.2. Дыхательная цепь Escherichia coli.......................... 115
5.2.3. Восстановление фумарата в митохондриях аскариды ........... 117
5.2.4. Дыхательная цепь Azotobacter vinelandii.................... 118
5.2.5. Окисление дыхательными цепями бактерий субстратов с
положительным редокс-потенциалом ................................ 120
5.2.6. Дыхательная цепь цианобактерий ............................ 121
5.2.7. Дыхательная цепь хлоропластов.............................. 122
5.3. Электрон-транспортная цепь метаногенных архей................... 123
5.3.1. Окислительная фаза метаногенеза ........................... 125
5.3.2. Восстановительная фаза метаногенеза........................ 126
358
Оглавление
Глава 6. Бактериородопсин.......................................... 128
6.1. Принцип действия.............................................. 128
6.2. Структура бактериородопсина................................... 130
6.3. Фотоцикл бактериородопсина.................................... 133
6.4. Светозависимый транспорт протонов бактериородопсином.......... 134
6.5. Другие ретиналь-содержащие белки.............................. 137
6.5.1. Галородопсин ............................................ 137
6.5.2. Распространенность бактериородопсина и его аналогов у различных
живых организмов................................................. 138
6.5.3. Сенсорный родопсин и фобородопсин........................ 140
6.5.4. Родопсин животных........................................ 141
Часть III. Потребители ДЦН+
Глава 7. Химическая работа за счет ДЦН+ ........................... 144
7.1. Н+-АТР-синтаза................................................ 144
7.1.1. Субъединичное строение Н+-АТР-синтазы.................... 144
7.1.2. Трехмерная структура и расположение в мембране .......... 147
7.1.3. Гидролиз АТР изолированным фактором У7! ................. 151
7.1.4. Синтез связанного АТР изолированным фактором ............ 153
7.1.5. Проведение протонов через фактор Fo ..................... 154
7.1.6. Возможный механизм преобразования энергии FOF}-АТР-синтазой... 156
7.1.7. Стехиометрия Н+/АТР...................................... 158
7.2. Н+-АТРазы — вторичные Дрн+-генераторы......................... 159
7.2.1. Н+-АТРазы /^-типа........................................ 161
7.2.2. Н+-АТРазы И0^-типа....................................... 162
7.2.3. Н+-АТРазы Е^-типа........................................ 163
7.2.3.1. Н+-АТРаза внешней клеточной мембраны растений и грибов... 164
7.2.3.2. Н+/К+-АТРаза слизистой желудка..................... 164
7.2.4. Соотношение функций Н+-АТРаз............................. 165
7.3. Н+-Пирофосфат-синтаза (Н+-Пирофосфатаза)...................... 166
7.4. Н+-Трансгидрогеназа........................................... 169
7.5. Другие системы обратного переноса восстановительных эквивалентов. 173
Глава 8. Механическая работа за счет Дцн+: движение бактерий ...... 174
8.1. Дцн+ вращает ротор флагеллярного мотора....................... 175
8.2. Структура флагеллярного мотора бактерий....................... 176
8.3. Возможный механизм Н+-мотора.................................. 180
8.4. Дцн+-зависимая подвижность прокариот, не содержащих флагелл, а также
внутриклеточных органелл эукариот ................................. 182
8.5. Подвижные симбионты эукариот и прокариот...................... 184
Оглавление
359
Глава 9. Осмотическая работа за счет АЦН+ .......................... 186
9.1. Определение и классификация.................................... 186
9.2. AH'как движущая сила........................................... 187
9.3. АрН как движущая сила.......................................... 189
9.4. Общая АЦН как движущая сила.................................... 190
9.5. АЦн+-зависимые транспортные каскады............................ 192
9.6. Карнитин как пример трансмембранного переносчика химической
группировки......................................................... 192
9.7. Некоторые примеры АЦн+-зависимых белков-переносчиков........... 197
9.7.1. (Лактоза, Н+)-симпортер из Е. coli........................ 198
9.7.2. Митохондриальный ATP/ADP-антипортер ...................... 200
9.8. Роль АЦН+ в транспорте макромолекул............................ 203
9.8.1. Транспорт митохондриальных белков. Биогенез митохондрий .. 203
9.8.2. Транспорт бактериальных белков ........................... 205
9.8.3. Роль АЦН+ в транспорте белков и их укладке в мембране..... 206
9.8.4. Транспорт бактериальной ДНК............................... 206
Глава 10. АЦН* как источник энергии для образования теплоты......... 208
10.1. Три способа превращения метаболической энергии в теплоту...... 208
10.2. Терморегуляторная активация свободного дыхания у животных..... 209
10.2.1. Бурый жир................................................ 209
10.2.2. Скелетные мышцы.......................................... 214
10.3. Терморегуляторная активация свободного окисления у растений... 217
Часть IV. Взаимосвязь и регуляция генераторов и потребителей
протонного потенциала
Глава 11. Регуляция, транспорт и стабилизация протонного потенциала. 220
11.1. Регуляция Ацн+................................................ 220
11.1.1. Альтернативные функции дыхания........................... 220
11.1.2. Регуляция потоков восстановительных эквивалентов между цитозолем
и митохондриями.................................................. 223
11.1.3. Взаимопревращение AH' и АрН.............................. 225
11.1.4. Отношение системы контроля АЦН+ к основным регуляторным
механизмам эукариот.............................................. 225
11.1.5. Контроль АЦН+ у бактерий................................. 226
11.2. Транспорт энергии вдоль мембран в форме АЦН+.................. 227
11.2.1. Общие положения.......................................... 227
11.2.2. Перенос АЦН+, образуемой светозависимыми АЦН+-генераторам и, вдоль
мембран галобактерий и хлоропластов.............................. 228
11.2.3. Трансклеточный перенос энергии в трихомах цианобактерий.. 229
11.2.4. Структура и свойства нитчатых митохондрий и митохондриального
ретикулума....................................................... 229
360
Оглавление
11.3. Дцн+-Буферы................................................... 239
11.3.1. Градиенты Na+ и К+ как Дцн+-буфер у бактерий............. 239
11.3.2. Другие системы стабилизации Дцн+ 242
Часть V. Натриевый мир
Глава 12. Генераторы ДцКа+.......................................... 244
12.1. Декарбоксилазы, транспортирующие Na+.......................... 244
12.2. Na+-транспортирующая NADH:xnHOH-oKcnaope4yKTa3a............... 246
12.2.1. Первичная структура субъединиц №+-трансл о пирующей
\АВН:хинон-оксидоредуктазы...................................... 247
12.2.2. Простетические группы Na+—NQR............................ 248
12.3. \а+-транспортирующий метилтрансферазный комплекс метаногенных архей 249
12.4. Na+-транспортирующая формилметанофурандегидрогеназа метаногенных
архей.............................................................. 250
12.5. Вторичные ДрNa+-генераторы: №+-транспортирующие АТРазы и
Na+-пирофосфатаза ................................................. 251
12.5.1. Бактериальные Na+—АТРазы................................. 251
12.5.2. Na+/K+-ATPa3a и №+-АТРаза животных ...................... 252
12.5.3. Na+-пирофосфатаза........................................ 253
Глава 13. Утилизация Др№+, образуемой первичными Дц№+-генераторами . 255
13.1. Осмотическая работа, поддерживаемая ApNa+..................... 255
13.1.1. (Na+,метабол ит)-симпортеры.............................. 255
13.1.2. Ионы Na+ и регуляция внутриклеточного pH................. 256
13.2. Механическая работа........................................... 258
13.3. Химическая работа............................................. 259
13.3.1. Дц№+-3ависимый синтез АТР у анаэробных бактерий.......... 259
13.3.2. Потребители Дц№+, совершающие химическую работу у
метаногенных архей ............................................. 260
Глава 14. Соотношение протонного и натриевых миров.................. 262
14.1. Как часто используется №+-цикл живыми клетками?............... 262
14.2. Возможные эволюционные отношения между протонным и натриевым
миром.............................................................. 263
14.3. Превращение энергии в биомембранах без участия Н+ и Na+....... 266
Часть VI. Опыт практического применения биоэнергетики:
активные формы кислорода и возможные пути отмены программы
старения организма
Глава 15. Предпосылки проекта по антиоксидантам, адресованным в митохондрии 269
15.1. Природа АФК и пути их образования в клетке.................... 269
15.2. Как живые системы защищаются от АФК?.......................... 271
15.2.1. Вещества-антиоксиданты................................... 271
Оглавление
361
15.2.2. Снижение внутриклеточной концентрации кислорода........ 271
15.2.3. Уменьшение генерации АФК дыхательной цепью.......... 275
15.2.4. Митоптоз................................................. 277
15.2.5. Апоптоз.................................................. 280
15.2.6. Некроз................................................... 281
15.2.7. Феноптоз................................................. 283
15.3. Биологические функции АФК..................................... 285
15.4. Старение как медленный феноптоз, вызываемый повышением уровня АФК 288
15.4.1. Определение понятия «старение» и краткая история проблемы... 288
15.4.2. Феноптоз организмов, размножающихся однократно........... 290
15.4.3. Старение — медленный феноптоз? .......................... 291
15.4.4. Мутации, продлевающие жизнь.............................. 295
15.4.5. АФК и старение........................................... 297
15.4.6. Голый землекоп........................................... 298
15.4.7. Парадокс белка р53....................................... 300
15.4.8. Снижение митохондриальных АФК как возможный способ
торможения программы старения.................................... 301
Глава 16. Проект по антиоксидантам, адресованным в митохондрии ..... 303
16.1. SkQ тормозит программу старения............................... 303
16.2. Сравнение эффектов SkQ и временного ограничения питания....... 316
16.3. От «человека разумного» к «человеку разумному и освободившемуся». 320
Приложения
ПРИЛОЖЕНИЕ 1. Энергия, работа и законы термодинамики................ 324
ПРИЛОЖЕНИЕ 2. Структурные формулы различных простетических групп
и кофакторов ферментов электрон-транспортных цепей............... 334
ПРИЛОЖЕНИЕ 3. Природный возобновляемый антиоксидант, адресованный
в митохондрии.................................................... 339
Предметный указатель................................................ 342
Именной указатель .................................................. 349
Указатель латинских названий организмов ............................ 352
Список сокращений .................................................. 354
TABLE OF CONTENCE
Preface 5
Part I. Principles of bioenergetics
Chapter 1. Introduction................................................................. 7
1.1. Definition of “bioenergetics” and some of its historical landmarks................. 7
1.2. Bioenergetics in the hierarchy of biological sciences.............................. 9
1.3. Laws of bioenergetics......................................................... 12
1.4. Evolution of bioenergetic mechanisms.............................................. 17
1.4.1. Adenosine triphosphate................................................... 17
1.4.2. Hypothesis on adenine photosynthesis..................................... 19
1.4.3. Reserve energetic resources and glycolysis................................... 22
1.4.4. Proton channels and H+-ATPase prevent acidification of a cell during
glycolysis.................................................................... 24
1.4.5. Bacteriorhodopsin photosynthesis — initial mechanism of visible light
energy conservation.......................................................... 25
1.4.6. Chlorophyll-dependent photosynthesis......................................... 26
1.4.7. Respiratory mechanism of energy conservation................................. 28
Part IL Generators of proton potential
Chapter 2. Chlorophyll-containing generators of proton potential ..................... 31
2.1. Light-driven cyclic redox chain of purple bacteria............................... 32
2.1.1. Main components of the redox chain and their operation mechanism. 33
2.1.2. Reaction center............................................................. 37
2.1.3. CoQ-cytochrome c-reductase.................................................. 48
2.1.4. Utilization of ДЦН+ formed by cyclic redox chain............... 50
2.2. Noncyclic light-driven redox chain of green sulfur bacteria....................... 51
2.3. Noncyclic light-driven redox chain of chloroplasts and cyanobacteria.............. 53
2.3.1. Operation mechanism......................................................... 55
2.3.2. Photosystem 1............................................................... 56
2.3.2. Photosystem 2............................................................... 58
2.3.3. Complex b(f................................................................. 60
2.3.4. Utilization of ДЦН+ formed by photosynthetic redox chain of chloroplasts 64
Table of contence 363
Chapter 3. Organotrophic energetics ............................................ 66
3.1. Substrates of organotrophic energetics ..................................... 66
3.2. Brief survey of sugar metabolism............................................ 66
3.3. Mechanism of substrate phosphorylation ..................................... 71
3.4. Fermentation................................................................ 74
3.5. Carnosine................................................................... 77
Chapter 4. Respiratory chain ................................................... 81
4.1. Operation mechanism......................................................... 81
4.2. NADH-CoQ-reductase.......................................................... 86
4.2.1. Subunit composition of complex I ..................................... 86
4.2.2. Prosthetic groups of complex I ....................................... 88
4.2.3. Subfragments of complex I ............................................ 88
4.2.4. Complex 1 inhibitors ................................................. 90
4.2.5. Probable mechanisms of ApH> generation by complex I .................. 91
4.3. CoQH2-cytochrome c-reductase................................................ 94
4.3.1. Structural aspects of /^-complex...................................... 95
4.3.2. Structural analysis of complex III ................................... 96
4.3.3. Operation mechanism of complex III ................................... 98
4.3.4. Complex III inhibitors................................................ 100
4.4. Cytochrome c-oxidase....................................................... 100
4.4.1. Cytochrome c.......................................................... 101
4.4.2. Complex IV (cytochrome c-oxidase) ................................... 102
4.4.3. Structural analysis of complex IV..................................... 103
4.4.3. Electron transfer pathway in complex IV.............................. 105
4.4.4. Mechanism of Ацн< generation by cytochrome c-oxidase 107
4.5. Inhibitors of cytochrome c-oxidase......................................... 108
Chapter 5. Respiratory chains of prokaryotes as well as of mitochondria of protists,
plants, and fungi .............................................................. 109
5.1. Respiratory chains of mitochondria of protists, plants, and fungi......... 110
5.2. Respiratory chains of prokaryotes ......................................... 113
5.2.1. Respiratory chain of Paracoccus denitrificans ....................... 113
5.2.2. Respiratory chain of Escherichia coli................................ 115
5.2.3. Fumarate reduction in mitochondria of ascarides ...................... 117
5.2.4. Respiratory chain of Azotobacter vinelandii.......................... 118
5.2.5. Oxidation of substrates with high redox potential by respiratory chains
of prokaryotes.............................................................. 120
5.2.6. Respiratory chain of cyanobacteria ................................... 121
5.2.7. Respiratory chain of chloroplasts..................................... 122
5.3. Electron transport chain of methanogenic archaea........................... 123
5.3.1. Oxidative part of methanogenesis...................................... 125
5.3.2. Reductive part of methanogenesis...................................... 126
364
Table of contence
Chapter 6. Bacteriorhodopsin................................................... 128
6.1. Operation mechanism....................................................... 128
6.2. Structure of bacteriorhodopsin............................................ 130
6.3. Bacteriorhodopsin photocycle.............................................. 133
6.4. Light-driven proton pumping by bacteriorhodopsin.......................... 134
6.5. Other retinal-containing proteins......................................... 137
6.5.1. Halorhodopsin......................................................... 137
6.5.2. Distribution of bacteriorhodopsin and its homologs among different living
organisms.................................................................... 138
6.5.3. Sensory rhodopsin and phoborhodopsin.................................. 140
6.5.4. Animal rhodopsin ..................................................... 141
Part III. ApH+ consumers
Chapter 7. Chemical work driven by ApH+..................................... 144
7.1. H+-ATP-synthase........................................................ 144
7.1.1. Subunit composition of H+-ATP-synthase............................ 144
7.1.2. 3D-structure and arrangement in membrane ......................... 147
7.1.3. ATP hydrolysis by isolated factor ................................ 151
7.1.4. Synthesis of bound ATP by isolated factor F\...................... 153
7.1.5. Proton transfer trough factor Fo ................................. 154
7.1.6. Proposed mechanism of energy transduction by EoErATP-synthase.... 156
7.1.7. Stoichiometry H+/ATP ............................................. 158
7.2. H+-ATPases — secondary AjlH+-generators................................ 159
7.2.1. H+-ATPases of EoErtype............................................ 161
7.2.2. H+-ATPasesof f^-type.............................................. 162
7.2.3. H+-ATPases of EjE2-type........................................... 163
7.2.3.1. H+-ATPase of plants and fungi plasmalemma.................. 164
7.2.3.2. H+/K+-ATPase of mucous coat of stomach..................... 164
7.2.4. Relation of functions of H+-ATPases............................... 165
7.3. H+-Pyrophosphate-synthase (H+-Pyrophosphatase)......................... 166
7.4. H+-Transhydrogenase.................................................... 169
7.5. Other systems of reversed electron transport........................... 173
Chapter 8. Mechanical work driven by ApH+: bacterial motility............... 174
8.1. AjlH. spins rotor of bacterial flagellar motor......................... 175
8.2. Structure of bacterial flagellar motor................................. 176
8.3. Proposed mechanisms of H+-motor........................................ 180
8.4. ApH+-dependent motility of flagellum-less prokaryotes and intracellular
organelles of eukaryotes ................................................... 182
8.5. Mobile symbiotes of eukaryotes and prokaryotes......................... 184
Table of contenee 365
Chapter 9. Osmotic work driven by AjlH+ ......................................... 186
9.1. Definition and classification .............................................. 186
9.2. AT as driving force......................................................... 187
9.3. ApH as driving force........................................................ 189
9.4. Overall AjlH+ as driving force.............................................. 190
9.5. AjlH+-dependent transport cascades.......................................... 192
9.6. Carnitine as an example of transmembrane carrier of a chemical group........ 192
9.7. Some examples of ApH+-dependent membrane transporters....................... 197
9.7.1. (Lactose,H+)-symporter from E. coli ................................... 198
9.7.2. Mitochondrial ATP/ADP-antiporter....................................... 200
9.8. AjlH+ function in transport of macromolecules............................... 203
9.8.1. Transport of mitochondrial proteins. Mitochondrial biogenesis ......... 203
9.8.2. Transport of bacterial proteins ....................................... 205
9.8.3. Role of AjlH+ in protein transport and their folding in membranes ..... 206
9.8.4. Transport of bacterial DNA ............................................ 206
Chapter 10. AjlH+ as energy supply for thermogenesis ............................ 208
10.1. Three pathways for conversion of metabolite energy into heat................ 208
10.2. Thermoregulatory activation of free respiration in animals.................. 209
10.2.1. Brown fat.............................................................. 209
10.2.2. Skeletal muscles....................................................... 214
10.3. Thermoregulatory activation of free respiration in plants................... 217
Part IV. Intercoupling and regulation of generators and consumers
of proton potential
Chapter 11. Regulation, transport, and stabilization of proton potential......... 220
11.1. Regulation of ApH+.......................................................... 220
11.1.1. Alternative functions of respiration................................... 220
11.1.2. Regulation of flows of reducing equivalents between cytosol and
mitochondria................................................................... 223
11.1.3. Interconversion of AT and ApH......................................... 225
11.1.4. Control of Ajlin the system of eukaryotic regulatory mechanisms ...... 225
11.1.5. Control of AjJH< in bacteria........................................... 226
11.2. Lateral energy transport along membranes in the form of AjlH+............... 227
11.2.1. General ideas.......................................................... 227
11.2.2. Lateral transport of AjlH+, created by light-dependent AjlH+-generators,
along membranes of halobacteria and chloroplasts............................... 228
11.2.3. Transcellular energy transport in cyanobacterial trichomes............. 229
11.2.4. Structure and properties of filamentous mitochondria and mitochondrial
reticulum...................................................................... 229
11.3. ApH+-Buffers................................................................ 239
11.3.1. Gradients of Na+ and K+ as AjlH+-bufTers in bacteria................... 239
11.3.2. Other systems of AjlH+ stabilization................................... 242
366
Table of contence
Part V. Sodium world
Chapter 12. Generators ApNa+.................................................. 244
12.1. Na+-translocating decarboxylases......................................... 244
12.2. Na+-translocating NADH:quinone oxidoreductase............................ 246
12.2.1. Subunits of Na+-translocating NADHrquinone oxidoreductase........... 247
12.2.2. Redox centers of Na+—NQR............................................ 248
12.3. Na+-translocating methyltransferase complex of methanogenic archaea...... 249
12.4. Na+-translocating formylmethanofuran dehydrogenase of methanogenic archaea 250
12.5. Secondary ApNa+-generators: Na+-translocating ATPases and
Na+-pyrophosphatase....................................................... 251
12.5.1. Bacterial Na+-ATPases............................................... 251
12.5.2. Na+/K+-ATPase and Na+-ATPase of animals............................. 252
12.5.3. Na+-pyrophspohatase................................................. 253
Chapter 13. Utilization of ApNa+, created by primary ApNa>-generators ........ 255
13.1. Osmotic work driven by AjlNa+............................................ 255
13.1.1. (Na+, metabolite)-symporters........................................ 255
13.1.2. Na+ ions in regulation of intracellular pH.......................... 256
13.2. Mechanical work driven by ApNa+ ......................................... 258
13.3. Chemical work driven by AjlNa+........................................... 259
13.3.1. ApNa+-Dependent ATP synthesis in anaerobic bacteria................. 259
13.3.2. Chemical work driven by ApNa+, in methanogenic archaea.............. 260
Chapter 14. Relation of proton and sodium worlds ............................. 262
14.1. How frequently is Na+-cycle employed by living cells?.................... 262
14.2. Possible evolutionary relationships between proton and sodium worlds .... 263
14.3. Energy conservation in biomembranes without H+ and Na+transport.......... 266
Part VI. Trial of practical application of bioenergetics:
reactive oxygen species and possible ways for cancelling
the senescence program of an organism
Chapter 15. Prerequisites of the project for antioxidants targeted into mitochondria 269
15.1. ROS nature and pathways of their generation in a cell ................... 269
15.2. How living systems defend against ROS?................................... 271
15.2.1. Antioxidants compounds.............................................. 271
15.2.2. Lowering of intracellular oxygen concentration...................... 271
15.2.3. Lowering of respiratory chain dependent ROS generation.............. 275
15.2.4. Mitoptosis.......................................................... 277
15.2.5. Apoptosis........................................................... 280
15.2.6. Necrosis............................................................ 281
15.2.7. Phenoptosis......................................................... 283
15.3. Biological functions of ROS.............................................. 285
Table of contence 367
15.4. Senescence as a slow phenoptosis caused by increasing ROS level ....... 288
15.4.1. Definition of the “senescence” concept and brief history of the question .. 288
15.4.2. Phenoptosis of once-breeding organisms............................ 290
15.4.3. Senescence — slow phenoptosis?.................................... 291
15.4.4. Mutations that prolong lifespan................................... 295
15.4.5. ROS and senescence................................................ 297
15.4.6. Naked mole-rat.................................................... 298
15.4.7. Paradox of p53 protein............................................ 300
15.4.8. Lowering of mitochondrial ROS as possible way to slow the senescence
program .................................................................. 301
Chapter 16. Project for antioxidants targeted into mitochondria............. 303
16.1. SkQ slows down the senescence program.................................. 303
16.2. Comparison of effects of SkQ and temporal calorie restriction.......... 316
16.3. From Homo sapiens to Homo sapiens discatenatus......................... 320
Supplements
SUPPLEMENT 1. Energy, work, and thermodynamics lows.................. 324
SUPPLEMENT 2. Structure of the coenzymes and prosthetic groups of enzymes of
electron transport chains.................................................. 334
SUPPLEMENT 3. Natural renewable antioxidant targeted into mitochondria . 339
Subject Index................................................................ 342
Names Index ................................................................. 349
Organisms Index ............................................................. 352
Abbreviations................................................................ 354