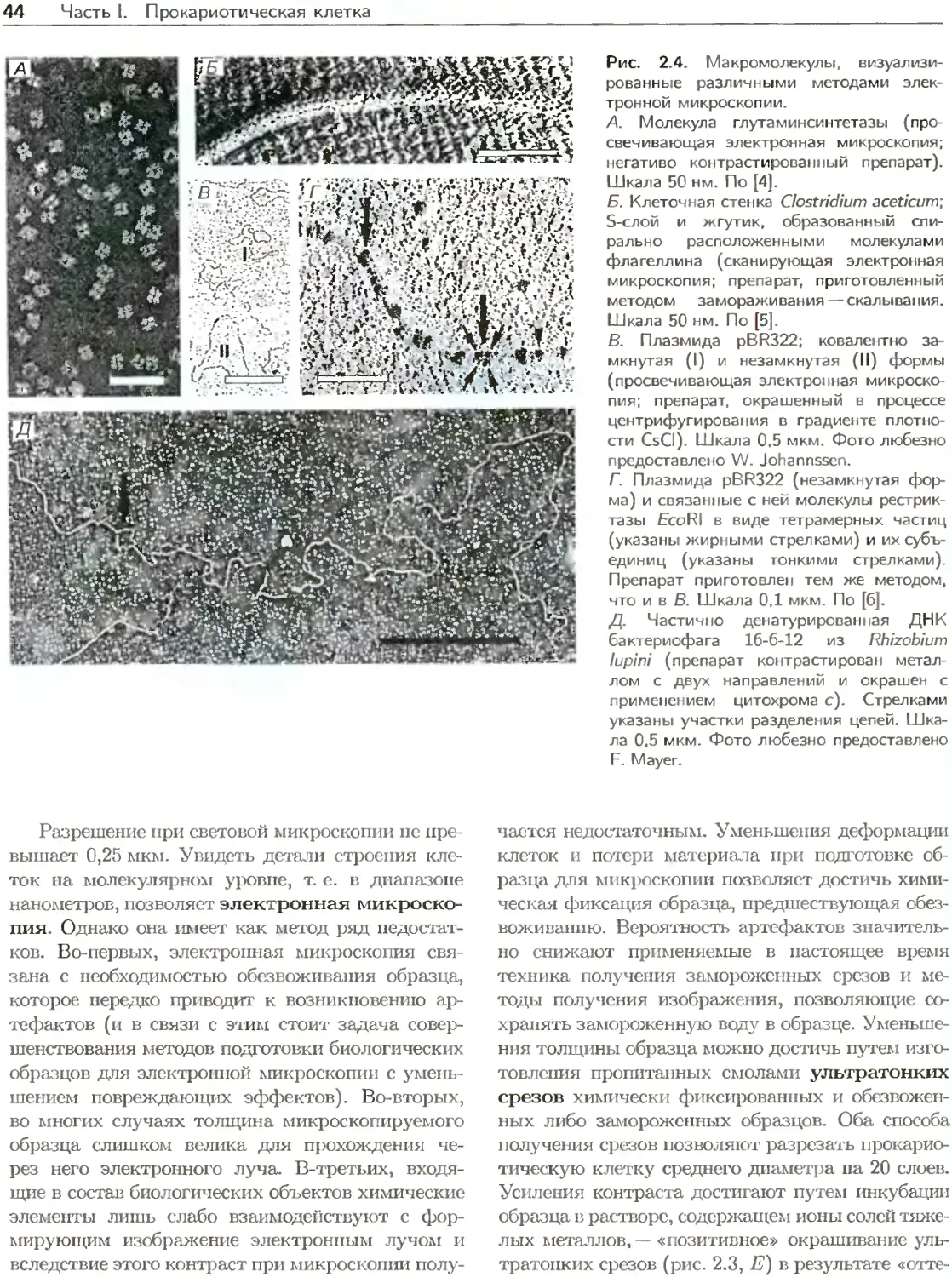
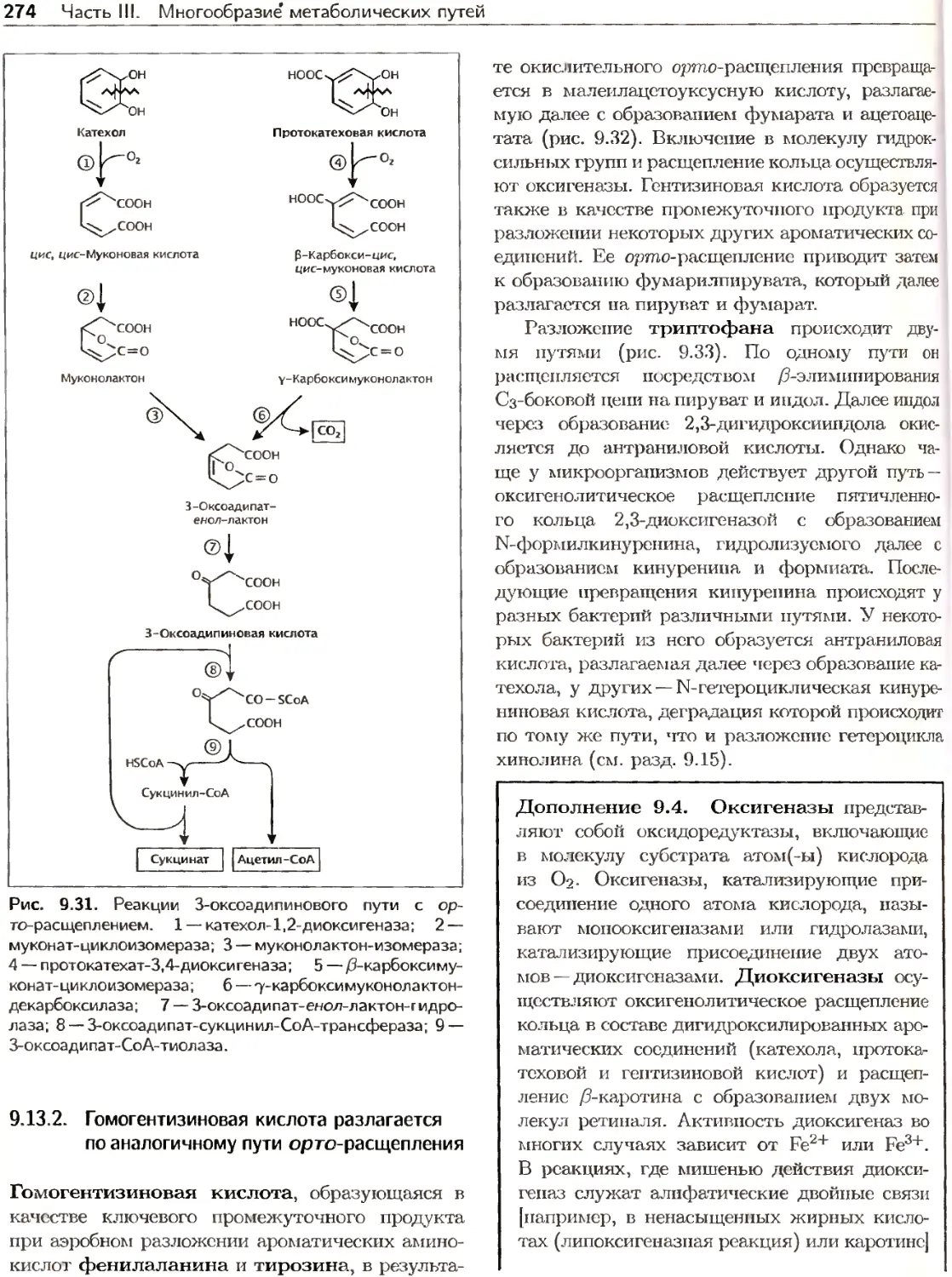
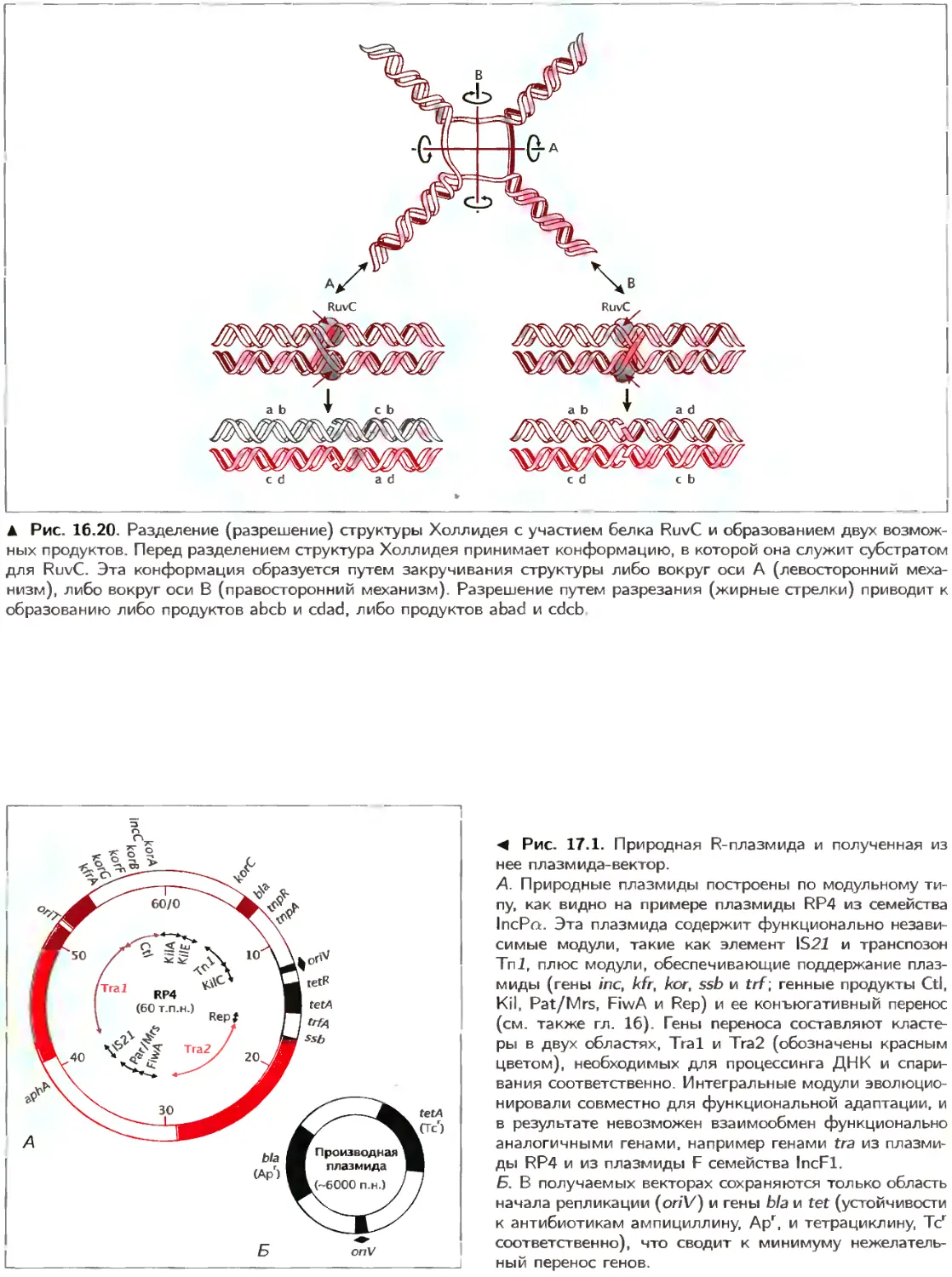
Author: Ленгелер Й.
Tags: микробиология
Text
ЛУЧШИЙ
ЗАРУБЕЖНЫЙ
УЧЕБНИК
современная
микробиология
ПРОКАРИОТЫ
Под редакцией
Й. Ленгелера, Г. Древса и Г. Шлегеля
В 2-х томах
Том 1
Перевод с английского
канд. биол. наук И. А. Берга, д-ра биол. наук Р. Н. Ивановского,
д-ра биол. наук А. И. Нетрусова, д-ра биол. наук Д. И. Никитина
и д-ра биол. наук В. К. Плакунова
под редакцией
д-ра биол. наук А. И. Нетрусова и д-ра биол. наукТ. С. Ильиной
Москва «Мир» 2005
Предисловие
Микробиология не сводится к биохимии или
молекулярной биологии микроорганизмов
Бактерии были открыты в 17 в. как повсемест-
но присутствующие мельчайшие одноклеточные
организмы, лишенные какой-либо видимой струк-
туры. К концу 19 в. их представляли как обшир-
ную группу организмов с характерными физио-
логическими свойствами, такими как способность
к сбраживанию углеводов, фотоавтотрофия или
патогенность. При классификации микробы объ-
единяли в то время с другими мелкими и, как
считалось, примитивными организмами — одно-
клеточными водорослями, грибами и простейши-
ми. Современная классификация разделяет мик-
роорганизмы на прокариотические и эукариоти-
ческие. В отличие от эукариотических клеток,
прокариоты лишены ядерной мембраны (т. е. яд-
ра), митохондрий и пластид, митоза и мейоза, но
обладают особой по строению клеточной стенкой
и компонентами мембран, не обнаруженными у
эукариот. При своих малых размерах прокариоты
представляют собой, однако, сложноорганизован-
ные и никоим образом не примитивные объекты.
По морфологии они не «мешочки, наполненные
ферментами», а высокоструктурироваппые клет-
ки, способные расти и размножаться с необычай-
но высокой скоростью. При такой скорости роста
механизм деления клеток у микробов столь же
точен, как у эукариот. Внутри микробных клеток
имеются компартменты, разделяющие различные
метаболические активности. Основной особенно-
стью прокариот всегда считалось огромное разно-
образие физиологических свойств и способность
легко адаптироваться к изменениям среды в ши-
роких пределах.
В прошлом биологию традиционно подразде-
ляли в соответствии с основными типами изу-
чаемых организмов на ботанику, зоологию и
микробиологию. Объектами микробиологии были
бактерии (прокариоты), простоорганизоваппые
эукариоты и вирусы. В современной биологии
сформировались более узкие дисциплины для
изучения отдельных типов объектов, выделенных
по признаку возрастающей сложности организа-
ции, начиная от макромолекул и генов до клеток,
многоклеточных организмов и популяций. Такое
подразделение способствует выявлению универ-
сальных принципов, общих для всех живых сис-
тем. В случае одноклеточных организмов клет-
ка— это по определению и организм, поэтому био-
логия микробов включает изучение всех уровней
жизни — от молекулярных клеточных структур и
клеточной физиологии до процессов дифферен-
цировки и поведения отдельных видов в составе
природных ассоциаций.
В чем особенность этого нового учебника
микробиологии?
Многие компоненты клеток и биохимические
механизмы являются общими для всех живых
организмов, но огромное физиологическое раз-
нообразие и способность к адаптации, присущие
прокариотам, их важная роль в экологических
процессах, применение в биотехнологии и меди-
цинское значение заставляют рассматривать и
изучать их как отдельный тип объектов. Поэтому
данная книга посвящена только биологии прока-
риот, т. е. бактерий (прежнее название — эубакте-
рии) и архей (прежнее название —архсбактерии),
а также их вирусов (бактериофагов), которые
на уровне генетического аппарата соответствуют
плазмидам, но не полноценным организмам.
В основном благодаря исследованиям на
бактериях происходило развитие молекулярной
биологии, включая разработку технологии ре-
комбинантной ДНК. В последние годы центр
молекулярных исследований сместился к эукари-
отам, но, безусловно, важное место прокариот в
фундаментальных и прикладных биологических
исследованиях сохранится. В связи с этим необ-
ходимы новые учебники, представляющие обоб-
щенные сведения о прокариотических клетках как
организмах и о всех прокариотах как огромной по-
пуляции, в которой организмы сообщаются между
собой и с окружающей средой. Именно по такому
принципу построена предлагаемая книга.
Несмотря на то что бактерии являются ав-
тономными клетками и самостоятельными орга-
низмами, о них нельзя иметь исчерпывающего
6
Предисловие
представления, если не рассматривать микробные
сообщества в целом, так же как функция секвепи-
рованного гена не будет ясна, если не исследована
его роль в организме. В связи с этим необходимо
иметь в виду одну из наиболее удивительных осо-
бенностей прокариот —их способность к горизон-
тальному переносу генов. Бактериальная клетка
может приобрести тот или иной полезный ген
от клетки другого штамма, и совокупность генов
всех клеток микробного сообщества можно рас-
сматривать как «коллективный» геном. Перенос
генов, однако, не является обязательным событи-
ем, и в каждом акте переноса транслоцируется
лишь небольшая доля генов. Из них в клеточную
хромосому встраиваются только видоспецифич-
ные гены, тогда как все остальные гены утрачи-
ваются, если они не необходимы для выживания в
условиях давления отбора. Популяции прокариот
с комплементарными (взаимодополняющими) ме-
таболическими и морфологическими свойствами
образуют временные экосистемы, структуру кото-
рых можно рассматривать как микробный экви-
валент многоклеточности. В составе микробного
сообщества любая бактериальная клетка с се хро-
мосомой и разнообразными автономными генети-
ческими элементами представляет собой как бы
аналог одной дифференцированной клетки эука-
риотического многоклеточного организма. Вместе
с тем в отсутствие строгой генетической изоляции
специфичность свойств не столь выражена в мире
прокариот, как среди специализированных клеток
в организмах эукариот. В связи с этим для эука-
риот требуется систематика нового типа. Археи
по ряду биохимических признаков обнаруживают
существенные отличия от бактерий и одновремен-
но сходство с эукариотами, но по способу жизни
близки к бактериям.
Как построена эта книга?
В основу изложения материала в книге положены
физиологический и функциональный подходы,
при этом разнообразие мира прокариот описы-
вается на характерных примерах. Книга состо-
ит из девяти частей; первые из них посвящены
описанию морфологических, биохимических и ге-
нетических основ жизнедеятельности микробных
клеток; этот материал необходим для восприя-
тия сведений, изложенных в последующих частях
книги. Таким образом, вначале представлены све-
дения о клеточных структурах, метаболических
процессах, генетических и регуляторных меха-
низмах, известных у прокариот. Затем следуют
главы, посвященные описанию более сложных
клеточных процессов, таких как дифференциров-
ка, основ систематики прокариот и микробной
экологии. Завершают книгу главы по различным
прикладным аспектам микробиологии.
Для кого предназначена эта книга?
Книга написана для студентов старших курсов,
студентов-дипломников, аспирантов и исследова-
телей, работающих в фундаментальной науке, а
также для специалистов, использующих бакте-
рии как инструмент в тех или иных методах,
например технологии рекомбинантной ДНК, в
биотехнологии и медицине. В книге довольно
подробно описаны клеточные биохимические и
генетические механизмы, но основное внимание
уделено разнообразию микробных способов жиз-
ни, физиологическому значению различных кле-
точных структур, метаболических путей и регуля-
торных механизмов. Изложение данных, особенно
касающихся генетического аппарата и регуляции
активности генов, может показаться «колицен-
тричным». Это объясняется тем, что Escherichia
coli на молекулярном уровне изучена наиболее
подробно, хотя уже осуществлено секвенирова-
ние хромосом и нескольких других бактерий.
Во всех случаях, если известно о существовании
феноменов, подобных тем, которые известны у
Е. coli, и исследована их молекулярная основа
либо если описываются особые свойства, напри-
мер споруляция или образование антибиотиков,
в книге приведены сведения о соответствующих
организмах. Раскрывая роль фундаментальных
микробиологических исследований в разработке
направлений прикладной микробиологии и под-
черкивая то, что большинство методов с исполь-
зованием прокариот, применяемых в современной
медицине, сельском хозяйстве, промышленности
и природоохранных мероприятиях, создано с ис-
пользованием достижений общей микробиологии,
авторы особо отмечают новые вероятные области
развития прикладных направлений.
Предисловие
7
В книге использованы приемы,
полезные для обучения
Каждую часть предваряет введение, в котором
кратко описывается ее содержание в связи с
темами других частей книги. Везде, где необ-
ходимо, приведены ссылки на сходные вопросы
в других главах. Наиболее показательна в этом
отношении табл. 20.1, в которой суммированы
сведения о регуляторных механизмах у прокари-
от. Эти данные лучше всего позволяют выявить
внутреннюю логику бактериального метаболизма
и свести воедино не связанные на первый взгляд
феномены, которые на самом деле являются ча-
стями одной общей цепи. Например, бактериаль-
ные таксисы и катаболитный контроль связаны
тем, что относятся к процессам питания, спору-
ляция и образование антибиотиков представляют
различные пути дифференцировки, строение кле-
точной поверхности и хромосомные перестройки
вместе определяют инфекционные стратегии па-
тогенных бактерий. Во всех главах определения и
наиболее важные сведения заключены в абзацы,
выделенные квадратными значками. Книга снаб-
жена предметным указателем. Описания особо
важных экспериментов и методов, а также допол-
нительная информация вынесены в специальные
«Дополнения». В конце всех глав предлагается
дополнительная литература, в которой приведены
работы и обзоры, полезные для более углубленно-
го изучения предмета или проведения исследова-
ний. Написание, редактирование и координацию
работы по созданию данной книги осуществлял
коллектив ученых, каждый из которых известен
как эксперт в данной области. Список авторов
с конкретным вкладом каждого приведен ниже.
Мы надеемся, что эта книга, с ее общей концепци-
ей и энциклопедическим содержанием, поможет
широкому кругу читателей лучше представить
себе все богатство удивительного мира прокариот.
Благодарности
Мы глубоко признательны всем, кто помогал
в создании этой книги, и особенно М. Хауфф-
Гишендорф из издательства Георг-Тиме-Ферлаг,
предложившей нам написать этот учебник ново-
го типа в том виде, какой мы выберем, а так-
же издательской группе, в частности редакторам
К. Брюне и Л. Роджерс-Блаут.
Авторы
Sankar Adhya
Laboratory of Molecular Biology
National Cancer Institute
Bethesda, Maryland 20892
USA
Carl-Alfred Alpert
INRA Institut National de la
Recherche Agronomique
Laboratoire Vivande
78352 Jouy-en-.losas Cedex
France
Ian R. Booth
University of Aberdeen
Dept, of Molecular + Cell Biology
Marishall College
Aberdeen AB9 IAS
Great Britain
Wolfgang Buckcl
Fachbereich Biologic
Universitat Marburg
Karl-von-FYisch-StraBe
35043 Marburg
Germany
Arnold L. Demain
Department of Biology
Massachusetts Institute
of Technology
77 Massachusetts Avenue
Cambridge, Mass. 02139
USA
D. N. Dowling
Dept, of Food Microbiology
University College Cork
Cork
Ireland
Gerhart Drews
Albert-Ludwigs Universitat
Institut fiir Biologie II
Mikrobiologie
Schanzlcstrafie 1
79104 Freiburg/Br
Germany
Barbel Friedrich
Ilumboldt-Universitat
Mathemat.-Naturwisscnsch.
Fakultat I
Institut fiir Biologie/Mikrobiologie
ChausseestraBe 117
10115 Berlin
Germany
Georg Fuchs
Albert-Ludwigs-Universitat
Inst. f. Biologie II — Mikrobiologie
Schanzlcstr. 1
79104 Freiburg
Germany
Fergal O’Gara
Dept, of Food Microbiology
University College Cork
Cork
Ireland
Mike Goodfellow
Department of Microbiology
The Medical School
Framlington Place
Newcastle upon Tyne NE2 4HH,
Great Britain
Jorg Hacker
Institut fiir Molekularc
Infektionsbiologie
Rontgenring 11
97070 Wiirzburg
Germany
Wolfgang Hillen
Institut fiir Mikrobiologie
und Biochernie der Universitat
Staudtstrafie 5
91058 Erlangen
Germany
Gary R. Jacobson
Boston University
Department of Biology
2, Cummington Street
Boston, Mass. 02215
USA
Klaus Jann
Barbara Jann
Max-Planck-Institut fiir
Immunbiologie
Stiibeweg 51
79108 Freiburg
Germany
Borries Kemper
Institut fiir Genetik
der Universitat zu Koln
Ziilpicher Str. 47
50674 Kbln
Germany
Rolf Knippers
Fakultat fiir Biologie
Universitat Konstanz
UniversitatsstraBe 10
78464 Konstanz
Germany
Werner Kohler
Adolf Reichwein Str. 26
07745 Jena
Germany
Reinhard Kramer
Institiit fiir Biochernie
der Universitat Koln
Ziilpicher Str. 47
50674 Koln
Germany
Achim Kroger
Institut fiir Mikrobiologie
Biozcntrum Niederursel
Marie-Curie-Str. 9
60439 Frankfurt a.M.
Germany
J. Gijs Kuenen
Laboratory of Microbiology
Delft University of Technology
Julianalaan 67A
2628 BC Delft
The Netherlands
Авторы
9
Giancarlo Lancini
Lepetit Research Center
Via R. Lepetit 34
21040 Gerenzano (Varese)
Italy
Erich Lanka
MPI fiir Molekulare Genetik
IhnestraCc 73
14195 Berlin
Germany
Joseph W. Lengeler
FB Biologie/Chemie
Universitat Osnabriick
Postfach 4469
49076 Osnabriick
Germany
Edmond C.C. Lin
Harvard Medical School
Dept, of Microbiology and Molecular
Genetics
Longwood Avenue
Boston, Mass. 02115
USA
Wolfgang Ludwig
Lehrstuhl fiir -Mikrobiologie
Technischc Universitat Munchen
ArcisstraBe 21
802890 Miinchen
Germany
Mohamed A. Marahiel
Universitat Marburg
Fachbereich Chemie
Hans-Meerwei n-StraBe
35043 Marburg/Lahn
Germany
Frank Mayer
Institut fiir Mikrobiologie
Georg-August-Universitat
GriscbachstraBe 8
37077 Gottingen
Germany
Walter Messer
MPI fiir Molekulare Genetik
Abteilung Trautncr
Ihnestrafie 73
14195 Berlin
Germany
Kurt Nordstrom
Department of Microbiology
Uppsala University
Biomedical Center
Box 581
75123 Uppsala
Sweden
M.P. Nuti
Dipt, di Biotechnologie Agrarie
Univcrsita di Padova
Via Gradenigo 6
Padova
Italy
Werner Pansegrau
Institute for Molecular
Plant Sciences
Clusius Laboratory
Leiden University
2333 AL Leiden
The Netherlands
Pieter W. Postma
Universiteit van Amsterdam
E.C. Slater Institute
for Biochemical Research
Plantage Muidergracht 12
1018 TV Amsterdam
The Netherlands
Ursula B. Pricfcr
Institut fiir Botanik
Rheinisch-Westfalische Technische
Hochschule
Worringcr Weg
52056 Aachen
Germany
Alfred Piihler
Fakultat fiir Biologie VI (Genetik)
Universitat Bielefeld
Postfach 10 01 31
33615 Bielefeld
Germany
Hermann Sahm
Institut fiir Biotechnologie I
Forschungszentrum Julich GmbH
Postfach 1913
52428 Julich
Germany
Bernhard Schink
Fakultat fiir Biologic
Universitat Konstanz
Universitatsstrafie 10
78464 Konstanz
Germany
Hans-Giinter Schlegel
Institut fiir Mikrobiologie
Universitat Gottingen
GrisebachstraBe 8
37077 Gottingen
Germany
Erko Stackebrandt
DSM — Deutsche Sammlung von
Mikroorganismcn u.
Zellkulturen
Mascheroder Weg lb
38124 Braunschweig
Germany
Brian Tindall
DSM — Deutsche Sammlung
von Mikroorganismen
u. Zellkulturen
Mascheroder Weg lb
38124 Braunschweig
Germany
Gottfried Unden
Institut fiir Mikrobiologie
u. Weinforschung
FB21 /Biologie
Joh. Gutenberg-Univ. Mainz
Becherweg 15
55099 Mainz
Germany
Peter Zuber
Department of Biochemistry and
Molecular Biology
Louisiana State University
Shreveport, Louisiana
USA
Биохимическая номенклатура
Таблица 1. Используемые в биохимии единицы физических величин
Физические величины Единицы в системе СИ
Наименование Обозначение величины Выражение в единицах системы СИ
русское международное
Длина метр м m
Масса килограмм КГ kg
Объем м3, л in3, 1
Время секунда с s
Сила электрического тока ампер А A
Плотность килограмм на метр кубический кг/м3 kg/m3
Поглощение (оптическая плотность) А Безразмерная величина (—logУ)
Пропускание Т Безразмерная величина (1/1о)
Температура, t цельсий °C °C
Термодинамическая темпе- ратура, Т кельвин К К
Количество вещества моль МОЛЬ mol
Сила ньютон II N — 2 м-кг-с
Энергия, работа, количество теплоты джоуль Дж J Нм = м2-кг-с-2; 4,1854 Дж -- 1 кал
Молекулярная масса дальтон Да Da
Молярная масса М г/моль g/mol
Относительная молекулярная масса Мг Безразмерная величина
Электрическая емкость фарад Ф F Кл-В-,= м-2-кг-1 -с4-А2
Количество электричества, электрический заряд кулон Кл C А-с
Электрическая проводимость сименс См S О-1 = м-2-кг-1-с3-А2
Электрическое напряжение вольт В V Дж-Кл-1 = м2-кг-с-3-А-1
Электрическое сопротивление ом Ом n В-А-1-с = м2-кг-с-3-А-2
Частота герц Гц Hz с-1
Освещенность люкс лк lx кд-ср-м-2 *
Мощность ватт Вт W Дж-с-1 = м-2кг-с-3
Давление паскаль Па Pa Н-м'2; 1 бар = 105 Па; 1 атм = 101325 Па; 1 мм рт. ст. = 1 торр = = 133,2 Па
Активность радиоактивных изотопов беккерель Бк Bq Один распад е-1
кд — единица силы света, кандела; ср — единица телесного угла, стерадиан.
Биохимическая номенклатура 11
Таблица 1 [продолжение)
Физические величины Единицы в системе СИ
Наименование Обозначение величины русское | международное Выражение в единицах системы СИ
Стандартное изменение свободной энергии AG° При концентрации реагентов 1 М и температуре 25 °C
AG0' При pH 7, концентрации реагентов 1 М и температуре 25 °C
Газовая постоянная R 8,31451 Дж-К—1-моль-1
Окислительно- восстановительный (редокс-)потснциал Eq Напряжение на электроде, погруженном в 1 М раствор окислителя или восстановителя, относительно стандартного водородного электрода
Приставки, используемые для производных единиц системы СИ
Множитель Приставка Обозначение Множитель Приставка Обозначение
ю-1 Деци Д 10 дека да
1СГ2 санти с 102 гекто г
10~3 милли м 103 КИЛО к
10“6 микро мк 106 мега М
10“9 нано н 109 гига Г
10-12 ПИКО п ю12 тера т
10“15 фемто ф ю15 пета п
10-18 атто а ю18 экза э
Таблица 2. Принятые обозначения химических групп. Эти обозначения могут быть приведены без расшифровки
Символ Название Символ Название
A, Ado Ас 'Ala, А Arg, R Asn, N Asp, D Asx, В C, Cyd Cho Cya Cys, C Doi Et Etn Fuc Fru Gal GalNAc Аденозин Ацетил Алании Аргинин Аспарагин Аспарагиновая кислота Аспарагиновая кислота или аспарагин Цитидин Холин Цистеиновая кислота Цистеин Долихил Этил Этанол амин Фукоза Фруктоза Галактоза 2-Дезокси-2-Ц-ацетиламино-П-галактоза G, Guo Glc GlcN GlcNAc Gin, Q Glu, E Glx, Z Gly, G G1 His, H Hyl Hyp lie, I I, Ino Ins Leu, L Lys, К Man Гуанозин Глюкоза 2- А м и но-2-дезо кси глюкоза 2-Дезокси-2-П-ацетиламино-В-глюкоза Глутамин Глутаминовая кислота Глутаминовая кислота или глутамин Глицин Глицерол Г истидин Гидроксилизин Гидроксипролин Изолейцин Инозин Инозитол Лейцин Лизин Манноза
12 Биохимическая номенклатура
Таблица 2 продолжен ше)
Символ Название Символ Название
Me Метил Rib Рибоза
Met, М Метионин Ser, S Серин
Муг Миристоил Т, The! Рибозилтимин (не тимидин, обозначаемый
N Нуклеозид как dT или dThd)
Neu Нейраминовая кислота Thr, T Треонин
Ole Олеоил Tip, W Триптофан
Orn Орнитин Туг, Y Тирозин
Р, Р Фосфат U, Urd Уридин
Pam Пальмитоил 4', 4'rd Псевдоуридин (5-рибозилурацил)
Ph Фенил Vai, V Валин
Phe, F Фенилаланин X, Xao Ксантозин
Pr Пропил Хаа, X Аминокислота
Pro, P 11ролин Xyl Ксилоза
Ptd Фосфатидил Y Пиримидиновый нуклеозид
R Пуриновый нуклеозид
аблица 3. Принятые сокращения для полусистематических или тривиальных названий. Данные аббревиатуры
тогут быть использованы без расшифровки
Сокращение Название
ADP-Rib Адснозин-б'-дифосфо-б-ДП-рибоза
AMP, ADP и АТР 1 Аденозип-б'-мопо-, -ди- и -трифосфат
п. и. Пара нуклеотидов
сАМР, циклический АМР Аденозин-З'-б'-циклофосфат
CD (КД) Круговой дихроизм
CMP, CDP и СТР 1 Цитидин-б'-моно-, -ди- и -трифосфат
СоА (или CoA-SH) Кофермент А
Со AS Ас Ацетил-кофсрмент А
ДЭАЭ-целлюлоза 0-(диэтиламиноэтил)целлюлоза
ДНК, кДНК, мтДНК и яДНК Дезоксирибонуклеиновая кислота, комплементарная ДПК, митохондриальная ДПК и ядерная ДПК
EDTA (ЭДТА) Этилендиамннтетраацстат
EGTA (ЭГТ^) Этиленгликоль-бис-(аминоэтилэфир)тетраацетат
ELISA Твердофазный имму коферментный анализ
ЭПР Электронный парамагнитный резонанс
ЭСР Электронный спиновый резонанс
FAD Флавинадениндинуклеотид
FMN Рибофлавин-57-фосфат
FPLC Жидкостная экспресс-хроматография белков (fast protein liquid chromatography)
ГХ Газовая хроматография
гжх Газо-жидкостная хроматография
GMP, GDP и GTP 1 Гуанозин-б'-моно-, -ди- и -трифосфат
НЬ, НЬСО и НЬО2 Гемоглобин, СО-гемоглобин и оксигемоглобин
ЖХВР Жидкостная хроматография высокого разрешения
ТХВР Тонкослойная хроматография высокого разрешения
ПФ Изоэлектрическое фокусирование
Биохимическая номенклатура 13
Таблица 3 (продол^кениё)
Сокращение Название
IgA и т. д. IMP, IDP и ITP1 Иммуноглобулин А и т. д. Инозин-б'-моно-, -ди- и -трифосфат
т. п. н. Тысяча пар нуклеотидов
мАт Моноклональные антитела
МС NAD, NAD+ и NADH NADP, NADP+ и NADPH Масс-спектрометрия Никотинамидадениндинуклеотид, его окисленная и восстановленная формы Никотинамидадениндинуклеотидфосфат, его окисленная и восстановленная формы
NMN NMP, NDP и NTP 1 ЯМР Никотинамидмононуклеотид Нуклеозид-б'-моно-, -ди- и -трифосфат Ядерный магнитный резонанс
ЭО Эффект Оверхаузера
ДОВ ЭФ в ПААГ Дисперсия оптического вращения Электрофорез в полиакриламидном геле
Pi poly(A) [поли(А)| PPi РИА Неорганический фосфат (3'—5х) поли (адениловая кислота) Неорганический пирофосфат Радиоиммуноанализ
РНК, гяРПК, мРНК, мтРНК, яРНК, рРНК и тРНК Рибонуклеиновая кислота, гетерогенная ядерная РНК, матричная (инфор- мационная) РНК, митохондриальная РНК, ядерная РНК, рибосомная РНК, транспортная РНК
РИП Р ибо! iy к л еоп ротеид
SDS(ДСН) тех ТМР, TDP и ТТР 1 U (ед.) UDP-Glc UMP, UDP и UTP 1 ХМР, XDP и ХТР 1 Додецилсульфат натрия Тонкое л о й ная хром атог рафия Рибозилтимин-б'-моно-, -ди- и -трифосфат 2 Единица, единица измерения Уридин-5'-дифосфо-1-а-D-глюкоза Уридин-б'-моно-, -ди- и -трифосфат Ксантозин-б'-моно-, -ди- и -трифосфат
1 Для обозначения соответствующего дезоксирибонуклеотида добавляют латинскую строчную букву d перед трехбуквенным
символом, например dADP. Изомеры обозначают 2/-NMP, 3Z-NMP или 5'-NMP (в случаях, когда возможна неясность).
2 Производные тимидина, содержащие дезоксирибозу, обозначают dTMP, dTDP и dTTP соответственно.
Генетическая номенклатура
Бактерии □ При описании фенотипов и гено-
типов бактерий каждое наблюдаемое свойство
обозначают трехбуквенным кодом, причем аб-
бревиатуры обычно бывают мнемоническими, по
Demerec et. al., 1966. Наиболее часто используе-
мые обозначения приведены в табл. 4.
1. Для обозначения фенотипа (например, His+
для штаммов, способных синтезировать гис-
тидин) используется обычный шрифт (не кур-
сив), первую букву делают прописной. Обо-
значения могут уточняться с помощью верх-
него индекса, в котором дается характери-
стика фенотипа. Например, фенотип дикого
типа обозначают His+, ауксотрофность по гис-
тидину— His , чувствительность к стрепто-
мицину — Strs и т. д. Эти обозначения могут
быть использованы также для белков — про-
дуктов соответствующих генов (например, бе-
лок LacZ).
2. Для обозначения генотипов, напротив, ис-
пользуют курсивный шрифт и все буквы сим-
вола как строчные (например, lac, his, mal).
Обозначения должны соответствовать фено-
типическим символам, но могут и отличать-
ся от них по историческим причинам. Так,
обозначению фенотипов Strs или Nals (чув-
ствительность к налидиксовой кислоте) соот-
ветствует обозначение генов rpsL (ribosome
protein, small L) и дуг A (gyrase subunit A).
Если несколько локусов отвечают за связан-
ные функции, их обозначают с использовани-
ем курсивной прописной буквы после символа
локуса (например, lacZ, lacY, lacC). Промо-
торные, операторные, терминаторные и ини-
циаторные сайты обозначают как lacZp (чи-
тается: промотор гена lacZ), lacZo, lacZt и
araBi, множественные премоторные сайты пе-
ред опероном — galEpl и да1Ер2.
3. Аллели дикого типа обозначают верхним ин-
дексом «плюс» (lac+ his+ mal+), тогда как
мутантный локус может обозначаться и без
верхнего индекса «минус». Таким образом,
предпочтительно говорить /ас-мутант, а не
1ас~-штамм. Индивидуальные мутантные сай-
ты или аллели обозначают последователь-
ными номерами изолятов (например, lacYl,
lacZ4). Для присвоения номера соответству-
ющие мутанты регистрируют, после чего при-
своенные им номера передают в лабораторию,
пославшую запрос. В случае, если известен
только единственный локус или не извест-
но, в каком из нескольких генов, ответствен-
ных за связанные функции, произошла мута-
ция, вместо прописной буквы ставится дефис
(например, mtl-1, ага-23).
4. Для обозначения генотипов используют толь-
ко верхний индекс +. Мутации обозначают,
указывая после номера аллеля их фенотипи-
ческие особенности: (Ат) для амбер-мутанта,
(Ts) для температурочувствительного му-
танта, (Con) для конститутивного мутан-
та, (Cs) для холодочувствительного му-
танта, (НуЬ) для мутанта, продуцирующего
гибридный белок {например, ага-230(Ат)
hisD21(Ts)]. Делеции обозначают символом
Д, который помещают перед названием де-
летированного гена (например, /\trpA432,
Д (lac-pro)...), слияния — Ф [например,
Ф (ага-1ас)95], инверсии — IN, инсерции
— D, или, например, в простых случаях
да1Т236::Тп5.
5. Новым генам, функция которых еще не уста-
новлена, должно присваиваться имя гомоло-
гичного гена, идентифицированного ранее у
другого организма, или временное наименова-
ние по правилам, описанным в работе Demerec
et. al., 1966.
Бактериофаги, плазмиды и транспози-
руюгциеся элементы □ Генетическая номен-
клатура этих элементов несколько отличается
от применяемой для бактерий. В случае фа-
гов генетические символы могут состоять из
одной, двух или трех букв (например, АН,
int2 и с1857 для мутаций в генах A, int и
cl фага Л соответственно), допускается исполь-
зование индексов «плюс» и «минус». Устой-
чивость к антибиотикам, кодируемую плазми-
дами, обозначают двухбуквенными символами
(например, Арг и Smr для устойчивости к ампи-
циллину и стрептомицину соответственно). При-
Генетическая номенклатура 15
сутствие плазмиды или эписомы указывают в
скобках [например, Е. coli (F+)|, присутствие ин-
тегрированной эписомы обозначают так же, как
присутствие инсерционных элементов и экзогенот,
например W3110/F'8. Происхождение фаголиза-
та указывают, например, следующим образом:
Pl-Е. coli К-12 — лизат фага Р1, выращенного
на Е. coli К-12. Наконец, для указания наличия
вставки транспозона по неизвестным сайтам хро-
мосома Е. coli и родственных ей бактерий поделе-
па на 10 секций по 10 мин каждая с обозначением
za., zb., zc. и т. д. для периодов с 1 по 10 мин, с 11
по 20 мин, с 21 по 30 мин и т. д. Каждая секция
разбита на отрезки длиной 1 мин, обозначаемые
zaa., zab., zac. и т. д. для 1, 2, 3 мин и т. д. Таким
образом, запись ze/-135.:Tn5 означает вставку но-
мер 135 транспозона Тп5 в отрезок генетической
карты 46 мин.
Более подробная информация публикуется
ежегодно в первом номере Journal of Bacteriology.
Таблица 4. Генетические маркеры
Обозначение гена Обозначение фенотипа Термин/название, от которого происходит сокращение Определяемый геном фенотипический признак
асе ade ala ага arg aro asn asp alp att bgl bio bla cat che chi cps erp err cya cys dna env fim Ав flh fit fnr fru fts gal gin Асе Ade Ala Ara Arg Aro Asn Asp Atp Att Bgl Bio Amp (Ap) Cam (Cm) Che Chi Cps Crp Crr Cya Cys Dna Env Fim Fig Flh Fli Fnr Fru Fts Gal Gin Acetate (ацетат) Adenine (аденин) L-Alanine (L-аланин) L-Arabinose (L-арабиноза) L-Arginine (L-аргинин) Aromatic (ароматические соединения) L-Asparagine (L-аспарагин) L-Aspartate (L-аспартат) ATP Attachment (прикрепление) /З-GIucosides (/3-глюкозиды) Biotin (биотин) /Э-Lactarnase (/3-лактамаза) Chloramphenicol acetyl-transferase (хлорамфеникол ацетилтрансфераза) Chemotaxis (хемотаксис) Chlorate (хлорат) Capsular (капсульный) Cyclic AMP receptor protein (белок рецептора циклического AMP) Catabolite repression resistance (устойчивость к катаболитной репрессии) Cyclic АМР (циклический AMP) L-Cysteine (L-цистеин) DNA (ДНК) Envelope (оболочка) Fimbria (фимбрия) Flagella (жгутик) Flagella (жгутик) Flagella (жгутик) Fumarate-nitrate reductase (фумарат-нитрат-редуктаза) D-Fructose (D-фруктоза) D-Galactose (D-галактоза) L-Glutainine (L-глутамин) Использование Биосинтез Биосинтез Использование Биосинтез Биосинтез ароматических аминокислот Биосинтез Биосинтез ATP-синтаза (также ипс) Сайты прикрепления фагов Использование Биосинтез Устойчивость к ам пицил л ину /пен ицил л ину Устойчивость к хлорамфениколу Способность к хемотаксису Биосинтез молибдоптерина Биосинтез капсульных полисахаридов Общий регулятор Субъединица IIAG,C фосфотрансфе- разной системы транспорта глюкозы Аденилатциклаза Биосинтез Биосинтез Клеточная оболочка Морфопоэз Морфопоэз Морфопоэз Морфопоэз Общий регулятор Использование Деление клетки Использование Биосинтез
16 Генетическая номенклатура
Таблица 4 (продолжение)
Обозначение гена Обозначение фенотипа Термин/название, от которого происходит сокращение Определяемый геном фенотипический признак
sip Glp sn-G lycerol-3-phosphate (sn-глицерол-З-фосфат) Использование
p/t Git L-Glutamate (L-глутамат) Использование
giy Gly Glycine (глицин) Биосинтез
gua Gua Guanine (гуанин) Биосинтез
дуг Nal Nalidixic acid resistance (устойчивость к налидиксовой кислоте) ДНК-гираза
his His L-Histidine (L-гистидин) Биосинтез
hut Hut L-Histidine (utilization) (L-гистидин, использование) Использование
He lie L-Isoleucine (L-изолейцин) Биосинтез
ilv Ilv L-Isoleucine/L-V aline (L-изолейцин / L-валин) Биосинтез
kan Kan (Kin) Kanamicine (канамицин) Устойчивость
lac Lac Lactose (лактоза) Использование
leu Leu L-Leucine (L-лейцин) Биосинтез
liv Liv Leu-Ile-V al Биосинтез
lys Lys L-Lysine (L-лизин) Биосинтез
mal Mal Maltose (мальтоза) Использование
man Man D-Mannose (D-манноза) Использование
mel Mel Melibiose (мелибиоза) Использование
met Met L-Methionine (L-метионин) Биосинтез
mot Mot Motility (подвижность) Мотор жгутика
mtl Mtl D-Mannitol (D-маннитол) Использование
mut Mut Mutator (мутатор) Мутагенез
nar Nar Nitrate reductase (нитратредуктаза) Использование
omp Omp Outer membrane protein (белок наружной мембраны)
ori Ori Origin (точка начала репликации) Точка начала репликации
pfk Pfk Р hosphof ructokinase (фосфофруктокиназа)
phe Phe L-Phenylalanine (L-фенилаланин) Биосинтез
pho Pho Phosphate (фосфат) Использование
pol Pol Polymerase (полимераза) ДНК полимеразы
pro Pro L-Proline (L-пролин) Биосинтез
pts Pts Phosphotransferase system (фосфотрансферазная система)
pur Pur Purine (пурин) Биосинтез
pyr Pyr Pyrimidine (пиримидин) Биосинтез
rec Rec Recombi nation (рекомбинация) Ферменты
rfa Rfa Rough (шероховатый) Биосинтез липополисахаридов
rpl Rpl Ribosomal protein large (белки большой субъединицы рибосомы) Белки SOS-субъединицы рибосомы
rpo Rpo RNA polymerase (РНК-полимераза) Субъединицы и сг-факторы
rpoB Rif Rifampicin (устойчивость к рифампицину) ^-Субъединица РНК-полимеразы
rps Rps Ribosomal protein small (белки малой субъединицы рибосомы) Белки 308-субъединицы рибосомы
rpsL Strr Streptomycin resistance (устойчивость к стрептомицину) Белок S12 308-субъединицы рибосомы
Генетическая номенклатура 17
Таблица 4 (продолжение)
Обозначение Обозначение Термин/название, от которого Определяемый геном
гена фенотипа происходит сокращение фенотипический признак
sec Sec Secretion (секреция) Выделение белков оболочки
ser Ser L-Serine (L-серин) Биосинтез
sue Sue Succinate (сукцинат) Использование
sup Sup Suppressor (супрессор) Супрессорные мутации
tet Tet(Tc) Tetracycline (тетрациклин) Устойчивость
thi Thi Thiamine (тиамин) Биосинтез
thr Thr L-Threonine (L-треонин) Биосинтез
thy Thy Thymine (тимин) Биосинтез
ton Ton T one (Tl) Устойчивость к фагу Т1
tra Tra Gene transfer (перенос генов) Перенос генов при конъюгации
trp Trp L-Tryptophan (L-триптофан) Биосинтез L-триптофана
tsx Tsx T-six (T6) Устойчивость к фагу Тб
tyr Tyr L-Tyrosine (L-тирозин) Биосинтез
uhp Uhp Uptake of hexose-phosphates
(поглощение гексозофосфатов)
ura Ura Uracil (урацил) Биосинтез
uvr Uvr UV radiation (УФ-излучепие) Устойчивость
vol Vai L-Valine (L-валин) Биосинтез
xyl Xyl D-Xylose (D-ксилоза) Использование
Глава 1
Бактериология проложила путь клеточной биологии:
исторический очерк
Бактерии были признаны особой группой орга-
низмов со специфической морфологией, харак-
терным способом размножения и разнообразны-
ми метаболическими свойствами лишь в конце
19 в., по именно они стали основными объекта-
ми в экспериментальных исследованиях но клю-
чевым аспектам клеточной биологии. Таким обра-
зом, бактериология проложила путь этой пауке.
Использование бактерий послужило существен-
ным стимулом развития общебиологических ис-
следований, и многие «современные» концепции
сегодняшней биологии появились еще в девятна-
дцатом веке и в первой половине двадцатого сто-
летия.
Приступая к изучению новой области знаний,
важно в первую очередь познакомиться с началь-
ным периодом ее развития, узнать, когда и кем
были сделаны первоначальные наблюдения, как
возникли первые идеи и в чем состояли решающие
эксперименты. Ранние этапы становления микро-
биологии и смежных областей биологии мы опи-
сываем в настоящей главе.
1.1. Развитию биологии способствовали новые гипотезы и
экспериментальные подходы
Начальному развитию биологии способствовали
успехи других наук, таких как математика, фи-
зика и химия. Дальнейшее продвижение, как и
в любой области исследований, требовало тру-
доемкой экспериментальной работы и одновре-
менно выработки новых взглядов и гипотез. Од-
нако необходимые для успешных экспериментов
теоретические знания, определенная фантазия,
интуиция, а также здравый смысл и мастер-
ство не всегда соединены в одном человеке, по-
этому не одна блестящая идея осталась прак-
тически без экспериментальной разработки и,
напротив, важные экспериментальные данные
не получили должного анализа и объяснения.
Многие наиболее яркие, удивительные открытия
были сделаны случайным образом и часто при
проведении экспериментов в другой области. Так,
Эдуард Бухнер (1860-1917) открыл процесс бро-
жения в бесклеточном экстракте дрожжей, когда
добавил к нему сахар, чтобы предотвратить пор-
чу этого препарата за ночь и наутро продолжить
своп иммунологические исследования. Алексан-
дер Флеминг (1881-1955), изучая морфологию
колоний стафилококков, обнаружил лизис бакте-
рий вокруг колонии случайно попавшего в чаш-
ку Петри гриба Peniczllium notatum. Ф. Гриффит
открыл трансформацию ДНК при изучении пато-
генных свойств Pneumococcus.
Многие открытия были сделаны независимо
практически в одно и то же время разными
исследователями, и часто несколько ученых вно-
сили вклад в одно открытие. В этом обзоре они
будут объединены «под одной крышей» — наград
всегда меньше, чем тех, кто их достоин. Неко-
торые выдающиеся исследователи, такие как Ан-
тон де Бари (1831-1888), Луи Пастер (1822-1895),
Фердинанд Кон (1828-1898), Мартин Бейеринк
(1851-1931), Сергей Николаевич Виноградский
(1856-1953), Вильгельм Пфеффер (1845-1920) и
Роберт Кох (1843-1910), своими открытиями и
теориями создали основу сразу для нескольких
направлений микробиологии, и мы еще неодно-
кратно будем упоминать их имена. В этой гла-
ве развитие микробиологии прослежено до нача-
ла шестидесятых годов 20 в. — рубежа бурного
развития биохимии и молекулярной биологии как
основы тех достижений, которые описаны в по-
следующих главах этой книги.
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 19
1.2. Как возникло предположение о существовании организмов —
возбудителей инфекций
В древности эпидемии считали не чем иным, как
наказанием Божиим. К концу средних веков воз-
никло представление о том, что болезни, вы-
зывающие эпидемии, связаны с инфекцион-
ными агентами. Когда бактерии еще не были
обнаружены с помощью микроскопа, Джироламо
Фракасторо (1478-1553), врач и поэт из Вероны, в
своем трактате «О контагии, о контагиозных бо-
лезнях и лечении» высказал мысль об инфекции
как следствии передачи «контагиума»—мель-
чайших живых телец, вызывающих данную бо-
лезнь. Он видел в контагиумах причину не только
болезней человека и домашних животных, по так-
же и разложения растительных остатков. Извест-
на медицинская поэма Фракасторо, озаглавлен-
ная «Сифилис, или французская болезнь» (1530).
Идеи Фракасторо оказались слишком преждевре-
менными для восприятия современниками и мог-
ли быть признаны лишь в 19 в., когда началось
бактериологическое изучение инфекционных бо-
лезней. Таким образом, выдвижение постулата о
микробной природе инфекционных болезней свя-
зано с именем человека, который никогда не видел
пи патогенных, ни каких-либо иных микроорга-
низмов.
1.2.1. Решающий прорыв в экспериментальной
микробиологии: бактерии стали доступны
для наблюдения
Начало бактериологии как науки легко датиро-
вать. Основателем ее стал Антони ван Левен-
гук (1632-1723). Он ввел понятие о бактери-
ях, благодаря тому, что смог их увидеть. Научив-
шись искусно шлифовать линзы, Левенгук создал
простейший микроскоп, состоящий лишь из дво-
яковыпуклой линзы с увеличением примерно в
280 раз. Рассматривая с помощью увеличитель-
ных линз и описывая бактерии, он доказал су-
ществование организмов, меньших по размерам,
чем все известные к тому времени растения и жи-
вотные. Открытие бактерий можно проследить
по переписке Левенгука (начало ее относится к
1673 г.) с секретарем Британского Королевского
общества в Лондоне Генри Ольденбургом. Начи-
ная с 1674 г. Левенгук регулярно присылал ему
сообщения о «маленьких зверьках» и «малень-
ких существах», которые наблюдал в воде, слюне
или зубном палете. Письма Левенгука были пе-
реведены на английский язык и опубликованы в
записках Королевского общества с использовани-
ем терминов «мелкие/очепь мелкие анималкулы»
(от лат. animalculum — зверек, микроскопическое
животное). В свое 39 письмо, датированное 17 сен-
тября 1683 г., Левенгук включил рисунки, изобра-
жающие кокки, палочки и спириллы.
Однако это великое открытие не имело какого-
либо продолжения в течение всего следующе-
го столетия, и даже развитие микроскопа
продвигалось медленно. Первый микроскоп с хо-
рошим разрешением был создан в 1821 г. вы-
дающимся итальянским математиком и физиком
Джованни Амичи (1784-1863). В конце того же
столетия были введены в практику апохрома-
тические объективы. Первые микрофотографии
получил Роберт Кох в 1876-1877 гг. с использова-
нием водно-иммерсионного объектива. Масляно-
иммерсионные объективы впервые использовали
Эрнст Аббе (1840-1905) и Карл Цсйсс (1816-
1888) в Иене в 1878 г. Флуоресцентный микроскоп
создал Дж. Барнард в 1919 г.; вслед за этим Фриц
Цернике (1888-1966) разработал метод фазового
контраста и изобрел фазово-контрастный микро-
скоп (1935), который с 1940 г. начала производить
фирма Цейсса в Иене. Электронный микроскоп
был создан в 1934 г. в Бельгии Л. Мартоном и в
Германии Эрнстом Руской.
Наблюдения Левенгука стали краеугольным
камнем в истории биологии. Открытие организ-
мов мельче червей и водорослей будило вообра-
жение и интерес к экспериментированию. Преж-
де всего возник вопрос, могут ли бактерии появ-
ляться из неживой материи путем спонтанного
зарождения. Подобную идею высказывали еще
древние греки, полагавшие, что рыбы, черви и
лягушки зарождаются из осадков рек и прудов.
Позднее это представление связывали лишь с мел-
кими животными, такими как мухи и их личинки,
и, наконец, стали относить лишь к мельчайшим из
организмов, бактериям.
Наряду с этим обсуждался вопрос об извест-
ной с древних времен передаче болезней при
20 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
контактах. Идея о «заразном начале» как аген-
те, вызывающем инфекционные болезни, получи-
ла экспериментальные доказательства лишь через
200 лет после открытия Левенгука. Потребова-
лось длительное время для того, чтобы бактерии
были признаны представителями нового, большо-
го класса самостоятельных организмов и на
основе этого была раскрыта природа процессов
брожения и гниения, а также инфекционных бо-
лезней.
1.2.2. Попытки опровергнуть идею о
самозарождении живых организмов
стали толчком для экспериментальных
исследований
Описание экспериментов по проверке идеи о са-
мозарождении микробов, проведенных Франчес-
ко Реди (1626-1697), Луи Джобло (1645-1723),
Джоном Нидхэмом (1713-1781), Жоржем Лек-
лерком де Бюффоном (1707-1788), Ладзаро
Спалланцани (1729-1799), Теодором Шванном
(1810-1882) и другими, привел Фридрих Лёфлер
(1852-1915) в своих «Лекциях по истории бак-
териологии» (1887). Эта идея, ставшая широко
известной, была камнем преткновения как для
философов, так и для исследователей того вре-
мени. Поиск ее экспериментальных доказательств
или опровержений служил наиболее сильным сти-
мулом для исследований в бактериологии. Убе-
дительное доказательство того, что теория само-
зарождения ошибочна, было получено Пастером,
работавшим в Париже. До этого в 1858 г. Ф. Пуше
представил Французской академии доклад, в ко-
тором изложил свои доказательства теории само-
зарождения, и в 1860 г. Академия установила пре-
мию за «попытку с помощью тщательных экспе-
риментов пролить свет на вопрос о так называе-
мом самозарождении живых организмов». В этот
период Пастер занимался изучением брожения,
вызываемого дрожжами и бактериями, и много
времени посвятил предложенной проблеме. Ранее
Франц Шульце (1815-1873) и Т. Шванн установи-
ли (1836-1837), что прокипяченная вытяжка из
разлагающегося материала остается стерильной,
если возвращаемый в емкость после остывания
раствора воздух простерилизовать пропусканием
через концентрированную кислоту, щелочь или
расплавленный металл. Пастер провел аналогич-
ные и новые, оригинальные эксперименты, опро-
вергающие возможность самозарождения микро-
бов. Сторонники идеи самозарождения заявили,
что стерилизация воздуха разрушает его «жиз-
ненную силу». Хотя оппоненты Пастера не смогли
повторить его эффектные эксперименты, он по-
лучил премию академии (1862). Причина разли-
чий в результатах экспериментов Пуше и Пасте-
ра стала понятной после открытия Коном в 1877 г.
устойчивых к нагреванию спор «сенной палочки».
Пастер использовал дрожжи, которые легко уби-
ваются кипячением, тогда как Пуше — сенной
настой, который невозможно простерилизовать
простым кипячением из-за присутствия в нем
бактериальных спор. Изобретательность Пастера
удачно соединилась здесь со счастливым случаем.
1.3. Бактерии составляют отдельную большую группу
самостоятельных организмов
С появлением микроскопа вошло в моду наблю-
дать различные водные микроорганизмы, и их
описывали многие «виртуозы-микроскописты»,
как ученые, так и любители. Первым, кто ввел
порядок в разнообразие описанных форм мик-
роорганизмов, был датский исследователь Отто
Мюллер (1730-1784). Его работа «Апималкулы
в настоях, реках и морях», опубликованная в
1786 г., содержала описания 379 различных видов
микробов.
К началу 19 в. нашла свое завершение од-
на из драматических историй, связанных с бак-
териями. Издавна люди наблюдали, что на
влажном хлебе и других углеводных пище-
вых продуктах появляются как бы пятна кро-
ви. Этот природный феномен стал причиной
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 21
трагических последствий, после того как като-
лическая церковь в раннем средневековье ста-
ла использовать для Евхаристии хлеб в ви-
де гостий (облатки). При храпении в сырых
помещениях церквей облатки часто начинали
«кровить», и так называемое «чудо кровящего
хлеба» служило постоянным поводом для обви-
нений и казней, пока в 1823 г. не было решено
создать комиссию из профессоров Падуанского
университета с целью выяснить, что происходит
с облатками. Один из ученых, вошедших в комис-
сию, Бартоломео Бизио, ошибочно описал «кро-
вяные» капли как грибные образования, назвав
«гриб» Serratia marcescens в честь своего учителя
физики Серафино Серрати. Кристиан Эренберг
(1795-1876), не зная о работе Бизио, в 1848 г. опре-
делил вызывающие этот феномен микробы как
бактерии и дал им название Monas prodigiosa (от
лат. prodigium — чудо).
Пигментированные микроорганизмы, образу-
ющие пленки, скопления или взвесь в водных
местообитаниях, привлекали внимание многих
ранних исследователей-натуралистов. Например,
гигантские фототрофные бактерии, известные те-
перь как Chromatium okenii. и Thiospirillum je-
nense, наблюдал К. Эренберг в 1836 г. во время
прогулки в окрестностях Йены. Формальное опи-
сание этих организмов под названием Monas и
Ophidomonas соответственно было включено в
работу Эренберга «Анималкулы из настоев как
самостоятельные организмы» (1838). Бактерия
Gallionella ferruginea, образующая гидроксид же-
леза, также была описана Эренбергом (1838); оби-
тающую в ассоциации с нею нитчатую бактерию
Leptothrix ochracea описал в 1843 г. Фридрих Кют-
цинг (1807-1893).
В последующие годы были описаны и дру-
гие окрашенные бактерии. Швейцарский бота-
ник Максимилиан Перри в своей работе «К на-
шим знаниям о мельчайших формах жизни» впер-
вые предложил родовое название Chromatium и
описал С. vinosum, С. weissei, С. violascens и
С. rubescens. В 1873 г. Р. Ланкестер (1847-1929)
описал персиково-красные маты, покрывающие
донные осадки в прудах, и назвал образующий их
организм Bacterium rubescens, определив его как
бактерию. Он дал также название пигменту этого
организма — бактсриопурпурин. Термин «пурпур-
ные бактерии» впервые предложил датский бота-
ник Эугениус Варминг (1841-1924).
Современные пре, оставления о морфологии
бактерий основаны па блестящих исследовани-
ях немецкого физиолога растений Ф. Кона, ра-
боты которого относятся к периоду 1853-1877 гг.
Изучая бактерии, он развил представления, став-
шие основами микробиологии. Кон отнес бакте-
рии к отдельной группе организмов с характерны-
ми морфологией, способом размножения (бинар-
ное деление) и типами метаболизма, включил их
в царство растений и ввел для них бинарную но-
менклатуру К. Линнея (1707-1778). Предложен-
ная Коном система бактерий оказалась весьма
полезной для развития как медицинской, так
и общей бактериологии. Основным открытием
Кона стало обнаружение светопреломляющих
спор у «сенной палочки» (1877), названной
впоследствии Bacillus subtilis. Описание Кохом
Bacillus anthracis подтвердило значение эндоспор
как дифференцирующего признака для класси-
фикации бацилл.
Насколько трудно воспринималось в то вре-
мя представление о постоянстве видов микробов,
выдвинутое Копом, показывает история дискус-
сии о плеоморфизме и мономорфизме бак-
терий. К 1850 г. были опубликованы описания
ржавчинных и головневых грибов с их сменой
морфологических форм в цикле размножения,
вызвавшие среди бактериологов разногласия.
Некоторые из них считали, что одна и та же бак-
терия может существовать в различных формах
(плеоморфизм), вызывая при этом различные бо-
лезни и образуя различные продукты метаболиз-
ма, в зависимости только от условий роста. Такие
представления высказывали авторитетные уче-
ные— Т. Бильрот (1829-1894), К. Негели (1817—
1891), Э. Хэлиер, Дж. Листер, Р. Ланкестер и
В. Цопф — даже после введения в практику мето-
дов получения чистых культур, вплоть до сере-
дины 1880-х гг. Другие исследователи, такие как
Пастер, Кон, Кох и О. Брсфсльд, доказывали
важность изучения чистых культур и подчерки-
вали значение точности экспериментов. Таким
образом, признание факта мономорфизма, т. е.
постоянства видов бактерий, потребовало дли-
тельного времени. Как известно, пет ничего труд-
нее, чем изменить сложившиеся представления.
Утверждение о постоянстве бактериальных видов
естественным образом вызывало сомнения, когда
исследователи наблюдали изменчивость и мута-
ции даже в чистых культурах.
22 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
1.4. Использование плотных сред и методов получения чистых культур
произвело революцию в микробиологических исследованиях
Первые исследователи использовали для выращи-
вания микроорганизмов жидкие среды, например
Пастер применял для этого вытяжки. Он опреде-
лил, что дрожжи, подобно растениям, содержат
углерод, кислород, водород, азот и минеральные
вещества (1858). Рост дрожжей и бактерий по-
лучали в растворах, содержащих дистиллирован-
ную воду, тартрат аммония, сахара и золу дрож-
жей. Позже стали заменять последний компонент
соответствующими минеральными солями и ва-
рьировать источники углерода. В 1873 г. Джозеф
Листер (1827-1912) ввел в практику метод се-
рийных разведений бактерий в жидкой сре-
де для получения чистых культур. Выделенный
таким способом штамм Streptococcus lactis, как
продемонстрировал (1909) Сигурд Орла-Иенсеп
(1870-1949), был чистой культурой. Однако по-
лучить желаемый результат этим методом уда-
валось не каждому исследователю. Настоящий
переворот в исследованиях вызвало применение
плотных сред. Плотные среды в виде при-
родных субстратов, таких как экскременты жи-
вотных, навозные шарики, срезы картофеля и
моркови, использовали уже задолго до этого
для выращивания грибов. В 1852 г. был впер-
вые применен желатин как прозрачная питатель-
ная среда, необходимая для изучения жизненно-
го цикла грибов (Ц. Виттадини). Оскар Брефельд
(1839-1925) использовал этот метод для изу-
чения гриба Empusa muscac (1868). Благодаря
изобретательности Коха появились метод при-
готовления плотной прозрачной среды с жела-
тином и метод выделения чистой культу-
ры на плотной среде, разлитой в стеклян-
ные тарелки (1881). Коху, по-видимому, помог
его опыт в использовании желатина для изго-
товления фотопластинок. Заменить желатин ага-
ром в качестве отвердителя предложила Фан-
ни Хессе, супруга Вальтера Хессе (1846-1911),
занимавшегося определением числа микроорга-
низмов в воздухе (1880); именно от Хессе ис-
ходило это нововведение в лаборатории Коха
(1882). Вероятно, никто из исследователей не
был знаком с кулинарной книгой 1873 г. изда-
ния, рекомендовавшей применять агар-агар для
приготовления желе. Позже стеклянные тарел-
ки были заменены стеклянными чашками
Петри (1887).
1.5. Новые бактериологические методы помогли доказать роль бактерий
как возбудителей инфекционных болезней
В середине 18 в. австрийский врач Маркус фон
Пленцис (1705-1786) в опубликованном им меди-
цинском трактате (1762) высказал идею о том,
что каждую болезнь вызывает особый семиниум
(семя), и даже процессы гниения яблок или вишен
и брожения теста отметил как примеры деятель-
ности семиниумов. В то время появилась насто-
ящая мания выискивать маленьких «червячков»
повсюду. В такой атмосфере идею об участии за-
разного начала в болезнях не приняли всерьез,
она была отвергнута и почти забыта. Медицина
не стала путеводной звездой микробиологии, по-
ка «на сцену» не выступили Пастер и Кох.
В 1850-х гг. Пастер осуществил ряд исследова-
ний, доказавших, что каждый тип брожения вы-
зывают особые микроорганизмы. Позднее он вы-
сказал предположение, что и возбудители инфек-
ций специфичны для вида болезней. Не будучи
ни ветеринаром, ни врачом, Пастер, по образо-
вания химик, первым взялся за изучение при-
роды инфекционных болезней. В ответ па прак-
тические нужды он стал исследовать болезни
вина и пива, куриную холеру и болезнь тутово-
го шелкопряда. Сотрудник лаборатории Пасте-
ра Ч. Шамберлан (1851-1908) ввел в лаборатор-
ную практику автоклав для стерилизации сред
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 23
и фарфоровые фильтры (свечи Шаь.берлана)
для очистки культуральной жидкости от микро-
организмов.
Бесспорные доказательства роли бактерий как
возбудителей инфекционных болезней получил
Кох при изучении сибирской язвы — в то вре-
мя распространенного заболевания, поражающе-
го крупный рогатый скот. В середине 19 в.
А. Поллендер (1800-1879) и К. Давен (1811-1882)
сообщили о присутствии огромного количества
палочковидных телец в крови животных, погиб-
ших от сибирской язвы. Кох столкнулся с пей во
время работы врачом в Воллстайне в Силезии.
В 1875 г. ему удалось выделить из инфицирован-
ного материала бактерии в виде хорошо разли-
чимых палочек, которые он пассировал на мы-
шах. Используя в качестве питательных сред
сыворотку крови, жидкость из бычьего глаза
и залитые парафином срезы тканей животных,
Кох обнаружил, что для роста выделенных бак-
терий необходим доступ воздуха и температура
30-35 °C, а также установил образование ими эн-
доспор. В этих экспериментах, занявших всего
пять недель, были выработаны этапы бактерио-
логического исследования, позднее ставшие из-
вестными как постулаты Коха [в том виде, как
их сформулировали Э. Клебс (1877) и Ф. Лефлер
(1884)]. Кох сообщил об экспериментах по изуче-
нию жизненного цикла Bacillus anthracis Ф. Копу.
И. Конгейму, Э. Эйдаму и К. Вейгерту в Бреслау
и в мао 1876 г. сдал в печать рукопись «Этиология
сибирской язвы, основанная на жизненном цик-
ле Bacillus anthracis». Это исследование доказа-
ло, что определенные бактерии вызывают опре-
деленные болезни. Следующими работами Коха
были «Методы изучения, сохранения и фото-
графирования бактерий» и «Изучение этиологии
раневых инфекций». Когда Кох опубликовал ра-
боту по сибирской язве, еще не был разработай
метод выделения чистых культур на плотной сре-
де. Использованные в этом исследовании куль-
ту ры, полученные путем заражения животных,
были накопительными. После разработки и стан-
дартизации основополагающих методов выделе-
ния чистых культур Кох и его сотрудники создали
руководство по выделению и исследованию бакте-
рий. Ь. Методы Коха до сих пор используются почти
без модификаций, и постулаты Коха не утратили
своего значения (см. гл. 33). Эти исследования по-
служили сильным импульсом, открывшим золо-
той век микробиологии. Заслуги Коха - развитие
важных концепций, открытие нескольких видов
бактерий и главным образом создание основных
методов и принципов бактериологии - поистине
велики.
Идея о том. что бактерии вызывают также
п болезни растений, принималась с большими
сомнениями. О фитопатогеиных грибах сообщал
ранее А. де Бари (1853). В 1878 г. Американский
ботаник Т. Баррил (1839-1916) описал бактерии,
обнаруженные им в тканях зараженных мучни-
стой росой персиковых деревьев, и назвал возбу-
дителя Micrococcus amylovorus. Спустя десять лет
американский бактериолог Эрвин Смит (1854-
1927) описал несколько фитопатогеиных бактерий
и высказал предположение, что бактериальных
болезней растений не меньше, чем инфекционных
болезней животных. Смит выявил многие бакте-
рии — возбудители болезней растений, в том числе
хорошо известный Agrobacterium tumefaciens, об-
разующий галлы (1907). В 1920 г. в честь Смита
был назван род бактерий — Erwinia.
1.6. Изучение процессов брожения положило начало развитию
физиологии и биохимии бактерий
Спиртные напитки и кисломолочные продукты
получали с использованием брожения еще за ты-
сячи лет до того, как стали известны возбудители
брожения. Об участии живых организмов в обра-
зовании спирта в 1837 г. одновременно сообщили в
своих работах Ф. Кютцинг, Шарль Капьяр де Ла-
тур (1777-1859) и Т. Шванн. Однако эта «дрож-
жевая теория» не была признана химиками, та-
кими как Фридрих Вёлер (1800-1882), Йенс Бер-
целиус (1779-1848) и Юстус Либих (1803-1873),
которые утверждали, что брожение вызывают хи-
мические катализаторы. В 1839 г. Либих опубли-
ковал анонимно статью «Разгадка секрета спир-
тового брожения» (Annalen der Pharmazie 29,
24 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
100-104), чтобы высмеять виталистическую тео-
рию. Эта публикация, демонстрирующая пора-
зительное высокомерие некоторых авторитетных
ученых того времени, стала причиной задерж-
ки в изучении брожения, продолжавшейся до
тех пор, пока Пастер не повторил эксперимен-
ты Шванна и не заключил, что именно дрожжи
вызывают спиртовое брожение. В экспериментах
1857-1961 гг. Пастер открыл, что различные типы
брожения и образование уксуса вызывают опреде-
ленные организмы, а также доказал существова-
ние анаэробных бактерий, участвующих в про-
цессах гниения (1863). Он называл возбудителей
брожения «живыми клетками» или «фермента-
ми», используя эти термины как синонимы. Мо-
риц Траубе (1828-1894), ученик Либиха, не отвер-
гая роли микроорганизмов в брожении и гниении,
связывал, однако, процесс брожения с белками,
находящимися внутри клетки (1858). Термин эн-
зимы для таких белков был предложен в 1878 г.
В. Кюпне (1837-1900).
Превращения субстратов в различных биоло-
гических образцах были описаны, например, в
лаборатории Эрнста Хоппе-Зейлера (1825-1895)
в Страсбурге, наблюдавшего, что добавление
сахаров или кальциевых солей органических кис-
лот, таких как формиат, ацетат, лактат, тарт-
рат и малат, к осадкам сточных вод вызывает в
анаэробных условиях активное брожение. Хоппе-
Зейлер количественно определял продукты бро-
жения (включая Н‘2 и СО2) и сделал множество
важных наблюдений, которые получили объясне-
ние лишь многие десятилетия спустя.
Наиболее распространенный объект биохими-
ческих и генетических исследований, бактерия
Escherichia coli, была описана в 1885 г. Теодо-
ром Эшерихом (1857-1911) как Bacterium coli
commune. Продукты вызываемого ею брожения
впервые определил (1901) Артур Гарден (1865-
1940), уровень исследований которого немно-
гим отличался от современного. Гарден даже
верно предположил, что водород при броже-
нии образуется из муравьиной кислоты и позд-
нее (1906) выявил особенности брожения, вызы-
ваемого Aerobacter (нынешнее название — Kleb-
siella).
1.7. Открытие литоавтотрофии — способности бактерий
получать энергию при окислении неорганических соединений
и усваивать углерод из углекислоты
Литоавтотрофия была впервые описана в
1887 г. русским физиологом растений С. П. Ви-
ноградским, работавшим в то время в лаборато-
рии де Бари в Страсбурге. Инкубируя гигантскую
серную нитчатую бактерию Beggiatoa во влажной
камере в присутствии сероводорода и воздуха, он
наблюдал отложение в клетках глобул серы, ис-
чезавших в отсутствие сероводорода, и образова-
ние серной кислоты. Виноградский заключил, что
Beggiatoa окисляет соединения серы вместо орга-
нических субстратов; это свойство было призна-
но новым способом жизни и получило название
аноргоксидация, или хемосинтез; теперь оно
известно как литотрофия. Исследуя нитрифи-
цирующие бактерии (1891), Виноградский открыл
также источник углерода, необходимый для био-
синтетических процессов. Ему удалось выделить
бактерии-нитрификаторы из почвы и получить их
рост па чисто минеральной среде. Определяя ко-
личество нитрита, нитрата и образованного кле-
точного углерода, Виноградский установил, что
имеется постоянное стехиометрическое соотно-
шение между продуктами окисления аммиака и
ассимилированным углеродом. Поскольку в среду
не добавляли органический субстрат, источником
клеточного углерода мог служить только диоксид
углерода из воздуха. Таким образом, Виноград-
ский открыл ассимиляцию бактериями угле-
кислоты — свойство, до того времени известное
лишь для растений. Физиолог растений Виль-
гельм Пфеффср (1845-1920), работавший в Лейп-
циге, ввел для подобного способа роста термин
автотрофия (1897). Литоавтотрофия присуща
большой группе бактерий, растущих в минераль-
ных средах с использованием неорганических до-
норов водорода, таких как аммиак, нитрит, сера,
сероводород, тиосульфат, восстановленное желе-
зо, молекулярный водород и оксид углерода, а
Глава 1 Бактериология проложила путь клеточной биологии: исторический очерк 25
также, в качестве единственного источника уг-
лерода, углекислоты. Отдельные представители
этих бактерий были выделены и изучены еще в на-
чале прошлого века, но многие литоавтотрофы из
экстремальных местообитаний удалось обнару-
жить совсем недавно. Открытие этого нового спо-
соба жизни имело чрезвычайно важное значение.
Хемолитотрофные бактерии с их особыми
потребностями в субстратах были первой фи-
зиологической группой организмов, выделенной
с помощью селективных сред—методом, извест-
ным сейчас как метод накопительных куль-
тур. Этим методом Виноградский (1887) по-
лучил смешанную культуру бесцветных и пур-
пурных серных бактерий. Как прежде, так и
теперь курс практических занятий по микробио-
логии часто начинают с демонстрации «колонки
Виноградского». С помощью метода накопитель-
ных культур немецкий ученый М. Бейеринк, рабо-
тавший в Дельфте, выделил множество видов спе-
циализированных бактерий. Принципы, разрабо-
танные Виноградским и Бейеринком, используют-
ся и в наше время для выделения микробов с осо-
быми потребностями в источниках питания или
в экстремальных условиях, причем новейшие спо-
собы выделения включают применение компьюте-
ризированных приставок для скрининга образцов.
Те же принципы лежат в основе методов отбора
мутантов и рекомбинантов в современных генети-
ческих исследованиях.
1.8. Выяснение природы светозависимых процессов — фототаксиса и
фотосинтеза — потребовало длительного времени
Аноксигенные фототрофные бактерии □
Как отмечено выше, некоторые фототрофные
бактерии привлекали внимание естествоиспыта-
телей задолго до того, как их способность ис-
пользовать световую энергию для роста могла
получить научное объяснение. Эти пигментиро-
ванные бактерии были описаны К. Эренбергом
(1838), М. Перти (1852), Р. Ланкестером (1873),
Э. Вармингом (1875) и Ф. Коном (1875). Первым
исследователем, изучавшим физиологию пурпур-
ных бактерий (1883), был Теодор Энгельманн
(1843-1910). Он описал ряд феноменов, вызы-
ваемых светом, например выделение кислорода
на свету талломом зеленых водорослей, к кото-
рому устремлялись подвижные аэробные бакте-
рии («аэротаксис»). Применяя способ, известный
как «световая ловушка Энгельманна», для изуче-
ния фототаксиса подвижных пурпурных бакте-
рий, он установил корреляцию между фотосин-
тезом и фототаксисом, придя к заключению, что
пурпурные бактерии как обладающие фототакси-
сом должны иметь фотосинтетический мета-
болизм. В то же время С. Н. Виноградский, изу-
чая аэробные серные бактерии Beggiatoa (1888) в
отношении механизма хемосинтеза, одновремен-
но установил, что пурпурные бактерии окисля-
ют сероводород в анаэробных условиях; он пред-
полагал, что необходимый для этого кислород
образуется при фоторазложении воды. Вино-
градский считал метаболизм бесцветных и пур-
пурных серных бактерий идентичным. Венский
ботаник Ганс Молиш (1856-1937) опубликовал
книгу с описанием пурпурных бактерий (1907), в
которой критиковал теории как Энгельманна, так
и Виноградского, подчеркивая, что пурпурные
бактерии ассимилируют на свету органическое
вещество и не образуют кислорода. Без сомне-
ния можно утверждать, что Молиш изучал лишь
песерные пурпурные бактерии. В 1919 г. немецкий
ботаник Йоханнес Будер (1884-1966) объяснил
па основании своих наблюдений причину всех
этих несоответствий: Энгельманн, Виноградский
и Молиш изучали совершенно разные бакте-
рии. Для Будера было очевидным, что имеется
два типа пурпурных бактерий — серные и несер-
ные. Представители первой группы осуществля-
ют литотрофпый метаболизм, как и бесцветные
серные бактерии. Для второй группы, помимо
литотрофии, характерен также органотрофный
метаболизм, по наличию которого они сходны с
гетеротрофами. Будер открыл, что пурпурные
бактерии имеют неизвестный до тех пор тип
метаболизма —ассимилируют на свету СО2 или
органические вещества, и объединил представле-
ния о фотосинтезе (введенные Энгельманном)
и хемосинтезе (введенные Виноградским). Кон-
26 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
цепция о механизме фотосинтеза у зеленых рас-
тений и пурпурных бактерий была предложена
Корнелиусом ван Нилем (1897-1985) в 1931 г. Он
работал с чистыми культурами обеих групп пур-
пурных бактерий и вывел общее уравнение фото-
синтеза:
СО2 + 2Н2А [СН2О] + Н2О + 2А,
где А обозначает кислород (в случае расте-
ний), серу (в случае серных пурпурных бактерий)
или окисленное органическое вещество (в случае
нессрных пурпурных бактерий). Это уравнение
отражает представление о том, что пурпурные
бактерии осуществляют фотосинтез без выделе-
ния кислорода.
Оксигенные фототрофные бактерии □
Цианобактерии, ранее известные как синсзеле-
ные водоросли, представляют собой оксигенные
фототрофные бактерии, т. е. образуют кисло-
род при фотосинтезе. Прокариотическое строе-
ние этих организмов было четко установлено в
60-х гг. прошлого столетия. Начиная со сред-
них веков ботаники классифицировали цианобак-
терии как растения по цвету талломов и по
признаку обитания в водных или влажных мес-
тах. К середине 19 в. были описаны морфология
нитей и колоний цианобактерий, а также на-
личие у них гормогониев, акинет и гетеро-
цист. Ф. Кютцинг (1843) назвал дополнитель-
ные пигменты цианобактерий фикоцианином и
фикоэритрином; их пигментная система была
названа фикохромом (К. Негели; 1849). Зави-
симость роста цианобактерий от света и СО2
свидетельствовала о растительном типе метабо-
лизма. Ф. Кон в своей классификационной сис-
теме (1875) объединил синезеленые водоросли с
бактериями. Используя название Schizomycetes,
предложенное Негели для бактерий, Кон назвал
объединенную группу Schizophytae. Объедине-
ние было основано на морфологических призна-
ках; внутри этой системы Кон разделял бес-
цветные и фикохромсодержащие формы. В ре-
зультате помещения Schizophytae в отдельную от
растений и животных группу бактерии больше
не считались червями, простейшими или однокле-
точными водорослями. Кроме того, это выделе-
ние стало первым указанием на принципиальное
различие между бактериями (включая цианобак-
терии) и всеми остальными организмами. Вы-
явление внутриклеточного строения подтвердило
закономерность объединения классических бакте-
рий с цианобактериями и легло в основу разде-
ления всех живых организмов па прокариот и
эукариот, предложенного Роджером Стейниером
(1916-1982) и К. ван Нилем в 1962 г.
Отнесение цианобактерий к бактериям име-
ло ряд последствий. Когда цианобактерии
считали растениями, их классифицировали
согласно правилам кодекса ботанической номен-
клатуры, нс основанным па признаках живых
культур. После объединения с бактериями они
стали субъектами кодекса номенклатуры бакте-
рий, предполагающего поддержание живых чи-
стых культур в официальных коллекциях бак-
терий. Впервые чистые культуры цианобактерий
получил в 1917 г. Р. Гардер (1888-1973), изучав-
ший цикл развития Nostoc punctiforme. Большое
количество аксеничпых культур цианобактерий
было выделено в лабораториях Стейниера в Берк-
ли и Париже.
1.9. Фиксация молекулярного азота присуща только прокариотам
Многовековой опыт земледелия, указывавший
на то, что бобовые растения повышают пло-
дородие почвы, получил объяснение в работах
Жана Батиста Буссенго (1802-1887), который об-
наружил обогащение почвы под бобовыми азо-
том (1837). Корневые клубеньки бобовых
считали тогда галлами, поскольку Дж. Лахманн
(1858) и М. С. Воронин (1866) наблюдали
заполнение их палочками, напоминающими бак-
терии. Эти «нетипичные» бактерии были названы
бактероидами (Ж. Брунхорст, 1885). Наблю-
дения показывали (1879), что образование клу-
беньков на корнях вызывают микроорганизмы
почвы (А. Франк; 1839-1900). Связь между кор-
невыми клубеньками и азотфиксацисй выявили
Г. Гельригель (1831-1895) и X. Вилфарт. В тонких
экспериментах (1884-1886) им удалось продемон-
стрировать, что клубеньки снабжают растение
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 27
связанным азотом. Клубеньковые бактерии были
затем выделены М. Бейеринком (1888) и названы
Bacterium radicicola. Открытие свободноживу-
щих азотфиксирующих бактерий (1895) при-
надлежит С. Н. Виноградскому. Из накопитель-
ных культур в средах, содержащих сахар, но ли-
шенных связанного азота, он выделил Clostridium
pasteurianum и установил его способность фик-
сировать молекулярный азот. Виноградский не
наблюдал роста бактерий на поверхности в этих
накопительных культурах (для их получения
он использовал высокие пробирки, позволяю-
щие создавать анаэробные условия) и таким
образом оставил возможность открытия аэроб-
ных исзогфиксаторов (Azotobuctcr clu оисоссит')
М. Бейеринку и А. ван Дельдсну (1902).
Уже в 1901 г. Бейеринк пришел к выводу,
что цианобактерии, например АпаЬаепа и Nostoc,
способны фиксировать молекулярный азот;
количественные эксперименты К. Древса (1928) и
Г. Фогга (1942) подтвердили это предположение.
Когда для выявления нитрогеназы стали при-
менять тест с ацетиленом, Г. Гест предположил
(1950), что все содержащие ее бактерии должны
обладать способностью фиксировать молекуляр-
ный азот и продемонстрировал это в опытах с
15N2 на пурпурных бактериях Rhodospirillum и
Chromatium.
1.10. Изучение анаболизма и катаболизма позволило обнаружить
субстраты, продукты, апоферменты, коферменты и
сами реакции метаболических путей
Пастер, учитывая роль химических реакций в
процессах брожения, определял выделение фер-
ментов дрожжами. Химики М. Бертло (1860)
и Ю. Либих (1870) выделили инвертазу из
дрожжей, П. Мигел (1893) — уреазу из бактерий.
Однако выделить фермент брожения «алькогола-
зу» из живых клеток дрожжей (как и кислород-
выделяющую систему из листьев растений) не
удавалось. Открытие бесклеточного броже-
ния—это пример случайного везения в науке.
В 1897 г. Э. Бухнер, приготовив в своей лабора-
тории в Тюбингене экстракт дрожжей для им-
мунологических исследований, добавил к нему
сахар лишь для того, чтобы сохранить от порчи до
утра, и через 20 мин в экстракте началось образо-
вание пены. Это была первая демонстрация слож-
ного биохимического процесса, протекающего без
участия целых клеток. Позднее Бухнер наблю-
дал также стимулирующее влияние ортофосфата
на выделение СО2 дрожжами (1903). А. Гарден
и В. Янг в Кембридже исследовали процесс
брожения в бесклеточном экстракте более деталь-
но и обнаружили образование в нем фруктозо-1,6-
бисфосфата (1906). Бухнер и В. Энтони (1905) а
также Гарден и Янг (1906) открыли действие ко-
ферментов. В 1918 г. Отто Мейергоф (1884-1951)
обнаружил взаимозаменяемость коферментов в
брожении, вызываемом бесклеточным экстрактом
дрожжей, и в процессе гликолиза в гомогенизиро-
ванной мышечной ткани.
Дальнейший импульс (1911-1912) к изучению
процессов брожения дали работы К. Нейберга
(1877-1956) в Берлине и С. П. Костычева (1887-
1931) с коллегами в Москве (1912-1913),
которые исследовали кинетику окислительно-
восстановительных реакций. Участие водорода,
входящего в состав субстрата, во многих фер-
ментативных реакциях было открыто благода-
ря применению метиленовой сини в качестве
акцептора водорода. Восстановление метилено-
вой сини биологическими тканями обнаружил
Пауль Эрлих (1854-1915) в 1885 г. В 1912 г. Ген-
рих Виланд (1877-1957) выдвинул теорию биоло-
гического окисления, в которой основную роль
в дыхании приписал водороду. В противополож-
ность этому Отто Варбург (1883-1970) основную
роль в нем отводил кислороду, связывая дыхание
с каталитическим действием железа, входящего в
состав гема (1928). Гсмсодержащие пигменты бы-
ли описаны еще в 1886 г. К. Макмюнпом; в 1925 г.
28 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
Д. Кейлин предложил для них название цито-
хромы. Поскольку Варбург работал с бактерия-
ми Acetobacter pasteurianum и Azotobacter (1932),
в дальнейшем функции цитохромов изучали в
основном на аэробных бактериях.
За открытиями, сделанными Бухнером и Гар-
деном, не последовало быстрого развития ра-
бот па бесклеточных экстрактах. Однако мно-
гие важные факты выявили Т. Тунбсрг (1916) и
позднее Гарден и Дж. Куастел из Кембриджской
школы (1924-1928), которые использовали для
изучения бактериальных дегидрогеназ покоящи-
еся клетки (т. е. суспензии отмытых от среды
клеток). В 1920-х гг. были получены чистые
культуры большинства бактсрий-бродильщиков.
Орла-Йенсен (1919) изучил большое число молоч-
нокислых бактерий и провел разделение между
гомо- и гетсрофермсптативным типами осуществ-
ляемого ими брожения. Гарден определил про-
дукты сбраживания глюкозы клетками Е. coli и
обнаружил (1906) отличия от него процессов бро-
жения, осуществляемых Aerobacter (нынешнее на-
звание — Klebsiella) и Serratia. В опытах с ба-
циллами и псевдомонадами в числе продуктов
брожения был обнаружен ацетоин. Масляно-
кислое брожение, открытое в 1861 г. Пастером,
изучали на культурах Granulobacter (Clostri-
dium) butyricum (Бейеринк, 1894) и Clostridium
pasteurianum (Виноградский, 1895).
Биохимическое единство жизни □ Об-
щая теория микробного метаболизма еще не бы-
ла создала, когда Альберт Клюйвер (1884-1957).
преемник М. Бейеринка в Дельфтской лаборато-
рии, попытался в 1925 г. внести порядок в ха-
ос известных феноменов. Клюйвер и X. Допкер
разделили известные бактерии, сбраживающие
сахара, па ряд групп, таких как спиртовые дрож-
п, настоящие молочнокислые бактерии, настоя-
щие пропионовокислые бактерии, бактерии груп-
пы Е. coli, маслянокислые и ацетоно-бутиловые
бактерии. Они определили, что общая особен-
ность процессов диссимиляции у всех бродиль-
щиков состоит в переносе водорода между мо-
лекулами интермедиатов или внутри одной мо-
лекулы, и одновременно установили, что основ-
ные реакции метаболизма являются общими для
различных организмов: «От слона до масляно-
кислых бактерий — все одинаково». В подробной
публикации «Единство в биохимии» (1926) Клюй-
вер и Допкер развили концепцию окислительно-
восстановительных процессов, протекающих по
энергетическому градиенту. Представления о био-
химическом единстве жизни сразу получили все-
общее признание.
Изучение бактериального метаболизма послу-
жило основой для теоретических разработок, объ-
ясняющих различия между катаболизмом и ана-
болизмом, роль промежуточного метаболизма,
сущность процессов репликации и транскрипции
ДНК, трансляции мРНК, функций мембраны и
множества других клеточных механизмов. Вви-
ду ограниченности объема главы мы рассмотрим
лишь некоторые примеры.
Гетеротрофная фиксация СОг была от-
крыта в 1935 г. Харлапдом Вудом (1907-1991)
при изучении им пропионовокислого брожения
в лаборатории К. Беркмана в Эймсе (шт. Ай-
ова, США). Изучая сбраживание глицерола
Propionibacterium arabinosum, Вуд обнаружил,
что СО2 служит субстратом многих реакций про-
межуточного метаболизма (например, карбокси-
лирования пирувата), т. е. является в микробном
метаболизме не только продуктом дыхания или
углеродным субстратом для автотрофов.
Механизм автотрофной фиксации СО2
был раскрыт в 1954 г. благодаря применению в ка-
честве метки радионуклида 14С (впервые исполь-
зованного для изучения фотосинтеза С. Рубеном
и М. Каменом, 1940), а также использованию ме-
тода распределительной хроматографии на бу-
маге (А. Мартин и Р. Синге, 1944). Изучение
фотосинтеза у автотрофных бактерий началось
после выяснения Мелвином Кальвином (1911—
1997), А. Бенсоном и Дж. Бассамом пути фикса-
ции COq у Chlorella и Scenedesmus (1954).
Факторы роста и витамины были впервые
обнаружены у молочнокислых бактерий. После
того как Орла-Йенсен (1936) установил зависи-
мость роста молочнокислых бактерий от нали-
чия в среде рибофлавина, американский исследо-
ватель Э. Снелл (1936-1951) в своих работах вы-
явил их потребность в пантотеновой, никотиновой
и фолиевой кислотах, производных пиридоксаля,
а также в биотине и открыл способность авиди-
на связывать биотин. Эти открытия внесли также
существенный вклад в общую биохимию.
Антибиотики и антиметаболиты □ Изу-
чение антибиотиков послужило основой многих
достижений в молекулярной биологии. Антибио-
тическая активность была описана еще в 19 в. На-
чало изучению антибиотиков положили открытие
пенициллина Флемингом в 1929 г. и последующие
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 29
фундаментальные исследования Говарда Флори
(1898-1968) и Эрнста Чейна (1906-1979), прове-
денные в конце 1940-х гг. Выяснение механизмов
действия антибиотиков на клетки-мишени име-
ло важное значение для развития молекулярной
биологии, особенно для изучения репликации и
транскрипции ДНК, трансляции мРНК и функ-
ций мембран.
Обнаружение эффектов конкуренции в ре-
акциях с участием метаболитов и их структур-
ных аналогов позволило разработать новые ме-
тодические подходы, в том числе для синтеза
новых препаратов с высокоселективным действи-
ем, например лекарственных препаратов и герби-
цидов. В работах 1910-1914 гг. Л. Михаэлис опи-
сал эффекты конкуренции между субстратами ре-
акций, катализируемых углевод-расщспляющими
ферментами, и их продуктами, выступающи-
ми в роли ингибиторов. В 1927 г. Куастел и
В. Вулдридж опубликовали данные о конкурент-
ном ингибировании сукцинатдегидрогеназпой
реакции малоновой кислотой, структурным
аналогом субстрата. Значительное открытие
был сделано Г. Домагком (1885-1964) при изуче-
нии в эксперименте пневмококковых инфекций;
он обнаружил явный терапевтический эффект
пронтозила — содержащего серу красителя крас-
ного цвета — in vivo и in vitro (1935). В том же году
Дж. Трсфел объяснил этот эффект активностью
сульфаниламидной части молекулы. Механизм
действия сульфаниловой кислоты как структур-
ного аналога и антиметаболита 4-аминобензойной
кислоты был изучен английским исследователем
Д. Вудсом (1940).
1.11. Изучение внутриклеточных включений и клеточных стенок
прояснило организацию бактериальной клетки
Сведения о внутреннем строении бактериальных
клеток начали появляться в конце 19 в. До этого
имелась лишь публикация К. Эренберга (1838) с
весьма четким описанием строения Monas okenii.
Внутриклеточные включения и их химическую
природу первыми стали изучать ботаники и хи-
мики.
Полисахариды крахмал и гликоген описа-
ли у спорообразующих бактерий Ф. ван Ти-
гем (1877) и Бейеринк (1893), «жировые тель-
ца»—ботаник А. Мейер (1899, 1912) (затем они
были идентифицированы как включения поли-
/3-оксимасляной кислоты французским хи-
миком М. Лемуаном; 1926). Метахроматиче-
ские гранулы (описанные А. Гиллермоном;
1903), или гранулы волютина (описанные
А. Мейером; 1912), идентифицировал как неор-
ганические полифосфаты Дж. Виам (1947). Ром-
бовидные, спороподобные включения обна-
ружил Э. Берлинер (1911) у бактерии Bacillus
thuringiensis, выделенной из погибшей личин-
ки Ephestia kuehniella-, в 1951 г. англичанин
Э. Стейнхаус (1951) предложил использовать этот
токсичный белок для разработки биологиче-
ских способов борьбы с насекомыми-вредителями.
Газовые вакуоли впервые увидел Ф. Кон и
описал С. Н. Виноградский (1888) у Lamprocystis
roseopersicina. Газ в них обнаружил в экспери-
менте, известном под названием «молоток, проб-
ка и бутылка», X. Клебан (1895). Поиски ана-
лога ядра у бактерий, начатые после работ
Фёльгена (1924), привели к открытию того, что
ядра растительных и животных клеток могут
быть окрашены щелочным фуксином [экспери-
менты А. Риппеля (1932), Ч. Робиноу (1942, 1953)
и других]. В опытах по ферментативному гидро-
лизу окрашенного ядерного материала (с исполь-
зованием РНКазы и ДНКазы) было установлено,
что ядро состоит из ДНК (Peters, Weigand, 1953).
Многие вопросы, возникавшие у цитологов, разре-
шились благодаря электронно-микроскопическим
исследованиям (Maalpe, Birch-Andersen, 1956), ге-
нетическим исследованиям (Ledcrberg, 1947) и
применению радиоавтографии (Cairns, 1963).
Изучение клеточных стенок бактерий
стало быстро развиваться после разработки
М. Салтоном и Р. Хорном методов выделения их
основных компонентов. Оказалось, что клеточ-
ную стенку бактерий можно разрушить с помо-
щью лизоцима (Salton, 1952) и в результате та-
кой обработки из клеток выходят нуклеотиды
(Parck, 1952). Эти данные навели на мысль о том,
30 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
что клеточная стенка представляет собой моле-
кулу муреина мешкообразной структуры (Weidel,
1964). Исследования липополисахаридов эн-
теробактерий, обладающих антигенными свой-
ствами и действующих в качестве эндотоксинов,
начались одновременно с серодиагностикой штам-
мов сальмонелл (White, 1931; Kauffmann, 1937) и
позволили получить химическую характеристику
О-специфических гетерополисахаридов (Westfahle,
Luderitz, 1952).
О подвижности бактерий сообщал' еще Ле-
венгук в 1683 г. Жгутики впервые описал
Ф. Кон в 1872 г.; впоследствии Р. Кох (1877) и
Ф. Лёфлер (1889) разработали способы их окрас-
ки. О вращении жгутиков сообщали Дж. Будер
(1915) и П. Метцнер (1920); первые электронно-
микроскопические фотографии жгутиков полу-
чили Г. Пикарски и Э. Руска (1939). Дальней-
шие исследования структуры жгутиков прово-
дили В. ван Итерсон, К. Вейбулл, А. Пайпер,
Э. Лейфсон и А. Хоувипк. Основную концеп-
цию таксической реакции сформулировали
Т. Энгельманн и В. Пфеффер. Аэротаксис и
фотофоботаксис открыл Энгельманн в 1881 и в
1882 гг. соответственно. Хемотаксис как привле-
чение или отталкивание в ответ на присутствие
различных растворенных химических веществ
изучал на сперматозоидах папоротника и мхов,
бактериях и жгутиковых Пфеффер (1865, 1888).
Он разработал методы с использованием стеклян-
ных капилляров и полужидкого агара и уже то-
гда рассматривал вопросы о механизме действия
стимула, его пороговой концентрации, передаче
сигнала, сенсорной адаптации и важной роли кле-
точной мембраны, т. е. подошел к современному
теоретическому уровню. Пфеффер высказал
предположение, что основные молекулярные ме-
ханизмы восприятия и передачи сигналов оди-
наковы у бактерий, грибов, водорослей, высших
растений и даже животных (1904). Предложив
экспериментально обоснованные представления
о составе плазматической мембраны, транспор-
те субстратов, сенсорном процессе, регуляции
ферментов и энергетическом метаболизме, Пфеф-
фер далеко опередил свое время. Плодотворные
концепции Пфеффера распространялись благо-
даря многочисленным ученикам, коллегам, ра-
ботавшим в его лаборатории, и написанным им
учебникам (1897, 1904); многие из идей Пфеф-
фера сохраняют свою ценность и в настоящее
время.
Таким образом, еще ранее середины 20 в. было
установлено, что клетки прокариот содержат уни-
кальные структурные макромолекулы и сложные
функциональные белковые комплексы, обладают
разнообразными свойствами и сложным строени-
ем, т. е. представляют собой полностью самостоя-
тельные живые организмы. Изучение их свойств
способствовало развитию молекулярной генетики
и современной клеточной биологии.
1.12. Адаптация бактерий была хорошо известна до открытия
молекулярных механизмов регуляции
Изучение регуляции микробного метабол иза ста-
ло возможным после введения в практику иссле-
дований метода чистых культур. Некоторые пред-
ставления о «саморегуляции» метаболизма мог-
ли быть заимствованы из физиологии растений.
Феномен субстратной специфичности открыл еще
Пастер в 1857 г., установив, что Penicillium
glaucum использует лишь правовращающий изо-
мер винной кислоты, но не левовращающий,
когда клетки выращиваются на их рацемат-
ной смеси (пара-винная кислота). Постепенно
накапливались данные о регуляции микробно-
го метаболизма. Например, выяснилось, что вы-
деление деполимераз, таких как амилаза, при
росте микробов на среде с крахмалом за-
держивается в присутствии соответствующего
мономера (т. е. глюкозы). В своем труде по
физиологии растений (1904 г.) Пфеффер поста-
вил кардинальный вопрос: «Что делает расте-
ние, когда два или большее число источни-
ков углерода, азота или других элементов при-
сутствуют и доступны одновременно?», подойдя
тем самым к открытию катаболитной реп-
рессии.
Поведение микробных культур при переносе
их в среду с новым субстратом называли адапта-
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 31
цией к новым условиям. Неопределенность терми-
на адаптация в течение долгого времени вызы-
вала споры и сомнения. Адаптацию как переход-
ное изменение ферментативной активности (то-
гда это относили к физиологической адаптации)
в ответ на смену питательных веществ изучал
финский ученый X. Карстрем (1930). Работая с
Bacttrium aerogenes, он установил, что использо-
вание ксилозы является адаптивным свойством,
тогда как потребление глюкозы — конститутив-
ным. Карстрем выявил ту закономерность, что
ферменты для расщепления распространенных
субстратов, таких как глюкоза, фруктоза, лактат,
пируват или сукцинат, синтезируются конститу-
тивно, тогда как ферменты для использования
редких сахаров или органических кислот относят-
ся к индуцибельным. Изучению ферментативной
адаптации способствовали эксперименты с покоя-
щимися клетками (Quastal, 1925), позволившие в
дальнейшем определить зависимость адаптацион-
ных процессов от источника азота, температуры
и ингибиторов роста (Stephenson, Yudkin, 1936).
Многие из этих экспериментов были возобновле-
ны в 1950-х гг. с развитием молекулярной био-
логии.
Начало важнейшим исследованиям по выяс-
нению регуляторных механизмов положили
простые эксперименты по выращиванию микро-
бов, в том числе Escherichia coli и Bacillus subtilis,
осуществленные Жаком Моно (1910-1976). Рост
культур он определял по их оптической плот-
ности. Описывая двухстадийный рост культуры
при последовательном использовании двух суб-
стратов, Моно ввел термин диауксия (1942).
Он подтвердил выводы Карстрема, Г. Эппса и
Э. Гейла. В 1952 г. Моно и М. Кон предложили
термины «индукция ферментов», «индуцируемые
ферменты», «внутренний индуктор» и «внешний
индуктор». Тогда же Г. Коен-Базир и Г. Жоли
были впервые выделены мутанты с конститутив-
ным синтезом ферментов использования лакто-
зы (1952). Благодаря получению этих мутантов
стало возможным изучение регуляции па гене-
тическом уровне. Появилась первая модель ин-
дукции катаболических ферментов (например,
/2-галактозидазы) и репрессии анаболических
ферментов у Escherichia coli (1952). Франсуа Жа-
коб с коллегами в 1960 г. предложил концепцию
«оперона», причем в основе этой теории лежали
данные, полученные в опытах с умеренным бак-
териофагом лямбда.
Регуляция метаболизма на уровне актив-
ности ферментов была открыта в 1956 г. Нали-
чие у Е. coli ферментов, не активных в присут-
ствии конечного продукта метаболической цепи,
выяснилось в экспериментах с конкуренцией изо-
топов (Roberts et al., 1954, 1955). Эти и другие
эксперименты (Brock, 1954) позволили выявить
влияние конечного продукта пути на активность
его ферментов. Механизм ингибирования по
принципу обратной связи установили Р. Йейтс
и А. Парди (1956) при изучении биосинтеза произ-
водных пиримидина, а также Г. Умбаргер (1956),
изучавший биосинтез изолейцина. Молекулярные
исследования позволили обнаружить аллостери-
ческие ферменты и разработать теорию их ре-
гуляции, сформулированную Моно, Ж. Биманом
и Ж. Шанже в 1965 г.
1.13. Изучение типов бактериального метаболизма выявило
их функциональную роль в биосфере
Еще в 1671 г. А. Кирхер сообщал об огромном
количестве очень мелких живых существ в поч-
ве, воде и гниющем материале. Много позже
возник вопрос о роли микроорганизмов в этих
экосистемах. В то время даже знаменитый фи-
зиолог растений Буссенго признавал лишь взаи-
мозависимость животных и растений, без учета
третьей стороны круговорота веществ — минера-
лизации, или деструкции. Внимание к вопросу
о роли «бесконечно малых» существ в круговоро-
те веществ привлекли впервые Пастер и другие
ученые того времени, в том числе Кон, де Бари и
Брефельд. Открытие бактерий с новыми, эко-
логически важными типами метаболизма стало
возможным благодаря сельскохозяйственным ис-
следованиям; например, существование бак-
терий-азотфиксаторов, нитрификаторов и
денитрификаторов было теоретически пред-
32 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
сказано на основе количественных измерений со-
держания азота в пахотных почвах, как уже упо-
миналось в разд. 1.7.
Термин экология ввел немецкий биолог
Эрнст Геккель (1834-1919). Первоначально сфор-
мулированное как «наука о всесторонних отноше-
ниях организма с окружающей средой... » (1866),
его определение остается почти без изменений
(Hungate, 1962). Для использования в микроб-
ной экологии термины экосистема, природная сре-
да, экологическая ниша, сообщество, биоценоз,
пищевая цепь, пищевая сеть и микроокружение
были модифицированы (Brock, 1966; Alexander,
1971). Кроме того, были уточнены некоторые тер-
мины для описания межвидовых взаимосвязей,
таких как мутуалистические или антагонистиче-
ские симбиозы (de Вагу, 1878), ризосфера (Hiltner,
1904) и микориза (Frank, 1885), а также добав-
лены новые понятия — автохтонные и аллохтон-
ные бактерии (С. Н. Виноградский, 1925), синтро-
физм и межвидовой перенос водорода (Wolin,
1975). Эти термины отражают основные положе-
ния микробной экологии.
В то время почвенные бактерии изучали в
основном после выделения в чистой культуре,
чтобы установить их основной метаболизм и
метаболические возможности, однако Виноград-
ский и некоторые его ученики разрабатывали
методы изучения бактерий in situ, в их при-
родных местообитаниях. После своего возвраще-
ния из Германии в С.-Петербург Виноградский
продолжил микроскопические исследования раз-
личных типов почв. Вкладом русских ученых
в микробную экологию стали также разработка
Н. Г. Холодным (1882-1953) метода «стекол об-
растания» и Б. В. Перфильевым (1891-1969) мето-
да капилляров с плоскопараллельными стенками.
В своем труде «Микробиология почвы. Проблемы
и методы» (1949) С. Н. Виноградский особо отме-
тил, что выводы, сделанные по лабораторным экс-
периментам, нельзя однозначно переносить на по-
ведение тех же бактерий в их природных средах,
так как лабораторные штаммы могут быть лишь
«артефактами», т. е. штаммами, приспособленны-
ми к определенным питательным средам, темпе-
ратуре, аэрации и перемешиванию. Соответствен-
но этому он предостерегал против использования
музейных штаммов как типовых для данного при-
родного вида. Теории Виноградского в области
почвеной микробиологии, в том числе об автох-
тонных и аллохтонных популяциях, остаются ос-
новой и для современных исследований.
1.14. Цели и методы классификации бактерий меняются
Мельчайшие организмы, обнаруженные Левен-
гуком, теперь описали бы как палочки, кок-
ки, вибрионы и спириллы. В системе Линнея
эти организмы были сгруппированы как species
dubiosa среди червей. К. Эренберг (1838) оста-
вил за ними обозначения Monas и Vibrio, дан-
ные О. Мюллером (1789) и добавил названия
Bacterium, Spirillum и Spirochaeta-, впоследствии
М. Перти (1852) ввел новые названия. Позд-
нее Ф. Кон пришел к заключению, что бакте-
рии являются особой группой мелких организ-
мов. Он нашел сходство между цианобактери-
ями (schizophyceae, «делящиеся водоросли») и
бактериями (schizomycetes, «делящиеся грибы») и
объединил их под названием schizophytae («де-
лящиеся растения»). Таким образом, он впервые
предложил считать бактерии отдельной группой
организмов.
В 1909 г. С. Орла-Йенсен опубликовал в Ко-
пенгагене работу «Естественная система бакте-
рий». Литоавтотрофные бактерии были отнесены
в ней к наиболее примитивным организмам и по-
мещены в начало системы. Хотя эта система не
составляла настоящего филогенетического древа,
она имела важное значение как стимул для даль-
нейших исследований. На основе морфологиче-
ских признаков естественную систему классифи-
кации создавали также А. Клюйвер, К. Ван Ниль
и Р. Стейниер (1936, 1941).
Нумерическая таксономия, впервые предло-
женная в 1957 г., означала новый подход к клас-
сификации (Sheath, 1963, 1973). Он состоит в том,
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 33
что большое число признаков подвергают ком-
пьютерному анализу с целью получения матриц
подобия и дендрограмм, похожих на генеалогиче-
ские деревья, но не имеющих отношения к генеа-
логии.
На основании дифференцирующих призна-
ков, известных к 1961 г., Стсйниер и Ван Ниль
разработали «концепцию бактерий». В ней бы-
ли введены термины прокариоты и эукарио-
ты (предложенные еще в 1937 г. Э. Чаттоном),
поскольку замечательные работы А. Райтера и
Э. Келленбергера (1958), а также Э. Вольмана и
Ф. Жакоба (1959), сделали очевидными основные
различия в организации генетического материала
между бактериями и другими организмами. Эта
новая концепция нашла всеобщее признание.
Совершенно иной подход к созданию есте-
ственной системы бактерий был предложен
Карлом Вёзе. Когда появились успехи в рас-
шифровке аминокислотных последовательностей
белков и нуклеотидных последовательностей нук-
леиновых кислот, Вёзе предложил новую осно-
ву для построения филогенетического древа
бактерий (1977). По результатам анализа
нуклеотидных последовательностей все живые
организмы были разделены на архебактерии
(теперь — домен Archaea, археи), эубактерии
(теперь — домен Bacteria, бактерии) и эукари-
оты (домен Eukarya). Полученное таким спосо-
бом древо бактерий частично подтверждает давно
известные взаимосвязи и, что более важно, выяв-
ляет новые. Ни одну из предложенных классифи-
каций нельзя считать совершенно удовлетвори-
тельной, поскольку они основаны на небольшом
количестве свойств (например, последовательно-
стях 16S-pPHK) и не учитывают значение гори-
зонтального переноса генов у прокариот, в соот-
ветствии с которым требуется новое определение
категории вида (с учетом «коллективного пула
генов»).
1.15. Вирусы бактерий (бактериофаги) были обнаружены
как «литические агенты»
Бактериология началась с визуализации объек-
тов— бактерий. В противоположность этому, ви-
русы, уже будучи объектом изучения, оставались
невидимыми до конца 30-х гг. 20 в., когда в элек-
тронном микроскопе исследователи увидели ви-
рус табачной мозаики и бактериофаги. Началь-
ные представления о вирусах разработали
Ф. Лефлер, П. Фрош и М. Бейеринк; на современ-
ном уровне исследования бактериофагов были на-
чаты Максом Дельбрюком (1906-1981).
Первые работы по изучению вирусов бак-
терий описывали «стекловидное преобразова-
ние» колоний микрококков (Wort, 1915) и «неви-
димый микробный антагонист дизентерийных
бацилл» (d’Herelle, 1917). Д’Эрелль продолжал
далее изучение вирусов (1919-1926). Исследуя
пустые пятна (бляшки) в местах размножения
вирусов на газонах бактерий, он пришел к вы-
воду, что бактериофаги («пожиратели» бакте-
рий) представляют собой частицы, специфичные
для каждого вида бактерий. Дальнейшие успе-
хи (1929-1936) были достигнуты Ф. Бернетом
(1899-1985), который описал фазы прикрепления,
размножения и высвобождения фагов из клеток
(лизис). Макс Шлёзингер впервые определил фи-
зические параметры фагов; при помощи темно-
польной микроскопии он наблюдал разрыв бак-
териальных клеток и выход фагов (1932-1934).
Лизогения была открыта одновременно
Ж. Борде, М. Сьюка и Э. Гильдемейстером в
1921 г. Ключевой вопрос состоял в том, служит
ли каждая клетка лизогенного штамма бактерий
носителем генетической информации для образо-
вания фагов, и ответ на него дал Бернет, работав-
ший с лизогенным штаммом Salmonella (1929).
Изучая лизогенный штамм Bacillus megaterium
(1931), Доорен де Йонг пришел к заключению,
что фаг находится в лизогенной бактерии в ла-
тентном состоянии (состоянии профага). Экс-
перименты де Йонга были продолжены Эженом
Вольманом и Элизабет Вольман (1936) и после
1945 г. —Андре Львовым (1902-1994) и его после-
дователями, среди которых были Моно и Жакоб.
В 1950 г. модельной бактерией для изучения ли-
зогении стала Е. coli. Вскоре Эстер Ледерберг
открыла (1951), что штамм Е. coli К-12, кото-
34 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
рый использовали для первых экспериментов по
конъюгации (1946) Джошуа Ледерберг и Эдуард
Татум (1909-1975), является лизогенным и несет
умеренный фаг, получивший название «лямбда»
(Л). Большинство лабораторных штаммов Е. coli
К-12 в настоящее время являются нелизогенными
(«излеченными») производными оригинального
штамма. Однако такие варианты К-12 остаются
подверженными лизису под действием фага Л.
Подобный штамм служил объектом при изучении
зиготной индукции, интеграции фага Л в хромосо-
му хозяина, литического и лизогенного циклов его
развития, а также эписом, проведенном Франсуа
Жакобом и Эли Вольманом. Благодаря изучению
лизогении было открыто существование репрес-
соров/операторов и оперонов у бактерий, а также
онкогенных вирусов.
Использование Е. coli К-12 с ее фагами А и Р1
послужило основой успеха в изучении феномена
контролируемых клеткой-хозяином модификации
и рестрикции бактериофагов, описанных ранее
JI. Бертани и Ю. Вайгле (1953). Вернер Арбер с
сотрудниками в своих исследованиях (1959-1968)
открыли сайт-специфическое пострепликативное
метилирование (модификацию) фаговой ДНК в
клетке-хозяине и функцию эндодезоксинуклеазы,
участвующей в рестрикции ДНК. Возможность
использования специфически разрезающих (рест-
рицирующих) ДНК эндонуклеаз для создания но-
вого метода молекулярной генетики была выска-
зана Арбером в 1969 г.
Новые внехромосомные элементы ДНК —
плазмиды — были открыты при изучении рас-
пространения устойчивости к антибиотикам сре-
ди различных бактерий. В Японии штаммы
Shigella flexneri, устойчивые к нескольким ан-
тибиотикам, были известны с 1952 г. В 1961 г.
Т. Ватанабе (1923-1972) и Т. Фукасава сообщи-
ли о присутствии в них плазмид, несущих фак-
торы устойчивости и факторы переноса. Термин
плазмида был введен Дж. Ледербергом еще в
1952 г., и особым классом плазмид были призна-
ны фаги. Обнаружить плазмиды удалось по нали-
чию при центрифугировании плазмидных полос
(«сателлитной ДНК»), а также с помощью элек-
трофореза в агарозном геле. Впоследствии были
выявлены различные плазмиды, обеспечивающие
метаболические и вирулентные свойства, а так-
же устойчивость к антибиотикам. Это показало,
что внехромосомные элементы ДНК выполняют у
микробов важнейшую роль. Вскоре помимо плаз-
мид стали известны мобильные элементы ДНК —
инсерционные последовательности (IS) и транс-
позоны, первоначально обнаруженные Барбарой
Макклинток (1902-1992) как «мобильные генети-
ческие элементы» у кукурузы (1937-1942).
1.16. Изучение генетического аппарата бактерий стало основой развития
молекулярной биологии, включая генные технологии
Существование пола у растений было известно с
конца 17 в.; в конце 19 в. исследователи наблю-
дали разделение хромосом в ядрах клеток рас-
тений и животных. Однако открытые Грегором
Менделем (1822-1884) законы наследственности и
его теория «маркера наследственности» слишком
опередили время и оставались незамеченными в
течение 35 лет, пока не были переоткрыты и зано-
во сформулированы в 1900 г. X. Де Фризом (1848-
1935), К. Корренсом (1864-1933) и Э. фон Черма-
ком (1871-1962). Спустя несколько недель после
лекции Де Фриза в Амстердаме (1900), в которой
он ввел понятия мутация и мутант, Бейеринк
выступил с докладом «Различные формы наслед-
ственности у микробов», отметив, что некоторые
варианты бактерий также можно назвать мутан-
тами. В этом докладе прозвучало, что микробы
представляют собой полезные объекты для изуче-
ния не только законов наследственности и измен-
чивости, но также принципов межвидовой конку-
ренции. В 1912 г. Бейеринк, полностью призна-
вая теорию Де Фриза («Теория мутаций», 1901,
1903), дал следующую трактовку введенному в
1909 г. датским биологом Вильгельмом Иогансе-
ном (1857-1927) понятию ген: «Гены, или едини-
цы наследственности, — это переносчики видимых
признаков, очевидно представляющие собой часть
протоплазмы или клеточного ядра». Идеи Бейе-
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 35
ринка относительно мутаций, обратных мутаций
(реверсий) и адаптации были основаны на его ра-
ботах с дрожжами и Serratic marcescens.
Хотя природа гена как функциональной ге-
нетической единицы («цистрона») и мутаций все
более прояснялась и в исследованиях на выс-
ших организмах, некоторые генетики рассматри-
вали мутации как направленные процессы. Оши-
бочность такого представления показали в сво-
их экспериментах Сальвадор Лурия (1912-1991)
и М. Дельбрюк, разработав «флуктуационный
тест» (1943) и установив наличие спонтанных
ненаправленных мутаций у бактерий. Их данные
были подтверждены «экспериментом по распре-
делению» X. Ньюкомба (1949) и экспериментами,
проведенными методом непрямого отбора (1952)
с применением метода отпечатков, или реплик,
Дж. Ледербергом и Э. Ледерберг.
Ранние попытки выявления пола у бакте-
рий описаны лишь в немногих работах. Копу-
ляционные пары клеток у гигантской пурпур-
ной бактерии Chromatium okenii и Rhodospirillum
наблюдали Ф. Фёрстер (1892) и X. Поттхоф
(1922). В 1925 г. были проведены эксперимен-
ты по скрещиванию двух ауксотрофных му-
тантов Escherichia coli, опубликованные позднее
(Schermon, Wing, 1937). Плодотворные экспери-
менты по совместному культивированию ауксо-
трофных мутантов Neurospora crassa (1941) и
открытие трансформации у Pneumococcus (см. ни-
же) побудило Ледерберга исследовать генетиче-
ские структуры бактерий с помощью скрещива-
ния мутантных штаммов Е. coli. Конъюгация (по-
ловая рекомбинация) была впервые описана в
1946 г. в работе Татума (1909-1975) и Ледерберга,
проведенной с использованием в качестве партне-
ров двух стабильных двойных ауксотрофных му-
тантов.
Открытие феномена трансформации с пе-
реносом «голой» ДНК было сделано в эпиде-
миологических исследованиях на Pneumococcus
(Streptococcus) pneumoniae. В 1928 г. Ф. Гриффит
обнаружил, что можно трансформировать
шероховатый (бескапсульный) R-вариант в глад-
кие (покрытые капсулой) S-клетки путем пас-
сирования R-клеток in vivo, если вводить их
мышам вместе с убитыми нагреванием клетка-
ми S-типа. Эксперименты in vitro, проведенные
О. Эвери, С. Маклеодом и М. Маккарти (1944),
доказали, что трансформирующим агентом при
таких наследуемых изменениях служит ДНК. От-
крытие ДНК в качестве носителя генетической
информации, означавшее революцию в биологии,
дало новый стимул исследованиям, и в 1950 г.
Дж. Ледерберг и Э. Чаргафф, проведя тонкие
количественные эксперименты, установили, что
представители различных таксономических групп
различаются по содержанию в ДНК гуанина и
цитозина (G 4- С) и существует общее прави-
ло: А = Т; G = С; А + G = С + Т. Начиная
с 1946 г. открытия следовали одно за другим, и
важнейшим среди них было установление моле-
кулярной структуры ДНК Джеймсом Уотсоном
и Френсисом Криком (1953). Кольцевую структу-
ру бактериальной хромосомы и ее способность к
репликации удалось выявить благодаря исследо-
ванию механизма конъюгации, роли F-плазмиды
и особенностей Hfr-штаммов, способных скрещи-
ваться с высокой частотой (Hayes, 1953). Меха-
низм переноса ДНК в результате непосредствен-
ного контакта клеток при конъюгации изучали
Э. Вольман и Ф. Жакоб (1955).
1.17. Заключение
Этот обзор этапов развития бактериологии, без-
условно, нельзя считать полным; он отражает
лишь основные направления исследований, сво-
ими истоками связанные с медициной, физио-
логией растений и сельскохозяйственной наукой.
На примере микробиологии как части общече-
ловеческой культуры хорошо виден вклад все
новых поколений в науку и то влияние, кото-
рое оказывает на нее дух века. Историческое
описание вскрывает эти связи, часто незамет-
ные для современников. Поэтому представляет-
ся логичным завершить обзор на этапе начала
60-х гг. 20 в. В последующих главах этой книги
читатель вновь убедится, что многие достиже-
ния современной микробиологии являются логи-
ческим следствием работ и идей исследователей,
развивавших эту науку в течение предыдущих
250 лет.
36 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
Таблица 1.1. Вехи развития микробиологии до начала 60-х годов 20 в. (НП — Нобелевская премия)
Год(-ы) Открытия
1676 А. ван Левенгук впервые наблюдает бактерии под микроскопом
1776 Л. Спалланцани демонстрирует, что микробы можно убить кипячением, и этим опровергает гипотезу об их спонтанном зарождении. По результатам экспериментов были разработаны способы сохранения пищевых продуктов путем кипячения и консервирования (Appert; 1810)
1796 1834-1837 Э. Дженнер впервые вакцинирует человека вирусом коровьей оспы ф. Кютцинг, Ш. Каньяр де Латур и Т. Шванн независимо определяют дрожжи как самостоятельные организмы, размножающиеся почкованием и сбраживающие сахар с образованием спирта и углекислоты
1838 Ж. Б. Буссенго устанавливает, что в почве под клевером увеличивается содержание азота
1838 К. Эренберг описывает микроорганизмы в своей книге «Анималкулы из настоев как самостоятельные организмы», в том числе виды Monas okenii и Ophidomonas jenensis
1853 X. Шрёдер и Т. фон Даг опровергают гипотезу спонтанного зарождения микробов; они же вводят в микробиологическую практику ватные пробки, обеспечивающие доступ воздуха в стерильную среду
1854 А. де Бари открывает фитопатогенные грибы — возбудители ржавчины и головни злаков (начало разви- тия микологии)
1857-1861 Л. Пастер описывает образование этанола дрожжами, а также молочной, масляной и уксусной кислот различными бактериями
1869 О. Брефельд получает культуру патогенного для насекомых гриба Empusa muscae на твердой питатель- ной среде с желатином
1876-1877 Ф. Кон описывает и классифицирует все известные к тому времени бактерии, а также эндоспоры бацилл и опровергает представления о мономорфизме бактерий
1877 Р. Кох (НП 1905) неопровержимо доказывает, что сибирскую язву вызывает Bacillus anthracis
1878 Дж. Листер выделяет Streptococcus lactis в чистой культуре методом предельных разведений
1881 Р. Кох разрабатывает метод получения чистых культур на плотных средах; начало «золотого века» микробиологии
1882 1883-1889 Т. Шлёзинг и А. Мюнц устанавливают, что нитрификация представляет собой биологический процесс Т. Энгельманн изучает фототаксис у пурпурных бактерий и описывает их как фотосинтезирующие ор- ганизмы
1884 К. Грам предлагает метод дифференциальной окраски бактерий
1884 В. Хессе использует агар в качестве отвердителя для микробиологических сред
1884-1888 В. Пфеффер описывает таксис бактерий как сенсорный процесс
1885-1886 Г. Гельригель и X. Вилфарт доказывают, что фиксация азота бобовыми связана с образованием у них корневых клубеньков благодаря заражению почвенными бактериями
1887 Дж. Петри предлагает для применения в исследованиях стеклянную чашку с крышкой, впоследствии названную его именем
1887 С. Н. Виноградский устанавливает, что при окислении сероводорода клетки Beggiatoa получают энергию (литотрофия)
1888 М. Бейеринк выделяет чистые культуры бактерий, образующих клубеньки на корнях бобовых
1891 С. Н. Виноградский доказывает существование процесса автотрофной фиксации углекислоты из воздуха в стехиометрии с окислением аммиака и получает чистые культуры представителей Nitrosomonas и Nitrobacter
1892 Д. И. Ивановский описывает фильтрующийся агент (вирус), вызывающий болезнь табака (табачную мо- заику), после чего М. Бейеринк (1899), рассматривая природу вирусов, предлагает гипотезу «жидкого инфекционного начала»
1895 С. Н. Виноградский впервые выделяет культуру свободноживущей азотфиксирующей бактерии Clostridium pasteurianum-, впоследствии М Бейеринк выделяет Azotobacter chroococcum (1901)
1897 Э. Бухнер (НП 1907) открывает процесс сбраживания сахара бесклеточным экстрактом дрожжей
1904-1906 А. Гарден (НП 1929) и В. Янг изучают влияние фосфата на процесс брожения в бесклеточных экстрактах дрожжей и устанавливают накопление гексозо-1,6-дифосфата; начало экспериментов на бесклеточных системах
Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк 37
Таблица 1.1 (продолжение}
Год(-ы) Открытия
1909-1919 С. Орла-Иенсеи описывает разнообразие молочнокислых бактерий
1911 К. Нейберг начинает исследования спиртового брожения с применением метода «ловушки метаболита», позволившие описать реакции декарбоксилирования пирувата и образования ацетальдегида
1915-1917 Ф. Туорт и Ф. д’Эрелль описывают вирусы бактерий (бактериофаги)
1919 Дж. Будер описывает пурпурные бактерии как анаэробные фотолитоавтотрофные организмы; впослед- ствии К. ван Ниль (1931) формулирует теорию фотосинтеза и выводит его общее уравнение
1920-1943 О. Варбург (НП 1931) открывает функцию клеточных дыхательных ферментов и выделяет NAD, NADP, PAD и апоферменты
1925-1926 А. Клюйвер и Г. Донкер предлагают теорию общности окислительно-восстановительных процессов, про- текающих в клетках эукариот и в микробных клетках при сбраживании субстратов (биохимическое единство жизни) и теорию брожения
1928 Дж. Куастел и В. Вулдридж демонстрируют подавление сукцинатдегидрогеназы малонатом, что стано- вится ключом к объяснению действия структурных аналогов субстратов и антиметаболитов
1929 А. Флеминг (НП 1945) открывает пенициллин (впоследствии С. Ваксман открывает стрептомицин; 1943)
1931-1933 Э. Руска (НП 1986) конструирует первый электронный микроскоп
1933 Ф. Цернике (НП 1953) изобретает фазово-контрастный микроскоп
1935 X. Вуд и К. Веркман при изучении сбраживания глицерола Propionibacterium arabinosum обнаруживают гетеротрофную фиксацию углекислоты
1936 Г. Домагк (НП 1939) открывает антибактериальное действие пронтозила (сульфонамида); его действие как структурного аналога 4-аминобензойной кислоты описывает Д. Вудс в 1941 г.
1936-1950 Э. Спелл демонстрирует потребность молочнокислых бактерий и дрожжей в некоторых факторах роста и витаминах [например, пантотенате, никотиновой кислоте, рибофлавине, биотине (и авидине), фолиевой кислоте и производных пиридоксаля]
1937 X. Кребс (1900-1981; НП 1953) открывает цикл лимонной кислоты
1941 Г. Бидл (1903-1989) и 9. Татум (совместно НП 1958) выделяют ауксотрофные мутанты Neurospora crassa и используют их для изучения метаболизма (концепция «один ген — один фермент»)
1941 Ф. Липман (1899-1986; НН 1953) открывает роль высокоэпергетических фосфатных связей в метаболиз- ме и кофермент А
1944 О. Эвери, К. Маклеод и М. Маккарти открывают процесс трансформации ДНК и демонстрируют пере- нос генетических маркеров у Pneumococcus в результате поглощения ДНК, доказывая таким образом, что ДНК содержит генетическую информацию
1917 Дж. Ледерберг (НП 1958) открывает перенос генетических маркеров при конъюгации у мутантов Escherichia coli
1948 Дж. Ледерберг и Б. Дэвис применяют отбор с помощью пенициллина для выделения ауксотрофных мутантов, открывая возможность быстрого исследования метаболических путей
1953 Дж. Уотсон и Ф. Крик (совместно НП 1962) расшифровывают структуру ДНК как двойной спирали, состоящей из двух комплементарных цепей
1953 А. Херши (НП 1969) и М. Чейз доказывают определяющую роль вирусной ДНК в размножении вирусов
1961 Ж. Моно и Ф. Жакоб (совместно НП 1965) предлагают гипотезу генетической регуляции синтеза фер- ментов (модель оперопа) и совместно с Дж. Шанже (1963) — модель регуляции аллостерических фермен- тов
1961 П. Митчелл (1920-1992; НП 1978) открывает сопряжение транспорта электронов с переносом протонов через мембрану в исследованиях па клетках Micrococcus и разрабатывает хемиосмотическую теорию
1961 М. Ниренберг (НП 1968) и Дж. Маттеи впервые синтезируют полипептиды в бесклеточных системах, используя как матрицу природные или синтетические полирибонуклеотиды; результаты этих экспери- ментов в конечном итоге позволяют расшифровать генетический код
1962 В. Арбер (НП 1978) открывает рестрикцию и модификацию ДНК
1962 Р. Стейниер и К. ван Ниль формулируют различия между прокариотической и эукариотической клет- ками, используя определения, введенные 9. Чаттопом (1937)
38 Глава 1. Бактериология проложила путь клеточной биологии: исторический очерк
Дополнительная литература
Allen Р. W. (1932) The story of microbes. Knoxville:
Bookmill.
Brock T. D. (1988) Robert Koch — A life in medicine and
bacteriology. Madison: Science Tech Publishers.
Bulloch W. (1938) The history of bacteriology. Oxford:
Oxford University Press.
Collard P. (1976) The development of microbiology.
Cambridge: Cambridge University Press.
Dobell C. (1932) Antony van Leeuwenhoek and his «little
animals». London: Constable.
Dubos R. (1950). Louis Pasteur, free lance of science.
Boston: Little, Brown and Co.
Iterson G. van, Den Dooren de Jong L. E., Kluyver A. J.,
eds. (1921-1940) Verzamelde Geschriften van
M. W. Beijerinck, vols. 1-6. Delft: Martinus Nijhoff,
1940.
KainpA.F., LaRiviere J. W. M., Ver hoe ven W. (1959)
Albert Jan Kluyver, his life and work. Amsterdam:
North-Holland Publishing.
LeChevalier H. A., Solotorovsky M. (1965) Three
centuries of microbiology. New York: McGraw-Hill.
Loeffler F. (1887) Vorlesungen uber die geschichtliche
Entwicklung der Lehre von den Bakterien. Leipzig:
Vogel Ver lag.
Mochmann H., Kiihler. W. (1984) Mcilensteine der Bak-
teriologic. Jena: Gustav Fischer Verlag.
Pfeffer W. (1897/1904) Pflanzenphysiologie. Ein Hand-
buch der Lehre vom Stoffwechsel and Kraftwechsel
in der Pflanze, vol. 1 (1897), vol. 2 (1904). Leipzig:
Wilhelm Engelmann Verlag.
Sackmann W. (1985) Biographische und bibliographische
Materialien zur Geschichte der Mikrobiologie. Frank-
furt Bern New York: Verlag Peter Lang.
Stent G.S. (1963) Molecular biology of bacterial viruses.
San Francisco London: Freeman.
Stephenson M. (1950) Bacterial metabolism, 3rd edn.
London: Longman.
Thimann К. V. (1955) The life of bacteria: their growth,
metabolism, and relationships. New York: Macmillan.
Часть I
ПРОКАРИОТИЧЕСКАЯ
КЛЕТКА
Глава 2
Клеточная и субклеточная организация прокариот
Большинство прокариот — это одноклеточные
микроорганизмы. Размеры прокариотических
клеток варьируют в пределах 0,5-20 мкм. В от-
личие от типичных клеток эукариот, содержа-
щих окруженные мембраной дифференцирован-
ные для тех или иных функций органеллы и
структуры, клетки прокариот не имеют отдель-
ных органелл, но в то же время обладают тон-
ко регулируемым и лабильным метаболизмом.
Отдельные активности локализованы внутри
прокариотической клетки в функциональных
компартментах, не обязательно окруженных
мембраной (см. гл. 24). Клетки со специальны-
ми функциями (например, гетероцисты) образу-
ются из вегетативных клеток путем дифференци-
ровки.
2.1. Клетки прокариот содержат структурные элементы,
необходимые для выживания и размножения
Наиболее заметное структурное отличие прока-
риотической клетки от эукариотической, послу-
жившее основанием для термина «про»кариоты —
это отсутствие у прокариот ядерпой мембраны,
т. е. локализация ДНК непосредственно в цито-
плазме. Большинство прокариот имеет однокле-
точное строение, но при этом у них выявляются
различные уровни ультраструктурпой организа-
ции. С помощью электронной микроскопии уста-
новлено, что ДНК образует особую структуру —
нуклеоид и, как правило, все клетки обладают
рибосомами, плазматической мембраной и кле-
точной стенкой. У сложноорганизованных прока-
риот имеются также дополнительные структуры,
такие как наружные слои клеточной стенки, пи-
ли и фимбрии, жгутики, внутри цитоплазматиче-
ские мембраны и внутриклеточные тельца (см.,
например, рис. 2.1; клетка Escherichia coli с при-
датками). Большинство структурных элементов
бактериальной клетки приведено па рис. 2.2 и в
табл. 2.1. Не все из них присутствуют одновремен-
но в клетке или во всех клетках культуры. Многие
их этих элементов имеются как у бактерий, так и
у архей.
Клетки прокариот принято считать нростоор-
ганизованными, и тем не менее перечень мак-
ромолекул, входящих в их состав, весьма об-
ширен (табл. 2.1). Рост микробных клеток на
основе потребления глюкозы и немногих неор-
ганических веществ происходит путем синтеза
вначале молекул-предшественников, затем строи-
тельных блоков для синтеза макромолекул и, на-
конец, самих макромолекул с последующей сбор-
кой структур и органелл. Процессы роста проте-
кают па основе строго регулируемых реакций био-
синтеза, полимеризации и сборки макромолекул
с образованием новых упорядоченных структур
из отдельных компонентов. Все эти структуры нс
статичны, но представляют собой динамические
системы с обновлением или деградацией компо-
нентов, инициацией и затуханием физиологиче-
ской активности. Таким образом, отмечаемое при
лабораторном культивировании физиологическое
состояние клеток и наблюдаемые в электронном
микроскопе клеточные структуры отражают вре-
менное состояние культур и клеток.
Рис. 2.1. Целые клетки Escherichia coli. Препарат кон-
трастирован металлом. На одной из двух клеток вид-
ны два жгутика (F) и пили перитрихиального (1) типа
(фимбрии) (Р). Шкала 0,5 мкм. Фото любезно предо-
ставлено R. Kuepez, М. Mlejnek и S. Nakotte.
Глава 2. Клеточная и субклеточная организация прокариот 41
Рис. 2.2. Схематическое изображение бак-
териальной клетки, отражающее основные
структурные особенности и необязательные
компоненты (продольный срез; масштаб не
соблюден). Клеточная оболочка грамотри-
цательного типа. Изображена только одна
копия каждой из хромосом и плазмид.
ВЦМ — внутрицитоплаз-
матические мембраны
ГВ — газовые вакуоли
ГГ—гранулы гликогена
ГС — глобулы серы
ДСБ — ДНК-связыва-
ющие белки
Ж — жгутики
К — капсула
Кс — карбоксисома
НК — нуклеоид
НМ — наружная
мембрана
Р, F — пили
ПГ — пептидогликан
(муреин)
ПГБ — полигидрокси-
бутират
ПЛ — плазмиды
ПМ — плазматическая
мембрана
ПП — периплазма в
пери плазматическом
пространстве
ПС — полисомы
ПС — поверхностный
слой (S-слой)
ПФ — полифосфаты
(волютин)
Р — рибосомы
РНП — РНК-полимераза
СС — слизистый слой
Ф — фимбрии
Хл — хлоросома
Цп — цитоплазма
Таблица 2.1. Макромолекулярный состав клеточных структур Escherichia coli
Оболочка и придатки
Оболочка Клеточная стенка Капсула Один сложный полисахарид
S-слой Если имеется: > 5000 единиц; 1 субъединица; 4 или 6 субъединиц на единицу
Наружная мембрана > 50 белков: 4 преобладающих; 106 молекул на клетку 5 фосфолипидов; ~5 • 106 молекул на клетку один липополисахарид (ЛПС); ~9 - 106 молекул на клетку
Пептидогликан 1 молекула на клетку
Периплазма ~50 белков; ~104 молекул на клетку
Плазматическая мембрана > 200 белков; ~ 2 105 молекул на клетку
Жгутики Пили, фимбрии > 10 белков; ~2 - 104 молекул на клетку
1 белок; 2 104 молекул на клетку
Цитоплазма Гликоген 3> 1000 белков; > 106 молекул на клетку 60 тРИК; ~2 - 105 молекул на клетку
Количество варьирует
Рибосомы/мРНК Рибосома 20-100 - 103 на клетку в составе > 1000 полисом 55 белков, по одной молекуле каждого на 708-ри- босому; 3 рРНК (5S-, 16S- и 23S-; по одной молекуле каждой на 708-рибосому) > 103 видов мРНК, по одному на полисому
Нуклеоид и плазмиды Хромосома Гаплоидная; одна кольцевая молекула; ~4200 т.п.н.
Плазмида(-ы) Если присутствует, то в количестве от одной до многих копий; кольцевая или линейная; размеры от мелких до крупных (до 1/3 длины хромосомы)
ДНК-связывающие белки Аппарат репликации и транскрипции ДНК
42 Часть I. Прокариотическая клетка
Клетки прокариот имеют микроскопиче-
ски малые размеры. В большинстве они не со-
держат морфологических структур, сравнимых с
органеллами клеток эукариот, но тем не менее
обладают функциональными компартментами,
содержащими все необходимые для выживания
и размножения структурные элементы. В сред-
нем прокариотическая клетка содержит 3500
структурных и регуляторных генов; примерно
50% этой информации кодирует ферменты и
структурные белки, 50% — регуляторные функ-
ции.
2.2. Клетки бактерий можно визуализировать и идентифицировать
различными способами
Малые размеры, а также низкие величины оп-
тической плотности и показателя преломления
большинства прокариотических клеток делают их
почти невидимыми в обычном световом микро-
скопе даже при большом увеличении. Наиболее
давно применяемым и традиционным способом
визуализации микроорганизмов служит окраши-
вание катионными и анионными красителями.
Датский бактериолог Грам в 1884 г. предложил
использовать с этой целью основный краситель
кристаллический фиолетовый (окрашивание по
Граму). Метод окраски по Граму заключает-
ся в том, что разбавленный раствор красите-
ля наносят на фиксированный препарат бакте-
рий, после чего обрабатывают его раствором иода.
Кристаллический фиолетовый образует с иодом
комплекс, умеренно растворимый в этаноле или
ацетоне, но не растворимый в воде, что позволя-
ет дифференцировать бактерии на «грамположи-
тельные» — их клетки удерживают комплекс иода
с красителем и остаются темно-фиолетовыми — и
«грамотрицательные», которые обесцвечивают-
ся этанолом и могут быть затем дополнитель-
но окрашены фуксином. Комплекс красителя с
иодом локализован, по-видимому, па плазмати-
ческой мембране. «Положительная» окраска по
Граму обусловлена тем, что клеточная стенка
данных бактерий препятствует экстракции этого
комплекса, тогда как у грамотрицательных бак-
терий клеточная стенка не обладает таким свой-
ством. Окраска по Граму по-прежнему сохраня-
ет свое значение в качестве важного таксономи-
ческого признака, коррелирующего со многими
другими свойствами бактерий.
Большим достижением в развитии методов ви-
зуализации микробных клеток стало изобретение
Цернике (Zernike) в 1934 г. фазово-контрастно-
го микроскопа и разработка этого вида микро-
скопии Кёллером (Kohler) и Лузом (Loos). При
обычной световой микроскопии контраст дости-
гается в том случае, если различные структурные
элементы по-разному поглощают свет. Такой тип
образца называют абсорбционным, или амплитуд-
ным, объектом, поскольку он меняет амплитуду
падающего света. Другие объекты, в том числе
многие бактерии, относятся к фазовому типу —
они совсем не поглощают свет или все части объ-
екта поглощают его одинаково. В структуре таких
образцов имеются различия по толщине или по-
казателю преломления, и поэтому они изменяют
только фазу волны падающего света, но не ампли-
туду. Человеческий глаз не способен уловить эти
фазовые сдвиги. Метод фазового контраста поз-
воляет сделать объекты видимыми путем превра-
щения фазовых сдвигов в амплитудные (различия
в яркости). Это превращение происходит благо-
даря интерференции, обусловленной свойствами
объекта (рис. 2.3, Л). Другим методом визуализа-
ции микробных клеток служит интерференци-
онная отражательная микроскопия, осно-
ванная на использовании интерференции волн,
отраженных от различных границ раздела фаз,
например стекло—вода и вода—плазмалемма.
Благодаря изменениям коэффициента прелом-
ления возникает псевдотрехмерное изображение,
в котором можно количественно определить тол-
щину объекта.
В настоящее время все большее применение
находит флуоресцентная эпимикроскопия —
микроскопия с использованием специальных при-
ставок для эпиосвещения (освещения через объ-
ектив), устанавливаемых на обычный световой
микроскоп. Этот метод используют для изучения
объектов, которые при облучении светом с длиной
Глава 2. Клеточная и субклеточная организация прокариот 43
Рис. 2.3. Микрофотографии клеток про-
кариот, полученные с помощью методов
световой и электронной микроскопии.
А Клетки Chromatium okenii, заполненные
глобулами серы. Световая микроскопия;
фазовый контраст. Шкала 10 мкм. По [1].
Б. Метаногенная архея Methanospirillum
hungatei (флуоресцентная световая мик-
роскопия) при освещении светом длиной
волны 420 мкм. Шкала 10 мкм. По [2].
В. Две клетки Е. coli в начальной ста-
дии конъюгации, соединенные F-пилями
(световая микроскопия с использовани-
ем меченного флуорохромом бактериофа-
га MS2, специфичного к F-пилям). Шкала
5 мкм. По [3].
Г. Клетки Alcaligenes eutrophus со жгути-
ками (электронная просвечивающая мик-
роскопия). Шкала 1 мкм.
Д, Е. Демонстрация присутствия адге-
зина на поверхности клеток Enterococcus
faecalis после индукции половыми феро-
монами (ультратонкие срезы клеток; элек-
тронная микроскопия).
Д. Обработанные полимером клетки с ба-
хромой из тонких фибрилл на поверхно-
сти. Шкала 0,1 мкм. Фото любезно предо-
ставлено R. Wirth.
Е. Клетки, обработанные антителами к
адгезину в комплексе со вторыми антите-
лами, конъюгированными с коллоидным
золотом. Адгезии виден как нитевидные
структуры между клеточной стенкой и ча-
стицами золота. Шкала 0,1 мкм. Фото
любезно предоставлено R. Wirth.
волны 420 нм (рис. 2.3, Б) флуоресцируют сине-
зеленым светом, благодаря присутствию в их
клетках кофермента F420 (как, например, метано-
гены). Флуоресценция характерна также для фи-
топатогенной бактерии Pseudomonas aeruginosa,
содержащей голубой пигмент пиоцианин (отно-
сится к семейству феназина; наличие служит ви-
довым признаком). Другой способ применения
флуоресцентной световой микроскопии основан
на добавлении к анализируемым клеткам флуоро-
хромов, одним из которых служит ДАФИ (4,6-ди-
амидинофенилиндол). Этот краситель связывает-
ся с двухцепочечной ДНК, что позволяет визу-
ализировать область локализации ДНК внутри
клеток. Различные виды прокариот можно иден-
тифицировать с помощью флуоресцентно мечен-
ных антител (рис. 2.3, В), используя антитела
против отдельных клеточных компонентов, на-
пример придатков клеточной стенки или мРНК.
Степень разрешения световой микроскопии
удалось повысить путем разработки метода ла-
зерной конфокальной сканирующей микро-
скопии. В этих приборах вместо обычного ис-
точника света используется лазер. Лазерный луч
сканирует шаг за шагом поверхность образца,
и получаемое изображение создается в результа-
те накопления результатов измерения интенсив-
ности проходящего, отраженного или испускае-
мого света в каждой точке и их компьютерной
обработки. Основанный на специфических свой-
ствах лазерного луча (когерентность), этот метод
позволяет получать изображения тонких плоско-
стей внутри образца и устранять «загрязняющие»
изображения соседних областей. Таким образом,
объект оптически разделяется на отдельные плос-
кости, что позволяет получать трехмерную рекон-
струкцию объекта и проводить разнообразные ко-
личественные измерения.
44 Часть I. Прокариотическая клетка
Рис. 2.4. Макромолекулы, визуализи-
рованные различными методами элек-
тронной микроскопии.
А Молекула глутаминсинтетазы (про-
свечивающая электронная микроскопия;
негативе контрастированный препарат).
Шкала 50 нм. По [4].
Б. Клеточная стенка Clostridium aceticunr,
S-слой и жгутик, образованный спи-
рально расположенными молекулами
флагеллина (сканирующая электронная
микроскопия; препарат, приготовленный
методом замораживания — скалывания.
Шкала 50 нм. По [5].
В. Плазмида pBR322; ковалентно за-
мкнутая (I) и незамкнутая (II) формы
(просвечивающая электронная микроско-
пия; препарат, окрашенный в процессе
центрифугирования в градиенте плотно-
сти CsCI). Шкала 0,5 мкм. Фото любезно
предоставлено W. Johannssen.
Г. Плазмида pBR322 (незамкнутая фор-
ма) и связанные с ней молекулы рестрик-
тазы EcoRI в виде тетрамерных частиц
(указаны жирными стрелками) и их субъ-
единиц (указаны тонкими стрелками).
Препарат приготовлен тем же методом,
что и в В. Шкала 0,1 мкм. По [б].
Д. Частично денатурированная ДНК
бактериофага 16-6-12 из Rhizobium
lupini (препарат контрастирован метал-
лом с двух направлений и окрашен с
применением цитохрома с). Стрелками
указаны участки разделения цепей. Шка-
ла 0,5 мкм. Фото любезно предоставлено
F. Mayer.
Разрешение при световой микроскопии пе пре-
вышает 0,25 мкм. Увидеть детали строения кле-
ток на молекулярном уровне, т. е. в диапазоне
нанометров, позволяет электронная микроско-
пия. Однако она имеет как метод ряд недостат-
ков. Во-первых, электронная микроскопия свя-
зана с необходимостью обезвоживания образца,
которое нередко приводит к возникновению ар-
тефактов (и в связи с этим стоит задача совер-
шенствования методов подготовки биологических
образцов для электронной микроскопии с умень-
шением повреждающих эффектов). Во-вторых,
во многих случаях толщина микроскопируемого
образца слишком велика для прохождения че-
рез него электронного луча. В-третьих, входя-
щие в состав биологических объектов химические
элементы лишь слабо взаимодействуют с фор-
мирующим изображение электронным лучом и
вследствие этого контраст при микроскопии полу-
чается недостаточным. Уменьшения деформации
клеток и потери материала при подготовке об-
разца для микроскопии позволяет достичь хими-
ческая фиксация образца, предшествующая обез-
воживанию. Вероятность артефактов значитель-
но снижают применяемые в настоящее время
техника получения замороженных срезов и ме-
тоды получения изображения, позволяющие со-
хранять замороженную воду в образце. Уменьше-
ния толщины образца можно достичь путем изго-
товления пропитанных смолами ультратонких
срезов химически фиксированных и обезвожен-
ных либо замороженных образцов. Оба способа
получения срезов позволяют разрезать прокарио-
тическую клетку среднего диаметра па 20 слоев.
Усиления контраста достигают путем инкубации
образца в растворе, содержащем ионы солей тяже-
лых металлов, — «позитивное» окрашивание уль-
тратопких срезов (рис. 2.3, Е) в результате «отте-
Глава 2. Клеточная и субклеточная организация прокариот 45
нения» металлами сухих образцов, размещенных
на пленках-подложках (рис. 2.1, 2.4), или «нега-
тивное» окрашивание, получаемое при выпадении
осадка солей тяжелых металлов вокруг объекта.
После удаления раствора солей промокательной
бумагой остающиеся вокруг объекта соли очер-
чивают его контуры. Непрямое изображение объ-
екта можно получить при использовании мето-
да реплик, который позволяет выявить структуру
наружной поверхности образца. Внутренние по-
верхности могут быть выявлены с помощью мето-
да замораживания—скалывания (рис. 2.4, Б;
2.12 и 2.13, Б, В). Результаты применения ме-
тодов контрастирования, используемых в элек-
тронной микроскопии, показывают распределение
тяжелого металла, а не структурные элементы
в образце. Недавно предложен метод получения
изображения образца, замороженного в водной
фазе, который не требует применения металлов,
поскольку изображение обеспечивается контра-
стом между водой и биологическим образцом.
В электронной микроскопии, как и в свето-
вой, применяют меченые антитела, обработан-
ные не флуоресцентными метками, а электроно-
непрозрачными маркерами, например коллоид-
ным золотом (рис. 2.3, Е). Этот подход называ-
ют электронно-микроскопической иммуно-
цитохимией .
Помимо обычной просвечивающей электрон-
ной микроскопии с использованием криопроце-
дур, имеются различные методы сканирования
для получения изображения образца на кле-
точном и макромолекулярном уровнях. Примене-
ние метода сканирования требует иных способов
подготовки препарата.
Морфологию и ультраструктуру прокариот
изучают с помощью световой и электронной мик-
роскопии. Предел разрешения светового микро-
скопа составляет примерно 0,25 мкм. Электрон-
ная микроскопия позволяет выявлять детали на
клеточном и макромолекулярном уровнях, давая
изображение в масштабе нанометров. Необходи-
мая подготовка биологических образцов для элек-
тронной микроскопии часто вызывает появление
артефактов.
2.3. Прокариоты встречаются в виде отдельных клеток и
клеточных ассоциаций
2.3.1. Микробные клетки варьируют
по размерам и форме
Размеры клеток прокариот обычно слишком ма-
лы для того, чтобы можно было обнаружить их
невооруженным глазом. Однако имеется исклю-
чение — бактерия Epulopiscium fishelsoni, в милли-
он раз более крупная по объему, чем типичные
бактерии. Такие необычные размеры могут быть
связаны с местообитанием — данная бактерия
присутствует как симбионт в пищеварительном
тракте хирурговой рыбы Acanthurus nigrofuscus,
обитающей в Красном море. Вероятно, существу-
ет и много других необычных микроорганизмов.
Форма клеток у прокариот может быть шаро-
видной (кокки), палочковидной (палочки), изо-
гнутой или спиральной; известны почкующиеся
бактерии, бактерии с выростами (простековые) и
даже прокариоты, представляющие собой плас-
тинчатые и прямоугольные клетки (рис. 2.5).
В зависимости от условий роста и стадии жизнен-
ного цикла размеры и форма клеток прокариот, в
том числе одного и того же вида или штамма, мо-
гут варьировать в генетически детерминирован-
ных пределах. Разнообразие морфологии одних
только бактерий рода Clostridium (рис. 2.5) по-
казывает, что размеры и форма клеток не могут
быть достаточными признаками для классифика-
ции прокариот на родовом уровне.
Клетки прокариот могут иметь форму ша-
риков, палочек (прямых, изогнутых, искривлен-
ных или лучеобразно изогнутых) либо пласти-
нок, быть неправильной формы, иметь выросты
(простеки) или почки. Размеры и форма клеток
существенно варьируют в генетически детерми-
нированных пределах в зависимости от условий
роста.
46 Часть I. Прокариотическая клетка
Рис. 2.5. Разнообразие форм и размеров клеток прока-
риот и клеточные ассоциации (световая микроскопия).
А—В. Различные формы клеток и локализация эндо-
спор у Clostridium. Шкала 10 мкм. По [7].
A. Clostridium butyricum; удлиненные палочки с терми-
нальными спорами, сильно преломляющими свет.
Б. С. bifermentans; пары и цепочки коротких палочек с
центрально расположенными спорами.
В. С. cocleatum; одиночные изогнутые палочки.
Г. Rhodospirillum rubrum', винтообразные клетки. Шкала
10 мкм.
Д. Thiopedia rosea; высокоупорядоченная ассоциация из
20-клеток. Шкала 10 мкм. Г и Д по [1].
Е. Бактерии квадратной формы с упорядоченной орга-
низацией (интерференционная световая микроскопия).
Шкала 5 мкм. По [8].
Ж. Leucothrix sp.; нитевидные клетки, образующие ро-
зетки. Шкала 20 мкм. По [9].
3. Воздушный мицелий Streptoverticillium sp.; сложно-
организованная клеточная ассоциация; концы цепочек
из спор иногда крючковидные. Шкала 0,1 мкм. По [10].
2.3.2. Клетки прокариот могут образовывать
скопления
Прокариоты встречаются не только как отдель-
ные клетки, но и в виде различных по степе-
ни сложности ассоциаций, образующихся, напри-
мер, в результате неполного деления или разделе-
ния клеток (гомологичные ассоциации). Так,
клетки Nitrosolobus multiformis образуют скопле-
ния, цианобактерии — многоклеточные нити. Пос-
ле деления клетки могут удерживаться вместе за
счет «склеивания» их наружных покровов, со-
держащих полисахариды. Такие покровы обра-
зуют слизистый матрикс (Zoogloea ramigera) или
чехлы (Sphaerotilus natans). Другими примерами
могут служить Lampropedia hyalina и Acetobacter
aceti вар. xylinum. Последний выделяет целлю-
лозу, формирующую фибриллы и состоящую из
них микодерму, «клеточную кожу». Образова-
ние ассоциаций, или агрегатов, клеток связа-
но также с фимбриями и пилями — клеточными
придатками белковой природы. Благодаря объ-
единению клетки менее подвержены вероятности
выноса из благоприятного местообитания; оно мо-
жет также играть важную роль в дифференци-
ровке, обмене метаболитами и сигнальными веще-
ствами. В качестве примеров можно указать на
взаимодействие между вегетативными клетками
и гетероцистами у цианобактерий и конъюгацию с
образованием звездчатых групп у почвенных бак-
терий. Некоторые роды цианобактерий, для кото-
рых характерны межклеточный обмен метаболи-
Глава 2. Клеточная и субклеточная организация прокариот 47
тами и дифференцировка клеток (см. рис. 2.21),
представляют собой пример многоклеточных про-
кариот. У миксобактерий (см. разд. 25.3) агрега-
ция клеток ведет к дифференцировке и образо-
ванию «тканей» наподобие эукариотических. Это
происходит в результате совместного морфоге-
неза клеток с обменом информацией по специ-
фическим клеточным функциям и образованием
кластеров размножения. Образующиеся при этом
плодовые тела проходят собственный жизненный
цикл, включающий вегетативный этап, спорооб-
разование и прорастание спор без формирования
цист или спорангиев, но с образованием вегета-
тивных клеток.
2.3.3. Клетки могут объединяться
для формирования консорций или
ассоциаций с хозяином
Многие прокариоты формируют ассоциации раз-
ной степени сложности с другими прокариотами,
с эукариотическими одноклеточными организма-
ми или с тканями эукариот. К таким гетероло-
гичным ассоциациям относятся понятия сим-
биоз, паразитизм, комменсализм и нейтрализм.
При симбиозе ассоциация благоприятна для обо-
их партнеров, обычно в этом случае адаптирован-
ных друг к другу. Если один партнер оказыва-
ет в ассоциации вредное воздействие, ассоциацию
называют паразитической. При комменсализ-
ме преимущество благодаря ассоциации получа-
ет только один партнер, для другого же она не
вредна, по и не благоприятна. Во многих случаях
партнеры сосуществуют без какого-либо влияния
друг на друга; такого рода феномены определяют
как нейтрализм.
В симбиотических ассоциациях возможны два
типа пространственного расположения партне-
ров. При эктосимбиозе ни один из них не проника-
ет в клетки другого, тогда как при эндосимбиозе
один партнер обитает внутри клеток другого (см.
рис. 34.5 и 34.12). Более крупного партнера обыч-
но называют хозяином. Ассоциация может обес-
печивать преимущество в питании (за счет фик-
сации азота, снабжения основными источниками
питания либо дополнительными факторами), опо-
знавательные функции (люминесцентные бакте-
рии в рыбах) или просто защиту.
Зеленые серобактерии образуют стабильные
симбиотические ассоциации (консорции) с бес-
цветными бактериями. Примерами могут слу-
жить консорции «Chlorochromatium aggrega-
tum», «Chlorochromatium glebulum» и «Cylidro-
gloea bacterifera». Кроме этих зеленых консор-
ций Chlorochromatium известны и бурые (см.
рис. 30.24).
Консорция «Chlorochromatium aggregatum»
впервые была описана в 1906 г. Центр ее фор-
мируют бесцветные подвижные бактерии неиз-
вестного таксономического положения; неясны
также их физиологические свойства. Вокруг
бесцветных бактерий расположены 10-12 равно-
мерно распределенных клеток неподвижных зеле-
ных серобактерий. Между членами этого сообще-
ства существует тесная метаболическая взаимо-
зависимость; рост клеток и деление происходят
синхронно. Неподвижные симбионты Chlorobium
передают фототаксический стимул подвижным
бактериям. Таким образом, благодаря ассоци-
ации ее фотосинтезирующие клетки находятся
в благоприятных условиях освещенности (см.
разд. 30.7.7).
Многие другие ассоциации между бактерия-
ми носят характер чисто паразитических, как, на-
пример, ассоциации с участием Bdellovibrio bac-
teriovorus. Род Bdellovibrio объединяет три вида
мелких грамотрицательных бактерий-хищников,
клетки которых имеют две альтернативные фор-
мы. В свободной форме это обладающие жгути-
ком (подвижные), не делящиеся клетки. Другая
форма — неподвижные, делящиеся клетки. Bdel-
lovibrio обнаруживаются в периплазме клеток-
хозяев, таких как энтеробактерии и бактерии
родов Pseudomonas, Rhizobium, Rhodospirillum,
Photobacterium или Chromatium. Наблюдаемые
клеточные формы представляют стадии клеточ-
ного цикла, который начинается с обратимой ста-
дии, следующей за контактом, и переходит в необ-
ратимую стадию. Проникнув через наружную
мембрану клетки-хозяина, паразит теряет жгутик
и проникает в периплазму. Затем он образует сеп-
тированный филамент (нитевидный вырост), ко-
торый растет за счет клетки-хозяина и распадает-
ся на клетки со жгутиками. Эти клетки лизиру-
ют стенку клетки-хозяина и высвобождаются во
внешнюю среду.
К внутриклеточным паразитическим бактери-
ям относятся также Chlamydia psittaci и дру-
гие хламидии, обитающие в клетках животных.
48 Часть I. Прокариотическая клетка
Жизненный цикл этих бактерий также разде-
лен на две стадии: внеклеточную и внутриклеточ-
ную. На внеклеточной стадии развития — стадии
покоя —их клетки, называемые «элементарными
тельцами», обладают высокой ипфекциопностью.
На внутриклеточной стадии, представленной «ре-
тикулярными тельцами», происходит рост и деле-
ние этих бактерий.
Прокариоты способны формировать ас-
социации различной степени сложности — три-
хомы, агрегаты правильной или неправильной
формы, а также стабильные либо нестабильные
сообщества с другими видами микроорганизмов
и ассоциации с клетками или тканями эукариот.
Ассоциации с другими организмами могут быть
симбиотическими либо паразитическими.
2.4. Структурные компоненты клеточных оболочек прокариот
служат барьерами и фазами раздела
2.4.1. Оболочки прокариотических клеток
имеют общие свойства
Оболочка бактериальной клетки состоит из кле-
точной стенки, периплазмы и плазматической
мембраны. Клеточная стенка включает поверх-
ностный слой, граничащий с наружной средой,
наружную мембрану (у грамотрицательных бак-
терий) и пептидогликановый слой, обеспечиваю-
щий форму клетки и ее целостность. Простран-
ство между наружной и плазматической мем-
бранами — периплазма — содержит множество
белков; плазматическая мембрана ограничи-
вает цитоплазму.
Поверхностные структуры, граничащие с
внешней средой, включают капсулу, S-слой, фим-
брии, пили, адгезины и нецитоплазматические
придатки. Эти компоненты оболочки обеспечива-
ют защиту клетки от неблагоприятных внешних
условий. Они опосредуют различные взаимодей-
ствия, такие как прикрепление к биотическим и
абиотическим поверхностям, а также контакт с
клетками-партнерами. Это разнообразие функ-
ций обеспечивается многообразием химических
и структурных свойств поверхности микробных
клеток.
Капсулы можно разделить на три типа: мак-
рокапсулы, микрокапсулы и слои слизи. Нали-
чие макрокапсул можно выявить путем окраши-
вания клеток тушью, позволяющего видеть кап-
сулы в световом микроскопе как светлую зону
между непрозрачной средой и клеточной стен-
кой (рис. 2.6, А). Способами выявления капсул
служат также фиксация клеток на предметном
стекле и обработка их антителами к капсуль-
ным антигенам. Микрокапсулы как очень тон-
кие структуры не видны в световой микроскоп
при негативном окрашивании, но могут быть об-
наружены с помощью серологических методов.
Слизистые слои представляют собой клеточные
выделения, непрочно адсорбированные на поверх-
ности и не имеющие заметной наружной границы.
При выращивании в жидкой среде слизь может
отделяться от клеток. У роящихся (швермерных)
клеток, например образуемых Proteus mirabilis и
Myxococcus xcmthus, окружающая их слизь слу-
жит матриксом, способствующим распростране-
нию колоний.
У патогенных прокариот образование капсулы
коррелирует с патогенностью (см. гл. 33). Утра-
тившие капсулу прокариоты обычно более чув-
ствительны к фагоцитозу. Образование капсул
может зависеть от условий роста даже у кле-
ток одного вида (Е. coll}. Могие прокариоты при
культивировании в лабораторных условиях утра-
чивают капсулы (Е. coli К-12).
Особым вариантом капсулы является «прикре-
пительная пята» («holdfast») и чехлы. Прикрепи-
тельная пята состоит из аморфного материала,
прикрепленного к одному из полюсов клетки, как,
например, конец стебелька у видов Caulobacter и
Asticcacaulis. В функции прикрепительной пяты
входит контакт с биотической или абиотической
поверхностью посредством полимерного мостика.
Чехол представляет собой длинную полую трубку
(например, у Sphaerotilus natans), заключающую
в себе цепочку бактериальных клеток.
Капсулы присутствуют не только у бактерий,
но также у архей (например, у Methanobacterium
Глава 2. Клеточная и субклеточная организация прокариот 49
Рис. 2.6. Компоненты поверхности
прокариотических клеток.
А. Слизь на поверхности клеток
Amoebobacter pendens-, вид, при-
надлежащий к сем. Chromatiaceae
(световая микроскопия, негатив-
ное контрастирование тушью).
Шкала 10 мкм. По [11].
Б. Макрокапсулы Klebsiella pneu-
moniae (просвечивающая элек-
тронная микроскопия; фиксация
лантаном альциановым синим и
осмий-трис(-1-азиридинил)-фос-
финоксид-альдегидом). МК —
макрокапсула; ПМ — плазматиче-
ская мембрана; НМ — наружная
мембрана; Н — нуклеоид. Шкала
0,1 мкм. По [12].
В. S-слой у грамположительных
бактерий: Clostridium thermo-
hydrosulfuricum (слева), Desulfo-
tomaculum nigricans (в центре) и
Bacillus stearothermophilus (спра-
ва) (просвечивающая электронная
микроскопия; препарат приготов-
лен методом замораживания —
скалывания. Видны различные
типы симметрии в структуре.
Шкала 0.1 мкм. По [13].
Г и Д. S-слои двух различных
типов у метаногенных архей.
Препарат приготовлен методом
замораживания—скалывания.
По [14]. Г. Трихомы Methano-
spirillum bungateii-, расположение
единиц S-слоя рядами. Шкала
0,1 мкм.
Д. Methanogenium marisnigri; гек-
сагональное расположение единиц
в S-слое; нарушение структуры.
Шкала 50 нм.
formicium). Чехлы обнаружены у бактерий с
квадратной формой клеток и у Methanospirillum
hungatei.
Капсулы состоят обычно из полисахарида и
воды, но могут включать также полипептиды,
содержать смесь полисахаридов и полипепти-
дов или целлюлозу. Капсульный материал свя-
зан с компонентами клеточной стенки ионными
связями и в некоторых случаях ковалентными
связями, как, например, у Bacillus anthracis (кап-
сульный материал в этом случае связан с пеп-
тидогликаном). Липополисахариды грамотрица-
тельных бактерий (см. ниже) не относятся к
компонентам капсул, представляя собой компо-
нент наружной мембраны этих бактерий.
У некоторых прокариот поверхность клетки
покрыта упорядоченно расположенными белко-
выми единицами, образующими монослой; эта
структура названа S-слоем (рис. 2.6). Имею-
щие S-слой организмы обнаружены почти в каж-
дой таксономической группе грамположительных
и грамотрицательных бактерий и у архей. По
структуре S-слой сходен с двухмерными кри-
сталлами. У бактерий обнаружены S-слои в ви-
де монослойных решеток с гексагональной (рб),
квадратной (р4) или наклонной (р2) симметри-
50 Часть I. Прокариотическая клетка
Рис. 2.7. Клеточная стенка грамотрицательных бактерий. (А, Б и В—ультратонкие срезы; шкала 0,1 мкм).
Д. Acinetobacter sp. шт. MJT/FS/S (химически фиксированный, обезвоженный, залитый смолой препарат; ультра-
тонкий срез). Наружная мембрана имеет волнообразную поверхность; видны область сжатия в результате потери
содержимого и кажущееся пустым пространство в промежутке между плазматической и наружной мембранами,
содержащем, по-видимому, только пептидогликановый слой. По [15].
Б. Криосрезы клеток Alcaligenes eutrophus (препарат, фиксированный метил целлюлозой и контрастированный ура-
нилацетатом). Видно компактное строение клеточной стенки. Слой пептидогликана между плазматической и на-
ружной мембранами не различим. Фото любезно предоставлено М. Rohde.
В. Криосрезы замороженных, химически нефиксированных, необезвоженных и неокрашенных клеток Е. coli. Четко
видны слои клеточной стенки. В промежутке между плазматической и наружной мембранами выявляется только
пептидогликан; другие присутствующие в периплазме компоненты не видны ввиду отсутствия контраста. По [4].
Г. Схематическое изображение слоев клеточной стенки с указанием соответствующих слоев на ультратонких срезах
(Д— В). По [16]. Ос — остов молекул липополисахаридов; ПМ — плазматическая мембрана; Л—липидА; ЛП—липо-
протеин; Л ПС —липополисахарид; О — О-специфическая часть молекулы липополисахарида (сахар); НМ—наруж-
ная мембрана; ПБ — периплазматический белок; Пр — порин; ПГ — пептидогликан (муреин); ТБ — трансмембранные
белки.
ей. У архей S-слои имеют преимущественно гек-
сагональную симметрию. Нарушения в струк-
туре S-слоя указывают на то, что им покры-
ты также округлые полюса клеток. Структур-
ные единицы S-слоя обычно образованы одним
однородным белком или гликопротеином. Субъ-
единицы структурных единиц связаны друг с
другом и с нижележащими компонентами обо-
лочки, обычно посредством ковалентных взаимо-
действий. У экстремально термофильных архей
S-слой высокоустойчив к денатурации, возможно
благодаря ковалентным связям между субъедини-
цами.
Сравнительное изучение распределения и од-
нородности S-слоев показывает, что различные
штаммы данного вида могут существенно варьи-
ровать по типу симметрии S-слоя и молекулярной
массе его субъединиц. После многократных пере-
севов бактерии иногда утрачивают S-слой, что не
влияет на их жизнеспособность.
2.4.2. Клеточная стенка грамотрицательных
бактерий отличается сложным строением
Отличительным компонентом клеточной стен-
ки грамотрицательных бактерий служит наруж-
ная мембрана (НМ; рис. 2.7; см. разд. 2.4.5).
В электронном микроскопе она выглядит как вол-
нообразная мембраноподобная структура (если
препарат фиксирован химической обработкой).
Между НМ и окружающей протопласт плазма-
тической мембраной (ПМ; см. разд. 2.4.5) на-
ходится слой муреина, или пептидогликана. Он
представляет собой мешкообразную структуру,
выявляемую в виде темной линии на этих пре-
паратах. «Периплазматическое пространство»,
т. е. промежуток между НМ и ПМ, не обна-
руживает в электронном микроскопе видимого
содержимого, отличающегося от слоя пептидо-
гликана (на ультратонких срезах клеток, фик-
сированных стандартным химическим методом).
Глава 2. Клеточная и субклеточная организация прокариот 51
Применение метода замораживания-скалывания
позволило установить, что это не какая-либо опре-
деленная структура клеточной стенки. Наруж-
ная мембрана со стороны периплазмы не волно-
образная, но ровная. Слой пептидогликана имеет
существенную толщину, образуя рыхлую трех-
мерную сеть, по-видимому заполняющую пери-
плазматическое пространство (о структуре и био-
синтезе пептидогликана см. разд. 23.1). Для
описания содержимого периплазмы предложен
термин «периплазматический гель». Этот обвод-
ненный материал содержит разнообразные бел-
ки. Слои клеточной стенки у грамотрицательных
бактерий связаны посредством липопротеинов.
Клеточная стенка типичных грамотри-
цательных бактерий представляет собой пеп-
тидогликановый «мешок», покрытый наружной
мембраной (содержащей порины, другие белки,
липополисахариды и фосфолипиды) и капсулой.
Внутренняя поверхность пептидогликанового
слоя граничит с плазматической мембраной, кото-
рая не относится к компонентам клеточной стен-
ки, но входит в состав оболочки клеток. Между
наружной и плазматической мембранами нахо-
дится периплазматическое пространство. Помимо
пептидогликана, оно содержит растворимые бел-
ки. Пептидогликан и наружная мембрана связаны
посредством липопротеинов.
В отличие от плазматической мембраны, на-
ружная мембрана не служит обычным барье-
ром диффузии. Молекулярное строение ее асим-
метрично. Внешний слой НГI содержит пептид
А — компонент липополисахарида (см. разд. 23.2),
внутренний слой — фосфолипиды. Присутствую-
щие в НМ белки-порины образуют в ней кана-
лы для переноса малых молекул (мол. массой
< 600). (Структура и функции пор инов описаны
в разд. 5.6.1.) В НМ содержатся также белки, осу-
ществляющие экспорт белков, и белки, выполняю-
щие функции рецепторов бактериофагов или спе-
цифических каналов поглощения веществ.
У цианобактерий с пептидогликаном кова-
лентно связан полисахарид. Хотя цианобакте-
рии имеют наружную мембрану, толстый слой
пептидогликана и наличие полисахарида могут
обусловливать грамположительную окраску этих
организмов. В состав наружной мембраны у
цианобактерий, кроме поринов, входят кароти-
ноиды.
2.4.3. Клеточная стенка грамположительных
бактерий имеет сложную структуру,
не выявляемую в электронном микроскопе
Грамположительпые бактерии не имеют наруж-
ной мембраны. Положительная окраска по Граму
показывает, что клеточная стенка этих бактерий
(рис. 2.8) способна удерживать продукт реакции
(комплекс иода с кристаллическим фиолетовым)
на последней стадии обработки. Это свойство
обусловлено значительной толщиной пептидо-
гликанового слоя в составе оболочки, распо-
ложенного поверх плазматической мембраны, и
наличием в нем дополнительного полимера —
тейхоевой кислоты (см. разд. 23.3). Тейхоевые
кислоты представляют собой фосфорилирован-
ные многоосновные спирты, часто несущие бо-
ковые цепи в виде олигосахаридных единиц и
присоединенных сложноэфирной связью остатков
D-аланина. Другими дополнительными компонен-
тами клеточной стенки могут быть тейхуроновые
кислоты (см. разд. 23.4) и липотейхоевые кисло-
ты. В этих веществах глицерол в составе тейхое-
вой кислоты связан с гликолипидом. Наличие гли-
колипида обеспечивает прикрепление молекулы к
плазматической мембране, тогда как гидрофиль-
ная часть молекулы проникает в клеточную стен-
ку. Тейхоевые кислоты ковалентно связаны с пеп-
тидогликаном .
Рис. 2.8. Клеточная стенка грамположительных бак-
терий.
А. Ультратонкий срез клетки Thermoanaerobacterium
thermosulfurigenes. Препарат химически фиксирован,
обезвожен, залит смолой. Видна плазматическая мем-
брана (ПМ), толстый пептидогликановый слой (ПГ) и
поверхностный слой (S). Шкала 0,1 мкм. По [17].
Б. Схематическое изображение макромолекулярного
строения: черточками указаны соответствующие слои
на ультратонких срезах (А). Молекулы липотейхоевых
кислот (ЛТ) в клеточной стенке; ТБ — трансмембран-
ные белки. Фото любезно предоставлено F. Mayer.
52 Часть I. Прокариотическая клетка
У микобактерий, нокардий и коринебакте-
рий 30% вещества клеточной стенки приходит-
ся на липиды. У некоторых микобактерий об-
наружены также воски (тетрасахариды пептидо-
гликана, присоединенные к этерифицированному
арабипогалактану). Фрагменты воска, образую-
щиеся, вероятно, при частичном автолизе, мо-
гут выполнять роль иммуноадъювантов. В со-
став клеточных стенок у бактерий родов Myco-
bacterium, Nocardia, Corynebacterium, Rhodococcus
и Caseobacter входят миколовые кислоты. Эти
высокомолекулярные 3-гидроксикислоты с длин-
ной алкильной боковой цепью у С2-атома слу-
жат важным хемотаксономическим маркером для
классификации и идентификации содержащих их
организмов.
Помимо полисахаридов, у некоторых бактерий
обусловливающих патогенность, клеточная стен-
ка грамположительных бактерий может содер-
жать белки, например у стафилококков белок А,
который связан с клеточной стенкой (он взаимо-
действует с Fc-фрагментом антител IgG челове-
ка), и энтеротоксины (временно связанные с кле-
точной стенкой перед экскрецией).
Основные компоненты клеточной стенки ти-
пичных грамположительных бактерий — это
многослойный пептидогликановый «мешок», тей-
хоевые кислоты, связанные с пептидогликаном,
липотейхоевые и тейхуроновые кислоты. У неко-
торых грамположительных бактерий в состав сте-
нок также липиды — воски и миколовые кислоты,
а также белки. Наружный покров клеточной стен-
ки состоит из нейтральных полисахаридов или
белка. Наружная мембрана у этих бактерий от-
сутствует.
2.4.4. Клеточные стенки архей:
«старое» решение
Характерной особенностью архей является отсут-
ствие в составе клеточной стенки типичного пеп-
тидогликана (рис. 2.9). Известно пять морфоло-
гических типов клеточных стенок архей. Тип 1:
электроноплотный слой, выявляемый на ультра-
Рис. 2.9. Клеточная стенка археи Methanogenium
marisnigri.
А. Ультратонкий срез клеток (препарат фиксирован хи-
мически, обезвожен, залит смолой); видна слабо выра-
женная структурированность. Шкала 0,1 мкм. По [18].
Б. Гипотетическая схема макромолекулярного строения.
Клеточная стенка состоит из плазматической мембра-
ны (ПМ), содержащей трансмембранные белки (ТБ), и
поверхностного слоя (S-слой). Рисунок любезно предо-
ставлен F. Mayer.
тонких срезах, состоит в основном из псевдомуре-
ина — сульфатированного или несульфатирован-
ного кислого гетерополисахарида (см. рис. 7.31).
Клетки со стенкой 1 типа окрашиваются по Граму
положительно. Клетки со стенкой редкого 2 ти-
па также окрашиваются по Граму положительно.
Стенка 2 типа отличается ригидностью и также
содержит псевдомуреин, покрытый поверхност-
ным слоем белка (рис. 2.9; см. разд. 23.10). Многие
грамотрицательные археи, например многие гало-
филы и метаногены и все термоацидофилы, име-
ют клеточную стенку 3 типа, содержащую только
поверхностный монослой из чисто белковых или
гликопротеиновых субъединиц; псевдомуреин в ее
составе отсутствует (см. разд. 23.10). У организ-
мов со стенкой 4 типа несколько клеток удержива-
ется вместе чехлом, состоящим из белковых фиб-
рилл; при этом каждая клетка окружена элек-
троноплотным слоем, также, вероятно, белковой
природы. Тип 5 означает отсутствие клеточной
стенки; единственным компонентом клеточной
оболочки служит в этом случае плазматическая
мембрана.
Клеточные стенки архей, в отличие от сте-
нок бактерий, построены из псевдомуреина, поли-
сахаридов, белков и гликопротеинов, формирую-
щих поверхностный слой или чехол.
Глава 2. Клеточная и субклеточная организация прокариот 53
2.4.5. Плазматическая и
внутрицитоплазматические мембраны
ограничивают протопласт
Плазматическая мембрана ограничивает цито-
плазму и участвует в транспорте ионов, раство-
рителей, метаболитов и макромолекул между ци-
топлазмой и окружающей средой. К наиболее
важным функциям мембраны относятся избира-
тельный транспорт веществ (поглощение и выде-
ление) и образование электрохимического ионно-
го потенциала (Н+ или Na+) (см. разд. 4.5.11).
На электронных микрофотографиях соответ-
ствующим образом обработанных ультратопких
срезов (рис. 2.7, Л) плазматическая мембрана
видна как тройной слой, имеющий толщину при-
мерно 5-6 нм и разделенный на центральный свет-
лый субслой плюс два электроноплотных (тем-
ных) субслоя. Эта картина отражает строение
мембраны, состоящей из двух слоев фосфолипи-
дов, гидрофильные головки которых ориентиро-
ваны в одном слое к поверхности клетки, в другом
к цитоплазме. Многочисленные белки мембраны
составляют примерно 50-70% ее сухого вещества;
они соединены с липидами бислоя (интегральные
мебранпые белки) либо более или менее свобод-
но связаны с одной из поверхностей мембраны
(периферические белки) и входят в состав асим-
метрично организованных функциональных мем-
бранных комплексов. Липидный бислой содержит
также переносчики электронов хиноны и у ор-
ганизмов большинства таксономических групп —
гопаноиды (см. разд. 7.10 и 29.3.4). Эти произ-
водные трптерпепоидов выполняют функцию ста-
билизаторов бактериальных мембран, которые в
их отсутствие утрачивают стеролы (например,
холестсрол, основной компонент мембраны эука-
риотических клеток). Данные компоненты мем-
браны присутствуют в мембране в жидкокри-
сталлическом состоянии и могут быстро диффун-
дировать в латеральном направлении или очень
медленно пересекать мембрану путем диффу-
зии (перенос флип-флоп). Наличие в мембране
пронизывающих ее белков четко выявляется в
препаратах, полученных методом заморажива-
ния-скалывания (рис. 2.10). Этот метод позволяет
раскалывать мембрану по границе субслоев. Мем-
браносвязанные белки, в частности ферменты,
четко видны при негативном окрашивании фраг-
ментов мембраны или везикул, так как они воз-
вышаются над плоскостью мембраны (рис. 2.10, Б
и В).
Мембраны архей в электронном микроскопе
выглядят подобно мембранам бактерий, но в то
же время принципиально отличаются от них по
природе эфирных связей и составу липидных ком-
понентов. У некоторых экстремальных галофилов
липиды содержат вместо жирных кислот изо-
преноидные цепи, присоединенные простой эфир-
ной связью. Липиды, представляющие собой про-
стые эфиры глицерола, обнаружены также у
Thermoplasma acidophilum. У метаногенов липи-
ды представлены разветвленными простыми эфи-
рами глицерола. Плазматическая мембрана гало-
бактерий содержит кластеры мембрапосвязапных
молекул бактериородопсина (рис. 2.10; «пурпур-
ные мембраны»; см. разд. 13.4 и рис. 13.13).
Плазматическая мембрана представляет
собой внутренний слой клеточной оболочки и
обеспечивает транспорт веществ между цитоплаз-
мой и окружающей средой. У бактерий плазма-
тическая мембрана имеет бислойную структуру,
сформированную фосфолипидами. Белки (в боль-
шинстве это ферменты, сенсоры и транспортные
системы) прикреплены к наружной или внутрен-
ней поверхности мембраны либо пронизывают ее.
У архей мембраны в электронном микроскопе вы-
глядят аналогично бактериальным, по в отли-
чие от них содержат простые эфиры глицерола
и С20- или Сдо-изопрсноидов (липиды бактерий
представляют собой сложные эфиры глицерола и
жирных кислот).
Внутрицитоплазматические мембраны в
клетках фототрофных бактерий увеличивают по-
верхность мембраны и содержат аппарат фото-
синтеза. Известно четыре основных типа впут-
рицитоплазматичсских мембран (ВЦМ) у фото-
трофных бактерий (рис. 2.11): везикулярные, в
виде трубочек, в виде плоских тилакоидоподоб-
пых мембран, образующих правильные стопки, и
в виде крупных тилакоидов, частично собранных
в стопки и неравномерно распределенных в клет-
ке (рис. 2.12). ВЦМ всех этих типов формируются
из пламатической мембраны путем инвагинации,
за исключением тилакоидов цианобактерий (см.
разд. 24.2).
54 Часть I. Прокариотическая клетка
Рис. 2.10. Структурные особенности плазматических мембран у прокариот.
А. Препарат Clostridium aceticum, приготовленный методом замораживания-скалывания (ср. рис. 2.4, Б); под
S-слоем видна сколотая плазматическая мембрана с многочисленными мембранными белками. Шкала 0,1 мкм.
По [5].
Б. Вывернутые мембранные везикулы Nitrobacter hamburgensis Х-14 (негативное контрастирование). Видны части-
цы фермента нитрит:(акцептор)-оксидоредуктазы в лара-кристаллической форме, прикрепленные к плазматической
мембране. В норме этот фермент обращен в цитоплазму. Шкала 0,1 мкм. Фото любезно предоставлено Е. Spieck.
В. Вывернутые мембранные везикулы археи Methanosarcina masei шт. Gol (негативное контрастирование). Видны
комплексы ATP-синтазы. В норме этот фермент обращен в цитоплазму. Шкала 0,1 мкм. Фото любезно предостав-
лено F. Mayer.
Г, Д. Пурпурные мембраны Halobacterium halobium [19].
Г. Плазматическая мембрана, содержащая кластеры пурпурной мембраны (в центре) (реплика с препарата, приго-
товленного методом замораживая-скалывания). Шкала 0,1 мкм.
\ Д. Структура пурпурной мембраны в проекции на плоскость мембраны. Рисунок, представляющий собой рекон-
струкцию изображений повторяющихся единиц на электронных микрофотографиях, показывает область клеточной
мембраны с тремя молекулами бактериородопсина. Треугольник означает тройную ось вращения. Каждая молекула
бактериородопсина содержит два примерно параллельных ряда а-спиралей. Три таких двойных ряда группируются
вокруг отмеченной треугольником оси. Внутренний ряд в каждой молекуле образуют три а-спирали, расположенные
почти вертикально, наружный ряд — четыре а-спирали, наклоненные под все большим углом к плоскости мембра-
ны от одного конца ряда к другому (ср. рис. 5.1, цв. вклейка). Пространство вокруг молекул бактериородопсина
заполнено молекулами липидов, образующих бислойную структуру. Шкала 1 нм.
Глава 2. Клеточная и субклеточная организация прокариот 55
Рис. 2.11. Строение внутрицитоплазматических фото-
синтезирующих мембран у фототрофных бактерий.
А. Мембраны везикулярного типа, присутствующие у
Rhodospirillium rubrum, Rhodobacter capsulatus, Chroma-
tium vinosum, Thiocapsa roseopersicina и других видов.
Б. Трубчатые мембраны у Thiocapsa pfennigii и некото-
рых других бактерий.
В. Плоские тилакоидоподобные мембраны в правиль-
ных стопках у Rhodospirillum molischianum, Ectothio-
rhodospira mobilis и других видов.
Г. Крупные тилакоиды, частично в стопках или свобод-
нолежащие, у Rhodopseudomonas palustris и Rps. viridis.
По [20].
Мембраны фототрофных бактерий содержат
светособирающие пигмепт-белковыс комплексы,
которые поглощают фотоны и передают энер-
гию возбуждения на фотохимические реакцион-
ные центры (см. гл. 13 и 24). У фотосинтезирую-
щих прокариот известно три типа свстособираю-
щих систем.
1. Тип 1 характерен для пурпурных бактерий
(Proteobacteria). Системы этого типа состоят
из мембранных белков, связанных с бактерио-
хлорофиллом (Бхл) и каротиноидами в сте-
хиометрических количествах.
2. Тип 2 представляют хлоросомы, характер-
ные для Chlorobium и сем. Chloroflexaceae
(рис. 2.13). Это везикулоподобные органел-
лы, прикрепленные к плазматической мем-
бране со стороны цитоплазмы; они содержат
агрегаты бактериохлорофилла в виде палоч-
ковидных элементов, окруженных липидным
монослоем. Контакт между хлоросомой и
плазматической мембраной обеспечивает кри-
сталлическая базальная пластинка — компо-
нент хлоросомы. Сайт прикрепления в плаз-
матической мембране содержит структуры
реакционных центров.
3. Тип 3 — это фикобилисомы цианобактерий
(рис. 2.14 и 13.11). Фикобилисомы прикреп-
лены к поверхности тилакоидов и во мно-
гих случаях образуют правильные структуры.
Они содержат водорастворимые дополнитель-
ные пигменты аллофикоцианин, фикоцианин
и фикоэритрин (белки, ковалентно связанные
с фикобилинами), и обнаруживают четкую
макромолекулярную архитектуру. Три стопки
дисковидных субъединиц образуют треуголь-
ную сердцевину. Каждая стопка содержит по
два диска диаметром 12 нм. Лучеобразно от
двух из трех сторон треугольной сердцевины
расположены группы из трех палочек, каж-
дая из которых состоит из пучка дископодоб-
ных субъединиц. У отдельных штаммов, про-
являющих хроматическую адаптацию, число
дисков на одну палочку зависит от длины
волны света, при котором клетки были вы-
ращены. Упорядоченная организация фикоби-
лисом на поверхности тилакоидов отражает,
возможно, упорядоченное расположение ре-
акционных центров фотосистемы II внутри
этих мембран. Помимо фикобилисом, фото-
синтетическиц аппарат цианобактерий вклю-
чает хлорофилл а-белковые мембранные ком-
плексы.
Клетки фототрофных бактерий содержат
внутрицитоплазматические мембраны, уве-
личивающие общую площадь мембраны и содер-
жащие фотосинтетический аппарат. Они имеют
форму везикул, трубочек, стопок или тилакоидов,
связанных с плазматической мембраной, и обра-
зуются в результате ее инвагинации, за исключе-
нием, вероятно, тилакоидов цианобактерий. Для
каждой группы фототрофных прокариот харак-
терен свой тип светособирающих систем.
Некоторые нефотосинтезирующие прокарио-
ты также обладают внутрицитоплазматически-
ми мембранами. Развитые ВЦМ присутствуют у
нитрифицирующих, азотфиксирующих и метано-
трофных бактерий (рис. 2.15); как и у фототроф-
ных бактерий, они происходят из плазматической
мембраны. Соотношение между поверхностя-
ми внутрицитоплазматических и плазматической
мембран подвержено регуляции. У Azotobacter
vinelandii внутрицитоплазматические и плазмати-
ческая мембраны не различаются по дыхательной
активности, представляя собой различно локали-
зованные части одной и той же мембранной сис-
темы.
56 Часть I. Прокариотическая клетка
Рис. 2.12. Электронные микрофотогра-
фии внутри цитоплазматических мембран
фототрофных бактерий.
А. Ультратонкий срез клетки Rhodobacter
sphaeroides. Видны инвагинации мембран.
Шкала 0,2 мкм.
Б. Ультратонкий срез Thiocystis violacea.
Видны пакеты хроматофоров, глобулы
серы (S) и ламеллярные или трубчатые
мембраны, характерные для старых
клеток. Шкала 0,5 мкм. А и Б по [21].
В. Ультратонкие срезы клетки Ecto-
thiorhodospira mobilis со стопками
фотосинтетических ламелл. Шкала
0,1 мкм. По [22].
Г. Внутрицитоплазматические мембраны
Rhodopseudomonas palustris (визу-
ализированные с помощью метода
замораживания—скалывания. Видна ор-
ганизация фотосинтетических мембран,
ламеллы (Л) которых расположены
параллельно плазматической мембране.
Шкала 0,2 мкм. По [23].
Скрученные внутрицитоплазматические мем-
бранные системы, выявленные на электронных
микрофотографиях Methanobacterium thermo-
autotrophicum, как установлено, являются арте-
фактом изготовления препаратов. То же отно-
сится к «мезосомам» — скрученным мембранным
системам бактерий, выявляемым в результате
неблагоприятного воздействия химической фик-
сации. Наличие мезосом может означать, что
плазматическая мембрана содержит отдельные
участки, структура которых отличается от струк-
туры других ее участков; эти отличия, возможно,
приводят к деформации.
Глава 2. Клеточная и субклеточная организация прокариот 57
Рис. 2.13. Строение хлоросом у зе-
леных бактерий Chlorobium limicola и
Chloroflexus aurantiacus.
А. Ультратонкий срез клетки. Видны
хлоросомы (Хс), прикрепленные к внут-
ренней части плазматической мембраны.
Шкала 0,1 мкм. По [24].
Б. Препарат, приготовленный методом
замораживания—скалывания. Скол про-
шел через периферию клетки; виден
участок прикрепления хлоросомы (Хс) к
плазматической мембране; все ближай-
шие хлоросомы в клетке имеют ту же
ориентацию Шкала 0,2 мкм. По [25].
В. Тот же метод, что в Б. Видны
базальные пластинки хлоросом с кри-
сталлической субструктурой. Шкала
50 нм. По [24].
Г. Модель хлоросомы, связанной с
плазматической мембраной. Бхлс — бак-
териохлорофилл с; FqFi — АТР-синтаза;
СК — светопоглощающий комплекс; РЦ —
реакционный центр. Рисунок любезно
предоставлен G. Drews.
g 0,2 мкм
g 50 нм
Рис. 2.14. Строение клеток цианобактерий.
А. Ультратонкий срез клеток нитчатой цианобактерии, относящейся к группе Lyngbya-Plectonema-Phormidium,
с кортико-параллельными рядами тилакоидов, несущих фикобилисомы. Шкала 0,5 мкм. По [26].
Б. Два изображения (вид сверху и снизу) объемной модели фикобилисомы. Белыми, черными и серыми дисками
изображены молекулы аллофикоцианина, фикоцианина и фикоэритрина. Одиночные диски — тримеры фикобили-
протеина (аД)з диаметром 12 нм и толщиной 3 нм. По [27].
58 Часть I. Прокариотическая клетка
Рис. 2.15. Внутрицитоплазматические мембранные си-
стемы нефототрофной нитритобразующей морской бак-
терии Nitrosomonas oceanus. Ультратонкий срез; препа-
рат приготовлен методом замораживания—скалывания.
Видна стопка ламелл, состоящих из параллельно
расположенных плоских везикул, часть которых свя-
зана с плазматической мембраной. Шкала 0,5 мкм.
По [28].
Клетки нитрифицирующих, азотфиксирую-
щих и метанотрофных бактерий содержат раз-
витые внутриклеточные мембранные структуры.
Благодаря такой внутриклеточной дифференци-
ровке возрастает площадь мембраны и тем самым
увеличивается содержание в клетке мембраносвя-
занных ферментов.
2.5. Организация внутриклеточных структур отражает
сложность строения прокариотической клетки
2.5.1. Цитоплазма содержит не только рибосомы
и полисомы
В цитоплазме присутствует огромное количе-
ство белков (ферментов, ферментных комплек-
сов, структурных молекул), мРНК, тРНК, других
макромолекул, малых молекул и растворенных
неорганических веществ. В то же время на элек-
тронных микрофотографиях ультратонких срезов
и криопрепаратов бактериальных клеток в цито-
плазме не выявляется видимых структур. Это,
однако, не может служить доказательством ее
неструктурированности. Возможно, структурная
организация цитоплазмы утрачивается при изго-
товлении препаратов либо не видна по причине
мелких размеров и отсутствия контраста.
Структурами, четко различимыми в бактери-
альных клетках, являются рибосомы (рис. 2.16),
в большинстве случаев организованные в поли-
сомы и расположенные в цитоплазме, иногда
вблизи плазматической мембраны. Они выполня-
ют функцию трансляции генетической информа-
ции— синтеза белков на матрице мРНК. Прока-
риотические рибосомы относятся к TOS-типу (S —
единица Сведберга, константа седиментации для
ультрацентрифуг). Они содержат 55 белков и 5S-,
16S- и 23S-pPHK. Количество рибосом в клетке
варьирует от 20 до 100 -103 и строго регулируется
(см. гл. 23).
При электронной микроскопии ультратонких
срезов прокариотических клеток в их цитоплаз-
ме не выявляется каких-либо структур, кроме ри-
босом в виде отдельных частиц или в составе по-
лисом (цепочек рибосом, расположенных вдоль
молекулы мРНК).
2.5.2. Организация нуклеоида у прокариот
обеспечивает тонкую регуляцию
метаболизма
На ультратонких срезах прокариотических
клеток четко различима область нуклеоплаз-
мы, не окруженная мембраной, — нуклеоид
Глава 2. Клеточная и субклеточная организация прокариот 59
Рис. 2.16. Структура 705-рибосом.
А. Рибосомы, выделенные из клеток Е. coli. Интактные 705-рибосомы указаны тройными стрелками,
505-субъединицы — двойными стрелками, 305-субъединицы — одной стрелкой. Препарат негативно контрастирован.
Шкала 0,1 мкм.
Б. Ультратонкий срез клетки Thermoanaerobacterium thermosulfurigenes ЕМ1; видны рибосомы (Р) вблизи плазмати-
ческой мембраны, расположенные цепочками (полисомы); КС — клеточная стенка; ПМ — плазматическая мембрана.
Фото любезно предоставлено F. Mayer.
В. Модель бактериальной рибосомы, содержащей малую и большую субъединицы. По [30].
(рис. 2.17, Л). Эта область имеет фибриллярную
структуру и лишена рибосом. Менее четко нук-
леоид виден при использовании криопрепаратов.
Цитоплазма и нуклеоид очень слабо различают-
ся по контрастности. Можно предположить, что
отчетливая видимость нуклеоида обусловлена ис-
кусственным изменением ионного состава клеточ-
ного содержимого. Такие изменения могут быть
вызваны нарушением барьера проницаемости, в
физиологических условиях обеспечиваемого плаз-
матической мембраной. Кроме того, причиной вы-
явления нуклеоида может быть разрушение свя-
зи транскрипционно-трансляционных комплексов
с ДНК или утрата ДНК-связывающих белков.
Бактериальная хромосома, высвобождающая-
ся из клеток при осмотическом шоке, в препарате
для электронной микроскопии имеет вид «голой»
ДНК, т. е. при таком способе выделения она утра-
чивает связь с белками (рис. 2.17, В). При исполь-
зовании мягких условий лизиса, т. е. не осмотчче-
ского шока, хромосомы выходят в среду вместе
со связанными белками и РНК в виде нитей-бус
(рис. 2.17, Б). В некоторых случаях эти нити пе-
реплетены и образуют сложные агрегаты. Нали-
чие таких нитей-бус свидетельствует о том, что
ДНК-связывающие белки и РНК могут играть у
прокариот важную роль в конденсации ДНК и
в регуляции процессов с участием ДНК. Поми-
мо прочего, нить двухцепочечной ДНК длиной не
менее 1,2 мм должна быть упакована в клетке в
структуру длиной несколько микронов, с сохра-
нением возможности тонкой регуляции процессов
репликации и транскрипции. У прокариот, обита-
ющих при экстремально высоких температурах,
стабильность ДНК повышена, предположительно
благодаря взаимодействию белков с ДНК. Когда
бактериальные нуклеоиды выделяют при низкой
концентрации соли и без добавок детергентов, по-
лиамипов или Mg2+, их упаковка становится ме-
нее плотной в результате разрушения комплск-
Часть I. ЧТрокариотическая клетка
Рис. 2.17. Строение нуклеоида у прокариот.
А Ультратонкий срез клеток Klebsiella pneumoniae. Видна фибриллярная ультраструктура нуклеоида (Н). К —кап-
сула. Шкала 0,1 мкм. По [31].
Б. Контрастированный металлом препарат клеток Е. coli, разрушенных на пленке-подложке для электронной мик-
роскопии. ДНК видна вокруг клетки в виде конденсированных хроматиноподобных нитей. Шкала 0,5 мкм. По [32].
В. Изолированный нуклеоид из Е. coli. Видны петли ДНК. Окрашенный препарат. Шкала 1 мкм. По [33].
Г. Активированный участок генома Е. coli — оперон с предположительным сайтом транскрипции. Окрашенный пре-
парат. Шкала 0,2 мкм. По [34].
сов белок—нуклеиновые кислоты. Хромосомная
ДНК, представляющая собой ковалентно замкну-
тую кольцевую макромолекулу, видна на таких
препаратах как структура, образующая независи-
мые домены-петли с отрицательными сверхвитка-
ми, образующимися для компенсации увеличения
числа положительных (правозакручепных) вит-
ков в спирали ДНК после освобождения кольце-
вого дуплекса от белков. Число таких доменов мо-
жет превышать 50 (рис. 2.17, В).
При мягких условиях выделения обнаружива-
ется связь нуклеоидов с плазматической мембра-
ной, участвующей, возможно, в регуляции про-
цесса репликации ДНК и делении нуклеоида.
Глава 2. Клеточная и субклеточная организация прокариот 61
Деление нуклеоида и клеток происходит коорди-
нированно, но не как строго коррелирующие про-
цессы. Клетки могут содержать более одного нук-
леоида.
На электронных микрофотографиях бактери-
альных клеток, лизированных в мягких услови-
ях, видны временно существующие комплексы,
содержащие ДНК-зависимую РНК-полимеразу и
новообразованную мРНК с поли сомами, осу-
ществляющими трансляцию (рис. 2.17, Г").
Следует учитывать, что нуклеоид представ-
ляет собой весьма динамичную структуру; счи-
тываться могут только участки ДНК, времен-
но экспонируемые в цитоплазме. Компоненты ап-
парата транскрипции-трансляции не проникают
внутрь нуклеоида. Структура и репликация ДНК,
а также разделение дочерних хромосом описаны
в разд. 14.1, 14.2 и 22.3.
Прокариотическая хромосома локализована в
области нуклеоплазмы, не содержащей рибосом.
Эта область — нуклеоид — не окружена мем-
браной. Хромосомная ДНК представляет собой
ковалентно замкнутую, кольцевую двухцепочеч-
ную молекулу, in vivo связанную с белками. При
электронной микроскопии на цепи ДНК вид-
ны комплексы, включающие РНК-полимеразу,
новообразованную мРНК и «сидящие» на ней по-
лисомы.
2.5.3. Клеточные включения выполняют
не только функцию запасных полимеров
В прокариотических клетках присутствуют
включения (рис. 2.18), представляющие собой
различные по химической природе продукты кле-
точного метаболизма, обычно нерастворимые. Ча-
сто они составляют значительную долю сухого
вещества клеток. В световом микроскопе включе-
ния во многих случаях видны благодаря тому, что
сильно преломляют свет. Клеточные включения
выполняют функцию хранения тех или иных ме-
таболитов при их избыточном образовании. Эти
запасные вещества используются при метаболи-
ческом стрессе или детоксикации. Включения не
имеют существенного значения для метаболиз-
ма, но обеспечивают преимущество на отдельных
стадиях роста или в особых условиях среды. Мно-
гие включения окружены оболочкой, которая не
является типичной бислойной мембраной и варьи-
рует по толщине и составу. Обычно она содержит
белки и может включать ферменты, катализиру-
ющие синтез или расщепление запасных веществ.
Данные о включениях у прокариот суммированы
в табл. 2.2. Некоторые включения, такие как газо-
вые везикулы и магнетосомы, выполняют особые
функции (например, ориентации).
К особым включениям относятся также ин-
тактные и дефектные бактериофаги, часто об-
ладающие свойствами бактериоцинов. В число
таких включений входят рапидосомы и свето-
преломляющие тельца, называемые R-частицами.
Бактерии, несущие R-частицы, обитают как эн-
досимбионты в клетках парамеций; эти включе-
ния встречаются и у некоторых свободноживу-
щих бактерий. В клетках многих прокариот от-
кладываются жирные полигидроксикислоты, что
представляет интерес для биотехнологического
использования. В виде включений часто отклады-
ваются также рекомбинантные белки у бактерий-
продуцентов.
В клетках прокариот часто присутствуют
включения. Как правило, они представляют со-
бой запасные вещества в полимерной форме и
нередко заключены в белковую оболочку. К осо-
бым включениям относятся газовые везикулы и
магнетосомы, а также интактные и дефектные
бактериофаги, многие из которых обладают свой-
ствами бактериоцинов. Образовывать включения
могут также продуцируемые бактериями реком-
бинантные белки.
62 Часть I. Прокариотическая клетка
Т4
Рис. 2.18. Внутриклеточные включения у бактерий.
А. Ультратонкий срез клетки Alcaligenes eutrophus. Вид-
ны включения полигидроксибутирата. Шкала 0,5 мкм.
Фото любезно предоставлено В. Vogt.
Б. Microcystis aeruginosa. Препарат, приготовленный ме-
тодом замораживания—скалывания. Видны скопления
газовых везикул. Шкала 1 мкм. По [35].
В. Негативно контрастированная изолированная газовая
везикула Anabaena flos-aquae. Шкала 0,1 мкм. По [36].
Г. Ультраструктура клетки, относящейся к виду маг-
нетотакси ческих спирилл (негативное контрастирова-
ние). М — магнетосома в цепочке магнетосом. Шкала
0,5 мкм. По [37].
Д. Ультратонкий срез клетки Thiobacillus neapolitanus.
Видны карбоксисомы. Шкала 0,2 мкм. По [36].
Е. Ультратонкий срез клетки Е. coli, инфицированной
бактериофагом Т4; бактериофаги прикреплены к плаз-
матической мембране, а также присутствуют внутри
клетки. Шкала 0,5 мкм. По [38].
Глава 2. Клеточная и субклеточная организация прокариот 63
Таблица 2.2. Внутриклеточные включения у прокариот
Включения Основной состав Встречаемость у бактерий
Карбоксисомы Р ибулозо-1,5-бисфосфат- карбоксилаза Бактерии, осуществляющие цикл Кальвина: Nitrosomonas, Thiobacillus, многие цианобактерии
Глобулы жирных полигидрокси- кислот Полиэфиры жирной гидроксикислоты Широко распространены у Pseudomonas-, Bacillus, Alcaligenes eutrophus, Pseudomonas oleouorans
Газовые везикулы Газ Пурпурные бактерии: Lamprocystis, Amoebobacter, Thiodictyon Зеленые бактерии: Pelodictyon Многие цианобактерии: Oscillatoria, Aphanizomenon, Microcystis Непигментированные бактерии: Pelonema, Peloploca Археи: Halobacterium, Methanosarcina
Магнетосомы ПегОз (магнетит) Палочки, кокки, спириллы (Aquaspirillum magnetotacticum)
Глобулы серы Сера Аэробные сероводородокисляющие бактерии: Beggiatoa, Thiothrix, Achromatium, Thiouulum Аноксигенные фототрофные серобактерии: Chromatium, Thiospirillum-, цианобактерии; обладающая чехлом бактерия Sphaerotilus natans
Полисахаридные гранулы Крахмалоподобное вещество; гликоген Clostridium pasteurianum, C. butyricum, Acetobacter pasteurianum, Neisseria, Escherichia coli, Bacillus polymyxa, Micrococcus luteus, Arthrobacter, кишечные бактерии
Полифосфатные гранулы (волютин) Полифосфаты, Mg2+, К+ Spirillum volutans, Acinetobacter johnsonii, Klebsiella pneumoniae
Цианофицин Белок (Asp/Arg) Цианобактерии
Белковые кристаллы Белок Токсин: Bacillus thuringiensis, B. laterosporus, B. medusa Мутант по РНК-полимеразе: Bacillus subtilis, Clostridium cochlearium, C. perfringens
Кристаллы СаСОз СаСОз Achromatium oxaliferum, Macromonas mobilis
Липиды Нейтральные липиды, вос- ки Очень редко: Pseudomonas aeruginosa 44T1
У глеводороды Гексадецен, нафтенат никеля Acinetobacter
Интактные и дефектные бакте- риофаги («бактериоцины») Белок +/— нуклеиновая кислота Широко распространены у Escherichia coli, Serratia marcescens, Alcaligenes eutrophus
Рапидосомы Белок Saprospira grandis, Aquaspirillum itersonii
R-частицы Белок Эндосимбиотические бактерии в парамециях, Pseudomonas taeniospiralis (несимбиотический вид)
Рекомбинантные белки Белок Бактерии — продуценты белка в биотехнологических процессах
64 Часть I. Прокариотическая клетка
2.6. Клеточные придатки служат для движения и распознавания
2.6.1. Прокариоты обладают различными
механизмами движения
Клетки большинства подвижных прокариот пере-
мещаются с помощью жгутиков (см. ниже). Для
некоторых прокариот, в том числе нитчатых ци-
анобактерий, таких как Oscillatoria и Anabaena,
и миксобактерий, например Myxococcus, харак-
терно скользящее движение. Механизм скольже-
ния пока неясен, но идентифицированы необхо-
димые для него гены. Этот способ движения,
по-видимому, требует образования слизи.
2.6.2. Жгутики представляют собой
вращательные органеллы,
обеспечивающие движение клеток
К настоящему времени накоплена обширная ин-
формация об ультраструктуре, сборке и регуля-
ции синтеза жгутиков, а также их роли в хемо-
таксисе (см. разд. 20.5 и 24.1). Количество жгути-
ков, их локализация, диаметр, длина волны этих
спиралевидных органелл и амплитуда спирали ге-
нетически детерминированы, высокоспецифичны
для каждого организма и имеют значение таксо-
номических признаков. Наиболее распространены
два типа жгутикования: полярный и перитрихи-
альный; полярные жгутики служат для движения
в жидкой среде, тогда как латеральные —для ро-
ения на влажной твердой поверхности (рис. 2.19).
Если у одного организма возможно образование
жгутиков обоих типов (как, например, у пред-
ставителей Proteus и Ser ratio), одновременно они
встречаются лишь в редких случаях.
Типичный жгутик грамотрицательной бакте-
рии состоит из трех частей: белковой нити —
спиралевидно извитого полого цилиндра диамет-
ром 15-20 нм, образованного молекулами белка
монополярное
монстр их иалыное
Типы жгутикования
биполярное
политрихиальное перитрихиальное
(амфитрихиальное)
Spirillium
Proteus
Vibrio
А
Рис. 2.19. Жгутики прокариот.
А. Типы расположения жгутиков. По [12].
Б. Негативно контрастированный жгутик
Pseudomonas facilis. Видны отдельные
молекулы флагеллина. Шкала 50 нм.
По [4].
В. Негативно контрастированные пуч-
ки жгутиков у метаногенной археи
Methanococcus jannaschii, выделенной
из подводных гидротермальных вентов.
Шкала 0,5 мкм. П [18].
Г и Д. Периплазматические фибриллы у
спирохет. По [39].
Г. Поперечный срез клетки.
Д. Продольный срез.
Глава 2. Клеточная и субклеточная организация прокариот 65
Рис. 2.20. F-пили и «пили» 1
типа.
А. Электронная микрофото-
графия (негативно контрасти-
рованный препарат) клетки
Е. coli, имеющей два F-пиля
(П), с прикрепленным к ним
специфичным бактериофа-
гом (MS2) (ср. рис. 2.3. В).
Видны также «пили» 1 типа
(фимбрии, Ф). Шкала 0,2 мкм.
По [40].
Б. Клетки Е. coli с «пиля-
ми» 1 типа (фимбрии, Ф)
(негативно контрастированный
препарат). Шкала 0,2 мкм.
Фото любезно предоставлено
В. Vogt.
флагеллина (рис. 2.19, Б), «крючка», и сложноор-
ганизованного базального тельца, которое обеспе-
чивает закрепление жгутика в клеточной стенке и
его вращение относительно клетки (см. рис. 20.21
и 24.2). Два внешних кольца, L и Р, по-видимому,
функционируют как подшипники для жгутика.
Они прикреплены соответственно к наружной
мембране и пептидогликановому слою; у грам-
положительных бактерий эти диски отсутствуют.
Комплекс, состоящий из М/S колец, компонен-
тов включающего аппарата (ответственного за
направление вращения) и аппарата выделения
(участвующего в росте жгутиков), образует внут-
реннюю часть базального тельца и размещает-
ся в плоскости плазматической мембраны. Ба-
зальное тельце, окруженное интегрированными в
мембрану компонентами системы движения, опо-
средует неясным пока способом вращение жгути-
ка относительно статических компонентов струк-
туры. Движущей силой вращения служит про-
тонный градиент (или, у некоторых бактерий,
натриевый градиент) между наружной стороной
периплазмы и цитоплазмой (см. гл. 20; сборка
жгутиков описана в разд. 23.9 и 24.1).
У спирохет движение обеспечивают нитевид-
ные структуры, закрученные вокруг спирально
изогнутого цилиндра клетки (рис. 2.19). По стро-
ению эти периплазматические «фибриллы» сход-
ны со жгутиками, но в отличие от них не вы-
ходят на поверхность клетки (в среду), находясь
под чехлом, покрывающим клетку. Движение спи-
рохет не имеет характера плавания или рывков,
наблюдаемых у других бактерий; оно обусловле-
но сокращениями, колебаниями, изгибанием, об-
разованием волн и вибрацией чрезвычайно гибкой
клетки под влиянием периплазматических фиб-
рилл. Археи сходны по типам жгутикования с бак-
териями. Помимо одного или нескольких жгути-
ков у них наблюдаются также пучки жгутиков
(рис. 2.19, В). По ультраструктуре жгутики архей
также в основном подобны жгутикам бактерий.
У большинства прокариот движение обеспе-
чивают жгутики. Тип жгутикования и струк-
турные особенности жгутиков генетически де-
терминированы. Жгутик представляет собой
образованную белковыми субъединицами (моле-
кулами флагеллина) трубковидную структуру,
снабженную «крючком» и базальным тельцем,
закрепляющим жгутик в клеточной оболочке.
Базальное тельце функционирует как мотор жгу-
тика по типу корабельного винта. У спирохет дви-
жение обеспечивают периплазматические фиб-
риллы. Жгутики архей в основном сходны по
строению со жгутиками бактерий.
2.6.3. Пили, фимбрии и адгезины опосредуют
межклеточное распознавание
Взаимодействие бактерий с внешними телами
(неспецифичное или специфичное прикрепление
к поверхности и реакции распознавания) мо-
жет происходить с участием фимбрий и пилей
(рис. 2.1 и 2.20; см. также разд. 23.8). Фим-
брии и пили представляют собой нитевидные кле-
66 Часть I. Прокариотическая клетка
точные придатки диаметром 3-10 нм, варьирую-
щие по длине. Они построены из белковых субъ-
единиц, формирующих спиралевидную трубча-
тую органеллу. Наличие таких фибриллярных
придатков обеспечивает прикрепление к поверх-
ностям, несущим тот же заряд, что и клеточ-
ная стенка. По-видимому, фимбрии и пили про-
никают сквозь «облако» поверхностного заря-
да, которое иначе препятствует прикреплению,
вследствие взаимоотталкивания. Пили, например
F-типа у Escherichia coli, способствуют на пер-
вом этапе конъюгации специфическому взаимо-
действию с клетками-партнерами, тогда как фим-
брии (включая «пили» 1 типа у Е. coli) функ-
ционируют менее специфично. F-пили, подобно
другим клеточным придаткам, могут также слу-
жить рецепторами для бактериофагов (рис. 2.3, В
и 2.20, А).
У клеток Enterococcus faecalis после ин-
дукции половыми феромонами на определен-
ных участках поверхности формируются волосо-
видные структуры — адгезины, обеспечивающие
высокоспецифичное эффективное распознавание
клеток-партнеров (рис. 2.3, Е).
Фимбрии, пили и адгезины опосредуют
прикрепление клеток к поверхностям и межкле-
точное распознавание.
2.7. Бактерии могут образовывать споры и другие покоящиеся формы
Споры и другие покоящиеся формы формируют-
ся у бактерий в процессе клеточной дифферен-
цировки, направленной на выживание в небла-
гоприятных условиях. Известны различные по
структуре, составу и развитию типы таких диф-
ференцированных клеток (рис. 2.21). Хорошо изу-
чены эндоспоры у грамположительных бакте-
рий (роды Bacillus, Clostridium, Sporolactobacillus,
Sporosarcina, Thermoactinomyces) и у грамотрица-
тельной бактерии Sporomusa, цисты у Azotobacter
arthrospora и Methylocystis, конидиальные споры
у Streptomyces, различные покоящиеся формы у
цианобактерий (например, гормоцисты Westiella,
беоцисты или эндоспоры у Pleurocapsa, акине-
ты у Anabaena, экзоспоры у Chamaesiphon) и
формы, называемые экзоспорами, у грамотрица-
тельных бактерий, в том числе миксоспоры у
миксобактерий (Myxococcus, Stigmatella). Эти пе-
реживающие формы хорошо видны в световом
микроскопе как яркие клетки, поскольку отлича-
ются по светопреломлению от вегетативных кле-
ток (рис. 2.5, А и Б).
Известны следующие способы формирования
переживающих стадий.
1. Дифференцировка настоящих эндоспор внут-
ри вегетативных клеток у грамположитель-
ных бактерий (см. разд. 25.1).
2. Превращение вегетативных клеток в устой-
чивые формы, главным образом путем утол-
щения клеточных стенок (цисты, или арт-
роспоры, миксоспоры, акинеты). Примером
подобных структур могут служить экзо-
споры Methylosinus trichosporium; они об-
разуются путем почкования вегетативных
клеток с утолщением клеточной стенки.
У Rhodomicrobium vannielii на конце просте-
ки, находящейся на конце клеточной нити,
образуются кластеры необычных покоящих-
ся клеток, в некоторой степени сходных с
экзоспорами Methylosinus. Образование спор
у Streptomyces и Myxobacterium описано в
разд. 25.2 и 25.3.
В благоприятных условиях переживающие
формы «прорастают». Прорастанию предшеству-
ет оводпепие и набухание с последующей быст-
рой дезинтеграцией наружных слоев оболочки и
образованием трещин. После разрушения оболоч-
ки развиваются типичные вегетативные клетки.
Молекулярные аспекты спорообразования рас-
смотрены в гл. 25.
Некоторые бактерии способны образовывать
формы, обеспечивающие выживание в неблаго-
приятных условиях — эндоспоры, цисты, или арт-
роспоры, акинеты и экзоспоры (включая миксо-
споры).
Глава 2. Клеточная и субклеточная организация прокариот 67
Рис. 2.21. Переживающие формы бактерий.
А. Ультратонкий срез клетки Clostridium
formicoaceticum на поздней стадии спорообра-
зования. Стрелкой указаны гранулы запасных
веществ. Шкала 0,5 мкм. По [4].
Б. Клетки Sporomusa sp. (световая микро-
скопия). Видны вегетативные клетки, клетки,
формирующие эндоспоры, и свободные споры.
Шкала 2 мкм. По [41].
В. Ультратонкий срез клетки Bacillus polymyxa с
прорастающей спорой. Внешняя оболочка споры
нарушена. Шкала 0,1 мкм. Э — экзоспориум;
ВОС — внутренняя оболочка споры; НОС —
наружная оболочка споры; КС — кортекс споры.
По [41].
Г. Ультратонкий срез клетки Azotobacter
vinelandii. Видны цисты. Шкала 0,2 мкм. Эз —
экзин; Пгб — полигидроксибутират; В — везику-
лярная интина. По [43].
Д. Нити цианобактерии Cylindrospermum sp.,
выращенной в отсутствие связанных источ-
ников азота (световая микроскопия). Хорошо
видны терминальные гетероцисты (Г) и суб-
терминальные акинеты (А). Шкала 20 мкм.
По [26].
Дополнительная литература
Методы
Aldrich H.S., Todd W. J. eds. (1986) Ultrastructure
techniques for microorganisms. New York: Plenum
Press.
Glauert A. M , ed. (1985) Practical methods in electron
microscopy. Vol. 10: Robards A. W., SleytrU. B.
(eds.) Low temperature methods in biological electron
microscopy. Amsterdam: Elsevier.
Hancock I., Poxton I. (1988) Bacterial cell surface
techniques. Chichester: Wiley.
Harris I. R., Horne R. W. (1994) Negative staining: a brief
assessment of current technical benefits, limitations
and future possibilities. Micron 25: 5-13.
Mayer F., ed. (1988) Methods in microbiology, vol. 20.
Electron microscopy in microbiology. London
Academic Press.
Pawley J., ed. (1995) Handbook of biological confocal
microscopy. 2nd edn. New York: Plenum Press.
White J. C., Amos W. B., Fordham M. (1987) An eva-
luation of confocal versus conventional imaging of
structures by fluorescence light microscopy. J. Cell
Biol. 105: 41-48.
Структура прокариотических клеток
Beveridge T. J. (1995) The periplasmic space and the
periplasm in Gram-positive and Gram-negative
bacteria. ASM News 61: 125-130.
Doyle R. J., Rosenberg M., eds. (1990) Microbial cell
surface hydrophobicity. Washington, DC: ASM Press.
Fuller R., Lovelock D. W., eds. (1976) Microbial
ultrastructure. London: Academic Press.
Kellenberger E. (1990) Intracellular organization of the
bacterial genome. In: Drlica K., Riley M. (eds.) The
bacterial chromatin. Washington, DC: ASM Press.
Mayer F. (1993) Principles of functional and structural
organization in the bacterial cell: «compartments»
and their enzymes. FEMS Microbiol. Rev., 104: 327-
346.
Mayer F. (1993) Cell structure. In: Rehm H.-.I., Reed C.
(eds) Biotechnology, 2nd edn., vol. 1: Sahm H. (ed.)
Biological fundamentals. Weinheim: VCH; 5-46.
Mayer F. (1986) Cytology and morphogenesis of bacteria.
Stuttgart: Borntrager.
Ofek I., Doyle R. J. (1994) Bacterial adhesion to cells and
tissues. New York: Chapman and Hall.
68 Часть I. Прокариотическая клетка
Источники рисунков
1. Triiper II. G., Pfennig N. (1981) In: Starr М.Р.,
Stolp H., Triipe H. G., Balows A., Schlegel II. G.
(eds.) The prokaryotes, vol. 1, Berlin, Heidelberg.
New York: Springer: 299-312.
2. Doddema.L.L, Vogels G.D. (1978) Appl. Environ.
IWtrobiol. 36: 752-754.
3. .larchau T. (1985) Untersuchungen zum Vbrkommen
und zur Haufigkeit von Proteinvorstufen bei der
Bildung von 1- und F-pili in Escherichia coli.
Doctoral Thesis, University of Gottingen.
4. Mayer F., ed. (1986) Cytology and morphogenesis of
bacteria. Berlin, Stuttgart: Gebriider Borntrager.
5. Braun M , Mayer F., Gottschalk G. (1981) Arch.
Microbiol. 128: 288-293.
6. Johannssen W., Schuette H., Mayor F. (1984) Arch.
Microbiol. 140: 265-270.
7. Gottschalk G., Andreesen .1. R., Hippe H. (1981)
The genus Clostridium (nonmedical aspects). In:
Starr M. P., Stolp H., Trilper H. G., Balows A.,
Schlegel H. G. (eds.) The prokaryotes, vol. 2. Berlin,
Heidelberg, New York: Springer: 1767-1803.
8. Kessel M., Cohen Y. (1982) Bacteriol. 150: 851-860.
9. Brock T. D. (1992) The genus Leucothrix. In:
Balows A., Trilper H.G., Dworkin M., Harder W.,
Schleifer K.-II. (eds.) The prokaryotes, 2nd edn.,
vol. 4. Berlin, Heidelberg, New York: Springer: 3247-
3255.
10. Kutzner H. J. (1981) The family Streptomycetaceae.
In: Starr M.P., Stolp H., Triiper H. G., Balows A.,
Schlegel H. G. (eds.) The prokaryotes, vol. 2. Berlin,
Heidelberg, New York: Springer: 2028-2090.
11. Andreesen M., Schlegel H. G., (1974) Arch.
Microbiol. 100: 351-361.
12. Cassone A., Garaci E. (1977) Can. .1. Microbiol. 23:
684-689.
13. SleytrU. B., Messner P. (1983) Annu. Rev.
Microbiol. 37: 311-339.
14. Handler O. (1979) Naturwissenschaften 66: 95-105.
15. Sleytr U. B. (1978) Int. Rev. Cytol. 53: 1-64.
16. Kleinig H., Sitte P. (1986) Zellbiologie. Stuttgart:
Gustav Fischer.
17. Antranikian G., Herzberg C., Mayer F., Gootschalk G.
(1987) FEMS Microbiol. Lett. 41: 193-197.
18. Jones W. J., Leigh.I. A., Mayer F., WoeseC. R.,
Wolfe R.S. (1983) Arch. Microbiol. 136: 254-261.
19. Unwin P. N. T., Henderson R. (1975) Mol. Biol. 94:
425-440.
20. Drews G., Imhoff J. F. (1991) Phototrophic purple
bacteria. In: Shively J. M., Barton L. I. (eds.)
Variations in autotrophic life. London: Academic
Press; 75.
21. Remsen С. C. (1978) Comparative subcellular
architecture of photosynthetic bacteria. In:
Clayton R. K., Sistron W. R., (eds.) The
photosynthetic bacteria. New York, London: Plenum
Press; 3160.
22. Remsen С. C.. Watson S.W., Waterbury J. B.,
Triiper H.G. (1968) J. Bacteriol. 95: 2374-2392.
23. Varga A. R., Staehelin L. A. (1983) J. Bacteriol. 154:
1414-1430.
24. Staehelin L. A., Golecki .1. R., Drews G. (1980)
Biochim. Biophys. Acta, 5879: 30-45.
25. Staehelin L. A., Golecki J. R., Fuller R. C., Drews G.
(1978) Arch. Microbiol., 119: 269-277.
26. Stanier R. Y., Pfennig N., Triiper H.G. (1981)
Introduction to the phototrophic bacteria. In:
Starr M.P., Stolp H., Triiper II G., Balows A.,
SchlerelH. G. (eds.) The proraryotes, vol. 1, Berlin,
Heidelberg. New York: Springer: 197-211.
27. Bryant D. A., Gugliehni G., Taudeau de MarsacN.,
Castets A., Cohen-Bazire G. (1977) Arch. Microbiol.
123: 113-127.
28. Remsen C.C., Valois F.M., Watson S.W., (1967)
J. Bacteriol. 94: 422-433.
29. Schlegel H. G. (1986) General microbiology. 6th edn.
Cambridge: Cambridge University Press.
30. Alberts B., Brey D., Lewis J., RaffM., Roberts K.,
Watson J. D. (1987) Molekularbiologie Zelle, 2nd
edn. Weinheim: VCH.
31. Cassone A., Garaci E. (1977) Can. J. Microbiol. 23:
684-689.
32. Griffith J.D. (1976) Proc. Natl. Acad. Sci. USA 73:
563-567.
33. Rogers H. J. (1983) Bacterial cell structure
Wokingham: Van Nostrand Rienhokl.
34. YamkaloB. A., Miller Jr., O. L. (1973) Annu. Rev.
Biochem. 42: 379-396.
35. Lehman H. (1979) Biologie in Unserer Zeit (BIUZ)
9: 129-134.
36. Shively J. V. (1974) Annu. Rev. Microbiol. 28: 167-
187.
37. Balkwill D. L., MarateaD., Blakemore R. P. (1980)
J. Bacteriol. 141: 1399-1408.
Глава 2. Клеточная и субклеточная организация прокариот 69
38. Alberts В., Bray D., Lewis J., RaffM., Roberts К.
Watson.I. D. (1983) Molecular biology of the cell.
New York, London: Garland.
39. Margulis L., To L. P., Chase D. G., (1981) The
Genera Pillotina, Hollandina, and Diplocalix.
In: Starr M.P., Stolp H., Triiper H. G., Balows A.,
Schlegel IL G. (cds.) The prokaryotes, vol. 1. Berlin,
Heidelberg, New York: Springer: 548-554.
40. Streycr L. (1981) Biochemistry. San Francisco:
Freeman.
41. Muller B., Ossmer R., Howard В. H., Gottschalk G.,
Hippe II. (1984) Arch. Microbiol. 139: 388-396.
42. GhuysenJ. A., Shockman G. D. (1973) Biosyn-
thesis of peptidoglycan. In: Leive L. (ed.) Bacterial
membranes and walls. New York: Dekker: 37-130.
43. Lin L. P., PankratzS., Sadoff H. L. (1978) J. Bacte-
rio!. 135: 641-646.
Часть II
ОСНОВЫ ЖИЗНЕДЕЯТЕЛЬНОСТИ
МИКРОБНЫХ КЛЕТОК
Эта часть книги посвящена описанию процессов
метаболизма. У прокариот метаболизм протека-
ет в условиях слабо выраженной компартмента-
ции клеток (см. ч. I), что отличает их от эука-
риот, клетки которых содержат разнообразные
органеллы. В бактериальной клетке можно выде-
лить лишь такие компартменты, как цитоплаз-
ма (включающая нуклеоид как область лока-
лизации хромосомы), плазматическая мембрана,
периплазматическое пространство (у грамотрица-
тельных бактерий) и наружные слои клеточной
стенки. В первых главах этой части рассматри-
ваются основные клеточные механизмы преобра-
зования энергии и энергетического сопряжения,
пути катаболизма и получение клетками энер-
гии из экзогенных субстратов. Глава 3 посвящена
анализу синтеза АТР по механизму субстратно-
го фосфорилирования — процесса, сопряженного
с расщеплением высокоэнергетических интерме-
диатов катаболизма, например гликолиза, и про-
текающего в цитоплазме. В гл. 4 описывается
механизм электронтранспортпого фосфорилиро-
вания-процесса синтеза АТР с использованием
электрохимического протонного потенциала на
мембране при дыхании и фотосинтезе. В гл. 5
рассмотрены разнообразные функции плазмати-
ческой мембраны, в том числе механизмы транс-
порта веществ. Глава 6 посвящена описанию
роста микроорганизмов — принципов питания,
стадий развития культур, способов культивирова-
ния и методов измерения роста. В гл. 7 подробно
рассматриваются процессы биосинтеза клеточных
строительных блоков, необходимых для построе-
ния макромолекул; пути их синтеза описаны для
случаев использования наиболее предпочтитель-
ных субстратов, таких как глюкоза, аммоний,
фосфат и сульфид в качестве источников углеро-
да, азота, фосфора и серы соответственно. Прин-
ципы описываемых в этой части книги процессов
одинаковы у всех микроорганизмов.
Глава 3
Субстратное фосфорилирование
Протекающие в клетке биохимические реакции,
в совокупности называемые метаболизмом, мож-
но разделить па два типа — процессы катаболиз-
ма, или энергетического метаболизма, обес-
печивающие синтез АТР из ADP и Р;, и процессы
анаболизма, или биосинтетические процес-
сы, требующие затраты энергии, т. е. сопряжен-
ные с гидролизом АТР и высвобождением ADP
и Pi либо АМР и пирофосфата, распадающего-
ся далее до Р, (рис. 3.1). Кроме реакций биосин-
теза, энергия гидролиза АТР (или других экзер-
гонических реакций, связанных с синтезом АТР)
необходима для движения клеток (см. разд. 2.6),
Рис. 3.1. Катаболизм и анаболизм — два типа метабо-
лических путей. При катаболизме происходит образова-
ние АТР, в реакциях анаболизма и других процессах —
гидролиз АТР.
транспорта веществ через цитоплазматическую
мембрану (см. гл. 5) и регуляторных процессов
(см. гл. 20). В данной главе будут рассмотрены ос-
новные принципы катаболизма на примере анаэ-
робного процесса гликолиза и аэробного процесса
окисления глюкозы до СО2 (см. разд. 9.11).
3.1. Синтез АТР сопряжен с экзергоническими реакциями окисления
Катаболические процессы направлены главным
образом на обеспечение эффективного синтеза
АТР из ADP и Р;, фосфорилирования. Для
протекания эндергонической реакции фосфори-
лирования в большинстве случаев использу-
ется энергия, высвобождаемая в экзергониче-
ских окислительно-восстановительных процессах.
Сопряжение окислительно-восстановительных ре-
акций с фосфорилированием происходит либо
на уровне превращений субстрата (субстратное
фосфорилирование, СФ), либо при функци-
Рис. 3.2. Упрощенная схема образования АТР при суб-
стратном и электронтранспортном фосфорилировании.
В каждом из этих двух процессов происходит перенос
фосфорильной группы от фосфорной кислоты на ADP.
[Н] — восстановительные эквиваленты.
Глава 3. Субстратное фосфорилирование 73
опировании электротранспортной цепи, по ко-
торой электроны переносятся от донора па ак-
цептор (окислительное, или электронтранс-
портное, фосфорилирование, ЭТФ; см. гл. 4
и 12). В обоих случаях происходит перенос
фосфорильной группы, образующейся из Pi, на
ADP с образованием АТР. В качестве примеров
окислительно-восстановительных реакций, кото-
рые служат источниками энергии для синтеза
АТР, на рис. 3.2 показано окисление альдегида
с образованием карбоновой кислоты (сопряжен-
ное с СФ) и восстановление кислорода до воды
в дыхательной цепи (сопряженное с ЭТФ). При
субстратном фосфорилировании фосфорильная
группа вначале присоединяется к субстрату с
образованием высокоэнергетического соединения,
тогда как при электроптрапспортном фосфорили-
ровании она выступает в качестве интермедиата,
образующегося в активном центре АТР-синтазы
(см. гл. 4).
3.2. Выход АТР зависит от изменения свободной энергии
в сопряженной с фосфорилированием реакции
Количество образующегося АТР (выход АТР)
определяется главным образом величиной изме-
нения свободной энергии в реакции, сопряженной
с его синтезом (см. дополнение 3.1). Это можно
проиллюстрировать сравнением выхода АТР при
расщеплении глюкозы в аэробных и анаэробных
условиях.
Многие бактерии получают АТР в процес-
се расщепления глюкозы. Начальный этап рас-
щепления глюкозы — это превращение ее в пиру-
ват, как правило по пути Эыбдена-Мейергофа-
Парнаса (гликолиз до стадии образования пи-
рувата; рис. 3.3). Далее пируват у анаэробных
бактерий восстанавливается, например до лакта-
та (рис. 3.3, А), тогда как у аэробных бактерий
он обычно окисляется до СО2 (рис. 3.3, Б). При
аэробном расщеплении глюкозы суммарное изме-
нение свободной энергии (AG07) составляет:
Глюкоза + 6O2 —» 6СО2 + 6Н2О (3.1)
AG07 = —2830 кДж/моль глюкозы
Эта величина существенно больше, чем суммар-
ное изменение свободной энергии при сбражива-
нии глюкозы с образованием лактата:
Глюкоза —> 2Лактат + 2Н+
AG07 = —198 кДж/моль глюкозы
(3.2)
Отсюда следует, что выход АТР в расчете на
1 моль глюкозы в аэробных условиях намного
выше, чем в анаэробных. Окисление глюкозы
до пирувата сопряжено с субстратным фосфо-
рилированием и приводит к образованию 2 моль
ATP/моль глюкозы. Восстановление кислорода в
дыхательной цепи сопряжено с электронтранс-
портным фосфорилированием, при котором обра-
зуется 34 моль АТР/моль глюкозы. Анаэробное
восстановление пирувата до лактата не сопряже-
но с фосфорилированием.
Механизмы сопряжения окислительно-восста-
новительных реакций с фосфорилированием (СФ
и ЭТФ) обеспечивают запасание в форме энер-
гии АТР части (пр • AGp) выделяющейся в них
свободной энергии (AG, Дж/моль потребленно-
го субстрата, S) (рис. 3.4). Остальная высвобож-
даемая в этих реакциях энергия превращается в
тепловую. Соотношение той части изменения сво-
4[Н]
12Пируват) | 2Лактоза |
| Глюкоза | |2Пируват[
2ADP
+ 2Р,
Б
А
Рис. 3.3. Суммарный энергетический выход анаэробного
процесса гликолиза (А) и аэробного окисления глюкозы
(Б). СФ сопряжено с образованием восстановительных
эквивалентов ([Н]), ЭТФ — с восстановлением Ог-
74 Часть II. Основы жизнедеятельности микробных клеток
Рис. 3.4. Сопряжение экзергонической химической ре-
акции (S —* Р) с образованием АТР из ADP и Р,. ДО —
изменение свободной энергии в химической реакции (в
кДж/моль S), ДСр — свободная энергия, необходимая
для синтеза АТР (кДж/моль АТР), пр — число моль
АТР на 1 моль субстрата.
бодной энергии, которая запасается в форме АТР,
и всей величины изменения свободной энергии в
реакции, сопряженной с фосфорилированием, на-
зывают энергетической эффективностью процес-
са (ту; см. дополнение 3.2):
т; = zipAGp/AG, (3.3)
где т?.р обозначает количество синтезированного
АТР (моль ATP/моль потребленного субстрата)
и AGp — изменение свободной энергии, необходи-
мое для синтеза АТР (кДж/моль АТР).
Дополнение 3.1. Протекающие в живых
организмах процессы подчиняются законам
термодинамики. Энергия в этих процессах не
образуется de novo и не исчезает (первый за-
кон термодинамики), но лишь переходит из
одной формы в другую. Вместе с тем клет-
ки не способны превращать тепловую энер-
гию в другие формы энергии, но эти другие
формы энергии могут переходить при жизне-
деятельности клеток в теплоту (второй закон
термодинамики). Эти правила применимы ко
всем реакциям метаболизма и, в частности,
объясняют сопряженные реакции (см. допол-
нение 3.2).
Энергетическая эффективность может варьи-
ровать от 0 до 1. В большинстве катаболических
процессов, например при сбраживании глюкозы
до лактата [реакция (3.2)], энергетическая эффек-
тивность синтеза АТР близка к 0,5. Зная измене-
ние свободной энергии в реакции фосфорилирова-
ния (AGp) и в реакции, с которой оно сопряжено
(AG), с помощью уравнения (3.3) можно рассчи-
тать выход АТР.
Дополнение 3.2. Теоретически изменение
свободной энергии (AG) в реакции S —> Р, со-
пряженной с фосфорилированием, могло бы
полностью использоваться для синтеза АТР
(т7.р - AGp) (рис. 3.4). Если реакция фосфо-
рилирования была бы сопряжена с «движу-
щей» реакцией идеальным образом, энергети-
ческая эффективность (г/) составляла бы 1 и
количество образовавшегося АТР (?ip) равня-
лось соотношению AG/AG', [уравнение (3.3)].
Для этого суммарный процесс должен быть
близок к состоянию равновесия и, кроме то-
го, его скорость должна быть бесконечно низ-
кой. Однако скорости метаболических реак-
ций весьма значительны и эти реакции часто
далеки от равновесного состояния, поэтому
часть энергии, высвобождаемой в «движу-
щей» реакции, теряется в виде теплоты и ве-
личина т) всегда меньше единицы.
Как указано в дополнении 3.3, изменение сво-
бодной энергии в реакции зависит от концентра-
ций реагентов. Значения AG° для реакций сбра-
живания глюкозы при различных концентрациях
реагентов (табл. 3.1) рассчитываются по уравне-
нию (3.4):
AG = AG° + ЛТ In (3 4)
[глюкоза]
При нейтральном значении pH величина AG по-
чти вдвое больше, чем при стандартных условиях
(1 М Н+). Уменьшение концентрации глюкозы и
лактата па два порядка приводит к возрастанию
величины AG (отрицательной) всего лишь на 5%.
Энергию, необходимую для синтеза АТР при
pH 7 в реакции (3.5), называют потенциалом фос-
форилирования (AGp) и рассчитывают по урав-
нению (3.6) из соотношения концентраций АТР,
ADP и Pi в клетках, предполагая, что все эти ре-
агенты присутствуют в цитоплазме в доступной
для реакции форме:
ADP + Р. + Н+ -> АТР + Н2О (3.5)
= + RT111 [ADP] [Pj]
При росте бактерий концентрации АТР и ADP
в клетках примерно равны. С учетом того, что
Глава 3. Субстратное фосфорилирование 75
AGp — 32 кДж/моль АТР и [Pi] = 10 мМ, энер-
гию, необходимую для синтеза 1 моль АТР (AGp),
можно рассчитать как 44 кДж. Эту величину
следует рассматривать лишь как грубую оцен-
ку, поскольку действительные цитоплазматиче-
ские концентрации реагентов в форме, доступной
для реакции, неизвестны. Часть их, по-видимому,
связана с белками, и часть этих нуклеотидов при-
сутствует в клетках в виде комплексов с ионами
магния.
В случае сбраживания глюкозы деление
величины AG0/ (198 кДж/моль глюкозы; см.
табл. 3.1) на AGp (44 кДж/моль АТР) дает зна-
чение 4,5 моль ATP/моль глюкозы — это теоре-
тический выход АТР при сбраживании глюко-
зы до лактата, который был бы возможен в
случае максимальной энергетической эффектив-
ности процесса = 1). Фактический выход со-
ставляет 2 моль ATP/моль глюкозы. Таким обра-
зом, согласно уравнению (3.3), 7] = 0,42.
Дополнение 3.3. Изменение свободной
энергии в реакции S —> Р зависит от того, на-
сколько концентрации реагирующих веществ
([ ]) близки к равновесным ([ ]равн.)-
&G = RT lni-f
Г, _ [Р]равн.
лравн. rQi
|р]равн.
(3-7)
(3-8)
Величина AG, рассчитанная для условий
протекания реакции в водном растворе при
концентрации реагентов 1 М и температуре
25 °C, называется изменением стандартной
свободной энергии (AG°). В случае концен-
трации реагентов 1 М уравнение (3.7) превра-
щается в уравнение (3.9), связывающее AG°
реакции с константой равновесия (А'равн.):
AG° — —7?Tln/<paBH. (3.9)
Объединив уравнения (3.7) и (3.9), получа-
ем уравнение (3.10), которое позволяет найти
AG по величинам AG° (или константы рав-
новесия Кравн.) и концентраций реагентов:
AG = AG° + RT In И (3.10)
[Ь|
В случае экзергонических реакций величина
AG < 0. Изменение стандартной свободной
энергии в реакциях, протекающих с выделе-
нием или поглощением протонов, обычно рас-
считывается для pH 7 (не одномолярной кон-
центрации Н+) и концентрации всех осталь-
ных реагентов 1 М. Эту величину обозначают
символом AG0/, тогда как изменение свобод-
ной энергии в таких реакциях, протекающих
при pH 7 и концентрациях реагентов, отлич-
ных от 1 М, — символом AG'.
Таблица 3.1. Изменение свободной энергии при сбражи-
вании глюкозы до лактата в зависимости от концентра-
ций веществ
Глюкоза, М Лактат, М pH AG, кДж/моль глюкозы
1 1 10-2 См. уравнени уравнению (3 Т = 298 К. Е чин изменени образования 1 1 10“2 е (3.2). Велич .4), где R = величины AG° я стандартной эеагентов, по 0 7 7 ина AG рассч 8,3 10~3 кДж рассчитаны н свободной энер hauer et al., 1{ -118 (AG°) -198 (AG0/) -209 итана согласно К-1-моль-1 и а основе вели- чии в реакциях )77.
3.3. Для сопряжения синтеза АТР с расщеплением глюкозы
необходим разрыв связи С—С и последующее
окисление образовавшихся продуктов
Гликолиз —это основной путь расщепления глю-
козы до пирувата у большинства аэробных бакте-
рий и бактерий-бродилыциков (рис. 3.5; см. также
разд. 9.11). На его начальном этапе глюкоза в ре-
зультате двух реакций фосфорилирования (с ис-
пользованием АТР) и реакции изомеризации пре-
вращается во фруктозо-1,6-бисфосфат. Далее в
альдолазной реакции этот продукт расщепляется
Часть II. Основы жизнедеятельности микробных клеток
Глице рал ьдегид-
3-фосфат
Глицеральдегид-
фосфат-
дегидрогеназа
Фосфоглицерат-
киназа
НО - СН;
| Д-Р-Глюкоза |
Гексокиназа
ОН
О
он о
• 11
© - о - сн2 - сн - с - н
Трнозофосфат-изомераза
Фрукгозобисфосфат-альдолаза
Дигидрокси-
— С — СН, — О — © ацетон-
/ фосфат
СН2- _
*
NAD+P-
NADH-*
он о
I II
©—о — сн2 — сн — с — о — ©
Japp;
ОН О
I И
©-о- сн2 — сн- с - о
тктр;
Фосфоглицеромутаза
Енолаза
о о
I II
но - сн2 — сн- с - о"
I ®
Н2О
Н2С=С —С —О”
Пируваткиназа
ТкТГ
_J о о
II 11
HjC-C-C-O'
Рис. 3.5. Интермедиаты и фермен-
ты пути Эмбдена-Мейергофа-Парнаса
(гликолиза). Р — фосфорильный оста-
ток.
О О
^РГ
два триозофосфата (глицсральдегид-3-фосфат
дигидроксиацетонфосфат), концентрации ко-
рых равновесны в результате активности три-
эфосфат-изомеразы. Последующее окисление
ицеральдегид-3-фосфата до 3-фосфоглицерата
едставляет собой с энергетической стороны
нтральный этап гликолиза. В реакции, катали-
руемой глицеральдегидфосфатдегидрогепазой,
разуется фосфоацил ангидрид (высокоэпер-
гическое соединение 1,3-бисфосфоглицсрат),
от которого фосфорильная группа переносит-
ся па ADP с образованием АТР. Образую-
щийся при этом 3-фосфоглицерат изомеризу-
ется в 2-фосфоглицерат, который дегидратиру-
ется с образованием фосфо енол пиру вата, так-
же высокоэнергетического фосфата. Гликолиз
завершается переносом фосфорильной группы от
фосфоенолпирувата на ADP, и таким образом
энергия вновь запасается в виде АТР. При этом
происходит таутомеризация енола в пируват.
Глава 3. Субстратное фосфорилирование 77
Энергетику отдельных реакций гликолиза ил-
люстрирует рис. З.б. По оси ординат на нем от-
ложена свободная энергия интермедиатов глико-
лиза с точкой отсчета от уровня лактата, Р, и Н2
(без учета свободной энергии взаимопревращений
NAD+, NADH, ADP и АТР). В качестве продукта
глицеральдегидфосфатдегидрогеназпой реакции
рассматривается молекулярный водород с учетом,
что он потребляется при восстановлении пирува-
та до лактата. Величины свободной энергии при-
ведены для стандартных условий и pH 7 (не для
реальных внутриклеточных концентраций интер-
медиатов гликолиза при росте бактерий). Сво-
бодная энергия интермедиатов постепенно воз-
растает от глюкозы к глицеральдегид-3-фосфату.
Резкое ее увеличение происходит при окислении
глицеральдегид-3-фосфата, что отражает образо-
вание высокоэнергетической фосфатной связи в
продукте реакции 1,3-бисфосфоглицерате. В об-
щем процессе это увеличение свободной энер-
гии сбалансировано протеканием экзергонической
реакции восстановления пирувата до лактата, по-
скольку данные две реакции сопряжены через пе-
репое водорода посредством NAD. Резкое умень-
шение свободной энергии происходит в реакциях,
сопряженных с синтезом АТР (фосфоглицератки-
пазной и пируваткиназной). По расчету для стан-
дартных условий в каждой из этих реакций выде-
ляется энергия в количестве примерно 120 кДж
на 1 моль АТР.
Одна из удивительных особенностей глико-
лиза — расходование 2 моль АТР на фосфори-
лирование гексозы, что неожиданно для пути,
направленного на образование АТР. Смысл обра-
зования фруктозо-1,6-бисфосфата перед расщеп-
лением молекулы глюкозы состоит в том, что
наличие двух отрицательно заряженных фосфат-
ных групп, расположенных в молекуле фруктозо-
1,6-бисфосфата близко друг к другу, способству-
ет протеканию альдолазной реакции. Тем нс менее
эта реакция остается эндергонической в стандарт-
ных условиях. Следовательно, равновесные кон-
центрации продуктов реакции существенно ниже,
чем субстрата. Расщепление фруктозы или фрук-
тозо-б-фосфата в гипотетическом альтернатив-
ном пути давало бы энергии примерно на 10 кДж
меньше, чем расщепление фруктозо-1,б-бисфос-
фата, а равновесные концентрации продуктов
были бы па порядок ниже, чем в альдолазной ре-
акции. Вследствие этого скорость реакций, следу-
ющих за реакцией разрыва С—С-связи, была бы,
по-видимому, недостаточной для выполнения гли-
колизом его катаболической функции.
Рис. 3.6. Энергетический профиль реакций гликолиза.
По оси ординат отложена стандартная свободная энер-
гия интермедиатов гликолиза с точкой отсчета от уров-
ня лактата, Р, и Нг- Изменения свободной энергии, свя-
занные с превращениями ADP/ATP и NAD+/NADH,
при построении диаграммы не учитывались.
3.4. При субстратном фосфорилировании происходит образование
высокоэнергетического соединения
Реакция, сопряженная с субстратным фосфори-
лированием, должна сопровождаться выделени-
ем большого количества энергии. Поскольку по-
тенциал фосфорилирования в растущих клетках
бактерий составляет примерно 50 кДж/моль АТР
и энергетическая эффективность катаболизма —
50%, изменение свободной энергии в реакции, со-
пряженной с образованием АТР, должно быть не
менее 100 кДж/моль АТР. В гликолитическом пу-
ти реакцией, которая служит движущей силой
для последующего синтеза АТР, является окисле-
ние глицеральдегид-3-фосфата с восстановлением
NAD+ (см. дополнение 3.4 и рис. 3.9). Механизм
этой реакции описан ниже.
78 Часть II. Основы жизнедеятельности микробных клеток
Рис. 3.7. Восстановление NAD+ и окисление NADH.
[Н~]— гидрид-ион, ферментативно отщепленный от
субстрата-донора: Рибоза — 1,5-замещенная рибоза.
NADP+ отличается от NAD+ наличием фосфатной
группы в 2/-положении остатка рибозы.
Дополнение 3.4. Никотин амидаденинди-
нуклеотид (NAD) и никотинамидаденинди-
нуклеотид-З'-фосфат (NADP) служат ос-
новными переносчиками восстановительных
эквивалентов, высвобождающихся и по-
требляемых в метаболических процессах
(рис. 3.7). Восстановление этих окисленных
пиридиновых нуклеотидов происходит при
переносе отрицательно заряженного иона
водорода Н~ (гидрид-иона) от субстрата
— донора электронов на пиридиновое коль-
цо. Восстановленные пиридиннуклеотиды —
NADH и NADPH —вновь окисляются при
переносе от них гидрид-иона на соответ-
ствующие акцепторы. Реакции обоих типов
катализируются специфическими дегидроге-
назами.
Окисление глицеральдегид-3-фосфата глицер-
альдегидфосфатдегидрогеназой происходит не
путем непосредственного отнятия гидрид-иона,
но через образование полумеркапталя путем
присоединения альдегида к SH-группе в актив-
ном центре фермента (рис. 3.9). Далее проис-
ходит перенос гидрид-иона от полумеркапталя
на NAD+, в результате чего образуется богатый
энергией тиоэфир. Последующий фосфоролиз
тиоэфира приводит к образованию ацилфосфата
(1,3-бисфосфоглицерата) с отщеплением его от
фермента. Большая часть свободной энергии,
выделяющейся в этой реакции, запасается в
высокоэнергетической ацилфосфатной группе
1,3-бисфосфоглицерата, которая служит доно-
ром фосфорила при образовании АТР из ADP
в происходящей затем фосфоглицераткиназной
реакции (рис. 3.5 и 3.9).
Рис. 3.8. Гипотетический путь отнятия гидрид-иона
от альдегида с образованием ацил-катиона (карбоний-
катиона) и взаимодействие последнего с Р, или НгО.
Дополнение 3.5. Окисление альдегида
с восстановлением NAD+ состоит в отня-
тии гидрид-иона от альдегида и переносе
его на NAD+ (рис. 3.8). При этом проис-
ходит образование в качестве интермедиа-
та ацил-катиона, соединенного с активным
центром фермента. Последующее присоеди-
нение к ацил-катиону Р, приводит к образова-
нию высокоэнергетического ацилфосфата —
продукта реакции. Ацил фосфаты служат
донорами фосфорильной группы при образо-
вании АТР из ADP и Р,, например в фосфо-
глицераткиназной реакции.
Способ запасания энергии при СФ можно
пояснить сравнением гипотетического меха-
низма окисления альдегида (рис. 3.8) с дей-
ствительным (рис. 3.9). По-видимому, тео-
ретически возможный механизм не реали-
зуется из-за высокой реакционноспособности
ацил-катиона, который не может быть ста-
билизирован в активном центре фермента.
Вероятным при таком гипотетическом пу-
ти превращением был бы гидролиз ацил-
катиона с образованием карбоксильной груп-
пы (рис. 3.8), т. е. окисление альдегида до
карбоновой кислоты без запасания энергии.
Напротив, стратегия СФ заключается в об-
разовании высокоэнергетического интерме-
диата, имеющего тенденцию к отщеплению
ацильной или фосфорильной группы, но дос-
таточно устойчивого к гидролизу или атакам
других нуклеофилов.
Ацилфосфаты (например, 1,3-бисфосфоглице-
рат), тиоэфиры (например, ацил-СоА) и АТР
называют высокоэнергетическими соединениями,
поскольку величины изменения стандартной сво-
бодной энергии в реакциях их гидролиза ниже
—30 кДж/моль. Эта свободная энергия гидроли-
Глава 3. Субстратное фосфорилирование 79
Таблица 3.2. Высокоэнергетические соединения, участвующие в субстратном фосфорилировании
Тип соединения Соединение Продукты гидролиза AG0' гидролиза, кДж/моль
Смешанные ангидриды фос- 1,3-Бисфосфоглицерат З-Фосфоглицерат + Р, -52
формой и карбоновых кислот А цетил фосфат Ацетат + Р, -45
Карбамоил фосфат НСО“ + NH^ + Pj -39
Фосфоангидриды АТР ADP + Pj -32
АТР AMP + РР; -42
PPi 2 Pi -22
ADP AMP + Pi -32
Фосфорные эфиры енолов ФЕП Пируват + Pj -52
Тиоэфиры карбоновых кислот Ацетил-СоА Ацетат + Co A -36
Пропионил-СоА Пропионат + CoA -36
Бутирил-СоА Бутират + CoA -36
Сукцинил-СоА Сукцинат + CoA -35
Рис. 3.9. Механизм глицеральдегидфосфатдегидрогеназной (А) и фосфоглицераткиназной (Б) реакций. H-S-E —
сульфгидрильная группа в активном центре дегидрогеназы.
Рис. 3.10. Глюкозо-6-фосфатдегидрогеназная реакция.
за обеспечивает перенос ацильной или фосфо-
рильной группы на нуклеофильное соединение,
например ADP. Величины изменения свободной
энергии в реакциях гидролиза различных высоко-
энергетических соединений приведены в табл. 3.2
(см. также дополнение 3.6).
Дополнение 3.6. При окислении глюкозо-
6-фосфата под действием глюкозо-6-фосфат-
дегидрогеназы в альтернативных гликолизу
путях катаболизма сахаров (рис. 3.10; гл. 9)
образуется эфир (6-фосфоглюконолактон) и
происходит восстановление NADP+.
Последующий гидролиз 6-фосфоглюконо-
лактона не сопряжен с образованием АТР, в
отличие от гидролиза тиоэфиров, поскольку
6-фосфоглюконолактон не относится к высо-
коэнергетическим соединениям. В глюкозо-
6-фосфатдегидрогеназной реакции полуаце-
тальная связь при С 1-атоме не превращает-
ся в полумеркапталь или другое альдегидное
производное, которое могло бы окисляться
с образованием высокоэнергетической свя-
зи. Таким образом, окисление глюкозы по
Cl-положению не приводит к субстратно-
му фосфорилированию и выход АТР в пу-
тях катаболизма, включающих окисление
глюкозо-6-фосфата (например, в 2-кето-З-
дезокси-6-фосфоглюконатном пути и гетеро-
ферментативном молочнокислом брожении;
см. разд. 9.11 и 12.2), составляет лишь 1 моль
АТР на моль глюкозы.
80 Часть II. Основы жизнедеятельности микробных клеток
3.5. Окисление пирувата сопряжено с запасанием энергии
У аэробных бактерий образующийся при ката-
болизме глюкозы пируват обычно окисляется до
СО2. Первый этап этого процесса — окисление пи-
рувата до ацетил-СоА с восстановлением NAD+ —
катализирует пируватдегидрогеназа:
Пируват + Со А + NAD+ —»
-> Ацетил-СоА 4- СО2 + NADH (3.11)
Пируватдегидрогеназа представляет собой муль-
тиферментный комплекс, в состав которого вхо-
дят три простатические группы: тиаминпирофос-
фат (ТПФ), липоат и FAD. Функция этих проста-
тических групп показана на рис. 3.11. На первом
этапе катализа пируват взаимодействует с ТПФ,
и продукт их реакции подвергается декарбоксили-
рованию. В результате образуется ацетальдегид,
связанный с ТПФ. Далее альдегид переносится
на окисленный липоат. На этом этапе происхо-
дит окисление связанного ацетальдегида с восста-
новлением липоата, связанного тиоэфирной свя-
зью с ацетильным остатком. После переноса аце-
тильной группы на СоА восстановленный липоат
окисляется с восстановлением NAD+, при участии
FAD в качестве переносчика водорода.
По механизму пируватдегидрогеназная реак-
ция сходна с глицеральдегид-3-фосфатдегидроге-
назной (рис. 3.9 и 3.11): в обоих случаях окис-
ление альдегидной группы субстрата приводит
к образованию высоксэпергетического соедине-
ния через образование тиоэфира как интерме-
диата. Кроме того, в обеих реакциях окисление
альдегидной группы происходит не путем непо-
средственного отщепления гидрид-иона. В слу-
чае пируватдегидрогеназной реакции к альдегид-
ной группе присоединяется ТПФ с образованием
С—С-связи и окисление происходит одновремен-
но с ее разрывом. Напротив, в глицеральдегид-
3-фосфатдегидрогеназной реакции альдегидная
группа субстрата присоединяется к SH-rpynne
фермента с образованием полу меркапталя, кото-
рый окисляется без расщепления связи субстра-
та с активным центром фермента. Продуктом
глицеральдегид-3-фосфатдегидрогеназной реак-
ции является ацилфосфат, в то время как
продукт пируватдегидрогеназной реакции — тио-
эфир. У многих анаэробных бактерий ацетил-СоА
превращается в ацетилфосфат [реакция (3.12)],
используемый далее для синтеза АТР из ADP [ре-
акция (3.13)]. Эти реакции катализируют соответ-
ственно фосфотрансацетилаза и ацетаткиназа:
Ацетил-СоА + Р, —»
—» Ацетилфосфат + СоА (3.12)
Ацетилфосфат + ADP —> Ацетат + АТР (3.13)
Рис. 3.11. Механизм пируватдегидрогеназной реакции с участием простетических групп [тиаминпирофосфата
(ТПФ) и липоата] и коферментов (СоА и NAD+).
Глава 3. Субстратное фосфорилирование 81
3.6. Катаболическая роль цикла трикарбоновых кислот состоит
в образовании восстановительных эквивалентов
для окислительного фосфорилирования
Из 24 восстановительных эквивалентов ([Н]),
образуемых при окислении глюкозы до СО2
(рис. 3.3, Б)у четыре высвобождаются в глико-
литическом пути, четыре —в пируватдегидроге-
назной реакции и остальные 16 — в цикле три-
карбоновых кислот (ЦТК) (табл. 3.3). Основная
цель образования [Н] состоит в том, чтобы обес-
печить процесс окислительного фосфорилирова-
ния восстановительными эквивалентами с наибо-
лее низким окислительно-восстановительным по-
тенциалом (см. дополнение 3.7 и гл. 7). Чем ниже
окислительно-восстановительный потенциал вос-
становительных эквивалентов, переносимых на
кислород, тем выше выход АТР при окислитель-
ном фосфорилировании.
В реакциях ЦТК происходит окисление аце-
тильной группы ацетил-СоА до СО2 с восстанов-
лением NAD+ и убихинона (Q):
Ацетил-СоА——> 2СО2 + CoASH
3NAD + Q Z Ч 3NADH + QH2
В начальной реакции цикла из оксалоацетата и
ацетил-СоА под действием цитратсиптазы обра-
зуется цитрат {рис. 3.12). Эта реакция имеет сход-
ство с альдолазной реакцией. Для нуклеофиль-
ной атаки оксалоацетата необходима активиро-
ванная ацетильная группа; ацетат сам по себе не
обладает для этого достаточной реакционноспо-
собностыо. Повышение ее обеспечивается влияни-
ем карбонильной группы тиоэфира Со А, мобили-
зующей протон метильной группы. В связи с этим
следует отметить, что бактерии, у которых функ-
ционирует ЦТЛ, не используют высокоэнсргети-
ческую связь ацетил-СоА для синтеза АТР в ре-
акциях (3.12) и (3.13) (см. дополнение 3.7).
Дополнение 3.7. Прямое окисление ацета-
та до СО2 в присутствии О2 (без промежу-
точного образования цитрата; рис. 3.13) дало
бы вдвое меньше восстановительных эквива-
лентов для окислительного фосфорилирова-
ния, чем окисление через ЦТК. Это связано
с тем, что ацетат (или ацетил-СоА) не мо-
жет быть окислен до гликолата в дегидро-
гепазной реакции; для этого требовалось бы
участие гидроксилазы, активность которой
сопряжена с потреблением [Н], а не высво-
бождением. Следовательно, два из шести [Н],
полученных при дальнейшем окислении гли-
колата до СО2, расходовались бы на реакцию
гидроксилирования, а не на окислительное
фосфорилирование. По этой причине, воз-
можно, показанный на рис. 3.13 гипотетиче-
ский путь не функционирует в живых орга-
низмах вместо ЦТК.
Образованный в цитратсинтазной реакции
цитрат окисляется далее ферментами ЦТК с об-
разованием оксалоацетата и двух молекул СОг-
Для этого цитрат, представляющий собой третич-
ный спирт, вначале превращается под действием
аконитазы во вторичный спирт — изоцитрат, спо-
собный подвергаться окислению. Окисление изо-
цитрата под действием изоцитратдегидрогеназы
Таблица 3.3. Выход АТР и количество высвобождаемых восстановительных эквивалентов при аэробном расщепле-
нии глюкозы
Путь Субстраты Продукты АТР или GTP, моль/моль глюкозы [Н]1
Гликолиз Пируватдегидрогеназная реакция ЦТК Окислительное фосфорилирование 1 [Н] — высвобождаемые в< Глюкоза 2Пируват 2Ацетил-СоА 24[Н] + 6О2 эсстановительные эквивал 2 Пируват 2Ацетил-СоА + 2СО2 4СО2 12Н2О енты 2 2 34 4 4 16
82 Часть II. Основы жизнедеятельности микробных клеток
Рис. 3.12. Цикл трикарбоновых кислот. Назва-
ния ферментов, катализирующих отдельные ре-
акции, приведены в табл. 3.4. NTP — АТР или
GTP; NDP — GDP или ADP; — CO.J—карбок-
сильная группа.
Рис. 3.13. Гипотетический путь окисления ацетата.
приводит к образованию 2-оксоглутарата и СОг, а
также восстановлению NAD+ или NADP+. Затем
происходит окислительное декарбоксилирование
2-оксоглутарата, катализируемое мультифсрмснт-
ным комплексом (2-оксоглутаратдегидрогеназой),
сходным по структуре, составу простетических
групп и механизму действия с пируватде-
гидрогеназой. В 2-оксоглутаратдегидрогеназной
реакции образуется сукцинил-CoA. Свободная
энергия гидролиза образующейся в реакции тио-
эфирной связи используется для образования
нуклеозидтрифосфата (АТР или GTP) из нуклео-
зиддифосфата и Pj (СФ). Эту реакцию катали-
зирует сукцинат-тиокиназа, совмещающая актив-
ности ацилтрансферазы и киназы [для сравнения
см. реакции (3.12) и (3.13)]. Образующийся сук-
цинат окисляется до фумарата. Последний пре-
вращается в малат ё реакции гидратации, катали-
зируемой фумаразой. Малат окисляется малатде-
гидрогеназой до оксалоацетата с восстановлением
NAD+
Сукцинатдегидрогеназа, в отличие от других
ферментов ЦТК, локализована в мембране бак-
териальных клеток. Восстановительные эквива-
ленты, образующиеся при окислении сукцината,
переносятся на мембраносвязанный убихинон,
тогда как для остальных дегидрогеназ ак-
цептором электронов служит NAD+. Значение
окислительно-восстановительного потенциала па-
ры NAD+/NADH (Eq = -0,32 В) на 0,35 В ни-
же по сравнению с парой фу Марат/сукцинат
(Eq = 0,03 В), в то время как окислительно-вос-
становительный потенциал пары Q/QH2 (Eq =
0,11 В) более высокий. Таким образом, окисление
сукцината с участием Q в качестве акцептора
электронов — это экзергоническая реакция; при
использовании в той же роли NAD+ реакция бы-
ла бы высокоэндергонической. Сукциватдегидро-
гепаза и убихинон служат компонентами дыха-
тельной цепи.
Катаболическую функцию ЦТК раскрывает
сравнение величины AG0/ для процесса окисле-
ния ацетил-CoA до СО2 с участием NAD+ и
убихинона в качестве акцепторов водорода [ре-
акция (3.14)] с тем же параметром в случае
окисления NADH [реакция (3.15)] и убихинола
Глава 3. Субстратное фосфорилирование 83
Таблица 3.4. Изменение стандартной свободной энергии при pH 7 и константы равновесия реакций в цикле трикар-
боновых кислот
Фермент Субстраты Продукты AG0', кДж/моль 1 К 2 **равн
Цитратсинтаза Ацетил-СоА 4- Цитрат 4- СоА -37,5 3,8 • 106
оксалоацетат
Аконитаза Цитрат Изоцитрат 4-6,7 0,066
Изоцитратдегидрогеназа Изоцитрат + NAD+ (NADP+) 2-Оксоглутарат 4- NADH (NADPH) + НСО3 -4,6 6,4
2-Оксоглутаратдегидрогеназа 2-Оксоглутарат 4- NAD+ + СоА Сукцинил-СоА + NADH 4- НСО“ -29,4 1,4- 105
Сукцинаттиокиназа (Сукцинил-СоА-синтетаза) Сукцинил-СоА + NDP + Pi Сукцинат 4- NTP 4- СоА -3,3 3,8
Сукцинатдегидрогеназа Сукцинат + Q Фумарат 4- QH2 -16,0 650
Фумараза Фумарат + Н2О Малат -3,7 4,5
Малатдегидрогеназа Малат 4- NAD+ Оксалоацетат 4- NADH 4-28,8 8,9-10~6
-59,0
1 AG0'— изменение стандартной свободной энергии при pH 7.
2 Аравн. — константа равновесия
[реакция (3.16)], образованных в ЦТК, с участием
кислорода в качестве акцептора водорода:
3NADH + |О2 + ЗН+ 3NAD+ + ЗН2О
(3.15)
AG0' = -677 кДж/3 моль NADH
QH2 + |02 Q + Н2О
(3.16)
AG0' = —137 кДж/моль QH2
Общее изменение свободной энергии при окис-
лении ацетил-СоА [уравнение (3.14)] составля-
ет сумма величин AG0' индивидуальных реак-
ций цикла (табл. 3.4). Эта суммарная величи-
на (—59 кДж/моль ацетил-СоА) более чем в де-
сять раз меньше изменения свободной энергии,
обеспечивающего окислительное фосфорилирова-
ние (814 кДж/моль ацетил-СоА). Таким образом,
только небольшая часть энергии, выделяющей-
ся при окислении ацетил-СоА с восстановлением
02, расходуется на обеспечение работы ЦТК, в то
время как основная ее часть запасается в виде
восстановительных эквивалентов с относительно
низким окислительно-восстановительным потен-
циалом и используется далее для синтеза АТР в
процессе окислительного фосфорилирования.
Дополнительная литература
Gottschalk G. (1985) Bacterial metabolism. New York:
Springer-Verlag.
Thauer R. K., Jungermann K., Decker К. (1977) Bacte-
riol. Rev. 41: 100-180.
Глава 4
Электронтранспортное фосфорилирование
Элсктронтранспортным фосфорилирова-
нием (ЭТФ) называют образование АТР, со-
пряженное с транспортом электронов по цепи
переносчиков от донора на акцептор через ряд
окислительно-восстановительных реакций. В бак-
териальных электротранспортных цепях (ЭТЦ)
конечным акцептором электронов может служить
молекулярный кислород и многие другие соедине-
ния (табл. 4.1; гл. 12). Образование АТР в процес-
се дыхания с участием кислорода в качестве ак-
цептора электронов называют окислительным
фосфорилированием (см. гл. 11). В отличие
от субстратного фосфорилирования (СФ), ЭТФ
обеспечивается совместным функционированием
многоферментной электронтранспортной це-
пи и ATP-синтазы в плазматической мембране
бактериальной клетки (рис. 4.1). Топологически
ATP-синтаза отделена от ЭТЦ, по ее активность
связана с образующимся при транспорте элек-
тронов трансмембранным электрохимическим
протонным потенциалом (Др), называемым
также протондвижущей силой. Перенос элек-
тронов по цепи транспорта позволяет запасать
энергию окисления в форме свободной энергии
Др благодаря одновременному перемещению про-
тонов из цитоплазмы через мембрану в наружную
среду. Энергия Др, высвобождаемая при движе-
нии протонов в обратном направлении, по гради-
енту концентрации, используется АТР-синтазой
для синтеза АТР.
Таблица 4.1. Стандартные окислительно-восстанови-
тельные потенциалы компонентов дыхательной цепи
(Eq) при pH 7
Окислительно-восстановительная пара Ео-В
НСО”/НСО2 -0,41
н+/н2 -0,42
НСО3 / ацетат -0,35
IICO3/CH4 -0,33
NAD+/NADH -0,32
s°/ns- -0,27
Ацетальдегид/этанол -0,20
Пируват/лактат -0,19
Дигидроксиацетонфосфат / -0,19
глицерол фосфат
Оксалоацетат/ малат -0,17
IISO“ /HS“ -0,12
SeO^/SeO2- +0,02
Фумарат/ сукцинат +0,03
NO7/HONII+ +0,06
ТМАО/ТМА1 +0,13
дмео/дме2 +0,16
NO2/NH+ +0,34
NO2 /NO +0,35
NO2/NO2 +0,43
Fe3+/Fe2+ +0,77
О2/Н2О +0,82
NO/N2O +1,18
n2o/n2 +1,36
1 ТМАО — триметиламиноксид; ТМА — триметиламин.
2 ДМСО — диметилсульфоксид; ДМС — диметилсульфид.
4.1. При электронтранспортном фосфорилировании выход АТР
соответствует изменению свободной энергии
в окислительно-восстановительной реакции
При субстратном фосфорилировании образуется
1 моль АТР на 1 моль субстрата, и, следователь-
но, изменение свободной энергии в этой реак-
ции должно превышать —44 кДж/моль субстра^
та. Реакции с меньшим изменением свободной
энергии не могут обеспечивать такой тип фос-
форилирования. В отличие от этого, при элек-
тронтранспортном фосфорилировании окисление
1 моль субстрата способно обеспечить синтез АТР
в количестве менее 1 моль, т. е. фосфорилиро-
вание этого типа возможно при реакциях, вы-
ход энергии в которых меньше —44 кДж/моль
субстрата. Это достигается за счет того, что
транспорт электрона может быть сопряжен с пе-
реносом через мембрану различного количества
протонов. По-видимому, благодаря такой энерге-
тической гибкости ЭТФ широко распространено у
анаэробных бактерий; в частности в процессах с
Глава 4. Электронтранспортное фосфорилирование 85
Рис. 4.1. Механизм сопряжения при электронтранспорт-
ном фосфорилировании. Электронтранспортная цепь и
ATP-синтаза локализованы в плазматической мембране
бактериальной клетки. Окисление донора электронов,
Двосст. (например, NADH или сукцината), с восстанов-
лением акцептора электронов, АОКисл. (например, О2),
сопровождается поглощением протона из цитоплазмы
и его высвобождением с наружной стороны мембраны.
Ответственные за связывание субстрата участки фер-
ментов ЭТЦ предположительно находятся на внутрен-
ней стороне мембраны. Синтез АТР сопряжен с пере-
носом протонов извне через мембрану клетки в цито-
плазму.
АТР, синтезированное при переносе одного элек-
трона); оно применимо и для дыхательных цепей
с иными конечными акцепторами. Соотношение
Пр/Пе можно рассчитать, зная изменения свобод-
ной энергии при транспорте электронов и в реак-
ции фосфорилирования, по уравнению (4.1) (по-
ясняемому в дополнении 4.1):
пр/пе = ДА • F T]/^G'p
(4-1)
Зависимость пр/пе от ДА1 при т] -- 1 приведена па
рис. 4.3. При аэробном окислении глюкозы функ-
ционирует дыхательная цепь, в которой донором
водорода служит NADH [реакция (4.2)[ или сук-
цинат [реакция (4.3)]:
NADH + |О2 + Н+
3ADP + ЗР,
NAD+ + Н2О
ЗАТР
(4-2)
Сукцинат + |О2
2ADP + 2Р,
Фумарат + Н2О
2АТР
незначительными величинами AG реакций, недо-
статочными дня СФ (см. гл. 12). Перечень соеди-
нений, способных служить донорами или акцеп-
торами при транспорте электронов, сопряженном
с ЭТФ (рис. 4.1), приведен в табл. 4.1.
Выход АТР при электроптранспортном фос-
форилировании в дыхательной цепи с участием
кислорода в качестве конечного акцептора элек-
тронов, как правило, выражают в виде коэффи-
циента P/О, т. е. как количество (моль) АТР,
образующееся при восстановлении атома кисло-
рода до Н2О (переносе двух электронов). В даль-
нейшем изложении под выходом АТР мы будем
подразумевать соотношение пр/пв (количество
(4-3)
Наиболее точно соотношение пр/пе измерено для
ЭТФ в митохондриях. При дыхании с использо-
ванием NADH его величина равна 1,5 [реакция
(4.2)], с использованием сукцината—1 [реакция
(4.3)1 (ПРИ окислении 1 моль NADH или сукци-
ната в дыхательную цепь поступает 2 моль элек-
тронов). Полученные данные могут быть исполь-
зованы для расчета энергетической эффективно-
сти (rf) этих двух реакций. В табл. 4.2 приведены
теоретические величины пр/пе, рассчитанные по
уравнению (4.1) для г] — 1, и значения этого пока-
зателя, измеренные в эксперименте. Сравнение их
показывает, что энергетическая эффективность
Таблица 4.2. Выход АТР и количество перенесенных через мембрану протонов на электрон при дыхании с исполь-
зованием NADH и сукцината в случае митохондрий
Донор Акцептор ДЕ0'. В Теоретическая величина Пн+/пе2 Пр/Пе1 Экспериментально полученная величина пн+/пе2 Пр/пе1
NADH Сукцинат Теоретически Количество АЕ/ рассчит 1 Пр/Пе — вы> 2 пн+/пе — к О2 02 ie величины р; 1еренесенных г аны по величи <од АТР, моль эличество пере -1,14 -0,79 1ССЧИТЭНЫ по у ротонов, необх нам Eq, привел АТР/моль эле несенных чере 7,6 2,5 5,3 1,7 равнениям (4.1) и (4.4) для т) = 1; одимое для синтеза АТР (пн+ /пр), енным в табл. 4.1. ктронов. з мембрану протонов при транспорте 4,5 1,5 3 1 AGp = 44 кДж/моль АТР и Ар = —0,15 В. принято равным 3 (см. рис. 4.1). Значения 1 электрона, моль Н+/моль электронов.
86 Часть II. Основы жизнедеятельности микробных клеток
окислительного фосфорилирования в ы итохон-
дриях при окислении NADH или сукцината равна
приблизительно 0,6.
Дополнение 4.1. При ЭТФ происходит
преобразование свободной энергии с участи-
ем трех ее форм (рис. 4.2): 1) свободной
энергии, выделяющейся в окислительно-вос-
становительных реакциях, катализируемых
ферментами ЭТЦ [она рассчитывается как
разность окислительно-восстановительных
потенциалов, ДЕ (в вольтах), донора и
акцептора, умноженная на количество пере-
несенных восстановительных эквивалентов
(neF, ампер-с); пе — количество электро-
нов (в молях); F — постоянная Фарадея,
96 485 Кл/моль]; 2) свободной энергии элек-
трохимического протонного потенциала,
или протондвижущей силы [рассчитывается
умножением Др (в вольтах) на величину
электрического заряда (пн+F, ампер-с),
переносимого протонами через мембрану
при транспорте е“| и 3) свободной энергии,
запасаемой в форме АТР при фосфори-
лировании с использованием энергии Др
[рассчитывается умножением потенциала
фосфорилирования (ДСр = 44 кДж/моль
АТР) на количество синтезированного АТР
(пр, моль)].
Если бы электротранспортное фосфори-
лирование функционировало с эффективно-
стью 100% (ту — 1), изменение свободной энер-
гии при транспорте электронов могло быть
полностью использовано для фосфорилиро-
вания. В этом случае количество энергии в
трех перечисленных выше формах было бы
одинаковым. На самом деле в живых орга-
низмах только часть свободной энергии «дви-
жущей» реакции запасается в высокоэнерге-
тической связи АТР и величина энергетиче-
ской эффективности ту равна долям единицы.
Уравнения (4.1) и (4.4) получены из выра-
жений, приведенных па рис. 4.2, после вве-
дения rj.
Количество протонов, перенесенных через
мембрану при транспорте одного электрона
(пн+ /пе)» можно рассчитать по следующему урав-
нению, если известна энергетическая эффектив-
ность процесса, tjz
пн+/пе = ДЕт?/Др (4.4)
Рис. 4.2. Формы свободной энергии, преобразуемые в
процессе фосфорилирования. Разность окислительно-
восстановительных потенциалов субстратов транспорта
электронов (ДЕ) и электрохимический трансмембран-
ный протонный потенциал (Др) выражаются в вольтах;
пе, пн+ и пр — молярные количества электронов, прото-
нов и АТР соответственно; Дб' (44 кДж/моль АТР) —
энергия высокоэнергетической фосфатной связи.
Уравнение (4.4) поясняется в дополнении 4.1. Ве-
личина пн+ /пе зависит от ДЕ (рис. 4.3). При по-
строении этого графика величина Др была взя-
та равной 0,15 В — среднему значению протонного
потенциала в большинстве систем при ЭТФ (см.
дополнение 4.2).
Приведенные в табл. 4.2 максимальные теоре-
тические значения пн+/пе при дыхании в мито-
хондриях с использованием NADH и сукцината
рассчитаны согласно уравнению (4.4) для ту = 1.
Сравнение их с экспериментально измеренными
величинами показывает, что реальная эффектив-
ность процесса составляет примерно 60%. Та-
ким образом, значения ту для переноса протонов
и окислительного фосфорилирования в митохон-
дриях примерно равны. Судя по этому, рассеяние
энергии при электротранспортном фосфорили-
ровании происходит в основном на этапе образо-
вания Др, тогда как зависящая от Др реакция об-
разования АТР близка к равновесному состоянию
и функционирует с максимальной энергетической
эффективностью.
Дополнение 4.2. В результате транс-
порта протонов через мембрану возника-
ет трансмембранный электрический потен-
циал и градиент pH (ДрН). Следовательно,
протондвижущая сила — электрохимический
протонный потенциал, Др — складывается из
электрической составляющей (Д 0) и протон-
ного диффузионного потенциала:
Др = Д^ + ДрН RT 2,3/F (4.5)
Глава 4. Электронтранспортное фосфорилирование 87
Измерение транспорта электронов показыва-
ет, что основной вклад в величину Др вно-
сит Д-0, в то время как величина градиента
pH у большинства бактерий незначительна.
Это можно объяснить различием между элек-
трической и буферной емкостями мембраны.
Электрическая емкость биологических мем-
бран (С) составляет 10~6 ампер-с/В-см2 и
определяется из уравнения:
ДН+/Д0 = С-О, (4.6)
где О — площадь двойного слоя, образуемо-
го фосфолипидами при их количестве, рав-
ном 1 г (2,6-106 см2/г фосфолипидов). Вклад
в величину площади мембраны встроенных
в нее белков не учитывается. Буферная ем-
кость фосфолипидов (В) определяется как
ДН+/ДрН - В, (4.7)
где ДН+ — увеличение или уменьшение коли-
чества протонов (моль), ДрН — происходящее
при этом изменение pH. Буферная емкость
фосфолипидов составляет 10-4 моль Н+/г
фосфолипидов. Подставляя расчет ДН+ из
уравнения (4.6) в уравнение (4.7), получаем
ДрН = С - О - Д0/В (4.8)
Перенос количества протонов, необходимого
для образования на мембране Д-0, равного
0,15 В, в соответствии с уравнением (4.8)
приводит к образованию ДрН, равного
0,04; эквивалентная величина протонного
диффузионного потенциала меньше 3 мВ.
В этом расчете принято во внимание, что
электрический эквиваленг 1 моль Н+ равен
постоянной Фарадея (96 485 Кл/моль).
Таким образом, согласно расчетам, созда-
ваемый переносом протонов через мембрану
протонный диффузионный потенциал имеет
незначительную величину, и это подтвержда-
ют экспериментальные данные. Если перенос
протонов сопровождается интенсивным про-
тивотоком других катионов или симпортом
анионов, Д'0 частично преобразуется в ДрН.
Однако эти процессы, по-видимому, протека-
ют намного медленнее, чем ЭТФ при обыч-
ных для роста бактерий условиях.
Рис. 4.3. Зависимость максимальных теоретически
рассчитанных величин пр/пе и пн+/пе от разности
окислительно-восстановительных потенциалов донора и
акцептора электронов при дыхании. График постро-
ен согласно уравнению (4.1) для пр/пе и уравнению
(4.4) для пн+/пе. Энергетическая эффективность ту = 1;
Др — 0,15 В; Д6Р = 44 кДж/моль АТР.
4.2. Все ATP-синтазы действуют по одному механизму
В отличие от электронтранспортных цепей, со-
стоящих из нескольких ферментных комплексов,
ATP-синтаза, или АТРаза, представляет собой
единый сложный полипептидный комплекс, ко-
торый можно выделить из мембраны. АТРазы,
выделенные из различных прокариотических и
эукариотических клеток, сходны по структуре и
аминокислотным последовательностям основных
субъединиц. Этот фермент обнаружен в клет-
ках аэробных, анаэробных и фототрофных бакте-
88 Часть II. Основы жизнедеятельности микробных клеток
рий, в митохондриях, хлоропластах и даже у та-
ких бактерий, которые не способны осуществлять
окислительное фосфорилирование, например у
Streptococcus faecalis. В последнем случае она вы-
полняет функцию протонпереносящего фермента
и создает протонный градиент, необходимый для
осуществления транспортных процессов.
В экспериментальных условиях можно полу-
чить синтез АТР с использованием АТР-синтазы,
выделенной из клеток и встроенной в искусствен-
ные мембранные структуры — липосомы. Образо-
вание АТР происходит при условии, что имеется
разность pH между внутренней средой липосом
и наружной средой (рис. 4.4). При встраивании
АТР-синтазы в мембрану липосом участок свя-
зывания субстрата оказывается на внешней по-
верхности мембраны, тогда как в плазматической
мембране клеток бактерий он обращен в цито-
плазму. Для осуществления синтеза АТР липосо-
мы, содержащие буфер с низким значением pH,
суспендируют в среде с высоким значением pH.
В этих условиях происходит вызываемый АТР-
синтазой выход протонов из липосом в среду по
градиенту pH, сопряженный с фосфорилировани-
ем. Транспорт протонов наружу возможен толь-
ко в том случае, если одновременно другой кати-
он входит в липосомы. В показанном на рис. 4.4
эксперименте в мембране липосомы присутству-
ет ионофор для калия, валиномицин, и в среде —
К+. ATP-синтаза содержит гидрофильный, обра-
щенный в цитоплазмазму домен F i и мембранный
домен Fo (рис. 4.5). Эти домены соединены «нож-
кой». Домен Fi имеет форму, близкую к сфсри-
Рис. 4.4. Синтез АТР ATP-синтазой, встроенной в мем-
брану липосомы. Движущей силой синтеза АТР служит
ДрН. Валиномицин обеспечивает вход в липосому ионов
калия, сопряженный с выходом из нее протонов, что
предотвращает поляризацию мембраны.
Рис. 4.5. Структура и локализация АТР-синтазы. Ката-
литический домен Fi включает пять различных поли-
пептидов— по три субъединицы о и /3 и по одной 7, б
и е. Встроенный в мембрану домен Fo в ферменте из
Е. coli состоит из трех различных субъединиц (а, b и
с; не показаны). Домены Fi и Fo соединены субъедини-
цей 7. Субъединицы 5 и е не показаны.
ческой (диаметром 10 нм), и несет каталитические
участки связывания субстратов — ADP, АТР и Р;.
Разрушение ножки приводит к отделению так на-
зываемой Fi-АТРазы от мембраны. Комплекс Fi
включает пять различных полипептидов в раз-
личных количествах — аз/Ззубе. Субъединицы а и
Д образуют гексамер О3Д3, имеющий форму коль-
ца; в проходящей по центру гексамера полости
располагается 7-субъединица, образующая своего
рода ось. Гексамер имеет три активных центра,
различающихся по конформации.
Предположительно каждый активный центр
может принимать три различных конформации
и переход от одной конформации к другой про-
исходит благодаря вращению 7-субъединицы от-
носительно гексамера. Движущей силой поворо-
та может быть перенос протона, катализируе-
мый доменом Fo- Это предположение согласует-
ся с гипотезой, постулирующей, что ADP и Pj
вначале слабо связываются с активным центром
АТР-синтазы, после чего он трансформируется,
принимая конформацию с прочным связыванием
(рис. 4.6). При этом состоянии фермента синтез
АТР происходит спонтанно, поскольку активный
центр защищен от доступа воды и реакция фос-
форилирования протекает как экзергоническая.
На третьей стадии АТР высвобождается из ак-
тивного центра. Изменение свободной энергии в
реакции фосфорилирования отражают констан-
Глава 4. Электронтранспортное фосфорилирование 89
ты связывания для каждого конформационного
состояния. Свободную энергию, необходимую для
переходов фермента из одного состояния в другое,
обеспечивает перенос протонов в направлении Др
(Н+аруж Н+нутр ). В деталях механизм конфор-
мационного сопряжения переноса протонов с вра-
щением субъединицы пока не ясен.
У некоторых бактерий образование АТР обес-
печивается транспортом через мембрану ионов
Na+. Осуществляющие эту реакцию натрийпе-
репосящие ATP-синтазы по структуре сходны с
протонпереносящими ATP-синтазами. Сходство
между этими двумя ферментами существенно
способствовало выяснению механизма образова-
ния АТР при электронтранспортном фосфорили-
ровании. К настоящему времени почти оконча-
тельно установлено, что условием фосфорилиро-
вания служит вход протонов (или Na+) в клетку,
причем пересекающие мембрану протоны непо-
средственно пе участвуют в реакции конденсации
Pi и ADP с образованием АТР,
Рис. 4.6. Гипотетический механизм действия АТР-син-
тазы. Каждый из трех активных центров фермента спо-
собен принимать три различных конформационных со-
стояния. Здесь реакционный цикл отображен только
для участка, выделенного серым. Перенос протонов с
участием домена Fo обозначен как Н^ружн. —» Н^утр_.
4.3. Дыхательные цепи весьма разнообразны по составу
Ферменты электронтранспортной цепи катали-
зируют окисление донора электронов (DBOCCT.
на рис. 4.1; например, NADH) определенным
акцептором (АОКИсл. на рис. 4.1; например,
О2), которое сопряжено с переносом прото-
нов через плазматическую мембрану бактериаль-
ной клетки. Электротранспортная цепь пред-
ставляет собой не единый белковый комплекс,
а набор отдельно расположенных компонен-
тов, и в том числе включает не менее двух
топологически разделенных ферментов — дегид-
рогеназу и редуктазу (рис. 4.7). Эти фермен-
ты перемещаются независимо в фосфолипидном
бислое и обычно присутствуют в мембране в
разных количествах. Дегидрогеназа и редукта-
за функционально связаны через входящий в со-
став дыхательной цепи хинон, способный свобод-
но диффундировать в липидной фазе мембра-
ны. Дегидрогеназы катализируют восстановление
хинона субстратом-донором, редуктазы — реокис-
ление хинона субстратом-акцептором. Структу-
ры хинонов — компонентов ЭТЦ — представлены
па рис. 4.8.
Рис. 4.7. Структура электронтранспортной цепи Е. coli
при росте в аэробных условиях в среде с глюкозой.
NADH-дегидрогеназа и сукцинатдегидрогеназа, лока-
лизованные в мембране, катализируют восстановление
убихинона (Q). Реокисление QH2 осуществляет мем-
бранная хинолоксидаза.
При росте Е. coll в аэробных условиях в сре-
де, содержащей глюкозу, основными субстратами-
донорами для ЭТЦ служат NADH и сукци-
нат (рис. 4.7). Соответственно основными ком-
понентами дыхательной цепи при этом являются
NADH-дегидрогеназа и сукцинатде гидрогеназа,
катализирующие восстановление в данном слу-
чае убихинона. Реокисленис убихипола с пере-
90 Часть II. Основы жизнедеятельности микробных клеток
Рис. 4.8. Структуры хинонов — компонентов дыхатель-
ной цепи. Количество изопреновых звеньев (п), состав-
ляющих боковую цепь молекулы, может варьировать от
б до 10.
носом электрона па кислород катализирует глав-
ным образом цитохром Ьо-хинолоксидаза.
В зависимости от условий роста бактерии со-
держат различные дегидрогеназы и редуктазы.
Ферменты, которые могут входить в состав ды-
хательной цепи у Е. coli, приведены на рис. 4.9.
Перенос электронов от каждого из субстратов-
доноров на субстрат-акцептор опосредует хи-
нон. Функция хинонов в плазматической мем-
бране аналогична функции NAD+ в цитоплазме
(рис. 4.10)—эти переносчики электронов переда-
ют восстановительные эквиваленты от субстрата-
донора па фермент, катализирующий восстанов-
ление субстрата-акцептора.
Глицерол-
фосфат
Дигидрокси-
ацетонфосфат
NADH
NAD*
HCO2
СО2
Сукцинат
Фумарат
Н2
2Н*
Лактат
Пируват
Рис. 4.9. Дегидрогеназы и редуктазы (оксидазы), входящие в состав электронтранспортной цепи у Е. coli и других
бактерий. Переносчиком электронов между дегидрогеназами и редуктазами служит у Е. coli убихинон, менахинон
или деметилменахинон (Q).
Рис. 4.10. Роль NAD+/NADH — метаболического интер-
медиата, переносящего восстановительные эквивален-
ты в цитоплазме. Хиноны выполняют сходную функ-
цию в бактериальной мембране. Круг и квадрат на
рисунке обозначают дегидрогеназы, реагирующие с
NAD+/NADH. Д — донор; А — акцептор.
Глава 4. Электронтранспортное фосфорилирование 91
Рис. 4.11. Структура гемов, входящих в состав бактери-
альных цитохромов. Гем d — 8,9-дегидропорфирин; гем
с ковалентно связан с двумя цистеиновыми остатками
апопротеина.
В состав ферментов дыхательной цепи входят
цитохромы — белки, содержащие гемы а, Ь, с или
d (рис. 4.11). Гем с ковалентно связан с апопротеи-
ном через два остатка цистеина. Гем а в основном
встречается в оксидазах. Гем «з — это гем а, непо-
средственно участвующий вместе с ионом меди в
связывании О2 с активным центром оксидазы (см.
гл. 11).
У Е. coli окисление хинона в дыхательной
цепи катализирует хинолоксидаза, тогда как у
других бактерий вместо этого фермента (или
дополнительно к нему) может присутствовать
хинолсцитохром с-оксидоредуктаза (см. гл. 11).
У таких бактерий восстановление кислорода ката-
Рис. 4.12. Состав электронтранспортной цепи, содержа-
щей bci-комплекс (хинол:цитохром с-оксидоредуктазу).
о/в — периплазматический цитохром с или другой пе-
реносчик электронов, выполняющий сходную функцию
(о — окисленный, В — восстановленный). Двосст./Докисл.
И Двосст./Докисл. ДОНОрЫ ЭЛеКТрОНОВ, Аокисл./Авосст.
акцептор электронов; Q — убихинон или менахинон;
QH2 — восстановленный Q.
лизирует цитохромоксидаза (рис. 4.12). Перенос-
чиком электронов между хинол:цитохром с-ок-
сидоредуктазой и оксидазой служит цитохром с.
Обычно он связан с мембраной со стороны пе-
риплазмы или иногда встроен в мембрану. В по-
следнем случае участок цитохрома, содержащий
гем, обращен в периплазму. У некоторых бакте-
рий окисление определенных субстратов-доноров
(например, метанола) не опосредовано хиноном.
Соответствующая дегидрогеназа передает вос-
становительные эквиваленты на периплазмати-
ческий цитохром с или другой переносчик, ко-
торый далее реокисляется цитохромоксидазой.
В отсутствие кислорода акцептором электронов
может служить другое соединение (например,
нитрат), редуктаза которого получает электро-
ны от периплазматического цитохрома с или
другого переносчика, способного взаимодейство-
вать с хинол:цитохром с-оксидоредуктазой. Хи-
нолщитохром с-оксидоредуктазу называют также
Ьс 1 -комплексом или комплексом III. Она состоит
по меньшей мере из трех различных субъединиц и
содержит сердцевинный железосерпый белок, гем
с и две группы гема Ь. Механизм действия этого
фермента описан в гл. 11.
92 Часть II. Основы жизнедеятельности микробных клеток
4.4, Механизмы сопряжения транспорта электронов
и переноса протонов могут быть различными
Транспорт электронов сопряжен с переносом про-
тонов из цитоплазмы через мембрану (подкисле-
нием среды снаружи от мембраны) и приводит
тем самым к образованию на мембране электро-
химического протонного потенциала, Др, в кото-
ром запасается часть свободной энергии транс-
порта электронов по градиенту окислительно-
восстановительного потенциала. Механизмы со-
пряжения транспорта электронов с переносом
протонов через мембрану так же разнообразны,
как и состав ЭТЦ у различных микроорганизмов.
Три принципиально различных механизма сопря-
жения изображены на рис. 4.13.
Работу зависящего от транспорта электро-
нов протонного насоса иллюстрирует рис. 4.13, А.
Перенос электронов с участием некоторых фер-
ментов ЭТЦ непосредственно сопряжен с переме-
щением протонов через мембрану. Типичные при-
меры протонных насосов, зависящих от транспор-
та электронов, — это NADH-дегидрогеназа и ци-
тохромоксидаза. Механизм сопряжения для этих
и других, аналогичных ферментов ЭТЦ пока
неясен. Цитохромоксидазы (см. гл. 11) катали-
зируют окисление восстановленного цитохрома с
[Fe2+]n до [Fe3+]n в реакции (4.9) молекулярным
кислородом и одновременный перенос одного про-
тона в расчете на один электрон из цитоплазмы в
периплазму:
2[Fe2+]n + |О2 + 2Н+ > 2[Fe3+|„ + Н2О
2Н+/ ''211/, (4.9)
Индексы п (периплазма) и ц (цитоплазма) ука-
зывают на локализацию цитохрома с и Н+.
Электрический потенциал на мембране образует-
ся в результате не только переноса протона, но
и окислительно-восстановительной реакции (4.9),
поскольку окисление цитохрома с происходит на
внешней стороне мембраны, тогда как поглощение
протонов при восстановлении кислорода—на ее
внутренней стороне. Таким образом, перенос двух
электронов на Ог сопровождается появлением на
периплазматической стороне мембраны четырех
положительных зарядов (два из которых пред-
ставлены протонами) и выходом четырех прото-
нов из цитоплазмы.
Альтернативный механизм, при котором пе-
ренос протонов сопряжен с окислением/вос-
становлением убихинона или мепахинона (Q),
находящихся в липидной фазе мембраны, изобра-
жен на рис. 4.13, Б. Как предполагается, при ка-
тализируемом дегидрогеназой переносе электро-
нов на хинон с образованием QH2 происходит
поглощение протонов из цитоплазмы. Последую-
щее окисление QH2 до Q, по-видимому, сопряже-
но с высвобождением протонов па периплазма-
тической стороне мембраны. Вероятно, направле-
ние переноса протонов определяется структурой
ферментов, восстанавливающих Q и окисляющих
QH2. Таким образом, реакции окисления/вос-
становления хинонов могут быть сопряжены с пе-
реносом протонов. Однако в других случаях по-
глощение и высвобождение протонов могут про-
исходить па одной и той же стороне мембраны (не
показано); при этом Ар не образуется.
При работе механизма сопряжения, изобра-
женного па рис. 4.13, В, образование электро-
химического протонного потенциала происходит
без переноса протонов. Субстрат-связывающий
сайт в молекуле дегидрогеназы находится при
этом па наружной стороне мембраны, в то
время как аналогичный сайт редуктазы обра-
щен в цитоплазму. Электроны от субстрата-
донора (DH2) транспортируются через мембра-
ну к субстрат-связывающему сайту редуктазы;
высвобождающиеся протоны выделяются в ак-
тивном центре дегидрогеназы па внешней стороне
мембраны. Восстановление редуктазой субстра-
та— акцептора электронов (А) связано с погло-
щением протонов из цитоплазмы.
При функционировании данного механизма
электроны передаются от дегидрогеназы на ре-
дуктазу, как правило, через хинон (см. рис. 4.7).
В других ЭТЦ их перенос осуществляет цито-
хром с (см. рис. 4.12).
Все три показанные на рис. 4.13 механиз-
ма сопряжения могут быть реализованы в од-
ной ЭТЦ или даже в одном ее ферменте. Так,
механизм действия цитохромоксидазы [реакция
(4.9)] можно рассматривать как комбинацию ме-
ханизмов, изображенных на рис. 4.13, А и В;
в случае bej-комплекса функционируют механиз-
мы (Л) и (В).
Глава 4. Электронтранспортное фосфорилирование 93
Рис. 4.13. Механизмы образования элек-
трохимического протонного потенциала
Др при транспорте электронов. Фермен-
ты ЭТЦ в мембране обозначены как
более темные прямоугольники. Q — уби-
хинон или менахинон QH2 — восстанов-
ленный Q; DH2/D — донор электронов;
А/АН2 — акцептор электронов.
4.5. Фотофосфорилирование происходит при транспорте электронов
и переносе протонов с использованием энергии света
Фототрофные бактерии используют для получе-
ния АТР энергию света (см. рис. 3.1). Фото-
фосфорилирование происходит в плазматической
мембране и по механизму сходно с электроп-
транспортным (рис. 4.14). Энергия света служит
движущей силой для транспорта электронов, со-
пряженного с образованием электрохимического
протонного градиента на мембране. Этот гра-
диент, как и при дыхании, служит источником
энергии для синтеза АТР. Цепь светозависимого
транспорта электронов описана в гл. 13. В отли-
чие от дыхательной ЭТЦ, она включает фотохи-
мический реакционный центр.
Энергетические параметры фотофосфорили-
рования приведены в табл. 4.3. Энергия светового
кванта (Elq) зависит от длины волны света А
ELQ = hcNAA-1, (4.10)
Рис. 4.14. Фотофосфорилирование по механизму сход-
но с фосфорилированием при дыхании. В обоих случа-
ях транспорт электронов приводит к образованию про-
тондвижущей силы Др, используемой для синтеза АТР
с участием ATP-синтазы (см. разд. 4.2). При фото-
фосфорилировании транспорт электронов происходит
за счет энергии света.
Дополнительная литература
уменьшаясь с ее увеличением. При этом даже
длинноволновый инфракрасный свет обладает до-
статочной энергией для синтеза одной молеку-
лы АТР на квант с энергетической эффективно-
стью ту, равной 0,3-0,4 [см. уравнение (3.3)[.
Таблица 4.3. Зависимость энергии светового кванта от
длины волны
Длина волны Л, 10“9 м Область спектра Elq. кДж/моль квантов 1
400 600 800 1000 Расчеты произвел тоянная Планка (3 108 м с-1) и Г 1 Elq—энергия к Синяя Красная Инфракрасная Инфракрасная цены по уравнению (6,6 • 10“34 Джс), \1д — число Авогадр< ванта света. 300 200 150 120 (4.10), где /1 — пос- с — скорость света э (6 • 1023).
Nichols D.G., Ferguson S. .1. (1992) Bioenergetics 2.
London: Academic Press.
Harold F.M. (1986) The vital force: a study of
bioenergetics. New York: Freeman.
Anthony C. (1980) Bacterial energy transduction.
London: Academic Press.
Abrahams.I. P., Leslie A. G. W., LutterR., Walker J. E.
(1994) Nature 370: 621-628.
Глава 5
Многообразие функций клеточной мембраны
у прокариот
Все клетки отделены от окружающей среды плаз-
матической мембраной, выполняющей множе-
ственные функции. Мембрана 1) отделяет внут-
реннее содержимое клетки от внешней среды и
тем самым создает отдельную «систему», необхо-
димую для протекания биохимических реакций,
поскольку они требуют определенных значений
pH и концентраций реагентов, стабильности бел-
ков, отсутствия токсичных соединений и т. д., и
2) опосредует обмен веществом и информацией
между клеткой и окружающей средой.
Таким образом, помимо функции физическо-
го барьера, окружающего цитоплазму, плазма-
тическая мембрана выполняет важные метабо-
лические, сенсорные и репродуктивные (участие
в процессе деления) функции. Она предотвра-
щает воздействие на клетку токсичных веществ
или вредных факторов, обеспечивает поддержа-
ние и регуляцию тургорного давления, служит
местом локализации мембраносвязанных фермен-
тов, участвует в обмене и процессинге инфор-
мации, передаче энергии, процессах движения
клетки, роста и дифференцировки, скоордини-
рованно осуществляет поглощение питательных
веществ, выделение конечных продуктов мета-
болизма и перенос строительных блоков для
синтеза клеточной стенки, обеспечивает выве-
дение токсичных соединений. От транспорта
веществ через мембрану зависит так или ина-
че большинство клеточных функций, и многие
связанные с мембраной механизмы транспор-
та и сенсорных процессов сходны у организ-
мов разных уровней — от прокариот до чело-
века.
5.1. Барьерная функция мембраны
Основу плазматической мембраны бактериаль-
ной клетки, как и других биологических мем-
бран, составляет фосфолипидный бислой, ко-
торый служит барьером проницаемости для
большинства растворенных веществ. Полярные
молекулы, например углеводы, и заряженные со-
единения, такие как ионы, карбоновые кислоты и
некоторые аминокислоты, диффундируют сквозь
него с очень низкой скоростью путем пассив-
ной диффузии (табл. 5.1). Способностью прони-
кать через мембрану с большей скоростью об-
ладают некоторые небольшие молекулы — вода,
этанол, аммиак, кислород и другие, а также непо-
лярные (гидрофобные) соединения, например фе-
нилаланин, глицерол и жирные кислоты. Поступ-
ление растворенных веществ через мембрану с
высокой скоростью, необходимой для протека-
ния процессов роста и метаболизма, обеспечива-
ют специальные мембранные белки-переносчики,
называемые также транспортными система-
ми (белками) или, по аналогии с ферментами,
пермеазами (табл. 5.1). Активностью этих транс-
портных систем, присутствующих в относительно
непроницаемой мембране, обеспечивается образо-
вание трансмембранных концентрационных гра-
диентов растворенных веществ, варьирующих от
10-30-кратных величин для Na+ и К+ до более
чем 10 000-кратных (Са2+) и даже до 200 000-
кратного накопления в цитоплазме некоторых со-
единений (например, мальтозы и отдельных ами-
нокислот).
Поскольку липидный бислой проницаем для
воды, плазматическая мембрана должна регули-
ровать осмотическое давление в клетке. Концен-
трация большинства растворенных веществ внут-
ри клетки выше, чем снаружи, и вода должна
Глава 5. Многообразие функций клеточной мембраны у прокариот 95
была бы непрерывно поступать внутрь клетки,
однако клетка не набухает и ее разрыва не проис-
ходит благодаря ригидной клеточной стенке. Раз-
ница в осмотическом давлении между цитоплаз-
мой и наружной средой — клеточный тургор —
возникает в результате сочетанных функций
избирательно проницаемой плазматической мем-
браны и ригидной клеточной стенки. Поддер-
жание необходимого тургорного давления на от-
носительно постоянном уровне (от 1-5 атм для
грамотрицательных бактерий до 15-20 атм для
грамположительных) обеспечивают специфичес-
кие транспортные системы.
Перенос растворенных веществ через полупро-
ницаемую клеточную мембрану осуществляют ин-
тегральные мембранные белки (белки-переносчи-
ки, или пермеазы).
Таблица 5.1. Сравнение скоростей переноса раство-
ренных веществ через бактериальную плазматическую
мембрану путем диффузии и с участием переносчика
Растворенное вещество Типичная скорость транспорта
в случае диффузии при следующей разности концентраций: с участием переносчика (Углах)
10 мкМ 10 мМ
к+ 0,00002 0,02 100
Глутамат <0,00005 <0,05 25
Глюкоза 0,001 1 50
Изолейцин 0,0015 1,5 30
Фенилаланин 0,08 8 1
Мочевина 0,04 40 5
Скорости диффузии [мкмоль • мин 1 (г сухой массы)
рассчитаны по величине проницаемости бактериальной
плазматической мембраны; для транспорта с участием пе-
реносчика приведена скорость переноса при щении. полном насы-
5.2. Структура и функции транспортных систем связаны с мембраной
Системы мембранного транспорта растворенных
веществ (по крайней мере основные их компонен-
ты) представляют собой встроенные в мембрану
белки — мембраносвязанные ферменты. В отли-
чие от растворимых ферментов, катализирующих
превращение субстрата в продукт, мембранные
белки осуществляют векторный перенос раство-
ренных веществ из одного компартмента в дру-
гой—извне клетки внутрь или изнутри наружу.
Существует большое разнообразие транспортных
механизмов в соответствии с разнообразием при-
родных соединений, типов мембран и метаболи-
ческих целей. Такое разнообразие особенно ха-
рактерно для микроорганизмов, поскольку они
должны приспосабливаться к частым и значи-
тельным изменениям концентраций растворенных
веществ и, кроме того, их транспортные системы
служат также для выполнения других, например
сенсорных и сигнальных, функций. Некоторые
транспортные системы встречаются только у про-
кариот, а именно системы, зависящие от водорас-
творимых субстрат-связывающих белков, и фос-
фотрансферазные системы.
Огромное разнообразие транспортных систем
можно объяснить тем, что они должны удо-
влетворять многим функциональным и физиоло-
гическим требованиям, включающим 1) специ-
фичность транспорта, соответствующую структу-
ре переносимых соединений; 2) необходимые для
данного вещества энергетические условия (напри-
мер, поддержание высокого коэффициента накоп-
ления) и 3) наличие механизмов преобразования
различных форм энергии для переноса веществ.
Последнее обеспечивают дополнительные доме-
ны (например, в зависящей от водорастворимых
субстрат-связывающих белков системе или в фос-
фотрансферазной системе; см. разд. 5.6).
Первым белком-переносчиком, для которого
была определена первичная структура, стала пер-
меаза лактозы из Escherichia coli (1980 г.). К на-
стоящему времени определены аминокислотные
последовательности большого числа прокарио-
тических и эукариотических транспортных бел-
ков и для некоторых из них построены моде-
ли трансмембранной топологии. В кристал-
лическом виде ни один из белков-переносчиков
пока не получен по причине гидрофобности их
молекул, поэтому их трехмерная структура пока
не установлена. Представление о вероятной про-
странственной организации мембраносвязанных
белков-переносчиков дает показанная на рис. 5.1
(см. цв. вклейку) модель простейшего белка-
переносчика — бактериородопсина, действующего
как светозависимый протонный насос (см. также
рис. 2.10, Г). Принцип укладки молекулы в виде
ряда пронизывающих мембрану п-спиралей, со-
96 Часть II. Основы жизнедеятельности микробных клеток
здающих путь переноса субстрата, по-видимому,
характерен для типичных белков-переносчиков,
хотя количество трансмембранных сегментов у
них может быть иным (см. ниже).
Большинство переносчиков, если не все они,
как у прокариот, так и у эукариот, вероятно,
сходны по структурной организации. Независи-
мо от выполняемых функций и от того, представ-
ляет ли собой трансмембранный сегмент молеку-
лы димер (как в случае систем, зависящих от во-
дорастворимых субстрат-связывающих белков, и
фермента II фосфотрансферазной системы), мо-
номер (как в системах вторичного транспорта)
или только домен в белковом комплексе (как в
некоторых АТРазах), большинство осуществляю-
щих мембранный транспорт белковых структур,
по-видимому, содержит примерно 12 (6 + 6) упо-
рядоченно расположенных трансмембранных сег-
ментов (рис. 5.2). Это, должно быть, особенно
характерно для многочисленных систем вторич-
ного транспорта, функционирующих по механиз-
му унипорта, с импорта или антипорта (см. ниже).
Общность структурной организации указывает на
единство происхождения и общий принцип дей-
ствия.
Рис. 5.2. Структурный мотив, общий для семейства
транспортных белков с 12 трансмембранными спираль-
ными сегментами.
А. Трансмембранные сегменты соединены гидрофиль-
ными петлями, более длинными с цитоплазматической
стороны мембраны; центральная петля часто бывает
наибольшей.
Б. Модель возможного расположения 12 трансмем-
бранных сегментов переносчика в мембране (вид в
плоскости мембраны). Звездочкой показан гипотетичес-
кий путь транспортируемого вещества через молекулу
белка.
5.3. Механизмы транспорта
Гипотетическая схема действия белка-переносчи-
ка представлена на рис. 5.3. Несмотря на то, что
механизм транспорта пока до конца не ясен, по-
добные модели помогают представить связанные с
ним молекулярные события. Данная модель отра-
жает основные этапы переноса — связывание, пе-
ремещение и высвобождение, а также два раз-
личных состояния транспортного белка («н» и
«в»). Центральный этап, транслокация, вклю-
чает существенное изменение конформации моле-
кулы переносчика, а именно переориентацию цен-
тра связывания от одной стороны мембраны к
другой, т. е. «переключение» в процессе транс-
порта. Наиболее простое из возможных объясне-
ний механизма этого конформационного измене-
ния состоит в том, что его вызывает различие
в концентрациях растворенного вещества по раз-
ные стороны мембраны. Альтернативная модель,
согласно которой экспозиция одного и того же
центра связывания поочередно на разных сторо-
нах мембраны обеспечивается вращением молеку-
лы переносчика, не может быть принята, посколь-
ку она не соответствует энергетическим характе-
ристикам процесса.
По функции мембранный транспортный бе-
лок (переносчик) сходен с ферментом. Перенос-
чик взаимодействует с транспортируемым веще-
ством, осуществляя 1) его связывание, 2) перенос
через мембрану посредством конформационного
изменения своей молекулы и 3) высвобождение по
другую сторону мембраны.
Глава 5. Многообразие функций клеточной мембраны у прокариот 97
Рис. 5.3. Предполагаемые конформационные изменения
молекулы переносчика при транспорте вещества. Основ-
ные этапы переноса: 1) связывание субстрата (S) с пе-
реносчиком, находящимся в конформации «н» (наруж-
ная) на одной стороне мембраны; 2) перенос субстрата,
связанный с основным конформационным изменением
молекул переносчика — переходом в конформацию «в»
(внутренняя); 3) высвобождение субстрата на противо-
положной стороне мембраны и 4) возвращение перенос-
чика в конформацию «н» в нагруженном или ненагру-
женном состоянии, в зависимости от вида транспорта
(например, унипорта или антипорта).
Действие системы транспорта по механизму
унипорта можно представить в виде простой
кинетической схемы (рис. 5.4). Каждая из ука-
занных на схеме форм переносчика — это проме-
жуточное соединение в цикле транспорта. Пе-
реносчик существует либо в свободной, либо в
связанной с субстратом форме (Си CS соответ-
ственно); его связывающий центр может быть об-
ращен либо наружу, во внеклеточное простран-
ство, либо внутрь клетки (Сн и Св соответствен-
но). Эта модель помогает объяснить механизм
транспорта, однако следует учитывать, что «дви-
жение» переносчика (реакции 2 и 4 на рис. 5.4) на
самом деле состоит в изменении конформации его
молекулы в процессе транспорта.
Рис. 5.4. Кинетическая схема работы унипортера. Свя-
зывание субстрата с наружной стороны ненагруженным
переносчиком, находящимся в конформации «н» (Си).
Нагруженный субстратом переносчик (CHS) переориен-
тируется в конформацию «в» (CBS, этап переноса). Суб-
страт высвобождается во внутриклеточное простран-
ство, и ненагруженный переносчик (Св) переориентиру-
ется вновь в конформацию «н».
Более подробно работу транспортного бел-
ка в мембране отражает модель действия одной
из систем вторичного транспорта — симпортера
лактоза/Н+ (или LacY) у Escherichia coli (рис. 5.5;
см. также разд. 5.6.2). Эта так называемая пер-
меаза лактозы транспортирует лактозу (L) или
другие /?-галактопиранозиды вместе с протона-
ми, т. е. действует по механизму симпорта, пере-
нося лактозу в клетку. Переносчик находится в
различных состояниях в зависимости от количе-
ства и типа связанных с ним лигандов (С, CL,
НС, HLC) и конформации своей молекулы (Сн
или Св). Сплошные стрелки на рисунке означают
Рис. 5.5. Кинетическая схема действия симпортера
лактоза/Н+ (пермеаза лактозы, LacY) у Е. coli. Изобра-
жено минимальное число возможных этапов катализа,
пронумерованных последовательно. Штриховые линии
показывают переходы, «запрещенные» по причи-
нам энергетического или кинетического характера.
Этапы связывания с наружной стороны мембраны по-
казаны на рисунке слева (L — лактоза, Сн — переносчик
в конформации «н»), тогда как каталитические этапы,
при которых центр связывания направлен внутрь —
справа (Св— переносчик в конформации «в»).
98 Часть II. Основы жизнедеятельности микробных клеток
кинетический переход между различными кон-
формационными состояниями; штриховые стрел-
ки указывают теоретически возможные, но ма-
ловероятные переходы. Вся последовательность
переходов и состояний составляет кинетически
приемлемое описание транспортного цикла, ко-
торое можно использовать для математического
анализа. Необходимо, однако, помнить, что изме-
нение конформации переносчика (Сн/Св) не озна-
чает его движение через мембрану (см. рис. 5.3).
5.4. Кинетический анализ служит методом идентификации
и описания транспортных процессов
Для того чтобы выяснить, каким способом ве-
щество проникает в клетку —путем диффузии
или транспорта с участием переносчика, изу-
чают скорость переноса растворенного вещества
через мембрану (рис. 5.6). Скорость диффузии
возрастает с увеличением концентрации раство-
ренного вещества линейно, тогда как скорость
транспорта с участием переносчика перестает воз-
растать после насыщения его субстратом, дости-
гая максимальной величины, т. е. в этом случае
зависимость от концентрации транспортируемо-
го вещества имеет характер кинетики с насыще-
нием, полностью аналогичной кинетике фермен-
тативной реакции. Таким образом кривые, пред-
ставленные на рис. 5.6, А и 5.6, Б, отражают
также различие между химической и фермента-
тивной реакциями в отношении того, как их ско-
рости зависят от концентрации субстрата. Для
изучения кинетики транспортных процессов ис-
пользуются подходы, принятые в ферментатив-
ной кинетике. Действительно, переносчик можно
рассматривать как фермент, активностью которо-
го вызывается не изменение структуры субстрата,
но изменение его локализации. При исследовании
транспорта полезен и графический анализ экс-
периментальных данных, аналогичный применя-
емому в ферментативной кинетике; особенно это
относится к кинетике ингибирования. Хорошо из-
вестные графики, например зависимости скоро-
сти реакции от концентрации субстрата (урав-
нение Михаэлиса-Ментен; рис. 5.6, Б) и обрат-
ных величин скорости и концентрации (уравнение
Лайнуивера-Берка, рис. 5.6, Г), можно использо-
вать для определения типа ингибирования (кон-
курентного или неконкурентного).
Наиболее простой механизм, с помощью ко-
торого растворенное вещество может пересекать
мембрану, преодолевая барьер проницаемости, —
это диффузия, т. е. перемещение без непосред-
ственного взаимодействия с мембранными белка-
ми. Скорость однонаправленной диффузии (vi)
вещества через мембрану из компартмента I в
компартмент II без участия переносчика прямо
пропорциональна концентрации растворенного
вещества в компартменте I (рис. 5.6, Л):
V) = PA[S],, (5.1)
где Р — коэффициент проницаемости и А —пло-
щадь мембраны. Аналогичное уравнение описы-
вает обратный поток — из компартмента II в ком-
партмепт I. Результирующий поток вещества (S)
из компартмента I в компартмент II описывается
уравнением
V = PA([S)I-[S]H) (5.2)
Процесс диффузии неспецифичен п происходит
только по градиенту концентрации данного рас-
творенного вещества. Скорость пассивной диф-
фузии через плазматическую мембрану боль-
шинства (гидрофильных) растворенных веществ
низка, и такой процесс нс имеет физиологически
важного значения у прокариот.
Пассивное движение молекул вещества через
мембрану путем диффузии зависит от разности
его концентраций по разные стороны мембраны.
В отличие от этого, для транспорта с участием
переносчика характерны: 1) кинетика с насыще-
нием; 2) специфичность и 3) чувствительность к
ингибированию.
Транспорт, опосредуемый переносчиком,
включает участие мембранного транспортного
белка. Доказать участие такого белка в транс-
порте не всегда легко. Основными аргументами в
пользу участия переносчика служат кинетические
Глава 5. Многообразие функций клеточной мембраны у прокариот 99
характеристики процесса: 1) кинетика с насыще-
нием, 2) субстратная специфичность, 3) подавле-
ние специфическим агентами и 4) кинетические
данные относительно противотока молекул суб-
страта между двумя компартментами.
Чтобы провести разграничение между транс-
портом с участием переносчика и транспортом
путем диффузии, можно начать с описания вто-
ричного унипорта, так называемой облегченной
диффузии (см. разд. 5.6). Это пассивный про-
цесс, но в нем участвует переносчик, и результи-
рующий поток, как правило, не прямо пропорци-
онален градиенту концентрации, но описывается
уравнением Михаэлиса-Ментен (рис. 5.6, Б), как
и многие другие транспортные системы.
V — Vmax ' [S]/(Am + [S]) (5.3)
Величина К^, используемая по аналогии с
ферментативной кинетикой, означает такую
концентрацию вещества, при которой скорость
транспорта v составляет половину максималь-
ной скорости (Инах)- Эту величину обозначают
также Кт (константа транспорта). Кинетический
анализ часто помогает установить одновременное
действие двух механизмов транспорта данного
субстрата. Это поясняет рис. 5.6, В на примере
комбинации диффузии и транспорта с участием
переносчика.
Рис. 5.6. Кинетика процесса диффузии и процесса
транспорта с участием переносчика.
А. Зависимость скорости переноса субстрата от его кон-
центрации в случае диффузии.
Б. Зависимость скорости переноса субстрата от его кон-
центрации в случае транспорта с участием переносчика
(график Михаэлиса-Ментен).
В. Скорость переноса субстрата посредством двух меха-
низмов— диффузии и с участием переносчика. 1 — ме-
ханизм диффузии; 2 — транспорт с участием переносчи-
ка; 3 — транспорт с участием переносчика + диффузия.
Г. График двойных обратных величин (график Лайнуи-
вера-Берка), построенный по тем же данным, что и (Б).
5.5. Энергетика транспорта с участием переносчика:
механизм сопряжения
Процесс диффузии (или облегченной диффузии)
не требует затрат метаболической энергии, по-
скольку связанное с ним изменение свободной
энергии имеет отрицательный знак. Это означа-
ет, что он не сопряжен с экзергонической реакци-
ей, но осуществляется главным образом за счет
разности концентраций вещества по разным сто-
ронам мембраны. Вместе с тем транспорт в клет-
ку многих веществ приводит к их накоплению в
цитоплазме. Такой перенос против градиента кон-
центрации как эндергоническая реакция харак-
теризуется положительным значением А(7, озна-
чающим, что процесс имеет не спонтанный ха-
рактер. Для его протекания необходимо, чтобы
он был сопряжен с процессом, в котором изме-
нение свободной энергии составляет значитель-
ную отрицательную величину, и таким образом
суммарное изменение свободной энергии в этих
двух сопряженных процессах также было бы элек-
троотрицательным. Основной принцип сопря-
жения «движущей» (экзергонической) и «дви-
жимой» (эндергонической) реакций показан на
рис. 5.7, А. Протекание эндергонической реакции
(на рисунке показанной справа) возможно толь-
ко в том случае, если она сопряжена с экзерго-
нической реакцией (показанной слева). Наруша-
100 Часть II. Основы жизнедеятельности микробных клеток
ющие эту взаимосвязь соединения называют раз-
общителями. Данная система действует в направ-
лении слева направо только в том случае, если ко-
личество энергии, выделяемой в экзергонической
реакции, больше количества энергии, поглощае-
мой в эндергонической реакции; иначе система
действует в обратном направлении. Механизмом
сопряжения определяется и то, что если величи-
на AG реакции, приведенной справа, возрастает
(например, за счет накопления продукта D) до
значения, уравновешивающего AG реакции, при-
веденной слева, экзергоническая реакция останав-
ливается. Для приложения данных принципов к
сопряжению транспортных процессов высказано
немало гипотез. В настоящее время установлен-
ными считаются два основных механизма: хими-
ческое сопряжение, которым обусловлен первич-
ный транспорт (рис. 5.7, Б), и сопряжение посред-
ством ионных потоков, определяющее вторичный
транспорт (рис. 5.7, В). Эти два механизма свя-
заны с двумя различными типами «энергетиче-
ской валюты» клетки: один с энергией АТР, фос-
фо енол пиру вата и других высокоэнергетических
соединений, другой — с энергией электрохимиче-
ских ионных потенциалов.
Принцип сопряжения в случае транспорт-
ных процессов состоит в том, что «движущий»
(экзергонический) и «движимый» (эндергоничес-
кий) процессы механистически связаны так, что
не могут протекать один в отсутствие другого.
Рис. 5.7. Принцип сопряжения при работе транспортных
систем.
А. Экзергонический процесс («движущая» реакция)
связан с эндергоническим процессом («движимой» ре-
акцией) специфическим механизмом сопряжения.
Б и В. Два основных механизма сопряжения. Б. Химиче-
ское сопряжение: в экзергонической («движущей») ре-
акции образуется богатое энергией соединение (как пра-
вило, АТР или фосфоенолпируват), которое использу-
ется далее в эндергонической («движимой») реакции.
В. Хемиосмотическое сопряжение: перенос субстрата
против градиента его концентрации обеспечивает энер-
гия электрохимического ионного потенциала, запасен-
ная в результате работы первичного ионного насоса.
5.6. Для прокариот характерно большое разнообразие
механизмов транспорта
Транспортные процессы можно классифициро-
вать по различным признакам, таким как струк-
тура белка-переносчика, природа транспортиру-
емого соединения и кинетические или энерге-
тические характеристики. В настоящее время
общепринятой является система классификации,
предложенная четверть века назад Питером Мит-
челлом, которая подразделяет процессы транс-
порта по признаку того, какой источник энер-
гии используется для их осуществления. По этому
признаку транспортные процессы делятся на че-
тыре класса (рис. 5.8).
I. Диффузия, путем которой в клетку про-
никают некоторые растворенные вещества.
У грамотрицательных бактерий диффузия
веществ обусловлена присутствием канало-
ообразующих белков (например, поринов) в
наружной мембране, иначе непроницаемой
(см. разд. 5.6.1 и рис. 5.8, А, Б).1
1 В микробиологической литературе обычно не рассматривают диффузию как один из видов транспорта; диффузией,
в отличие от транспорта, называют процесс, протекающий без затраты метаболической энергии и не приводящий к на-
коплению вещества в клетке против градиента его концентрации. — Прим. ред. перев.
Глава 5. Многообразие функций клеточной мембраны у прокариот 101
II. Вторичный транспорт, протекающий ис-
ключительно за счет использования энер-
гии электрохимического потенциала данно-
го растворенного вещества (см. разд. 5.6.2).
Эта энергия обеспечивает транспорт против
градиента концентрации транспортируемого
вещества. Механизм может состоять в том,
что транспорт «движущего» и «движимо-
го» соединений происходит как котрапс-
порт, т. е. перенос в одном направлении
(симпорт; рис. 5.8, Г), либо как перенос
в противоположных направлениях, путем
противотока (антипорт; рис. 5.8, Д). В этот
класс транспортных процессов включен так-
же (по сходству механизма и зависит.ости
от градиента концентрации) однонаправ-
ленный транспорт с участием переносчика,
осуществляемый исключительно за счет
энергии электрохимического потенциала
транспортируемого субстрата (унипорт, или
облегченная диффузия, рис. 5.8, В).
III. Первичный транспорт, при котором пе-
ренос растворенного вещества непосред-
ственно сопряжен с химической или фото-
химической реакцией. Системы первично-
го транспорта осуществляют превращение
световой или химической энергии в элек-
трохимическую, т. е. в электрохимический
потенциал транспортируемого соединения
(см. разд. 5.6.3; рис. 5.8, Е).
IV. Перенос с присоединением химичес-
кой группы, катализируемый фосфоенол-
пируват:углевод-фосфотрансферазпыми си-
стемами (ФТС) бактерий. Этот механизм
отличается от всех других тем, что связан
с химической модификацией (фосфорили-
рованием) транспортируемого соединения
(разд. 5.6.4; рис. 5.8, Ж).
Поскольку транспортные системы классов III
и IV, а также системы симпорта и антипорта
(класс II) могут осуществлять перенос веществ
против их электрохимического градиента, с затра-
той метаболической энергии, их называют также
системами первичного или вторичного активно-
го транспорта.
Рис. 5.8. Основные механизмы переноса веществ че-
рез биологические мембраны. Проникновение субстра-
тов (S) через фосфолипидную мембрану бактериаль-
ной клетки происходит путем (облегченной) диффузии
(1, А), диффузии через белковый канал (I, Б) и в про-
цессах с участием переносчиков, которые делятся на
несколько типов (II-IV) по источнику энергии и другим
характеристикам. ФЕП — фосфоенолпируват; X — веще-
ство, перенос которого сопряжен с транспортом субстра-
та; А — вещество—источник энергии, превращающееся
в продукт В.
Транспортные процессы можно разделить на
четыре класса по характеру используемого источ-
ника энергии: (облегченная) диффузия1, вторич-
ный транспорт, первичный транспорт и перенос с
присоединением химической группы.
5.6.1. Транспорт путем диффузии
и через пориновые каналы
Помимо газов, таких как О2, СО2 и NH3, а так-
же некоторых мелких молекул (например, воды
или этанола), более или менее свободно проникать
через плазматическую мембрану могут молекулы
гидрофобных (т. е. растворимых в липидах) со-
Не путать с облегченной диффузией как разновидностью вторичного транспорта. — Прим. вед. ред.
102 Часть II. Основы жизнедеятельности микробных клеток
единений (рис. 5.8, Д). К ним относятся алифа-
тические соединения (например, бутанол) и аро-
матические соединения (например, бензол). Для
многих растворенных веществ, представляющих
собой слабые кислоты или основания, способность
проникать через мембрану зависит от их протопи-
рования. Они легко проникают в клетку в неза-
ряженной форме и гораздо труднее преодолевают
барьер проницаемости в заряженной форме. При-
мерами таких веществ могут быть уксусная кис-
лота (проходит через мембрану в протонирован-
ной форме) и аммоний (проникает через мембра-
ну в депротонированной форме).
Такие процессы не требуют участия белков,
однако клетки часто продуцируют транспортные
системы даже для веществ, способных относи-
тельно легко проникать через плазматическую
мембрану. Это объясняется тем, что при неболь-
шом градиенте концентрации подобного субстра-
та скорость его диффузии может быть недоста-
точной для поддержания физиологических про-
цессов (например, быстрого роста). Типичный
пример соединений такого рода — глицерол, ко-
торый клетки Е. coli и других бактерий погло-
щают с помощью специфической облегчающей
транспорт системы, несмотря на то что мем-
брана для него легко проницаема. В качестве
других примеров можно привести ионы аммония,
ароматические аминокислоты и жирные кислоты.
Во многих клетках имеются даже каналы, специ-
фичные для молекул воды.
Наружная мембрана грамотрицательных бак-
терий, в отличие от плазматической мембраны,
лишь относительно проницаема для небольших
молекул. Ее основу составляет липидный бислой,
асимметрично построенный из липополисахари-
дов и фосфолипидов, и в принципе опа пред-
ставляет собой барьер для гидрофильных мо-
лекул, таких как углеводы, аминокислоты или
простые ионы, а также для крупных молекул,
например белков. Перенос таких молекул через
наружную мембрану происходит не с участием
переносчиков, а посредством каналообразующих
белков поринов (рис. 5.8 I, Б). Каналообразую-
щие белки наружной мембраны можно разделить
па три класса: 1) неспецифичпые каналы, назы-
ваемые также общими порипами, 2) более или ме-
нее специфичные каналы (специфичные норипы)
и 3) системы активного транспорта, родственные
поринам. К последнему классу относятся систе-
мы поглощения витамина В12 и хелатов железа
(см. разд. 8.8.1). Эти системы энергизуются по-
средством конформационного сопряжения с плаз-
матич( ской мембраной через их белковые компо-
ненты, пронизывающие периплазматическое про-
странство (Tol/Ton-система). Механизм действия
этих белков, хотя он еще недостаточно изучен,
следует отличать от механизма действия поринов.
Порины — это канал ©образующие белки, кото-
рые опосредуют пассивное проникновение раство-
ренных веществ через наружную мембрану гра-
мотрицательных бактерий.
Каналы, относящиеся к I и II классам,
представляют собой наполненные водой по-
ры. Субстратная специфичность поринов может
быть обусловлена наличием в канале лигапд-
связывающих участков. Поскольку внутренний
связывающий участок может достигать состояния
насыщения, поринам присущи некоторые свой-
ства, характерные для переносчиков (например,
субстратная специфичность и кинетика с на-
сыщением). Типичным примером специфичных
поринов может служить белок LamB наруж-
ной мебраны Е. coli, способствующий поступле-
нию мальтозы в периплазму; дальнейший перенос
мальтозы из периплазмы в цитоплазму осуществ-
ляет специфическая транспортная система, зави-
сящая от субстрат-связывающего периплазмати-
ческого белка (см. рис. 5.15). Кроме того, об-
наружены специфичные каналы для сахарозы и
нуклеозидов. Примерами неспецифичных пори-
пов у Е. coli могут служить белки, кодируемые
генами ompF, отрС и phoE. Наружная мембра-
на изобилует этими поринами; например, в клетке
Е. coli имеется порядка 105 молекул каждого из
этих белков.
С помощью рентгепоструктурпого анализа
определена трехмерная структура поринов из
Rhodobacter capsulatus и Е. coli (рис. 5.9; см.
цв. вклейку). Они представляют собой комплекс
из трех идентичных субъединиц молекулярной
массой примерно 35 кДа. Через канал диамет-
ром приблизительно 1 нм могут более или менее
свободно проникать молекулы массой до 600 Да.
/3-Слои (складки, образуемые антипараллельны-
ми /3-цепями) в молекулах поринов, по-видимому,
образуют цилиндрическую структуру, напомина-
ющую бочонок. Таким образом, по структуре по-
рипы отличаются от большинства транспортных
белков (ср. рис. 5.9 и 5.2).
Глава 5. Многообразие функций клеточной мембраны у прокариот 103
5.6.2. Системы вторичного транспорта
Системы вторичного транспорта (рис. 5.8, II)
используют в качестве движущей силы уже су-
ществующий трансмембранный градиент, образо-
вавшийся в результате действия систем первич-
ного транспорта. Примером вторичного транспор-
та может служить симпортер лактоза/Н+ (LacY)
Е. coli (рис. 5.10), подробно описанный ниже. Си-
стемы первичного активного транспорта, в дан-
ном случае дыхательная цепь, перекачивают ио-
ны (в большинстве случаев Н+ или Na+) через
мембрану, создавая таким образом электрохими-
ческий ионный потенциал. Энергия этого потен-
циала используется далее для транспорта лакто-
зы в клетку против градиента ее концентрации.
Эти данные о поглощении субстрата с накоплени-
ем его в клетке послужили основанием для введе-
ния термина «вторичный активный транспорт».
Величина суммарного изменения свободной энер-
гии при протекании обоих этих процессов должна
быть отрицательной, т. е. результирующий транс-
порт происходит «под гору», согласно принципу
энергетического сопряжения (см. разд. 5.5).
Системы вторичного транспорта действуют
по механизму унипорта, симпорта или антипор-
та в соответствии с количеством участвующих со-
единений и характером сопряжения их потоков.
Движущей силой вторичного транспорта служит
суммарный электрохимический потенциал соеди-
нений, участвующих в процессе.
Унипортом называют механизм, посред-
ством которого через мембрану переносится од-
но вещество (рис. 5.8, В). Такой транспорт проис-
ходит с использованием энергии трансмембранно-
го градиента концентрации этого вещества, если
оно не несет заряда. При симпорте (рис. 5.8, Г)
переносятся два вещества (S и X) одновременно
в одном направлении. В случае антипорта два
вещества транспортируются в противоположных
направлениях (рис. 5.8, Д). Принцип вторичного
транспорта состоит в сопряжении двух потоков —
движущего потока (происходит по градиенту кон-
центрации субстрата) и движимого потока (про-
исходит против градиента), таким образом, что
один поток невозможен в отсутствие другого.
В табл. 5.2 представлены примеры различных
транспортных систем и механизмы их сопряже-
ния с градиентами веществ на плазматической
Рис. 5.10. Хемиосмотическое сопряжение в системе вто-
ричного транспорта у бактерий. В результате работы
дыхательной цепи (ДЦ, первичный насос) протоны вы-
ходят из клетки, создавая электрохимический протон-
ный потенциал (протондвижущая сила). На использо-
вании энергии этого градиента основано действие пе-
реносчика лактозы (ПЛ), обеспечивающего накопление
лактозы в цитоплазме. S — субстрат.
мембране бактерий, а также указаны использу-
емые при транспорте источники энергии. Коли-
чественно эти системы описываются на основе
хемиосмотической теории (см. гл. 4). Электрохи-
мический потенциал, А/щ/F, иона S (находяще-
гося в двух компартментах, I и II) описывается
уравнением
A/ls/F = пА'0 + RT/F In [Sn]/[Si] (5.4)
Электрохимический протонный потенциал
(S = Н+, n = 1), как правило, называют терми-
ном, предложенным Митчеллом, — протондви-
жущая сила (Ар). При 25 °C величина Ар
(в милливольтах) рассчитывается по уравнению:
Ар = Ат/; — 59 АрН (5-5)
Энергия, запасенная в виде электрохимического
протонного потенциала или потенциала других
сопрягающих ионов, например Na+, использует-
ся в системах вторичного транспорта для осу-
ществления направленного движения растворен-
ных веществ против градиента их концентрации
(табл. 5.2).
Электронейтральный транспорт по механиз-
му унипорта (табл. 5.2, 1) осуществляется за счет
энергии диффузионного потенциала субстрата So,
который можно рассчитать (в вольтах) по урав-
нению Нернста, зная внутреннюю и наружную
концентрации субстрата (|So]B и [So]H соответ-
ственно). Если транспортируемое путем унипор-
та вещество несет заряд, при расчете энерге-
тики транспорта диффузионный потенциал суб-
страта суммируют с электрическим потенциалом
104 Часть II. Основы жизнедеятельности микробных клеток
Таблица 5.2. Движущая сила переноса веществ через мембрану в некоторых типичных системах вторичного транс-
порта
Механизм Движущая сила транспорта1 Транспортная система (ген)
Среда I Цитоплазма Z1°gf§] 1ьв1
1 Поглощение глюкозы (S°) у Zymotnonas mobilis (gif)
2 s° Zlog^l + АФ [s+[ Z log + A V + ZApH ZIO6ll+^+zlogI^l Поглощение лизина (S+) у Bacillus stearo- thermophilus
3 Поглощение лактозы (S°) у Escherichia coli
4 s° — Na* — (lacY) Поглощение пролина (S°) у Escherichia coli
(putP)
5 2Na+ — <-2- Zlog + ДФ + 2Zlog 1^1 KI 6 [Na+I Поглощение глутамата (S“) у Escherichia coli (gltS)
6 Зн* — Z log !• + АФ + 3ZApH [Sb ] Z log - A V + ZApII [Sb ] Zlog|^J-AV4-Zlog||J P1bI P‘2h1 Zlog||^ + ZApH [Sh J Поглощение цитрата (НЦит2- = S2—) у Esche-
7 s2 - н+ - richia coli в аэробных условиях (citH) Поглощение малата (S2-) у Lactococcus lactis
(malP)
8 [W sS Малат (НМал- = 8-1)/лактат (НЛак — Sg)-
9 + r ->2 F' AY - антипорт у Lactococcus lactis (mlfP) Выделение тетрациклина (S+ ) у Escherichia coli (tetA) (антипорт катион/тетрациклин)
6,5 1 1 ApH 7,5
Механизмы транспорта: 1, 2 — унипорт; 3-7 — симпорт; 8. 9 — антипорт. 1 Для упрощения принято приводить со знаком «+» компоненты электрохимического потенциала, которые способствуют протеканию реакции транспорта в прямом направлении, и со знаком « —» — в обратном. S — субстрат; Z = 2.3RT[F\ AV— мембранный потенциал; АрН — градиент pH; [SH] и [SB]— концентрация растворенного вещества снаружи клетки и внутри клетки соответственно.
(мембранный потенциал Д'0; табл. 5.2.2). В этом
случае результирующий транспорт прекращается,
когда величина диффузионного потенциала ста-
новится равной ЛтД При данном условии можно
рассчитать стационарный концентрационный гра-
диент. Если мембранный потенциал составляет
120 мВ (плюс снаружи), внутриклеточная концен-
трация S+ будет превышать наружную в 100 раз.
При транспорте электронейтральной лактозы пу-
тем симпорта с протоном (табл. 5.2, 3) происхо-
дит перенос заряда через мембрану. В случае та-
кого электрогенного (т. е. связанного с переносом
заряда) транспортного процесса мембранный по-
тенциал (Д'0) и диффузионный потенциал суб-
страта So суммируются с диффузионным про-
тонным потенциалом (Z-ДрН). Другой процесс
электрогенного транспорта — зависимое от Na+
поглощение пролина (табл. 5.2, 4) —отличается от
рассмотренного процесса тем, что вместо протон-
ного потенциала действует натриевый потенциал.
Поглощение глутамата у Е. coli с участием си-
стемы GltS сопряжено с транспортом двух ионов
натрия, поэтому для расчета энергетики транс-
порта берут удвоенный диффузионный потенциал
Na+ (табл. 5.2, 5). При транспорте цитрата путем
симпорта с тремя протонами вклад протонного
потенциала является трехкратным (табл. 5.2, 6).
Симпорт малата с протоном (табл. 5.2,7) со-
провождается результирующим переносом отри-
цательного заряда, поэтому в движущую силу
транспорта вносит вклад отрицательная величи-
на Д'р!. Энергетические характеристики процессов
антипорта (табл. 5.2, 8 и 9) рассчитываются так
же, как и в случае симпорта или унипорта, но с
учетом направления транспорта каждого из ве-
ществ.
Глава 5. Многообразие функций клеточной мембраны у прокариот 105
Таблица 5.3. Типичные примеры систем вторичного транспорта у бактерий
Тип транспорта Пример Ген Сопрягающий ион Организм Основная функция
Унипорт Симпорт Антипорт 1 В системах ап —антипор! Переносчик глюкозы Пермеаза лактозы Переносчик пролина Переносчик глутамата Переносчик галактозы Переносчик К+ Антипортер малат/лактат Антипортер оксалат/формиат Антипортер аргинин/орнитин Антипортер ГЛЮКОЗО-6-Р/Рв анти порта субстрата и прод г. gif lacY putP gltT galP trkAGH mlfP oxlT arcD uhpT укта оба ве н+ Na+ Н+ + Na+ н+ н+ ап 1 ап 1 ап 1 ап 1 щества служат одн Zymomonas mobilis Escherichia coli Escherichia coli Bacillus stearo- thermophilus Escherichia coli Escherichia coli Lactococcus lactis Oxalobacter formigenes Pseudomonas aeruginosa Escherichia coli ©временно и «движущи Поглощение глюкозы Поглощение /3-галакто- зидов Поглощение пролина Поглощение глутамата Поглощение галактозы Транспорт К+; осморе- гуляция Антипорт субстрат/продукт; образование Др Антипорт субстрат/продукт; образование Др Антипорт субстрат/продукт Поглощение глюкозо-6-Р и фосфата м», и «движимым» ионами
Транспорт путем упипорта характерен для
клеток эукариот (например, транспорт глюко-
зы в различных клетках, включая клетки дрож-
жей), тогда как у бактерий он встречается
редко. К известным бактериальным системам
унипорта относится только переносчик, обес-
печивающий облегченную диффузию глю-
козы у Zymomonas mobilis (табл. 5.3), и системы
транспорта глицерола, функционирующие у мно-
гих бактерий.
Системы антипорта распространены бактерий.
Хороню изучены механизмы антипорта субстра-
та и продукта реакции, например, антипорт ма-
лат/лактат при сбраживании малата до лак-
тата у Lactococcus lactis (рис. 5.11), транспорт
оксалат/формиат у Oxalobacter formigenes, а так-
же лактоза/галактоза и аргинин/орнитин у мо-
лочнокислых бактерий. Системы антипорта могут
служить обменниками как очень сходных веществ
(например, при антипорте субстрата и продук-
та), так и относительно различающихся соедине-
ний, например фосфата и сахарофосфата у Е. coh
(табл. 5.3), или токсичных соединений и продук-
тов их детоксикации (см. табл. 5.2, 9).
Рис. 5.11. Антипорт субстрата и продукта при сбра-
живании малата с образованием молочной кислоты у
Lactococcus lactis. Поглощение субстрата в анионной
форме и выделение электронейтрально го продукта с по-
ступлением одного иона Н+ в цитоплазму приводят к
образованию электрохимического протонного потенци-
ала (со знаком плюс на внешней стороне мембраны),
используемого данным организмом в качестве источни-
ка энергии, н — наружная сторона мембраны; в — внут-
ренняя сторона мембраны.
Наиболее распространено у бактерий погло-
щение растворенных веществ путем симпор-
та, сопряженного в большинстве случаев с пе-
реносом Н+ или Na+, как при транспорте
многих аминокислот, моносахаридов и дисаха-
ридов. Среди бактериальных белков-переносчи-
ков хорошо изучен /3-галактозид/Н+-симпор-
тер из Е. coli, называемый также пермеазой
106 Часть II. Основы жизнедеятельности микробных клеток
Рис. 5.12. Три возможных варианта действия /3-галак-
тозид/Н * -симпортера у Е. coli.
А. Поглощение лактозы против ее концентрационного
градиента с использованием протондвижущей силы.
Б. Выделение лактозы по градиенту ее концентрации,
приводящее к образованию протонного градиента.
В. Электронейтральный равновесный обмен между вне-
клеточным и внутриклеточным пулами лактозы. Lac —
лактоза.
лактозы, LacY. Он осуществляет симпорт ряда
галактозидов с протоном, который может проис-
ходить по одному из трех различных механизмов
(рис. 5.12).
1. Сопряженное с переносом протона поглоще-
ние лактозы против ее концентрационного
градиента. При этом накопление лактозы в
клетке сопряжено с входом протонов по их
электрическому и/или концентрационному
градиенту.
2. Сопряженное с переносом протона выделе-
ние лактозы по градиенту ее концентра-
ции. При этом градиент лактозы служит
источником образования электрохимическо-
го протонного потенциала (протопдвижу-
щей силы).
3. Электронейтральный равновесный обмен
между внеклеточной и внутриклеточной
лактозой.
Действие этих механизмов транспорта описыва-
ется с помощью приведенной выше кинетической
модели (рис. 5.5). Обе формы молекулы пере-
носчика— не связанная с субстратом и в виде
комплекса с субстратами — лактозой и Н+ — на-
зывают мобильными, поскольку они претерпева-
ют при переносе конформационные изменения (3)
и (6). Для поглощения лактозы (рис. 5.12, Л) и
ее выделения (рис. 5.12, Б) требуется осуществле-
ние полного цикла работы переносчика (рис. 5.5,
этапы 1-6), тогда как для равновесного объема
(рис. 5.12, Б) достаточно этапов (2)-(4) (рис. 5.5).
Мембранный потенциал влияет только па погло-
щение и выделение субстрата (т. е. на электроген-
ный транспорт), по не на перенос путем обмена.
С помощью различных методов изучены вто-
ричная структура пермеазы лактозы из Е. coli —
расположение <т-спиральпых участков ее моле-
кулы в мембране и соединяющих их петель с
цитоплазматической и периплазматической сто-
рон мембраны (рис. 5.13). Всего молекула это-
го переносчика содержит 12 а-спиральных транс-
мембранных сегментов. Путем изучения мутантов
lacY, полученных методом сайт-направлепного
мутагенеза, удалось определить, какие аминокис-
лотные остатки в молекуле переносчика участву-
ют в узнавании им субстрата, в сопряжении пере-
носа лактозы с переносом протона и осуществле-
нии отдельных этапов цикла переноса (рис. 5.5).
При некоторых мутациях с заменой одного ами-
нокислотного остатка переносчик обеспечивает
вместо сопряженного электрогенного транспорта
лишь облегченную диффузию одного субстрата
(лактозы или Н+), т. е. происходит разобщение
транспорта. Следовательно, энергетический ба-
рьер для необходимого конформационного изме-
нения переносчика снижается только после того,
как центр связывания присоединит оба субстрата.
Сопрягающими ионами при вторичном транс-
порте в большинстве случаев служат ионы Н+
или Na+ (табл. 5.3). Использование ионов Na+
предпочтительно, например, для бактерий, при-
способленных к росту в щелочной среде, т. е.
при избытке Na+, или для термофильных бакте-
рий, поскольку при экстремально высокой темпе-
ратуре мембраны легко проницаемы для прото-
нов. В некоторых системах вторичного транспор-
та в качестве сопрягающих ионов используются и
Na+, и Н+ (например, при переносе глутамата у
Bacillus stearothermophilus), в других — или Na+,
или Н+. Например, сопрягающими ионами в слу-
чае переносчика мелибиозы могут быть Na+, Li+
пли Н+, в зависимости от типа транспортируемо-
го субстрата.
Транспортные системы, используемые для по-
глощения субстратов, как правило, способны осу-
ществлять и их выделение из клеток. Гидрофоб-
ные конечные продукты метаболизма, такие как
спирты (например, бутанол), ацетон и некото-
рые органические кислоты (в недиссоциирован-
ной форме), могут выходить из клеток путем
диффузии. Выведение других веществ, например
аминокислот и карбоновых кислот, происходит с
участием переносчиков. Часто выведение мета-
болитов осуществляется по механизму аптипорта
субстрат/продукт. Выделение лактата, образую-
Глава 5. Многообразие функций клеточной мембраны у прокариот 107
Рис. 5.13. Модель вторичной структуры пермеазы лактозы Е. coli, построенная с использованием биофизических,
биохимических и генетических методов. Аминокислоты обозначены однобуквенными символами. Предполагаемые
трансмембранные спиральные участки молекулы пронумерованы римскими цифрами и заключены в рамки; петли
пронумерованы арабскими цифрами. Рисунок любезно предоставлен Н. Jung.
щегося при сбраживании глюкозы у Е. coli и
Lactococcus lactis, происходит путем симпорта с
протонами, приводя к образованию электрохи-
мического протонного потенциала. Выведение из
клеток многих антибиотиков (например, тетра-
циклина; табл. 5.2, 9) и других токсичных со-
единений осуществляет особое семейство транс-
портных белков, называемых бактериальными
системами множественной лекарственной устой-
чивости. Большинство этих белков функциониру-
ет как системы вторичного транспорта. Их ак-
тивностью обусловлено возрастание устойчивости
к этим веществам. У многих бактерий имеются
также системы ATP-зависимого выведения цело-
го ряда токсичных соединений, включая ионы тя-
желых металлов, путем первичного транспорта
(см. разд. 5.6.3).
5.6.3. Системы первичного транспорта
Действие систем первичного транспорта
(рис. 5.8, III) непосредственно сопряжено с хи-
мической или фотохимической реакцией (А —-> В;
рис. 5.8, Е). Процессы первичного транспорта де-
лятся на три класса (табл. 5.4). Транспортные
системы 1 класса функционируют за счет энер-
гии окислительно-восстановительной реакции или
света; в транспортных системах 2 класса перенос
растворенного вещества сопряжен с синтезом или
гидролизом АТР. В системах 3 класса транспорт
Na+ сопряжен с реакцией декарбоксилирования.
Некоторые типичные примеры этих транспорт-
ных систем приведены на рис. 5.14 и в табл. 5.4.
Класс 1 □ Эти транспортные системы осу-
ществляют перенос Н+ или Na+, сопряженный
с окислительно-восстановительными или световы-
ми реакциями (при дыхании или фотосинтезе).
Принцип их действия описан в гл. 4 и 13. Веро-
ятно, прототипом подобных транспортных систем
и переносчиков вообще можно считать системы
переноса Н+ и С1“ у галобактерий, при функ-
ционировании которых выброс протона (в случае
бактериородопсина) или поглощение С1“ (в слу-
чае галородопсина) непосредственно сопряжено с
поглощением света. В качестве хромофора в мо-
лекуле белка, выполняющего роль светозависи-
мого ионного насоса, у галобактерий содержит-
ся ретиналь, ковалентно связанный с остатком
лизина через шиффово основание (рис. 5.1). По-
108 Часть II. Основы жизнедеятельности микробных клеток
Таблица 5.4. Типичные примеры систем первичного транспорта у бактерий
Тип системы Пример Транспор- тируемое соединение Источник энергии Организм (ген) Функция
1 Светозависимые насосы Насосы, зависящие от окислительно-восста- новительных процес- сов 2а «АТРазы» 26 АВС-перепосчики 2 3 Перенос с декарбо- ксилированием 1 У некоторых бактерий (н< 2 АВС-переносчики — транс Бактериородопсин Бактериальная фотосистема Дыхательная цепь FiFo-АТРаза (F-тип) К+-АТРаза ( Kdp-система; Р-тип) Cd2+-ATPa3a (Р-тип) Системы, зависящие от субстрат-связы- вающих белков: транспорт мальтозы Системы множествен- ной лекарственной устойчивости: транс- порт гемолизина Декарбоксилирование оксалоацетата зпример, Vibrio alginolyticu портные белки со сходной п+ н+ н+ п+ (Na+) к+ Cd2+ Мальтоза Гемолизин Na+ s) действует ft последовател h и Il и Окислителы ю- восстанови- тельная реак- ция Д/t (Ка+) 1 АТР АТР АТР АТР Оксалоацетат а’^-переносящая ьностью, участву! Галобактерии Фототрофные бактерии Волыни! ICTBO бактерий Большинство бактерий Е. coli и другие бактерии Е. coli и другие бактерии Е. coli (malEFGK) Е. coli (hlyBCL) Klebsiella pneumoniae дыхательная цеп ощей в связывай Образование прото ндвижу- щей силы Образование прогон- яли Na+)-дви- жущей силы Синтез АТР Транспорт К+ Выведение кадмия Поглощение мальтозы Цитотоксичность Образование Na+-движу- щей силы ь. ии АТР (см. текст).
Рис. 5.14. Бактериальные системы первичного транс-
порта. Перенос Н+ (протонный насос) при работе дыха-
тельной цепи (тип 1); FiFo АТРаза (тип 2а); транспорт,
зависимый от субстрат-связывающих белков (тип 26);
выделение Na+. сопряженное с декарбоксилированием
(тип 3). S —субстрат.
глощение фотона ретиналем с последующей фо-
тоизомеризацией этой хромофорной группы вы-
зывает изменения конформации молекулы транс-
портного белка, обеспечивающие направленный
перенос иона вдоль определенных аминокислот-
ных остатков по пути, сформированному семью
^спиральными участками (см. рис. 13.12 и 13.13).
Класс 2 □ К этому гетерогенному классу
отнесены системы первичного транспорта, со-
пряженного с синтезом или гидролизом АТР —
АТРазы, или ATP-синтазы. Общепринятое на-
звание АТРазы для большинства этих систем
представляется не вполне приемлемым, так как
обычно их функцией является ионный транспорт
Глава 5. Многообразие функций клеточной мембраны у прокариот 109
при синтезе АТР, но не его гидролиз. Употребле-
ние названия АТРаза объясняется тем, что актив-
ность этих ферментов обычно определяют по гид-
ролизу АТР. Главным образом АТРазы участву-
ют в переносе небольших одновалентных (Н+, К+,
Na+) или двухвалентных (Са2+, Mg2+) катионов,
превращая энергию фосфатной связи АТР в элек-
трохимический градиент переносимого иона или
наоборот — энергию градиента в энергию АТР,
как в случае АТР-сиптаз, сопряженных с дыха-
тельной цепью. Все АТРазы можно разделить
по меньшей мере на три различных подкласса
(табл. 5.4, класс 2а).
1. АТР-синтазы F-типа (например, FiFq-
АТРаза) — многокомпонентные белки, учас-
твующие в процессах первичного превраще-
ния энергии, таких как сопряженный с ды-
ханием или фотосинтезом перенос Н+ (или
Na+) в клетках бактерий, митохондриях и
хлоропластах. Роль этих АТРаз и их струк-
тура рассмотрены в гл. 4. У факультатив-
но анаэробных и, возможно, у других бакте-
рий АТРазы F-типа функционируют в обоих
направлениях. При окислительном фосфо-
рилировании они синтезируют АТР, исполь-
зуя в качестве движущей силы вход прото-
нов в клетку по градиенту их концентра-
ции. При брожении АТРазы осуществляют
перенос Н+ против его градиента с затра-
той энергии АТР, создавая на плазматиче-
ской мембране электрический потенциал.
2. АТРазы P-типа (например, Na+/K+-
АТРаза эукариот или К+-АТРаза бакте-
рий) обычно локализованы в плазматиче-
ской мембране и состоят из одной или двух
субъединиц. В катализируемом ими реак-
ционном цикле образуется высокоэнергети-
ческий фосфорилированный интермедиат.
АТРазы P-типа широко распространен у
бактерий и осуществляют транспорт К+,
Са2+ или Mg2+.
3. АТРазы V-типа (в табл. 5.2 не приведены)
присутствуют в мембране вакуолей эукари-
отических клеток; у прокариот они не обна-
ружены.1
Рис. 5.15. Система поглощения мальтозы, зависящая от
субстрат-связывающих белков у Е. coli. Функции раз-
личных субъединиц, локализованных в плазматической
мембране, периплазме и наружной мембране, рассмот-
рены в тексте. Обозначения субъединиц: В — LamB; Е —
MalE; F—MalF; G — MaIG: К — MalK. Белок LamB не
входит непосредственно в системы транспорта мальто-
зы; он способствует поступлению мальтозы через на-
ружную мембрану. S — субстрат.
Системы транспорта, зависимые от пе-
риплазматических субстрат-связывающих
белков, осуществляют первичный транспорт
другого типа, непосредственно связанный с гид-
ролизом АТР (рис. 5.15), и присутствуют в
основном у грамотрицательных бактерий. По-
добные системы представляют собой белковые
комплексы. У Е. coli к настоящему времени об-
наружено более 20 таких систем. Они перено-
сят разнообразные субстраты, включая амино-
кислоты, пептиды, моносахариды, дисахариды,
органические анионы, нуклеотиды, коферменты
и неорганические ионы, такие как сульфат или
фосфат. Хорошо изучены системы поглощения
мальтозы, гистидина и олигопептидов (у Е. coli
и Salmonella typhimurium). Как правило, моле-
кулы этих белков-переносчиков состоят из четы-
рех субъединиц, или доменов (рис. 5.15). Две из
них высокогидрофобны и погружены в мембрану,
тогда как две другие, по-видимому, лишь соеди-
нены с ней с цитоплазматической стороны. От-
личительная особенность этих систем состоит в
том, что молекулу субстрата должен транспор-
тировать к ним дополнительный водораствори-
мый субстрат-связывающий белок, локализован-
1 К настоящему времени АТРазы V-типа обнаружены и у прокариот, например у Enterococcus hirae и многих архей. По
структуре они близки к АТРазам F-типа. — Прим, перев.
110 Часть II. Основы жизнедеятельности микробных клеток
ный в периплазме. Некоторые подобные системы,
например система транспорта мальтозы, включа-
ют также расположенный в наружной мембране
специфичный каналообразующий белок — порин,
обеспечивающий диффузию субстрата. Механизм
транспорта мальтозы показан на рис. 5.15. Маль-
тоза проникает в периплазму через специфичный
к этому сахару порин LamB и прочно связывает-
ся субстрат-связывающим белком Ма1Е. В резуль-
тате связывания конформация этого белка изме-
няется— он переходит из «открытого» состояния
в «закрытое». При взаимодействии данного бел-
ка, нагруженного субстратом, с расположенными
в мембране субъединицами MalF и MalG перенос-
чика происходит высвобождение субстрата и пе-
ренос его в цитоплазму. Этот процесс сопряжен с
гидролизом АТР, который осуществляют две мем-
браносвязанные субъединицы Ма1К.
Системы поглощения субстратов, зависящие
от периплазматических субстрат-связывающих
белков, характеризуются однонаправленностью
транспорта. Они обладают высоким сродством
к субстрату (в микромолярном диапазоне его
концентраций) и отличаются относительно низ-
кой максимальной скоростью транспорта. Осо-
бенность такого вида транспорта у грамотрица-
тельных бактерий состоит в его чувствительно-
сти к осмотическому шоку, который вызывает
потерю водорастворимых субстрат-связывающих
белков и соответственно транспортной актив-
ности. Некоторые периплазматические субстрат-
связывающие белки, помимо роли высокоспеци-
фичных акцепторов субстратов, выполняют и
другую важную функцию — сигнализации об из-
менениях в наличии питательных веществ — и
связаны поэтому с хемотаксисом (см. гл. 20).
Ранее считалось, что зависящие от субстрат-
связывающих белков транспортные системы при-
сутствуют только у грамотрицательных бакте-
рий, поскольку грамположительные бактерии не
имеют наружной мембраны. Однако к насто-
ящему времени транспортные схемы этого ти-
па обнаружены и у грамположительных бакте-
рий. Субстрат-связывающие белки присоединены
у них посредством N-концевого липидного ком-
понента к наружной поверхности плазматической
мембраны.
Транспортные системы, связанные с водорас-
творимыми белками, имеются как у бактерий,
так и у эукариот и образуют обширное супер-
семейство. Для всех этих переносчиков характе-
рен общий мотив в аминокислотной последова-
тельности, образующей участок связывания АТР,
поэтому данный класс транспортных АТРаз на-
зван семейством ABC-переносчиков (от АТР-
binding cassette). Белки этого семейства участ-
вуют у бактерий во многих физиологических
процессах, таких как поглощение растворенных
веществ, выведение антибиотиков и дифференци-
ровка; у эукариот они выполняют такие важные
функции, как обеспечение множественной устой-
чивости к токсинам, транспорт пептидов и С1~.
Различные ABC-переносчики сходны по ами-
нокислотной последовательности и структурной
организации. К числу веществ, выделяемых из
клеток с участием ABC-переносчиков, относятся
белки (например, гемолизин), полисахариды (на-
пример, глюканы и компоненты капсул) и различ-
ные токсины. Ионы тяжелых металлов, например
кадмия и мышьяка, выводятся так называемы-
ми экспортирующими АТРазами, родственными
АТРазам Р-типа.
Класс 3 □ Эти специфические транспорт-
ные системы осуществляют выведение из кле-
ток Na+, сопряженное с декарбоксили-
рованием; они открыты недавно у некоторых
бактерий (Propionigenium modestum, Klebsiella
pneumoniae и Salmonella typhimurium). Декарбок-
силированию подвергаются карбоновые кислоты,
например оксалоацетат или метилмалонил-СоА.
Процесс катализирует мембрапосвязаниая, био-
тин-зависимая декарбоксилаза (см. рис. 5.10).
АТРазная реакция при таком векторном транс-
порте, связанная с электрохимическим градиен-
том Na+, рассмотрена в гл. 4.
Системы первичного транспорта осуществ-
ляют направленный перенос растворенных
веществ, непосредственным образом сопряжен-
ный 1) со световыми или окислительно-восста-
новительными реакциями, 2) с синтезом/гид-
ролизом АТР (АТРазы, АВС-псреносчики) или
3) с реакцией декарбоксилирования.
5.6.4. Перенос с присоединением
химической группы
Особенность этого специфического механизма
транспорта состоит в том, что вещество в процессе
переноса подвергается фосфорилированию. Изве-
стен только один тип переносчиков, осуществля-
Глава 5. Многообразие функций клеточной мембраны у прокариот 111
Рис. 5.16. Различные типы фосфотрансферазных си-
стем (ФТС). Фермент I (EI) и «гистидиновый» белок
НРг у всех ФТС общие. Фермент II (ЕН) специфичен для
каждого транспортируемого соединения, в данном слу-
чае маннитола (llMtl), глюкозы (llGlc) и маннозы (ПМап).
Все ферменты ЕП включают не менее трех автоном-
ных доменов, которые могут существовать как незави-
симые белки или соединяться с образованием крупно-
го белка ЕП. Первый сайт фосфорилирования (P~His)
локализован в гидрофильном домене ПА (прежнее на-
звание этого домена — фермент III, или EIII), вто-
рой сайт фосфорилирования (обычно P^Cys, реже
P—His)— в гидрофильном домене IIB. Мембраносвязан-
ный (гидрофобный), или транспортный, домен ПС мо-
жет разделяться на две части (ПС и IID). Р~ — фос-
форилированные формы растворимых белков/доменов;
стрелками показано направление протекания соответ-
ствующих реакций. По [3].
ющих такой транспорт — бактериальные фос-
фоенолпируват (ФЕП)-зависимые фосфо-
трансферазные системы транспорта угле-
водов (ФТС). В одной клетке может присут-
ствовать до 20 различных ФТС, при участии
которых происходит поглощение тех или иных уг-
леводов. Структура их в основном сходна у всех
бактерий (рис. 5.16). При транспорте с присоеди-
нением группы связанный с переносчиком угле-
вод транспортируется через мембрану и фосфо-
рилируется с использованием в качестве донора
фосфата ФЕП. Фосфорильная группа последо-
вательно переносится от ФЕП через протеинки-
назу, называемую ферментом I (EI), па один
из фосфат-акцепторных белков ФТС —термоста-
бильный, или гистидиновый, белок (НРг) либо
фермент II (ЕП) — и далее на специфический уг-
левод. Белки EI и НРг у всех ФТС в клетке общие;
в то же время каждый субстрат распознается од-
ним или несколькими специфичными фермента-
ми II. Фосфорильная группа ковалентно связыва-
ется с определенным остатком гистидина в моле-
кулах EI и НРг.
Перенос с присоединением группы, осуществ-
ляемый фосфоенолпируват-зависимыми фосфо-
трансферазными системами (ФТС), включает
фосфорилирование поглощаемого сахара или
полиспирта в процессе транспорта.
Молекулы различных ЕП состоят из трех или,
реже, четырех субъединиц (доменов): ПА, ПВ
и ПС (четвертая, если есть, IID) (рис. 5.16).
Эти субъединицы могут соединяться с образо-
ванием одного крупного белка, как в случае
маннитол-специфичного ЕП (IIMtI), либо фор-
мировать комплекс из 2-4 белков, среди кото-
рых по меньшей мере один погружен в мембра-
ну, как, например, в случае глюкозоспецифич-
ного ЕП (IICBG,CIIAG1C) и маннозоспецифичного
ЕП (IIABManIICManIIDMan) кишечных бактерий.
В любом случае при транспорте с присоединени-
ем группы фосфорил от Р ~ НРг переносится на
остаток гистидина в домене ПА и далее на оста-
ток цистеина (или, реже, гистидина) в домене ПВ.
Таким образом, осуществляемый ФТС перенос с
фосфорилированием субстрата включает следую-
щие реакции (см. также рис. 5.16).
ФЕП + EI -> Р-His EI + Пируват (5.6)
Р~Е1 + НРг -> P-His НРг + EI (5.7)
Р~НРг + ПА -> Р—His ПА + НРг (5.8)
Р~ПА + ПВ -> P-Cys ПВ + ПА (5.9)
(или P~His ПВ + ПА)
ПС (IID)
Р~ПВ + Субстратнар--------->
ПС (IID)
---------------> Субстрат—Рвиутр. + ПВ (5.10)
Поскольку энергия связи P~His (или P^Cys) при-
мерно равна энергии высокоэпергетической свя-
зи в молекуле ФЕП (AG0/ = —61,5 кДж/моль),
реакции (5.6)-(5.9) относятся к легкообратимым.
Реакция (5.10), напротив, при физиологических
условиях практически необратима. Фосфориль-
ная группа переносится от Р~ПВ па субстрат, свя-
занный с доменом(-ами) ПС (IID) переносчика;
ЕП вновь фосфорилируется, получая фосфориль-
ную группу от Р~НРг. Перенос молекулы углево-
да возможен только в том случае, если фосфори-
лирована субъединица ПВ. Согласно этой модели,
112 Часть II. Основы жизнедеятельности микробных клеток
на первом этапе происходит высокоспецифичное
взаимодействие субстрата с находящимся в до-
мене ПС участком связывания переносчика, ори-
ентированным в сторону периплазмы. Если поли-
пептид ЕП не фосфорилирован, перенос прочно
связанного субстрата происходит очень медлен-
но (если вообще происходит) путем, если мож-
но так сказать, облегченной диффузии, требу-
ющей в данном случае переориентации участка
связывания переносчика к цитоплазматической
стороне мембраны. В противоположность этому,
аналоги субстрата, не обладающие высоким срод-
ством к данному переносчику, легко диффунди-
руют с участием нефосфорилированного ЕП и да-
же его неполного варианта — переносчика, лишен-
ного доменов ПА и ПВ и состоящего только из
ПС. Субстраты с высоким сродством к данному
переносчику, по-видимому, «запирают» участок
связывания ПС, препятствуя осуществлению пе-
реноса и последующего фосфорилирования. Пе-
ренос резко стимулируется благодаря фосфори-
лированию домена ПВ; возможно, оно «отпирает»
участок связывания. Одновременно с «отпирани-
ем» или после него происходит фосфорилирова-
ние субстрата, хотя субстрат еще остается свя-
занным на внутренней стороне цитоплазматиче-
ской мембраны с доменом ПС, перешедшим те-
перь в состояние низкого сродства к субстрату.
Затем фосфорилированный субстрат диссоцииру-
ет от переносчика, поступая в цитоплазму, и этим
завершается процесс поглощения; транспортный
белок вновь фосфорилируется. В нормальных фи-
зиологических условиях, т. е. при переносе высо-
коаффинных субстратов с участием фосфорили-
рованного ЕП, данный вид транспорта тесно со-
пряжен с фосфорилированием, но тем не менее
это отдельные последовательные события, кото-
рые можно легко разобщить — либо получив му-
тацию в гене, кодирующем домен ПС переносчи-
ка, либо используя углеводы с низким сродством
к ФТС.
В настоящее время не ясно, следует ли отно-
сить переносчики ЕП к особому классу или они по
механизму действия принципиально не отличают-
ся от других транспортных систем. Вопрос об их
классификации осложняется еще и тем, что фос-
фотрансферазы, помимо транспорта, участвуют в
сигнальных процессах и хемотаксисе, т. е. важней-
ших для клетки функциях поиска питательных
веществ (см. разд. 20.2).
5.7. Регуляция и разнообразие транспортных систем
Транспортные системы необходимы для многих
клеточных процессов — поглощения питательных
веществ, выделения конечных продуктов метабо-
лизма и строительных блоков для биосинтеза кле-
точной стенки, а также передачи сигналов. Все
эти процессы требуют строгой регуляции, обес-
печивающей, например, адаптацию к различным
условиям среды (присутствию или отсутствию пи-
тательных веществ, изменению их концентраций,
наличию нескольких субстратов, вызывающему
необходимость выбора выгодного источника угле-
рода, и т. д.). Кроме того, активность транспорт-
ных систем должна регулироваться для поддер-
жания постоянства внутриклеточного соотноше-
ния концентраций К+, Na+, Н+ и Са2+, а также
других растворенных веществ. Именно с необхо-
димостью регуляции транспорта связано наблю-
даемое разнообразие его механизмов (табл. 5.5).
Поглощение растворенных веществ обеспечивает-
ся их пассивным проникновением и активным пе-
реносом плюс действием транспортных систем с
различными механизмами сопряжения (антипорт
или симпорт). Некоторые растворенные вещества
у одного организма часто переносятся несколь-
кими транспортными системами. Так у Е. coli
поглощение D-глюкозы и D-галактозы осуществ-
ляют не менее семи различных переносчиков,
транспорт глутамата и аспартата — не менее пяти
систем.
Наблюдаемое разнообразие механизмов пере-
носа веществ можно объяснить тем, что в зави-
симости от концентрации субстрата, а также от
того, насколько велики энергетические затраты
на метаболизм и транспорт, используются различ-
Глава 5. Многообразие функций клеточной мембраны у прокариот 113
Таблица 5.5. Некоторые примеры, иллюстрирующие разнообразие транспортных систем
Транспортная система (механизм) Ген(-ы) Субстрат(-ы) Кинетические параметры Функция Регуляция
Ку, мкМ ^rnax» ИМОЛ Ь • мин"-1 • мг'1
Поглощение аминокислот с разветвленной цепью у Escherichia coli
Система, зависимая от субстрат-связыва- ющего белка HvGMHKLJ Leu, He, Vai 0,01-0,2 ? Поглощение аминокислот Регулируется лейцином
Система вторичного транспорта (Na+-со- пряженная) liv-II Leu, He, Vai 2-4 ? Поглощение аминокислот Конститутивная система
Поглощение пролина у Е. coli и Salmonella typhimurium
Система вторичного транспорта (Na+ -со- пряженная) putP Pro 2 ? Использование пролина Индуцируется пролином
Система вторичного транспорта (Н+-со- пряженная) proP Бетаин/Рго 40/300 32 Реакция на осмотический стресс Индуцируется и активируется при гипоосмотичес- ких условиях
Система, зависимая от субстрат-связыва- ющего белка proUVW Бетаин/Рго 1/35 ? Реакция на осмотический стресс Индуцируется и активируется при гипоосмотичес- ких условиях
Поглощение цитрата у Klebsiella pneumoniae
Аэробная система citH НгЦит2 4- 4-3H+ 2000 ? Поглощение цитрата Экспрессируется в присутствии Ог
Анаэробная система citS НгЦит2- 4- + Na+/2H+ 1000 ? Поглощение цитрата Экспрессируется в отсутствие Ог
Поглощение глутамата/аспартата у Е. coli
Система, зависимая от субстрат-связыва- ющего белка ? Glu + Asp 0,5 30 Поглощение ам инокис лот
Система вторичного транспорта (Н+-со- пряженная) gltP Glu + Asp 5 68 Поглощение аминокислот
Система вторичного транспорта (Na+-со- пряженная) gltS Glu 1,5 50 Поглощение аминокислот
Система вторичного транспорта 7 Asp 1,5 5 Поглощение аминокислот
Система вторичного транспорта det Дикарбоновые кислоты, Asp 30 ? Поглощение аминокислот
114 Часть II. Основы жизнедеятельности микробных клеток
ные системы переноса веществ. Может возник-
нуть вопрос, в связи с чем в клетках прокари-
от помимо простых белков-переносчиков, состоя-
щих из одной субъединицы (системы вторичного
транспорта), имеются также и сложные, состоя-
щие из нескольких субъединиц системы первично-
го транспорта (например, зависимые от субстрат-
связывающих белков или фосфотрансферазные).
Множественность транспортных систем объясня-
ется тем, что разные системы используются для
разных целей. Системы первичного транспорта
характеризуются высоким сродством к субстра-
ту и однонаправленностью переноса, т. е. обла-
дают свойствами, которые обеспечивают образо-
вание высоких градиентов концентрации транс-
портируемых веществ. Напротив, действие систем
вторичного транспорта в большинстве случаев об-
ратимо и может приводить к утечке субстрата,
особенно нежелательной, когда его наружная кон-
центрация низка или клетки испытывают недо-
статок в энергии. Поскольку системы вторично-
го транспорта сопряжены с мембранным потен-
циалом и/или ионным градиентом, коэффициент
накопления в клетках транспортируемых ими ве-
ществ не превышает 102-103. В отличие от этого
системы первичного транспорта, благодаря сво-
им источникам энергии, способны создавать зна-
чительные градиенты субстратов, что необходимо
при их низкой концентрации в среде. Так, зависи-
мое от субстрат-связывающих белков поглощение
мальтозы у Е. coli с использованием энергии АТР
приводит к 2-105-кратному накоплению субстрата
в клетке.
Примером механизмов, обеспечивающих спе-
цифические потребности клеток, могут служить
также системы аптипорта субстрата и продук-
та реакции. Брожение дает клеткам относитель-
но немного полезной энергии, поэтому для них
выгодно сокращать ее затраты на поглощение
субстратов. Этому и способствует использова-
ние транспортных систем, в которых поглощение
субстрата и выделение продукта брожения осу-
ществляется одним и тем же переносчиком. Так,
малат/лактат-антипортер у Lactococcus lactis от-
ветствен как за поступление в клетки малата, так
и за выделение из них лактата при молочнокис-
лом брожении (рис. 5.11). Использование малата
внутри клетки приводит к образованию направ-
ленного внутрь градиента его концентрации, то-
гда как образование лактата в цитоплазме созда-
ет его градиент, направленный наружу и благо-
приятствующий выделению из клетки. Поскольку
при физиологических значениях pH малат несет
два отрицательных заряда, а лактат один, функ-
ционирование антипортера приводит к возникно-
вению мембранного потенциала со знаком минус
на внутренней стороне мембраны. Энергию мем-
бранного потенциала клетки этого организма ис-
пользуют для синтеза АТР в ATP-синтазной ре-
акции. Другие хорошо изученные примеры си-
стем, обеспечивающих получение метаболической
энергии за счет выделения из клеток конеч-
ных продуктов метаболизма, — это антипорт окса-
лат/формиат у Oxalobacter formigenes (табл. 5.3)
и антипорт гистидин/гистамин у Lactobacillus
buchneri.
Наличие у бактерий большого числа различ-
ных транспортных систем для одного и того же
соединения можно объяснить и с учетом физио-
логических потребностей. Единственная система
поглощения часто синтезируется, во-первых, для
редких или необычных субстратов и, во-вторых,
для субстратов, постоянно присутствующих в сре-
де в высокой концентрации, причем в послед-
нем случае система поглощения обычно устроена
очень просто. (Пример — Z. mobilis, средой обита-
ния которого служат фруктовые соки, содержа-
щие большое количество сахара. У этой бактерии
для поглощения сахаров действует только один,
простейший из возможных механизмов — облег-
ченная диффузия). Несколько транспортных си-
стем для того или иного вещества присутствует у
бактерии, как правило, в том случае, если оно слу-
жит важным питательным субстратом в данном
местообитании и его концентрация в среде изме-
няется в широком диапазоне. При этом по край-
ней море одна из таких систем являемся обычно
конститутивной и обладает относительно низким
сродством к субстрату (высокие величины Км)>
но высокой скоростью переноса (высокие значе-
ния Епах)- В то же время дополнительные, инду-
цибельпые системы обладают чаще всего высоким
сродством к субстрату, но низкой скоростью дей-
ствия (табл. 5.5) и функционируют главным об-
разом в чрезвычайных ситуациях, в связи с чем
их называют иногда системами зачистки. Индук-
цию дополнительных переносчиков часто вызы-
вает их основной субстрат, что отражает регуля-
торная связь между генами данной транспортной
системы и генами, кодирующими ферменты ката-
болизма их субстрата, т. е. эти гены часто органи-
зованы в оперон или регул он.
Глава 5. Многообразие функций клеточной мембраны у прокариот 115
Как правило, набор систем поглощения данного
субстрата включает не менее чем один конститу-
тивно синтезируемый переносчик с высокой ско-
ростью переноса и низким сродством к субстрату
плюс одну ипдуцибельную транспортную систе-
му с низкой скоростью переноса и высоким срод-
ством к субстрату.
Помимо регуляции транспорта на уровне экс-
прессии переносчиков, существуют механизмы
контроля их активности. Факторами регуляции
могут служить энергетический статус клеток,
внутриклеточный и наружный pH и осмоляр-
ность среды. На активность транспорта спо-
собны также влиять те или иные метаболиты
(например, циклический АМР), регуляторные
белки или компоненты других транспортных си-
стем (например, компонент ПА фосфотрапсфера-
зы; см. разд. 5.6.4). Связь между переносчика-
ми и ферментами метаболизма может быть очень
сложной в соответствии с предпочтением данно-
го микроорганизма к определенным субстратам.
Это означает, например, что в присутствии глю-
козы и галактозы Е. coli будет сначала исполь-
зовать глюкозу и лишь затем галактозу. Свя-
занная с этим регуляция подробно рассмотрена
в гл. 20. Наконец, отдельные компоненты неко-
торых транспортных систем обладают альтерна-
тивными функциями и в связи с этим способны
отделяться от переносчика. Например, мальтозо-
связывающий белок Ма1Е служит хеморецепто-
ром, фермент IIAGlc фосфотрансферазной систе-
мы поглощения глюкозы участвует в передаче
сигналов.
5.8. Секреция макромолекул
Данная глава посвящена главным образом транс-
порту небольших молекул. Транспорт макромоле-
кул, также необходимый для роста и выживания
клеток и чрезвычайно разнообразный по меха-
низмам (перенос белков, сложных липидов, таких
как компоненты наружной мембраны, углеводов,
в том числе внеклеточных полисахаридов, и нук-
леиновых кислот, например при трансформации)
тесно связан с внутриклеточной компартментаци-
ей (гл. 19), сборкой клеточной мембраны и кле-
точной стенки (гл. 23) и переносом генов (гл. 16),
в связи с чем он подробно рассматривается в со-
ответствующих главах.
Дополнительная литература
Ames G. F.-L, Mimura С. S., Holbrook S. R., Shyamala V.
(1992) Traffic ATPases; a superfamily of transport
proteins operating from Escherichia coli to humans.
Adv. Enzymol. 65: 1-47.
Anthony C., ed. (1988) Bacterial energy transduction.
New York: Academic Press.
Antonucci T. K., OxenderD.L. (1986) The molecular
biology of amino-acid transport in bacteria. Adv.
Microbiol. Physiol. 28: 146-180.
Boos W., Lucht J. M. (1996) Periplasmic binding protein-
dependent ABC transporters. In: Neidhardt F. C.
(ed.). Escherichia coli and Salmonella. 2nd. edn.
Washington DC: ASM Press.
Dimroth P. (1991) Na+-coupled alternative to H+-coup-
led primary transport systems in bacteria. Bioessays
13: 463-468.
Harold F. (1986) The vital force: a study of bioenergetics.
New York: Freeman.
Henderson P. J. F. (1990) Proton-linked sugar transport
systems in bacteria. J. Bioenerg. Biomemb. 22: 525-
569.
Kaback H. R. (1992) In and out and up and down with
lac permease. Intern. Rev. Cytol. 137A-. 97-125.
Kaback II. R., Voss J., Wu .1. H. (1997) Helix packing in
polytopic membrane proteins — the lactose permease
of Escherichia coli. Curr. Opin. Struct. Biol. 7: 532-
542.
KoningsW. N., Kaback H. R., Lolkema.I.S. (1996)
Transport processes in eukaryotic and prokaryotic
organisms. Handbook of biological physics, vol 2.
Amsterdam, New York: Elsevier.
Kramer R. (1994) Functional principles of solute
transport systems: concepts and perspectives.
Biochim. Biophys. Acta 1185: 1-34.
Krulwich T. A., ed. (1990) Bacterial energetics. The
bacteria, vol. 12. San Diego: Academic Press.
Lengeler .1. W. (1993) Bacterial transport under
environmental conditions, a black box? Leuwenhoek
Antonie van 63: 275-288.
Maloney P. C. (1990) Anion exchange reactions in
bacteria. J. Bioenerg. Biomemb. 22: 509-523.
MargerM.D., SaicrM. H. (1993) A major superfamily
of transmembrane facilitators that catalyse uniport,
symport and antiport. Trends Biodiem. Sci. 18:
13-20.
116 Часть II. Основы жизнедеятельности микробных клеток
Mathies R. A., Lin S. W., Ames .J. В., Pollard Т. W.
(1991) From femtoseconds to biology: mechanisms of
bacteriorhodopsin’s light-driven proton pump. Annu.
Rev. Biophys. Chem. 20: 491-518.
Nikaido H. (1992) Porins and specific channels of
bacterial outer membranes. Mol. Microbiol. 6:
435-442.
Nikaido H., Saier M II. (1992) Transport proteins in
bacteria-common themes in their design. Science 258:
936-942.
Poolman B. (1990) Precursor product antiport in
bacteria. Mol. Microbiol. 4: 1629-1636.
Poolman B., KoningsW. N. (1993) Secondary solute
transport in bacteria. Biochim. Biophys. Acta 1183:
5-39.
Postma P.W., Lengeler J. W., Jacobson G. R. (1993)
Phosphocnolpyruvate-carbohydrate phosphotransfe-
rase systems of bacteria. Microbiol. Rev. 57: 543-594.
Pugsley A. P. (1993) The complete general secretory
pathway in Gram-negative bacteria. Microbiol. Rev.
57: 50-108.
Senior A. E. (1990) The proton-translocating ATPase ol
Escherichia coli. Annu. Rev. Biophys. Chem. 19:
7-41.
Stein W.D. (1990) Channels, carriers, and pumps. New
York London: Academic Press.
Weiss M.S., Abele U., Weckesser J., Welte W.,
Schiltz E., Schulz G. E. (1991) Molecular architecture
and electrostatic properties of a bacterial porin.
Science 254: 1627-1630.
Источники рисунков
1. Henderson R., Baldwin J. M., CeskaT. A., Zem-
lin F., Beckmann E., Downing K.H. (1990) J. Mol
Biol. 213: 899-929.
2. Jones T. A., Zou J.-Y., Cowan S. W., Kjeldegaard M
(1991) Acta Cryst. A47: 110.
3. Postma P. W., Lengeler J. W., Jacobson G. R. (1993^
Microbiol. Rev. 57: 543-594.
Глава 6
Рост и питание
В микробиологии успех любого исследования
во многом зависит от того, насколько изучены
характер роста данного микроорганизма и его
питательные потребности. Начало выращиванию
бактерий и выделению чистых культур положи-
ли работы отцов-основателей этой науки — Луи
Пастера и Роберта Коха. К настоящему времени,
спустя более чем 100 лет, получено в культуре и
описано, вероятно, все еще менее одной десятой
части существующих в природе видов прокари-
от. Хотя молекулярно-биологические методы поз-
воляют обнаружить присутствие в природных об-
разцах даже одиночной клетки бактерий того или
иного вида и определить примерно ее филогене-
тическое родство с другими бактериями (с помо-
щью этих методов можно идентифицировать и ис-
пользовать для исследований отдельные гены и
их продукты, ничего не зная об организме, из ко-
торого они получены), тем не менее о свойствах
любой бактерии и ее роли в природе нельзя су-
дить до тех пор, пока она не изучена в лаборатор-
ной культуре. Например, без этого часто невоз-
можно определить, патогенен данный микроб или
нет. Более чем 90% бактерий не выделены в виде
культур, не описаны как виды и, таким образом,
«скрыты» от человека; остается неизвестной их
биологическая ценность. Выяснение питательных
и физиологических потребностей необходимо не
только для того, чтобы выращивать микроорга-
низмы. По требованиям к условиям культивиро-
вания и составу среды можно определить экологи-
ческую питу н значение микроорганизма, а также
его отличительные признаки, используемые дня
таксономии, экологического описания и решения
практических задач. Характеристики роста отра-
жают физиологические особенности микроорга-
низмов. Изучая влияние па рост различных му-
таций, можно получить сведения о роли много-
численных генов, выявляемых при секвенирова-
нии бактериальных геномов как «гены-сироты»
с гипотетической или неизвестной функцией.
Наконец, управление ростом культур лежит в ос-
нове биотехнологического применения микроор-
ганизмов. Все это подчеркивает важность изуче-
ния характера роста и питательных потребностей
бактериальных культур. В данной главе описа-
ны закономерности роста микробов в периодиче-
ской и непрерывной культурах, а также рассмот-
рено влияние на рост физико-химических факто-
ров среды.
6.1. Характер роста периодической культуры отражает
физиологические особенности микроорганизма
Понятие микробный рост означает увеличение
числа клеток микроорганизма. Под ростом от-
дельной бактериальной клетки понимают увели-
чение ее длины и последующее деление па две
дочерние клетки (бинарное деление). У поч-
кующихся бактерий возрастание числа клеток
может также происходить в результате почко-
вания (см. гл. 2). Дочерние клетки имеют те
же размеры и состав, что и материнские. Когда
время удвоения числа клеток остается постоян-
ным, культура находится в экспоненциальной
фазе роста (неверно называемой также логариф-
мической, или лог-фазой, по соображениям удоб-
ства построения графика роста в полулогарифми-
ческой шкале). Период, необходимый для удво-
ения числа клеток в экспоненциально растущей
популяции, называют временем генерации,
или удвоения, Ad. Рост называют сбаланси-
рованным, если пропорционально числу клеток
увеличивается их масса и количество всех хими-
ческих компонентов, таких как белок, РНК или
ДНК. Прирост любого их этих параметров (N)
118 Часть II. Основы жизнедеятельности микробных клеток
описывается уравнениями (6.1) и (6.2).
Величина N в момент времени t составляет:
Nt = NoeM(t-to), (6.2)
где Nt и Nq —биомасса клеток или количество
какого-либо компонента в момент времени t и в
момент начала культивирования to соответствен-
но. Логарифмируя уравнение (6.2), получаем
Ь — = p(t - to) (6.3)
IN О
и далее
lnNt-lnN0 = p(t-t0) (6.4)
или
10gNt - logNo = y^(t - *o) (6.5)
Биологический смысл константы р становится
ясен, если рассмотреть, что происходит при удво-
ении No до 2N0 за время генерации tj. В этом
случае Nt = 2Nq и t — to = t<i; уравнение (6.3) пре-
образуется в уравнение (6.6), которое раскрывает
связь между д и tj:
In 2 0,693 [с г.
Р - — = -7— (6-6)
*d иЗ
Коэффициент пропорциональности д, называе-
мый удельной скоростью роста, имеет размер-
ность 1/ед. времени (например, ч-1).
Для определения скорости сбалансированно-
го роста можно измерять любой из его парамет-
ров, поскольку с любым из них при расчете бу-
дет получено одно и то же значение д, причем
постоянное во времени. Величина д зависит от
многих факторов, например от температуры, pH,
осмолярности и состава среды, в частности от
вида субстрата и наличия готовых «строитель-
ных блоков» (как, например, в богатой среде)
или акцептора электронов. Таким образом, удель-
ная скорость роста определяется ферментативны-
ми возможностями данного вида бактерий, соста-
вом среды и всеми биофизическими факторами,
влияющими на скорость роста. Время генерации
id у одной и той же бактерии может колебаться
от 15 мин в лабораторных условиях до несколь-
ких суток или даже недель в природе, в зависи-
мости от условий. Минимальное время генерации
у различных бактерий также варьирует в широ-
ких пределах, от 15 мин у быстрорастущих видов
до 1 сут у медленнорастущих.
Дополнение 6.1. С антропоцентрической
точки зрения, более высокооргапизованы и
адаптированы к условиям среды бактерии с
высокой удельной скоростью роста. Однако
быстрый рост — это лишь одна из возможных
стратегий. Другие, медленнорастущие бакте-
рии, благодаря наличию у них систем с высо-
ким сродством к субстратам, приспособлены
к росту в «бедных» средах, содержащих пи-
тательные вещества в низких концентрациях.
В определенных местообитаниях выгодна вы-
сокая пластичность метаболизма, позволяю-
щая использовать широкий круг субстратов,
в других — узкая специализация. Наконец,
у ряда микробов стратегия существования со-
стоит в том, что они извлекают энергию из
субстрата с высокой эффективностью, обес-
печивающей высокий выход биомассы.
Произведем расчет прироста биомассы для
Escherichia coli, клетка которой имеет объем при-
мерно 1 мкм3, массу 10“12 г (сырая биомасса)
и время генерации 1 ч. Если период выращива-
ния равен 48 ч, из одной клетки образуется 248,
или 3 • 1014, клеток общей массой 300 г; за 72 ч
образуется 5 • 1021 клеток общей массой 50 т.
Конечно, при росте в периодической культу-
ре, т. е. в фиксированном объеме, такого прироста
пе происходит, поскольку исчерпание питатель-
ных веществ и накопление продуктов обмена до
токсической концентрации приводят к постепен-
ной остановке роста и переходу культуры в ста-
ционарную фазу, за которой следует фаза от-
мирания. Обычно причинами гибели — лизиса—
клеток в культуре становятся их энергетическое
истощение и действие ферментов автолиза. Клет-
ки некоторых бактерий не погибают после прекра-
щения роста, благодаря тому что образуют спо-
ры или цисты, способные переживать неблагопри-
ятные условия. В стационарной фазе происходит
сложная адаптация клеток к условиям голодания
и переживания (см. разд. 28.5) и возможен скры-
тый рост выживших клеток на остатках лизиро-
ванных клеток. Скорость роста в начальной ста-
дии, сразу после инокуляции, низка, поскольку в
это время происходит адаптация клеток посевного
материала к новым условиям. Длительность этой
Глава 6. Рост и питание 119
Рис. 6.1. Типичная кривая роста периодической куль-
туры, построенная в полулогарифмической шкале: за-
висимость log N от времени (величина инокулята 1%).
Для сравнения приведена теоретическая кривая экспо-
ненциального роста. Обратите внимание, что сходная
продолжительность лаг-фазы наблюдалась бы в случае,
если в инокуляте (No) лишь 10% клеток были жизнеспо-
собными. Наклон прямой (tg угла) равен д/2,303. При
построении графика использован log N, а не In N.
фазы, называемой лаг-фазой или фазой задерж-
ки роста, зависит от количества клеток в иноку-
ляте и возраста культуры, служившей посевным
материалом, а также от различий в составе старой
и новой сред. За это врет тя клетки переходят из
состояния адаптации к стационарной фазе роста
культуры (часто именно такие, старые культуры
используют для засева сред) в состояние актив-
ного роста. Длительность лаг-фазы увеличивает-
ся, если посевной материал был выращен па бо-
лее богатой среде. При засеве материалом, взя-
тым из культуры в экспоненциальной фазе роста,
при одинаковом составе сред рост начинается без
лаг-фазы. Типичная кривая роста, построенная
в полулогарифмической шкале, приведена на
рис. 6.1.
Для приспособления к новым условиям и ре-
парации поврежденных клеток необходим синтез
(индукция) новых ферментов. Он требуется и при
росте бактерий в среде с двумя субстратами —
богатым и бедным, из которых богатый как
предпочтительный используется вначале. При ис-
черпании этого субстрата происходит временная
остановка роста, после которой он возобновляет-
ся благодаря индукции ферментов катаболизма
второго, менее выгодного субстрата. Такой рост
называют диауксическим (см. разд. 20.2).
В определенных условиях наблюдается не экспо-
ненциальный, а линейный рост — если лимити-
рующий субстрат поступает в среду с постоянной
скоростью, например добавляется в виде раство-
ра по каплям или, в случае газа (такого, как О2),
проникает в среду путем диффузии. Линейный
рост может быть также обусловпеп недостатком
того или иного фермента, например при исчерна-
нии его кофактора. В данном случае имеющееся
количество фермента, пока его концентрация не
станет слишком низкой в результате увеличения
числа клеток, обеспечивает образование соответ-
ствующего интермедиата лишь с постоянной ско-
ростью (и, следовательно, линейный рост). Это
часто наблюдается при переходе культуры из экс-
поненциальной фазы роста в стационарную.
Микробные культуры используются во мно-
гих биотехнологических процессах в качестве био-
катализаторов. Требуемый продукт они синте-
зируют чаще всего в стационарной фазе роста,
поэтому вначале их выращивают отдельно в опти-
мальных для роста условиях (трофофаза) и за-
тем переносят в «перостовые» условия, обеспечи-
вающие синтез продукта, необходимого для дан-
ного технологического процесса (идиофаза).
6.2. На рост и физиологическое состояние клеток
влияют физико-химические факторы
Скорость роста, а также урожай клеток, их
жизнеспособность, характер метаболизма, диф-
ференцировка и химический состав зависят от
различных физико-химических факторов среды.
Наиболее важные из них —pH, температура и
содержание кислорода. Отдельные группы бакте-
рий способны расти в таких экстремальных усло-
виях, к которым не обладают устойчивостью ни-
какие другие организмы (рис. 6.2).
120 Часть II. Основы жизнедеятельности микробных клеток
Температура Pyrococcus Pyrodictium Methanopyrus Sulfolobus Thermotoga Thermus aquaticus Bacillus stearothermophilus Synechococcus livid us Bacillus subtilis Escherichia coli Pseudomonas Callionella Vibrio marinus Flavobacterium islandicum СС Гидротермы -100 Области вулканической активности - 80 Нагретая почва Разлагающийся компост - 60 - 40 Тело человека _ 20 Почва Пресные воды Питьевая вода Вода океанских глубин - 0 Поверхность раздела 10 морская вода/лед pH Sulfolobus Thiobacillus Acetobacter Lactobacillus Escherichia coli Pseudomonas Alcaligenes Bacillus alcaliphilus Natronobacterium pH | t Ж- - д Кислые источники v в областях вулканической активности Желудочный сок Лимонный сок 2 Кислые шахтные дренажные воды Уксус Многие фрукты . Вино, кисломолочные * продукты Кислая почва Томаты ;, Кожа человека - б Многие продукты питания - 7 Чистая вода Животные ткани - 8 Морская вода Почвы в тропиках Толстая кишка Щелочные (высоко- карбонатные) почвы " Ю Щелочные озера Мыльный раствор > ’ 12 Известь
Активность воды Caulobacter, Spirillum, - Streptococcus, Escherichia, Vibrio, Pseudomonas Большинство грам- положительных палочек Большинство грам- положительных кокков (Некоторые дрожжи) Ectothiorhodospira (Некоторые дрожжи и мицелиальные грибы) Halobacterium (Ксерофильные грибы) а. - 1,00 Вода 0,995 Кровь человека - 0,980 Морская вода - 0,95 Хлеб - 0,90 Сироп, ветчина - 0,85 Салями Морские лагуны - 0,80 Джемы, фруктовые торты - 0 75 Солень,е озера, соленая рыба - 0 70 ^яаки’ конфеты, ’ сухофрукты Кислород Аэробы Факультативные микроаэрофилы Микроорганизмы, осуществля-_ ющие анаэробное дыхание Бактерии-бродильщики Сульфатредукторы Метаногены %0z - 20 Воздух, морская вода Пресная вода Сухие почвы Животные ткани 0 Поверхностный слой осадков Заболоченные почвы Почвы рисовых полей Тундра Болота Грунтовые воды Кишечный тракт
Рис. 6.2. Физико-химические параметры возможных местообитаний бактерий и некоторые характерные для них
организмы.
6.2.1. pH среды необходимо регулировать
Величина pH раствора — это отрицательный де-
сятичный логарифм активности протонов. Обыч-
ные питательные среды представляют собой раз-
бавленные растворы, в которых активность ионов
Н+ примерно соответствует их молярной концен-
трации.
Внутриклеточный pH □ Большинство ви-
дов бактерий способно расти в широком диапа-
зоне pH (~4 ед.), по их быстрый рост наблюдается
в более узком диапазоне — примерно 2 ед. pH. При
этом значение pH цитоплазмы поддерживается на
постоянном, оптимальном уровне, который часто
сильно отличается от pH среды. Регуляция внут-
риклеточного pH опосредована неизвестной пока
сенсорной системой и протондвижущей силой. Ес-
ли pH среды более щелочной, чем pH цитоплазмы,
клетки бактерий должны поглощать Н+ с исполь-
зованием энергии мембранного потенциала (Д^),
т. е. за счет Д^ создается ДрН (см. разд. 28.3).
Диапазон pH □ Бактерии, для которых оп-
Глава б. Рост и питание 121
тимальны значения pH, близкие к 7,0, напри-
мер Е. coli, составляют группу нейтрофилов.
Экстремофильные виды, приспособленные к
очень низким значениям pH, называют ацидо-
филами. К ним относится, например, бактерия
Thiobacillus ferrooxidans, растущая при pH 2,0-8,0.
Виды-алкалифилы растут в щелочных средах;
например, для Bacillus alcaliphilus оптимальное
значение pH составляет примерно 10,5. Внутри-
клеточный pH у этих трех приведенных в каче-
стве примеров бактерий равен примерно 7,6; 6,5
и 9 соответственно. Некоторые бактерии, такие
как Acetobacter и Lactobacillus, способны сохра-
нять жизнеспособность при экстремальных значе-
ниях pH в течение определенного времени. Боль-
шинство грибов предпочитает слабокислую среду.
Природные среды □ Спектр значений pH
в природных местообитаниях представлен на
рис. 6.2. Алкалифилы способны выживать при
pH > 10, ио рост их возможен, как правило, при
pH < 10. Многие бактерии при росте потребляют
и/или образуют кислоты либо основания. Напри-
мер, при использовании NH4CI в качестве источ-
ника азота клетки ассимилируют NH3, выделяя в
среду НС1.
Дополнение 6.2. Действие бикарбонат-
ных буферов, таких как бикарбонат/раство-
ренный СО2 (pKj = 6,35; 30 °C) и бикарбо-
нат/карбонат (р1<2 — Ю,3; 30 °C), основано
на реакциях с участием СО2, растворенного
в воде:
pKj
[растворенный СО2 + Н2О Н2СО3]
РК'1 , РК2 ,
<=* НСО3 + Н+ СО^- 4- 2Н+ (6.7)
Равновесные концентрации растворенных
СО2 и Н2СО3 соотносятся примерно как
1000 : 1, поэтому при расчетах величиной
[Н2СО3] можно пренебречь. Эти буферные
системы применяют главным образом для
выращивания автотрофных бактерий и, кро-
ме того, используют для культивирования
многих гетеротрофных бактерий, потребля-
ющих СО2. Буферное действие оказывает
также добавленный в среду в виде порошка
мел (СаСОз); он поддерживает pH па уровне,
близком к нейтральному, даже при силь-
ном кислотообразовании. В агаризованных
средах, содержащих мел (0,3%), рост кисло-
тообразующих микроорганизмов можно оп-
ределять по просветлению среды в результате
растворения СаСОз кислотой.
Для буфера СО2 /бикарбонат уравне-
ние Хендерсона-Хассельбальха записывается
следующим образом:
„ , [НСО3]
Р - Р 1 + og [растворенный СО2]
Коэффициент растворимости а для СО2 ва-
рьирует в зависимости от температуры и
солености среды, а также от парциального
давления (газообразного) СО2 в атмосфере.
На практике значение pH при нормальном
давлении можно достаточно точно рассчи-
тать при помощи следующего уравнения:
pH = pKj + 1оё[НСОз ]
— log[o • (СО2 газообр., % об.) •
• (4,35 • 10-4)], (6.8)
где а = 0,64 и рК* = 6,35 (30 °C). Величина
а означает количество (мл) СО2 (приведен-
ное к условиям 0 °C, 1 атм) в 1 мл воды при
давлении газа 1 атм и соответствующей тем-
пературе.
Буферные растворы □ Для предотвраще-
ния значительных колебаний pH в питательные
среды часто добавляют тот или иной буфер. Со-
став буфера с данным pH рассчитывается по урав-
нению Хендерсона-Хассельбальха:
pH^pK + loglQ^fl (6.9)
[Кислота]
Буферная емкость раствора наиболее высока при
значениях pH, близких к рК буфера, т. е. в случае,
когда [Основание-] = [Кислота].
Регуляция pH среды □ Для контроля
за изменением pH среды при росте бактерий
(например, как диагностическим признаком) в со-
став многих питательных сред вводят индикато-
ры pH (слабые органические кислоты или осно-
вания, яркоокрашенные в зависимости от прото-
нирования/депротонировапия). В качестве таких
индикаторов используют бромфеноловый синий
122 Часть II. Основы жизнедеятельности микробных клеток
(рКа 4,0), метиловый красный (рКа 5,2) и тимо-
ловый синий (рКа 8,9), в кислой форме приоб-
ретающие желтую окраску. Поддерживать зна-
чение pH среды в узком диапазоне позволяют
автоматические системы контроля pH, состоя-
щие из рН-электрода, pH-метра, системы регуля-
ции/установки допустимых пределов изменения
pH и насоса для добавления кислоты или осно-
вания.
Влияние рн на микробные клетки □
Неблагоприятная концентрация Н+ и ОН- в сре-
де влияет па различные структурные и био-
химические параметры микробных клеток. Ци-
топлазма хороню забуферена; при ее буферной
емкости для изменения pH на 1 ед необходи-
мо > 0,1 моль кислоты или щелочи. Изменение
pH среды в первую очередь влияет па клеточ-
ные покровы; диссоциация/протонировапие вхо-
дящих в их состав макромолекул, таких как ли-
пополисахариды, белки поверхностного слоя и
компоненты плазматической мембраны, приводят
к изменениям в локальном распределении заря-
да и вследствие этого к нарушениям в делении,
морфологии, адгезии и флокуляции клеток или
к разрушению плазматической мембраны. Кро-
ме того, сдвиги pH среды влияют на метабо-
лизм. В промышленных технологиях путем из-
менения pH среды вызывают остановку роста
культуры и выделение того или иного продук-
та (трофофаза —» идиофаза; см. гл. 27). Когда
в результате брожения pH снижается до опреде-
ленного критического уровня, в качестве конеч-
ного продукта начинает образовываться спирт, а
не кислота 4- Н2- От pH среды зависит токсич-
ность многих соединений. Слабые кислоты, такие
как уксусная, пропионовая, сорбиновая (для всех
трех рКа = 4,7) и бензойная (рКа = 3,7), способ-
ны проникать через мембрану в протонированной
форме [АН] путем пассивной диффузии. В цито-
плазме они диссоциируют с образованием анио-
на [А-], не способного проникать через мембрану,
и Н+ («ионная ловушка»), что приводит к сни-
жению внутриклеточного pH. Ингибирующее дей-
ствие эти кислоты оказывают лишь в том случае,
если значение pH среды достаточно низкое, т. е.
сравнимо с величиной их рК. Поскольку эти кис-
лоты не токсичны для человека, их широко ис-
пользуют как консерванты в производстве пище-
вых продуктов. Механизмы адаптации бактерий
к изменениям pH среды описаны в гл. 28.
6.2.2. Микробный рост возможен в широком
диапазоне температуры с пределами
ниже 0 и выше 100 °C
Температурный диапазон о Для большин-
ства прокариот интервал температур, в котором
возможен рост, составляет примерно 40 °C; с вы-
сокой скоростью рост происходит в более узком
интервале — примерно 20 °C (рис. 6.3). Мини-
мальная, максимальная и оптимальная тем-
пературы (основные температурные точки) зна-
чительно варьируют среди прокариот. По отно-
шению к температуре их условно делят на три
группы: мезофилы, термофилы и психрофи-
лы. У мезофилов, к которым относится большая
часть бактерий, оптимальная для роста темпера-
тура лежит в интервале между 20 и 42 °C. Сре-
ди этих организмов имеются термотолераптные
виды, способные выживать при температуре до
50 °C. Большинство термофильных видов растет
при температуре до 70 °C. Таких значений она
достигает, например, в гниющем компосте и на-
гретом солнцем поверхностном слое почвы. У от-
дельных термофильных организмов, называемых
экстремальными термофилами или гипер-
термофилами, температурный оптимум превы-
шает 70 °C; например, Sulfolobus acidocaldarius
растет при 80 °C, Pyrodictium occultum — при
105 °C. В природе такие значения температуры
встречаются только в зонах вулканической актив-
ности. Оптимальная температура для роста пси-
хрофильных бактерий не превышает 20 °C. Они
обитают в морской воде с температурой около
5 °C и в полярных областях земного шара. Неко-
торые бактерии хорошо растут при температуре
— 10 °C в микроскопических водных «карманах»
па границе раздела между льдом и морской водой;
в этих условиях рост, по-видимому, лимитирован
недостатком жидкой воды. При кратковременном
нагревании до комнатной температуры психро-
фильные организмы погибают. В противополож-
ность этому большинство мезофилов характери-
зуется психротолерантностыо.
Влияние температуры на рост □ Зависи-
мость скорости роста от температуры в основ-
ном сходна у всех бактерий; в графическом ви-
де она представлена на рис. 6.3. В ограничен-
ном диапазоне температуры (21-37 °C), кривая
роста описывается уравнением Аррениуса; в этом
«нормальном» температурном интервале клеткам
Глава б. Рост и питание 123
Рис. 6.3. Скорость роста мезофильной бактерии
(Escherichia coli) в зависимости от температуры. Изоб-
ражена зависимость десятичного логарифма удельной
скорости роста от 1/Т, аналогичная графику Аррениуса
для зависимости скорости химической реакции от 1/Т.
Величина к равна l/t<i (ч-1); Т — абсолютная темпера-
тура (К = кельвин). Для сравнения приведены значения
температуры в °C. • — рост в богатой среде; о — рост в
минимальной среде с глюкозой. Штриховые экстрапо-
ляционные линии, проведенные от кривой для богатой
среды, показывают области линейного изменения ско-
рости роста при изменении 1/Т; нижняя штриховая ли-
ния— линейное изменение к в нормальном диапазоне
температуры. По [1].
не требуются особые механизмы терморегуляции.
Для данного случая логарифм скорости роста
пропорционален 1/Т (в градусах Кельвина), с от-
рицательным углом наклона кривой. У большин-
ства бактерий в этом диапазоне температурный
коэффициент Qio скорости роста равен пример-
но 2 (что соответствует влиянию температуры на
скорость многих химических реакций), т. е. при
повышении температуры на 10 °C скорость роста
увеличивается в два раза. Изменения температу-
ры в рамках этого «нормального» диапазона не
влияют на физиологическое состояние бактерии.
Скоординированность клеточных реакций обеспе-
чивается просто изменением активности фермен-
тов. Стабильное состояние текучести мембраны
обеспечивают сдвиги в жирнокислотном составе
мембранных фосфолипидов, зависящие от тем-
пературы (см. гл. 7). Молекулярные механизмы
адаптации к экстремальным температурам у пси-
хрофилов и термофилов рассмотрены в разд. 28.2.
Быстрое изменение температуры среды от
нормальной до экстремальной, например резкое
охлаждение до 4 °C или нагревание до 54 °C, мо-
жет вызвать повреждение клеток. Чувствитель-
ность к нагреванию зависит от влажности среды,
а также от физиологического состояния культуры
(в стационарной фазе роста клетки менее чувстви-
тельны, чем в фазе активного роста). От физиоло-
гического состояния культуры зависит и реакция
клеток на быстрое охлаждение. Все эти эффекты
подробно рассматриваются в разд. 28.2.
6.2.3. Микробный рост существенно зависит
от присутствия кислорода и других газов
Облигатно аэробные бактерии нуждают-
ся для роста в молекулярном кислороде; для
факультативных анаэробов предпочтительны
аэробные условия, но они способны расти и в от-
сутствие Оз- Многие бактерии относятся к мик-
роаэрофилам, т. е. приспособлены к росту при
очень низком содержании кислорода в среде (на-
пример, 0,1-0,5%), типичном для природных ме-
стообитаний. Такие бактерии часто не удается
культивировать в обычных лабораторных услови-
ях; иногда их рост можно получить в виде тон-
ких бактериальных пленок па поверхности пла-
вающих частиц, где они понижают концентрацию
кислорода благодаря дыхательной активности.
Растворимость газов □ Кислород служит
конечным акцептором электронов (в случае
аэробных бактерий); другие газы могут исполь-
зоваться иным образом, например Щ, СЛЬ и СО,
как доноры электронов и/или источники углеро-
да, N2-как источник азота, H2S — как восста-
новитель, удаляющий кислород из среды, донор
электронов и источник серы, СО2 — как допол-
нительный или единственный источник углерода.
Кислород, подобно другим газам, относительно
слабо растворим в воде (см. разд. 30.1.3). Раство-
римость любого газа прямо пропорциональна его
парциальному давлению и снижается с увеличе-
нием температуры и осмотического давления.
Аэрация □ При большой плотности клеток
в культуре аэробным бактериям необходима уси-
ленная аэрация. Достаточное снабжение клеток
кислородом можно обеспечить различными спо-
собами, позволяющими повысить скорость его
массонереноса и увеличить площадь поверхности
раздела газ/жидкость. С целью обеспечения до-
ступа кислорода сосуды для культивирования
124 Часть II. Основы жизнедеятельности микробных клеток
бактерий закрывают пробками из пористого ма-
териала, чаще всего ваты. Для культивирова-
ния аэробных микроорганизмов имеются специ-
альные плоскодонные колбы (Эрленмейера или
Фернбаха) и колбы с отбойниками, в которые сре-
ду наливают небольшим слоем; для большей эф-
фективности газообмена эти колбы помещают на
качалку. При выращивании культур в объеме сре-
ды более 0,5 л используют ферментеры, снабжен-
ные мешалкой и системой продувания воздуха
или кислорода. Все эти способы культивирования
помогают добиться того, чтобы как можно боль-
ше мельчайших пузырьков воздуха подолгу нахо-
дилось в среде, обеспечивая эффективное поступ-
ление Ог из газообразной фазы в жидкую. В неко-
торых случаях при продувании газа требуется
принимать меры против избыточного ценообразо-
вания.
Контроль за концентрацией О2 □ Коли-
чество растворенного кислорода в среде под-
держивают на постоянном уровне, регулируя
скорость потока газа, процентное содержание кис-
лорода в газовой смеси и скорость перемешива-
ния (концентрацию О2 определяют при помощи
кислородного электрода; см. рис. 11.1). Эффек-
тивность подачи Ог в ферментер рассчитывают
как скорость абсорбции кислорода, выражая
ее в ммоль Ог, поступающих в 1 л не содержа-
щей кислород среды за 1 мин. В условиях хо-
рошей аэрации находятся бактерии, растущие в
виде топкой пленки на поверхности среды. Одна-
ко в бактериальных пленках или колониях на по-
верхности агара поглощение кислорода клетками
обычно превышает его поступление путем диффу-
зии, что приводит к образованию бескислородной
зоны внутри колонии и под нею в агаре. Подоб-
ный градиент Ог характерен также для биопле-
нок и донных осадков; метаболизм многих бакте-
рий переключается в этих условиях на брожение
или анаэробное дыхание.
СО2 □ При культивировании автотрофных
бактерий, для которых диоксид углерода служит
единственным источником углерода, его во мно-
гих случаях вносят в среду в виде ИаНСОз. Необ-
ходимо учитывать, что концентрации растворен-
ных СО2 и НСО3 и’ следовательно, распределе-
ние углекислоты между жидкой и газовой фазами
зависит от pH среды (см. разд. 6.2.1). Диоксид уг-
лерода необходим также гетеротрофным бактери-
ям, так как оп участвует в биосинтетических ре-
акциях карбоксилирования. Многие патогенные и
симбиотические бактерии адаптированы к высо-
кому парциальному давлению СО2 в организме-
хозяине и часто могут расти только при высокой
концентрации (примерно 10%) СО2 в газовой фа-
зе. Тщательное удаление СО2 из среды с помо-
щью щелочной ловушки приводит к остановке ро-
ста большинства бактерий.
6.2.4. Активность воды и осмотическое давление
зависят от концентрации растворенных
осмотически активных частиц
Вода в живых организмах не только выполняет
роль растворителя, но также служит субстратом
многих ферментативных реакций, влияет па кон-
формацию макромолекул, принимающих благо-
даря гидратации необходимую структуру, и под-
держивает клеточный тургор. Доступность воды
зависит от ее содержания в среде обитания, т. е.
от уровня влажности, например почвы или хлеба,
либо, в водных средах, от концентрации раство-
ренных веществ — ионы (Na+, С1_ и др.), сахара
и другие соединения конкурируют за молекулы
воды и «связывают» их, переводя в недоступную
для организма форму. В этом смысле условия вы-
сокого содержания в жидкой среде соли или са-
хара аналогичны условиям сухости, но в целом
влияние тех и других условий, как и механизмы
адаптации к ним, различны. Тем не менее при обо-
их типах «сухости» диффузия воды происходит
из области ее высокой концентрации (влажная
область или низкая концентрация растворенных
веществ) в область низкой концентрации (сухая
область или высокая концентрация растворенных
веществ). Доступность влаги для микроорганиз-
мов оценивают с помощью такого показателя, как
активность воды (ав) в среде, представляющего
собой отношение давления водяного пара в ис-
следуемой системе (растворе или твердой среде)
к давлению пара над чистой водой. В среде, со-
держащей растворенные вещества, осмотическое
давление (Р) и ав связаны следующим соотноше-
нием:
Р = ^1пав, (6.10)
V В
где R — газовая постоянная, Т — абсолютная тем-
пература и VB — объем 1 моль воды. В идеальном
случае осмотическое давление раствора, содержа-
щего 1 моль осмотически активных частиц (на-
пример, ионов Na+ или С1~ либо молекул глю-
козы), составляет 22 бар (2,2 МПа). Эта величина
Глава б. Рост и питание 125
соответствует давлению газа при его концентра-
ции 1 моль/л. Величины ав для некоторых при-
родных местообитаний приведены на рис. 6.2.
В соответствии с различиями между услови-
ями «сухости» варьируют и молекулярные меха-
низмы адаптации к ним микробов. Наиболее рас-
пространенная на Земле природная среда —это
морская вода; она содержит примерно 3% NaCl,
а также небольшое количество других неоргани-
ческих веществ. Большинство морских микроор-
ганизмов нуждается в повышенной концентрации
Na+, и поэтому они названы галофилами. Неко-
торые бактерии способны расти в средах с высо-
ким содержанием соли, но не нуждаются в ней —
это галотолерантные организмы. Степень га-
лофилии варьирует у бактерий от низкой (1-6%) и
средней (6-15%) до экстремальной (15-30%). При
низкой активности воды, как правило, микроорга-
низмы не выживают, и благодаря этому засолка,
сушка или добавление сахара предохраняет пи-
щевые продукты от порчи. Для большей части
бактерий предпочтительны значения ав 0,98-0,99.
Организмы, растущие в средах с высоким содер-
жанием сахара, называют осмофилами; расту-
щие в очень сухих (из-за отсутствия воды) сре-
дах — ксерофилами. При выращивании морских
бактерий высокое осмотическое давление среды
обычно создают добавлением солей (NaCl, КС1,
Na2SO4; искусственная морская вода). Необходи-
мо учитывать, однако, что многие ионы в повы-
шенных концентрациях могут оказывать вредное
воздействие. Механизмы адаптации к экстремаль-
ным значениям осмолярности среды рассмотрены
в разд. 28.4 и 31.4.
6.2.5. Давление не оказывает
существенного влияния на рост бактерий
При изучении влияния гидростатического давле-
ния на рост бактерий были получены неожидан-
ные результаты: оказалось, что изменение дав-
ления в диапазоне 0-100 бар (0-10 МПа) не ока-
зывает никакого эффекта на рост большинства
бактерий или же его влияние незначительно. Тем
пе менее барофильные бактерии, обитающие в
морских глубинах, не только адаптированы к вы-
сокому давлению, характерному для этих место-
обитаний, но и нуждаются в нем (например, в
давлении 600 бар на 6000-метровой глубине). Для
изучения глубоводных микроорганизмов требует-
ся сложное оборудование, позволяющее поддер-
живать высокое давление.
6.2.6. Анаэробы растут в бескислородных средах
Природные местообитания □ Многие при-
родные среды содержат растворенный кислород в
незначительном количестве, не содержат кислоро-
да вообще или становятся анаэробными на опре-
деленные промежутки времени (рис. 6.2). Анаэ-
робные условия возникают в случае, если О2
потребляется микроорганизмами и при этом диф-
фузия его ограничена. Кроме того, концентрация
молекулярного кислорода может падать в резуль-
тате его восстановления характерными для анаэ-
робов конечными продуктами метаболизма, таки-
ми как H2S.
Дополнение 6.3. Окислительно-восстано-
вительный потенциал системы можно вычис-
лить из уравнения Нернста. Стандартный
окислительно-восстановительный потенциал
при pH 7,0, отнесенный к потенциалу водо-
родного электрода, обозначают Е'о. При сте-
пени восстановления 1/2 (равенство концен-
траций окисленной и восстановленной форм)
и pH 7,0 окислительно-восстановительный
потенциал Е' равен стандартному значению
Е’о (такие значения можно найти в специаль-
ной литературе), приведенному к pH 7,0 (см.
табл. 4.1).
Анаэробы □ Микроорганизмы, способные
расти как в присутствии, так и в отсутствие кис-
лорода, называют факультативными анаэро-
бами. К микроаэрофилам относят те организ-
мы, которые нуждаются в кислороде для дыха-
ния, но растут только при низком содержании
его в среде. Анаэробы не способны осуществ-
лять дыхание с участием О2; одни из них мо-
гут расти в присутствии кислорода и устойчивы
к нему (аэротолерантные бактерии), другие
же — облигатные (строгие) анаэробы — поги-
бают при контакте с О2 или по крайней мере
растут в его присутствии очень слабо. Метабо-
лизм облигатно анаэробных бактерий приспособ-
лен к средам с низким значением окислительно-
восстановительного потенциала, и некоторые их
ферменты чувствительны к кислороду. Таким об-
разом, рост строгих анаэробов возможен только
в отсутствие кислорода и при восстановительных
126 Часть II. Основы жизнедеятельности микробных клеток
условиях [окислительно-восстановительный по-
тенциал среды (Eq) должен быть отрицательной
величиной]. Механизмы токсического действия
кислорода и защиты от него микроорганизмов
описаны в гл. 11.
Удаление кислорода □ Для уменьшения
содержания кислорода в среде се вначале ки-
пятят. Оставшийся О2 удаляют пропусканием
через среду газа, например очищенного от кис-
лорода N2 или смеси N2/CO2. После этого в сре-
ду добавляют восстановитель и сосуд гермети-
чески закрывают. Восстановитель поддерживает
окислительно-восстановительный потенциал сре-
ды, аналогично тому как буфер регулирует ее pH.
В качестве восстановителей для этого используют
Na2S, FeS, дитионит, органические тиоловые со-
единения, такие как тиогликолат и цистеин, или
цитрат титана(Ш). Величина Eq этих соединений
варьирует приблизительно от —0,2 В (цистеин) до
—0,5 В [Ti(III)]. Под действием восстановителя О2
восстанавливается до Н2О, и таким образом вос-
становитель функционирует как окислительно-
восстановительный буфер. Следы кислорода из
газов удаляют путем абсорбции или добавления
к газу Н2 (~5%), который при участии катали-
затора (палладий) реагирует с О2, в результа-
те чего образуется вода. Значение окислитель-
но-восстановительного потенциала среды удобно
контролировать, добавляя в среду следовое ко-
личество нетоксичного, окрашенного в окислен-
ном состоянии, самоокисляющегося красителя,
который становится бесцветным в восстановлен-
ной форме. Значение Е'о для наиболее часто
используемых красителей такого рода варьирует
от 0 В (метиленовый синий, резазурин) до —0,25 В
(феносафранин). Следовательно, если резазурин
не окрашен при pH 7,0, значение Е' среды мень-
ше 0 В, т. е. опа подходит для роста строгих анаэ-
робов.
При работе со строгими анаэробами (на-
пример, посеве культур) весьма удобна пласт-
массовая анаэробная камера, оснащенная специ-
альным устройством с перчатками. Используе-
мые при работе материалы вносят и выносят
из псе через специальный переходной блок, воз-
дух из которого откачивают и заменяют N2 с
5% Н2 (см. выше). Применяются также и бо-
лее простые методы культивирования. Чаще всего
среду, налитую в пробирки или бутыли довер-
ху, продувают для удаления кислорода очищен-
ным от примесей кислорода азотом, и закрывают
сосуды резиновыми пробками. Для внесения доба-
вок и отбора проб используют стерильные шпри-
цы. Менее чувствительные к кислороду анаэроб-
ные бактерии можно выращивать даже на ага-
ризованной среде в чашках Петри в вакуумном
эксикаторе, из которого кислород удален в ре-
зультате его взаимодействия с водородом. Источ-
ником водорода служит NaBH4, выделяющий Нг
при низком pH. Этот реагент в виде порошка по-
мещают в эксикатор в отдельной емкости и до-
бавляют к нему воду, после чего камеру закрыва-
ют. Образующийся Н2 в присутствии катализато-
ра реагирует с О2 с образованием воды.
6.2.7. Свет может служить источником энергии
для микроорганизмов, но одновременно
оказывает повреждающее действие
Фототрофные прокариоты используют свет
того или иного участка спектра и определенной
интенсивности в качестве источника энергии. В то
же время свет высокой интенсивности может ока-
зывать ингибирующее действие и на фототроф-
ныс, и на нефототрофныс микроорганизмы в ре-
зультате фотохимических реакций. У фототро-
фов защиту от повреждающего действия света
обеспечивают те же пигментные системы, кото-
рые участвуют в фотосинтезе; защитные пигмент-
ные системы обнаружены также у многих нефо-
тотрофных организмов (см. гл. 13 и разд. 30.1
и 31.1).
Глава б. Рост и питание 127
6.3. Среды для выращивания бактерий содержат
все необходимые питательные вещества
Помимо соответствующих физико-химических
условий среды, бактериям необходимы для роста
источники энергии и всех элементов, из которых
состоят компоненты клеток (см. гл. 7). «Узкоспе-
циализированные» бактерии нуждаются в стро-
го определенных питательных веществах, тогда
как «малоспециализировапныс» способны исполь-
зовать широкий набор питательных веществ.
Бактсрии-прототрофы могут расти на про-
стых средах, содержащих одно вещество в ка-
честве источника углерода и энергии, а также
несколько неорганических солей для обеспече-
ния потребности в других элементах. В отли-
чие от этого рост ауксотрофов зависит от при-
сутствия в среде готовых клеточных компонен-
тов— либо витаминов в следовых количествах в
качестве предшественников коферментов и про-
стетических групп, либо (в большем количестве)
аминокислот или других органических соедине-
ний, входящих в состав клеточных полимеров
или представляющих собой важные растворимые
вещества. У многих микроорганизмов потребно-
сти в питательных веществах изучены пока недо-
статочно, и их удается культивировать лишь в
средах, содержащих сложные природные компо-
ненты, такие как сыворотка крови, жидкость руб-
ца, дрожжевой автолизат или пептоны. Неко-
торые облигатно паразитические или сим-
биотические бактерии не способны, по-видимому,
расти вне живого организма-хозяина. Подобно
этому некоторые анаэробные бактерии, сбражива-
ющие «пизкоэнергетические» субстраты, растут
лишь в присутствии партнера — сиптрофного ор-
ганизма, который потребляет продукты брожения
благодаря функционированию специальных мета-
болических путей (см. разд. 30.7).
6.3.1. В наибольшем количестве для роста
необходимы источники энергии,
электронов и углерода
плюс акцепторы электронов
Источники энергии □ Основной источник
энергии на Земле — это солнечный свет; среди
прокариот его способны использовать фото-
трофные бактерии, цианобактерии и неко-
торые археи. Микроорганизмы, нс использую-
щие свет, получают энергию для роста путем
окисления или сбраживания химических веществ
(хемотрофы). Для окисления, как правило,
необходим Оо в качестве акцептора электронов,
но многие бактерии способны к анаэробному ды-
ханию. Таким образом, для роста бактерий, осу-
ществляющих дыхание, необходимо присутствие
в среде кислорода или другого окислителя.
Доноры электронов □ В качестве доноров
электронов для дыхания и биосинтеза лито-
трофные микроорганизмы используют неор-
ганические соединения, органотрофные мик-
роорганизмы — органические вещества.
Источники углерода □ Для гетеротро-
фов источником клеточного углерода служат ор-
ганические соединения. Автотрофы при нали-
чии источников энергии и восстановителей ис-
пользуют в качестве единственного источника
углерода СОг- Тем микроорганизмам, которые
не обладают способностью использовать энергию
света, требуется при этом органический или неор-
ганический субстрат в качестве донора электро-
нов и источника энергии. Бактерии, осуществля-
ющие дыхание, нуждаются, кроме того, в акцеп-
торе электронов (см. гл. 10-12).
6.3.2. Основными питательными элементами
служат углерод, азот, сера и фосфор
Всем бактериям для синтеза компонентов клеток
необходимы углерод, азот, сера и фосфор. Эти
элементы вместе с Н и О входят в состав кле-
точных полимеров. Потребность в них можно рас-
считать количественно, зная элементный состав
клетки (см. гл. 7). Он приблизительно соответ-
ствует формуле СгНуОхдИ плюс небольшое ко-
личество Р, S, Fe, щелочных и щелочноземельных
металлов, а также следовое количество микро-
элементов. Источником углерода, составляющего
50% сухого вещества клеток, обычно служат те
же органические соединения, которые использу-
ются как источники энергии. Аэробные микроор-
ганизмы, как правило, включают в состав клетки
примерно 50% органического субстрата — намно-
го больше, чем бактерии, осуществляющие бро-
жение (10-20%). Остальное количество органи-
128 Часть II. Основы жизнедеятельности микробных клеток
Таблица 6.1. Основные микроэлементы и их роль в клетках бактерий
Элемент Локализация
Железо (Fe) Марганец (Мп) Кобальт (Со) Никель (Ni) Медь (Си) Цинк (Zn) Молибден (Мо) Вольфрам (W) Селен (Se) Ванадий (V) Гемы, сирогем; Fe-S-кластеры в составе многих оксидоредуктаз и ферментов некоторых других классов; переносчики электронов Ферменты, взаимодействующие с активными формами кислорода, такие как супероксиддисмутаза; фермент, расщепляющий воду в фотосистеме II Кобаламин (витамин В12, специфический кофермент реакций перестройки углеродного скелета молекул и переноса метильной группы) Ni-содержащий тетрапиррол метаногенов; уреаза; гидрогеназа; СО-дегидрогеназа Многие ферменты, взаимодействующие с Ог, такие как цитохром с-оксидаза, некоторые супер- оксиддисмутазы, пластоцианин, оксигеназы Ферменты различных классов, в частности карбоангидраза, алкогольдегидрогеназа, РНК- и ДНК-полимеразы, некоторые протеазы Многие оксидоредуктазы, катализирующие введение в молекулу субстрата гидроксильной группы из воды или обратную реакцию (молибдоптерин); большинство нитрогеназ Заменяет Мо в некоторых оксидоредуктазах, которые обычно содержат Мо; в этих случаях не может быть заменен Мо Входит в состав селеноцистеина в некоторых оксидоредуктазах; встречается в тРНК V-зависимая нитрогеназа, бромпероксидаза
ческого субстрата клетки используют в качестве
источника энергии. Все встречающиеся в приро-
де органические вещества можно рассматривать
как потенциальные субстраты для роста микроор-
ганизмов; при этом предпочтительным для мно-
гих бактерий источником углерода служит глюко-
за— наиболее распространенное органическое ве-
щество.
Азот, составляющий 14% сухого вещества
клеток, входит в состав многих природных со-
единений; бактерии предпочтительно использу-
ют его в форме NHJ. Многие бактерии ассими-
лируют нитрат, мочевину, аминосахара и амино-
кислоты; последние обычно добавляют в среду
в виде белкового гидролизата — пептона. Немно-
гие бактерии способны усваивать молекулярный
азот (N2). Потребляемые окисленные формы азо-
та (например, нитрат) восстанавливаются в клет-
ках до NH3, который включается в метаболизм.
Источниками серы, составляющей менее 1%
сухого вещества клеток, в большинстве природ-
ных местообитаний служат органические серусо-
держащие соединения и лишь в морской воде —
сульфат, концентрация которого составляет в ней
28 мМ. К предпочтительно используемым органи-
ческим тиолам относятся цистеин, цистин и мети-
онин (они присутствуют в пептоне). Лишь немно-
гие микроорганизмы способны использовать
молекулярную серу. Окисленные соединения серы
(например, сульфат) восстанавливаются в клет-
ках до H2S, который включается в метаболизм.
Фосфор (3% сухого вещества клеток) встре-
чается в природе обычно в виде фосфатов или
фосфорных эфиров. Стабильных (в нормальных
условиях) восстановленных соединений фосфо-
ра не существует. Внутри клеток восстановления
фосфата не происходит, и он включается в мета-
болизм именно в этой форме.
Источниками кислорода и водорода, вхо-
дящих в состав клеточных компонентов, служат
для клеток вода и/или органические соединения
и лишь в отдельных биосинтетических реакци-
ях гидроксилирования используется молекуляр-
ный кислород (атом(-ы) кислорода из О2 вклю-
чаются при этом в состав ОН-группы).
6.3.3. Неорганические соединения
используются как минорные,
но важные элементы питания
Для роста микроорганизмов требуются в неболь-
ших количествах ионы щелочных металлов (Na+,
К+) и щелочноземельных металлов (Mg2+, Са2+),
необходимые им в качества электролитов и обес-
печивающие протекание различных каталити-
ческих реакций. Помимо этих металлов, для
роста микробов необходим ряд элементов в сле-
довых количествах (их называют микроэлемен-
тами), в первую очередь Fe и в меньшем ко-
личестве Zn, Мп, Со, Mo, Си, Ni, W, Se, V,
В и др. (табл. 6.1), причем не всем бактери-
ям требуется полный набор этих элементов. Кон-
Глава б. Рост и питание 129
Таблица 6.2. Основные витамины и их функции в клетках бактерий
Витамин Функция
Фолиевая кислота п-Аминобензойная кислота Биотин Н икотиновая кислота Пантотеновая кислота Рибофлавин Липоевая кислота Тиамин Пиридоксаль, пиридоксамин Кобаламин (В12) Кофермент Ci-метаболизма и Ci-переноса Предшественник фолиевой кислоты Кофермент, участвующий в ATP-зависимом карбоксилировании метиленовой группы —СНг-, следующей после карбонильной группы — С=О, например при биосинтезе жирных кислот Предшественник NAD(P) Предшественник СоА Предшественник FAD и FMN Необратимое окислительное декарбоксилирование 2-оксокислот Декарбоксилирование 2-оксокислот, транскетолазные реакции Предшественник пиридоксальфосфата, кофермента реакций взаимопревращения аминокислот Реакции переноса СНз-группы; предшественник кофермента В12, необходимого для несколь- ких реакций перестройки углеродного скелега; рибонуклеотидредуктаза
центрация данных элементов в средах варьиру-
ет от миллимолярной (для щелочных и щелоч-
ноземельных металлов) до микромолярной (Fe)
и меньшей 1 мкМ (10~6-10-8 М для остальных
микроэлементов). При более высоких концентра-
циях микроэлементы оказывают токсическое дей-
ствие. Большинство двух- и трехвалентных кати-
онов металлов при нейтральном или щелочных
значениях pH образуют нерастворимые гидрок-
сиды или фосфаты и становятся недоступными
для использования бактериями. Поэтому концен-
трированные растворы неорганических солей ча-
сто хранят в анаэробных условиях при pH < 7 в
присутствии небольших количеств комплексооб-
разующих соединений, таких как ЭДТА или нит-
рилотриацетат (НТА). Растворимые комплексы с
ионами многих металлов способны также образо-
вывать некоторые питательные вещества в соста-
ве сред (например, ряд аминокислот — Cys, His —
и карбоновых кислот — малат, цитрат). К недо-
статку металлов в среде, помимо осаждения,
приводит также избыточное хелатирование.
6.3.4. Некоторым бактериям необходимы
витамины для биосинтеза коферментов
Бактериям, не способным синтезировать те или
иные витамины, необходимо присутствие их в сре-
де. Многие бактерии нуждаются лишь в каком-
либо одном витамине; так, для роста Е. coli в
случае некоторых субстратов требуется витамин
В12- Витамины, представляющие собой органиче-
ские соединения — предшественники или компо-
ненты коферментов либо простетических групп
ферментов (табл. 6.2) — и необходимые клеткам в
очень небольшом количестве (от 10~6 до 10-7 М),
присутствуют во многих природных средах обита-
ния бактерий как продукты разложения биологи-
ческого материала. Поскольку их биосинтез тре-
бует участия многих ферментов, бактериям часто
выгоднее не синтезировать их, а поглощать из сре-
ды с помощью высокоаффинных транспортных
систем. Минимальные потребности большинства
бактерий в витаминах удовлетворяет добавление в
среду дрожжевого экстракта (0,1-0,5%), но пред-
почтительнее использовать приготовленные в
лаборатории растворы витаминов с точно извест-
ным составом. Такие растворы, имеющие слабо-
кислый pH, стерилизуют фильтрованием и добав-
ляют в среду для выращивания бактерий только
после ее автоклавирования; хранят их в стериль-
ном виде на холоду, в анаэробных условиях и в
темноте.
6.3.5. Ауксотрофы нуждаются в аминокислотах
или других факторах роста
Аминокислоты и другие факторы роста служат
компонентами или предшественниками клеточ-
ных макромолекул либо других важных для ме-
таболизма веществ. Присутствие этих веществ в
среде, причем в относительно высоких концен-
трациях (миллимолярных), необходимо для роста
бактерий, не способных их синтезировать. К фак-
130 Часть II. Основы жизнедеятельности микробных клеток
Таблица 6.3. Пример минимальной синтетической пита-
тельной среды. Эта среда содержит примерно 20 компо-
нентов. Для сравнения, в состав среды неопределенно-
го состава (LB), на которой выращивают представите-
лей Enterobacteriaceae, входят только триптон (10 г/л),
дрожжевой экстракт (5 г/л), NaCI (5 г/л) и NaOH
(последний в количестве, необходимом, чтобы довести
pH среды до 7,0). В обоих случаях для приготовления
агаризованной среды вносят 15 г/л агара
Вещество (Мг) Концентрация в среде
г/л мМ
Иа2ПРО4 (142) КН2РО4 (136) Глюкоза (180) NH4CI (53) MgSO4 7Н2О (246) СаС12-2Н2О (147) FeSO4-7H2O (278) Раствор микроэле- ментов (100х) Вода (pH 7,3) 6 3 4 1 0,2 0,01 0,01 (10 мл) (1 л) 42 22 22 19 0,8 0,068 0,036 0,0005-0,005 (каждого)
торам роста, помимо аминокислот, относятся, на-
пример, пептиды, пиримидины, пурины, (ненасы-
щенные) жирные кислоты, холестерол, мевалоно-
вая кислота, холин, бетаин и полиамины. В сы-
воротке крови или дрожжевом экстракте могут
присутствовать неидентифицироваппые факторы
роста.
6.3.6. Среды неопределенного состава
дешевле и удобнее в работе
Изложенные в предыдущих разделах сведения о
питательных потребностях микроорганизмов поз-
воляют составлять среды из определенных хими-
ческих соединений (среды определенного со-
става, или синтетические среды; табл. 6.3).
Иногда для целей исследования, в первую очередь
для выяснения потребностей объекта, используют
минимальные среды, содержащие лишь наи-
более необходимые для роста компоненты. При-
родные среды чаще всего относятся к средам
сложного неопределенного состава; для ла-
бораторного культивирования во многих случаях
также применяют среды неопределенного состава
на основе дешевого пищевого сырья. В качестве
источника углерода и энергии в лабораторные
среды включают крахмал, солод или мелассу, в
качестве источников азота, серы, фосфора и ами-
нокислот — ферментированные, кислотные или
щелочные белковые гидролизаты (пептоны из
казеина, соевого белка, мяса или рыбы) либо ку-
курузный экстракт. Для обеспечения аминокисло-
тами, пептидами, водорастворимыми витаминами
и углеводами, а также микроэлементами в сре-
ды добавляют дрожжевой экстракт, получаемый
автолизом пекарских дрожжей. Для определен-
ных бактерий готовят среды на основе, напри-
мер, томатного или фруктового сока либо сня-
того молока. Патогенные микроорганизмы нуж-
даются в сыворотке крови, бактерии рубца—в
жидкости из него. Большинство молочнокислых
бактерий выращивают на молоке. Среды опреде-
ленного состава для тех же бактерий должны со-
держать примерно 40-50 химических соединений,
включая большинство аминокислот, витаминов и
микроэлементов.
6.3.7. Дополнительные компоненты сред,
такие как буфер и агар, не используются
бактериями в качестве питательных
веществ
Для поддержания на нужном уровне pH в среды
добавляют тот или иной буфер, чаще всего фос-
фатный (рКг = 7), бикарбонат/СОг (рК^ = 6,3)
или буфер па основе карбоновой кислоты (уксус-
ной, янтарной или лимонной —рК от 3,1 до 6,4)
либо белков (рК 7,0). При использовании для бу-
фера природных органических соединений следу-
ет учитывать, что они не должны потребляться
бактериями. Широко применяются для добавки
в среду синтетические буферы, такие как Трис
или «Good» (цвиттер-ионы органических сульфо-
новых кислот). Необходимо иметь в виду, что да-
леко не все буферы инертны — их компоненты мо-
гут образовывать либо комплексы с ионами двух-
и трехвалентных металлов, либо нерастворимые
осадки, взаимодействуя с компонентами среды,
а также служить питательными веществами для
выращиваемых микроорганизмов; фосфат в вы-
Глава б. Рост и питание 131
сокой концентрации подавляет рост многих бак-
терий.
Для получения плотной среды в жидкий пита-
тельный раствор добавляют агар (0,8% для полу-
жидкой среды, 1,5-2,0%—для плотной). Агар —
это полисахарид сложного состава, получаемый
из морских красных водорослей; он плавится при
температуре 90 °C и после расплавления засты-
вает при температуре 45 °C. Среды для бакте-
рий, растущих при экстремально высокой темпе-
ратуре, высоких концентрациях солей или низких
значениях pH либо способных разжижать агар,
уплотняют силикагелем. Это неорганическое со-
единение применяют также для получения плот-
ной среды, если необходимо определить способ-
ность бактерии к автотрофному росту.
6.4. Для выращивания чистых культур микроорганизмов
необходима стерилизация сред и инструментов
Стерилизацией называют освобождение какого-
либо объекта от любых живых организмов. Ниже
кратко описаны методы стерилизации и указаны
области их применения.
Автоклавирование □ Питательные среды и
жаропрочное оборудование обычно стерилизуют
текучим паром в автоклаве —15 мин при 121 °C.
Такой обработки достаточно для того, чтобы уни-
чтожить клетки и споры бактерий (необходи-
мо помнить, однако, что некоторые экстремофи-
лы могут выживать даже при этих условиях).
Указанная температура достигается в автоклаве
при давлении насыщенного водяного пара 2 атм
(0,2 МПа). Если в стерилизационной камере име-
ется воздух, этому давлению соответствует более
низкая температура. Чтобы установить требуе-
мый температурный режим стерилизации, воздух
из камеры, прежде чем ее герметизировать, вы-
тесняют паром. По соображениям безопасности
в автоклавах обычно установлен только датчик
давления, а не температуры, и нужно учитывать,
что показание манометра 2 атм может не соот-
ветствовать температуре 121 °C, если не удален
воздух.
Кинетика гибели микробных клеток при таком
воздействии подобна кинетике химической реак-
ции первого порядка, т. е. чаще всего имеет ха-
рактер экспоненциальной зависимости, при кото-
рой доля клеток, отмирающих в единицу времени,
постоянна. Эффективность стерилизации и чув-
ствительность к ней микроорганизма определя-
ют по времени, необходимому для десятикратного
(90%) уменьшения микробной популяции (вели-
чина Ею)- В качестве индикатора эффективности
стерилизации используют чрезвычайно термо-
устойчивые эндоспоры Bacillus stearothermophilus,
для которых величина Dio при 121 °C равна при-
близительно 30 с (рис. 6.4).
При работе важно иметь в виду различия в
термоустойчивости клеток и спор бактерий, а так-
же то, что с увеличением температуры величи-
на Dio практически экспоненциально снижается
и наоборот. Для стерилизации объектов, содержа-
щих большое число эндоспор (например, почвы),
необходимы особые условия. Следует также учи-
тывать, что время, которое требуется для уничто-
жения определенной доли клеток, не зависит от
их начальной концентрации.
Рис. 6.4. Выживание эндоспор двух видов Bacillus в
жидкой среде при различных значениях температуры
(шкала полулогарифмическая). Для примера стрелками
на рисунке показано время десятикратного уменьшения
популяции В. stearothermophilus при 121 °C (приблизи-
тельно 0,6 мин).
132 Часть II. Основы жизнедеятельности микробных клеток
Пастеризация □ Для многих практических
целей достаточно лишь существенно уменьшить
количество жизнеспособных микроорганизмов в
объекте путем выдерживания его при 65-75 °C
в течение короткого времени (минут). При такой
обработке погибает большинство патогенных бак-
терий и срок храпения продуктов, например моло-
ка, возрастает. Молоко прогревают при 71-74 °C в
течение 20 с, консервируемые продукты — 20 мил
при 80 °C. Необходимо помнить, что такая об-
работка не равнозначна стерилизации, посколь-
ку споры при этом не погибают; однако во мно-
гих консервированных продуктах их прорастания
не происходит благодаря тому, что эти продукты
имеют кислую реакцию.
Стерилизация сухим жаром □ При дей-
ствии сухого жара споры бактерий выдерживают
более высокую температуру, чем при стерилиза-
ции паром. Поэтому посуду, инструменты и все
остальные используемые при работе с чистыми
культурами предметы стерилизуют в сушильном
шкафу при температуре 160 °C в течение 2 ч или
при 180 °C в течение 30 мин.
Фильтрование □ Водные растворы термо-
лабильных или летучих веществ для внесения
их в среды (после автоклавирования) стерили-
зуют фильтрованием. При небольших объемах
жидкости применяют предварительно простери-
лизованные насадки на колбы Бухнера, помещая
в них мембранные фильтры с диаметром пор
0,2-0,45 мкм. Для фильтрования больших объе-
мов используют различные специальные системы,
например па основе толстых пористых трубок из
фарфора или кизельгура (диатомита).
Облучение □ Для стерилизации в промыш-
ленных масштабах применяют рентгеновское или
гамма-излучение, а также другие виды ионизиру-
ющей радиации. В исследовательских лаборато-
риях и медицинских учреждениях рабочие места
и помещения стерилизуют ультрафиолетом.
6.5. Рост можно измерять различными методами
Рост бактерий означает деление клеток и, следо-
вательно, увеличение их общего количества. Со-
ответственно одним из основных методов измере-
ния роста служит прямой подсчет числа клеток
под микроскопом. Однако этот метод не позволя-
ет различать живые и мертвые клетки, и, кро-
ме того, в природных образцах при его использо-
вании иногда трудно отличить мелкие клетки от
других частиц. Поэтому во многих случаях, на-
пример при низкой плотности клеток в пробах,
для измерения роста определяют число клеток,
образующих колонии (колониеобразующис едини-
цы, КОЕ). Часто рост определяют по приросту
биомассы. Этот способ наиболее пригоден, в част-
ности, для организмов, образующих мицелий, ни-
ти или скопления клеток. В качестве показателя
роста культур в жидкой среде измеряют светорас-
сеяние, или мутность. При промышленном куль-
тивировании показателем роста во многих слу-
чаях служит потребление субстрата (например,
Ог) или образование продуктов обмена (напри-
мер, СО2 или кислот), пропорциональное росту
культуры.
Турбидиметрия □ Размеры бактериальных
клеток относятся к тому же порядку величин, что
и длины волн видимого света, поэтому бактери-
альные суспензии довольно значительно рассеи-
вают свет, т. е. имеют мутность. Величину све-
торассеяния можно измерить с помощью спек-
трофотометра (рис. 6.5). Этот прибор позволя-
ет определить долю падающего света, которая
при его прохождении через пробу теряется в
результате рассеяния и поглощения света. Для
измерений используют кюветы одной и той же
толщины, чтобы можно было сравнивать резуль-
таты. Поглощение связано с интенсивностью па-
дающего (1о) и пропускаемого (I) света зависимо-
стью А = log(Io/I). Соотношение между концен-
трацией раствора и поглощением, известное как
закон Ламберта-Бэра, А — е с • d, применимо в
строгом смысле только к не рассеивающим свет
растворам. Тем не менее существует линейная за-
висимость между «поглощением» (А) и количе-
ством клеток бактерий в суспензии N : А = d • N
в диапазоне величин А < 0,3. Обычно для из-
мерения роста используют длины волны от 500
до 660 нм, поскольку большинство компонентов
клеток не поглощает свет этой области спектра
(длину волны указывают нижним индексом, на-
пример, Аббо)- Показания прибора за вычетом
величины поглощения кюветы с чистой средой
(контроль) называют оптической плотностью, OD
Глава б. Рост и питание 133
Нефелометрия
Фотодетектор
Фильтр
Рис. 6.5. Измерение светорассеяния при прохождении
пучка света через суспензию клеток бактерий. 1о — ин-
тенсивность падающего света; I — интенсивность про-
пущенного света. Показания прибора означают собой
оптическую плотность OD = log (Io/О- Интенсивность
рассеянного света измеряют с помощью нефелометра,
d— толщина кюветы; N — количество клеток.
(при толщине кюветы 1 см), или единицами Клст-
та («Klett units») при использовании фотометра
типа Klett-Summerson. Пробы из культур с высо-
кой плотностью клеток перед измерением погло-
щения разводят.
Светорассеяние зависит не только от количе-
ства частиц в суспензии, по также от их разме-
ров и форм ы. Тем не менее разбавленные суспен-
зии большинства бактерий независимо от разме-
ров клеток характеризуются почти одинаковым
поглощением в расчете па концентрацию сухого
вещества. Для перевода показаний спектрофото-
метра в значения биомассы используют калибро-
вочную кривую, показывающую зависимость оп-
тической плотности культуры от концентрации
биомассы (высушенных клеток). Таким образом,
турбидиметрия служит высокоточным и удобным
методом непрямого определения биомассы. Одна-
ко следует учитывать, что величины поглощения
света суспензиями отдельных бактерий с клетка-
ми разных размеров могут быть различными.
Реже для определения биомассы используют
нефелометрию — измерение светорассеяния под
углом 90 ° к падающему пучку света (рис. 6.5; об-
ратите внимание, однако, что большая часть све-
та рассеивается лишь на небольшой угол, 2-12 °).
Это высокочувствительный метод, по он может
давать ошибочные результаты при наличии в сре-
де примесей в виде частиц. Для точности измере-
ний нефелометр необходимо часто калибровать.
Определение биомассы □ Турбидиметрия
как способ определения биомассы в ряде случаев
неприменима (для культур с мицелиальным или
поверхностным ростом, для бактерий, образую-
щих длинные нити, агрегаты и скопления клеток,
а также для смешанных культур, в которых ва-
рьирует количественное соотношение видов); из-
мерение количества сырой биомассы дает обыч-
но весьма неточные результаты. В связи с этим
для измерения биомассы определяют массу высу-
шенных клеток. Отцентрифугированную (или от-
фильтрованную) и промытую водой биомассу вы-
сушивают до постоянного веса в сушильном шка-
фу при 105 °C. Другим способом сушки служит
лиофилизация. Сухое вещество клеток составляет
обычно 10-20% их сырой массы. Количество био-
массы можно также оценить косвенно по содер-
жанию белка в культуре. Для этого клетки оса-
ждают кислотой, после чего определяют белок с
помощью колориметрического метода. Соотноше-
ние биомассы клеток и количества в ней белка по-
стоянно только при сбалансированном росте, т. е.
когда состав клеток по мере роста культуры не
претерпевает изменений. Однако в большинстве
случаев это соотношение изменяется в конце экс-
поненциальной фазы роста, а также при образо-
вании бактериями большого количества запасных
веществ. Способом измерения роста может также
служить определение содержания С или N в био-
массе.
Метаболические параметры, пропорцио-
нальные росту □ Если рост культуры относи-
тельно сбалансированный и метаболизм не разоб-
щен с биосинтезом, увеличение биомассы удобно
контролировать по поглощению субстратов (на-
пример, Ог или источника углерода) либо по об-
разованию продуктов обмена (например, СО2).
Концентрацию газов наиболее просто опреде-
лить на входе и выходе культиватора с помо-
щью масс-спектрометра, инфракрасного абсорб-
ционного спектроскопа или другого прибора. Зная
экономический коэффициент (отношение массы
клеток к количеству потребленного субстрата) и
метаболические параметры роста, можно оценить
увеличение биомассы.
Подсчет колоний □ Этот широко приме-
няемый метод позволяет определять количество
жизнеспособных клеток, образующих на плотной
среде видимые колонии. На получаемые резуль-
таты может, однако, влиять изменение в состоя-
нии клеток при инкубации в новых условиях и,
кроме того, при использовании этого метода мо-
гут оказаться неучтенными покоящиеся формы
134 Часть II. Основы жизнедеятельности микробных клеток
бактерий. Как правило, перед посевом готовят
серийные разведения культуры, например в фи-
зиологическом растворе, содержащем фосфатный
буфер. Если культура густая, делают несколь-
ко 10- или 100-кратных разведений, поскольку
количество жизнеспособных клеток в про-
бе заранее не известно. Напротив, разбавленные
пробы, например из природных водоемов, содер-
жащие незначительное число бактерий, концен-
трируют фильтрованием или иногда центрифу-
гированием. Посев производят поверхностным
или глубинным способом. При поверхностном
посеве инокулят в виде суспензии клеток объе-
мом 0,1 мл наносят на поверхность застывшей
агаровой среды. При глубинном посеве вносят
0,1-1,0 мл инокулята в еще не застывшую среду,
после чего ее перемешивают и разливают по чаш-
кам Петри (предполагается, что кратковременное
пребывание клеток в расплавленной агаровой сре-
де, при 45 °C не влияет на их жизнеспособность,
но это необходимо проверять). Анаэробные бак-
терии для подсчета клеток выращивают во вра-
щаемых пробирках: пробирки с небольшим ко-
личеством расплавленной агаризованной среды,
закрытые пробками, вращают в горизонтальном
положении на холоду, в результате чего агар
застывает в виде тонкой пленки на стенках про-
бирки. Другой способ учета анаэробных бакте-
рий—это посев в двухслойный агар; бакте-
рии высевают на агаризованную среду в чашках
Петри и поверх нее наносят тонкий слой полу-
жидкого агара. Развитие небольших, компактных
колоний происходит под его поверхностью. Для
анаэробов используют также посев в тонкий
слой агара: инокулят вносят в небольшое коли-
чество расплавленного и остуженного полужид-
кого агара (0,75%), который выливают затем в
чашку Петри с плотной средой. Подсчет колоний
производят обычно в тех чашках (или вращаемых
пробирках), в которых содержится от 30 до 300
колоний. Для достоверности результатов необхо-
димо подсчитать несколько сотен колоний. При
статистической обработке данных определяют
стандартное отклонение как квадратный корень
числа подсчитанных колоний. Каждый из этих
методов предполагает контроль эффективно-
сти посева с помощью прямого подсчета чис-
ла клеток (см. ниже); эта эффективность должна
быть близка к 100%. Кроме того, следует прове-
рять, что клетки в инокуляте не образуют скоп-
лений. Результаты количественного учета клеток
обычно выражают в колониеобразующих еди-
ницах.
Для определения численности бактерий в
сильно разбавленных пробах (например, питьевой
воде) рекомендуется использовать метод под-
счета колоний на мембранных фильтрах.
Пробы фильтруют через мембранные фильтры с
необходимыми размерами пор, после чего фильтр
помещают на агаризованную среду или просто
на фильтровальную бумагу, пропитанную пита-
тельной средой. Колонии образуются на поверх-
ности фильтра благодаря проникновению через
него питательных веществ из среды. Недостаток
всех описанных методов состоит в том, что мно-
гие бактерии могут быть высокочувствительными
к некоторым компонентам агара. Посев для под-
счета колоний можно объединить с физиологиче-
скими тестами, используя индикаторный агар.
Метод определения наиболее вероятно-
го числа бактерий (метод предельных разве-
дений) □ Этот способ позволяет провести гру-
бый подсчет числа жизнеспособных клеток. Он
состоит в том, что приготавливают несколько по-
следовательных разведений культуры в ростовой
среде и после инкубации подсчитывают число
пробирок, в которых отсутствует рост. Предпола-
гается, что в эти пробирки при посеве не было вне-
сено ни одной жизнеспособной клетки. Принимая,
что распределение клеток описывается формулой
Пуассона, среднее число клеток т в данном раз-
ведении вычисляют по формуле
т= — 1пР0, (6-11)
где Ро — отношение количества пробирок, в ко-
торых отсутствует рост, к общему числу проби-
рок в данном разведении. Затем среднее значение
умножают на фактор разбавления и корректиру-
ют с учетом объема инокулята, чтобы вычислить
число жизнеспособных клеток в исходной куль-
туре. Этот метод более трудоемок по сравнению
с методами прямого подсчета, но его приходится
использовать, если микроорганизм не растет на
плотных средах. Кроме того, он позволяет учесть
организмы, растущие медленнее других, если они
находятся в одной пробе с быстрорастущими
формами. Наиболее важное преимущество этого
метода состоит в том, что в тех образцах, где, по-
мимо исследуемых, присутствуют иные организ-
мы, он позволяет выявить интересующий объект,
например с помощью микроскопии или по образо-
ванию характерных продуктов (например, серово-
Глава 6. Рост и питание 135
дорода бактериями сульфатрсдукторами; в при-
сутствии H2S и Fe(II) образуется черный осадок
FeS). Кроме того, можно исключить контамини-
рующие бактерии, применяя селективные среды.
Прямой подсчет □ Количество микробных
клеток можно подсчитывать непосредственно под
микроскопом с помощью счетной камеры, пред-
ставляющей собой специальное предметное стек-
ло с небольшой выемкой известной глубины
(обычно 0,02 мм) и нанесенной сеткой из неболь-
ших квадратов известной площади. Выемку за-
полняют исследуемой суспензией бактерий, и
плотно закрывают камеру притертым прочным
покровным стеклом, после чего подсчитывают ко-
личество бактерий в этом определенном объе-
ме суспензии. Для прямого подсчета под мик-
роскопом можно использовать также мембран-
ные фильтры, окрашивая осажденные на них
бактерии. При этом на высушенные фильтры на-
носят иммерсионное масло, благодаря чему они
становятся прозрачными. Этот метод полезен
для тех случаев, когда образец содержит менее
106 клеток/мл. Другим способом концентрирова-
ния проб может быть центрифугирование. Для
подсчета бактериальных клеток весьма удобен
электронный счетчик частиц (счетчик Коулте-
ра), позволяющий определять, помимо числа кле-
ток, распределение их по размерам.
В природных условиях измерять рост бак-
терий довольно сложно. Обычно для этого ис-
пользуют косвенные методы, такие как опреде-
ление фиксации 14СОг или [3Н]-тимидина. Кро-
ме того, проводят прямой подсчет числа клеток
с использованием флуоресцентного микроскопа,
окрашивая клетки флуоресцентными красителя-
ми (например, 4',6-диамидино-2-фенилиндолом,
ДАФИ) или обрабатывая их флуоресцентными
ДНК-зондами.
6.6. Методы хранения культур обеспечивают
длительное поддержание их жизнеспособности
Основные цели хранения культур — это поддер-
жание жизнеспособности клеток и чистоты куль-
туры, а также предотвращение изменений и му-
таций, т. е. сохранение микроорганизма в макси-
мально близком к исходному штамму состоянии.
Для хранения важен правильный выбор среды и
метода культивирования, а также возраста куль-
туры на момент начала хранения.
Методы непродолжительного хранения
лишь частично удовлетворяют этим критериям.
Из таких методов чаще всего применяется пери-
одический пересев культур на свежую среду с
выращиванием при низкой температуре и после-
дующим хранением в холодильнике. Культуры
споровых бактерий, содержащие зрелые споры,
можно хранить сухими в стерильной почве, на
стерильной фильтровальной бумаге или в виде
культур, высушенных при помощи силикагеля.
Некоторые бактерии хорошо переносят хранение
в высушенных каплях желатина. Для многих це-
лей хранят клетки в жизнеспособном состоянии в
течение лет при температуре —20 °C или, что луч-
ше, при —70 °C (глубокое замораживание). Для
храпения с помощью этих методов необходимо ис-
пользовать культуры в середине или в конце экс-
поненциальной фазы роста, сконцентрированные
и затем ресуспендированные в небольшом количе-
стве свежей питательной среды. При заморажи-
вании в среде должны присутствовать криопро-
текторы, такие как глицерол (15-40 об. %) или
диметилсульфоксид (ДМСО, 5-10 об. %), предо-
храняющие клетки от повреждения заморажи-
ванием, которое должно происходить со скоро-
стью 1 ° С/мин. Оттаивание замороженных куль-
тур рекомендуется производить в более быстром
режиме.
В настоящее время широко применяются ме-
тоды длительного хранения, основанные па
лиофилизации или ультразамораживании
культур в жидком азоте (—196 °C) либо над
жидким азотом (—150 °C). Для оценки эффек-
тивности этих методов их сравнивают по доле вы-
живших клеток после определенного времени хра-
нения. Ожидаемый период выживания бактерий
при обоих способах длительного хранения превы-
шает 40 лет, в то время как при глубоком замо-
раживании он составляет 1-3 года. При ультра-
замораживании к суспензии обычно добавляют
136 Часть II. Основы жизнедеятельности микробных клеток
криопротекторы, такие как глицерол (10 об. %)
или ДМСО (5 об. %). Эти соединения водораство-
римы и способны легко проходить через клеточ-
ную мембрану, имеют низкую точку плавления и
могут замещать воду в качестве гидратной обо-
лочки, уменьшая таким образом повреждающее
влияние дегидратации при замерзании воды. По-
этому замораживание и образование кристаллов
льда в среде протекает замедленно. Происходя-
щее при этом возрастание концентрации внекле-
точного раствора приводит к тому, что вода на-
чинает выходить из клеток. По мере заморажива-
ния вся свободная вода кристаллизуется (в виде
чистого льда), оставляя концентрированный рас-
твор, замерзание которого приводит к образова-
нию лишь незначительного количества поврежда-
ющих клетку кристаллов.
Лиофилизация заключается в удалении
воды из замороженных клеток путем сублима-
ции при низком давлении; при этом вода ис-
паряется без перехода в жидкую фазу. Лио-
фильно высушенные клетки сохраняют жизне-
способность в течение длительного времени, если
защищены от действия кислорода, влаги, высо-
кой температуры и света. При лиофилизации к
суспензии часто добавляют криопротекторы, та-
кие, например, как молочная сыворотка (20%,
вес/объем), лошадиная сыворотка (10 об. %), са-
хароза (12%, вес/объем) или другие химические
вещества.
6.7. Работа микробиологов основана на методах
элективного культивирования и получения чистых культур
До сих пор мы рассматривали методы выращива-
ния и поддержания имеющихся культур бактерий.
Однако для решения многих проблем научного и
прикладного характера необходимы поиск в при-
роде и выделение новых видов с ранее не опи-
санными свойствами. При этом используют ме-
тод накопительных культур, введенный в прак-
тику более 100 лет назад С. Н. Виноградским и
М. Бейеринком.
Принцип методов выделения □ В боль-
шинстве природных образцов в одном грамме
материала присутствуют сотни различных видов
бактерий, и тем не менее среди них можно не най-
ти искомого. Чтобы выделить желаемый микро-
организм, важно иметь подходящий материал
из соответствующего местообитания. Например,
экстремально термофильные бактерии с большой
вероятностью можно выделить из воды горячих
источников, анаэробные — из иловых отложений.
В природе происходит естественное обогащение
сред теми или иными микроорганизмами, если
имеется постоянный приток специфического суб-
страта и относительно постоянные условия. По
аналогии с этим метод накопительных культур
основан на подборе селективной (элективной)
среды — благоприятной для искомого организма
и неблагоприятной для других, а также селек-
тивных физико-химических условий культивиро-
вания. К сожалению, при использовании такого
метода в накопительной культуре, как правило,
доминируют быстрорастущие виды, которые по-
давляют все остальные формы. Медленнорасту-
щие виды удается выделить только в том слу-
чае, если своевременно пересевать пробы из нако-
пительной культуры на плотную среду в чашках
Петри. Можно также высевать непосредствен-
но природные пробы на плотную элективную
среду, где медленнорастущие виды при длитель-
ной инкубации образуют видимые колонии.
Селективные условия создают путем ком-
бинирования различных источников энергии, уг-
лерода и других элементов (N, Р, S и т. д.) плюс
доноров и акцепторов электронов, путем внесения
в среду ингибиторов, варьирования освещенности,
концентрации кислорода, температуры, pH, ак-
тивности воды, солености и т. д., а также концен-
трации компонентов среды и спектрального соста-
ва света.
Чистые культуры, или клопы, получаемые
из одной клетки, выделяют в большинстве слу-
чаев с помощью методов, описанных в разд. 6.5
как способы измерения роста путем подсчета ко-
лоний. Простейший способ получения колоний —
это посев проб из накопительной культуры на по-
верхность плотной питательной среды исто-
щающим штрихом или в расплавленную и
Глава 6. Рост и питание 137
остуженную агаризованную среду, разлива-
емую затем в чашки Петри либо пробирки. Среди
выросших колоний выбирают полностью изоли-
рованные от других и тем же способом высева-
ют их в виде суспензии на аналогичную среду'.
Если все колонии из второго пересева выглядят
одинаково, их можно использовать далее для по-
сева в жидкую среду (при этом также нужно
брать изолированную колонию). Однако бакте-
рии, способные к быстрому движению, в особенно-
сти спирохеты, могут легко распространяться по
влажной поверхности среды и контаминировать
чашку. Другой способ выделения — это последо-
вательное разведение клеточной суспензии пи-
тательной средой в соотношении 1 : 2 (или 1 : 10,
1 : 100; метод предельных разведений), с тем до-
пущением, что последнее из разведений, где бу-
дет наблюдаться рост, исходно содержало лишь
одну бактериальную клетку. Этот метод исполь-
зуют, если выделяемый организм количественно
преобладает в накопительной культуре. В случа-
ях, когда нельзя использовать ни высев на плот-
ные среды, ни разведение пробы в жидкой среде,
чистую культуру можно получить из отдельной
бактериальной клетки, отобранной под микроско-
пом с помощью капиллярной пипетки и микро-
манипулятора. Все этапы выделения необходимо
производить в нескольких повторностях и прове-
рять чистоту выделенных колоний или культур по
всем необходимым критериям.
6.8. Непрерывное культивирование служит
ценным инструментом исследования
6.8.1. Рост в хемостате
Скорость роста бактерий может изменяться в со-
ответствии с условиями и составом среды, напри-
мер в ответ на сдвиг в концентрации субстра-
та. Это свойство бактерий наглядно иллюстриру-
ет хемостатная (непрерывная) культура (рис. 6.6).
При непрерывном культивировании, в отличие от
периодического, в культиватор постоянно пода-
ется свежая питательная среда и концентрация
одного из субстратов поддерживается па уровне,
лимитирующем рост. Одновременно происходит
постоянный отток культуры, так что объем ее в
культиваторе не изменяется. Культиватор снаб-
жен мешалкой для равномерного распределения
свежей среды.
Хемостатная культура обладает двумя неожи-
данными свойствами. Во-первых, при постоян-
ном притоке свежей среды плотность клеток в
пей сохраняется на постоянном уровне (рис. 6.7),
и, во-вторых, стационарная концентрация клеток
N остается практически неизменной даже при
больших изменениях скорости протока (f; размер-
ность объем/ед. времени, например л/ч). Однако
при скорости протока выше определенного значе-
ния стационарная концентрация клеток начина-
ет резко падать, достигая нуля при критической
скорости протока, соответствующей максималь-
Рис. 6.6. Система для непрерывного культивирова-
ния (хемостат). Уровень поверхности культуры сохра-
няется постоянным, поскольку скорость разбавления
свежей средой равна скорости оттока культуры. V —
объем культуры, Sr — концентрация субстрата в ре-
зервуаре; f—скорость протока; N — количество клеток;
S — концентрация субстрата в культиваторе (и прием-
ном сосуде).
ной удельной скорости роста р,мах периодической
культуры того же организма (см. рис. 6.1). Оста-
точная концентрация субстрата в культуре обыч-
138 Часть II. Основы жизнедеятельности микробных клеток
Рис. 6.7. Плотность клеток N (или количество кле-
ток) и концентрация лимитирующего рост субстрата S
при стационарном состоянии непрерывной культуры в
зависимости от скорости протока f, скорости разбавле-
ния D и удельной скорости роста д. Критическая ско-
рость разбавления Dc равна дтах, т. е. удельной ско-
рости роста данной бактерии в периодической куль-
туре. — время генерации, AN/At — продуктивность
хемостата. На графике показаны теоретически рас-
считанные значения для: культуры объемом 1 л при
Mmax — 1 ч-1; значения Y, равного 0,5 г биомассы на 1 г
потребленного субстрата; концентрации субстрата (глю-
козы) в резервуаре 10 мМ (1,8 г/л) и Ks для глюкозы
0,1 мМ. Реальные величины N при низких значениях д
показаны штриховой линией (объяснение наблюдаемой
зависимости см. в разд. 6.8.4, об энергии поддержа-
ния). Произведение D и плотности клеток N в хемостате
(D • N) отражает скорость оттока, или выход биомассы
(производительность, или продуктивность, г клеточной
биомассы на единицу времени).
но очень низка, но возрастает гиперболически с
увеличением скорости протока, пропорционально
падению концентрации клеток (рис. 6.7).
Установление постоянной плотности бак-
терий (steady state) при данной скорости про-
тока можно объяснить тем, что при стационар-
ном состоянии культуры скорость деления клеток
(4-dN/dt = д • N; см. уравнение (6.1)) в постоян-
ном объеме культуры (V) равна скорости их вы-
мывания:
(6Л2)
Таким образом, стационарное состояние описыва-
ется следующим уравнением:
M-N = |.N (6.13)
Скорость разбавления D равна
D = 1 (6.14)
где f— скорость протока (л/ч) и V — объем сосу-
да. Подставляя это выражение для f в уравнение
(6.13), получаем уравнение (6.14), в котором ско-
рость разбавления D можно рассматривать как
частоту обновления всего объема культуры в еди-
ницу времени:
д = D (6.15)
Изменение биомассы бактерий dN/dt в культи-
ваторе складывается из двух скоростей — роста
(деления клеток) и разбавления культуры:
dN
dt
= д • N - D • N,
причем в состоянии динамического равновесия
культуры д равно D. Стабильность такого состоя-
ния в хемостате определяется тем, что рост лими-
тирован концентрацией одного из субстратов. Ес-
ли при постоянной скорости разбавления D кон-
центрация субстрата в резервуаре (Sr) возраста-
ет, происходит установление повой равновесной
плотности клеток N, но не увеличение равновес-
ной удельной скорости роста д. Вначале после
увеличения Sr культура растет быстрее и плот-
ность ее возрастает, но вскоре достигается повое
равновесное состояние, в котором клетки, в ре-
зультате возрастания их числа, потребляют прак-
тически весь субстрат по мере его поступления;
таким образом, скорость разбавления вновь опре-
деляет скорость роста.
После изменения скорости разбавления проис-
ходит саморегуляция системы и довольно быстро
достигается новое значение д. Этот удивительный
феномен можно объяснить па основе гиперболи-
ческой зависимости д от концентрации субстрата
S (рис. 6.8), известной как уравнение Mono:
Д = Мтах • S/(7<s + S) (6.16)
Ks — это константа сродства организма к субстра-
Глава 6. Рост и питание 139
Рис. 6.8. Зависимость удельной скорости роста д от кон-
центрации лимитирующего рост субстрата S в соответ-
ствии с уравнением Моно (уравнение (б. 16)].
ту, численно равная такой концентрации лими-
тирующего рост субстрата, при которой скорость
равна 1/2 ее максимальной величины (Дтах/2)-
Величины Ks лежат обычно в микромолярном
диапазоне.
Зависимости скорости роста бактерий и ак-
тивности ферментов от концентрации субстрата
описываются одинаковыми функциями [ср. урав-
нения (6.16) и (5.3)]. По-видимому, скорость ро-
ста определяется скоростью самой медленной ре-
акции метаболизма, часто скоростью транспорта
субстрата через бактериальную мембрану с уча-
стием переносчика. Поэтому зависимость скоро-
сти роста от притока субстрата описывается кри-
вой насыщения, в которой S представляет собой
концентрацию субстрата в культуре (не в подава-
емой в культиватор свежей среде). Концентрацию
субстрата в хемостате можно вычислить из урав-
нения (6.17), полученного преобразованием урав-
нения (6.16):
S = Ks-----(6.17)
Р'тах Д
Поскольку при равновесии в хемостате д = D,
уравнение (6.17) можно преобразовать следую-
щим образом:
q_ • Г
О — -------
/Апах
Таким образом, при равновесии концентрация
(6.18)
субстрата в хемостате S не зависит от его концен-
трации в резервуаре (Sr), а определяется лишь
величинами Ks и D при данном /л,т&х. Концентра-
ция субстрата в резервуаре (т. е. в подаваемой све-
жей среде) Sr влияет только на плотность куль-
туры N:
N = Y(Sr — S) = Y •
Ks-D
/Апах О
(6.19)
Чем больше клеток образуется в культуре при
использовании данного количества субстрата
(Sr — S), тем больше энергии бактерии могут
получить при его потреблении. Y — экономиче-
ский коэффициент, рассматриваемый в разд. 6.8.3
(уравнение (6.20)).
Культивирование в хемостате
- обеспечивает постоянное получение молодых
клеток, выросших в строго определенных
условиях при известной удельной скорости ро-
ста; такие клетки необходимы для изучения
различных регуляторных процессов;
- позволяет определять важные показатели ро-
ста, такие как Ks, дтах, ins и любые другие,
связанные с д, а также изучать физиологи-
ческую реакцию культуры на лимитирование
питательными веществами;
- служит полезной моделью для описания ро-
ста во многих природных местообитаниях (см.
разд. 30.3 и 30.4);
- позволяет выявлять предпочтительно исполь-
зуемые субстраты в их смеси, а также конку-
ренцию или сосуществование двух или трех
видов при данных условиях роста;
- позволяет проводить подпитку токсичными
субстратами в более высоких концентрациях;
- обеспечивает отбор мутантов с более низким
значением Ks лимитирующего рост субстрата
или более высоким значением
— позволяет исследовать стабильные двухком-
гюнентные культуры, такие как синтрофные
ассоциации, или, например, простейших, пи-
тающихся бактериями.
6.8.2. Рост в турбидостате
Культивирование в турбидостате основано на ав-
томатизированном поддержании постоянной за-
140 Часть II. Основы жизнедеятельности микробных клеток
данной концентрации клеток путем регулирова-
ния скорости подачи свежей среды в соответствии
с изменением плотности культуры. Все субстра-
ты при этом содержатся в культиваторе в избыт-
ке. Рост в турбидостате наиболее стабилен, когда
его удельная скорость д близка к дтах, т. е. из-
менение скорости протока приводит к изменению
биомассы, в соответствии с уровнем которой про-
исходит регуляция системы. Рост в хемостатах в
этих условиях наименее стабилен. На практике
наиболее трудную проблему при культивировании
в турбидостате представляет постоянный монито-
ринг количества биомассы. Как правило, ее опре-
деляют по непосредственно связанным с ростом и
метаболизмом клеток показателям, например по
концентрации COq в газовой смеси на выходе пз
культиватора.
6.8.3. Экономический коэффициент
Количество биомассы бактерий (N), образующей-
ся при потреблении 1 моль энергетического суб-
страта (субстрат катаболизма, Sc), называют мо-
лярным экономическим коэффициентом Y:
Если рост лимитирован концентрацией субстра-
та катаболизма, величина Y в экспоненциальной
фазе роста, как правило, постоянна. (Экономиче-
ский коэффициент определяют также как биомас-
су, отнесенную к количеству образовавшихся про-
дуктов метаболизма, которое пропорционально
количеству потребленного субстрата.) Использу-
ется и экономический коэффициент Yatp — коли-
чество биомассы в расчете па 1 моль использо-
ванного АТР. Связь между' Yatp и Y описыва-
ется уравнением (6.21), где н— количество АТР,
моль, образующееся при потреблении 1 моль ка-
таболизируемого субстрата Sc, используемого как
источник энергии:
Y = n-YATp (6.21)
Величину Y используют для вычисления количе-
ства АТР (п), образуемого при катаболизирова-
пии 1 моль Sc. Допуская, что состав клеток и по-
требности в АТР для биосинтеза их компонентов
идентичны у всех бактерий при росте с исполь-
зованием одинаковых энергетических субстратов,
можно использовать для расчетов одно и то же
значение Yatp- Однако в зависимости от исполь-
зуемого источника углерода величина Yatp мо-
жет существенно варьировать. Расчеты, основан-
ные на данных о путях биосинтеза, показывают,
что необходимое для синтеза клеточных компо-
нентов количество АТР в грубом приближении
обратно пропорционально числу атомов углерода
в соединении, используемом как источник углеро-
да (сравнивать можно лишь субстраты со сходной
степенью восстановления). Таким образом, при
росте в среде с лактатом или ацетатом в качестве
источников углерода величина Yatp будет в два
или три раза ниже, чем при росте в среде с глю-
козой.
При обычных условиях культивирования суб-
страт (например, глюкоза) одновременно исполь-
зуется и для получения энергии, и для реакций
биосинтеза. При определении Y, т. е. биомассы в
расчете на 1 моль субстрата, расходуемого для по-
лучения энергии (Sc), та часть субстрата, которая
была использована в качестве источника углеро-
да (Sb), т. е. на биосинтез, должна быть вычтена
из общего количества потребленного субстрата
[уравнение (6.22)]. Долю субстрата Sb/S, исполь-
зованную в качестве источника углерода, можно
рассчитать из уравнения (6.23), полученного пу-
тем объединения уравнений (6.22), (6.24) и (6.25).
S = Sc + SB (6.22)
Sb/S = 1/[1 + 24a/(n • YAtp)] (6.23)
N = 24 - a - SB (6.24)
N/Sc = h-YAtp (6-25)
Уравнение (6.24) показывает, что образовавшая-
ся биомасса (N) равна удвоенной массе углерода
(мол. масса 12 г/моль) использованного субстра-
та, поскольку углерод составляет половину сухо-
го вещества клеток. Количество атомов углеро-
да в субстрате обозначено как а. Уравнение (6.25)
получено путем объединения уравнений (6.20) и
(6.21) и замены величины dN/dSc на N/Sc.
Согласно уравнению (6.23), доля субстрата,
использованная в качестве источника углерода
(Sb/S), по существу является функцией выхода
АТР (п), поскольку величины а/Yatp пример-
но одинаковы при потреблении, например, глю-
козы, малата, лактата или ацетата в качестве
источника углерода. Зависимость Sb/S изобра-
жена графически как функция п при величине
а/Удтр = 0,6 моль АТР/г клеток на рис. 6.9. Эта
Глава 6. Рост и питание 141
Рис. 6.9. Доля субстрата, использованная в качестве
источника углерода (Sb/S), в зависимости от выхода
АТР в катаболических процессах. Субстрат расходуется
и по пути катаболизма, и на реакции биосинтеза. Кривая
построена по уравнению (6.23) для а/Удтр = 0,6 моль
АТР/г клеток.
величина соответствует значению Yatp, равно-
му 10 г биомассы/моль АТР, которое характер-
но для роста многих бактерий в среде с глюкозой
при периодическом культивировании. Как видно
из рис. 6.9, при образовании 2 (30) моль АТР па
моль субстрата в катаболических реакциях бак-
терии используют в качестве источника углерода
12% (70%) субстрата. Эти два значения соответ-
ствуют двум основным типам метаболизма глюко-
зы: 1) молочнокислому или спиртовому брожению
(2 моль АТР) и 2) полному окислению глюкозы до
СО2 (30 моль АТР).
6.8.4. Трата энергии на поддержание
Значения Yatp, вычисленные по уравнению (6.21)
для известной величины п и измеренного в
периодической культуре выхода биомассы, оказы-
ваются значительно ниже значений Yatp, рассчи-
танных теоретически на основе анализа биосинте-
тических реакций (см. гл. 7). Наблюдаемое рас-
хождение в значениях объясняют, как правило,
тратой энергии на поддержание, т. е. потребле-
нием АТР или энергетических эквивалентов АТР
в процессах, не связанных с ростом клеток. Пред-
положительно доля эквивалентов АТР, расходу-
емая на поддержание, тем меньше, чем выше
скорость роста. Эта гипотеза проверена экспери-
ментально на непрерывной культуре. Измерение
величины Y при возрастающей скорости роста по-
казывает обычно линейную зависимость между
1/Y и 1/д (рис. 6.10). Такую зависимость можно
объяснить, основываясь на двух следующих пред-
положениях.
1. Часть катаболизируемого субстрата Sc ис-
пользуется на поддержание (Sm), остальное
количество (Se) — на обеспечение эндергони-
ческих реакций биосинтеза [уравнение (6.26)].
Дифференцированием уравнения (6.26) полу-
чаем уравнение (6.27).
Sc = SE + SM (6.26)
dSc _ dSE dSM
dt dt + dt ( ‘ J
2. Скорость потребления доли субстрата, со-
ставляющей Sm, пропорциональна плотности
культуры:
= т8 N (6.28)
dt
Величину ms называют коэффициентом под-
держания. Подстановкой уравнений (6.1) и
(6.20) в уравнение (6.27) можно получить
уравнение Перта (6.29), где Ymax — это коли-
чество образовавшихся клеток в расчете на
моль потребленного субстрата Se:
1/Y = 1/Ymax 4- шй/д (6.29)
Согласно уравнению (6.29), зависимость меж-
ду 1/Y и 1/д линейная, и это подтверждают
экспериментальные данные (рис. 6.10). Мак-
симальный экономический коэффициент, вы-
численный с учетом траты энергии на под-
держание, Ymax, определяют путем экстрапо-
ляции измеренных значений Y на бесконечно
большое значение д (1/д = 0). В отдельных
экспериментах определенная таким образом
величина Ymax оказалась близка к значениям,
рассчитанным по уравнению (6.21) с использо-
ванием известного значения п и теоретически
вычисленной из биосинтетических потребно-
стей клеток величины Yatp- Наклон прямой
(tg угла; ms) на рис. 6.10 характеризует коли-
чество катаболизируемого субстрата, исполь-
зуемое на поддержание, в расчете на единицу
времени и массы клеток, т. е. коэффициент
поддержания. Количество АТР, необходимое
клеткам для той же цели, обозначают гпатр
(табл. 6.4). К сожалению, каких-либо других,
независимых методов измерения ms, с помо-
щью которых можно было бы подтвердить
142 Часть II. Основы жизнедеятельности микробных клеток
правомерность предположений, лежащих в ос-
нове уравнения Перта, не имеется. Некоторые
экспериментально полученные для различных
бактерий значения коэффициента поддержа-
ния приведены в табл. 6.4.
Рис. 6.10. Зависимость экономического коэффициента
Y от скорости разбавления D в гипотетическом экспе-
рименте с использованием хемостата. Точки получены
на основании экспериментально измеренных величин N
и Sc. См. уравнение Перта (6.29).
Таблица 6.4. Величина коэффициента поддержания у различных бактерий
Вид Условия культивирования ms. мкмоль субстрата- (г сух. в-ва клеток)-1-ч-1 тАТР> мкмоль АТР- (г сух. в-ва клеток)-1-ч—1
Escherichia coli Глюкоза; аэробные условия 0,2-0,4 4,0-8,0
Escherichia coli Глюкоза; брожение 2,3 6,9
Paracoccus denitrificans Глюкоза; аэробные условия 0,08 2,7
Pseudomonas fiuorescens Ацетат; аэробные условия 0,25-0,6 2,5-6,3
Klebsiella aerogenes Глюкоза; аэробные условия 0,35 6,9
Desulfovibrio vulgaris Этанол + сульфат 4,3 4,3
Nitrosomonas europaea Аммиак + Ог 1,5 1,5
Desulfobulbus propionicus Этанол + сульфат 0,9 0,9
Propionigenium modestum Сукцинат; брожение 0,87 0,29
6.8.5. Количественное определение ферментов
по величинам ц и Y
Ферменты катаболизма □ Скорость потребле-
ния катаболического субстрата dSc/dt в экспонен-
циально растущей культуре связана с д и Y сле-
дующей зависимостью:
dSc/dt = (д/Y) - N (6.30)
Соотношение д/Y, называемое метаболическим
коэффициентом, отражает скорость потребле-
ния субстрата бактериями, которая пропорцио-
нальна специфической активности ферментов его
катаболизма. Сравнение активности ферментов,
вычисленной на основе метаболического коэффи-
циента, с экспериментально измеренной активно-
стью позволяет выяснить путь катаболизирова-
ния субстрата у исследуемой бактерии. Предпо-
ложим, что реальные активности ферментов в
клетках близки к Vmax; тогда активность фер-
мента А (моль субстрата, потребленного за еди-
ницу времени) в расчете на 1 г сухого вещества
клеток (N) равна д/Y (имеет ту же размерность,
что и A/N):
А д
N ~ Y
Если известно число оборотов фермента Т
(т. е. количество, моль, субстрата, превращенное в
продукт за единицу времени), можно определить
молярную концентрацию фермента Е в расчете на
1 г биомассы:
Vmax = E-T (6.32)
Активности ферментов [величины Vmax, измерен-
ные в клеточных гомогенатах; уравнения (6.31) и
(6.32)] должны превышать рассчитанные по урав-
нению (6.30), поскольку маловероятно, что в рас-
тущих клетках ферменты функционируют при
насыщающих концентрациях субстратов.
Ферменты анаболизма □ Скорость синте-
за клеточного компонента С (dC/dt) в экспонен-
циально растущей культуре можно вычислить,
зная // и содержание этого компонента в клетках
(моль/ г биомассы):
£ = М-С (6.33)
Глава 6. Рост и питание 143
Это уравнение, полученное путем замены N на
С в уравнении (6.1) (при допущении, что со-
став клеток бактерий неизменен во время роста),
можно использовать для вычисления специфиче-
ских активностей ферментов биосинтеза. Сравне-
ние рассчитанной таким образом активности с из-
меренной экспериментально (в гомогенатах кле-
ток) может быть полезным подходом для выясне-
ния путей биосинтеза, функционирующих у той
или иной бактерии.
6.8.6. Полунепрерывное культивирование
Этот способ культивирования, называемый так-
же периодическим культивированием с под-
питкой, состоит в том, что в периодическую
культуру непрерывно добавляют основной пита-
тельный субстрат, экспоненциально увеличивая
скорость его подачи. Таким путем удлиняют экс-
поненциальную фазу роста, чтобы можно было
периодически отбирать часть культуры для ее ис-
пользования. Полунепрерывное культивирование
применяют, например, в тех случаях, когда суб-
страт в высоких концентрациях токсичен. При та-
ком способе удается получать больший урожай
клеток или выход продукта, чем при обычном
периодическом культивировании, и для этого не
требуется много дополнительного оборудования.
Таким образом, обеспечивая культуру основны-
ми питательными веществами в возрастающем ко-
личестве соответственно ростовым потребностям
микроорганизма, но не создавая их избытка, в
периодической культуре удается достичь очень
высокой плотности клеток (до 150 г сухого
вещества биомассы/л). Если биомассу необходи-
мо использовать в качестве биокатализатора, ее
можно возвращать в культиватор после отделе-
ния от среды (обратная связь через биомас-
су). Когда исследователей интересует продукт,
а не клетки, полезным методом может служить
диализное культивирование, при котором
культура, находящаяся в специальном сосуде,
сообщается через диализную мембрану с рецир-
кулирующей средой, из которой постоянно удаля-
ются продукты обмена. Мембрана легко проница-
ема для питательных веществ и продуктов обме-
на, но не для клеток. К преимуществам диализной
культуры относятся: 1) возможность достижения
очень высокой плотности клеток; 2) ослабление
ингибирования продуктом и отделение метаболи-
тов от клеток; 3) возможность изучения чистых
культур в природных средах и 4) возможность
изучения взаимодействия между двумя чистыми
культурами.
6.9. Методы консервирования основаны на подавлении микробного роста
Физические факторы □ Любой фактор, вли-
яющий на скорость роста бактерий, при его экс-
тремальном уровне оказывает ингибирующее дей-
ствие (исключение составляет случай экстремо-
филов, способных выживать в таких условиях).
На практике подобного рода воздействия позво-
ляют консервировать любые органические мате-
риалы, например продукты питания, и предотвра-
щать их порчу патогенными, гнилостными или
токсинобразующими микроорганизмами. Физиче-
ские методы обработки включают прогревание
или замораживание, подкисление, высушивание,
засолку или добавление большого количества са-
хара для понижения доступности воды. Небла-
гоприятный эффект экстремальных температур,
значений pH или осмолярности повышается при
удалении из среды кислорода. На применении
этих факторов основаны традиционные методы
консервирования продуктов питания. Относящи-
еся к ним фильтрование и обработка ионизирую-
щим излучением описаны выше в разд. 6.4.
Химическая обработка □ В качестве ин-
гибиторов роста микроорганизмов могут приме-
няться некоторые безопасные для человека хими-
ческие вещества в низких концентрациях. Напри-
мер, при добавлении газообразного SO2 в воду
образуется сернистая кислота (H2SO3; pKi = 2;
рКо = 7), которая в протонированной форме
144 Часть II. Основы жизнедеятельности микробных клеток
проникает через клеточную мембрану и как вос-
становитель (окисляясь до H2SO4) расщепляет
—S—S-связи с образованием — S—SO3 + HS~. Это
позволяет использовать SO2 для консервирова-
ния кислых продуктов, таких как вино или су-
хие фрукты, если их pH 3,5-4. Бактериаль-
ный рост может быть предотвращен добавлени-
ем слабых органических кислот или их обра-
зованием микробами in situ, если значение pH
среды поддерживается на низком уровне. Послед-
нее необходимо для того, чтобы кислоты преиму-
щественно находились в протонированной форме,
способной проникать сквозь клеточную мембра-
ну (АН; см. разд. 6.2.1). В качестве таких инги-
биторов используют молочную, муравьиную, про-
пионовую, лимонную, виннокаменную, бензойную
и сорбиновую кислоты. Эфиры бензойной кис-
лоты легко проникают через мембрану при ней-
тральном pH и внутри клеток расщепляются эс-
теразами. Благодаря этому они используются как
добавки для консервирования продуктов пита-
ния, имеющих нейтральную или щелочную ре-
акцию. Если не исключен доступ воздуха, кон-
сервируемые кислотами продукты могут портить-
ся под действием дрожжей и грибов. Этиловый
спирт при высоком содержании также предот-
вращает микробный рост. Такие обладающие ан-
тимикробным действием соединения, как фено-
лы, метилфенолы (крезолы), альдегиды и другие,
менее безопасные соединения, содержащие в ды-
ме, воздействуют на пищевые продукты при коп-
чении.
Антимикробные агенты, более сильнодейству-
ющие по сравнению с теми, которые используются
для консервирования, находят применение в дру-
гих областях. К таким ингибиторам относятся со-
ли тяжелых металлов (например, сулема HgCh),
хлорноватистая кислота (НОС1), бром, иод, детер-
генты (мыло) и органические растворители, а так-
же разнообразные синтетические и природные ан-
тибиотики.
Дополнительная литература
Atlas R. М. (1993) Handbook of microbiological media.
Boca Raton: CRC Press.
DemainA.L., SolomanN.A. (eds.) (1986) Manual of
industrial microbiology. Washington, DC: American
Society for Microbiology.
Gerhardt R., Murray R. G. E., Wood W. A., Krieg N. R.
(eds.) (1994) Methods for general and molecular
bacteriology. Washington, DC: American Society for
Microbiology.
Harder W., Dijkhuizen L. (1983) Physiological responses
to nutrient limitation. Annu. Rev. Microbiol. 37:
1-23.
KirsopB. E., Doyle A. (1991) Maintenance of microor-
ganisms and cultured cells, 2nd edn. New York,
London: Academic Press.
Krieg N.R., Holt J. G. (eds.) (1989) Bergey’s manual of
systematic bacteriology, vol. 1. Baltimore: Williams
& Wilkins.
Monod J. (1949) The growth of bacterial cultures. Annu.
Rev. Microbiol. 3: 371-394.
Neidhardt F. C., Ingraham J. L, Schaechter M. (1990)
Physiology of the bacterial cell. Sunderland: Sinauer
Associates.
Neidhardt F. C., Curtiss R., Ingraham J.L., Lin E. C.C.,
LowK.B., MagasanikB., ReznikoffW., Riley M.,
Schaechter M., Umbarger H. E. (eds.) (1996) Esche-
richia coli and Salmonella: cellular and molecular
biology. 2nd edn. Washington, DC: ASM Press.
PirtS.J. (1975) Principles of microbe and cell
cultivation. New York: Wiley.
Veldkamp H. (1976) Continuous culture in microbial
physiology and ecology. Durham: Meadowfield Press.
White D. (1995) The physiology and biochemistry of pro-
karyotes. Oxford: Oxford University Press.
Источник рисунка
1. Ingram .I. L., Marr A. G. (1996) Effect of tempera-
ture, pressure, pH, and osmotic stress on growth.
In F. C. Neidhardt et al. eds. (1996) Escherichia
coli and Salmonella: Cellular and molecular biology,
vol. 2, 2nd edn. Washington, DC: ASM Press.
Глава 7
Биосинтез клеточных строительных блоков
В этой главе описаны функционирующие у про-
кариот механизмы синтеза клеточных строитель-
ных блоков, или малых молекул (например, ами-
нокислот), из которых далее синтезируются все
клеточные компоненты — растворимые соедине-
ния, макромолекулы и сложные структуры, по-
строенные из различных макромолекул. Наибо-
лее важные конечные продукты метаболизма —
это белки, РНК, ДНК, пептидогликан клеточной
стенки, запасные вещества и мембранные липиды
(96% сухого вещества клеток). Последовательные
стадии их биосинтеза из питательных субстратов
показаны на рис. 7.1.
Синтез макромолекул и комплексных струк-
тур, включающий активацию строительных бло-
ков, их полимеризацию и процессы сборки, описан
в других главах. Строительные блоки необходи-
мы и для таких процессов, как обновление (обо-
рот) клеточных компонентов, например пептидо-
гликана клеточной стенки, репарация поврежде-
ний, например ДНК, и адаптация к изменениям
окружающей среды, основанных на сложном, по-
ка не вполне понятном во многих случаях сочета-
нии реакций биосинтеза и деградации.
Большая часть информации, приведенной
в этой главе, относится к бактериям кишеч-
ной группы — Escherichia coli и Salmonella
typhimurium (Proteobacteria). О биосинтетиче-
ских путях, функционирующих у других групп
прокариот, сведений пока гораздо меньше, но
можно предполагать, что рассматриваемые
процессы протекают у них сходным образом.
В то же время очевидно, что чем дальше та
или иная группа прокариот (например, ар-
хеи) отстоит в систематическом отношении от
Proteobacteria, тем более вероятны у ее пред-
ставителей отклонения от описанных здесь
путей биосинтеза, а также иные клеточные ком-
поненты и их предшественники. Однако ре-
акции синтеза аминокислот и нуклеотидов —
мономеров для образования белков и нуклеи-
новых кислот — весьма сходны у всех живых
организмов; это принцип биохимического един-
ства жизни. В то же время структура и пути био-
синтеза других компонентов клетки (например,
веществ клеточной стенки, липидов или полиса-
харидов) обнаруживают значительное разнооб-
разие.
7.1. Молекулярный состав клеток прокариот соответствует
сложности их организации
Вначале необходимо расск отреть некоторые об-
щие сведения, имеющие отношение к процессам
биосинтеза в прокариотической клетке.
Белки составляют примерно половину
общего количества сухого вещества кле-
ток □ Как оценить количество «строительных
блоков», необходимое для образования 1 г кле-
ток? Лучше всего биосинтетические потребности
микробных клеток иллюстрирует их молекуляр-
ный состав (табл. 7.1). Примерно половину сухого
вещества клеток составляет белок и 1/5 часть —
нуклеиновые кислоты, причем количество ста-
бильной РНК (рРНК и тРНК) значительно пре-
вышает содержание ДНК. Примерно 50% всего
количества РНК приходится на 23S-pPHK, 27%—
на 16S-pPHK, 2% —на 5S-pPHK, 15% — на более
чем 60 видов тРНК и 4% — на мРНК, транскри-
бируемую приблизительно с 1000 оперонов и 4000
генов. В табл. 7.1 приведены также основные
строительные блоки (их количество достигает
70-100), из которых образуются клеточные мак-
ромолекулы.
146 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.1. Последовательные стадии синтеза нового клеточного материала (на примере белков) из экзогенных суб-
стратов у прокариот. Схема справедлива также и для эукариотических клеток. В качестве примера приведены стан-
дартные субстраты — глюкоза, аммоний, фосфат и сульфат. H4F — тетра гидрофолат; Glu — глутамат; Gin — глута-
мин; Cys — цистеин.
Состав микробных клеток в некоторой степени
варьирует в зависимости от скорости роста, по-
скольку вместе с ней увеличивается относитель-
ное количество клеточных молекул и структур,
участвующих в синтезе белка (белок-синтезирую-
щий аппарат может составлять до 50% сухого ве-
щества клеток). Так, содержание в клетках РНК,
из которой на 50% состоят рибосомы, варьиру-
ет от нескольких процентов в медленнорастущих
клетках до почти 20% в быстрорастущих клет-
ках. Различия в составе микробных клеток связа-
ны также с тем, что у грамположительных бакте-
рий клеточная стенка имеет значительную толщи-
ну и содержит много слоев пептидогликана, тогда
как у грамотрицательных она состоит из одного
слоя пептидогликана плюс наружной мембраны,
покрытой слоем липополисахаридов.
Клеточные строительные блоки синте-
зируются из основных метаболитов-пред-
шественников □ Какая доля генов связана с
процессами биосинтеза? Это можно установить,
поскольку известны все гены Е. coli и пример-
но для половины из них продукты. Синтез ма-
лых молекул — строительных блоков для син-
теза полимеров и кофакторов — связан с активно-
стью примерно 1/5 части всех клеточных генов.
Это предполагает, что центральные интермеди-
аты метаболизма, из которых построены блоки,
синтезируются независимо от них как продукты
центрального метаболизма. Интермедиаты цен-
тральных метаболических путей, из которых син-
тезируются строительные блоки, называют цен-
тральными, или основными, метаболитами-
предшественниками.
Клетки предпочтительно используют го-
товые строительные блоки □ Если строи-
тельные блоки присутствуют в среде, клетки, как
правило, используют для синтеза макромолекул
эти готовые элементы при условии, что способ-
ны их поглощать (см. разд. 7.4). В этом случае,
т. с. при ассимиляции готовых строительных бло-
ков, их синтез или синтез основных метаболитов-
предшественников из простых субстратов может
быть подавлен.
Многие бактерии не способны синтезировать
все необходимые строительные блоки, т. е. явля-
ются ауксотрофами по тем или иным соедине-
ниям (например, аминокислотам, ненасыщенным
жирным кислотам, пуринам или предшественни-
кам кофакторов). Такие соединения, называемые
факторами роста, могут присутствовать в среде
обитания; в лабораторных условиях их добавляют
в питательную среду, например в виде дрожжево-
го экстракта, белкового гидролизата, сыворотки
крови или комплекса витаминов.
Глава 7. Биосинтез клеточных строительных блоков 147
Таблица 7.1. Состав прокариотической клетки (на примере грамотрицательной бактерии Escherichia coli)
Компоненты, % сухого веще- ства клеток Количество строительных блоков, необхо- димое для синтеза 1 г клеток, мкмоль Число строи- тельных бло- ков, необходи- мое для син- теза одной молекулы Строительные блоки
Макромоле- кулы (~96% сухого веще- ства клеток) Белки (50-60%) 5000 — 20 различных L-аминокислот в активированной форме (в виде аминоацил-тРНК); редкие ами- нокислоты: Tip, Lys, His
РНК (10-20%) 300-600 — 4 различных нуклеозидтрифос- фата (АТР, GTP, СТР, UTP)
ДНК (-3%) 100 4 различных 2'-дезоксинуклео- зидтрифосфата (dATP, dGTP, DCTP, dTTP); А и T, G и С, пу- рины и пиримидины содержатся в равных количествах
Липиды (~10%) 130 1 Глицерол-З-фосфат в активиро- ванной форме (в виде CDP-ди- ацилглицерола)
260 2 Жирные кислоты (например, С1б:0, С1;18Д9, Сщлдп), свя- занные с ацилпереносящим белком
130 1 Полярные головки (например, этаноламин, глицерол, L-серин, фосфатидилглицерол)
Муреин (3-10%) 30-60 1 UDP-N-ацетилглюкозамин Гликан
1 UDP-N-ацетилмурамовая кислота
90-180 3 Активированные АТР D- и L-аминокислоты (например, L-аланин, D-глутамат и мезо- диаминопимелиновая кислота) Пептид
1 Di-D-аланин, активированный АТР
Липополисаха- риды (~3-4%) 16 2 UDP-N-ацетилглюкозамин Липид А
48 6 Жирные кислоты, связанные с ацилпереносящим белком (на- пример, 14:0, R-3-OH 14:0, 16:0)
24 1-2 CDP-этаноламин
24 3 СМР-2-дезокси-0-маннооктоно- вая кислота (активированная форма кетодезоксиоктоновой кислоты) Остов
148 Часть II. Основы жизнедеятельности микробных клеток
Таблица 7.1 (продолжение)
Компоненты, % сухого веще- ства клеток Количество строительных блоков, необхо- димое для синтеза 1 г клеток, мкмоль Число строи- тельных бло- ков, необходи- мое для син- теза одной молекулы Строительные блоки
24 3 ADP-гептоза
32 4 UDP-гексозы (например, глюкоза, галактоза)
100-200 ~40 Нуклеотид-сахара (повторяющи- еся единицы из 3-5 моносахари- дов) О-специ- фическая боковая цепь
Гликоген (2,5-25%) 150-1500 — ADP-глюкоза
Растворимые соединения (~4% сухого вещества клеток) Полиамины 60 — Основные аминокислоты
Свободные ко- ферменты, ко- факторы и переносчики электронов NAD, NADP, CoA, пиридоксаль- фосфат, тетрагидрофолат, уби- хинон и менахинон, ундекапре- нол, тиорсдоксин, глутаредоксин, глутатион
Простетические группы FAD, FMN, биотин, гемы и пор- фирины, липоевая кислота, тиа- минпирофосфат, молибдоптерин, кобаламин
Осмопротекторы Например, бетаин
Пул интермеди- атов Промежуточные продукты рас- щепления субстратов, централь- ных путей метаболизма и процес- сов биосинтеза
Пул раствори- мых строитель- ных блоков Например, аминокислоты
Неорганические ионы Na+, К+, Mg2+, Са2+, Мп2+, С!", Pj, PPi-
Наконец, многие бактерии, обитающие в бо-
гатых органическими веществами средах, таких
как кровь, молоко, гниющие растительные остат-
ки, соки или содержимое кишечного тракта жи-
вотных, обладают лишь существенно неполным
биосинтетическим потенциалом. Это особенно ха-
рактерно для симбиотических прокариот и об-
лигатно паразитических форм. В то же вре-
мя прокариоты-симбионты часто обеспечивают
организм-хозяин незаменимыми аминокислотами
(например, триптофаном) или витаминами, кото-
рые он не способен синтезировать и не получает
с кормом, поскольку многие организмы-хозяева,
в частности насекомые, представляют собой узко-
специализированные в отношении питания орга-
низмы.
Глава 7. Биосинтез клеточных строительных блоков 149
7.2. Основные метаболиты-предшественники — это немногочисленные
интермедиаты центральных путей метаболизма
К основным метаболитам-предшественникам от-
носятся двенадцать соединений, по существу од-
них и тех же у всех живых организмов. Они обра-
зуются как промежуточные продукты в трех важ-
нейших путях обмена — цикле трикарбоновых
кислот, гликолизе (или сходных путях разложе-
ния сахаров)/глюконеогенезе и пентозофос-
фатном цикле. Первые два пути рассмотрены
в гл. 3, пентозофосфатпый цикл —в разд. 7.7.1.
Дополнение 7.1. Несмотря на несомнен-
ное сходство биосинтетических процессов у
разных организмов, участвующие в них фер-
менты могут существенно различаться да-
же для одной и той же реакции. Такие
ферменты различных организмов представ-
ляют собой изоферменты — продукты дивер-
гентной эволюции. Однако известны приме-
ры и конвергентной эволюции, такие как
различные типы фруктозобисфосфат-альдо-
лаз, глицеральдегид-3-фосфатдегидрогеназ и
глутаминсиптетаз. В одной клетке, как пра-
вило, синтез каждого изофермента регули-
руется отдельно. Механизмы регуляции фер-
ментов биосинтетических путей варьируют в
зависимости от вида бактерий. Кроме того,
варьируют функциональная и структурная
организация соответствующих генов, а так-
же способы их регуляции. Ферменты прока-
риот чаще всего представляют собой неболь-
шие индивидуальные белки, в то время как
для эукариот более характерны ферменты
в виде крупных полифункциональных бел-
ков. Многие ферменты построены из функ-
циональных доменов, или модулей, которые
в процессе эволюции комбинировались неза-
висимым образом с образованием различных
ферментов.1
Центральные метаболические пути вы-
полняют двойную функцию □ На рис. 7.2
представлены структурные формулы основных
метаболитов-предшественников и их количество,
расходуемое на синтез такого количества строи-
тельных блоков, которое необходимо для обра-
1 См. прим, в гл. 29 (вед. ред.).
зовапия 1 г биомассы. Прокариоты могут также
ассимилировать в качестве субстратов готовые
строительные блоки, синтезированные другими
организмами, чаще всего растениями. Поглоща-
емые микроорганизмами органические субстраты
расщепляются с образованием тех или иных мета-
болитов-предшественников, и таким образом пу-
ти деградации сопряжены с путями биосинтеза.
Реакции разложения органических субстратов, с
одной стороны, обеспечивают клетку энергией и,
с другой стороны, служат источником образова-
ния всех молекул-предшественников для процес-
сов биосинтеза. Организмы, получающие энергию
путем окисления неорганических веществ и ис-
пользующие в качестве единственного источни-
ка углерода СО2 или одноуглеродные (Ci) со-
единения, образуют из этих субстратов те же
метаболиты-предшественники. Пути биосинтеза
клеточных строительных блоков в основном сход-
ны у всех живых организмов, хотя имеются неко-
торые важные исключения. Это сходство путей
биосинтеза разительно контрастирует с чрезвы-
чайным разнообразием путей деградации органи-
ческих субстратов.
Как правило, молекулы субстратов расщеп-
ляются в клетке с образованием основных ме-
таболитов-предшественников, и таким обра-
зом реакции деградации сопряжены с реакциями
биосинтеза. Все пути катаболизма выполняют две
функции: обеспечения клетки энергией и снабже-
ния ее необходимыми для процессов биосинтеза
молекулами-предшественниками.
Центральные метаболиты- предшествен-
ники, такие как ацетил-СоА, пируват, оксалоаце-
тат, 2-оксоглутарат, фосфое? ta/ширу ват (ФЕП),
гексозофосфаты и некоторые другие соединения,
служат исходным материалов для синтеза при-
мерно 70-100 клеточных строительных блоков
(рис. 7.2). Число клеточных низкомолекулярных
соединений вместе с другими растворимыми ве-
п1 сствами, например коферментами и полиамина-
ми, приближается к 150. Необходимое для роста
бактерий количество строительных блоков ука-
150 Часть II. Основы жизнедеятельности микробных клеток
нс=о
неон
неон
неон
сн2о(р)
Рибозо-5-
фосфат —
нс=о
।
неон
I
неон
СН2О®
Эритрозо-4-
фосфат
нс=о
I
неон
носн
,__ неон
неон
СН2О(р)
Глюкозо-6-фосфат
сн2он
с=о
; носн
I неон
J »
I неон
.: сн2о®
Фруктозо-6-фосфат
неон
СН2О©
Триозофосфат
ADP-глюкоза
NOP- сахара
мио-Инозитол
UDP-N-ацетИ-.
лглюкозамин
UDF N-ацетил-
мур_мовая
кислота
UDP-
глюкозамин
js. Глицерол-
----(X* 3-фосфат
Рис. 7.2. Синтез строительных блоков
из основных промежуточных про-
дуктов углеродного метаболизма.
Указано количество предшествен-
ников (ммоль) в расчете на 1г
прироста биомассы. ЦТК — цикл
трикарбоновых кислот; ЭМП—путь
Эмбдена-Мейергофа-Парнаса; ПФЦ
— пентозофосфатный цикл; КАФ—
карбамоилфосфат; Пир — пируват;
КДО — кетодезоксиоктоновая кис-
лота в составе липополисахаридов;
NDP — нуклеозиддифосфат; ФРПФ—
5-фосфорибозил-1-пирофосфат; Ci —
Ci-фрагменты, связанные с тетрагид-
рофолатом.
соон
I
неон
Этанол амин
Холин
СООН
Глава 7. Биосинтез клеточных строительных блоков 151
зано в табл. 7.1. Наиболее важные строитель-
ные блоки — это L-аминокислоты (мономеры в
составе белков), нуклеотиды (мономеры для
синтеза нуклеиновых кислот), активированные
сахара (необходимые для синтеза компонентов
клеточной стенки и других структур), а также
жирные кислоты (или изопреноидные спирты у
архей) в качестве компонентов липидов. Потреб-
ность в других строительных блоках варьирует
в зависимости от вида бактерий. Так, грамотри-
цательным бактериям (например, Е. coli) требу-
ется значительное количество предшественников
липополисахаридов для синтеза клеточной стен-
ки, тогда как грамположительным бактериям для
той же цели необходимо больше предшественни-
ков пептидогликана.
Для биосинтетических реакций требу-
ются аммонийный азот, фосфат и серусо-
держащие группы, а также одноуглерод-
ные единицы □ Поскольку в процессе разло-
жения от органических субстратов отщепляются
группы, содержащие азот, фосфор или серу, об-
разующиеся метаболиты-предшественники состо-
ят только из углерода, водорода и кислорода
(некоторые из них содержат также фосфатную
группу). В то же время большинство клеточных
молекул содержит N, Р и S, и для синтеза стро-
ительных блоков необходимы источники азота,
фосфора, серы и Сi-единиц. У аэробов в отдель-
ных биосинтетических реакциях участвует, кро-
ме того, молекулярный кислород. И наконец, все
процессы синтеза клеточных компонентов требу-
ют затраты энергии (чаще всего источником ее
служит АТР) и восстановителя (NADPH). Преж-
де чем перейти к описанию процессов синтеза
различных строительных блоков, необходимо рас-
смотреть, каким путем покрываются эти общие
биосинтетические потребности.
Субстратами могут служить простые неорга-
нические соединения и низкомолекулярные или
макромолекулярные органические вещества. Они
поступают в центральные метаболические пути,
которые обеспечивают сопряжение процессов де-
градации с процессами биосинтеза через образо-
вание пула центральных метаболитов-предшест-
венников для синтеза строительных блоков.
Для понимания материала этой и следующих
глав требуется знание химии аминокислот, уг-
леводов, ароматических и гетероциклических со-
единений. Необходимо хорошо представлять себе
различия между отдельными типами связей, на-
пример простой и сложной эфирными связями, а
также гликозидной, ангидридной, амидной и пеп-
тидной связями. Кроме того, необходимо иметь
представление об особенностях и номенклатуре
хи л I ических соединений.
7.3. Механизмы включения азота, фосфора, серы, Ci-фрагментов и
молекулярного кислорода в состав клеточных компонентов
На основе современных знаний о микробном мета-
болизме можно рассчитать количество всех ком-
понентов, необходимых для образования 1 г био-
массы (табл. 7.2). Включение азота, фосфора,
серы и Ci-едипиц в состав клеточных компо-
нентов происходит с участием небольшого чис-
ла центральных соединений, выполняющих роль
переносчиков соответствующих групп (например,
аминогрупп) при синтезе строительных блоков
(например, аминокислот). Далее мы рассмотрим,
как осуществляется «загрузка и разгрузка» таких
метаболитов-переносчиков (не путать с перенос-
чиками веществ через мембрану— пермеазами).
7.3.1. Большинство бактерий способно
использовать несколько источников азота
Для синтеза 1 г биомассы клеток необходимо
приблизительно 140 мг азота. В природе азот
встречается в различных по степени его окисле-
ния формах (далее она указана в скобках), на-
пример в виде NH^ (—3), NO3 (+5), N2 (0),
в составе аминокислот (—3), мочевины (—3),
пуринов (—3) и пиримидинов (—3). Поскольку
степень окисления азота в составе клеточных ком-
понентов (азот аминогрупп и гетероциклов) в
большинстве случаев соответствует степени его
152 Часть II. Основы жизнедеятельности микробных клеток
Таблица 7.2. Количество исходных субстратов для синтеза основных метаболитов-предшественников и необходимых
строительных блоков в расчете на 1 г прироста биомассы. Активация строительных блоков требует дополнитель-
ного расхода АТР. При росте в средах сложного состава (богатые среды, например мясо-пептонных бульон), где
присутствуют практически все строительные блоки, клетки не синтезируют их de novo, что экономит 100%, NADPH
и 85% АТР
Исходные субстраты Количество, ммоль Си нтез и руем ые соединен и я-п редшествен ники
Углеродные скелеты (—40 ммоль С) 14 Основные метаболиты-предшественники, некоторое количество СО 2
NH3 10 Глутамин, глутамат, аспартат, карбамоилфосфат
Фосфат 1 АТР
H2S 0,3 Цистеин
С1 -фрагменты 1.2 С1 -тетрагидрофолат, S-адеиози л метионин
Восстановленные субстраты (восстановители) -19 NADPH
Окисленные субстраты (окислители) -3,5 NAD+
Источник энергии -19 АТР
окисления в аммиаке (—3), при ассимиляции ам-
миака, используемого большинством микроорга-
низмов, не требуется окисления или восстановле-
ния азота, тогда как при использовании нитрата
азот вначале должен быть восстановлен. В резуль-
тате восстановления или гидролиза аммиак пре-
вращается в аммоний (NH3 + Н+ NHJ, рКъ =
9,3), который затем ассимилируется клетками с
участием четырех основных переносчиков амино-
и амидогрупп, в первую очередь глутаминовой
кислоты, глутамина, а также аспарагиновой
кислоты и карбамоилфосфата (рис. 7.3). Та-
ким образом, ассимиляция азота клеткой проис-
ходит в три этапа.
1. Поглощение и восстановление □ Внача-
ле соединение — источник азота должно быть
поглощено клеткой, причем поглощение, на-
пример NHj, — это один из основных энерго-
потребляющих транспортных процессов. Об-
разование аммиака внутри клетки происходит
путем восстановления нитрата или N2 либо
путем гидролиза органических азотсодержа-
щих субстратов.
Рис. 7.3. Ассимиляция азота. Величины в процентах показывают, сколько азота переносит (внутри клетки) каждое
из соединений (например, 80% переносится в виде а-аминогруппы глутамата, обозначенного как Glu-NH2, что-
бы подчеркнуть его участие в переносе NH3). 1 — транспорт источников азота в клетку с использованием энергии
трансмембранного потенциала; 2 — нитратредуктаза; 3 —нитритредуктаза; 4 — глутаминсинтетаза; 5 — глутамат-
дегидрогеназа; б — глутаматсинтаза; 7 — глутаматюксалоацетат-трансаминаза; 8 — карбамоилфосфатсинтаза; 9 —
аминотрансферазы; 10 — амидотрансферазы; 11 — карбамоилтрансферазы; 12 — двухэтапное трансаминирование
с участием аспартата.
Глава 7. Биосинтез клеточных строительных блоков 153
2. «Загрузка» переносчиков азота □ По-
ступление примерно 15% азота в процессы
биосинтеза обеспечивает глутамин (обозна-
чаемый здесь GIn-NH2). Единственный путь
ассимиляции NH^ с участием глутамина —
это глутаминсинтетазная реакция (рис. 7.4).
В ней происходит амидирование 7-карбок-
сильной группы глутамата, требующее затра-
ты АТР для первоначального дегидрирова-
ния ОН-группы при замене ее на NH2-rpynny
и для обеспечения однонаправленности реак-
ции. Глутамин служит непосредственным до-
нором N при синтезе большинства азотистых
компонентов клетки, за исключением содер-
жащих си-аминогруппу аминокислот, при син-
тезе которых он выступает в качестве косвен-
ного донора (см. ниже).
Универсальным донором азота для син-
теза а-ам инокисл от, содержащих примерно
80% клеточного азота, служит глутамино-
вая кислота (обозначаемая здесь GIU-NH2).
Внутриклеточный пул глутаминовой кисло-
ты достигает довольно высокой величины
(>100 мМ; например, при осмоадаптации).
Глутамат может синтезироваться из 3-оксо-
глутаровой кислоты двумя путями; использо-
вание того или иного из них определяется кон-
центрацией NH3 в клетке. В зависимости от
вида микроорганизмы могут обладать одним
или двумя путями синтеза GI11-NH2.
Условия избытка азота □ При высокой
концентрации аммиака (обычно >1 мМ) про-
исходит непосредственное включение NHJ в
оксоглутарат с образованием глутаминовой
кислоты (рис. 7.4). Обратимое аминирование
2-оксоглутарата с образованием 2-иминоглу-
тарата и восстановление этого продукта с уча-
стием NADPH до 2-аминоглутаровой кислоты
(GIU-NH2) катализирует L-глутаматдсгидро-
геназа (в расщеплении аминокислот участ-
вуют ПАВ+-зависимый фермент, функ-
ционирующий в обратном направлении).
У некоторых бактерий эту функцию вместо
глутаматдегидрогеназы выполняет аланинде-
гидрогеназа (пируват 4- NADH + NH^ —> ала-
нин + NAD+ + Н2О); при этом глутамат об-
разуется из 2-оксоглутарата в реакции тран-
саминирования (аланин + 2-оксоглутарат —>
пируват -Ь глутамат). Однако для этих дегид-
рогеназ характерно низкое сродство к NH^
(Ам ~ 5 мМ), и они функционируют только
при его высокой внутриклеточной концентра-
ции, а также при недостатке энергии и источ-
ника углерода.
Условия лимитирования по азоту □ В
большинстве случаев бактерии растут в усло-
виях недостатка азота, при которых глутамат-
дегидрогеназа эффективно не функциониру-
ет. Поэтому при низкой концентрации NH3
(обычно < 0,5 мМ) ассимиляция азота с об-
разованием глутаминовой кислоты происхо-
дит другим путем и в два этапа: вначале в
глутаминсинтетазной реакции образуется глу-
тамин, затем посредством восстановительно-
го аминирования 2-оксоглутарата с участием
глутамина в качестве донора NH3 и HADPH
в качестве восстановителя образуется глута-
миновая кислота (рис. 7.4). В этой последней
реакции действуег индуцируемый при недо-
статке азота фермент глутаматсинтаза, или
глутамин: 2 - оксоглутарат - аминотрансфераза
(ГОГАТ; флавин-содержащий железосерный
белок); уровень глутаминсинтетазы возраста-
ет при снижении концентрации NH3. Асси-
миляция аммония этим путем требует затра-
ты 1 моль ATP/моль NH3, поскольку энергия
необходима для образования Gln-NEb из Glu-
NH2. Преимущество в данных условиях глу-
таминсинтетазного / глутаматсинтазного пути
обеспечивается довольно высоким сродством
глутаминсинтетазы к NH3 (кажущаяся вели-
чина Км <0,5 мМ), а также тем, что эта ре-
акция практически необратима, поскольку яв-
ляется энергопотребляющей. Таким образом,
этот путь функционирует при условии, что
клетки обеспечены энергией, или при сниже-
нии концентрации аммония либо фосфата в
среде.
Существует связь между величиной из-
менения свободной энергии в данной реак-
ции и кинетическими константами ее фер-
мента (константой скорости реакции к и кон-
стантой диссоциации К<\). Следовательно, для
понижения /<d фермент-субстратного ком-
плекса и/или увеличения константы скорости
прямой реакции к может быть использована
энергия гидролиза АТР. Примером этого мо-
жет служить глутамипсинтетаза, которая ха-
рактеризуется значительно более низким зна-
чением Км для NHJ, чем глутаматдегидроге-
наза.
154 Часть II. Основы жизнедеятельности микробных клеток
Ассимиляция азота регулируется в зависи-
мости от типа и количества источника азота
и энергетического состояния клетки (см. гл. 19
и 20).
Далее необходимо рассмотреть реакции с
участием вторичных переносчиков азота —
карбамоилфосфата (КАФ) и аспарагино-
вой кислоты (обозначаемой здесь Asp-i\H2):
азот которых происходит из глутамина или
глутаминовой кислоты. Перенос азота «-ами-
ногруппы глутаминовой кислоты и амидной
группы глутамина на другие соединения про-
исходит следуюптими путями.
3. «Разгрузка» переносчиков азота
(рис. 7.5) □ Перенос «-аминогруппы L-глу-
таминовой кислоты па 2-оксокислоты
(непосредственные предшественники амино-
кислот) осуществляют аминотрансферазы
(трансаминазы). Примером подобной реакции
может служить синтез аспарагиновой кисло-
ты из оксалоацетата (рис. 7.5, А). Большин-
ство клеток содержит несколько трансаминаз,
каждая из которых ответственна за аминиро-
вание определенной группы 2-оксокислот.
В некоторых биосинтетических реакциях до-
нором «-аминогруппы служит аспарагиновая
кислота, от которой — NH2 в два этапа перено-
сится па молекулу акцептора, содержащую оксо-
группу (=С=О) (рис. 7.5, В). Вначале образуется
ковалентная связь между акцептором и аспараги-
новой кислотой. Под действием второго фермента
происходит распад этого интермедиата с высво-
бождением фумарата и продукта реакции в виде
имина (=C=NH; см. синтез L-аргинипа и азоти-
стых оснований). При этом акцепторная карбо-
нильная группа активируется с участием АТР —
для удаления атома кислорода к нему присоеди-
няется легкоуходящая группа в виде АМР.
При биосинтезе большинства азотсодержащих
соединений (пуринов, пиримидинов, триптофа-
на, гистидина и глкжозамин-6-фосфата) доно-
ром амидной группы выступает L-глутамин, от
которого амидотрансферазы (трансамидазы) пе-
реносят на акцептор группу —NH2; при этом
замещаемая группа для ее удаления обычно акти-
вируется АТР (рис. 7.5, Б). Несколько глутамин-
зависимых реакций аминирования происходит без
затраты АТР, поскольку акцептор уже активи-
рован (5-фосфорибозил-1-пирофосфат + Gln-NH2
—> 5-фосфорибозил-1-амип + Glu) или в свя-
зи с тем, что в реакции происходит изомериза-
ция продукта [D-фруктозо-б-фосфат (кетоза) +
GI11-NH2 —> D-глюкозамин-б-фосфат (альдоза) +
Glu]. Отщепляемый от глутамина при глутамин-
зависимых реакциях аминирования NH3 может
Рис. 7.4. Реакции ассимиляции NH3.
Глава 7. Биосинтез клеточных строительных блоков 155
Субстраты
Донор N Акцептор N
Реакция
Продукты
Регенерированный Элиминированный
пре-донор акцептор
Конечные продукты
СООН
I
св-н
I Clu-NH2|
2-Оксокислота
(например, оксалоацетат)
Т рансаминирование
(аминотрансферазы)
СООН
0=св
I
СООН
Н^)-Со-Н
2-Оксоглутарат
а-Аминокислота
^например, аспартат)
сг-МН2-группы
аминокислот
ADP-P ADP+P,
Трансамидирование
(амидотрансферазы)
СН,
ХС
о" он
Глутамат
Азот в составе
пуринов, пиримидинов,
Trp, His, гексозаминов,
карбамоилфосфата,
часто а-НН2-группы
глутамата
СООН
|Asp-NH2|
Трансаминирование
(два фермента, 1 и 2)
СООН
I
с-н
II
н-с
Азот в составе пуринов,
NHj-группа аденина,
азот аргинина
| Фумарат~|
( h2n-r
Перенос карбамоила
(транскарбамоилазы)
Азот в составе
аргинина и
пиримидинов
Рис. 7.5, Типичные реакции переноса аминогруппы. А Переносчик глутамат. Б. Переносчик глутамин. В. Переносчик
аспартат. Г. Переносчик карбамоилфосфат.
быть замещен свободным аммиаком при его не
физиологической, высокой концентрации. Таким
образом, глутамин-зависимые амидотрансферазы
могут также способствовать ассимиляции аммиа-
ка при его большом избытке.
Карбамоилфосфат (КАФ) □ Этот высо-
коэпергетический интермедиат служит непосред-
ственным донором азота при синтезе пирими-
динов и гуанидиновой группы в составе арги-
нина. Образование его происходит с участием
фермента карбамоилфосфатсинтстазы и двух мо-
лекул АТР — по одной для фосфорилирования би-
карбоната и аминирования. Присоединение кар-
бамоильного остатка к аминогруппе аспарта-
та (синтез пиримидинов) или орнитина (синтез
аргинина) осуществляют карбамоилтрансферазы
(рис. 7.5, Г).
Регуляция □ Многие прокариоты способны
использовать, помимо аммиака и/или нитрата,
более двадцати органических азотсодержащих со-
единений в качестве единственного источника азо-
та. Как правило, для их ассимиляции необхо-
дим синтез индуцибсльных ферментов. Предпо-
чтительным источником азота служит NHj, и
рост за счет использования других субстратов
можно считать лимитированным по азоту, по-
скольку высвобождение из них NH3 является ста-
дией, лимитирующей скорость ассимиляции.
Наиболее важная реакция ассимиляции NH3 —
глутаминсинтетазная — тонко регулируется как
на уровне активности фермента (путем ковалент-
ной модификации), так и на уровне синтеза фер-
мента. Главным сигналом об уровне азота служит
соотношение концентраций 2-оксоглутарата (ос-
новного акцептора NH^) и глутамина (основно-
го донора азота в условиях лимитирования по N),
но, кроме того, регуляторный эффект оказывает
также уровень многих азотсодержащих соедине-
ний, образующихся с участием глутамина. Раз-
личные механизмы регуляции синтеза и актив-
156 Часть II. Основы жизнедеятельности микробных клеток
ности глутаминсинтетазы в ответ на изменения
уровня NH4 рассмотрены в разд. 19.3 и 20.4.3.
У многих бактерий активность карбамоилфос-
фатсиптазы ингибируется UMP — первым нуклео-
тидом, образующимся при биосинтезе пиримиди-
нов, в то время как орнитин (предшественник ар-
гинина) и IMP (первый пуриновый нуклеотид в
процессе биосинтеза) оказывают противополож-
ный эффект (см. разд. 19.2.2). Синтез этого фер-
мента кумулятивно подавляют аргинин и пирими-
диновые нуклеотиды, причем в подавлении участ-
вуют один или два фермента (один для аргинина
и один для пиримидинов).
7.3.2. Основным источником фосфора
для микробов служит фосфат
Содержание фосфора в микробной биомассе со-
ставляет примерно 30 мг Р/г клеток. Основные
фосфорсодержащие соединения клетки — это нук-
леиновые кислоты, фосфолипиды и коферменты.
Все они включают фосфор в виде фосфатной
группы; донором-пере носчиком фосфата в
клетке служит АТР.
Фосфор легко окисляется кислородом возду-
ха и в природной среде присутствует главным
образом в форме фосфата. Фосфат служит для
прокариот основным неорганическим источником
фосфора; для его ассимиляции не требуется вос-
становления. Основные органические источники
фосфора для бактерий — это продукты гидролиза
фосфорсодержащих полимеров. Различные фер-
менты катаболизма, расщепляющие моно- или
диэфиры фосфатов и фосфоангидридные связи,
локализованы в периплазматическом простран-
стве. К таким ферментам принадлежат относи-
тельно неспецифичная щелочная фосфатаза и
б'-пуклеотидаза, отщепляющая фосфат от нук-
леотидов.
Многие процессы, протекающие у грамотри-
цательных бактерий в периплазматическом про-
странстве, у других бактерий осуществляются
при участии ферментов (липопротеинов), связан-
ных с наружной стороной плазматической мем-
браны.
Транспорт □ При нейтральном значении pH
фосфат присутствует в растворе в виде ионов
НгРО^ и НРО4- (р/<а = 7). Поглощение их клет-
ками происходит с участием нескольких транс-
портных систем. 1. При высокой концентрации
фосфата (>0,1 мМ) функционирует конститутив-
ная система, обладающая относительно низ-
ким сродством к субстрату, но действующая
с высокой эффективностью (Pit-система, от Р,
transport). Опа использует энергию протондвижу-
щей силы — перепое фосфата через мембрану про-
исходит путем симпорта с Н+, с затратой мень-
шего количества энергии, чем дает гидролиз од-
ной молекулы АТР. 2. При низкой концентрации
фосфата (<10 мкМ) функционирует тонко регу-
лируемая система с высоким сродством к суб-
страту, но низкой эффективностью (Pst-система,
от phosphate-specific transport); синтез ее подав-
ляется при определенном уровне внеклеточного
фосфата. Эта система транспорта зависит от суб-
страт-связывающего белка (ABC-система) и дей-
ствует с использованием энергии гидролиза АТР.
Образование и функция донора-перенос-
чика фосфора (рис. 7.6) □ Переносчиком фос-
фора в клетке служит АТР, выполняющий также
функцию универсального энергетического доно-
ра. Синтез АТР из ADP и Р, происходит либо при
участии АТР-синтазы с использованием энергии
электрохимического протонного потенциала (см.
гл. 4), либо в процессе субстратного фосфорили-
рования (см. гл. 3). Перенос фосфора осуществ-
ляется путем переноса фосфорильной группы.
Рис. 7.6. Ассимиляция фосфора. 1 и 3 — системы по-
глощения органического и неорганического фосфата со-
ответственно; 2 — фосфатазы, отщепляющие Р, от ор-
ганических фосфатов; 4 — образование АТР из ADP
при субстратном или электронтранспортном фосфори-
лировании; 5 — перенос фосфорильной или пирофосфо-
рильной группы; 6 — пирофосфатаза; 7 — аденилаткина-
за. Обратите внимание, что АТР используется также
для активации карбоновых кислот с образованием ацил-
АМР. сопровождающимся высвобождением РР,.
Глава 7. Биосинтез клеточных строительных блоков 157
Киназы катализируеют перенос 7-фосфо-
рильной группы, РО3 (не фосфатной группы,
НОРО|“) на различные акцепторные группы (на-
пример, —ОН, —NHq, —СООН и др.). Пере-
нос фосфорила от молекулы АТР способствует
протеканию многих реакций, например облегча-
ет удаление гидроксильной группы из молеку-
лы субстрата при аминировании или восстанов-
лении, когда ОН-группа уходит в составе фос-
фата (НОРОз-). Таким образом, АТР служит
также универсальным косубстратом многих реак-
ций, протекание которых затруднено по причинам
механистического характера. В этой главе рас-
сматривается большое число реакций такого ти-
па, где АТР выполняет и термодинамическую, и
механистическую функции.
Регуляция □ Рост бактерий во многих при-
родных местообитаниях лимитирован дефицитом
фосфата вследствие низкой растворимости его
солей — AIPO4, FePChj и СаНРС>4. Ассимиляция
фосфата у большинства прокариот тонко ре-
гулируется (см. разд. 20.1.1). Гены, экспрессия
которых зависит от концентрации фосфата, вхо-
дят в модул он pho, частью которого является ре-
гулон pho (см. гл. 20). Действие модулопа pho
перекрывается с эффектами других клеточных
систем общей регуляции, и в условиях лимити-
рования роста уровнем фосфата он регулирует
индукцию не только системы поглощения с вы-
соким сродством, по и ферментов, гидролизую-
щих органические фосфорсодержащие соедине-
ния. За немногими исключениями, органические
фосфорсодержащие вещества не проникают через
плазматическую мембану, поэтому на поверхно-
сти клетки или в периплазматическом простран-
стве присутствуют специальные ферменты — фос-
фатазы, или эстеразы, отщепляющие от них Pi.
Синтез этих ферментов в присутствии фосфа-
та, как правило, подавлен. Фосфониевые кислоты
(R—РО3Н9; содержат связи С—Р) редко встреча-
ются в живых организмах; они поглощаются клет-
кой с помощью особой транспортной системы и
расщепляются цитоплазматическими «С~Р-лиа-
зами». Многие бактерии в условиях избытка фос-
фора и источника энергии, если рост лимитирован
при этом другими факторами (например, недо-
статком N или Ее), образуют полифосфаты — ре-
зервный источник энергии и фосфора. Расщепле-
ние внутриклеточного пирофосфата (PPi —* 2PJ
осуществляет фермент пирофосфатаза. Некото-
рые анаэробы используют РР, вместо АТР для
фосфорилирования тех или иных субстратов, на-
пример ацетата.
7.3.3. Основным источником серы для бактерий
служит сульфат
Для образования микробной биомассы сера требу-
ется в количестве 3-10 мг на 1 г клеток. Перенос-
чиком серы в клетке служит цистеин (Cys-SH),
из которого сера непосредственно или с участием
других косубстратов включается в большинство
других, если не всех, серу содержащих клеточных
компонентов (рис. 7.7) в виде сульфгидрильной
группы — SH. Степень окисления серы в составе
клеточных компонентов, как и в молекуле серо-
водорода H2S, равна в большинстве случаев —2.
В то же время, поскольку при pH 7 восстанов-
ленные соединения серы легко окисляются на воз-
духе, в природной среде сера присутствует чаще
всего в форме сульфата (SO^-) и других оксосо-
единений (например, тиосульфата ЗгОд-), кото-
рые и служат основными источниками серы для
аэробных микроорганизмов. Сероводород может
выделяться из серусодержащих органических суб-
стратов при их разложении.
Рис. 7.7. Ассимиляция серы. АФС — аденозинфос-
фосульфат; ФАФС — З'-фосфоаденозинфосфосульфат
(см. разд. 8.7); 1 и 2 — транспортные системы для суль-
фата и тиосульфата; 3 — АТР-сульфурилаза; 4 — АФС-
киназа; 5 — ФАФС-сульфотрансфераза (глутатион- или
тиоредоксин-зависимое восстановление); б — сульфит-
редуктаза; 7 — серинтрансацетилаза и О-ацетилсерин-
сульфгидрилазы А и В; 8 —восстановление S-сульфо-
цистеина; 9 — образование эфиров серной кислоты; 10 —
реакции переноса сульфгидрильной группы.
158 Часть II. Основы жизнедеятельности микробных клеток
Транспорт и восстановление до H2S □
Большинство прокариот поглощает SO^"” или
ЗгОз- и восстанавливает их до H2S в процес-
се ассимиляционной сульфатредукции (рис. 7.7).
Перенос сульфата осуществляет высокоаффинная
(1<м = 0,1 мМ), АТР-зависимая ABC-система с
участием субстрат-связывающего белка, сходная
с системой переноса фосфата. Эта транспортная
система переносит также тиосульфат и его ток-
сичный аналог хромат (СгО^-); лишенные данной
системы мутантные штаммы устойчивы к хро-
мату. Кроме того, микроорганизмы могут обла-
дать и транспортной системой с низким срод-
ством. У сульфатредуцирующих бактерий (см.
разд. 12.1.8), использующих сульфат в качестве
конечного акцептора электронов, функциониру-
ют две системы симпорта сульфата и протонов:
одна — при высокой концентрации сульфата в сре-
де (симпорт иона сульфата с двумя Н+), другая
при низкой (симпорт иона сульфата с тремя Н+).
У морских бактерий вместо Н+ в симпорте могут
участвовать ионы Na+.
Анаэробные бактерии-сульфатредукторы вос-
станавливают сульфат до H2S в процессе анаэ-
робного дыхания. Образующийся H2S используют
другие анаэробные бактерии в качестве источника
серы (сероводород проникает в клетку путем диф-
фузии; при высокой концентрации он оказывает
токсическое действие). На границе раздела аэроб-
ной и анаэробной зон в природных местообита-
ниях присутствуют тиосульфат (S2Of ~) и другие
оксиды серы, которые, как и H2S, служат пред-
почтительными серными субстратами для многих
анаэробов. Молекулярная сера (Sg), образующая-
ся при окислении сероводорода кислородом воз-
духа или при микробном окислении, малораство-
рима. Лишь немногие прокариоты способны ис-
пользовать Sg — в качестве акцептора электронов
при анаэробном дыхании.
«Загрузка» переносчика серы □ Серово-
дород— летучее (H2S HS-+ Н+; р/<а = 7) и
высокотоксичное соединение в клетке немедлен-
но улавливается с помощью фермента О-ацетил-
серинсульфгидрилазы, превращаясь в сульфгид-
рильную группу цистеина (рис. 7.8, А). Субстрат
этой реакции О-ацетилсерин, образующийся пу-
тем переноса ацетильной группы от ацетил-СоА
на серин, содержит легкоуходящую ацильную
группу, что обеспечивает включение в него H2S,
даже если этот последний присутствует лишь
в следовом количестве. Аналогичный фермент
Рис. 7.8. Ассимиляция H2S и перенос сульфгидрильной
группы.
А. Ассимиляция H2S: 1 — серинтрансацетилаза; 2—
0-ацетилсеринсульфгидрилаза; 3 — цистеинтиосульфо-
нат-образующий фермент; 4 — тиосульфонат-восстанав-
ливающий фермент.
Б. Перенос сульфгидрильной группы: 5 — цистеин-ад-
дукт-синтаза (например, глутатиона); 6 — цистеин-ад-
дукт-лиаза (см. рис. 7.17).
обеспечивает включение тиосульфата в молекулу
серина с образованием цистеинтиосульфоната, ко-
торый восстанавливается до цистеина и сульфита
(SOg-); сульфит может быть восстановлен далее
до H2S.
Эфиры серной кислоты (R— О—SO3) обра-
зуются, вероятно, при участии активированно-
го сульфата (ФАФС; см. гл. 8). В синтезе
редко встречающихся органических сульфонатов
(R—SO3 ), возможно, участвует сульфит.
Включение серы в клеточные компонен-
ты □ Сера в составе всех остальных серусодер-
жащих соединений (например, метионина, кофер-
мента А, липоевой кислоты, тиаминпирофосфата
или глутатиона) происходит, вероятно, из цистеи-
на (рис. 7.8, Б). Синтез Fe—S-центров, составляю-
щих основной пул серы у большинства прокариот,
пока мало изучен. Кислотолабильная сера в их
составе предположительно происходит из цисте-
ина и включается с участием цистеинилперсуль-
фида (R—S—S~), связанного с ферментом. Обра-
зование селеноцистеина рассмотрено в разд. 8.8.2.
Поглощение сульфата и синтез цистеина
контролируются с?/5-регулоном □ В природе
Глава 7. Биосинтез клеточных строительных блоков 159
сера в основном присутствует в составе органи-
ческих соединений. Большинство прокариот спо-
собно использовать не менее двух источником се-
ры. Для многих бактерий, например для Е. coli,
предпочтительность серусодержащих соединений
убывает в следующем ряду: цистеин или его окис-
ленный дисульфид цистин, H2S (в низкой концен-
трации), HSOJ, S2O|~, SO^“, трипептид глутати-
он и метионин (последний чаще используется как
аминокислота, а не источник серы). Предпочти-
тельное использование связано со сложным меха-
низмом регуляции по типу положительного гене-
тического контроля. Поглощение сульфата и син-
тез цистеина происходят не координированно, по
оба эти процесса контролирует один комплексный
регулон (cys). Образование О-ацетилсерипа инги-
бируется цистеином (по механизму отрицатель-
ной обратной связи), тогда как сам О-ацетилсерин
индуцирует экспрессию ферментов, осуществля-
ющих восстановление сульфата. Необходимость
этой регуляции диктуется тем, что на восстанов-
ление 1 моль сульфата клетке необходимо затра-
тить 3 моль АТР и 4 моль NADPH. В то же время
органические серусодержащие соединения, за ис-
ключением цистеина, индуцируют синтез фермен-
тов, гидролизующих эфиры серной кислоты, т. е.
способствующих высвобождению из них сульфата
(например, сульфогидролаз).
7.3.4. Для синтеза многих соединений
необходимы одноуглеродные единицы
Одноуглеродные (Ci-) фрагменты — это углерод-
ные структурные единицы, отделенные от других
атомов С в молекуле гетероатомами (например,
О, N или S). Они присоединяются в процессе био-
синтеза с помощью С1-переносящих коферментов,
в которых С1-фрагменты соединены с атомом азо-
та или серы. Расщепление этих Ci-содержащих
соединений часто сопряжено с присоединением
С1-фрагмента к соответствующему переносчику.
Переносчиком активированного бикарбоната слу-
жит биотин.
Метильная, метенильная и формильная груп-
пы, связанные с гетероатомами (N, S или О), не
входят в состав основных метаболитов-предшест-
венников, однако присутствуют в молекулах мно-
гих строительных блоков (например, метионина и
пуринов), и для их включения, а также для даль-
нейшего метилирования строительных блоков или
клеточных полимеров необходимы С i-доноры.
«Загрузка» Ci-переносчиков □ Универ-
сальными Cj-переносчиками служат S-аденозил-
метионнн (SAM) и тетрагидрофолиевая кислота
(H4F) либо близкий к ней по строению тетра-
гидроптерин (рис. 7.9). Одноуглеродные фраг-
менты образуются главным образом из серина
в катализируемой серин-гидроксиметилтрансфе-
разой реакции: НОСН2 —CHNH2—СООН + Н2О
НОСН2ОН+ ch2nh2-cooh.~
Переносчиком гидратированного формальде-
гида (НОСН2ОН) выступает тетрагидрофолие-
вая кислота (H4F) в форме метилен-ЩР. Дру-
гой продукт вышеприведенной реакции, глицин,
также может служить дополнительным Ci-до-
нором в реакции, катализируемой глиципде-
карбоксилазой. Метилен-Н4Р далее окисляется
Рис. 7.9. Взаимопревращения одно-
углеродных фрагментов: некоторые
ферменты и коферменты (Ci-nepe-
носчики). Изображена каталитически
наиболее важная часть молекулы ко-
фермента— тетрагидрофолиевой кис-
лоты (H4F); H2F— дигидрофолиевая
кислота; 1 и 2 — серин-гидроксиметил-
трансфераза и глициндекарбоксилаза
либо сходный глицин-расщепляющий
фермент; 3 — метилен-Н4 F-редуктаза;
4 — метилен-Н4Р-дегидрогеназа; 5 —
метенил-Н4Р-циклогидролаза; 6 —
формил-Н4Р-синтетаза; 7 — дигидро-
фол атредуктаза; 8 — метионин-адено-
зилтрансфераза.
160 Часть II. Основы жизнедеятельности микробных клеток
до формил-ЩР либо восстанавливается до метил-
H4F. Многие бактерии в качестве источника
Ci-фрагментов могут использовать формиат,
включая его в метаболизм посредством обра-
тимой ATP-зависимой формилтетрагидрофолат-
синтетазной реакции.
«Разгрузка» Ci-переносчиков (перенос
Ci-фрагментов) □ Вышеперечисленные C1—H4F-
соединения служат Ci-предшественниками, на-
пример при синтезе метионина, пуринов или
N-формилметионина. Метил-ЩР часто высту-
пает также косвенным донором метильных
групп через образование S-аденозилметио-
нина (SAM), катализируемое метионин-адено-
зилтранферазой. При последующем переносе ме-
тильной группы от SAM на молекулу акцептора
SAM превращается в аденозилгомоцистеин.
7.3.5. Большая часть клеточного кислорода
происходит из воды
Реакции биосинтеза в большинстве протекают без
участия молекулярного кислорода. Это становит-
ся понятным, если учесть, что О2 появился в ат-
мосфере в результате возникновения оксигенно-
го фотосинтеза, тогда как основные биосинтети-
ческие пути сформировались за миллиарды лет
до этого. Тем не менее у облигатно аэробных
бактерий Оо участвует в нескольких реакциях
гидроксилирования, а также в реакциях с об-
разованием двойных связей в исходно насы-
щенных соединениях, например в синтезе уби-
хинона, мононенасыщенных жирных кислот у
некоторых бактерий (см. разд. 7.10.2) и полине-
насыщенных жирных кислот.
7.4. Образование строительных блоков из основных
метаболитов-предшественников, полимеризация и сборка
макромолекул происходят с затратой АТР и NADPH
В табл. 7.3 приведено количество АТР и восста-
новителя, необходимое для синтеза основных кле-
точных компонентов в расчете на 1 г клеток ти-
пичной грамотрицательной бактерии при росте в
среде с глюкозой, аммонием, фосфатом и сульфа-
том в качестве основных субстратов.
Таблица 7.3. Затраты энергии и восстановителя на синтез клеточных компонентов (в расчете на 1 г прироста
биомассы Е. coli в аэробных условиях на минимальной среде, содержащей в качестве источников Р, N и S фос-
фат, аммоний и сульфат соответственно и в качестве источника углерода и энергии глюкозу. Расхождение между
теоретически рассчитанным и экспериментально измеренным количествами АТР может быть связано 1) с менее
эффективным, чем предполагается, запасанием энергии, 2) с заниженной оценкой траты энергии на биосинтез и
транспорт и/или 3) с неучтенной тратой энергии на другие связанные с ростом процессы
Клеточный компонент или параметр Необходимое количество АТР, ммоль/г клеток Количество NADPH, необходимое для синтеза строитель- ных блоков, ммоль
для синтеза строитель- ных блоков для активации строи- тельных блоков и поли- меризации
Белки 7,3 29 11,5
РНК 6,5 1,5 0,4
ДНК 1,1 0,3 0,2
Липиды 2,6 0,3 5,3
Липополисахариды 0,5 — 0,6
Пептидогликан 0,3 0,2 0,2
Гликоген 0,2 — —
Всего -19 -32 -19
Транспорт -6
Общее количество АТР, -57
рассчитанное теоретически Общее количество АТР, 72
установленное экспериментально
Глава 7. Биосинтез клеточных строительных блоков 161
7.4.1. Насколько велики затраты АТР и NADPH
Затраты на синтез строительных блоков □
АТР расходуется в основном на синтез белков
и нуклеиновых кислот, NADPH —на синтез бел-
ков и липидов (табл. 7.3). Большинство бактерий
предпочтительно использует готовые строитель-
ные блоки, присутствующие в средах сложного
состава (богатые среды). При этом экономится до
85% АТР (100% = 19 ммоль АТР/г клеток) и до
100% NADPH (100% = 19 ммоль NADPH/r кле-
ток). Кроме того, неиспользованные для синте-
за мономеров метаболиты-предшественники мо-
гут служить субстратами энергетического мета-
болизма.
Дополнение 7.2. АТР выполняет
в биосинтетических реакциях пять
функций: 1) перенос фосфорильной
группы (правильнее говорить о перено-
се именно фосфорильной группы, РОз-,
а не фосфатной группы, НОРО|-) в ки-
назной и фосфатазной реакциях; 2) пе-
ренос пирофосфорильной группы
при синтезе 5-фосфорибозил-1-пирофосфата
ФРПФ), гуанозин-5'-ди фосфата-З'-дифос-
фата (ppGpp), а также фосфоеполпирувата
(ФЕП; с участием ФЕП-синтазы и пируват:
фосфат-дикиназы); 3) перенос нуклео-
тидного остатка (например, АМР) при
активации карбоксильной группы, синтезе
производных аденозинфосфодиэфиров, ак-
тивации сахаров для синтеза полисахаридов,
синтезе фосфолипидов, активации сульфата
или аденилировании ферментов, связанном
с их каталитической функцией или регуля-
цией; в этой реакции используется энергия
гидролиза ее продукта — пирофосфата (PPi).
На рисунках и в таблицах для реакций с
участием АТР приняты обозначения ADP~P,
АМР~РР и АМР~, отражающие различные
пути его использования; фосфорильная и
пирофосфорильная группы обозначаются ~Р
и ~РР; 4) перенос аденилового остатка,
играющий важную роль при образовании
аденозилкобаламина (кофермента В12 и
S-аденозилметионина) и, наконец, 5) при
синтезе гистидина АТР служит донором
С1-фрагментов и азота.
Затраты на полимеризацию □ Полимери-
зация аминокислот с образованием белков — это
основной энергопотребляющий процесс в прока-
риотической клетке. Для синтеза белка необходи-
мо больше энергии, чем для синтеза всех стро-
ительных блоков: в 1 г клеток содержится при-
мерно 0,5 г белка, т. е. 5 ммоль аминокислот. Для
образования амино ацил-тРНК требуется гид-
ролиз двух молекул АТР; связывание одной
аминоацил-тРНК и ее транслокация требуют за-
траты четырех высокоэнергетических нуклеоти-
дов (АТР или GTP). Значительное количество
энергии необходимо для обновления пула мРНК
(время полужизни молекулы мРНК составляет
всего 3 мин, что достаточно для синтеза на ней
примерно 20 копий белка) и ее транспорта.
Общие энергетические потребности клеток мо-
гут быть вдвое выше при росте с использованием
«бедных» субстратов, таких как ацетат и нитрат.
Поэтому для многих прокариот предпочтитель-
ными субстратами служат глюкоза и аммоний.
7.4.2. Регенерация АТР из ADP происходит
путем электронтранспортного или
субстратного фосфорилирования
Образование АТР из ADP происходит в основном
при участии ATP-синтазы в процессе электрон-
транспортного фосфорилирования (см. гл. 4). Оно
протекает с использованием энергии протонного
градиента, который образуется в результате пе-
реноса электронов через мембрану при дыхании
и фотосинтезе. Субстратное фосфорилирование
(см. гл. 3) вносит лишь небольшой вклад в образо-
вание АТР (если не учитывать анаэробные микро-
организмы). Превращение образующегося при ак-
тивации кислот АМР (см. дополнение 7.2) в ADP
происходит, как и у всех живых организмов, в об-
ратимой аденилаткиназной реакции:
Mg2+
АМР + АТР 2ADP
Адениловые нуклеотиды выполняют важные
регуляторные функции в метаболизме. Соотноше-
ние г .,
[АТР] + |[ADP]
[АМР] + [ADP] + [АТР]
называют энергетическим зарядом клетки.
В живых организмах его величина поддерживает-
ся на уровне 0,9. Как правило, АМР и ADP сти-
162 Часть II. Основы жизнедеятельности микробных клеток
мулируют связанные с образованием АТР катабо-
лические реакции и подавляют протекание АТР-
потребляющих реакций биосинтеза. АМР в высо-
ких концентрациях служит сигналом голодания.
Такой путь регуляции обеспечивает очень быст-
рый ответ, поскольку оборот АТР происходит с
высокой скоростью (время полужизни его моле-
кулы составляет приблизительно 10-100 мс). Как
отмечено выше, затраты АТР при росте составля-
ют примерно 70 ммоль АТР (Мг = 507)/г клеток,
т. е. 35 г АТР/г клеток(!).
Восполнение пула NADPH обеспечивают
несколько катаболических NADP+-3aBHCHMbix эк-
зергонических реакций окисления (рис. 7.10).
Субстрат Реакция и фермент(-ы)
Продукт
3-ОН-кислота
Примеры
3-Оксокислота
промежуточный
продукт
2-Оксо-
соединение
7.4.3. Восстановление NADP+ происходит
в нескольких катаболических реакциях
В восстановительных этапах биосинтеза участ-
вует главным образом NADPH, тогда как
в катаболических реакциях — NAD+ (лишь в
немногих реакциях катаболизма восстанавли-
вается NADP+— регенерирует NADPH). Таким
образом, NADPH служит в клетках восстанови-
телем в реакциях биосинтеза, NAD+ — окислите-
лем в реакциях разложения субстратов. Как пра-
вило, пирвдиннуклеотид-зависимые оксидоредук-
тазные реакции полностью обратимы.
Чтобы обратимые реакции восстановительных
этапов биосинтеза (анаболизма) и окислительных
этапов разложения (катаболизма) протекали в
правильном направлении, в клетках поддержива-
ются высокое соотношение [NADPH]/[NADP+] и
низкое [NADH|/[NAD+]. Соотношение
[NADH]
[NAD+] + [NADH]
поддерживается примерно на уровне 1/20
(катаболический восстановительный за-
ряд); соотношение
[NADPH]
[NADP+] + [NADPH]
составляет примерно | (анаболический восста-
новительный заряд).
Таким образом, пиридиннуклеотиды выполня-
ют важные регуляторные функции (аллостериче-
ская регуляция), причем их быстрый оборот обес-
печивает возможность чрезвычайно быстрой ре-
акции на изменение условий.
(Г)б-Фосфо-
глюконат
(g) Изоцитрат
(5) Малат
б-Фосфоглюконат-
дегидрогеназа
Изоцитрат-
дегидрогеназа
Малик-фермент
Риболузо-
5-фосфат
2 -Оксоглутарат
Пируват
ОН
| Альдоза~
(д) Глюкозо-
6-фосфат
(?) NAD®
Глюкозо-6-фосфат-
дегидрогеназа
NADP* NADP®
Трансгидрогеназа NAD
(активность сопряжена
с протондвижущей силой)
nadp++(h^ nadp(h)
(б) 2 Ферредоксин^.^. -------------►
Ферредоксин-
N ADP-
редуктаза
ОН
| Лактон ]
6-Фосфо-
глюконолактон
2 Ферредоксин^,,
Рис. 7.10. Метаболические реакции с образованием
NADPH. Эти реакции включают окисление 3-гидро-
ксикислот (например, б-фосфоглюконата, изоцитрата
или малата) до лабильных 3-оксокислот, связанное с
их декарбоксилированием, и окисление альдегидной
группы альдоз (например, глюкозо-6-фосфата) с об-
разованием лактонов (сложных внутренних эфиров).
Основным источником образования NADPH служит
окислительный пентозофосфатный цикл, в котором
глюкозо-б-фосфат в три этапа окисляется до рибулозо-
5-фосфата. Одна молекула NADPH образуется в пер-
вой его реакции, катализируемой глюкозо-6-фосфатде-
гидрогеназой. После гидролиза продукта этой реакции
(6-фосфоглюконолактона) лактоназой с образованием
6-фосфоглюконовой кислоты происходит окислительное
декарбоксилирование 6-фосфоглюконата с образовани-
ем рибулозо-5-фосфата. катализируемое 6-фосфоглю-
конатдегидрогеназой, при котором образуется еще одна
молекула NADPH. Этот путь обеспечивает также обра-
зование пула пентозофосфатов в качестве строительных
блоков.
Глава 7. Биосинтез клеточных строительных блоков 163
Дополнение 7.3. В обычных условиях
для процессов биосинтеза необходимо значи-
тельно больше NADPH, чем образуется при
окислении 6-Р-глюконата до рибулозо-5-Р,
используемого в качестве строительного
блока, а именно больше чем 2 моль NADPH
на 1 моль пентозофосфата (пример 1 на
рис. 7.10). Образование дополнительного ко-
личества NADPH происходит двумя путями.
1. Благодаря тому, что пентозофосфатный
путь замкнут в цикл и шесть молекул
пентозо-5-фосфата превращаются в пять
молекул глюкозо-6-фосфата, в самом цикле
регенерирует его субстрат, который вновь
служит источником образования NADPH и
пентоз (см. рис. 7.20). Один оборот этого
цикла приводит к окислению до COg одного
атома С на молекулу гексозы и образованию
2 моль NADPH. Цикл называют окислитель-
ным пентозофосфатным, поскольку за шесть
его оборотов происходит в сумме окисление
одной молекулы гексозофосфата через об-
разование пентозофосфатов (см. разд. 7.7).
2. Восстановление NADP+ происходит так-
же в реакциях, катализируемых изоцитрат-
дегидрогеназой и малик-ферментом. Многие
бактерии осуществляют энергозависимое вос-
становление NADP+ (с использованием энер-
гии электрохимического протонного потен-
циала) с участием NADH и мембраносвя-
занной трансгидрогеназы. У аноксигенных
фототрофных бактерий и хемолитотрофов
необходимый для трансгидрогеназной актив-
ности NADH образуется путем обратного
транспорта электронов от восстановленных
хинонов. Оксигенные фототрофные микро-
организмы — цианобактерии — благодаря на-
личию у них фотосистемы II получают
NADPH при фотосинтезе в ферредоксин:
КАБР+-оксидоред\гктазной реакции. Мно-
гие анаэробы способны восстанавливать фер-
редоксин при окислении 2-оксокислот (на-
пример, с участием пируват:ферредоксин-
оксидоредуктазы), формиата (с участием
формиатдегидрогеназы) или Н2 (с участием
гидрогеназы).
7.5. Основные метаболиты-предшественники для синтеза
строительных блоков образуются как интермедиаты
центральных метаболических путей
К этим путям относятся цикл трикарбоновых кис-
лот (ЦТК), гликолиз/глюконеогенез и пентозо-
фосфатный цикл (рис. 7.2). Бактерии, у кото-
рых действуют в качестве центральных путей
какие-либо другие механизмы, обладают тем не
менее и этими основными путями, но в непол-
ной форме (например, неполным ЦТК вслед-
ствие отсутствия 2-оксоглутаратдегидрогеназы),
либо удовлетворение потребностей их клеток в
основных метаболитах-предшественниках обеспе-
чивают сами альтернативные механизмы (как,
например, путь Энтнера-Дудорова). Основные
пути метаболизма, будучи амбивалентными (био-
синтез/деградация), жестко регулируются и на
уровне активности, и на уровне синтеза фер-
ментов. Несколько необратимых реакций, кото-
рые находятся под аллостерическим контролем
(т. е. на уровне активности ферментов) приве-
дены на рис. 7.11 (см. также рис. 19.8). Об-
ратите внимание, что полностью обратимые ре-
акции не регулируются. Принципы регуляции
сложных биосинтетических сетей рассмотрены в
гл. 18-21.
Десять из двадцати аминокислот, входящих
в состав белков, образуются из промежуточных
продуктов ЦТК; кроме того, его интермедиаты
используются для синтеза тетрапирролов и дру-
гих клеточных компонентов. Следовательно, пул
промежуточных продуктов ЦТК должен воспол-
няться, чтобы цикл не остановился в результа-
те исчерпания С4-дикарбоновых кислот — акцеп-
торов ацетил-CoA. Реакции, выполняющие эту
функцию восполнения, называют анаплероти-
ческими. В зависимости от используемого для
роста субстрата такую роль играют различные ре-
акции (рис. 7.12).
164 Часть II. Основы жизнедеятельности микробных клеток
Гликоген
ADP-Глюкоза
NADPH —ч
©
6-Р-Глюконо- <=
лактон
Глюкозо-6-Р
® — Фруктозо-6-Р
Фруктозо- 1,6-бисР
ФЕЛ—I
ADP-
Фруктозо-1,6-бисР
Фруктозо-6-Р
-АМР
Аспартат—► ©
Ацетил-СоА —► ©
Фосфоенол пируват
— Фруктозе-1,6-бисР
Пируват
I—Ацетил-СоА, NADH
I—ФЕЛ, АМР
Ацетил-СоА
Оксалоацетат
— NADH,
2-Оксоглутарат
Цитрат
NADP*
Рис. 7.12. Анаплеротические реакции и гетеротрофная
фиксация СОг. 1 — ФЕП-карбоксилаза; 2 — пиру-
ваткарбоксилаза (биотин-зависимый фермент); 3 —
пируват: НгО-дикиназа (ФЕП-синтетаза); 4— пиру-
ват:фосфат-дикиназа; 5 — ФЕП-карбоксикиназа; б—
малик-фермент.
NADPH + Н+
Рис. 7.11. Аллостерическая регуляция необратимых ре-
акций центрального метаболизма (источников образо-
вания молекул-предшественников). Схема применима к
Е. coli и родственным бактериям. «+»— активация.
« —» — ингибирование. По [1].
Восполнение пула оксалоацетата зави-
сит от анаплеротических реакций и гете-
ротрофной фиксации СО2 (рис. 7.12) □ Об-
разование оксалоацетата обеспечивает чаще все-
го ФЕП-карбоксилазная реакция. Кроме того,
оксалоацетат образуется из пирувата при участии
биотин- и, следовательно, ATP-зависимой пиру-
ваткарбоксилазы; этот фермент у большинства
бактерий аллостерически активируется ацетил-
СоА (как и у млекопитающих). В редких слу-
чаях ФЕП-карбоксилазу заменяет ФЕП-карбокси-
трансфосфорилаза, катализирующая реакцию
ФЕП + СО2 + Pi —> Оксалоацетат + РР,
У пропионовокислых бактерий (см. разд. 12.2.2
и 12.2.3) оксалоацетат образуется из пирувата в
реакции, где донором СО2 служит метилмалонил-
СоА; катализирует ее метилмалонил-СоА: пиру-
ват-транскарбоксилаза:
Метилмалонил-СоА + Пируват
Оксалоацетат 4- Пропионил-СоА
ФЕП-карбоксикиназная реакция (рис. 7.12) теоре-
тически обратима, но при росте бактерий в среде
с С4- и Сб-дикарбоновыми кислотами этот фер-
мент действует обычно в направлении образова-
ния ФЕП. То же относится к малик-ферменту, ка-
тализирующему синтез пирувата.
Анаплеротические реакции варьируют в
зависимости от источника углерода □ При
росте за счет использования в качестве источ-
ника углерода Сз-соединений, таких как пиру-
ват или лактат, бактериям необходимо синтезиро-
вать ФЕП с помощью дополнительных ферментов
и с участием АТР, поскольку пируваткиназная
реакция в ЦТК (образование пирувата из фос-
фоенол пиру вата с участием ADP) необратима.
Такое превращение осуществляют два фермен-
та — ФЕП-синтетаза (пируват:Н20-дикиназа) и
пируват: фосфат-дикиназа, присутствующая так-
же у С4-растений (рис. 7.12). В обеих реакци-
ях образуется как промежуточный продукт пи-
рофосфорилированный фермент; от него одна
высокоэнергетическая фосфатная группа перено-
сится на субстрат (пируват), в то время как дру-
гая—на молекулу воды или фосфат. Во втором
случае образуется пирофосфат, который, как пра-
вило, гидролизует далее пирофосфатаза, обеспе-
чивая протекание суммарной реакции в прямом
направлении. Таким образом, в обеих реакци-
ях синтеза ФЕП расходуется 2 моль АТР/моль
ФЕП. Фосфоенолпируват может также образо-
вываться посредством пируваткарбоксилазной и
Глава 7. Биосинтез клеточных строительных блоков 165
ФЕП-карбоксикиназной реакций с той же затра-
той АТР.
Наибольшее разнообразие анаплеротических
реакций, в частности обеспечивающих образова-
ние пирувата или ФЕП, характерно для клеток,
растущих с использованием либо Сг-соедипений
плюс субстратов, метаболизируемых через этап
образования ацетил-СоА (таких как жирные кис-
лоты), либо С1-соединений (таких как метанол).
Эти реакции описаны в разд. 8.2 и 8.3.
7.6. Аминокислоты образуются
из нескольких основных метаболитов-предшественников
Строительными блоками для образования ос-
новных компонентов микробных клеток — бел-
ков (50-60% сухого вещества клеток) — служат
20 природных L-аминокислот. Пептидные ком-
поненты полимеров клеточных стенок состоят
из D- и L-аминокислот; D-изомеры образуют-
ся из L-форм под действием рацемаз. Помимо
структурных и функциональных белков, некото-
рые микроорганизмы, такие как азотфиксирую-
щие цианобактерии, синтезируют запасные бел-
ки. Ряд аминокислот участвует также в синте-
зе нуклеотидов. Все 20 природных L-аминокислот
большинство микроорганизмов способно синте-
зировать из нескольких основных метаболитов-
предшественников (рис. 7.2).
Дополнение 7.4. История расшифровки
путей биосинтеза аминокислот служит яр-
ким примером использования междисципли-
нарного подхода, часто необходимого при
изучении микробного метаболизма. Он вклю-
чает радиоизотопный анализ, энзимологиче-
ские исследования и применение генетиче-
ских методов с получением мутантов. Такой
подход весьма продуктивен, и в подтвержде-
ние этого можно привести несколько при-
меров. 1. Клетки мутантных штаммов ча-
сто накапливают или даже выделяют в среду
промежуточные продукты обмена, посколь-
ку их дальнейшие превращения блокирова-
ны мутацией. Определение таких продуктов у
различных мутантов позволяет выяснить по-
следовательность реакций биосинтеза или
разложения. 2. Другой метод позволяет иден-
тифицировать этап метаболизма, нарушен-
ный мутацией. Предполагаемые интермедиа-
ты исследуемого пути вносят по отдельности
как субстраты в среду для выращивания
мутантов. Рост каждого из мутантов обес-
печивают лишь те из них, которые должны
образовываться после этапа, блокированного
мутацией. 3. Клетки выращивают (или
инкубируют) в присутствии специфически
меченных 14С предшественников. После этого
осуществляют химическое расщепление ме-
ченых продуктов (аккумулируемых или
выделяемых мутантами либо образуемых
клетками дикого типа), чтобы определить
содержание 14 С в каждом положении угле-
родной цепи и установить таким образом про-
исхождение всех атомов С. Эти данные часто
позволяют проследить ретроспективно путь
биосинтеза. Однако такой метод весьма тру-
доемок, и его теперь заменяет другая методи-
ка. 4. Бактерии выращивают в присутствии
13С-мсченных предшественников, после
чего распределение метки в разных атомах
углеродного скелета исследуемых продук-
тов (например, аминокислот) определяют по
спектрам 13С-ядерного магнитного резонанса
(ЯМР).
Многие ферменты аминокислотного обмена со-
держат пиридоксальфосфат в качестве простети-
ческой группы.
Соответственно путям биосинтеза аминокис-
лоты подразделяют па пять семейств (названных
по общему предшественнику), в которые не вхо-
дит лишь гистидин. Все эти пути в значитель-
ной степени сходны у разных микроорганизмов,
за немногими исключениями. Далее мы рассмот-
рим каждый путь в отдельности. Здесь необхо-
166 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.13. Синтез аминокислот семейства глутамата. Глутамат (Glu): восстановительное аминирование
2-оксоглутарата. Глутамин (Gin): 1 — глутаминсинтетаза. Пролин (Pro): 2 — 7-глутамилкиназа; 3 — дегид-
рогеназа 7-полуальдегида глутаминовой кислоты; 4 — Д1-пирролин-5-карбоксилат-редуктаза. Аргинин (Arg): 5 —
N-ацетилглутаматсинтаза; б — N-ацетилглутаматкиназа; 7 — N-ацетилглутамилфосфат-редуктаза; 8 — N-ацетилор-
нитин-аминотрансфераза; 9 — N-ацетилорнитин-деацетилаза; 10 — орнитин-карбамоилтрансфераза (или изофер-
менты); 11 — аргининосукцинат-синтетаза; 12 — аргининосукциназа. КАФ — карбамоилфосфат.
димо указать, что большинство реакций восста-
новления в процессах биосинтеза катализируют
NADP-зависимые (4-2{Н]) ферменты, тогда как
реакции окисления относятся к NAD+-3aBiicn-
мым; в описаниях и схемах реакций тип пиридин-
нуклеотидов не приводится (исключения сделаны
для окислительных реакций, в которых образует-
ся NADPH; см. разд. 7.4.3).
7.6.1. Аминокислоты семейства глутаминовой
кислоты образуются из 2-оксоглутаровой
кислоты
Общая особенность биосинтеза аминокислот се-
мейства глутаминовой и аспарагиновой кислот со-
стоит в том, что все реакции относятся к карбок-
сильной группе боковой цепи и для активации
этой группы используется АТР. Наиболее важные
реакции данного пути — амидирование и восста-
новление. (Напомним, что глутаминовая кислота
и глутамин служат также основными переносчи-
ками азота в процессах биосинтеза.)
В семейство глутаминовой кислоты входит 4
аминокислоты (глутаминовая кислота, глута-
мин, пролин и аргинин), имеющих Сб-скелет
(у аргинина к Сб-скелету присоединена гуа-
нидиновая группа). Все они синтезируются из
3-оксоглутаровой кислоты через этап образования
глутаминовой кислоты (рис. 7.13). Путь синте-
за глутаминовой кислоты и глутамина как основ-
ных доноров-переносчиков NH2-группы был рас-
смотрен выше, в разд. 7.3.1. При синтезе глута-
мина происходит ATP-зависимое образование в
качестве промежуточного продукта глутамилфос-
фата (см. рис. 7.4), необходимое для удаления
ОН-группы и протекания реакции амидирования
только в прямом направлении.
Аналогично этому ATP-зависимая химическая
активация необходима при биосинтезе пролина и
аргинина для восстановления С5-карбоксильной
группы до альдегида (рис. 7.13). В случае пролина
образующийся альдегид спонтанно превращается
в циклическое шиффово основание, из которого
путем восстановления образуется пролин.
Глава 7. Биосинтез клеточных строительных блоков 167
NHj или
Cln-NH
Аспарагин
АМР-РР
СООН
Clu-NH2 h2N—С—Н
Оксало- < I
ацетат
О'' ОН
Аспартат
Thr! !
Met!
Пируват Lys
+NH3 Н2О
Гомоцистеин
----1---
Н —С—SH
I
н
|Лизин |
t
Диаминопимелиновая
О-сукцинил-
Цистатионин
гомосерин
н-с-о©
н
Гомосерин-(р)
I
—С—ОН
н—С—н
I
н
СН3—H.F
Треонин
----1--------
Н— С —S—СН,
4|
н
Метионин
I
|Изолейцин|
Рис. 7.14. Синтез четырех аминокислот семейства аспартата. Аспартат (Asp): трансаминирование оксалоацетата
с глутаматом. Аспарагин (Asn): 1а/1б — аспарагинсинтетазы. Общий участок и синтез треонина (Thr): 2а/2б/2в —
аспартаткиназы I, II и III (различаются по механизму регуляции): 3 — дегидрогеназа полуальдегида аспарагино-
вой кислоты; 4а/4б— гомосериндегидрогеназы I, II (т. е. аспартаткиназы I и II; бифункциональные ферменты);
5 — гомосеринкиназа; б — треонинсинтаза (пиридоксальфосфат-зависимый фермент). Синтез метионина (Met): 7 —
гомосерин-сукцинилтрансфераза; 8 — цистатионин-7-синтаза (пиридоксальфосфат-зависимый фермент); 9 — цис-
татионин-7-лиаза (пиридоксальфосфат-зависимый фермент); 10 — гомоцистеин-метилтрансфераза (может быть
В12-зависимой или независимой). Реакции 2—4 составляют общий участок в синтезе метионина, треонина и изолей-
цина (Не); реакции 2-3 — общие для синтеза этих аминокислот плюс лизина (Lys). Штриховыми линиями показано
ингибирование ферментов по принципу обратной связи.
При биосинтезе аргинина a-NI^-rpynna
глутаминовой кислоты временно ацилируется,
что предотвращает циклизацию молекулы по-
сле восстановления С5-карбоксильной группы
(рис. 7.13). Далее происходит трансаминирование
альдегида и отщепление ацильной группы, приво-
дящее к образованию диаминокислоты орнитина.
К орнитину затем присоединяется карбамоиль-
ная группа с образованием L-цитруллина, после
чего оксогруппа цитруллина замещается на ими-
погруппу с образованием аргинина; ГШг-донором
в последней реакции служит аспарагиновая кис-
лота, которая при этом превращается в фумарат
(см. рис. 7.5, В). L-орнитин у многих бактерий
входит в состав муреина. Аргинин играет важ-
ную роль в синтезе полиаминов (см. разд. 7.12.1).
Регуляция □ Регуляция синтеза глутамина
описана в разд. 19.3 и 20.4.3. Активность перво-
го фермента пути синтеза пролина (глутаматки-
назы) регулируется по механизму ингибирования
конечным продуктом (т. е. пролином; рис. 7.13).
Относительно пролина ранее предполагалось, что
он служит осмопротектором, поскольку аккуму-
лируется клетками из среды при гиперосмоти-
ческом стрессе. Однако теперь установлено, что
физиологическими осмопротекторами служат бе-
таины, а также то, что скорость синтеза про-
лина не изменяется в ответ на осмотический
стресс. Аргинин регулирует активность N-ацетил-
глутаматкииазы по механизму отрицательной об-
ратной связи и подавляет экспрессию всех фер-
ментов своего пути биосинтеза.
168 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.15. Синтез лизина (семейство аспартата) и диаминопимелиновой кислоты. 1 — дигидродипиколинат-синтаза;
2 — дигидродипиколинат-редуктаза; 3 — тетрагидродипиколинат-сукцинилаза; 4 — сукцинил-диаминопимелат-ами-
нотрансфераза; 5 — сукцинил-диаминопимелат-десукцинилаза; б — диаминопимелат-эпимераза; 7 — диаминопиме-
лат-декарбоксилаза.
7.6.2. Оксалоацетат и пируват служат
предшественниками аминокислот
двух семейств
В семейство аспарагиновой кислоты обыч-
но включают, кроме нее, пять аминокислот —
аспарагин, треонин, метионин, лизин и
изолейцин, для которых служит предшествен-
ником аспартат (рис. 7.14). Из этих аминокис-
лот образуются л<сзо-диаминопимелиновая
кислота (компонент клеточной стенки), дипи-
колиновая кислота (компонент эндоспор) и
S-аденозилметионин (универсальный перенос-
чик С1-фрагментов), и тем самым этот путь раз-
ветвляется дальше.
Аспарагиновая кислота образуется из окса-
лоацетата путем трансаминирования (переамини-
рования) с глутаматом. Аспарагин синтезирует-
ся из аспартата с участием L-аспарагинсинтетазы
в реакции, аналогичной глутаминсинтетазной.
Образование треонина и метионина из аспарта-
та происходит через этапы превращения его в
/3-полуальдегид. Таким образом, как и при син-
тезе аминокислот семейства глутаминовой кисло-
ты, для модификации /3-карбоксильной группы
аспартата необходимо ее восстановление до аль-
дегидной с участием АТР. Дальнейшие превра-
щения идут по трем путям. 1. Восстановление
полуальдегида до спирта (гомосерина) и после-
дующая его изомеризация с образованием трео-
нина; переносу ОН-группы способствует фос-
форилирование С4-гидроксила в составе гомосе-
рина. 2. Образование гомосерина и замена его
спиртовой группы на тиольную. Как и при
синтезе цистеина, в молекулу гомосерина вводит-
ся легкоуходящая группа (ацетильная или сук-
цинильная); донором SH-группы служит цисте-
ин. Продукт этой реакции гомоцистеин метили-
руется далее при участии СНз-тетрагидрофолата
до метионина. Катализирующий эту реакцию
фермент может быть витамин В^-зависимым.
3. У большинства прокариот (за некоторым
исключением) из полуальдегида аспартата об-
разуется также лизин и изолейцин и допол-
нительно пируват. Первый этап этого ответвле-
ния от основного биосинтетического пути, ве-
дущий к образованию лизина (рис. 7.15),—это
конденсация аспартат-/3-полуальдегида и пиру-
вата с последующей циклизацией с образовани-
ем дигидропиридина (2,3-дигидродипиколиновой
кислоты). Последняя восстанавливается далее
до тетрагидродипиколиновой кислоты. Синтез
дипиколиновой кислоты — основного раство-
римого вещества эндоспор, придающего им тер-
Глава 7. Биосинтез клеточных строительных блоков 169
неустойчивость, — происходит за счет окисления
дигидродипиколината при споруляции. Дальней-
шие превращения тетрагидродипиколината связа-
ны с его дециклизацией. Это соединение содер-
жит в цикле связь —N=C, т. е. может рассмат-
риваться как шиффово основание, образованное
взаимодействием —NH2- и О=С-групп. Разрыву
связи N=C (и, соответственно, цикла) способ-
ствует ацилирование аминогруппы (с помощью
ацетил- или сукцинил-CoA). (Сходная реакция
имеет место при синтезе пролина и аргинина.) Да-
лее происходит трансаминирование с-оксогруппы,
что приводит к отщеплению ацильной группы,
поскольку циклизация становится невозможной.
Образующаяся при этом Ь,Ь-си,£-диаминопиме-
линовая кислота эпимеризуется в .мезо-форму,
декарбоксилирование которой приводит к обра-
зованию L-лизина. Мезо-диаминопимелино-
вая кислота входит в состав муреина — пепти-
догликана клеточной стенки. Изолейцин, син-
тез которого рассматривается ниже, образуется из
2-оксобутирата и пирувата; 2-оксобутират синте-
зируется путем дезаминирования треонина.
Дополнение 7.5. У микроорганизмов
известны некоторые модификации описы-
ваемых в этой главе путей биосинтеза,
характерных для Proteobacteria в целом.
Лизин. У некоторых грамположительных
прокариот, содержащих в клеточной стенке
вместо диаминопимелиновой кислоты лизин,
изображенные на рис. 7.15 реакции 3-6 заме-
няет одна реакция, катализируемая фермен-
том мезо-диаминопимелатдегидрогеназой.
У архей обнаружен другой, характерный
для многих эукариот, путь синтеза лизина —
через образование о-аминоадипиповой кис-
лоты. В этом случае происходит конденсация
2-оксоглутарата и ацетил-CoA, продукт
KOTopoii в несколько стадий превращается в
2-оксоадипиновую (Сб-дикарбоновую) кисло-
ту. Такой путь образования 2-оксоадипината
сходен с механизмом синтеза 2-оксоглутарата
в цикле трикарбоновых кислот. К образо-
ванию лизина приводят трансаминирование
2-оксогруппы 2-оксоадипината, восстанов-
ление его Е-карбоксильной группы до аль-
дегидной и трансаминирование последней.
Аминокислоты с разветвленной цепью.
Анаэробы могут синтезировать предшествен-
ники этих аминокислот, 2-оксокислоты, в
реакциях восстановительного карбоксилиро-
вания СоА-эфиров продуктов брожения —
пропионата (образование 2-оксобутирата),
2-метилбутирата (образование 2-оксо-/3-ме-
тилвалерата, предшественника изолейцина)
и изобутирата (образование 2-оксоизовале-
рата, предшественника валина). 2-Оксобути-
рат может синтезироваться также из мети-
онина. Другие микроорганизмы используют
так называемый цитрамалатный путь синте-
за изолейцина, который начинается с кон-
денсации ацетил-CoA и пирувата с обра-
зованием цитрамалата. Аргинин. Введен-
ная в молекулу глутамата на первом этапе
синтеза аргинина ацетильная группа может
вновь использоваться с участием глутамат-
ацетилтрансферазы. Глицин и серин. Пред-
шественниками серина у некоторых метило-
трофных бактерий служат глицин и фор-
мильная группа. Образование глицина может
также происходить в результате расщепления
треонина па глицин и ацетальдегид, катали-
зируемого треонинальдолазой. Ароматиче-
ские аминокислоты. У некоторых прокари-
от действует несколько иной путь синтеза фе-
нилаланина и тирозина: вначале происходит
трансаминирование префената с образовани-
ем арогената; последующие этапы в основном
не отличаются от обычного пути. Ацили-
рование. Донорами вводимой при синтезе в
молекулу субстрата защитной или активиру-
ющей группы могут служить различные со-
единения, например ацетил-CoA или сукци-
нил-СоА.
Аланин, валин и лейцин, составляющие се-
мейство пирувата, синтезируются из пирувата.
Выделение этой группы следует считать несколь-
ко произвольным, поскольку пируват необходим
также для синтеза лизина и изолейципа. Ала-
нин образуется непосредственно из пирувата пу-
тем трансаминирования. D-аланин, необходимый
компонент вещества клеточной стенки, синтези-
руется с участием конститутивного фермента ала-
нинрацемазы. В расщеплении D-аланина участву-
ет другая, индуцибельная О,Ь-аланинрацемаза.
В синтезе аминокислот с разветвленной
цепью — изолейцина, валина и лейцина — име-
ется много сходных этапов (рис. 7.16). Один
170 Часть II. Основы жизнедеятельности микробных клеток
н2о
СН,— COS-CoA'
онн
сн,-сн -с-сн-соон
Н Н он
СН,- с- с- сн-соон
2[Н]
со;
Ацетил-СоА
CoA-SH СН, СООН
сн.соон
О Clu-NH;
CHj-CH -CH2-C-COOH^i: CHj-CH - СНг-СН-СООН
NH;
а-Изопропилмалат
0-Изопропилмалат
нбн|о
СН:
СН:
2-Оксоизокапроноат
[.Лейцин |
О
NH;
Пируват
о он
о
сн
СН:
сн,-с-соон
Пируват
Vai
Не
сн,—с—с—соон
сн,—сн-с-соон
сн, — сн — сн-соон
СН,Н
сн
а-Ацетолактат
а,|3-Дигидроксиизовалерат
2[Н]
2-Оксоизовалерат
Clu-NH;
СН3
|Валин|
II
с-СООН
I
сн2
I
сн3
2-Оксобутират
Треонин
О ОН
II I
сн3-с-с-СООН
сн2
сн3
а-Ацето-
а -гид роке и бути рат
НОН|О
сн3-с-с-соон
сн2н
сн3
о
II
сн3-сн-с-соон
сн2
сн3
а.|3-Дигидрокси-0-метил валерат
а-Оксо-0-метил валерат
NH2
I
сн3-сн-сн-соон
I
сн2
I
сн3
I Изолейцин
Рис. 7.16. Синтез аминокислот с разветвленной цепью — валина (Vai), изолейцина (Не) и лейцина (Leu). 1 — трео-
нин дегидратаза; 2 — синтазы ацетогидрокси кислот; катализируют реакции, ингибируемые (2а/2б) или не ингиби-
руемые (2в) конечным продуктом; 3 — редуктоизомераза гидроксикетокислот; 4 — дегидратаза ди гидроксикислот;
5а/5б, 5в/5г — трансаминазы; б — изопропилмалат-синтаза; 7 — изопропилмалат-изомераза; 8 — /3-изопропилмалат-
деги дрогеназа.
и тот же набор ферментов параллельно ката-
лизирует следующие четыре реакции. 1. Кон-
денсация 2-оксокислоты [например, пирувата
(2-оксопропионата) или 2-оксобутирата, синтези-
рованного путем дезаминирования треонина] с
активированным ацетальдегидом (образующим-
ся из пирувата) в тиаминпирофосфат-зависи-
мой реакции с последующим восстановлением
о-карбонильной группы продукта, которое сопро-
вождается интересным сдвигом алкильной груп-
пы. Продукт этих превращений — 2,3-дигидрок-
си-соединение— дегидратируется до 2-оксосоеди-
пения, трансаминирование которого приводит к
образованию аминокислоты — валина или изо-
лейцина. При конденсации непосредственного
предшественника валина (2-оксоизовалерата) с
ацетил-СоА образуется о-изопропилмалат (реак-
ции такого типа называют конденсацией Клай-
зена; см., например, синтез цитрата, а также
разд. 8.2). Дальнейшие превращения о-изопро-
пилмалата приводят к синтезу лейцина.
Регуляция синтеза аминокислот семей-
ства аспартата (см. также разд. 19.3 и рис. 7.11).
Пути синтеза аминокислот этого семейства су-
щественно варьируют у разных организмов, как
и механизмы их регуляции. Описываемый здесь
путь регуляции, характерный для представите-
лей Enterobacteriaceae, не характерен для мно-
гих других бактерий (например, рода Bacillus).
Аспарагин. Существуют две аспарагинсинтета-
зы; одна из них использует глутамин в каче-
стве донора аминогруппы (функционирует при
недостатке азота), тогда как другая — NH3 (функ-
ционирует при избытке азота; ср. с образо-
ванием глутамина из глутамата с участием
ЬШз-зависимых ферментов). Функционирование
обоих ферментов требует гидролиза АТР до
АМР и PPj. Общий участок биосинтеза
метионина, треонина, лизина и изолей-
цина. Первый этап — аспартаткиназную реак-
цию— катализируют три аспартаткиназы, I, II
и III, различающиеся по механизму их регуляции.
Аспартаткиназы I и II катализируют также гомо-
серипдегидрогеназную реакцию. Синтез трео-
нина. Гены соответствующих ферментов обра-
зуют оперон, экспрессию которого подавляют
Глава 7. Биосинтез клеточных строительных блоков 171
треонин и изолейцин (мультивалентная репрес-
сия). Треонин ингибирует также аспартаткиназу I
(по механизму отрицательной обратной связи).
Синтез метионина. Метионин подавляет экс-
прессию аспартаткиназы II и воздействует на все
(кроме одного) этапы метиониновой ветви; напри-
мер, активность первого ее фермента (гомосерин-
сукцинилтрансферазы) аллостерически регули-
руется метионином и S-аденозил метионином.
Синтез лизина. Лизин ингибирует активность
и синтез аспартаткиназы III, а также регулирует
этапы той ветви пути, которая ведет к его синтезу.
Регуляция синтеза аминокислот с раз-
ветвленной цепью □ Синтез этих аминокис-
лот регулируется весьма тонко. Следует, однако,
иметь в виду, что у грамположительных бакте-
рий из 2-оксокислот — предшественников амино-
кислот с разветвленной цепью (рис. 7.16) —синте-
зируются также жирные кислоты с разветвленной
цепью.
7.6.3. Общим предшественником аминокислот
семейства серина—глицина
(включающего также цистеин)
служит обычно серин
Серин образуется из 3-фосфоглицерата в три
этапа (рис. 7.17): окисления свободной гидрок-
сильной группы 3-фосфоглицерата, трансамини-
рования и удаления фосфата. Серин служит пред-
шественником цистеина (внутриклеточного пе-
реносчика серы; рис. 7.8) и глицина.
Регуляция □ Ферменты, участвующие в
образовании серина, синтезируются конститутив-
но. Активность первого фермента пути ингибиру-
ется серином. Экспрессию серингидроксиметил-
трансферазы (серингидроксиметилазы) — фер-
мента, ответственного за образование не только
глицина, но и одноуглеродных фрагментов, — по-
давляют несколько продуктов С i-метаболизма
(а именно, серин, глицин, метионин, пурины и
тимин). Синтез цистеина регулируется отдельно
(см. cj/s-регулон).
7.6.4. Предшественниками ароматических
аминокислот служат эритрозо-4-фосфат
и фосфоенолпируват
Ароматическое кольцо в составе трех арома-
тических аминокислот — фенилаланина, тиро-
зина и триптофана — образуется из эритро-
СООН
|н-с-он|
СН2О0
3-(р)Тлицерат
СООН
I
h2n-c-h
IСН2ОН
|Серин)
СООН
4---
с=о
р, Н2о соон
[Цистеин I
СН2
I
SH
H«F CH2=H4F
2[Н]
соон
I
h2n- с-н
I
н
Рис. 7.17. Синтез аминокислот семейства серина-гли-
цина. Ser — серин; Gly — глицин. 1 — 3-фосфоглицерат-
дегидрогеназа; 2 — 3-фосфосерин-аминотрансфераза;
3 — 3-фосфосеринфосфатаза; 4 — серин-гидроксиме-
тилтрансфераза; 5 —ферменты расщепления глицина;
б — серин-ацетилтрансфераза; 7 — О-ацетилсерин-
сульфгидрилаза (см. рис. 7.8).
зо-4-фосфата и фосфо енолпирувата; Сз-боковая
цепь происходит из фосфо енолпиру вата или
(в случае триптофана) из серина. Два угле-
родных атома гетероцикла триптофана происхо-
дят из С1- и С2-атомов 5-фосфорибозил-1-пи-
рофосфата (рис. 7.18). В биосинтезе аромати-
ческих аминокислот есть общий участок (путь
шикимовой кислоты), который начинается
конденсацией двух вышеназванных предшествен-
ников с образованием Су-соединения — 3-дезокси-
В-арабиногептулозонат-7-фосфата (ДАГФ); ре-
акцию конденсации катализируют три изофер-
мента (ДАГФ-синтазы).
Далее происходят циклизация Су-соединения
(ДАГФ) с образованием 3-дигидрохинната и пре-
вращение последнего через шикимовую кислоту
в хоризмат (рис. 7.18). После этого этапа пу-
ти синтеза трех ароматических аминокислот рас-
ходятся. Мутазная реакция (т. е. внутримолеку-
лярный перенос группы) приводит к образова-
нию из хоризмата префената, предшественника
фенилаланина и тирозина. Специфические ре-
акции синтеза триптофана начинаются с пре-
вращения хоризмата в антранилат. Антранилат
взаимодействует с ФРПФ (см. разд. 7.6.5) с обра-
172 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.18. Синтез ароматических аминокислот — фенилаланина, тирозина и триптофана. Общий участок:
1а/1б/1в — 3-дезокси-С-арабиногептулозонат-7-фосфат (ДАГФ)-синтазы (phe, tyr, trp); 2 — 3-дегидрохиннатсин-
таза; 3 — 3-дегидрохиннатдегидратаза; 4 — шикиматдегидрогеназа; 5 — шикиматкиназы (различия в функциях меж-
ду этими двумя ферментами не установлены); б —5-еноилпирувоилшикимат-З-фосфат-синтаза; 7 — хоризматсин-
таза. Синтез фенилаланина (Phe): 8а/8б — хоризматмутаза/префенатдегидратаза (phe; бифункциональный фер-
мент). Синтез тирозина (Туг): 9а/96— хоризматмутаза-префенатдегидрогеназа (tyr; бифункциональный фермент);
10— тирозинаминотрансфераза. Синтез триптофана (Тгр): 11 — антранилатсинтаза; 12 — антранилат-фосфорибо-
зилтрансфераза; 13 — 1\!-5'-фосфорибозил-антранилат-изомераза; 14 — индол-3-глицерофосфатсинтаза (активности
13 и 14 могут относиться к одному или двум разным ферментам); 15 — триптофансинтаза. ФРПФ — 5-фосфорибо-
зил-1-пи рофосфат.
Глава 7. Биосинтез клеточных строительных блоков 173
Рис. 7.19. Синтез гистидина. ФРПФ
— 5-фосфорибозил-1-пирофосфат;
His — гистидин; 1 — АТР-фосфори-
бозилтрансфераза; 2 — фосфорибо-
зил-АТР-пирофосфогидролаза; 3 —
фосфорибозил-АМР-циклогидрола-
за; 4 — фосфорибозилформими-
но - 5 - аминоимидазол - карбоксамид-
рибонуклеотид-изомераза; 5 — фос-
форибозилформимино -5- аминоими-
дазол - кар боксамид рибо нук ле отид:
глутамин-аминотрансфераза; выс-
вобождающееся в этой реакции со-
единение (обведено) — 5-аминоими-
дазол -4- карбоксамидрибонуклеотид
(АИКАР); 6 — циклаза; 7 — имида-
золглицеролфосфат-дегидратаза; 8
— гистидинолфосфат-аминотранс-
фераза; 9 — гистидинолфосфатаза
(бифункциональный фермент или
два отдельных фермента); 10 —
гистидинолдегидрогеназа (катали-
зирует двухэтапное дегидрирование
гистидинола до L-гистидина).
зованием б-фосфорибозил-И-гликозида антрани-
ловой кислоты, после чего происходит его цикли-
зация (б-фосфорибозил-И-гликозиды образуются
также на последних этапах синтеза пиримиди-
новых нуклеотидов или па ранних этапах син-
теза пуринов). На завершающей стадии, ката-
лизируемой пиридоксальфосфат-зависимым фер-
ментом триптофансинтазой, происходит замена
Сз-боковой цепи в индольном цикле, которая
осуществляется посредством замещения /3-гид-
роксильной группы серина индолом (рис. 7.18).
Триптофансинтаза катализирует также синтез
триптофана из серина и индола и /3-элиминиро-
вание NH3 из серина с образованием пиру-
вата.
Четыре дополнительных пути ведут к синтезу
из хоризмата трех важных ароматических ко-
ферментов (входящего в состав фолиевой кисло-
ты 4-аминобензоата, синтезируемого из 4-гид-
роксибензоата; убихинона, содержащего бензо-
хинон, и менахинона, содержащего нафтохинон)
и хелатирующего железо энтерохелина, в со-
став которого входит 2,3-дигидроксибензоат (см.
разд. 8.8).
174 Часть II. Основы жизнедеятельности микробных клеток
Промежуточные соединения, образующиеся
при синтезе ароматических аминокислот, бы-
ли идентифицированы с использованием ауксо-
трофных мутантов. Единственным веществом из
55 исследованных ароматических и гидроарома-
тических соединений, способным удовлетворять
потребность некоторых ауксотрофных штаммов
Е. coli в тирозине, фенилаланине и триптофане,
оказалась шикимовая кислота. Другие мутанты,
дефектные по ферментам общей части пути био-
синтеза ароматических аминокислот, могут на-
капливать шикимат и иные интермедиаты (в ос-
новном в дефосфорилированной форме).
Регуляция (см. также гл. 19) □ Как актив-
ность, так и синтез каждой из трех ДАГФ-синтаз
ингибируется одной из ароматических аминокис-
лот. Другие ферменты общего участка путей
биосинтеза ароматических аминокислот синте-
зируются конститутивно. Организация генов,
кодирующих эти пути (например, trp-оперона,
детерминирующего биосинтез триптофана, или
^7/г’/?-регу.пона, контролирующего в том числе
транспорт тирозина), их транскрипция и транс-
ляция описаны в других главах этой книги. Регу-
ляция синтеза ароматических аминокислот и ор-
ганизация соответствующих генов варьируют у
разных бактерий, что отражает их эволюционную
историю и приспособленность к различным усло-
виям среды.
7.6.5. Гистидин синтезируется
совершенно особым путем
Путь синтеза гистидина состоит из одиннадца-
ти реакций, катализируемых девятью или деся-
тью ферментами (рис. 7.19). Предшественником
Сз-боковой цепи и двух соседних углеродных ато-
мов (—С=СН—) гетероцикла гистидина служит
5-фосфорибозил-1-пирофосфат (ФРПФ). Атомы
—К=СН-группы гетероцикла происходят из N1
и С2 в остатке аденина АТР. (Обратите внима-
ние, что С2-атом в составе аденина происходит из
С1-метаболизма и что имидазольное кольцо аде-
нина не переходит в имидазольное кольцо ги-
стидина.) Группа — NH в гетероцикле гистидина
происходит из глутамина, а-аминогрупп а — из
глутамата. (Как будет указано ниже, побочный
продукт при образовании гистидина — АПК АР —
является интермедиатом в синтезе пуриновых
нуклеотидов; см. рис. 7.24.)
Регуляция □ У Е. coli гены, кодирующие
ферменты биосинтеза гистидина, организованы в
оперон his. У других бактерий гены his могут на-
ходиться в нескольких отдельных кластерах. Ак-
тивность первого фермента пути регулируется ги-
стидином по механизму обратной связи.
7.7. Фосфорилированные углеводы служат важными предшественниками
многих строительных блоков
В качестве активированных предшественни-
ков фосфорилированные углеводы участвуют
в некоторых реакциях биосинтеза аминокис-
лот [эритрозо-4-фосфат в синтезе ароматических
аминокислот, 5-фосфорибозил- 1-пирофосфат
(ФРПФ) — в синтезе триптофана и гистидина], в
образовании нуклеотидов и дезоксинуклеотидов
(различные пентозофосфаты) и в синтезе компо-
нентов клеточной стенки, таких как пептидогли-
кан, гликолипиды, липополисахариды и поверх-
ностные полисахариды. Поэтому прежде чем пе-
рейти к рассмотрению следующих строительных
блоков, необходимо описать пути взаимопревра-
щений фосфосахаров, их активации и участия в
синтезе нуклеотидов и разнообразных гликанов.
Отметим, что в природе углеводы встречаются
главным образом в D-форме. Вначале будут опи-
саны характерные для большинства прокариот
реакции образования фосфосахаров из основных
метаболитов-предшественников и затем этапы их
активации.
Взаимопревращения фосфорных эфиров Сз- и
Сб-альдоз и кетоз происходят в процессах гли-
колиза (см. гл. 3) и глюконеогенеза. Здесь мы
рассмотрим синтез фосфорилированных С4- и
Сб-сахаров, которые входят у прокариот в чис-
ло основных метаболитов-предшественников (см.
рис. 7.2), и пути образования из них остальных
сахаров и углеводов.
Синтез углеводов — строительных блоков —из
промежуточных продуктов гликолиза и глюко-
неогенеза происходит в четыре этапа.
Глава 7. Биосинтез клеточных строительных блоков 175
Рис. 7.20. Окислительный пентозофос-
фатный цикл. Реакции, замыкающие
цикл, изображены как результат
превращений трех молекул гексозы.
Окислительный этап (образование
NADPH и пентоз): 1 — глюкозо-6-фос-
фатдегидрогеназа; 2 — лактоназа;
3 — б-фосфоглюконатдегидрогеназа.
Взаимопревращения пентоз: 4 — рибо-
зо-5-фосфат-изомераза; 5 — рибулозо-
5-фосфат-З-эпимераза. Превращение
пентозофосфатов в две молекулы
гексозо-6-фосфата и одну молекулу
триозо-3-фосфата катализируют транс-
альдолаза (ТА) и транскетолаза (ТК).
он
н-с-он
н-с-он
Н2С-О(Р)
Ри6улозо-5-(р)|
нсо
I
н-с-он
I
н-с-он
н-с-он
н2с-о(р)
|Ри6озо-5-(р) |
но-с-н
н-с-он
Н2С-о(Р)
Ксилулозо- 5<PJ
X 3 Гексозо-6-Р
3 Пентозо-5-Р + ЗСО;
Зх2[Н]
Фруктозе-6-(р)
Ксилулозо-5 ► Глицеральдегид-3-(Р) —?-----
[сЛ(ТК) [о] (ТА)
Рибозо-5-©------► Седогептулозо-7-(р)----Эритрозо-4-(р) —> Фруктозо-6-(р)
[%](ТК)
Гл и не рал ьде ги д-3-©
Ксилулозо- 5-©
*2- 3 Пентозо-5-^) , * 2 Гексозо-6-(р) + 1 Триозо-3-(р)
1. Взаимопревращения многих фосфоса-
харов происходят в пентозофосфатном
цикле (рис. 7.20), действующем у всех жи-
вых организмов. Продукты этого цикла — ос-
новные метаболиты-предшественники,
этерифицировапиые фосфатом по одному из
концевых атомов углерода.
2. Из центральных метаболитов-предшествен-
ников, приведенных на рис. 7.2, образу-
ется несколько основных 1-фосфосахаров
(рис. 7.21) (в этих соединениях фосфат связан
с альдегидной группой сахара в 1 положении,
т. е. эта связь гликозидная).1
3. Для превращения в строительные блоки
1-фосфосахара активируются путем присо-
единения к ним пирофосфатным мостиком
у Cl-атома нуклеотидного остатка от нук-
леозидтрифосфата (NTP) с высвобождением
PPi (рис. 7.21 и 7.22, В), тогда как рибо-
зо-5-фосфат активируется путем присоедине-
ния в 1 положении пирофосфорильной груп-
пы от нуклеозидтрифосфата с высвобожде-
нием NMP и образованием 5-фосфорибозил-
1-пирофосфата (ФРПФ; рис. 7.22, Л). И тот,
и другой механизмы обеспечивают активиза-
цию группы, образующей гликозидную связь.
4. Активированный рибозо-5-фосфат (ФРПФ)
используется непосредственно как пред-
шественник в процессах биосинтеза
(рис. 7.22, Б). Нуклеотидсахара [нуклеозид-
дифосфат (NDP)-caxapa] либо служат стро-
ительными блоками, образуя гликозидную
связь посредством своей активированной
Cl-группы с различными акцепторными груп-
пами (с сохранением или обращением конфи-
гурации у Cl-атома; рис. 7.22, Г1), либо пре-
вращаются в другие нуклеотидсахара, так-
же используемые как строительные блоки
(разд. 7.9).
1 В строгом смысле эта связь не гликозидная (см. «Химическая энциклопедия». Т. 1. М.: «Советская энциклопедия».
1988); обычно ее называют фосфоэфирной. — Прим. вед. ред.
176 Часть II. Основы жизнедеятельности микробных клеток
| NDP-глюкоза |
РР.
NMP-PP
Глюкозе-1 -фосфат
f
I Глюкозо-6-фосфат I
Cln-NH
Фруктозо-6-фосфат I-
Глюкозамин-6-фосфат
Маннозо-6-фосфат
Ацетил~$СоА
N - Ацетилгл юкозам ин -
1-фосфат
NMP-PP
РР,
Маннозо-1-
фосфат
NMP-PP
РР.
jNDP-N-ацетилглюкозамин]
NDP-манноза
Дополнение 7.6. Путь расщепления уг-
леводов можно определить эксперименталь-
но следующим образом. Клетки инкубируют
(или выращивают) в присутствии гексоз, ме-
ченных 14С в различных положениях, после
чего определяют радиоактивность выделен-
ного СОг- При окислении гексоз через пен-
тозофосфатный путь СО2 происходит из С1,
при гликолизе и окислении образующегося
в нем пирувата — из СЗ- и С4-атомов, при
функционировании пути Энтнера-Дудорова
из С1- и С4-атомов. Этот метод получил
название радиореспирометрии, поскольку
с его помощью измеряют радиоактивность
СОг, выделяющегося при дыхании.
Рис. 7.21. Образование основных 1-фосфосахаров из
центральных метаболитов-предшественников. Неболь-
шое число D-гексоз в форме 1-фосфатов активирует-
ся присоединением NDP-остатка (ADP, UDP, GDP, CDP
или dNDP) от соответствующего нуклеозидтрифосфата
(NTP). Образование и взаимопревращения других саха-
ров происходят, как правило, на уровне их N DP-произ-
водных. В отличие от этого, галактозо-1-фосфат может
синтезироваться непосредственно из галактозы с после-
дующей активацией UDP при участии UDP-глюкозы; в
итоге образуются UDP-галактоза и глюкозе-1-фосфат.
А Рибозо-5-фосфат
5 -Фосфо рибоз ил-1 - п и рофосфат (ФРПФ)
+HX-R
(HX=NH)
I
Пентозо-1-XR (гликозид)
НО—СНг
он ОН
В a-D-глюкозо- 1-фосфат
UMP-PP РР,
НО-СН;
Урацил
о
.. II .
О — Р— О — Р— О—рибоза
ОН он
UDP-глюкоза
НО
|ОН
UMP
Г UDP-глюкоза (а-гексозо-1-NDP)
+HX-R
(НХ=НО, H2N)
Гексозо-1-XR (гликозид)
Рис. 7.22. Активация 5-фосфорибозы
присоединением пирофосфорилы :ой
группы (А) и 1-фосфосахаров присо-
единением нуклеотидильного остатка
(В). Участие активированных сахаров в
биосинтетических реакциях гликозили-
рования (Б) и (Г).
А. 1 — рибозофосфат-пирофосфокиназа.
Б. 2 — соответствующие ферменты.
В. 3 — МТР:гексозо-1-фосфат-нуклеоти-
дилтрансферазы.
Г. 4 — соответствующие ферменты.
Глава 7. Биосинтез клеточных строительных блоков 177
7.7.1. Пентозофосфатный цикл служит
основным источником
сахаров-предшественников и NADPH
Этот путь взаимопревращений сахаров можно
разделить на три этапа. На первом этапе про-
исходит окисление гексозофосфатов. Из глюкозо-
6-фосфата образуется рибулозо-5-фосфат (см.
разд. 7.4.3 о регенерации NADPH). Данная после-
довательность реакций необратима; вместе с дру-
гими реакциями она замыкается в цикл, называе-
мый окислительным пентозофосфатным циклом.
Этот путь действует также как шунт, посколь-
ку в него происходит отток глюкозо-6-фосфата из
гликолиза в тех случаях, когда клетки нуждают-
ся в NADPH; рис. 7.20). Это основной путь вос-
полнения пула NADPH и синтеза всех основных
сахаров-предшественников.
Реакции следующих двух этапов не относят-
ся к окислительно-восстановительным и полно-
стью обратимы. На втором этапе происходят
взаимопревращения пентозофосфатов: изомери-
зация (кетоза —> альдоза) рибулозо-5-фосфата
в рибозо-5-фосфат и эпимеризация (обращение
конфигурации одного из нескольких хиральных
центров молекулы Щ— СНОН—R2), т. е. изоме-
ризация особого типа, например рибулозо-5-фос-
фата в ксилулозо-5-фосфат. На третьем этапе
осуществляются взаимопревращения других фос-
фосахаров. Из ксилулозо-5-фосфата и рибозо-
5-фосфата при циклической регенерации гексо-
зо-6-фосфатов (например, фруктозо-6-фосфата)
образуется эритрозо-4-фосфат — один из основ-
ных метаболитов-предшественников. Эти реак-
ции катализируют трансальдолаза и тиаминпиро-
фосфат-зависимая транскетолаза. Транскетолаза
переносит остаток гликолевого альдегида
(Сг-фрагмент; происходит из атомов С1 и С2 до-
нора— кетозофосфата) в 1 положение молекулы
акцептора — альдозофосфата (см. гл. 8). Тран-
сальдолаза в свою очередь переносит на альдо-
зофосфат остаток дигидроксиацетона (Сз-едини-
ца; происходит из С1-СЗ-атомов кетозофосфата).
Реакции превращения трех молекул пентозо-5-
фосфата в две молекулы гексозо-6-фосфата и
одну молекулу триозо-3-фосфата изображены на
рис. 7.20.
Данные реакции обратимы, и благодаря это-
му они обеспечивают также синтез фосфатов С4-
и Св-сахаров из фруктозо-6-фосфата и глицер-
альдегид-3-фосфата, если образование NADPH
происходит в других реакциях (см. разд. 7.4.3).
По этому же механизму многие бактерии пре-
вращают пентозофосфаты в гексозо-6-фосфаты.
У большинства бактерий, способных расти с ис-
пользованием гексоз, действуют одновременно и
основной путь расщепления углеводов (напри-
мер, гликолиз и/или путь Энтнера-Дудорова), и
окислительный пентозофосфатный путь, необхо-
димый для образования NADPH и пентозофос-
фатов. Относительный вклад этих путей опре-
деляется наличием других реакций, в которых
образуется NADPH, и потребностью в пентозо-
фосфатах. Обладание таким набором обратимых
реакций обеспечивает высокую гибкость микроб-
ного метаболизма — связанные взаимопревраще-
ниями фосфосахара образуют общий пул как ис-
точник необходимых предшественников.
7.7.2. В метаболизме участвует лишь несколько
основных 1-фосфосахаров
Эти 1-фосфосахара образуются из центральных
метаболитов-предшественников (рис. 7.2) в про-
стых реакциях (рис. 7.21). Взаимопревращения
альдозофосфатов и кетозофосфатов (например,
фруктозо-6-фосфата и маннозо-6-фосфата, глю-
козо-6-фосфата и фруктозо-6-фосфата) происхо-
дят под действием изомераз. Перенос фосфата
от Сб-атома гексозы к Cl-атому (например, пре-
вращение глюкозо-б-фосфата в глюкозо-1-фос-
фат) осуществляют мутазы; при этом образование
альдозо-1-фосфата (в котором связь с фосфатом
гликозидная) происходит с затратой энергии.1
Тем не менее эти реакции взаимопревращений са-
харов в принципе обратимы и могут быть как ка-
таболическими, так и анаболическими. Обычно из
гексозо-6-фосфатов образуется лишь небольшое
число основных 1-фосфосахаров (таких, как глю-
козе-1-фосфат, маннозо-1-фосфат, N-ацетилглю-
козамин-1-фосфат и галактозе-1-фосфат). Синтез
аминосахаров происходит путем трансаминирова-
ния в реакции с глутамином, например фрукто-
зо-6-фосфата с образованием глюкозамин-6-фос-
фата. Донором ацетильной группы при образо-
вании N-ацетилглюкозамина служит ацетил-СоА.
Реакции превращения 1-фосфосахаров в нуклео-
тидсахара (активированные сахара) относятся к
необратимым.
1 См. прим, на с. 175.
178 Часть II. Основы жизнедеятельности микробных клеток
7.7.3. Для последующих превращений и
участия в биосинтетических реакциях
фосфосахара должны быть активированы
Для повышения реакционноспособности фосфо-
сахаров, т. е. их способности образовывать в ре-
акциях биосинтеза гликозидные связи, они под-
вергаются активации путем введения в моле-
кулу легкоуходящей группы. Рибозо-5-фосфат
активируется присоединением к С 1-группе пи-
рофосфорильной группы от нуклеозидтрифосфа-
та (NTP) с высвобождением NMP (рис. 7.22, Л),
1-фосфосахара — присоединением нуклеотидного
остатка из NTP с высвобождением PPj (рис. 7.21
и 7.22, В).
Перенос пирофосфорильной группы □
В активированной форме рибозо-5-фосфат пред-
ставляет собой 5-фосфо-а-рибозо-1-пирофосфат
(ФРПФ), в котором уходящей группой слу-
жит пирофосфорил. Пирофосфорильная группа
ФРПФ происходит из (3- и 7-фосфатных остат-
ков АТР; синтез ФРПФ из рибозо-5-фосфата и
АТР катализирует рибозофосфатпирофосфоки-
наза или ФРПФ-синтетаза (рис. 7.22, А). ФРПФ
служит общим субстратом для ферментов, ка-
тализирующих образование /3-гликозидных свя-
зей с участием активированной С 1-группы рибо-
зы (рис. 7.22, В).
Перенос нуклеотидильного остатка □
Альдогексозы активируются присоединением к
Cl-группе остатка пуклеозиддифосфата (NDP)
в качестве легкоуходящей группы. Образование
NDP-гексоз из гексозо-1-фосфата и NTP (с выде-
лением PPj) катализирует ПТР:гексозо-1-фосфат-
нуклеотидилтрансфераза (рис. 7.22, В). Равнове-
сие этой реакции сдвинуто в сторону образова-
ния NDP-сахаров вследствие распада ее продук-
та РР, на два Pj. Свободная энергия высоко-
энергетической связи в NDP-гексозах составляет
примерно —33 кДж, и ее достаточно для образо-
вания связей при синтезе нуклеотидов и углевод-
содержащих полимеров (рис. 7.22, В). (Свобод-
ная энергия N- и О-гликозидных связей рав-
на примерно — 20 кДж/моль, свободная энергия
фосфоэфирных связей в таких соединениях, как
глюкозо-6-фосфат, — примерно —14 кДж/моль.)
Четвертый этап взаимопревращений углево-
дов — использование NDP-сахаров для образова-
ния сложных углеводов путем переноса глико-
зильного остатка (рис. 7.22, Г) или участие дру-
гих углеводов-предшественников — рассмотрен в
разд. 7.9. Основные реакции переноса гликозиль-
ного остатка показаны на рис. 7.28.
Регуляция □ Все этапы синтеза сахаров-
предшественников, протекающие со значитель-
ным выделением энергии, строго регулиру-
ются. Окислительный пентозофосфатный
цикл. Фермент первой реакции цикла, глюко-
зо-6-фосфатдегидрогеназу, ингибирует NADPH.
ФРПФ-синтетаза. ФРПФ служит субстратом
примерно для 12 ферментов, участвуя, напри-
мер, в синтезе пуриновых и пиримидиновых
нуклеотидов, гистидина, триптофана и никотин-
амид-содержащих коферментов. Поэтому ФРПФ-
синтетазная реакция строго регулируется и на
уровне активности, и на уровне синтеза фермен-
та. Активность ПТР:гексозо-1-фосфат-нуклеоти-
дилтрапсфераз (называемых также NDP-гексозо-
пирофосфорилазами) строго регулируется по ме-
ханизму обратной связи.
7.8. Строительными блоками для синтеза нуклеиновых кислот
служат рибонуклеотиды и дезоксирибонуклеотиды
Нуклеиновые кислоты (РНК и ДНК) составля-
ют до 20% сухого вещества микробных клеток.
В состав их рибонуклеотидов и дезоксирибонук-
леотидов входят пуриновое или пиримидиновое
основание, остаток рибозы или дезоксирибозы и
фосфатные группы. 2-Дезоксирибонуклеотиды
образуются путем восстановления рибонуклеоти-
дов в реакции, катализируемой рибонуклеотидре-
дуктазой. Синтез всех нуклеозидтрифосфатов, за
исключением СТР, происходит из соответству-
ющих нуклеозидмонофосфатов. Остаток пенто-
зы всегда образуется из ФРПФ, однако включе-
ние ФРПФ в состав предшественников различных
нуклеотидов происходит на разных этапах синте-
за. Так, при синтезе пуринов к ФРПФ присоеди-
няются различные группы с образованием гете-
Глава 7. Биосинтез клеточных строительных блоков 179
Рис. 7.23. Происхождение атомов в соста-
ве предшественников пуриновых и пирими-
диновых нуклеотидов, IMP и UMP соответ-
ственно. A. IMP. Б. UMP.
рецикла. Напротив, при биосинтезе пиримидинов
рибозофосфат из ФРПФ присоединяется к уже
сформированному гетероциклу.
Рибонуклеотиды входят как мономеры в со-
став РНК и служат предшественниками моно-
меров, образующих ДНК, а также входят в со-
став многих коферментов. мРНК метаболически
нестабильна; с этим связана высокая скорость
оборота ее молекул и соответственно высокая по-
требность в нуклеозидтрифосфатах. Регенерация
их происходит в основном из нуклеозидмонофос-
фатов— продуктов расщепления мРНК. Образо-
вание стабильных форм РНК и ДНК требует син-
теза нуклеотидов de novo.
Нуклеозидмонофосфаты и нуклеозиддифос-
фаты (NMP, NDP) образуются в клетках с вы-
сокой сиростью в результате использования клет-
ками NTP в качестве высокоэнергетических со-
единений и переносчиков фосфата. Как NMP, так
и NDP могут фосфорилироваться АТР под дей-
ствием нуклеотид-специфичных NMP-киназ (на-
пример, GMP киназы) и NDP-киназ (например,
GDP-киназы). Оба типа киназ фосфорилируют
также dNMP и dNDP соответственно. Кроме того,
взаимопревращения адениннуклеотидов катали-
зирует фермент аденилаткиназа (см. разд. 7.4.2).
Пути синтеза пуриновых и пиримидиновых нук-
леотидов существенно различаются; структурные
формулы предшественников пуринов и пирими-
динов представлены на рис. 7.23.
Дополнение 7.7. Рибонуклеотиды и
дезоксирибонуклеотиды состоят их трех
компонентов: 1) азотистого основания (пу-
ринового или пиримидинового; к пуринам
относятся аденин и гуанин, к пиримиди-
нам—цитозин, тимин и урацил); 2) рибозы
или 2-дезоксирибозы; азотистые основания,
связанные с Cl-атомом (дезокси)пентозы,
называют нуклеозидами, точнее рибонук-
леозидами или дезоксирибонуклеозидами, и
сокращенно обозначают буквами: А — адено-
зин, G — гуанозин, С — цитидин, Т — тими-
дин и U — уридин; для обозначения соответ-
ствующих дезокси-производных к ним добав-
ляют букву d (например, dA) и 3) моно-,
ди- или трифосфатной группы, присоединен-
ной к 5'-группе рибозы (цифра со штри-
хом означает, что нумерация ведется в
углеводном фрагменте, а не в гетероцик-
ле; нумерация атомов, принятая для азоти-
стых оснований, приведена на рис. 7.23). Все
моно-, ди- и трифосфаты нуклеозидов (на-
пример, AMP, ADP, АТР и соответствующие
дезокси-производные) называют нуклеоти-
дами (рибонуклеотидами или дезокси-
рибонуклеотидами), пуриновыми или пи-
римидиновыми. ДНК отличается от РНК по
химическому составу тем, что содержит вме-
сто рибозы дезоксирибозу и вместо уридина
тимидин.
7.8.1. Пуриновые рибонуклеотиды
синтезируются в несколько этапов
из активированного рибозо-5-фосфата
Пуриновый гетероцикл образуется в поразитель-
ной по своей сложности последовательности из
десяти реакций поэтапным присоединением к ак-
тивированной форме рибозо-5-фосфата, 5-фос-
форибозил-1-пирофосфату, различных функцио-
нальных групп: остатка глицина, аминогрупп из
глутамина и аспартата, Ci-фрагментов (метени-
ла и формила) и СОг (рис. 7.24). В первой
реакции аминирования происходит обращение
конфигурации С1-атом а рибозы — превращение
а-иземера и /3-форму. В ходе реакций вначале за-
мыкается имидазольный гетероцикл, затем пири-
мидиновый. Общим промежуточным соединени-
180 Часть II. Основы жизнедеятельности микробных клеток
5 -Фосфорибозил-1 -
пирофосфат
АМР
СМР
NH2________
Рибозо-5-(р)
Аденозин-5'-монофосфат
| 5'-Фосфорибозмл|амин
| Рибозо-5-(?) |
| [-Глицинамид
@^CH^F
Инозин-5’-монофосфат (IMP)
| |-4-Карбоксамид-5-формаминоимидазол
ОН
Ксантозин-5'-монофосфат (ХМР)
Gln-NH
н
с—н
^|-4-Кар6оксамид-5-аминоимидазол (AICAR)
АМР-РР
| Рибозо-5-(р) |
| |~/У-Формилглицинамид
С—Н
Н
ADP+Pj
ADP-P
| |- 5 -Ам ин о и м и дазол-4 - карбоновая кислота
| Рибозо-5-(р) |
| 5'-Фосфори6озил
Рис. 7.24. Синтез пуриновых нуклеотидов (АМР и GMP). 1 — амидофосфорибозилтрансфераза; 2 — фосфорибо-
зилглицинамид-синтетаза; 3 — фосфорибозилглицинамид-формилтрансфераза; 4 — фосфорибозилформилглицин-
амидин-синтетаза; 5 — фосфорибозиламиноимидазол-синтетаза; б — фосфорибозиламиноимидазол-карбоксилаза;
7 — фосфорибозиламиноимидазол-сукцинокарбоксамид-синтетаза; 8 — аденилосукцинат-лиаза (бифункциональный
фермент, идентичный ферменту 12); 9 — фосфорибозиламиноимидазолкарбоксамид-формилтрансфераза; 10 —
IMP-циклогидролаза; 11 — аденилосукцинат-синтетаза; 12 — тот же фермент, что и 8; 13 — IMP-дегидрогеназа; 14 —
GMP-синтетаза.
Глава 7. Биосинтез клеточных строительных блоков 181
ем в синтезе пуриновых рибонуклеотидов служит
ипозип-б^монофосфат (IMP), содержащий азоти-
стое основание гипоксантин (6-гидроксипурин).
После образования IMP пути синтеза АМР и GMP
расходятся: аминирование IMP в положении 6
приводит к образованию аденозинмонофосфата,
окисление IMP в положении 2 до ксантозинмо-
нофосфата (ХМР; азотистое основание ксантин)
и аминирование этого продукта (также по С2) —
к образованию гуанозинмонофосфата. При после-
дующем их фосфорилировании образуются соот-
ветственно ADP и GDP и затем АТР и GTP. Эти
нуклеотиды в свою очередь служат предшествен-
никами ряда эффекторных молекул и алармонов,
таких как с АМР (циклический АМР) или ppGpp
(гуанозин-б'-дифосфат-З'-ди фосфат).
Регуляция □ Первую реакцию синтеза пу-
риновых нуклеотидов, аминирование ФРПФ, ин-
гибируют АМР и GMP (по механизму обратной
связи). Здесь необходимо отметить, что синтез пу-
ринов связан с синтезом гистидина.
7.8.2. Пиримидиновые рибонуклеотиды
синтезируются из аспартата
и карбамоилфосфата
Синтез пиримидиновых нуклеотидов включает
три этапа (рис. 7.25); 1) образование из аспар-
тата и карбамоил фосфата общего предшествен-
ника пиримидинов — оротата (пиримидин, заме-
щенный двумя гидроксильными и одной карбок-
сильной группами); 2) присоединение к оротату
5-фосфорибозил-1-пирофосфата и декарбоксили-
рование продукта с образованием уридинмоно-
фосфата (UMP) и 3) фосфорилирование UMP до
UTP; последующее аминирование UTP приводит
к образованию СТР. Происхождение отдельных
атомов UMP показано на рис. 7.23.
|Рибозо-5-© ©© |
Цитидин-
трифосфат
(СТР)
UMP©©"»
Уридин-
трифосфат
(UTP)
ADP-P
Оротидин-
монофосфат
Рис. 7.25. Синтез пиримидиновых нуклеотидов. 1 — аспартат-карбамоилтрансфераза; 2 — дигидрооротаза; 3 —
дигидрооротат-дегидрогеназа; 4 — оротат-фосфорибозилтрансфераза; 5 — оротидин-5-фосфат-декарбоксилаза; 6 —
нуклеозидмонофосфаткиназа; 7 — нуклеозиддифосфаткиназа; 8 — СТР-синтаза. Синтез карбамоил фосфата (КАФ)
описан в разд. 7.3.1.
182 Часть II. Основы жизнедеятельности микробных клеток
Регуляция (см. рис. 19.3) □ Ферменты, ката-
лизирующие три стратегически важные реакции
биосинтеза пиримидинов — карбамоилфосфат-
синтаза, аспартат-карбамоилтрансфераза и СТР-
синтаза — подвержены аллостерической регуля-
ции. По-видимому, наиболее изучена в отношении
регуляции аспартат-карбамоилтрансфераза (на-
зываемая также (аспартат]транскарбамоилазой).
Этот фермент эволюционно родствен орнитин-
карбамоилтрансферазе, ферменту биосинтеза ар-
гинина.
7.8.3. 2,-Дезоксирибонуклеотиды образуются
путем восстановления рибонуклеотидов
Мономеры, составляющие ДНК, 2,-дезоксирибо-
нуклеотиды, образуются из рибонуклеотидов (ри-
бонуклеозиддифосфатов или рибонуклеозидтри-
фосфатов) в сложной восстановительной реак-
ции, катализируемой рибонуклеотидредуктазой
(рис. 7.26). Активность этого фермента зависит
от В12 и у ряда микроорганизмов от железа. Из-
вестно по меньшей мере пять его типов, и все
их реакции строго регулируются многими спосо-
бами. Механизм реакции включает образование
свободных радикалов. Донором электронов, как
правило, служит восстановленный тиоредоксин —
низкомолекулярный дитиолсодержащий пептид,
регенерация которого осуществляется при уча-
стии NADPH. Фосфорилирование дезоксинуклео-
зиддифосфатов с участием АТР приводит к об-
разованию соответствующих трифосфатов. Один
из образующихся дезоксинуклеотидов, дезокси-
уридинтрифосфат (dUTP), не входит в состав
ДНК. Его превращения необычны — вначале он
гидролизуется с образованием dUMP пирофосфа-
тазой и затем dUMP метилируется до dTMP в
тимидилатсинтазной реакции (рис. 7.26). Особен-
ность этой реакции состоит в том, что метилентет-
рагидрофолиевая кислота (переносчик формаль-
дегида) служит донором метиленовой группы и
одновременно восстанавливает ее до уровня ме-
тильной за счет окисления переносчика — тет-
рагидрофолата —до дигидрофолата. Регенерация
тетрагидрофолата, необходимая для переноса на
него нового Ci-фрагмента, осуществляется с
участием дигидрофолатредуктазы. Образование
dTTP может происходить и другими путями.
Рис. 7.26. Синтез дезоксирибонуклеотидов. 1 — рибону-
клеотидредуктаза; 2 — тиоредоксинредуктаза; 3 — тими-
дилатсинтаза; 4 — дигидрофолатредуктаза; 5 — dUTP-
пирофосфатаза или dUDP-фосфатаза. H4F—тетрагид-
рофолат; H2F — дигидрофолат.
7.8.4. Нуклеозиды и азотистые основания
используются для регенерации
нуклеотидов
Микробные клетки содержат набор так называе-
мых ферментов регенерации, выполняющих три
функции: 1) использования азотистых оснований
или нуклеозидов, присутствующих в среде, (по-
глощение их происходит путем активного транс-
порта) для синтеза нуклеотидов, 2) использова-
ние пентоз и азотистых оснований в качестве ис-
точников углерода, энергии и азота (нуклеотиды
очень редко поглощаются клетками; обычно они
дефосфорилируются до нуклеозидов периплазма-
тическими 5'-нуклеотидазам и и фосфатазами (см.
разд. 7.3.2) и 3) реутилизации азотистых основа-
ний и нуклеозидов — продуктов эндогенного обме-
на нуклеотидов (а также сигнальных соединений,
таких как с АМР или ppGpp). Все три функции
механизмов реутилизации выгодны для клеток,
так как снижают необходимость синтеза соответ-
ствующих клеточных компонентов de novo благо-
даря различным регуляторным эффектам.
Пути регенерации, включающие в том чис-
ле расщепление компонентов нуклеиновых кис-
лот, существенно варьируют у различных бакте-
Глава 7. Биосинтез клеточных строительных блоков 183
Рис. 7.27. Некоторые реакции реутилизации и
взаимопревращений компонентов нуклеиновых
кислот. 1 — пурин-фосфорибозилтрансферазы;
2 — нуклеозидфосфорилазы; 3 — нуклеозидки-
назы; 4—NMP-нуклеозидазы.
рий. Наиболее распространенные реакции можно
сгруппировать следующим образом (рис. 7.27).
1. Взаимодействие азотистых оснований с
С1-активированным пентозо-5-фосфатом —
ФРПФ, катализируемое фосфорибозилтранс-
феразами. Эта типичная реакция использова-
ния азотистых оснований в биосинтетических
процессах сильно сдвинута в направлении об-
разования нуклеотидов.
2. Взаимопревращения азотистых оснований и
(дезокси )нуклеозидов под действием нук-
леозидфосфорилаз, которые можно рассмат-
ривать как замену N-гликозидной связи
на эфирную (образование рибозо-1-фосфата);
константа равновесия таких реакций близка к
единице.
3. Фосфорилирование (дезокси) нуклеозидов до
(дезокси) нуклеозидмонофосфатов под дей-
ствием нуклеозидкиназ. Эти реакции сильно
сдвинуты в направлении образования нуклео-
тидов. Реакции (2) и (3) служат альтернатив-
ными реакции (1) механизмами синтеза NMP
из азотистых оснований. Использование неко-
торыми бактериями экзогенных оснований —
тимина или тимидина — позволяет специфи-
чески метить ДНК.
4. Гидролиз гликозидной связи NMP, катализи-
руемый нуклеозидазами.
5. Катализируемые различными специфически-
ми киназами реакции фосфорилирования,
описанные выше.
6. Взаимопревращения различных азотистых ос-
нований. Хотя последние этапы синтеза нук-
леотидов необратимы, существуют пути их
обхода, например дезаминирование цитози-
на в свободной форме или в составе (дезок-
си) цитидина приводит к образованию урацила
или (дезокси)уридина соответственно. Сход-
ные взаимопревращения характерны также
для адениновых и гуаниновых соединений; на-
пример, дезаминирование и последующее вос-
становление аденина (6-аминопурина) в (дез-
окси) аденозине приводит соответственно к об-
разованию гипоксантина в свободной форме
или в составе IMP. Общий предшественник пу-
риновых нуклеотидов, IMP, может также об-
разовываться из GMP (гуанин представляет
собой 6-амипо-2-оксипурин) в результате его
дезаминирования и восстановления в положе-
нии 2. Эти реакции осуществляются также
при расщеплении пуринов (см. разд. 9.15 и
12.2.4).
7. Рециклизация АИКАР, образуемого при син-
тезе гистидина (рис. 7.19). АИКАР служит
предшественником пуриновых нуклеотидов;
в несколько этапов он превращается в IMP
(рис. 7.24).
184 Часть II. Основы жизнедеятельности микробных клеток
7.9. Сахара и нуклеотидсахара служат важными строительными блоками
Сахара и аминосахара выполняют в микробном
метаболизме не только роль основных энергети-
ческих субстратов, но служат также важными
строительными блоками при синтезе многих по-
лимерных углеводов и липидов, образующих ан-
тигенные компоненты клеточной поверхности у
прокариот. К таким веществам относятся, напри-
мер, компоненты клеточной стенки большинства
бактерий и архей, липополисахариды грамотри-
цательных бактерий, тейхоевые и липотейхоевыс
кислоты в составе поверхности грамположитель-
ных бактерий, гликопротеиновые компоненты по-
верхности, полисахариды и капсульный матери-
ал, гомополимер N-ацетилнейраминовой кислоты
и гликолипиды. Гликаны клеточной поверхности
могут образовывать гликокаликс (см. разд. 23.5).
Полимеры глю козы служат внутриклеточными
запасными веществами. Структурные полисаха-
риды прокариот весьма разнообразны, хотя и по-
строены из сходных мономеров; они могут слу-
жить достоверными маркерами для установления
филогенетических связей.
7.9.1. Реакции взаимопревращений углеводов
разнотипны
Взаимопревращения сахаров можно разделить на
две группы: реакции с участием фосфорилиро-
ванных сахаров и реакции с участием сахаров, ак-
тивированных присоединением нуклеозиддифос-
фата (NDP). Реакции первого типа, а также ак-
тивация рибозо-5-фосфата с образованием ФРПФ
и превращение 1-фосфосахаров в нуклсотидсаха-
ра рассмотрены выше (см. разд. 7.7). Нуклеотид-
сахара образуются, как правило, лишь из немно-
гих основных 1-фосфосахаров-предшественников,
таких как глюкозо-1-фосфат, машюзо-1-фос-
фат, N-ацетилглюкозамин-Х-фосфат и галактозо-
1-фосфат (рис. 7.21).
7.9.2. NDP-caxapa выполняют роль
интермедиатов при синтезе углеводов
В этом разделе мы опишем превращения
нуклеотид-активированных сахаров. Они обра-
зуются в процессе полимеризации фосфосаха-
Сахар-1—» О-R (сахар)
(например,
дисахарид,
олигосахарид,
полисахарид)
Сахар-1----» "Css
NMP Липид-РР-сахар
(промежуточное
соединение)
| NDP-caxap |
NDP
Сахар-1---» NH-R (белок)
Гликопротеины
Рис. 7.28. Перенос активированных сахаров на акцеп-
торы.
ров, протекающей в три этапа: 1) актива-
ция 1-фосфосахаров путем присоединения остат-
ка NTP с образованием NDP-сахаров (катали-
зируемая пирофосфорилазами); 2) модификация
нуклеотид (NDP)-caxapoB, например в реакциях
эпимеризации или синтеза дезоксисахаров (ка-
тализируемых эпимеразами и редуктазами соот-
ветственно) и 3) перенос гликозильного остат-
ка от нуклеотидсахаров (гликозилтрансфераза-
ми) па соответствующие акцепторы (рис. 7.28).
В процессе синтеза сложных углеводных
полимеров нуклеозиддифосфатсахара участву-
ют в качестве 1) интермедиатов при образо-
вании большинства углеводных строительных
блоков; 2) предшественников или активирован-
ных мономеров (допоров гликозильного остат-
ка) и 3) регуляторных медиаторов внутрикле-
точной сортировки сахаров-предшественников.
Ферменты, катализирующие активацию саха-
ров путем присоединения нуклеотидного остатка
к 1-фосфосахарам — NTP-гeкcoзo-l-фocфaт-нyк-
леотидилтрансферазы (NDP-гексозо-пирофосфо-
рилазы), специфичны не только к моносахари-
ду, но и к типу NTP (рис. 7.22, В). От ти-
па нуклеотида зависят дальнейшие превращения
сахара: ADP-глюкоза используется у большин-
ства бактерий для синтеза гликогена, в то вре-
мя как UDP-глюкоза служит предшественником
при синтезе пептидогликана и липополисахарида.
Следовательно, нуклеотидсахара функциониру-
ют как регуляторные молекулы-посредники, на-
правляя сахара (даже одного типа) в различ-
ные процессы синтеза углеводсодержащих поли-
меров. Благодаря этому возможен независимый
Глава 7.Биосинтез клеточных строительных блоков 185
Рис. 7.29. Типичные реакции взаи-
мопревращений нуклеотидсахаров.
А. Окисление с образованием уро-
новых кислот
Б. Эпимеризация.
В. Восстановление до дезоксиса-
харов.
контроль метаболизма углеводов путем аллосте-
рической регуляции активности пирофосфорилаз,
катализирующих образование NDP-сахаров (см.
разд. 19.4.2).
Взаимопревращения сахаров □ Некото-
рые взаимопревращения сахаров происходят на
уровне их фосфорных эфиров (рис. 7.21). Та-
ким путем образуется несколько основных 1-фос-
фосахаров, из которых затем синтезируются ос-
новные нуклеотидсахара. Значительно большую
группу составляют NDP-caxapa, образовавшие-
ся из этих основных и подвергаемые различным
взаимопревращениям (рис. 7.29). Неожиданным
образом большинство этих реакций зависит от
NAD+. Это закономерно в случае таких реак-
ций, как образование уроновых кислот путем
окисления сахара в два этапа по Сб-атому де-
гидрогеназами, когда NAD+ служит акцептором
электронов (рис. 7.29, А). Однако в реакциях
эпимеризации, в образовании дезоксисахаров или
синтезе сахаров с разветвленной цепью также
участвует NAD+, связанный с ферментом и опо-
средующий внутримолекулярный перенос водо-
рода, предшествующий превращению. При этом
окисление приводит к образованию оксосахара,
который далее может претерпевать различные пе-
рестройки и затем восстанавливается с сохранени-
ем или обращением конфигурации ОН-группы.
Эпимеризация (обращение конфигура-
ции одного из хиральных центров молекулы
RiR^HC—ОН) протекает с промежуточным окис-
лением гидроксильной группы до оксогруппы
(RiR2C=O) и последующим ее восстановлени-
ем с обращением конфигурации (рис. 7.29, Б).
Примеры такого превращения — эпимеризация
остатка глюкозы в положении 4 (UDP-глюкоза —>
UDP-галактоза), катализируемая UDP-глюкозо-
4-эпимеразой, и в положении 2 (UDP-глюкоза
—> UDP-манноза) под действием НОР-глюкозо-2-
эпимеразы. Образование 6-дезоксигексоз про-
исходит в три этапа (рис. 7.29, В): 1) окисление
гидроксильной группы у С4-атома до оксогруп-
пы (С=0), за которым следует дегидратация в
положении 6 и восстановление образовавшейся
при этом =СН2-группы до метильной, 2) эпи-
меризация с образованием ендиола в качестве
промежуточного продукта и 3) восстановление до
дезоксигексозы.
186 Часть II. Основы жизнедеятельности микробных клеток
7.9.3. Для присоединения к акцепторам
на поверхности клеток активированные
сахара переносятся через мембрану
Перенос на акцепторные субстраты
(рис. 7.28) □ В реакции гликозилирования ак-
цепторной группой часто выступает ОН-группа
в положении 4 или 6 (реже 3 или 2) альдозы-
акцептора; в случае кетоз (в форме кеталя) —
ОН-группа в положении 2. Акцепторный суб-
страт X-R —это нуклеофил, который атакует
связь между С1-атомом активированного саха-
ра и атомом кислорода, расщепляя ее, причем
часто с обращением конфигурации (превращени-
ем о-изомера в /?-форму). В качестве примеров
можно привести синтез дисахаридов, полисахари-
дов и углеводных компонентов гликопротеинов, а
также механически сходную с ними реакцию об-
разования 5-фосфорибозил-1-/3-амипа из 5-фос-
форибозил-1-пирофосфата (ФРПФ; при синтезе
пуринов). Группа — ОРР представляет собой эф-
фективную легкоуходящую группу в отличие от
малоактивной в этом отношении С1-гидроксиль-
ной группы (см. рис. 7.22); кроме того, при-
сутствие пирофосфорила в молекуле блокирует
раскрытие цикла, возможное в полуацетальной
структуре.
Через клеточную мембрану к синтезируемым
молекулам поверхностных структур (например,
пептидогликана, липополисахарида или глико-
протеина) переносятся нуклеотидсахара, связан-
ные с липидным переносчиком (рис. 7.28),
или липид-связанные олигосахариды, синтези-
рованные путем последовательного присоедине-
ния нуклеотидсахаров к первому связавшемуся
с липидом сахарному остатку. Таким образом
осуществляется проникновение водорастворимых
сахаров и олигосахаридов в активированной фор-
ме через липидный бислой плазматической мем-
браны. Переносчиками служит иолиизопреноид-
ныс мембранные липиды С55-С60 (рис. 7.30), к
которым сахар или олигосахарид присоединяется
через пирофосфатный мостик у С 1-атома. Высо-
коэнсргетическая связь обеспечивает перенос са-
хара или олигосахарида от этих промежуточных
соединений на конечный акцептор. У микробов
функционируют в качестве таких липидных пе-
реносчиков ундекапренолфосфат (содержит 11
изопреновых единиц; участвует в синтезе пепти-
догликана и полисахаридов) и долихолфосфат
(в его молекуле двойная связь в первом изопрено-
Рис. 7.30. Структура ундекапренол-(бактопренол)фос-
фата. Изопреноидные мембранные Сбб-липиды служат
остовом для синтеза олигосахаридов и переносят их
с участием ABC-переносчиков через плазматическую
мембрану на акцепторные молекулы — компоненты кле-
точной стенки (пептидогликан, липополисахариды, кап-
сульные полисахариды и тейхуроновые кислоты). Сход-
ный по строению изопреноид долихолфосфат аналогич-
ным образом участвует в синтезе и переносе олигосаха-
ридов на внеклеточные полипептиды для образования
гликопротеинов.
идиом остатке восстановлена; участвует в синтезе
гликопротеинов). Это еще один механизм сорти-
ровки для направления сахаров к участкам син-
теза различных внеклеточных полимеров.
7.9.4. Гексозамины служат основными
строительными блоками при синтезе
структурных полисахаридов
клеточной стенки
Синтез пептидогликана и липополисахаридов
подробно описан в гл. 23. Мономерными ком-
понентами пептидогликана (муреина) служат
^ацетил-В-глюкозамин и N-ацетилмурамовая
кислота (рис. 7.31). Их синтез начинается с
аминирования фруктозо-6-фосфата у С2-атома с
помощью глутамина с образованием глюкозамин-
6-фосфата, который претерпевает N-ацетилирова-
ние и затем мутазную реакцию, превращаясь в
N-ацетил-В-глюкозамин- 1-фосфат (см. рис. 7.21).
Последний активируется при участии UTP с обра-
зованием и1ЭР-К-ацетил-В-глюкозамина (ср.
рис. 7.22, В) — строительного блока для синте-
за муреина и псевдомуреина, а также липида
А липополисахаридов. Вторым предшественни-
ком бактериального муреина служит эфир аце-
тилглюкозамина и молочной кислоты — N-ацетил-
мурамовая кислота. При ее синтезе образуется
простая эфирная связь между UBP-N-ацетилглю-
козамином и фосфоеншшируватом (содержащим
активированный енольный гидроксил) с последу-
I лава /.Ьиосинтез клеточных строительных блоковIBf
UDPNAc-
D-глюкозамин
L-Ala
D-Clu
мезо- DAP
UDP-N-Ac-
мурамовая кислота
L-Ala
i
D-Clu
I
мезо-DAP
2 L-Ala
2 D-Ala
ATP D-Ala
(8) D-Ala
Синтез псевдомуреина (компонент клеточной
стенки у некоторых метаногенных архей)
D-Clu
meso-DAP
D-Ala
D-Ala
Рис. 7.31. Синтез предшественников пептидогликана (мурамовой кислоты и пептидов), псевдомуреина и муреи-
на. А. Синтез предшественников пептидогликана: 1 — UDP-N-ацетилглюкозамин-З-енолпирувилэфир-синтаза; 2 —
UDP-N-ацетиленолпирувилглюкозамин-редуктаза; 3-5 — ферменты, катализирующие присоединение индивидуаль-
ных аминокислот; б — фермент, присоединяющий О-аланил-О-аланин; 7 — аланинрацемаза; 8 — О-аланил-О-аланин-
синтетаза. Б. Синтез псевдомуреина у некоторых метаногенных архей. В. Синтез муреина (у бактерий). При обра-
зовании гликозидной связи между UDP-N-Ac-D-глюкозамином и ацетилмурамовой кислоты последняя связана с
липидным переносчиком (см. гл. 23). Пептидогликановая цепь и образование пептидной связи между соседними
пептидами изображены во вставке. Мезо-DAP — мезо-диаминопимелиновая кислота; G — N-ацетил-О-глюкозамин;
М — N-ацетилмурамовая кислота; Т—М-ацетил-Ь-талозаминуроновая кислота. Аминокислотные остатки обозначе-
ны кружками. Стрелки, обозначающие пептидные связи в А, указывают направление: карбоксильная группа —»
аминогоуппа.
188 Часть II. Основы жизнедеятельности микробных клеток
ющим восстановлением остатка ФЕП до остат-
ка молочной кислоты (рис. 7.31, Л). К карбок-
сильной группе остатка молочной кислоты при-
соединяются L- и D-аминокислоты, а также D-
аланил-Р-аланип. При этом образование каждой
амидной связи сопряжено с гидролизом АТР для
активации растущей цепи, по-видимому, через
фосфорилирование концевого остатка. В итоге
синтезируется второй строительный блок для син-
теза пептидогликана — UDP-N-ацетилмурамо-
вая кислота с присоединенным пентапепти-
дом (рис. 7.31, В) (о сборке пептидогликана см.
разд. 23.1).
У Methanobacteriales клеточную стен-
ку образует псевдомуреин □ Археи отлича-
ются по строению клеточной стенки от бакте-
рий; кроме того, ее состав варьирует внутри то-
го и другого доменов. Для Methanobacteriales
характерен пептидогликан, называемый псев-
домуреином (рис. 7.31, Б). Он подобен муре-
ину, однако синтезируется из других активи-
рованных нуклеотидами соединений. Различия
между псевдомуреином и муреином состоят в
следующем: 1) в состав псевдомуреина входят
только L-аминокислоты; 2) вместо N-ацстил-
мурамовой кислоты псевдомуреин содержит
N-ацетил-Е-талозаминуроновую кислоту;
3) в процессе синтеза псевдомуреина происхо-
дит образование UDP-дисахарида, в котором
UDP-N-ацетилглюкозамин (или галактозамин)
соединен с N-ацетилталозаминуроновой кисло-
той /3-(3 —> 1), а не /3-(1 —> 4)-связью; 4) далее к
UDP-дисахариду присоединяются L-аминокисло-
ты; для образования амидной связи между пер-
вой аминокислотой олигопептида (L-глутаматом)
и уроновой кислотой глутамат активируется UDP
(при этом фосфат связан с а-ИЩ-группой связью
Р—N!). Далее происходит последовательное при-
соединение молекул UDP-L-глутамата с обра-
зованием UDP-пентапептида. Добавление каждо-
го нового аминокислотного остатка к растущему
UDP-олигопептиду требует ATP-зависимой акти-
вации карбоксильной группы последнего амино-
кислотного остатка в цепочке.
7.9.5. В состав клеточной стенки
некоторых архей и бактерий входят
непептидогликановые компоненты
Эти компоненты представляют собой гликоза-
мин-О-гликаны, сходные с хондроитинсульфат-
ной (мукополисахаридной) частью белков со-
единительных тканей (протеогликанов) у жи-
вотных, однако не содержащие сульфата и
пептидного фрагмента. Примерами таких гли-
козаминогликанов могут служить метахондро-
итин Methanosarcina и тейхуроновые кислоты
Bacillus. Эти гликозаминогликаны синтезируются
из UDP-активированного N-ацетилгалактозамина
и UDP-глюкуроновой кислоты, которые соединя-
ются с образованием UDP-олигосахаридов, необ-
ходимых для синтеза повторяющихся олигосаха-
ридных единиц вещества клеточной стенки.
У многих архей клеточная стенка состоит
только из гликопротеинового (S) слоя, тогда
как у бактерий этот слой лежит поверх муреи-
новой клеточной стенки. Гликан в составе этого
слоя соединен с белковой частью N-гликозид-
ной связью через аминогруппу аспарагина либо
О-гликозидной связью через гидроксильную
группу серина, треонина или тирозина, входящих
в особую пептидную структуру, называемую се-
квонной. Строительными блоками повторяющих-
ся единиц в составе гликана служат NDP-олиго-
сахариды, которые образуются из NDP-сахаров
(таких, как N-ацетилглюкозамин, манноза или
галактоза) и далее подвергаются модификаци-
ям (например, частичному О-метилировапию или
ацетилированию).
Несмотря на различия в структуре, полиме-
ры, формирующие слои поверхности микробных
клеток, как правило, выполняют сходные функ-
ции — определяют форму клеток, избирательную
проницаемость, поглощение ионов и осмотиче-
скую устойчивость, обеспечивают защиту от дей-
ствия ферментов и фагоцитоза, адгезию и меж-
клеточные контакты (важные для патогенности
или формирования биопленок), а также создают
периплазматическое пространство.
Глава 7. Биосинтез клеточных строительных блоков 189
7.10. Биосинтез липидов в соответствии с их структурой весьма сложен
Строительными блоками для синтеза мембран
служат липиды (они составляют примерно 10%
сухого вещества клеток). Вместе с белками липи-
ды участвуют в транспорте, запасании энергии,
биосинтезах, экскреции и других клеточных про-
цессах. Прокариоты не синтезируют триглицери-
дов (сложные эфиры глицерола и трех молекул
жирных кислот); для них характерны несколь-
ко типов других нейтральных липидов. В ос-
новном микробные клетки содержат липиды, в
состав которых входят две связанные с глице-
ролом (липидным остовом) гидрофобные угле-
водородные цепи, входящие в липидный бислой
мембраны, и также связанная с остовом поляр-
ная группа — головка, обращенная в водную фа-
зу. В следующих разделах рассматриваются пути
синтеза фосфо- и гликолипидов, а также других
липидов, функционирующие у бактерий и архей.
Компоненты-предшественники □ Раз-
личные группы прокариот заметно различаются
по структуре и механизмам синтеза липидов, в
связи с чем липиды используются как надежные
маркеры в хемотаксономии. В состав большинства
микробных липидов входят следующие компонен-
ты: 1) глицерол фосфат, который образуется
восстановлением фосфодиоксиацетона (у архей,
это может происходить иначе; см. ниже); 2) два
углеводородных компонента, синтезируемых
из ацетил-СоА; у бактерий это С^-Сщ-жирные
кислоты, активируемые образованием тиоэфир-
пой связи с небольшим ацил-переносящим бел-
ком (АПБ) (см. рис. 7.33) и образующие затем
сложные эфиры с глицеролом; у архей в состав
липидов входят Сго-изопреноидные спирты, ак-
тивируемые присоединением пирофосфата и об-
разующие затем простые эфиры с глицеролом;
3) полярная группа, которую могут представ-
лять различные соединения (например, серин или
фосфосахар); так, в фосфолипидах с глицеро-
лом связан фосфат, в гликолипидах — глико-
зильный остаток (рис. 7.36).
7.10.1. Липиды —это наиболее разнообразные
компоненты прокариотических клеток
Липидный состав микробных клеток варьирует
как между систематическими группами прока-
риот, так у отдельно взятого организма в зави-
симости от условий, в которых происходит его
рост. Особо сложным составом липидов характе-
ризуются микобактерии. В разнообразие липид-
ного состава клеточной мембраны вносит вклад
то, что она может содержать в небольших коли-
чествах специфические липиды, такие как сква-
лен (у архей), гопаноиды (у бактерий), кароти-
ноиды и другие нейтральные липиды. Особенно-
сти липидного состава грамотрицательных бак-
терий связаны с тем, что эти организмы обла-
дают дополнительно наружной мембраной, внут-
ренний фосфолипидный слой которой сходен по
структуре с плазматической мембраной, тогда
как внешний слой образован липополисахарида-
ми. В фосфолипидном слое наружной мембране
заякорены липопротеины, связывающие эту мем-
брану с муреином клеточной стенки. Липопротеи-
ны могут быть также заякорены липидной частью
молекулы в плазматической мембране. Мно-
гие прокариоты содержат жироподобные запас-
ные вещества — жирные поли-3-гидроксикислоты
(гидроксиалкачоаты; см. разд. 7.11).
7.10.2. Большинство бактерий содержит лишь
несколько основных жирных кислот
Типы жирных кислот в составе микроб-
ных клеток □ Микробные клетки могут со-
держать С14-С18-жирные кислоты, в том числе
С14:0, С16:О» С18:0> С16:1Д9> С18:1Д11, ЦИКЛОПрОПаН-,
10-метил-С1б:о> а также 2- или 3-гидроксикис-
лоты. Эти жирные кислоты могут быть насыщен-
ными или ненасыщенными (с одной цис-двойной
связью в середине цепи). Присутствие ненасыщен-
ных жирных кислот увеличивает текучесть мем-
браны. У большинства грамположительных бак-
терий сходную функцию (адаптации к температу-
ре) выполняют жирные кислоты с разветвленной
цепью или алициклические жирные кислоты. Чем
выше содержание ненасыщенных или разветвлен-
ных жирных кислот в мембране, тем ниже тем-
пература ее плавления (т. е. перехода из твердой
фазы в жидкую). У цианобактерий присутству-
ют полиненасыщенные жирные кислоты.
С участием этих немногих типов жирных кис-
лот синтезируется небольшой набор фосфолипи-
дов (редко гликолипидов). В табл. 7.4 представ-
лен липидный состав клеток Е. coli (типичного
представителя бактерий, содержащих ненасыщен-
ные жирные кислоты) и Bacillus subtilis (организ-
ма, содержащего жирные кислоты с разветвлен-
ной цепью).
190 Часть II. Основы жизнедеятельности микробных клеток
Таблица 7.4. Типичный липидный состав грамотрицательных бактерий (на примере Е. coli) и грамположительных
бактерий (группа с низким содержанием G + С; на примере В. subtilis) в условиях роста при 37 °C
Escherichia coli1 Bacillus subtilis
Жирные кислоты; содержание, % Полярная головка; содержание, % 1 В условиях роста при 25 °C количествен рола выше в экспоненциальной фазе роста, (кардиолипина). Температура плавления некоторых жирных Пальмитиновая n-Ci6:o 45 Пальмитолеиновая ri-Cie;iA9 35 ццс-Вакценовая п-Силдп 18 Миристиновая п-С14:о 2 -Р-этаноламин 75 -Р-глицерол 18 -Р-фосфатидиглицерол 5 -Р-серин Следы ное соотношение п-С1б:1Д9 и п-Снлдн обр тогда как в стационарной фазе возрастает кс кислот: С12:0 40 °C; Сил 70 °C; Сил 13 °C ан7пегхзо-С15;о 40 li3O-C17:0 20 U3O-C15:0 15 Tl-C16:0 5 Tl-C16:l 7 -Глюкоза -Глюкозо-0-глюкоза -Р-этаноламин -Р-глицерол атное. Уровень фосфатидилглице- зличество дифосфатидилглицерола : С18:2 -5 °C.
Пути использования жирных кислот
и фосфолипидов □ Примерно 90% жирных
кислот (в основном это С1б:о) в форме ацил-АПБ
(см. ниже) используется для синтеза фосфоли-
пидов и 10% (в основном эту долю составляет
3-ОН-С14;о) — в качестве предшественников липи-
да А липополисахаридов; в следовых количествах
жирные кислоты участвуют в образовании липо-
евой кислоты и биотина. Небольшое количество
фосфолипидов участвует в синтезе связанных
с мембраной олигосахаридов и липопротеинов.
Ферменты синтеза липидов локализованы
между цитоплазмой и внутренней стороной плаз-
матической мембраны, причем те из них, которые
катализируют образование глицерол-3-фосфата и
жирных кислот, относятся к растворимым, тогда
как остальные — к мембраносвязанным.
Синтез глицерол-3-фосфата □ Образова-
ние глицерол-3-фосфата происходит в реак-
ции восстановления фосфодиоксиацетона под
действием биосинтетической глицерол-3-фосфат-
дегидрогеназы. Катаболическая глицерол-3-фос-
фатдегидрогеназа участвует в разложении глице-
рола. Глицерол, поглощаемый из среды, может
непосредственно фосфорилироваться до глице-
рол-3-фосфата.
Синтез длинноцепочечных насыщенных
жирных кислот □ У бактерий он протекает с
участием синтазного комплекса II типа, как и
в хлоропластах растений; данный путь синтеза
сходен с синтезом поликетидов (также у бакте-
рий). Синтазный комплекс II типа состоит из
автономных ферментов, кодируемых отдельны-
ми генами, в отличие от синтазного комплекса I
типа (катализирующего этот синтез у дрожжей,
птиц и млекопитающих), который представля-
ет собой один многофункциональный белок, т. е.
единую полипептидную цепь, и катализирует по-
следовательные реакции посредством различных
доменов.
Дополнение 7.8. Номенклатура жирных
кислот включает систему обозначений, кото-
рую можно проиллюстрировать следующим
примером. Обозначение указыва-
ет длину углеродной цепи (Сщ), количество
двойных связей (1), положение двойной свя-
зи (Д, между С9 и С10) и тип конфигура-
ции (cis). Существует множество вариантов
пути синтеза жирных кислот. Одни и
те же основные реакции осуществляют мно-
гочисленные изоферменты, различающиеся
по субстратной специфичности. Благодаря
наличию изоферментов возможна регуляция
распределения продуктов этого пути. У мно-
гих грамотрицательных бактерий некоторые
фракции жирных кислот с неразветвленной
цепью должны быть цис- ненасыщенными во
избежание ригидности мембран. У грампо-
ложительных бактерий текучесть мембра-
ны обеспечивают разветвленные или али-
циклические жирные кислоты, «нарушаю-
щие» псевдокристаллическую структуру из
алкильных цепей.
Ацетил-СоА-карбоксилаза □ Активацию
ацетил-СоА (рис. 7.32), предшественника жирных
кислот, осуществляет комплексный, строго регу-
Глава 7. Биосинтез клеточных строительных блоков 191
Рис. 7.32. Реакции, катализируемые ацетил-СоА-кар-
боксилазой. Различные активности этого комплексно-
го фермента обусловлены входящими в его состав
отдельными субъединицами: 1 — биотинкарбоксилазная
субъединица катализирует Мп2+- и АТР-зависимое
карбоксилирование карбоксибиотинпереносящего белка;
2 —карбоксилтрансферазная субъединица катализирует
перенос «активированного бикарбоната» от комплекса
карбоксибиотин—белок на ацетил-СоА.
лируемый биотин-содержащий фермент ацетил-
СоА-карбоксилаза, катализирующий реакцию:
Ацетил-СоА 4- АТР + НСО3
—> Малонил-СоА 4- ADP 4- Р,
Ацилпереносящий белок (АПБ) □ Цен-
тральную роль в синтезе жирных кислот выпол-
няет ацил переносящий белок — термостабильный,
кислый белковый кофактор (мол. массой пример-
но 9000) (см. рис. 7.33). Он переносит растущую
ацильную цепь от одного фермента к другому,
а также доставляет молекулы-предшественники
для реакций конденсации. Ацильный интермеди-
ат присоединен к этому белку тиоэфирной свя-
зью, в образовании которой участвует простети-
ческая группа АПБ — 4'-фосфопантетеин. Данная
простетическая группа в составе АПБ происхо-
дит из СоА, в молекуле которого она присутству-
ет как каталитически важный компонент. С поли-
пептидной цепью АПБ 4/-фосфопантетеин связан
через фосфодиэфирную связь с остатком серина
(рис. 7.33). АПБ относится к числу белков, наибо-
лее обильно представленных в микробной клетке
(0,25% общего клеточного белка); пул СоА у боль-
шинства прокариот примерно в восемь раз больше
пула АПБ.
Трансацилирование и инициация
(рис. 7.34, А) □ Перенос ацетильного и мало-
нильного остатков на АПБ (от ацетил-СоА
и малопил-СоА соответственно) осуществляют
ацилтрансферазы. Инициация синтеза жирных
кислот может происходить путем образования
ацетил-АПБ или ацетоацетил-АПБ из малонил-
СоА и/или ацетил-СоА. Для продолжения кон-
денсации необходим перенос малонильного остат-
ка на другую молекулу АПБ ферментом АПБ-ма-
лопилтрансферазой:
Малонил-СоА 4- АПБ
Малонил-АПБ 4- СоА
Элонгация (рис. 7.34, Б) □ Процесс наращи-
вания цепи включает следующие четыре этапа:
1) конденсацию — присоединение к растущей це-
пи ацетильного фрагмента от малонил-АПБ с вы-
свобождением СО2 и АПБ (единственный необ-
ратимый этап элонгации); катализирующий эту
реакцию фермент 3-кетоацил-АПБ-синтаза пред-
ставлен у прокариот несколькими изофермента-
ми; 2) восстановление 3-оксогруппы до D-(—)-
/3-гидроксигруппы; Д кетоацил-АПБ-редуктазная
реакция; 3) дегидратацию с удалением гидрок-
сильной группы и образованием (3- транс-нена-
сыщенного ацил-АПБ; дегидратазная реакция;
4) восстановление по двойной связи еноил-АПБ-
редуктазой. Образовавшийся насыщенный ацил-
АПБ либо служит субстратом для следующего
цикла наращивания цепи, либо выходит из про-
цесса как строительный блок. Активность обеих
участвующих в удлинении цепи редуктаз зависит
от NADPH.
Рис. 7.33. Структура 4'-фосфопантетеина— об-
щей простетической группы ацилпереносящего
белка и кофермента А. АПБ-SH — ацилперенося-
щий белок; CoA-SH — кофермент А.
4'-Фосфопантетеин А
I-----------------------------------------------------1
Пантотенат I | .„итх
।-----------------------------------] у |АПБ^5Н)
сн, но ^,Ser--._____
| hs|ch2-ch2-nh-co-ch2 -СН2- NH-CO-CHOH -С-СН2-О-Р-О*
CHj ° *\р) СоА<яГ)
I
Аденин—Рибоза
192 Часть II. Основы жизнедеятельности микробных клеток
Инициация
О
CHj-C-S-АПБ
Ацетил-АПБ
о
НООС- СН2—c-s- АПБ
Малонил-АПБ
Ацетил-СоА
или
О О
II 11
СН3—С-СН2-C-s- АПБ
А
Ацетоацетил-АПБ (затравка)
Восстанов-
ление
Цикл удлинения цепи О
СН3- (СН2)Х— С- S-АПБ —
О
НООС- СН2-С -s- АПБ
Малонил-АПБ Н
[конденсация|
АПБ-SH
СО;
2|Н]
о
CHj—(СНг)х—СН=
О О
СН-С-S-АПБ СН}-(СН2)х-С-СН2-С-5-АПБ*^
транс
Н;
(7) \ 21Н1
|дегидратация|
Б
3) ОН О
СН3 - (СН2)Х-СН - СН2 - с - S—АПБ
[ Восстановление |
Образование
цис-ненасыщенных
ацил-АПБ
НО-10:0 /3-Гидроксидеканоил-АПБ
| ГДД
10:1Д2 транс-2-Деценоил-АПБ
ГДД
10:1ДЗцис-3-Деценоил-АПБ
Рис. 7.34. Синтез жирных кислот.
А. Инициация.
Б. Цикл удлинения цепи: 1 — конденсация малонил-
АПБ и ацил-АПБ с участием одной из /3-кетоацил-
АПБ-синтаз; 2 — восстановление, катализируемое
NADPH-зависимой /3-кетоацил-АПБ-редуктазой; 3 —
дегидратация, катализируемая /3-гидроксиацил-АПБ-
дегидратазой; 4 — восстановление, катализируемое
NADPH-зависимой еноил-АПБ-редуктазой.
В. Синтез ненасыщенных жирных кислот и регуляция
образования конечных продуктов. Особый фермент
/З-гидроксидеканоил-АПБ-дегидратаза (ГДД) катализи-
рует не только дегидратацию, но также изомеризацию
2-транс-изомера в 3-цис-форму — ключевой этап син-
теза ненасыщенных жирных кислот. Удлинение цепи
образовавшегося при этом ненасыщенного ацил-АПБ до
Стел осуществляет Д-кетоацил-АПБ-синтаза I (КАС 1).
За удлинение Ci^i до Cisi отвечает Д-кетоацил-АПБ-
синтаза II (КАС II). Т — температура.
Синтез ненасыщенных жирных кислот
(рис. 7.34, В). Предшественником ненасыщенных
жирных КИСЛОТ (C16:lA9Wc, С18:1A11W) СЛуЖИТ
Сю-АПБ. Специфичная дегидратаза катализи-
рует дегидратацию Сю-фрагмента и последу-
ющую изомеризацию связанного с ферментом
продукта реакции — транс-2-деценоил-АПБ в
цис-3- деценоил- АПБ.
Этот г^с-изомер не распознается специфичной
редуктазой, действующей на 4 этапе элонгации
(рис. 7.34, Б), по наращивается синтазой I первого
этапа элонгации до Синтаза II, способ-
ная удлинять Сюлдэцис до С18:1Д11чис, высокоак-
тивна при низкой температуре и, напротив, ма-
лоактивна при высокой, что обеспечивает стиму-
ляцию синтеза Сщцдицис в ответ на понижение
температуры для увеличения текучести мембран.
Это так называемый анаэробный путь синте-
за ненасыщенных жирных кислот, действующий
у анаэробов и многих аэробов.
Для большинства грамположительных аэроб-
ных микроорганизмов характерен аэробный
путь синтеза ненасыщенных жирных кислот
(сходный с аналогичным механизмом эукари-
от) из насыщенных жирных кислот. Он состо-
ит в том, что при участии молекулярного кис-
лорода в реакции под действием десатуразной
ферментной системы происходит введение двой-
ной связи в середину углеводородной цепи паль-
митоил-АПБ (Ci6:o) с образованием пальмито-
леил-АПБ (С1б:1Д9цгхс)- Образование полиненасы-
щенных жирных кислот (у цианобактерий и в
хлоропластах) также протекает по этому Ог-за-
висимости пути.
Синтез изо-, антеизо- и омега-али-
циклических жирных кислот □ У некото-
рых бактерий (рода Bacillus и многих других
грамположительных бактерий) присутствуют:
1) изо- жирные кислоты (жирные кислоты с ме-
тильной группой у предпоследнего углеродно-
го атома углеводородной цепи); 2) антеизо-
жирные кислоты (жирные кислоты с метильной
группой у третьего от конца углеродного ато-
ма) и 3) сц-алициклические жирные кислоты
(жирные кислоты, содержащие на конце цепи
насыщенное углеродное С5-Су-кол ьцо, иногда с
двойной связью или гидроксильной группой в
качестве заместителя). Эти соединения изобра-
жены на рис. 7.35, А. Наиболее часто встречаю-
щиеся жирные кислоты с разветвленной цепью —
это W3O-16-, изо-15/17, антеизо-15/17- и 10-ме-
Глава 7. Биосинтез клеточных строительных блоков 193
Рис. 7.35. Структура модифицированных жирных
кислот.
А Разветвленные, o’-алициклические и модифициро-
ванные жирные кислоты.
Б. Предшественники разветвленных жирных кислот.
тил-17/18-типы. Пути синтеза жирных кислот с
разветвленной и неразвствленной цепями разли-
чаются только использованием различных ацил-
АПБ в качестве затравки для удлинения цепи
и специфичностью катализирующих конденсацию
ферментов (синтаз) к модифицированным ацил-
АПБ, а не к ацетоацетил-АПБ. Предшествен-
никами таких модифицированных затравок слу-
жат следующие соединения: 1) разветвленные
2-оксокислоты (промежуточные продукты син-
теза аминокислот с разветвленной цепью, лей-
цина, валина и изолейцина), которые декарбок-
силируются с образованием альдегида, присо-
единяемого к малонил-АПБ (рис. 7.35, Б); эта
конденсация, приводящая к синтезу разветвлен-
ных /3-гидроксиацил-АПБ, мало изучена; 2) эк-
зогенные разветвленные короткоцепочечные
карбоновые кислоты; они поглощаются клетка-
ми, после чего происходит их активация посред-
ством СоА и перенос на АПБ специальными ацил-
трансферазами (этот путь синтеза разветвленных
ацил-АПБ характерен, например, для бактерий
рубца, использующих продукты брожения, такие
как изобутират, изовалерат или 2-метилбутират)
и 3) новосинтезированныс циклогексил- и цикло-
гептил карбоновые кислоты, включающиеся в со-
став жирных кислот так же, как экзогенные раз-
ветвленные карбоновые кислоты (см. пункт 2);
возможно, они образуются из шикимата (цикло-
гексил) или другого соединения (циклогептил).
Конечные этапы синтеза липидов: пе-
ренос ацильных цепей (рис. 7.36) □ Ко-
нечные этапы синтеза липидов ассоциированы
с плазматической мембраной. Глицерофосфат-
ацилтрансфераза присоединяет ацильную цепь
от ацил-АПБ к sn-глицерол-З-фосфату в пер-
вом положении. Затем другой аналогичный
фермент ацилирует С2-гидроксильную группу
ацилглицерол-3-фосфата с образованием так на-
зываемой фосфатидной кислоты, т. е. диацил-
глицерол-3-фосфата. Асимметричность располо-
жения жирных кислот в положениях 1 и 2 обес-
печивается различной специфичностью этих двух
ацилтрансфераз по отношению к длине цепи, к
цис-ненасыщенным или разветвленным кислотам.
Жирнокислотный состав бактериальных ли-
пидов определяют с целью диагностики возбу-
дителей инфекций, для идентификации микро-
организмов и в таксономических исследованиях,
обычно с помощью газожидкостной хроматогра-
фии. Предварительно жирные кислоты, получен-
ные путем щелочного гидролиза липидов, под-
вергают метилированию для придания им лету-
чести.
Разнообразие групп, образующих поляр-
ную головку (рис. 7.36) □ Диацилглицерол-3-
фосфат превращается далее в тот или иной фос-
фолипид. У Е. coli обнаружены только три основ-
ных типа фосфолипидов — фосфатидилэтанол-
амины, фосфатидилглицеролы и кардиоли-
пины, а также, в следовых количествах, фос-
фолипиды несколько других типов (табл. 7.4).
Их образованию предшествует активация диацил-
глицсрол-3-фосфата переносом нуклеотидильного
остатка СТР с образованием CDP-диацилгли-
церола, катализируемая фосфатидат-цитидилил-
трансферазой. Полярная головка образуется из
спиртов (R— ОН; например, глицерола, сери-
на или фосфатидилглицерола), которые при
участии специфических ферментов этерифициру-
ются СМР- активированной фосфорильной груп-
пой (с высвобождением СЫР). Остаток сери-
на может быть декарбоксилирован до остат-
ка этаноламина, дальнейшее метилирование
которого (редкое у прокариот) приводит к об-
разованию холина (т. е. фосфатидилхолина,
194 Часть II. Основы жизнедеятельности микробных клеток
И
R,~С—S—АПБ R,
Н2С-ОН I HS-АПБ
НО-СН —
Н2С—о-© ®
ненасыщенный
о
II
у О Н2С— О- С - R, -<— насыщенный
II I
r2-c-o-ch
—’-----------
Н2С-О-(р)
Глицерол-3-Р
СМР-РР
РР.
Диацилглицерол-З^Р) =фосфатидовая кислота
UDP-глюкоза
Глицерол-Р
Серин
UDP
СМР
СМР
СМР
НОСН2
CDP-диацилглицерол
СООН
О
Фосфолипид
Гликолипид I
ОН
Фосфатидилсерин
Глюкоза
Фосфатидилглицерол
Н2С—О—Р —О—СН2—СН—NH
о
1 II
Н2С- О- Р - О—сн2—сн—сн2—о(р)
он
но----[
______он
Н2С-О- Р-О-СН2-СН2 —NH
ОН
Фосфатидилэтаноламин
3 SAM
R.-C-O-CH
Р-О-СН;
он
ОН
он
©ZCH
-N-CH
чсн
Н2С-О-Р -О-СН2-СН-СН2-О
он
о
I II
Н2С— О- Р —О- СН2 - СН;
Фосфатидилхол ин
Дифосфатидил глицерол=Кардиолипин
Фосфатидилглицерол
0=4
HjC-O-C-R,
Рис. 7.36. Синтез фосфолипидов и гликолипидов из предшественников. Формулы наиболее характерных фосфо-
липидов и гликолипидов заключены в рамки. 1-2 — перенос к мембране с участием ацилпереносящей глицерол-3-
фосфат-ацилтрансферазы; 3 — фосфатидат-цитидилилтрансфераза; 4 — фосфатидилсерин-синтаза; 5 — фосфати-
дилсерин-декарбоксилаза; б — глицерофосфат-фосфатидилтрансфераза; 7 — фосфатидилглицерофосфатаза; 8—
кардиолипин-синтаза; 9 — фосфатидатфосфатаза; 10 — диацилглицерол-гликозилтрансферазы (например, глю-
козилтрансфераза). Фосфатидилглицерол участвует также в синтезе связанных с мембранами олигосахаридов и
липопротеинов (см. ниже в тексте). SAM — S-аденозилметионин.
называемого также лецитином). Полярной голов-
кой в фосфолипидах могут быть и другие груп-
пы, не представленные на рис. 7.36, такие как
лшо-инозитол-1-фосфат (шестичленное кольцо с
шестью ОН-группами), моносахариды, дисахари-
ды или олигосахариды. (мио-Инозитол- 1-фосфат
образуется из D-глюкозо-б-фосфата.) Если оста-
ток сахара соединен с диацилглицеролом глико-
зидной связью, липид называют гликолипидом.
Постсинтетические модификации □
Некоторым превращениям подвергаются мем-
бранные фосфолипиды. Например, присоедине-
ние к молекулам ненасыщенных жирных кислот
в участке двойной связи метиленового мостика
от S-аденозилметионина приводит к образованию
жирных кислот, содержащих циклопропановое
кольцо.
Регуляция синтеза липидов □ Здесь необ-
ходимо рассмотреть несколько аспектов метабо-
лизма и функций липидов.
Реакция на воздействие факторов сре-
ды □ Некоторые внешние факторы влияют на
фосфолипидный и (до некоторой степени) липо-
полисахаридный состав клеточных мембран и тем
самым на их текучесть и другие свойства. Наи-
более важные из этих факторов — температура
и присутствие органических липофильных соеди-
нений в среде. Механизмы регуляции текучести
мембран зависят от того, какие жирные кисло-
ты характерны для данного организма, ненасы-
щенные или разветвленные. Соответственно у од-
них бактерий текучесть мембраны определяется
изменениями в относительном содержании нена-
сыщенных жирных кислот, тогда как у других—
Глава 7. Биосинтез клеточных строительных блоков 195
метилразветвленных, причем в последнем слу-
чае ненасыщенные жирные кислоты не играют
существенной роли. В обоих случаях регуляции
подвержена, помимо относительного содержания
этих жирных кислот, длина их цепей и лишь в
ограниченной степени — состав полярной головки.
Содержание ненасыщенных или раз-
ветвленных жирных кислот, длина цепи
и постсинтетические модификации синте-
зированных липидов (например, метилирова-
ние или образование циклопропанового кольца) □
Один аспект регуляции жирнокислотного со-
става связан с конкурентным балансом между
уровнями активности ацил-АПБ-образующих и
ацил-АПБ-потребляющих ферментов. Этот про-
стейший механизм регуляции основан на раз-
личиях чувствительности данных ферментов к
температуре (энергии активации), их кинетиче-
ских констант для разных ацил-АПБ (напри-
мер, 1<м или Ипах) и субстратной специфич-
ности. Примерами таких ферментов могут слу-
жить: 1) различные 3-кетоацил-АПБ-сиптазы—
ферменты, катализирующие конденсацию, т. е.
удлинение насыщенной или ненасыщенной жир-
ной кислоты; 2) 3-кетоацил-АПБ-редуктаза, ка-
тализирующая образование 3-гидроксиацил-АПБ
и 3) глицерофосфат-ацилтрансфераза и соответ-
ствующие ферменты синтеза липополисахаридов,
для которых жирные кислоты служат субстра-
тами.
Общее содержание жирных кислот □
Этот клеточный параметр регулируется на уровне
ацетил-СоА-карбоксилазной реакции и на уровне
инициации синтеза жирных кислот, которая обес-
печивается образованием ацил-АПБ. Механизм
регуляции синтеза липидов в зависимости от ско-
рости роста пока нс установлен.
7.10.3. Липид А, связанные с мембраной
олигосахариды и липопротеины входят
в состав клеточной стенки
Липид А □ Микробные липополисахариды
состоят из трех доменов — липида А, остова
(сердцевинной части) и О-замещенной боко-
вой цепи (О-антигена). Структура липида А,
в отличие от О-антигена, весьма консерватив-
на. У Е. coli липид А представляет собой ди-
сахарид из двух фосфорилированных остатков
глюкозамина, соединенных /3-1,6-связью и аци-
лированных четырьмя остатками 3-гидрокси-
С14;о-жирной кислоты (3-гидроксимиристиновая
кислота), два из которых в свою очередь эте-
рифицированы двумя ацильными группами по
СЗ-гидроксильным группам. Синтез липида А
происходит следующим образом (см. рис. 23.3).
Глюкозамин превращается в UDP-N-ацетил-
глюкозамин и ацилируется с образованием
иБР-2,3-диацилглюкозамина; это соединение
сходно с CDP-диацилглицеролом. Активирован-
ный NDP 2,3-диацилглюкозамин присоединяет-
ся по Сб'-положению к другому липосахариду —
2,3-диацилглюкозамин- 1-фосфату (называемому
липидом X), в котором оба ацильных фрагмен-
та представляют собой З-ОН-С14. Далее проис-
ходит фосфорилирование первого остатка глю-
козамина по С4'-гидроксильной группе. Затем к
Сб-группе присоединяется начальный остов из
двух остатков 2-кето-3-дезоксилшн?ю-октоновой
кислоты (КДО), и свободные гидроксильные
группы связанных с глюкозамином жирных кис-
лот ацилируются еще двумя короткоцепочечны-
ми насыщенными или ненасыщенными жирными
кислотами (C12-C16). Подробно этот процесс опи-
сан в разд. 23.2.
Связанные с мембранами олигосахари-
ды и липопротеины □ Водорастворимые пе-
риплазматические олигосахариды, принимающие
участие в осморегуляции, связаны с остатком гли-
церола и через него с мембраной. Источником это-
го глицерола служит фосфатидилглицерол (см.
рис. 7.36), полярная группа которого в виде
бп-глицерол-1-фосфата переносится на олигоса-
харид; образующийся при этом диацилглицерол
фосфорилируется диацилглицеролкиназой с обра-
зованием диацилглицерол-3-фосфата. Аналогич-
ное происхождение имеет остаток глицерола в со-
ставе липопротеинов наружной мембраны и выде-
ляемых из клетки липопротеинов.
7.10.4. У всех бактерий присутствуют
нейтральные липиды
Определенное значение для формирования струк-
туры и функций мембраны могут иметь раз-
личные нейтральные липиды, например сква-
лен, гопаноиды, С4о-изопреноиды, каротиноиды,
а также липиды, характерные для особых групп
прокариот (рис. 7.37). Эти разнообразные по
структуре и функциям соединения, составляющие
196 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.37. Структура некоторых нейтральных липидов
с различными функциями. Гопаноиды (политерпенои-
ды) обнаружены у многих видов бактерий; сквален при-
сутствует у многих архей. Каротиноиды — пигменты, ха-
рактерные для фототрофных и многих нефототрофных
прокариот.
большую группу, синтезируются из ацетил-СоА
через образование Сб-изопреновых единиц, кото-
рые полимеризуются в изопреноиды. К бактери-
альным изопреноидам относятся, например 1) хи-
ноны, 2) ундекапренол и долихол, 3) каротиноиды
и ретиналь и 4) сквален и гопаноиды, участвую-
щие соответственно в транспорте электронов (1),
переносе моносахаридов и олигосахаридов через
мембрану (2), поглощении света (для защиты от
него или использования световой энергии (3) и
поддержании стабильности мембраны (4).
Первый этап синтеза нейтральных ли-
пидов — конденсация двух молекул ацетил-
СоА с образованием ацетоацетил-Со А □
Ацетоацетил-СоА взаимодействует далее с тре-
тьей молекулой ацетил-СоА, превращаясь в
З-гидрокси-З-метилглутарил-СоА (конденсация
Клайзена) (рис. 7.38). Активированная с помо-
щью СоА карбонильная группа этого соедине-
ния восстанавливается до гидроксильной группы
с образованием мевалоновой кислоты, которая
затем фосфорилируется с образованием 5-дифос-
фомевалоновой кислоты. Последняя подвергается
декарбоксилированию и дегидратации, превра-
щаясь в изопентенилдифосфат (первая, изо-
преновая единица). Протеканию этой реакции
способствует фосфорилирование 3-ОН-группы
5-дифосфомевалоната. Изопентенилдифосфат
изомеризуется в диметилаллилдифосфат (вторая,
преновая единица). У некоторых бактерий, зеле-
ных водорослей, а также высших растений (хло-
ропласты) действует другой путь синтеза этих со-
единений, который начинается с взаимодействия
глицеральдегид-3-фосфата и пирувата с образо-
ванием 1-дезоксиксилулозо-5-фосфата. Послед-
ний превращается в изопентенилдифосфат. Ак-
тивированные с помощью дифосфата преновые и
изопреновые единицы вступают в реакцию поли-
меризации. Уходящая пирофосфатная группа от-
крывает атом кислорода (разрыв связи С—О), что
приводит к превращению аллильного соединения
в реакционноспособный карбений-катион («голо-
ва»), который легко присоединяется к двойным
связям электрофильной изопентеновой единицы
(«хвост»). Продукт реакции затем стабилизиру-
ется путем удаления протона. Структура С55-ИЗО-
прсноидов и хинонов служит иллюстрацией того,
что данный процесс может повторяться вновь
и вновь. На последнем этапе конденсация двух
полипренилдифосфатных единиц может происхо-
дить по правилу «голова к хвосту» (как описано
выше), «голова к голове» или «хвост к хвосту».
В состав полипреновых соединений могут входить
две (терпены), три (сесквитерпены, полуторатер-
пены), четыре (дитерпены) или больше изопрено-
идных единиц. Изопреноиды, содержащие больше
четырех таких единиц, образуются, как правило,
из двух сесквитерпенов (шесть изопреноидных
единиц) или из двух дитерпенов (восемь изопре-
ноидных единиц).
Сквален (С30), состоящий из шести изопре-
ноидных единиц, образуется в результате конден-
сации двух сесквитерпенов фарнезил-РР (С15) по
правилу «голова к голове» (см. рис. 7.37). Сква-
лен может подвергаться циклизации (одна реак-
ция) с образованием гопаноидов, которые содер-
жат четыре алициклических кольца и таким об-
разом сходны со стероидами высших организмов.
Аналогично этому, образование каротиноидов
происходит путем конденсации Сго-предшествен-
ника (фитол-РР). В состав некоторых каротинои-
дов входят ароматические кольца, синтезируемые
окислением алициклических шестичленных колец
(ароматизация, второй способ образования арома-
тических колец; третий — это так называемый по-
ликетидный путь). У архей алкильные цепи ли-
пидов происходят из ненасыщенных изопреновых
спиртов, которые синтезируются путем восстанов-
ления части двойных связей в молекулах изопре-
ноидов.
Глава 7. Биосинтез клеточных строительных блоков 197
Рис. 7.38. Синтез полиизопреноидов.
А. Образование активированных
изопреновых единиц: 1 — ацетил-СоА-
ацилтрансфераза; 2 — 3-гидрокси-
3-метилглутарил-СоА-синтаза; 3-4
— З-гидрокси-З-метилглутарил-СоА-
редуктаза; 5 — две реакции, катали-
зируемые киназами: б — декарбок-
силирование и сопутствующая ему
дегидратация; 7 — изомеризация.
Б. Конденсация активированных изо-
преновых единиц (перенос пренила) и
высших терпенов: 8-9 — конденсация
по механизму «голова к хвосту»; 10 —
конденсация по механизму «голова к
голове». Третий возможный вариант
конденсации, «хвост к хвосту», не
показан.
н3с оно
НООСх^Ок
S-CoA
З-Гидрокси-З-
метил-глутарил-СоА
Сквален
7.10.5. Липиды архей отличаются от липидов
бактерий и эукариот
Липиды бактерий (и эукариот) отличаются от ли-
пидов архей 1) природой связи между глицеро-
лом и углеводородными цепями (сложноэфирная
связь у бактерий в отличие от простой эфирной
связи у архей); 2) структурой углеводородных це-
пей (ацильные остатки с прямой цепью у бакте-
рий в отличие от метилразветв ленных, главным
образом насыщенных изопреновых цепей у архей)
и 3) стереохимической конфигурацией остатка
глицерола («п-1,2-ди-О-К-глицерол у бактерий и
sn-2,З-ди-О-Я-глицерол у архей) (рис. 7.39).
Археи могут содержать, помимо липидов-
диэфиров, также и тетраэфиры, в которых два
С4о-изопрсновых диола, образованных конденса-
цией Сго-изопреноидных спиртов по правилу «го-
лова к голове», этерифицированы с обоих концов
глицеролфосфатом (рис. 7.40). У бактерий, отно-
сящихся к нижней ветви филогенетического древа
Bacteria, липиды содержат длинноцепочечные ди-
карбоповые кислоты (например, С30). Различия
между липидами бактерий и архей отражают их
происхождение, а не адаптацию к условиям окру-
жающей среды.
Archaea
Cl-атом триозофосфата
I
Простая эфирная
"СН, у
у 2 д/ связь
Изопреновый спирт
Bacteria, Eukarya
Жирная кислота
О
Н2С— О— С— (СН2)„Н
Т
н,.... с ....«О—с— (СН2) н
1 А II
х-о-сн2 I °
t Сложноэфирная
связь
СЗ-атом триозофосфата
Рис. 7.39. Основные различия между липидами Archaea
и липидами Bacteria и Eukarya.
198 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.40. Структура некоторых липидов архей. 1. Ди-
эфир археола. 2. Тетраэфир кальдархеола. 3. Мак-
роциклический диэфир археола. 4. Диэфир 3-гид-
роксиархеола. Для термоацидофильных архей харак-
терно присутствие циклопропановых колец в составе
фитанильных цепей. По [2].
Рис. 7.41. Предположительный путь синтеза
липидов у архей. Первый этап — образование
3-моноалкенил-5л-глицерол-1-фосфата из
фосфодигидроксиацетона и связанного
с пирофосфатом изопреноидного спирта
(например, геранил геранил пирофосфата) —
может варьировать у различных архей. Ме-
ханизм превращения sn- гл и церол-3-фосфата
в $л-глицерол-1-фосфат в настоящее время
изучается. Цифрами 1, 2 и 3 (выделены
кружками) обозначена нумерация атомов
углерода в остатке глицерофосфата в
соответствии с sn-номенклатурой [2]. При
восстановлении включенного в состав липида
изопреноида он становится насыщенным.
Природа полярных головок X рассмотрена
в тексте. 5/7-Г-1-Р-—sn-глицерол-Х-фосфат;
sn-Г-З-Р — sn-гл ицерол-3-фосфат; ФДА—
фосфодигидроксиацетон.
Возможно, липиды архей обеспечивают им
преимущество для выживания при экстремально
высокой температуре, однако и сложноэфирные
липиды, характерные для бактерий, легко моди-
фицируются в соответствии с разнообразными и
изменяющимися условиями среды.
Биосинтез липидов у архей и его регуляция
изучены в гораздо меньшей степени, чем те же
процессы у бактерий. Возможный путь биосинте-
за показан на рис. 7.41. Полярные головки липи-
дов у архей значительно варьируют. Так, в фос-
фолипидах глицерол по СЗ-гидроксилу этерифи-
Глава 7. Биосинтез клеточных строительных блоков 199
цирован фосфатом, тогда как в гликолипидах со-
единен гликозидной связью с С-атомом гексозы.
Можно выделить следующие основные эта-
пы биосинтеза липидов у архей: 1) синтез
фитанильной цепи; 2) образование эфирной
связи; 3) завершение образования структуры
«?г-2,3-ди-О-Н-глицерола. Для синтеза тетраэфи-
ров необходимы дополнительные реакции; точ-
ная структура их предшественников и механиз-
мов конденсации «голова к голове» пока не ясны.
Предшественником фитанильных цепей (С20) слу-
жит дитерпеноид геранил-геранилпирофосфат,
синтезируемый из четырех молекул мевалоно-
вой кислоты, которая в свою очередь образуется
из ацетил-СоА. Эта последовательность реакций
сходна с характерным для большинства бакте-
рий процессом синтеза изопреноидов через обра-
зование мевалоната, по, по-видимому, не идентич-
на ему. Образование эфирной связи происходит
при нуклеофильной атаке геранил-геранилпиро-
фосфата (э)-З-ОН-группой глицерофосфата. Точ-
ная структура Сз-предшественника и механизм
инверсии гидроксильной группы в положении
sn-2 остатка глицерофосфата неизвестны; воз-
можно, существуют два независимых биосинтети-
ческих пути.
7.11. Все бактерии синтезируют одно или
несколько полимерных запасных веществ
У большинства прокариот могут откладываться
внутри клеток одно или больше запасных веществ
(рис. 7.42). Они представляют собой гомополи-
меры, образующие водонерастворимые гранулы
(тельца, или включения); в клетках их удает-
ся обнаруживать и идентифицировать с помощью
различных способов окрашивания. Запасные ве-
щества накапливаются при определенных услови-
ях среды, а именно, когда источники энергии при-
сутствуют в избытке, но рост лимитирован недо-
статком одного из необходимых элементов (N, Р,
S или Fe). Возможно, запасные полимеры исполь-
зуются бактериями для получения энергии под-
держания при голодании, а также для инициации
роста, когда лимитировавший субстрат появляет-
ся в среде. Регуляция метаболизма запасных по-
лимеров пока мало изучена.
Полимеры глюкозы (запасной источ-
ник энергии и углерода) (рис. 7.42, А) □
Предшественником гликогена, разветвленно-
го полимера глюкозы, служит, как правило,
ADP-глюкоза. Остатки глюкозы соединены в
гликогене о-1,4-связями на прямых участках
и о-l,6-связями в точках ветвления. Синтез
ADP-глюкозы осуществляет глюкозо-1-фосфат-
аденилилтрансфераза, активность которой сти-
мулируется промежуточными продуктами гли-
колиза и подавляется АМР и ADP. Образова-
ние гликозидной связи между активированной
С 1-группой ADP-глюкозы и С4-атомом нереду-
цирующего концевого остатка глюкозы в рас-
тущей олигосахаридной цепи (который функ-
ционирует как затравка) катализирует глико-
генсинтаза. Эта реакция сходна с реакцией
образования гликозидной связи между нуклео-
тидсахаром и другой молекулой сахара при син-
тезе дисахаридов (например, лактозы, маль-
тозы, сахарозы или трегалозы). Разветвление
цепи путем образования а-(1 —> 6)-связей проис-
ходит под действием амило-(1,4—>1,6)-трансглико-
зилазы (1,4-а-глюкан-ветвящий фермент). Этот
фермент отщепляет от расту щей цепи гликогена
олигосахарид и переносит его па Сб-гидроксиль-
ную группу остатка глюкозы, расположенного на
несколько глюкозных единиц дальше по цепи.
Полигидроксиалканоаты (запасной ис-
точник энергии и углерода) (рис. 7.42, Б) □
Эти липофильные соединения представляют со-
бой полиэфиры, образуемые путем конденсации
3-гидроксиацил-СоА, который в свою очередь
синтезируется из ацетил-СоА. Содержание по-
лигидроксиалканоата (ПГА) может достигать
90-95% сухого вещества клеток. Количество мо-
номеров в молекуле ПГА варьирует от нескольких
сотен до нескольких тысяч. Длина цепи мономе-
ра, образующего ПГА, зависит от типа углерод-
ного субстрата. В большинстве случаев мономе-
ром служит 3-гидроксимасляпая кислота, однако
при росте в средах с длинноцепочечными алкана-
ми, спиртами или жирными кислотами (алкано-
200 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.42. Строительные блоки для
синтеза запасных веществ.
А. Гликоген. (О синтезе ADP-глюкозы пу-
тем присоединения АМР к глюкозо-1-фос-
фату см. разд. 7.7.) 1 — гликоген-синтаза;
2—[амило-(1,4 —♦ 1,б)-]трансгликозилаза
(ветвящий фермент).
Б. Полигидроксиалканоаты (ПГА):
1 — ацетил-СоА-ацилтрансфераза; 2 —
D(—) - 3-гидроксибутирил-СоА-дегидроге-
наза; 3 — D(—)-3-гидроксибутирил-СоА-
пол и мераза. Продуктом восстанов-
ления ацетоацетил-СоА может быть
Ь(+)-3-гидроксибутирил-СоА, если вме-
сто фермента 2 действует фермент 4.
В этом случае необходимо участие еще
двух ферментов (кротоназ), один из
которых (5) специфичен к 1_(+)-3-ОН-
субстрату. другой (6) - к D(—)-3-ОН.
В. Полифосфаты: 1 — полифосфатки-
наза.
Г. Запасной белок цианофицин: 1 —
фермент, конденсирующий попеременно
аспартат и аргинин.
атами) мономер может содержать до 12 ато-
мов углерода. Синтез строительного блока ПГА,
D(—)-3-гидроксибутирил-СоА, из двух молекул
ацетил-СоА протекает так же, как при синте-
зе жирных кислот. Образование сложноэфир-
ной связи между активированными кофермен-
том А строительными блоками и свободной
3-гидроксильной группой растущей цепи катали-
зирует связанная с гранулой полимераза.
Полифосфаты (запасной источник энер-
гии и фосфора) (рис. 7.42, В) □ Очень мно-
гие бактерии в условиях избытка энергии и
фосфата синтезируют из АТР полифосфаты
(волютин). Полифосфатная цепь может вклю-
чать от нескольких сотен до нескольких тысяч
фосфатных групп. Перенос 7-фосфата АТР на
растущую линейную полифосфатную цепь ката-
лизирует мембраносвязанная полифосфаткиназа
(легкообратимая реакция). Отрицательные заря-
ды компенсируют ионы Mg2+, Са2+ и другие
катионы, которые котранспортируются в клет-
ки низкоаффинной системой транспорта фосфа-
та. Кальций-содержащие полифосфаты и ПГА
в качестве компонентов мембраны предположи-
тельно делают клетку компетентной для транс-
формации. У Е. coli гены полифосфаткиназы и
экзополифосфатазы составляют один оперон, от-
носящийся к рАо-модулону.
Глава 7. Биосинтез клеточных строительных блоков 201
Сера (запасной восстановитель) □ Мно-
гие фототрофные пурпурные серобактерии и
аэробные бактерии окисляющие соединения се-
ры, при избытке H2S в среде временно накапли-
вают внутри клеток глобулы серы. В этих услови-
ях происходит неполное окисление излишка H2S
с образованием водорода и серы, однако химиче-
ская природа накапливаемой «серы» пока неясна.
При исчерпании H2S эта сера окисляется далее до
сульфата.
Запасной белок (резервный источник
энергии, азота и углерода) (рис. 7.42, Г) □
Многие цианобактерии образуют запасной бе-
лок цианофицин, представляющий собой поли-
L-Asp-L-Arg. Количество его может достигать
8% сухого вещества клеток. Предположитель-
но синтез цианофицина не связан с рибо-
сомами. Цианофицин используется в качестве
запасного источника энергии, азота и угле-
рода.
7.12. Многие растворимые клеточные компоненты
необходимы лишь в небольшом количестве
Помимо малых молекул в клетке содержится мно-
го других важных растворимых веществ (напри-
мер, коферментов), но в отличие от строитель-
ных блоков они необходимы лишь в небольших
количествах. Соответственно синтез этих минор-
ных компонентов в меньшей степени определя-
ет стратегию метаболизма в отношении потоков
энергии, восстановителей и элементов. Рассмот-
рим несколько основных групп таких соединений.
7.12.1. Для нормального роста клетке
необходимы полиамины
Свойства полиаминов определяются их полиос-
новной природой, однако пока до конца не уста-
новлено, какую роль эти соединения выполняют
в микробных клетках. Возможно, они необходи-
мы для поддержания внутриклеточного pH, ней-
трализации отрицательного заряда нуклеиновых
кислот, регуляции ионной силы цитоплазмы и
стабилизации структуры рибосом. Не исключено
также их косвенное участие в синтезе белка. Об-
разование полиаминов связано главным образом
с путями биосинтеза аргинина и лизина, причем
потребность в полиаминах равна потребности в
аргинине. Структурные формулы некоторых по-
лиаминов представлены на рис. 7.43.
Образование полиаминов происходит путем
декарбоксилирования аргинина (с образованием
агматина), лизина (с образованием кадавери-
на) или орнитина (с образованием путресцина)
(рис. 7.43). Когда биосинтез аргинина в клетках
подавлен в результате его присутствия в среде,
агматин может гидролизоваться до путресцина и
мочевины. Взаимодействие путресцина с продук-
том декарбоксилирования S-аденозилметионина
приводит к образованию спермидина. О важ-
ной биологической роли полиаминов свидетель-
ствует сложная регуляция процессов их биосин-
теза; так, в клетках присутствуют две орнит-
индекарбоксилазы, одна из которых участвует в
расщеплении, тогда как другая — в биосинтезе.
Экспрессия биосинтетического фермента строго
регулируется. Наиболее эффективным регулятор-
ным механизмом служит, по-видимому, подавле-
ние активности этого фермента в результате его
взаимодействия с белком-ингибитором (антифер-
ментом) .
Рис. 7.43. Структура и синтез полиаминов. Ферменты:
1-4 — декарбоксилазы; 5 — агматинуреогидролаза; б —
сперм идин-си нтаза (п утресци н-а м и но п ро п и л тра нсфера-
за). R — 5'-метилтиоаденозин.
202 Часть II. Основы жизнедеятельности микробных клеток
Рис. 7.44. Структура циклических тетрапирролов. 1 —
гемы; 2 — хлорофиллы и бактериохлорофиллы с, d и е;
3 — бактериохлорофиллы а. b и g; 4 — сирогем; 5 — кор-
риноиды; б — кофермент F430. Показано окислительно-
восстановительное состояние молекулы: двойные связи
и системы сопряженных двойных связей отмечены чер-
ным. По [3].
7.12.2. Разнообразные метаболические функции
выполняют тетрапирролы
В состав многих пигментов, простетических групп
и коферментов входит тетрапиррол — соединение,
образованное четырьмя пятичлепными N-гетеро-
циклическими пиррольными кольцами. Линейные
тетрапирролы (к ним относятся желчные пигмен-
ты) представляют собой цепи из четырех пир-
ролов. Макроциклические тетрапирролы в соста-
ве клеточных компонентов образуют комплекс
с ионом металла, который подвергается окисли-
тельно-восстановительным превращениям в про-
цессе катализа (рис. 7.44). Различия в свойствах
(в том числе окраске) этих соединений определя-
ются количеством (от 8 до 11) и положением со-
пряженных двойных связей.
Различные тетрапирролы и их функции приве-
дены в табл. 7.5. Общим предшественником этих
соединений служит <5-аминслевулиновая кислота
(АЛК), синтез которой составляет первый из пя-
ти этапов пути синтеза тетрапирролов (рис. 7.45).
Последовательность реакций в этом процессе сле-
дующая. 1. Образование АЛК либо из глу-
тамата через Сб-путь, либо из сукцинил-СоА и
глицина через С^путь (называемый также пу-
тем Шемина по имени его открывателя). Шире
распространен более «древний» Сб-путь, тогда
как Сунуть характерен, по-видимому, в основном
для бактерий о-ветви Proteobacteria (их считают
предшественниками митохондрий, и митохондрии
обладают именно этим путем, в отличие от хлоро-
пластов). С5-путь. Примечательная особенность
данного пути состоит в том, что а-карбоксильная
группа глутамата активируется, как при син-
тезе белка, присоединением tPHKg1u, что
Таблица 7.5. Макроциклические и линейные тетрапирролы: функции и распространение
Макроциклические тетрапирролы Центральный атом Процессы с участием Распространение
Гемы ре2+/з+ Дыхание, перенос электронов, запасание энергии, гидрокси- лирование Большинство бактерий
Хлорофиллы 1 Mg2+ Поглощение света, запасание энергии Цианобактерии
Бактериохлорофиллы 1 Mg2+ Поглощение света, запасание энергии Фототрофные бактерии, за исключением цианобакте- рий и галобактерий
Сирогем Fe2+ Восстановление HSO3 до H2S и NO“ до NH3
Корриноиды Coi+/2+/3+ Разнообразные реакции, изо- меризация, перенос метиль- ной группы Большинство бактерий
Кофермент F430 Ni2+ Восстановление связанной с ко- ферментом М СНз-группы до СН4 Метаногены (Archaea)
Феофитин H+ Перенос электронов в реакцион- ном центре фотосистемы II Фототрофы, обладающие фото- системой II или ее эквива- лентом
Линейные тетрапирролы фикобилины 1 См. рис. 13.1. Поглощение света Цианобактерии
Глава 7. Биосинтез клеточных строительных блоков 203
I С5-путь
тРНКс'“
Путь Шенина (С4-путь)
h2n
L-глутамат
АМР-РР
тРНК
/
о=с Л соон
/
h2n
Глутамат-1-полуальдегид
Порфо-
билиноген
Рис. 7.45. Синтез тетрапирролов.
А Синтез <5-аминолевулиновой кислоты (АЛК);
1 — ё-а м и нолевул и натси нтаза; 2 — гл ута м ил-тР Н К-си н-
тетаза; 3 — глутамил-тРНК-редуктаза; 4 —глутамат-1-
полуал ьдеги д-а м и нотра нсфераза.
Б. Синтез макроциклических тетрапирролов из АЛК
через образование уропорфириногена III и далее либо
через протопорфирин IX, либо через дигидросирогид-
рохлорин: 5 — АЛ К-дегидрата за. Структуру соединений
см. на рис. 7.44. А — ацетил(-СН2-СООН); Р — про-
пионил (—СНг-СНг-СООН); Me — метил (—СНз);
Vn — винил (—СН=СНг); пиррольные гетероциклы
обозначены буквами А, В, С и D в кружках.
способствует восстановлению глутамата до по-
луальдегида. Далее происходит необычное тран-
саминирование, катализируемое пиридоксальфос-
фат-зависимой изомеразой: карбонильный атом
кислорода и аминогруппа полуальдегида глу-
тамата меняются местами, в результате чего
образуется АЛК. С4-путь. Синтез АЛК по
Сд-пути происходит в один этап — конденсации
сукцинил-СоА и глицина. 2. Образование пир-
рольного кольца. В реакции, катализируемой
АЛК-дегидратазой, происходит конденсация двух
молекул АЛК с образованием порфобилиногена:
аминогруппа первой молекулы образует шиффо-
во основание с оксогруппой второй молекулы, в
то время как оксогруппа первой молекулы кон-
денсируется с СЗ-метиленовой группой второй мо-
лекулы. 3. Соединение пиррольных колец;
синтез уропорфириногена III. Конденсация
четырех пиррольных колец тетрапиррола — уро-
порфириногена III происходит в точке разветв-
ления общего пути синтеза тетрапирролов. Далее
пути синтеза различных тетрапирролов расходят-
ся (сведения о них можно найти в дополнительной
литературе, приведенной в конце главы). 4. Пре-
вращение уропорфириногена III по одному пути
в протопорфириноген IX или по другому пути
в дигидросирогидрохлорин. На этапах обра-
зования этих соединений биосинтетические пути
вновь разветвляются. 5. Внедрение в молеку-
лу тетрапиррола атома металла с участием
ATP-зависимой металл-хелатазы. 6. Возмож-
но, далее происходят модификации кольца и его
заместителей, а также введение боковых групп и
лигандов, которые могут образовывать координа-
ционные связи с атомом металла.
7.12.3. Синтез других пигментов, кофакторов,
простетических групп и переносчиков
электронов
Клетки микроорганизмов синтезируют также
множество более мелких молекул, необходимых
для роста в очень незначительных количествах,
но выполняющих важные метаболические функ-
ции. Пути их образования весьма сложны, и зна-
чительная часть генома у большинства прокари-
от обеспечивает синтез именно этих соединений.
Пути их биосинтеза описаны в приведенной ниже
дополнительной литературе.
204 Часть III. Основы жизнедеятельности микробных клеток
Дополнительная литература
Boom Т. V. (1989) Genetics and regulation of bacterial
lipid metabolism. Annu. Rev. Microbiol. 43: 317-343.
Crawford I. P. (1989) Evolution of a biosynthetic
pathway: the tryptophan paradigm. Annu. Rev.
Microbiol. 43: 567-600.
Cunin R., Glansdorff N., Pierard A., Stalon V. (1986)
Biosynthesis and metabolism of arginine in bacteria.
Microbiol. Rev. 50: 314-352.
DeRosa M., Gambocorta A., Gliozzi A. (1986) Structure,
biosynthesis, and physicochemical properties of
archaeal lipids. Microbiol. Rev. 50: 70-80.
Enzyme nomenclature (1992) Nomenclature committee
of the International Union of Biochemistry and
Molecular Biology. New York, London: Academic
Press.
Gerhard P., Murray R. G. E., Wood W. A., Krieg N.R.,
eds. (1994) Methods for general and molecular
bacteriology. Washington, DC: ASM Press.
Gottschalk G. (1986) Bacterial metabolism, 2nd edn.
Berlin, New York, Heidelberg: Springer.
Kaneda T. (1991) Iso- and anteiso-fatty acids in bacteria:
biosynthesis, function, and taxonomic significance.
Microbiol. Rev. 55: 288-302.
Kates M., Kushner D. J, Matheson A. T., eds. (1993) The
biochemistry of Archaea (Archea). Amsterdam, New
York: Elsevier.
Koga Y., Masateru N., Morii Y., Akagawa-Matsushita M.
(1993) Ether polar lipids of methanogenic bacteira:
structures, comparative aspects, and biosynthesis.
Microbiol. Rev. 57: 164-182.
Lechner J. (1989) Structure and biosynthesis of
prokaryotic glycoproteins. Annu. Rev. Biochem. 58:
173-194.
Lederberg J., ed. (1992) Encyclopedia of microbiology,
vols. 1-4. New York, London: Academic Press.
Madigan M.T., Martinko J. M., Parker J. (1997) Biology
of microorganisms, 8th edn. Englewood Cliffs, NJ:
Prentice-IIall.
Magnuson K., Jackowski S., RockC.O., Cronan.I. E.,
Jr. (1993) Regulation of fatty acid biosynthesis in
Escherichia coli. Microbiol. Rev. 57: 522-542.
Neidhardt F. C., Curtiss R., Ingraham J.L., Lin E.C.C.,
LowK.B., Magasanik B., ReznikoffW., Riley M.,
Schaechter M., Umbarger H. E. (eds.) (1996)
Escherichia coli and Salmonella: cellular and
molecular biology. 2dn edn. Washington, DC: ASM
Press.
Neidhardt F. C. Ingraham .I. L., Schaechter M. (1990)
Physiology of the bacterial cell: a molecular approach.
Sunderland, Mass.: Sinauer; 351-388.
Raetz C. R. H. (1990) Biochemistry of endotoxins. Annu
Rev. Biochem., 59: 129-170.
Riley M. (1993) Functions of the gene products of
Escherichia coli. Microbiol. Rev. 57: 862-952.
Sahin H., Rohmer M., Bringcr-Meyer S., SprengerG. A,
Welle R. (1993) Biochemistry and physiology of
hopanoids in bacteria. Adv. Microbiol. Physiol. 35:
247-273.
Schnaitman C. A., KlenaJ.D. (1993) Genetics of
lipopolysaccharide biosynthesis in enteric bacteria.
Microbiol. Rev. 57: 655-682.
Sonenschein A. L., Hoch J. A., Losick R., eds. (1993)
Bacillus subtilis and other Gram-positive bacteda.
Washington, DC: ASM Press.
Stanier R. Y., Ingraham .1. L., Wheelis M. L., Painter P.R.
(1986) The microbial world, 5th edn. Englewood
Cliffs, N.I: Prentice-Hall.
Walsh C. (1979) Enzymatic reaction mechanisms. San |
Francisco: Freeman.
Woese C. R. (1987) Bacterial evolution. Microbiol. Rev. |
51: 221-271.
Источники рисунков
1. Gottschalk G. (1986) Bacterial metabolism, 2nd edn.
Berlin, Heidelberg, New York: Springer.
2. KogaY., Masateru N., Morii Y., Akagawa-Matsu-
shita M. (1993) Microbiol. Rev. 57: 164-182.
3. Friedman Y. C., Thauer R. K. (1992) Macrocylic
tetrapyrrole biosynthesis in bacteria. In: Leder-
berg J. (ed.) Encyclopedia of microbiology, vol. 3.
New York, London: Academic Press; 1-19.
Часть III
МНОГООБРАЗИЕ
МЕТАБОЛИЧЕСКИХ ПУТЕЙ
Изложенные в части II сведения об основных пу-
тях энергетического метаболизма (на примере ка-
таболизма глюкозы как общею для многих бакте-
рий субстрата) и различных способах получения
при этом АТР, о многочисленных функциях ци-
топлазматической мембраны, основных процессах
роста и питания микробных клеток, а также о ме-
тодах их определения относятся практически ко
всем прокариотам. Рассмотренные в гл. 7 процес-
сы синтеза из простых субстратов необходимых
молекул-предшественников для построения кле-
точных поли* еров в некоторой степени варьиру-
ют, но в основном сходны у различных бактерий.
В то же время различные группы прокариот обла-
дают невероятно разнообразными метаболически-
ми возможностями, позволяющими им использо-
вать самые разные субстраты и условия среды.
Описанию поразительного разнообразия микроб-
ного метаболизма и посвящена данная часть кни-
ги. В гл. 8 подробно рассмотрены механизмы асси-
миляции одноуглеродных субстратов, различных
форм неорганического азота, серы и других эле-
ментов. Для синтеза из этих субстратов всех необ-
ходимых строительных блоков у прокариот дей-
ствуют особые пути, многие из которых харак-
терны только для «специализированных» микро-
организмов. Одни и те же типы метаболических
процессов, например автотрофная фиксация СО2,
у прокариот представлены различными механиз-
мами. В последующих главах рассмотрены пути
окисления разнообразных органических и неорга-
нических субстратов, лежащие в основе таких ти-
пов микробного питания, как хемотрофия и лито-
трофия. В гл. 11 подробно изложены механизмы
использования бактериями молекулярного кисло-
рода в процессе дыхания и его роль в других мета-
болических процессах. Описанию получения энер-
гии анаэробными бактериями, окисляющими суб-
страты с использованием вместо кислорода иных
акцепторов электронов (анаэробное дыхание) или
осуществляющими брожение, т. е. окисление час-
ти молекулы субстрата с перенесением электро-
нов на промежуточные продукты и образованием
восстановленных конечных продуктов брожения,
посвящена гл. 12, и, наконец, в гл. 13 описаны пу-
ти использования прокариотами света. При этом
огромном многообразии путей метаболизма, поз-
воляющем микробам заселять самые разнообраз-
ные среды, в основе всех метаболических путей
лежат одни и те же фундаментальные механизмы.
Глава 8
Ассимиляция макро- и микроэлементов
Исходными субстратами для основных биосин-
тетических путей служат 12 центральных мета-
болитов-предшественников. При описании этих
путей в предыдущей главе предполагалось, что
необходимые для образования таких субстратов
питательные вещества присутствуют в среде в
легкоусвояемой форме: углерод в виде органи-
ческих соединений (например, глюкозы как ис-
точника углерода и энергии; уже па первом эта-
пе расщепления глюкозы образуются централь-
ные метаболиты-предшественники, используемые
в различных биосинтетических процессах; см.
гл. 3, 4 и 7), азот — в виде NH^ (рК для
NH3 = 9,3), фосфор —в виде Н2РО7 (рК2 для
Н3РО4 = 7,0), сера в виде HS_ (pKj для
H2S — 7,0) и микроэлементы в соответствую-
щей форме (например, железо в виде Fe2+). Пу-
ти транспорта ростовых субстратов рассмотрены
в гл. 5.
В то же время в природной среде обитания
питательные элементы чаще всего присутствуют
в иных молекулярных формах, например вместо
легкоусвояемых органических субстратов основ-
ными или единственными источниками углерода
могут быть лишь СО2 или другие Ci-соединения.
В этом случае первый метаболит-предшествен-
ник, используемый как субстрат для путей био-
синтеза, и в итоге все предшественники должны
быть образованы из (неорганического) источни-
ка углерода. Аммиак в природе быстро окисля-
ется до нитрата нитрифицирующими бактерия-
ми, H2S — кислородом воздуха до молекулярной
серы, которая далее окисляется серобактерия-
ми рода Thiobacillus до сульфата; железо, наи-
более важный питательный элемент из металлов,
в аэробных условиях существует в виде практи-
чески нерастворимых гидратов или карбонатов
его окисленной формы, Fe(III). В легкодоступной
форме присутствует только фосфор, поскольку
природные среды лишены необходимого для его
восстановления сильного восстановителя и сам
восстановленный фосфат нестабилен. Механизмы
получения прокариотами клеточных «строитель-
ных материалов» из наименее выгодных, в основ-
ном неорганических субстратов рассматриваются
в данной главе.
Пути ассимиляции питательных веществ у
бактерий весьма разнообразны, и этим прокари-
оты отличаются от растений с их большей частью
однотипным анаболизмом. Стоит отметить, что
ассимиляционный потенциал растений ограничен
метаболическими возможностями хлоропластов,
которые предположительно происходят от эндо-
симбиотических цианобактерий. Именно благода-
ря прокариотическому эпдосимбионту растение-
хозяин способно расти за счет использования ди-
оксида углерода, нитрата, фосфата и сульфата в
качестве единственных источников углерода, азо-
та, фосфора и серы. Предполагаемым эндосим-
биотическим происхождением хлоропластов объ-
ясняют локализацию в них большинства фер-
ментов, участвующих в ассимиляции экзогенных
субстратов, и сходство этих ферментов с фермен-
тами прокариот.
8.1. Автотрофные бактерии используют СОг
в качестве единственного источника углерода
Значительное число бактерий обладает способно-
стью использовать СО2 в качестве единственного
источника клеточного углерода. Эти организмы,
называемые автотрофами ( — самопитающимися),
относятся к различным эволюционным ветвям
прокариот. Гетеротрофы также потребляют СОг,
но лишь в небольшом количестве, как субстрат
отдельных метаболических реакций. Важнейшие
реакции включения СО2 в состав клеточного уг-
лерода у бактерий приведены в табл. 8.1. Про-
Глава 8. Ассимиляция макро- и микроэлементов 207
Таблица 8.1. Важнейшие реакции фиксации СО2 у бактерий
Реакция AG0' (2[Н] = Н2). кДж/моль СО2 Акцептор СО2 Фермент
Рибулозо-1,5-бисфосфат + СОг + НгО —» -» 2 З-Фосфоглицсрат Рибулозо-1,5-бисфос- фат Рибулозо-1,5-бис- фосфат-карбокси- ЛЕ13с1
СО2 + 2[Н] НСОО- + Н+ +3,4 Мо- или W-содержа- щий фермент Формиатдегидро- геназа
СО2 + 2[Н] [СО] + Н2О < +20,1 Ni-содержащий фермент СО-дегидрогеназа
СОг + Метанофуран ♦=* Карбоксиметанофуран ? Метанофуран Формилметанофу- ран-дегидрогеназа
СНз-CO-SCoA + СО2 + 2[Н] СНз-СО-СОО" + Н+ + CoASII +16,3 Ацетил-СоА Пируватсинтаза
-OOC-CH2-CH2-CO-SC0A + СО2 + 2[Н] -ООС-СН2-СН2-СО-СОО- + Н+ + CoASH +14,8 Сукцинил-СоА 2-Оксоглутарат- синтаза
-OOC-CH2-CII2-CO-COO- + СО2 + 2[Н] <-> -OOC-CH2-CII-CHOH-COO- + н+ -9,6 2-Оксоглутарат Изоцитратдегид- рогеназа
СОО-
СНз-СО-СОО- + НСО3 + АТР -> -ООС-СН2-СО-СОО- + ADP + Pi +0,1 Пируват Пируваткарбокси- лаза
сн2=с-соо~ + НСО^ -» 1 О-РО^- -»-ООС-СН2-СО-СОО- + Pi -19,7 Фосфо енолпируват (ФЕП) ФЕП-карбокси- лаза
ФЕП + НСО3 + pi Г* -ООС-СН2-СО-СОО- + РР-, +2,3 Фосфо енолпируват (ФЕП) ФЕП-карбоксики- наза (РР)
Ацетил-СоА + НСО^ + АТР —♦ —» Малонил-СоА + ADP + Р-, Ацетил-СоА Ацетил- Со А-кар- боксилаза
Пропиопил-СоА + НСО3 + АТР —> -»Метилмалонил-СоА + ADP + Р, Пропионил-СоА Пропионил-СоА- карбоксилаза
цесс автотрофной ассимиляции СО2 описывается
уравнением (8.1), где (СН2О) представляет собой
клеточное углеродное соединение со средней сте-
пенью окисления, равной нулю, т. е. соответствую-
щей степени окисления углерода в углеводах (или
в составе формальдегида). Для восстановления
углерода одной молекулы СО2 (степень окисле-
ния +4) до степени окисления углерода в соста-
ве клеточных органических соединений (пример-
но 0) требуется четыре электрона и дополнитель-
ная энергия:
СО2 + 4Н + пАТР 1=»
*=» (СН2О) + Н2О + 11ADP + nPj (8.1)
Известно четыре различных механиз-
ма фиксации СО2 □ Наиболее распространен
у прокариот цикл Кальвина-Бенсона-Бассама
(или, кратко, цикл Кальвина), функциониру-
ющий также в хлоропластах. Он характерен
208 Часть III. Многообразие метаболических путей
Таблица 8.2. Сравнение автотрофных путей ассимиляции СОг
Путь фиксации СО2 Трата АТР на синтез 1 мо- лекулы три- озофосфата Трата восстанови- теля на синтез 1 молекулы триозо- фосфата Фермент, фиксиру- ющий СОг Продукт фикса- ции СОг Ключевые ферменты
Цикл Кальвина— Бенсона-Бассама (восстановитель- ный пентозофос- фатный цикл) 9 молекул АТР 6 молекул NAD(P)H Рибулозо-1,5-бис- фосфат-карбокси- лаза З-Фосфоглице- рат Рибулозо-1,5- бисфосфат- карбоксилаза; фосфорибуло- киназа
Восстановитель- ный цикл трикар- боновых кислот 5 молекул АТР 3 молекулы NAD(P)H, 1 моле- кула неизвестного донора, 2 молеку- лы ферредоксина 2-Оксоглутарат- синтаза, изоцит- рат-дегидрогена- за, пируватсин- таза 2-Оксоглутарат, изоцитрат, пиру- ват 2-Оксоглутарат- синтаза, АТР- цитрат-лиаза
Восстановитель- ный ацетил-СоА путь 4-5 молекул АТР 3-4 молекулы NAD(P)H, 2-3 — ферредок- сина, 1 — Нг (у метано- генов) Ацетил-СоА-син- таза/ СО-дегид- рогеназа, форми- атдегидрогеназа, пируватсинтаза СО, связанный с ферментом, фор- миат, пируват Ацетил-СоА- синтаза/ СО-де- гидрогеназа; фермент, восста- навливающий СО2 до СН3-Н4- птерина
3-Г идроксипро- пионатный цикл ? ? Ацетил-СоА- карбоксилаза; пропионил-СоА- карбоксилаза Малонил-СоА; метилмалонил- СоА Ферменты, вос- станавливающие малонил-СоА до пропионил-СоА; мал ил-СоА- лиаза
для аэробных бактерий, тогда как у аэробных ар-
хей, по-видимому, отсутствует. Два других меха-
низма — восстановительный цикл трикарбоповых
кислот и восстановительный ацетил-СоА путь —
действуют у некоторых анаэробных бактерий и
архей. Наконец, специфический четвертый путь
пока обнаружен только у фототрофной зеленой
несерной бактерии Chloroflexus aurantiacus\ веро-
ятно, он функционирует и у некоторых аэробных
архей. Все эти механизмы фиксации СОг пред-
ставлены в табл. 8.2.
Автотрофные способы питания □ Среди
автотрофных бактерий можно выделить следу-
ющие типы по способу питания. Облигатные
автотрофы практически не способны использо-
вать органические субстраты, по-видимому вслед-
ствие отсутствия у них соответствующих транс-
портных систем. Факультативные автотрофы
при появлении в среде доступных органических
субстратов переключаются на их использование,
прекращая автотрофную фиксацию СОг- Мик-
сотрофные бактерии способны ассимилировать
СО2 одновременно с органическими субстратами.
Некоторые аноксигенные фототрофные бакте-
рии — факультативные автотрофы — предпо-
чтительно используют органические субстраты,
однако в процессе ассимиляции, например жир-
ных кислот, в которых углерод более восстанов-
лен, чем углерод клеточных компонентов, они
должны «сбрасывать» избыток восстановитель-
ных эквивалентов, осуществляя для этого фик-
сацию СО2- У таких бактерий цикл Кальви-
на, а также иногда другие механизмы фикса-
ции диоксида yi лерода выполняют важную роль
в поддержании внутриклеточного окислительно-
восстановительного баланса.
Глава 8. Ассимиляция макро- и микроэлементов 209
Дополнение 8.1. Фиксация диоксида
углерода — это второй по значимости после
синтеза АТР биохимический процесс. Клю-
чевой фермент автотрофной ассимиляции
СО2 — рибулозобисфосфат-карбоксилаза —
характеризуется низким числом оборотов
и обладает более низкой эффективностью,
чем ATP-синтаза, поэтому для эффектив-
ного осуществления фиксации СО2 клетки
должны содержать значительное количество
карбоксилазы. Именно этим объясняется
тот факт, что количество рибулозобисфос-
фат-карбоксилазы в природе превышает
содержание всех остальных ферментов.
У хемолитоавтотрофов на рибулозобис-
фосфат-карбоксилазу приходится примерно
20% общего клеточного белка; в хлоро-
пластах это соотношение мсжет быть еще
выше. У некоторых хсмолитоавтотрофных
бактерий рибулозобисфосфат-карбоксилаза
образует кристаллические включения, назы-
ваемые карбоксисомами; их биологическая
функция в настоящее время до конца нс яс-
на. Учитывая важность процесса фиксации
СО2, можно предполагать, что на ранних
этапах эволюции этот процесс мог осуществ-
ляться в результате неферментативпых,
автокаталитических реакций и автотрофная
ассимиляция СО2 представляет собой один из
наиболее древних биологических механизмов.
В то же время многие ученые-эволюционис-
ты отрицают это, утверждая, что первичные
органические вещества на Земле накаплива-
лись в результате их абиогенного синтеза.
Запас органического вещества, несомненно,
был необходимым условием возникнове-
ния жизни, однако ее последующее развитие
нельзя представить без автотрофии. В любом
случае, автотрофные бактерии существовали
задолго до того, как примерно два миллиарда
лет назад в результате формирования эндо-
симбиотической связи между прокариотами,
подобными цианобактериям, и эукариотиче-
скими гетеротрофными клетками появились
растительные организмы. До этого бактерии
были единственными первичными продуцен-
тами органического вещества на Земле.1
Распространение и роль автотроф-
ных бактерий в природе □ Оценить вклад
бактериальной фиксации СО2 в общую ассими-
ляцию неорганического углерода в водных экоси-
стемах довольно трудно. В прошлом лимнологи
часто преувеличивали вклад микропланктона
(прокариот) в этот процесс. Доминирующую
группу микропланктона водных экосистем состав-
ляют оксигениые фототрофные цианобакте-
рии, использующие в качестве источника энергии
свет и получающие восстановитель в реакции све-
тозависимого разложения воды. Учитывая чис-
ленность цианобактерий в планктоне и эффек-
тивность фиксации ими СО2, можно считать эти
организмы основными СОг-фиксирующими бак-
териями водных биотопов. Аноксигенные фото-
трофные бактерии, осуществляющие фотосинтез
без выделения кислорода, обитают главным об-
разом по линии раздела между аэробной и анаэ-
робной зонами водной толщи —в области, куда
проникает свет (источник энергии) и диффунди-
руют со дна восстановленные соединения, такие
как H2S, Fe2+ и Н2 (доноры электронов).
Хемолитоавтотрофная фиксация СО2 не
обеспечивает высокой эффективности роста.
У аэробных хемолитоавтотрофных бакте-
рий (за исключением водородокисляющих бак-
терий) более половины энергии, получаемой в
результате окисления неорганических восстанови-
телей, используется для восстановления NAD(P)
в процессе обратного транспорта электронов.
Тем не менее такие медленнорастущие бакте-
рии могут доминировать в особых экологиче-
ских нишах, например в месторождениях суль-
фида меди. Крайне малочисленную группу среди
автотрофов-прокариот составляют анаэробные
хемолитоавтотрофные бактерии. Рост их час-
то лимитирован недостатком восстановленных
субстратов. Как правило, они обитают в анаэроб-
ных зонах, где в результате жизнедеятельности
бактерий-бродилыциков образуются Н2 и форми-
ат, используемые анаэробными хемолитотрофами
в качестве источника электронов и энергии, а так-
же присутствует СО2 или сульфат, используемые
ими как конечные акцепторы электронов.
В то же время автотрофы в изобилии пред-
ставлены в некоторых особых условиях среды, та-
ких, например, как граница раздела между аэроб-
1 См. прим, в гл. 29 (вед. ред.).
210 Часть III. Многообразие метаболических путей
ной и анаэробной зонами (в почве и в страти-
фицированных водных системах), где доминиру-
ют аэробные хемолитоавтотрофы и анок-
сигенные фотолитоавтотрофы. Еще более
благоприятными местообитаниями для хемолито-
автотрофов служат морские глубоководные гид-
ротермальные венты, где богатая сульфидом
гидротермальная жидкость смешивается с мор-
ской водой, содержащей кислород. В таких усло-
виях первичные продуценты представлены только
этими бактериями.
8 1.1 Основным путем фиксации СОг
служит цикл Кальвина-Бенсона-Бассама
Ключевые и специфические для цикла Каль-
вина ферменты —это рибулозо-1,5-бисфосфат-
карбоксилаза и фосфорибулокиназа. Процесс
фиксации СОг но данному пути включает три ста-
дии (рис. 8.1).
1. Необратимое карбоксилирование рибуло-
зо-1,5-бисфосфата, приводящее к образова-
нию двух молекул 3-фосфоглицериновой кис-
лоты как первичного продукта карбоксилиро-
вания. Одна из двух карбоксильных групп в
составе этого соединения происходит из СО2.
2. Восстановление двух карбоксильных
групп фосфоглицериновой кислоты до
уровня альдегида ферментом глюконео-
генеза 3-фосфоглицераткиназой и глицер-
альдегид-3-фосфатдегидрогеназой (легкооб-
ратимые реакции). Данная бактериальная
дегидрогеназа, как правило, NADH-специ-
фична, тогда как в аналогичной дегидро-
геназной реакции у растений используется
NADPH. Восстановление требует активации
карбоксильной группы путем ее фосфорили-
рования 3-фосфоглицераткиназой с образова-
нием 1,3-бисфосфоглицерата. На этой стадии
расходуется практически вся энергия и восста-
новитель, необходимые для фиксации СО2.
3. Регенерация акцептора СО2 □ Первая
реакция в процессе регенерации акцептора
СО2 — это синтез фруктозо-6-фосфата из двух
молекул триозофосфатов, как и при глюко-
неогенезе; за ней следует ряд реакций однона-
правленной перестройки углеродного скелета
с образованием пентозо-5-фосфата(-ов). Реак-
ция фосфорилирования в первом положении
(С1-ОН) завершает регенерацию первично-
го акцептора СО2-рибулозо-1,5-бисфосфата
(рис. 8.2).
Рис. 8.1. Реакции цикла Кальвина.
А. Реакция карбоксилирования, катализируемая рибуло-
зо-1,5-бисфосфат-карбоксилазой (1). Ингибитор реак-
ции, 2-карбокси-0-арабитол-1,5-бисфосфат, — это ана-
лог промежуточного продукта.
Б. Восстановительная стадия, протекающая с участием
3-фосфоглицераткиназы (2) и глицеральдегид-3-фос-
фатдегидрогеназы (3). Обе реакции легкообратимы.
В. Полная схема цикла, включающая стадии А и В,
а также стадию С — регенерации первичного акцептора
СО2. Продуктом цикла является одна молекула трио-
зофосфата, используемая далее для синтеза клеточных
компонентов.
Глава 8. Ассимиляция макро- и микроэлементов 211
Рис. 8.2. Регенерация первичного акцептора СОг — ри-
6улозо-1,5-6исфосфата (путь превращения пяти моле-
кул триоз в три молекулы пентоз). Все реакции, за
исключением обозначенных жирными стрелками, лег-
кообратимые; 1 — триозофосфат-изомераза; 2 — фрук-
тозобисфосфат-альдолаза; 3 — фруктозобисфосфатаза;
4 — транскетолаза; 5 — седогептулозобисфосфат-альдо-
лаза; б — седогептулозобисфосфат-фосфатаза; 7 —
3-пентозофосфат-изомераза; 8 — рибозофосфат-изоме-
раза; 9 —фосфорибулокиназа (рибулозо-5-фосфатки-
наза).
Некоторые ферменты этих реакций пере-
стройки углеродного скелета по сути анало-
гичны тем, которые катализируют реакции глю-
конеогенеза и пентозофосфатного цикла в клет-
ках гетеротрофных бактерий (см. гл. 7). Одна-
ко механизмы образования седогептулозо-7-фос-
фата в окислительном пентозофосфатном цик-
ле и в цикле Кальвина различны (ср. рис. 7.20
и 8.2). В пентозофосфатном цикле Сз-единицы
переносятся трансальдолазой от фруктозо-6-фос-
фата на эритрозо-4-фосфат с образованием седо-
гептулозо-7-фосфата и глицеральдегид-3-фосфа-
та. В цикле Кальвина происходит необратимое
дефосфорилирование седо гептулозе-1,7-фосфата,
синтезированного из глицеральдегид-3-фосфата,
по С1-атому. Баланс реакций ассимиляции СО2 в
цикле Кальвина можно представить следующим
уравнением:
ЗСО2 + 9АТР + 6NAD(P)H + 6Н+ -»
> 1 Триозофосфатассих1ИЛИруемЫй +
+ 9ADP + 8Pi + 6NAD(P)+ (8.2)
В результате трех оборотов этого цикла обра-
зуется одна молекула триозофосфата, ассимили-
руемая в реакциях метаболизма (рис. 8.1); тра-
та энергии при фиксации составляет ЗАТР/СО2.
Две молекулы АТР необходимы для восстанов-
ления карбоксильной группы до уровня альде-
гида, третья — для фосфорилирования в первом
положении (С1-ОН) пентозо-3-фосфата. Таким
образом, всего два дополнительных к окисли-
тельному пентозофосфатному циклу фермента
— рибулозо-1,5-бисфосфат-карбоксилаза и
фосфорибулокиназа, называемые ключевы-
ми ферментами цикла Кальвина, — придают
организму способность к автотрофии. У факуль-
тативных автотрофов активность этих ферментов
максимальна в условиях автотрофного роста.
Рибулозо-1,5-бисфосфат-карбоксилаза □
Этот фермент существует в двух формах. До-
минирующая форма состоит из восьми боль-
ших (L) и восьми малых (S) субъедин дц мол.
массой, близкой соответственно к 53 и 14 кДа.
Большая субъединица содержит активный центр
фермента; функции малой субъединицы неиз-
вестны. Карбоксилаза с такой структурой при-
сутствует у большинства автотрофов, ассими-
лирующих СО2 в цикле Кальвина. Известна
также минорная форма карбоксилазы, обнару-
женная пока только у Rhodospirillum rubrum и
состоящая из двух больших субъединиц. Функци-
онально активные области больших субъединиц
обеих форм карбоксилазы высокогомологичны
по аминокислотной последовательности. Исход-
но этот фермент был назван карбоксидисмута-
212 Часть III. Многообразие метаболических путей
Рис. 8.3. Рибулозо-1.5-бисфосфат-оксигеназная реакция, катализируемая карбоксилазой в присутствии Ог.
зой, поскольку в процессе карбоксилирования
он осуществляет дисмутазную реакцию внутри-
молекулярного восстановления С2-атома и окис-
ления СЗ-атома рибулозо-1,5-бисфосфата. Актив-
ный центр карбоксилазы содержит ион Mg24,
Субстратом фермента служит СО2, нс НСО3.
Как предполагается, промежуточным продук-
том реакции является ендиол(-ят), образуемый
в реакционном центре и обладающий высокой ре-
акционноспособностыо в отношении взаимодей-
ствия как с СО2 (карбоксилазная активность),
так и с О2 (оксигеназная активность; см. ниже).
Для реакции карбоксилирования необходима
потеря протона 3-ОН-группы с образованием
енолят-аниона. Данный гипотетический проме-
жуточный продукт карбоксилазной реакции, ве-
роятно, подвергается гидролитическому расщеп-
лению (рис. 8.1). На такой механизм указывает то,
что структурный аналог предполагаемого проме-
жуточного соединения является сильным ингиби-
тором карбоксилазной реакции.
В отсутствие СО2 и при наличии кисло-
рода данный фермент катализирует кислород-
зависимое расщепление рибулозо-1,5-бисфосфата
с образованием фосфогликолата и фосфогли-
церата (рис. 8.3). Сродство фермента к СО2 вы-
ше, чем к О2. Отношение констант специфич-
ности к СО2 и О2 (VJnaxZ-^м) для карбокси-
лазной/оксигеназной активности равно примерно
80 : 1 у аэробных бактерий и 10 : 1 у аноксигенных
фототрофов. У бактерий образующийся в оксиге-
назной реакции фосфогликолат дефосфорилиру-
ется фосфатазой с выделением гликолата как по-
бочного продукта в среду. У растений гликолат
окисляется кислородом в процессе фотодыхания.
Другие ферменты □ Молекула второго
ключевого фермента цикла Кальвина, фосфо-
рибулокиназы, у бактерий состоит из шести
или восьми идентичных субъединиц. Анало-
гичный фермент растений представляет собой
гомодимер. У большинства бактерий субстратом
для ссдогепту лозо-1,7-бисфосфат-альдолазы и
седогепту лозо-1,7-бисфосфат-фосфатазы может
служить также фруктозобисфосфат. Однако у
некоторых прокариот эти ферменты строго спе-
цифичны к субстрату. У факультативно авто-
трофных штаммов обнаружены изоформы тех
ферментов цикла, которые участвуют также в
других путях метаболизма (например, альдолазы
и фруктозобисфосфатазы); изоферменты регу-
лируются независимо. В клетках бактерий, со-
держащих гены (опероны) фиксации СО2 как в
хромосоме, так и в плазмиде, присутствуют два
одинаковых набора ферментов автотрофной ас-
симиляции СО2.
Регуляция активности и синтеза фер-
ментов □ Ключевые ферменты цикла Кальви-
на, и, возможно, другие ферменты, необходи-
мые для автотрофной фиксации СО2, регулиру-
ются как на уровне синтеза, так и на уровне
активности под влиянием различных сигналов и
регуляторных белков. Механизмы регуляции за-
висят от типа микроорганизмов, различаясь у
облигатных/факультативных автотрофов, окси-
генных/аноксигенных фототрофов, хемолитоав-
тотрофов и т. д. Наиболее важные регуляторные
сигналы при фиксации СО2 — это сигналы о на-
личии восстановителя и энергетическом состоя-
нии клеток. Существенное значение имеет, кро-
ме того, регуляция по принципу обратной связи.
Например, большинство бактериальных карбок-
силаз ингибируется 6-фосфоглюконатом — проме-
жуточным продуктом катаболизма гексоз через
окислительный пентозофосфатный цикл. У фа-
культативных автотрофов этот механизм обеспе-
чивает переключение с автотрофного типа пита-
ния на хемогетеротрофный.
Гены ферментов, участвующих в ассимиляции
неорганического углерода и процессах автотроф
кого роста, могут быть локализованы в хромосоме
Глава 8. Ассимиляция макро- и микроэлементов 213
и/или в (мега)плазмиде. Вследствие этого способ-
ность к литоавтотрофии может переноситься пу-
тем конъюгации от автотрофного штамма дикого
типа мутанту, лишенному такой способности, или
даже весьма далекому в систематическом отно-
шении гетеротрофному организму. У Alcaligenes
eutrophus экспрессируются одновременно гомоло-
гичные опероны фиксации СО2 в хромосоме и в
мегаплазмиде; они образуют регулон и находятся
под контролем общего регуляторного белка — ак-
тиватора транскрипции. Природа внутриклеточ-
ной молекулы, действующей как сигнал потреб-
ности в фиксации СО2 и влияющей как положи-
тельный или отрицательный эффектор на этот
регуляторный белок, пока неизвестна. Наиболее
подробно регуляция автотрофной фиксации СО2
изучена у Rhodobacter sphaeroides, Rhodospirillum,
rubrum и Xanthobacter flavus.
Дополнение 8.2. Для исследования путей
включения СОг в состав клеточных компо-
нентов используются следующие методы.
1. Метод кратковременной фикса-
ции радиоактивно меченного СО2 (14СОг)
применяют для выявления первого продук-
та его ассимиляции. Впервые использование
14С-метки было предложено Каменом и Рубе-
ном в 1940 г. Метод заключается в том, что к
густой суспензии клеток, выращенных в авто-
трофных условиях, добавляют 14СОг, после
чего через различные промежутки времени
(обычно от 3 до 150 с) клетки быстро вносят
в кипящий или охлажденный на льду этанол
для прекращения фиксации СО 2 и одновре-
менно экстрагирования клеточных компонен-
тов. Экстракты подвергают двумерной тонко-
слойной хроматографии, и затем определяют
включение метки с помощью радиоавтогра-
фии. Кинетика включения 14С в продукты,
обнаруживаемые па радиоавтограмме, поз-
воляет судить о том, является ли меченый
продукт первым или одним из ранних интер-
медиатов процесса ассимиляции СО2. Пер-
вичный продукт содержит, как правило,
практически всю метку, фиксированную в
первые (<5) секунды экспозиции. Мече-
ные соединения, синтезируемые из первично-
го продукта, появляются на более поздних
(>5 с) стадиях экспозиции с 14СОг- Абсолют-
ное содержание * 14 С в составе продуктов асси-
миляции 14СС>2 на поздних стадиях экспози-
ции (>180 с) отражает величину внутрикле-
точного пула этих соединений.
2. Метод долговременной фиксации —
определение продуктов включения радио-
активного углерода из меченных 13С или
14С (по определенному положению) субстра-
тов роста, внесенных в среду для куль-
тивирования (например, 1-14С-ацегага или
2-13С-ацетата). В качестве таких субстратов
выбирают либо предполагаемые интермедиа-
ты фиксации СО2, либо соединения, способ-
ные превращаться в них (например, ацетат
легко трансформируется в ацетил-СоА). Эти
меченые молекулы, следуя в «потоке угле-
рода», основным источником которого слу-
жит СО2, включаются в состав клеточных
полимеров. Микроорганизм выращивают па
средах, содержащих меченые соединения, в
условиях сбалансированного роста в течение
периода времени, равного продолжительно-
сти нескольких циклов деления. После этого
путем гидролиза клеток получают фракции
сахаров и аминокислот и с помощью мето-
дов масс-спектроскопии и 13С-ядерного маг-
нитного резонанса анализируют внутримоле-
кулярное распределение метки в каждой из
фракций. Получаемые данные указывают, по
какому биосинтетическому пути были синте-
зированы соответствующие соединения.
3. Определение ключевых ферментов
автотрофной ассимиляции СО2 — рибулозо-
1,5-бисфосфат- карбоксил азы и фосфорибуло-
киназы (цикл Кальвина); АТР-цитрат-лиазы
и 2-оксоглутарат:ферредоксин-редуктазы
(восстановительный цикл трикарбоновых
кислот); ацетил-Со А-синтазы и СО-де-
гидрогеназы (восстановительный ацетил-
СоА-путь) или ферментов восстановления
малонил-СоА до пропионил-СоА (тригид-
роксипропионатный цикл).
4. Мутационный анализ, позволяющий
выяснять участие тех или иных ферментов
автотрофной фиксации СО2 (мутации в генах
этих ферментов приводят к снижению спо-
собности клеток расти в автотрофных усло-
виях) .
214 Часть III. Многообразие метаболических путей
5. Метод гибридизации ДНК с ме-
чеными зондами для выявления генов, от-
ветственных за автотрофную фиксацию СО2-
Этот тест позволяет судить о наличии или от-
сутствии данного гена, однако на основании
его результатов нельзя определить, функци-
онирует ли данный ген у исследуемого мик-
роорганизма. Кроме того, отрицательный ре-
зультат может быть ошибочно истолкован
как отсутствие искомого гена, если искомый
ген присутствует, но не содержит консер-
вативную последовательность, соответствую-
щую ЗОНД}7.
6. Изучение регуляции процесса
на уровне транскрипции или на пост-
транскрипционном уровне (см. гл. 19-21).
8.1.2. У строгих анаэробов, микроаэрофилов
и архей действуют альтернативные
пути фиксации СОг
Вначале необходимо рассмотреть восстановитель-
ный цикл трикарбоновых кислот (рис. 8.4) и вос-
становительный ацетил-СоA-путь (рис. 8.5), при
функционировании которых из двух молекул СО2
синтезируется одна молекула ацетил-СоА:
2СО2 + 8[Н] + пАТР + CoASH
—> ацетил-СоА + nADP + пР; (8.3)
В гетеротрофных условиях оба пути функциони-
руют в обратном направлении; при этом ацетил-
СоА окисляется с образованием двух молекул
СО2 (см. гл. 12).
После этих механизмов в данном разделе будет
рассмотрен 3-гидроксипропионатный цикл и про-
веден сравнительный анализ всех четырех путей
фиксации СОг-
Восстановительный цикл трикарбоно-
вых кислот □ При функционировании цикла
трикарбоновых кислот в обратном, восстанови-
тельном направлении три необратимых реак-
ции катализируются не теми ферментами, кото-
рые обеспечивают его работу в окислительном
направлении, — вместо сукцинатдегидрогеназы
участвует фумаратредуктаза, катализирующая
восстановление фумарата до сукцината, вместо
2-оксоглутаратдегидрогеназы, катализирующей
необратимое окислительное декарбоксилирование
2-оксоглутарата, действует 2-оксоглутарат:ферре-
доксин-оксидоредуктаза, осуществляющая обра-
тимое карбоксилирование сукцинил-СоА, и вме-
сто цитратсинтазы необратимого действия — об-
ратимая ATP-зависимая цитрат-лиаза [реакция
(8.4)].
Цитрат + CoASH + АТР —»
Оксалоацетат + ADP + Р, (8.4)
Таким образом, синтез ацетил-СоА протекает с
затратой двух молекул АТР — одной в сукцинил-
СоА-синтазной реакции и другой при АТР-зави-
симом расщеплении цитрата.
Этот путь функционирует у зеленых сер-
ных бактерий (Chlorobium), с некоторыми моди-
фикациями у некоторых сульфатредуцирующих
бактерий (Desulfobacter), у термофильных водо-
родных бактерий (Hydrogenobacter), осуществля-
ющих окисление водорода в микроаэробных усло-
виях, и у анаэробных сульфатредуцирующих ар-
хей (Thermoproteus).
Рис. 8.4. Реакции восстановительного цикла трикар-
боновых кислот: 1 — малатдегидрогеназа; 2 — фума-
ратгидратаза (фумараза); 3 — фумаратредуктаза; 4 —
сукцинил-СоА-синтетаза; 5 — 2-оксоглутарат:ферре-
доксин-оксидоредуктаза; б — изоцитратдегидрогеназа;
7 — аконитатгидратаза (аконитаза) и 8 — АТР-цитрат-
лиаза.
Глава 8. Ассимиляция макро- и микроэлементов 215
Рис. 8.5. Реакции восстановительного ацетил-СоА пути (вариант этого пути у ацетогенных бактерий): 1 —формиат-
дегидрогеназа; 2 — формил-птерин-Щ-синтетаза; 3 — метенил-птерин-Щ-циклогидролаза; 4 — метилен-птерин-Н4-
дегидрогеназа; 5 — метилен-птерин-Нд-редуктаза; б — ацетил-СоА-синтазный комплекс, состоящий из метилтранс-
феразы, В12-содержащего белка и СО-дегидрогеназы/ацетил-СоА-синтазы. Птерин-Н4—тетрагидрофолат (FH4)
или другие тетрагидроптерины.
Восстановительный ацетил-Со А-путь □
Этот механизм, в отличие от рассмотренных вы-
ше путей, действует как нециклический и обес-
печивает синтез ацетил-СоА из двух молекул
СОг через образование связанной с ферментом
карбонильной (СО) группы и связанной с тет-
рагидроптерипом метильной группы (рис. 8.5).
(Конечный этап соответствует промышленному
способу синтеза ацетата из СО и СН3ОН.) Клю-
чевой фермент ацетил-СоА-нути — это ацстил-
СоА-синтаза/СО-дегидрогеназа. Две молекулы
СО2 восстанавливаются независимо различны-
ми путями. Одна молекула СО2 восстанавли-
вается до формиата, который переносится на
тетрагидрофолат при участии формпл-тетрагид-
рофолатсинтазы. Реакция протекает с затратой
одной молекулы АТР. Связанный с коферментом
формильный остаток в несколько этапов восста-
навливается до метильной группы, аналогично то-
му, как происходят биосинтетические превраще-
ния Сцфрагментов у гетеротрофов (см. гл. 7).
Специфический этап ацетил-СоА-синтазного
пути — это синтез ацетил-СоА из СО2 и метил-
тетрагидроптерина, осуществляемый с участи-
ем трех ферментов. Мстилтрансфсраза перено-
сит метильную группу от метилтетрагидрофолата
на комплекс белка с корриноидом, действую-
щий как переносчик метильной группы. Ключе-
вой фермент этого процесса—никсльсодержащая
ацетил-СоА-сип газа/СО-дегидрогеназа, вероятно
представляющая собой мембраносвязанный бе-
лок. Данный фермент восстанавливает вторую
молекулу СО2 до СО-группы, связанной с фер-
ментом (СО-дегидро.^спазная реакция). В этой
эндергонической реакции используется энергия
трансмембранного электрохимического потенци-
ала. Далее па фермент переносится метильная
группа от комплекса белка с корриноидом. Тре-
тья реакция —это взаимодействие карбонильной
группы и метильной группы с образованием аце-
тильной группы, связанной с ферментом. При
участии СоА эта ацетильная группа высвобожда-
ется в составе ацетил-СоА (ацетил-СоА-синтазная
реакция). Подробно ацетил-СоА-синтазный путь
описан в разд. 12.1.6. Он функционирует не толь-
ко при автотрофной фиксации СО2, но также в
процессе синтеза ацетата у ацетогенных бактерий
и —в обратном направлении — при расщеплении
ацетата до СО2 и С1Д у использующих ацетат ме-
таногенных бактерий и в процессе полного окис-
ления ацетата у различных анаэробных бактерий.
Восстановительный ацетил-СоА-путь действу-
ет как механизм автотрофной ассимиляции СО2 у
некоторых сульфатредуцирующих бактерий (De-
sulfobacterium) и архей (Archaeoglobus), а также
у большинства ацетогенных бактерий и метано-
генов, т. е. только у строгих анаэробов. К харак-
терным ферментам этого пути относятся фермен-
ты, восстанавливающие СО2 до метильной груп-
пы, связанной с тетрагидроптерином, в первую
очередь ацетил-СоА-синтаза/СО-дегидрогеназа.
Известно много вариантов данного пути, напри-
мер с образованием формиата в виде свободно-
го интермедиата или комплекса с коферментом
216 Часть III. Многообразие метаболических путей
(табл. 8.1), участием различных Ci-переносящих
коферментов (например, тетрагидрофолата или
тетрагидрометаноптерина) и доноров электронов
(например, ферредоксина или фактора 420).
Ассимиляция ацетил-СоА, продукта ав-
тотрофной фиксации СОг о Синтезирован-
ный в восстановительном цикле трикарбоновых
кислот или в восстановительном ацетил-СоА пу-
ти ацетил-СоА ассимилируется путем восстанови-
тельного карбоксилирования при участии пиру-
ватсинтазы (пируват:ферредоксин-оксидоредук-
тазы) [реакция (8.5)]:
Ацетил-СоА 4- СОг +
4- Ферредоксинвосст 4- 2Н+ —> Пируват 4-
4- CoASH 4- Ферредоксинокисл (8.5)
Ассимиляция пирувата происходит различными
путями (см. анаплеротические реакции; гл. 7).
Дополнение 8.3. Образование С~С-связи,
о котором идет речь в этой главе, а так-
же расщепление С—С-связи в большинстве
случаев происходят по механизму альдоль-
ной реакции или реакции конденсации Клай-
зена (рис. 8.7). Альдольная реакция — это
конденсация о-атома углерода в составе аль-
дегида или кетона с карбонильным атомом
углерода в молекуле того же или другого аль-
дегида или кетона. Водород в ш-положении
относительно карбонильной группы в од-
ной молекуле отщепляется с образованием
нуклеофильного енолят-апиона, который ата-
кует электрофильный карбонильный атом
углерода другой молекулы того же или дру-
гого альдегида (либо кетона) с образовани-
ем новой С—С-связи. Продукт конденсации
двух молекул альдегида или кетона носит
название альдоль, чем объясняется назва-
ние реакции. Альдольная конденсация лег-
ко протекает как в прямом, так и в обрат-
ном направлении. Конденсация Клайзе-
на может происходить как конденсация двух
молекул эфира, при котором одна молекула
ацилируется по о-углеродному атому второй
молекулой эфира, либо как реакция ацилиро-
вания эфира молекулой альдегида или кето-
на. Реакциопноактивной молекулой служит
при этом енолят эфира, атакующий углерод
электрофильной карбонильной группы мо-
лекулы-партнера. В биологических системах
нуклеофильным компонентом в этой реак-
ции служит анион при а-атоме углерода
в составе ацилтиоэфира кофермента А, а
не ацил-кислородные эфиры. Как и в аль-
дольной реакции, первая стадия конденсации
Клайзена состоит в отщеплении протона от
о-атома углерода с образованием стабили-
зированного сполят-аниона. Этот нуклео-
фильный продукт конденсируется с другим
эфиром или кетоном в качестве электро-
фильного компонента. Конденсация Клайзе-
на обычно протекает только в направлении
формирования С—С-связи. Примерами аль-
дольных реакций могут служить реакции,
катализируемые альдолазой и траисальдо-
лазой, конденсации Клайзена — малатсинтаз-
ная, цитратсинтазная, АТР-цитрат-лиазная
и тиолазная реакции (см. Walsh. Ensymatic
reaction mechanisms; разд. Дополнительная
литература).
З-Гидроксипропионатный цикл □ Этот
циклический механизм, по которому происходит
синтез глиоксилата из двух молекул бикарбоната
(рис. 8.6), описывается следующим уравнением:
2НСО3 + 2NADPH 4- ЗН+ 4- ЗАТР ->
-> СНО-СОСП 4- 2NADP+ 4- 3ADP + ЗР, (8.6)
Глиоксилат относится к метаболитам-предшест-
венникам, используемым в биосинтетических ре-
акциях. З-Гидроксипропионатный цикл функ-
ционирует как путь автотрофной ассимиляции
СОг У зеленой несерной фототрофной бактерии
Chloroflexus aurantiacus и, возможно, у некоторых
аэробных архей.
Первая реакция цикла — это АТР-зависимое
карбоксилирование ацетил-СоА с образованием
метилмалонил-СоА, катализируемое биотин-зави-
симой ацетил-СоА-карбоксилазой (этот фермент
принимает также участие в синтезе жирных кис-
лот). Затем в двух последовательных реакци-
ях восстановления активированная коферментом
А карбоксильная группа малоната восстанавли-
вается до гидроксильной с образованием 3-гид-
роксипропионата в свободной форме. З-Гидро-
ксипропионат активируется коферментом А с
затратой одной молекулы АТР и образованием
3-гидроксипропионил-СоА, который далее под-
вергается дегидратации с образованием акрило-
Глава 8. Ассимиляция макро- и микроэлементов 217
Рис. 8.6. Предполагаемые реакции 3-гидрокси-
пропионатного цикла: 1 — ацетил-СоА-карбок-
силаза; 2 — дегидрогеназа малонового полуаль-
дегида; 3 — 3-гидроксипропионатдегидрогеназа;
4 — 3-гидроксипропионат-СоА-лигаза; 5 — акри-
лоил-СоА-гидратаза; 6 — акрилоил-СоА-редуктаза;
7 — пропионил-СоА-карбоксилаза; 8 — метилма-
лонил-СоА-эпимераза; 9 — метил малой ил-СоА-му-
таза; 10 — сукцинил-СоА:малат-СоА-трансфераза;
11 — сукцинатдегидрогеназа; 12 — фумаратгидра-
таза; 13—малил-СоА-лиаза.
ил-СоА. Затем происходит восстановление акри-
лоил-СоА до пропионил-СоА — акцептора для
последующей фиксации второй молекулы СО2
с участием пропиоиил-СоА-карбоксилазы. Про-
дукт фиксации — метилмалонил-СоА — изомери-
зуется в сукцинил-СоА, который превращается в
малил-СоА, расщепляемый в малил-СоА-лиазпой
реакции на ацетил-СоА и глиоксилат:
Малил-СоА —* Ацетил-СоА + Глиоксилат (8.7)
Путь включения глиоксилата в один из централь-
ных метаболитов-предшественников пока не ясен.
Сравнение путей автотрофной фиксации
СО2 □ Четыре описанных выше механизма ав-
тотрофной фиксации СО2 (табл. 8.2) различают-
ся по количеству молекул АТР, расходуемых на
синтез молекулы триозы из трех молекул СО2,
и используемым восстановителям. В анаэробных
механизмах (восстановительный цикл трикарбо-
новых кислот и восстановительный ацетил-СоА-
путь) помимо NAD(P)H используется восстанов-
ленный ферредоксин и фиксация СО2, как пра-
вило, заключается в реакции восстановительного
карбоксилирования. Характерный признак анаэ-
робных механизмов фиксации СО2 — обратимость
их реакций. У одного и того же организма в
автотрофных условиях они обеспечивают авто-
трофную фиксацию СО2, тогда как в хемогетеро-
трофных условиях — окисление ацетил-СоА как
продукта катаболизма органических субстратов.
Альдольная реакция
R-C-C-C-R'
<4 ^SCoA
I ?Н
H-C-C-R,
К, к,
Конденсация клайзена
^SCoA
I
нс©
।
Ri
R2
1
с=о
I
R3
Рис. 8.7. Механизмы альдольной реакции и конденса-
ции Клайзена.
218 Часть III. Многообразие метаболических путей
8.2. Для синтеза метаболитов-предшественников из Сг-субстратов
необходимы дополнительные реакции
При росте в среде с ацетатом в качестве един-
ственного источника углерода микроорганизмы
должны синтезировать все клеточные компонен-
ты из ацетил-СоА, как и при росте с исполь-
зованием жирных кислот или накапливаемого в
клетках в качестве запасного вещества полигид-
роксибутирата (продуктом их расщепления явля-
ется ацетил-СоА). Пируват и фосфоегюлпируват
не могут быть синтезированы из ацетил-СоА в ре-
акциях, обратных пируватдегидрогеназной и пи-
руваткиназной, поскольку обе эти реакции необ-
ратимы. Решение проблемы состоит здесь в том,
что в дополнение к ферме ггам цикла трикарбо-
новых кислот действуют еще два фермента, обра-
зующие глиоксилатный цикл.
Глиоксилатный цикл □ Ключевые фер-
менты глиоксилатного цикла (рис. 8.8) —это изо-
цитрат-лиаза, катализирующая реакцию
Изоцитрат —> Глиоксил ат 4- Сукцинат, (8.8)
и малатсинтаза, катализирующая реакцию
Глиоксилат 4- Ацетил-СоА 4- Н2О —>
-> Малат + CoA-SH (8.9)
Малатсинтазная реакция сходна с цитратсин-
тазной. В обоих случаях конденсация субстратов
происходит в реакции Клайзена. Функционирова-
ние цикла приводит к синтезу из двух молекул
ацетил-СоА (С2) дополнительной молекулы окса-
лоацетата (С4), которая служит предшественни-
ком пирувата и фосфоемолпирувата (ФЕП)—ос-
новных исходных метаболитов для всех биосинте-
тических процессов.
Ассимиляция ацетил-СоА у строгих
анаэробов □ Строгие анаэробы, обладающие
пируват: ферредоксин-оксидоредуктазой, ассими-
лируют ацетил-СоА не через глиоксилатный
цикл, а путем восстановительного карбоксилиро-
вания ацетил-СоА, т. е. в обратной реакции, ка-
тализируемой этим ферментом в качестве пиру-
ватсинтазы [реакция (8.5)]. Таким способом ас-
симилируется ацетил-СоА, синтезированный из
двух молекул СО2 в альтернативных путях ав-
тотрофной фиксации СО2 — восстановительном
цикле трикарбоновых кислот и восстановитель-
ном ацетил-СоА пути. Из пирувата различными
путями образуются оксалоацетат и ФЕП (см. ана-
плеротические реакции; гл. 7).
Ассимиляция других Сг-субстратов □
Когда единственными источниками углерода в
среде являются такие Сд-субстраты, как глиок-
силат, гл и колат или оксалат, для синтеза ацетил-
СоА, пирувата и ФЕП используются особые меха-
низмы; некоторые из них рассмотрены в гл. 9.
Рис. 8.8. Ассимиляция ацетил-СоА в глиоксилатном
цикле. За один оборот цикла из двух молекул ацетил-
СоА синтезируется молекула оксалоацетата — исходно-
го субстрата для синтеза всех основных метаболитов-
предшественников. Окисление ацетил-СоА происходите
цикле трикарбоновых кислот и сопряжено с запасанием
энергии. Ферменты глиоксилатного цикла: 1 — цитрат-
синтаза; 2 — аконитаза; 3 — изоцитрат-лиаза; 4 — малат-
синтаза; 5 — сукцинатдегидрогеназа; б — фумаратгидра-
таза; 7 — малатдегидрогеназа.
Глава 8. Ассимиляция макро- и микроэлементов 219
8.3. Метилотрофные бактерии используют в качестве
единственного источника углерода одноуглеродные соединения
Среди бактерий, называемых мети л строфами,
одни способны использовать в качестве един-
ственного источника углерода СО, формиат,
формальдегид, метанол, метиламин, метилмер-
каптан или метан, тогда как другие могут
ассимилировать одноуглеродные фрагменты,
присутствующие в органических субстратах и
соединенные с многоуглеродным остатком че-
рез гетероатом (N, S или О). Пример субстра-
тов такого типа — арил-О-метиловые эфиры,
вещества растительного происхождения. У аэроб-
ных бактерий расщепление метиловых эфиров на-
чинается с монооксигеназной реакции окисления
R-О—СНз —> R—О—СНзОН. Продукт окисления
расщепляется на соответствующий спирт (R—ОН)
и формальдегид (СН2О). Анаэробы метаболи-
зируют подобные соединения совершенно иным
путем, осуществляя тетрагидрофолат-зависимое
деметилирование метилового эфира, при кото-
ром спирт (R—О“) высвобождается, а метильная
группа (CHg ) переносится на белок и затем па
тетрагидрофолиевую кислоту. Далее мы рассмот-
рим, каким образом эти разнообразные бактерии
синтезируют из одпоуглеродных соединений ос-
новные метаболиты-предшественники.
8.3.1. Аэробные бактерии могут ассимилировать
Ci-субстраты двумя путями
Один путь — он действует у аэробных бакте-
рий, для которых Ci-соединения пе служат
основными субстратами роста, — это окисление
Ci-соединений до СО2, который затем ассими-
лируется в цикле Кальвина. Такой способ энер-
гетически неэффективен, поскольку энергия, по-
лученная в результате окисления С i-субстратов,
расходуется затем в реакциях ассимиляции СО2,
в то время как степень восстановления Ci-сое-
динений соответствует уровню восстановления
клеточного углерода (или С в составе формаль-
дегида). Другой путь ассимиляции С i-субстратов
у аэробов — это непосредственное включение фор-
мальдегида—интермедиата, образующегося при
окислении метилсодержащих соединений и по сте-
пени окисления С эквивалентного углеводам. Все-
го известно три циклических пути ассимиляции
формальдегида, два из которых функционируют
у метилотрофов. Они названы по первому продук-
ту— сериновый путь, гексулозофосфатный путь
(рибулозомонофосфатпый цикл) и дигидрокси-
ацстоновый путь. Два первых пути функциони-
руют у метилотрофов-прокариот, последний цикл
обнаружен только у метилотрофных дрожжей.
Сериновый путь □ Как отмечено в гл. 7,
образование Сi-фрагментов, используемых в био-
синтетических реакциях, происходит главным
образом путем превращения серина в гли-
цин. В этой обратимой реакции, катализируе-
мой серингидроксиметилазой, происходит перенос
Сз-фрагмента серина на тетрагидрофолиевую
кислоту (FH4) с образованием Д;5,Л^10-метилен-
тетрагидрофолиевой кислоты. По степени восста-
новления Сз-фрагмент серина эквивалентен фор-
мальдегиду; образование А'5,А/’10-метилентетра-
гидрофолата может протекать неферментативио
при смешивании формальдегида и тетрагидро-
фолиевой кислоты. В сериновом пути (рис. 8.9)
действует катализируемая серингидроксиметила-
зой обратимая реакция синтеза серина из гли-
цина для фиксации формальдегида. Чтобы этот
путь действовал как замкнутый цикл с регене-
рацией глицина в качестве первичного акцепто-
ра формальдегида, серин превращаётся в глице-
рат и затем в фосфо енолпиру ват (ФЭП). Послед-
ний карбоксилируется путем включения второй
одноуглеродной группы из СО2 с образованием
оксалоацетата. Оксалоацетат восстанавливается
до малата, который при участии малил-СоА-
синтетазы и АТР превращается в малил-СоА.
Малил-СоА расщепляется малил-СоА-лиазой на
глиоксилат и молекулу ацетил-СоА — конечный
продукт серинового цикла, в котором один из уг-
леродных атомов ацетильного остатка происхо-
дит из СО2, а другой из формальдегида. Гли-
оксилат вступает в реакцию переаминирования с
серином, которая обеспечивает регенерацию гли-
цина. Таким образом, замыкание цикла осуществ-
ляют четыре дополнительных ключевых фер-
мента — трансаминаза, гидроксипируватредукта-
за, малил-СоА-синтетаза и малил-СоА-лиаза.
220 Часть III. Многообразие метаболических путей
NADH
NAD
Глицин COOH COOH СООН +Н СООН
I (1) I @1 V / 1
H.N-CH. - ► H?N"CH ——► с = о ---------X-----► снон
А '___. А 1 @1
[сн^н] [_Nh21 с,^он сн*он
|сн2о|
л Серин Гидроксипируват Глицерат
Рис. 8.9. Сериновый путь фиксации фор-
мальдегида.
А и Б — ключевые реакции цикла, В—
полный цикл. 1 — серингидроксиметила-
за; 2 — трансаминаза, превращающая се-
рин в гидроксипируват и глиоксилат
в глицин; 3 — гидроксипируватредуктаза'
4 — глицераткиназа; 5 — фосфоглицерат-
мутаза и енолаза; б — ФЕП-карбоксилаза;
7 — малатдегидрогеназа; 8 — малил-СоА-
синтетаза; 9 — малил-СоА-лиаза.
В
Последующая ассимиляция ацетил-СоА — ко-
нечного продукта серинового пути — происходит
в глиоксилатном цикле (см. гл. 7) при участии
изоцитрат-лиазы и малатсинтазы. Полностью се-
риновый цикл изображен на рис. 8.9. Затраты
АТР на синтез одной молекулы триозы в сери-
новом цикле больше, чем в рибулозомопофосфат-
пом. Дополнительные молекулы АТР использу-
ются для фиксации СО2-
Гексулозофосфатный цикл □ В этом цик-
ле (рис. 8.10) акцептором формальдегида слу-
жит рибулозо-5-фосфат. Образуемый при участии
гсксулозо-6-фосфатсиптазы гсксулозо-6-фосфат
затем изомеризуется во фруктозо-6-фосфат.
Акцепторная молекула рибулозо-5-фосфата ре-
генерирует аналогично тому, как это происходит
в цикле Кальвина (см. рис. 8.2), за исключени-
ем того, что часть молекул фруктозо-6-фосфата
фосфорилируется с образованием фруктозо-1,6-
фосфата, который альдолаза расщепляет па две
молекулы фосфотриозы. Одна из них использу-
ется в реакциях биосинтеза, другая — для регене-
рации рибулозо-5-фосфата, акцептора формаль-
дегида. Весь процесс ассимиляции формальдеги-
да с упрощенной схемой регенерации рибулозо-5-
фосфата представлен на рис. 8.10. Характерные
особенности рассмотренных путей ассимиляции
формальдегида суммированы в табл. 8.3.
Модификации путей ассимиляции фор-
мальдегида □ Некоторые бактерии, ассимили-
рующие формальдегид через сериновый путь,
не способны усваивать ацетил-СоА с использо-
ванием глиоксилатного цикла, поскольку у них
отсутствует изоцитрат-лиаза или малил-СоА-
синтаза. Механизм включения ацетил-СоА —
продукта серинового цикла — в биосинтетиче-
ские процессы у этих бактерий пока неизвестен.
В рибулозомопофосфатном цикле у некото-
рых метилотрофов вместо ферментов пути
Эмбдена-Мейергофа функционируют фермен-
ты пути Энтнера-Дудорова. В этом случае суб-
стратом для основных путей биосинтеза стано-
Глава 8. Ассимиляция макро- и микроэлементов 221
Рис. 8.10. Гексулозофосфатный путь ассимиляции фор-
мальдегида.
А. Начальные реакции.
Б. Регенерация акцептора Ci. Штриховой линией об-
ведены реакции образования из трех молекул триозо-
фосфата и одной молекулы фруктозо-б-фосфата трех
молекул рибулозо-5-фосфата. Эта часть пути практиче-
ски идентична соответствующей части цикла Кальви-
на (см. рис. 8.2). 1 —гексулозофосфатсинтаза; 2 — гек-
сулозофосфат-изомераза; 3 — фосфофруктокиназа; 4 —
фруктозо-1,б-бисфосфат-альдолаза.
сн2о |
сн2он
с=о
| СН2ОН |
носн
сн2он
с=о
носн
неон
неон
неон
неон
। _
СН2О©
Фруктозо-6-Р
О-эритро-L-
глицеро-3-
НСОН
I _
СН2О©
неон
СН2О®
Рибулозо-5-Р
Б
3 СН2О + 2АТР
1|триозо-р| + 2ADP + Р,
Таблица 8.3. Сравнение путей ассимиляции Ci-соединений
Путь ассимиляции Ci-соединений С1-фиксирующий фермент СОг-фиксирующий фермент Продукты ассимиляции углерода
Сериновый путь Гексулозофосфатный путь Ацетил-СоА-путь (только у анаэробов) Серингидроксиметилаза Гексулозофосфатсинтаза Формилтетрагидрофолат- синтаза, неферментативная реакция взаимодействия формальдегида с FH4 ФЕП-карбоксилаза СО-дегидрогспаза Серин, оксалоацетат Гексулозофосфат Метилен-тетрагидроптерин, СО, связанный с ферментом
Ф
вится пируват и вместо фруктозо-1,6-бисфосфат-
альдолазы и седогептулозобисфосфатазы функ-
ционируют КДФГ-альдолаза и трансальдолаза.
8.3.2. Ассимиляция Ci-субстратов
у анаэробных бактерий
Рассмотренные выше аэробные пути ассимиляции
формальдегида теоретически могли бы функцио-
нировать и у анаэробных бактерий, однако боль-
шинство метилотрофпых анаэробов ассимилиру-
ет Ci-субстраты через восстановительный ацетил-
СоА-путь фиксации СОг (рис. 8.11). Как вид-
но из рисунка, источником связанных с тетра-
гидрофолиевой кислотой Ci-фрагментов могут
служить как СО2, так и различные экзогенные
Ci- или С]-содержащие соединения, для исполь-
222 Часть III. Многообразие метаболических путей
Рис. 8.11. Анаэробная ассимиляция Ci-суб-
стратов через восстановительный ацетил-
СоА-путь. См. также рис. 8.5.
зования которых необходимы некоторые дополни-
тельные ферменты промежуточного обмена, на-
пример специфические метилтрансферазы, осу-
ществляющие перенос метильной группы от
метанола или арилметилового эфира на тетрагид-
рофолиевую кислоту. Продукт деметилирования
представляет собой соответствующий спирт, т. е.
кислородный атом остается связанным с многоуг-
леродным остатком (например, с ароматическим
кольцом).
8.4. Источником аммиака могут служить
различные азотсодержащие соединения
Бактерии обладают разнообразными механизма-
ми для высвобождения аммиака из азотсодержа-
щих органических субстратов (см. гл. 9 и 12). Наи-
более распространенные органические источники
азота — это мочевая кислота, мочевина и алланто-
ин (продукты детоксикации NH3 у человека и жи-
вотных). Получение микробными клетками NH3
из мочевины, одного из простейших органических
соединений, происходит при участии никельсодер-
жащего фермента уреазы в следующей реакции:
H2N-CO-NH2 + Н2О -> 2NH3 + СО2. (8.10)
Путь деградации мочевой кислоты рассмотрен в
гл. 9.
Ассимиляционная нитратредукция □
В природных экосистемах растворимый азот ча-
ще всего представлен NO3 , и многие бактерии
способны восстанавливать нитрат до NH3 (При
физиологических значениях pH аммиак присут-
ствует в растворе главным образом в виде HN4 . —
Ред.}. Для поглощения ионов нитрата, а также
нитрита, содержание которого в среде обитания
всегда незначительно, они обладают специаль-
ными транспортными системами. Восстановление
нитрата до аммиака происходит в два этапа (ре-
акции 8.11 и 8.12). Обе реакции сопровождаются
выделением большого количества энергии.
HNO3 + 2[Н] -> HNO2 + Н2О (8.11)
HNO2 + 6[Н] NH3 + 2Н2О (8.12)
Двухэлектронное (сопряженное с переносом двух
электронов) восстановление нитрата до нит-
рита катализирует нитратредуктаза; этот этап
называют нитратредукцией [реакция (8.11)|.
В состав фермента входит флавин, молибден и
Fe-S-кластеры (см. гл. 12). Нитратредуктаза вос-
станавливает также химический аналог нитрата
хлорат (СЮ3) с образованием высокотоксично-
го хлорита (СЮ2), и это се свойство исполь-
зуют в исследованиях для выявления мутантов,
лишенных нитратредуктазы, по их устойчи-
вости к хлорату. Шестиэлектронное восста-
новление нитрита до аммония — нитритредук-
ция [реакция (8.12)] — катализирует нитритре-
дуктаза. Большинство нитритредуктаз содержит
железо-серные кластеры и сирогем — железосо-
держащий порфирин. Сирогем присутствует так-
же в качестве простетической группы в суль-
фитредуктазе, катализирующей восстановление
HSO^" до H2S. Ассимиляционные нитратредук-
тазы и нитритредуктазы представляют собой во-
дорастворимые ферменты; их синтез подавляет-
Глава 8. Ассимиляция макро- и микроэлементов 223
ся аммиаком и индуцируется нитратом. Дис-
симиляционные ферменты с теми же назва-
ниями связаны с мембраной или локализованы
в периплазматическом пространстве; в аэробных
условиях их синтез подавлен (см. гл. 12). До-
нором электронов для обоих ассимиляционных
ферментов в зависимости от вида бактерий мо-
жет быть NAD(P)H или ферредоксин. В анаэроб-
ных условиях Escherichia coli и некоторые другие
бактерии способны расти в среде с NO3 с ис-
пользованием механизма диссимиляционной нит-
ратрсдукции, однако в аэробных условиях они
не ассимилируют нитрат в качестве источника
азота.
8.5. Восстановление N2 до NH3 катализирует нитрогеназа
Во многих местообитаниях азот в связанной фор-
ме отсутствует, и здесь могут развиваться только
бактерии, способные фиксировать атмосферный
азот (диазотрофия) путем восстановления его
до аммиака. Способность к азотфиксации широ-
ко распространена среди бактерий и архей, тогда
как среди эукариот организмы, обладающие этим
свойством, не обнаружены. Реакцию восстанов-
ления N2 до 1\Н3 катализирует нитрогеназа.
В нитрогеназной реакции происходит восстанов-
ление молекулы N2 с затратой 16 молекул АТР,
6 протонов и 6 электронов от восстановительных
эквивалентов плюс двух дополнительных элек-
тронов для восстановления двух протонов до Н2:
N2 + 8Н+ + 8е“ + 16АТР + 16Н2О ->
-> 2NH3 + Н2 + 16ADP + 16Pi (8.13)
Затраты АТР и восстановленного ферре-
доксина в нитрогеназной реакции □ Восста-
новление N2 до NH3 с использованием 3 молекул
Н2 в качестве источника электронов — это реак-
ция с выделением энергии (—91 кДж/моль). В то
же время биологическая фиксация азота требу-
ет значительной траты АТР и восстановителя.
Энергия затрачивается на преодоление высоко-
го активационного барьера для разрыва первой
из трех чрезвычайно устойчивых при нормаль-
ной температуре связей в молекуле N=N. В усло-
виях промышленного синтеза NH3 из Н2 и N2
(реакция Харбера-Боша) этот барьер преодо-
левается под действием высоких температуры и
давления в присутствии металлсодержащих ката-
лизаторов. Затраты АТР и восстановителя при
биологической фиксации азота настолько высо-
ки, что экономический коэффициент и скорость
роста бактерий с использованием N2 в качестве
источника азота значительно ниже, чем в присут-
ствии NH3. Это вполне объяснимо, поскольку азот
составляет примерно 14% сухого вещества мик-
робных клеток и при этом на восстановление од-
ной молекулы N2 затрачивается 8 восстановитель-
ных эквивалентов, для получения которых необ-
ходимо полное окисление одной молекулы ацета-
та, и еще одна молекула ацетата требуется для
обеспечения процесса необходимым количеством
АТР.
Восстановителем в нитрогеназной реакции
служит восстановленный ферредоксин (в усло-
виях дефицита железа заменяемый в нитроге-
назной и различных других восстановительных
реакциях низкомолекулярным флавопротеидом
флаводоксином). Восстановление ферредокси-
на может происходить различными путями
(рис. 8.12).
Чувствительность нитрогеназы к кисло-
роду □ Активный центр нитрогеназы, который
для осуществления реакции должен быть в высо-
кой степени восстановленным, легко окисляется
кислородом воздуха, и по причине этого нитроге-
наза высокочувствительна к 02 — она инактиви-
руется на воздухе и в аэробных условиях ее син-
тез прекращается. Таким образом, фиксация азо-
та представляет собой строго анаэробный процесс.
Чувствительность нитрогеназы к 02 не затруд-
няет осуществление азотфиксации в случае стро-
гих анаэробов, но является лимитирующим фак-
тором в случае аэробов и факультативных анаэ-
робов. Тем не менее эти бактерии осуществляют
азотфиксацию при низком содержании кислорода
в среде — благодаря наличию у них специальных
защитных механизмов.
224 Часть III. Многообразие метаболических путей
Рис. 8.12. Реакции восстановления ферредоксина
как источника водорода для нитрогеназной реакции.
У оксигенных фототрофных цианобактерий ферредок-
син восстанавливается фотосистемой I на свету
и пируват:ферредоксин-оксидоредуктазой в темно-
те. У анаэробных хемотрофов он восстанавливается
ферредоксин-зависимыми оксидоредуктазами, такими
как пируват:ферредоксин-оксидоредуктаза, гидрогена-
за и формиатдегидрогеназа. У аэробных хемотрофов
и аноксигенных фототрофов восстановление ферредок-
сина происходит при участии NAD(P)H и ферредок-
син:1\1А0(Р)+-оксидоредуктаз. У аэробных хемолитоав-
тотрофов ферредоксин восстанавливается путем энер-
гозависимого, опосредованного мембраносвязанными
белками обратного переноса на него электронов от
NAD(P)H или от восстановленных компонентов элек-
тронтранспортной цепи с более положительным, чем у
ферредоксина, окислительно-восстановительным ютен-
циалом; источником АТР для такой регенерации восста-
новленного ферредоксина служат фотосинтез, дыхание
или брожение. Приведенная схема отражает и механиз-
мы восстановления флаводоксина.
1. У некоторых аэробных почвенных бактерий,
таких как Azotobacter, защитный в отноше-
нии нитрогеназы эффект оказывает потреб-
ление ими с высокой скоростью кислорода из
среды, т. с. действует так называемая дыха-
тельная защита, обеспечиваемая высокоак-
тивной и разветвленной дыхательной цепью
(см. разд. 11.3.2). При фиксации азота у этих
бактерий действуют те ветви этой цепи, кото-
рые имеют только один участок сопряжения с
фосфорилированием, но при этом эффектив-
но восстанавливают Ог до воды. У Azotobacter
при высокой концентрации кислорода индуци-
руется синтез терминальной цитохром d-окси-
дазы; эта цитохромоксидаза обладает низким
сродством к О2, но высокой Цпах. (У не фикси-
рующих азот бактерий цитохром d имеет вы-
сокое сродство к О2 и синтезируется в усло-
виях недостатка О2; см. гл. 10.) Благодаря
высокой скорости переноса в этой цепи элек-
тронов на кислород происходит его быстрое
удаление из среды, предотвращающее инакти-
вацию нитрогеназы, хотя одновременно про-
исходит и повышенная трата NADH. В других
условиях эти бактерии используют альтерна-
тивную ветвь дыхательной цепи, имеющую,
подобно митохондриальной цепи, три участка
сопряжения с фосфорилированием.
2. У других бактерий, например у факульта-
тивных фототрофов, защиту нитрогеназы при
низкой концентрации О2 обеспечивает осо-
бый защитный белок. Механизм его действия
пока пе вполне ясен. Предположительно он
связывается с нитрогеназой, что вызывает из-
менение ее конформации, сопровождаемое по-
терей активности, но вместе с тем приобрете-
нием устойчивости к кислороду, — эффект, на-
званный конформационной защитой. Это
связывание носит обратимый характер, и при
исчерпаниии кислорода нитрогеназа возвра-
щается в активное состояние (механизм пере-
ключения).
3. У некоторых бактерий защиту от кислорода
обеспечивает морфологическая или пове-
денческая адаптация. Типичный пример
морфологической адаптации — это образо-
вание гетероцист (см. разд. 24.3 и 34.2).
Другой механизм, препятствующий досту-
пу кислорода к клеткам (например, у Azo-
tobacter),— это продукция большого количе-
ства слизи. Симбиотические азотфиксирую-
щие бактерии индуцируют синтез в клетках
растения-хозяина белка леггемоглобина, ко-
торый связывает кислород, снижая его пар-
циальное давление. У многих азотфиксирую-
щих бактерий защитный эффект оказывает
агрегация клеток или образование тесных ас-
социаций с аэробными гетеротрофами. Для
подвижных азотфиксаторов эффективным
способом защиты служит отрицательный
аэротаксис, позволяющий избегать области
среды с повышенным содержанием кислорода.
Глава 8. Ассимиляция макро- и микроэлементов 225
Поскольку восстановление N2 сопровождается
восстановлением протонов до Н2, все ^-фикси-
рующие бактерии, за исключением симбиотиче-
ских ризобиев, обладают никельсодержащей, мем-
браносвязанной гидрогеназой, осуществляющей
восстановление ферредоксина с использованием
образующегося молекулярного водорода. Присут-
ствием никеля в этом необходимом ферменте, воз-
можно, объясняется зависимость азотфиксации
от наличия в среде не только молибдена (или ва-
надия), но и никеля. Следует, однако, отметить,
что скорость дыхания за счет использования во-
дорода, выделяющегося в нитрогеназной реакции,
настолько низка, что не обеспечивает, безусловно,
защиту нитрогеназы от кислорода.
Распространение свойства азотфиксации
среди прокариот □ Способностью к азотфик-
сации обладают только прокариоты. Все эукари-
оты так или иначе зависят от этого микробного
процесса, либо косвенно, либо, как растения, об-
ладающие азотфиксирующими прокариотически-
ми эндосимбионтами, непосредственно. На гло-
бальном уровне азотфиксация важна для поддер-
жания цикла азота; в том числе она восполняет
потерю связанного азота, происходящую в ре-
зультате процесса денитрификации. Способность
к азотфиксации широко распространена среди
прокариот. Она обнаружена у представителей
всех таксономических групп, включая анаэроб-
ные, аэробные и фототрофные бактерии. Как
предполагается, гены азотфиксации часто пере-
даются путем горизонтального переноса от одного
вида или рода другому. Возможность такого пере-
носа экспериментально подтверждена получением
коныогационного переноса nif -генов (от nitrogen
fixation) от Klebsiella к Escherichia.
Нитрогеназы □ Известно три типа нитро-
геназ. Наиболее распространенная форма содер-
жит молибден, связанный с гомоцитратом и
Fe-S-цептром (рис. 8.13); в других формах это-
го фермента вместо молибдена присутствует ва-
надий или железо. Некоторые микроорганиз-
мы в зависимости от наличия в среде молибде-
на или ванадия способны синтезировать две или
даже все три (Azotobacter spp.) формы нитрогена-
зы. Все формы нитрогеназы включают два белко-
вых компонента. Компонент 1 — это собственно
нитрогеназа, или МоГе-белок (динитрогеназа,
или молибдоферредоксин); компонент 2—это
редуктаза динитрогеназы, называемая также
Fe-белком или азоферредоксином (Fe-S-белок, ко-
торый принимает электроны от восстановленного
ферредоксина или флаводоксина и передает их на
нитрогеназу в ATP-зависимой реакции).
Структура нитрогеназы, роль АТР и
возможный механизм реакции □ Динитро-
геназа, MoFe-белок (мол. масса примерно
240 кДа), состоит из четырех субъединиц двух
типов, т. е. имеет структуру «2/^2 Она содер-
жит 30 атомов негеминового железа, 34 ато-
ма сульфидной серы и два атома молибдена
(в составе FeMo-кофактора). Атомы металлов об-
разуют две пары центров. Два идентичных пара-
магнитных М-центра имеют состав 1Мо : 7Fe : 9S
плюс один остаток гомоцитрата (рис. 8.13).
Два диамагнитных P-центра содержат по два
[4Ре-48]-кластера, соединенных через атом се-
ры. Редуктаза, или Ее-белок,—это гомоди-
мер из двух идентичных субъединиц, с>2 (мол.
массой примерно 60 кДа), соединенных через
[4Ее-48]-кластер, который претерпевает одноэлек-
Рис. 8.13. Структура активного центра Мо-содержащей
нитрогеназы. FeMo-кофактор содержит семь атомов
Fe(ll) и один атом Мо, образующие комплекс с серой
и с гомоцитратом. Лиганд Y, по-видимому, представля-
ет собой атом серы.
Рис. 8.14. Механизм нитрогеназной ре-
акции. Фд— ферредоксин; Флд — фла-
водоксин.
226 Часть III. Многообразие метаболических путей
тронный окислительно-восстановительный никл.
Этот фермент содержит два сайта связывания
нуклеотидов и участвует в сопряжении гидролиза
АТР с переносом электронов на MoFe-белок.
Реакции, протекающие (гипотетически) в нит-
рогеназном комплексе, представлены на рис. 8.14.
Fe-белок предположительно присоединяется к
MoFe-белку, и они донируют одновременно по од-
ному электрону на два P-центра, которые уже
имеют высокую степень восстановления. При об-
разовании этого комплекса происходит переклю-
чение между альтернативными конформацион-
ными состояниями двух участвующих белков в
результате связывания и гидролиза АТР па гра-
нице между их молекулами. Далее электро-
ны переносятся от P-центра на FeMo-центр, в
котором и происходит восстановление субстра-
та. Вероятно, молекула N=N восстанавливается
до NH3 в результате трехкратного переноса
двух электронов, через образование связанных
с ферментом интермедиатов HN=NH (диимид)
и H2N—NH2 (гидразин). Наиболее высокий
энергетический барьер должна иметь пер-
вая стадия двухэлектронного восстановле-
ния, HN=NH до HN=NH. Однако ни один из
перечисленных интермедиатов нс доступен для
определения и единственным обнаруживаемым
продуктом является NH3.
тивные ферменты восстанавливают этилен
до этана, что позволяет проводить разли-
чие между этими формами даже в живых
клетках. Для измерения азотфиксации при-
меняют также радиоизотопный метод, опре-
деляя включение 15N из 15N2 в клетки с
помощью масс-спектроскопии. Если требует-
ся выяснить возможность П2-зависимого ро-
ста у аэробных организмов, колбы с культу-
рами пе помещают на качалку, для создания
микроаэробных условий, и если такой рост
возможен, он наблюдается в топком слое на
поверхности среды или несколькими милли-
метрами ниже. Кроме этих методов, в каче-
стве подхода для выявления способности к
диазотрофии можно рассматривать примене-
ние генных зондов к консервативным участ-
кам генов нитрогеназы. Однако следует учи-
тывать, что отрицательный результат в этом
случае может быть следствием использова-
ния неподходящего зонда, тогда как положи-
тельный результат необходимо подтверждать
с помощью других критериев. Вместе с тем
существенным преимуществом данного под-
хода следует считать то, что он позволяет вы-
являть гены нитрогеназы даже у организмов,
во многих условиях не обнаруживающих их
экспрессии.
Дополнение 8.4. Кроме N2 нитрогена-
за катализирует ATP-зависимое восстанов-
ление и других соединений, пе имеющее,
по-видимому, существенного значения в при-
роде.
НС=СН + 2Н -> Н2С=СН2 (8.14)
NH3 + 2Н NH3 + N2 (8.15)
HCN + 6Н -ч NH3 + СН4 (8.16)
N20 + 2H -ч N2 + Н2О (8.17)
Для косвенного измерения нитрогеназной
активности обычно используют реакцию вос-
становления ацетилена до этилена. Про-
дукт ее — этилен — можно определять с помо-
щью газовой хроматографии высокого раз-
решения. Применение этого удобного метода
позволило значительно ускорить изучение
азотфиксации. Проведение измерений с ис-
пользованием данного метода in vitro требу-
ет создания строго анаэробных условий (пар-
циальное давление О2 С 1 • Ю“с>). Альтерна-
Регуляция □ Синтез нитрогеназы и азот-
ный метаболизм регулируются либо посредством
иерархической каскадной системы белков — акти-
ваторов транскрипции, либо с участием парал-
лельных регуляторных сетей (см. гл. 18-20). Ин-
дукция синтеза нитрогеназы происходит только
при очень низком внутриклеточном содержа-
нии NH3. При наличии в среде NH^ или ве-
ществ, легко превращаемых в NH^, нитрогеназа
не синтезируется. Ионы NHj подавляют тран-
скрипцию генов азотфиксации (ш/-генов). Кро-
ме того, нитрогеназная активность подавляется
NH+ и ADP. Наиболее полно регуляция процес-
са азотфиксации исследована у Klebsiella pneu-
moniae и видов Rhizobium. Экспрессию ш/-генов
непосредственно регулирует белок NifA, выпол-
няющий функцию активатора альтернативного
сигма-фактора — ст54. Этот сигма-фактор у мно-
гих бактерий участвует в экспрессии генов, свя-
занных с особыми метаболическими функциями,
в том числе ш/-генов. При высокой концентра-
ции в среде аммиака или кислорода экспрес-
Глава 8. Ассимиляция макро- и микроэлементов 227
сия генов азотфиксации подавляется в результа-
те связывания белка NifA с другим регулятор-
ным белком — NifL. У Klebsiella экспрессия генов
nifA и nifL находится под контролем двухкомпо-
нентной системы общей регуляции азотного об-
мена, NtrB—NtrC. У Rhizobium регуляцию азот-
фиксации в зависимости от концентрации О2 осу-
ществляет отдельная двухкомпонснтпая система
FixJ—FixL. При возникновении анаэробных усло-
вий сенсорный белок FixJ фосфорилирует ответ-
ный регулятор FixL, который в свою очередь ини-
циирует транскрипцию генов nifA и fixK и тем
самым экспрессию двух белков — активаторов
nif-генов (см. гл. 34).
Симбиотическая азотфиксация □ Мно-
гие растения получают необходимый для пита-
ния азот в виде аммония благодаря симбиозу
с азотфиксирующими бактериями, заселяющи-
ми особые органы растений. Растение-хозяин в
свою очередь обеспечивает бактерии источника-
ми углерода и энергии (например, дикарбоновы-
ми кислотами) и другими питательными веще-
ствами. Масштаб симбиотической азотфиксации
может составлять от 100 до 300 кг/га в год, тогда
как масштаб фиксации азота свободноживущими
бактериями не превышает нескольких процентов
этой величины. Бактерии, способные фиксиро-
вать азот в симбиозе с растениями, принадлежит
к различным таксономическим группам. Процесс
инфицирования ими растений и формирования
специальных симбиотических структур в органах
растения (клубеньках), а также обмен низкомо-
лекулярными питательными веществами и сигна-
лами описан в разд. 34.2. Защита нитрогеназы от
кислорода обеспечивается потреблением избытка
О2 растительной тканью клубеньков в процессе
дыхания. Постоянный приток кислорода, необ-
ходимого для дыхания облигатно аэробных сим-
биотических бактерий, обеспечивает кислород-
связывающий белок растений леггемоглобин.
Наиболее распространенные симбиотические
азотфиксирующие бактерии относятся к родам
Rhizobium, Bradyrhizobium и Azorhizobium, входя-
щих в а-подгруппу протеобактерий. Они форми-
руют корневые клубеньки и стеблевые (Azorhi-
zobium) клубеньки у бобовых растений. Наиболее
распространен симбиоз с бактериями рода Rhizo-
bium, которые вносят наибольший вклад в азот-
фиксацию. Из представителей /3-подгруппы про-
теобактерий обнаружены в качестве азотфикси-
рующих симбионтов (тропического травянистого
растения белокрыльник) бактерии рода Azoarcus
и близких родов. Относящиеся к группе актино-
мицетов грамположительпые бактерии рода Ргап-
kia обитают в качестве эндосимбионтов на кор-
нях деревьев, например ольхи (Alnus) и облепи-
хи (Hyppophae). Цианобактерии Anabaena azollae
образуют симбиотическую ассоциацию с водным
папоротником Azolla, внося большой вклад в азот-
фиксацию на рисовых плантациях, где этот папо-
ротник растет на поверхности покрывающей поч-
ву воды. Цианобактерии рода Nostoc образуют
симбиотическую ассоциацию с мхами-печепочни-
ками и тропическим растением Gunnera тасго-
phylla. Кроме того, симбиотические цианобакте-
рии присутствуют в лишайниках, представляю-
щих собой ассоциацию этих прокариот с грибами.
Благодаря тому что цианобактерии осуществля-
ют азотфиксацию и имеют фотоавтотрофный тип
метаболизма, нуждаясь для роста только в СО2,
N2 и минеральных солях, лишайники первыми за-
селяют неорганические среды, например камени-
стые поверхности, создавая условия для развития
других организмов.
Накопление азотфиксирующих бактерий на-
блюдается в ризосфере растений, растущих на
бедных почвах. В этом случае взаимоотношения
между прокариотами и растениями нельзя счи-
тать истинным симбиозом, но их ассоциация,
по-видимому, взаимовыгодна. В морских место-
обитаниях симбиотические ассоциации с азотфик-
сирующими прокариотами пока не обнаружены,
неизвестен также вклад свободноживущих циано-
бактерий в фиксацию азота в этих экосистемах.
Фиксация азота нитчатыми цианобакте-
риями □ Азотфиксирующие свободноживущие
цианобактерии представлены как одноклеточ-
ными (Synechococcus), так и многоклеточ-
ными нитчатыми формами (цепочки кле-
ток). При росте па среде, нс содержащей азота,
некоторые нитчатые цианобактерии (например,
Anabaena и Nostoc) образуют гетероцисты —
крупные клетки с толстой клеточной оболочкой
(процесс дифференцировки этих клеток описан
в разд. 24.3). Гетероцисты содержат нитрогеназу
и осуществляют азотфиксацию. Фотосинтезиру-
ющий аппарат в гетероцистах ограничен фото-
системой I, функционирование которой обеспе-
чивает циклический перенос электронов, сопря-
женный с синтезом АТР. Благодаря отсутствию
фотосистемы II в гетероцистах не накапливает-
ся кислород, способный инактивировать нитро-
228 Часть III. Многообразие метаболических путей
геназу. Из соседних вегетативных клеток, обла-
дающих обоими фотосистемами и фиксирующих
СОо в цикле Кальвина, в гетероцисты поступа-
ет органическое вещество (например, мальтоза) в
качестве источника углерода и электронов. Окис-
ление мальтозы в гетероцистах происходит по
окислительному пентозофосфатному пути. Обра-
зующийся при этом NADPH служит для вос-
становления ферредоксина. В свою очередь ге-
тероцисты снабжают аммонием этот «многокле-
точный» организм, т. е. лишенные нитрогеназы
вегетативные клетки, из которых в основном
состоят нити. Азотфиксирующие одноклеточные
цианобактерии и нитчатые цианобактерии, не об-
разующие гетероцист, осуществляют азотфикса-
цию соответственно только при низком парциаль-
ном давлении кислорода.
Существует идея делать растения с помо-
щью методов генной инженерии способными к
азотфиксации. Однако осуществить се весьма
непросто, поскольку система nif-генов многоком-
понентна и се активность контролируют сложно-
организованные общие регуляторные сети. Для
решения этой задачи необходимо обеспечить в
клетках наличие микроэлементов, достаточно-
го количества АТР и восстановленного фер-
редоксина, защиту от кислорода и модифи-
цированную регуляцию синтеза и активности
т/-генов. Кроме того, для сборки и созревания
молекулы нитрогеназы требуются дополнитель-
ные ферменты и иные белки, например осуществ-
ляющие поглощение Мо, синтез Fe~Мо-кофакто-
ра и гомоцитрата, а также ряд этапов процес-
синга.
8.6. Ассимиляция фосфора не требует
окислительно-восстановительных реакций
Валентность фосфора как в аэробных, так и в
анаэробных условиях составляет +5. Во многих
природных местообитаниях фосфор присутству-
ет в таком количестве, которое лимитирует рост
микроорганизмов; концентрация Р обычно не пре-
вышает нескольких микромоль, тогда как в клет-
ках он содержится в миллимолярном количестве.
Предпочтительно фосфор используется микроор-
ганизмами в форме неорганического ортофосфата
(Pi). В его присутствии подавляется транскрип-
ция генов р/го-регулона, ответственных за ассими-
ляцию альтернативных источников фосфора (ор-
ганических фосфорных эфиров, диэфиров, ангид-
ридов и фосфоновых кислот, в которых фосфор
непосредственно связан с углеродом); (подроб-
но начальные этапы ассимиляции Р; описаны в
гл. 7).
Поглощение фосфатов □ Неорганический
фосфат клетки микроорганизмов поглощают
при участии двух транспортных систем (см.
рис. 7.6) — конститутивно синтезируемой перме-
азы, имеющей низкое сродство к фосфату (Pit),
и ATP-зависимой транспортной системы с высо-
ким сродством к фосфату (Pst; Кд < 1 ткМ
Pi), активируемой в условиях низкого содержа-
ния Pi в среде. Фосфат в составе органических
соединений прокариоты могут поглощать дву-
мя способами. 1. У грамотрицательных бакте-
рий поглощение распространенных низкомолеку-
лярных фосфорсодержащих органических соеди-
нений (например, глицерол-3-фосфата, высвобож-
даемого липазами из липидов), происходит с уча-
стием систем, зависящих от периплазматических
субстрат-связывающих белков. Фосфорорганиче-
ские соединения могут служить источниками С,
Р и энергии. 2. Высокомолекулярные органи-
ческие фосфаты, которые клетки прокариот не
способны поглощать, все же используются ими
как источник фосфора. Они поступают в пери-
плазматическое пространство, где гидролизуют-
ся при участии специфических или относительно
специфических эстераз (фосфомоноэстераз или
фосфодиэстераз). Высвобождающийся неоргани-
ческий фосфат переносится в клетку по механиз-
му активного транспорта. Подобные механизмы
функционируют и у грамположительных бакте-
рий. Длинноцепочечные полифосфаты и, возмож-
но, олигонуклеотиды проникают через клеточную
стенку сквозь специальные поры и гидролизуются
в периплазме специфическими полифосфатазами
или нуклеазами и фосфатазами соответственно.
Использование фосфоната □ Фосфоно-
вые кислоты (R3C—РОзН-) содержат химически
высокостабильную С—P-связь. Разложение та-
Глава 8. Ассимиляция макро- и микроэлементов 229
ких соединений требует участия специфических
ицдуцибсльпых ферментов и транспортных си-
стем. С—P-связь расщепляют комплексные фер-
менты— гидролитическим путем, если субстрат
активирован, как в случае фосфоноацетальде-
гида, или, возможно, с участием радикального
механизма в большинстве других случаев.
Pi как регулятор метаболизма □ У Esche-
richia coli более 20 промоторов регулируются Pi
и синтез более 100 белков значительно интенси-
фицируется в условиях лимитирования роста кон-
центрацией фосфора. Эти гены (pst, от phosphat
starvation) относятся к различным классам. Один
из них принадлежит к р/ю-регулону, обеспечива-
ющему использование альтернативных источни-
ков фосфора в случае низкой (микромолярной)
концентрации неорганического фосфора в среде.
Другие гены относятся к различным регулятор-
ным системам. Механизмы генетической регуля-
ции с участием двухкомпонентных систем, регу-
лонов и консенсусных последовательностей по-
дробно описаны в гл. 20.
8.7. Источниками серы для микроорганизмов обычно служат
сульфат и тиосульфат
Многие бактерии и растения используют в каче-
стве источников серы сульфат и тиосульфат, по-
глощая их с помощью переносчиков. Для вклю-
чения в реакции биосинтеза эти соединения серы
должны быть восстановлены до H2S.
Сульфат □ Ассимиляционная сульфатре-
дукция протекает в два этапа (см. рис. 7.7).
Первый из них — это двухэлектронное восста-
новление сульфата до сульфита, второй — ше-
стиэлектронное восстановление сульфита до H2S.
Поскольку пара SO^/SO^- имеет чрезвычайно
низкий окислительно-восстановительный потен-
циал (—600 мВ), для восстановления сульфата
требуется его активация с помощью АТР:
SC)2“ +ЛТГ-^
—» Аденозипфосфосульфат + Pi (8.18)
РР; | П2О ^ 2Pi (8.19)
Аденозипфосфосульфат + АТР
—> З'-Фосфоаденозин-б'-фосфосульфат +
+ ADP (8.20)
З'-Фосфоаденозин-б'-фосфосульфат + 2[Н] —»
-> З'-Фосфо-АМР + HSO3 (8.21)
HSO3 + 6[Н] HS" + ЗН2О (8.22)
Образование высокоэнергетического соединения
аденозин-б'-фосфосульфата (АФС) катализиру-
ет АТР-сульфурилаза [реакция (8.18)]. Проте-
кание этой эндергонической (с затратой АТР)
реакции обеспечивается гидролизом пирофосфа-
та, осуществляемым пирофосфатазой [реакция
(8.19)[. Таким образом, на этом этапе тратит-
ся энергия двух высокоэнергетических фосфоап-
гидридпых связей. Далее для активации суль-
фатной группы в составе АФС затрачивается
еще одна, молекула АТР в реакции фосфорили-
рования З'-ОН-рибозы. В результате синтезирует-
ся З'-фосфоаденозин-б'-фосфосульфат (ФАФС).
Эту реакцию катализирует АФС-киназа [реак-
ция (8.20)]. Сульфатная группа в составе ФАФС
при участии ФАФС-редуктазы восстанавливает-
ся до сульфита с высвобождением З'-фосфо-АМР
[реакция (8.21)[. Эта реакция протекает в два
этапа. На первом этапе сульфотрапсфераза пе-
реносит сульфонильный фрагмент ФАФС на
тиолсодержащий акцептор, например низкомо-
лекулярный белок тиоредоксин, с образованием
интермедиата: акцептор—S—SO^. Этот эфир
подобен органическим тиоловым эфирам, таким
как ацетил-СоА (СоА—S—СО—СН3). На втором
этапе происходит восстановление тиоэфира с вы-
свобождением сульфита и дисульфидной фор-
мы акцептора, который далее восстанавливает-
ся. У некоторых бактерий, однако, восстанавли-
вается, по-видимому, АФС вместо ФАФС, Как
230 Часть III. Многообразие метаболических путей
это установлено, например, для диссимиляцион-
ных сульфатреду кторов, осуществляющих анаэ-
робное дыхание. Сульфит восстанавливается при
участии сирогем-содержащей сульфитредуктазы
до H2S [реакция (8.22)]. Для восстановления сиро-
гема в этой реакции обычно используется NADPH
в качестве донора электронов. Образующийся H2S
немедленно связывается с О-ацетил серином с об-
разованием цистеина — конечного продукта асси-
миляционной сульфатредукции (см. гл. 7).
Все эти этапы ассимиляции сульфата ка-
тализируют растворимые ферменты, активность
которых обычно подавляется цистеином. В дис-
симиляционной сульфатредукции участву-
ют другие, мембраносвязанные ферменты (см.
гл. 12).
Тиосульфат □ Тиосульфат непосредственно
взаимодействует с О-ацетил серином с образовани-
ем S-сульфоната, который далее восстанавливает-
ся до цистеина.
Сульфоновые кислоты □ Сульфоновые
кислоты (R—SO3H) в природе встречаются до-
вольно редко (примером соединений, содержащих
остаток такой кислоты, является сульфонатный
эфир 6-сульфо-В-хиновоза в составе сульфоли-
пида растений). Связь С-S довольно устойчи-
ва, из-за чего бактерии сравнительно редко ис-
пользуют эти соединения в качестве источника
серы. У аэробных бактерий разложение сульфо-
новых кислот происходит при участии диокси-
геназ или монооксигеназ, осуществляющих от-
щепление сульфита при участии кислорода (см.
разд. 9.17.2). Процесс деградации этих соедине-
ний у анаэробных бактерий изучен недостаточно.
Возможно, высвобождение серусодержащей груп-
пы происходит у них путем восстановления или
гидролиза молекул.
Регуляция процесса ассимиляции серу-
содержащих соединений □ Основной мише-
нью регуляции служит серин-ацетилтрансфераза,
осуществляющая синтез акцептора сульфида —
О-ацетилсерина (см. гл. 7). Активность этого фер-
мента ингибируется цистеином по механизму ка-
таболитной репрессии. Кроме того, ассимиляция
серных соединений регулируется на уровне тран-
скрипции. О-ацетилсерин служит коактиватором
регуляторного белка, кодируемого геном cysB ци-
стеинового (cys) регулона. У Е. coli этот регулон
включает гены, необходимые для синтеза цистеи-
на из сульфата/тиосульфата и серина. Ингибито-
рами cys-регулона, по-видимому, служат цистеин
или его производные. При использовании источ-
ников с низким содержанием серы, например глу-
татиона или дьенколовой кислоты, внутриклеточ-
ный уровень цистеина истощается, что приводит
к дерепрессии cys-регулопа.
8.8. Микроэлементы и электролиты клетки поглощают
с помощью специальных транспортных систем
Помимо макроэлементов (С, О, Н, N, Р, S),
из которых состоят клеточные полимеры и рас-
творимые органические соединения, для построе-
ния клеток необходимы важные в качестве элек-
тролитов щелочные металлы (К, Na), щелоч-
ноземельные металлы (Mg, Са, выполняющие
функции кофакторов ферментов) и микроэле-
менты— металлы переходной группы (V, Мп, Fe,
Со, Ni, Си, Zn, Mo, W) и неметаллы (такие,
как Se, В, С1 и др.). Набор требуемых микро-
элементов зависит от вида микробов. В природе
микроэлементы обычно присутствуют в виде сво-
бодных катионов или анионов, поглощаемых мик-
робными клетками с помощью относительно спе-
цифичных транспортных систем. Некоторые из
микроэлементов встречаются в форме оксиани-
онов, таких как 8еОз (селенит), WoO^- (воль-
фрамат) и МоО^- (молибдат). В клетках они
подвергаются ферментативному восстановлению,
приобретая валентность, необходимую для асси-
миляции. Важную роль у бактерий играет способ-
ность к поглощению железа, поскольку в природе
содержание этого элемента часто относится к ли-
митирующим рост факторам.
8.8.1. Железо поглощается в виде
хелатных комплексов при участии
различных транспортных систем
Железо требуется микроорганизмам в относи-
тельно больших количествах. Оно входит в со-
Глава 8. Ассимиляция макро- и микроэлементов 231
став гемов, Fe—S-центров и активных центров
многих ферментов. Будучи четвертым по сте-
пени распространения элементом в земной ко-
ре (О > Si > Al > Fe), оно, однако, не относит-
ся к числу легкодоступных питательных веществ.
В аэробных условиях железо присутствует в среде
в окисленной форме, Fe(III), образуя практически
нерастворимые гидраты оксида железа FeO(OH),
карбонат железа Рв2(СОз)з и магнетит FC3O4 [ок-
сид Fe(II/III)]. Эти соединения растворимы толь-
ко при крайне низких значениях pH, в связи с чем
большинство аэробных микроорганизмов для по-
глощения железа синтезирует и секретирует в сре-
ду сидерофоры — органические соединения, по
сути переносчики железа, образующие хелаты с
Fe3+; в виде комплексов с сидерофорами железо
поглощается микробными клетками. В анаэроб-
ных условиях железо не является лимитирующим
рост элементом, присутствуя в форме Fe2+, хоро-
шо растворимой и в отсутствие кислорода доволь-
но устойчивой. Потребление клетками железа в
этой форме обеспечивают обычные транспортные
системы.
Такие катионы, как К+ или Zn2+, клетки по-
глощают при помощи специфичных к ним транс-
портных систем. Источником энергии при этом
часто служит мембранный потенциал (с отри-
цательным зарядом на внутренней поверхности
плазматической мембраны). В то же время по-
глощение связанного с сидерофорами железа в
виде хелатных комплексов как особых по раз-
мерам и заряду структур осуществляют совер-
шенно иные транспортные структуры. Это слож-
ный, строго регулируемый процесс, включающий
несколько стадий: 1) синтез сидерофоров; 2) вы-
деление сидерофоров; 3) транспорт хелатных ком-
плексов Fe(III) с сидерофорами в клетку; 4) вы-
свобождение Fe(III) из хелатного комплекса и вос-
становление до Fe(II) и 5) включение Fc2+ в состав
коферментов и простетических групп.
Способность микроорганизма синтезировать и
использовать сидерофоры определяют нескольки-
ми способами. Один из них основан на том, что ко-
лонии клеток, способных к синтезу сидерофора,
вызывают образование на агаризоваппой среде,
содержащей окрашенные Бе(Ш)-соединения, бес-
цветных зон, поскольку Fe(ITI), образуя комплекс
с сидерофором, обесцвечивается. Другой метод
заключается в использовании бумажных дисков,
пропитанных сидерофором. Бактерии, способные
использовать данный сидерофор, растут на агари-
зованной среде, содержащей Fe(III), в виде зоны
вокруг этого диска.
Сидерофоры □ Поглощение Fe(III) подроб-
но исследовано у Е. coli. Этот микроорганизм
способен синтезировать сидерофоры трех типов
(рис 8.15). К первому из них относятся сиде-
рофоры — производные катехола, примером
которых может служить энтеробактин. Он содер-
жит три остатка собственно хелатора, 2,3-дигид-
роксибензоата, связанные с циклической струк-
турой из трех остатков серина. Комплекс энте-
робактина с Fe3+ несет положительный заряд.
Второй тип представлен производными гидрок-
саматов, способными образовывать стабильные
окрашенные комплексы с Fe(TII). Сидерофор это-
го типа ферриоксамин состоит из трех остатков
гидроксамовой кислоты; они формируют цикли-
ческую структуру, внутри которой связывается
ион Fe3+. Комплекс фсрриоксамина с Fe(III) элек-
трически нейтрален. Третий тип сидерофоров—
это дикарбоновые и трикарбоновые кислоты
(в частности, цитрат), также эффективные хела-
торы железа.
Грибы синтезируют циклические гексапепти-
ды феррихромы, которые могут использовать и
Рис. 8.15. Схематическое изображение структуры сиде-
рофоров.
232 Часть III. Многообразие метаболических путей
Таблица 8.4. Кажущиеся константы связывания для
Бе(П1)-комплексов при pH 7. Для реакции между метал-
лом (М) и лигандом (Л): М + Л = МЛ константа связы-
вания определяется как К = [МЛ]/[М] [Л]. Константа
связывания гидроксида Fe(lll) при pH 7 примерно рав-
на 1038
Жел езосодержа щи й комплекс Константа связывания Fe(III) при pH 7
Ре(Ш)-энтеробактин 1052
Ее(Ш)-ферриоксамин Е 1032
Ее(1П)-феррихром А ю29
Ее(Ш)-трансферрин А 1024
Ее(Ш)-ЭДТА 1025
бактерии, например Е. coli. Эффективность свя-
зывания Fe3+ сидерофорами в сравнении с дру-
гими хелатобразующими молекулами приведена в
табл. 8.4.
Транспортные системы для сидерофо-
ров □ Имеющиеся в наружной мембране грамот-
ридательных бактерий каналообразующие белки
(порины) двух типов — неспецифичные (тип I) и
специфичные (тип II) — не обеспечивают проник-
новение сидерофоров в периплазматическое про-
странство. Для прохождения крупных молекул
сидерофоров в клетки через наружную мембра-
ну необходимы белки третьего типа, называемые
рецепгорными. Они прочно связывают крупные
молекулы, например разнообразные сидерофоры
или витамин В12. Связанные с такими много-
функциональными рецепторами сидерофоры про-
никают через наружную мембрану, что сопряже-
но с затратой энергии, и в периплазматическом
пространстве образуют комплексы со связываю-
щими белками. Перенос Fe3+, связанного с сиде-
рофором, через плазматическую мембрану могут
осуществлять несколько ATP-зависимых транс-
портных систем (рис. 8.16).
Дополнение 8.5. Некоторые бактериофа-
ги (например, Т1), антибиотики (например,
альбомицин) и ко лицины связываются на по-
верхности клеток с полифупкциональными
рецепторами и могут проникать внутрь мик-
робных клеток, используя систему транспор-
та железа. Неспецифичность этих рецепторов
позволяет' использовать различные лиганды
для изучения процесса транспорта. Так, бла-
годаря исследованию некоторых мутантов с
нарушением транспорта железа, устойчивых
к инфицированию фагом Т1 (Т-one), выяв-
лен как продукт мутантного гена Топ-белок,
один из компонентов этой транспортной си-
стемы (см. ниже). Некоторые антибиотики
являются структурными аналогами сидеро-
форов и за счет этого способны проникать в
клетку с использованием системы транспорта
железа (рис. 8.16).
Сидерофоры -
производные
гидроксаматов
Сидерофоры -
производные
катехола
Рис. 8.16. Схема транспорта железа у
Escherichia coli. Рецепторные белки наружной
мембраны (НМ) специфически связывают
сидерофоры и переносят их в периплазму
(ПП). Здесь сидерофоры взаимодействуют со
связывающими белками, которые передают
их на гидрофобные транспортные белки
плазматической мембраны (ПМ). Перенос
через ПМ требует затраты АТР (гидролиз
АТР катализируют белки, ассоциированные с
внутренней поверхностью ПМ). Tl, Т5, Ф80 —
бактериофаги; ДОБК — дигидробензойная
кислота. По [2].
Глава 8. Ассимиляция макро- и микроэлементов 233
Дополнение 8.6. Высшие организмы со-
держат железо в форме малорастворимых
комплексов с особыми белками — трансфер-
рином, лактоферрином и ферритином, вы-
полняющими функцию связывания и запаса-
ния железа (табл. 8.4). Прочность связыва-
ния железа этими белками в тканях, крови,
молоке или слезной жидкости настолько вы-
сока, что оно недоступно для микробов как
питательный элемент, т. е. их рост в орга-
низме-хозяине лимитирован дефицитом же-
леза. Патогенные микроорганизмы преодоле-
вают это препятствие различными путями
(см. разд. 33.3.5). К ним относятся 1) син-
тез сидерофоров, обладающих таким высо-
ким сродством к железу, которое обеспечи-
вает извлечение его атомов из комплексов с
Fe-связывающими животными белками (си-
стемы поглощения железа у многих возбуди-
телей инфекций, кодируемые плазмидными
генами, относятся к факторам патогенности);
2) синтез гемолизинов, вызывающих лизис
эритроцитов; он позволяет использовать же-
лезо гемоглобина; 3) связывание бактериями
на своей поверхности белков хозяина, перено-
сящих железо, с извлечением из них Fe(III) и
4) отсутствие потребности в железе для ката-
болизма, например у молочнокислых бакте-
рий, способных расти в условиях значитель-
ного дефицита Fe. Следует отметить, что,
присутствуя в избытке, свободные ионы же-
леза оказывают токсический эффект; они ка-
тализируют реакцию Фентона, связанную с
образованием гидроксил-радикала (НО’) (см.
гл. 9).
Энергозависимый транспорт железа че-
рез наружную мембрану грамотрицатель-
ных бактерий □ Железо в форме Fe3+ в со-
ставе комплекса [Fe(III)]—сидерофор, а также
витамин В12 переносятся через наружную мем-
брану с затратой энергии. В наружной мембране
и периплазматическом пространстве отсутству-
ют какие-либо источники энергии, и предположи-
тельно источником энергии для транспорта слу-
жит электрохимический потенциал на плазмати-
ческой мембране. В связи с этим возникает во-
прос, каким образом энергизуются рецепторы в
наружной мембране. Возможно, трансмембран-
ный белковый комплекс, локализованный в плаз-
матической мембране (ТопВ-комплекс), посред-
ством длинного нериплазматического полипеп-
тидпого фрагмента контактирует с этими рецеп-
торами в наружной мембране и закрытый канал
рецептора энергизуется для открывания благода-
ря энергии конформационного состояния, когда
ТопВ-комплекс изменяет его конформацию под
влиянием электрохимического потенциала, гене-
рируемого на плазматической мембране.
Высвобождение железа из комплексов с
сидерофорами □ Выход железа из комплекса с
сидерофорами происходит путем его восстановле-
ния (например, в случае феррихрома А, не свя-
зывающего Fe2+), либо путем ферментативного
гидролиза сидерофора (например в случае энте-
робактина) с последующим синтезом сидерофо-
ра de novo. В случае цитрата в клетку проникает
только Fe(III).
Регуляция □ Поскольку синтез многокомпо-
нентных систем транспорта железа требует боль-
шой затраты энергии, он индуцируется только в
условиях дефицита этого элемента. Уровень же-
леза влияет на экспрессию более чем двадцати
белков, в том числе компонентов транспортных
систем. Гены этих белков находятся под контро-
лем белка Fur (от ferric uptake regulation) — ре-
прессора, подавляющего экспрессию большин-
ства из них в присутствии Fe2+ как коре-
прессора. Для индукции транспортной системы
комплексом цитрат—Fe(III) требуется участие
комплекса ТопВ; при поглощении железа цитрат
в клетку не проникает. Разнообразие сидерофо-
ров и механизмов транспорта железа очень вели-
ко; например, у видов Pseudomonas сидерофора-
ми служат пигменты, обусловливающие зеленова-
тую флуоресценцию их клеток.
8.8.2. «Добывание» других важных
микроэлементов, в частности, селена,
обеспечивают особые механизмы
При недостатке того или иного микроэлемента
бактерии могут избежать лимитирования роста
благодаря тому, что способны синтезировать аль-
тернативные ферменты с другими микроэлемен-
тами в активном центре. Примером такой замены
может служить нитрогеназа. Здесь мы рассмот-
рим подробно изученные пути ассимиляции селе-
на— микроэлемента, относящегося к неметаллам.
234 Часть III. Многообразие метаболических путей
HSe ОН'
tPHKS"
АТР
Серил-тРНК
Ген селенсодержащего
белка
ДНК----1----ТСА
О-P—О—Р—О-АМР—Д—>'О—Р —SeH
II @1
О' О' О'
Рис. 8.17. Включение селена в ферменты, содержащие в активном центре селеноцистеин. 1 — селенофосфат-синте-
таза; 2 — селеноцистеин-синтаза; 3 — серил-тРНК-синтетаза. На последующих этапах в процессе участвуют tPHKScc
и специфический фактор элонгации для селеноцистеил-тРНК5ес.
Селенсодержащие клеточные компонен-
ты □ Для роста Е. coli в анаэробных услови-
ях необходимо присутствие в среде в качестве
микроэлементов (10-8 М) селенита (Н8еОз) и
молибдата (МоО^-), поскольку атомы Se и Мо
входят в состав активного центра формиатде-
гидрогеназы — фермента, катализирующего окис-
ление формиата, одного из промежуточных
продуктов сбраживания глюкозы. Всего извест-
но три типа селенсодержащих белков: 1) оксидо-
редуктазы, например формиатдегидрогеназы (по-
мимо селена, они содержат молибден, чем объ-
ясняется отмеченная выше потребность Е. coli
и в Se, и в Мо), гидрогеназы и глицинредук-
таза, содержащие селеноцистеин, т. е. цисте-
ин, в состав которого вместо серы входит се-
лен; 2) несколько молибденсодержащих фермен-
тов, таких как ксантиндегидрогеназы и дегидро-
геназы никотиновой кислоты, в молибденсодер-
жащем кофакторе которых присутствует так-
же селен (вместо серы), и 3) модифицирован-
ный урацил; в антикодонах некоторых тРНК
присутствует урацил, в котором вместо кисло-
рода у С2-атома пиримидинового кольца при-
сутствует атом серы, в свою очередь способный
замещаться селеном.
В чем состоит преимущество использо-
вания селена? □ Селен входит в IV группу
элементов периодической системы и расположен
в ней непосредственно после серы. Химические
свойства этих элементов сходны, за исключени-
ем одной важной особенности: сера в окислен-
ном состоянии имеет валентность +6 (сульфат,
SO^~), тогда как валентность селена +4 (селенит,
HScO-{). В составе биологических макромолекул
Se присутствует в форме селепола (—SeH; валент-
ность —2). Селенид (HSe-) и селеполы (RSe-) при
нейтральном pH представляют собой более силь-
ные нуклеофилы, чем их серные эквиваленты, что
определяет и более высокую каталитическую ак-
тивность селенсодержащих ферментов.
Синтез селеноцистеина и включение его
в белки □ Включение селеноцистеина в белки
детерминируется стоп-кодоном UGA внутри рам-
ки считывания соответствующего гена и про-
исходит в процессе трансляции на рибосоме, а
не как посттрансляционпая модификация белка-
предшественника (рис. 8.17). Предварительно се-
ленит должен быть перенесен в клетку и фер-
ментативно восстановлен до селенида. В синтезе
селенсодержащих белков участвуют приведенные
ниже продукты четырех генов.
Глава 8. Ассимиляция макро- и микроэлементов 235
1. Необычная tPHKuga (тРНК8ес), способная
узнавать стоп-кодон UGA в мРНК. В ре-
зультате связывания ею серина, которое ка-
тализирует серил-тРНК-синтетаза, образует-
ся серил-тРНК8ес.
2. Селеноцистеил-тРНК, распознающая UGA-
кодон в мРНК. Она образуется в два этапа
из серил-тРНК8ес. Вначале селенид активи-
руется селенофосфат-синтетазой, превращаю-
щей его в «селенофосфат» HSePO^-:
АТР + HSe- —* Селенофосфат + АМР + Р;
(8.23)
Затем активированный селенид используется
для синтеза селеноцистеина. Реакцию ка-
тализирует содержащая пиридоксальфосфат
селеноцистеин-синтаза:
Серил-тРНК3ес + Селенофосфат —*
—> Селеноцистеил-тРНК8ес + Pi (8.24)
В этой реакции от серина, связанного с тРНК,
отнимается молекула воды и селенид при-
соединяется к интермедиату аминоакрилоил-
тРНК.
3. Специфичный фактор элонгации, необходи-
мый в связи с тем, что кодон UGA, обеспе-
чивающий включение остатков селеноцистеи-
на в белок, должен быть дифференцирован
от настоящего кодона терминации. Посколь-
ку TPHKSec не может связаться с обычным
фактором элонгации EF-Tu, для нее требует-
ся особый, модифицированный фактор элон-
гации, способный отличать tPHKScc от других
тРНК.
4. Специальный фактор элонгации, распозна-
ющий особую последовательность нуклеоти-
дов вокруг кодона UGA, кодирующего селено-
цистеин. Благодаря этой последовательности
данный кодон UGA пе распознается как тер-
минирующий.
Включение селена в состав модифицированных
Se-содержащих тРНК также происходит через об-
разование селенофосфата, но подробно этот про-
цесс пока не изучен.
Дополнительная литература
Braun V. (1995) Energy-coupled transport and signal
transduction through the Gram-negative outer
membrane via TonB-ExbB-ExbD-dependent receptor
proteins. FEMS Microbiol. Rev. 16: 295-307.
Cole.I. A., Ferguson S. J. (1988) The nitrogen and
sulphur cycles. Cambridge: Cambridge University
Press.
Heider J., Bock A. (1993) Selenium metabolism in micro-
organisms. In: Rose A. H., ed. Advances in microbial
physiology 35: 71-109.
Large P. .1. (1983) Methylotrophy and methanogenesis.
Washington, DC: ASM Press.
Ncidhardt F. C, Curtiss R., Ingraham J. L., Lin E. С. C,
LowK.B., Magasanik B., ReznikoffW., Riley M.,
Schaechter M., Umbarger H. E. (eds.) (1996) Esche-
richia coli and Salmonella: cellular and molecular
biology. 2nd edn. Washington, DC: ASM Press.
Postgate J. R. (1982) The fundamentals of nitrogen
fixation. Cambridge: Cambridge University Press.
Schlegel II. G., Bowien B. (1989) Autotrophic bacteria.
Berlin Heidelberg New York: Springer.
Shively.1.М., Barton L.L. (1991) Variations in auto-
trophic life. London: Academic, Press.
Walsh C. (1979) Enzymatic reaction mechanisms. San
Francisco: Freeman.
Источники рисунков
1. Karlson P., Doenecke D., Koolman I. (1994)
Biochemie, 14th edn. Stuttgart: Thieme.
2. Braun V. (1995) FEMS Microbiol. Rev. 16: 295-307.
Глава 9
Окисление органических соединений
Многие аэробные бактерии способны расти за
счет окисления глюкозы, однако помимо глюкозы
большинство бактерий использует для роста ши-
рокий круг органических соединений, например
виды Pseudomonas — более 200. Ферменты пери-
ферического метаболизма, ответственные за на-
чальные этапы ассимиляции этих соединений, у
многих микробов кодируются плазмицными гена-
ми, и это, благодаря способности плазмид к меж-
клеточному переносу, делает метаболизм прока-
риот еще более гибким Существуют, однако, и
узкоспециализированные микроорганизмы, на-
пример такие, как метанокисляющие бактерии,
которые используют лишь небольшое число сход-
ных соединений.
Большая часть используемых бактериями,
грибами и животными органических субстра-
тов— это полимеры растительного происхожде-
ния. В минерализации растительных остатков
участвуют прокариоты, эукариотические микро-
организмы (грибы, водоросли и простейшие), а
также мелкие животные — нематоды, черви, на-
секомые и их личинки, членистоногие и моллюс-
ки. Разложение растительных остатков на поверх-
ности почвы в значительной мере обеспечивают
грибы, составляющие примерно половину общей
массы живых организмов в почве. Анаэробные и
микроаэрофильные бактерии, а также некоторые
грибы и простейшие участвуют в переваривании
растительной пищи в пищеварительном тракте
животных и человека.
Основные органические субстраты представ-
ляют собой, таким образом, макромолекулы, не
способные проникать через плазматическую мем-
брану бактерий, и первый этап их разложения со-
стоит в расщеплении до олигомеров и мономеров
под действием выделяемых бактериями экзофер-
ментов, главным образом гидролаз, связанных
с наружной поверхностью клеток или экскрети-
руемых в растворимой форме. Водорастворимые
олигомерные и мономерные соединения, прони-
кая в клетку, подвергаются дальнейшей деграда-
ции с образованием небольшого числа ключевых
интермедиатов основных метаболических путей,
окисляемых до СО2 при наличии молекулярного
кислорода или другого конечного акцептора элек-
тронов.
В анаэробных условиях происходит неполное
разложение органических субстратов путем их
сбраживания. Продукты брожения служат суб-
стратами для аэробных микроорганизмов, когда в
среде появляется кислород («субстратная цепь»;
в отличие от этого пищевой цепью называют по-
требление одних организмов другими в качестве
пищи). В строго анаэробных условиях конечны-
ми продуктами субстратой цени являются ме-
тан 4- СО2 (биогаз). Анаэробное разложение осу-
ществляют преимущественно прокариоты с уча-
стием немногих анаэробных грибов и простейших.
Переваривание растительной пищи в пищевари-
тельном тракте животных также косвенно зави-
сит от анаэробных бактерий, осуществляющих
расщепление большинства растительных вс окон
(лигноцеллюлозы и хитина). Полная деградация
биополимеров в природе происходит как слож-
ный многоступенчатый процесс, осуществ-
ляемый совместно различными бактериями
и грибами.
Процесс разложения органических соединений
можно условно разделить на два этапа — окисли-
тельный и восстановительный (рис. 9.1). Окис-
лительный этап включает все реакции, необ-
ходимые для окисления субстрата до СО2. Он
не требует участия молекулярного кислорода; ве-
роятно, кислород в молекуле СО2 происходит
из воды и высвобождаемые при окислении элек-
троны переносятся на коферменты. Исключение
составляют инертные субстраты, содержащие
прочные химические связи. Они окисляются ок-
сигеназами с участием молекулярного кислоро-
да в качестве косубстрата. В ходе восстанови-
тельного этапа восстановленные коферменты
восстанавливают экзогенные акцепторы элек-
тронов, что обеспечивает запасание основной
части энергии, выделяющейся при деградации
субстрата (об аэробном транспорте электронов
см. гл. 4., об анаэробном электронном транспор-
те—гл. 12).
Глава 9. Окисление органических соединений 237
Рис. 9.1. Окислительные и восстанови-
тельные этапы путей деградации субстра-
тов. Окислительные этапы. 1. Деградация
полимера; поглощение клетками водорас-
творимых продуктов; активация субстратов
для включения в метаболизм; превращение
различных соединений одного класса (на-
пример, углеводов или ароматических со-
единений) в основные интермедиаты ка-
таболизма (например, глюкозо-б-фосфат и
катехол). Все эти реакции относятся к пери-
ферическому метаболизму. 2. Превращение
продуктов периферического метаболизма
в основные метаболиты-предшественники
(например, пируват; см. гл. 7); это реакции
центрального метаболизма. Метаболиты-
предшественники используются для синтеза
всех клеточных компонентов. 3. Превраще-
ние общих метаболитов-предшественников
в ацетил-СоА и окисление его до СОг. Вос-
становительные этапы. 1. Окисление восста-
новленных акцепторов электронов. 2. Функ-
ционирование электронтранспортной цепи.
3. Восстановление конечного акцептора
электронов.
рование
Разложение органических субстратов до уров-
ня основных метаболитов-предшественников не
зависит от конечных акцепторов электронов (за
исключением кислород-зависимых путей метабо-
лизма; см. ниже). Как правило, используемые
для роста органические субстраты служат един-
ственным источником получения клеточных стро-
ительных блоков. Таким образом, катаболические
пути должны обеспечить образование всех цен-
тральных метаболитов-предшественников основ-
ных метаболитов-предшественников (см. гл. 7).
Дополнение 9.1. Для изучения микробно-
го метаболизма используют различные мето-
дические подходы 1. Изотопные исследо-
вания. В среду для роста бактерий вносят
органические субстраты, меченные 14С или
13С, после чего изотопными методами или
с применением методов ядерного магнитного
резонанса (ЯМР) определяют в клетках или
в среде продукты их превращений. Корот-
кая экспозиция в присутствии меченых суб-
стратов (импульсное мечение) позволяет вы-
являть первые или ранние продукты мета-
болизма меченого субстрата. 2. Выявление
и идентификация промежуточных про-
дуктов метаболизма. Для выяснения пу-
ти метаболизма того или иного соединения
применяют специфические ингибиторы, бло-
кирующие процесс на промежуточных ста-
диях. Выделяющиеся при этом в среду со-
единения идентифицируют с помощью со-
временных (например, высокоэффективная
жидкостная хроматография) или классиче-
ских (тонкослойная хроматография) мето-
дов. 3. Адаптация как показатель. При
росте на том или ином субстрате клетки спо-
собны немедленно включать в метаболизм до-
бавляемые в среду интермедиаты того пу-
ти, по которому он метаболизируется. В то
же время деградация добавляемых соедине-
ний, не относящихся к этому пути, начи-
нается только после индукции необходимых
ферментов, занимающей обычно от 20 мин
238 Часть III. Многообразие метаболических путей
до нескольких часов. 4. Мутационный ана-
лиз. Мутанты, дефектные по тому или ино-
му ферменту, участвующему в метаболизме
данного субстрата, могут накапливать мета-
болиты, образующиеся на предшествующих
блокированному участку этапах. При этом
мутантные штаммы сохраняют способность
расти с использованием субстратов, вклю-
чающихся в данный путь деградации «ниже»
поврежденного участка. Предварительные
данные о путях использования того или
иного субстрата можно получить, исследуя
способность штамма дикого типа расти с
использованием предполагаемых промежу-
точных продуктах его метаболизма.
9.1. Использование микробами полимерных органических субстратов
включает внеклеточную стадию разложения
Большинство потенциальных субстратов для ро-
ста бактерий исходно представляет собой нерас-
творимые органические полимеры. Способы их
разложения различными микроорганизмами ос-
нованы на ряде общих принципов.
Общие принципы микробной деграда-
ции полимеров □ Включение высокополимер-
ных органических соединений растительного про-
исхождения в круговорот веществ в большой
степени зависит от выделения микробами вне-
клеточных ферментов (экзоферментов), в боль-
шинстве гидролитических. Они весьма много-
численны и разнообразны, в соответствии с
разнообразием атакуемых субстратов, видов мик-
роорганизмов и типов природных сред. Этот
класс ферментов широко используется в промыш-
ленных технологиях. Осуществляемые внеклеточ-
ными ферментами реакции, как правило, являют-
ся лимитирующей стадией деградации полимеров.
Это обусловлено тем, что растительные полиме-
ры входят в химически устойчивые структуры,
обладают кристалличностью и малорастворимы в
воде.
Начальная стадия разложения биополимеров
чаще всего состоит в их гидролитическом расщеп-
лении. Существенное исключение составляет де-
градация лигнина (незначительное исключение —
^-элиминирование сахаров; см. лиазы; разд. 9.5.5
и рис. 9.8). Деградация лигнина — основного ком-
понента древесины и наиболее распространенно-
го биополимера — происходит не путем гидролиза,
а с участием Н2О2- Активность расщепляющих
лигнин экзоферментов зависит от наличия окис-
ляемых косубстратов и О2, необходимого для об-
разования пероксида водорода. Лигнин способны
использовать глав! гым образом грибы и лишь ред-
кие прокариоты. Кислород выполняет также важ-
ную роль в деградации таких инертных субстра-
тов, как углеводороды и эфиры, которые обычно
не могут быть гидролизованы (об анаэробном раз-
ложении этих соединений см. разд. 9.13.4 и 9.13.5).
Природные субстраты, такие как древесина,
состоят из нескольких сложных полимеров, обра-
зованных различными мономерами. Разложение
таких субстратов требует участия разнообразных
экзоферментов, полным набором которых какие-
либо отдельные микроорганизмы не обладают.
Как правило, полное разложение полимерных
субстратов происходит в результате совместного
воздействия па них различных микроорганизмов.
Разложение устойчивых биополимеров («плохих»
субстратов) во многих случаях возможно только
при одновременном потреблении — кометаболи-
зировании — какого-либо легкоразлагаемого со-
единения («хорошего» субстрата). Так, при раз-
ложении древесины легпогидролизуемая целлю-
лоза (косубстрат) служит источником энергии и
электронов для образования пероксида водорода,
с участием которого расщепляется устойчивый к
деградации лигнин.
Экзоферменты относятся к важным факто-
рам вирулентности патогенных микроорганиз-
Глава 9. Окисление органических соединений 239
мов. Они обеспечивают проникновение возбудите-
ля инфекции через клеточные барьеры.
Далее мы рассмотрим различные аспекты,
связанные с активностью экзоферментов, в том
числе: предотвращение их разбавления во внеш-
ней среде; получение преимущества в использова-
нии продуктов гидролиза при конкуренции с дру-
гими микроорганизмами; регуляцию синтеза эк-
зоферментов и механизмы их транспорта через
мембраны, а также возможные способы сигнали-
зации о наличии в среде полимерных субстратов.
Биополимеры — это основные субстраты мик-
робного метаболизмаа. Разложение их происхо-
дит при совместном участии различных микроор-
ганизмов, образующих те или иные необходимые
экзоферменты. Начальное расщепление под дей-
ствием экзоферментов — это стадия, лимитирую-
щая скорость использования биополимеров и тем
самым рост микроорганизмов. Последующий ме-
таболизм растворимых продуктов гидролиза по-
лимеров можно разделить на два этапа—окисли-
тельный и восстановительный.
9.2. Экзоферменты выделяются во внешнюю среду
или остаются связанными с клеточной поверхностью
Ферменты, выделяемые через плазматическую
мембрану во внешнюю среду, называют внекле-
точными или экзоферментами. К ним относят
также ферменты, связанные с мембраной. Ло-
кализация экзоферментов у прокариот зависит
главным образом от строения наружных покро-
вов клеток.
Синтез и локализация экзоферментов □
У грамположительных бактерий, клеточная стен-
ка которых представляет собой толстый слой пеп-
тидогликана, экзоферменты локализованы как на
внутренней, так и па внешней поверхности плаз-
матической мембраны и пронизывают ее. Те фер-
менты, которые отделяются от наружной по-
верхности мембраны, проходят сквозь клеточ-
ную стенку, становясь полностью внеклеточными.
Другие, например /3-лактамаза, в форме липо-
протеина связаны с мембраной. Липидная часть
такого липопротеина сходна с липидами в со-
ставе липопротеинов наружной мембраны гра-
мотрицательных бактерий. Клетки грамотрица-
тельных бактерий окружены двумя гидрофобны-
ми поверхностными барьерами — плазматической
и наружной мембранами, и соответственно вари-
анты локализации экзоферментов у них более раз-
нообразны. Эти ферменты могут быть локализо-
ваны на поверхности и внутри плазматической
мембраны, в периплазме, а также на поверхно-
сти и внутри наружной мембраны. Локализация
некоторых из них может меняться в зависимости
от возраста культуры и условий роста с цитоплаз-
матической па связанную с мембраной, периплаз-
матическую либо внеклеточную. Среди экзофер-
ментов хорошо изучены пуллулапаза, амилаза, ле-
вапсахараза, щелочная фосфатаза, ^-лактамазы,
протеазы, целлюлазы и липазы (см. гл. 19).
Ферменты грамположительных бактерий, свя-
занные с мембраной и клеточной стенкой, ча-
сто рассматривают как эквивалентные фермен-
там периплазматического пространства грамот-
рицательных бактерий, и они действительно
обладают общими свойствами. Выяснению лока-
лизации экзоферментов существенно способству-
ет применение технологии рекомбинантной ДНК,
а именно метода соединения генов экзоферментов
с репортерными генами. Продукты таких химер-
ных конструкций проявляют ферментативную ак-
тивность только после переноса через плазмати-
ческую мембрану.
Некоторые гидролитические ферменты лока-
лизованы на поверхности клеток в отдельных
крупных структурах, имеющих высокое сродство
как к клеткам, так и к субстрату и ответствен-
ных таким образом за его связывание. Примером
подобных структур могут служить целлюлосомы.
Некоторые бактерии используют иные механиз-
мы ассимиляции макромолекул, сходные скорее с
теми, которые характерны для лизосом эукариот.
Например, они связываются с поверхностью крах-
мала посредством индуцируемого мальтозой мем-
брапосвязаппого белка. Предположительно крах-
мал накапливается в периплазме и гидролизуется
240 Часть III. Многообразие метаболических путей
периплазматическими ферментами пуллуланазой
и амилазой. Образующиеся при этом мальтодекс-
трины поступают в цитоплазму, где подвергаются
дальнейшему гидролизу под действием глюкози-
дазы.
Адгезия и хемотаксис □ Для того чтобы
не происходило разбавления экзоферментов во
внешней среде и, кроме того, выделяющий их
микроорганизм мог иметь преимущество в ис-
пользовании продуктов гидролиза, у прокариот
действует ряд механизмов, таких как связывание
экзоферментов на поверхности клеток, адгезия
клеток к нерастворимым субстратам и перенос по-
лимерных субстратов в периплазматическое про-
странство. Адгезия клеток к субстрату, возможно,
позволяет им постоянно «следить» за содержани-
ем в среде питательных веществ. Индуцибельным
механизмом можгт быть хемотаксис в отношении
продуктов гидролиза полимеров.
Секреция □ Процесс секреции довольно
консервативен в филогенетическом отношении,
т. е. весьма сходен у бактерий и высших эукари-
от. Подробно механизмы секреции и связанного
с ней процессинга белков описаны в гл. 5, 16, 19,
24 и 33. Эффект секреции ограничен у микро-
бов рядом факторов. Во-первых, активности сек-
ретируемых ферментов во внешней среде могут
препятствовать такие условия, как неблагоприят-
ный pH или присутствие подавляющих ее ионов
либо молекул. Во-вторых, продукты гидролиза
могут потребляться конкурирующими микроор-
ганизмами. Можно предполагать, что в связи с
этим синтез экзоферментов находится под гиб-
ким контролем сложной системы регуляции.
9.3. Синтез и секреция экзоферментов осуществляются
как тонко регулируемые процессы
Внеклеточные ферменты постоянно синтезиру-
ются в клетках бактерий на некотором относи-
тельно низком, фоновом уровне, и при благопри-
ятных условиях происходит гидролиз субстрата
во внешней среде. Низкомолекулярные продук-
ты гидролиза транспортируются в клетки и при
соответствующих условиях, в частности в отсут-
ствие катаболитной репрессии, вызывают повы-
шение уровня синтеза экзоферментов в десятки
раз. Для некоторых конститутивных ферментов
такая индукция не характерна, но уровень их
синтеза варьирует в зависимости от вида субстра-
та, что главным образом определяется изменени-
ем катаболитной репрессии под действием сигна-
ла индукции. При этой сложной системе регуля-
ции на синтез внеклеточных ферментов влияют
строго определенные сигналы индукции и ката-
болитной репрессии. Кроме того, регуляция их
синтеза может быть связана с общей регуляцией
метаболизма, а также с процессом спорообразова-
ния, подвижностью клеток или их компетентно-
стью к ДНК-трансформации.
Катаболитная репрессия □ Это наиболее
распространенный путь регуляции при синтезе эк-
зоферментов. Он состоит в том, что в присут-
ствии легкометаболизируемых источников угле-
рода, обычно глюкозы, но в принципе и других
«хороших» субстратов, синтез внеклеточных фер-
ментов даже в присутствии индуктора в значи-
тельной степени или полностью подавлен. Такой
механизм энергетически эффективен, поскольку
препятствует трате энергии на синтез не нужных
в данных условиях ферментов периферического
углеродного метаболизма (в присутствии пред-
почтительного источника углерода). Таким обра-
зом, эффект катаболитной репрессии превосходит
эффект индукции синтеза экзоферментов. Поми-
мо этой общей схемы, действуют и различные
другие молекулярные механизмы регуляции (см.
гл. 18-20).
Зависимость синтеза экзоферментов от
фазы роста культуры □ У некоторых бак-
терий (например, у бацилл) синтез многих ин-
дуцибельных и конститутивных экзоферментов
(в частности, протеаз и амилаз) подавлен в фа-
зе экспоненциального роста, но в стационарной
фазе происходит его дерепрессия. Это связано с
тем, что в конце экспоненциальной фазы роста,
Глава 9. Окисление органических соединений 241
когда в среде истощается запас легкометаболи-
зируемых низкомолекулярных субстратов, возни-
кает потребность в экзоферментах, обеспечиваю-
щих поступление питательных веществ в резуль-
тате разложения полимерных веществ.
Системы передачи сигнала □ Бактерии
осуществляют постоянный мониторинг окружаю-
щей среды и реагируют на ее изменения путем
изменения экспрессии специфических регулонов.
У многих бактерий действуют при этом сходные
механизмы, например в регуляции синтеза экзо-
ферментов и спорообразования основное значение
имеют двухкомпонентные системы передачи сиг-
нала (см. гл. 20).
Синтез и выделение внеклеточных ферментов
находятся у микробов под контролем сложной си-
стемы регуляции. Кроме того, бактерии способны
предотвращать разбавление ферментов во внеш-
ней среде и потерю растворимых низкомолекуляр-
ных продуктов деградации полимеров, например
путем связывания экзоферментов с клеточной по-
верхностью или даже путем поглощения полимер-
ных субстратов.
9.4. Внутриклеточные запасные полимеры
расщепляются ферментами цитоплазмы
Практически все прокариоты способны синте-
зировать внутриклеточные запасные полимеры,
которые используются при дефиците источника
энергии (или фосфата, как в случае полифосфа-
тов) (рис. 9.2). Мобилизация запасов происходит
при участии внутриклеточных ферментов и ча-
сто иным путем, чем расщепление внеклеточных
биополимеров. Способностью к синтезу и исполь-
зованию запасных полимеров обладает большин-
ство микроорганизмов, и процессы их разложения
необходимо рассмотреть прежде, чем переходить
к описанию процессов разложения внеклеточных
полимеров.
Полимеры глюкозы □ Разложение глико-
гена происходит при участии гликоген-фосфо-
рил азы, последовательно отщепляющей остатки
глюкозы на нередуцирующем конце полимерной
цепи. Этот фермент катализирует фосфороли-
тическое расщепление о-1,4-гликозидной связи с
образованием глюкозо-1-фосфата. Данная реак-
ция обратима, но не осуществляется при син-
тезе гликогена (см. разд. 7.11). Продукт рас-
щепления, глюкозо-1-фосфат, изомеризуется в
глюкозо-6-фосфат, который служит субстратом
основных путей метаболизма. В точках разветв-
ления цепи полимера происходит фосфоролиз
си-1,6-связей при участии 1,6-глюкозидазы. В от-
личие от этого деградация экзогенных полимеров
глюкозы осуществляется путем гидролитического
расщепления, и оно приводит к быстрому распа-
ду всей структуры полимерной молекулы, тогда
как в процессе деградации запасного полисахари-
да образование молекул глюкозо-1-фосфата про-
исходит при сохранении общей структуры поли-
мера.
Полигидроксиалканоаты □ Расщепление
поли-3-гидроксибутирата катализирует депо-
лимераза, связанная с гранулами этого внут-
риклеточного полимера. Продукт реакции
D(—)-3-гидроксибутират (или родственные
3-гидроксикислоты) окисляется NAD-специфич-
ной D(— )-3-гидроксибутиратдегидрогеназой до
3-оксобутирата (ацетоацетата). Далее при уча-
стии сукцинил-СоА происходят образование
ацстоацетил-СоА и его тиолиз с высвобождением
двух молекул ацетил-СоА.
Полифосфаты □ Использование внутри-
клеточных полифосфатов происходит в случае,
если рост лимитирован дефицитом энергии и/или
фосфата, например при недостатке кислорода.
Полифосфат-АМР-фосфотрансфераза фосфо-
рилирует АМР с образованием ADP. Из двух
молекул ADP под действием аденилаткиназы
формируется молекула АТР (рис. 9.2). Все ре-
акции разложения полифосфатов относятся к
легкообратимым. Альтернативным механизмом
использования этих запасных веществ служит
гидролитическое отщепление орто-фосфата по-
лифосфатазой. Вероятно, орто-фосфат перено-
сится затем через мембрану путем симпорта с
одним или двумя протонами, что сопряжено с
синтезом АТР мембранной Н+-АТР-синтазой.
При этом формируются мелкие гранулы поли-
фосфатов.
242 Часть III. Многообразие метаболических путей
Рис. 9.2. Деградация запасных полимеров.
А. Гликоген; 1 — гликоген-фосфорилаза.
Б. Пол и гидроксиалканоат; 1 — деполимераза; 2 —
NAD-зависимая D-3-гидроксибутиратдегидрогеназа;
3 — сукцинил-СоА-трансфераза; 4 — кетотиолаза.
В. Полифосфаты; 1 — полифосфат-АМР-фосфотранс-
фераза; 2 — аденилаткиназа, 3 — пол и фосфатаза; 4 —
Н+-симпорт (выделение).
Г. Сера; окисление до сульфата.
Д. Запасной белок; 1 — протеиназа.
Сера □ Полимеры молекулярной серы [S°]n
окисляются с образованием сульфата в тех усло-
виях, когда рост лимитирован дефицитом источ-
ника электронов (восстановителя), но в среде в
достаточном количестве присутствуют источник
углерода (например, СО2) и источник энергии для
синтеза АТР. Механизм использования запасной
серы пока неясен. Путь окисления молекулярной
серы до сульфата описан в гл. 10.
Запасные белки □ Известные у цианобакте-
рий запасные белки утилизируются при участии
протеиназ, синтезируемых в условиях голодания
и при недостатке азота в среде.
9.5. Расщепление высокополимерных субстратов
с образованием растворимых продуктов катализируют экзоферменты
В этом разделе рассматриваются механизмы ис-
пользования наиболее распространенных углевод-
ных биополимеров — основных питательных суб-
стратов для бактерий.
9.5.1. Целлюлоза — наиболее распространенный
органический субстрат в природе
Целлюлоза, основной углевод растительных кле-
ток, в виде лигноцеллюлозы входит наряду с
другими полимерами, гемицеллюлозой и лигни-
ном, в состав клеточных стенок. Синтезировать
целлюлозу способны также некоторые бактерии,
например Acetobacter xylinum. Из всех органиче-
ских субстратов целлюлоза присутствует в при-
роде в наибольшем количестве. Молекула целлю-
лозы представляет собой линейный полимер, со-
держащий примерно от 100 до 10 000 остатков
глюкозы, соединенных /3-1,4-связью; эта связь
обеспечивает высокую прочность молекулы цел-
люлозы, как и других структурных полиса-
харидов, на растяжение. В полимерной цепи
целлюлозы каждый остаток глюкозы повернут
относительно соседнего на 180°; такую повторяю-
Глава 9. Окисление органических соединений 243
Целлобиоза Г люкоза
д
Кристаллический участок Аморфный участок Кристаллический участок
I 1 I
Б
Рис. 9.3. Строение целлюлозы.
Д. /^-Гликозидные связи.
Б. Схематическая структура фибриллы. По [1].
щуюся пару остатков в составе целлюлозы назы-
вают целлобиозой (рис. 9.3). Целлюлозные цепи,
связанные между собой многочисленными меж-
молекулярными водородными связями, формиру-
ют ригидные и нерастворимые в воде фибриллы.
Такие фибриллы содержат как высокоупоря-
дочепные, кристаллические структуры, так и
аморфные, рыхлые участки. Кристаллические
участки, в отличие от аморфных, высокоустой-
чивы к действию гидролитических ферментов.
В составе клеточной стенки целлюлозные микро-
фибриллы объединены в более толстые волокна,
погруженные в матрикс из гемицеллюлозы и
лигнина (рис. 9.4). (Структурные аналоги цел-
люлозы— Д-1,4-мапнан и /3-1,3-ксилан — синтези-
руют некоторые водоросли.) Гемицеллюлоза-
ми называют группу разветвленных полисаха-
ридов матрикса, основные из которых — ксиланы
и глюкоманпаиы. Молекулы ксиланов включа-
ют остов из остатков ксилозы, от которого от-
ходят короткие боковые цепи из остатков глю-
куроновой кислоты и арабинозы, этерифициро-
ванные ароматическими (фенольными) кислота-
ми. Эти остатки ароматических кислот связаны
простыми эфирными связями с лигнином, благо-
даря чему образуется единый комплекс лигпин-
гемицеллюлоза. Глюкоманнаны построены из
молекул D-глюкозы и D-маннозы, связанных
/3-1,4-связью. Лигнин представляет собой силь-
поразветвленпый ароматический полимер нерегу-
лярного строения. Обладая высокой устойчиво-
стью к биодеградации, он защищает целлюлозу и
гемицеллюлозу от ферментативного гидролиза.
Разложение целлюлозы изучают с
использованием ее стандартизованных
форм □ Эти формы различаются по степени
Рис. 9.4. Строение растительной клеточной стенки —
важного источника питательных субстратов для микро-
организмов.
Д. Слои клеточной стенки, образующие волокна древе-
сины.
Б. Возможное расположение лигнина и гемицеллюло-
зы относительно микрофибрилл целлюлозы во вторич-
ных клеточных стенках. (Диаметр клетки составляет
примерно 25 мкм.) П.с. — первичная клеточная стен-
ка; В.с. 1 — В.с. 3 — вторичные клеточные стенки 1-3.
По [1].
кристалличности, площади доступной поверхно-
сти, размерам пор, растворимости, степени за-
мещения ОН-групп карбоксиметильными группа-
ми и другим свойствам. Примером аморфных,
легкорасщепляемых форм могут служить рас-
творимая карбоксиметилцеллюлоза и целлюлоза,
способная к набуханию в кислой среде. В исследо-
ваниях используют также хромогенные субстра-
ты— модифицированные аналоги целлюлозы, в
которых к аномерному Cl-атому целлобиозы че-
рез Д-гликозидную связь присоединена молеку-
ла окрашенного соединения — хромофора. Ката-
литическую активность целлюлаз определяют, в
частности, по накоплению в среде редуцирующих
сахаров (эквивалентов глюкозы) или по окраши-
ванию среды в результате гидролиза хромогенно-
го субстрата.
Целлюлозолитические и родственные
ферменты □ Целлюлазы представляют собой
комплексы из нескольких компонентов, которые
физически и синергидно взаимодействуют друг
с другом, с волокнами субстрата и с поверхно-
стью клеток микроорганизма. Эти компоненты
имеют независимые каталитический и субстрат-
связывающий центры либо состоят из отдель-
ных доменов со сходными аминокислотными по-
следовательностями и биохимическими свойства-
244 Часть III. Многообразие метаболических путей
ми. В зависимости от гидролизуемого субстра-
та целлюлазы варьируют по составу компонен-
тов. Многие бактерии, в отличие от грибов, раз-
рушают целлюлозную поверхность с помощью
экзоферментов, связанных с клеточной поверх-
ностью. Это обеспечивает им преимущество в
водной среде, рубце жвачных и на поверхности
хищных простейших. Все целлюлозолитические
микроорганизмы обладают набором ферментов,
различающихся по специфичности к длине поли-
сахаридной цепи, а также по атакуемому участ-
ку (концевые или внутренние позиции, аморф-
ные или кристаллические участки фибрилл). Это
необходимо, чтобы гидролизовать данный струк-
турно разнообразный субстрат, который, кроме
того, изменяется в результате деградации, что
требует для дальнейшего разложения участия но-
вых ферментов. Разложение гемицеллюлозного
комплекса осуществляет сходный набор фермен-
тов, гидролизующих остов и боковые цепи поли-
мера. Конечные продукты разложения полисаха-
ридов под действием целлюлозолитических фер-
ментов—это целлобиоза и глюкоза. Целлобиоза
гидролизуется целлобиазой с образованием двух
молекул глюкозы.
Классификация □ Классификация сотен
известных целлюлаз и ксиланаз основана на ами-
нокислотной последовательности входящих в их
состав белков. Для удобства целлюлазы подраз-
деляют на экзоглюканазы (целлобиогидролазы,
отщепляющие остатки целлобиозы от нередуци-
рующего конца целлюлозной цепи), эндоглюка-
назы (расщепляющие цепь во внутренних пози-
циях) и /3-глюкозидазы (гидролизующие водо-
растворимые олигосахариды и дисахариды). По
данным рентгеноструктурного анализа, субстрат-
ная специфичность эндо- и экзоглюканаз опре-
деляется геометрией их реакционных центров.
Реакционный центр эндоглюканаз и ксиланаз об-
разует открытую полость, в которой размещает-
ся цепь полиглюкозы, и расщепление этой цепи
может происходить на любом ее участке. Реакци-
онный центр экзоглюканаз формирует отверстие,
размеры которого соответствуют целлобиозному
остатку на нередуцирующем конце целлюлозной
цепи.
Гликозидазная реакция протекает в соответ-
ствии с кислотно-основным механизмом. Вначале
кислород гликозидной связи протонируется с уча-
стием одного аминокислотного остатка в соста-
ве реакционного центра; за этим следует нуклео-
фильная атака другого аминокислотного остатка,
приводящая к образованию гидроксильной груп-
пы. Гидролиз может происходить с обращением
или сохранением конфигурации в зависимости от
типа фермента (см. рис. 9.8).
Целлюлозолитические и ксилаполитические
ферменты относятся к гликозилгидролазам и де-
лятся па несколько семейств. Гены этих фер-
ментов могут передаваться от одних микроорга-
низмов другим путем горизонтального переноса,
либо целиком, либо в виде модулей, кодирую-
щих отдельные домены. Как правило, неконсер-
вативный каталитический домен фермента связан
гибким шарнирным участком с консервативным
субстрат-связывающим доменом. Эти компонен-
ты могут быть соединены в молекуле фермента в
различном порядке.
Целлюлосомы □ Образование целлюло-
сом — стабильных мультифермептных целлюлаз-
ных комплексов — наиболее достоверно установ-
лено для нескольких анаэробных микроорганиз-
мов, в частности Clostridium thermocellum. Такой
комплекс содержит набор ферментов, способных
гидролизовать различные целлюлозные струк-
туры, в том числе и кристаллическую, а также
другие углеводные полимеры растительной кле-
точной стенки. Целлюлосома как физически ин-
тегрированная структура молекулярной массой
более 2 МДа состоит из более чем десяти белков
и гликопротеинов, одни из которых присутству-
ют в гораздо большем количестве, чем другие.
Большинство компонентов целлюлосом обладает
целлюлазной, ксиланазной или лихеназной ак-
тивностью. Центральный белок комплекса («ста-
пель») содержит домен, связывающий целлюло-
зу, и регулярно повторяющиеся якорные домены,
обеспечивающие связывание различных катали-
тических белков (рис. 9.5).
Прикрепление целлюлозолитических
организмов к субстрату □ Как правило, меж-
ду клетками целлюлозолитического микроорга-
низма и субстратом формируется тесная связь,
что обеспечивает эффективное потребление рас-
творимых продуктов гидролиза. Целлюлосомы
могут образовывать в поверхностном слое кле-
точной стенки крупные скопления (которые на
электронных микрофотографиях выглядят как
Глава 9. Окисление органических соединений 245
Рис. 9.5. Предположительное строение целлюлосомы. Изображена часть целлюлосомы: три каталитические субъ-
единицы, центральный (стапельный) белок CipA, содержащий домен связывания с целлюлозой, и повторяющиеся
участки связывания каталитических субъединиц. Остатки глюкозы и компоненты целлюлосомы изображены в раз-
ных масштабах. По [1].
выступы), формировать полицеллюлосомы, пол-
ностью покрывающие целлюлозный фрагмент,
или быть лишь слабо связанными с клеточной по-
верхностью.
Деградация целлюлозы в кишечном
тракте травоядных животных □ Основными
питательными веществами для травоядных слу-
жат компоненты растительной биомассы — цел-
люлоза, ксилапы, фруктозаны и другие полимер-
ные углеводы. Рубец жвачных заселен анаэробны-
ми бактериями и простейшими (реже грибами),
образующими симбиотическое сообщество, кото-
рое функционирует как полунепрерывная мик-
робная культура (см. разд. 31.5).
Регуляция синтеза целлюлазных ком-
плексов □ В присутствии низкомолекулярных
источников углерода, более легко метаболизиру-
емых, чем целлюлоза, синтез целлюлаз подав-
лен (катаболитная репрессия). Следует отмстить,
что многие целлюлозолитические микроорганиз-
мы не способны расти, используя глюкозу в ка-
честве единстве иного субстрата. Синтез целлю-
лаз индуцируется при наличии в среде целлюлозы
или олигомерных продуктов ее деградации (цел-
лобиозы либо целлодекстринов). Однако слабая
целлюлазная активность присутствует у целлю-
лозолитических организмов, по-видимому, посто-
янно, обеспечивая ограниченный гидролиз целлю-
лозы. Растворимые продукты гидролиза транс-
портируются в клетку, где индуцируют синтез
целлюлазных комплексов. Какие конкретно со-
единения служат при этом сигналом, пока неяс-
но. Возможно, эту роль выполняет целлобиоза
(/3-1,4), которая подвергается трансгликозилиро-
ванию с образованием другого дисахарида, содер-
жащего /3-1,2-гликозидную связь. Большинство
генов, ответственных за синтез белков целлюлаз-
ного комплекса, представляет собой моноцистро-
ны, и их транскрипция не обязательно строго ско-
ординирована.
Применение □ Целлюлазы и гемицеллюла-
зы широко используются для модификации цел-
люлозы и гемицеллюлозы путем частичного гид-
ролиза. Их применяют, например, для обработки
соломы, используемой в качестве субстрата при
выращивании грибов, для осветления соков, в пи-
воварении, при производстве текстиля, получении
бумажной пульпы и очистке сточных вод в цел-
люлозной промышленности. В сельском хозяйстве
эти ферменты могут применяться для приготов-
ления силоса. Путем полного гидролиза целлю-
лозу можно использовать как дешевый источник
глюкозы.
Целлюлозолитические микроорганиз-
мы □ Разложение целлюлозы осуществляют
представители многих родов прокариот, гри-
бы (например, Trichoderma и анаэробный оби-
татель рубца Neocallimastix) и простейшие
(Diplodinium, Eudiplodinium, Entodinium). К цел-
люлозолитическим прокариотам относятся, на-
пример, аэробные бактерии родов Acetivibrio,
Actinomyces, Alcaligenes, Bacillus, Cellulomonas,
246 Часть III. Многообразие метаболических путей
Рис. 9.6. Ферменты, участвующие в
разложении крахмала. 1 — Ферменты,
расщепляющие гликозидные связи внут-
ри молекулы полимера; 2 — ферменты,
отщепляющие концевые остатки; 3 — глю-
козидазы; 4 — пуллуланаза (расщепляет
связи внутри молекулы полимера); 5 —
ци клодекстри н-гл юкозилтра нсфераза.
Механизм гидролиза гликозил—кислород-
ной связи см. на рис. 9.9.
Erwinia, Microbispora, Pseudomonas, Streptomyces
и Thermomonospora, а также анаэробные бакте-
рии родов Bacteroides, Butyrivibrio, Clostridium,
Fibrobacter, Thermoanaerobacter и Ruminococcus.
Из них лишь немногие синтезируют полный на-
бор ферментов, необходимых для эффективного
разложения целлюлозы в составе природных суб-
стратов. Большинство целлюлозолитических ор-
ганизмов обладает частью этих ферментов и, ве-
роятно, участвует в этом процессе в ассоциации с
другими прокариотами.
9.5.2. Предпочтительными субстратами для
бактерий служат запасные вещества
растений — крахмал и другие ск-глюканы
Крахмал — основное запасное вещество расте-
ний— представляет собой полимер q-D-глюкозы,
состоящий из двух глюканов — амилозы и амило-
пектина. Амилоза — это полимер в виде длин-
ной неразветвленной цепи, в которой остатки
D-глюкозы соединены а-1,4-гликозидным и связя-
ми. В отличие от нее, цепи амилопектина силь-
но разветвлены; они состоят из амилозных фраг-
ментов, связанных а-1,6-гликозидными связями.
Амилопектин содержит дополнительно остат-
ки фосфорной кислоты и ионы Са2+ и Mg2+.
Цепи амилозы спирально закручены и могут
содержать от нескольких сотен до нескольких
тысяч остатков глюкозы. Амилоза и амилопек-
тин способны связывать иод, при этом ами-
лоза окрашивается в синий цвет, тогда как
амилопектин — в красно-фиолетовый или корич-
невый. Гликоген состоит из более разветвлен-
ных цепей и при добавлении иода окрашивается
в коричневый цвет. Эти полимеры существенно
различаются по степени полимеризации, струк-
туре и другим свойствам. Пуллулан — линей-
ный полимер из остатков мальтотриозы, соеди-
ненных а-1,6-гликозидпыми связями, — синтези-
руется дрожжеподобным грибом Aureobasidium
pullulans. Циклодекстрины представляют со-
бой циклические полисахариды, содержащие 6, 7
или 8 остатков глюкозы (6 остатков — о-декстрин,
7 — /3-декстрин, 8 — 7-декстрин), соединенных
о-1,4-гликозидными связями. С4-атом «послед-
него» остатка связан с Cl-атомом «первого», так
что редуцирующего конца не остается.
Амилазы расщепляют а-1,4- и а-1,6-глико-
зидные связи в молекулах крахмала и других глю-
канов с образованием смеси водорастворимых са-
харов, от глюкозы до мальтодекстринов, содержа-
щих в среднем десять остатков глюкозы (рис. 9.6).
Эти ферменты классифицируют в соответствии
с субстратной специфичностью и расположением
атакуемой связи в молекуле полисахарида (эццо-
и экзоамилазы). Кроме того, при классификации
учитывается тип конечного продукта (глюкоза,
мальтоза, мальтотриоза, мальтодекстрин, цикло-
декстрины), а- или /J-копфигурация аномерного
атома продукта (см. а- или /3-амилаза) и тип
расщепляемой связи (а-1,4; а-1,6 или обе). Все
амилазы содержат три или четыре консерватив-
Глава 9. Окисление органических соединений 247
ныс аминокислотные последовательности, ответ-
ственные за связывание субстрата и сам механизм
кислотно-основного гидролиза, однако по общей
первичной структуре существенно различаются.
Ферменты □ К эндоамилазам (эти фермен-
ты расщепляют гликозидную связь внутри моле-
кулы полисахарида) относятся «-амилаза, пуллу-
ланаза и циклодекстрин-глюкозилтрансферазы.
Они эффективно разрушают полимерную струк-
туру полисахарида с образованием мальто-
олигосахаридов. Наиболее известный фермент
этого класса—«-амилаза. К экзоамилазам от-
носятся /3-амилаза и амилоглюкозидазы. Они
расщепляют а-1,4-гликозидную связь на псреду-
цирующем конце цепи, не нарушая общей целост-
ности полимерной структуры полисахарида. При
гидролизе под действием /3-амилазы образуется
дисахарид мальтоза. Амилоглюкозидазы последо-
вательно отщепляют от полисахаридной цепи по
одному остатку глюкозы. Глюкозидазы гидро-
лизуют короткоцепочечные декстрины, например
мальтозу, с образованием глюкозы. Пуллулана-
за гидролизует «-1,6-гликозидные связи в струк-
турах крахмала и пуллулапа. Циклодекстрин-
глюкозилтрансферазы, помимо «-амилазной
активности, обладают способностью замыкать
в кольцо короткоцепочечные (из 6-8 остатков
глюкозы) полисахариды. Циклические продукты
циклодекстрин-глюкозилтрансферазной активно-
сти (циклодекстрины) широко используются в
промышленности (см. ниже). Изоамилазы рас-
щепляют гликоген с образованием короткоце-
почечных декстринов, содержащих значительное
количество 1,6-гликозидных связей. Некоторые
растения синтезируют кроме или вместо глюка-
нов фруктаны, или леваны, — гомополисахари-
ды, состоящие из остатков D-фруктозы. Они гид-
ролизуются при участии «-фруктапазы. Мальто-
за и олигомерные полисахариды для поглощения
их клетками предварительно гидролизуются вне-
клеточной мальтазой с образованием олигомера,
состоящего из двух остатков глюкозы.
Регуляция разложения крахмала □ Фер-
менты расщепления крахмала и других о-глюка-
нов обычно действуют во внеклеточной среде как
экзоферменты; в некоторых случаях их молеку-
лы связаны с S-слоем клеточной стенки. Синтез
этих ферментов ассоциирован с ростом и происхо-
дит конститутивно на низком уровне. Низкомоле-
кулярные продукты деградации, такие как маль-
тодекстрины и мальтоза, стимулируют их синтез.
Катаболитным репрессором синтеза амилолити-
ческих ферментов служит глюкоза. Однако ме-
ханизмы репрессии, например у энтеробактерий,
псевдомонасов и бацилл, различны.
Применение □ Амилолитические фермен-
ты широко используются для получения из крах-
мала мальтозы, глюкозы, глюкозо-мальтозного
сиропа. декстринов и циклодекстринов.
Кроме хорошо известных применяются и новые
ферменты с необычными свойствами, например
термостабильные ферменты из мезофильных и
экстремально термофильных микроорганизмов.
Они представляют ценность для практического
использования, поскольку сохраняют активность
в течение длительного времени при температуре
до 100 °C.
Микроорганизмы □ К типичным орга-
низмам. разлагающим крахмал, относятся бак-
терии родов Bacillus, Bacteroides, Clostridium,
Klebsiella, Pseudomonas, Pyrococcus, Streptomyces,
Thermoanaerobacter, Thermotoga, Thermus,
Therm omonospora и Thermoactinomyces.
9.5.3. Разложение гемицеллюлозы
Вместе с целлюлозой гемицеллюлоза входит в
состав растительных клеточных стенок. Мягкая
древесина голосеменных, твердая древесина по-
крытосеменных и стебли травянистых растений
различаются по составу лигнинов и гемицеллю-
лоз.
Гемицеллюлозы представляют собой второй
наиболее важный источник углеводов в приро-
де. Они входят в состав как вторичной, так и,
в меньшей степени, первичной клеточной стенки
и сравнительно легко экстрагируются из расти-
тельных клеток. По химическому строению это
слаборазветвлепные гомо- или гетерополимеры
из остатков ксилозы, маннозы, глюкозы и га-
лактозы (все в форме D-пираноз), соединенных
/^-гликозидными связями (/3-1,4, /3-1,6, /3-1,3 и
др.); их цепи содержат заместители различной
природы (ацетиловые или метиловые эфиры, уро-
новые кислоты, другие пентозы). Гемицеллюлозы
различного происхождения различаются по ти-
пам связей между остатками сахаров и степени
ветвления. Наиболее распространены среди геми-
целлюлоз ксиланы, маннаны и галактаны, содер-
жащие в качестве основных мономеров D-ксилозу,
D-маннозу и галактозу соответственно. Мономе-
248 Часть III. Многообразие метаболических путей
ры в них соединены (3-1,4-гликозидной связью.
Ксилан можно рассматривать как аналог цел-
люлозы (/^-D-ксилоза отличается от /З-И-глюкозы
тем, что вместо ОДОН-группы в положении 6
глюкозы содержит водородный атом), по с мень-
шей степенью полимеризации и наличием ветв-
ления. Кроме ксилозы, ксилан содержит остатки
арабинозы, глюкозы, галактозы и глюкуроновой
кислоты.
Ксилапы и другие гемицеллюлозы сравни-
тельно легко гидролизуются, вследствие чего спо-
собность к использованию гемицеллюлоз широко
распространена среди микроорганизмов. Как и в
случае целлюлозы, в местообитаниях с кислой ре-
акцией среды гидролиз гемицеллюлоз осуществ-
ляют в основном грибы, при нейтральной и ще-
лочной реакции — бактерии. Ксилапазы содержат
многие микроорганизмы, способные к гидролизу
целлюлозы.
Ферменты □ В соответствии со значитель-
ным структурным разнообразием гемицеллюлоз
для их полного гидролиза требуется набор раз-
личных ферментов. Так, в деградации ксилана
принимают участие эпдо-1,4-/3-ксиланаза, гидро-
лизующая основную цепь, и /3-ксилозидаза (эк-
зогликозидаза), последовательно отщепляющая
остатки D-ксилозы от нередуцирующего конца
цепи. Активность гемицеллюлазпого комплекса
обычно определяют по скорости накопления ре-
дуцирующих сахаров (ксилозы или ксилобиозы).
Дополнительные ферменты □ Дополни-
тельные ферменты необходимы для отщепления
заместителей от основной цепи гемицеллюлозы,
например для деацетилирования, после которого
молекула гемицеллюлозы становится менее водо-
растворимой, но вместе с тем менее устойчивой к
воздействию ферментов.
Регуляция □ У бактерий, использующих
преимущественно ксиланы (например, у видов
рода Clostridium), ксиланаза синтезируется кон-
ститутивно; у других микроорганизмов ее синтез
индуцируют ксилапы.
9.5.4. Глюкозаминогликаны хитин и хитозан
выполняют у многих беспозвоночных,
животных и грибов ту же функцию,
что целлюлоза у растений
Хитин представляет собой гомополимер из
остатков М-ацетил-И-глюкозамипа, соединенных
/3-1,4-гликозидной связью. Прочность его струк-
туры обеспечивается многочисленными водород-
ными связями между боковыми N-ацетильными
группами. Хитин служит основным структур-
ным элементом твердого наружного скелета бес-
позвоночных— насекомых, ракообразных и про-
стейших. В огромном количестве он присутствует
в морской среде как компонент зоопланктонных
организмов, а также в почве, где его образуют
членистоногие, имеющие наружный скелет, про-
стейшие, а также грибы, у которых он является
основным компонентом клеточной стенки. Таким
образом, хитин можно рассматривать как второй
или третий наиболее распространенный углевод
в природе. Прокариоты и растения не содержат
хитина, однако в состав клеточной стенки бак-
терий входит его структурный аналог — муреин
(см. рис. 7.32 и 23.1). Кристаллическую струк-
туру хитина формируют аптипараллельные це-
пи. Молекулы хитина., как и других структурных
полимеров, образуют перекрестные связи с мо-
лекулами белков, /3-глюканов или других соеди-
нений. Во многих случаях наблюдается уплотне-
ние (склерификация) хитиновых структур в ре-
зультате включения фенольных и липидных моле-
кул, а также минерализация (кальцификация) —
включение ионов Са2+. Деацетилированная фор-
ма хитина (рис. 9.7) называемая хитозаном, об-
разуется под действием деацетилазы у некоторых
дрожжей и мицелиальных грибов.
Ферменты и пути деградации хитина и
хитозана □ Свободноживущие или обитающие
в кишечнике животных хитинолитические мик-
роорганизмы обладают, как правило, нескольки-
ми хитиназами и N-ацетилглюкозаминидазами с
различной субстратной специфичностью. В це-
лом механизм деградации хитина сходен с ме-
ханизмом деградации целлюлозы. Экзохити-
наза отщепляет диацетилхитобиозный остаток
от нередуцирующего конца цепи. Эндохити-
наза расщепляет случайным образом глико-
зидные связи внутри цепи. Конечными про-
дуктами эндохитиназпой активности являются
диацетилхитобиоза и триацетилхитобиоза. Да-
лее /З-ГЧ-ацетилглюкозаминидаза (хитобиаза)
гидролизует димер хитобиозы с образованием
N-ацетилглюкозамина. Известен также механизм
деградации хитина путем предварительного деа-
цетилирования с образованием хитозана. Под дей-
ствием хитозаназы хитозан гидролизуется до хи-
тобиозы, которую глюкозаминидаза расщепляет
на две молекулы глюкозамина. В эксперименте
Глава 9. Окисление органических соединений 249
Рис. 9.7. Строение хитина и хитозана и их расщепление
хитинолитическими ферментами.
процесс гидролиза регистрируют по исчезнове-
нию макромолекулярного хитина (зона просвет-
ления па поверхности агара) или появлению
растворимых олигомеров. У хитинобразующих
организмов эти же ферменты, локализованные
внутриклеточно, выполняют важную роль в мор-
фогенезе. Хитиназы представляют собой глико-
протеины и выделены в особую группу внутри се-
мейства гликозилгидролаз.
Прикрепление к субстрату и регуляция
синтеза ферментов □ Подобно целлюлозоли-
тическим бактериям, хитинолитические микро-
организмы осуществляют разложение субстрата
при непосредственном контакте в данном случае с
волокнами хитина. Примером могут служить па-
тогенные микроорганизмы, разрушающие наруж-
ный скелет членистоногих или внутреннюю мем-
брану их кишечника. Синтез хитиназ индуциру-
ют олигомеры хитина и при низкой концентрации
N-ацетилглюкозамин.
Применение □ Хитиназы и хитозаназы ис-
пользуются в биотехнологии для переработки хи-
типсодержащих отходов и в научных исследова-
ниях для получения протопластов грибов. Хито-
зап широко используется в качестве клеящего ве-
щества.
Микроорганизмы □ Разлагающие хитин
бактерии и грибы весьма распространены в
почве и донных осадках водоемов. Его способ-
ны использовать как аэробные, так и анаэроб-
ные бактерии, например представители родов
Alteromonas, Cytophaga, Chromobacterium, Curto-
bacterium, Vibrio, Pseudomonas, Aeromonas, Strep-
tomyces, Clostridium, Photobacterium, Bacillus, Ha-
loanaerobacter, Serratia, Flauobacterium, Lysobacter
и Arthrobacter. В среде с хитином легко получить
рост актиномицетов.
9.5.5. Пектины и другие углеводсодержащие
полимеры входят в состав матрикса
растительной клеточной стенки
Пектины и гидролизующие их ферменты □
Пектины входят в число полисахаридов матрик-
са растительной клеточной стенки и, кроме того,
присутствуют в растительных соках. По структу-
ре молекул пектины представляют собой полиани-
онные полимеры, состоящие из остатков сахарных
кислот, соединенных о-(1-4)-гликозидными свя-
зями (например, из остатков галактуроновой кис-
лоты; галактуронаны). Некоторые карбоксильные
группы в их составе этерифицированы метиль-
ными группами. В состав пектина могут входить
также пентозы. Расщепление основной цепи пек-
тина осуществляют эндо- и экзопектиназы, дей-
ствующие аналогично амилазам и целлюлазам.
Комплекс пектинолитических ферментов вклю-
чает также метилэстеразы, гидролизующие ме-
тиловые эфиры с образованием метанола. Функ-
циональный аналог галактуронанов, полимер,
состоящий из остатков альгиновой кислоты, со-
держится в клеточной стенке бурых и некоторых
других водорослей.
Пектин-лиазы □ Наряду с гидролитически-
ми ферментами разложения полисахаридов бак-
терии обладают пектин-лиазами, которые рас-
щепляют С—О-связь между о-(1,4)-связанными
остатками гексоз (/3-уроновой кислоты) путем
/3-элиминирования. Продуктами такого рас-
щепления являются сахара, молекулы которых
содержат двойную связь (рис. 9.8).
Другие гликозидазы □ Многие другие гли-
козидазы гидролизуют О-гликозильные соеди-
нения, такие как инулин (1,2-/3-Б-фруктан) и
250 Часть III. Многообразие метаболических путей
Рис. 9.8. Механизм /3-элиминирования, катализируемо-
го лиазами полисахаридов, в сравнении с гидролизом,
катализируемым гидролазами глюканов.
декстран (1,6-а-О-глюкан). Сиалидаза (нейрами-
нидаза) расщепляет о-2,3-, а-2,6- и о-2,8-глико-
зидпые связи терминальных остатков сиаловых
кислот в составе, например, олигосахаридов и
гликопротеинов. Гидролиз гиалуроновой кисло-
ты (полимер из остатков D-глюкуроновой кис-
лоты и К-ацетил-О-глюкозамина, соединенных
1,4-/3-гликозидной связью) катализирует гиалу-
ронидаза. Известны гликозидазы, расщепляющие
хондроитин, хонд роит пн-4-сульфат, хондроитин-
6-сульфат и дерматан (полимеры, состоящие
из остатков D-глюкуроновой кислоты и N-аце-
тил-О-глюкозамипа либо N-ацетилгалактозамин-
сульфата, соединенных 1,4-/3-гликозидной свя-
зью), а также леваны (гомополимеры из остат-
ков D-фруктозы, соединенных 2,6-/3-гликозидной
связью). Агароза (полимер из остатков галакто-
зы, соединенных 1,3-/3-гликозидной связью) гид-
ролизуется под действием агаразы. Фермент ли-
зоцим расщепляет пептидогликан (муреин, по-
лимер в составе клеточной стенки бактерий),
гидролизуя L,4-/3-гликозидную связь между
остатками Х-ацетил-О-глюкозамипа и N-ацстил-
мурамовой кислоты. Экзополисахарид ксантан,
синтезируемый Xanthomonas campestris, гидроли-
зует фермент ксантаназа.
9.6. Разложение лигнина — сложного гетерополимера,
состоящего из фенилпропаноидных соединений
Лигнин — это один из немногих природных поли-
меров, разложение которых осуществляют толь-
ко внеклеточные оксидазы при участии молеку-
лярного кислорода. Лигнин относится к основным
компонентам растительных тканей и по степе-
ни распространенности в природе считается вто-
рым после целлюлозы. По химической струк-
туре это ароматический полимер, мономерными
единицами которого являются фепилпропапои-
ды — n-кумаровый, конифериловый и синаповый
спирты (рис. 9.9), соединенные разнообразными
связями. Именно разнообразием этих связей обу-
словлено нерегулярное строение молекул лигни-
на. Доля отдельных фенилпропаноидных еди-
ниц в составе лигнина зависит от типа растений
(хвойные, лиственные или травянистые). Лиг-
нин инкрустирует растительную клеточную стен-
ку, окружая микрофибриллы целлюлозы и геми-
целлюлозы и формируя матрикс, определяющий
характерные свойства дре юсины и чрезвычайно
устойчивый к биодеградации. Содержание лигни-
на в древесине составляет от 20 до 30%, и соотно-
шение С/N в ней значительно выше, чем во мно-
гих других природных субстратах. В связи с этим
использование древесины лимитируется недостат-
ком азота, и микробы удаляют излишек углеро-
да путем окисления его кислородом воздуха либо
путем образования вторичных метаболитов, тогда
как азот включают в реакции метаболизма.
Лигноцеллюлоза служит в количественном
отношении наиболее важным органическим суб-
стратом для микроорганизмов. Опа довольно
быстро разлагается в древесине живых растений,
зараженных фитопатогенными грибами, или в
Глава 9. Окисление органических соединений 251
Модель связывания мономеров
лигнина через эфирную связь (0-0-4)
Феруловая кислота
В л-Кумаровая кислота
4-Гидроксибензойная кислота
Рис. 9.9. Строение лигнина и номенклатура его компонентов.
А. Три спирта — предшественника лигнина — кумаровый, конифериловый и синаповый. При синтезе лигнина они
подвергаются одноэлектронному окислению, после чего полимеризуются с образованием трехмерной структуры
Стрелками показано положение межмономерных связей в молекуле лигнина — арилэфирной, бифенильной и дифе-
нилэфирной.
Б. Модель связывания мономеров в составе лигнина через простую эфирную связь (/3-0-4).
В. Ароматические кислоты, обнаруживаемые в гидролизате лигнинсодержащих углеводных структур.
отмершем растительном материале, однако в поч-
ве, в анаэробных условиях, ее распад происходит
очень медленно, и здесь она служит источником
образования почвенного органического вещества,
в частности гуминовых кислот, важных для пло-
дородия почв.
Ферментативное разложение лигнина проис-
ходит при участии пероксидаз, катализирую-
щих восстановление пероксида водорода (Н2О2) с
образованием в качестве промежуточных про-
дуктов высокореакционноспособных кислород-
ных радикалов. Пероксид водорода служит, та-
ким образом, косубстратом-окислителем в реак-
циях разложения лигнина. Разрушение лигнина
осуществляют в первую очередь мицелиальные
грибы. Их гифы, проникая в древесину, обеспечи-
252 Часть III. Многообразие метаболических путей
вают тесный контакт с этим инертным субстратом
и выделяют особые соединения — глиоксаль или
метилглиоксаль, которые служат источником об-
разования Н9О2, а также внеклеточные оксидазы,
что позволяет окислять лигнин с помощью сво-
бодных кислородных радикалов (рис. 9.10).
Дополнение 9.2. Изучение путей биоде-
градации лигнина весьма затруднено из-за
сложности строения его молекул. Исследо-
вания в основном проводятся с использова-
нием синтетических модельных субстра-
тов— димеров, содержащих соответствую-
щие эфирные связи. Одни из таких димеров,
в котором мономеры связаны /З-О-4-эфирпой
связью, показан на рис. 9.9, Б. Эта струк-
турная единица содержит в о- и 7-положе-
ниях гидроксильные группы, способные, как
и свободная гидроксильная группа фенола,
обеспечивать ее присоединение к углеводам.
Обычно процесс разложения лигнина реги-
стрируют по выделению 14СОг из радиоак-
тивно меченного лигнина. В экспериментах
используют 14С-лигнин, синтезируемый био-
логическим или химическим путем из со-
ответствующих меченных по углероду пред-
шественников. Микроорганизмы способны
минерализовать значительную фракцию лиг-
нина, однако часть его превращается в нерас-
творимые полимерные продукты, недоступ-
ные для гидролиза.
Сложность и нерегулярность строения лиг-
нина связана с тем, что в процессе его синте-
за полимеризация строительных блоков происхо-
дит без участия ферментов и носит случайный,
стереопеспецифический характер. Фенилпропапо-
идпые предшественники (рис. 9.9, Л) предвари-
тельно окисляются пероксидом во, юрода или кис-
лородом воздуха под действием соответственно
пероксидаз и лакказ с образованием ароматиче-
ских спиртов. Эти спирты спонтанно полимеризу-
ются, вступая в разнообразные сопряженные ре-
акции. Возникающие при этом простые эфирные
и углерод-углеродные связи чрезвычайно устой-
чивы к гидролизу. Примерно половина всех меж-
мономерных связей в структуре лигнина —это
простые эфирные связи (рис. 9,9, Б) между бо-
ковой цепью спиртового остатка и ароматическим
ядром (/З-О-4-эфир). Следующие по распростра-
ненности связи между мономерами в составе лиг-
нина — это углерод-углеродные связи меж-
ду боковой пропиловой цепью и ароматическим
ядром. Формирование лигноцеллюлозного ком-
плекса происходит путем образования сложно-
эфирпых связей между свободными гидроксиль-
ными группами уроновых кислот в составе геми-
целлюлозы и пропиловыми боковыми цепями в
составе компонентов лигнина. Многообразие меж-
мономерных связей и нерегулярность строения
лигнина иллюстрирует рис. 9.9, А. На рис. 9.9, В
показана структура наиболее распространенных
низкомолекулярных ароматических моноь еров в
составе компонентов растительных клеточных
стенок.
Дополнение 9.3. Пероксидазы (донор е-:
ЩС^-оксидоредуктазы) — эго гемопротеи-
ны, содержащие одну протогемовую груп-
пу (желсзопорфирип IX). В процессе ката-
лизируемой ими реакции молекула перок-
сидазы окисляется; при этом сс активный
центр переходит в более высоковалентпое
окисленное состояние, а пероксид водорода
восстанавливается др воды. Пероксидазы иг-
рают, в частности, важную роль в окислении
ксенобиотиков. Лигнинпероксидазы, или
лигниназы, окисляют ароматические суб-
страты с переносом одного электрона и об-
разованием нестабильного арильного катион-
радикала, который подвергается расщепле-
нию ио С-С-связям и различным другим
превращениям в ходе деградации. Марган-
цевые пероксидазы окисляют свободный
Мп(П) до Мп(П1); диффундируя от этих фер-
ментов, он затем окисляет субстраты, содер-
жащие свободные фенильные группы. [Сле-
дует отметить, что Мп(Ш) является слабым
окислителем и не может индуцировать раз-
рыв нсфенольной устойчивой эфирной связи
бензил—О—С. Эфирные связи фенил—О—С
более легко гидролизуются, например путем
щелочного гидролиза.] Таким образом, нефе-
нольныс связи, придающие устойчивость мо-
лекуле лигнина, расщепляются лигнинперок-
сидазами, но не марганцевыми пероксидаза-
ми. В то же время известны не обладающие
лингинпероксидазами организмы, эффектив-
но разрушающие лигнин. Это указывает' на
возможность существования иных механиз-
мов деградации лигнина.
Глава 9. Окисление органических соединений 253
Рис. 9.10. Разложение лигнина грибом Phanerochaete
chrysosporium— возбудителем белой гнили. Глиоксаль
(или метилглиоксаль) продуцируется самим грибом;
гликолевый альдегид образуется из /3- и 7-углеродных
атомов фенилпропаноидных единиц при разложе-
нии лигнина. Окисление этих субстатов глиоксаль-
оксидазой приводит к образованию Н2О2, глиоксилата
и в конечном итоге оксалата (хелатирующие агенты).
Эти хелаторы связывают Mn(l11), образуемый марганец-
пероксидазой. Кроме того, в процессе разложения лиг-
нина образуются как продукты выделения гриба или
разложения лигнина ароматические спирты, например
вератриловый спирт. Эти спирты служат субстратом для
лигнинпероксидазы и стимулируют ее активность; меха-
низм стимуляции пока неясен. Мп(1П)-хелаты окисляют
наиболее реакционноспособные фенольные структуры,
из которых лигнин состоит примерно на 10%. Вероят-
но, это способствует последующему воздействию более
крупной по размерам, но и более эффективной лигнин-
пероксидазы. Арильные катион-радикалы, образующие-
ся при действии этих пероксидаз, спонтанно разлага-
ются на низкомолекулярные продукты или остаточные
полимерные продукты. По [3].
Микроорганизмы □ Разложение лигнина,
несмотря на важность этого процесса в при-
роде, пока мало изучено. Во многом неясен
механизм анаэробной деградации лигнина. Из-
вестно лишь, что в этих условиях отщепля-
ются легкогидролизуемые остатки и 0-метиль-
ные группы, а также модифицируются некото-
рые боковые цепи. В большинстве исследований
используют низкомолекулярные модельные суб-
страты, которые клетки способны поглощать и
метаболизировать в цитоплазме, тогда как де-
градация лигнина in situ происходит внеклеточ-
но. По-видимому, в основном разложение лиг-
нина осуществляют мицелиальные грибы —
возбудители белой гнили. К этим грибам
относится, например, базидиомицет Phanerochaete
chrysosporium. Он разрушает лигнин (бурый ком-
понент) в составе древесины с образованием по-
чти белой легкометаболизируемой массы, состоя-
щей из целлюлозы и гемицеллюлозы (рис. 9.10).
Вероятно, этот процесс необходим для подготовки
легкоусвояемого субстрата, поскольку сам по се-
бе лигнин не может обеспечивать рост. Большин-
ство представителей этой группы грибов сапро-
фиты, по некоторые (например, Armillaria mellea)
известны как фитопатогеппые. Другие грибы —
возбудители бурой гнили и мягкой гнили —
превращают древесину в красновато-коричневую
массу, разлагая главным образом целлюлозные
и гемицеллюлозные компоненты и почти не дей-
ствуя на фенил пропановые полимеры.
Бактерии не способны, вероятно, эффектив-
но разлагать лигнин, но могут переводить его
в водорастворимое состояние. Это свойство об-
наружено у представителей родов Streptomyces,
Thermomonospora, Actinomadura, Pseudomonas и
Xanthomonas, которые могут расти на природной
лигноцеллюлозе в качестве источника углерода.
Солюбилизация лигнина, видимо, облегчает его
удаление для использования целлюлозы и геми-
целлюлозы. Поскольку данных о том, каким об-
разом бактерии могли бы разлагать лигнин, не
имеется, мы рассмотрим хорошо изученный ме-
ханизм разложения лигнина грибами (рис. 9.10).
Ферменты □ В биодеградации лигнина
участвуют различные ферменты, косубстраты,
металлы и молекулярный кислород. Процесс про-
текает главным образом на кончиках гиф, где
254 Часть III. Многообразие метаболических путей
экзоферменты секретируются в среду путем эк-
зоцитоза. У возбудителей белой гнили в этом про-
цессе участвуют гемсодержащие лигнинперокси-
дазы, марганец-зависимые пероксидазы и медь-
содержащие лакказы — семейства ферментов,
осуществляющих кислород-зависимую деграда-
цию лигнина. Как правило, они представлены
множеством функционально сходных изофермен-
тов. Все они катализируют реакции окисления с
переносом одного электрона и образованием сво-
бодных радикалов, стимулирующих нефермента-
тивную деградацию лигнина.
Предположительно основным ферментом раз-
ложения лигнина служит лигнинпсроксидаза.
При одноэлектронпом окислении, катализиру-
емом лигнинпероксидазой, образуются проме-
жуточные продукты в виде ароматических
катион-радикалов, которые затем спонтанно
отщепляются от молекулы лигнина (рис. 9.10).
Например, расщепление ^-арильной эфирной свя-
зи арилглицерола (/3-0-4) происходит между
Со- и С/з-атомами в боковых цепях спиртовых
остатков. При этом образуются Са-бензальдегид,
фенол и гликолевый альдегид. Источником пе-
роксида водорода у грибов служат различные
субстраты. Некоторые грибы секретируют альде-
гиды, такие как глиоксалевый альдегид, и окис-
ляют его с помощью внеклеточной глиоксальок-
сидазы, другие используют иные альдегиды, на-
пример гликолевый альдегид — один из продуктов
деградации лигнина. В результате окисления аль-
дегидов кислород восстанавливается до Н2О2.
Отдельные грибы секретируют в среду различ-
ные ароматические альдегиды и арил-алкоголь-
оксидазы.
Ограничения предполагаемых механиз-
мов деградации лигнина □ Размеры моле-
кул экзоферментов, например лигнинпсроксида-
зы, слишком велики, чтобы они могли проникать
внутрь плотной структуры древесины. Поэтому
предполагается, что эти ферменты действуют на
поздних стадиях деградации лигнина, тогда как
начальную деполимеризацию обеспечивают низ-
комолекулярные соединения, способные генери-
ровать кислородные радикалы внутри раститель-
ной клеточной стенки и вызывать неспецифиче-
ское свободнорадикальное расщепление лигнина.
Примером такого процесса может служить из-
вестная реакция Фентона, в которой при хими-
ческоы взаимодействии Fe2+ и Н2О2 образуется
гидроксил-радикал (НО*):
Fe2+ + Н2О2 Fe3+ + НО* + ОН~ (9.1)
Гидроксил-радикал имеет исключительно высо-
кий окислительно-восстановительный потенциал,
обеспечивающий возможность его одноэлектрон-
ного восстановления с образованием воды:
НО* + Н+ + е" -* Н20; Е'о = +2180 мВ (9.2)
Поскольку гидроксил-радикал служит наиболее
сильным неспсцифическим окислителем в биоло-
гических системах, предполагается, что именно
он инициирует начальные стадии деградации лиг-
нина. Однако возможная роль реакции Фентона
ограничивается тем, что радикал НО’ в силу сво-
ей высокой подвижности, реакционноспособности
и неспецифичиости может разрушать любые био-
логические молекулы и должен поэтому образо-
вываться па расстоянии от грибных гиф. Меха-
низм этого процесса пока неизвестен.
Применение □ Микробное разложение цел-
люлозы может применяться для разрушения и
отбеливания древесных волокон с целью
их последующего промышленного (напри-
мер, для производства бумаги) или сельско-
хозяйственного (в качестве корма для жи-
вотных) использования, а также для перера-
ботки токсичных отходов и очистки сточных
вод.
9.7. Белки как субстраты для роста многих микроорганизмов
Составляя большую долю живой биомассы, т. е.
будучи распространенным субстратом, белки
служат важным источником питательных суб-
стратов для микроорганизмов. Белковые цепи по-
строены из более чем 20 различных L-аминокис-
лот, соединенных пептидной связью. Эту связь
способны расщеплять протеолитические фермен-
ты протеазы (гидролазы). Начальные стадии гид-
ролиза белка протекают с участием экзофер-
ментов, после чего продукты гидролиза — амино-
Глава 9. Окисление органических соединений 255
кислоты и олигопептиды — транспортируются в
клетку специальными транспортными системами.
Нерастворимые в воде структурные белки кера-
тин, элластин и коллаген высокоустойчивы к про-
теолизу. Еще более эта устойчивость повышается
в результате связывания белков с полифенолами
(например, в процессе дубления кожи). Отщепле-
ние полифенолов является лимитирующей стади-
ей гидролиза таких белков. Чувствительность к
протеолитическим ферментам повышается после
денатурации белка — развертывания белковой мо-
лекулы под действием высокой температуры,
сильных кислот или щелочей.
Ферменты □ Микроорганизмы синтезируют
множество различных протеаз. Их тип и коли-
чество зависят от вида микроорганизма и усло-
вий роста. Часто протеазы синтезируются в неак-
тивной форме, в виде проферментов, и активиру-
ются в результате посттрансляционной модифи-
кации, в процессе транспорта или аутокаталити-
ческой активации. В зависимости от положения
атакуемой пептидной связи протеазы делят на
эндопептидазы и экзопептидазы. Эндопептида-
зы расщепляют пептидные связи внутри поли-
пептидной молекулы, тогда как экзопептидазы
отщепляют аминокислотные остатки от С- или
N-конца полипентидной цепи (рис. 9.11). Проте-
азы относятся к наиболее хорошо изученным фер-
ментам; структура их молекул и механизм ка-
тализа детально известны. Измерение протеоли-
тической активности проводят с использованием
синтетических полипептидов, в состав которых
входят модифицированные аминокислоты, содер-
жащие хромофорные группы.
Классификация □ Протеазы обычно клас-
сифицируют в соответствии с природой актив-
ного центра (нс по разлагаемым субстратам),
подразделяя их на сериновые, цистеиновые, ас-
парагиновые и металлсодержащие. Протеазы, от-
носящиеся к различным классам, различаются по
чувствительности к определенным ингибиторам.
Сериновые протеазы (например, субтилизин
Bacillus subtilis и др.) чувствительны к диизо-
пропилфторфосфату и его фосфорорганическим
производным, которые ковалентно связываются
с гидроксильной группой серинового остатка в
составе активного центра. Протеазы, содержащие
в активном центре цистеин (например, трипси-
ноподобные ферменты, синтезируемые многими
бактериями), чувствительны к действию ионов
металлов, алкилирующих агентов и окислителей.
Рис. 9.11. Участки расщепления полипептиднои цепи
протеазами.
Атомы металлов могут удаляться из активного
центра, например термолизина, в результате свя-
зывания хелатирующими соединениями или при
диализе. /^-Карбоксильная группа аспарагиновой
кислоты, входящей в активный центр пепсинопо-
добных ферментов (относительно редко встреча-
ющихся у бактерий, по широко распространенных
у дрожжей и других грибов), может инактиви-
роваться некоторыми алкилирующими агентами.
Внутри этих четырех классов протеазы подразде-
ляются далее по специфичности к тем или иным
боковым цепям, т. е. к аминокислотным остаткам
в сайте расщепления.
Применение □ Микробные протеазы произ-
водят в больших количествах (для применения
в медицине и различных отраслях промышлен-
ности) с помощью промышленного культивиро-
вания шт аммов-продуцентов. Ценность микробов
как источников получения протеаз обусловлена
рядом факторов: 1) микроорганизмы способны
синтезировать широкий набор различных по свой-
ствам протеаз, варьирующих по активности в ши-
роком диапазоне температуры (от 4 до ПО °C)
и значений pH (от 0,1 М НС1 до 0,1 М NaOH), а
также устойчивых к действию мочевины в кон-
центрации до 8 М; 2) для выращивания микро-
организмов с целью получения протеаз примени-
мо в качестве субстрата дешевое сырье; 3) име-
ются высокопродуктивные штаммы продуцентов,
синтезирующих протеазы в количестве до 10 и
более г/л; 4) свойства продуцентов в отношении
синтезируемого фермента (в том числе его спе-
цифичность к той или иной боковой цепи, рН-
и температурный оптимумы, стабильность, чув-
ствительность к детергентам, мочевине, солям и
ингибиторам, каталитическая активность и др.)
могут быть значительно улучшены с помощью му-
тагенеза и отбора, а также с применением мето-
256 Часть III. Многообразие метаболических путей
дов генетической инженерии и 5) микробные про-
теазы широко применимы в пищевой промыш-
ленности, например для свертывания молока,
в производстве кожи, в химических технологиях,
в качестве добавки к стиральным порошкам, а
также при получении гормональных лекарствен-
ных препаратов. Кроме того, протеазы могут ис-
пользоваться для синтеза пептидов, т. е. катализа
обратной реакции в средах с низким содержанием
воды.
Клеточные функции протеаз и их ре-
гуляция □ Многие клеточные протеазы, лока-
лизованные в цитоплазме, плазматической или
наружной мембране либо в периплазме, выполня-
ют ключевую роль в регуляции клеточных про-
цессов (не в расщеплении питательных субстра-
тов). Ограниченное протеолитическое расщепле-
ние имеет важное значение в посттрапсляционном
процессинге белков, т. е. процессе их «созрева-
ния», в транспорте, а также в инактивации регу-
ляторных белков и при дифференцировке (напри-
мер, образовании спор; см. ATP-зависимые про-
теасомы; гл. 10). Эти клеточные функции долж-
ны осуществляться под строгим контролем, меха-
низм которого в большинстве случаев неизвестен.
Протеазы представляют собой также важ-
ные факторы вирулентности бактерий, многие
из которых питаются белками организма-хозяина.
Примерами таких ферментов могут служить суб-
тилизин, стрептокиназа, гемолизины и эластаза,
имеющие свои мишени действия и расщепляющие
структурные белки клеток (см. гл. 33).
Организмы □ Протеолитической активно-
стью обладают бактерии большинства таксоно-
мических групп, как аэробных, так и анаэроб-
ных. Многие протеолитические бактерии способ-
ны гидролизовать желатин, что используется для
определения протеолитической активности как
таксономического признака. Способность к гид-
ролизу желатина определяют по наличию зон
просветления вокруг колоний па плотной среде с
тушью, в состав которой входит желатин.
9.8. Рибонуклеиновые и дезоксирибонуклеиновые кислоты —
распространенные биополимеры,
легко разлагаемые внеклеточными гидролазами
Разложение нуклеиновых кислот катализируют
внеклеточные катаболические фосфодиэстеразы,
относительно неспецифичные к последователь-
ности оснований. В результате расщепления
образуются мононуклеотиды и разнообразные
низкомолекулярные олигонуклеотиды, способные
проникать в клетки. Обычно нуклеотиды дефос-
форилируются периплазматическими фосфатаза-
ми, при этом нуклеозиды и фосфат поглощают-
ся клетками независимо. Компоненты нуклеино-
вых кислот — рибозу, дезоксирибозу, нуклеотиды,
нуклеозиды и азотистые основания — способны
использовать многие микроорганизмы. Внутри-
клеточные нуклеазы, в большей степени сайт-
специфичные, выполняют важные функции в раз-
личных клеточных процессах; в данном разделе
эти ферменты не рассматриваются. Рибонукле-
азы (РНКазы) и дезоксирибонуклеазы (ДНКа-
зы) в соответствии с их свойствами подразделяют
па несколько основных типов: 1) расщепляющие
ДНК, РНК и ДНК-РНК-гибриды; 2) расщепля-
ющие одноцепочечные или двухцепочечные суб-
страты; 3) экзонуклеазы, отщепляющие нуклео-
тиды от 3'- или 5'-конца цепи; 4) эндонуклеазы,
расщепляющие фосфодпэфирную связь во внут-
ренних областях молекул ДНК или РНК; 5) нук-
леазы, распознающие определенную последова-
тельность нуклеотидов и 6) неспецифические нук-
леазы. Подобно протеазам, нуклеазы выполняют
важные функции в метаболизме микробов, что
требует сложной системы их регуляции и защи-
ты клеточных нуклеиновых кислот.
Применение □ Нсспецифические внеклеточ-
ные нуклеазы используются в небольших мас-
штабах для процессинга нуклеиновых кислот или
нуклеотидов. Высокоспецифичные к последова-
тельности внутриклеточные нуклеазы — рестрик-
тазы — широко применяются в молекулярно-
генетических исследованиях и технологии реком-
бинантной ДНК.
Глава 9. Окисление органических соединений 257
9.9. Липиды входят в состав мембран у всех организмов
Липиды не относятся к полимерам в строгом
смысле слова, но разложение этих труднораство-
римых соединений основано на ряде принципов
разложения полимеров. У всех организмов липи-
ды служат основными структурными компонен-
тами клеточных мембран и, кроме того, у многих
эукариот жиры и масла отлагаются как запас-
ные вещества, жидкие или твердые при различ-
ных температурах. Основным компонентом этих
жиров и масел (> 95%) являются триацил глице-
ролы (триглицериды), и в небольшом количестве
(< 5%) они содержат фосфолипиды или гликоли-
пиды, стероиды и каротиноиды. В отличие от них
липиды мембран нс являются триацилглицерола-
ми. Каротиноиды и стероиды относятся к неомы-
ляемым липидам. Омыление других компонентов
липидов (щелочной гидролиз) происходит с вы-
свобождением жирных кислот, глицерола и по-
лярных групп (головок). Жирные кислоты окис-
ляются и/или ассимилируются через образование
ацетил-СоА либо непосредственно после модифи-
кации (элонгация, десатурация; см. разд. 9.14.1).
Ассимиляция глицерола описана в гл. 7. Мно-
гие микроорганизмы образуют поверхностно-
активные вещества, главным образом гликоли-
пиды, эмульгирующие липиды в среде.
Липазы □ Липазами или ацилгидролазами
называют ферменты, катализирующие разложе-
ние триглицеридов до ди- и моноглицеридов, гли-
церола и жирных кислот. Обычно они с равной
эффективностью гидролизуют три-, ди- и моно-
глицериды. В системах с низкой активностью во-
ды липазы катализируют обратную реакцию —
этерификацию глицерола жирными кислотами —
и другие реакции (рис. 9.12, А). Субстратами для
липаз могут служить также некоторые липопро-
теины (например, яичного желтка). Ряд липаз
обладает фосфолипазной активностью. По лока-
лизации липазы делятся на внеклеточные, пери-
плазматические и связанные с клеточной поверх-
ностью. Они воздействуют как на водораствори-
мые, так и на водонерастворимые субстраты, но
для их активности требуется наличие фазы раз-
дела липид-вода (вокруг капель или обращен-
ных мицелл; углеводородные хвосты липидов в
таких мицеллах укрыты от контакта с водой и
образуют гидрофобную фазу, а гидрофильные го-
ловки располагаются на внешней поверхности).
Рис. 9.12. Реакции, катализируемые липазами (А), и ме-
ханизмы гидролиза (Б). Rl, R2 — алкильные цепи.
Поэтому условием разложения липидов явля-
ется их эмульгирование — перевод в состояние
мелкодисперсных мицелл. Необходимость в
эмульгировании липидов (путем применения син-
тетических поверхностно-активных веществ) за-
трудняет процедуру измерения липазной ак-
тивности in vitro, например с использованием
окрашенных или флуоресцирующих субстратов.
Другим способом определения липазной активно-
сти служит титрование высвобождаемых жирных
кислот.
Липазы различаются по субстратной специ-
фичности. 1. Наиболее распространенные, неспе-
цифическис липазы осуществляют обратимый
гидролиз триацил глицеролов, преимущественно
содержащих длинноцепочечные жирные кислоты.
В спиртовых растворах (< 1% воды), они про-
являют эстеразную активность. 2. Некоторые ли-
пазы специфичны в отношении жирных кислот
в составе липидов. 3. Существуют липазы, спе-
цифично отщепляющие жирные кислоты в по-
258 Часть III. Многообразие метаболических путей
зициях у первого и третьего атомов углерода в
остатке глицерола (рис. 9.12, Б). Липазная актив-
ность, в отличие от эстеразной, требует связыва-
ния фермента на поверхности раздела фаз липид-
вода. В полипептидной цепи липазы содержится
липофильный о-спиральный домен-петля, выпол-
няющий роль «крышки» для активного центра.
Этот домен открывает активный центр фермента
(сериновой гидролазы) только при связыва-
нии фермента с поверхностью раздела вода-
липид (феномен, называемый интерфазной
активацией). Данным свойством объясняются
необычные кинетические характеристики липаз.
Субстрат-связывающие домены у различных ли-
паз высокогомологичны но аминокислотным по-
следовательностям, тогда как остальные части их
молекул имеют лишь незначительное сходство.
Регуляция □ Некоторые микроорганизмы
синтезируют липазы конститутивно, у других их
синтез тонко регулируется. На синтез и секрецию
липаз могут оказывать влияние, например, нали-
чие в среде железа, альтернативных источников
углерода или неметаболизируемых полисахари-
дов. Выход экзолипаз стимулируют некоторые
соединения нелипидной природы (не относящи-
еся к питательным субстратам), возможно спо-
собствуя (в результате конкуренции) отделению
липаз от клеточной поверхности.
Фосфолипазы □ Этой активностью обла-
дают в большинстве случаев внутриклеточные,
у многих бактерий мембраносвязанные фермен-
ты, гидролизующие фосфолипиды по различным
участкам их молекул (рис. 9.13). Продукты фос-
фолипазной активности — лизофосфолипиды —
представляют собой поверхностно-активные ве-
щества, эффективно лизирующие биологические
мембраны, и соответственно синтез и активность
фосфолипаз находятся под строгим контролем.
Фосфолипазы относятся к важным факторам
вирулентности патогенных бактерий (некото-
рые бактериальные токсины представляют собой
фосфолипазы) и обеспечивают колонизацию и
персистенцию патогенных бактерий на коже и
клеточных поверхностях в организме-хозяине.
Разрушение фосфолипидов ферментами возбу-
дителя инфекции вызывает патологический эф-
фект в том числе и в результате высвобождения в
качестве продуктов реакции лизофосфатидовых
кислот (в частности, 1-ацилглицсрол-3-фосфата),
которые у эукариот выполняют роль высокоак-
тивных внутриклеточных сигнальных молекул.
Рис. 9.13. Сайты расщепления фосфолипида фосфоли-
пазами Ai, Az. С и D. Относительно фосфолипаз С и D
пока не установлено, расщепляют они С—О- или Р—0-
связь.
Четыре типа фосфолипаз, атакующих суб-
страт в различных сайтах, показаны па рис. 9.13.
Единственный экзофермент в группе липаз, фос-
фолипаза С, гидролизует связь между остат-
ком фосфорной кислоты и глицеролом; продукт
этой реакции диацилглицерол диффундирует че-
рез мембрану. Фосфолипазы В не имеется. От-
щепление оставшихся ацильных групп осуществ-
ляют лизофосфолипазы L1 (у Cl-атома) и L2
(у С2-атома). Фосфолипазы А1 и А2 также от-
щепляют ацильные группы. Фосфолипаза D ката-
лизирует отщепление и обмен полярных головок.
Все эти ферменты высокоактивны в органических
растворителях.
Применение □ В промышленных техноло-
гиях используются различные реакции, катализи-
руемые липазами: гидролиз жиров и масел, эте-
рификация, этграис-этерификация и ацилирование
различных ОН-содсржащих акцепторных соеди-
нений, таких как сахароспирты, глицерол и мо-
носахариды, а также образование лактонов. Ли-
пазы применяют в пищевой промышленности, в
производстве мыла, детергентов, поверхностно-
активных веществ (моноацилглицерола, моно-
ацилэфиров сахаров), косметических препаратов,
пластмасс и красок. Представляют практиче-
ский интерес некоторые алкалифильпые и тер-
мостабильные липазы, а также липазы с необыч-
ными каталитическими свойствами. Существуют
исключительно термоустойчивые липазы, способ-
ные вызывать порчу стерилизованных пищевых
продуктов.
Организмы □ Липазами обладают бактерии
большинства родов; наиболее изучены в от-
ношении их образования представители родов
Staphylococcus, Pseudomonas, Bacillus, Strepto-
myces, Aeromonas, Xenorhabdus, Moraxella, Propio-
nibacterium, Chromobacterium и Serratia.
Глава 9. Окисление органических соединений 259
9.10. Для ассимиляции продуктов разложения биополимеров
используются различные варианты основных метаболических путей
В предыдущих разделах рассмотрены пути высво-
бождения микробами мономерных и олигомерных
строительных блоков из биополимеров. Эти стро-
ительные блоки далее окисляются главным об-
разом до пирувата, ацетил-CoA или интермеди-
атов цикла трикарбоновых кислот. Прежде чем
перейти к рассмотрению огромного разнообразия
катаболических путей, необходимо коснуться
некоторых специальных аспектов центрального
метаболизма, которые не были рассмотрены в
предыдущих главах. Эти аспекты относятся к фа-
культативным или строгим анаэробам, использу-
ющим для окисления органических субстратов до
СО2 неорганические акцепторы электронов, такие
как сульфат или нитрат. Для этих организмов ха-
рактерен ряд особенностей центральных метабо-
лических путей.
Окисление пирувата и ацетил-СоА □
Пируват не всегда окисляется обычным способом.
Известно пять разлагающих его ферментов (см.
разд. 12.2.2). У аэробных микроорганизмов про-
исходит окислительное декарбоксилирование пи-
рувата, катализируемое пируватдегидрогепазпым
комплексом. У факультативных анаэробов и стро-
гих анаэробов его разложение происходит с уча-
стием иных ферментов; при этом возможно окис-
ление органических веществ полностью, до СО2.
Различия имеются также в путях конечного окис-
ления ацетил-СоА. У аэробов он окисляется в
цикле трикарбоновых кислот, тогда как некото-
рые строгие анаэробы окисляют ацетат в реак-
циях модифицированного цикла трикарбоновых
кислот либо окислительного ацетил-Со А/СО-де-
гидрогеназного пути (см. гл. 12).
Глюконеогенез и катаболизм углево-
дов □ Образование гексозофосфатов из СЗ-сое-
динений — глюконеогенез — у всех прокариот осу-
ществляется, насколько известно, одним и тем
же способом — путем обращения реакций гли-
колиза. Соответствующие ферменты окисления
глюкозы в норме синтезируются конститутивно.
Белки и ферменты, необходимые для транспор-
та и окисления других углеводов и гликози-
дов, являются индуцибельными, и их синтез под-
вержен регуляции по механизму катаболитной
репрессии. В отличие от единообразных биосин-
тетических путей, процессы катаболизма углево-
дов могут протекать различными путями, в за-
висимости от вида микроорганизма и типа суб-
страта.
9.11. Окисление углеводов — наиболее распространенных питательных
субстратов — происходит несколькими путями
В этом разделе рассмотрены пути расщепле-
ния олигосахаридов и превращения мономер-
ных сахаров в интермедиаты катаболических пу-
тей. Структурные формулы основных углеводных
строительных блоков и их производных представ-
лены на рис. 9.14.
9.11.1. Реакции периферического метаболизма
обеспечивают поступление гексоз и
пентоз в центральные пути катаболизма
Для того чтобы разнообразные низкомолекуляр-
ные углеводы могли включиться в централь-
ные катаболические пути, они должны быть пре-
образованы в реакциях взаимопревращений в
типовые субстраты таких путей; эта часть
метаболизма названа периферической. Синтез
ферментов периферического метаболизма гексоз
индуцируется соответствующими субстратами, в
отличие от ферментов центрального метаболизма,
которые, как правило, являются конститутивны-
ми. Периферический метаболизм сахаров вклю-
чает реакции фосфорилирования, фосфороли-
за гликозидов, кето-ещэл-изомеризации, окисле-
ния/восстановления и альдольного расщепления.
Дополнительные реакции обеспечивают удаление
заместителей, таких как группы NH2, — ОСН3 и
—ООС—СН3. Регуляция поглощения и метаболиз-
ма гексоз описана в гл. 18 и 20.
260 Часть III. Многообразие метаболических путей
Рис. 9.14. Строение гексоз, пентоз (альдоз и кетоз), глю-
козидов, аминосахаров, гексуроновых кислот, гексурони-
дов, гексуронатов и полиспиртов.
Превращение олигосахаридов и дисаха-
ридов в моносахариды □ Перечень наиболее
распространенных трисахаридов и дисахаридов
приведен в табл. 9.1. Многие бактерии способны
поглощать распространенные дисахариды, такие
как сахароза, целлобиоза или мальтоза, с уча-
стием пермеаз (рис. 9.15). Фосфоролитическое
расщепление гликозидной связи в молеку-
лах дисахаридов (в частности, мальтозы) специ-
фичными фосфорилазами приводит к образова-
нию глюкозо-1-фосфата и второго сахара. Кро-
ме того, глюкоза может высвобождаться из маль-
тодекстринов амиломальтазой, катализирующей
следующую обратимую реакцию:
(Глюкоза) п + (Глюкоза) m <->
<-> (Глюкоза)п+п1_! + Глюкоза (9.3)
Дисахарид
n"'U
> Дисахарид
(Сахар 1)-1-Р + Сахар 2
| Пермеаза]
Н2О
Сахар 1 + Сахар 2
А
Дисахарид
Гликозид
Пируват
(5-Глико-
зид-6-Р
Пируват
Дисаха-
рид-6-Р
Н,О
Н,0
> (Сахар D-6-P
+ Сахар 2
-► Глюкозо-6-Р
+ Спирт
Б
Рис. 9.15. Поглощение и внутриклеточная деградация
дисахаридов (сахар 1 — сахар 2) и гликозидов. ФТС—
фосфотрансферазная транспортная система; ФЕП —
фосфоенолпируват. С участием ФТС в клетку транспор-
тируются такие дисахариды, как, например, трегалоза,
лактоза и сахароза; из глюкозидов хорошо изучен пере-
нос арбутина (гликозида глюкозы и гидрохинона).
Другие сахара, такие как лактоза (/^-галактозид)
и мелибиоза (а-галактозид), гидролизуются
специфическими галактозидазами с образова-
нием свободных сахаров. В отличие от этого
D-глюкозиды, например трегалоза (а-гликозид),
проникают в клетку с помощью фосфотранс-
феразной транспортной системы (ФТС), фосфо-
рилирующей молекулу дисахарида в процессе
транспорта по Сб-атому остатка глюкозы. Обра-
зующийся дисахарид-6-фосфат гидролизуется в
клетке с образованием глюкозо-6-фосфата и
второй молекулы сахара. Аналогичным образом
осуществляется транспорт /3-гликозидов в виде
6-фосфогликозидов. Внутри клеток происходит
их гидролиз с образованием глюкозо-6-фосфата и
спирта.
Превращение сахаров в интермедиа-
ты путей катаболизма □ Субстратами мно-
гих путей катаболизма углеводов служат фосфо-
рилированные сахара. Глюкоза превращается в
глюкозо-6-фосфат в процессе переноса в клетку с
участием фосфотрансферазной транспортной си-
стемы (гл. 5 и 20). Тем же путем образуются и
другие гексозо-6-фосфаты. Глюкозо-1-фосфат вы-
свобождается при разложении запасного полиса-
харида гликогена фосфорилазой, изомеризуется
в 6-фосфат и вступает в метаболизм. Включение
в метаболизм других гексоз, альдоз, кетоз, ами-
ногексоз и иных продуктов разложения дисаха-
ридов требует участия дополнительных, индуци-
Глава 9. Окисление органических соединений 261
Таблица 9.1. Некоторые наиболее распространенные дисахариды и трисахариды
Сахар 1 (пираноза) Гликозидная связь Сахар 2 (пираноза, если не указано иначе)
Ди сахариды Целлобиоза D-глюкоза fi 1-4 D-глюкоза
Мальтоза D-глюкоза о 1-4 D-глюкоза
Изомальтоза D-глюкоза а 1-6 D-глюкоза
Трегалоза D-глюкоза а 1-1 а D-глюкоза
Сахароза D-глюкоза а 1-2 fi D-фруктоза (фураноза)
Лактоза D-галактоза fi 1-4 D-глюкоза
Мелибиоза D-галактоза а 1-6 D-глюкоза
Гентибиоза D-глюкоза fi 1-6 D-глюкоза
Хитобиоза D-глюкозамин fi 1-4 D-глюкозамин
Хондрозин D-глюкозамин fi 1-3 D-галактоза
Гиалобиуроновая кислота D-глюкуроновая кислота fi 1-3 D-глюкозамин
Ксилобиоза D-ксилоза fi 1-4 D-ксилоза
Трисахариды Рафиноза D-галактоза а 1-6 Сахароза
больных ферментов. Свободная D-глюкоза, об-
разующаяся при разложении многих дисахаридов
гликозидазами, например лактозы под действи-
ем /5-галактозидазы или мелибиозы под действи-
ем a-галактозидазы (табл. 9.1), превращается в
глюкозо-6-фосфат в глюкокиназной реакции:
Глюкоза + АТР —>
—> Глюкозо-6-фосфат + ADP (9.4)
Для превращения галактозы (образующейся, на-
пример, из лактозы под действием /3-галакто-
зидазы или в процессе поглощения клеткой с
участием пермеазы) в глюкозо-1-фосфат требу-
ется три дополнительных фермента (рис. 9.16).
D фруктоза, D-манноза и L-сорбоза при по-
глощении клетками с участием ФТС превра-
щаются соответственно во фруктозе-1-фосфат,
мапнозо-6-фосфат и глюцитол-6-фосфат. Реакции
их последующего превращения во D-фруктозо-
1,6-бисфосфат представлены на рис. 9.17.
Аминосахара, такие как М-ацетил-О-глюко-
замин и D-глюкозамин, образуются как основные
продукты разложения хитина, хитозана и струк-
турных компонентов бактериальных клеточных
стенок. В процессе транспорта с участием ФТС
они фосфорилируются по Сб-атому и далее деа-
цетилируются или дезаминируются, превращаясь
во фруктозо-6-фосфат. D-глюкозамин-б-фосфат
синтезируется из фруктозо-6-фосфата при уча-
стии глутамина как донора аминогруппы (см.
гл. 7).
Рис. 9.16. Пути катаболизма D-галактозы и D-галак-
тозидов. 1 — о- и /3-галактозидазы; 2 — киназа; 3 —
UDP-трансфераза; 4 — эпимераза. При использовании в
качестве субстратов /3-галактозы и /3-галактозидов пре-
вращение /3-галактозы в а-галактозу катализирует ро-
тамутаза.
Превращение пентоз в интермедиаты
путей катаболизма □ Пентозы, такие как
D-ксилоза, D-рибоза и L-арабиноза, входящие в
состав гемицеллюлоз (см. разд. 9.5.3) и нуклеино-
вых кислот (см. разд. 9.8), относятся к наиболее
распространенным субстратам. Они поглощают-
ся клетками путем активного транспорта с уча-
стием пермеаз. Пентитолы вначале окисляются
до соответствующих кетопентоз. Пентозы и кето-
262 Часть III. Многообразие метаболических путей
L-сорбоза D-манноза D-фруктоза
сн2—о —р сно СНг_0_р
С=О " с=О
(дезокси)
Рибонуклеозид
(дезокси)Рибозо-1-Р
CHO
I
СН2
н—с—о|н
н-с-он
I
сн2—о —Р
Ацетальдегид
+
Глицераль-
дегид-З-Р
(дезокси)Рибозо- 5 -Р
(дезокси)Рибозо-5-Р
СН2 — О — Р ~
СН2ОН СН2ОН
Г-сорбоза-1-Р D-манноза-б-Р D-фруктоза- 1-Р
СН2—О —Р
D-сорбитол-б-Р
Рис. 9.17. Пути катаболизма D-фруктозы, D-маннозы
и L-сорбозы. 1 — киназа; 2 — изомераза; 3 — редуктаза;
4 — дегидрогеназа.
пентозы превращаются в В-ксилулозо-5-фосфат.
Дальнейший метаболизм пентозофосфатов может
происходить несколькими путями. Обычно D-кси-
лулозо-5-фосфат и рибозо-5-фосфат под действи-
ем ферментов пентозофосфатного цикла тран-
сальдолазы и транскетолазы превращаются во
фруктозо-6-фосфат и глицеральдегид-3-фосфат,
которые далее окисляются по пути гликолиза
(путь Эмбдена-Мейергофа-Парнаса). Однако из-
вестны и другие варианты их метаболизма.
Метилпентозы, такие как L-рамноза и L-фу-
коза, образуются из гексоз при восстановлении
группы —СН2ОН при Сб-атоме до —СНз-группы.
Они поглощаются клетками с помощью перенос-
чиков и затем фосфорилируются по С 1-атому с
образованием 1-фосфокетулозы,которая расщеп-
ляется специфичными альдолазами с образовани-
ем дигидроксиацетонфосфата и L-лактальдегида.
Лактальдегид окисляется через L-лактат до пи-
рувата.
Пентозы, входящие в состав нуклеозидов
и дезоксинуклеозидов, высвобождаются сле-
дующим образом. Нуклеозиды и дезоксинук-
леозиды образуются из продуктов расщепления
нуклеиновых кислот — нуклеотидов и дезокси-
нуклеотидов — в результате их дефосфорилирова-
Рис. 9.18. Пути катаболизма пентоз и (дезокси)нукпео
зидов. 1 — фосфорилазы; 2 — мутаза; 3 — дезоксирмбо-
альдолаза.
пия внеклеточными ферментами. Затем (дезок-
си) нуклеозиды транспортируются в клетку, где
азотистые основания в составе некоторых из
них [(дезокси)цитидина и (дезокси)аденозина]
дезаминируются специфичными нуклеозиддез-
аминазами [с образованием (дезокси)уридина
и (дезокси)инозина]. (Дезокси)рибозо-1-фосфат
высвобождается из (дезокси)нуклеозидов, как по-
казано на рис. 9.18. N-гликозидная связь рас-
щепляется при этом фосфорилазой (обрати-
мая реакция). В последующей мутазной реак-
ции (дезокси)рибозо- 1-фосфат превращается в
(дезокси)рибозо-б-фосфат. Этот продукт расщеп-
ляет альдолаза класса I с образованием глицер-
альдегид-3-фосфата и ацетальдегида (рис. 9.18).
Рибозо-5-фосфат метаболизируется далее, напри-
мер в пентозофосфатном цикле.
Превращение других углеводов в суб-
страты путей катаболизма □ Гексурониды
например, гликозиды глюкуроновой кислоты),
гексуронаты (например, глюкуроновая кисло-
та) и гексонаты (например, глюконовая кисло-
та) транспортируются в клетки специфическими
пермеазами и в несколько этапов превращаются в
2-кето-З-дезокси-б-фосфоглюконат, который оки-
сляется по пути Энтнера-Дудорова. Сахаро-
спирты, такие как сорбитол, маннитол и дуль-
цитол) в процессе транспорта с участием ФТС
фосфорилируются по Сб-атому. Фосфаты саха-
роспиртов окисляются до фруктозо-6-фосфата
или тагатозо-6-фосфата (производное дульци-
тола). Дополнительное фосфорилирование по
С 1-атому приводит к образованию кетозо-1,6-бис-
фосфатов, которые расщепляются фруктозобис-
фосфатальдолазой и тагатозобисфосфатальдола-
зой с образованием триозофосфатов. Пятиатом-
ные спирты D-арабинитол, рибитол и ксилитол
Глава 9. Окисление органических соединений 263
2 Пируват
Гликолиз
Путь Энтнера-Дудорова
Фосфокетолазный путь
Окислительный
пентозофосфатный цикл
2 Пируват
2 АТР
2 NADH
Фруктозе-1,6-
бисфосфат-альдолаза
2 Пируват
1 АТР
1 NADH
1 NADPH
КДФГ-альдолаза
Ацетилфосфат,
пируват, СО2
1 АТР
2 NADPH
1 NADH
Фосфокетолаза
3 СО2, пируват
1 АТР
6 NADPH
1 NADH
(J®
Т рансальдолаза,
транскетолаза
Рис. 9.19. Наиболее распространенные пути разложения глюкозы. Представлены основные этапы, промежуточные
и конечные продукты, а также ключевые ферменты, катализирующие расщепление С—С связей. 1 — фруктозо-1,б-
бисфосфат-альдолаза; 2 — КДФГ-альдолаза; 3 — фосфокетолаза; 4 —трансальдолаза; 5 — транскетолаза. КДФГ —
2-кето-З-дезокси-б-фосфоглюконат; ФТС — фосфотрансферазная транспортная система.
окисляются NAD-зависимыми дегидрогеназами с
образованием соответствующих пентулоз, кото-
рые для включения в последующие реакции фос-
форилируются ATP-зависимыми киназами.
Такими способами поглощаемые клетками уг-
леводы превращаются в интермедиаты основных
путей катаболизма и окисляются далее по этим
путям. Наиболее распространенные процессы де-
градации сахаров показаны на рис. 9.19. У микро-
организмов известны, кроме того, различные ва-
рианты этих основных путей катаболизма, причем
у архей обнаружены только модификации данных
пуюй. Сведения о катаболизме сахаров приведе-
ны также в гл. 5 (транспорт сахаров), гл. 18-20
(регуляция окисления сахаров), гл. 3 (гликолиз)
и гл. 12 (путь Энтнера-Дудорова).
9.11.2. Существуют различные варианты
основного пути деградации
гексозофосфатов — гликолиза
Как правило, гексозы окисляются по гликолити-
ческому пути (пути Эмбдена—Мейергофа—
Парнаса) с образованием двух молекул пирувата
и двух молекул NADH (см. гл. 3 и рис. 3.5). Имеет-
ся, однако, несколько важных модификаций этого
основного пути. Некоторые бактерии содержат
особые фосфофруктокиназы, которые в каче-
стве донора фосфорильной группы используют
нс АТР а пирофосфат. У анаэробных восстанав-
ливающих серу архей, например Pyrococcus spp.
(Thermococcales), донором фосфорильных групп
в реакциях, катализируемых гексокиназой и фос-
264 Часть III. Многообразие метаболических путей
Рис. 9.20. Модификация гликолитического пути у ана-
эробных архей на примере Pyrococcus furiosus. Фд —
ферредоксин; W — вольфрам.
фофруктокиназой, служит ADP, а не АТР, как
у бактерий (рис. 9.20). Акцептором электро-
нов в окислительно-восстановительных реакци-
ях у этих организмов служит не NAD, как
у бактерий, а ферредоксин. Глицеральдегид-
3-фосфат окисляется у них вольфрамсодер-
жащей ферредоксин-зависимой глицеральдегид-
3-фосфат-оксидоредуктазой, пируват окисляет
пируват:ферредоксин-оксидоредуктаза с образо-
ванием ацетил-СоА. Энергию эти анаэробные бак-
терии получают главным образом путем осу-
ществления следующей реакции:
Ацетил-СоА + ADP + Р> —»
—> Ацетат + Со ASH + АТР (9.5)
У многих бактерий, в частности Е. coli, имеются
ферменты не только гликолиза, но и других путей
катаболизма сахаров (рис. 9.21).
Рис. 9.21. Взаимосвязь гликолитического пути, пенто-
зофосфатного пути и пути Энтнера-Дудорова в метабо-
лизме углеводов у бактерий. Реакции показаны схема-
тически; участвующие в них кофакторы и косубстраты
(ADP, Р;, NAD и др.) не указаны. Приведены обозначе-
ния участвующих или (в скобках) предполагаемых ген-
ных продуктов, используемые для ферментов Е. coli.
9.11.3. Путь Энтнера-Дудорова и
его модификации
как механизм разложения сахаров
У многих бактерий гликолитический путь не
функционирует, хотя осуществляется обратный
путь — глюконеогенез, в котором ферменты гли-
колиза действуют в обратном направлении (за
исключением нс участвующей в глюконеогенезе
фосфофруктокиназы). У таких бактерий ката-
Глава 9. Окисление органических соединений 265
болизм углеводов происходит по пути Энтнера-
Дудорова (рис. 9.21). Известны примеры разло-
жения разных сахаров с помощью разных меха-
низмов, например у Halococcus глюкоза метабо-
лизируется по пути Энтнера-Дудорова, тогда как
фруктоза — по гликолитическому пути.
Общая схема пути Энтнера-Дудорова □
Глюкозо-6-фосфат окисляется через 6-фосфоглю-
копат с образованием пирувата и глицеральдегид-
3-фосфата; при этом происходит восстановление
одной молекулы NADP. В процессе дальнейше-
го окисления глицеральдегид-3-фосфата до пиру-
вата происходит восстановление одной молекулы
NAD и образование двух молекул АТР путем суб-
стратного фосфорилирования. Однако результи-
рующий выход АТР составляет 1 моль, так как
на транспорт глюкозы затрачивается содержащий
высокоэнергетическую связь фосфо енол пируват.
Таким образом, путь Энтнера-Дудорова отлича-
ется от гликолиза тем, что в нем образуется од-
на молекула NADPH и в качестве энергетиче-
ского выхода лишь одна молекула АТР на мо-
лекулу глюкозы. Возможно, по причине более
низкого выхода АТР этот путь не функциони-
рует у бактерий-бродильщиков с низким эконо-
мическим коэффициентом использования саха-
ров. Путь Энтнера-Дудорова содержит только
две реакции, дополнительные к реакциям глико-
лиза и пентозофосфатного пути. Как и в этом
последнем пути, глюкоза окисляется до 6-фосфо-
глюконата, но далее в пути Эптпера-Дудорова
действует 6-фосфоглюконатдегидратаза, пре-
вращающая 6-фосфоглюконат в 2-кето-З-дезокси-
6-фосфо глюконат (КДФГ). Второй характер-
ный только для этого пути фермент — это
КДФГ-альдолаза, катализирующая альдоль-
ное расщепление КДФГ с образованием пирувата
и глицеральдегид-3-фосфата.
У различных бактерий путь Энтнера-Дудоро-
ва может иметь разное значение — либо он вы-
полняет роль основного пути катаболизма углево-
дов, что главным образом характерно для некото-
рых грамотрицательных бактерий, либо, у многих
других бактерий, в том числе Е. coli, роль инду-
цибельного механизма, дополнительного к глико-
лизу и пентозофосфатному пути, ферменты ко-
торых синтезируются конститутивно (рис. 9.21).
Синтез фэрмептоз пути Энтнера-Дудорова инду-
цируется для использования глюконата, превра-
щаемого глюкокиназой в 6-фосфоглюконат, а так-
же гексуроновых кислот (см. ниже).
Окисление глюкозы через глюконовую
кислоту и окисление гексонатов □ Роль пу-
ти Энтнера-Дудорова у бактерий, осуществля-
ющих гликолиз, может быть спорной, однако в
присутствии экзогенного пирролохинолинхинона
(ПХХ; рис. 9.42, Б), кофактора глюкозооксидазы,
некоторые бактерии способны окислять глюкозу
до глюконовой кислоты с помощью этого фер-
мента. Далее глюконат фосфорилируется с об-
разованием 6-фосфоглюконата, который исполь-
зуется затем по пути Энтнера-Дудорова. В дру-
гих случаях происходит окисление глюконата
глюконатдегидрогеназой до 2-кетоглюконата,
который затем фосфорилируется и вновь восста-
навливается до 6-фосфоглюкопата. Обе эти де-
гидрогеназы, локализованные в периплазме, пе-
редают электроны непосредственно в дыхатель-
ную цепь. Сахарные кислоты транспортируются
внутрь клетки. Другие сахара, например фрукто-
зу, эти бактерии метаболизируют непосредствен-
но по пути Энтнера-Дудорова. Данный путь пре-
вращения глюкозы в 6-фосфоглюконат использу-
ется, по-видимому, у бактерий, приспособленных
к транспорту и деградации глюконовой и 6-кето-
глюконовой кислот; для этих бактерий глюкоза —
менее обычный природный субстрат.
Гексуроновые кислоты (гексозы, окислен-
ные по Сб-атому) в три этапа превращают-
ся в 2-кето-З-дезокси-глюконат, который затем
фосфорилируется. Гликозиды уроновых кислот
(гексурониды) включаются в метаболизм после
гидролиза.
Модификации пути Энтнера—Дудо-
рова □ Обнаружены две модификации это-
го пути. 1. У галофильных архей и некото-
рых бактерий происходят окисление глюкозы
до глюконата, дегидратация этого последне-
го с образованием 2-кето-З-дезоксиглюконата и
лишь затем фосфорилирование с образованием
2-кето-3-дезокси-6-фосфоглюконата, расщепля-
емого далее альдолазой па пируват и глицер-
альдегид-3-фосфат (рис. 9.22). 2. У архей ро-
дов Thermoplasma и Sulfolobus функциониру-
ет путь Эптпера-Дудорова, в котором все ин-
термедиаты находятся в не фосфорилированной
форме (нефосфорилирующий вариант пу-
ти Энтнера-Дудорова) (рис. 9.22). В этом ва-
рианте альдольному расщеплению подвергается
2-кето-З-дезоксиглюконат, из которого образуют-
ся пируват и глицеральдегид; последний окисля-
ется до глицерата, который фосфорилируется с
266 Часть III. Многообразие метаболических путей
Рис. 9.22. Варианты пути Энтнера-Дудорова у аэробных
архей.
образованием 2-фосфоглицсрата. Этот продукт
превращается через этап фосфо енолпирувата в
пируват. АТР, синтезированный путем субстрат-
ного фосфорилирования в пируваткипазпой ре-
акции, затрачивается па активацию глицерата.
Таким образом, результирующий выход АТР от-
сутствует. Действующие в этом пути дегидрогена-
зы относятся к №АО(Р)-зависимым.
9.11.4. В окислительном пентозофосфатном
цикле происходит полное окисление
сахаров
У многих бактерий пентозофосфатный путь
обычно действует как нециклический — для обра-
зования пентоз и NADPH посредством окисле-
ния Cl-атома гексоз до СОг (окислительная часть
цикла). Полный путь включает далее взаимопре-
вращения различных фосфосахаров, необходимые
для разложения пентоз через их преобразование
в гексозы. Эти реакции называют неокислитель-
пой ветвью пентозофосфатного цикла. Она ис-
пользутся также в метаболизме глюконата.
Т ранскетолаза
Н
I
н — С — ОН
I '
с=о
—
но-с-н
-1 I
н — С —он
Рис. 9.23. Окислительный пентозофосфатный цикл.
А. Реакции превращения пентозофосфата в гексозо-
фосфат. Rul — рибулоза; Rbs — рибоза; Xul — ксилулоза;
Fru — фруктоза; ТК — транскетолаза, ТА — трансальдо-
лаза.
Б. Окисление одной молекулы глюкозы приводит к об-
разованию трех молекул СОг и одной молекулы триозо-
фосфата, а также шести молекул NADPH.
В. Реакции, катализируемые транскетолазой и тран-
сальдолазой.
При последовательном протекании окисли-
тельных и неокислительных этапов (полный
цикл) осуществляется окисление гексозо-6-фос-
фата до СОг и триозофосфата с восстанов-
лением NADP (рис. 9.23, А). Продуктами пол-
ного цикла являются 3 молекулы СОг, 6 мо-
лекул NADPH и 1 молекула триозофосфата
(рис. 9.23, Б). Таким образом, возможно пол-
ное окисление глюкозы в окислительном пен-
тозофосфатном цикле, без участия фермен-
тов пути Эмбдена-Мейергофа-Парнаса или пу-
Глава 9. Окисление органических соединений 267
ти Энтнера-Дудорова. Пентозофосфатный цикл
функционирует у многих цианобактерий, обес-
печивая окисление глюкозы до СО2; эти мик-
роорганизмы не обладают полным циклом три-
карбоновых кислот из-за отсутствия у них
2-оксоглутаратдегидрогеназы, т. е. не способны
окислять ацетил-СоА, и пути биосинтеза начина-
ются у них с превращений триозофосфатов. По
этой же причине некоторые уксуснокислые бак-
терии (Gluconobacter spp.) окисляют триозофос-
фаты, синтезированные в пентозофосфатном цик-
ле, только до ацетата, который они выделяют в
среду. У Thiobacillus novellus и Brucella abortus
пентозофосфатный цикл действует как основной
путь окисления сахаров, заменяя пути Энтнера-
Дудорова и Эмбдена-Мейергофа-Парнаса.
9.11.5. Метилглиоксалевый шунт функционирует
при низких концентрациях фосфата
Когда окисление глицеральдегид-3-фосфата гли-
церальдегид-3-фосфатдегидрогеназой лимитиро-
вано низким содержанием фосфата в среде, у
Е. coli и некоторых других бактерий происходит
окисление дигидроксиацетонфосфата до пирува-
та через метилглиоксалевый шунт, включающий
три реакции. На первом этапе лиаза отщепляет
фосфат с образованием мети л глиоксаля, который
р, Н2О 2[Н]
СН2ОН т сн. к, сн3 сн3
С=О (1) с=о 1 (X снон с=о 1
СН2—О—Р СНО соон соон
Дигидрокси- ацетонфосфат Метил глиоксаль D-Лактат Пируват
Рис. 9.24. Метилглиоксалевый шунт. 1 — метилглиок-
сальсинтаза; 2 — глиоксилазы I и II; 3 — D-лактатокси-
даза (флавин-зависимая).
во второй реакции гидратируется глиоксилазой с
образованием лактата. Лактат окисляется мем-
браносвязанной флавин-содержащей D-лактато-
ксидазой до пирувата (рис. 9.24). При высоком
содержании фосфора в среде мстилглиоксалевый
шунт не функционирует в результате ингибирова-
ния первого фермента фосфатом.
У анаэробных бактерий обнаружены допол-
нительные пути разложения углеводов. Напри-
мер, бактерии, для которых предпочтитель-
ным субстратом служат пентозы, превращают
гексозы и пентозы в ксилулозо-5-фосфат, рас-
щепляемый затем фосфокетолазой (этот фермент,
подобно транскетолазам и дегидрогеназам 2-оксо-
кислот, содержит тиаминпирофосфат и катализи-
рует внутреннюю окислительно-восстановитель-
ную реакцию, в которой в качестве интермедиата
образуется высокоэнергетический ацетилфосфат;
см. гл. 12).
9.12. Аминокислоты служат вторыми по значению
питательными субстратами
Второе место после сахаров занимают в качестве
питательных субстратов аминокислоты. Во мно-
гих природных местообитаниях источниками уг-
лерода, азота и энергии служат для бактерий
белки, олигопептиды и смеси аминокислот. Лабо-
раторные питательные среды готовят па основе
таких дешевых источников аминокислот, как пеп-
тон, триптон и гидролизат казеина. Степень ис-
пользования отдельных аминокислот зависит от
доступности других источников углерода и со-
отношения С/N в среде. Прежде чем описывать
пути деградации аминокислот, необходимо рас-
смотреть основные подготовительные реакции —
их преобразование для последующего разложе-
ния.
9.12.1. На первой стадии разложения
аминокислот происходит
их дезаминирование или
декарбоксилирование
Большинство природных аминокислот относится
к L-аминокислотам. В тег же время в состав, на-
пример, муреина входят D-аминокислоты. Взаи-
268 Часть III. Многообразие метаболических путей
Рис. 9.25. Механизм аминотрансферазной реакции с
участием пиридоксаль-б'-фосфата. Реакция протекает в
две стадии. На первой стадии эта простетическая груп-
па связывается через образование шиффова основания
с остатком лизина в активном центре фермента (не по-
казано). На второй стадии аминокислота-субстрат вза-
имодействует с простетической группой с образованием
нового шиффова основания, которое подвергается внут-
римолекулярной окислительно-восстановительной реак-
ции с образованием пиридоксамин-б'-фосфата и 2-оксо-
кислоты. Затем простетическая группа взаимодействует
тем же образом с акцептором аминогруппы 2-оксоглута-
ратом, в результате чего образуется глутамат. При этом
регенерирует пиридоксальфосфат и происходит превра-
щение 2-оксокислоты в аминокислоту. Трансаминазная
реакция протекает по механизму «пинг-понг» — первый
продукт реакции (2-оксокислота) покидает фермент до
присоединения второго субстрата.
1. Окислительное дезаминирование □
Окислительное отщепление аминогруппы осу-
ществляют различные дегидрогеназы. При
этом аминогруппа окисляется до иминогруп-
ны, после чего иминокислота гидролизуется
с образованием о-оксососдинения и аммцака.
На этом этапе действуют флавин-содержащие
оксидазы D- и L-аминокислот, связанные
непосредственно с цитохромами дыхательной
цепи как доноры электронов. Эти оксидазы
имеют низкую субстратную специфичность и
могут дезаминировать несколько аминокис-
лот. Дегидрогеназы аминокислот катали-
зируют эндергоническую реакцию окисления
с участием NAD, например окисление алани-
на до пирувата + NH3 (аланиндегидрогеназа)
или глутамата до 2-оксоглутарата + NH3 (глу-
таматдегидрогеназа). Следует отметить, что
обратную реакцию, используемую для биосин-
теза глутамата, катализирует NADP-зависи-
мая глутаматдегидрогеназа (см. гл. 7).
2. Трансаминирование □ Этот процесс опи-
сан в гл. 7; источником о-аминогруппы при
трансаминировании служит глутамат. Анало-
гичным образом окисление путем транса-
минирования включает 2 этапа (рис. 9.25).
На нервом этапе а-амипогруппа донорной
аминокислоты переносится трансаминазами
на 2-оксоглутарат или пируват с образова-
нием соответствующей 2-оксокислоты. Про-
дукт реакции — глутамат или аланин — под-
вергается окислительному дезаминированию,
при котором регенерирует 2-оксокислота в ка-
честве акцептора аминогруппы. В итоге ами-
нокислота окисляется NAD+ с образованием
2-оксокислоты и NH3 [реакции (9-6)—(9.8)]:
Аминокислота 4- 2-Оксоглутарат —>
—» 2-Оксокислота 4- L-глутамат (9.6)
мопревращения D- и L-стереоизомеров аминокис-
лот катализируют ферменты рацемазы. На пер-
вой стадии метаболизирования аминокислот про-
исходит их дезаминирование или декарбоксилиро-
вание. Как правило, вначале отнимается тем или
иным способом п-аминогруппа (механизм восста-
новительного замещения описан в разд. 12.2.3).
L-Глутамат 4- NAD+ 4- Н2О —>
—> NH3 4- N ADH 4- Н+ 4- 2-Оксоглутарат
(9.7)
Аминокислота 4- NAD+ 4- Н2О —>
—> NH3 4- 2-Оксокислота 4- NADH 4- Н+
(9-8)
Глава 9. Окисление органических соединений 269
Рис. 9.26. Механизм (3- и 7-элиминирования амино-
кислот.
А Общая схема элиминирования аминогруппы серина,
треонина, метионина, цистеина, тирозина и триптофа-
на. Кофактором в этих реакциях служит пиридоксаль-
б'-фосфат, с которым связываются в ходе реакции все
субстраты (за исключением L-серина) и промежуточные
продукты. В процессе элиминирования отщепляется как
аминогруппа, так и заместитель — X. Если заместите-
лем является —COOH-группа (аспартат, 3-метиласпар-
тат), фенил (фенилаланин) или имидазол (гистидин),
происходит отщепление только аминогруппы и продук-
тами реакции являются соответственно а- и /З-ненасы-
щенные кислоты — фумарат или метилфумарат, корич-
ная и уроканиновая кислоты. Пока неясно, содержат
ли бактерии, подобно растениям, фенилаланин:аммиак-
лиазу. Образование шиффова основания в результате
связывания а-аминогруппы с пиридоксаль-б'-фосфатом
снижает рКа n-H-атома, способствуя тем самым /3- или
7-элиминированию. В случае серина в реакции участву-
ет [Fe—SJ-центр, который, как в аконитазной реакции,
меняет положение гидроксильной группы, способствуя
ее отщеплению.
Б. В реакции /3-элиминирования аминогруппы гистиди-
на участвует гистидин:аммиак-лиаза. Активный центр
этого фермента содержит остаток дегидроаланина, об-
разующийся в результате дегидратации остатка серина.
Сб-атом гистидина образует ковалентную связь с остат-
ком дегидроаланина, активируя тем самым перенос во-
дорода от СЗ-атома гистидина и высвобождение NH3.
3. Дезаминирование путем /3-элиминиро-
вания (рис. 9.26) □ Отщепление —ОН или
—SH группы в /3- или 7-положении к карбок-
сильной группе аминокислоты облегчает уда-
ление о-амипогруппы лиазами. Этот ме-
ханизм используется везде, где возможно.
Дегидратазы (—Н2О) действуют на серин
или треонин, десульфгидраза (—H2S) — на
цистеин. Эти ферменты содержат пиридок-
сальфосфат и катализируют зависимое от
пего образование в молекуле аминокислоты
о, /3-С=С-связи, т. е. енамина, который за-
тем в реакции таутомеризации превращает-
ся в имин, содержащий С=М-связь (кетимин).
Имин гидролизуется затем с образованием
NH3 и соответствующей 2-оксокислоты — пи-
рувата (в случае серина и цистеина) или
2-оксобутирата (в случае треонина). Амми-
ак-лиазы аминокислот катализируют от-
щепление NH3 от аспартата, гистидина и
фенилаланина с образованием транс-С=С-
связи. Эти аминокислоты содержат электро-
фильный заместитель при /3-углеродном ато-
ме с подвижными электронами (—СОО",
остаток имидазола или фенола), способству-
ющий отщеплению NH3 и стабилизации обра-
зующейся двойной связи. Продукты элимини-
рования NH3 — фумарат (в случае аспартата),
урокапат (в случае гистидина) и циннамат
(в случае фенилаланина) относятся к кисло-
там олефинового ряда (содержат двойную со-
пряженную связь). При 7-элиминировании
в случае тирозина и триптофана образуются
соответственно фенол и индол.
Многие бактерии, использующие пептиды или
аминокислоты, способны декарбоксилировать
m-аминокислоты с образованием первичных
аминов, окисляемых далее до соответствующих
жирных кислот.
270 Часть III. Многообразие метаболических путей
9.12.2 . Окислительную деградацию
аминокислот обеспечивают особые пути
В природе аминокислоты редко встречаются по
отдельности, поскольку при расщеплении бел-
ков образуется смесь олигопептидов, дипептитрв
и аминокислот, одновременно поглощаемых мик-
робными клетками. Здесь мы рассмотрим пути
деградации нескольких основных аминокислот и
соответствующих 2-оксокислот. Разложение аро-
матических аминокислот описано в разд. 9.13.2
и 9.15, анаэробное брожение с использованием
аминокислот — в гл. 12.
Аминокислоты семейства глутаминовой
кислоты □ При деградации аминокислот это-
го семейства в качестве центрального промежу-
точного продукта образуется глутамат. Далее
в реакции окислительного дезаминирования он
превращается в 2-оксоглутарат. Распространен-
ной реакцией является гидролиз глутамина,
катализируемый глутаминазой, с образованием
глутамата и NH3. Пролин окисляется до 5-1-
пирролин-5-карбоновой кислоты. Далее двойная
№=С-связь между С5-атомом и a-N-атомом гете-
роцикла пролина гидролизуется и образующийся
полуальдегид глутаминовой кислоты окисляется
до глутамата. В разложении и биосинтезе проли-
на принимают участие одни и те же ферменты
(см. разд. 7.6.1). Разложение аргинина на пер-
вой стадии могут катализировать четыре различ-
ных фермента. В двух путях из этих четырех раз-
ложение происходит через образование орнитина,
который окисляется далее до глутамата. Образу-
ющийся здесь в процессе превращения цитрулли-
на в орнитин карбамоилфосфат используется для
синтеза АТР (см. гл. 12). В двух других путях
в качестве промежуточного продукта образуется
4-амипобутират, окисляемый в конечном итоге
до сукцината. Некоторые бактерии обладают не
менее чем двумя из этих путей разложения
аргинина. В условиях недостатка азота бакте-
рии используют аргинин в качестве источника
N, поскольку он содержит четыре атома азота.
Дезаминирование или трансаминирование амино-
кислот семейства глутамата — глутамата, аспар-
тата и аланина — приводит к образованию 2-оксо-
глутарата, оксалоацетата и пирувата, т. е. основ-
ных интермедиатов центральных метаболических
путей.
Аминокислоты семейства аспарагино-
вой кислоты □ Аспарагин обычно гидроли-
Рис. 9.27. Разложение аминокислот с разветвленной це-
пью (на примере L-лейцина). Этот путь включает реак-
цию гетеротрофной фиксации СОг, поэтому рост бак-
терий с использованием этих субстратов зависит от на-
личия СОг в среде. Следует указать, что интермедиат
данного пути — З-гидрокси-З-метилглутарил-СоА — син-
тезируется также (из трех молекул ацетил-СоА) при био-
синтезе изопреноидных соединений.
зуется аспарагиназой с образованием аспартата и
NH3. Треонин предварительно дегидратируется
с образованием енамина, который превращается
в о-иминокислоту, гидролизуемую затем с обра-
зованием 2-оксобутирата и аммиака. Кроме того,
треонин может расщепляться треонин-альдолазой
Глава 9. Окисление органических соединений 271
на глицин и ацетальдегид. Разложение метиони-
на может происходить различными путями.
Аминокислоты с разветвленной цепью —
валин и лейцин — окисляются в конечном итоге до
ацетил-СоА и пропионил-СоА. Путь разложения
лейцина показан па рис. 9.27.
Аминокислоты семейства серина, аро-
матические аминокислоты, гистидин □ При
разложении серина и цистеина образуется пи-
руват (рис. 9.26, Л). Глицин дезаминируется
с образованием глиоксилата, используемого да-
лее для синтеза СЗ- или С4-сосдипсний (см.
разд. 9.16). Пути разложения перечисленных ами-
нокислот анаэробными бактериями описаны в
гл. 12. Гистидин разлагается с образованием
глутамата и формамида (рис. 9.28). Сведения о
путях разложения других соединений можно най-
ти в учебниках биохимии. Следует отметить, од-
нако, что анаэробное разложение ароматических
аминокислот связано с особыми механизмами (см.
ниже).
СООН СООН СООН
Гистидин Уроканат 4-Имидазолон-
5-пропионат
СООН
I
СН2
1
сн2
I о
НС - NH2 //
1 + Н- с
СООН х
nh2
L-глутамат
Формамид
СООН
I
СООН
сн2
I
N-Формимино-!--
глутамат
Рис. 9.28. Разложение гистидина. 1 — гистидаза; 2 —
уроканаза; 3 — имидазолонпропионаза; 4 — формимино-
глутамат-гидролаза.
9.13. Разложение ароматических соединений происходит с участием
молекулярного кислорода или анаэробным способом
Ароматические вещества, в том числе аромати-
ческие аминокислоты, хиноны и фенольные со-
единения, синтезируются в больших количествах
всеми организмами, в первую очередь растени-
ями для синтеза лигнина. Аэробное разложение
этих соединений протекает как комплексный про-
цесс с участием многих ферментов, но при этом
воздействие на ароматическую структуру основа-
но па немногих общих принципах. Первые стадии
ее аэробной деградации требуют участия моле-
кулярного кислорода для введения в разлагаемое
соединение гидроксильных групп и расщепления
ароматического кольца. Анаэробное разложение
осуществляют иные ферменты (рис. 9.29).
Аэробное разложение ароматических соедине-
ний включает три этапа: 1) этап модификации и
превращения различных соединений в несколько
центральных ароматических интермедиатов, ко-
торые могут подвергаться на этапе 2) окисли-
тельному расщеплению кольца диоксигеназами с
последующим — этап 3) — разложением нецикли-
ческих продуктов и образованием интермедиа-
тов центральных путей метаболизма. На первом
этапе (его относят к реакциям периферического
метаболизма) происходит существенная модифи-
кация циклических структур или отщепление за-
мещающих групп. В итоге этих превращений об-
разуются, как правило, такие центральные интер-
медиаты, как катехол (1,2-дигидроксибензол) и
протокатеховая кислота (3,4-дигидробензоат).
Разложение некоторых ароматических соедине-
ний происходит через образование гентизиновой
(2,5-дигидроксибензойной) кислоты. На рис. 9.30
приведены примеры реакций периферическо-
го метаболизма различных ароматических со-
единений. Как правило, ароматические соедине-
ния, имеющие заместители по первому и второму
С-атомам (например, салициловая кислота), и
многие монозамещеппые соединения (например,
фонол) превращаются в катехол. Большинство
незамещенных ароматических углеводородов (та-
ких как бензол и нафталин) разлагается через
образование 1,2-дифенольных соединений также
до катехола. Ароматические соединения, несущие
272 Часть III. Многообразие метаболических путей
АС
( «Анаэробные» косубстраты; 2[Н], СО2, АТР, СоА, Н2О )
Восстановлен не
ароматического
кольца, гидро-
литическое
расщепление
Основные
интермедиаты
анаэробного
разложения
Бензоил-СоА
(«Аэробные» косубстраты: О2, Н2О^
Флороглюцинов
Основные
интермедиаты
аэробного
разложения
Протокатеховая кислота
Рис. 9.29. Аэробный (кислород-зависимый) и анаэробный метаболизм ароматических соединений. Представлены
участвующие в реакциях косубстраты и основные интермедиаты периферических реакций. В аэробных условиях бен-
зойная кислота может превращаться, например, в катеховый спирт (катехол) с последующим оксигенолитическим
расщеплением кольца. В анаэробных условиях прямому восстановлению ароматического кольца бензойной кислоты
препятствует высокий энергетический барьер, обусловленный высокой резонансной энергией перехода от системы
подвижных тг-электронов к гипотетической структуре циклогексотриена. Субстратом восстановления служит тиоло-
вый эфир бензойной кислоты и СоА. В реакции восстановления участвуют 2 молекулы АТР как источника энергии
для преодоления энергетического барьера. Продукт восстановления подвергается гидролитическому расщеплению.
Разложению фенольных соединений может предшествовать их карбоксилирование с использованием СОг (не пока-
зано; см. рис. 9.35).
заместители в положениях 1,3 или 1,4 (например,
3-гидроксибензоат и 4-гидроксибензоат), а так-
же полизамещенные ароматические соединения
(например, ванильная кислота) метаболизируют-
ся через образование протокатеховой кислоты.
Основные реакции периферического метабо-
лизма ароматических соединений — введение гид-
роксильных групп в ароматическое кольцо и
часто отщепление заместителей — катализируют
оксигеназы. Гидроксильными группами могут за-
мещаться атомы хлора, питрогруппы и сульфо-
группы. Алифатические боковые цепи подверга-
ются укорачиванию тем или иным способом либо
остаются интактными. Кислород-зависимое (ок-
сигенолитическое) разрушение бензольного коль-
ца катехола или протокатеховой кислоты может
происходить в результате орто- или мета-ръс-
щепления.
Глава 9. Окисление органических соединений 273
Рис. 9.30. Разложение ароматических соединений с образованием катехола. Для превращения в этот конечный про-
дукт самых разнообразных ароматических субстратов подвергаются модификации заместители, во многих случаях
с участием оксигеназ. Расщепление молекул катехола и протокатеховой кислоты может происходить под действием
диоксигеназ двух типов, либо между двумя соседними гидроксилированными атомами С (орто-расщепление), либо
между гидроксилированным и негидроксилированным атомами С (мета-расщепление).
9.13.1. Орто-расщепление катехола и
протокатеховой кислоты ведет к
образованию 3-оксоадипиновой кислоты
Катехол и протокатеховая кислота расщепляют-
ся по opmo-пути (разрыв кольца между двумя
соседними гидроксилированными атомами С) с
образованием в качестве общего интермедиата
3-оксоадипата и в качестве конечных продуктов
сукцината и ацетил-СоА (рис. 9.31). Начальный
этап деградации — оксигеиолитическое расщепле-
ние — катализируют соответственно катехол-1,2-
диоксигепаза и 3,4-диоксигеназа протокатеховой
кислоты. Оба эти фермента расщепляют аро-
матическое кольцо, присоединяя к нему атомы
кислорода из Ог- Продукты реакции — цис,цис-
муконовая и /3-карбокси-цис,цис-муконовая кис-
лоты изомеризуются, образуя пятичленные
циклические лактоны — муконолактон и 4-кар-
боксимуконолактон. Под действием изомеразы
двойная связь в этих соединениях перемещается с
образованием нестабильного енол-лактона, кото-
рый в случае 4-карбоксимуконолактона декарбок-
силируется. Енол-лактон легко гидролизуется с
образованием специфического интермедиата —
3-оксоадипиновой кислоты (С6-дикарбоновая кис-
лота). В соответствии с этим рассматриваемый
путь разложения ароматических кислот име-
ет также название 3-оксоадипиновый путь.
З-Оксоадипиновая кислота активируется с уча-
стием одного из конечных продуктов, сук-
цинил-СоА, и образующееся 3-оксоацил-СоА-
соединение расщепляется тиолазой, как при
/3-окислении жирных кислот. Продукты расщеп-
ления представляют собой ацетил-СоА и сукци-
пил-СоА.
274 Часть III. Многообразие метаболических путей
Рис. 9.31. Реакции 3-оксоадипинового пути с ор-
то-расщеплением. 1 — катехол-1,2-диоксигеназа; 2 —
муконат-циклоизомераза; 3 — муконолактон-изомераза;
4 — протокатехат-3,4-диоксигеназа; 5 — /3-карбоксиму-
конат-циклоизомераза; 6 —у-карбоксимуконолактон-
декарбоксилаза; 7 — 3-оксоадипат-енол-лактон-г идро-
лаза; 8 —3-оксоадипат-сукцинил-СоА-трансфераза; 9 —
3-оксоадипат-СоА-тиолаза.
9.13.2. Гомогентизиновая кислота разлагается
по аналогичному пути орто-расщепления
Гомогентизиновая кислота, образующаяся в
качестве ключевого промежуточного продукта
при аэробном разложении ароматических амино-
кислот фенилаланина и тирозина, в результа-
те окислительного о;?то-расщепления превраща-
ется в малеилацстоуксусную кислоту, разлагае-
мую далее с образованием фумарата и ацетоаце-
тата (рис. 9.32). Включение в молекулу гидрок-
сильных групп и расщепление кольца осуществля-
ют оксигеназы. Гентизиновая кислота образуется
также в качестве промежуточного продукта при
разложении некоторых других ароматических со-
единений. Ее opmo-расщепленис приводит затем
к образованию фумарилпирувата, который далее
разлагается па пируват и фумарат.
Разложение триптофана происходит дву-
мя путями (рис. 9.33). По одному пути он
расщепляется посредством /3-элиминирования
Сз-боковой цени на пируват и индол. Далее индол
через образование 2,3-дигидроксиипдола окис-
ляется до антраниловой кислоты. Однако ча-
ще у микроорганизмов действует другой путь —
оксигенолитическое расщепление пятичленно-
го кольца 2,3-диоксигеназой с образованием
N-формилкинуренина, гидролизуемого далее с
образованием кинуренина и формиата. После-
дующие превращения кинуренина происходят у
разных бактерий различными путями. У некото-
рых бактерий из него образуется антраниловая
кислота, разлагаемая далее через образование ка-
техола, у других — N-гетероциклическая кинуре-
ниновая кислота, деградация которой происходит
по тому же пути, что и разложение гетероцикла
хинолина (см. разд. 9.15).
Дополнение 9.4. Оксигеназы представ-
ляют собой оксидоредуктазы, включающие
в молекулу субстрата атом(-ы) кислорода
из О2. Оксигеназы, катализирующие при-
соединение одного атома кислорода, назы-
вают монооксигеназами или гидролазами,
катализирующие присоединение двух ато-
мов — диоксигеназами. Диоксигеназы осу-
ществляют оксигенолитическое расщепление
кольца в составе дигидроксилированных аро-
матических соединений (катехола, нротока-
тсховой и гептизиновой кислот) и расщеп-
ление /3-каротина с образованием двух мо-
лекул ретиналя. Активность диоксигеназ во
многих случаях зависит от Fe2+ или Fe3+.
В реакциях, где мишенью действия диокси-
геназ служат алифатические двойные связи
[например, в ненасыщенных жирных кисло-
тах (липоксигеназная реакция) или каротине]
Глава 9. Окисление органических соединений 275
Малеилацетоацетат
Гомогентизиновая кислота
Фумарилацетоацетат
(енольная форма)
СООН
I
сн2
I
с = о
I
сн3
Ацетоацетат
Рис. 9.32. Разложение фенилаланина и тирозина (путь гомогентизиновой кислоты). 1—фенилаланингидроксилаза;
2 —трансаминаза; 3 — п-гидроксифенилпируват-оксидаза (при гидроксилировании по первому С-атому использу-
ется в качестве Н-донора карбоксильная группа, подвергаемая при этом окислительному декарбоксилированию
с перемещением боковой цепи); 4—гомогентизат-1,2-диоксигеназа; 5 — малеилацетоацетат-изомераза (глутатион-
зависимая); б —фумарилацетоацетатгидролаза; 7—гентизат-1,2-диоксигеназа. Разложение гентизиновой кислоты
происходит через этапы, аналогичные этапам разложения гомогентизиновой кислоты.
Рис. 9.33. Различные пути разложения триптофана. 1—триптофан-индол-лиаза; 2 — триптофан-2,3-диоксигеназа.
276 Часть III. Многообразие метаболических путей
образуются гидропероксидные [—С(ОО)С~]
связи. Некоторые диоксигеназы осуществ-
ляют окислительное декарбоксилирование
о-амино- или а-гидроксикислот (внутренние
монооксигеназы). Особые диоксигеназы ката-
лизируют окисление одновременно двух суб-
стратов с включением кислорода из О2 в один
из них или в тот и другой. Примерами мо-
гут служить ферменты, окисляющие 2-оксо-
глутарат в качестве косубстрата (с включени-
ем в него одного атома О) до сукцината; ос-
новной субстрат при этом гидроксилируется
в результате включения в пего другого ато-
ма из молекулы О2. Определенные диоксиге-
назные реакции требуют участия NAD(P)H;
к ним относятся, например, реакции окисле-
ния ароматических углеводородов с образо-
ванием цис-диоловых производных и образо-
вания дигпдроксилировашгых ароматических
соединений с удалением из кольца заместите-
лей (карбокси-, сульфо- или аминогрупп ли-
бо атомов хлора). Многие монооксигена-
зы также нуждаются для своей активности
в доноре электронов, таком как NAD(P)H,
восстановленный флавин или флавопротеин,
восстановленный белок, содержащий железо-
серный центр, или восстановленный птери-
дин. Немногие другие монооксигеназы одно-
временно с основным субстратом окисляют
второй органический субстрат вместо восста-
новленного кофермента.
9.13.3. При мета-расщеплении разрыв
ароматического кольца происходит
между гидроксилированным и
негидроксилированным атомами
углерода
В более редких случаях диоксигеназы расщепля-
ют ароматическое кольцо не между двумя гид-
роксилированными атомами С (как при орто-
расщеплении), а между гидроксилированным и
не гидроксилированным атомами углерода. Так,
катехол-2,3-диоксигеназа и 4,5-диоксигеназа про-
токатеховой кислоты осуществляют подобные ре-
акции с образованием 2-гидроксимуконового по-
луальдсгида и 2-гидрокси-4-карбоксимуконового
полуальдегида соответственно (рис. 9.34). После-
дующие реакции катаболизировапия этих про-
дуктов приводят к образованию формиата, пи-
рувата и ацетальдегида. Один и тот же штамм
бактерий может осуществлять как орто-. так и
•ме/гш-раегцепление ароматических соединении, в
зависимости от того, служит субстратом для ро
ста бензоат или фенол соответственно; гены фер-
ментов одного из этих путей могут быть локали-
зованы в плазмиде.
Рис. 9.34. Пути разложения катехола и протокатеховой
кислоты с мета-расщеплением. 1 — катехол-2,3-ди-
оксигеназа; 2 — гидролаза 2-гидроксимуконового
полуальдегида; 3 — гидролаза 2-оксопент-4-еноата;
4 — 4-гидрокси-2-оксовалерат-альдолаза; 5 — прото-
катехат-4,5-диоксигеназа; б — гидролаза 2-гидрокси-
4-карбокси муконового полуальдегида; 7 — гидролаза
2-оксо-4-карбоксипент-4-еноата; 8 — 4-гидрокси-4-кар-
бокси-2-оксовалерат-альдолаза.
Глава 9. Окисление органических соединений 277
9.13.4. Анаэробное разложение ароматических
соединений требует иной стратегии
В случае строгих анаэробов и факультатив-
ных анаэробов молекулярный кислород — «маги-
ческая пуля» аэробов — не может быть использо-
ван для активации кольца путем гидроксилиро-
вания или для его оксигенолитического расщеп-
ления. 13 анаэробных условиях деградация аро-
матических веществ зависит от наличия «бед-
ных» косубстратов, таких как вода, СОг, АТР,
кофермснт-А, тиоэфиры, а также восстановлен-
ные и окисленные коферменты.
Эта совершенно иная стратегия состоит в
том, что ароматическое кольцо подвергается вос-
становлению с последующим гидролитическим
расщеплением образовавшейся алициклической
структуры. Центральными интермедиатами дан-
ного пути являются бензоил-СоА, флороглю-
цинол (1.3,5-тригидроксибензол), резорцииол
(1,3-дигидрокспбензол) и, возможно, другие ме-
таболиты. Промежуточные метаболиты анаэроб-
ного разложения ароматических соединений, бу-
дучи продуктами восстановления, а не окисления
молекулярным кислородом, существенно отлича-
ются от интермедиатов аэробного разложения
(катехола, протокатеховой кислоты и гентизино-
вой кислоты). Анаэробное разложение включает
реакции карбоксилирования фенольных соеди-
нений, восстановительного отщепления заме-
стителей (—ОН, —NH2, —галоген), расщепле-
ния О-метильных эфиров, трансгидроксилирова-
пия, присоединения фумарата к —СНз-группам,
о-окисления — СЩ—COOH-групп, и восстанов-
ления ароматического кольца (рис. 9.35). Фа-
культативные анаэробы способны синтезировать
ферменты как окислительного, так и восстанови-
тельного путей разложения ароматических соеди-
нений.
Анаэробное разложение ароматических соеди-
пений происходит в три этапа. На первом этапе
в результате периферических (канализующих)
реакций различные ароматические соединения
превращаются в небольшое число центральных
интермедиатов, активированных для восстанов-
ления ароматического кольца. На втором эта-
пе происходит восстановление ароматическо-
го кольца с образованием 1,3-дикетона и его
гидролиз. Третий этап —это /3-окисление с об-
разованием одного из центральных метаболитов
(ацетил-СоА). Центральные интермедиаты фло-
Рис. 9.35. Некоторые ароматические соединения, ката-
болизируемые в анаэробных условиях.
А. Разложение с образованием бензоил-СоА.
Б. Разложение с образованием резорцинола и флоро-
глюцинола.
роглюцинол и резорцинол образуются из феноль-
ных соединений, содержащих две или три гидрок-
сильные группы в .метле-положениях.
Периферические реакции с образованием
бензоил-СоА (канализующие реакции), фло-
278 Часть III. Многообразие метаболических путей
Рис. 9.36. Восстановление ароматического кольца и по-
следующий метаболизм бензоил-СоА (А) и резорцино-
ла/флороглюцинола (Б) в анаэробных условиях.
роглюцинола и резорцинола представлены на
рис. 9.35. Эти примеры иллюстрируют функ-
цию основных анаэробных альтернативных реак-
ций. Дальнейшее двухэлсктронное восстановле-
ние ароматического кольца ведет к образованию
диена. В случае бслзоил-СоА в реакции участ-
вуют также две молекулы АТР, что необходи-
мо для преодоления высокого активационного ба-
рьера резонансной энергии сопряженных связей
(рис. 9.36, А). (Аналогичную функцию АТР вы-
полняет в нитрогеназной реакции при разрыве
стабильной тройной связи N=N в молекуле азо-
та.) К диену присоединяется затем молекула во-
ды с образованием /3-дикстон-структуры. В слу-
чае флороглюцинола и резорцинола, обладающих
значительно менее выраженными ароматически-
ми свойствами, восстановление кольца не требует
участия АТР и образующийся ендиол уже пол-
ностью имеет Д-дикето-форму (рис. 9.36, Б). По-
следующие реакции являются общими для путей
/3-окисления и окисления дикарбоновых кислот.
В качестве конечного продукта анаэробного ка-
таболизма ароматических субстратов образуется
ацетил-СоА.
9.13.5. Существуют общие принципы
анаэробного окисления инертных
субстратов — ароматических соединений,
углеводородов и эфиров
Если в аэробных условиях расщепление бактери-
ями ароматических и других химически инерт-
ных соединений, таких как циклические, линей-
ные и разветвленные алифатические углеводоро-
ды, терпены и стероиды, основано па участии мо-
лекулярного кислорода, то в анаэробных услови-
ях требуются иные стратегии. Фототрофные бак-
терии, бактерии-бродилыцики и бактерии, полу-
чающие энергию в процессе анаэробного дыха-
ния, разлагают такие соединения независимыми
от Ог способами, например через восстановле-
ние кольца. Введение в ароматические структуры
гидроксильных групп осуществляется у них пу-
тем дегидрирования и присоединения воды, по-
лярные карбоксильные группы вводятся путем
карбоксилирования. Расщепление простых эфир-
ных связей происходит при участии сильных нук-
леофилов, таких как Со(1) в составе В12-зави-
симых белков, образующих реакционноспособные
Со(ТП)-алкильные группы.
9.14. Жирные кислоты, воски, углеводороды, стеролы и
Ci-соединения используют специализированные бактерии
Липиды и фосфолипиды не могут поглощать-
ся бактериями, поэтому вначале они должны
быть гидролизованы экзоферментами с высво-
бождением жирных кислот, глицерола и поляр-
ных групп. Гидролиз восков — эфиров ддинно-
цепочечпых жирных кислот и спиртов — катали-
зируют эстеразы. Спирты далее окисляются до
жирных кислот.
Глава 9. Окисление органических соединений 279
9.14.1. Разложению жирных кислот
предшествует их транспорт в клетку
и активация
В случае грамотрицательных бактерий длинно-
цепочечные (Cg-Cis) жирные кислоты про-
никают в периплазматическое пространство при
участии рецепторного белка, локализованного в
их наружной мембране (рис. 9.37). Механизм
транспорта этих соединений через плазматиче-
скую мембрану менее изучен. Возможно, в про-
цессе переноса через мембрану жирные кислоты
немедленно активируются ацил-СоА-сиптетазой,
свободно связанной с ее внутренней поверхностью
и характеризующейся широкой специфичностью
к длине цепи. Такая активация могла бы предот-
вращать нежелательный эффект жирных кислот
как поверхностно-активных веществ и поврежде-
ние мембраны. Предполагаемая реакция актива-
ции может протекать в соответствии с уравне-
нием:
R-COOH + CoA-SH + АТР
-> R-CO-SCoA + АМР + PR (9.9)
Гидролиз образующегося пирофосфата пирофос-
фатазой
PPi + Н2О -> 2Pi (9.10)
может обеспечивать необратимость процесса ак-
тивации. Таким образом, активация должна быть
сопряжена с затратой двух высокоэнергстических
Рис. 9.37. /^-Окисление длинноцепочечных и среднецепочеч-
ных жирных кислот. Процесс протекает в четыре этапа. На пер-
вом этапе CoA-эфиры жирных кислот при участии флавин-
содержащей ацил-СоА-дегидрогеназы (1) подвергаются двух-
электронному окислению с образованием си-[3-транс-двойной
связи (транс-изомер 2,3-еноил-СоА) и восстановлением FAD.
(Окислительно-восстановительный потенциал этой реакции
близок к нолю (Eq r; 0) и недостаточен для восстановле-
ния NAD+.) FADH2 передает водород в дыхательную элек-
тронтранспортную цепь на уровне хинона. Реакции второго,
третьего и четвертого этапов катализируют два фермента в
составе полифункционального ферментного комплекса мол.
массой примерно 260 кДа; при этом промежуточные продук-
ты почти не накапливаются. Первый из этих двух ферментов
(2) катализирует 4 реакции (2а—2d), обладая 4 активностями.
Реакция 2а — второй этап окисления — состоит в гидратации
двойной связи ацил-CoA (2,3-еноил-СоА-гидратаза, или кро-
тоназа) с образованием L-3-гидроксиизомера. В реакции 2Ь
— третий этап окисления — продукт кротоназной реакции окис-
ляется специфичной к L-изомеру и NAD+ L-3-гидроксиацил-
СоА-дегидрогеназой с образованием (CoA-эфира) 3-оксокис-
лоты. На четвертом этапе второй белок комплекса — тиола-
за (3) — катализирует тиолитическое отщепление ацетил-СоА,
укорачивая цепь жирной кислоты на два углеродных атома.
Укороченная жирная кислота в виде ацил-СоА-тиоэфира ста-
новится субстратом для следующего цикла окисления. В ка-
честве конечного продукта полного окисления жирных кис-
лот с четным числом атомов углерода образуется в соответ-
ствии с этим ацетил-CoA, с нечетным — пропионил-СоА. При
разложении ненасыщенных жирных кислот с двойной связью
в цис-положении осуществляются две дополнительных реак-
ции: изомеразная (2с) — превращение цис-изомеров в транс-
изомеры — и эпимеразная (2d) — превращение D-3-гидрокси-
ацил-СоА в L-изомер. Обе реакции катализирует первый бе-
лок комплекса. Начальную активацию жирных кислот для
последующего окисления катализируют ацил-СоА-синтаза (4)
и пипогЬосгЬатазэ ГЧУ
280 Часть III. Многообразие метаболических путей
фосфорсодержащих эквивалентов. Более токсич-
ные среднецепочечные (С7-С11) жирные кис-
лоты, возможно, проникают в клетку путем диф-
фузии и затем активируются коферментом А.
СоА-производные жирных кислот разлагаются
путем /3-окисления, названного так в соответ-
ствии с тем, что окислению подвергается атом С в
/3-положении относительно активированного ато-
ма С.
/3-Окисление насыщенных жирных кислот
протекает как циклический процесс (рис. 9.37).
За один оборот цикла отщепляется одна молеку-
ла ацетил-СоА и образуется по одной молекуле
FADH2 и NADH (механизм ассимиляции ацетил-
СоА описан в гл. 7). При окислении жирных
кислот с нечетным числом атомов углерода
образуется также Сз-соедипение — пропионил-
СоА, который карбоксилируется с образовани-
ем метилмалонил-СоА, далее подвергаемого изо-
меризации в сукцинил-СоА. Другие возможные
пути окисления пропионата рассматриваются в
разд. 9.16.
При /3-окислении мононенасыщенных
жирных кислот (например, 18:1Д9) образу-
ется З-г^ис-ненасыщенный ацил-СоА, в котором
двойная связь расположена «неверно» — меж-
ду СЗ- и С4-атомами вместо С2- и СЗ-атомов
и в неверной цис-конфигурации вместо транс-
конфигурации, характерной для промежуточ-
ных продуктов окисления насыщенных жир-
ных кислот, цис-транс-Изомеразная активность
комплексного фермента 2,3-еноил-СоА-гидрата-
зы (кротоназы) / З-гидроксиацил-Со А-дегидроге-
назы (см. подпись к рис. 9.37) обеспечивает об-
разование правильного 2-традс-пзомера в реак-
ции 3-цис-ацил-СоА —> 2-транс-ацил-СоА. Этот
продукт вступает в последующую реакцию цик-
ла /3-окисления. Для окисления полиненасыщен-
пых жирных кислот (например, 18:2 Д9, ДП),
необходим дополнительный индуцибельный фер-
мент 2,4-диеноил-СоА-редуктаза, катализирую-
щая превращение 2-транс,4-цис-диеноил-СоА в
3-mpauc-еноил-СоА. Указанная выше цис-транс-
изомеразная активность обеспечивает образова-
ние 2-еноил-СоА-изомера. В разложении корот-
коцепочечных (С4-С6) жирных кислот и
ацетоацетата участвует другой тиолазный
изофермент и ацетоацетил-СоА-трансфераза
(рис. 9.38).
Синтез СоА-лигазы и ферментов последующе-
го /3-окисления индуцируется при росте бактерий
Рис. 9.38. Разложение короткоцепочечных жирных кис-
лот у Е. coli. 1 — ацетоацетил-СоА-трансфераза; 2 —
тиолаза.
на средах, содержащих нефтепродукты, жирные
кислоты или алканы, и подавляется глюкозой по
принципу катаболитной репрессии. Индукторами
служат длинноцепочечные жирные кислоты, то-
гда как короткоцепочечные жирные кислоты не
вызывают индукции, даже если используются в
качестве субстратов для роста. Синтез фермен-
тов окисления короткоцепочечных кислот инду-
цирует ацетоацстат. Регуляция систем разложе-
ния длинно- и средпецепочечных жирных кислот
и окисления короткоцепочечных жирных кислот
осуществляется с участием различных регулятор-
ных белков.
Длинноцепочечные дикарбоновые кис-
лоты переносятся через плазматическую мем-
брану, после чего их активирует специальная
СоА-лигаза. Образующиеся моно-СоА-тиоэфиры
подвергаются /3-окислению с образованием сук-
цинил-СоА или глутарил-СоА при четном или
нечетном числе атомов С в дикарбоновой кислоте
соответственно. Глутарил-СоА окисляется глута-
рил-СоА-дегидрогеназой до глутакопил-СоА, ко-
торый спонтанно декарбоксилируется с образова-
нием кротопил-СоА (см. гл. 12). Известны также
многочисленные другие пути окисления жирных
кислот, в том числе с участием монооксигеназ.
Глава 9. Окисление органических соединений 281
Глицерол
Липиды
Глицерол-
З-Р
СН2ОН
Переносчик |
> СНОН
Глицерол
Облегченная
диффузия
СН2ОН
С = О
СН, —О—Р
Глицерол-З-Р
СН,-О-Р
Дигидрокси-
ацетон -Р
Рис. 9.39. Метаболизм глицерола и глицерол-3-фосфа-
та у бактерий семейства Enterobacteriaceae. 1 — киназа;
2 —аэробные и анаэробные дегидрогеназы.
Окисление глицерола □ Глицерол и глице-
рол-3-фосфат — основные продукты разложения
липидов — в аэробных условиях окисляются через
образование 3-фосфоглицерата (рис. 9.39). В анаэ-
робных условиях глицерол метаболизируется в ре-
акциях брожения (гл. 12).
9.14.2. Углеводороды присутствуют в составе
восков, смол и других природных веществ
Помимо указанных в заголовке природных ис-
точников, поступление углеводородов в биосфе-
ру связано с переработкой нефти и выбросом
промышленных отходов. Источником образова-
ния метана служит, кроме того, сбраживание про-
кариотами органических веществ в анаэробных
условиях, при отсутствии альтернативных акцеп-
торов электронов, таких как сульфат или нитрат
(до метана сбраживается примерно половина все-
го используемого прокариотами в этих условиях
органического углерода). Несмотря на то что уг-
леводороды химически чрезвычайно устойчивы,
некоторые микроорганизмы способны использо-
вать их как единственный органический субстрат.
Начальные этапы микробного разложения углево-
дородов и соответственно рост микробов за счет
этого процесса, как правило, зависят от нали-
чия Ог- В анаэробных условиях возможна очень
медленная микробная деградация некоторых уг-
леводородов. Хотя углеводороды богаты энергией
(имеют высокую теплоту сгорания), выход био-
массы при росте с использованием этих субстра-
тов относительно низок, вероятно из-за его лими-
тирования на уровне поступления в клетки ис-
точника углерода. Использовать метан и другие
С i-соединения способны лишь немногие специа-
лизированные организмы.
Роль биологических поверхностно-ак-
тивных соединений в ассимиляции угле-
водородов □ Углеводороды практически нерас-
творимы в воде, что затрудняет их поглощение
микробными клетками и ферментативное разло-
жение. Условием эффективного разложения угле-
водородов, в частности нефти, является обширная
поверхность раздела фаз углеводород-вода. По-
этому большинство микроорганизмов, способных
использовать алканы, выделяет для диспергиро-
вания подобных субстратов низкомолекулярные,
внеклеточные и связанные с клеткой вещества—
гликолипиды, ацилполиолы, липопептиды, жир-
ные кислоты, фосфолипиды или нейтральные ли-
пиды, обладающие поверхностной активностью.
Молекулы этих веществ, различных по структуре,
состоят из гидрофильного и гидрофобного участ-
ков и в жидкой среде образуют мелкодисперсные
прямые или обращенные мицеллы, способствуя
поглощению углеводородов.
Поглощение углеводородов □ Процесс
поглощения углеводородов считается этапом, ли-
митирующим скорость их потребления. Лишь
низкомолекулярные углеводороды (до Cg) на-
столько растворимы или летучи, что их диф-
фузия (даже из газовой фазы) может быть
достаточной для удовлетворения потребности
бактерий в субстрате. Высокомолекулярные угле-
водороды, крайне плохо и медленно растворимые,
проникают в клетки в виде микрокапель (часто
они видны на электронных фотографиях внутри
клеток; механизм такого поглощения неизвестен).
Кроме того, многие микробы, использующие угле-
водороды, имеют гидрофобные клеточные покро-
вы, образующиеся конститутивно или индуциру-
емые углеводородным субстратом. Гидрофобная
поверхность обеспечивает связывание клеток с
нерастворимым субстратом. Капли углеводорода
могут даже инкапсулироваться, т. е. заключаться
в окружение и поглощаться в виде мелких мем-
бранных везикул путем слияния.
Аэробное разложение углеводородов □
Наиболее распространенные субстраты для роста
бактерий—это длинноцепочечные (С ю-Cig) али-
фатические углеводороды. Они быстро и эффек-
тивно окисляются, например, многими грамполо-
жительными бактериями с высоким содержали-
282 Часть III. Многообразие метаболических путей
ем G + С (Arthrobacter, Coi'ynebacterium, Nocardia,
Mycobacterium, Acinetobacter), а также отдельны-
ми штаммами Pseudomonas. Окисление коротко-
цепочечных углеводородов (С2Ся) способны осу-
ществлять лишь немногие бактерии. Для разло-
жения этих n-алканов требуется их активация
молекулярным кислородом с помощью оксигеназ
по одному из трех путей (рис. 9.40).
1. Наиболее распространен путь с участием мо-
нооксигеназы, окисляющей концевой атом
n-алкана с образованием первичного спирта:
R-СНз + О2 + NAH(P)H + Н+
-> R-CH2OH + NAD(P)+ + Н2О (9.11)
2. Диоксигеназы также атакуют концевой атом
n-алкана с образованием гидропероксида, ко-
торый далее восстанавливается до спирта:
R-СНз + О2 ->
-> R-CH2OOH + NAD(P)H + Н+ ->
-> R-CH2OH + NAD(P)+ + Н2О (9.12)
3. В редких случаях монооксигеназа осуществ-
ляет субтерминальное окисление алкана, т. е.
по С2-атому, с образованием вторичного
спирта.
Эти реакции гидроксилирования и последую-
щие реакции окисления алканов происходят, как
правило, в мембране. Донором электронов для!
монооксигеназ служит рубредоксин — низкомоле-
кулярный белок, активный центр которого содер-
жит атом Fe2+/Fe3+, связанный с остатком ци-
стеина. В свою очередь рубредоксин восстанав-
ливается цитоплазматическим NADH-зависимым
ферментом. В некоторых случаях роль донора!
электронов в оксигеназных реакциях выполня-
ет цитохром Р-450, восстанавливаемый NADH с
участием флавин-Fe—S-содсржащего белка. По-
следующий метаболизм образовавшихся спиртов
происходит различными путями. Чаще всего пер-
вичные спирты окисляются до жирных кислот.
Вторичные спирты окисляются до кетонов и да-
лее под действием монооксигеназы превращают-
ся в ацетил-эфир, гидролизуемый с образовани-
ем ацетата и спирта (рис. 9.40). Спирт окисляется
до жирной кислоты. Свойства алкоголь- и аль-
дегид-дегидрогеназ, участвующих в окислении
77-алканов у различных микроорганизмов, варьи-
руют— они могут быть растворимыми или свя-
занными с мембранами, действовать с использо-
ванием в качестве кофактора NAD+ или NADP+
и относиться к индуцибельным либо конститутив-
ным ферментам.
Рис. 9.40. Основные пути разложения п-алкан<
с окислением концевого или соседнего с ни
атома углерода. 1—п-алканмонооксигеназа; 2
алкогольдегидрогеназа; 3 — альдегиддегидрогеназа
4, 5, 7 — монооксигеназы; б — алькогольдегидрогена
за вторичных спиртов; 8 — ацетилэстераза.
Глава 9. Окисление органических соединений 283
Рис. 9.41. Метаболизм циклогексана у Nocardia и Pseudomonas 1 — циклогексанмонооксигеназа; 2 — циклогексанол-
дегидрогеназа; 3 — циклогексанонмонооксигеназа; 4 — е-капролактонгидролаза.
Алканы с разветвленной цепью раз-
лагаются более медленно, как правило путем
а-окисления обоих концевых атомов углерода. Де-
градация ненасыщенных алканов (алкенов) про-
исходит либо путем окисления по двойной связи,
либо по механизму окисления п-алканов. 1. Окси-
геназа окисляет концевую метильную группу до
спиртовой. 2. Субтерминальная оксигеназа гид-
роксилирует второй углеродный атом с образова-
нием вторичного спирта; 3. Окисление по двойной
связи приводит к образованию эпоксида, который
далее гидролизуется с образованием дигидрокси-
алкана. 4. Окисление по двойной связи приводит
к образованию диола.
Деградацию циклоалифатических соединений
иллюстрирует рис. 9.41 на примере разложения
циклогексана. Расщепление кольца осуществля-
ет монооксигеназа. Существуют и другие пути
разложения циклексана с образованием в каче-
стве промежуточного продукта циклогексан-1,2-
диола.
Анаэробное разложение алифатических
углеводородов □ Ранее считалось, что в отсут-
ствие кислорода разложения углеводородов не
происходит. Однако теперь известны сульфат- и
нитратредуцирующие бактерии, способные мед-
ленно метаболизировать углеводороды в анаэ-
робных условиях и использовать их в качестве
единственных органических субстратов. В этих
условиях метаболизм алканов начинается либо с
удлинения цепи путем присоединения С i-фраг-
мента, либо с окисления концевой метильной
группы до карбоксильной с использованием воды
в качестве источника кислорода. Далее жирные
кислоты окисляются путем /3-окисления. Нена-
сыщенные алканы гидроксилируются по двойной
связи путем присоединения воды с образованием
вторичных спиртов. Механизм анаэробного раз-
ложения углеводородов в настоящее время интен-
сивно изучается.
9.14.3 . Разложение труднорастворимых
природных соединений — стеролов,
гопаноидов, монотерпенов и других
изопреноидных соединений
Монотерпены (Сю)—это основные компонен-
ты растительных масел, синтезируемые из двух
изопреновых единиц. Они образуют ацикли-
ческие, моноцикличсские или бициклические
структуры. Разложение их включает сложные
сочетания реакций, отдельные из которых рас-
смотрены в предыдущем разделе. Конечные про-
дукты деградации изопреноидов представляют
собой ацетил-СоА и пропионил-СоА.
9.14.4 . Использование одноуглеродных
органических субстратов
Наиболее распространенное одноуглеродное со-
единение в природе — это метан (СН4). Он об-
разуется в результате анаэробного сбраживания
органических соединений и содержится как ос-
новная составная часть в природном газе. Кроме
того, важную роль в природе выполняют та-
кие одноуглеродные соединения, как мета-
нол (СН3ОН), формальдегид (СН2О), формиат
(НСООН), метиламин (СН3—NH2), метилмеркап-
тан (СН3—SH) и другие. Образование Ci-соединс-
ний происходит при разложении сложных органи-
ческих субстратов, в состав которых входят функ-
циональные С1-группы, присоединенные через
гетероатом (О, N или S), как, например, в случае
метилового эфира фенола (фенол—О—СПз). По-
скольку С1-соединения не могут быть окислены в
цикле трикарбоновых кислот, для их включения
в метаболизм действуют особые механизмы. Мик-
роорганизмы, способные метаболизировать одно-
углеродпые соединения, подразделяются на две
группы: 1) облигатные метилотрофы, т. е. мик-
284 Часть III. Многообразие метаболических путей
роорганизмы, растущие за счет использования
только С1-соединений; эта группа включает мета-
нокисляющие бактерии (метанотрофы) и 2) фа-
культативные мстилотрофы — микроорганизмы,
способные использовать одноуглеродные соедине-
ния (как правило, за исключением метана) наряду
с другими органическими субстратами.
Облигатные метилотрофы □ На границе
раздела аэробной и анаэробной зон в донных
осадках и заболоченных почвах обнаруживается
обильное развитие бактерий, окисляющих СЩ до
СО2 с использованием молекулярного кислорода.
В клетках этих метилотрофпых бактерий имеется
развитая система мембран, расположенных в виде
стопок по периферии. Мембраны содержат фер-
мент, окисляющий метан до метанола, компонен-
ты электронтранспортной цепи и терминальные
оксидазы. В клетках, растущих в среде с метано-
лом, система внутриклеточных мембран не фор-
мируется.
Окисление метана до СО2 включает четы-
ре этапа двухэлектронного окисления (рис. 9.42).
Первая реакция, катализируемая мембраносвя-
занной метан-монооксигеназой (гидроксилазой),
требует участия молекулярного кислорода для
активации химически инертного СН4 и расщеп-
ления стабильной С—Н-связи (энергия ее диссо-
циации равна 435 кДж/моль). Этот неспецифич-
ный фермент, способный гидроксилировать и раз-
нообразные другие соединения, содержит медь.
В некоторых условиях (например, при дефици-
те меди) используется водорастворимая железо-
содержащая метан-монооксигеназа. В этой первой
реакции гидроксилирования участвует NADH или
восстановленный цитохром с.
Образованный при окислении метана ме-
танол не может быть окислен далее до фор-
мальдегида с помощью NAD+, поскольку окис-
лительно-восстановительный потенциал пары
метанол-формальдегид (Eq=182 мВ) недостато-
чен для восстановления NAD(P) (Е'о = — 320 мВ).
Акцептором электронов в метаполдегидроге-
назпой реакции служит особый хинон PQQ
(pyrroloquinoline quinone; Е'о = +120 мВ). Хими-
ческая структура PQQ приведена на рис. 9.42, Б.
Этот хинон используется также для окисле-
ния спиртовых групп других соединений, на-
пример в глюкозооксидазной реакции. Метанол-
дегидрогепаза локализована в периплазматиче-
ском пространстве. Формальдегпд-дегидрогеназа
и формиатдегидрогеназа представляют собой
ПАБ+-зависимые ферменты. Восстановленный
в этих реакциях NAD отдает электроны в дыха-
тельную цепь на уровне хинона, восстановленный
PQQ — на уровне цитохрома с. Формальдегид
связывается с глутатионом, входящим в актив-
ный центр формальдегид-дегидрогеназы, и в виде
S-гидроксиметилглутатиона окисляется до S-фор-
милглутатиона, который далее гидролизуется с
высвобождением формиата. Формиат окисляет
до СО2 формиатдегидрогеназа.
Метанол служит дешевым субстратом для
получения биомассы метилотрофпых бактерий
(микробный белок), используемой в качестве
Рис. 9.42. Окисление метана.
А. 1 — метанмонооксигеназа; 2 — метанолдегидрогеназа; 3 — формальдегиддегидрогеназа; 4 — формиатдегидрогена-
за. Метанмонооксигеназы окисляют и другие углеводороды. По многим свойствам эти ферменты сходны с аммиак-
монооксигеназой, окисляющей NH3 до NH2OH. Это отражает образование в обоих случаях сильного окислителя в
активном центре.
Б. Структура кофермента PQQ и его окислительно-восстановительные превращения.
В. Стехиометрия процесса окисления метана.
Глава 9. Окисление органических соединений 285
белково-витамипной добавки к корму живот-
ных.
N- и S-содержащие одноуглеродныс соедине-
ния метаболизируются с участием дополнитель-
ных ферментов. Так, триметиламин окисляется
флавин-содержащим ферментом в следующей ре-
акции:
(CH3)3N + Н2О + [FAD] ->
(CH3)2NH + СН2О + [FADH2] (9.13)
Возможно также гидроксилирование триметил-
амина при участии монооксигеназы до N-оксида
триметиламина, который альдолаза гидролизует
до диметиламина и формальдегида. Окисление
метиламина происходит несколькими различны-
ми путями.
Факультативные метилотрофы □ Мно-
гие бактерии способны использовать одноугле-
родные соединения (за исключением метана), но
предпочтительными субстратами для них слу-
жат другие органические вещества. Окисление
Ci -соединений сопряжено у этих бактерий с вос-
становлением хинонов. У некоторых из них для
окисления формальдегида действует диссимиля-
ционный гексулозофосфатный, или рибулозомо-
нофосфатпый. цикл. В реакциях этого пути фор-
мальдегид присос, щняется к рибулозо-5-фосфату
с образованием гсксулозофосфата, который через
образование фруктозо-6-фосфата окисляется до
рибулозо-5-фосфата и СО2 (см. гл. 8).
Ci-соединения как источники углеро-
да □ Метилотрофы могут использовать СЩ и
другие одноуглеродные соединения не только
как источник энергии, по и как единственный
источник углерода. Поступление Cj-субстратов
в углеродный метаболизм происходит при уча-
стии особых механизмов ассимиляции, в кото-
рые формальдегид включается как интермеди-
ат (см. гл. 8). Некоторые факультативные ме-
тилотрофы вначале окисляют С i-соединения до
СО2, который затем ассимилируют в цикле Каль-
вина.
Анаэробный метаболизм Ci-соедине-
ний □ Метан, вероятно, не окисляется в анаэ-
робных условиях. Анаэробный метаболизм других
С]-соединений, осуществляемый метаногенными
и ацетогенными бактериями, описан в гл. 8 и 12
соответственно (см. гл. 12 и 8).
9.15. Ассимиляция микробами гетероциклических
азотсодержащих соединений
К гетероциклическим азотсодержащим соедине-
ниям относятся пурины и пиримидины, входя-
щие в состав нуклеиновых кислот, аминокислоты
триптофан, пролин и гистидин, разнообразные
природные метаболиты и синтетические, чуже-
родные для живых организмов вещества — ксе-
нобиотики. Большинство N-гетероциклических
соединений — это ароматические вещества с
неравномерным распределением тг-электропов в
цикле, при котором атомы азота характеризу-
ются избыточной электронной плотностью, то-
гда как С2- и С4-атомы обеднены электрона-
ми и представляют собой мишень для нуклео-
фильной атаки. В других соединениях избы-
точная электронная плотность создает благо-
приятные условия для электрофильного заме-
щения.
Гидроксилирование гетероцикла может осу-
ществляться двумя путями — с участием моноок-
сигеназ и молекулярного кислорода как источ-
ника кислорода гидроксильных групп [реакция
(9.14)] или с участием молибден-содержащих де-
гидрогеназ и воды в качестве источника кислоро-
да [реакция (9.15)]:
N-гетероциклическое соед. + 2[Н] + О2 —>
—» Гидроксилированное N-гетероциклическое соед. + Н2О (9.14)
N-гетероциклическое соед. + Н2О + Акцептор электронов —>
—> Гидроксилированное N-гетероциклическое соед. + Восстановленный акцептор электронов ]2Н]
(9.15)
286 Часть III. Многообразие метаболических путей
9.15.1. Пуриновые и пиримидиновые основания
высвобождаются при разложении ДНК,
РНК и нуклеотидов
Пурины □ В аэробных условиях пуриновые ос-
нования окисляются до глиоксилата и мочевины
(рис. 9.43) (разложение их в анаэробных усло-
Рис. 9.43. Аэробное разложение пуриновых оснований
(аденина и гуанина). 1 — адениндезаминаза; 2—гуа-
ниндезаминаза; 3 — ксантиноксидаза; 4 — уриказа; 5 —
аллантоиназа; б — аллантоиказа; 7 — амидогидролаза
аллантоиновой кислоты; 8 — аминогидролаза уреидо-
глицина; 9 — уреидогликолаза.
виях рассмотрено в гл. 12). На первой стадии
разложения аденин и гуанин превращаются в
ксантин и гипоксантин, которые ксантиноксидаза
окисляет до мочевой кислоты. Далее мочевая кис-
лота окисляется до аллантоина, после чего про-
исходит гидролиз этого продукта с образованием
аллантоиновой кислоты. Последняя разными пу-
тями у различных микроорганизмов разлагается
на глицин и мочевину. Мочевина под действием
никсльсодержащей уреазы гидролизуется до СОг
и аммиака:
H2N-CO-NH2 + Н2О 2NH3 + СО2 (9.16)
Пиримидины □ В аэробных условиях пи-
римидиновые основания окисляются с образова-
нием /3-аланина (рис. 9-44). Разложение цитози-
на начинается с его дезаминирования до ураци-
ла. Реакции разложения урацила почти полно-
стью обратны реакциям его синтеза (см. гл. 7).
Кольцо подвергается гидрированию и гидроли-
зу между N3- и С4-атомами. Поскольку при
синтезе уридинмонофосфата С1-карбоксильная
группа аспартата утрачивается, конечным про-
дуктом распада урацила является /3-алании, а
не аспарагиновая кислота. Аланин подвергается
окислительному дезаминированию. Продукт дез-
аминирования, малоновый полуальдегид, окисля-
ется до малопил-СоА. Тимин разлагается анало-
гичным образом, с той лишь разницей, что про-
межуточным продуктом его разложения является
у0-аминоизобутират, который окисляется далее до
Рис. 9.44. Аэробное разложение пиримидиновых
оснований (цитозина и урацила). 1 — цитозиндез-
аминаза; 2 — 5.6-дигидроурацилдегидрогеназа; 3 —
5,6-дигидроурацил гидролаза; 4 — /3-уреидопропионаза.
Глава 9. Окисление органических соединений 287
метилмалоновой кислоты:
H2N-CH2-CH(CH3)-COOH ->
— НООС-СН(СН3)-СООН (9.17)
Метилмалоновая кислота через образование
метилмалонил-СоА превращается в сукцинат.
9.15.2. Разложение гетероциклических
соединений, содержащих один атом N,
происходит путем гидроксилирования
Разложение пиридина начинается с его восста-
новления до 1,4-дигидропиридина. Затем пири-
диновое кольцо подвергается гидролитическому
или оксигенолитическому расщеплению. В первом
случае конечным продуктом является глутаровый
диальдегид, во втором — полуальдегид сукцината
и формиат. Деградация гидроксилированных пи-
ридинов включает предварительное введение в их
структуру второй гидроксильной группы —либо
из воды в реакции с участием дегидрогеназы, ли-
бо из О2 в монооксигеназной реакции. Образую-
щиеся диолы расщепляются диолдиоксигеназами.
Аналогичным образом легко происходит раз-
ложение пиридоксина, пиридоксамина и пи-
ридоксаля (три формы витамина Вс), а так-
же пиридинмонокарбоновой и пиридипдикарбо-
повой кислот. Для иллюстрации разнообразия
путей и продуктов деградации рассмотрим меха-
низмы разложения никотиновой (пиридип-3-кар-
боповой) кислоты. В аэробных условиях ее моле-
кула с участием атома кислорода из воды гидрок-
силируется по Сб-атому молибден-содержащим
ферментом с образованием 6-гидроксиникотино-
вой кислоты, подвергаемой далее окислитель-
ному декарбоксилированию с образованием 2,3-
диола, расщепляемого диолдиоксигепазой. Неко-
торые бактерии гидроксилируют молекулу ни-
котиновой кислоты по второму атому углерода.
В анаэробных условиях 6-гидроксиникотиновая
кислота восстанавливается, превращаясь в о-ме-
тиленглутарат.
Сходный набор ферментов, вводящих в моле-
кулу субстрата ОН-группу с использованием О2
(монооксигеназы) или Н2О (дегидрогеназы, чаще
всего молибден-содержащие), участвует в разло-
жении гетероциклов хинолина и изохинолина.
Разложение индола и триптофана рассмотрено
в разд. 9.13.2.
9.16. Органические кислоты представляют собой распространенные
природные субстраты, образующиеся и как продукты брожения
Органические кислоты способны метаболизиро-
вать многие бактерии. Поглощение их клетками
происходит с участием более или менее специфич-
ных транспортных систем.
Ацетат включается в метаболизм в активи-
рованной форме — в виде ацетил-СоА. Известны
четыре реакции активации ацетата:
Ацетат + HSCoA + АТР —»
—» Ацетил-SCoA + АМР + PPi (9.18)
Ацетат + АТР —> Ацетилфосфат + ADP (9.19)
Ацетилфосфат + HSCoA —>
—» Ацетил-СоА + Р, (9.20)
Ацетат + Сукципил-СоА —*
—> Ацетил-СоА + Сукцинат (9.21)
Ацетат + АТР + HSCoA
—> Ацетил-СоА + ADP + Pi (9.22)
Ацетил-СоА окисляется в цикле трикарбоновых
кислот. Если ацетат служит также единственным
источником углерода, Сз-(фосфоенолпируват) и
С4-предитествепники для биосинтетических про-
цессов образуются в реакциях глиоксилатпого
цикла. В анаэробных условиях ацетил-СоА окис-
ляется в цикле трикарбоновых кислот (или вари-
антах этого пути) либо по ацетил-СоА-пути.
Пропионат, образующийся в результате раз-
ложения жирных кислот с нечетным числом ато-
мов углерода, включается в метаболизм также
288 Часть III. Многообразие метаболических путей
в активированной форме — в виде пропионил-
СоА — и, как правило, превращается в сукцинил-
СоА. Протекающие реакции в общем можно рас-
сматривать как обратные реакциям сбраживания
пропионата через образование сукцинил-CoA (см.
гл. 12). Вначале пропионил-CoA карбоксилирует-
ся биотип-зависимой пропионил-СоА-карбоксила-
зой в ATP-зависимой реакции, сходной с реакцией
карбоксилирования пирувата. Образующийся при
этом метилмалонил-СоА под действием витамин
В ^-зависимой мутазы изомеризуется в сукцинил-
СоА, окисляемый далее в цикле трикарбо новых
кислот. Известны и другие пути окисления пропи-
оната у бактерий, например окисление через ста-
дию образования 3-гидроксипропионата или пу-
тем конденсации с оксалоацстатом, при которой
образуется метилцитрат, расщепляемый затем на
пируват и сукцинат, как в изоцитрат-лиазной ре-
акции глиоксилатного цикла. Окисление бутирата
и более длиппоцепочечных жирных кислот описа-
но в разд. 9.14.1.
Гидроксикислоты и кетокислоты относят-
ся к легкометаболизируемым субстратам. При-
мером их могут служить пируват и малат —
интермедиаты центральных путей метаболизма.
Малат окисляется до пирувата при участии
мал ик-фс рмента:
L-малат + NAD+ —»
-> Пируват + NADH + Н+ + СО2 (9.23)
Аналогичная реакция, катализируемая NADP-
зависимым изоферментом, служит источником
NADPH для биосинтеза. Фосфоенолпируват —
интермедиат многих центральных биосинтетиче-
ских и катаболических путей — образуется из ок-
салоацетата или непосредственно из пирувата
(см. гл. 7).
Глиоксилат образуется как продукт распада
пурина и глицина, а также окисления гликола-
та. Для превращения этого окисленного субстра-
та в интермедиат центрального метаболизма ис-
пользуются дополнительные ферменты глицерат-
ного пути (рис. 9.45, А). Образующийся в этих
реакциях 3-фосфоглицерат является промежу-
точным продуктом гликолиза. Кроме того, гли-
оксилат служит источником восполнения пула
интермедиатов цикла лимонной кислоты; под
действием малатсинтазы он конденсируется с
ацетил-СоА с образованием малата (рис. 9.46).
Другой путь, ведущий к образованию оксалоаце-
А. Глицератный путь. 1 — глиоксилаткарболигаза; 2—
редуктаза тартронового полуальдегида: 3 — глицератки-
наза.
Б. /З-Гидроксиаспартатный путь. 1 — трансаминаза; 2—
альдолаза эритро-^б-гидроксиаспартата; 3 — дегидрата-
за эритро-/3-гидроксиаспартата.
Рис. 9.46. Ассимиляция глиоксилата в цикле дикарбо-
новых кислот, сопряженном с реакциями глицератно-
го пути. 1 — малатсинтаза; 2 — малатдегидрогеназа; 3 —
фосфоенолпируваткарбоксикиназа; 4— пируваткиназа;
5 — пируватдегидрогеназа; 6 — глиоксилаткарболигаза.
Большими стрелками указано поступление субстратов
в биосинтетические пути.
тата, представлен па рис. 9.45, Б; он включа-
ет превращение глиоксилата в глицин в реакции
трансаминирования, конденсацию двух молекул
глицина с образованием /3-гидроксиаспартата и
дезаминирование последнего с образованием ок-
салоацетата.
Глава 9. Окисление органических соединений 289
Оксалат, наиболее окисленное двууглеродное
соединение, разлагается в три этапа с участием
формил-СоА (рис. 9.47). Окисление начинается
с образования оксалил-СоА в результате перено-
са СоА от формил-СоА. Затем оксалил-СоА де-
карбоксилируется с образованием формил-СоА.
Высвобождаемый формиат окисляет до СО2 фор-
миатдегидрогеназа. Оксалил-СоА может также
восстанавливаться до глиоксилата в следующей
реакции:
Оксалил-СоА + NADH + Н+ ->
—* Глиоксилат + NAD+ + CoA-SH (9.24)
Глиоксилат служит субстратом для синтеза кле-
точных компонентов в реакциях глицератного
пути.
Этиленгликоль (СН2ОН—СЩОН) окисля-
ется через стадии образования гликолевого аль-
дегида и гликолевой кислоты до глиоксилата,
Рис. 9.47. Окисление оксалата у Pseudomonas oxala-
ticus. 1 — СоА-трансфераза; 2 — оксалил-СоА-декарбо-
ксилаза; 3 — формиатдегидрогеназа.
далее ассимилируемого в соответствии с описан-
ными выше механизмами.
9.17. Ксенобиотики — синтетические, устойчивые к биодеградации
соединения, в норме не характерные для природных сред
Это определение ксенобиотических веществ при-
менимо и для токсичных (таких, как фенол), и
для устойчивых к разложению (таких, как угле-
водороды) веществ, концентрация которых в есте-
ственных средах на много порядков ниже, чем
в антропогенных. Ксенобиотики оказывают вред-
ное воздействие на человека, животных и расте-
ния. Как правило, устойчивость ксенобиотиков к
микробному разложению определяется особенно-
стями их химического строения, т. е. стабильно-
стью химических связей. В природных незагряз-
ненных экосистемах обнаруживается все больше
ксенобиотических и близких к ним соединений,
образующихся естественным путем. Микроорга-
низмы обладают способностью модифицировать
многие из этих веществ и использовать их в ка-
честве субстратов, хотя скорость разложения ксе-
нобиотиков чаще всего крайне низка.
9.17.1. Первый этап разложения
галогенсодержащих соединений часто
состоит в их дегалогенировании
Галогенированные органические вещества состав-
ляют большую группу синтетических токсикан-
тов, загрязняющих природную среду. В то же
время они образуются в больших количествах в
природных абиотических и биотических процес-
сах (например, как продукты выделения многих
морских водорослей). Известно уже более тысячи
природных галогенированных органических со-
единений. Как правило, устойчивость галогенсо-
держащих веществ к разложению увеличивается
в ряду заместителей I, Вг, С1, Рис возрастанием
числа замещающих групп.
Разложение галогенсодержащих ксенобиоти-
ков могут осуществлять как аэробные, так и
анаэробные микроорганизмы. Основные фермен-
тативные реакции, приводящие к отщеплению га-
логенов, представлены на рис. 9.48. Анаэробы
осуществляют восстановительное дегалогениро-
вание. Кроме того, может происходить спонтан-
ное дегалогенирование в результате химического
разложения нестабильных первичных продуктов
посторонней ферментативной реакции. Такое де-
галогенирование называют «спонтанным», в от-
личие от «случайного» дегалогенирования, вызы-
ваемого ферментами с широкой субстратной спе-
цифичностью; между этими двумя процессами
существуют переходы. Часто разложение ксено-
биотиков происходит путем кометаболизма с дру-
гим субстратом.
290 Часть III. Многообразие метаболических путей
Рис. 9.48. Механизмы дегалогенирования при фермен-
тативном расщеплении связи углерод-галоген.
Д. Восстановительное дегалогенирование, катализируе-
мое редуктазами; в процессе восстановления атом гало-
гена замещается водородом.
Б. Оксигенолитическое дегалогенирование, катализиру-
емое моно- или диоксигеназами; атом галогена замеща-
ется гидроксильной группой, кислород которой проис-
ходит из Ог-
В. Гидролитическое дегалогенирование, катализируе-
мое галогенидгидролазами; атом галогена замещается
гидроксильной группой из воды.
Г. Тиолитическое дегалогенирование, катализируемое
S-глутатионтрансферазами; в процессе такого дегалоге-
нирования происходит связывание галоген-содержащего
субстрата с глутатионом (G) в составе активного центра
фермента и последующий гидролиз этой связи с высво-
бождением галогена.
Д. Внутримолекулярное нуклеофильное замещение ато-
ма галогена соседней гидроксильной группой с образо-
ванием эпоксидов.
Е. Дегалогенирование с отщеплением HCI и образова-
нием двойной связи.
Ж. Гидратация соседней с атомом галогена двойной
связи, вызывающая спонтанное отщепление НО.
9.17.2. Органические сульфоновые кислоты
могут служить источником углерода
и/или серы
Значительное количество серы присутствует’ в
биосфере в составе органических сульфоновых
кислот (R—SO3 ), содержащихся главным образом
в гумусе. Существуют низкомолекулярные суль-
фонаты, такие как коферменты М (см. рис. 12.10);
хлоропласты растений содержат сульфолипид
6-сульфохиновозилдиглицерид. Кроме того, к
сульфонатам относятся важные синтетические де-
тергенты и красители, представляющие собой ксе-
нобиотики. Они метаболизируются только в усло-
виях голодания.
Связь С—S в сульфонатах весьма стабиль-
на. Тем не менее микробы способны осуществ-
лять оксигенолитическое удаление сульфонатной
группы в виде сульфита несколькими путями.
В случае ароматических сульфоновых кислот это
происходит перед или во время расщепления ок-
сигеназами либо после гидролитического расщеп-
ления кольца. При «оксигенолитичсском» удале-
нии сульфонатной группы субстрат подвергается
диоксигеназной реакции и в результате происхо-
дит спонтанное высвобождение сульфита. Вклю-
чение ОН-группы делает связь S~SO3 лабиль-
ной и всю группу легкоуходящей. Сульфит может
также удаляться в результате монооксигеназных
реакций для получения источника серы. Десуль-
фонирование происходит и в анаэробных усло-
виях, но механизмы этого процесса пока пе из-
вестны.
Глава 9. Окисление органических соединений 291
9.18. Некоторые бактерии осуществляют неполное окисление
простых органических веществ
Полное разложение сложных органических суб-
стратов возможно только при «кооперации» раз-
личных микроорганизмов (например, грибов и
бактерий, как при разложении древесины). Од-
нако некоторые бактерии даже простые орга-
нические субстраты окисляют лишь частично и
выделяют в среду продукты неполного окисле-
ния — органические кислоты и другие соединения.
Такого рода кислотообразование (например, вы-
деление уксусной кислоты при окислении этано-
ла уксуснокислыми бактериями) приводит к сни-
жению pH среды, препятствуя росту других бак-
терий. Процесс неполного аэробного окисления
называют также аэробным брожением. В числе
выделяемых продуктов могут быть уксусная, глю-
коновая, фумаровая, лимонная и другие орга-
нические кислоты, оксокислоты, кетоны и даже
аминокислоты, поэтому неполное окисление име-
ет большое значение для промышленного полу-
чения соответствующих веществ. Трансформация
органических соединений, не связанная с ростом
микроорганизма (кометаболизм), в данном разде-
ле не рассматривается.
Дополнение 9.5. Неполное окисление про-
стых органических субстратов осуществля-
ют облигатно аэробные бактерии. Они мо-
гут рассматриваться как специализирован-
ная группа организмов, быстро растущих за
счет частичного окисления того или ино-
го, обычного низкомолекулярного субстрата,
который временно накапливается в среде
их обитания в большом количестве. Таким
субстратом может быть, например, этанол,
образующийся в результате быстрого сбра-
живания растительных соков (сахаристых
выделений растений) кислотоустойчивыми
дрожжами. Обитающие совместно с ними ук-
суснокислые бактерии окисляют этанол до
уксусной кислоты. При высокой концентра-
ции этанола и образующейся из него уксус-
ной кислоты другие микроорганизмы могут
лишь сохранять жизнеспособность (если они
кислото- и спиртоустойчивые), но не расти,
т. е. создаются элективные условия для при-
способленных к этой экстремальной среде
организмов и предотвращается конкуренция
за субстраты со стороны других микроор-
ганизмов. По исчерпании этанола большин-
ство уксуснокислых бактерий способно пе-
реключаться на потребление ацетата и мед-
ленно расти, осуществляя его окисление до
СО2. Необходимый для этого фермент цик-
ла трикарбоновых кислот сукцинатдегидро-
геназа отсутствует при росте с использо-
ванием этанола и появляется в результате
индукции при переходе на использование аце-
тата. По способности использовать ацетат
уксуснокислые бактерии делятся на группы
peroxydans, т. с. использующих ацетат, и
suboxydans, не использующих ацетат. Сход-
ные закономерности характерны для окисле-
ния глюкозы до глюконовой кислоты и дру-
гих продуктов неполного окисления.
Уксуснокислые бактерии, например ви-
ды Acetobacter и Gluconobacter, — это близкород-
ственные грамотрицательные бактерии, способ-
ные при избытке спирта или сахаров окислять
их с образованием органических кислот. Они
окисляют этанол до ацетата в два этапа; фер-
менты обоих этапов — алкогольдегидрогеназа и
альдегид-дегидрогеназа относятся к NAD+-He3a-
висимым и восстанавливают хинон PQQ (см.
разд. 9.11.3 и 9.11.4, а также рис. 9.42). Этот хи-
нон передает электроны в дыхательную цепь на
уровне цитохрома с. При окислении этанола АТР
образуется только в процессе электронтранспорт-
пого фосфорилирования. При росте с исполь-
зованием Сг-субстратов необходимые для био-
синтетических процессов С3- и С4-соединения
образуются в анаплеротических реакциях (см.
глиоксилатный цикл; гл. 7). Цикл трикарбоновых
кислот, в котором происходит окисление ацета-
та у других бактерий, в случае уксуснокислых
бактерий рода Acetobacter неполный из-за отсут-
ствия сукцинатдегидрогеназы, и его реакции вы-
полняют только биосинтетические функции. Ук-
суснокислая бактерия Acetobacter aceti использу-
ется для производства уксуса.
292 Часть III. Многообразие метаболических путей
Бактерии рода Gluconobacter способны окис-
лять глюкозу в окислительном пснтозофосфат-
ном цикле до глицеральдегид-3-фосфата, далее
окисляемого до ацетата с образованием в качестве
промежуточных продуктов пирувата и ацетил-
СоА. Вначале глюкоза обычно окисляется до глю-
коновой кислоты глюкозооксидазой с участием
PQQ в качестве акцептора электронов. Глюко-
нат поглощается клетками. Еще один биотехно-
логический процесс, осуществляемый с приме-
нением уксуснокислых бактерий, — это окисление
D-сорбитола в L-сорбозу, из которой далее пу-
тем химического окисления получают L-аскорби-
повую кислоту. D-сорбитол образуют некоторые
бактерии, восстанавливающие глюкозу при ее из-
бытке в среде, и они используются для получе-
ния D-сорбитола в качестве исходного субстрата
для производства аскорбиновой кислоты. Алко-
гольдегидрогеназы и ацетальдегиддегидрогеназы
уксуснокислых бактерий имеют широкую суб-
стратную специфичность и осуществляют так-
же превращение вторичных спиртов в кетоны
(например, изопропанола в ацетон, глицерола в
дигидроксиацетон и глюконата в 5-оксоглюко-
нат). Сахароспирты окисляются ими до соответ-
ствующих альдоз и кетоз. Хинон PQQ-зависи-
мые ферменты Acetobacter и Gluconobacter ал-
когольоксидаза, альдегидоксидаза и глюкозоок-
сидаза локализованы в периплазматическом про-
странстве; они передают электроны на цитохром
с, локализованный на периплазматической сто-
роне клеточной мембраны. Субстраты и продук-
ты катализируемых ими реакций не проникают в
клетки, и этим, в частности, объясняется устойчи-
вость уксуснокислых бактерий к токсичным кон-
центрациям субстратов и продуктов неполного
окисления.
Некоторые представители рода Bacillus при
росте в условиях избытка углеводов осуществ-
ляют неполное окисление глюкозы с образова-
нием ацетата, пирувата, ацетоина и бутандиола
(их структурные формулы см. в разд. 12.2.2) —
продуктов, характерных для анаэробного броже-
ния. В условиях дефицита других питательных
веществ, таких как фосфор или азот, клетки
Bacillus переходят в стадию споруляции и исполь-
зуют продукты неполного окисления в качестве
источника энергии, окисляя их до СО2. При этом
ацетоин, аналогично пирувату, окисляется муль-
тиферментным комплексом при участии тиамин-
пирофосфата (см. разд. 3.5). Как и в случае ук-
суснокислых бактерий, на быстрой стадии роста
за счет неполного окисления у бацилл действует
неполный цикл трикарбоновых кислот.
Дополнительная литература
Gottschalk G. (1986). Bacterial metabolism, 2nd ed. New
York: Springer.
Neidhardt F. C., Curtiss R., Ingraham J. L., Lin E. C. C.J
LowK.B., Magasanik B., ReznikofFW., Riley XI.,
Schaechter M., Umbarger H. E., eds. (1986). Esche-
richia coli and Salmonella: cellular and molecular
biology. 2nd edn. Wachington, DC: ASM Press.
Ratledge C., ed. (1993). Biochemistry of microbial
degradation. Dordrecht: Kluwer.
Источники рисунков
1. Beguin P., Aubert I. P. (1994). FEMS Microbiol.
Rev. 13: 25-58.
2. Sutherland I. W. (1995). FEMS Microbiol. Rev. 16:
323-347.
3. De Jong E., Field J. A., de Bont.J. A. M. (1994).
FEh’.S Microbiol. Rev. 13: 153-188.
4. Gottschalk G. (1986). Bacterial metabolism. Berlin,
Heidelberg, New York: Springer.
5. Fetzner S., Lingens F. (1994). Microbiol. Rev. 58:
641-685.
[Глава 10
Окисление неорганических соединений
хемолитотрофами
10.1. Хемолитотрофы получают энергию в процессе окисления
неорганических субстратов
Многие почвенные и водные бактерии способны
получать энергию в результате окисления неор-
ганических соединений, таких как водород (Щ,
оксид углерода (СО), восстановленные соедине-
ния серы (SG и др.) и азота (NHJ), а также
двухвалентные катионы (например, Fe2+, Мп2+)
(рис. 10.1). Эти бактерии называют хемолитотро-
фами. Окисление ими восстановленных неорга-
нических субстратов возможно только при на-
личии соответствующего акцептора электронов.
Многие хемолитотрофы используют в качестве
акцептора электронов молекулярный кислород.
Хемолитотрофы, относящиеся к факультативным
анаэробам, могут использовать в качестве акцеп-
тора электронов нитрат или нитрит. Разнообраз-
ные облигатно анаэробные бактерии, например
получающие энергию в результате окисления во-
дорода, могут использовать в качестве акцепто-
ра электронов сульфат или бикарбонат. Две эти
последние группы организмов описаны в гл. 12.
Для многих хемолитотрофов единственным или
основным источником клеточного углерода слу-
жит СО2. Такие бактерии называют хемолитоав-
тотрофами. В природе имеется большое разнооб-
разие частично или полностью восстановленных
неорганических соединений, которые могут слу-
жить субстратами для получения энергии. Наи-
более важные реакции биологического окисления
неорганических субстратов с использованием кис-
лорода и нитрата в качестве акцепторов электро-
нов представлены в табл. 10.1. Метан формаль-
но относится к органическим субстратам, однако
многие особенности метаболизма метанокисляю-
щих бактерий сближают их с хемолитотрофами
(см. гл. 9) и поэтому процесс окисления метана
также приведен в этой таблице.
10 .1.1. Значительным источником
восстановленных неорганических
соединений служат промежуточные
компоненты биогеохимических циклов
Наиболее восстановленные неорганические соеди-
нения образуются в анаэробных условиях как про-
дукты микробных процессов — анаэробного дыха-
ния и брожения. Например, Щ выделяется в ка-
честве побочного продукта при многих процессах
брожения, аммоний —при аэробном и анаэроб-
ном разложении азотсодержащих органических
соединений, а также при анаэробном восстановле-
нии нитрата. Сероводород и СО2 образуются как
конечные продукты анаэробного разложения ор-
ганических веществ сульфатредуцирующими бак-
Получение энергии и восстанови-
Окисленные неорганические
соединения, например НгО, SO*',
SOj'. s°, NO3. no;, Fe3t, Mn<+, CO2
CO2 или органические
субстраты в качестве
исто ник в уг ерода
Диссимиляция
Ассимиляция
Рис. 10.1. Хемолитоавтотрофия. При этом способе пи-
тания бактерии получают энергию путем окисления
неорганических соединений и ассимилируют СОг как
единственный источник углерода. Др — протондвижу-
щая сила, или электрохимический протонный потен-
циал.
294 Часть III. Многообразие метаболических путей
Таблица 10.1. Примеры энергодающих реакций у хемолитотрофов
Роды и виды Реакция дс~
Nitrosomonas еигораеа 2 МД + 3 О2 — 2 NO^ + 2 Н2О + 4 Н+ -551,2
Смешанные культуры NHj + NO2 -> N2 + 2 Н2О -357,0
Nitro barter winogradskyi 2 NO2 + О2 -> 2 NO" -74,3
Alcaligenes eutrophus 2 Н2 4- О2 —» 2 Н2О -472,5
Para coccus denitrificans 5 Н2 + 2 NO3 4- 2 Н+ -> 6 Н2О + N2 -958,8
Desulfovibrio desulfuricans 4 Н2 + SQ2" 4- 2 Н+ —» H2S + 4 Н2О -154,4
Methanobacterium 4 Н2 4- НСО" + 11+ СН4 + 3 П2О -138,6
thermoautotrophicum 1
Pseudomonas carboxydovorans 2 СО 4- О2 2 СО2 -504,9
Methylomonas spp. 2 СН4 + 2 О2 — НСО3 4- П+ + Н2О -814,5
Thiobacillus thioparus и Beggiatoa spp. HS" + 2 О2 — SO2" 4- Н+ -798,2
Thiobacillus thiooxidans 2 S0 4- 3 О2 + 2 Н2О -> 2 SO4" + 4 Н+ -588,2
Thiomicrospira denitrificans 5 82Оз~ +8 NO7 4- П2О -* 10 SO^" + 2 Н *- + 4 N2 -3925,6
Desulfovibrio sulfodismutans 1 S2O2" 4- Н2О HS" + ЭОД + 11+ -18,9
Thiobacillus ferrooxidans 4 Fe2 + О2 + 4 Н+ —» 4 Fe3+ + 2 И2О -17,7
Leptothrix spp. 2 Мп2+ + О2 + 2 Н2О -> 2 МпО2 + 4 Н+ -77,6
Stibiobacter spp. 2 Sb3+ + О2 + 4 Н+ -* 2 Sb5+ + 2 Н2О Данных нет
1 Процесс подробно описан в гл. 12.
2 Процесс подробно описан в гл. 9.
териями (рис. 10.1). Сероводород может затем
окисляться до сульфата хемолитотрофами в при-
сутствии 0'2 или нитрита. Таким образом, хемо-
литотрофные микроорганизмы выполняют суще-
ственную роль в биогеохимическом цикле серы, а
также азота, железа и многих других элементов.
Важно представлять, что движущей силой
всех этих циклов служит в конечном счете сол-
нечное излучение как источник энергии для пер-
вичной продукции органического вещества путем
фиксации СОг в процессе фотосинтеза. Органи-
ческие вещества выполняют затем роль восстано-
вителей в биогеохимических циклах. Некоторые
аспекты круговорота элементов, в котором участ-
вуют хемолитотрофные микроорганизмы, рас-
смотрены в разд. 10.5; специально этому вопросу
посвящены гл. 30-32.
Некоторые восстановленные неорганические
соединения могут иметь также вулканическое
происхождение, как H2S и Fe2+, либо происхо-
дить из геологических пород. Кроме этого, в
значительном количестве восстановленные неор-
ганические соединения образуются в результате
деятельности человека, включая сельское хозяй-
ство, нефтяную и химическую промышленность
и процессы горения.
Понятие хемолитоавтотрофия было сформу-
лировано выдающимся русским микробиологом
С. Н. Виноградским на основе изучения суль-
фидокисляющих бактерий Beggiatoa и аммиак-
окисляющих бактерий. В своих исследованиях
Виноградский установил, что Beggiatoa способны
окислять сульфид до молекулярной серы и далее
до сульфата с использованием Ог (см. гл. 1). Воз-
можность использования этими бактериями энер-
гии окисления H2S для ассимиляции СОг как
основного источника углерода было трудно до-
казать по причине нестабильности сульфида в
присутствии кислорода. Способность к фиксации
СОг и автотрофному росту Виноградский экс-
периментально доказал для аммиак-окисляющих
бактерий.
Реакции окисления восстановленных неорга-
нических соединений при хемолитоавтотрофном
росте представлены в табл. 10.1. Для окисле-
ния того или иного неорганического соедине-
ния необходим в качестве окислителя акцептор
электронов, имеющий более высокий по срав-
нению с восстановителем окислительно-восстано-
вительный потенциал. Как видно из таблицы,
таким окислителем чаще всего служит кисло-
род (окислительно-восстановительный потенциал
4-816 мВ). Другие акцепторы электронов приве-
дены в табл. 10.2. Стандартные окислительно-
восстановительные потенциалы (Д') указаны в
ней для стандартных условий и pH 7,0.
Глава 10. Окисление неорганических соединений хемолитотрофами 295
Таблица 10.2. Окислительно-восстановительные полуреакции электрон-донорных и электрон-акцепторных пар,
принимающих участие в процессах энергообеспечения (хемо)литотрофного роста бактерий, а также некото-
рых коферментов и компонентов электронтранспортной цепи. Приведены значения стандартных окислительно-
восстановительных потенциалов Е'о (температура 25 °C; pH 7,0. Изменения стандарной свободной энергии Гиббса
рассчитывается в соответствии с уравнением AGr = —nF [Ео (акцепторной пары) —Е'о (донорной пары)], где п —
число переносимых в реакции электронов и F = 96 485 Кл/моль. Необходимо отметить, что реакции, которые могут
протекать и как восстановительные, и как окислительные в отношении субстратов, здесь приведены как реакции
окисления. В зависимости от условий среды некоторые реакции могут иметь направление либо восстановления,
либо окисления. Реакции, идущие только в направлении восстановления субстратов, обозначены звездочкой
Окислительно-восстановительные полуреакции Eq, мВ
1. Водород Н2 — 2 Н+ + 2 с" -418
(Ео = 0; pH 0)
2. Восстановленные одноуглеродные соединения СН4 + 2 Н2О -> СО2 + 8 Н+ + 8 е“ -239
СО 4- П2О -> СО2 + 2 Н+ + 2 е" -492
3. Восстановленные соединения серы HS“ + 4 II2O -> SO2- + 9 Н+ + 8 е~ -218
S0 + 4 Н2О — SO2~ + 8 П+ + G е“ -200
HS- — S° + Н+ + 2 е“ -278
SO2- + Н2О — SO2- + 2 Н+ + 2 е- -526
S2O2- + 8 Н+ + 8 е~ -» 2 HS~ 4- 3 Н2О * -193
S2O“ 2 + 5 Н2О 2 SO2- + 10 II1 + 8 е- -242
SO^~ + 7 Н+ + 6 е" -> IIS” + 3 Н2О * -116
4. Восстановленные соединения азота NH+ + 2 Н2О NO“ +8 Н+ + 6 е“ 4-340
NO2 + Н2О -» NO3 + 2 Н+ + 2 е“ 4-431
2 NO" + 12 Н+ + 8 е“ -> N2 4- 6 Н2О * 4-824
2 NO^ 4- 8 14+ 4- 6 е_ -> П2 4- 4 П2О * +956
N2O 4- 2 II+ + 2 е~ -> Ы2 4- Н2О * 4-1354
2 NIl+ -> N2 4- 8 Н+ 4- 6 е“ -277
5. Восстановленные металлы Ре2+ -» Fe3+ 4- е" 4-770
Мп2+ 4- 2 Н2О -> МпО2 + 4 11+ 4- 2 е" 4-615
6. Пиридиннуклеотиды NADH 4- Н+ -> NAD+ 4- 2 Н+ 4- 2 е~ -320
NADPH 4- Н+ -> NADP+ 4- 2 Н+ 4- 2 е~ -324
7. Хиноны
QH2 —» Кофермент Q 4- 2 Н+ 4- 2 е~ 4-Ю0
8. Цитохромы 2 Цитохром Ьк(восст.} 2 Цитохром Ьк(ок ) 4- 2 е" 4-30
2 Цитохром свосст —» 2 Цитохром сОК 4- 2 е“ 4-254
2 Цитохром овосст —» 2 Цитохром оок 4- 2 е~ 4-270
2 Цитохром а3(восст.) -> 2 Цитохром а3(ок } 4-2 е- 4-385
9. Кислород О2 4- 4 Н+ 4- 4 е“ -> Н2О 4-816 4-Ю54 (pH 3) 4-1233 (pH 0)
296 Часть III. Многообразие метаболических путей
Дополнение 10.1. Из данных, представ-
ленных в табл. 10.2, следует, что при окис-
лении Нг с участием таких акцепторов элек-
тронов, как Ог, NO3, SO4- или НСО3,
изменение свободной энергии Гиббса (AG)
равно соответственно —237, —224, —38 и
—34 кДж/моль Н2, т. е. наибольшее количе-
ство энергии может быть получено при окис-
лении водорода кислородом, наименьшее — в
случае, когда акцептором электронов служит
НСО3 . Поэтому не удивительно, что предпо-
чтительным акцептором электронов служит
для микробов молекулярный кислород и при
его недостатке в первую очередь использует-
ся нитрат. Восстановление сульфата (сульфа-
тредукция) и НСО^ (метаногенез) возможно
только в строго анаэробных условиях, после
полного исчерпания в среде кислорода и нит-
рата. При этом в условиях высокого содер-
жания сульфата протекает преимущественно
процесс сульфатредукции, тогда как метано-
генные бактерии начинают развиваться толь-
ко после исчерпания сульфата. В зависимости
от физических, химических или биологиче-
ских факторов в конкретных местообитани-
ях могут наблюдаться и отклонения от этого
правила.
Приставки «окси-» и «анокси-» озна-
чают наличие и отсутствие кислорода
соответственно. Например, оксигенный фо-
тосинтез — это фотосинтез с выделением
кислорода, аноксигенный — без выделения
кислорода. Близкими по смыслу к этим
приставкам терминами аэробный и анаэ-
робный описывают условия в среде обита-
ния. В то же время в микробиологической
литературе нет строгих правил использо-
вания этих терминов. Часто приставкой
(ан) окси-характеризуют наличие/отсутствие
кислорода в том или ином местообита-
нии, термином (ан) аэробный — тип обмена
веществ или способ существования микроор-
ганизма. В описаниях микробиологических
технологий приставка «анокси-» означает
рост в отсутствие кислорода, тогда как тер-
мином анаэробный характеризуется рост в
отсутствие кислорода, нитрата или нитрита.
В таком контексте эти термины указывает
не наличие или отсутствие О2, а значение
редокс-потенциала среды культивирования.
10 .1.2. Изменение свободной энергии Гиббса
в реакции зависит от концентраций
субстратов и продуктов
Для расчета изменения свободной энергии Гиббса
(AGpJ в данной реакции необходимо внести по-
правку в стандартное значение, приведенное для
нее в справочниках (AGpJ, с учетом реальных
концентраций субстратов и продуктов. Напри-
мер, для реакции
аА + ЬВ => сС + dD (10.1)
поправка должна быть следующей:
AGR = AG°R + KTtagg, (10.2)
где AGr — изменение свободной энергии Гиббса
в данной реакции, АС’р — изменение стандартной
свободной энергии Гиббса, R — универсальная га-
зовая постоянная (= 8,314 Дж-моль-1-К-1), Т —
температура в градусах Кельвина. В химических
и физических справочниках значения AG^ при-
ведены для концентрации всех субстратов и про-
дуктов 1 моль/л, включая [Н+] (т. е. pH = 0).
Поскольку в биологических системах реакции
протекают при pH, близком к нейтральному, в
биологической литературе величины изменения
стандартной свободной энергии AG^ приводят-
ся для pH 7 (концентрация Н+, равная 10-7 М)
на основании расчета в соответствии с уравнени-
ем (10.2). Окислительно-восстановительный по-
тенциал полуреакции (редокс-потенциал одно-
го из двух участвующих в реакции субстратов;
табл. 10.2) рассчитывают с помощью следующего
уравнения:
r~t/ . R^E б^окисл. . .
F = Во + — In --------, (10.3)
‘ в о с ст.
где Е' — окислительно-восстановительный по-
тенциал полурсакции; Е'с — стандартный окис-
лительно-восстановительный потенциал при
Сокисл. = Свосст. = 7,0; F — константа Фарадея
(96 485 Кл-моль-1) и п — число переносимых в
реакции электронов.
Расчет стандартного окислительно-восстано-
вительного потенциала пары окис лите ль/восста-
новитель производят по уравнению
А£?0 — ^(акцептор) — Е'о (донор), (10-4)
где Eq (донор) и ^(акцептор)— стандартные по-
тенциалы полуреакций акцептора и донора элек-
тронов, представленные в табл. 10.2. На основа-
нии уравнения AG^' = —nFAE’g, по величине
Глава 10. Окисление неорганических соединений хемолитотрофами 297
окислительно-восстановительного потенциала ре-
акции окисления-восстановления рассчитываются
величины изменения свободной энергии Гиббса в
реакциях.
Поправку на реальные концентрации реаген-
тов (ниже 1 моль/л) для биологических систем
особенно важно делать при рассмотрении реак-
ций с небольшим изменением свободной энергии.
К ним относятся многие реакции окисления неор-
ганических соединений, в которых низкая концен-
трация субстрата или продуктов может влиять па
величину и знак (+ или —) AG, как показывают
следующие примеры.
1. Влияние низкой концентрации субстрата. Ве-
личина изменения стандартной свободной
энергии AG^ в реакции восстановления
НСО3 водородом [парциальное давление Н2
(рН2) = 1, pH = 7,0]
4 Н2 + Н+ + НСОз -> СН4 + 3 Н2О (10.5)
составляет —138,2 кДж/моль. Отрицательное
значение AGr означает, что при парциальном
давлении водорода, равном единице, реакция
сопровождается выделением энергии и, следо-
вательно, может протекать спонтанно. Однако
при рН2 = 10-6, приблизительно соответству-
ющем содержанию молекулярного водорода в
окружающей среде, величина AG^ становит-
ся равной 3,8 кДж/моль, и это означает, что
при данной концентрации водорода реакция
не может протекать спонтанно в направлении
восстановления НСО3 , но происходит в обрат-
ном направлении.
2. Примером влияния pH может служить реак-
ция окисления двухвалентного железа моле-
кулярным кислородом.
4Fe2+ + О2 + 4Н+ -> 4 Fe3+ J, +2Н2О (10.6)
Изменение свободной энергии AGr в
этой реакции при pH 7,0 равно лишь
— 17,7 кДж/моль, однако при снижении pH до
3,0 оно становится равным —91,0 кДж/моль,
поскольку в реакции с участием О2 потребля-
ются протоны. Этот пример связан с услови-
ями существования железоокисляющих бак-
терий, способных расти в нейтральной или
сильно кислой среде.
3. Влияние низкой концентрации продукта. Этот
пример также относится к реакции (10.6).
Многие соли железа, например карбонаты
и гидроксиды, практически нерастворимы
(знак |) при физиологических значениях pH.
Приведенная реакция сдвинута вправо в ре-
зультате удаления продукта. Если раствори-
мость Fe(OH)s при pH 7,0 принять равной
4 IO"38, реальная концентрация иона Fe3+ в
среде составит 4 • 10-17 М. При этой концен-
трации продукта изменение свободной энер-
гии AGp в реакции равно —373,88 кДж/моль.
Возрастание отрицательной величины AGr
происходит и в том случае, когда продукт дан-
ной реакции служит одновременно субстра-
том другой реакции или потребляется други-
ми микроорганизмами (например, в процес-
сах с межвидовым переносом водорода; см.
разд. 30.7.2).
Даже если данная реакция термодинамиче-
ски возможна, осуществление ее микробной клет-
кой еще не гарантирует получение биологиче-
ски полезной энергии. Свободная энергия, выде-
ляющаяся в той или иной химической реакции,
может быть использована осуществляющим эту
реакцию организмом лишь в том случае, если
он обладает механизмом ее сопряжения с запа-
санием химической энергии. Энергия может за-
пасаться в форме электрохимического протон-
ного потенциала па плазматической мембране
(синонимы — протондвижущая сила, протонный
потенциал, Ар, АрН+) или в виде богатого энер-
гией соединения, например АТР. У хемолитотро-
фов запасание энергии происходит главным обра-
зом в виде Ар (см. гл. 4). Для переноса прото-
нов с внутренней на внешнюю сторону мембраны
при Ар = —200 мВ затрачивается энергия, рав-
ная 19,3 кДж/«моль» Н+. Отсюда следует, что
окислительно-восстановительная реакция может
быть биологически полезной в том случае, если
изменение свободной энергии в пей составляет нс
менее 20 кДж на моль окисленного субстрата.
Хемолитотрофы получают энергию толь-
ко в результате осуществления окислительно-
восстановительных реакций. Некоторые из этих
реакций характеризуются низкими изменениями
свободной энергии Гиббса (AGp'). Для того, что-
бы предсказать, будет ли протекать та или иная
реакция в реальных условиях, необходимо скор-
ректировать стандартное значение AGp (= AGp
при pH 7) для действительных концентраций суб-
стратов и продуктов реакции.
298 Часть III. Многообразие метаболических путей
Таблица 10.3. Физиологические типы нефототрофных бактерий, окисляющих восстановленные соединения серы,
(Хемоорганогетеротрофы способны окислять соединения серы, но не получают за счет этих процессов энергию)
Физиологический тип Источник энергии (донор электронов) Источник углерода
восста но влен н ые соединения серы органические вещества СО2 органические вещества
Облигатные хемолитоавтотрофы + — + —
Факультативные хемолитоавтотрофы + + + +
Хемолитогетеротрофы + + — +
Хемоорганогетеротрофы — + — +
10.2. Хемолитотрофы весьма разнообразны по типам метаболизма
Концепция Виноградского вначале относилась ис-
ключительно к облигатным хе молитоавтотро-
фам, способным получать энергию только из
неорганических соединений и углерод только из
СОг- Однако помимо облигатных хемолитоавто-
трофов теперь известны многие роды нитрифи-
цирующих бактерий, водородокисляющих бакте-
рий и бесцветных серобактерий, включающие фа-
культативно хемолитоавтотрофные виды и
хемолитогетеротрофные виды. В этом смыс-
ле особенно показательны бесцветные серобакте-
рии, типы метаболизма которых представлены в
табл. 10.3.
Как видно на этом примере, облигатные
хемолитоавтотрофы — это «узкоспециализиро-
ванные» бактерии, получающие энергию путем
окисления неорганических соединений и углерод
из СОг, тогда как факультативные хемолито-
автотрофы обладают более широкими метабо-
лическими возможностями и способны расти как
автотрофно, окисляя соединения серы, так и ге-
теротрофно. Факультативно хемолитоавтотроф-
ные бактерии иногда называют миксотрофами,
поскольку они используют в определенных усло-
виях смесь субстратов, и осуществляемый ими
тип питания получил название миксотрофия. При
миксотрофном росте одновременно использу-
ются различные метаболические пути (например,
источником энергии служат сульфид и/или орга-
ническое соединение, источником углерода — СОг
и/или органическое вещество). Обычно миксотро-
фия имеет место при низких концентрациях ор-
ганических и неорганических субстратов в среде,
тогда как при высоких концентрациях субстратов
может наблюдаться диауксия — последователь-
ное использование двух субстратов. Хемолито-
гетеротрофы могут использовать восстановлен-
ные соединения серы как дополнительный источ-
ник энергии, но нс способны фиксировать СОг,
т. е. при любых условиях нуждаются в органиче-
ском источнике углерода.
Последнюю важную группу в этом спек-
тре представляют хемоорганогетеротрофные
бактерии. Они способны окислять соединения
серы, по не используют их в качестве источника
энергии. Для этих бактерий источником энергии
и углерода служат органические субстраты. Роль
процесса окисления восстановленных соединений
серы у этих бактерий остается неясной. Предпо-
ложительно окисление ими сульфида необходимо
для его детоксикации либо для детоксикации об-
разующегося в процессах метаболизма пероксида
водорода. Неспецифическос окисление неоргани-
ческих субстратов наблюдается и в других груп-
пах бактерий. Так, среди аммоний-окисляющих
бактерий известны «гетеротрофные нитрифика-
торы». Особый случай неспецифического окисле-
ния—это аэробное окисление аммония метано-
окисляющими бактериями. Содержащийся в их
клетках ключевой фермент окисления метана, мо-
нооксигеназа, обладает также низким сродством
к аммиаку, поскольку это структурный аналог
метана и его окисление происходит как побоч-
ный результат функционирования метанмоноок-
сигеназы. Этот тип случайного метаболизма на-
зывают кометаболизмом.
Глава 10. Окисление неорганических соединений хемолитотрофами 299
10.3. По механизмам запасания энергии хемолитотрофы
не отличаются принципиально от хемогетеротрофов
Водород и оксид углерода по сравнению с
другими соединениями имеют наиболее низ-
кие окислительно-восстановительные потенциа-
лы (см. табл. 10.2), и, следовательно, это наи-
более богатые энергией субстраты для хемоли-
тотрофного роста. Кроме того, благодаря низ-
кому редокс-потенциалу они могут, в отличие,
например, от аммония и/или ионов восстановлен-
ного железа, окисляться микробами с использо-
ванием таких акцепторов электронов, как суль-
фат или бикарбонат. В табл. 10.2 перечислены не
все реакции, способные поддерживать хемолито-
автотрофный рост бактерий. Дополнительно из-
вестно несколько необычных реакций, в которых
высвобождается достаточное количество свобод-
ной энергии, чтобы обеспечить возможность та-
кого роста. К ним относятся, в частности, диспро-
порционирование тиосульфата в сульфид и суль-
фат (AGr = 21,9 кДж/моль):
S2O|“ + Н2О -» HS“ + SO^ + Н+ (10.7)
Эта реакция, как установлено, обеспечивает хе-
молитотрофный рост некоторых сульфатредуци-
рующих бактерий (табл. 10.1). Другой пример —
это окисление аммония нитритом или нитратом
(AGr = —360 кДж/моль):
NH+ + NO2 -> К2 + 2Н2О (10.8)
Эта реакция поддерживает (автотрофный) рост
сообщества микроорганизмов, видовой состав ко-
торого пока не установлен.
10.3.1. Необходимые условия для запасания
энергии — отрицательное значение AG0/
и наличие механизма сопряжения
Как отмечено в начале этой главы, отрицатель-
ная величина изменения свободной энергии Гибб-
са (AG0/) — это обязательное условие протекания
реакции, но оно не означает автоматически, что
энергия, высвобождаемая в этой реакции, может
быть использована в метаболизме. Для запасания
энергии необходим механизм сопряжения, пре-
вращающий свободную энергию в энергию элек-
трохимического протонного потенциала (Ар) или
АТР. Напомним, что существует три механизма
образования протондвижущей силы (см. гл. 3 и 4;
рис. 4.1-4.7): 1) «конформационная» протонная
помпа в электронтранспортной цепи (папример,
цитохромоксидаза), переносящая протоны с внут-
ренней стороны плазматической мембраны на ее
внешнюю сторону; 2) перенос протонов через мем-
брану посредством Q-цикла и 3) формирование
протонного потенциала без переноса протонов че-
рез мембрану, по за счет связывания и выделе-
ния Н+ по разные стороны м ембраны в результате
протекания окислительно-восстановительных ре-
акций. Этот последний тип образования протон-
ного потенциала, называемый скалярным, иллю-
стрируют два следующих примера.
1. Бактерии Thiobacillus ferrooxidans окисляют
восстановленные соединения серы до серной кис-
лоты, и вследствие этого среда их обитания все-
гда имеет кислую реакцию. В то же время внут-
риклеточный pH у них близок к нейтральному
и благодаря этому на плазматической мембране
создается высокий протонный градиент, который
может быть использован для синтеза АТР, при
условии того что поступающие внутрь клетки
протоны нейтрализуются в химической реакции.
Это происходит при окислении железа:
4Fe2+ —» 4Fe3+ + 4е~ (снаружи) (10.9)
О2 + 4Н+ + 4е“ —* 2Н2О (внутри) (10.10)
В результате окисления Fe2+ электроны пересека-
ют мембрану по цепи переносчиков и передаются
на кислород (см. рис. 10.13), тогда как протоны
потребляются. Нейтрализация внутриклеточных
протонов с образованием воды в цитохромокси-
дазной реакции обеспечивает поддержание про-
тонного градиента и образование АТР при ста-
бильно кислой реакции наружной среды.
2. Сульфатрсдуцирующие бактерии окисляют
молекулярный водород с образованием Н+ на
внешней стороне мембраны. Электроны перено-
сятся по дыхательной цепи на внутреннюю сторо-
ну мембраны, где их акцептором служит сульфат.
Таким образом происходит, с одной стороны, вы-
деление протонов на внешней стороне мембраны
и, с другой стороны, связывание протонов внут-
ри клеток, т. е. образуется протонный градиент,
300 Часть III. Многообразие метаболических путей
используемый для синтеза АТР.
4Н2 —» 8Н++ 8е~ (снаружи) (10.11)
SO2- + 8Н+ + 8е~ —> S2- + 4Н2О (внутри)
(10.12)
Суммарная реакция записывается следующим об-
разом:
4Н2 + SO2~ + 8Н+ (внутри) —>
-> H2S + 4Н2О + 8Н+ (снаружи) (10.13)
В процессах окисления многих неорганических
субстратов протонные помпы и системы скаляр-
ного формирования градиента протонов могут
функционировать одновременно, и это следует
учитывать при расчете результирующей величи-
ны протондвижущей силы.
10.3.2. В редких случаях механизмом запасания
энергии служит у хемолитотрофов
субстратное фосфорилирование
В отдельных случаях образование АТР у хемо-
литотрофов происходит, возможно, путем суб-
стратного фосфорилирования (см. гл. 3).
Пока известен только один пример действия
такого механизма — субстратное фосфорилирова-
ние при окислении сульфита у некоторых ви-
дов рода Thiobacillus (например, Т. thioparus и
Т. denitrificans) [реакции (10.14)-(10.16)]. В этой
экзергонической реакции из АМР образуется вы-
сокоэнергетический интермедиат адепозинфосфо-
сульфат (АФС), превращающийся затем в ADP.
Из двух молекул ADP образуются АТР и АМР.
„ АФС-редуктаза
SO^“ + АМР----------------> АФС + 2е~ (10.14)
ADP-сульфурилаза „
АФС + Pi------------------->ADP + SO2~ (10.15)
Адеиилаткиназа
2ADP----------------> АТР + АМР (10.16)
10.3.3. Дыхательные цепи у хемолитотрофов и
хемоорганогетеротрофов весьма сходны
К настоящему времени подробно изучены элек-
тронтранспортные цепи у нескольких хемолито-
трофных бактерий. В некоторых деталях эти це-
пи различаются, по принципиально они сход-
ны по составу компонентов и могут быть рас-
смотрены на примере Paracoccus denitrificans —
факультативного хемолитоавтотрофа, способно-
го использовать в качестве донора электронов
водород или восстановленные соединения серы
(рис. 10.2). Сходные по составу цитохромов це-
пи переноса электронов обнаружены у других
бактерий, включая близкородственный организм
Thiosphaera pantotropha.
При использовании в качестве источника энер-
гии органических веществ, в процессе их окис-
ления образуется NADH, от которого электро-
ны передаются на флавин (относительно низкий
редокс-потенциал; см. табл. 10.2), затем на хи-
нон и далее па цитохромы. Конечным акцепто-
ром электронов служит в данном случае кисло-
род или окисленные соединения азота (рис. 10.2).
Штриховыми вертикальными стрелками на этом
рисунке показаны участки электронтрапспортной
цепи, сопряженные с переносом протона через
плазматическую мембрану (протонтрапслоциру-
ющая петля). Если донором электронов служит
используемый многими хемолитотрофными мик-
роорганизмами молекулярный водород, он окис-
ляется с участием, вместо NAD-зависимой окси-
доредуктазы, гидрогеназы, передающей его элек-
троны непосредственно на хинон или цитохром Ь.
Такое окисление Н2 дает меньше биологически ис-
пользуемой энергии в форме Др, чем окисление
NADH, хотя теоретически при окислении Н2 энер-
гии выделяется больше, чем при окислении NADH
(см. табл. 10.2). Тем не менее этот путь окисле-
ния Н2 более выгоден, поскольку он обеспечивает
большую скорость получения энергии, во-первых,
за счет потерн одного участка трансмембранного
переноса Н+, и, во-вторых, вследствие возраста-
Рис. 10.2. Дыхательная электронтранспортная цепь и
реакции денитрификации у Paracoccus denitrificans и
родственных бактерий. Сплошными стрелками обозна-
чен перенос электронов, пунктирными — поступление е-
в цепь, штриховыми — перенос протона. Фп — флаво-
протеин; Цит — цитохром; Q — хинон.
Глава 10. Окисление неорганических соединений хемолитотрофами 301
ния отрицательной величины изменения свобод-
ной энергии. При окислении водорода через хи-
нон или цитохром b [уравнение (10.10)] величина
выделяющейся в реакции свободной энергии вы-
ше по сравнению с теоретически возможной при
окислении с участием NAD+ [уравнение (10.17)],
даже при обычном в природных местообитани-
ях низком содержании водорода, 10~4-10-5 атм
(1-10 Па) [уравнение (10.20)].
NADH + Н+ + О2 + 3ADP + 3Pi ->
NAD+ + Н2О + ЗАТР (10.17)
ДС'0/ = —131,2 кДж/моль
Н2 + — О2 + 3ADP + ЗР i —>
->Н2О + ЗАТР (10.18)
ДС0/ = —149,4 кДж/моль
Н2 + i О2 + 2ADP + 2Р, ->
-> Н2О + 2АТР (10.19)
Д<90/ = —178,8 кДж/моль
Н2 (10“4 атм; 10 Па) + | О2 + 2ADP + 2Р, -»
-> Н2О + 2АТР (10.20)
ДС0/ = —156,2 кДж/моль
Увеличение свободной энергии, выделяющей-
ся в реакции, означает сдвиг последней в направ-
лении образования продуктов и, следовательно,
ускорение реакции. Таким образом, потеря одного
пункта сопряжения с синтезом АТР компенсиру-
ется более высокой скоростью окисления Н2 [ре-
акция (10.19) и даже (10.20) протекают с большей
скоростью, чем реакция (10.18)]. Некоторые водо-
родные бактерии, например Alcaligenes eutrophus,
имеют две гидрогеназы — одна из них передает
электроны в дыхательную цепь на уровне цито-
хромов, другая представляет собой водораство-
римую NAD+-3aBHciiMyio оксидоредуктазу. В то
же время у большинства водородных бактерий
и почти всех других хемолитотрофов восстанов-
ление NAD+ происходит с затратой энергии, по-
скольку используемый неорганический источник
энергии/допор электронов имеет слишком высо-
кий окислительно-восстановительный потенциал,
чтобы электроны могли передаваться па NAD+.
Во многих случаях соответственно окисли-
тельно-восстановительному потенциалу субстра-
та, например, если это тиосульфат, начальным ак-
цептором электронов при его окислении может
служить только цитохром b или с. В немногих
случаях возможна передача электронов в цепь на
уровне цитохрома Ь. Это означает, что электроны
проходят только через одну или иногда две про-
тонтранслоцирующих петли на пути к кислоро-
ду. У многих серных бактерий электроны посту-
пают в дыхательную цепь на уровне цитохрома с,
что, вероятно, обусловлено кинетически. У денит-
рпфикаторов некоторое количество электронов
должно поступать в цепь на уровне цитохрома Ь,
чтобы могло происходить восстановление нитрата
до нитрита. Нитрит, в свою очередь, может быть
восстановлен цитохромом с (рис. 10.2). Посколь-
ку во всех этих случаях число пунктов сопряже-
ния переноса электронов с синтезом АТР огра-
ничено двумя или даже одним участком, такие
бактерии, как, например, Paracoccus denitrificans
и Thiosphaera pantotropha, в присутствии тиосуль-
фата как донора и нитрата как акцептора элек-
тронов либо растут очень медленно, либо не спо-
собны к росту, тогда как водород хорошо поддер-
живает их рост в среде с нитратом.
Обратный транспорт электронов □ В со-
ответствии с законами термодинамики перенос
электронов в электронтранспортной цепи возмо-
жен от донора электронов, имеющего более низ-
кий окислительно-восстановительный потенциал,
к акцептору электронов с более высоким потен-
циалом. Вместе с тем хемолитотрофы часто ис-
пользуют в качес ве доноров электронов субстра-
ты с более высоким потенциалом (например, тио-
сульфат или сульфид), чем пара NAD+/NADH.
В этом случае NADH, основной восстановитель в
метаболизме аэробных бактерий, восстанавлива-
ется путем обратного переноса электронов, т. е.
их транспорта против термодинамического гра-
диента потенциала — от донора электронов с бо-
лее высоким стандартным окислительно-восста-
новительным потенциалом на NAD+, имеющий
более низкий стандартный окислительно-восста-
новительный потенциал. Все реакции, протекаю-
щие в направлении против термодинамического
потенциала, требуют затраты энергии. Для пере-
302 Часть III. Многообразие метаболических путей
носа двух электронов от цитохрома с —акцепто-
ра электронов от тиосульфата или сульфида — на
NAD+ затрачивается энергия трансмембранного
градиента протонов, эквивалентная энергии двух
молекул АТР. В целом хемолитоавтотрофы для
восстановления NAD+, который далее использу-
ется в процессе фиксации СОг, расходуют от 10
до 20% энергии, запасенной в молекуле неоргани-
ческого восстановителя. Количество затраченной
на эти цели энергии зависит от вида бактерий и
особенностей их метаболизма.
У хемолитоавтотрофов при окислении неорга-
нических восстановленных соединений электро-
ны передаются в электронтранспортную цепь на
уровне цитохрома b или с. Далее их перенос про-
исходит в двух противоположных направлени-
ях: «вниз» — по термодинамическому потенциалу
для запасания энергии в форме трансмембран-
ного протонного электрохимического потенциала,
Др, и «вверх», против термодинамического потен-
циала, для образования восстановителя — NADH,
используемого при фиксации СОг-
10.4. По углеродному метаболизму хемолитотрофы
не отличаются от гетеротрофов и фототрофов
Известно большое число хемолитоавтотрофных
видов как среди бактерий, так и среди архей.
Углеродный метаболизм у этих видов отличает-
ся от углеродного метаболизма гетеротрофов в
основном наличием автотрофной фиксации СОг-
Большинство бактерий-хемолитоавтотрофов осу-
ществляет автотрофную ассимиляцию СОг в цик-
ле Кальвина-Бенсона-Бассама (см. разд. 8.1.1).
Метаногены, ацетогены и некоторые сульфатрс-
дукторы фиксируют СОг по ацетил-СоА-пути.
Третья группа хемолитотрофов для фиксации
СО2 использует восстановительный цикл трикар-
боновых кислот. Недавно открыт также 3-гидро-
ксипропионатный цикл, способный обеспечивать
фиксацию СО2.
Большинство хемолитоавтотрофов фик-
сирует СО2 в цикле Кальвина □ Необходи-
мо рассмотреть аспекты углеродного и энергети-
ческого метаболизма, связанные с этим циклом.
В целом цикл Кальвина высокоэнергоемкий про-
цесс: в расчете па одну фиксированную молеку-
лу СО2 в нем расходуется для образования гек-
созы, по-видимому, 3 молекулы АТР и 2 молеку-
лы NADH. В отношении АТР этот расчет верен
только для случая образования NADH в резуль-
тате прямого восстановления с участием Н2, как у
Alcaligenes eutrophus. Если водород (или тиосуль-
фат) окисляется с передачей электронов на ци-
тохром b или с, дополнительно необходимы две
или четыре молекулы АТР соответственно на об-
ратный транспорт электронов для восстановле-
ния двух молекул NAD+, т. е. образование гексо-
зы требует в расчете на одну молекулу СОг (3+2)
или (3 + 4) молекулы АТР. В расчете на молекулу
гексозы это составляет 30 (или 42) молекулы АТР.
Урожай клеток при автотрофном росте примерно
коррелирует со степенью восстановления донора
электронов (источника энергии), но может суще-
ственно варьировать у разных видов. При окис-
лении железа в условиях кислой реакции среды
выход биомассы составляет 0,4-0,7 г/2 моль е~,
перенесенных на О2, при окислении тиосульфа-
та— 0,7-2,0 г/2 моль е”, для аммония и водоро-
да — 0,6 и 2,0 г/2 моль соответственно.
Анаплеротические реакции карбоксили-
рования □ Помимо цикла Кальвина, хемолито-
автотрофы ассимилируют СО2 в анаплеротиче-
ских реакциях карбоксилирования, необходимых
им, в частности, как и гетеротрофам, для вос-
полнения пула промежуточных продуктов цик-
ла Кребса, используемых в биосинтетических
реакциях. Одна из анаплеротических реакций —
карбоксилирование фосфоеншширувата с обра-
зованием оксалоацстата. При хемолитоавтотроф-
ном росте цикл Кребса обеспечивает исклю-
чительно биосинтетические потребности, но не
получение энергии. В этом случае он действует
не как замкнутый, а как разомкнутый цикл в ви-
де «подковы» (рис. 10.3) в результате отсутствия
в клетках 2-оксоглутаратдегидрогеназы. Облигат-
ные хемолитоавтотрофы не способны синтезиро-
вать этот фермент, у факультативных видов его
Глава 10. Окисление неорганических соединений хемолитотрофами 303
Рис. 10.3. Неполный цикл трикарбоновых кислот и
биосинтетические функции его реакций у облигатных
хемолитоавтотрофов — организмов, лишенных 2-оксо-
глутаратдегидрогеназы. Экзогенный ацетат может
участвовать в биосинтезе аминокислот семейства
глутаминовой кислоты, но не аспарагиновой кислоты,
в отличие от того, что имеет место у бактерий с
функционирующим полным циклом.
синтез в условиях автотрофного роста подавлен.
Поэтому оксалоацетат необходим не только для
синтеза обычным путем 2-оксоглутарата, но и для
синтеза в обратном направлении малата и сукци-
ната. Такой экзогенный субстрат, как ацетат, мо-
жет включаться только в реакции правой части
«подковы». Поскольку хемо литоавтотрофы нс об-
ладают ферментами глиоксилатного цикла, аце-
тат используется ими исключительно как источ-
ник углерода для синтеза аминокислот семей-
ства глутамата и для других реакций с участием
ацетил-СоА.
Облигатные хемолитоавтотрофы не спо-
собны к транспорту органических субстра-
тов □ Выяснению причин неспособности об-
лигатных автотрофов расти с использованием
органических веществ были посвящены много-
численные исследования. Эта неспособность каза-
лась особенно необъяснимой в связи с тем, что
внутриклеточные полимеры глюкозы (запасные
вещества) могут окисляться у этих организмов
через пентозофосфатный цикл, и это обеспечива-
ет получение энергии поддержания. Как теперь
известно, облигатные хемолитоавтотрофы лише-
ны белков-переносчиков, которые могли бы пере-
носить сахара в клетки. В то же время они об-
ладают переносчиками для ацетата и некоторых
аминокислот, однако и эти субстраты не обеспе-
чивают гетеротрофный рост. При внесении в сре-
ду они ассимилируются клетками, но вклад их в
общил клеточный углерод не превышает 20-30%
общего углерода биомассы, т. е. в любых услови-
ях основным источником углерода служит для об-
лигатных хемолитоавтотрофов СОг- Следует от-
метить, что NADH-дегидрогеназная активность
у них очень низка даже в присутствии экзоген-
ных органических соединений, что также препят-
ствует эффективному использованию последних
для роста. Таким образом, облигатный характер
автотрофии отражает крайнюю степень специ-
ализации этих организмов, при которой все
необходимые метаболические пути действуют
конститутивно и лишь немногие ферменты син-
тезируются как индуцибельные. Исключение со-
ставляет глутаминсинтетазный-глутаматсинтаз-
пый путь ассимиляции азота, используемый при
дефиците этого элемента (см. гл. 7). Неспособ-
ность облигатных хемолитоавтотрофов к пере-
ключению па альтернативные источники пита-
ния существенно ограничивает возможности их
изучения молекулярно-генетическими методами с
использованием рекомбинантных ДНК, посколь-
ку мутации, затрагивающие пути ассимиляции и
диссимиляции, у них, как правило, летальны. По-
этому в большинстве исследований хемолитоавто-
трофного метаболизма и его регуляции объекта-
ми служат факультативные хемолитоавтотрофы.
Можно было бы обойти эту трудность, например
путем клонирования генов облигатных хемолито-
трофов в клетках факультативных хемолитотро-
фов, однако здесь возникает то препятствие, что
многие облигатные хемолитоавтотрофы не спо-
собны формировать колонии при росте на плот-
ной среде в чашках Петри и поэтому невозможен
скрининг колоний по искомым признакам.
Из-за своей узкой специализации облигатные
хемолитотрофы энергетически весьма «стеснены
в средствах» и, кроме того, для них особую про-
блему составляет получение достаточного коли-
чества восстановительных эквивалентов для ас-
симиляции СОг- Тем не менее они успешно вы-
живают в условиях конкуренции благодаря спо-
собности окислять «свой» набор субстратов или
один субстрат с очень высокой скоростью, обыч-
но в 2-3 раза превосходя в этом отношении фа-
культативно хемолитотрофные организмы. Такая
скорость окисления связана с повышенным содер-
304 Часть III. Многообразие метаболических путей
жанием в плазматической мембране компонентов
дыхательной цепи, и весьма вероятно, что их вы-
сокая концентрация просто «экономически» ис-
ключает присутствие в мембранах переносчиков
сахаров. В то же время высокая скорость окисле-
ния неорганического субстрата обеспечивает об-
лигатным хемолитотрофам способность конкури-
ровать с факультативными видами только в усло-
виях низкого содержания органических субстра-
тов в среде. Таким образом, автотрофию можно
рассматривать также как адаптацию к росту в
средах, бедных органическими субстратами.
10.5. Хемолитотрофы адаптированы к росту в особых,
часто экстремальных средах, бедных органическими веществами
Для роста и выживания хемолитотрофам, как и
другим живым организмам, необходимы благо-
приятные физико-химические условия (pH, тем-
пература, редокс-потенциал, соленость и др.), но
особенность этих бактерий состоит в том, что они
способны обитать даже на границах того диа-
пазона экологических сред, в которых возможна
жизнь. Так, некоторые экстремально термофиль-
ные водородокисляющие бактерии могут расти
при температуре 105 °C, ацидофильные бактерии
(окисляющие соединения серы) — при pH ниже 2,
другие хемолитотрофы толераптны к высоким
концентрациям тяжелых металлов. Главное усло-
вие для существования хемолитотрофов — это
наличие неорганических субстратов, одни из ко-
торых могут быть использованы как источники
энергии/доноры электронов и другие как акцеп-
торы электронов.
Местообитания хемолитотрофов богаты ис-
точниками восстановленных неорганических
соединений геологического, биологического и ан-
тропогенного происхождения. Их многообразие
иллюстрирует рис. 10.4. В табл. 10.4 приведены
количественные оценки образования и потребле-
ния соответствующих атмосферных газов.
Хемолитотрофпые бактерии выполняют су-
щественную роль в общем круговороте веществ
(см. гл. 32). Как видно из рис. 10.1, осу-
ществляемый фототрофами процесс фотосинтеза
(первичной продукции) служит источником обра-
зования органических веществ, которые в свою
очередь служат источниками энергии для всех
других форм жизни. Многие из этих соединений
окисляются в аэробных условиях с использовани-
ем выделяемого при фотосинтезе кислорода, кото-
рый при этом рециклизуется с образованием Н2О
(на рис. 10.1 не показано). При исчерпании О2
прокариоты осуществляют сбраживание органи-
Рис. 10.4. Геологические, биологические и антропоген-
ные источники восстановленных неорганических соеди-
нений, используемых хемолитотрофами. Наибольшее
количество восстановленных неорганических субстратов
происходит из биогенных источников.
ческих веществ либо их окисление с образо-
ванием, в качестве конечных продуктов, вос-
становленных неорганических соединений, таких
как Н2, H2S, N2, NH3, СН4 и Fe(II). Хемоли-
тотрофы переводят эти восстановленные неор-
ганические конечные продукты, за исключени-
ем N2, вновь в окисленную форму, исполь-
зуя кислород или нитрат в качестве акцепторов
электронов. Типичное местообитание большин-
ства физиологических типов хемолитотрофов —
это граница раздела кислородной и бескислород-
ной зон, например поверхность иловых донных
отложений или зона термоклина в стратифици-
рованных водоемах. В этих зонах присутству-
ют одновременно органические вещества, кис-
Глава 10. Окисление неорганических соединений хемолитотрофами 305
Таблица 10.4. Скорость образования и потребления
(исчезновения) атмосферных газов. Диапазоны значе-
ний, приведенные в таблице, составлены по данным раз-
ных авторов, чтобы показать порядок величин для гло-
бальных потоков газов. Tg = 1012 г
Соединение Tg/год1
образование поглощение
СО 3315 ± 1 700 2500 ± 770
СН4 170-854 ?
н2 89 89
H2S (43) ? 3
so2 (86) ? 3
NOX 39-48,4 24-43
n2o 15,3 ±6,7 2 14 ± 3,5 2
NH3 54 49
1 По Warneck Р. (1988) Chemistry of the natural atmosphere.
San Diego: Academic Press.
2 По Davidson E. A. (1991) Fluxes of nitrous oxide and
nitric oxide from terrestrial ecosystems. In: Rogers J. E.<
Whitman W. B. (eds.). Microbial production of greenhouse
gases: methane, nitrogen oxide and halomethanes.
Washington DC: ASM Press; 219-236.
3 Оценка потребления газов, содержащих серу, затруднена
из-за их быстрых взаимопревращений.
лород и окис ленные/восстанов ленные неоргани-
ческие соединения, т. е. создаются условия, бла-
гоприятные для роста хемолитотрофов.
Дополнение 10.2. Геохимические цик-
лы. 1. Молекулярный водород образует-
ся в качестве конечного продукта во многих
процессах брожения. Последующее его пре-
вращение-окисление до воды (переход в
наиболее окисленное состояние). Поскольку
образование Н2 происходит главным образом
в анаэробных условиях, окисляют его в ос-
новном сульфатредуцирующие бактерии, ме-
таногены или ацетогены. Если Н2 проника-
ет в зону, где присутствует кислород или
нитрат, его окисляют хемолитотрофные бак-
терии. 2. Соединения серы. Сероводород
образуется при (ан)аэробном гидролитиче-
ском разложении серусодержащих органиче-
ских соединений и в большом количестве в
процессе сульфатредукции. Через ряд проме-
жуточных стадий H2S окисляется до суль-
фата (рис. 10.5) хемолитотрофными и фо-
тотрофными бактериями. Промежуточные
продукты окисления H2S используют в
качестве акцепторов электронов сульфатре-
дуцирующие бактерии, и в результате могут
возникать те или иные минициклы, в за-
висимости от наличия доноров е~ для
активности сульфатредукторов или акцепто-
ров электронов для бактерий, окисляющих
соединения серы. 3. Металлы. В анаэ-
робных местообитаниях Fe(III) и М11О2
могут использоваться бактериями в качестве
терминального акцептора электронов в про-
цессах анаэробного дыхания. Образующиеся
при этом Fe(II) и Мп2+ используют соот-
ветствующие хемолитотрофные бактерии,
обитающие вблизи границы раздела между
аэробной и анаэробной зонами. Окисляя
эти субстраты, они переводят их в труд-
иорастворимые формы — Ее(Ш)-гидроксид,
Ее(П)-сульфид, Ее(Ш)-фосфат и М11О2.
По-видимому, этот цикл Fe(II)/Fe(III) и цикл
Мп с промежуточным образованием М11О2
служат важными электрон-переносящими
циклами при относительно высоких величи-
нах редокс-потепциала в анаэробных осадках.
4. Соединения азота. Аммоний образуется
в результате анаэробного или аэробного
микробного разложения азотсодержащих ор-
ганических веществ (аммонификация). При
анаэробном окислении органических веществ
источником образования NH3 служит также
диссимиляционная нитратредукция (нитрат-
ное дыхание), осуществляемая некоторыми
анаэробными гетеротрофными бактериями.
Последующее окисление аммония до нитрита
и далее до нитрата осуществляют нитрифи-
цирующие бактерии (нитрификация). Они
обитают на. границе раздела между аэробной
и анаэробной зонами в водоемах, поскольку
донные отложения служат богатым источ-
ником аммония. Все эти микроорганизмы
создают на границе раздела миницикл азо-
та, в котором аэробные питрификаторы
окисляют аммоний с образованием нитрита,
тогда как анаэробные депитрификаторы
немедленно вновь восстанавливают его до
аммония.
306 Часть III. Многообразие метаболических путей
Рис. 10.5. Мини-циклы в общем цикле серы.
Таким образом, в местах обитания хсмоли-
то грофов имеется большое разнообразие восста-
новленных неорганических соединений, способ-
ных служить источниками энергии/донорами е~.
Соответственно этому существует поразительное
физиологическое и метаболическое многообразие
хемолитотрофных бактерий. Многие их метабо-
лические типы весьма сходны, однако анализ
16S-pPHK показывает, что они лишь отдален-
но родственны в таксономическом отношении.
Исходя из этого предполагается, что хемолито-
трофный тип метаболизма мог возникать неза-
висимо в различных эволюционных линиях как
результат конвергентной эволюции. Совместное
обитание столь многочисленных видов бактерий
со сходными свойствами возможно благодаря
наличию большого числа экологических ниш, обу-
словленных не только абиотическими, но и биоти-
ческими факторами. Поэтому при описании раз-
личных групп хемолитотрофов необходимо рас-
сматривать не только характер их местообитаний,
но и различные возможные типы микробного вза-
имодействия, такие как мутуализм, конкуренция
за субстраты и хищничество, влияющие на рост
и выживание хемолитоторофов с различными ти-
пами питания. В последующих разделах рассмат-
риваются различные группы литотрофных бакте-
рий, выделяемые в соответствии с их основными
субстратами, а также использование этих бакте-
рий для очистки сточных вод и выщелачивания
руд (см. также гл. 32).
Дополнение 10.3. Разнообразие физиоло-
гических типов хемолитотрофов тесно свя-
зано с различиями в их экологических ни-
шах. Закономерен вопрос, каким образом в
одном и том же месте могут выживать и
даже сосуществовать все метаболические ти-
пы хемолитрофов, приведенные в табл. 10.3.
Современное объяснение этого феномена со-
стоит в том, что, по-видимому, «ниша» каж-
дого метаболического типа обусловлена от-
носительной скоростью оборота органиче-
ских соединений по сравнению с неоргани-
ческими в данном местообитании (рис. 10.6).
Эта гипотеза основана, па допущении, что в
большинстве сред скорость роста микробной
популяции лимитируют уровни источников
углерода и энергии. В этих условиях теорети-
чески возможна миксотрофия. Если скорость
поступления в среду неорганического суб-
страта значительно превышает скорость по-
ступления органических соединений, преиму-
щество имеют высокоспециализированные
хемолитоавтотрофы, тогда как при равенстве
скоростей поступления в среду органическо-
го и неорганического субстратов создаются
благоприятные условия для роста факульта-
тивно хемолитоавтотрофных бактерий, кото-
рым свойствен миксотрофный тип питания.
Высокое соотношение концентрации органи-
ческих/неорганических субстратов благопри-
ятствует росту хемолптогетсротрофов. Хотя
такая смена популяций доказана в модельных
экспериментах па смешанной культуре серу-
окисляющих бактерий при проточном куль-
тивировании с лимитированием по источнику
энергии, следует принимать во внимание, что
в природных условиях экологическую нишу
данного организма определяют и многие дру-
гие факторы и механизмы, например, суточ-
ный ритм, который может вызывать значи-
тельные колебания в содержании кислорода,
органических и неорганических субстратов и
уровне pH. Разумеется, лимитировать рост
могут и другие питательные вещества, на-
пример микроэлементы. Такие факторы без-
условно влияют па результат конкуренции за
субстраты, и как выживание, так и рост каж-
дого микроорганизма зависят не только от од-
ного или двух, но от всех влияющих факто-
ров.
Глава 10. Окисление неорганических соединений хемолитотрофами 307
Рис. 10.6. Встречаемость метаболически различных ти-
пов серных бактерий в пресной воде в условиях лимити-
рования роста недостатком энергии. Данное распреде-
ление представляет собой функцию относительной ско-
рости оборота имеющихся органических и неорганиче-
ских субстратов.
10.6. Серные бактерии составляют весьма гетерогенную группу
Сероводород, сульфиды металлов, полисульфи-
ды, тиосульфат, политионаты, молекулярная се-
ра и сульфит служат субстратами для разнооб-
разных бактерий; эту чрезвычайно гетерогенную
группу обычно называют группой бесцветных
серных бактерий. Термин бесцветные исполь-
зуется для того, чтобы отличать эти бактерии
от пигментированных фототрофов, окисляющих
соединения серы (см. гл. 13). Наиболее распро-
страненные роды бесцветных серных бактерий
приведены в табл. 10.5. Близкие по способности
окислять соединения серы, они тем не менее в
большинстве относятся к различным, не родствен-
ным в систематическом отношении группам бак-
терий. Низкая степень родства по данным анализа
16S-pPHK обнаруживается даже в пределах одно-
го рода Thiobacillus (рис. 10.7).
Большинство известных родов бесцветных сер-
ных бактерий относится к Proteobacteria (домен
Bacteria), и два рода — Sulfolobus и Acidianus— к
домену Archaea. Многие бесцветные серобактерии
отличаются крупными размерами (до 200 мкм в
диаметре); их клетки могут содержать различи-
мые под микроскопом включения серы, облегча-
ющие идентификацию этой группы. Благодаря
своим необычным особенностям эти серобактерии
были описаны и получили название еще до выде-
ления в виде чистой культуры.
Большинство этих серных бактерий окисляет
восстановленные соединения серы до сульфата;
немногие способны лишь к их неполному окис-
лению. Промежуточными продуктами окисления
являются молекулярная сера (S°), тиосульфат
(ЗгОд-) и тетратиопат (S4O|“) (см. табл. 10.2).
По-видимому, окисление соединений серы слу-
жит у этих бактерий источником получения
энергии.
Все бесцветные серные бактерии способны окис-
лять восстановленные неорганические соединения
серы в темноте (однако не все бактерии, осу-
ществляющие этот процесс, относятся к данно-
му типу бактерий). Например, некоторые пред-
ставители фототрофных бактерий, относящихся
к роду Chrornatiurri, способны к хемолитоавто-
трофному росту в темноте в аэробных услови-
ях с использованием тиосульфата в качестве ис-
точника энергии. Некоторые бактерии, например
Paracoccus denitrificans, были идентифицированы
до того, как обнаружилось, что они способны к хе-
молитоавтотрофному росту в аэробных условиях
в среде с тиосульфатом. Если бы Р. denitrificans
был изначально выделен на среде, содержащей
тиосульфат в качестве единственного источника
энергии, он, несомненно, был бы описан как вид
рода Thiobacillus.
Среди серных бактерий имеются представите-
ли различных физиологических групп — аэробы,
денитрификаторы, облигатные и факультативные
автотрофы, хемолитогетеротрофы, нейтрофилы,
ацидофилы, алкалифилы и термофильные орга-
низмы. Перечень наиболее подробно исследован-
ных родов и видов серных бактерий представлен
в табл. 10.6. При изучении этих микроорганизмов
получены основные имеющиеся на сегодня сведе-
ния но серному и углеродному метаболизму бак-
терий, окисляющих соединения серы.
308 Часть III. Многообразие метаболических путей
Бесцветные серные бактерии — это псфото-
трофпые микроорганизмы, способные получать
энергию в результате окисления восстановленных
неорганических соединений серы. Практически
все они могут использовать в качестве конечно-
го акцептора электронов кислород. Некоторые
из них способны осуществлять процесс денитри-
фикации, используя нитрат, нитрит или оксид
азота как акцепторы электронов в процессе анаэ-
робного дыхания. Небольшое число бесцветных
серных бактерий может использовать в качестве
акцептора электронов Fc(III). Среди бесцветных
серных бактерий обнаружено много видов,
для которых характерны экстремальные место-
обитания, — ацидофилы (pH 1-5), алкалифилы
(pH 8-11), термофилы (температура до 95 °C) и
галофилы (концентрация NaCl до 150 г/л).
10.6.1 . Биохимический механизм окисления
восстановленных соединений серы
пока не вполне ясен
Изучение путей окисления соединений серы
осложняет их высокая реакционноспособность, по
причине которой происходит спонтанное окис-
ление продуктов в аэробных условиях. Кро-
ме того, не имеется чувствительных аналити-
ческих методов определения этих соединений;
в процессе приготовления бесклеточных экстрак-
тов активность некоторых ферментов серного
метаболизма, по-видимому, может утрачиваться.
Возможно, будет обнаружено некоторое биохими-
ческое единство серного метаболизма, по, вероят-
но, существуют различные его пути.
Таблица 10.5. Роды бесцветных бактерий, способных использовать соединения серы, и их физиологические ха-
рактеристики. А — Archaea; В — Bacteria; Р — класс Proteobacteria; U — точное систематическое положение не опре-
делено (данные получены на основе анализа 16S-pPHK; С — в роде известны симбионты; Н — нейтрофилы; Ац—
ацидофилы; М —мезофилы; Т — термофилы; Д — денитрификаторы; АЭ —акцептор электронов S0 или Fe3+. По
Robertson L. A., KuenenJ.G. (1992). The colorless sulfur bacteria. In: BalowsA., TrijperH.G., Dworkin M., Harder,
Scheleifer К. H. (eds.). The Prokaryotes. Berlin, Heidelberg, New York. Springer; 385-413
Род Отношение к pH Отношение к температуре Анаэробный рост
Бесцветные серные бактер] Thiobacillus (Р) Thiomicrospira (Р) (S) 1 Thiosphaera (P) Sulfolobus (A) Acidianus (A) Thermothrix (U) Thiovulum (P) Beggiatoa (P) Thiothrix (P) Thioploca 2 (P) Thiobacterium (U) Macromonas (U) Achromatium 2 (P) Другие бактерии, способные Paracoccus (P) Hyphomicrobium (B) Alcaligenes (P) Pseudomonas (P) Hydrogenobacter (B) 1 Систематическое положение y< 2 В виде чистой культуры не вы 3 Конечный продукт нитратреду ИИ II, Ац Н Н Ац Ац И н н н II н II использовать восстановлены Н Н Н И Н :тановлено только по результа' делены. кции неизвестен. М, Т М м т т т м м м м м м >ie соединения серы М М М м т гам анализа 16S-pPHK. д д д АЭ д АЭ (Д)3 АЭ АЭ Д д д
Глава 10. Окисление неорганических соединений хемолитотрофами 309
Таблица 10.6. Характеристики некоторых хорошо изученных одноклеточных (не нитчатых) серных бактерий. Все
приведенные виды используют кислород как акцептор электронов
Вид Диапазон pH, благоприятный для роста Неорганический донор электронов
Thiobacillus thiooxidans (о) Thiobacillus ferrooxidans (о) Thiobacillus acidophilus (ф) Thiobacillus thioparus (о) Thiobacillus neapolitanus (o) Thiobacillus tepidarius (o) Thiobacillus denitrificans (o) Thiobacillus intermedins (ф) Thiobacillus novellus (ф) Thiobacillus versutus (ф) Thiomicrospira pelophila (o) Thiosphaera pantotropha (ф) Sulfolo bus acidocaldarius (ф) (о) — облигатные хемолитотроф нические соединения в зависим 1 Температурный оптимум—43 2 Температурный оптимум — 66 2-5 2-6 3-6 5-8 5-7 6-8 1 6-8 4-7 6-8,5 6-8,5 6-8,5 6-8,5 2-3 2 ы; (ф) — факультативные хемоли ости от вида). -44 °C. -74 °C. s2-, s°, s2o2- s2-, s°, s2o2-. s4o*- Fe2+, FcS2, сульфидные минералы s2-, s2ol~. s°, s3o|-, S4O2“ S2-, S°, S2C)2“, SCN“, S4C>2_ CS2, (CH3)2S S2-, S°, S2O2“, S4O^“ S2-. s°, S2O2-, s4o^_ S2-, S°, S2O^, S4O^“ S2-. S°, S2C>2", S4q2_ S2O*-, S4Oj?- S2-, S2O*“ S2-, S°, S2O2“, s4c^~ S2-. S°, S2o2“ S°, (Fe2+, сульфидные минералы) тоавтоторофы (способные использовать различные орга-
Рис. 10.7. Родство по признаку 16S-pPHK
между штаммами Thiobacillus внутри (3-
и 7-подклассов протеобактерий. Звездоч-
кой обозначены типовые штаммы. По [1].
310 Часть III. Многообразие метаболических путей
Источником энергии для роста бесцветных
серных бактерий может служить неорганическая
сера в различной форме и степени окисления
[H2S (-2), S8 (0), SOj- (+6)1 и более слож-
ные серусодержащие вещества, такие как поли-
сульфоновые кислоты (Н—Sn~Н), моно- и ди-
сульфоновые органические кислоты (Н—Sn— R,
R—Sn—R), политионаты (“OgS—Sn— SO3 ) и поли-
сульфиды (_S~-Sn~S_). Наиболее известные по-
литиопаты — это тиосульфат (“Оз8—SO3 ) и гст-
ратионат (“OgS—S—S—SO3 ). Водорастворимые
сульфиды, такие как Na2S, в воде протонируют-
ся с образованием HS- и H2S. Сульфид-ион S2~
образуется только при pH > 14, что связано с
экстремально высоким значением рКа для HS-
(14,9). Молекулярная сера растворяется в раство-
рах, содержащих HS-, в виде полисульфидов с
числом атомов S от 2 до 7 и имеет низкую, но
определимую растворимость в воде (5 мкг/л).
Ацидофильные и нейтрофильные серные бак-
терии окисляют соединения серы различными пу-
тями (рис. 10.8). Различия касаются в основном
превращений политиопатов (тетратионата и три-
тионата) и тиосульфата. По меньшей мере у неко-
торых ацидофильных видов ( Thiobacillus ferrooxi-
dans и Thiobacillus acidophilus) промежуточным
продуктом окисления соединений серы являет-
ся тетратионат, тогда как у некоторых нейтро-
филов это может быть тиосульфат, который да-
лее гидролизуется до молекулярной серы и суль-
фита. Точно пока не известно, действительно ли
в этом пути образуется молекулярная сера или
продукт гидролиза тиосульфата представляет со-
бой серу в комплексе с органическим соедине-
нием (R) либо полисульфид в форме R—Sn— S-.
У некоторых тиосульфат-окисляющих бактерий
(например, Thiobacillus versutus) этот процесс осу-
ществляет мембраносвязанный ферментный ком-
плекс, в состав которого входят по меньшей
мере два фермента (оксидоредуктазы) и цито-
хромы. Он превращает тиосульфат в сульфат,
при этом какие-либо промежуточные продукты
в свободной форме не определяются. У боль-
шинства серных бактерий электроны поступают
при окислении тиосульфата в дыхательную цепь
предположительно на уровне цитохрома с, тогда
как у денитрифицирующих бактерий, таких как
Thiobacillus denitrificans и Thiomicrospira denitri-
ficans, электроны, возможно, передаются от тио-
сульфата на цитохром Ь. Этим можно объяснить
способность данных бактерий к восстановлению
Рис. 10.8. А. Условная схема окисления соединений
серы у ацидофильных серных бактерий Thiobacillus
ferrooxidans и Thiobacillus acidophilus. 1 — тритионат-
гидролаза; 2 — тиосульфатдегидрогеназа; 3 — тетратио-
натгидролаза; 5 — сульфит-окисляющий фермент; 4, б
и 7 — ферменты не установлены. S~—(Sn)—S-—поли-
сульфиды.
Б. Основные реакции окисления соединений серы —у
нейтрофильных серных бактерий, например Thiobacillus
thioparus. 1 — сульфидоксидоредуктаза; 2 — тиосульфат-
расщепляющий фермент (родоназа); 3 — ферменты
окисления серы (серадиоксигеназа или сераоксидо-
редуктаза); 4 — сульфитоксидоредуктаза; 5 — аденозин-
фосфосульфатредуктаза; 6 — ADP-сульфурилаза.
нитрата при использовании восстановленных со-
единений серы в анаэробных условиях и относи-
тельно высокий выход биомассы при росте с их
использованием в аэробных условиях.
Одним из природных субстратов для серных
бактерий служит молекулярная сера, встречаю-
щаяся а природе в основном в форме Sg. Хотя се-
ра не абсолютно нерастворима в воде, первый этап
ее метаболизма состоит, по-видимому, в образова-
нии растворимого или связанного с клеткой (ор-
ганического) полисульфида. Остается неясным,
Глава 10. Окисление неорганических соединений хемолитотрофами 311
окисляется ли молекулярная сера (S°) оксидо-
редуктазой, передающей электроны в дыхатель-
ную цепь, или оксигеназой (моно- или диокси-
геназой), катализирующей включение кислорода
непосредственно в субстрат с образованием суль-
фита (SO|~) и обнаруженной у некоторых окис-
ляющих серу бактерий. В случае Thiobacillus сера,
возможно, вначале восстанавливается до сульфи-
да, который затем окисляется до сульфита.
У Thiobacillus thioparus и Thiobacillus denit-
rificans окисление сульфита до сульфата (см.
разд. 10.3.2), вероятно, сопряжено с субстратным
фосфорилированием (рис. 10.8, Б).
Ферменты окисления серы у облигатно хе-
молитоавтотрофных представителей Thiobacillus
и Thiomicrospira синтезируются конститутивно,
причем уровень их синтеза может возрастать в
3-4 раза. У факультативно хемолитоавтотрофпых
видов Thiobacillus ферменты окисления серы (как
и фиксации СОг) чаще всего индуцибельные и их
синтез регулируется по механизму катаболитной
репрессии.
Поскольку большинство серных бактерий об-
разует как конечный продукт окисления со-
единений серы серную кислоту (рКа 1,9), мно-
гие из них относятся к ацидофилам, либо устой-
чивы к низким значениям pH. Нейтрофильные
тиобациллы способны выживать при pH до
3-4, для ацидофила Thiobacillus thiooxidans
этот уровень кислотности оптимален, Thiobacillus
ferrooxidans способен расти при pH 1,8 и сохра-
няет жизнеспособность при pH < 1,0. Некото-
рые окисляющие соединения серы ферменты ло-
кализованы в периплазме или обращены в нее; их
очень низкий pH-оптимум указывает на то, что
они действуют в кислой среде (например, фермен-
ты 1, 2 и 3 на рис. 10.8).
10.6.2 . Факультативные серные бактерии
способны к миксотрофному росту
У облигатно хемолитоавтотрофных представите-
лей Thiobacillus и Thiomicrospira ферменты цик-
ла Кальвина синтезируются конститутивно, то-
гда как у факультативных хемолитоавтотрофов
при гетеротрофном росте их синтез полностью
подавлен. Однако при одновременном лимити-
ровании по органическому субстрату и соедине-
нию серы факультативные хемолитотрофы спо-
собны расти миксотрофпо (см. рис. 10.2), осу-
ществляя одновременно два типа обмена. Особый
случай миксотрофии (иногда называемый мик-
солитотрофией) — это одновременное использова-
ние различных неорганических восстановленных
соединений, однако такой тип питания возможен
только в условиях лимитирования по источнику
энергии. Так, Thiobacillus ferrooxidans в присут-
ствии тиосульфата, пирита (FeS2) и Fe2+ может
одновременно окислять все три соединения. По-
добная смесь неорганических соединений имеется
в природных местообитаниях Т. ferrooxidans.
У некоторых штаммов Т. ferrooxidans фер-
менты окисления серы синтезируются консти-
тутивно, тогда как синтез ферментов окисле-
ния железа подавляется в результате длитель-
ного выращивания клеток на среде с серой в
отсутствие восстановленного железа. Умеренно
термофильные водородные бактерии могут рас-
ти с использованием одновременно водорода и
восстановленных соединений серы. Такие бакте-
рии, как Thiosphaera pantotropha и Paracoccus
denitrificans, способны к миксолитотрофии — ис-
пользованию одновермепно водорода и тиосуль-
фата при их лимитирующих рост концентраци-
ях. Рост хемолитогетеротрофных представителей
Thiobacillus облигатно зависит от присутствия в
среде органического субстрата в качестве источ-
ника углерода и энергии, однако восстановленные
соединения серы могут служить у них дополни-
тельным источником энергии, потребление кото-
рого увеличивает выход биомассы.
Среди архей способностью окислять восста-
новленные соединения серы обладают, напри-
мер, термофильные ацидофильные бесцветные
организмы, относящиеся к родам Sulfolobus и
Acidianus. Все известные представители этих ро-
дов — факультативные хемолитотрофы. Об их
серном метаболизме известно лишь очень немно-
гое. Предположительно молекулярная сера окис-
ляется у них либо при участии диоксигеназы
[реакция (10.21)] с образованием сульфита, ли-
бо в восстановительно-окислительных реакциях
с образованием сульфида и сульфита [реакция
(10.22)]; сульфид при этом окисляется вначале до
молекулярной серы [реакция (10.23)]:
S° + H2S + О2 -> HSO3 + Н+ (10.21)
3S° + ЗН2О -> HSO3 + 2HS“ + ЗН+ (10.22)
2HS" + 2Н+ + О2 2S° + 2Н2О (10.23)
312 Часть III. Многообразие метаболических путей
Электроны, высвобождаемые в реакциях
(10.22) и (10.23), могут передаваться в электрон-
транспортную цепь, внося тем самым вклад в
запасание энергии в форме электрохимического
протонного потенциала. Оксигеназная реакция
окисления S0 (10.21) не приводит к высвобож-
дению электронов и не сопряжена с запасани-
ем энергии. Автотрофная ассимиляция СО2 у
Sulfolobus, по-видимому, происходит в восстано-
вительном цикле трикарбоновых кислот, однако
регуляция этого процесса изучена недостаточно.
Поскольку местообитанием окисляющих серу
бактерий часто служит область раздела аэроб-
ной и анаэробной зон, многие из них обладают
способностью к анаэробному энергетическому ме-
таболизму, обеспечивающему выживание в анаэ-
робных условиях. У Thiobacillus neapolitanus это
механизм гетероферментативного молочнокисло-
го брожения с использованием в качестве субстра-
та внутриклеточного запасного полисахарида и
образованием лактата плюс этанола. У Beggiatoa в
этом случае используется запас внутриклеточной
серы, которая служит акцептором электронов для
окисления экзогенных органических субстратов.
Некоторые окисляющие серу бактерии, например,
Thiobacillus ferrooxidans, для роста в анаэробных
условиях используют внутриклеточную серу как
источник энергии и Fe(III) в качестве акцептора
электронов.
Из необычно крупных (диаметром > 5 мкм)
бесцветных серных бактерий изучены виды нит-
чатых скользящих бактерий Beggiatoa, среди ко-
торых, по-видимому, представлен весь спектр
возможных у серных бактерий типов питания
(табл. 10.3). Большинство описанных к насто-
ящему времени видов Beggiatoa — это хемолито-
гетеротрофные бактерии или хемоорганотрофы,
не использующие энергию окисления сульфида.
Немногочисленные морские виды Beggiatoa спо-
собны расти хемолитоавтотрофно, получая энер-
гию при окислении сульфида и фиксируя СО2 в
цикле Кальвина. В лабораторных условиях эти
микроорганизмы удастся культивировать в ага-
ровых столбиках с градиентами компонентов, где
они растут в виде топкого слоя на границе раз-
дела зон сульфид/кислород (рис. 10.9). Обычное
природное местообитание видов Beggiatoa — гра-
ница раздела сульфидной и кислородной зон у по-
верхности донных отложений. Благодаря сколь-
зящему движению их нити могут перемещаться
вслед сдвигам этой границы в ходе суточного и
Рис. 10.9. Сосуд для выращивания видов Beggiatoa в
агаризованной среде с градиентом сульфида и кислоро-
да. В воздушной фазе присутствует достаточно кисло-
рода для полного окисления H2S. Источником углерода
служит НСО3 . Зона роста Beggiatoa показана темно-
серым. По [2].
приливного циклов. Описанный выше анаэробный
метаболизм отражает, таким образом, приспособ-
ление к жизни на границе аэробной и анаэроб-
ной зон. Другие нитчатые серные бактерии, виды
Thiothrix, растут хемолитоавтотрофно с исполь-
зованием тиосульфата, CS2, и некоторых произ-
водных тиофена.
У многих гетеротрофных видов Beggiatoa, а
также сходных с ними по типу метаболизма бакте-
рий, таких как Thiobacterium и Macromonas, окис-
ление сульфида, возможно, компенсирует отсут-
ствие каталазы, позволяя обезвреживать Н2О2,
образующийся в процессе гетеротрофного роста.
Неферментативпое взаимодействие сульфида с
пероксидом водорода может обеспечивать деток-
сикацию этого побочного продукта обмена и при-
водить к отложению образующейся при этом мо-
лекулярной серы внутри клеток.
Недавно описаны гигантские нитчатые бак-
терии Thioploca, образующие плотные ма-
ты в осадочных отложениях на морском дне
вдоль побережья Чили. Эти бактерии образуют
нити длиной до 7 см, состоящие из клеток диа-
метром 15-40 мкм и длиной до 60 мкм. Ни-
ти образуют тяжи размерами 1,5 х 100-150 мм,
покрытые чехлом из слизистого полимерно-
го вещества. Этот район тихоокеанского побе-
режья характеризуется чрезвычайно высокой
сезонной продуктивностью фитопланктона и со-
ответственно высокой активностью микробно-
го процесса сульфатредукции, протекающего в
Глава 10. Окисление неорганических соединений хемолитотрофами 313
донных осадках. Образующийся при сульфат-
редукции сульфид эффективно окисляется до
сульфата бактериями Thioploca. Вместо Ог, ко-
торого в придонном слое недостаточно, они ис-
пользуют в качестве конечного акцептора элек-
тронов нитрат, с избытком присутствующий в
омывающей маты морской воде. Для поглощения
нитрата нити Thioploca активно выскальзывают
из чехла, покрывающего их пучки, в воду, где
клетки накапливают нитрат в крупных вакуолях
до концентрации примерно 500 ммоль/л. Затем
они скользят обратно в чехол, погруженный в
сульфидсодержащие донные осадки. Благодаря
своему сложному поведению Thioploca настоль-
ко процветают, что их маты покрывают тысячи
квадратных километров морского дна вдоль бе-
реговой линии.
Сульфидокисляющие бактерии, свободно жи-
вущие и симбиотические, обитают также в зо-
нах глубоководных гидротерм (см. разд. 31.1.4
и 31.1.7). В этих особых условиях встречаются
роды Beggiatoa, Thiomicrospira и Thiobacillus, а
также некоторые водород- и метапокисляющие
бактерии. Серные бактерии образуют здесь сим-
биоз с трубчатыми червями, моллюсками и дру-
гими беспозвоночными, причем если моллюски,
например, питаются па обильно образующейся
микробной биомассе, то полутораметровые труб-
чатые черви потребляют непосредственно суль-
фид, который затем поглощают сульфидокисляю-
щие бактерии, обитающие внутри клеток их тела.
Симбиотические сульфидокисляющие бактерии
широко распространены и в других экосистемах,
например как симбионты мелких моллюсков, мор-
ских ежей и других беспозвоночных, обитающих
на границе кислородной и бескислородной зон в
иле литоралей.
На применении бесцветных серных бактерий
основаны используемые на практике технологии
очистки сточных вод и выщелачивания сульфид-
ных руд. Из сульфидокисляющих бактерий со-
стоит в основном бактериальная популяция ак-
тивного ила, освобождающего сточные воды от
сульфида путем превращения его в относительно
безвредный сульфат. Как правило, окисление H2S
происходит в процессе очистки на стадии актив-
ной аэрации. Это очевидный недостаток техно-
логии, поскольку высокотоксичный сероводород
вместе с воздухом попадает в атмосферу, загряз-
няя окружающую среду. Чтобы избежать утеч-
ки сероводорода, аэротенки можно снабжать по-
крытием и газоулавливающими устройствами, но
радикальным решением этой проблемы должен
быть переход па анаэробную технологию окисле-
ния H2S с использованием в качестве окислителя
нитрата. Однако это не единственная проблема,
с которой приходится сталкиваться при очистке
сточных вод. Повышенная концентрация сульфа-
та в воде, выходящей из очистных сооружений,
может быть причиной резкой активации процес-
са сульфатредукции в окружающей среде. Для
устранения этой опасности предложен способ при-
менения хемолитоавтотрофных видов Thiobacillus
для неполного окисления сульфида сточных вод,
т. е. превращения его в нерастворимую в воде мо-
лекулярную серу, которая при этом могла бы ис-
пользоваться далее как химическое сырье.
Дополнение 10.4. При очистке сточных
вод с их аэрацией, если концентрация H2S
относительно низка, внутри бактериальных
хлопьев могут развиваться нитчатые бакте-
рии Thiothrix. Их присутствие затрудняет
отделение хлопьев от водной фазы на эта-
пе осветления воды и поэтому чрезвычайно
нежелательно.
Неблагоприятным последствием активно-
сти окисляющих серу бактерий являются так-
же некоторые экологические проблемы и эко-
номический вред, связанный с коррозией.
Они обусловлены образованием серной кис-
лоты при окислении серы этим бактериями.
Этот процесс является причиной сильного за-
кисления почв, содержащих нерастворимые
сульфиды или серу. Например, на террито-
риях, отвоевашшых у моря, окисление сер-
ными бактериями присутствующего в такой
почве пирита (БеБг) может привести к сниже-
нию в ней pH до 1, т. е. сделать ее непригод-
ной для сельскохозяйственного использова-
ния. В этом случае для нейтрализации почвы
применяют карбонат кальция. Другой при-
мер— это окисление серы в составе бетона,
из которого изготавливают канализационные
трубы. Образующаяся при этом серная кис-
лота растворяет входящие в состав бетона
карбонаты, вызывая интенсивное разрушение
канализационных систем.
314 Часть III. Многообразие метаболических путей
10.7. Нитрифицирующие бактерии окисляют аммоний и нитрит
Нитрифицирующие хемолито(авто)трофные бак-
терии могут окислять аммиак (при физиологиче-
ских значениях pH присутствующий в форме ам-
мония; рК = 9,3), гидроксиламин, нитрит и дру-
гие неорганические соединения азота. Окисление
аммония до нитрата происходит в два этапа. Вна-
чале нитрозобактерии окисляют аммоний до нит-
рита, после чего нитробактерии окисляют нитрит
до нитрата. Наиболее важные роды этих бакте-
рий перечислены в табл. 10.7. Большинство опи-
санных нитрифицирующих бактерий относится к
облигатным хемолитоавтотрофам и некоторые —
к факультативным хемолитоавтотрофам; пи од-
ного хемолитогетеротрофного вида среди них не
известно. Однако разнообразные гетеротрофные
микроорганизмы способны окислять аммоний до
нитрита и нитрит до нитрата одновременно с по-
треблением органических субстратов (кометабо-
лизм, или соокислепие). Этот процесс называют
гетеротрофной нитрификацией.
Ферменты окисления аммония и нитрита ло-
кализованы у нитрифицирующих бактерий в раз-
витой системе внутриклеточных мембран. Сведе-
ния о путях этого окисления имеются лишь для
немногих видов, что связано с трудностью полу-
чения биомассы нитрифицирующих бактерий в
достаточном количестве. Скорость их роста и вы-
ход биомассы очень низки из-за высокой токсич-
ности нитрита. В смешанной культуре нитрозо-
бактерии и нитробактерии растут соответственно
лучше, чем в чистых культурах.
Нитрозобактерии окисляют аммиак до
нитрита □ Механизм окисления аммония де-
тально изучен у Nitroso-monas еигораеа. Сум-
марный процесс полного окисления аммония до
нитрата с участием кислорода приводит к обра-
зованию кислоты:
2NH3 + 4О2 -> 2NO3 + 2Н2О 4- 2Н+ (10.24)
Окисление NH3 до NO2 происходит через образо-
вание ряда промежуточных продуктов:
NH3 NH2OH -> (NOH) -> NO2 (10.25)
На первом этапе окисления аммония (предпо-
ложительно субстратом здесь служит NH3, а не
NH4 ), приводящем к образованию гидроксилами-
на, специфическая монооксигеназа катализирует
зависящее от восстановителя гидроксилирование
NH3 путем включения в его молекулу атома кис-
лорода из О2:
NH3 + «NAD(P)H> + Н+ + О2
-> NH2OH 4- Н2О 4- NAD(P)+ (10.26)
В отсутствие кислорода изменение свободной
энергии Гиббса в реакции окисления аммиака до
гидроксиламипа составляет положительную вели-
чину; исключение NADH делает ее отрицатель-
ной. Хотя в бесклеточных экстрактах восстанови-
телем в этой реакции может служить NAD(P)H,
in vivo его роль выполняет предположительно
один из компонентов электронтранспортной це-
пи (рис. 10.10). Окисление гидроксиламина ката-
лизирует локализованная в периплазме гидрок-
силаминоксидоредуктаза, которая восстанавлива-
ет при этом периплазматический цитохром с:
NH2OH 4- Н2О -> HNO2 4- 4[Н] (10.27)
Электроны от гидроксиламина, по-видимому, пе-
редаются в дыхательную цепь на уровне хинона
(рис. 10.10). Здесь путь электронов разветвляется.
Часть из них передается па цитохромоксидазу и
далее па О2, что сопряжено с запасанием энергии
в виде Др. Другая часть электронов посредством
обратного транспорта используется для образова-
ния NADH, необходимого в качестве восстанови-
теля в монооксигеназной реакции (10.26) и при
Таблица 10.7. Нитрифицирующие бактерии
Реакции Организмы
Аммоний-окисляющие (питрозо)бактерии nh+ + 1|О2 — NO^ + 2 н+ + П2О 11итрит-окисляющие (нитро)бактерии NOj 4- |О2 -> NO3 Nitrosococcus oceanus, Nitrosolobus multiformis, Nitrosomonas еигораеа, Nitrosospira briensis, Nitrosovibrio tenuis Nitrobacter hamburgensis, Nitrobacter vulgaris, Nitrobacter winogradskyi, Nitrococcus mobilis, Nitrosrina gracilis, Nitrosrira marina
Глава 10. Окисление неорганических соединений хемолитотрофами 315
Рис. 10.10. Локализация ферментов окисления амми-
ака и переносчиков электронов у Nitrosomonas. Чис-
ла в скобках — относительное количество переносчиков
в расчете на молекулу гидроксиламиноксидоредуктазы
(ГАО). Локализация монооксигеназы, окисляющей ам-
миак (АМО), указана предположительно. АТР-синтаза
показана внизу; а и с — цитохромы а и с соответственно.
фиксации СОг- В связи с этим процесс окисле-
ния аммония имеет низкий энергетический выход,
ио можно предполагать, что последнее компен-
сируется высокой скоростью окисления. Возмож-
но, развитая система мембран в клетках нитри-
фицирующих бактерий, с которой связана участ-
вующая в окислении электронтранспортпая цепь,
является адаптацией, необходимой для окисления
NH3 с высокой скоростью.
Монооксигеназа, катализирующая окисление
аммиака, вероятно, имеет сравнительно низкую
субстратную специфичность и окисляет также
субстраты, которые можно рассматривать как
структурные аналоги NH^. Этим объясняется
способность нитрифицирующих бактерий окис-
лять разнообразные соединения подобной струк-
туры, в том числе метан до метанола. Скорость
окисления метана, однако, примерно в 100 раз
ниже скорости окисления аммиака. Данная мо-
нооксигеназа катализирует также окисление ок-
сида углерода, этилена, циклогексана, бензило-
вого спирта и фенола. По сравнению с аммиа-
ком скорость окисления этих соединений также
очень низка, но, учитывая чрезвычайно низкую
скорость их оборота в окружающей среде, мож-
но предполагать, что нитрифицирующие бакте-
рии вносят существенный вклад в их разложение.
Нитробактерии окисляют нитрит до нит-
рата □ Окисление нитрита до нитрата видами
Nitrobacter осуществляется в два следующих эта-
па (полуреакции):
NO2 + Н2О ->• NO3 + 2Н+ + 2е~ (10.28)
| О2 + 2Н+ + 2е" -» Н2О (10.29)
Нитрит: нитрат-оксидореду ктаза локализована
внутри плазматической мембраны, и единствен-
ным пунктом транслокации протонов в дыхатель-
ной цепи Nitrobacter служит цитохромоксидаза.
Образование NAD(P)H происходит у этих бакте-
рий путем обратного переноса электронов. Неко-
торые представители рода Nitrobacter способны
расти и как хемоорганогетеротрофы.
Гетеротрофную нитрификацию осуществ-
ляют многие прокариоты и грибы. Механизмы та-
ких процессов образования нитрата чрезвычайно
разнообразны. Одни гетеротрофные нитрифика-
торы осуществляют прямое окисление восстанов-
ленных неорганических соединений азота по опи-
санному выше пути. У других при окислении об-
разуются в качестве промежуточных продуктов
азотсодержащие органические соединения. У мно-
гих гетеротрофных нитрификаторов в процес-
се окисления нитрита выделяются восстановлен-
ные газообразные продукты — N2O или N2, при-
чем это может происходить даже при полностью
аэробных условиях. Удельная скорость нитрифи-
кации у гетеротрофных организмов в среднем в
100-10 000 раз ниже, чем у хемолитоавтотрофов.
Многие нитрифицирующие хемолито-
трофы — облигатные автотрофы □ Все из-
вестные к настоящему времени хемолитотроф-
ные нитрификаторы фиксируют СО2 в цикле
Кальвина. Вместе с тем по меньшей мере один
штамм, относящийся к хемолитоавтотрофному
роду Nitrosomonas, обладает, видимо, слабой спо-
собностью получать энергию в процессе денит-
рификации с использованием в качестве донора
электронов пирувата, возможно лишь для под-
держания жизнеспособности в анаэробных усло-
виях. Факультативная хемолитоавтотрофия чрез-
вычайно редко встречается у бактерий, окисля-
316 Часть III. Многообразие метаболических путей
Рис. 10.11. Упро-
щенная схема систе-
мы очистки сточных
вод.
ющих аммоний, ио довольно широко распростра-
нена у микроорганизмов, окисляющих нитрит.
Так, Nitrobacter agilis, ранее известный как обли-
гатный хемолитоавтотроф, способен, как выясни-
лось, очень медленно расти за счет использования
ацетата. Кроме того, некоторые виды Nitrobacter
(например, Nitrobacter haviburgensis) также долж-
ны быть, вероятно, отнесены к факультативным
хемолитоавтотрофам. Другие штаммы способны
расти гетеротрофно в условиях денитрификации.
Местообитания нитрификаторов □ Нит-
рификаторы присутствует в водоемах и почве,
везде, где образуется аммоний и присутствует
кислород. Длительное применение аммонийных
удобрений приводит к значительному обогащению
обрабатываемых земель автотрофными нитрифи-
каторами. В водоемах нитрификаторы особенно
активно развиваются, как и многие хемолитотро-
фы, у поверхности донных отложений и в зоне
термоклина, т. е. на границах аэробной и анаэроб-
ной зон. Вклад гетеротрофной нитрификации в
общее окисление аммония в условиях низкого со-
держания органических субстратов (С) на фоне
высокого содержания аммония (N) чрезвычайно
л ала. Однако при соотношении С/N выше 10 по-
пуляция гетеротрофов в качестве доминирующей
может вносить значительный вклад в окисление
аммония. Отмечено также, что в зоне термокли-
на, где во множестве присутствуют метапокисля-
ющие бактерии, окисление аммония происходит
в том числе под действием метанмонооксигеназы.
Образующийся при этом гидроксиламип окисля-
ется гетеротрофными нитрификаторами до нит-
рита. В этом случае кометаболическое окисление
может составлять существенную конкуренцию ав-
тотрофной нитрификации.
Роль нитрификаторов в процессе очист-
ки сточных вод □ Хемо лито автотрофные бак-
терии, окисляющие аммоний и нитрит, выпол-
няют важную роль в современных технологи-
ях очистки сточных вод от азота. Они окисля-
ют аммоний — продукт разложения органических
отходов—до нитрата, который затем денитрифи-
цирующие бактерии превращают в молекуляр-
ный азот. Схема такого водоочистного сооруже-
ния представлена па рис. 10.11. Первая, анаэроб-
ная, стадия очистки предназначена для удаления
нитрата путем восстановления его до Ng денитри-
фикаторами-гетеротрофами в процессе нитратно-
го дыхания с использованием органических ве-
ществ. На второй, аэробной стадии происходит
аэробное окисление остаточного органического ве-
щества. На третьей, также аэробной стадии, од-
нако значительно более продолжительной по вре-
мени, чем вторая, при участии автотрофных нит-
рификаторов происходит окисление аммония и
нитрита (часто здесь используют системы фик-
сации клеток путем либо иммобилизации, либо
седиментации). Затем вода, очищенная от орга-
нического вещества, но обогащенная в результа-
те нитрификации нитратом, возвращается на вход
очистных сооружений для удаления нитрата. Эта
третья стадия выделена для того, чтобы медлен-
норастущие нитрифицирующие бактерии не мог-
ли быть подавлены в результате роста гетеротро-
фов и избыток образовавшегося па второй стадии
активного ила мог быть возвращен из отстойника
в реактор без потери нитрифицирующей актив-
ности. Часть активного ила, отделяемого на каж-
дой стадии в отстойнике, возвращается в преды-
дущий реактор для восстановления численности
микроорганизмов, участвующих в процессе очист-
Глава 10. Окисление неорганических соединений хемолитотрофами 317
ки. Особенно это важно для поддержания числен-
ности медленнорастущих автотрофных нитрифи-
каторов. Поскольку количество высвобождаемого
в окружающего среду азота ограничено законом,
большинство современных установок для очист-
ки сточных вод снабжено системой нитрифика-
ции / денитрификации.
Роль нитрификаторов в почве и их зна-
чение для земледелия □ Аммоний, вносимый
в почву как удобрение, прочно связываемся с
отрицательно заряженными минеральными ча-
стицами почвы и гуминовыми кислотами. В поч-
ве под сельскохозяйственными культурами про-
исходит его медленное высвобождение из этих
комплексов и окисление нитрифицирующими
бактериями до нитрата, который большинство
растений усваивает предпочтительнее аммония.
Однако нитрит и нитрат как отрицательно заря-
женные ионы легко вымываются из почвы дож-
девыми водами. Во время обильных и затяжных
дождей в почве могут создаваться анаэробные
условия, благоприятные для развития денитри-
фицирующих бактерий. По имеющимся оценкам,
в результате вымывания и денитрификации на по-
лях под кукурузой, например, теряется примерно
55% связанного азота почвы, внесенного в виде
аммонийных и нитратных удобрений.
Разрушение известняка и закисление
почвы □ Аммиак как летучее соединение мо-
жет в заметных количествах поступать в ат-
мосферу в результате той или иной деятельно-
сти человека (например, производства мяса пти-
цы, свиней и крупного рогатого скота) и затем
поглощаться почвой, водой и даже пористыми
стенами зданий. При этом, помимо загрязнения
воды и почвы, аммиак вызывает разрушение
построенных из известняка (СаСОз) историче-
ских зданий п памятников, поскольку становится
субстратом для роста нитрифицирующих бак-
терий в порах камня глубиной несколько мил-
лиметров и даже сантиметров. Образующаяся
в процессе окисления аммония кислота [реак-
ция (10.27)], растворяя известняк с выделением
СОг, разъедает стены. В слабозабуфереппой поч-
ве микробное окисление поступающего из атмо-
сферы аммиака приводит к ее закислению и в ре-
зультате к вымыванию металлов, используемых
растениями в качестве микроэлементов, дожде-
выми потоками, что может быть одной из при-
чин наблюдаемой гибели лесов. В средние ве-
ка процесс нитрификации служил источником
получения селитры как основного компонента
пороха. Ее счищали с каменной облицовки на-
возных ям, на которой в процессе компости-
рования навоза появлялись селитряные выцве-
ты. Образование нитрата из аммиака — продук-
та разложения органического материала — под
действием нитрифицирующих бактерий приводи-
ло к постепенной кристаллизации селитры па
камне.
Хемолитотрофные нитрифицирующие бакте-
рии выполняют основную роль в очистке сточных
во/, от аммиака (аммония). Они окисляют аммо-
ний до нитрита и нитрата, которые на последу-
ющем этапе очистки восстанавливаются денитри-
фицирующими бактериями до N2. При этом этап
нитрификации лимитирует скорость всего про-
цесса очистки из-за относительно низкой скорости
роста нитрифицирующих бактерий. Деятельность
нитрифицирующих бактерий рассматривают
также как одну из причин разрушения истори-
ческих зданий и памятников, построенных из из-
вестняка.
10.8. Водородокисл я ющие бактерии получают энергию
путем окисления водорода
Водород могут использовать в качестве субстра-
та разнообразные бактерии, как аэробные, так и
факультативно анаэробные (табл. 10.8). Акцепто-
ры электронов при его окислении также широ-
ко варьируют, включая кислород, Ее3+, нитрат,
нитрит и оксид азота. Большинство аэробных во-
дородных бактерий — факультативные хемолито-
автотрофы, и лишь немногие виды относятся к
облигатным хемолитотрофам или хемолитогете-
ротрофам. Среди строгих анаэробов, способных
к окислению водорода, много облигатно хемоли-
тоавтотрофпых метанобразующих бактерий (они
318 Часть III. Многообразие метаболических путей
Таблица 10.8. Роды и виды прокариот, способные окислять водород
Грамотрицательные бактерии Грамположительные бактерии Археи Acidovorax facilis, Alcaligenes eutrophus, Alcaligenes eutrophus CH34, Alcaligenes hydrogenophilus, Alcaligenes latus, Alcaligenes paradoxus, Alcaligenes ruhlandii, Aqua- spirillum autotrophicum, Azospirillum lipoferum, Calderobacterium hydrogenophi- lum, Derxia gummosa, Flavobacterium autothermophilum, Hydrogenophaga flava, Hydrogenophaga palleronii, Hydrogenophaga pseudoflava, Hydrogenobacter thermophi- lus, Microcyclus aquaticus, Paracoccus denitrificans, Pseudomonas hydrogenothermo- phila, Pseudomonas hydrogenouora, Pseudomonas saccharophila, Pseudomonas ther- mophila, Renobacter vacuolatum, Rhizobium japonicum, Xanthobacter autotrophicus, Xanthobacter flatus и большинство карбокситрофных бактерий Arthrobacter шт. 11/X, Bacillus schlegelii, Bacillus tusciae, Mycobacterium gordonae, Nocardia autotrophica, Rhodococcus opacus Aquifex pyrophilus
описываются в гл. 12). Водород окисляют так-
же многие карбоксидобактерии (см. разд. 10.9).
Совершенно очевидно, что водородокисляющие
бактерии представляют таксономически весьма
разнородную группу. Помимо немногих обли-
гатно хемолитоавтотрофных видов она включа-
ет ацидофильную серную бактерию Thiobacillus
ferrooxidans, способную расти с использовани-
ем На, восстановленных соединениях серы и/или
Fe(III), и термофильный вид Hydrogenobacter
thermophilus, способный кроме водорода окислять
восстановленные соединения серы. Оба эти ви-
да могут расти миксолитоавтотрофпо, окисляя
одновременно водород и другие восстановленные
неорганические соединения. Способностью расти
за счет окисления водорода обладают также раз-
личные фототрофные микроорганизмы. Многие
водородные бактерии могут использовать в каче-
стве источника энергии оксид углерода (см. ни-
же). В реакциях окисления водорода и СО кисло-
родом выделяется примерно одинаковое количе-
ство свободной энергии (—474 и —514 кДж/моль
соответственно).
10.8.1. Окисление водорода катализируют
гидрогеназы двух типов
Большинство использующих Иг бактерий содер-
жит мембраносвязанную гидрогеназу, передаю-
щую электроны в дыхательную цепь на уровне
цитохрома Ь, и лишь небольшое число их ви-
дов — ПАП+-зависимую водорастворимую гидро-
геназу, локализованную в цитоплазме. На са-
мом деле обе эти гидрогеназы могут и отдавать
электроны в дыхательную цепь, обеспечивая за-
пасание энергии, и катализировать образование
восстановительных эквивалентов. Однако в фи-
зиологических условиях функция NAD+-зависи-
мой дегидрогеназы ограничивается в основном
генерацией NADH, используемого далее в био-
синтетических реакциях. Это редкий случай
непосредственного использования неорганическо-
го восстановителя для восстановления NAD+.
Микроорганизмы, обладающие только мембрано-
связанной гидрогеназой, восстанавливают NAD+
путем обратного переноса электронов с затратой
энергии. Соответственно у бактерий, обладаю-
щих гидрогеназами обоих типов, выход биомассы
при окислении водорода выше, чем у микроорга-
низмов, обладающих только мембраносвязанным
ферментом.
Окисление водорода мембраносвязанной гид-
рогеназой осуществляется на внешней стороне
плазматической мембраны (рис. 10.12) и со-
пряжено с образованием протондвижущей си-
лы в результате выделспия/потребления Н+
снаружи/внутри мембраны (скалярный меха-
низм), а также активности протонной пом-
пы (рис. 10.2). Оба типа гидрогеназ деталь-
но исследованы у Alcaligenes eutrophus. Мем-
браносвязанный фермент состоит из большой
(67 кДа) и малой (35 кДа) субъединиц, связанных
с мембраной через цитохром Ь-подобный якор-
ный белок (рис. 10.12). Ni—Fe-содержащий ак-
тивный центр фермента локализован на боль-
шой субъединице. Малая субъединица содержит
несколько Fe—S-кластеров, через которые элек
троны, полученные при окислении водорода в
Ni—Fe-активном центре, передаются на цито-
Глава 10. Окисление неорганических соединений хемолитотрофами 319
Рис. 10.12. Структурная модель и функции двух
Ni—Fe-гидрогеназ у Alcaligenes eutrophus. МСГ — мем-
бранносвязанная гидрогеназа; РГ — растворимая гидро-
геназа; ПМ — плазматическая мембрана. Рисунок лю-
безно предоставлен В. Friedrich.
хром b и далее в дыхательную цепь. Водо-
растворимая гидрогеназа также относится к
классу Ni—Fe-гидрогеназ. Она состоит из двух
функциональных димерных частей — гидрогена-
зы и NADH-оксидоредуктазы (диафоразы). Гид-
рогеназная часть высокогомологична мембра-
носвязанной гидрогеназе, диафоразпый ком-
плекс— КАОНгубихинон-редуктазе (комплекс 1)
дыхательных цепей. Гены обеих гидрогеназ
у A. eutrophus локализованы в мегаплазмиде
(450 т.п.н.). Кроме генов растворимой и мембра-
носвязанной гидрогеназ, она содержит также ге-
ны, ответственные за созревание этих двух бел-
ков, поглощение никеля, электронтранспортную
функцию и регуляцию на уровне транскрипции.
У A. eutrophus шт. Н16 синтез обеих гидрогеназ
координировано регулируется факторами внеш-
ней среды: при наличии в среде избытка бога-
тых энергией субстратов он подавлен, но при де-
фиците субстратов индуцируется независимо от
присутствия водорода. У других водородных бак-
терий экспрессия пщрогеназы строго зависит от
присутствия водорода. Учитывая, что содержа-
ние водорода и органических субстратов в среде,
как правило, лимитировано, можно ожидать, что
большинство факультативных водородных бакте-
рий должно быть типичными миксотрофами (см.
ниже и дополнение 10.5).
10.8.2. Практически все водородные бактерии
ассимилируют СОг в цикле Кальвина
Исключение из этого правила составляют
Hydroqenobacter thermophilus и Aquifex pyrophilus,
которые ассимилируют СО2 через восстано-
вительный цикл трикарбоновых кислот (см.
разд. 10.4 и рис. 8.4). Подобно облигатным
автотрофам, окисляющим серу или аммоний,
Н. thermophilus использует органические соеди-
нения в качестве дополнительного источника уг-
лерода, однако независимо от условий роста ос-
новным источником углерода для него служит
СО2- Факультативно хемолитотрофные водород-
ные бактерии — это типичные гетеротрофы, часто
обладающие разнообразными метаболическими
возможностями. Многие из этих микроорганиз-
мов в присутствии высоких концентраций различ-
ных субстратов используют их последовательно
(диауксия), по при концентрациях, лимитирую-
щих рост, растут миксотрофно. В соответствии с
этим синтез ферментов водородного метаболиз-
ма и автотрофной фиксации СО2 у них стро-
го регулируется. Механизмы этой регуляции мо-
гут различаться, по, как правило, автотрофный
метаболизм подавляется в присутствии органи-
ческого субстрата в высокой концентрации. Ин-
дукция/репрсссия гидрогеназной системы также
может зависеть от наличия или отсутствия во-
дорода, однако некоторые водородные бактерии
синтезируют гидрогеназу конститутивно.
Дополнение 10.5. Гены, кодирующие гид-
рогеназу, нитрогеназу, а также детерминиру-
ющие способность к автотрофному росту и
денитрификации часто локализованы в плаз-
миде, и это создает возможность их горизон-
тального переноса в микробных сообществах,
экспериментально доказанного в ряде случа-
ев. Таким межвидовым переносом генов мо-
жет частично объясняться широкое распро-
странение этих специфических свойств среди
микроорганизмов.
Все азотфикенрующие бактерии в процессе
фиксации азота выделяют водород как побоч-
ный продукт функционирования нитрогеназного
комплекса (см. разд. 8.5). При этом его потери
не происходит благодаря активности специальной
гидрогеназы, катализирующей поглощение Н2.
320 Часть III. Многообразие метаболических путей
Таким образом, использование Щ азотфикси-
рующими бактериями вызвано главным обра-
зом его эндогенной продукцией. Однако немногие
азотфиксаторы, такие как Rhizobium japonicum,
Azospirillum lipoferum и ряд видов Xanthobacter
способны к хемолитоавтотрофному росту в среде
с молекулярным водородом и N2 в качестве един-
ственного источника азота.
10.9. Карбокситрофные бактерии — факультативные хемолитоавтотрофы
Многие карбокситрофные (окисляющие оксид уг-
лерода, СО) бактерии могут расти также с ис-
пользованием водорода (табл. 10.9). Несколько
из приведенных в таблице бактерий, в частности
некоторые виды Rhizobium, могут даже использо-
вать СО, осуществляя при этом денитрификацию.
Для Hydrogenophaga pseudoflaua продемонстриро-
ван миксотрофный рост с использованием Н2 или
СО как доноров электронов и пирувата в качестве
органического субстрата. Эффективность фикса-
ции СО2 у Pseudomonas carboxydovorans, происхо-
дящей, как и у других СО-окисляющих бактерий,
в цикле Кальвина, составляет 0,18 моль фиксиро-
ванного СО2 на моль окисленного СО. Это срав-
нимо с эффективностью фиксации СО2 у водо-
родных бактерий (0,10-0,22 фиксированного СО2
на моль окисленного Н2).
СО-дегидрогеназа □ Этот фермент де-
тально изучен у Р. carboxydovorans— типичного
представителя карбоситрофных бактерий. СО-
дегидрогеназа имеет мол. массу 230-300 кДа
и включает в качестве кофактора молибден-
содержащий птерин (бактоптерин). Аналогич-
ный или сходный птерин содержат все молиб-
деновые (за исключением нитрогеназы) окси-
доредуктазы /дегидрогеназы. СО-дегидрогеназа
Р. carboxydovorans, локализованная внутри кле-
точной мембраны, передает электроны от СО в
дыхательную цепь на уровне цитохрома Ь. Об-
разование NADH+ происходит путем обратного
переноса электронов. Поскольку СО инактиви-
рует обычные цитохромоксидазы, при его окис-
лении используется особая, пе чувствительная
к СО цитохромоксидаза, на которую электроны
передаются через цитохром 656З- Перенос двух
электронов от СО на цитохромоксидазу сопро-
вождается транслокацией через плазматическую
мембрану четырех протонов. При окислении Н2
используется энергетически более эффективная
ветвь дыхательной цепи: электроны с участием
Таблица 10.9. Характеристики некоторых карбок-
ситрофных бактерий. Все приведенные в таблице
СО-окисляющие бактерии используют кислород как
акцептор электронов и немногие способны использовать
(как альтернативный акцептор) нитрат. Нг— рост с ис-
пользованием Нг 4-СОг; NO^—использование нитра-
та как акцептора электронов; N2 — использование Мг
как источника азота; М—мезофилы; Т — термофилы.
По Meyer О. (1989). Aerobic carbon monoxide-oxidizing
bacteria. In: Schlegel H. G., Bowien B. (eds). Autotrophic
bacteria. Madison, Wise.: Science Tech.; 331-350
Виды
Arthrobacter sp. (H2, M)
Hydrogenophaga pseudoflava (Нг, M)
Pseudomonas carboxydohydrogena (Пг, M)
Pseudomonas carboxydovorans (H2, M)
Pseudomonas compransoris (Нг, M)
Pseudomonas gazotropha (Нг, M)
Bacillus schlegelii (Иг, T)
Pseudomonas thermocarboxydovorans (T)
Strep tomyces G26 (T)
Alcaligenes carboxydus (M)
Acinetobacter spp. (M)
Azomonas spp. (M)
Azotobacter spp. (Нг, N2, M)
Rhizobium japonicum (NO^, Иг, Иг, M)
Изолиты S17 и A305 (Нг, Иг, M)
цитохрома с передаются на цитохромоксидазу
о-типа с переносом через мембрану 6 протонов в
расчете на 2 электрона.
Промышленное применение водородных
и СО-окисляющих бактерий □ Рассматрива-
ется возможность использования бактерий этих
групп для синтеза из СОг и водорода поли-/3-гид-
роксимасляной кислоты и других полигидрокси-
алканоатов в качестве основы пластмасс, доступ-
ных для биодеградации. Перспективным может
быть использование денитрифицирующих водо-
родных бактерий для удаления нитрата из пи-
тьевой воды. Привлекательность этого метода
Глава 10. Окисление неорганических соединений хемолитотрофами 321
состоит в использовании нетоксичного аген-
та—водорода, который необходимо при этом
продувать через реакторы с иммобилизованны-
ми водородными бактериями, превращающими в
анаэробных условиях в N2. В следующем,
аэрируемом реакторе остаточный нитрит реокис-
ляется до нитрата и минерализуются примеси
органических соединений, а также происходит
окисление остаточного водорода. На последнем
этапе (фильтрация через песок) происходит отде-
ление нерастворимых минеральных частиц. Сме-
шанные культуры водородных и СО-окисляющих
бактерий широко используются в биофильтрах
для очистки от СО и Нг газообразных промыш-
ленных отходов.
Практически все водородные и СО-окисляющие
бактерии — факультативные хемолитоавтотрофы.
Это означает, что они могут использовать органи-
ческие субстраты в качестве основного или допол-
нительного источника углерода и энергии. При
миксотрофном росте водородные и СО-окисляю-
щие бактерии используют Н2 и/или СО2 одновре-
менно с органическим субстратом.
10.10. Железо- и марганец-окисляющие бактерии
Несмотря на то, что железо присутствует в био-
сфере как один из основных элементов, извест-
но лишь немного бактерий, способных получать
энергию путем его аэробного окисления. Это мож-
но объяснить рядом причин. Во-первых, в доступ-
ной для окисления (растворимой) форме, Fe(II),
железо редко присутствует в среде в достаточ-
ной концентрации и значительно более распро-
странены нерастворимые соединения Fe(III), па-
пример сульфиды и (гидро) ксиды. Источником
образования Fe2+ мог бы служить процесс анаэ-
робного дыхания с использованием Fe3+ в каче-
стве акцептора электронов, однако его скорость
ограничена чрезвычайно низкой растворимостью
гидроксидов Fe(III) при нейтральном значении
pH. Во-вторых, как отмечено в разд. 10.1.2 (при-
мер 3), изменение свободной энергии в реакции
окисления Fe2+ кислородом воздуха имеет та-
кую величину, которая обеспечивает спонтанное
протекание химического окисления железа и при
pH 7 оно конкурирует с бактериальным окис-
лением. При снижении pH (тот же разд., при-
мер 2) растворимость Ве(Ш)-соединений суще-
ственно возрастает и при pH ниже 4 концентра-
ция железа в форме Fe(II) более стабильна в при-
сутствии кислорода. При pH 3 величина изме-
нения свободной энергии AGr в реакции (10.6)
составляет (—91,0 кДж/моль), поэтому неудиви-
тельно, что многие хемолитоавтотрофные желе-
зоокисляющие прокариоты относятся к ацидофи-
лам (табл. 10.10). Часть их способна окислять
и соединения серы (табл. 10.5). Бактерии рода
Leptospirillwn окисляют только железо, хотя рас-
тут с использованием пирита, благодаря тому что
образующийся в реакции окисления Fe(II) ион
Fe3+ воздействует на пирит как окислитель.
FeS2 + 14Fe3+ + 8Н2О ->
-> 15Fe2+ + 2SO^“ + 16Н+ (10.30)
Существует предположение, что аналогичный ме-
ханизм обеспечивает рост Thiobacillus ferrooxidans
с использованием пирита, но вместе с тем имеет-
ся много данных в пользу того, что Т. ferrooxidans
обладает ферментами окисления серы и получает
в этом процессе больше энергии, чем при окисле-
нии железа.
Таблица 10.10. Ацидофильные железоокисляющие прокариоты
Мезофилы Умеренные термофилы Экстремальные термофилы
Leptospirillum ferrooxidans Thiobacillus ferrooxidans Sulfobacillus thermosulfidooxidans Неидентифицированные Thiobacillus-noppGnbie изоляты (штаммы ш-1, ТН1, ТНЗ, ALV, ВС и К) Acidianus brierleyi Metallosphaera sedula Sulfolobus acidocaldarius Sulfolobus solfataricus
322 Часть III. Многообразие метаболических путей
Таблица 10.11. Нейтрофильные железобактерии, участвующие в отложении Fe(lll). По Jones J.G. (1986) Adv.
Microbial. EcoL 9: 149-185
Морфологический тип Род или группа
Чистые культуры В чистой культуре не выделены
Нитчатые бактерии Простековые и стебельковые бактерии Кокки, обладающие капсулой Палочки, вибрионы Leptothrix, Sphaerotilus Hyphomicro Ыитп, Gallionella, Pedomicrobium, Planctomyces З'-Proteo bacteria Clonothrix, Crenothrix, Lieskeella, Toxothrix Metallogenium, Seliberia? Naumanniella, Ochrobium, Siderocapsa (Arthrobacter), Siderococcus
Среди ацидофильных железоокисляющих
прокариот известны облигатные и факультатив-
ные хемолитоавтотрофы, а также организмы, для
которых окисление железа является «побочным»
процессом, не сопряженным с получением энергии
(например, Acidiphilium cryptum). Существуют ли
хемолитогетеротрофные железобактерии, в на-
стоящее время не известно. В большом количестве
ацидофильные железобактерии обнаруживаются
в сульфидных минералах, таких как пирит и суль-
фиды других металлов; при доступе кислорода
и воды они сильно подкисляют среду обитания,
что часто наблюдается, например, в угольных
шахтах. Если кислые шахтные воды попадают в
грунтовые воды, имеющие нейтральный pH, про-
исходит выпадение в осадок основных сульфатов
Fe(III) — ярозитов, которые снижают плодородие
почвы и вызывают засорение дренажных труб.
Закисление почвы при этом приводит к гибели
многих живых организмов.
Наиболее известные представители нейтро-
фильных железобактерий—Gallionella ferrugino-
sa и виды Leptothrix (табл. 10.11). Они участву-
ют в образовании ржавых осадков (охры) в бо-
лотах и заболоченных почвах с нейтральной и
слабощелочной реакцией среды. Стебельковая
бактерия G. ferruginosa использует энергию
аэробного окисления Fe(II) для фиксации СОг в
цикле Кальвина, т. е. относится к литоавтотро-
фам. Нитчатые, имеющие трубковидный чехол
бактерии Leptothrix окисляют Fe(II) с образова-
нием вокруг нитей в большом количестве хло-
пьев и налетов оксидов железа [Fe(III)|. В массо-
вом количестве нейтрофильные железобактерии
растут в дренажных трубах и железосодержащих
ручьях. Недавно из таких очагов «цветения» пу-
тем культивирования в градиенте Fe2+—Ог (см.
рис. 10.9) были выделены железоокисляющие хе-
молитотрофные микроорганизмы в форме обыч-
ных палочек и вибрионов.
Механизм окисления Fe(II) подробно иссле-
дован у Thiobacillus ferrooxidans. Оно происхо-
дит в периплазме и сопровождается выделением
Fe(III) во внешнюю среду. Цитохромсодержащая
Ре(П)-оксидаза передает электроны от Fe(II) на
медьсодержащий белок рустицианин, который да-
лее переносит их непосредственно на терминаль-
ную цитохромоксидазу (рис. 10.13). Она высво-
бождает электроны, вероятно, на цитоплазмати-
ческой стороне мембраны, где их акцептирует
кислород с образованием воды. Таким образом,
в этой реакции происходит внутриклеточное по-
требление протонов. Поскольку Т. ferrooxidans,
образуя H2SO4, обитает в очень кислой среде и
в то же время pH цитоплазмы у него близок к 6,
на мембране существует постоянный протонный
градиент, который обеспечивает образование АТР
при участии АТР-синтазы. У других ацидофиль-
ных организмов, как показали недавние иссле-
дования, в окислении железа могут участвовать
иные растворимые и мембраносвязанные перенос-
чики электронов.
На использовании ацидофильных железобак-
терий основаны методы бактериального выщела-
чивания меди, марганца, урана, золота и других
драгоценных и редких металлов из бедных руд.
переработка которых металлургическими метода-
ми экономически нецелесообразна. Технолог пя со-
стоит в том, что рудные отвалы или отходы ме-
таллургических производств, содержащие суль-
фиды редких металлов, орошают подкисленной
водой, что способствует бактериальному окисле-
нию сульфидных минералов до серной кисло-
ты и Fe(III) и сопровождается снижением pH
Глава 10. Окисление неорганических соединений хемолитотрофами 323
Рис. 10.13. Предполагаемая схема расположения пере-
носчиков электронов при окислении Fe2+ у Thiobacillus
ferrooxidans. Цит с — растворимый цитохром С552;
Си-белок — рустицианин, Сид и Сив — медьсодержащие
белки терминальной оксидазы; Fo и Fi — интегрирован-
ный в мембрану и ассоциированный с мембраной ком-
поненты ATP-синтазы. По [4].
Таблица 10.12. Реакции микробного выщелачивания
металлов из руд, осуществляемые многими ацидофиль-
ными бактериями. Например, Thiobacillus ferrooxidans
окисляет пирит (FeS2) до сульфата и Fe2+, который да-
лее окисляется до Fe3+. Ионы Fe3+ химически окис-
ляют нерастворимые сульфиды металлов (такие, как
FeS2 и CuS) с образованием молекулярной серы (S°) и
ионов двухвалентных металлов. Сера и Fe2+ окисляются
бактериями до сульфата и Fe3+ соответственно. Меха-
низм бактериального окисления сульфидов, включаю-
щий стадию химического окисления, называют непря-
мым, механизм непосредственного окисления сульфи-
дов бактериями — прямым
2 FeS2 + 2 Н2О + 7 О2 -> Fc2+ + SO2- + 4 Н+
4 Fe2+ + О2 + 4 Н+ -> 4 Fe3+ + 2 Н2О
2 Fe3+ + FeS2 — 3 Fe3+ + 2 S°
2 S° + 3 O2 + 2 H2O 2 SO2~ +4 H+
4 Fe3+ + CuS 4 Fe2+ + Cu2+ + S°
до 1,0-1,5 (в этом диапазоне кислотности действу-
ет буфер HSO4-/SO4 , рК 1,9). Кислота раство-
ряет медь, переводя се в двухвалентную форму.
Растворенный Fc3+ может вызывать химическое
окисление минералов. Некоторые из протекаю-
щих при этом реакций суммированы в табл. 10.12.
Для выделения металла через породу пропус-
кают воду и затем металлургическими способа-
ми добывают из нее медь. Отработанные про-
мывные воды пропускают через аэрируемый ре-
актор, где Fe(II) реокисляется бактериями до
Таблица 10.13. Роды бактерий, включающие марганец-
окисляющие виды. По Nelson К. Н. (1983) The microbial
manganese cycle. In: Krumbein W. E. (ed.) Microbial
geochemistry. Oxford: Blackwell; 191-221
Aero-monos Leptothrix
Arthrobacter Metallogenium
Bacillus Micrococcus
Caulococcus Nocardia
C'lonothrix Oceanospirillum
Flavobacterium Pedomicrobium
Hyphomicrobium Pseudom onas
Kuznetsovia Streptomyces
Fe(TII), после чего этими водами вновь орошают
отвалы породы. Микробное выщелачивание эко-
номически весьма рентабельно, и с его помощью
в США, например, добывается до 15-20% меди.
Железобактерии окисляют Fe2+ до Fe3+. Трсх-
валептное железо как сильный окислитель может
принимать участие в окислении других метал-
лов в местах обитания железобактерий. Многие
ацидофильные железобактерии, способные так-
же окислять восстановленные соединения серы
с образованием серной кислоты, используются
для выщелачивания металлов из сульфидных руд,
содержащих, например, нерастворимый сульфид
меди CuS. Эта технология позволяет растворять
CuS и добывать из бедной руды медь. Отрица-
тельным результатом деятельности железобакте-
рий может быть закисление почв и загрязнение их
осадками оксидов и сульфатов железа, нераство-
римых при нейтральной реакции среды.
Марганец способны окислять представители
различных систематических групп (табл. 10.13).
Изменение свободной энергии в реакции окис-
ления двухвалентного марганца составляет весь-
ма высокую отрицательную величину, вследствие
того что в реакции образуется нерастворимый
продукт, МпОг- Убедительно доказано, что по
крайней мере некоторые марганец-окисляющие
бактерии относятся к хемолитоавтотрофам. Пред-
положительно они выполняют определенную роль
на границах аэробной и анаэробной зон у поверх-
ности донных осадков и в зоне термоклина в во-
доемах, участвуя в цикле окисления сероводорода
кислородом с образованием промежуточных Мп-
и Fe-содержащих продуктов (см. гл. 30-32). Воз-
можно также, что марганец-окисляющие бакте-
рии вносят вклад в образование марганцевых кон-
креций, обнаруженных на морском дне.
324 Часть III. Многообразие метаболических путей
Дополнительная литература
Balows А., TriiperH. G., Dworkin М., Harder W.,
Schleifer К. Н. (eds.) (1992). The prokaryotes,
2nd edn. Berlin, Heidelberg, New York: Springer;
Chapters 14 Kelly D.P. (chcmolithotrophs); 15
Aragno M., Schlegel H. G. (Knallgas bacteria); 16
Robertson L. A., Kuenen .1. G. N. (colorless sulfur
bacteria); 17 Bock E., Koop II. P., Ahlers B.,
Harms H. (nitrifiers); 18 Lidstrom M.E. (methylo-
trophs); 113 BockE., Koops H.P. (Nitrobacter);
114 Nealson К. H. (manganese oxidizers); 115
Van Verseveld ILL W., Stouthamer A. H. (Paracoc-
cus')-, 137 Koops H. P. R., Moller U.C. (manganese
oxidizers); 138 Kuenen.LG., Robertson L. A.,
Tuovinen О. H. (Thiobadllus, Thiomicrospira, and
Thiosphaera)’, 166 Nelson D. C. (Beggiatoa)-, 215
Felbeck H., DistelD.L. (symbiotic lithotrophs); 217
Aragno M. (thermophilic Knallgas bacteria); 218
la Rivifere J. W.M., Schmidt К. (conspicuous sul-
furoxidizing cubacteria); 236 Ilanert K. (iron and
manganese oxidizers).
De Zwart J. M. M., Kuenen .LG. (1992) Ci cycle of sulfur
compounds. Biodegradation 3: 37-50.
Friedrich B., Schwartz E. (1993). Molecular biology of
hydrogen utilization in aerobic chemolithotrophs.
Annu. Rev. Microbiol. 47 351-383.
Kelly D. P., Kuenen .LG. (1984). Ecology of the colorless
sulphur bacteria. In: Codd G. A. (ed.). Aspects of
microbial metabolism and ecology. London: Academic
Press; 211-240.
Kuenen J. G., Robertson L. A., Van Gemerden II. (1985).
Microbial interactions among aerobic and anaerobic
sulfur oxidizing bacteria. Adv. Microbial. Ecol. 8
1-59.
Kuenen.LG., Pronk.LT., Ilazeu W., Meulenberg R„
Bos P. (1993). A review of bioenergetics and
enzymology of sulfur compound oxidation by
acidophilic thibacilli. In: TormaA.E., ApelM. L.,
Brierley C. L. (eds.) Biohydrometallurgical technolo-
gies, vol. 2. Warrendale, Penn.: Minerals, Metals and
Materials Society: 487-494.
Kuenen J. G., Robertson L. A. (1994). Combined nitri-
fication-denitrification processes. FEMS Microbiol.
Rev. 15: 109-117.
Nealson K.Y., Saffarini D. (1994). Iron and manganese
in anaerobic respiration: Environmental significance,
physiology and regulation. Annu. Rev. Microbiol. 48:
311-343.
Pronk.LT., Johnson D. В. (1992). Oxidation and
reduction of iron by acidophilic bacteria.
GeomicrobioL .1. 10: 153-171.
Rawling D. E., Kusano T. (1994). Molecular genetics of
Thiobadllus ferrooxidans. Microbiol. Rev. 58: 39-55.
Schlegel II. G-, Bowien B. (eds.) (1989). Autotrophic
bacteria. Madison, Wise.: Science Tech.
Источники рисунков
1. LaneD.J., Harrison A. P., Stahl D., PaceB.,
Giovannoni S. J., Olsen G. J., PaceN. R. (1992). J.
Bacteriol. 174: 269-278.
2. Nelson D. C. (1989). Physiology and biochemistry
of filamentous sulfur bacteria. In: Schlegel H. G.,
Bowien B. (eds.). Autotrophic bacteria. Madison,
Wise.: Science Tech.: 219-238.
3. Hooper A. H. (1989). Biochemistry of the nitrifying
lithoautotrophic bacteria. In: Schlegel H.G.,
Bowien B. Autotrophic bacteria. Madison, Wise.:
Science Tech.: 239-265.
4. Rawlings D. E., Kusano T. (1994). Microbiol. Rev.
58: 39-55.
Глава 11
Аэробное дыхание и регуляция аэробного/анаэробного
метаболизма
В этой главе рассмотрена роль кислорода в
метаболизме аэробных, микроаэрофильпых и фа-
культативно анаэробных прокариот. Как по-
всеместно присутствующее соединение с высо-
ким окислительно-восстановительным потенциа-
лом молекулярный кислород служит наиболее
важным и предпочтительным окислителем в про-
цессах обмена веществ. Вначале следует кратко
описать основные химические и физические свой-
ства Оз-
ll.1. Уникальными свойствами Ог обусловлена его роль
в жизнедеятельности клеток
11.1.1. Свойства молекулярного кислорода
Содержание Оз в атмосферном воздухе состав-
ляет 21%. В насыщенной воздухом воде
его содержание ниже — 0,276 ммоль/л при 20°С
(табл. 11.1). Этого количества растворенного Оз
достаточно для окисления до СО2 и воды лишь
0,046 ммоль глюкозы/л. При повышении темпе-
ратуры или ионной силы раствора растворимость
О2 в воде снижается. Доступность кислорода ли-
митирована также скоростью его диффузии, ко-
торая в воде на четыре порядка ниже, чем в воз-
духе. Таким образом, в условиях интенсивного по-
требления кислорода микроорганизмами скорость
его поступления становится фактором, лимитиру-
ющим рост. В клетки Ог проникает путем диф-
фузии через плазматическую мембрану. Фосфо-
липидные мембраны легко проницаемы для О2,
как и для других газов. Каких-либо специаль-
ных переносчиков О2, подобных гемоглобину, у
прокариот не имеется. Для роста аэробных бак-
терий содержание Ог в среде представляет важ-
ный параметр; его влияние можно определить при
культивировании их в оксистате, где количество
кислорода поддерживается па том или ином по-
стоянном уровне. Для измерения концентрации
Ог, в нем используется кислородный электрод
(рис. 11.1).
В природных местообитаниях молекулярный
кислород в основном представлен неактивиро-
ванной формой — триплетным кислородом.
В этой форме он используется бактериями в ка-
честве субстрата для дыхания. При аэробном
метаболизме в ферментативных или нефермен-
тативных окислительно-восстановительных реак-
циях образуются высокореакционноспособные и
поэтому токсичные формы кислорода, такие как
супероксид-анион, или супероксид-радикал
(O-J'), пероксид водорода (Н2О2) или гидрок-
сил-радикал (Н0‘) (табл. 11.2). Обычно концен-
трация этих форм кислорода поддерживается в
клетках аэробных бактерий на низком уровне бла-
годаря активности защитных ферментов, превра-
щающих Н2О2 и O-J' в Н2О и Ог- Пероксид во-
дорода химически относительно стабилен и уме-
ренно токсичен, тогда как супероксид-радикал и,
в особенности, гидроксил-радикал высокотоксич-
пы. Время полураспада гидроксил-радикала со-
ставляет несколько миллисекунд, и он реагирует
практически со всеми органическими соединени-
ями. Две эти высокотоксичные формы кислоро-
да вызывают перекисное окисление мембранных
липидов в составе клеток с образованием псрок-
сидных радикалов (ROO’), способных разрушать
многие другие клеточные компоненты и нарушать
клеточные функции.
326 Часть III. Многообразие метаболических путей
Таблица 11.1. Содержание Ог и скорость его диффузии в различных средах
Среда Содержание Ог Коэффициент диффузии, см2- сек"1
Воздух (20 °C) 0,21 атм 1 2,0 - 10”1
Вода, насыщенная воздухом (20 °C) 0,276 ммоль/л 2,3 • 10~5
(35 °C) 0,22 ммоль/л —
Этанол (20 °C) 1,35 ммоль/л —
Нефть (20 °C) 3,8 ммоль/л —
Фосфолипидная мембрана (20 °C) — ~ 2,0 10~5
1 1 атмосфера (атм) = 1 бар = 705 Торр (мм . рт. ст.) = 105 Па
Рис. 11.1. Электрод Кларка для измерения количе-
ства растворенного Ог. Электрод состоит из платино-
вого (Pt) катода и хлор-серебряного (Ag/AgCI) электро-
да сравнения (анод), на которые подается напряжение
0,7 В. На платиновом электроде Ог восстанавливается
до воды электронами, поступающими на него в резуль-
тате окисления серебра в электроде сравнения. Возника-
ющий при этом электрический ток пропорционален кон-
центрации кислорода у платинового электрода и может
быть измерен. Платиновый электрод отделен от изме-
ряемой жидкости тонкой тефлоновой мембраной (плен-
кой), проницаемой для Ог. Равенство концентраций кис-
лорода в измеряемой жидкости и у платинового элек-
трода достигается за счет плотного прилегания мембра-
ны к электроду и высокой скорости диффузии через нее
кислорода. Перед измерением электрод калибруют, ис-
пользуя насыщенный воздухом буфер и бескислородный
буфер, получаемый путем добавления дитионита.
Реакция на аноде: 4Ag 4- 4CI- —> 4AgCI + 4е~
Реакция на катоде: 4Н+ 4-4е“ 4- О? —» 2Н2О
Суммарная реакция: 4Ag 4- 4Н+ 4- 4С1“ 4- Ог —♦
-> 4AgCI 4- 2Н2О
Реакция Формы кислорода ш m
О2 4* е —» С>2 Супероксид- анион -0,33
О^- 4-е“ 4- 2Н+ Н2О2 Пероксид водорода 0,89
Н2О2 4- е~ 4- Н+ —» НО- 4- Н2О Гидроксил- радикал 0,38
НО- 4-е” 4-Н+ ->Н2О Вода 2,33
О2 4-4е~ 4-4Н+ Н2О Вода 0,82
Таблица 11.2. Биологически важные формы кислорода
и их образование в восстановительных реакциях с пере-
носом одного электрона
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 327
11.1.2. Кислород служил важным фактором
эволюции живых организмов
Атмосфера Земли исходно не содержала кисло-
рода, и появившийся в ней молекулярный кис-
лород имеет биологическое происхождение, глав-
ным образом как продукт оксигенного фотосин-
теза. Возникновение фотосинтеза с выделением
кислорода предположительно относят ко време-
ни 2,7 • 109 лет назад.1 Спустя примерно 500 млн.
лет после окисления основных запасов восстанов-
ленных соединений, в первую очередь Fe(II), кис-
лород начал накапливаться в атмосфере, где его
содержание достигло современного уровня при-
мерно 400 млн. лет назад и с тех пор остается при-
близительно постоянным. Появление кислорода
сделало возможным развитие аэробного мета-
болизма, став важнейшим фактором эволюции.
По-видимому, только с возникновением аэробно-
го метаболизма как более эффективного по срав-
нению с анаэробным стало возможным разви-
тие эукариотических клеток. В настоящее вре-
мя образование кислорода в процессе оксигенного
фотосинтеза [реакция (11.1)] и его поглощение
в результате аэробного дыхания [реакция (11.2)]
близки к равновесию (табл. 11.3) и являются ос-
новными процессами в глобальном цикле кисло-
рода на Земле. Вклад в него иных биологических
и абиотических процессов менее значителен.
2Н2О + СО2 -> [СН2О] + Н2О + О2 (11.1)
[СН2О] + О2 -> Н2О + СО2 (11.2)
Таблица 11.3. Процессы образования и поглощения О2
в цикле кислорода
Процессы Количество, 1012 моль 02/год
Образование О2 Оксигенный фотосинтез Абиогенное разложение Н2О Поглощение О2 Дыхание и аэробный метаболизм Абиогенное окисление метана Выветривание (С-, S- и FeO-содержащие минералы) Сгорание (древесина, уголь, нефть) 15 000 0,007 ^15 000 14 940 50 10 350 ^15 350
11.2. Кислород выполняет разнообразные функции в метаболизме прокариот
Молекулярный кислород участвует во многих
метаболических реакциях. У аэробных и мик-
роаэрофильиых организмов он служит предпо-
чтительным акцептором электронов в процессе
дыхания. Аэробное дыхание сопряжено с обра-
зованием электрохимического мембранного по-
тенциала и фосфорилированием ADP. У неко-
торых бактерий, таких как толерантные к кис-
лороду анаэробы, кислород используется для
окисления избытка внутриклеточных восстанови-
телей— NADH или других восстановленных со-
единений, что не связано, как правило, с запаса-
нием энергии. К реакциям этого типа относится
окисление лактата, катализируеь юе лактатокси-
дазой:
L-лактат + О2 —» Пируват 4- Н2О2 (П-3)
Этот фермент присутствует у некоторых молоч-
нокислых бактерий. У аэробных бактерий во мно-
гих катаболических и анаболических реакциях
кислород используется в качестве косубстрата.
Так, микробное разложение химически инертных
субстратов, например алканов и ароматических
соединений, начинается с включения в их моле-
кулы кислорода из О2 при участии мопо- или
диоксигеназ. Кислород некоторых гидроксиль-
ных групп в составе клеточных компонентов —
продуктов биосинтеза — происходит из О2- В то
же время при использовании О2 аэробами об-
разуются токсичные продукты. В соответствии
с многообразием эффектов О2 бактерии облада-
ют многочисленными механизмами ответа на его
присутствие. Таким образом, молекулярный кис-
лород служит важным фактором (сигналом) ре-
1 См. прим, в гл. 29 (вед. ред.).
328 Часть III. Многообразие метаболических путей
гуляции катаболизма и анаболизма на уровне
транскрипции. Многие бактерии, кроме того, от-
вечают па благоприятные концентрации О2 по-
ложительным аэротаксисом и на неблагоприят-
ные — отрицательным (см. разд. 20.5.7).
11.2.1. Большое число ферментов и кофакторов
катализирует реакции с участием
кислорода
Разнообразные ферменты катализируют окисли-
тельно-восстановительные реакции с участием Ог
как субстрата или продукта (табл. 1.4). Эти фер-
менты содержат в активном центре нростетиче-
ские группы в виде атомов металлов (таких как
железо, медь или марганец), флавина или гема.
В свободном состоянии эти группы могут мед-
ленно взаимодействовать с Ог неферментативным
путем. Ионы металлов и гемы соединяются с фер-
ментами данного типа таким образом, что одна
из их координационных связей остается свобод-
ной для взаимодействия с Ог-
Ферменты, катализирующие перенос электро-
нов на Ог, называют оксидазами (табл. 11.4).
Они могут быть мембраносвязанными, как окси-
дазы дыхательной цепи, или растворимыми, как
глюкозооксидаза. Продуктами реакций окисления
являются НгО или Н2О2. В случае дыхательных
оксидаз Ог связывается с двухъядерпым актив-
ным центром гем-гем- или гем-Си-типа и восста-
навливается до НгО. Оксигеназы катализируют
включение Ог в молекулу субстрата. Диоксиге-
назы расщепляют молекулу Ог с последующим
включением обоих атомов кислорода в органиче-
ские субстраты. Важная функция диоксигеназ у
аэробных бактерий состоит в расщеплении аро-
матических колец. Монооксигеназы (гидрокси-
лазы) катализируют включение в органический
субстрат только одного атома кислорода из мо-
лекулы Ог, восстанавливая второй атом до НгО.
Активный центр многих гидроксилаз содержит
гем b или негемовое железо. Эти кофакторы
связывают Ог и восстанавливают его с образо-
ванием реакционноспособной формы кислорода,
необходимой для гидроксилирования субстрата.
Восстановителем во многих монооксигеназных ре-
акциях служит NADH. Относящийся к классу
монооксигеназ фермент люцифераза светящихся
грамотрицательных бактерий содержит ковалент-
но связанный кофактор флавин. .Люциферазная
реакция сопровождается эмиссией света.
Таблица 11.4. Типы бактериальных ферментов и кофакторов, участвующих в реакциях с потреблением или выде-
лением кислорода
Фермент Кофактор, взаимодействующий с Ог Реакция
Оксидазы Цитохром-с-оксидаза ааз Хинолоксидаза Ьоз Гл юкозооксидаза Оксигеназы Катехолдиоксигеназа Метанмонооксигеназа Люцифераза Реакции с образованием О2 Каталаза Супероксиддисмутаза Система фотолиза НгО (фотосистема II) R — алкильный остаток; Цит. — ци Гем аз, Сив Гем оз, Сив FAD+ Fe3+ Двухъядерный Fe~Fe-центр FMN Гем b Fe3+ или Мп3+ Мн-содержащий комплекс (4 атома Мп) тохром, Q — убихинон 4Цит.восст + О2 + 4Н+ 2Н2О + 4Цитокисл. 2QH2 + О2 — 2Н2О Глюкоза + О2 —» Глюконат + Н2О2 Катехол + О2 —» цис.цмс-Муконат СН4 + NADH + Il+ + О2 -» СН3ОН + NAD+ + Н2О R-CHO + NAD(P)II + Н+ + О2 -> — NAD(P)+ + Н2О + R-COOH + Яр н2о2 + Н2О2 —> Н2О + о2 Og + О2 + 2Н+ —» П2О2 + О2 2Н2О + 4/ш - О2 + 4Н+ + 4с~
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 329
Многие прокариоты обладают ферментами, в
результате активности которых из реакционно-
способных форм кислорода, таких как пероксиды
(Н2О2, R—ООН) или О2образуются Ог и Н2О
и тем самым осуществляется важная функция де-
токсикации. Эти ферменты содержат в большин-
стве случаев те же кофакторы, что и ферменты,
катализирующие реакции с участием 02- Ката-
лазы содержат в качестве простота ческой груп-
пы гем Ь; они катализируют восстановление Н2О2
с образованием Н2О и Ог, используя вторую моле-
кулу Н2О2 в качестве восстановителя. Суперок-
сиддисмутазы осуществляют реакцию дисмута-
ции супсроксид-аниона О2' с образованием Н2О2
(см. разд. 11.5.2). В их активный центр входит в
качестве кофактора Fe3+ или Мн3+. Ионы мар-
ганца выполняют важную роль в образовании О2
из Н2О в фотосистеме II при оксигешюм фотосин-
тезе.
11.2.2. Присутствие О2 служит важным
экологическим и физиологическим
фактором
Роль О2 как фактора роста микроорганизмов
определяется, с одной стороны, его участием в ме-
таболизме и, с другой стороны, его токсическими
эффектами (рис. 11.2). Способность различных
микроорганизмов заселять тот или иной биотоп
зависит от влияния на них О2. Это можно про-
демонстрировать на примере микробного роста в
столбике полужидкого агара. Кислород присут-
ствует только в его верхней части благодаря мед-
ленной диффузии. Аэробные бактерии растут
и образуют колонии на поверхности агара или под
ней, тогда как облигатно анаэробные бакте-
рии — только в нижней части столбика. Факуль-
тативные анаэробы растут и образуют колонии
во всем столбике агара. Микроаэрофилы рас-
тут в слое агара с низким содержанием 02-
Аэробные бактерии используют О2 для роста
и метаболизма (в первую очередь для дыхания),
тогда как анаэробные организмы растут в отсут-
ствие О2, причем у строгих анаэробов молеку-
лярный кислород вызывает подавление роста или
гибель. Толерантные к О2 анаэробы, напри-
мер молочнокислые бактерии, устойчивы к его
действию при обычных концентрациях. Факуль-
тативно анаэробные бактерии способны расти и
в аэробных, и в анаэробных условиях, осуществ-
Рис. 11.2. Реакция различных бактерий на кислород.
Если бактерии, относящиеся к различным физиологи-
ческим типам, засеять в расплавленную и остуженную
агаризованную среду, содержащую необходимые суб-
страты, то после соответствующей инкубации можно на-
блюдать в застывшем агаре рост колоний в тех зонах
столбика, где концентрация 02 адекватна потребностям
данного микроорганизма.
ляя аэробный или анаэробный метаболизм в за-
висимости от условий среды. Во многих природ-
ных биотопах, например в почве, значительная
часть микробной популяции представлена микро-
аэрофилами. Они нуждаются в О2 для дыхания,
но устойчивы к нему лишь при его пониженном
содержании в среде.
11.2.3. Бактерии способны выживать
при недостатке и постоянном изменении
концентрации О2
Многие бактерии выживают при недостатке О2
или его временном отсутствии в их местообита-
нии.
Во многих местообитаниях условия
микроаэробные □ Микроаэробными называют
условия, при которых концентрация кислорода
не превышает 5% уровня насыщения, что соот-
ветствует 10 мкМ концентрации растворенного в
воде 02- Такие условия создаются во многих био-
топах, когда поступление кислорода обусловле-
но только медленным проникновением его путем
диффузии из воздуха. Микроаэробные усло-
вия характерны, например, для клубеньков бо-
бовых растений, в которых развиваются симбио-
тические азотфиксирующие бактерии Rhizobium
или Bradyrhizobium. Низкая концентрация 02
(С1 мкМ) внутри клубеньков благоприятна для
их роста и процесса фиксации N2.
Для биотопов многих типов характерно по-
стоянное изменение уровня О2. Оно происхо-
330 Часть III. Многообразие метаболических путей
Рис. 11.3. Схема градиентов концентрации кислорода
внутри и на поверхности колонии Bacillus cereus на ага-
ровой среде. Содержание Ог определяли с помощью
кислородного микроэлектрода. Числа на штриховых ли-
ниях— содержание кислорода в %. За 100% принято со-
держание Ог в среде, насыщенной воздухом.
дит, например, на границе раздела между аэроб-
ной и анаэробной зонами в толще воды или у по-
верхности донных отложений, а также в твердых
субстратах, например почве. В почвенных части-
цах и сходных с ними биотопах имеется высо-
кий градиент концентрации кислорода. Всего на
несколько миллиметров ниже аэробной поверхно-
сти условия могут быть анаэробными. Граница
раздела этих зон перемещается в результате из-
менений в поступлении О2, например снижения
его диффузии при ливневых осадках, или вслед-
ствие интенсивного поглощения кислорода клет-
ками при росте бактерий. Таким образом, даже
в аэробных местообитаниях микробные популя-
ции с высокой плотностью клеток, такие как об-
растания, маты или колонии, нс снабжаются в
достаточной степени кислородом и становятся
анаэробными. Концентрацию О2 на поверхности
колонии и под ней можно измерить с помощью
микроэлектродов и представить в виде контур-
ной карты (рис. 11.3). Уже в нескольких мик-
рометрах ниже поверхности она равна пулю, по-
этому лишь топкий слой клеток па поверхности
колонии растет с использованием кислорода, то-
гда как в более глубоких слоях колонии преобла-
дает анаэробное дыхание или брожение. Это де-
монстрируют эксперименты с включением в со-
став агаровой среды в качестве рН-индикаторов
красителей, показывающих образование кислых
продуктов брожения. В водных местообитаниях
причиной сдвигов в концентрации О2 служит из-
менение интенсивности его образования фотосин-
тезирующими организмами в течение суточного
цикла. Такие быстро меняющиеся условия благо-
приятствуют факультативно анаэробным бакте-
риям, которые благодаря гибкости их метаболиз-
ма могут расти и в аэробных, и в микроаэробных,
и в анаэробных условиях.
Микроаэрофильные бактерии приспо-
соблены к низким концентрациям О2 □ Хо-
тя в высоких концентрациях О2 подавляет рост
микроаэрофилов, они нуждаются в нем для ды-
хания. Терминальные оксидазы этих бактерий
имеют низкие (<1 мкМ) величины Км для О2.
Многие «факультативно» микроаэрофильные
бактерии, способные расти при нормальной и по-
ниженной концентрации О2, в микроаэробных
условиях синтезируют терминальные оксидазы с
высоким сродством к кислороду. Так, Escherichia
coli при низком парциальном давлении кисло-
рода синтезирует хинолоксидазу bd, способную
использовать следовые количества О2. Анало-
гично этому клубеньковые бактерии Rhizobium и
Bradyrhizobium в условиях симбиоза внутри клу-
беньков и в свободноживущей форме синтезируют
различные дыхательные ферменты.
Микроаэрофильные бактерии, которые состав-
ляют обширную и важную физиологическую
группу, трудно выращивать в культуре из-за
их особых потребностей в отношении концен-
трации Ог- Один из типов таких бактерий —
магнитные бактерии, например Aquaspirillum
magnetotacticum. Эти бактерии обладают спо-
собностью направленно перемещаться в маг-
нитном поле—магнитотаксисом. Предположи-
тельно она обеспечивает им преимущество в поис-
ке и миграции к микроаэробным зонам.
Факультативные анаэробы могут расти
и в аэробных, и в анаэробных условиях □
В отсутствие кислорода эти бактерии получают
энергию в процессах брожения, анаэробного ды-
хания или фотосинтеза, а также сочетая различ-
ные типы метаболизма. У большинства этих бак-
терий молекулярный кислород вызывает регуля-
торное переключение с одного типа метаболизма
на. другой, что указывает на экспрессию в каждом
случае только ферментов предпочтительного ме-
таболического пути. В аэробных и в анаэробных
условиях у факультативных анаэробов функци-
онируют весьма различающиеся метаболические
пути. Переключение под действием О2 влияет на
синтез ферментов как катаболизма, так и анабо-
лизма. У Е. coli в анаэробных условиях уровень
синтеза большинства ферментов цикла трикарбо-
новых кислот понижен до 5-20% уровня их сии-
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 331
Глюкоза
2ФЕП
I
2 Пируват
2 NADH
Рост в аэробных условиях
Глюкоза
Рост в анаэробных условиях
Рис. 11.4. Функционирование цикла трикарбоновых кислот и сопутствующих реакций при росте Escherichia coli в
аэробных и анаэробных условиях. Жирными стрелками показаны основные пути катаболизма. Реакции, катализиру-
емые в аэробных и анаэробных условиях различными изоферментами, обозначены следующими символами: FumA
и FumB — фумаразы; Sdh— сукцинатдегидрогеназа, Fdr— фумаратредуктаза; AceEF — пируватдегидрогеназа; Pfl —
пируват:формиат-лиаза.
теза в аэробных условиях, причем в результате
почти полного подавления синтеза 2-оксоглута-
ратдегидрогеназы этот цикл разделен на две вет-
ви— окислительную с конечным продуктом ок-
соглутаратом и восстановительную с конечным
продуктом сукцинил-CoA (рис. 11.4). Оксоглу-
тарат и сукцинил-CoA используются в качестве
предшественников для синтеза аминокислот се-
мейства глутамата и других биосинтетических
реакций. Восстановительная ветвь, начиная с
фосфоеиолпирувата, выполняет также катаболи-
ческую функцию, обеспечивая образование фума-
рата как акцептора, электронов. Синтез пируват-
дегидрогеназы в анаэробных условиях подавлен,
тогда как пирува.т:формиат-лиаза синтезируется
в большем количестве (рис. 11.4). При подавле-
нии цикла трикарбоновых кислот полное окисле-
ние ацетил-СоА до СОз невозможно и в среду
выделяются ацетат, этанол или другие продукты
обмена.
В то же время у многих денитрифицирующих
бактерий, таких как Pseudomonas, Paracoccus и
Alcaligenes, в анаэробных условиях синтез фер-
ментов цикла трикарбоновых кислот не подавля-
ется, если в среде присутствует нитрат. В про-
цессе нитратного дыхания окисляются хинол и
NADH, восстановленные при окислении органи-
ческих субстратов.
11.2.4. Молекулярный кислород служит
доминирующим регуляторным сигналом
Переключение с аэробного на анаэробный метабо-
лизм у факультативно анаэробных бактерий тре-
бует существенного изменения в наборе фермен-
тативных активностей, как катаболических, так
и анаболических. Этот сдвиг происходит глав-
ным образом на уровне транскрипции, приводя
к повышению или снижению синтеза ферментов
аэробного или анаэробного метаболизма. У Е. coli
экспрессия более 150 генов (примерно 5% их обще-
го числа, в хромосоме) положительно или отрица-
тельно регулируется уровнем О2. Таким образом,
у факультативных анаэробов молекулярный кис-
лород служит одним из наиболее важных регуля-
торных сигналов.
У факультативных анаэробов функци-
онируют предпочтительно пути с высо-
ким выходом АТР □ Некоторые факультатив-
но анаэробные бактерии способны использовать
в качестве акцептора электронов не только О2,
но также нитрат, нитрит и фумарат. Эти соеди-
нения, как правило, регулируют синтез фермен-
тов соответствующего пути по иерархическому
принципу. Например, у Е. coli функционирование
того или иного пути определяется присутствием
332 Часть III. Многообразие метаболических путей
Таблица 11.5. Регулируемые кислородом метаболические пути и ферменты у факультативных анаэробов
Путь/фермент Регуляторный эффект Ог (положительная или отрицательная регуляция) М и кроорга н измы (примеры)
Катаболизм Аэробное дыхание Цикл трикарбоновых кислот Пируватдегидрогеназа Оксигеназа (разложение ароматических соединений) Анаэробное дыхание Брожение Фотосинтез Пируват:формиат-лиаза Анаболизм/промежуточный метаболизм Глиоксилатный цикл Фиксация N2 Положительная Положительная Положительная Положительная Отрицательная Отрицательная Отрицательная Отрицательная Положительная Отрицательная Escherichia coli Escherichia coli Escherichia coli Pseudomonas Escherichia coli Escherichia coli Rhodobacter Escherichia coli Escherichia coli Klebsiella
конкретных акцепторов электронов — более пред-
почтительные из них подавляют синтез фермен-
тов, использующих менее выгодные в энергети-
ческом отношении акцепторы. Так, О2 подав-
ляет синтез ферментов анаэробного метаболиз-
ма, нитрат — синтез ферментов брожения и анаэ-
робного дыхания с фумаратом в качестве ко-
нечного акцептора (табл. 11.5). Иерархический
ранг данного метаболического пути определяет-
ся суммарной величиной AG'0/ и выходом АТР.
У многих бактерий О2 регулирует также синтез
кофакторов, коферментов и биосинтетических
ферментов, активность которых зависит от О2 в
качестве косубстрата, например синтез оксигеназ
(табл. 11.5). Однако у некоторых бактерий, таких
как Thiosphaera, О2 и нитрат не подавляют синтез
ферментных систем, использующих другие акцеп-
торы электронов, и различные акцепторы могут
использоваться одновременно. Так, нитратное ды-
хание может происходить в присутствии кислоро-
да, анаэробное дыхание с использованием фума-
рата— в присутствии нитрата.
Бактерии содержат различные регуля-
торные системы, чувствительные к О2 □
Регуляция метаболизма в ответ на О2 на уровне
транскрипции у Е. coli осуществляется тремя
регуляторныт ш системами. Экспрессия генов
аэробного метаболизма зависит от регуляторной
системы Аге (от aerobic respiratory control). В ре-
гуляции транскрипции генов анаэробного дыха-
ния принимает участие активатор транскрипции
Fiir (от fumarate nitrate reductase regulation).
Синтез некоторых ферментов брожения, напри-
мер формиат/гидроген-лиазы регулируется бел-
ком FhlA (от formate hydrogen lyase regulation).
Механизм чувствительности к О2 у каждой из
этих систем особый. Функционирование и взаимо-
действие этих трех регуляторных систем рассмот-
рены в гл. 21.
Бактерии обладают таксисом по отноше-
нию к О2 □ Многие бактерии, имеющие жгу-
тики, в среде с градиентом концентрации О2 ак-
тивно перемещаются в область его оптимальной
для них концентрации. Эту реакцию называют
аэротаксисом (см. также разд. 20.5.7). Положи-
тельный аэротаксис — это движение в область бо-
лее высокой концентрации О2, отрицательный —
в область его более низкой концентрации. Для
аэробных и факультативно анаэробных бактерий
характерен положительный аэротаксис, для анаэ-
робных— отрицательный. В области концентра-
ций О2, превышающих оптимальную, аэробные
бактерии могут проявлять отрицательный аэро-
таксис.
По-видимому, аэротаксис у аэробных и фа-
культативно анаэробных бактерий — это основная
реакция, необходимая для поддержания предпо-
чтительных в отношении уровня О2 условий и
метаболизма, и только в том случае, если эта
стратегия не дала результатов, происходит пе-
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 333
реключение па анаэробный тип обмена веществ.
Микроаэрофильные бактерии способны как к по-
ложительному, так и к отрицательному аэротак-
сису. Они концентрируются в узких зонах с опти-
мальной концентрацией О2- При смещении этой
зоны слой бактерий также меняет свое положение.
В механизмах передачи сигнала и регуляции вра-
щения жгутиков при аэротаксисе участвуют эле-
менты, не используемые в передаче сигнала при
хемотаксисе.
11.3. Использование кислорода в качестве акцептора электронов
обеспечивает эффективное получение энергии
11.3.1. Кислород служит энергетически
наиболее выгодным акцептором
электронов
Возможность запасания большого количества
свободной энергии при аэробном окислении суб-
стратов (см. гл. 4) и повсеместное присутствие
кислорода как компонента среды — это два фак-
тора, которые определяют преимущества аэроб-
ного метаболизма и тем самым значение О2 для
процессов минерализации. Вследствие этих пре-
имуществ более 90% органического вещества ми-
нерализуется микробами с использованием Ог-
Высокий выход АТР в процессе аэробного раз-
ложения органических веществ обусловлен глав-
ным образом высокой положительной величиной
окислительно-восстановительного потенциала О2
как акцептора электронов (см. табл. 4.1) и, поми-
мо того, более полным окислением органических
соединений при участии О2. В аэробных усло-
виях многие микроорганизмы окисляют глюко-
зу до СОг и воды. В отсутствие О2 образуются
более восстановленные конечные продукты, ино-
гда даже при наличии акцепторов электронов, на-
пример нитрата (рис. 11.5). В результате в ды-
хательную цепь поступает меньше электронов и
соответственно синтезируется меньше АТР. Наг
пример, у Е. coli при аэробном окислении мо-
лекулы глюкозы в дыхательную цепь поступает
24 [Н], тогда как в отсутствие кислорода, когда
глюкоза окисляется до двух молекул ацетил-СоА
и двух молекул СО2, в дыхательную цепь (нитрат-
ное дыхание) поступает лишь 8 [Н]. В тоже время
некоторые штаммы Pseudomonas и другие денит-
рифицирующие бактерии, используя нитрат как
конечный акцептор электронов, способны окис-
лять глюкозу полностью до СО2; при этом в ды-
хательную цепь также поступает 24 [Н] на каж-
дую молекулу глюкозы и соответственно процесс
характеризуется более высокой величиной AG'0'.
Количество энергии, запасаемое при функци-
онировании аэробной или анаэробной дыхатель-
ной цепи, зависит от количества, протонов, пере-
секающих мембрану в процессе переноса электро-
нов по дыхательной цепи. Теоретические расчеты,
приведенные в гл. 4, показывают, что при окис-
Рис. 11.5. Окисление глюкозы в процессе аэробного и анаэробного дыхания у Escherichia coli и Pseudomonas. Клетки
Е. coli окисляют глюкозу до СОг и воды только при росте в аэробных условиях. Величины AG0/ относятся ко всему
пути метаболизма глюкозы. Для упрощения схемы принято, что нитрат восстанавливается только до нитрита.
334 Часть III. Многообразие метаболических путей
лении NADH молекулярным кислородом макси-
мальное количество протонов, перенесенных че-
рез мембрану, может быть равно 12Н+/2е~.
Экспериментально измеряемая величина этого со-
отношения в случае митохондрий и некоторых
бактерий достигает 10. У многих бактерий отно-
шение Н+/2е~, зависящее от типа окисляемого
субстрата и используемого акцептора электронов,
может быть значительно ниже максимальной ве-
личины. Учитывая, что на синтез АТР расходует-
ся от 3 до 4 протонов, и зная величину Н+/2 с",
можно определить количество АТР, запасаемого
при окислении того или иного субстрата.
11.3.2. У бактерий обнаружены различные типы
аэробных дыхательных цепей
Аэробные электронтранспортные цепи, описан-
ные у бактерий, можно подразделить на два ти-
па—содержащие хинол щитохром с-оксидоредук-
тазу и не содержащие этот фермент (рис. 11.6).
Электронтранспортные цепи первого типа со-
держат два переносчика электронов — хинон и
цитохром с, а также три оксидоредуктазы.
Молекула цитохрома с у некоторых бакте-
рий, в отличие от митохондрий, содержит
липофильный якорный домен, связывающий его
с мембраной. Кислород в этой цепи восстанавли-
вается при участии цитохром с-оксидазы. В элек-
тротранспортных цепях второго типа цитохром с
отсутствует и хинон окисляется хинолоксидазой,
выполняющей функцию терминальной оксидазы.
Многие бактерии обладают несколькими терми-
нальными оксидазами, которые синтезируются в
различных условиях роста. Эти оксидазы разли-
чаются по сродству к О2, чувствительности к ин-
гибиторам и протонпереносящей активности. Ок-
сидазы с высоким сродством к О2 синтезируются
в условиях низкого содержания кислорода.
Тип электронпереносящей цепи можно опре-
делить с помощью оксидазного теста, кото-
рый обычно используют для выявления окси-
дазной активности как таксономического кри-
терия при идентификации аэробных бактерий.
В этом тесте определяют окисление бактериями
восстановленного N jN-диметил-п-фенилендиами-
на (ТМФД) или дихлорфенол-индофенола. В вос-
становленной форме эти красители не имеют
окраски, тогда как в окисленном окрашены. Их
Рис. 11.6. Структура аэробных дыхательных цепей, со-
держащих и не содержащих хинолоксидазу. Указаны
различные субстраты первичных дегидрогеназ. Элек-
троны от этих субстратов передаются через хинон и ци-
тохромы на оксидазы. Q — убихинон; Цит — цитохром.
окисление бактериями зависит от присутствия ци-
тохрома с, поскольку он имеет соответствующий
окислительно-восстановительный потенциал и ло-
кализован в периплазме, т. е. доступен для краси-
телей.
Электроны поступают в дыхательную цепь
в результате окисления разнообразных субстра-
тов специфическими дегидрогеназами (рис. 11.6).
Некоторые дегидрогеназы представлены у бак-
терий двумя или большим числом изофермен-
тов, катализирующих одну и ту же реакцию, но
различных по составу субъединиц, типу кофакто-
ров или механизмам регуляции. Так, у Е. coli,
относящейся к факультативным анаэробам,
sn-глицерол-З-фосфат окисляется одной из двух
дегидрогеназ, кодируемых различными генами.
Одна из них (продукт гена glpD), синтезируемая в
аэробных условиях, передает электроны в аэроб-
ную дыхательную цепь, вторая (продукт генов
glpABC) синтезируется в анаэробных условиях и
передает электроны в анаэробную дыхательную
цепь. Обе эти дегидрогеназы — мембраносвязан-
ные ферменты, содержащие в качестве простати-
ческой группы FAD.
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 335
Цитохром-с-оксидаза аа3
Paracoccus denitrificans
Запасаемая энергия:
2Н^ + 2 заряда/2е"
Хинолоксидаза Ьо3
£. coli
Запасаемая энергия:
4Н’/2е"
Хинолоксидаза bd
Е. coli
Запасаемая энергия:
2Н*/2е
Рис. 11.7. Типы терминальных оксидаз в дыхательных цепях бактерий. Показаны только каталитические субъеди-
ницы (I и II, А и В) и соответствующие генные продукты для Escherichia coli и Paracoccus denitrificans. Субъединицы I
и II цитохром-с-оксидазы и хинолоксидазы Ьоз в высокой степени сходны по первичной структуре, а, Ь, о и d — гемы.
Гем, взаимодействующий с кислородом в медьсодержащих оксидазах, имеет подстрочный индекс «3». Цитохром
с-оксидаза и хинолоксидаза содержат атомы меди. Q — убихинон, Цит — цитохром.
Для оксидоредуктаз бактериальных дыха-
тельных цепей используют различные названия,
отражая в них либо донорный, либо акцептор-
ный субстрат. Ферменты, окисляющие первичный
донор электронов, называют дегидрогеназами,
тогда как ферменты, восстанавливающие акцеп-
тор электронов — редуктазами или оксидаза-
ми, если этот акцептор О2. Например, фермент,
катализирующий реакцию (11.4), имеет назва-
ния сукцинатжофермспт Q-оксидоредуктаза (си-
стематическое название) и сукцинатдегидрогена-
за (рекомендуемое название) (прежнее название
хинонредуктаза). Фермент, катализирующий ре-
акцию (11.5), называют хинолоксидазой.
Сукцинат + Q —» QH2 + Фумарат (11.4)
QH2 4- |о2 -> Q + Н2О (11.5)
Цитохром с-оксидазы и хинолоксидазы
представляют собой функционально род-
ственные ферменты Всего известно три ос-
новных типа оксидаз (рис. 11.7).
1. Цитохром с-оксидазы. Наиболее подробно
исследован фермент этого типа из Paracoccus
denitrificans. Он состоит из двух каталити-
ческих субъединиц (I и II). Субъединица I,
содержащая два гема а и один атом меди,
действует как протонная помпа, переносящая
2Н+/2е_. Помимо этого, два отрицательных
заряда переносятся через мембрану в проти-
воположном направлении, т. е. в сумме пере-
носится четыре заряда, что эквивалентно че-
тырем протонам на каждую пару электронов
(4Н+/2е ). Субъединица II содержит два иона
меди и выполняет функцию акцептора элек-
тронов от цитохрома с.
2. Медьсодержащие хинолоксидазы. Про-
тотип оксидаз этой группы — хиполоксида-
за Ьоз, синтезируемая Е. coli. Этот фермент
содержит две каталитические субъединицы
(I и II), гомологичные субъединицам цито-
хром с-оксидазы. В состав субъединицы I
входят два гема (гем b и гем о) и один атом
меди. Подобно субъединице I цитохром с-ок-
сидазы, она восстанавливает кислород и пере-
носит протоны. Субъединица II, не содержа-
щая меди, принимает электроны от хинола и
передает их на субъединицу I. Всего в хино-
локсидазной реакции через мембрану перено-
сится 4Н+/2е“. Из них два протона перено-
сит протонная помпа и два других высвобож-
даются в периплазму в результате окисления
хинола с наружной стороны мембраны.
Медьсодержащие хинолоксидазы и цитохром
с-оксидазы называют гем-медь-содержащими
дыхательными оксидазами.
336 Часть III. Многообразие метаболических путей
3. Хинол оксидаза bd, синтезируемая Е. со И,
представляет иной тип дыхательных оксидаз.
Она не содержит меди и первичная структу-
ра двух ее субъединиц (А и В) имеет лишь
небольшое сходство с последовательностями
субъединиц медьсодержащих оксидаз. Элек-
троны от хинола, переносятся с участием од-
ного гема b на содержащий гемы b и d
двухъядерный центр, в котором происходит
восстановление О2. Эта оксидаза не функ-
ционирует как протонная помпа, и образова-
ние протонного градиента с эффективностью
2Н+/2е“ обеспечивается только тем, что окис-
ление хинона и восстановление О2 происхо-
дят на противоположных сторонах мембраны
(рис. 11.7).
Рис. 11.8. Механизм протон-переносящей активности
цитохром с-оксидазы Paracoccus denitrificans. Показа-
ны пути переноса электронов и протонов. Этот фер-
мент, детально исследованный методом рентгенострук-
турного анализа высокого разрешения, состоит из
четырех субъединиц (I—IV), две из которых (I и II) обла-
дают каталитической активностью. Восстановление О2
происходит в двухъядерном гем аз—CuB-центре, лока-
лизованном в субъединице I со стороны периплазмы.
Центр связывания цитохрома с на субъединице I распо-
ложен вблизи двухъядерного CuA-центра в субъедини-
це II на периплазматической стороне мембраны. Элек-
троны в цитохромоксидазном комплексе переносятся по
цепи: Сид - Сид —> гем а —> гем аз. Путь протонов, необ-
ходимых для восстановления Ог внутри фермента, от-
личается от пути протонов, которые перекачивает про-
тонная помпа (4Н+/Ог). В переносе протонов помпой на
периплазматической стороне мембраны участвует оста-
ток гистидина, расположенный вблизи Сив, причем ме-
ханизм переноса на этом участке непосредственно свя-
зан с восстановлением Ог.
Рис. 11.9. Перенос протонов в цикле хинона (Q),
катализируемый хинол:цитохром с-оксидоредуктазами.
Предполагаемый механизм Q-цикла, объясняющий пе-
ренос электронов и протонов хинол:цитохром с-ок-
сидоредуктазой митохондрий, по-видимому, действует
аналогичным образом у Paracoccus denitrificans и других
бактерий. Пути переноса электронов и протонов показа-
ны черными стрелками. Цикл начинается окислением
двух молекул хинола (QH2). Из четырех высвобождае-
мых при этом электронов два передаются на цитохром с
и столько же на хинон. Восстановление Q и окисление
QH2 происходят в различных активных центрах окси-
доредуктазы. Окисление 2QH2 на периплазматической
стороне мембраны приводит к высвобождению 4Н+ в
периплазму, тогда как восстановление Q — к поглоще-
нию 2Н+ из цитоплазмы. Перенос электронов в моле-
куле фермента осуществляют две гем Ь-группы — с низ-
ким (fei_) и с высоким (Ьн) редокс-потенциалом. Окисле-
ние и восстановление молекул хинола, осуществляемые
в различных активных центрах, ингибируют миксо-
тиазол и антимицин А соответственно. Хинолгцито-
хром с-оксидоредуктаза катализирует следующие реак-
ции:
2QH2 + ЗЦит Сокмсл. —> 2Q + 2Цит сВОсст. + 4Н+ + 2е-
Q + 2Н+ + 2е~ -> QH2
Суммарная реакция: QH2 + 2Н+ + 2Цит Сокисл —♦
—> Q + 2ЦИТ Свосст. + 4Н +
Дополнение 11.1. Образование про-
тондвижущей силы (Др) в процессе аэробно-
го дыхания обеспечивают три основных меха-
низма (см. гл. 4): 1) редокс-петли — участки
дыхательной цепи, где в результате пере-
носа электронов протоны поглощаются на
внутренней стороне мембраны и высвобож-
даются на наружной; 2) конформационные
протонные помпы (рис. 11.8) и 3) Q-циклы
(рис. 11.9). Величина протонного градиен-
та, образующегося при функционировании
дыхательной цепи, зависит от наличия этих
механизмов в структуре цепи. У Paracoccus
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 337
denitrificans дыхательная цепь сходна по рас-
положению переносчиков и механизму гене-
рации Др с дыхательной цепью митохондрий
(рис. 11.10). В цепях этого типа при переносе
двух электронов от NADH к О2 через мем-
брану переносится 10 протонов (10Н+/2е_),
шесть из которых — за счет функциониро-
вания протон-переносящих NADH-дегидро-
геназы и цитохром с-оксидазы и четыре —
в результате функционирования Q-цикла,
связанного с хинол:цитохром с-оксидоредук-
тазой.
Рис. 11.10. Топология ферментов и генерация про-
тондвижущей силы (Др) в дыхательной цепи мито-
хондрий. Аналогичным образом организована и функ-
ционирует дыхательная цепь у Paracoccus denitrificans.
Цит — цитохром; ДГ I—дегидрогеназа I; Q — убихинон.
11.3.3. Paracoccus denitrificans обладает
цитохром с-оксидазами
и хинолоксидазами
У Р. denitrificans описаны три дыхательных це-
пи с тремя различными терминальными окси-
дазами (рис. 11.11). Одна из цепей, включаю-
щая NADH-дегидрогеназу, хинол:цитохром с-ок-
сидоредуктазу и цитохром с-оксидазу, по набо-
ру ферментов, механизмам их каталитической ак-
тивности, составу простетических групп и ката-
литических единиц, а также механизму транс-
локации протонов весьма сходна с митохондри-
альной дыхательной цепью. Соотношение Н+/е“
при функционировании этих цепей достигает 10.
Однако у Paracoccus ферменты содержат толь-
ко каталитически важные субъединицы, то-
гда как в состав митохондриальных фермен-
тов входит большое число дополнительных субъ-
единиц с неизвестными функциями. Если у
Р. denitrificans молекулы NADH-дегидрогеназы,
хинол:цитохром с-оксидоредуктазы и цитохром с-
оксидазы ааз состоят соответственно из 14, 4
и 4 субъединиц, то те же ферменты митохон-
дрий содержат соответственно 39,11 и 13 субъеди-
ниц. В качестве простатической группы NADH-
дегидрогеназа Р. denitrificans содержит FAD и
в отличие от NADH-дегидрогеназ многих других
бактерий обладает функцией протонной помпы.
Цитохром-с-оксидаза. ааз из Р. denitrificans была
первой из протонперепосящих оксидаз, третич-
ную структуру которых удалось исследовать с по-
мощью рентгеноструктурного анализа высокого
разрешения. Для нее подробно известен механизм
сопряжения окислительно-восстановительных ре-
акций с транслокацией протонов (рис. 11.8).
Сходство этой дыхательной цепи Р. denitri-
ficans с дыхательной цепью митохондрий свиде-
тельствует в пользу эндосимбиотической гипоте-
зы происхождения митохондрий. Согласно этой
гипотезе организм из того же подкласса про-
теобактерий, что и Р. denitrificans, внедривший-
ся в эукариотическую клетку как эндосимбионт,
был прокариотическим предшественником мито-
хондрий. В пользу такого предположения гово-
рят также результаты анализа 16S-pPHK, ука-
зывающие на близкое филогенетическое родство
Paracoccus с митохондриями.
Две другие дыхательные цепи, обнаруженные
у этих бактерий, включают соответственно цито-
хром с-оксидазу сЬЬз и хинолоксидазу, которые
также функционируют как протонные помпы. Хи-
нолоксидаза синтезируется в условиях низкого со-
держания О 2 в среде. Донором электронов для
дыхания у Р. denitrificans может служить, по-
мимо других органических субстратов, метанол
(Е'и ж —0,2 В) пли метиламин (рис. 11.11). Со-
ответствующие дегидрогеназы, локализованные в
периплазме, передают электроны па цитохром с.
338 Часть III. Многообразие метаболических путей
Рис. 11.11. Ферменты и электронтраиспортиые цепи (аэробное дыхание) у Paracoccus denitrificans. Электроны от
NADH, Нг и сукцината поступают в дыхательную цепь на уровне убихинона (Q), от метанола и метиламина —
на уровне цитохрома с (цит с). Метанолдегидрогеназа, метиламиндегидрогеназа и цитохром с локализованы в
периплазматическом пространстве, другие ферменты — в плазматической мембране.
11.3.4. Дыхательная цепь Escherichia coli
не содержит цитохромоксидазу
В аэробно выращенных клетках Escherichia coli
отсутствует цитохром с. Электроны переносятся
от убихинола на О2 двумя хиполоксидазами, Ьо$
и bd (рис. 11.7 и 11.12). В условиях сильной аэра-
ции доминирует хинолоксидаза Ьоз; при недостат-
ке кислорода ее заь [еняет хинолоксидаза bd, име-
ющая значительно более высокое сродство к О2.
Такая адаптация позволяет Е. coli в микробных
условиях использовать следовые количества кис-
лорода для осуществления дыхания как более эф-
фективного способа получения энергии по сравне-
нию с брожением.
В качестве доноров электронов Е. coli мо-
жет использовать при аэробном дыхании NADH,
формиат, сукцинат, sn-глицерол-З-фосфат, лак-
тат и пируват. Все дегидрогеназы, окисляющие
эти субстраты, передают электроны в дыхатель-
ную цепь на один и тот же акцептор — хинон
(рис. 4.9 и 11.12). Большинство перечисленных
субстратов служат донорами электронов и при
анаэробном дыхании, по в этом случае их могут
окислять другие дегидрогеназы. Как установлено,
Е. coli обладает двумя NADH-дегидрогеназами.
NADH-дегидрогеназа I, как и у Paracoccus
denitrificans, состоит из 14 субъединиц и содер-
жит в качестве простетической группы FMN.
Окисление молекулы NADH этой дегидрогеназой
Рис. 11.12. Участие оксидаз в аэробном
транспорте электронов у Е. coli. Q — убихи-
нон, ФДА — фосфодиоксиацетон; Gly-3-Р —
глицерол-З-Р.
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 339
Таблица 11.6. Оксидазы дыхательных цепей различных бактерий. Название оксидаз соответствует природе вхо-
дящего в их состав гема. Цит.— цитохром; Q — хинон; МК— менахиноп
Хинолоксидазы Цит. с-оксидазы Хиноны
Escherichia coli Paracoccus dejiitrificans Bacillus subtilis Bradyrhizobium japonicum и Rhodobacter sphaeroides Цит. Ьоз, Цит. bd$ Цит. ba$ Цит. оаз Цит. ЬЬз Отсутствует Цит. ааз, Цит. Мз Цит. сааз Цит. сааз, Цит. сЬЬз Q, МК Q МК Q
сопряжено с переносом 4 протонов (4Н+/2е-).
NADH-дегидрогеназа TI содержит FAD и не об-
ладает функцией протонной помпы.
11.3.5. Многие бактерии обладают
разветвленной аэробной
дыхательной цепью
У большинства аэробных бактерий имеется не ме-
нее двух терминальных оксидаз, представленных
различными цитохром с-оксидазами и хинолокси-
дазами (табл. 11.6). Так, хинолоксидазы у различ-
ных бактерий могут содержать гем а, гем Ь, гем о
или гем d в разнообразных сочетаниях. В неко-
торых хпполоксидазах, например хинолоксидазе
сЬЪз, гем с служит заменой Си А в качестве пер-
вичного акцептора электронов от хинола. Цито-
хром с-оксидазы также варьируют по составу
гемов. В состав многих из этих оксидаз также мо-
жет входить гем с как третий гем, однако здесь
он присутствует дополнительно к СнА и принима-
ет электроны от водорастворимого цитохрома с.
Большинство этих ферментов гомологичны
между собой и относятся к семейству гем-
медьсодержащих оксидаз.
11.3.6. Соотношение Н+/2е_ при аэробном
дыхании может варьировать
У Е. coli соотношение Н+/2е“ при аэробном окис-
лении NADH может значительно меняться в зави-
симости от условий культивирования, влияющих
на состав дыхательной цепи (рис. 11.13). В усло-
виях сильной аэрации оно достигает 8Н+/2е_.
Из восьми протонов, пересекающих мембра-
ну, шесть переносятся протонными помпами,
NADH-дегидрогеназой 1 и хинолоксидазой 603 и
два — в редокс-петле при окислении/восстановле-
нии хинона. В микроаэробных условиях хинолок-
сидазу Ьс>з заменяет хинолоксидаза bd с высо-
ким сродством к О 2 и более низким коэффици-
ентом Н+/е~. Таким образом, клетки могут рас-
ти с использованием следовых количеств О2 лишь
ценой снижения Н+/е_ (в случае использования
NADH-дегидрогеназы II — до 2Н+/2е“. Таким об-
разом, у Е. coli и других бактерий эффективность
запасания энергии может изменяться в результа-
те замены ферментов. Количество АТР, образу-
емое при дыхании, зависит не только от вели-
чины AG'0/ реакции окисления, но и от механиз-
мов, обеспечивающих в данных условиях запаса-
ние энергии.
Аэробные дыхательные цепи у бактерий мо-
гут быть двух типов. Дыхательные цепи перво-
го типа содержат хинолоксидазу, второго типа —
хинол: цитохром с-оксидоредуктазу и цитохром
с-оксидазу. Дыхательная цепь второго типа по-
добна дыхательной цепи митохондрий. Многие
бактерии обладают не менее чем двумя различ-
ными терминальными оксидазами. Соотношение
П+/2е- при дыхании зависит от типа цепи и ее
ферментного состава, определяемого условиями
среды.
11.3.7 . При использовании Fe2+ или нитрита
в качестве донора электронов необходим
обратный перенос электронов
для восстановления NAD+
В аэробных условиях бактерии Nitrobacter и
Thiobacillus ferrooxidans используют соответ-
ственно нитрит и Fe2+ в качестве донора элек-
тронов для дыхания. Поскольку стандартные
окислительно-восстановп гельные потенциалы пар
нитрит/нитрат (Е'т = +0,42 В) и Fe2+/Fe3+
(Е'п = +0,78 В при pH 2 и +0,2 В при pH 6) зна-
чительно выше, чем у большинства других доно-
ров электронов, окисление нитрита и Fe2+ дает
низкие величины Н+/2е~ и энергетического вы-
хода (< 1 моль АТР на 1 моль нитрита). Бактс-
340 Часть III. Многообразие метаболических путей
Рис. 11.13. Изменение величины отношения Н * /2е у Escherichia coli при функционировании альтернативных си-
стем переноса электронов. На рисунке представлены топология ферментов аэробной дыхательной цепи и меха-
низмы образования протондвижущей силы (Др). В аэробных условиях количественно доминирует хинолоксида-
за Ьоз, в микроаэрофильных—хинолоксидаза bd. В зависимости от условий в клетках присутствуют различные
HADN-дегидрогеназы. NADH-дегидрогеназы I (NADH-DHI) содержат FMN в качестве кофактора и обладают функ-
цией протонной помпы (4Н+/2е“). NADH-дегидрогеназа II не обладает функцией Н+-помпы и содержит FAD.
А. Дыхательная цепь при росте в условиях высокой аэрации содержит DHI и хинолоксидазу Ьоз; величина отноше-
ния Н+/2е- равна 8.
Б. Дыхательная цепь при росте клеток в микроаэрофильных условиях. Если цепь содержит DHII и хинолоксидазу
bd, величина Н+/2е~ равна 2. Чаще всего при культивировании Е. coli функционируют ферменты обоих возможных
типов в том или ином соотношении, поэтому возможны промежуточные величины Н+/2е~. Q — убихинон.
рии Nitrobacter получают энергию для роста пу-
тем осуществления следующей реакции:
NO2" + |о2 -> NO3
ДС0/ = — 82 кДж/моль нитрита (11-6)
Окисление нитрита молекулярным кислородом
происходит через дыхательную цепь, включа-
ющую питритоксидазу и цитохром с-оксидазу.
Переносчиком электронов между ними предпо-
ложительно служит растворимый цитохром с
(Е'т = +0,2 В). Нитритоксидаза сходна с нитрат-
редуктазой анаэробной дыхательной цепи. Раз-
личие между ними заключается в том, что в
случае нитритоксидазы акцептором электронов
служит цитохром с, тогда как на питратредуктазу
электроны передаются от хинола.
Бактерии Nitrobacter растут автотрофпо и ас-
симилируют СО2 в цикле Кальвина. Исполь-
зуемый в цикле Кальвина и других биосинте-
тических реакциях NAD(P)H (Е'т = —0,32 В)
образуется в результате транспорта электронов
от нитрита (Е'т = +0,42 В). Это резко выражен-
ный эндергонический процесс, поскольку восста-
новитель имеет на 0,74 В более положительный
окислительно-восстановительный потенциал, чем
NAD(P)+; он протекает с затратой большого ко-
личества энергии протонного электрохимического
потенциала (Др):
NO2 + NAD(P)+ + H2O^=--------
Н+ Н+
наружи. внутр.
NO3 + NAD(P)H + Н+ (11.7)
Предположительная величина Др на клеточной
мембране бактерий равна примерно 0,18 В, следо-
вательно для восстановления NAD(P) с использо-
ванием NO2 в качестве восстановителя требуется
перенос не менее 5Н+/е_. Этот процесс, назван-
ный обратным переносом электронов, про-
текает в дыхательной цепи, состоящей из нитри-
токсидазы, хинол-цитохром с-оксидоредуктазы,
убихинона и протонпереносящей NADH-дегидро-
геназы. Обращение электронного транспорта
возможно благодаря обратимости этих окис-
лительно-восстановительных реакций и перено-
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 341
са Н+. Таким образом, протонный электрохи-
мический потенциал, образующийся в результа-
те аэробного окисления нитрита, обеспечивает
у Nitrobacter синтез АТР и восстановление
NAD(P)+. Оба эти процесса ингибируют-
ся разобщителями. Восстановление NAD(P)+
путем обратного переноса электронов осуществ-
ляют также все автотрофные бактерии, исполь-
зующие в качестве донора электронов Fe2+ или
Мп2+, окислительно-восстановительный потенци-
ал которых составляет положительную величину
(см. гл. 10).
11.4. О2 может служить косубстратом в реакциях метаболизма
Молекулярный кислород участвует в качестве ко-
субстрата во многих катаболических и анаболиче-
ских реакциях при аэробном метаболизме. Анаэ-
робы для тех же целей обладают не зависимыми
от О2 механизмами либо не осуществляют пол-
ное окисление субстрата в таких реакциях (см.
разд. 9.13).
11.4.1. Некоторые катаболические процессы
требуют участия О2
в качестве косубстрата
Углеводороды не могут окисляться непосред-
ственно дегидрогеназами. Для их разложения
необходим начальный этап активации — превра-
щение оксигеназами в спирты с участием Ог- По-
этому в отсутствие Ог большинство микроорга-
низмов не способно использовать алканы, алкены
и ароматические соединения, даже в том случае,
если в среде присутствует альтернативный акцеп-
тор электронов, такой как нитрат. Реакции перво-
го этапа разложения углеводородов, катализиру-
емые оксигеназами, представлены на рис. 11.14.
Аналогичным образом участия Ог требует про-
цесс нитрификации (окисления аммиака) бакте-
риями рода Nitrosomonas. Аммиак гидроксилиру-
ется аммиакмонооксигеназой с образованием гид-
роксиламина, который далее окисляется дегидро-
геназами аэробной дыхательной цепи (см. гл. 10).
Ароматические соединения, отличающиеся
особой химической стабильностью, также требу-
ют активации с участием Ог- Включение в их мо-
лекулы гидроксильных групп моно- или диокси-
геназ дестабилизирует ароматическое кольцо, де-
лая возможным его расщепление диоксигеназой.
У анаэробных бактерий расщепление ароматиче-
ского кольца происходит в результате различных
реакций восстановления. Полное разложение лиг-
нина— наиболее распространенного ароматиче-
ского полимерного субстрата — возможно только
при участии молекулярного кислорода в качестве
косубстрата (см. разд. 9.13).
11.4.2. О2 участвует как косубстрат
в реакциях биосинтеза
Биосинтез тетрапирролов, убихинонов, пирими-
динов, стеролов и ненасыщенных жирных кислот
у аэробных бактерий включает СД-зависимые ре-
Реакция
Фермент (путь метаболизма)
СН4 + О2 + NADH + Н* ► СН3-ОН + NAD++H2O
R-H + О2 + NADH + Н+ -► R-OH + NAD++H2O
NH3+O2+2[H] ---► NH2OH+H2O
Катехол цис, цис-Муконат
Метанмонооксигеназа (окисление метана)
Алканмонооксигеназа (разложение алканов)
Аммиакмонооксигеназа (нитрификация)
Катехолдиоксигеназа (разложение ароматических
соединений)
Рис. 11.14. Примеры катаболических реакций с участием Ог в качестве косубстрата.
342 Часть III. Многообразие метаболических путей
акции. У анаэробов эти компоненты клеток син-
тезируются без участия кислорода. При синтезе
убихинона у Е. coll О2 служит источником ато-
мов кислорода в составе трех ОН-групп, вклю-
чаемых в его молекулу гидроксилазами. В анаэ-
робных условиях источником кислорода для этого
служит Н2О и синтез происходит с участием гид-
ратаз. Процесс биосинтеза гемов и пиримидинов в
аэробных условиях включает реакции окисления,
в которых молекулярный кислород служит акцеп-
тором электронов. В анаэробных условиях его за-
меняют в этой роли другие акцепторы, например
фумарат. В случае некоторых ферментов, напри-
мер рибонуклеотидредуктазы, требуется участие
О2 для превращения их в активную форму пу-
тем введения радикала в молекулу. У анаэробных
бактерий такие реакции катализируют иные фер-
менты (см. гл. 7).
11.5. Бактерии обладают механизмами защиты
от действия токсичных форм кислорода
В результате одноэлектронных актов восста-
новления О2 в процессах аэробного метабо-
лизма неизбежно происходит образование вы-
сокореакционноспособных форм кислорода —
супероксид-аниона (О2*), пероксида водорода
(Н2О2) и гидроксил-радикала (Н0‘) (табл. 11.2 и
рис. 11.15). Гидроксил-радикал может быть про-
дуктом неферментативного восстановления О2
хинонами или Fe2+; аналогично этому, О2" об-
разуется в результате неспецифических реакций
окисления восстановленных флавопротеинов.
Хинолы
FAD- и FMN-зависимые
ферменты (неспецифичные)
Супероксиддисмутаза
Дисмутация
Fe2’
Рис. 11.15. Образование активных форм кислорода.
В левой части рисунка показаны неферментативные
реакции, в правой — реакции, катализируемые фермен-
тами.
11.5.1. У чувствительных к Ог микроорганизмов
его доступ в клетки ограничен
Ограничение свободного доступа кислорода в
клетки для защиты от токсичного действия Ог
наблюдается у многих бактерий, например у
аэробных азотфиксирующих бактерий, использу-
ющих О2 в качестве акцептора электронов при
дыхании; они нуждаются в защите от О2, по-
скольку он подавляет активность нитрогеназы.
Свободной диффузии кислорода в клетки этих
бактерий препятствует толстая клеточная стенка
или слизистая капсула. Так, у Azotobacter клетки
окружены капсулой и слоем слизи. В корневых
клубеньках бобовых растений, содержащих клет-
ки азотфиксирующих бактерий Rhizobium или
Bradyrhizobium, барьерную функцию выполняет
кора клубеньков, обеспечивающая микроаэроб-
ные условия для развития бактероидов. В слу-
чае гетероцист цианобактерий основным барье-
ром для проникновения О2 служит, по-видимому,
гликолипидный слой толстой клеточной стенки.
Другим механизмом защиты нитрогеназы может
быть «дыхательная защита», предположительно
имеющая место в случае Azotobacter. Благодаря
высокой скорости дыхания клеток может умень-
шаться диффузия кислорода во внутриклеточное
пространство, где локализована нитрогеназа (см.
разд. 8.5).
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 343
11.5.2. Бактерии осуществляют детоксикацию
активных форм кислорода
Реакционноспособные формы активного кислоро-
да могут инактивироваться у аэробных бактерий
в результате химических и ферментативных ре-
акций. Неферментативная детоксикация происхо-
дит с участием глутатиона, который в клетках
многих бактерий присутствует в высоких концен-
трациях (до 10 мМ). Глутатион восстанавливает
С>2НО* и Н0О2 до Н2О. Однако основную роль в
детоксикации токсичных форм кислорода выпол-
няют каталазы, пероксидазы и супсроксиддисму-
тазы. Супероксиддисмутаза (СОД) превраща-
ет ОД в менее токсичный Н2О2 [реакция (11.8)],
который далее под действием каталазы разлага-
ется на нетоксичные продукты [реакция (11.9)].
202 * + 2Н+ -> Н2О2 + О2 (П.8)
2Н2О2 -* 2Н2О + О2 (11.9)
Супероксиддисмутазой обладают практически
все аэробные бактерии. У прокариот известно два
типа супероксиддисмутаз — Бе3+-содержащис и
Мп3+ -содержащие ферменты. Большинство бак-
терий обладает только одним типом СОД. В то же
время Е. coli обладает ферментами обоих типов,
причем если Fe-содержащая СОД обнаруживает-
ся при росте как в аэробных, так и в анаэробных
условиях, то синтез Мп-содержащсй СОД инду-
цируется только в аэробных условиях. Каталаза
присутствует, как правило, у аэробных и факуль-
тативно анаэробных бактерий. У Е. coli синтез
ферментов, осуществляющих детоксикацию ак-
тивных форм кислорода, регулируют два незави-
симых моду лона «окислительного стресса», отве-
чающих на присутствие Н2О2 и О 2 '•
Клеточные компоненты, подвергшиеся окисле-
нию активными формами кислорода, могут быть
восстановлены лишь частично. Так, ачкилгидро-
пероксиды превращаются в спирты под действием
пероксидаз, катализирующих реакцию, подобную
каталазной:
R—ООН + 2[Н] -> R—ОН + Н2О (11.10)
Репаратщю окислительных повреждений ДНК
осуществляет SOS-система репарации ДНК, ин-
дуцируемая при окислительном стрессе.
11.6. Биолюминесценция зависит от присутствия кислорода
Способностью к биолюминесценции обладают
многие организмы — бактерии, грибы, водорос-
ли дапофлагелляты, насекомые, кальмары и ры-
бы. Ферменты, субстраты и механизмы реакций,
которыми обусловлено свечение этих организмов,
существенно различаются, но во всех случаях
реакция, приводящая к эмиссии света, требует
участия О2. Светящиеся бактерии встречаются в
морских, пресноводных и наземных экосистемах.
Они могут быть свободиоживущими сапрофита-
ми или симбионтами, обитающими в пищевари-
тельном тракте или световых органах костистых
рыб и кальмаров. Большинство светящихся про-
кариот относится к родам Photobacterium и Vibrio.
Это грамотрицатсльпые, факультативно анаэроб-
ные бактерии, обладающие полярными жгути-
ками.
11.6.1. Биохимический механизм
биолюминесценции
Бактериальная система биолюминесценции вклю-
чает фермент люциферазу и ферментный ком-
плекс, называемый редуктазой жирных кислот.
Реакцию, в результате которой происходит фо-
тоэмиссия, катализирует люцифераза-моноокси-
геназа, осуществляющая сопряженное окисле-
ние NAD(P)H и длинноцепочечного альдегида
(R—ОНО) молекулярным кислородом. Реакция
сопровождается эмиссией голубовато-зеленого
света (длина волны 490 нм).
NAD(P)H + Н+ + R-CHO + О2 ->
-> NAD(P)+ + Н2О + R-COOH + ho (11.11)
344 Часть III. Многообразие метаболических путей
Свободная энергия, выделяющаяся в этой окисли-
тельно-восстановительной реакции, расходуется
не на синтез АТР, как в реакциях аэробного ды-
хания, а па свечение. Люцифераза локализована в
цитоплазме и характеризуется сравнительно низ-
кой скоростью оборота (1-0,1 с-1). Она содержит
связанный FMN, восстановление которого обес-
печивается NAD(P)H. В восстановленной форме
(FMNH2) флавин окисляется О2 с образованием
пероксифлавина и стабильного промежуточно-
го продукта — комплекса с альдегидом [реакция
(11.12); Е —фермент]. После окисления субстра-
тов комплекс медленно распадается, высвобождая
продукты. На этой стадии происходит эмиссия
света:
о
и
сн2-сн;
сн3—сн2—сн2—с—сн2—с—nh —сн
Рис. 11.16. Аутоиндуктор биолюминесценции у Vibrio
fischeri. Данный аутоиндуктор (/3-кетокапроилгомс-
серинлактон, или А-(3-оксогексанол)-1_-гомосеринлак-
тон) — один из представителей большого семейства сиг-
нальных молекул — производных гомосеринлактона.
гены luxCDE кодируют комплекс ферментов вос-
становления жирных кислот'; продукты luxGH
необходимы для восстановления флавина.
О2 R-CHO R-COOH
E-FMNH2-^—►E-FMNH^^-—>
ООН
Е + FMN + Н2О +/гр (11.12)
Участвующий в люциферазной реакции альдегид
образуется из соответствующей жирной кислоты
под действием редуктазного комплекса, состо-
ящего из синтетазы, трансферазы и редуктазы
[реакция (11.13)]:
R-COOH + АТР + NADPH -»
-» NADP++ АМР + PF, + R-CHO (11.13)
Синтетаза активирует жирную кислоту, присо-
единяя к ней АМР. Ацильная группа переносит-
ся на редуктазу, где с участием NADPH проис-
ходит ее восстановление до альдегида, который
высвобождается из ферментного комплекса. Ин-
тенсивность свечения зависит от концентрации
АТР и NAD(P)H, потребляемых в реакции (11.13)
(на этом основан высокочувствительный метод
определения низких концентраций NAD(P)H или
АТР с использованием люциферазного комплекса
из бактерий или светляка Photinus pyralis соответ-
ственно).
У бактерий рода Vibrio ферменты лю-
циферазного комплекса кодируются локусом
luxCDABEGH. Входящие в его состав гены
luxAB — это структурные гены люциферазы;
11.6.2. Свечение бактерий зависит
от плотности их популяции
Интенсивность люминесценции у большинства
светящихся бактерий четко зависит от плотно-
сти клеток в культуре: свечение густых культур
может в 1000 раз превышать свечение разбав-
ленных культур в расчете на клетку. Исследо-
вание этого эффекта у симбиотической бактерии
Vibrio fischeri показало, что регуляция свечения,
зависящая от плотности клеток (эффект «кворум
сенсинг»), происходит па уровне транскрипции.
Клетки V. fischeri конститутивно синтезируют и
выделяют в среду небольшое количество сигналь-
ного соединения — аутоиндуктора (рис. 11.16). Он
накапливается в среде, по-видимому, пропорци-
онально скорости роста и плотности бактерий.
При высокой плотности клеток достигается по-
роговая концентрация аутоиндуктора, в которой
он способен индуцировать люминесценцию. Лег-
ко проникающий через клеточную мембрану ауто-
индуктор связывается в клетках со своим рецеп-
тором-регулятором транскрипции LuxR, кото-
рый в этих условиях активирует экспрессию ге-
нов luxGDABEGH. У симбиотических светящих-
ся бактерий эффект регуляции, зависящей от
плотности, проявляется, когда при размножении
в ограниченном пространстве светящегося орга-
на рыб их популяция достигает высокой плотно-
сти. Аналогичный тип ауторсгуляции обнаружен
у свободноживущих светящихся бактерий, плот-
ность популяции которых в природе обычно не
достигает той, которая необходима для индукции
люминесцентного комплекса (см. разд. 20.1.4).
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного метаболизма 345
Дополнительная литература
Babcock G.T., Wikstrom М. (1992) Oxygen activation
and the conservation energy in cell respiration.
Nature 356: 301-309.
Friedrich T., Steinmiiller K., Weiss II. (1991) The
proton-pumping respiratory complex I of bacteria
and mitochondria and its homologue in chloroplasts.
FEBS Lett. 367: 107-111.
Garcia-IIorsman .1. A., BarqueraB., Rumbley J., Ma J.,
Gennis R. B. (1994) The superfamily of heme-copper
respiratory oxidases. J. Bacteriol. 176: 5587-5600.
IwataS., Ostermeier C., Ludwig B., Michel H. (1995)
Structure at 2.8 A resolution of cytochrome c oxidase
from Paracoccus denitrificans. Nature 376: 660-669.
Karlson P., Doenecke D., Koolman J. (1994) Biochemie,
14th edn. Stuttgart: Thieme.
Meighen E. A. (1991) Molecular biology of bacterial
biolumi-nescence. Microbiol. Rev. 55: 123-142.
Miles J. S., Guest J.R. (1987) Molecular genetic aspects
of the citric acid cycle of Escherichia coli. Biochem.
Soc. Symp. 54: 45-65.
Nicholls D. G., Ferguson S. .1. (1992) Bioenergetics 2.
London: Academic Press.
Unden G.. Bongacrts .1. (1997) Alternative respiratory
pathways of Escherichia coli: Energetics and
transcriptional regulation. Biochim. Biophys. Acta
1320: 217-234.
Voct D.. Voet.I.G. (1995) Biochemistry, 2nd edn. Now
York: Wiley.
Wiinpenny J.W. T. (1982) Responses of microorganisms
to physical and chemical gradients. Philos. Tians. R
Soc Lond. Biol. 297: 497-515.
Zannoni D. (1995) Aerobic and anaerobic electron
transport chains in anoxigenic phototrophic
bacteria. In: Anoxigenic Bacteria, Blankenship R. E.,
Madigan M.T., Bauer C.E., eds. pp. 943-971
Dordrecht: Kluwer.
Глава 12
Анаэробный энергетический метаболизм
12.1. В анаэробной электронтранспортной цепи вместо О2
используются другие акцепторы электронов
Большинство процессов, сопряженных с запаса-
нием энергии у живых организмов, — это окис-
лительно-восстановительные реакции, в кото-
рых окисление одного субстрата сопровождается
восстановлением другого. Для аэробных бак-
терий-гетеротрофов донорами электронов обыч-
но служат органические субстраты, акцептором
электронов — молекулярный кислород. В окис-
лительной ветви энергетического метаболизма
(окисление субстрата) энергия запасается в фор-
ме АТР путем субстратного фосфорилирования
(СФ), тогда как в его восстановительной вет-
ви (восстановление акцептора электронов) син-
тез АТР сопряжен с транспортом электронов по
дыхательной цепи (электротранспортное фосфо-
рилирование, ЭТФ; рис. 12.1; см. гл. 4) и пере-
носом Н+ (реже Na+) в качестве сопрягающего
иона. Анаэробные бактерии, способные расти в от-
сутствие О 2, окисляют органические субстраты с
использованием вместо кислорода других неор-
ганических или органических акцепторов элек-
тронов. Перенос электронов в этих процессах,
который также сопровождается запасанием энер-
гии, называют анаэробным дыханием. Анаэ-
робные окислительно-восстановительные процес-
сы, не связанные с электротранспортным фос-
форилированием, но обеспечивающие получение
энергии за счет СФ, называют процессами
брожения. Ферменты реакций брожения ло-
кализованы в цитоплазме, в отличие от мем-
браносвязанных ферментов дыхания, включая
ATP-синтазу, переносчики электронов и протон-
ные помпы.
Различают два типа анаэробного дыхания:
1) с участием акцепторов, имеющих положитель-
ный (высокий) окислительно-восстановительный
потенциал (нитрат, нитрит, Fe(III), фумарат, ди-
метилсульфоксид и оксиды азота) и 2) с участи-
ем акцепторов, имеющих отрицательный (низкий)
потенциал (сера, сульфат и карбонат). Важней-
Восстановленные Окисленные
субстраты акцепторы
ADP + Р,
СФ
АТР + Н2О
Окисленные
Восстановленные
продукты
акцепторы
Восстановительная
ветвь
метаболизма
Окислительная
ветвь
метаболизма
Рис. 12.1. Способы запасания энергии в процессе
дыхания. Субстраты — органические соединения или
Нг; продукты — обычно НгО + СОг; акцепторы— ак-
цепторы электронов; Д/7Н+ /—протонный или
натриевый электрохимический потенциал на мем-
бране; СФ — субстратное фосфорилирование; ЭТФ —
электронтранспортное фосфорилирование. Дыхание не
всегда сопряжено с СФ.
шие акцепторы электронов и их окислительно-
восстановительные потенциалы приведены в
табл. 4.1. Использование акцепторов электронов с
высоким потенциалом характерно для факульта-
тивных анаэробов; такое дыхание конкурирует с
аэробным и подавляется Ог- Анаэробное дыхание
с участием акцепторов электронов, обладающих
низким потенциалом, обнаружено только у стро-
гих анаэробов, не способных расти в аэробных
условиях.
Анаэробное дыхание — это процесс окисле-
ния органических субстратов или молекулярно-
го водорода с использованием вместо Ог таких
акцепторов электронов, как NO3 , NO2, фума-
рат, сера, Fe3+, диметилсульфоксид, N-оксид три-
метиламина, СОг, сульфат или органические со-
единения. Энергия запасается при анаэробном
дыхании в виде электрохимического протонного
или натриевого потенциала, через образование ко-
торого электронтранспортное фосфорилирование
сопряжено с синтезом АТР.
Глава 12. Анаэробный энергетический метаболизм 347
12.1.1. Два пути нитратного и
нитритного дыхания
Многие микроорганизмы используют в качестве
акцептора электронов нитрат (NO^-), восстанав-
ливая его до нитрита [NO^; реакция (12.1)] и
далее через оксид азота [NO; реакция (12.2)] и
гемиоксид азота [N2O; реакция (12.3)] до молеку-
лярного азота [N2; реакция (12.4)]; этот процесс в
целом назван денитрификацией. Кроме то-
го, нитрит при участии NAD(P)H может непо-
средственно восстанавливаться до аммиака
[NHs/NH^; реакция (12.5), рис. 12.2] в процес-
се аммонификации.1
NO' -----► no; -----► NO ------► N2O -----► N2
Денитрификация
▼
nh;
Аммонификация
Рис. 12.2. Два пути восстановления нитрита.
Биологически важные соединения азота при-
ведены в табл. 12.1. Наиболее стабильные из
них — молекулярный азот, аммиак, нитрат и ок-
сид азота (расположены по степени убывания
, Нитратредуктаза
NO3 + 2е“ + 2Н+-----------------> NO2 + Н2О
NO-образующая нитритредуктаза
NO2 + е“ + 2Н+-------------------------------> NO + Н2О
, Редуктаза оксида азота
2NO + 2е“ + 2Н+----------------------> N2O + Н2О
, Редуктаза гемиоксида азота
N2O“ + 2е“ + 2Н+--------------------------> N2 + Н2О
, ЬШз-образующая нитритредуктаза
NO-7 + 3NAD(P)H + 5Н+--------------------------------> КП4' + 3NAD(P)+ + 2Н2О
(12-1)
(12-2)
(12-3)
(12.4)
(12-5)
Восстановление нитрата до аммиака может
происходить двумя путями: 1) в процессе дыхания
с участием электронтранспортной цепи — дисси-
миляционная аммонификация — и 2) при ис-
пользовании нитрата в качестве источника азо-
та для биосинтеза азотсодержащих компонентов
клеток — ассимиляционная аммонификация
(см. гл. 8). Диссимиляционную и ассимиляци-
онную аммонификацию катализируют различные
ферменты. Ферменты диссимиляционной аммони-
фикации интегрированы в плазматическую мем-
брану или локализованы в периплазме, и их син-
тез подавляется О2. Ферменты ассимиляционной
аммонификации водорастворимы; их синтез ин-
гибируется аммиаком. Среди высших эукари-
от к ассимиляционной аммонификации способны
только растения и грибы. Бактерии, таким об-
разом, обладают более широкими возможностя-
ми. Они способны получать энергию в анаэробных
условиях в процессах не только денитрификации,
но и диссимиляционной аммонификации, а также
использовать нитрат в качестве источника азота,
восстанавливая его до аммиака при ассимиляци-
онной аммонификации.
стабильности). Нитрит стабилен при pH 7, но в
кислой среде реагирует с аммиаком с образова-
нием молекулярного азота (пефермептативпая дс-
Таблица 12.1. Степень окисления биологически важных
соединений азота
Степень окисления Соединение/функция
+5 +4 +3 +2 +1 ±0 -1 -1 —2 -3 1 Реакционн тронами. нитрат; акцептор электронов NO2, диоксид азота1; см. текст NO.J, нитрит; акцептор электронов NO, оксид азота1; интермедиат при денитрификации N2O, гемиоксид азота; интермедиат при денитрификации N2, молекулярный азот; субстрат азотфиксации NH2OH, гидроксиламин; интермедиат при аммонификации и нитрификации NH=NH, диимин; промежуточный продукт при фиксации азота NH2 —NH2, гидразин; промежуточный продукт при фиксации азота NH3, аммиак; субстрат нитрификации оспособное соединение с неспаренными элек-
1 В отечественной литературе аммонификацией называют процесс разложения белков с высвобождением аммиака. —
Прим. ред. перев.
348 Часть III. Многообразие метаболических путей
нитрификация):
NH+ + NO2 -> N2 + 2Н2О (12.6)
Молекулы оксида азота (NO) и диоксида азота
(NO2) содержат по одному неспаренному электро-
ну, что объясняет их высокую реакционноспособ-
пость. В газовой фазе в присутствии молекуляр-
ного кислорода NO спонтанно окисляется до NO2:
2NO + О2 2NO2 (12.7)
Однако концентрация оксида азота биологическо-
го происхождения в атмосфере очень низка (мень-
ше 10 частей на млн.). Поэтому реакция (12.7),
которая требует соударения трех атомов и про-
текает со скоростью, пропорциональной квадрату
концентрации NO, в нижних слоях атмосферы не
имеет существенного значения. В верхних слоях
атмосферы NO более эффективно окисляется до
NO2 озоном (Оз) или ОН-радикалами. В воде NO2
может вступать в реакцию диспропорционирова-
ния с образованием нитрата и нитрита:
2NO2 + Н2О -» NO3 + NO2 + 2Н+ (12.8)
У животных оксид азота NO выполняет функцию
нейромедиатора. Он образуется в реакции окис-
ления аргинина молекулярным кислородом и на-
капливается в концентрациях, превышающих 10
частей на млн.
2Аргипин+ + ЗО2 —»
—> 2Цитруллин + 2NO + Н2О2 + 2Н+ (12.9)
В процессах аммонификации и нитрификации
(окисление аммиака молекулярным кислородом)
(разд. 10.7) в качестве промежуточного продукта
участвует связанный с ферментом гидроксиламин
(NH2OH). Помимо этого, гидроксиламин участву-
ет также в образовании гидроксамовых кислот,
которые служат сидерофорами (гл. 8). В про-
цессе азотфиксации образуются промежуточ-
ные продукты, связанные с нитрогеназой, такие
как высокореакциопноспособный диимин NII^NH
и относительно стабильный гидразин NH2—NH2
(гл. 8).
Дыхательная аммонификация у большин-
ства энтеробактерий и стрептококков обеспечива-
ет получение энергии в анаэробных условиях
[реакции (12.10)-(12.12)].
Глюкоза + 12NO3 -» 6СО2 + 12NC>2 + 6Н2О
AG0' = —1926 кДж/моль глюкозы (12.10)
Глюкоза + 4NC>2 + 8Н+ 6СО2 + 4NHJ + 2Н20
AG0' = —1713 кДж/моль глюкозы (12.11)
Глюкоза + 3NO3 + 6Н+ -> 6СО2 + 3NHJ + ЗН2О
AG0/ = —1767 кДж/моль глюкозы (12.12)
Нитрат как конечный акцептор электронов в
электротранспортной цепи восстанавливается до
нитрита с использованием в качестве донора
электронов NADH, образующегося при окисле-
нии глюкозы в процессе гликолиза [реакция
(12.10); см. денитрификация]. Процесс восстанов-
ления нитрата сопровождается запасанием энер-
гии. При последующем шестиэлектропном восста-
новлении нитрита до аммиака водорастворимой
питритредуктазой [реакция (12.13)] (без запаса-
ния энергии) также расходуется восстановитель
(NAD(P)H), получаемый при окислении глюкозы
[реакция (12.11)], и это обеспечивает возможность
экономии нитрата в качестве конечного акцепто-
ра электронов. Неполное восстановление нитрата
(до нитрита) может давать более высокий выход
АТР в расчете на моль окисляемой глюкозы, чем
его полное восстановление до аммиака.
NO2 + 3NAD(P)H + 5Н+ ->
-> NHj + 3NAD(P)+ + 2Н2О (12.13)
У Wolinella succmogenes восстановление нит-
рита до NH3 происходит с участием водорода
или формиата и сопряжено с запасанием энер-
гии другим способом (рис. 12.5). Нитритредук-
таза у этого организма представляет собой мем-
браносвязанный фермент, использующий в каче-
стве донора электронов восстановленный менахи-
нон (рис. 12.3).
У строгих анаэробов, таких как Veillondla
parvula, Clostridium perfringens и виды Propioni-
bacterium, дисимиляционное восстановление нит-
рата до аммиака используется как путь сброса
электронов (сток электронов), и это позволяет со-
хранять органические субстраты для окисления,
при котором происходит субстратное фосфорили-
рование. Такой процесс может быть назван фер-
ментативной I штратреду кцией.
Глава 12. Анаэробный энергетический метаболизм 349
Рис. 12.3. Менахинон (сокращенное название метил-
нафтохинона). Восстановление менахинона одним элек-
троном приводит к образованию менасемихинона
(анион). В результате восстановления менасемихинона
вторым электроном и присоединения двух протонов об-
разуется менахинол (менагидрохинол).
Денитрификация (восстановление нит-
рата до N2) — широко распространенный
процесс □ Способность к денитрификации об-
наружена у представителей более чем 40 родов
бактерий и только у одной группы архей, от-
носящихся к экстремальным галофилам. Среди
бактерий способностью к денитрификации об-
ладают грамотрицательпые протообактерии ро-
дов Pseudomonas, Thauera, Alcaligenes, Paracoccus,
Hyphomicrobium и Thiobacillus, а также некоторые
представители грамположительных бактерий ро-
да Bacillus. В процессе денитрификации происхо-
дит полное окисление органических субстратов до
СОг и воды [реакции (12.14) и (12.15)].
Механизмы окисления органических субстра-
тов в процессах анаэробного дыхания, как пра-
вило, не отличаются от действующих в аэроб-
ных условиях. Исключение составляет окисление
ароматических соединений и углеводородов, в на-
чальной стадии которого в аэробных условиях
участвует О2. В анаэробных условиях осуществ-
ляются независимые от кислорода реакции [на-
пример такие, как восстановительная деаромати-
зация бснзоил-СоА у Thauera aromatica\ реакция
(12.16)]. Некоторые субстраты, такие как лигнин,
в условиях денитрификации не метаболизиру-
ются.
У большинства денитрифицирующих микро-
организмов NADH, получаемый при окислении
глюкозы и используемый для восстановления нит-
рата до N2 [реакции (12.1)-(12.4)], окисляется в
анаэробной дыхательной цепи МАБНгубихипоп-
оксидоредуктазой. В отличие от этого фермента,
терминальные оксидоредуктазы в анаэробной ды-
хательной цепи не являются протонными помпа-
ми. Однако дыхательная нитратредуктаза способ-
на генерировать электрохимический протонный
потенциал на мембране посредством альтерна-
тивного механизма — в этой реакции происходит
перенос двух электронов с наружной стороны
мембраны (заряженной положительно) на внут-
реннюю сторону мембраны (заряженную отрица-
тельно) с поглощением двух протонов в цито-
плазме и выделением двух протонов в периплаз-
матическое пространство (рис. 12.4). Сопряжена
ли с образованием протонного градиента реак-
Рис. 12.4. Структура и функция нитратредуктазы.
У Е. coli функцию убихинона выполняет менахинон (см.
рис. 12.3). По [1]. NarG, NarH и Narl — три субъедини-
цы в составе нитратредуктазы; Ь — цитохром Ь; МГД —
молибдоптерингуаниндинуклеотид (см. рис. 12.6).
Глюкоза 4- 8NO2 4- 8Н+ —» 6СО2 4- 4N2 4- ЮН2О
AG'0/ = —3144 кДж/моль глюкозы
(12.14)
5 Глюкоза + 24NO3 + 24Н+ —> ЗОСО2 + 12N2 4- 42НгО ДС?0/ = —2657 кДж/моль глюкозы (12.15)
Бензоил-СоА 4- 2е- 4- 2Н+ 4- 2АТР 4- 2Н2О —» Циклогексо-1,3-диен-2-карбокси-СоА 4- 2ADP 4- 2Р,
(12.16)
350 Часть III Многообразие метаболических путей
Рис. 12.5. Образование электрохимического протонно-
го потенциала при транспорте электронов у Wolinella
succinogenes. NiFe, FeS, Цит b и FAD — простетические
группы в составе гидрогеназы и фумаратредуктазы.
Вместо фумаратредуктазы в процессе может участво-
вать нитратредуктаза или сульфатредуктаза.
Среднее значение экономического коэффици-
ента—выход биомассы (по сухому веществу)
в расчете на моль АТР (Удтр) — равно 10.
Отсюда следует, что потребление 1 моль фор-
миата, обеспечивающее образование 6-7 г
сухого вещества биомассы, действительно
сопровождается синтезом 2/3 моль АТР.
Однако термодинамические расчеты показы-
вают, что реакция восстановления нитрата
формиатом [AG0/ = —167 кДж/моль; ре-
акция (12.17)] может обеспечить синтез
примерно 2 моль АТР. поскольку синтез
1 моль АТР, как установлено для многих ре-
акций брожения и дыхания, обеспечивается
при величине AG0/ от —70 до —80 кДж.
НСОО“ + н+ + NO3 -> NO2 + со2 + н2о
AG0' = -167 кДж/моль (12.17)
ция восстановления нитрита нитритредуктазой,
пока неизвестно. Несмотря на то что восстанов-
ление нитрита сопровождается большим измене-
нием свободной энергии, чем восстановление нит-
рата [ср. реакции (12.14) и (12.15)], в силу опре-
деленных кинетических закономерностей выход
АТР при восстановлении нитрата выше, чем при
восстановлении нитрита. Как установлено для
нескольких микроорганизмов, в начальной стадии
роста они используют только нитрат. Нитрит на-
капливается в среде, и клетки используют его по-
сле исчерпания нитрата.
---------------------------------------------!
Дополнение 12.1. У некоторых анаэробов,
например Wolinella succinogenes, существует
альтернативный механизм образования про-
тондвижущей силы (рис. 12.5). Окисление во-
дорода или формиата с наружной стороны
мембраны сопровождается выделением двух
протонов. При этом восстановление акцепто-
ров электронов (нитрата, нитрита, фумарата,
серы или диметилсульфоксида) на внутрен-
ней стороне мембраны сопровождается погло-
щением двух протонов. Поскольку для синте-
за молекулы АТР требуется 3 Н+ (см. гл. 4),
при окислении 1 моль водорода или формиа-
та предположительно может синтезировать-
ся 2/3 моль АТР. Эти расчеты согласуют-
ся с результатами измерений выхода био-
массы. Для формиата он равен 6-7 г сухого
вещества на моль потребленного субстрата.
Ферменты, участвующие в денитрифи-
кации и аммонификации, содержат мо-
либдоптерин □ Нитратредуктазы анаэробных
бактерий-бродильщиков и ассимиляционные нит-
ратредуктазы — это водорастворимые ферменты,
использующие в качестве доноров электронов
NADH или NADPH [реакция (12.18)]. Они пред-
ставляют собой флавопротеиды (FAD или FMN),
содержащие связанный с белком динуклеотид мо-
либдоптерин (рис. 12.6).
NAD(P)H + NO3 + Н+ ->
-> NAD(P)+ 4- NO2 + Н2О
AG0' = —143 кДж/моль (12.18)
Диссимиляционные нитратредуктазы —
это мембраносвязанные компоненты анаэробной
дыхательной цепи. Они состоят из трех субъеди-
ниц, которые в соответствии с их генами обо-
значают Narl, NarH и NarG (Nar —нитратре-
дуктаза; рис. 12.4). Фермент Narl представляет
собой цитохром Ь. Он содержит пять пронизы-
вающих мембрану спиральных доменов, между
которыми размещаются два гема. С участи-
ем гемов электроны переносятся от убихино-
ла (QH2) или менахинола на периферический
мембранный белок — NarH. Затем электроны
через (3Fe—48]-кластер и три [4Fe~ 4Б]-клас-
тера в составе субъединицы NarH переносят-
ся на [4Fc—48]-кластср в составе субъединицы
NarG и далее па молибдоптерипгуапозиндинук-
леотид (МГД), где происходит восстановление
Глава 12. Анаэробный энергетический метаболизм 351
Рис. 12.6. Молибдоптерингуаниндинуклеотид (МГД).
Вместо гуанина у бактерий и архей могут быть связаны
с молибдоптеринами цитидин, аденин или урацил. Сре-
ди молибдоптеринов эукариот МГД не обнаружен. Мо-
либдоптерины служат простети чески ми группами мно-
гих дегидрогеназ и редуктаз. В процессе восстановления
субстрат (например, нитрат), вероятно, образует коор-
динационную связь с атомом Мо.
нитрата до нитрита. В процессе переноса элек-
тронов через нитратредуктазный комплекс два
протона выделяются в псриплазматичсскос про-
странство при окислении хинолов и два поглоща-
ются из цитоплазмы, что приводит к образованию
трансмембранного электрохимического протонно-
го потенциала.
Дополнение 12.2. В состав всех молиб-
денсодержащих ферментов (за исклю-
чением нитрогеназы) входит молибдоптерин
(эукариоты) или молибдоптериндинуклеотид
(бактерии и археи; рис. 12.6). В большин-
стве случаев основанием в этом динуклео-
тиде является гуанин, по им может быть
также аденин, урацил или цитозин. Как
правило, ферменты, содержащие молибдо-
птерип, катализируют обратимое включение
в молекулу субстрата атома кислорода
из воды. К таким ферментам относят-
ся формиатдегидрогеназа, формилметанофу-
ран-дегидрогепаза (участвует в метаногене-
зе; см. рис. 12.9), альдегид-дегидрогеназа,
сульфитоксидаза, ксантиндегидрогеназа (см.
разд. 12.2.4), оксидаза оксида углерода,
С0-дегидрогеназа (но не Ni-содержащая
ацетил-СоА-синтаза; см. рис. 12.8), редуктаза
триметиламин-И-оксида и диметилсульфок-
сидредуктаза. Некоторые из этих ферментов
имеют изоформы, в которых молибден (Мо)
заменен вольфрамом (W).
Рис. 12.7. Простатические группы нитритредуктаз.
А. Окрашенный в зеленый цвет порфириндион (иногда
его ошибочно называют гем <А)— простатическая груп-
па нитритредуктаз, участвующих в процессе денитри-
фикации (например, у Paracoccus denitrificans). Анало-
гичные по функции ферменты другого класса содержат
Си (например, у Alcaligenes eutrophus).
Б. Сирогем — простатическая группа нитритредуктаз,
участвующих в аммонификации (например, у Е. coli).
Сирогем, как и другие гемы, синтезируется из уро-
порфирина III и сохраняет все карбоксилированные
заместители предшественника. В отличие от других
гемов, молекулы порфириндиона и сирогема метилиро-
ваны (кольца А и В). Механизм биосинтеза порфирин-
диона пока неясен.
Нитритредуктазы, участвующие в де-
нитрификации, катализируют одноэлектрошюе
восстановление нитрита до оксида азота [ре-
акция (12.2)]. Известны такие ферменты двух
типов — содержащие цитохром ctZi (Pseudomonas
aeruginosa) и содержащие медь (другие псевдо-
монады и Alcaligenes). Цитохром d\ идентифици-
рован как белок, содержащий 1,3-порфириндион
(рис. 12.7, Л). Многие нитритредуктазы облада-
ют также оксидазной активностью — катализиру-
ют восстановление кислорода до воды.
Часть III. Многообразие метаболических путей
Рис. 12.8. Ацетил-Co А-синтаза (СО-дегидрогеназа).
Этот ферментный комплекс обладает следующими ак-
тивностями: метилтрансферазной (1), СО-дегидроге-
назной (2), карбонилазной (3) и ацетилтрансфераз-
ной (4). Кобамид — производное витамина В12 (см.
рис. 12.10); [4F—4S]— железо-серный кластер, содер-
жащий четыре атома железа и четыре атома серы;
Нд-фолат — тетрагидрофолат (ТГФ); ~ — высокоэнер-
гетическая связь. X — вероятно, сера; Y — переносчик
ацетильной группы, вероятно остаток цистеина в соста-
ве фермента.
NO-редуктаза представляет собой комплекс из
цитохромов b и с и является единственным фер-
ментом, способным формировать N—N-связь (см.
табл. 12.1). ^0-редуктаза— это медьсодержащий
фермент с двухъядерным Cu-центром, аналогич-
ным CuA-центру митохондриальной цитохромок-
сидазы. Все эти ферменты более или менее прочно
связаны с плазматической мембраной либо инте-
грированы в нее.
Нитритредуктаза, участвующая в процессе ам-
монификации [реакция (12.14)],—это водорас-
творимый фермент, содержащий сирогем (см.
рис. 12.7, Б) и [4Fe—48]-кластер в качестве просте-
тических групп. Осуществляемое этим фермен-
том шестиэлектронное восстановление нитрита до
аммиака [реакция (12.5)] сходно по механизму с
восстановлением сульфита (HSO^; степень окис-
ления серы +4) до сероводорода (степень окисле-
ния серы —2) диссимиляционными сульфитредук-
тазами [см. разд. 12.1.8; реакция (12.63)].
В процессе нитратного дыхания нитрат (сте-
пень окисления азота +5) восстанавливается до
нитрита (степень окисления +3). В реакции
участвуют цитохром Ь, железо-серные центры и
мембраносвязанный молибдоптерин-содержащий
фермент. Энергия на этом этапе запасается в виде
электрохимического протонного потенциала. Нит-
рит далее может превращаться в аммиак в ре-
зультате шестиэлектронного восстановления при
участии сирогем-содержащего фермента (аммо-
нификация) или восстанавливаться до N2 (сте-
пень окисления 0) в три этапа (реакции, катали-
зируемые 1,3-порфирипдионом и медьсодержащи-
ми ферментами) с образованием оксида азота NO
(степень окисления азота +2) и гемиоксида азо-
та N2 О (степень окисления азота +1) в качестве
промежуточных продуктов (денитрификация).
12.1.2. Восстановление фумарата сопряжено
с транспортом электронов
Восстановление сц/З-ненасыщенных монокарбоно- J
вых кислот (в свободной форме или в форме
СоА-эфиров) до соответствующих насыщенных |
жирных кислот катализируют растворимые цито-
плазматические ферменты, использующие в ка-
честве донора электронов восстановленные пи-
ридиннуклеотиды. Эти реакции не сопряжены с |
запасанием энергии, возможно по причине то-
го, что субстраты имеют низкий окислительно-
восстановительный потенциал (—30 мВ). В отли-
чие от этого восстановление фумарата (Е'о =
+30 мВ) с использованием различных доноров ;
электронов (NADH, Н2, формиат) происходит при i
участии мембранной электронтранспортной цепи.
В ее состав входят соответствующие дегидроге-
назы и фумаратредуктаза, связанные между со-
бой через пул менахинонов (рис. 12.3 и 12.5).
Фумаратредуктаза сходна с нитритредуктазой, за
исключением того, что вместо молибдоптерин-
содержащей субъединицы в ней присутствует
субъединица, содержащая FAD, который связан
ковалентной связью с остатком гистидина. Сход-
ны также механизмы образования электрохими-
ческого протонного потенциала в результате ак-
тивности этих ферментов.
Примечательно, что Е. coli обладает двумя
родственными ферментами, катализирующими
взаимопревращение сукцинат/фумарат. В аэроб-
ных условиях клетки содержат сукцинатдегидро-
геназу, использующую убихинон (Eq = +45 мВ)
в качестве акцептора электронов. В анаэробных
условиях синтезируется фумаратредуктаза, ис-
Глава 12. Анаэробный энергетический метаболизм 353
пользующая в качестве донора электронов мена-
хинол (Eq — —100 мВ).
В природных местообитаниях фумарат, как
правило, отсутствует, однако микроорганизмы
могут получать его из сахаров, малата, цитра-
та и, главным образом, из аспартата и аспа-
рагина— аминокислот, с большой частотой при-
сутствующих в составе белков. Большинство
фумарат-восстанавливающих бактерий содержит
фумаразу, аспартат:аммиак-лиазу и аспараги-
назу. Синтез этих ферментов контролирует
Ог-чувствительный регуляторный белок Fnr (см.
гл. 11 и 21). Энтеробактерии и Helicobacter
способны синтезировать сукцинат из аспараги-
на и аспартата. Пропионовокислые бактерии и
Veillonella parvula образуют фумарат из лакта-
та через этапы образования пирувата и окса-
лоацетата. У пропионовокислых бактерий фума-
рат далее восстанавливается при участии фума-
ратредуктазы с образованием сукцината, который
через образование метилмалонил-СоА превраща-
ется в пропионат (рис. 12.25). У Clostridium
oroticum аспартат образуется при сбраживании
оротата — предшественника в синтезе пиримиди-
нов [реакция (12.19)].
Оротат" + 2Н2О 4- ЗН+ + 2е" ->
—> NH^ 4- СО2 4- L-аспартат (12.19)
У анаэробов восстановление фумарата с обра-
зованием сукцината (фумаратное дыхание) ката-
лизирует фермент фумаратредуктаза, подобный
нитратредуктазе, но вместо молибдоптерипа со-
держащий FAD. Донором электронов для пего
служит менахинол. У аэробов родственный фер-
мент сукцинатдегидрогеназа катализирует обрат-
ную реакцию — окисление сукцината с участием
убихинона в качестве первичного акцептора элек-
тронов.
12.1.3. Некоторые бактерии и археи
осуществляют серное дыхание
Прокариоты, восстанавливающие соединения се-
ры, обитают в разнообразных условиях среды
от среднетемпературных и щелочных до высо-
котемпературных и кислых. Некоторые из этих
организмов окисляют простые органические со-
единения, такие как этанол, ацетат или формиат.
Встречаются также штаммы, нуждающиеся для
роста в сахарах и пептидах. Известно несколько
экстремально термофильных архей, сбраживаю-
щих эти органические субстраты в отсутствие мо-
лекулярной серы. Однако добавление серы стиму-
лирует их рост, благодаря тому, что обеспечивает
удаление выделяющегося в процессе брожения во-
дорода (см. разд. 12.2).
Молекулярная, или аморфная, сера,
встречающаяся обычно в форме восьмиатомных
кольцевых молекул (S8), практически нераство-
рима в воде при 25 °C, и ее непосредствен-
ное восстановление до сульфида бактериями ма-
ловероятно. Для Wolinella succinogenes установ-
лена способность восстанавливать полисульфиды
~S—Sn) - растворимые промежуточные продук-
ты восстановления серы . Характерно ли это и
для других бактерий, неизвестно. Полисульфи-
ды, главным образом S4" и S|", образуются абио-
тически из молекулярной серы и гидросульфида
[реакции (12.20), (12.21)].
S8 + HS" -> “S-Sg 4- Н+ (12.20)
~S~Sg 4- HS" —> 84", S|~ и другие
полисульфиды (12.21)
Количество So, растворяющееся при pH 8 и тем-
пературе 37 °C в растворе сульфида, примерно
эквивалентно содержанию сульфида. Однако при
снижении pH стабильность полисульфидов рез-
ко снижается, и маловероятно, что при pH ниже
5 они могут служить субстратами для бактерий,
восстанавливающих серу.
Механизм восстановления полисульфидов по-
дробно исследован только у W. succinogenes. Оно
происходит с участием водорода или формиа-
та и электротранспортной цепи, в состав ко-
торой входят гидрогеназа или формиатдегид-
рогеназа и полисульфидредуктаза. Все эти три
фермента встроены в плазматическую мембра-
ну таким образом, что их субстрат-связывающие
участки обращены в периплазму. Перенос элек-
тронов между гидрогеназой и полисульфидре-
дуктазой, осуществляемый без участия хинонов,
происходит в результате диффузионных столк-
новений молекул ферментов внутри плазмати-
ческой мембраны. Полисульфидредуктаза содер-
жит две гидрофильных и одну гидрофобную
субъединицы. Субстрат-связывающий участок
расположен на большей из гидрофильных субъ-
354 Часть III. Многообразие метаболических путей
единиц и содержит молибдоптерингуаниндинук-
леотид (рис. 12.6). Меньшая гидрофильная субъ-
единица—это железо-серный белок. Способность
клеток W. succinogenes расти с использованием
водорода или формиата (доноры электронов) и
полисульфида ([S], акцептор электронов) позво-
ляет предполагать, что перенос электронов при
восстановлении [S] сопряжен с синтезом АТР.
Н2 + [S] -> HS“ + Н+ (12.22)
Однако разность окислительно-восстановитель-
ных потенциалов донора (Н2, Eq = —414 мВ)
и акцептора ([S], Eq = —270 мВ) электронов
очень незначительна. Это означает, что отноше-
ние Н+/е~ в данном случае должно быть мень-
ше единицы. Принимая отношение Н+/е- равным
0,5, получаем, что в этом случае при окислении
1 моль Н2 должно синтезироваться 1/3 моль АТР.
Для восстановления серы до H2S (Е'о =
—270 мВ) требуется Н2 или формиат в качестве
донора электронов. Поскольку молекулярная се-
ра (Sg) практически нерастворима в воде, дей-
ствительным субстратом для молибдоптерипди-
нуклеотид-содержащего фермента в процессе вос-
становления серы служат полисульфиды (S2-;
п = 4-5).
12.1.4. Система восстановления Fe(lll)
имеет высокий
окислительно-восстановительный
потенциал
Окислительно-восстановительная пара Fe3+/Fe2+
имеет очень высокий окислительно-восстанови-
тельный потенциал (Eq = +770 мВ), близкий
к потенциалу кислорода (Е'о = +820 мВ; см.
табл. 4.1), и при окислении 1 моль ацетата с
использованием Fe3+ (акцептор электронов) мо-
жет быть синтезировано до 11 моль АТР [реакция
(12.23)]. Почти такое же количество АТР образу-
ется в митохондриях при окислении ацетата кис-
лородом.
Ацетат- + 8Fe3+ + 2Н2О — ♦
-> 2СО2 + 8Fe2+ + 7Н+
AG0/ = —815 кДж/моль ацетата (12.23)
Растворимость Рс(ОН)з в воде чрезвычайно низ-
ка ([Ре3+][ОН_]з = 10-39) и зависит от pH сре-
ды. При pH 7 концентрация Fe3+ равна 10-18 М,
и только при pH ниже 4 концентрация Fe3+ до-
стигает микромоляркого уровня. При pH 7 изме-
нение свободной энергии в реакции (12.23) (AG' =
—34 кДж/моль ацетата) недостаточно для синте-
за 1 моль АТР. В почве окисленное железо обыч-
но присутствует в еще менее растворимых фор-
мах— в составе гематита (а-Пе20з), ферригидри-
та (5Рс20з - 9Н2О), маггемита (7-Ре20з), гётита
(o-Fe()OH) и лепидокрокита (7-FeOOH). Количе-
ство энергии, запасаемой в реакции (12.23) при
использовании этих соединений, неизвестно.
Способностью восстанавливать Fe(III) до
Fe(II) обладают бактерии родов Bacillus, Clostri-
dium, Escherichia, Pseudomonas, Serratia и ря-
да других. Однако для большинства этих орга-
низмов неизвестно, означает ли данный процесс
диссимиляционное восстановление с запасанием
энергии или несет ассимиляционную функцию.
У бактерий-бродилыциков Fe(III) может исполь-
зоваться только в качестве акцептора электронов
для удаления избытка восстановителей, образую-
щихся при брожении. У Geobacter metallireducens
и Shewanella putrefadens рост непосредствен-
но зависит от восстановления Fe(III). При этом
G. metallireducens в качестве донора электронов
может использовать толуол. Структура электрон-
транспортной цепи и фюрментов, участвующих
в процессе диссимиляционного восстановления
Fe(III) у этих организмов, пока не изучены. Мож-
но предполагать, что мембрапосвязанная редук-
таза железа, в частности у грамотрицательных
бактерий, должна выступать наружу с внешней
стороны мембраны, чтобы происходил ее контакт
с нерастворимым ферригидритом 5Fe2O2 - 9Н20.
Таким образом, ион восстановленного железа
(Fe2+) должен образовываться вне клетки. Меха-
низмы ассимиляционного использования Fe(III),
в отличие от этого, довольно подробно изучены
(см. гл. 8).
Недавно были выделены анаэробные фото-
трофные бактерии, способные использовать Fe2+
в качестве донора электронов для автотрофной
фиксации СО2. Это указывает, что в докембрий-
ский период эволюции биосферы биогенное обра-
зование окисленного железа, возможно, предше-
ствовало образованию молекулярного кислорода.
Таким образом, Fe3+ можно рассматривать в ка-
честве первого неорганического акцептора элек-
Глава 12. Анаэробный энергетический метаболизм 355
тронов, появившегося раньше, чем нитрат, суль-
фат или Ог- В современных биоценозах Fe3+ игра-
ет важную роль при окислении органических суб-
стратов в осадочных отложениях. Имеются дан-
ные о том, что и другие металлы с переменной
валентностью могут быть использованы в каче-
стве акцепторов электронов в процессе анаэроб-
ного дыхания. Например, многие бактерии спо-
собны восстанавливать Mn(IV) в форме нераство-
римого М11О2, превращая его в водорастворимый
Мп(П). По биохимическому механизму и геохи-
мическому значению бактериальное восстановле-
ние М11О2, по-видимому, сходно с восстановлени-
ем Fe3+.
Железо в форме Fe3+ имеет высокий окис-
лительно-восстановительный потенциал, сопоста-
вимый с потенциалом О2, но использование его
микроорганизмами в этой окисленной форме в
качестве акцептора электронов затруднено из-за
почти абсолютной нерастворимости Ве(Ш)-соеди-
нений при нейтральном pH. Тем пе менее в дон-
ных отложениях восстановление железа играет
важную роль в процессе окисления органических
субстратов.
12.1.5. Восстановление диметилсульфоксида
и триметиламин-Ы-оксида путем
анаэробного дыхания приводит
к образованию продуктов
с резким запахом
Подобно фумарату и нитрату, диметилсульфок-
сид или триметиламин-П-оксид могут служить
конечными акцепторами электронов при анаэроб-
ном дыхании, главным образом у энтеробактерий,
а также у Wolinella suednogenes Эти соединения
восстанавливаются до диметилсульфида [реакция
(12.24)] и триметиламина [реакция (12.25)] соот-
ветственно.
Триметиламин-Ы-оксид + 2 Н+ + 2 е —>
(CH3)3N+—О-
—> Триметиламин + Н2О (12.25)
(CH3)3N
Ферменты обеих реакций представляют собой
интегральные мембранные белки; донором элек-
тронов для них служит убигидрохинол или ме-
нагидрохинол. Дыхательная цепь и способ запа-
сания энергии в этих случаях аналогичны тем,
которые действуют в процессах фумаратного и
нитратного дыхания у соответствующих организ-
мов.
Дополнение 12.3. В результате деграда-
ции (CH3)2S+-CH2-CH2-COO- (диметил-
сульфопропионата) , выполняющего функцию
осмолитика у многих морских растений, в ат-
мосферу над морями в значительном коли-
честве поступает продукт его разложения —
летучее соединение диметилсульфид. Он
частично окисляется кислородом воздуха с
образованием диметилсульфоксида. Образо-
вывать диметилсульфоксид могут также фо-
тотрофныс бактерии, использующие диме-
тилсульфид в качестве донора электронов
при фиксации СОг- В промышленности диме-
тилсульфоксид получают при производстве
целлюлозы и используют в качестве универ-
сального растворителя. В медицине его ра-
нее применяли в качестве растворителя для
наружных лекарственных средств, проника-
ющего через кожные покровы, однако теперь
он как высокотоксичпый агент запрещен к
применению. Триметиламин-К-оксид образу-
ется в результате окисления триметилами-
на — продукта разложения триметиламмопи-
евых соединений, например холина, при гни-
ении рыбы.
Диметилсульфоксид + 2Н + 2е —>
CH^SO-СНз
—> Диметил сульфид + Н2 О (12.24)
CH3-S-CH3
В анаэробных условиях факультативные анаэ-
робы могут использовать в качестве конечных
акцепторов электронов, наряду с фумаратом и
нитратом, диметил сульфоксид и триметиламин-
N-оксид. Транспорт электронов сопряжен при
этом с запасанием энергии.
356 Часть III. Многообразие метаболических путей
12.1.6. Синтез ацетата из двух Ci-единиц
сопровождается выделением энергии
Строго анаэробные ацетогенные бактерии со-
ставляют чрезвычайно гетерогенную в таксоно-
мическом отношении группу грамположитель-
ных организмов. Они входят в состав родов
Peptostreptococcus, Butyrobacterium, Eubacteriwn,
Clostridium, Acetobacterium, Sporomusa и Syntro-
phococcus. Ацетогены синтезируют ацетат из двух
С]-единиц, чаще всего двух молекул СО2, восста-
навливая их с использованием молекулярного во-
дорода [реакция (12.26)]. Кроме СО2, в качестве
субстратов для синтеза ацетата могут быть ис-
пользованы также метанол [реакция (12.27)] и ок-
сид углерода [реакция (12.28)].
2СОг + 4Нг —> Ацетат- 4- 2Нг 4- Н+
ДС0/ = —95 кДж/моль ацетата (12.26)
4Метанол 4- 2СОг —> 3Ацетат- 4- 2НгО 4- ЗН+
ДО07 = —70 кДж/моль ацетата (12.27)
4СО 4- 2Н2О -> Ацетат- 4- 2СО2 4- Н+
ДС°7 = —175 кДж/моль ацетата (12.28)
Большинство ацетогенов способно также гид-
ролизовать или окислять многоуглеродныс суб-
страты до одноуглеродных соединений, исполь-
зуемых ими для синтеза ацетата. Хорошо изу-
ченным примером таких превращений может
служить реакция синтеза трех молекул ацетата из
молекулы глюкозы, осуществляемая Clostridium
aceticum [реакция (12.29)]. Уксусную кислоту,
С2Н4О2, можно рассматривать как представитель
углеводов с общей формулой СПН2ПОП (в случае
ацетата п = 2, в случае глюкозы —6).
Глюкоза —> ЗАцетат- 4- ЗН+
ДС°7 = —104 кДж/моль ацетата (12.29)
Вначале глюкоза сбраживается С. aceticum по пу-
ти Эмбдена-Мейергофа с образованием двух мо-
лекул пирувата, которые затем окисляются с об-
разованием двух молекул ацетата и двух молекул
СО2. При этом в процессе субстратного фосфори-
лирования синтезируется 4 молекулы АТР. Далее
из двух молекул СО2 с использованием восста-
новителей, полученных при окислении глюкозы,
синтезируется третья молекула ацетата.
Многие ацетогены способны расщеплять про-
стые эфиры, такие как метилированные фе-
нольные соединения — продукты разложения лиг-
нина. Высвобождающаяся при этом метильная
группа через образование метилтстрагидрофола-
та превращаемся в метильную группу ацетата,
источником карбоксильной группы которого слу-
жит СО2. Так, Clostridium formicoaceticum спо-
собен синтезировать из ванилина [(3-метокси)-
4-гидроксибснзальдегид] и СО 2 протокатеховую
кислоту [3,4-дигидроксибензойная кислота] и аце-
тат. Источником восстановительных эквивален-
тов для синтеза ацетата также служит ванилин
[реакции (12.30)-(12.31)].
Ванилин 4- 2Н2О —> Протокатехат- 4-
+ [СН3ОН] 4- 2[Н] 4- Н+ (12.30)
[СН3ОН] 4- 2[Н] 4- СО2 ->
СНзСОО- + Н+ + Н2О (12.31)
Ванилин 4- 2Н2О 4- СОг —>
—> Ацетат - 4- Протокатехат- 4- 2Н+
Уравнение (12.31) почти полностью повторяет
реакцию, катализируемую ключевым ферментом
ацетогенсза — ацетил-СоА-синтазой (называемой
также СО-дегидрогеназой). Она катализирует об-
разование ацетил-СоА из СО2 и метильной груп-
пы, связанной с тетрагидрофолатом [реакция
(12.32)].
А”5-метилтетрагидрофолат 4-
4- 2[Н] + СО2 4- CoASH -> Ацетил-S-CoA 4-
4- Тетрагидрофолат 4- Н2О (12.32)
Ацетил-СоА-сиптаза чрезвычайно чувствительна
к кислороду, имеет сложную структуру и об-
ладает четырьмя активностями: 1) кобаламин-
зависимой метилтраисферазы (метилированная
форма витамина В]2, сходная с кобамидоы;
рис. 12.10), принимающей метильную группу от
тетрагидрофолата; 2) никель- и |4Fe—48]-содер-
жащей СО-дегидрогеназы, катализирующей вос-
становление СО2 до СО; 3) также никель- и
[4Fe—4й]-содержащей карбонилазы, катализиру-
ющей присоединение метильной группы к СО
с образованием связанной с ферментом аце-
тильной группы, и 4) ацетилтрансферазы, от-
Глава 12. Анаэробный энергетический метаболизм 357
дсляющей ацетильную группу от фермента с
высвобождением ацетил-СоА (рис. 12.8). Реакции,
катализируемой карбонилазой, аналогичен хими-
ческий процесс получения ацетата (технология
Монсанто), в котором СО внедряется в участок
С—О-связи метанола:
СО + СН3ОН -> СН3-СООН (12.33)
Процесс образования метильной группы из СО2
включает три реакции двухэлектронного восста-
новления с образованием формиата и формаль-
дегида в качестве промежуточных продуктов.
Если в качестве предшественника ацетил-СоА ис-
пользуется экзогенный формальдегид, он как вы-
сокотоксичный агент поступает в клетку в свя-
занной форме —в виде Ат5,А10-метилентетрагид-
рофолата. Это соединение спонтанно образуется
из формальдегида и тетрагидрофолата. В восста-
новлении СО2 до метильной группы (А5-метил)
тетрагидрофолата участвуют пять ферментов [ре-
акции (12.34)-(12.38)].
В качестве донора электронов, обеспечиваю-
щего восстановление NAD(P)+ и неизвестного до-
нора для формиатдегидрогеназы, используется
молекулярный водород, окисляемый в гидроге-
назной реакции (12.39).
Энергетика синтеза ацетата □ При стан-
дартных условиях (одномолярной концентрации
Формиатдегидрогеназа
+ 2[Н]----------------> НСОО- + Н+
всех субстратов) в реакции синтеза ацетата вы-
деляется энергия в количестве, достаточном для
синтеза 1 моль АТР [реакция (12.26)]. Однако
в природных местообитаниях ацетогенов концен-
трация Н2 значительно ниже, и, поскольку на
синтез 1 моль ацетата расходуется 4 моль Н2, с
уменьшением концентрации водорода резко пада-
ет’ изменение свободной энергии:
AG' = AG0' + КТ1п([Ацетат-][СО2]-2[Н2]-4)
(12.40)
При концентрации водорода, равной 102 Па
(1 мМ), концентрациях СО2 Ю5 Па (1 М) и аце-
тата 1 М величина изменения свободной энер-
гии составляет: ДО' — —95 + 5,71gl0+l2 =
—27 кДж/моль. Этого количества энергии недо-
статочно для образования 1 моль АТР, посколь-
ку с учетом энергетических потерь (см. разд. 3.2)
оно требует затраты энергии в количестве не ме-
нее —70 кДж/моль. Эти расчеты показывают, что
субстратное фосфорилирование в таких условиях
невозможно. То количество АТР, которое образу-
ется с использованием ацетил-СоА, синтезируемо-
го ацетил-СоА-синтазой [реакция (12.32)], расхо-
дуется на активацию формиата [реакция (12.35)].
Таким образом, единственный путь запасания
энергии в этих условиях — это фосфорилирова-
ние, сопряженное с транспортом электронов в
цепи, где акцептором служит СО2 (анаэробное
(12.34)
Формилтетрагидрофолат-синтетаза
НСОО- + АТР4- + Тетрагидрофолат------------------------------------>
—> А10-формилтетрагидрофолат + ADP3 + НРО2 (12.35)
Формилтетрагидрофолат-циклогидролаза
А -формилтетрагидрофолат —----------------——-----—---------->
—> А5,А10-метенилтетрагидрофолат + Н2О (12.36)
Метенилтетрагидрофолат-оксидоредуктаза
А ,А10-метенилтетрагидрофолат + NAD(P)H 4- Н+------------------------------------->
—> А5, А10-метилентетрагидрофолат 4-NAD(P)+ (12.37)
Метилтетрагидрофолат:КАОР+-оксидоредуктаза
А5,А-метилентетрагидрофолат -f- NADPH + Н+------------------------------------------->
—> А5-метилтетрагидрофолат 4- NADP+ (12.38)
Гидрогеназа
Н2-----------> 2Н+ 4- 2е- (См. дополнение 12.4) (12.39)
358 Часть III. Многообразие метаболических путей
„ Фосфат-ацетилтрансфераза о ____ ,
Ацетил-СоА + НРО4 ---------------------------> Ацетилфосфат2 + CoASH (12.41)
Ацетилфосфат2- + ADP3~ Ацета™нназа_, ATP4" + Ацетат" (12.42)
NO3 + 4Н2 + 2Н+ -4 NHJ + ЗН2О AG0/ - -600 кДж/моль (12.43)
дыхание). При наличии источников метильной
группы может быть получено дополнительное ко-
личество АТР из ацетил-СоА путем субстратного
фосфорилирования в фосфат-ацстилтрансфераз-
ной и ацетаткиназной реакциях (12.41) и (12.42).
Ацетогенныс клостридии С. thermoaccticum и
С. formicoaceticum содержат цитохром 6, и у них в
качестве сопрягающих ионов в процессе электрон-
транспортного фосфорилирования используются
протоны. У бактерии Acetobacterium woodii, не со-
держащей цитохром Ь, в качестве сопрягающего
иона используется Na+ и присутствует Na+-зави-
симая АТР-синтаза.
В присутствии нитрата у некоторых ацетоген-
ных бактерий способность к восстановлению СО2
подавляется. В таких условиях они восстанавли-
вают нитрат до аммония [реакция (12.43)]; при
этом высвобождается в шесть раз больше энер-
гии, чем при восстановлении СО2 [см. реакцию
(12.26)].
Ацетогенныс бактерии способны синтезиро-
вать ацетат путем восстановления СОг, используя
восстановители с низким окислительно-восста-
новительным потенциалом (например, водород
или восстановленный ферредоксин, получаемый
при окислении 2-оксокислот или альдегидов).
Метокси-группы могут подвергаться непосред-
ственному превращению в метильную группу аце-
тата. Синтез ацетил-СоА из мстилтетрагидрофо-
лата и СО2 с использованием восстановительных
эквивалентов катализирует ацетил-СоА-синтаза,
содержащая три металла с переменной валентно-
стью — железо, кобальт и никель. Энергия запаса-
ется в виде протонного или натриевого электрохи-
мического потенциала.
12.1.7. Способностью к метаногенезу
обладают только археи
В строго анаэробных условиях метаногенные
организмы способны разлагать ацетат до СО2
и метана (СН4; биогаз) или восстанавливать
Ci-соединения с образованием метана. Субстрата-
ми для метаногенов, восстанавливающих Ci-coe-
динения, служат: СО2/Н2, оксид углерода, фор-
миат, метанол, метанол/Щ, метиламины, метил-
сульфиды и СОг/снирты. Способность к мета-
ногенезу обнаружена только у архей. Метано-
гены составляют 17 родов, содержащих 50 ви-
дов. Некоторые из этих родов, например род
экстремально термофильных архей Methanopy-
rus (G + С = 60 мол.%), растущих только с ис-
пользованием СО2/Н2 при температуре ^1.10 °C,
и род мезофильных архей Methanosarcina
(G + С ~ 40 мол.%), растущих при температуре
37 °C с использованием наиболее широкого среда
метаногенов круга субстратов, лишь отдаленно
родственны друг другу, как грамположительные
бактерии и протеобактерии в домене бактерий.
Реакции метаногенеза можно разделить на
три группы: 1) восстановление Ci-субстратов с
использованием молекулярного водорода или
спиртов (с двумя или большим числом ато-
мов углерода) в качестве восстановителей [ре-
акции (12.44)-(12.46)]; 2) диспропорционирова-
ние (внутримолекулярные окислительно-восста-
новительные реакции) с участием Сi-соединений
в качестве доноров и акцепторов электронов [ре-
акции (12.47)-(12.50)] и 3) кажущееся декарбок-
силирование ацетата, которое в действительности
также представляет собой реакцию диспропорци-
онирования [реакция (12.51)].
Реакции восстановления С i-соединений:
СО2 + 4Н2 -* СН4 + 2Н2О
СН3ОН + Н2 -> СН4 + Н2О
СО2 + 2СНзСН2ОН -> СН4 + СН3СОО“ + 2Н+
AG0/ = -131 кДж/моль СН4 (12.44)
AG0' = -112 кДж/моль СН4 (12.45)
AG0' = -111 кДж/моль СН4 (12.46)
Глава 12. Анаэробный энергетический метаболизм 359
Реакции диспропорционирования Сц-соедипений:
4НСОО" + 4Н+ -> СН4 + ЗСО2 + 2Н2О
4СО + 2Н2О -> СН4 + ЗСО2
ЗСНзОН -> ЗСН4 + СО2 + 2Н2О
4CH3NH+ 2Н2О -> ЗСН4 + СО2 + 4NHJ
Реакция диспропорционирования ацетата:
СНзСОО- + Н+ СН4 + СО2
AG0' = — 144 кДж/моль СН4 (12.47)
AG0/ = —448 кДж/моль СН4 (12.48)
AG0' = —319 кДж/моль СН4 (12.49)
AG0/ = —235 кДж/моль СН4 (12.50)
AG0' = -36 кДж/моль СН4 (12.51)
Хорошо изучен механизм восстановления СО2
до метана с использованием молекулярного водо-
рода в качестве восстановителя [реакция (12.44)].
Процесс восстановления СО2 до метана включа-
ет семь этапов (рис. 12.9), в которых участву-
ют семь обнаруженных только у архей кофермен-
тов, в том числе метанофуран, тетрагидрометано-
птерин (Н4МП), кофермент F42q, кофермент М,
кофермент В (5-гидроксибензимидазол-гидрокси-
кобамид) и кофермент F43o (рис. 12.10). Из них
только тетрагидрометаноптерин, кофермент F42q
и 5-гидроксибепзимидазол-гидроксикобамид име-
ют сходство с коферментами, присутствующими
у бактерий и эукариот.1
Тетрагидрометаноптерин сходен с тетрагидро-
фолатом (H4F); F42o представляет собой произ-
водное 5-деазафлавипа и по свойствам аналог Как
видно из рис. 12.10, часть структуры восстанов-
ленной формы этого кофермента идентична ча-
сти молекулы NADH. Однако окислительно-вос-
становительный потенциал F42q (—360 мВ) ниже,
чем у NAD (—320 мВ). Кофермент 5-гидроксибен-
зимидазол-гидроксикобамид по структуре близок
к гидроксикобаламину (гидроксилированная фор-
ма витамина В12, характерная для ацетогенных
бактерий), отличаясь от него лишь тем, что вме-
сто диметилбепзимидазола (аксиальный лиганд
кобальта) содержит 5-гидроксиимидазол.
Тетрагидрометаноптерин выполняет у метано-
генных архей ту же функцию, что тетрагидро-
фолат у бактерий и эукариот, перенося С i-ос-
татки (от формильных до метильных) и защи-
щая клетки от токсичного действия свободного
формальдегида (табл. 12.2). Формильный оста-
ток присоединяется к №-атому тетрагидромета-
ноптерина (у ацетогенов он присоединяется по
положению IV10 тетрагидрофолата) и дегидра-
тируется с образованием ТУ5,7У1О-метенилтетра-
гидрометаноптерина. Восстановление до уровня
формальдегида (степень окисления углерода 0)
осуществляется либо непосредственно молекуляр-
ным водородом, либо при участии кофермен-
та F420. Продукт восстановления — N5,7У10-мети-
лентетрагидрометаноптерин — восстанавливается
далее до А^5,Аг10-метилтетрагидромстаноптери-
на, метильная группа которого переносится на
SH-группу кофермента М с образованием метил-
S-CoM. Этот продукт является субстратом по-
следней стадии восстановления, на которой об-
разуется свободный метан. Восстановителем в
этой реакции служит 7-меркапто-гептаноилтрео-
нипфосфат (HS-ГТФ), который называют так-
же коферментом В [реакция (12.52)]. Эту ре-
акцию катализирует метил-СоМ-редуктаза, со-
держащая в качестве простетической группы
кофермент F43o—тетрапиррол с центральным
атомом Ni.
Мстил-S-CoM 4- HS-ГТФ
Метил-СоМ-редуктаза
СН4 + CoMS-S-ГТФ
AG,0/ = —45 кДж/моль метана (12.52)
Промежуточным продуктом в процессе об-
разования метана предположительно являет-
ся метильная группа, связанная с атомом ни-
келя. Кроме метана в метил-СоМ-редуктаз-
иой реакции образуется СоМ—S—S~СоВ — ге-
теросульфид кофермента В и кофермента М.
Восстановление этого гетеросульфида молеку-
лярным водородом (AG()/ = —40 кДж/моль)
происходит при участии связанного с мем-
браной ферментного комплекса, состоящего
из гидрогеназы и гетеродисульфид-редуктазы.
Как предполагается, этот комплекс, содержа-
1 Недавно метанофуран и Н4МП были обнаружены у аэробных метилотрофных бактерий. — Прим. ред. перев.
360 Часть III. Многообразие метаболических путей
Таблица 12.2. Степень окисления углерода в составе
биологически важных Ci-соединений
Степень окисления Соединение
+4 +2 ±0 —2 -4 Диоксид углерода, СОг; бикарбонат, НСО^; карбонат, СОд" Карбамат, R—NH—СОО- Мочевина, NH2—СО-NH2, Гуанидиний, R—NH—NH2 Цианид, С=Ы— Оксид углерода, СО Формиат, НСОО- Формамид NH2-CHO; N-формил, R1R2N—СНО N.N'-метенил, R1R2N—CH=N—R3RJ Углерод, С Гидратированный формальдегид, НО-СН2-ОН Ы,1+-метилен, RiR2N—СН2—NR3R4 Метанол, СН3ОН Метил, R1R2N—СНз, R—О—СНз или R—S~СНз Метан, СН4
щий несколько [Fe-Sj-кластеров и FAD, служит
электрогенной протонной помпой, благодаря ак-
тивности которой запасается основная часть энер-
гии, высвобождаемой в процессе метаногенеза.
На первой стадии метаногенеза происходит
восстановление СО2 до уровня формиата в соста-
ве формилметанофурана. Эта реакция протека-
ет с затратой энергии (AG0' = +16 кДж/моль).
В природных условиях расход энергии в ней зна-
чительно больше по причине низкой концентра-
ции водорода (ниже 105 Па, величины, эквива-
лентной 1 М). Реакция происходит при участии
молибдоптериндинуклеотида, который в качестве
лиганда может содержать атом Мо или W. Эти
так называемые молибдоптерины или вольфрам-
содержащие птерины имеются не только у ме-
таногенных архей, но встречаются также у бак-
терий (рис. 12.6). Источник энергии для акти-
вации СО2 пока не установлен; возможно, им
служит АТР или градиент ионов натрия, со-
здаваемый метилтрансферазой (мембраносвязан-
ный фермент, содержащий в качестве кофактора
5-гидроксибензимидазолкобамид). Свободная
энергия (AG0/ ~ —30 кДж/моль), выделяемая
при переносе метильной группы от N к S в метил-
трансферазной реакции, преобразуется в энергию
электрохимического натриевого потенциала. Хи-
мически сходную реакцию переноса метильной
Рис. 12.9. Путь атома углерода СОг в процессе мета-
ногенеза. 1 — формил-метанофуран-дегидрогеназа; X—
неизвестный донор водорода; 2 — формил трансфера-
за; 3 — циклогидролаза; 4 — р42о-зависимая /V5,А/10-ме-
тенилмета-ноптерин-дегидрогеназа; 5 — б42о-зависимая
Д/51Л/10-метиленметаноптерин-дегидрогеназа; б — мети-
лтрансфераза; 7 — метил-S-CoM-редуктаза. По [2]. Дру-
гие сокращения см. в подписи к рис. 12.10.
Глава 12. Анаэробный энергетический метаболизм 361
Рис. 12.10. Коферменты, участвующие
в процессе метаногенеза. F420—флуо-
ресцирующее производное деазафлавина
с максимумом поглощения при 420 нм,
содержащее структуру, сходную с NAD
(выделена полужирным шрифтом);
CoB-SH, или HS-ГТФ, — 7-меркапто-
гептаноилтреонинфосфат; CoM-SH —
меркаптоэтансульфонат; МФ — метано-
фуран, Н4МП —тетра гидромета ноптерин,
F430—содержащий никель тетра пиррол с
максимумом поглощения при 430 нм.
5-Гидроксибензимидазолилгидроксикобамид
группы катализирует метионипсинтаза, осуществ-
ляющая S-метилирование гомоцистеина при уча-
стии 775-метилтетрагидрофолата. Однако этот
фермент водорастворимый и, следовательно, не
может генерировать градиент ионов натрия.
Таким образом, при восстановлении СО2 до
метана [реакция (12.44)] энергия запасается толь-
ко в форме электрохимического ионного потен-
циала. Фосфорилирование на субстратном уровне
непосредственно зависит от изменяю
у данных организмов отсутствует, и
энергии
щихся в природных условиях концентраций суб
стратов. При стандартных условиях (концентра
ция Н2 105 Па), количество свободной энергии
высвобождающееся в этом процессе (AG0/ =
—131 кДж/моль метана), является достаточны»
для синтеза 1 к оль ATP/моль СН4. Однако в при
родных местообитаниях метаногенов концентра
362 Часть III. Многообразие метаболических путей
Рис. 12.11. Образование метана из ацетата. 1 — аце-
таткиназа; 2 — фосфат-ацетилтрансфераза; 3 (реакция,
заключенная в рамку) — ацетил-СоА-синтаза (СО-де-
гидрогеназа, см. рис. 12.8); 4 — метилтрансфераза
(генерирует ДД№+); 5 — метил-СоМ-редуктаза; б —
гетеродисульфид-редуктаза (генерирует Адн+); 7 —
ATP-синтаза (ДДН+- или Дд№+ -зависимая). Сокраще-
ния названий коферментов см. в подписи к рис. 12.10.
ция Нг, как уже указывалось, несравнимо ни-
же (1-10 Па) и поэтому значение AG" варьирует
от —22 до —45 кДж/моль СНд. Такая выражен-
ная зависимость выхода энергии от концентрации
Нг связана с тем, что реакция метаногенеза ха-
рактеризуется высоким потреблением водорода —
4 моль Нг/моль СН4 [реакция (12.44) и уравнение
(12.53)1
AG' = AG0,+RTln([CH4][CO2]"1[H2]"4), (12.53)
что при [СЩ] = [СОг] и [Нг] = 10"5 М состав-
ляет:
AG" = -131 + 5,71g[l(F5]'4
AG7 = —131 4-114 = —17 кДж/моль СН4
В процессе диспропорционирования метанола с
образованием СО2 и метана все реакции от об-
разования СО2 до метил-ЩМП обратимы. Един-
ственными необратимыми реакциями в катабо-
лизме у метаногенов являются последующие эта-
пы образования СН4. Имеются геохимические
данные, указывающие на потребление метана в
анаэробных условиях, однако неизвестно, проте-
кает ли этот процесс по пути обращения мета-
ногенеза или с использованием неизвестного ме-
ханизма активации С—Н-связи. Представители
родов Methanosarcina и Methanothrix единствен-
ные среди метаногенов способны расщеплять аце-
тат на метан и СО2. Эта реакция вносит ос-
новной вклад в образование метана в природе.
Как отмечено во введении к данной главе, де-
карбоксилирование ацетата с образованием СО2 и
метана — это внутримолекулярный окислительно-
восстановительный процесс (рис. 12.11). На его
первой стадии ацетат активируется, превращаясь
в ацетил-СоА при участии ацетаткиназы [реак-
ция (12.41)] и фосфат: ацетил-трансферазы [реак-
ция (12.42)] либо ацстил-СоА-синтазы [реакция
(12.54)].
Ацетат- + АТР4" + CoASH ->
—> Ацетил-СоА + АМР2" + Дифосфат3"
(12.54)
Дополнение 12.4. У метаногенных архей
присутствуют гидрогеназы по меньшей
мере трех типов: гидрогеназы, восстанав-
ливающие кофермент-Р42о [реакция (12.55)],
гидрогеназы, не восстанавливающие кофер-
mcht-F42o [реакция (12.56)], и А5,Аг10-мети-
лентетрагидромстаноптерин-дегидрогеназа,
образующая водород [реакция (12.57)].
Н2 + F420 -» H2F42o (12.55)
(Гидрогеназа, восстанавливающая
кофермент /420)
Этот фермент содержит никель. Восстанов-
ленный F/j2o используется в реакциях, ка-
тализируемых метенил- и метилен-Щ-МП-ре-
дуктазами.
Н2 + 2 А -> 2 Н+ + 2 А" (12.56)
(Гидрогеназа, нс восстанавливающая ко-
фермент Едго; содержит Ni. А —акцептор.)
Н2 + Метенил-ЕЦМП —»
-> Н+ + Метилен-ЩМП (12.57)
(Лг5,Лг10-метилен-тетрагидрометаноптер1ш-
дегидрогеназа, образующая водород)
При высокой концентрации Н2 возмож-
но прямое восстановление метенил-Н4МП во-
дородом в реакции (12.57). Катализирую-
щий ее фермент не содержит металлов с
Глава 12. Анаэробный энергетический метаболизм 363
переменной валентностью. Это противоречит
общепринятым представлениям о том, что ак-
тивация Н2 возможна только с участием та-
ких металлов, как Ni и/или Fe. Данный фер-
мент предположительно осуществляет пря-
мую атаку углерода метенильной группы в
составе метенил-ЩМП, приводящую к об-
разованию интермедиата с атомом углерода,
образующим пять координационных связей.
Остальные гидрогеназы метаногенов являют-
ся «обычными» гидрогеназами, т. е. содержат
Ni-F-центр и Fe-S-кластеры. У некоторых из
этих ферментов одним из лигандов Ni служит
селеноцистеин, чем обусловлена их гораздо
более высокая специфическая активность (до
105 с-1) по сравнению с гидрогеназами, со-
держащими только серу. У гидрогеназ, вос-
станавливающих F420, водород вначале свя-
зывается Ni-Fe-центром, откуда электроны
передаются через цепочку [Fe-Sj-кластеров на
FMN и далее на F^o- Протоны, образую-
щиеся в Ni-Fe-центре, расположенном глубо-
ко внутри молекулы фермента, переносятся
на ее поверхность через канал, богатый ги-
стидиновыми остатками. Гидрогеназы, вос-
станавливающие F420, изучены в меньшей
степени. Они составляют часть двух энерго-
передающих ферментных комплексов — фор-
мил-метанофуран-дегидрогеназы и гетеро-
дисульфид-редуктазы. У некоторых мета-
ногенов (например, Methanosarcina barkeri)
последний комплекс содержит также цито-
хром Ь.
Далее ацетил-СоА декарбонилируется с об-
разованием Н4МП и СО, который окисляется
до СОг- Декарбонилирование ацетил-СоА и по-
следующее окисление СО катализирует СО-де-
гидрогеназа (ацетил-СоА-синтаза), содержащая
никель и кобальт. Этот фермент сходен с ацетил-
СоА-синтазой ацетогенных бактерий. Образую-
щиеся в этой реакции восстановительные эквива-
ленты используются для образования метана в со-
ответствии со схемой, приведенной на рис. 12.9.
Количество энергии, запасаемой в реакции де-
карбоксилирования ацетата, невелико, поскольку
большая часть АТР, синтезируемого Н+-трансло-
цирующей АТРазой, расходуется на активацию
ацетата. Для синтеза АТР используется также
градиент ионов натрия, образование которого со-
пряжено с переносом метильного остатка при
участии На+/Н+-антипортера. В целом в реакции
диспропорционирования ацетата с образованием
СН4 и СО2 синтезируется примерно 1/3 моль АТР
на моль образующегося метана, что хорошо со-
гласуется с общим изменением свободной энергии
(AG0/ — — 30 кДж/моль).
Все метаногенные археи способны восстанав-
ливать СОг до метана, используя молекуляр-
ный водород. Однако основная часть метана
в природе образуется в результате диспропорци-
онирования (кажущегося декарбоксилирования)
ацетата с образованием СО2 и СН4. Эту ре-
акцию осуществляют археи только двух ро-
дов — Methanosarcina и Methanothrix. Образова-
ние метана из СО2 происходит при участии семи
уникальных коферментов, не встречающихся ни
у бактерий, ни у эукариот, — мотапофурана, тет-
рагидрометаноптерина, кофермента F420, кофер-
мента М, кофермента В, 5-гидроксибензими-
дазолилгидроксикобамида и кофермента F430.
Энергия запасается в этом процессе в форме элек-
трохимического протонного или натриевого по-
тенциала.
12.1.8. Диссимиляционное восстановление
сульфата до H2S широко распространено
в природе
Сульфатредуцирующие бактерии и археи способ-
ны использовать сульфат или тиосульфат в ка-
честве акцептора электронов в анаэробном ды-
хании (табл. 12.3), называемом в данном слу-
чае диссимиляционной сульфатредукцией.
На образование конечного продукта — сероводо-
рода— расходуется восемь электронов в расчете
на моль сульфата. Донором электронов при этом
может служить молекулярный водород [реакции
(12.58) и (12.59)], а также разнообразные орга-
нические субстраты (табл. 12.4). Таким образом,
сульфатредуцирующие организмы имеют суще-
ственно более широкую субстратную специфич-
ность по сравнению с метаногенами.
SO^- + Н+ + 4Н2 -> HS + 4Н2О
AG0' — —152 кДж/моль (12.58)
S2O^~ + Н+ + 4Н2 -> 2HS" + ЗН2О
AG0' = -174 кДж/моль (12.59)
364 Часть III. Многообразие метаболических путей
Таблица 12.3. Биологически важные неорганические
соединения серы
Степень окисления Соединение
+6 +5 +10/(х + 2) +4 +3 +2 ±0 -1 —2/(х + 2) -2 Как правило, 1 При раствор s2o2- + Н2О Триоксид серы, SO3 Сульфат, SO2- Гидросульфат, р/<2 = 1,9 Дитионат, ~Оз8—SO^- Политионат, “OgS—Sx—SO^" Диоксид серы, SO2 Сульфит, SO2- Бисульфит, -Н8Оз, или HOSOjT; р/<2 = 6,9 Дисульфит, -ОзЭ—SO^- 1 Дитионит, -O2S—SO^“ Тиосульфат, _S—80^ Сера, Sg или Sx Дисульфид, -S~S- Полисульфид, ~ S—Sx—S ~ Сульфид, S2- Гидросульфид, HS-; рК2 = 12 Сероводород, H2S; p/<i = 7 < < б, но известны соединения с х > 8. ении в воде гидролизуется: —» 2— HSO3
Способность к сульфатредукции обнаружена у
микроорганизмов четырех неродственных групп.
Наиболее крупная из них относится к 7-подгруп-
пе протеобактерий и включает роды Desulfovib-
rio, Desulfobulbus, Desulfomicrobium, Desulfobac-
ter, Desulfobacterium, Desulfosarcina, Desulfococ-
cus, Desulfonema и др. Три остальные группы
составляют: грамположительные бактерии ро-
да Desulfotomaculum (родственные клостридиям),
Таблица 12.4. Доноры электронов, используемые
сул ьфатредуктора м и
Субстраты, используемые всеми сульфэтредукторами Субстраты, используемые некоторыми сульфатре- дукторами
Молекулярный водород Формиат, ацетат Пропионат, жирные кислоты от бутирата (С4) до арахината (С2о) Лактат Фумарат Сукцинат Метанол Этанол, пропанол Аланин, глутамат Холин, глицерол Фруктоза Никотиновая кислота Индол У глеводороды (преимущественно С16, но нс СП4) Крахмал и пептиды (только Archaeoglobus) Бензоат, фенилацетат, фенол
грамотрицательныс бактерии рода Thermo desulf о-
bacterium (принадлежат к отдельной ветви бакте-
рий) и археи рода Archaeoglobus.
Механизм диссимиляционной сульфатредук-
цпи приведен па рис. 12.12. Весь процесс можно
разделить па два этапа: 1) эндергонические ре-
акции восстановления сульфата до сульфита, ка-
тализируемые водорастворимыми ферментами, и
2) экзергонические реакции восстановления суль-
фита до H2S, катализируемые, вероятно, мембра-
носвязанпыми ферментами. Поскольку восстанов-
ление сульфата до сульфита (Eq — —516 мВ) тре-
бует участия более сильного восстановителя, чем
Н2 (Е'с = —414 мВ), субстрат вначале активиру-
ется АТР с образованием аденозипфосфосульфа-
Рис. 12.12. Диссимиляционная сульфатредук-
ция. 1 — АТР-сульфурилаза; 2 — аденозилфос-
фосульфат-редуктаза (АФС-редуктаза); 3 —
сульфитредуктаза; 4—гидрогеназа или дегид-
рогеназа; 5 — гипотетическая Н+-переносящая
АТР-дифосфатаза.
Глава 12. Анаэробный энергетический метаболизм 365
та (АФС), редокс-потенциал которого значитель-
но выше (Eq = —60 мВ).
SO^~ + АТР4- + Н+
АТР-сульфурилаза
-> АФС2- + НР2О?_
ДС0' = +46 кДж/моль
(12.60)
АФС2-
АФС-редуктаза
+ 2Н--------------->
-> АМР2" + HSO3 + Н+ (12.61)
НР2О7- + АМР2” -> АТР + Н2О
(АТР-дифосфатаза,
использующая энергию Ддн+)
AG0/ — +35 кДж/моль (12.62)
Эндергоническую реакцию активации сульфа-
та [реакция (12.60)] стимулирует последующее
восстановление АФС2- с образованием сульфита
[реакция (12.61)], сдвигающее предыдущую реак-
цию в направлении образования АФС2-. Предпо-
лагается возможность синтеза АТР из АМР и бо-
гатого энергией дифосфата [реакция (12.62)], но
такая реакция до настоящего времени не обна-
ружена. Активация сульфата функционально по-
добна активации ацетата с образованием ацетил-
СоА, обнаруженной у некоторых эукариот и архей
[реакция (12.54)]. Двухэлектронное восстановле-
ние АФС с образованием сульфита осуществля-
ет флавопротеин, содержащий [Fe-S] -кластеры.
Этот механизм (диссимиляционное восстанов-
ление АФС) отличается от ассимиляцион-
ной сульфатредукции, осуществляемой многи-
ми организмами, например растениями, которые
используют сульфат исключительно как источ-
ник серы (см. гл. 8). Восстановитель, использу-
емый в АФС-редуктазной реакции, неизвестен.
У сульфатредуцирующих организмов обна-
ружено четыре типа сульфитрсдуктаз: десул ь-
фовиридин, десульфоруберин, десульфофусцидин
и фермент Р-582 (сходный с цитохромом Р).
Все они содержат сирогем (рис. 12.7, В) и
[4Fe—4Б]-кластеры, но различаются своими спек-
тральными характеристиками, что отражено в
их названиях (лат. viridis — зеленый, rubrum —
красный, fuscus — темно-коричневый). Промежу-
точными продуктами в процессе шсстиэлектроп-
ного восстановления сульфита являются, возмож-
но, тритионат (-O3SSSO3 ) и тиосульфат (SSO3 )
[реакция (12.63)].
На первом этапе восстановления в реакции
участвуют три сульфит-иона, из которых один
восстанавливается до [S2+], соединенного с двумя
сульфитными группами. Последующее двухэлек-
тронное восстановление этого атома серы до [S0]
приводит к образованию тиосульфата, который
далее восстанавливается до сероводорода. На эта-
пах 2 и 3 происходит регенерация сульфитных
групп — носителей. Внутриклеточные восстанови-
тели, используемые в этих реакциях, пока неиз-
вестны.
Способ запасания энергии, используемый
сульфатредукторами, также остается неизвест-
ным. Установлено, что активация сульфата требу-
ет расхода 1 моль ATP/моль SO2-; следователь-
но, в процессе восстановления сульфита до H2S
должно образовываться более 1 моль АТР/моль
SO2-. Учитывая наличие у сульфатредукторов
цитохромов и менахинонов, можно предполагать,
что восстановление сульфита сопряжено с синте-
зом АТР через протонную помпу — мембрапосвя-
занные белковые комплексы, подобные митохон-
дриальным комплексам I, III и IV и FiFq-ATP-
синтазе.
Сульфатредукторы могут различаться
по углеродному метаболизму □ Еще в 1886 г.
Хоппе-Зейлер продемонстрировал, что анаэроб-
ные накопительные культуры, полученные путем
внесения ила в среду, содержащую гипс (CaSO.;),
способны полностью окислять целлюлозу, образуя
при этом H2S. Тем не менее до конца 1970-х гг.
считалось, что сульфатредукторы окисляют орга-
нические соединения только до ацетата, как, на-
пример, в случае Desulfovibrio vulgaris, растущего
1) 3HSO3 + 2е“ + ЗН+ -O3S-S-SO3 + ЗН2О
2) -O3S-S-SO3 + 2е“ + Н+ -+ “S-SO3 + HSO3
3) -S-SO3 + 2е" + ЗН+ -> HSO3 + H2S
Баланс:
, Сульфитредуктаза
HSO3 + 6е“ + 7Н ..................... > H2S + 3 Н2О
(12.63)
366 Часть III. Многообразие метаболических путей
с использованием лактата:
2 Лактат- 4- SO2- 4- 2 Н+ —»
2 Ацетат- + 2 СО2 4- H2S 4- 2 Н2О
AG0/ = —160 кДж/моль (12.64)
К концу 1980-х гг. уже было описано боль-
шое число сульфатредукторов, способных окис-
лять органические субстраты до СО2. По-види-
мому, такой способностью обладает большинство
сульфатредукторов; остальные названы «непол-
ными окислителями». Эти последние растут со
значительно большей скоростью и соответствен-
но выделяются легче, чем те сульфатредукторы,
которые окисляют субстраты полностью. Мик-
роорганизмы, осуществляющие полное окисле-
ние органических субстратов, распадаются на две
группы: одни из них обладают модифицирован-
ным циклом Кребса (см. ниже), другие —обра-
щенным путем ацетогенеза с участием СО-дегид-
рогеназы (ацетил-СоА-синтазы; рис. 12.8). Род
Archaeoglobus относится ко второй группе, по у
его представителей функционирует характерный
для архей вариант этого пути, в котором вместо
тетрагидрофолата (см. гл. 9) участвует тетрагид-
рометаноптерип (рис. 12.10).
У Desulfurella acetivorans окисление ацетата
происходит через цикл Кребса, функциониру-
ющий так же, как в митохондриях. Бактерии
родов Desulfobacter и Desulfuromonas содержат
вместо сукцинат-тиокипазы сукцинил-СоА:аце-
тат-СоА-трансферазу [реакция (12.65)]. Таким об-
разом, ацетат активируется у них с образовани-
ем ацетил-СоА непосредственно с помощью сук-
цинил-СоА, без участия АТР.
У большинства сульфатредукторов имеется
обычная для цикла трикарбоновых кислот цит-
ратсинтаза [реакция (12.66)]. Исключение состав-
ляют виды Desulfobacter, содержащие АТР-зави-
симую цитрат-лиазу [реакция (12.67)]. В реакции,
катализируемой этим ферментом, синтезируется
одна молекула АТР.
Сульфатредукторы и метаногены кон-
курируют в природе за Н2 и другие субстра-
ты. Обычно сульфатредукторы присутствуют в
морских донных осадках, тогда как метаноге-
ны—в донных осадках пресноводных водоемов,
в почве рисовников и в рубце крупного рогато-
го скота. Такие особенности распределения отра-
жают различия в концентрации сульфата — высо-
кой (28 мМ) в морской воде и низкой (пример-
но 0,2 мМ) в прудах и озерах, а также связаны
с тем, что сульфат в высокой концентрации по-
давляет образование метана. Поскольку при вос-
становлении сульфата изменение свободной энер-
гии [AG0/ = —152 кДж/моль сульфата; реакция
(12.58)] больше, чем при метаногенезе [AG0/ =
—131 кДж/моль СЩ; реакция (12.44)], сульфат-
редукторы способны расти при более низких кон-
центрациях водорода [см. пояснение к реакции
(12.39)]. Помимо того, они способны использовать
более широкий набор органических субстратов.
Благодаря всем этим свойствам сульфатредукто-
ры обладают преимуществом в конкуренции с ме-
таногенами. Хотя и сульфатредукция, и метано-
генез чрезвычайно чувствительны к кислороду,
микроорганизмы, осуществляющие эти процессы,
выживают в аэробных условиях. Некоторые суль-
фатрсдукторы обладают даже терминальной ци-
тохромоксидазой и способны использовать моле-
кулярный кислород в качестве акцептора электро-
нов для дыхания.
Сульфатредукция — это обратимый про-
цесс, т. е. сульфатредуцирующие организмы осу-
ществляют также реакции диспропорционирова-
ния промежуточных соединений этого процесса
с образованием сульфата и H2S. Термодинами-
ческие расчеты показывают, что изменение сво-
„ . — * — Сукцинил-СоА-трансфераза 9— * „ *
Сукцинил-СоА + Ацетат - - - - Сукцинат" 4- Ацетил-СоА
AG0/ ~ 0 кДж/моль (12.65)
АТР-цптратсинтаза „
Ацетил-СоА 4- Оксалоацетат + Н2О------------------> Цитрат3 + CoASH 4- Н+
AG0/ = —33 кДж/моль (12.66)
Ацетил-СоА + Оксалоацетат2- + ADP3- 4- НРО^- ?— - =—— —- Цитрат3- 4- CoASH 4- АТР4-
AG0/ « 0 кДж/моль (12.67)
Глава 12. Анаэробный энергетический метаболизм 367
бодпой энергии в реакциях диспропорционирова-
ния сульфита и тиосульфата [реакции (12.68) и
(12.69)] составляет отрицательную величину и,
следовательно, они могут вносить вклад в запа-
сание энергии.
s2ol- + н2о -> so^- + HS- + Н+
AG'0/ = — 22 кДж/моль тиосульфата (12.68)
4SO| + Н+ -> 3SO^- + HS-
AG0/ — —59 кДж/моль сульфита (12.69)
Недавно была выделена сульфатредуцирую-
щая бактерия Thiocap sa thiozymogenes, способная
расти с использованием тиосульфата или сульфи-
та в качестве единственного источника энергии.
Кроме того, она осуществляет реакцию диспро-
порционирования молекулярной серы с образова-
нием сульфида и сульфата [реакция (12.70)], но в
силу термодинамических характеристик (AG'0/ >
0) эта реакция не поддерживает рост данного мик-
роорганизма.
4S0 + 4Н2О -> SO^~ + 3HS- + 5Н
AG0' = +10 кДж/моль S0 (12.70)
Та же бактерия способна с невысокой скоростью
расти в присутствии гидроксида железа, восста-
навливая его до сульфида с регенерацией молеку-
лярной серы [реакция (12.71)].
3HS- + 2FeOOH + ЗН+ -> S° + 2FeS + 4Н2О
AG0' = -144 кДж/моль S0 (12.71)
В результате реакций (12.70) и (12.71) происходит
полное окисление молекулярной серы, которое
можно назвать неорганическим брожением
[реакция (12.72)]
3S° + 2FeOOH -> SO^- + 2FeS + 2Н+
AG0/ = -34 кДж/моль S° (12.72)
Процесс диссимиляционной сульфатре-
дукции включает два этапа — энергозависимую
эндергоническую активацию сульфата и восста-
новление его до сульфита с последующим экзерго-
ническим восстановлением до сероводорода, при
котором энергия запасается в форме электрохи-
мического протонного потенциала. В отличие от
метаногенов, использующих только Ci-соедипе-
ния и ацетат, сульфатредукторы в качестве доно-
ров электрона могут использовать Н2 и разнооб-
разные органические субстраты, различаясь при
этом по конечным продуктам их окисления. Од-
ни сульфатредукторы окисляют органиче-
ские соединения полностью, до СО2, другие
не полностью — только до ацетата. Полное окис-
ление органических субстратов происходит либо
в реакциях модифицированного цикла трикарбо-
новых кислот, либо, в большинстве случаев, в
реакциях, обратных ацетогепезу. У сульфатрс-
дуцирующих архей (Archaeoglobus), в противопо-
ложность бактериям, в полном окислении органи-
ческих соединений участвуют некоторые кофер-
менты метаногенеза.
12.1.9. Получение энергии в процессе
восстановительного дехлорирования
Сульфатредуцирующая бактерия Desulfomonile
tiedjei способна использовать в качестве акцеп-
тора электронов 3-хлорбензойпую кислоту и род-
ственные .меттш-хлорароматические соединения
(рис. 12.13) с восстановлением хлорбензоата до
бензойной кислоты [реакция (12.73)]. Эта реак-
ция сопряжена с окислением формиата [реакция
(12.74)] или молекулярного водорода (гидрогена-
за), при котором запасается энергия путем обра-
зования электрохимического протонного потенци-
ала. В реакции дегалогенирования участвуют те
же переносчики электронов, которые опосредуют
восстановление сульфита до сероводорода.
Как установлено недавно, бактерия Dehalo-
spirillum multivorans (е-подгруппа протеобакте-
рий) способна расти с использованием водоро-
да и промышленного растворителя тетрахлорэте-
на (перхлорэтен, ПХЭ) как акцептора электронов
{реакция (12.75)], образуя в качестве конечного
продукта цг/с-дихлорэтен (ДХЭ) и промежуточ-
ного— трихлорэтеп (ТХЭ) (рис. 12.13). В клет-
ках D. multivorans выявлены ферменты, участ-
вующие в данном процессе, — гидрогеназа (см.
дополнение 12.4) и ПХЭ/ТХЭ-дегалогеназа [реак-
ция (12.75)]. Дегалогеназа содержит коррипоиды
(производные витамина Bi2) и, вероятно, два раз-
личных [4Fe—48]-кластера.
368 Часть III. Многообразие метаболических путей
З-Хлорбензоат- дегалогеназа
З-Хлорбензоат- -Ь 2е- + Н+-------------------------> Бензоат 4- С1 (12.73)
Формиатдегидрогеназа
Формиат ----------------------> СО2 + 2е + Н+ (12.74)
Перхлорэтен + 2Н2 —> цг^с-Дихлорэтен + 2Н+ + 2С1- AG,0/ = —376 кДж/2 моль С1“ (12.75)
Рис. 12.13. Субстраты восстановительного дехлориро-
вания.
Некоторые анаэробные бактерии способны вос-
станавливать связь С—С1 с образованием связи
С—Н, запасая при этом энергию в форме электро-
химического протонного потенциала. Механизм
этого процесса, называемого восстановитель-
ным дехлорированием, пока не установлен.
12.1.10. Выбор акцептора электронов чаще всего
зависит от его редокс-потенциала
В природных средах обычно одновременно при-
сутствуют различные акцепторы электронов, и
в связи с этим возникает вопрос, одновременно
или последовательно используют их микроорга-
низмы. Для растущих микробных клеток более
экономично синтезировать компоненты одной
электронтранспортной цепи, чем одновременно
компоненты нескольких цепей. В донных осад-
ках всегда наблюдается использование акцепто-
ров электронов в порядке, соответствующем энер-
гетическому выходу, который они дают. В первую
очередь используются окислители, присутствую-
щие в высокой концентрации и имеющие наибо-
лее высокий окислительно-восстановительный по-
тенциал. Соответственно этому факультативные
анаэробы «предпочитают» О2 другим акцепторам
электронов. Только после исчерпания кислорода
они используют последовательно нитрат, Fe(III),
фумарат, триметиламин-TV-оксид и диметилсуль-
фоксид. Соединения с еще более низким редокс-
потенциалом, такие как диоксид углерода и суль-
фат, потребляют в качестве акцепторов электро-
нов лишь строгие анаэробы, обычно не способные
к использованию кислорода. Исключение состав-
ляют представители Wolinella, предпочитающие в
присутствии нитрата и серы использовать серу,
имеющую наиболее низкий окислительно-восста-
новительный потенциал (см. табл. 4.1). Последо-
вательность использования различных акцепто-
ров электронов у каждого организма генетически
детерминирована и контролируется сложными ре-
гуляторными механизмами. Вероятно, она опре-
деляется влиянием нс только термодинамических,
но также кинетических и экологических факто-
ров. Исчерпав все акцепторы электронов, микро-
организмы переключаются на брожение.
Факультативные анаэробы обычно использу-
ют при дыхании акцепторы электронов в поряд-
ке убывания их окислительно-восстановительного
потенциала, т. е. в первую очередь потребляют со-
единения с более высоким потенциалом. Строгие
анаэробы обычно используют только акцепторы с
низким редокс-потенциалом.
12.2. Брожение — это анаэробный окислительно-восстановительный процесс
Многие анаэробные бактерии способны расти в
отсутствие неорганических акцепторов электро-
нов, используя в качестве источника энергии ор-
ганические соединения. Такие бактерии обнару-
живаются везде, где происходит анаэробное раз-
ложение органического материала: в почве, мор-
ских и пресноводных донных осадках, в актив-
ном иле, а также в пищеварительном тракте и
Глава 12. Анаэробный энергетический метаболизм 369
других анаэробных участках организма живот-
ных и человека. Энергетический метаболизм (ка-
таболизм), осуществляемый в анаэробных услови-
ях, без участия неорганических акцепторов элек-
тронов, называют брожением.
По механизму брожение представляет со-
бой анаэробный окислительно-восстановительный
процесс, в котором АТР синтезируется путем суб-
стратного фосфорилирования, сопряженного с ре-
акциями окисления субстратов (окислительная
ветвь метаболизма). Перенос электронов на ак-
цепторы (восстановительная ветвь метаболизма),
как правило, не сопряжен с запасанием энергии
(рис. 12.14). Доноры и акцепторы электронов об-
разуются при этом в процессе катаболизирования
органических субстратов, имеющих среднюю сте-
пень окисления, таких как сахара, органические
кислоты, аминокислоты и гетероциклические со-
единения. Высокоокислснные соединения (напри-
мер, диоксид углерода) и высоко восстановленные
соединения (например, углеводороды и жирные
кислоты) не служат субстратами брожения, но
используются в анаэробных условиях в процес-
се анаэробного дыхания с участием неорганиче-
ских допоров электронов (например, молекуляр-
ного водорода) или акцепторов электронов (на-
пример, нитрата, сульфата или диоксида углеро-
да; см. разд. 12.1).
Если при дыхании органические субстраты
разлагаются в большинстве случаев до воды и
СО2, то продуктами брожения могут быть раз-
нообразные органические соединения (некоторые
из них приведены в табл. 12.5). В связи с этим
при анализе процессов брожения может возникать
необходимость в проверке того, все ли продук-
ты выявлены. С этой целью определяют два па-
раметра— регенерацию углерода и окислительно-
восстановительный баланс. Их значения должны
быть равны 100% и 1,0 соответственно. Послед-
нее значение получают путем деления количества
(моль) окисленных соединений (продукты минус
субстраты) на количество восстановленных соеди-
нений (продукты минус субстраты; см. табл. 12.5).
В большинстве типов брожения субстрат одно-
временно служит и донором, и акцептором элек-
тронов. Только при сопряженном сбраживании
некоторых аминокислот субстратами брожения
выступают две разные аминокислоты, одна в роли
донора (Si), другая в роли акцептора электронов
(S2) (реакция Стикланда; рис. 12.14, А; см. также
рис. 12.31). При сбраживании одного субстрата за
Рис. 12.14. Механизмы брожения. S — субстрат; Р —
продукты; X и У — промежуточные соединения; п — чис-
ло электронов (е~), переносимых из окислительной вет-
ви в восстановительную ветвь пути.
А. Путь сбраживания двух субстратов (реакция Стик-
ланда): Si — аланин; S2 — 2 молекулы глицина; п = 4;
Pi—ацетат, СО2 и аммиак; Р2 — 2 молекулы ацетата и
2 молекулы аммиака.
Б. Прямой путь сбраживания одного субстрата (гомо-
ферментативное молочнокислое брожение): S — глюко-
за; X — 2 молекулы пирувата; п = 4 (2 NADH); Р —
2 молекулы лактата (см. рис. 12.18).
В. Разветвленный путь сбраживания одного субстрата
(глутаматное брожение): S — глутамат; Y — кротонил-
СоА; п 2; Pi — С02 и аммиак, Р2 — ацетат; Р3— бу-
тират и Н2.
стадией его окисления следует этап восстановле-
ния (рис. 12.14, Б) либо происходит образование
промежуточного соединения (пирувата, ацетил-
СоА или кротонил-СоА), после чего путь разветв-
ляется на два направления, в одном из которых
этот интермедиат окисляется, в другом восста-
навливается (рис. 12.14, В). Иногда такие окис-
лительно-восстановительные реакции протекают
внутри одной молекулы, как в случае ксилулозо-
5-фосфата (рис. 12.16; фосфокетолазный путь).
При этом окислительная ветвь или этап обеспе-
чивает превращение субстрата или интермедиата
в богатый энергией органический фосфат, способ-
ный фосфорилировать ADP. Восстановительная
ветвь или этап служит только для стока электро-
нов, поскольку реакции восстановления не сопря-
жены с субстратным фосфорилированием. Важ-
ное исключение составляют некоторые к л остри-
370 Часть III. Многообразие метаболических путей
Таблица 12.5. Расчет углеродного и окислительно/восстановительного баланса при брожении смешанного типа
(сбраживание глюкозы) для Escherichia coli (механизм данного типа брожения см. на рис. 12.22)
Субстрат/п родукты моль Суммарная формула Углерод, моль Степень окисления Количество восста- новленных соединений (—), моль Количество окислен- ных соединений (+), моль
Глюкоза 100 С6Н12О6 600 ±0 0 0
2,3-Бутандиол Ацетоин Глицерол Этанол Муравьиная кислота Уксусная кислота Молочная кислота Янтарная кислота СО2 н2 0,3 0,06 1,4 50,0 2,4 36,5 79,5 10,7 88,0 75,0 С4Н10О2 C4HgO2 СзНйОз С2НсО СН2О2 С2Н4О2 Сз11бО2 с4н6о2 со2 Н2 1,2 0,2 4,2 100,0 2.4 73,0 238,5 42,8 88,0 0 -6 —4 -2 -4 +2 0 0 +2 +4 —2 -1,8 -0,2 -2,8 -200,0 0 0 -150.0 +4,8 +21,4 +352,0
Сумма(Е) 550,3 -354,8 +378,2
Степень окисления рассчитана по составу веществ, исходя из того что у отдельных элементов она следующая: С = 0; Н = —1; 0 = +2; N = +3; S = +2. Количество восстановленных или окисленных соединений рассчитано как произведение степени окисления и количества субстрата либо продукта.
Углеродный баланс = $2 восст.(продукты — С} L. ^продукты брожения 550,3 100 = 91,7 600 окисл.(продукты — субс
52 ^-субстр /бстрат) = ат брожения - 354,8; грат) = 378,2
Окислит ельно/восстановительный (О/В) баланс — £ОКИСЛ-(ПРОАУКТЬ —субстрат) 378,2 л
52 восст.(продукты е- \ л 1,07 — субстрат) 354,8
дин и родственные грамположительныс бактерии,
способные восстанавливать глицин с образовани-
ем ацетилфосфата (рис. 12.32), который далее
используется для фосфорилирования ADP. Это
единственный пример сопряжения реакций вос-
становления с субстратным фосфорилированием.
Продукты брожения включают диок-
сид углерода, молекулярный водород, формиат,
ацетат и другие короткоцепочечные жирные кис-
лоты. При сбраживании аминокислот допол-
нительно образуются аммиак, сероводород, ме-
тилмеркаптан, а также разветвленные жирные
кислоты и ароматические кислоты. Полная анаэ-
робная трансформация этих продуктов до СОг и
метана происходит только при участии консорций
синтрофных бактерий (см. разд. 12.2.5), включа-
ющих ацстогены (см. разд. 12.1.6) и метаногены
(см. разд. 12.1.7).
Образование молекулярного водорода
требует особого рассмотрения, поскольку оно про-
исходит не в соответствии с изложенными вы-
ше механизмами. Щ образуется в результате
восстановления протона гидрид-ионом или вос-
становления двух протонов двумя электронами,
катализируемого гидрогеназой. Таким образом,
функцию акцептора электронов выполняет здесь
протон вместо органического субстрата, исполь-
зуемого в процессе брожения. При этом сбражи-
ваемое органическое соединение расходуется бо-
лее экономно, что увеличивает выход АТР в рас-
чете на моль потребленного субстрата. Однако
удаление восстановительных эквивалентов, таких
как Hq (Е'о = —420 мВ), термодинамически менее
выгодно, чем восстановление большинства суб-
стратов, имеющих более высокий окислительно-
восстановительный потенциал. Многие бродиль-
тцики, по-видимому, выделяют водород в количе-
стве, которое обусловлено термодинамически, и
этим обеспечивается оптимизация роста.
Неясным остается вопрос о том, какое коли-
чество АТР запасается при сбраживании 1 моль
субстрата. Приблизительно эту величину можно
оценить по изменению свободной энергии (AGf/)
в процессе брожения в целом. Поскольку этот
Глава 12. Анаэробный энергетический метаболизм 371
процесс необратим, на синтез 1 моль АТР долж-
но расходоваться не менее 70-80 кДж (для усло-
вий равновесия эта величина оценивается как
40-50 кДж/моль). Во многих случаях максималь-
ное количество АТР можно рассчитать, просто
разделив AG" на —80 кДж, хотя ошибка при та-
ком расчете может быть значительной, поскольку
из практических соображений AG7 обычно при-
равнивают к AG0/. Кроме того, иногда синтез
АТР невозможен по той или иной причине, да-
же если величина AG0/ реакции значительно ни-
же —80 кДж/моль.
Строгой номенклатуры типов брожения
не разработано. Как правило, их называют в со-
ответствии с метаболизируемым субстратом или
продуктами брожения в зависимости от того, что
более характерно для данного процесса. Напри-
мер, сбраживание глюкозы до лактата молочно-
кислыми бактериями в соответствии с продук-
том брожения называют молочнокислым броже-
нием, разложение глюкозы до бутанола и ацетата
Clostridium acetobutyricum — ацетоно-бутиловым
брожением, сбраживание глюкозы до этанола и
СО2 дрожжами и Zymomonas— спиртовым бро-
жением. Сбраживание аминокислот с образова-
нием аммиака, СО2, короткоцепочечных жирных
кислот и молекулярного водорода называют в
соответствии с используемым субстратом, а не
продуктами. Например, сбраживание глицина с
образованием ацетата и аммиака называют гли-
циновым брожением, сбраживание глутамата с
образованием аммиака, СО2, ацетата, бутирата
и Н2 — глутаматным брожением. Иногда послед-
ний процесс по его основному продукту называют
маслянокислым брожением. Термин «аминокис-
лотное брожение» часто неверно используют для
общего описания биотехнологических процессов
анаэробного разложения сахаров с целью полу-
чения некоторых аминокислот. Например, терми-
ном аминокислотное брожение называют частич-
ное окисление глюкозы до глутамата, осуществ-
ляемое Corynebacterium glutamicum.
Брожение —это анаэробный окислительно-
восстановительный процесс, в котором образо-
вание АТР происходит путем субстратного фос-
форилирования. сопряженного с окислением суб-
страта (окислительная ветвь метаболизма), тогда
как перенос электронов на молекулу акцептора
(восстановительная ветвь метаболизма), как пра-
вило, не сопряжен с запасанием энергии. Доно-
ры и акцепторы электронов при брожении об-
разуются из органических субстратов со сред-
ней степенью окисления, таких как сахара, ор-
ганические кислоты, аминокислоты и гетероцик-
лические соединения, в процессе их сбраживания
до СО2, молекулярного водорода, формиата, аце-
тата и других короткоцепочечных жирных кис-
лот. При сбраживании аминокислот образуются
аммиак, сероводород, метилмеркаптап, разветв-
ленные жирные кислоты и ароматические кис-
лоты. Дальнейшие превращения этих продуктов
могут происходить в процессе дыхания. Количе-
ство синтезированного АТР (моль/моль субстра-
та) можно примерно оценить, разделив величи-
ну AG" (кДж), суммарную для данного процесса
брожения, на —80 кДж.
12.2.1. Известны четыре пути анаэробного
разложения фосфосахаров
Субстратами брожения чаще всего служат гексо-
зы и пентозы. Кроме того, микробы-бродилыцики
способны сбраживать продукты их разложе-
ния — сахарные кислоты, глицерол, цитрат,
малат, сукцинат, пируват, лактат, этанол и аце-
тат. У бактерий расщеплению гексоз и пентоз
предшествует их фосфорилирование. Некоторые
виды архей, как было установлено недавно, раз-
лагают сахара без их предварительного фосфори-
лирования. Существует по меньшей мере четыре
пути превращения фосфосахаров в пируват или
пируват плюс ацетилфосфат, в которых участ-
вуют характерные для каждого пути ферменты:
1) фруктозобисфосфат-альдолаза (путь Эмбдена-
Мейергофа и его вариант у архей), 2) 2-дегидро-
З-дезокси-6-фосфоглюкопат-альдолаза (КДФГ-
альдолаза; путь Энтнера-Дудорова), 3) ксилуло-
зо-5-фосфат-фосфокетолаза (фосфокетолазный
путь) и 4) трансальдолаза, и кетолаза (путь, обна-
руженный у Bifidobacterium bifidum). Продуктом
первых двух путей с участием ключевого фермен-
та альдолазы является пируват (см. рис. 9.21); в
фосфокетолазном пути образуется, помимо пиру-
вата, ацетилфосфат. Термин ключевой фермент
применяется для специфического фермента дан-
ного пути.
Путь Эмбдена-Мейергофа составляет
окислительную ветвь метаболизма □ Этот
путь выполняет важную роль в метаболизме жи-
вотных и растительных клеток, грибов, в том
372 Часть III. Многообразие метаболических путей
числе дрожжей, и многих бактерий, таких как
Escherichia coli, клостридии и гомофермептатив-
ные молочнокислые бактерии. Он описан в гл. 3.
Термин «путь Эмбдена-Мейергофа» применяют
только к окислительной части гликолиза,
называя им путь образования из 1 моль глюко-
зы 2 моль пирувата, сопряженный с синтезом
2 моль АТР из ADP и неорганического фосфата.
По этому пути метаболизируются также и дру-
гие гексозы. Последующее разложение пирувата,
который служит источником образования акцеп-
торов электронов для окисления образующегося
в этой части гликолиза NADH, у разных мик-
роорганизмов происходит различными путями.
Начальные стадии брожения — образование
глюкозо-6-фосфата и фруктозо-6-фосфата — так-
же варьируют у разных микроорганизмов в за-
висимости от способа фосфорилирования глю-
козы— с участием АТР или фосфоенолпирувата
(фосфотрапсферазная система; см. гл. 3) — или от
пути включения в процесс брожения других гек-
соз. У некоторых архей начальное фосфорилиро-
вание катализируют ADP-зависимые ферменты,
и при этом высвобождается АМР (см. гл. 9).
При разложении молекулы глюкозы по пу-
ти Энтнера-Дудорова образуется только од-
на молекула АТР, поэтому данный путь в
основном встречается у аэробных организмов
или у бактерий, способных осуществлять, по-
мимо брожения, анаэробное дыхание, сопряжен-
ное с элсктронтрапспортным фосфорилировани-
ем и тем самым обеспечивающее образование
дополнительного количества АТР. Разложение
глюкозы по этому пути обнаружено только у
Zymomonas — бактерий, адаптированных к ро-
сту при высоких концентрациях сахаров. Кроме
того, но нему происходит сбраживание глюко-
пата у Escherichia coli. Реакции пути Энтнера-
Дудорова (рис. 12.15) включают фосфорилирова-
ние глюкозы с образованием глюкозо-6-фосфата,
последующее окисление его в NAD(P)+- или
NAD+-зависимой реакции до глюконо-1,5-лактон-
6-фосфата и гидролиз последнего с образо-
ванием 6-фосфоглюконата. В последних двух
Рис. 12.15. Путь Энтнера-Дудорова.
1 — глюкокиназа; 2 — глюкозо-б-фосфат-
дегидрогеназа; 3 — лактоназа; 4 — б-фос-
фоглюконатдегидратаза; 5 — 2-дегидро-З-
дезокси-б-фосфогл юконат-ал ьдолаза.
Глава 12. Анаэробный энергетический метаболизм 373
реакциях альдегид окисляет ся до карбоновой кис-
лоты, по, в противоположность 3-фосфоглице-
ральдегид-дегидрогеназной реакции, при этом нс
происходит образования высокоэнергетического
ацилфосфата, чем и объясняется более низкий
выход АТР в пути Энтнера-Дудорова. Эти два.
последовательных этапа катализируют ключевые
ферменты данного пути — фосфоглюконатдегид-
ратаза и 2-дегидро-3-дезокси-6-фосфоглюконат-
альдолаза. Дегидратация 6-фосфоглюконата по
С2- и СЗ-атомам приводит к образованию ено-
ла, который спонтанно и практически необратимо
таутомеризуется в 2-дегидро-3-дезокси-6-фосфо-
глюконат, называемый также 2-кето-З-дезокси-б-
фосфоглюкопатом (КДФГ). В последующей аль-
долазной реакции формируется шиффово основа-
ние между определенным остатком лизина в со-
ставе фермента и карбонильной группой субстра-
та, что облегчает расщепление связи между СЗ-
и С4-атомами, в результате которого образуются
пируват и глицеральдегид-3-фосфат.
В фосфокетолазном пути глюкозо-6-фос-
фат окисляется с образованием СО2 и пентозо-
5-фосфата, который при участии неорганическо-
го фосфата расщепляется па глицеральдегид-3-
фосфат и ацетилфосфат (см. также разд. 9.11.4).
Затем глицеральдегид-3-фосфат превращается в
пируват, как и в пути Эмбдена-Мейергофа. Пен-
тозы включаются в фосфокс голазный путь че-
рез реакцию прямого фосфорилирования без
предварительного окисления (рис. 12.16). Как
и в пути Энтнера-Дудорова или пентозофос-
фатном пути, глюкозо-6-фосфат окисляется до
6-фосфоглюконата. Вторая реакция окисления по
СЗ-атому происходит при участии ПАП+-зави-
симой дегидрогеназы и приводит к образованию
/3-оксокислоты, которая легко декарбоксилирует-
ся с образованием рибулозо-5-фосфата. Послед-
ний далее эпимеризуется по СЗ-атому в кси-
лулозо-5-фосфат. Следующий этап катализиру-
ет тиаминдифосфат-зависимая фосфокетолаза -
ключевой фермент данного пути (рис. 12.17).
Протон при С2,-атоме тиаминдифосфата легко
диссоциирует (рК ~ 18), и образовавшийся ани-
он атакует карбонильную группу ксилулозо-5-
фосфата. После протонирования возникший ком-
плекс расщепляется, в результате того что поло-
жительно заряженный атом азота притягивает к
себе электроны; происходит высвобождение гли-
цсральдегпд-3-фосфата (рис. 12.17). Второй про-
межуточный продукт дегидратируется; его после-
дующая таутомеризация приводит к образованию
ацетилтиамипдифосфата, который при участии
неорганического фосфата расщепляется с высво-
бождением ацетилфосфата; при этом кофермент
(простетическая группа) регенерирует.
Рис. 12.16. Фосфокетолазный путь. Механизм пре-
вращения глюкозы в б-фосфоглюконат представлен
на рис. 12.15. 1 — 6-фосфоглюконатдегидрогеназа
(декарбоксилирующая); 2 — рибозо-5-фосфат-изо-
мераза; 3 — ксилулозо-5-фосфат-эпимераза; 4 —
фосфокетолаза-2 (с тиаминдифосфатом в качестве
простетической группы).
374 Часть III. Многообразие метаболических путей
Рис. 12.17. Механизм действия транскетолазы
и фосфокетолазы-2. ТДФ — каталитическая часть
молекулы тиаминдифосфата; Фк — фосфокето-
лаза-2; Тк — транскетолаза. Ср. первый интерме-
диат с интермедиатом 2-дегидро-З-дезокси-б-фос-
фоглюконат-альдолазной реакции (рис. 12.15).
При брожении по пути, обнаруженному
у Bifidobacterium bifidum, расщепление и
окисление глюкозо-6-фосфата приводит в ито-
ге к образованию пирувата и ацетилфосфата
(2Се —* 2Сз 4- ЗС2) (рис. 12.18). Диоксид углеро-
да в реакциях данного пути не образуется. Внача-
ле происходит изомеризация 2 молекул глюкозо-6-
фосфата в 2 молекулы фруктозо-6-фосфата. Да-
лее одна молекула фруктозо-6-фосфата при уча-
стии неорганического фосфата расщепляется на
ацетилфосфат и эритрозо-4-фосфат, тогда как
вторая молекула фруктозо-6-фосфата вступает
в трансальдолазную реакцию (через образова-
ние шиффова основания или при участии иона
металла) с эритрозо-4-фосфатом. Продуктами
этой реакции являются глицеральдегид-3-фосфат
и седогептулозо-7-фосфат (Сб 4- С4 —> С3 4- С7).
В последующей транскетолазной реакции (с уча-
стием тиаминдифосфата в качеств/? промежу-
точного переносчика) оба продукта обменивают-
ся Сг-фрагментами, превращаясь в ксилулозо-
5-фосфат и рибозо-5-фосфат (Сз 4- С7 —» 2 С&).
Рибозо-5-фосфат изомеризуется в рибулозо-5-
фосфат, который через реакцию эпимеризации
при СЗ-атоме превращается в ксилулозо-5-фос-
|2 Глюкоза]
2 Фруктозо-
6-фосфат
Седогептулозо-
7-фосфат
г-ОН
г-ОН
-ОРО,
Ксилулозо- Рибозо-
5-фосфат 5-фосфат
Рибулозо-
5-фосфат
ПЭМ
2 З-Фосфоглицеральдегид
2 L-лактат 2 Ацетилфосфат -► 2 Ацетат
Рис. 12.18. Путь брожения у Bifidobacterium bifidum. 1 —
фосфокетолаза-1; 2 — трансальдолаза; 3 — транскето-
лаза; 4 — рибозо-5-фосфат-изомераза; 5 — рибулозо-5-
фосфат-эпимераза; б — фосфокетолаза-2. ПЭМ —путь
Эмбдена-Мейергофа. Ферменты, участвующие в пре-
вращениях глюкозы и ацетилфосфата, описаны выше.
Глава 12. Анаэробный энергетический метаболизм 375
фат. 13 завершение 2 молекулы ксилулозо-5-фос-
фата при участии неорганического фосфата рас-
щепляются на 2 молекулы ацетилфосфата и
2 молекулы глицеральдегид- 3-фосфата. Послед-
ние окисляются с образованием 2 молекул пиру-
вата. Для регенерации используемого в этой реак-
ции NAD+ пируват восстанавливается до лактата,
в лактатдегидрогеназной реакции. Суммарно про-
цесс этого брожения можно описать следующим
образом:
2Глюкоза —» 2L-лактат- + 2Ацетат- + 5Н+
Д<70/ = — 510 кДж/2 моль глюкозы
(102 кДж/моль АТР) (12.76)
Дополнение 12.5. Активность ферментов,
расщепляющих С—С-связь, соседнюю с кар-
бонильной группой (1,2-расщепление), таких
как фосфокетолаза, транскетолаза и пиру-
ватдекарбоксилаза, зависит от тиаминдифос-
фата. Альдолазы, расщепляющие углерод-
ную связь между С2- и СЗ-атомами, содержат
остаток лизина, который участвует в образо-
вании шиффова основания. После протони-
рования этот остаток притягивает электроны
сильнее, чем карбонильная группа. Для ана-
логичной активности альдолаз другой груп-
пы необходим ион металла, входящий в состав
кислоты Льюиса (Mg2+, Mn2+, Zn2+). Струк-
туры промежуточных соединений в реакциях
с образованием шиффова основания, катали-
зируемых кетолазой и альдолазой, практи-
чески идентичны (рис. 12.15 и 12.17; структу-
ры, выделенные полужирным шрифтом).
У микробов существует по меньшей мерс че-
тыре пути окисления фосфосахаров с образова-
нием пирувата или пирувата плюс ацетилфос-
фата. Ключевыми ферментами этих путей слу-
жат 1) фруктозо-1,6-альдолаза (путь Эмбдена-
Мейергофа и его модифицированный вари-
ант у архей), 2) 2-ксто-3-дезокси-6-фосфоглюко-
нат (КДФГ-альдолаза; путь Энтнера-Дудорова),
3) ксилулозо-5-фосфат-фосфокетолаза (фосфоке-
толазпый путь) и 4) трансальдолаза и кетолаза
(Bifidobacterium bifidum).
12.2.2. Пируват образуется как интермедиат
во многих процессах брожения
Как указано в предыдущем разделе, пируват об-
разуется в большинстве случаев в пируватки-
назной реакции — на последнем этапе пути Эмб-
дена-Мейергофа [реакция (12.77)]. Кроме того,
его образование происходит также во многих дру-
гих реакциях: 2-кего-3-дезоксиглюконат-6-фос-
фат-альдолазной реакции (12.78)], цитрат-лиаз-
ной реакции [расщепление цитрата на ацетат и
оксалоацетат, который декарбоксилируется далее
с образованием пирувата; реакция (12.79)] и при
расщеплении (8)-цитрамалата (2-метилмалат) и
(2/?..3|8)-2,3-диметилмалата па пируват и ацетат
[реакция (12.80)] либо пируват и пропионат со-
ответственно [реакция (12.81)]. Малик-фермент
катализирует КАГ)(Р)+-зависимос окислительное
декарбоксилирование малата с образованием пи-
рувата [реакция (12.82)]. При сбраживании ала-
нина (рис. 12.36) пируват образуется как про-
дукт аминотрансферазной реакции при участии
2-оксоглутарата [реакция (12.83)]. Реже встреча-
ется прямое окисление аланина в КАП+-зави-
симой аланиндегидрогеназной реакции [реакция
(12.84)]. Наконец, пируват может быть продуктом
реакций /З-элпмипирования серина и цистеина [ре-
акции (12.85) и (12.86)].
Фосфо е?шлпиру ват3 + Н+ + ADP3 —> Пируват + АТР4 (12.77)
(пируваткиназа; присутствует у многих организмов) ДС0/ = —31,4 кДж/моль
2-Кето-З-дезоксиглюконат-б-фосфат3- —> Пируват- + Глицеральдегид-З-фосфат2- (12.78)
(КДФГ-альдолаза; см. выше) AG0/ = +17 кДж/моль
Оксалоацетат2- + Н+ —> Пируват- + СОг (12.79)
(оксалоацетатдекарбоксилаза; присутствует у бактерий,
сбраживающих цитрат; рис. 12.27) AG07 = —31 кДж/моль
J76 Часть III. Многообразие метаболических путей
(5)-цитрамалат2 —» Пируват + Ацетат (12.80)
(цитрамалат-лиаза; присутствует у клостридий, сбраживающих глутамат
через образование 3-метиласпартата; рис. 12.37) AG0/ = +3,6 кДж/моль
(2Я,35')-2,3-диметилмалат2- —> Пируват- + Пропиопат- (12.81)
(диметилмалат-лиаза; обнаружена у Clostridium barkeri,
сбраживающего никотиновую кислоту; рис. 12.43) AG0/ = +1,8 кДж/моль
(5)-малат2- + NAD(P)+ -»• Пируват- + СО2 + NAD(P)H (12.82)
(малик-фермент; присутствует у многих микроорганизмов) AG0/ = — 3 кДж/моль
L-аланин + 2-Оксоглутарат2- —» Пируват- + L-глутамат- (12.83)
(аланинамипотрансфераза;
присутствует у многих микроорганизмов) AG0/ = +1 кДж/моль
L-аланин + NAD+ —> Пируват- + NHj + NADH + Н+ (12.84)
(аланип:ПАП+-оксидоредуктаза (дезаминирующая);
присутствует у некоторых видов Bacillus) AG0/ = +29 кДж/моль
L-серин или D-серин —> Пируват- + NH^ (12.85)
(L-серипдегидратаза; присутствует у многих микроорганизмов;
D-сериндегидратаза у Е. coli) AG0/ — —43 кДж/моль (необратимая реакция)
L-цистеин + Н2О —» H2S + Пируват- + NH+ (12.86)
(цистеиндесульфгидраза;
присутствует у многих микроорганизмов) AG0/ = —11 кДж/моль
Дальнейшие превращения пирувата включа-
ют реакции (12.87)-( 12.91).
Пируват- + NAD+ + CoASH -> Ацетил-SCoA + СО2 + NADH (12.87)
(пируватдегидрогеназа; присутствует почти у всех аэробных микроорганизмов)
AG0' = —40 кДж/моль (необратимая реакция)
Пируват- + 2 Ферредоксин + CoASH —» Ацетил-SCoA + 2 Ферредоксин-осс.г + СО2 + Н+ (12.88)
(пируват:ферредоксин-оксидоредуктаза, или пируватсиптаза;
распространена у архей, анаэробных грамположительных бактерий
и анаэробных одноклеточных эукариот-паразитов)
AG0/ = — 20 кДж/моль (обратимая реакция)
Пируват- + CoASH —> Ацетил-СоА + Формиат- (12.89)
(пируват:формиат-лиаза; присутствует у энтеробактерий, лактобацилл и
некоторых клостридий при росте в строго анаэробных условиях; рис. 12.24)
AG0/ = —17 кДж/моль (обратимая реакция)
Глава 12. Анаэробный энергетический метаболизм 377
Пируват 4- Н+ —> Ацетальдегид + СОг
(пируватдекарбоксилаза; Zymomonas и дрожжи)
А<70/ = —20 кДж/моль (обратимая реакция)
2 Пируват- + Н+ —» 2-Ацетолактат- + СО2
(2-ацетолактатсинтаза, присутствует у энтеробактерий, Bacillus
и всех микроорганизмов, способных синтезировать валин; см. ниже)
(12.90)
(12.91)
Гомоферментативные молочнокислые
бактерии образуют в качестве единственно-
го продукта сбраживания гексоз D- или L-лак-
тат. Брожение происходит но пути Эмбдена-
Мейергофа [реакция (12.92)]; образующийся
пируват восстанавливается до лактата NAD+-3a-
висимой лактатдегидрогеназой [реакция (12.93)].
При этом брожении на 1 моль глюкозы обра-
зуется 2 моль АТР (рис. 12.19) и высвобож-
дается энергия в количестве 99 кДж в расч< те
на 1 моль АТР. У Streptococcus возможно обра-
зование дополнительного количества АТР (до
2/3 моль на 1 моль глюкозы) благодаря выде-
Глюкоза —> 2 Лактат 4- 2 Н+ А<70/ = —198 кДж/моль глюкозы
лению лактата путем симпорта с Н+. Образую-
щийся протонный электрохимический потенци-
ал используется для синтеза АТР при участии
ATP-синтазы. Образование лактата как един-
ственного продукта брожения наблюдается толь-
ко при избытке субстрата (например, лактозы,
как в молоке). Когда концентрация гексоз стано-
вится фактором, лимитирующим рост, у некото-
рых видов Streptococcus и Lactobacillus направле-
ние метаболизма пирувата изменяется, что обес-
печивает увеличение выхода АТР. При участии
пируват:формиат-лиазы пируват расщепляется
на ацетил-СоА и формиат [реакция (12.89)].
(12.92)
Пируват 4- NADH 4- Н+ —> D- или L-лактат 4- NAD+
(12.93)
(D- или L-лактатдегидрогеназа) AG0/ = —32 кДж/моль
Рис. 12.19. Гомоферментативное молочнокислое
брожение. 1 —путь Эмбдена-Мейергофа; 2 — D- или
L-лактатдегидрогеназа; 3 — пируват:формиат-лиаза;
4 — ацетал ьдегидегидрогеназа (CoASH-ацетил ирую-
щая): 5 — алкогольдегидрогеназа; б — фосфат-ацетил-
трансфераза, называемая также фосфотрансацетила-
зой; 7 — ацетаткиназа. У Escherichia coli активности
ферментов 4 и 5, а также инактивазы пируват:фор-
миат-лиазы (рис. 12.24) осуществляет один белок —
AdhE.
378 Часть III. Многообразие метаболических путей
Ацетил-СоА используется далее в качестве ак-
цептора электронов и восстанавливается (2 моль
NADH/моль ацетата) до ацетальдегида и затем
до этанола [(12.94) и (12.95)]. Превращения дру-
гих молекул ацетил-СоА служат источником син-
теза третьей (в расчете на исходную молекулу
глюкозы) молекулы АТР путем субстратного
фосфорилирования [реакции (12.41) и (12.42)].
Суммарный баланс гомофермептативного мо-
лочнокислого брожения представлен уравнением
(12.96).
зависимую реакцию декарбоксилирования пи-
рувата [реакция (12.90)]. Продукт реакции —
ацетальдегид — восстанавливается до этанола
[реакция (12.95)]. Суммарное уравнение спирто-
вого брожения записывается следующим образом:
Глюкоза —> 2СО-2 + 2 Этанол
ДС0/ = —236 кДж/моль глюкозы (12.98)
Таким образом, ацетальдегид может образовы-
ваться двумя путями: в результате 1) восстанов-
Ацетил-СоА 4- NADH 4- Н+ —> Ацетальдегид 4- NAD+ + CoASH (12.94)
(ацетальдегиддегидрогеназа, ацетилирующая CoASH)
Ацетальдегид 4- NADH + Н+ —> Этанол 4- NAD+ (12.95)
(алкогольдегидрогепаза)
Баланс : Глюкоза + ЩО —» Ацетат + 2 Формиат + Этанол 4- 3 Н+ (12.96)
ДС0/ = —219 кДж/моль
Продуктами гетероферментативного мо-
лочнокислого брожения являются лактат, ССЬ
и этанол либо ацетат. По этому пути гексозы
окисляются до пеитозо-5-фосфатов, пентозы
включаются в процесс без предварительного окис-
ления. Все сахара превращаются в ксилулозо-5-
фосфат, расщепляемый затем на пируват и аце-
тил фосфат. Если субстратом служит гексоза,
избыток NADH расходуется на восстановление
ацетилфосфата через ацетил-СоА до этанола [ре-
акции (12.94) и (12.95)]. Таким образом, при ис-
пользовании в качестве субстратов брожения пен-
тоз выход АТР выше (рис. 12.20). Гетерофермен-
тативные молочнокислые бактерии, растущие с
использованием гексоз, легко идентифицировать
по образованию ими СО2, который интенсивно
выделяется в виде пузырьков, поскольку реакция
среды кислая [реакция (12.97а)].
Глюкоза —> СОг 4- Лактат- 4- Н+ 4- Этанол
ДС0/ = -211 кДж/моль (1 АТР) (12.97а)
Рибоза —> Лактат- 4- Ацетат- 4- 2 Н+
ДС0/ = -210 кДж/моль (2 АТР) (12.976)
Спиртовое брожение без образования кис-
лот [реакция (12.98)] включает тиаминдифосфат-
ления ацетил-СоА, как показано выше (молочно-
кислые бактерии, клостридии и энтеробактерии)
или 2) декарбоксилирования пирувата (дрож-
жи и Zymomonas). Пируват образуется у дрож-
жей Saccharomyces cerevisiae по пути Эмбдена-
Мейергофа (2 АТР), у Zymomonas — по пути
Энтнера-Дудорова (1 АТР). В последнем случаев
Рис. 12.20. Гетероферментативное молочнокислое бро-
жение 1 — фосфокетолаза-2 (см. рис. 12.16 и 12.17).
Ферменты других путей, участвующие в этом брожении,
указаны на рис. 12.18 и 12.21 и в тексте.
Глава 12. Анаэробный энергетический метаболизм 379
результате низкого выхода АТР образуется мень-
шее количество биомассы, что делает Zymomonas
перспективным объектом в качестве продуцен-
та этанола (поскольку в промышленном процессе
биомассу необходимо удалять).
Масляную кислоту образуют при бро-
жении Clostridium pasteurianum (кластер
1 клостридий) и некоторые другие клостри-
дии. Брожение происходит по пути Эмбдена-
Мейергофа, продукт которого, пируват, окисля-
ется до ацетил-СоА и СОг пируват:ферредоксин-
оксидорсдуктазой. Ферредоксин имеет низкий
окислительно-восстановительный потенциал
(Eq— — 420 мВ) и поэтому способен восстанав-
ливать протоны с образованием молекулярного
водорода. Ацетил-СоА служит акцептором элек-
тронов для окисления NADH как продукта пу-
ти Эмбдена-Мейергофа. Продукт восстановления
ацетил-СоА — бутирил-СоА — подвергается фос-
форилированию или отщеплению СоА-группы с
последующим образованием бутирата или аце-
тата соответственно в реакциях, сопряженных с
субстратным фосфорилированием. В итоге сбра-
живание глюкозы с образованием бутирата обес-
печивает синтез 3 моль АТР па моль глюкозы
[реакция (12.99); рис. 12.21].
Глюкоза —> 2СО2 + 2Н2 + Бутират- + Н+
ДС0/ = —255 кДж/моль глюкозы
(85 кДж/моль АТР) (12.97)
Рис. 12.21. Сбраживание глюкозы клостри-
диями. До пирувата глюкоза разлагается
по пути Эмбдена-Мейергофа. 1 — пиру-
ват:ферредоксин-оксидоредуктаза (другое
название — пируватсинтаза); 2 — ацетил-
СоА-ацетилтрансфераза, или тиолаза; 3 —
3-гидроксибутирил-СоА-дегидрогеназа; 4 —
кротонил-СоА-гидратаза, или кротоназа;
5 — гидроксибутирил-СоА-дегидрогеназа;
б — диафораза; 7 — бутиральдегидде-
гидрогеназа, CoASH-ацилирующая; 8 —
1-бутанолдегидрогеназа; 9 — бутират:СоА-
трансфераза; 10 — ацетоацетат:СоА-транс-
фераза; 11 — ацетоацетатдекарбоксилаза;
12 — 2-пропанолдегидрогеназа; 13 —
N A D Н: фер редокси н-окси дореду кта за +
гидрогеназа; ЭПФ — электронпереносящий
флавопротеин. Другие реакции с участием
ацетил-СоА приведены на рис. 12.19.
380 Часть III. Многообразие метаболических путей
Альтернативно этому синтезируемый в процес-
се брожения NADH может восстанавливать фер-
редоксин, который в свою очередь при уча-
стии гидрогеназы восстанавливает протоны с
образованием молекулярного водорода. В этом
случае при окислении одной молекулы глюко-
зы синтезируется 4 молекулы АТР, посколь-
ку вместо одной молекулы бутирил-CoA об-
разуется 2 молекулы ацс гил-Со А [уравнение
(12.100)]. В то же время процесс требует энер-
гозависимого обратного транспорта электронов
от NADH (Eq = —320 мВ) с образовани-
ем Н2 (Eq = —420 мВ). Для этого исполь-
зуется энергия электрохимического протонного
потенциала (Адн+), па создание которого расхо-
дуется АТР. Реально при росте С. pasteurianum
в периодической культуре брожение происхо-
дит в соответствии с уравнением (12.101) и со-
провождается выходом 3,3 моль АТР па 1 моль
глюкозы (рис. 12.21). В присутствии микроор-
ганизмов, эффективно использующих Щ, его
редокс-потснциал (Е') в силу термодинамических
закономерностей превышает —320 мВ, в резуль-
тате чего необходимости в обратном транспорте
электронов не имеется (см. разд. 12.2.5).
Глюкоза —* 2СО2 + 4Н2 + 2Ацетат- + 2Н+
АС0/ = —206 кДж/моль глюкозы
(52 кДж/моль АТР) (12.98)
Глюкоза —* 2СО2 4- 2,6Н2+
+0,7Бутират~ + 0,6Ацетат“ 4- 1,ЗН+
АС0' = —240 кДж/моль глюкозы
(71 кДж/моль АТР) (12.99)
Следовательно, с участием NADH образуется
0,6 моль Нг, на что затрачивается 0,3 моль АТР.
Эта продукция водорода не дает микроорганиз-
му энергетической выгоды, но обеспечивает эко-
номию глюкозы, как описано выше в данной
главе.
Clostridium acetobutyricum (кластер
1 клостридий) образует из кислот раствори-
тели □ В начале роста культуры, когда реакция
среды нейтральная, С. acetobutyricum сбраживает
глюкозу с образованием продуктов маслянокис-
лого брожения. Однако на поздних, предшеству-
ющих спорообразованию стадиях роста, когда pH
среды снижается до 5 в результате накопления
кислот, подавляющих рост культуры, направ-
ление брожения изменяется путем включения
в него трех дополнительных ветвей, конечными
продуктами которых являются нейтральные со-
единения — этанол, ацетон, пропанол и 1-бутанол
(рис. 12.21). Регуляция синтеза соответствую-
щих ферментов и генетика С. pasteurianum как
возможного продуцента 1-бутанола интенсивно
изучаются, поскольку это вещество представляет
ценность в качестве технического растворителя.
Брожение смешанного типа, характер-
ное для энтеробактерий и бацилл, происходит
с образованием 2,3-бутапдиола, ряда кислот и
других продуктов [уравнение (12.102)]. В этом
случае часть молекул пирувата — продукта пу-
ти Эмбдена-Мейергофа — восстанавливается до
лактата, тогда как остальной пируват расщеп-
ляется па формиат и ацетил-CoA при участии
пируват:формиат-лиазы [реакция (12.89)]. Фор-
миат может выделяться в среду или разлагаться
формиат:водород-лиазой на Н2 и СО2- Ацетил-
СоА превращается в ацетат в реакции, сопря-
женной с синтезом АТР, или восстанавливается
до этанола. В качестве другого пути удале-
ния восстановительных эквивалентов использу-
ется восстановительное карбоксилирование фос-
фоеполпирувата с образованием сукцината. Вос-
становление фумарата сопряжено с синтезом АТР
путем электроптранспортного фосфорилирова-
ния (разд. 12.1.2). Наконец, из двух молекул пи-
рувата может образовываться (Я)-2-ацетолактат
с высвобождением СО2. (А)-2-ацстолактат де-
карбоксилируется с образованием (Л!)-ацетоина,
который далее восстанавливается до (ЯД)-бутан-
2,3-диола или окисляется до диацетила (рис. 12.22
и 12.23). Суммарное уравнение брожения этого
типа (без учета стехиометрии) записывается сле-
дующим образом:
Глюкоза —> Сукцинат2- 4- Ь-лактат“4-
4-Ацетат- + Формиат- 4- Этапол-Ь
4-(Л,А)-бутан-2,3-диол + Диацетил-Ь
+СО2 + Н2 4- Н+ (12.100)
Данные о количестве продуктов брожения, об-
разуемых Е. coli, Serratia marcescens и Bacillus
subtilis, приведены в табл. 12.6.
Глава 12. Анаэробный энергетический метаболизм 381
Рис. 12.22. Брожение смешанного типа. 1 —
триозофосфат-изомераза; 2 — пируваткиназа; 3 —
L-лактатдегидрогеназа; 4 — пируват:формиат-лиаза;
5 — формиатдегидрогеназа и гидрогеназа; 6 — аце-
толактатсинтаза; 7 — ацетолактатдекарбоксилаза;
8 — ацетоиндегидрогеназа; 9 — 2,3-бутандиолдегид-
рогеназа; 10 — фосфоенолпируват-карбоксикиназа;
11 — малатдегидрогеназа; 12 — фумараза; 13 — фу-
маратредуктаза (рис. 12.5). В отличие от фумаразы
млекопитающих, два изофермента фумаратре-
дуктазы Е. coli, подобно аконитазе, содержат
железо-серный центр, чем обусловлено увеличение
скорости оборота фермента и его чувствительность
к кислороду. В условиях кислородного стресса
Е. coli синтезирует третью фумаразу, сходную с
ферментом млекопитающих. 14 — глицерол-3-фос-
фатдегидрогеназа; 15 — глицерол-3-фосфатаза.
| З-Фосфоглицеральдегид ]
| Глюкоза"]
|atp
NAD* (D
, /*ATP + NADH + 2H*
| Фосфоенолпируват
ADP
2
— [ Пируват"] —
ATP CoASH
NADH + H
, NAD*
| L-лактат]
6
2x
H*
CO;
COO
H,C
| (Д)-Ацетолактат [
OH
CH3
| Дигидроксиацетонфосфат |
NADH + H*
И)
ADP
| Формиат"]
| Ацетил-СоА
s- ADP + P,
, /^NAD*
| Глицерол-3-фосфат ]
H2O
V^P,
| Глицерол"]
| Оксалоацетат ]
S NADH + H*
NAD*
V^ATP
| Ацетат"]
.-малат
v H2O
| Фумарат"]
x- MQH2
V*MQ
j Сукцинат [
•2[H]
H:
OH
CH3
OH
4 | (К,К)-Бутан-2,3-диол ]
NAD* NADH + H* О
о
CH;
о
| Диацетил |
Р7к)-Ацетоин |
Таблица 12.6. Брожение смешанного типа
Продукты Escherichia coli Serratia marcescens Bacillus subtilis
моль/100 моль глюкозы
2,3-Бутандиол 0,3 64,0 54,6
Ацетоин 0,06 1,9 1,6
Глицерол 1,4 1.3 56,8
Этанол 50,0 46,0 7,7
Формиат 2,4 48,2 1,3
Ацетат 36,5 3,8 0,2
Лактат 79,5 10,1 17,6
Сукцинат 10,7 8,2 1,1
СО2 88,0 116,8 117,8
н2 75,0 0,0 0,16
Баланс по углероду, % 91,7 102,5 98,0
О/В-баланс 1,07 1,01 1,00
Теоретические значения: для углеродного баланса —100%, для окислительно/восстановительного баланса (О/В) — 1,0; см.
также табл. 12.5.
382 Часть III. Многообразие метаболических путей
Дополнение 12.6. Путь синтеза и ме-
ханизм действия пируват:формиат-лиазы
[реакция (12.89)] к настоящему времени
подробно изучены. У Е. coli этот фермент
вначале синтезируется как неактивный го-
модимер (170 кДа), не содержащий металла
и кофермента, и в такой форме претерпе-
вает посттрапсляциопную модификацию
под действием S'-адепозилмстионипа и вос-
становленного флаводоксипа, в реакции,
катализируемой железосодержащей акти-
вазой. Последняя отщепляет протон от
определенного остатка глицина в молекуле
фермента, разлагая нри этом S’-адспозилме-
тиошш па метионин и б'-дезоксиаденозин.
Образовавшийся свободный радикал фер-
мента (HS-фермент; рис. 12.24), стабильный
в анаэробных условиях, представляет собой
активированную форму фермента, катализи-
рующую двухступенчатый процесс:
Пируват 4- HS-фермент —»
—> Ацетил-Э-фермент + Формиат
Ацетил-8-фермент + CoASH —>
—> Ацетил-SCoA + HS-фермент
Таким образом, пируват расщепляется не ге-
теролитическим, но гомолитическим спосо-
бом. При перенесении клеток Е. coli из анаэ-
робных условий в аэробные фермент в ви-
де свободного радикала восстанавливается
с участием NAD+ в реакции, катализируе-
мой полифункциопалыюй ипактивазой, об-
ладающей также алкогольдегидрогеназной и
ацетальдегиддегидрогеназной активностями.
В аэробных условиях пируват окисляется до
ацетил-СоА при участии не чувствительно-
го к кислороду фермента — пируватдегидро-
геназы [реакция (12.87)].
Рис. 12.23. Синтез ацеголактата из пирувата, катализи-
руемый ацетолактатсинтазой. 1 — ацетолактатсинтаза.
Дополнение 12.7. Ацетолактатсинтаза ка-
тализирует тиаминдифосфат-зависимую ре-
акцию декарбоксилирования пирувата с об-
разованием гидроксиэтилтиаминдифосфата
(рис. 12.23). Он взаимодействует с другой мо-
лекулой пирувата, в результате чего высво-
бождается /Аоксо кислота (ацетолактат) и ре-
генерирует тиамипдифосфат. Максимальная
активность ацетолактатсинтазы наблюдается
при слабокислой реакции среды, и с этим свя-
зано ее другое название — «pH 6-фермент».
Образование бутандиола энтеробактериями
и бациллами, как и клостридиями, явля-
ется физиологическим ответом на подкис-
ление среды, позволяющим исключить вы-
деление кислот. Другая ацетолактатсинтаза,
имеющая оптимум pH 8, участвует в пути
синтеза аминокислоты валина. Этот фермент
содержит тиаминдифосфат и FAD; его актив-
ность регулируется путем ингибирования ва-
лином по механизму обратной связи.
Глава 12. Анаэробный энергетический метаболизм 383
Рис. 12.24. Взаимопревращения активной (в ви-
де радикала Е') и неактивной (нерадикальной, Ен)
форм пируват:формиат-лиазы. Флаводоксин — низко-
молекулярный белок, по величине редокс-потенци-
ала сходный с ферредоксином. 1 — пируват:флаводок-
син-оксидоредуктаза; 2 — NADPH:флаводоксин-оксидо-
редуктаза; 3 — активаза; 4 — инактиваза (AdhE — см.
подпись к рис. 12.19). Знаки « + » и « —» означают по-
ложительный и отрицательный эффект влияния пирува-
та на взаимопревращения активной и неактивной форм
фермента.
Пропионовокислое брожение осуществля-
ют различные микроорганизмы с использовани-
ем в большинстве случаев глюкозы и лактата,
сбраживая их до пропионата одним из двух пу-
тей (см. ниже). Пропионат может образовываться
также при сбраживании глицерола, сукцината
и некоторых аминокислот, таких как аланин,
серин, цистеин, треонин, метионин и глутамат.
Путь образования пропионата можно определить
изотопным методом с использованием [2- или
3-13С]лактата. У бактерий, принадлежащих к
роду Propionibo,cterium, и у большинства дру-
гих продуцентов пропионовой кислоты брожение
включает реакцию транскарбоксилирования пи-
рувата в оксалоацетат (рис. 12.25) (первый путь).
В этом пути образуется в качестве промежуточ-
ного продукта симметричная молекула сукцина-
та, в результате чего метка случайным образом
(рандомизированно) распре, является между С2- и
СЗ-атомами пропионата, и независимо от поло-
жения метки в лактате продуктом брожения яв-
ляется 2,3-13С-пропионат. Положение метки в
молекуле пропионата легко определить, анали-
зируя 13С-спектры ядерного магнитного резо-
нанса (ЯМР). При брожении, характерном для
Clostridium propionicum и Megasphaera elsdenii
(второй путь; рис. 12.36), в качестве интермедиа-
та образуется акрилоил-CoA, имеющий несиммет-
ричную молекулу, вследствие чего метка в пропи-
онате имеет ту же локализацию, что и в исход-
ном лактате. Соответственно этому данные пу-
ти называют рандомизирующим и нерандомизи-
рующим. В рандомизирующем пути (рис. 12.25)
образуется дополнительно 2/3 моль АТР за счет
восстановления фумарата до сукцината, сопря-
женного с электронтранспортным фосфорилиро-
ванием. По нерандомизирующему пути сбражива-
ется аланин (см. разд. 12.2.3; рис. 12.36). Третий
возможный путь образования пропионата вклю-
чает окислительное декарбоксилирование 2-оксо-
бутирата— продукта /3-элиминирования воды из
L-треонина или 7-элиминирования мстилмеркап-
тана (СН3—SH) из L-метионина (см. разд. 12.2.3).
В качестве промежуточного продукта броже-
ния в рандомизирующем пути образуется сук-
цинат.
ЗЛактат- —> Ацетат- -j- СО2 4- 2Пропионат-
AG,0/ = —169 кДж/моль ацетата
(2,3 АТР; 72 кДж/моль АТР) (12.101)
ЗГлюкоза —> 2Ацетат- 4- СО2+
+ 4Пропионат- 4- 6Н+
AG,0/ = —934 кДж/2 моль ацетата
(10,7 АТР; 87 кДж/моль АТР) (12.102)
Глицерол —> Пропионат- 4- Н+ 4- Н2О
AG0/ — —149 кДж/моль
(1,7 АТР; 87,6 кДж/моль АТР) (12.103)
Сбраживание глицерола энтеробактериями с
образованием в качестве конечных продуктов
пропан-1,3-диола, ацетата и формиата происходит
в соответствии с уравнением (12.106):
3Глицерол —> 2Пропап-1,3-диол + Ацетат-4-
4- Формиат- 4- 2Н+ 4- Н2О (12.104)
В энергодающей ветви этого пути глицерол окис-
ляется через глицерол-3-фосфат с образованием
пирувата и далее ацетата и формиата в реак-
циях, аналогичных реакциям кислотпо/бутан-2,3-
диолового брожения (смешанного типа) у Е. coli
и сопряженных с синтезом АТР (рис. 12.26).
Во второй ветви этого пути брожения действу-
ет его ключевой фермент — кофермент В 12-за-
висимая глицеролдегидратаза, катализирующая
384 Часть III. Многообразие метаболических путей
Рис. 12.25. Пропионовокислое брожение у
Propionibacterium (рандомизирующий путь). 1 —
L-лактатдегидрогеназа; 2 — пиру ват: ферредок-
син-оксидоредуктаза, фосфатгацетил-трансфе-
раза (фосфотрансацетилаза) и ацетаткиназа;
3 — транскарбоксилаза (содержит биотин); 4 —
малатдегидрогеназа; 5 — фумараза; 6 — фумара-
тредуктаза (см. рис. 12.5); 7 — пропионат-СоА-
трансфераза; 8 — метилмалонил-СоА-мутаза
(содержит витамин В12 — кофермент В12, или
дезоксиаденозилкобаламин; см. рис. 12.10 и
разд. 12.2.2); 9 — метилмалонил-СоА-эпимераза.
Рис. 12.26. Сбраживание глицерола до 1,3-пропандиола.
1 — кофермент В12-зависимая глицеролдегидратаза;
2 — пропан-1,3-диолдегидрогеназа; 3 — глицеролкиназа;
4 — глицерол-3-фосфатдегидрогеназа; 5 — пируват:фор-
миат-лиаза. О метаболизме дигидроксиацетонфосфата
см в разд, о брожении смешанного типа (рис. 12.22).
дегидратацию глицерола с образованием 3-гид-
роксипропионового альдегида (см. рис. 12.35),
который при участии NADH восстанавливается
до пропан-1-,3-диола (это соединение представ-
ляет интерес для промышленного получения).
З-Гидроксипропионовый альдегид может также
дегидратироваться в ферментативной реакции с
образованием акролеина, или пропенала (слезото-
чивый газ; летучий побочный продукт при произ-
водстве виски, ухудшающий его качество).
Цитрат легко сбраживается энтеробакте-
риями, молочнокислыми бактериями, Veillondla
и клостридиями. Фототрофные протеобактерии
(Rhodopseudomonas gelatinosd) в анаэробных усло-
виях используют цитрат в качестве источника уг-
лерода. Богатым источником образования цитра-
та служит молоко. Цитрат расщепляется цитрат-
лиазой на ацетат и оксалоацетат. В анаэробных
условиях оксалоацетат декарбоксилируется с об-
разованием пирувата, далее разлагаемого с обра-
зованием ацетил-СоА и формиата (рис. 12.27 и
12.28). Суммарное уравнение брожения данного
типа можно записать в виде реакции (12.107).
Цитрат3- + Н2О —* Формиат- + 2Ацетат“ + СО2
AG0/ = —79 кДж/моль цитрата (12.105)
Глава 12. Анаэробный энергетический метаболизм 385
Энтеробактерии способны превращать пиру-
ват и оксалоацетат также и в другие продук-
ты. Один из возможных вариантов — это вос-
становление части молекул оксалоацетата до
сукцината с использованием формиата в каче-
стве источника электронов (см. брожение сме-
шанного типа; рис. 12.22). Молочнокислые бак-
терии Streptococcus lactis subsp. diacetylactis и
Leuconostoc cremoris синтезируют из пирувата
(продукта превращений цитрата при их росте в
молоке) ацетоин и диацетил (рис. 12.22), опреде-
ляющие запах сливочного масла. У Е. coli име-
ется цитрат-лиаза, по отсутствует оксалоацетат-
декарбоксилаза, в результате чего этот организм
способен расти анаэробно с использованием цит-
рата только в том случае, если оксалоацетат вос-
станавливается до сукцината с участием допол-
нительного восстановителя, такого как глицерол
или глюкоза [уравнение (12.108)].
Цитрат3 + 4[Н] —>
—* Ацетат- 4- Сукцинат2- + Н2О (12.106)
Сбраживание этанола с образованием ко-
роткоцепочечных жирных кислот осуществляет
Clostridium kluyveri (кластер 1 клостридий). Оно
происходит через образование в качестве проме-
жуточного продукта ацетил-СоА. Окисление эта-
нола до уровня ацетата сопровождается синтезом
1 моль АТР на 1 моль этанола [реакция (12.109)].
Этанол + Н2О —» Ацетат- 4- Н+ + 2 Н2
AG07 — +9,6 кДж/моль этанола (12.107)
Поскольку изменение свободной энергии в ре-
акции (12.109) составляет положительную вели-
чину, она сопряжена с высокоэкзергоническими
реакциями синтеза бутирата и капроната [реак-
ции (12.110) и (12.111)]. Суммарное уравнение
сбраживания этанола записывается в виде реак-
ции (12.112).
Этанол 4- Ацетат —> Бутират 4- Н2О
ДС07 — —39 кДж/моль (12.108)
2Этанол 4- Ацетат —> Капронат 4- 2Н2О
AG'07 - -77 кДж/моль (12.109)
бЭтанол 4- ЗАцетат- —>
—> ЗБутират- 4- Капронат- 4- Н+ 4- 2Н2 4- 4Н2О
ДС°7 = —183 кДж/моль Н+ (1 моль АТР)
(12.110)
Результаты экспериментов с использованием
протонофора 3,5,37,57-тетрахлорсалициланилида
позволяют предполагать, что сопряжение обес-
печивается электрохимическим протонным по-
тенциалом. Однако механизм его образования и
способ сопряжения остаются неясными. Извест-
но лишь, что эффективность сопряжения крайне
низка, если на синтез 1 моль АТР расходуется
—183 кДж.
Другой путь анаэробного окисления этанола —
это использование сукцината вместо протонов в
качестве акцептора электронов [реакция (12.113);
рис. 12.29].
2Сукцинат2- 4- ЗЭтанол —>
—> 2Бутират- 4- ЗАцетат- 4- Н+ 4- Н2О
AG07 = -165 кДж/моль Н+ (12.111)
Рис. 12.27. Сбраживание цитрата. 1 — цитрат-лиаза
(цитрат-Знлиаза; стереоспецифический фермент, пре-
вращающий SZ-карбоксиметильный остаток цитра-
та в ацетат); 2 — оксалоацетатдекарбоксилаза; 3 —
пируват:формиат-лиаза.
386 Часть III. Многообразие метаболических путей
Ацетил-S-X-
переносчик
Цитрйл-S-X-
переносчик
Оксалоацетат [
Мд**
Трансфераза Ацил-переносчик Лиаза
HS-X-переносчик
’ (неактивный) '
АТР + | Ацетат [
АМР + Р2О*'
Ацетил-S-X-
переносчик
(активный)
Рис. 12.28. Механизм цитрат-лиазной реакции. Фер-
мент (1) состоит из б х 3 различных субъединиц: транс-
феразы, лиазы и ацил-переносящего белка. Ацетиль-
ный или цитрильный остаток связан тиоэфирной свя-
зью с фосфорибозил-дифосфо-CcASH, который в свою
очередь ковалентно связан с сериновым остатком ацил-
переносящего белка. Гидролиз ацил-переносящего белка
приводит к отщеплению ацетата (3); при этом перенос-
чик инактивируется, превращаясь в HS-фермент. Неак-
тивная форма может быть реактивирована в результа-
те спонтанного ацетилирования уксусным ангидридом
или в ферментативной реакции, катализируемой акти-
вазой при участии АТР и ацетата (2). У Rhodocyclus
gelatinosus реакцию 3 катализирует инактиваза, актив-
ность которой ингибирует глутамат. Таким образом,
расщепление цитрата возможно только в присутствии
глутамата (одновременно и источника азота). Синтез
глутамата происходит путем ИАО(Р)Н-зависимого вос-
становления аммиака и аминирования 2-оксоглутарата,
который образуется в изоцитратдегидрогеназной ре-
акции. Источником образования изоцитрата служит
цитрат.
Рис. 12.29. Восстановление сукцината с образованием
бутирата у Clostridium kluyveri. 1 — сукцинат:СоА-трзнс-
фераза; 2 — дегидрогеназа янтарного полуальдегида
(сукцинилирующая CoASH); 3 — 4-гидроксибутиратде-
гидрогеназа; 4 — 4-гидроксибутират:СоА-трансфераза;
5 — 4-гидроксибутирил-СоА-дегидратаза; 6 — бутирил-
СоА-дегидрогеназа.
Несмотря на то что 3 молекулы этанола окис-
ляется с образованием 3 молекул ацетил-СоА,
это сопровождается синтезом только одной мо-
лекулы АТР, поскольку 2 молекулы ацетил-СоА
расходуются на активацию 2 молекул сукцина-
та с превращением его в тиоловый эфир. По-
следний восстанавливается до полу альдегида сук-
цината в NADPH-зависимой реакции и далее
до 4-гидроксибутирата в NADH-зависимой ре-
акции. Специфическая CoA-трансфераза [реак-
ция (12.114); разд. 12.2.3] катализирует образова-
ние 4-гидроксибутирил-СоА, который дегидриру-
Глава 12. Анаэробный энергетический метаболизм 387
Рис. 12.30. Механизм дегидратации 4-гидроксибутирил-
СоА. Для отщепления в виде протона инактивированно-
го /3-атома водорода субстрат окисляется путем отщеп-
ления гидрид-радикала Н- (Н+ -f-е-). В результате об-
разуется енокси-радикал, способный депротонироваться
по /3-положению с образованием стабильной резонанс-
ной формы кетила (радикал-апион), легко теряющего
ОН--группу. Продукт этого превращения восстанавли-
вается Н'.ив конечном итоге образуется кротонил-СоА.
Описанные реакции сходны с внутримолекулярными пе-
рестройками, осуществляемыми при участии кофермен-
та В12 (рис. 12.35).
соо'
nh„ +со
ADP + Р,
АТР
R,— СОО
Окислительная ветвь
> 2n [Н]
nRz—СН —СОО"
Восстановительная ветвь
Рис. 12.31. Общая схема сбраживания аминокислот.
В процессе брожения участвуют две молекулы амино-
кислот, из которых одна окисляется, другая восстанав-
ливается. Эта пара может состоять из молекул различ-
ных аминокислот или одной и той же аминокислоты.
И в окислительной, и в восстановительной ветвях про-
цесса брожения могут участвовать следующие амино-
кислоты: аланин, цистеин, глицин, метионин, лейцин,
фенилаланин, серин, треонин, триптофан и тирозин.
Изолейцин и валин используются исключительно как
доноры электронов, пролин —только как акцептор элек-
тронов. Синтез АТР происходит только в окислитель-
ной ветви брожения. Исключение составляет сбражи-
вание глицина. Имеются особые пути для сбраживания
некоторых из перечисленных аминокислот, а также глу-
тамата, глутамина, гистидина, аргинина, аспартата, ас-
парагина и лизина. Для роста Clostridium acetireducens
(группа I клостридий) дополнительно к некоторым ами-
нокислотам, подвергаемым только окислению, требует-
ся ацетат, поскольку для стока электронов используется
реакция образования бутирата из двух молекул ацетата.
ется с образованием кротонил-СоА (рис. 12.30).
Конечные продукты брожения — ацетат и бути-
рат — образуются в реакциях, представленных на
рис. 12.21.
Большое разнообразие путей сбражива-
ния углеводов, помимо четырех путей сбражи-
вания глюкозы, обусловлено большим числом воз-
можных реакций восстановления пирувата. Ти-
пичными продуктами их являются D- и L-лактат,
СО2, Н2, формиат, ацетат, пропионат, бутират,
валерат, капронат, этанол, ацетон, изопропанол,
1-бутанол, ацетол актат, ацетоин, бутан-2,3-диол,
диацетил и пропан-1,3-диол.
12.2.3. Субстратами брожения
могут служить аминокислоты
Входящие в состав белков 20 аминокислот име-
ют в среднем ту же степень восстановления, что
н сахара. Поэтому они могут служить субстра-
тами окислительно-восстановительных процессов
брожения. Анаэробные организмы, способные
разлагать аминокислоты, были открыты более
столетия назад; стехиометрию этого процесса
впервые описал Л. Стиклапд (Stickland) в 1930-х
гг. Он выяснил, что при сбраживании Clostridium
sporogenes (кластер 1) двух аминокислот од-
на из них (например, аланин) используется в
качестве донора электронов, тогда как дру-
гая (например, глицин или пролин) — в каче-
стве акцептора электронов (рис. 12.31). Позже,
в 1940-х гг., Г. Баркер (Barker) с сотрудниками
выделил клостридии и родственные им неспо-
рообразующие анаэробные бактерии, способные
осуществлять брожение в присутствии только
одной аминокислоты. Так, С. propionicum, (кла-
стер 14b) в качестве единствсппного субстра-
та брожения использует аланин; недавно выде-
388 Часть III. Многообразие метаболических путей
Рис. 12.32. Механизм действия глициндегидрогена-
зы, или глицин:ЫА0+-оксидоредуктазы (дезаминиру-
ющей). Белок @ (12 кДа) содержит селеноцистеин.
Пирувоильный остаток в составе белка (в) образует
шиффово основание с глицином. ct-Атом углерода свя-
занного таким образом глицина атакуется анионом се-
лена (A)-Se~ с образованием карбокси метил сел еноци-
стеина, связанного с белком (А), и иминопирувоила.
В следующем обороте цикла либо путем гидролиза вы-
свобождается аммиак. Отделение кетена, связанного с
цистеиновым остатком селенсодержащего белка, при-
водит к образованию окисленного (A)-Se-S, который
далее восстанавливается тиоредоксином. Низкомолеку-
лярный белок тиоредоксин содержит две SH-группы,
между которыми при окислении формируется дисуль-
фидный мостик. Восстановление тиоредоксина проис-
ходит при участии тиоредоксинредуктазы с использо-
ванием NADH или другого донора электронов. Гипо-
тетический кетеновый интермедиат присоединяется к
цистеиновому остатку в составе белка (С) с образовани-
ем S-ацетилцистеина, который при участии неоргани-
ческого фосфата расщепляется, высвобождая ацетил-
фосфат. Прол ин редуктаза также содержит пирувоиль-
ный остаток, но лишена селена.
ленный вид Eubacterium acidaminophilum (кла-
стер 5) — глицин. Как показывает анализ 16S-
РНК, почти все организмы, способные сбражи-
вать аминокислоты, относятся к клостридиям и
родственным им бактериям (кластеры 1-29).
Процесс сбраживания аминокислот состоит из
ряда анаэробных окислительно-восстановитель-
ных реакций, и его окислительная ветвь всегда
сопряжена с субстратным фосфорилированием,
обеспечивающим рост (рис. 12.31). Как прави-
ло, вначале образуется ацил-СоА, который при
участии СоА-трансферазы [реакция (12.114)] пре-
вращается в ацетил-СоА. Далее при участии аце-
тилтрансферазы [называемой также фосфотран-
сацстилазой; реакция (12.41)] и ацетаткиназы
[реакция (12.42)] синтезируется АТР.
R—СО-SCoA + Ацетат- —>
—> R—СОО- + Ацетил-SCoA
AG'0/ ~ 0, варьируя в зависимости от R (12.112)
В реакциях восстановительной ветви брожения
АТР обычно не образуется. Исключение составля-
ют сбраживание глицина, при котором субстрат-
ное фосфорилирование сопряжено с реакциями
восстановления (рис. 12.32), и сбраживание ас-
партата, превращаемого в фумарат — потенциаль-
ный акцептор электронов при анаэробном дыха-
нии (см. разд. 12.1.2). В результате сбражива-
ния аминокислот образуются аммиак, СОг, Нг,
спирты и короткоцепочечные жирные кислоты.
Последние являются продуктами восстановитель-
ной ветви брожения (рис. 12.31) и часто имеют
тот же углеродный скелет-, что исходные амино-
кислоты. Например, лейцин восстанавливается до
4-метилвалериановой кислоты, триптофан—до
индолпропионата. Окисление аминокислот через
соответствующие 2-оксокислоты приводит к со-
кращению углеродного скелета на один атом угле-
рода. Наиболее важные исключения из этого пра-
вила— сбраживание глутамата (рис. 12.37 и 12.38)
и лизипа (рис. 12.39).
При сбраживании аминокислот, которое осу-
ществляют главным образом клостридии и
родственные им бактерии, одна аминокислота
служит донором электронов, другая — акцепто-
ром либо одна и та же аминокислота использу-
ется и как донор, и как акцептор электронов.
В качестве конечных продуктов образуются ам-
миак, диоксид углерода, молекулярный водород
и коротко цепочечные жирные кислоты, которые
обычно сохраняют углеродный скелет исходной
аминокислоты. Энергия запасается при этом пу-
тем субстратного фосфорилирования. И
Глава 12. Анаэробный энергетический метаболизм 389
Отщепление аминогрупп от аминокис-
лот в процессе их сбраживания может происхо-
дить путем окисления, элиминирования или вос-
становления. Два первых пути характерны также
для аэробных процессов метаболизировапия ами-
нокислот (см. гл. 9), тогда как восстановительное
замещение аминогрупп глицина и пролина харак-
терно только для анаэробов. Восстановление гли-
цина до ацетилфосфата катализирует глиципрс-
дуктаза, представляющая собой комплекс из трех
ферментов [рис. 12.32; реакция (12.115)].
Глицин + NADH + 2Н+ 4- НРО^~
—» Ацстилфосфат2- 4- NH+ 4- Н20 4- NAD+
Дб?0/ = —23 кДж/моль глицина (12.113)
D-пролип восстанавливается до 5-аминовалериа-
новой кислоты без образования в качестве про-
межуточного продукта ацилфосфата [реакция
(12.116)]. Эта реакция не сопряжена с запасани-
ем энергии. Превращение природного L-пролина
в D-энантиомер осуществляет рацемаза [реакция
(12.117)].
D-пролин + 2Н+ + 2е~ —*
—» 5-Аминовалериановая кислота (12.114)
Lr-пролип D-пролип (12.115)
2-Оксокислоты, образующиеся при дез-
аминировании аминокислот путем окисления,
трансаминирования или элиминирования, часто
окисляются далее в реакциях декарбоксилирова-
ния с образованием СоА-эфиров соответствую-
щих короткоцепочечных жирных кислот. Окис-
лителем служит при этом у аэробов NAD+
[например, в пируватдегидрогеназной реакции
(12.87)], у строгих анаэробов — ферредоксин.
Ферредоксины — это низкомолекулярные (<10
кДа) кислые белки, содержащие [4Fe—4S]- или
[2Fe—28]-цснтры; они акцептируют только один
электрон па такой центр (Фд_). Окислительное
декарбоксилирование аминокислот осуществля-
ют 2-оксокислота: ферредоксин-оксидореду ктазы
[реакция (12.118); например пируват:ферредок-
син-оксидоредуктаза]; эти ферменты содержат
тиаминдифосфат и в качестве простатических
групп — железо-серные центры. Осуществляемые
ими оксидоредуктазные реакции, в отличие от
КАП+-зависимых дегидро геназных реакций с
участием 2-оксокислот в качестве субстратов, об-
ратимы, поскольку ферредоксин имеет более низ-
кий окислительно-восстановительный потенциал
(Е'о = —420 мВ) по сравнению с NAD+ (Е'о =
-320 мВ).
R-CO-COO" + 2 Фд + CoASH
— R-CO-SCoA 4- СО2 4- 2 Фд" 4- Н+
(2-оксокислота: ферредоксин-оксидореду ктаза)
AG'0/ ~ —20 кДж/моль (12.116)
Восстановительный 2-гидроксикислотный
путь, широко распространенный у анаэробов,
включает восстановление 2-оксокислот до (Л)-2-
гидрокснкислот с их последующей активаци-
ей (образование СоА-эфиров) и sv/п-дегидрата-
цией, при которой образуется еноил-СоА-эфир
(рис. 12.33). Второй этап восстановления катали-
зируют ацил-CoA-дегидрогеназы или споил-СоА-
редуктазы. Продукты этих реакций — насыщен-
ные CoA-эфиры, из которых при участии СоА-
трансфераз высвобождается свободная кислота.
В одном из вариантов этого пути происходит пе-
ренос СоА от еноил-CoA на 2-гидроксикислоту
и свободный еноат восстанавливается до насы-
щенной кислоты еноатредуктазой (Clostridium
sporogenes). По этому пути у ряда организмов
сбраживаются аланин, цистеин, глутамат, глута-
мин, гистидин, лейцин, метионин, фенилаланин,
серии, треонин, триптофан и тирозин. Другие
микроорганизмы используют иные пути, напри-
мер для сбраживания глутамата (рис. 12.37 и
12.38). Механизм обратимой дегидратации (А)-2-
гидроксиацил-СоА с образованием еноил-CoA нс
вполне ясен, поскольку элиминируется /3-атом во-
дорода, нс активированный тиоловым эфиром.
Величина рК для активированного а-атома водо-
рода равна примерно 20, тогда как в случае пеак-
тивированного /3-атома водорода рК > 30 и этот
атом нс может быть отщеплен с участием основа-
ния, входящего в состав фермента. Подробно изу-
ченный пример такого отщепления — дегидрата-
ция (Л)-2-гидроксиглутарил-СоА с образованием
глутаконил-СоА (рис. 12.34) у строгого анаэроба
Acidaminococcus fermentans (кластер 9). Реакцию
осуществляет высокочувствительная к кислоро-
ду гидроксиглутарил-СоА-дегидратаза (100 кДа),
содержащая [Fe—8]-кластеры, восстановленный
рибофлавин и FMNH2. Активация этой дегидра-
тазы, требующая участия восстановителя и в ка-
390 Часть III. Многообразие метаболических путей
Рис. 12.33. 2Тидрокси кислотный путь сбраживания
аминокислот. 1 — начальный этап превращения ами-
нокислоты в соответствующую оксокислоту путем
окисления, трансаминирования или элиминирования;
2 — дегидрогеназа (/?)-2-гидроксикислот; 3 — СоА-
трансферазы; 4— (А?)-2-гидроксиацил-СоА- дегидрата-
за; 5 — бутирил-СоА-дегидрогеназа (ЭПБ — электрон-
переносящий белок); б — еноатредуктаза.
Рис. 12.34. Механизм дегидратации (К)-2-гидрокси-
глутарил-СоА с образованием глутаконил-СоА. Вначале
тиоэфирная карбонильная группа, которую можно рас-
сматривать как кетон, восстанавливается одним элек-
троном до анион-радикала (кетил-радикал). Донором
электронов в этой реакции служит либо флавин, окисля-
емый до уровня семихинона, либо железо-серный центр.
Кетильный радикал способствует отщеплению соседней
гидроксильной группы. Образующийся енокси-радикал
депротонируется с образованием кетильного радикала
глутаконил-СоА, реокисляемого до глутаконил-СоА —
конечного продукта дегидратации. Электрон, вносимый
в цикл восстановителем и восстанавливающий тиоло-
вый эфир, обладает высокой энергией, получаемой в
результате гидролиза АТР. Поскольку окислительно-
восстановительные реакции замкнуты в цикл, электрон
остается в высокоэнергетическом состоянии в течение
многих оборотов цикла и АТР требуется для этих реак-
ций лишь в каталитическом количестве.
талитическом количестве АТР и Mg2+, проис-
ходит под действием активатора, содержащего
[Fe—SJ-кластер. В условиях in vivo восстанови-
телями служат NADH и дополнительный фер-
мент; in vitro для этого может использовать-
ся Ti(III)-цитрат. Предполагается, что эти реак-
ции гидратации протекают по неизвестному ранее
механизму с образованием в качестве промежу-
точных соединений тиоловых эфиров радикал-
анионов кетилов (рис. 12.34). Интересно, что дан-
ная дегидратаза имеет сходство с бсизоил-СоА-
рсдуктазой протеобактерии (Thauera, Azoarcus и
Phodopseudomonas), в том что гидролиз АТР
повышает восстановительную силу электрона
(величина Е'о становится более низкой).
Кротонил-СоА (2-бутеноил-СоА) образуется
как интермедиат в некоторых путях сбраживания
глутамата, лизина, треонина и метионина. Подоб-
но этому в процессе сбраживания 5-амнновале-
риановой кислоты образуется гомокротонил-СоА
(2-пентепоил-СоА); (рис. 12.42). Кротонил-СоА
образуется как промежуточпй продукт в различ-
ных процессах брожения, поскольку он способен
окисляться до ацетата в реакции, сопряженной
с субстратным фосфорилированием, либо вос-
станавливаться до бутирата (рис. 12.21). Однако
его восстановление, в отличие от восстановления
фумарата, по сопряжено с синтезом АТР пу-
тем окислительного фосфорилирования (см.
разд. 12.1.2).
Глава 12. Анаэробный энергетический метаболизм 391
Рис. 12.35. Механизм внутримолекулярных перестро-
ек, катализируемый коферментом В12. Гомолитиче-
ское расщепление связи между кобальтом и углеро-
дом в молекуле аденозилкобаламина (кофермент В12)
приводит к образованию б'-дезоксиаденозин-радикала
(Дад-СН^). Это расщепление индуцируется в комплексе
субстрат-фермент. 5'-Дезоксиаденозин-радикал отщеп-
ляет гидрид-ион (IT) от Cl-атома субстрата с образова-
нием б'-дезоксиаденозина (Дад-СНз) и отщеплением от
субстрата радикала Х‘ (X — перемещаемая группа). Ра-
дикал Х‘ перемещается к Cl-атому субстрата, и к обра-
зованному таким путем продукту присоединяется один
из трех атомов водорода в составе Дад-СНз. Тем самым
происходит регенерация б'-дезоксиаденозин-радикала
для использования в следующем обороте цикла пере-
стройки. Соответственно Х-группа совершает внутримо-
лекулярное перемещение, тогда как Н-атом — межмоле-
кулярное перемещение с участием метильной группы
б'-дезоксиаденозина. В перестройке углеродного скеле-
та участвуют: метилмалонил-СоА-мутаза (рис. 12.25),
глутаматмутаза (рис. 12.38) и 2-метиленглутаратмутаза
(рис. 12.43). Х-группа в этих реакциях представлена
формилил-СоА, 2-глицилом или 2-акрилилом соответ-
ственно. Общим во всех этих реакциях является то, что
образовавшиеся из субстрата радикалы расщепляются
па X* и акрилат (R=COO~). На данном рисунке пред-
ставлены стереохимические формулы компонентов глу-
таматмутазной реакции. В случае Д-лизин-5,б-мутазы
(рис. 12.39) X означает аминогруппу, которая переносит-
ся как связанная с пиридоксаль-5-фосфатом. В реакции,
катализируемой глицеролдегидратазой (рис. 12.26), ме-
няются местами атом водорода у Cl-атома и гидрок-
сильная группа у С2-атома в молекуле глицерола.
Рис. 12.36. Путь сбраживания L-аланина у Clostridium
propionicum. 1 — аланинаминотрансфераза (2-Ог —
2-оксоглутарат; Глу — глутамат); 2 — глутаматдегид-
рогеназа; 3 — пируват.-ферредоксин-оксидоредуктаза
(Фд — ферредоксин); 4 — фосфат:ацетил-трансфераза;
5 —ацетаткиназа; б —D-лактатдегидрогеназа; 7 — лак-
тат:СоА-трансфераза; 8 — D-лактоил-СоА-дегидратаза;
9 — пропионил-СоА-дегидрогеназа.
392 Часть III. Многообразие метаболических путей
Рис. 12.37. Превращение L-глутамата в кротонил-СоА.
1 — глутаматдегидрогеназа; 2 — (/?)-2-гидроксиглута-
ратдегидрогеназа; 3 — глутаконат или 2-гидрокси гл у-
тарат:СоА-трансфераза; 4 — (/?)-2-гидроксиглутарил-
Со А-дегидра таза; 5 — глута кон ил-Со А-декарбоксилаза.
Рис. 12.38. Превращение L-глутамата в пируват. 1 — глу-
таматмутаза; 2 — метиласпартаза; 3 — мезаконатгидра-
таза; 4 — цитрамалат-лиаза.
В Сбраживание аминокислот происходит по сле-
дующим основным путям.
1. Прямое восстановительное элиминирование
аминогруппы в случае глицина и пролина.
Восстановление глицина приводит к образо-
ванию ацетилфосфата, фосфатная группа ко-
торого используется для фосфорилирования
ADP. Это единственный пример восстанови-
тельного субстратного фосфорилирования.
2. Реакции окисления, трансаминирования или
/5-элиминирования с образованием 2-оксокис-
лот, подвергающихся затем окислительному
декарбоксилированию с образованием ацил-
СоА или восстановлению до (А)-2-гидрокси-
кислот. Активация последних путем при-
соединения СоА обеспечивает дальнейшее
необратимое, вследствие структурных ограни-
чений, /5-элиминирование воды, с образовани-
ем епоил-СоА, который далее восстанавлива-
ется до ацил-СоА (гидроксикислотный путь,
ГКП).
3. Превращение глутамата и лизина в /5-амино-
кислоты, из которых аминогруппа удаляется
путем /5-элиминирования.
4. Образование кротонил-СоА как промежуточ-
ного продукта во многих путях сбраживания
аминокислот.
5. Аспартат и аспарагин дезаминируются с обра-
зованием фумарата, который служит акцеп-
тором электронов при анаэробном дыхании
(разд. 12.1.2).
Ферменты, содержащие кофермент В12,
участвуют в сбраживании лизина, глутамата
(через 3-метиласпартат) и гетероциклического
соединения — никотиновой кислоты. Все они осу-
ществляют зависимое от кофермента В12 внут-
римолекулярное перемещение атома водорода
к соседнему атому углерода, от которого в об-
ратном направлении перемещается группа X
(рис. 12.35). С реакцией, катализируемой ко-
ферментом В12, сходно превращение а-лизина в
Глава 12. Анаэробный энергетический метаболизм 393
Рис. 12.39. Путь сбраживания L-лизина
у Clostridium subterminale и Fusobacterium
nucleatum. 1 — лизин-2,3-аминомутаза;
2—/3-лизин-5,б-аминомутаза; 3 — 3,5-ди-
аминогексаноат-дегидрогеназа; 4 — 3-оксо-
5-аминогексаноат:ацетил-трансфераза;
5 — 3-аминобутирил-СоА-амино-л иаза;
б—бутирил-СоА-дегидрогеназа; 7 — аце-
тоацетат:СоА-трансфераза; 8 — тиолаза;
9 — фосфат-а цетилтра нсфераза и а цетат-
киназа.
(3- л из ии, но активность лизин-2,3-аминомутазы
из С. subterminale (кластер 1) не связана с
аденозилкобаламином; этот фермент содержит
железо-ссрные центры и пиридоксаль-б'-фосфат.
Кроме того, в осуществляемой им реакции при-
нимает участие S-аденозилмстионин — его 57-дез-
оксиаденозиновый остаток опосредует внутримо-
лекулярный перенос водорода от (3- к «-атому
углерода, как и в адепозилкобаламин-зави-
симой реакции. Однако последующая мигра-
ция е-аминогруппы Длизина в ^-положение у
С. subterminale (рис. 12.39) происходит при уча-
стии фермента, содержащего, помимо пиридо-
ксачь-б'-фосфага, кофермент В12-
Глицин сбраживается Eubacterium acidami-
nophilum с образованием ацетата, NHJ и СОг по
следующему пути.
Окислительная ветвь: Глицин 4- 2 Н2О —>
2СО2 + NH+ + 5Н+ + 6е“ (12.117)
Восстановительная ветвь:
3 Глицин 4- 6Н+ + 6е~ —>
3 NH4 4- 3 Ацетат- (12.118)
Суммарное уравнение:
4Глицин + 2НгО + Н+ —>
—> 4NH4 4- 2СО2 + ЗАцетат-
ДС?0/ = —217 кДж/4 моль глицина (12.119)
Реакции окислительной ветви этого пути обна-
ружены также у аэробных бактерий, восстанови-
тельная ветвь — только у клостридий. Величина
изменения свободной энергии при сбраживании
глицина (ДС0/ = —217 кДж/4 моль глицина)
вполне достаточна для синтеза 3 моль АТР
(ДС0/ = — 72 кДж/моль АТР). Теоретически в ре-
зультате субстратного фосфорилирования долж-
но синтезироваться 4 моль АТР — три из них в
глицинредуктазных реакциях и один в окисли-
тельной ветви. Однако в этом случае брожение
[уравнение (12.121)] находится в равновесии с син-
тезом АТР из ADP и неорганического фосфата.
Следовательно, часть образующегося ацетилфос-
фата должна подвергаться гидролизу, чтобы про-
цесс брожения шел до полного завершения.
Сбраживание L- аланина у С. propionicum
[уравнение (12.122)] начинается реакцией транса-
минирования [уравнение (12.83)] с образованием
пирувата, который затем окисляется до ацетил-
СоА. Последний, превращаясь в ацетилфосфат,
394 Часть III Многообразие метаболических путей
служит источником энергии для синтеза АТР
(рис. 12.36).
ЗЬ-аланип + 2Н2О —>
—> 3NH4 + СО2 + Ацетат- + 2Пропионат-
Д(70/ = —135 кДж/моль ацетата (12.120)
В восстановительной ветви этого процесса броже-
ния пируват восстанавливается до пропионата че-
рез гидроксикислотпый путь (рис. 12.33). В про-
тивоположность восстановлению кротонил-СоА,
восстановление акрилоил-CoA, подобно восста-
новлению фумарата, предположительно сопряже-
но с электротранспортным фосфорилировани-
ем (см. разд. 12.1.2), при котором синтезируется
1/3 моль АТР/2 е“. Следовательно, сбраживание
аланина должно давать 5/3 моль АТР на 3 моль
исходного субстрата, что соответствует общему
изменению свободной энергии в процессе броже-
ния (81 кДж/моль АТР). У бактерии Megasphacra
elsdenii, обитающей в рубце жвачных, (кластер 9),
при функционировании этого пути образуются,
помимо перечисленных выше продуктов, бутират
и валериановая кислота в результате конденсации
ацетил-CoA со второй молекулой ацетил-СоА или
с пропиопил-СоА соответственно.
Сбраживание L-серина и цистеина у
С. propionicum, как и описанное выше сбражива-
ние аланина, включает реакции диспропорциони-
рования пирувата, хотя и с иной стехиометрией,
обусловленной более высокой степенью окисления
этих субстратов [уравнения (12.123) и (12.124)[.
ЗЬ-серин + Н2О -> 3NH+ 4- 2СО2+
4-2Ацетат-+ Пропионат- (12.121)
ЗЬ-цистеин + 4Н2О 3NHJ + 3H2S+
4-2СО2 + 2Ацетат- 4- Пропионат (12.122)
Сбраживание L-серина начинается его дезами-
нированием под действием L-сериндегидратазы
при участии входящего в ее состав [4Fe~4S]-
кластера с образованием пирувата [реакция
(12.85)]. На первом этапе этой реакции проис-
ходит отщепление воды, которому способствует
образование координационной связи между гид-
роксильной группой и атомом железа в составе
центра. Продукт реакции — дегидроаланип — тау-
томеризуется неферментативным путем в имино-
пируват, который в конечном итоге гидролизуется
с образованием аммиака и пирувата. Интерес-
но, что аналогичную реакцию дезаминирования
D-серина и треонина катализируют фермен-
ты, содержащие пиридоксальфосфат и ли-
шенные железо-серных кластеров (см. гл. 9).
Пиридоксальфосфат-содержащая цистеинде-
сульфгидраза катализирует начальное отщеп-
ление H2S [реакция (12.86)]. Образующийся
дегидроаланип гидролизуется с образованием пи-
рувата.
Сбраживание треонина может происходить
тремя различными путями. У С. propionicum эта
аминокислота, как и серин, дезаминируется в
пирпдоксаль-б'-фосфат-зависимой реакции с об-
разованием 2-оксобутирата, который далее дис-
пронорционируегся в пропионат и бутират [урав-
нение (12.125)] в реакциях, аналогичных описан-
ным для катаболизма серина через гидрокспкис-
лотпый путь (см. рис. 12.33).
1) ЗЬ-треонип + Н2О -> 3NHJ 4- 2СО2+
+2Пропиопат- 4- Бутират- (12.123)
У С. pasteurianum (класте}) 1) треонин сбражи-
вается с образованием аммиака и ацетата [ре-
акция (12.126)]. На первом этапе происходит
расщепление треонина на глицин и ацетальде-
гид под действием треопинальдолазы, кофер-
ментом которой служит пиридоксаль-б'-фосфат
[реакция (12.127)]. Ацетальдегид окисляется до
ацетил-СоА ацетальдегиддегидрогеназой [реак-
ция (12.94)], тогда как глицин восстанавливается с
образованием ацетилфосфата и аммиака. В сумме
при сбраживании одной молекулы треонина син-
тезируется 2 молекулы АТР.
2) L-треопип 4- Н2О —♦
NHJ 4- 2 Ацетат- 4- Н+ (12.124)
Треонпналъцолаза
L-трсонин-----------------
Глицин 4- Ацетальдегид (12.125)
Альтернативный путь сбраживания треонина до
ацетата и аммиака обнаружен у С. sticklandii
(кластер 11). Вначале происходит окисление суб-
страта до L-2-амипо-З-оксобутирата [2-С-ацетил-
глицин; реакция (12.128)], который далее расщеп-
ляется на глицин и ацетил-СоА [реакция (12.129)]
при участии ацетил-СоА:С-ацстилтрансферазы.
Глава 12. Анаэробный энергетический метаболизм 395
Эта реакция сходна с подробно изученной тио-
лазной реакцией [реакция (12.130); ацетил-СоА:С-
ацстилтрансфераза; см. также рис. 12.21J, однако
тиолазную реакцию катализирует фермент, со-
держащий в качестве кофермента пиридоксаль-
5'-фосфат. Глицин метаболизируется далее в со-
ответствии с уравнением (12.121).
3) L-треонин 4- NAD+ —>
—> L-2-амипо-З-оксобутират 4- NADH + Н+
(12.126)
L-2-амино-З-оксобутират + CoASH —>
—> Глицин 4- Ацетил-СоА
(глицин-С-ацети лтрансфераза) (12.127)
Ацетоацетил-СоА 4- CoASH —> 2Ацстил-СоА
(тиолаза) (12.128)
Сбраживание глутамата — одной из наибо-
лее распространенных аминокислот — может про-
исходить по меньшей мере четырьмя различными
путями. Основными служат два пути: один с об-
разованием в качестве промежуточного продукта
3-метиласпартата и другой — 2-гидроксиглу-
тарата. Конечные продукты в этих путях броже-
ния одинаковые [уравнение (12.131)].
5 Глутамат 4- 6Н2О 4- 2Н+ —> SNHj 4-
4- 5СО2 4- бАцетат- 4- 2Бутират- 4- Щ
(0,6 ATP/моль глутамата)
ДС0/ = — 59 кДж/моль глутамата
(98 кДж/моль АТР) (12.129)
Сбраживание глутамата через образование
(Р)-2-гидроксиглутарата (« гидроксиглутаратный
путь») начинается реакциями 2-гидроксикислот-
ного пути (рис. 12.33). Продукт дегидратации
(7?)-2-гидроксиглутарил-СоА, глутаконил-СоА,
декарбоксилируется с образованием кротонил-
СоА (рис. 12.37). Свободная энергия, выделяю-
щаяся в этой реакции, запасается в виде электро-
химического натриевого потенциала (разд. 12.3).
Диспропорционирование кротонил-СоА приво-
дит к образованию ацетата, бутирата, молеку-
лярного водорода и АТР (путем субстратно-
го фосфорилирования). Данный путь броже-
ния обнаружен у клостридий и родственных
им бактерий, обитающих в анаэробных отде-
лах пищевого тракта человека, теплокровных
животных и птиц. К этим бактериям отно-
сятся: Acidaminococcus fermentans (кластер 9),
Fusobacterium nucleatum (кластер 19), Clostridium
symbiosum (кластер 14a), C. aminophilum (кла-
стер 14a), C. sporosphaeroides (кластер 4) и
Peptostreptococcus asaccharolyticus (кластер 13).
Метиласпартатный путь служит альтер-
нативным путем сбраживания глутамата, в
котором линейный углеродный скелет этой ами-
нокислоты под действием кофермент-Bi 2-зависи-
мой мутазы перестраивается в разветвленный ске-
лет (25',35')-3-метиласпартата (рис. 12.38). Эта
перестройка скелета облегчает отщепление ам-
миака Д-мстиласпартазой, поскольку приводит к
активации /^-водородного атома соседней карбок-
сильной группой. Продукт этой реакции мезако-
нат гидратируется с образованием (й')-цитрама-
лата, который, аналогично цитрату (рис. 12.28),
расщепляется на ацетат и пируват [реакция
(12.80)]. Окислительное декарбоксилирование пи-
рувата приводит к образованию ацетил-СоА и
восстановленного ферредоксина, который реокис-
лястся в реакции синтеза бутирил-СоА из двух
молекул ацетил-СоА. В отличие от гидрокси-
глутаратного пути, 3-метиласпартатный путь об-
наружен у группы близкородственных клостри-
дий, обитающих в почве: С. tetani (кластер 1),
С. tetanomorphum (кластер 1), С. cochlearium
(кластер 1), С. malenominatum (кластер 1) и
С. limosum (кластер 2). Следует отметить, что эти
бактерии в качестве субстратов брожения способ-
ны использовать любой путь сбраживания и глу-
тамина, и D-глутамата, поскольку все они содер-
жат глутаминазу и глутаматрацемазу.
Сбраживание глутамата по 'у-аминобутират-
ному пути происходит при участии двух орга-
низмов — один из них декарбоксилирует глутамат
до 4-амипобутирата [7-аминобутират, ГАБ; реак-
ция (12.132)], тогда как другой сбраживает про-
дукт декарбоксилирования в соответствии с урав-
нением (12.133).
Глутаматдекарбоксилаза
L-глутамат 4- Н+---------------------->
—* 4-Аминобутират 4- СО2 (12.130)
2 х 4-Аминобутират 4- 2Н2О —> 2^’4^4-
4-2 Ацетат- 4- Бутират- 4- Н+ (12.131)
396 Часть III. Многообразие метаболических путей
4-Аминобутират образуют многие эукариоты и
бактерии [реакция (12.132)]. В организме жи-
вотных и человека он выполняет функцию
нейромедиатора (ГАМК, гамма-аминомасляная
кислота); бактерии выделяют его в среду.
У некоторых бактерий свободная энергия реак-
ций декарбоксилирования аминокислот запасает-
ся в форме электрохимического натриевого по-
тенциала (разд. 12.3). Способность использовать
4-аминобутират в качестве субстрата брожения
известна только у С. amino butyricum (кластер 11)
[реакция (12.133)]. Вначале этот субстрат тран-
саминируется с образованием полуальдегида сук-
цината, который восстанавливается с участием
NADH до 4-гидроксибутирата. Эти реакции при-
водят к замещению аминогруппы на гидроксиль-
ную группу. Далее 4-гидроксибутират метаболи-
зируется по тому же пути, что у С. kluyveri
(рис. 12.29 и 12.30).
Пропионатный путь сбраживания глутама-
та [реакция (12.134)] обнаружен у Selenomonas
acidaminophila и Barkera propionica (кластер 9).
Этот путь рассматривается как комбинация ме-
тиласпартатного пути (рис. 12.38; превращение
глутамата в ацетат и пируват) и пути, в ко-
тором пируват диспропорционируется в пропи-
онат и дополнительную молекулу ацетата (как
у Propionibacterium-, рис. 12.25). Таким образом,
данный путь должен включать два действую-
щих последовательно В 12-зависимых фермента —
глутаматмутазу и метилмалонил-СоА-мутазу —
и давать 2 моль АТР па 3 моль глутамата
(субстратное фосфорилирование). Дополнитель-
но при электронтранспортном фосфорилирова-
нии, сопряженном с фумаратредуктазпой реакци-
ей (см. разд. 12.1.2), образуется 2/3 моль АТР.
ЗГлутамат- 4- 4Н2О —> 3NH4h 4- 2СО2 +
4- бАцетат- 4- Пропионат-
AG0' = —187 кДж/3 моль глутамата
(70 кДж/моль АТР) (12.132)
Гистидин способны сбраживать те же бак-
терии, которые используют в качестве субстрата
глутамат.
L-гистидин + ЗН2О —> NHj +
4- Формамид 4- L-глутамат- (12.133)
Формамидаза
Формамид 4- HqO------------->
NIlJ 4- НСОО- (12.134)
L-лизин сбраживают с образованием ацетата
и бутирата Clostridium subterminale (кластер 1) и
Fusobacterium, nucleatum (кластер 19) [уравнение
(.12.137); рис. 12.39].
L-лизин 4- 2П2О 2NH4 +
4-Ацетат- 4- Бутират- 4- Н+ (12.135)
Вначале L-лизин [(2,S)-2,6-диаминогексановая
кислота] в результате S'-аденозилметионин-за-
висимого внутримолекулярного переноса ами-
ногруппы из а- в /3-положение превращается в
/3-лнзин [(2S)-3,6-диаминогексановая кислота].
Кофермент В12 в этой реакции не участвует
(см. рис. 12.35). На следующем этапе при уча-
стии кофермента В12 происходит внутримоле-
кулярное перемещение аминогруппы из положе-
ния 6 в положение 5, что приводит к образованию
(3S,5S')-3,5-диаминогексановой кислоты. Послед-
няя окисляется при участии NAD+, что приводит
к образованию аммиака и (58)-3-оксо-5-аминогек-
саповой кислоты. В необычной реакции ее рас-
щепления при участии ацетил-СоА образуется
3-аминобутирил-СоА и ацетоацетат (рис. 12.40).
3-Аминобутирил-СоА дезаминируется путем
/3-элиминирования с образованием кротонил-СоА,
который восстанавливается до бутирил-СоА. Да-
лее происходит перенос СоА-группы от бутирил-
СоА на ацетоацетат с образованием бутирата и
ацстоацетил-СоА, который расщепляется па две
молекулы ацетил-СоА. На последнем этапе при
участии фосфат:ацетил-трансферазы и ацетатки-
назы синтезируется 1 моль ATP/моль лизина.
L-аргинин гидролизуется с образовани-
ем аммиака и L-цитруллина [реакция (12.138);
рис. 12.41], который далее в результате фосфоро-
лиза расщепляется на L-орнитин и карбамоилфос-
фат [реакция (12.139)]; фосфатная группа перено-
сится при этом па ADP [реакция (12.140)]. Сум-
марный процесс описывает уравнение (12.141).
Аргининдезимипаза
Б-аргинин+ 4- Н2О---------------->
—> L-Цитруллин 4- NHj-
AG0/ = -38 кДж/моль (12.136)
Глава 12. Анаэробный энергетический метаболизм 397
Рис. 12.40. Механизм расщепления З-оксо-5-аминогек-
сановой кислоты при участии ацетил-СоА в сравнении
с СоА-трансферазной реакцией.
Д. «Кислый» о-атом водорода З-оксо-5-аминогекса-
новой кислоты отщепляется в результате щелочного
гидролиза с образованием карбоксил-аниона, который
конденсируется с ацетил-СоА с образованием разветв-
ленного 1,3-диоксо-С8-интермедиата. При участии вы-
свобождающегося в реакции конденсации CoAS- про-
исходит расщепление 1,3-диоксоаминокислоты на аце-
тоацетат и (5)-3-аминобутирил-СоА.
Б. В СоА-трансферазной реакции 7-глутамил-анион
фермента (R2—СОО-) атакует тиоловый эфир с об-
разованием смешанного ангидрида — тиолового эфира
фермент—СоА, который аналогичным образом реагиру-
ет с карбоксил-анионом второй молекулы субстрата с
образованием CoA-эфира продукта реакции.
о Орнитин-карбамоилтрансфераза __
L-цитруллин + НРО4 + Н+--------------------------> Карбамоилфосфат2- + Ь-орнитин+ (12.137)
АС?0' = +29 кДж/моль
Карбамоилфосфат2- + ADP3- + Н2О + 2Н+---------------> СО2 + NH+ + АТР4- (12.138)
А А0' = — 29 кДж/моль
Суммарное уравнение:
Ьаргинин+ + ADP3- + 2Н2О + НРО^- + ЗН+ -> Ь-орнитин+ + СО2 + 2NH+ + АТР4- (12.139)
АС?0' — —38 кДж/моль
Рис. 12.41. Сбраживание аргинина с образовани-
ем орнитина. 1 — аргининдезиминаза; 2 — орнитин-
карбамоилтрансфераза; 3 — карбаматкиназа.
398 Часть III. Многообразие метаболических путей
Рис. 12.42. Сбраживание 5-аминовалериановой
кислоты у Clostridium viride. 1 — 5-аминовале-
рат-аминотрансфераза; 2 — глутаматдегидро-
геназа; 3 — 5-гидроксивалерат-дегидрогеназа;
4 — 5-гидроксивалерат-СоА-трансфераза;
5(а,б,в) — 5-гидроксивалерил-СоА-дегидратаза;
б — пента диеноил-СоА-редуктаза; 7 — 3-пен-
теноил-СоА-Д-изомераза; 8 — диспропорцио-
нирование 2-пентеноил-СоА с образованием
валериановой кислоты, пропионата и ацетата,
аналогичное диспропорционированию крото-
нил-СоА с образованием бутирата и ацетата.
В отсутствие внешних акцепторов электронов
под действием очищенной 5-гидроксива-
лерил-СоА-дегидратазы образуется только
4-пентеноил-СоА. В реакции (5в) происходит
регенерация FAD.
Хотя реакция образования карбамоилфосфа-
та является эндергонической, в клетках ее проте-
кание, очевидно, обеспечивает предшествующий
необратимый гидролиз аргинина. Необратимость
этого этапа приводит к накоплению в клетках
цитруллина, из-за. чего реакция последующего
фосфоролиза этого продукта сдвинута в направ-
лении образования карбамоилфосфата. Способ-
ностью превращать аргинин в орнитин облада-
ют по только грамположительныс бактерии, но
также многие грамотрицательныс бактерии и да-
же археи. Так, она обнаружена у Halobacterium
halobium, который в темноте в анаэробных усло-
виях использует аргинин в качестве источника
энергии.
Clostridium viride (кластер 3) содержит
три окрашенных в зеленый цвет фермента,
участвующих в катаболизме аминовалерата.
2 • 5-Аминовалерат 4- 2НзО —*
—> 2NH4 + Ацетат- 4- Пропионат- =
= Валерат- 4- Н+ (12.140)
Все анаэробы, растущие за счет брожения, вос-
станавливают пролин только до 5-аминовалерата.
поэтому последний должен накапливаться в среде
(при отсутствии организма, способного его разла-
гать). Известна только одна бактерия, способ-
ная сбраживать 5-аминовалерат, — С. viride (кла-
стер 3) (прежнее название—С. aminovalericum).
Путем трансаминирования с 2-оксоглутаратом
и последующего NADH-зависимого восстанов-
ления глутарового полуальдегида аминогруппа
5-аминовалерата заменяется на гидроксильную
группу (рис. 12.42). Образовавшийся в резуль-
тате этих реакций 5-гидроксивалерат активиру-
ется путем присоединения СоА. с образовани-
ем тиолового эфира [реакция (12.114)] и далее
в результате окислительного дегидратирования
превращается в 2,4-пентадиепои.п-СоА. Восста-
новление конъюгированных двойных 1,4-связей
приводит к образованию 3-пентсноил-СоА, кото-
рый изомеризуется в 2-пентеноил-СоА. На по-
следней стадии брожения происходит диспро-
порционирование 2-пентеноил-СоА с образова-
нием конечных продуктов брожения ацетата,
пропионата и валерата. При этом синтезируется
0,5 моль ATP/моль аминовалерата. Флавинсодер-
Глава 12. Анаэробный энергетический метаболизм 399
жащие ферменты гидроксивалергш-СоА-дегидра-
таза, 2,4-пентадиеноил-СоА-редуктаза и валерил-
СоА-дегидрогеназа окрашены в зеленый цвет, по-
скольку поглощают свет в красной (700 нм) и
желтой (450 нм) областях спектра.
II При сбраживании аминокислот почти все
они (17 из 20 входящих в состав белков) мо-
гут служить как донорами, так и акцептора-
ми электронов; изолейцин и валин использу-
ются исключительно как доноры электронов,
пролин — только как акцептор электронов.
Некоторые из аминокислот сбраживаются раз-
личными путями, но с образованием одних и
тех же продуктов. Так, продуктом сбражива-
ния глутамата как через В ^-зависимый путь,
так и через 2-гидроксиглутаратный путь являет-
ся бутират. Аналогичным образом лактат (про-
дукт катаболизма аланина) при его сбраживании
восстанавливается до пропионата как по рандо-
мизирующему пути (кофермепт-В12-зависимому;
рис. 12.24), так и по нерандомизирующему пути
(рис. 12.35).
12.2.4. Сбраживание N-гетероциклических
соединений происходит аналогично
сбраживанию аминокислот
Наиболее распространенные N-гетероцикличес-
кие соединения в природе — это входящие в состав
нуклеиновых кислот пуриновые и пиримидиновые
основания. К данному классу соединений отно-
сятся также креатин, присутствующий в мышеч-
ной ткани позвоночных, и никотиновая кислота —
компонент NAD. Степень окисления этих соедине-
ний в среднем равна 2, что делает их субстратами,
пригодными для брожения. В то же время такие
соединения, как индол, индо л ацетат и индол про-
пионат — продукты катаболизма триптофана — не
способен сбраживать ни один из известных мик-
роорганизмов, поскольку они слишком восстанов-
лены и не могут обеспечить запасание энергии при
данном типе энергетического метаболизма.
Пурины легко разлагаются до аммиа-
Гуанин 4- 7Н2О + 4Н+ —>
5NH+ + ЗСО2 + Ацетат- (12.141)
Аденин + 8Н2О + ЗН+ -> 5NHJ + 2СО2+
4-Формиат- 4-Ацетат- (12.142)
2Урат- 4- 12Н2О 4- 7Н+ 8NHJ 4- 6СО2+
4-2Формиат“ 4- Ацетат- (12.143)
Основным промежуточным продуктом деграда-
ции пуринов является ксантин, который образу-
ется из них в тех же реакциях, что при аэробной
деградации (см. гл. 9).
Пиримидины сбраживаются не так лег-
ко, как пурины □ Хорошо изучены лишь про-
цессы восстановления урацила и оротовой кисло-
ты. При росте на среде сложного состава бактерия
С. uracilium (не классифицированный организм)
восстанавливает урацил до дигидроурацила, ко-
торый далее гидролизуется с образованием СО2,
аммиака и /3-аланина [уравнение (12.146)].
Урацил 4- 2Н2О 4- ЗН+ 4- 2е- —>
NH+ 4- СО2 4- /3-Аланин (12.144)
В результате простого /^-элиминирования ^-ала-
нин превращается в /З-алапин-СоА и далее в
акрилоил-CoA, который через образование про-
пионил-СоА восстанавливается до пропионата
(см. рис. 12.36). Оротовая кислота, через обра^
зование аспартата восстанавливается С. oroticurr.
(кластер 14а) с образованием СОг, аммиака, аце-
тата и сукцината [реакция (12.147)].
Оротат- 4- 2НгО 4- ЗН+ 4- 2е- —>
—> NH4h 4- СО2 4- L-аспартат- (12.145)
Единственный известный микроорганизм, способ-
ный сбраживать никотиновую кислоту, — этс
С. barkeri (кластер 15).
Никотинат- 4- 4Н2О -> NH+ 4- СО2 4-
4- Ацетат- 4- Пропионат- (12.146)
Никотиновая кислота (пиридин-5-карбоксилат)
400 Часть III. Многообразие метаболических путей
Рис. 12.43. Путь сбраживания никотиновой
кислоты у Clostridium barkeri. 1 — никотинат-
гидролаза; 2 — 6-гидроксиникотинатредуктаза;
3 — б-оксоникотинатгидролаза; 4 — 2-гидроксиме-
тилглутаратдегидрогеназа; 5 — 2-гидроксиметил-
глутаратдегидратаза; б — 2-метиленглутаратму-
таза (кофермент В12); 7 — З-метилитаконат-Д-
изомераза; 8 — 2,3-диметил малатдегидратаза;
9 — 2.3-диметил малат-л иаза; 10 — пируватфер-
редоксин-оксидоредуктаза; 11 — фосфат-ацетил-
трансфераза; 12 — ацетаткиназа.
го пути брожения — это 2-метиленглутарат, об-
разующийся, возможно, в результате гидролиза
гетероцикла. Продукт этой реакции — енамин —
таутомеризуется, после чего происходит спон-
танный гидролиз амидной группы с образова-
нием 2-формилглутарата. После восстановления
2-формилглутарата с участием NADH до
2-гидроксиметилглутарата последний должен
легко дегидратироваться с образованием ненасы-
щенного соединения — 2-метиленглутарата. Сбра-
живание 2-метиленглутарата подробно изучено.
При участии кофермента-Bj 2 2-метилепглута-
рат изомеризуется в (В)-З-метилитаконат (2-ме-
тилен-3-метилсукцинат), который в свою оче-
редь изомеризуется в 2,3-диметилмалеиновую
кислоту (рис. 12.35). Последующее присоеди-
нение молекулы воды приводит к образованию
(2А,3<§)-диметилмалата, расщепляемого затем на
пируват и пропионат [реакция (12.81)]. Пиру-
ват окисляется пируват: ферредоксин-оксидоре-
дуктазой с образованием ацетил-СоА [реакция
(12.88)]. В этой реакции регенерирует восстанов-
ленный ферредоксин, необходимый для восста-
новления 5-гидроксиникотиновой кислоты. В ре-
зультате сбраживания 1 моль никотиновой кисло-
ты синтезируется 1 моль АТР.
Глава 12. Анаэробный энергетический метаболизм 401
Дополнение 12.8. В сбраживании ни-
котиновой кислоты у Clostridium barkeri
участвуют несколько необычных ферментов:
гидроксилаза никотиновой кислоты, 2-ме-
гиленглутаратмутаза и диметилмалат-лиаза.
ИАВР+-зависимая гидроксилаза, сходная с
ксантиндегидрогеназой (см. гл. 9), содержит
флавин, железо-серные центры, молибдопте-
рин (рис. 12.6) и даже селен, но не в форме се-
леноцистеина. Механизм действия кофермент
В 12-зависимой 2-метиленглутаратмутазы по-
казан па рис. 12.35. Расщепление (2R,3S)-
диметилмалата с образованием пирувата и
пропионата осуществляет фермент, сходный
по строению с изоцитрат-лиазой. Оба эти
фермента содержат реакционноспособную
SH-группу, но лишены, в отличие от цитрат-
лиазы и цитрамалат-лиазы, ацетил-Со А-по-
добной простетической группы (рис. 12.28).
Способностью сбраживать TV-гетероцикли-
ческие соединения обладает небольшая группа
клостридий и родственные им организмы, разла-
гающие пурины, пиримидины и никотиновую кис-
лоту. Катаболизм всех пуринов начинается с их
превращения в ксантин, который далее разлага-
ется с образованием аммиака, диоксида углеро-
да, формиата и глицина. Механизм разложения
пиримидинов исследован только для урацила и
оротовой кислоты. Эти соединения расщепляют-
ся с образованием /3-аланина и аспартата соответ-
ственно. Сбраживание никотиновой кислоты с об-
разованием аммиака, диоксида углеода, ацетата и
пропионата катализируют необычные ферменты,
характерные для этого пути брожения.
12.2.5. Синтрофные бактерии связывают
процессы брожения и метаногенеза
Среди разнообразных продуктов брожения толь-
ко ацетат, Щ, СОг и Ci-соединения используются
в качестве субстратов метаногенными археями,
тогда как пропионат, бутират и этанол не мо-
гут служить для них субстратами (разд. 12.1).
В отсутствие подходящих акцепторов электро-
нов, таких как нитрат или сульфат, эти соедине-
ния в анаэробных условиях трансформируются
в природной среде только синтрофными бакте-
риями (облигатными Н+-редукторами), которые
окисляют их до ацетата и Н2. Окисление прямо-
цепочечных жирных кислот, например бутирата,
синтрофными бактериями Syntrophobacter wolinii,
Syntrophomonas wolfei и Syntrophospora bryantii
(все они относятся к кластеру 8) описывается
уравнением (12.149).
Бутират- + 2Н2О —» 2Ацетат- 4- Н+ 4- 2Нг
AG0' = —48,1 кДж/моль бутирата (12.147)
Величина свободной энергии этой реакции тако-
ва, что в стандартных условиях она не может
протекать в направлении окисления бутирата.
Однако простой расчет, подобный приведенно-
му для уравнения (12.53), показывает, что при
парциальном давлении Н2, равном 10 Па, про-
цесс характеризуется равновесием (ДО' = 0)
и при величине парциального давления ниже
1 Па становится возможным синтез АТР. Имен-
но такое низкое содержание водорода в природ-
ной среде обеспечивается активностью метано-
генов, поэтому синтрофные бактерии могут су-
ществовать только совместно с метаногенами
(синтроф —от греч. crvvrpEipuj, кормить вме-
сте). Поскольку минимальное парциальное дав-
ление Н2, необходимое для роста метаногенов,
выше 0,1 Па, синтрофы могут получать толь-
ко примерно 20 кДж свободной энергии и это-
го едва достаточно для синтеза 1 /3 моль АТР.
Вероятно, они получают энергию не за счет
субстратного фосфорилирования через образо-
вание ацетилфосфата, но путем электронтранс-
портного фосфорилирования с использованием
энергии ДДн+ или АДиа+- Механизм создания
этих электрохимических потенциалов пока неиз-
вестен. Перенос водорода от синтрофных бак-
терий к метаногенам в растворе затруднен; по-
видимому, он осуществляется непосредственно
между клетками бактерий разных видов при
их прямом контакте. Данный феномен назван
межвидовым переносом водорода. В некото-
рых случаях водород переносится вместе с СО2
в форме формиата с участием формиат:водород-
лиазы [реакция (12.150)].
Н2 4-СО2 —» НСОО-4-Н+
AG'0' = 4-3,5 кДж/моль (12.148)
Для превращения пропионата в ацетат в консор-
ции синтрофов и метаногенов используются два
пути [уравнения (12.151) и (12.152)].
402 Часть III. Многообразие метаболических путей
Пропионат + Н2 + СО2 —> 2Ацетат + Н+
AG0/ = —23,7 кДж/моль пропионата. (12.149)
Пропионат-* + 2Н2О --> Ацетат- + ЗН2 4- COq
AG0/ = +71,3 кДж/моль пропионата (12.150)
В первом пути [уравнение (12.151)], не требующем
участия метаногенов, пропионил-СоА подверга-
ется восстановительному карбоксилированию с
образованием 2-оксобутирата. Эта реакция анало-
гична превращению ацетил-СоА в пируват, ката-
лизируемому пируват:ферредоксип-оксидорсдук-
тазой [реакция (12.88)]. Далее через реакции
восстановления и дегидратации, осуществляемые
при сбраживании 2-гидроксикислот (рис. 1.2.33),
2-оксобутират превращается в кротонил-СоА, ко-
торый окисляется с образованием двух молекул
ацетата. Во втором пути (уравнение 12.152), тре-
бующем, в отличие от первого, участия метано-
генов, пропионил-СоА через мети лмалони л-СоА
превращается в сукцинил-СоА (рис. 12.25), кото-
рый далее метаболизируется в цикле Кребса.
О превращениях ароматических кислот из-
вестно существенно меньше. Предположитель-
но они разлагаются с образованием бензоил-
СоА. Далее происходит восстановление [реакция
(12.16)], гидратация, окисление и расщепление
ароматического кольца с образованием ацетил-
СоА, кротонил-СоА и СО2, как это установлено
у денитрифицирующей протеобактерии Thauera
aiomatica.
Сбраживание полимерных углеводов, белков и
нуклеиновых кислот приводит, через превраще-
ние их в мономеры, к образованию таких конеч-
ных продуктов, как аммиак, H2S, ацетат, СО2 и
Н2. В отсутствие таких акцепторов электронов,
как нитрат или сульфат, единственным акцепто-
ром электронов при осуществлении ацетогеноза и
метаногенеза является СО2. Метаногены разлага-
ют ацетат до СЩ и СОо, так называемого «био-
газа» — конечного продукта функционирования
анаэробных трофических цепей. Диффундируя в
аэробную зону, метан окисляется метанотрофами
до СО2, который при участии фотосинтезирую-
щих организмов включается в следующий оборот
углеродного цикла. Синтрофные бактерии ис-
пользуют в качестве доноров электронов низшие
жирные кислоты (Е'о 320 мВ) и в качестве ак-
цепторов электронов протоны (Е'о = —420 мВ).
Соответственно эти процессы брожения являют-
ся эндергоническими, но в присутствии водород-
потребляющих микроорганизмов (обычно метано-
генов), т. с. при низком давлении Н2, они обеспе-
чивают синтез АТР. Водород переносится от спн-
трофпого организма к метаногену, не выделяясь
в среду (межвидовой перенос водорода).
12.3. Энергия запасается не только посредством
окислительно-восстановительных реакций
Аэробные хемотрофпые организмы получают
энергию, осуществляя окислительно-восстанови-
тельные реакции с участием О2 в качестве ак-
цептора электронов. В анаэробных условиях, как
описано в разд. 12.1, запасание энергии также
могут обеспечивать реакции, связанные с транс-
портом электронов, по не на кислород, а на раз-
личные органические или другие неорганические
акцепторы электронов. У большинства этих ак-
цепторов редокс-потенциал существенно ниже по
сравнению с О2, вследствие чего меньше и коли-
чество получаемой с их участием энергии для син-
теза АТР. Выход АТР при этом может быть да-
же ниже 1 моль/моль субстрата, как, например, в
процессах, осуществляемых ацетогспами и мета-
ногенами. Поэтому у анаэробов скорость превра-
щений субстрата по сравнению с аэробными мик-
роорганизмами должна быть существенно выше.
Для получения дополнительной энергии анаэро-
бы осуществляют реакции, не известные у аэро-
бов и не относящиеся к брожению или дыханию.
Они представляют третий тип процессов получе-
ния энергии и показывают, что дегидрирование
и связанный с ним перенос электронов —это хо-
тя и весьма распространенные, но не единствен-
ные способы запасания энергии, что служит еще
одним свидетельством разнообразия анаэробных
метаболических процессов.
Глава 12. Анаэробный энергетический метаболизм 403
При разложении аргинина с образованием ор-
итина образуется высокоэнергетическое со-
единение карбамоилфосфат, способный фос-
юрилировать молекулу ADP (рис. 12.41). Этот
иособ запасания энергии широко распространен
бактерий и архей, а также известен у некоторых
укариот, приуроченных к анаэробным местооби-
апиям.
Биотин-зависимые мембрапосвязанпые де-
арбоксилазы генерируют A/iNa+, как, на-
ример, оксалоацетатдекарбоксилаза в процессе
браживания цитрата (рис. 12.27), мстилмало-
ил-СоА-декарбоксилаза при декарбоксилирова-
ии сукцината с образованием пропионата у
^ropionigenium modestum (кластер 19 клостри-
дй; путь, сходный с пропионовокислым брожепи-
м; рис. 12.25) и глутаконил-СоА-декарбоксилаза,
чествующая в сбраживании 2-гидроксиглутара-
а (рис. 12.37). Образование A/ZNa+ может проис-
юдить в результате обмена энергией между свя-
анным с ферментом отрицательно заряженным
статном карбоксибиотина и не несущей заряда
юлекулой биотина.
В реакциях декарбоксилирования оксала-
?а и аминокислот происходит потребление од-
юго протона внутри клетки и продукт реакции
1есет на один отрицательный заряд меньше, чем
:убстрат. Молекула продукта выделяется из клет-
ей в обмен па поглощаемую молекулу субстрата с
счастием системы антипорта. В результате обра-
(уется Ацн+, достаточный для синтеза 1/3 моль
\ТР/моль субстрата. У Oxalobacter formigenes
ipoijecc декарбоксилирования оксалата с образо-
ванием формиата через этапы образования ок-
;алил-СоА и формил-CoA служит единственным
юточником энергии для роста (рис. 12.44).
Выделение лактата путем симпорта с дву-
ля протонами также приводит к образованию
Этот процесс обеспечивает дополнитель-
1ый источник энергии для молочнокислых бак-
терий, сбраживающих глюкозу с образованием
I моль лактата- и 2 моль Н+ па 1 моль глюкозы.
У метаногенов перенос метильной группы
эт атома N па SH-группу (АС?0/ = 30 кДж/моль)
юпровождается образованием A/iNa+. Таким спо-
собом запасается энергия в метилтрансферазной
эеакции при образовании метана (рис. 12.9 и
12.11), что служит для этих организмов источ-
шком энергии, помимо транспорта электронов с
^пользованием гетеродисульфида в качестве ак-
цептора электронов. В процессе переноса метпль-
Рис. 12.44. Сишез АТР, сопряженный с декарбок-
силированием оксалата, у Oxalobacter formigenes.
1 — оксалат2-/формиат- -антипортер; 2 — оксалат-СоА-
трансфераза; 3 — оксалоил-СоА-декарбоксилаза (тиа-
миндифосфат); Fi/Fo-ATP-синтаза.
ной группы метилированная форма кобамидного
кофермента [Со(Ш)], содержащая шесть коорди-
национных связей, превращается в пеметилиро-
ванную форму [Со(1)] с четырьмя координацион-
ными связями. При этом пятый лиганд кобальта,
концевой остаток гистидина в составе фермепта,
перемещается во время метилирования к атому
Со, тогда как деметилирование сопровождается
перемещением остатка гистидина в направлении
от атома Со. Предположительно именно это пере-
мещение служит движущей силой для натриевой
помпы.
Приведенные примеры показывают важную
роль процессов, не включающих окислительно-
восстановительные реакции, в получении энергии
у анаэробных бактерий.
Дегидрирование и транспорт электронов чаще
всего, но не обязательно служат условием образо-
вания высокоэнергетических соединений для суб-
стратного фосфорилирования либо электрохими-
ческого Н+- или Na+-потенциала для электрон-
трапспортного фосфорилирования. У анаэробов
для получения энергии используются также про-
цессы, не относящиеся к окислительно-восстано-
вительным.
404 Часть III. Многообразие метаболических путей
Дополнительная литература
Andreescn .1. R. (1994). Glycine metabolism in
anaerobes. Antonie van Leeuwenhoek 66: 223-327.
Barker H. A. (1961). Fermentations of nitrogenous
organic compounds. In Gunsalus I. C., Stanier R. Y.
(eds.). The bacteria. Vol. 2. New York: Academic
Press; pp. 151-207.
Barton L. L., cd. (1995). Sulfate-rcducing bacteria. New
York, London: Plenum Press.
Buckcl W. (1990). Amino acid fermentation: coenzyme
Bi2-dependent and -independent pathways. In:
The molecular basis of bacterial metabolism. 41st
Colloquium — Mosbach 1990 (Hanska G., Thauer R.,
eds.). Berlin, Heidelberg, New York: Springer;
pp. 21-30.
Buckel W. (1996). Unusual dehydrations in anaerobic
bacteria: considering ketyls (radical anions) as
reactive intermediates in enzymatic reactions. FEBS
Lett. 389: 20-24.
Buckel W., Barker H. A. (1974). Two pathways of
glutamate fermentation by anaerobic bacteria. .1.
Bactcriol. 117: 1248-1260.
Buckel W., Bobi A. (1976). The enzyme complex
citramalate lyase from Clostridium tetanomorphum.
Eur. .1. Biochem. 64: 255-262.
Buckcl W., Golding B.T. (1996). Glutamate and
2-methyleneglutarate mutase: from microbial
curiosities to paradigms for coenzyme Bi2-dependent
enzymes. Chem. Soc. Rev. 25: 329-337.
Collins M. D., Lawson P. A., Willems A., Cordoba J. J.,
Fernandez-Garayzabal .1., Garcia P., Cai .1.,
Hippe H., Farrow J. A. (1994). The phylogeny of
the genus Clostridium: proposal of five new genera
and eleven new species combinations. Int. J. Syst.
BacterioL 44: 812-826.
Dimroth R., Schink B. (1998). Energy conservation in the
decarboxylation of dicarboxylic acids by fermenting
bacteria. Arch. Microbiol, (in press). Drake II. L., ed.
(1994). Acetogenesis. Vols. 1-3. New York, London:
Chapman & Hall.
Ermler U., GrabarseW., ShimaS., Goubeaud M.,
Thauer R. K. (1997). Crystal structure of methyl-
coenzyme M reductase: The key enzyme of biological
methane formation. Science 278: 1457-1462.
Fontecillacamps J. C., Frey M., Garcin E., Hatchikian C.,
Montet Y., Piras C., Vernede X., Volbeda A. (1997).
Hydrogenase — a hydrogen-mctabolizing enzyme
What do the crystal structures tell us about its mode
of action? Biochimie 79: 661-666.
Kisker C., Schindelin H., ReesD.C. (1997). Molyb-
denum-cofactor-containing enzymes-structure and
mechanism. Annu. Rev. Biochcm. 66: 233-267.
Kroger A., Geisler V., Lemma E., Theis F., Longer R.
(1992). Bacterial fumarate respiration. Arch.
Microbiol. 158: 311-314.
LovleyD.R., Giovannoni S. .L, White D.C., Cham-
pine J. E., Philipps E. J., Gorby Y. A., Goodwin S.
(1993). Geobactcr metallireducens gen. nov. sp. nov.,
a microorganism capable of coupling the complete
oxidation of organic compounds to the reduction of
iron and other metals. Arch. Microbiol. 159: 336-344.
Schauder R., Kroger A. (1993). Bacterial sulphur
respiration. Arch. Microbiol. 159: 491-497.
Schink B. (1997). Energetics of syntrophic cooperation in
methanogenic degradation. Microbiol. Mol. Biol. Rev.
61: 262-280.
Thauer R. K., Joungermann K., Decker K. (1977).
Energy conservation in chemotrophic anaerobic
bacteria. BacterioL Rev. 41: 100-180.
Wagner A. F. V., Frey M., Neugebauer F.A., Schafer W.,
Knappe-I. (1992). The free radical in pyruvate
formate-lyase is located on glycine-734. Proc. Natl.
Acad. Sci. USA 89: 996-1000.
Widdcl F., Schnell S., Heising S., Ehrenreich A.,
Assmus B., Schink B. (1993). Ferrous iron oxidation
by anoxygenic phototrophic bacteria. Nature 362:
834-835.
Zumft W. G. (1997). Cell biology and molecular basis
of denitrification. Microbiol. Mol. Biol. Rev. 61:
533-616.
Источники рисунков
1. Berks В. C., Page M. D., Richardson D. .1., Reilly A.,
Cavill A., Outen F., Ferguson S..I. (1995). Mol.
Microbiol. 15: 319-331.
2. Weiss D. S., Thauer R. K. (1993). Cell 72: 819-822.
Глава 13
Использование света прокариотами
Первичным источником свободной энергии, по-
требляемой живыми организмами, служит сол-
нечная энергия. Превращение энергии света в
химическую энергию — это важнейший биологи-
ческий процесс, возникший на раннем этапе эво-
люции. Механизм передачи световой энергии в
реакционные центры построен по одному и то-
му же принципу у высших растений, водорослей,
цианобактерий, пурпурных бактерий и зеленых
бактерий. Пигменты, поглощающие свет, белки в
составе пигмент-белковых мембранных комплек-
сов и окислительно-восстановительные компонен-
ты фотосинтетического аппарата у всех фотосин-
тезирующих организмов в основном сходны, одна-
ко по механизму фотосинтез разделяется на два
типа—оксигеппый (с образованием кислорода) и
Таблица 13.1. Группы аноксигенных фототрофных бактерий. Под номерами 1-6 приведены группы из некоторых
репрезентативных родов, определенные на основе нуклеотидной последовательности 16S-pPHK; буквы а, /3 и 7 обо-
значают соответствующие отделы протеобактерий. Подвижность: (+)—движение с помощью жгутиков; (+/—) —
подвижностью обладают не все виды; Ск— скользящее движение. Локализация антенны: (+/—)— во внутрикле-
точных мембранах, плазматической мембране (ПМ) или хлоросомах. РЦ I и II — реакционные центры I и II
(см. текст). Другие ферменты — кроме рибулозо-1,6-бисфосфат-карбоксилазы организмы обладают и другими
карбоксилазами, при этом цикл Кальвина (+) может быть основным путем фиксации СОг
165-рРНК-классификация Подвижность Окраска по Грамму Локализация антенн X LQ Тип фотосистем Ферменты цикла Кальвина Другие ферменты H2S или So как единственные доноры е" Глобулы серы внутри клеток Факультативная хемотрофия (аэробные условия, темнота) Фотоавтотрофия облигатная или как основной тип питания
Группа Роды Внутрицитоплазматические мембраны РЦ
1 Chromatium Y + - а или b II + (+) 4- + +/- +
Thiocapsa - - а или b И + (+) + + +/- +
Thiocystis + - а II + (+) + + +/- 4-
Amoebobacter - - а II + (+) + +/-
2 Ectothiorhodospira + - а или b II + (+) - - -/+ +
3 Rhodobacter (X +/- - а II + (+) - - +/-
Rhodopseudomonas +/- - а или b II + (+) - - +
Rhodospirillum + - а II + (+) - - +
Rhodocyclus ₽ +/- - +\- а II + (+) - - -
4 Heliobacillus Грам- пол ОЖИТ. + + ПМ д 1 + - - - -
Heliobacterium Ск + д + - - - -
5 Chlorobium Зеленые серные бактерии - - Хлоросомы + ПМ а + с 1 - + + - - +
Prosthecochloris - - а+с, d, е 1 - + + - - +
6 Chloroflexus Зеленые б-рии Ск - а + с II - + - - + -
406 Часть III. Многообразие метаболических путей
аноксигенный (без образования кислорода). Окси-
генный тип фотосинтеза присущ всем фототроф-
пым эукариотам (растения и водоросли) и двум
группам прокариот — цианобактериям и прохло-
рофитам. Пурпурные и зеленые бактерии, а также
гелиобактерии осуществляют аноксигенный фо-
тосинтез (табл. 13.1). В результате аноксигенно-
го фотосинтеза на фотосинтетической мембране
образуется электрохимический протонный потен-
циал, используемый для синтеза АТР и в дру-
гих энергопотребляющих процессах (см. гл. 4).
Аноксигенные фототрофпые бактерии содержат
фотохимические реакционные центры одного ти-
па. В отличие от этого у оксигенных фототрофов
последовательно соединены реакционные центры
двух типов — фотосистемы I и фотосистемы II.
При оксигенном фотосинтезе образуется электро-
химический протонный потенциал и восстанови-
тельные эквиваленты в виде NADPH, исполь-
зуемые для фиксации СОг- Высокое сходство в
организации и механизме функционирования фо-
тосинтетического аппарата у организмов различ-
ных уровней указывает па то, что он возник в
процессе эволюции только один раз.1 У эука-
риот фотосинтетический аппарат локализован в
хлоропластах — органеллах, происхождение кото-
рых предположительно связано с симбиотически-
ми цианобактериями.
13.1. В фотосинтезе участвуют три группы пигментов
К фотосинтетическим пигментам относятся хло-
рофиллы, каротиноиды и фикобилипротеины.
Хлорофиллы осуществляют фотохимический
процесс передачи энергии света в реакционные
центры. Поглощение фотонов, образование и пе-
ренос энергии возбужденного состояния моле-
кул обеспечивают пигменты светособирающих
антенн — каротиноиды, хлорофиллы и фикобили-
протеипы (рис. 13.1-13.4). Хлорофиллы (Хл),
пигменты фототрофных кислород-образующих
(оксигенных) организмов, и бактериохлоро-
филлы (Бхл), пигменты аноксигенных фото-
трофных бактерий, представляют собой цикли-
ческие тетрапирролы с дополнительным пятым
изоциклическим кольцом, в которое замыкается
боковая цепь в виде остатка пропионовой кислоты
у С13-атома протопорфирина (рис. 13.1, структу-
ра 2). Четыре атома азота пиррольных колец свя-
заны координационными связями с атомом Mg.
Молекулы большинства Хл и Бхл этернфици-
рованы длинноцепочечпым гидрофобным спир-
том фитолом по четвертому пиррольному кольцу.
Благодаря наличию в молекулах сопряженной си-
стемы чередующихся одинарных и двойных свя-
зей хлорофиллы и бактериохлорофиллы высоко-
эффективно поглощают свет в видимой, ближней
ультрафиолетовой и ближней инфракрасной об-
ластях спектра. В клетках молекулы хлорофил-
ла нековалентпо связаны с белками: высококон-
сервативный остаток гистидина в составе гид-
рофобного о-спиралыюго участка пигмепт-евя-
зывающего белка представляет собой, вероятно,
пятый лиганд центрального атома Mg. Карбо-
нильные группы, присоединенные к тстрапир-
рольному кольцу (Ri в Бхл а и Ь\ рис. 13.1),
образуют водородные связи с определенными
группами в составе полипептидов. Гидрофобные
взаимодействия между бактериохлорофилом и
белковыми участками влияют также на локали-
зацию и ориентацию тетрапирролыюго кольца
в белковом окружении. В результате пигмент-
белковых и пигмент-нигмептпых взаимодействий
полосы поглощения нижнего синглетного уровня
хлорофиллов сдвигаются в более длинноволно-
вую область спектра (рис. 13.3). Например, ин-
фракрасная полоса поглощения Бхл а в растворе
(смесь метапол-ацетон) находится при 770 нм,
тогда как область его поглощения в мембрано-
связанном комплексе с белком — при 800-880 нм.
Известно шесть типов бактериохлорофиллов
(а, Ь, с, d, е, д') и два типа хлорофиллов (а, Ь).
Хл а и Бхл а, b и д выполняют функцию фото-
химически активных пигментов в составе реак-
ционных центров. Кроме того, вместе с другими
пигментами они входят в состав светособирающих
комплексов — антенн (табл. 13.1 и рис. 13.1).
1 См. прим, в гл. 29 (вед. ред.).
Глава 13. Использование света прокариотами 407
Рис. 13.1. Структура тетрапиррольно-
го кольца в молекулах хлорофиллов
и бактериохлорофиллов. 1 — нумера-
ция атомов углерода в тетрапирроль-
ном кольце порфирина; 2 — нумера-
ция атомов в структуре хлорофилла а;
R1-R7 — заместители в молекуле хло-
рофилла а, варьирующие в молекулах
бактериохлорофиллов (Бхл; показаны
в таблице); Me — метильная группа;
серым фоном показана система со-
пряженных двойных и одинарных свя-
зей; 3 — структура этерифицирующих
спиртов в положении Rg. Углеродные
атомы С7 и С8 тетрапиррольного коль-
ца в молекулах Бхл с, d и е свя-
заны насыщенной связью, в молеку-
лах Бхл а и b — ненасыщенной связью.
Звездочка в графе Rz означает на-
личие двойной связи между атомами
С7 и С8. Поглощение — длинноволно-
вая полоса поглощения пигмента, свя-
занного с белком, in vivo.
Пигмент Ri R2 Re R? Поглощение, нм
Бхл а -CO-CH, -сн, -СН2СН, -сн. -со-осн, Фитил или геранил- геранил -н 800-880
Бхл b -CO-CH, -сн. =сн-сн, -сн, -со-осн, Фитил или фитади- енил -н 1020
Бхл с -СНОН -сн, -сн,* от -С2Н5 до -С,Н9 от -СН, до -С2Н5 -н Фарнезил или стеарил -сн, 750
Бхл d -СНОН -сн3 -СН,* от -С2Н5 до -С5Нн от -СН, до -С2Н5 -Н Фарнезил -н 725-745
Бхл с -СНОН -сн, -сно* от -С2Н5 до-С4Н9 -С2Н, -н Фарнезил -сн, 715-725
Бхл g -сн=сн, -СН,* =СН-СН, сн, -со-осн. Фарнезил или геранил- геранил -н 788
Рис. 13.2. Структура некоторых каротиноидов пурпур-
ных и зеленых бактерий. Спектральные и функциональ-
ные свойства каротиноидов определяются сопряженной
системой двойных связей (показана серым).
2,5 г-
о.оLi 1 1...1....7 "'“1 1 \i
400 500 600 700 800 900 1000 1100 нм
Рис. 13.3. Спектры поглощения мембраносвязанных
пигмент-белковых комплексов из различных фототроф-
ных бактерий. Зеленая нитчатая бактерия, обладающая
способностью к скользящему движению, Chloroflexus
aurantiacus (сплошная линия) содержит в качестве ос-
новного пигмента Бхл с (поглощение при 740 нм), лока-
лизованный в хлоросомах, а также Бхл а (865 нм) и ка-
ротиноиды (496 нм). Rhodopseudomonas palustris (штри-
ховая линия) содержит Бхл а (370, 590, 803 и 860 нм) и
каротиноиды (462 нм). Rhodcpseudomonas viridis (пунк-
тирная линия) содержит Бхл b (370, 600 и 1020 нм) и
каротиноиды (449 и 482 нм). У Rps. palustris и Rps. viridis
пигменты локализованы в ламеллярных внутриклеточ-
ных мембранах.
408 Часть III. Многообразие метаболических путей
Рис. 13.4. Тетрапирролы с незамкнутой структурой —
фикоцианобилин и фикоэритробилин — входят в со-
став фикобилипротеинов, светособирающих пигментов
фотосистемы II цианобактерий (см. рис. 13.11). Они
состоят из двух белковых субъединиц, несущих фико-
билины в качестве простетических групп. Фикоциано-
билин синтезируется из порфирина путем отщепления
от него одного атома углерода в форме СО. Про-
стетическая группа связана с белком через остаток
цистеина (—Cys—). Основная полоса поглощения фи-
кобилипротеинов, 565-670 нм, заполняет промежуток
между полосами поглощения хлорофилла а и кароти-
ноидов в видимой части спектра (рис. 13.5). Таким об-
разом, цианобактерии способны поглощать свет в широ-
ком диапазоне — от ультрафиолетовой до инфракрасной
области спектра. Положение максимумов поглощения
фикобилипротеинов зависит от ряда факторов, вклю-
чая степень их агрегации. В фикобилисомах мономеры
фикобилипротеинов соединены связывающими белками
(рис. 2.14 и 13.11).
Рис. 13.5. Спектры поглощения пигмент-белковых ком-
плексов цианобактерий.----хлорофилл а (Хл а);----
фикоэритрин;....../3-каротин;---фикоцианин.
Каротиноиды представляют собой поли-
еновые соединения, обычно тетратерпеноиды,
варьирующие по числу и химической природе за-
местителей (рис. 13.2). Благодаря наличию в их
молекулах сопряженных систем двойных связей
каротиноиды выполняют функцию светособираю-
щих пигментов. Кроме того, они предотвращают
вредные для клеток реакции фотоокисления, вы-
зываемые синглетным кислородом. Лишенные ка-
ротиноидов мутанты пурпурных бактерий погиба-
ют в течение нескольких секунд при освещении в
присутствии кислорода.
У цианобактерий, красных и некоторых
криптофитовых водорослей в поглощении света
участвуют фикобилипротеины. Эти пигменты
состоят из белковых субъединиц, несущих в каче-
стве простетических групп фикобилины. Струк-
туру фикобилинов образуют четыре пиррольных
кольца, соединенных метиленовыми или мстино-
выми группами, т. с. фикобилины — это нецик-
лические тетрапирролы (рис. 13.4). С полипеп-
тидной цепью фикобилиновая группа связана
через тиоэфирпую связь с остатком цистеина. Фи-
кобилипротеины, к которым относятся фикоциа-
нин, фикоэритрин и аллофикоциапин, поглоща-
ют фотоны в диапазоне длин волн 480-650 нм
(рис. 13.5), выполняя роль светособирающих мо-
лекул.
Хлорофилл а, бактериохлрофиллы a, b, с, d, е
и р, фикобилипротеины и каротиноиды — это пиг-
менты, молекулы которых содержат сопряжен-
ную систему чередующихся одинарных и двойных
связей и благодаря этому эффективно поглоща-
ют свет в ближней ультрафиолетовой, видимой
и ближней инфракрасной областях спектра. Они
связаны ковалентными или нековалсптными свя-
зями с белками фотосинтетического аппарата и
выполняют функцию поглощения и передачи све-
товой энергии.
Глава 13. Использование света прокариотами 409
13.2. Зеленые бактерии, пурпурные бактерии и гелиобактерии
осуществляют аноксигенный фотосинтез
13.2.1. У пурпурных бактерий светособирающие
системы представляют собой связанные
с мембранами пигмент-белковые
комплексы
Светособирающие антенны выполняют функцию
поглощения фотонов и преобразования их энер-
гии в энергию синглетного возбужденного состо-
яния Бхл. Молекулы каротиноидов и бактерио-
хлорофиллов нековалентно связаны с интеграль-
ными мембранными белками таким образом, что
тетрапиррольпые кольца находятся в строго фик-
сированном положении по отношению друг к
другу и к плоскости мембраны. Пигмент-белко-
вые комплексы образуют олигомерные структу-
ры, обеспечивающие оптимальный путь перено-
са энергии на реакционный центр. Большинство
светособирающих комплексов у пурпурных бак-
терий локализовано во внутриклеточных мем-
бранах (см. рис. 2.11, 2.12 и 13.6). Ориентация
молекул бактериохлорофилла может быть проде-
монстрирована с помощью абсорбционной спек-
троскопии с использованием линейпополяризо-
ванного света. Заряженные группы в участках
связывания белков и электрическое сопряжение
между хромофорами влияют па спектр поглоще-
ния in vivo. Среднее число молекул Бхл па один
реакционный центр, т. е. размеры фотосинтети-
Рис. 13.6. Модель внутриклеточной мембраны пурпурной бактерии Rhodobacter capsulatus и родственных видов.
Реакционный центр (РЦ; выделен темно-серым) состоит из белковых субъединиц М, L (ML) и Н. С субъединица-
ми М и L связаны: специальная пара молекул Бхл [(Бхл)г] (первичный донор), две молекулы мономерного Бхл,
две молекулы бактериофеофитина (Бфф), убихиноны А и В (UQa и UQb) и атом Fe. Субъединица Н не содер-
жит пигментов. Реакционный центр окружен пигмент-белковыми комплексами внутренней антенны В870 (CCA I),
передающей энергию возбуждения непосредственно на РЦ. Две спирали изображают низкомолекулярный транс-
мембранный белок, с которым связаны две молекулы Бхл. Символы Qy (870 нм, порфириновое кольцо I—III) и Qx
(590 нм, порфириновое кольцо II-IV) означают положение тетрапиррольного кольца в различной ориентации от-
носительно плоскости мембраны, определяемое путем спектроскопии в линейнополяризованном свете. При низкой
интенсивности света доминирующим комплексом становится периферическая антенна CCA II (В800-850), в которой
объединены различные фотохимические единицы, образующие эффективную систему передачи и распределения
энергии возбужденного состояния. Два полипептида, входящие в состав CCA II, связывают три молекулы Бхл. из
которых одна отличается от двух других по ориентации относительно плоскости мембраны. Мембранный пул хино-
нов (Q/QH2) связывает РЦ с комплексом цитохромов b/ci. содержащим цитохром Ci (Ci), цитохром b с высоким
потенциалом (цит Ьн) и цитохром Ь с низким потенциалом (цит £>l)- Перенос электронов между комплексом цито-
хромов b/ci и РЦ осуществляет цитохром с2, локализованный в периплазматическом пространстве. Образующийся
на мембране протонный градиент обеспечивает синтез АТР из ADP и Pi, катализируемый Н+:АТР-синтазой (FxFo).
410 Часть 111. Многообразие метаболических путей
ческой единицы, варьирует в генетически детер-
минированных пределах, изменяясь в зависимо-
сти от условий роста, главным образом интен-
сивности света (см. разд. 24.2). В результате
поглощения фотона один из электронов хромо-
фора, занимающий молекулярную орбиталь низ-
шего энергетического уровня, перемещается на
незанятую в основном состоянии орбиталь. Таким
образом энергия фотона используется для пере-
вода электрона па более высокий энергетический
уровень и всей молекулы в возбужденное состоя-
ние. Время жизни возбужденного состояния для
молекулы Бхл а составляет примерно 0,1—0,2 нс
(1 нс = 10“12 с). Перенос энергии возбуждения
между' молекулами Бхл в пределах одного свс-
тособираюгцего комплекса имеет очень высокую
скорость (0,1-0,2 пс па один акт переноса). Боль-
шинство фотосинтетических систем гетерогенно
по своему пигмепт-белковому составу, чем обу-
словлена множественность полос поглощения в
инфракрасной области спектра. Различные по-
лосы поглощения обусловлены наличием специ-
фических пулов пигмент-белковых комплексов.
Они организованы таким образом, что пигменты,
поглощающие фотоны в коротковолновой части
светового спектра (т. е. фотоны с высокой энерги-
ей), располагаются па периферии светособираю-
щей системы (антенны), в то время как пигмен-
ты, поглощающие свет в длинноволновой обла-
сти спектра (фотоны с низкой энергией), непо-
средственно прилегают к реакционному центру
(РЦ). Внутри гомогенной популяции пигмепт-бел-
ковых комплексов быстро устанавливается равно-
весие плотности возбуждения. Перенос возбуж-
дения по светособирающей антенне на реакцион-
ный центр пе является линейным процессом и
зависит от многих факторов — интенсивности по-
ступающего потока световой энергии, размеров и
строения антенны, расстояний между молекула-
ми пигмента, перекрывания полос эмиссии его до-
норных молекул и полос поглощения акцептор-
ных молекул, температуры среды и состояния РЦ.
В «открытом» состоянии РЦ способен быстро по-
лучить энергию возбуждения, в «закрытом» со-
стоянии — когда этот первичный донор электро-
нов находится в действии, т. с. в процессе окис-
ления, — оп не может получить энергию и ее пе-
ренос па РЦ тормозится. Перенос энергии воз-
буждения между слабо связанными (разделен-
ными относительно большим расстоянием) пиг-
ментами происходит посредством диполь-диполь-
ного индуктивного резонанса (механизм Фёрсте-
ра) и распространяется на очень далекое рассто-
яние (до 2 нм), занимая время от 0,1 до 1,0 пс
на один акт переноса. Перенос энергии между
тесно взаимодействующими пигментами (рассто-
яние ~0,5 нм) происходит посредством двух дру-
гих механизмов. Энергия возбуждения мигриру-
ет' через различные популяции пигментов све-
тособирающей антенны к РЦ и захватывается
реакционным центром за время, примерно рав-
ное 50 пс (открытый РЦ), или за время >200 пс
(закрытый РЦ). Энергия возбуждения мигриру-
ет от пигментов, поглощающих свет в более ко-
ротковолновой области, к поглощающим в бо-
лее длинноволновой области, что сопровождается
снижением свободной энергии кванта. Например,
Крт => (Бхл) В800 => В850 => В870 => РЦ
1L_________Ltt_____it______it_____it
(Крт — каротиноиды; В — полоса поглощения пиг-
мента.)
Энергия возбуждения, которая не может быть
захвачена реакционным центром, рассеивается в
форме теплоты или флуоресценции. Стадией, ли-
митирующей суммарную скорость светособираю-
щего процесса, является перенос энергии возбуж-
дения от внутренней антенны на РЦ.
Внутреннюю антенну у пурпурных бакте-
рий, называемую светособирающей антенной I
(CCA I), формируют молекулы Бхл, окружаю-
щие реакционный центр. У Rhodobacter capsulatvs
это Бхл а В870, у Rhodopscudomonas viridis —
Бхл Ь В1020. Обычно CCA I содержит примерно
25-30 молекул бактериохлорофилла па один реак-
ционный центр (рис. 13.6 и 13.7).
У большинства пурпурных бактерий в со-
ставе светособирающего комплекса имеется так-
же периферическая вариабельная антенна
(ССА II) с основной полосой поглощения, обу-
словленной Бхл а, между 820 и 860 нм и вто-
рой полосой поглощения при 800 нм (рис. 13.3).
Комплекс CCA II состоит из белкового а, /3-гете-
родимера (мол. массой 5-7 кДа) и пековалент-
но связанных с ним трех молекул Бхл а и 1-2
молекул каротиноидов. Из таких субъединиц об-
разуются олигомерные комплексы (до нонаме-
ров). У Rhodopseudomonas acidophila активная
единица комплекса CCA II состоит из двух спи-
ральных белковых субъединиц в виде концентри-
ческих цилиндров, пронизывающих мембрану, и
расположенных между ними восемнадцати моле-
кул Бхл п, образующих непрерывную систему.
Глава 13. Использование света прокариотами 411
Рис. 13.7. Схематическое изображение первичных ре-
акций аноксигенного фотосинтеза в реакционном цен-
тре II типа. Световая энергия, поглощаемая перифе-
рической антенной В800-850 (CCA II), преобразуется
в энергию возбужденного состояния пигментов, пере-
дается во внутреннюю антенну В870 (CCA I) и далее
на РЦ (выделен светло-серым), где происходит фото-
химический процесс преобразования ее в химическую
энергию. Акцептором энергии возбужденного состояния
в РЦ служит специальная пара молекул (димер) Бхл
(Р, в состоянии возбуждения Р*). За время 3 пс форми-
руется катион-радикал [Бхлг](Р+), который через мо-
номер Бхл передает электроны на бактериофеофитин
(Бфф). Бактериофеофитин за время, не превышающее
200 пс, передает электрон на убихинон A (Qa)- Процесс
разделения зарядов на мембране, обладающей свой-
ствами диэлектрика, завершается образованием P+Q“.
В результате на ней возникает разность окислительно-
восстановительных потенциалов. Последующие процес-
сы использования запасенной световой энергии описаны
в тексте. QH2—убихинол; Сг — цитохром сг-
Девять дополнительных молекул Бхл а локали-
зованы между наружными спиралями, так что
плоскость их тетрапиррольных колец ориенти-
рована перпендикулярно оси спирали трансмем-
бранных белков.
Молекулы каротиноидов, входящие в состав
CCA II, переплетены с фитольными цепями Бхл,
что способствует эффективному переносу энергии
возбуждения между молекулами пигментов. В со-
став CCA II входит также третий белок, не свя-
занный с пигментами и выполняющий функцию
стабилизатора этого пигмент-белкового комплек-
са. Относительные размеры дополнительной све-
тособирающей антенны (содержание CCA II от-
носительно комплекса CCA 1 при РЦ) зависят
от условий выращивания бактерий, особенно от
интенсивности света. При низкой освещенности
синтезируется дополнительное количество компо-
нентов CCA II и она становится доминирующим
пигмент-белковым комплексом. Соответственно
увеличиваются и размеры фотосинтетической
единицы (количество молекул Бхл антенны в рас-
чете на реакционный центр), т. е. светособира-
ющая площадь антенны значительно возраста-
ет. Некоторые фототрофные бактерии, такие как
Rhodopseudomonas palustris, Rhodopseudomonas
acidophila и Chromatium vinosum, способны в от-
вет на изменение освещенности и температуры
синтезировать множественные CCA II, различные
по составу белков. С реакционным центром ком-
плексы CCA II, вероятно, связаны через внутрен-
ние антенны, CCA I (рис. 13.6 и 13.7). Эффектив-
ность передачи энергии от периферической антен-
ны на РЦ достигает 95%.
Дополнение 13.1. Субъединица перифе-
ричсс кой светособирающей антенны (CCA II)
представляет собой гетсродимер из поли-
пептидов о и /3 (мол. массой примерно
5-7 кДа), с которым связаны Бхл а и кароти-
ноиды в стехиометрическом соотношении 1:1.
С помощью методов резонансной раманов-
ской спектроскопии и рентгеновской спектро-
скопии высокого разрешения удалось устано-
вить характер связи молекулы Бхл с белком.
Высококонсервативные остатки гистидина в
трансмембранной о-спирали белка, локализо-
ванные на периплазматической стороне мем-
браны, взаимодействуют в качестве пятых
лигандов с центральным атомом Mg в мо-
лекуле Бхл. Карбонильные и кето- боковые
цепи тетрапиррольного кольца образуют до-
полнительные водородные связи с заря-
женными группами аминокислотных остат-
ков, расположенных вблизи тетрапирроль-
ной структуры. Фитольная боковая цепь
Бхл взаимодействует с гидрофобными транс-
мембранными участками полипептидов. Та-
кие мономерные субъединицы антенны по-
глощают свет in vivo при 820 нм. Образу-
емые ими олигомерные ССА П-комплсксы
(см. рис. 24.6, А) имеют полосу поглощения
в ближней инфракрасной области при 870-
880 нм.
Светособирающие антенны у пурпурных бак-
терий представляют собой олигомерные пигмент-
белковые структуры, локализованные во внутри-
клеточных мембранах. Пигменты в составе антен-
ны поглощают световую энергию и переходят в
возбужденное синглетное состояние, энергия ко-
412 Часть III. Многообразие метаболических путей
торого передается па другие молекулы пигмен-
тов или рассеивается в результате эмиссии света
(флуоресценции) либо выделения тепловой энер-
гии. Достигнув реакционного центра, энергия воз-
бужденного состояния трансформируется в нем в
энергию разности потенциалов па мембране.
13.2.2. У зеленых бактерий светособирающие
системы локализованы в хлоросомах,
у гелиобактерий — в плазматической
мембране
Известны две группы фототрофных зеленых бак-
терий: 1) неподвижные зеленые или бурые сер-
ные бактерии (например, Chlorobium, облигат-
ные анаэробы и фотоавтотрофы) и 2) анаэроб-
ные или факультативно аэробные, нитчатые, зеле-
ные или желто-зеленые, обладающие скользящим
движением бактерии Chloroflexus, способные рас-
ти как фотоавтотрофы, но по основному типу пи-
тания— фотогетеротрофы (табл. 13.1)? Для обе-
их групп характерно наличие в клетках хлоро-
сом— богатых липидами везикул продолговатой
формы, локализованных в цитоплазме и связан-
ных с плазматической мембраной через свою ба-
зальную пластинку, имеющую кристаллическую
структуру (рис. 2.13 и 13.8). Вероятно, базаль-
ная структура содержит Бхл а в составе пигмент-
белкового комплекса. Хлоросома отделена от ци-
топлазмы одинарной липидной мембраной, в со-
став которой входят молекулы белка. Внутрен-
няя часть хлоросомы заполнена пучками палоч-
ковидных структур, содержащих агрегаты моле-
кул Бхл с, d или е (рис. 13.1 и 13.8). Молекулы
Бхл с не связаны с белками. На один реакционный
центр приходится примерно 1000 молекул Бхл с,
d или е. В составе хлоросом присутствуют так-
же липиды и каротиноиды. Локализованный в ба-
зальной пластинке или плазматической мембране
Бхл а осуществляет перенос энергии возбуж-
денного состояния от хлоросом на реакционный
центр (первичный донор Р840), расположенный
в мембране. Максимум поглощения большинства
перечисленных Бхл находится в ближней инфра-
красной области спектра. Весь процесс переноса
энергии занимает несколько десятков пикосекунд.
Рис. 13.8. Структура хлоросомы. По данным электрон-
ной микроскопии и биохимических исследований, хло-
росомы прикреплены к внутренней стороне плазмати-
ческой мембраны посредством белковой базальной пла-
стинки. Поглощение света происходит в цилиндрических
структурах, состоящих из линейно расположенных моле-
кул Бхл с, d или е, которые выполняют функцию свете
собирающей антенны. Антенна связана с реакционным
центром (РЦ), локализованным в плазматической мем-
бране, через Бхл а, присутствующий в базальной пла-
стинке. FiFo — ATP-синтаза; ССА — светособирающая
антенна.
[Бхл с => Бхл а 795] =>
Хлоросома
=> [Бхл а 809] =>
Базальная пластинка
=> [Бхл а 813-836 => Р840]
Мембрана
Дополнение 13.2. Бактериохлорофилл д
существует в трех спектральных формах —
В778, В793 и В808. Энергия возбуждения
быстро аккумулируется в длинноволновом
комплексе В808. Время жизни возбужденного
состояния пигментов антенны, В778 и В793,
составляет менее 1 и примерно 2 пс соот-
ветственно. Затухание возбужденного состо-
яния Бхл В808 характеризуется временными
константами, равными приблизительно 4, 20
и 100 пс. Основная, короткоживущая ком-
понента кинетики этого процесса (примерно
равная 4 пс) отражает, по-видимому, перенос
энергии возбужденного состояния от В808 на
реакционный центр.
1 К настоящему времени выделена новая группа нитчатых зеленых бактерий — род Oscillochloris. Это облигатные анаэ-
робы и фотоавтотрофы, способные к скользящему движению. — Прим, перев.
Глава 13. Использование света прокариотами 413
Гелиобактерии (табл. 13.1) не содержат хло-
росом. Фотохимические реакционные центры ло-
кализованы у них в плазматической мембране и
связаны с 30-40 светособирающими молекулами
Бхл д (рис. 13.1).
Хлоросомы зеленых серных и несерных бак-
терий— это богатые липидами везикулы про-
долговатой формы, связанные с плазматической
мембраной и содержащие основную часть светосо-
бирающих бактериохлорофиллов с, d или е, моле-
кулы которых уложены в виде агрегатов-стопок.
Хлсросомы аналогичны по строению фикобили-
сомам цианобактерий. У гелиобактерий светосо-
бирающий пигмент (Бхл д) локализован в плаз-
матической мембране.
13.2.3. В фотохимических реакционных центрах
энергия фотонов используется
для разделения зарядов
У фототрофных организмов — высших растений,
водорослей и фотосинтезирующих бактерий —
обнаружено два типа реакционных центров —
РЦ I и РЦ II. Реакционные центры II типа
присутствуют у серных и несерных пурпурных
бактерий (например, Rhodopseudomonas viridis,
Rhodobacter sphaeroides и Chromatium vinosum),
зеленых несерных бактерий Chloroflexus, ци-
анобактерий и фототрофных эукариот. Моле-
кулярная структура реакционного центра этого
типа детально исследована у Rhodopseudomonas
viridis и Rhodobacter sphaeroides. Подобные по
структуре, составу и функции РЦ характерны
для всех пурпурных бактерий, зеленых бакте-
рий рода Chloroflexus, цианобактерий и расте-
ний (в последних двух случаях они составляют
основу фотосистемы II) (рис. 13.7 и 13.9). Ре-
акционные центры I типа присутствуют у зе-
леных серных бактерий (например, Chlorobium
limicola и Prosthecochloris aestuarii), грамположи-
тельных бактерий Heliobacterium chlorum и He-
liobacillus mobilis, цианобактерий (например, Апа-
cystis nidulans и Anabaena variabilis), водорослей
и высших растений (у цианобактерий и фототро-
фов-эукариот они представляют фотосистему I)
(рис. 13.10 и 13.11).
Рис. 13.9. Система циклического транспорта электро-
нов у аноксигенных фототрофных бактерий. 1. Разделе-
ние зарядов в реакционном центре (P+Q-) приводит к
образованию мембранного потенциала (ДФ) величиной
примерно 55 мВ. 2. В результате второго оборота РЦ
(структура, выделенная серым, слева) образуется убихи-
нол QH2, который обменивается с убихиноном из мем-
бранного пула. Диффундируя в липидный слой мембра-
ны, QH2 связывается хинол-акцепторным участком (Qo)
в составе комплекса цитохромов b/ci (структура, выде-
ленная серым, справа). 3. В процессе окисления QH2
(Q-цикл) в b/ci-комплексе происходят перенос прото-
нов из цитоплазмы в периплазматическое пространство,
восстановление цитохрома с2 и формирование мембран-
ного потенциала величиной примерно 110 мВ. R и Ьн —
цитохромы b с низким и высоким потенциалом; Су, Ci
и с2 — цитохромы с; Бфф — бактериофеофитин; Qa—
убихинон A; Qb —убихинон В; Qi —сайт восстановления
хинона; Qo — сайт окисления хинола; Fe — атом железа;
Fe-S — железо-серный центр.
Реакционный центр II (хиноновый тип; в
этой фотосистеме конечными акцепторами элек-
тронов служат хиноны). Первичным донором
электронов в РЦ II у пурпурных бактерий! слу-
жит специальная пара молекул, Бхл а или Бхл b
(Бхлг; Р), которая переходит в возбужденное со-
стояние Р*, захватывая энергию возбужденного
состояния молекул Бхл внутренней антенны или
непосредственно поглощая квант света. При этом
первичный донор становится сильным восстано-
вителем, способным передать электрон в цепь
акцепторов электронов внутри РЦ. Первичным
акцептором электронов служит вспомогательный
Бхла (ВА). Акт переноса электрона на этом
участке осуществляется за 3,5 пс, и в результате
формируется короткоживущий комплекс Р+Вд,
который за время 0,9 пс передает электрон на мо-
лекулу бактериофеофитина (Бфф); при этом РЦ
переходит в состояние Р+Вфф“ (рис. 13.7). Р+
имеет окислительно-восстановительный потенци-
ал примерно +0,4 В. Электрон за время в пре-
делах 200 пс переносится от Бф)ф_ на хинон А
414 Часть III. Многообразие метаболических путей
Рис. 13.10. Фотохимический реакционный центр II
типа у зеленых серных бактерий рода Chlorobium и
Heliobacterium. Первичный донор электронов Р798 у
Heliobacterium — это димер Бхл g; у Chlorobium первич-
ный донор электронов Р840 — это димер Бхл а. Ао—
первичный акцептор электронов, которым у Heliobac-
terium служит, по-видимому, 8-гидроксихлорофилл а
(Р670). Ai — хинон; Fx — [4Fe—45]-кластер; FeA/FeB —
железо-серные кластеры. Первичный донор восстанав-
ливается электронами (е~), поступающими через че-
тырехгемовую субъединицу (содержащую четыре тетра-
пиррольных кольца).
Рис. 13.11. Фотосинтетический аппарат цианобактерий, состоящий из двух фотосистем. Фотосистема II (ФС II)
получает энергию от прикрепленных к цитоплазматической стороне мембраны фикобилисом и небольшой антенны,
содержащей Хл а (СР43, СР47). Система фотолиза воды в ФС II расположена на внутренней стороне тилакоидной
мембраны. Пластохиноны (Пх) мембранного пула связывают ФС II и комплекс цитохромов be/f, выполняющий, по-
добно комплексу цитохромов b/ci, функцию протонной помпы. Пластоцианин (ПЦ) или цитохром С553 осуществляет
перенос электронов между 6б//-комплексом и фотосистемой I (ФС I) — пластоцианин:ферредоксин-оксидоредукта-
зой. Р700 — первичный донор электронов (Хл а); Ао — первичный акцептор электронов; Ai (хинон) — промежуточ-
ный акцептор электронов; FeS — Fe-S-кластер; Fa и Fb (Fe-S-кластеры) — конечные акцепторы электронов в РЦ.
Структура ФС I цианобактерий сходна с РЦ зеленых серных бактерий и Heliobacterium. Фд — ферредоксин; FNR —
ферредоксин:ПА0РН-оксидоредуктаза; Z — акцептор электронов от системы расщепления воды (Мп-центр); 6559 —
цитохром b с максимумом поглощения при 559 нм. Другие обозначения приведены в тексте (разд. 13.3).
(Qa)> находящийся на цитоплазматической сто-
роне мембраны на расстоянии примерно 2,5-3 нм
ог [Бхл]2 (рис. 13.7). На этой стадии стабилизи-
руется разделение зарядов на мембране (Р+ QX)-
Далее электрон за время 50-200 мкс передается от
Qa на хинон В (Qb)- В результате второго цикла
работы реакционного центра QB получает второй
электрон и присоединяет два Н+, превращаясь в
убихинол (QH2). Пока первичный акцептор вос-
становлен, РЦ «закрыт» для поглощения новой
Глава 13. Использование света прокариотами 415
порции энергии возбуждения. Убихипол В обме-
нивается на убихинон из пула хинонов плазма-
тической мембраны. Первичный донор (Р+) вос-
станавливается электронами непосредственно от
растворимого периплазматического цитохрома сг
(у Rhodobacter sphaeroides] рис. 13.9) или опосре-
дованно при участии четырехцитохромной субъ-
единицы, связанной с РЦ, в большинстве случаев
(например, это имеет место у Rhodopseudomonas
viridis и Chromatium vinosum). В этом состоя-
нии реакционный центр «открыт» для получе-
ния энергии возбуждения. Перенос электронов
ограничен, как правило, L-ветвыо РЦ, хотя име-
ется и вторая, М-ветвь (рис. 13.6). В резуль-
тате происходящих в РЦ II процессов энергия
возбуждения, полученная от пигментов антен-
ны, преобразуется в энергию разделения зарядов
(Р+ Q”; Д^) и разности потенциалов на мембране
(AEh). Разделение зарядов происходит с высокой
эффективностью благодаря тому, что скорости
обратных реакций на несколько порядков ниже.
Высокая скорость переноса электронов па пер-
вой стадии стадии разделения зарядов (перенос
от [Бхл] 2 к феофитину) определяется близостью
взаиморасположения донора и акцептора, высо-
ким значением ДС° реакции, белковым окруже-
нием реагентов и оптимальной величиной энергии
реорганизации.
Основные этапы переноса электронов в реак-
ционных центрах I типа сходны с этапами их
переноса в РЦ II (рис. 13.10). Различия касают-
ся в основном электрон-акцепторного участка, ко-
торый в случае РЦ I включает Fe-S-кластеры.
Первичным донором электронов (специальная па-
ра молекул Бхл, Р) у зеленых серных бактерий
служит Р840 — димер бактериохлорофилла а, у
гелиобактерий — Р798, димер бактериохлорофил-
ла д. Окислительно-восстановительный потенци-
ал этих доноров равен +240 мВ, что примерно на
150 мВ ниже, чем потенциал первичного донора в
РЦ II пурпурных бактерий и в фотосистеме I ци-
анобактерий. Первичным акцептором (Ао) пред-
положительно служит мономерный Бхл В663 —
изомер хлорофилла а, присутствующий у зеленых
серных бактерий, гелиобактерий и в составе фото-
системы II цианобактерий. Акцептор Aq окисля-
ется вторичным акцептором электронов Ai, воз-
можно хиноном. Переносчик Aj передает элек-
трон на железо-серный кластер Fx [4Fe-4S], ко-
торый в цепи переноса электронов располагается
между' хинонами Qa и Qb, как негемовое железо
в РЦ пурпурных бактерий (рис. 13.9). Электроны
от Fx поступают на связанные железо-серные кла-
стеры Fa и Fb (рис. 13.10). У зеленых серных бак-
терий эти окислительно-восстановительные кла-
стеры связаны с гомодимером гидрофобного
белка мол. массой 82 кДа, каждая субъединица
которого, вероятно, содержит 11 пронизывающих
мембрану спиральных структур. Кроме того, РЦ I
содержит две молекулы каротиноидов на молеку-
лу Р840. Зеленые серные бактерии способны осу-
ществлять непосредственное фотовосстановление
NAD(P)+ с участием ферредоксина в качестве пе-
реносчика.
У гелиобактерий первичный донор электронов
(Р798) представляет собой димер Бхл д или его
132-эпимера (рис. 13.10) с окислительно-восста-
новительным потенциалом 225-250 мВ. Как и у
зеленых серных бактерий, РЦ здесь связан с Бхл
антенны. Все РЦ и пигменты антенны связаны
с гомодимером полипептида мол. массой 68 кДа,
С-концевая последовательность которого па 40%
гомологична С-концевой области полипептидов А
п В фотосистемы I цианобактерий. N-концевая
последовательность этого белка гелиобактерий в
значительной степени сходна с хлорофилл-свя-
зывающимп белками СР47 и СР43 антенны в со-
ставе фотосистемы II цианобактерий, особенно
в гидрофобных участках. Первичным акцепто-
ром электронов (Ао) в РЦ гелиобактерий служит
81-гидроксихлорофилл а (Р670). Освещение
приводит к быстрому (10 пс) выцветанию в
полосе поглощения при 670 нм, сопровожда-
ющемуся изменениями поглощения в обла-
сти 785 нм. Р798 восстанавливается цитохро-
мом С553. Роль вторичного акцептора элек-
тронов выполняет, по-видимому, менахинон.
Аналогичную роль в фотосистеме I выпол-
няег филлохипоп. Конечными акцепторами
электронов в РЦ гелиобактерий служат три
Fe-S-кластера. Первичный донор и Fe-S-кластеры
локализованы и ориентированы так же, как в
ФС I цианобактерий. Акцептор хинонового типа
Ai в ФС I располагается в области, сходной с за-
нимаемой им в РЦ зеленых серных бактерий. РЦ
у гелиобактсрий функционируют подобно ФС I.
С учетом высокой степени гомологии белков и
сходства процессов транспорта электронов пред-
ложена гипотеза о происхождении фотосистем I
и II от общего гомодимерного предкового реакци-
онного центра, возможно подобного РЦ гелиобак-
терий.
416 Часть III. Многообразие метаболических путей
В реакционных центрах происходит транс-
формация световой энергии в энергию разде-
ления зарядов (мембранный потенциал, А'0) и
разность окислительно-восстановительных потен-
циалов на мембране (ДЕи). Разделение заря-
дов происходит между первичным донором элек-
тронов—димером хлорофилла или бактериохло-
рофилла, локализованным на внешней стороне
плазматической мембраны, — и вторичными ак-
цепторами электронов, находящимися на внут-
ренней стороне мембраны — хинонами в случае
РЦ II и железо-серными кластерами в случае
РЦ I. Сходство аминокислотных последователь-
ностей пигмент-связывающих белков антенного
комплекса, а также организации и функциониро-
вания реакционных центров указывает на общее
происхождение реакционных центров всех типов
в процессе эволюции.
13.2.4. Фотосинтетический транспорт
электронов обеспечивает образование
электрохимического протонного
потенциала
У факультативных фототрофов — пурпурных
бактерий и бактерий сем. Chloroflexaceae —
электрохимический протонный потенциал на
плазматической или внутриклеточной мембране
создается благодаря либо циклическому транс-
порту электронов при фотосинтезе, либо транс-
порту электронов при дыхании. При циклическом
транспорте электронов у бихинол, восстанавли-
ваемый в реакционном центре, служит донором
электронов для у бихинол щитохром 6/сх-оксидо-
редуктазы (см. гл. 11; рис. 11.9). Комплекс цито-
хромов Ь/с\ функционирует как протонная помпа,
создавая протондвижущую силу (электрохими-
ческий протонный потенциал А//ц( (рис. 13.9).
Этот ферментный комплекс окисляет убихинол
и восстанавливает цитохром С2 с использованием
электрохимического потенциала, образующего-
ся в окислительно-восстановительных реакциях
так называемого Q-цикла, для переноса прото-
нов из цитоплазмы в периплазму. Восстановлен-
ный цитохром С2 служит челноком, переносящим
электроны на первичный донор электронов (Р+)
реакционного центра. У мутантов, лишенных ци-
тохрома С2, эту функцию выполняет цитохром у
(Су на рис. 13.9). В результате двух оборотов РЦ
в мембранный пул хинонов высвобождается одна
молекула QbN-
Дополнение 13.3. Убихинол (QH2, вос-
становленный убихинон), связывается с Qq-
сайтом комплекса цитохром Ъ/с\ (рис. 13.9 и
11.9). Окисление QH2 включает перенос одно-
го электрона на Fe-S-кластер и цитохром щ
и другого электрона —на цитохром 6г с вы-
свобождением двух Н+ в периплазму. Цито-
хром 6ц с высокой скоростью окисляется ци-
тохромом 6ц (6ц и Ьц — цитохромы 6-типа с
низким и высоким редокс-потепциалом соот-
ветственно). От цитохрома 6ц электрон по-
ступает на хинон из мембранного пула, ко-
торый связывается с Qi-сайтом цитохрома.
Происходит восстановление этого хинона до
семихинона, связанное с поглощением одного
протона из цитоплазмы. Источником второго
электрона для восстановления семихинона до
QH2 служит реакция окисления второй моле-
кулы QH2 в Qo-сайте. Восстановление семи-
хинона сопровождается поглощением второго
протона из цитоплазмы. Таким образом, в хо-
де окисления двух молекул QH2 в периплазму
переносится четыре протона.
В дыхательной электроптранспортной цепи
цитохром С2 передает электроны па цитохро-
моксидазу. У пурпурных бактерий образующа-
яся в процессе циклического транспорта элек-
тронов при фотосинтезе: РЦ => пул хинонов =>
комплекс цитохромов б/ci => цитохром сг => РЦ
(рис. 13.9) или при функционировании дыхатель-
ной цепи протондвижущая сила используется для
восстановления NAD+. Таким образом, фиксация
СОг у пурпурных бактерий в отличие от рас-
тений не сопряжена напрямую с фотосинтетиче-
ским транспортом электронов. Используемый для
фиксации СО2 NADH образуется в результате об-
ратного переноса электронов от комплекса тш-
тохромов б/ci с участием NADH-дегидрогеназы.
У зеленых серных бактерий величина отрицатель-
ного окислительно-восстановительного потенциа-
ла Fe-S-кластера, конечного акцептора электро-
нов в реакционном центре, достаточна для восста-
новления ферредоксина, который прямо или опо-
средованно используется для фиксации СО2 (см.
разд. 8.1). Электрохимический протонный потен-
циал на мембране, образующийся при фотосин-
Глава 13. Использование света прокариотами 417
тетическом циклическом транспорте электронов
или в дыхательных цепях, используется для син-
теза АТР из ADP—Mg и неорганического фосфа-
ia, катализируемого ATP-синтазой (см. разд. 4.2
и рис. 4.5).
Основная функция аноксигенного фотосинтеза
состоит в образовании электрохимического про-
тонного потенциала (мембранный потенциал -Ь
градиент протонов) на мембране. При фотосинте-
зе этого типа происходит циклический транспорт
электронов с участием фотохимического реакци-
онного центра, комплекса цитохромов Ь/с\, мем-
бранного пула хинонов и цитохрома с в качестве
челночной системы. Восстановительные эквива-
ленты при аноксигенном фотосинтезе, как прави-
ло, не образуются.
13.2.5. Электронтранспортные системы
фотосинтеза и дыхания
функционально конкурируют
Некоторые аноксигенные фотосинтезирующие
бактерии, например Rhodobacter capsulatus, Rho-
dobacter sphaeroides и Rhodospirillum rubrum, спо-
собны как к фототрофному росту в анаэробных
условиях на свету, так и к хемотрофпому росту
в аэробных условиях в темноте. В природных
местообитаниях эти факультативные автотрофы
должны адаптироваться к постоянным измене-
ниям освещенности и содержания кислорода в
среде. И фотосинтетическая, и дыхательная цепи
переноса электронов связаны у них с мембрана-
ми и служат для генерации электрохимического
протонного потенциала на плазматической мем-
бране или внутриклеточных мембранах. Некото-
рые мембраносвязанные компоненты в этих двух
электроптрапспортпых системах общие, и таким
образом фотосинтетическая и дыхательная цепи
конкурируют за электроны.
Возможно, вследствие такой конкуренции ды-
хание у факультативных фототрофов подавляет-
ся па свету. Лимитирующим переносчиком пред-
положительно является цитохром С2. На свету
восстановленный цитохром С2 служит источником
электронов для восстановления окисленного пер-
вичного донора (Р+) в фотосинтетическом реак-
ционном центре, из-за чего па цитохромоксидазу
дыхательной цепи электроны могут не поступать.
Однако эта гипотеза не объясняет ингибирующе-
го действия света на дыхание у тех факультатив-
ных фототрофов, дыхательная цепь которых со-
держит хинолоксидазу, не связанную с цитохро-
мом С2 как донором электронов. Так или иначе,
факультативно фототрофные бактерии реагиру-
ют на временные изменения интенсивности света
или парциального давления кислорода подавлени-
ем одной из этих эпергодающих систем. Свойства
некоторых аноксигенных фототрофных бактерий
суммированы в табл. 13.1.
13.3. Цианобактерии осуществляют оксигенный фотосинтез
Цианобактерии представляют собой одноклеточ-
ные или многоклеточные (преимущественно нит-
чатые) прокариотические организмы и не содер-
жат в клетках окруженных мембранами орга-
нелл, подобных хлоропластам или митохондриям.
Большинство видов цианобактерий относится к
облигатным фотоавтотрофам. По механизму фо-
тосинтеза цианобактерии сходны с растениями, по
по структурной организации фотосинтетического
аппарата отличаются от них рядом особенностей.
1. Фотосинтетический аппарат у цианобактерий
локализован в тилакоидах — уплощенных дис-
ковидных (мешковидных) мембранных струк-
турах, расположенных на периферии клеток
и не окруженных липидной мембраной, в от-
личие от хлоро пластов эукариот. Тилакоиды
расположены параллельными слоями, подоб-
но чешуям луковицы, или формируют раз-
ветвленные либо складчатые структуры, но
никогда не образуют стопок, подобных гра-
418 Часть III. Многообразие метаболических путей
нам хлоропластов. По-видимому, тилакоиды
цианобактерий не связаны регулярным обра-
зом с клеточной плазматической мембраной.
2. Цианобактерии содержат пигменты фикоби-
липротеины, локализованные в особых струк-
турах—фикобилисом ах. Эти структуры при-
креплены к тилакоидным мембранам и выпол-.
няют функцию основных светособирающих
антенн (рис. 2.14 и 13.11). Фикобилисомы име-
ются также у красных водорослей. Мембрано-
связанные хлорофилл-содержащие антенны у
цианобактерий намного меньше по размерам,
чем в тилакоидах хлоропластов. Цианобакте-
рии содержат хлорофилл а, но лишены хлоро-
филла Ь, присутствующего в качестве допол-
нительного пигмента у эукариот.
3. В тилакоидах цианобактерий локализована по
меньшей мере часть компонентов дыхатель-
ной цепи (NADH-дегидрогеназа, комплекс ци-
тохромов &6/f, цитохромом с-оксидаза).
Светособирающая пигментная система ци-
анобактерий состоит из фикобилисом и неболь-
шой Хл ^.-содержащей антенны, связанной с внут-
ренней частью реакционного центра.
13 .3.1. Фотосистема II цианобактерий — это
НгСкпластохинон-оксидоредуктаза
Фотосистема II (ФС II) цианобактерий представ-
ляет собой пигмент-белковый комплекс, локали-
зованный в тилакоидной мембране (рис. 13.11).
Он состоит из более чем двадцати различных
белковых субъединиц и действует как НгОшлас-
тохинон-оксидоредуктаза. Функциональная ак-
тивность разделения зарядов локализована на ге-
теродимере, образованном белками D1 и D2 (экви-
валенты L- и М-субъединиц реакционного центра
пурпурных бактерий). С белками D1 и D2 свя-
заны: димер хлорофилла а (Р680, первичный до-
нор; Ега — +600-800 мВ), феофитин а, /3-каротип,
дополнительный хлорофилл а, а также предпо-
ложительно два хинона (Qa, Qb) и одна Fe-со-
держащая молекула, находящаяся в цепи между
Qa и Qb (рис. 13.11). На стороне мембраны,
обращенной в просвет тилакоида, локализова-
ны связанные с фотосистемой II белки, которые
вместе с белками D1 и D2 представляют собой
Мп-связывающие сайты кислород-выделяющей
системы. В противоположность ФС I и реакци-
онному центру пурпурных бактерий, первичный
донор в ФС II — это сильный окислитель, необ-
ходимый для расщепления молекул воды фотоси-
стемой II с образованием О 2 и 4Н+. Высвобож-
даемые при этом электроны используются для
восстановления окисленного первичного донора.
После разделения зарядов в ФС II образуется
восстановленный пластохинон. Вместо комплек-
са цитохромов b/су, присутствующего у пурпур-
ных бактерий, цианобактерии содержат комплекс
пластохинон-цитохромы b^/f, участвующий в об-
разовании протонного потенциала на мембране.
В акцепторном сайте этого комплекса электро-
ны переносятся на пластоцианин (медьсодержа-
щий белок) или цитохром С553, которые слу-
жат донорами электронов для ФС I. Цианобакте-
рия Oscillatoria limnetica способна осуществлять
как оксигенный, так и аноксигенный (сульфид-
зависимый) фотосинтез. Аноксигенный фотосин-
тез индуцируется у О. limnetica в анаэробных
условиях в присутствии сульфида, используемого
в качестве донора электронов для ФС I.
Поглощение световой энергии происходит в
фикобилисомах, расположенных на внешней
стороне тилакоидной мембраны (рис. 13.11). Как
правило, с одной фикобилисомой связаны два
комплекса ФС II. Фикобилисома состоит из серд-
цевины и радиально расположенных вокруг нее
цилиндрических структур — «палочек». Сердце-
вина также содержит антипараллельно распо-
ложенные цилиндрические структуры из диско-
видных субъединиц, содержащих тримеры ал-
лофикоцианипа (полоса поглощения 620-670 нм).
Радиальные палочки состоят из аналогичных
дисков, скрепленных связывающими белками.
К сердцевине прикреплен диск, образованный
гексамером фикоцианина (максимум поглощения
615-620 нм). Следующие диски состоят из гек-
самеров фикоцианина, фикоэритроциапипа (568,
590 нм) или фикоэритрина (565, 568 нм; рис. 13.5).
Энергия возбуждения в фикобилисомах переда-
ется в направлении от фикоэритрина, поглоща-
ющего свет в коротковолновой области спектра,
к «длинноволновому» фикоцианину и далее че-
рез Хл а мембраносвязанных светособирающих
комплексов на ФС II (рис. 13.11). Количество
светособирающих пигментов изменяется обратно
пропорционально интенсивности света. При сни-
жении интенсивности света фикобилисомы уве-
личиваются в размерах путем удлинения палочек
Глава 13. Использование света прокариотами 419
и, кроме того, возрастает число фикобилисом на
единицу площади мембраны.
Цианобактерии реагируют не только на из-
менение интенсивности, но и на изменение спек-
трального состава падающего света. При увели-
чении интенсивности света, поглощаемого в ос-
новном фикобилисомами, т. е. ФС II (470-660 нм),
возрастает относительное содержание ФС I. При
перенесении клеток цианобактерий на красный
(>660 нм) или голубой (^450 нм) свет, погло-
щаемый в основном хлорофиллом а в составе
ФС I, относительное содержание ФС I снижает-
ся. У некоторых штаммов наблюдается хромати-
ческая адаптация — изменение состава фикобили-
сом, например возрастание синтеза фикоэритрина
на зеленом свету и фикоцианина на красном.
Цианобактерии обладают также способностью
к быстрому ответу на изменения интенсивно-
сти или качества света посредством так называ-
емого переходного процесса. Он заключается в
подстройке распределения энергии возбуждения
между ФС I и ФС II при возбуждении какой-
либо одной из них. Этот отве т не сопровождается
какими-либо морфогенетическими изменениями.
13 .3.2. Фотосистема I цианобактерий — это
пластоцианин:ферредоксин-оксидо-
редуктаза
Реакционный центр фотосистемы I представляет
собой мембраносвязанный комплекс, осуществля-
ющий пластоцианин: ферредоксин-оксидореду к-
тазпую реакцию (рис. 13.11). Первичный донор
реакционного центра ФС I (Р700) непосредствен-
но поглощает свет или захватывает энергию воз-
буждения от антенны (50-100 молекул Хл о),
переходя в возбужденное состояние (Р700*). За
время менее 10 пс Р700* восстанавливает пер-
вичный акцептор А(). Вероятнее всего им слу-
жит мономерная молекула Хл а. В этой реакции
происходит первичное разделение зарядов между
Р700 и Aq. Очень короткое время пара Р700+ —
Ар существует в форме радикала и затем пере-
дает электрон через промежуточные акцепторы
Ai (фнлохпнон) и Fx (Fe-S-клас гср) на конечные
акцепторы Рл и Fb (оба Fe-S-кластеры). Моле-
кулы Р700, Ар и Fx локализованы на белковом
гетеродимере PsaA/PsaB, молекулы Fa и Fb —
на полипептиде мол. массой 8,9 кДа. Трансмем-
бранное расстояние между Aq и Ai существенно
меньше расстояния между P70G и Ар Восста-
новление Fx, Fa и Fb характеризуется многосту-
пенчатой кинетикой с длительностью отдельных
составляющих от 15 до 200 нс. Железо-серные
[4Fe—48]-кластеры фотосистемы I, обладающие
низким окислительно-восстановительным потен-
циалом (Ет = —0.7 В), восстанавливают NAD+
или NADP+ через другие железо-серные класте-
ры. Восстановленный ферредоксин служит доно-
ром электронов для восстановления NADP фер-
редоксип:КАП+-оксидоредуктазой или для вос-
становления нитрата. Как и при аноксигенном
фотосинтезе, для фотофосфорилирования при
оксигешюм фотосинтезе используется протонный
электрохимический потенциал на мембране.
Фотосинтетический аппарат цианобактерий
включает две фотосистемы: НгОгпластохипоп-
оксидоредуктазу (ФС II) и пластоциапин:ферре-
доксин-оксидоредуктазу (ФС I), сопряженные че-
рез линейную цепь транспорта электронов. Роль
свегособирающей антенны выполняют фикоби-
лисомы. В отличие от растений, цианобактерии
содержат только хлорофилл а. В результате ли-
нейного транспорта электронов при оксигенном
фотосинтезе образуются О2, 1XADPH и электро-
химический протонный потенциал.
13.4. Бактериородопсин функционирует как светозависимая протонная помпа
у Halobacterium halobium
Все фотосинтетические системы, описанные в
разд. 13.1-13.3, построены на основе хлорофил-
ла или бактериохлорофилла. У архей подобный
аппарат фотосинтеза не обнаружен. В то же вре-
мя экстремально галофильный представитель ар-
хей Halobacterium halobium обладает светозави-
симой протонной помпой, действующей на иной
основе. При низком содержании кислорода в сре-
де этот организм синтезирует пигмент бактерио-
родопсин (Бр), содержащий ретиналь. В ви-
420 Часть III. Многообразие метаболических путей
Рис. 13.12. Бактериородопсин в пурпурной мембране
археи Halobacterium halobiurrr, фотоцикл ретиналя.
Светозависимая цис-транс-изомеризация ретиналя и
протонирование/депротонирование шиффова основа-
ния приводят к переносу протона через мембрану. Ос-
новное состояние и интермедиаты (например, Ксзб) ре-
тиналя обозначены буквами К, L, М, N и О с указани-
ем максимума их поглощения подстрочным индексом.
Связи в молекуле ретиналя, участвующие в светоинду-
цируемых реакциях, выделены серым. Зигзагообразной
линией со стрелкой показан единственный светозависи-
мый этап. К216 — остаток лизина, участвующий в обра-
зовании шиффова основания; D85 и В96— остатки ас-
парагиновой кислоты, осуществляющие перенос прото-
на. Рядом со стрелками указано время перехода рети-
наля из одного состояния в другое; наиболее быстрой
реакцией является первая стадия фотоцикла бактерио-
родопсина (время в диапазоне пикосекунд); поглощение
протона и регенерация бактериородопсина 568 (Бр56е)
требует нескольких миллисекунд. Перенос протона ука-
зан жирными стрелками.
де пурпурно-фиолетовых кристаллических бля-
шек Бр встроен в мембрану, состоящую в этих
условиях на 25% из липидов и на 74: из Бр. По-
липептидная цепь Бр включает семь ш-спираль-
ных структур, пронизывающих мембрану. Рети-
наль через протонированное шиффово основа-
ние ковалентно связан с остатком лизина в по-
ложении 216 (К216) апофермента Бр (мол. мас-
са 27 кДа; рис. 13.12). а-Спиральные структуры
формируют трансмембранное пространство, за-
нимаемое ретиналем и протонируемыми амино-
кислотными остатками. Шиффово основание ре-
тиналя находится посредине этого пространства,
разделяя его на цитоплазматический «канал», со-
держащий многочисленные гидрофобные остатки
[треонина в позиции 46 (Т46), аспарагиновой кис-
лоты в позиции 96 (D96) и аргинина в позиции 227
(R227)] плюс связанную воду, и периплазмати-
ческий «канал», содержащий заряженные остат-
ки аспарагиновой кислоты в позициях 85 и 212
(D85, D212) и аргинина 82 (R82) плюс связан-
ную вод}' (рис. 13.13). Внутренний канал выпол-
няет функцию протон-поглощающего домена, на-
ружный— функцию высвобождения протонов в
среду7. Остаток аспарагиновой] кислоты в пози-
ции 96 служит внутренним донором протонов для
шиффова основания, остаток аспарагиновой кис-
лоты 85 — акцептором протонов. В итоге эта до-
менная структура обеспечивает перенос протонов
через мембрану. При поглощении фотонов про-
исходит ф/с-т/хшс-изомеризация региналя с вре-
менным депротонированием шиффова основания
(рис. 13.12). Свободная энергия, запасаемая в ре-
зультате поглощения фотона (К-состояние), равна
примерно 50 кДж. Эта энергия используется для
векторного переноса протонов из цитоплазмы в
периплазматическое пространство. Перенос осу-
ществляется в результате последовательных ре-
акций протопировапия/депротонирования остат-
ков аспартата D96 и D85 в наружном и внутрен-
нем каналах Бр. В результате переноса протонов
образуется электрохимический протонный потен-
циал величиной 300 мВ, обеспечивающий синтез
АТР ферментом Н+: FjFo-ATP-синтазой. Синте-
зируемый таким путем АТР поддерживает мед-
ленный рост Н. halobium в анаэробных условиях
при дефиците органических субстратов. Протон-
ный градиент служит также источником энергии
для откачки из клеток ионов натрия с участием
Ма+/Н+-антипортера, для поглощения субстра-
тов путем симпорта с различными ионами (см.
разд. 5.6) и движения жгутиков.
Поглощение света бактериородопсином приво-
дит к гщс-тргжс-изомеризации ретиналя и де-
протонированию шиффова основания. Энергия
этой фотореакции используется для векторно-
го переноса протонов из цитоплазмы через кле-
точную мембрану в результате последовательных
реакций протонирования-депротонирования ами-
нокислотных остатков в формируемом бактерио-
родопсином трансмембранном канале. Образую-
щийся градиент используется для синтеза АТР
или транспорта растворенных веществ.
Глава 13. Использование света прокариотами 421
Рис. 13.13. Белковая цепь в составе бактериородопсина
образует петли, пронизывающие плазматическую мем-
брану. Полипептидная цепь Бр имеет семь гидрофобных
о-спиральных участков (A—G), пронизывающих плаз-
матическую мембрану. Ретиналь связан через шиффо-
во основание с остатком лизина в позиции 216 (К216).
Остаток аспарагиновой кислоты в позиции 96 (D96)
участвует в поглощении протона из цитоплазмы, оста-
ток аспарагиновой кислоты 85 (D85) — в выделении про-
тона на периплазматической стороне мембраны. Внут-
ренний (цитоплазматический) и наружный (периплаз-
матический) протонные каналы (показаны стрелками)
открываются в цикле лишь временно. При этом бел-
ковый участок, содержащий шиффово основание, вы-
полняет функции светозависимого затвора между дву-
мя этими каналами и переносит протон через плазмати-
ческую мембрану с ее цитоплазматической стороны на
периплазматическую. По [1]. См. также рис. 2.10 и рис.
5.1 (на цв. вклейке).
13.5. Для изучения бактериального фотосинтеза используются
спектроскопические, биохимические и генетические методы
Кинетику фотохимических реакций можно опре-
делять с помощью методов абсорбционной и
флуорометрической спектроскопии высокого раз-
решения, позволяющей исследовать короткожи-
вущие состояния переносчиков в составе реакци-
онных центров. При таком анализе препараты
выделенных фотосинтетических мембран или
реакционных центров освещают короткими
(IO"15 с) вспышками света низкой (не насыща-
ющей) интенсивности. Индуцируемые ими корот-
коживущие возбужденные состояния отдельных
переносчиков в составе реакционных центров ана-
лизируют с применением высокочувствительной
абсорбционной спектрофотометрической техни-
ки. При освещении препарата серией таких вспы-
шек возможен анализ с накоплением сигнала,
обеспечивающий высокое отношение сигнал/шум
в процессе измерения. Кинетику пигмепт-белко-
вых взаимодействий на первичных стадиях фо-
тосинтеза исследуют с использованием эффекта
рамановского рассеяния в инфракрасной обла-
сти спектра. Разложение сигнала в рядах Фурье
позволяет исследовать резонансные взаимодей-
ствия молекул в процессе переноса энергии. Дру-
гой подход заключается в получении и очистке
мембраносвязанпых комплексов фотосинтетиче-
ского аппарата путем солюбилизации с примене-
нием детергентов и последующего выделения с
использованием различных хроматографических
методов. В немногих случаях при этом удается до-
стичь кристаллизации комплексов. Например, та-
ким способом были получены в кристаллическом
виде препараты реакционных центров Rhodobacter
sphaeroides и Rhodopseudomonas viridis, а также
пигмент-белковые светособирающие комплексы
Rhodospirillum molischianum и Rhodopseudomonas
acidophila. Разрешение этих структур па атомном
уровне с помощью рептгеноструктурного анализа
в комбинации со спектроскопическими методами
высокого разрешения позволило получить важ-
ные сведения о механизме разделения зарядов и
этапах переноса электронов внутри реакционных
центров.
Третья группа применяемых для изучения
бактериального фотосинтеза методов — это моле-
кулярно-генетические приемы, позволяющие кло-
422 Часть IV. Многообразие метаболических путей
нировать гены и определять аминокислотные
последовательности белков, участвующих в фо-
тосинтезе. Для выявления в них функцио-
нально важных аминокислотных остатков при-
меняют сайт-паправленный мутагенез. Замена
высококонсервативных аминокислотных остатков
приводит к изменению структурных и функци-
ональных свойств молекул. Например, замена
в составе реакционного центра консервативного
остатка гистидина, образующего координацион-
ную связь с центральным атомом магния в мо-
лекуле Бхл, на остаток аланина приводит к появ-
лению фотосинтетически неактивных мутантов.
Дополнительная литература
Barber Anderson В. (1994) Revealing the blueprint of
photosynthesis. Nature 370: 31-34.
Blankenship R. E., Madigan M.T., Bauer C.E., eds.
(1995) Anoxygenic photosynthetic bacteria. Dord-
recht, Netherlands: Kluwer Academic Publishers.
Bryant D. A., ed. (1994) The molecular biology of
cyanobacteria. Dordrecht, Netherlands: Kluwer
Academic Publishers.
GramerW. A., KnafFD.B. (1990) Energy transduction
in biological membranes. Berlin: Springer-Verlag.
Dutton P. L.. Mosser С. C. (1994) Quantum biomecha-
nics of long-range electron transfer in protein:
hydrogen bonds and reorganization energies. Proc.
Nat. Acad. Sci. USA 91: 10247-10250.
Haupts V., Tittar J., Bamberg E., Oesterhelt D. (1997)
General concept for ion translocation by halobacterial
retinal proteins. Biochemistry 36: 2-7.
van Grondelle R.., Dekker .1.Р., Gillbro T., Sundstrom V.
(1994) Energy transfer and trapping in photosyn-
thesis. Biochim. Biophys. Acta 1187: 1-65.
Источник рисунка
1. LanyiJ.K. (1993). Biochim. Biophys. Acta 1183:
241-261.
Часть IV
ГЕНЕТИКА БАКТЕРИЙ
И БАКТЕРИОФАГОВ
Долгое время основными отличиями прокариот от
высших организмов считали отсутствие не только
ядра, по также хромосом и половых признаков.
Поэтому вышедшие в 1961 г. книга Ф. Жакоба
и Э. Вольмана под названием «Пол и генети-
ка бактерий» и вслед за ней в 1964 г. книга
другого классика в этой области, У. Хейеса,
«Генетика бактерий и бактериофагов» вызвали
сенсацию. Суммированные в них результаты ис-
следований бактерий и их вирусов убедительно
показывали, что микробные клетки содержат хро-
мосомы и обладают выраженными половыми при-
знаками, включая разделение клеток на доноры
и реципиенты. Как известно, 60-е годы прошед-
шего столетия были периодом важнейших от-
крытий в области молекулярной биологии. В это
время складывались представления о ДНК как
носителе генетической информации и о полу-
консервативном механизме ее репликации с уча-
стием реплисом — сложных органелл, катализи-
рующих координированный синтез «ведущей» и
«запаздывающей» цепей ДНК в составе бактери-
альной хромосомы. У бактерий хромосома не свя-
зана с гистонами и не окружена ядерпой оболоч-
кой, как хромосомы эукариот, но тем не менее в
комплексе со множеством молекул РНК и бел-
ков она образует сложпооргапизоваппую струк-
туру, названную нуклеоидом. Реплисомы свя-
зывают реплицирующуюся бактериальную ДНК
(хромосому) с плазматической мембраной и обес-
печивают тесное сопряжение процессов репли-
кации и клеточного деления. Хромосома бакте-
рий, включающая точку начала двунаправлен-
ной репликации (огг), представляет собой наи-
более крупный репликон в их клетках. Как
правило, клеточная хромосома содержит необхо-
димые «обслуживающие» гены (гены «домашнего
хозяйства») и видоспецифичпые гены, что состав-
ляет не весь геном, но его основную часть. Обыч-
но бактериальный геном содержит, помимо этого,
дополнительные гены, детерминирующие фа-
культативные свойства, например горизонталь-
ный перенос генов между донорными и реци-
пионтпыми клетками, устойчивость к токсичным
агентам, дополнительные метаболические актив-
ности, способность к симбиозу и патогенность.
Гены факультативных признаков локализованы
в подвижных генетических элементах — инсер-
ционных последовательностях (IS, от insertion
sequences), транспозонах (Tn, от transposable
element), копъюгативпых транспозонах (СТп, от
conjugative tra textbfnsposable elements), «остро-
вах патогенности» (PAI, от pathogenicity islands)
и плазмидах. Плазмиды, к которым в строгом
смысле относятся также вирусы бактерий (бак-
териофаги), представляют собой автономно реп-
лицирующиеся элементы ДНК, т. е. репликоны,
присутствующие в клетке в количестве одной или
многих (до 50) копий. Они могут быть кольцевы-
ми или линейными, конъюгативными или неконъ-
424 Часть IV. Генетика бактерий и бактериофагов
негативными; по размерам плазмиды варьируют
от мелких криптических плазмид, присутствие
которых не отражается на фенотипе (10 т.п.н.,
3 гена) до крупных мегаплазмид (>500 т.п.н.),
близких по размерам к небольшим бактериаль-
ным хромосомам (примерно 700 т.п.н.). Описанию
свойств ДНК, хромосом и подвижных генетиче-
ских элементов посвящена гл. 14.
Многие гены прокариот (обычно размера-
ми примерно 1 т.п.н.) организованы в едини-
цы транскрипции (оперопы). Регуляция их осу-
ществляется координированно, благодаря тому
что транскрипцией группы генов управляет один
промотор и в направленной трансляции поли-
цистронной мРНК участвуют сразу несколь-
ко рибосом (полисома). Этим обеспечивается
характерная для прокариот высокая скорость
роста и быстрая адаптация к изменению окружа-
ющих условий. Кроме сопряженной транскрип-
ции и трансляции бактерии обладают и дру-
гими свойствами, способствующими лабильно-
сти их обмена. К таким свойствам относится
присутствие в клетке нескольких РНК-полиме-
раз, имеющих общий сердцевинный полипептид.
Полимераза каждого типа содержит одну специ-
фическую сигма-субъединицу (сг-фактор), обес-
печивающую узнавание промотора определенного
типа. Предположительно в зависимости от усло-
вий среды действуют различные сг-субъединицы,
и этим обеспечивается транскрипция специфи-
ческих генов. Процессы транскрипции и транс-
ляции описаны в гл. 15. Другая особенность
прокариот, способствующая быстрой адаптации —
это горизонтальный перенос генов посредством
трансформации, трансдукции и конъюгации, рас-
смотрению которых посвящена гл. 16. Благодаря
такому переносу возможен эффективный обмен
генетическим материалом с образованием меро-
генот, или «меродиплоидов», а также рекомби-
нация ДНК. Если рассматривать биологическую
половую стратегию в ее основе, как способ об-
мена генетической информацией для наилучшей
выживаемости, то можно считать, что сведенная
к самому необходимому (наличие донора и реци-
пиента, обмен генами и рекомбинации), опа при-
сутствует у прокариот — в форме, соответствую-
щей их способу жизни и клеточной организации.
В эту часть книги включена также глава 17,
посвященная технологии рекомбинантной ДНК,
или генетической инженерии, поскольку это
направление возникло в генетике бактерий и
необходимые для пего препараты (например, ре-
стриктазы, векторы и гены) получают из про-
кариотических организмов, причем большинство
методов генетической инженерии для эукариот
включает промежуточные этапы, в которых ис-
пользуется Е. coli. Здесь изложены лишь основ-
ные принципы этих методов; поскольку техно-
логия рекомбинантной ДНК развивается чрез-
вычайно быстро, постоянно разрабатываются
новые подходы. С некоторыми из них читатель
может более подробно познакомиться на много-
численных примерах, описанных в частях V и IX
и в дополнительной литературе, приведенной ни-
же, а также в некоторых других главах.
Дополнительная литература
Beckwith .1., Silhavy Т. .1. (1992) The power of bacterial
genetics. Cold .Spring Harbor, New York: Cold Spring
Harbor Press.
Birge E. A. (1994) Bacterial and bacteriophage genetics.
3rd edn. New York: Springer.
Ilayes W. (1964) The genetics of bacteria and their
viruses. New York: Wiley.
Jacob F., Wollmann E. L. (1961) Sexuality and the
genetics of bacteria. New York: Academic Press.
Joset F., Guespin-Michel J. (1993) Procaryotic genetics.
Genome organization, transfer and plasticity.
London: Blackwell Scientific.
Miller J. II. (1992) A short course of bacterial genetics. A
laboratory manual and handbook for Escherichia coli
and related bacteria. Cold Spring Harbor, New York:
Cold Spring Harbor Press.
SteipsU. N., YasbinR. E. (1991) Modern microbial
genetics. New York: Wiley-Liss.
Snyder L., Champness W. (1997) Molecular genetics of
bacteria. Washington DC: ASM Press.
Глава 14
ДНК, хромосомы и плазмиды
Более ста лет назад Грегор Мендель открыл, что
наследственные свойства высших организмов де-
терминированы отдельными «факторами» (гена-
ми), которые комбинируются в потомстве более
или менее независимо. Дальнейшим этапом раз-
вития генетики стало открытие хромосом и ли-
нейного расположения в них генов. Большое зна-
чение для развития исследований имело обнару-
жение хромосом и генов у бактерий, поскольку
бактерии можно выращивать в контролируемых
условиях и использовать как удобные эксперимен-
тальные объекты. Кроме хромосом, генетическая
информация содержится у прокариот в более мел-
ких элементах — плазмидах, вирусах и транспо-
зонах, и ключевой процесс клеточного цикла со-
стоит в точном удвоении и вертикальной переда-
че всей этой генетической информации дочерним
клеткам. В данной главе рассмотрены структу-
ра и свойства различных генетических элементов,
известных для прокариот, а также способы их ре-
пликации.
Гены расположены линейно в хромосомах.
У бактерий хромосома включает двухцепочечную
молекулу ДНК, РНК и белки и формирует в цито-
плазме структуру, называемую нуклеоидом
14.1. ДНК как носитель генетической информации у бактерий
Генетическая информация, передаваемая верти-
кально от родительских клеток дочерним, зако-
дирована в ДНК (дезоксирибонуклеиновой
кислоте), чаще всего представленной двухцепо-
чечной молекулой. Исключения из этого прави-
ла составляют лишь некоторые вирусы прокари-
от (бактериофаги; см. гл. 26), содержащие в каче-
стве генетического материала РНК. В начальный
период развития молекулярной биологии ДНК не
считали настолько сложной молекулой, чтобы она
могла служить генетическим материалом, одна-
ко затем возникло предположение, что последо-
вательность азотистых оснований в составе
ДНК кодирует генетическую информацию.
Основными экспериментальными доказательства-
ми генетической роли ДНК послужили два экспе-
римента с бактериями и бактериофагами.
1. В 1944 г. О. Эвери. К. Маклеод и М. Мак-
карти трансформировали в пробирке непато-
генный (шероховатый) штамм Pneumococcus
(Streptococcus) pneumoniae с помощью экс-
тракта патогенного (гладкого) штамма.
Трансформанты приобрели способность вы-
зывать инфекцию у мышей. В этой работе
авторы доказали, что трансформирующим
фактором служит ДНК.
2. В 1952 г. А. Херши и М. Чейз опубликовали
данные о том, что при инфицировании Е. coh
бактериофагом Т2 в клетку хозяина прони-
кает только ДНК, т. е. именно она несет ин-
формацию, определяющую репликацию фа-
га, структуру его белков и морфогенез (см.
гл. 26).
Благодаря этим работам полностью утверди-
лось представление о ДНК как универсальном
носителе генетической информации у бактерий
и большинства бактериофагов; для эукариотиче-
ских клеток прямые доказательства удалось по-
лу нить позднее. Как будет показано в следующем
разделе, именно уникальная структура ДНК обес-
печивает перенос генетической информации, по-
скольку эта структура не зависит от специфичес-
кой последовательности оснований.
426 Часть IV. Генетика бактерий и бактериофагов
Рис. 14.1. Пары пуриновых и пиримиди-
новых оснований в составе ДНК. Пара
аденин—тимин (А—Т) образует две водо-
родные связи (показаны серым), гуанин—
цитозин (G—С) — три. Следует обратить
внимание на нумерацию атомов в остат-
ках оснований (1-9) и сахаров (Iх—5х).
14.1.1. ДНК —это поли нуклеотидная цепь,
состоящая из дезоксинуклеотидов
Компоненты ДНК □ Молекула ДНК по-
строена из нуклеотидов. Каждый нуклеотид
включает азотистое основание, связанное N-гли-
козидной связью с Cl-атомом (обозначаемым в
нуклеотидах Iх) 2-дезоксирнбозы. Соединение,
образованное основанием и пентозой, называет-
ся нуклеозидом. Нуклеозиды, точное 2х-дезокси-
нуклеозиды в случае ДНК, могут присоединять
одну, две или три фосфатных группы в 3х- или
5х-положениях пентозного кольца, и такие соеди-
нения называют дезоксинуклеотидами. В по-
линуклеотидной цепи ДНК дезоксинуклеотиды
соединены 3х—5х-фосфодиэфирными связями, об-
разующимися между кольцами дезоксирибозы.
Таким образом, сахарофосфатный остов ДНК
представляет собой последовательность из чере-
дующихся остатков сахара и фосфата. Благодаря
присутствию фосфатной группы на 5х-копце и
гидроксильной группы на 3х-конце цепь ДПК об-
ладает полярностью.
Основания в составе ДНК представлены пу-
ринами — аденином (6-аминопурин) и гуани-
ном (2-амино-б-оксипурин), и пиримидинами-
цитозином (2-окси-4-аминопиримидин) и тими-
ном (2,4-диокси-5-метилпиримидпн). Обычно для
их обозначения используют только начальные
буквы: A, G, С и Т (правильнее, dA, dG, dC
и dT). В некоторых случаях отдельные основа-
ния после репликации модифицируются с обра-
зованием, например, 4- или 5-метилцитозина или
6-метиладенипа (см. разд. 15.6). ДНК фагов Т2,
Т4 и Тб Е. coli содержит вместо дезоксицитозина
5-оксиметилдезоксицитозин, который может до-
полнительно к такой модификации подвергаться
гликозилированию (см. гл. 26).
В начале 1950-х гг. Э. Чаргафф путем хими-
ческого анализа ДНК из многих организмов об-
наружил, что частота встречаемости А соответ-
ствует частоте встречаемости Т и то же самое
справедливо для G и С. Величина отношения
(А + Т) : (G + С) служит специфической харак-
теристикой данного организма. Указанное соот-
ветствие объясняется способностью данных ос-
нований образовывать водородные связи: аденин
спаривается с тимином, образуя две водородные
связи, и гуанин образует три водородные связи с
цитозином (рис. 14.1).
Антипараллельные цепи и двойная спи-
раль □ В 1953 г. Джордж Уотсон и Френсис
Крик па основе анализа полученных М. Уил-
кинсоном и Р. Франклин рентгенограмм нитей
ДНК и с учетом правила Чаргаффа о коли-
чественном соответствии А—Т и G—С создали
модель структуры ДНК в виде двух цепей, име-
ющих противоположную направленность (анти-
параллельных; рис. 14.2) и взаимно закручен-
ных в правостороннюю спираль, в которой гид-
Глава 14. ДНК, хромосомы и плазмиды 427
рофобные основания обращены внутрь. Посколь-
ку мсныпие по размерам пиримидиновые основа-
ния (Т или С) спариваются с большими по раз-
мерам пуриновыми основаниями (А или G соот-
ветственно), двойная спираль имеет постоянный
диаметр, равный примерно 2,0 нм, что согласу-
ется с постулатом о независимости общей струк-
туры ДНК от конкретной последовательности ос-
нований. Пространственно плоские остатки осно-
ваний расположены как ступеньки лестницы, и
каждая их пара повернута вокруг оси спирали па
34,6° относительно предыдущей пары. Соответ-
ственно один полный виток составляют 10,4 пар
оснований и шаг спирали равен 3,4 нм. Эта мо-
дель описывает В-форму ДНК (рис. 14.3; см.
цв. вклейку), как ее теперь называют. Сахаро-
фосфатный остов па внешней стороне двойной
спирали образует большую (главную) и малую
(минорную) бороздки, в которых белки могут
узнавать последовательность пар оснований. По-
скольку главная бороздка «открывает» больше
информации, максимальное количество регуля-
торных белков связывается именно в пей.
В-форма ДНК состоит из двух антипарал-
лельных комплементарных цепей. Молекула ДНК
имеет диаметр 2 нм и шаг спирали, равный 3,4 нм;
на один виток приходится 10,4 пар оснований.
В результате однозначности спаривания осно-
ваний две антипараллельпые цепи ДНК содержат
одинаковую информацию. Каждая из цепей мо-
жет использоваться как матрица для синтеза ком-
плементарной цепи, что обеспечивает сохранение
генетической информации в процессах реплика-
ции и репарации.
Большая часть ДНК в клетке или в раство-
ре представлена В-формой, однако возможна и
другая конфигурация — A-форма, которая ме-
нее гидратирована и имеет более компактную
структуру. Плоскость остатков оснований в
A-форме слегка наклонена относительно оси спи-
рали, диаметр спирали равен 2,3 нм и па один ви-
ток приходится 11 пар оснований. In vitro в по-
линуклеотидных цепях с чередованием пуринов
и пиримидинов при высокой концентрации солей
обнаруживается Z-форма ДНК. Она является
единственной формой с левоспиральной копфор-
Рис. 14.2. Комплементарные и антипараллельные це-
пи в двухцепочечной ДНК. По определению, концевые
участки, содержащие фосфат (показан серым), называ-
ют 5'-концами, тогда как концевые участки, содержащие
гидроксильную группу (показана полужирным шриф-
том),— З'-концами. Обратите внимание на антипарал-
лельное расположение двух комплементарных цепей.
мацией, описанной для ДНК; название Z-форма
объясняется зигзагообразным расположением са-
харофосфатного остова. Пока неизвестно, имеет
ли Z-форма какую-либо физиологическую функ-
цию. 1
ДНК может иметь различные конфор-
мации □ В отличие от эукариотических клеток,
где ДНК представлена линейной двухцепочечной
молекулой, клетки прокариот содержат ДНК, за-
мкнутую в кольцо (сссДНК, от covalently closed
circles). Молекулу ДНК, образующую плоское
кольцо, называют релаксированной. Существует
также свсрхспирализованная форма ДНК в ви-
де молекулы, закрученной вокруг своей оси или
обвивающей белковую сердцевину и за счет кова-
лентного связывания концов замкнутой в кольцо.
Молекулы с одной и той же последовательностью
нуклеотидов, но различной топологией, например
в виде релаксированного или сверхспирализоваи-
ного кольца, называют топоизомерами (рис. 14.4
и 14.5); соответственно ферменты, катализирую-
щие их взаимопревращения, имеют название то-
поизомеразы .
При закручивании ДНК в направлении, про-
тивоположном ориентации (по часовой стрелке)
витков двойной спирали, возникает отрицатель-
ная сверхспираль. Такая молекула ДНК находит-
ся в напряженном состоянии; напряжение скручи-
вания может быть уменьшено путем частичного
раскручивания (рис. 14.4 и 14.5).
1 К настоящему времени Z-форма ДНК обнаружена также в про- и эукариотических хромосомах in vivo. См. Сингер М.,
Берг П. «Гены и геномы». М.: Мир. 1998. — Прим., вед. ред.
428 Часть IV. Генетика бактерий и бактериофагов
Ковалентно замкнутая кольцевая (ссс)ДНК
Рис. 14.4. Различные топологические конформации
(топоизомеры) молекул ДНК. Идентичные во всем
остальном молекулы ДНК могут принимать различ-
ные топологические конформации, образуя топоизоме-
ры. Специфические ДНК-нуклеазы, лигазы и топоизо-
меразы (геликазы, гиразы) превращают, например, ли-
нейную ДНК в ковалентно замкнутую кольцевую ДНК
или сверхспирализованную форму в релаксированную
либо разделяют сцепленные кольцевые ДНК (кате-
наны).
В структуре В-формы ДНК возможны неболь-
шие вариации, в том числе угла поворота од-
ной пары оснований относительно другой с из-
менением числа пар оснований, приходящихся
на одип виток спирали, в пределах 10-10,5.
Кроме того, угол, образуемый парой основа-
ний с осью спирали, может несколько откло-
няться от нормы, соответствующей 90°, и ось
спирали при этом смещается в том или дру-
гом направлении. Указанные вариации зависят
в первую очередь от первичной последователь-
ности оснований (но не однозначно определя-
ются ею). Таким образом, молекула ДНК пе
обязательно представляет собой прямую палочко-
видную структуру и может приобретать искрив-
ленную или изогнутую форму. Изгибы как откло-
нения от прямой осп между соседними парами ос-
нований в сумме (па участке протяженностью в
несколько пар оснований) определяют кривизну.
Изгибание ДНК происходит также в результате
взаимодействия с пей ДНК-связывающих белко-
(см. разд. 18.8).
14.1.2. Биохимический механизм синтеза ДНК
универсален
Полуконсервативная репликация ДНК о
Двухцепочечная структура ДНК сама по себе
указывает на способ ее репликации. Цепи ДНК,
содержащие одинаковую информацию, разделя-
ются, и каждая из них служит матрицей для
синтеза комплементарной цени (модель «застеж-
ка-молния»). Каждая из дочерних молекул напо-
ловину состоит из родительского материала. Этот
механизм назван полуконсервативной репликаци-
ей (рис. 14.6).
Репарационная репликация (точнее, репараци-
онный синтез ДНК) происходит на небольших
участках, где родительская ДНК в одной цепи
замещается вновь синтезированной ДНК. Сход-
ный локальный синтез ДНК, при котором матри-
цей служит комплементарная цепь, имеет место
при гомологичной рекомбинации, и в этом случае
его называют дисперсивпым синтезом ДНК (см.
разд. 15.6 и 16.4).
Рис. 14.5. Топоизомеры плазмидной
(RFS1010) ДНК. Слева направо: линейная,
релаксированная, кольцевая сверхспирали-
зованная и частично развернутая (показана
стрелкой) сверхспирализованная ДНК. (Фото
любезно предоставлено R. Lurz.)
Глава 14. ДНК, хромосомы и плазмиды 429
Рис. 14.6. Полуконсервативная репликация (экс-
перимент Мезельсона-Сталя). Схематически пред-
ставленные справа тяжелая, меченная 15N роди-
тельская ДНК (обозначена черным), гибридная
(15I\I/14N) ДНК первой генерации (обозначена се-
рым) и легкая (14N/14N) дочерняя ДНК (обозначена
штриховкой) разделяются в равновесном градиенте
плотности CsCI, как показано слева. Сдвиг в плот-
ности фрагментов (примерно 30 т.п.н.) хромосомной
ДНК из Е. coli в процессе переноса из «тяжелой»
среды в «легкую» анализировали через 0, 1 и 2 ге-
нерации соответственно.
ДНК синтезируют
ДНК-полимеразы □ Эти ферменты,
ферментные комплексы,
отдельных нуклеотидов,
матрицы существующую
(и, насколько известно,
ДНК-зависимые
вернее
синтезируют ДНК из
используя в качестве
цепь ДНК. У Е. coli
у других бактерий)
имеются три ДНК-полимеразы (табл. 14.1).
ДНК-полимераза I, кодируемая геном polA, —
это один полипептид с тремя ферментативными
активностями, каждая из которых связана с от-
дельным доменом. Помимо полимеразной актив-
ности, этот фермент обладает 3х—>5х-экзонуклеаз-
ной активностью, которую можно рассматривать
как корректирующую, и 5х—>Зх-экзонуклеазной
активностью, благодаря которой фермент спосо-
бен удалять РНК из РНК—ДНК-гибридов. Глав-
ная функция ДНК-полимеразы I — это репара-
ционный синтез ДНК, но по крайней мере ее
5х—>3,-экзонуклеазная активность используется
также и в репликации для удаления затравоч-
ной (праймерной) РНК из отстающей цепи (см.
ниже). Обеспечивающий эту активность домен
может' быть удален протеолитически. Остальную
часть фермента называют фрагментом Клепова;
опа используется при операциях с ДНК in vitro.
Все ДНК-полимеразы синтезируют ДНК по-
средством одного и того же основного меха-
низма: к З'-концу растущей цепи ДНК через
а-фосфатную группу присоединяются последова-
тельно пуклеозид-б'-трифосфаты. Необходимую
для такого взаимодействия энергию обеспечи-
вает гидролиз высокоэнергетической фосфатный
связи, сопровождающийся высвобождением пи-
рофосфата. ДНК-полимераза при этом выбирает
комплементарный нуклеотид — способный спари-
ваться с основанием в матричной цепи (рис. 14.7).
Растущая цепь ДНК удлиняется па З'-конце и син-
тез идет в направлении 5х —» 3х.
Таблица 14.1. ДНК-зависимые ДНК-полимеразы Escherichia coli
Полимераза 1 Полимераза II Полимераза III
Размеры, кДа Структура Число молекул на клетку Ферментативные активности Полимераза 3'—♦б'-экзонуклеаза (корректирующая) 5'—*3/-экзонуклеаза Функция Гены (субъединицы) 103 Мономер 300 + + + Репарация и репликация polA 90 Мономер Неизвестно + + Репарация polB 918 Гетеромультимер 10 + + Репликация dnaE (a), dnaN (/3), dnaQ (е), dnaX (т+7), holA (<5), holB (<$'), holC (у), holD (V>), holE (6)
430 Часть IV. Генетика бактерий и бактериофагов
—Общее направление
репликации ДНК Ведущая цепь
Рис. 14.7. Биохимический механизм полимериза-
ции (синтеза) ДНК. Показаны матрица и растущая
цепь ДНК. б'-Дезокси нуклеотидтри фосфат (фосфат-
ные группы показаны серым, дезокси нуклеозид — полу-
жирным кружком) присоединяется к Зх-ОН-концу (по-
казан полужирным шрифтом) растущей цепи в соответ-
ствии с правилом комплементарности пар оснований;
при этом высвобождается пирофосфат (РР).
Отстающая цепь
Рис. 14.8. Схематическое изображение репликационной
вилки в молекуле ДНК. После инициации, зависящей
от РНК-затравки, ведущая цепь копируется непрерыв-
но (5х —* 3х), тогда как отстающая цепь синтезирует-
ся прерывисто (каждый фрагмент Оказаки начинается
с новой РНК-затраски) (5х —> 3х). Общее напрвление
репликации на рисунке — справа налево; РНК-затравки
обозначены штриховой линией.
В результате при синтезе двухцепочечной
ДНК одна цепь (ведущая) синтезируется непре-
рывно, тогда как другая цепь — небольшими пор-
циями (фрагменты Оказаки), начиная с РНК-за-
травки, синтезируемой в обычном направлении
(5х —> 3х) и имеющей свободный Зх-ОН-конец. Эти
затравки синтезируются праймазами, которые
представляют собой РНК-полимеразы, использу-
емые только для синтеза коротких цепей РНК.
Относительно движения репликационной вилки
синтез фрагментов Оказаки (5х —» 3х) происходит
в противоположном направлении. Данную цепь
называют запаздывающей или отстающей
(рис. 14.8), поскольку синтез очередного фраг-
мента Оказаки становится возможным только по-
сле освобождения соответствующего участка мат-
рицы в результате наращивания ведущей цепи.
Координация синтеза этих цепей будет описана
ниже.
Механизм синтеза Дик называют полукон-
сервативным и полунепрерывным. Индивидуаль-
ные цепи синтезируются только в направлении
5х —> 3х. Для активности ДНК-полимеразы необ-
ходимы матрица и РНК-затравка со свободным
Зх-ОН-копцом. РНК-затравку обычно синтезиру-
ют праймазы.
ДНК-полимеразы не только выбирают пра-
вильный нуклеотид для присоединения против
последнего свободного основания матрицы, но и
проверяют, правильно ли произошло спаривание
оснований в предыдущей позиции. Если спарива-
ние неправильное, ошибочный нуклеотид удаля-
ется с помощью 3х —» 5х-экзонуклеазной актив-
ности (коррекция) и фермент отступает на одну
пару оснований. В случае ДНК-полимеразы I кор-
рекцию осуществляет один из доменов ее молеку-
лы; в случае ДНК-полимеразы III за коррекцию
отвечает специальная субъединица. Частота оши-
бок ДНК-полимераз, обладающих корректирую-
щей активностью, таких как полимеразы I и III,
составляет примерно 10~8, тогда как у фермен-
тов, лишенных этой активности —10~4-10~6.
Глава 14. ДНК, хромосомы и плазмиды 431
Таблица 14.2. Белки, участвующие в репликации хромосомы у Escherichia coli
Фермент Размеры, кДа Число молекул на клетку 1
Инициация
DnaA 52 1000
HU-аД 19 40 000
IHF-а/З 21,8 3000
FIS (димер) 22,4 30 000
H-NS 15,5 20 000
РНК-полимераза (а? 6/3'а) Инициация и элонгация 450
Геликаза (DnaBe) 6 х 50 = 300 20
DnaC (DnaC6) 6 х 29 = 174 20
Праймаза 60 50-100
ДНК-тираза (Аг + Во) 2 х 97 + 2 х 90 - 374 500
SSB (Белок, связывающий одноцепочечную ДНК) Элонгация 4 х 18,9 = 75,6 800
ДНК-полимераза III а2£2б2'Г2'У2^^,Х'Ф(34 918 10
ДНК-полимераза I 103 300
ДНК-лигаза 75 3
Топоизомераза I 100 1000
Топоизомераза III 74 10
Топоизомераза IV (РагСг + РагЕ-г) (2 х 84) + (2 х 70) = 308 500
1 Примерное количество в клетках, растущих со скоростью 1-2 генерации/ч.
Рис. 14.9. ДНК-полимераза III (холофермент) Escheri-
chia coli. Показана схема строения асимметричных ди-
меров, связанных т-белком. Оба димера содержат субъ-
единицы сердцевинного полипептида (а, е, 0) и «сколь-
зящий зажим» (/3-субъединица), которые необходимы
для быстрой полимеризации (приблизительно 103 нук-
леотидов в секунду). 7-Комплекс (субъединицы 7, 6, 6',
X и ^) необходим для связывания «зажима». Размеры
субъединиц показаны в масштабе, близком к реальному.
Полноразмерная ДНК-полимераза III
(холофермент) представляет собой сложный
белковый комплекс, осуществляющий реплика-
цию хромосом, большинства плазмид и фагов.
Этот комплекс состоит из десяти индивидуаль-
ных субъединиц (табл. 14.1), образующих асим-
метричный димер, одна часть которого служит
для синтеза ведущей цепи, другая — для синтеза
запаздывающей цепи (рис. 14.9). Координация ак-
тивностей отдельных частей ДНК-полимеразы III
будет рассмотрена ниже.
И ДНК-полимеразы обладают, помимо поли-
меразной активности, корректирующей активно-
стью (3'' —> б'-экзонуклеазной). Одно из исключе-
ний — термоустойчивая ДНК-полимераза Taq.
В синтезе ДНК участвуют и другие бел-
ки □ Кроме ДНК-полимеразы, в синтезе ДНК
у бактерий участвуют и многие другие бел-
ки (табл. 14.2), среди которых наиболее важны
ДНК-геликазы и ДНК-праймазы. Некоторые
из этих белков рассмотрены в других главах при
432 Часть IV. Генетика бактерий и бактериофагов
описании процессов репарации (разд. 15.6) и ре-
комбинации (разд. 16.4).
Важную функцию выполняет в репликации
ДНК-лигаза, сшивающая разрывы в цепи ДНК
при синтезе фрагментов Оказаки или репараци-
онном синтезе. Этот фермент ковалентно связы-
вает фосфатную группу на 5'-копце предыдущего
фрагмента ДНК с З'-ОН-группой на З'-конце но-
вого.
Гистоноподобные белки □ Белки HU, THF
(от integration host factor), FIS (от factor for
inversion stimulation) и H-NS (от histon-likc
nucleoid structuring protein) выполняют струк-
турную (морфопоэтическую) роль в формиро-
вании инициаторного комплекса. Именно поэто-
му их рассматривают вместе с инициаторными
белками. В более общем смысле они (особенно
FIS и IHF) необходимы для того, чтобы силь-
но изогнуть ДНК, например в процессе инициа-
ции транскрипции (см. разд. 18.8) или произвести
вырезание либо интеграцию фаговой ДНК (см.
разд. 26.4).
У Е. coli идентифицированы четыре топо-
изомеразы: топоизомераза I (ген top А), ДНК-
гираза (топоизомераза II, гены дуг А и дугВ), то-
поизомераза III (ген topB) и топоизомераза IV
(гены рагС и рагЕ}. Из этих ферментов толь-
ко гираза вводит в ДНК сверхвитки in vitro.
По-видимому, она же осуществляет сверхспира-
лизацию in vivo, поскольку ингибиторы гиразы
(налидиксовая кислота или коумермицин) блоки-
руют возникновение отрицательных сверхвитков
и вызывают потерю сверхспиральности хромосо-
мами и плазмидами. Мутанты topA, дефицит-
ные по топоизомеразе I, отличаются повышенным
уровнем сверхспиралыюсти, но очень быстро на-
капливают компенсаторные мутации в одном из
гиразных генов. Таким образом, гираза и то-
поизомераза I антагонистичны также и in vivo.
Кроме поддержания сверхспиралыюсти, функция
ДНК-гиразы состоит в ослаблении напряжения
скручивания перед репликационной вилкой. Ги-
раза и топоизомеразы III и IV участвуют в разъ-
единении (декатенации) связанных между собой
конечных продуктов («конкатемеров») при ре-
пликации кольцевых хромосом и плазмид. Все то-
поизомеразы производят временный разрыв цепи
ДНК путем образования ковалентного промежу-
точного продукта ДНК—белок. Таким способом
ферменты позволяют одной цепи ДНК пересечь
другую цепь.
Репликативная геликаза у Е. coli — продукт
гена dnaB (см. ниже). Опа перемещается с ис-
пользованием энергии гидролиза АТР вдоль цепи
ДНК в направлении 5' —» 3', раскручивая перед
собой двойную спираль.
Топоизомеразы производят временный раз-
рыв в одной цепи (ферменты первого типа:
топоизомеразы I и III) или разрыв двойной спи-
рали (ферменты второго типа: гираза, топоизо-
мераза IV) и позволяют одной цепи ДНК пере-
сечь другую цепь. Гираза создает отрицательные
сверхвитки, тогда как топоизомераза I ослабля-
ет их. Некоторые антибиотики (например, нали-
диксовая кислота и коумермицин) подавля-
ют активность ДНК-гиразы. Геликазы — это фер-
менты, раскручивающие двойную спираль ДНК.
Репликативная геликаза Е. coli — продукт гена
dnaB.
Практически во всех превращениях ДНК
участвует белок SSB (от single-strand binding),
связывающийся с одноцепочечпой ДНК (ген ssb.
Он стабилизирует и предохраняет одноцепочеч-
ную ДНК, появляющуюся в процессах реплика-
ции, рекомбинации и репарации, путем коопера-
тивного связывания с этими участками.
14.1.3 . От механизмов инициации синтеза ДНК
зависит, где и как начнется репликация
В 1963 г. Ф. Жакоб, С. Бреннер и Ф. Кюзе-
н разработали модель репликона, основан-
ную на предположении, что каждая способ-
ная автономно реплицироваться молекула ДНК
(репликон) содержит «репликатор» — сайт
ДНК в цис-положении (теперь называемый
точкой начала репликации), на который дей-
ствует инициаторный белок. Воспринятая вна-
чале как весьма спекулятивная, эта модель тем не
менее стала плодотворной основой для дальней-
ших исследований. Оказалось, что репликоны мо-
гут быть различными но размерам. В бактериаль-
ной клетке наиболее крупный репликон — это хро-
мосома; помимо нее, автономно реплицироваться
способны плазмиды и фаговые ДНК, также пред-
ставляющие собой репликоны.
Глава 14. ДНК, хромосомы и плазмиды 433
Репликон — это автономная репликационная
единица, содержащая точку начала репликации,
с которой взаимодействует инициаторный белок.
Точка начала репликации локализуется в репли-
цирующейся ДНК в цггс-положении.
Первый этап синтеза ДНК — это инициа-
ция, и именно на этом первом этапе действу-
ют основные регуляторные механизмы репли-
кации, связанные главным образом с инициа-
торным белком. Стратегия контроля состоит в
том, что при изменении внешних условий адап-
тация, как правило, происходит путем регули-
рования частоты инициации синтеза новых мак-
ромолекул, но не скорости их полимеризации.
Инициация репликации включает три стадии:
1) узнавание правильного места старта —точ-
ки начала репликации; 2) синтез РНК-затрав-
ки и 3) связывание ДНК-геликазы с матрицей.
У некоторых организмов эти этапы тесно сопря-
жены, у других разделены во времени и про-
странстве. Прежде чем рассматривать механизмы
узнавания точки начала репликации и отдельные
этапы репликации ДНК, следует описать раз-
личные способы формирования РНК-затравки и
праймосом.
Механизмы образования РНК-затравок
(праймеров) удалось установить при изучении
одноцепочечных фаговых ДНК. ДНК-полиме-
разы не могут начать синтез новой цепи ДНК,
пока не синтезирована РНК-затравка. Подготов-
ку к синтезу затравки осуществляют праймо-
сомы; они обеспечивают образование необходи-
мого для действия ДНК-полимеразы свободного
З'-ОН-копца и опосредуют связывание ДНК-гели-
казы, которая необходима для раскручивания и
репликации двухцепочечной матрицы.
В большинстве случаев затравки — это ко-
роткие молекулы РНК. Синтез затравки про-
исходит без корректирования, и именно РНК
удобна для данной цели, поскольку она, хотя и
может содержать ошибки, впоследствии уда-
ляется. РНК-затравка синтезируется как цепь,
комплементарная, в случае фагов, инфекцион-
ной вирусной ДНК, называемой (+)-цепыо. Эта
ДНК-цепь покрыта белком SSB. Три фага Е. coli
различаются по стратегии, обеспечивающей син-
тез затравки. У фага М13 на (+)-цепи имеется
вторичная шпилечная структура, которую узнает
обычная, осуществляющая транскрипцию РНК-
полимераза. Этот фермент синтезирует корот-
кую РНК-затравку. У фага G4 сходную вторич-
ную структуру узнает другая РНК-полимера-
за, а именно праймаза — у Е. coli продукт ге-
на dnaG. Наиболее сложный механизм синтеза
РНК-затравки обнаружен у фага ФХ174. Шпи-
лечную структуру на (+)-цепи узнает белок PriA,
и это инициирует сборку пре-праймосомного ком-
плекса, включающего, кроме PriA, белки PriB,
PriC и DnaT. К образовавшемуся комплексу при-
соединяется при участии DnaC-белка DnaB-re-
ликаза, после чего происходит присоединение
DnaG-праймазы, завершающее формирование
полной (ФХ174-типа) праймосомы. Как и у фага
G4, у ФХ174 РНК-затравку синтезирует прай-
маза; ДНК-полимераза III синтезирует в ее про-
должение (—)-цепь, которая вместе с матричной
(+)-цепыо образует двухцепочечную молекулу,
называемую R.F II (репликационная форма II).
Затем ДНК-полимераза I удаляет РНК-затравку,
и молекула ДНК при участии ДНК-лигазы замы-
кается в кольцо (ковалентно замкнутая форма —
RF I).
Праймосомы осуществляют присоедине-
ние геликазы □ У Е. coli известны два основ-
ных типа праймосом. Рассмотренная выше прай-
мосома ФХ 174-типа функционирует при репли-
кации одноцепочечной ДНК. Белок PriA узнает
шпилечную структуру pas (от primosorae assembly
site), которая образуется только в том случае, ес-
ли ДНК частично расплетена с помощью друго-
го механизма, например формирования R- или
D-петли. Праймосомы этого типа функционируют
при репликации плазмид, таких как ColEl, или
в системах обратной репликации, например ста-
бильной репликации ДНК (SDR, от stable DNA
replication) (см. ниже).
Праймосомы — это белковые комплексы, ко-
торые присоединяют геликазу к ДНК-матрице.
Поскольку с геликазой связывается ДНК-прай-
маза, праймосомы обеспечивают также наличие
РНК-затравки для синтеза ДНК. У Е. coli име-
ются два основных типа праймосом: 1) праймосо-
ма ФХ 174-типа, состоящая из белков PriA, PriB,
PriC и DnaT, комплекса DnaB/DnaC и праймазы,
и 2) праймосома DnaA-типа, состоящая из белка
DnaA, комплекса DnaB/DnaC и праймазы.
Репликацию хромосом осуществляет праймо-
сома DnaA. Вместо белков PriA, PriB, PriC и
DnaT опа содержит DnaA. Этот белок связыва-
434 Часть IV. Генетика бактерий и бактериофагов
ется с двухцепочечпой ДНК и, взаимодействуя с
гексамерным комплексом DnaB-DnaC, присоеди-
няет DnaB-геликазу. Праймаза включается в этот
комплекс, связываясь с геликазой.
Узнавание точки начала репликации осу-
ществляется различными способами. У прокари-
от репликопы в большинстве случаев представля-
ют собой ковалентно замкнутые двухцепочечные
кольцевые ДНК (сссДНК). Известно два основ-
ных способа репликации кольцевых матриц. Они
обозначены буквами греческого алфавита но сход-
ству с используемой структурой ДНК: двунаправ-
ленная 0-репликация и сг-репликация по механиз-
му «катящегося кольца».
В случае репликации 0-типа использует-
ся один из двух возможных способов узнава-
ния точки начала репликации, чаще всего меха-
низм инициации оггС-типа, характерный для
хромосомных, а также для большинства плаз-
мидных и фаговых ДНК. При таком узнава-
нии несколько субъединиц инициаторного белка
связывается с повторяющимися сайтами узнава-
ния (другое название -итероны), присутствую-
щими в точке начала репликации, что приводит к
возникновению особой нуклеопротеиновой струк-
туры. На следующем этапе происходит локаль-
ное раскручивание спирали в ближайшем бога-
том АТ-основаниями районе, вероятно за счет
искривлений в структуре инициаторного ком-
плекса (рис. 14.10; см. цв. вклейку). С участием
праймосомы синтезируются одна пли две моле-
кулы затравочной РНК. Образующаяся R-петля
служит исходным элементом для сборки репли-
кационной вилки. Если образуется единственная
РНК-затравка на ведущей цепи, репликация про-
исходит в одном направлении. Для двунаправлен-
ной репликации необходимы две затравки и две
праймосомы. Такая инициация зависит главным
образом от доступности инициаторного белка (см.
гл. 22).
R-петля — это трехцепочечпый участок (гла-
зок), содержащий ДНК-РНК-гибрид и соответ-
ствующую одноцепочечпую ДНК.
При репликации плазмид ColEl-типа дей-
ствует альтернативный путь образования R-пет-
ли и РНК-затравки. В этом случае РНК-затрав-
ку синтезирует обычная ДНК-зависимая РНК-по -
лимераза с обычного промотора, после чего
затравка подвергается процессингу под действи-
ем фермента РНКазы Н, вырезающей РНК из ги-
бридов РНК-ДПК Узнавание точки начала ре-
пликации состоит в определении положения про-
мотора и места процессинга. По, щобно инициация
по ColEl-типу и ее регуляция описаны в гл. 22.
Инициация 0-типа при синтезе ДНК на
кольцевой матрице осуществляется следующи-
ми способами: 1) посредством ori(7-механизма,
включающего образование специальной нук-
леопротеиновой структуры, включающей итерон-
содсржащий участок в точке начала репликации
и связанный с итеронами инициаторный белок,
или 2) посредством ColEl-механизма с использо-
ванием РНК-затравки, синтезируемой РНК-поли-
меразой и удаляемой путем процессинга РНКа-
зой Н.
При репликации по механизму катящего-
ся кольца ((т-тип) инициация и узнавание точки
начала репликации происходят совершенно иным
образом (рис. 14.11; см. цв. вклейку). В этом
случае затравкой служит не РНК, а свободный
З'-ОН-копец ДНК. По этому механизму репли-
цируются преимущественно плазмиды грамотрп-
цательных бактерий, некоторых (мелких) фагов,
а также осуществляется репликация, сопряжен-
ная с переносом ДНК в процессе конъюгации,
и репликация двухцепочечной RFI-формы фага
ФХ174 и сходных фагов. Инициаторный белок
узнает при этом участок, называемый dso (от
double-strand origin), и разрывает в нем цепь.
Возникающий в результате свободный З'-конец
используется как затравка для синтеза ведущей
цепи ДНК, причем матрицей служит кольцевая
цепь; свободная (+)-цепь ДНК вытесняется. По-
сле того как репликация минует сайт, названный
sso (от single-strand origin), он активируется в
(+)-цспи и с помощью праймосомы может начать-
ся синтез отстающей цепи. Синтез ДНК вдоль
кольцевой матрицы может повторяться несколь-
ко раз, поэтому при репликации по механизму ка-
тящегося кольца образуется длинный конкате-
мер, который содержит несколько копий генома
и подвергается в дальнейшем процессингу с обра-
зованием мономерных геномов, как, например, в
случае фага Л (см. разд. 26.3). В случае плазмид
обычно образуется и замыкается в кольцо моно-
мерная (+)-цепь.
У бактерий функционируют все три способа
инициации и репликации. Репликация хромосом
Глава 14. ДНК, хромосомы и плазмиды 435
происходит по oriC-типу (узнавание точки нача-
ла репликации инициаторным белком DnaA, об-
разование комплекса из отгС и DnaA, локальное
раскручивание и присоединение DnaB-геликазы с
помощью DnaA-праймосомы). У Е. coli и, веро-
ятно, у других бактерий имеются дополнитель-
ные системы репликации, называемые система-
ми репликации стабильной ДНК (SDR, от
stable DNA replication), поскольку инициация ре-
пликации этого типа, не зависит от необходимого
для других систем синтеза белка de novo. У му-
тантов с дефектом РНКазы Н имеет место кон-
ститутивная репликация стабильной ДНК
(eSDR), при которой стабильные R-петли фор-
мируются на многих участках хромосомы. Инду-
цированная репликация стабильной ДНК
(iSDR) обнаружена при индукции SOS-отве-
та (см. разд. 15.7). В этом случае образуются
ДНК-затравки из промежуточных продуктов ре-
комбинации. Гомологичная одноцепочечная ДНК
внедряется в двухцепочечную ДНК в местах вре-
менных вздутий, образующихся при взаимодей-
ствии с белком RecA (см. гл. 15). В результате
возникает D-петля — трехцепочечная структура
ДНК со свободным З'-ОН-концом, который мо-
жет использоваться как затравка и удлиняться
ДНК-полимеразой. Для репликации таким спосо-
бом протяженных участков ДНК требуется прай-
мосома, но лить немногие сайты хромосомы соот-
ветствуют структурным требованиям (например,
близкого расположения к сайту связывания прай-
мосомы), которые обеспечивают эффективность
данного способа репликации. Инициация посред-
ством промежуточных продуктов рекомбинации
имеет место также у некоторых фагов (например,
у фага Т4 Е. coli).
Кроме РНК или ДНК, затравкой могут слу-
жить белки. Так, у фага ф29 В. subtilis затравкой
для синтеза его линейной ДНК служит находя-
щийся на конце молекулы ДНК белок, к которо-
му ковалентно присоединяется первый нуклеотид
вновь синтезируемой цепи ДНК.
14.1.4 . При синтезе ДНК в хромосомной
репликационной вилке взаимодействуют
несколько белков
Как отмечено выше, основные различия между
репликацией двух цепей в составе двухцепочеч-
ной ДНК связаны с их полярностью. Ведущая
цепь сип тезируется непрерывным способом, тогда
как отстающая — прерывистым, т. е. путем обра-
зования и объединения фрагментов Оказаки (см.
рис. 14.8). Ответственный за такой синтез аппа-
рат, холофермент ДНК-полимераза III (рис. 14.9),
состоит из полимеразной и корректирующей субъ-
единиц (сердцевинный полипептид Poll!!),
«скользящего зажима» (/3-субъединица) и бел-
ка, выполняющего роль «скобы» (скрепки), или
«связывающего зажима» (7-комплекс, субъ-
единицы 'уёб'хф). Скрепляющий белок узнает
З'-конец затравки в R- или D-петле и присоеди-
няет «скользящий зажим». Затравкой в точке на-
чала репликации может быть 3'-конец ведущей
цепи или РНК-затравка для фрагментов Оказа-
ки при синтезе отстающий цепи. «Скользящий
зажим» представляет собой субъединицу, ответ-
ственную за непрерывность процесса и образую-
щую кольцо вокруг ДНК. Это кольцо обладает
симметрией шестого порядка и образуется двумя
^-субъединицами ДНК-полимеразы III (в случае
Е. coli).
ДНК-полимераза II — это комплекс из
нескольких компонентов: сердцевинного белка
PolIII, выполняющего функции полимеризации
и коррекции, «скользящего зажима» (/3-субъеди-
ница), обеспечивающего непрерывность процесса,
и белков «связывающего зажима» (7-комплекс).
Фермент представляет собой асимметричный ди-
мер, синтезирующий одновременно ведущую и от-
стающую цепи (рис. 14.12). Н
Рис. 14.12. Хромосомная репликационная вилка. Отста-
ющая цепь заворачивается назад, что позволяет асим-
метричному димеру ДНК-полимеразы III осуществлять
координированный синтез ДНК на обеих цепях. Обозна-
чения те же, что на рис. 14.9 и в тексте. SSB — белок,
связывающий одноцепочечную ДНК.
436 Часть IV. Генетика бактерий и бактериофагов
«Скоба» и «скользящий зажим» способствуют
присоединению сердцевинного полипептида поли-
меразы III к общему комплексу, и в присутствии
(1NTP этот комплекс может синтезировать длин-
ные участки, содержащие более 50 000 нуклеоти-
дов, со скоростью свыше 500 нуклеотидов в се-
кунду. Запаздывающая цепь синтезируется тем
же самым ферментным комплексом. После того
как закапчивается синтез одного фрагмента Ока-
заки, «скользящий зажим» остается связанным с
ДНК, тогда как сердцевинный полипептид поли-
меразы III диссоциирует и вновь связывается для
удлинения затравки следующего фрагмента Ока-
заки. Репликация обеих цепей, ведущей и отста-
ющей, протекает координированно благодаря ди-
меризации этих двух полимеразных комплексов.
Для координации синтеза отстающая цепь долж-
на загибаться назад, чтобы обеспечить движение
обоих полимеразных комплексов в направлении
перемещения репликационной вилки (рис. 14.12).
14.2. Клетки большинства бактерий содержат одну кольцевую хромосому
У большинства прокариот гены, необходимые
для жизнедеятельности и определяющие видовую
специфичность, расположены линейно в един-
ственной, ковалентно замкнутой кольцевой мо-
лекуле ДНК, называемой хромосомой. Данный
цитологический термин — хромосома — по свое-
му значению не эквивалентен в применении к
прокариотам генетическому термину геном, ко-
торый в данном случае означает сумму всех
генов клетки, находящихся не только в хромо-
соме, по также в плазмидах или бактериофагах.
В молекулярно-биологическом смысле хромосома
прокариот представляет собой лишь крупный ре-
пликон.
14.2.1. Насколько генетические карты бактерий
коррелируют с хромосомами
как физическими объектами
Первой была получена с помощью методов гене-
тического анализа, основанных на использовании
конъюгации и трансдукции, генетическая карта
Е. coli. Поскольку картирование длинных отрез-
ков хромосомы в тот период осуществляли путем
прерывания конъюгации, в процессе которой пе-
ренос целой хромосомы Е. coli занимает прибли-
зительно 100 мин, генетическую карту Е. coli до
сих пор калибруют в (санти-) минутах, изображая
в виде кольца. В 1963 г. Дж. Кейрпс получил ра-
диоавтограмму меченной [3Н]-тимидином хромо-
сомы Е. coli, показавшую, что контурная длина
этой хромосомы составляет 1,3 мм , т. е. примерно
в 500 раз больше длины самой клетки Е. coli, что
хромосома в клетке Е. coli одна и что она имеет
кольцевую форму. В отличие от этого, как уста-
новлено недавно, у Streptomyces и Borrelia хро-
мосомы линейные (и более крупные, 7,8 м.п.н. и
9,5 м.п.н. соответственно), у Burkholderia cepacia
в клетках присутствуют три кольцевые хромосо-
мы (3,6; 3,2 п 1,1 м.п.н.).
Приведение генетической карты в соответ-
ствие с физической потребовало значительных
усилий. Однако полученные при этом сведения
все больше утрачивают свою ценность по мере
накопления результатов секвенирования бактери-
альных геномов, представляя уже лишь исто-
рический интерес. К настоящему времени пол-
ностью секвенирована последовательность ос-
нований в хромосомах Mycoplasma genitalium
(580 т.п.н.), Mycoplasma pneumoniae (816 т.п.н.),
Helicobacter pylori (1,8 м.п.н.), Haemophilus inf-
luenzae (1,83 м.п.н.), Methanococcus jannaschii
(1,67 м.п.н.), Bacillus subtilis (4,2 м.п.н.), Entero-
coccus faecalis (3,0 м.п.н.) и Escherichia coli K-12
(4,7 м.п.н.).
Репликация типичных хромосом, подобных
хромосомам Е. coli или В. subtilis, начинает-
ся с единственной точки начала репликации
(oriC) и происходит в двух направлениях до
конечной точки. Участок терминации ограни-
чен сайтами терминации, с которыми связывают-
ся белки терминации. Эти белки обладают по-
лярностью и позволяют репликационным вилкам
проникнуть в этот район, но не покинуть его (бо-
лее подробно процесс терминации и регуляции ре-
пликации в клеточном цикле рассмотрен в гл. 22).
У Streptomyces хромосома также имеет единствен-
ную точку начала репликации; о процессе репли-
кации линейных хромосом данных пока недоста-
точно.
Глава 14. ДНК, хромосомы и плазмиды 437
14.2.2. Нуклеоид и внутриклеточная
организация бактериальной хромосомы
Бактериальные хромосомы отличаются от эука-
риотических относительно низкой степенью кон-
денсации, зависящей от белков. Бактериальная
ДНК не организована в нуклеосомы и не окру-
жена мембраной, но компактно локализована в
определенной области, называемой нуклеоидом,
и покрыта гистоноподобными белками, в частно-
сти HU и Н-NS (белки, структурирующие нук-
леоид), однако менее плотно, чем ДНК в клет-
ках эукариот. Нуклеоиды можно выделить путем
.’визирования клеток при высоких концентрациях
соли. Будучи распределенным на подложке, нук-
леоид выглядит на электронных микрофотогра-
фиях как многочисленные петли, исходящие из
общего центра. Эти петли в большинстве случа-
ев сверхспирализованы и, возможно, представля-
ют собой индивидуальные сверхспирализовапные
домены хромосомы (рис. 14.13).
Область нуклеоида в цитоплазме почти не
содержит рибосом. Нуклеоид имеет крупные раз-
меры относительно размеров бактериальных кле-
ток (например, в случае Е. coli —1,3 мм про-
тив 3 мкм); ДНК в нем плотно упакована и ма-
лодоступна для действия ферментов, таких как
РНК-полимераза, а также для рибосом. Поэто-
му транскрипция, по-видимому, возможна не в
основной массе ДНК, а только на поверхности
нуклеоида. Можно предполагать, что сверхспира-
лизованные петли проникают в области цитоплаз-
мы, содержащие РНК-полимеразу и рибосомы, и
вся структура нуклеоида весьма динамична.
Нуклеоид —это область внутри бактериаль-
ной клетки, где локализована плотно упакованная
ДНК. Он не окружен мембраной и может быть
выделен путем лизировапия клеток при высокой
концентрации соли. Н
Рис. 14.13. Изолированный нуклеоид Escherichia coli.
Выделенный из клеток нуклеоид имеет вид нитевидных
петель, возможно хромосомных доменов, многие из ко-
торых сверхспирализованы. Нуклеоид обработан детер-
гентом и осторожно расправлен с использованием ци-
тохрома с. (Шкала ~1 мкм). По [1].
Поскольку нуклеоид не окружен мембраной,
повосинтезированная мРНК сразу доступна для
взаимодействий и непосредственно по мере син-
теза с пей связываются рибосомы, происходит
образование полисом и осуществляется трансля-
ция. Такое прямое сопряжение транскрипции и
трансляции составляет важное отличие прокари-
отических клеток от эукариотических. Координа-
ция процессов репликации, сегрегации нуклеоида
и деления клетки рассмотрена в гл. 22.
14.3. Плазмиды как независимые репликоны
Размеры природных плазмид варьируют от
1 т.п.н. до нескольких сотен т.п.н. Плазмиды
представляют собой независимые репликоны и в
большинстве случаев замкнуты в кольцо. И вновь
исключение составляют представители Strepto-
myces, Borrelia и Rhodococcus, у которых обнару-
жены линейные плазмиды.
В состав плазмид входят гены, обеспечиваю-
щие их воспроизведение, а именно ответственные
за инициацию и контроль репликации. Часто они
438 Часть IV. Генетика бактерий и бактериофагов
Таблица 14.3. Распространенные плазмиды грамотрицательных бактерий
Плазмида Размеры, т.п.н. Число копий на хромосому Характерные маркеры1
ColEl 6 10-20 сеп+ (колицин Е1)
pSClOl 9 6 tet+ (Тс)
R6K 38 10-20 Ыа+ (Ар), str+ (Sm), tra+
PR4, RK2 60 5 bla+ (Ар), aph.A+ (Kin), tet+ (Tc), tra+
R100 90 1 aadA+ (Sm), cat+ (Cm), sul+ (Su), (Tc), mer+ (Hg), tra+
F 90 1 tra+
1 Фенотипы кодируемых плазмидой маркеров устойчивости приведены двухбуквенным кодом.
кодируют также факультативные свойства, обес-
печивающие клетке-хозяину преимущества в тех
или иных условиях. Крупные плазмиды иногда
трудно отличить от хромосом. По договоренно-
сти крупные плазмиды называют хромосомами,
если они содержат гены «домашнего хозяйства»
(за исключением F' или R'-плазмид). Такие плаз-
миды образуются в результате неточного выреза-
ния эписом (плазмид, способных включаться в
хромосому) из сайтов хромосомной локализации
(см. гл. 16). В строгом смысле ДНК бактериофа-
гов также относится к плазмидам. Однако, по со-
ображениям историчности изложения, речь о них
пойдет в гл. 26. В табл. 14.3 приведен ряд рас-
пространенных плазмид грамотрицательных бак-
терий. Единой номенклатуры плазмид пока не
разработано. Часто их обозначения включают на-
чальную букву «р», за которой следуют иници-
алы автора и число (как, например, в обозначе-
нии pBR322) или буквы, обозначающие функцию
плазмиды (например, рЕХ для экспрессируемого
вектора). Исторически сложилось так, что обо-
значения плазмид, содержащих гены устойчиво-
сти к антибиотикам, половых факторов или ко-
лицинов, нс содержат начальной буквы «р» (на-
пример, R100, RSF1010, F, mini-F, ColEl).
Плазмиды — это независимые генетические эле-
менты, содержащие дополнительные гены (необ-
ходимые лишь в специфических условиях). По-
добно хромосомам, плазмиды реплицируются ав-
тономно. Особые плазмиды, эписомы, способны,
помимо того, включаться в хромосому. В отли-
чие от плазмид, транспозирующисся элемен-
ты (Тп) существуют только в интегрированном с
хромосомой состоянии. Н
14.3.1. Плазмиды регулируют
собственную репликацию и
количество образуемых копий
Репликация различных плазмид осуществляется
разными способами, рассмотренными выше. Неза-
висимо от способа репликации плазмиды контро-
лируют количество своих копий, т. е. скорость
их репликации соответствует скорости реплика-
ции хромосомы, благодаря чему количество ко-
пий остается постоянным. У разных плазмид оно
может существенно варьировать, от 1 копии на
хромосому до более чем 100 копий, но для каж-
дой плазмиды число копий относительно посто-
янно. Все изученные плазмиды контролируют
собственную репликацию, и, следовательно, ко-
личество копий по механизму отрицательной об-
ратной связи на уровне инициации репликации.
В этой регуляции участвуют три транс-активных
элемента, действующих по отдельности или сов-
местно. Один из них представляет собой неболь-
шой антисмысловой транскрипт РНК, способ-
ный непосредственно ингибировать инициацию,
взаимодействуя с РНК-затравкой, как в случае
плазмид ColEl-типа, либо подавлять трансля-
цию инициаторного белка, обычно обозначаемо-
го Rep (не путать с Rep-геликазой). Второй
элемент представляет собой репрессор гена г ер.
Третий элемент — это набор коротких повторяю-
щихся последовательностей, таких же, как в точ-
ке начала репликации, которые связывают белок
Rep и предотвращают инициацию транскрипции
(дополнительную информацию и рисунки см. в
гл. 22).
В случае регуляции по механизму отрицатель-
ной обратной связи плазмиды с одним и тем же
Глава 14. ДНК, хромосомы и плазмиды 439
типом контроля репликации или системы рас-
пределения несовместимы, т. е. в данной популя-
ции клеток невозможна стабильная репликация
двух типов плазмид. В то же время плазмиды
с разными типами контроля инициации вполне
совместимы. Несовместимость определяется
свойством основного репликона плазмиды и не
зависит от тех или иных дополнительных генов
плазмиды. На характеристике несовместимости
основана классификация плазмид — подразделе-
ние нх на группы несовместимости, такие как
IncP (RP1, R.K2), IncFI (F, ColV), IncFII (Rl) и
IncY (фаг Pl). Для установления группы несовме-
стимости осуществляют следующую процедуру.
Клетки, содержащие плазмиду известной груп-
пы несовместимости, подвергают трансформации,
используя для этого исследуемую плазмндпую
ДНК. Затем эти клетки выращивают в условиях,
селективных для исследуемой плазмиды, после
чего проверяют наличие первой плазмиды, и, если
она еще присутствует, плазмиды считают совме-
стимыми. В случае, если они относятся к одной
группе несовместимости, исходно присутствовав-
шая плазмида быстро утрачивается.
Плазмиды с одинаковым типом контроля ре-
пликации несовместимы. Они могут сохранять-
ся в одной и той же клетке только в условиях,
селективных для обеих плазмид.
Системы распределения и зависимо-
сти □ Сохранение плазмид в бактериальных
популяциях обеспечивают различные генетиче-
ские системы распределения и зависимости. Для
мультикопийных плазмид такие специальные си-
стемы не обязательны, по в случае плазмид,
присутствующих в виде одной или небольшого
числа копий, они необходимы. Обычно даже од-
покопийные плазмиды утрачиваются из бактери-
альной популяции с частотой менее 10“7 в пе-
ресчете па клеточный цикл. Механизмы такого
чрезвычайно стабильного наследования плазмид
в популяциях бактерий действуют па трех уров-
нях. Часто плазмиды обладают несколькими си-
стема! (и сохранения.
При репликации по $-типу, а также при ре-
комбинациях образуются димерные или мульти-
мерные (сцепленные) кольцевые продукты. Для
передачи по отдельности дочерним клеткам ’эти
мультимеры должны быть разделены на инди-
видуальные единицы. Функцию разделения спо-
собны выполнять ДНК-топоизомеразы клетки-
хозяина. Однако многие плазмиды и фаги облада-
ют собственными сайт-специфичными систе-
мами рекомбинации для эффективного разде-
ления мультимеров.
Специальные системы распределения
обеспечивают в процессе деления клетки попада-
ние хотя бы одной плазмиды в каждую дочернюю
клетку. Изученные к настоящему времени систе-
мы этого типа включают два белка, действую-
щих по гпранс-типу, и цпе-активный сайт в мо-
лекуле ДНК. В случае плазмиды F (см. рис. 1С.З)
это локусы sop A, sop В и incD\ у фага Р1 —par А,
рагВ и incB\ в геноме фага R1 — stbA, sthB и
incA. Функционирующие по цпе-типу шс-сайты
являются функциональными аналогами центро-
мер эукариотических хромосом. Механизм функ-
ционирования ?пра?/.с-активных белков, обеспе-
чивающих равномерное распределение плазмид,
пока неизвестен. Вероятно, эти белки опосредуют
взаимодействие цнс-активного сайта плазмиды со
специальным сайтом на клеточной мембране (см.
гл. 22).
Действие системы зависимости основано на
том, что несущая плазмиду бактерия выживает
только при условии, что опа сохраняет эту плаз-
миду. Гибсль клетки при утрате плазмиды обеспе-
чивается способностью плазмиды продуцировать
«яд» и «противоядие». «Яд» относительно устой-
чив, тогда как «противоядие», блокирующее его
действие, представляет собой неустойчивую моле-
кулу, утрачиваемую при потере плазмиды. В от-
сутствие плазмиды клетка погибает под действи-
ем «яда». Виохимические механизмы действия
«яда» и «противоядия» могут быть различны-
ми; например, в случае плазмиды F оба эти ком-
понента являются белками, тогда как «противо-
ядие» плазмиды R1 — это небольшая антисмысло-
вая РНК, предотвращающая трансляцию мРНК
токсичного белка.
Плазмиды существенно различаются в отно-
шении круга хозяев. Среди них известны узко-
специфичные, ограниченные в своем распростра-
нении только одним видом-хозяином, и широ-
коспецифичпые, такие как плазмида RP4 (см.
рис. 17.1), способная переноситься практически в
любые грамотрицательные бактерии. Плазмиды
с узкой специфичностью используют аппарат ре-
пликации хозяина, тогда как при широкой специ-
фичности плазмиды обычно несут гены большин-
ства собственных белков, участвующих в репли-
440 Часть IV. Генетика бактерий и бактериофагов
кации. Гены, сайты и механизмы, ответственные
за горизонтальное распространение плазмид пу-
тем конъюгации и мобилизации, описаны в гл. 16.
14.3.2. Плазмиды кодируют
разнообразные функции
Плазмиды состоят из модулей, в число кото-
рых входит обязательный основной репликон,
содержащий точку начала репликации, и гены,
обеспечивающие и контролирующие протекание
репликации. Многие плазмиды включают одну
или большее число систем распределения. Бо-
лее крупные (конъюгативные) плазмиды кодиру-
ют также функцию переноса — горизонтальной
передачи плазмиды другим клеткам данной бак-
терии или другим бактериям (см. гл. 16). Эти три
модуля ответственны за поддержание и распро-
странение плазмид. Известны природные плаз-
миды, состоящие только из основного репликопа
и не оказывающие заметного влияния на фено-
тип клетки-хозяина; они получили название крип-
тических. Однако большинство плазмид кодиру-
ет определенные функции, позволяющие клеткам-
хозяевам выживать в ;гех или иных условиях
среды. Этим свойством плазмид в большой степе-
ни обусловлена физиологическая вариабельность
бактерий.
Плазмиды состоят из модулей — обязательного
модуля основного репликопа и, помимо того, мо-
дулей распределения, переноса и различных био-
химических свойств.
Нерациональное использование антибиотиков
в медицине и сельском хозяйстве привело к рас-
пространению бактерий, устойчивых одно времен-
но ко многим (до десяти) антибиотикам. Устой-
чивость к антибиотикам часто распространя-
ется внутри данной бактериальной популяции,
поскольку обусловлена генами, находящимися в
составе плазмид резистентности, или R-плаз-
мид. Гены устойчивости нередко входят в состав
транспозонов — подвижных генетических эле-
ментов, которыми обмениваются различные плаз-
миды или плазмиды и хромосомы (см. разд. 14.4).
Карта плазмиды R100 — типичной R-плазмиды —
показана на рис. 14.14.
Рис. 14.14. Карта плазмиды устойчивости R100. Гены
указаны на внешней стороне, определяемые ими фе-
нотипы (в виде двухбуквенных кодов) — на внутренней.
Мобильные элементы показаны серым; в них треуголь-
никами обозначены инвертированные последователь-
ности.
Механизмы устойчивости весьма разнообраз-
ны и широко распространены у прокариот. Такие
гены, как aphA (кап — ген амипогликозид-фос|
фотрапсферазы: фенотип Кт — устойчивость к
канамиципу), cat (ген хлорамфеникол-ацетил-
трансферазы; фенотип Ст — устойчивость к хло-
рамфениколу) и aadA (str —ген аминоглико-
зид-аденилилтрансферазы; фенотип Sm —устой-
чивость к стрептомицину) кодируют ферменты,
модифицирующие антибиотики путем фосфори-
лирования, ацетилирования или аденилирования.
Ген Ыа (фенотип Ар) кодирует фермент /3-лакта-
мазу, расщепляющую пенициллины; устойчивость
к тетрациклину (фенотип Тс, кодируемый геном
tet) обусловлена изменением проницаемости кле-
точной мембраны для тетрациклинов. Гены устой-
чивости к Hg2+ кодируют КАВР(Н)-зависиыую
редуктазу, восстанавливающую Hg2+ до нераство-
римой молекулярной ртути. Устойчивость к ан-
тибиотикам, кодируемую плазмидпыми генами,
условно обозначают двухбуквеппым кодом для
отличия от устойчивости, кодируемой хромосом-
ными детерминантами.
Глава 14. ДНК, хромосомы и плазмиды 441
Другие плазмиды, имеющие медицинское зна-
чение, несут гены вирулентности или токси-
нов. Так, плазмиды Е. coli могут содержась гены
энтеротоксинов; у некоторых бактерий они обу-
словливают образование пилей (фимбрий), явля-
ющихся фактором вирулентности и опосредую-
щих прикрепление к клетке-хозяину. Это лишь
отдельные примеры важного для медицины вли-
яния плазмид па свойства бактерии-хозяина (по-
дробнее опо рассмотрено в гл. 33).
Многие плазмиды несут гены белков, направ-
ленных против других бактерий. К таким бел-
кам относятся выделяемые некоторыми бактери-
ями бактериоцины, вызывающие гибель бакте-
рий того же вида или родственных видов, но не
оказывающие действия на сами клетки, несущие
«бактериоципогенные» плазмиды. Среди бакте-
риоцинов наиболее изучены колицины, продуци-
руемые Е. coli и направленные против клеток
той же бактерии; кодирующая полиции плазми-
да ColEl является прототипом большинства плаз-
мид, используемых в генной технологии. Разные
колицины различаются по механизму действия.
Так, колицин Е1 и некоторые другие повыша-
ют проницаемость плазматической мембраны, ко-
лицин Е2 вызывает деградацию ДНК, колицин
ЕЗ —деградацию рибосомной РНК. Иной способ
уничтожения бактерий в своем окружении — это
образование антибиотиков; он распространен
среди актипомицетов, у которых имеются плаз-
миды, несущие гены этих веществ. Защиту от фа-
говой инфекции или внедрения чужеродной ДНК
обеспечивают бактериальные системы рестрик-
ции/модификации. В связи с этим многие плаз-
миды кодируют рестрицирующие эндонуклеазы и
родственные метилтрапсферазы.
Плазмиды деградации, часто обнаружи-
ваемые у бактерий, обеспечивают метаболи-
зировапис разнообразных веществ, например,
у Pseudomonas — алифатических углеводородов
(октан, декан и др.), ароматических углеводоро-
дов (ксилолы, толуол, нафталин и др., а так-
же продукты их окислительных превращений —
салицилат, бензоат), терпенов и хлорсодержащих
углеводородов, в том числе пестицидов (см. гл. 9
и 34). Другие бактерии содержат плазмиды, поз-
воляющие им разлагать наиболее доступные ис-
точники углерода (например, сахарозу, рафинозу
и лактозу в случае кишечных бактерий). Такие
плазмиды могут кодировать все ферменты дан-
ного пути деградации или лишь часть из них;
в последнем случае полная деградация возмож-
на при кооперации различных микроорганизмов.
Ферменты деградации, как правило, относятся к
индуцибельпым; их гены организованы в опероны
и регулоны.
Для некоторых бактерий, содержащих плаз-
миды, характерна специфическая взаимосвязь с
растениями. Так, вид Agrobacterium tumefaciens,
содержащий крупную (примерно 500 т.п.н.)
Ti-плазмиду (tumor-inducing plasmid), пара-
зитирует на растениях. При инфицировании в
клетки растения переносится примерно 10% гене-
тического материала этой плазмиды (Т-ДНК, от
tumor DNA), что индуцирует в них образование
подобных аминокислотам веществ, вызывающих
рост клеток в виде каллуса, т. е. опухоли. По-
скольку для переноса необходимы только концы
этого сегмента, находящиеся в ц?/с-потожении, в
генной технологии данную плазмиду используют
с целью переноса чужеродной ДНК в растения
(см. гл. 34).
Другой тип взаимодействия плазмид-содер-
жащих бактерий с растениями — это симбиоз с
ними азотфиксирующих бактерий, благода-
ря которому на земном шаре за год в ам-
моний превращается почти 108 т атмосферного
азота. Примерно 20% этого количества фиксиру-
ют клубеньковые бактерии Rhizobium, обитающие
на корнях бобовых растений. Необходимые для
образования клубеньков гены nod/vir, а также ге-
ны nif, необходимые для азотфиксации, локализо-
ваны у них в крупной плазмиде (см. гл. 34).
Плазмиды могут нести гены устойчиво-
сти к антибиотикам, гены вирулентности и ге-
ны синтеза различных соединений— токсинов,
бактериоцинов, антибиотиков, систем рестрик-
ции/модификации, фермейтов катаболизма, ве-
ществ, вызывающих образование опухолей у рас-
тений, и ферментов азотфиксации. Таким обра-
зом, с природными плазмидами в значительной
степени связано физиологическое разнообразие
бактерий. Я
442 Часть IV. Генетика бактерий и бактериофагов
14.4. Мобильные генетические элементы — транспозоны
Бактериальные геномы способны изменяться в ре-
зультате мутаций и отбора, переноса ДНК от дру-
гих бактерий (горизонтальный перенос) или пе-
рестройки собственной ДНК. (Обмен ДНК меж-
ду клетками различных бактерий рассмотрен в
гл. 16.) Наряду с этими механизмами важным
фактором изменчивости ДНК служат транспо-
зирующиеся (мобильные) элементы ДНК,
которые способны непосредственно перемещать-
ся из одного сайта в другой внутри хромосо-
мы или во впехромосомную ДНК в пределах
одной клетки. Сходства между донорным и ак-
цепторным сайтами при этом обычно не трсбут-
ся («незаконная рекомбинация»). Некоторые
транспозоны, названные конъюгативными
и обозначаемые СТп, могут перемещаться в дру-
гие клетки в процессе, сходном с конъюгацией
(см. гл. 16). Транспозирующиеся элементы непо-
средственно влияют па геном хозяина, поскольку
внедряются внутрь генов или в близко прилега-
ющие участки, нарушая генную структуру или
подчиняя экспрессию этих генов новым регуля-
торным элементам. Рекомбинация между двумя
копиями одного и того же мобильного элемен-
та может приводить к делециям, дупликаци-
ям, амплификациям, инверсиям и транс-
позициям сегментов генома (рис. 14.15) или к
слиянию независимых репликонов. Мобильные
элементы вызывают многие хромосомные мута-
ции и обусловливают их высокую частоту. По
сложности структура мобильных элементов ва-
рьирует от простой в случае IS-элементов до
сложной в случае транспозонов.
Рис. 14.15. Происхождение хромосомных мутаций и
роль мобильных элементов.
А. Если транспозиция (например, IS-элементов) сопро-
вождается образованием прямых повторов (DR) гомо-
логичной ДНК, рекомбинация может вызывать делецию
(«looping-out»; образование петли и ее исключение) или
дупликации, и в результате повторных актов рекомби-
нации (например, с вырезанными, looped-out, кольцами
ДНК или после репликации ДНК) амплификацию генов.
Б. В присутствии инвертированных повторов (IR) ре-
комбинация вызывает инверсию («flip-flop»; изменение
ориентации сегмента ДНК) последовательности ДНК,
расположенной между IR-элементами.
Транспозоны—это мобильные сегменты
ДНК, непосредственно перемещающиеся внут-
ри генома из одного сайта в другой. Простые
транспозоны (IS-элементы) содержат на концах
инвертированные последовательности и кодиру-
ют фермент транспозазу, катализирующую их
перенос. Сложные транспозоны содержат на кон-
цах инвертированные повторы, иногда в виде
IS-элементов, и включают, кроме гена транспо-
зазы, дополнительные гены.
14.4.1. Инсерционные последовательности
(IS-элементы) — простейшие
мобильные элементы
Инсерционные (вставочные) последователь-
ности широко распространены в клетках прока-
риот, их фагах и плазмидах. Они были открыты
в начале 1970 гг. П. Старлинжером, Г. Седлером
ц Дж. Шапиро при изучении мутаций необычно-
го типа (с сильно полярным эффектом) в ре/-опе-
ропе Е. coli. Существуют различные IS-элемен-
ты, и бактерии обычно содержат в хромосоме по
Глава 14. ДНК, хромосомы и плазмиды 443
Таблица 14.4. Обычные инсерционные последовательности (IS) Escherichia coli
IS-элемент Длина, т.п.н. Инвертированные концевые повторы, т.п.н. Прямые повторы в мишени, т.п.н. Выбор мишени Количество копий на геном Е. coli
ISJ 768 23 9 Случайный 5-10
IS2 1327 41 5 Горячие точки 4-8
IS3 1258 40 3 Горячие точки 5
IS5 1195 16 4 Горячие точки 10-12
IS10 1329 22 9 NGCTNAGCN 2
IS50 1531 9 9 Горячие точки 0
CCAGATTCCTTCCTCTCCCCACCTAATGT
GCTCTAACGAAGGAGACGCGTCCATTACA
------------------------- IS I -----------------------►
CCACATTCCTTCCTCTCCCGGTCATGCTCCCAACTTACTGAT--------ATCAATAAGTTGGAGTCATTACC CAGCTAATGT
CCTCTAACGA CCACTACCACCCTTGAATGACTA--------TAGTTAT1CAACCTCAGTAATGGAGGACACCCG1CCATTACA
I
------------------------- IS1
CCAGATTGCTTCCTCTGCGGGTGATGCTGCCAACTTACTGAT--------ATCAATAAGTTGGAGTCATTACCTCCTCTGCGCAGGTAATGT
GGTCTAACGAAGGAGACGCCCACTACGACCGTTGAATGACT A-------TACTTATTCAACCTCAGTAATCCAGGAGACGCGTCCATTACA
DR
Несовершенный палиндром IS 1
JSI морднилап йыннешревосен DR
Рис. 14.16. Сайт внедрения IS1 внутри гена galT у Escherichia coli. Кодируемая IS1 транспозаза (TnрА)производит
ступенчатые разрезы в ДНК (с расстоянием между разрезами на противоположных цепях 9 п.н.). При этом концы
разрезов расходятся, что позволяет внедриться IS-элементу. Образовавшиеся одноцепочечные бреши заполняются
путем репаративного синтеза, приводящего к образованию прямых повторов (DR; показаны серым), фланкирующих
внедрившийся IS1. Обратите внимание на несовершенный палиндром на конце IS1; этот палиндром участвует в
процессе интеграции/вырезания (см. текст).
несколько копий каждого из них (табл. 14.4). Пе-
ренос таких элементов в новые сайты происходит
довольно редко, по если мишень находится внутри
гена, он инактивируется. Размеры IS-элементов
варьируют в пределах 750-1550 н.п.
На обоих концах эти элементы содержат необ-
ходимые для перемещения, почти идентичные ин-
вертированные последовательности (IR) в цис-
положении. 13 центральной Части все IS-элемен-
ты содержат одну открытую рамку считыва-
ния (tnp)\ исключение составляет элемент IS1,
включающий две таких рамки. Продукт гена tnp
назван транспозазой; этот белок взаимодейству-
ет с инвертированными концевыми последова-
тельностями в процессе перемещения. Внедре-
ние транспозонов в новый локус сопровождается
дупликацией (прямой повтор) последовательно-
сти из нескольких нуклеотидов в сайте-мишени.
Число дуплицированных нуклеотидов специфич-
но для каждого TS-элемента, и сама последо-
вательность варьирует, поскольку выбор сайтов
внедрения случаен (рис. 14.16). Механизм возник-
новения дупликаций рассмотрен в разд. 14.4.3.
14.4.2. Сложные транспозоны содержат, кроме
необходимых для перемещения генов,
маркеры устойчивости к антибиотикам
или другие гены
Сложные транспозоны обозначают буквами Тп,
после которых обычно помещают цифры, напри-
мер Тп1. Тн5 пли ТпЮ. Транспозоны, содержа-
щие гены устойчивости к антибиотикам, как пра-
вило, обнаруживаются в R-плазмидах (например,
R100 на рис. 14.14), содержащих часто несколь-
ко различных транспозонов. Передачей транспо-
зонов отчасти обусловлено быстрое приобретение
патогенными бактериями множественной лекар-
ственной устойчивости.
Сложные транспозоны подразделяют на два
класса. Транспозоны класса I содержат па
444 Часть IV. Генетика бактерий и бактериофагов
Таблица 14.5. Примеры сложных бактериальных транспозонов
Транспозон Длина, п.н. Структура концов Ориентация IS Сходство IS Функцио- нальная IS Ген устойчи- вости к Механизм транспозиции
Класс 1 Тп5 5820 IS 50 R/IS50 L Инверти- Замена IS50 R капамиципу Нерепли-
Тп9 2650 IS1 ро ванная Прямая 1 п.н. Идентичны Обе хлорамфен и колу кативный Нерепли-
Тп 10 9300 IS 10 R/IS10 L Инверти- Различие IS10 R тетрациклину кативный Нерепли-
Тп903 3094 IS:903 рованная Инверти- 2,5% Идентичны Обе камицину кативный Нерепли-
Класс II ТпЗ Тп 1000 (= Т<5) 4957 5981 Инвертированные повторы длиной 38 п.н. Инвертированные повторы длиной 38 п.н. рованная ам пи ци л л и I iy нет кативный Реплика- тивный Реплика- тивный
концах ипсерционные последовательности, спо-
собные перемещать расположенные между ними
маркеры. Если это маркеры лекарственной устой-
чивости, можно легко провести селекцию дан-
ного транспозона. Два IS-элемепта могут иметь
как прямую, так и инвертированную ориентацию
(рис. 14.15 и табл. 14.5). У многих транспозонов
IS-элементы не полностью идентичны, и только
один из них может кодировать функциональную
транспозазу (табл. 14.5). Это облегчает осуществ-
ление контроля за частотой перемещений. Транс-
позоны класса I перемещаются посредством нере-
пликативного механизма.
Частота перемещения четко регулируется и за-
висит от наличия транспозазы. Механизм перено-
са определен типом транспозона, например в слу-
чае Тп5 оба IS 50-элемента транскрибируются с
промоторов, расположенных вблизи внешних кон-
цов. У расположенного слева инсерционного эле-
мента IS5I7L кодон GAA в потенциальной рамке
считывания заменен на кодон ТАА, в результа-
те чего с левого элемента транспозаза не синте-
зируется. Вместо этого данный промотор служит
для регуляции экспрессии гена устойчивости к
капамиципу aphA, кодирующего аминогликозид-
фосфотрансферазу. Оба этих белка считываются
с расположенного справа инсерционного элемен-
та (IS5I7R) п с одной и той же рамки считыва-
ния. Один из них короче с N-копца на 55 ами-
нокислотных остатков; он ингибирует транспози-
цию, по-видимому путем образования комплекса
с более длинной транспозазой и дистальным кон-
цом Тн5. Перемещение Тп5 регулируется так же,
как и ThlO, путем Dam-метилирования.
Контроль транспозиции ТпЮ осуществляется
многими способами (рис. 14.17); при этом актив-
ным модулем служит IS10R. Вблизи дистального
конца данного модуля расположены два промо-
тора. Промотор Pin, считываемый внутрь, ответ-
ствен за синтез транспозазы. Промотор, считыва-
емый наружу, Pout, значительно более активен, и
с пего образуется в 30 раз больше транскриптов,
чем с Р;п, причем оба типа транскриптов пере-
крываются на 36 п.н., чем обусловлена регуляция
с участием антисмысловой РНК.
Транспозазы действуют преимущественно в
сайтах, находящихся в цис-положении по отно-
шению к гену транспозазы; это общее свойство
данных ферментов, кодируемых IS-элементами, и
в соответствии с ним частота перемещения зави-
сит от числа копий данного элемента (например,
ТпЮ), присутствующих в клетке. Важным типом
регуляции в случае транспозиций ТпЮ служит
Dam-метилирование, которое состоит в метилиро-
вании аденина с участием метилтрансферазы на
участке узнаваемой последовательности GATC.
Dam-метилирование участка оггС требуется так-
же для инициации репликации у энтеробактерий;
кроме того, оно играет важную роль в репара-
ции ошибочного спаривания (см. разд. 15.6.1).
Глава 14. ДНК, хромосомы и плазмиды 445
Репрессор Транспозаза
Dam-метилирование
предотвращает связывание
транспозазы и осуществление
экспрессии
Рис. 14.17. Карта транспозона Тп20. Элемент Тп20
фланкирован двумя IS-элементами: IS1OL (слева) и
IS1OR (справа); транспозазу кодирует только IS10R.
Транскрипция гена транспозазы регулируется сложным
образом с участием двух промоторов (Pjn и РО|Л) и
антисмысловой РНК. Транспозаза может связываться
только с частично метилированной ДНК IS10, т. е. сразу
после репликации. Репрессор TetR (ген tetR) контроли-
рует экспрессию гена устойчивости tetA (кодирующего
белок, ответственный за экскрецию антибиотика) и кон-
тролирует собственную экспрессию.
Непосредственно после репликации ДНК частич-
но метилирована, благодаря чему происходит
активация промотора (Pin) транспозазы и свя-
зывание транспозазы с концами IS 10. Как толь-
ко эти сайты оказываются полностью метилиро-
ванными, транспозиция блокируется. Таким об-
разом, Dam-метилирование обеспечивает «окно»
для транспозиции, которое открывается сразу по-
сле завершения репликации. В случае транспозо-
нов, перемещаемых нерепликативно, путем выре-
зания из донорной последовательности, такой ме-
ханизм обеспечивает сохранение полной дочерней
цепи ДНК, необходимой для выживания клетки.
Транспозоны II класса также содержат па
концах инвертированные последовательности, од-
нако это не IS-элементы. Транспозон ТпЗ относит-
ся к семейству транспозонов ТпЛ и содержит гены
трех белков: геи Ыа, определяющий устойчивость
к ампициллину, ген tnpA, кодирующий транспо-
зазу, и ген tnpR, кодирующий продукт с двойной
функцией, который регулирует как свой собствен-
ный синтез, так и синтез транспозазы путем вза-
имодействия с сайтом res, расположенным меж-
ду промоторами дивергентно считываемых генов
tnpA и tnpR. Транспозоны II класса перемеща-
ются посредством репликативного механизма, по-
этому продукты транспозиции должны быть раз-
делены (см. ниже). Этот процесс катализируется
белком TnpR посредством сайт-специфичной ре-
комбинации в локусе res, в связи с чем белок TnpR
называют резольвазой.
Транспозоны I класса содержат на концах
полноразмерные IS-последовательности и переме-
щаются посредством перепликативпого механиз-
ма вырезания и встраивания. Транспозоны II
класса имеют короткие (38 п.н.) инвертирован-
ные повторы на концах; расположенная между
ними последовательность кодирует транспозазу.
Эти транспозоны перемещаются с помощью ре-
пликативного механизма с образованием проме-
жуточного продукта — коинтеграта.
14.4.3. Транспозиция может осуществляться
по репликативному или
нерепликативному механизму
Фаг Мп представляет собой транспозон, кото-
рый может быть упакован в фаговую оболоч-
ку. Он способен перемещаться посредством как
репликативного, так и нерепликативного механиз-
ма, и здесь эти процессы рассматриваются на его
примере. Перемещение других транспозонов, ве-
роятно, также осуществляется с помощью репли-
кативного или перепликагивпого механизма. Эти
механизмы сходны по начальным этапам и проме-
жуточному продукту (рис. 14.18; см. цв. вклейку).
При инфицировании фаг Ми внедряется в хро-
мосому посредством нерепликативной транспози-
ции. В ходе литического цикла количество мо-
лекул Ми-ДНК увеличивается за счет действия
репликативного механизма. Этот общий этап
осуществляет транспозаза, производящая четыре
одноцепочечных разреза в ДНК. Два из них (сайт-
специфичные) происходят на концах транспозо-
на в донорной молекуле. Сайт-мишень разреза-
ется ступенчато, с образованием б'-выступов, так
что разрезы отделены один от другого небольшим
числом нуклеотидов (в случае фага Ми пятью).
Соединение 5'-концов, образовавшихся в этом
сайте, с З'-концами транспозона и заполнение
брешей приводят к дупликации с образованием
прямых повторов ДНК-мишени в сайте транспо-
зиции, что характерно для всех процессов транс-
позиции. Возникшая в результате крестообразная
структура (рис. 14.18) может быть разделена дву-
мя способами.
При нерепликативном способе одиночные це-
пи разрезаются в местах, указанных маленькими
стрелками на рис. 14.18, и образованные неболь-
шие бреши заполняются путем репаративного
синтеза. В итоге ДНК-мишень приобретает транс-
446 Часть IV. Генетика бактерий и бактериофагов
позон и небольшую дупликацию в сайте-мишени,
тогда как донорная молекула — брешь в участке
первоначального расположения транспозона. Та-
ким образом, происходит транспозиция по типу
вырезание-вставка. В присутствии полной сест-
ринской цепи брешь в донорной ДНК может быть
заполнена путем репарации.
При репликативном способе транспозиции
З'-концы ДНК-мишени в крестообразной струк-
туре используются как затравки для синтеза
ДНК, включая транспозон, и вновь синтезирован-
ная ДНК сшивается с б'-копцом донорной ДНК.
В результате возникает коинтеграт (рис. 14.16),
который может быть разделен при помощи рс-
зольвазы, кодируемой транспозоном, или, менее
эффективно, путем гомологичной рекомбинации
с участием ферментов клетки-хозяина.
Наличие IS-элементов обеспечивает по всей
длине хромосомы Е. coli области гомологии, ис-
пользуемые, например, для интеграции F-плаз-
миды (см. гл. 16). Таким образом, IS-элементы
и транспозоны обеспечивают пластичность гено-
ма, важную для эволюции хромосом и плазмид,
и служат инструментами для сохранения «кол-
лективного генома» бактерий, т. е. всей суммы ге-
нов, характеризующих данный вид. Коллектив-
ный геном осуществляют гены, присутствующие
в отдельной клетке, плюс все гены, доступные для
горизонтального переноса между штаммами. На-
пример, отдельная клетка Е. coli содержит лишь
примерно 80% всей суммы генов, имеющихся у
различных штаммов этого вида, т. е. коллектив-
ный геном больше по размерам, чем индивиду-
альный, и характеризует вид полностью на гене-
тическом уровне.
Дополнительная литература
Berg D. Е., HoweM.M., eds. (1989). Mobile DNA.
Washington, DC: ASM Press.
DrlicaK., Riley M. (1990). The bacterial chromosome.
Washington, DC: ASM Press.
Holloway B.W. (1993). Genetics for all bacteria. Annu.
Rev. Microbiol. 47: 659-684.
Kclman Z., O’Donnell M. (1995). DNA polymerase III
holoenzyme: structure and function of a chromosomal
replicating machine. Annu. Rev. Biochem. 64:
171-200.
KittellB.L., Helinski D. R. (1993). Plasmid incompati-
bility and replication control. In: Cleweil D. B. (ed.).
Bacterial conjugation. New York: Plenum Press.
Kleckner N. (1990). Regulation of transposition in
bacteria. Annu. Rev. Cell. Biol. 6: 297-327.
Kornberg A., Baker T. A. (1992). DNA replication. New
York: Freeman.
Marians К..I. (1992). Prokaryotic DNA replication.
Annu. Rev. Biochem. 61: 673-719.
Neidhardt F. C., Curtiss III, R., Ingraham .I., Lin E. C.,
LowK.B., Magasanik B., ReznikoffW.S., Riley M.,
Schaechtcr M., Umbarger H.E., eds. (1996). Escheri-
chia coli and Salmonella, 2nd edn. Washington, DC:
ASM Press.
Skarstad К., Boye E. (1994). The initiator protein DnaA:
evolution, properties and function. Biochim. Biophys.
Acta. 1217: 111-130.
Sonenshein A. L., Hoch .1. A., Losick R., eds. (1993).
Bacillus sublilis and other gram-positive bacteria:
biochemistry, physiology, and molecular genetics.
Washington, DC: ASM Press.
Источник рисунка
1. KavenoffR., Bowen В. C. (1976) Chromosoma 59:
89-101.
Глава 15
Генетическая информация
У большинства микроорганизмов генетическая
информация хранится в нуклеотидной последо-
вательности ДНК хромосом и внехромосомных
элементов, например, плазмид. Однако у неко-
торых вирусов, как оказалось, геном представ-
лен молекулой РНК. Это открытие заставило пе-
ресмотреть ранние концепции молекулярной био-
логии, основанные па представлении о четком
разграничении между связанными с ДНК хра-
нением и воспроизводством генетической инфор-
мации, с одной стороны, и опосредуемыми РНК
процессами использования генетической инфор-
мации, с другой стороны (синтезом функциональ-
ных белков па основе нуклеотидной последова-
тельности мРНК, называемым экспрессией ге-
нов). В связи с новыми данными о функциях
РНК пришлось отказаться от центральной догмы
молекулярной биологии, предполагавшей одно-
направленный перенос информации от ДНК к
РНК и далее к белку. Именно у РНК-содержащих
ретровирусов был впервые обнаружен процесс
обратной транскрипции, позднее выявленный у
Escherichia coli и миксобактерий. Как выясни-
лось, поток генетической информации может
быть направлен не только от ДНК к РНК, по
и в обратную сторону — на матрице РНК способ-
на синтезироваться комплементарная ДНК. Те-
перь известно также, что молекулы мРНК эу-
кариот могут подвергаться аутосплайсипгу, т. е.
очищенная РНК в присутствии ионов металлов
способна катализировать химические реакции, а
именно вырезание участков своей последователь-
ности, интронов (функция, ранее приписывае-
мая только белкам). Таким образом, в случае
РНК пет четкого различия между молекулами,
содержащими генетическую информацию, и мо-
лекулами, выполняющими закодированные в ней
функции.
Молекулы ДНК — носители генов — организо-
ваны внутри клеток в особые структуры — хромо-
сомы. Термин хромосома был введен для ядер-
ных структур эукариотических клеток, но позже
стал использоваться с определенными оговорка-
ми и для ДНК-структуры бактерий. Бактериаль-
ные клетки содержат, как правило, только одну
хромосому. Независимо от хромосомной или вне-
хромосомпой локализации генов всю их совокуп-
ность у данного микроорганизма называют гено-
мом.
Организация и использование генетической
информации в клетках эукариот, бактерий и ар-
хей существенно различаются (см. табл. 29.5).
У эукариот генетическая информация заключена
главным образом в генах, причем их кодирую-
щие участки (экзоны) прерываются некодирую-
щими участками (интронами). Транскрипцион-
ная единица у эукариот обычно включает один
ген; его РНК-копия образуется в ядре и там же
претерпевает модификацию, при которой проис-
ходит удаление интронов и соединение экзонов.
При этом формируется сплайсома—многоком-
понентный рпбонуклсопротеиновый комплекс.
После такого процессинга мРНК транспорти-
руется в цитоплазму. У некоторых организмов
возможны дополнительные этапы этих процес-
сов: альтернативный и шрлнс-сплайсинг, а так-
же редактирование РНК. В цитоплазме происхо-
дит трансляция мРНК и синтезированные белки
транспортируются к месту назначения.
У бактерий многие транскрипционные едини-
цы включают несколько генов и, как правило, не
содержат интронов. Транскрипция и трансляция
у них тесно сопряжены и происходят в цитоплазме
(рис. 15.1; см. цв. вклейку). Правильная трансля-
ция генов, расположенных в опероне ниже про-
мотора, часто зависит от успешной трансляции
предшествующего гена(-ов). Археи, насколько из-
вестно к настоящему времени, по экспрессии ге-
не гической информации имеют общие черты как
с эукариотами, так и с бактериями. В этой главе
448 Часть IV. Генетика бактерий и бактериофагов
рассматриваются главным образом организация и
экспрессия генов у бактерий.
У бактерий транскрипция и трансляция
тесно сопряжены. Завершение транскрипции ча-
сто зависит от одновременно протекающей транс-
ляции. С этим связано действие некоторых меха-
низмов регуляции транскрипции.
Вначале мы опишем организацию генов и опе-
ропов, затем процесс экспрессии генов и, наконец,
рассмотрим механизмы изменчивости и поддер-
жания стабильности генетической информации,
т. е. мутагенез и репарацию повреждений ДНК.
Организация генетического материала у бактерии
15.1.
15.1.1. Генетическая информация
содержится в генах
Начало современной генетике положили прове-
денные в 1865 г. Грегором Менделем опыты по
изучению наследования признаков при скрещива-
нии растений. Объяснение сделанных Менделем
наблюдений, ставшее возможным лишь спустя по-
чти столетие, было получено па основе экспери-
ментов по скрещиванию бактерий и фагов. Один
из использованных при этом методов состоит в
совместном инфицировании бактериальной куль-
туры парами различных мутантных фагов, от-
личающихся по морфологии образуемых ими бля-
шек, или негативных колоний (зон лизиса бакте-
рий), от фага дикого типа.
Некоторые комбинации мутантов дают 100%
выход негативных колоний с морфологией ди-
кого типа, тогда как другие образуют их лишь
с очень низкой частотой. Анализ потомства фа-
гов из таких колоний показал, что в первом
случае фаги-потомки имеют мутантные фено-
типы, тогда как во втором случае они обла-
дают фенотипом дикого типа. Эти результаты
свидетельствовали о том, что в первом слу-
чае фенотип дикого типа обусловлен комплемен-
тацией функций двух дефектных фагов и их
мутации локализованы в независимо экспрессиру-
емых генах (хотя возможна и впутригенная ком-
плементация, если кодируемый белок является
олигомером; когда комплементации не происхо-
дит, мутации скорее всего локализованы в одном
гене). Во втором случае имеет место изменение в
нуклеотидной последовательности ДНК исходно
мутантных фагов, происходящее вследствие ре-
комбинации между ДНК двух мутантов. Экс-
перименты такого типа известны как тест на
комплементацию (цис-транс-тест; рис. 15.2),
и с их помощью выявляются независимые ге-
нетические единицы, называемые дистропами.
Цистрон, или структурный ген, представляет
собой функциональную единицу генетического
материала. Гены включают, помимо цистронов,
регуляторные последовательности, такие как опе-
раторы, которые служат цис-действующими эле-
ментами, проявляющими свой эффект только в
отношении генов, расположенных рядом с ними
{цис-доминантность). В то же время гопы способ-
ны проявлять и транс-актпвпость если кодируют
транс-активные белки. Таким образом цистрон,
являясь частью гена, кодирует диффундирую-
щий т/хше-активиый продукт, тогда как ген со-
держит также генетические элементы, активные
только в цис-положении.
Цис-транс-тест позволяет определять гены
на основе их комплементации. Цистроны, или
структурные гены, кодируют диффундирующие
продукты. Ген, помимо структурных элементов,
содержит регуляторные последовательности, спо-
собные связываться с регуляторными белками. I
15.1.2. Цистроны могут транскрибироваться
совместно в оперонах
Характерная особенность бактерий состоит в том,
что у них несколько цистронов могут транскри-
бироваться с образованием общей полицистрон-
ной мРНК (рис. 15.3; см. цв. вклейку; см. также
разд. 15.2). Организованные таким образом ци-
строны составляют оперон. При их совместной
транскрипции и трансляции часто имеют место
полярные эффекты, вызванные тем, что экс-
прессия цистронов, расположенных ниже по на-
правлению транскрипции, зависит от экспрессии
вышерасположенных цистронов.
Глава 15. Генетическая информация 449
Двойное инфицирование фагом
Д дикого типа А+В+ и мутантом А В
Двойное инфицирование
мутантами АВ и А В
Двойное инфицирование фагами
Ж с мутациями (аллелями) А! и А2
Рис. 15.2. Цис-транс-тест (тест на комплементацию). Схема единичного (с множественностью инфицирования <1)
и двойного инфицирования фагом дикого типа и мутантными фагами. Предполагается, что продукты генов А и В
необходимы для лизиса клеток бактерии-хозяина.
А. Фаг дикого типа (А+В+) лизирует клетку, как показывают зоны лизиса на газоне бактерий.
Б. Фаг с мутацией гена В (Д'* 1 В-) не способен лизировать клетку бактерии-хозяина.
В. Фаг с мутацией гена А (А~В+) не способен лизировать клетку бактерии-хозяина.
Г. Фаг с мутациями генов А и В (А-В-) не способен лизировать клетку бактерии-хозяина.
Д. Двойное инфицирование фагом дикого типа и двойным мутантом А-В- приводит к лизису клеток бактерии-
хозяина, поскольку в них синтезируются функциональные продукты генов А и В. В зонах лизиса присутствуют фаги,
происходящие от родительских форм, и только 50% из них способны лизировать клетки хозяина при последующем
единичном заражении.
Е. Двойное инфицирование фагами А“В+ и А *"В- приводит к лизису клеток хозяина. Однако потомство этих фагов
представлено теми же мутантами и не способно лизировать клетки хозяина при последующем единичном инфици-
ровании.
Ж. Двойное инфицирование фагами А1 и А2, несущими различные мутации (= аллели) гена А. При такой комби-
нации лизис отсутствует, если в гене А не происходит внутригенной рекомбинации.
450 Часть IV. Генетика бактерий и бактериофагов
Полярным эффектом объясняется то, что
мутация в одном цистроне может влиять на экс-
прессию другого цистрона, расположенного по-
лярно, т. е. ниже в данной молекуле мРНК по на-
правлению транскрипции.
15.1.3. Функциональные продукты большинства
цистронов представлены белками и лишь
немногих цистронов — РНК
Процесс экспрессии генов включает два эта-
па-транскрипции и трансляции (рис. 15.1; см.
цв. вклейку). Транскрипцией называют синтез
РНК на матрице ДНК (матричной цепи ДНК).
Образующаяся РНК может представлять собой
конечный продукт гена (как, например рРНК,
тРНК или антисмысловая РНК) либо матрицу
(мРНК) для синтеза белка в процессе трансля-
ции. Термин трансляция означает перевод ин-
формации, которую несет нуклеотидная после-
довательность, в аминокислотную последователь-
ность кодируемого белка па основе генетическо-
го кода (см. разд. 15.3). Нуклеотидные триплеты
в составе нуклеиновой кислоты кодируют опреде-
ленные аминокислоты; некоторые триплеты слу-
жат сигналами запуска или остановки синтеза
белка. В функциональном белке полипептидная
цепь имеет необходимую для проявления его ак-
тивности третичную или четвертичную структуру
(см. гл. 19), причем информация об укладке цепи
содержится в первичной структуре белка. Однако
чем выше молекулярная масса белка, тем меньше
вероятность того, что полипептидная цепь свер-
нется должным образом самостоятельно.
Дополнение 15.1. цис-Доминантностью
называют способность генетического элемен-
та действовать только в пределах локуса, в
состав которого он входит. Типичным при-
мером г^с-доминантного элемента служит
оператор Zac-оперона, необходимый для бло-
кирования транскрипции структурных генов
lacZYA репрессором LacI (ген 1асГ). Чтобы
выявить это свойство, необходимо распола-
гать штаммам и- меродиплоидами, в гено-
ме которых присутствуют два аллеля од-
ного гена, например lacZ. Такие штаммы
могут быть сконструированы при помощи
плазмид. В качестве примера рассмотрим
случай, когда мутация lacZl локализована в
хромосоме Е. coli. При этой мутации обра-
зуется нефункциональная /2-галактозидаза,
присутствие которой можно обнаружить с
помощью специфичных антител. В комби-
нации с мутацией lacZo (Сон), обусловли-
вающей конститутивную активность опера-
тора, конститутивно синтезируется дефект-
ный (укороченный) белок, но клетка не
обладает /^-галактозидазной активностью.
В результате данной мутации /ас-оператор
не распознается репрессором LacI и сам ре-
прессор конститутивно экспрессируется как
продукт гена lacl. Конъюгационный пере-
нос в клетки такого мутантного ш/амма
F'-плазмиды, несущей аллели дикого ти-
па lacZo+lacZ+, приводит к конститутив-
ной экспрессии lacZl и индуцибельной экс-
прессии lacZ+. Таким образом, Lac-репрессор
активен в mptmc-положении в отношении
lacZo+lacZ+-аллелей в составе Г'-пла^ыиды,
однако lacZo (Сон)-оператор обладает цис-
доминантностыо, т. е. lacZo пс влияет на
lacZo (Con) и наоборот.
В составе другого меродиплоида ген lacZo
может проявляться как транс- активный эле-
мент: на мультикопийной плазмиде, напри-
мер pBR322, он конкурирует с хромосом-
ным геном lacZo за связывание с репрес-
сором Lad. Как и другие регуляторные
белки, Lacl-penpeccop образуется в неболь-
шом количестве и его не хватает для насы-
щения всех локусов lacZo. Таким образом, ген
lacZo в ДНК мультикопийной плазмиды спо-
собен предохранять хромосомный ген lacZo
от связывания с репрессором, что приводит
к дерепрессии синтеза /^-галактозидазы. При
этом фенотип проявляется так, как если бы
ген lacZo был активен в транс-положении,
хотя на самом деле это артефакт, вызванный
присутствием мультикопийной плазмиды.
Глава 15. Генетическая информация 451
15.2. Транскрипция: синтез молекулы РНК,
комплементарной матричной цепи ДНК
Бактериальные клетки содержат РНК по мень-
шей мерс трех типов. В наибольшем количестве
(до 80% всей РНК) в них присутствует рибосом-
ная РНК (рРНК), т. е. РНК, входящая в со-
став рибосом (см. разд. 15.3.1), и РНК других
рибонуклеопротеиновых комплексов, например
4,5S-PHK, участвующая в экспорте белков у
Е. coli и Bacillus subtilis. Второй тип РНК — это
транспортная РНК (тРНК); молекулы тРНК
связываются с кодонами соответствующих амино-
кислот (см. разд. 15.3). После завершения тран-
скрипции РНК обоих этих типов обычно подвер-
гаются процессингу и химической модификации
Молекулы РНК третьего типа наиболее разно-
образны— это информационная (матричная)
РНК (мРНК), т. е. промежуточная матрица, по-
средством которой генетическая информация, за-
кодированная в ДНК, реализуется в виде ами-
нокислотной последовательности — белковой мо-
лекулы.
Еще один, редко встречающийся тип РНК
недавно обнаружен у миксобактерий и Е. coli. Он
представляет собой гибрид ДНК-РНК, образуе-
мый с участием обратной транскриптазы; функ-
ции такого гибрида пока неизвестны.
Все типы РНК в бактериальной клетке син-
тезируются путем транскрипции. В большин-
стве случаев участки ДНК транскрибируются по
отдельности и независимо друг от друга, хотя
в случае некоторых фагов весь геном служит
матрицей для образования одного транскрип-
та. Транскрипционная единица может включать
один или (в случае оперопов) несколько ци-
стронов. Транскрипция, осуществляемая на мат-
рице ДНК,— это процесс полимеризации рибо-
нуклеозидтрифосфатов с образованием рибону-
клеиновой кислоты и высвобождением одной
молекулы пирофосфата на каждую образовав-
шуюся фосфодиэфирную связь. Подобно любо-
му процессу синтеза биологических макромоле-
кул, транскрипция включает три функционально
различных этапа — инициации, элонгации и тер-
минации; процесс катализируется ДНК-зависи-
мой РНК-полимеразой (РНП). Как только рас-
тущая цепь мРНК начинает высвобождаться
из комплекса белок—нуклеиновая кислота, си-
стема трансляции узнает определенные сигна-
лы и на мРНК начинается синтез белка. Та-
кое непосредственное сопряжение транскрипции
и трансляции является характерной особенностью
бактерий. Растущая цепь мРНК включается в
состав полисом как часть сложной многоком-
понентной структуры, которая перемещается по
ДНК-матрице (рис. 15.1 и 15.4). Поскольку
вращательная подвижность растущей мРНК в
транскрипционном комплексе ограничена, сверх-
спирализованная ДНК-матрица должна раскру-
чиваться перед локусом транскрипции и вновь
закручиваться позади него. В результате общая
эффективность транскрипции зависит от степени
исходной сверхспирализации матрицы, а также от
способности клеток эффективно изменять это ее
состояние.
15.2.1. Инициация транскрипции зависит
от структуры и функций промотора
Инициация транскрипции происходит на участ-
ках ДНК, называемых промоторами, кото-
рые распознаются ДНК-зависимыми РНК-поли-
мсразами. Эти ферменты сильно различаются у
эукариот, архей, бактерий и фагов. Здесь мы рас-
смотрим только бактериальные РНК-полиме-
разы. Основу этих ферментов составляют четы-
ре полипептида: две «-субъединицы, одна /3- и
одна /^'-субъединицы, которые образуют четвер-
тичную структуру «2 ДО'. Для инициации тран-
скрипции РНК-полпмераза должна содержать до-
полнительную <т-субъединицу. Эта субъедини-
ца обеспечивает специфичесое узнавание сайта
начала транскрипции — промотора — и связыва-
ние с ним. Комплекс «г/З/З'сг имеет название хо-
лофермент РНК-полимераза. Клетки бакте-
рий содержат несколько различных сг-факторов
и, следовательно, эквивалентное количество ти-
пов специфических пром оторных последователь-
ностей. Группы генов, которым предшествует об-
щий промотор, могут регулироваться совместно
путем экспрессии или активации соответствую-
щих сг-факторов, что представляет собой важ-
ный механизм общей регуляции (см. гл. 20).
452 Часть IV. Генетика бактерий и бактериофагов
Он хорошо изучен па спорообразующей бакте-
рии Bacillus subtilis, у которой идентифицирова-
но по меньшей мере 10 различных <т-факторов
(см. гл. 25). Несколько различных сг-факторов
обнаружено также у Е. coli: гены, индуцируе-
мые стрессовым воздействием, транскрибируют-
ся РНК-полимеразой, содержащей сг-фактор мол.
массой 32 Кда (ст32, или RpoH); гены, активные
в стационарной фазе роста, транскрибируются
РНК-полимеразой, содержащей сг-фактор массой
54 Кда (ст54, или R.poN).
Сигма-субъединицы придают бактериальной
ДНК-зависимой РНК-полимеразе специфичность
к нуклеотидным последовательностям. Эти субъ-
единицы распознают промоторы генов, которые
должны экспрессироваться в данных условиях.
Например, фактор ст70 (RpoD) необходим для экс-
прессии генов, обеспечивающих рост клеток, фак-
тор ст54 (RpoN)—для экспрессии ферментов ас-
симиляции азота и других специализированных
белков, фактор <т32 (RpoH)—для синтеза белков
теплового шока и, наконец, фактор crs (RpoS) —
для транскрипции генов, специфически активных
в стационарной фазе роста культур.
У Е. coli в наибольшем количестве относитель-
но других сг-факторов присутствует фактор ст70
(RpoD), ответственный за узнавание большинства
«вегетативных» (регулирующих экспрессию бел-
ков фазы роста культур) промоторных последо-
вательностей. Последние содержат консенсусные
элементы TTGACA, расположенные на 35 п.н.
выше точки начала транскрипции, и ТАТААТ —
на 10 п.н. выше этого сайта; это так называ-
емые сегменты —35 и —10. Консервативные
последовательности расположены также перед
-10-сегментом (расширенный —10-район), и око-
ло позиции —43 (здесь это АТ-богатая последо-
вательность, называемая вышерасположенной
активирующей областью) (рис. 15.4).
Инициация транскрипции происходит в три
этапа (рис. 15.5; см. цв. вклейку). Первый этап —
это термодинамически регулируемое узнавание
и связывание холофермента РНК-полимеразы
с промоторпой последовательностью, приводя-
щее к образованию так называемого закрытого
комплекса. В связывании участвует АТ-богатая
вышерасположенная активирующая область.
На втором этапе происходит кинетически регули-
руемая изомеризация с формированием откры-
АТ-богатый
участок
RTRTCNTATAAT
-43-район -35-сегмент Расширенный _10 сегмент tsp
-10-сегмент
Рис. 15.4. Участки промотора генов, связанных со ста-
дией роста у Е. coli. Точка начала транскрипции (tsp)
обозначена 4-1. Показаны консервативные (консенсус-
ные) последовательности, характерные для промоторов
многих штаммов Е. coli и других бактерий, и приведены
их обозначения (см. также рис. 15.5).
того комплекса — расхождение цепей ДНК на
участке длиной примерно 10 п.н. вокруг точки
начала транскрипции (tsp, или +1) и образова-
ние первой фосфодиэфирной связи между дву-
мя рибонуклсо гидтрифосфатами, т. е. динуклео-
тида РНК, от которого начинается удлинение
цепи РНК. Таким образом, открытый комплекс
характеризуется наличием одноцепочечного взду-
тия (глазка) ДНК. В открытом комплексе синте-
зируется короткий фрагмент РНК длиной при-
мерно 10 нуклеотидов. Если он диссоциирует от
комплекса, завершается цикл абортивной ини-
циации. Третий этап, называемый высвобож-
дением промотора, представляет собой переход
от инициации транскрипции к элонгации.
В процессе инициации транскрипции ст70-РНК-
иолимераза, связываясь с промотором, вызывает
изомеризацию ДНК с образованием открытого
комплекса, сохраняющегося до этапа высвобож-
дения промотора и начала элонгации. «Сила»
промотора, вероятно, связана с наличием консер-
вативных —10- и -35-сегментов.
15.2.2. Элонгация и терминация транскрипции
После образования фрагмента РНК длиной при-
мерно 12 нуклеотидов a-фактор покидает иници-
аторный комплекс и молекула РНК-полимеразы
переходит в состояние, характерное для эта-
па элонгации. Фермент продвигается вдоль це-
пи мРНК, непрерывно раскручивая двойную спи-
раль ДНК впереди точки полимеризации и вновь
закручивая ее позади этой точки, т. е. высвобож-
дая повосинтезированную цепь мРНК. Синтез мо-
лекул РНК длиной несколько тысяч нуклеоти-
дов возможен только при высокой упорядочен-
Глава 15. Генетическая информация 453
Рис. 15.6. РНК-последовательность, компле-
ментарная области терминации транскрипции
trp-оперона у Е. coli. Показан З'-конец молекулы
мРНК, образовавший вторичную структуру. Ко-
^он, завершающий открытую рамку считывания,
заключен в рамку. Нетранслируемая термини-
рующая последовательность новосинтезирован-
ной мРНК характеризуется самокомплементар-
ностью и образует шпилькообразную структуру,
вызывающую остановку РНК-полимеразы. По-
следующий U-богатый участок способствует дис-
социации рибо-U-дезокси-А-гибрида.
пости транскрипции. Тем пс менее скорость это-
го процесса не постоянна — синтез может останав-
ливаться во многих участках, главным образом в
области налиндромных последовательностей, спо-
собных образовывать шпилькообразные структу-
ры в растущей цепи РНК. На каждом участке
остановки РНК-полимераза может либо возобно-
вить элонгацию, либо преждевременно завершить
синтез. Терминацию синтеза РНК на З'-конце
транскрибируемой последовательности обеспечи-
вают присутствующие в цепи ДНК сигналы
терминации транскрипции (стоп-сигналы) двух
типов.
ный РНК-связывающий белок предположи-
тельно сворачивает растущую цепь РНК по-
зади РНК-полимеразы. Первичная структу-
ра стоп-сигналов II типа недостаточно изу-
чена; известно, что для терминации in vitro
важен участок длиной примерно 200 п.н.,
расположенный выше сайта терминации и
обозначенный rut (от Rho utilization); он
содержит два типа последовательностей —
CACA(Y)3 и C(N)3CC. Когда Rho-фак-
тор достигает остановленной стоп-сигналом
РНК-полимеразы, происходит терминация
транскрипции (см. гл. 26).
1. Стоп-сигналы I типа —это сайты фактор-
псзависимой терминации, в которых останов-
ку РНК-полимеразы вызывают GC-богатые
участки ДНК, образующие петлеобразную
структуру. Последующий, Т-богатый участок
матрицы обусловливает образование термо-
динамически неустойчивого РНК-ДНК-гиб-
рида, облегчающее диссоциацию РНК. Этот
тип сигнала терминации часто присутству-
ет в конце оперопов, например, (гр-оперопа
Е. coli (рис. 15.6). Соответствующая после-
довательность в молекуле мРНК не транс-
лируется. Поэтому стоп-сигналам этого типа
обычно предшествует один или большее число
стоп-кодонов, завершающих открытую рамку
считывания (см. ниже).
2. Стоп-сигналы II типа вызывают термина-
цию при участии терминирующего транскрип-
цию белка — Rho-фактора. Этот гексамер-
Сигналы терминации транскрипции (стоп-
сигналы)— это участки ДНК, на которых тран-
скрипция останавливается и новосинтезиро-
ванпая РНК отделяется от РНК-полимеразы,
Фактор-независимые стоп-сигналы действуют
без участия терминирующих белков, тогда как
фактор-зависимые сигналы терминации оказы-
вают эффект совместно с дополнительным бел-
ком, Rho-фактором. Транскрипцию петранслиру-
емых рРНК и тРНК осуществляет особая форма
РНК-полимеразы, содержащая факторы антитер-
минации, или антитермипаторы.
Терминация и остановка транскрипции
нетранслируемых РНК, характеризующихся
сложной структурой, а именно, рРНК и тРНК,
имеют свои особенности. В завершении синте-
за этих РНК участвуют дополнительные бел-
ки, названные антитерминаторами, например
154 Часть IV. Генетика бактерий и бактериофагов
Nus-бслки (от N-utilization; название связано с
функцией у фага А) и рибосомный белок S10
у Е. coli. Начальная нуклеотидная последова-
тельность в составе генов рРНК, названная анти-
герм ипаторпой, вызывает связывание с РНК-по-
лимсразой дополнительных белков, препятству-
ющих ее остановке. Феномен антитерминации
исследован в связи с процессами регуляции мно-
гих 1ЮН0В и оперонов у бактерий и бактериофагов
(см. разд. 18.10). Процесс транскрипции у бак-
терий имеет отличия от того же процесса у эу-
кариот, в частности бактериальный синтез РНК
специфически подавляется антибиотиком рифам-
пицином — он подавляет инициацию транскрип-
ции, связываясь с ^-субъединицей РНК-нолиме-
разы.
15.2.3. Период полужизни бактериальных мРНК
существенно варьирует
Стационарные уровни различных мРНК зависят
от соотношения скоростей их синтеза и распада.
Эффективная система деградации мРНК часто
необходима для прекращения экспрессии. О важ-
ности этой системы свидетельствует то, что му-
танты Е. coli, лишенные соответствующих РНКаз,
нежизнеспособны. Период полужизни мРНК у
Е. coli варьирует от менее чем 0,5 до 50 мин, обыч-
но составляя 0,5-2 мин. Деградация мРНК про-
исходит под действием экзонуклеаз (с 3'-конца)
или под действием эндонуклеаз (главным обра-
зом в районе б'-конца). Общие заключения отно-
сительно периода полужизни мРНК невозможно
сделать из-за их огромного структурного разнооб-
разия, однако предполагается, что многие мРНК
стабильны б. агодаря трансляции, поскольку свя-
зывание с рибосомой, по-видимому, маскирует
участки, подвергающиеся расщеплению. Введение
в ближайшие к промотору гены стоп-кодонов ока-
зывает полярный эффект на дистальные гены, ве-
роятно вследствие ускорения деградации мРНК.
Первичный, лимитирующий скорость расщепле-
ния этан деградации, по-видимому, представляет
собой эндонуклсотичсское расщепление цепи осо-
бой рибонуклеазой, РНКазой Е; па это указывает
более высокая стабильность мРНК у штаммов с
дефектом этого фермента. Известно, что на пери-
од полужизни мРНК влияет физиологическое со-
стояние клетки, однако регуляторные механизмы,
ускоряющие или замедляющие их распад, пока не
ясны.
У Е. coli мРНК расщепляют специфическая
эндо-РНКаза, РНКаза Е (ген те) и несколько
экзонуклеаз. Стабильность различных мРНК ва-
рьирует в широких пределах, подвергаясь регуля-
ции и возрастая при трансляции.
15.3. Трансляция: синтез белка на РНК-матрице
Трансляцией, как уже было указано, назван
процесс перевода генетической информации, со-
держащейся в линейной последовательности ос-
нований нуклеиновой кислоты, в линейную по-
следовательность аминокислотных остатков в со-
ставе белка (рис. 15.7). Молекула мРНК может
содержать одну или большее число открытых
рамок считывания (о?/), каждая из которых
определяет структуру полипептида и содержит
сигнальные последовательности для инициации,
элонгации и терминации синтеза белка. Встраива-
ясь в рибосому, мРНК становится матрицей для
последовательного считывания тринуклсотидных
сегментов—«триплетов», или кодонов, в ро-
ты включаются в растущую полипептидную цепь
Декодирование информации осуществляют сов
местно рибосомы и тРНК-белковыс комплексы
Молекулы тРНК представляют собой коротко-
цепочечные, сильно модифицированные рибону-
клеиновые кислоты. Вторичная структура их мо-
лекул напоминает клеверный лист, третичная
структура (пространственная укладка) — букву L
Типичная структура тРНК показана на рис. 15.8
Одна (средняя) петля ее молекулы содержит ан-
тикодон — триплет, комплементарный распозна-
ваемому кодону; З'-копец (акцепторный стебель}
связывает кодируемую аминокислоту в виде ак-
тивированного цис-диольного эфира. Присоеди-
Глава 15. Генетическая информация 455
Рис. 15.7. Молекула мРНК транслируется с одновремен-
ным участием многих рибосом. Показана цепь мРНК
(точечная волнистая линия) с несколькими рибосомами
(всего их участвует примерно 500), передвигающимися
в направлении от ее 5'- к З'-концу (направление пока-
зано стрелкой); полипептидные цепи синтезируются в
направлении от N- к С-концу. Всю эту структуру назы-
вают полисомой. Инициаторной аминокислотой служит
1\1-форм ил метионин (f-Met). После терминации транс-
ляции рибосомы (70S) могут отделяться от мРНК с по-
следующей диссоциацией на 50S- и 305-субъединицы.
Рис. 15.8. Первичная, вторичная и третичная
структуры транспортной РНК.
А Вторичная структура тРНК в виде клевер-
ного листа. Показаны консервативные после-
довательности. DHU—ди гидроуридин; Ф—
псевдоуридин; X'Y'Z7 — три нуклеотида анти-
кодона, комплементарные и антипараллель-
ные кодону XYZ.
Б. Третичная структура (L-форма).
зирует фермент аминоацил-тРНК-синтетаза;
он активирует соответствующую аминокислоту с
участием АТР, узнает и выбирает нужную тРНК
из общего пула структурно сходных, но «нерод-
ственных» видов тРНК и обеспечивает образова-
ние химической связи между тРНК и аминокис-
лотой, соответствующей специфическому кодону,
тем самым осуществляя перевод информации из
нуклеиновой кислоты в аминокислотную последо-
вательность. Нагруженная неправильной амино-
кислотой тРНК вызывает ошибочное включение
ее в полипептид.
15.3.1. Рибосома представляет собой
сложную структуру из белков и рРНК
Рибосомы — это крупные рибонуклеопротеиновые
комплексы; они опосредуют связывание кодонов
в составе мРНК с антикодонами нагруженных
аминокислотами тРНК и после связывания пра-
вильных тРНК катализируют образование пеп-
тидной связи между двумя аминокислотами.
Бактериальные 708-рибосомы состоят из двух
субъединиц—30S (малая) и 50S (большая), дис-
социирующих при низких концентрациях Mg2+.
Денатурация 308-субъединицы приводит к вы-
свобождению IOS-рРНК и примерно 20 различ-
ных белков, кодируемых генами rps (от ribosomal
protein small); число определяемых белков за-
висит от жесткости условий получения препара-
та. Субъединица 50S содержит 5S- и 23S-pPHK
плюс примерно 30 белков (гены rpl, от ribosomal
protein large) (см. рис. 2.16). Содержание бел-
ка в препаратах рибосом варьирует, поскольку
ряд дополнительных белковых факторов связан
с рибосомами более или менее лабильно в за-
висимости от стадии трансляции. По-видимому,
пе все функции рибосом обеспечиваются белка-
ми; некоторые ферментативные активности (на-
пример, пептидил-трансферазная; см. рис. 15.12)
могут принадлежать самой рРНК.
456 Часть IV. Генетика бактерий и бактериофагов
15.3.2. Инициация трансляции начинается
на 305-субъединице рибосом
Комплекс, инициирующий трансляцию, состоит
из 308-субъединицы рибосомы, участка мРНК
вблизи стартового кодона, инициаторной тРНК.
нагруженной инициаторной аминокислотой фор-
милметионином, и нескольких факторов иници-
ации (IF) (рис. 15.9). Инициаторным кодоном
у Е. coli чаще всего служит AUG. Кроме то-
го, инициаторными кодонами могут быть GUG
(7% генов) и UUG (4% генов), хотя они обыч-
но менее эффективны, чем AUG, и обусловлива-
ют, например, экспрессию регуляторных белков в
небольших количествах. Поскольку AUG служит
Рис. 15.9. Инициация трансляции у бактерий.
Трансляция начинается с образования инициатор-
ного комплекса.
1. 305-субъединица рибосомы, отделенная от
505-субъединицы с помощью факторов инициации
IF1 и IF3, присоединяется к сайту связывания
рибосомы (RBS, или последовательность Шайна-
Дальгарно, показанная в виде серого прямоуголь-
ника) в молекуле мРНК. Сайт RBS локализован на
5 нуклеотидов выше инициаторного кодона AUG
данного гена.
2. Нагруженная TPHKfMet, активированная фак-
тором инициации IG2 и GTP, связывается с
инициаторным кодоном.
3. После диссоциации факторов IF1, IF2 и 1F3 и гид-
ролиза GTP с ЗОб-инициаторным комплексом связы-
вается 505-субъединица. В новом 705-инициаторном
комплексе нагруженная fMet rPHKfMet располага-
ется в Р-пептидил-тРНК-связывающем участке,
освобождая A-сайт (аминоацил-тРНК-связывающий
участок) для новой нагруженной аминокислотой
тРНК (см. рис. 15.12); Е (сайт выхода) остается
свободным.
также внутривенным кодоном, кодирующим ме-
тионин, существуют механизмы, различающие
кодоны инициации и элонгации. Сравнение
нуклеотидных последовательностей на участ-
ках, близких к стартовым кодонам многих ге-
нов, выявило наличие консервативной после-
довательности — участка связывания рибосо-
мы (RBS, от ribosome binding sequence) на их
5'-стороне. Эта последовательность (ранее на-
званная последовательностью Шайна-Дальгар-
но) комплементарна З'-концу 16S-pPHK в соста-
ве 308-субъединицы, доступному для спаривания
оснований. Узнавание элементов этих последо-
вательностей, вероятно, составляет первый этап
инициации трансляции. Последовательность RBS
Глава 15. Генетическая информация 457
Рис. 15.10. Структура сайта инициации трансляции
у Е. coli. Показана последовательность мРНК, коди-
рующая белок А фага R17, со стартовым кодоном
и сайтом связывания рибосом (RBS, серый прямо-
угольник) и предполагаемое взаимодействие этого
сайта с З'-концом 16S-pPHK.
16S-PHK
мРНК 5' CAUUCCU
UCCUCCA
I I I I I I I
ACCACCU
_______/
UU САСС UAUCCCaCCU UUU— 3'
fMet-Arg—Ala— Phe —
RBS
Рис. 15.11. Сопряжение трансляции поздних генов бактериофага Л. Стоп-кодон подчеркнут; инициаторный кодон
показан полужирным шрифтом. Белок А — компонент терминазы, производящей разрез в сайте cos\ белок W необ-
ходим для завершения сборки головки фага (см. гл. 26).
и комплементарная ей часть нуклеотидной после-
довательности 16S-pPHK для белка А фага И17
Е. coli показаны на рис. 15.10. Эффективность
инициации зависит от степени комплементарно-
сти 16S-pPHK и участка между R.BS и стартовым
кодоном. На эффективность может также влиять
природа второго кодона в рамке считывания и,
возможно, другие элементы нуклеотидной после-
довательности, о чем свидетельствует консерва-
тивный характер соответствующих нуклеотидов
во многих мРНК.
Инициация является этапом, влияющим па
скорость трансляции, и в ряде случаев также
регулируется. Например, трансляцию рибосом-
ных белков ингибируют сами продукты посред-
ством связывания с узнающими последователь-
ностями па 5'-конце собственной мРНК; это свя-
зывание приводит к маскировке сайта инициации
(см. гл. 18).
Кроме нуклеотидной последовательности,
важным фактором трансляции служит вторич-
ная структура мРНК — удаление RBS-последо-
вательностей или стартовых кодонов в ее пет-
леобразных структурах влияет на инициацию
трансляции. Инициация трансляции белков на
полицистронных мРНК часто связана с тем, что
рибосома, завершившая трансляцию первой рам-
ки считывания, не диссоциирует от мРНК, но
нахоциг следующий стартовый кодон, постепенно
продвигаясь вдоль се цепи. Предположительно
этот механизм важен для координации синте-
за белков. Один из наиболее известных приме-
ров сопряженной трансляции — это синтез белков
оболочки фага Л, кодируемых поздними генами
(гены А-W) и необходимых одновременно, при-
чем в нужном соотношении, для сборки фаговой
частицы. Эти гены организованы таким образом,
что стоп-кодон предыдущего гена перекрывается
со стартовым кодоном следующей рамки считы-
вания (см. рис. 15.11). Возможно, транслирую-
щая рибосома завершает и вновь начинает синтез
белка в одном и том же месте, что обеспечивает
координированный и сходный уровень экспрессии
всех кодируемых белков.
Для инициации трансляции необходим со-
держащийся в мРНК инициаторный кодон, ко-
торому предшествует расположенная на опреде-
ленном расстоянии нуклеотидная последователь-
ность, обеспечивающая связывание с рибосомой
(ни одна из этих структур не формирует вторич-
ную структуру мРНК). По-видимому, инициация
трансляции — это основной этап, лимитирующий
скорость экспрессии многих генов.
458 Часть IV. Генетика бактерий и бактериофагов
Рис. 15.12. Цикл элонгации в процессе трансляции.
1. На первом этапе элонгации происходит связывание новоприбывшей, нагруженной аминокислотой тРНК, активи-
рованной фактором элонгации EF-Tu и GTP, с кодоном в A-сайте (на данном рисунке это GCU, кодон аланина).
Процесс включает гидролиз GTP и образование комплекса EF-Tu • GDP + Р;. Регенерация EF-Tu GTP происходит
в присутствии EF-Ts и GTP. Новоприбывшая тРНК проверяется с участием белка S12 (ген rpsL) на правильность
спаривания с кодоном. (Антибиотик стрептомицин препятствует этой проверке, увеличивая частоту ошибок считы-
вания.)
2. cv-Аминогруппа присоединенной к тРНК аминокислоты в A-сайте образует пептидную связь с активированной
карбоксильной группой аминокислоты, присоединенной к тРНК в P-сайте. Образование пептидной связи катализи-
рует эндогенная «пептидилтрансферазная» активность 505-субъединицы рибосомы. (Этот этап подавляется анти-
биотиком хлорамфениколом.)
3. После образования пептидной связи происходит продвижение элонгационного комплекса вдоль мРНК с участием
фактора элонгации EF-G; для этого перемещения необходим гидролиз одной молекулы GTP на каждый триплет.
Одновременно из Е-сайта высвобождается ненагруженная тРНК вместе с фактором EF-G и A-сайт освобождается
для следующего цикла. Если на этой стадии с A-сайтом соединяется антибиотик пуромицин (аналог З'-конца тРНК),
то синтезируется пептидилпуромицин, препятствующий дальнейшей элонгации пептида. Показаны также участки
подавления процесса другими антибиотиками.
4. При нормальных условиях цикл элонгации повторяется, пока не встретится стоп-кодон в молекуле мРНК.
15.3.3 . От элонгации и терминации
зависит правильность
аминокислотной последовательности
Состоящий из трех этапов цикл элонгации син-
теза белка (рис. 15.12) обеспечивает правиль-
ное включение аминокислот в соответствии с
кодонами мРНК (колинеарность) в растущую
нолипептпдную цепь. По завершении инициа-
ции второй кодон рамки считывания становит-
ся доступен для взаимодействия с антикодоном
тРНК в элонгационном комплексе. Образуется
тройной комплекс из новоприбывшей молеку-
лы тРНК, нагруженной аминокислотой и присо-
единяющейся к аминоацил-тРНК-связывающему
участку — А-сайту рибосомы — фактора элонга-
ции Tu (EFTu) и GTP. Благодаря образованию
такого комплекса аминогруппа соответствующей
аминокислоты занимает положение, способству-
ющее образованию пептидной связи с активиро-
Глава 15. Генетическая информация 459
ванной карбоксильной группой остатка второй
аминокислоты на растущем конце полипептид-
ной цепи. Молекулу тРНК, соединенную с рас-
тущим концом цепи, удерживает пептидил-тРНК-
связывающий участок—Р-сайт — рибосомы. По-
сле образования пептидной связи происходит опо-
средуемое еще одним фактором элонгации, EFG,
перемещение (транслокация) элонгационного
комплекса вдоль мРНК и высвобождение нена-
груженной тРНК. Одновременно новая молеку-
ла тРНК, нагруженная очередной аминокисло-
той, связывается с A-сайтом; ее ан гикодоп спари-
вается со следующим кодоном мРНК. Факторы
элонгации относятся к G-белкам — их конфор-
мация зависит от связываемого кофактора, GTP
или GDP. Как предполагается, конформационные
изменения в элопгациоппом комплексе обусловле-
ны гидролизом GTP, присоединенного к фактору
элонгации. Рибосома осуществляет наращивание
полипептидной цепи с высокой скоростью и точ-
ностью, включая в полипептид примерно 15-20
аминокислот в секунду' и совершая при этом не бо-
лее одной ошибки па 50 000 включений. Точность
включения аминокислот резко снижается под
действием антибиотика стрептомицина, что при-
водит к синтезу дефектных белков. В деталях ме-
ханизмы процесса элонгации пока не полностью
изучены.
Для экспрессии некоторых белков, например
фактора 2, ответственного за высвобождение пеп-
тида (RF-2) у Е. coli, рибосома сдвигает рам-
ку трансляции в процессе элонгации (рис. 15.13).
Возможно, сдвиг рамки происходит в сайте, где
процесс элонгации прерывается и рибосома про-
скальзывает по мРНК. Сдвиг рамки происходит
только в соответствующих участках и с низкой
частотой, чем обусловлен низкий уровень экспрес-
сии данной рамки считывания.
Конец рамки считывания в молекуле мРНК
определяется стоп-кодоном (рис. 15.14). Посколь-
ку тРНК, комплементарных трем имеющимся в
коде стоп-кодонам, не существует, при достиже-
нии рибосомой любого стоп-кодона трансляция
останавливается, после чего к рибосоме присоеди-
няется фактор высвобождения (RF), вызыва-
ющий отделение синтезированного полипептида
от рибосомы. После этого рибосома либо отделя-
ется от мРНК, либо начинает синтез новой мо-
лекулы белка с нового кодона инициации вблизи
стоп-кодона.
15.3.4 . Многие антибиотики подавляют
процесс трансляции у бактерий
По механизму трансляции бактерии настолько
отличаются от эукариот, что многие антибиоти-
ки — ингибиторы белкового синтеза специфич-
ны в отношении 708-рибосом (см. рис. 15.9 и
15.12). В некоторой степени они подавляют так-
же трансляцию в митохондриях и хлоропластах.
Тетрациклины подавляют элонгацию, блоки-
руя, по-видимому, A-сайт рибосомы. Хлорам-
феникол подавляет пептидилтрансфсразпую
активность, тогда как аминогликозидный анти-
биотик стрептомицин действует на этапе элон-
гации, нарушая правильность узнавания кодонов.
Эритромицин, прототип макролидных анти-
биотиков, препятствует перемещению пептидил-
тРНК от A-сайта к P-сайту (этап транслокации).
Подробно действие антибиотиков описано в гл. 27.
Трансляция —это процесс перевода генети-
ческой информации, заключенной в линейной по-
следовательности нуклеотидов в составе нуклеи-
новой кислоты, в линейную последовательность
аминокислот в составе пептида. Для этого процес-
са необходимы 30S- и 508-субъединицы рибосомы,
Thr — Clu — Arg — Ser -- Asp — Vai — Leu — Arg — Cly — Tyr — Leu || 4
|mPHK| 5' AUG ••• ACC CAA CCC UCC CAC CUD CUD ACC CCC UAU CUD |UCA| C UAC CA«--3'
Leu — Asp — Tyr •••
Рис. 15.13. Сдвиг трансляционной рамки, необходимый для экспрессии RF-2 у Е. coli. Показана соответствующая
нуклеотидная последовательность мРНК, кодирующей фактор RF-2. Аминокислоты, кодируемые рамкой считы-
вания, расположенной слева, показаны над цепью мРНК. Сайт RBS отмечен полужирным шрифтом. Стоп-кодон
UGA, обозначенный рамкой, малоэффективен как стоп-сигнал в данном нуклеотидном окружении при низкой кон-
центрации RF-2. В этом случае транслирующую рибосому тормозят три расположенные подряд остатка урацила
(подчеркнуты), что вызывает сдвиг рамки вперед'на один нуклеотид и продолжение синтеза RF-2 на новой рамке,
определяющей последовательность аминокислот, приведенную ниже цепи мРНК.
460 Часть IV. Генетика бактерий и бактериофагов
Рис. 15.14. Терминация трансляции. При до-
стижении стоп-кодона (в данном случае UAG),
для которого не существует соответствующей
тРНК (см. исключение для мутантных супрес-
сорных тРНК в разд. 15.5.2), с A-сайтом ри-
босомы связываются факторы высвобождения
полипептида RF1 (для UGA и UAA), RF2 (для
UAA и UGA) или RF3, в результате чего фор-
мируется комплекс, необходимый для терми-
нации. Эндогенная «пептидилтрансферазная»
активность 505-субъединицы обеспечивает вы-
свобождение полностью синтезированного по-
липептида и вызывает диссоциацию мРНК,
факторов освобождения, тРНК и неактивной
705-рибосомы, что сопровождается гидролизом
GTP. Комплекс 70S диссоциирует на 505- и
305-субъединицы с участием факторов IF1 и
IF3, чем завершается процесс терминации.
факторы IF, EF и RF, кофактор GTP и нагру-
женные аминокислотами молекулы тРНК. Неко-
торые антибиотики, такие как тетрациклины,
хлорамфеникол, аминогликозиды и эритро-
мицин, подавляют синтез белка у бактерий, по
не влияют на трансляцию в клетках эукариот.
15.4. Генетический код характеризуется как вырожденный,
универсальный и триплетный
Благодаря генетическому коду информация, со-
держащаяся в нуклеотидной последовательности
(нуклеиновой кислоте), переводится в аминокис-
лотную последовательность (белок). Поскольку
большую часть клеточных функций осуществля-
ют или катализируют ферменты и другие белки,
генетический код обеспечивает ключевую связь
между хранящейся в ДНК генетической инфор-
мацией и биологическими функциями. Инфор-
мация закодирована в нуклеотидных последова-
тельностях генов, организованных в транскрип-
ционные единицы в составе хромосом. Каждая
транскрипционная единица содержит 1) регу-
ляторную информацию, определяющую, когда
именно в жизненном цикле клетки и в каком ко-
личестве будет синтезироваться кодируемый про-
дукт, и 2) информацию о первичной структу-
ре продукта — рибонуклеиновой кислоты или, в
большинстве случаев, полипептида.
15.4.1. Особенности генетического кода и
использование кодонов тесно связаны
Белки обычно построены из 20 различных
L-аминокислот. Минимальное число пар нук-
леотидов, необходимое для кодирования каждой
аминокислоты, равно трем — код триплетный.
Таким образом, число возможных комбинаций
нуклеотидов составляет 43 = 64, т. е. большин-
ство аминокислот кодируется более чем одним ко-
доном, и поэтому код называют вырожденным.
Глава 15. Генетическая информация 461
Для двух аминокислот — метионина и триптофа-
на— имеется только по одному кодону, UGG и
AUG соответственно, причем последний исполь-
зуется и как инициаторный кодон. Генетический
код представлен на рис. 15.15. Три из 64 кодо-
нов не кодируют аминокислот, а определяют пре-
кращение синтеза белка, в соответствии с чем
названы стоп-кодонами. Иногда их ошибочно
называют «бессмысленными» (nonsense) кодона-
ми, в отличие от кодирующих аминокислоты,
«смысловых» (sense) кодонов. Генетический код
универсален для всех известных типов клеток,
хотя существует несколько исключений; напри-
мер, один из стоп-кодонов может кодировать ами-
нокислоту. Структурный ген, кодирующий бе-
лок, представляет собой рамку считывания, на-
чинающуюся со стартового кодона и завершаю-
щуюся стоп-кодоном. Порядок триплетов между
ними определяет первичную структуру кодируе-
мого белка. Немногочисленные белки, в том чис-
ле формилгидроген-лиаза (ген fhl) у Е. coli, со-
держат необычную аминокислоту селено цистеин,
кодируемую стоп-кодоном UAG, который в усло-
виях данной последовательности нуклеотидов пе
воспринимается как стоп-кодон и обеспечивает
присоединение селеноцистеинил-тРНК. Таким об-
разом, селеноцистеин — это 21-я биогенная ами-
нокислота (см. разд. 8.8.2).
Генетический код служит связующим зве-
ном между нуклеиновой кислотой и аминокислот-
ной последовательностью белка. Он представлен
триплетами нуклеотидов — кодонами, последова-
тельность которых определяет аминокислотную
последовательность. Генетический код имеет ха-
рактер вырожденного (для 20 аминокислот суще-
ствует 61 кодон) и универсален для всех из-
вестных типов клеток.
Кодоны распознаются в процессе трансляции
молекулами тРНК, содержащими комплементар-
ный кодону антикодон. Для некоторых аминокис-
лот имеется больше одной тРНК, и одну ами-
нокислоту могут связывать несколько изоак-
цепторных тРНК. Возможность декодирования
одного и того же кодона несколькими видами
тРНК обусловлена менее строгими правилами
взаимодействия кодон-антикодон, чем при спа-
ривании оснований в процессах репликации и
транскрипции. Взаимодействие кодон-антикодон
требует точного распознавания первых двух ос-
Рис. 15.15. Вырожденный и универсальный триплет-
ный генетический код. Показаны все возможные 64
кодона, состоящие из трех нуклеотидов. 5,-нуклеотид
показан в центре, средний нуклеотид—в следующем
круге, З'-нуклеотид — во внешнем круге. Для каждого
кодона приведена кодируемая аминокислота. Закрашен-
ные кружки обозначают стоп-кодоны, закрашенные тре-
угольники— стартовые кодоны. Приведены также исто-
рические названия стоп-кодонов: охра, амбер и опал.
повапий кодопа, тогда как третье может спари-
ваться и неверно, т. е. допустимо неоднознач-
ное соответствие. Например, остаток G может
спариваться с остатком С или U. Таким образом,
каждый из 61 кодона распознается одним или
большим числом видов тРНК. Механизм неодно-
значного соответствия, а также кодирование ами-
нокислот двумя или тремя триплетами означает
вырожденность генетического кода.
Хотя генетический код универсален для всех
известных организмов, у некоторых из них раз-
личные кодоны не равноценны по использова-
нию, т. е. для какой-либо аминокислоты предпо-
чтительно используется тот или другой кодон.
Так, у бактерий с высоким содержанием G + С
в ДНК, как правило, преимущественно присут-
ствуют кодоны, обогащенные G и С, тогда как у
бактерий с низким содержанием G + С в ДНК —
кодоны, обогащенные А и Т. Одно время пред-
полагалось, что в генах, для которых характерен
низкий уровень экспрессии, представлены более
редкие кодоны по сравнению с теми, которые со-
держатся в генах с высоким уровнем экспрессии.
Однако в большинстве случаев скорость синтеза
белка лимитирована, по-видимому, этапом иници-
ации трансляции, а не этапом элонгации. Тем не
462 Часть IV. Генетика бактерий и бактериофагов
менее преимущественное использование тех
или иных кодонов может быть важным усло-
вием экспрессии генов, так как существует четкая
корреляция между предпочтительными кодонами
и обилием тРНК, содержащих соответствующий
антикодон.
15.4.2. Специфическое распознавание
с участием аминоацил-тРНК-синтетаз
Расшифровка нуклеотидной последовательности
мРНК посредством взаимодействия кодонов с
антикодонами тРНК на рибосоме подчиняется
общим правилам комплементарное™ для пар
оснований нуклеиновых кислот (A—U, G—С),
хотя и с некоторым снижением специфичности.
Узнавание тРНК и связывание ее с соответствую-
щей аминокислотой осуществляют специфичные
для каждой аминокислоты амипоацил-тРНК-син-
тетазы. В процессе синтеза белка на рибосоме,
ио-видимому, невозможно исправление ошибки,
допущенной при «загрузке» тРНК, если к ней
присоединена неверная аминокислота. Полный
антикодон используется в узнавании при син-
тетазной реакции лишь в некоторых случаях.
У Е. coli для 17 из 20 аминокислот продемонстри-
ровано участие по крайней мере одного нуклеоти-
да антикодона в узнавании синтетазой изоакцеп-
торных тРНК. В распознавании тРНК важную
роль, кроме антикодона, играют нуклеотиды, рас-
положенные на акцепторном конце, а также в по-
ложении 73 (см. рис. 15.8). Другие детерминанты,
определяющие специфичность распознавания, ло-
кализованы в вариабельной («синтетазной») пет-
ле тРНК.
Присоединение к тРНК правильной амино-
кислоты — это ключевой этап перевода информа-
ции, исходно заключенной в нуклеотидной по-
следовательности ДНК, на уровень аминокислот-
ной последовательности в молекуле белка. В нем
участвуют аминоацил-тРНК-синтстазы, специ-
фично распознающие определенные тРНК.
15.5. Мутагенез и отбор мутантов используются
как важные генетические методы
Мутации —это наследственные изменения гено-
типа в результате изменения нуклеотидной по-
следовательности ДНК. Большинство мута-
ций, в частности те, которые использовались для
построения генетических карт, вызывают фено-
типические изменения, отличающие мутантный
штамм от родительского штамма дикого ти-
па. Далее будут рассмотрены классификация му-
таций, их возможное влияние па фенотип и, на-
конец, внешние факторы, способствующие мута-
генезу.
15.5.1. Мутации могут быть точковыми
или хромосомными
Простейшие мутации — изменения в одной паре
нуклеотидов в молекуле ДНК — называются точ-
ковыми. Они могут быть обусловлены заменой,
добавлением или делецией пары нуклеотидов.
Замены, при которых порядок нуклеотидов в по-
следовательности сохраняется, например, Т —» С
или А —> G, называют транзициями, тогда как
замены, при которых этот порядок нарушается,
например С или Т —» А или G, —трансверсия-
ми. Последствия мутаций для кодируемого белка
могут быть различными. В случае замены нуклео-
тида в положении неоднозначного соответствия
изменения фенотипа обычно не наблюдается, по-
скольку мутантная ДНК и ДНК штамма дико-
го штамма кодируют одну и ту же аминокисло-
ту (например, при замене UUC —> UUU; оба эти
триплета кодируют Phe). Такую мутацию назы-
вают скрытой или нейтральной. Большинство
нуклеотидных замен приводит и к замене амино-
кислоты — это missense-мутации (например, за-
мена CUU —♦ UUU ведет к замене Leu па Phe).
Миссенс-мутации изменяют фенотип, если заме-
на происходит в позиции, важной для свертыва-
ния молекулы или проявления активности коди-
руемого белка, либо не влияют на фенотип, ес-
ли затрагивают аминокислотные остатки, несуще-
Глава 15. Генетическая информация 463
ственпые для функции белка. Значительные фе-
нотипические изменения вызывают те мутации,
которые превращают кодон аминокислоты в стоп-
кодон; это нонсенс-мутации, приводящие к син-
тезу укороченного полипептида. Нонсенс-мутации
могут, кроме того, вызывать разобщение процес-
сов транскрипции и трансляции РНК, демонстри-
руя полярный эффект (см. разд. 15.1.2).
Вставки или делеции отдельных пар нуклеоти-
дов (мутации со сдвигом рамки считывания)
нарушают рамку считывания, т. е. не только за-
трагивают один кодон, но и влияют на информа-
ционный смысл всех кодонов, расположенных ни-
же по ходу транскрипции. В большинстве случаев
транскрипция измененной рамки считывания об-
рывается через несколько кодонов, поэтому такие
мутации резко изменяют фенотип.
Мутации, затрагивающие множество пар
нуклеотидов, называют хромосомными. Они
происходят в результате гомологичной или спе-
цифической рекомбинации и делятся на ряд
типов: дупликации — возникновение в данной
нуклеотидной последовательности одного или,
чаще, нескольких повторов: делеции и встав-
ки (инсерции) — утрата либо добавление двух
или нескольких пар оснований соответствен-
но (см. гл. 14); инверсии — изменение поряд-
ка нуклеотидов в ДНК на обратный по отно-
шению к ориентации в штаммах дикого типа,
возникающее обычно в результате рекомбина-
ции с переворотом (flip-flop) (примером могут
служить антигенные варианты у Salmonella и
G-инверсии у фага Ми; см. гл. 18), и, нако-
нец, транслокации — перепое фрагмента ДНК
в повое положение, например в результате ин-
теграции плазмиды в различные участки хромо-
сомы хозяина или обмена гомологичными после-
довательностями нуклеотидов между плазмидой
и хромосомой либо между двумя хромосома-
ми после удвоения ДНК и деления клетки
(сюда же можно включить перенос генов в
диплогенотах).
Мутации — это наследуемые изменения гено-
ма. Они могут быть толковыми (замена, делеция
или вставка одной пары нуклеотидов), и в этих
случаях вероятность фенотипических изменений
зависит от характера мутации и важности затро-
нутого сайта, либо хромосомными, затрагиваю-
щими более чем одну пару нуклеотидов.
15.5.2. Мутантные фенотипы могут быть
«исправлены» посредством реверсии или
супрессии (мутации в другом сайте)
У большинства мутантов исходный фенотип
может быть восстановлен в результате повой му-
тации. Если затронутая пара нуклеотидов заме-
няется при этом на исходную, восстановление
называют реверсией. Восстановление исходного
фенотипа благодаря мутации в другом сайте, на-
зывают супрессией или реверсией за счет
второго сайта. Точковые мутации подвергают-
ся реверсии с высокой частотой, тогда как де-
леции не могут быть восстановлены в результа-
те простой реверсии. Супрессия данного кодона
может быть внутригенной или внесенной.
Если первая мутация изменяет кодон так, что
новая аминокислота несовместима с нормальной
функцией белка, супрессорной будет такая мута-
ция, которая приводит к включению в белок дру-
гой аминокислоты, совместимой с функцией бел-
ка. Внутривенная супрессия может происходить в
другом кодоне, в результате чего новая аминокис-
лота восстанавливает структуру кодируемого бел-
ка, нарушенную первой мутацией. Этот тип ревер-
сии за счет второго сайта часто используют для
изучения взаимодействия аминокислотных остат-
ков в по. шпептидной последовательности (напри-
мер, между двумя доменами). Наиболее извест-
ным примером внегенной супрессии является му-
тация гена тРНК, которая позволяет мутантной
тРНК декодировать стоп-кодон, введенный исход-
ной мутацией. Этот тип супрессии иногда назы-
вают информационной супрессией. Возмож-
но также восстановление исходного фенотипа бла-
годаря функциональной замене одного фермента
другим или путем активации нового метаболиче-
ского пути (см. разд. 19.1).
15.5.3. Спонтанные мутации как источник
эволюционного развития
Наблюдаемые у всех организмов спонтанные
мутации возникают в отсутствие каких-либо яв-
ных внешних факторов, ускоряющих мутагенез.
Спонтанные точковые мутации могут быть обу-
словлены неточностью репликации ДНК или по-
вреждающим ДНК воздействием химических ве-
464 Часть IV. Генетика бактерий и бактериофагов
Положение UAC
Положение UAC
Рис. 15.16. Распределение спонтанных мутаций в гене
lad у Е. coli. В гене lad существует 37 сайтов, в ко-
торых могут возникать амбер-(иАС)-мутации путем за-
мены одной пары оснований. Возможны как транзиции
(GC <-» АТ), так и трансверсии (все остальные мута-
ции), причем транзиции преобладают. Эти мутации про-
исходят с высокой частотой в местах С-метилирования
(горячие точки) и, вероятно, объясняются нерепариру-
емым дезаминированием 5-метилцитозина.
В то же время имеются данные о повышенной ча-
стоте мутаций в колониях бактерий в условиях
голодания; это некоторым образом противоречит
вышеизложенному правилу, поскольку в этом слу-
чае мутациям чаще подвергаются гены, необходи-
мые для выживания, по сравнению с несуществен-
ными («молчащими») генами. Механизмы таких
«адаптивных» мутаций пока неясны. Возможно,
исследование данного свойства бактерий позво-
лит открыть их новые генетические особенности
(например, связанные с частотой возникновения
индуцибельных мутаций).
Особый класс спонтанных мутаций — это мута-
ции, обусловленные событиями транспозиции, ко-
торые иногда сопровождаются крупными дслеци-
ями в сайге включения или исключения мобиль-
ных элементов, особенно часто при транспозиции
путем вырезания и вставки (см. гл. 14). Транс-
позоны эффективно используются для изучения
мутагенеза, поскольку с их помощью можно по-
метить сайт мутагенеза индикаторным геном, со-
держащимся в его составе. Этот метод приобрел
особое значение при изучении бактерий, для кото-
рых не разработаны системы клонирования гопов,
поскольку многие транспозоны характеризуются
широким спектром хозяев.
Спонтанные мутации возникают главным
образом вследствие неточностей при репликации,
а также из-за химической нестабильности азоти-
стых оснований в клетке. Мутации необходимы
для эволюции; они возникают во всех генных ло-
кусах, по с разной частотой.
ществ либо космической радиации. Мутации ДНК
происходят не в случайных местах нуклеотидной
последовательности, но в так называемых горя-
чих точках (рис. 15.16). Одна из причин суще-
ствования мутационно горячих точек — это при-
сутствие метилированного гуанозина, способного
превращаться в природный тимидин путем дез-
аминирования. Другой вид горячих точек — это
последовательность Т-Т, чувствительная к дей-
ствию света (см. разд. 15.6.3). Частота спонтан-
ных мутаций широко варьирует: у бактерий она
составляет в среднем 10-7 на ген за одну гене-
рацию.
Спонтанные мутации у бактерий происходят
случайным образом во многих генах, но усло-
вия среды способствуют преимущественному вы-
живанию мутантных клеток с выгодными в дан-
ных условиях изменениями (давление отбора).
15.5.4. Мутагенез можно индуцировать
Частоту мутаций у бактерий можно существен-
но повысить путем химического или физическо-
го воздействия либо путем использования штам-
мов, несущих ген-мутатор (см. разд. 15.6). Ха-
рактер наиболее часто возникающих при этом
мутаций зависит в основном от способа их индук-
ции (рис. 15.17). Например, применяемые в ка-
честве мутагенов аналоги оснований, такие как
5-бромурацил, включаются в ДНК, что приво-
дит к ослаблению силы спаривания оснований
(по сравнению с урацилом) и возникновению му-
таций в дочерних клетках. В этом случае между
модификацией ДНК и проявлением мутации про-
Глава 15. Генетическая информация 465
Мутаген Механизм действия Мутация
Аналог основания 5-Бромурацил НО Вг У \\ Спаривается с С \ / (-5% случаев) д D-рибоза О V Вг Спаривается с А нЧ / (-95% случаев) Ъ— \ D-рибоза Соединения, реагирующие с ДНК Азотистая кислота (HNO2) Гидроксиламин (NH2OH) Алкилирующие агенты Монофункциональные, например этилметансульфонат О II нчс—s—о-сн2-сн3 О Бифункциональные, например N-нитро-М-нитрозо гуанидин zCHJ O=N-N Н чс-\ NH NOz Вставка Полициклические ароматические соединения, например, бромистый этидий Вг’ As H2N у' \ C2HS 0 Облучение УФ Включение вместо Т; случайное ошибочное спаривание с С Окислительное дезаминирование А и С Превращение NH2 в позиции 4 С в —NHOH или —NHO—СН3 Метилирование С, ошибочное спаривание с Т Алкилирование и сшивка цепей ДНК с удалением модифицированного участка ДНКазой; мутации в результате неправильного узнавания ферментом Poll Внедрение между двумя нуклеотидными парами Образование пиримидиновых димеров (с последующим вырезанием очень короткого фрагмента ДНК); мутации в результате неправильного узнавания ферментом Poll («непрямой мутагенез») АТ—^СС (-5%) АТ—>СС и СС—*-АТ СС—>АТ СС—>АТ Точковые мутации и делеции Вставки и делеции Замена пары нуклеотидов или делеция
Рис. 15.17. Механизмы действия различных мутагенов. Аналог основания 5-бромурацил, включаясь в ДНК вме-
сто Т, спаривается в 5% случаев с G вместо А, в результате чего происходит замена АТ на GC. Азотистая кислота
и гидроксиламин взаимодействуют с находящимися вне цикла аминогруппами в составе оснований, изменяя их
способность к образованию водородных связей и тем самым вызывая ошибочное спаривание. Алкилирующие аген-
ты вызывают ошибочное спаривание либо непосредственно, модифицируя гуаниновые остатки, либо как результат
приводящего к ошибкам репаративного синтеза, осуществляемого ДНК-полимеразой I («непрямой мутагенез»).
Последний эффект наблюдается также при воздействии бифункциональных агентов и в случае образования пири-
мидиновых димеров.
ЧОО Часть IV. I енетика бактерий и бактериофагов
Испытуемое
химическое
соединение
Ферментный препарат
из стимулированной
печени крысы
+ NADP
+ глюкозо-6-фосфат
Культуры His--WTaMMOB
S. typhimurium,
несущих различные
типы мутаций
his-генов
I
______I
Полужидкий
агао
со следовым
количеством
гистидина
Контрольный вариант Опытный вариант
Плотный агар
с глюкозой,
не содержащий гистидина
Плотный агаг
с глюкозой,
содержащий гис
Рис. 15.18. Тест Эймса для количественной оценки му-1
тагенного потенциала химического соединения. Ночную!
(выращенную с вечера до утра) культуру Salmonella]
typhimurium с мутацией в опероне биосинтеза гистиди-'
на — rfa, повышающей проницаемость клеточной стен-
ки, и делецией uvrB, повышающей частоту мутаций,
инкубируют с экстрактом растворимых белков из пече-
ни крысы с добавлением NADP и глюкозо-б-фосфата в
присутствии (опытный вариант) и в отсутствие (отри-
цательный контроль) испытуемого химического соеди-
нения в полужидком агаре, содержащем следовое коли-
чество гистидина для обеспечения слабого роста.1 После
инкубации полужидкий агар с культурой наносят на по-
верхность плотной миним.альнсй среды с глюкозой, не
содержащей гистидина, в чашках Петри. Чашки инкуби-
руют при 37 °C в течение двух суток. Ревертанты разных
/ws-мутантов образуют на этих чашках с двуслойным
агаром крупные колонии, тогда как мутанты растут в ви-
де микроколоний. Различия между опытным вариантом
и контрольным отражают мутагенный потенциал хими-
ческого соединения для того типа мутаций (транзиции,
трансверсии, делеции), к которому относятся исходные
мутации.
ходит один цикл репликации. Мутагены друго-
го типа — К-метил-К'-нитро-П-нитрозогуанидип,
этил метансул ьфонат, гидроксил амин, азотистая
кислота — вызывают химическую модификацию
ДНК, большей частью специфичную в отношении
определенных оснований, изменяя их способность
к спариванию с другими основаниями; такие
мутагены влияют па точность репликации. Му-
тагены обоих этих типов оказывают прямое дей-
ствие, т. е. вызывают прямой мутагенез. Поли-
циклические ароматические соединения (папри-
мер, производные акридина) могут внедряться
между парами оснований в ДНК и имитировать
в процессе репликации наличие дополнительной
пары нуклеотидов, что приводит к мутациям со
сдвигом рамки считывания. В качестве физиче-
ского мутагенного фактора при исследованиях на
бактериях чаще всего применяют ультрафиолет.
ДНК наиболее интенсивно поглощает ультрафи-
олет в области 260 нм, что приводит к химиче-
ской активации оснований, чаще всего к димери-
зации тимина и возникновению циклобутановых
кольцевых структур между соседними остатка-
ми тимина в одной и той же цепи ДНК. В та-
ком участке ДНК пс способна реплицироваться,
и клетка может приступить к делению только по-
сле репарации повреждения (см. ниже). При репа-
рации вызванных ультрафиолетом повреждений
ДНК-полимеразой I (Poll, ген polA) возникают до-
полнительные мутации вблизи первоначально по-
врежденного сайта; этот феномен получил назва-
ние непрямой мутагенез (см. разд. 15.7).
Все промышленно производимые химические
продукты обычно проверяются на предмет мута-
генности с помощью набора тестов, разработан-
ных Б. Эймсом (Ames); этот исследователь полу-
чил и подробно охарактеризовал несколько точко-
вых мутаций в гистидиновом опероне Salmonella
typhimurium. Дополнительные мутации повыша-
ют у тест-штаммов поглощение химических со-
1 Экстракт ферментов используется в этом тесте в связи с тем, что многие соединения проявляют мутагенную активность
только при активации ферментами млекопитающих. — Прим. вед. ред. _____
Глава 15. Генетическая информация 467
единений и снижают способность к репарации;
оба этих дефекта увеличивают чувствительность
к мутагену.
В тесте Эймса определяют частоту ревер-
сии мутаций, вызванных воздействием испытуе-
мых соединений (рис. 15.18). Эта система очень
чувствительна, так как только рсвертанты способ-
ны расти на минимальной среде без добавки со-
ответствующего соединения (например, His+-pe-
вертанты на среде без гистидина в случае му-
тантов по /izs-оперону). Данный способ анализа,
названный положительной селекцией, позволяет
выявить даже низкую частоту мутаций. Кроме то-
го, при анализе реверсий можно выявлять различ-
ные типы мутаций гистидинового оперона: транс-
версии, транзиции, сдвиг рамки считывания и др.
По частоте реверсии определяют, какой тип мута-
ций вызывает исследуемый агент. Некоторые хи-
мические продукты относятся к промутагенам,
т. е. сами не вызывают мутации, но превращают-
ся в мутагены в результате химических реакций
детоксикации в печени хозяина. Эта потенциаль-
ная способность обычно выявляется в тесте Эймса
после инкубации исследуемого агента с экстрак-
том печени крысы. Вероятно, тест Эймса наибо-
лее широко используется па практике для оценки
стимуляции бактериального мутагенеза различ-
ными химическими агентами.
Индуцированные мутации получают путем
воздействия на клетки химическими мутагенами
или УФ-облучением. Мутагенный потенциал хи-
мических соединений определяют в тесте Эймса с
использованием бактерий.
15.5.5. Использование мутаций и мутантов
в генетике бактерий
Использование мутаций помогло определить осно-
вополагающую связь между заложенной в генах
информацией и теми функциями, которые они
детерминируют. Анализируя влияние мутаций
на биохимические свойства у гриба Neurospora
crassa, будущие нобелевские лауреаты Дж. Бидл
и Э. Татум установили фундаментальное правило
«один ген —один фермент». Мутации были ис-
пользованы также при анализе генетического ко-
да. В исследованиях с применением мутантов уда-
лось обнаружить природные механизмы обмена
генетическим материалом у бактерий — конъюга-
цию, трансдукцию и трансформацию (см. гл. 16).
Современные методы позволяют вводить практи-
чески любую единичную или множественную му-
тацию в исследуемый участок бактериальной хро-
мосомы (локализованный мутагенез), помогая
установить роль данного генетического локуса в
физиологии микроорганизма или роль определен-
ного аминокислотного остатка в функционирова-
нии белка. Кроме того, мутации используются при
клонировании генов (см. гл. 17). Исследования с
применением мутагенеза проводят с целью
выявления неизвестных пока функций бел-
ков, кодируемых многими открытыми рамка-
ми считывания (orfs) в установленных недавно
полных нуклеотидных последовательностях хро-
мосом некоторых бактерий.
15.5.6. Получение мутантов требует иногда
немалого искусства
Мутации удается получать с большими или мень-
шими усилиями для любого фенотипа бакте-
рий. Они могут обусловливать преимущества для
роста или, напротив, вызывать дефекты мета-
болизма. Мутанты первого типа в большинстве
случаев легко выделить путем положительной
селекции, осуществляемой, например, по при-
знаку устойчивости к антибиотикам или фагам,
если мутация препятствует поглощению антибио-
тика либо его взаимодействию с мишенью или, на-
пример, узнаванию фагом клетки-хозяина. Устой-
чивые мутанты растут в присутствии антибиоти-
ка или фага, к чему дикий штамм неспособен.
Такие мутанты легко выделять благодаря тому,
что па пластинку агара можно наносить одновре-
менно 106-108 клеток.
Мутанты, нуждающиеся для роста в том
или ином дополнительном питательном веществе,
называют ауксотрофными (штамм дикого ти-
па— прототрофный). Ауксотрофные мутанты
выделяют с применением метода реплик —путем
переноса колоний с агаровой среды, обеспечива-
ющей рост как штамма дикого типа, так и му-
тантного штамма, на среду, обеспечивающую рост
только штамма дикого типа. Искомый дефектный
468 Часть IV. Генетика бактерий и бактериофагов
фенотип выявляют по отсутствию колоний па вто-
рой среде. Эта процедура скрининга весьма тру-
доемка для рутинного применения, поскольку ча-
стота мутации с появлением искомого фенотипа
низка и к тому же па одной чашке Петри мето-
дом реплик можно проверить не более 100 коло-
ний. В этих случаях часто применяют обратный
способ, т. е. отрицательную селекцию для обо-
гащения бактериальной популяции мутантными
клетками. Обратная селекция с использованием
устойчивости к антибиотикам основана па том,
что многие антибиотики, например пенициллин,
налидиксовая кислота и стрентозотоцин, вызыва-
ют гибель только растущих клеток (рис. 15.19).
Условия для роста выбирают так. чтобы в при-
сутствии антибиотика мог расти штамм дикого
типа, но не ауксотрофные мутантные штаммы;
в результате под действием антибиотика поги-
бают растущие клетки дикого типа и выжива-
ют покоящиеся мутантные клетки. Для достаточ-
ного обогащения ауксотрофными мутантами эту
процедуру повторяют нс менее двух раз. Клетки
ауксотрофных мутантных штаммов изолируют и
идентифицируют затем с помощью метода отпе-
чатков (реплик).
Новые подходы к выделению мутантов основа-
ны па одновременном использовании методов се-
лекции и скрининга с применением определенных
генетических конструкций. Такими конструкция-
ми могут служить транспозоны Тп5 и Тп 10 (см.
гл. 14), имеющие широкий спектр хозяев и незна-
чительную избирательность в отношении мише-
ни (они кодируют соответственно устойчивость к
капамиципу и тетрациклину). Мутанты, получае-
мые в результате транспозиций Тн5 и ТпЮ, выде-
ляют с помощью селекции на устойчивость к ан-
тибиотикам. В выделенных искомых мутантных
клетках генетический локус-мишень помечен Тп,
что существенно облегчает клонирование мутант-
ного гена.
Мутации в жизненно важных генах оказыва-
ют летальный эффект, и клетки с такими мута-
циями не могут быть выделены описанными выше
методами. Для изучения жизненно важных локу-
сов получают условно-летальные мутации, в
большинстве случаев выделяя в результате тем-
пературочувствительные мутанты (затраги-
ваемые в этом случае гены кодируют белки, ак-
тивные при пониженной, пермиссивной темпсра-
Метод отрицательной селекции на примере
использования пенициллина
Выращивание культуры в минимальной среде
без какого-либо необходимого для ауксотрофных
мутантов компонента, например гистидина. В этих условиях
могут расти только прототрофные клетки.
Добавление пенициллина. В растущих клетках подавляется
образование поперечных сшивок в пептидогликане;
растущие, т. е. прототрофные клетки лизируются,
тогда как нерастущие, т. е. ауксотрофные, клетки выживают.
Центрифугирование клеток, ресуспендирование
в минимальной среде и повторение обработки пенициллином
для обогащения культуры ауксотрофными клетками.
Перенос колоний методом реплик на среды с добавлением
и без добавления гистидина для идентификации и
выделения ауксотрофных мутантов
Рис. 15.19. Метод отрицательной селекции мутантов
(на примере использования пенициллина). Аналогич-
ный подход применяется для накопления ауксотрофных
мутантов в присутствии большого количества клеток
прототрофного штамма с использованием различных
бактерицидных агентов.
туре и неактивные при повышенной температу-
ре). Такие мутанты идентифицируют с помощью
метода реплик, инкубируя культуры при различ-
ных температурах. Обычно стабильность кодиру-
емого белка снижается в результате аминокис-
лотных замен. Для получения условно-летальных
мутаций можно также использовать супрессор-
ные (sup) штаммы, содержащие мутантные гены
тРНК. В таких пермиссивных хозяевах могут син-
тезироваться белки с мРНК-матрицы, содержа-
щей искусственный стоп-кодон (см. разд. 15.5.2).
У штаммов дикого типа (sup+) синтез этих белков
преждевременно прекращается.
Мутанты выделяют путем селекции или скри-
нинга. Перед скринингом часто проводят отрица-
тельную селекцию для исключения штамма дико-
го типа. Мутагенез с применением транспозонов
позволяет пометить повреждаемый локус извест-
ной нуклеотидной последовательностью транс-
позона. Полученные мутантные клетки можно
отделить от клеток дикого типа по устойчиво-
сти к соответствующему антибиотику, кодируе-
мой транспозоном.
Глава 15. Генетическая информация 469
15.6. Стабильность бактериального генома повышается
благодаря репарации ДНК
Точное воспроизведение видов возможно при
условии стабильности их геномов, тогда как эво-
люция основана па изменениях в геноме — мута-
циях. Для предотвращения гибели клеток при
интенсивном мутагенезе у всех организмов име-
ются системы репарации ДНК, контролирующие
модификацию и нарушения генетической инфор-
мации. Чтобы была обеспечена консервативность
генетической информации вида, каждое нару-
шение, вызванное часто происходящими мута-
ционными событиями, подвергается исправлению
благодаря активности специальных систем репа-
рации, действие которых описано в следующих
разделах.
Репарация обеспечивает исправление наруше-
ний, вызванных мутациями, и предохраняет та-
ким образом геном от нежелательных гдагЛ^генип.
Благодаря репарации устраняются ошибки, воз-
никающие при репликации или рекомбинации, а
также повреждения ДНК.
15.6.1. Репарация путем Dam-метилирования
(репарация длинными
последовательностями) устраняет
ошибки репликации
Неточности в структуре ДНК могут возникать
в результате ошибок при репликации, образова-
ния гетеродуплсксов в процессе рекомбинации и
дезаминирования 5-метилцитозипа с образовани-
ем тимидина. Репарация ошибок репликации тре-
бует распознавания правильного и неправильно-
го нуклеотидов. Наиболее изучена метилирующая
система репарации у Е. coli, Darn (от DNA adenine
Рис. 15.20. Механизм репарации оши-
бок спаривания путем DAM-метилирования.
Вверху показана частично метилированная
(СНз) двухцепочечная ДНК с ошибкой спа-
ривания А—С. Белок MutS узнает ошибоч-
ный сайт и связывается с ним, после чего
совместно с белками MutL и MutH при ис-
пользовании энергии АТР образует четвер-
тичную структуру, включающую частично
метилированные сайты. Фермент MutH про-
изводит разрезы в неметилированной це-
пи по обе стороны от ошибочной пары.
При участии различных экзонуклеаз и ДНК-
полимеразы III происходит сшивка концов
(лигирование) и метилирование с образо-
ванием реларированной ДНК (репарация
длинными последовательностями).
470 Часть IV. Генетика бактерий и бактериофагов
methylase), которая метилирует свободную ами-
ногруппу аденина в сайтах с последовательностью
нуклеотидов GATC (рис. 15.20). Мутантные по си-
стеме Dam штаммы Е. coli, у которых отсутству-
ет метилозная активность (белки MutH, MutL и
MutS), обнаруживают повышенную частоту спон-
танных мутаций. Прямое доказательство участия
Dam-зависимого метилирования в репарации по-
лучено при анализе процесса исправления оши-
бок репликации в гетеродуплсксах с частично ме-
тилированными сайтами GATS. Установлено, что
метилированная цепь ДНК служит матрицей для
исправления нарушения и это обеспечивает уда-
ление данного нуклеотида из пеметилировашюв
цепи. Таким образом, механизм репарации поз-
воляет эффективно исправлять ошибки реплика-
ции, поскольку вновь синтезированная полу кон-
сервативным способом ДНК в течение коротко-
го периода оказывается нолуметилированной, и в
это время могут быть исправлены ошибки репли-
кации. Брешь в цепи, образующаяся при репара-
тивном синтезе, устраняется путем сшивания кон-
цов разрыва, в результате чего образуется двой-
ная цепь с правильно спаренными основаниями.
Поскольку временно образующаяся брешь может
достигать величины в несколько сотен пар нук-
леотидов, этот процесс репарации называют так-
же репарацией длинными последовательно-
стями. Аналогичные системы могут участвовать
в поддержании точности репликации у многих, ес-
ли не всех, микроорганизмов.
15.6.2. Репарация ошибок короткими
последовательностями позволяет
исправлять мутации в горячих точках
Репарация короткими последовательностя-
ми отличается от репарации длинными после-
довательностями ограниченными размерами вы-
резаемого участка, длина которого в этом слу-
чае обычно не превышает 10 п.н. Наиболее изу-
чена репарация короткими последовательностями
у Е. coli. Она включает Dem (от DNA cytosine
metylase)-зависимое метилирование, которое при-
водит к образованию двух внутренних остатков
5-метилцитозипа в нуклеотидных последователь-
ностях CCTAGG. При этом возникает мутациошю
горячая точка, поскольку при спонтанном дезами-
нировании 5-метилцитозина образуется ч имин и в
результате происходит ошибочное спаривание G
и Т. В составе нуклеотидной последовательности
CCTAGG эта ошибка может быть исправлена в
полностью метилированной ДНК с образованием
нары GC под действием ферментов MutS и MutL,
входящих в Dam-зависимую систему репарации,
плюс фермента Vsr — репарационной эндонукле-
азы одноцепочечной ДНК. Таким образом, этот
механизм репарации можно рассматривать как
пример системы защиты на участках образования
горячих точек мутирования. Другой механизм ис-
правления ошибок спаривания путем репарации
короткими последовательностями у Е. coli вклю-
чает участие фермента MutY, который узнает и
репарирует пары A-G, G-А и А-С. Этот фермент
представляет собой аденин-ДНК-гликозилазу. ко-
торая удаляет остатки аденина из этих непра-
вильных пар. Таким образом, системы репара-
ции короткими последовательностями представ-
ляют еще один тип стратегии для поддержания
генетической стабильности у многих организмов.
15.6.3. Специализированной системой
репарации служит фотореактивация
повреждается ультрафиолетом. Для ликвидации
возникающих нарушений действует защитный ме-
ханизм, названный фотореактивацией. Он уда-
ляет из двухцепочечной ДНК индуцированные
ультрафиолетовым излучением пиримидиновые
димеры. Экспериментально доказано, что крат-
ковременное облучение ультрафиолетом вызыва-
ет образование мутаций с большей частотой, чем
длительное облучение, т. е. УФ-свет за опреде-
ленное время индуцирует аптимутагепную си-
стему. Системы повреждения и репарации по-
разному зависят от длины волны света. В отли-
чие от исправления ошибок спаривания, фоторе-
активация нс связана с выщеплением поврежден-
ных нуклеотидов из ДНК; ее механизм состоит
в том, что фермент фото-лиаза (ген phr) по-
глощает длинноволновый (>300 нм) свет, затем
узнает пиримидиновые димеры в двухцепочечной
ДНК и с использованием энергии поглощенно-
го света расщепляет циклобутановые структуры,
восстанавливая нуклеотиды в неповрежденном
виде. Ферменты с такой активностью имеются у
многих организмов, вероятно благодаря давлению
отбора, направленного на предохранение генети-
ческой информации от повреждений, индуцируе-
мых ультрафиолетом.
Глава 15. Генетическая информация 471
15.6.4. Репарация повреждений ДНК
алкилирующими агентами
сопровождается модификацией
репарирующих ферментов
У Е. coli обнаружен адаптивный ответ на
мутагенное воздействие алкилирующих агентов
(например, диметилсульфата и Гч-этил-Н-нитро-
зомочевипы), выражающийся в том, что при воз-
действии агента частота мутаций после первона-
чального возрастания достигает уровня плато и
далее не увеличивается. В случае Ы-метил-Ы'-нит-
po-N-питрозогуанидина или этилметансульфона-
та период достижения плато составляет 60 мин.
Это явление связано не с репарацией путем
вырезания нуклеотидов, а с индукцией синтеза
06-метилгуанин-ДНК-метилтрансферазы I, уда-
ляющей метильную группу из положения О6 гуа-
нина с переносом ее на остаток цистеина в соста-
ве данного фермента. Аналогичная система репа-
рации существует у Е. coli для О^-алкилтимина
и фосфорных триэфиров в ДПК, причем соот-
ветствующие реакции осуществляются двумя раз-
ными белками. Подобные ферменты обнаружены
и у многих других бактерий, а также у дрож-
жей Saccharomyces cerevisiae и плодовой мушки
Drosophila melanogaster.
Иной тпп удаления алкилированных нуклео-
тидов у Е. coli обеспечивают ДНК-гликозилазы;
некоторые из них обнаруживают субстратную
специфичность в отношении химически модифи-
цированных нуклеотидов ДНК. Наиболее извест-
ный фермент этого класса — урацил-ДНК-глико-
зилаза (ung), удаляющая остатки урацила путем
гидролиза его N-гликозидной связи. Субстра-
тами данного фермента могут также служить
3-метиладенозин, гипоксантин, 5,6-диоксидигид-
ропвримидип и димеры пиримидинов. После
удаления нуклеотидов цепь ДНК расщепляется
эндонуклеазой с последующим восстановлением
посредством обычного репаративного синтеза.
13 противовес часто происходящим поврежде-
ниям ДНК у микробных клеток имеются специ-
фические механизмы репарации.
15.7. Одноцепочечная ДНК индуцирует у Е. coli SOS-ответ
Появление в клетках в результате повреждения
одноцепочечпой ДНК вызывает у Е. coli акти-
вацию ряда генов, а. именно регулопа, включаю-
щего примерно 20 генов. Функция индуцирован-
ных таким образом белков состоит в репарации
повреждений ДНК. Этот феномен получил на-
звание SOS-ответа. Он тесно связан с реком-
бинацией, поскольку главный белок, участвую-
щий в рекомбинации, RecA, способен восприни-
мать сигнал о появлении одноцепочечной ДНК.
Комплекс RecA-опДНК стимулирует аутопротео-
лиз белка-репрессора LexA, вызывая дерепрсс-
сию SOS-генов (называемых также dm-генами,
от damage-induced). Кодируемые этими генами
белки обеспечивают SOS-репарацию. Таким обра-
зом, в условиях стресса повышается репарацион-
ная способность клетки. Регуляторные эффекты,
связанные с SOS-ответом, показаны на рис. 15.21.
SOS-ответ означает инициацию процесса ре-
комбинации, поскольку синтез белка RecA так-
же контролируется репрессором LexA. Предпо-
ложительно SOS-ответ обеспечивает репарацию
брешей пли разрывов двойной спирали, возникаю-
щих при незаконной рекомбинации или поврежде-
ниях ДНК. Синтез ДНК при SOS-ответе, вероят-
но, подвержен ошибкам и приводит к повышен-
ной частот* мутаций в «репарированной» ДНК
(«непрямой мутагенез»). На это указывают дан-
ные о большей частоте мутаций при облучении
ультрафиолетом у штамма Е. coli с нормальной
SOS-системой по сравнению с мутантом, лишен-
ным участвующих в SOS-ответе генов umuCD.
По-видимому, функционирование белков, коди-
руемых SOS-гепами, повышает частоту мута-
ций. Вместе с тем не способные к SOS-реакции
мутанты сверхчувствительны к ультрафиолету.
Таким образом, локус umuCD обусловливает
репарацию, связанную с ошибками. Весьма прав-
доподобной считается гипотеза о том, что репара-
ционный синтез ДНК при различных поврежде-
ниях осуществляется белками UmuCD «умышлен-
но» не точно и подверженная ошибкам репарация
472 Часть IV. Генетика бактерий и бактериофагов
Дерепрессия
Образование
большого количества
белка RecA и
продуктов других
генов, находящихся
под контролем LexA
(например, Uvr,
Umu и Din)
Репарация
ДНК
Исчезновение
индуцирующего
сигнала
Прекращение
протеолиза LexA
под действием
RecA
Накопление
репрессора LexA
и репрессия генов,
регулируемых
оператором 1ехА
Рис. 15.21. Регуляторная сеть, контролирующая SOS-репарацию у Е. coli. Присутствие одноцепочечной ДНК как
показателя повреждения ДНК обнаруживает белок RecA, катализирующий при этом аутопротеолиз белка LexA-
общего репрессора SOS-системы — с активацией SOS-регулона. Этот регулон включает большое количество генов
din и оперонов, которые регулируются путем связывания LexA с общей консенсусной последовательностью, предше-
ствующей этим генам. После завершения SOS-репарации LexA вновь накапливается, репрессируя гены, участвующие
в SOS-ответе.
совместно с повышенной частотой рекомбинации
могут в условиях повреждения ДНК благоприят-
ствовать выживанию популяции благодаря увели-
чению вероятности благоприятных мутаций.
Репарационный ответ у Е. coli обеспечивают
главным образом SOS-гены. Система SOS-генов
реагирует на повреждения ДНК независимо от их
природы. Она инициирует связанный с ошибками
репарационный синтез ДНК, вызывающий повы-
шение частоты мутаций в ответ на. повреждение
ДНК («непрямой мутагенез»). И
Дополнительная литература
BusbyS., EbrightR.II. (1994). Promoter structure,
promoter recognition, and transcription activation in
prokaryotes. Cell 79: 743-746.
Dale.l.W. (1994). Molecular genetics of bacteria. New
York: Wiley.
Farabaugh P. J. (1996). Programmed translational
frameshifting. Microbiol. Rev. 60: 103-134.
Friedberg E. C., Walker G.C., Siede W. (1995). DNA
repair and mutagenesis. Wachington, DC: ASM
Press.
Hopwood D. A., Chater К. E. (1989). Genetics of bacte-
rial diversity. New York, London: Academic Press.
Knippers R. (1977). Moleculare Genetik 7th edn. Stutt-
gart, New York: Thieme.
Krohn M., Pardon B., Wagner R. (1992). Effects of
template topology on RNA polymerase pausing
during in vitro transcription of the Escherichia coli
rrnB loader region. Mol. Microbiol. 6: 581-589.
Kucherlapati R., Smith G.R. (1988). Genetic recombina-
tion. Washington, DC: ASM Press.
Moses R.E., Summers W.C. (1988). DNA replication
and mutagenesis. Washington, DC: ASM Press.
Neidhardt F. C., Curtiss R., Ingraham J. L., Lin E. С. C.,
LowK.B., Magasanik B., ReznikofFW., Riley M.,
Schaechter M., Umbarger H. E. (eds.) (1996). Esche-
richia coli and Salmonella: cellular and molecular
biology. 2nd edn. Washington, DC: ASM Press.
NierhausK.il. (1993). Solution to the ribosome riddle:
how the ribosome selects the correct aniinacyl-tRNA
out of 41 similar contestants. Mol. Microbiol. 9:
661-669.
Scaife J., Leach D., Galizzi A. (1985). Genetics of
bacteria. New York, London: Academic Press.
Singer M., Berg P. (1991). Genes and genomes. Oxford,
London: Blackwell. (Имеется русский перевод: Син-
гер М., Верг П. Гены и геномы. М.: Мир, 1998.)
Snyder L., Champncss W. (1997). Molecular genetics of
bacteria. Washington DC: ADM Press.
Sonenshein A. L., Hoch .LA., LosickR. (1993). Ba-
cillus subtilis and other Gram-positive bacteria.
Washington, DC: ASM Press.
Zubay G. (1987). Genetics. Menlo Park, Calif.: Benja-
min/Cummings.
Глава 16
Обмен генетической информацией
между микроорганизмами
Прокариоты обладают уникальной способностью
реагировать на изменения условий среды быст-
рым приобретением необходимых генетических
признаков. Наглядным примером такой адапта-
ции к изменению условий может служить по-
явление устойчивых к антибиотикам патогенных
микроорганизмов, распространение которых ста-
новится в паше время все более серьезной про-
блемой. Пластичность генома прокариот обуслов-
лена существованием эффективных природных
механизмов горизонтального переноса генов
между клетками бактерий, которые пс являются
родительскими и дочерними, а также между бак-
териями и другими организмами. Обмен генети-
ческой информацией служит важным фактором
эволюции прокариот. Известны три пути переноса
ДНК: 1) трансформация — поглощение свобод-
ной ДНК из внешней среды; 2) конъюгация —
внедрение ДНК из бактериальной клетки-донора
в клетку-реципиент и 3) трансдукция — распро-
странение генов бактерий умеренными бактерио-
фагами.
Судьба проникшей в клетку-реципиент моле-
кулы ДНК зависит от ее нуклеотидной последо-
вательности. Если ДНК не содержит собственной
точки начала репликации, се стабильное насле-
дование возможно только при интеграции в ге-
ном хозяина. Интеграция у большинства прока-
риот может происходить с помощью механизмов
гомологичной или незаконной рекомбинации.
Плазмиды и бактериофаги реплицируются ав-
тономно. Однако их геномы, как и все чуже-
родные ДНК, подвергаются воздействию систем
рестрикции—модификации со стороны клетки-
хозяина. Рестрикция чужеродной ДНК пред-
положительно служит способом защиты бакте-
риальной клетки от гибели, вызванной бакте-
риофагами, и от слишком частых изменений
клеточного генома, способных снижать жизнеспо-
собность бактериальной популяции. Для преодо-
ления рестрикционного барьера некоторые плаз-
миды и фаги обладают антирестрикционными
системами, препятствующими деградации внед-
рившейся ДНК.
16.1. Поглощение свободной ДНК приводит
к генетической трансформации бактерий
Поглощая ДНК из внешней среды и вклю-
чая ее в свой геном, бактерии становятся
генетически трансформированными. Процесс
такой трансформации интенсивно изучается в те-
чение уже более чем трех десятилетий на неболь-
шом числе видов. Наиболее детально он иссле-
дован у Streptococcus pneumoniae, Bacillus subtilis
и Haemophilus influenzae. Впервые трансформа-
ция была обнаружена как феномен в эксперимен-
тах на S. pneumoniae, когда удалось продемон-
стрировать, что непатогенные мутантные клетки
S. pneumoniae могут стать патогенными при их
инъекции мышам одновременно с убитыми на-
греванием вирулентными клетками, и это измене-
ние происходит в результате трансформирующего
действия высвобождающейся из убитых клеток
ДНК. Частота трансформации может быть очень
высокой, в зависимости от числа компетентных
клеток в данной популяции.
Генетическая компетентность — это спо-
собность бактериальных клеток к поглощению
экзогенной ДНК с последующим изменением ге-
нома.
474 Часть IV. Генетика бактерий и бактериофагов
Компетентными бактерии могут становить-
ся в результате обработки их физическими и хи-
мическими агентами, которые способствуют по-
глощению трансформирующей ДНК. В отличие
от такой искусственной компетентности, природ-
ная компетентность — это генетически и физиоло-
гически детерминированное, специфическое свой-
ство данного штамма. Природная компетентность
может быть индуцибельпой или конститутивной.
Так, у S. pneumoniae компетентность индуциру-
ют диффундирующие факторы — пептиды, экс-
кретируемые в среду. Конститутивной компетент-
ностью обладает Neisseria gonorrhoeae. Способ-
ность к трансформации у В. subtilis зависит от
фазы роста; при лимитировании его скорости при-
мерно 10% клеток становятся компетентными.
Процесс трансформации протекает в три стадии:
вначале ДНК адсорбируется на клеточной стенке,
затем проникает внутрь клетки и, наконец, реком-
бинирует с клеточной хромосомной ДНК. Прони-
кать в клетку может только ДНК в одноцепочеч-
ной форме, устойчивой к действию нуклеаз.
16.1.1. Генетическая компетентность у Bacillus
subtilis зависит от фазы роста
Проявление компетентности □ У В. subtilis
компетентность проявляется в условиях ограни-
чения скорости роста, например в стационарной
фазе роста культуры. Добавление глюкозы стиму-
лирует развитие компетентности. Напротив, до-
бавка глутамата подавляет этот процесс, из чего
можно заключить, что определяющим фактором
возникновения компетентности служит дефицит
азота.
Связывание ДНК □ Первый этап транс-
формации В. subtilis — это связывание экзоген-
ной ДНК с поверхностью компетентных кле-
ток (рис. 16.1; см. цв. вклейку); адсорбиро-
ванная на этой стадии ДНК не отделяется от
клеток при их отмывании. Адсорбция ДНК про-
исходит на специальных структурах, обеспечи-
вающих, по-видимому, ее проникновение через
клеточную стенку и плазматическую мембрану.
Если предположить, что один связывающий
центр адсорбирует одну молекулу ДНК, мож-
но рассчитать, что на поверхности компетент-
ной клетки имеется примерно 50 таких центров.
Связь между поверхностными структурами и
ДНК нековалентная — при обработке детергента-
ми или фенолом ДНК отделяется от клетки.
Связывание ДНК не зависит от ее нуклеотид-
ной последовательности, однако гликозилирован-
ная ДНК и двухцепочечная (дц) РНК связыва-
ются слабо. По-видимому, природным субстратом
для связывания служит двухцепочечная ДНК.
Фрагментация □ Обе цепи связанной ДНК
подвергаются разрезанию, которое происходит в
случайных точках, но приводит к образованию
фрагментов с определенным распределением по
размерам. В связанном состоянии ДНК остает-
ся чувствительной к воздействию ДНКазы, по-
видимому образуя па поверхности клетки вы-
тянутую структуру. В случае ДНК фага Т7
(ее приблизительная длина 40 т.п.н.) средняя ве-
личина образующихся при трансформации фраг-
ментов составляет 19 т.п.н.
Поглощение трансформирующей ДНК □
После фрагментации связанная с клеткой-реципи-
ентом ДНК в течение 1-2 мин полностью теряет
чувствительность к ДНКазе. Считается, что это
обусловлено либо транспортом ДНК через мем-
брану, либо проникновением ее в участки, недо-
ступные для добавленных нуклеаз. Измерение в
эксперименте скорости поступления ДНК в клет-
ку с использованием генных маркеров показыва-
ет, что ДНК поглощается как линейная молекула
со скоростью при (28 °C) 50-200 п.н./с.
На этой стадии поглощаемая ДНК может быть
извлечена из клеток в одноцепочечной форме.
При появлении устойчивых к ДНКазе транс-
формантов в супернатантах культур обнаружи-
ваются кислоторастворимыс фрагменты ДНК;
по-видимому, одна цепь трансформирующей ДНК
подвергается деградации под действием нуклеаз в
процессе поглощения. По предварительным дан-
ным, не существует предпочтения в отношении
химической полярности, с которой одноцепочеч-
ная ДНК переносится в клетку. Если это так, то
данный процесс должен полностью отличаться от
других систем переноса ДНК, таких как конъ-
югативпый перенос или инъекция ДНК фагами,
содержащими одноцепочечную (оц) ДНК. Мож-
но предполагать, что В. subtilis либо обладает
двумя различными системами поглощения ДНК,
либо поглощает при трансформации двухцепочеч-
ную ДНК, после чего внутри клетки происходит
деградация одной цепи. Оба эти варианта пред-
ставляются малореальными, и необходимы даль-
нейшие эксперименты для изучения полярности
поглощения ДНК у В. subtilis.
Глава 16. Обмен генетической информацией между микроорганизмами 475
Интеграция ДНК и завершение процес-
са □ Интеграция трансформирующей ДНК осу-
ществляется путем RecE-зависимой рекомбина-
ции. Гоп гесЕ В. subtilis является аналогом ге-
на. recA Е. coli, необходимого для гомологичной
рекомбинации (см. разд. 16.4). В конечном ито-
ге интегрируется примерно 75% оцДНК. Продукт
рекомбинации представляет собой спаренный
(трехцепочечный) гетеродуплекс из донорной и
реципиентной молекул. Интегрированные сегмен-
ты ДНК располагаются группами, что подтвер-
ждает данные о фрагментации донорной ДНК на
поверхности клетки. Если эффективное поглоще-
ние и интеграция происходят после расщепления
на фрагменты, должен иметь место ряд независи-
мых событий интеграции групп сегментов из пер-
воначально связанной молекулы ДНК.
Генетика природной компетентности о
По способу экспрессии и предполагаемой функ-
ции в процессе трансформации гены, определя-
ющие природную компетентность у В. subtilis,
можно разделить на два типа: регуляторные
(«ранние») гены и необходимые для компетент-
ности (сот, от competence—«поздние») гены.
Последние экспрессируются лишь кратковремен-
но, и их продукты, вероятно, непосредственно
участвуют в связывании ДНК к ее процессинге
либо в сборке структур, обеспечивающих компе-
тентность (см. разд. 25.1).
Мутационный анализ генов компетентности
показал, что в фазе постэкспоненциального ро-
ста транскрибируются три генетических едини-
цы (сотС, comDE и comG); мутации в них
приводят к фенотипу нарушенной компетентно-
сти. Полученные к настоящему времени мутан-
ты с Corn--фенотипами недостаточно информа-
тивны, чтобы можно было выявить роль опре-
деленных генных продуктов. Предположения о
возможной функции генов делаются, например,
на основании сходства аминокислотной после-
довательности продуктов гена comG и белков,
участвующих в переносе макромолекул через бак-
териальную мембрану, а также пилинов 4 типа
у грамотрицательных бактерий. In vitro обна-
ружена эндопептидазная активность продукта
гена сотС. Некоторые мутации в локусе comDE
не препятствуют связыванию ДНК с поверхно-
стью клетки, и на основании этого предполага-
ется, что продукт данного гена участвует в по-
глощении ДНК. Два других гена, по-видимому,
кодируют сенсорный белок (СошР) и ответный
регулятор (ComA), которые составляют двухком-
понентную систему, обеспечивающую реакцию
на голодание и индукцию компетентности (см.
рис. 25.2).
16.1.2. У других видов обнаружены
структурные отличия в механизме
природной компетентности
Haemophilus influenzae □ Механизм транс-
формации Н. influenzae, по-видимому, отличается
от обнаруженного у S. pneumoniae и В. subtilis.
С началом стационарной фазы роста на поверх-
ности клеток Н. influenzae образуются везикуляр-
ные структуры и меняется липидный и белковый
состав клеточной стенки. Параллельно этому воз-
растает частота рекомбинации; в хромосомной
ДНК возникают одпоцепочечные бреши и «хво-
сты», т. е. она как бы подготавливается для вклю-
чения экзогенной ДНК. Фактически все клетки
культуры могут стать компетентными. Поглоще-
ние ДНК носит характер высокоизбирательпо-
го процесса в отношении гомологичной ДНК.
Распознавание гетерологичной и гомологичной
ДНК, по-видимому, обеспечивают присутствую-
щие в ДНК И. influenzae «сайты поглощения»,
состоящие из 11 п.п. (S'-AAGTGCGGTCA-S')
и повторяющиеся через интервалы длиной при-
мерно 4 т.п.н. В узнавании ДНК, а также в се
поглощении и защите от нуклеаз участвуют ве-
зикулярные мембранные выросты, называемые
трансформосомами. Они локализованы пре-
имущественно в точках контакта плазматической
и наружной мембран («сайты адгезии»; см. гл. 2).
Добавление гомологичной ДНК вызывает переход
трапсформосом во внутреннее пространство клет-
ки с потерей чувствительности ДНК к нуклеазам.
После проникновения в цитоплазму происходит
высвобождение ДНК и се включение в геном пу-
тем гомологичной рекомбинации.
Streptococcus pneumoniae □ Появление
компетентности у S. pneumoniae связано с на-
коплением в культуральной жидкости диффун-
дирующего фактора компетентности (CF,
от competence factor). Это основный белок, по-
видимому взаимодействующий с рецепторами
клеточной стенки. Процесс трансформации в
данном случае сходен с аналогичным процессом
у В. subtilis. Поглощение ДНК сопровождается
деградацией одной из ее цепей под действием
476 Часть IV. Генетика бактерий и бактериофагов
нуклеаз. Идентифицирована локализованная в
мембране нуклеаза, необходимая для поглощения
ДНК. В растворе опа проявляет эндонуклеаз-
ную активность, тогда как in situ является экзо-
нуклеазой, что, вероятно, обусловлено се тополо-
гией в мембране. Для S. pneumoniae установлены
(З7—>5/)-полярность поглощения ДНК и использо-
вание в этом процессе АТР.
16.1.3. Эффективная трансформация
Escherichia coli требует обратимой
модификации клеточной стенки
химическими или физическими агентами
У колиформных бактерий состояния высокоэф-
фективной компетентности в том виде, в каком
оно описано выше, не существует. По-видимому,
трансформация не служит у этих организмов
важным механизмом обмена генетической инфор-
мацией. Однако в связи с тем, что Е. coli име-
ет важнейшее значение как модель для генетиче-
ских исследований, специальные работы были по-
священы поиску способов ее трансформации. Как
удалось установить, обработка клеток Е. coli рас-
твором CaCh на холоду делает их компетентными
для поглощения экзогенной ДНК в течение ко-
роткого периода нагревания («heat pulse»). Раз-
работка такой методики стала важным этапом в
развитии генетической инженерии.
Модификация этой процедуры с заменой
СаСЬ смесью солей, в которой основным ком-
понентом является RbCl и дополнительно при-
сутствует диметилсульфоксид, позволила уве-
личить выход трансформантов до 20% живых
клеток при оптимальных условиях. Механизм
действия СаС1-2 или других солей на клетки по-
ка мало изучен. В отличие от существующего в
природе высокоэффективного механизма транс-
формации с превращением экзогенной ДНК в ли-
нейную одноцепочечную форму, при искусствен-
ной компетентности клетки поглощают кольце-
вую двухцепочечную ДНК.
Используется также другой метод, разрабо-
танный исходно для трансформации эукариотиче-
ских клеток и заключающийся во введении ДНК
в бактериальные клетки с помощью электропо-
рации. Клетки подвергают воздействию высоко-
вольтного электрического разряда, что обеспечи-
вает проникновение ДНК через клеточную мем-
брану. Этот метод имеет то преимущество, что в
отличие от солевой обработки может быть приме-
нен к большинству бактерий без существенных из-
менений процедуры. Выход трансформантов при
его использовании сравним или даже выше, чем
при солевой обработке.
16.2. Для конъюгативного переноса ДНК
необходим тесный межклеточный контакт
Конъюгация делает возможным однонаправлен-
ный перенос генетического материала от донора
реципиенту при непосредственном контакте кле-
ток. Таким способом обмен ДНК происходит нс
только между различными видами бактерий, но
и между прокариотами и эукариотами (рис. 16.2),
поэтому конъюгативный перенос ДНК считается
основным типом обмена генетическим материа-
лом в природе.
Аппарат переноса, необходимый для этого
сложного процесса, обычно кодируется плазми-
дами или транспозонами. Плазмиды могут быть
мобилизуемыми или способными к самостоятель-
ному переносу (см. гл. 14). Для копъюгатив-
ного переноса мобилизуемых плазмид требуется
присутствие нерезидентной плазмиды, способной
к самостоятельному переносу и обеспечивающей
необходимую транспортную функцию.
Транспортные функции, необходимые для
конъюгации бактерий, подразделяются на два
типа. Одни из них обеспечивают образование
межклеточного контакта (Mpf-тип, от mating
pair formation), тогда как другие - перенос и ре-
пликацию ДНК (Dtr-тип, от DNA transfer and
replication).
Глава 16. Обмен генетической информацией между микроорганизмами 477
Рис. 16.2. Известные пути переноса генов между вида-
ми бактерий и от бактерий эукариотам по механизму
бактериальной конъюгации.
Открытие бактериальной конъюгации Дж. Ле-
дербергом и Э. Татумом в 40-х гг. 20 в. стало од-
ним из краеугольных камней генетики бактерий.
Благодаря изучению мобилизации хромосомных
генов Е. coli под действием «полового» факто-
ра F были получены первые сведения о кольцевой
форме бактериальной хромосомы и о процессе го-
мологичной рекомбинации. Однако F-фактор, на-
званный позднее У. Хейесом конъюгативной плаз-
мидой (нынешнее название — F-плазмида), ока-
зался совершенно нетипичным представителем
семейства родственных «F-подобных» плазмид:
экспрессия генов tra, ответственных за его пе-
ренос, постоянно дерспрсссировапа, что удалось
доказать путем разрушения гена корепрессора
(finO) путем внедрения в пего 183-элемепта.
В других природных изолятах F-подобных плаз-
мид продукт гена finO, действуя совместно с ан-
тисмысловой РНК — продуктом транскрипции го-
па finP, предотвращает экспрессию гена traJ, ко-
дирующего активатор других ответственных за
перепое генов. F-плазмида содержит полный на-
бор инсерционных элементов, позволяющих ей
включаться в хромосому Е. coli во многих участ-
ках. Это включение происходит путем реципрок-
ной рекомбинации с присутствующими в геноме
Е. coli гомологичными IS-элементами и приводит
к образованию Hfr-штамма, а также мобили-
зует с высокой частотой примыкающие к F-плаз-
миде гопы клетки-хозяина (см. разд. 16.2.1).
Без такого поразительного сочетания всех де-
талей процесса частота обмена хромосомными
маркерами между F+- и Р~-клетками Е. coli бы-
ла бы значительно ниже возможностей метода
ее определения. После открытия F-плазмиды у
Е. coli был начат поиск аналогичных элементов
у других бактерий, который привел к открытию
FP-фактора у Pseudomonas и трансмиссибельно-
го колициногенного фактора у Vibrio. Колицино-
геппые факторы, способные переноситься среди
энтеробактерий, составили первую из описанных
крупных групп конъюгативных плазмид.
Вторая, еще более крупная и важная груп-
па конъюгативных плазмид, представляющих со-
бой факторы переноса резистентности к ан-
тибиотикам, была открыта в конце 1950-х -
начале 1960-х гг. японскими исследователями.
R-факторы (или R-плазмиды, как они бы-
ли названы позднее) оказались ответственными
за быстрое распространение генов устойчивости
к антибиотикам среди энтеробактерий, главным
образом в больницах. Вскоре количество выде-
ленных плазмид настолько возросло, что потре-
бовалось создать унифицированную систему их
классификации. В основу такой системы было по-
ложено разделение плазмид на группы несовме-
стимости, обусловленное взаимодействием меж-
ду регуляторными системами, контролирующими
репликацию плазмид.
Дополнение 16.1. Основные термины, от-
носящиеся к бактериальной конъюгации.
• Реципиент □ Любая клетка, способная
принимать ДНК от бактерии-донора по-
средством горизонтального переноса.
• Донор □ Бактерия, содержащая копъ-
югативпую плазмиду или конъюгативный
транспозон и способная передавать ДНК
реципиенту путем горизонтального пере-
носа генов. Перенос ДНК от донора реци-
пиенту обычно является однонаправлен-
ным.
• Конъюгативная плазмида □ Плазми-
да, способная к самостоятельному перено-
су. Содержит гены tra, белковые продук-
ты которых обеспечивают образование
межклс го шого контакта и перенос ДНК
в клетку-реципиент. Примеры таких плаз-
мид — F-плазмиды (от fertility), обеспе-
чивающие фертильность, и R-плазмиды
(от antibiotic resistance), обусловливаю-
щие устойчивость к антибиотикам (при-
сутствуют у многих бактерий).
• Ее+-клетка □ Донорная клетка, напри-
мер Е. coli, содержащая F-плазмиду в
форме, способной к автономной реплика-
ции (со своего, плазмидного сайта oriV).
Часть IV. Генетика бактерий и бактериофагов
• Сексдукция □ В ранний период иссле-
дований так называли перенос конъюга-
тивной плазмиды реципиенту. В случае
F-плазмиды ее перепое от F ^-донора
F“-реципиенту называют также F-дук-
цией (или конъюгацией). Этот про-
цесс приводит к превращению исходного
F^-штамма в донорный Р+-штамм.
• Hfr-штамм (от high frequency of recom-
bination) □ Донорный штамм, в клетках
которого конъюгативная плазмида инте-
грирована в один из нескольких хромо-
сомных сайтов (у Е. coli их 12) путем
гомологичной рекомбинации с участием
IS-элементов. Плазмида реплицируется с.
точки oriV хромосомы, и поэтому репли-
кация строго координирована, хотя плаз-
мидные гены tra экспрессируются посто-
янно.
• Эписома □ Плазмида, которая либо
реплицируется как автономная единица
(с участием плазмидного ori V-сайта),
либо интегрирована в хромосому хозяина
(например, F-плазмида).
• Г'-плазмида (а также БГ-плазмида) □
Плазмида, полученная из Hfr-штамма, ко-
торая посредством незаконной рекомби-
нации захватывает хромосомные гены из
хромосомы хозяина. Соответствующие ге-
ны, локализованные в F'-плазмиде, обо-
значают F'lac+, F'gal+, F'his+ и т. д.
• Конъюгация □ Перенос (хромосомной)
ДНК от донора реципиенту при непосред-
ственном контакте клеток. Для устой-
чивого наследования перенесенной ДНК
обычно необходимо ее включение в хро-
мосому путем рекомбинации.
• Мерогенота, или диплогенота □ По-
скольку при конъюгации бактерий лишь
немногие гены становятся диплоидны-
ми (например, гены, локализованные в
Р'-плазмидах), термин мерогенота или
диплогенота используют для обозначе-
ния эксконъюгаптов (меро- означает «ча-
стичный»). Р'-плазмиды используют для
определения группы комплементации, а
также в тестах на цис-транс-доминант-
ность и при картировании генов.
• Прерванное спаривание □ При конъ-
югации с участием Hfr-штаммов внача-
ле переносится лидерная область плаз-
миды (например, F), а затем хромосом-
ные гены. Процесс идет с постоянной
скоростью, и перенос всей хромосомы
Е. coli занимает примерно 100 мин. Ес-
ли его прервать искусственно (например,
путем интенсивного встряхивания про-
бирки), можно определить время, необхо-
димое для переноса данного гена; исполь-
зование различных Hfr-штаммов и хро-
мосомных мутантов позволяет построить
таким путем генетическую карту.
Конъюгативные плазмиды, распространен-
ные у бактерий, обусловливают непредсказуемое
разнообразие геномных модификаций в резуль-
тате горизонтального переноса генов. С ними
связана важная практическая проблема—пере-
нос устойчивости к антибиотикам, а также про-
цесс эволюции с участием бактерий. На последнее
непосредственно указывает недавно открытый пе-
репое генов между организмами разных царств по
механизму бактериальной конъюгации. И
16.2.1. Плазмиды опосредуют конъюгативный
перенос ДНК у грамотрицательных
бактерий
F- и F-подобные плазмиды □ Прототипом
плазмид группы несовместимости FI являет-
ся плазмида F, содержащая приблизительно
100 т.п.н. (рис. 16.3). Это низкокопийная плаз-
мида, присутствующая в количестве 1-2 копий
на хромосомный эквивалент. Обнаружено много
плазмид, имеющих, по данным гибридизации, об-
ширные участки гомологии с F-плазмидой. По-
скольку эти плазмиды совместимы с плазмидой F,
а также одна с другой, их называют F-подобньши
плазмидами и относят к группам несовместимо-
сти FII-FVII. Механизм репликации F-плазмиды
имеет сложный характер: плазмида содержит по
меньшей мере два полных (основных) репликона
(RcpFIA и RepFIB) и часть третьего (RepFIC).
Идентифицированы некоторые функции, связан-
Глава 16. Обмен генетической информацией между микроорганизмами 479
Рис. 16.3. Структура F-плазмиды. Плазмида F пред-
ставляет собой ковалентно замкнутую кольцевую мо-
лекулу ДНК (100 т.п.н.), содержащую область перено-
са (гены tra) с точкой начала переноса (ог/Т; белый
треугольник), от которой в процессе конъюгации на-
чинается перенос ДНК, продолжающийся в направ-
лении лидерной области. Показаны транспозирующие-
ся элементы IS2, IS3 и ТпЮОО (7-5) (черные прямо-
угольники), протяженность лидерной области и обла-
сти переноса, а также два района репликации, RepFIA
и RepFIB, с участком двунаправленной вегетативной
репликации oriV. Числа внутри карты обозначают коор-
динаты в т.п.н. Ген finO (кодирующий репрессор) инак-
тивирован внедрением IS3, и в результате происходит
синтез регуляторной РНК на finP и конститутивная экс-
прессия крупного регулона tra (>30 т.п.н., ~2б генов,
~34 генных продукта). По [1].
ные со стабилизацией и распределением плазми-
ды, а также сопряжением цикла ее репликации с
делением клетки-хозяина (см. гл. 14).
F-плазмида содержит инсерционные элемен-
ты по меньшей мере трех типов: по одной ко-
пии IS2 и ТпЮОО (7-5) и две копии IS3. Все эти
элементы образуют кластер длиной 20 т.п.н. По-
скольку большинство природных штаммов Е. coli
и Salmonella typhimurium несет множественные
копии IS2, IS.3 и/или ТпЮОО (см. разд. 14.4),
присутствие этих IS-элементов в F-плазмиде
позволяет ей включаться во множество участ-
ков хромосомы хозяина. Включение происхо-
дит путем реципрокной рекомбинации между го-
мологичными IS-элементами, поэтому встроен-
ная плазмида фланкирована прямыми повторами
IS-последовательпостей. Кодируемая плазмидой
транспортная функция сохраняется и при вклю-
чении плазмиды в хромосому. Начавшийся одно-
направленный перенос плазмиды не останавлива-
ется па границе между плазмидой и хромосомой;
напротив, он приводит к конъюгативному пере-
носу хромосомных маркеров. Штаммы, содержа-
щие F-плазмиду в интегрированном в хромосому
виде, при конъюгации с клетками F--штаммов пе-
редают хромосомные маркеры с высокой часто-
той и поэтому названы Hfr-штаммами (см. до-
полнение 16.1). Такие штаммы широко использу-
ются для картирования хромосомных маркеров.
Перенос ДНК имеет однонаправленный характер,
и у некоторых Hfi-штаммов он начинается со спе-
цифического участка хромосомной ДНК. Поэто-
му последовательность поступления генетических
маркеров в клетку-реципиент указывает их рас-
положение; очередность поступления определяют,
прерывая процесс конъюгации (например, путем
интенсивного встряхивания пробирки с клетками)
в разное время и измеряя частоту переноса кон-
кретных маркеров (см. также выше).
Хромосомные гены могут включаться в
F-плазмиду, если интегрированная плазмида
неточно вырезается в результате незаконной
рекомбинации. Образующиеся в этом случае плаз-
миды обозначают символами F' или R' (если ис-
ходной служила F- или R-плазмида соответствен-
но). Гены tra, ответственные за перенос F-плаз-
мид, локализованы сцепленно на участке длиной
примерно 34 т.п.н. Механизм переноса F-плазмид
описан в разд. 16.2.2.
IncP-плазмиды □ Для этих плазмид харак-
терен широкий круг хозяев; они присутствуют
как устойчиво наследуемые практически у всех
грамотрицательных бактерий. В связи с этим
репликон IncP стал важным инструментом ге-
нетических исследований па грамотрицательных
бактериях, отличных от Е. coli. Плазмиды IncP
содержатся в клетках Е. coli в количестве 6-8 ко-
пий на хромосомный эквивалент. Минимальный
репликон IncP включает всего два элемента, кото-
рые определяют вегетативную репликацию сайта
oriV и синтез продукта гена trfA (от irans-acting
replication function), который связывается с oriV
и активирует его для узнавания аппаратом ре-
пликации клетки-хозяина. Однако такой репли-
480 Часть IV. Генетика бактерий и бактериофагов
коп, состоящий всего из двух этих компонентов,
легко утрачивается и нуждается в стабилизации
посредством системы распределения.
В зависимости от круга организмов, в которых
плазмиды способны стабильно наследоваться, эти
элементы подразделяют па два типа: с широким
кругом хозяев и с узким кругом хозяев. Однако
круг потенциальных реципиентов аппарата конъ-
югативного переноса ДНК обычно гораздо шире.
Это наглядно демонстрирует перенос ДНК дрож-
жам, осуществляемый плазмидами с узким кру-
гом хозяев, например плазмидой F,
Другая характерная особенность IncP-плаз-
мид — это наличие в них kil-kor-регулона, вклю-
чающего по меньшей мерс пять рсирсссорных
генов (korA-korG), которые регулируют ряд
функций, частью потенциально летальных для
хозяина, если их экспрессия пс регулируется.
О функциях kil-гснов почти ничего не известно;
продукты ког-геиоъ участвуют в регуляции про-
цесса репликации, поддержания и переноса плаз-
мид. Белок КогВ предположительно участвует в
согласовании функций поддержания и переноса,
обеспечивая экспрессию генов в зависимости от
физиологического состояния клетки-хозяина.
Гены, ответственные за перенос IncP-плазмид,
локализованы в отдельных областях размерами
примерно 25 т.н.п. Транспортные области плаз-
мид IncPa и IncP/? весьма сходны по организа-
ции генов, но обмен некоторыми детерминантами
специфичности между ними невозможен, что дает
ключ к идентификации генных продуктов, непо-
средственно взаимодействующих с точкой начала
переноса (oriT). Подробно аппарат переноса рас-
смотрен в разд. 16.2.2.
Мобилизация плазмид □ Многие мелкие
плазмиды грамотрицательных бактерий не спо-
собны к самопереносу при конъюгации, однако
практически все природные плазмиды могут быть
эффективно мобилизованы нерезидентной копъ-
югативной плазмидой, обладающей хелперной
функцией (функция помощи). Типичные предста-
вители этого класса плазмид—ColEl (6,6 т.н.п.),
RSF1010 (8,7 т.н.п.) и pSClOl (9,3 т.н.п.).
Для мобилизации плазмид необходимо, кроме
хелперной плазмиды, наличие цис-активного эле-
мента—точки начала переноса (оггТ) в мо-
билизуемой плазмиде, а также ряда продуктов,
кодируемых мобилизуемой плазмидой и специ-
фично взаимодействующих с точкой начала пе-
реноса. Их активности называют функциями мо-
билизации или Mob-функциями. С нуклеопро-
теиновым комплексом, образующимся в сайте
отгТ и называемым также релаксосомой (см.
разд. 16.2.2), взаимодействует аппарат переноса
хелперной плазмиды. Эффективность этого вза-
имодействия может быть различной, и не любая
мелкая плазмида может быть мобилизована дан-
ной коиъюгативной плазмидой. Возможно, моби-
лизация зависит от степени «комплемептарности»
релаксосом мобилизуемой плазмиды и систем об-
разования пор (Mpf, от mating pore formation) со-
ответствующих конъюгативных плазмид.
Плазмиды могут быть либо способными к конъ-
югативному самопереносу, либо мобилизуемыми
(не способными к самостоятельному переносу).
Первые кодируют полноценный аппарат конъюга-
тивного переноса ДНК (Tra-функции), тогда
как вторые обычно обладают только функциями
инициации переноса собственной ДНК, сопряжен-
ного с репликацией (Mob-функции).
Взаимодействие между системами пере-
носа □ Присутствие в одной клетке двух различ-
ных конъюгативных плазмид может приводить
к взаимному нарушению их транспортных функ-
ций. Например, активность подавления фертиль-
ности, которой обладают плазмиды IncFI и IncP,
направлена против плазмид IncP и IncW соответ-
ственно. Плазмиды IncFI, например F-плазмида,
кодируют белок PifC, участвующий в регуля-
ции репликации, а также регуляции оперона pif
[от phage inhibition by F plasmid; продукты
его генов обеспечивают исключение (вырезание)
некоторых фагов, например Т7]. Плазмида RP4,
относящаяся к группе IncP (см. рпс. 17.1), веро-
ятно, содержит по меныпей мере один связыва-
ющий сайт для PifC, судя по тому что скорость
переноса RP4 снижается в 102-103 раз в при-
сутствии плазмиды F (PifC+). Соответственно в
присутствии RP4 экспрессия генов pif возраста-
ет. Тот же эффект наблюдается в присутствии
нуклеотидной последовательности, соответствую-
щей рг/О-оператору. При наличии в клетке до-
полнительных сайтов связывания продукта pifC
концентрация свободного белка PifC, очевидно,
снижена и в результате на более высоком уровне
экспрессируются гены рг/-оперопа. В последова-
тельности IncP обнаружен сегмент, соответствую-
Глава 16. Обмен генетической информацией между микроорганизмами 481
щий половине симметричной последовательности
рг/О-оператора. Этот сегмент локализован внутри
tral-гена. IncP, кодирующего функцию рслаксазы,
которая участвует в инициации конъюгативной
репликации ДНК (см. ниже). Вероятно, данный
участок служит мишенью для PifC, и его связы-
вание приводит к понижающей регуляции образо-
вания продуктов транспортных генов IncP.
Дополнение 16.2. На основании данных
по гибридизации ДНК плазмиды IncP разде-
лены на две подгруппы — IncPo и IncP/?. Од-
нако все они обнаруживают несовместимость
P-типа (симметричную или асимметричную),
поскольку различия между ними относятся
главным образом к областям, кодирующим
аппарат переноса. Подгруппа IncP се включа-
ет так называемые бирмингемские плазмиды,
выделенные в ожоговом отделении Бирмин-
гемской больницы скорой помощи в 1969 г.
Эти плазмиды прибрели известность в свя-
зи с тем, что они кодируют устойчивость
к трем клинически важным классам анти-
биотиков: /3-лактамным антибиотикам (ампи-
циллину, карбенициллипу), амино гликозид-
ным антибиотикам (каиамицину, неомицину)
и тетрациклинам. Кроме того, плазмиды
IncPo содержат ключевые гены ипдуцибель-
ной устойчивости к теллуриту, которые экс-
прессируются только при наличии в них му-
таций, активирующих эти гены или их про-
дукты. Прочие IncPa-плазмиды в основном
сходны с бирмингемскими плазмидами, от-
личаясь от них главным образом по набо-
ру IS-элемсптов и транспозонов. Подгруп-
па IncP/? более гетерогенна; входящие в нее
плазмиды существенно различаются по нук-
леотидным последовательностям, ответствен-
ным за поддержание и перенос плазмид.
Наиболее детально изученная плазмида под-
группы IncP/? — R751 (53 т.п.н.) — сообщает
клеткам-хозяевам устойчивость к тримето-
приму; соответствующая детерминанта коди-
рует дигидрофолатредуктазу и локализована
в элементе Тп402.
В то же время плазмиды IncP существен-
но подавляют перенос нерезидентных плазмид
IncW, таких как R388. Этот эффект связан с дву-
мя отдельными областями, обозначенными fiwA
и fiwB (от fertility inhibition of IncW plasmids).
Оба типа отмеченных взаимодействий являют-
ся однонаправленными: на перенос плазмиды F
не влияет присутствие плазмиды RP4, и плаз-
мида R388 нс подавляет перенос плазмиды RP4.
Другой пример взаимодействия систем переноса
ДНК — это подавление плазмидами IncW у агро-
бактерий способности вызывать образование опу-
холей растений, скорее всего в результате репрес-
сии функции(-й) вирулентности Ti-плазмиды.
Плазмиды, способные подавлять транспортные
функции других конъюгативных плазмид, при-
сутствующих в той же клетке (подавление фер-
тильности), обладают эволюционным преимуще-
ством.
16.2.2. Механизм переноса конъюгативных
плазмид между грамотрицательными
бактериями
Наиболее подробно изучены две конъюгативные
плазмиды: плазмида F, открытая первой, и плаз-
мида RP4, относящаяся к подгруппе IncPcv (она
практически идентична плазмидам с широким
кругом хозяев —RP1, R18, RK2 и R68). Для двух
этих плазмид установлена полная нуклеотидная
последовательность областей, ответственных за
перенос; для плазмиды RP4 и плазмиды R751
из подгруппы IncP/? расшифрована полная по-
следовательность кольцевой ДНК, состоящей из
из 60 099 п.н. (см. рис. 17.1) и 53 339 п.н. соответ-
ственно. По современным представлениям, конъ-
югативный перенос плазмидной ДНК у грамот-
рицательных бактерий происходит в шесть этапов
(рис. 16.4; см. цв. вклейку) и включает 1) образо-
вание и стабилизацию межклеточного контакта;
2) сайт-специфическое разрезание в точке начала
переноса (оггТ) одной из цепей молекулы ДНК,
предназначенной для переноса; 3) раскручивание
ДНК и перенос разрезанной цепи с 5'-копца в
клетку-реципиент с одновременным замещающим
синтезом ДНК в донорной клетке посредством ме-
ханизма катящегося кольца; 4) рециркуляризация
перенесенной отдельной цепи ДНК; 5) синтез ком-
плементарной цепи в клетке-реципиенте и восста-
новление сверхспирализации плазмидной ДНК и
6) расхождение клеток. При конъюгации, вклю-
чающей хромосомные гены, этапы 4-6 заменены
гомологичной рекомбинацией, посредством кото-
482 Часть IV. Генетика бактерий и бактериофагов
Рис. 16.6. Клетки Escherichia coli с пилями. Штамм Е. coli JE2571 использован как хозяин конъюгативных или
рекомбинантных плазмид. Этот штамм (Pil“ Fla“) неспособен образовывать обычные пили, фимбрии или жгутики,
поэтому кодируемые плазмидами пили могут быть однозначно идентифицированы.
А. Е. coli JE2571 (F-плазмида). Б. Е. coli JE2571 (РР4-плазмида)
В. Е. coli JE2571 [плазмиды pML123 (Tra2), pWP471 (traF)]. Последний штамм является сверхпродуцентом жгу-
тиков, кодируемых плазмидой RP4. Клетки негативно окрашены уранилацетэтом. Фото любезно предоставлены
Р. Lurz.
рой эти гены внедряются в хромосому реципиен-
та, как описано в разд. 16.4.
Организация областей переноса □ Обла-
сти переноса плазмид F и R.P4 содержат очень
длинные полицистронные опероны. Наибольший
транскрипт в системе F (рис. 16.5, А; см. цв.
вклейку) включает более 30 т.н.п. и кодирует по
меньшей мере 34 генных продукта. У плазмиды
R.P4 (рис. 16.5, Б) функции переноса локализова-
ны в двух областях, Tral и Тга2, разделенных об-
ластью, включающей инсерционный элемент ISS,
ген устойчивости к канамицииу и локус mrs/par,
который участвует в сегрегации и стабилизации
плазмиды.
В ДНК плазмиды RP4, в отличие от F-плаз-
миды, гены переноса образуют кластеры: область
Тга2 контролирует исключительно образование
межклеточного контакта и поверхностное растя-
жение, тогда как область Tral кодирует необхо-
димые для процессинга ДНК компоненты релак-
сосомы и обеспечивает функции переноса. В обеих
системах точка начала переноса (oriT") локализо-
вана в пределах межгенного района на конце об-
ласти Тга. Перенос плазмид характеризуется по-
лярностью, и основная часть генов tra проникает
в клетку-реципиент последней. При конъюгации с
участием клеток Hfr-штаммов ДНК разрушается
прежде, чем завершится перенос всей хромосомы,
поэтому гены tra никогда не попадают в клетку-
реципиент и она не становится донорной, в отли-
чие от того, что имеет место при конъюгации с
участием F+- или Е'-донора.
Этап 1: образование и стабилизация
межклеточного контакта с участием конъ-
югативных, или половых, пилей □ Непо-
средственный контакт клеток, необходимый для
конъюгации, требует преодоления сил отталки-
вания между ними, связанного с наличием на
их поверхности в ионном растворе ^-потенциала.
Такой контакт обеспечивают специальные поверх-
ностные структуры, белки которых закодированы
в конъюгативных плазмидах грамотрицательных
бактерий. Эти структуры, имеющие вид нитевид-
ных выступов (рис. 16.4 и 16.6), названы поло-
выми пилями. Пили, кодируемые плазмидами
разных групп несовместимости, могут различать-
ся по морфологии. Если клетки Е. coli содержат
плазмиду F, они имеют11-3 длинных и гибких пи-
ля (рис. 2.21 и 16.6, Л), тогда как в случае плазми-
ды R.P4 пили короткие и ригидные (рис. 16.6, Б).
Глава 16. Обмен генетической информацией между микроорганизмами 483
По данным электронно-микроскопических иссле-
дований, только одна из 20 клеток, содержащих
плазмиду RP4, песет пили. Морфология пилей
коррелирует со способностью клеток конъюгиро-
вать либо в жидкой среде, либо на твердой по-
верхности; так, плазмида F лучше переносится в
жидкой среде, плазмида RP4 — когда клетки на-
ходятся на твердой поверхности.
Половые пили — это волосовидные выросты
на поверхности бактериальной клетки. Образую-
щие их белки кодируются генами конъюгативных
плазмид грамотрицательных бактерий. Половые
пили опосредуют первичный контакт с потенци-
ально рсципиентной клеткой.
Синтез и сборку функциональных F-пилей
(см. гл. 23) контролируют 13 генов, расположен-
ных в области tra (рис. 16.5). Пили состоят в ос-
новном, если не полностью, из множества субъ-
единиц, образованных процессированным продук-
том гена tra А. Этот ген кодирует белок пропил ин
(121 аминокислотный остаток; 13,2 кДа), который
подвергается процессингу с отщеплением сегмен-
та из 51 аминокислотного остатка и образованием
зрелого пилина (7 кДа). Для процессинга пропи-
лина необходимы гены traO и traH. Дальнейшее
созревание пилина включает N-ацетилирование,
опосредуемое продуктом гена traX, а также, воз-
можно, фосфорилирование и гликозилирование.
Еще десять генов необходимы для сборки пилей
и формирования в клеточной стенке предполагае-
мого трансмембранного комплекса, осуществляю-
щего физическую связь с переносимой ДНК. Од-
нако конкретные функции продуктов этих генов,
локализованных в стенке, пока неясны. Образую-
щие F-пиль молекулы пилина, располагаясь во-
круг его оси в порядке пятикратной круговой сим-
метрии, формируют полый цилиндр диаметром
8 нм с осевым отверстием диаметром 2 нм (см.
рис. 2.20). Теоретически через этот цилиндр мог-
ла бы проникать одиночная цепь ДНК, но пока
перенос ДНК через пили не продемонстрирован.
Начальный контакт образуется между кон-
чиком пиля и рецепторным сайтом на поверх-
ности клетки-реципиента. Этот начальный агре-
гат спаривания нестабилен и разрушается под
действием сил смыва и ионных детергентов.
Для стабилизации контакта происходит сокра-
щение пиля путем частичной деполимеризации;
при этом контакт клеток становится более тес-
ным. Как установлено, F+-клетки содержат при-
мерно 105 молекул пилина, но из них лишь
10-15% собраны в пили. Предполагается, что про-
цессы сборки и разборки пилей протекают как
равновесные и этим обусловлено притягивание до-
норной и реципиентной клеток после образова-
ния начального контакта. Стабилизация агре-
гата спаривания из двух клеток требует уча-
стия генов traG и traN плазмиды F и со стороны
реципиента — основного белка наружной мембра-
ны ОтрА. а также ее специфических липополиса-
харидных структур. Возможно, образование кон-
такта служит пусковым сигналом для кодируемой
плазмидой Dtr-системы, приводя в результате к
инициации репликации проникающей ДНК.
Пили, кодируемые плазмидой RP4
(Р-пили), чрезвычайно чувствительны к дей-
ствию сил смыва, поэтому для их электронно-
микроскопического исследования клетки необ-
ходимо выращивать па плотной среде. Эффек-
тивный перенос плазмиды RP4 также возможен
только в том случае, если клетки как донора, так
и реципиента выращены па плотной среде. При-
способленность конъюгативного аппарата плаз-
миды RP4 к переносу ДНК па твердой поверх-
ности или в биоплепках согласуется с гипотезой
о том, что плазмиды группы IncP возникли у
почвенных бактерий (например, Pseudomonas).
Для синтеза компонентов и сборки пилей Р-типа
необходимы гены trbB-trbL, расположенные в об-
ласти Тга2 плазмиды RP4, а также продукт гена
traF, локализованного в области Tral (рис. 16.5).
Продукт гена trbC плазмиды RP4 обнаруживает
заметное сходство по аминокислотной последова-
тельности с пропилином (белок ТгаА), кодируе-
мым плазмидой F, и его можно рассматривать
как предшественник, из которого в результате
процессинга образуется пилин P-типа. Сверхэкс-
прессия генов Тга2-области и гена traF приводит
к избыточному образованию пилей (рис. 16.6, В),
т. е. этого набора генов достаточно для сборки
пилей Р-типа.
Внедрение донор-снецифичных фагов □
Кодируемые копъюгативными плазмидами по-
верхностные структуры бактерий, в частности
пили, могут служить специфичными рецептора-
ми для некоторых бактериофагов. Поскольку та-
кие бактериофаги инфицируют исключительно
бактерии с плазмидой, кодирующей подобный
рецептор, данный фенотип называют донор-
специфичной чувствительностью к фагу (Dps).
484 Часть IV. Генетика бактерий и бактериофагов
Донор-специфичные фаги могут служить инстру-
ментом для выяснения родства между Mpf-сис-
тсмами плазмид, относящихся к разным груп-
пам несовместимости. Например, липидсодержа-
щий фаг PRD1 с линейным двухцепочечным
геномом длиной 14,5 т.п.н. инфицирует клетки,
несущие плазмиды групп несовместимости N, Р
и W, но не F. Действительно, анализ нуклеотид-
ной последовательности ДНК показывает близ-
кое сходство продуктов Mpf-гснов плазмид N-,
Р- и W-типов, но не F-типа (см. разд. 16.2.5).
Существование донор-специфичных фагов явля-
ется, по-видимому, главной причиной того, что
в нормальных условиях синтез пилей и, следова-
тельно, конъюгативпый перенос ДНК у большин-
ства конъюгативных плазмид подавлены.
Поверхностное исключение, или исклю-
чение проникновения □ Большинство конъ-
югативных плазмид, в том числе плазмиды F и
RP4, резко понижают способность несущих их
клеток служить реципиентами при конъюгации
с клетками, содержащими идентичные или близ-
кородственные плазмиды. Это явление называют
поверхностным исключением или исключе-
нием проникновения.
Поверхностное исключение следует отличать
от несовместимости плазмид, которая про-
является на уровне их репликации и распреде-
ления в процессе клеточного деления. Поверх-
ностное исключение предотвращает образование
стабильного межклеточного контакта при конъ-
югации и/или перенос ДНК в клетку-реци-
пиент.
У клеток, содержащих F-плазмиду, способ-
ность служить реципиентами при скрещивани-
ях F+ х F+ обычно снижена по сравнению с
клетками F- в 100-300 раз. Такой Sfx-фенотип
определяют два плазмидных гена, traS и traT.
Хотя они проявляют синергичный эффект, меха-
низмы действия их продуктов совершенно различ-
ны. Продукт гена traS (16,9 кДа) —это интеграль-
ный мембранный белок, по-видимому препятству-
ющий запуску конъюгативной репликации ДНК.
В отличие от него продукт гена traT (23,8 кДа)
образует липопротеин, локализованный на внеш-
ней стороне наружной мембраны и блокирующий
конъюгацию на ранней стадии, до формирования
стабильного контакта клеток. Относительно ме-
ханизма действия TraT предполагается, что либо
он блокирует специфический участок в молекуле
белка наружной мембраны ОшрА, распознавае-
мого верхушкой пиля, либо связывается с верхуш-
кой пиля, препятствуя контакту конъюгирующих
клеток.
Функцию поверхностного исключения (Еех, от
entry exlusion function) плазмиды RP4 кодиру-
ет область Тга2. В случае плазмид IncP, в отли-
чие от F-плазмиды, уменьшенную частоту пере-
носа в клетки штаммов с резидентной плазмидой
IncP-типа контролирует только один ген trbK.
Этот фенотип проявляется независимо от того,
находится ген trbK в цис- или транс-положении.
Зрелый продукт TrbK представляет собой, по-
видимому, интегральный липопротеин внутрен-
ней мембраны, состоящий из 47 аминокислотных
остатков и соединенный с липидным компонен-
том через N-копцсвой остаток цистеина. Функ-
ция этого белка проявляется в клетке-реципиенте,
но не доноре. Белок TrbK препятствует передаче
плазмид гомологичных систем IncP-комплекса, но
инертен по отношению к плазмидам Ind-системы.
Вероятная мишень действия TrbK — это участок
формирования межклеточного контакта, посколь-
ку ею нс может быть ни ДНК, ни какой-либо из
компонентов релаксосомы.
Этап 2: сайт-специфическое разрезание
в точке оггТ одной из цепей ДНК, предна-
значенной для переноса; начало переноса □
Локус оггТ представляет собой сайт конъюга-
тнвной или мобилизуемой плазмиды, в котором
специфическим разрезанием одной из цепей ини-
циируется процесс переноса. Общая особенность
точек начала переноса — это наличие в них пря-
мых и инвертированных повторов, которые пред-
положительно служат мишенями для распознава-
ния ДНК белками. Содержание АТ в оггТ обыч-
но выше, чем во фланкирующих участках (то же
характерно для точек качала вегетативной ре-
пликации; см. гл. 14). Кроме того, сайты опТ
могут содержать промоторы, ответственные за
транскрипцию tra- или mob-генов. Важные ге-
ны транскрибируются независимо от промоторов
в области оггТ плазмид группы IncP. Продукты
этих генов специфично взаимодействуют с соот-
ветствующим локусом оггТ в ДНК (рис. 16.7; см.
цв. вклейку).
Как показывает анализ делеций, область на-
чала переноса плазмиды F имеет протяженную
длину и включает домены, отвечающие по отдель-
ности за разрезание ДНК, ее перенос и общую
Глава 16. Обмен генетической информацией между микроорганизмами 485
структуру. Основные детерминанты, определяю-
щие место разреза, по-видимому, локализованы
в интервале от 22-й п.н. справа от места разре-
за до 70-й п.н. слева от места разреза (рис. 16.8,
см. цв. вклейку). Этот домен включает сайт свя-
зывания IHF (консенсусная последовательность
YAANNNNN-TGATA/T). Сайты связывания IHF
увеличивают внутренний изгиб молекулы ДНК в
области oriT плазмиды F и могут участвовать
в формировании ДНК-белковой структуры более
высокого порядка. Зависимый от IHF перенос об-
наружен только у плазмид F-типа.
Этап 3: для инициации конъюгативного
переноса ДНК необходима сборка релаксо-
сомы — сложной нуклеопротеиновой струк-
туры в области начала переноса □ Впер-
вые релаксосомы были обнаружены при изучении
нетрапсмиссивпой, но мобилизуемой плазмиды
ColEl; тогда было установлено, что с областью
начала переноса связаны три белка. Молекуляр-
ные массы этих белков соответствуют величи-
нам, рассчитанным на основе нуклеотидных по-
следовательностей мобилизационных генов, при-
мыкающих к oriT. Обработка релаксосом ColEl
ионными детергентами нарушает взаимодействие
компонентов релаксазы с ДНК. После такой об-
работки один из белков (МЪеА, 60 кДа) остает-
ся прочно связанным (скорее всего, ковалентно)
с плазмидами, которые фиксируются в разрезан-
ном состоянии.
Релаксосомы (рис. 16.9; см. цв. вклеп-
ку) — это специализированные нуклеопротеино-
вые комплексы, состоящие из свсрхспирализован-
ной (форма 1) плазмидной ДНК и компонентов
релаксазы, специфично связанных с областью на-
чала переноса. Релаксазы обладают способностью
производить специфичные в отношении сайтов и
цепей ДНК разрезы и соединения. В разрезанном
состоянии ДНК связана ковалентными и неко-
валентными связями с релаксазой и сохраняет
сверхспирализованную форму, характерную для
плазмиды.
Генетическое и биохимическое изучение плаз-
миды F и родственных ей плазмид, в частности
плазмиды R100 (рис. 14.14), позволило выявить
сложную цепь белок-белковых и ДНК-белковых
взаимодействий. В регуляции экспрессии регу-
лона tra участвуют белки TraJ, FinO и TraY.
Другие белки, такие как гистоноподобный фак-
тор интеграции хозяина (IHF), а также ТгаМ, свя-
зываются с участком oriT при формировании об-
щей структуры F-релаксосомы (рис. 16.8). Нако-
нец, белок Tral, обладающий активностью релак-
сазы /геликазы, осуществляет oriТ-специфичное
разрезание одной цепи ДНК Для конъюгативно-
го переноса ДНК важна ДНК-голиказная актив-
ность ТгаТ и, кроме того, физическая связь меж-
ду7 доменами релаксазы и геликазы. Возможно,
геликазная активность белка Tral необходима не
только для разделения цепей ДНК, но также в
качестве движущей силы для транслокации ДНК
между7 донором и реципиентом. Интересно, что
мобилизация мелких плазмид, таких как ColEl,
происходит в отсутствие Tral. Это можно объяс-
нить либо участием в процессе геликазы хозяина,
либо тем, что механизм разделения цепей и транс-
локации ДНК в случае мелких плазмид в основе
отличается от механизма, характерного для плаз-
миды F.
Модель химических реакций, происходящих в
процессе разрезания/воссоединения остова ДНК,
представлена па рис. 16.10. Гидроксильная группа
ароматического кольца Туг22 активируется путем
смещения протона к атому азота в составе Hisll6.
В результате Туг22 осуществляет нуклеофильную
атаку фосфодиэфирпой связи в сайте разреза, что
приводит к реакции транс-этерификации — кова-
лентному связыванию Tral с цитидильным остат-
ком па б'-конце транслоцируемой цепи ДНК. Гид-
роксильная группа на З'-конце восстанавливается
за счет протона в составе Hisll8. Реакция воссо-
единения осуществляется аналогичным образом:
остаток Hisll8 активирует гидроксильную груп-
пу па З'-копце молекулы ДНК с образованием ак-
тивной нуклеофильной группы, атакующей фос-
фодиэфирную связь между Tral и б'-копцом мо-
лекулы ДНК. В результате mpaitc-этерификации
фосфодиэфирная связь в месте разреза вос-
станавливается и высвобождается белок Tral.
Эксперименты с применением синтетических оли-
гонуклеотидов показали, что белок Tral катали-
зирует также специфичные к нуклеотидной по-
следовательности разрезание и сшивку одноцепо-
чечной ДНК. В отличие от реакции с участием
двухцепочечной ДНК, для разрезания/воссоеди-
нения одноцепочечпой ДНК необходимы толь-
ко ионы Mg2+, но пс дополнительные белки.
Можно предполагать, что функции дополнитель-
ных белков релаксосомы, необходимых для раз-
резания/воссоединения двухцепочечной ДНК, со-
486 Часть IV. Генетика бактерий и бактериофагов
Рис. 16.10. Предполагаемая модель oriТ-специфичного разрезания/воссоединения ДНК плазмиды RP4 релаксазой
Tral. Аминокислотные и нуклеотидные остатки, участвующие в реакции, обозначены соответственно тонкими и
жирными линиями. Буквой В обозначен неидентифицированный компонент, выполняющий основную функцию.
По [2].
стоят в локальном раскручивании участка раз-
реза, позволяющем открыть доступ белку Тга!
к его мишени в нуклеотидной последовательно-
сти. Локальному раскручиванию участка разреза
способствует другой белок, ТгаК, который внед-
ряется внутрь изгиба спирали на участке oriT
протяженностью примерно 180 н.п. (рис. 16.7
и 16.9). Белок ТгаК (14,7 кДа) обладает основ-
ными свойствами и образует в растворе тетра-
меры. В присутствии ТгаК баланс между раз-
резанием и воссоединением в рслаксосоме RP4
сдвигается в направлении образования про-
дуктов разрезания. Однако для разреза-
ния/воссоединепия двухцепочечной ДНК белок
ТгаК не требуется. Поскольку белок ТгаК необ-
ходим для переноса ДНК in vivo, можно предпо-
лагать, что во время конъюгации он выполняет
какие-либо дополнительные функции.
Конъюгативный синтез ДНК □ 1псР-ре-
лаксосомы присутствуют у содержащих плазми-
ды клеток независимо от наличия клеток по-
тенциального реципиента, тогда как инициация
переноса ДНК из клетки-донора наблюдается
только в присутствии клетки-реципиента. Сход-
ные результаты получены для» клеток, содержа-
щих F-плазмиды: репликация ДНК, сопряженная
с переносом плазмиды F, происходит только после
формирования контакта между клетками. На ос-
новании этого высказано предположение, что об-
разование контакта приводит к передаче релак-
сосоме «сигнала спаривания», вызывающего
запуск необратимого разрезания цепи ДНК в ло-
кусе оггТ и инициацию синтеза ДНК, сопряжен-
ного с ее переносом. Сигнал конъюгации, возмож-
но, опосредован белком ТгаМ, который связыва-
ется специфически с локусом оггТ (рис. 16.8), по
не участвует в формировании рслаксосомы и пи-
лей или стабилизации контакта.
Разрезание цепи ДНК в сайте отгТ приводит
как в случае плазмиды F, так и в случае плазмиды
RP4 к образованию свободного З'-ОН-конца, ко-
торый, по-видимому, используется в качестве за-
травки для элонгации цепи ДНК с помощью ап-
парата репликации хозяина (например, холофер-
мента ДНК-полимеразы III).
Этап 4: рециркуляризация цепей ДНК о
Элонгация на З'-конце приводит к замещающе-
му синтезу по механизму «катящегося кольца»
(рис. 16.11; см. цв. вклейку). Для F-плазмиды
имеются, однако, косвенные данные о необхо-
димости дополнительных событий, обеспечиваю-
щих инициацию синтеза комплементарной цепи в
клетке-доноре. Во время переноса F-плазмиды ре-
пликацию ДНК в клетке-доноре можно предот-
вратить путем подавления активности прапмо-
сомы, используя термочувствительный мутант
dnaB при непермиссивных условиях и ингиби-
руя активность РНК-полимеразы рифампици-
ном. В этих условиях функции ДНК-полимераз
клетки-хозяина нс нарушаются, на основании
чего сделан вывод, что З'-ОН-конец в локусе пге
F-плазмиды для них недоступен и не может слу-
жить затравкой. Другая возможность состоит в
том, что после первичной элонгации З'-ОН-конца
замещающий синтез цепи ДНК происходит пре-
рывисто и зависит от активности праймосом, как
Глава 16. Обмен генетической информацией между микроорганизмами 4BZ
это обнаружено in vivo в случае синтеза ДНК бак-
териофага <^Х174.
По-видимому, 5'-конец с ковалентно присоеди-
ненной релаксазой переносится через канал, обра-
зованный в мембране Mpf-системой. Взаимодей-
ствие между релаксазой и Mpf-системой могут
опосредовать белки TraG и TYaD плазмид RP4
и F соответственно. Эти белки имеют сходные
аминокислотные последовательности и содержат
локусы связывания пуклеозидтрифосфатов, по-
этому они могут также участвовать в разделе-
нии цепей ДНК и обеспечении процесса переноса
энергией. Поскольку оба эти белка, вероятно, свя-
заны с плазматической мембраной, можно пред-
полагать наличие у них функций специфических
геликаз, которые через разделение цепей обеспе-
чивают также движущую силу для перемещения
ДНК в клетку-реципиент (рис. 16.11).
Этап 5: синтез комплементарной цепи в
клетке-реципиенте и восстановление сверх-
спиральности плазм идной ДНК □ В клетку-
реципиент ДНК поступает как одиночная цепь;
в случае плазмиды RP4 с пей транспортирует-
ся продукт гена traCl. Этот белок обнаружен
в большом количестве в клетках, содержащих
плазмиду RP4 (> 103 копий на клетку); воз-
можно, он образует на одноцепочечной ДНК че-
хол, предохраняющий ее от действия нуклеаз. Бе-
лок TraCl (116,7 к Да) —это один из двух продук-
тов trcC-гена RP4, образующихся при трансля-
ции с двух заключенных внутри рамки считы-
вания инициаторных сайтов; второй белок — это
ТгаС2 (81,6 кДа) (рис. 16.5). В процессе конъ-
югации переносится только более крупный белок
(TraCl). Оба эти белка обладают активностью
праймазы, т. е. катализируют зависимый от мат-
рицы синтез коротких олигонуклеотидпых затра-
вок на одноцепочечной ДНК. Эти затравки могут
быть использованы ДНК-полимсразами клетки-
реципиента для инициации прерывистого синте-
за комплементарной цепи (рис. 16.11). Однако
в большинстве случаев межвидовой и внутриви-
довой конъюгации продукты гена traC для нее
не требуются, что указывает на существование
других SSB-белков (связывающих одноцепочеч-
ную ДНК), способных заменять TraCl в процессе
конъюгации, а также па участие затравочных ме-
ханизмов, кодируемых клеткой-хозяином, в ини-
циации синтеза комплементарной цепи. Плазми-
да F не кодирует праймазу, но содержит геи белка,
связывающего одноцепочечную ДНК и сходного
с кодируемыми клеткой-хозяином SSB-белками.
Возможно, какой-либо из белков SSB предохра-
няет одпоцепочечные участки ДНК от действия
нуклеаз, но относительно того, что SSB-белки
покрывают в виде чехла молекулу ДНК в про-
цессе ее переноса, данных нет. Синтез комплемен-
тарной цепи в клетке-реципиенте должен проте-
кать с участием затравок, синтезированных ли-
бо РНК-полимеразой, либо праймосомой, судя по
тому, что ни рифампицин, ни мутация гена dnaB
при непермиссивных условиях по отдельности не
препятствуют синтезу ДНК. Для сборки прай-
мосомы необходимо присутствие в одноцепочеч-
пой ДНК сайта pas\ эта нуклеотидная последова-
тельность часто ассоциирована с особой вторич-
ной структурой, узнаваемой продуктом гена рггЛ
(обозначаемым также в7) клетки-хозяина. Связы-
вание белка PriA инициирует сборку праймосомы
(см. гл. 14). Среди первых 130 нуклеотидов лидер-
ного района F-плазмиды, который первым всту-
пает в клетку-реципиент, удивительным образом
отсутствуют как промотор, так и сайт pas, поэто-
му локализация локусов инициации синтеза ком-
плементарной цепи ДНК пока неизвестна.
Этап 6: терминация переноса ДНК и раз-
деление конъюгирующих клеток □ Вслед за
переносом фрагмента одноцепочечной ДНК, рав-
ного по длине одной се молекуле, должна происхо-
дить реакция терминации, обеспечивающая вос-
становление плазмиды. Предположительно она
состоит во вторичном разрезании цепи ДНК на
участке регенерированного разреза, что приво-
дит к рециркуляризации перемещенной ДНК.
При этом релаксаза должна играть центральную
роль в узнавании участка разрезания и в ката-
лизе реакций тпраис-этерпфикации, восстанавли-
вающих фосфодиэфирпые связи на этом участ-
ке. Возможно, для осуществления этих функций
релаксаза остается связанной вблизи поры, ко-
торая позволяет ДНК проходить через клеточ-
ную оболочку, и отслеживает экспортируемую
ДНК для обнаружения одноцепочечного участ-
ка разреза, оггТ (рис. 16.11). Эксперименты с
использованием белка Tral плазмиды RP4 и од-
поцепочечных олигонуклеотидов показали, что
Tral катализирует сайт-специфичную рекомби-
нацию двух отдельно расположенных олигонук-
леотидов на участке разреза. Однако эта ре-
акция происходит только в том случае, если
для нее доступен нуклеотид, расположенный на
З'-конце участка разрезания. Поэтому существу-
488 Часть IV. Генетика бактерий и бактериофагов
ют две возможности: либо во втором событии раз-
рсзания/рециркуляризации участвуют две моле-
кулы белка Tral, либо, как предполагается для
системы F-плазмиды, З'-ОП-конец в участке раз-
резания не удлиняется в процессе переноса и оста-
ется доступным для осуществляемой белком ТгаТ
сшивки, что продемонстрировано in vitro.
16.2.3. Сборку обеспечивают гены
лидерной области
Лидерная область — это первый сегмент ДНК,
проникающий в клетку-реципиент при конъюга-
ции, и он может содержать детерминанты, назы-
ваемые инсталляционными генами, которые обес-
печивают существование передаваемой плазми-
ды в новой клетке-хозяине. Лидерной областью
F-плазмиды служат первые 13 т.п.н. между oriT
и первым реплицирующимся участком, RepFIA
(см. рис. 16.3). На этом участке идентифици-
рованы следующие гены: ген fim из семейства
hok-генов, выполняющих функцию поддержа-
ния; ген psiB, детерминирующий ингибирование
SOS-ответа клеток, и ssb — геи SSB-белка, коопе-
ративно связывающегося с одноцепочечной ДНК,
независимо от нуклеотидной последовательности.
Лидерная область Collb содержит также ан-
тирестрикционпый ген ard (от alleviation of
restriction of DNA), локализованный между oriT
и psiB. Экспрессия этого гена, как и других из-
вестных генов лидерной области, возрастает при
дерепрессии системы переноса Indi. Белок Ard
подавляет рестрикцию ДНК рестриктазами I типа
(трех известных семейств), включая ЕсоК. Гене-
тический анализ показывает, что для защиты от
действия рестриктаз ген ard должен экспресси-
роваться в клетке-реципиенте с переданной плаз-
миды. Возникает вопрос, каким образом белок
Ard успевает накопиться до того, как переда-
ваемая плазмида будет разрушена рестриктазой.
Возможно, проникновение ДНК через мембрану в
процессе конъюгации происходит так, что позво-
ляет синтезироваться белку Ard до того, как плаз-
мида становится доступной для рестриктазы I
типа. Однако следует рассматривать и другую
возможность: не исключено, что гены лидер-
ной области транскрибируются до образования
дуплекса в результате синтеза комплементарной
цепи.
Дополнение 16.3. Плазмидные гены ssb
гомологичны гену ssb Е. coli\ они компенси-
руют дефекты температурочувствительпых
мутантов ssb, что указывает на общую функ-
цию этих генов. Биологическое значение
SSB-плазмид остается неясным. Мутации ге-
на ssb у F-подобных плазмид или плазмид
Incl не приводят к явным дефектам конъюга-
ции; однако регуляция плазмидных генов ssb
со стороны системы подавления фертильно-
сти в плазмидах IncFII и Incll свидетельству-
ет об участии этих генов в копъюгативном
метаболизме ДНК. Об участии SSB-белков в
образовании чехла для ДНК в процессе ее пе-
реноса в клетку-роциписпт данных не имеет-
ся. Возможно, плазмидные ssb-гены должны
предотвращать нехватку белков SSB в конъ-
югирующих клетках. Не исключено, что су-
ществует более выраженная потребность в
плазмидных генах ssb у других бактерий, в
отличие от Е. coli, или в природных услови-
ях, отличающихся от лабораторных.
Локус psiB (от plasmid SOS inhibition) ко-
дирует полипептид мол. массой 12 кДа, инги-
бирующий SOS-ответ пропорционально своей
внутриклеточной концентрации. Для индук-
ции этого ответа необходима активация ко-
протеазной функции белка RecA; сигналом
для такой активации служит образование
одноцепочечной ДНК (см. разд. 15.7). Ве-
роятно, белок PsiB проявляет ингибиторное
действие путем прямого взаимодействия с ак-
тивированным белком RecA. Ген psiA локали-
зован сразу же за psiB по ходу транскрипции
и не является необходимым для функции Psi;
его роль пока не определена. При конъюга-
ции происходит сильная, но кратковремен-
ная индукция экспрессии psiB в составе плаз-
мид F и Collb в клетке-реципиенте па уровне,
достаточном для проявления Psi-фенотипа.
По-видимому, гены psiB необходимы для ин-
сталляции плазмиды в новой клетке-хозяине,
поскольку они обеспечивают предотвращение
SOS-ответа, который мог бы индуцироваться
по мере переноса одпоцепочечной ДНК.
Лидерная область плазмиды RP4 отличается
от аналогичных областей других плазмид в участ-
ке локализации родственных генов ssb и psiB.
Глава 16. Обмен генетической информацией между микроорганизмами 489
Кроме того, в отличие от плазмид F и Collb, ли-
дерная область RP4 содержит один важный tra-
ген (traK) и два вспомогательных ira-гена (traL и
traM) (см. рис. 17.1). Вместе с тем плазмида RP4
кодирует белок, сходный с другими SSB-белками;
при сверхсинтезе этого белка компенсируется эф-
фект мутаций ssb у Е. coli. Соответствующий ген
ssb картирован вблизи гена инициаторного белка
вегетативной репликации (trfA) и, по-видимому,
составляет часть Rep-локуса плазмиды RP4.
Возможно, плазмида RP4 обладает дефектной ан-
тирсстрикционной системой, состоящей из генов
klcA, klcB и когС. Белок KlcA обнаруживает зна-
чительное сходство с белком ArdB. кодируемым
плазмидой pKMIOl из группы IncN. Белок ArdB
специфически ингибирует рестрикцию I типа, но
не влияет па модификацию I типа. У плазмид
группы IncPa, таких как RP4, рамка считыва-
ния гена klcB нарушена из-за вставки транспозо-
на Tnl, кодирующего устойчивость к ампицилли-
ну. У плазмид группы IncP этот транспозон от-
сутствует и оперон klcAB-korC самостоятельно
регулируется геном когС. Таким образом, плаз-
миды группы IncP, по-видимому, содержат гены,
которые можно рассматривать как инсталляцион-
ные, однако они не собраны в лидерной области,
а распределены по всему геному плазмиды.
16.2.4. Механизм конъюгативного переноса ДНК
у грамположительных бактерий
Виды Staphylococcus □ Один из прототипов
конъюгативных репликонов у Staphylococcus —
это плазмида pGOl (52 т.п.н.), обусловливаю-
щая устойчивость к триметоприму, гентамици-
ну и четвертичным соединениям аммония. В ней
обнаружены две отдельные области, достаточ-
ные для конъюгативного переноса ДНК; одна
протяженностью менее 14,5 т.п.н., другая — при-
мерно 2 т.п.н. Эти области идентифицированы
с помощью метода транспозон-индуцированпого
мутагенеза. К настоящему времени установлена
точка начала переноса и определен сайт разреза-
ния ДНК. Нуклеотидная последовательность это-
го сайта идентична соответствующей последова-
тельности в плазмидах группы IncQ.
Для мобилизации белком pGOl мелких плаз-
мид. пс способных к самостоятельному перено-
су, необходимы продукты генов то bА и тоЬВ,
присутствующих в этих плазмидах. Белки МоЪА
и МоЬВ могут формировать сайт- и цепь-
специфичный разрез в межгенном участке плаз-
мид, предположительно содержащем точку на-
чала переноса. Аминокислотная последователь-
ность одного из этих белков включает три моти-
ва, обнаруженных в релаксазах многих трансмис-
сибельпых плазмид грамотрицательпых бактерий
(релаксазы участвуют в узнавании ДНК и процес-
сах специфического разрезания/воссоединения;
см. гл. 14 и 15). Один из этих мотивов содер-
жит остаток тирозина, который ковалентно свя-
зывается с 5'-концом разрезанной цепи ДНК, что
позволяет данному белку «вести» ДНК в клетку-
реципиепт 5'- концом вперед. Такой механизм
непосредственно доказан только для родственных
рслаксаз Тга! плазмиды RP4 и VirD2 плазмиды
pTi грамотрицательных бактерий; сходный меха-
низм однонаправленного переноса специфической
цепи ДНК представляется весьма вероятным.
Практически ничего не известно относительно
механизма образования межклеточного контакта.
Для него необходима твердая поверхность; с по-
мощью электронной микроскопии на поверхности
клеток не обнаружено ни пилей, ни каких-либо
иных структур, связанных с конъюгацией.
Enterococcus faecalis □ Важной особенно-
стью переноса многих плазмид Е. faecalis явля-
ется участие в образовании контакта при конъ-
югации половых феромонов. Нс содержащие
плазмид клетки Е. faecalis секретируют ряд
(по крайней мере, пять, и, возможно, намного
больше) плазмидоспецифичных половых феро-
монов.
Соответствующий феромон индуцирует син-
тез клетками-донорами ряда белков, вызываю-
щих агрегацию клеток и активирующих ь ехапизм
процессинга ДНК при конъюгативпом переносе.
Приобретение клеткой плазмиды приводит к пре-
кращению синтеза ею данного специфичного фе-
ромона. Некоторые клетки, несущие плазмиды,
секретируют специфические конкурентные ин-
гибиторы ответа на феромон. Возможно, они
предотвращают контакт путем снижения уровня
феромона, так что он становится слишком низ-
ким для индукции межклеточного контакта, или
препятствуют самоиндукции из-за дефекта в ре-
прессии образования феромона (см. разд. 20.1.4).
490 Часть IV. Генетика бактерий и бактериофагов
Дополнение 16.4. Процесс конъюгации у
Е. faecalis наиболее изучен для плазмиды
pADl (60 т.п.н.), кодирующей образование ге-
молиз ина/бактсриоцина, и плазмиды pCFlO
(54 т.п.н.), которая обусловливает устойчи-
вость к тетрациклину за счет присутствия
в ней транспозона Т11,925. Феромон, специ-
фичный для pADl (сAD 1),—это гидрофоб-
ный октапептид Leu-Pro-Ser-Lcu-Val-Leu-Ala-
Gly. Инкубация содержащих pADl клеток
в присутствии cADl приводит к их агре-
гации в результате накопления па поверх-
ности этих клеток-доноров «вещества аг-
регации» (AS, от aggregation substance),
имеющего микрофибриллярпую структуру.
Структурный ген этого белка (asa-1) коди-
рует полипептид мол. массой 140 кДа, на
N-копце которого имеется сигнальная по-
следовательность, необходимая для экспорта
белка. Иммунологическими методами уста-
новлено, что данный белок присутствует в
виде микрофибриллярных структур на по-
верхности индуцированных клеток. Амино-
кислотная последовательность продукта ге-
на asa-1 содержит несколько известных мо-
тивов: 1) «якорный» сегмент на С-концевом
участке, обнаруженный в составе некото-
рых поверхностных белков у ряда грампо-
ложительпых бактерий (например, в составе
М-белка у Streptococcus pyogenes)-, 2) богаг-
тый пролином сегмент, по-видимому связан-
ный с клеточной стопкой, и 3) два типа по-
следовательностей, предположительно участ-
вующих в связывании с поверхностными
интегрипами эукариотических клеток. Об-
ласть, ответственная за перенос плазмиды
pADl, составляет примерно половину ее ге-
нома; локус oriT расположен на одном из
концов этой области. Гены, определяющие
реакцию на феромон и регуляторные функ-
ции (примерно 15 т.п.н.), разделяют область,
определяющую перенос ДНК (приблизитель-
но 11 т.п.н.).
Конъюгативные транспозоны (СТп) □
Генетические элементы этого типа впервые бы-
ли обнаружены у некоторых видов Enterococcus и
Streptococcus. Круг хозяев конъюгативных транс-
позонов очень широк; в пего входят грамотрица-
тельные бактерии, у которых описаны три конъ-
югативных транспозона, в том числе один — у эн-
теробактерий. Исследованные к настоящему вре-
мени транспозоны этого типа можно разделить
на два класса: 1) сходные с ТпШб (16,4 т.п.н.)
и 2) сходные с Тп5252 (47,5 т.п.н.). Данные
транспозоны-прототипы придают клетке-хозяину
устойчивость соответственно к тетрациклину и
хлорамфениколу. Конъюгативные транспозоны,
вероятно, в большей степени, чем плазмиды, от-
ветственны за распространение устойчивости к
антибиотикам среди стрептококов.
Межклеточный перенос элементов, подобных
Тп916, по имеющимся данным, включает три эта-
на (рис. 16.12; см. цв. вклейку): 1) вырезание
из донорного репликона и образование кольце-
вого промежуточного продукта, неспособного к
автономной репликации; 2) копъюгативный пе-
репое транспозона в клетку-реципиент, вероятно
через одноцепочечпып промежуточный продукт;
3) транспозиция реконструированного элемента
в репликон реципиента. Вырезание и интеграция
происходят по механизму реципрокной рекомби-
нации, сходному с системой Xis/Int лямбдоид-
ных фагов. Транспозон Тп916 кодирует два белка,
Xis-Tn и Int-Tn, сходных по первичной структуре
с продуктом гена xzs фага Р22 и в меньшей степе-
ни с продуктами фагов А и </?80, а также с семей-
ством родственных Int-рекомбипаз.
Разрезание является, по-видимому, лимитиру-
ющим скорость переноса этапом, судя по тому
что генетические маркеры донорного репликона,
локализованные по обо стороны транспозона, не
мобилизуются с определимой частотой. В то же
время совместный перенос других, по функци-
онально близких к Тп916 последовательностей
происходит с высокой частотой (примерно 50%)
даже в отсутствие давления отбора. Это пока-
зывает, что перемещение одного транспозона мо-
жет запускать процесс транс-активации выре-
зания и переноса другого транспозона. Выреза-
ние происходит путем ступенчатого расщепления
цепи ДНК (с образованием выступа величиной
6-7 н.п.) в примыкающих к транспозону участках
с последующим реципрокным соединением пере-
крывающихся концов транспозона и ДНК хозяина
(рис. 16.12). В отличие от других процессов транс-
позиции. интеграция Тп916 в молекулу-мишень
не вызывает образования коротких прямых по-
второв. Объединение ступенчатых концов обыч-
но приводит к формированию гетеродуплексно-
го участка из 6-7 п.н., который может быть раз-
Глава 16. Обмен генетической информацией между микроорганизмами 491
решен только в процессе последующего переноса
ДНК или, в случае рециркуляризации донорного
репликона, в процессе репликации.
О самом механизме межклеточного переноса
ДНК практически ничего не известно. Для то-
го чтобы произошел перепое, необходим участок
транспозона Т11916 размером примерно 9 т.п.н.;
пока не установлена ни оперенная структура это-
го участка, ни место локализации точки нача-
ла переноса. Для интеграции подобных Тп916'
элементов необходимы два отрезка молекулы-
мишени длиной 20 п.н., имеющих некоторое
сходство с концами транспозона и разделен-
ных сердцевинным участком с варьирующей нук-
леотидной последовательностью длиной 6 п.н.
Ступенчатые разрезы на концах кольцевого
транспозона и вблизи варьирующей сердцеви-
ны инициируют процесс интеграции. Реципрокное
соединение перекрывающихся концов завершает
транспозицию. При этом также может образо-
вываться гетсродуплскс протяженностью 6-7 п.н.,
который разрешается только в последующих
раундах репликации. Несколько потенциальных
сайтов связывания фактора интеграции клетки-
хозяина (IHF) обнаружено в виде кластеров вбли-
зи концов Тп916, что указывает па возможную
роль IHF в реакции интеграции/вырезания конъ-
югативпых транспозонов, подобную роли THF у
бактериофагов семейства лямбда.
Конъюгативные плазмиды Streptomyces
Клетки бактерий рода Streptomyces могут со-
держать плазмиды, размеры которых варьируют
от менее 4 т.п.н. до более 100 т.п.н. Большин-
ство этих плазмид представляет собой замкнутые
кольцевые структуры, но описаны также двухце-
почечпые линейные плазмиды. Типичным приме-
ром мелких (8,8 т.п.н.) двухцепочечных кольце-
вых плазмид, способных к самопереносу, может
служить плазмида pl.JlOl. Она присутствует в
клетках в большом числе копий (300 копий па
хромосому). Эта плазмида впервые была выде-
лена из S. Hvidans, однако круг ее хозяев сре-
ди бактерий, образующих мицелий, довольно ши-
рок; опа устойчиво сохраняется у нескольких
видов Streptomyces, у Micromonospora, Thermomo-
nospora, Saccharopolyspora и Amycolatopsis. При
репликации плазмиды pl J101 образуется одпоце-
почечный интермедиат, и скорее всего она про-
исходит по механизму катящегося кольца. Для
вегетативной репликации необходимы только ко-
дируемый плазмидой белок Rep (50 кДа) и неко-
дирующий участок выше гена г ер, содержащий,
по-видимому, точку начала вегетативной репли-
кации. Хотя плазмида pIJlOl не несет какого-
либо маркера, полезного для отбора, за ее конъ-
югативным переносом легко проследить благода-
ря образованию круглых зон замедленного роста
в тех участках на агаровой среде в чашках Пет-
ри. где конъюгативный перенос pIJlOl вызывает
вспышку экспрессии плазмидных генов в клетках-
реципиентах. Она тормозит рост и может при-
водить к изменению физиологического состояния
клеток, например к преждевременному образова-
нию окрашенных антибиотиков в зонах замедлен-
ного роста на газоне S. coelicolor и S. Hvidans.
В норме эти антибиотики образуются только по-
сле завершения вегетативного роста.
Для конъюгативного переноса плазмиды
pIJlOl необходима минимальная генетическая ин-
формация; половые пили при этом не образуются
и для переноса ДНК требуется только один ген
tra. Он кодирует полипептид мол. массой 66 кДа
и является первым геном оперона, содержащего
еще три гена: spdA, spdB и «66-аа ORF». Про-
дукты этих генов, возможно, мембраносвязапные
белки, поскольку они содержат сильно гидрофоб-
ные домены, судя по составу нуклеотидной по-
следовательности соответствующих генов. Хотя
гены spdA и spdB не являются необходимыми для
переноса ДНК, мутанты по этим гопам (spd, от
«spread») образуют пустулы меньшего размера.
Поэтому предполагается, что данные гены участ-
вуют в миграции плазмид в гифах реципиента.
Экспрессия оперона tra регулируется по меха-
низму отрицательного контроля продуктом гена
когА — ауторегулируемого гена, который располо-
жен отдельно от оперона tra, по транскрибируется
с общего для этих генов промотора, локализован-
ного в межгенном участке.
Убедительно доказано, что при конъюгации
у грамположительных бактерий в качестве про-
межуточного продукта переноса образуется од-
ноцепочечная ДНК. Это сходство с процесом
конъюгации у грамотрицательных бактерий, а
также структурное сходство продуктов ге-
нов переноса и сайтов разрезания (у плазмид
Staphylococcus aureus и конъюгативных транспо-
зонов), позволяют предполагать, что конъюгатив-
ные системы грамположительных и грамотрица-
тельных бактерий имеют общее присхождение.
Однако их важное различие состоит в присут-
492 Часть IV. Генетика бактерий и бактериофагов
ствии у последних конъюгативных пилей, участ-
вующих в соединении клеток. По-видимому, у
грамположительных бактерий функцию пилей
выполняют вещества агрегации.
16.2.5. Системы переноса ДНК
филогенетически родственны
Различные механизмы конъюгативного перено-
са ДНК у грамотрицатсльпых бактерий имеют
две общих особенности: 1) первичный физический
контакт донорной и реципиентной клеток в про-
цессе конъюгации обеспечивают копъюгативныс
пили; 2) ДНК переносится в клетку-реципиент
в одноцепочечной форме. Помимо общих меха-
нистических моментов обнаружено сходство ря-
да специфических нуклеотидных последователь-
ностей в составе плазмид. По механизму спари-
вания плазмиды IncP имеют два аналога среди
плазмид других групп несовместимости — группы
IncW (PilW, R388) и группы IncN (pKMIOl). Об-
ласть Тга2 плазмиды RP4 обнаруживает сходство
с опероном virB плазмиды Ti (рис. 16.13; см. цв.
вклейку). Опорой virB участвует в образовании
контакта бактериями рода Agrobacterium с клет-
ками растений, возможно с помощью структур,
подобных пилям. Предполагается, что компонен-
ты белка VirB вместе с продуктом гена virD 4,
локализованного в области virD плазмиды pTi
(см. ниже), опосредуют перенос ДНК. Как уста-
новлено, перенос плазмиды RSF1010 из группы
IncQ (см. разд. 16.2.1) между бактериями рода
Agrobacterium, а также от них в клетки растений
может быть инициирован областью VirB в присут-
ствии VirD4. Это означает, что гены vir плазмиды
pTi могут функционировать как «гены конъюга-
тивного переноса» и продукты генов virDl/virD2
не обязательны для переноса ДНК в клетки расте-
ний, если присутствуют компоненты релаксосом
гетерологичной системы переноса ДНК.
Значительное сходство обнаружено также
между генами Tra2, virB и опероном ptl пато-
генной для человека бактерии Bordetella pertussis.
Этот оперон, по-видимому, участвует в выде-
лении данной бактерией токсина. На основа-
нии имеющихся -„ведений можно предполагать,
что перечисленные опероны относятся к семей-
ству родственных генов, связанных с экспортом
белков. Эти опероны имеют общие компоненты
(рис. 16.13), продукты которых могут обеспечи-
вать экспортные процессы энергией, гидролизуя
nic
1
IncPa АСТТСАССТАТ СС TCiCCCCCCT
R751 (IncPB) ACTTCACACAT СС TCJCCCCCCT
PTF-FC2 АСААСССТСА1 СС ТСГГАТТССТ
R64 (Incll) CAATTCCACAT СС тсксссстт
pTiC58 Т-ДНК (RB) ССССААТАТ|аЬ pTiC58 Т-ДНК (LB) ССА СААТАТ[а]1 ГЙсГГсИ САААСА jqqTCjcccACCA
pci94 ttctttcttIaIi {cItItcUtaataa
pUBUO TTCTTTCTT[A]I |с|т|тс!атасата
Фаг 9X174 TCCTCCCCcIaI/ JcIt TCiATATTAA
Фаги St-1, a-З СТССТССССА/ ^ст TCSATAATAC
Фаги C4, С14, U3 ТССТСССАСА/ kCT TCiATATTAA
Фагмида ТААСТССА с[а]7 \[с]т CCiATCTTAC X тс
Консенсусная последовательность Y AWC Y
Рис. 16.14. Консервативность областей разрезания опТ
в районах начала вегетативной репликации по механиз-
му катящегося кольца. Сайты разрезания (n/с) отме-
чены стрелками. Строго консервативные нуклеотидные
остатки обведены рамками; позиции, консервативные
как остатки пиримидинов (Y) или остатки А/Т (W), от-
мечены серым. По [5].
пуклеозидтрифосфаты; по-видимому, такие бел-
ки входят в состав транспортных систем, а также
систем, ответственных за перенос и репликацию
ДНК. Локусы ДНК-релаксаз и вспомогательных
белков, участвующих в инициации и терминации
переноса ДНК, также имеют сходную организа-
цию.
Функциональная аналогия продемонстриро-
вана для белков VirD2 и Tral. Подобно Tral,
белок VirD2 специфически разрезает in vitro
одноцепочечную ДНК, содержащую участок раз-
резания плазмид pTi или RP4. Более рудимен-
тарная консенсусная последовательность обнару-
жена при сравнении точек начала репликации
по асимметричному механизму катящегося коль-
ца в плазмидах или точек начала репликации в
(-Ь)-цепи некоторых фагов, содержащих одноце-
почечпую ДНК (рис. 16.14).
Значительная гомология нуклеотидных после-
довательностей областей virB и virD плазмиды
pTi с участками Тга2 и Tral плазмиды RP4, а так-
же функциональное сходство продуктов некото-
рых генов этих областей позволяет постулировать
общий механизм переноса Т-цепи ДНК в клет-
ки растений и ДНК при конъюгации бактерий
(рис. 16.15; см. цв. вклейку). Участок разреза-
ния оггТ плазмиды RP4 и пограничные нуклео-
тидные последовательности плазмиды pTi име-
ют общую внутреннюю последовательность из
7-8 п.н., которая служит сигналом узнавания для
Глава 16. Обмен генетической информацией между микроорганизмами 493
релаксаз Tral и VirD2 и вспомогательных бел-
ков (TraIIJ/VirDlD3) соответственно. Разреза-
ние ДНК в сайте оггТ приводит к ковалент-
ному соединению релаксазы с 5'-концом ДНК.
В результате замещающего синтеза цепи ДНК
с помощью ДНК-полимеразы хозяина образуется
Т-цепь, предназначенная для переноса в клетку-
реципиент. Специальные белки (TraCl/VirE2),
связывающиеся с одноцепочечной ДНК, образу-
ют чехол, который предохраняет ДНК от рас-
щепления нуклеазами и. вероятно, способствует
инициации синтеза комплементарной цепи в
клетке-реципиенте. Предположительно Т-комп-
лекс взаимодействует с продуктами области
Tra2/VirB, которые образуют отверстие наподо-
бие поры в бактериальной мембране и тем самым
способствуют активному транспорту Т-комплекса
с помощью релаксазы (TraI/VirD2) б'-коицом впе-
ред. Белки VirE2 и VirD2 содержат сигналы
ядерной локализации NLS (от nuclear localization
signals), обеспечивающие, возможно, поступление
Т-комплекса в ядро растительной клетки. Суще-
ственное сходство этих двух процессов дает осно-
вания для предположения об общем предшествен-
нике и о том, что перенос Т-ДНК в клетки расте-
ний — это особый случай бактериальной конъюга-
ции, модифицированной в соответствии с услови-
ями переноса ДНК между организмами из раз-
личных царств.
Описанные родственные связи пс касаются
F-нлазмиды или подобных ей плазмид, посколь-
ку они нс обнаруживают значительного струк-
турного сходства с другими плазмидами. В част-
ности. область разрезания oriT плазмиды F не
соответствует последовательностям, представлен-
ным па рис. 16.14. Вполне вероятно, что систе-
мы, подобные ГнсР, эволюционировали практиче-
ски независимо от F-систем. Вместе с тем некото-
рые плазмиды, например, R388 (IncW) и pkNIOl
(IncN), по-видимому, содержат компоненты как
F-подобиых, так и P-подобных систем переноса.
Эти примеры показывают, что сложные системы
с новыми свойствами могут возникать благода-
ря накоплению (и/или обмену) независимо эво-
люционировавших компонентов («модульная эво-
люция»).
Конъюгация бактерий и перенос Т-ДНК в клет-
ки растений представляют собой функционально
и генетически родственные процессы.
16.3. Трансдукцию осуществляют бактериофаги,
содержащие невирусную генетическую информацию
Бактериофаги (см. гл. 26) — это своего рода «мо-
лекулярные паразиты», использующие для са-
мовоспроизведения аппараты репликации ДНК
и синтеза белка «оккупированных» ими клеток.
Подобно плазмидам, бактериофаги иногда вы-
ступают векторами переноса ДНК клеток-хозяев.
Поэтому фаговая инфекция может служить ме-
ханизмом обмена генетическим материалом меж-
ду бактериями. Такой обмен с участием фагов,
называемый трансдукцией, способен обеспечи-
вать бактериальным популяциям эволюционное
преимущество.
Различают два вида трансдукции, обуслов-
ленных двумя типами жизненного цикла фа-
гов: 1) специфическую трансдукцию — пере-
нос ограниченного числа генов клетки-хозяина,
расположенных в участке включения ДНК фа-
га в хромосому бактерии, и 2) неспецифиче-
скую, или общую, трансдукцию — перенос раз-
нообразных генов хозяина, расположенных в раз-
личных участках генома бактерии. Устойчивое
наследование перенесенных генов возможно толь-
ко при их включении в геном. Обычно это вклю-
чение происходит путем гомологичной рекомби-
нации (см. разд. 16.4). Если ген не может быть
включен в геном, он присутствует в отдельных
клетках бактериальной популяции в виде един-
ственной копии. Такой вид переноса генов на-
зывают абортивной трансдукцией. Перенесен-
ная ДНК в этом случае транскрибируется (про-
исходит синтез продукта), но не реплицируется.
При посеве ма агаровую среду; селективную для
клеток, содержащих перенесенный ген, образуют-
ся микроколонии, содержащие примерно 104 кле-
ток. Их рост происходит в результате того, что
дочерние клетки клеток-реципиентов еще содер-
жат продукт абортивно трансдуцированного ге-
на и благодаря этому выживают в селективных
494 Часть IV. Генетика бактерий и бактериофагов
условиях. Дальнейшее деление клеток и оборот
продукта этого гена приводят к его исчерпанию,
и рост таких клеток после нескольких генераций
прекращается.
16.3.1. Специфическую трансдукцию
осуществляют умеренные
бактериофаги, способные включаться
в хромосому клетки-хозяина
Бактериофаг Л □ Фаг А после его открытия
Э. Ледерберг в 1951 г. стал классическим объек-
том для изучения феномена лизогении. После за-
ражения чувствительных клеток Е. coli фаг А мо-
жет размножаться двумя способами.
I. При литическом типе жизненного цикла ге-
ном фага присутствует в клетке в виде авто-
номной молекулы ДНК, интенсивно реплици-
рующейся и обеспечивающей синтез фаговых
белков. При этом в каждой инфицированной
клетке образуются сотни фаговых частиц, ко-
торые в результате лизиса высвобождаются из
нее в среду (см. также гл. 26).
2. В случае лизогении ДНК фага интегрирована
в бактериальную хромосому; большая часть
фагового генома инактивирована общим ре-
прессором (с!) и фаговая ДНК реплицируется
пассивно вместе с хромосомной ДНК.
Включение фага А в бактериальную хромосо-
му происходит путем сайт-специфической ре-
комбинации. катализируемой фаговым белком
Int (рис. 16.16, А; см. цв. вклейку). Вспомогатель-
ную роль выполняет при этом гистопоподобный
белок IHF клетки-хозяина, особым образом изги-
бающий ДНК. Специфическая рекомбинация про-
исходит в так называемых сайтах включения —
локусах attP (в фаговом геноме) и attB (участок
бактериальной хромосомы, обозначаемый также
flit А). Сайты attP и attB состоят из трех ча-
стей: Р, О, Р7 и В, О, В' соответственно. Части
Р, Р7, В и В' называют «плечами», часть О —
«остовом» сайта присоединения. Интеграция фа-
га приводит к формированию химерных сайтов
attL и attR, имеющих структуру ВОР7 и РОВ7
соответственно. При индукции литического пути
развития происходит исключение (эксцизия) про-
фага А — процесс, обратный интеграции. Вспомо-
гательную роль при этом выполняет фаговый бе-
лок Xis, ингибирующий интеграцию, но необходи-
мый для вырезания (см. разд. 26.4).
В случае неточного вырезания при эксцизии,
обычно происходящей путем незаконной рекомби-
нации (рис. 16.16, Б), образуются фаги, осуществ-
ляющие специфическую трансдукцию. Посколь-
ку локус attB фланкирован оперонами galKTE
(регуляция метаболизма галактозы) и bioABFCD
(биосинтез биотина), трансдуцирующие фаги А
обычно включают часть хромосомы, содержащую
маркеры gal (Xgal+) или bio (ХЫо+). В норме
трансдуцирующие фаги А обычно являются де-
фектными (Ad), так как у них отсутствует часть
собственного генома, необходимая для образова-
ния оболочки или репликации ДНК. Однако эти
фаги способны к размножению, если использу-
ются для инфицирования чувствительных клеток
совместно с интактными вспомогательными фа-
гами, которые обеспечивают восполнение утра-
ченных функций. Этим методом можно получать
лизаты клеток с высоким титром идентичных фа-
гов, осуществляющих специфическую трансдук-
цию (HFT-лизаты).
Специфическая трансдукция происходит в
том случае, когда умеренные фаги, интегрирован-
ные в ДНК клетки-хозяина в их сайтах вклю-
чения. исключаются из нес совместно с фланки-
рующими сайт включения хромосомными генами
(в результате неточной рекомбинации). Транс-
дуцирующие фаги либо остаются полноценными
и образуют фаговые частицы, либо утрачивают
некоторые гены (дефект фага обозначают бук-
вой d) и могут размножаться только в присут-
ствии вспомогательного фага, осуществляющего
комплементацию.
16.3.2. Ошибочное узнавание бактериальных
ДНК-последовательностей аппаратом
упаковки фаговых частиц приводит
к общей трансдукции
Бактериофаги Р1 и Р22 □ Жизненный цикл
умеренного фага Pl Е. coli отличается от жиз-
ненного цикла фага А в том отношении, что его
геном в лизогенном состоянии присутствует в
клетке в виде автономного реп.тикона (низко-
копийной плазмиды). Фаг Р22 S. typhimurium
в большей степени напоминает фаг А, посколь-
ку интегрируется в геном клетки-хозяина. Ко-
гда фаги Р1 и Р22 вступают в литический цикл,
активируется особая точка начала репликации,
инициирующая репликацию фагового генома по
Глава 16. Обмен генетической информацией между микроорганизмами 495
механизму катящегося кольца с образованием
конкатемеров длиной в несколько фаговых гено-
мов. ДНК фага подвергается упаковке в процес-
се сборки инфекционных фаговых частиц, высво-
бождающихся из клетки. Упаковка инициируется
в так называемых рас-сайтах. Количество ДНК.
содержащееся в головке фага (~ 100 т.п.н. у фа-
га Pj и 41,8 т.п.н. у фага Р22), детерминировано
величиной головки (headful packaging). У фага
Р22 оно примерно на 2% болыне, чем длина од-
ного генома. В результате происходит частичная
циркулярная пермутация фаговой ДНК и воз-
никает концевая избыточность нуклеотидов
(1,7 т.п.н.) на концах линейной молекулы ДНК.
упакованной в фаговую головку.
Единственным условием формирования фа-
говых частиц, способных осуществлять общую
трансдукцию, является наличие рас-подобных
нуклеотидных последовательностей в хромосом-
ной ДНК хозяина. Если такую последователь-
ность узнает аппарат упаковки фаговых частиц,
бактериальная хромосома используется при упа-
ковке, подобно копкатсмеру фаговой ДНК, т. е.
происходит образование фаговых частиц, содер-
жащпх только бактериальную ДНК, и фаговых
лизатов, в которых теоретически могут содер-
жаться любые хромосомные гены (отсюда назва-
ние общая трансдукция). В отличие от фага Р1,
который не интегрируется в хромосому хозяина,
фаг Р22 может также осуществлять специфиче-
скую трансдукцию. Механизм се аналогичен опи-
санному для фага А.
Система переноса генов (GTA) Rhodo-
bacter capsulatus □ Особая система трансдук-
ции генов существует у грамотрицателыюй фо-
тотрофной бактерии R. capsulatus. Большинство
природных изолятов R. capsulatus образует фа-
гоподобные частицы, называемые агентами пере-
носа генов (GTA; от gene transfer agent). Эти
частицы имеют «головку» диаметром 30 нм, с ко-
роткими выступами, и «хвост» варьирующей дли-
ны (30-50 нм) и диаметром 6 нм, с отростками
и чехликом. Таким образом, GTA-частицы мень-
ше по размерам любого морфологически сходно-
го с ними вируса. Они содержат только хромо-
сомную ДНК бактерии-до нора (длиной примерно
4,5 т.п.н.). ДНК из GTA-частиц может поглощать-
ся клетками-реципиентами и вступать в реком-
бинацию с хромосомой, замещая таким образом
часть генетической информации реципиента ин-
формацией из генома донора. Поскольку GTA со-
держат относительно небольшие фрагменты гено-
ма донора и практически любая часть хромосомы
может быть включена в GTA, их можно использо-
вать в генетических исследованиях R. capsulatus,
в частности для анализа близкорасположенных
мутантных маркеров, которые часто разделяют-
ся при переносе.
Вероятно, GTA произошли от интегрирован-
ных в хромосому умеренных фагов, утратив-
ших способность к упаковке своей ДНК. Судя
по небольшим размерам этих частиц и незна-
чительному количеству ДНК, они не могут со-
держать полный геном гипотетического предка.
Морфология GTA также соответствует скорее
функции межклеточного обмена генами, а не
статусу бактериофагов. Возможно, подобный де-
фектный фаг сохраняется среди различных штам-
мов R. capsulatus благодаря тому, что он повы-
шает жизнеспособность популяций в результате
эффективного переноса их генов. Существование
такой системы, как GTA, свидетельствует о важ-
ной роли опосредуемой фагами трансдукции ге-
нов в обмене генетической информацией в при-
родных популяциях.
Общую трансдукцию широко используют в
генетике бактерий как инструмент исследования,
в частности для картирования расстояния между
генами-маркерами, а также при конструировании
штаммов с целью введения или замещения специ-
фических генов.
16.4. Включение экзогенной ДНК в геном
происходит по механизму гомологичной рекомбинации
Гомологичная рекомбинация — это сложный про-
цесс обмена участка клеточной ДНК на сходный
(гомологичный) или идентичный участок другой
ДНК, экзогенной или образовавшейся в самой
клетке. В последнем случае рекомбинация важ-
на для поддержания целостности клеточной ге-
нетической информации (см. разд. 15.5), тогда
как рекомбинация с экзогенной ДНК необходи-
496 Часть IV. Генетика бактерий и бактериофагов
Таблица 16.1. Классификация генов и белков, участвующих в рекомбинации у Escherichia coli
Гены Белки Размеры генного продукта, кДа Активности
Инициация (пресинапсис)
гесВ RecBCD 134 АТРаза, 5' —» 3' дцДНК-экзонуклеаза, ДНК-геликаза, х-специ- фичная эндонуклеаза
тесС RecBCD 129 АТРаза, 5' —» 3' дцДНК-экзонуклеаза, ДНК-геликаза, х-специ- фичная эндонуклеаза
recD RecBCD 67 АТРаза, 5' —» 3' дцДНК-экзонуклеаза, ДНК-геликаза, х-специ- фичная эндонуклеаза
тесЕ RecE 96 5' —♦ 3' дцДНК-экзонуклеаза
recJ RecJ 63 5' —* 3' оцДНК-экзонуклеаза
recQ RecQ 68 3' —» 5х ДНК-геликаза
Гомологичное спаривание и обмен участками между цепями (синапсис)
гесА RecA 38 Образует свою спиральную цепь поверх ДНК; АТРаза, ката- лизирует гомологичное спаривание и обмен между цепями; ко-протеаза при стимуляции посредством оцДНК
recF RecF 40,5 Связывается с оцДНК
гесО RecO 27 Стимулирует связывание RecA с оцДНК (совместно с RecR)
recR RecR 22 Стимулирует связывание RecA с оцДНК (совместно с RecO)
ssb SSB 18 Связывается с оцДНК
Миграция/разделение ветвей (постсинапсис)
ruvA RuvA 22 Специфически связывается со структурой Холлидея; присоеди- няет RuvB к ДНК
rUvB RuvB 37 АТРаза, способствует миграции ветвей (совместно с RuvA)
ruvC RuvC 19 Эндонуклеаза, специфически разделяет структуру Холлидея
recG RecG 76 АТРаза. специфически связывается со структурой Холлидея, ускоряет миграцию ветвей
ма для стабильного наследования ДНК, поступа-
ющей в клетку путем горизонтального переноса
генов, т. е. при трансформации, трансдукции или
конъюгации в случае Hfr- и F'-штаммов.
Варианты гомологичной рекомбина-
ции □ Выделено огромное количество феноти-
пически различающихся мутантов Е. coli с дефек-
тами рекомбинации (Rec-). Некоторые из этих
мутаций лишают клетки способности использо-
вать в рекомбинации ДНК некоторых типов (на-
пример, оцДНК, дцДНК, линейную или кольце-
вую ДНК), другие мутации вызывают полную
утрату способности к рекомбинации. Это свиде-
тельствует о существовании различных, хотя и
взаимосвязанных путей гомологичной рекомби-
нации (рис. 16.17; см. цв. вклейку). Разнообразие
было выявлено лишь недавно благодаря примене-
нию новых методов для анализа слабоэкспресси-
руемых генов. Такие методы позволяют получать
в значительном количестве очищенные продук-
ты генов, участвующих в рекомбинации, и рекон-
струировать процесс гомологичной рекомбинации
шаг за шагом in vitro.
Процесс гомологичной рекомбинации включа-
ет три стадии (рис. 16.17): инициацию, или пре-
синапсис (образование одноцепочечной ДНК),
синапсис (спаривание гомологичных участков и
обмен между цепями) и постсинапсис (разде-
ление двух молекул ДНК путем специфическо-
го разрезания промежуточных продуктов реком-
бинации, называемых структурами Холлидея;
см. ниже).
16.4.1. Инициация включает образование
одноцепочечной ДНК, необходимой
для рекомбинации
Для начала рекомбинации у Е. coli (и, возможно,
у других бактерий) требуется образование одноце-
Глава 16. Обмен генетической информацией между микроорганизмами 497
почечной ДНК. На этой стадии действует муль-
тифсрмептный комплекс RecBCD, обладающий
геликазно-нуклеазной активностью, или другая
система, включающая белки RecQ, RecJ, RecE,
UvrD или HclD. Вероятно, какой-либо из этих бел-
ков либо все они вместе служат инициаторами ре-
комбинации (рис. 16.17 и табл. 16.1).
Путь с участием RecBCD □ Фермент-
ный комплекс RecBCD —это необходимый ком-
понент основного пути гомологичной рекомбина-
ции у Е. coli. В условиях in vitro этот комплекс
расщепляет дцДНК посредством АТР-зависимой
экзонуклеазной активности и оцДНК— посред-
ством ATP-стимулируемой эпдонуклеазной ак-
тивности. Комплекс RecBCD обладает также ак-
тивностью геликазы, которая может последова-
тельно раскручивать большие участки дцДНК
(>30 т.п.н., без диссоциации от ДНК) со ско-
ростью до 1000 п.п./с. Геликазная активность
RecBCD необычна в том отношении, что субстра-
тами для нее служат линейные дуплексы ДНК,
содержащие 3'- или 5'-хвосты длиной менее 25
нуклеотидов. В процессе раскручивания дцДНК
АТР-зависимос расщепление ДНК осуществляет-
ся асимметричным способом, причем цепь ДНК
с З'-концом сайта вступления для RecBCD рас-
щепляется быстрее, чем цепь с б'-копцом. Процесс
раскручивания приводит к образованию петли на
3х-конце. Инициации гомологичной рекомбинации
с участием RecBCD способствует присутствие в
ДНК х-сайтов, которые состоят из нуклеотидов
5'-GCTGGTGG-3z. Стимуляция рекомбинации в
их присутствии происходит преимущественно на
5'-стороне х-сайта и распространяется со сниже-
нием эффекта более чем па 10 т.п.н. от х-
Набор ферментативных активностей комплек-
са RecBCD указывает на следующий механизм
инициации гомологичной рекомбинации у Е. coli
(рис. 16.18; см. цв. вклейку): RecBCD захватыва-
ет один конец линейной дцДНК и быстро переме-
щается вдоль псе. Цепь ДНК на З'-конце подвер-
гается ограниченной деградации (на рисунке пе
показано). В отсутствие SSB-белка оцДНК, обра-
зовавшаяся в результате геликазной активности
RecBCD, вновь образует двойную спираль сзади
ферментного комплекса. После того как фермент
встречает нуклеотидную последовательность х в
необходимой ориентации, он разрезает ДНК в
этом х-савте и продолжает раскручивать ее мо-
лекулу. После разрезания в х-сайте эндонуклеаз-
ная функция ослабевает, пока RecBC(D) полно-
стью не покинет молекулу ДНК. Одиночная цепь
ДНК, которая образуется в результате разрезания
в х-сайте, захватывается белком RecA и исполь-
зуется в процессе обмена между цепями ДНК.
16.4.2. Синапсис включает спаривание и обмен
гомологичными участками ДНК
Вслед за образованием одноцепочечной ДНК бе-
лок RecA инициирует спаривание гомологичных
участков и их обмен с образованием промежуточ-
ного продукта рекомбинации — структуры Хол-
лидея. Молекулы RecA связываются с цепью
ДНК, формируя свою длинную полимерную цепь,
в пределах которой происходит спаривание цепей
ДНК (рис. 16.19; см. цв. вклейку). Сборка бел-
кового полимера на оцДНК идет в направлении
5х—>3'. Нуклеопротеиновая нить имеет спираль-
ную структуру с шагом спирали 9,5 нм; она со-
держит па виток 6,2 мономеров RecA и от 10,5
до 18,6 п.н. (ДНК в В-форме). Различия в растя-
жении ДНК —это следствие того, что на струк-
туру ДНК накладывается собственная спирализа-
ция белка RecA. О важности данной комплексной
цепи свидетельствует ее наличие при рекомбина-
ции нс только у прокариот, но также у дрожжей
и, весьма вероятно, у млекопитающих. По данным
недавних исследований, белки RecF, RecO, RecR
и SSB действуют как вспомогательные для RecA
(табл. 16.1).
Второй гомологичный отрезок ДНК спари-
вается с одноцепочечной ДНК внутри нук-
леопротеиновой нити с образованием, вероятно,
трехцепочечной структуры (рис. 16.19). Обмен
участками протекает однонаправленно (5'—>3' от-
носительно одпоцепочечного участка) и срав-
нительно медленно (3-10 п.п./с). Основной осо-
бенностью опосредуемого RecA трехцепочечно-
го механизма обмена является возможность
обхода структурных преград в одном или обоих
ДНК-субстратах, включая гетерологичные встав-
ки длиной до 50-100 п.н. Обмен с участием че-
тырех цепей всегда инициируется по механизму
трехцепочечного обмена в одноцепочечной бре-
ши первой молекулы ДНК. Когда процесс обмена
участками достигает двухцепочечпой структуры
первой молекулы ДНК, образуется промежуточ-
ный продукт — структура Холлидея (рис. 16.20;
см. цв. вклейку).
498 Часть IV. Генетика бактерий и бактериофагов
Структура Холлидея — это промежуточный
продукт рекомбинации, в котором два дуплекса
ДПК соединены за счет частичного обмена гомо-
логичными участками ДНК (рис. 1(5.20).
Нуклеопротеиновая нить, содержащая белок
RecA. способна связывать по меныпей мере три
цепи ДНК и катализировать их обмен участками.
Для данной активности не требуется АТР, но его
гидролиз существенно влияет не реакции обмена,
замедляя его до скорости 3000 п.п. за 5-10 мин,
делая однонаправленным и протекающим с уча-
стием четырех цепей ДНК, а также способствуя
обходу существенных структурных преград. Все
это указывает на необходимость гидролиза АТР
для обмена участками ДНК и стимуляцию про-
цесса репарации рекомбинантной ДНК. однако
молекулярный механизм такого сопряжения пока
не ясен.
Кроме участия в рекомбинации, функции бел-
ка RecA включают индукцию SOS-ответа, а так-
же экспрессию ряда оперонов при повреждении
клеточной ДНК (оно приводит к появлению од-
ноценочечных участков ДНК, узнаваемых белком
RecA).
16.4.3. На стадии постсинапсиса происходит
разделение промежуточных продуктов
рекомбинации
Миграция ветвей □ Наряду с однопаправлен
ной миграцией ветвей, которая происходит в пре-
делах нитей RecA в присутствии АТР, Е. coli об-
ладает но меньшей мере еще двумя дополнитель-
ными механизмами для транслокации структур
Холлидея.
1. Велки RuvA и RuvB. действуя совместно, сти-
мулируют миграцию ветвей в структурах Хол-
лидея. Добавление очищенного RuvA (ответ-
ственного за связывание) и RuvB (иниции-
рующего ATP-зависимую миграцию ветвей)
к системе рекомбинации, опосредуемой RecA,
ускоряет обмен участками и образование 1 ете-
родуплексной ДНК.
2. Другую активность, связанную с миграцией
ветвей у Е. coli, осуществляет белок RecG.
Единичная мутация recG или ruv снижает
скорость конъюгативпой рекомбинации при-
мерно в 3 раза; у двойного мутанта recG ruv
скорость рекомбинации снижается более чем
в 500 раз. Двойные мутанты, кроме того, зна-
чительно более чувствительны к ультрафио-
лету, чем клетки с одной мутацией. Такой си-
нергизм указывает на перекрывание функций,
выполняемых продуктами генов recG и ruv.
Белок RecG (76 кДа), подобно RuvB, обладает
активностью ДНК-зависимой АТРазы и свя-
зывается со структурами Холлидея, подобно
RuvA.
Разделение (разрешение) и разрезание
структур Холлидея □ Для завершения реком-
бинации из структур Холлидея должны восстано-
виться две отдельные молекулы ДНК. Один меха-
низм разделения структуры Холлидея, выявлен-
ный в экстрактах Е. coli, опосредует белок RuvC.
Этот белок в счищенном виде in vitro специфиче-
ски связывается со структурой Холлидея и разде-
ляет ее путем эндонуклеолитического разрезания
в точке перекреста (рис. 16.20). В зависимости от
конформации ДНК в этой точке разрезание мо-
жет приводить к образованию одного из двух воз-
можных продуктов.
16.5. Рестрикция и модификация ДНК
предохраняет клетку от чужеродной ДНК
Прокариоты обладают несколькими механизма-
ми защиты генетической информации от физиче-
ских и химических повреждений (см. разд. 15.5),
а также от внедрения чужеродной ДНК. Благо-
даря этому они нечувствительны ко многим ви-
дам бактериофагов, но одновременно данный ме-
ханизм защиты создает барьер для переноса плаз-
мид. Рост многих бактериофагов на газонах кле-
ток Е. coli чрезвычайно сильно зависит не только
от типа, инфицируемого штамма, но и от предыду-
Глава 16. Обмен генетической информацией между микроорганизмами 499
Габлица 16.2. Классификация систем рестрикции-модификации
Характеристика Тип 1 Тип II Тип III
Встречаемость Entciobacteriaccae Все прокариоты Escherichia coli, Haemophilus influenzae
Примеры jEcoK, AcoB EcoRI, Г/mdIII EcoPl, HinflU
Субъединицы, осуществляющие рестрикцию Гетеропептамср (HsdB.2 IIsdM2 HsdS) Гетеродимер Гомодимер
Субъединицы для модификации Кофакторы рестрикции Гетеропентамер (HsdR2-HsdM2HsdS) или гетеродимер (HsdM-IIsdS) Гетеродимер или мономер Мономер
необходимые стимулирующие Кофакторы модификации AdoMet, АТР, Mg2+ Mg2+ ATP, Mg2+ AdoMet
необходимые стимулирующие AdoMet ATP, Mg2+ AdoMet AdoMet, Mg2-1’
Сайт узнавания Состоящий из двух частей и асимметричный ГI ос л едовател ьность из 4-8 п.н., часто палипдромная 5-7 п.н., асимметричная
Сай” распределения Случайное, на расстоянии > 1000 п.н. от сайта узна- вания В пределах сайта узнавания или вблизи него На расстоянии 25-30 п.н. ниже сайта узнавания
Оборот фермента - + +
Координация рос грикции/моди- фикации Взаимное исключение Раздельные реакции Конкурирующие реакции
Транслокация ДНК + — —
АТРаза + - -
щего хозяина фага. Например, фаги, выращенные
в клетках Е. coli К-12, одинаково растут на газо-
нах этого штамма и Е. coli С, но дальше они ве-
дут себя по-разному: фаги, выращенные в клетках
Е. coli С, рассеваются с высокой эффективностью
на газоне клеток того же штамма, но с низкой —
па газоне Е. coli К-12. Более того, один цикл роста
фага, в клетках Е. coli С лишает его способности
хорошо расти в клетках Е. coli К-12.
Молекулярный механизм этого феномена со-
стоит в том, что в клетках Е. coli К-12 проис-
ходит деградация чужеродной ДНК с участием
специфической эндонуклеазы, которая отсутству-
ет у Е. coli. ДНК фага, выращенного в клет-
ках Е. coli К-12, модифицируется метилтранс-
феразой, узнающей сайты эндонуклеазы, что
придает этой ДНК устойчивость к деградации
эндонуклеазой. Такую комбинацию ферментатив-
ных активностей называют контролируемой хо-
зяином системой рестрикции—модификации
(П -М). В зависимости от потребностей в кофакто-
рах и особенностей субъединичной структуры си-
стемы рестрикции-модификации делятся на три
класса (табл. 16.2), и все они присутствуют у
Е. coll. Однако у некоторых штаммов, например
Е. coli С, R-M-систсмы не обнаружены. Биологи-
ческую роль R-M-систем в ограничении переноса
плазмид и инфицирования фагами доказывает то,
что у многих фагов и конъюгативных плазмид об-
наружены системы антирестрикции.
16.5.1. Системы рестрикции-модификации
II типа
Системы II типа широко распространены у про-
кариот: примерно 30% изученных бактериальных
500 Часть IV. Генетика бактерий и бактериофагов
штаммов имеет по меньшей мере одну R-M-сис-
тему II типа. Функции R-M-систем осуществ-
ляют ферменты двух типов. Рсстрицирующие
эндонуклеазы II типа обычно существуют в ви-
де гомодимеров и узнают нуклеотидную после-
довательность длиной 4-6 п.н. (в отдельных слу-
чаях также 8 п.н.), которая часто представляет
собой палиндром. Соответствующие модифициру-
ющие метилазы, хотя они распознают те же са-
мые нуклеотидные последовательности, отлича-
ются по аминокислотной последовательности и
функционируют в виде мономеров. Весьма веро-
ятно, что оба эти компонента систем II типа воз-
никли в результате конвергентной эволюции, а не
дупликации гена и последующей адаптации к раз-
личным функциям.
Палиндромпые носледоватслыюсти-мишени
могут существовать в трех состояниях: пеметили-
рованном, частично метилированном и полностью
метилированном в обеих цепях. Неметилиро-
ванная ДНК является природным субстратом
как для эндонуклеазы, так и для метилазы. Весь-
ма вероятно, однако, что немстилироваппая ДНК
эндонуклеотически расщепляется, а не сохраня-
ется путем приобретения модификации, харак-
терной для нового хозяина. Частично метили-
рованная ДНК существует короткое время в
процессе репликации. Она пс распознается рс-
стрицирующей эндонуклеазой и превращается в
полностью метилированную ДНК под действием
модифицирующей метилазы. Наконец, полно-
стью метилированная ДНК пс служит суб-
стратом ни для эндонуклеазы, ни для метилазы.
Модифицирующие метилазы катализируют
перепое метильных групп от S-аденозилметио-
нина (AdoMet) к специфическим остаткам в
нуклеотидной последовательности-мишени. В за-
висимости от типа R-M-системы метилирован-
ными могут оказаться либо Ыб-метиладенозин,
либо 5-метилцитозин. В случае Hhal-метилтранс-
феразы — фермента, распознающего последова-
тельность GCGC и метилирующего первый цити-
дильный остаток, — путем химической фиксации
установлена кристаллическая структура проме-
жуточного продукта реакции. Интересно, что под-
вергающийся метилированию цитидильный оста-
ток для попадания в активный центр фермента
полностью отодвигается от двойной цепи ДНК.
Фермент стабилизирует посредством водородных
связей комплементарный, «осиротевший» гуапо-
зильный остаток, придавая ему почти такую
же конформацию, какая существует в интактной
В-форме ДНК, и предотвращая таким образом
разрушение се спиральной структуры. Рсстри-
цирующис эндонуклеазы II типа имеют важ-
ное значение для генной технологии, поскольку
их можно использовать для создания специфи-
ческих фрагментов ДНК. Многие рестрицирую-
щпе эндонуклеазы производят ступенчатые раз-
резы с перекрыванием 2-4 п.н. Образующиеся при
этом фрагменты с липкими концами могут быть
специфически и направленно лигированы ДНК-
лигазами (см. разд. 17.1).
В процессе контролируемой хозяином
рестрикции—модификации специфичная к
нуклеотидной последовательности эндонуклеаза
(рестриктаза) расщепляет незащищенную (чуже-
родную) ДНК в участке консенсусной последо-
вательности. Организм-хозяин содержит также
модифицирующий фермент, который связывает-
ся с той же последовательностью и модифициру-
ет (метилирует, гликозилирует) один нуклеотид,
предотвращая таким образом расщепление (ре-
стрикцию) ДНК данной эндонуклеазой.
16.5.2. Системы рестрикции-модификации
I типа
В отличие от систем II типа, ферменты I ти-
па функционируют в виде сложных мультиме-
ров, катализирующих как эндо нуклеазную, так
и модифицирующую метилазную реакции. Их
типичными представителями являются системы
Hsd (от host specificity7 of DNA) ЕсоК и ЕсоВ
у Е. coli. Система ЕсоК содержит в каче-
стве одной субъединицы белка HsdS (55 кДа),
обеспечивающего специфичность реакции, и по
две копии белков HsdR (135 кДа) и HsdM
(62 кДа), обладающих рестриктазной активно-
стью и мстилазной активностью соответствен-
но. Мишень-последовательность, распознаваемая
всеми ферментами I типа, асимметрична и состо-
ит из двух специфических участков длиной 3 п.н.
и 4 или 5 п.п., разделенных нсспецифическим
спейсером фиксированной длины (например,
AAC(N)6GTGC для ЕсоК или TGA(N)8TGCT
для ЕсоК). В соответствии с этими структура-
ми специфичные к ним полипептиды (HsdS) со-
держат два ДНК-распозпающих домена, каждый
из которых узнает один из двух специфических
участков последовательности-мишени.
Глава 16. Обмен генетической информацией между микроорганизмами 501
Рсстрицирующая эидонуклеазная активность
ферментов I типа строго зависит от AdoMet, тре-
бует затраты АТР и присутствия ионов Mg2+
(табл. 16.2). Белок AdoMet и АТР служат ко-
факторами и аллостерическими эффекторами.
AdoMet связывается с субъединицей HsdM и
аллостерически меняет ее конформацию, обеспе-
чивая связывание с ДНК. ATP-зависимый ме-
ханизм инициирует либо метилирование, либо
рестрикцию в зависимости от степени метилиро-
вания распознаваемой последовательности ДНК.
На псмстилированном сайте AdoMet высвобож-
дается, и начинается расщепление ДНК, при ко-
тором рестриктаза посредством АТР-зависимого
механизма перемещается вдоль ее цепи. Во вре-
мя перемещения фермент остается связанным с
сайтом узнавания, поэтому происходит образова-
ние петли ДНК. Фермент разрезает цепь ДНК в
случайных местах на. расстоянии более ЮООп.н.
от распознаваемой последовательности нуклео-
тидов. Эта рестрикция приводит к необратимой
инактивации фермента, т. е. его оборот отсутству-
ет. Для метилазпой реакции необходим в каче-
стве кофактора только AdoMet, и опа протекает
на частично (в одной цепи) метилированных по-
следовательностях. Если фермент связан с полно-
стью метилированной ДНК, для его высвобожде-
ния необходим АТР.
16.5.3. Системы рестрикции-модификации
III типа
Системы III типа изучены наиболее подробно; у
Е. coli это ферменты EcoPl и ЕсоР 15, кодируемые
фагами Р1 и Р15 соответственно, у Haemophilus
influenzae — фермент HinfllL Ферменты R-M III
типа состоят из двух субъединиц; одна из них
(HsdMS, 75 кДа) осуществляет узнавание и ме-
тилирование нуклеотидш)й последовательности-
мишени, тогда как другая (HsdR, 108 кДа)
обладает активностью рестрицирующсй эндо-
нуклеазы. Для связывания фермента с ДНК необ-
ходим АТР, но пс его гидролиз (табл. 16.2).
Рестрикционная и модифицирующая активности
проявляются одновременно и конкурируют за
ДНК. Реакция модификации состоит в метили-
ровании аденильного остатка, расположенного в
распознаваемой нуклеотидной последовательно-
сти, и протекает с участием AdoMet в каче-
стве донора метильных групп. Рестриктаза рас-
щепляет’ ДНК на расстоянии 25-39 нуклеотидов
ниже узнаваемой нуклеотидной последователь-
ности, что обусловлено особенностью структуры
ферментов III типа, у которых функции узна-
вания и рестрикции осуществляют разные субъ-
единицы. связывающиеся с различными участка-
ми ДНК. Расщепление приводит к образованию
ступенчатых разрезов с перекрыванием 2-4 п.н.
Удивительно, что остатки аденина, содержит толь-
ко одна узнаваемая белками EcoPl и ЕсоР15
последовательность (AGACC в случае EcoPl и
CAGCAG в случае ЕсоР15) и поэтому только опа
может быть метилирована.
Каким образом метилированная модификация
ДНК сохраняется в процессе репликации, неясно,
поскольку одна из копий должна быть полностью
в пеметилированпом состоянии, оставаясь чув-
ствительной к эндонуклеолитическому расщепле-
нию ферментом рестрикции.
Дополнительная литература
Birge Е. А. (1994). Bacterial and bacteriophage genetics,
3rd edn. Berlin, Heidelberg, New York: Springer.
Calendar R., cd. (1988). The bacteriophages, vol. 1 and 2.
New York, London: Plenum Press.
ClewellD.B.. ed. (1993). Bacterial conjugation. New
York: Plenum Press.
Dubnau D. (1991). Genetic competence in Bacillus
subtilis. Microbiol. Rev. 55: 395-424.
Holloway B. W. (1993). Genetics for all bacteria. Annu.
Rev. Microbiol. 47: 659 684.
Josct F., Guespin-Michel J. (1993). Prokaryotic genetics.
Genome organization, transfer and plasticity. Oxford:
Blackwell.
Kornberg A., Baker T. (1992). DNA replication, 2nd edn.
New York: Freeman.
Mazodier P., Davies J. (1991). Gene transfer between
distantly related bacteria. Annu. Rev. Genet. 25:
147-171.
Neidhardt F. C-, Curtiss R., Ingraham .1. L., Lin E. С. C.,
LowK.B., Magasanik B., ReznikoffW., Riley M.,
Schaechter M.. Umbargcr H. E. (eds.) (1996). Esche-
richia coli and Salmonella: cellular and molecular
biology. 2nd edn. Wachington, DC: ASM Press.
Pansegray W., Lanka E. (1996). Enzymology of DNA
transfer by conjugative mechanisms. Prog. Nucl.
Acid. Res. Mol. Biol. 54: 197-251.
02 Часть IV. Генетика бактерий и бактериофагов
alycrsA. A.. Shoemaker N. В., Stevens Л. М., Li L.-Y.
(1995). Conjugative transposons: an unusual and
diverse set of integrated gene transfer elements.
Microbiol. Rev. 59: 579-590.
cott .L, Churchward G. G. (1995). Conjugative transpo-
sition. Annu. Rev. Microbiol. 49: 367-397.
mith G. R. (1988). Homologous recombination in
prokaryotes. Microbiol. Rev. 52: 1-28.
nyder L., Champness W. (1977). Molecular genetics of
bacteria. Washington, DC: ADM Press.
onenshein A.L., ed. (1993). Bacillus subtilis and other
Gram-positive bacteria. Washington, DC: ASM
Press.
paink И. P., Kondorosi A., Hoyykaas P. F. F., eds.
(1998). Kluwer Academic Publishers.
Vest S. C. (1992). Enzymes and molecular mechanisms
of genetic recombination. Annu. Rev. Biochem. 61:
603-640.
VilsonG.G., Murray N.E. (1991). Restriction and mo-
dification systems. Annu. Rev. Genet. 25: 585-627.
Источники рисунков
1. Keidhardt F.C., Curtiss R., Ingral
Lin E. С. C., Low К. B., Magasanik B., Rczi
Riley M , Schaechtcr M., UmbargerH.I
(1996). Escherichia coli and Salmonella
and molecular biology. 2nd edn. Washing
ASM Press.
2. Pansegray W., Lanka E. (1996). Prog. Nucl
Res. Mol. Biol. 54: 197-251.
3. Wilkins B., Lanka E. (1993). In: Glewell D
Bacterial conjugation. New York: Plenum;
4. Lessl M., Lanka E. (1994). Cell 77: 321-32
5. Pansegray W., Lanka E., Barth P. T., Figui
GuineyD.G., Haas D., Helinski D. R., S<
Stanisch V. A., Thomas C.M. (1994). .1. Г
239: 623-663.
6. West S.C. (1994). Cell 76: 9-15.
7. West S. C. (1992). Annu. Rev. Biochem. 61:
Глава 17
Технология рекомбинантной ДНК
До середины 1970-х гг. объектами молекулярно-
биологических исследований служили лишь
немногочисленные бактерии и бактериофаги.
На этих объектах были получены важные данные
о структуре и функции генов. Разработка новых
методов, получивших название генная техноло-
гия или технология рекомбинантной ДНК.
оказала огромное влияние на все области биоло-
гии, от биофизики и биохимии до систематики и
экологии; эти методы нашли применение как в
фундаментальных исследованиях, так и в биотех-
нологии, медицине и сельском хозяйстве.
Быстрое развитие молекулярно-генетических
методов стало возможным благодаря обширному
опыту, накопленному в исследованиях бактерий
и бактериофагов. Основные методы генной тех-
нологии весьма просты, однако конкретные экс-
периментальные подходы в той или иной мерс
усложняются в зависимости от объекта и цели
эксперимента. В данной главе будут рассмотрены
основные принципы технологии рекомбинантной
ДНК, используемой для изучения и практическо-
го применения прокариот. Конкретные примеры
ее использования приведены в ч. IV-IX.
Технология рекомбинантной ДНК вклю-
чает четыре основных этапа.
1. Получение определенных фрагментов клеточ-
ной ДНК с помощью рестриктаз.
2. Разделение фрагментов ДНК и создание биб-
лиотеки генов.
3. Выделение и амплификация необходимого
фрагмента ДНК с определением его нуклео-
тидной последовательности и природы коди-
руемых белков.
4. Модификация ДНК и экспрессия гетероло-
гичных генов.
17.1. Геномные библиотеки содержат определенные фрагменты ДНК
Для первого этапа — разрезания молекул клеточ-
ной ДНК на определенные фрагменты — необхо-
димы рестрицирующие эндонуклеазы. Эти
ферменты узнают специфические последователь-
ности нуклеотидов и расщепляют цепь ДНК (см.
разд. 16.5). Рассмотрим два. примера.
1. Фермент ЕсоR1 разрезает ДНК независимо
от ее природы в локусе нуклеотидной после-
довательности GAATTC. Если такая после-
довательность распределена случайным обра-
зом, ДНК будет разрезаться на фрагменты,
содержащие в среднем 4-5 т.п.н. Таким обра-
зом, EcoRl разрезает хромосому длиной, на-
пример, 5ТО6 п.н. па 5 • 10б/5 • 103, т. е. па 1000,
фрагментов.
2. Фермент Alul разрезает ДНК в месте располо-
жения тетрануклеотпдной последовательно-
сти AGCT, ’гго в случае ДНК бактериальных
клеток приводит к образованию фрагментов
длиной 250-350 н.п.
Статистическую частоту сайтов рестрикции
можно определить следующим образом. Рассмот-
рим ДНК, в которой входящие в ее состав четыре
вида нуклеотидов присутствуют в равных коли-
чествах. Если узнаваемая последовательность со-
держит все четыре нуклеотида, например AGCT
в случае фермента Alul, сайты разрезания бу-
дут расположены друг от друга на расстоянии
44 = 256 нуклеотидов. Соответственно гексанук-
леотидные последовательности должны распола-
гаться на удалении 46 = 4096 нуклеотидов. Од-
нако в молекулах клеточных ДНК расположение
распознаваемых последовательностей не удовле-
творяет такому простому правилу, поскольку в
504 Часть IV. Генетика бактерий и бактериофагов
них распределение сайтов рестрикции существен-
но отличается от случайного. Путем теоретиче-
ских расчетов можно определить только среднюю
длину предполагаемых фрагментов. Например,
частота и распределение сайтов разрезания спе-
цифической рестрицирующей эндонуклеазой яв-
ляются специфичными для данного генома (т. е.
представляют собой «фипгерпринт»).
Таким образом, при обработке определенной
рсстрицирующей эндонуклеазой ДНК конкретно-
го организма всегда образуется один и тот же
набор фрагментов. Этот набор фрагментов пред-
ставляет собой сложную смесь, отдельные компо-
ненты которой обычно могут быть разделены пу-
тем их переноса в клетки компетентной бактерии
(см. гл. 16). Однако при этом псрепликативные ре-
стрикционные фрагменты могут быть легко утра-
чены за счет расщеп пения в трансформирован-
ных клетках-хозяевах. Для репликации рестрик-
ционные фрагменты должны быть включены в
ДНК-переносчик, или клонирующий вектор,
как его называют в генной технологии.
Векторами обычно служат плазмиды и бакте-
риофаги или скомбинированные из них последо-
вательности. В настоящее время в распоряжении
исследователей имеются сотни различных векто-
ров. Мы рассмотрим здесь лишь немногие, часто
используемые прокариотические векторы.
17.1.1. Векторы, получаемые из плазмид
Наиболее широко используемые плазмидпые век-
торы получены из R-плазмид (плазмиды рези-
стентности; см. гл. 16). Природная плазмида
RP4 из семейства IncP, содержащая гены пе-
реноса, гены устойчивости к антибиотикам, об-
ласть начала двунаправленной репликации (oriV)
и вторую область начала репликации (од/'Т), ко-
торая участвует в однонаправленной репликации
в процессе переноса плазмиды от клетки-донора
в клетку-реципиент, схематически изображена па
рис. 17.1 (см. цв. вклейку).
Клонирующие векторы (или просто векто-
ры) — это небольшие кольцевые молекулы ДНК
(обычно 3-11 т.п.н.), способные включать клони-
руемую ДНК в специфические сайты рестрикции
и размножать эту ДНК в клетке-хозяине. По сооб-
ражениям безопасности векторы обычно лишены
области оп.7, а также генов tra и mob, что делает
невозможным их перепое в другие клетки путем
конъюгации.
Интактная R-плазмида непригодна для целей
генной технологии по следующим причинам: она
присутствует в клетках бактерий только в од-
ной или двух копиях и, кроме того, легко повре-
ждается под действием сил смыва при обычных
биохимических процедурах, поскольку имеет
крупные размеры (до 100 т.п.н.), и наконец, наи-
более важная причина состоит в том, что боль-
шинство R-плазмид легко переносится из одной
бактериальной клетки в другую и это затруд-
нило бы эффективное разделение рестрикцион-
ных фрагментов. Обычно используют модифи-
цированные плазмиды, которые образуют в бак-
териальных клетках большое количество копий,
осуществляя двунаправленную репликацию, но не
переносятся в другие клетки. Простейшая мо-
дифицированная плазмида, которую часто ис-
пользовали в начале эры генной технологии —
это плазмида pBR322. Опа содержит область
oriV. а также гены Ыа и tet из других плазмид,
обеспечивающие репликацию в клетках Е. coli
и устойчивость к ампициллину (Арг) и тетра-
циклину (Тсг) соответственно (рис. 17.2). Соглас-
но номенклатуре нлазмидных векторов, строчная
буква, р указывает, что данный вектор является
плазмидой, буквы BR представляют собой ини-
циалы ученых, сконструировавших данный век-
тор (F. Bolivar, R. L. Rodrigues), стоящий вслед за
ними лабораторный номер позволяет различить
сходные, но не идентичные плазмиды. Необходи-
мо отмстить, что маркеры плазмидного феноти-
па обозначают двухбуквенпым кодом (Арг, Тс1’),
в отличие от трехбуквенного кода (Ampr, Tetr),
принятого для хромосомных маркеров.
В процессе клонирования рестрикционные
фрагменты интегрируют в вектор. Для облегче-
ния этого процесса используют одну и ту же ре-
стрицирующую эндонуклеазу, разрезающую как
чужеродную ДНК, так и ДНК-вектор в сайте,
который встречается в векторе только один раз.
В случае плазмиды pBR.322 (рис. 17.3; см. цв.
вклейку) для ее открывания («линеаризации»)
можно использовать специфический сайт ВшпН1,
расположенный в гене tet. Рестрикционные фраг-
менты чужеродной ДНК добавляют к линейной
векторной ДНК, и обе молекулы ковалентно сши-
вают с помощью ДНК-лигазы. Образующиеся
Глава 17. Технология рекомбинантной ДНК 505
Рис. 17.2. Модифицированная плазмида pBR322. Ну-
мерация начинается со специфического сайта EcoRI и
продолжается по часовой стрелке. Плазмида содержит
также несколько других специфических сайтов рестрик-
ции (их положение обозначено в скобках), что способ-
ствует точному клонированию; локусы устойчивости к
ампициллину (Арг) и тетрациклину (Тсг) облегчают се-
лекцию; область oriV необходима для репликации ДНК.
Обратите внимание, что гены, необходимые для конъ-
югации и мобилизации, отсутствуют.
продукты представляют собой кольцевые молеку-
лы ДНК, содержащие участки как вектора, так и
чужеродной ДНК.
В ходе клонирования необходимо предот-
вратить замыкание на себя концов линейной
молекулы вектора и обеспечить включение в
него чужеродной ДНК. Это достигается внесе-
нием чужеродной ДНК в избытке относительно
ДНК вектора; еще более эффективна обработка
ДНК-вектора фосфатазой для удаления 5'-фос-
фатных групп с концов вектора. Присутствие
этих групп необходимо для ковалентного связыва-
ния концов ДНК с помощью ДНК-лигазы. С кон-
цами молекул вектора, обработанного фосфата-
зой, могут связываться только концы фрагмен-
тов чужеродной ДНК, содержащие б'-фосфатные
группы. В получаемых гибридных молекулах
цепь чужеродной ДНК связана каждым из кон-
цов с вектором. Противоположные цепи в этой ре-
акции ковалентно не связываются, однако после
переноса путем трансформации в клетки хозяина
они сшиваются резидентными лигазами.
После проведения этих этапов осуществляют
разделение молекул клонируемой ДНК с исполь-
зованием бактерий. Клетки Е. coli обрабатывав
ют ионами Са2+, в результате чего они становят-
ся компетентными (см. гл. 16), т. е. способными
к трансформации. В процессе трансформации в
клетки бактерий должно проникать не более од-
ной молекулы ДНК, что обеспечивается использо-
ванием большого избытка бактериальных клеток
относительно молекул ДНК. Затем трансформи-
рованные бактерии высевают на агаровую среду в
чашках Петри для получения отдельных кочоний,
причем в среду вносят антибиотик. Клетки, не со-
держащие плазмиду, погибают под действием ан-
тибиотика, тогда как клетки, в которые проникла
плазмида pBR322, растут с образованием колоний
как на среде с ампициллином, так и на среде с тет-
рациклином. Бактерии, получившие эту плазмиду
с чужеродной ДНК, могут расти только на среде
с ампициллином, поскольку гены tet инактивиру-
ются при включении чужеродной ДНК. При этих
условиях обеспечивается автоматическое разделе-
ние фрагментов чужеродной ДНК, так как каж-
дая индивидуальная колония состоит из бакте-
рий, содержащих идентичные фрагменты чуже-
родной ДНК, включенные в плазмидный вектор.
Генетически идентичное потомство родительской
клетки в биологии традиционно называют кло-
ном. В соответствии с этим описанную процеду-
ру часто называют клонированием ДНК или
клонированием генов; совокупность копий ре-
стрикционного фрагмента, содержащихся в коло-
нии, называют клоном ДНК и соответствую-
щую ДНК — клонированной.
Если все этапы завершены успешно, исход-
ная клеточная хромосома, разделенная на мелкие
фрагменты, становится доступной для дальней-
шего исследования. Полученный набор векторов,
содержащих клонированную ДНК, часто называ-
ют геномной (ДНК-) библиотекой или гено-
текой. Любой фрагмент чужеродной ДНК может
быть взят из геномной библиотеки и детально изу-
чен. Поскольку бактерии легко вырастить в боль-
ших количествах, за. короткое время можно полу-
чать практически любое количество исследуемой
ДНК. Необходимым условием является легкость
извлечения ДНК из бактерий и возможность вы-
свобождения клонированного фрагмента ДНК из
плазмиды путем рестрикции.
В связи с тем, что ДНК, включенную в плаз-
миду pBR322, трудно идентифицировать, приоб-
506 Часть IV. Генетика бактерий и бактериофагов
ной ДНК в области MSC нарушает рамку счи-
тывания гена lacZ, в результате чего бактерии,
содержащие вектор с клонируемой ДНК, остают-
ся бесцветными и в присутствии X-Gal. Другими
словами, колонии на агаре, содержащем ампицил-
лин и X-Gal, будут синими, если бактерии содер-
жат плазмиду pUC19, по останутся белыми, если
в состав нлазмидного вектора входит чужеродная
ДНК. Такую «сине-белую селекцию» исполь-
зуют во многих методах рекомбинантной ДНК.
---MCS
EcoRI (396)
Sad
Крп!
Smal
ВатШ
Xbal
Sall
BspMI
Pstl
Sphl
H/ndlll (447)
440 450
• •
Pstl H/ndlll
CAATTCGAGCTCGGTACCCGGGGATCCTCTAGAGTCGACCTGCAGGCATGGAAGCTTGG
Sad Xmal Xbal BspMI Sphl
Smal
Рис. 17.4. Вектор pUC19, позволяющий проводить
«сине-белую селекцию». Плазмида pUC19 представ-
ляет собой типичный экспрессируемый вектор, содер-
жащий область or/V, ген Ыа, способствующий Арг-се-
лекции, неполный ген lacz', содержащий промоторно-
операторный участок lacZo.p, и ген-регулятор /ас/,
необходимый для индукции с помощью изопропил-jG-D-
тиогалактозида (IPTG). Ген lacz' содержит множествен-
ные сайты клонирования (последовательность MCS)
для нескольких рестрицирующих эндонуклеаз и кодиру-
ет N-концевую часть /3-галакгозидазы (LacZ), что поз-
воляет использовать метод сине-белой селекции для со-
ответствующих штаммов бактерий (см. текст).
рели популярность другие плазмидные векторы,
например плазмида pUC19, представитель боль-
шого семейства плазмид pUC (рис. 17.4). По-
добно другим плазмидным векторам, плазмида
pUC19 содержит область oriV, геп Ыи, прида-
ющий устойчивость к ампициллину, и, кроме
того, особый фрагмент ДНК с несколькими раз-
личными сайтами, узнаваемыми рестрицирую-
щими эндонуклеазами. Эта последовательность
с множественными сайтами клонирования
MCS) локализована, па б'-конце гена lacZ, ко-
дирующего N-копцевую часть молекулы Дгалак-
тозидазы (lacZ) Е. coli. Для этой системы се-
лекции необходимы штаммы бактерий, которые
содержат З'-конец гена lacZ, кодирующий интакт-
ную С-копцевую часть Дгалактозидазы. Бакте-
рии, содержащие плазмиду pUC19, устойчивы к
ампициллину и кодируют функциональную (3-га-
лактозидазу, собранную из частей, кодируемых
плазмидой и хромосомой. Эти бактерии обра-
зуют синие колонии в присутствии хромогенно-
го субстрата 5-бром-4-хлор-3-индолил-ДБ-галак-
топиранозида (X-Gal). Однако инсерция чужерод-
17.1.2. Векторами могут служить
производные фага Л и космиды
Клонирование в составе плазмид — это техни-
чески простой метод, однако он имеет недо-
статок, состоящий в том, что в плазмиды
можно включить лишь относительно короткий
фрагмент ДНК (до нескольких т.н.п.). Более
длинные фрагменты при включении в плазми-
ду резко нарушают процесс се репликации в
бактериях. Функционально связанные генетиче-
ские системы, такие как оиеропы, при клонирова-
нии в плазмидах могут оказаться раз целенными,
что обычно нежелательно. Поэтому часто предпо-
чтительнее использовать векторы, позволяющие
включать более длинные фрагменты чужеродной
ДНК. Простая и широко применяемая система
клонирования создана на основе фага Л. Боль-
шую часть его генома можно заменить чужерод-
ной ДНК и при этом сохраняется только лити-
ческий цикл инфекции, для которого необходи-
ма область интеграции Ь2. включающая гены xis
и int, а также гены red, кодирующие фермен-
ты рекомбинации (см. рис. 26.13). Однако натив-
ная ДНК фага Л не содержит сайтов рестрикции,
которые позволяли бы легко удалять протяжен-
ную область. Поэтому был сконструирован ряд
модифицированных фагов Л. В качестве приме-
ра рассмотрим вектор EMBL3 (рис. 17.5; см. цв.
вклейку).
Б случае вектора EMBL3 центральная часть
фагового генома замещена необязательным фраг-
ментом ДНК, который фланкирован с обеих кон-
цов сайтами разрезания, специфичными для тех
или иных рестрицирующих ферментов. Методи-
ка клонирования в составе векторов Л включает
следующие этапы.
Глава 17. Технология рекомбинантной ДНК 507
1. Частичное разрезание клонируемой ДНК ре-
стрицирующей эндонуклеазой для получения
длинных фрагментов.
2. Смешивание изолированных «плеч» вектора Л
с разрезанной ДНК и ковалентное соединение
их лигазой с образованием длинных конкате-
меров ДНК.
3. Упаковка копкатсмерной ДНК in vitro в фа-
говые частицы. Сборку фаговых частиц из
отдельных компонентов осуществляют в про-
бирке, для чего клонируемая ДНК должна
быть в форме конкатемера и содержать па
концах сайты cos (см. гл. 26). В частицы фа-
га Л могут быть включены фрагменты ДНК
размерами 10-20 т.п.н. Рекомбинантные фа-
ги разделяют, высевая для образования бля-
шек на газоне бактерий. Отдельная бляшка
содержит более миллиона идентичных фаго-
вых частиц (фаговый клоп), которые можно
далее амплифицировать в количестве, необхо-
димом при анализе клонированной чужерод-
ной ДНК.
Космиды представляют собой плазмиды с
липкими концами — cos-сайтами ДНК фа-
га Л и дополнительными генами, например bla,
обусловливающими устойчивость к ампициллину.
В коемвдах объединены преимущества плазмид
(простота для манипулирования) и Л-векторов
(возможность включения крупных фрагментов
чужеродной ДНК, до 50 т.п.н.). Конкатемерная
ДНК космид может быть упакована в фаго-
вые частицы и использована для инфицирования.
Клетки-реципиенты приобретают способность об-
разовывать колонии на агаровой среде с ампицил-
лином (рис. 17.6; см. цв. вклейку).
17.1.3. Геномные библиотеки и кДНК
используют для идентификации генов
Исходным материалом для целей клонирования
вместо ДНК может служить РНК. Например,
при клонировании эффективно транскрибируе-
мого гена можно получить большое количество
копий его мРНК из одной копии гена в хромо-
сомной ДНК. Такой ген будет’ также иметь пре-
имущество по сравнению с нетранскрибируемы-
ми генами при использовании для клонирования
мРНК вместо ДНК. Однако большая часть бакте-
риальных мРНК имеет короткое время жизни, по-
этому кДНК, полученные из мРНК, могут нести
пе полную информацию в результате частичной
деградации мРНК.
Дополнение 17.1. Геномные библиоте-
ки ДНК должны быть полными и удобными
для использования. Качество геномной биб-
лиотеки определяется степенью ее полноты
и перекрываемости. Полноту как статисти-
ческий показатель можно оценить на основе
следующего уравнения:
1п(1 - Р)
b(l-f)’
(17-1)
N -
где Р — вероятность того, что определенный
фрагмент ДНК (ген) содержится в библиоте-
ке, f—отношение средней длины фрагмента.
ДНК, включенного в вектор, к длине полной
ДНК и N — число плазмид или фаговых кло-
нов.
Если желательна вероятность, равная 0,99,
библиотека фага Л со средними размерами
включенного элемента 2 • 104 п.н. должна со-
держать в случае Mycoplasma 228 клонов
(размеры генома примерно 106 п.н.), в слу-
чае Е. coli — 1103 клопа (размеры генома
4,8 • 106 п.н.).
Библиотека должна содержать перекры-
вающиеся фрагменты, поскольку это дела-
ет возможным или облегчает анализ смеж-
ных сегментов хромосомной ДНК. Если
конец одного фрагмента ДНК идентифици-
руется как начало другого, можно собрать
непрерывный участок хромосомы, как пока-
зано на рис. 17.8. Аналогичный подход ис-
пользуют для получения информации о по-
следовательностях ДНК целых хромосом (ме-
тод «прогулка по хромосоме»). Недавно с
его помощью закопчено секвенирование пол-
ных хромосом Bacillus subtilis, Enterococcus
faecalis, Escherichia coli K-12. Haemophilus
influenzae, Helicobacter pylori, Mycobacterium
genitalium и Methanococcus jannaschii.
После выделения из клеток с нарушен-
ной регуляцией или из индуцированных кле-
ток бактерий общей фракции РНК синтези-
руют па матрице РНК с помощью обратной
транскриптазы комплементарную ДНК, полу-
508 Часть IV. Генетика бактерий и бактериофагов
Клон 1
Клон 2
Клон 3
Клон 4
А Ген 1 В С рН Ген 3 I
I I I I I Г ; Клон 5 ~1~ | | I
Зонд 1
D Е
3о”д3 I ....I •” rfP;
С ВС D Е
‘ч -1/11 । —L Зонд 2 Зонд 4
F С Н
ДНК, составленная
с использованием
метода «прогулка
по хромосоме»
А Ген 1 В С D Е Ген 2 F С Н Ген 3 I
Рис. 17.8. Клонирование последователь-
ных фрагментов ДНК методом «прогулка
по хромосоме». Как только осуществлено
клонирование гена (ДНК; клон 1) и его
физическое картирование или даже се-
квенирование, можно получать ДНК-зонд
(зонд 1), соответствующий его дисталь-
ному концу. Этот зонд можно использо-
вать для идентификации путем гибриди-
зации других фрагментов ДНК, перекры-
вающих конец первого фрагмента. Такие
фрагменты представляют собой либо сле-
дующий сегмент ДНК (клон 2), позволя-
ющий идентифицировать фланкирующую
ДНК, либо совпадают с частью клона 1
(клон 3), подтверждая физическое карти-
рование с использованием рестрицирую-
щих эндонуклеаз А-Е. Повторение этого
цикла с использованием концевых после-
довательностей клонов 2, 3 и 4 (и дру-
гих) в качестве зондов 2, 3 и 4 приве-
дет к сборке последовательных сегмен-
тов ДНК, включающих несколько генов и
даже большую часть хромосомы (сайты
рестрикции А-1) («прогулка по хромосо-
ме»).
чая кДНК, которую можно затем использовать
для клонирования, секвенирования или анализа
методом гель-хроматографии, как и любую дру-
гую ДНК.
Синтез кДНК включает четыре этапа, пред- 2.
ставленные на рис. 17.7 (см. цв. вклейку).
1. Синтез первой цепи из дезоксинуклео-
тидтрифосфатов (dNTP) с помощью обрат-
ной транскриптазы инициируют либо ко-
роткими олигонуклеотидами со случайными
последовательностями оснований, которые ги-
бридизуются случайным образом с любой
комплементарной молекулой РНК, либо оли-
гонуклеотидами со специфическими последо-
вательностями оснований, которые гибриди-
зуются только с одной из специфических мо-
лекул РНК. R результате получают гибрид
ДНК-РНК, и часто синтез кДНК прерыва-
ют на. этой стадии. Если для начальной точ-
ки синтеза используют специфические олиго- 3.
нуклеотиды, которые гибридизуются на опре-
деленном расстоянии от б'-конца молекулы
мРНК, обратная транскриптаза удлиняет за-
травку вплоть до самого конца матрицы.
Если с той же затравкой использовать про-
дукты реакции секвенирования и вместо мат-
рицы — ДНК из этого организма, можно опре-
делить стартовую точку транскрипции соот-
ветствующих мРНК. Этот метод называют
анализом путем надстраивания затрав-
ки (primer extension analysis).
Синтез второй цепи необходим для получе-
ния на матрице РНК молекулы двухцепочеч-
ной ДНК. Его можно осуществить несколь-
кими способами. Часто используют метод с
применением фермента РНКазы Н, которая
частично расщепляет РНК в гибридной моле-
куле РНК-ДНК. Реакцию прерывают прежде,
чем произойдет полное удаление цепи РНК,
и остающийся короткий олигонуклеотид, еще
связанный с кДНК, служит подходящей точ-
кой старта для ДНК-полимеразы I Е. coli.
Затравкой для синтеза служит З'-коиец
РНК-олигопуклеотида, при этом сама РНК
расщепляется по ходу синтеза посредством эк-
зонуклеазной активности ДНК-полимеразы I.
Последовательные фрагменты ДНК кова-
лентно сшивают ферментом ДНК-лигазой
и на этом синтез кДНК завершается. Следует
отметить присущую данному методу особен-
ность: если для синтеза первой цепи исполь-
зуют набор случайных олигонуклеотидов, от-
даленный б'-конец матрицы РНК скорее всего
не будет скопирован.
Глава 17. Технология рекомбинантной ДНК 509
4. Последний этап — подготовка кДНК для
включения в клонирующий вектор. Высту-
пающие одпоцепочечныс участки ДНК отщеп-
ляют соответствующими нуклеазами, причем
часто используют 3'—►б'-экзонуклсазпую ак-
тивность ДНК-полимеразы. Затем осуществ-
ляют подгонку концов кДНК к вектору путем
добавления коротких синтетических олиго-
нуклеотидов, так называемых линкеров, с
помощью ДНК-лигазы. Эти линкеры должны
содержать сайты узнавания рестрицирующей
эндонуклеазы, которая образует концы, сов-
местимые с концами вектора.
17.1.4. Некоторые векторы обеспечивают
специфическую экспрессию
клонированных генов
Часто возникает необходимость проанализиро-
вать продукт (-ы) гена, кодируемые определенным
фрагментом клонированной ДНК. Существует
множество плазмид для конструирования экс-
прессируемых векторов, позволяющих контроли-
ровать экспрессию клонированных генов. Вектор
должен соответствовать конкретным условиям
эксперимента. Рассмотрим два примера из боль-
шого числа экспрессируемых векторов (рис. 17.9 и
17.10). Эти векторы содержат обычные плазмид-
пые элементы, такие как ori V, и ген blat использу-
емый для селекции с помощью антибиотика. Од-
нако в состав вектора pRSET (рис. 17.9) входят,
кроме того, дополнительные элементы, перечис-
ленные ниже.
1. Промоторно-операторная последовательность
(lacZp,o), за которой следует последователь-
ность, кодирующая репрессор LacI (см. также
рис. 17.4).
2. Сайт связывания с рибосомой (rbs) и корот-
кая открытая рамка считывания (ORF), коди-
рующая cv-фрагмент LacZ, который содержит
синтетические MCS для включения фрагмен-
та чужеродной ДНК. Если включенная ДНК
не содержит собственных связывающих сай-
тов rbs, рамка считывания ORF, кодируемая
вновь введенным фрагментом ДНК, может
сформировать с ORF вектора общую непре-
рывную ORF, которая обусловливает экспрес-
сию химерного белка.
Рис. 17.9. Универсальный экспрессируемый плазмид-
ный вектор. Экспрессируемый вектор, в данном случае
pRSET (Invitrogen, San Diego, Calif., USA), содержит
обычную область oriV и гены устойчивости к анти-
биотикам (Ыа), необходимые для репликации и селек-
ции. Кроме того, pRSET содержит промотор-оператор
(LacZp.o), сайт связывания рибосомы (rbs), инициа-
торный кодон (ATG), гистидиновую метку (His)e, мно-
жественные сайты клонирования (MCS) и терминатор
(ter). Эта система находится под контролем Lacl-pe-
прессора и обеспечивает экспрессию транскрипции и
трансляции гибридного белка с His-меткой, облегчаю-
щей очистку любого пептида, ген которого соединен с
множественными сайтами клонирования.
Вектор pRSET не экспрессируется, когда тран-
скрипция внедренной ДНК подавлена репрессо-
ром LacI, однако транскрипцию легко индуциро-
вать добавлением цеметаболизируемого индукто-
ра IPTG (см. разд. 18.1.2). После этого бактерии
начинают синтезировать большое количество хи-
мерного белка. Часто такие белки нерастворимы
и образуют внутри клеток бактерий осадок, назы-
ваемый тельцами включения.
Экспрессируемые векторы обеспечивают
протекание процессов транскрипции и трансля-
ции с образованием определенного генного про-
дукта, часто находящегося под контролем регу-
ляторных генов Zac-оперона и белков (репрессора
LacI; промоторно-операторного участка lacZp,o;
генов rbs). Другие векторы обеспечивают клони-
рование любого гена, связанного с главными про-
моторами фага А (АР^ и АРу?) под контролем со-
ответствующих операторов и репрессора CI в тем-
пературочувствителыюй форме (аллель с!857),
обеспечивающей быструю индукцию фага. В дру-
гих векторах использован промотор фага Т7, для
транскрипции с которого необходима Т7-РНК-по-
510 Часть IV. Генетика бактерий и бактериофагов
Рис. 17.10. Четыре варианта универсального фагмидно-
го вектора. Четыре вектора pBluescript (Stratagene, La
Jolla; Calif., USA) представляют собой гибриды фага и
плазмиды («фагмиды»). Они относятся к мультикопий-
ным векторам, так как содержат точку начала реплика-
ции (origin) плазмиды pColEl; благодаря наличию точ-
ки начала репликации фага fl они могут производить в
присутствии фага-хелпера одноцепочечную ДНК — ли-
бо смысловую (+)-, либо антисмысловую ( —)-цепь для
секвенирования (см. рис. 17.13) или локализованного
мутагенеза (см. рис. 17.16). Гены Ыа обеспечивают воз-
можность отбора по устойчивости к ампициллину (Арг);
область LacZp.o и гены lad и lacZ позволяют осуществ-
лять сине-белую селекцию (см. рис. 17.4) и индуцибель-
ный синтез химерных белков, а также проводить скри-
нинг с помощью антител к белку LacZ. Вектор содержит
полилинкер (MCS) в двух противоположных ориентаци-
ях (SK и KS), включающий 21 специфический сайт ре-
стрикции и позволяющий получать гнездовые делеции с
помощью, например, экзонуклеазы III (см. рис. 17.16),
а также промоторы фагов ТЗ и Т7 внутри MCS. Все
это позволяет проводить эффективный синтез мРНК in
vitro, используя очищенную фаговую РНК-полимеразу,
или эффективную сверхпродукцию белка in vivo (обыч-
но в клетках-хозяевах, содержащих в хромосоме кассе-
ту, в которой экспрессируется Т7-полимераза со строго
контролируемого промотора, например lacZp,o, при на-
личии репрессора LacI).
лимераза. Эти векторы применяют для получения
сверхпродукции генных продуктов, оказывающих
летальный эффект и требующих поэтому падеж-
ного контроля в неиндуцированном состоянии.
При использовании вектора pRSET образо-
вание гибридного белка может служить спосо-
бом очистки искомого белка в случае присоедине-
ния к нему полигистидинового пептида. Наличие
последовательно расположенных остатков гисти-
дина приводит к прочному связыванию со свобод-
ными координационными центрами хелатов Ni,
присоединенных к твердым хроматографическим
носителям. Такие белки можно легко выделять из
экстрактов бактерий, пропуская их через колонку
с агарозным носителем, содержащим никелевый
комплекс. Белок с гистидиновой «меткой» His-tag
задерживается на колонке, когда остальные веще-
ства элюируются. Связанный белок затем элюи-
руют, вытесняя его конкурирующими вещества-
ми, гистидином и имидазолом, либо понижая pH.
Этот метод позволяет получать почти гомогенный
белок за один хроматографический этап. В та-
кие векторы часто включают последовательно-
сти. узнаваемые специфичными протеазами, для
удаления гистидиновой метки после извлечения
белка с колонки; присутствие этого дополнитель-
ного участка, обычно пс влияет на активность изу-
чаемого белка. Метод с введением гистидиновой
метки оказался пригодных! даже при необходи-
мости проведения процедур с применением де-
натурирующих реагентов, например детергентов,
используемых для солюбилизации мембранных
белков, или хаотропных агентов (мочевина), до-
бавляемых для растворения телец включения.
Получаемые таким способом очищенные белки
можно использовать для структурного или функ-
ционального анализа, а также в качестве антител.
Многие белки, в первую очередь мембран-
ные, высокотоксичны при образовании в боль-
ших количествах мультикопий и ыми экспресси-
руемыми векторами, у которых отсутствует
строгий контроль, как в случае векторов, вклю-
чающих систему lacZp,o-lacI. С целью предот-
вращения этого эффекта во многие клонирующие
векторы включают специфичные для фагов про-
моторы, фланкирующие MCS (рис. 17.10). Чаще
всего применяют промотор ПО фага Т7 (23 п.н.).
РНК-полимераза фага Т7 специфична для фа-
говых промоторов и пе узнает (или неэффек-
тивно узнает) бактериальные промоторы. Если
активность бактериальной РНК-полимеразы по-
давить рифампицином, то будут транскрибиро-
ваться только гены, расположенные ниже промо-
тора Т7. Поскольку эта система весьма эффек-
тивна, она должна быть строго регулируемой для
предотвращения преждевременной гибели кле-
ток из-за дефицита рибопуклеозидтрифосфатов.
В связи с этим сконструированы специальные
плазмиды, в которых обеспечен строгий контроль
Глава 17. Технология рекомбинантной ДНК 511
активности РНК-полимеразы фага Т7. Обычно
экспрессия клонированных генов осуществляется
с промотора АРщ контролируемого температуро-
чувствительным репрессором (аллель с/857; см.
гл. 2G). Изображенный на рис. 17.10 вектор име-
ет еще один интересный элемент — область нача-
ла репликации fl из нитевидного фага fl, близ-
кородственного фагу М13. Область fl обеспечива-
ет регенерацию одноцепочечной плазмидной ДНК
при одновременном инфицировании клеток — хо-
зяев плазмиды хелперным фагом. Такая ДНК мо-
жет использоваться для получения одноцепочеч-
пой ДНК, применяемой при секвенировании или
сайт-специфичном мутагенезе.
17.2. Геномные (ДНК) библиотеки часто используют
как стартовый материал для анализа генов и их продуктов
Одна из задач при клонировании, как отмечено
выше, состоит в разделении сложной смеси фраг-
ментов ДНК и получении отдельных компонентов
путем амплификации каждого фрагмента в со-
ставе плазмидного или фагового клона. Геномная
библиотека может быть использована для кон-
струирования физической карты гена на основе
перекрывающихся фрагментов ДНК (см. допол-
нение 17.1). Однако обычно исследователей инте-
ресует определенный ген и его продукт. Искомый
ген можно выделить с помощью одного или двух
наиболее часто используемых приемов: либо пу-
тем определения коротких амипокислотпостных
последовательностей и синтеза соответствующих
Последовательность аминокис-
лотных остатков в пептиде
Полученный на основе пептида
меченый олигонуклеотид
Met-Arg-Trp-Lys-Clu—
ATC-ACA-TGC-AAA-CAA
ACG ААС САС
1
Зонды
Рис. 17.11. Скрининг геномной (или кДНК-) библиоте-
ки с помощью олигонуклеотидных зондов. Имея данные
о составе короткой аминокислотной последовательно-
сти (обычно N-концевой или другой высококонсерватив-
ной последовательности), можно синтезировать соот-
ветствующий ей олигонуклеотидный зонд. По причине
вырожденности генетического кода точный состав ко-
дирующей последовательности при этом неизвестен и
необходимо синтезировать ряд возможных олигонукле-
идов. Бактерии, содержащие клонированную в плазми-
дах, космидах или фагах геномную библиотеку, выра-
щивают на агаровой среде в чашках Петри, затем дела-
ют отпечаток колоний на нитроцеллюлозном фильтре и
инкубируют его до образования колоний. Эти колонии
лизируют непосредственно на фильтре, и высвобожден-
ную ДНК денатурируют, используя NaOH. После фикса-
ции на фильтре ДНК гибридизуют с меченым зондом и
выявляют «положительные» клоны, содержащие ком-
плементарную зонду ДНК. Соответствующие колонии
на исходной чашке Петри выделяют для дальнейшего
анализа.
512 Часть IV. Генетика бактерий и бактериофагов
образцов ДНК, либо с применением антител, спе-
цифичных для очищенного белка. Такие антите-
ла и образцы ДНК могут быть использованы для
процедуры скрининга.
Часто оказывается достаточным разделить
белки методом электрофореза в полиакриламид-
ном геле и затем провести микроссквенирова-
пие фрагментов, полученных путем протеолиза.
Нуклеотидную последовательность можно опре-
делить по аминокислотной последовательности
фрагмента белка и после этого синтезировать
и химически пометить соответствующий оли-
гонуклеотид (рис. 17.11). Поскольку генетиче-
ский код является вырожденным, часто возника-
ет неясность, какие именно кодоны соответству-
ют данной аминокислотной последовательности,
и необходимо синтезировать набор возможных по-
следовательностей. Полученные олигонуклеоти-
ды представляют собой ДНК-зонды, позволяю-
щие идентифицировать соответствующий ген пу-
тем блот-гибридизации по Саузерну. Другой спо-
соб скрининга геномных библиотек основан на
применении специфических антител.
Оба метода включают много общих проце-
дур. Вначале на нитроцеллюлозном фильтре де-
лают отпечаток бактериальных колоний или бля-
шек бактериофага, образовавшихся па агаровой
среде, подобно процедуре получения отпечатков
(см. разд. 15.5.6). Затем на фильтре проводят
гибридизацию связанной с ним (после лизиса кле-
ток) ДНК, используя меченые олигонуклеотид-
ныс зонды, или применяют метод связывания ан-
тител. Реакция будет происходить только в ме-
стах, содержащих «положительные» колонии или
бляшки (рис. 17.11). Локализация меток на филь-
тре соответствует положению колоний (бляшек)
на исходной агаровой пластинке, что позволяет
идентифицировать немногие положительные кло-
ны среди сотен или даже тысяч отрицательных
клонов.
Положительные колонии или бляшки выделя-
ют и затем размножают бактерии или фаги с
помощью микробиологических методов. Колонии
бактерий суспендируют в питательной среде и вы-
ращивают культуры с высокой плотностью кле-
ток, необходимые для последующего выделения
плазмидной или космидпой ДНК. Клонами бакте-
риофагов инфицируют большое количество бак-
териальных клеток, также получая достаточное
количество ДНК для дальнейших исследований.
17.3. Секвенирование ДНК как важный метод биологических исследований
Обзор основных методов генной технологии был
бы неполным без описания, хотя бы кратко-
го, наиболее распространенных методов опреде-
ления нуклеотидной последовательности (секве-
нирования) генов. В настоящее время исполь-
зуются два основных метода секвенирования:
химический метод, предложенной Максимом и
Гилбертом (Maxam, Gilbert) в 1977 г., и биохи-
мический дидезокси-метод, или метод прерыва-
ния цепи, разработанный Сэнгером (Sanger) в том
же 1977 г. Хотя последний метод более трудое-
мок, большинство исследователей предпочитают
его как более точный и дающий воспроизводимые
результаты в случае длинных последовательно-
стей. Более 95% сведений о нуклеотидных после-
довательностях ДНК, хранящихся в международ-
ных банках данных, получено именно этим спосо-
бом. Мы рассмотрим только биологическую часть
метода Сэнгера. Описание его химической части,
а также метода Максама-Гилберта можно найти
в руководствах по молекулярной биологии.
Стандартным способом получения одноцепо-
чечпых кольцевых ДНК служит клонирование
ДНК в составе репликативной формы (RF) фа-
га М13 (рис. 17.12). Для целей клонирования в
молекулярной биологии используют производные
формы фага КПЗ, близкие по свойствам к плазми-
дам серии pUC (см. рис. 17.4; цв. вклейка). Внут-
ривенная область КПЗ содержит часть гена lacZ,
используемого в методе сине-белой селекции, и
множественные сайты клонирования. Эта область
позволяет перевести RF-ДНК фага КПЗ в линей-
ную форму для инсерции чужеродной ДНК. Ги-
бридную конструкцию из RF и чужеродной ДНК
затем переносят в клетки бактерий для размно-
жения. В цикле инфекции образуются фаги с од-
поцепочечной ДНК, содержащие также чужерод-
ную ДНК. Эти одноцепочечные кольцевые моле-
кулы служат матрицами для синтеза ДНК in vitro
(рис. 17.13).
Секвенирование дидезокси-мстодом прерыва-
ния цепи включает следующие этапы (рис. 17.14;
Глава 17. Технология рекомбинантной ДНК 513
Рис. 17.12. Геном нитевидного фага М13. Геном фага
М13, заключенный в капсиды, представляет собой одно-
цепочечную кольцевую ДНК и кодирует 10 генов, необ-
ходимых для репликации ДНК, синтеза белков оболочки
и сборки (морфопоэза) зрелого фага. Одиночная инфи-
цирующая цепь быстро превращается в клетке-хозяине
в двухцепочечную репликативную форму ДНК (RF) с
межгенной областью, в которую может включаться чу-
жеродная ДНК без нарушения репликации и сборки фа-
га. Присутствующую в капсиде фага одноцепочечную
ДНК используют в качестве матрицы при секвениро-
вании ДНК дидезокси-методом прерывания цепи и при
локализованном мутагенезе.
Рис. 17.13. Фаг М13 в качестве вектора для клонирования и определения нуклеотидной последовательности. Фаг
М13тр7 — модифицированная форма одноцепочечного фага М13 — содержит множественные сайты клонирования
(MCS).
А Геном М13тр7 и затравка, используемая в дидезокси-методе прерывания цепи.
Б. Двухцепочечная репликативная форма фага M13mp7 (RF), в которой природная межгенная область (см.
рис. 17.12) удлинена присоединением генов lad и lacZ', используемых для сине-белой селекции, а также мно-
жественных сайтов клонирования (MCS).
см. цв. вклейку): 1) гибридизация ДНК-затравки
(олигонуклеотида) с участком вблизи MCS;
2) удлинение с помощью ДНК-полимеразы I Кле-
нова или другой полимеразы, которая не облада-
ет 57—>3/-экзонуклеазной активностью, для удли-
нения З'-ОН-копца затравки при синтезе компле-
ментарной цепи.
Процесс секвенирования основан на осуществ-
лении направленного, по подчиняющегося зако-
нам вероятности прерывания синтеза комплемен-
тарной цепи ДНК путем добавления к смеси
обычных дезоксинуклеотидов (dNTS) дидезок-
синуклеотидов (ddNTS). Поскольку ddNTS ли-
шены З-ОН'-группы (см. гл. 14), при включении
любого дидезокеппуклеотида в растущую цепь
ДНК ее синтез прерывается. За один эксперимент
может быть «прочитано» несколько сотен нук-
леотидов в последовательности ДНК. Для про-
чтения длинных последовательностей исходный
фрагмент ДНК необходимо разделить на мень-
шие части, клонировать каждый фрагмент в со-
ставе вектора КПЗ и затем определять их нук-
леотидные последовательности. Разделение круп-
ных сегментов ДНК и получение клонов меньших
фрагментов необходимо для того, чтобы мож-
но было синтезировать специфические олигопук-
514 Часть IV. Генетика бактерий и бактериофагов
лсотидпые затравки, которые должны гибридизо-
ваться с концами нуклеотидных последовательно-
стей, изученных в предыдущем цикле секвениро-
вания.
Новые специфические затравки можно ис-
пользовать в следующем цикле секвенирования
в качестве исходных точек для установления но-
вых последовательностей включенной в плазмиду
ДНК. Для определения всей последовательности
фрагмента ДНК этапы повторяют столько раз,
сколько необходимо без получения новых субкло-
нов. Этот метод называют стратегией блужда-
ющей затравки (primer walking).
Большинство исследовательских групп, осу-
ществляющих секвенирование ДНК, либо про-
водят его с помощью автоматизированных си-
стем, либо получают результаты секвенирования
от коммерческих фирм. Даже при использовании
автоматизированного оборудования с получени-
ем компьютерных данных о последовательности
нуклеотидов в двухцепочечной ДНК вряд ли воз-
можно определять более 1000 п.п. в день с учетом
этапа клонирования. Полную последовательность
прокариотического генома (от 700 до 7000 т.п.н.)
теперь реально установить в течение месяцев или
года, и такая процедура стала обычным методом
в современной биологии.
Дополнение 17.2. Бактериофаг М13 и его
производные (например, фаги fd и fl)—это
нитевидные фаги Е. coli (см. рис. 26.4).
ДНК внутри их капсидов имеет одпоцепочеч-
ную форму |(—)-цепь] и содержит пример-
но 6400 нуклеотидов. В клетке-хозяине она
превращается в двухцепочечную, или репли-
кативную, форму (RF-ДНК). Геном это-
го фага состоит из 10 генов, ответственных
за репликацию ДНК, синтез белков оболочки
и сборку (морфопоэз) фаговых частиц (см.
гл. 26). Внутригепный участок длиной при-
мерно 500 нуклеотидов между генами 2 и 4
может быть значительно расширен без влия-
ния на размножение фага. Одноцепочечная
ДНК покрывается белками капсида, и но-
вые фаговые частицы непрерывно высвобож-
даются из инфицированной клетки-хозяина
без ос лизиса. Частицы фага могут удли-
няться путем простого добавления молекул
gp8 к белковой трубке, покрывающей более
длинную цепь ДНК. Эго свойство, а также
способность фага М13 синтезировать одноце-
почечную ДНК делают его одним из полез-
нейших инструментов молекулярной биоло-
гии (например, для секвенирования ДНК).
17.4. Локализованный мутагенез помогает идентифицировать
специфические функции
Важным начальным этапом изучения структуры
и функции генов служит анализ мутантов, т. е.
влияния спонтанных и индуцированных мутаций
па фенотип. На следующем этапе обычно выделя-
ют ген и определяют его структуру путем секве-
нирования ДНК. Однако генная технология поз-
воляет осуществлять и обратный процесс (подход
«обратная генетика»): получение биохимически-
ми методами in vitro определенной мутации изо-
лированного гена, который затем возвращают в
организм для изучения его влияния па фенотип.
Здесь, как и в других разделах этой главы, бу-
дут описаны только основные принципы данного
подхода. Методы переноса ДНК в организмы пу-
тем трансформации рассмотрены в других разде-
лах (см. гл. 16 и дополнительную литературу).
17.4.1. Возможно осуществление замен
отдельных нуклеотидов
Для замены определенного нуклеотида необхо-
дим фрагмент ДНК с известным нуклеотидным
составом, клонированный в составе вектора М13
(рис. 17.15; см. цв. вклейку). Этот встроенный
фрагмент ДНК гибридизуют с комплементарным,
обычно синтетическим олигонуклеотидом, несу-
щим одну или несколько нуклеотидных замен. Та-
Глава 17 Технология рекомбинантной ДНК 515
кой олигонуклеотид достраивают с З-ОН'-конца
с помощью ДНК-полимеразы, в результате чего
образуется полная комплементарная цепь ДНК,
и полученную RF-ДНК вводят в клетки бак-
терий. Инфекционный процесс приводит к об-
разованию потомства фагов, содержащих либо
неизмененную исходную цепь ДНК, либо компле-
ментарную ей цепь с нуклеотидными заменами.
Мутантную ДНК выделяют с помощью селекции
или идентифицирую!’ известными способами.
Для выявления мутантов используют раз-
личные варианты этого подхода. Представлен-
ная на рис. 17.15 исходная цепь М13 получена
в результате инфицирования клеток мутанта
Dut~Ung“ Е. coli (см. разд. 15.6). У бактерий
с измененным геном did отсутствует фермент
сЮТРаза. 13 норме dUTP, обычный побочный про-
дукт синтеза дезоксипуклсотидов, превращает-
ся под действием сПЗТРазы в dUMP. Однако у
dwt-кутаитов молекулы dUTP сохраняются и мо-
гут включаться в ДНК вместо dTTP. Если в
результате ип(/-мутации отсутствует и фермент
ДНК-гликозилаза, остатки урацила сохраняются
в ДНК, как в ДНК фага М13 из инфицированных
^и£-Ш1</-мутантов. Такую ДНК можно использо-
вать в качестве матрицы для синтеза in vitro
комплементарной цепи ДНК, поскольку урацил
спаривается с аденином. Полученную двухцспо-
чечпую ДНК вводят в Ung+ -бактерии. Под дей-
ствием урацил-ДНК-гликозилазы, присутствую-
щей в этих клетках, в ДНК-матрице возникают
сайты, лишенные пуринов, что приводит к обрыву
цепи. Эта ДНК-матрица с высокой вероятностью
будет утрачиваться, тогда как мутантная компле-
ментарная цепь, в которой отсутствуют остатки
урацила, сохранится.
17.4.2. Делеции и инсерции помогают
идентифицировать функциональные
домены белков
Индуцированные мутации в клонированных
фрагментах ДНК могут представлять собой де-
леции или инсерции. Технически проще вызвать
короткие делеции в сайтах разрезания рестри-
цирующими эндонуклеазами. Выступающие кон-
цы удаляют с помощью нуклеаз, специфичных
для одноцепочечпых ДНК (например, нуклеаз
S1 из Aspergillus oryzae\ см. гл. 15). Затем ДНК
восстанавливают с помощью ДНК-лигазы. Эта
процедура приводит к делеции нескольких пар
оснований, природа которых зависит от специфи-
ки использованного фермента рестрикции.
Сайт-специфичный, или локализованный,
мутагенез служит важным методом исследо-
ваний в современной биологии. Он позволяет
получать определенные мутации в любой ДНК
с известной нуклеотидной последовательностью,
заменяя отдельные нуклеотиды, вводя делеции
определенных размеров или вставки с использо-
ванием специально предназначенных для этого
векторов. Для инактивации путем инсерции опре-
деленного гена в хромосоме любого организ-
ма часто используют кассеты ДНК. содержащие
маркеры устойчивости к антибиотикам. Это поз-
воляет проводить селекцию гомогенот, у кото-
рых мутантный аллель путем гомогенотизации
включился в хромосому.
Сложнее ввести делеции различной дли-
ны, т. е. произвести ряд гнездовых деле-
ций. Широко применяемым инструментом для
этого служит фермент ЕжоШ из Е. coli —
3'—>5/-экзокуклеаза, которая удаляет 5'-нук-
леотиды с З'-ОН-конца двухцепочечпой ДНК.
Поскольку З'-выступающие концы не являются
субстратом фермента, можно производить од-
нонаправленные делеции в молекуле ДНК, на-
пример в чужеродной ДНК в составе плазми-
ды. ДНК разрезают двумя различными рестрик-
тазами, одна из которых образует защищенный
З'-выступающий конец, а другая — б^выступаю-
щий конец либо тупой конец, который служит
субстратом для EroIII. Воздействие ЕхоШ на
ДНК в течение разных промежутков времени
приводит к образованию набора молекул ДНК с
различной длиной одноцепочечного выступающе-
го 5'-конца. На следующем этапе эти выступаю-
щие б'-копцы, а также защищенные З'-выступы
удаляются нуклеазой, специфичной к одноцепо-
чечной ДНК (нуклеаза S1, или нуклеаза гниющих
бобов). Затем молекулы с тупыми концами вновь
сшивают с помощью ДНК-лигазы, получая коль-
цевые плазмиды, которые могут быть перенесены
в клетки бактерий путем трансформации. Влия-
ние делеций на функции клонированной чужерод-
ной ДНК выявляют либо путем фенотипического
анализа, либо после амплификации плазмид и ис-
пользования их в качестве матриц для секвени-
516 Часть IV. Генетика бактерий и бактериофагов
Разрезание рестриктазами А и В
5'-выступающий | З'-выступающий
конец конец (защищенный)
tp " I ~т~
Расщепление с помощью Exo III
(интервалы времени 1, 2, 3, ... п)
I
Ч-----................................. г~~т~
t2------ивам .... । г
t3 I I ~
» I I
Обработка нуклеазой S1
(образование тупых концов)
I
Ч т~~1
t„ ВЯ I I
Полимераза Кленова и ДНК-лигаза Т4
I
Рис. 17.16. Образование «гнездовых» однонаправлен-
ных делеций при обработке ЕхоШ. Вектор с клониро-
ванной ДНК (to) разрезают ферментами рестрикции
А и В, образующими З'-выступ вблизи сайта связы-
вания затравки, а также б'-выступ вблизи включенной
ДНК. Обработка экзонуклеазой III в течение различ-
ных периодов времени позволяет получать однонаправ-
ленные делеции от б'-выступающего конца (ti—tn), то-
гда как З'-конец оказывается защищенным (например,
a-thio-dNTP). Обработка нуклеазой S1 и полимеразой
Кленова обеспечивает образование двух тупых концов
в молекуле ДНК. После лигирования и переноса путем
трансформации в клетку-хозяин можно выделять кло-
ны, соответствующие каждому периоду обработки экзо-
нуклеазой; делеции идентифицируют с помощью гель-
электрофореза и секвенирования ДНК.
рования ДНК (рис. 17.16). Для этой цели скон-
струированы специальные векторы, содержащие
в области MCS сайты узнавания для ферментов,
производящих защищенные З'-выступы на внеш-
них концах, и расположенные в центре сайты
узнавания ферментами, образующими тупые кон-
цы, или б'-выступы (см. рис. 17.10). Завершают
эту конструкцию сайты связывания затравки по
обоим фланкирующим участкам, что позволяет
вводить гнездовые делеции на любом конце кло-
нируемой ДНК.
Удобный метод введения инсерций состоит
в обработке препарата ДНК муравьиной кисло-
той в такой концентрации, при которой в среднем
образуется один апуриновый сайт на молекулу.
Для разрезания полученных молекул применяют
EroIII — нуклеазу, специфичную к подобным сай-
там. Она производит один разрез па молекулу с
образованием набора линейных молекул ДНК, в
которых эти разрезы расположены в различных
сайтах. К концам таких ДНК до их обратного за^
мыкания присоединяют с помощью ДНК-лигазы
олигонуклеотиды и в результате получают кол-
лекцию молекул ДНК с инсерциями в различных
сайтах. Другие методы для введения инсерций ос-
нованы на использовании ДНК, несущей мутации,
либо кассету ДНК с маркером, необходимым для
селекции, (они включаются в хромосому путем го-
могспотизации) (рис. 17.17).
17.4.3. Универсальным методом служит
полимеразная цепная реакция
Сама по себе полимеразная цепная реакция
(ПЦР) не относится к технологии рекомбинант-
ных ДНК, но ее используют как вспомога-
тельную процедуру в различных методах ана^
лиза ДНК и генной инженерии. Метод ПЦР
позволяет амплифицировать in vitro небольшие
количества ДНК (теоретически и одну моле-
кулу) до количества, достаточного, например,
для секвенирования, клонирования или гель-
хроматографического анализа и получения «фин-
герпринта» некультивируемых бактерий.
Основный принцип ПЦР — ферментативная
амплификация/репликация фрагмента ДНК.
фланкированного двумя олигонуклеотидными за-
травками, которые гибридизуются с противопо-
ложной цепью ДНК (рис. 17.18; см. цв. вклейку).
Для проведения анализа с применением ПЦР
необходимо знать нуклеотидные последователь-
ности, фланкирующие амплифицируемую ДНК,
и располагать соответствующими затравками.
Олигопуклеотидные затравки добавляют в из-
бытке относительно ДНК-матрицы в условиях
Глава 17. Технология рекомбинантной ДНК 517
Кассета, содержащая
гены cat (устойчивость
к хлорамфениколу. Ст)
HZndlll
Ц cat
EcoRI
ori (Ts)
Htndlll
Олигонуклеотиды
(= мутантная ДНК)
EcoRI
днк-лигаза
ori
(Ts)
xyzA-ДНК
дикого
типа
EcoRI
HZndlll
EcoRI
ori (Ts)
ДНК
штамма
дикого
типа
Hmdlll
Мутантная ДНК
Трансформация при ЗО'С
xyzA-ДНК
xyzA-ДНК
Трансформация при 42‘С
HZndlll EcoRI
cat-Кассета инактивирует
ген xyzA
Рис. 17.17. Мутагенез посредством инсерции ДНК
(«кассетный мутагенез»). Из клонированной ДНК
(в данном случае гипотетического гена xyzA) с помощью
двух рестрицирующих эндонуклеаз (например, Hind\\\
и EcoRI) вырезают фрагмент, который замещается ли-
бо мутантной формой той же самой ДНК (слева), ли-
бо сегментом чужеродной ДНК (справа). Для получе-
ния мутаций в гене xyzA (который может также со-
держать инсерции или делеции) используют мутантную
двухцепочечную ДНК или набор мутантных олигонук-
леотидов. В качестве альтернативы в клонированный
ген xyzA может быть включена кассета ДНК с маркером,
облегчающим селекцию (в данном случае ген cat, при-
дающий устойчивость к хлорамфениколу, Cmr). Далее
может произойти гомологичная рекомбинация (гомоге-
нотизация) между хромосомным аллелем и xyzA-ДНК,
фланкирующей кассету с генами cat. Если вектор неспо-
собен реплицироваться в клетке-хозяине [в данном слу-
чае при 42° из-за температурочувствительной мутации
точки начала репликации, ori (Ts)], селекция по призна-
ку Cmr при 42° приведет к образованию хромосомных
копий с инсерцией кассеты ДНК и, как следствие, му-
тантов XyzA-.
Плазмиды реплицируют
мутантный ген xyzA
Гомогенотизация в хромосоме
приводит к возникновению
мутантов Cm XyzA
гибридизации (при температуре от 40 до 60 °C в
зависимости от природы затравки). После повы-
шения температуры (до 72 °C) термостабильная
ДНК-полимераза удлиняет затравки путем присо-
единения нуклеотидов к их З'-ОН-копцам, синте-
зируя таки и образом комплементарные последо-
вательности ДНК. Полученные двухцепочечные
ДНК денатурируют при 94 °C; при последующем
снижении температуры до уровня, допускающего
гибридизацию, олигопуклеотидпые затравки ас-
социируют как с цепями исходных матриц, так и с
вновь синтезированными цепями ДНК, после чего
при повышении температуры начинается новый
цикл удлинения матрицы и репликации in vitro.
Эти циклы повторяют много раз (обычно 20-50).
и амплификация ДНК протекает экспоненциаль-
но. Увеличение количества исходной ДНК может
достигать 106 и больше в зависимости от количе-
ства циклов.
Когда в 1986 г. Маллис (Mullis) предложил ме-
тод ПЦР, в качестве ДНК-полимеразы исполь-
зовали фрагмент Клепова из ДНК-полимеразы
Е. coli. Поскольку этот фермент денатурирует при
высокой температуре, необходимой для плавле-
ния двухцепочечной ДНК, после каждого цикла
денатурации и гибридизации затравок для осу-
ществления синтеза ДНК добавляли его новые
порции. В настоящее время используют термо-
стабильные ДНК-полимеразы из термофильных
бактерий или архей. Это позволило автоматизи-
ровать метод и способствовало его широкому рас-
пространению; теперь аппараты для ПЦР рас-
сматривают как основное оборудование в любой
лаборатории молекулярной биологии. Этот ме-
тод регулярно используют при выделении генов
из кДНК и геномных библиотек (см. разд. 17.2),
выделении РНК из клеток (РНК-ПЦР) и лока-
лизованном мутагенезе (см. разд. 17.4), а также
в систематике бактерий (см. гл. 29) и в при-
кладной микробиологии (например, для быст-
рой клинической диагностики; см. гл. 33). Раз-
витие методов, связанных с применением ПЦР,
происходит очень быстро, и описано много их
новых приложений. Один из интересных подхо-
дов, например, объединяет технику надстраива-
ния затравки с термической циклизацией. Выде-
518 Часть V. Генетика бактерий и бактериофагов
ление из организма и очистка РНК-матрицы, ис-
пользуемой в соответствующих экспериментах по
надстраиванию затравки, являются весьма тру-
доемким процессом, тогда как сама надстрой-
ка затравки осуществляется в одной реакции.
Новый прием надстройки затравки «in situ»
основан на использовании активности обрат-
ной транскриптазы, присущей термостабильной
ДНК-полимсразе из Thermus thermophilus в при-
сутствии МпС12. Исследуемую РНК выделяют из
бактерий путем инкубации их в течение 30 с при
94°С, одновременно приводящей к денатурации
всех нуклеиновых кислот. При повторении цик-
лов тепловой обработки и использовании затрав-
ки, комплементарной З'-концу этой РНК, можно
получить множество кДНК-копий. Как и в лю-
бом другом варианте метода ПЦР. процесс состо-
ит в циклическом повторении денатурации, ассо-
циации с затравкой и ее надстраивания. Однако
амплификация продукта реакции протекает ли-
нейно, а не экспоненциально, так как затравка
присоединяется к одпоцепочечной РНК, которая
не амплифицируется в этом процессе, и поэто-
му необходимо большее количество циклов (от 70
до 100). В то же время пет необходимости вы-
делять РНК. которая может быть использована
in «statu nasccndi», так как клеточные экстрак-
ты используют сразу после центрифугирования.
При этом исключаются как деградация мРНК,
так и артефакты, вызываемые обычной проце-
дурой выделения РНК, и, кроме того, требуется
лишь небольшое количество клеточного материа-
ла.
Дополнительная литература
AusubelF. М., Brent R., Kingston R. Е., Moore D.D.,
Scidman J.G., Smith Л. A., Struhl К. (1989). Current
protocols in molecular cloning. New York: Wiley.
Brown T. A. (1995). Gene cloning, 3rd edn. London:
Chapman & Hall.
Gassen IL. Minol K., eds. (1997). Gentechnik. Ein-
fiihrung in Prinzipien und Methoden, 4th edn.
Stuttgart: Fischer.
Glick B.R., Pasternak J. Л. (1994). Molecular biotech-
nology. Principles and applications of recombinant
DNA. Washington, DC: ASM Press.
Glover D.M. (1985). Gene cloning: the mechanics of
DNA manipulation. London: Chapman & Hall.
Henikofl’S. (1987). Unidirectional digestion with exonuc-
leases III in DNA sequence analysis. Meth. Enzymol.
155: 156-165.
Kaspar P., Zadrazil S., Fabry M. (1989). An improved
double-stranded DNA sequencing method using gene
32-protein. Nucleic. Acid. Res. 17: 3316.
Martinez E., Bartholome B., de la Cruz F. (1988).
pACYC184-derivcd cloning vectors containing the
multiple cloning site and lacZ, a reporter gene of
pUC8/9 and pUC18/19 plasmids. Gene 68: 159-162.
MaxamA.M., Gilbert W. (1977). A new method for
sequencing DNA. Proc. Natl. Acad. Sci. USA 74:
560-564.
Old R. WT., Primrose S. B. (1994). Principles of gene ma-
nipulation. An introduction to genetic engineering.
London: Blackwell Scientific.
Prcntki P., Krisch II. M. (1984). In vitro insertional
mutagenesis with a selectable DNA fragment. Gene
29: 303-313.
Sambrook .1., Fritsch E. F., Maniatis T. (1989). Mole-
cular cloning. A Laboratory manual. Cold Spring
Harbor: Cold Spring Harbor Laboratory Press.
Sanger F., Nicklen S., Coulson A. R. (1977). DNA se-
quencing and chain terminating inhibitors. Proc.
Natl. Acad. Sci. USA 74: 5463-5467.
TaborS., Richardson С. C. (1985) A bacteriophage T7
RNA polynierasc/promoter system for controlled
exclusive expression of specific genes. Proc. Natl.
Acad. Sci. USA 82: 1074-1078.
Watson J. D., Gilman M., Witkowski J., Zoller M.
(1992). Recombinant DNA, 2nd edn. New York:
Freeman.
Winnacker E. L. (1987). brom genes to clones. Intro-
duction to gene technology. Weinheim: VCII.
Yanisch-Perron C., Vieira.)., Messing.]. (1985). Impro-
ved M13 phage cloning vectors and host strains:
nucleotide sequences of the M13mpl8 and pUC19
vectors. Gene 33: 103-119.
Часть V
ЭКСПРЕССИЯ ГЕНОВ И
МЕХАНИЗМЫ РЕГУЛЯЦИИ
Прокариотическую клетку, как и любой живой
организм, можно рассматривать как продукт ее
генов, предыстории родительских клеток и усло-
вий среды. С этой точки зрения клеточный по-
тенциал определяется совокупностью генов ин-
дивидуальной микробной клетки и тех генов,
которые дополнительно присутствуют в «коллек-
тивном» видовом геноме. Этот потенциал спо-
собен реализоваться в виде тех или иных кле-
точных структур и разнообразных путей метабо-
лизма при участии механизмов обмена генами,
описанию чего посвящены предыдущие части
книги (I-V). Какая именно из потенциальных
программ генома будет реализована, зависит от
предыстории организма и реальных условий сре-
ды.
В этой части книги мы рассматриваем моле-
кулярные механизмы, которые позволяют прока-
риотам воспринимать изменения внешних усло-
вий и адаптироваться к ним путем регуляции
экспрессии генов. В случае одноклеточных орга-
низмов внешней средой обычно служит внекле-
точное (физическое) окружение. В отличие от это-
го в многоклеточных эукариотических организ-
мах каждая клетка окружена другими клетками
того же клопа и восприятие внешних изменений
входит в функции особых, высокоспсциализиро-
ванпых клеток. Однако это несомненное различие
можно считать скорее кажущимся, а не действи-
тельным. если рассматривать сенсорные механиз-
мы на клеточном и молекулярном уровнях. Неза-
висимо от того, происходит ли изменение экспрес-
сии генов в данной клетке вследствие связывания
с ее поверхностью гормонов, выделяемых соседни-
ми клетками (в случае многоклеточного организ-
ма) или является результатом появления сахаров
среде (в случае микроба), оно обусловлено одним
и тем же сенсорным механизмом, включающим
передачу сигнала и регуляцию активности генов.
Это пс так удивительно, как может показаться,
поскольку прокариоты обладают сложными меж-
клеточными связями па популяционном уровне.
Таким образом, клон бактерий можно рассматри-
вать как функциональный аналог многоклеточно-
го организма или клеточной популяции в составе
такого организма. Лежащую в основе этого общ-
ность биохимических процессов можно, следова-
тельно, считать результатом общей и частной эво-
люции.1
По современным представлениям, хромосомы,
плазмиды и вирусы (бактериофаги) у прокариот
равнозначны как носители генетической инфор-
мации в том отношении, что экспрессируются под
контролем одних и тех же регуляторных меха-
низмов. Таким образом, пути регуляции, выявлен-
ные для одного типа этих генетических структур,
1 См. прим, в гл. 29 (вед. ред.).
520 Часть V. Экспрессия генов и механизмы регуляции
должны относиться и к двум другим. В частно-
сти, фаги на уровне ДНК (вегетативные формы и
профаги) точно соответствуют другим автономно
реплицирующимся генетическим элементам, на-
пример плазмидам. Как и плазмиды, это не жи-
вые организмы, которыми по определению счита-
ются только клеточные формы жизни, но части
живых организмов. В соответствии с этим кон-
кретные примеры, выбранные для иллюстрации
важнейших механизмов регуляции активности ге-
нов и передачи сигналов, относятся ко всем этим
трем типам генетических элементов.
Начальным и важнейшим шагом к понима-
нию молекулярной регуляции экспрессии генов
стала модель оперона, сформулированная Фран-
суа Жакобом и Жаком Моно в конце 1950 гг.
В основе она не утратила значения до сих пор
(хотя обнаружен ряд отклонений), и нельзя не
поражаться, что введенные авторами модели по-
нятия об индукции, репрессии, аттенуации и
антитерминации, а также о положительном и от-
рицательном контроле оказались совершенно вер-
ными. В соответствии с этой моделью первая гла-
ва этой части книги (гл. 18) посвящена механиз-
мам регуляции оперонов, т. е. контроля синтеза
ферментов на уровне транскрипции и трансля-
ции. Сюда относится понятие о регулоне — группе
оперев ов, регулируемых общим регулятором. По-
добно тому как активность оперонов зависит от
влияния репрессоров, индукторов, аттенуаторов,
факторов антитерминации и других эффекторов,
действие этого регулятора обычно определяется
связыванием с ним специфических молекул, боль-
шей частью субстратов данного катаболическо-
го пути или конечных продуктов анаболического
пути. Помимо контроля синтеза, регуляция осу-
ществляется на уровне активности ферментов, и
вторая глава данной части книги (гл. 19) посвя-
щена описанию посттрансляциоппых регулятор-
ных процессов и модификации белков, включая
компартментацию. Этот тип регуляции характе-
рен для самих регуляторных белков, которые в
результате регуляции часто обратимо переходят
из активной формы в неактивную.
Согласно полученным в последние годы дан-
ным, регуляция клеточных процессов в целом по-
строена по иерархическому принципу, в соответ-
ствии с которым над уровнем упомянутых выше
специфических систем контроля имеется система
общей, единой регуляции. Как правило, система
общей регуляции включает сложные пути пере-
дачи сигнала, например через двухкомпонентные
системы и зависимые от фосфо енол пиру вата фос-
фотрап сферазпые системы транспорта углеводов
(ФТС). Эти системы отвечают па резкие измене-
ния физиологического состояния клеток или усло-
вий среды, такие как голодание пли смена аэроби-
оз/анаэробиоз, а также па стрессовые ситуации,
требующие более сложной адаптации, чем про-
сто активация или подавление активности одного
оперона либо небольшого числа оперонов. Груп-
пы оперонов (до 50 и больше), контролируемые
совместно высшим (общим) регулятором, называ-
ют модулоном. Для совокупности всех генов, от-
вечающих па один и тот же стимул, предложен
термин стимулон. Общие регуляторные системы
и пути передачи сигналов рассмотрены в третьей
главе этой части книги (гл. 20). Типичным при-
мером системы общей регуляции может служить
модулой сгр, активность которого связана с поис-
ком питательных веществ (при участии алармона
с АМР) и такими эффектами, как диауксия, уг-
леродный катаболитный контроль и исключение
индуктора. Этот модулон функционирует сопря-
женно с сенсорной системой (ФТС), механизмом
строгого контроля с участием алармона (индика-
торной молекулы) ppGpp, несколькими двухком-
попептными системами и хорошо известным ме-
ханизмом хемотаксиса.
Многие физиологические феномены в мире
прокариот следует рассматривать как адаптив-
ные механизмы, контролируемые общими регу-
ляторными системами. В число этих феноменов
входит переход факультативных анаэробов на
другой тип метаболизма при смене аэробных усло-
вий па анаэробные и наоборот. Соответствующие
биохимические пути и участвующие в них мем-
брапосвязаппыс белковые комплексы (например,
дыхательные цепи и ATP-синтетазы) описаны в
предыдущих главах (см. гл. 4, 5 и 9-12), однако
подробно их регуляция рассмотрена в четвертой,
и последней, главе этой части (гл. 21).
Помимо тех примеров специфических и об-
щих механизмов регуляции генов, которые рас-
смотрены в этой части книги, известны и мно-
гие другие подобные системы; некоторые из них,
приведенные в табл. 20.1, относятся к процессам,
рассматриваемым в ч. VI и XI, в том числе к кле-
точному делению, клеточной дифференцировке,
например спорообразованию или вторичному ме-
таболизму у стрептомицетов, морфогенезу фагов,
стрессовой реакции, симбиозу, клеточному пара-
Часть V. Экспрессия генов и механизмы регуляции 521
зитизму и молекулярной патологии. Все более
очевидным становится значение этой повой тео-
рии регуляции и для таких традиционных обла-
стей микробиологии, как систематика и микроб-
ная экология, а также для биотехнологии. От-
крытие лежащего в основе клеточной регуляции
модульного принципа с участием на разных
иерархических уровнях сходных биохимических и
генетических модулей, таких как промоторы, опе-
раторы, репрессоры и активаторы, в общей си-
стеме регуляции и даже на уровне межклеточ-
ных контактов и коммуникации у прокариот (и у
многоклеточных эукариот), заставляет по-новому
анализировать функционирование прокариотиче-
ских экосистем и указывает на необходимость пе-
ресмотра понятия прокариотический вид на ос-
нове представлений о коллективном генофонде.
Разумное применение этих природных модулей
могло бы стать направлением развития новой «по-
лусиптстичсской» биотехнологии.
Дополнительная литература
Lengeler .1. (1993) Carbohydrate transport in bacteria
under environmental conditions, a black box? Antonie
van Leeuwenhoek 63: 275-288.
Neidhardt F. C.. Ingraham .I. L., Schaechter M. (1990)
Physiology of the bacterial cell. A molecular
approach. Sunderland. Mass.: Sinauer.
Neidhardt F. C., Savageau M. A. (1996) Regulation
beyond the operon. In.: Neidhardt F. C., Curtiss R.,
Ingraham J. L., Lin E. С. C., LowK.B., Magasa-
nik B., Reznikofi’W., Riley M., Schaechter M., Um-
bargcr IL E., (eds.) Escherichia coli and Salmonella,
2nd edn. Washington, DC; ASM Press: 1310-1324.
Magasanik B. (1988) Research on bacteria in the
mainstream of biology. Science 240: 1435-1439.
Shapiro L., Kaiser D., Losick R. (1993) Development and
behavior in bacteria. Cell 73: 835-836 (A summary
of the following six reviews in the issue).
SoneaS. (1989) A new look at bacteria. ASM News 55:
584-585.
Глава 18
Регуляция экспрессии генов: опероны и регулоны
Тысячи организмов, составляющие царство про-
кариот, занимают те или иные экологические ни-
ши, обеспечивающие оптимальные возможности
для их роста. Клетки прокариот находятся в пря-
мом контакте с окружающей средой, параметры
которой могут изменяться от идеальных для ро-
ста до угрожающих выживанию, однако в боль-
шинстве случаев (если не всегда) микробы мо-
гут к ним приспособиться. Быстрая и эффектив-
ная адаптация к резким изменениям окружающей
среды достигается двумя путями: мгновенным из-
менением активности важных в данной ситуации
метаболических ферментов и более медленной, по
действующей длительное время положительной
или отрицательной согласованной регуляцией ак-
тивности генов. Кроме того, поскольку клеткам
могут быть необходимы лишь несколько молекул
белка одного типа, но тысячи молекул белка дру-
гого типа, некоторые гены должны транскрибиро-
ваться каждую секунду, тогда как другие — лишь
один раз за генерацию. Для эффективной адап-
тации и экономного использования клеточных ре-
сурсов экспрессия генов должна регулироваться
так, чтобы продукт каждого гена синтезировал-
ся в нужном количестве и в нужное время. Бла-
годаря применению методов микробной генетики
и глубокому логическому анализу, к настоящему
времени удалось существенно продвинуться в по-
нимании регуляции генов у бактерий и создать
оперонную модель экспрессии гопов. Использо-
вание современной генной технологии и чувстви-
тельных биохимических методов позволило рас-
крыть поразительно топкие механизмы регуляции
активности генов, существование которых до это-
го невозможно было представить.
Концепция оперона первоначально описывала
регуляцию процесса инициации транскрипции, в
основном сходного у всех прокариот. Однако регу-
ляция синтеза белка осуществляется, кроме того,
на уровне элонгации и терминации транскрипции,
метаболизма мРНК, трансляции и стабильности
белков. Посттранскрппциоппая регуляция может
каза гься энергетически невыгодной, по она обес-
печивает тонкую настройку и встречается чаще,
чем можно было бы предполагать, особенно у бак-
териофагов. Гены могут также целенаправленно
активироваться и инактивироваться посредством
рекомбинации ДНК. В этой главе описываются
структура оперопов, па которой основана регуля-
ция их активности у бактерий и бактериофагов,
участвующие в регуляции молекулы и их функ-
ции, а также молекулярные механизмы экспрес-
сии генов, насколько они известны к настоящему
времени. Для иллюстрации общих принципов и
характерных путей регуляции приводятся приме-
ры, поясняющие основную теорию и более слож-
ные понятия, например понятие о регулопах. Фи-
зиологические аспекты регуляции по оперенному
и регулонному типу в общем рассмотрены в гл. 20.
Модели регуляции активности прокариотических
гопов приложимы также к генам эукариот и по-
лезны для изучения процессов развития, природы
наследственных и инфекционных болезней, а так-
же жизненного цикла и изменчивости вирусов.
18.1. Опероны и регулоны как транскрипционные единицы
В простейшей форме оперон представляет собой
транскрипционную единицу в составе хромосо-
мы, содержащую один (моноцистронная единица)
или несколько (полицистронпая единица) генов,
старт-сигнал и стоп-сигнал для РНК-полимеразы.
В полицистронном опероне гены подвергаются
сопряженной регуляции. Физическое сцепление
этих генов обеспечивает транскрипцию их в вице
Глава 18. Регуляция экспрессии генов: опероны и регулоны 523
Рис. 18.1. Элементы оперона. а (сайт активации) — сайт связывания белка, активирующего транскрипцию; о
(оператор) — сайт связывания белка-репрессора, подавляющего транскрипцию; р (промотор) — сайт связывания
РНК-полимеразы, определяющий скорость инициации транскрипции; tsp (стрелка) — сайт начала транскрипции,
соответствующий основанию в позиции +1 в молекуле РНК; / (соответствует лидерной РНК) — участок, кодиру-
ющий сегмент мРНК между tsp и сайтом аттенуации транскрипции; t — сайт терминации транскрипции в конце
оперона.
одной молекулы РНК, количество копий которой
изменяется под действием вис- или впутриопсроп-
ных регуляторных элементов.
Оптроны, находящиеся в разных участках хро-
мосомы, но регулируемые общим регулятором, со-
ставляют регулои (см. рис. 20.1). При регуляции
по регулониому типу осуществляется координиро-
ванный контроль нескольких оперонов, кодиру-
ющих сходные функции. В отличие от этого па
уровне модулопа один и тот же белок системы
общей регуляции изменяет экспрессию оперонов,
не сходных по функциям, по связанных участием
в общей сверхзадаче (см. рис. 20.2). Входящие в
модулой опероны регулируются своими индивиду-
альными, специфическими регуляторами и сверх
этого общим регулятором (см. разд. 20.1).
Опероны кодируют ферменты, структурные
компоненты клетки, системы поддержания и бел-
ки, необходимые для дифференцировки и деления
клеток. Структура и регуляция оперонов и регу-
лонов обеспечивает логичное, т. е. целесообразное
и экономичное использование метаболических пу-
тей и других клеточных процессов.
Структура оперонов и регулонов лежит в
основе различных механизмов регуляции генной
активности и обеспечивает осуществление таких
функций, как координированная экспрессия и од-
нотипный контроль функционально родственных
генов, интеграция генов, участвующих в тран-
скрипции и трансляции, синтез отдельных ком-
понентов генного продукта в правильной пропор-
ции, а также поддержание механизмов транскрип-
ции и трансляции.
18.1.1. Оперон состоит из нескольких
компонентов
Структура оперона может изменяться, однако
обычно он включает следующие основные компо-
ненты (рис. 18.1): промотор, точку начала тран-
скрипции, область, кодирующую лидерную РНК,
цистрон(-ы), участок, кодирующий сайт связыва-
ния рибосомы, регуляторный (на уровне ДНК)
элемент и сигнал терминации транскрипции.
Промотор (р)—это нуклеотидная после-
довательность ДНК, определяющая связывание
РНК-полимеразы и контролирующая скорость
инициации транскрипции с определенной точ-
ки. Обычно, однако, понятие промотор расши-
ряют, включая в него регуляторный элемент,
примыкающий к промотору. Мутации промо-
тора цпе-доминаитны. Точка начала тран-
скрипции (tsp)—это сайт инициации данного
процесса. Область лидерной РНК (Z), варьиру-
ющая по размерам, находится между tsp и пер-
вым [Шетроном. Этот участок может содержать
цис-активные структурные регуляторные элемен-
ты и открытую рамку считывания (orf), ко-
дирующую небольшой полипептид, называемый
лидерным пептидом (L). Цистроном назы-
вают структурный ген, кодирующий белок. Каж-
дый цистрон начинается со стартового кодона,
кодирующего метионин, (обычно ATG), и закан-
чивается «бессмысленным» кодоном, называемым
также стоп-кодоном: TAA (ochre), TAG (amber)
или TGA (opal). В полицистронном оперопс от-
крытые рамки считывания (orf) двух последо-
вательных цистропов могут перекрываться, хо-
524 Часть V. Экспрессия генов и механизмы регуляции
тя такое перекрывание может быть очень неболь-
шим (например, ... ATGA...). Значительное
перекрывание наблюдается в компактных хромо-
сомах бактериофагов (см. гл. 26). Участок, ко-
дирующий сайт связывания рибосомы (rbs),
представляет собой богатый пуринами участок
ДНК, состоящий из пяти нуклеотидов и предше-
ствующий каждому стартовому кодону. Регуля-
торный элемент, примыкающий к промотору, —
это цис-активная нуклеотидная последователь-
ность ДНК, которая связывает транс-активмый
белок-регулятор. В результате связывания проис-
ходит либо активация промотора, либо подавле-
ние его активности. Белок-регулятор может быть
активатором, осуществляющим положительную
регуляцию (активацию) путем связывания с
активаторным сайтом(-ами) (а; иногда обо-
значается как г), или репрессором, осуществ-
ляющим отрицательную регуляцию (инактива-
цию) путем связывания с сайтом ДНК, назы-
ваемым оператором (о). Па активность таких
регуляторных белков могут влиять небольшие
молекулы-эффекторы (индукторы или коре-
прессоры). Локализация сайтов а или о может
существенно различаться; они либо перекрывают-
ся с промотором, либо находятся на значительном
расстоянии от пего. Сайт о может даже находить-
ся внутри структурных генов. Во многих случа-
ях регуляторные элементы состоят из несколь-
ких частей; происходящие в них мутации являют-
ся цис-доминантными, тогда как мутации в генах
транс-активных регуляторных белков обычно от-
носятся к рецессивным и лишь иногда к транс-до-
минантным (отрицательная комплементация).
Сигнал терминации транскрипции (t)
обозначает конец транскрипционной единицы в
опероне. Терминация транскрипции РНК-полимс-
разой в этом сайте может зависеть от белкового
фактора. В оперопах, экспрессируемых в особых
ситуациях, обнаружены латентные сигналы тер-
минации (см. разд. 18.10.1). Внутри оперопа могут
также присутствовать сайты, которые с участи-
ем особых белков, называемых факторами анти-
терминации, предотвращают терминацию тран-
скрипции па нижележащих участках.
Некоторые опероны пс кодируют каких-либо
белков (например, это опероны синтеза рРНК,
тРНК и небольших регуляторных молекул РНК).
Их РНК-продукты отличаются от большинства
других мРНК в двух отношениях: они метаболи-
чески устойчивы и обычно транскрибируются в
виде единой крупной молекулы РНК, которая за-
тем разрезается (подвергается процессингу) с об-
разованием зрелых продуктов (см. разд. 18.12).
18.1.2. Инициация транскрипции
регулируется различными путями
Как отрицательная, так и положительная регу-
ляция осуществляется путем взаимодействия ре-
прессоров или активаторов с эффекторами. Все
четыре типа индуцибстьной и репрсссибельной
регуляции у прокариот, приведенные в табл. 18.1,
предназначены для контроля инициации тран-
скрипции в оперонах и рсгулопах с участием эф-
фекторов. В зависимости от типа регуляторной
системы эффектор может служить индуктором,
корепрессором, ингибитором или коактива-
тором. На рис. 18.2 приведены типичные приме-
ры этих четырех типов регуляторных механизмов
в упрощенной форме. В случае оперонов и регуло-
нов, кодирующих ферменты, эффектором обыч-
но служит субстрат, промежуточный продукт
или конечный продукт метаболического пути. Ес-
ли аналогичные функции выполняет пеметабо-
лпзируемый аналог природного эффектора, его
называют нефизиологическим эффектором.
На уровне модулона эффектором служит сигнал
из окружающей среды, который воспринимается
регуляторным белком непосредственно или через
промежуточный сенсорный элемент (см. гл. 20).
Строгих правил не существует, но стратегии, по-
казанные на рис. 18.2 в пунктах А и Г (репрессор-
индуктор и апоактиватор-коактиватор соответ-
ственно), используются в основном для регуляции
синтеза катаболических ферментов. Стратегия с
участием репрессора и индуктора (рис. 18.2, Л),
обеспечивая синтез ферментов de novo, позво-
ляет использовать отличный от глюкозы источ-
ник углерода и энергии (например, другой сахар).
При такой регуляции клетка синтезирует фер-
менты данного метаболического пути только
тогда, когда в них имеется потребность. Стра-
тегии анорепрессор-корепрессор (рис. 18.2, Б) и
активатор-ингибитор (рис. 18.2, В) обычно свя-
заны с синтезом ферментов для анаболических
процессов (например, синтеза аминокислот и ви-
таминов) и позволяют предотвращать бесполез-
ный расход субстратов метаболического пути, ко-
гда конечный продукт имеется в достаточном ко-
личестве.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 525
Активированный
репрессор
Отрицательным контроль (/ас-оперон)
Оперон
не активен
Положительный контроль (/еи-оперон)
Активированный активен
активатор
И»С II с If
Оперон
не активен
Инактивированный
активатор
Положительный контроль (ага-оперон)
Отрицательный контроль (trp-оперон)
Инактивированный
апорепрессор
Инактивированный
апоактиватор
Оперон
не активен
Рис. 18.2. Стратегии регуляции (контроля) инициации транскрипции на примере Escherichia coli.
А. Отрицательная регуляция лактозного оперона (/ас) посредством взаимодействия Lac-pen рессора (LacI) с опе-
ратором lacZo (сайт о). Активный LacI инактивируется индуктором, р — промотор lacZp; Z, Y и А — структурные
гены.
Б. Отрицательная регуляция оперона, кодирующего ферменты синтеза триптофана (trp) посредством взаимодей-
ствия Тгр-апорепрессора (TrpR) с оператором trpEo. В норме белок TrpR неактивен, но активируется корепрессором
триптофаном, р—промотор trpEp-, Е, D, С, В и А — структурные гены.
В. Положительная регуляция оперона синтеза лейцина (leu) через взаимодействие белка-оператора, чувствительно-
го к лейцину (Lrp), с активаторным сайтом leuAa (а). Белок Lrp инактивируется лейцином, р — промотор leuAp-, А,
С, В и D — структурные гены.
Г. Положительная регуляция оперона деградации арабинозы (ага) через взаимодействие апоактиватора АгаС с сай-
том активации агаВа (а). Как теперь известно, сайт а состоит из нескольких компонентов (см. рис. 18.5, В). Белок
АгаС активируется арабинозой в качестве коактиватора (называемого также индуктором), р—промотор агаВр; В,
А и D — структурные гены. Описанные системы представлены в упрощенной форме (относительно номенклатуры
см. дополнение 18.1).
Аллостерические эффекторы □ Тран-
скрипция генов может адаптивно регулировать-
ся посредством низкомолекулярных эффекторов.
Оперон способен «включаться» или «выключать-
ся» в ответ па присутствие или отсутствие такого
эффектора, причем уровень транскрипции опе-
рона при его экспрессии пропорционален концен-
трации эффектора. Эффектор взаимодействует
с регуляторным белком, аллостерически изменя-
ет его конформацию и влияет тем самым на его
526 Часть V. Экспрессия генов и механизмы регуляции
Таблица 18.1. Механизм инициации транскрипции. Примеры стратегий А-Г приведены на рпс. 18.2, А -Г соот-
ветственно
Стратегия регуляции Регулируемая функция Регуляторный элемент в ДНК Регуляторный белок Эффектор Транскрипция оперона
Нет Да
А. Отрицательны й контроль (индуци- бельный) Катаболическая Оператор (о) Репрессор Индуктор Репрессор Репрессор + индуктор
Б. Отрицательный контроль (репрес- сибельный) Анаболическая Оператор (о) А поренрессор Коренрессор Апо репрессор + коренрессор Активатор
В. Положитель- ный контроль (репрессибельный) Анаболическая Сайт актива- ции (а) Активатор Ингибитор Активатор + ингибитор Активатор
Г. Положительный контроль (индуци- бельный) Катаболическая Сайт актива- ции (а) А поактиватор Коактпватор (индуктор) Апоактива гор Апоактиватор 4- коактиватор (индуктор)
активность (инактивирует белок, находящийся в
функциональном состоянии, либо активирует бе-
лок в нефункциональном состоянии). Такие ал-
лостерические изменения препятствуют (напри-
мер, в случае белка LacI) или способствуют (на-
пример, в случае белка TrpR) специфическому
связыванию с ДНК или даже изменяют харак-
тер с вязывания (например, в случае белка LysR;
см. разд. 18.6). Влияние аллостерических моду-
ляторов на экспрессию генов осуществляется бо-
лее медленно, чем контроль на уровне активности
ферментов, но обеспечивает непрерывное реаги-
рование на изменения окружающей среды, бла-
годаря тому что связь с модулятором обычно
является нековалептной и его эффект имеет ха-
рактер легкообратимого. Иногда, впрочем, меха-
низмом регуляции служит ковалентная модифи-
кация регуляторного белка, например под дей-
ствием такого общего регулятора, как XtrC (см.
гл. 20).
Способы регуляции процесса инициации тран-
скрипции могут быть различными (табл. 18.1).
Например, для регуляторного белка может не су-
ществовать эффектора или регуляторный белок
может выполнять двойную роль, действуя как
активатор на один промотор и как репрессор па
другой. Кроме того, регуляторный белок, дей-
ствующий как репрессор, может становиться ак-
тиватором после взаимодействия с молекулой
эффектора (см. разд. 18.6). Если оперой пред-
ставляет собой часть модулона (см. гл. 20), его
транскрипция регулируется двумя регуляторами:
специфическим регулятором оперона (или регуло-
па) и общим регулятором, специфичным для мо-
дулона.
Дополнение 18.1. Оперой —это тран-
скрипционная единица, характерная для про-
кариот (рис. 18.1 и 18.2). Условно опероны
обозначают курсивными строчными буквами,
например lac, his или rps, взятыми обычно
из названия их функции, например разло-
жение лактозы (lactose), биосинтез гистиди-
на (histidine) или малая субъединица белка
рибосом (ribosomal protein small). Большин-
ство опсронов содержит несколько струк-
турных генов, или цистронов, каждый из
которых обозначают прописной буквой кур-
сивом, располагая их в порядке локализа-
ции гопов в оперопе вслед за промотором
(например, lacZYA ггли trpEDCBA). Про-
мотор получает название, соответствующее
первому структурному гену (например, lacZp
или trpEp), тогда как терминатор — послед-
нему (например, lacAt или trpAt). Други-
ми существенными элементами служат сай-
ты связывания репрессора, или операторы
(например, lacZo), сайты связывания акти-
ватора (например, агаВа-, иногда, в случае
Глава 18. Регуляция экспрессии генов: опероны и регулоны 527
инициатора, агаВг}, сайт инициации тран-
скрипции (tsp, часто обозначается стрелкой)
при паре нуклеотидов +1, лидерная по-
следовательность (например. hisGl), и сай-
ты связывания рибосомы (г&з; на уровне
мРНК обозначаются Rbs). Открытые рам-
ки считывания для неизвестных генных
продуктов (Orf) обозначают orf-1, orf-2 и
т. д.. для конкретного оперопа—ко анало-
гии с аллелями: lac-l, 1ас-4 и т. д. На рисун-
ках, изображающих сложные опероны, часто
используют такие символы, как Р1}
F3, для обозначения различных промоторов.
В случае оперонов, управляемых одним и тем
же специфическим регулятором (т. е. образу-
ющих регулоп), условные обозначения и но-
менклатура совпадают с используемыми для
индивидуальных оперонов. Однако для групп
генов, контролируемых общим регулятором
и организованных в модулоны (рис. 20.2)
(вапример, модулей сгр, модулой 1гр), исполь-
зуются иные условные обозначения.
18.2. Регуляторы часто контролируют
свой собственный синтез; ауторегуляция
Концентрация регуляторного белка во многих
случаях должна поддерживаться на определен-
ном уровне для реагирования на изменения
условий среды. Этот уровень обеспечивается
ауторегуляцией путем положительного или от-
рицательного контроля. При отрицательном кон-
троле регуляторный белок действует как репрес-
сор, связываясь с оператором его собственно-
го оперопа. Снижение концентрации этого белка
приводит к подавлению его связывания с опера-
тором, пропорционально ослабляя репрессию, и,
наоборот, повышение его концентрации усилива-
ет репрессию. Положительная регуляция синтеза
белка-активатора сама по себе привела бы к его
экспоненциальному накоплению, чего не должно
быть, и поэтому в случае, когда регуляторный бе-
лок действует как активатор, система ауторегуля-
ции должна включать отрицательный контроль.
Действительно, ауторегуляция во многих случаях
(см. разд. 18.6) основана на сочетании эффектов
активации и репрессии.
Ауторегуляция состоит в том, что при высо-
кой внутриклеточной концентрации регуляторно-
го белка происходит торможение транскрипции с
промотора его гена, тогда как при низкой внутри-
клеточной концентрации этого регулятора — сти-
муляция транскрипции под контролем того же
промотора.
18.3. Мультимерный фермент бактериальная РНК-полимераза
инициирует транскрипцию в промоторе
В механизме инициации транскрипции важную
роль выполняют трамс-активная РНК-полиме-
раза и гщс-активный промотор, каждый из
которых (или оба) могут быть объектами регуля-
ции. Бактериальная РНК-полимераза представ-
ляет собой мультимерный фермент, включающий
основной блок из четырех субъединиц (fifl'a-z)
плюс a-субъединицу (гг-фактор), распознающую
промотор. В клетках присутствует несколь-
ко различных о-субъединиц. Подробно струк-
тура промотора и РНК-полимеразы описаны
в гл. 15.
Опероны часто содержат больше одного про-
мотора, причем промоторы одного и того же или
528 Часть V. Экспрессия генов и механизмы регуляции
различных оперонов могут располагаться после-
довательно или даже перекрываться. Как уста-
новлено, их разделяют отрезки длиной от 5 до
С00 п.н. Тандемно расположенные промоторы для
различных оперонов могут быть конвергентны-
ми или дивергентными. Существует несколько ти-
пов функционирования тандемно расположенных
промоторов: 1) регуляторный белок, связываясь
с общим сайтом ДНК, может регулировать два
тандемных промотора, управляющих одним и тем
же оперопом или двумя различными опсронами
одновременно и координированно, по обязатель-
но в одном и том же направлении (т. е. стиму-
ляции или подавления). В случае сочетания по-
следовательно расположенных дивергентных про-
моторов одни из них часто управляет собствен-
ным регуляторным геном и таким образом само-
регулируется (см. разд. 18.6); 2) более сильный
промотор может работать как антенна, «собирая»
молекулы РНК-полимеразы и передавая их на бо-
лее слабый промотор; 3) транскрипция с сильно-
го промотора, расположенного выше по направле-
нию транскрипции, может подавлять активность
расположенного ниже слабого промотора и 4) про-
мотор, расположенный внутри оперона, может
допускать транскрипцию только тех цистронов,
которые расположены ниже по направлению
транскрипции.
18.4. Отрицательная регуляция означает подавление транскрипции
Первоначальная модель отрицательной регу-
ляции постулировала, что репрессор, ингиби-
рующий инициацию транскрипции, стерически
препятствует связыванию РНК-полимеразы с
промотором. Однако способность репрессоров ин-
гибировать инициацию транскрипции с различно
локализованных операторов, а также существо-
вание опсронов с множественными операторами
указывают на то, что репрессоры действуют, ве-
роятно, на различных уровнях. В качестве воз-
можных механизмов предполагаются следующие.
1. Согласно модели А, репрессор препятству-
ет связыванию РНК-полимеразы. Этот меха-
низм используется в случае перекрывания ло-
кусов оператора и промотора.
2. Согласно модели Б, репрессор подавляет ак-
тивность РНК-полимеразы. Если отсуствуст
перекрывание оператора с промотором, ре-
прессор, очевидно, не может препятствовать
связыванию РНК-полимеразы. Такие систе-
мы иногда характеризуются кпюжественно-
стыо операторов, и репрессор подавляет этап,
следующий за связыванием РНК-полимеразы.
3. По модели В, репрессор изменяет структуру
ДНК, в результате чего блокируется функция
промотора.
4. Согласно модели Г, репрессор препятству-
ет осуществлению функций активатора (сме-
шанный контроль).
18 .4.1. Два типа отрицательной регуляции
представляют опероны lac и trp
Раскрытию механизма отрицательной регуляции
помогло изучение двух систем, одной из кото-
рых послужил /ос-опсроп, кодирующий фермен-
ты катаболизма лактозы у Escherichia coli. В этом
опероне осуществляется стратегия репрессор-
индуктор (рис. 18.2, А). Репрессор LacI связы-
вается с оператором и подавляет инициацию
транскрипции с Ztzc-промотора более, чем в 1000
раз. Инактивация LacI индуктором аллолак-
тозой (o-D-гал актози л-/3-1, G-D-глюкоппраиозид),
продуктом метаболизма лактозы cy-D-галактозил-
Д1,4-D-глюкопиранозидом или иеметаболизиру-
емым аналогом изопропилтпо-/3-В-галактозидом
(IPTG) увеличивает частоту транскрипции до
уровня, соответствующего состоянию дерепрес-
сии. Связывание Lad с оператором (lacZol), ло-
кализованным в позиции +7, стерически препят-
ствует связыванию РНК-полимеразы, т. е. озна-
чает отрицательную регуляцию (модель А). В то
же время молекулярный механизм действия LacI
определяется тремя операторными локусами: ос-
новным оператором lacZol в области позиции +7,
расположенным ниже оператором lacZo2 в обла-
сти позиции 4-401 и расположенным выше, в об-
ласти позиции —82, оператором lacZo3. Сродство
локусов lacZo2 и lacZo3 к репрессору значитель-
но ниже, чем сродство локуса lacZol, и предполо-
Глава 18. Регуляция экспрессии генов: опероны и регулоны 529
жительно они усиливают связывание репрессора
с основным оператором по механизму кооператив-
ности (см. разд. 18.4.2).
Оперой trp, кодирующий ферменты синтеза
триптофана, может служить типичным приме-
ром другой стратегии отрицательной регуляции,
а. именно, стратегии корепрессор-аиорепрессор;
рис. 18.2, Б). Для связывания белка-апорспрес-
сора TrpR с единственным оператором (trpEo) в
позиции —3 и подавления связывания РНК-поли-
меразы необходим корепрессор — молекула трип-
тофана (модель А). Таким образом, при высокой
концентрации триптофана в клетке комплекс ко-
репрессор-апорепрессор снижает частоту инициа-
ции транскрипции с промотора trpEp. При низкой
концентрации триптофана в клетке апорспрессор
переходит в свободную форму, не способную свя-
зываться с оператором.
18 .4.2. Механизм отрицательного контроля
может быть более сложным
Представленный на рис. 18.2 механизм с репрес-
сором в виде единственного белка, ингибирующе-
го инициацию транскрипции путем связывания со
специфическим оператором, не являемся строгим
правилом; часто механизм регуляции более сло-
жен.
Один оператор может контролировать
два промотора регулона □ Одного оператор-
ного локуса может быть достаточно для подавле-
ния транскрипции двух дивергентных оперонов.
Например, сайты начала транскрипции (tsp) двух
конвергентных промоторов в дивергентных опе-
ропах bio разделены участком длиной лишь 9 п.п.
в едином операторе, занимающем отрезок от по-
зиции +11 промотора ЫоАр (Ра) Д° позиции —21
промотора ЫоБр (Рв)- Комплекс из корепрессо-
ра биотинил-б'-аденилата и апорепрессора BirA,
связываясь с этим сайтом, ингибирует инициацию
транскрипции с обоих промоторов, составляющих
регулон Ыо (синтез биотипа) (рис. 18.3). Распо-
ложение репрессора в этой позиции перекрыва-
ния обоих промоторов обеспечивает отрицатель-
ную регуляцию, соответствующую стратегии А.
Репрессорами могут служить фермен-
ты □ Дивергентные анаболические опероны bio
у Е. coli, кодирующие ферменты синтеза биоти-
на, регулируются по механизму отрицательного
контроля апорепрсссором BirA. Однако BirA вы-
Биотин-5'-аденилат
BirA
ЫоАр
ЫоА |
_________+1 -10
Оператор
-10 +1
bioBFCD
ЫоВр
Рис. 18.3. Дивергентные опероны Ыо у Escherichia
coli. Два перекрывающиеся промотора ЫоАр (Ра) и
ЫоВр (Рв) управляют двумя дивергентными оперонами
Ыо. Соответствующие сайты начала транскрипции (tsp,
обозначенные +1) разделены отрезком длиной 9 п.н.
Единственный операторный локус длиной 40 п.н. пере-
крывается как с ЫоАр, так и с ЫоВр. ЫоА и bioBFCD —
структурные гены; BirA — репрессор, обладающий син-
тетазной активностью.
полняет и другие функции. Он служит фермен-
том биотин-сиптетазой и катализирует синтез сво-
его собственного/ корспрессора, биотинил-б'-адс-
нилата. Комплекс из корспрессора и репрессора
либо связывается с оператором оперона bio, ли-
бо переносит остаток биотинил-б'-аденилата. па
остаток лизина в составе апофермента ацетил-
СоА-карбоксилазы Е. coli. Кроме того, белок BirA
участвует в удержании биотина внутри клетки.
Один из генов дивергентных оперопов put, от-
ветственных за синтез ферментов катаболизма
пролина у Salmonella typhimurium, put А, кодирует
бифункциональный белок PutA, который при наг-
личпи в клетке пролина связывается с мембраной
и катализирует оба ферментативных этапа разло-
жения пролина до глутамата. В отсутствие про-
лина в цитоплазме белок PutA действует как ре-
прессор двух дивергентных р?/7-опсронов, состав-
ляющих регулон. Таким образом, функции BirA
и PutA служат примером использования фермен-
тов в качестве белков — регуляторов активности
генов.
Мультимерные операторы действуют
путем создания петель ДНК □ В нескольких
известных оперопах осуществление отрицатель-
ной регуляции обеспечивается наличием двух или
нескольких пространственно разделенных опера-
торов. Такие мультимерные операторы окружают
репрессируемые промоторы. При этом два связан-
ных с операторами репрессора взаимодействуют
между собой, как если бы они были сцеплены, и
за счет вовлечения в этот процесс промежу точной
области (содержащей промотор) образуется петля
ДНК. Такую петлю можно обнаружить с помо-
530 Часть V. Экспрессия генов и механизмы регуляции
щыо электронной микроскопии (рис. 18.4). Далее
мы рассматриваем образование подобных петель
ДНК на примере трех оперонов.
Опсрон galETKM (рис. 18.5, Л) □ Репрефор
GalR опосредует образование петли с участием
двух операторов, galEoE (Qe) и galEol (О/),
отстоящих один от другого на 113 п.н. в оне-
роне galETKM (кодирует ферменты метаболиз-
ма галактозы у Е. coli). В результате образова-
ния петли подавляется инициация транскрипции
с двух расположенных последовательно промо-
торов, galEpl (Рг) и да1Ер2 (Рг), этого оперона.
Образование петли приводит к инактивации про-
моторов в результате изменения структуры ДНК
(модель В).
Опсрон deo (рис. 18.5, Б) □ В этом опероне,
кодирующем ферменты катаболизма нуклеозидов
и дезокспнукчсозидов у Е. coli, репрессор DcoR
подавляет активность двух промоторов, deoCpl
(Pi) и deoCp2 (Рг), находящихся один от дру-
гого па расстоянии 600 п.н., при участии трех
операторов: dcoCoI, deoCo2 и deoCoE (Oi, О 2 и
Ое соответственно). Для репрессии этих промото-
ров необходимо образование петли мвжду опера-
тором deoCol и ближайшим промотором deoCpl,
а также между оператором deoCo2 и ближай-
шим промотором deoCp2', любая неустойчивость
этой петли исправляется оператором deoCoE, ко-
торый способствует репрессии путем формирова-
ния страховочной петли с операторами deoCpl
или deoCp2. При образовании петли ДНК по-
вышается сродство репрессора DcoR к операто-
рам благодаря правилу кооперативного связыва-
ния. Поскольку deoCpl перекрывается с deoCol и
deoCp2 с deoCo2 (модель А), механизмом репрес-
сии является, по-видимому, стерическое препят-
ствие.
Оперон araBAD (рис. 18.5, В) □ В отличие
от начальной модели регуляции оперона агаВ у
Е. coli, представленной па рис. 18.2, апоакти-
ватор АгаС действует также и как репрессор,
связываясь в отсутствие эффектора (индуктора),
L-арабинозы, с двумя пространственно разде-
ленными сайтами, атаВИ (Д) и атаВо2 (Ог), с
образованием петли, оказывающей эффект ре-
прессии. Добавление арабинозы приводит к вы-
прямлению этого участка (исчезновению «петли
репрессии») и связыванию АгаС в качестве акти-
Рис. 18.4. Образование петли ДНК. Электронная микро-
фотография Lac-penpeccopa (показан стрелкой) связан-
ного с двумя конструкциями /ас-оперонов, разделенных
отрезком длиной 113 п.н. в gaZ-опероне Escherichia coli.
По [1].
ватора с двумя примыкающими один к другому
сайтами агаВИ и araBi2 (Д, I2). Таким образом,
АгаС выполняет двоякую роль, действуя и как ре-
прессор, и как активатор — сочетание стратегий
репрессор-индуктор и апоактиватор-коактиватор
(рис. 18.2, А, Г). Дополнительные примеры регу-
ляторных белков, выполняющих двойную роль,
приведены в разд. 18.6.
fl Механизм отрицательного контроля обес-
печивает надежную регуляцию и дает клеткам
селективное преимущество, поскольку повышает
экономичность и эффективность метаболизма.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 531
Рис. 18.5. Множественные операторы у Escherichia coli.
А. Оперон galETKM содержит два промотора:
galEpl (1’1) и galEp2 (Pi), дифференцированно
регулируемых комплексом сАМР—Сгр. Этот комплекс
стимулирует galEpl (Pi) посредством контакта с
РНК-пол имеразой и в то же время ингибиру-
ет galEp2 (Р2). препятствуя связыванию с ним
РНК-полимеразы. Эти функции комплекс сАМР-Сгр
осуществляет, связываясь с кодоном в позиции —41,5,
считая от сайта начала транскрипции в Pi (не пока-
зан). На эту регуляцию накладывается отрицательный
контроль обоих промоторов посредством Gal-penpec-
сора, который действует путем связывания с двумя
операторами — galEoE (Об) (в районе позиции —60,5)
и galEol (Oi) (в районе позиции +53,5). Оператор
galEol (Oi) локализован внутри первого структурного
гена galE. Штриховыми линиями показано образование
петли при взаимодействии указанных репрессоров,
связанных с операторами.
Б. Оперон deoCABD содержит два промотора,
deoCpl (Pi) (в позиции +1) и deoCp2 (Р2) (в районе
позиции +599). Репрессор DeoR действует путем
связывания с тремя с/еоСо-операторами, dcoCol (Oi)
(в позиции +7), deoCo2 (О2) (в районе позиции +592)
и dcoCoE (Ое) (в районе позиции —286). Штриховые
линии показывают альтернативные возможности об-
разования петель между связанными с операторами
репрессорами.
В. Оперон araBAD. Отрицательный контроль его актив-
ности осуществляется путем формирования петли ДНК
между молекулами белка АгаС, связанного с двумя
операторами, araBi (Д) и агаВо (Ог). Добавление
арабинозы вызывает изменение конформации белка
АгаС, который после этого связывается с последо-
вательно расположенными сайтами [araBzl (Ii) и
агаВг‘2 (Д)] и становится активатором промотора
(см. разд. 18 5). Для активации необходимо также
связывание комплекса сАМР-Сгр с сайтом активации
агаВа (А) в районе позиции —92.
gal
А
18.5. Механизмы положительной регуляции
служат для активации транскрипции
Положительный контроль предназначен для
активации промоторов, которые в норме неак-
тивны. Активность многих промоторов у бак-
терий является фактором, лимитирующим ско-
рость инициации транскрипции на одном или
нескольких этапах. При положительном контро-
ле лимитирование скорости процесса устраняется
посредством активатора. Для биохимического
анализа сайта воздействия активатора важна рас-
шифровка всех последовательных этапов инициа-
ции транскрипции (гл. 15). Механизмом регуля-
ции с участием активаторов может быть стиму-
ляция формирования закрытого или открытого
комплекса РНК-полимеразы с промотором пли
ускорения освобождения промотора. Это установ-
лено для регуляции оперонов и регулонов, а также
общего контроля модулонов.
18.5.1. Сайты активации могут располагаться
на небольшом расстоянии от промотора
Сайты активации (а), опосредующие положитель-
ную регуляцию, могут быть расположены близко
или далеко от промотора. Типичный механизм,
при котором активатор действует путем связыва-
532 Часть V. Экспрессия генов и механизмы регуляции
Рис. 18.6. Активация транскрипции с промотора lacZ
(А) у Escherichia coli с участием белка Сгр. В виде ком-
плекса с сАМР белок Сгр связывается с расположенным
выше промотора активатором lacZa, палиндромной по-
следовательностью с центром в позиции —61,5 от tsp
(+1). Белок Сгр представляет собой димер, каждый из
мономеров которого занимает половину сайта ДНК.
Б, В. Белок Сгр образует контакт с ci-субъединицей
(-ами) РНК-полимеразы (RNP), только находясь на той
же стороне спирали ДНК. Взаимодействие происходит
в том участке поверхности молекулы белка Сгр, кото-
рый может модифицироваться в результате рс- (поло-
жительный контроль) мутаций.
Г. В случае pc-мутаций активация транскрипции невоз-
можна.
Д, Е. Функциональный контакт белка Сгр с РНК-поли-
меразой осуществляется только одной из его субъеди-
ниц. Гетеродимер этого белка с одной мутантной субъ-
единицей и другой субъединицей дикого типа может
активировать транскрипцию в том случае, если субъ-
единица дикого типа находится со стороны промотора.
ния с сайтом активации, находящимся на расстоя-
нии пс более 100 п.н. от промотора, состоит в том,
что связанный с ДНК активатор контактирует с
РНК-полимеразой и стимулирует ее активность.
Наиболее наглядно этот принцип можно проил-
люстрировать на примере хорошо изученное о ме-
ханизма активации промотора lacZp. В нем участ-
вует общий активатор Сгр, который в комплексе с
сАМР действует по модели апоактиватор-коакти-
ватор (см. разд. 18.1.2). Имеется пять убедитель-
ных доказательств того, что комплекс сАМР-Сгр
контактирует с РНК-полимеразой (рис. 18.6).
1. Активаторы и РНК-полимераза связывают-
ся с ДНК кооперативно, что проще всего
объяснить белок-белковыми взаимодействия-
ми (рис. 18.6, Б).
2. Хотя ДНК-связывающие сайты для комплек-
са сАМР-Сгр в различных промоторах Е. coli
расположены в участках, легкодоступных для
связывания РНК-полимеразы, данный акти-
ватор действует только в том случае, когда
эти сайты отделены от генов tsp целым чис-
лом витков спирали ДНК. Активатор должен
находиться на той же стороне спирали ДНК,
где расположена РНК-полимераза, чтобы
их контакт был геометрически возможным.
Если методом генетической инженерии пере-
нести центр связывания активатора па про-
тивоположную сторону промотора путем до-
бавления 5 п.н. между центром связывания
активатора и промотором, активации не про-
исходит (ср. рис. 18.6, Б, Б).
3. Доказательство существования белок-белко-
вого взаимодействия получено в генетических
экспериментах, основанных на предположе-
нии, что мутантные белки с нарушением спо-
собности к взаимодействию должны нормаль-
но связываться с ДНК, но не вызывать при
этом активацию транскрипции (рис. 18.6, Г).
Такие мутации (обозначаемые в случае по-
ложительного контроля рс) позволяют иден-
тифицировать на поверхности белка Сгр
участки, вклад которых в активацию тран-
скрипции зависит от локализации сайтов
активации в промоторах. Кроме того, мута-
ции рс могут указывать па «кислый» уча-
сток (обычный для эукариотических актива-
торов), подобный существующему в молекуле
белка-регулятора CI фага А (см. разд. 18.6).
Соответствующие точки контакта могут быть
локализованы в нескольких субъединицах
РНК-полимеразы. Мутации в РНК-полиме-
разе, нарушающие ее реакцию па актива-
тор сАМР-Сгр и некоторые другие актива-
торы, локализованы на С-копце о-субъеди-
пицы, что свидетельствует о взаимодействии
этих активаторов с данной субъединицей. На-
против, мутации, устраняющие pc-дефект в
активаторе CI, локализованы в сг-субъеди-
Глава 18. Регуляция экспрессии генов: опероны и регулоны 533
ницс. Вероятнее всего, мутации сг-субъеди-
ницы восстанавливают поврежденную спо-
собность структуры CI к взаимодействиям.
Весьма вероятно также наличие точек взаи-
модействия в /3- и //-субъединицах РНК-поли-
меразы.
4. Поскольку белок Сгр представляет собой ди-
мер, можно получить его гетеродимер, содер-
жащий одну субъединицу' штамма дикого ти-
па и другую с мутацией рс. Когда такой ге-
тсродимср связывается с ДНК, субъединица
штамма дикого типа в одних случаях лока-
лизуется дальше от промотора (рис. 18.6, Д),
в других — ближе к промотору (рис. 18.6, Е).
Стимуляция транскрипции происходит только
в последнем случае.
5. Эксперименты по перекрестной сшивке свя-
занных белков показали, что активирующий
участок на поверхности белка Сгр в связан-
ном состоянии находится в непосредственной
близости от С-конца П'-субъединицы РНК-по-
лимсразы. Примеры функционирования раз-
личных активаторов приведены в табл. 18.2.
Двойной положительный контроль и
множественные сайты активации □ При ре-
гуляции по механизму накладывающихся эффек-
тов (см. гл. 20) па опероны воздействуют два
активатора —специфический (локальный) и об-
щий. Оба эти активатора должны быть в ак-
тивной форме, чтобы вызвать транскрипцию с
промотора. Примером положительного контроля
с наложением эффектов может служить актива-
ция промоторов malEp (Ре) и malKp (Рк) двух
дивергентных оперопов malB у Е. coli. Эти два
индуцируемых мальтозой промотора зависят от
локального апоактиватора МаГГ, связывающего
мальтотриозу, и от общего активатора сАМР-Сгр
(рис. 18.7). Сегмент длиной 271 п.п. между дву-
мя дивергентными сайтами tsp содержит набор
активаторных сайтов: пять для комплекса маль-
тотриоза-MalT (Т1-Т5) и четыре для комплека
сАМР-Сгр (С1-С4), причем с первыми тремя из
них этот последний комплекс связывается прочно,
тогда как с четвертым слабо. Связывание сАМР-
Сгр со всеми тремя сайтами, обладающими к нему
высоким сродством, необходимо для транскрип-
ции как с malEp, так и с malKp, поэтому мута-
ция в любом из этих сайтов снижает степень их
активации. Сайты Ti и Т2 необходимы для регу-
ляции расположенного вблизи промотора malEp,
сайты Т.з, Т4 и Т-— для контроля ближайшего к
ним промотора malKp. Активация malEp и malKp
двумя активаторами представляет собой слож-
ный процесс, включающий образование ДНК-
мул ьтнбелкового комплекса, имеющего структуру
высшего порядка. Например, хотя специфическое
связывание специфического активатора мальто-
триоза-МаГГ с сайтами Т3, Т4 и Т5 имеет
характер достаточно прочного, в присутствии
общего регулятора сАМР Сгр специфический ак-
тиватор перемещается на вторые три сайта свя-
зывания — Т3, и Т5, которые расположены
ближе к элементу —10 промотора malKp. Эти
вторые три сайта связывания частично пере-
крываются с первыми. Образование комплекса
Таблица 18.2. Этапы функционирования активаторов. Кв — стадия начального связывания РНК-полимеразы с
промотором; kf — последующий этап изомеризации (см. гл. 15). а.—сайт связывания активатора; Enh — энхансер;
т.п.н. — порядок расстояния энхансера от промотора; (+) — стимуляция образования открытого комплекса на про-
моторе glnAp в присутствии фосфолирированного белка NtrC; gp—продукт гена
Промотор Активатор Локализация а/Enh Активация
Кв kf
Рцм (фаг А) CI -42 Нет 11
LacZp {Escherichia coli) cAMP-Crp -61,5 20 Нет
Ere (Фаг A) СП -33 15 40
Pi (фаг A) СП -33 100 100
glnAp (Salmonella typhimurium) NtrC-Р т.п.н. Нет +
Mate (фаг T4) gp44, gp62, gp45 т.п.н. Нет 8
534 Часть V. Экспрессия генов и механизмы регуляции
Рис. 18.7. Дивергентные промоторы malEp (Ре) и
malKp (Рк) в локусе та1В у Е. coli. Множественные
сайты активации Т1-Т5 (серые квадраты) и С1-С4 (за-
штрихованные прямоугольники) для двух активаторов
связываются с комплексами индуктор-мальтотриоза
(мальтотриоза-Ма1Т) и Сгр—сАМР соответственно.
После связывания Сгр—сАМР с его сайтами-мишенями
(Ci—С4) область связывания комплекса мальтотриоза-
MalT вблизи промотора malKp перемещается с сайтов
Тз, Та и Тз на сайты Т^, Та и Т$ (квадраты, ограничен-
ные пунктирной линией). Локализация сайтов актива-
ции указана относительно сайта tsp промотора malEp.
Два сайта tsp разделены отрезком длиной 271 п.н.
ДНК-белок с участием второго набора сайтов за-
пускает транскрипцию с промотора malKp. Ак-
тивная структура комплекса ДНК-белок вклю-
чает взаимодействие между молекулами Ма1Т,
связанными с сайтами Т1-Т2 и Т3-Т5. Роль ком-
плекса сАМР-Crp, связанного с промежуточным
сегментом ДНК, состоит в том, что он обусловли-
вает изгибание молекулы ДНК, способствуя соот-
ветствующим белок-белковым и ДНК-белковым
взаимодействиям. Следует отметить, что для эф-
фекта МаГГ требуется гидролиз АТР.
При регуляции промоторов с участием двух
активаторов, одним из которых служит Сгр, ме-
ханизмы действия общего активатора Сгр могут
быть различными в отношении разных промото-
ров.
Ферменты-«самоубийцы» в качестве ак-
тиваторов □ Активаторы не являются особой
группой белков; например, некоторые метаболи-
ческие ферменты также могут служить актива-
торами. Белок Ada устраняет повреждения ДНК,
удаляя из пуринов возникающие в результате му-
таций алкильные группы (см. разд. 15.6.4). В про-
цессе репарации ДНК эти алкильные группы пе-
реносятся па сам белок, что препятствует репа-
рации ДНК, так как алкилированный (например,
метилированный) Ada (meAda) теряет фермента-
тивную активность. Дефицитность этой системы
репарации ДНК компенсируется путем дерепрсс-
сии синтезе! Ada, поскольку именно meAda (но не
сам Ada) действует как активатор транскрипции
собственного гена (ado) путем связывания с акти-
ваторпым локусом промотора (ada).
18.5.2. Активация с удаленных сайтов
и роль энхансеров
Сайты активации, расположенные на большом
удалении от промоторов и обнаруженные глав-
ным образом у эукариот, получили название эн-
хансеров. Энхансеры эффективно функциони-
руют на больших расстояниях (большое число
т.п.н.) от промоторов независимо от их ориен-
тации и от того, расположены ли они выше
или ниже по направлению транскрипции. Нук-
леотидные последовательности энхансеров функ-
ционируют у бактерий путем связывания акти-
ваторов. Например, у Proteobacteria, а также у
грамположительных бактерий обнаружено семей-
ство активаторов, способных связываться с эн-
хансерами, которые функционируют сопряженно
с узнаваемыми <754-РПК-полимсразой промотора-
ми (см. гл. 15 и 28). Хорошо изучен у Е. coh
и Salmonella typhimurium общий активатор этой
группы —белок NtrC (называемый также NRII),
который активирует транскрипцию с промотора
гена д1пЛ, связываясь с двумя энхапсерпыми сай-
тами (рис. 18.8 и разд. 20.4). Хотя с этим промо-
тором ассоциировано два эпхансерпых сайта, ак-
тивацию, по-видимому, обеспечивает один из них.
^модифицированный белок NtrC действует как
апоактиватор и связывается с энхансером с вы-
соким сродством; апоактиватор становится акти-
ватором транскрипции после фосфорилирования.
Время жизни фосфорилированного белка очень
невелико. Эта двухкомпопентная система реаги-
рует на недостаток азота в клетке (см. разд. 20.4).
Связанный с энхансером фосфорилированный бе-
лок NtrC физически контактирует с РНК-полиме-
разой, связанной с промотором, в результате об-
разования петли ДНК, которую можно наблюдать
в электронном микроскопе.
В случае регуляции посредством гомологично-
го NifA-активатора, стимулирующего транскрип-
Глава 18. Регуляция экспрессии генов: опероны и регулоны 535
Рис. 18.8. Активация транскрипции путем связывания
активатора с энхансерным элементом (Enh). Разрыв в
линии, изображающей ДНК, означает, что энхансерный
элемент может находиться на расстоянии нескольких
т.п.н. от промотора. На нижнем рисунке показана пет-
ля ДНК, образующаяся в результате взаимодействия
(показано штриховыми линиями) белков (заштрихован-
ные кружки), связанных с энхансерами, и ст54-РНК-
полимеразы, связанной с промотором (в районе пози-
ции —20). Образование петли ДНК в случае некоторых
активаторов может достигаться путем связывания ДНК
на промежуточном участке с изгибающим белком IHF
(от integration host factor).
цию с промотора nifH у Klebsiella pneumoniae,
образование петли ДНК происходит путем изги-
бания промежуточного сегмента под действием
изгибающего белка (см. рис. 18.8). Примечатель-
но, что когда сайты энхансера и промотора нахо-
дятся (в тпранс-положсяии) в разных кольцевых
молекулах ДНК, образующих конкатемер, энхан-
сер сохраняет способность функционировать. Это
означает, что для активации транскрипции до-
статочно белок-белкового взаимодействия между
связанным с энхансером активатором и связанной
с промотором РНК-полимеразой. Связанные с эн-
хансером активаторы стимулируют ее изомериза-
цию, т. е. действуют па этапе превращения закры-
того комплекса в открытый (табл. 18.2). Связан-
ный с энхансером активатор, подобно белку МаГГ,
нуждается в гидролизе АТР для выполнения сво-
ей функции. Бактериальные энхансеры служат
удобной моделью для изучения их эукариотиче-
ских аналогов.
Белки, связывающиеся с энхансерами, акти-
вируют транскрипцию в результате их взаимо-
действия с РНК-полимеразой. Эти белки имеют
модульное строение и содержат функционально
различные домены: связывания ДНК, актива-
ции транскрипции и димеризации. Установ-
лено, что при комбинировании домена одного из
представителей белков этого семейства с доменом
другого образуется химерный белок, обнаружива-
ющий функциональную активность обоих источ-
ников.
18.5.3. Бактериофаги обладают
мобильными энхансерами
Необычный механизм активации транскрипции
обнаружен у бактериофага Т4 (см. гл. 26). Позд-
ние промоторы Т4 транскрибируются РНК-поли-
меразой. содержащей кодируемый фагом фактор
<т5°. Для транскрипции поздних генов фагаТ4, со-
пряженной in vivo с репликацией ДНК, необходим
фактор транскрипции gp33 (генный продукт 33) и
несколько белков (gp44, gp62 и gp45), участвую-
щих в репликации ДНК Т4 in vitro. Белок gp33
совместно с сг5°-РНК-полимеразой связывается с
промотором, тогда как белки репликации активи-
руют транскрипцию in vitro в отсутствие репли-
кации не путем узнавания какой-либо специфи-
ческой нуклеотидной последовательности ДНК,
по путем нахождения одпоцепочечного разрыва в
ДНК, который может быть расположен на раз-
личных расстояниях выше или ниже промотора.
Активация транскрипции эффективна только в
том случае, если этот разрыв в репликационной
вилке расположен на нетранскрибируемой цепи,
независимо от его точной локализации и рассто-
яния от промотора. Поскольку белки gp44, gp62
и gp45 обычно присутствуют в репликационной
вилке, создающей разрезы в ДНК и передвигаю-
щейся вдоль ее молекулы, эта вилка служит мо-
бильным энхансером, активирующим транскрип-
цию. Таким образом, в отличие от механизма с об-
разованием петли ДНК при активации с участием
энхансера, активация посредством мобильного эн-
хансера включает сканирование ДНК (рис. 18.9).
Мобильный энхансер ускоряет превращение за-
крытого комплекса в открытый при функциони-
ровании сгоо-РНК-полимсразы. Использование ре-
пликационной вилки в качестве мобильного эн-
хансера представляет собой сложный механизм
сопряжения репликации и транскрипции — фено-
мена, характерного для многих поздних промото-
ров бактериофагов.
536 Часть V. Экспрессия генов и механизмы регуляции
Рис. 18.9. Механизм сканирования ДНК мобильными
энхансерами.
А, Б. Два возможных механизма сканирования ДНК
белками, приводящего к усилению транскрипции позд-
них генов бактериофага Т4.
А. Перемещение всех (или некоторых) вспомогательных
белков, необходимых для активности РНК-полимеразы,
[gp44, gp62 (показаны темно-серым) и gp45 (обозначен
штриховкой)] от энхансера (Enh) к комплексу РНК-по-
лимеразы с промотором (показан светло-серым).
Б. Перемещение активированной РНК-полимеразы от
энхансера к свободному позднему промотору (Р). Оба
механизма подчеркивают двунаправленную (стрелки) и
зависимую от ориентации функцию энхансера поздних
генов Т4.
В. Комплекс энхансер-промотор изображен произволь-
ным образом как содержащий, кроме РНК-полимеразы,
все три вспомогательных белка, хотя последнее не явля-
ется обязательным условием для рассматриваемой мо-
дели. По [2].
18.6. Регуляторные белки часто выполняют двойную роль
В табл. 18.1 регуляторные белки приведены в
упрощенной трактовке, только как активаторы
или репрессоры, однако теперь очевидно, что мно-
гие из них выполняют обе эти роли. Примеры та-
кого двойного действия обычно, хотя и нс обя-
зательно, встречаются при анализе расположен-
ных тандемно дивергентных промоторов, один из
которых служит промотором гена, кодирующего
сам регулятор. Такие регуляторы действуют од-
новременно как репрессоры на один промотор и
как активаторы на другой без участия эффекто-
ра, как показывают примеры нескольких регуля-
торов у бактериофагов, таких как CI у фага Л
Е. coli и р4 у фага <£>29 Bacillus subtilis.
Тонкий, но в то же время весьма простой ме-
ханизм, посредством которого один и тот же бе-
лок выступает и как репрессор, и как активатор,
обеспечивает регуляцию дивергентных промото-
ров (right mantcnance) и Pr (right) у фага А
(рис. 18.10). В случае профага регулятор CI, син-
тезируемый с промотора Prm, действует как ре-
прессор Pr, который служит промотором в лити-
ческом цикле развития этого фага (см. рис. 26.15).
Уровень CI поддерживается постоянным для со-
хранения состояния профага. При концентраци-
ях CI, в которых он присутствует у лизогенного
штамма, этот белок, репрессируя Pr, активирует’
Prm- Поскольку уровень CI саморегулируется пу-
тем положительного контроля, активация долж-
на быть компенсирована посредством отрицатель-
ной регуляции. При высоких концентрациях CI
действует как репрессор для Prm , подавляя свой
собственный синтез. Такая всесторонняя регуля-
ция достигается путем связывания белка CI с тре-
Рис. 18.10. Двойная роль и ауторегуляция белка CI фа-
га А. Распределение трех частей оператора, От, Orz
и Опз (показаны серым), при дивергентных промоторах
Prm (right maintenance) и Pr (right). В то время как
связывание CI (серый кружок) с Ori и От. выключа-
ет транскрипцию с промотора Pr, транскрипция с Prm
включается при связывании Cl с Or2 и выключается при
связывании с Ors. Знак X указывает, что соответству-
ющий сайт ДНК не занят белком CI. Этот белок стиму-
лирует также этап kf (изомеризацию РНК-полимеразы
после ее связывания с промотором) на промоторе Prm
(см. табл. 18.2).
Глава 18. Регуляция экспрессии генов: опероны и регулоны 537
мя сходными и расположенными последователь-
но операторными локусами («right») (Ori, Oro
и Ors) и обеспечивается следующими тремя его
свойствами/эффектами: 1) различиями в специ-
фическом сродстве к Ori, Or2 и Орз (наибольшее
сродство СТ имеет к Ori, наименьшее — к Одз);
2) взаимодействием двух молекул СТ между со-
бой (если они занимают соседние сайты), приво-
дящим к кооперативному связыванию, и 3) взаи-
модействием молекулы СТ, занимающей оператор
Or2, для активации транскрипции с РНК-поли-
меразой, занимающей промотор Prm-
Дополнение 18.2. Присутствуя в низкой
концентрации, белок СТ связывается с опера-
тором Ori , а также с Or2 вследствие коопера-
тивного взаимодействия, тогда как сайт Ors
остается свободным. Связывание с Ору созда-
ет пространственные препятствия для связы-
вания РНК-полимсразы с промотором Pr, пе-
рекрывающимся с Ori, т. е. в этом случае
СТ выполняет роль репрессора. В то же вре-
мя, связываясь с Or2, СТ взаимодействует с
РНК-полимсразой, находящейся на промото-
ре Prm (см. разд. 18.5.1), что стимулирует
транскрипцию с этого промотора. Таким об-
разом, в последнем случае СТ выступает как
активатор и ауторегулятор (табл. 18.2). При-
сутствуя в высокой концентрации, СТ взаимо-
действует также с оператором Or^. Посколь-
ку нуклеотидная последовательность Or%
перекрывается с Prm, белок CI подавля-
ет транскрипцию с Prm , создавая стери-
ческис препятствия для связывания с ним
РНК-полимсразы. Когда концентрация СТ
падает до низкого уровня, он отделяется от
Одз> что приводит к активации этого промо-
тора. Такое генетическое переключение в от-
вет главным образом на концентрацию бел-
ка СТ, не зависящее от молекул какого-либо
эффектора, выполняет важную физиологиче-
скую роль в жизненном цикле фага А (см.
разд. 26.4).
Рис. 18.11. Двойной контроль двух дивергентных про-
моторов с участием белка LysR у Escherichia coli. Тран-
скрипция гена lysR происходит с левого промотора,
lysRp. Транскрипция структурного гена lysA, кодирую-
щего фермент биосинтеза лизина, происходит с право-
го промотора, lysAp. Оператор (серый прямоугольник
на линии, обозначающей цепь ДНК) связывает белок
LysR, подавляющий транскрипцию с левого промотора,
тогда как второй сайт (заштрихованный серый прямо-
угольник) связывает комплекс Lys—LysR и активирует
транскрипцию с правого промотора.
Некоторые регуляторы действуют как репрес-
соры, по в присутствии эффекторов становятся
активаторами. К таким регуляторам относятся
белки LysR. SorC и АгаС. Тонкие детали их то-
пографии и механизма действия варьируют, по
общим правилом является то, что в свободном
состоянии они действуют как репрессоры двух
родственных дивергентных промоторов. После
связывания с эффекторами эти регуляторы ста-
новятся активаторами одного из этих двух промо-
торов. Бифункциональная роль LysR-активатора,
регулирующего биосинтез лизина у Е. coli, пока-
зана на рис. 18.11. Связывание эффектора (ли-
зина) с апоактиватором (LysR) снижает сродство
LysR к оператор) ауторегуляции, но позволяет
ему взаимодействовать с новым участком ДНК,
действующим как сайг активации для дивергент-
ного промотора гопа lysА. При сочетании в раз-
личных комбинациях регуляторы и их эффекто-
ры могут выполнять более разнообразные функ-
ции. Например, общий регулятор Lrp (от leucine
responsive promoter protein) и его эффектор лей-
цин способны действовать на основе всех шести
известных стратегий регуляции (табл. 18.3).
538 Часть V. Экспрессия генов и механизмы регуляции
Таблица 18.3. Множественные регуляторные функции белка Lpr — отвечающего на лейцин регулятора промотора у
Escherichia coli. По Е. В. Newman, R. D’Ari и R. Т. Lin (1992) Cell 68: 617-619
Функция Lpr Роль эффектора—лейцина Регулируемые опероны и их функции
Активатор Антагонист Важна Отсутствует ilvIII serA gltBDF leuABCD Cp4 Cp5 Cp52 geu Биосинтез lie, Vai, Leu Биосинтез Ser Биосинтез Glu Биосинтез Leu Неизвестны Неизвестны Неизвестны Расщепление Gly
Репрессор Антагонист Важна Отсутствует sdaA tdh/kdl oppA BCD lysU CpGO C‘p61 ilvJK Cp36 Irp L-Ser-дезаминаза Thr-дегидрогеназа Поглощение олигопептидов Синтетаза Lys-тРНК I Теизвестиы Неизвестны Поглощение He, Vai Отсутствует Peiynarop
18.7. Смешанный механизм регуляции: репрессор ингибирует активатор
По меньшей мере семь промоторов у Е. coli ре-
гулируются по механизму отрицательного кон-
троля совместным действием специфического
репрессора (CytR) и общего регулятора сАМР-
Сгр, однако сам по себе комплекс сАМР-Сгр
действует как активатор. Одним из этих про-
моторов является deoCp (Рг) оперона deoC (см.
разд. 18.4.2), активность которого индуцирует-
ся цитидином (рис. 18.12). Комплекс сАМР-Сгр
связывается с двумя сайтами — Aj и А2, при
этом связывание с сайтом Ai уже обеспечива-
ет активацию, по для полной активации требу-
ется связывание и с сайтом Аг- Репрессию про-
мотора deoCp вызывает связывание комплексов
сАМР-Сгр с этими двумя пространственно раз-
деленными сайтами плюс связывание CytR с соб-
ственным сайтом, расположенным между ними.
Для осуществления репрессии CytR должен фи-
зически взаимодействовать с двумя комплексами
сАМР-Сгр, связанными с ДНК. Мутантные белки
Сгр, лишенные способности взаимодействовать с
CytR, пе подавляют транскрипцию с deoCp. Свя-
зывание CytR с ДНК пе обязательно для репрес-
сии, по оно обеспечивает стабильность образую-
щегося петлеобразного комплекса. Таким обра-
зом, отрицательный контроль с участием CytR
осуществляется путем подавления активности ак-
тиватора.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 539
Рис. 18.12. Промотор deoCp (Р2) у Escherichia coli.
А. Репрессор CytR осуществляет отрицательный кон-
троль, связываясь с оператором (О). локализованным
между сайтами связывания комплекса сАМР—Сгр (Aj
и Аг).
Б. В отсутствие репрессора CytR комплекс сАМР-Сгр,
связываясь с Ai, способствует активированию тран-
скрипции с данного промотора. Связывание с Аг не яв-
ляется необходимым для положительного контроля, но
обязательно для отрицательного контроля, опосредуе-
мого репрессором CytR. Сходный тип комбинированного
механизма регуляции существует в случае промоторов
оперонов cdd. tsx и cytR.
18.8. Инициация транскрипции зависит от структуры ДНК
Структура ДНК может выполнять роль регу-
ляторного фактора инициации транскрипции на
двух уровнях контроля: специфическом и общем.
18.8.1. Изменение степени сверхспирализации
ДНК влияет на многие промоторы
одновременно
Примером влияния структуры ДНК на уровне об-
щего контроля может служить регуляция тран-
скрипции изменением сверхспирализации ДНК.
Степень сверхспирализации ДНК служит либо
фактором стимуляции, либо подавления, либо не
влияет па активность промоторов. Как правило.
с70-РНК-полимсраза инициирует транскрипцию с
большого числа промоторов более эффективно,
когда ДНК-матрица свсрхспнрализовапа, а пс ре-
лаксирована. в результате того что сверхспиралн-
зация способствует связыванию и/или изомери-
зации РНК-полимеразы. По-видимому, в случае
сверхспирализованной матрицы величина энер-
гии активации для связывания белка и разде-
ления цепей ниже, чем в случае релаксирован-
ной. Добавление некоторых антибиотиков, а так-
же мутации в генах ферментов, влияющих на
сверхспирализацшо, оказывают действие па ак-
тивность многих промоторов. На сверхспирали-
зацию ДНК влияют в основном два фермента —
ДПК-гираза (гены дуг), образующая отрицатель-
ные сверхвитки, и топоизомераза I (ген top А),
которая удаляет отрицательные свсрхвитки (ре-
лаксирует) ДНК (см. разд. 14.1.2.). Инактивация
ДНК-гиразы снижает частоту инициации тран-
скрипции с упомянутых выше промоторов, тогда
как инактивация топоизомеразы Т ее увеличива-
ет. Известны также промоторы, активность ко-
торых возрастает при инактивации ДНК-гиразы
и снижается при инактивации топоизомеразы I
(см. разд. 28.1.3). На физиологическое значение
контроля транскрипции путем изменения степени
сверхспирализации ДНК указывает то, что увели-
чение сверхспирализации ДНК стимулирует тран-
скрипцию с промотора гопа, кодирующего топо-
изомеразу I (topА), и в то же время снижает
транскрипцию с промоторов генов, кодирующих
ДНК-гнразу (дугА и дуг В). Ауторегуляция син-
теза ДНК-гиразы и топоизомеразы I поддержи-
вает сверхспирализацию бактериальной ДНК на
постоянном уровне (см. разд. 14.1.2).
18.8.2. Изгибание ДНК влияет на активность
ближайших промоторов
Большинство белков, регулирующих активность
генов, при связывании с ДНК вызывает изги-
бание ее цепи в участке взаимодействия. Нали-
чие изгиба устанавливают на основании сравне-
ния электрофоретической подвижности фрагмен-
та, содержащего место изгиба, в нативных гелях с
подвижностью, рассчитанной для прямого фраг-
540 Часть V. Экспрессия генов и механизмы регуляции
Рис. 18.13. Регуляция транскрипции посредством изги-
бания ДНК на примере двух дивергентных промоторов,
Да2Ь и Раз, фага <^29 Bacillus subtilis. гтЛ-РНК-поли-
мераза (RNP) узнает Разъ или Раз в зависимости от
связывания с ними регуляторного белка р4 (димер; по-
казан штриховкой). Обратите внимание на ориентацию
РНК-полимеразы на двух промоторах. Промотор Раз не
содержит участков, сходных с консенсусной последова-
тельностью в области —35.
мента ДНК. Изгибание ДНК может влиять на
структуру ближайшего промотора, облегчая или
затрудняя формирование оптимальной структу-
ры комплекса промотора с РНК-полимеразой.
Кроме того, изгиб может способствовать или
препятствовать дополнительным белок-белковым
или ДНК-белковым взаимодействиям с участи-
ем белков, связанных с ДНК на удаленных одни
от другого участках. Активатор или репрессор
также способны действовать, вызывая изгибание
ДНК. Примерами этого могут служить два дивер-
гентных промотора фага ^29 Bacillus subtilis: Ра2Ь
(ранний промотор) и Раз (поздний промотор),
транскрибируемые сгА-РНК-полимсразой. Коди-
руемый фагом белок р4 с двойной функцией по-
давляет промотор Раз и активирует Ра2Ь путем
связывания с единственным сайтом, расположен-
ным в участке —79 п.н. от Раз tsp и —43 п.н. от
Ра2Ь tsp (рис. 18.13). Этот белок локализуется па
той же стороне ДНК, что РНК-полимераза на
промоторе Раз, и на противоположной стороне
ДПК относительно РНК-полимеразы на промото-
ре РА2Ь-
Если для эффективной инициации транскрип-
ции промотор должен «запирать» РНК-полиме-
разу, связывание белка и изгибание ДНК способ-
ствуют ее оптимальной конфигурации для акти-
вации и препятствуют репрессии
18.8.3. Метилирование ДНК
локально модулирует транскрипцию
с соседних промоторов
РсгНпяторное влияние на инициацию транскрип-
ции может оказывать метилирование нуклео-
тидной последовательности ДНК вблизи про-
мотора. Некоторые промоторы содержат после-
довательность GATC, в которой остаток А
метилируется с помощью фермента ДНК-аденин-
метилтрапсферазы (продукт гена dam у Е. coli-,
см. разд. 15.6.1). В транспозоне ТпЮ промо-
тор гена ДНК-транспозазы, содержащий после-
довательности GATC, десятикратно активирует-
ся, когда находится в неметилировапном или ча-
стично метилированном (по одной цепи) состоя-
нии, и подавляется, если метилированы обе цепи.
Этот промотор в клетках dam+ транскрибирует-
ся преимущественно в течение короткого перио-
да клеточного цикла, когда временно переходит в
частично метилированное состояние после про-
хождения репликационной вилки через этот уча-
сток. Напротив, транскрипция с промотора ге-
на dnaA Е. coli, содержащего несколько сайтов
GATC, подавлена, когда промотор находится в
псмстилированпом или частично метилирован-
ном состоянии, и активируется, когда он полно-
стью метилирован. В этом случае промотор вре-
менно репрессируется при прохождении репли-
кационной вилки. Полное метилирование ДНК
вблизи промотора dnaA служит сигналом для
инициации транскрипции в обоих направлениях
и обеспечивает механизм сопряжения регуляции
гена, например, с фазой деления клетки.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 541
18.9. Регуляторный эффект оказывают
изменения структуры и функции РНК-полимеразы
18.9.1. Существуют РНК-полимеразы,
кодируемые бактериофагами
У бактериофагов в соответствии с временной
регуляцией транскрипции гены ранних оперо-
нов, как правило, транскрибируются РНК-по-
лимеразой клетки-хозяина (в форме основного
холофермента) (см. гл. 26). Исключение состав-
ляет ДНК-содсржащий бактериофаг N4 Е. coli,
обладающий для этого специальной РНК-поли-
меразой. Отложенные ранние гены и поздние
гены бактериофагов транскрибируются с помо-
щью продукта раннего гена(-ов). Переключение
на транскрипцию более поздних генов в соот-
ветствующие периоды жизненного цикла может
происходить путем образования новых РНК-по-
лимераз. Так, некоторые бактериофаги (напри-
мер, ТЗ и Т7 Е. coli, SPG S. typhimurium и SPO1
В. subtilis) синтезируют новые РНК-полимеразы,
специфичные для поздних промоторов. Интерес-
но, что эти РНК-полимеразы представляют со-
бой одну полипептидную цепь мол. массой ме-
нее 100 кДа. Существование 1 аких ферментов по-
казывает, что аппарат синтеза РНК может быть
значительно проще, чем полных"! бактериальный
фермент, состоящий из нескольких субъединиц.
В отличие от такого холофермента эти фаговые
РНК-полимеразы распознают соседнюю нуклео-
тидную последовательность ДНК в промоторах,
перекрывающихся с точкой начала транскрипции,
и синтезируют РНК с более высокой скоростью
(-^200 нуклеотидов/с), чем бактериальная РНК-
полимсраза, что соответствует большей динамич-
ности жизненного цикла бактериофагов.
18.9.2. Замена сг-субъединицы изменяет
специфичность РНК-полимеразы
Для прокариот характерно наличие множествен-
ных сг-субъединиц (см. табл. 25.1 и 28.3). РНК-по-
лимеразы, содержащие различные сг-субъедипи-
цы, образуют семейство бактериальных РНК-по-
лимераз с общей основной структурой. Поскольку
сг-факторы определяют специфичность связыва-
ния с ДНК, образующиеся при их присоединении
холоферменты специфичны к промоторам. Холо-
фермент, содержащий основной, или вегетатив-
ный, сг-фактор (например, <т70 у Е. coli и а43 у
В. subtilis), транскрибирует подавляющее боль-
шинство генов в клетке. Холоферменты с ми-
норными сг-факторами транскрибируют отдель-
ные наборы оперонов и регулопов в ответ па спе-
цифические физиологические потребности. Хотя
сг-факторы различаготся по размерам, они обна-
руживают значительное сходство нуклеотидных
последовательностей, что свидетельствует о суще-
ствовании общей предковой последовательности.
Исключение составляет сго4-фактор энтеробакте-
рий. который пе обнаруживает сходства с други-
ми сг-субъединицами. Это указывает, что для вза-
имодействия с общего основой фермента важны
пе гомологичные последовательности, по некие
структурные свойства, h Тинорпые гг-факторы рас-
познают специфические промоторпые элементы
—35 и —10. Замена хт-субъсдиницы как эффек-
тивный способ получения различных РНК-ноли-
мераз позволяет клеткам регулировать два типа
оперонов. Опероны первого из этих типов коди-
руют белки, обеспечивающие ответ на стрессо-
вые условия или резкие изменения среды (напри-
мер, тепловой или химический шок, голодание;
см. табл. 20.1 и 28.3). Опероны второго типа коди-
руют белки, необходимые для процессов диффе-
ренцировки (например, формирования жгутиков,
развития фага или образования спор у бактерий;
другие примеры см. в гл. 22-28).
18.9.3. Ковалентная модификация
РНК-полимеразы переключает
транскрипцию с генов хозяина
на гены фага
При фаговой инфекции РНК-полимераза бакте-
рии-хозяина может модифицироваться фагом для
переключения аппарата транскрипции клетки с
экспрессии генов хозяина на экспрессию фаговых
генов. Так, в случае фага Т4 кодируемые фагом
белки ADP-рибозилируют а-субъединицу и фос-
форилируют /3- и /З'-субъедипицы, в результате
чего нарушается присоединение хт70-субъсдиницы
к основной структуре РНК-полимеразы. Тем са-
мым эта модификация подавляет или прекраща-
542 Часть V. Экспрессия генов и механизмы регуляции
ст синтез РНК клетки-хозяина на определенной
стадии жизненного цикла фага.
18.9.4. На РНК-полимеразу
влияет концентрация
гуанозинтетрафосфата (ppGpp)
При аминокислотном голодании происходит на-
копление ppGpp и в результате его регуляторно-
го эффекта клеточные ресурсы перенаправляют-
ся от транскрипции опсропов рРНК, тРНК и ри-
босомных белков, требующей больших затрат, на
транскрипцию оперонов, кодирующих ферменты
биосинтеза аминокислот (см. разд. 20.3).
Модификация РНК-полимеразы обеспечива-
ет возможность последовательной регуляторной
активации генов в строгом порядке, с высокой
специфичностью к промоторам и эффективно-
стью. В результате ковалентной или зависимой от
эффекторов модификации РНК-полимеразы «от-
ключаются» промоторы тех генов, транскрипция
которых нс требуется в данных условиях, и акти-
вируются необходимые промоторы.
18.10. Элонгация и терминация транскрипции также подвержены регуляции
Исходно предполагалось, что как только РНК-
полнмсраза. покидает промотор в виде комплек-
са элонгации, процесс транскрипции протекает
непрерывно и завершается только при достиже-
нии сигнала терминации в конце транскрипцион-
ной единицы (оперона). Однако на самом деле
перемещение РНК-полимеразы происходит нерав-
номерно и в определенных участках прерывает-
ся паузами или преждевременной гермпнацией.
На оба процесса — наступление пауз и термина-
цию элонгации — регуляторно влияют белки, ми-
шенью действия которых служит не ДНК, а РНК.
Регуляция терминации транскрипции (см.
разд. 15.2.2) обеспечивает 1) обозначение гра-
ницы транскригпщонной единицы (оперона);
2) изменение транскрипции оперона в ответ на
избыток генных продуктов (аттенуация); 3) сни-
жение уровня транскрипции последователь-
но расположенных генов в пределах единицы
(природная полярность): 4) прерывание тран-
скрипции в случае преждевременной остановки
трансляции (мутационная полярность); 5) свя-
зывание отдельных опсропов. которые могут не
иметь собственных промоторов, в общую тран-
скрипционную единицу (антитерминация) и
б) предупреждение преждевременной терминации
транскрипции длинных нетранслируемых РНК.
18.10.1. Внутриоперонная терминация
транскрипции и полярные эффекты
Для нонсенс-мутации и мутаций со сдвигом рам-
ки считывания характерны полярные эффек-
ты, влияющие на экспрессию оперона. Такие му-
тации инактивируют цистропы, в которых они
происходят, и снижают или исключают экспрес-
сию цистронов. более удаленных от промотора
относительно сайта мутации в полпцистроппых
оперонах. Этот феномен, называемый мутаци-
онной полярностью, заключается в термина^
ции транскрипции, обусловленной присутствием
в опероне сайтов rut и Rho-зависиыых сайтов —
^-сигналов (терминации). Сигнал ti, находя-
щийся в латентном состоянии, активируется,
когда трансляция этого участка преждевре-
менно останавливается на стоп-кодоне и раз-
общается с транскрипцией. Это прекращение
трансляции демаскирует участок растущей це-
пи РНК (сегмент rut), предшествующий сай-
ту ti, и позволяет Rho-фактору воздейство-
вать на РНК-полимеразу (рис. 18.14). Мутацион-
ный полярный эффект устраняют мутации гена
rho. Преждевременная остановка трансляции
не является обязательной для активации ла-
тентных внутриопероппых сайтов терминации.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 543
Рис. 18.14. Модель полярного эффекта.
А Сопряженные транскрипция и трансляция.
Б. Отделение рибосом от мРНК, обусловленное присут-
ствием бессмысленных (нонсенс-) мутаций (стоп-кодон,
знак х), позволяет фактору Rho связываться с растущей
цепью РНК, используя сайт rut. Rho-фактор после зави-
симого от гидролиза АТР перемещения вдоль демаски-
рованной мРНК встречается с РНК-полимеразой (RNP),
остановившейся на шпилечной структуре в РНК, соот-
ветствующей внутригенному терминатору транскрипции
(it), что приводит к преждевременной терминации и
препятствует транскрипции генов этого оперона, более
удаленных от промотора. При наличии мутации, приво-
дящей к дефекту фактора R'io, такой преждевременной
терминации не происходит. В терминации транскрипции
могут участвовать и другие белки (NusA или NusG), вли-
яющие на длительность задержки РНК-полимеразы в
отдельных сайтах в процессе элонгации.
Если связывание рибосом с растущей цепью РНК
происходит с низкой частотой, расстояние меж-
ду РНК-полимеразой и замыкающей цепь рибо-
сомой увеличивается, и это обеспечивает доступ
Rho-фактора к РНК для осуществления терми-
нации. Процесс усиливается в результате дегра-
дации демаскированной мРНК. Данный феномен
получил название природная полярность (см.
также разд. 15.5).
18.10.2. Регуляция путем задержки
РНК-полимеразы в процессе
освобождения промотора
Для двух бактериальных оперонов, pyrBI и
galETKM Е. coli, обнаружен новый механизм ре-
гуляции транскрипции — изменением внутрикле-
точной концентрации UTP. Этот нуклеотид вы-
зывает задержку РНК-полимеразы в процессе
освобождения промотора и тем самым подавляет
транскрипцию с промоторов pyrBI и да1Ер2. На-
чальная нуклеотидная последовательность РНК
в участках tsp этих двух промоторов представ-
ляет собой ррр(А)]-2(и)з .... При высокой кон-
центрации UTP in vitro РНК-полимераза задер-
живается па уридиновых кластерах и произво-
дит вместо полноценного транскрипта большое
количество псевдоматричного продукта с нуклео-
тидной последовательностью ppp(A)i_2(U)n, где
п 20. При низкой концентрации UTP тран-
скрипция продолжается обычным путем без за-
держки. Значение отрицательного контроля по-
средством UTP гена pyrBI, кодирующего фер-
менты синтеза предшественников UTP, очевидно.
Отрицательный контроль гена galETKM связан,
вероятно, с участием остатков уридина в каче-
стве промежуточных продуктов в метаболизме га-
лактозы (например, UDP-галактозы). Регуляция
экспрессии генов изменением концыгграции нук-
леотидов в клеточном пуле представляет собой,
возможно, более распространенный феномен, чем
считается в настоящее время.
18.10.3. Контроль элонгации и терминации
транскрипции путем аттенуации
Регуляция транскрипции путем аттенуации па
специфическом сайте терминации, локализован-
ном между лидерным участком к первым струк-
турным геном, наблюдается как в анаболических,
так и в катаболических оперонах. В контроле пу-
тем аттенуации участвуют терминаторы Т и IT ти-
пов (см. разд. 15.2.2). Транскрипция всего опере-
на происходит только при устранении этого сиг-
нала аттенуации.
Опероны синтеза аминокислот □ Регуля-
ция оперонов синтеза аминокислот различает-
ся отдельными деталями, но во многих случа-
ях включает контроль путем аттенуации. Общий
механизм представлен на рис. 18.15 на приме-
ре оперона trp у Е. coli. Лидерный транскрипт
может формировать несколько различных шпи-
лек, одна из которых (в случае спаривания 3
и 4 участков) образует терминаторпую структу-
ру I типа. При этом образование шпильки 1:2 до-
пускает формирование шпильки 3:4, тогда как
образование шпильки 2:3 предотвращает фор-
мирование шпильки 3:4. Лидерный пептид со-
держит «регуляторные кодоны», которые соот-
ветствуют аминокислоте — конечному продукту
544 Часть V Экспрессия генов и механизмы регуляции
Таблица 18.4. Регуляторные кодоны в лидерных пептидах оперонов биосинтеза аминокислот у Е. coli
Оперон Аминокислотная последовательность лидерного пептида Am и нокислоты- регуляторы
trp thr his ivlGDMEA leu PheA ilvBN Met Lys Ala He Phe Vai Leu Lys Gly Trp Trp Arg Thr Sei- Met Lys Arg lie Ser Thr Thr He Thr Thr Thr lie Thr lie Thr Thr Gly Asn Gly Ala Gly Met Thr Arg Vai Gin Phe Lys His His His His His His His Pro Asp Met Thr Ala Leu Leu Arg Vai lie Ser Leu Vai Vai He Ser Vai Vai Vai He He He .. ,,, Pro Pro Cys Gly Ala Ala Leu Gly Arg Gly Lys Ala Met Ser His He Vai Arg Phe Thr Gly Leu Leu Leu Leu Asn Ala Phe lie Vai Arg Gly Arg Pro ... ,., Vai Gly Gly He Gin His Met Lys His He Pro Phe Phe Phe Ala Phe Phe Phe Thr Phe Pro Met Thr Thr Ser Met Leu Asn Ala Lys Leu Leu Pro Thr Ala Pro Ser Ala Ala Vai Vai Vai . ... Vai Arg Vai Vai Vai Vai Vai Gly Asn Ala Pro Trp Thr, He His He, Vai, Leu Leu Phe Vai, Leu
Рис. 18,15. Регуляция транскрипции по механизму ат-
тенуации у Escherichia coli.
А. На Б'-конце мРНК trp присутствует лидерный уча-
сток (незакрашенный прямоугольник), кодирующий ли-
дерный пептид. Заштрихованный прямоугольник — ре-
гуляторные кодоны. Стрелками показаны участки (1-4),
способные формировать шпилечные структуры в РНК.
Б. Если рибосомы (показаны серым) завершают транс-
ляцию лидерного пептида (т. е. нагруженные тРНКТгр
присутствуют в достаточном количестве), образуется
шпилька 3 : 4, терминирующая трансляцию.
В. Если рибосомы тормозятся на регуляторных кодо-
нах из-за отсутствия нагруженных тРНКТгр, происходит
формирование шпильки 2 : 3, предотвращающей атте-
нуацию.
данного оперона (например, кодоны Тгр в лидер-
ном пептиде оперона trp). При недостатке дан-
ной аминокислоты и, следовательно, соответству-
ющих аминоацил-тРНК, рибосома тормозится на
соответствующих регуляторных кодонах. В этом
случае лидерпый участок РНК образует шпиль-
ку 2:3, что позволяет продолжать транскрип-
цию, минуя сигнал аттенуации. Если данные
а^иноацил-тРНК присутствуют в достаточном
количестве, рибосома останавливается только в
конце лидерного пептида, что препятствует фор-
мированию шпильки 2:3 и тем самым приводит к
образованию шпильки 3:4, вызывая аттенуацию.
Как предполагается, мутации в генах амивюацил-
тРНК-сиптетаз и тРНК. специфичных к регуля-
торным кодонам, приводят к стимуляции тран-
скрипции сквозь сигнал аттенуации, тогда как му-
тации, влияющие на синтез лидерного пептида,
способствуют аттенуации. Мутации с заменой ос-
нований или делеции ключевых нуклео гидов, из-
меняющие относительную стабильность шпилек,
также нарушают контроль по механизму аттену-
ации предсказуемым образом. Регуляторные ко-
доны лидерных пептидов в различных аминокис-
лотных оперонах приведены в табл. 18.4.
Замена набора регуляторных кодонов в дан-
ном аминокислотном оперопе набором кодонов
для другой аминокислоты устраняет регуляцию
в ответ па голодание по первой аминокислоте.
Однако повью лидерные участки могут быть под-
вержены регуляции в ответ на голодание по ами-
нокислоте, соответствую] цей этим регуляторным
кодонам. Следует отметить, что лидерпый пеп-
тид оперона, кодирующего ферменты биосинтеза
более чем одной аминокислоты (в разветвленных
путях, например, thr и ilvGMEDA), содержит ре-
гуляторные кодоны для всех этих аминокислот.
В случае одних оперонов, контролируемых путем
Глава 18. Регуляция экспрессии генов: опероны и регулоны 545
аттенуации, может существовать также контроль
инициации транскрипции с участием репрессора,
тогда как другие (например, оперон биосинтеза
гистидина, his) лишены такого контроля.
Антитерминация определяется вторичной
структурой лидерной РНК, связана с цис-эффек-
тами и осуществляется в процессе трансляции
лидерного пептида данного оперона, по не под
действием самого пептидного продукта. Переме-
щение транслирующей рибосомы обусловливает
формирование в РНК альтернативных шпилько-
образных структур, которые либо способствуют,
либо препятствуют терминации транскрипции па
сайте аттенуации.
Биосинтез пиримидинов □ Контроль по-
средством аттенуации осуществляется также в
случае бактериальных оперонов биосинтеза пи-
римидинов. При транскрипции оперона pyrBI у
Е. coli от степени сопряжения между транскрип-
цией и трансляцией лидерного участка зави-
сит, образуется ли в лидерной мРНК шпилечная
структура, вызывающая аттенуацию. Лидерная
РНК оперона pyrBI не содержит других шпи-
лечных структур; она кодирует лидерный пеп-
тид, состоящий из 44 аминокислотных остатков,
и включает важный участок из 8 остатков уриди-
на, расположенный на 20 нуклеотидов выше сай-
та терминации. При низкой концентрации UTP
РНК-полимераза задерживается на уридиновом
кластере и это обеспечивает достаточный проме-
жуток времени для того, чтобы рибосома мог-
ла начать синтез лидерного пептида и догнать
заторможенную РНК-полимеразу. В результате
достигается сопряжение транскрипции и транс-
ляции, помогающее разрушить терминирующую
шпильку, пройти уридиновый кластер и избежать
преждевременной терминации транскрипции. На-
против, при высокой концентрации UTP тран-
скрипция уридинового кластера происходит без
паузы, что препятствует сопряжению и способ-
ствует формированию терминирующей шпильки.
Мутации рибосомных генов, снижающие скорость
элонгации трансляции, пропорционально понижа-
ют уровень экспрессии pyrBI даже при недостат-
ке UTP. Интересно, что лидерный пептид оперона
pyrBI у Е. coli длиной 238 аминокислотных остат-
ков функционально представляет собой фермент
процессинга тРНК, РНКазу Р. На самом деле этот
оперон является двухцистронным, причем сигнал
аттенуации расположен между двумя цистрона-
ми, первый из которых кодирует лидерный пеп-
тид.
Уровень экспрессии генов биосинтеза пири-
мидинов, соответствующий внутриклеточной кон-
центрации UTP, обеспечивается наряду с кон-
тролем путем задержки РНК-полимеразы (см.
разд. 18.10.2) также и контролем посредством
преждевременной аттенуации.
Аминоацил-тРНК-синтетазы □ При не-
достатке в клетках каких-либо аминокислот
повышается концентрация соответствующих
синтетаз, и это позволяет эффективнее использо-
вать остаточное количество лимитирующей ами-
нокислоты. Таким образом, клетка может быст-
ро восстановить нормальное состояние благодаря
дерепрессии генов, кодирующих ферменты био-
синтеза необходимой аминокислоты. У Е. coli и
родственных бактерий гены аминоацил-тРНК-
синтетаз аминокислот регулируются с участием
разнообразных механизмов, включая контроль
путем аттенуации, как в оперопах синтеза ами-
нокислот. В то же время у Bacillus subtilis и,
весьма вероятно, у Lactobacillus casei большин-
ство генов аминоацил-тРНК-синтетаз регули-
руется путем обычного механизма аттенуации,
при котором терминация зависит от образова-
ния вторичных шпилечных структур в лидер-
ной РНК. Несмотря на значительные различия
первичной структуры лидерных участков мРНК
для разных синтетаз, эти вторичные структу-
ры обнаруживают удивительную консерватив-
ность. В качестве примера подобных структур
на рис. 18.16 приведена структура лидерного
участка мРНК тирозил-тРНК-синтетазы. Сигна-
лом, указывающим на недостаток акцептируемой
аминокислоты, служит ее кодон, присутствую-
щий в идентичной позиции (спецификаторной
последовательности) в каждой лидерной струк-
туре. Данный регуляторный механизм требует
наличия в качестве эффектора соответствующей
тРНК (с антикодоном для данной аминокислоты),
хотя регуляторный кодон не транслируется. Низ-
кому уровню этой аминокислоты соответствует
высокий уровень данной свободной тРНК, и в
этом случае тРНК взаимодействует с растущей
лидерной РНК посредством связывания кодон-
антикодон в области спецификаторной последо-
вательности (и, вероятно, в других участках). Это
546 Часть V. Экспрессия генов и механизмы регуляции
с с и
с /с
С ™ А
С
С
с с и
/ с
70 ,
с
A—U
60-U—А
А С А С —С 80
с С
Терминатор
60—и—А
АСА С—С 80
лС-С а С
U-50
U
С
CCAU С-С
U—А
40—A—U—90
и—А
с-с
с—с
и—А
и—А
С—С
с—с
С—С-260
240—U—С
С—С
С-С
U U
A U
A U
с и
А 110—А С A U U
20—А С С 180-А А О
А С А С С U А 270-А
U С A U —A A U-230 и
С С-С С —U С A U
С О —A A — U- UC С U
A U—A U—А С С U
А и—А —150 A —U U С
A U —С А — О С
А 120 С-U С —С220С С
С АХС—С д \ A — U U А
10—и А и с С—С Т-сегмент
А А д А—и
U СA—UС a—U
С A—U
U С—С
и С—С
С —С -200
U С
и и
С 130 —С—С III
С С А
А С £ С
А и
Б
Анти терминатор
АСс с—V—240
С с иС-С
40—A—U—90
U—А
A—U
A—U
и"50 и С-С
UCCAU С-С
160-С
110—А
A—U
С—С
и—А
U-A-150
и—С
120 С —U
U—А
с—С —200
V С
и и
III
и—170 А /
230—U—А
A—U
С—С
с—и
и—А
С —U
А-0-210
U—А
A —U
A —U
С—С
С A —U С
A —U—140
A—U
Рис. 18.16. Структура лидерного участка мРНК тирозил-тРНК-синтетазы, tyrS, у Bacillus subtilis. А. Форма, благо-
приятствующая терминации. Б. Форма, благоприятствующая антитерминации. Числа показывают позицию отно-
сительно tsp. Римские цифры обозначают участки образования шпилечных структур I, II и III. Между шпилечными
структурами II и III расположена полностью консервативная последовательность CGUUA (позиции от 167 до 171 в
tyrS), которая у многих прокариот присутствует в участках потенциальных вторичных структур. Существует также
высококонсервативная последовательность CAGAGA в позициях от 52 до 57 в tyrS. Нуклеотидные остатки, отмечен-
ные серыми квадратами, указывают спецификаторные последовательности. Точка начала трансляции находится в
районе позиции +298 ниже терминатора транскрипции.
В. Модель активации tyrS ненагруженной тирозил-тРНК. Структура «клеверный лист», показанная серым, означает
ненагруженную или нагруженную тирозином тирозил-тРНК. Последняя по порядку шпилечная структура обознача-
ет терминатор (верхняя часть) или антитерминатор (нижняя часть). При высокой концентрации тирозина большая
доля тирозил-тРНК нагружена и не способна взаимодействовать соответствующим образом с лидерной мРНК, по-
этому концентрация тирозина снижается, количество ненагруженной тирозил-тРНК повышается и ее кодон взаимо-
действует с антикодоном спецификаторной последовательности растущего транскрипта. В результате формируется
(или стабилизируется) антитерминаторная структура, которая позволяет считывать терминатор. По [3].
Глава 18. Регуляция экспрессии генов: опероны и регулоны 547
приводит к формированию структуры, благопри-
ятной для антитерминации в сайте аттенуации.
При высокой концентрации данной аминокисло-
ты большая часть ее тРНК нагружена и, по-
скольку в такой форме тРНК не способна взаи-
модействовать с лидерным участком, происходит
образование терминаторной структуры. Замена
регуляторного кодона па кодон другой аминокис-
лоты, а также введение бессмысленного (нонсенс)
кодона в это положение приводит к неиндуцибель-
ному фенотипу.
Механизм аттенуации является примером того,
что взаимодействие кодон-антикодон может ис-
пользоваться не только для дешифровки генети-
ческого кода, по и для другой цели.
Разложение триптофана □ По механизму
аттенуации регулируются также опероны, коди-
рующие ферменты катаболизма. В этом случае
контроль основан на принципе мутационной по-
лярности. Транскрипцию оперона tnaAB у Е. coli,
кодирующего ферменты деградации триптофа-
на, индуцирует триптофан. Сайт аттенуации в
опероне tna — это Rho-зависимый терминаторный
сигнал II типа; синтезируемая на нем лидерная
РНК не образует четко выраженной шпилечной
структуры. Эта РНК длиной 319 нуклеотидов
кодирует лидерпый пептид из 24 аминокислот-
ных остатков и содержит единственный кодон для
триптофана в определяющей позиции. В отсут-
ствие триптофана рибосомы останавливаются на
этой позиции, что позволяет фактору Rho присо-
единиться к РНК, вызвав тем самым терминацию.
При избытке триптофана эффект Rho и термина-
ция предотвращаются и происходит 100-кратная
стимуляция экспрессии оперона tnaAB.
Механизмы задержки и аттенуации, посред-
ством которых регулируется элонгация тран-
скрипции, просты и определяются полностью
первичной структурой ДНК. Их обеспечивает
обычный аппарат транскрипции и трансляции без
участия специальных регуляторных белков.
18.10.4. Антитерминация транскрипции
требует участия регуляторных белков
В регуляции транскрипции путем антитермина-
ции во многих дискретных сайтах терминации,
имеющихся в крупных оперонах, участвуют ре-
гуляторные белки. Фактор-зависимая антитерми-
нация действует, например, в оперонах, коди-
рующих ферменты деградации /3-глюкозидов и
биосинтеза пуринов у Е. coli, а также разложе-
ния сахарозы у В. subtilis. У бактериофагов се-
мейства Л регуляцию ряда процессов обеспечива-
ет модифицированный механизм антитерминации
(см. гл. 26).
На каждой стадии транскрипции после обра-
зования первой фосфодиэфирной связи возмож-
на регуляция в соответствии с метаболическими
потребностями, в которой участвуют различные
метаболические или генетические сигналы.
18.11. Регуляция активности генов происходит в том числе
путем рекомбинации ДНК
Неограниченное разнообразие регуляторных ме-
ханизмов, участвующих в процессах роста и раз-
вития, включает сайт-специфичную реципрокную
рекомбинацию с перестройкой первичной струк-
туры ДНК для контроля экспрессии генов. Если
мутации, происходящие с частотой не более 10~6,
могут необратимо активировать или инактиви-
ровать гены, то перестройки структуры ДНК,
происходящие с частотой 10~5-10“2, многократ-
но «отключают» и «включают» гены, обеспечи-
вая адаптацию организма к изменениям условий
среды или изменения метаболизма в ходе жизнен-
ного цикла.
18.11.1. Инверсия промотора:
фазовая вариация у Salmonella
Белок флагеллин, образующий волокно жгутика
у Salmonella и обладающий антигенными свой-
ствами, представлен у этих бактерий двумя им-
548 Часть V. Экспрессия генов и механизмы регуляции
мунологически различными типами, и клетки
с определенной частотой переключаются с син-
теза белка одного типа на синтез другого —
свойство, называемое фазовой вариацией (см.
разд. 33.4.1). Изменение антигенных свойств поз-
воляет патогенным бактериям рода Salmonella
обходить защитные механизмы хозяина. Гены, ко-
дирующие два. взаимоисключающих типа анти-
генных белков флагеллинов, HagA и HagB (полу-
чивших у разных штаммов Salmonella различные
названия), локализованы в разных сегментах ее
хромосомы.
Фазовая вариация происходит (в зависимо-
сти от штамма Salmonella) с частотой 10-5-
1СГ3 в расчете на клетку одного поколения.
транс-Активным репрессором гена hagA служит
белок HagR; ген этого белка образует с геном
hagB общий оперон (рис. 18.17; см. цв. вклей-
ку). Благодаря этому координированный синтез
HagB и HagR приводит к подавлению активности
гена hagA. В альтернативой фазе регуляторный
элемент локуса hagB подавляет экспрессию hagB
и hagR, дерепрессируя синтез флагеллипа HagA
(ген hagA). Регуляторным элементом локуса hagB
служит инвертируемый сегмент ДНК, содержа-
щий промотор для оперона hagBR и независимо
экспрессируемый ген hin, продукт которого, Hin,
катализирует инверсию данного сегмента. При од-
ной ориентации этого сегмента указанный промо-
тор объединяется с опероном hagBR, тогда как
при другой промотор ориентируется в противопо-
ложном направлении, что и определяет фазовую
вариацию.
Опосредуемая белком Hin инверсия сегмен-
та ДНК происходит путем сайт-специфичной
рекомбинации между двумя инвертированными
нуклеотидными повторами, hixL и hixR. Реком-
бинацию стимулирует связывание белка Fis с
энхансерным сайтом, которое приводит к из-
гибанию ДНК и способствует формированию
ДНК-мультибелкового рекомбинационного ком-
плекса с соответствующим расположением аг-
регатов ДНК-ДНК, ДНК-белок и белок-белок.
Мутации в генах hin, hixL или hixR блокируют
экспрессию флагеллинов обоих типов.
Подобный этому механизм регулирует экс-
прессию пилей I типа у Е. coli', в нем также участ-
вует инвертируемый промотор, от которого зави-
сит образование пилей. Наличие пилей I типа обу-
словливает вирулентность штаммов; обладающие
ими клетки прикрепляются к клеткам эпителия,
эритроцитам и лейкоцитам. Однако, в отличие от
системы hin, рекомбинацию, активирующую или
инактивирующую оперон, в данном случае стиму-
лируют различные белки, FimE и FimB соответ-
ственно (см. разд. 33.4.1).
18.11.2. Спектр хозяев у бактериофагов
может изменяться в результате
инверсии структурных генов
Повышение выживаемости бактериофагов Ми,
D108 и Р1 обеспечивают гомологичные инверти-
руемые сегменты ДНК, контролирующие спектр
хозяев и способствующие адаптации фага к изме-
нениям среды. Инверсию катализирует рекомби-
наза. Например, фаг Ми в одной фазе связыва-
ется с липополисахаридными рецепторами Е. coli
К-12, тогда как в другой фазе вообще не способен
инфицировать этот штамм, но инфицирует Е. coli
С, Citrobacter, Shigella и Serratia. В случае из-
менения спектра хозяев путем инверсии ДНК
соответствующий сегмент лишен промотора, но
включает два набора генов, ответственных за спе-
цифичность отростков фага к хозяину. Какой из
этих наборов будет транскрибироваться, зависит
от способа ориентации инвертируемого сегмента
ДНК, расположенного вслед за промотором. При
одной его ориентации транскрибируются гены от-
ростков, обусловливающих адсорбцию па клетках
Е. coli К-12; при иной — гены отростков, специ-
фичных к другим энтеробактериям (рис. 18.18;
см. цв. вклейку).
Примечательно, что рекомбиназы Gin у фага
Mu, Pin у фага Р1 и Hin у Salmonella обнаружи-
вают перекрестную комплементарность и значи-
тельное сходство аминокислотных последователь-
ностей.
18.11.3. Синтез сг-субъединицы в процессе
спорообразования у В. subtilis
происходит путем объединения
разделенных генов
Часть специфических для спорообразования ге-
нов транскрибируется в материнских клетках
В. subtilis с участием сгк-РНК-полимеразы (см.
разд. 25.1.3). Ген фактора сгк в бактериаль-
ной хромосоме представлен двумя отдельно рас-
положенными сегментами, spoIV СВ и spoIIIC
Глава 18. Регуляция экспрессии генов: опероны и регулоны 549
(рис. 18.19; см. цв. вклейку), которые разделя-
ет участок длиной 10 т.п.н.. Они объединяются в
единую рамку считывания в результате катали-
зируемой белком SpoIVCA сайт-специфичной ре-
комбинации между двумя прямыми нуклеотид-
ными повторами на промежуточной стадии спо-
рообразования. Данный феномен рекомбинации
не может быть реципрокным или обратимым, так
как материнская клетка и ее хромосома на послед-
ней стадии спорообразования отделены от пред-
споры. Субъединица <тк участвует в синтезе кор-
текса и оболочки предспоры, которые отделяют
последнюю от материнской клетки, поэтому пе-
риод синтеза сгк ограничен; клетка не может осу-
ществлять фоновый синтез <тк и соответственно
перемещать разделенные гены.
Регуляция экспрессии генов путем их рекомби-
нации, по-видимому, характерна для нескольких
систем, связанных с дифференцировкой у мик-
робов, например для образования плодовых тел
у миксобактерий, воздушного мицелия у стреп-
томицетов и гетероцист у Anabaena (см. гл. 24
и 25). Аналогичный механизм регуляции харак-
терен также для некоторых генов, связанных с
вирулентностью и патогенностью у бактерий (см.
разд. 33.4.1).
Запрограммированная сайт-спеифичная ре-
комбинация служит для стимуляции или подав-
ления активности генов путем разделения или
объединения промоторов и структурных генов ли-
бо отдельных сегментов одного и того же струк-
турного гена. По такому механизму обычно ре-
гулируются необратимые процессы, характерные
для клеточной дифференцировки.
18.12. Экспрессия генов зависит от метаболизма РНК
В одной из первых моделей регуляции син-
теза индуцибельных ферментов было посту-
лировано существование мРНК, синтезируемой
конститутивно, ио подвергающейся быстрой де-
градации. Предполагалось, что присутствие ин-
дуктора предотвращает распад мРНК, об вспени-
вая ее трансляцию. Однако на самом деле у прока-
риот регуляция происходит в основном на уровне
синтеза мРНК, а не на уровне ее деградации (см.
разд. 15.2.3).
Обычно мРНК транслируются у прокариот
в той же форме, в какой образуются, но су-
ществуют исключения, например в случае тран-
скриптов генов некоторых бактериофагов, а
также генов стабильных форм бактериальных
РНК, функциональная форма которых образу-
ется в результате процессинга РНК под дей-
ствием рибонуклеазы (РНКазы III). Сайты для
расщепления этой РНКазой расположены в
участках неспарепных оснований, «вздутиях», в
шпилечных структурах.
Наряду с расщеплением мРНК для предотвра-
щения бесполезной трансляции после завершения
транскрипции существуют специфические меха-
низмы деградации мРНК для осуществления ее
процессинга, обеспечивающего регуляцию экс-
прессии генов
18.12.1. Процессинг необходим для образования
рРНК и тРНК из более длинных
Р Н К- предшествен н и ков
Стабильные РНК транскрибируются у бактерий
в виде более длинных последовательностей. На-
пример, молекула РНК, синтезируемая с оперо-
нов гт с участием механизма антитерминации,
содержит 23S-, 16S- и 5S-pPHK плюс несколько
тРНК-последовательностзй (рис. 18.20). Этот
крупный транскрипт разрезается РНКазой III
с образованием индивидуальных молекул, при
дальнейшем процессинге которых формируются
зрелые формы рРНК и тРНК.
18.12.2. Процессинг мРНК бактериофагов
Транскрипция ранних генов бактериофага Т7 с
участием РНК-полимеразы хозяина приводит к
образованию полицистронной мРНК, кодируемой
этими генами. Перед трансляцией такая РНК
подвергается процессингу, а именно разрезается
550 Часть V. Экспрессия генов и механизмы регуляции
Рис. 18.20. Процессинг РНК у Escherichia coli. Суще-
ствует семь оперонов (ггл) стабильных форм РНК. Каж-
дый их них содержит гены 23S-pPHK (гг/), 16S-pPHK
(rrs), 5S-PHK (rtf), а также нескольких тРНК. Эти функ-
циональные цистроноподобные гены РНК, разделенные
промежуточными участками (спейсерами), транскриби-
руются в виде общей молекулы РНК, которая подвер-
гается затем процессингу — разрезанию РНКазой III в
специфических сайтах с образованием зрелых функци-
ональных рРНК, тРНК и других молекул. Показаны про-
моторы (pi, рг) и терминаторы (ti, £2).
РНКазой III на меньшие фрагменты, представля-
ющие собой отдельные виды РНК. В случае фага
А процессинг с участием РНКазы III приводит к
расщеплению мРНК гена int (см. разд. 26.4.3). Де-
градация мРНК может обеспечивать регуляцию
экспрессии генов в противоположных направле-
ниях в результате освобождения мРНК от вторич-
ных структур.
18.12.3. Сплайсинг мРНК у прокариот
происходит как редкое событие
Имеющиеся в цистронах интроны отсутству-
ют в транслируемой мРНК. У эукариот интро-
ны обычно вырезаются из первичных продуктов
транскрипции, однако у бактерий, за редкими
исключениями, интроны в РНК не обнаружива-
ются. Несколько интронов содержит геном бак-
териофага Т4; они удаляются из мРНК посред-
ством сплайсинга в цикле размножения фага. При
сплайсинге in vitro к 5х-концу интрона в мРНК
присоединяется G-остаток. У фага Т4 единствен-
ный интрон имеется в гене тимидилатсинтетазы
(М). Этот интрон удаляется in vitro из мРНК td
путем аутосплайсинга. По-видимому, в реакциях
сплайсинга in vivo у бактерий и фагов участвуют
транс-активные белковые факторы.
18.13. Во многих случаях регуляция осуществляется на уровне трансляции
Регуляция трансляции у прокариот может осу-
ществляться на этапах инициации, элонгации или
терминации. Если контроль транскрипции в опе-
ронах и регул он ах помогает координировать экс-
прессию группы структурных генов, то контроль
трансляции предназначен для дальнейшей тонкой
регуляции количества синтезируемых генных про-
дуктов. В некоторых случаях контроль трансля-
ции означает выбор рамки считывания.
18.13.1. Трансляцию могут подавлять белки
или антисмысловая РНК
Подавление трансляции происходит посредством
связывания молекулы белка или «антисмысло-
вой» РНК с мРНК; такое связывание препят-
ствует взаимодействию рибосомы с сайтом свя-
зывания (Rbs) либо стерически, либо индуцируя
конформационные изменения в РНК. Примеры
белков, подавляющих трансляцию, приведены в
табл. 18.5.
Опероны рибосомных (R-) бел ко в □ Гены
R-белков (rps и грГ) присутствуют в нескольких
оперонах, содержащих гены с различными функ-
циями (рис. 18.21). В каждом случае регулятор-
ный R-белок связывается со специфической нук-
леотидной последовательностью его собственной
мРНК. Этот сайт связывания R-белка локализо-
ван вблизи сайта rps первого гена R-белков из ре-
гулируемого набора. Последовательности соответ-
ствующих специфических сайтов сходны с сайта-
ми связывания R-белков в рРНК. Таким путем
ауторегуляция синтеза R-белков через синтез ри-
босомной РНК сопряжена с контролем скорости
роста клеток. Когда скорость синтеза рРНК соот-
ветствует высокой скорости роста, регуляторные
R-белки преимущественно связываются с рРНК,
поскольку сродство этих белков к рРНК выше,
чем к мРНК, и, следовательно, их свободный ре-
зерв отсутствует. Когда сборка рРНК в рибосомы
заканчивается, R-белки накапливаются и связы-
ваются с мРНК, что приводит к подавлению даль-
Глава 18. Регуляция экспрессии генов: опероны и регулоны 551
Таблица 18.5. Подавление трансляции
Белки, подавляющие трансляцию Мишень Сайт связывания
Белок оболочки бактериофага R17 ДНК-полимераза бактериофага Т4 Белок RcgA бактериофага Т4 Рибосомные (R) белки Продукт gp32 бактериофага Т4 Ген репликазы бактериофага R17 ДНК-полимераза бактериофага Т4 Ранние гены бактериофага Т4 Гены R-белков Ген 32 бактериофага Т4 Сайт связывания рибосомы (Rbs) Сайт связывания рибосомы (Rbs) Инициирующий кодон ATG Инициирующий кодон ATG 5Z-Лидерная РНК, включая иниции- рующий кодон ATG
Рис. 18.21. Опероны, содержащие гены ри-
босомных (R) белков у Е. coli. Специфиче-
ский R-белок (показан кружком) в каждом
опероне ауторегул и рует на уровне трансля-
ции как собственный синтез, так и синтез
продуктов нескольких соседних генов (обве-
дены прямоугольниками).
нейшей трансляции. Таким образом, сопряжение
уровня рРНК с регуляцией трансляции при уча-
стии R-белков способствует поддержанию необхо-
димого равновесия в клетке. Точный молекуляр-
ный механизм, посредством которого подавляется
синтез именно R-белков, а не других белков того
же оперона, пока неизвестен. Эта стратегия поз-
воляет исключить связанную с ростом регуляцию
синтеза нерибосомных белков, гены которых вхо-
дят в общие с генами рибосомных белков опероны;
синтез этих нерибосомпых белков контролируют
другие механизмы (рис. 18.2).
Общее свойство опсронов рибосомных (R) бел-
ков—это ауторегуляция одним из них своего
собственного синтеза и синтеза всех остальных
R-белков, кодируемых данным опероном.
Белки фага Т4 □ Некоторые репрессоры
трансляции имеют фаговое происхождение. Бе-
лок gp32 фага Т4, связывающий одноцепочеч-
ную ДНК, может взаимодействовать специфич-
но с собственной мРНК, по нс с другими мРНК
клетки, и ингибировать (путем ауторегуляции) ее
трансляцию. Обычно большая часть белка gp32
в клетке связывается с оцДНК, однако в отсут-
ствие оцДНК этот белок связывается с собствен-
ной мРНК, следующей структурой в иерархии по
сродству к нему, и подавляет ее трансляцию, по-
скольку необходимость в его синтезе отсутствует.
Антисмысловые РНК □ Небольшие моле-
кулы РНК, например РНК micF, также мо-
гут служить репрессорами трансляции. Подоб-
но белкам-репрессорам, «антисмысловая РНК»
представляет собой продукт независимых от опе-
рона генов и действует путем связывания с
5'-концом мРНК с участием комплементарных по-
следовательностей. Область связывания покры-
вает участок Rbs, делая его недоступным для
рибосом. Такой механизм действует при контро-
ле трансляции гена ompF у Е. coli (рис. 18.22).
В данном случае репрессор трансляции, РНК
552 Часть V. Экспрессия генов и механизмы регуляции
XU4
С С
с«с
A-U
U-A
и» С
WA
у-ииииии
‘CVUUAUCC-C-CAUUUCUCUCUAACUCUUUACUUACVCCCAUUAUUUA
micF
.и.
с
UUACUACUAUCCC’ AUAAGAUC
UCACUUCCAAAA
с-с
A-U
A-и
A-U
лСССС- ACUCC—CACGUC—UCAUAAA
uUc '
5‘—CACACAACUUA /
AUCACGGUAAUAAAU----AAUGAUGA-ACCGCAAUAUUCUGC-C-ACUCAUGC^
- I___I I__I CcGUCCUCUCUUA— У
Rbs
Met
мРНК ompF
Рис. 18.22. Репрессия трансляции у Е. coli с участием антисмысловой РНК. Молекула РНК micF (репрессор транс-
ляции; показана полужирным шрифтом) содержит последовательность, строго комплементарные участку связы-
вания рибосомы и инициаторной AUG-области в молекуле мРНК ompF. Образование этого гибрида препятствует
трансляции мРНК ompF.
micF, в условиях, когда она не взаимодействует
с мРНК, принимает такую вторичную структуру,
которая инициирует его расщепление. Действую-
щие по этому принципу комплементарные РНК,
синтезируемые в клетках с использованием искус-
ственно сконструированных генов, применяются
для инактивации генов в клетках эукариот.
18.13.2. С аттенуацией трансляции
связана устойчивость к антибиотикам
Регуляция экспрессии генов, которую можно на-
звать аттенуацией трансляции, действует при ин-
дукции устойчивости к антибиотикам-макроли-
дам, линкозамидам и стрептограминам В-типа
(MLS) у грамположительных патогенных бакте-
рий, таких как Staphylococcus aureus, Streptococcus
faecalis и Streptomyces. Устойчивость этих бакте-
рий к MLS-антибиотикам объясняется модифи-
кацией 23S-pPHK, снижающей сродство данных
антибиотиков к 508-субъединице рибосом. Устой-
чивость к эритромицину у S. aureus обусловлена
индукцией при низкой концентрации антибиотика
синтеза РНК-метилазы, кодируемой плазмидным
геном егт. Этот фермент катализирует NC-диме-
тилирование остатка аденина в 23S-pPHK, что
придает клеткам устойчивость к высоким концен-
трациям эритромицина.
Лидерная мРНК оперона егт кодирует лидер-
ный пептид из 19 аминокислотных остатков и со-
держит четыре комплементарных нуклеотидных
последовательности 1, 2, 3 и 4 (последователь-
ность 1 комплементарна последовательности 2,
последовательность 2 — последовательности 3 и
последняя — последовательности 4; рис. 18.23).
В отсутствие индуктора — эритромицина — рибо-
сомы, транслирующие полный лидерный пептид,
экранируют сегменты 1 и 2, что допускает фор-
мирование шпильки 3 : 4. В результате сайт Rbs и
кодон ATG изолируются, что делает мРНК недо-
ступной для инициации трансляции. В присут-
ствии эритромицина в индуцирующей концентра-
(D © (5) ®
Лидерный пептид
+1 Rbs [ кодон|9 S Rbs lerm 5
мРНК егт
Рис. 18.23. Модель аттенуации трансляции у Staphylo-
coccus aureus. Показан лидерный сегмент мРНК — про-
дукта гена егт, кодирующего индуцибельную устойчи-
вость к эритромицину. Обозначен участок, кодирующий
лидерный пептид; цифрами 1, 2, 3 и 4 обозначены
сегменты, образующие альтернативные шпилечные
структуры в молекуле мРНК (сплошные стрелки ука-
зывают неиндуцибельные структуры, штриховые стрел-
ки— индуцибельные). Образование шпильки 3:4 пре-
пятствует трансляции участка, соответствующего егт.
В присутствии эритромицина комплекс антибиотика с
рибосомой тормозится на кодоне 9, способствуя образо-
ванию шпильки 2:3, и в результате трансляция проис-
ходит (Rbs — сайт связывания рибосомы).
Глава 18. Регуляция экспрессии генов: опероны и регулоны 553
ции комплекс из молекулы антибиотика и рибосо-
мы тормозится на специфической последователь-
ности в кодоне 9, допуская спаривание сегментов 2
и 3. Это приводит к высвобождению сайта Rbs и
кодона ATG и в результате делает мРНК доступ-
ной для трансляции. Данный механизм сходен с
аттенуацией транскрипции путем формирования
альтернативных шпилечных структур в области
оперопов синтеза аминокислот (см. разд. 18.10.3).
Индукция синтеза РНК-метилазы происходит
посредством конформационных перестроек в ли-
дерном участке мРНК этого фермента, в резуль-
тате которых мРНК переходит из неактивной
формы в форму, доступную для трансляции.
Рис. 18.24. Контроль элонгации трансляции путем сдви-
га рибосомой рамки считывания гена dnaX у Е. coli. По-
казан участок мРНК, на котором происходит сдвиг рам-
ки считывания. Разнонаправленные стрелки указывают
на возможность формирования шпилечной структуры.
Рамка считывания субъединицы г начинается на пози-
ции 0. Для считывания гена 7-субъединицы необходим
сдвиг рамки считывания рибосомой к позиции —1 с об-
разованием шпильки. Кодон UGA в позиции —1 выделен
рамкой, а.о. — аминокислотные остатки.
18.13.3. Контроль элонгации связан
с «прыжком» рибосомы и
смещением рамки считывания
Информация, записанная неперекрывающимся
триплетным генетическим кодом, прочитывается
последовательно, начиная с фиксированной точ-
ки в молекуле мРНК. Однако у вирусов эукариот
распространена трансляция мРНК со смещением
рамки считывания; подобные механизмы извест-
ны теперь у Е. coli и ее фагов; возможно, они име-
ются также у других прокариот.
Зависящие от нуклеотидной последовательно-
сти мРНК сдвиги рамки считывания рибосомой в
процессе трансляции запрограммированы и при-
водят к генным перестройкам.
Сдвиг рамки считывания рибосомой □
Ген dnaX кодирует у Е. coli г- и 7-субъединицы
холофермента ДНК-полимеразы III (рис. 18.24).
Субъединица т содержит 643 аминокислотных
остатка и считывается с 0-рамки мРНК dnaX.
Последовательность кодонов для т в позици-
ях 428-442 содержит 6 остатков аденина, под-
ряд, за которыми следует стоп-кодон UGA в
позиции —1 рамки, объединяющей кодоны 431
и 432. Для синтеза 7-субъединицы, состоящей
из 431 аминокислотного остатка и имеющей
ту же аминокислотную последовательность, что
N-концевой участок т-субъсдипицы, рибосомы
сдвигают начало рамки считывания с позиции 0
па —1 и завершают трансляцию на кодоне UGA.
Сдвиг рамки происходит в последовательности из
остатков аденина в одном из двух соседних ко-
донов лизина (позиции 429 и 430). Шпилечная
структура, следующая за кодоном UGA, стимули-
рует сдвиг рамки посредством неизвестного меха-
низма. Субъединицы т и 7 образуются в соотно-
шении 1 : 4. Аналогичные последовательности, с
которыми связано проскальзывание рибосом, най-
дены в сайтах сдвига рамки считывания в РНК у
ретровирусов.
Прыжок рибосомы □ Сдвиг рамки считы-
вания может быть обусловлен «прыжком» рибо-
сомы по РНК, как, например, при синтезе бел-
ка дрбО фага Т4 (субъединица топоизомеразы).
В мРНК этого белка кодоны в позициях 46 и 47
разделяет отрезок из 50 нуклеотидов (рис. 18.25).
Транслирующая рибосома обходит этот сегмент,
как бы «взлетая» после трансляции кодона 46 в
рамке с началом в позиции 0 и «приземляясь»
на кодоне 47, после чего возобновляет трансля-
цию рамки с началом при —1. Каким образом
аппарат трансляции взаимодействует при этом с
мРНК, пока неизвестно. Вероятно, этот механизм
включает промежуточное формирование вторич-
ной структуры РНК. В связи с чем используется
сдвиг рамки считывания для регуляции синтеза
белков на стадии элонгации трансляции, остается
загадкой.
554 Часть V. Экспрессия генов и механизмы регуляции
40 46
АСА GAC CCA CAU САС CAU GGA
Thr Asp Ala Asp His Asp Cly
UACCCUUCCCCCUAUCUAUACAAAUACCUCAUAAUUAACACAIIUAUUCCA
47 50
UUA GGU UCU AUU--3'
Leu Cly Ser lie — COOH
A-l\
A' "A S4S
A 'C
C C
A U
Б Asp-45 Gly-46 Leu-47 Gly-48
Рис. 18.25. Контроль элонгации трансляции в случае гена 60 фага Т4 путем сдвига рамки считывания скачком ри-
босомы. Участок РНК, на котором происходит скачок рибосомы между кодонами 46 и 47, заключен в прямоугольник
(Д) и показан как потенциально возможная вторичная структура (Б).
18.13.4. Сплайсинг белков: интеины и экстеины
Для продуктов прерывистых генов характерен
сплайсинг па уровне белка, который состоит в
удалении спейссрпых участков, называемых ан-
теннами, из белка-предшественника. Продукт
соединения (сплайсинга) двух концевых сегмен-
тов предшественника называют экстеином. Ге-
нетически обусловленный сплайсинг белков, в от-
личие от вырезания (эксцизии) ДНК, сплайсинга
РНК и прыжков рибосом, редко встречается у
прокариот. Так, по одному интеиму присутствует
в продукте гена recA у Mycobacterium tuberculosis
и М. leprae. Обнаружены также гены, кодирую-
щие белок с двумя иптеинами. Сплайсинг конце-
вых сегментов с образованием экстеина протекает
автокаталитически.
Интеины могут обладать сайт-спсци-
фичной ДНК-эндонуклеазной активностью
и участвовать в транспозиции па уровне ДНК.
Вырезанный интеип стимулирует однонаправлен-
ную генную конверсию — перемещение участка
ДНК, кодирующего интеип, в другой сайт. Этот
феномен, инициируемый эндопуклеазной актив-
ностью свободного интеина, называют хомин-
гом. Свободный интеип узнает и специфиче-
ски расщепляет ДНК в сайте, соответствующем
вакантному сайту в гене без участка интеина.
У М. tuberculosis свободный интеин, кодируемый
гее А, также обладает сходной сайт-спсцифичной
эндонуклеазпой активностью, что указывает на
возможное существование хоминга. Аминокислот-
ные последовательности интеинов содержат кон-
сервативные участки и обнаруживают гомологию
с ДНК-эндонуклеазой, инициирующей конверсию
генов в процессе спаривания у дрожжей.
18.13.5. У бактерий встречается рестрикция
использования кодонов
Генетический код характеризуется значительной
вырожденностью, вследствие чего в клетках при-
сутствует, как правило, набор молекул тРНК
(изоакцепторных, с различными антикодонами),
используемых для данной аминокислоты. Дру-
гим следствием вырожденности является спо-
собность некоторых изоакцепторных тРНК спа-
риваться с двумя или большим числом ко-
донов-синонимов соответствующих аминокислот
(неоднозначное соответствие). Существует также
строгая корреляция между использованием спе-
цифического кодона аминокислоты в первичной
структуре генов и количеством соответствующих
изоакцепторных тРНК. Таким образом, общее ко-
личество остатков данной аминокислоты в белках
коррелирует с общим уровнем тРНК для нее (см.
разд. 15.4.1).
Различные кодоны для одной и той же ами-
нокислоты могут использоваться дифференциро-
ванно, по характер употребления кодонов-синони-
мов в различных генах одного и того же орга-
низма обычно совпадает, независимо от функции
генов. Использование кодонов ограничивается у
бактерий путем исключения некоторых кодонов
данной аминокислоты.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 555
У Streptococcus coelicolor и Streptomyces
Hvidans ген активатора транскрипции для биосин-
тетического рсгулона антибиотика актинородина
содержит для лейцина кодон UUA, который лишь
редко встречается у стрептомицетов. Мутации,
инактивирующие ген соответствующей изоакцеп-
торной тРНКЬеи, препятствуют образованию ан-
тибиотика у этих организмов. Кроме того, замена
UUA на другой кодон в гене активатора восста-
навливает нормальный синтез актинородина. По-
добно этому у Е. coli используется редкий кодон
аргинина AGA, узнаваемый минорной TPHKArg.
Мутация с заменой G —* А в позиции первого нук-
леотида в зрелой тРНК делает ее неактивной, и
рост мутантного организма становится темпера-
турочувствительным. Такая мутация ограничи-
вает экспрессию индуцибельных генов с множе-
ственными кодонами AGA и сверхсинтез эукари-
отических белков, гены которых богаты AGA, не
влияя на гены, лишенные AGA.
У РНК-содержащих бактериофагов рестрик-
ция использования кодонов встречается чаще, чем
можно было бы ожидать, исходя из случайного
выбора. Например, в случае гена белка оболоч-
ки фага MS2 (содержащего 129 аминокислотных
остатков) из трех кодонов для лейцина исполь-
зуются по четыре раза AUU и AUC, тогда как
третий кодон AUA не используется вовсе. Анало-
гично этому, из двух кодонов для тирозина один
кодон, UАС, используется четыре раза, тогда как
другой, UAU, не используется.
Рестрикция использования кодонов обусловле-
на тем, что нуклеотиды в составе РНК должны
удовлетворять условиям спаривания для поддер-
жания вторичной и третичной структур, важных
для регуляции трансляции, а также для процес-
синга мРНК. В случае бактериофагов вторичные
структуры имеют также значение при упаковке
молекул РНК.
18.14. Количество продукта гена может зависеть от протеолиза
Увеличение количества белка, необходимого в
данных условиях среды, может происходить за
счет временного повышения его стабильности,
при том что в норме он нестабилен. Кон-
троль уровня белков путем протеолиза описан в
разд. 19.3.4.
18.15. Ключевая роль в регуляции активности генов
принадлежит ДНК-белковым взаимодействиям
ДНК-белковые взаимодействия играют ключевую
роль как в регуляции активности генов, так и в
репликации, рекомбинации, модификации и кон-
денсации ДНК. Регуляторные белки узнают опре-
деленную последовательность из 8-20 т.п.н. на
фоне миллионов нуклеотидных пар, что отлича-
ет эти белки от других типов ДНК-связывающих
белков, не обладающих специфичностью к нук-
леотидным последовательностям. Высокоспеци-
фичное связывание с ДНК является условием
действия активаторов и репрессоров. Участву-
ющие в этом связывании сайты ДНК, а, р и
о, обычно локализованы в стратегически важ-
ных участках (рис. 18.2 и 18.6). Специфичное к
нуклеотидным последовательностям связывание
регуляторных белков отвечает трем целям: 1) на-
правления белков к их мишеням без наруше-
ния необходимой экспрессии генов; 2) повы-
шения локальной концентрации регуляторных
белков вблизи их мишеней для стимуляции со-
ответствующих белок-белковых и ДНК-белковых
взаимодействий и 3) осуществления необходимых
структурных изменений взаимодействующих мо-
лекул. Для активации транскрипции может быть
необходимо изгибание ДНК, индуцируемое регу-
ляторным белком, или, напротив, индуцируемое
556 Часть V. Экспрессия генов и механизмы регуляции
ДНК конформационное изменение активаторно-
го белка, необходимое для его взаимодействия с
РНК-полимеразой.
Специфичное к нуклеотидной последователь-
ности связывание регуляторных белков с ДНК —
это важнейший этап транскрипции, репликации,
модификации и конденсации ДНК. Пока ис-
следовано лишь относительно небольшое число
специфических ДНК-белковых комплексов, одна-
ко можно предполагать, что обусловливающие
их образование взаимодействия аминокислотных
остатков с остатками оснований не определяются
кодом. В молекулах этих белков обнаружено че-
тыре типа структурных мотивов, распознающих
нуклеотидные последовательности и осуществ-
ляющих связывание: спираль—виток—спираль,
/3-складка, лейциновая застежка-молния и
цинковые пальцы.
Неспецифические ДНК-белковые взаимодей-
ствия часто происходят путем образования водо-
родных связей между атомами кислорода в соста-
ве фосфатной группы и NH-группами в составе
основной аминокислотной цепи белков. Специфи-
ческие взаимодействия, которые в 1000 и более
раз сильнее неспецифических, определяются во-
дородными, гидрофобными и ионными связями,
главным образом с участием боковых цепей ами-
нокислотных остатков и доступных для взаимо-
действия оснований по краям бороздок в молеку-
ле ДНК.
18.15.1. Наиболее распространена в качестве
ДНК-связывающего мотива
в регуляторных белках у прокариот
структура спираль-виток-спираль
У бактерий многие белки — регуляторы активно-
сти генов представляют собой димеры. Распозна-
ванию ДНК этими белками способствует молеку-
лярная симметрия. Симметрично расположенные
ДНК-связывающие структуры в димерных бел-
ках взаимодействуют со специфическими участ-
ками ДНК длиной 16-20 п.н., обладающими двой-
ной симметрией. Чаще всего ДНК-связывающие
мотивы в молекулах таких белков состоят из
двух а-спиралей, соединенных напряженно изо-
гнутой (3-цепью (/3-витком), с углом 90° меж-
ду спиралями (рис. 18.26, А; см. цв. вклейку).
В димере две эти спирали в одной субъединице
расположены симметрично аналогичным спира-
лям в другой субъединице. Структуры спираль-
виток-спираль (называемые также спираль-
петля-спираль) разделены в димере расстоянием
34 А, что эквивалентно одному витку двойной це-
пи В-ДНК. <т2-Спираль каждой такой структу-
ры, называемая распознающей спиралью, свя-
зывается в большой бороздке с одной половиной
симметричной структуры ДНК, тогда как анало-
гичная спираль другой субъединицы димера, со-
относящаяся с первой по правилу двойной кру-
говой симметрии, связывается в большой бо-
роздке с другой половиной палиндрома ДНК
(рис. 18.26, Б; см. цв. вклейку). cd-Спираль каж-
дой субъединицы димера посредством боковых
цепей, состоящих из остатков основных аминокис-
лот, образует ионные связи с фосфатным остовом
ДНК. Несколько молекул регуляторных белков,
содержащих мотивы спираль-виток-спираль, мо-
гут формировать тетрамеры, которые одновре-
менно связываются с двумя участками ДНК, об-
ладающими двойной симметрией. Это позволя-
ет таким белкам формировать петли ДНК (см.
разд. 18.4). Во всех изученных ДНК-белковых
комплексах молекула ДНК изогнута (о влиянии
деформации молекулы ДНК на регуляцию актив-
ности генов см. разд. 18.8).
Строение и аминокислотная последо-
вательность структур спираль—виток—спи-
раль □ Трехмерная структура спираль-виток-
спираль стабилизирована расположенными в
определенных позициях аминокислотными остат-
ками с особыми свойствами (табл. 18.6). Как
правило, такая структура содержит 20 амино-
кислотных остатков, семь из которых входят в
первую спираль, четыре образуют виток и девять
остальных — вторую спираль. Сравнение амино-
кислотных последовательностей нескольких бак-
териальных белков, содержащих структуру спи-
раль-виток-спираль, показывает консервативные
аминокислотные остатки и их позиции, обеспе-
чивающие стереостабильность: глициновый оста-
ток в позиции 9 /3-витка противодействует сте-
рическому взаимодействию атомов углерода в
^-положении с главной цепью; гидрофобные или
слабополярные и незаряженные аминокислотные
остатки в позициях 4, 8, 10 и 15 стабилизируют
остальную часть белковой молекулы; отсутствие
пролиновых остатков в спиральных участках в
Глава 18. Регуляция экспрессии генов: опероны и регулоны 557
Таблица 18.6. Характеристики аминокислот, занимающих различные позиции в составе некоторых связывающихся
с ДНК структур спираль-виток-спираль. Показаны выровненные последовательности структур спираль-виток—спи-
раль белков — регуляторов активности генов прокариот. Позиции, связанные с пространственным расположением,
отмечены светло-серым; позиции, определяющие взаимодействие с ДНК (в спирали 2) отмечены темно-серым.
Представлены белки из Е. coli (если не указан иной источник) и других бактерий (указаны в нижнем индексе: Кр —
Klebsiella pneumoniae-, Ра — Pseudomonas aeruginosa; Rm — Rhizobium meliloti; St — Salmonella typhimurium), а также
из бактериофагов Л, 434 и Р22 (указаны этими обозначениями)
Белки — Cn 3 ираль 4 8 — Виток — 11 2 - 17 18 19 20
1 2 1 5 6 7 12 13 14
9 10 15 16
АгаС A К L L L S T T R M E 1 A T V G R N V G
Сгр R Q E I G Q I V G c S R E T V G R I L K.
CysB CytR V M s к S D T V A A E L G К L A К T V 8 S Q P A G T I V S: S К R* Q A V L R M
EbgR 434cl L Q к A D E I L A A I Q E К A V G G V T l ,Q T s V I Q V L L E N
434Cro Q T E L A T К A G v a s I Г I E A-
Fnr R G D I G N Y L G L T Y is T I 8 r L L G
FruR L D E I A R L A G V S R T T A s Y V I Ml
GaIR I К D V A R L A G V S V A T V 8 R V I Ni
GalS I R D V A R Q A G V S V A, T V R V L iNij
Hinst R Q Q L A I I F G I G V s T L Y eFj Y F
IIvY F G R S A R A M H V s E $; T L 8 R Q F
LacI L Y D V A E Y A G V s Y Q T V 8 R V V N
Ьас1кр L E D V A R R G R V E A p G L R R V L N
Acl Q E S V A D К M G M G a 8 G V G A, L F N
AcII T E К T A E A V G V p к 8 Q I S R w К R
ACro Q T К T A К D L G V Q s A I :N Jfe A I H
LexR R A E I A Q R L G F « в N A A, J E H L?
LysR L T E A A H L L H T s Q p T v R E L A
Mall I H D V A L A A G V S ,'v- $ , T V 8 ft V L 8
MetR L A A A A A V L H Q T Q s A L S : H Q F 8
NodDRm L T A A A R s I N L S Q Ё A M 8 A I qi
OxyR F R R A A D s C H V 8 Q P T L s Q I r|
P22C2 Q A A L G К M V G V •S: К V A I Q w Q R
P22Cro Q R A V A К A L G I =8 D A- A v S Q w к E ;
PurR I К D V A К R A N V S T T V 8 V I nJ
ScrRKp I К D I A E L A G V 8 К 71 T A S V L NH
TnpR E A К L К G I К F G R R? R T V D R N V V
Trplpft I S L A A E E L H V T ~H G A V R Q V Ri
TrpR Q R E L К N E L G A G I A. T I T. R G s N
позициях 3-7 и 15-20 предотвращает разрушение
спирали, и отсутствие аминокислотных остатков с
разветвленной боковой цепью в позиции 5 способ-
ствует относительному выравниванию этих двух
спиралей. Боковые цепи, доступные для раство-
рителя и участвующие во взаимодействии с ДНК,
расположены почти исключительно в позициях
11-13, 16-17 и 20.
558 Часть V. Экспрессия генов и механизмы регуляции
Благодаря особенностям структур спираль-
виток-спираль в некоторых случаях можно экс-
периментально заменить распознающие амино-
кислотные остатки в двух близких по структуре
ДНК-связывающих белках. Такая замена поз-
воляет модифицировать ДНК-специфичность
(рис. 18.27; см. цв. вклейку).
Семейство белков, содержащих структу-
ры спираль—виток—спираль □ Связывающие
ДНК бактериальные и фаговые белки (как спе-
цифичные, так и общие регуляторы) со струк-
турами спираль-виток-спираль можно сгруппи-
ровать в несколько семейств по сходству амино-
кислотных последовательностей или структуры.
Следует отметить, что структуры спираль-
виток-спираль могут быть расположены в N-koh-
цевом домене белка (как, например, у белков
семейства LacI) или в С-концевом домене (как, на-
пример, у белков семейства LysR). Число специ-
фических регуляторных белков у прокариот, как
правило, весьма велико, поскольку они необхо-
димы для регуляции многочисленных отдельных
оперонов и регулонов. В то же время общих ре-
гуляторов, управляющих одновременно многими
оперонами, в клетках значительно меньше. Дан-
ные, приведенные в табл. 18.6, указывают на ши-
рокое распространение консервативных структур
среди регуляторных белков у бактерий и под-
черкивают важность дальнейшего изучения роли
пептидных мотивов в функциях доменов и эволю-
ции белков.
18.15.2. В регуляторных белках прокариот
в качестве ДНК-связывающих мотивов
встречаются ^-складчатые структуры
Иногда роль связывающихся с ДНК структур в
белках прокариот выполняют /3-складки, называ-
емые также /3-листками и /3-слоями. Среди бел-
ков известного строения, специфично регулиру-
ющих активность генов, только у двух обнару-
жена в качестве ДНК-связывающей структуры
/3-складка. Такую структуру, сформированную
двумя антипараллельными /3-цепями, образуют
репрессор MetJ Е. coli и репрессор Аге фага
Р22 Salmonella. /З-Складчатые структуры этих
белков распознают участок в большой бороздке
молекулы ДНК. Для апорепрессора MetJ, кон-
тролирующего регулон met (кодирует фермен-
ты биосинтеза метионина), корепрессором служит
S-аденозилметионин (SAM). В димере MetJ ан-
типараллельные /3-цепи двух субъединиц образу-
ют выступающую /З-складку, которая связывается
в большой бороздке с палиндромной последова-
тельностью из 8 п.н. ?7?.е£-оператора В-ДНК. Вза-
имодействие осуществляют боковые цепи амино-
кислотных остатков в составе /3-цепей, образую-
щих складку внутри большой бороздки молекулы
ДНК (рис. 18.28; см. цв. вклейку).
Генетические, биохимические и физические ис-
следования позволили выявить топкую структу-
ру нескольких регуляторных белков, а также их
комплексов с ДНК и прояснить характер конфор-
мационных изменений, влияющих на активность
генов. Насколько велико разнообразие макро-
молекулярных взаимодействий, участвующих в
регуляции биохимических реакций, осуществля-
емых РНК-полимсразой, еще предстоит выяс-
нить.
Две другие ДНК-связывающие белковые
структуры, так называемые лейциновая застеж-
ка-молния и цинковые пальцы, известные у эука-
риот, не обнаружены в каких-либо белках, регу-
лирующих активность генов у прокариот.
18.15.3. На способность белков-регуляторов
связывать ДНК влияют
аллостерические эффекторы
Способность многих белков, регулирующих ак-
тивность генов, специфически связывать ДНК
может изменяться аллостерически под действи-
ем небольших молекул (см. разд. 18.1 и гл. 19).
Генетические, биохимические и структурные ис-
следования показали, что эти белки обычно
содержат два домена, соединенные шарнирной
связью; один из них связывается с ДНК, другой —
с эффектором. Связывание лиганда с одним до-
меном вызывает конформационное изменение в
структуре белка, влияющее на другой домен че-
рез шарнирную связь. Индуцированная эффекто-
ром модификация обеспечивает возможность кон-
такта ДНК-связывающего мотива с нуклеотидной
цепью в соответствующей большой бороздке мо-
лекуле ДНК либо изменяет этот мотив так, что
взаимодействие разрушается или контакт стано-
вится невозможным.
Глава 18. Регуляция экспрессии генов: опероны и регулоны 559
18.16. Заключение
У прокариот гены входят в состав оперонов
(как правило, не содержащих интроны) и ре-
гулонов, что облегчает регуляцию их активно-
сти в ответ на изменения вне- или внутрикле-
точной среды. Экспрессия генов по оперонному
типу определяется двумя основными моментами:
во-первых, особенностями первичной и вторичной
структур ДНК и РНК, которыми обусловлен ме-
ханизм транскрипции и трансляции, процессинг
мРНК, даже определение рамки считывания, а
также сопряжение транскрипции и трансляции, и,
во-вторых, участием трсшс-активных регулятор-
ных белков (иногда РНК) и небольших молекул-
эффекторов, влияющих па скорость и эффек-
тивность различных этапов всех этих процессов.
Существуют разнообразные механизмы регуля-
ции отдельных этапов процесса экспрессии генов.
Опсроп обычно регулируется па нескольких уров-
нях, что способствует координации процессов в
каждом опероне, а также активности оперонов в
составе регулопа. Действующие помимо этого ме-
ханизмы общей регуляции обеспечивают допол-
нительные возможности контроля (формирование
модулонов), расширяя спектр сигналов для экс-
прессии генов (см. гл. 20). Такое сочетание кон-
трольных механизмов обеспечивает слаженность
системы регуляции и предотвращает несогласо-
ванность, возможную в том случае, если бы от-
дельные системы функционировали независимо.
Современные молекулярно-биологические методы
позволяют изменять в экспериментах как in vivo,
так и in vitro любые компоненты регуляторных
систем, что открывает большие перспективы для
изучения механизмов регуляции.
Дополнительная литература
Adhay S. (1989) Multipartite genetic control elements:
communication by DNA loop. Annu. Rev. Genet. 23:
227-250.
Beckwith J., Silhavy T. J. (1992) The power of bacterial
genetics. Cold Spring Harbor, N. Y.: Cold Spring
Habor Laboratory Press.
BusbyS., Ebright R. H. (1997) Transcription activation
at class II Cap-dependent promoters. Mol. Microbiol.
23: 853-859.
Calvo .1.М., Matthews R.G. (1994) The leucine-
responsive regulatory protein, a global regulator of
metabolism in Escherichia coli. Microbiol. Rev. 58:
461-490.
Condon C., Squires C., Squires C. L. (1995) Control of
rRNA transcription in Escherichia coli. Microbiol.
Rev. 59: 623-645.
Court D. (1993) RNA processing and degradation by
RNase III., In: Brawerman G., Beleaso J. (eds.)
Control of mRNA stability. Vol. 5. San Diego:
Academic Press; 71-116.
Dorman С. Л. (1995) DNA topology and the global
control of bacterial gene expression: implications for
the regulation of virulence gene expression. Microbio-
logy 141: 1271-1280.
Farabaugh P. .1. (1996) Programmed translational frami-
shifiting. Microbiol. Rev. 60: 103-134.
Gallegos M. T., SchleifR., Bairoch A., Hofimann K.,
Ramos J. L. (1997) AraC/XylS family of transcrip-
tional regulators. Microbiol. Mol. Biol. Rev. 61:
393-410.
Gold L. (1988) Posttranscriptional regulatory mechanism
in Escherichia coli. Annu. Rev. Biochem. 57:
199-233.
Ischihama A. (1993) Protein-protein communication
within the transcription apparatus. J. BacterioL 175:
2483-2489.
Kolb A., Busby S., Buc H., Garges S., Adhya S. (1993)
Transcriptional regulation by AMP and its receptor
protein. Annu. Rev. Biochem. 62: 749-795.
Lambowitz A. M., Belfort M. (1993) Introns as mobile
genetic elements. Annu. Rev. Biochem. 62: 587-622.
Lin E. С. C., Lynch A. S., eds. (1996) Regulation of gene
expression in Escherichia coli. Austin, Tex: Landes.
Neidhardt F. C., Curtiss R., Ingraham J. L., Lin E. С. C.,
Low К. B., Magasanik B., ReznikofTW., Riley M.,
Schaechter M., Unbarger H. E. (eds.) (1996) Esche-
richia coli and Salmonella, cellular and molecular
biology. 2nd edn. Washington. DC: ASM Press.
North A. K., Klose К. E., Stedman К. M., Kustu S.
(1993) Prokaryotic enhancer binding proteins reflect
eukaryotic-like modularity: the puzzle of nitrogen
regulatory protein C. J. BacterioL 175: 4267-4273.
Ptashne M. (1992) A genetic switch. Cambridge, Vass:
Cell Press and Blackwell.
Richet E., Vidal-Ingigliardi D., Raibaud O. (1991) A new
mechanism for coactivation of transcription initiation:
repositioning of an activator triggered by the binding
of a second activator. Cell 66: 1185-1195.
Schell M. A., (1993) Molecular biology of the LysR family
of transcriptional regulators. Annu. Rev. Microbiol.
47: 597-626.
560 Часть V. Экспрессия генов и механизмы регуляции
Sonnenschein A. L., ed. (1993) Bacillus subtilis and
other Gram-positive bacteria. Washington, DC: ASM
Press.
Summers A. O. (192) Untwist and shout: a heavy metal-
responsive transcriptional regulator. J. Bacterio!.
174: 3097-3101.
Travers A. (1993) DNA-protein interactions. London:
Chapman and Hall.
Wagner E. G.Y., Simons R.W. (1994) Antisense RNA
control in bacteria, phages and plasmids. Annu. Rev.
Microbiol. 48: 655-686.
Источники рисунков
1. Mandal N., Su W., Haber R., AdhyaS., Echols H.
(1990) Genes Dev. 4: 410-418.
2. Herendren D. R., Kassavetis G. A., Geiduschek E.P.
(1992) Science 256: 1298-1303.
3. Grundy F. J., Henkin T. M. (1993) Cell 74: 475-482.
4. Branden C., Tooze J. (1991) Introduction to protein
structure. New York: Garland.
5. Wharton R., Ptashne M. (1985) Nature 316: 602.
А Рис. 5.1. Модель трехмерной структуры бактериородопсина из Halobacterium halobium, установленная методом
дифракции электронов.
А. Вид сбоку. Молекула бактериородопсина содержит семь трансмембранных cv-спиральных сегментов и в каче-
стве хромофорной группы — ретиналь, соединенный с лизиновым остатком (выделен красным и кружком) через
шиффово основание (выделено цветом и квадратом). Присутствием ретиналя обусловлено поглощение света бак-
териородопси ном.
Б. Вид сверху. «-Спиральные сегменты образуют в мембране структуру, осуществляющую перенос через нее про-
тонов; транспортируемые протоны входят в верхний канал (верхняя часть молекулы), связываются с находящимся
в центре молекулы бактериородопсина ретиналем и затем высвобождаются через выходной канал (в нижней ча-
сти молекулы). Фото любезно предоставлены J. Granzin; структурные данные [1] получены от Protein Data Bank;
использовано программное обеспечение «О» [2].
▲ Рис. 5.9. Трехмерная структура порина из наружной мембраны Rhodobacter capsulatus, установленная методом
дифракции рентгеновских лучей.
А. Мономер порина у грамотрицательных бактерий; 16 антипараллельных /Тцепей образуют J-складки, формиру-
ющие структуру наподобие бочонка.
Б. Функционально активный тример — канал, образуемый тремя «бочонками». Рисунок любезно предоставлен
W. Welte.
▲ Рис. 14.10. Инициация в точке начала репликации,
содержащей итероны (ог/С-тип инициации). Несколько
субъединиц инициаторного белка связываются с ите-
ронами (повторяющимися последовательностями нук-
леотидов, сайтами связывания оп) и способствуют
раскручиванию ближайшего АТ-богатого участка. Это
обеспечивает связывание одной праймосомы (одной
РНК-затравки) для однонаправленной репликации ДНК
или двух праймосом (двух РНК-затравок) для двуна-
правленной репликации ДНК. ДНК-геликазы (в данном
случае DnaB) способствуют инициированию реплика-
ции.
▲ Рис. 14.3. Двойная спираль В-формы ДНК. Две ан-
типараллельные цепи ДНК закручены в правосторон-
нюю двойную спираль, имеющую большую и малую
бороздки, в которых ДНК-связывающие белки узнают
последовательности нуклеотидов (пиримидиновые ос-
нования показаны красным).
► Рис. 14.11. Репликация плазмид по механизму ка-
тящегося кольца, или по с-типу. Двухцепочечные ДНК
многих плазмид (например, рТ181) и фагов (напри-
мер, </?Х174) расщепляются инициаторным белком на
участке dso (double-strand origin, точка начала репли-
кации двухцепочечной ДНК). Образовавшийся З'-конец
используется как затравка для синтеза ведущей цепи на
кольцевой (—)-цепи как матрице. Цепь со свободным
Б^концом, (+)-цепь, становится матрицей для синтеза
запаздывающей цепи, как только точка начала реплика-
ции одноцепочечной ДНК (sso, single-strand origin) ока-
зывается в одноцепочечной форме и связывает прай-
мосому. Репликация кольцевой (—)-цепи может повто-
ряться несколько раз, приводя к образованию длинных
повторов, или конкатемеров, которые подвергаются рас-
щеплению на мономерные формы, например в процессе
упаковки фаговой ДНК.
Репликативная
транспозиция
Донорная ДНК
(транспозирующийся
элемент)
ДНК-мишень
(дана не в масштабе)
Коинтеграт
Нерепликативная
транспозиция
▲ Рис. 14.18. Механизмы нерепликативной и репли-
кативной транспозиции на примере фага Ми. Нере-
пликативная транспозиция начинается с образования
ступенчатых разрезов с обеих сторон транспозирую-
щегося элемента (в донорной ДНК) и в ДНК-мишени
(см. рис. 14.16). Далее она осуществляется посредством
кроссинговера, повторного сшивания и заполнения бре-
шей в одноцепочечных участках ДНК с образованием
прямых повторяющихся последовательностей в ДНК-
мишени. Если транспозиция сопровождается реплика-
цией ДНК, образуется коинтеграт, обычно разрешаемый
в сайте res с помощью кодируемой транспозоном ре-
зольвазы, с сохранением транспозирующегося элемента
как в донорной ДНК, так и в ДНК-мишени. В последнем
случае этот элемент фланкирован прямыми повторя-
ющимися последовательностями. В процессе нерепли-
кативной транспозиции вырезание транспозирующегося
элемента из донорной ДНК происходит в пределах пря-
мых повторяющихся последовательностей, вследствие
чего дупликация носит обратимый характер и донорная
ДНК остается интактной.
▲ Рис. 15.1. Сопряжение транскрипции и трансляции
у бактерий. В участке транскрипции (прямоугольник)
двойная спираль ДНК подвергается диссоциации под
действием РНК-полимеразы, раскручивающей спираль
ДНК перед участком транскрипции и закручивающей
ее позади него. К синтезирующейся РНК (показана
красным) присоединяются рибосомы, осуществляющие
трансляцию. При таком непосредственном сопряжении
свободной в клетке может быть только нетранслируемая
РНК (в основном рРНК и тРНК).
facZp] lacZo [ lacZ [ lacY [ /асА | lacAt
₽- Гал а кто- Пермеаза Трансаце-
зидаза тигаза
▲ Рис. 15.3. Генетическая структура /ас-оперона у
Е. coli. Показаны функциональные элементы (прямо-
угольники) в молекуле ДНК (без соблюдения мас-
штаба). lacZp— промотор, участок инициации транс-
крипции; lacZo — оператор, участок присоединения
регуляторных молекул. Ген lad, кодирующий Lacl-pe-
прессор и локализованный выше /ас-оперона, не пока-
зан. Три гена, lacZ, lacY и lacA, составляют оперон и
кодируют ферменты Д-галактозидазу, Д-галактозидпер-
меазу и тио-Д-галактозидтрансацетилазу соответствен-
но. lacAt — сайт терминации транскрипции, определяю-
щий З'-конец мРНК. Промотор, оператор и терминатор
действуют только в цис-положении.
▲ Рис. 15.5. Инициация транскрипции.
А. Взаимодействие РНК-полимеразы (РНП) с промо-
тором. Субъединицы /3 и в' расположены на переднем
конце молекулы фермента; ст-субъединица узнает — L0-
и -35-элементы промотора; каждая о-субъединица со-
держит два функциональных домена. N-терминальные
домены (oNTD) контактируют с другими субъедини-
цами, тогда как С-терминальные домены (otCTD) —
с АТ-богатым районом вблизи позиции —43, часто при-
сутствующим в «сильных» промоторах.
Б. «Открытый» комплекс: цепи ДНК под действием
РНК-полимеразы диссоциируют вокруг точки начала
транскрипции и фермент синтезирует короткий фраг-
мент РНК длиной до десяти нуклеотидов.
В. Как только длина новосинтезированной РНК пре-
высит 12 нуклеотидов, РНК-полимераза продвигается
вдоль ДНК и бт-субъединица покидает комплекс, осво-
бождая промотор.
▲ Рис. 16.4. (подпись см. на след. с. вверху)
Рекомбинация
с хромосомной
(хр) ДНК
Разрешение
гетеродуплексов
Расщепление нуклеазой
оцДНК хрДНК
◄ Рис. 16.1. Модель процесса трансфор-
мации у Bacillus subtilis. Экзогенная двух-
цепочечная (дц) ДНК связывается со спе-
циальными белковыми комплексами на
поверхности клетки. После фрагментации
ДНК в сайтах связывания одна цепь ДНК
поглощается, тогда как комплементарная
цепь на поверхности клетки расщепляет-
ся нуклеазой. Импортированная одноце-
почечная (оц) ДНК включается в бактери-
альную хромосому (хрДНК) путем гомо-
логичной рекомбинации (см. разд. 16.4).
◄ Рис. 16.4. Модель переноса плазмидной ДНК в процессе конъюгации. Клетка-донор, содержащая конъюгативную
плазмиду, контактирует с клеткой-реципиентом, не содержащей плазмиды (хромосомы не показаны), и инициирует
контакт клеток. В процессе, называемом конъюгацией, в клетку-реципиент переносится одиночная цепь ДНК. Эта
цепь, а также цепь, оставшаяся в клетке-доноре, реплицируются и рециркуляризуются. После разделения клеток
клетка-донор сохраняет плазмиду, клетка-реципиент превращается во вторичный донор. При конъюгации с участием
F-фактора от донора реципиенту переносится также хромосомная ДНК, которая путем гомологичной рекомбинации
интегрируется в хромосому хозяина.
traMp II-»-traJp traYp
1—V-*--------------------------------
oriT finPp
Ш EZEEFTT ..ШЮЙЕ
traM traY traL traK traP trbC traR
traJ traA traE traB trbD traV
0,0 5,0
traTp ~
traSp traDp
?------------------------ '
> ......> >. Л Кй
traC trbl traU trbC traN trbE trbA traQ
traW traF artA
10,0 15,0 т.п.н.
trbj traH
trbB trbF
A
traC
20,0
traS
traT
traD
25,0
trbH
tral traX find
30,0 т.п.н.
Внутренняя последовательность Tra2
trbAp
trbBp
► ►► ► ► ►► ► H I
trbA trbC trbE trbF trbH trbl trbj trbL
trbB trbD trbC trbK
£ 20,0 25,0 30,0
Оперон
праймазы
Внутренняя последовательность Tral
Оперон Лидерный
traCp РелаксазЬ| оперон TRLHд
traJp traKp J
<<HV
traA traC traD traE traF traC traH tral traJ traL
traB traX traK traM
??—1------------------------1------------------------1----------------
40,0 45,0 50,0 т.п.н.
▲ Рис. 16.5. Организация области переноса плазмиды (Тга). Гены, ответственные за перенос (tra), показаны в виде
широких полос, внутри которых треугольниками отмечены Б'-концы. Функциональная классификация генов указа-
на цветом: светло-красным — система Dtr; белым — система Mpf, а также синтез и сборка пилей; светло-серым —
исключение вхождения; серым — стабилизация контакта; красным — регуляторные гены; области генов с неизвест-
ными функциями не закрашены. Точки начала переноса отмечены белыми треугольниками-стрелками, которые
указывают направление переноса ДНК. Стрелки, расположенные над генами, обозначают размеры транскриптов.
Промоторная последовательность указана буквой р; rho-независимый терминатор транскрипции — буквой t.
А. Организация области Тга F-плазмиды. Б. Организация области Тга плазмиды RP4 (см. также рис. 17.1).
▲ Рис. 16.7. Модульная структура области переноса плазмиды RP4. Область переноса изображена в виде полосы.
Сайты связывания белков Tral и TraJ показаны прямоугольниками, окрашенными в темно- и светло-красный цвета
соответственно. Серым показан участок изгиба молекулы ДНК, содержащий сайт связывания белка TraK. Тран-
скрипция оперонов релаксазы и лидерного участка инициируется в двух дивергентных промоторах, traJp и traKp
соответственно. Б'-Концы структурных генов белков TraJ и TraK изображены в виде белых полос. Ниже представ-
лена нуклеотидная последовательность области ДНК, примыкающей к сайту разрезания (nic, указан стрелками).
Инвертированные повторы указаны стрелками; отклонения от симметрии отмечены пунктиром. Позиции нуклео-
тидов, распознаваемых белками Tral и TraJ, показаны темно- и светло-красным цветами соответственно. Верхняя
цепь ДНК подвергается разрезанию и переносится в ориентации Б7—+3' в клетку-реципиент. По [2].
L
100 п.н.
CACCCCTTTTTTAAATATCATAAACACACTAACACAAACTAATTTTTCATAACACTCTATT
CTCCCCAAAAAATTTATACTATTTCTCTCATTCTCTTTCATTAAAAACTATTCTCACATAA
Сайт связывания IHF UHFA)
I me
◄---------------► r
TATAAAGAAAAATCACCAAAAACTTGTTTTTCCCT СИ&Т GTGGTGCTTTTGGTGGTCAGA
ATATTTCTTTTTAGTCGTTTTTGAACAAAAACGCACCCCACACCACGAAAACCACCACTCT
Рис. 16.8. Сайты связывания белков в области начала переноса F-плазмиды. Обозначения те же, что на рис. 16.7.
пецифические сайты связывания ТгаМ (sbmA, В, С) и TraY (sbyA) обозначены темно-серым и розовым цветом
^ответственно. Сайты связывания кодируемого хозяином гистоноподобного белка IHF показаны светло-серым. Об-
зсть, узнаваемая релаксазой/геликазой Tral, кодируемой F-плазмидой, отмечена красным цветом. По общей орга-
лзации область начала переноса F-плазмиды аналогична этой области плазмиды RP4, однако на лидерном участке
случае F-плазмиды отсутствуют сайты связывания каких-либо известных белков.
А Рис. 16.9. Модель релаксосомы IncP. Спиралями
изображены цепи ДНК, глобулярными телами — моле-
кулы белков. TraJ — специфический компонент, направ-
ляющий релаксазу Tral к области разрезания. Связы-
вание TraJ и Tral с ДНК вызывает локальное разделе-
ние цепей, в результате чего ДНК в области разрезания
оказывается одноцепочечной. Локальному раскручива-
нию ДНК способствует оборот области начала переноса
размером 180 п.н. вокруг сердцевинной части релаксо-
сомы, образованной субъединицами гистоноподобного
белка ТгаК, участвующего в формировании релаксосо-
мы. Комплекс Tral-TraJ-on'T может быть стабилизиро-
ван белком ТгаН (не показан), который выполняет роль
«зажима» между Tral и TraJ, но сам не связывается с
ДНК. По [2].
Клеточные мембраны
ДНК-геликаза
Тга1-релаксаза
ТгаС-праимаза
РНК-затравка
Прерывистый
синтез ДНК
полимеразой
клетки-хозяина
Репликация ДНК полимеразой
клетки-хозяина по механизму
катящегося кольца
▲ Рис. 16.11. Модель репликации ДНК по механизму
катящегося кольца в процессе переноса.
А. Ранняя стадия переноса, следующая за инициацией.
Б. Стадия перед терминацией, происходящей путем вто-
рого разрезания цепи в сайте регенерированного участка
разрезания. По [3].
► Рис. 16.12. Модель конъюгативного переноса транс-
позона Тп916. Цепи ДНК конъюгативного транспо-
зона изображены темно-серыми линиями; цепи ДНК
донорного и реципиентного репликонов-мишеней —
светло-серыми линиями. Концы транспозона отмече-
ны красным; последовательности-мишени, ограничен-
но сходные с концами транспозона, отмечены розовым.
Образующийся гетеродуплекс в пределах варьирующей
сердцевинной области показан более тонким отрезком.
Разрешение гетеродуплекса происходит в процессе конъ-
югативного переноса или последующей репликации про-
дуктов включения/вырезания (не показано). Положения
разрезов показаны стрелками.
Xis-Tn
Int-Tn
IHF (?)
Вырезание путем ступенчатых
разрезов и реципрокное
соединение концов ДНК
Донор
Перенос через
клеточные мембраны
Реципиент
А
Интеграция путем
Int-Tn ступенчатого разрезания и
IHF (?) реципрокного соединения
11 концов ДНК
▲ Рис. 16.13. Общая организация генов специализированной системы выделения макромолекул. Гены, кодирующие
гомологичные белки, показаны одинаковым цветом или/и соединены штриховыми линиями. Буквами А, Е и L
отмечены последовательности, предположительно ответственные за связывание нуклеозидтрифосфатов экспорт
белков и присоединение липидов соответственно (см. также рис. 16.5). По [4].
Перенос Т-ДНК,
опосредуемый pTi
Конъюгативный перенос ДНК,
опосредуемый RP4
Правая
граница
Т-ДНК
5'
Область
разрезания
опТ
Образование
комплекса
3'
VirD2
VirDl
VirD3
Tral
TraJ
TraH
Tral
TraC
gal
bio
1
X Int
IHF
Продукты
генов Тга2
TraG
А
ВОВ'
Интеграция путем
ступенчатого
t разрезания
и реципрокного
соединения
уконцев ДНК
cos
Профг
Ью
РОВ'
a rtf?
attL
BOP'
Растительная клетка
Реципиент
Бактериальная клетка
▲ Рис. 16.15. Аналогия процессов бактериальной конъ-
югации и переноса Т-ДНК в растительные клетки. По-
яснения см. в тексте и разд. 16.2.2. По [4].
► Рис. 16.16. Модель специфической трансдукции.
А. А lnt-зависимая интеграция генома фага А (показан
темно-серым) в хромосому Escherichia coli (показана
светло-серым). Сайты внедрения attP (POP') и attB
(BOB') обозначены красным и светло-красным цветом
соответственно. Сердцевинная область (О) показана в
обоих сайтах красным.
Б. Образование специфических трансдуцирующих
фагов в результате неточного вырезания профага А.
В данном примере незаконная рекомбинация между
профагом и хромосомной ДНК приводит к образованию
фагового генома, содержащего gaZ-оперон. Присутствие
cos-сайта фага А обеспечивает эффективную упаковку
ДНК в ходе литического цикла.
A
Б
Рекомбинация
в сайте X
► Рис. 16.17. Механизмы рекомбинации
у Escherichia coli. Представлены четыре
разных, но взаимозависимых пути гомо-
логичной рекомбинации и их этапы. По-
дробности см. в тексте. По [б].
Red
RecQ
RecBCD
RecE
ДНК-геликаза/
Постсинапсис
RuvABC
RecC + ?
Миграция ветвей/разделение цепей
► Рис. 16.18. Инициация гомологич-
ной рекомбинации белковым комплексом
RecBCD. Этапы с участием ферментов,
приведенных на рис. 16.17 и в табл. 16.1.
Внедрение
RecBCD
между цепями
Частичное
раскручивание
Разрезание
в х-сайте,
ослабление
эндонуклеазной
активности
А Рис. 16.19. Гипотетический трехцепочечный механизм обмена в участке ДНК, окруженном нитью из молекул
белка RecA Белковые молекулы (показаны как шарики) изображены не в масштабе. По [7].
J
▲ Рис. 16.20. Разделение (разрешение) структуры Холлидея с участием белка RuvC и образованием двух возмож-
ных продуктов. Перед разделением структура Холлидея принимает конформацию, в которой она служит субстратом
для RuvC. Эта конформация образуется путем закручивания структуры либо вокруг оси А (левосторонний меха-
низм), либо вокруг оси В (правосторонний механизм). Разрешение путем разрезания (жирные стрелки) приводит к
образованию либо продуктов abcb и cdad, либо продуктов abad и cdcb
◄ Рис. 17.1. Природная R-плазмида и полученная из
нее плазмида-вектор.
А. Природные плазмиды построены по модульному ти-
пу, как видно на примере плазмиды RP4 из семейства
IncPfi. Эта плазмида содержит функционально незави-
симые модули, такие как элемент \S21 и транспозон
Тп1, плюс модули, обеспечивающие поддержание плаз-
миды (гены inc, kfr, kor, ssb и trf ; генные продукты Ctl,
Kil, Pat/Mrs, FiwA и Rep) и ее конъюгативный перенос
(см. также гл. 16). Гены переноса составляют класте-
ры в двух областях, Tral и Тга2 (обозначены красным
цветом), необходимых для процессинга ДНК и спари-
вания соответственно. Интегральные модули эволюцио-
нировали совместно для функциональной адаптации, и
в результате невозможен взаимообмен функционально
аналогичными генами, например генами tra из плазми-
ды RP4 и из плазмиды F семейства IncFI.
Б. В получаемых векторах сохраняются только область
начала репликации (or/V) и гены Ыа и tet (устойчивости
к антибиотикам ампициллину, Арг, и тетрациклину, Тсг
соответственно), что сводит к минимуму нежелатель-
ный перенос генов.
Лигаза
Упаковка в капсиды
▲ Рис. 17.3. Принципы клонирования ДНК. Векторную
и клонируемую ДНК разрезают рестрицирующей эндо-
нуклеазой, в данном случае BamHI, для которой в век-
торе существует уникальный сайт разрезания. Показан-
ный здесь сайт локализован внутри гена tetA плазмиды
pBR322 (см. рис. 17.2). Таким образом, коинтеграт по-
сле инсерции теряет фенотип Тсг, но сохраняет устой-
чивость к ампициллину (Арг), облегчающую селекцию.
Для предотвращения лигирования концов разрезанный
вектор обычно обрабатывают фосфатазой. Чтобы обес-
печить единственно возможную ориентацию клонируе-
мой ДНК внутри вектора, фрагменты ДНК и векторы
могут быть получены путем разрезания двумя рестрици-
рующими эндонуклеазами (например, Hind III и BamHI)
вместо одной.
▲ Рис. 17.5. Использование А-векторов для клониро-
вания. Чужеродную ДНК разрезают путем частичной
рестрикции на фрагменты размером 10-20 т.п.н. По-
сле разрезания А-вектора (в данном случае EMBL3) и
отделения лишней ДНК его «плечи» сшивают с фраг-
ментами клонируемой ДНК. Образующиеся в результа-
те длинные конкатемеры in vitro упаковывают в капси-
ды. Полученные фаги высевают на газон чувствитель-
ной бактерии-хозяина для образования бляшек. Каждая
бляшка представляет собой клон, содержащий > 106
фаговых частиц, которые несут по одному фрагменту
клонируемой ДНК. Эти фрагменты выделяют и исполь-
зуют для анализа.
▲ Рис. 17.6. Космиды в качестве клонирующих век-
торов. А. Космидный вектор содержит необходимую
для репликации область oriV, гены Ыа, обеспечивающие
Арг-селекцию, и сайт cos фага А. На рисунке по-
казана упрощенная схема вектора SuperCosI, содер-
жащего, кроме множественных сайтов клонирования
(MSC), промоторы фагов Т7 и ТЗ. Эти промоторы
могут быть использованы как сайты связывания за-
травки для определения последовательности нуклео-
тидов на обоих концах вставки с целью облегчения
ее идентификации или для образования in vitro РНК-
зондов, специфичных для всей цепи и ее концов (на-
пример, для идентификации перекрывающихся клонов
методами гибридизации). Космида переводится в ли-
нейную форму разрезанием в сайте Xbal с последу-
ющим включением чужеродной ДНК в сайтах MCS.
После лигирования осуществляют упаковку ДНК in
vitro в капсиды фага А. Наличие двойного сайта cos
способствует эффективному клонированию и упаков-
ке ДНК. После трансдукции клетки хозяина, содержа-
щие космиды, могут быть легко выделены путем отбора
Арг-клонов и проанализированы.
Б. Когда космиды содержат единственный сайт cos, ли-
гирование клонируемой ДНК in vitro приводит к об-
разованию конкатемерной структуры за счет ассоциа-
ции природных cos-сайтов. Такие структуры могут быть
упакованы в капсиды in vitro, если расстояние между
cos-сайтами составляет примерно 37—52 т.п.н. Для про-
цесса упаковки, кроме наличия рекомбинантной ДНК,
необходимо присутствие в высокой концентрации пре-
капсидов фага, а также белков отростков и белков,
участвующих в упаковке. После попадания в клетку хо-
зяина космида реплицируется, подобно плазмиде, и мо-
жет быть изолирована из клеток-хозяев, имеющих фе-
нотип Арг.
5'— . 3' мРНК
<Г~ ~ 15'
v 3'-5'-затравка
Первая цепь | | з'
3' 3' 3' 3' 3'
Лигирование линкерных ДНК
Рестрикция
Клонирование в векторе
▲ Рис. 17.7. Создание библиотеки кДНК из РНК. Для
этого метода, часто применяемого в исследованиях эу-
кариот и иногда — малоизученных прокариот, исполь-
зуют особые виды РНК, например те, которые обра-
зуются только в определенных условиях выращивания.
Вначале с помощью обратной транскриптазы синтезиру-
ют первую комплементарную цепь ДНК, затем с помо-
щью одной из ДНК-полимераз — вторую цепь ДНК, по-
лучая в конечном итоге двухцепочечную комплементар-
ную ДНК, или кДНК. Для удобства манипулирования с
кДНК перед началом клонирования в составе вектора
и для амплификации в оба ее конца вводят искусствен-
ные сайты рестрикции. Все виды РНК данного организ-
ма могут быть выделены и клонированы одновременно
для создания библиотеки кДНК.
Секвенируемая ДНК
Затравка
Реакция 3
Реакция 1
Реакция 2
Реакция 4
a-[32P]dATP a-[32P]dATP a-[32P]dATP a-[32P]dATP ddATP
dCTP dCTP dCTP ddCTP dCTP
dCTP dCTP ddCTP dCTP dCTP
dTTP ddTTP dTTP dTTP dTTP
ТТССАААССТТССАТС
ТТ ССАААССТТССАТ
ТТССАААССТТССА
ТТССАААССТТСС
ТТССАААССТТС
ТТССАААССТТ
TTCGAAACCT
ТТССАААС
ТТССААА
TTCGAA
ТТССА
ТТСС
ТТС
Комплементарный олигонуклеотид
с одной или большим числом ошибок
▲ Рис. 17.15. Локализованный мутагенез in vitro. Про-
цедура начинается с клонирования ДНК в составе век-
тора М13, содержащего несколько остатков урацила
вследствие репликации в клетках мутанта Ung~Dut-.
Для локализованного мутагенеза клонированной ДНК
необходима комплементарная затравка с одной или
большим числом замен оснований (показана красным).
Эту затравку удлиняют путем синтеза ДНК с образо-
ванием двухцепочечной, или RF, молекулы. После ин-
фицирования этой ДНК Ung'1 -клеток цепь, содержащая
остатки урацила, инактивируется, тогда как мутантная
комплементарная цепь, не содержащая остатков ура-
цила, сохраняется и размножается (подробности см. в
тексте).
▲ Рис. 17.14. Схема секвенирования дидезокси-методом прерывания цепи. Параллельно готовят четыре реакцион-
ных смеси, каждая из которых содержит дезоксинуклеотид, меченный радиоизотопом или другим способом (в дан-
ном случае a-[32P]dATP), а также три других немеченых дезокси нуклеотида. Кроме того, каждая реакционная смесь
содержит ди дезокси нуклеотид: ddTTP, ddCTP, ddGTP или ddATP, как показано в таблице. Соотношение ddNTP и
dNTP выбирают в зависимости от условий эксперимента —1/50, 1/100 или 1/200. Синтез комплементарной цепи
инициируется при добавлении ДНК-полимеразы и прерывается, когда в активный центр этого фермента включается
дидезоксинуклеотид. В реакции 1 это происходит, когда в соответствии с правилом комплементарное™ последо-
вательность матрицы требует включения тиминового нуклеотида. Поэтому в реакции 1 накапливаются фрагменты
ДНК, длина которых соответствует положениям адениловых остатков в матричной цепи. Аналогично этому в ре-
акции 2 картируют положение гуаниловых остатков, в реакции 3 — цитидиловых и в реакции 4 — тимидиловых.
Важным этапом эксперимента является четкое разделение продуктов синтеза, для которого синтезированные цепи
ДНК подвергают денатурации и фракционируют в специальных полиакриламидных гелях. Наличие метки позволяет
определять продукты реакции радиоавтографически или специальными методами окрашивания. В нижней части
рисунка показана схема результатов гель-электрофореза. Самый мелкий фрагмент, мигрирующий в крайнюю ниж-
нюю часть геля, указывает положение первого нуклеотида в последовательности; следующий, большего размера —
положение второго нуклеотида и т. д.
Этап О
QQOwtiiiii......ни.........и 11 iTTTmTTTi^y^Q
I
Этап 1
Исходная ДНК
Денатурация и
гибридизация
с затравками
/— 11 1ШШШШШШЩЦ[Щ^1
Синтез ДНК
с затравок
Этап 2
Денатурация и
гибридизация
с затравками
I
◄ Рис. 17.18. Полимеразная цепная реакция (пцр).
А. Для ПЦР необходимы смысловая и антисмысловая
затравки, фланкирующие оба конца подлежащей репли-
кации ДНК. На этапе 1 их гибридизуют с денатуриро-
ванной ДНК и используют в качестве З'-затравок для
синтеза обеих комплементарных цепей ДНК с помо-
щью термостабильной ДНК-полимеразы Taq. На этапе 2
ДНК вновь денатурируют и повторно гибридизуют с за-
травками для проведения второго цикла синтеза ДНК;
при этом образуются первые две молекулы ДНК, флан-
кированные затравками. На этапе 3 и на всех последу-
ющих этапах денатурацию, гибридизацию с затравками
и синтез ДНК повторяют вновь и вновь до тех пор, пока
не образуется (Б) примерно после 25 циклов более 10б
копий ДНК (масса порядка микрограммов), фланкиро-
ванных затравками. Благодаря применению термоста-
бильной ДНК-полимеразы процедуру можно автомати-
зировать и осуществлять со скоростью 30-60 циклов в
час.
Синтез ДНК
,О~ЯШИт1Л11Тгт11ТГ1111Тттп11тттп'
Этап 3
21ИНН.
iiiiiiiiiiiiii
Денатурация и
гибридизация
с затравками
Синтез ДНК
Enh____________
_______^11 I hin ~~У | >
hixL'^. hixR
р[—__________________ _________________
hagB активен '/л—| hagB hagR У op | hagA У
hagA не активен i i д q
п Инверсия у ---''
] 'Флагеллин Репрессор
I HagB HagR
1 hagB )[
hagR У
QP1! hagA У
Флагеллин НадА
hin
д | hagB » hagR >
▲ Рис. 18.17. Активация и репрессия генов путем пе-
рестройки ДНК. При фазовой вариации у Salmonella
экспрессия генов hag контролируется путем рекомбина-
ционной инверсии (переключения) промотора (подроб-
ности см. в тексте). Enh — энхансер; р — промотор; о —
оператор.
Нити отростка фага в случае £ coli К-12
gixL 1
i Р Ш I 5„> ПО
------
|Р| 5с ||] ^/•| и'У _______
I <Sv П < % 9/n I
Нити отростка фага в случае Е. coli С
▲ Рис. 18.18. Изменение спектра хозяев у бактериофа-
га Ми в результате рекомбинационной инверсии струк-
турных генов (подробности см. в тексте).
А Белок CI бактериофага 434
▲ Рис. 18.19. Синтез сг-субъединицы, специфической
для процесса спорообразования у Bacillus subtilis.
Чтобы осуществлялась транскрипция гена этой ст-
субъединицы, должно произойти катализируемое
SpoIVCA образование путем рекомбинации (штриховой
знак «X») полного гена, состоящего из сегментов
spoIVCB' и spolllC' (подробности см. тексте).
Ъег Т.р я
Белок Cl бактериофага Р22
Модифицированный гибридный
белок CI бактериофага 434
Сторона, удаленная от ДНК
▲ Рис. 18.27. Связывающаяся с ДНК поверхность рас-
познающей спирали белка-репрессора CI бактериофа-
га 434 Е. coli генетическими методами превращена
в аналогичную структуру белка Cl бактериофага Р22
Salmonella typhimurium (с заменой шести аминокислот-
ных остатков, участвующих во взаимодействии с ДНК).
Представлены аминокислотные последовательности: CI
фага 434 (A); CI фага Р22 (Б);
В. Модифицированная последовательность CI фага 434.
Вид вдоль оси этой спирали показан в части Г;
Г. Модифицированная последовательность CI фага 434,
обладающая всеми ДНК-связывающими свойствами CI
фага Р22. Аналогичные эксперименты по замене спи-
ральных участков проведены с белками LacI и GaIR,
FruR и ScrR, Сгр и Fnr. По [5].
▲ Рис. 18.26. ДНК-связывающая структура спираль-
виток—спираль и ее специфичное к нуклеотидной после-
довательности связывание с ДНК.
А. Схематическое изображение структуры спираль—
виток-спираль в случае Cro-белка (репрессора) фага Л.
Распознающая спираль показана красным. Полностью
молекула белка не показана.
Б. Две структуры спираль—виток-спираль в случае ди-
мерного Cro-белка; распознающие спирали (показаны
красным) связываются с операторной последовательно-
стью в большой бороздке ДНК. Полностью структура
димера не показана. По [4].
◄ Рис. 18.28. Связывание репрессора MetJ с опера-
торной последовательностью в ДНК Е. coli. Репрессор
представляет собой димерный белок, способный в фор-
ме комплекса с SAM прочно связываться с ДНК. Две
>3-цепи (красные стрелки), по одной из каждой субъ-
единицы димера, образующие /3-складку, специфично
связываются с одной и той же последовательностью в
большой бороздке молекулы ДНК. Гибкие N-концевые
петли и N-концы а-В-спиралей неспецифически взаи-
модействуют с фосфатным остовом молекулы ДНК
SAM — S-аденозилметионин. По [4].
▲ Рис. 19.14. Схема секреции белков, зависимой от продуктов генов sec. Белок SecB — молекула-шеперон, под-
держивающая пре-белок в «транслокационно компетентном» состоянии. SecA — белок, принимающий участие в
передаче комплекса SecB—пре-белок на мембранный транслокационный комплекс SecY/E/G, а также в процессе
транслокации с помощью SecG. Точная роль белков SecD и SecF остается неизвестной. Сигнальная пептидаза (Lep)
действует, по-видимому, на периплазматической стороне плазматической мембраны. Сигнальный пептид обозначен
красным цветом. Объяснения см. в тексте. По [3].
Глава 19
Посттрансляционный контроль и модификация белков
Для успешной конкуренции с другими организ-
мами бактерии должны обладать способностью
быстро реагировать на изменения в окружаю-
щей среде, в том числе концентрации питатель-
ных веществ. Одним из механизмов реагирова-
ния служит описанная в других главах этой ча-
сти книги регуляция экспрессии генов. Однако
такой способ ответа можно назвать долговремен-
ным, поскольку, во-первых, возможна значитель-
ная задержка в индукции активности определен-
ных генов и, во-вторых, при действии механиз-
мов репрессии может требоваться до несколь-
ких периодов генерации, чтобы снизился уро-
вень ранее синтезированных ферментов в ре-
зультате их разбавления. Наряду с такой «мед-
ленной» регуляцией для бактерий важна также
способность к более гибкой координации мета-
болической активности с изменениями окружаю-
щей среды, и такую координацию обеспечивают
посттрансляциоикый контроль уровня белков,
включающий внутриклеточную компартмен-
тацию.
19.1. Посттрансляционный контроль
обеспечивает быструю адаптацию бактерий
19.1.1. Посттрансляционный контроль
и модификация белков играют роль
во многих клеточных процессах
Важными механизмами посттрансляционной ре-
гуляции служат аллостерическая регуляция
активности ферментов метаболизма и в некото-
рых случаях их ковалентная модификация.
Посттрапсляционная модификация (главным об-
разом фосфорилирование) у бактерий является
одним из механизмов регуляции экспрессии генов,
поведенческих реакций, например хемотаксиса, и
действия общего регуляторной сети (см. гл. 20).
Ряд процессов, таких как регуляция функций,
оборот и компартментация белков, зависит от
протеолитической модификации белков. В дан-
ной главе мы рассмотрим некоторые хорошо изу-
ченные примеры посттрансляциоиного контроля
и его роли в физиологии и адаптации бактерий.
Посттрансляционный контроль обеспечивает
быстрое (в течение секунд) приспособление ме-
таболизма прокариот к изменениям окружающей
среды. Он включает аллостерическую регуляцию
ферментативной активности, ковалентную моди-
фикацию ферментов и компартментацию бел-
ков.
19.1.2. Посттрансляционный контроль включает
как нековалентную модификацию
ферментативной активности,
так и ковалентный процессинг белков
Активность некоторых ферментов, называемых
аллостерическими, подвержена изменениям (сти-
муляции или подавлению) в результате некова-
лентного связывания с их регуляторными сай-
тами определенных метаболитов. Такая прямая
регуляция служит либо для быстрой инакти-
вации ненужного в данный период фермента
(например, ингибирование ферментов путей био-
синтеза их продуктами по механизму обратной
связи) либо для стимуляции активности при сроч-
ной потребности в образовании того или иного
продукта. Кроме того, данный путь регуляции
служит для поддержания необходимой интенсив-
ности ферментативных реакций катаболизма.
562 Часть V. Экспрессия генов и механизмы регуляции
Аллостерическая
модификация
Ковалентная модификация
(менее активное
состояние)
(более активное
состояние)
Рис. 19.1. Регуляция активности ферментов путем ал-
лостерической и ковалентной модификации.
А. При аллостерической регуляции эффектор (темные
квадраты) связывается с сайтом, отличным от связыва-
ющего субстрат активного центра (S), и сдвигает рав-
новесие между Т- (менее активным) и R- (более актив-
ным) состояниями фермента. В представленном на ри-
сунке гипотетическом примере эффектор представляет
собой аллостерический активатор.
Б. При ковалентной модификации фермент обратимо
модифицируется, например путем фосфорилирования
(Р), что увеличивает (показано) или уменьшает его ак-
тивность. Состояние ковалентной модификации фер-
мента обычно зависит от метаболических факторов
и/или факторов окружающей среды.
Как правило, аллостерическая регуляция осу-
ществляется за счет конформационного измене-
ния молекулы фермента в результате обратимо-
го связывания ингибитора или активатора с его
определенным сайтом (пс с активным центром).
В отдельных случаях активность фермента из-
меняется (альтернативно или дополнительно) пу-
тем обратимой ковалентной модификации, кото-
рую способны катализировать ферменты, в свою
очередь подверженные аллостерической или ко-
валентной регуляции (рис. 19.1). Специфические
примеры этих механизмов рассмотрены в следу-
ющем разделе.
Ковалентная посттрансляционная модифика-
ция белков у бактерий осуществляется путем фос-
форилирования, протеолиза (специфического и
неспецифического), метилирования, ацетилирова-
нпя, аденилирования, уридилирования или аци-
лирования жирными кислотами. Как будет опи-
сано далее, от модификаций этого типа зависит
протекание и регуляция разнообразных клеточ-
ных процессов. Многие из таких модификаций,
в частности влияющие на активность фермен-
тов, экспрессию генов и поведение клеток, пол-
ностью обратимы, благодаря тому что специ-
фические ферменты катализируют как реакции
модификации, так и обратные реакции. Другие
модификации, например протеолиз, необратимы
и используются в тех клеточных процессах, для
которых восстановления прежнего состояния бел-
ка не требуется (например, в случае деградации
белка как источника аминокислот, введения мет-
ки в белок или завершения необратимых фаз в
клеточном цикле).
19.2. Аллостерическая регуляция активности ферментов
широко распространена у прокариот
Аллостерическая регуляция с участием низкомо-
лекулярных метаболитов в качестве ингибиторов
или активаторов характерна как для анаболиче-
ских, так и для катаболических путей метабо-
лизма.
19.2.1. Механизмы аллостерической регуляции
весьма разнообразны
В анаболических процессах первый специфи-
ческий фермент данного пути (например, фер-
мент, действующий после разветвления двух пу-
тей), как правило, служит мишенью для инги-
бирования по механизму обратной связи ко-
нечным продуктом пути (рис. 19.2, А). Накопле-
ние конечного продукта биосинтеза служит сиг-
налом, что он синтезирован (или поступает из
внешней среды) в избытке. Этот механизм регу-
ляции действует во многих путях биоситеза ами-
нокислот, нуклеотидов и витаминов. Разветвлен-
ные биосинтетические пути, в которых из одного и
того же предшественника образуется более одно-
го конечного продукта, могут регулироваться пу-
Глава 19. Посттрансляционный контроль и модификация белков 563
Рис. 19.2. Гипотетические механизмы аллостерической
регуляции анаболических путей. Интермедиаты обозна-
чены прописными буквами, ферменты — строчными.
А. Регуляция первого ключевого этапа анаболического
пути по механизму обратной связи. Для интермедиата
В существует единственный вариант превращения — об-
разование конечного продукта Е, поэтому Е подавляет
активность фермента (а), катализирующего превраще-
ние А в В.
Б. Последовательное ингибирование по механизму об-
ратной связи в разветвленных путях. Каждый конечный
продукт подавляет активность фермента, катализирую-
щего первую ключевую стадию его биосинтеза. Если оба
продукта присутствуют в избытке, накапливается интер-
медиат С, подавляющий активность первого ключевого
фермента собственного биосинтеза и вследствие этого
весь метаболический путь.
В. Кумулятивное ингибирование по механизму обратной
связи. Если в метаболическом пути образуется несколь-
ко конечных продуктов, каждый из них лишь частично
подавляет активность первого фермента (а). Эти эф-
фекты аддитивны, поэтому, когда все конечные продук-
ты присутствуют в избытке, активность фермента (а)
подавляется полностью.
Г. Изоферменты (ai, аг), регулируемые раздельно.
В некоторых разветвленных метаболических путях пер-
вый этап катализируют несколько изоферментов, актив-
ность которых раздельно подавляется каждым из конеч-
ных продуктов.
тем последовательного ингибирования, когда
каждый конечный продукт ингибирует ключевой
фермент своего пути синтеза (рис. 19.2, Б); или
по механизму кумулятивного ингибирования,
при котором конечный продукт каждого пути ча-
стично подавляет активность фермента общего
этапа двух ветвей биосинтеза (рис. 19.2, В). Од-
на из разновидностей кумулятивного ингибирова-
ния— это согласованное ингибирование, при
котором каждый из конечных продуктов сам по
себе не оказывает влияния, однако два или боль-
шее число продуктов совместно подавляют актив-
ность фермента. Кроме того, в некоторых биосин-
тетических путях у прокариот действуют изофер-
менты, катализирующие одну и ту же начальную
реакцию пути, но регулируемые различными ко-
нечными продуктами (рис. 19.2, Г).
В анаболических путях возможна также регу-
ляция путем аллостерической активации фер-
ментов. Активатором чаще всего служит мета-
болит, не относящийся к регулируемого пути, но
сигнализирующий своим присутствием о необхо-
димости дополнительного синтеза конечного про-
дукта.
Катаболические пути также могут регу-
лироваться путем ингибирования по механизму
обратной связи или посредством аллостериче-
ской активации, включающей «предупредитель-
ную» регуляцию. Механизм обратной связи состо-
ит в том, что активность фермента подавляют на
ранних стадиях данного пути один или несколько
промежуточных (не конечных) продуктов метабо-
лического пути. Активаторами ферментов ката-
болизма могут служить метаболиты какой-либо
части данного пути или другого метаболическо-
го пути. В некоторых случаях наблюдается пре-
дупредительная регуляция, при которой про-
межуточные метаболиты влияют на активность
564 Часть V. Экспрессия генов и механизмы регуляции
Таблица 19.1. Примеры анаболических путей, подверженных аллостерической регуляции у Е. coli и/или Salmonella
typhimurium. (+) — активатор; (—) — ингибитор
Метаболический путь Фермент-мишень Эффектор(-ы)
Синтез пиримидинов Синтез аргинина Синтез пиримидинов/аргинина Ассимиляция NH3 Синтез аминокислот из L-аспартата Аспартат-транскарбамилаза /V-ацетилглутаматсинтетаза Карбамоилфосфат (КФ)-синтаза Гл утам и нс и 11тетаза Аснартаткиназа I Аспартаткиназа III СТР (-) АТР (+) Arg UMP (-) IMP (+) Орнитин (+) АМР, СТР, карбамоил-Р, глюкозамин-6-Р, Ala, Glu, His, Trp (все —) Thr (-) Lys (-)
фермента более позднего этапа пути. Кроме то-
го, взаимосвязанные реакции гликолиза, глюко-
неогенеза и цикла трикарбоновых кислот — цен-
тральных путей катаболизма у большинства гете-
ротрофных бактерий — находятся под контролем
общей регуляторной сети.
Аллостерический контроль путей анаболиз-
ма и катаболизма широко распространен у про-
кариот. Он служит для регуляции ключевых ре-
акций и включает участие низкомолекулярных
метаболитов в качестве ингибиторов или актива-
торов. Для данного типа регуляции характерно
ингибирование по принципу обратной свя-
зи (последовательное, кумулятивное или согласо-
ванное) с участием конечного продукта метаболи-
ческого пути, а также предупредительная ак-
тивация промежуточными продуктами.
19.2.2. Аллостерическая регуляция
анаболических путей высоковариабельна
Некоторые анаболические пути, действующие у
бактерий под контролем аллост срической регуля-
ции, соответствующие ферменты-мишени и эф-
фекторы приведены в табл. 19.1. Наиболее по-
дробно такие пути изучены у Е. coli и Salmonella
typhimurium. Биохимическое описание этих путей
обмена можно найти в гл. 7-12.
Пример: аспартат-карбамоилтрансфера-
за □ Аспартат-карбамоилтрансфераза (другое
название — аспартат-транскарбамилаза, АТКа-
за) катализирует первую реакцию, специфич-
ную для биосинтеза пиримидиновых нуклеоти-
дов: конденсацию карбамоилфосфата и аспарта-
та с образованием карбамоиласпартата. и неорга-
нического фосфата (см. разд. 7.8.2 и рис. 7.25).
Нативная АТКаза Е. coll состоит из двух тример-
ных каталитических (С) субъединиц (мол. масса
каждой субъединицы 100 кДа) и трех димерных
регуляторных (R) субъединиц (мол. масса каж-
дой субъединицы 34кДа), которые диссоцииру-
ют в присутствии некоторых сульфгидрильных
реагентов, например ртутьорганических соеди-
нений. Изолированные С-субъедипицы способны
катализировать АТКазпую реакцию, тогда как
R-субъединицы не обладают какой-либо извест-
ной каталитической активностью.
Активность нативной АТКазы подавляется
СТР (конечным продуктом пиримидинового пу-
ти) в относительно низкой концентрации и ак-
тивируется АТР (конечным продуктом отдельно-
го пути биосинтеза пуриновых нуклеотидов; см.
разд. 7.8.1). Такой аллостерической регуляцией
обусловлена относительно низкая интенсивность
потока веществ по этому пути в присутствии из-
бытка конечных продуктов, подобных СТР. В то
же время активация АТКазы под действием АТР
служит, по-видимому, механизмом увеличения по-
тока веществ по пиримидиновому пути при из-
бытке пуриновых нуклеотидов; благодаря этому
необходимый для биосинтеза нуклеиновых кис-
лот синтез пуринов и пиримидинов может поддер-
живаться на более или менее одинаковом уровне
(рис. 19.3).
Кинетика реакции, катализируемой натив-
ной АТКазой, описывается S-образной кривой
(рис. 19.4), форма которой наиболее выражена
в случае присутствия СТР и менее— АТР. Од-
Глава 19. Посттрансляционный контроль и модификация белков 565
Рис. 19.3. Регуляция пути биосинтеза пиримидинов.
СТР (конечный продукт) аллостерически подавляет
активность аспартат-транскарбамилазы (АТКазы) (—),
тогда как АТР (пуриновый нуклеотид, конечный про-
дукт другого биосинтетического пути) активирует этот
фермент (+).
соон
I
АТ Каза О H СН2
------► II I I + ро’-
h2n-c-n-c-h
@/ V© соон
/ \
nh2 соон
I I
с=о сн2
о h-c-nh2
но - Р - - о соон
I
он
Карбамоил- фосфат Аспарагиновая кислота
Карбамоиласпарагиновая
кислота
Рис. 19.4. Зависимость скорости реакции от концен-
трации аспартата для АТКазы. Эта кривая зависимо-
сти для нативной АТКазы имеет S-образную форму
(сплошная линия), наиболее выраженную в присутствии
СТР (штриховая линия) и менее четкую в присутствии
АТР (пунктирная линия). Г рафик для изолированной
субъединицы С имеет гиперболическую форму (штрих-
пунктирная линия), что свидетельствует о некоопера-
тивном взаимодействии аспартата с этой субъединицей.
Путь биосинтеза
пуринов
пако в случае изолированных С-субъединиц кри-
вая зависимости имеет вид гиперболы и добав-
ление СТР или АТР лишь незначительно вли-
яет на ее форму. Кроме того, изолированные
R-субъединицы связывают СТР и АТР в одном
и том же сайте. Таким образом, в нативном фер-
менте связывание эффекторов с R-субъединицсй
влияет на активность С-субъедизицы в резуль-
тате уменьшения (в случае СТР) или увеличе-
ния (в случае АТР) кажущегося сродства к одно-
му из субстратов (аспартату). Поэтому при обыч-
ной внутриклеточной концентрации аспартата это
приводит соответственно к ингибированию или
активации фермента.
Активность многих аллостерических фермен-
тов характеризуется S-образной кинетической
кривой, по крайней мере для одного из субстра-
тов. Этот тип зависимости активности фермен-
та от концентрации субстрата указывает па ко-
оперативный характер взаимодействия суб-
страта с ферментом. При низких концентрациях
субстрата кажущееся сродство фермента к суб-
страту ниже, чем при высоких концентрациях
субстрата. По-видимому, эти изменения кажу-
щегося сродства обусловлены конформационным
изменением белка, которому способствует свя-
зывание им одной или большего числа молекул
субстрата. Таким образом, в случае нативной
АТКазы связывание аспартата с частью катали-
тических центров (всего их 6) повышает сродство
к аспартату всех остальных каталитических цен-
тров, включая не занятые субстратом.
Для большинства аллостерических ферментов
постулировано в связи с этим существование по
меньшей мере двух конформационных состояний:
состояния с низким сродством, Т (от tight — на-
пряженное), преимущественно имеющего место в
отсутствие субстрата или при его низкой концен-
трации и в присутствии аллостерического инги-
битора. а также состояния с высоким сродством,
R (от relaxed —релаксированное), преимуще-
ственно наблюдаемого при высокой концентрации
субстрата и в присутствии активатора. Возмож-
ны также промежуточные состояния. В случае
АТКазы структура фермента в Т- и R.-состояпиях
определяется рентгенографически и позволяет
объяснить, каким образом связывание аспартата
с одним центром влияет па сродство к субстрату
других центров, а также то, каким образом свя-
зывание нуклеотидов влияет на равновесие меж-
ду этими двумя конформационными состояниями
(рис. 19.5).
566 Часть V. Экспрессия генов и механизмы регуляции
Рис. 19.5. Структура АТКазы в Т- и R-состояниях. Две
тримерные С-субъединицы (показаны светло-серым) об-
разуют «сэндвич» вокруг трех димерных R-субъединиц
(показаны темно-серым). В Т-состоянии (в отсутствие
связанного субстрата) этот «сэндвич» компактен, то-
гда как в R-состоянии при связывании аналогов суб-
страта или продукта (черные мелкие овалы) он приоб-
ретает значительно более открытую конформацию. По
Lipscomb et al.
Рис. 19.6. Роль карбамоил фосфата в биосинтезе арги-
нина и пиримидинов. Поскольку карбамоилфосфат слу-
жит субстратом обоих этих путей, карбамоилфосфат-
синтаза является объектом сложной аллостерической
регуляции. Она подвергается ингибированию по ме-
ханизму обратной связи (штриховые стрелки со зна-
ком —) под действием UMP (пиримидиновый нуклео-
тид), но этому эффекту противодействуют (знак + в
случае активации) IMP (пуриновый нуклеотид) и орни-
тин (промежуточный продукт в биосинтезе аргинина).
Подробности см. в тексте.
Пример: карбамоилфосфатсинтаза и пу-
ти биосинтеза аргинина и пиримидинов □
Карбамоилфосфатсинтаза (КФ-синтаза) катали-
зирует образование карбамоилфосфата из СО2,
АТР и глутамата. 13 свою очередь карбамоил-
фосфат служит субстратом АТКазы в биосин-
тезе пиримидинов (см. разд. 7.8.2), а также
субстратом для орнитин-карбамоилтрансферазы
(см. разд. 7.6.1), фермента пути биосинтеза ар-
гинина из глутамата (рис. 19.6). У Е. coli
КФ-синтетаза состоит из двух субъединиц (мол.
массой 130 кДа и 42 кДа) и обнаруживает необыч-
ный характер аллостерической регуляции, сви-
детельствующий о значении этого фермента для
двух упомянутых метаболических путей. Актив-
ность КФ-синтазы подавляется по механизму об-
ратной связи UMP, промежуточным продуктом
биосинтеза пиримидиновых нуклеотидов, однако
этому эффекту противодействуют IMP (промежу-
точный продукт пути биосинтеза пуриновых нук-
леотидов) и орнитин (рис. 19.6).
Аллостерические ферменты состоят из
нескольких (двух, четырех или большего числа)
субъединиц, которые могут быть идентичными
(гомомеры) или различными по структуре (ге-
теромеры). Кроме субстрат-связывающего сайта
эти ферменты содержат один или несколько сай-
тов связывания молекул-эффекторов; связыва-
ние или диссоциация последних изменяет ак-
тивность фермента. Вследствие кооперативных
взаимодействий между субъединицами кине-
тика активности аллостерических ферментов во
многих случаях характеризуется S-образной кри-
вой с пороговой концентрацией субстрата (при бо-
лее низкой его концентрации активность фермен-
та практически отсутствует), оптимальным диа-
пазоном, в пределах которого малые изменения
концентрации субстрата резко изменяют актив-
ность фермента, и областью насыщения. Эффек-
торы либо снижают (обычно так действуют ко-
нечные продукты), либо повышают (обычно про-
межуточные продукты) активность фермента.
Глава 19. Посттрансляционный контроль и модификация белков 567
Таким образом, в присутствии избытка пи-
римидинов синтез карбамоилфосфата подавлен.
Если при этом активность начальной части
пути биосинтеза аргинина остается высокой, про-
исходит накопление орнитина в результате отно-
сительного дефицита карбамоилфосфата. Высо-
кий уровень орнитина частично устраняет инги-
бирование активности КФ-синтазы под действием
UMP, и аргинин может синтезироваться. Если же
имеется избыток и UMP, и аргинина, функци-
онирование КФ-синтазы практически полностью
тормозится, поскольку аргинин подавляет актив-
ность N-ацетиглутаматсинтетазы — первого фер-
мента пути его биосинтеза, и в результате орни-
тин не накапливается. Активация КФ-синтазы по-
средством IMP, по-видимому, имеет ту же цель,
что активирующее влияние АТР па АТКазу, т. с.
координации путей биосинтеза пуринов и пи-
римидинов. Этот пример регуляции активности
КФ-синтазы иллюстрирует один из множества
сходных механизмов, действующих у прокариот
для координации и соответствующей регуляции
взаимосвязанных путей метаболизма в ответ па
метаболические потребности клеток.
Пример: аллостерический контроль глу-
таминсинтетазы □ Глутамипсинтетаза (GlnS)
из Е. coli представляет собой додекамер, состо-
ящий из идентичных субъединиц мол. массой
55 кДа. Она катализирует синтез L-глутамина из
аммиака и L-глутамата, сопровождающийся гид-
ролизом АТР (см. разд. 7.G.1 и рис. 7.13). Глу-
тамин используется для синтеза белка, как донор
амидных групп в биосинтезе многих азотсодержа-
щих соединений, а также для ассимиляции ам-
миака при дефиците последнего в среде. Как
биосинтез (см. разд. 18.5.2), так и активность
(см. разд. 19.3.1) GlnS регулируется посредством
сложного механизма в соответствии с внутрикле-
точным уровнем азота, показателем которого слу-
жит соотношение глутамин/2-оксоглутарат. Кро-
ме того, активность одной из форм GlnS (см.
рис. 19.10) подвергается кумулятивному ингиби-
рованию по механизму обратной связи рядом ме-
таболитов, в большинстве продуктами метаболиз-
ма глутамина, такими как АМР. СТР, карбамоил-
фосфат, глюкозамип-6-фосфат, глицин, L-аланин,
L-гистидин и L-триптофан. Каждый из них
лишь частично подавляет активность GlnS, имея,
по-видимому, собственный сайт связывания, од-
нако при совместном присутствии эти соединения
способны полностью подавлять активность GlnS.
Пример: регуляция активности аспар-
таткиназы с участием изоферментов □
L-аспарагиновая кислота служит предшественни-
ком в синтезе аминокислот L-лизина, L-мстиони-
на, L-треонина и L-изолейципа (см. разд. 6.2 и
рис. 7.14 и 7.15). У Е. coli разветвленный путь их
синтеза регулируется как последовательным ин-
гибированием по механизму обратной связи, так
и путем использования трех изофункциопальных
аспартаткипа з (AspKI, AspKII и AspKIII),
каждая из которых катализирует первый этап
аспартатного пути: синтез аспартилфосфата из
L-аспартата и АТР (рис. 19.7). Изоферменты
AspKI и AspKII катализируют также третий этап
этого пути — образование гомосерина, обладая ак-
тивностью гомосериндегидрогеназы. Как показа-
но в табл. J9.2, регуляция активности этих ас-
партаткиназ осуществляется различными путя-
ми. Аллостерическим ингибитором активности
AspKI служит треонин, для AspKIII аналогич-
ную роль выполняет лизин; фермент AspKII не
подвергается аллостерическому контролю. Син-
тез всех трех ферментов регулируется так же
независимо конечными продуктами данного ме-
таболического пути, действующими как репрессо-
ры. Благодаря этому сложному механизму регу-
ляции избыток какой-либо одной аминокислоты —
конечного продукта данного пути — не вызывает
дефицита других его конечных продуктов.
Пути регуляции процессов анаболизма
варьируют в пределах одного вида и меж-
ду видами □ У Е. coli представлены все пока-
занные на рис. 19.2 механизмы аллостерической
регуляции. Однако у бактерий других видов те
же самые биосинтетические пути могут регули-
роваться иначе. Например, если у Е. coli суще-
ствуют три нефункциональных аспартаткиназы,
то у некоторых видов Pseudomonas имеется лишь
одна AspK, которая аллостеричсски регулируется
путем согласованного ингибирования по механиз-
му обратной связи, т. е. подавление ее активно-
сти наблюдается только в присутствии всех трех
конечных продуктов данного метаболического пу-
ти. У Е. coli и других энтеробактерий синтетаза
7-фосфо-З-дезоксиарабиногептулозоновой кисло-
ты (катализирующая первый этап пути биосин-
теза ароматических аминокислот) представле-
на несколькими изофункциональными формами.
У Bacillus имеется только один тип такого фер-
мента, регулируемый последовательным ингиби-
рованием по механизму обратной связи. У различ-
568 Часть V. Экспрессия генов и механизмы регуляции
Рис. 19.7. Пути биосинтеза аминокис-
лот семейства аспартата. У Е. coli пер-
вый этап биосинтеза катализируют три
изоферментные формы аспартаткина-
зы (AspKI, II и III). AspKI и AspKII
катализируют также третий этап это-
го пути, обладая гомосериндегидроге-
назной активностью Показано (штри-
ховые жирные стрелки) ингибирование
по механизму обратной связи конечны-
ми продуктами (—).
Изофермент Аллостерический ингибитор Репрессоры
AspK-гомосерин- дстндрогеназа I AspK-гомосери н- дегидрогеназа II AspK III Thr Нет Lys Thr + Пе Met Lys
пых видов Pseudomonas этот фермент регулиру-
ется путем согласованного либо кумулятивного
ингибирования по механизму обратной связи (см.
также разд. 35.4.1 и рис. 35.5).
19.2.3. По аллостерическому механизму
регулируются также процессы
катаболизма
Ферменты катаболических путей также подвер-
жены аллостерической регуляции по механиз-
му ингибированию и активации. На рис. 19.8
показана аллостерическая регуляция гликоли-
за (пути Эмбдена-Мейергофа-Парнаса), глю-
конеогенеза, а также цикла трикарбоновых
кислот у Е. coli. Следует отмстить, что для ка-
таболических путей, в отличие от биосинтети-
ческих, характерно участие в аллостерической
регуляции промежуточных, а не конечных про-
дуктов. Частично это обусловлено тем, что су-
ществует взаимосвязь на уровне промежуточ-
ных продуктов пути Эмбдена-Мейергофа-Пар-
наса между этим процессом, пентозофосфатпым
путем и циклом трикарбоновых кислот; соответ-
ственно количество этих промежуточных продук-
тов в клетке должно контролироваться индивиду-
ально. Кроме того, одни и те же промежуточные
продукты-эффекторы могут служить либо инги-
биторами, либо активаторами или и теми и дру-
гими в отношении различных ферментов. Напри-
мер, накопление фруктозо-1,6-бисфосфата (сви-
детельствующее о том, что скорость синтеза этого
Таблица 19.2. Регуляция по механизму обратной свя-
зи и репрессия трех изоформ аспартаткиназы (AspK) у
Escherichia coli
фосфосахара превышает скорость его превраще-
ния в триозофосфаты) приводит к активирова-
нию как ADP-глюкозопирофосфорилазы (GlyC,
участвующей в синтезе гликогена), так и пиру-
ваткиназы (предупредительная регуляция). Вме-
сте с тем накопление фосфоенолпирувата (ФЕП),
продукта конечного этапа, приводит к ингиби-
рованию фосфофруктокиназы (PfkА), но акти-
вирует пируватдегидрогеназу, которая превраща-
ет пируват в ацетил-СоА, поступающий в цикл
трикарбоновых кислот. В заключение необходи-
мо отмстить, что аллостерическими эффекто-
рами данных путей метаболизма служат также
адениловые нуклеотиды и NADH. Количествен-
ное соотношение различных адениловых нук-
леотидов определяет энергетическое состояние
клетки («энергетический заряд»), тогда как со-
отношение NADH и NAD — «восстановительный
потенциал» клетки (см. разд. 7.4.2). Поскольку
катаболические процессы обеспечивают образова-
ние АТР и NADH, их ферменты должны реагиро-
вать также на эти состояния клетки.
Пример: структурная основа аллостери-
ческого контроля фосфофруктокиназы □
Как показано па рис. 19.8, фосфофруктокиназа
подвергается аллостерическому ингибированию
фосфоеисмшируватом и активации ADP. Струк-
турная основа такой регуляции изучена для фос-
фофруктокиназы из Bacillus stearothermophilus с
помощью рентгеиоструктурного анализа в при-
сутствии субстратов и эффекторов. Этот фермент
Глава 19. Посттрансляционный контроль и модификация белков 569
Рис. 19.8. Регуляция катаболизма по механизму обратной связи: путь Эмбдена—Мейергофа—Парнаса (ЭМП), глюко-
неогенез и цикл трикарбоновых кислот (ЦТК). Штриховыми линиями показана регуляция по механизму обратной
связи (ингибирование) и аллостерическая регуляция (активация) указанными соединениями (подробности см. в
тексте и на рис. 7.11). GlgC — ADP-глюкозопирофосфорилаза.
В. stearothermophilus представляет собой тетра-
мер из идентичных субъединиц (А — D), содер-
жащих по 139 аминокислотных остатков. Каждая
из этих субъединиц имеет раздельные сайты для
субстратов (АТР и фруктозо-6-фосфата), продук-
тов (фруктозо-1,6-дифосфата и ADP) и аллосте-
рических эффекторов. Связывание фруктозо-6-
фосфата оказывает сильное кооперативное дей-
ствие, и предположительно фосфофруктокиназа
подвергается более или менее согласованному пе-
реходу из Т-состоянис в R-состояние при связы-
вании этого субстрата с одним из четырех связы-
вающих сайтов.
Как показано на рис. 19.9, структура фер-
мента в R-состоянии (при связывании фруктозо-
6-фосфата и ADP) отличается от структуры в
Т-состоянии (при связывании 2-фосфогликолата
— аналога фосфо енолпирувата) относительным
поворотом субъединиц примерно на 7°. Хотя эти
структурные различия представляются незна-
чительными, они существенно влияют на сай-
ты связывания фруктозо-6-фосфата, располо-
женные в областях контакта субъединиц. При
R-состоянии фосфатная группа связанного
фруктозо-6-фосфата соединена водородными свя-
зями с Arg-162 фосфофруктокиназы, тогда как в
570 Часть V. Экспрессия генов и механизмы регуляции
Рис. 19.9. Структурные различия между Т- и R-cocto-
яниями фосфофруктокиназы из Bacillus stearothermo-
philus. Четыре идентичные субъединицы (А—D) в R-со-
стоянии (обозначено прерывистой линией) повернуты
приблизительно на 7° по сравнению с этими же субъ-
единицами в Т-состоянии (обозначено сплошной ли-
нией). Показаны также центры связывания субстрата
(фруктозо-б-фосфата), продукта (ADP) и эффектора
(ADP). По [1].
Т-состоянии боковая цепь, содержащая Arg-162,
повернута приблизительно на 180° относительно
ее ориентации в R-состоянии и поэтому не мо-
жет взаимодействовать с субстратом; се место за-
нимает боковая цепь отрицательно заряженного
остатка Glu-161. Эти различия в знаке заряда и
водородных связях в функциональных сайтах
фосфофруктокиназы, вероятно, в значительной
степени объясняют, почему сродство фермента в
R-состоянии к фруктозо-6-фосфату на три поряд-
ка выше, чем в Т-состоянии.
Аллостерическая регуляция характерна для
ферментов метаболических путей, включающих
общие промежуточные продукты, таких как пу-
ти биосинтеза аминокислот и пиримидинов (при-
меры — аспартат-трапскарбамилаза и карбамо-
илфосфатсинтаза) и гликолиза/глюконеогенеза
(пример — фосфофруктокиназа), а также для
путей с участием изоферментов, регулируемых
различным образом (например, аспартаткина-
зы и синтетазы 7-фосфо-З-дезоксиарабиногеп-
тулозоновой кислоты).
19.3. Многие процессы зависят у прокариот от регуляции на уровне
посттрансляционной ковалентной модификации белков
Многие процессы у прокариот, в том числе
транскрипция, ферментативные реакции, раз-
нообразные пути передачи сигналов, а так-
же внутриклеточная сортировка белков, вклю-
чают механизм регуляции их активности путем
ковалентной модификации. На такой моди-
фикации основана передача сигнала в двух-
компонептных регуляторных системах (посред-
ством фосфорилирования или иногда метили-
рования белков), а также действие некоторых
фосфотрансферазных систем (фосфорилирова-
ние/дефосфорилированис белков), что подробно
рассматривается в гл. 20. В данном разделе при-
водится несколько примеров, показывающих ме-
ханизм влияния ковалентной модификации па ак-
тивность белков и роль протеолитических фер-
ментов в регуляции.
Ковалентная модификация белков у
прокариот осуществляется путем фосфорили-
рования аминокислотных остатков, уридили-
рования, аденилирования, метилирования,
ацилирования жирными кислотами и про-
теолиза. Эти превращения, за исключением про-
теолиза, обычно обратимы, и в них, как правило,
участвуют два фермента, например протеипкина-
за и фосфатаза или метилтрансфераза и демети-
лаза.
Глава 19. Посттрансляционный контроль и модификация белков 571
Рис. 19.10. Регуляция активности глутаминсинтетазы
путем ее ковалентной модификации. Глутаминсинтета-
за (GlnS) ингибируется в результате аденилирования
остатка тирозина аденилилтрансферазой (АТазой). Ча-
стично аденилированная форма GlnS наиболее чувстви-
тельна к кумулятивному ингибированию по механизму
обратной связи (см. разд. 19.2.2) посредством АМР,
СТР, карбамоилфосфата, GlcN6P, Ala, Gly, His и Trp.
Активность АТазы в свою очередь контролируется ре-
гуляторным белков Рп, активность которого зависит от
степени его уридилирования, катализируемого уридил-
трансферазой (УТазой). Активность УТазы аллостери-
чески регулируется глутамином и 2-оксоглутаратом. По-
дробное описание см. в тексте. По [1].
19.3.1. Активность глутаминсинтетазы у Е. coli
регулируется путем уридилирования
и аденилирования
Глутаминсинтетаза (GlnS) участвует в ассими-
ляции аммиака при его низкой концентрации в
среде, а также в образовании глутамина, необ-
ходимого для синтеза белка и в качестве доно-
ра амидных групп. Синтезом и активностью GlnS
управляют сложные регуляторные механизмы,
реагирующие на соотношение в клетке глутами-
на и 2-оксоглутарата как показатель уровня азо-
та. Активность имеющейся GlnS контролируется
путем ковалентной модификации молекулы фер-
мента и кумулятивного ингибирования по меха-
низму обратной связи (рис. 19.10). В каждой из 12
субъединиц молекулы GlnS определенный тиро-
зиновый остаток может быть аденилирован спе-
цифичной аденилилтрансферазой (АТазой),
переносящей AMP-группу от АТР, а также ката-
лизирующей реакцию деаденилирования. Полно-
стью аденилированная молекула GlnS не обладает
активностью; активность частично аденилирован-
ного фермента пропорциональна числу модифи-
цированных субъединиц. Именно частично аде-
нилированная форма наиболее чувствительна к
кумулятивному ингибированию по механизму об-
ратной связи (см. разд. 19.2.2).
Контроль аденилирования GlnS осуществля-
ют два белка: регуляторный белок Рц и ури-
дилтрансфераза (УТаза). Неуридилированная
форма Рн аллостерически взаимодействует с
АТазой, стимулируя аденилирование GlnS и инги-
бируя ее активность. Уридилированная (также по
остатку тирозина) форма Рн стимулирует деаде-
нилирующую активность АТазы и тем самым об-
разование немодифицированьой, активной фор-
мы молекул GlnS (рис. 19.10). Именно активность
УТазы подвергается аллостерический регуляции
посредством глутамина хл 2-оксоглутарата. Глута-
мин стимулирует деуридилируюхцую активность
УТазы и тем самым образование модифициро-
ванного Рп и аденилирование GlnS, тогда как
2-оксоглутарат служит аллостерическим ак-
тиватором уридилтрансферазной активности
УТазы, вызывая модификацию Рц и деаденили-
рование (активацию) GlnS. Таким образом, при
высоком соотношении глутамин/2-оксоглутарат,
отражающем избыток аммиака, активность
GlnS падает и характеризуется высокой чувстви-
тельностью к ингибированию по механизму об-
ратной связи, тогда как при низкой величине это-
го соотношения, соответствующей недостатку
аммиака, активность GlnS возрастает. Эти ме-
ханизмы, наряду с упомянутыми метаболитами,
контролируют также синтез GlnS (см. гл. 20),
предотвращая бесполезный расход АТР для син-
теза глутамина с участием GlnS, когда в этом нет
потребности.
Активность глутаминсинтетазы (GlnS) — од-
ного из ферментов азотного метаболизма — ре-
гулируется сложным механизмом уридилирова-
пия/аденилирования в ответ на изменение кон-
центрации аммиака. При высоком соотношении
Gln/2-оксоглутарат (отражающем высокий уро-
572 Часть V. Экспрессия генов и механизмы регуляции
вень аммиака) активность GlnS подавляется, при
низком (соответствующем недостатку аммиака) —
повышается. Синтез этого фермента контролиру-
ет система общей регуляции (Ntr; см. разд. 20.4),
также в соответствии с соотношением Gln/2-оксо-
глутарат.
19.3.2. Многие клеточные функции
регулируются у бактерий путем
фосфорилирования белков
За последние 20 лет установлено, что в регу-
ляции клеточных процессов у бактерий важную
роль выполняют реакции фосфорилирования бел-
ков (помимо осуществляемых фосфотрансфер аз-
пыми системами, о которых см. гл. 5 и 20), и чис-
ло известных прокариотических фосфобелков, а
также фосфорилирующих их киназ быстро рас-
тет. В табл. 19.3 приведен перечень некоторых
из этих фосфобелков и киназ вместе с указани-
ем их роли в приеме и передаче сигналов, а так-
же в регуляции активности ферментов. У многих
бактерий обнаружено фосфорилирование гисти-
диновых остатков (в сенсорных белках двухком-
понептных систем и белках ФТС), остатков аспар-
тата (в регуляторных белках двухкомпонентных
систем), цистеиновых (в белках ФТС), тирозино-
вых, сериновых и треониновых остатков в моле-
кулах различных белков. Протеинкиназы, обычно
классифицируемые в соответствии с акцепторны-
ми аминокислотными остатками, переносят фос-
фатную группу от донора (как правило, у-фос-
фатную группу АТР и GTP) па определенный
аминокислотный остаток в белке-мишени. Удале-
ние фосфатной группы происходит либо путем
спонтанного гидролиза, либо под действием спе-
цифических фосфопротеинфосфатаз. За исклю-
чением двухкомпонентных систем и ФТС (см.
гл. 20), больше сведений имеется о протеинкина-
зах, чем о белках-мишепях и физиологической ро-
ли таких модификаций.
В случае двухкомпонентных систем (см.
разд. 20.4) фосфорилируется (по остатку гисти-
дина) с участием АТР молекула сенсорного бел-
ка в димерной форме, причем обычно реакция
протекает аутокаталитически (аутокиназа); этот
процесс фосфорилирования зависит от внешнего
сигнала. Такой сенсорный фосфобелок затем фос-
форилирует остаток аспартата в белке, выпол-
няющем роль ответного регулятора, что вызы-
вает соответствующую реакцию клетки (напри-
мер, изменение направления вращения жгутика
при хемотаксисе, регуляцию на уровне транскрип-
ции при осмотическом контроле или спорообразо-
вание у Bacillus'). В случае ФТС, ответственной у
многих бактерий за транспорт углеводов с их фос-
форилированием (см. гл. 5), в каскадном перено-
се фосфогруппы от фосфо енол пиру вата участву-
ет несколько белков с фосфорилируемым остат-
ком гистидина и один белок с фосфорилируемым
остатком цистеина (по крайней мере при транс-
порте манпитола и глюкозы). По-видимому, два
белка, осуществляющих промежуточный перенос
фосфо-группы в ФТС, ПАс’1с и НРг, участвуют в
регуляции тех или иных процессов в клетке в за-
висимости от степени их фосфорилирования (см.
гл. 20).
В остальной части этого раздела кратко рас-
сматриваются несколько наиболее подробно изу-
ченных примеров фосфорилирования белков у
бактерий.
Ковалентная модификация путем фосфо-
рилирования белков — это, по-видимому, наибо-
лее распространенный механизм посттрансляци-
онного контроля у прокариот. В нем участвуют
протеинкиназы и фосфопротеинфосфатазы, спе-
цифичные к остаткам гистидина, цистеина, ти-
розина, аспартата, треонина или серина. Эти
ферменты выполняют главную роль в передаче
сигнала (двухкомпонентныс системы регуляции),
общей системе регуляции па уровне экспрессии ге-
нов (фосфотрансферазные системы), а также в
процессах клеточной дифференцировки (напри-
мер, спорообразования).
Пример: фосфорилирование изоцитрат-
дегидрогеназы при регуляции цикла три-
карбоновых кислот и глиоксилатного шун-
та □ Изоцитратдсгидрогспаза (ИДГ) катали-
зирует окисление изоцитрата с образованием
2-оксоглутарата при участии NADP в цикле три-
карбоновых кислот (ЦТК) (см. разд. 3.6). Однако
для роста с использованием ацетата или жирных
кислот бактериям, например Е. coli, требуется
функционирование глиоксилатного шунта, пер-
вый этап которого состоит в превращении изоцит-
рата в глиоксилат с участием изоцитрат-лиазы
(рис. 19 11). При этом углерод, поступающий в
цикл трикарбоновых кислот в форме ацетил-СоА,
образованного из ацетата или жирных кислот, ко-
личественно превращается в СО2, не включаясь
в промежуточные продукты метаболизма.
Глава 19. Посттрансляционный контроль и модификация белков 573
Таблица 19.3. Некоторые примеры фосфорилируемых белков и протеинкиназ бактерий
Фосфорилируемые белки Аминокислотные остатки Киназы Роль
Белки фосфотрансфераз- ных систем (ФТС) Белки ФТС IIAG1C и НРг Сенсорные киназы (двух- компонентные системы) Ответные регуляторы (двух- компонентные системы) Белок НРг (ФТС) Изо! щтратдегидрогеназа (гон) SpoIIAA Различные His, Cys His His Asp Ser Ser Ser Ser/Thr Белки ФТС Фермент 1 ФТС Аутокиназа, передаю- щая сигнал Сенсорная киназа, при- нимающая сигнал НРг-киназа IDH-киназа SpoIIAB PKN1 Поглощение углеводов Регуляция ассимиляции пита- тельных веществ Различные виды сенсорной адаптации (см. табл. 20.1) Различные виды сенсорной адаптации (см. табл. 20.1) Регуляция ассимиляции пита- тельных веществ у грамполо- жительных бактерий Регуляция активности ПЭН Спорообразование у Bacillus Развитие у Myxococcus и дру- гих организмов
Рис. 19.11. Глиоксилатный шунт, ЦТК и изо-
цитратдегидрогеназа. Глиоксилатный шунт (по-
казан жирными стрелками) необходим для роста
Е. coli в присутствии ацетата или жирных кислот.
В этих условиях изоцитратдегидрогеназа (ИДГ)
цикла трикарбоновых кислот ингибируется путем
фосфорилирования и изоцитрат направляется в
глиоксилатный шунт. Подробности см. в тексте.
При росте Е. coli в среде с ацетатом изоцит-
ратдегидрогеназа ингибируется приблизительно
на 75% по сравнению с условиями роста в при-
сутствии других источников углерода, и это спо-
собствует поступлению изоцитрата в глиоксилат-
ный шунт. Такое ингибирование обусловлено фос-
форилированием единственного остатка серина
(Ser-113) в молекуле изоцитратдегидрогена-
зы, приводящим к ее полной инактивации
(рис. 19.11). Фосфорилирование изоцитратдегид-
рогепазы осуществляет ATP-зависимая ИДГ-ки-
наза/фосфатаза (кодируемая у Е. coli геном
асе К), катализирующая также дефосфорилирова-
ние фосфоизоцитратдегидрогсназы. На важность
регуляции этого типа указывает неспособность
мутантов по гену асеК к росту в среде с ацетатом
в качестве единственного источника углерода.
Цикл фосфорилирования изоцитратдегид-
рогеназы, вероятно, регулируется многими ме-
таболитами — аллостерическими эффекторами
ИДГ-киназы/фосфатазы. Изоцитрат и 3-фосфо-
глицерат стимулируют ее фосфатазную актив-
ность и подавляют киназную активность. Уровень
этих соединений отражает общее содержание в
клетке промежуточных продуктов метаболизма,
и поэтому при их низком уровне (например, в
574 Часть V. Экспрессия генов и механизмы регуляции
Глицеролкиназа
Катаболитная репрессия
модулона ссрА
Рис. 19.12. Регуляция активности белка НРг фосфо-
трансферазной системы (ФТС) путем АТР-зависимого
фосфорилирования у грамположительных бактерий.
Фосфорилирование остатка серина в молекуле НРг с
участием HPr-киназы подавляет способность этого бел-
ка участвовать в переносе фосфорильной группы (при
участии остатка His) в процессе фосфорилирования суб-
стратов ФТС. Таким способом может осуществляться
механизм обратной связи, по крайней мере у грамполо-
жительных бактерий. Фосфо-(5ег)-НРг участвует пред-
положительно в репрессии некоторых генов, кодирую-
щих катаболические ферменты, у грамположительных
бактерий, благодаря его способности образовывать ком-
плекс с регуляторным белком СсрА. Фосфо-(Н|5)-НРг
путем фосфорилирования регулирует активность других
катаболических ферментов, например глицеролкиназы.
случае переноса в среду, содержащую ацетат) ки-
назная активность превышает фосфатазную, в ре-
зультате чего большее количество изоцитрата по-
ступает в глиоксилатный шунт. Как установлено,
АМР также активирует ИДГ-фосфатазу и инги-
бирует киназу. Высокий уровень АМР означает
дефицит энергии в клетке и должен приводить к
увеличению количества изоцитрата, проходящего
через полный цикл трикарбоновых кислот.
Пример: фосфорилирование остатка се-
рина в молекуле белка НРг (ФТС) и ис-
пользование питательных веществ грампо-
ложительными бактериями □ Фосфотранс-
феразные системы обеспечивает поглощение и
фосфорилирование различных углеводов у грам-
отрицательных и у грамположительных бакте-
рий (см. разд. 5.6.4). Эти системы хорошо из-
вестны как регуляторы катаболических процессов
у грамотрицательных бактерий (см. разд. 20.2).
У грамположительных бактерий они, по-видимо-
му, также участвуют в регуляции катаболизма, по
посредством других механизмов (см. разд. 20.2.4).
По крайней мере один из этих механизмов дей-
ствует с участием ATP-зависимой протеинкипа-
зы, обнаруженной одной из первых среди подоб-
ных ферментов у грамположительных бактерий.
По-видимому, только у этих бактерий НРг-киназа
фосфорилирует остаток серина (Ser-46) в общем
белке ФТС, НРг, переносящем фосфогруппу.
Фосфорилирование остатка серина в НРг де-
лает этот белок значительно менее благоприят-
ным субстратом для фосфорилирования по остат-
ку гистидина (His-15) фосфоферментом I. По-
следняя реакция необходима для последующе-
го фосфорилирования углеводов, транспортиру-
емых посредством этой системы (рис. 19.12).
Активность HPr-кипазы аллостерически стиму-
лируют промежуточные продукты гликолиза, на-
пример фруктозо-1,6-фосфат, тогда как другой
белок, HPr-фосфатаза, обладает наибольшей ак-
тивностью при высокой концентрации неоргани-
ческого фосфата. Это позволяет предполагать,
что ATP-зависимое фосфорилирование НРг пред-
ставляет собой механизм обратной связи в регу-
ляции поглощения углеводов, при котором актив-
ность белка НРг подавляется путем его АТР-за-
висимого фосфорилирования в условиях, когда
интермедиаты гликолиза образуются быстрее,
чем могут быть использованы. Окончательно су-
ществование такого механизма обратной связи по-
ка не доказано.
Фосфо- (серил)-Нрг предположительно участ-
вует в катаболитной репрессии у В. subtilis.
Ряд генов катаболических ферментов у этого
организма контролируется посредством цис-ак-
тивпого элемента, реагирующего на катаболи-
ты (catabolite responsive element, ere). Мутации
в этом гене приводят к устранению катаболит-
ной репрессии некоторых генов (например, атуЕ,
кодирующего а-амилазу), опосредованной глюко-
зой и другими субстратами фосфотрансфераз-
ных систем. В качестве репрессора функциониру-
ет, вероятно, трбше-активпый регуляторный бе-
лок СсрА (от catabolite control protein), взаи-
модействующий с сайтами сге в определенных
условиях. Кроме того, обнаружено прямое белок-
белковое взаимодействие между СсрА и фосфо-
(серил)-НРг, но не другими формами этого белка.
Глава 19. Посттрансляционный контроль и модификация белков 575
Фосфо-(серил)-НРг является, вероятно, пре-
обладающей формой этого белка в процессе по-
глощения субстратов ФТС, но в отсутствие дан-
ных соединений ее уровень низок. Возможно,
фосфо-(серил)-ПРг служит корспрессором на-
ряду с Сер А, по крайней мере в некоторых
механизмах катаболитной репрессии у Bacillus
(рис. 19.12). Это подтверждают данные об от-
сутствии катаболитной репрессии ряда мета-
болических процессов у мутанта В. subtilis,
образующего единственный НРг с заменой
Ser-46 на Ala. Наконец, описан еще один меха-
низм, посредством которого НРг может регули-
ровать катаболизм у грамположительных бакте-
рий на основе ковалентного фосфорилирования.
Фосфо- (гистидил)-НРг фосфорилирует гистиди-
новый остаток в глицерол-(дигидроксиацетон)-
кипазе у Enterobacter faecalis. Такое фосфорили-
рование увеличивает активность киназы пример-
но в десять раз. Эти данные вместе с данными
о подавлении субстратами ФТС поглощения гли-
церола у Е. faecalis свидетельствует, что фосфо-
(гистидил)-НРг (доминирующая форма НРг в от-
сутствие субстратов ФТС) определяет более высо-
кую активность глицеролкиназы в этих условиях
(рис. 19.12).
Фосфорилирование белков служит основ-
ным механизмом регуляции транспорта и метабо-
лизма углеводов у грамположительных бактерий.
В нем участвует гистидин- и серин-протеинкиназ-
ная/фосфатазпая система, причем первая стиму-
лирует поглощение и метаболизирование углево-
дов, тогда как вторая обеспечивает подавление
(катаболитная репрессия) активности генов и
ферментов углеводного метаболизма.
Пример: сериновые/треониновые про-
теинкиназы могут регулировать процессы
дифференцировки у различных бактерий □
Спорообразование у В. subtilis представляет со-
бой сложный и необратимый процесс развития,
завершающийся лизисом материнской клетки и
высвобождением весьма устойчивой эндоспоры.
Сложный путь дифференцировки частично кон-
тролируется генами spo, определяющими направ-
ление процесса, и для передачи сигналов ис-
пользуется фосфорилирование белков (см. гл. 20
и 25). Один из специфических для споруляции
белков, SpoOA, служит типичным ответным ре-
гулятором в двухкомпопентной регуляторной си-
стеме (см. рис. 25.2), и его фосфорилированная
форма действует как регулятор (активатор или
репрессор) генов, участвующих в дифференци-
ровке. Фосфорилирование по остаткам серина, в
частности катализируемое сериновой протеинки-
пазой Spoil АВ, также может выполнять опреде-
ленную роль в спорообразовании у В. subtilis.
Г рам отрицательная бактерия Myxococcus
xanthus, обладающая способностью к скользяще-
му движению, в условиях дефицита питательных
веществ вступает в сложный цикл развития, при
котором индивидуальные клетки обнаруживают
своего рода социальное поведение, обеспечива-
ющее формирование многоклеточных плодовых
тел, содержащих относительно устойчивые мик-
соспоры (см. разд. 25.3.3). Недавно обнаружено
участие в этом процессе сериновых и/или трео-
ниновых протеинкиназ. Клонирован и секвени-
ровап ген pknl М. xanthus. Реконструирован-
ная аминокислотная последовательность белка
(PKN1, 693 аминокислотных остатка) высокого-
мологична N-копцевому сегменту эукариотиче-
ских серин/трсонинкиназ, в наибольшей степени
Са2+/кальмодулин-зависимой протеинкиназы II
крысы. Подобно киназам эукариот, PKN1 под-
вергается аутофосфорилированию по сериново-
му и треониновому остаткам при участии АТР.
Однако белки — субстраты этой киназы остают-
ся неизвестными. Анализ геномной библиоте-
ки М. xanthus с применением метода Саузерн-
блоттинга показал возможность существования у
этого организма до 26 рЫ-подобиых генов, тогда
как попытки выявить аналогичные гены у Е. coli,
лишенной явно выраженного цикла развития, не
дали положительных результатов.
19.3.3. В некоторых случаях происходит
модификация белков путем
метилирования и ацетилирования
Карбоксиметилирование белков служит у бакте-
рий механизмом адаптации в процессе хемотакси-
са с участием метил-акцептирующих белков хе-
мотаксиса (МаБХ) — интегральных мембранных
белков-рецепторов (см. разд. 20.5.4)., Метилирова-
ние МаБХ осуществляет метилтрансфераза CheR
с использованием в качестве донора метильных
групп S-аденозилметионина. В зависимости от ти-
па МаБХ фермент CheR может метилировать
от 4 до 6 остатков глутамата на С-конце цито-
576 Часть V. Экспрессия генов и механизмы регуляции
плазматического домена этих белков. Метилиро-
вание МаБХ, по-видимому, разобщает их рецеп-
торный домен и цитоплазматический домен, пере-
дающий сигнал, позволяя, возможно, по крайней
мере частично, реагировать на изменения уров-
ня химических эффекторов в широком диапазоне
концентраций. Деметилирование МаБХ катали-
зирует метилэстераза CheB, активность которой
стимулируется фосфорилированием остатка ас-
партата в ее молекуле при участии белка ChcA —
сенсорной гистидинкипазы из семейства белков
двухкомпонентных регуляторных систем. Роль
этой модификации в хемотаксисе рассмотрена в
гл. 20.
Метилирование известно и для других бак-
териальных белков (например, фактор элонга-
ции белкового синтеза EF-Tu метилируется по
остатку лизина). Однако его физиологическая
функция в этих случаях неизвестна. Установле-
но также, что ряд бактериальных белков мо-
жет подвергаться ацетилированию, но и для
этого процесса пока не ясно, какое значение
оп имеет для физиологических функций. Наи-
более изученным примером здесь служит ри-
босомный белок L7 Е. coli, молекула которого
подвергается ацетилированию по N-копцсвому
остатку; в остальном этот белок идентичен рибо-
сомному белку L12. Белки L7/L12 (RplL)—един-
ственные белки большой субъединицы рибосом,
которые, по-видимому, присутствуют в множе-
ственных (четырех) копиях. Как и в других слу-
чаях, физиологическое значение ацетилирования
L7 для функции рибосом неизвестно.
19.3.4. Протеолитический процессинг как
механизм посттрансляционного контроля
В клетках Е. coli идентифицировано более 20
эндопротеаз (см. табл. 19.4), однако физиологи-
ческая роль многих из них до конца не ясна.
Ряд этих протеаз, несомненно, выполняет функ-
ции «домашнего хозяйства», т. е. удаления оши-
бочных, поврежденных, неправильно свернутых
или чужеродных белков. Другие протеазы выпол-
няют регуляторную роль, «конститутивно» раз-
лагая 1) некоторые белки вскоре после синтеза
для поддержания их низкого равновесного уров-
ня, 2) «скелетные» белки, участвующие в синтезе
сложных структур, таких как жгутики или фим-
брии, и 3) различные белки в ответ на определен-
ные сигналы, например голодание. В большинстве
случаев протеолитическая деградация, по край-
ней мере у Е. coli, требует затраты метаболиче-
ской энергии в форме АТР. Разнообразие про-
теаз у Е. coli и значительные затраты энергии
на деградацию белков позволяют предполагать,
что данный тип посттрансляционной модифика-
ции чрезвычайно важен для функционирования
бактериальных клеток.
В экспериментах с импульсным мечением уста-
новлено, что за время одной генерации у Е. coli
происходит деградация примерно 20% синтези-
рованного белка. Однако белки различаются по
времени полужизпи. Например, в экспоненциаль-
но растущих клетках приблизительно 40% суммы
всех белков имеет время полужизни более 3 сут,
тогда как 15%—менее 5 ч. В этой короткоживу-
щей фракции присутствуют в том числе дефект-
ные или мутантные формы, время полужизни
которых составляет менее 1 ч. Кроме того, неко-
торые регуляторные белки, а также белки, участ-
вующие в репликации ДНК и делении клеток (на-
пример, белок SulA или сигма-субъединица бел-
ка теплового шока, ст32), весьма чувствительны
к протеолизу и время их полужизпи не превыша-
ет 2 мин (см. также далее). На чувствительность
белков Е. coli к протеолитической дегргщации су-
щественно влияют условия среды. Например, в
отличие от условий экспоненциального роста, при
голодании в клетках Е. coli примерно 50% общего
белка имеет время полужизни менее 5 ч.
В растущих клетках Е. coli до 60% общего бел-
ка разлагают две ATP-зависимые протеазы, Lon
и С1р. Эти ферменты, а также протеолитическая
активность белка RecA будут кратко рассмотре-
ны в данном разделе как примеры бактериаль-
ных протеаз, выполняющих одновременно функ-
ции домашнего хозяйства и более специфические
регуляторные функции.
Протеаза Lon как пример протеазы об-
щего и специфического действия □ Проте-
аза Lon, или La, продукт гена Ion у Е. coli,
представляет собой ATP-зависимую сериновую
протеазу, которая разлагает специфические регу-
ляторные белки и аномальные белки. По структу-
ре белок Lon — это тетрамер из субъединиц мол.
массой 87 кДа, содержащих по 783 аминокислот-
ных остатка. Аллостерическим активатором этой
протеазы служит АТР, гидролизуемый в процес-
се оборота фермента, наиболее интенсивно при де-
градации крупных белков. Протеаза Lon обладает
эндопептидазной активностью и расщепляет суб-
Глава 19. Посттрансляционный контроль и модификация белков 577
Таблица 19.4. Эндопротеазы Escherichia coli. (По Maurizi М. R. 1992. Experientia, 48: 178-201.)
Протеаза Ген Субстраты in vivo (in vitro) Тип протеаз Примечания
Цитоплазматические про Протеаза Lon (или La) теазы Ion SuIA; белок N фага A; Сериновый ATP-зависимая; разлагает белок
Протеаза С1р (или Ti) clpP RcsA; транспозаза Tn903 npo-ClpP; ClpA; гибриды Сериновый N фага A in vitro ATP-зависимая активация
RecA/LexA clpA recA LacZ (Репрессор cl фага A; Сериновый посредством АТРазной активности ClpA ATP-зависимая; аутопротеолиз
Hfl А lexA hflK UmuD) LexA репрессор сП фага A Сериновый Низкая активность в отношении
Протеазы Do, Re, Fa, So Протеаза Ci ISP-L-Eco Протеаза II HfiC (Казеин) (Инсулин) (Z-AAL-PNA) (BAEE) Сериновый Металл о- Сериновый Сериновый сП in vitro Очень низкая активность
Протеаза, родственная Alp (alp A) SuIA; RcsA в отношении белков Alp влияет па экспрессию
Периплазматические ил г ассоци ированные с мембранами г ротеазы ATP-зависимой протеазы
Протеаза Mi Протеаза Pi (протеаза III) ptr (Казеин) (Инсулин) Сериновый Металле- Суперсемейство инсулиназ
Сигнальная пептидаза I lep П редшественники Плазматическая и
Сигнальная пептидаза II Isp экспортируемых белков Предшественники наружная мембраны Наружная мембрана
Deg Р (HtrA) degP липопротеинов Гибриды PhoА Сериновый Белок теплового шока <тЕ
Протеаза I (NAPNE) Сериновый Очень низкая активность
Протеаза IV sppA Сигнальные пептиды Сериновый в отношении белков Пептидаза сигнальных пептидов
Протеаза Iva Протеаза V после процессинга (Z-Phe-ONP) Сериновый Плазматическая и
Протеаза VI Протеаза VII umpT Мебранные белки Рецептор ферриэпте- Сериновый Сериновый наружная мембраны Расщепление между остатками
Протеаза пери? робактииа (Казеин) Металле- основных аминокислот Активируется АТР
Протеаза пери8 (Казеин) Сериновый
страты с образованием коротких олигопептидов
длиной 5-20 аминокислотных остатков.
Различные данные указывают на то, что про-
теаза Lon участвует в деградации аномальных
белков. Так, у /од-мутантов по сравнению с клет-
ками дикого типа увеличено время полужизни
нестабильных белков, температурочувствитель-
ных и других аномальных белков (например, бел-
ков, содержащих аналоги аминокислот или кло-
нированных чужеродных белков). In vitro проте-
аза Lon предпочтительно расщепляет продукты
частичной или полной денатурации крупных бел-
ков и, судя по этому, распознает в качестве сай-
тов расщепления протяженные или гибкие участ-
ки полипептидной цепи.
Очевидно, однако, что in vivo белок Lon осу-
ществляет и более специфические реакции про-
теолитического расщепления, связанные с ре-
гуля горными эффектами. Lon-мутапты Е. coli
обнаруживают повышенную чувствительность к
ультрафиолету в результате увеличения време-
ни полужизни белка SuIA, синтез которого ин-
дуцируется при SOS-ответе. Этот белок служит
ингибитором образования септы в процессе кле-
точного деления и выполняет промежуточную
роль в репарации ДНК, осуществляемой SOS-сис-
578 Часть V. Экспрессия генов и механизмы регуляции
темой (см. разд. 15.7 и 22.4.3). В Lon--клетках
белок SulA, накопленный в период кратковре-
менной SOS-реакции, деградирует замедленно, в
результате чего клетки приобретают форму длин-
ных нитей и погибают. I [ри другом фенотипе
Zon-мутаптов клетки становятся слизистыми за
счет увеличения синтеза капсульного полисахари-
да. Это происходит в результате повышения уров-
ня белка Res А — активатора транскрипции генов
cps (от capsular polysaccharide), необходимых для
синтеза капсульных полисахаридов. Обычно ко-
личество белка RcsA остается на низком уровне,
частично вследствие его быстрой деградации под
действием белка Lon. Таким образом, приведен-
ные примеры указывают па. две функции белка
Lon: он либо быстро и специфически расщепляет
белок SulA, необходимый клеткам лишь в тече-
ние короткого времени после его индукции, либо
поддерживает низкий стационарный уровень бел-
ка RcsA, повышенное количество которого необ-
ходимо только при особых внешних условиях.
Белок, по-видимому гомологичный Lon, обна-
ружен у М. xanthus. Мутанты этого организма по
гену bsgA пе способны к дифференцировке и спо-
рообразованию (см. разд. 25.3.2). Аминокислот-
ная последовательность белка BsgA сходна с по-
следовательностью белка Lon, и очищенный белок
BsgA обладает ATP-зависимой протеазной актив-
ностью. Таким образом, он может играть важную
роль в регуляции никла развития у М. xanthus.
Весьма вероятно, что у многих бактерий будут
обнаружены гомологи белка Lon, выполняющие,
помимо функции разложения аминомальпых бел-
ков, различные регуляторные функции.
ATP-зависимая протеаза С1р, подробно
изученная у Е. coli, представляет собой кон-
сервативный белок, присутствующий у ор-
ганизмов различных классов □ У Zon-му-
тантов Е. coli идентифицирована вторая важная
ATP-зависимая протеаза, способная разлагать ка-
зеин in vitro. Анализ очищенных препаратов
белка показал, что этой активностью обладает
комплекс из двух белков, ClpA и С1рР, кодируе-
мых генами clpA и clpP соответственно. Нативная
протеаза С1р (называемая также протеазой Ti)
имеет мол. массу 750 кДа и, вероятно, представ-
ляет собой комплекс, образованный додекамером
ClpP, состоящим из субъединиц 21,5 кДа, и гек-
самером ClpA, состоящим из субъединиц 85 кДа.
Очищенный белок ClpA проявляет АТРазную ак-
тивность, активируемую ClpP и белковым суб-
стратом, и содержит две консенсусных последо-
вательности. связывающих АТР. Таким образом,
протеазой является белок ClpP, представляющий
собой, по-видимому, класснчсскуюб протеазу се-
ринового типа. Он способен расщеплять мелкие
пептиды и более крупные денатурированные бел-
ки в отсутствие ClpA. Однако ClpA в присутствии
АТР существенно стимулирует протеолитическую
активность ClpP, особенно в отношении крупных
белков. При этом АТР выполняет, вероятно, роль
источника энергии как для связывания ClpA и
ClpP. так и для самой реакции протеолиза, по
крайней мере в случае крупных белков.
Физиологическая роль протеазы С1р, судя по
всему, включает деградацию аномальных белков.
У клеток с мутациями в локусах clpА и clpP
эта функция частично нарушена, причем намного
более значительно на фоне мутации Ion. Примеча-
тельно, что белок ClpP синтезируется с дополни-
тельным сегментом из 14 аминокислотных остат-
ков на Х-конце, удаляемым вскоре после завер-
шения синтеза, по-видимому за счет активности
самого белка ClpP без участия ClpA. Значение
этой реакции процессинга пока пе установлено.
Уровень ClpP и ClpA возрастает в клетках в
конце экспоненциальной фазы роста, что указы-
вает на связь функции С1р с фазой роста. Однако
протеаза С1р пе относится к необходимым компо-
нентам клеток, судя по тому что мутанты, лишен-
ные С1р, не обнаруживают существенных наруше-
ний роста при различных условиях.
Белки ClpA и ClpP, по-видимому, высоко-
консервативны у организмов различных уровней
сложности; аналогичные гены и/или белки об-
наружены у других микроорганизмов, а также
у растений и животных. В большинстве случа-
ев функции их остаются неясными, но степень
консервативности указывает на то, что сходные
с ClpA и С1рВ белки у других организмов также
представляют собой АТР-зависимыс протеазы.
Репрессор LexA инактивируется пу-
тем аутопротеолиза □ Некоторые белки у
Е. coli способны к специфическому аутопро-
теолизу, обеспечивающему регуляцию их актив-
ности. Один из таких белков —это репрессор
LexA, участвующий в контроле ряда генов, ко-
торые экспрессируются в ответ па поврежде-
ние ДНК. В число таких генов входит ген
sulA, участвующий в регуляции формирования
клеточной перегородки. При повреждении ДНК
происходит инактивация репрессора LexA пу-
Глава 19. Посттрансляционный контроль и модификация белков 579
тем зависимого от белка RecA и АТР про-
теолиза единственной связи Gly—Ala. Вероятно,
комплекс RecA —АТР (возможно, в ассоциа-
ции с фрагментами одноцепочечной ДНК) дей-
ствует как аллостерический активатор имеюще-
гося в молекуле LexA домена с активностью
сериновой протеазы, которая саморасщсплястся и
инактивируется. Реакция расщепления также, по-
видимому, требует участия АТР, поэтому LexA
можно рассматривать как высокоспецифичную
ATP-зависимую аутопротсазу, проявляющую эту
активность только в присутствии RecA. Инте-
ресно, что две другие аутопротеазы — репрессор
CI фага лямбда и белок UmuD (находящийся
под контролем репрессора LexA и участвующий
в SOS-индуцированном мутагенезе) — также под-
вергаются аутопротеолизу в присутствии белка
RecA. Расщепление репрессора CI приводит к его
инактивации, и следовательно, к индукции про-
фага (см. разд. 26.4.4), тогда как расщепление
UmuD активирует этот белок.
Посттрансляционная регуляция посредством
протеолиза характерна, вероятно, для необ-
ратимых этапов метаболизма, а также необра-
тимых процессов дифференцировки, таких как
индукция профага, деление клетки или спорооб-
разование. В такой регуляции участвуют 1) про-
теазы общего действия (например, фермент Lon
у Е. coli), которые расщепляют несколько регу-
ляторных белков, а также поврежденные и ано-
мальные белки и 2) специфические протеазы (па-
пример, LexA), осуществляющие собственное рас-
щепление и инактивацию.
19.4. Посттрансляционный контроль включает у прокариот
внутриклеточную компартментацию ферментов и других белков
У большинства бактерий, в отличие от клеток
эукариот, отсутствуют специализированные внут-
риклеточные органеллы, и сложность регуляции
катаболических и анаболических процессов у про-
кариот в значительной степени объясняется, веро-
ятно, тем, что они протекают главным образом в
гомогенной цитоплазме. При таком условии ана-
болизм и катаболизм данного соединения долж-
ны регулироваться раздельно, чтобы избежать
«холостых циклов»; контроль двунаправленных и
разветвленных путей должен обеспечивать диф-
ференцированные изменения их активности в от-
вет на изменения среды, и, наконец, в некоторых
случаях экспрессия генов должна регулировать-
ся последовательно (временная регуляция). Та-
кие способы регуляции обеспечивают эффектив-
ную компартментацию метаболизма в отсутствие
физической компартментации.
Вместо с тем некоторые бактериальные бел-
ки после синтеза подвергаются физической ком-
партментации, как. например, компоненты фото-
синтетического аппарата у фототрофных бакте-
рий (см. разд. 24.4.2), мембраносвязанные белки,
периплазматическис белки у грамотрицательных
бактерий, а также белки, выделяемые во внеш-
нюю среду. В данном разделе будут кратко рас-
смотрены отдельные механизмы кемпартмепта-
ции, главным образом физической компартмента-
пии белков. Некоторые из этих процессов более
подробно описаны в других главах.
В клетках прокариот осуществляется эффек-
тивный посттрапсляционный контроль — регуля-
ция на уровне активности ферментов — путем
компартментации белков. Ферментативные ре-
акции, протекающие в противоположных направ-
лениях (например, биосинтез и деградация дан-
ной аминокислоты), либо регулируются раздель-
но на кинетическом уровне (на основе разли-
чий в сродстве компонентов и константах рав-
новесия), либо осуществляются в определенной
последовательности благодаря поочередной ин-
дукции синтеза ферментов (временная компарт-
ментация), либо разделены за счет того, что
их катализируют разные ферментные комплексы.
Однако наиболее эффективным способом раз-
дельной регуляции служи г физическая компарт-
ментация.
580 Часть V. Экспрессия генов и механизмы регуляции
19.4.1. Направление белка к мембране
или наружу из клетки и
физическая компартментация
У грамотрицательных бактерий определенные
белки после их синтеза должны включиться в
плазматическую мембрану, другие— поступить в
нериплазматическое пространство или наружную
мембрану, и некоторые белки должны быть выде-
лены из клетки. У грамположительных организ-
мов определенные белки также направляются к
плазматической мембране для включения в нее
или для выделения в среду. В число периплаз-
матических белков и экскретируемых белков вхо-
дят многие гидролазы, разлагающие доступные
субстраты (собирательная функция), белки, обес-
печивающие устойчивость к антибиотикам, экзо-
токсины, ферменты биосинтеза клеточной стенки,
а также белки, связывающие растворимые суб-
страты. К интегральным белкам плазматической
мембраны относятся некоторые ферменты, цито-
хромы, Fi/Fo-субъсдиницы АТР-синтазы и спе-
циальные транспортные белки; в наружной мем-
бране грамотрицательных бактерий присутству-
ют порипы и другие белки-переносчики.
Направление (транспорт) белков к плазмати-
ческой мембране для переноса через нее обыч-
но осуществляется по механизму, зависимому от
сигнальной последовательности («метки»), тогда
как перенос через обе мембраны у грамотри-
цатсльных бактерий обеспечивается (по край-
ней мере частично) другими механизмами, в том
числе действующими при синтезе жгутиков, пи-
лей, фимбрий и других адгезивных придатков.
Перенос через плазматическую мембрану, по-
сле которого белок остается, например, в пс-
риплазматическом пространстве или, у грамот-
рицатсльиых бактерий, в наружной мембране,
называют секрецией; для процесса высвобож-
дения белков в среду применяют термин экс-
креция1. Интегральные мембранные белки, как
правило, направляются к мембране благодаря
своим гидрофобным свойствам, однако в некото-
рых случаях и для них используется специальный
механизм направления к мембране. В немногих
других случаях для встраивания в мембрану осу-
ществляется посттрансляционное ацилирование
белка жирными кислотами (см. ниже).
У прокариотической клетки существует
несколько физических компартментов: ци-
топлазма, плазматическая мембрана, периплаз-
матичсское пространство, наружная мембрана,
наружная поверхность клетки и примыкающее к
поверхности клетки внеклеточное пространство.
Все синтезируемые клоакой белки специфическим
образом сортируются и распределяются для на-
правления к месту их окончательной локализа-
ции. Перепое белков через плазматическую мем-
брану называют секрецией, выделение их из
клетки в среду — экскрецией. Последний про-
цесс распространен у грамположительных бакте-
рий.
Для секреции белков через мембраны у
бактерий обычно используется Sec-путь □
Многие белки, секретируемые через плазмати-
ческую мембрану бак гериальпых клеток, име-
ют на N-конце сигнальную последователь-
ность (рис. 19.13), благодаря которой они на-
правляются к локализованному в плазматической
мембране аппарату секреции. Это, вероятно, ха-
рактерно для большинства белков грамотрица-
тсльпых бактерий, локализованных в псриплаз-
матическом пространстве и в наружной мем-
бране, а также для белков грамположительных
бактерий, выделяемых в среду. Белки грамотри-
цательных бактерий, выделяемые в среду, могут
проникать через плазматическую мембрану как с
участием механизма, зависимого от сигнальной
последовательности, так и другим путем. Генети-
ческие и биохимические исследования, главным
образом Е. coli, позволили идентифицировать ряд
генов (названных sec-генами) и их продуктов,
опосредующих этот процесс (табл. 19.5).
Роль sec-генов в секреции белков через плаз-
матическую мембрану иллюстрирует рис. 19.14
(см. цв. вклейку). Белок SecB, представляющий
собой специфический белок-шепсрон, связывается
со многими пре-белками (предшественниками)
в процессе их секреции, главным образом че-
рез детерминанты в зрелой области молекул.
К белкам-шеперонам относятся белки, стаби-
лизирующие специфическое конформационное со-
стояние других белков либо в процессе их синтеза,
либо, чаще, после его завершения. Такая стабили-
зация способствует последующему свертыванию
1 Существует и другое применение данных терминов. Так, термин секреция часто относят к выделению в среду фер-
ментов, тогда как экскрецией называют выделение в среду низкомолекулярных веществ. Для процесса, которые авторы
называют секрецией, существует термин экспорт (см. также гл. 21). — Прим, перее.
Глава 19. Посттрансляционный контроль и модификация белков 581
Таблица 19.5. Функции продуктов sec-генов у Е. coli
Белок Размеры полипептида, кДа Функция
SecB SecA SecY SecE SecG SecD, SecF 17 (тетрамер) 102 (димер) 49 14 11 67, 35 Связывает пре-белки и поддерживает их в «транслокационно-компетепт- ной» конформации АТРаза, связывающая комплекс белка SecB с пре-белком и передающая его на комплекс SecY/E/G; участвует в транслокации Интегральный мембранный белок, по-видимому транслоказа Интегральный мембранный белок, образующий комплекс с SecY; возмож- но, прямо или косвенно участвует в транслокации Интегральный мембранный белок, способный функционировать в процессе секреции совместно с SecA Мембранные белки, возможно участвующие в поздних этапах секреции
Рис. 19.13. Консенсусная сигнальная последователь-
ность, необходимая для секреции бактериальных белков
через плазматическую мембрану. Полипептидная цепь
новосинтезированного пре-белка содержит N-концевую,
несущую положительный заряд сигнальную последова-
тельность и гидрофобный «остов» из 15—18 аминокис-
лотных остатков, который завершается остатком Gly или
Ala, отмечающим сайт расщепления (жирная стрелка)
сигнальной пептидазой. Расщепление приводит к высво-
бождению зрелого белка. X — гидрофильный или гидро-
фобный остаток; Z — участок, состоящий в основном из
гидрофобных остатков.
(морфопоэзу) белковой молекулы и/или ее уча-
стию в сборке более сложных структур.
Предположительно в случае секреции, зави-
сящей от Sec-белков, белок SecB сохраняет про
белок в «транслокациошю-компетентном» состо-
янии. Однако секреция некоторых белков не
зависит от белков SecB, и в этих случаях ана-
логичную роль, по-видимому, выполняют белки-
шепероны более общего действия (например,
GroEL). Комплекс пре-белок-SecB связывается с
белком SecA, часть молекулы которого находит-
ся в свободном состоянии, тогда как другая часть
связана с интегральным мембранным комплек-
сом SccY/E/G на внутренней стороне плазмати-
ческой мембраны. Белок SecA связывается с ли-
гандами в молекуле SecB и с сигнальной последо-
вательностью, а также с другими участками мо-
лекулы бслка-предшествеппика. Комплекс SecB —
пре-белок — Sec А взаимодействует с комплексом
мембранных белков SecY/E/G, что стимулиру-
ет АТРазную активность белка SecA. Возможно,
гидролиз АТР частично способствует освобожде-
нию прс-бс. гка из комплекса с SecA и соединению
его с «транслоказой» SecY/E/G.
Секрецию белков через плазматическую
мембрану осуществляет сложный аппарат сек-
реции, кодируемый генами sec и включающий
белки SccD, SecE, SccF, SecG и SecY, а так-
же интегральный мембранный белок SecA, обла-
дающий АТРазпой активностью. Гидролиз АТР
требуется для переноса пептида через пору в мем-
бране. Белки, содержащие сигнальную последо-
вательность — метку для сортировки, связывают-
ся с SecA при участии белка-шеперопа (обычно
SecB), после чего происходит их секреция. Сиг-
нальная пептидаза, локализованная на периплаз-
матической стороне мембраны, отщепляет сиг-
нальную последовательность, превращая секре-
тируемый белок в его зрелую форму. Дальней-
шие этапы сортировки белков и их направления к
месту окончательной локализации пока мало изу-
чены.
Полностью механизм секреции полипептидов
с участием Sec-белков не установлен, однако име-
ются сведения о том, что в процессе транслока-
ции пре-белка часть молекулы SecA внедряется в
мембрану, временно экспонируясь на ее периплаз-
матической стороне. Это сопровождается суще-
ственным изменением в ориентации белка SecG.
Возможно, для переноса белка через мембрану
необходимо несколько циклов внедрения в мем-
брану и высвобождения SecA, требующих учас-
582 Часть V. Экспрессия генов и механизмы регуляции
1 20 21
Пролило- H2N — Met------Cly — Cys
протеин I
SH cNH;
Фосфатидил-
глицерол
Глицерил-
лролило-
лротеин
Глицерид-
липопротеин
Met-Cly — Cys —
V
HO —CH
I
HO - CH2
Lys—СООН
cNH2
I Фосфолипид-
▼ ацилтрансфераза
Пептидогликан
I Сигнальная
▼ петидаза
Met----Cly H2N — Cys —
COOH S
о сн2
II I
R — CO — CH
О
II I
R'— CO — CH2
- Lys
I
nh2
I
c = o
I
DAP — пептидо-
гликан
Рис. 19.15. Реакции ацилирования жирными кислота-
ми, определяющие локализацию главного липопроте-
ина у Е. coli. N-концевой остаток цистеина (отмечен
полужирным шрифтом) главного липопротеина моди-
фицируется с образованием глицерилтиоэфира, после
чего происходит ацилирование жирными кислотами по
гидроксильным группам глицерильного остатка. Ациль-
ные группы жирных кислот закрепляют белок в наруж-
ной мембране до его процессинга. Молекулы некоторых
из этих белков связываются также ковалентно с остат-
ком мезо-диаминопимелиновой кислоты (DAP) в соста-
ве пептидогликана посредством С-концевого остатка ли-
зина.
тия АТР. Предположительно белок SecA, возмож-
но в комплексе с SecG, в процессе транслока-
ции действует как своего рода прошивающая мем-
брану швейная машина, транспортируя на каж-
дом этапе примерно 20 аминокислотных остат-
ков. Белки SccY и SecE могут способствовать
формированию поры или канала, через которые
проходит полипетидпая цепь. По завершении сек-
реции большинства пре-белков сигнальная после-
довательность отщепляется «сигнальной пептида-
зой» (табл. 19.4), локализованной на внешней по-
верхности плазматической мембраны, и зрелый
белок высвобождается на этой се стороне.
Данный механизм секреции белков полно-
стью зависит от наличия сигнальной последова-
тельности. Удаление или некоторые мутационные
изменения этой последовательности препятству-
ют секреции. Для эффективной секреции обыч-
но требуется, чтобы вблизи N-конца сигнальной
последовательности присутствовали положитель-
но заряженные аминокислотные остатки и боль-
шинство составляющих се остатков имело гидро-
фобную природу. Возможно, в процессе секреции
положительно заряженные участки N-копцевой
последовательности остаются па внутренней по-
верхности мембраны, вероятно в ассоциации
с отрицательно заряженными фосфолипидами.
Выталкивание молекулы белка инициируется об-
разованием «петли» за счет проникновения че-
рез мембрану следующего гидрофобного отрезка
сигнальной последовательности и вслед за этим
остальной части белка при участии белка SccA и
комплекса SecY/E/G (рис. 19.14; см. цв. вклейку).
Определенную роль в механизме секреции это-
го типа выполняют также белки SccD и SccF
(табл. 19.5 и рис. 19.14). Эти белки ассоциированы
с плазматической мембраной, однако значитель-
ная часть их полипетидпых цепей находится в пе-
риплазме. Точная функция белков SecD и SccF
неизвестна; скорее всего они участвуют в послед-
них этапах процесса секреции.
Большинство псриплазматичсских белков и
белков наружной мембраны у грамотрицатель-
пых бактерий, а также экскретируемые белки
грамоположитсльных бактерий проникают через
плазматическую мембрану посредством механиз-
ма, зависимого от сигнальной последовательно-
сти. В случае белков наружной мембраны грам-
отрицательных бактерий, например, поринов,
секреция сопровождается внедрением белка в на-
ружную мембрану посредством специального ме-
ханизма. пока малоизученного.
В немногих случаях белки, секретируемые
через плазматическую мембрану Sec-зависимым
путем, ацилируются жирными кислотами
для последующего связывания посредством это-
го участка с плазматической или наружной
мембраной. Наиболее изученный пример тако-
го механизма — перенос главного липопротеина
(«липопротеина Брауна»), ассоциированного и с
пептидогликановым слоем, и с наружной мем-
браной, у Е. coli. После завершения синтеза
X-концевой цистеиновый остаток в молекуле это-
го белка модифицируется с образованием тиоэфи-
ра глицерола и происходит ацилирование гидрок-
сильных групп глицерола и аминогруппы цистеи-
нового остатка жирными кислотами (рис. 19.15).
Затем в процессе транслокации сигнальная по-
следовательность отщепл} сзся сигнальной пепти-
дазой II (рис. 19.4). Ацилированный жирными
кислотами участок главного липопротеина как
Глава 19. Посттрансляционный контроль и модификация белков 583
«якорь» закрепляет этот белок в наружной мем-
бране, и, кроме того. С-концевой участок белко-
вой молекулы ковалсптпо связывается с пептидо-
гликановым елеем амидной связью посредством
взаимодействия остатка лизина, с остатком диа-
мипопимелиновой кислоты (рис. 19.15).
Липопротеины с аналогичными модифика-
циями (например, липопротеин-28) обнаружены
в плазматической мембране Е. coli и как особо
характерные у грамположительных бактерий (на-
пример, это гомологи псриплазматических свя-
зывающих белков, характерных для грамотрица-
тельпых бактерий). Интересно, что локализация
такого белка — в плазматической или наружной
мембране — зависит от остатка, соседствующего
с модифицируемым цистеиновым остатком. Ес-
ли соседний остаток — Asp, белок локализуется
в плазматической мембране, если пс Asp (как в
главном липопротеине) — в наружной мембране.
Некоторые белки секретируются неза-
висимо от белков Sec или с участием
дополнительных белков □ Многие белки у
грамотрицательных бактерий секретируются че-
рез обе мембраны, т. е. представляют собой
внеклеточные белки. Экскреция происходит по-
средством различных механизмов. Одни белки
(например, пуллуланаза или амилолитический
фермент у Klebsiella) пересекают плазматическую
мембрану Sec-зависип.ым путем, тогда как наруж-
ную мембрану — с использованием другого пути,
требующего участия нс менее 14 генов. Другие
внеклеточные белки, от многих из которых за-
висит вирулентность у патогенных бактерий
(см. гл. 33), например бактериальные токси-
ны о-гемолизин и колицин V Е. coli, лейко-
токсин Pasteurella haemolytica, адснилатциклаза
Bordetella pertussis и мсталлопротеазы (у Er-
winia, Serratia и Pseudomonas), секретируются
Sec-независимым путем, без образования пери-
плазматического интермедиата. В этих случа-
ях для секреции необходимы по крайней ме-
ре два белка плазматической мембраны и один
белок наружной мембраны. Некоторые из этих
белков плазматической мембраны (например, бе-
лок Н1уВ в случае гемолизина и белок PrtD в
случае протеаз Erwinia, принадлежат к суперсе-
мсйству АТР-связывающих белков (белки АВС;
см. гл. 5), которое включает не только бак-
териальные белки, участвующие в транспорте,
но и ряд эукариотических белков-переносчиков,
например белок множественной лекарственной
устойчивости (Р-гликопрогеин), а также регу-
ляторный белок трансмембранной проводимо-
сти, несущий дефект при кистозном фиброзе
(белок CFTR, от Cystic fibrosis transmenbrane
conductance regulator protein). Морфопоэз более
сложных структур клеточной поверхности, таких
как жгутики, пили и фимбрии (см. гл. 23, 24 и
33), обычно требует участия систем экспорта бел-
ков, специфичных для органелл, а также систем
АВС-типа.
У грамотрицательных бактерий многие бел-
ки подвергаются экскреции путем переноса че-
рез обе мембраны. Некоторые из них проникают
через плазматическую мембрану Sec-зависимым
путем, тогда как через наружную мембрану — с
помощью специфичных для конкретных полипеп-
тидов механизмов. Системы последнего типа ха-
рактерны для белков, участвующих в морфопоэзе
жгутиков, пилей, фимбрий и других клеточных
придатков, бактериальных токсинов (например,
гемолизинов и лейкотоксипов), бактериоципов, а
также экзобелков патогенных бактерий, обеспечи-
вающих внедрение в организм-хозяин.
Помимо описанных систем у Е. coli идентифи-
цированы два полипептида, гомологичные компо-
нентам известной у эукариот частицы, распознаю-
щей сигнал, ЧРС. Эта частица, представляющая
собой сложный комплекс из шести различных
полппептидных цепей, связанных с одной моле-
кулой 7SL-PHK, взаимодействует с сигнальной
последовательностью в составе новосинтезиро-
ванного белка и направляет его к специфическо-
му рецептору в мембране эндоплазматического
ретикулума, т. е. выполняет у эукариот важную
роль в переносе белков в ЭР. Входящей в со-
став ЧРС субъединице 54 кДа гомологичен белок
Ffli Е. coli; его дефекты, по-видимому, влияют па
транспорт белков через плазматическую мембра-
ну различным образом, и в связи с этим пока неяс-
но, какую именно роль белок Ffli и ассоциирован-
ная с ним 4,5S-PHK выполняют в направлении
белков к местам их локализации.
Направление интегральных белков плаз-
матической мембраны к месту локали-
зации □ Большинство белков плазматической
мембраны у бактерий синтезируется без классиче-
ской сигнальной последовательности. Тем не ме-
нее в немногих случаях эффективное внедрение в
мембрану этих белков, возможно, зависит от уча-
584 Часть V. Экспрессия генов и механизмы регуляции
стия одного или нескольких белков Sec; в других
случаях этот процесс, вероятно, от них нс зависит.
Предположительно во включении интегральных
белков в мембрану участвуют белок Ffli и ассоци-
ированная с ним РНК.
Скорее всего, включение интегральных бел-
ков в мембрану определяется главным образом
их аминокислотными последовательностями, для
которых характерно высокое содержание гидро-
фобных остатков, а также распределением в их
полипептидпых ценях положительно заряженных
остатков в качестве топографического фактора.
Короткие цитоплазматические петли (примерно
из 10 остатков) между предполагаемыми транс-
мембранными гт-спиралями в молекулах этих бел-
ков обогащены остатками Lys и Arg по срав-
нению с периплазматическими (или внеклеточ-
ными) петлями и длинными (более 80 остатков)
внутриклеточными петлями. Эти положитель-
но заряженные участки, возможно, способству-
ют закреплению цитоплазматических петель пу-
тем взаимодействия с отрицательно заряженными
головками фосфолипидов, образующих внутрен-
ний слои мембраны. Рассматривается также роль
трансмембранного электрического потенциала (со
знаком минус внутри клетки) в фиксации положе-
ния белка.
Большинство представителей одного из клас-
сов белков плазматической мембраны, а именно
ферментов II ФТС (см. разд. 5.4 и 20.2), содер-
жит (часто па N-копце молекулы) аминокислот-
ную последовательность, способную формировать
о-спирапь с выраженными амфипатическими
свойствами. Эти участки сходны с сигнальными
пептидами сортировки в составе белков митохон-
дриальных мембран у эукариот. Некоторые дан-
ные указывают на то, что данные последователь-
ности могут играть важную роль в направлении
ферментов II к мембране. Они имеются по-види-
мому, только у этого класса мембранных бе ikob,
и такой возможный механизм сортировки нс рас-
сматривается как распространенный у бактерий.
19.4.2. Другие механизмы «компартментации»
Катаболические и анаболические пути, имеющие
общие промежуточные продукты, должны регу-
лироваться у бактерий особенно тонко, во из-
бежание так называемых «холостых циклов»,
при которых, например, вещество, синтезирован-
ное посредством анаболической реакции, могло
Рис. 19.16. Превращения D-глюкозамин-б-фосфата
(GlcN-б-Р) в катаболических и анаболических путях.
Синтез и активность катаболического фермента с об-
ратимой активностью [GlcN-б-Р-изомераза (дезамини-
рующая); NagB] регулируется иначе, чем анаболическо-
го фермента аминотрансферазы (GlcN-6-Р-синтетаза,
GlmS). Регулятор NagC подавляет синтез NagB и акти-
вирует синтез GlmS. В присутствии индуктора N-ацетил-
GlcN-б-Р синтез NagB индуцируется, тогда как синтез
GlmS подавлен. Активность синтетазы GlmS при тех же
условиях подвергается ингибированию по механизму об-
ратной связи. По [4].
бы разлагаться ферментом, катализирующим об-
ратный процесс, часто с бесполезной тратой АТР.
К таким примерам относятся реакции, катализи-
руемые фосфофруктокиназой (PfkA) и фруктозо-
1,6-бисфосфатазой (Fbp) в процессах гликолиза и
глюкопео! епеза соответственно (см. рис. 19.8), ме-
таболизм гистидина с участием /шАсистемы ката-
болизма и /zis-систсмы анаболизма (см. гл. 7 и 9),
а также метаболизм аминосахаров, при котором
анаболические пути приводят к синтезу пептидо-
гликана и липополисахарида, тогда как катаболи-
ческие пути — к гликолизу (рис. 19.16).
В этих случаях «компартментация» (катабо-
лического, либо анаболического пути) осуществ-
ляется посредством регуляции экспрессии ге-
нов, аллостерического контроля катаболических и
анаболических ферментов, а также во многих слу-
чаях определяется кинетическими характеристи-
ками ферментов или сдвигом соответствующих
реакций в одном направлении. Например, при ме-
таболизме аминосахаров (рис. 19.16) катаболиче-
ский фермент D-глюкозамин-б-фосфат-изомераза
(дезаминирующая) (NagB) активируется N-аце-
тилглюкозамин-б-фосфатом как физиологиче-
ским индуктором и обладает низким сродством
к своему субстрату фруктозо-6-фосфату, тогда
как биосинтетический фермент D-глюкозамип-б-
фосфат-синтетаза (GlmS) обладает высоким срод-
Глава 19. Посттрансляционный контроль и модификация белков 585
ством к своему субстрату. Синтез фермента GlmS
подавляется при высокой концентрации N-аце-
тилглюкозамина и, по-видимому, его активность
ингибируется по механизму обратной связи. Эти
механизмы контроля при нормальных условиях
предотвращают’ у бактерий холостые циклы и бес-
полезную трату энергии.
Наконец, разделение функций у бактерий мо-
жет осуществляться также благодаря временной
«компартментации», т. е. индукции экспрессии
генов в определенной последовательности. Чаще
это встречается у бактерий, обладающих свой-
ством дифференцировки (часто индуцируемой го-
лоданием), например при спорообразования у
Bacillus, образовании плодовых тел у Myxococcus
или развитии роящихся клеток у Caulobacter (см.
гл. 24 и 25). В этих случаях последовательная
индукция генов обеспечивает нормальное проте-
кание цикла дифференцировки в ответ на внеш-
ний сигнал(-ы). В некоторых из этих процес-
сов, например при спорообразовании у Bacillus
(см. гл. 25 и выше в данной главе), использует-
ся также пространственная компартментации, со-
провождающая развитие споры внутри материн-
ской клетки).
Дополнительная литература
Freestone Р., Grant S., Toth I., Norris V. (1995) Identi-
fication of phosphoproteins in Escherichia coli. Mol.
Microbiol. 15: 573-580.
Gottesman S., MauriziM.R., (1992) Regulation by
proteolysis: energy-dependent proteases and their
targets. Microbiol. Rev. 56: 592-621.
Hueck C. J. Hillen W. (1956) Catabolite repression in Ba-
cillus subtilis: a global regulatory mechanism for the
Gram-positive bacteria? Mol. Microbiol. 15: 395-401.
Kontrowitz E. R., Lipscomb W. N. (1990) Escherichia
coli aspartate transcarbamoylase: the molecular basis
for a consorted allosteric transition. Trends. Biochem.
Sci. 15: 53-59.
Miller C. G. (1996) Protein degradation and proteolytic
modifications. In: Neidhardt F. C., Curtiss R.,
Ingraham .1. L., Lin E. С. C., Low К. B. Magasanic B.,
Reznikoff W., Riley M., Schaechtcr M., Unbarger H.E.
(eds.) Escherichia coli and Salmonella: cellular and
molecular biology, 2nd edn. Washington, DC: ASM
Press; 938-954.
Min K.T., Ililditch С. M., Diederich .1. E., Yudkin M. D.,
(1993) crF, the first compartment-specific transription
factor of B. subtilis, is regulated by an anti-o factor
that is also a protein kinase. Cell 74: 735-742.
Murphy C.K. Beckwith.!. (1996) Export of proteins
to the cell envelope in Escherichia coli.
In: Neidhardt F. C., Curtiss R., Ingraham J. L.,
Lin E. С. C., Low K.B., Magasanic B., Reznikoff W.,
Riley M., Schaechtcr M., Umbarger H. E., (eds.)
Escherichia coli and Salmonella: cellular and
molecular biology, 2nd edn. Washington, DC: ASM
Press: 967-978.
Neidhardt F. C., Ingraham .I. L. Schaechter M. (1990)
Physiology of the bacterial cell: a molecular approach.
Sunderland, Mass.: Sinauer Associates; 302-319.
Pugbsley A. P. (1992) Protein traffic in bacteria. In:
Lederberg J. (ed.) Encyclopedia of microbiology.
Vol. 3 San Deigo: Academic Press; 466-479.
Reitzer L. .1. (1996) Ammonia assimilation and
the biosynthesis of glutamine, aspartate,
asparagine, L-alanine, and D-alanine. In: Neid-
hardt F. C., Curtiss R., Ingraham .1. L., Lin E. С. C.,
LowK.B., Magasanik B., Reznikoff W., Riley M.,
Schaechter AL, Unbarger H. E., (eds.) Escherichia coli
and Salmonella: cellular and molecular biology. 2nd
edn. Washington, DC: ASM Press; 391-407.
Saier M.H., Jr. (1993) Introbuction: protein phospho-
rylation and signal transduction in bacteria. .!. Cell
Biochem. 51: 1-6.
Schirmer T., Evans P. R. (1990) Structural basis of the
allosteric behaviour of phosphofructokinase. Nature
343: 140-145.
Wandersman C. (1996) Secretion across the bac-
terial outer membrane. In: Neidhardt F. C.,
Cutriss R., Ingraham J. L., Lin E. С. C., Low К. B.,
Magasanik B., Reznikoff W., Riley M., Schaechter M.,
Umbarger H. E. (eds.) Escherichia coli and Sal-
monella: cellular and molecular biology. 2nd edn.
Washington, DC: ASM Press; 955- 966.
WickncrW., Driessen A..I., Hartl F.-U. (1991) The
enzymology of protein translocation across the
Escherichia coli plasma membrane. Annu. Rev.
Biochem. 60: 101-124.
Источники рисунков
1. Schirmer T., Evans P. R. (1990) Nature 343: 140-
145.
2. Reitzer L..I. (1996) In: Neidhardt F. C., Curtiss R.,
Ingraham J. L. Lin E. С. C., Low К. B., Magasa-
nik B., Reznikoff W., Riley M., Schaechter M.,
Unbarger II. E. (eds.) Escherichia coli and Sal-
monella: cellular and molecular biology, 2nd edn.
Washington, DC: ASM Press; 391-407.
3. WicknerW., Driessen A..I. M., Hartl F.-U. (1991)
Annu. Rev. Biochem. 60: 101-124.
4. Vogler A. P., Trentmann S., Lengeler .1. W., (1989) J.
Bacteriol. 171: 6586-6592.
Глава 20
Общие регуляторные сети и пути передачи сигналов
Прокариоты, как и все одноклеточные организмы,
должны быть способны обнаруживать изменения
в окружающей среде и метаболически приспосаб-
ливаться к ним. Немедленная адаптация к таким
изменениям составляет отличительное свойство
прокариот, как и быстрый рост. Адаптивные мета-
болические изменения носят характер временных
и, как правило, сохраняются ненамного дольше,
чем данные внешние условия. Прокариоты «сле-
дят» за ними посредством мсмбрапосвязанных и
внутриклеточных сенсоров, а также транспорт-
ных систем. Сенсоры связаны с путями переда-
чи сигналов и общей регуляторной сетью. К на-
стоящему времени установлено, что все прокарио-
ты — свободноживущие комменсапы, симбионты и
патогенные организмы — обладают сходными спо-
собами адаптации. Пути передачи сигналов вклю-
чены также в общий контроль процессов метабо-
лизма. клеточной дифференцировки и поведения
бактериальных популяций.
20.1. Для прокариот характерны объединенные метаболические сети
и пути передачи сигналов
В двух предыдущих главах описана регуляция от-
дельных метаболических путей па уровне оперо-
нов и регулолов (т. е. синтеза ферментов) (гл. 18),
а также рассмотрен контроль активности фер-
ментов (гл. 19). Гены в опероне сгруппированы в
одну транскрипционную единицу, что позволяет
координировать экспрессию генов, кодирующих
связанные функции (рис. 20.1). Сложные анабо-
лические и катаболические пути детерминирова-
ны множеством генов, которые не могут быть,
по-видимому, объединены в общий оперон.
Несколько оперонов, контролируемых общим ре-
гуляторным белком, составляют регулон. Веро-
ятно, регулоны характерны для путей деграда-
ции химически сходных веществ, если эти пути
должны действовать при различных условиях
роста. Например, регулон glp у Escherichia coli
(рис. 20.1) кодирует ферменты катаболизма гли-
церола и sn-глицерол фосфата. Для транспорта
этих соединений в аэробных и анаэробных услови-
ях требуются различные транспортные системы
и ферменты: в деградации глицерола участвует
только глицеролкиназа (GlpK), тогда как sn-гли-
церолфосфат индуцирует экспрессию всех опе-
ронов glp, контролируемых общим репрессором
GlpR.
В этой главе рассматривается другой свой-
ственный прокариотам тип регуляции — согласо-
ванное изменение экспрессии оперонов, которые
функционально пс родственны, но связаны общей
целью. Такая регуляция, называемая общей, на-
кладывается на регуляцию с участием специфи-
ческих регуляторов (контролирующих отдельный
оперон или регулон) и во многих случаях необхо-
дима для резких и существенных сдвигов в мета-
болизме.
20.1.1. Опероны, связанные общей конечной
целью, сгруппированы в модулоны
Функционирование сложных метаболических пу-
тей требует координации целых блоков или це-
почек метаболических процессов. Соответствую-
щие гены локализованы во множестве оперонов
или регулонов, и для их совместной регуляции
действует контроль па более высоком уровне.
Группу оперонов или регулопов, каждый из ко-
торых регулируется не только своим индиви-
дуальным регуляторным белком, но, кроме то-
го, общим регулятором, называют модуло-
ном. Эта регуляторная система более высокого
уровня накладывается на специфические системы
регуляции. Мутация в гене общего регулятора
имеет плейотропный эффект, т. е. влияет на экс-
Глава 20. Общие регуляторные сети и пути передачи сигналов 587
Рис. 20.1. Структура /ас-оперона (метаболизм лакто-
зы) и ^/р-регулона (метаболизм глицеролфосфата) у
Е. coli. Промоторные последовательности обозначены р,
структурные гены — прописными буквами; отрицатель-
ный контроль со стороны соответствующих репрессоров
в операторе (о) указан значком (©)• Сплошные стрел-
ки указывают направление транскрипции. Символом а
обозначен сайт связывания общих регуляторов.
Оперон — ►о
Метаболизм лактозы
[-►Репрессор г>
/ас|р] / | /ас-оперон | а | р | о | Z | У | А ~|
Регулон > Q
f Анаэробный метаболизм С1р
' д/р-оперон 1|а |р|Т| А | С | В |
!----------------► ©
< Аэробный метаболизм С1р
к ф
। д/р-оперон 2|а |р|о| G | £ | D ~|
[•►Репрессор — — — ► Q
д/р|р] В Поглощение и метаболизм
Г> глицерола
I д/р-оперон з|а|р|о[ F | к |
4---------------- о
Поглощение С1р
д/р-оперон4|а |р[о| Г | Q [
Рис. 20.2. Структура модулона сгр. В присутствии цик-
лического аденозин-З'ф'-фосфата (сАМР) белок Сгр ак-
тивируется и взаимодействует с консенсусной последо-
вательностью (а), действуя как активатор (положитель-
ный контроль, (+)) для всех оперонов (единичные стрел-
ки) и регулонов (множественные стрелки), содержащих
в промоторе последовательность сгр. Не содержащие
этой последовательности промоторы не активируются
белком Сгр. Регуляция посредством системы множе-
ственных эффектов накладывается на регуляцию каж-
дого оперона его индивидуальным, специфическим ре-
гулятором в сайте-операторе (отрицательный контроль,
репрессор) или сайте-инициаторе (/, положительный
контроль, активатор).
прессию всех единиц в составе модулона. На-
пример, у энтеробактерий опероны и рсгулопы,
кодирующие ферменты периферического катабо-
лизма (рис. 20.2), регулируются по механизму
катаболитной репрессии с участием комплекса
сАМР-Crp (см. разд. 20.2), находясь в соста-
ве модулона сгр (названного так по его струк-
турному гену суу;, кодирующему общий регу-
ляторный белок Сгр; этот белок обозначают
так же, как CRP, — по первым буквам названия
сАМР-receptor protein или catabolite repression
protein. Первоначально белок Сгр был назван
САР, от сАМР-binding protein.
К типичным примерам других метаболиче-
ских блоков, контролируемых общей регулятор-
ной системой, относятся пути синтеза аминокис-
лот, нуклеотидов и витаминов, механизм трансля-
ции и процесс спорообразования. По имеющимся
оценкам, число систем, контролируемых общими
регуляторами, варьирует от 50 у отдельной бак-
териальной клетки до нескольких сотен во всем
мире прокариот. Неполный перечень типичных и
наиболее важных из этих систем с указанием глав
книги, в которых они рассматриваются, приведен
в табл. 20.1. Известные к настоящему времени
генетические системы, находящиеся под общим
контролем, разделены на четыре класса: 1) мо-
дул оны. участвующие в обеспечении клеток пи-
тательными веществами и энергией, 2) модулоны,
участвующие в стресс-реакции, 3) модулоны диф-
ференцировки и 4) модулоны, участвующие в аг-
регации клеток и межклеточных контактах.
588 Часть V Экспрессия генов и механизмы регуляции
Таблица 20.1. Системы общей регуляции у прокариот
Система или ответная реакция Стимул Сенсор/ответный регулятор Регулируемые гены и системы Номер главы
Обеспечение питательными веществами
Катаболитная ре- прессия; исклю- чение индуктора Уровень источника углерода ФТС: IIAGlc и сАМР-Сгр или ФТС: P-Ser, НРг и СсрА Большинство катаболитных опе- ронов периферического метабо- лизма и системы транспорта уг- леводов; белки хемотаксиса 19, 20
Строгий/ослаб- ленный ответ 11ул тРНК Рибосомы; RelA, SpoT и PPGPP Механизм трансляции; большин- ство анаболических ферментов 20
Азотный Уровень источника Глутам и нсинтетаза; Большинство оперонов, участвую- 8, 19,
метаболизм азота NtrB/NtrC; NifR2/NifRl: RpoN (<т54) щих в ассимиляции и фиксации азота; белки хемотаксиса 20
Фосфорный метаболизм Уровень источника фосфора PhoP.Q/PhoB.P Несколько оперонов ассимиляции фосфата (неорганического и ор- ганического) 8, 20
Аэробное дыхание Уровень кислорода АгсВ/АгсА Многие гены ферментов аэробных процессов; аэротаксис 11, 21
Анаэробное дыхание Уровень акцепторов электронов (не кислорода) NarQ.X/NarL; Nir; Fnr Многие гены анаэробного дыхания 11, 21
Брожение Отсутствие акцепто- ров электронов Неизвестны Многие гены ферментов путей брожения 11, 21
Литоавтотрофный метаболизм Окисление водорода IloxA; RpoN (a54) Многие гены ферментов литоавто- трофного метаболизма у Alcali- genes 10, 20
Метаногенез Неизвестен 11еизвестны Многие гены 12, 20
Синтез экзоферментов Голодание DesS/DegU Многие гены экзоферментов, участвующих в разложении по- лимеров 9, 20
Стресс-реакция
SOS-ответ Повреждение ДНК LexA, RecA Примерно 20 генов din (от damage inducible genes), ответственных за репарацию повреждений ДНК 15, 20
Реакция на алки- лирование Алкилирование ДНК Ada Гены, ответственные за удаление алкилированных оснований 15, 20
Реакция на окис- ление П2О2 или другие окислители OxyR, SoxR/SoxS Несколько генов, ответственных за предотвращение окисления 11, 28
Тепловой шок Быстрый подъем температуры Рибосомы; RpoII (cr32) Многие гены, ответственные за процессинг макромолекул, их свертывание/развертывание (белки-шеперопы) и деградацию 20, 28
Холодовой шок Быстрое снижение температуры Неизвестны Гены и белки, сходные с участву- ющими в тепловом шоке 28
Реакция на осмо- тическое давле- ние Быстрое повышение или снижение осмол я рности (тургора) EnvZ/OmpR; KpdD/KpdE Гены белков наружной мембра- ны, поринов, MDO, переносчи- ков понов калия 28
Общая реакция на голодание Прекращение роста CreC/CreB; RpoS (<r3S) Многие опероны, активируемые при голодании и необходимые для выживания в стационарной фазе 20, 28
Глава 20. Общие регуляторные сети и пути передачи сигналов 589
Таблица 20.1 (продолжение)
Система или ответная реакция Стимул Сенсор/ответный регуля- тор Регулируемые гены и системы Номер главы
Дифференцировка Реакция на стацио- нарную фазу роста Регуляция скорости роста Клеточное деление Спорообразование (1) Спорообразование (2) Компетентность Вторичный метаболизм Аппарат фотосин- теза Вирулентность (1) (животные клетки) Вирулентность (2) (растительные клетки) П рекращение роста Неизвестен Неизвестен Голодание (по ис- точнику энер- гии) Голодание (по ис- точнику энер- гии) Голодание (по ис- точнику энер- гии) Неизвестен Свет, кислород Быстрое измене- ние температу- ры, осмотичес- кого давления, pH или содер- жания свобод- ного железа Углеводы, ране- вой экссудат Неизвестны; вероятно, PilB/FilA; RcsC/RcsB; RpoS (ст38) I Геизвестны Неизвестны; вероятно. Sfx KinA/SpoOF(B,A); DivJ/DivK; KinB, PleC/SpoOF(B,A), несколько сигма-факто- ров у Bacillus У стрептомицстов неиз- вестны ComP/ComA Неизвестны, вероятно, фактор A; VanS/VanR; RteA RegB/RegA; PrrB/PrrA Vibrio (Тох); Bordetella (BvgS, Lem А); многие бактерии (Fur); Yersinia (Yop); Shigella, Salmo- nella-, Staphylococcus (Agr, Exp); Pseudomonas (Alg) Agrobacterium tumefaci- ens (VirA/VirC); Rhizo- bium (FixL/FixJ); Bra- dyrhizobium (NodV/NodW) Гены, ответственные за формиро- вание колоний, поверхностную адгезию, хромосомные пере- стройки, усиленный мутагенез Неизвестны; вероятно, многие из них связаны с аппаратом транс- ляции и клеточным делением Сотни генов, связанных с реплика- цией ДНК, образованием кле- точной перегородки и координа- цией клеточного деления Многие гены, ответственные за формирование эндоспор Многие гены, ответственные за формирование экзоспор Гены, ответственные за поглоще- ние ДНК Многие гены, ответственные за синтез антибиотиков и вторич- ных метаболитов Многие гены компонентов фото- синтеза и системы фототаксиса Многие хромосомные, плазмид- ные и фаговые гены, контроли- рующие инфицирование, ко- лонизацию, образование токси- на, противодействие защитным системам хозяина и т. д. Как в предыдущем случае 23, 24 22 22 25 25 16, 25 27 24 33 34
Межклеточные конг Подвижность и раз- витие Конъюгация Кворум-сенсинг (ре- акция на числен- ность клеток в по- пуляции) гакты Голодание Клетки противо- положного пола Плотность попу- ляции У многих бактерий системы хемотак- сиса (CheA/CheY,B), фототаксис; спорообра- зование у Myxobacteria (FrzE/FrzZ,G) Двухкомпонентный сен- сор (срх) энтеробакте- рий; феромоны у грам- положительных бакте- рий LuxN,Q/LuxO Многие гены, связанные с подвиж- ностью, агрегацией клеток, обра- зованием спор Многие tna-гепы, необходимые для конъюгации и координации ре- пликации хромосомы и плазмид Многие гены 20, 25 16 20
590 Часть V. Экспрессия генов и механизмы регуляции
<- Стимуляция
Передача
*’ сигнала
Ответная
реакция
Сенсорные Домен,
домены переда-
(рецепторы) клций
сигнал
Стимул ) \
Стимул ) - ► © | I ->
К А
Стимул
Домен, _ _ Общая
принима- Ответныи регуля-
ющий регулятор торная
Гены
Модулоны
Регуляторы
Метаболизм
Дифференцировка
Поведение
Рис. 20.3. Общая схема сенсорных систем с крат-
ковременной реакцией на стимул. Центральную
роль выполняет белок, передающий сигнал; он
же превращает стимул, полученный от сенсора,
в сигнал; белок, принимающий сигнал, стимули-
рует или подавляет (±) активность ответного ре-
гулятора, и, наконец, адаптер прекращает стиму-
ляцию.
Адаптер
Адаптация ----►
Модулон представляет собой группу или сеть
оперонов и регулонов, регулируемых не только
специфическими регуляторами, но также общей
регуляторной системой более высокого уровня.
Эта система реагирует обычно на внешние изме-
нения, воспринимаемые клеткой через сенсорные
рецепторные системы. Организованные в модулон
гены связаны общей функциональной целью, на-
пример снабжения клетки теми или иными источ-
никами питания, осуществления споруляции, раз-
вития симбиоза или инфицирования организма-
хозяина.
20.1.2. Для общей регуляции необходимы
кратковременно действующие пути
передачи сигнала
Адаптация микробных популяций к изменениям
среды носит, как правило, кратковременный ха-
рактер. Исключение составляют процессы диф-
ференцировки, такие как спорообразование, ин-
дукция профага или длительно сохраняющиеся
перестройки генов, необратимые на уровне инди-
видуальных клеток; однако даже эти процессы об-
ратимы на уровне популяции. Исходное состояние
клеток восстанавливается после завершения пол-
ного цикла размножения (см. гл. 22 и 24).
Сенсорные системы рецепции о Прока-
риоты обладают множеством внеклеточных и
внутриклеточных сенсоров для слежения за из-
менениями внешней и внутренней среды. Как по-
казывает схема на рис. 20.3, сенсоры опосреду-
ют преобразование стимулов в сигналы, которые
передаются по соответствующим путям на специ-
фические или общие регуляторы, например регу-
ляторы модулонов. Регуляторы вызывают реак-
ции клеток путем изменения активности генов и
ферментов. Кроме того, они запускают процесс
адаптации, обеспечивающий прекращение реак-
ции, несмотря на продолжающееся присутствие
стимула.
Пониманию сложных феноменов адаптации
и дифференцировки у прокариот как процес-
сов, опосредуемых временно действующими сен-
сорными системами, помогает их сравнитель-
ный анализ. Некоторые из наиболее изучен-
ных сенсорных процессов, например хемотаксис
у энтеробактерий (см. разд. 20.5) или регуля-
ция посредством двухкомпонентных систем (см.
разд. 20.4), у прокариот весьма сходны с ана-
логичными сенсорными системами эукариот. По-
скольку модулон образовался, вероятно, в процес-
се эволюции из более простых единиц — оперонов
и рсгулонов, можно, по-видимому, найти более
просто устроенные системы — предшественники
сенсорной части его регуляторной системы. При-
мером простой сенсорной системы может служить
механизм, обеспечивающий реакцию /ос-оперона
па внесение лактозы в растущую культуру Е. coli
(рис. 20.4). Лактоза (внешний стимул) обнару-
живается в среде пермеазой (сенсор). Субстрат
транспортируется через мембрану и превращает-
ся под действием /3-галактозидазы в аллолактозу,
которая выступает в роли внутреннего индукто-
ра (сигнала), связываясь с рецептором лактозно-
го оперона. Этот репрессор контролирует синтез
ферментов, катализирующих первые этапы сбра-
живания лактозы (ответная реакция). Если бро-
жение протекает с высокой скоростью, достаточ-
ной для углеродной катаболитной репрессии и
исключения индуктора, устанавливается новое
равновесие путем адаптации. Таким образом, лак-
тозную систему можно рассматривать как пред-
шественник систем, распознающих изменения во
внешней среде непрямым путем по изменению
скорости транспорта или пула внутриклеточных
интермедиатов (в данном случае сАМР).
Глава 20. Общие регуляторные сети и пути передачи сигналов 591
Рис. 20.4. Модель простой сенсорной си-
стемы, обеспечивающей адаптацию на
уровне оперона lac и метаболизма лакто-
зы (Lac). В этой модели индукция соот-
ветствует получению сигнала, гидролиз
лактозы — ответной реакции, катаболит-
ная репрессия вместе с исключением ин-
дуктора — адаптации.
20.1.3. Разработан ряд методов изучения
общих регуляторных сетей
Выявление и анализ многих сложных регулятор-
ных систем, таких как модулоны и сенсоры, на-
чинались с выделения мутантов. Так, первые му-
танты энтеробактерий с изменениями в системах
катаболитной репрессии и исключения индуктора
были выделены по признаку устойчивости к раз-
личным «эффектам глюкозы» задолго до опреде-
ления данной системы регуляции в качестве мо-
дулона и выяснения ее биохимического механиз-
ма. То же относится к мутантам rel и модулону
«строгого/слабого» контроля, а также к мутан-
там spo у В. subtilis и регуляции спорообразования
и т. д. Молекулярные механизмы регуляции изу-
чают с использованием биохимических методов.
Блестящим примером такого рода исследований
может служить анализ систем бактериального
хемотаксиса, рассмотренный в разд. 20.5. Пути
передачи сигналов основаны на участии немного-
численных высококопсервативных белков, имею-
щих сходные функции и аминокислотные после-
довательности. Поиск таких последовательностей
может быть подходом к выявлению новых белков
данной группы.
Генетические методы □ Как правило, ге-
нетический этап исследования начинают с выде-
ления мутантов, характеризующихся специфиче-
скими изменениями компонентов сенсорной систе-
мы или общего регулятора модулопа. Мутации
в гене регулятора обусловливают изменение экс-
прессии всех одновременно регулируемых оперо-
нов и таким образом позволяют определить гра-
ницы модулона. Мутации в гене сенсора позволя-
ют идентифицировать соответствующий стимул.
Другой генетический подход основан на проце-
дуре слияния генов. Опа позволяет вводить в ге-
ном исследуемого организма так называемый ре-
портерный ген (например, ген lacZ из Е. coli., за
которым легко следить по активности Дгалакто-
зидазы) для его соединения с различными про-
моторами хозяина. Этот индикаторный ген помо-
гает идентифицировать промоторы, реагирующие
на один и тот же стимул и один и тот же общий ре-
гулятор. Простейший способ слияния исследуемо-
го гена с lacZ основан на использовании дефект-
ных частиц фага Мн. Такие дефектные мутанты,
называемые Mudlac (рис. 20.5), содержат: 1) обо
концевые последовательности фага Мн, необходи-
мые для интеграции профага в хромосому хозяи-
на; 2) Zac-оперон без промотора и 3) ген Ыа, ко-
дирующий ^-лактамазу (он облегчает отбор ин-
фицированных клеток, придавая им устойчивость
к ампициллину). В присутствии хелперного фага
Мн фаг Mudlac интегрируется в различные участ-
ки бактериальной хромосомы. Если инфицируе-
мый штамм песет делению /ас-оперона, мутанты
592 Часть V. Экспрессия генов и механизмы регуляции
Сегмент С lacZ Y Ыа
IIIIIIIIIII-1 >------К
Концевая
область Интеграция в хромосому
фага Ми клетки-хозяина с помощью
фага-хелпера Ми
. lacZ Y Ыа
Е——---------1 >------ЕТ}
AA/WWWWV*
мРНК
Сегмент S
-----IIIIIIIIIII
Концевая
область
фага Ми
'xyz
Промотор р для генов xyz
Рис. 20.5. Слияние генов с помощью бактериофага
Mudlac. В присутствии фага-хелпера этот дефектный
(d) фаг Ми, содержащий ген lac без промотора и ген
jS-лактамазы (b/а), придающий инфицированным клет-
кам устойчивость к ампициллину (для облегчения от-
бора), интегрируется во многие участки хромосомы
клеток штамма-хозяина, характеризующегося делецией
/ас-генов. Колонии клеток Lac’* возникают в том слу-
чае, если фаговые гены lac соединяются (вследствие
хромосомных перегруппировок) с каким-либо промото-
ром (р) и проявляются в условиях, активирующих этот
промотор. Гены xyz разделены в результате инсерции на
фронтальную (xyz') и дистальную (xyz) половины.
Мутация в гене А
Дикий тип
Стимул
Стимул
Супрессорная
мутация в гене В
Стимул
Сигнал
Сигнал
Отсутствие
сигнала
Рис. 20.6. Использование конформационной супрессии
для идентификации соседних компонентов в пути пере-
дачи сигнала. Влияние мутации в белке А, который фи-
зически контактирует с белком В, компенсируется вто-
ричной, или супрессорной, мутацией в гене белка В.
Lac+ могут возникать только в случае, когда ин-
теграция произошла таким образом, что фаговые
гены lac экспрессируются с расположенного выше
промотора хозяина. Условия, влияющие на актив-
ность этого промотора, влияют при этом и иа экс-
прессию jG-галактозидазы. Клопы клеток, в кото-
рых произошло слияние репортерного гена с тем
или иным из промоторов, принадлежащих к одно-
му модулону, выявляют (при высеве на питатель-
ную среду) как колонии, обнаруживающие экс-
прессию Zac-генов в ответ на стимулы для данного
модулона, подобные перечисленным в табл. 20.1.
Третий генетический подход, основанный на
получении так называемой конформационной су-
прессии, особенно полезен для идентификации
компонентов сложных путей преобразования сиг-
нала. Если выделены мутанты с нарушением пу-
ти передачи сигнала, причина которого состоит в
изменении структуры одного из белков и потере
им в результате этого способности к связыванию
со следующим компонентом пути (рис. 20.6), лег-
ко получить вторичные, супрессорные мутации,
изменяющие структуру или конформацию этого
следующего белка таким образом, чтобы восста-
новилась его способность к связыванию с первым
мутантным белком. С этой целью часто осуществ-
ляют клонирование генов в плазмидах, позволя-
ющее повысить частоту мутаций и вероятность
получения требуемых мутантов. Чтобы отличать
данный феномен от мутаций, приводящих к ин-
формационной супрессии в результате изменений
в тРНК (см. гл. 15), используют термин «кон-
формационная супрессия», который отражает
механизм процесса.
Мутации, приводящие к конформационной су-
прессии, высокоспецифичны в том отношении,
что позволяют идентифицировать белки и даже
белковые домены, функционирующие в комплексе
или при непосредственном физическом контакте с
другими белками, как в случае белков, участвую-
щих в передаче сигналов.
Биохимические методы □ При анализе об-
щих систем регуляции проводят двумерный гель-
электрофорез клеточных экстрактов, позволяю-
щий выявлять большинство клеточных белков и
таким образом устанавливать изменения в их син-
тезе до и после изменения условий среды. Обычно
в пробы из культуры, растущей в заданных усло-
виях (контрольный вариант), и пробы, отобран-
ные сразу после изменения условий роста, вносят
в качестве метки [3о8]-Ь-метионин. После необ-
ходимой инкубации клетки разрушают, прово-
Глава 20. Общие регуляторные сети и пути передачи сигналов 593
Рис. 20.7. Анализ белков Е. coli методом двумерного электрофореза.
А. Стандартная двумерная полипептидная карта для аэробно выращенных клеток Е. coli KL-19. Идентифицирован-
ные полипептиды: рибосомный белок S1 (а), продукт гена groE (b), /3-субъединица АТР-синтазы (с), енолаза (d) и
факторы элонгации Ти (е) и Ts (f). В одном направлении белки разделяли путем изоэлектрического фокусирования,
в другом — электрофорезом в полиакриламидном гене в присутствии додецилсульфата натрия по методу, впервые
описанному О'Фарреллом (O'Farrell). Отмечены пептиды, синтез которых индуцируется в аэробных условиях при
росте в среде с глюкозой (□).
Б. Пептиды из клеток, выращенных в среде с глюкозой в анаэробных условиях в присутствии формиата или нитрата.
Отмечены пептиды, индуцируемые в анаэробных условиях (О)- Г1о [1].
дят гсль-электрофорез клеточных экстрактов и
сравнивают варианты по составу клеточных бел-
ков. Измененные белковые пятна идентифициру-
ют на радиоавтограммах (рис. 20.7). При нали-
чии мутантов аналогичным образом сравнивают
состав белков штамма дикого типа и мутантов с
измененной регуляцией модулона. В случае Е. coli
имеется неполная пока полипептидная карта, ко-
торую можно использовать для идентификации
компонентов различных систем общей регуляции.
В отношении других бактерий это пока недости-
жимо. Искомые белки элюируют из геля и анали-
зируют для установления частичной или полной
аминокислотной последовательности. Затем полу-
чают комплементарный соответствующему гену
(или его части) олигонуклеотидный зонд и при-
меняют его для Саузерн-гибридизации с целью
выявить в банке генов фрагменты ДНК, содержа-
щие данный ген. Более подробно этот метод, ча-
сто неадекватно называемый подходом «обрат-
ная генетика», описан в гл. 17.
В настоящее время применяется новый под-
ход к изучению генетических систем общей ре-
гуляции у Е. coli., при котором используются
совместно методы выявления, клонирования и
физического картирования групп совместно регу-
лируемых генов. Он состоит в том, что из кон-
трольной и опытной культур выделяют РНК и
при помощи техники обратной транскрипции по-
лучают меченную [32Р] кДНК. На следующем
этапе методом дот-блоттинга фрагменты меченой
кДНК гибридизуют с фрагментами хромосомной
ДНК (геномной библиотеки), полученной из хро-
мосомы Е. coli К-12 в фагах Л и М13. Для вы-
явления индуцированных и репрессированных ге-
нов сравнивают уровни мРНК, транскрибируе-
мых с клонированного участка ДНК в контроль-
ной и опытной культурах в условиях, например,
теплового либо осмотического шока или голода-
ния. В других случаях сравнивают уровни мРНК
при переходе бактериальных культур от экспонен-
циального роста к стационарной фазе, от аэроб-
ного к анаэробному росту или от роста в про-
бирке к обитанию в кишечнике гнотобиотических
мышей. В качестве альтернативы можно анали-
зировать влияние плейотропных мутаций генов
594 Часть V. Экспрессия генов и механизмы регуляции
сгр, fnr, rpoS, rpoH, rpoN, himA и других пред-
полагаемых генов общих регуляторных систем на
экспрессию других генов. Обнаружив представ-
ляющий интерес клон ДНК, определяют точную
физическую локализацию данного фрагмента в
хромосоме, идентифицируют продукт или про-
дукты генов и после этого устанавливают их
функции с помощью подхода «обратная генети-
ка». Преимущество такого объединенного метода
по сравнению с упомянутыми выше методами за-
ключается в том, что он может быть применен
почти к любому организму и любому (не крити-
ческому и не покоящемуся) гену, независимо от
того, существенна его роль или нет, если имеется
библиотека генов.
20.1.4. Для иерархических регуляторных систем
необходима новая номенклатура
Согласно первоначальному определению Жакоба
и Моно, опероном называют транскрипционную
единицу, координированно экспрессируемую с об-
щего промотора (с образованием «нолицистрон-
ной мРНК») и контролируемую общим операто-
ром. Сцепленный с промотором оператор кон-
тролирует инициацию транскрипции посредством
связывания или высвобождения аллостерических
регуляторных белков (репрессоров или активато-
ров). Последние реагируют на специфические эф-
фекторы — обычно субстраты ферментов, кодиру-
емых структурными генами данного оперона, или
конечные продукты путей, в которых участвуют
эти ферменты. Совокупность оперонов, распреде-
ленных тем или иным образом в хромосоме, но ре-
гулируемых одним и тем же репрессором либо ак-
тиватором, называют регулоном. Такие опероны
обычно содержат гены, ответственные за различ-
ные участки одного и того же метаболического пу-
ти (например, биосинтеза аргинина у Е. coli}, или
гены различных метаболических путей превра-
щения одних и тех же или близкородственных
субстратов (например, деградации глицерола и
sn-глицеролфосфата; рис. 20.1). Таким образом,
способы контроля оперонов и регулонов практи-
чески одинаковы и представляют низший уровень
регуляции.
В модулоне совокупность оперонов и регу-
лонов, связанных общей целью, но в других от-
ношениях неродственных, контролирует общий
регулятор. Такой регулятор реагирует не на спе-
цифические молекулы, например субстраты и ко-
нечные продукты, а на условия общего характе-
ра, например голодание или другие стрессовые
условия, способные вызывать резкие изменения в
метаболизме. Это общий контроль более высо-
кого уровня относительно систем, основанных па
эффектах специфических регуляторов, и мутации
в гепах, участвующих в общей регуляции, при-
водят к множественным изменениям. Некоторые
регуляторы реагируют на внутриклеточный пул
метаболитов, отражающих состояние того или
иного метаболического блока: подобные метаболи-
ты называют алармонами. Ниже будут подроб-
но рассмотрены два примера такого механизма:
1) регуляция модулона сгр, для которого алар-
моном выступает с АМР, контролирующий угле-
родную катаболитную репрессию и сходные фе-
номены в многочисленных системах, связанных с
поиском питательных веществ, и 2) регуляция мо-
дулона. relA/spoT с участием в качестве алармо-
на ppGpp, регулирующего процессы биосинтеза
макромолекул. Другие регуляторы связаны с сен-
сорными системами рецепции, непосредственно
воспринимающими специфические условия сре-
ды. К системам, регулируемым на этой основе,
относятся модулой pho, реагирующий па изме-
нения концентрации фосфата в среде, модулон
envZ/ompR, реагирующий на изменения осмоти-
ческих условий, модулон nt.г, контролирующий
азотный метаболизм, и система che, участвующая
в контроле подвижности клеток. Некоторые из
примеров, перечисленных в табл. 20.1, рассмот-
рены в других разделах данной главы. Регулято-
ры, участвующие в общем контроле, обычно из-
меняют активность РНК-полимеразы на промо-
торах всех оперонов и регулонов, составляющих
модулон. Они либо сами связываются как акти-
ваторы или репрессоры с консенсусной последо-
вательностью, общей для всех единиц в составе
модулона, либо изменяют активность таких ре-
гуляторов, например в форме альтернативных
сигма-факторов, которые позволяют РНК-поли-
меразе специфически связываться с промоторами
конкретного модулона.
Отдельный стимул (например, внесение в сре-
ду глюкозы в случае энтеробактерий, глубокое
и длительное голодание, холодовой или тепло-
вой шок, повреждение ДНК или инфицирова-
ние организма-хозяина) может вызывать реакцию
клеток с участием компонентов различных моду-
лонов. Для обозначения крупных групп оперонов,
совместно реагирующих на данный внешний сти-
Глава 20. Общие регуляторные сети и пути передачи сигналов 595
мул, независимо от количества входящих в их со-
став генов и регуляторных элементов, предложен
термин стимулон. Он имеет в первую очередь
эвристическое значение как полезный в началь-
ной стадии анализа, когда еще неизвестны при-
рода регуляторных процессов и состав модулона,
и не обязательно означает наличие общей регуля-
торной сети для всех реагирующих систем.
Многие клеточные регуляторные сети, объеди-
ненные общей целью, превосходят по сложнос-
ти модулем. Они обеспечивают протекание та-
ких процессов, как деление, спорообразование
или изменения поверхности бактериальных кле-
ток при инфицировании организма-хозяина. По-
добные процессы затрагивают функционирование
клетки в целом и требуют регуляции на уровне
мультигенных семейств. Это понятие также
используется пока лишь в описательном смыс-
ле и не означает, что установлено наличие об-
щей регуляторной системы для нескольких мо-
дулонов. Существование подобных регуляторных
систем третьего уровня, накладывающихся на си-
стемы контроля оперонов и модулонов, представ-
ляется вероятным, поскольку в прокариотической
клетке, как можно предполагать, все метаболиче-
ские этапы интегрированы на разных иерархиче-
ских уровнях и образуют единый ансамбль, необ-
ходимый для достижения определенной цели.
Как и в случае эукариотических клеток в со-
ставе многоклеточного организма, регуляция на
уровне одной прокариотической клетки не состав-
ляет высший уровень сложности. Клетки про-
кариот способны также к межклеточным внут-
рипопуляционпым контактам и кооперативному
поведению. Такое поведение обеспечивается сен-
сорной системой аутоиндукции, позволяющей
клеткам реагировать на плотность своей попу-
ляции. Этот феномен получил название quorum
sensing («кворум-сенсинг»), означающее реакцию
на плотность популяции. В процессе роста мик-
робные клетки выделяют аутоипдуктор, накапли-
вающийся в среде; когда его концентрация пре-
вышает пороговый уровень (обычно при высокой
плотности клеток), он вызывает аутоиндукцию,
т. е. активацию определенных генов. У грамот-
рицатсльпых бактерий аутоиндукторы представ-
ляют собой N-ацилгомосеринлактоны. Эти ам-
фифильные молекулы легко диффундируют че-
рез мембраны и связываются с регуляторными
белками семейства LuxR, контролирующими син-
тез аутоипдуктора и социальное поведение (см.
разд. 11.6.2). Аутоиндукторы регулируют, напри-
мер, следующий процессы.
1. Биолюминесценция и «роение» у бакте-
рий родов Vibrio, Proteus и Serratic □ Сим-
бионт некоторых морских организмов, бак-
терия V. fischeri, достигает внутри их све-
тящихся органов очень высокой численности
(101°-1011 кл/мл), и при этом происходит
аутоиндукция люминесценции, тогда как от-
дельные клетки данной бактерии в морской
воде пе обнаруживают свечения. Аналогич-
ным образом регулируется роение на плотных
поверхностях, характерное для Р. mirabilis и
S. marcescens и отличающееся от обычной по-
движности в жидкой среде.
2. Вирулентность у Erwinia carotovora и Pse-
udomonas aeruginosa □ Многим бактериям,
патогенным для растений и животных, тре-
буется высокая плотность популяции (бо-
лее 106 кл/мл) для локального накопления
большого количества экзоферментов (пектин-
лиаз, полигалактуроназ, целлюлаз или про-
теаз), лизирующих защитные клеточные обо-
лочки, либо для преодоления защитных
механизмов хозяина. Активность соответству-
ющих генов, в число которых во многих
случаях входят гены для особых функций, на-
пример роения (специального механизма по-
движности для совместного передвижения по
плотной поверхности и агрегации клеток),
регулируется аутоиндукторами, обнаружен-
ными у большинства грамотрицательных бак-
терий.
3. Конъюгация у Agrobacterium tumefaciens
(см. разд. 34.2) Возможно, к подобным фе-
номенам относится также превращение нор-
мальных клеток Rhizobium spp. в бактероиды
(см. разд. 34.3).
Еще один пример социального поведения, ос-
нованный, однако, на ином биохимическом меха-
низме, обнаружен у Enterococcus faecalis. В попу-
ляциях данного организма имеются донорные и
репипиентпые клетки, между которыми происхо-
дит обмен диффундирующими сигналами спари-
вания, феромонами; эти сигналы стимулируют
необходимое для конъюгации образование агре-
гата из двух клеток. Аналогичным образом спо-
рулирующие клетки миксококков должны выде-
лять сигнальные молекулы (возможно, сАМР) в
596 Часть V. Экспрессия генов и механизмы регуляции
процессе агрегации клеток и образования плодо-
вых тел (см. разд. 20.5.8). При изучении этих
организмов получены мутанты, клетки которых
агрегируют только при смешивании с мутантны-
ми клетками другого типа, которые сами по се-
бе пс способны к агрегации. Мутанты первого ти-
па выделяют сигнальные молекулы, но не способ-
ны их распознавать, тогда как мутанты второго
типа распознают эти молекулы, по не способны
их синтезировать. При смешивании мутанты двух
подобных типов дополняют друг друга и образу-
ют плодовые тела. В связи с этим следует отмс-
тить, что для Е. coli описан феномен выделения
большого количества сАМР; возможно, это слу-
жит сигналом другим клеткам популяции о на-
личии питательных веществ. Наконец, имеются
сведения о центральной роли производных бути-
ролактона (например, фактора А) в спорообразо-
вании у актиномицетов (см разд. 25.2 и 27.7). Воз-
можно, эти данные указывают на существование
сигнальных систем нового типа, например необхо-
димых для развития и поддержания стабильности
сложных микробных экосистем.
Дополнение 20.1. Регуляторные системы,
контролирующие экспрессию генов у прока-
риот, могут быть описаны как на молекуляр-
ном, так и па феноменологическом уровне.
Известные термины регул он и модулон,
введенные рапеее, означают группы оперо-
нов, контролируемых одной регуляторной си-
стемой (регулон) или двумя различными си-
стемами, одна из которых превосходит по
уровню другую (модулон). Термин стиму-
лов, в отличие от этого, относится ко всем
оперопам, совместно реагирующим на дан-
ных"! внешний стимул. Этот термин пока не
наполнен конкретным содержанием, по тем
не менее полезен для первичного описания
феномена клеточного ответа, который ча-
сто наблюдается в виде координированной
экспрессии генов; каких-либо данных, ука-
зывающих на участвующие в нем механиз-
мы, в настоящее время не имеется. Воз-
можно, для некоторых координированно экс-
прессируемых оперопов не существует обще-
го регуляторного белка или контролирующе-
го элемента, и в таких случаях стимулоп
эквивалентен модулону. Аналогичным обра-
зом, термины общая регуляция и ре-
гуляция на уровне мультигенных се-
мейств не отражают непосредственно уча-
стие неких общих регуляторных элементов,
по лишь означают существование групп опе-
ропов, участвующих в общей метаболиче-
ской задаче. Наконец, термином аутоин-
дукция обозначают систему регуляции, чув-
ствительную к внешним стимулам и обес-
печивающую коммуникацию клеток на по-
пуляционном уровне, в том числе реак-
цию на плотность собственной популяции
(«кворум-сенсинг»). Аутоипдукцией часто
объясняются особые свойства, проявляемые
популяциями с высокой плотностью клеток
в отличие от популяций с низкой плотно-
стью, — биолюминесценция, роение, спорооб-
разование и другие типы кооперативного по-
ведения, а также наблюдаемые в ферменте-
рах эффекты слипания и флокуляции клеток.
20.2. Углеродная катаболитная репрессия
тесно связана с другими феноменами
В предыдущем разделе рассмотрены понятия,
важные для анализа систем общей регуляции.
Данный раздел посвящен описанию феномена уг-
леродной катаболитной репрессии, наблю-
даемой у разнообразных микроорганизмов. По
механизму катаболитной репрессии регулируют-
ся различные процессы, включая синтез пе-
реносчиков и ферментов катаболизма углево-
дов (см. ниже), синтез компонентов жгутиков и
фимбрий, ферментов синтеза гликогена, белков,
участвующих в спорообразовании, и внеклеточ-
ных ферментов, необходимых для разложения по-
Глава 20. Общие регуляторные сети и пути передачи сигналов 597
Рис. 20.8. Эффект диауксии при росте Е. coli в среде
с глюкозой (0,04%) и лактозой (0,2%). Кинетика роста
(О) и синтеза /^-галактозидазы (•). По [3].
Рис. 20.9. Влияние экзогенного сАМР на постоянную и
кратковременную катаболическую репрессию у Е. coli.
Клетки Е. coli К-12 выращивали в богатой жидкой сре-
де Лурия, содержащей 0.5 мМ изопропил-/3-тиогалакто-
зида в качестве индуктора /ас-оперона. В момент, ука-
занный стрелкой, добавлены следующие компоненты:
глюкоза (0,8%) —•; глюкоза (0,8%) и 5 мМ сАМР —
А; контроль без добавок— О. Одна единица активности
(3-галактозидазы соответствует образованию 1 нмоль
о-нитрофенола/мин при 28 °C на мл. По [3].
лимерных субстратов. Вначале следует рассмот-
реть эффекты репрессии синтеза ферментов,
участвующих в центральном углеродном метабо-
лизме.
При высокой концентрации (>1 мМ) в среде
двух источников углерода бактерии, как прави-
ло, вначале преимущественно используют один
из них и рост происходит в две фазы, разделен-
ные лаг-периодом (рис. 20.8). Эта задержка ро-
ста, в течение которой клетки адаптируются к ис-
пользованию второго источника углерода, может
занимать период продолжительностью до одного
цикла размножения. Феномен такого двухфазного
роста, получивший название диауксия, был де-
тально изучен Ж. Моно. К настоящему времени
он исследован в основном у энтеробактерий, глав-
ным образом Е. coli, по сходные свойства наблю-
даются у многих бактерий в отношении разнооб-
разных субстратов. Поскольку в большинстве ис-
следований в качестве ингибирующего источника
углерода используют глюкозу, часто применяет-
ся неточный термин глюкозный эффект (глю-
козная репрессия) вместо термина углеродная ка-
таболитная репрессия. Однако следует подчерк-
нуть, что, во-первых, многие другие источники
углерода могут влиять таким же образом, как
глюкоза и, во-вторых, у организмов, отличных от
энтеробактерий, иногда обнаруживается противо-
положный эффект, т. е. другие соединения подав-
ляют использование глюкозы. Недавние исследо-
вания, в частности проведенные на энтеробакте-
риях, показали, что углеродная катаболитная ре-
прессия часто наблюдается в случае дисбаланса
между катаболизмом и анаболизмом, а именно,
когда скорость катаболизма превышает скорость
анаболизма.
20.2.1. Углеродная катаболитная репрессия
у энтеробактерий — сложный феномен,
включающий несколько механизмов
Общее понятие углеродная катаболитная репрес-
сия относится но меньшей мере к трем эффектам:
постоянной репрессии, кратковременной репрес-
сии и исключению индуктора. Постоянная
репрессия обычно выражена в два-три раза сла-
бее кратковременной и длится все время, пока
присутствует подавляющий субстрат. Кратко-
временная репрессия, имеющая характер силь-
новыраженной (вызывает более чем 90% инги-
бирование), длится лишь 0,1-1 период времени
удвоения (рис. 20.9). Постоянную репрессию
вызывают вещества, которые клетки способны
метаболизировать, тогда как кратковременная
репрессия может возникать п в присутствии неме-
598 Часть V. Экспрессия генов и механизмы регуляции
таболизируемых аналогов субстратов. Молеку-
лярные механизмы этих типов регуляции различ-
ны, но оба они связаны с внутриклеточной кон-
центрацией второго посредника, сАМР, и регуля-
цией синтеза ферментов. Напротив, исключение
индуктора — это процесс, в котором подавляет-
ся активность, но не синтез ферментов (напри-
мер, предотвращается поступление индуктора в
клетки). Типичным примером его может служить
исключение под действием глюкозы активности
лактозы как индуктора /сс-опсропа у Е. coli. Каж-
дый из этих феноменов рассмотрен ниже более по-
дробно с описанием того, каким образом контроль
синтеза сАМР и поступления индуктора регули-
рует клеточный метаболизм.
20.2.2. Модулон сгр участвует в углеродной
катаболитной репрессии
у энтеробактерий
Многие, хотя и не все бактерии синтезируют
сАМР (см. рис. 20.14). Концентрация этого со-
единения, обнаруженного еще в ранних иссле-
дованиях у Е. coli, регулируется в клетках пу-
тем его синтеза, разложения и секреции. Синтез
сАМР из АТР катализирует аденилатциклаза, ко-
торую у Е. coli кодирует ген суаА. Внутрикле-
точная концентрация сАМР составляет примерно
1-10 мкМ. Гидролиз его осуществляет фосфоди-
эстераза (кодируемая геном cdp). Другой путь
снижения концентрации сАМР — это выделение
его в среду. Последний процесс пока мало изу-
чен, однако известно, что при некоторых услови-
ях роста в среде присутствует большое количество
сАМР. У энтеробактерий сАМР выполняет важ-
ную роль при росте на средах с различными ис-
точниками углерода, и его можно рассматривать
как алармон, сигнализирующий об условиях уг-
леродного голодания.
Алармоны — эго молекулы, сигнализирующие
о стрессовых условиях. Во многих случаях они
представляют собой производные нуклеотидов,
как, например, сАМР, регулирующий модулон сгр
(синтез ферментов катаболизма), или гуанозин-
тетрафосфат (ppGpp), опосредующий контроль
синтеза ферментов анаболизма. Участие алармо-
нов, по-видимому, характерно для общих регуля-
торных систем, контролирующих активность цен-
тральных ферментов метаболизма и воспринима-
ющих изменения в условиях роста (через измене-
ние потоков метаболитов) при участии внутрикле-
точных сенсоров.
Это удалось установить благодаря выделению
ст/аА-мутаптов, дефектных по аденилатциклазе.
Данная мутация не детальна, т. е. не препят-
ствует росту на сложных средах, однако рост па
минимальной среде, содержащей лишь один из
многих субстратов (например, лактозу, мальто-
зу, глицерол, мапнитол или промежуточные про-
дукты цикла лимонной кислоты) при ней стано-
вится невозможным. Добавление в среду в вы-
сокой концентрации (> 1 мМ) сАМГ восстанав-
ливает высокий метаболический потенциал этих
мутантов. Соответствующие опероны (например,
lac, mtl) или регулопы (mal, glp) относятся к моду-
лопу стр (см. рис. 20.2). Транскрипция этих опе-
ропов и рсгулонов требует присутствия сАМР и
рецепторного для сАМР белка Сгр, поскольку в
обычном состоянии их промоторы «закрыты» и пс
способны связывать РНК-полимеразу. Для эф-
фективного связывания РНК-полимеразы необ-
ходимо одновременное связывание комплекса
сАМР-Сгр с консенсусной последовательностью
выше мотива в районе позиции —35 (см. гл. 18).
Лишенные белка Сгр мутанты обнаруживают фе-
нотип с множественными нарушениями метабо-
лизма углеводов, характерный для суаА-мутан-
тов, не способных синтезировать сАМР. В отличие
от этих последних, рост сгр-мутантов не стимули-
руется добавлением сАМР.
На связь сАМР с феноменом углеродной ката-
болитной репрессии указал тот факт, что и посто-
янная, и кратковременная репрессия устраняют-
ся при добавлении сАМР (рис. 20.9). Кроме того,
была обнаружена корреляция между синтезом,
например, Дгалактозидазы и внутриклеточной
концентрацией сАМР (рис. 20.10). Низкая концен-
трация сАМР при использовании «сильных ката-
болитных репрессоров», таких как глюкоза, глю-
конат или глюкозо-6-фосфат, коррелирует с низ-
ким уровнем синтеза Д галактозидазы, тогда как
высокая концентрация сАМР при использовании
«слабых катаболитных репрессоров», например
глицерола или лактата, — с трех-пятикратным по-
вышением активности /3-галактозидазы. Это со-
ответствует результатам ранних экспериментов, в
которых был обнаружен низкий уровень синте-
за Дгалактозидазы при росте бактерий на средах
с источниками углерода, обеспечивающими быст-
Глава 20. Общие регуляторные сети и пути передачи сигналов 599
Рис. 20.10. Корреляция между ско-
ростью роста, синтезом /З-галактози-
дазы и внутриклеточной концентра-
цией сАМР у Е. coli К-12.
А. Взаимосвязь между скоростью
синтеза галактозидазы и внут-
риклеточной концентрацией сАМР.
По [4].
Б. Взаимосвязь между скоростью
роста и синтезом /3-галактозидазы.
Рост происходил с использовани-
ем указанных субстратов (20 мМ).
По [5].
рый рост (например, глюкозой или глюконатом),
и высокий уровень этого фермента при росте па
средах с источниками углерода, обеспечивающи-
ми лишь слабый рост (например, сукцинатом пли
лактатом; рис. 20.10). Другими словами, об усло-
виях голодания сигнализирует высокий уровень
алармоиа сАМР, тогда как об избытке питатель-
ных веществ — низкий уровень сАМР.
20.2.3. ФЕП-зависимая фосфотрансферазная
система выполняет центральную роль
в катаболитной репрессии
и исключении индуктора
Для объяснения механизма углеродной катабо-
литной репрессии необходимо установить пу-
ти регуляции внутриклеточной концентрации
сАМР и связывающего его белка Сгр, а так-
же механизмы контроля поступления индукто-
ра в клетки. У энтеробактерий основную роль
в углеродной катаболитной репрессии играет си-
стема транспорта углеводов — фосфоенолпируват
(ФЕП)-зависимая фосфотрансферазная система
(ФТС). Как указано в разд. 5.6.4, ФТС служит ос-
новной транспортной системой у разнообразных
бактерий. Эта важнейшая система, впервые опи-
санная Роузменом (Roseman) с соавторами, обес-
печивает накопление субстратов в виде соответ-
ствующих фосфорных эфиров при избытке ФЕП.
Такие системы обнаружены у грамотрицательных
и грамположительных облигатно и факультатив-
но анаэробных бактерий и у некоторых облигат-
ных аэробов. Принцип их действия, сходный у
большинства бактерий, схематически показан па
рис. 5.16. В общем случае ФТС транспортируют и
фосфорилируют различные углеводы путем пере-
носа па молекулы углеводов фосфорильной груп-
пы от ФЕП через этапы с участием белков фер-
мент I (Enzyme I; EI) и НРг, а также сахароспеци-
фичных комплексов фермента II (Enzyme II; ЕП).
Фосфотрансферазная система, адени-
латциклаза и сАМР □ Согласно модели, при-
веденной па рис. 20.11, мутанты с повреждени-
ем основных белков ФТС, белка EI (кодируемо-
го геном ptsl) и белка НРг (кодируемого гоном
ptsH), должны утрачивать способность к росту в
присутствии любого углеводного субстрата ФТС,
тогда как мутанты, лишенные белка ЕП, напри-
мер специфичного для маннитола белка HMtl, нс
способны метаболизировать маннитол и расти в
его прису гствии, но сохраняют способность к нор-
мальному росту в присутствии других субстратов
ФТС. Эти предсказания подтверждаются феноти-
пами соответствующих мутантов. Однако мутан-
ты Е. coli и S. typhimurium с повреждением ptsH
и ptsl обнаруживают интересные дополнительные
фенотипы: они пс способны расти в присутствии
ряда веществ, не являющихся субстратами ФТС,
т. е. данные мутации вызывают множественные
нарушения.
Такой плейотроппый фенотип pis Я,/-мутантов
сходен с фенотипом рассмотренных выше мутан-
тов суаА и сгр в том отношении, что мутанты
всех этих трех типов не способны расти в присут-
ствии, например, лактозы, мелибиозы, мальтозы,
глицерола или промежуточных продуктов цикла
лимонной кислоты. Это сходство подчеркивают
следующие данные: 1) рост ptsH, /-мутантов с ис-
пользованием соединений, не являющихся суб-
600 Часть V. Экспрессия генов и механизмы регуляции
стратами ФТС (но не субстратов ФТС), вос-
станавливается при добавлении в среду сАМР;
2) синтез сАМР в интактных клетках и актив-
ность аденилатциклазы в клетках, обработанных
толуолом, подавляются в присутствии субстра-
тов ФТС, таких как глюкоза или ее немета-
болизируемый аналог cv-метилглюкозид; 3) ак-
тивность аденилатциклазы существенно ниже у
мутантов, лишенных белка EI и/или НРг, чем в
клетках с интактной ФТС и 4) супрессорные му-
тации, восстанавливающие рост ptsH,7-мутантов
в присутствии указанных вып е источников уг-
лерода, не являющихся субстратами ФТС, вклю-
чают также мутации белка Сгр. Эти сгр* [или
стр (In), от Independent] мутации приводят к то-
му, что функция белка Сгр становится независи-
мой от сАМР. На характер мутаций этого класса
указывают данные о влиянии добавленного сАМР
па фенотип ptsH, 7-мутантов: данный мутантный
белок Сгр связывается с промоторами и активи-
рует их в отсутствие сАМР. Из этих эксперимен-
тов был сделан вывод, что дефосфорилировапие
одного или нескольких белков ФТС при добав-
лении к клеткам субстратов ФТС (или в резуль-
тате мутации) подавляет аденилатциклазную ак-
тивность. Альтернативное объяснение состоит в
том, что один или несколько фосфорилированных
белков ФТС могут участвовать в активации аде-
нилатциклазы.
Фосфотрансферазная система и исклю-
чение индуктора □ У энтеробактерий получе-
ны также супрессорные мутации гена err (от
carbohydrate repression resistance). Они восстанав-
ливают рост ptsH, 7-мутантов в присутствии ис-
точников углерода, пс являющихся субстратами
ФТС — лактозы, мальтозы, мелибиозы и глице-
рола. Ген err кодирует специфичный в отноше-
нии глюкозы белок ФТС IIAGlc (рис. 20.11). Из-
вестный из других экспериментов регуляторный
эффект — подавление в течение нескольких се-
кунд после внесения какого-либо субстрата ФТС
(или его пеметаболизируемого аналога) поглоще-
ния других источников углерода, не относящих-
ся к субстратам ФТС, — у err-мутантов отсут-
ствует, из чего следует, что данный эффект не
связан с уровнем синтеза ферментов, но обу-
словлен активностью системы поглощения и уча-
стием белка TIAGlc. Подобные эффекты имеют
название исключение индуктора, или, что бо-
лее правильно, исключение индуктора, опо-
Рис. 20.11. Модель углеродной катаболит-
ной регуляции, опосредуемой фосфотранс-
феразной системой (ФТС), у энтеробакте-
рий. Указаны общие ферменты ФТС: фер-
мент I (EI), НРг и два фермента II [ПА—С
и IICBGIc/IIAGIc (прежнее название — lllGlc)j.
Символом ~Р обозначено фосфорилирование
ферментов ФТС. Знаком @ обозначена акти-
вация аденилатциклазы под действием фосфо-
рилированного I IAGIc (Р ~ IIAGIc), знаком 0 —
подавление двух отличных от ФТС систем по-
глощения, Si и S2 (участвующих в транспорте
и метаболизме лактозы, мелибиозы, мальтозы
или глицерола). По [6].
Глава 20. Общие регуляторные сети и пути передачи сигналов 601
средованное ФТС. Как показывают генетиче-
ские эксперименты, белок IIAGlc взаимодейству-
ет скорее всего со специфическими компонентами
различных систем поглощения, поскольку мута-
ции, устраняющие эффект исключения индукто-
ра, получены в генах lacY (пермеазы лактозы),
melB (пермеазы мелибиозы), malK (компонен-
та пермеазы мальтозы) и glpK (глицеролкина-
зы). В биохимических экспериментах установле-
но, что очищенный нефосфорилированный белок
IIAG1C связывается с белками, кодируемыми эти-
ми генами, и подавляет их активность, тогда
как фосфорилированный ПАС1с лишен способно-
сти к связыванию. Недавно удалось установить
трехмерную структуру одного из этих комплек-
сов— глицеролкипаза—IIAG,C; предположительно
фосфорилирование белка IIAG,C по остатку
His-90 предотвращает в результате электростати-
ческого отталкивания и стерических препятствий
его связывание с глицеролкиназой. В представ-
ленной па рис. 20.11 экспериментально подтвер-
жденной модели регуляции различных процессов
у энтеробактерий, опосредуемой ФТС, отражена
центральная роль специфичного к глюкозе белка
IIAG,C.
В условиях, когда катаболические процессы
преобладают над анаболическими, например при
быстром росте в присутствии глюкозы («глюкоз-
ный эффект»), у энтеробактерий наблюдается уг-
леродная катаболитная репрессия. Сигнал о
таких условиях воспринимает ФТС и передает его
далее через P~IIAG,C на фермент аденилатцикла-
зу и зависимый от сАМР модулон сгр, кодирую-
щий общий регулятор Сгр, что приводит к вре-
менной и постоянной катаболитной репрес-
сии. Параллельно эта система регулирует через
IIAGlc активность систем транспорта углеводов и
ферментов их метаболизма и тем самым погло-
щение и синтез индукторов («исключение ин-
дуктора»). В этой сложной системе контроля
принимают также участие независимые от ФТС
элементы, механизм действия которых неизве-
стен. У других бактерий углеродный катаболит-
ный контроль может быть обусловлен другими
источниками углерода (например, у псевдомо-
над — карбоновыми кислотами).
Количественные аспекты опосредуемой
ФТС регуляции □ Как показано на рис. 20.11,
белок IIAGlc выполняет две важные роли: 1) в
нефосфорилированной форме подавляет актив-
ность транспортных систем различных веществ,
не относящихся к субстратам ФТС, и 2) в фосфо-
рилированной форме служит активатором адени-
латциклазы. Прямое взаимодействие данных бел-
ков не доказано, поэтому пока нельзя исключать
участие в процессе активации этого фермента до-
полнительных белков.
При росте клеток с использованием источни-
ков углерода, не относящихся к субстратам ФТС,
белки данной системы теоретически должны на-
ходиться в полностью фосфорилированной фор-
ме, поскольку свободная энергия гидролиза ФЕП
с переносом фосфогруппы составляет значитель-
ную величину. Если в клетках присутствуют как
субстраты ФТС, так и не относящиеся к ним
источники углерода, поглощение первых приво-
дит к дефосфорилированию белков ФТС и по-
следующему их фосфорилированию с участием
ФЕП. В зависимости от скорости (де)фосфорили-
рования равновесный уровень фосфорилирован-
ной формы IIAGlc может снижаться, как это про-
исходит при некоторых условиях. Увеличение ко-
личества нефосфорилированного IIAGlc приводит
к двум последствиям. Во-первых, снижается аде-
нилатциклазная активность, поскольку уменьша-
ется концентрация активатора, P-IIAGlc; вслед-
ствие этого замедляется транскрипция оперонов
и регулонов, зависимых от сАМР, и снижается
уровень соответствующих транспортных систем и
метаболических ферментов. Во-вторых, сохранив-
шиеся системы поглощения подвергаются ингиби-
рованию посредством IIAGlc. Это нарушает по-
ступление индуктора в клетки, что дополнитель-
но ограничивает транскрипцию.
При рассмотрении взаимодействия белков,
подобных IIAGlc или Сгр, соответственно с бел-
ками-мишенями или специфическими нуклеотид-
ными последовательностями могут иметь значе-
ние стехиометрические соотношения. Если белок-
мишень для IIAg,c , например переносчик лактозы
или глицеролкиназа, синтезируются в очень боль-
шом количестве либо число молекул IIAGlc ниже
нормального уровня (приблизительно 20 000 ко-
пий на клетку), эффект исключения индуктора
может быть выражен слабо или вообще отсутство-
вать в связи с тем, что часть молекул белка-мише-
ни остается в свободном состоянии. В отсутствие
субстратов для белков-мишеней неэффективное
связывание последних с IIAGlc предотвращается.
Так, для связывания его с переносчиком лактозы
602 Часть V. Экспрессия генов и механизмы регуляции
или глицеролкиназой необходимо присуствие суб-
стратов этих белков (/3-галактозидов либо глице-
рола соответственно). Это показывает, что усло-
вием связывания являются конформационные из-
менения связываемого белка.
Сходные стехиометрические эффекты воз-
можны и в случае белка Сгр. Как установле-
но, в определенных условиях, например при ро-
сте в присутствии глюкозы, добавление к клеткам
сАМР пс устраняет постоянную репрессию. При-
чиной может быть низкое число молекул Сгр, по-
скольку в клетках с его повышенным уровнем
(достигаемым при использовании плазмид, поз-
воляющих контролировать синтез Сгр) добав-
ление сАМР полностью устраняет постоянную
репрессию. Остается неясным, каким образом
репрессор — источник углерода — может снижать
концентрацию белка Сгр. В разд. 20.2.1 уже
упоминалось о том, что обеспечивающие быст-
рый рост источники углерода, не относящиеся к
субстратам ФТС (такие, как глюконат и глю-
козе-0-фосфат), также могут вызывать сильную
катаболитную репрессию, возможно в результате
изменения синтеза Сгр, как и в случае эффекта
глюкозы.
Анализ механизмов регуляции, опосредуемой
ФТС, показывает, что она основана на передаче
сигнала: изменение условий среды вызывает кова-
лентную модификацию внутриклеточного регуля-
торного белка IIAGlc и тем самым его активацию.
Поскольку все реакции с участием белков ФТС
обратимы, любой углеводный субстрат ФТС мо-
жет действовать как сигнал: P-IIAG,C способен де-
фосфорилироваться непосредственно в резуль-
тате связывания с IICBG,C (переносчик глюко-
зы) или непрямым путем при взаимодействии
с НРг, который дефосфорилирустся любым дру-
гим белком ЕП (для всех углеводов — субстратов
ФТС, кроме глюкозы).
20.2.4. Углеродную катаболитную репрессию
у других бактерий также опосредует ФТС
У большинства некишечных бактерий углерод-
ную катаболитную репрессию вызывают, вероят-
но, другие механизмы. Во-первых, у многих из
них, например В. subtilis, не обнаружен внутри-
клеточный сАМР. Во-вторых, для них пс полу-
чено доказательств, что белок IIAGlc, даже если
он присутствует, выполняет ту же роль, что у эн-
теробактерий. Среди организмов, не относящихся
к энтеробактериям, механизм углеродной катабо-
литной репрессии изучен пока у немногих.
У нескольких грамположительных организмов
получены мутанты с экспрессией генов, обыч-
но репрессированных рядом источников углерода.
Установлено наличие реагирующих на катаболи-
ты цис-активных нуклеотидных последовательно-
стей — промоторов (catabolite responsive elements,
ere), опосредующих такую репрессию; предпо-
лагается участие консенсусной последовательно-
сти. Иногда последовательность сге частично пе-
рекрывается с промоторами чувствительных к
репрессии генов, однако в других случаях эти
последовательности составляют часть структур-
ного гена. У Bacillus такие цис-активные по-
следовательности обнаружены, например, в гене
атуЕ, кодирующем «-амилазу, а также в оперо-
нах, участвующих в метаболизме глюконата (gnt),
ксилозы (xyl), глюкана (bgl) и гистидина (hut).
Мутации, устраняющие опосредуемую сге ката-
болитную репрессию, локализуются в гене сер А,
кодирующем белок СсрА (от catabolite control
protein). Этот белок относится к Lacl-семейст-
ву регуляторов транскрипции и способен связы-
ваться с нуклеотидной последовательностью сге.
У В. subtilis и других грамположительных бак-
терий обнаружена связь между опосредуемой ге-
ном сге катаболитной репрессией, белком СсрА и
ФТС. В разд. 5.6.4 описан механизм фосфорили-
рования гистидинового остатка в белке НРг с уча-
стием белка Р~Е1. У грамположительных бакте-
рий белок НРг может фосфорилироваться также
по остатку серина с участием протеинкиназы и
АТР в качестве донора фосфогруппы; удаляет-
ся эта группа фосфопротеип-фосфатазой. Про-
теинкиназу активируют фруктозо-1,6-дифосфат
и другие промежуточные продукты гликолиза.
В клетках с высокой гликолитической активно-
стью обнаружен белок P-(Ser)-HPr, который пред-
положительно взаимодействует с белком СсрА и
способствует его связыванию с нуклеотидной по-
следовательностью сге, что вызывает репрессию
(рис. 20.12). Отсутствие легкометаболизируемого
источника углерода благоприятствует образова-
нию нефосфорилированной формы НРг и приво-
дит к устранению катаболитной репрессии.
Глава 20. Общие регуляторные сети и пути передачи сигналов 603
Рис. 20.12. Модель углеродной
катаболитной репрессии, опосредуе-
мой фосфотрансферазной системой
(ФТС) у грамположительных бакте-
рий. На схеме ФТС представлена,
как и на рис. 20.11, с одним крупным
ферментом II. Поглощение субстра-
тов вызывает дефосфорилирование
различных белков ФТС, в частности
НРг, и приводит к образованию
промежуточных продуктов глико-
лиза. Эти продукты активируют
(©) ATP-зависимую протеин кин азу,
фосфорилирующую остаток Ser-46 в
свободном белке НРг (у В. subtilis).
По-видимому, под действием HPr-Ser-
4б-Р активируется общий репрессор
СсрА, регулирующий все промоторы,
содержащие связывающий сайт сге.
Эти промоторы и контролируемые ими
гены составляют модулон ссрА. Цикл
завершает фосфопротеин-фосфатаза.
Как и у энтеробактерий, у грамположитель-
ных бактерий степень фосфорилирования бел-
ков ФТС, в данном случае НРг, играет важную
роль в контроле экспрессии генов модулона че-
рез влияние на активность белка СсрА, взаимо-
действующего с определенными элементами ДНК
(промоторами сге). В обоих случаях ФТС как си-
стема передачи сигнала воспринимает состояние
периферического катаболизма и передает сигнал
па общий регулятор.
20.3. Модулон RelA/SpoT контролирует
пути анаболизма и биосинтез макромолекул
В зависимости от условий роста время удвоения
клеток бактерий в культуре может варьировать
от 20 мин до 1 нед. Каждой скорости роста соот-
ветствует характерная для данных условий ско-
рость биосинтеза макромолекул и размеры кле-
ток, т. е. определенное физиологическое состоя-
ние. Как правило, быстрорастущие клетки содер-
жат больше ДНК, РНК, белков, фосфолипидов и
материала клеточной стенки и имеют более круп-
ные размеры по сравнению с медленнорастущими
клетками. В зависимости от условий может из-
меняться также и относительное содержание кле-
точных компонентов. Быстрорастущие культуры
характеризуются большим содержанием в клет-
ках рибосом; количество их возрастает с 2000 на
клетку при росте в бедной среде (время генерации
180 мин) до 20 000 на клетку в богатой среде
(время генерации 20 мин). При нормальных усло-
виях роста рибосомы катализируют синтез белка
со скоростью, близкой к максимальной (примерно
16 этапов полимеризации в секунду), и скорость
синтеза может возрастать только за счет увеличе-
ния количества рибосом. Изменения в макромоле-
кулярном составе, вызываемые внезапным изме-
нением внешних условий, могут быть существен-
ными, поскольку белки и рибосомы составляют до
половины массы бактериальной клетки. Измене-
ние времени удвоения указывает на существова-
ние гипотетических модулонов и регуляторных се-
тей, контролирующих синтез анаболических фер-
604 Часть V. Экспрессия генов и механизмы регуляции
ментов. Одну из таких систем у энтеробактерий
представляет собой модулон RelA/SpoT, выпол-
няющий ту же роль, что эквивалент модулона стр
в случае катаболических систем. Ниже модулон
RelA рассмотрен подробно.
20.3.1. Изменения времени удвоения
вызывают строгий ответ
Добавление питательных веществ к культуре
Е. coli, растущей с постоянной скоростью, вы-
зывает после небольшого лаг-периода увеличение
скорости роста (эффект стимуляции), измеряе-
мого, например, по возрастанию оптической плот-
ности (рис. 20.13) и скорости синтеза ДНК. Ско-
рость синтеза РНК возрастает непосредственно
после добавки питательных веществ, причем на
короткое время может даже превышать средний
уровень. Вместе с тем скорость деления сохраня-
ется на прежнем уровне, и клетки увеличиваются
в длину. В результате образуются крупные клет-
ки, содержащие больше рибосом и больше ДНК.
После того как произойдет изменение макромоле-
кулярного состава в соответствии с новым физио-
логическим состоянием клеток, возрастает ско-
рость деления.
В то же время в случае клеток, перенесенных
в фазе экспоненциального роста из богатой среды
в минимальную, или после быстрого удаления из
среды одной или нескольких аминокислот, а так-
же после исчерпания источника углерода увели-
чение клеточной массы почти полностью прекра-
щается (эффект подавления), тогда как синтез
ДНК и рост числа клеток некоторое время сохра-
няют прежнюю скорость (рис. 20.13). Напротив,
синтез РНК тормозится немедленно и на длитель-
ный период времени, до тех пор пока макромоле-
кулярный состав не изменится в соответствии с
новой скоростью роста. Клетки в этот переходный
период имеют меньшую длину и меньший удель-
ный вес, и затем время удвоения возрастает.
Детальное исследование показало, что при эф-
фекте подавления временно снижается не толь-
ко синтез белков и РНК, по также инициа-
ция новых циклов репликации ДНК и биосинтез
углеводов, фосфолипидов и компонентов клеточ-
ной стенки, как и поглощение низкомолекулярных
предшественников этих макромолекул. Напротив,
другие процессы, в частности биосинтез амино-
кислот и контроль точности трансляции, стиму-
лируются (табл. 20.2). Это сочетание ответных ре-
акций, обеспечивающее тесное сопряжение между
скоростью роста, синтезом белка на рибосомах и
размерами клеток, называют строгим контро-
лем или строгим ответом. Получены мутанты,
у которых строгий контроль синтеза РНК ослаб-
лен (relaxed); отсюда происходит обозначение rel
соответствующих генов (рис. 20.13). У мутантов
RelA- изменения затрагивают большинство про-
цессов, перечисленных в табл. 20.2. Такой плей-
отроппый эффект единственной мутации в гене
relA указывает на существование общей регуля-
торной системы. Эффективным способом контро-
ля всех элементов модулона при стрессовых усло-
виях является образование специфического соеди-
нения— алармона, внутриклеточное содержание
которого возрастает во время стресса. Строгий
контроль, сходный с катаболитной репрессией,
влияет па основные метаболические реакции при
участии производного гуанозина, ppGpp, в каче-
стве алармона (рис. 20.14).
Эффект стимуляции
100 -
0 ---------I I ।
О 30 60 90
Время, мин
Рис. 20.13. Реакция Е. coli на смену условий
(богатая среда/бедная среда). Показаны изме-
нения в скоростях синтеза РНК (----), ДНК
(...), оптической плотности как показателя
клеточной массы (---) и количества клеток
(-----), сопровождающие изменение скорости
роста (отмечено вертикальной линией). В ниж-
ней части рисунка показаны также изменения
уровня ppGpp (в мМ) для штамма Rel+ ( )
и мутанта Rel- (---).
Глава 20. Общие регуляторные сети и пути передачи сигналов 605
Таблица 20.2. Прямые и непрямые эффекты алармона ppGpp
Исчерпание аминоацилированных тРНК (подавление трансляции) или преобладание процессов анаболизма относительно процессов катаболизма вызывает возрастание внутриклеточного уровня ppGpp
Прямые эффекты (модулон) Ингибирование РНК-полимеразы синтеза рРНК и тРНК элонгации полипептидиой цепи Активация транскрипции опсропов, кодирующих ферменты биосинтеза оперонов, кодирующих ферменты катаболизма Вторичные эффекты (стимулон) Ингибирование синтеза рибосомных белков процессинга тРНК общего синтеза белка синтеза фосфолипидов синтеза нуклеотидов синтеза компонентов клеточной стенки репликации ДНК (инициации) деления клеток Возрастание точности трансляции синтеза белков-шеперонов синтеза белков стресс-реакции деградации белка активности катаболических процессов
20.3.2. Синтез алармона ppGpp инициируется
с участием «заторможенных» рибосом
и белка RelA
При аминокислотном голодании в клетках мно-
гих бактерий быстро накапливаются до милли-
молярных концентраций необычные нуклеотиды,
первоначально названные магическими пятна-
ми I и II. Позднее они были идентифици-
рованы как производные GTP — гуанозин-б'-ди-
фосфадЗ'-дифосфат (ppGpp, или гуанозинтет-
рафосфат) и гуанозин-б'-трифосфат.З'-дифосфат
(ppGpp, или гуанозинпентафосфат) соответствен-
но (рис. 20.14). Синтез ppGpp инициируется свя-
зыванием пспагруженных тРНК, появляющихся
при аминокислотном голодании, с акцепторным
(А) сайтом рибосом (рис. 20.15). Рибосомы с за-
торможенным процессом элонгации пептида акти-
вируют (р)ррСрр-синтетазу. Этот фермент пред-
ставляет собой продукт гена relA и, по-видимому,
связан с большой (50S) субъединицей рибосом че-
рез пептид L11 (ген rplK). Активированная синте-
таза I (или RelA) катализирует перепое пирофос-
форилыюй группы, происходящей из /3,7-фосфат-
ных групп в составе АТР, на З'-гидроксильную
группу GTP (реже GDP). На заторможенных ри-
босомах, вероятно, происходит циклический про-
цесс связывания ненагружепной тРНК, освобож-
дения тРНК и синтеза (p)ppGpp с использовани-
ем GTP, который в норме участвует в элонгации
пептида. Делеция гена relA не только превращает
О—СН2 I Аденин I
н\ /н
O-P-----О ОН
I
О"
Циклический аденозин-3',S'-монофосфат (сАМР)
О—СН2 I Гуанин I
кд
О-Р----О он
I
О“
Циклический гуанозин-3',5'-монофосфат (сСМР)
Гуанозин-З'-дифосфат, 5'-дифосфат
(гуанозинтетрафосфат, ррСрр)
Рис. 20.14. Редкие нуклеотидные производные (алармо-
ны), участвующие в общей регуляции клеточных про-
цессов. Гуанозинпентафосфат (pppGpp) представляет
собой гуанозин-З'-дифосфат, Б^трифосфат.
606 Часть V. Экспрессия генов и механизмы регуляции
Рис. 20.15. Метаболизм алармона ppGpp у энтеробакте-
рий. В отсутствие нагруженной тРНК процесс трансля-
ции останавливается в сайте А; с участием белка RelA
(синтетаза I для ppGpp) и белка L11 рибосома ини-
циирует синтез pppGpp. Его инициация возможна так-
же в условиях углеродного голодания; механизм этого
в данном случае неизвестен, но установлено участие в
нем белка SpoT (синтетаза II для ppGpp). Под действи-
ем 5-фосфогидролазы pppGpp превращается в алармон
ppGpp. В завершение цикла белок SpoT [(p)ppGpp-3'-nn-
рофосфогидролаза] гидролизует ppGpp с образованием
GDP, после чего нуклеозид-й'-дифосфат-киназа (Ndk)
превращает его в GTP.
строгий контроль клеток дикого типа в ослаблен-
ный контроль, но и резко (хотя нс до нуля) сни-
жает уровень ppGpp (рис. 20.13). Это означает,
что для данного эффектора существует независи-
мый от RelA путь биосинтеза, причем альтерна-
тивная синтетаза II функционирует при различ-
ных стрессовых условиях.
При строгом контроле происходит возрастание
внутриклеточного уровня ppGpp, тогда как при
ослабленном — его снижение. Таким образом, этот
редко встречающийся нуклеотид обладает всеми
свойствами алармона. Как показано на рис. 20.15,
контролируется не только синтез, но и деграда-
ция этого белка, т. е. в клетках поддерживает-
ся стационарный уровень ppGpp. Кроме синте-
тазы I (RelA), в этом участвуют рррСрр-5'-фос-
фогидролаза (Gpp, ген дрр), пуклеозиддифосфат-
киназа (Ndk; ген ndk) и белок SpoT (ген spoT).
Мутации в любом из этих генов также приводят
к фенотипу Rel”.
20.3.3. При углеродном голодании
активируется альтернативный,
независимый от RelA
путь биосинтеза ppGpp
В клетках строгих ге/А-мутантов сохраняется
остаточный пул ppGpp, и они проявляют по-
чти нормальный ответ на некоторые условия го-
лодания, например углеродного. Однако после
утраты второго гена, spoT (кодирующего «ма-
гическое пятно»), обе активности утрачиваются
полностью. Мутантный штамм с делецией обоих
генов (relA и spoT) сохраняет жизнеспособность,
но в значительной степени утрачивает способ-
ность к выживанию при длительном аминокис-
лотном или углеродном голодании. Геи spoT коди-
рует альтернативную синтетазу II для (p)ppGpp,
активация которой не зависит от подавления
трансляции на рибосомах, но обусловлена только
углеродным голоданием (рис. 20.15). Белок SpoT
участвует также в деградации ppGpp с образова-
нием GTP, в том числе по пути, зависимому от
прекращения трансляции. Такая двойная функ-
ция затрудняет правильное понимание его точной
роли.
В отсутствие нагруженных тРНК процесс
трансляции останавливается, и в результате при
участии белка RelA запускается синтез алармо-
на ppGpp. При длительном углеродном голодании
также начинается синтез ppGpp, по по альтерна-
тивному пути, с участием белка SpoT.
20.3.4. Некоторые из эффектов строгого
контроля обусловлены непосредственно
действием алармона ppGpp
Аминокислотное или углеродное голодание вы-
зывает целый ряд приспособительных реакций,
множественность которых затрудняет выявление
причин и следствий. Так, при резкой смене усло-
вий — переносе с богатой среды на минималь-
ную — недостаток нагруженных амипоацил-тРНК
почти сразу приводит к остановке трансляции
на большинстве рибосом и снижению скорости
синтеза белка. Временно прекращается инициа-
ция новых репликационных вилок и синтез но-
вых белков. Это приводит по механизму обрат-
ной связи к подавлению вначале синтеза ДНК и
белка и затем биосинтеза их низкомолекулярных
предшественников. В результате остановки роста
клеток должен прекращаться синтез клеточной
стенки и фосфолипидов для предотвращения на-
Глава 20. Общие регуляторные сети и пути передачи сигналов 607
прасного расхода энергии. В конечном счете при
строгом контроле имеет место отрицательная или
положительная регуляция синтеза примерно по-
ловины клеточных белков. Однако па строгий
контроль должно накладываться действие ряда
других систем общей регуляции, поэтому многие
из наблюдаемых эффектов, по-видимому, не явля-
ются прямыми. Например, значительное накопле-
ние пептидов с неполной последовательностью ак-
тивирует белки-шепсропы и другие белки стресса,
а также стимулирует деградацию белков. Оба эти
эффекта способствуют быстрому приспособлению
к условиям аминокислотного голодания.
Для изменения внутриклеточной концентра-
ции ppGpp независимо от аминокислотного или
углеродного голодания в экспериментах исполь-
зуют мутанты с делециями генов relA и spoT,
лишенные синтетазы (p)ppGpp I или II соответ-
ственно. Выделен ген relA с укороченной после-
довательностью, кодирующий пептид меньших
размеров, но без утраты ppGpp-синтетазпой ак-
тивности. Этот неполный ген клонирован с ис-
пользованием промотора tac, контролируемого
laclq. Индукция посредством IPTG приводит к
синтезу пептида RelA и резкому возрастанию
уровня ppGpp. Эта искусственная индукция син-
теза ppGpp подавляет через нескольких минут
рост, транскрипцию рибосомной РНК и синтез
белка на 90%. Этот результат, а также данные,
полученные ранее in vitro, доказывают, что по-
добные эффекты подавления вызваны непосред-
ственно повышением уровня ppGpp. Как пока-
зало изучение влияния уровня ppGpp на ско-
рость транскрипции с разных промоторов in vitro,
мишенями для строгого контроля служат про-
моторы генов тРНК и рРНК, точнее располо-
женная выше активаторная последовательность,
ppGpp-зависимый дискриминатор и ppGpp-зави-
симые сайты торможения. Сходные результаты
получены в опытах in vivo, в которых к дан-
ным промоторам был присоединен индикаторный
ген lacZ. Многие супрессорные мутации, обуслов-
ливающие фенотип с ослабленным контролем,
т. е. устраняющие строгий ответ, картированы
в гене гроВ — структурном гене /9-субъединицы
РНК-полимеразы. Вероятно, в присутствии
ppGpp РНК-полимераза не способна транскриби-
ровать промоторы модулона RelA. В соответствии
с этим, по-видимому, супрессорные мутации гроВ
должны приводить к независимости РНК-поли-
меразы от ppGpp.
Алармом ppGpp подавляет транскрипцию
генов стабильных форм РНК, однако транскрип-
цию других генов он, судя по всему, акти-
вирует. При недостатке одной или нескольких
аминокислот в среде прекращение синтеза макро-
молекул, включая общий синтез белка, и возрас-
тание деградации белков имеет физиологический
смысл лишь в том случае, если полученное в ре-
зультате небольшое количество аминокислот ис-
пользуется для преимущественного образования
ферментов синтеза недостающей аминокислоты.
По некоторым косвенным данным, ряд оперонов,
участвующих в биосинтезе аминокислот и нуклео-
тидов, а также разложении источников углерода,
в присутствии ppGpp транскрибируется с повы-
шенной скоростью. При строгом контроле тре-
буется общее возрастание биосинтеза всех пред-
шественников макромолекул и разложения всех
источников углерода. Те опероны, конечные
продукты которых не лимитированы или индук-
торы отсутствуют, должны оставаться в репрес-
сированном состоянии, тогда как ферменты син-
теза лимитирующих компонентов могут синтези-
роваться с повышенной скоростью. Согласно этой
модели, двойные мутанты relA-spoT становятся
ауксотрофными в отношении нескольких амино-
кислот и не способны расти в присутствии неко-
торых источников углерода, а именно лактозы
и сукцината. Таким образом, экспрессия соот-
ветствующих опсропов зависит, по-видимому, по
крайней мере частично, от присутствия алармона
ppGpp-
20.3.5. Многие эффекты при строгом ответе
не обусловлены непосредственно
действием ppGpp
При адаптации по механизму строгого ответа на-
блюдаются, как правило, два следующих феноме-
на: 1) подавление общего синтеза белка и 2) уве-
личение точности остаточной трансляции. Они
не обусловлены непосредственно ppGpp, по яв-
ляются следствием ингибирования синтеза ста-
бильных форм РНК. 1. Подавление синтеза ста-
бильных форм РНК вызывает накопление свобод-
ных рибосомных белков. Эти белки, как описано
в гл. 18, подавляют свой собственный синтез на
уровне трансляции путем связывания с кодиру-
ющими их мРНК. В результате трансляция по-
давляется без прямого влияния ppGpp. 2. В слу-
чае отсутствия какой-либо аминокислоты общий
608 Часть V. Экспрессия генов и механизмы регуляции
синтез белка прекращается, хотя остаточный мо-
жет продолжаться. Этот синтез зависит от амино-
кислот, высвобождающихся в результате усилен-
ной деградации белков, характерной для условий
строгого контроля. У мутантов relA, в отличие от
штаммов дикого типа rel+, такой остаточный син-
тез происходит весьма неточно. По одной из гипо-
тез, при остаточном белковом синтезе ppGpp за-
медляет элонгацию пептида. В результате должно
возрастать время для коррекции синтеза и точ-
ность трансляции.
Многие другие эффекты, указанные в
табл. 20.2, еще более опосредованно связаны со
строгим контролем. Подавление синтеза ДНК
может быть обусловлено снижением синтеза ини-
циаторных белков. Биосинтез фосфолипидов и
компонентов клеточной стенки также зависит от
синтеза и экспрессии белков. По-видимому, пи
один из этих процессов не зависит от подавле-
ния синтеза стабильных форм РНК в результате
действия ppGpp и активации транскрипции соот-
ветствующих оперонов.
При резком дисбалансе процессов анаболизма
и катаболизма у прокариот происходит метабо-
лическая адаптация по механизму строгого от-
вета— путем изменения специфичности РНК-по-
лимеразы под действием ppGpp, а также через
эффекты модулона relA/spoT. Кроме того, в ре-
гуляции участвует стимулон со множественными
функциями, косвенно регулируемый механизмом
строгого ответа.
20.3.6. Механизм строгого ответа включается
при дисбалансе между анаболизмом
и катаболизмом
Строгий ответ можно охарактеризовать как вре-
менно действующий сенсорный механизм, осу-
ществляющий общий контроль анаболизма и, в
частности, синтеза макромолекул. Он реагирует
на резкий дисбаланс между анаболизмом и ка-
таболизмом и быстро устанавливает новое сба-
лансированное состояние. Стимулом, восприни-
маемым сенсорами строгого контроля, служит
изменение количества ненагруженных тРНК.
Сигнал о данном изменении, вызывающем про-
стой рибосом, передается от них на белок RelA
(синтетаза I) и далее неизвестным способом на
синтетазу II, активируемую в условиях углеродно-
го голодания. Сигналом служит изменение внут-
риклеточного уровня алармона ppGpp, который в
качестве регулятора, по-видимому, модифициру-
ет РНК-полимеразу. Как немедленная ответная
реакция па возрастание уровня ppGpp снижает-
ся транскрипция оперонов стабильных форм РНК
и возрастает транскрипция специфических опе-
ронов, участвующих в снабжении клетки амино-
кислотами и источниками углерода. Ряд последо-
вательных событий (перечисленных в табл. 20.2)
способствует повышению выживаемости и устра-
нению повреждения клеток. В конечном счете
приспособление к новым условиям роста обеспе-
чивают ферменты (см. рис. 20.15), устанавливаю-
щие новый внутриклеточный уровень (p)ppGpp.
Описанный у Е. coli механизм строгого от-
вета обнаружен также у многих других бакте-
рий и у архей. Он служит, вероятно, основной
системой, ответственной за поддержание внутри-
клеточного уровня аминокислот для нормального
роста клеток. Таким образом, механизм строгого
ответа (контроля) анаболических оперонов с учас-
тием алармона ppGpp представляет собой эквива-
лент системы регуляции катаболических оперонов
с участием модулона сгр. Сенсорная Сгр-система
также реагирует на изменение в соотношении ка-
таболизма и анаболизма посредством своего алар-
мопа сАМР. Обе эти системы обеспечивают ре-
акцию на внешние изменения косвенным путем,
что отличает их от механизмов общей регуляции
с участием двухкомпонентных систем. Последние,
как будет описано ниже, обычно реагируют на
специфические внешние стимулы непосредствен-
ным образом.
20.4. Передача сигнала двухкомпонентными регуляторными системами
связана с функцией общих регуляторных сетей
Многие адаптивные реакции у бактерий, как
теперь известно, происходят с участием двух-
компонентных регуляторных систем. Все эти
системы, объединяемые в одно семейство па осно-
вании общих свойств, состоят из двух ассоцииро-
ванных белков: сенсора (S, sensor) и ответно-
го регулятора (RR, response regulator). Сенсор,
представляющий собой гистидиновую протеинки-
Глава 20. Общие регуляторные сети и пути передачи сигналов 609
Рис. 20.16. Последовательность доменов
(модулей) и фосфорилирующих активно-
стей в двухкомпонентных системах. Двух-
компонентная система состоит из белка-
сенсора и белка — ответного регулятора.
А Сенсор воспринимает стимул («вход-
ной импульс») посредством рецепторно-
го домена и преобразует его в сигнал,
означающий изменение передающего до-
мена (Т, серый прямоугольник). Послед-
ний представляет собой протеинкиназу,
которая аутофосфорилируется по остат-
ку гистидина (Н) и фосфорилирует домен,
принимающий сигнал (R, серый овал) по
аспартильному остатку (D).
Б. Цикл фосфорилирования завершает-
ся спонтанным или катализируемым фос-
фатазой дефосфорилированием. Домен,
принимающий сигнал, в конечном сче-
те вызывает изменение регуляторного до-
мена, который инициирует ответную ре-
акцию клеток (результирующий сигнал).
По [7].
пазу, фосфорилирует консервативный остаток ги-
стидина (His) в собственной молекуле и затем
переносит фосфорильную группу на остаток ас-
парагиновой кислоты (Asp) в молекуле ассоции-
рованного с ним ответного регулятора. Таким об-
разом, все двухкомпонентные системы осуществ-
ляют следующие реакции:
АТР + (His)-S -> ADP + P~(His)-S
P~(His)-S + (Asp)-RR -» (His)-S + P-(Asp)-RR
P~(Asp)-RR + H2O -» (Asp)-RR + P,
Двухкомпонентные системы — это сигналь-
ные системы, включающие два белковых ком-
понента: сенсорный белок и регуляторный
белок, вызывающий ответную реакцию клетки.
В таких системах действуют четыре функцио-
нальных домена: вариабельный рецепторный
домен, воспринимающий внешний стимул, плюс
консервативный домен, передающий сигнал (про-
теипкипаза), в сенсорном компоненте и консерва-
тивный домен, принимающий сигнал плюс ва-
риабельный регуляторный домен в регуляторе,
вызывающем ответ (рис. 20.16). Передача сигнала
от домена, передающего сигнал, происходит пу-
тем фосфорилирования по остаткам гистидина и
аспартата.
Как установлено, подобные сенсорные систе-
мы имеются у многих бактерий. Процессы, за-
висящие от этих регуляторных белков, весьма
разнообразны. Они инициируют таксис в ответ'
на различные стимулы и реакции на изменение
окислительно-восстановительных условий, сдвиг
осмолярности, голодание, фиксацию азота или
смену источников углерода. У Е. coli, например,
имеется, вероятно, 40-50 таких систем (некоторые
из них указаны в табл. 20.1). Далее мы описываем
общие принципы их действия и некоторые систе-
мы рассматриваем более подробно.
20.4.1. Общая структура двухкомпонентных
систем отражает их функцию
Общая структура и функция двухкомнонснтных
систем отображены на рис. 20.16. Сенсор содер-
жит N-концевой рецепторный (воспринимающий
стимул) домен и С-концевой домен, передающий
сигнал. Рецепторные домены специфичны в отно-
шении стимула и различаются в разных системах,
тогда как передающие домены включают несколь-
ко консервативных мотивов, в том числе остаток
гистидина, подвергающийся фосфорилированию
(модификация, регулирующая активность данно-
го белка). Второй компонент этих сенсорных си-
стем — ответный регулятор — содержит консерва-
тивный N-концевой домен, принимающий сигнал,
и вариабельный регуляторный домен, подобно ре-
цепторному домену специфичный для регулиру-
емого процесса. В большинстве случаев сенсор и
ассоциированный с ним ответный регулятор явля-
ются разными полипептидами. Однако известны
610 Часть V. Экспрессия генов и механизмы регуляции
Система Организм Сенсор Ответный регулятор
Катаболитный контроль Есо CreC CreB
Осмолярность Есо EnvZ OmpR
Тургорное давление Есо KdpD KdpE
Фосфат Синтез пилой var PhcQ.R PiiB PhoB.P PilA
Воздействие антибиотиков Efa VanS VanR
Перенос генов Bsu ConiP > Й H®tI<©rX > ComA
Симбиоз Rme FixL FixJ
Реакция на изменение окислительно-восстанови- тельных условий Есо NarQ,X NarL
Симбиоз Bja NodV NodW
Поиск и адаптация к источнику углерода Есо UhpB UhpA
Реакция на уровень кислорода Есо ArcB ArcA
Реакция на плотность популяции (кворум-сенсинг) Vfi LuxN.Q 2 LuxO
Синтез капсулы Его RcsC RcsB
Вирулентность Atu VirA VirG
Вирулентность Воздействие антибиотиков Bpe Вас BrgS LemA RteA > В! Н®т К©-<Ж >
Голодание Bsu DegS 2 H®lJ <©£<_> DegU
Адаптация к источнику азота var NifR2 NifRl
Адаптация к источнику азота Sty NtrB NtrC
Хемотаксис var CheA ЮПОН GZ> ( 2 CheY FliG.M.N CheB
Спорообразование Mxa FrzE |®Tp| FrzZ.G
Спорообразование Bsu KinA > > Spo0F(B,A)
Деление клеток var DivJ Ж]@®00 DivK
Спорообразование Bsu KinB SpoOF(B,A)
Спорообразование Bsu PleC Spo0F(B,A)
Рис. 20.17. Сигнальные белки и передающие сигнал домены у прокариот. Сенсор и ответный регулятор, со-
держащие соответственно остаток гистидина (Н) в качестве донора фосфогруппы и остаток аспарагиновой кис-
лоты (D) в качестве акцептора фосфогруппы (обозначения, как на рис. 20.16), образуют в различных комби-
нациях двухкомпонентные системы. Горизонтальными линиями обозначены пептидные связи, заштрихованными
прямоугольниками — трансмембранные спиральные участки доменов-рецепторов. Обозначения организмов: Atu —
Agrobacterium tumefaciens, Вас — Bacteroides sp.; Bja — Bradyrhizobium japonicum; Bpe — Bordetella pertussis; Bsu —
Bacillus subtilis; Eco — Escherichia coli; Efa — Enterococcus faecium; Mxa — Myxococcus xanthus; Rme — Rhizobium
melHoti; Sty — Salmonella typhimurium; var — различные грамположигельные и грамотрицательные бактерии; Vfi—
Vibrio fischeri (см. также табл. 20.1).
примеры систем, в которых эти домены разделе-
ны как сенсорный и регуляторный компоненты,
но объединены в одном белке. Далее в этом раз-
деле будут описаны системы, в которых сенсор
содержит рецепторный домен плюс домен, пере-
дающий сигнал, и ответный регулятор содержит
домен, принимающий сигнал, плюс регуляторный
домен. Двухкомпонентные системы, схемы кото-
рых представлены на рис. 20.17, построены из од-
них и тех же основных модулей (доменов), но кле-
точная локализация этих доменов и количество
составляющих их полипептидов варьируют.
Глава 20. Общие регуляторные сети и пути передачи сигналов 611
Как уже упоминалось, сенсоры обладают ауто-
киназной активностью, и в ряде случаев у них
обнаружена фосфатазпая активность, благодаря
которой они отщепляют фосфогруппу от фосфо-
рилированного ответного регулятора. Некоторые
воздействия стимулируют киназную активность,
другие — фосфатазную. Период полужизни раз-
личных фосфорилированных ответных регуля-
торов варьирует от секунд до многих минут.
Очевидно, он служит важной характеристикой
системы, так как определяет длительность ответ-
ной реакции системы на изменение условий. Как
показывают биохимические исследования, сенсо-
ры обычно образуют димеры; АТР связывается
с одной субъединицей и фосфорилирует другую,
и таким образом происходит аутофосфорилирова-
ние. Димеризации могут также подвергаться по-
сле фосфорилирования ответные регуляторы, что
усиливает их связывание с ДНК.
Поскольку все передающие сигнал и принима-
ющие его домены содержат консервативные мо-
тивы, возникает вопрос, может ли сенсор, при-
надлежащий к одной двухкомпонентной системе,
фосфорилировать ответный регулятор другой си-
стемы. Генетические и биохимические исследова-
ния показывают, что при некоторых условиях мо-
жет наблюдаться перекрестная регуляция.
Обнаружен и другой механизм, при котором
фосфорилирование некоторых ответных регуля-
торов происходит в отсутствие ассоциированного
с ними сенсора. Низкомолекулярные соединения,
содержащие фосфатную группу, например аце-
тилфосфат, карбамоилфосфат или фосфоамидат
(но не АТР или ФЕП) способны непосредствен-
но фосфорилировать такие ответные регуляторы,
как регуляторные белки CheY и NtrC. Независи-
мое от сенсора фосфорилирование ответного ре-
гулятора обнаружено в исследованиях in vitro с
использованием очищенных белков, но возможно,
что оно вносит вклад в фосфорилирование ответ-
ного регулятора и в интактных клетках.
При перекрестной регуляции на ответ-
ный регулятор воздействует сигнал, не связан-
ный с фосфорилированием сенсора-партнера. Та-
кой контроль может обеспечивать координацию
различных, но непосредственно связанных систем
для сопряжения роста и метаболизма клеток.
Как сенсор, так и ответный регулятор со-
держат рецепторный и регуляторный домены,
специфичные для конкретного процесса, напри-
мер осморегуляции или регуляции азотного пита-
ния. Рецепторный для внешнего стимула домен
включает но меньшей мере два трансмембранных
сегмента. Часть его молекулы обращена в пери-
плазматическое пространство, и этот периплаз-
матический сенсорный домен распознает внеш-
ние стимулы. Цитоплазматический домен, пере-
дающий сигнал, соединен с рецепторным доменом
через трансмембранный участок, однако каким
образом внешний стимул преобразуется во внут-
ренний сигнал, остается неясным. В то же вре-
мя выявлены индуцированные лигандом кон-
формационные изменения, например в случае
рецепторов сенсорной системы хемотаксиса (см.
разд. 20.5), и выделены штаммы бактерий с мута-
циями в трансмембранных доменах, в результате
которых сенсор фиксирован в одной из двух кон-
формаций. Кроме того, сконструированы гибрид-
ные сенсоры из рецепторного домена А и переда-
ющего сигнал домена Б из другой системы; в этих
сенсорах воздействие на рецептор А вызывает от-
ветную реакцию домена Б, в норме обусловлен-
ную его собственным сенсорным доменом.
Ниже подробно рассматриваются два примера
двухкомпонентпых систем. В первом случае пара
сенсор/ответный регулятор локализована в плаз-
матической мембране и цитоплазме соответствен-
но и реагирует па осмолярность среды. Во втором
случае оба компонента локализованы в цитоплаз-
ме и реагируют па внутриклеточный стимул. Еще
одна известная двухкомполнентная система (хе-
мотаксиса), описываемая в разд. 20.5, содержит
ответный perулятор, действующий нс как актива-
тор транскрипции, но как регулятор направления
движения жгутиков.
Участие двухкомпонентных регуляторных си-
стем в передаче сигнала установлено к настоя-
щему времени для многих видов бактерий, и во
всех случаях они содержат одни и те же основ-
ные функциональные блоки. Сенсорный и регуля-
торный домены присутствуют в одном полипеп-
тиде либо по одному в двух белках (рис. 20.17).
Подобные системы имеются и у эукариот. Так, у
Arabidopsis и некоторых дрожжей найдены пере-
дающие сигнал белки, сходные с белками бактери-
альных двухкомпонентных систем. У Arabidopsis
это продукт гена ETR1, участвующий в реакции
па этилен, у дрожжей — продукт гена SLN1, об-
наруживающий сходство с воспринимающим сти-
612 Часть V. Экспрессия генов и механизмы регуляции
мул и передающим сигнал доменами бактериаль-
ных двухкомпонептных систем (функции его пока
неизвестны).
20.4.2. Система EnvZ/OmpR осуществляет
осморегуляцию в ответ
на внешний стимул
Клетки Е. coli реагируют на изменения осмо-
лярности среды, изменяя уровень синтеза двух
белков-поринов — ОтрС и OmpF, присутству-
ющих в наружной мембране. Поры, образуе-
мые обоими этими белками, обеспечивают про-
никновение малых молекул (мол. массой до
нескольких сотен дальтон), но в случае OmpF их
диаметр несколько больше. Интересно, что уве-
личение количества пор одного типа компенси-
руется снижением количества пор другого типа.
Синтез обоих поринов регулируется двухкомпо-
нентпой системой, состоящей из сенсора EnvZ
и ответного регулятора OmpR (рис. 20.18).
Рис. 20.18. Осморегуляция у Е. coli. Белки EnvZ и
OmpR реагируют на изменение осмолярности среды.
Аутофосфорилирование EnvZ и дефосфорилирование
белка Р-EnvZ влияет на состояние фосфорилирования
OmpR, который в свою очередь определяет экспрес-
сию генов отрС и ompF, кодирующих два различных
порина. На схеме показано также, что ответный регуля-
тор OmpR может быть фосфорилирован другими доно-
рами фосфата, другими фосфорилированными сенсо-
рами или низкомолекулярными соединениями, напри-
мер а цетил фосфатом (см. текст; обозначения, как на
рис. 20.16). По [7].
Белок EnvZ локализован в плазматической мем-
бране и содержит периплазматический домен,
цитоплазматический домен и два трансмембран-
ных участка. Он способен определять (неизвест-
ным способом) осмолярность внеклеточной сре-
ды и при повышении осмолярности фосфори-
лируется. Фосфорильная группа переносится от
него па цитоплазматический ответный регулятор,
OmpR. При низкой осмолярности Р-OmpR дефос-
форилируется с участием нефосфорилироваппого
EnvZ. Скорость синтеза ОтрС и OmpF опреде-
ляется степенью фосфорилирования OmpR, так
как он может действовать в качестве активато-
ра транскрипции как локуса отрС, так и локу-
са ompF, которые содержат сайты связывания
OmpR. Транскрипцию с промотора отрС стиму-
лирует белок Р-OmpR, тогда как OmpR активиру-
ет транскрипцию с промотора ompF и ингибирует
транскрипцию с промотора отрС. Таким образом,
при высокой осмолярности среды клетки содер-
жат относительно больше молекул порина ОтрС,
тогда как при низкой осмолярности преобладают
поры, образуемые белком OmpF. Биологическое
значение этой регуляции пока не установлено.
20.4.3. Система NtrB/IMtrC регулирует
ассимиляцию азота в ответ
на внутриклеточные стимулы
Катализируемый глутаминсинтетазой синтез глу-
тамина из глутамата и аммиака служит важ-
ным путем ассимиляции азота, и аммиак явля-
ется предпочтительным источником азота для
многих бактерии. При его недостатке усилива-
ется транскрипция ряда оперонов. У Е. coli ос-
новным из них является опероп glnALG. Ген
glnA кодирует глутаминсинтетазу, гены glnL и
glnG — белки двухкомпонептпой регуляторной си-
стемы GlnL (другие обозначения — NtrB; NRn)
и GlnG (NtrC; NRj) соответственно. В по-
следующем изложении мы используем во из-
бежание путаницы термины NtrB и NtrC (от
nitrogen regulation). При снижении внутрикле-
точной концентрации глутамина возрастает уро-
вень транскрипции гена glnA, и, кроме того,
уровень глутамина влияет на активность глута-
минсинтетазы. Функция кодируемой этим оперо-
ном двухкомпонентной системы формально состо-
ит только в активации транскрипции, но регу-
ляция активности ферментов здесь также будет
Глава 20. Общие регуляторные сети и пути передачи сигналов 613
Рис. 20.19. Регуляция экспрессии генов glnA, glnL и
glnG. Ген glnA кодирует глутаминсинтетазу, гены glnL
и glnG — белки NtrB (NRn) и NtrC (NR|) соответствен-
но, составляющие двухкомпонентную систему. В усло-
виях избытка азота транскрипция начинается со слабых
промоторов glnApl и glnLp с использованием сигма-
фактора ст70 и завершается на терминаторных сайтах
glnAt и glnGt. В условиях дефицита азота транскрип-
54
ция зависит от g , начинается с сильного промотора
glnAp2 (жирная стрелка) и активируется белком P-NtrC.
В этих условиях промоторы glnApl и GlnLp инактивиру-
ются под действием белка Р-NtrC (P-Ntri) и транскрип-
ция завершается только на сайте glnGt.
включена в рассмотрение, поскольку один из бел-
ков, участвующих в этом процессе, влияет на дан-
ную двухкомпопснтную систему.
Ответный регулятор NtrC действует как акти-
ватор транскрипции одного из промоторов glnA
(см. рис. 20.19). При избытке азота транскрип-
ция начинается с промоторов glnApl и glnLp
и протекает с низкой скоростью, обеспечивая
лишь низкий уровень синтеза глутаминсинтета-
зы и компонентов NtrB/NtrC. При транскрип-
ции с. этих промоторов используется РНК-но-
лимераза, содержащая основной сг-фактор — а70,
или RpoD (кодируемый геном rpoD). При азот-
ном голодании транскрипция начинается со вто-
рого промотора, glnAp2, и для нее необходим
минорный ст-фактор — <т54, или RpoN (продукт
гена rpoN), а также ответный регулятор NtrC.
При этом стимулируется синтез как глутамипсин-
тетазы, так и продуктов NtrB/NtrC. Фосфори-
лированная форма NtrC, P-NtrC, образуется пу-
тем переноса фосфогрупиы от фосфорилирован-
ного сенсора, P~NtrB. Белок P-NtrC связывается
выше промотора glnAp2 и активирует его («ауто-
регуляция»), ингибируя в то же время транскрип-
цию с промотора glnApl. Кроме того, он препят-
« 70
ствует зависимой от а транскрипции с промото-
pa glnLp.
Кроме генов оперона glnALG той же си-
стеме общего контроля подчинены другие ге-
ны, участвующие в азотном метаболизме. На-
пример, у Klebsiella pneumoniae оперон nif, в
который входят участвующие в синтезе нитро-
геназы гены nifHDK, также активируется фос-
форилированной формой ответного регулятора
NtrC. При недостатке азота белок P-NtrC ак-
тивирует синтез фактора транскрипции NifA,
который в свою очередь стимулирует синтез
нитрогеназы для синтеза аммиака из молеку-
лярного азота (см. гл. 34). Примерами дру-
гих оперонов, участвующих в ассимиляции азо-
та п контролируемых системой NtrB/NtrC, могут
служить опероны hut и put, кодирующие фер-
менты катаболизма гистидина и пролина соответ-
ственно.
Состояние фосфорилирования NtrC зависит
от двух факторов (см. рис. 20.20): 1) скоро-
сти его фосфорилирования с участием Р-NtrB и
2) скорости дсфосфорилировапия P-NtrC посред-
ством белка NtrB и при участии второго белка,
Рц, стимулирующего NtrB. На рис. 20.20 показа-
но также действие второго каскада ковалентной
модификации белков. Бифункциональный фер-
мент UT/UR катализирует уридилирование и де-
урпдилирование остатка тирозина в белке Рц.
Уридилтрапсферазную (UT) н обратную, удаля-
ющую уридин (UR) активности регулирует кон-
центрация 2-оксоглутарата и глутамина (см. так-
же разд. 19.3.1). Недостаток азота стимулирует
активность UT (в этих условиях уровень глута-
мина низкий, тогда как 2-оксоглутарата — высо-
кий). Зависимая от NtrC транскрипция с промо-
тора glnAp2 регулируется следующим образом:
при низком уровне 2-оксоглутарата преобладает
активность UT и в результате Рп превращается
в уридилированную форму UMP-Рц. При этом
белок NtrB действует главным образом как про-
теинкиназа, фосфорилируя NtrC, что стимулиру-
ет транскрипцию. При избытке аммиака преобла-
дает активность UR и образуется свободный бе-
лок Рп, который взаимодействует с белком NtrB,
повышая его фосфатазную активность и вызы-
вая тем самым фосфорилирование NtrC и сни-
жение скорости транскрипции. Кроме того, NtrB
в псфосфорилироваппой форме снижает актив-
ность промотора glnAp2. Таким образом, белок
Рц переводит NtiB из конформации, в которой
он действует как активатор, в одну из тех кон-
формаций, в которых он действует как репрессор
614 Часть V. Экспрессия генов и механизмы регуляции
Рис. 20.20. Регуляция азотного метаболизма у Е. coli.
Двухкомпонентная система NtrC-NtrB (обозначения,
как на рис. 20.16) определяет экспрессию глутамин-
синтетазы в соответствии с состоянием фосфорилиро-
вания ответного регулятора NtrC. Фосфорилирование
NtrC контролируется сенсором NtrB, обладающим ауто-
киназной и фосфатазной активностями. Соотношение
этих двух активностей в свою очередь зависит от степе-
ни уридилирования фермента Рп (см. текст). По [7].
транскрипции. Положительная и отрицательная
регуляторные функции этого белка могут быть
разделены с помощью генетических методов.
Существует также дополнительная возмож-
ность регуляции азотного питания. Помимо рас-
смотренной в предыдущих разделах регуляции
транскрипции и синтеза белка (долговременная
адаптация), здесь, как и в случае углеродной ката-
болитной репрессии (разд. 20.3.2), контроль осу-
ществляется па уровне активности ферментов для
кратковременной адаптации.
Глутаминсинтетаза регулируется, помимо син-
теза, и па уровне активности путем ковалентной
модификации с участием того же фермента Рщ
Клетки Е. coli содержат бифункциональный фер-
мент аденилилтрансферазу (АТ), которая перено-
сит аденильную группу на остаток тирозина в глу-
таминсинтетазс или удаляет ее из этого участка
(см. разд. 19.3.1). Аденилированная форма глу-
тамипсиптетазы малоактивна, и ее образование
стимулируется неуридилированной формой бел-
ка Рп, который, таким образом, предотвращает
синтез глутамипсиптетазы и подавляет ее оста-
точную активность. Напротив, если возникает
потребность в глутамипсиптетазе, может быть
легко активирован неактивный фермент (кратко-
временная адаптация) и синтезировано дополни-
тельное количество этого фермента (долговремен-
ная адаптация).
20.5. Бактериальный хемотаксис — другой пример регуляции
с передачей сигнала через двухкомпонентную систему
Многие прокариоты характеризуются подвижно-
стью и способны перемещаться в определенном
направлении, т. е. обладают способностью к так-
сису. Они могут плыть в направлении более бла-
гоприятных условий (положительный таксис) или
избегать неблагоприятных условий (отрицатель-
ный таксис). Способностью к активному движе-
нию обладают не все виды бактерий, но все по-
движные виды, вероятно, способны к таксису.
Таксис — это ориентированное движение
активно подвижных организмов в направлении к
аттрактанту (положительный таксис) или удале-
ния от репеллента (отрицательный таксис). Тип
перемещения обозначают терминами фоботак-
сис (реакция избегания) и топотаксис (реакция
направления к чему-либо); у прокариот преоб-
ладает фоботаксис. В зависимости от внешнего
стимула используют следующие термины: хемо-
Глава 20. Общие регуляторные сети и пути передачи сигналов 615
таксис (реакция на изменение концентрации рас-
творенных веществ); аэротаксис (реакция на из-
менение концентрации кислорода); осмотаксис
(реакция на изменение осмолярности); фототак-
сис (реакция на изменение освещенности); тер-
мотаксис (реакция на изменение температуры);
тигмотаксис (реакция на механические воздей-
ствия); гальванотаксис (реакция на изменение
силы электрического тока) и магнитотаксис (ре-
акция на изменение магнитного поля). Реакцию,
состоящую в изменении скорости плавания, назы-
вают кинезом.
20.5.1. Существуют различные механизмы
движения бактерий
У прокариот известно два механизма движения:
один с использованием жгутиков и другой пут< м
скольжения.
Движение с помощью жгутиков □
У большинства подвижных видов, как грамполо-
житсльных, так и грамотрицательных бактерий,
а также археи, для движения служат жгутики,
строение которых у всех прокариот одинаково
(см. гл. 2; рис. 20.21 и 24.2, Л). Жгутик представ-
ляет собой длинное волокно, обычно закрученное
в полужссткую спираль и связанное посредством
гибкого «крючка» с базальным тельцем («под-
шипником»), которое состоит из стержня, соеди-
няющего волокно с «мотором», нескольких дис-
ков, стабилизирующих вращающийся стержень в
клеточной стенке, и собственно мотора. Обяза-
тельными компонентами мотора служат подвиж-
ный диск, погруженный в плазматическую мем-
брану, и статор, иммобилизованный благодаря
связи с пептидогликановым слоем. В простран-
стве между подвижным диском и покрывающим
его статором находятся протонные каналы (от 8
до 16). Движение протонов по этим каналам в
соответствии с протонным градиентом вызывает
вращение подвижного диска относительно ста-
тора и вследствие этого вращение жгутикового
волокна. В деталях механизм эпергизации мото-
ра пока не ясен.
Некоторые бактерии образуют жгутики,
специализированные для перемещения в особых
средах. Например, бактерии, обитающие в ризо-
сфере и способные перемещаться со скоростью
200 мкм • с-1 (т. с. преодолевая за секунду рассто-
(MotA.B)
Рис. 20.21. Строение бактериального жгутика. Базаль-
ное тельце, или мотор, жгутика состоит из подвиж-
ного диска (П) в плазматической мембране и стато-
ра (С), иммобилизованного путем ковалентного связы-
вания с пептидогликаном. Подвижный диск сопряжен
через центральный стержень и гибкий «крючок» с во-
локном— длинной (>10 мкм) трубочкой, образованной
полимером белка флагеллина и завершающейся белко-
вой «шапочкой». Подвижный диск окружен сетью про-
тонных каналов (MotA и MotB) и связан с белками-
переключателями (FliG, FliM и FliN). Поток протонов
приводит подвижный диск во вращение относительно
статора. Механизмы энергизации мотора и переключе-
ния направления вращения остаются неясными. СД —
стабилизирующий диск.
яние, превышающее в 40-50 раз длину их клет-
ки), обладают более ригидными и сложными по
строению жгутиками, специально приспособлен-
ными к среде с повышенной вязкостью. Бактерии,
относящиеся к родам Proteus, Vibrio и Serratia, пе-
риодически изменяют свою морфологию, превра-
щаясь из коротких клеток с редко расположенны-
ми жгутиками в длинные клетки с большим ко-
личеством жгутиков. Представители рода Vibrio
передвигаются в жидкой среде с помощью един-
ственного полярного жгутика. Если подвижность
затруднена, например в очень вязких средах или
па поверхности твердых сред, они образуют ла-
теральные жгутики по всей поверхности кле-
ток (перитрихиальное жгутпкование). Этот тип
жгутикования позволяет клеткам перемещаться
группами по плотным влажным поверхностям,
например по агаризованиой среде в чашках Пет-
ри. Такое поведение клеток, называемое роени-
ем (см. разд. 20.1.4), относится к периодическим
процессам дифференцировки, как и перестройка
616 Часть V. Экспрессия генов и механизмы регуляции
Рис. 20.22. Механизм движения (плавания) эн-
теробактерий. В отсутствие стимула клетки пере-
мещаются по прямой линии («пробежка») при-
мерно в течение 1 с; все их жгутики вращаются
при этом против часовой стрелки (CCW) и об-
разуют пучок («корабельный винт»). Пробежка
периодически прерывается кувырканием с вра-
щением жгутиков по часовой стрелке (CW). что
ориентирует клетку в новом, случайном направ-
лении. Когда клетка попадает в градиент концен-
трации аттрактанта, кувыркание подавляется на
длительный период времени, если клетка плы-
вет в направлении возрастания его концентра-
ции, однако, если она перемещается в противо-
положном направлении, частота кувыркания уве-
личивается. Последовательное повторение этих
этапов обеспечивает в итоге положительный хе-
мотаксис в направлении отверстия капилляра.
поверхности клеток — фазовая вариация — у
Salmonella (см. гл. 18). Спирохеты перемещают-
ся путем винтообразного вращения клеток даже в
полужидких средах. Такое движение обеспечива-
ется осевым филаментом, который тянется вдоль
всей клетки и, по-видимому, представляет собой
нечто наподобие вращающихся жгутиков, соеди-
ненных с противоположными полюсами клетки.
Эти жгутики обвиты вокруг цилиндра клетки и
располагаются под наружной мембраной. Обра-
зуя витки, они генерируют спиральные волны, со-
общающие клетке поступательное движение.
Скользящее движение □ У представите-
лей семейств грамотрицательных бактерий Мухо-
bacteriales и Cytophagales, а также некоторых ро-
дов фототрофпых цианобактерий движение про-
исходит по механизму скольжения в контакте с
твердой поверхностью. Такие клетки непрерыв-
но скользят взад и вперед вдоль своей длинной
оси и иногда поворачиваются или сгибаются. При
этом на поверхности, по которой они перемещают-
ся, остается след из внеклеточной слизи, исполь-
зуемый другими клетками для преимуществен-
ного перемещения. Такое поведение напоминает
роение, для которого также характерно образо-
вание большое количество внеклеточной полиса-
харидной слизи. При скользящем движении, по-
видимому, важное значение имеет прикрепление
к поверхностным выступам и активное измене-
ние поверхностного натяжения; действительный
механизм(-ы) этого способа движения бактерий,
звисящего, как и перемещение с помощью жгу-
тиков, от протондвижущей силы, пока остается
предметом гипотез.
Большинство подвижных бактерий перемеща-
ется посредством вращения либо одного жгути-
ка, либо пучка жгутиков, действующего наподо-
бие корабельного винта. Другие формы движения
— это роение и скольжение по твердой поверх-
ности.
20.5.2. Движение энтеробактерий, обладающих
жгутиками, в норме происходит
по случайной траектории
Жгутик бактерий можно сравнить с корабель-
ным винтом, присоединенным универсальным уз-
лом (крюком) к мотору. Жгутиковый «мотор»
может вращаться с максимально!! скоростью
(например, у Е. coli 60 Гц, или оборотов в секун-
ду), даже будучи соединен с пустыми клеточны-
ми оболочками, в условиях, когда внешний pH
примерно на 4 единицы ниже внутреннего. Один
оборот мотора требует в случае Е. coli переноса
по энергетическому приводу примерно 1000 про-
тонов. Эффективность этого процесса генерации
энергии очень высока (~ 50%), тогда как затра-
ты энергии невелики. У некоторых бактерий для
движения мотора используются другие ионы (на-
пример, у алкалифилов ионы натрия). Важная
особенность жгутикового мотора состоит в том,
что он вращается поочередно по часовой стрелке
(CW) и в противоположном направлении (CCW)
(по направлению вдоль волокна в сторону клет-
ки), периодически переключая направление вра-
щения.
Глава 20. Общие регуляторные сети и пути передачи сигналов 617
Энтеробактерии и другие прокариоты с пери-
трихиальным жгутиковая нем, как правило, рав-
номерно движутся по прямой в течение прибли-
зительно 1 с (совершают пробежку) благода-
ря вращению всех жгутиков в виде одного пуч-
ка против часовой стрелки и перемещаются при
этом примерно на 30 мкм, т. е. на расстояние, в
10 раз превышающее длину клетки (рис. 20.22).
В среднем один раз в секунду клетка соверша-
ет быстрый кувырок (приблизительно за 0,1 с)
в результате переключения вращения жгутика
на противоположное. Кувыркание резко изменяет
направление перемещения, в среднем на 60°. По-
сле того как все жгутики восстановят вращение
против часовой стрелки, клетка вновь перемеща-
ется равномерно, по, как правило, в новом направ-
лении. В результате таких последовательных про-
бежек и кувырков клетка перемещается в трех-
мерном пространстве по случайной траектории.
Механизмы изменения направления движения
варьируют у разных бактерий. Организмы с од-
ним полярным жгутиком, например многие псев-
домонады, изменяют направление движения пу-
тем изменения направления вращения жгутика па
обратное. Организмы, имеющие сложные жгути-
ки с жестким опорным волокном, которое может
вращаться только в одном направлении, переме-
щаются путем пробежек и кратковременных оста-
новок. То же относится к бактериям, имеющим
один латеральный жгутик (например, Rhodobacter
spp.). У бактерий с биполярным жгутиковапи-
ем, таких как Spirillum, вращение жгутиков на
обоих концах должно быть синхронным, чтобы
не было постоянного кувыркания. Аналогичное
условие существует для спирохет, обладающих
осевым волокном. Вращением осевых фибрилл в
одном или противоположных направлениях, по-
видимому, объясняется вращательное, сгибатель-
ное или винтообразное движение этих бактерий.
20.5.3. Бактериальный таксис —это результат
перемещения случайным образом
по механизму фоботаксиса
Как было установлено еще в 19 в. Пфеффсром,
Энгельманном, Сталом и другими исследовате-
лями, прокариоты проявляют реакцию такси-
са в ответ на разнообразные стимулы. Пфеф-
фер продемонстрировал в остроумном экспери-
менте, что подвижные бактерии собираются у
кончика капилляра, если он содержит аттрак-
тант, например раствор углеводов, аминокис-
лот и неорганических ионов, но удаляются от
капилляра, если раствор содержит репеллент,
например раствор слабых органических кислот
или других вредных веществ. Для этой реак-
ции подвижных организмов па химические со-
единения, в отличие от реакций на другие, упо-
мянутые выше воздействия, Пфсффером был
предложен термин хемотаксис. Все виды так-
сиса (включая хемотаксическую реакцию на из-
менение pH и на акцепторы электронов), за ис-
ключением магнитотаксиса, зависят у клеток,
обладающих жгутиками, от описанных выше пе-
ремещений посредством пробежек и кувырков
(или остановок). Поскольку эти виды таксиса не
связаны с направленной реакцией, но обуслов-
лены в основном избеганием неблагоприятного
направления, Пфеффер ввел для них общее на-
звание фоботаксис (реакция избегания). Дру-
гой механизм таксической реакции наблюдается
у бактерий, способных к магнитотаксису: они пас-
сивно ориентируются в магнитном поле благодаря
присутствию в клетках микрокристаллов синте-
зируемого ими чистого магнетита (рис. 2.18, Г).
Таксис посредством ориентированного переме-
щения или активного направленного движения
Пфеффер назвал топотаксисом, чтобы отличать
его от фоботаксиса.
Изучение бактериального хемотаксиса возоб-
новил в 1960-х гг. И. Адлер (Adler). Он исполь-
зовал в качестве объектов энтеробактерии и при-
менял в сочетании генетический, биохимический
и физиологический подходы. В световом микро-
скопе жгутики плывущих в жидкой среде бак-
терий неразличимы, однако можно определять
смену пробежек и кувырков по зигзагам тра-
ектории их движения (рис. 20.22). Когда клет-
ка перемещается в направлении возрастания кон-
центрации аттрактанта (т. е. вверх по гра-
диенту), кувыркание становится более редким.
Репелленты вызывают обратный эффект — их до-
бавление увеличивает частоту кувырканий, то-
гда как удаление уменьшает. Благодаря этому
механизму клетки более длительное время плы-
вут в благоприятном направлении, и переориен-
тацию клетки, движущейся в неверном направле-
нии, обеспечивает именно кувыркание (не движе-
ние, активно направленное к чему-либо). Таким
образом, регуляция частоты кувыркания являет-
ся главным моментом в этой форме хсмотакси-
618 Часть V. Экспрессия генов и механизмы регуляции
са (фоботаксисе). Когда суспензию нестимулиро-
ванных бактерий быстро смешивают с раствором
аттрактанта, кувыркание сразу подавляется, хотя
пространственный градиент концентрации отсут-
ствует. Бактерии в этом случае до 5 мин могут
плыть в одном направлении (пробежка). Такой
эксперимент показывает, что бактерии способны
«помнить» об отсутствии аттрактанта до смеши-
вания и «чувствуют» его высокую концентрацию
после смешивания. Они ведут себя так, как если
бы плыли вверх по градиенту концентрации, что
указывает на обладание ими механизмом памяти.
Клетки как бы измеряют концентрацию аттрак-
танта, «запоминают» ее, вновь измеряют, сравни-
вают с предыдущей и таким способом «ощуща-
ют», движутся они в благоприятном направлении
или неблагоприятном.
Подобно большинству других биологических
сенсорных систем, бактерии реагируют не на аб-
солютную концентрацию, а на изменение концен-
трации вещества. Они должны последовательно
адаптироваться к все более высокой концентра-
ции вещества, чтобы определить еще более высо-
кую его концентрацию. Эта адаптация приводит
к тому, что клетки в описанных экспериментах со
смешиванием через некоторое время возвращают-
ся к той частоте пробежек/кувырков, которая бы-
ла у нестимулированных клеток, хотя воздействие
(высокая концентрация аттрактанта) сохраняет-
ся. Если суспензию таких адаптированных клеток
быстро разбавить средой, не содержащей аттрак-
танта (что эквивалентно перемещению в сторо-
ну уменьшения градиента), частота кувыркания
у них временно возрастает, пока не произойдет
адаптация к новым условиям.
Для регистрации движения бактерий исполь-
зуют компьютерный способ реконструкции пу-
ти, пройденного стимулированными и нестиму-
лированными клетками. Специальный микроскоп
осуществляет автоматическое слежение за пере-
мещением клеток в трех измерениях и регистри-
рует их локализацию с интервалом 80 мкс. При
использовании темнопольной микроскопии и яр-
кого луча света можно непосредственно наблю-
дать движение пучка жгутиков. Во время про-
бежки от шести до восьми жгутиков у Е. coli
и S. typhimurium синхронно вращаются против
часовой стрелки в одном пучке, вращение которо-
го обеспечивает равномерное перемещение клет-
ки в среде. Во время кувырков жгутики враща-
ются по часовой стрелке, при этом пучок рас-
падается, и каждый жгутик толкает клетку в
своем направлении. Клетки можно лишить жгу-
тиков путем многократного пропускания клеточ-
ной суспензии через шприц с узкой иглой. Такая
обработка укорачивает жгутики до коротких об-
рубков, которые могут использоваться клетками,
например, для связывания с предметным стек-
лом. Если клетка связана со стеклом за счет од-
ного обрубка, при вращении жгутикового мото-
ра она начинает медленно вращаться, что мож-
но наблюдать в световом микроскопе. Изучение
таких связанных клеток подтверждает, что по-
ложительное воздействие (повышение концентра-
ции аттрактанта или снижение концентрации
репеллента) подавляет кувыркание, тоща как от-
рицательное воздействие (снижение уровня ат-
трактанта или повышение уровня репеллента)
индуцирует его. Можно даже продемонстриро-
вать, что клетки интегрируют эффекты положи-
тельных и отрицательных стимулов, действую-
щих одновременно.
20.5.4. Хемотаксис связан с несколькими
сложными механизмами передачи
сигналов и включает этапы
фосфорилирования белков
Подобно другим сенсорным системам, отвеча-
ющим па кратковременный стимул, бактери-
альный механизм хемотаксиса можно описать
моделью, представленной па рис 20.3. У энте-
робактерий существует по меньшей мере три раз-
личных пути передачи сигнала хемотаксиса и три
типа связанных с ними специфических хеморецеп-
торов. К этим хеморецепторам относятся 1) четы-
ре сенсорных белка; эти трансмембранные белки
— рецепторы стимулов, ответственные за переда-
чу сигнала через плазматическую мембрану,—
метилируются во время адаптации и поэтому на-
званы метил-акцептируюгцими белками хе-
мотаксиса (МаБХ, англ. МСР); 2) ферменты II
(ЕИ) п общие белки ФТС — фермент I (EI) и НРг,
а также -3) компоненты дыхательной электрон-
транспортпой цепи (например, цитохромы и цито-
хромоксидазы). Сенсорные системы других бак-
терий рассматриваются ниже, после механизма
хемотаксиса энтеробактерий.
Отбор необходимых для анализа мутантов с
измененным хемотаксическим поведением мож-
но производить с помощью простого и удоб-
Глава 20. Общие регуляторные сети и пути передачи сигналов 619
него метода агаровых пластинок (рис. 20.23).
Небольшой инокулят культуры подвижных бак-
терий засевают в полужидкую агаризованную
среду (в чашке Петри), содержащую аттрак-
тант — источник углерода в микромолярпой кон-
центрации. Клетки, способные использовать это
соединение, поглощают его, создавая тем са-
мым градиент концентрации аттрактанта. Все
подвижные клетки, способные определять кон-
центрацию субстрата, будут двигаться в направ-
лении ее возрастания, г. е. от центра колонии.
Размножаясь, они образуют постепенно расширя-
ющиеся концентрические кольца. В то же время
мутанты, утратившие способность к движению
или определению градиента концентрации ат-
трактанта, размножаются только в месте ино-
куляции. Кроме мутантов с повреждением жгу-
тиков (Fla-) или аппарата движения (Mot-),
выделены мутанты трех других классов с наруше-
нием хемотаксиса: 1) мутанты, сохранившие спо-
собность к вращению жгутиков, но не реагирую-
щие па какие-либо хемотаксические стимулы; они
рассматриваются как не обладающие хемотакси-
сом (Che-). Для этих мутантов характерно по-
стоянное вращение жгутика по часовой стрелке
или против нее и полное отсутствие смены на-
правления вращения либо ее низкая частота. Они
несут дефект либо в системе переключения мото-
ра, либо в компоненте центральной регуляторной
системы, общей для разных хсмосспсоров. Эта
центральная система состоит из продуктов генов
che, обозначенных ChcA, CheW, CheY и CheZ;
2) мутанты, имеющие дефекты в системе распо-
знавания ограниченного набора стимулов. Эти де-
фекты влияют на один из четырех известных хе-
мосенсоров, или МаБХ, а именно Tsr (таксис в
отношении серина и репеллентов), Таг (таксис в
отношении аспартата и репеллентов), Trg (таксис
в отношении рибозы и галактозы) и Тар (таксис
в отношении олигопептидов) и 3) мутанты, специ-
фически неспособные к хемотаксису в результате
дефектов в отдельных хсморсцспторах, таких как
белки, связывающие мальтозу или галактозу.
Хемотаксис, зависимый от МаБХ, иницииру-
ется связыванием химических веществ с сенсо-
ром—МаБХ, называемым также передатчиком
сигнала (рис. 20.24). Инициация ответа с уча-
стием МаБХ пе зависит пи от метаболизма, ни
от транспорта веществ. Каждый белок — пере-
датчик сигнала содержит два трансмембранных
участка (вероятно, в виде «-спиралей) с пахо-
Рис. 20.23. Использование среды для роения при изу-
чении бактериального таксиса.Чашки Петри заполня-
ют полужидкой агаровой средой (0,25% агара), со-
держащей в качестве источников углерода D-маннитол
(100 мкМ) и D-сорбитол (100 мкМ). После инокуляции
суспензией клеток (примерно 5 107) и инкубации при
30 °C наблюдается следующее: 1) неподвижные клетки
остаются на месте, образуя четкое пятно (вверху сле-
ва), 2) подвижные клетки, не способные определять на-
личие в среде углеводов, распространяются случайным
образом и образуют колонию в виде диска с размытым
контуром (вверху справа) и 3) клетки дикого типа (вни-
зу), определяя присутствие более подходящего субстра-
та (D-маннитола) и утилизируя его в процессе роста,
создают градиент его концентрации и перемещаются в
сторону возрастания его концентрации, образуя четкие
(наружные) концентрические кольца. Другие клетки ди-
кого типа, «не успевшие на поезд», образуют вторич-
ную популяцию, которая растет в направлении повы-
шения градиента концентрации менее благоприятного
субстрата, D-сорбитола, и образуют вторичные (внут-
ренние) концентрические кольца. Клетки, остающиеся
в центре колонии,—это мутанты, не способные к дви-
жению или к определению наличия какого-либо из двух
использованных субстратов. Популяция изогенных бак-
териальных клеток в этом процессе разделяется на две
физиологически различные стабильные субпопуляции
(«эффект поддержания»). (Фото любезно предоставле-
но R. Lux.)
дящсйся между ними периплазматической гид-
рофильной последовательностью. Она образует
петлю, которая служит участком связывания раз-
личных аттрактантов и репеллентов и обуслов-
ливает специфичность передатчика. Связывание
лиганда с периплазматической аминокислотной
последовательностью в составе МаБХ приводит,
по-видимому, к изменению конформации транс-
мембранных «-спиральных сегментов и цито-
плазматического сегмента молекулы этого белка-
620 Часть V. Экспрессия генов и механизмы регуляции
передатчика. Наиболее консервативным участком
молекул всех четырех МаБХ является именно
этот С-концевой цитоплазматический домен; он
взаимодействует с белками CheA и CheW. Та-
ким образом, периплазматический сегмент моле-
кулы МаБХ, связывающий лиганды, представля-
ет собой вариабельный домен для восприятия вхо-
дящего сигнала, тогда как цитоплазматический
участок — консервативный домен вывода сигнала.
Этот домен вывода может находиться в двух сиг-
нальных состояниях: одно из них вызывает вра-
щение жгутикового мотора по часовой стрелке,
другое — против. Выделены мутанты, у которых
индивидуальные МаБХ фиксированы в одном из
этих состояний. Анализ подобных мутаций по-
могает идентифицировать соответствующие сиг-
нальные домены.
20.5.5. Центральная регуляторная единица,
контролирующая переключение
жгутикового мотора, состоит
из элементов двухкомпонентной системы
У мутантов Е. coli, лишенных всех белков Che,
жгутиковый мотор вращается только в направ-
лении против часовой стрелки. Для восстапов-
Рис. 20.24. Зависимый от МаБХ хемотаксис у энте-
робактерий. При стимуляции аттрактантом (вверху сле-
ва) метил-акцептирующие сенсорные белки хемотаксиса
(МаБХ) передают сигнал через мембрану на внутрикле-
точный сигнальный домен, фиксируя его в CCW-конфи-
гурации (вращения против часовой стрелки). Это состо-
яние подавляет взаимодействие данного домена через
белок CheW с передатчиком сигнала CheA и обеспечива-
ет зависимое от S-аденозилметионина (SAM) метилиро-
вание ферментом, действующим с низкой скоростью,—
метилтрансферазой CheR — по четырем остаткам глу-
тамата (ф). Если метилирование произошло (адапта-
ция), аттрактант диссоциирует от МаБХ либо с МаБХ
связывается репеллент. В результате сигнальный до-
мен переходит во вторую конфигурацию, вращения по
часовой стрелке (CW), и образует комплекс с белка-
ми CheW и CheA. При этом инициируется аутофосфо-
рилирование белка CheA и фосфорилирование перво-
го принимающего сигнал белка, CheY. Белок P-CheY
стабилизирует жгутиковый мотор в состоянии CW (ку-
выркание) до тех пор, пока фосфат не будет отщеплен
фосфатазой CheZ. Освободившийся мотор возвраща-
ется в основное состояние (CCW), и клетка вновь со-
вершает пробежку. Параллельно с этими быстрыми со-
бытиями (^100 мкс) Р—CheA фосфорилирует второй
принимающий сигнал белок, CheB, контролирующий
метилэстеразную активность. В активированной фор-
ме белок P-CheB деметилирует все клеточные МаБХ —
состояние, определяющее вращение жгутиков по ча-
совой стрелке (этот процесс занимает до 10 мин).
Полное деметилирование вызывает возвращение сиг-
нального домена в основное состояние, т. е. происхо-
дит адаптация. Периодическое кувыркание у не стиму-
лированных или адаптированных клеток обусловлено,
по-видимому, замедленным повторением того же цикла,
что при реакции на стимул. Диссоциация репеллента со-
ответствует положительному стимулу. Обозначения, как
на рис. 20.16.
ления кувыркания необходим по меньшей мере
белок CheY, тогда как для восстановления ре-
гулярной последовательности пробежка/кувырок
требуются дополнительно белки CheA, CheW и
CheZ. Белок CheA функционирует при хемо-
таксисе как центральная единица, осуществля-
ющая процессинг сигнала. Подобно другим пе-
редающим сигнал доменам двухкомпонентных
систем, он аутофосфорилируется по остатку ги-
стидина в ATP-зависимой реакции. Фосфори-
лированный CheA передает фосфогруппу на.
остаток аспарагиновой кислоты в составе ассо-
циированного с ним белка CheY, принимающего
сигнал. В присутствии P-CheY возрастает время
вращения жгутикового мотора по часовой стрел-
ке, поскольку, но-видимому, блокируется его пе-
Глава 20. Общие регуляторные сети и пути передачи сигналов 621
реключспие. Молекулярный механизм переклю-
чения жгутикового мотора между состояниями
вращения по часовой стрелке и против, а так-
же роль в нем фосфорилированного белка CheY
пока неизвестны; по-видимому, в этом механизме
участвуют белки FliG, FliM и FliN.
На аутокиназпую активность Che А влияют пе-
редающие сигнал домены белков МаБХ, и для
этого также необходим белок CheW (рис. 20.24).
При связывании аттрактанта с МаБХ (или при
любом другом положительном стимуле) сигналь-
ный домен переходит в состо.чние, определяющее
вращение жгутика против часовой стрелки. Эта
форма предотвращает или резко снижает ауто-
фосфорилирование CheA. Напротив, связывание
МаБХ с репеллентом (или любой другой отри-
цательный стимул) переводит сигнальный домен
в состояние CW. Это приводит к формирова-
нию белками CheW и CheA комплекса с высокой
аутокиназной активностью и образованию внача-
ле фосфо-CheA, а затем фосфо-CheY. Фосфори-
лированные формы этих эффекторов сохраняют-
ся лишь короткое время, что особенно выражено
в присутствии белка CheZ. Он обладает фосфа-
тазпой активностью и специфически дефосфори-
лируют молекулы фосфо-CheY, связанные с бел-
ками — переключателями жгутикового мотора.
В этой модели, предложенной для пути пе-
редачи сигнала, зависимого от метил-акцепти-
рующих белков хемотаксиса, предполагается, что
передающий сигнал белок CheA и принимающий
сигнал белок CheY составляют центральную ре-
гуляторную единицу двухкомпонентной системы,
контролирующую переключение жгутикового мо-
тора, и каждый МаБХ связан со вспомогательным
белком, сопрягающим рецептор МаБХ с передат-
чиком сигнала CheA. Наличием таких сложных
систем можно объяснить распознавание аттрак-
тантов и репеллентов, а также интеграцию эф-
фектов положительных и отрицательных стиму-
лов.
20.5.6. Адаптация к стимулам,
воспринимаемым МаБХ, зависит
от метилирования/деметилирования
этих белков бактериальной «памяти»
Метил-акцептирующие белки хемотаксиса содер-
жат несколько остатков глутаминовой кисло-
ты, которые подвергаются обратимому мети-
лированию. Эти остатки локализованы вблизи
линкерного участка между периплазматическим
рецепторным доменом, воспринимающим сиг-
нал, и цитоплазматическим доменом, передаю-
щим сигнал. Сайты метилирования распознают-
ся двумя модифицирующими ферментами, спе-
цифичными для МаБХ: CheR и CheB. Первый
представляет собой метилтрансфсразу, перенося-
щую с низкой скоростью, но постоянно метиль-
ные группы от S-аденозилметиопина (SAM) на
карбоксильные боковые цепи остатков глутамино-
вой кислоты в составе МаБХ с образованием глу-
тамилметилового эфира. Второй фермент — это
метилэстераза, гидролизующая метиловые эфиры
с образованием свободного метилового спирта.
Степень метилирования каждого МаБХ опре-
деляется относительной активностью белков
CheR и CheB. В отсутствие стимула метилирова-
на примерно половина всех сайтов. При положи-
тельном стимулировании метилируется большин-
ство сайтов; при отрицательном — лишь немногие.
Молекула МаБХ, связанная с аттрактантом, яв-
ляется плохим субстратом для фермента CheB,
но хорошим—для фермента CheR. Поскольку
активность CheR постоянна, кратковременные
флуктуации в степени метилирования всех МаБХ
определяются изменениями активности CheB.
Этот фермент содержит рецепторный домен, ана-
логичный домену CheY, т. е. способен фосфори-
лироваться с участием CheA по остатку аспара-
гиновой кислоты с повышением при этом эсте-
разной активности. Как схематически показано
на рис. 20.24, положительные стимулы подав-
ляют фосфорилирование CheA и, следователь-
но, CheB. Короткоживущие фосфорилированные
формы CheA и CheB превращаются в пефозфори-
лировапиые, что приводит к снижению метилэсте-
разной активности, в то время как CheR продол-
жает с низкой скоростью метилировать остатки
глутаминовой кислоты. Отрицательные стимулы,
напротив стимулируют фосфорилирование CheA
и активируют более эффективно действующий по
сравнению с CheR белок CheB, который вызывает
результирующее деметилирование всех МаБХ.
Изменения в степени метилирования МаБХ
обеспечивают сенсорную адаптацию, но не вно-
сят какого-либо вклада в ипцукцию ответной ре-
акции жгутикового мотора. Таким образом, у му-
тантов с дефектами в ферментах CheB и CheR мо-
жет инициироваться ответ жгутиков на стимул,
по эта реакция не прекращается, пока химиче-
ский стимул не удален. Напротив, у клеток ди-
622 Часть V. Экспрессия генов и механизмы регуляции
кого типа реакция происходит лишь до тех пор.
пока не будет достигнут соответствующий уро-
вень метилирования МаБХ. Согласно существу-
ющим гипотезам, изменения в степени занято-
сти рецептора вызывают переход передающих
доменов МаБХ либо в состояние CCW (поло-
жительный сигнал), либо в состояние CW (от-
рицательный сигнал); изменения в степени ме-
тилирования сдвигают процесс переключения в
противоположном направлении для прекращения
ответной реакции, например путем разобщения
рецепторного и сигнального доменов. В соответ-
ствии с этим предположением мутанты, лишен-
ные ферментов CheR и CheB, имеют фенотип
Che“ и постоянно совершают пробежку или ку-
вырки.
Сенсорная адаптация в системе хемотаксиса
носит характер постоянного процесса, позволяю-
щего клетке сравнивать во времени прежние и
новые условия существования. Адаптация устра-
няет последнюю реакцию на воздействие, и клет-
ка получает возможность реагировать на любое
повое изменение в концентрации химического эф-
фектора. Сочетание быстрой передачи сигнала с
более медленной отменой реакции па воздействие
составляет биохимическую основу бактериальной
памяти. Ее длительность достигает у быстрорас-
тущих клеток Е. coli 15 мин или 3/4 времени ге-
нерации, что согласуется с продолжительностью
жизни бактериальной клетки.
20.5.7. У энтеробактерий действует несколько
путей передачи сигнала при хемотаксисе
Описанный путь передачи сигнала, зависимый от
МаБХ, — это не единственный механизм хемотак-
сиса у энтеробактерий (рис. 20.25). Мутанты, ли-
шенные МаБХ или ферментов CheR и CheB, со-
храняют способность к хемотаксису в отношении
углеводов — субстратов ФТС, а также акцепто-
ров электронов, например кислорода. Сенсора-
ми в этих случаях служат компоненты транс-
портных систем и метаболических путей, которые
«имеют дело» со стимулирующими хемоэффек-
торами. Такие не зависимые от МаБХ системы,
по-видимому, воспринимают стимулы, обеспечи-
вающие удовлетворение основных потребностей
клеток при росте, например в источнике энер-
гии, кислороде и других акцепторах электронов
или в наличии света в случае фотосинтезирую-
щих бактерий. При хемотаксисе, зависимом от
ФТС, эффект положительной стимуляции оказы-
вают поглощение и фосфорилирование субстрата,
осуществляемые ферментом II. Одного лишь свя-
зывания субстрата недостаточно для инициации
хемотаксического ответа; внутриклеточное накоп-
ление фосфосахаров или интенсивное метаболи-
зирование стимулирующего субстрата при этом
также ие играет роли. Мутанты, лишенные фер-
мента I или белка НРг, ие обнаруживают реак-
ции хемотаксиса в отношении субстратов ФТС,
даже если у них имеется фермент II, способный
связывать субстраты. Таким образом, имеющиеся
данные свидетельствуют о том, что при хемотак-
сисе, зависимом от ФТС, сигналом служит быст-
рое снижение уровня фосфорилирования фермен-
та I вследствие транспорта субстрата с участием
фермента II. По-видимому, накапливающийся дс-
фосфорилированный фермент I подавляет актив-
ность киназы CheA, в результате чего снижается
уровень фосфо-CheY. В свою очередь это способ-
Рис. 20.25. Энтеробактерии обладают нес-
колькими механизмами передачи сигналов
хемотаксиса. В процессе поглощения и фос-
форилирования многих углеводов с участи-
ем фермента II (ЕН) накапливаются дефос-
форилированные белок НРг и фермент I
(EI). В этой форме EI подавляет аутофос-
форилировэние передающего сигнал белка
CheA и кувыркание. Поэтому углеводы —
субстраты ФТС служат аттрактантами и
вызывают положительный хемотаксис. Ре-
акция на кислород (аэротаксис) и на ак-
цепторы электронов требует, по-видимому,
участия компонентов дыхательных цепей
и недавно открытого МаБХ Аег, а так-
же хорошо известного МаБХ Tsr и цен-
тральных регуляторных элементов — бел-
ков CheA, CheW и CheY.
Глава 20. Общие регуляторные сети и пути передачи сигналов 623
2твуст движению клеток (пробежкам) и вызывает
положительную реакцию хемотаксиса.
Реакции таксиса, зависимые от электронтрапс-
тортной цепи, в том числе аэротаксис, пока ма-
ло изучены. Для большинства свободноживущих
эактерий реакция на акцепторы электронов или
вещества, влияющие па скорость транспорта элек-
тронов, может быть важна в связи с необхо-
димостью поддержания организмом постоянства
протондвижущей силы (Др)- В этом типе так-
сиса часто трудно отличить прямое влияние на
жгутиковый мотор от воздействий на компонен-
ты пути передачи сигнала. В хемотаксисе, за-
висимом от транспорта электронов, участвуют
открытые недавно МаБХ, получившие обозна-
чение Аег (от aerotaxis and energy responses),
а также белки Tsr. Сенсорный компонент си-
стемы должен включать элементы дыхательной
цепи, т. е. для реакции на кислород необхо-
дим активный транспорт электронов. Как извест-
но, в различных условиях роста бактерии син-
тезируют цитохромоксидазы и редуктазы, специ-
фичные, например, для кислорода, нитрата или
фу мара га. Однако разнообразные цепи перено-
са электронов имеют общие компоненты, облег-
чающие интеграцию различных сенсорных сигна-
лов, например определяемых как общее измене-
ние окислительно-восстановительного потенциала
компонента цепи электронного транспорта. Тако-
го рода сенсор, возможно, представляет собой бе-
лок, реагирующий на изменения окислительно-
восстановительного потенциала, потока энергии
или протондвижущей силы.
Молекулярные механизмы этих хемотаксиче-
ских реакций остаются неизвестными, однако их
физиологическое значение очевидно. При росте
Е. coli в анаэробных условиях в присутствии
нитрата как акцептора электронов аттрактанта-
ми для клеток служат нитрат и присутствую-
щий в низкой концентрации кислород. При ро-
сте в аэробных условиях этот организм утрачива-
ет реакцию на нитрат, по сохраняет реакцию па
кислород. Аналогичную реакцию обнаруживает
Rhodobacter sphaeroides, растущий аэробно. В то
же время па фотосинтезирующие бактерии кисло-
род действует на свету как репеллент. Для многих
облигатных анаэробов он даже в следовом количе-
стве служит репеллентом, тогда как па факульта-
тивные анаэробы и строгие аэробы действует по-
добным образом только в высокой концентрации.
Общая закономерность состоит в том, что таксис,
зависимый от транспорта электронов, у большин-
ства бактерий способствует поиску условий, обес-
печивающих максимальную энергизацию клеток,
и пребыванию в этих условиях.
20.5.8. Другие бактерии могут обладать иными
компонентами механизма фототаксиса
Наряду с тем, что достигнуты существенные
успехи в изучении механизмов хемотаксиса, за-
висимого от белков МаБХ, у энтеробактерий,
у прокариот в целом поразительно разнооб-
разные поведенческие реакции, связанные с
движением и таксисом, как и их физио-
логическое значение, остаются малоисследо-
ванными. На разнообразие подобных реак-
ций указывает, например, то, что у Bacillus
subtilis зависимый от белков МаБХ меха-
низм хемотаксиса, хотя и сходен с аналогич-
ным механизмом энтеробактерий, включая в
качестве центральных компонентов белки — ана-
логи CheA п CheY, отличается от него тем не
менее по многим деталям. Два основных отли-
чия— это обращение процесса генерации кувыр-
каний и большая сложность механизма адап-
тации. Положительный стимул у В. subtilis не
подавляет, но, напротив, активирует белок CheA
с образованием фосфо-CheY, который блокиру-
ет переключатель мотора в положении вращения
против часовой стрелки и таким образом вызыва-
ет пробежку. При адаптации к положительному
стимулу происходит перенос метильных групп от
белков МаБХ к неидентифицировашюму регуля-
торному белку и, возможно, белкам жгутикового
мотора. Однако в отличие от энтеробактерий,
в механизме таксиса у В. subtilis не участву-
ет белок, подобный CheZ. В случае пурпурной
несерной бактерии Rhodobacter sphaeroides, обла-
дающей единственным латеральным жгутиком,
периоды движения чередуются с остановками.
Клетки содержат белки МаБХ и, вероятно, эк-
виваленты белков CheA, CheB и CheY. При по-
вышении концентрации любого лимитирующего
метаболита скорость вращения жгутика и, сле-
довательно. скорость передвижения возрастают
примерно на 20%. Такое поведение получило на-
звание хемокинез. Оно способствует распростра-
нению популяции бактерий в присутствии мета-
624 Часть V. Экспрессия генов и механизмы регуляции
болита. Все метаболиты служат аттрактантами,
тогда как неметаболизируемые соединения, да-
же если они транспортируются внутрь клетки, пе
вызывают ответной реакции. Клетки, плывущие
с большей скоростью, реагируют, кроме того, на
градиенты метаболитов посредством хемотакси-
са. Сенсорная система его, сходна, по-видимому,
с двухкомпонентными системами, известными у
других бактерий.
У бактерий, сходных с энтеробактериями
по размерам клеток и механизму движения —
В. subtilis, Caulobacter crescentus (см. разд. 24.1)
и Rhizobium meliloti, обнаружены белки, функцио-
нально подобные МаБХ и Che. Клетки Myxococcus
xanthus, имеющие удлиненную форму, переме-
щаются путем скольжения по поверхности твер-
дых субстратов. Одна из стадий вегетативно-
го роста этого организма представляет собой
одиночные клетки (или небольшие группы кле-
ток), обладающие механизмом подвижности А (от
«Adventurous»). На стадии образования плодо-
вых тел крупные скопления клеток перемещают-
ся по механизму S (от «Social») с низкой скоро-
стью (2-4 мкм/мин) и каждые 7-8 мпн меняют
направление скольжения. Выделены мутанты Frz
(от названия морфологии колоний «frizzy»), кото-
рые меняют направление движения либо редко,
либо с повышенной частотой. Они соответству-
ют с/ге-мутантам Е. coli, совершающим либо про-
бежки, либо кувырки. Продукты мутантных ге-
нов Frz весьма сходны с соответствующими бел-
ками МаБХ, белками адаптации CheB и CheR, а
также бейками CheW и CheA. Белок CheA связан
у М. xanthus с белком CheY посредством линкера
Pro-Ala. Обнаружено также обратимое фосфори-
лирование и метилирование белков, которое ка-
тализируют белки, передающие сигнал. Очевид-
но, что эта система действует на основе информа-
ции об условиях питания (голоданье индуцирует
образование плодовых тел) и плотности популя-
ции (см. разд. 20.1.4) для регуляции подвижно-
сти клеток в обеих фазах роста. Механизм соци-
альных поведенческих реакций у подобных «мно-
гоклеточных» прокариот можно рассматривать
как производный относительно систем обычно-
го хемотаксиса и одноврек енно как предшествен-
ник механизмов морфопоэза и дифференцировки,
которые сопровождаются высокоупорядоченпым
перемещением клеток (или таксисом), напомина-
ющим поведение многоклеточных эукариотиче-
ских организмов (см. гл. 25).
20.5.9. У архей фототаксис и хемотаксис
осуществляются как
интегрированные сенсорные процессы
Многие фотоавтотрофы, как бактерии, так и
археи, реагируют па свет по механизму фототак-
сиса. Классический фотоответ у бактерий пред-
ставляет собой фоботаксическое поведение (реак-
ция избегания), в результате которого клетки из-
меняют направление движения при попадании на
участки, освещаемые светом с низкой интенсив-
ностью или неблагоприятной длины волны. Об-
ращая направление движения, они скапливают-
ся в участках с оптимальной освещенностью и
длиной волны света. В большинстве исследова-
ний фототаксиса используют крупные палочко-
видные или спиралевидные организмы с полярны-
ми жгутиками (папример, Rhodobacter) или нит-
чатые цианобактерии, обладающие скользящим
движением (Anabaena, Phormidium и другие). Как
установлено, бактериохлорофиллы могут выпол-
нять роль фоторецепторов и компоненты элек-
тронтранспортной цепи — роль передатчиков сиг-
нала. На молекулярном уровне эти процессы де-
тально пока пс изучены.
Особый интерес вызывает механизм фото-
таксиса у археи Halobacterium salinarum, по-
скольку в нем участвует уникальный для мира
прокариот фотосспсор и реакция происходит на
основе интеграции световых и химических стиму-
лов. В фотобиохимических процессах у галобак-
терий участвуют ретипальсодсржащие пигменты
родопсины: бактериородопсин (Бр) — светоза-
висимая протонная помпа, генерирующая необхо-
димую для синтеза АТР протондвижущую силу
(см. разд. 13.4); галородопсип (Гр) — светозави-
си.лая хлоридная помпа и два сенсорных родоп-
сина — I и II (СР I, СР И). Первичная фотохими-
ческая реакция в молекулах всех четырех родоп-
синов представляет собой изомеризацию трапс-
ретиналя в его 13-цис-изомер с конформацион-
ным изменением белка. Таким образом, рстиналь
выполняет роль светозависимого переключателя
двух сигнальных состояний (on/off) в молекулах
этих сенсорных родопсинов.
При экспоненциальном росте клетки Н. sa-
linarum несут полярный пучок жгутиков; вра-
щаясь по часовой стрелке (CW), он обеспечи-
вает движение клетки вперед, против часовой
стрелки (CCW) — назад. В отсутствие стимула
происходит периодическое переключение направ-
Глава 20. Общие регуляторные сети и пути передачи сигналов 625
ления вращения жгутиков и соответственно дви-
жение вперед — назад. Изменение направления,
по-видимому, носит пассивный характер и проис-
ходит из-за небольших неоднородностей среды; в
результате клетки перемещаются случайным об-
разом. В аэробных условиях Н. salinarum консти-
тутивно синтезирует белок СР II, но на низком
уровне (400 молекул на клетку), тогда как белок
СР I в клетках отсутствует. В своем основном со-
стоянии СР II (обозначаемый СР II480) поглощает
синий и УФ-свет и претерпевает простой фото-
цикл (рис. 20.26). Этот цикл выполняет роль от-
рицательного сигнала, воспринимаемого пока не
идентифицированным передатчиком. Данная си-
стема служит для предотвращения повреждения
клеток, вызываемого синим и УФ-светом, путем
классической реакции избегания (фоботаксис).
Галобактерий относятся к факультативным
анаэробам. В отсутствие кислорода или аль-
тернативного акцептора электронов они растут,
осуществляя фотосинтез. Способность к фотосин-
тезу для них жизненно важна, поскольку в их
природных местообитаниях на ярком солнечном
свету (в рассолах и соленых водоемах) парциаль-
ное давление кислорода может быть очень низ-
ким. При снижении содержания О 2 число моле-
кул СР I возрастает от небольшого количества до
4000 на клетку. Этот белок ответствен за пребыва-
ние клеток в области благоприятного оранжевого
света и удаление из области синего света. В ос-
новном состоянии данный фотосснсор (СР I578)
поглощает оранжевый свет и в течение < 1 мкс пе-
реходит в новое, сигнальное состояние (СР I373).
Этот метастабильный промежуточный продукт
вызывает отрицательную реакцию на ближний
УФ-свет. В основное состояние он возвращается
либо в процессе медленного теплового распада,
либо в альтернативной фотохимической реакции
за счет поглощения нового протона. Медленный
переход СР I373 —> СР I578 вызывает положитель-
ную реакцию, т. е. подавляет переключение мо-
тора.
Белок СР I представляет собой интеграль-
ный мембраносвязанный белок (239 аминокислот-
ных остатков), имеющий небольшие цитоплазма-
тические домены-петли. Анализ мутантов с на-
рушением фототаксиса позволил обнаружить пе-
редающий сигнал белок Htrl (от halobacterial
transducer for sensory rhodopsin I), который об-
ладает многими свойствами белков МаБХ эн-
теробактерий. Мутанты Н. salinarum, дефицит-
ные по Htrl, не реагируют положительно на свет
и не обнаруживают характерного светоиндуци-
рованпого деметилирования. Вычисленная нук-
леотидная последовательность, кодирующая Htrl,
указывает на высокую мол. массу (56 675), ха-
рактерную для других белков МаБХ, наличие
в белке двух трансмембранных спиралей вблизи
N-конца молекулы и крупного цитоплазмати-
ческого домена (490 аминокислотных остатков).
Участок из 270 С-концевых аминокислотных
остатков этого домена сходен с сигнальным доме-
ном бактериальных МаБХ (30% гомология). Этот
сходный с бактериальными МаБХ сигнальный
Рис. 20.26. Фототаксис у Halobacterium
salinarum. При фотоциклических пре-
вращениях сенсорного родопсина I
(СР I, реакция на оранжевый свет) и
сенсорного родопсина II (СР II, реакция
на синий свет) аттрактантный (©) или
репеллентный (Q) сигнал поступает на
передатчик: белок Htrl (в случае СР I)
или неидентифицированный компонент
(в случае СР II). Первый, по-видимому,
участвует также в хемотаксисе, тогда
как последний связан с интегратором
сигнала (CheA, CheY), влияющим на
высвобождение внутриклеточного фу-
марата — предполагаемого регулятора
переключения жгутикового мотора.
Адаптация, по-видимому, включает
метилирование/деметилирование, ана-
логично механизму, действующему у
энтеробактерий.
626 Часть V. Экспрессия генов и механизмы регуляции
домен фланкирован характерным образом остат-
ками глутаминовой кислоты, которые служат
сайтами метилирования. Однако в отличие от
других МаБХ, белок Htrl лишен протяженно-
го внемембранного рецепторного домена. Можно
предполагать, что трансмембранные спирали и,
возможно, внецитоплазматический участок из 220
аминокислотных остатков, локализованный меж-
ду этими спиралями, а также сигнальный домен
воспринимают фотохимические стимулы, индуци-
рованные переходами в СР I, и передают эту ин-
формацию на сигнальный домен белка Htrl.
Метил-акцептирующие белки хемотаксиса
участвуют у Н. salinarum в реакциях фототак-
сиса и хемотаксиса (на глюкозу, гистидин, лей-
цин и фенол). Некоторые из них, по-видимому,
участвуют и в хемотаксисе, и в фототаксисе. При
адаптации посредством таксиса весьма вероятна
роль метилирования, однако пока молекулярные
механизмы этих реакций не изучены.
Сигналы от фоторецептора не могут распро-
страняться вдоль мембраны в виде электрических
импульсов, поскольку реакция на стимул носит
локальный характер. Возможно, роль сигналов
выполняют Са2+, cGMP, G-бслок или, что наи-
более вероятно, фумарат. Равномерно передви-
гающийся мутант Н. salinarum лишен фактора
переключения, быстро накапливающегося в клет-
ках дикого типа в ответ на отрицательный фо-
тостимул. Фактор переключения, идентифициро-
ванный как фумаровая кислота, восстанавлива-
ет у этого мутанта переключение жгутикового
мотора. При отрицательной стимуляции в клет-
ках галобактерий быстро накапливается фумаро-
вая кислота (в количестве примерно 70 000 мо-
лекул на клетку и 370 молекул на квант синего
света) за счет ее высвобождения из клеточно-
го пула мембраносвязанных молекул. Накопле-
ние фумарата требует присутствия белков СР I
и СР II и не связано с его оборотом в цикле
трикарбоновых кислот. Эти данные указывают,
что концентрация свободной фумаровой кислоты
в цитоплазме может регулировать переключение
жгутикового мотора. Если концентрация фума-
рата отражает суммарный эффект всех внеш-
них фото- и хемотаксических стимулов, его
внутриклеточный пул можно рассматривать как
предполагаемый интегрированный сигнал (см.
рис. 20.26), т. е. периодическими колебаниями это-
го пула может объясняться регулярное переклю-
чение направления движения клеток. Таким обра-
зом, молекулярный анализ данной сенсорной си-
стемы архей указывает на присутствие в ней эле-
ментов бактериальных систем передачи сигнала.
Однако возможное участие фумарата в качестве
способного к диффузии второго посредника ско-
рее имеет аналогию с механизмами передачи сиг-
нала в эукариотических клетках, где эту функцию
выполняют Са2+, cGMP, сАМР, инозитол-3-фос-
фат и другие малые молекулы.
Дополнительная литература
AlexL.A., Simon M.I. (1994) Protein histidine
kinase and signal transduction in prokaryotes and
eukaryotes. Trends. Genet. 10: 133-138.
Armitage J. P., Lackie J.M., eds. (1990) Biology of the
chemotactic response. Society for General Microbio-
logy Symposium, vol. 46. Cambridge, New York:
Cambridge University Press.
Bremer H., Ehrenberg M. (1995) Guanosine tetraphos-
phate as a global regulator of bacterial RNA synthe-
sis: a model involving RNA polimerase pausing and
queuing . Biochim. Biophys. Acta 1262: 15-36.
Chuang S.-E., Daniels D. L., Blattner F. R. (1993) Global
regulation of gone expression in Escherichia coli.
.1. Bacteriol. 175: 2026-2036.
Hoch .1. A., Silhavy T. J.,eds. (1995) Two-component
signal transduction. Washington, DC: ASM Press.
Hueck C. .J., Ilillen W. (1995) Catabolite repression in
Bacillus subtilis: a global regulatory mechanism for
the Gram-positive bacteria? Mol. Microbiol. 15: 395-
401.
Kjellberg S. (1993) Starvation in bacteria. New York:
Plenum Press.
Kolb A., BusbyS., Buc IL, GargesS., AdhyaS. (1993).
Transcriptional regulation by cAMP and its receptor
protein. Annu. Rev. Biochem. 62: 749-795.
Kurjan .1., Taylor B.L., eds. (1995) Signal transduction.
San Diogo: Academic Press.
Lengener J. W., Jahreis K. (1996) Phosphotransferase
system or PTSs as carbohydrate transport and
as signal transduction systems. In: Konings W. N.,
KabackH.R., Lolkema J. S.(eds.) Handbook of bio-
logical physics, vol. 2. Amsterdam: Elsevier: 573-598.
Lin E. С. C., Lynch A. S., eds. (1995) Regulation of gene
expression in Escherichia coli. Austin. Tex: Landes.
Manson M. D., Armitage .1. P., Hoch .1. A., Macnab R. M.
(1998) Bacterial locomotion and signal transduction.
.1. Bacteriol. 180: 1009-1022.
Neidhardt F. C., Ingraham J. L., Schaechter M. (1990)
Physiology of the bacterial cell: a molecular approach.
Sunderland, Mass.: Sinauer Associates: 351-388.
Глава 20. Общие регуляторные сети и пути передачи сигналов 627
Parkinson J.S., Kofoid Е. С. (1992) Communication mo-
dules in bacterial signalling. Annu. Rev. Genet. 26:
71-112.
Piggot P. J., Moran Jr., С. P., Youngman P., eds. (1994)
Regulation of bacterial differentiation. Washington,
DC: ASM Press.
PostmaP. W., Lengeler J. W., lacobsonG.R. (1993)
Phosphoenolpyruvate: carbohydrate phosphotransfe-
rase system of bacteria. Microbiol. Rev. 57: 543-594.
Salmond G. P. C., Bycroft B. W., Stewart G. S. A., Wil-
liams P. (1995) The bacterial «enigma»: cracking the
code of cell-cell communication. Mol. Microbiol. 16:
615624.
Schuster S. C., KahnS. (1994) The bacterial flagellar
motor. Annu. Rev. Biophys. Biomol. Struct. 23: 509 -
539.
Sonebshein A. L., Hoch J. A., LosickR., eds. (1993)
Bacillus subtilis and other Gram-positive bacteria.
Washington, DC: ASM Press.
Spudich J. (1993) Color sensing in the Archaea: a
eukaryotic-like receptor coupled to a prokaryotic
transducer. J. Bacteriol. 175: 7755-7761.
SvitilA.L., Cashel M., Zyskind J.W. (1993) Guanosine
tetraphosphate inhibits protein synthesis in vivo: a
possible protective mechanism for starvation stress in
Escherichia coli. J. Biol. Chem. 268: 2307-2311.
Torriani-Gorini A., Yagil E., Silver S., eds. (1994)
Phosphate in microorganisms: cellular and molecular
biology. Washington DC: ASM Press.
Wagner R. (1994) The regulation of ribosomal RNA
synthesis and bacterial cell growth. Arch. Microbiol.
161: 100-109.
Ward M. J., Zusman D. R. (1997) Regulation of directed
motility in Myxococcus xanthus. Mol. Microbiol. 24:
885-893.
Источники рисунков
I. SawersR. G., Zehelein E., Bock A. (1988) Arch.
Microbiol. 149: 240-244.
2. Epstein W., Naono S., Gross F. (1966) Biochem.
Biophys. Res. Commun. 24- 588-592.
3. Ishizuka H , HanamuraA., KunimuraT., Aiba H
(1993) Mol. Microbiol. 10: 341-350.
4. Epstein W., Rothman-Denes L. B., Hesse J. (1975)
Proc. Natl. Acad. Sci. USA 72: 2300-2304.
5. Okinaka R. T., Dobrogosz W. J. (1967) Bacteriol. 93:
1644-1650.
6. Postma P. W., Lengeler J. W., Jacobson G. R. (1993)
Microbiol. Rev. 57: 543-594.
7. Parkinson J. (1993) Cell 73- 857-871.
Глава 21
Регуляция процессов брожения и дыхания
В предыдущих главах книги, где рассматривает-
ся важнейшая роль кислорода в различных ме-
таболических процессах и эффекты его токсич-
ных реакционноспособных форм (гл. 4, 9-12),
основное внимание уделено биохимическим ме-
ханизмам реакций с участием О2 и его произ-
водных. В данной главе описываются сенсорные
и регуляторные системы, участвующие в регуля-
ции связанных с этими реакциями генов, в основ-
ном у энтеробактерий, поскольку у других бак-
терий эти системы мало изучены (можно пред-
полагать, что они не отличаются принципиально
от рассматриваемых здесь систем регуляции; см.
гл. 34).
21.1. Существует три основных механизма аккумуляции
метаболической энергии
Механизм получения необходимой для метабо-
лизма энергии можно представить как последо-
вательность биохимических реакций, в которых
электроны поэтапно переносятся от положитель-
ного «полюса» к отрицательному в замкнутой це-
пи. Такой поток электронов происходит либо в
реакциях дисмутации, протекающих в цитоплаз-
ме (например, при гликолизе), либо в цепи пере-
носа через плазматическую мембрану с участием
переносчиков и внешнего акцептора электронов
(например, при дыхании). Микробные процессы
превращения энергии можно расположить в со-
ответствии с уровнем их эффективности и пред-
полагаемой очередностью появления в ходе эво-
люции следующим образом: брожение, анаэ-
робное дыхание, аэробное дыхание. Однако
следует отметить, что когда доминирующий путь
оказывается недостаточным для сброса элек-
тронов, у прокариот могут действовать дру-
гие, вспомогательные или альтернативные пути.
Принцип состоит в том, что микробные клет-
ки способны максимально использовать преиму-
щества данной энергетической ситуации, т. е.
окисление внешнего акцептора для них пред-
почтительнее, чем получение энергии в реакци-
ях дисмутации, а при наличии нескольких ко-
нечных акцепторов электронов (внешних окис-
лителей) преимущественно используется акцеп-
тор с наиболее высоким окислительно-восста-
новительным потенциалом (см. табл. 4.1). Здесь
механизмы регуляции энергетического метабо-
лизма рассматриваются главным образом на
примере Escherichia coli. Однако следует пом-
нить, что эволюция носит явно выраженный оп-
портунистический характер и реализует почти
любой потенциально возможный регуляторный
механизм. В то же время несмотря на все разно-
образие весьма вероятно, что специфические ме-
ханизмы регуляции брожения и дыхания коорди-
нируются у других организмов системами общего
контроля, аналогичными тем, которые обнаруже-
ны у Е. coli.
21.1.1. При анаэробном росте за счет
брожения запасание энергии
обеспечивается субстратным
фосфорилированием
В процессах брожения с использованием в
качестве субстратов сахаров, например глюко-
зы, энергия запасается в реакциях субстратного
фосфорилирования (см. гл. 3), и при этом окис-
лительно-восстановительное равновесие поддер-
живается за счет реакции дисмутации. Цен-
тральным метаболитом в этом процессе слу-
Глава 21. Регуляция процессов брожения и дыхания 629
жит фосфоенолпировиноградная кислота (ФЕП),
этап синтеза которой отделяет реакции об-
разования восстановительных эквивалентов
(т. е. пар Н+/е~) от реакций их использова-
ния. Среди трех типов энергетического мета-
болизма наиболее древний, по-видимому, бро-
жение, на что указывают следующие фак-
ты: 1) фосфорилированные промежуточные
продукты и коферменты (например, триозофос-
фаты, NADH/NAD+ и ADP/ATP) участвуют во
многих других метаболических процессах как ос-
новные компоненты живых систем; 2) роль глю-
козы как универсального субстрата возникла,
вероятно, благодаря стабильности ее кольце-
вой структуры, ограничивающей возможность
нежелательного спонтанного (некатализируемо-
го) гликозилирования белков; 3) гликолиз широко
распространен у живых организмов, и многие со-
единения используются в нем как источники уг-
лерода и энергии.
При сбраживании одной молекулы глюко-
зы до фосфо енол пиру вата образуются две мо-
лекулы АТР (из ADP и Р; путем субстратного
фосфорилирования) и четыре восстановительных
эквивалента. Восстановительные эквиваленты за-
тем утилизируются в нескольких терминальных
путях, берущих начало от ФЕП. Относительный
поток через каждый из этих путей варьирует со-
ответственно условиям роста.
21.1.2. Анаэробное дыхание — это
мембраносвязанный процесс
без участия кислорода
Возникновение дыхательной электронтранспорт-
ной цепи, связанной с мембраной, открыло но-
вую возможность получения энергии, благодаря
тому что осуществляемые в ней окислительно-
восстановительные реакции сопряжены с выходом
протонов из цитоплазмы (см. гл. 4), т. е. создани-
ем протонного потенциала (протондвижущей си-
лы, Др). Появление такого источника энергии бы-
ло связано с добавлением флавинов, хинонов и ге-
мов к набору биологически активных соединений
(см. гл. 4, 11 и 12).
Хотя транспорт протонов через мембрану
обеспечивается в первую очередь дыханием, сле-
дует учитывать, что метаболические превраще-
ния в процессе брожения также могут вносить
вклад в образование Др. Например, протонный
потенциал может возрастать в результате любых
реакций, вызывающих подщелочение цитоплаз-
мы. Один из примеров этого — гидрогеназная ре-
акция:
2Н+ + 2е" Н2
Другой пример — выделение из клетки лакта-
та совместно с протоном системой симпорта
лактат/Н+.
21.1.3. Наиболее эффективный способ
получения энергии — аэробное дыхание —
появилось на более позднем
этапе эволюции
Развитие аэробного дыхания началось, вероятно,
вскоре после появления фотосинтеза с образова-
нием С>2- Эффективность аэробного дыхания про-
является в повышении не только скорости роста,
но и выхода биомассы. Возможно, этот эффектив-
ный способ получения энергии сделал некоторых
древних аэробов полезными эндосимбионтами
эукариот, впоследствии превратившимися в ми-
тохондрии. В совокупности процессы брожения,
анаэробного дыхания и аэробного дыхания можно
рассматривать как различные пути превращений
центрального метаболита пирувата и переносчика
электронов NADH.
Основные метаболиты, участвующие в различ-
ных путях получения метаболической энергии, —
это ФЕП и пируват. Наиболее вероятно, что в
ходе эволюции возникновение типов энергети-
ческого метаболизма происходило в следующей
последовательности: брожение, анаэробное
дыхание, аэробное дыхание. Эта гипотеза со-
гласуется, во-первых, с «принципом Горовица»,
гласящим, что метаболические пути, теснее свя-
занные с центральным метаболизмом, должны
были появляться раньше, чем более удаленные
от него, и, во-вторых, с необходимостью увеличе-
ния количества коферментов для развития более
эффективных процессов.
630 Часть V. Экспрессия генов и механизмы регуляции
И Глюкоза
NADH
Рис. 21.1. Схема путей брожения у Escherichia coli, ил-
люстрирующая баланс восстановительных эквивален-
тов (NADH и FADH2). Аск —АТР:ацетат-фосфотранс-
фераза, или ацетаткиназа, кодируемая геном аскА,
Adh— алкогольдегидрогеназа, или этанол:МАС+-окси-
доредуктаза, кодируемая геном adhE; FdhH — форми-
атдегидрогеназа F, кодируемая геном fdhF; этот белок
является частью комплекса формиат-гидроген-лиазы,
включающего также белки НусВ, НусС, HycD, НусЕ,
HycF и HycG, кодируемые опероном hyc (локализа-
ция в хромосоме — 58,8 мин); Frd — фумаратредукта-
за, кодируемая геном frdABCD; FumB — фумаратгид-
ратаза В, или фумараза В — изофермент, синтезируе-
мый в анаэробных условиях и кодируемый геном fumB;
НусЕ — гидрогеназа 3, кодируемая геном hycE; Ldh —
D-лактатдегидрогеназа, или 0-лактат:ЫАО+-оксидоре-
дуктаза, кодируемая геном IdhA; Mdh— малатдегидро-
геназа, или малат:МАО+-оксидоредуктаза, кодируемая
геном mdh; Pfl— пируват:формиат-лиаза, кодируемая
геном pfl; Ррс — фосфоенолпируват-карбоксилаза, ко-
дируемая геном ррс; Pta — фосфотрансацетилаза, коди-
руемая геном pta; PykA и PykB — пируваткиназы А и В,
кодируемые генами рукА и рукВ.
21.2. Регуляция брожения включает общий
и специфический контроль экспрессии генов
У Е. coli, осуществляющей брожение смешанного
типа, из ФЕП и пирувата как основных интерме-
диатов образуются в качестве конечных продук-
тов сукцинат, D-лактат, ацетат, этанол, формиат,
СОг и Н2 (рис. 21.1). Соотношение этих конеч-
ных продуктов меняется в зависимости от условий
питания и других факторов внешней среды; по-
ка закономерности его варьирования и лежащий
в основе этого механизм регуляции па уровне экс-
прессии генов во многом не ясны.
21.2.1. При росте в анаэробных условиях важную
роль выполняет общий регулятор Fnr
Акроним Fnr (ген fnr) означает восстановление
фумарата/нитрата (от fumarate nitrate reduc-
tion). Белок Fnr выполняет роль общего регу-
лятора транскрипции, обеспечивающего эффек-
тивное использование путей брожения и/или
анаэробного дыхания, главным образом тех, ге-
ны которых организованы в модулон fnr.
Этот белок активирует многочисленные оперо-
ны, функционирующие в анаэробных услови-
ях, и подавляет некоторые опероны, необходи-
мые только в аэробных условиях (табл. 21.1).
Он высокогомологичен белку Сгр (cyclic АМР
receptor protein, белок — акцептор сАМР), по от-
личается от него высоким содержанием остат-
ков цистеина в N-копцевой части цепи. Весь-
ма сходны также узнаваемые этими двумя бел-
ками консенсусные ДНК-последовательности в
промоторах-мишенях: домен, узнаваемый бел-
ком Fnr (Fnr-бокс), содержит инвертирован-
ный повтор длиной 5 п.н. TTGAT--------АТСАА,
и, подобно этому, домен, узнаваемый белком Сгр
(Crp-бокс), содержит повтор TGTGA-----ТСАСА
(см. разд. 18.5).
По-видимому, именно ген сгр был первым про-
дуктом эволюции, обеспечивающим преимуще-
ственное использование наиболее выгодных ис-
точников углерода и энергии (широко распростра-
ненных и богатых энергий) еще в то время, когда
молекулярный кислород отсутствовал в атмосфе-
ре Земли. С появлением кислорода из дублика-
та гена сгр эволюционным путем образовался ген
fnr, обеспечивающий преимущественное исполь-
зование наиболее выгодных источников энергии.
В бактериальных белках семейства Fnr име-
ется высококонсервативная структура — кластер
Глава 21. Регуляция процессов брожения и дыхания 631
Рис. 21.2. Схематическое изображение активной и неак-
тивной форм белка Fnr. В анаэробных условиях белок
Fnr содержит ион Fe2+ и проявляет активность регу-
лятора транскрипции, связываясь в форме димера с
промотором-мишенью. В аэробных условиях происходит
окисление Fe2+ до Fe3+ и белок теряет активность. Ион
Fe3+ может оставаться связанным с белком Fnr или об-
разовывать хелат с другим соединением.
из четырех остатков цистеина, с которым связан
атом железа, и через этот атом белки Fnr реа-
гируют па окислительно-восстановительные усло-
вия среды. Когда атом железа находится в форме
Fe(II), белок функционально активен как регуля-
тор транскрипции (рис. 21.2); при окислении же-
леза-состояние Fe(III) — конформация белка из-
меняется и он теряет активность. Как установле-
но, металл-кофактор окисляется непосредственно
молекулярным кислородом; его физиологический
восстановитель пока неизвестен.
Белок Fnr служит общим регулятором транс-
крипции, реагирующим на окислительно-восста-
новительные условия среды. Он функциональ-
но активен, когда связанный с ним атом желе-
за находится в восстановленной форме, Fc(II), и
в анаэробных условиях активирует многочислен-
ные опероны, входящие в модулон fnr.
21.2.2. В процессе брожения стимулируется
образование D-лактата из пирувата
NAD ^-зависимая оксидоредуктаза D-лактата
(ген IdhA) катализирует окисление пирувата с об-
разованием D-лактата при использовании NADH
в качестве донора электронов (см. разд. 12.2).
Уровень этого фермента наиболее высок при
росте в условиях брожения, т. е. при низком
pH; обеспечивающие это механизмы регуляции
остаются неясными. Интересно, что у мутантов,
лишенных этого фермента, не наблюдается на-
рушения роста. По-видимому, клетки бактерий
обладают значительным выбором конечных реак-
ций брожения (см. ниже).
21.2.3. Путь расщепления пирувата
строго регулируется
Ключевую реакцию брожения катализиру-
ет пируват:формиат-лиаза (формиат-С-ацетил-
трансфераза), расщепляющая пируват с образо-
ванием ацетил-СоА и формиата (см. рис. 21.1 и
разд. 12.2). Ген этого фермента кодируется оперо-
ном pfl\ его экспрессию контролируют семь про-
моторов, благодаря чему уровень синтеза фер-
мента при переходе от аэробного дыхания к бро-
жению может изменяться в 15 раз. Транскрипцию
гена активирует белок Fnr совместно с общим ре-
гулятором АгсА (в фосфорилированной форме;
см. разд. 21.4). Экспрессия гена pfl в анаэробных
условиях может дополнительно возрастать при
добавлении пирувата. Транскрипцию этого опе-
рона подавляет нитрат, эффект которого опосре-
дует белок NarL (в фосфорилированной форме;
см. разд. 21.3). Следует отметить, что несмотря
на важность пути расщепления пирувата и чет-
кого контроля оперона pfl посредством белка Fnr,
мутант, у которого отсутствует этот общий регу-
лятор, все же способен расти за счет брожения в
среде с глюкозой, хотя и с меньшей скоростью.
Этот слабый рост можно значительно стимулиро-
вать добавлением ацетата.
Пируват: формиат-лиаза подвергается обрати-
мому посттрансляционному превращению из ак-
тивной (в анаэробных условиях) в неактивную
(в аэробных условиях) форму. Активазу этого
фермента кодирует ген act. Дезактивация ак-
тивированной формы лиазы происходит при се
физическом взаимодействии с этанолдегидрогена-
зой, кодируемой геном adhE. Биологическое зна-
чение феномена дезактивации неясно. Возможно,
избыток дегидрогеназы регулирует лиазу по меха-
низму отрицательной обратной связи. Не исклю-
632 Часть V. Экспрессия генов и механизмы регуляции
Таблица 21.1. Гены модулонов fnr и агсА. «+» — положительная регуляция; «—»—отрицательная регуляция;
О — отсутствие эффекта; НД — нет данных. По Guest J. R., Green J., Irvine A. S., Spiro S. (1996) The fnr modulon and
Fnr-regulated gene expression (317-337); Lynch A. S., Lin E. С. C. (1996) Responses to molecular oxygen (361-373). In:
Lin E. С. C., Lynch A. S. (eds.) Regulation of gene expression in Escherichia coli. Austin, Texas: Landes
Опероны-мишени Фермент/функция Регуляторные эффекты белков
Fnr АгсА-фосфат
асеВАК Малатсинтаза, изоцитрат-лиаза и киназа/фосфатаза нд —
изоцитратдегидрогеназы
асп Аконитаза НД —
агсА АгсА (ответный регулятор) + 4-
cydAB Цитохром d-оксидаза — +
cyoABDCE Цитохром о-оксидаза — —
d'ms ABC Диметилсульфоксидредуктаза + 0
dcuB-fumB Транспорт дикарбоновых кислот и фумараза В + НД
fdnGHI Формиатдегидрогеназа N + —
fnr Fnr (общий регулятор) — НД
fumA Фумараза А (аэробные условия) 0 —
fumB Фумараза В (анаэробные условия) + НД
frdABCD Фумаратредуктаза + 0
glpACB sn-Глицерол-З-фосфат-дегидрогеназа (анаэробные условия) + 0
gbpD sn-Глицерол-З-фосфат-дегидрогеназа (аэробные условия) 0 —
gltA Цитратсинтаза НД —
hyaA-F Гидрогеназа 1 0 +
hypBCDE-fhlA Гидрогеназная активность и регуляция формиатом — нд
icd Изоцитратдегидрогеназа нд —
lid (IctD) L- лактатдегидрогеназа 0 —
mdh Малатдегидрогеназа нд —
narGHJI Нитратредуктаза + 0
narX NarX (сенсорный белок) — нд
ndh NADH-дегидрогеназа II — нд
nirBDC NADH-зависимая нитритредуктаза + НД
nrfA-G Формиат-зависимая нитритредуктаза + нд
pdhR-aceEF-lpd Пируватдегидрогсназный комплекс и регулятор — —
pfl Пируват:формиат-лиаза + +
sdhCDAB Сукцинатдегидрогеназа — —
sodA М n-зависимая супероксиддисму газа — —
sucAB а-кетоглутаратдегидрогеназа нд —
sucCD Сукцинат-тиолкиназа нд —
чено также, что этот способ регуляции обеспечи-
вает сохранение лиазы и дегидрогеназы в аэроб-
ных условиях.
Пируват:формиат-лиаза находится под
двойным контролем: ее синтез регулируют на
уровне транскрипции белки Fnr, NarL и АгсА; ак-
тивность синтезированного фермента регулирует-
ся путем его активации активазой Act и дезакти-
вации этанолдегидрогеназой AdhE.
21.2.4. Метаболизм ацетил-СоА в соответствии
с его центральной ролью регулируется
на многих уровнях
Конечным продуктом метаболизирования ацетил-
СоА может быть либо этанол, либо ацетат. Эта-
нол образуется в результате двух последователь-
ных реакций восстановления с участием двух мо-
лекул NADH. У многих прокариот эти реакции
катализируют два различных фермента, однако
Глава 21. Регуляция процессов брожения и дыхания 633
у Е. coli происходит следующая обратимая ре-
акция, катализируемая одним крупным фермент-
ным комплексом:
Ацетил-СоА + 2NADH <->
2 Этанол + 2NAD+ (21.1)
Этот фермент (кодируемый геном adhE) называ-
ют этанолдегидрогеназа или алкогольдегидроге-
наза, однако, если исходить из физиологической
функции, его следовало бы называть ацетил-СоА-
редуктаза. По-видимому, благодаря тому, что эти
две связанные реакции катализирует один и тот
же фермент, накопление свободного ацетальдеги-
да, токсичного из-за его высокой химической ак-
тивности (см. гл. 12), сведено к минимуму.
Экспрессия гена adhE регулируется па уровне
транскрипции. Активность этого фермента в про-
цессе анаэробного роста может возрастать бо-
лее, чем в 10 раз. По-видимому, действуют два
различных, примерно равных по значению меха-
низма регуляции его транскрипции: 1) при вы-
соком соотношении NADH/NAD+, на которое
может реагировать некий регуляторный белок,
происходит стимуляция транскрипции и 2) сис-
тема NarX/NarL осуществляет подавление тран-
скрипции (см. разд. 21.3.1). Экспрессия гена adhE
регулируется также и на уровне трансляции; фи-
зиологическое значение этого неясно. Для син-
теза данного фермента необходимо расщепление
РНКазой III шпилечной структуры в молеку-
ле мРНК. Помимо трансляционного контроля,
действует механизм деградации фермента при
аэробном метаболизме. Находящийся в активном
центре(-ах) ион Fe(II) вызывает саморасщепление
фермента, катализируя образование из перокси-
да водорода реакционноспособных кислородных
радикалов (см. разд. 21.5). Уменьшение времени
полужизни этого фермента в аэробных услови-
ях способствует поступлению ацетил-СоА в цикл
трикарбоновых кислот, благодаря чему предот-
вращается бесполезная трата источников углеро-
да и энергии на образование этанола.
При росте клеток в анаэробных условиях
ацетил-СоА превращается в ацетилфосфат по
альтернативному пути с участием фосфотранса-
цетилазы (кодируемой геном pta). Присоединение
фосфорильной группы ацетилфосфата к ADP с
помощью ацетил киназы (кодируемой геном аскЛ)
приводит к образованию АТР. Образовавшийся
ацетат высвобождается из клеток, по-видимому
путем симпорта с Н+, судя по тому что при этом
генерируется протонный потенциал (см. гл. 5).
На уровень активности трансацетилазы и кина-
зы аэробные условия почти не влияют, вероят-
но потому, что данный путь частично служит
для использования экзогенного ацетата в качестве
субстрата дыхания. Возможно, также, что одной
из причин отсутствия здесь регуляции является
значительная утечка ацетата в среду в процессе
аэробного роста с использованием глюкозы.
В зависимости от условий роста метаболизм
ацетил-СоА может приводить к образованию в
качестве конечных продуктов этанола или ацета-
та. Основную роль в превращениях ацетил-СоА
выполняют этанолдегидрогеназа и ферменты ме-
таболизма ацетилфосфата. Переключение меж-
ду этими двумя путями метаболизма. ацетил-СоА
осуществляется с помощью различных механиз-
мов, контролирующих уровень синтеза соответ-
ствующих ферментов и их активность. Слож-
ность механизма регуляции отражает централь-
ную роль данного интермедиата в катаболических
процессах.
21.2.5. В регуляции метаболизма формиата
участвуют внутриклеточный формиат
и селеноцистеин
Внутриклеточный формиат либо превращается
в СО2 + Н2, либо просто выделяется из кле-
ток. Реакцию расщепления формиата катали-
зирует формиат-гидроген-лиаза. Этот фермент
представляет собой комплекс белков, включаю-
щий формиатдегидрогеназу Н (кодируемую геном
fdhF) и гидрогеназу 3 (кодируемую геном hycE).
Совместное действие этих ферментов приводит к
превращению формиата в СО2 и Щ. Механизм
выделения формиата, возможно, аналогичен пу-
ти выделения ацетата.
Число компонентов формиат-гидроген-лиазы
как сложного мембрапосвязанного комплекса точ-
но пока не установлено (см. гл. 12). Остаются
неидентифицированными около десяти генов, ко-
дирующих субъединицы этого комплекса и бел-
ки, участвующие в его созревании; эти гены
распределены в дивергентных оперонах hyc и
hyp. Для проявления каталитической активности
формиат-гидроген-лиазы необходимы молибден-
634 Часть V. Экспрессия генов и механизмы регуляции
содержащий кофактор, Ni и Fe. Интересная осо-
бенность формиатдегидрогеназы Н состоит в
присутствии остатка ранее неизвестной амино-
кислоты селеноцистеина (содержащая вместо
серы, в отличие от цистеина, селен) в положе-
нии 140 от N-концевого аминокислотного остат-
ка; эту аминокислоту кодирует кодон UGA. Дан-
ный внутренний кодон терминации предназначен
для включения селеноцистеина в белок с участи-
ем тРНКБес и нескольких факторов трансляции.
Если методами генной инженерии заменить селе-
ноцистеин в этом ферменте на цистеин, величина
Acat снижается на два порядка по сравнению с
ферментом дикого типа. При pH 7 атом Se в мо-
лекуле ссленоцистеина присутствует главным об-
разом в форме аниона, в отличие от атома серы
в цистеине, присутствующего в нем в протониро-
ванной форме. Биохимическая функция селепо-
цистеина пока не установлена.
Уровень активности данной лиазы при аэроб-
ном росте существенно снижен, тогда как в слу-
чае анаэробного роста опероны fdhF, hyc и hyp
активируются под действием регуляторного бел-
ка FhlA. Этот белок частично гомологичен бел-
кам— ответным регуляторам в составе двухком-
попсптных систем регуляции и реагирует на при-
сутствие формиата как на сигнал. Варьирование
уровня индукции при различных условиях анаэ-
робного роста зависит, по-видимому, в первую
очередь от внутриклеточной концентрации фор-
миата, однако как именно воспринимается этот
параметр, неизвестно. Картину еще более услож-
няет участие недавно открытого регуляторного
белка, кодируемого геном fhlB. Быстро развиваю-
щиеся исследования раскрывают все более слож-
ный механизм регуляции на уровне транскрип-
ции. Например, оказалось, что Fnr-связывающий
участок гена hypA ответствен за активацию опе-
рона hypDCDE. Еще более удивительным обра-
зом регуляция транскрипции оперонов fdhF, hyc
и hyp полностью зависит от альтернативной субъ-
единицы ст54 (кодируемой геном rpoN). Это долж-
но означать, что регуляция брожения происходит
координированно с азотным метаболизмом и сами
эти метаболические пути с их регуляторными ме-
ханизмами являются результатом конвергентной
эволюции процесса азотфиксации (восстановле-
ния N2 до аммиака) при строго анаэробных усло-
виях. Осуществляющий фиксацию N2 фермент
нитрогеназа чрезвычайно чувствителен к присут-
ствию Ог-
Формиат-гидроген-лиазная активность регули-
руется на уровне синтеза фермента с участием
системы, которая, по-видимому, определяет уро-
вень формиата; кроме того, в регуляции участву-
ют белки Fnr, RpoN (<т54) и другие общие регуля-
торы. Данная лиаза содержит остаток необычной
аминокислоты — селеноцистеина.
21.2.6. Образование сукцината из ФЕП
в анаэробных условиях обеспечивает
утилизацию восстановительных
эквивалентов
Как наиболее эффективные пути утилизации вос-
становительных эквивалентов при анаэробном ме-
таболизме можно рассматривать образование сук-
цината или этанола из пирувата: в каждом из
этих случаев перенос четырех атомов Н (вос-
становительных эквивалентов) позволяет регене-
рировать 2 молекулы NAD+ из двух молекул
NADH, образующихся в процессе превращения
глюкозы в пируват, и, таким образом, обеспе-
чить непрерывное потребление сахара. Четырех-
углеродный остов молекулы сукцината форми-
руется в результате конденсации трехуглерод-
ного предшественника, ФЕП, с молекулой СОг
под действием фосфоемолпируват-карбоксилазы
(пирофосфатюксалоацетат-карбоксилазы), коди-
руемой гопом ррс. Продукт реакции — оксалоаце-
тат — восстанавливается до малата под действием
NADH-зависимой оксидоредуктазы (пока окон-
чательно не установлено, является ли она фер-
ментом, кодируемым геном mdh). Малат пре-
вращается затем в фумарат с участием фума-
ратгидратазы В, или фумаразы В (кодируемой
геном fumB и активируемой белком Fnr). Фума-
рат восстанавливается до сукцината фумаратре-
дуктазой (кодируемой опсроном frdABCD) с пере-
носом еще двух восстановительных эквивалентов
см. разд. 21.3.2).
Дополнение 21.1. Брожение, осуществля-
емое Е. coli, относится к смешанному типу:
при росте с использованием углеводов клет-
ки выделяют в среду сукцинат, D-лактат,
ацетат, формиат, этанол, СОг и Нг (см.
гл. 12). Соотношение продуктов изменяется
в зависимости от источника углерода и
физических условий. Гибкость регуляции со-
ответствующих путей указывает па участие
в ней, помимо белка Fnr, нескольких специ-
Глава 21. Регуляция процессов брожения и дыхания 635
фических регуляторов. В противоположность
этому Lactobacillus lactis сбраживает глюко-
зу с образованием только молочной кислоты.
Хотя превращение одного молекулы сахара в
две молекулы молочной кислоты обеспечива-
ет баланс реакций окисления и восстановле-
ния в процессе брожения, все шесть атомов
углерода в конечном итоге выделяются в сре-
ду. Поэтому данная бактерия нуждается в до-
полнительных источниках питания для обес-
печения процессов анаболизма и не способна
расти за счет брожения в среде с глюкозой
как единственным источником углерода.
21.2.7. Разнообразие образуемых различными
бактериями продуктов брожения
весьма велико
Помимо названных продуктов брожения извест-
но и множество иных, образуемых другими
бактериями соединений, здесь не упоминаемых.
Например, Klebsiella pneumoniae выделяет диаце-
тил и ацетоин, Clostridium kluyveri — бутират и
бутанол, различные бактерии образуют пропио-
нат (см. гл. 12). Регуляция экспрессии участвую-
щих в этих процессах генов в большинстве случа-
ев пока слабо изучена.
21.3. Анаэробное дыхание требует участия сложной регуляторной сети
В процессе анаэробного дыхания пируват ме-
таболизируется как по пути с участием пиру-
ват:формиат-лиазы, так и по пути с участием
пируватдегидрогепазы. Акцепторами электронов
при этом служат фумарат, диметилсульфоксид
(ДМСО), триметиламин-Х-оксид (ТМАО), нит-
рит или нитрат. Если они присутствуют в смеси,
их использование происходит одновременно, одна-
ко предпочтительно потребляется нитрат как ак-
цептор с наиболее высоким окислительно-восста-
новительным потенциалом (см. табл. 4.1). В этих
случаях основным продуктом пути метаболизма,
инициируемого лиазой, является ацетат, что поз-
воляет избежать бесполезного образования D-лак-
тата и этанола. Для переключения с брожения
на анаэробное дыхание необходимо кооперативное
действие нескольких общих регуляторов; кроме
того, они же обеспечивают преимущественное по-
требление нитрата в качестве конечного акцепто-
ра при наличии наряду с ним других акцепторов.
21.3.1. В регуляции анаэробного дыхания
участвуют две двухкомпонентные
системы, реагирующие на нитрат
и нитрит
За редкими исключениями, экспрессия генов, свя-
занных с анаэробным дыханием, требует участия
активаторного белка Fnr. Если в качестве акцеп-
торов электронов используются нитрат и нитрит,
в регуляцию включаются регуляторы транскрип-
ции из семейства белков Nar. Эта аббревиату-
ра предложена для обозначения процесса восста-
новления нитрата (nitrate reduction). Белки Nar
опосредуют два параллельных пути передачи сиг-
нала: с участием NarX (мембранный сенсорный
белок)/NarL (цитоплазматический ответный ре-
гулятор) и с участием NarQ (мембранный сенсор-
ный белок)/NarP (цитоплазматический ответный
регулятор). Интересно, что нитрат стимулирует
аутофосфорилировакие обоих сенсорных белков,
NarX и NarQ, и появление у них киназной ак-
тивности в отношении NarP и NarL, тогда как
нитрит стимулирует, с одной стороны, опосре-
дуемое NarQ фосфорилирование NarP, и с дру-
гой стороны, опосредуемое NarX дефосфорилиро-
вание NarL-фосфата (рис. 21.3). Как и в случае
других двухкомпонентных систем, только фосфо-
рилированные формы NarL и NarP (т. е. NarL- и
NarP-фосфат) функционируют в качестве ре-
гуляторов транскрипции (табл. 21.2). Влия-
ние каждого фосфорилированного регулятора на
промоторы-мишени зависит от их нуклеотидной
последовательности. Сайтом, распознаваемым
NarL-фосфатом, предположительно служит кон-
сенсусная ДНК-последовательность TACYNKT
(где Y —это С или Т и К —А или С).
636 Часть V. Экспрессия генов и механизмы регуляции
Таблица 21.2. Гены модулонов NarL и NarP. «+» — положительная регуляция; «—»—отрицательная регуляция;
О — отсутствие эффекта; НД — нет данных. NarL-фосфат активирует оперон nrfABCDEFG в присутствии нитрита и
репрессирует в присутствии нитрата. По: Darwin A. J., Stewart V. (1996) In: Lin Е. С. С., Lunch A. S. (eds.) Regulation
of gene expression in Escherichia coli. Austin, Texas; 343-359
Опероны-мишени Фермент/функция Регуляторные эффекты белков
NarL-фосфат NarP-фосфат
adhE Алкоголь(этанол)дегидрогеназа — нд
dmsABC Диметилсульфоксидредуктаза — ИД
fdnGHI Формиатдегидрогеназа N + +
frdABCD Фумаратредуктаза — 0
modABCD Поглощение молибдата + нд
пар-сст Периплазматическая нитратредуктаза — +
narGHJI Н итратредуктаза + 0
narK Выделение нитрита + 0
narXL Регуляция нитратом и нитритом + +
nirBDC N A DI 1-нитритредуктаза + +
nrfABCDEFG Формиат:нитрит-редуктаза +/- 4-
nuoA-N NADH-дегидрогеназа I + +
Pfl Пируват:формиат-лиаза — —
Рис. 21.3. Упрощенная модель регулируемых белка-
ми Nar процессов передачи сигнала. NarX и NarQ—
сенсорные киназы, субстратами которых служат от-
ветные регуляторы NarL и NarP. Фосфорилирован-
ные формы этих белков (NarL- и NarP-фосфат), об-
разованные с затратой АТР, стимулируют или инги-
бируют транскрипцию оперонов-мишеней: оперона fdn
(кодирующего комплекс формиатдегидрогеназы N),
оперона МА (кодирующего фумаратредуктазу), опе-
рона napF (кодирующего периплазматическую нитра-
тредуктазу) и оперона narQ (кодирующего основной
комплекс нитратредуктазы). Сплошными стрелками
показано влияние нитрата или нитрита на степень фос-
форилирования сенсорных киназ, штриховыми стрелка-
ми— влияние NarL- или NarP-фосфата на транскрип-
цию с промоторов (р) оперонов-мишеней; «+»— ак-
тивация; « —» — репрессия (другие обозначения, как
на рис. 20.16). Нитрат стимулирует фосфорилирование
NarL и NarP всеми сенсорными киназами. В отличие от
этого нитрит стимулирует фосфорилирование NarP ки-
назой NarQ, но в то же время и дефосфорилирование
NarL-фосфата ферментом NarX. NarP-фосфат не влия-
ет на экспрессию оперонов narG и МА, но препятствует
репрессии narF-оперона NarL-фосфатом.
Подробно механизмы регуляции транскрипции
белков Nar пока не изучены, но можно предпола-
гать, что общая стратегия действия данной си-
стемы состоит в следующем. С одной стороны,
нитрат должен использоваться предпочтительнее
нитрита в силу его потенциального преимуще-
ства как акцептора электронов. С другой сторо-
ны, нитрит не должен накапливаться выше опре-
деленной концентрации, поскольку он токсичен.
В итоге, при наличии нитрата или нитрита клетке
должно быть энергетически невыгодно использо-
вать другие акцепторы электронов, например фу-
марат (см. табл. 4.1, рис. 21.4 и следующие разде-
лы).
Для функциональной мобилизации системы
Nar необходим, кроме нитрата и нитрита, молиб-
дат в качестве коэффектора. Эта дополнитель-
ная потребность, возможно, связана с тем, что
активация кодирующих нитратредуктазы оперо-
нов, сопряженная с репрессией альтернативных
Глава 21. Регуляция процессов брожения и дыхания 637
путей анаэробного дыхания, самоподавляется при
дефиците молибдена как кофактора каталити-
ческой активности нитратредуктазы.
21.3.2. Экспрессия редуктаз фумарата,
ДМСО и ТМАО определяется
окислительно-восстановительным
потенциалом и наличием субстратов
Эволюционный переход от брожения к анаэ-
робному дыханию, возможно, отмечен появлени-
ем фумаратредуктазы (кодируемой опероном
frdABCD). Этот мембранный ферментный ком-
плекс катализирует реакцию восстановления, со-
пряженную с выбросом протонов в среду (образо-
вание протондвижущей силы). Относительно по-
глощения фумарата как акцептора электронов и
выделения продукта его восстановления, сукци-
ната, пока не установлено, осуществляются ли эти
процессы одной и той же пермеазой дикарбоновых
кислот (см. гл. 12). Убедительных данных в поль-
зу эндогенной индукции оперона frdABCD нет, но
очевидно, что его транскрипцию активирует бе-
лок Fnr и что она существенно подавлена в при-
сутствии нитрата — предпочтительного акцептора
электронов. Это подавление связано с эффектом
NarL-фосфата, но не NarP-фосфата (рис. 21.3).
ДМСО (диметилсульфоксид)-редукта-
зу — еще один молибдофермент — кодирует опс-
рон dmsABC. Экспрессия этого оперона в анаэроб-
ных условиях не зависит от индукции субстратом,
но стимулируется белком Fnr. В присутствии нит-
рата экспрессию данного оперона подавляет си-
стема Nar.
ТМАО (триметиламин-1Ч-оксид)-редук-
тазу кодирует оперон tor АВ С. В значительном
количестве ТМАО присутствует у рыб. Экс-
прессию этого оперона индуцируют в анаэроб-
ных условиях субстраты его продукта: ТМАО,
ДМСО, тетрагидротеофен-1-оксид и пиридин-N-
оксид. Судя по широкой субстратной специфич-
ности фермента, независимости экспрессии дан-
ного оперона в анаэробных условиях от белка Fnr
и преимущественной локализации этого фермента
в периплазме, он участвует в детоксикации, а не в
процессе дыхания. Эту точку зрения подтвержда-
ет то, что активность данного оперона не подав-
ляется системой Nar.
Данных о связи между экспрессией оперо-
нов frdABCD, torABC и dmsABC не имеется,
однако при одновременном присутствии общих
субстратов этих оперонов они утилизируются в
следующем порядке: ДМСО, ТМАО, фумарат.
По-видимому, это зависит от окислительно-вос-
становительного потенциала субстратов и срод-
ства к ним ферментов.
21.3.3. Мембраносвязанная и
цитоплазматическая нитритредуктазы
выполняют различные функции
Существуют два пути шестиэлектронного восста-
новления нитрита до аммиака: основной Nir-путь,
инициируемый цитоплазматической NADH-
зависимой нитритредуктазой (кодируемой оперо-
ном nirBDC), и побочный (минорный) Nrf-путь,
инициируемый мембраносвязанной и формиат-
зависимой нитритредуктазой (кодируемой кла-
стером генов nrf\ см. гл. 12). Цитоплазматический
фермент детоксифицирует нитрит и регенерирует
NAD+, тогда как мембранный фермент дополни-
тельно генерирует протонный потенциал. Оперон
nirBCD активируется как NarL-, так и NarP-фос-
фатом в присутствии нитрата или нитрита (см.
табл. 21.2). R противоположность этому актив-
ность оперона nrfA индуцирует нитрит (при уча-
стии NarL- и NarP-фосфата), но подавляет цит-
рат (что связано, главным образом, с эффектом
NarL-фосфата). Экспрессия обоих оперонов зави-
сит от белка Fnr.
21.3.4. Экспрессия нитратредуктаз зависит
от нескольких общих регуляторов
Бактерии обладают двумя нитратредуктаза-
ми. Основной фермент кодируется опероном
narGHJI. Экспрессию этого оперона, как и оперо-
на fdnGHI (кодирующего формиатдегидрогеназу
N, которая участвует в нитратном дыхании), ин-
дуцируют и нитрат, и нитрит (см. рис. 21.3). Опе-
рон narGHJI высокоэффективно активируется
NarL-фосфатом, но не NarP-фосфатом, тогда как
оперон fdnGHI активируют оба эти регулятора.
Примечательно, что для индуцированной нитра-
том экспрессии оперона narGHJL, но не оперона
fdnGHI, необходим фактор интеграции хозяина
(IHF). Формиат-нитратный путь — это энерге-
тически наиболее эффективный тип анаэробного
638 Часть V. Экспрессия генов и механизмы регуляции
дыхания. В этом пути формиатдегидрогеназа N
выполняет ту же роль, которую формиатдегид-
рогеназа F осуществляет в брожении. Минорную
нитратредуктазу кодирует оперон narZYWV. Для
ее экспрессии не требуется участия регуляторов
системы Nar, но, как и для экспрессии оперона
narGHJI, необходим регуляторный белок Fnr.
Завершая описание регуляторного цикла си-
стемы Nar, необходимо напомнить, что оперон
pfl, кодирующий пируват:формиат-лиазу, репрес-
сируется как NarL-, так и NarP-фосфатом. По-
скольку этот фермент участвует в нескольких
путях брожения, репрессия его синтеза служит
эффективным механизмом подавления брожения
при осуществлении нитратного дыхания.
С появлением нитратредуктазы стало воз-
можным развитие аэробного дыхания. Вероят-
но, в процессе перехода к аэробиозу функ-
ции менахинонов как промежуточных переносчи-
ков электронов постепенно перешли к убихино-
нам (обладающим более высоким окислительно-
восстановительным потенциалом: см. табл. 4.1).
Среди различных акцепторов электронов,
доступных в анаэробных условиях, наиболее
высокий окислительно-восстановительный потен-
циал имеет нитрат. Механизм направления
потока электронов к нитрату основан па способ-
ности фосфорилированного белка NarL, на-
капливающегося в присутствии нитрата, активи-
ровать оперон, кодирующий основную форму нит-
ратредуктазы, и подавлять опероны, кодирующие
другие редуктазы (например, фумаратредукта-
зу). В активации почти всех оперонов, связан-
ных с анаэробным дыханием, участвует регулятор
Fnr. Этот белок выполняет регуляторную роль
также и в отношении некоторых оперонов, участ-
вующих в процессах брожения.
21.4. В регуляции аэробного дыхания участвует двухкомпонентная система
Молекулярный кислород, имеющий окислительно-
восстановительный потенциал +0,82 В, представ-
ляет собой энергетически наиболее выгодный ак-
цептор электронов. В аэробных условиях при сла-
бо выраженной катаболитной репрессии пируват,
образующийся из различных источников угле-
рода, быстро поступает в цикл трикарбоновых
кислот (рис. 21.4). Скорость его потока контро-
лируется комплексом пируватдегидрогеназы, ак-
тивность которого ингибируется NADH и синтез
подавляется в анаэробных условиях.
21.4.1. Сенсорная киназа АгсВ и ответный
регулятор АгсА осуществляют общую
регуляцию аэробного дыхания
Как и в регуляции нитратного дыхания на уровне
транскрипции, в центральной регуляции аэробно-
го дыхания участвует двухкомпонентная систе-
ма, в которой белок АгсВ выполняет роль сен-
сорной киназы и белок АгсА — роль ответного ре-
гулятора (рис. 21.5) (Аге —от aerobic respiration
control). Однако между сенсорными киназами Nar
и Аге существует ряд существенных структурных
различий (см. также рис. 20.17). Сенсорные бел-
ки Nar содержат крупный периплазматический
домен (предположительно несущий рецепторные
сайты для нитрата или нитрита), тогда как в
случае АгсВ в периплазме находится лишь це-
почка из семи аминокислотных остатков, связы-
вающая два трансмембранных сегмента. Другая
существенная особенность АгсВ состоит в том,
что на С-конце классического передающего до-
мена расположен принимающий домен и дисталь-
нее второй передающий домен. Принимающая об-
ласть молекулы АгсВ обнаруживает сходство с
аналогичным участком в молекуле ответного ре-
гулятора АгсА, по лишена участка спираль—ви-
ток— спираль, предназначенного для связывания
с ДНК; второй С-концевой передающий домен
лишь незначительно сходен с основным передаю-
щим доменом. В отличие от АгсВ, как не сходного
с другими сенсорными киназами, белок АгсА име-
ет типичную структуру ответного регулятора.
Глава 21. Регуляция процессов брожения и дыхания 639
Рис. 21.4. Три основные пути аэробного метабо-
лизма, регулируемые системой Аге. Представлены
ферменты цикла трикарбоновых кислот и глиоксилат-
ного шунта, а также конечный участок цепи транспорта
электронов на молекулярный кислород. 1 — пируватде-
гидрогеназа (pdhR, aceEF); 2 — 3-гидроксиацетил-СоА-
дегидрогеназа (зависимая от NAD+); 3 — цитратсинтаза
(g/tA); 4 —аконитаза (асл); 5 — изоцитратдегидроге-
наза (icd); б — 2-кетоглутаратдегидрогеназа (sucAB);
7 — сукцинатдегидрогеназа (sdhCDAB)-, 8 — фумараза А
(fumA)-. 9 — малатдегидрогеназа (mdh); 10 — изоцитрат-
лиаза и малатсинтаза (асеВАК) (оба фермента
кодируются одним и тем же опероном, вместе с си-
стемой киназа/фосфатаза изоцитратдегидрогеназы; см.
разд. 19.3.2); 11 —цитохром о (cyoABCDE) и цито-
хром d (cedAB; терминальные оксидазы убихинола-1);
Н — восстановительный эквивалент; QH2—убихинол-1;
Q — убихинон; @—репрессия общим регулятором АгсА;
©—активация цитохрома d под действием АгсА; чис-
лами обозначены ферменты, репрессируемые (или ак-
тивируемые) белком АгсА.
Рис. 21.5. Модель передачи сигнала с участием си-
стемы Аге. Молекула мембранной сенсорной киназы
АгсВ содержит 778 аминокислотных остатков и име-
ет два трансмембранных участка на N-конце, основ-
ной передающий домен (Т) с консервативным остатком
His-292, принимающий домен (R) с консервативным
остатком Asp-576 и второй передающий домен с
консервативным остатком His-717. Молекула белка —
ответного регулятора, АгсА, содержит 238 аминокислот-
ных остатков и включает принимающий домен с кон-
сервативным остатком Asp-54, а также домен спираль-
виток-спираль, распознающий промотор. Сплошными
стрелками показано направление установленного (жир-
ные стрелки) или предполагаемого (тонкие стрелки)
переноса фосфорильной группы (Р). Фосфорильная
группа каждого рецепторного сайта может подвергать-
ся гидролизу, катализируемому еще не обнаруженным
доменом(-ами) фосфатазы. (Другие обозначения, как
на рис. 20.16.)
Элемент дыхательной цепи?
640 Часть V. Экспрессия генов и механизмы регуляции
21.4.2. Стимулами и эффекторами сенсора АгсВ,
вероятно, служат метаболиты
Стимулы □ Подобно другим сенсорным кина-
зам, белок АгсВ при стимуляции аутофосфорили-
руется с участием АТР. По данным мутационного
анализа, молекулярный кислород сам по себе не
служит стимулом для АгсВ, но этот сенсор реа-
гирует на понижение уровня окисления («окисли-
тельной силы») внутри клетки при создании анаэ-
робных условий. У Е. coli имеются две основные
терминальные оксидазы, восстанавливающие О2:
одна с низким сродством к нему, по высокой Vmax
(ее кодирует оперон cyoABCDE) и другая с вы-
соким сродством к О2, но низкой Vmax (кодирует-
ся опероном cydAB). У двойного мутанта с дсле-
циями генов цитохромов система Аге нечувстви-
тельна к присутствию или отсутствию 02- Таким
образом, белок АгсВ может реагировать на на-
копление какого-либо восстановленного метаболи-
та при недостаточной скорости оттока электронов
(см. разд. 20.5.7).
Затухание сигнала □ После прекращения
стимуляции молекулы АгсВ и Аге А, будучи в фос-
форилированной форме, должны дефосфорили-
роваться, чтобы быть готовыми к восприятию
другого стимула. По имеющимся данным, один
из доменов АгсВ катализирует также реакцию де-
фосфорилирования. Редуцированный белок АгсВ
(лишенный обоих трансмембранных сегментов на
N-конце молекулы) подвергается in vitro быстро-
му фосфорилированию в присутствии АТР без
какого-либо стимула. После исчерпания АТР этот
белок постепенно дефосфорилируется. Напротив,
АгсА-фосфату, образующемуся в результате фос-
форилирования под действием АгсВ, присуща
стабильность. Вероятно, по аналогии с некоторы-
ми другими двухкомпонентными системами, сен-
сорная киназа АгсВ катализирует дефосфорили-
рование АгсА-фосфата — ответного регулятора.
Эффекторы □ Скорость фосфорилирова-
ния укороченного с N-конца белка АгсВ может из-
меняться под действием некоторых метаболитов.
Например, D-лактат и пируват в концентрациях,
близких к внутриклеточным, способствуют фос-
форилированию этого белка. В анаэробных усло-
виях внутриклеточные концентрации D-лактата и
пирувата возрастают, и можно предполагать, что
накопление этих метаболитов приводит к усиле-
нию сигнала через аллостерическое воздействие
на АгсВ. Феномен усиления был подтвержден с
использованием вывернутых (внутренней поверх-
ностью наружу) мембранных везикул, содержа-
щих белок АгсВ.
21.4.3. Предложен гипотетический механизм
передачи сигнала системой белков Аге
Поскольку белок АгсВ содержит три высоко-
консервативных сайта, рецепторных для фосфо-
рильной группы (His-292, Asp-576 и His-717), он
должен существовать в виде нескольких фос-
форилированных форм. Действительно, после
фосфорилирования этого белка 7-фосфорильной
группой АТР, меченной [32Р], метка обнаружи-
вается в остатках гистидина и аспартата. Могут
быть фосфорилированы и оба остатка гистидина,
His-292 и His-717.
Можно предполагать, что передача сигнала
с участием белка АгсВ происходит следующим
образом (рис. 21.5). По данным, полученным
в экспериментах in vivo и in vitro, двухкомпо-
нептпая система Аге передает сигнал посред-
ством реакции переноса фосфорила по цепочке
His-Asp-His-Asp. После воздействия стимула на
мембранный сегмент белка АгсВ консервативный
остаток His-292 в основном передающем домене
подвергается аутофосфорилированию с участием
АТР. Затем фосфорильная группа мигрирует к
консервативному остатку Asp-576 в принимаю-
щем домене. Здесь она может отщепляться в реак-
ции гидролиза или мигрировать к консервативно-
му остатку His-717 во втором передающем домене.
Из этого домена фосфорильная группа может пе-
реноситься па консервативный остаток Asp-54 в
белке АгсА, придавая ему способность к распо-
знаванию промоторов-мишеней. Затухание сигна-
ла также включает реакцию переноса фосфориль-
ной группы: эта группа мигрирует от остатка
Asp-54 в белке АгсА на остаток His-717 в белке
АгсВ и затем на Asp-576, от которого может гид-
ролитически отщепляться (см. рис. 21.5).
Согласно этой модели, такие метаболиты, как
D-лактат и пируват, должны усиливать эффект
поступающего из мембраны сигнала через уве-
личение скорости фосфорилирования белка АгсВ
и соответствующее повышение концентрации
АгсА-фосфата. Это может расширять круг ре-
гулируемых промоторов, а именно включать в
мишени такие промоторы, которые не обладают
высокой связывающей способностью. Сайтом
Глава 21. Регуляция процессов брожения и дыхания 641
узнавания, возможно, служит нуклеотидная по-
следовательность ДНК (A/T)GTTAATTA(A/T).
21.4.4. Модулон аге содержит гены
нескольких метаболических путей
Модулон arc представляет собой семейство
оперонов — мишеней белков Аге, состоящее из
генов многочисленных флавин-содержащих де-
гидрогеназ и ферментов цикла трикарбоповых
кислот, глиоксилатного шунта, пути деградации
жирных кислот и цепи транспорта электронов
(см. табл. 21.1 и рис. 21.4). Два белка последней
группы представлены цитохромами о и d. В по-
давляющем большинстве случаев АгсА-фосфат
выступает в роли репрессора транскрипции.
Одним из наиболее изученных оперонов-
мишеней является оперон cydAB, кодирующий
цитохром d. Для промотора этого оперона белок
АгсА-фосфат служит активатором, белок Fnr —
репрессором. Сложность контроля транскрипции
связана с тем, что кодируемый переносчик элек-
тронов наиболее полезен для клетки при низком
парциальном давлении О2 (составляющем при-
близительно 1% его концентрации в атмосфере).
Подробно механизм, регулирующий транскрип-
цию этого оперона, не изучен, по предваритель-
ные данные свидетельствуют, что результирую-
щее влияние на экспрессию генов определяется
константами диссоциации белков АгсА-фосфат и
Fnr от связывающих их сайтов ДНК, а также ко-
личеством и локализацией этих сайтов.
Система Аге и в меньшей степени систе-
мы Nar модулируют экспрессию генов, связан-
ных с процессами дыхания, в частности кодиру-
ющих дегидрогеназы и переносчики электронов.
Например, под действием этих регуляторных бел-
ков синтез основных дегидрогеназ флавопротеи-
нового типа и терминальных переносчиков элек-
тронов, цитохромов о и d, постепенно снижается
по мере исчерпания 02- Не менее важна регуля-
ция системой Аге центральных путей метаболиз-
ма, например цикла трикарбоновых кислот.
21.5. Аэробный метаболизм связан с образованием
токсичных форм кислорода (кислородный стресс)
Высокий выход энергии, получаемый при аэроб-
ном дыхании, имеет оборотную сторону — небла-
гоприятный побочный эффект участия кислоро-
да, который особенно проявляется при гипербари-
ческих условиях (например, при кислородном фо-
тосинтезе). В процессе восстановления О2 до во-
ды неизбежно образуются реакционноспособные
формы кислорода. Молекулярный кислород мо-
жет акцептировать по одному электрону в каж-
дой из следующих реакций:
+е- +е_ +е~ +е“
02 -> О2* -> Н2О2 -» Н2О + НО" -> Н20
2Н+ Н+ Н+
(21-2)
Пероксид водорода обычно образуется в реак-
циях, катализируемых некоторыми флавиновы-
ми ферментами, О2 ’ (супероксид-радикал) и НО"
(гидроксил-радикал) — как побочные продук-
ты катализа. Именно электронтранспортные це-
пи аэробного дыхания в наибольшей степени от-
ветственны за образование этих токсичных форм
кислорода (см. рис. 11.15).
21.5.1. От окислительного повреждения
микробные клетки защищает
несколько обезвреживающих ферментов
Микробные клетки обладают многочисленными
механизмами для защиты от токсичных веществ
(см. разд. 11.5.2). Например, О2 ’ превращается
под действием супероксиддисмутазы в пероксид
водорода, который в свою очередь разрушается
каталазой.
В то же время не существует ферментов,
защищающих от НО", поскольку этот радикал
настолько химически активен, что повредил бы
множество чувствительных структур еще до по-
падания в активный центр гипотетического обез-
642 Часть V. Экспрессия генов и механизмы регуляции
вреживающего фермента. Радикал НО' образует-
ся при взаимодействии Н2О2 с ионами Fe2+ (глав-
ным образом связанными с белками).
Н2О2 + Fe2+---------> НО’ + Fe3+ (21.3)
Вероятно, НО’-радикал воздействует па боковую
аминокислотную цепь вблизи активного центра,
вызывая необратимую инактивацию белка.
Превращение неблагоприятного фак-
тора в преимущество □ Благодаря «хитро-
умию» природы деструктивная реакция может
обращаться на пользу клетке. Например, оксидо-
редуктазы, катализирующие зависимое от NADH
восстановление карбонильной группы до спирто-
вой в процессе брожения, как правило, содер-
жат в активном центре Fe2+. При переключении
на аэробный метаболизм активность таких фер-
ментов приводит к потере потенциально ценных
метаболитов в результате их выделения. В этих
случаях наличие Fe2+, как саморазрушающего
агента в присутствии Н2О2, становится причи-
ной значительного уменьшения времени жизни
содержащих железо белков, пс требующихся в
этих условиях. Для быстрой адаптации к аэроб-
ным условиям действует также регуляторный ме-
ханизм па уровне транскрипции, как в случае ал-
когольдегидрогеназы (см. разд. 21.2.4). Следует
отметить, что в регуляции активности ферментов,
связанных с NAD+ и необходимых как в аэроб-
ных, так и в анаэробных условиях, вместо ионов
ре2+ участвуют ионы Zn2+, которые не реагиру-
ет с Н2О2. Возможно, в период изобилия Fe2+
(до возникновения кислородного фотосинтеза)
все редуктазы, зависящие от NAD+ и NADH, со-
держали именно этот металл и лишь с накоплени-
ем в среде О 2 начали появляться оксидоредукта-
зы, содержащие Zn2+ и благодаря этому не под-
вергающиеся быстрому разрушению при аэроб-
ном метаболизме.
21.5.2. Химической нейтрализации
токсичных форм кислорода существенно
способствуют ферменты репарации
Существуют и другие способы защиты от окис-
лительного повреждения, в том числе обезврежи-
вание опасных оксидантов в реакциях стехиомет-
рического взаимодействия с метаболитами, таки-
ми как NADPH, NADH, тиоредоксин и глутатион
(см. разд. 11.5.2). Другой путь состоит в репара-
ции поврежденных макромолекул, причем особен-
но успешно в клетках осуществляется репарация
ДНК (см. разд. 15.6).
Данных о способах защиты белков от окис-
лительного повреждения пока немного, по указа-
нием на важность такой защиты можно считать
наличие двух систем общих регуляторных генов,
контролирующих синтез ферментов репарации и
защиты.
Регуляторные гены soxRS и oxyRS
и их модулоны □ Гены soxRS, транскриби-
руемые дивергептно, кодируют регуляторные
белки (рис. 21.6). Регенерируемые окислительно-
восстановительные соединения (например, мена-
дион), опосредующие одноэлектронное восстанов-
ление О2 путем переноса электронов от NADH
или HADPH, активируют белок SoxR, содержа-
щий Fe—S-центр. В свою очередь активирован-
ный SoxR стимулирует транскрипцию гена soxS,
кодирующего общий регулятор SoxS. Белок SoxR
может быть активирован О2 ’ или NO’ (бакте-
рицидные агенты, продуцируемые макрофагами).
Модулон sox кодирует примерно 40 белков, за-
щищающих клетки от окислительного стресса;
их синтез определяется положительной регуля-
цией посредством белка SoxR. Одним из оперо-
пов-мишеней служит оперон sod А (кодирующий
Мп-супероксиддисмутазу). О важности контроля
транскрипции этого оперона свидетельствует уча-
стие в нем по меньшей мерс шести регуляторных
белков.
Еще одна система защиты от окислитель-
ного стресса контролируется генами oxyRS
(рис. 21.7), транскрибируемыми также дивер-
гентпо. Ген oxyR кодирует регуляторный бе-
лок, активируемый зависимым от Н2О2 сигна-
лом или самим этим соединением. Модулон оху
кодирует примерно 20-30 защитных белков, син-
тез большинства из которых зависит от поло-
жительной регуляции на уровне транскрипции.
Одним из оперонов-мишеней здесь служит katG
(кодирующий каталазу HPI). Продукт регулятор-
ного гена oxyS неожиданным образом представ-
ляет собой небольшую молекулу нетранслируемой
мРНК; роль таких мРНК в защите от окислитель-
ного стресса в настоящее время интенсивно изу-
чается (см. также разд. 28.6).
Глава 21. Регуляция процессов брожения и дыхания 643
Рис. 21.6. Модулон soxS и его общий контроль. Редокс-
сигналы активируют белок SoxR, содержащий FeS-ак-
тиватор, регулирующий транскрипцию гена soxR. Белок
SoxS репрессирует собственный синтез (ауторегуляция)
и активирует большинство генов модулона soxS, коди-
рующих примерно 40 белков защиты от окислительного
стресса.
@1
Модулон soxS, включающий:
sodA Mn-содержащая супероксиддисмутаза
fumC Фумараза
аспА Аконитаза
micF Регулятор Отр
плюс примерно 40 белков защиты
от окислительного стресса
Рис. 21.7. Модулон oxyR и его общая регуляция. Об-
щий регулятор OxyR активируется под действием пе-
роксида водорода Н2О2, образующегося, например, из
супероксидного радикала (О2 ) с участием белка SodA,
кодируемого геном sodA (см. рис. 21.6). Активирован-
ный белок OxyR стимулирует транскрипцию модулона
oxyR, кодирующего примерно 20-30 белков, а также ге-
на белка OxyS; все эти белки участвуют в защите от
окисления и в механизмах множественной устойчивости
к антибиотикам (Маг).
4*
Модулон oxyR, включающий
katC Каталаза HPI
ahpCF Алкил-гидропероксидредуктаза
догА Глутатионредуктаза
dps Белок, связывающий ДНК
20-30 генов, кодирующих
и белки защиты от окисления и механизмов
множественной устойчивости
к антибиотикам (Маг)
Функционирование аэробного дыхания созда-
ет для микробных клеток одновременно с вы-
годой и проблему, поскольку приводит к слу-
чайному или регулярному образованию высо-
кореакционноспособных форм кислорода.
Эти агенты могут сильно повреждать нукле-
иновые кислоты, белки и липиды. Для защи-
ты от них микробные клетки обладают несколь-
кими механизмами, включая стехиометрическую
нейтрализацию токсичных компонентов или их
ферментативное разрушение, а также репарацию
повреждений. Детальные исследования окисли-
тельных повреждений на молекулярном уровне
важны, очевидно, и в медицинском отношении,
в связи с тем, что широко распространенная тео-
рия старения человека предполагает, что этот
процесс, по крайней мере частично, вызван про-
грессирующим накоплением поврежденных мак-
ромолекул, избежавших разрушения или репара-
ции.
21.6. Заключение
Становится все более очевидным, что многие
белки полифункциональны: наличие множествен-
ных доменов позволяет им взаимодействовать
с разнообразными макромолекулами. Благодаря
этой особенности клеточных белков достигается
эффект молекулярной экономии. Для выяснения
механизмов генетической и метаболической регу-
ляции микробных ферментов существенно важ-
но раскрыть информационные связи между раз-
личными биохимическими циклами. Поразитель-
644 Часть V. Экспрессия генов и механизмы регуляции
но сложные ответные реакции могут быть резуль-
татом взаимодействия нескольких регуляторов.
Остается неясным, что служит сигналом до-
статочного обеспечения клетки энергией, предот-
вращающим излишнее потребление субстратов.
Неизвестно также, каким образом клетки строят
свой «бюджет», т. е. распределяют количество ор-
ганических субстратов на обеспечение энергетиче-
ских и конструктивных процессов. Представляет-
ся маловероятным, чтобы столь важные решения
определялись только законами термодинамики.
Сторонникам эволюционной гипотезы пред-
стоит проанализировать «археологические слои»
в организации регуляторных сетей, контролиру-
ющих процессы получения энергии у микробов.
Возможно, здесь потребуется установить времен-
ные корреляции между геологическими периода-
ми и гомологией ДНК, РНК и белков. Трудно
представить, каким образом на пути эволюции об-
щие регуляторы согласованно со специфически-
ми регуляторами и оперонами-мишспями должны
были подвергаться бесчисленным и многообраз-
ным адаптационным изменениям, чтобы достичь
существующей эффективности регуляции.
Дополнительная литература
Aristarkhov A., MinulskisA., Belasco J. G., Lin E. С. C.
(1996) Translation of the adhE transcript to produce
ethanol dehydrogenase reguires RNase III cleavage in
Escherichia coli. .1. BacterioL 178: 3427-4332.
Clark D. P. (1989) The fermentation pathways of
Escherichia coli. FEMS Microbiol. Lett. 63: 223-224.
Georgellis D., Lynch A. S, Lin E. С. C. (1997) In vitro
phosphorylation study of the Arc two-component
signal transduction system of Escherichia coli.
J. BacterioL 179: 5429-5435.
Gottschalk G. (1985) Bacterial Metabolism 2nd edn.
Berlin Heidelberg New York: Springer.
Harold F. M. (1986) The vital force: a study of
bioenergetics, Chapter 3. New York: Freeman.
Lin E. C.C., Lynch A.S. Eds. (1996) Regulation of gene
expression in Escherichia coli. Austin, Texas: Landes.
Neidhardt F. C., Curtiss R., Ingraham .1. L., Lin E. С. C.,
Low К. B., Magasanik B., ReznikolTW., Riley M.,
Schaechter M., Umbargcr II. E. (eds.) (1996) Esche-
richia coli and Salmonella: cellular and molecular
biology 2nd edn. Washington DC: ASM Press.
Parkinson .L S., Kofoid E. C. (1992) Communication
modules in bacterial signaling proteins. Annu. Rev.
Genet. 26: 71-112.
Rossmann R., Sawers G., Bock A. (1991) Mechanism of
regulation of the formate-hydrogen lyase pathway by
oxygen, nitrate and pH: definition of the formate
regulon. MoL Microbiol. 5: 2807-2814.
Sonenshein A. L. ed. (1993) Bacillus subtilis and other
Gram-positive bacteria. Biochemistry, physiology and
molecular genetecs. Washington DC: ASM Press.
Spiro S., Guest J. R. (1990) FNR and its role in oxygen-
regulated gene expression in Escherichia coli. FEMS
Microbiol. Rev. 75: 399-428.
Stewart V. (1993) Nitrate regulation of anaerobic
respiratory gene expression in Escherichia coli. MoL
Microbiol. 9: 425-434.
Unden G., Bongaerts J. (1997) Alternative respiratory
pathways of Escherichia coli: energetics and
transcriptional regulation in response to electron
acceptors. Biochim. Biophys. Acta 1320: 217-234.
Оглавление
Предисловие...................................................................... 5
Авторы........................................................................... 8
Биохимическая номенклатура Перевод И. А. Берга .................................. 10
Генетическая номенклатура Перевод И. А. Берга ................................... 14
Глава 1. Бактериология проложила путь клеточной биологии:
исторический очерк............................................................... 18
Г. Шлегель, В. Кёлер. Перевод А. И. Нетрусова
1.1 Развитию биологии способствовали новые гипотезы и экспериментальные
подходы............................................................. 18
1.2 Как возникло предположение о существовании организмов — возбудителей
инфекций............................................................ 19
1.3 Бактерии составляют отдельную большую группу самостоятельных орга-
низмов ............................................................. 20
1.4 Использование плотных сред и методов получения чистых культур произвело
революцию в микробиологических исследованиях........................ 22
1.5 Новые бактериологические методы помогли доказать роль бактерий как воз-
будителей инфекционных болезней..................................... 22
1.6 Изучение процессов брожения положило начало развитию физиологии и био-
химии бактерий...................................................... 23
1.7 Открытие литоавтотрофии — способности бактерий получать энергию при
окислении неорганических соединений и усваивать углерод из углекислоты. 24
1.8 Выяснение природы светозависимых процессов — фототаксиса и фотосинте-
за — потребовало длительного времени................................ 25
1.9 Фиксация молекулярного азота присуща только прокариотам........ 26
1.10 Изучение анаболизма и катаболизма позволило обнаружить субстраты, про-
дукты, апоферменты, коферменты и сами реакции метаболических путей... 27
1.11 Изучение внутриклеточных включений и клеточных стенок прояснило орга-
низацию бактериальной клетки........................................ 29
1.12 Адаптация бактерий была, хорошо известна до открытия молекулярных ме-
ханизмов регуляции.................................................. 30
1.13 Изучение типов бактериального метаболизма выявило их функциональную
роль в биосфере..................................................... 31
646 Оглавление
1.14 Цели и методы классификации бактерий меняются............... 32
1.15 Вирусы бактерий (бактериофаги) были обнаружены как «литические
агенты»......................................................... 33
1.16 Изучение генетического аппарата бактерий стало основой развития молеку-
лярной биологии, включая генные технологии...................... 34
1.17 Заключение.................................................. 35
Часть I. Прокариотическая клетка................................... 39
Глава 2. Клеточная и субклеточная организация прокариот...................... 40
Ф. Майер. Перевод Д. И. HuKumutia
2.1 Клетки прокариот содержат структурные элементы, необходимые для выжи-
вания и размножения............................................. 40
2.2 Клетки бактерий можно визуализировать и идентифицировать различными
способами....................................................... 42
2.3 Прокариоты встречаются в виде отдельных клеток и клеточных ассоциаций 45
2.4 Структурные компоненты клеточных оболочек прокариот служат барьерами
и фазами раздела................................................ 48
2.5 Организация внутриклеточных структур отражает сложность строения про-
кариотической клетки............................................ 58
2.6 Клеточные придатки служат для движения и распознавания...... 64
2.7 Бактерии могут образовывать споры и другие покоящиеся формы. 66
Часть II. Основы жизнедеятельности микробных клеток............. п
А. Крёгер, Г. Фукс. Перевод И. А. Берга
Глава 3. Субстратное фосфорилирование..................................... 72
А. Крёгер. Перевод И. А. Берга
3.1 Синтез АТР сопряжен с экзергоническими реакциями окисления.. 72
3.2 Выход АТР зависит от изменения свободной энергии в сопряженной с фос-
форилированием реакции.......................................... 73
Оглавление 647
3.3 Для сопряжения синтеза АТР с расщеплением глюкозы необходим разрыв
связи С—С и последующее окисление образовавшихся продуктов............ 75
3.4 При субстратном фосфорилировании происходит образование высокоэнерге-
тического соединения.................................................. 77
3.5 Окисление пирувата сопряжено с запасанием энергии................. 80
3.6 Катаболическая роль цикла трикарбоновых кислот состоит в образовании
восстановительных эквивалентов для окислительного фосфорилирования... 81
Глава 4. Электронтранспортное фосфорилирование..................................... 84
А. Крёгер. Перевод И. А. Берга
4.1 При электротранспортном фосфорилировании выход АТР соответствует из-
менению свободной энергии в окислительно-восстановительной реакции .... 84
4.2 Все ATP-синтазы действуют по одному механизму..................... 87
4.3 Дыхательные цепи весьма разнообразны по составу................... 89
4.4 Механизмы сопряжения транспорта электронов и переноса протонов могут
быть различными....................................................... 92
4.5 Фотофосфорилирование происходит при транспорте электронов и переносе
протонов с использованием энергии света............................... 93
Глава 5. Многообразие функций клеточной мембраны у прокариот....................... 94
Р. Кремер. Перевод И. А. Берга
5.1 Барьерная функция мембраны........................................ 94
5.2 Структура и функции транспортных систем связаны с мембраной....... 95
5.3 Механизмы транспорта.............................................. 96
5.4 Кинетический анализ служит методом идентификации и описания транс-
портных процессов..................................................... 98
5.5 Энергетика транспорта с участием переносчика: механизм сопряжения. 99
5.6 Для прокариот характерно большое разнообразие механизмов транспорта.. 100
5.7 Регуляция и разнообразие транспортных систем..................... 112
5.8 Секреция макромолекул............................................ 115
648 Оглавление
Глава 6. Рост и питание............................................................ 117
Г. Фукс, А. Крёгср. Перевод И. А. Берга
6.1 Характер роста периодической культуры отражает физиологические особен-
ности микроорганизма.................................................. 117
6.2 На рост и физиологическое состояние клеток влияют физико-химические
факторы............................................................... 119
6.3 Среды для выращивания бактерий содержат все необходимые питательные
вещества.............................................................. 127
6.4 Для выращивания чистых культур микроорганизмов необходима стерилиза-
ция сред и инструментов............................................... 131
6.5 Рост можно измерять различными методами.......................... 132
6.6 Методы хранения культур обеспечивают длительное поддержание их жизне-
способности .......................................................... 135
6.7 Работа микробиологов основана на методах элективного культивирования и
получения чистых культур.............................................. 136
6.8 Непрерывное культивирование служит ценным инструментом исследования 137
6.9 Методы консервирования основаны на подавлении микробного роста... 143
Глава 7. Биосинтез клеточных строительных блоков................................... 145
Г. Фукс. Перевод И. А. Берга
7.1 Молекулярный состав клеток прокариот соответствует сложности их органи-
зации................................................................. 145
7.2 Основные метаболиты-предшественники — это немногочисленные интермеди-
аты центральных путей метаболизма..................................... 149
7.3 Механизмы включения азота, фосфора, серы, Ci-фрагментов и молекуляр-
ного кислорода в состав клеточных компонентов......................... 151
7.4 Образование строительных блоков из основных метаболитов-предшествен-
ников, полимеризация и сборка макромолекул происходят с затратой АТР
и NADPH............................................................... 160
7.5 Основные метаболиты-предшественники для синтеза строительных блоков
образуются как интермедиаты центральных метаболических путей.......... 163
7.6 Аминокислоты образуются из нескольких основных метаболитов-предшест-
венников ............................................................. 165
7.7 Фосфорилированные углеводы служат важными предшественниками многих
строительных блоков................................................... 174
7.8 Строительными блоками для синтеза нуклеиновых кислот служат рибонук-
леотиды и дезоксирибопуклеотиды....................................... 178
7.9 Сахара и нуклеотидсахара служат важными строительными блоками.... 184
7.10 Биосинтез липидов в соответствии с их структурой весьма сложен... 189
7.11 Все бактерии синтезируют одно или несколько полимерных запасных веществ 199
7.12 Многие растворимые клеточные компоненты необходимы лишь в небольшом
количестве............................................................ 201
Оглавление 649
Часть III. Многообразие метаболических путей........................................... 205
Г. Фукс. Перевод Р. Н. Ивановского
Глава 8. Ассимиляция макро- и микроэлементов........................................... 206
Г. Фукс. Перевод Р. Н. Ивановского
8.1 Автотрофные бактерии используют СО2 в качестве единственного источника
углерода............................................................. 206
8.2 Для синтеза метаболитов-предшественников из Сг-субстратов необходимы
дополнительные реакции........................................... 218
8.3 Метилотрофные бактерии используют в качестве единственного источника
углерода одноуглеродные соединения............................... 219
8.4 Источником аммиака могут служить различные азотсодержащие соединения 222
8.5 Восстановление N2 до NH3 катализирует нитрогеназа............... 223
8.6 Ассимиляция фосфора не требует окислительно-восстановительных реакций 228
8.7 Источниками серы для микроорганизмов обычно служат сульфат и тио-
сульфат ............................................................. 229
8.8 Микроэлементы и электролиты клетки поглощают с помощью специальных
транспортных систем.................................................. 230
Глава 9. Окисление органических соединений.................................... 236
Г. Фукс. Перевод Р. Н. Ивановского
9.1 Использование микробами полимерных органических субстратов включает
внеклеточную стадию разложения....................................... 238
9.2 Экзоферменты выделяются во внешнюю среду или остаются связанными с
клеточной поверхностью............................................... 239
9.3 Синтез и секреция экзоферментов осуществляются как топко регулируемые
процессы............................................................. 240
9.4 Внутриклеточные запасные полимеры расщепляются ферментами цито-
1 плазмы............................................................... 241
9.5 Расщепление высокополимсрпых субстратов с образованием растворимых
продуктов катализируют экзоферменты.................................. 242
9.6 Разложение лигнина — сложного гетерополимера, состоящего из фенилпро-
паноидных соединений................................................. 250
9.7 Белки как субстраты для роста многих микроорганизмов................. 254
9.8 Рибонуклеиновые и дезоксирибонуклеиновые кислоты — распространенные
биополимеры, легко разлагаемые внеклеточными гидролазами............. 256
9.9 Липиды входят в состав мембран у всех организмов..................... 257
9.10 Для ассимиляции продуктов разложения биополимеров используются раз-
личные варианты основных метаболических путей........................ 259
650 Оглавление
9.11 Окисление углеводов — наиболее распространенных питательных субстра-
тов — происходит несколькими путями.................................. 259
9.12 Аминокислоты служат вторыми по значению питательными субстратами... 267
9.13 Разложение ароматических соединений происходит с участием молекуляр-
ного кислорода или анаэробным способом............................... 271
9.14 Жирные кислоты, воски, углеводороды, стеролы и Сi-соединения использу-
ют специализированные бактерии....................................... 278
9.15 Ассимиляция микробами гетероциклических азотсодержащих соединений .. 285
9.16 Органические кислоты представляют собой распространенные природные
субстраты, образующиеся и как продукты брожения...................... 287
9.17 Ксенобиотики — синтетические, устойчивые к биодеградации соединения, в
норме не характерные для природных сред.............................. 289
9.18 Некоторые бактерии осуществляют неполное окисление простых органиче-
ских веществ......................................................... 291
Глава 10. Окисление неорганических соединений хемолитотрофами.................... 293
Й. Куэнен. Перевод Р. Н. Ивановского
10.1 Хемолитотрофы получают энергию в процессе окисления неорганических
субстратов........................................................... 293
10.2 Хемолитотрофы весьма разнообразны по типам метаболизма............ 298
10.3 По механизмам запасания энергии хемолитотрофы не отличаются принципи-
ально от хемогетеротрофов............................................ 299
10.4 По углеродному метаболизму хемолитотрофы не отличаются от гетеротрофов
и фототрофов......................................................... 302
10.5 Хемолитотрофы адаптированы к росту в особых, часто экстремальных сре-
дах, бедных органическими веществами................................. 304
10.6 Серные бактерии составляют весьма гетерогенную группу........... 307
10.7 Нитрифицирующие бактерии окисляют аммоний и нитрит.............. 314
10.8 Водородокисляющие бактерии получают энергию путем окисления водорода 317
10.9 Карбокситрофные бактерии — факультативные хемолитоавтотрофы..... 320
10.10 Железо-и марганец-окисляющие бактерии.......................... 321
Глава 11. Аэробное дыхание и регуляция аэробного/анаэробного
метаболизма...................................................................... 325
Г. Уодсп. Перевод Р. Н. Ивановского
11.1 Уникальными свойствами Ог обусловлена его роль в жизнедеятельности
клеток............................................................... 325
11.2 Кислород выполняет разнообразные функции в метаболизме прокариот .... 327
Оглавление 651
11.3 Использование кислорода в качестве акцептора электронов обеспечивает эф-
фективное получение энергии......................................... 333
11.4 О2 может служить косубстратом в реакциях метаболизма........... 341
11.5 Бактерии обладают механизмами защиты от действия токсичных форм кис-
лорода.............................................................. 342
11.6 Биолюминесценция зависит от присутствия кислорода.............. 343
Глава 12. Анаэробный энергетический метаболизм................................. 346
В. Буккель. Перевод Р. Н. Ивановского
12.1 В анаэробной электроптранспортной цепи вместо О2 используются другие
акцепторы электронов................................................ 346
12.2 Брожение — это анаэробный окислительно-восстановительный процесс. 368
12.3 Энергия запасается не только посредством окислительно-восстановительных
реакций............................................................. 402
Глава 13. Использование света прокариотами....................................... 405
Г. Древе. Перевод Р. Н. Ивановского
13.1 В фотосинтезе участвуют три группы пигментов................... 406
13.2 Зеленые бактерии, пурпурные бактерии и гелиобактерии осуществляют анок-
сигенный фотосинтез................................................. 409
13.3 Цианобактерии осуществляют оксигенный фотосинтез............... 417
13.4 Бактериородопсин функционирует как свстозависимая протонная помпа у
Halobacterium halobium.............................................. 419
13.5 Для изучения бактериального фотосинтеза используются спектроскопичес-
кие, биохимические и генетические методы............................ 421
Часть IV. Генетика бактерий и бактериофагов.......................................423
Б. Фридрих, И. Ленгелер. Перевод В. К. Плакунова
Глава 14. ДНК, хромосомы и плазмиды.............................................. 425
В. Мессер. Перевод В. К. Плакунова
14.1 ДНК как носитель генетической информации у бактерий............ 425
14.2 Клетки большинства бактерий содержат одну кольцевую хромосому.... 436
14.3 Плазмиды как независимые репликопы............................. 437
14.4 Мобильные генетические элементы — транспозоны.................. 442
652 Оглавление
Глава 15. Генетическая информация .............................................. 447
В. Хиллен. Перевод В. К. Плакуноеа
15.1 Организация генетического материала у бактерий................. 448
15.2 Транскрипция: синтез молекулы РНК, комплементарной матричной цепи
ДНК................................................................. 451
15.3 Трансляция: синтез белка па РНК-матрице........................ 454
15.4 Генетический код характеризуется как вырожденный, универсальный и три-
плетный ............................................................ 460
15.5 Мутагенез и отбор мутантов используются как важные генетические методы 462
15.6 Стабильность бактериального генома повышается благодаря репарации ДНК 469
15.7 Одноцепочечная ДНК индуцирует у Е. coli SOS-ответ.............. 471
Глава 16. Обмен генетической информацией между микроорганизмами . 473
Э. Ланка, В. Пансеграу. Перевод В. К. Плакуноеа
16.1 Поглощение свободной ДНК приводит к генетической трансформации бак-
терий .............................................................. 473
16.2 Для конъюгативного переноса ДНК необходим тесный межклеточный кон-
такт ............................................................... 476
16.3 Трансдукцию осуществляют бактериофаги, содержащие невируспую генети-
ческую информацию................................................... 493
16.4 Включение экзогенной ДНК в геном происходит по механизму гомологичной
рекомбинации........................................................ 495
16.5 Рестрикция и модификация ДНК предохраняет клетку от чужеродной ДНК 498
Глава 17. Технология рекомбинантной ДНК......................................... 5оз
Р. Книпперс, К.-А. Альперт. Перевод В. К. Плакуноеа
17.1 Геномные библиотеки содержат определенные фрагменты ДНК........ 503
17.2 Геномные (ДНК) библиотеки часто используют как стартовый материал для
анализа генов и их продуктов........................................ 511
17.3 Секвенирование ДНК как важный метод биологических исследований.. 512
17.4 Локализованный мутагенез помогает идентифицировать специфические
функции............................................................. 514
Оглавление 653
Часть V. Экспрессия генов и механизмы регуляции................................. 519
Й. Ленге.лер. Перевод В. К. Плакунова
Глава 18. Регуляция экспрессии генов: опероны и регулоны........................ 522
С. Адхья. Перевод В. К. Плакунова
18.1 Опероны и регулоны как транскрипционные единицы............... 522
18.2 Регуляторы часто контролируют свой собственный синтез; ауторсгуляция .. 527
18.3 Мультимерный фермент бактериальная РНК-полимераза инициирует тран-
скрипцию в промоторе............................................... 527
18.4 Отрицательная регуляция означает подавление транскрипции...... 528
18.5 Механизмы положительной регуляции служат для активации транскрипции 531
18.6 Регуляторные белки часто выполняют двойную роль............... 536
18.7 Смешанный механизм регуляции: репрессор ингибирует активатор.. 538
18.8 Инициация транскрипции зависит от структуры ДНК............... 539
18.9 Регуляторный эффект оказывают изменения структуры и функции РНК-
полимеразы ........................................................ 541
18.10 Элонгация и терминация транскрипции также подвержены регуляции.. 542
18.11 Регуляция активности генов происходит в том числе путем рекомбинации
ДНК................................................................ 547
18.12 Экспрессия генов зависит от метаболизма РНК.................. 549
18.13 Во многих случаях регуляция осуществляется на уровне трансляции. 550
18.14 Количество продукта гена может зависеть от протеолиза........ 555
18.15 Ключевая роль в регуляции активности генов принадлежит ДНК-белковым
взаимодействиям.................................................... 555
18.16 Заключение................................................... 559
Глава 19. Посттрансляционный контроль и модификация белков .............. 561
Г. Джейкобсон. Перевод В. К. Плакунова
19.1 Посттрансляционный контроль обеспечивает быструю адаптацию бактерий. 561
19.2 Аллостерическая регуляция активности ферментов широко распространена
у прокариот........................................................ 562
19.3 Многие процессы зависят у прокариот от регуляции на уровне посттрансля-
ционной ковалентной модификации белков............................. 570
19.4 Посттрансляционный контроль включает у прокариот внутриклеточную ком-
партментацию ферментов и других белков............................. 579
654 Оглавление
Глава 20. Общие регуляторные сети и пути передачи сигналов........................ 586
И. Ленгелер, П. Постма. Перевод В. К. Плакунова
20.1 Для прокариот характерны объединенные метаболические сети и пути пере-
дачи сигналов........................................................ 586
20.2 Углеродная катаболитная репрессия тесно связана с другими феноменами.. 596
20.3 Модулон RelA/SpoT контролирует пути анаболизма и биосинтез макро-
молекул ............................................................. 603
20.4 Передача сигнала двухкомпонентными регуляторными системами связана с
функцией общих регуляторных сетей.................................... 608
20.5 Бактериальный хемотаксис—другой пример регуляции с передачей сигнала
через двухкомпонентную систему....................................... 614
Глава 21. Регуляция процессов брожения и дыхания ................................ 628
<9. Лин. Перевод В. К. Плакуноеа
21.1 Существует три основных механизма аккумуляции метаболической энергии 628
21.2 Регуляция брожения включает общий и специфический контроль экспрессии
генов................................................................ 630
21.3 Анаэробное дыхание требует участия сложной регуляторной сети.... 635
21.4 В регуляции аэробного дыхания участвует двухкомпонентная система. 638
21.5 Аэробный метаболизм связан с образованием токсичных форм кислорода
(кислородный стресс)................................................. 641
21.6 Заключение...................................................... 643