Text
МИНИСТЕРСТВО ПИЩЕВОЙ ПРОШШЛЕННОСТИ СССР
ГДАВЙНО
ВСЕСОЮЗНЫЙ НАУЧНО41ССЛЕДОВАТЕДЬСКИЙ ИНСТИТУТ
виноделия и виноградарства "магарач"
Гайа Б.С., Павхеисо Н.П.
Датужаавжлж Е.Н.,Порош»я Г.Н
СПОСОБЫ ПОЛУЧЕНИЯ МОБИЛИЗОВАННЫХ ФМЕНТСВ
и ИХ ПРИМЕНЕНИЕ в ПИЩЕВОЙ ПРОШШЛЕННОСТИ
( Обзор )
ЦНИИТЭИПИЩЕПРОМ
Иооква - 1974
Уда 663.154664.022.39:577.15(088.8)(-87)
Обзор содержит систематизированный материал по ретодам
иммобилизации ферментов, знакомит с современным составе*1
вопроса производства иммобилизованных ферментов н их приме-
нением в пищевой промышленности.
Обзор составлен в результате анализа патентио-л/Цензи_
онной и периодической литературы за последние года.
। Редактор Бузни А.Н.
3,
I, ВВЕДЕНИЕ
ХХ1У съезд КЛОС поставил перед пищевой промышленностью
задачу значительного увеличения выпуска продукции, повышения
ее качества, полной механизации и автоматизации всех произ-
водственных процессов.
При этом, наряду с вопросами повышения рентабельности
производства ряда продуктов пищевой промышленности, большое
внимание должно уделяться повышению их гигиенических и дие-
тических свойств.
За последнее десятилетие в практике производства пище-
вых продуктов широкое применение нашли ферментные препараты.
Используются они с целью увеличения выхода, повышения каче -
ства готовой продукции, а также для совершенствования техно-
логических схем производства.
Ферменты - это белки, способные катализировать многие
реакции, протекающие не только в живых организмах, но н in
vitro . Преимуществом ферментного катализа является тс, что
процессы протекают при обычных условиях температуры и дав-
ления, без больших энергетических затрат. По мере развития
научных исследований и производства ферментов шлс их быстрое
освоение в различных отраслях промышленности, в том числе н
в пищевой при приготовлении продуктов питания.
До последнего времени воздействие на субстрат, в ходе
ферментативных процессов, проводили растворенными ферментами,
а обработку осуществляли периодическими порциями. Из-за от-
сутствия подходящих способов удаления оставшихся в гстовом
продукте ферментов, зачастую сохраняющих активность, прибе -
гают к их тепловой денатурации, чтс в ряде случаев приводит
к ухудшению качества обрабатываемого продукта, т.к. раство -
римые ферментные препараты часто содержат ряд нежелательных
компонентой! - технологические примеси и включения. Серьезную
озабоченность вызывает также наличие в ферментных препаратах
грибкового дрсисхождения токсических веществ (афлотсксииа н
др.) (Виссарионова ВЛ.,1970), из-за чего ряд препаратов быи
полиобтью запрещены к применению в пищевой промышленности
(Квашиной А Л., 1973).
4
Кроме того,способы использования растворимых ферментов
являются неэкономичная по следующим причинам:прерывность тех-
нологии их использования, нестабильность ферментов, легкость
инактивации, высокая стоимость. Техника применения растворимых
ферментных препаратов недостаточно совершенна, что прейятству-
ет осуществлению автоматического контроля и регулирования про-
цессов ферментации.
В связи с этим, в последние годы в ряде стран (США, Япо -
нии, Англии, СССР, Швеции, франции и др.) начаты интенсивные
исследования по возможности применения гетерогенного фермен -
тативного катализа в исследовательской практике и в произвол -
ственных процессах ряда отраслей (медицинской, пищевой и др.).
В результате проведенных работ» найдено несколько спосо-
бов химического присоединения фермента к твердой матрице,
вследствие чего получается нерастворимый комплекс фермент-но -
ситель, обладающий всеми каталитическими свойствами фермента,
нс значительно более устойчивый и более стабильный.
Пролонгированнооть действия,повышенная стабильность не-
растворимых ферментов открывают широкие перспективы их исполь-
зования. С технологической же точки зрения применение фермен-
тов привадит к улучшению технико-экономических показателей
производств и дает возможность регулирования технологических
процессов. Вследствие направленности и специфичности реакций
иммобилизации ферментов на носителе,исключается попадание в
комплекс фермент-носитель технологических примеоей ферментных
препаратов, что приводит к повышению гигиенической ценности
готовых продуктов.
В постановлении Президиума Академии Наук СССР о состоя-
нии и перспективах развития научных исследований по проблемам
разработки и промышленного внедрения методов синтеза и биссин-
теза белковых веществ, включая ферменты, гормоны и др., отме-
чено, что применение нерастворимых ферментов позволит в бли-
жайшем будущем коренным образом изменить технологию ряда
производств.
Академик А.Е.Браунштейн отнес использование систем фер-
ментов и ингибиторов на твердой основе к наиболее перспектив-
5
нш направлениям технологии (Веотник АН СССР, * 6 за 1972г.)
В докладах Международного симпозиума "Ферменты - получе-
ние и применение" (Гронинген, 1971), в решениях 1-го Всесоюз -
ного координационного совещания по получению и применению фер-
ментов пролонгированного действия (Таллин,1972) и на П-й Все-
союзной научно-технической конференции по биохимии винограда и
вина (Ялта,1973) также обращалось внимание на важность решения
данных вопросов.
В настоящем обзоре, в результате анализа патентной и пе-
риодической литературы за последние годы, систематизирован ма-
териал по производству и применению иммобилизованных ферментов.
Авторы сочли необходимым остановиться здесь подробнее на
работах, раскрывающих применение гетерогенного катализа в пи-
щевой промышленности, с целью привлечь к ним большее внимание
иоследователей и практиков.
Известно,что наибольшая информация о новейших открытиях
и изобретениях, а также о путях воплощения их технического ре-
шения в производство содержится в патентно-лицензионной литера-
туре. В настоящее время во многих странах выдано большое коли-
чество патентов и авторских свидетельств на способы получения
и применения нерастворимых ферментов.Представленный обзор со-
ставлен на основании изучения НО описаний отечественных и за-
рубежных изобретений за последние 7-8 лет. Распределение этих
описаний по странам и классам приведено в таблице I.
Таблица I
Страна Национальная классификация Количество изобретений
США 195-63; 195-68 30 х)
Франция С 07; С 12 25
Англия С 3 Н 28
ФРГ С 07; S- ; 12 10
Япония 36В0; 36С0; 36Н 6
СССР С 07; G- ; 12 4
Прочие страны 7
х> Здесь не включены патенты,относящиеся к получению детер-
гентов, наполнителей паст и др. на основе нерастворимых
ферментов.
6
П.СПОССЕЫ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ
Фермента проявляют свои каталитические свойства, благода-
ря наличию у них активных центров, а также вторичной и третич-
ной структуры.Существует два участка активного центра,различаю-
щихся по своим функциям (Тибета И.,1970): один из них отвечает
за реакционную способность ферментного катализатора (т.н. ката-
литический участок), другой - поддерживает высокую субстратную
специфичность в ферментативной реакции (специфический участок).
Для того,чтобы ферменты и в нерастворимом состоянии проявляли
каталитические свойства, необходимо, чтобы сохранилась нативная
структура такого типа, а аминокислотные остатки в активном
центре не подвергались бы изменениям. Поэтому к способам полу-
чения нерастворимых ферментов предъявляют крайне строгие требо-
вания.
Вторичная и третичная структура белков-ферментов поддер-
живается водородными, гидрофобными, ионными и другими сравни-
тельно слабыми связями. При переведении ферментов в нераствори-
мую форму следует, разумеется, избегать реакций, протекающих
при высоких температурах, при участии аильных кислот, щелочей
и т.п.
Из наиболее изученных и распространенных способов иммоби-
лизации ферментов следует отметить следующие: адсорбция,включе-
ние в гель, образование химической ковалентной связи, микрокап-
сулирование, заключение в полые волокна, межмолекулярная (кова-
лентная) сшивка и другие.
I. Способы иммобилизации ферментов.
Адсорбция
Этот метод заключается в том, что белок физически адсор-
бируется на нерастворимом в воде носителе и, таким образом,пе-
реходит в нерастворимую форму. Физическая адсорбция при помощи
сил Ван-дер-ваальса (например, на активированном угле) или при
помощи сил Кулона (на ионообменниках) относится к старейшим ме-
телам иммобилизации. Так были фиксированы на древесном угле,
стекле и окислах аллюминия ферменты уреаза и трипсин -
пийг а., 195%). °
7
Следует отметить, что адсорбция белка на элетрснейтраль-
ном веществе является простейшим способом иммобилизации, полу-
чившим широкое применение (1,2,3,4). В качестве носителя часто
используют перистое стекло,бентонит,диатомит.каолинит и другие
глины.Учитывая полиэлектролитную природу энзимного белка, для
иммобилизованных ферментов адсорбцией можно использовать также
природные и синтетические ионоебменники: целлюлозу и ее произ-
водные, декстран, смолы Амберлит, Дауэкс и другие. Иммобилиза-
ция в этом случае осуществляется колоночной хроматографией или
путем перемешивания носителя в растворе фермента. В СССР раз-
работан способ выделения антител при помощи фиксированных на
целлюлозе антигенов (искусственных иммунооорбентов) (5).
Однако к серьезным недостаткам способа фиксации фермен -
тав адсорбцией следует отнести: неспвцифичность адсорбции;
низкую прочность фиксации, что приводит к значительной элюации
адсорбированных ферментов (8); снижение активности ферментов в
результате фиксации.
Фиксация ферментов включением в нерастворимый гель
Способ заключается в полимеризации растворе мономера в
присутствия фермента; полученный таким образом гель может со-
держать значительное количество фермента, сохранившего , в
большей или меньшей степени, часть ферментативной активности.
Таким образом получен гельфермент, в который была включена про-
теаза (6) и ряд других ферментов (7).
Благодаря рыхлости структуры гельфермента, через неге
возможна диффузия молекул субстрата, продуктов реакции и воды
(II). Чаще всего иммобилизацию ферментов в геле осуществляют
на базе полиакриламида или кремниевой кислоты (9,12), реке -
крахмального геля (10). Сам процесс приготовления гельфермен -
тов достаточно прост.Ферменты в гелях хорошо сохраняют актив-
ность и устойчивы * вымыванию.
Среди недостатков -указанного способа фиксации ферментов
наиболее важным является высокое диффузионное сопротивление по-
лученных гельферментов, что затрудняет ирсцесо ферментации вы-
сокомолекулярных субстратов (Креэн И.И., Кестнер А.И.,1972).
8,
Образование химической ковалентной связи
Способ фиксации ферментов ковалентной связью, благодаря
большому выбору носителей, связующих агентов, разнообразию пу-
тей осуществления иммобилизации, находит наибольшее раскроет -
ранение. Он имеет несколько разновидностей:
а) образование ковалентной связи между молекулами фер-
ментов при помощи бифункционального реагента (27). Например,
(.Bar-Eli 1., Kat chai eki E. ,1962,1970) была получена "нераство-
римая каталаза" через реакцию амино-групп этого фермента с
глутаральдегидом по схеме:
оно - (сн2)5 - оно
гдутаральдегид
растворимая
каталаза
"нерастворимая каталаза"
б) образование ковалентной связи непосредственно меж-
ду реакционно-способнши группами носителя и фермента или
между группами связующего агента, носителя и фермента. Для
примера приводам соответственно две схемы образования ко-
валентной связи: между энзакрил полилактоном и ферментом; и
между целлюлозой о циануралхлоридсм ( связующий агент ) ж
ферментом.
9,
Bpton R., Thomae I.- 1971
- CH - CHg -
CO - HH
(
CH - C
I I
CHg -s
- CH
г
Суринов Б.П. и МавоАлов С.Н.,1966
целлюлоза цианурилхлорид цвавурцвллвлоза
>-он ХС1
Г /Xя -%
г о - с к
В - С — ЭНЗИИ
у он
"нерастворимый энзим"
10.
Для уменьшения потери активности ферментов химическое ко-
валентное связывание необходимо проводить по функциональна!
группам, не входящим в состав активного центра. Часто, с целы»
защиты активного центра белка от "повреждения" во время реак-
ции фермента с носителем или связующим агентом, связывание про-
водят в присутствии субстрата. На практике применяют реактивы,
атакующие преимущественно первичные аминогруппы, ароматические
ядра, делее гидроксильные, карбоксильные и сульфгидрильные
группы, а также имидозольные ядра (13,14,15,16).
При получении иммобилизованных ферментов химическими ме-
тодами применяют активирование поверхности носителя,т.е. обо-
гащение ее активными группами. В этих случаях прикрепление эн-
зимного белка происходит через следующие активные группы:
ароматические диазогруппы (5,17,18),
галогенпроизводные триазина (19,20,26),
ангидриды и галогенангидриды кислот (21,22,23,24,25),
азиды кислот ( Hitz М., 1961, Антонов В.К.,1971),
иминокарбонаты (дхеп в. , 1967),
альдегиды (Epton В.,Thomas Т„ 1971),
сульфгидрильные группы ( sundaram P.,Homhy W. ,1970).
Наиболее полный материал, относящийся к химическому свя-
зыванию ферментов на неорганических носителях, приведен в описа-
нии к патенту (13), выданному в 1970 г. в США (coming Glass
Works ). Ниже приводится классификация носителей и типы химичес-
кой связи,используемые для их активации.
Таблица 2
Неорганические носители
Силе 1 к а т н Окиси металлов
Аморфные Кристалли- ческие Переходной Кислотный МеО Щелочной МеО
Стекло Силикагель Бентонит Воластонит ню А1 0 2 3 Гидроксил аппатит
Коллоидный
кремнезем
II.
Таблица 3
Типы связей
Реактивные группы
Тилы
связей
связующий
агент
знзим
Амидная -со- мн - - соон - мн2 - ын2 - G00H
Сульфамидная -мн-с -мн - S - мн2 тирозин -MH2+ G1-C-C1 S
Азо-связь -н - м- Q он гистидин лизин - М2+С1"
Простая эфирная к- о - r - и - ONa - к - X
Сложная эфирная - 0 - R - СООН - к - он
Дисульфидная R - S - S - В К - БН - к - SH
В настоящее в ремя в патентной литературе описан ряд спо-
собов активации носителей. Среди них наибольшее распростране -
ние нашли следующие: диазотирование (Katchaiski Е. )(13;29,30),
обработка галогенцианами ( Axen R), связывание фермента с но-
сителем через галогеналкил (32,33), обработка цианурилхдорида-
ми ( Kay G.)(19,20).введение аминоарильной группы с последую -
щим восстановлением и диазотированием ( Weetali н. )(13,31).
Однако привести общие правила осуществления иммобилиза-
ции ферментов невозможно. Условия матрицирования выбираются,
исходя из конкретных задач; чаще всего активированный носи-
тель в виде суспензии перемешивают с раствором фермента при
температуре в пределах 0+4°C и в течение 1+48 часов.Этот спо-
соб нашел довольно широкое применение в практике. Остаточная
активность фиксированного таким образом трипсина достигала
I00J? от исходной и сохранялась на таком уровне в течение 140
часов»непрерывного использования в проточной колонке (13,14).
12
Рис. I. Стабильность трипсина в зависимости от времени.
( ti-230c). Носитель - пористое отекло (13)
I - свободный трипсин, 2- химически связанный трипсин
Следует отметить, что полученные комплексы фермент-носи-
тель отмечаются высокой стойкостью к pH ореде, условиям раст-
ворителя, денатурации и микробиальному действию.
Эффективность использования иммобилизованных ферментов
пропорциональна удельной поверхности носителя (пористое стекло,
глины и пр.). В связи с этим, комплексам придают различные фор-
мы для более эффективного использования иммобилизованных фер-
ментов в различных отраслях промышленности. Например, для обра-
ботки высокомолекулярных субстратов используют фиксированные
ферменты преимущественно на поверхности носителя.
К недостаткам рассмотренного способа следует отнести его
дороговизну (используются дефицитные и дорогие реактивы), дли-
тельность цикла получения готовых комплексов и не всегда высо-
кую остаточную активность препаратов.
Включение фермента в гель
Способ впервые описан Brenfeid. р. и*ал 1.в начале
60-х годов. Сущность метода заключается в том, что во время по-
лимеризации фермент захватывается в пространственную решетку
13
геля, а субстраты с небольшим молекулярным весом, продукты ре-
акции и веда могут свободно диффундировать в нем, благодаря
рыхлости структуры гельфермента.
, Чаще всего получение комплекса фермент - гель осуществ-
ляется на базе полиакриламида, образующегося при полимеризации
смеси акриламида, Т^Х'-метил - бис - акриламида, а также с ис-
пользованием интенсивного светового потока в качестве инициа -
тора образования свободных радикалов. Химическим инициатором
является надсернокислый аммоний - (nh4)z 52 0g , а роль катализа-
тора выполняет рибофлавин (Кестнер А.И., 1971).
Следует отметить, что способы включения ферментов в гель
просты и легко реализуемы. К недостаткам же их необходимо от-
нести слабую механическую прочность геля и диффузию высокомоле-
' кулярных субстратов в гель. Для достижения большей механичео-
! кой прочности используют неорганический гель кремниевой кисло-
ты (9).
В СССР работы по получению и применению гельферментов
(инвертазы, глюкозосксидазы) в полиакриламидном геле успешно
ведутся в Таллинском политехническом институте под руковсдст -
вам А.И.Кестнера.
Микрокапсулирование
За последние 5-6 лет микрокапсулирование, как метод
н фиксации, приобрело большое значение. Это объясняется удач -
ным решением гетерогенного катализа с использованием микро-
капсул при сбраживании жидкостей без дрожжевых клеток (Kita-
|! jiaa м. »Kondo А. Д971),получением фармацевтических пре-
паратсв и детергентов на основе твердых ферментов (31,36,37)
4, Чаото в микрокапсулах фиксируют группы ферментов или
Ч энзимные комплексы и структуры. Размеры капсул варьируют в
широком пределе: от обычных микрогранул (d = 1-2 мм) до
мельчайших (d = 20-500jK).
14,
Рис. 2. Микрокапсулы, содержащие энзимные капсулы,
(по Кондо А., 1970).
Иммобилизация ферментов на микроорганизмах
Данный способ разработан английским ученым Kovats G. в
1971г. Он предусматривает образование химической ковалентной
связи между маннаном клеточной стенки микроорганизмов и ак-
тивными группами энзимного белка посредством ионов солей тя-
желых металлов. Такое решение представляет практический инте-
рес для некоторых отраслей пищевой промышленности (пивоварен-
ной, винодельческой н др.) На основе использования комплек -
сов дрожжи-фермент представляется возможным повысить эффектив-
ность обработки ряда пищевых продуктов (Emeri A. et al.,1972)
В периодической литературе известны также методы зак-
лючения ферментов в полых трубках и в полупроницаемых мембра-
нах.
В итоге следует отметить, что способ фиксации должен
обеспечить повышенную стабильность фермента, позволяющую уве-
личить количество прореагировавшего субстрата к весу фермента
в сотни я даже тысячи раз. Важно также, чтобы выбранный спо-
соб иммобилизации ферментов позволял получать высоксгигиени -
15
ческие продукты (исключая растворение ферментов и связующего
агента, автолиз ферментов).
Схемы иммобилизации ферментов.
Схематически процесс получения иммобилизованных фермен-
тов на минеральных носителях можно изобразить в следующем ви-
де (2):
минеральный носитель
4-
перемешивание ферментный субстрат
реакция фермент
I схема
энзимный
смыв
ание
ccaKj
центрифугирование
высушивание
выс
осаждающий
реагент
раствори-
тель и
примеси
нерастворимый фермент
Однако в каждом конкретном случае технологические схемы
иммобилизации ферментов могут претерпевать существенные изме-
нения, связанные с конкретными условиями иммобилизаций:свой -
ствами фермента и носителя, температурой, pH и буферностью
среды.
Важным критерием оценки технологии фиксации ферментов
на твердой основе являются технико-экономические показатели
использования технологии на основе иммобилизованных ферментов
В связи с тем, что свойства фермента связаны с его структурой
метод фиксации является важным, но не единственным фактором,
определяющим устойчивость фермента к денатурации в процессе
эксплуатации. Следовательно, выбору реакции фиксирования и
условий ее проведения должно быть уделено большое внимание.
К сожалению, привести механизм реакции всех известных
способов фиксации ферментов, описанных в патентно-лицензион -
ной и периодической литературе, не представляется возможным.
16
Некоторые хе из них приведены в предыдущих разделах обзора.
В последние годы широкое распространение получил способ
иммобилизации ферментов диазотированием целлюлозы (28),напри-
мер, получение иммобилизованных ферментов на диазобензилцел -
люлсзе по схеме (Mitz м.,1961 ):
ц + /о2® -<О>- CHg- о - сн2- +к<О>/ 01"
Ц - 0 - CHg И02**Ц - О - СН2 -<О>- мн2 —*-
.—ч 3H3IM f—<
Ц - 0 - CHg -\О/- +N = Cl-—*- Ц -O-CHg -\2/~К^яим
где Ц - целлюлоза.
Карбсксиметилцеллюлсзу превратили в сложный метиловый
эфир, а воздействием на него гидразином получен гидразид.
Далее, при низкой температуре азид, полученный из гидразида,
вступает в реакцию с химотрипсином, в результате чего образу -
етоя нерастворимый химотрипсин (Суровцев В.И., 1972).
Я - О - СН2 - СООН Я - о - СН2 - COCHj ^2^2
а - о - oHg-co-BH-BHg HaN03 ? я-о-с^-со-к^ знзим ?
НС1
я _ о - СЙ2 - СО - NH - ЗНЗИМ
Образцы нерастворимых ферментов, подученные этим спссс -
бои, обладали сравнительно высокой активностью и успешно при -
менялись в исследовательской практике.
В литературе списаны способы фиксации ферментов на по-
лимерах посредством следующих групп:
хлорид кислоты (55)
Полимер - соон -* Полимер - cool —*-
-> Полимер - соян — знзим.
Полимер - so2 - C1 •—*- Полимер - 6О2 - ин - энзим.
17
иминокарбснатная (Дхвп н.,1971)
/- CHg - CHg - он - он - / п трипсин *
-CHg - CHg - CH - CH - CHg - CHg - CH - CH -
0- C 000“ . c C
I \
ж о C 0
I
ЭНЗИМ ---NHg
NH
I
C-0 coo
I I
-CHg - CHg - CH — CH-
18
Сейчас внимание исследователей и практиков обращено на
перспективность использования в качестве носителя пористого
стекла. В связи с этим следует подробнее остановиться на ре-
акции активированного стекла и фиксации фермента. Пористое
стекло (обычно используют стекло пористостью частиц 96%,имею-
щих 40 м2 площади поверхности на грамм, 550 анготрем, диаметр
пор и размеры частиц в пределах от 40 до 80 меш -Wee-tall н.,
1971) обрабатывается ^-аминопропилтриэтоксисилансм или я-ув-
-аминопропиддаметилсиланом с получением аминоалкильной груп-
пы и дальнейшей замены ее на аминоарильную. После восстанов-
ления и диазотирования аминоарильной группы носитель готов
к проведению фиксации ферментов (13).
о~
- о - si - он +
о-
поверхность
стекла Q_
- О - Si - О
О -CgHj
С^О - Si - 0 - (CHgJj - НН2 ---►
о -
^-аминопропилтризтоксисилан
0-
Si — OHg — CHg — CHgHHg
0-0-
алкиламинное стекло (обозначим "стекло -кн2")
Стекле -BHg ♦ 01 -
1 -<£/- к02 —*-
р - нитробензоил хлорид
о
и
—► стекло-нн - о
о
—*- стекло-ни - с
-<О>-Я02
X—/ л BOCOT.
Н01
- энзим,
о
«
с
19.
Встречаются, однако, а случаи шнобилизации ферментов на
амнноалкильном производном стекле через диазо-связь по следую-
щей схеме ( Weetall Н.,1971)»
О- о
I м
-Si - (CH^J - КН - С
о- о
|О- II
-Si - (GHg)5 - НН - С
0-
ЭНЗИМ -*
Носители и связующие агенты
В качестве носителя испытано большое количество мине -
ральннх и органических вещеотв. Условно их можнс разделить на
следующие группы и подгруппы:
I) неорганические:веществ*(пористое стекле, глина,акта -
вированный уголь, силикагель, окисли металлов);
2) органические вещества - полимеры: а) природные -инер-
тные полисахариды (целлюлоза, ЕЫ-целлюлоза,агароза,декстран),
б) синтетические (полиакриламид, найлон, полистирол,полиамино-
кислоты, а также ионообменные смолы, например, Дауэкс и Амбер-
лит);
3) микроорганизмы (дрожжи и бактерии).
Технология использования иммобилизованных ферментов предъ-
являет к носителям ряд требований: I) стабильность фермента на
носителе, 2) стойкость к pH средн и температуре, 3) гидрофиль-
ность, 4) недопустимость неспецифической адсорбции (взаимодей-
ствие Ван-дер-Ваальса, Кулона) к ферменту и субстрату, 5) на-
личие большой удельной поверхности , 6) требование механичес-
кой прочности, позволяющей придать носителю необходимую кон-
фигурацию, 7) невосприимчивость к микробиологическому дейст -
вию и свойствам растворители.
20,
Однако многие носители отвечают не всем названным тре-
бованиям, а удовлетворяют лишь нескольким из них (39,40,41).
Как было указано, наибольшее распространение в качестве носи-
теля получает пориотое стекло (1,2,13,14,50), широко иополь -
зуются производные целлюлозы (5,8,28),синтетические полимеры
/например,сополимер этилена и малеинового ангидрида (ЭМА)
(40,44,45)/, смолы (29,51), силикагель (12,48,52,53), поли -
аминокислоты (16,47,49) и другие носители (25,45).
Некоторые перспективные носители по-прежнему остаются
дорогими, что является существенным препятствием на пути их
широкого применения в практике. При разработке носителей для
пищевой промышленности представляется необходимым ориентире -
ваться на разработку высокопористого, механически прочного
стекла с достаточным числам реакционноспособных групп и не-
дорогой технологией производства, а также на полимерные но-
сители, устойчивые к микробиальной атаке и не снижающие * ги-
гиенических свойств пищевых продуктов.
Выбор связующего агента для активирования поверхностей
носителя - задача комплексная. Это зависит от преследуемой
цели, от.свойств применяемого носителя, от условий фикоиро -
вания ферментов и ряда других факторов. В литературе часто
встречается прием активирования поверхности носителя с исполь-
зованием галогенцианов (CNBr,CN01,CNI ) и дальнейшего свя -
зывания фермента с носителем через галогеналкил (32). Образую-
щиеся активине радикалы, т.н. иминокарбонаты, реагируют с
энзимными белками в нейтральней и щелочной среде.
Для природных органических и неорганических носителей
(целлюлоза, бентонит и др.) в качестве активаторов применя-
ют производные циануровой кислоты: 2-амино-4,6-дихлор- В -
-триазин и 2,4,6-трихлор- s-триазин (19,20). Носители, содер-
жащие ароматические амино-группы, обычно активируются диазо -
тированием юю2 или NaN02 (17). (См.предыдущую чаоть дан-
ного раздела). Диазопроизводные ферментов получены с исполь-
зованием в качестве носителей полисахаридов (28),сополимеров
аминокислот (30). Хороших результатов по иммобилизации фер-
ментов достигли при обработке поверхности пористого отекла
N -/?- аминопропидциметилсиланом или /-аминопропилтриэтакси-
21
силаном о последующей заменой аминоалкильной группы на ямина-
арильную (13,14).
В качестве связующих агентов для иммобилизации фермен -
тов на неорганических, органических носителях и микроорганиз -
мах рекомендованы Tier, Tici,, Ti_(soA)_ , Snci„, SnCl_ ,
4 p 4 p 4 d
ZrCl^, VO1j, VeCIg, FeClj (Emery A. etal., 1972).
Ш. СВОЙСТВА ФИКСИРОВАННЫХ ФЕРМЕНТОВ
Достоинство того или иного способа иммобилизации фер -
ментов, возможность его широкого применения определяется
свойствами полученного комплекса фермент-носитель.
Обычно процесс фиксации приводит к изменению свойств
ферментов. Наиболее важным изменением является повышение ста-
бильности ферментов, которое и придает им совершенно новое ка-
чество - пролонгированность. В результате этого, отношение ко-
личества прореагировавшего субстрата к весу иммобилизование -
го фермента увеличивается в сотни и тысячи раз нс сравнению с
растворимым ферментом. Активность таких комплексов остается
высокой при хранении в соответствующих условиях в течение не-
окольких лет (2,16).
Устойчивость и пролонгированность действия иммобилизо -
ванных ферментов объясняется, во-первых, предотвращением ав -
толиза ферментов, во-вторых, защитой от действия ингибиторов
и, в-третьих, повышенной микробиологической стойкостью.
Фиксирование молекулы энзимов лишены возможности кон-
тактировать между собой, в результате чего их автолиз умень-
шается. Последнее обстоятельство особенна важно при фикса-
ции на носителях протеолитических ферментов и ферментных пре-
паратов (Тибета И., 1970).
В отношении защиты от действия ингибиторов предполага -
ется, что это - результат экранирования носителем молекул
фермента и взаимодействия с матрицей.
В случае заключения ферментов в пористый носитель с раз-
мерами пор меньше размеров микроорганизмов,ограничивается раз-
22
рушение ферментов микроорганизмами (13).
Важнейшим свойством фиксированных ферментов является их
остаточная активность. Большинство способов иммобилизации фер-
ментов приводят к снижению активности полученных комплексов.
При правильном выборе способа иммобилизации и, соответственно,
носителя, остаточная активность обычно составляет 30% (19), а
в отдельных случаях - 100% (ТЗ).Неправельный подбор условий им-
мобилизации может привести к полной инактивации ферментов на
носителе.
Основными причинами снижения энзиматической активности
иммобилизованных ферментов являются следующие: конформационная
модификация молекул энзимного белка, диффузионное сопротивле -
ние и экранирование активного центра фермента.
Применяемые способы химического связывания ферментов с
носителями образованием ковалентной связи приводят к конформа-
ционным модификациям молекул энзимного белка, вследствие чего
снижается его активность. В случае же образования ковалентной
связи между реакционноспособными группами носителя и аминокис-
лотами активного центра белка, часто наблюдается полная инак -
тп-нация фермента (Barker Б., EptonH., 1970 ).
Результаты обработки патентной информации показывают,что
активность иммобилизованных ферментов варьирует в крайне широ-
ких пределах. Большой интерес представляют сообщения об акта -
вации ферментов в процессе фиксации (2). Наблюдали также повы-
шение активности иммобилизованных многоферментных систем, как
следствие малых расстояний между молекулами ферментов и умень-
шения сопротивления диффузии промежуточных продуктов (Mosbach К.
1971).
Ликвидация пространственных затруднений во время хими -
ческого связывания осуществляется удалением реакционноспособ -
ной группы- белка от матрицы посредством промежуточного соеди -
нения (гексаметалендиамин, зтилендиамин, ог-аминокапроновая
кислота и др.),в оилу чего сохраняется конформация молекул фер-
мента (73).
23
Известно, что один и тот же иммобилизованный фермент мо-
жет хорошо действовать на низкомолекулярные субстрата и совсем
не действовать на высокомолекулярные. Диффузионное сопротивле-
ние, как фактор снижения энзиматической активности, в большей
степени проявляется в случае использования субстратов с высо-
ким молекулярнж веоом.
Объяснить механизм снижения активности фермента вследст-
вие экранирования активного центра, также как и наличие диф-
фузионного сопротивления, весьма затруднительно. Вероятно это
происходит по причине экранирования активного центра фермента
цепями (радикалами) носителя и затруднения доступа субстрата к
активному центру ( Mitz М., 1959 )•
Температурный оптимум и термостабильность - это свойст -
ва иммобилизованных ферментов, предотвращающие их пригодность
в проведении многих технологических процессов в пищевой про -
мышленности и в других отраслях. Установлено, что при иммоби -
лизации повышается температурный оптимум и увеличивается ста-
бильность комплексов фермент-носитель в отношении тепловой
денатурации. На рисунке 3 показано изменение ферментативной
активности свободной и иммобилизованной на бентоните инверта-
зы в зависимости от температуры. Свободная инвертаза имеет
максимум активности при 45°С, тогда как Иммобилизованная име-
ет растянутый температурный максимум от 40° до 60°С. Сле-
довательно, иммобилизованная; инвертаза в большей степени за-
щищена против тепловой денатурации ( Monsan Р., Durand G.,
.1971 ).
24,
Рис. 3. Зависимость активности свободной и иммобилизованной
инвертазы от температуры.
I- свободная инвертаза, 2- иммобилизованная инверта-
за.
Работами в основном советских ученых доказана неоднород-
ность фиксированных ферментов по отношению к тепловой денату -
рации. Существуют фракции "лабильная" и "стабильная", и объяс-
няется это неодинаковой степенью образования химической связи
(числом точек ковалентного связывания энзимного белка). Термо-
стабильность, например, свободного химотрипсина значительно
ниже термсстабильности обеих фракций этого фермента, иммобили-
зованного на КМ-целлюлоэе (Суровцев В.И., Козлов Л.В., Анто -
нов В.К., 1970).
25
Рис. 4. Зависимость устойчивости химотрипсина и КМЦ-хи-
мстрипсина от температуры. Продолжительность ин-
кубации 10 мин.
I- свободный химотрипсин, 2- КМЦ-химотрипсин.
Ферменты проявляют максимальную активность при каком-то
оптимальном значении pH среды. Иммобилизация ферментов часто
приводит к смещению оптимума pH действия. На рисунке 5 на
примере папаина показаны различия между pH профилями свобод-
ного и иммобилизованного папаина ( Weetall н., 1971 ) •
26
Рис. 5. pH профиль свободного и иммобилизованного папаина.
I- свободный папаин, 2- иммобилизованный папаин.
Причина этого явления (Katchalski Е., 1966) заключает -
ся в том, что в результате ковалентного присоединения фер -
мента к зараженной матрице создается микроокружение, отличное
от среды. Отличия в pH среде на поверхности носителя ив на-
ружном слое раствора приводят к изменению pH оптимума нераот -
воримого фермента.
Схематическое представление эффекта pH на "микросреду"
фермента, фиксированного на пористом стекле о первоначальными
аминогруппами, дано на рисунке 6 (Weetail н.,1971). Ионы во-
дорода, аккумулируясь на поверхности частиц, создают более
кислую ореду, по сравнению о внешним раствором.
27
i
Рис. 6. Эффект pH на "микросреду" энзима на пористом
отекле.
Чаще pH оптимум ферментов при их иммобилизации, сохрани -
стоя; более того, сохраняется и форма кривой pH профиля для
растворимых ферментов. Однако в ряде случаев имеет место сме-
щение pH оптимума как в щелочную, так и в кислую зону ( Mela -
renA., 1957)»
Одной из важных характеристик фермента является его спе-
цифичность. Необходимо учитывать то, что процессы фиксирования
ферментов на носителях иногда приводят к изменению специфик -
нооти их по отношению к оуботратам. Например, легче гидроли -
зуются низкомолекулярные субстраты, чем высокомолекулярные.
28
Было обнаружено, что растворимый и нерастворимый трипсин по
разному гидролизует пептидные связи. Однако серьезные измене-
ния в специфичности действия иммобилизованных ферментов на-
блюдаются редко и поэтому не могут быть преградой на пути их
внедрения.
Кинетика иммобилизованных ферментов описывается уравне-
нием Михазлиса-Ментена.
Согласно теоретическим предпосылкам, кажущееся значение
константы Михазлиса Км при иммобилизации ферментов увеличивает-
ся (Ахап а.,1970). Однако встречаются случаи, когда кажущееся
значение Км сдвигается в ту или иную сторону вследствие влия-
ния диффузионного сопротивления и коэффициента активности суб-
страта. Исчерпывающая трактовка указанного явления в литера -
туре не дана.
Из вышеизложенного следует, что достичь хороших технико-
зкономических показателей применения твердых препаратов фер -
ментов можно лишь на основе глубокого изучения механизма им-
мобилизации и химических свойств полученных компонентов.
1У. АППАРАТУРНОЕ РЕШЕНИЕ ГЕТЕРОГЕННОГО ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
Конечной целью работ по иммобилизованным ферментам яв-
ляется их внедрение в практику.
Как было уже отмечено, существующая технология исполь -
зевания растворимых ферментов, а также ферментных препаратов
имеет ряд недостатков. Стремление преодолеть главные из них
привело исследователей к идее создания "вечного" катализато -
ра. Такая идея в прямом смысле зтого слова, разумеется, не -
осуществима. Но исследователи приходят к убеждению, что соз -
дание систем и комплексов ферментов пролонгированного дейст -
вия вполне реально. Видный американский ученый H.Waatall
(1971) писал по зтому поводу: "Технология, считавшаяся все -
го пять лет назад лабораторным недоразумением, стала тем ,
что можно называть главным достижением технологии в последнее
десятилетие". Рентабельность процессов производства дорого-
29
стоящих биологически активных веществ (антибиотиков, витами -
нов,гормонов и др.) на основе использования иммобилизованных
ферментов даже при современной высокой их стоимости доказана
практикой.
Следует отметить, что разработке технологических схем
и аппаратурного решения технологии, основанной на гетероген -
ном ферментативном катализе, уделяется большое внимание. Ис -
следования ведутся по пути создания и совершенствования аппа-
ратов для осуществления гетерогенного ферментативного катали-
за - в основном реакторов и колонок.
В литературе описаны:
I) реакторы периодического действия с непрерывным пе-
ремешиванием;
2) реакторы непрерывного действия на принципах: а)ульт-
рафильтрации, б) взвешенно-контактного слоя, в) периодически
меняющихся мешков с твердым ферментом;
3) колонки с фиксированным ферментом.
Отсутствие поточности в реакторах периодического дейст-
вия и опасность механического разрушения нерастворимых комп-
лексов ферментов при перемешивании характеризует реакторы
как недостаточно эффективные. Более перспективны колонки, в
которых нерастворимые ферменты используются во взвешенном
слое или на насадках. Работа таких колонок характеризуется
непрерывностью, пролонгированностью и одностадийностью осуще-
ствляемых процессов. В них создается возможность снижения
процессов автолиза ферментов ( особенно протеолитических ),
а также регулирования стационарного режима работы аппарата с
постоянной концентрацией готового’ продукта на выходе (вслед-
ствие учета падения остаточной активности ферментов во вре-
мени, их старения, денатурации и ряда других факторов).
К недостаткам колонок реакторов непрерывного действия
с насадкой относится то, что необходимо считаться с высоким
30,
гидростатическим сопротивлением, особенно при обработке вяз -
ких или содержащих взвешенные примеси растворов. Применение
реакторов со взвешенным контактным слоем твердого фермента,с
одной стороны, затрудняется сложностью отделения компонентов
от растворов субстрата и продукта реакции, а с другой - сни-
жением эффективности обработки в результате флокулирующего
действия продуктов реакции на ферменты,
С теоретической и практической точек зрения представля-
ют интерес трубчатые реакторы для гетерогенного ферментатив-
ного катализа. В литературе описан ряд способов изготовления
открытых трубчатых реакторов, в которых фермент действует как
гетерогенный катализатор. Чаще в качестве материала для изго-
товления трубок используют найлон (НогЪу W.,Eilippueeon. н.,
1970). Так на внутренних стенках найлоновых трубок путем ко-
валентного связывания был иммобилизован трипсин. Проведено
подробное исследование реакторов, собранных из таких трубок.
При использовании различных субстратов найдено, что кинетика
реакций подчиняется уравнению Михаэлиоа-Ментена, даже при
низких скоростях потока, причем полученные величины Км выше,
чем в случае растворимого трипсина. Максимальная скорость
реакции была достигнута тогда, когда трубки содержали значи-
тельное количество активного(ва единицу веса носителя) фер -
мента и когда реакция контролировалась (была в зависимости)
диффузией субстрата к катализатору, расположенному на стен -
ках трубки.
Описаны реакторы, в которых ферменты каталаза, уреаза,
химотрипсин и щелочная фосфатаза были заключены внутрь полых
волокон с полупроницаемыми стенками из целлюлозы и ацетатцел-
люлозы.
31
Рис.7. Непрерывно действующий реактор на принципе
взвешенно-контактноро слоя.
I- раствор субстрата, 2- хладоагрегат.
Но l. и Humphrey А. (1970) впервые дали анализ технико-
экономических показателей работы ряда реакторов гетерогенного
ферментативного катализа и показали пути оптимизации режимов
их функционирования. Выход'готовых продуктов оптимизирован в
зависимости от pH, температуря, продолжительности процессов,
скорости инактивации ферментов и их стоимости. Установлено,что
температура реакционной смеси является одним из наиболее важ-
ных параметров контроля процесса. С экономической точки зре-
ния оказалось выгоднее обеспечить сохранение активности фер-
мента в ходе реакции, чем контролировать и поддерживать ос-
тальные параметры процесса.
В заключение раздела необходимо отметить, что для широ-
кого применения реакторов для гетерогенного ферментативного
катализа необходима разработка теории гетерогенного катали -
за и разработка расчетов аппаратов. Это возможно на базе ши -
рокого применения математического моделирования процесса.
32,
У. ПРИМЕНЕНИЕ ИММ0ЫП1Й30ВАННЫХ ФЕРМЕНТОВ В ПИЩЕВОЙ
ПРОМЫШЛЕННОСТИ
Пищевая промышленность является одной из отраслей с на-
ибольшими перспективами использования нерастворимых ферментов
на различных стадиях производства. Широкое применение находят
не только высокоспецифические иммобилизованные ферменты, но и
катализаторы комплексного действия. Основные работы по исследо-
ванию применения твердых катализаторов направлены на усовершен-
ствование технологии производства пищевых продуктов в целях по-
вышения качества продукции при одновременном снижении ее себе-
стоимости.
Технологические процессы по направлениям использования
иммобилизованных средств можно классифицировать следующим обра-
зом:
I. Получение конечного продукта,
2. устранение примесей,
3. разделение смесей продуктов реакции.
Эта классификация дает возможность получить полное пред-
ставление о перспективах применения иммобилизованных ферментсв
в пищевой промышленности.
Приведем описание некоторых способов.
Представляют практическую значимость споссбы разделения
рацемической смеси аминокислот (23,71,72). Технологическая схе-
ма получения Ь -аминокислот (Тибата И. и др., 1969 показана на
риоунке 8.
Как следует из описания процесса получения продукта в ко-
лонке с диэтиламинозтилсефадексаминоцилазой, скорость расщепле-
ния субстрата обратно пропорциональна скорости протекания суб-
страта, прямо пропорциональна концентрации ферментов и не зави-
сит от формы и высоты колонки. Авторы успешно осуществляли про-
мышленное применение непрерывной асимметрической реакции гидро-
лиза по вышеописанному способу с получением оптически активных
аминокислот .
33
Рис.8 Технологическая схема получения L-аминркислот
I- ДЭАЭ-сефадевс; 2- резерзуар для получения иммоби -
лизованного фермента: 3- резервуар фермента; 4- аце -
тил-Д-аминокислота; 5- насос; 6- фильтр; 7- теплооб -
менник; 8- ферментационная колонка с рубашкой; 9-рас-
ходомер; 10- резервуар с горячей водой; II- насос;
12- продукт ферментативной реакции; 13- устройство
для непрерывного концентрирования; 14- ацетил-Д-ами-
нокислота; 15-l -аминокислота; 16- резервуар для ра -
цемизации.
34
Колонка такого типа функционирует стабильно в течение
длительного времени. Так, например, колонка с амииоацилазой,че-
рез которую непрерывно пропускали в течение 32 дней 2М раст-
вор ацетил-Д1-метионина при 50°С сохраняла более §0% активности
фермента. Путем повторного пропускания раствора фермента можно
восстановить его активность в колонке.
Технологические схемы получения конечного продукта в пище-
вой промышленности чаще всего основаны на процессах гидролиза.
Применяются также реакции окисления-воостановления, отщепления,
изомеризации и др.
В СССР и за рубежом проведены широкие исследования по по-
лучению глюкозной патоки из крахмала (3,4,58,59) по схеме:
крахмал + HgO гликоза,
и инвертного сахара из сахарозы (60) по схеме:
сахароза + HgO —глюкоза + фруктоза.
Большие перспективы открывает перед пищевой промышленнос-
тью способ гидролитического получения глюкозы из целлюлозы (61).
Наша страна располагает огромным запасом целлюлозного сырья для
будущего нового направления в производстве пищевых продуктов.
Большое значение придают этому вопросу и за рубежом, в частнос-
ти, в США.
В нашей стране в институте химии природных соединений
им. М.М.Шемякина АН СССР (Антонов В.К., 1970) и за рубежом
(Green, м. , 1969 , 01 eon. и., 1971) разрабатывается способ свер-
тывания молока. В сыродельной промышленности он применяется для
экономии и замены дефицитного сычужного фермента (реннина) дру-
гими протеолитическими ферментами. Для иммобилизации здесь ис-
пользуются реннин и -химотрипсин, а в качестве носителя КМ-цел-
люлоза. Процесс свертывания молока протекает в две стадии: 1)фер-
меитацжя казеина молока при температуре ниже Ю°С, и 2) коагу-
ляция молоиа при повышенной температуре.
Предложен также способ обработки молока для снижения со-
держания в ием лактозы. Для этого лактаза (у?-галактозидаза)
фиксирована на неподвижном носителе, нерастворимом в обрабаты-
ваемом молоке. I
35,
Препарат иммобилизованной лактазы мог использоваться повторно.
Обработанное указанным способом молоко лучше переносится людь-
ми, плохо усваивающими лактозу, а при его использовании для
производства некоторых видов мороженого предотвращается выпа-
дение кристаллов (62,63).
Представляет интерес описание способов синтеза веществ,
предназначенных для улучшения вкусовых свойств коньяка с ис-
пользованием ферментов, выделенных из Bhizopue (Suzuki S. ,
1970) и сыра рокфор (9,48).
Дая устранения нежелательных примесей в пищевых продук-
тах с успехом применяют гидролазы на носителях.
Выдав ряд патентов (США, франция, ФРГ, Англия и др.) на
известный способ обработки пива протеазами против белковых по-
мутнений, где предлагается применение фиксированных протеаз на
твердых носителях. В одном из патентов (67) описан способ при-
дания пиву устойчивости на холоду путем обработки его протео-
литическим ферментом (папаин, фицин, бромелин). Обработку осу-
ществляют внесением в пиво твердых частиц с иммобилизованными
ферментами, которые затем и используют вновь. В описании к это-
му патенту дается таблица, показывающая, что нерастворимый па-
паин такие эффективен, как и растворимый, и что действие нерас-
творимого папаина очень мало изменяется при изменении его кон-
центрации. Заметно такие, что энзиматическая активность повтор-
но примененного нерастворимого папаина улучшает прозрачность
пива.
Таблица 4.
Агент устойчивости к охлаждению Прозрачность (град."п<^у4ие")
Наименование | Конг^туация WlJC
Контроль — 30 17 70 26
Растворим.папаин 0,04 17,b —
Не раствор.папаин 0,9 16,5 16,0 17,0 16,0
Нераствор.папаин 0,45 18,5 16,5 17,0 16,0
Нераствор.папаин 0,11 16,5 15,5 17,0 16,0
Повтори.иопользов. — 22,5 20,0 25,0 19,0
Х/Пиво, охлаждённое до 0°С в течение 4-х дней.
"/Пиво, выдержанное 8 дней при 43% и 6 дней при 0°С.
36.
Данный способ обеспечивает получение пива в более корот-
кий срок и сохранение его прозрачности и вкуоа при охлаждении
перед траяопортировкрй л употреблением.
Ряд других патентов выдан на способы обработки напитков
также для придания им стойкости при охлаждении (пиво, элю, ви-
на, ликеры, сиропы) (4,64,65,66). Обработку напитков осущест-
вляют нерастворимыми соединениями полимеров о ферментами, ко-
торые действуют при pH обрабатываемого напитка. В результате
продолжительного воздействия их ла неустойчивые компоненты
напитков образуется ооадок, который в дальнейшем отделяют. Об-
работанные таким образом напитки прозрачны, имеют повышенную
стойкость при охлаждении, обладают хорошим вкусом и не содер-
жат соединений полимеров о ферментами.
Обработку ферментов осуществляют на различных этапах
процесса производства - до брожения, во время брожения, при
купаже и выдержке, перед розливом и т.д. Для осуществления об-
работки напитки пропускают через колонку с нерастворимым фер-
ментом, причем в колонке поддерживается температура, близкая
к той, при которой проявляется наибольшая активность фермен-
тов.
Наиболее эффективным приемом оказалась обработка продук-
тов комплексом иммобилизованных ферментов. В качестве носите-
ля при этом рекомендуются полимеры из гранул, включающие сопо-
лимеры малеинового ангидрида с этиленом (ЭМА), отирол,винил-ме-
тиловый эфир, винилацетат, полималенновый и полиакриловый ан-
гидриды. В составе комплексов были использованы папаин, нейт-
ральная и кислая протеазы, фицин. Применялись также комбинации
двух или более ферментов (протеазы и амилазы или диастазы,
пепЛи и папаин). Последнее позволяет достичь лучших технологи-
ческих результатов.
Интересны работы по предотвращению окисления соков, в
основу которых положены скислительно-вооотановительные реак-
ции под действием нерастворимой глхвозооксидазы
глюкоза + Og —>. глюконовая к-та +^2»
Кеотиером А.И. с сотрудниками (1973) предложен способ
устранения кислорода из соков при помощи связанной в полиак-
риламидном геле глюкозоокоидазы.
37.
Ниже дам опытная установка, используемая авторами.
Еже. 9 Схема опытной установки для устранения кислорода из
ооков при помощи иммобилизованной в гель глюкозооксидазн
I - резервуар о исходным соком: 2- насос; 3 - колон-
ка; 4 - анализатор кислорода; 5 - измерительный при-
бор; 6 - резервуар с обработанным соком.
В опытах использовалась колонка о размерами 16 х 70 мм
при 30°С, о фиксированной в геле глижозоокоидазей активностью
0,2 Е/г. Обрабатывались натуральные яблочные и вишневые оони,
предварительно фильтрованные через диатомит. Полученные резуль-
таты даны в таблице 5. Как свидетельствуют данные, при низкой
скорости потока в колонке (длительный контакт) устраняется бо-
лее 74% кислорода из яблочиого оока и более 30% кислорода из
вишневого сока.
38.
Таблица 5
Устранение кислорода из соков при
помощи связанной глюкозооксидазы ( по Кестнеру А.И.)
Сои Скорость мд/мии 1 „ i Насншея.иоздухом
остаточный и2 ! остаточнмй 2
мг/л % н* 1 %
Исходный 15,4 200 4,7 [00
2,5 8,1 52,6 2,3 49,0
Яблочный 1,5 5,4 35,0 1,6 34,0
0,7 3,7 24,0 1,1 23,4
Исходный 8,8 100 3,8 100
2,0 4,1 46,0 1,6 42,2
Вкшиевый 1,4 2,7 30,7 1,1 29,3
0,6 1,9 21,6 0,7 18,4
Кстати, глюкозооксидаза используется и при изготовлении
энзимных электродов для определения концентрации глюкозы (70).
Нами ио ВНИИ ВжВ "Магарач" ведутся исследования по исполь-
зованию иммобилизованных ферментов в виноделии и соковом произ-
водстве. В частности, проведена работа пс выбору приемлемых носи-
телей и способов иммобилизации ферментных препаратов. В качестве
носителей испытаны вещества, разреиеияые и уже используемые в
виноделии: бентонит, диатомит, фосфорный эфир целлюлозы, титано-
вый порошок, пористое стекло, а также осадочные дрожжи виноде-
лия. Ферментные препараты: Пектаваморжн П10Х (ВНИИПр.Б), Ксилана-
за, препарат из Asp.flavus* 238 (Укр.ВИИШ) - иммобилизовались
методами адсорбции (бентонит, диатомит, фосфорный эфир целлюло-
зы) и методом образования' химической ковалентной связи с помощью
цианурилхлорида ( бентонит, фосфорный эфир целлюлозы, пористое
стекло).
Эффект иммобилизации и эффективность работы колонок с им-
мобилизованными ферментами оценивали по снижению вязкости раст-
воров пектина и карбоксиметилцеллшозы, а также по снижению мут-
39,
octi виноградного сусла и вжна после его обработка.
Ишобилжзация химическим методой составила в среднем 40-
50 мг белка на I г носителя, адсорбция 10-30 мг/л. Однако ре-
зультата во определению остаточной аитивиости полученных ком-
плексов показала, что адсорбция приводила и большому ингибиро-
ванию фериежтов (в частности, эидо-полигалактуроназы) и мень-
шей прочнооти комплексов.
Оптимизацией-параметров работы колонки с иммобилизован-
ными ферментами достигнут технологический эффект снижения вяз-
кости сусла на 0,6 спз*/, по сравнению с контролем, и мутности
до 0,5 у.е.10* , также в сравнения с контролем.
Последнее обстоятельство открывает широкие перспективы
в виноделии, в принципе на этой основе будет возможно осуществ-
ление стабилизации внв в истоке против помутнений, обусловлен-
ных высокомолекулярными соединениями вина, и проведение других
технологических операций, в основе которых лежит ферментатив-
ный процесс.
Как можно видеть из рассмотренных примеров, применение
иммобилизованных ферментов в пищевой промышленности уже вышло
за рамки лабораторий. Долг исследователей и практиков отдель-
ных отраслей промышленности уделить должное внимание работам
по быстрейшему внедрению в производство технологии, основан-
ной на использовании иммобилизованных ферментов..
Прибор Heoteet -2, положение I-12-а.
Прибор конструкции ВНИИ ВиВ "Магарач".
х хх/ Ганна Б.С., Павленко Н.П. .Датунашвили Е.Н. - см. в
тезисах докладов 1-го Всесоюзного симпозиума по
жишобклизоваиинм ферментам (в печати).
40.
Список иммобилизованных ферментов, перспективны?
для применения в пищевой промышленности
В литературе описаны способы иммобилизации почти 100 фер-
ментов, их комплексов и выделенных биологических структур, а
такие определены области их применения. Иммобилизованы прак-
тически ферменты всех классов: гидролазы, оксидоредуктазы,
трансферазы, изомеразы, лигазы и лиазы (14,19,38,42,51).
В конце 60-х годов за рубежом появились в продаже пре-
параты иммобилизованных ферментов. Среди них препараты
•fee' фирмы "Miles seravac", "Sephazyme" фирмы "Pharmacia";
ряд иммобилизованных ферментных препаратов выпускают также
фермы "Merck" «"Boehringer" »"Koch Light Laboratories " »
"Worthington Bichemical Corporation", "Corning Glass Works"H
другие. В нашей стране специальным конструкторско-технологи-
ческим бюро биологически активных веществ Сибирского отделения
АН СССР освоено производство ряда ферментов на носителях.
Широкий перечень ферментов с указанием способов иммоби-
лизации , носителей и связующих агентов приведен в недавно опуб-
ликованной обзорной информации Кестнером А.И. и Крези М.И.
(Таллин, 1973).
Однако необходимо отметить, что большинство предлагае-
мых препаратов дороги, иммобилизовании иа носителях, мало
приемлемых для применения в пищевой промышленности (инертные
полисахариды, полимеры), или используются не совсем подходя-
щим методом для того или иного практического применения им-
мобилизованных ферментов и обрабатываемых пищевых продуктов,
а также для варианта аппаратурного решения гетерогенного фер-
ментного катализа.
Из опубликованных сведений по применению иммобилизован-
ных ферментов в пищевой промышленности приводам лишь наиболее
перспективные.
41
Фермент j. t ! Способ иммоби- } Вариант } Источники низацжи, носи- [применения j таль ! ! 1 !
I ! 2 ! 3 ! 4
Глюкоамилаза Адсорбция на не- Получение глю- ( 3,4,58,
(о(-1,4глюканглю- органических но- козы из крахма- 59)
когидролаза), сителях, на ДЭАЭ- ла.Осахарива- / 3 / хх
КФ 3.2.1.3.) целлюлозе.Хжми- ние крахмала
ческое связыва- для получе-
ние на целлюлозе, ния спирта
микроорганизмах.
оС-амилаза Химическое связи- Гидролиз крах- (28,67,78,
(о(-1,4глюкан- ваше на синтети- мального клей- 79)
4-глюканогидро- ческих полимерах стера с полу- / 35 /
лаза, (ЭМА,полиакрила- чением мальтозы.
КФ 3»2>1еХ» мид и др.) и на
целлюлозе.
^-амилаза Химическое связи- Стабилизация (28,78,67)
(д-1,4-глюкаи- ваше на целлюло- пива против по-
мальтогидролаза) ’ зе, межмолекуляр- мутнений при вы-
КФ 3.2.1.2) ная ошивна. держие на холоду.
Декстраназа Химическое связи- Стабилизация ( 20,64 )
W-1,6-глюкан- ваше на целлюло- пива против по-
-6-глхжаиогидро- зе и ткаш мутиений при вы-
лаза, держие на холоду
КФ 3.2.1.II)
Целлюлаза Химическое связыва- Получение глю- (11,61,
^-1,4-глвкав- ние на синтети- козы из целлю- 79,80)
глюканогидро- ческих полимерах лозного сырья
лаза, (ЭМА,производные
Кф 3.2.1.4) метакриловой и-ты)
42.
I ! 2 ! 3 ! 4
Инвертаза (Д-Д- Адсорбция на Инвероия сахаро- /II/
фруктофуранозид- угле,бентони- зы для улучшения
фруктогидрола- те и др.иеор- качества,коиди-
за. ганических но- терских изделий,
КФ 3.2.1.26) сителях.Хими- с целью примеие-
ческое связыва- ния в шампаис- (80)
ние на синте- ком произведет-
тических полк- ве при приготов-
мерах.Вилюче- лении ликеров и
ние в гель. ДР. /23/
Амилаза («уточненная) Химическое связывание на синтетических полимерах.Ад- Гидролиз амилозы 1 [80)
сорбция на лиг- (8)
кине.
Аминоацилаза Адсорбция на Получение амино- (23,71,
(ациламид-ами- ДЭАЭ-целлюлозе. кислот из шеей 72)
догидролаза, Химическое свя- рацематов.
КФ 3.5.1.4) зывание на сии-
тетических по-
димерах.
^-галактозида- Адсорбция на Обработка молока с (19,62,
за ДЭАЭ-целлглозе. целью гидролиза 63)
(/З-Д-галакто- зид-галактози- Химическое связи- лактозы.предотвра ванне на полиса- щение образования
даза, харидах,стекле. кристаллов в моро
КФ 3.2.1.23) кеиом.
Епжозооксидаза Межмолекулярна я Устранение кислорода (64)
(j^-глхжоза: сшивка. Заключе из вин и соков и др.
02-оксидоредук- ние в полые волок- напитков,а также kt»)
таза, на. изготовление энзим-
КФ I.1.3.4) „ них электродов для кW Химическое связи- измеренм нОвдевт_ ванне на стекле. (тд\ Заключение в гель. *>“’« глгаозы- ?
43
II 2 ! 3 ' ! 4
Трипсин Адоорбция на лиг- КФ 3.4.4.4. Химическое связыва- ние на стекле. Заключение в гель кремниевой кислоты. Химическое связыва- ние на полиамино- кислотах (8) (К) (9) (17,30)
Химотрипсин Химическое связыва- Замена сычуж- (32)
КФ 3.4.4.5. ние на целлюлозе, них ферментов /17/
КМ-целлюлозе.стек- ле .сополимере ЭМА* Включение в гель полиакриламида. Реннин Химическое соедкне- реннина в сы- родельном про- изводстве. Повышение эф- /2£/ /34/
КФ 3.4.4.3. ние на инертных по- лисахаридах. Фицин Химическое связы- фективности ис- пользования рен- нина, его эконо- мия. Рекомендован в (13,14)
КФ 3.4.4.12. ванне на стекле, окиси кремния,цел- люлозе .сополимерах ЭМА. составе комплек- са ферментов для обработки напит- ков (пиво и др.) /13/ (67)
Межмолекулярная сшивка. Бормелин Химическое связыва- Рекомендован в (67)
ние на полимерах,меж- молекулярная сшивка составе комплек- са ферментов для обработки напит- ков (пиво и др.)
44
I ! ' 2 .! 3 ! 4
Папаин Адсорбция на стек- Придание стойкое- (I)
КФ 3.4.4.10 ле.Химическое свя- зывание на стекле, целлюлозе. ти недистиллиро- ванным напиткам (пиво,элю .ви- нам, сиропам, ликерам). (14) (25) (65)
Пепсин Адсорбция на стек- Используется в /II/
КФ 3.4.4.I ле.Химическое свя- зывание на окиси ник еля,сополимерах ЭМА,полимере мета- криловой кислоты и ее флоуронитро- анилида. комплексе с пеп- сином и амилазой для стабилизации различных напит- ков (вина,пива, ликера) (14,79, 80)
Протеаза (неуточнен- Адсорбция на неор- ганических носите- Гидролиз белковых веществ напитков, (2,53)
нал) лях.Химическое свя- зывание на сополи- мерах ЭМА. вызывающих соот- ветствующие помут- нения. (25)
Кислая про- теаза (не- Адсорбция и хими- ческое связывание Стабилизация со- ков и вин,пива и /29/
уточненная) на неорганических носителях,ионооб- менниках.полиме- рах. Пектиназа Адсорбция и хими- (неуточненяая) ческое связывание на неорганических носителях,иоиооб- меияиках,полиме- рах. др.напитков про- тив белковых по- мутнений. Осветление сусла, соиов, вин и др. напитков. /30/
45,
I ! 2 ! 3 ! 4
Каталаза Адсорбция на неор- Рекомендуется /II/
(Н202:Н202- оксидоредук- таза, КФ I.II.I.6 ганических носите- для обработки лях,а также на пищевых про- ДЭАЭ-целлюлозе и дуктов,совмест- на КМ-целлюлозе. но с глюкозоок- Химическое связыва- сндазой, с ние на целлюлозе, целью устране- сополимере ЭМА, ния кислорода, стекле. (79)
( ) - патентно-лицензионные источники
/ / - литературные источники
У1, ЗАКЛЮЧЕНИЕ
Изучение патентно-лицензионной и периодической литерату-
ры по получению и применению иммобилизованных ферментов в раз-
личных отраслях пищевой промышленности позволяет судить о сос-
тоянии разработок, общем техническом уровне и экономической
целесообразности применения гетерогенного ферментативного ка-
тализа.
Описано большое число способов иммобилизации ферментов,
предложены носители, а такие связующие агенты.
Наибольший практический интерес представляет способ иммо-
билизации ферментов образованием химической ковалентной связи
между носителем (связующим агентом) и ферментом . Способ дает
в большинстве случаев хорошую остаточную активность и полнос-
тью исключает попадание фермента в готовый продукт.
Большое внимание уделяется способам повышения устойчи-
вости, стойкости, остаточной/активности нерастворимых фермен-
тов.
46.
В отличие от "классического"метода применения ферментных
препаратов, твердые (ферментные катализаторы позволяют вести
технологический процесс с полным контролем и регулированием
обработки пищевых продуктов в колонках и реакторах непрерывно-
го действия с твердыми ферментными препаратами.
Однако ряд предложенных способов не имеет достаточных тео-
ретических обоснований, а также соответствующих технологичес-
ких данных, позволяющих научно доказать преимущества того или
иного способа использования иммобилизованных ферментов и наме-
тить пути широкого их применения.
Приведенный список иммобилизованных ферментов, которые
удалось применить в лабораторном и промышленном масштабах, по-
зволит читателю получить информацию для решения конкретных за-
дач по обработке пищевых продуктов.
Авторы надеются, что настоящий обзор повысит интерес к
актуальным вопросам разработки теории ж практики гетерогенно-
го ферментативного катализа для применения его в сыродельной,
консервной, соковой, винодельческой, мясо-молочной и других
отраслях пищевой промышленности.
47,
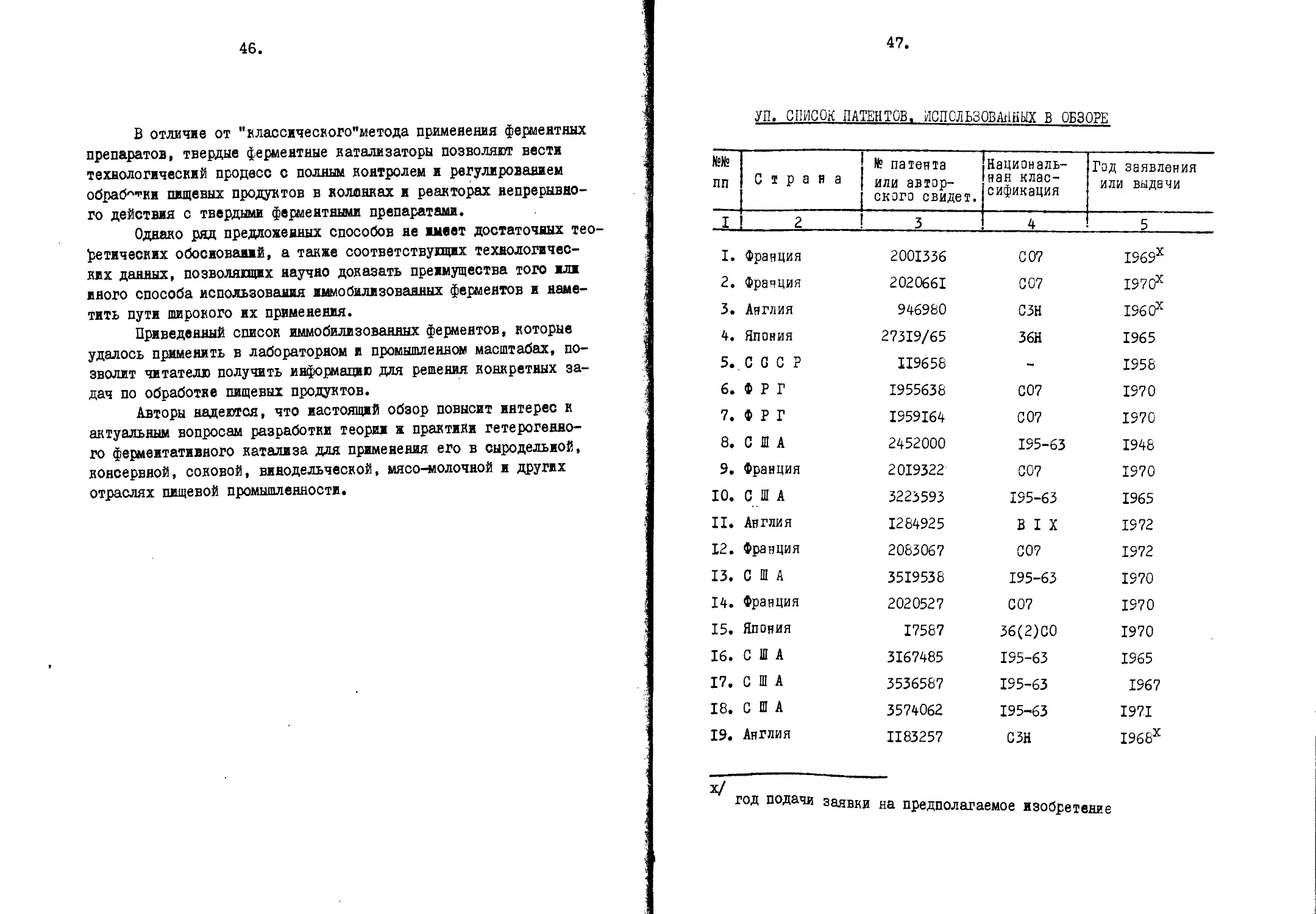
УП, СПИСОК ПАТЕНТОВ, ИСПОЛЬЗОВАННЫХ В ОБЗОРЕ
№№ пп Страна № патента или автор- ского свидет. Националь- ная клас- сификация Год заявления или выдачи
I 2 3 4 5
I. Франция 2001336 СО? 1969х
2. Франция 2020661 С 07 1970х
3. Англия 946980 СЗН 1960х
4, Япония 27319/65 36Н 1965
5., СССР II9658 - 1958
6. ФРГ 1955638 С07 1970
7. ФРГ I959I64 С 07 1970
8. США 2452000 195-63 1948
9. Франция 2019322 СО? 1970
10. США 3223593 195-63 1965
II. Англия 1284925 BIX 1972
12. Франция 2083067 СО? 1972
13. США 3519538 195-63 1970
14. Франция 2020527 СО? 1970
15. Япония 17587 36(2)00 1970
16. США 3167485 195-63 1965
17. США 3536587 195-63 1967
18. США 3574062 195-63 1971
19. Англия II83257 СЗН 1968х
х/
год подачи заявки на предполагаемое изобретение
48,
i : 2 : 3 4 5
20. Англия II83260 СЗН 1970
21. франция I528I84 007 1968х
22. франция 2019085 007 1970
23. Англия II08533 СЗН 1969
24. Франция 2019502 С07 1970
25. Франция 2019084 С07 1970
26. С Ш А 3654083 195-63 1972
27. Англия 1258095 СЗН 1971х
28. Англия I2326I9 СЗН 1971
29. С Ш А 3536587 195-63 1967х
30. С Ш А 3167485 195-63 1965
31. С Ш А 3573170 195-63 1971
32. Англия 1062596 СЗН. 1963х
33. С Ш А 3715278 195-63 1973
34. Япония 8910 36В0 1967
J5. Англия II83I59 СЗА 1970х
36. Франция 2057561 007 1971
37. С Ш А 3519570 252-135 1970
38. С Ш А 3448009 195-63 1969
39. С Ш А 326324 195-63 1957
40. С Ш А 3649457 195-68 1972
41. С Ш А 3556945 195-63 1971
42. Ф Р Г 2137043 6а,22/10 1971
43. Ф Р Г 2035739 ЗОЙ ,9/02 1972
44. С Ш А 3650901 195-63 1972
45. С Ш А 3650900 195-63 1972
46. С Ш А 3208918 195-66 1965
47. С Ш А 3243356 195-63 1966
48. Англия 1267685 СЗН 1972
49. Япония 321808 36В0 1963
50. Ф Р Г I9444I8 007 1970
51. С Ш А 3672955 195-68 1972
52. Англия I25932I СЗН 1972
53. Англия 1259322 СЗН 1972
49.
i : 2 : 3 : 4 : 5
54. Франция 2084750 007 1972
55. Япония 6810986 - 1968
56. Ф Р Г 1945680 007 1970
57. С Ш..А 3597220 99-48 1971х
58. Франция 2П2634 012 а 1972
59. С Ш А 3616229 195-63 1971
60. Ф р..г I90568I 6а,22/10 1970
61. Франция 2019083 012,13/00 1970
62. Франция 2122405 С13к 1972
63. Англия 1224947 СЗН 1971
64. Англия 1258095 СЗН 1971
65. С Ш А 3597220 99-48 1971
66. С Ш А 3597219 99-48 1971
67. Франция 2091786 012,9/00 1972
68. Англия I224I8I С2А 1968х
69. Франция 1552939 007 1969х
70. С DL.A 3542662 204-195 1971
71. Франция I47I792 007 1967х
72. Ф Р Г 2015009 007 1971х
73. С..С С Р 247134 6а/22 1967
74. Англия. 1274869 СЗН 1972
75. Англия 1276006 СЗН 1972
76. Англия 1289549 СЗН 1972
77. Франция 6902432 007 1969
78. Ф Р..Г 2052246 007 1971
79. Франция 2043161 С07 1971
80. Ф Р Г 1282579 60-22/10 1960х
50
СПИСОК ОСНОВНЫХ ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ,
ИСПОЛЬЗОВАННЫХ В ОБЗОРЕ
1. Joustга М.К. "Enzymen on inhibitoren op vasts dragers".
yoedingsmiddelentechnplodie, 1971, v.2, 29/30, p. 3-10.
2, Тибата И. "Приготовление и использование ферментов, не-
растворимых в .воде". Юкигосзй кагаку, 1970, т.28 К! 5,
с.471-484 (перевод с японского).
3. Усами С., Моцубара М., Нода Д. Активность фермента, ад-
сорбированного на носителях. Ханко кекайси, 1971, т.29,
№ 4, с.195-199 (перевод с японского).
4. Martiny S. Vand-uopl0selige derivator of' enzymeг.
Dansk kemi, 1971, v. 52, N 9, p.131-136.
5. Bpton £., Thomas Т.Н. Ал introduction to water-insoluble
enzymes. Kech-Light Laboratories Ltd., Coinbrook, 1971.
6. Zaborsky 0. Nine lives for trapped enzymes. New scientist,
1973, v.57. H 839, p.719-720.
7. Mitz M.A., Summaria L.J. Synthesis of biologically active
cellulose derivatives of enzymes. Nature, 1961 ,v.189,p. 86-87
8. Gryszkiewicz J. Insoluble enzymes, folia biologies, 1971,
v. 19, В 1.
9. Melrose G.J.H. "Insolubilized enzymes; biochemical
application of synthetic polymers". Bev. Pure Appl. Cham.,
1971, 21, 83.
10. Kitajima M.m Kondo A. fermentation without Multiplication
of Cells using Microcapsules that contain Zymase coalpex
and Muscle Enzyme Extract. Bui. Chea. soc. Japan,1971,
v.44, p. 5201-3802.
11. Langmuir J., Schaefer V.J. Activities of urease and its
nonobayers. J. An. Ch. Sec., 1938, v.60, p.13?1«;
51
12» Messing Б.A., Relationship of port size and surface area
to qantity of stabilized enzyme bound to glass.
Enzymologia, 1970» v.39, И 1» p.12.
13 • Weetail H.R. Enzymes immobilized on inorganis carriers.
Research/Development, 1971, v.22, N 12, p.18-22.
14. Axon R. et al. Ribonuclease chemically attached to beads
of epichlorhydrin cross - linked agarose.
Enzymologia, 1971, v.41, p.359«
15. Emery A.H. et al. Some applications of solid - phase
enzymes in Biological Engineering. Chemical Engineer,
1972, К 258, p.71-76.
16. Monsan P., Durand G. Preparation d*invertase insolubi-
lisie par fixation sur bentonite. EBBS Letters, 1971,
v.16, it 1, p.39-42.
17. Суровцев В.И.,Козлов Л.В. .Антонов В.К. Свойства химо-
трипсина, ковалентно связанного с карбожсиметжлцеллюло-
зой. Доклады АН СССР,1970, т.195, « 6, g.1463-1465.
18. Долги! Т.В. и др."Исследование свойств химотрипсина,кова-
лентно связанного с иарбоксиметжлцеллюлозсй в отношении
свертывания молока" .Прикладная бисхимия и микробиология,
1971, т.УП, выл.6, с.686-689.
19. Суровцев В.И. Исследование свойств ок-хжмотршгскиа,кова-
лентно связанного с жарбожсиметжлцелдюжозой. Диссерта-
ция на соискание ученой степени наяд.хим.наук,
М., 1972.
20. Mclaren A.D. Concerning the pH dependence of enzyme
reactions on cells, particulates and in solutions.
Sciens, 1957, v.125, H 3250, p.S97.
21. Silman H., Albu-Weissenberg M., Katchalski E. Some
water-insoluble papain derivatives. Biopolymers,
1966, v,4, p. 441.
22. Hornby W.E., Eilippusson H, The preparation of trypsin
chemically attached to nylon tubes. Biochim. Biophys.
acta, 1970, 220, N2, p.343-345.
52
23. Креэи М.И., Кёстнер А.И., Каск К.А. Получение фиксирован-
ной полиакриламидным гелем инвертазы. Труда ТЛИ, серия
А, М 300, 1971, с.21-31.
24. Креэи М.И., Кёстнер А.И., Каск К.А. Гижозооксидаза,
фиксированная в полиакриламидный гель. Труда ТЛИ, серия А,
1 331, 1973, с.147-156.
25» Brown. Е, Raeds A. Les enzymes LnsolubilisAes. Bui. Soo.
Ohim. Prance, 1971, Я 12, p.4613-4617.
26. Суринов Б.П., Манойлов C.E. Получение и свойства нераст-
воримых соединений некоторых ферментов с целлюлозай. Гео-
химия, 1966, т.31, М2, с.387-397.
27. Николаев В.Я. Каталитическая активность аспарагиназы в
растворе и в адсорбированном состоянии. Геохимия, 1962,
т.27, » 5, с.843-848.
28. Но L J ,Humphrey А.А. Optimal control of an enzyme reac-
tion subject to enzyme deactivation. Biotehn.Bioengn.,
1970, v.12, p. 291.
29. Гаииа Б.С.«Павленко H.M. Сравнительные данные по адсорб-
ции и химическому связыванию ферментных препаратов на
твердых носителях. Тезисы доклада на I Всесоюзном симпо-
зиуме по иммобилизованным ферментам (в печати).
30. Датунашвили Е.Н., Гаииа Б.С. Осветление виноградного со-
ка на колонках с иммобилизованными ферментами. Тезисы
доклада на I Всесоюзном симпозиуме по иммобилизованным
ферментам (в печати).
31. Иваницкий А.М. О токсикологических ферментных препаратах,
предназначенных для использования в пищевой промышленнос-
ти. Вопросы питания, 1973, * 4, с.39.
32. Виссарионова В.Я, и др. Влияние ферментов пектиназы,по-
лученных из поверхностной и глубинной культур гриба ац>.
awamorl шт.16, на некоторые биохимические и морфологи-
ческие показатели состояния организма. Вопросы питания,
1970, * 4, с.60.
53
33. Kay G., Lilly M.D. The chemical attachament ofchimo-
trypsin to water—insoluble polymers using 2-amuno~4,6
dichloro-s-triazine Biochim. Biophys. Asta, 1970,198,
p. 276-285.
34. Green M.L., Grutchfield G. Studies on the preparation
of water-insoluble derivatives of rennin and chymo-
trypsin and their use in the hudrolysis of casein and
clotting of milk. Biochem. J., 1969, v.115, N 2,p.183.
35» Кретович В.Л. и др.Техническая биохимия , М., 1973.
36. Barker S., JSpton К. Water-insoluble enzymes. Process
Biochem, 1970, v. 5» N 14.
37. Звягинцев Д.Г..Великанов Л.Я. Активность адсорбированных
ферментов. Тезисы севд. сообщ. 2 Всесоюзного Биохимичес-
кого Симпозиума, Ташкент, 1969, 2А -2-5, с.18.
38. Звягинцев Д.Г., Алиев Р.А. "Адсорбированные ферменты и
перспективы их использования". Вестник Московского уни-
верситета, Биология, № 3, 1973, с. 68-72.
39. Porath J. Gelpartikelbundna enzymer. Kemisk tidskrift.,
1972, v. 84,N 1-r2, p.40-47.
40. Полторак O.M., Чухрай E.C. Физико-химические основы фер-
ментативного катализа. "Высшая школа", М., 1971.
54
СОДЕРЖАНИЕ
стр.
I. Введение 3
П. Способы получения иммобилизован-
ных ферментов 6
Ш. Свойства фикоированных ферментов 21
ТУ. Аппаратурное решение гетероген-
ного ферментативного катализа 28
У . Применение иммобилизованных
ферментов в пищевой промышлен-
ности 32
Список иммобилизованных ферментов,
перспективных для применения в
пищевой промышленности. 40
У 1. Заключение 45
У П. Список патентов, использованных в
обзоре 47
Список основных литературных источ-
ников, использованных в обзоре 50
55
Формат 60x90^/16
Тираж 1000 8КЗ.
Подписано к печати 28.2.1974г. Л69386
Объем п. л. 3,5 Уч.-изд. л. 2,12
Цена 21 коп. Изд. № 4860 3ait.J/0
Типография ЦНИИТЭИпищепрома