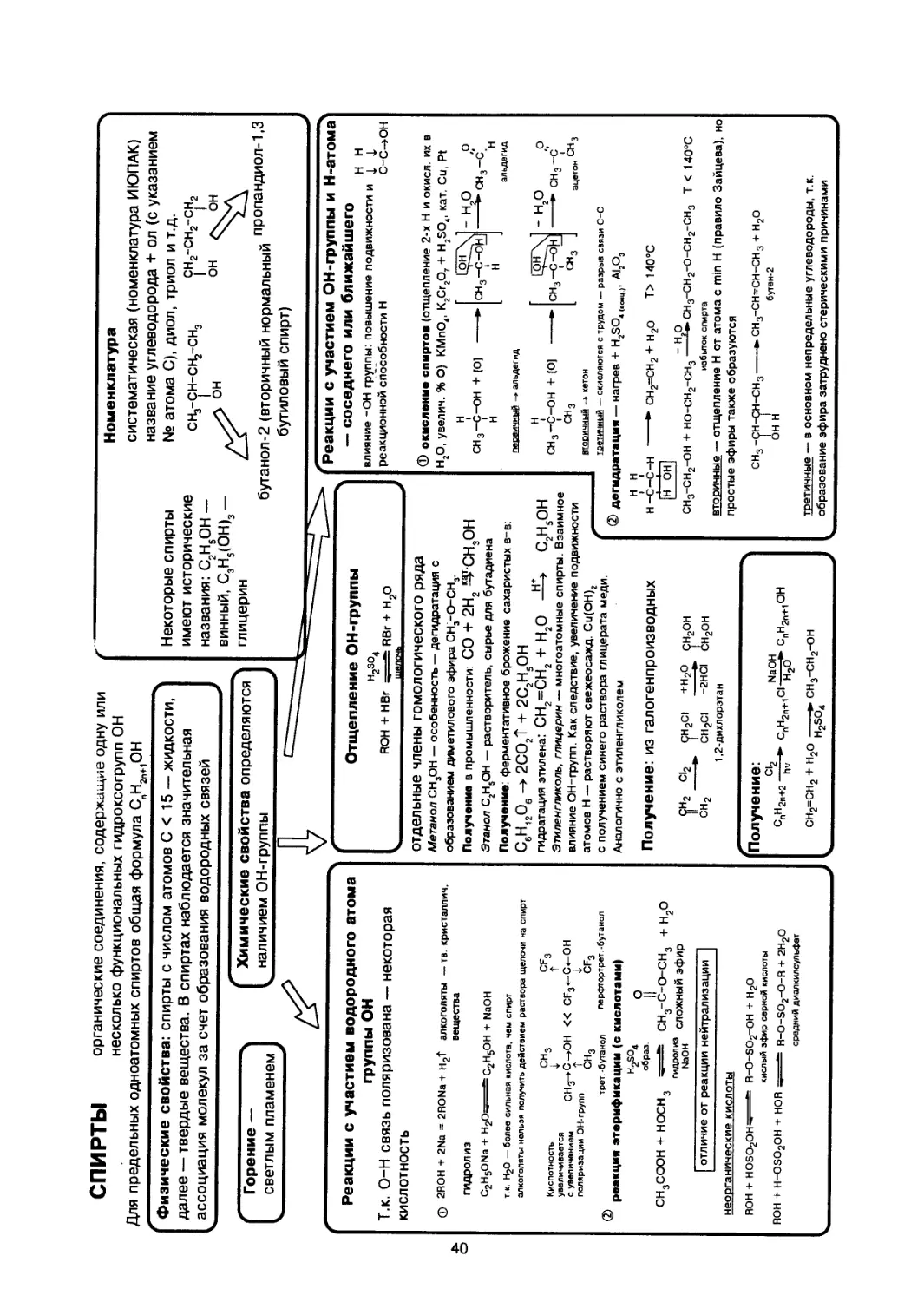
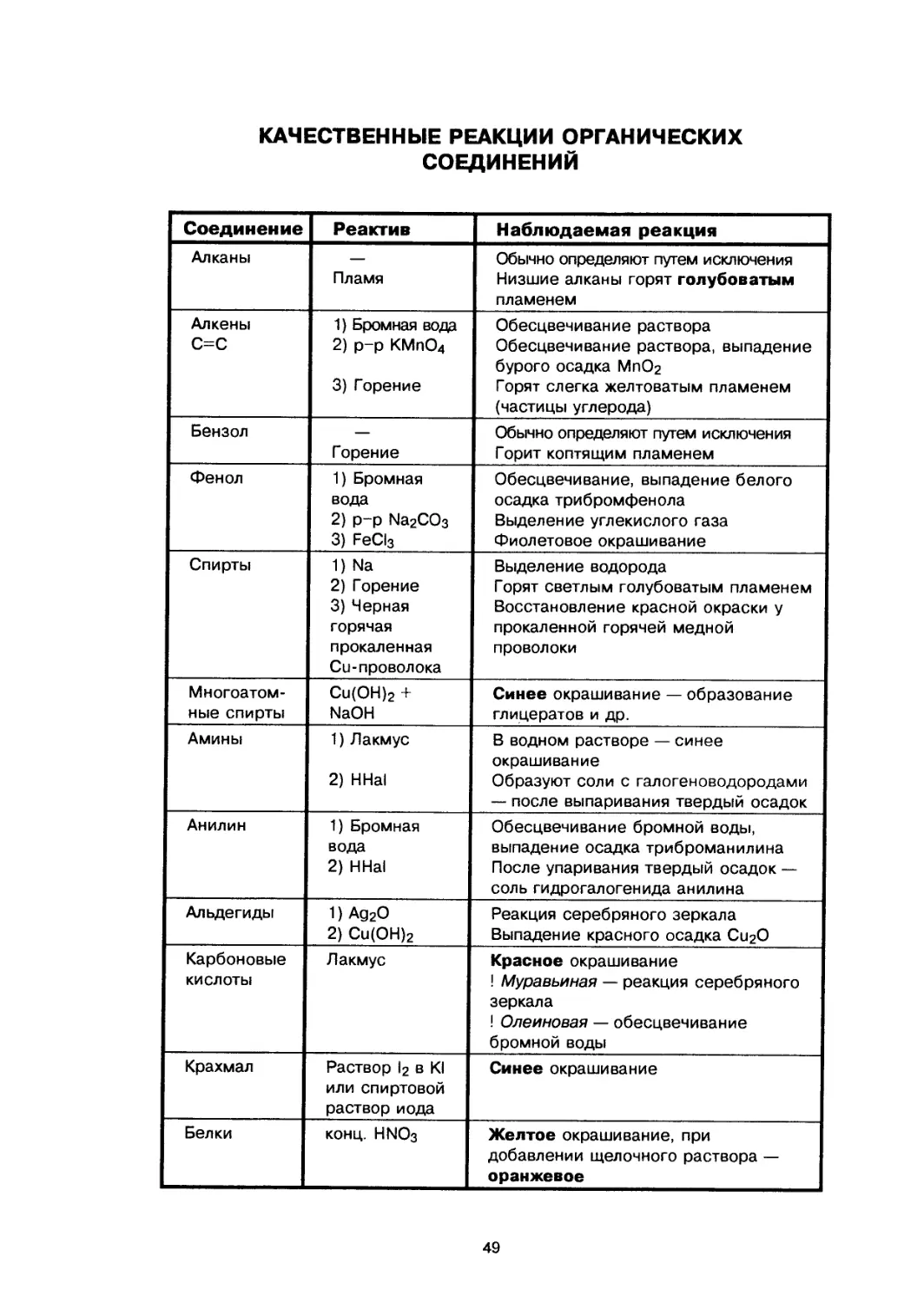
Text
А.Ю. СТАХЕЕВ
ВСЯ химия
А.Ю. СТАХЕЕВ
ВСЯ химия
В 50 ТАБЛИЦАХ
Пособие для учащихся старших классов
и абитуриентов
Под редакцией С.С. БЕРДОНОСОВА
Издание второе,
переработанное и дополненное
'рост
Москва 1998
Стахеев А. Ю.
Вся химия в 50 таблицах. Под ред. С. С. Бердоносова. 3-е изд.—
М.: МИРОС, РОСТ, 1998. — 64 с.
ISBN 5-7804-0063-6
Пособие в краткой и наглядной форме содержит теоретический материал по
химии, отвечающий курсу химии средней школы. При подготовке данного изда-
ния учтены многочисленные замечания, высказанные читателями, которые ис-
пользовали его в своей работе. Предназначено для повторения теоретического
материала при подготовке к экзаменам в средней школе и к вступительным экза-
менам по химии в вузе. Заключительная часть пособия содержит краткое реше-
ние 25 типичных расчетных задач по различным разделам химии. Предназначено
для учащихся старших классов средних школ и абитуриентов.
Изд. № ФЗО(ОЗ)
ISBN 5-7804-0063-6
© Стахеев А. Ю., 1997
© Московский институт развития
образовательных систем, 1997
ПРЕДИСЛОВИЕ
Вниманию читателей предлагается новое,
существенно переработанное издание пособия
«Вся химия в 50 таблицах», предыдущее изда-
ние которых было встречено учащимися и учи-
телями с определенным интересом. В предла-
гаемых таблицах сделана попытка в краткой
наглядной форме изложить основные сведения,
входящие в школьный курс химии. По наше-
му мнению, таблицы могут быть использова-
ны, во-первых, учащимися при повторении
материала по химии при подготовке к зачет-
ным занятиям, контрольным работам, тести-
рованию, а также к экзаменам. Во-вторых, мно-
гие таблицы, как нам представляется, можно
использовать как раздаточный материал при
изучении химии на уроке. Наконец, в-треть-
их, использование таблиц может быть полезно
абитуриентам при подготовке к вступительно-
му экзамену по химии.
Разумеется, пользование таблицами возмож-
но только наряду с использованием школьных
учебников по химии, а никак не вместо них.
Фактически в данном пособии сделана попыт-
ка разработать краткий конспект школьного
курса химии, а, как известно, конспект ни при
каких условиях не может заменить самого кон-
спектируемого материала.
В настоящее время на отдельные вопросы,
отнесенные действующей программой к базо-
вому школьному курсу, существуют разные
точки зрения. К тому же имеется довольно мно-
го учебников по химии разных авторов, под-
час придерживающихся заметно различающих-
ся точек зрения по отдельным вопросам школь-
ного курса химии. Поэтому при подготовке
таблиц была сделана попытка в этих случаях
дать такое изложение соответствующего вопро-
са, которое представляется нам наиболее кор-
ректным и понятным учащемуся. Именно по
этой причине в отдельных случаях может на-
блюдаться расхождение между тем, как изло-
жен соответствующий материал в том или ином
учебном пособии и в данных таблицах.
Однако, разумеется, ни в коем случае нель-
зя считать, что данная в таблицах трактовка —
это истина в последней инстанции. Вполне
возможно, что и иное изложение тех или иных
вопросов вполне допустимо. В этом случае
читателю предстоит самому проанализировать
необходимые аргументы в пользу той или иной
точки зрения и решить, какая из них представ-
ляется ему наиболее правильной.
В заключительной части таблиц кратко из-
ложены простейшие, наиболее доступные уча-
щемуся и широко применяемые на практике
способы решения некоторых наиболее типич-
ных расчетных задач, относящихся к школь-
ному курсу химии. При выборе этих способов
авторы опирались как на свой опыт многолет-
него преподавания химии, так и на практику
решения подобных задач в повседневной жиз-
ни. Конечно, предлагаемые способы — не
единственно возможные, тем более, что речь
здесь идет о решении довольно простых задач.
Мы будем признательны читателям за за-
мечения по тексту предлагаемых таблиц.
А.Ю.СТАХЕЕВ
С.С.БЕРДОНОСОВ
ХИМИЧЕСКИЙ ЭЛЕМЕНТ
(составная часть простых и сложных тел)
ЯВЛЕНИЯ ФИЗИЧЕСКИЕ
И ХИМИЧЕСКИЕ
«Вся сущность теоретического учения в химии лежит в отвлечен-
ном понятии об элементах. Найти их свойства, определить причи-
ны их различия и сходства, а потом, на основании этого, предуга-
дать свойства образуемых ими тел — вот путь, по которому идет
эта наука.»
Д. И. Менделеев
Химический элемент: вид атомов, характеризующийся опреде-
ленным зарядом ядра.
Физические
без изменения
состава и строения
веществ
Нагревание утюга
Испарение сухого льда (СО 2)
Химические
изменяются состав
и строение веществ
2О3 = ЗО2
2Cu + О2 = 2СиО2
СаСО3 = СаО + СО2
Химический элемент
формы существования
при смешении
механическая смесь
химическое соединение
вещества сохраняют
химическую
индивидуальность
образуется новое вещество
Простые вещества \
атомы химически связаны '
с атомами того же эломеша
Н2, 02, оз, Р4,
графит и т.д.
Одиночные
аюмы
ИНГ«| 'lllhltf I 4 IIЛ
Не, No,Аг
<•< |.ЦП,Н1Д> J/IMMOMIN
• ifilJ1 и » • Н| HI HIJ( n
* и • I pmi im| ы I Y| iux
H, O, Cl
Сложные вещества
атомы химически связаны
с атомами других элементов
со2> NH4CI и др.
Hg + S нагре-в » HgS
(темная масса) (красное вещество)
н2 + Cl2 hv > 2HCI
Существование химического элемеша и форме нескольких
простых веществ называется аллотропией
1. При составлении механической смеси веществ их можно брать в любых коли-
чественных соотношениях. Чтобы получить химическое соединение, не оставив в
избытке какое-либо исходное вещество, их надо брать в строго определенных
стехиометрических соотношениях, определяемых уравнением химической ре-
С — алмаз, графит, фуллерены и др.
О — О2, О3 и др.
S — моноклинная, ромбическая и др.
Р — белый, красный, черный
акции, а в конечном счете — составом исходных и конечных веществ.
2. Свойства веществ, составивших механическую смесь — сохраняются, вступив-
ших в химическую реакцию — не сохраняются.
3. Составные части смеси могут быть разделены на основании их физических
свойств, для разложения химического соединения необходимо проведение хими-
ческой реакции.
4. При механическом смешении не наблюдается выделения или поглощения теп-
лоты. При химических реакциях теплота, как правило, выделяется или погло-
щается .
СТРОЕНИЕ АТОМА
открытия конца XIX — начала XX в привели к ВЫВОДУ:
атом делим, состоит из ядра ® и электронов ё
ЭЛЕКТРОНЫ
1853 г. — М. Фарадей — электролиз
растворов и расплавов солей — ВЫВОД:
ионы переносят строго определенные порции
заряда
1903 г. — Дж. ТОМСОН — предложил
модель строения атома, согласно которой
электроны располагаются внутри сферы,
имеющей положительный заряд («пудинговая
модель»)
1910 г. — Р. Милликен — измерил
заряд электрона
1,601 • 10'1в Кл, m = 1/1840 у.е.,
9,11 -Ю28 г
ЯДРО
1911 г. - Э. Р частиц (ядер гелия большинства а-час примерно 1 из 105 Резерфорд предпо очень маленькое п ядро. •е )* Тк и лс 0 Au зерфорд — прохождение а- нерез золотую фольгу. Пуги ц оказались прямолинейными, только спытывала сильное отклонение, жил, что в центре атома находится размеру положительно заряженное Ядро Не — тяжелая частица, не , взаимодействует с электронами.
тяжелого ядра.
Размер атома = 10 10 м
г* Размер ядра = 10 ’5 м
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
В центре — Ф - ядро, вокруг вращаются электроны, в целом атом электронейтрален.
ЬЮ — электрон, двигаясь с ускорением (центростремительная сила), должен излучать и терять энергию
1913 г. — Н. Бор
дополнил планетарную модель
теорией квантов Планка —
энергия может поглощаться и испускаться
только порциями;
Н. Бор объяснил линейчатый (дискретный)
спектр атома водорода
Современное состояние:
Постулаты Бора:
1. Электрон движется вокруг ядра по строго определе-
нным (стационарным) орбитам и при движении по
ним не излучает энергию
2. Энергия излучается и поглощается при переходе
электрона с орбиты на орбиту
ДЕ = hv = Ej - Е, |
I924 г. — Л. де Бройль — двойственная природа (дуализм)
лектрона, — электрон — волна и частица одновременно.
Электрон — волна «размазан» в пространстве, представляет собой как бы
блако. Для отражения этой особенности поведения электрона в атоме
ведено понятие электронной орбитали.
Согласно современным представлениям:
электроны формируют электронные слои (называемые также оболочками или
/ровнями), характеризующиеся главным квантовым числом л.
Уровень расщепляется на подуровни, характеризующиеся орбитальным или азиму-
тальным квантовым числом / = 0, 1,... л-1. Т.е. для п = 3 / = 0, 1, 2
Каждый подуровень с квантовым числом / содержит 2/+1 орбиталей, характеризую-
щихся магнитным квантовым числом т\ т = I, /~1, ...0 ... —/+1, Значение I
определяет форму орбиталей, т — ориентацию в пространстве
0 12 3 4
s Р d f g
п — 1,1=0 уровень содержит одну ^-орбиталь
п = 2,1 = 0, 1 уровень содержит одну 1s и три 2р орбитали (всего 4 орбитали),
л = 3, / = 0, 1,2 уровень — одна 3s, три Зр и пять 3d орбитали (всего 9 орбиталей).
КРОМЕ ТОГО, электрон имеет спин —4-е квантовое число (s = ±1/2)
Е
ГТ I ТГ I I ~1 41
I II II I 4d
OT3d ^4^
ГО зр LJ 43
□ 3s
ЯДРО
Было установлено, что ядра
состоят из протонов ,р и
нейтронов оп
,р + оп — ядерные силы
Нуклид — вид атомов с опре-
деленными числами протонов
и нейтронов ( ^и, ^к, 14с и
ДР-)
Изотопы — нуклиды одного
элемента ^7ci, 377ci )
Изотопы одного элемента
химически неразделимы.
Радиоактивный-рэспад:
22ft 4 222
ee Ra ~2 Не + ee Rn (ot-распад)
Зв Sr - +зэ Y (₽~-распад)
! если ядро атома испускает а-
частицу, то образуется элемент,
расположенный на 2 клетки
левее, если испускается 0'-
частица — на 1 клетку правее.
п = 1 п = 2
а р
Заполнение орбиталей: 1 Очередность заполнения — принцип наименьшей
энергии. 2 Принцип Паули — в одном атоме не может быть двух электронов с
одинаковыми значениями п, I, т и s. 3. Правило Хунда — в пределах подуровня
электроны располагаются так, что их суммарный спин максимален.
Ядерные реакции
+iH = ^Np + 2>
кратко 238 и (d.Znf38 Np
5
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Попытки упорядочить, классифицировать эле-
менты в соответствии с их свойствами
Й. Дёберейнер (1816-1823) — выделил триады сходных
элементов
Л. Мейер (1864) — объединил элементы со сходными
свойствами в группы
Дж. Ньюленде (1866) — отметил повторяемость свойств
через 7 элементов на 8-ой (правило «октав»)
Д. И. Менделеев положил в основу классификации атомный вес
группа
г
и Be В с N О F
Na Mg AI SI Р S CI
К Са
Э2О эо Э2О3 э< Рг ЭгОв ЭОз SjOy
и Be В С N 0 F Na Mg Al Si P S a К Ca
7 9 11 12 14 16 19 23 24 27 28 31 32 35.5 39 40
^Свойства элементов, а следовательно и образованных ими простых и сложных тел, '
находятся в периодической зависимости от атомных весов элементов»
Д. И. Менделеев, 1869
При составлении таблицы Д.И. Менделеев (в отличие от предшественников):
1. Сравнил между собой не только сходные элементы, но и несходные естественные группы
элементов;
2. Изменил атомные веса 20 элементов (Ве2О3 -> ВеО => 13.5 -> 9)
3. При определении положения — руководствовался в первую очередь химическими
свойствами I <-> Те; Со <-> Ni;
4. Ряд элементов не был открыт — оставил пустые клетки (под Si — экасилиций (Ge) и др.)
Г. Мозли (1913 г.) —заряды ядер атомов последовательно возрастают на * 1 и г_О'.*«ь-й номер
элемента соответствует значению заряда его ядра.
Современная трактовка: Свойства элементов и их соединений находятся в периодической
зависимости от значения заряда ядер атомов (равного атомному номеру элемента в периодичес-
кой таблице элементов).
Заряд ядра определяет число электронов в нейтральном атоме и число запсп-е—= электронных
оболочек в невозбужденном атоме, а также их заселенность (химические эб:й:“ =
положения в периодической таблице
В МАЛОМ ПЕРИОДЕ: заполнение одного электронного уровня
переход к следующему периоду -»
переход к другому электронному уровню,
расположенному дальше от ядра, поэтому —
уменьшение притяжения внешнего
электрона 7 _
U Be В С N О F
О О О О О О О
0.155 нм радиус нейтрального атома ° 0®'
В периоде наблюдается увеличение заряда ядра, увеличение притяжения е ~ __Г2
к ядру, увеличение электроотрицательности — способности атома оттягивать
к себе электроны -» переход от металлических свойств к неметаллическим
Тенденция образования устойчивой внешней электронной
оболочки (оболочки инертного газа)
элементы начала периода
1----------------С----7----------------
легко отдают е, образуют преимущ.
образуя Ф-ионы ковалентные связи
элементы конца периода
.легко принимают е,
образуя Ф-ионы
В rovnneNa О
К Q
Rb ( ) И
увеличение числа электронных уровней (слоев)
в невозбужденном атоме;
увеличение размера атома;
уменьшение притяжения внешнего электрона к ядру;
уменьшение способности присоединять электрон;
усиление металлических свойств
1. Атомный номер элемента = заряду ядра
2. Номер периода = числу уровней (обычно)
3. Номер группы = max. полож. степень
окисления (обычно)
4. Металлические свойства возрастают
сверху вниз и справа налево
5. Металлические свойства проявляют
элементы с малым числом валентных
электронов на внешнем уровне (оболочке)
6. Периодичность изменения свойств объяс-
няется определенной повторяемостью в
заполнении электронных уровней (оболочек)
6
ХИМИЧЕСКАЯ СВЯЗЬ
Взаимодействие атомов, приводящее к образованию
устойчивой многоатомной системы
/перераспределение и (или)Л
(^обобществление электронов^внешних, валентных), повышение
’ электронной плотности между атомами, притягивающей ядра.
q + + q
• 1. Энергия связи — энергия, затрачиваемая на ее разрушение (обычно сотни кДж/моль)
• 2. Длина связи г — расстояние между ядрами связываемых атомов (обычно 0.1-0.3 нм)
J 3. Дипольный момент ц — при различии электроотрицательности атомов — мера полярности связи
УЛЭлектроотрицательность — численная характеристика способности атомов в соединениях Li — 1.0, F — 4.0
_______________________________смещать к себе электроны других атомов_______________Rb — 0.8, I — 2.5
Правило октета: при образовании химической связи атомы 1-го — 3-го периодов стремятся к созданию устойчивой 8-
(октет) или 2-х (дублет) -электронной оболочки инертного газа
г
X Г
твердые вещества I силы притяжения
высокие Т плавления [ между ионами
обобществление
лектронов между
всеми атомами кри-
сталла
Н
H-N
При соединении атомов с различными
электроотрицательностями—полярная
HNH>90" —> 107"
Н
l-оС» +Н+
Н
I
Н— N! +Н+
I
Н
тг-связь
ередача
электронов
обобществление
электронов
’Cl:'
VI ,VII [Ne] [Аг]
ИОННАЯ СВЯЗЬ
Na • + • Cl: -> Na+ +
КОВАЛЕНТНАЯ СВЯЗЬ
:С1- + :С1- -> :CI:CI: (CI-CI)
;N • + :N- -> :N :N: (NsN)
ДОНОРНО-АКЦЕПТОРНЫЙ "'Ч
МЕХАНИЗМ \
донор — имеет неподеленную е-пару
обобществление
электронной пары
одного атома
при плавлении, растворении в воде
хорошо проводят электрический ток
Na| :CI: -> Na+ + СГ
направленность связи — формы орбиталей
Различные типы перекрывания е-облаков
освязь
ВАЛЕНТНОСТЬ -----------
1853 г. — Франкланд. Способность атома
присоединять или замещать определенное
число других атомов при образовании
молекулы
ЭЛЕКТРОВАЛЕНТНОСТЬ — способность атома,
образующего ионную связь, отдавать или
принимать определенное число электронов
КОВАЛЕНТНОСТЬ — способность образовывать общие
электронные пары
Для характеристики перераспределения электронов при
образовании связи.
СТЕПЕНЬ ОКИСЛЕНИЯ — условный заряд атома,
вычисленный по определенным правилам:
1. Степень окисления (СО) атома в простом веществе
равна 0 (Нг, Р4. Se и др.)
2. Алгебраическая сумма СО атомов в молекулах (СО2, СНд) равна 0, в ионе (30дг , МпОд ) — его заряду
3. Степень окисления F в его соединениях всегда равна -1
4. СО атомов щелочных и щелочноземельных металлов в соединениях всегда равна +1 и +2
5. СО Н в соединениях +1 (см. также п. 7)
6. СО О в соединениях -2 (см. также п. 7)
7. Всегда предпочтение отдается правилу с меньшим номером, поэтому K+1Н ; Н2 Ог И ДР
8. СО может быть отрицательной, положительной, равной 0 (Ге(С0)5 и ДР ), дробной (K2S5
Часто наблюдается гибридизация S-, р- и d-
орбиталей
отталкивание
Н
н—о'»
н
акнешар — свободную орбиталь (Н +)
Н
н I Н
Н
О'
н
1. Все связи эквивалентны.
2. Заряд распределен по всем атомам
ВОДОРОДНАЯ связь
Связь Э’...Н...Э”, где Э’ и Э” — атомы
элементов с большими значениями
электроотрицательности, чем ЭО Н.
Все три атома Э’, Э" и Н расположены
на прямой, например F—Н—О, О—Н—N.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
электропроводность, теплопровод-
ность, ковкость металлов.
Модель «электронного газа», который
удерживает вместе атомные положи-
тельно заряженные остовы.
Современная модель — электроны
расположены не на отдельных энерге-
тических уровнях, а в «энергетической
зоне», и легко в этой зоне перемеща-
ются
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИИ
Явление, при котором одни вещества превращаются в другие, называют
ХИМИЧЕСКОЙ РЕАКЦИЕЙ
Возможные типы классификаций реакций
По числу исходных и образующихся веществ По изменению степени окисления атомов
Без изменения степени окисления С изменением степени окисления (окислительно-восстановительные)
СОЕДИНЕНИЯ А + В + С -> D несколько веществ продукт более более простого состава сложного состава СаО + Н2О = Са(ОН)2 РЬО + SiO2 = PbSiO3 СаСО3 + Н2О + СО2 = Са(НСО3)2 С2Н4 +Н2О = С2Н5ОН Н2 + Cl2 = 2HCI PbS + 4О3 = PbSO4 + 4О2 4Fe(OH)2 + 2Н2О + О2 = 4Fe(OH)3
РАЗЛОЖЕНИЯ А -> В + С + D более сложное несколько веществ более простого состава Разложение кристаллогидратов, кислот, оснований (не щллочлй!), солей кислородсодержащих кислот и др. Cu(OH)2 = СиО + Н2О С3СО3 = СаО + СО2 NH4CI = NH3 + HCI 4HNO3 = 2Н2О + 4NO2 + О2 диспропорционирование 4КСЮ3 = ЗКС1О4 + KCI
ЗАМЕЩЕНИЯ А + ВС -> АВ + С простое сложное сложное простое С изменением степени 1 окисления CuSO4 + Fe = FeSO4 + Си 2KBr + Cl2 = 2KCI + Br2
ОБМЕНА АВ + CD -> АС + BD Наиболее распространены реакции между слож- ными веществами, протекающие без изменения степени окисления и сопровождающиеся удале- нием продукта (продуктов) реакции в виде газа, осадка или образованием малодиссоциирующе- го соединения. AgNO3 + KBr = AgBr 1 + KNO3 Нейтрализации NaOH + HCI = NaCI + Н2О малодиссоц^*** Гидролиза CH3COONa + Н20^=гСН3С0ОН + NaOH малодиссоц. Без изменения степени "1 । окисления
Необходимо отметить: существует много реакций, которые трудно отнести к одному определен-
ному типу:
NH3 + СО2 + Н2О + NaCI = NH4Cl + NaHCO3i; ЗО2-е==г2О3
Возможны и другие классификации: по тепловому эффекту, Скорости, механизму (ионные, радикальные, цеп-
ные, каталитические и некаталитические), как обратимые и необратимые и т.д.
ПО ТЕПЛОВОМУ ЭФФЕК'
В ходе химических реакций происходит разрыв одних связей и образование других
Если сумма энергий разрушенных связей < суммы энергий вновь образованных —> избыток энергии выделяется в виде теплоты, света,
работы расширяющихся газов.
4AI + ЗО2 -> 2А12Оз + Q
N2 + 02^=r2NO - Q
— теплота выделяется, реакция экзотермическая
— теплота поглощается, реакция эндотермическая
тепловой эффект реакции Q
Термохимические уравнения — с указанием
теплового эффекта
Простые вещества в стандартном состоянии
(1 атм., 25°C. А. В, С. D), ДОо6р = О
2Н2 + О2 = 2Н2О(ж) + 572 кДж
Термохимические расчеты основаны на законе
Гесса:
• тепловой эффект химической реакции зависит от состояний
исходных веществ и продуктов реакций, но не зависит от промежу-
точных стадий процесса
• тепловой эффект химической реакции равен сумме теплот
образования продуктов реакции за вычетом суммы теплот
образования исходных веществ
тепловой эффект
«в »
Q = ZviQT*
чж •u",v|4Xo6p
Lv;Q™
"*1чхобр
АВ + CD
Закон сохранения энергии
Q — Запас энергии в продуктах минус
запас энергии в реагентах
8
Сущность химической реакции состоит в получении новых веществ,
г.каз № 2263
п в перегруппировке атомов исходных веществ в продукты реакции
JL Количественно химическая реакция может быть охарактеризована
V скоростью протекания и глубиной протекания
Скорость протекания (химическая кинетика)
Скорость гомогенной химической реакции определяется количеством
вещества (числом молей Ап), превращенного в объеме (V) за промежу-
ток времени (At);
6 = — -----------► А = - А2е®аг = +ДС продукт
VAt V = const дт
Чем определяется скорость?
Реакция происходит при столкновении молекул реагирующих веществ, поэтому скорость
определяется Ф числом столкновений и ® их энергией
Ф Концентрация (число молекул в единице объема). Чем выше концентрация, тем чаще
происходят столкновения.
О = [А] • [В] для А + В -> С
О = к[А] • [В] где к — константа скорости (к = О, если, например, [А] = [В] = 1)
Если в реакции в отдельном столкновении, т.е. элементарном акте, участвуют п молекул А и
m — В, т.е. nA + тВ С, то
Закон действующих масс
(К.М.Гульдберг и П.Вааге, 1864 г)
fl = к • [А]п • [В]
n, m — порядки реакции — часто не равны стехиометрическим
коэффициентам. Причина — сложный механизм реакций.
® Температура (мера кинетической энергии
молекул). Чтобы реакция прошла, необходимо разру-
шить связи в исходной молекуле. Для этого требуется
энергия (энергия активации). Молекулы должны
столкнуться с определенной энергией.
Так как доля молекул, обладающих необходимой
энергией, быстро увеличивается с ростом температу-
ры, скорость реакции резко возрастает с ростом
температуры.
Приближенное правило Вант-Гоффа: скорость
возрастает в 2-4 раза при нагревании на 10°С.
^акт
k = const • е- rt ,
Уравнение Аррениуса:
R — газовая постоянная, T — температура, К
® Катализатор — изменение механизма реакции
уменьшение энергии активации—> увеличение скорости.
Ингибитор — уменьшение скорости реакции.
Глубина протекания (химическая термодинамика)
Многие химические реакции не удается довести до конца
Н2 + 12 => 350°С => 80%Н1 + 10%Н2 + 10%12 <= 350’С <= HI
смесь чистый
Реакции, протекающие одновременно в двух противоположных
направлениях, называют обратимыми
fyip
Н2 + 12 = 2HI
обр
2HI = Н2 + 12
При равновесии: $np = ф
Химическое равновесие имеет динамический характер
Для реакции: mA + пВ-=!-рС + qD
константа равновесия К
= [C]p[D]q
К “ [A]m[B]n
При данной температуре К имеет
постоянное значение, характери-
зует равновесный состав смеси
Способы смешения химического равновесия
Принцип Ле Шателье: если на систему, находящуюся в состоянии равновесия,
оказывать внешнее воздействие (изменить T, Р, концентрацию), то равновесие в системе
смещается в том направлении, при котором эффект воздействия уменьшается.
ЗНг+ N2-p=!-2NH3+ Q |< Т
Катализатор не влияет на положение равновесия (константу
равновесия), а только ускоряет его достижение
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
реакции, протекающие с изменением степеней окисления атомов
Условно считают, что окисление — это отдача атомом, ионом, молекулой электронов, а восстановление — присоединение к
ним электронов. При окислении степень окисления атома возрастает, при восстановлении уменьшается.
Окисление одних атомов (А) в данной реакции: А -п ё = Ап+ (А — восстановитель) всегда сопровождается
восстановлением других атомов (Э) в данной реакции: Э +пе = Э"~ (Э — окислитель)
ВОССТАНОВЛЕНИЕ
понижение степени окисления
... -3-2-1012 3...
повышение степени окисления
ОКИСЛЕНИЕ
Для того, чтобы определить направление протекания и продукты реакции, необходимо установить:
Окислители:
1. Простые вещества, образованные атомами
элементов-неметаллов VI-VII групп (F2, О3, О2, Cl2,
Вг2 и др.)
2. Многие многозарядные ионы металлов:
Fe3+ + ё = Fe2+; Cu2+ + ё = Cu+
3. Ионы, содержащие атомы элементов в высоких
степенях окисления:
МпО/ (Мп VII), Cr2O72- (Cr VI)
4. Ионы и молекулы, содержащие атомы неметал-
лов в высших степенях окисления:
+5 +5
HNO3, КСЮ3 и др.
5. Кислоты (за счет ионов Н+)
6. Пероксиды, надпероксиды, озониды
Н2О2, К^, КО3
Восстановители:
1. Атомы металлов l-Ш групп и др. (Na, Са, Al, Fe...)
2. Отрицательно заряженные ионы неметаллов S2',
СГ и др.
3. Многие сравнительно малозарядные ионы метал-
лов (Fe2+, Мп2+ и др.)
4. Ионы и молекулы, содержащие атомы в проме-
жуточных степенях окисления:
+4+4 +3
so2, so32*, Н3РО3 и др.
5. н2, СО, СН4, NH3, С
6. Гидриды металлов НИ групп (СаН2, LSH и др.)
Для составления уравнений окислительно-восстановительных реакций используют:
Метод электронного баланса
(газ + газ, газ + тв., тв. + тв.)
1. Найти окислитель и восстановитель
Метод электронно-ионного баланса
(в водных растворах)
1. Найти окислитель и восстановитель.
2. Определить, какие ионы существуют в растворе
3. Записать схемы полуреакций окисления и восстановления
4. Сбалансировать число атомов в каждой части, добавляя
Н + или Н2О — в кислой среде
ОН " или Н 2О — в щелочной
5. Уравнять число электронов (зарядов)
б. Суммировать полуреакции в полное электронно-
ионное уравнение (электроны сокращаются!)
7. Найти коэффициенты
KMnO4 + HCI -> KCI + МпС12 + С12 + Н2О
2. Записать схемы полуреакций окисления и восстановления
3. Сбалансировать заряды и электроны
4. Суммировать полуреакции в полное электронное
уравнение (электроны должны сократиться)
5. Найти коэффициенты
А! + О , -> А1,О,
О +3 2 2 3
4 А! - Зе = А! (окисление)
3 О2° + 4е = 20 (восстановление)
МпО4“ + 8Н+ + 5е~= Мп2+ + 4Н2О (восстановление)
2СГ - 2е= Cl2________________(окисление)______
2МпО4" + 10СГ + 16Н+ = гмп2* + 5С12 + 8Н2О
2КМпО4 + 16HCI = 2KCI + 2МпС12 + 5С!2 + 8Н2О
т.о., наибольшая окислительная активность КМпО 4 —
в кислой среде (обычно используют разбавл. Н 2SO4)
4AI + 30 2 = 4^3+ 6О"2
Сг2О3 — темно-зеленый; СгО 3 — темно-красный
2КСгО2 + 3Br2 + 8К0Н -> 2К2СгО4 + 6КВг + 4Н2О
K2Cr2O7 + 14HCI -> 2CrCI3 + ЗС12Т + 2KCI + 7Н2О
2
5
10
РАСТВОРЫ
Гомогенные системы переменного состава, состоящие из двух и более компонентов
Растворитель — количественно преобладает и находится в том же агрегатном состоянии, что и образующийся раствор
Устойчивость
определяется размером
распределенных частиц
Количественная характеристика
Качественная характеристика
т, (масса растворенного вещества)
Массовая доля W = --------------—----------------------;----
т2 (общая масса раствора)
обычно выражают в процентах
Если количество растворенного вещества п отнесено
к общему объему раствора V, то говорят о молярной
концентрации С
прастворенного вещества ч
С = ---------------------- (МОЛЬ/ДМ , моль/л)
^раствора
Разбавленные: относительно малое содержание
растворенного вещества.
Концентрированные: относительно высокое содер-
жание растворенного вещества. Например, 95-98%
масс. H2SO4
Растворение, растворимость
[подобное растворяется в подобном
-----------------к растворение
твердое вещество-вещество в растворе
_________________ кристаллизации _________________
Равновесие: насыщенный раствор. Отсутствие равновесия — ненасыщенный раствор (концентрация ниже
насыщенного), или пересыщенный раствор — выше насыщенного.
Концентрация насыщенного раствора — мера растворимости вещества, его способности растворяться
в данном растворителе.
избыток
над твердым
веществом
Если теплота в результате растворения:-'
выделяется, то с увеличением температуры растворимость
уменьшается. Например, растворение в воде О2.
поглощается, то с увеличением температуры растворимость
увеличивается. Например, растворение в воде KCI, KNO3 и др.
Для газов — закон Генри — с увеличением давления растворимость газа увеличивается.
Растворение
Преимущественно химический процесс Р2О5 + ЗН2О = 2Н3РО4
2Na + 2Н2О = 2NaOH + Н2Т
нельзя физически выделить исходное вещество
Преимущественно физический процесс NaCI + Н2О
12 + бензол
можно выделить физически растворенное вещество
твердое вещество + молекулы растворитеря
А-А-А-А
1111
А-А-А-А
1111
А-А-А-А
А-Ь-А-Л
сольватация
(гидратация)
А*пН2О сольваты (гидраты)
[А1(Н2О)б]3+
[Си(Н2О)4]2+
иногда настолько прочны, что могут
быть выделены из раствора в
кристаллическом состоянии
н2° Н2° Н2О
Н2О н2° н2о
Н2О Н2°
кристаллогидраты
CuSO4•5Н2О
Na2S04-10H20
---------Тепловые эффекты --------------
сольватация
разрыв связей (гидратация)
AQ < 0 -Pr-A-k-flr- ----———► А А А А А —н
энепнла образование
новых связей
энергия
поглощается
общий
тепловой эффект
11
ДО = ДО2 — ДО,
А*пН2О ДО2>0
энергия
выделяется
2*
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворы многих солей, кислот,
оснований
1. Проводят электрический ток (хотя в сухом состоянии — изоляторы)
< 2. Некоторые коллигативные свойства растворов (Ткипения, Тэамврзания и т.д.)
изменяются то., как будто число частиц в целое число раз больше, чем число
k молекул (формульных единиц) растворенного вещества.
Электролиты — вещества, растворы и расплавы которых проводят электрический ток
г Теория
электролитической
диссоциации
1887 г. Сванте
Аррениус
s_________________
1. При внесении в воду электролитов в растворе оказываются положительно и
отрицательно заряженные частицы (ионы) (электролитическая диссоциация)
2. Под действием электрического катод гп г-1 анод
I I катионы яниомы I I
тока ионы перемещаются I „_____@ Q "°
3. Электролитическая диссоциация может быть обратима “
4. Степень диссоциации зависит от природы электролита и растворителя, Т, концентрации
Механизм
диссоциации на
ионы полярной
молекулы
Ч____________
_дЛ -|- дл гидратированные
разрушения связи (СОЛЬВаТИрОваННЫв)
ИОНЫ
Количественно процесс АВ а; **
характеризуют
степенью диссоциации а
и константой диссоциации Кдис
*\число распавшихся молекул)
^(исходное число молекул в растворе)
значение а не связано с
J[B J растворимостью вещества в воде
[АВ] Кдис — константа при данной температуре
Условное деление электролитов по силе для 0.1 моль/л растворов
3%
30%
Слабые электролиты H2S, \ /Электролиты средней
HjCO3, СН3СООН, фенол, силы (по 1- йступени) H2SO3, Н3РО4
NH • Н2О „
3 2 Константа диссоциации
. [а+ив-]
АВ — А^В- К= —
Ступенчатая диссоциация
[Н+][Н2РО4-]
К, =-----------= 7 - 10-3
[Н3РО4]
_ [H+jfHPO^-]
*2 [Н2РО4-]
[Н+][РО43-]
Кз [НРО42-]
Н3РО4-=тН+ + Н2РО4-
Н,РО / = Н+ + НРО л2-
2 4 4
= 6- 10'8
НРО 2--=Н + + РО.3-
4 4
Вода — слабый электролит
2Н2О4==гН3О+ + ОН- — аутодиссоциация
к = [н+цон-]
V___х[Н2О]
= 4-10-13
Сильные электролиты
гидроксиды щелочных и
щелочноземельных металлов,
некоторые кислоты, соли
(почти все).
Произведение растворимости
Малорастворимые соли — это сильные
электролиты. Их растворимость м.б.
охарактеризована концентрацией ионов
в насыщенном растворе
BaSO4 = Ва2+ + SO42~
[Ba2+][SO 2-]
К =-------------; [BaSO4] = const
[BaSO4]
К' = ПРВа5 = [Ba2+][SO42-]
4
При T = const ПР = const
Если [А+][В-]>ПР, .1 осадок
. Н2°
[н^ “ioiTT
К'[Н2О] = [Н+][ОН-] = 10-14 (22°) (ионное
произведение воды)
Водородный показатель
pH = -lg[H +]
pH = 7
pH < 7
pH > 7
[Н2О] = const
[Н+] = [ОН ~] — нейтральная
[Н4] > [ОН-] — кислая
[Н4] < [ОН-] — щелочная
Ионные реакции: реакции между ионами, протекающие в растворе электролитов
Протекают в случае образования осадков >1, легколетучих веществ Т и малодиссоциированных веществ
NaCI + К SO * 1 Смеси ионов, реакции не идут.
2 4 > Нельзя говорить об изменении
КОН + NaCI * J состава исходных веществ
Na-SO. + BaCI, = 2NaCI + BaSO Д
2 4 2 4
в ионной форме:
2Na+ + SO42- + Ва2+ + 2СГ = BaSO4l + 2Na+ + 2СГ
SO42-+ Ba2+= BaSO44- — краткая форма
12
Электролиты----->
ЭЛЕКТРОЛИЗ
проводят
электрический ток
Совокупность химических реакций, протекающих под действием
электрического тока на электродах, помещенных в раствор или
расплав электролита, называется электролизом
Ф Расплав NaCI = Na+ + СГ
катод
анод
® Раствор NaCI
суммарно Na+ + CI -♦ Na° + С12
2NaCI -I 2Na + Cl2
Na+ + е -> Na°______
pH > 7^2Н^О + 2OH“]
pH < 7 2Н+ + 2е-> Н2
В растворе — сложнее из-за присутствия воды
~СГ - е -> 4р1?______
L — ±-°2_t 4Htl рН -7
. 2ОН- - 4ё“-> О2 + 2Н2О pH > 7
2Н2О + 2CI -> С12Т + H2T + 2ОН
2Н2О + 2NaCI —7 С12Т + Н2Т + 2NaOH
Еще сложнее электролиз протекает в смесях солей. Возможность осуществления того или
процесса зависит от окислительно-восстановительных свойств ионов в растворе
Для металлов — электрохимический ряд напряжений (ряд стандартных потенциалов Е°)
иного
АЕ
АЕ
Си©
V2+
Zn
Pt
Стандартный
водородный электрод
HCI, (Н+) = 1 моль/л
| Н2, 1 атм (10s Па)
усиление восстановительных свойств атомов металлов
® 6
Си'
[Zn2+] = 1 моль/л
Fe° + Си2+ -> Си0 + Fe2+
2FeCI3 + Си = CuCl, + ZFeC^
окисленная К+ Са2+ Na* Mg2± Al3+ Mn2t Zn2+ Cr2+ Fe2+ Cr3± Co2+ Ni2± Sn2± Pb2± H+ Cu2t Fe3+ Ag+ Au3t
форма
[Си2+] = 1 моль/л
восстановленная К Са Na Mg Al Мп Zn Cr Fe Cr2+ Co Ni Sn Pb H2 Cu Fe2+ Ag Au
форм а увеличение окислительной способности ионов
S*’ о^снов — аналогично можно построить ряд
увеличение восстановительной активности анионов
F" NO" SO^ ОН"
СГ Вг" Г S2"
_________________у
с= молекулы воды: окисляются сами при электролизе водных растворов
- 4I-T
2Н2О
ек-оолиз с активным анодом
2Н2О - 4е-> О2 + 4Н +
Ni° - 2ё Ni2+
черновой Ni рас-
5 творяется на аноде
Законы электролиза: М. Фарадей —
равные количества электричества выделяют на
электродах эквивалентные массы веществ
96520 Кл
Э-1-t Э-1-t
m =---------- = -----------
F 96520
где Э — электрохимический эквивалент
(молярная масса эквивалента)
Э = — (п — число ё )
п '
13
оксиды
Оксиды — сложные вещества, состоящие из 2-х элементов, один из которых — кислород в
степени окисления -2
Формула Название Формула Название
СО оксид углерода (II) Fe2O3 оксид железа (III)
NO оксид азота (II) СгО3 оксид хрома (VI)
n2o5 оксид азота (V) Мп2О7 оксид марганца (VII)
Агрегатное состояние при н.у.: газы (NO, СО, СО2 и др.), жидкости (Н2О) и твердые (Fe2O3,
MgO, СаО и др.) вещества.
Получение оксидов
1) Окисление кислородом а) простых веществ: 2Мд + О2 = 2МдО
б) сложных веществ: 2H2S + ЗО2 = 2Н2О + 2SO2
_ _ „ __ t°„* _ , ___ , „ «кроме солей щелочных металлов:
2) Разложение а) нагреванием солеи: 2CuSO4 = 2CuO + 2SO2 + О2 j2knq = 2KNO + О
2Pb(NO3)2 = 2РЬО + 4ЫО2 + О2
б) нагреванием Са(ОН) = СаО + Н2О | гидроксиды щелочных металлов
оснований: Cu(OH)2 = СиО + Н2О " ^зла,™м м°Ме U°H
' 2 2 2LiOH = Li,О + Н,О
в) нагреванием кислородсодержащих кислот
в случае термически неустойчивых кислот (Н2СОЭ, H2SO3) — простое нагревание
H2so3 = so2 + н2о
в случае термически устойчивых кислот — нагревание в присутствии Р2О5
2HCIO. == CIO + Н,О ; 2HNO, == N2O. + Н2О
4р2о5 2 7 2 РА 2 5 2
3) Разложение высших оксидов и окисление низших:
4CrO3 = 2Сг2О3 + ЗО2 4FeO + О2 = 2Fe2O3
4) Вытеснение летучего оксида менее летучим при высокой температуре:
Na2CO3 + SiO2 = Na2SiO3 + СО2?
5) Взаимодействие кислот — окислителей (H2SO4(kohu), HNO3) с металлами и некоторыми
неметаллами:
Zn + 4HN03(kohu) = Zn(NO3)2 + 2NO2? + 2H2O
2H2SO4 + С -° 2SO2t + CO2T + 2H2O
ОКСИДЫ j [
несолеобразующие (N2O, NO,
CO и др.)
Основные — реагируют с
избытком кислоты с образова-
нием соли и воды. Основным
оксидам соответствуют
основания.
1) Некоторые — с водой (окси-
ды щелочных и щелочнозе-
мельных металлов):
СаО + Н2О = Са(ОН)2
2) Все — с кислотами
Fe2O3 + 6HCI = 2FeCI3 + ЗН2О
3) С кислотными оксидами
СаО + СО2 = СаСО3
4) С амфотерными оксидами
ЦО + А12О3 = 2LiAIO2
Амфотерные
ZnO, AI2O3, Сг2О3, МпО2
Взаимодействуют как с кислота-
ми, так и с основаниями.
ZnO + 2HCI = ZnCI2 + Н2О
ZnO + 2NaOH + Н2О = Na2[Zn(OH)4]
Реагируют с основными и кислот-
ными оксидами
t°
ZnO + СаО = CaZnO2
t°
ZnO + SiO2 = ZnSiO3
Кислотные — реагируют с
избытком щелочи с образо-
ванием соли и воды. Кис-
лотным оксидам часто соот-
ветствуют кислоты.
1) Большинство — с водой
SO3 + Н2О = H2SO4
2) Со щелочами
2NaOH + SiO2 = Na2SiO3 + Н2С
3) С основными оксидами
SiO2 + СаО = Са8Ю3(шли)
4) С амфотерными оксидами
А12О3 + 3SO3 - AI2(SO4)3
14
ОСНОВАНИЯ
С позиций теории электролитической диссоциации основания — соединения, образующие при
растворении в воде из отрицательных ионов только ионы гидроксида ОН-
С позиции протонной теории Й. Бренстеда и Т. Лоури основания — акцепторы протонов
(NH3 + Н+ = NH/)
С позиции электронной теории Г. Льюиса основания — доноры электронной пары (ОН-, HF и др.)
гидроксиды щелочных и щелоч-
ноземельных металлов —
щелочи
/ОН
Са гидроксид кальция
^он
/О-Н
Fe-0-H
О-Н
гидроксид железа (III)
Физические Твердые кристаллические вещества. В воде растворимы щелочи: LiOH, NaOH,
свойства: КОН, CsOH, RbOH, Са(ОН)2, Sr(OH)2, Ва(ОН)2, другие — малорастворимы. Водные
растворы щелочей мылки на ощупь, разъедают кожу, ткань — едкие щелочи
ПОЛУЧЕНИЕ
Щелочи можно получить по реакциям:
1 Металл + вода 2Na + 2Н2О = 2NaOH + Н2Т
Ва + 2Н2О = Ва(ОН)2 + H2t
2. Оксид + вода Li2O + Н2О = 2UOH
СаО + Н2О = Са(ОН)2
3. Электролиз водных растворов солей /
щелочных металлов 2NaCI + 2Н2О = 2NaOH + Cl2t + H2t
Нерастворимые в воде основания:
Соль + щелочь CuSO4 + 2NaOH = Cu(OH) 4 + Na2SO4 Cu2+ + 2OH- = Cu(OH)2i
MgCI2 + 2KOH = Мд(ОН)2Ф + 2KCI Mg2+ + 2OH’ = Mg(OH)2i
Исключение Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3i
насыщенный
раствор
Химические 1. Основания реагируют с кислотами Cu(OH) + Н SO = CuSO + 2Н О
свойства (реакция нейтрализации) Cu(OH)2 + 2Н+ = Си2+ + 2Н2О
2. С кислотными оксидами «ОН + СО = КНСО
2КОН + СО2 = К2СО33 + Н2О
2NaOH + SiO2 = Na2SiO3 + Н2О
сплавлвнив
3. Растворы щелочей имеют pH > 7, изменяют окраску индикаторов. В
щелочной среде окраска лакмуса — синяя, фенолфталеина — малиновая
t°
4. Щелочи взаимодействуют 2КОН + ZnO = K2ZnO2 + Н2ОТ
с амфотерными оксидами
5. Щелочи взаимодействуют с Ва(ОН)2 + Na2SO4 = BaSO^ + 2NaOH
солями, если образуется мало- 2NaOH + CuCl2 = Cu(OH)2>l + 2NaCI
растворимая соль или малорастворимое основание
6. При нагревании:
гидроксиды щелочных металлов — не разлагаются (кроме LiOH)
щелочноземельных — разлагаются при прокаливании
7. Нерастворимые в воде гидроксиды Cu(OH)2 = СиО + Н2ОТ
при нагревании разлагаются: 2Fe(OH)3 = Fe2O3 + 3H20t
Амфотерные гидроксиды (AI(OH)3, Zn(OH)2, Ве(ОН)2, Сг(ОН)3 и др.)
реагируют с
кислотами щелочами
Zn(OH)2 + 2HCI = ZnCl2 + 2Н2О AI(OH)3 + NaOH = Na[AI(OH)]4
15
кислоты
С позиции электролитической диссоциации кислоты — соединения, образующие при растворе-
нии в воде из положительных ионов только ионы водорода ИГ (ионы гидроксония ИД*). С по-
зиции протонной теории Й. Бренстеда и Т. Лоури кислоты — доноры протонов (HCI, Н3РО4 и
др.). С позиции электронной теории Г. Льюиса кислоты — акцепторы электронной пары (Н3О+,
BF и Др.). число ионов водорода Н+ определяет
основность кислот
Бескислородные (HCI, HBr, H2S) Кислородсодержащие (H2SO4, HNO3) -
анион _ «-ид» гидроксиды неметаллов, диссоциирующие по
HCI — хлороводородная (соляная), СГ — хлорид кислотному типу
Н S — СерОВОДОрОДнаЯ, S2’ — сульфид -г- *ат> — высокая степень окисления SO42- — сульфат
2 анион
«ит» — низкая степень окисления SOj — сульфит
Кислородсодержащие кислоты
Э(ОН)гаОп
H2SO4 — серная
H2SO3 — сернистая
Если п = 0, то
НвТеОв).
Если п = 1, то
средней силы
Если л > 2, то
HNO3).
кислота
кислота
(Н3РО4).
кислота
слабая (Н3ВО3, НСЮ,
слабая (Н2СО3) или
сильная (H-SO.,
' 2 4
Если число оксогрупп ОН разное при постоянной степени
окисления элемента, то кислоту с максимальным числом
ОН-групп называют ортокислотой, а с минимальным —
метакислотой
но
.О
о ртофосфорная
но—
\ О / п
мета фосфорная
Получение
Ф кислородсодержащие — взаимодей-
ствие соответствующих оксидов (ангидридов)
с водой
® некоторые кислородсодержащие —
действие на неметаллы сильных окислите-
лей
® бескислородные — взаимодействие прос-
тых веществ
@ реакции обмена между солью и менее
летучей кислотой
Г SO3 + Н2О - H2SO4
“[N2Os + Н2О = 2HNO3
ГЗР + 5HNO3 + 2Н2О = ЗН3РО4 + 5NO
[3I2 + 10HNO3 = 6НЮ3 + 10NO + 2Н2О
Г Н2 + Cl2 = 2HCI
[н2 + S = H2s
:NaCI + H2SO4 = HClt + NaHSO4
' NaNO. + H,S04 = HNO.T + NaHS04
3 2 4 3 4
Физические жидкости — H2SO4, HCIO4
свойства твердые — H3PO4, H2SiO3
некоторые существуют только в растворах — H2SCL Н.СО,
Химические свойства
Ф Растворы кислот имеют рН<7, окрашивают
лакмус в красный цвет
® Все кислоты реагируют с основаниями
(реакция нейтрализации)
Ф С основными оксидами (и амфотерными)
@ Кислоты, анионы которых—неокислители,
реагируют с металлами, стоящими в ряду
стандартных потенциалов до водорода, с
выделением водорода
Ф С солями, если образуется малораствори-
мое, летучее или малодиссоциирующее
вещество
® При нагревании кислородсодержащие
кислоты разлагаются
метилоранж и
H2SO4 + Fe(OH). - FeS04 - 2Н.0
Fe2O3 + 6HCI - 2FeCI, - 3H.0
Zn + 2HCI = ZnCI2 + H2?
H2SO4 + BaCI2 = BaSOj + 2HCI
2HCI + Na2CO3 = 2NaCI + H2O +CO2T
H ,SiO = H.OT + SiO, H,S04 - H,OT + SO J
2 4 2 2242 J
__________________________________,____________/
16
соли
С позиции теории электролитической диссоциации соли — сильные электролиты, сущест-
вующие в водных растворах в виде положительно заряженных ионов металлов и отрицатель-
но заряженных ионов кислотных остатков (иногда в растворах солей имеются также ионы Н+
и ОН’).
Соли можно рассматиривать как продукт полного или частичного замещения атомов водоро-
да (Н) в молекуле кислоты на металл (H2SO4 -> NaHSO4 -> Na2SO4) или замещения гидроксо-
групп в основании на кислотный остаток (Мд(ОН)2 -> MgOHCI -> МдС12)
кислые
NaHSO.
4
о. .OH
^ONa
NaHSO. = Na++ HSO/
4 4
= Na+ + H+ + SO.2’
4
средние
Na,SO.
4
^ONa
^ONa
Na,SO. = 2Na+ + SO 2“
2 4 4
основные
MgOHCI
CI-Mg-OH
MgOHCI = MgOH + +
+ СГ = Mg2+ + OH~
+ СГ
двойные
содержат катионы
двух металлов и
анион одной кислоты
KAI(SO4)2
смешанные
содержат катион
одного металла и
анионы двух кислот
гкислые соли: гидро + анион основные соли: гидроксо + анион Анионы
NaHCO3 — гидрокарбонат MgOHCI — гидроксохлорид Одноатомные — элемент + «ид»
натрия магния F’ — фторид
Са(Н2РО4)2 — дигидрофосфат А1(ОН)2С1 — дигидроксохлорид S2~ — сульфид
кальция >• алюминия кислородсодержащие высш. ст. окисл.5О42~ — сульфат низкая SO,2- — сульфит J
Получение
Г1. С использованием металлы с неметаллами: 2Mg + Cl2 = МдС12 ' Zn + H,S04 = ZnS04 + Н,Т 2 4 4 2
металлов металлы с кислотами:
металлы с солями: Fe + CuS04 = Си + FeS04 4 4
2. С использованием основные оксиды с кислотами: оксидов кислотные оксиды с основаниями: кислотные оксиды с основными: амфотерные оксиды: вытесняет стоящий левее в электрохимическом ряду левее Н, или — кислота — окислитель HNO3, H2SOdie:)htu СаО + 2HCI = CaCI2 + Н2О СО2 + Са(ОН)2 = СаСО3 + Н2О СаО + С02 = СаСО3 А12О3 + СаО = Са(АЮ2)2
3. Реакцией нейтра- лизации H2SO4 + 2NaOH = Na2SO4 + 2Н2О HCI + NaHCO3 = NaCI + H2O + CO2t
4. Из солей соли с солями соли с основаниями соли с кислотами AgNO3 + NaCI = AgCl4- + NaNO3 CuS04 + 2NaOH = Cu(OH)2i + Na2SO4 Na2CO3 + 2HCI = 2NaCI + H2O + CO2t
ионные реакции, один из продуктов должен удаляться из зоны реакции
кислые СОЛИ получают такими же способами, что и средние, но при других мольных соотношениях регентов 2NaOH + H2so4 = Na2SO4 + 2Н2О NaOH + H2SO4 = NaHSO4 + H2O 2NaOH + CO2 = Na2CO3 + H2O NaOH + C02 = NaHCO3 2 1 — средняя 1 1 — кислая Избыток кислоты, взаимодействуя со у Са3(РО4)2 + Н3РО4 = ЗСаНРО4 средней солью, переводит ее в кислую j Са3(РО4)2 + 4Н3РО4 = ЗСа(Н2РО4)2 основные соли образуются при взаимодействии некоторых солей с щелочами: ZnCI2 + NaOH = ZnOHCl4- + NaCI. Основные соли обычно хуже растворимы в воде, чем средние
Физические свойства твердые кристаллические вещества. Многие соли имеют высокие температуры пл. и кип. По
растворимости в воде делятся на хорошо (NaCI, KCI), мало (PbCI2, CaSO4) и практически
нерастворимые (BaSO4, PbSO4, PbS, CaCO3), Сильные электролиты.
Химические свойства 1. Разлагаются при прокаливании (см. получение оксидов). 2. Взаимодействуют с металлами,
другими солями, щелочами, кислотами (см. выше).
3 Заказ № 2263 1 7
ГИДРОЛИЗ СОЛЕЙ
Гидролиз солей — взаимодействие солей с водой, приводящее к присоединению протона Н+
молекулы воды к аниону кислотного остатка и (или) групп ОН' молекулы воды к катиону металла.
Гидролизу подвергаются соли, образованные катионами, соответствующими слабым основаниям,
и анионами, соответствующими слабым кислотам. Обычно гидролиз обратим и протекает на 15-
20% (т.е. в гидролизе участвуют 15-20% соответствующих катионов или анионов).
z s
Соль образована слабым основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой
CuCI2 = Си2+ + 2СГ Cu2+ + H2O^=rCu(OH)+ + Н+ Na2CO3 = 2Na+ + СО32' СО32' + н2о^-нсо3- + он-
Образуется слабодиссоциирующий катион Си(ОН)+. Среда в растворе кислая Образуется слабодиссоциирующий анион НСО3'. Среда в растворе щелочная
CuCI2 + H2O^--Cu(OH)CI + HCI Na2CO3 + Н2О^—-NaHCO3 + NaOH
ч J
Соль образована слабой кислотой и
слабым основанием
(NH ) S = 2NH/ + S2' Al S + 6Н2О = 2AI(OH)J + 3H.S?
NH/ + H2O^^NH3 • Н2О + Н+
S2' + H2O-i=rHS' + ОН' Данная реакция гидролиза необратима, т.к.
образуется осадок гидроксида алюминия
Образуется слабодиссоциированный анион HS" А1(ОН)3 и выделяется сероводород H2S
и растворенный в воде аммиак. Среда близка к
нейтральной.
Гидролизу подвергаются соли как неорганических, так и органических кислот:
CH3COONa = СН3СОО' + Na+
СН3СОО' + Н2О -^СН3СООН + ОН'
CH3COONa + Н2О-г=^СН3СООН + NaOH
Гидролиз усиливается
а) при нагревании раствора (т.к. гидролиз — обычно
эндотермический процесс)
б) при разбавлении раствора водой:
АЮ13 = А!3+ + ЗСГ
Al3+ + Н2О-г=-'А1(ОН)2+ + Н+
А1(ОН)2+4- Н2О^=-'А1(ОН)2+ + Н+
AI(OH)2+ + H204=rAI(0H)3 + Н+
Специальные случаи гидролиза
NaF = Na+ + F* NH4NO3 = NH/ + NO3'
F'+ H2O^=rHF + OH' NH/+ H2O-^NH3-H2O + H+
HF+ F'^=rHF2' NH4NO3 + H2O-f=^NH3-H2O + HNO3
2NaF + H2O^rNaHF2 + NaOH
2AICL + 3Na,CO, + 3H,0 = 2AI(OH)J + 3CO,t + 6NaCI
О лил 'О л
18
ПОДГРУППА la ЩЕЛОЧНЫЕ МЕТАЛЛЫ Li, Na, К, Rb, Cs
усиление
восстановительных
свойств
относительно небольшая энергия ионизации
Электрохимический ряд стандартных
потенциалов
! Li, Cs, К, Na...
большая энергия гидратации иона Li+ (малый радиус)
Физические
свойства:
очень мягкие металлы, легко
режутся ножом. На срезе —
белого цвета с серебристым
металлическим блеском, исчеза-
ющим на воздухе из-за окисления. Плотность
увеличивается от 0,53 (Li) до 1,90 (Cs) г/см3. Тпл
понижается от 181 (Li) до 29°С (Cs).
В природе: Na — 2.64% (по массе), К — 2.5%(по
массе), Li, Rb и Cs — значительно меньше
NaCI — поваренная соль (каменная соль), галит
Na2SO4’10H2O — глауберова соль
NaNO3 — чилийская селитра
Na3AIFe — криолит
Na2B4O7 • 1ОН2О - бура
KCI — сильвин
KCl'NaCI — сильвинит
калийные удобрения
Химические свойства ПОЛУЧЕНИЕ т.к. щелочные металлы — это самые сильные восстановители, их можно восстановить из соединений только при электролизе распла- вов солей: 2NaCI = 2Na + CI2T на катоде: Na+ + е = Na на аноде: СГ - е = 1 /2CI2t
очень активны, наиболее сильные восстановители 1. С кислородом Rb, Cs — самовоспламеняются 2Na + О2 - Na2O2; 2К + 2О2 = К2О4 — пероксиды 4Li + О2 = 2Li2O — оксид лития 2. С галогенами — с выделением большого количества тепла Cl2 + 2Na = 2 NaCI — галогенид (хлорид) 3. С серой при нагревании S + 2Li = Li2S — сульфид 4. Литий взаимодействует с азотом (при комнатной тем-ре) N2 + 6Li = 2Li3N — нитрид 5. С водородом при нагревании Н2 + 2Na = 2NaH — гидрид 6. Легко окисляются даже водой 2Н2О + 2Na = 2NaOH + Н2Т
+ 1 Соединения щелочных металлов Щелочные металлы — самые сильные восстановители, их ионы (Na+, К+ и др.) не проявляют окислительных свойств
Гидроксиды (едкие щело- чи) — твердые кристалличес- кие вещества, типично ионные соединения, сильные основа- ния. NaOH — едкий натр, каусти- ческая сода; КОН — едкое кали Получение 1. Электролиз водного раство- ра NaCI: катод: 2Н2О + 2е = Н2Т + 2ОН’ анод: 2CI’ -2е = С12Т суммарная реакция: 2Н2О + 2NaCI = Cl2t + Н2Т + 2NaOH 2. Каустификация соды: Na,СО, + Са(ОН), = 2NaOH + СаСоД Соли — типично ионные соедине- ния, как правило — хорошо растворимы в воде (кроме некоторых солей Li — LiF, Li3PO4 и др.). Образованные слабыми кислотами соли гидролизуются. Na2CO3 ЮН2О — кристаллическая сода Na2CO3 — кальцинированная сода NaHCOg — питьевая сода К2СО3 — поташ Получение соды аммиачный способ (метод Сольвэ) — насыщение раствора NaCI газами СО2 и NH3: NH3 + СО2 + Н2О = nh4hco3 NH4HCO3 + NaCI = NaHCO3l + NH4CI NaHCO3 выпадает в осадок (сравнительно мало растворим), кальцинирование — прокаливание t° 2NaHCO3 = Na2CO3 + CO2t + H2O? Качественные реакции: окрашивание пламени ионами Ll+ — карминово-красное Na+ — желтое К+ — фиолетовое
3*
19
ПОДГРУППА Ila. Be, Mg и щелочноземельные металлы Са, Sr, Ba
—s. /_2е Л V Вв не взаимодействует с водой Мд слабо взаимодействует с горячей водой
'C/\ s Са ' щелочноземельные металлы k реагируют с водой как металлы, I7 Ва Г так и их оксиды («земли») V Ra J гает радиус атома, усиливаются металлические свойства, гают восстановительные свойства
Illi возрас! Bospaci
Магний: легкий (p 1.74 г/см3) серебристый В природе: в земной коре содержится магния металл, 1°пл 650°С, устойчив на воздухе 2.35% по массе, кальция «3.6% Кальций: легкий (р 1.55 г/см3) металл, на Встречаются только в виде соединений — воздухе быстро окисляется и разрушается, силикатов, алюмосиликатов. Минералы: МдСО3 1°пл 842°С — магнезит, МдСО3 • СаСО3 — доломит, МдС12 • 6Н2О — бишофит, СаСО3 — мел, мрамор известняк, CaSO4 • 2Н2О — гипс, CaF2 — флюо- рит, ЗСа3(РО4)2 • CaF2 — фторапатит
X Оба металла — сильные 2Мд + О2 = 2МдО (при поджиг 2Са + О2 = 2СаО (при комнатн М + С12 = МС12 (М = Мд, Са) М + S = MS — сульфиды ЗМ + N2 = M3N2 — нитриды М + Н2 = МН2 — гидриды 2М + Si = M2Si — силициды Са + 2Н2О = Са(ОН)2 + Н2Т (koi Mg + 2Н2О = Mg(OH)2 + Н2Т (к М + 2HCI = МС12 + Н2Т Качественная р В случ имические свойства Мд и Са восстановители. Степень окисления в соединениях всегда +2 ании) 2М + UF4 = U + 2MF2 (кальций- и магнийтермия) ой температуре) Оксиды МдО и СаО — основные. СаО — нега- шеная известь, МдО — жженая магнезия МдО + Н2О — практически не реагирует СаО + Н2О = Са(ОН)2 + Q (гашеная известь) .при нагревании МО + SiO2 MSiO3 2Мд + СО. = 2МдО + С t dH. температура) СаО + ЗС - СаС2 + СО ипячение) 2МдО + 5С = Мд2С3 + 2СО Гидроксид Мд(ОН)2 — среднее по силе основание. Гидроксид Са(ОН)2 — сильное основание. еакция на ионы М2+: М2+ + Na2CO32- = 2Na+ + MCO3i ае Са(ОН)2: Са(ОН)2 + СО2 = СаСО3Ф + Н2О СаСО3 + СО2 + Н2О = Са(НСО3)2
ПОЛУЧЕНИЕ т.к. металлы На подгруппы сильные восстановители, то получение возможно только путем электролиза расплавов солей. В случае Са обычно используют СаС12 (с добавкой CaF2 для снижения t° плавления) СаС12 — Са + С12Т
Жесткость воды — наличие в воде ра ние накипи. В жесткой воде плохо mi 2С17Н35СОО карбонатная — временная Са(НСО3)2, Mg(HCO3)2, Fe(HCO3)2 кипячением Са(НСО3)2 = CaCO3i + CO2t + Н2О добавлением соды Са(НСО3)2 + Na2CO3 = CaCO3i + 2NaH ЖЕСТКОСТЬ ВОДЫ створимых солей Са2+, Мд2+ и др. Обусловливает образова- илится мыло: Na + Са2+ = Ca(C17H35COO)2i + 2Na+ некарбонатная — постоянная r CaCI2, CaSO4, MgCI2, MgS04 и др. , удаление жесткости< добавлением соды «смягчение» воды | caci2 + Na2CO3 = CaCO3i + 2NaCI СО3 MgSO4 + Na2CO3 = MgCO3i + Na2SOt
20
ПОДГРУППА Illa. АЛЮМИНИЙ Al
[Ne]3s23p1 p
В неметалл
Al оксиды и гидроксиды
Ga проявляют амфо-
1п терные свойства
TI металлические свойства
Физические свойства: серебристо-белый металл,
пластичный, легкий (2,7 г/см3), хорошо проводит тепло и
электрический ток. Тпл = 660°С
В природе: многие горные породы
по своему составу — алюмосиликаты
(AI, О, Si, щелочные и
щелочноземельные металлы)
глины — А12О3 • nSiO2 • mH2O
бокситы — А12О3 • лН2О
нефелины — KNa3[AISiO4]4
Очистка от
примесей
Получение — электролизом расплава (расходуется около 16 кВт*час на 1 кг AI)
ОбезвоживаниИ|с==^ Электролиз А12О3 при 950°С в расплав) криолита Na3[AIF6] На катоде: Al3+ + Зе = AI0 На угольном аноде (расходуется в процессе электролиза): О2’ -2е = 0°; С + 0 = СО; 2С0 + 0, = 2С0,
Химические свойства
Активный металл, восстановитель, устойчив на
воздухе и в воде из-за наличия плотной защит-
ной пленки А12О3.
с простыми веществами
1. 4AI + ЗО2 = 2А1гО3 + Q — покрывается
пленкой оксида, но в мелкораздробленном
виде горит с выделением большого количес-
тва теплоты.
2. Алюминотермия — получение металлов:
Fe, Сг, Мп, Ti, W и другие, например:
8AI + 3Fe3O4 = 4AI2O3 + 9Fe
3. 2AI + 3CI2 = 2А!С13 (Вг2, 12) — на холоду
4. 2AI + 3S = AI2S3 — при нагревании
5. 4AI + ЗС = А14С3 — при нагревании
со сложными веществами
1. 2AI + 6Н2О = 2А!(ОН)3 + ЗН2Т — после
разрушения пленки А12О3
2. Растворяется в щелочах
2AI + 2NaOH + 6Н2О = 2Na[AI(OH)J + ЗН2Т
гидроксоалюминат натрия
3. 2AI + 6HCI = 2AICI3 + ЗН2Т
4. С HNO3 и концентрированной H2SO4 на
холоду не реагирует — пассивируется. При
нагревании:
2AI + 6H2SO4 = AI2(SO4)3 + 3SO2t + 6Н2О
КОНЦ.
Al + 6HNO3 = AI(NO3)3 + 3NO2T + 3H2O
КОНЦ.
Соединения co степенью окисления +3
Оксид AI2O3 — очень твердый (корунд, рубин),
тугоплавкий — 2050°С. Не растворя-
ется в воде
Получение: 2AI(OH)3 = А12О3 + ЗН2О
Свойства: амфотерный оксид
AI2O3 + 6HCI = 2AICI3 + ЗН2О
AI2O3 + 2NaOH + ЗН2О = 2Na[AI(OH)J
—перевода в растворимое состояние
лс~ользуют сплавление:
AI2O3 + 2NaOH = 2NaAIO2 + Н2О
AI2O3 + Na2CO3 = 2NaAIO2 + СО2
метаалюминат
Гидроксид А1(ОН)3
Получение: осаждение из растворов солей
AICI3 + 3(NH3* Н2О) = А1(ОН)3>1 + 3NH4CI
AI2S3 + 6Н2О = 2AI(OH)3>L + ЗН ST
2Na[AI(OH)J + СО2 = 2AI(OH)31 + Na2CO3 + Н2О
Амфотерные свойства:
А1(ОН)3 + 3HCI = А1С13 + ЗН2О
А1(ОН)3 + NaOH = Na[AI(OH)J
» соли А1(+3) хорошо растворимы в воде (кроме А1РО4), они гидролизуются (кислая
А13+ + Н2О А1(ОН)2+ + Н+
21
:Ar]3d64s2
Подгруппа VIII6. ЖЕЛЕЗО Fe
3d
-Зё
3d
3d
-2ё
II t I I I 4s
-гг'-ивая полузапол-
---ая d-подоболочка
/звестны соединения, содержащие железо в других степенях окисления
С получение Э
"менный газ
Руда (Fe2O3, Fe3O4, примеси SiO2),
кокс — С, флюсы — известняк СаСО 3
В природе:
Fe3O4 — магнетит (магнитный железняк)
Fe3O3 — гематит (красный железняк)
Fe3O3- хН3О — лимонит (бурый железняк)
FeS3 — пирит
FeCO3 — железный шпат (сидерит)
По распространению — 4-й элемент
(4,6% по массе) земной коры
становление
науглеро-
живание
сгорание
кокса
газование
шлака
3Fe2O3 + СО = 2Fe,0„ + С
Fe О
3 4
— _. -3—4 -
СО = 3FeO + С02
СО = Fe + С02
С = Fe + СО
FeO
FeO
СаСО3 = СаО + С02
СаО + SiO2 = CaSiO3(ujna|()
Fe + С чугун
2С + 02 = 2С0
С + о2 = со2
-зрячее кисло-
эодное дутьё
шлак
металл-чугун
450°С
600°С
700°С
1200°С
1600°С
800°С
1000°С
О
*
см
$
ш
2
Получение стали
удаление С (Р, Si, S, Мп)
1. Кислородный конвертер
С + О2 = СО2
2Fe + О2 = 2FeO
2. Мартеновская печь
С + О2 = СО2
4Р + 50- = 2Р.0-
S + 02 = so2
Si + 02 = SiO2 и др.
3. Электоодуговой метод
4. Возможно и бездомен-
ное получение стали
О
£
1Л
о
з
ю
о
£ §
чугун (выше 2.14% С) — хрупкий, расширяется при
затвердевании
Доменный процесс
изические свойства: чистое железо — пластичный металл, плотность 7,87 г/см3, tnn
1 35°С. Существует a-железо (кубическая объемноцентрированная решетка) и у-железо
(к.бическая гранецентрированная решетка). a-Fe обладает магнитными свойствами.
з;
Химические свойства
лезо — металл средней химической активности, восстановитель, в сухом воздухе покрывается
дитной пленкой оксида, во влажном — ржавеет: Fe + Н2О + О2 -> Fe(OH)3 -хН2О.
сильные
окислители
слабые
окислители
4Fe + ЗО2 = 2Fe2O3
3Fe + 20г(чист) = Fe3°4
3CI2 + 2Fe = 2FeCI3
Fe + S = FeS
Fe + CuSO. = FeSO. + Cu
4 4
+3
Fe2O3 — порошок бурого цвета
Получение:
4FeS2 + 1102 = 2Fe2O3 + 8SO2t
4Fe + 3O2 = 2Fe2O3
Fe(OH)3 — амфотерный гидроксид с преобладанием
основных свойств
сплавление
Na2CO3 + Fe2O3 = 2NaFeO2 + С02
6HCI + Fe2O3 = 2FeCI3 + 3H2O
NaFeO2 + 2Нг0 = Fe(OH)3l + NaOH
окислитель: 2FeCI3 + 2KI = 2FeCI2 + l2 + 2KCI
конц. HNO3, конц. H2SO4 с железом не реагируют
2Fe + 6H2SO4(65.70%) = Fe2(SO4)3 + 3SO2t + 6H2O
Fe + 4HNO3 = Fe(NO3)3 + NOt + 2H2O
(1:1)
Fe + 2HCI = FeCI2 + H2T
Fe + Н2ЗО4(20Цименее) = FeSO4 + H2T
+2
FeO — порошок черного цвета
Получение:
Fe2O3 + Н2 = 2FeO + Н20
FeC,O4 = FeO + CO, + CO
6 4 z
оксалат
качественные реакции на Fe3+
1) Fe3+ + SCN" = [FeSCN]2+ красное окрашивание
2) Fe3+ + K4[Fe(CN)6] —> синее окрашивание KFe[Fe(CN)6]
гексацианоферрат(И) калия,
желтая кровяная соль
Fe(OH)2 = FeO + Н20
FeO — основный оксид
2HCI + FeO = FeCI2 + Н20
FeCI2 + 2К0Н = Fe(OH)2l + 2KCI
соединения Fe(+2) на воздухе, как правило, неус-
тойчивы, т.к. обладают восстановительными
свойствами и легко окисляются (особенно в
щелочной среде)
качественная реакция на Fe2+
Fe2+ + KJ[Fe(CN)6] —> синяя окраска KFe[Fe(CN)g]
гексацианоферрат(Ш) калия,
красная кровяная соль
22
la ПОДГРУППА *------- ВОДОРОД Н-------► Vila ПОДГРУППА
щелочные металлы галогены
н+ H-1S1 н-’
протон
элементарная частица
отсутствие электронных оболочек
малый размер
Состоит из протия Н (1Н) (99.985%), дейтерия
D (2Н) и следов радиоактивного трития Т (3Н).
Во Вселенной — наиболее
распространенный элемент (90% массы
Солнца — водород).
В земной коре — 1% по массе.
Входит в состав воды, метана, нефти,
каменного угля.
В свободном виде встречается очень редко
ПОЛУЧЕНИЕ
z .....
в промышленности
1. Конверсия метана (катализатор, нагрев)
н2о
СН4 + О2 -> СО2 + 2Н2
2. Коксовый газ (80% Н2)
3. Крекинг нефти
4. Крекинг метана
t°
СН4 = С + 2Н2
5. Пары воды и уголь, при ®1000°С:
Н2О + С = СО + Н2 (водяной газ)
Редко:
6. Железопаровой способ (водяные пары с
раскаленным железом)
Н2О + Fe = FeO + Н2 (выше 570°С)
4Н2О + 3Fe = Fe3O4 + 4Н2 (ниже 570°С)
7. Электролиз воды (обычно — растворы
щелочей): 2Н2О = 2Н2 + О2
СВОЙСТВА
1. Электролиз водных растворов солей
(Na2SO4) или щелочей:
2Н2О = 2Н2Т + O2t
2. Zn + H2SO4(k20%) = ZnSO4 + H2T
3. 2AI + 2NaOH + 6H2O = 2Na[AI(OH)4] + 3H2T
Химические: при обычных условиях довольно малоактивен (реагирует только с F2), т.к. молекула Н2 прочна. восстановитель 1. Потеря электрона — образование протона — Н+ — (в водных растворах — ион гидроксония Н3О+) 2. Наиболее характерно — образование поляр- ных ковалентных связей (валентная оболочка [Не]) 2Нг + О2 = 2Н2О (со взрывом) «гремучая» смесь 2Н2 + О2 ЗН2 + N2^=!-2NH3 Н2 + Fj = 2 HF — со взрывом при любой температуре Н2 + О2 = 2 HCI — на свету цепная реакция Br2, 12 — менее энергично, не идут до конца Н2 + S4=?H2S — пропускание Н2 над нагретой до 150-200°С серой Восстановление оксидов: ЗН2 + Fe2O3 = 2Fe + ЗН2О зн2 + wo3 = W + зн2о Оксиды металлов, более активных, чем Fe, водородом до металла не восстанавливаются. Физические: газ без цвета и запаха. Ткип -252°С. Самый легкий газ. Плохо растворим в воде. Растворяется в некоторых металлах (Rd, N't), переходя в атомарное состояние.
окислитель образование гидрид-иона Н‘ — при взаимо- действии со щелочными и щелочноземельны- ми металлами Н2 + 2Na = 2NaH Н2 + Са = СаН2 гидриды — ионные соединения, сильные восстановители: NaH + Н2О = NaOH + Н2
применение: синтез HCI, NH3, при восстановлении оксидов некоторых металлов, реакции
гидрирования в органической химии, для получения маргарина — гидрирование растительных
жиров, синтез метанола СН3ОН и др.
23
эо
4.0
3,0
2.8
2,5
степень
окисле-
ния -1
Физические свойства: f2 ci2 вг2<ж) 12(тв)возг
размер атома, поляризуемость,
интенсивность окраски (от зеленовато-желтой
до темно-фиолетовой), энергия межмоле-
кулярного взаимодействия
Химические свойства: галогены — сильные окислители, взаимодействуют с металлами,
неметаллами, сложными веществами.
F2 — наиболее реакционноспособен, реакции идут на холоду, при нагревании — даже с учас-
тием Au, Pt
С простыми веществами:
Н2 + F2 = 2HF
Si + 2F2 = SiF4
2Na + F2 = 2NaF
Xe + 2F2 = XeF4
многие металлы в атмосфере фтора загораются.
На поверхности Ni, Си и некоторых других
возникает защитная пленка, реакции прекращаются
Со сложными веществами:
2F2 + 2Н2О = 4HF + О2
SiO, + 2F = SiF. + О,
2 2 4 2
ci2 — также сильно реакционноспособен, но в
темноте с Н2 не взаимодействует.
Вг2 — реакционноспособен
12 — химически менее активен. Реакция
Н2 + l2-i=^2HI протекает при 300°С
уменьшение окислительной активности
предыдущий вытесняет последующий из
галогенидов:
С12 + 2КВг = KCI + Вг2
HHal — газы,
хорошо растворимы в воде
! SiO2 + 4HF = SiF4 + 2Н2О
HF HCI HBr HI
увеличивается
сила кислоты
восстановительная и
способность
галогенид-иона
Образуют соли:
Качественные
реакции
Са2+ + 2F- = CaF2i
белый осадок
фториды, хлориды, бромиды, иодиды (ионные соединения)
Cl“ — AgCl белый осадок
Вг — АдВг бледно-желтый осадок
I" — Agl желтый осадок
нерастворимы
в азотной
кислоте
Получение HHal:
1. CaF, + H,S04 = CaSO, + 2HF
2 2 4 4
2. Н2 + Cl2 = 2HCI
3. РВг, + ЗН,0 = ЗНВг + Н,РО,
4.
5.H.S + I, Si + 2HI
2 ‘ "2’
2 ‘ '“*,2
_.3 ^1 «2w OI IUI •
Р13 + ЗН2О = 3HI + Н3РО3
>2'-' 1 <2 —7 1 «I
В природе:
F — флюорит CaF2, фторапатит ЗСа3(РО4)2 • CaF2
Cl — каменная соль NaCI, сильвинит NaCI • КО
В Г, I — в водах, сопутствующих нефти, в водах
горьких озер и др. г
Получение
электролиз фторидов
электролиз раствора NaCI, HCI + КМпО4 и др
бромиды
иодиды
2Na) + MnO, + 2Н SO. —» I + MnSO. +
2 2 4 2 4
Na2SO4 + 2Н2О и др.
24
Подгруппа Vila. ХЛОР Cl
участие d-орбиталей
-пе
+3
+5
кислородные
Физические свойства: Ткип = -34*С, газ зеленовато-желтого
цвета, ядовит, немного растворим в воде.
Получение:
в технике: электролиз раствора NaCI;
в лаборатории: 16HCI + 2KMnO4 = 2MnCI2 + 5CI2 + 2KCI + 8Н2О
или 2HCI + CaOCI2 -> Cl2 + Н2О + СаС12__________________
соединения
В природе всегда
степень окисления -1
NaCI — поваренная соль, галит
NaCI, KCI — сильвинит
KCI — сильвин
MgCI2 • KCI • 6Н2О — карналлит
Химические свойства Cl2: сильный окислитель с простыми веществами: 1. 2Fe + 3CI2 = 2FeCI3 2. 2Р + 5CI2 = 2РС15 3. Си + Cl2 = СиС12 4. Н2 + Cl2 = 2HCI на свету цепной механизм: hv ci2 -> CI • + CI • н2 + CI • = HCI + н • Н • + Cl2 = HCI + CI • Н • + CI • = НО (обрыв цепи) С N2, С, 02 — непосредственно не реагирует со сложными веществами: 1. Вытесняет бром из бромидов Cl2 + 2КВг = 2KCI + Вг2 2. Окисляет SO2 и др. вещества: Cl2 + SO2 + 2Н2О = 2HCI + H2SO4 3. С органическими веществами: реакции замещения: C 2Hg + Cl2 -> C2H5CI + HCI (на свету) присоединения: H2C=CH2 + Cl2 -> ClH2C—CH2CI 4. С водой: Н2О + Cl2^=r НО + HOC -Q (хлорная вода) 5. С растворами щелочей на холоду: 2КОН + О2 = КО + КСЮ + н2о при нагревании: 6КОН + ЗО2 = 5KCI + ксю3 + зн2о 6. С Са(ОН)2: О2 + Са(ОН)2 = Са(С1)ОС1 + Н2О Г А > (белильная или хлорная известь)
Получение HCI: в промышленности: Cl2 + Н2 = 2HCI в лаборатории: NaCI + H2S04i<ohu £ NaHSO4 + HClt HCI — бесцветный газ с резким запахом, хорошо растворим в воде (400 л HCI в 1 л воды — макс. 37-40% HCI). Водный раствор — сильная хлороводоро- дная (соляная) кислота. Может проявлять восстановительные свойства (за счет СГ): МпО2 + 4HCI = MnCI2 + Cl2 + 2Н2О Соли — хлориды, ионные соеди- нения, хорошо растворимы в воде (кроме AgCI, PbCI2, Hg2CI2, CuCI) Качественная реакция: белый творожистый осадок в кислой среде: Ag+ + О' = AgCl4- AgCI + 2NH3 • Н2О = [Ag(NH3)2]CI - 2Н2О ! В отличие от АдВг и Agl, AgCI растворяется в избытке раствора аммиака. Кислородные соединения S П НСЮ — хлорноватистая кислота. Очень слабая a g 2 кислота, сильный окислитель. Соли — о о х гипохлориты NaCIO 11 ? НС1О2 — хлористая кислота. Средней силы. з о § Соли — хлориты NaCIO2, КСЮ2 I | НСЮ, — хлорноватая кислота, 'I g | \ 1 соли — хлораты КСЮ3 з £ \1 НС1О4 —хлорная кислота, соли ” ||| \/ перхлораты КСЮ4, NH4CIO4 о5 V на светуj^HCI + От ? < HOCI —► на + нею, ^СаС12 ° н2о + С12о КСЮ3 — бертолетова соль, разлагается при нагревании 2КСЮ3 = 2KCI +ЗО2Т (катализатор МпО2) 4КСЮ3 = KCI + ЗКСЮ4 (без катализатора) Применение хлора: получение HCI, обеззараживание воды, синтез органи- ческих соединений, хлорирование руд и др
V 2263
25
ПОДГРУППА Via. О, S, Se, Те
(халькогены — образующие руды [меди])
Сера — твердое кристаллическое вещество
желтого цвета,Тпл = 119°С, Ткип =
445°С, циклич. молекулы S8, пары: S8,
S6, S4, S2 аллотропия (полиморфизм).
t' ------------------А-----------ч
ромбическая <-> моноклинная <-> аморфная
Химические свойства на холоду — низкая
О, S, Se, Те
Г -
радиус атома
длина связи Н-Э и сила кислот
Н2О, H2S, H2Se, Н2Те_______
В природе: самородная сера
сульфиды — пирит FeS2, галенит PbS и др.
сульфаты — CaSO4 • 2Н2О (гипс) и др.
Получение
1. Очистка самородной серы
2. 2H2S + О2 = 2S + 2Н2О (недостаток О2)
3. 2H2S + SO2 = 3S + 2Н2О
реакционная способность, при нагревании возрастает
1. как окислитель Fe + S = FeS
2. как восстановитель S + О2 = SO2 — горит (примесь SO3)
3. диспропорционирование: 3S + 6КОН = K2SO3 + 2K2S + ЗН2О
-2
+6
,н
В природе — вулканические газы
H2s
S
\н
бесцветный газ с запахом тухлых получение-
яиц, слабо растворим в Н2О
Получение:
//°
СЗд бесцветный газ с резким запахом
/
легко переходит в (SOJ
Н2 + S^-'H2S
FeS + 2HCI = FeCI2 + H2S
Химические свойства:
Водный раствор H2S — слабая
кислота (слабее H2SO3)
Т = 16,8°С, Т = 44.8°С
ПЛ ’ ’ кип
Получение:
а) В контактном аппарате, содержащем
катализатор V2O5, 400-600°С
2SO2 + O24=t2SO3 + Q
б) Поглощением SO3 в поглотительной
соли
сульфиды, растворимы
в HgO только щелочных
металлов. Са^+, Ва^+
гидросульфиды
известны только
в растворах
1. S + О2 = SO2 — горение серы
2. 4FeS2 + 11О2 = 2Fe2O3 + 8SO2
обжиг пирита
в лаборатории
Na2SO3 + 2H2SO4 = 2NaHSO4 + SO2 башне методом противотока H2SO4
4- Н о и"и' получают раствор SO3 в H2SO4 — олеум.
Си + 2H,SO. = CuSO. + SO, + Н,0 Олеум Разбавляют Д° 98% H2SO<
2 4 конц. 4 2 2
Химические свойства:
кислотный оксид SO2 + Са(ОН)2 =
CaSO3 + Н2О
SO2 + Н2О 4=г H2SO3 — сернистая
кислота средней силы
s
серная кислота но/
гидролиз S2' + H2O^c=rHS' + ОН'
качественная реакция:
Pb2+ + S2' = PbSl черного цвета
восстав овитель
обычно окисляется до S0, иногда
до S(+4) и S(+6) в зависимости от
силы и количества окислителя
2H2S + О2 = 2S + 2Н2О недостаток О.
2H2S + ЗО2 = 2SO2 + 2Н2О избыток О.‘
с галогенами
H2s + Br2 = 2HBr + S
H2S + 4CI2 + 4Н2О = H2SO4 + 8HCI
с HNO3 — зависит от концентрации
H2S + 2HNO3 = S + 2NO2 + 2H2O
и даже co слабыми окислителями
H2S + 2FeCI3 = 2FeCI2 + 2HCI + S
2H2S + H2SO3 = 3H2O + 3S
соли
растворимы только
сульфиты щелочных
металлов, гидролиз
гидросульфиты
как правило,
растворимы
SO2 Л окислительно-восстанови-
Na2SO3 ) тельная двойственность
( восстановитель
2 с окислителями
'2 SO2 + Br2 + 2Н2О = H2SO4 + 2НВг
бромная вода, обесцвечивание
2Na2SO3 + О2 = 2Na2SO4
окислитель
с восстановителями
SO2 + 2H2S = 3S + 2Н2О
диспропорционирование
4K2SO3 = 3K2SO4 + K2S
(прокаливание)
присоединение S:
Na2SO3 + S -> Na2S2O3 тиосульфаты
(кипячение раствора c S)
сильная кислота (при диссоциации по
1-й ступени). Концентрированная —
водоотнимающее свойства (обугли-
вание):
С12Н22О„ = 12С+11Н2О
сахар
окислительные свойства за
счет S(+6)
S + 2H,SOA = 3SO, + 2Н,0
2 4конц 2 2
С + 2H,SO. = СО, + 2SO, + 2Н„О
2 4конц. 2 22
с металлами, стоящими после Н2, при Г
Си + 2H2SO4 = CuSO4 + SO2 + 2Н2О
с активными — смесь
Zn + H2SO4 -► SO2, S, H2S + ZnSO4
На холоду: пассивирует Fe, Al, Cr
Разбавленная — как обычная кислота
окислитель — Н*
сульфаты
SO42'
гидросульфаты
HSO ~
4
Качественная реакция:
Ва2+ + SO42' = BaSO4 белый осадок
не растворимый в кислотах
26
Via ПОДГРУППА. КИСЛОРОД О
Р Р
*ПГПТП --гахгл/ПТПТПП
Я. ——т/ИГ (N.i
валентность 2
только со фтором ст. ОкИсления -2 (главная)
В природе состоит из
16О, 17О, 18О. Самый рас-
пространенный элемент
земной коры (49,1 масс.%).
Атмосфера содержит 21%
l кислорода по объему j
Возможны также степени окисления -1 (пероксиды Na2O2, Н2О2), —1/2 (KjOJ, + 1(F2O2) и +2 (F2O)
Получение:
в промышленности
Перегонка жидкого воздуха, т.к. Тотп О2 = -183°С, а Ткип N2 = -196°С
в лаборатории
1. Электролиз водных растворов солей и щелочей 2Н2О = 2Н2 + 02 (см. получение Н2)
2. Разложение перманганата калия, 2KMnO4 = l4MnO4 + МпО2 + О2
пероксида водорода, 2Н2О2 = 2нг^ + Q (катализатор МпО2)
бертолетовой соли 2КСЮ3 = 2KCI + ЗО2 (катализатор МпО2)
3. Из пероксида бария 2ВаОг = 2ВаО + О2
Свойства:
Физические: бесцветный газ, без запаха. Ттп
-183°С, в 1 л Н2О растворяется 0.04 г О2.
Парамагнитен — втягивается в магнитное поле
Химические: в реакциях со всеми простыми
веществами — окислитель. Непосредственно не
реагирует с галогенами, инертными газами, Au,
Pt, кислородные соединения которых получают
косвенными путями
Реакции
с неметаллами S + О2 = so2 4Р + 5О2 = 2Р2О5 С + о2 = со2 2Н2 + О2 = 2Н2О N2 + O24=?2NO 2000°С с металлами сгорают с образованием оксидов 2 Мд + О2 = 2МдО 3Fe + 2О2 = Fe3O4 (чистый кислород) AI, Сг — тонкая защитная пленка оксида щелочные металлы (кроме Li) при нагревании в сухом О2 образуют пероксиды: 2Na + О2 = Na2O2 и надпероксиды: 2К + 2О2 = К2О4 со сложными веществами при горении в избытке кислорода образуются, как правило, соответствующие оксиды: 2H2S + ЗО2 = 2SO2 + 2НгО СН4 + 2О2 = СО2 + 2Н2О при недостатке О2 — сажа (С), СО... с2н5он + ЗО2 = 2СО2 + зн2о 4FeS2 + 11Ог = 2Fe2O3 + 8SO2 пирит
Газообразный кислород существует в двух аллотропных модификациях — дикислород О2 и
трикислород О3 (озон)
Озон О3 образуется при электрических разрядах: О2 + энергия = 20; О + О2 = О3
суммарно ЗО2^=^2О3 - 286 кДж
Озон — нестойкое вещество, легко распадающееся, обладает сильным окислительным дей-
ствием
PbS + 4О3 = PbSO4 + 4О2
О3 + 2KI + Н2О = l2 + 2КОН + О2 — качественная реакция на озон
ПРИМЕНЕНИЕ О2 основано на его использовании как окислителя:
в металлургии при производстве стали и чугуна » 60% промышленного О2
для получения HNO3, H2SO4, обжига руд (например, FeS2, CuFeS2, PbS и др.)
горение Н2 + О2 — при сварке металлов
В ПРИРОДЕ с участием О2 совершается дыхание — один из важнейших жизненных процес-
сов. Наличие в атмосфере кислорода обеспечивает гниение органических веществ. Содержание
гислорода в атмосфере постоянно, т.к. его расход компенсируется образованием кислорода
-ой фотосинтезе: СО2 + Н2О -> Cn(H2O)m + О2
2 кисление кислородом углеводов, жиров и белков служит источником энергии живых
организмов
27
104° 8+
+1 -2
ВОДА (оксид водорода) Н2О
Высокая ЭО атома О, большой дипольный момент
молекулы, прочные водородные связи приводят к
сильной ассоциации молекул (Н2О)П. При 20°С п в
среднем 4, при 100°С п = 1 и 3% п = 2.
Физические свойства:
Чистая вода не имеет вкуса, цвета и запаха, в тонких слоях — бесцветная, в толще —
голубоватая. Наибольшая плотность при +4°С — 1 кг/л, при 0°С — 0.998 кг/л, так как согласно
одной из точек зрения
. 0°С, Тгип 100°С. Характеризуется высокой
теплоемкостью (4.13 кДж/моль-кг-К), высокой теплотой испарения.
Химические свойства:
Вода реагирует с простыми веществами:
Ф С щелочными и щелочноземельными, а при
нагревании — и с другими металлами
@ С галогенами
Са + 2Н2О = Са(ОН)2 + Н2Т
3Fe + 4Н2О = Fe3O4 + 4НгТ
2F2 + 2Н2О = 4HF + О2Т
Cl2 + Н2О4=тНСЮ + HCI
Вода реагирует со сложными веществами:
Ф С оксидами основными
кислотными
® С ионными гидридами
® Образование кристаллогидратов
© Гидратация непредельных
органических соединений
® Гидролиз ионных и ковалентных (в том
числе — органич.) соединений
Особые свойства воды:
Ф Вода — катализатор
I ® Вода — очень слабый электролит:
I_______________В чистой воде при 22°С [Н*] = [ОН~] = 10~7
СаО + Н2О = Са(ОН)2
SO3 + Н2О = H2SO4
КН + Н2О -> КОН + Н2Т
NaOH + 2Н2О -» NaOH • 2Н2О
CuSO4 + 5Н2О -» CuSO4 • 5Н2О
СН =СН2 + Н2О -> СН3СН2ОН (Н+) о
снисн + н2о -> сн3с (Нд2)
А1С13 + Н2О4=тАЮНС12 + HCI 'н
РС15 + 4НгО -> Н3РО4 + 5HCI
о о
сн3с +нон«= сн3с +сн3он
осн3 он
2AI + 312 -» 2А113
Н2О4=тН+ + он-
ь/л, pH = 7
г Очистка: 1) От крупных частиц — фильтрованием
2) От растворенных солей: временная жесткость — Са(НСО3)2 + Са(ОН)2 = 2СаСО34- + 2Н2О или кипячением: Са(НСО3)2 = СаСО31 + СО2 + Н2О постоянная жесткость — CaSO4 + Na2CO3 = СаСО34- + Na2SO4 3) От взвесей — добавлением солей алюминия или железа (III) AI2(SO4)3 + ЗСа(ОН)2 = 2А1(ОН)34- + 3CaSO/ Fe2(SO4)3 + ЗИаДЗО, + ЗН2О = 2Fe(0H)4 + 3Na2SO4 + 3CO2T
Рыхлые осадки А1(ОН)Э и Fe(OH)3 захватывают примеси < 4) Обеззараживание — хлорирование или озонирование 5) В случае необходимости — дистилляция или деминерализация (пропускание через катионит в ЬГ форме и анионит в ОН" форме) >
— I 0
ПерОКСИД ВОДОрОДЭ НгОг —жидкость. Обычно в фармакологии (антисептик) 3%-ный
водный раствор или 30%-ный раствор в промышленности (пергидроль). Легко разлагается при хранении, при нагревании и
на свету. Разложение катализирует МпО2 2Н2О2 = 2Н2О + О2
Получение: ВаО2 + H2SO4 = BaSOj + Н2ОH,S,OB + 2Н,0 -» 2H,SO4 + Н,О,
пероксид надсерная к-та
Свойства: 1) Очень слабая кислота! Н2О2-г=^Нч + НО2‘, соли — пероксиды Н2О2 + Ва(ОН)2 —> BaO2i + 2Н?О
2) окислитель: Н2О"’2 + 2KI + H2SO4 — 12 + K2SO4 + 2Н2О"2
3) восстановитель: 5Н2О-12 + 3H2SO4 + 2KMnO4 = K2SO4 + 2MnSO4 + 8Н2О + 5О°2
Применение Н2О2 и пероксидов: отбелка различных материалов, хим. промышленность,
решение, медицина, поглощение СО2: 2Na2O2 + 2СО2 -> 2Na2CO3 + О2
28
Va ПОДГРУППА. АЗОТ N
-1Ч-!
2p Z i В природе: 0.01% массы земн. коры, 78.1% по объему атмосферного воздуха. NaNO3, KNO3 — селитры
5e 2s t t t +3e l=>@
J n
+2
+3
+4
+5
"Получение: Ф в промышленности — фракционирование жидкого воздуха (t^ О2 = -183*С, N2 = -196*0) ® в лаборатории — разложение нитрита аммония при нагревании: NH.NO, = N, + 2Н.О, NaNO, + NH.CI = N, + NaCI + 2Н,0 4222 242 2
СВОЙСТВА
Физические: газ без цвета, запаха и вкуса? = -196°С, плохо растворим в воде (2.3 мл в 100 мл Н2О при 0°С) Химические: молекула N=N очень устойчива' (прочная тройная связь, Е = 942 кДж/моль) низкая реакционная способность
Восстановитель: высокая температура (эл. дуга, С Окислитель: при комнатной температуре — т Li, при нагревании — с другими Реагирует с водородом. При давлении 20-40 МП; пературе 400-500°С и в присутствии катализатор за, активированного различными добавками. JOOO°C) N + О = 2NO -Q ‘замороженное» равновесие, 2 2 продувка через разряд олько с 6Li + N2 = 2Li3N нитрид металлами ЗСа + N2 = Ca3N2 з, тем- р, t кат а — желе- ЗН2 + N2^=r2NH3 + Q
Аммиак NH3 Соли аммония NH/
г В промышленности: см. выше н2 + n2 В лаборатории: нагрев солей аммония со щелочами или нагревание NH3 • Н2О (NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3t + 2H2O Физические свойства: бесцветный газ с резким запахом, хорошо растворим в воде (при 20°С 700 л NH3 в 1 л Н2О) Химические свойства: NH3 + Н+ = NH4+ — ион аммония донорно-акцепторное взаимодей- \ н ствие, присоединяет Н+ -> ион треугольная ЭММОНИЯ пирамида Основание: при реакции с кислотами — соли NH3 + HCI = NH4CI хлорид аммония при растворении в воде: NH3 + H204=rNH4+ + ОН' щелочная реакция 3% водный раствор — «нашатырный спирт» Восстановитель: за счет №', окисляется обычно до N2: Ф ЗВг, + 8NH = N,t + 6NH.Br 2 3 2 4 * N2 + Н2о горение ® О.+ NH, мп + и о стадия получения Pt-кат. n° + h2o hnq^ ® ЗСиО + 2NH3 = N2T + ЗСи + ЗН2О (оксиды некоторых металлов) Окислитель: за счет Н+: 2Na + 2NH32NaNH2 + Н2 k амид NH4+ — ведет себя как катион щелочного металла Соли аммония хорошо растворимы в воде В водных растворах соли аммония существуют в виде ионов: Г н 1+ (NH4)2SO4 = 2NH4+ + SO42' A Разложение при нагревании: An -X Ф если кислота летучая, а анион — н'^^' неокислитель: нагрев тетраэдр NHCI^- NH + HCI 4 3 Г охлажд. ® если кислота нелетучая, а анион — неокис- литель, то происходит частичное разложение: t° (NHJ,S04 = NH t + NH4HS04 ® если анион — окислитель, то происходит окисление азота в ионе аммония: NH4NO3 = N2O + 2Н2О (NH4)2Cr2O7 = N2 + 4Н2О + Cr2O3 Качественная реакция на ион NH4+ — выде- ление аммиака при реакции солей аммония со щелочами: NH4CI + NaOH = NaCI + NH.t + H,0 4 3 2 Азотные удобрения Аммиачная вода NH3, Селитры NaNO3, KNO3, NH4NO3 Сульфат аммония (NH4)2SO4 Карбамид (мочевина) CO(NH2)2
29
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
- - ,2р,
+Ф Оксид азота (I), N20
Получение:
t°
NH4NO3 = N2o + 2H2O
бесцветный газ co сладкова-
тым запахом, заметно рас-
творяется в Н20
несолеобразующий
+(2) Оксид азота (II), NO
Получение:
в промышленности (стадия
производства HNO3)
Pt
4NH3 + 5О2 = 4NO + 6Н2О
в лаборатории
ЗСи + 8HNO3 = 3Cu(NO3)2 +
2NOT + 4Н2О
Положительные степени окисления
+(§) Оксид азота (IV), N02
Получение:
1. 2NO + О2 = 2NO2
2. Си + 4HNO, = Cu(NO,), + 2NO, +
конц. + 2Н2О
3. 2Pb(NO3)2 = 2РЬО + 4NO2 + О2
-11.2°С
2NO24=rN2O4
бурый газ +140°с бесцв. кристалл.
+(D Оксид азота (III), N2O3
Получение:
NO2 + NO^NjOj, нестоек
Кислотный оксид
со щелочами
N2O3 + 2NaOH = 2NaNO2 + H2O
нитрит натрия
/? х°
Н—О—N ИЛИ Н—О—N* +
+ч°- % -4
строение молекулы азотной кислоты
>500°С — разлагается
2N2O = 2N2 + 02
поэтому окисляет вещества,
реагирующие с О2
N2O + Н2 = N2 + Н20
2N2O + С = СО2 + 2N2
бесцветный газ, трудно сжижаемый,
плохо растворим в H2O
| несолеобразующий
окисл ител ьно- восстановительная
двойственность
восстановитель:
2N0 + 02 = 2NO2 <J=
2N0 + Cl2 = 2NOCI с==[>
окислитель:
2N0 + 2SO2 = 2SO3 + N2
в водном растворе.
2N0 + 2Н О + 2S0 = N, + 2H,SO„
2 2 2 2 4
HNO2 — кислота средней силы,
неустойчивая кислота
диспропорционирует
=□ to
2HNO2 = Н20 + N02 + NO crz
хранение
окислительно-восстановительная
двойственность
-) окислитель:
2HI + 2HNO2 = l2 + 2N0 + 2Н2О
восстановитель:
2КМпО4 + 6HNO2 = 2Mn(NO3)2 +
KNO3 + KNO2 + 3H2O
Соли азотистой кислоты — нитриты
(KNO,, NaNO?)
кислотный оксид
►При растворении в воде —
2NO2 + Н20 = HNO3 + HNO2
со щелочами:
2NO2 + 2NaOH = NaNO3 + NaNO2 +
H2°
сильный окислитель:
no2 + CO = NO + co2
NO2 + SO2 -> NO + SO3 (нитрозный
способ получения серной кислоты)
Химические свойства hno3
сильная кислота, окислитель: HNO, => NO, => N,O, => NO => N,0 => N, => NH.NO,
___________________________J ___2____2 3 2 2 4 3
Си + 4HNOaiioH4) = Cu(NO3)2 + 2NO2 + 2H2O
ЗСи + 8HNOapa361 = 3Cu(NO3)2 + 2NO + 4H2O
4Mn + IOHNOj,^) = 4Mn(NO3)2 + N2O + 5H2O
4Zn + lOHNO^^, = 4Zn(NO3)2 + NH4NO3 + 3H2O
Смесь продуктов в зависимости от активности металла и
концентрации HNO3. Концентрированная HNO, пассивирует
(на холоду) Fe, Al, Cr
+(5) Оксид азота (V), N2O5
Получение:
1. 6HNO3 + Р2О5 = 2Н3РО4 + 3N2O5
дегидратация HNO3
2. 2NO2 + О3 -> N2O5 + О2
бесцветные нестойкие кристаллы
>0°
2N2O5 = 4NO2 + О2
Кислотный оксид
N2O5 + Н2О = 2HNO3
сильный окислитель
Азотная кислота HNO3
Получение:
В лаборатории
t’
NaNO3 + H2SO4 = NaHSO4 + HNO3T
В промышленности
Pt
1) 4NH3 + 5O2 = 4NO + 6H2O
2) 2NO + O2 = 2NO2 (при охлаждении)
3) 4NO2 + O2 + 2H2O = 4HNO3 (под
давлением O2)
Физические свойства
Бесцветная жидкость, при -42°С перехо-
дит в кристаллическое состояние, с Н20
смешивается в любых соотношениях
Неметаллы: окисляются до соответствующих кислот, HNO3 => NO2 или NO (в зависимости от разбавления)
Р + SHNO^j = Н3РО4 + 5NO2T + Н,О I, + 10HNO „ = 2HIO3 + 10NO.T + 4Н2О S + eHNO^, = H2SO4 + 6NO2T + 2HjO 1 объем HNO3 + 3 объема HCI «царская водка» Au + HNO3 + 4HCI -> NO + 2H2O + H[AuCI4]
Качественная реакция на ион NO3~
Нитраты — хорошо растворимы в воде. Разлагаются при сильном нагревании.
Щелочные и щелочноземельные металлы Малоактивные металлы
i’NuNO, 2NaNO, I О/ 2Pb(NO3)2 = 2РЬО + 4NO2T + O2T 2AgNO3 = 2Ag + 2NO2T + O2T
2NaNO, + 3H,S04 + Си = 2NO,t + CuS04 +
3 2 4 2 4
2NaHSO. + 21-1,0 бурый газ
4 2
Va ПОДГРУППА. N, P, As, Sb, Bi. ФОСФОР P
известны и другие
d
степени окисления
+3е
1-3
Фосфор: несколько аллотропных модификаций
Белый (желтый) фосфор, молекулярное строение Р4,
44°С, сильно ядовит, растворим в CS2, С2Н5ОН и др.
Окисление белого фосфора на воздухе сопровождается
N '
р .неметаллы
AS-
металлы
NH3
РНэ
AsH.
з
SbH3
BiH
ОСНОВНОСТЬ 3
восстано-
вительные
свойства
свечением. Химически активен.
Красный фосфор полимерное строение, не ядовиты,
Черный фосфор Г нерастворимы в воде и органи-
J ческих растворителях
нагревание, пов. давление
Белый фосфор •<- . .... ------ , Красный фосфор
нагревание, пониж. давление
В природе: земн. кора 0.1%. В свободном
виде не существует. Фосфорит Са3(РО4)2,
фторапатит — ЗСа3(РО4)2 • CaF2 и др.
Получение: 2Са3(РО4)2 + ЮС + 6SiO2 =
ЮСОТ + 6CaSiO3 + Р4Т (электр. печь)
Химическая активность фосфора значительно выше, чем N2
восстановитель: 5О2 + 4Р = 2P2OS ЗО2 + 4Р = 2Р2О3 (недостаток О2)
5С12 + 2Р = 2PCIS 3I2 + 2Р = 2Р!3
ЗР + 5HNO3 + 2Н2О = ЗН3РО4 + 5NO
2Р + 5CuS04 + 8Н О = 5Н SO4 + 5Cu + 2Н3РО4
окислитель: 2Р + ЗМд = Мд3Р2 (фосфид магния)
+5
+3
кислородные соединения
более устойчивы,чем у N
соединения с водородом —
« _____„ ы
гфосфиды: Са3Р2 ЗСа + 2Р = Са3Р2 фосфин: РН3 Са3Р2 + 6Н2О = ЗСа(ОН)2 + 2РН3Т фосфин — ядовитый газ, бес- цветен, плохо растворим в Н2О, нестоек. РН3 — более слабое основание, чем NH3 РН3 + HI = [PH4]I — в воде соли фосфония полностью гидроли- зуются. РН3 — сильный восстановитель РН3 + 2О2 = Н3РО4 pci3, р2о3 Образуются при недостатке окислителя 2Р + ЗС12 -> 2РС13 4Р + ЗО2 = 2Р2О3 кислотный оксид Р2О3: 4NaOH + Р2О3 = 2Na2HPO3 + Н2О Р2О3 + ЗН2О = 2Н3РО3 двухосновная фосфористая кислота средней силы Нк /ОН р / х°н соли — фосфиты (Na2HPO3 и др.) восстановитель: Р2О3 + О2 = Р2О5[ соединения фосфора в этой степени окисления наиболее устойчивы, поэтому не проявляют окислительных свойств Р205 — белый порошок, получают сгоранием Р в избытке О2: 4Р + 5О2 = 2Р2О5 сильное водоотнимающее действие 6HNO3 + Р2О5 = 2Н3РО4 + 3N2O. кислотный оксид ЗВаО + Р2О5 = Ва3(РО4)2 6NaOH + Р2О5 = Na3PO4 + ЗН2О при растворении в Н2О Р2О5 + н2о -> (НРО3)п > метафосфо риал кислота П>4 Н4Р4О12 + 2Н2О = 2Н4Р2О7 пирофосфорная кислота
Ортофосфорная кислота — кислота средней силы, окислитель- -ой о»1лы за счет Р(+5) не имеет. j зада солей: средние фосфаты (К3РО4, Са3(РО4)2 и др.); гидрофос- са-ы (СаНРО4, К2НРО4) и дигидрофосфаты (Са(Н2РО4)2, КН2РО4 и ч но—P-о—Р —он нс/ '''ОН I Н4Р2О7 + Н2О = 2Н3РО4 [
к
ортофосфорная или просто
фосфорная кислота
Средние фосфаты, кроме фосфатов щелочных металлов, в
-нерастворимы.
--«из РО43- + Н2О^=гОН- + НРО42-
канественная реакция: в нейтральной среде ЗАд+ + РО43* = Ад3РО4
<ж - - жгг-s»* осадок
* хс^Ьоения:
. — молотый фосфорит, «фосфоритная мука» — нерастворим в воде
^а3(РО4)2 + 2H2SO4 = Са(Н2РО4)2 + 2CaSO4 — суперфосфат
Саз(РО4)2 + 4Н3РО4 = ЗСа(Н2РО4)2 — двойной суперфосфат
Са(ОН)2 + Н3РО4 = СаНР04 + 2Н2О — преципитат, нерастворим в Н2О,
растворим только в кислых почвах
3NH3 + 2Н3РО4 = NH4H2PO4 + (NH4)2HPO4 - аммофос
+ соль К — аммофоска
О=Р—ОН
Чэн
РС15 — легко гидролизуется:
PCL + 4Н,0 -» Н3РО4 + 5HCI
Э 2 4 4
В промышленности:
Са3(РО4)2 + 3H2SO4 = 2Н3РО4 +
3CaSOj экстракционная фосфор- I
ная кислота ,
31
IVa подгруппа. УГЛЕРОД С
В природе: органические вещества, СО2,
СаСО3 — известняк, мел, мрамор
МдСО3 — магнезит
FeCO, — железный шпат и др.
< __________________—___________________/
Физические свойства: 4 аллотропные модификации
г алмаз зр3-ги6ридизация, тетраэдрические сг- связи прочные, ковалентные, поэтому очень тверд. Изолятор, р = 3.51 г/см3 графит J—< >. sp’-гибридизация, слоистая структура, большое расстояние и непроч- ные связи между слоями, поэтому мягкий. Хорошая электропроводимость. р = 2.22 г/см3 карбин эр- гибридизация =с=с=с=с= линейный полимер, твердое вещество ФУллеРит гхЙЭм НЙТХТЧ состоит из фуллеренов Сда, с70 и др., имеющих форму сферы или сфероида. Растворим в орг. растворителях. Получают при испарении графита в атм. Не и др. методами. л
Химические свойства
малоактивен, на холоду реагирует только с F2 -> CF4
восстановительные <- слабо выражены -> окислительные
1) С + О2 = СО2 — ниже 500°С
2) С + Н2О = СО + Н2 выше 1200°С
С + 2Н2О — СО2 + 2Н2 ок. юоо°с
3) СиО + С = Си + СО при нагревании
4) 4HNO3 + ЗС = ЗСО2 + 4NO + 2Н2О
1) Са + 2С = СаС2 карбид кальция
(др. способ СаО + ЗС = СаС2 + СО)
2) 2Н2 + С = СН4 и др. углеводороды
получение
нагревание без
доступа воздуха
древесины каменного
[древесный уголь" угля
активирован- | кокс |
ный уголь
Самый чистый С (сажа):
СНЛ = С + 2Н,
4 i
крекинг метана
—4 и др. +2 +4
Углеводороды (СН4, С2Н2,
С6Н6идр.)
Карбиды — получают при непо-
средственном взаимодействии С с
металлами, или оксидами металлов.
2 группы карбидов.
I Карбиды металлического
характера — карбиды переходных
металлов (Fe3C и др.). Электронная
проводимость, металлический блеск,
хим. инертность, термостойкость.
II Ионные карбиды — более
электроположительные металлы.
Бесцветны, прозрачны, не проводят
электрический ток, полный гидролиз:
1) А14С3 + 12Н2О = 4А1(ОН)3 +
ЗСН4Т (Ве2С)
2) СаС2 + 2Н2О = Са(ОН)2 +
с2н2Т
(Na2C2, К2С2, SrC2, ВаС2, Си2С2,
Мд2С3 и др.)
При гидролизе — ацетилен С2Н2 ,
пропин С3Н4 и др.
Оксид углерода (II), СО угарный
газ донорно-акцептор-
ное): ное взаимодействие
высокая прочность связи, 1080 кДж/моль.
Бесцветный газ без запаха, ядовит, т.к.
соединяется с гемоглобином крови. Плохо
растворим в Н2О,
Получение:
СО2 + С = 2CO нагревание без
С + Н2О = СО + Н2 Доступа воздуха
в лаборатории: J
действие конц. H2SO4 на HCOOH или Н2С2О4
муравьиная к-та НСООН = СОТ + Н2О
щавелевая к-та Н2С2О4 = СОТ + СО2 + Н2О
восстановитель
г
Fe2O3 + ЗСО = 2Fe + ЗСО2Т
2СО + О2 = 2СО2 + Q
СО + Cl2 -» СОС12 — фосген (свет, катал.)
несолеобразующий, но при 2оо°с
NaOH + СО -> нс*°
__ . , ONa
СО с d-элементами образует прочные
комплексы — карбонилы Fe(CO)5, Со2(СО),
и др.
качественная реакция
«вскипание" (сильная кислота)
1. СаСО3 + 2HCI = СаС12 + СО2Т +
н2о
2. СО2 вызывает помутнение
известковой и баритовой воды
Са(ОН)2 + СО2 = СаСО31 + Н2О
возможно растворение осадка:
СаСО3 + Н2О + СО2( избыток) =
Са(НСО3)2
карбонаты гидрокарбонаты
растворимы в Н2О — хорошо растворимы,
только щелочных и NH 4+ неустойчивы
сильный гидролиз (кроме NaHCO3),
Г
2NaHCO3 = Na2CO3 + Н2О + СО2
карбонаты щелочных металлов плавятся без
разложения, остальные карбонаты при нагре-
вании разлагаются: >доо<>с
СаСО3 = СаО + СО 2Т
Оксид углерода (IV) С02
О=С=О углекислый газ
неполярная, линейная молекула. Без
цвета и запаха, растворим в Н2О (880
мл в 1 л Н2О). При давлении 50 атм
сжижается. ~76°С — «сухой лед»
Получение:
в промышленности — обжиг известня-
ка, конверсия метана и др.
в лаборатории — вытеснение сильной
к-той:
СаСО3 + 2HCI = СаС12 + СО2Т + Н2О
Окислительные свойства
выражены слабо, обычно со2
не поддерживает горения. Только при
высоких температурах реагирует с
металлами, сродство к кислороду
которых больше, чем у С
2Mg + СО2 = 2МдО + С
Кислотный ОКСИД. При
растворении в Н2О образуется
небольшое количество слабой
угольной кислоты
СО2 + Н2О 4=СО2- Н2О 4=г Н2СО3
ОН ,
_ • в свободном виде
—неустойчива
Получение солей угольной кислоты:
соли угольной кислоты — карбонаты и
гидрокарбонаты
1) 2NaOH + СО2 = Na2CO3 + Н2О
Na2CO3 + Н2О + СО2 = 2NaHCO3
(изб. СО2)
2) СаО + СО2 -> СаСО3
3) Обменная реакция
BaCI2 + Na2CO3 = ВаСО34- + 2NaCI
32
кристаллический — темно-серый, алмазо-
подобная структура, sp3-гибридизация,
металлический блеск, полупроводниковые
свойства. Химически инертен. Плотность
2,33 г/см3, t 1415°С
' пл.
В ПрирОДб: 2-е место по распростра
ценности (27.6% массы земной коры).
Кремнезем — SiO2 (песок, кварц).
Силикаты и алюмосиликаты:
NaAISi3Oe полевой шпат
AI2O3-xSiO2-yH2O глины и мн. др.
КРЕМНИЙ
«аморфный» кремний —
высокодисперсный бурый поро-
шок, более реакционноспособен,
чем кристаллический
Химические свойства сравнительно инертен, реагирует преимущественно с сильными окислителями или восстановителями, как правило, требуется высокая температура: как восстановитель: Si + 2F2 = SiF4? (при комнатной температуре) Si + 02 = SiO2 Si + 2CI2 = SiCI4 400ч-600°С Si + 2NaOH + Н2О = Na2SiO3 + 2Н2Т при нагревании С + Si = SiC (карборунд, очень тверд) 2N2 + 3Si = Si3N4 (>1000°С) как окислитель: 2Са + Si = Ca2Si силицид кальция ^во многих металлах Si заметно растворяется без химического взаимодействия Получение: 1800°С SiO2 + С Si + 2СО t° SiH. —> Si -h 2H9 2Mg + SiO2 = 2MgO + Si
r+4 SiO2 — оксид кремния (IV), существует в нескольких кристал- лических модификациях, тугоплавок, инертен, но реагирует c HF: 4HF + SiO2 = SiF4T + 2Н2О 6HFp^ + SiO2 = H2SiF6 + 2H2O Кислотный оксид: сплавл. 2NaOH + SiO2 > Na2SiO3 + Н2О сплавл. Na2CO3 + SiO2 > Na2SiO3 + CO2t (более летуч) Высокодисперсный SiO2, образующийся при горении кремнийводородов, измель- чении горных пород и др. опасен, т.к. при попадании в лёгкие вызывает силикоз. Силикаты — соли кремниевых кислот. Силикаты Na, К растворимы в воде. Их называют жидким стеклом (силикатный клей). Сильный гидролиз (кремниевые кислоты — оч. слабые) 2Na2SiO3 + H2O^rNa2Si2O5 + 2NaOH метасиликат соли поликремниевых натрия кислот — диметасиликат Na и т.п. Кремниевые кислоты слабее угольной: Na,SiO, + 2Н О + 2СО, = 2NaHCO + H,SiOj -4 кремнииводороды (силаны) SiH4, Si2H6 и др. Получают из силицидов: Mg2Si + 4HCI = 2MgCI2 + SiH4t Горят на воздухе: SiH4 + 2О2 = SiO2 + 2Н .0 силициды: Mg2Si, Ca2Si и др.
Окислительных свойств SiO2 не проявляет, исключения (при сильном нагревании): 2Mg + SiO2 = 2МдО + Si ЗС + SiO2 = SiC + 2С0 Кремниевые кислоты nSiO2 • mH20: H4SiO4 — ортокремниевая H2SiO3 — метакремниевая H2Si2O5 — диметакремниевая, и т.д. Нестойкие при нагревании: H2SiO3 = Н20 + SiO2 — образу- ется силикагель (развитая поверх- ность — адсорбент, осушитель)
Цементы: прокаливание во вращающихся печах, в газовом пламени смеси глины AI2O3*xSiO2*yH2O, известняка СаСО3 и др. обычный цемент (СаО, SiO2) портланд-цемент СаО • SiO£ + СО2 + Н2О = СаСО3Ф + H2SiO34- смесь Ca3SiO5, -хватывние — за счет СОг из воздуха Ca2SiO4, Саз(АЮ3)г и др.
Г Стекло: Na2CO3 + SiO2 + СаСО3 -> t°C, сплавление, обычное оконное стекло Na. О • СаО • 6SiO2 замена части СаО на РЬО — хрустальное И^екло схватывание — за счет гидратации Ca3SiO5 + Н2О = Ca2SiO4 + Са(ОН)2 Ca2SiO4 + 4Н2О = Ca2SiO4 • 4Н2О Са3(АЮ3)2 + 6Н2О = Са3(АЮ3)2 • 6Н2О
33
VI6 ПОДГРУППА. ХРОМ Cr
[Ar]3ds4s1 3d5 х-'ч Т t t t Т 4s1 ®@© <J—-j □ устойчивость полузаполненной d-подоболочки В природе: в земной коре 8 • 10"3 масс.% Сг Важнейшие минералы:хромит FeCr2O4 мангохромит (Mg,Fe)Cr2O4
Получение: 1) Электролиз растворов солей 2) Алюминотермия: Cr2O3 + 2AI = А!2О3 + 2Сг Физические свойства: голубовато- серебристый металл, плотность 7,2 г/см3, tnj] = 1890°С, хрупкий. На воздухе устойчив.
Химические свойства:
металл средней активности, в электрохимическом ряду — ...Zn Cr Fe... Н2...
покрыт плотной защитной пленкой Сг2О3 и поэтому довольно инертен
с простыми веществами: со сложными веществами:
При обычных условиях реагирует только со F2. Cr реагирует с кислотами — неокислителями
При нагревании — с Cl2> Br2, S, О2 и др.: Cr + 2HCI = СгС12 + Н2
2Сг + ЗС12 = 2СгС13 красное каление Cr + H2SO4(p3:j6( = CrS04 + Н2
с конц. и разб. HNO3, царской водкой — не
реагирует (пассивация)
Cr + 6С0 = Сг(СО)6 (образование карбонила)
Cr + H2SO4 = CrS04 + Н2?
Cr + 2HCI -ч- CrCI2 + Н2
В растворах быстро окисляются до Сг(+3):
2CrCI2 + 2HCI = 2СгС13 + Н2
Соединения малоустойчивы, легко окисляются
Получение:
СгО — основной оксид.
Сг(ОН)2 — основание средней силы:
CrCI2 + 2NaOH = Cr(OH)2i + 2NaCI (желт, осадок)
Соединения Сг(+2) — сильные восстановители
____________________________________________>
Оксид Сг2О3
— тугоплавкие темно-зеленые
кристаллы, практически не рас-
творимые в воде, кислотах,
растворах щелочей.
Получение:
сжигание Сг в О2,
нагревание СгО3:
4СгО3 = 2Сг2О3 + ЗО2,
разложение (NH4)2Cr2O7:
(NH4)2Cr2O7 = N2T + 4Н2ОТ + Cr2O3
Полученный при невысоких
температурах Сг2О3 амфотерен
Cr2O3 + 3H2SO4 = Cr2(SO4)3 + ЗН2О Окислительно-восстанови-
сплавление: Cr2O3 + 2NaOH = тельная двойственность
2NaCrO2 + Н2О
раствор: Cr2O3 + 6NaOH + ЗН2О = окислитель:
2Na3[Cr(OH)6] ~
Сг О3, прокаленный при высоких
температурах, не реагирует ни с
кислотами, ни с основаниями.
Гидроксид Сг(ОН)3 амфотерен: 2NaCrO + ЗВг + 8NaOH =
Cr(OH)3 + 3HCI = CrCI3 + ЗН2О 2Na_CrO + 6NaBr + 4Н.0
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
В воде хромит-ионы зеленого цвета.
Ионы Сгэ+ гидролизуются:
Cr* + Н2О^=?Сг(ОН)2+ + Н+
2CrCI3 + Zn + H2SO4 = 2CrCI2 +
+ ZnSC), + 2HCI
восстановитель:
х J Оксид СгО3 кислотный оксид легкоплавкие темно-красные кристаллы. Легко растворя- ются в воде с образованием существующих только в Равновесие Сильные окислители 5 хромат дихромат определяется pH К Сг О + 14HCI = 2KCI + гК.СгС, + 2HCI = К.СГ.Д + 2KCI + Н2О 2CrCI3 + ЗС12Т + 7Н2О желтый хромат оранжевый дихромат калия калия 2СгО, + 3H,S = СГ,О, + K2Cr2O7 + 2КОН = 2K2CrO4 + Н2О ЗН2О + 3S
растворе кислот: СгО3 + Н2О = Н2СгО4 — хромовая к-та 2СгО3 + Н2О = Н2Сг2О7 - дихромовая к-та < хроматы канцерогенны! к сг о + s = Cr2O3 + K2SO4 Получение СгО3: 227 2 з 24 + ЖУ™* ^бЫТОк) = Качественная реакция 2CrO3l + 2KHS04 + Н2О Сг0 2_ + Ваг+ = Васю! 4 4 желтого цвета
34
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ, ПАРАФИНЫ)
соединения, состоящие из С и Н, в которых все
связи атомов С, не затраченные на образова-
ние одинарных связей С—С, насыщены атома-
ми Н
спн2п+2
СН4 — метан
C2Hg — этан
С3Н8 — пропан
С4Н10 —бутан
С5Н12 — пентан
СсН,. — гексан
С,Н,К — гептан
I 1о
СаН18 — октан
Возможна изомерия углеродного скелета:
Изомеры — соединения,
одинаковые по составу и
молекулярной массе, но
различающиеся по
строению или
расположению атомов в
пространстве (по
свойствам).
—с-с-с-с—
—с-с-с—
с
н-бутан
2-метилпропан
(изобутан)
Номенклатура: сначала выбирают самую
длинную цепь. Название:
М’(гп|п)заместителя-
заместитель-цепь.
Например, 2,3,3,-
триметил-4-этилгексан
С1,С6 — первичные, С5 — вторичный, С2,С4 —
третичные, С3 — четвертичный атомы углерода
сн„
2 1з 4 5
6
н3с-сн-с-сн-сн 2-сн3
сн3 сн3 с2н5
Физические свойства: СН4 — бесцветный газ, tKMn = -162°С. С2-С4 — газы; С5-С15 — жидкости
(при обычных условиях), далее —тв. вещества. tKMn предельных углеводородов с неразветвлен-
ной цепью выше, чем tran у соответствующих углеводородов с разветвленной цепью.
Строение:
sp3-гибридизация 4 эквивалентн. о-связи С—Н, направлен-
В° атома с°СТ -----------*" ные к вершинам тетраэдра, Z 109°28'
возможно свободное вращение вокруг связи С—С
Химические свойства: связи С-С и С-Н прочные, характеризуются низкой поляризуе-
мостью, поэтому свободнорадикальный механизм реакций: СН3:Н -+ СН3* + Н •
С—Н-связь*^ Покисление
С—С-связь
ф
m П
Г1. Горение СН4 + 2О2 -
СО2 + 2Н2О
смеси с воздухом
взрывоопасны
2. Каталитическое
ОКИСЛение (промыш-
ленность)
гКрекинг
От англ, to crack — расщеплять —
нагревание нефти и нефтепро-
дуктов без доступа воздуха,
приводящее к разрыву связей
С-С и образованию продуктов с
меньшей молекулярной массой.
15°2£С + 2Н2
сн„ 2
Реакции свободнорадикального
замещения (свет, нагрев):
hv
сн4 + С12 СН3С! + HCI
хлористый метил
CH3CI + Cl2 -> CH2CI2 + HCI
хлористый метилен
хлороформ СНС!Э
четыреххлористый углерод СС14
Механизм: CI2h-> CI • + CI •
СН4 + CI • -> СН3 • + HCI
СН3 • + Cl2 —> CH3CI + О • и т.д. до обрыва:
CI • + СН3 • -ч- СН3С1 или CI • + CI • -ч- Cl2
_. СН.СНВгСН, 90%
для гомологов __
СН3СН2СН2Вг 10%
третичный > вторичный > первичный
Нитрование (реакция М.Н. Коновалова):
С6Н14 + HNO3 -> C6H13NO2 + Н2О (т-ра выше 400°С)
Дегидрирование:
С4Н10 -> С4Н8 + Н2 (Ni-катализатор, 360°С)
сн.
4
СН3ОН
неон
нс=сн + н,
1600°С 2
Г омологи — с разрывом С-С
связи:
[О]
СН3СН2СН2СН3 -> 2СН3СООН +
Н2О соед. Мп
получение уксусной кислоты
с4н10 с2н6 + С2Н4
смесь продуктов —
разветвленные, непре-
дельные.
Получение (природный газ, нефть):
Без изменения числа атомов С.
1. СН2=СН2 + Н2 -> СН3-СН3 2. СН31 + 2Н -> СН„ + HI
СН31 + HI -» СН4 + 12
или с увеличением числа атомов С:
3. Реакция Вюрца С2Н5[j + 2Na + l]C2H5 -> С4Н10 + 2Nal
С уменьшением числа атомов С:
Циклопарафины: углеводороды, в которых атомы
СпН2п С образуют цепь (цикл), связи
насыщены атомами Н
Названия: Цикло + алкан
снз Н
сн3
о
'/
4 СН«—С + NaOH-> CH, + NaoCOq
3 4 с. 3
ONa
5. Синтез из СО и Н2: СО + Н2 -> смесь углеводор. + Н2О
6. Электролиз растворов солей карбоновых кислот (Кольбз)
2CH3COO- -2е -> 2CO2 + СН3-СН3
Н3С Н
метилциклобутан транс-1,2-диметилциклопропан
Изомерия: углеводородного скелета + пространственная
Химические свойства: подобны парафинам. Характерно
свободнорадикальное замещение.
Следует отметить:
1. Для циклогексанов — легкая дегидрогенизация
аснэ ________________________. СНЭ
О + эн,
pt
2. Легкое разрушение 3-4-членных циклов: /\ + Вг2 ->
Вг-СН-СН ~СН,Вг
г г 4 ,
35
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ, ОЛЕФИНЫ)
q Н Номенклатура: систематическая (ИЮПАК)
углеводороды, содер-
жащие двойные (С=С)
связи
Изомерия: углеродного скелета, положения
С=С связи, пространственная изомерия (цис-
транс)
от названия соответствующих
насыщенных углеводородов ан -> ен (№(rrin)
4 3 2 1
сн,-сн-с=сн,
3 I I 2
СН_ С,Нс
З-метил-2-этилбутен-1
Иногда в названиях
группу СН2=СН-
называют винил
сн=сн2
винилциклогексан
Строение:
sp2-гибридизация, Z 120°. 2р-электрона соседних атомов С образуют я-связь вне
линии с связи С—С. Поэтому нет вращения вокруг связи С=С.
легкость электрофильного 2 6+5-
11 + H-Y -
присоединения с
л-связь более реакционноспособна, чем ст-связь
С®
I
С—Н
с
i
Р"н
Горение:
С2Н4 + ЗО2 2СО2 + 2Н2О
слабо коптящее пламя
Реакции присоединения по связи С=С
1. СН2=СН2 + Вг2 —> BrCH2CH2Br 1,2-дибром этан
протекает легко — обесцвечивается бромная вода
Реакции соседней с С=С связью группы
Активация С=С связью соседнего радикала.
Энергия связи С-Н в пределах «380-420
кДж/моль, а у соседней с С=С «320 кДж/моль
Возможно:
С12, 500°С
С1СН2СН=СН2 + HCI
Ф сн3сн=сн2
@ сн3сн=сн2
О2, кат. , О
-> сн2=сн-с' + Н2О
Н
2. СН =СН-СН + НВг -> сн.-сн-сн.
* «з । 2 । 3
Н Вг
/Правило Марковникова: атом Н из HHal ~
присоединяется к атому С с наибольшим
числом атомов Н
Причины:
Ф сдвиг электронов в несимметричной молекуле к С=С-
связи, т.к. электроотрицательность > С^г > С з
S+ 5- 6+ 5-
СН3->СН=СН2 место атаки Н-Вг
@ большая устойчивость промежуточного карбокатиона
®
[СН3->СН<-СН3]
®
[СН3-СН2->СН2]
первичный < вторичный < третичный
Получение:
Ф при крекинге нефтепродуктов:
с н ^C1SH32 + CH3CH=CH2
18 ^^С^ + СН^СН,
@ этилен содержится в газе, выделяющемся
при коксовании каменного угля
® дегидрогенирование предельных углеводо-
родов: t, Ni
с2нв -+ с2н4 + н2
@ из спиртов — дегидратация:
сн3-сн=сн2
Ч Ч 150-170°С Н н
Н С С Н --------► р—р z 4. u q
H2so4 н-с-% ”2°
н он
3. Полимеризация (соединение молекул друг с другом):
пСН2=СН2 -> (-СН2-СН2-)п — полиэтилен
п — степень полимеризации
4. Гидратация СН2=СН2 + Н2О -> СН3-СН2-ОН
0°С, H2SO4
5. Окисление протекает легко:
ЗСН2=СНг + 2МпО4- + 4НгО -> 3CH2-CH2 + 2ОН' + 2МпОг1
® из моногалогенных производных:
кон нх Н
СН3—СН2—CI -+ с=С + KCI + Н2О
спирт 'н 2
ОН ОН
обесцвечивание р-ра — качественная реакция на
двойную связь
6. Гидрирование СН =СН, + Н„ -+* СН--СН,
(гидрогенизация) Ni или и J
Г Отщепление Н происходит прежде всего от
наименее гидрогенизированного атома С
(правило Зайцева). М.б. использовано
для перемещения С=С связи по цепи._________
® из дигалогенпроизводных:
-u Zn пыль
СН2-СН2 ----> CH2=CH2 + ZnBr2
Вг Вг
е
36
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ CnH2n_2
непредельные углеводороды, содержащие 2 двойные связи С=С
Изомерия: углеродного скелета,
пространственная (цис-, транс-),
положения С=С
к_____________________________________>
z
Номенклатура: такая же, как у алкенов, но
ен -> диен
СН2=С-СН=СН2 2-метилбутадиен-1,3
I (изопрен)
с5на
СН2=С=СН-СН2-СН3 пентадиен-1,2
СН3-СН=С=СН-СН3 пентадиен-2,3
СН2=СН-СН2-СН=СН2 пентадиен-1,4
СН2=СН-СН=СН-СН3 пентадиен-1,3
Наибольшее практическое значение имеют 1,3-
диены с сопряженными С=С связями (группами
С=С-С=С)
Химические свойства: из-за взаимного влияния С=С связей вся ненасыщенная система в
реакциях присоединения реагирует как одно целое
сн2=сн-сн=сн2 + Вг2
сн„-сн=сн-сн,
Л' I
' Вг Вг
продукт 1,4-присоединения -/
основной продукт
СН2=СН-СН=СН2 + Вг2
сн,=сн-сн-сн,
2 ||2
Вг Вг
продукт 1,2-присоединения
побочный продукт
[СН2=СН-СН-СН2 Вг]+ Вг
аналогично — реакция полимеризации:
пСН2=СН-СН=СН2 -> (-CH2-CH=CH-CH2-)n
© ’
[СН2-СН=СН-СН2 Вг]+ Вг ->
ВгСН2-СН=СН-СН2 Вг
ПОЛИМЕРЫ: Высокомолекулярные соединения, молекулы которых состоят из большого
числа повторяющихся группировок (мономерных звеньев)
(-CH2-CH=CH-CH2-)n + СН2=СН-СН=СН2 -> (-CH2-CH=CH-CH2-)nff^
элементарное звено мономер полимер —дивиниловый каучук степень
1930-1931, С В. Лебедев полимеризации
Полимеризация: Процесс синтеза полимера путем последовательного присоединения молекул
низкомолекулярного вещества (мономера) к активному центру, находящемуся
на конце растущей цепи.
природный каучук — изопреновые
промышленные каучуки (сополимеры)
:-. = :-«-сн=сн2
• ?»~адиена
сн=сн2
автомобильные шины
резиновые изделия
СН-СН2 бензо-маслостойкий
CN
акрилонитрил
г реЗИНЫ — образуются при сшивании макромолекул за
счет оставшихся С=С связей S-S мостиками
(«вулканизация»)
СтереорегулярнЫЙ — звенья только цис-строения,
что обусловливает хорошие механические свойства.
Для искусственного получения — специальные катализаторы
(К.Циглер, Д. Натта)
1
2С2Н5ОН СН2=СН-СН=СН2 * 2Н2О + Н2
А12О2
сн3сн2сн2сн3 -+ сн2=сн-сн=сн2 + 2Н2
Cu/Cr
сн3ч ,
CH -СН2-СН3 -» СН2=С-СН=СН, -I- 2Н,
37
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ) СпН2п_2
непредельные углеводороды, содержащие тройную связь С=С
г Номенклатура: Систематическая (ИЮПАК) Иногда используют рациональную
аналогична олефинам замена ЕН -» ИН сн,-сн-с®сн З-метилбутин-1 3 I на основе ацетилена СН3-ОСН метилацетилен СН2=СН-ОСН винилацетилен
сн.
Изомерия: углеводородного скелета + положение связи ОС,
пространственной нет.
Строение:
। । । Для атома С в алкинах характерна sp-гибридизация, Z 180°. Группа
-j---—— -ОС- имеет линейное строение.
— Длина связи ОС 1,20 А, что короче, чем связь С-С (1,54А) или С=С
(1,33 А). л-Связи образуют компактное облако, поэтому в некоторых реакциях
присоединения ОС связь мало реакционноспособна.
Горение: ацетилен С2Н2 горит коптящим
пламенем (много углерода). При вдувании О,
— ослепительно белое пламя (до 2500°С).
Смесь С2Н2 и О2 взрывоопасна.
Реакция присоединения по ОС связи
протекает ступенчато Вг
Ф Н-ОС-Н + Вг, -> Н"с=<Вг+ вг, -> Н"с-<Вг
обесцвечивание 2 z 2 ✓ ।
Br-воды А1С13 вг Вг вг
® Н-ОС-Н + HCI -> Н,С=СНС1 + HCI -+ Н C-CHCI,
2 хлористый ВИНИЛ 3 О
,, + ’ ПВХ — пластмасса пп ппг>1
н^ .Вг
гС-С^ц + Вг2
ВГ Н
2
по правилу
(3{ ___с Марковникова
уксусный Н
альдегид
® н-ос-н + Н2о [Н2С=СНОН] ->
виниловый спирт
Реакцию Кучерова используют в промышленности
Присоединение Н20, HCI и др. происходит по правилу
Марковникова: н+
сн3-ссн + Н>0 ->
но2+
СНз-С=СН2 CHj-C-CHg
ОН
енол
О
ацетон
® Н-ОС-Н + Н -4. Н2С=СН. + н. -> н3с-сн3
4 NI.Pt 4 4 4 3 3
® полимеризация
Реакция С-Н связи, соседней с
группой ОС
Сильное влияние ОС связи на свой-
ства связанного с ней атома Н. Т.к.
углерод сильно ненасыщен, электро-
отрицательность
С^ > Csp2 > С5рз, наблюдается сдвиг
электронов ОС~Н. Поляризация
связи С-Н приводит к появлению
кислотных свойств.
При пропускании НОСН через амми-
ачный раствор солей Си+ и Ад+ обра-
зуется осадок:
НОСН + 2[M(NH3)2]+ -+ M2C2^ + 2NH4+
М = Cu+, Ад+ и др.
Ацетилениды М2С2 после высушива-
ния взрываются
юо°с
а) тримеризация —>
акт. уголь
бензол
6) димеризация -> CH2=CH-CsCH -
присоединение HCI по тройной связи
(пр. Марковникова)
Получение:
2500°С
Ф СаСО3 + 4 С -> СаС2 + 3COf
карбид кальция
СаС2 + 2Н2О = Са(ОН)2 + НС=СНТ
н,с =с-сн=сн, -> I -сн,-с=сн-сн,- I
1. \ 1. /п
хлоропрен
2-хлорбутадиен-1,3
® окисление
хлоропреновый каучук
16ОО°С
® 2СН4 НОСН + ЗН2
(3) из дигалогенпроизводных:
H-CsC-H + [О] ->
КМпО.
р-р
обесцвечивание р-ра
перманганата
(качеств, реакция)
,о
с-он
, с-он
1 л
о
щавелевая
к-та
4
О
нс' + СО,
ОН
муравьиная
к-та
С1Н2С-СН2С1 CH2=CHCI
Са(ОН)2 хлористый винил NaOH
носн
или
спиртовой р-р
CIH2C-CH2CI + 2КОН -> носн
+ 2KCI + 2Н2О
38
со
<о
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
<>|и.шичрски»1 соединения, в состав которых входит одно или
нисколько бензольных ядер
Номенклатура: название заместителя + бензол
бензол нафталин
антрацен
сн
— метилбензол
(толуол)
сн
— 1,3-диметилбензол
(мета-ксилол)
сн3
бензольные кольца сконденсированы
Изомерия: заместителей и их положения
Строение: зр2-гибридизация, каждый атом С образует 3 ст-связи, Z
120°, плоская молекула. 6 я-электронов образуют единую л-
электронную систему. Длина связи О-С 1.39А
В результате при образовании молекулы С6Н6 выделяется
теплоты на 150 кДж/моль больше, чем ее выделилось бы при
наличии в С6Н6 трех С=С связей. Ароматическая система
характеризуется высокой устойчивостью.
Горение: бензол и его аналоги (толуол и др.)
горят сильно коптящим пламенем
с.н5
СН
орто-ксилол
СН
Реакции замещения
происходят в присутствии
катализаторов (AICI3, FeBr3), которые
вызывают поляризацию молекул:
40°
+ Br2 FeBr*
+ НВг
Вг
+ СН3Вг
+ СН3-СН=СН2 -тт*
нитрование
сн3
+ НВг
СН-
сн3
+ HO-NO2
'г + НгО
этилбензол
сн3
мета-ксилол
пара-ксилол
сн3
р-р КМпО
Реакции присоединения
+ ЗН Р-Тг
Ni, Pt
Н
CI
УФ-свет
+ 3CL -------► н
CI
CI
CI
Н
CI
Н
Протекают в жестких условиях, т.к.
происходит разрушение устойчивой
ароматической системы
Получение:
1. Содержатся в некоторых нефтях
2. Дегидрирование
<D
ш
3
о
£
ш
3. Тримеризация ацетилена
„ 100°С
ЗнОеСН ------► ।
акт. уголь
о
ф
ш
X
Л
кипячение
кипячение
CH_.Br
р-р КМпО4
СНВг2
сн3
Реакции заместителей, связанных с кольцом
сн.сн, о
Вг2
hv
оч
'с
но' он
терефталевая к-та
ОН
бензойная к-та
о
У
Влияние имеющихся в молекуле группировок
.6-
Б-
HNO3, 20°С
H2SO4
no2
3 + o2n
HNO3, 100°С
снз ях °2'
no2
сн3
no2
орто-, пара-ориентация
—NO2
орто-, пара-ориентанты: OH, NH 2, R, Hal, OR
O2N мета-ориентанты: NO2, SO3H, CHO, COOH
Толуол легче, чем бензол, замещает Н на Hal в кольце в присут-
ствии катализатора. СН3-группа легче, чем СН4, бромируется на
свету и может быть окислена кипячением толуола с КМпО4
о
8-—'
HNO3, 100°С
H2SO4
СПИРТЫ
органические соединения, содержащие одну или
несколько функциональных гидроксогрупп ОН
Для предельных одноатомных спиртов общая формула СН2п+1ОН
Физические свойства: спирты с числом атомов С < 15 — жидкости,
далее — твердые вещества. В спиртах наблюдается значительная
ассоциация молекул за счет образования водородных связей
Горение —
светлым пламенем
Номенклатура
систематическая (номенклатура ИЮПАК)
название углеводорода + ол (с указанием
№ атома С), диол, триол и т.д.
CHj-CH-CHj-CHg сн2-сн2-сн2
он он
Некоторые спирты
имеют исторические
названия: С2Н5ОН —
винный, С3Н5(ОН)3 —
глицерин
Химические свойства определяются
наличием ОН-группы
бутанол-2 (вторичный нормальный пР°панДиол"1'3
бутиловый спирт)
Реакции с участием водородного атома
группы ОН
Т.к. О-Н связь поляризована — некоторая
кислотность
® 2ROH + 2Na = 2RONa + Н2'Г алкоголяты — тв. кристаллин,
вещества
ГИДРОЛИЗ
C2H5ONa + Н2О=5=^с2Н5ОН + NaOH
т.к. —более сильная кислота, чем спирт
алкоголяты нельзя получить действием раствора щелочи на спирт
Кислотность:
увеличивается
с увеличением
поляризации ОН* групп
CH3 CF3
CHg->C-»OH « СГ3«-С«-ОН
T i
сн3 CF3
трет.-бутанол перфтортрет.-бутанол
реакция этерификации (с кислотами)
H2S04 О
образ. ||
СН3СООН + НОСН3 сн3-с-о-сн3 + н2о
ГИ№ЮН3 сложный ЭФИР
| отличие от реакции нейтрализации |
неорганические кислоты
ROH + HOSO2OH-. “ r-o-so2-oh + Н2О
кислый эфир серной кислоты
ROH + H-OSO2OH + HOR оь...— R-0-S02-O-R + 2Н2О
средний диалкилсульфат
Отщепление ОН-группы
Н2зо4
ROH + НВг RBr + Н2о
< Ш8ЛОЧЬ
отдельные члены гомологического ряда
Метанол СН3ОН — особенность — дегидратация с
образованием диметилового эфира СН3~О~СН3.
Получение в промышленности: СО + 2Н2 Ч? СН3ОН
Этанол С2Н5ОН — растворитель, сырье для бутадиена
Получение: ферментативное брожение сахаристых в-в:
С6Н12О6 Щ 2СО2Т + 2С2Н5ОН
гидратация этилена: СН2=СН2 + Н2О —С2Н5ОН
Этиленгликоль, глицерин — многоатомные спирты. Взаимное
влияние ОН-групп. Как следствие, увеличение подвижности
атомов Н — растворяют свежеосажд. Си(ОН)2
с получением синего раствора глицерата меди.
Аналогично с этиленгликолем
Реакции с участием ОН-группы и Н-атома
— соседнего или ближайшего н н
влияние -ОН группы: повышение подвижности и j, j,
реакционной способности Н С-С-»ОН
О окисление спиртов (отщепление 2-х Н и окисл. их в
Н2О, увелич. % О) КМпО4, К2Сг2О7 + H2SO4, кат. Си, Pt
Н
СН3-С-ОН 4- (О]
н
3
н2о р
-*-сн3-с
н
альдегид
альдегид
I3-U-U
сн3
н
сн3- С- ОН + (О]
сн3
вторичный кетон
третичный — окисляются с трудом — разрыв связи С-С
® дегидратация — нагрев + H2SO4Uohu), AI2O3
н н
О
ацетон СН3
Получение: из гапогенпроизводных
сн2=сн2 + н2о Т> 140°С
<jjH2 С12 qh2ci
сн2
СН2С1
1,2-дихлорэтан
+н2о сн2он
-2HCI СН2ОН
Получение:
„ М Cl2 NaOH ,
CnH2n+2 hv ► cnH2n+1CI н2О* CnH2n+1OH
СН,=СН, + Н,0 ---► сн,-сн,-он
222 H2SO4 2 2
1----1 - н„о
сн3-сн2-он + но-сн2-сн3 —2*-СН3-СН2-О-СН2-СН3 T < 140°С
избыток спирта
вторичные — отщепление Н от атома с min Н (правило Зайцева), но
простые эфиры также образуются
сн3
он н
сн3-сн=сн-сн3 + н2о
бутен-2
третичные — в основном непредельные углеводороды, т.к.
образование эфира затруднено стерическими причинами
ФЕНОЛЫ
Производные ароматических углеводородов, у которых функциональная группа ОН
присоединена непосредственно к углеродному атому бензольного кольца
---------V--------
одноатомные фенолы
ОН
гидрохинон резорцин
двухатомные фенолы
пирогаллол
трехатомный фенол
Физические свойства: простейший представитель — фенол. Бесцветное кристаллическое
вещество (Тпл = 42’С) с характерным запахом (карболовая кислота). Темнеет, окисляясь на
воздухе. При комнатной температуре — малорастворим в НгО. При 60‘С — растворим в любых
L соотношениях. Ядовит.
Строение: ОН-группа связана с ароматическим радикалом (фенилом).
л-Электроны бензольного ядра вовлекают неподеленные электроны
атома кислорода ОН-группы в свою систему
Реакции с участием ОН-группы
Реакции с участием бензольного кольца
Возрастает полярность связи ОН и
подвижность атома Н (т.е. кислотность)
Фенол — более слабая кислота, чем Н2СО3
или H2S (не окрашивает лакмус в красный
цвет), но более сильная, чем одноатомные
т.к. возрастает электронная плотность в
кольце — облегчается атака кольца частицами,
испытывающими недостаток электронной
плотности — электрофилами — реакции
электрофильного замещения:
спирты
Феноляты разлагаются слабыми кислотами:
+ NaHCO3
(3) образуют простые и сложные эфиры
Получение:
Ф кумольный способ (наряду с ацетоном)
ООН
I
® «щелочное плавление»
Na-соль бензолсуль-
фокислоты
ONa
+ Na2SO3 + Н2О
41
АЛЬДЕГИДЫ И КЕТОНЫ
С Н О органические соединения, имеющие в
п 2п „ .
своем составе карбонильную функци-
альдегид в переводе на русский —
спирт, лишенный водорода ональную группу с=о (карбонил)
q |_| ОН~2Н->СН О альдегиды 1 изомерные соединения, также возможна
n 2n+1 п 2п кетоны Г изомерия углеводородного радикала
'Номенклатура:исторически сложившиеся систематическая номенкла- тура ИЮПАК
названия
альдегиды от соотв. кислот углеводород + «аль»
СН3-Сч уксусный альдегид этаналь
кетоны 11 названия радикалов углеводород + «он»
о + кетон
СН3-С' 'сн,-сн- метилэтилкетон бутанон-2 г
Строение: характерные химические свойства определяются наличием поляризованной двойной связи \=о . Для альдегидов характерны реакции
ООО
" гм гм прочность СВЯЗИ С=О
s *“з”S ^“3—
н н сн.
присоединения к группе С=О молекул воды, спиртов и др.
Окисление ч
для альдегидов характерна реакция £=о
«серебряного зеркала»: н )
С=О+2Ag(NH_)2OH----► С=О + Н,О + 3NH, + 2Agi
NH4OZ * 1 2 3 4
муравьиный альдегид окисляется до СО2:
НО\ [Ад2О)
с=о ---► н,о + СО.Т + 2Agi
h/ 2 2
реакция с гидроксидом меди:
снзч г СНЗЧ
C=O+ 2Cu(OH)2 -► С=О + Си-04- + 2Н,О
L1Z i НГ)/ 2 2
гт красн. осадок
кетоны окисляются только сильными окислите-
лями (K2Cr2O7 + H2SO4), причем происходит
разрыв С-С связей:
CH-
'S [О]
С=О + 3[О] ► СН-СООН + НСООН —► СО, + Н,О
VCH3 J
3. Полимеризация (только альдегиды):
✓--------------------------------
Присоединение по с=о
1. Восстановление Н2 х
СНЗЧ Ni, pt СНЗЧ
с=о+н,—► с-он
сн/ сн<
ацетон пропанол-2
кетон ----►вторичный спирт
альдегид --►первичный спирт
2. Присоединение спиртов (Н+ - кат.)
U -L. *П
ПзСч^ кат. Н /
С=о+ :О-С„Н- ----►H-C-C-H + :О-С,Н,------►
н/ I 2 5 3 \
н ос2н5 н
полуацеталь
ОС2Н5 (полукеталь)
---» H.C-C-H
3 \
ОС2Н5
ацеталь
4. Поликонденсация (с фенолом) — образуется
фенолформальдегидная смола
Реакции с участием а-Н-атома
т Г7°
Н3С-С —С - увеличение подвижности а-атома H
i R
.° .°
снз— с'* + ЗС12-► cci3-c'' + 3HCI
Н хлораль Н
химически очень активен
Получение:
1. Окисление спиртов (О2 над Си, К2Сг2О7,
КМпО4): о
СН-СН-ОН-> CH-— с" альдегиды легко
3 2 3 'м ОКИСЛЯЮТСЯ до кислот
этанол -» этаналь и
вторичный спирт -> кетон
2. Реакция Кучерова в присутствии солей Нд2+:
Н,С-С=СН + Н,0 -> сн,-с-сн,
J 2 о ц о
° о
НС^СН + Н2о -> сн3-с'
'н
3. Гидролиз дигалогенпроизводных:
CI 1 Na
сн3-с -н +
Iе' N‘l
он
он
,о
► снз-с'' + 2NaCI + н 2о
н
первичные -» альдегиды
вторичные -» кетоны
КАРБОНОВЫЕ КИСЛОТЫ
с„н2пог
предельные одно-
основные кислоты
основность = число карбоксильных групп -СООН
органические соединения, содержащие одну или
несколько карбоксильных групп: карбонил + гидроксил
о
II
с
'он
Номенклатура исторические тривиальные названия систематическая ИЮПАК углеводород + к-та
СН3СН2СООН пропионовая пропановая
СН3СН2СН,С00Н >3 £ « масляная бутановая
Превращения карбоксильной группы
1. как кислоты
функциональные
2R-COOH + Mg = Mg(RCOO)2 + H2t
R-COOH + NaOH^=RCOONa + H20
т.к. более сильные кислоты, чем Н2СО3
2R-COOH + СаСО3 = (RCOO)2Ca + Н2О +
2.
соД
о
R-C'
ОМ
3.
4.
5.
соли карбо
новых к-т
Структура: Взаимное влияние карбонила и гидроксила:
Химические свойства О смещение электронов в С=О группе
Определяются -уС вызывает смещение электронов в ОН
ОН и поляризует связь -О-Н
В результате <=£>
1. увеличение кислотности
о
О
R-C'
|он
О
’C-R
О РС15_
R-C- Н2о (NaOH)
им
О
-н2о r-c'
R-CP
‘о
ангидрид
о
r-c' + nh3
‘он
о
R-c'
а
О
-JL*I
- -н,о 1
onh4 *
этерификация (катализируется кислотами)
О
NH2
о
он
механизм
О
? + н2о
O-R1
хлор-
ангидриды
амид
сложный
эфир
.° 1
R-C5+ + н+
ОН
ОН
R— С+ '
ОН
ОН
R—С +
ОН .
R1
взаимодействие
протонов с 5-
О'н
R-cfoH
6-н
-н2о
R-C
и
О
-н+
о
R-C
OR1
Получение:
1. окисление спиртов, альдегидов
2. окисление предельных углеводородов (80-120°С,
NaOH, MnCI2 - катализатор, крекинг)
R-OH
Замещение Н- в а-положении
СН3СООН + С12 СН2С1СООН + HCI
хлоруксусная
н он
СН3СН2СООН + Вг2 -> СН3СНВгСООН + НВг С1^Сн2^Р
а-бромпропионовая о<^н
увеличение кислотности
он
К = 10-5 10-’° 10-,в
сильнее угольной кислоты
лакмус — красное окрашивание
2. Увеличение прочности С=О — связи.
Отсутствуют реакции присоединения.
Увеличение прочности С-ОН —
невозможно заместить HHal
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Ф Муравьиная (метановая) кислота — бесцветная жидкость с острым запахом, хорошо растворима а Н2О, довольно
сильная кислота, т.к. нет СН3-> группы
особенность — сочетание
карбоксильной группы с
атомом Н
СНООН Л Н,О + cot
H2S°4 2 р
получение: СО + NaOH Л HCOONa
® Уксусная (этановая) кислота — безводная — кристаллин. в=во (ледяная к-та), tTO = 17°С, смешивается с водой в
любых соотношениях. Нд2, н.
Получение: 1. НС=СН + Н2О -> СН3-СНО -> СН3-СООН
2. 2СН3СН2СН2СН3 + 5О2 -> 4СН3-СООН + 2Н2О
3. Уксуснокислое брожение (пищевой уксус)
® Пальмитиновая С15Н3,СООН, стеариновая С,7НКСООН — тв. в-ва, нерастворимые в Н2О. Смесь — стеарин. Входят
в состав жиров.
••° NH3 о
НО-С + Дд2о -----------НО-С' -
Н как альдегид
угольная
со2 + Н2о
® Олеиновая CH3(-CH2)7-CH=CH(-CH2)7-COOH способна присоединять Н2, Вг2 и др.
. изомеры
фумаровая малеиновая
акриловая к-т о-фталевая м-фталевая терефталевая
(изофталевая) к-та
СЛОЖНЫЕ ЭФИРЫ
функциональные производные карбоновых кислот — продукты
замещения ОН-групп кислоты на остаток спирта OR1. Брутто-
формула такая же, как и у карбоновых кислот!
О
r-c';
О—R
Физические свойства: летучие жидкости
(отсутствие водородных связей), мало
растворимы в воде, обладают приятным
запахом
Номенклатура:
Ф кислота + спирт
+ эфир
® спирт + кислотный
остаток
,о
сн3-с''
'осн3
уксуснометиловый
эфир
метилацетат
Химические свойства: наличие поляризованного атома кислорода активирует
связь C-O-R, и она легко разрывается даже под действием воды. Расщепление
сложных эфиров под действием воды называется гидролизом или омылением. Эта
реакция обратна реакции этерификации. Реакция катализируется протонами Н+ и
гидроксид-ионами ОН'. В присутствии щелочи реакция необратима (происходит
омыление — образование соли карбоновой кислоты).
, О гидролиз ' О
сн3-с'' +НОН СН3-с'' +С2Н5ОН
'ос2н5 этерификация ОН
СН3—С*' + NaOH ----► СН3-С' + С2Н5ОН
'ОС2Н5 O"Na+
Получение: 1) реакция этерификации — кислота + спирт (преимущественно первичный).
Реакция обратима, поэтому требуется избыток одного из реагентов или отгонка
эфира о
2) ангидрид орг. кислоты + спирт: сн3с'' о
О +СН3ОН ----► СН3-С'" +сн3соон
СН3СЧ ОСН3
о
Сложные эфиры, образованные Q
глицерином и высшими (жирными) сн -О-С1”
карбоновыми кислотами, называют | 2
глицеридами. о
Жиры: смесь этих эфиров сн-О-с’’
Животные жиры: твердые. I 4R2
Образованы преимущественно | о
предельными кислотами CH2-O-CZ#
С15Н3,СООН — пальмитиновой и 4R3
С^Н^СООН — стеариновой общая формула жиров
Растительные жиры или масла: жидкие, образованы
преимущественно непредельными кислотами:
С17НгаСООН — олеиновой и
С,7Н3,СООН — линолевой
Если остаток глицерида связан с 3 остатками кислот, то
образуется триацилглицерин — тристеарин.
Физические свойства: животные жиры — тв. в-ва без
определенной т-ры плавления, растительные — жидкие.
Плотность большинства жиров меньше плотности воды.
Жиры нерастворимы в воде, они выступают как поверх-
ностноактивные вещества (ПАВ), образуя стойкие эмуль-
сии (молоко).
Мыла: соли высокомолекулярных карбоновых
кислот (обычно стеариновой или
пальмитиновой)
Na — твердые, например, C,7H35COONa
К — жидкие, например, С)5Н31СООК.
Моющие свойства связаны со строением
молекул, с наличием неполярных и ионных
групп.
Мыла не пенятся в жесткой воде, т.к.
нерастворимы соли Са:
2RCOO' + Са2+ Ca(RCOO)2>L
Детергенты — синтетические моющие
средства (СМС)
Химические свойства: 1) гидролиз жиров:
,о сн2-о-с'' I 'С17Н35 СН2-°—H I . ° ЗЫаОН О сн-о-сч —► сн-о-н + зс)7н„-с' ^35 I ONa I -Р сн-о-н сн2-о-сч 2 2) Гидрогенизация растительных жиров — их превращение в твердые (маргарин) за счет присоединения Н2 к двойным связям (Ni-катализатор, 160- 200°С, 2-15 атм)
тристеарин
44
сл
АМИНЫ
производные NH3, в котором атомы водорода частично или полностью
замещены углеводородными радикалами (жирного, ароматического
рядов или смешанные)
Номенклатура:
r-nh2
первичный
R
'NH
R1'
вторичный
R. -R2
N
третичный
радикалы + амин
(по алфавиту первых букв названия
радикалов)
H,C-N-C2HS
| метил-этиламин
Н
Физические свойства: метиламин, диметиламин, триметиламин — газы
с резким запахом, остальные амины жирного
ряда — жидкости, растворимые в Н2О
Химические свойства обусловлены наличием неподеленной
электронной пары у атома азота:
(C6HS)3N < (CeHs)2NH < C6H5NH2 < NH3
Изменение
основности
NH < CH NH, < (СН ) NH > (СН ) N
О чЭ чЗ 4 чЗ чЗ
Химические свойства — напоминают свойства NH3. Амины реагируют:
1. С кислотами — образуют соли — нелетучие тв. ионные вещества
ch3nh2 + HCI
н
н3с-г-н
н
2. С алкилгалогенидами
по номенклатуре ИЮПАК:
сн3
Н3С-С-С2Н5 2-метил-2-бутиламин
nh2
АНИЛИН — ароматический амин. Жидкость, Т^. = 184°С, бесцветный,
на воздухе желтеет из-за окисления, плохо растворим в Н2О
8-
а-
8 $+ Основность мала. В молекуле увеличена электронная
1Н2 плотность в орто- и пара-положениях {как в феноле)
ХИМИЧЕСКИЕ СВОЙСТВА
CI -----► CH3NH2 + NaCI + Н2о
NaOH
(болев сильное
основание)
-ын2
с кислотами:
с
C6H5-NH2 + HCI -> [C6HS-NH3]+ Cl-
солянокислый анилин
или гидрохлорид анилина
CH3NH2 + CH3-I (CH3)2NH + HI -----►[(CH3)2NH2]T
смесь вторичных и
третичных аминов
Из третичных аминов м.б. получены четвертичные аммониевые соли:
(CH3)3N + CH3I^[(CH3)4N]+|-
3. С органическими кислотами и ангидридами о
СН СООН + CH3NH2 -> [СН СОО]-[СН NH ]+ -> сн3-с"
чЭ чЗ 4 чЗ чЗ чЗ- чЗ К
N—H
сн/
4. В водных растворах аминов щелочная среда:
ch3nh2 + h2o^ch3nh; + он-
+ н2о
с алкилгалогенидами:
nh2 н-n-сн3 ch3-,n-ch3
6
бромной водой:
Nh2 NH,
Вг
Вг
белый осадок
триброманилина
формальдегидом — образуется
анилинформальдегидная смола
с
Получение: Н.Н. Зинин, 1842 г. — восстановлением нитробензола с
использованием (NH4)2S или H2S:
»2 + 3H2S
2 + 2H2O + 3S
В настоящее время: каталитическое и электрохимическое восстанов-
ление нитробензола или его восстановление в кислой среде (Fe, Zn,
Sn)
АМИНОКИСЛОТЫ
органические дифункциональные соединения, в состав которых входят две функциональные
,о
группы — карбоксильная -с'' и амино -NH2
он
Реакции функциональных групп
КИСЛОТНЫЕ (см. карбоновые кислоты)
Ф NH2CH2COOH + NaOH -> NH2CH2COONa + Н20
или
NH3+CH2COO- + NaOH NH2CH2COONa + Н20
® 2NH2CH2COOH + CuO (NH2CH2COO)2Cu +
Н20
Ф 2NH2CH2COOH + Na2CO3 -> 2NH2CH2COONa +
Н20 + С02
„ -,° н+
® NH2-CH2-C4 + С2Н5ОН ^7-»
он
или в виде соли
о
NH2-CH2-c'? + Н20
'ос2н5
ОСНОВНЫЕ (см. амины)
®NH2CH2COOH + HCI -> [NH3+CH2COOH]Cr
солянокислая соль
т.о. это — органические амфотерные
соединения. Водный раствор практически
нейтрален
¥ Реакции функциональных групп
друг с другом
Для карбоновых кислот характерно образование амидов
О р 1
о г*** ч z м.б. остаток
R-С о1 вместо м
\,^п \ о аминокислоты
\ R2
R2
аминокислота + аминокислота -> дипетид
,о нч ,о
nh„-ch„-c'' + 'n-ch.-c'’'’ —►
[он н'| 'он н2°
о
___NH2-CH2-C\ о
\-сн2-с*
н' 'он
->трипептид -> полипептид
Реакция обратима — в присутствии
кислот и оснований — гидролиз
о
-с''
\н-
пептидная
связь
Капроновое волокно: е-аминокапроновая
кислота -> поликонденсация
Получение: из карбоновых кислот
Cl2 NH3
СН3СН2СООН -> СН3|СНСООН -> CH3CjHCOONH4 -> СН^НСООН
Cl Cl NH2
о
nH2N-(CH2)5 -с'
'он
капроновая смола —> нити
t° _
-(п-1)Н2О
О
-HN-(CH2)5-c''
п
г Белки: важнейшая составная часть живых организмов, входят в состав кожи, роговых покровов?
мышечной и нервной ткани
Высокомолекулярные соединения,
молекулярная масса —до нескольких
миллионов
Состав: определен через гидролиз (разбавл.
кислоты, ферменты)
Почти исключительно — а-аминокислоты («20),
связанные пептидными связями.
Белок — полипептид
Ф Последовательность аминокислот — первичная
структура
® образование водородных связей между
С=О и NH — спираль — вторичная структура
Качественная реакция : желтое окрашивание
с HNO3; нитрование
фенилаланина
„о
сн-сн-с
21 он
nh2
® взаимодействие NH2, ОН, СООН групп, не прини-
мающих участия в образовании пептидной связи —
третичная структура
нагрев до высокой температуры, радиоактивное
облучение, соли тяжелых металлов — вызывают
разрушение вторичной и третичной структур —
денатурацию
46
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КАТИОНЫ
Катион Воздействие или реактив Наблюдаемая реакция
Li+ Пламя Карминово-красное окрашивание
Na+ Пламя Желтое окрашивание
К+ Пламя Фиолетовое окрашивание
Са2+ Пламя Кирпично-красное окрашивание
Sr2+ Пламя Карминово-красное окрашивание
Ва2+ Пламя SO42" Желто-зеленое окрашивание Выпадение белого осадка, не раствори- мого в кислотах: Ва2+ + SO42" = ВаЗО4Ф
Си2+ Вода Гидратированные ионы Си2+ имеют голубую окраску
РЬ2+ S2" Выпадение черного осадка: РЬ2+ + S2- = РЬЗФ
Ад+ СГ Выпадение белого осадка; не раствори- мого в HNO3, но растворимого в конц. NH3 • Н2О: Ад+ + СГ = АдОФ
Fe2+ гексациано- феррат (III) калия (красная кровяная соль) K3[Fe(CN)6] Выпадение синего осадка: К+ + Fe2+ + [Fe(CN)6]3* = KFe[Fe(CN)6]i
Fe3+ 1) гексациано- феррат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 2) роданид-ион SCN- Выпадение синего осадка: К+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]i Появление ярко-красного окрашивания за счет образования комплексных ионов Fe(NSC)2+, Fe(NSC)2+ и др.
Al3+ щелочь (амфотерные свойства гид- роксида) Выпадение осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании
nh4+ щелочь, нагрев Запах аммиака: NH4+ + OhT -> ЫНзФ + Н2О
Н+ (кислая среда) Индикаторы: лакмус, метиловый оранжевый красное окрашивание красное окрашивание
47
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ
Анион Реактив Наблюдаемая реакция
SO42" Ва2+ Выпадение белого осадка, нерастворимого в кислотах: SO42" + Ва2+ = ВаЗО4Ф
NO3" 1) добавить КОНЦ. H2SO4 и Си, нагреть 2) смесь H2SO4 + FeSO4 Образование голубого раствора, содержащего ионы Си2+, выделение газа бурого цвета (NO2) Возникновение окраски сульфата нитрозо- железа (II) [Fe(H2O)sNO]2+. Окраска от фи- олетовой до коричневой (реакция «бурого кольца»)
РО43’ ионы Ag+ Выпадение светло-желтого осадка в нейтральной среде: ЗАд+ + РО43" = Ад3РО4Ф
СгО42" ионы Ва2+ Выпадение желтого осадка, не раствори- мого в уксусной кислоте, но растворимого в HCI: Ва2+ + СгО42" = ВаСгО4Ф
S2" ионы РЬ2+ Выпадение черного осадка: РЬ2+ + S2" = РЬЗФ
СО32" ионы Са2+ выпадение белого осадка, растворимого в кислотах: Са2+ + СО32" - СаСОзФ
СО2 известковая вода Са(ОН)2 Са(ОН)2 + СО2 -> СаСО3Ф + Н2О, СаСОз + СО2 + Н2О —> Са(НСОз)2 Выпадение белого осадка и его растворе- ние при пропускании СО2
SO32" ионы Н+ Появление характерного запаха SO2: 2Н+ + SO32" = Н2О + SO2t
F" ионы Са2+ Выпадение белого осадка: Са2+ + 2F" = CaF2i
СГ ионы Ад+ Выпадение белого осадка, не растворимо- го в HNO3, но растворимого в конц. NH3 • Н2О: Ад+ + СГ = АдС|Ф AgCI + 2(NH3 • Н2О) -> [Ag(NH3)2]+ + СГ + 2Н2О
Вг" ионы Ад+ Выпадение светло-желтого осадка, не растворимого в HNO3: Ад+ + Вг" = АдВгФ осадок темнеет на свету
Г ионы Ад+ Выпадение желтого осадка, не раствори- мого в HNO3 и NH3 конц.: Ад+ + Г = Ад|ф осадок темнеет на свету
ОН" (ще- лочная среда) индикаторы: лакмус фенолфталеин синее окрашивание малиновое окрашивание
48
КАЧЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Соединение Реактив Наблюдаемая реакция
Алканы Пламя Обычно определяют путем исключения Низшие алканы горят голубоватым пламенем
Алкены С=С 1) Бромная вода 2) р-р КМпО4 3) Горение Обесцвечивание раствора Обесцвечивание раствора, выпадение бурого осадка МпО2 Горят слегка желтоватым пламенем (частицы углерода)
Бензол Горение Обычно определяют путем исключения Горит коптящим пламенем
Фенол 1) Бромная вода 2) р-р Na2CO3 3) FeCI3 Обесцвечивание, выпадение белого осадка трибромфенола Выделение углекислого газа Фиолетовое окрашивание
Спирты 1) Na 2) Горение 3) Черная горячая прокаленная Си-проволока Выделение водорода Горят светлым голубоватым пламенем Восстановление красной окраски у прокаленной горячей медной проволоки
Многоатом- ные спирты Си(ОН)2 + NaOH Синее окрашивание — образование глицератов и др.
Амины 1) Лакмус 2) HHal В водном растворе — синее окрашивание Образуют соли с галогеноводородами — после выпаривания твердый осадок
Анилин 1) Бромная вода 2) HHal Обесцвечивание бромной воды, выпадение осадка триброманилина После упаривания твердый осадок — соль гидрогалогенида анилина
Альдегиды 1) Ag2O 2) Си(ОН)2 Реакция серебряного зеркала Выпадение красного осадка Си2О
Карбоновые кислоты Лакмус Красное окрашивание ! Муравьиная — реакция серебряного зеркала ! Олеиновая — обесцвечивание бромной воды
Крахмал Раствор 12 в KI или спиртовой раствор иода Синее окрашивание
Белки КОНЦ. HNO3 Желтое окрашивание, при добавлении щелочного раствора — оранжевое
49
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ В ХИМИИ
Обозна- чение Наименование величины Размер- ность
тв, т(СН4), тсн4 Масса вещества кг, г и про- изводные
тС| Абсолютная атомная масса атома Масса атома, выраженная в единицах массы кг, г и про- изводные; а.е.м.
1 Примечание: атомная единица массы (а.е.м.) — масса — части атома нуклида углерода 12С 1 а.е.м. = 1.667-10'27 кг
АГ(35С1) Относительная атомная масса атома данного нуклида — масса атома, отнесенная к 1/12 массы атома углерода 12С. Величина безразмер- ная
Ar(CI) Относительная атомная масса элемента — средняя масса атома элемента при его природном изотопном составе, отнесенная к 1/12 массы атома 12С. Величина безразмер- ная
Мг, МГ(СН4) Относительная молекулярная масса — отношение средней массы молекулы вещества к 1/12 массы атома 12С. Равна сумме относительных атомных масс атомов, сос- тавляющих молекулу. Величина безразмер- ная
П(О2). п(Сн4) Количество вещества 1 моль — такое количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов и др.), сколько атомов содержится в 12 г нуклида 12С (6.02 • 1023) моль
М(СН4), Мв Молярная масса — отношение массы вещества тв к количеству веществ пв mR мв = — пв кг/моль (г/моль) и производ- ные
Na Постоянная Авогадро Число частиц в одном моле: NA = 6.02 • 1023 Значение Na находится экспериментально. моль-1
N Число частиц (молекул, атомов, ионов) равно количеству вещества (числу молей), умноженному на постоянную Авогадро: N = п • Na частицы
V(B) Объем, занимаемый веществом В м3(в химии также литр, л (IO"3 м3))
Vm(B) Молярный объем Объем, который занимает 1 моль вещества. Равен отношению объема, занимаемого веществом, к количеству вещества: V(B) VM(B) = "(В) При нормальных условиях объем, который занимает 1 моль идеального газа, равен 22,4 л М3/МОЛЬ л/моль и производ- ные (см3/моль и ДР)
50
Обозна- чение Наименование величины Размер- ность
Рв Плотность вещества. Отношение массы вещества к занимаемому им объему тв р = V VB кг/м3 и производ- ные (г/см3 и др.)
D Относительная плотность газа показывает, во сколько раз объем одного газа легче (тяжелее) такого же объема другого, т.е. во сколько раз плотность одного газа больше (меньше) плотности другого. Из закона Авогадро (в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул) следует: Pi М^/22.4 М1 D р2 М2/22.4 “ М2 Величина безраз- мерная
wB Массовая доля вещества В в смеси. Отношение массы вещества В к массе всей смеси. Для смеси из трех веществ А, В и С: mR W _ В в гпд + тв + тс Для раствора: mR wb = - В тВ трастворителя Массовую долю часто выражают в процентах Величина безраз- мерная
хв Мольная доля вещества В в смеси. Отношение количества вещества В (числа его молей) к суммарному количеству (числу молей) всех веществ в смеси. Для смеси трех веществ: По х = в В Пд + По + пг А О L, Величина безраз- мерная
Фв Объемная доля вещества В в смеси. Отношение объема, занимаемого веществом В, к объему всей смеси: VB фо = “ vA + vB + vc Величина безраз- мерная
хв; [В] Молярная концентрация Отношение числа молей пв вещества В, содержащихся в растворе объемом V, к объему раствора (в дм3 или литрах): х Хв V раствора моль/л
51
РЕШЕНИЕ 25 ТИПОВЫХ РАСЧЕТНЫХ ЗАДАЧ
Общие рекомендации при решении химических задач
Перед тем, как приступить к решению задачи, после внимательного прочтения
условия следует:
1. Все физические величины, о которых говорится в условии, выразить в одинако-
вых единицах (например, массы всех реагентов — в килограммах или граммах,
объемы всех газов — в литрах или миллилитрах и т.д.).
2. Если в условии задачи имеются данные об объемах газов, отнесенных к усло-
виям, не соответствующим нормальным (105 Па, 0°С), то, используя уравнение
Р V Р V
== , следует пересчитать объем газа на нормальные условия.
Т1 Т2
3. Во многих случаях целесообразно найти количества реагирующих веществ и
продуктов реакции (в молях).
4. Если при решении задачи необходимо учесть уравнение протекающей реакции,
то при его составлении необходимо найти коэффициенты перед формулами
веществ, входящих в уравнение реакции.
5. Если в условии задачи нет указаний о численном значении величины, характе-
ризующей исходную систему, то часто целесообразно допустить, что взято 100 г
раствора, 1 л газовой смеси и т.д.
6. Удобно неизвестное, о котором речь идет в условии задачи, выразить через х.
Далее на основании химического уравнения составляют алгебраическое урав-
нение и, решая его, находят х. Если неизвестных два, то их обозначают через х
и у, записывают систему из двух алгебраических уравнений. Решение системы
уравнений позволяет найти х и у.
7. При решении задач атомные массы всех химических элементов, кроме Ar(CI),
округляют до целого значения. Для Ar(CI) принимают значение 35,5.
1. Определение относительной молекуляр-
ной массы Мг
Условие-. Какова относительная молекулярная
масса Мг нитробензола СбН5МО2? Какова
молекулярная масса этого вещества в а.е.м.?
Решение:
Mr = 6Ar(C) + 5Ar(H) + Ar(N) + 2АГ(О) = 6x12 +
5x1 + 14 + 2x16 = 123
Для нахождения массы молекулы нитробензола
в а.е.м. надо найденное значение умножить на
1 а.е.м.. Получаем 123 а.е.м.
Ответ: 123; 123 а.е.м.
2. Определение массы атома в граммах
Условие: Какова масса в граммах 1 атома 1311?
Решение: Обозначим массу 1 атома 1311 через
х. Составим запись: 1 моль атомов 1311 содер-
жит 6,02-1023 атомов, их масса 131 г/моль 1
131
атом I имеет массу х г.
Составив пропорцию и решив ее, находим:
1 • 131 __
X =------= 2.18 - 10~22 г
6,02- 1023
Ответ: 2,18 • 10~22 г.
3. Определение числа молекул в порции
вещества
Условие: Сколько молекул воды содержится в 1
капле воды массой 0,03 г?
Решение: Обозначим число молекул воды в 1
капле через х. Составляем запись:
23
1 моль воды, масса 18 г, содержит 6.02 • 10
молекул,
масса 0.03 г — х молекул
Составив пропорцию и решив ее, находим:
18 _ 6,02- 1023 0,03-6,02-1023 „
0,03 X X ------—-----= 1021 молекул
Ответ: 1021 молекул
4. Определение массовой доли элемента в
соединении
Условие: Какова массовая доля фосфора в
фосфате кальция Саз(РОд)2?
Решение:
2 ' Аг(Р>
3 • Ar(Ca) 4-SjA^pi + 4Аг(0))
2-31
----------------- = 0.2 или 204-
3-40 + 2(31 +4-16)
52
Ответ: w = 0.2 или 20%
5. Определение молярной массы М
Условие: Какова молярная масса вещества, если
масса 2.5 моль этого вещества равна 250 г?
Решение: Из условия следует, что п = 2.5 моль,
a m = 250 г.
(YI 250
MR = -НЬ = — = 100 г/моль
° П 2.Э
Ответ: 100 г/моль
6. Определение массового отношения
элементов в соединении
Условие: Каково массовое отношение углерода,
водорода и кислорода в глюкозе СбН12Об?
Решение: Отношение масс элементов в этом
соединении равно:
тс:тн:то = 6 АГ(С) : 12 Аг<н) : 6 АГ(О) = 6’12:
12-1 : 6-16 = 6:1:8
Ответ: тс:тн:то =6:1:8
7. Определение объема, который занимает
порция газа при нормальных условиях
(н.у.)
Условие: Какой объем (н.у.) занимают 66 г
СО2?
Решение: Обозначим объем, который занимает
66 г СО2, через х. Составим запись:
1 моль СО2 масса 44 г — объем 22.4 л
масса 66 г — объем х л
Решение пропорции позволяет найти х:
Ответ: 33.6 л.
8. Определение теплового эффекта
реакции
Условие: Молярная теплота сгорания угля на
воздухе 393.5 кДж/моль. Сколько теплоты
выделится при полном сгорании 1 кг угля?
Решение: Из условия следует, что масса сго-
ревшего угля 1 кг, т.е. 1000 г. Обозначим
количество теплоты, выделяющееся при сгора-
нии 1000 г угля через х, и составляем запись:
При сгорании 1 моль угля, масса 12 г,
выделяется 393.5 кДж теплоты
При сгорании 1000 г угля, выделяется х кДж
теплоты
Решение пропорции позволяет найти х:
1ппп•яаяч
х = J = 32800 кДж или 32.8 МДж
Ответ: 32.8 МДж
9. Определение максимального выхода
продукта реакции
Условие: Сколько максимально литров (н.у.)
водорода можно получить, используя 45.5 г
цинка и избыток соляной кислоты?
Решение: Запишем уравнение протекающей
реакции. Внизу, под формулами соответствую-
щих веществ, записываем их молярную массу
(под знаком Zn) и молярный объем (под фор-
мулой Н2). Сверху записываем массы прореа-
гировавшего цинка и объем выделившегося
водорода (обозначим его через х):
45.5 г х л
Zn + 2HCI = ZnCI2 + Н2Т
65 г/моль 22.4 л/моль
Из пропорции:
45,5 _ _х_
65 “ 22,4
находим, что х = 15.7 л.
Ответ: 15.7 л.
10. Определение реального выхода
продукта реакции
Условие: При прокаливании 15,8 г пермангана-
та калия КМпО4 получено 0,896 л (н.у.) кисло-
рода. Каков выход кислорода в данном случае?
Решение: Записываем уравнение реакции
15,8 г V
2КМпОд = К2МпОд + МпО2 + О2
2-158 г/моль 22,4 л/моль
При максимальном (100%-ном) выходе объем
выделившегося кислорода V можно найти из
пропорции:
15,8 г V
2-158 ~ 22,4
V = 1.12 Л.
Так как, в соответствии с данными условия,
получено 0,896 л кислорода, то, следовательно,
выход кислорода равен:
0.896
q = 1 = 0.8 или 80%
Ответ: 80%.
11. Определение выхода продукта по
стехиометрическим соотношениям
Условие: Сколько граммов азотной кислоты
HNO3 максимально можно получить из 44.8 л
(н.у.) азота?
Решение: С учетом того, что в одной молекуле
HNO3 содержится 1 атом азота, составляем
запись:
44,8 х
N2 -> 2HNO3
22,4 2x63
Обозначив массу образующейся при 100%-ном
выходе азотной кислоты через х, записываем
пропорцию:
44,8 л _ х
22,4 л/моль 2 • 63 г/моль
Из нее находим, что
Ответ: 252 г.
12. Определение содержания основного
компонента (или содержания примеси) в
исходном веществе
Условие: Каково содержание (в процентах)
53
СаСОз в образце известняка, при длительном
прокаливании 400 г которого получено 78,4 л
СО2 (н.у.)?
Решение: Запишем уравнение реакции:
х г 78,4 л
СаСОз — СаО + СО2
100 г/моль 22,4 л/моль
Обозначим через х г массу СаСОз, разложение
которой приводит к получению 78,4 л СО2. Из
соответствующей пропорции находим, что
78.4-100
х = --------- = 350 г
22.4
Таким образом, содержание СаСОз в исходном
образце составляет:
4 = ~400~ = °’875 ИЛИ 875%
Примесей в исходном образце 100 - 87,5 =
12,5%
Ответ: 87,5%
13. Определение выхода реакции, когда
одно из исходных веществ взято в избытке.
Условие: Сколько граммов поваренной соли
NaCI можно получить, если смешать два рас-
твора, один из которых содержит 29,2 г HCI, а
другой 44 г NaOH?
Решение: Записываем уравнение протекающей
реакции:
29,2 44
HCI + NaOH = NaCI + Н2О
36,5 40
г/моль г/моль
29 2
Находим, что в случае HCI отношение = 0.8
моль меньше, чем в случае NaOH = 1,1 моль.
Так как в данной реакции вещества реагируют в
равномолярных количествах (на 1 моль HCI
расходуется 1 моль NaOH), то в данном случае
NaOH взят в избытке. Поэтому расчет массы
образовавшегося NaCI ведем по массе израсхо-
дованного полностью HCI:
29,2 х г
HCI + NaOH = NaCI + Н2О
36,5 г/моль 58,5 г/моль
Находим, что:
29.2-58.5 „„ „
х = ---^7— = 46,8 г
об.О
Массу образующегося NaCI можно найти также,
учитывая, что израсходовано 0,8 моль HCI и,
следовательно, образуется также 0,8 моль
NaCI. Тогда масса NaCI равна:
0,8 МйаС1 ~ 46,8 г
Ответ: 46,8 г.
14. Определение состава газовой смеси (в
объемных процентах)
Условие: 20 л (н.у.) аммиака пропустили через
нагретую до 350°С трубку с железным катали-
затором. Объем полученной газовой смеси
(н.у.) равен 25 л. Каков состав полученной
газовой смеси (в объемных процентах)?
Решение: При пропускании аммиака над нагре-
тым катализатором протекает реакция:
2NH3 = N2 + ЗН2
2 л 1л 3 л
Прирост объема AV при разложении 2 л аммиа-
ка равен 1 + 3 - 2 = 2 л. Обозначив объем
разложившегося аммиака через х л, и учтя, что
увеличение объема составило 25 - 20 = 5 л,
можно записать:
Разложение 2 л аммиака приводит к возраста-
нию объема на 2 л
Разложение х л аммиака приводит к возраста-
нию объема на 5 л
Из пропорции
2 2 5-2
— = — находим, ЧТО* = —— = 5 л
Таким образом, в смеси осталось 20 - 5 л
аммиака. Учитывая уравнение реакции, нахо-
дим объем образовавшегося при разложении
5л аммиака водорода b и азота а:
5 л а b
2NH3 = N2 + ЗН2
2 л 1л 3 л
1-5 3-5
а =—-—=2.5 л Ь=—— = 7.5 л
В смеси объемное содержание аммиака 15/25
= 0,6 или 60%, объемное содержание азота
2.5/25 = 0,1 или 10%, объемное содержание
водорода 7,5/25 = 0,3 или 30%.
Ответ: N2 10%, Н2 30%, NH3 60%.
15. Определение объема газа, расходуемого
на проведение реакции с другими газами
Условие: Какой минимальный объем кислорода,
содержащего 10 объемн. % озона, необходим
для полного сжигания 4 л пропана С3Н8?
Решение: Составляем уравнение реакции
горения пропана в атмосфере кислорода:
4 л х л
СэН8 + 5О2 = ЗСО2 + 4Н2О
1л 5 л
Для полного сжигания 4 л пропана требуется х
5 • 4
= —j— = 20 л О2. При взаимодействии озона с
пропаном также образуется СО2 и вода. Поэто-
му можно принять, что в реакцию с пропаном
вступает смесь, каждый литр которой содержит
0,9 л О2 и 0,1 л О3. При превращении в кисло-
род О2 озона объем увеличивается в 1,5 раза:
2О3 = ЗО2
При этом из 0,1 л О3 образуется 0,15 л О2.
Таким образом, 1 л исходной смеси кислорода
и озона эквивалентен 0,9 + 0,15 = 1,05 л О2.
Поэтому для полного сгорания 4 л пропана
необходимо V = = 19,05 л кислорода,
содержащего 10 объемн. % озона.
Ответ: 19,05 л.
16. Определение молекулярной формулы
вещества по относительной плотности его
паров
54
Условие: Относительная плотность паров
углеводорода по воздуху 2,69. Массовая доля
водорода в соединении 7,69%. Какова молеку-
лярная формула углеводорода?
Решение: Обозначим относительную молеку-
лярную массу углеводорода как Мг. Из соотно-
шений мг мг
----!' = 2.69
мг(воздух) 29
находим, что Мг = 29 • 2,69 = 78. Так как масса
молекулы в а.е.м. численно равна относитель-
ной молекулярной массе, то молекулярная
масса углеводорода 78 а.е.м.
На водород в углеводороде приходится
78 • 0,0769 = 6 а.е.м. Следовательно, в составе
6 oil
молекулы атомов водорода: — = 6. На угле-
род приходится 78 - 6 = 72 а.е.м. Число ато-
мов С в молекуле равно: у|- = 6. Таким обра-
зом, формула углеводорода СбНб (бензол).
Ответ: СбН6.
17. Определение состава газовой смеси
Условие: Относительная плотность 30 л смеси
метана СН4 и азота N2 по гелию равна 5.
Сколько литров метана и азота взято для
приготовления смеси?
Решение: Сначала находим среднюю относи-
тельную молекулярную массу смеси М г.
Мг М.
= -д2- = 5, И М=4-5 = 20
мг(Не) 4 г
Пусть метана взято х л, тогда азота взято (30 -
х) л. Масса 1 л метана 16/22,4 г, а масса 1 л
азота — 28/22,4 г. Масса х л метана
(16/22,4) -х г, а масса (20 - х) л азота равна
(28/22,4) • (30 - х) г. Масса 1 л смеси равна
20/22,4 г, а масса
Очевидно, что
30 л смеси — (20/22,4) • 30 г.
28(30-х) 20 • 30
22~4 ~ 22.4
16Х
22.4
Решая уравнение относительно х, находим, что х
= 20. Таким образом, для приготовления смеси
было взято 20 л метана и 30 - 20 = 10 л азота.
Ответ: 20 л метана и 10 л азота.
18. Определение состава солей в растворе
Условие: В растворе смешали 9,8 г H2SO4 и
6,5 г NaOH. Какие соли и в каких количествах
образовались?
Решение: Примем, что смешивание проходило
так, что раствор NaOH медленно вливали в
раствор серной кислоты. Первоначально в
кислой среде протекала реакция:
NaOH + H2SO4 = NaHSO4 + Н2О
В исходном растворе было 7^- = 0,1 моль
У О
серной кислоты. Когда в раствор ввели 4,0 г
NaOH (т.е. 0,1 моль NaOH), то серная кислота
прореагировала полностью (как видно из
уравнения реакции, при реакции молярное
отношение реагентов 1:1). В результате обра-
зовалось 0,1 моль кислой соли NaHS04.
При последующем добавлении в раствор
оставшихся 6,5 - 4 = 2,5 г NaOH, т.е. 0,0625
моль, протекает реакция образования из кис-
лой соли средней:
NaHSO4 + NaOH = Na2SO4 + Н2О
С 0,0625 моль NaOH прореагирует 0,0625 моль
NaHSO4 и образуется 0,0625 моль средней
соли Na2SO4. В результате в растворе будет
находиться 0,0625 моль Na2SO4 и 0,1 - 0,0625
= 0,0375 моль NaHSO4.
Ответ: 0,0625 моль Na2SO4 и 0,0375 моль
NaHSO4
19 -22. Приготовление раствора с заданной
массовой долей растворенного вещества
а) Условие: Сколько граммов сахарозы надо
растворить в 250 г воды, чтобы получить
раствор с массовой долей сахарозы 0,3 (30%)?
Решение: Обозначим массу использованной
сахарозы через х г. Масса раствора равна
(250+х) г и, следовательно
——-----= о.з
250 + х .
Решая это уравнение, находим, что х = 107 г.
Ответ: 107 г.
б) Условие: Сколько граммов медного купороса
CuSO4 • 5Н2О надо добавить к 300 г 2%-го
раствора сульфата меди, чтобы получить 5%-
ный раствор?
Решение: Отметим, что в 300 г 2%-го раствора
содержание CuSO4 равно 0,02 • 300 = 6 г.
Обозначим теперь массу добавляемого в
раствор CuSO4 • 5Н2О через х. Так как молярная
масса CuSO4-5H2O равна 250, а молярная
масса CuSO4 — 160, то массовая доля вз-
водного CuSO4 в CuSO4 • 5Н2О равна =
0,64. Следовательно, в х г медного купороса
содержание безводного CuSO4 составляет
0,64х. С учетом этого можно составить
уравнение:
6 + 0.64х
--------= О 05
300 + х
Решение этого уравнения позволяет наити, что
х = 15,25 г.
Отвег. 15,25 г.
в) Условие: Сколько миллилитров воды нужно
добавить к 100 мл 30%-го раствора соляной
кислоты с плотностью 1,15 г/мл, чтобы
получить раствор с массовой долей НО 5%?
Решение: Учитывая, что плотность раствора
1,15 г/мл, находим массу исходного раствора:
m = pV = 1,15-100 = 115 г
Исходный раствор 30%-ный, следовательно, в
нем содержится 0,3 • 115 = 34.5 г НО.
Если массу добавляемой воды обозначить
через х г, то можно записать уравнение:
34,5
115 + х
Отсюда х = 575 г.
= 0,05
55
Ответ: 575 г.
г) Условие: Сколько граммов ВаО надо доба-
вить к 100 г воды, чтобы получить 5%-ный
раствор?
Решение: При внесении ВаО в воду протекает
реакция:
х у
ВаО + Н2О = Ва(ОН)2
153 171
Обозначим массу ВаО, который надо добавить,
через х. Тогда массу образующегося в воде
Ва(ОН)2 у можно выразить как
у= 1-12*
С учетом того, что из х г ВаО образуется
1,12хг Ва(ОН)2, можно записать уравнение:
1.12х _
—.....— = 0.05
100 + х
Решение уравнения дает х = 4,67 г.
Ответ: 4,67 г.
23. Приготовление раствора с заданной
молярной концентрацией
Условие: Сколько граммов сульфата натрия
Na2SO4 • 10Н2О необходимо для приготовления
0,5 л раствора с молярной концентрацией
0,02 моль/л?
Решение: Приготовляемый раствор должен
содержать 0,5 • 0,02 = 0,01 моль вещества, т.е.
0,01 моль Na2SO4. 0,01 моль Na2SO4 содержит-
ся в 0.01 моль Na2SO4* ЮН20. Следовательно,
для приготовления раствора нужно использовать
m = 0,01 юн2О) = 0,01 *322 = 3,22 г
Ответ: 3,22 г.
24. Определение формулы органического
вещества по данным о массе продуктов
реакции
Условие: При полном сгорании 6,0 г органичес-
кого вещества получено 8,8 г СОг и 3.6 г воды.
Плотность паров органического вещества по
водороду равна 30. Какова молекулярная
формула вещества?
Решение: Сначала находим молекулярную
массу вещества. Она равна Мг = 2 • 30 = 60.
Порция вещества массой 6,0 г содержит
Аг(С) 12
углерода 8.8 —--'-= 8.8 — = 2.4 г
мг(СОЗ 44
2А^#н)
Водорода она содержит з.б——~
Mr(Hi>)
= 2~ ..= 0.4 г.
18
0,4 + 2,4 < 6,0 и, следовательно в состав
вещества входит также кислород. Его в порции
вещества массой 6,0 г то = 6,0 - 2,4 - 0,4
= 3,2 г.
В молекуле вещества отношение чисел атомов
С, Н и О равно:
24 04 32
пС:пН:пО = 77-= -Г = ТГ = 0,2 : 0,4 : 0,2 = 1 : 2 : 1
Простейшая формула вещества СНгО. Значе-
ние Мг для такой формулы равно Мг = 12 + 2 • 1
+ 16 = 30. Так как это значение в два раза
меньше Мг вещества (60:30), то, следователь-
но, молярная формула вещества будет СгЩОг-
Такой формуле отвечает формула уксусной
кислоты СН3СООН и метилового эфира
муравьиной кислоты НСООСН3.
Ответ: формула вещества С2Н4О2.
25. Определение молекулярной формулы
органического вещества по данным о
продукте реакции
Условие: При обработке 14,8 г одноосновной
карбоновой кислоты избытком цинка получено
2,24 л водорода. Какова молекулярная форму-
ла кислоты?
Решение: Получено 2,24:22,4 = 0,1 моль Н2.
Так как кислота одноосновная и из каждой ее
молекулы металл вытесняет только 1 атом
водорода, то, следовательно, кислоты исполь-
зовано 0,1 - 2 = 0,2 моль. Молярная масса
кислоты равна = 74 г/моль.
В общем виде формулу одноосновной кислоты
можно записать как CnH2n+iCOOH, и значение
Мг = 12-п + (2п + 1)’ 1 + 12 + 2« 16 + 1. Для
определения п составляем уравнение:
12 • п + (2п + 1) • 1 + 12 + 2 • 16 + 1 = 74
Решая это уравнение, находим, что п = 2, и
молекулярная формула кислоты С2Н5СООН
(пропионовая кислота).
Ответ: С2Н5СООН
автор задач С. С. Бердоносов
56
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ.........................................3
ХИМИЧЕСКИЙ ЭЛЕМЕНТ..................................4
СТРОЕНИЕ АТОМА......................................5
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.....................6
ХИМИЧЕСКАЯ СВЯЗЬ....................................7
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ.............................8
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.........................9
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ............ 10
РАСТВОРЫ.......................................... 11
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ..................... 12
ЭЛЕКТРОЛИЗ........................................ 13
ОКСИДЫ............................................ 14
ОСНОВАНИЯ......................................... 15
КИСЛОТЫ........................................... 16
СОЛИ.............................................. 17
ГИДРОЛИЗ СОЛЕЙ.................................... 18
ПОДГРУППА la.ЩЕЛОЧНЫЕ МЕТАЛЛЫ Li, Na, К, Rb, Cs... 19
ПОДГРУППА Па И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ Са, Sr, Ва.20
ПОДГРУППА Illa. АЛЮМИНИЙ AI........................21
ПОДГРУППА VIII6. ЖЕЛЕЗО Fe.........................22
ВОДОРОД Н..........................................23
ПОДГРУППА Vila. ГАЛОГЕНЫ F, Cl, Вг, 1..............24
ПОДГРУППА Vila. ХЛОР CI............................25
ПОДГРУППА Via,О, S, Se, Те.........................26
ПОДГРУППА Via.КИСЛОРОД О...........................27
ВОДА (ОКСИД ВОДОРОДА) Н20..........................28
ПОДГРУППА V.A3OT N.................................29
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА.......................30
ПОДГРУППА Va. N, Р, As, Sb, Bi. ФОСФОР Р...........31
ПОДГРУППА IVa.УГЛЕРОД С............................32
ПОДГРУППА IVa.С, Si, Ge, Sn, Pb. КРЕМНИЙ Si........33
ПОДГРУППА VI6.XPOM Cr..............................34
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ, ПАРАФИНЫ).........35
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ, ОЛЕФИНЫ)........36
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ..............................37
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ).................38
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ).................39
СПИРТЫ.............................................40
ФЕНОЛЫ.............................................41
АЛЬДЕГИДЫ И КЕТОНЫ.................................42
КАРБОНОВЫЕ КИСЛОТЫ.................................43
СЛОЖНЫЕ КЕТОНЫ.....................................44
АМИНЫ..............................................45
АМИНОКИСЛОТЫ.......................................46
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КАТИОНЫ....................47
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ.....................48
кА-ЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.......49
г/ЗИЧЕСКИЕ ВЕЛИЧИНЫ В ХИМИИ....................... 50
-Е_ЕЧИЕ 25 ТИПОВЫХ РАСЧЕТНЫХ ЗАДАЧ................ 52
57
Стахеев Александр Юрьевич
Вся химия в 50 таблицах
Под ред. С. С. Бердоносова
Оригинал-макет изготовлен П. С. Бердоносовым
Лицензия № 030689 от 11 апреля 1996 г.
Изд. № ФЗО(ОЗ). Подписано в печать 30.03.98.
Формат 60 х 847s Бумага офсетная. Объем 8,0 п. л.
Тираж 10 000 экз. Заказ № 2263. Цена договорная.
Московский институт развития образовательных систем
109004, Москва, Нижняя Радищевская ул., д. 10.
Контактные телефоны: 915-69-57,915-72-55.
Содействие развитию образовательных систем и технологий
107082, Москва, ул. Бакунинская, д. 96/98.
По вопросам реализации обращаться:
— фирма «Скрин»
Тел. (095) 350-33-27
Тел./факс (095) 350-41-98
Отпечатано с готового оригинал-макета
в Смоленской областной ордена «Знак Почета»
типографии им. Смирнова.
214000, г. Смоленск, проспект им. Ю. Гагарина, д. 2.
Тел.: 3-01-60, 3-46-20, 3-46-05.
ПЕРИНУ ГРУППЫ ЭЛЕМЕНТОВ
а 1 б a II 6 a III 6 а IV б а V б a VI 6 a VII 6 a VIII 6
1 IHI H ’ ШТМ±Т 1p lOQOPOfl l He 2 *,00260712 2 ГЕЛИЙ S 2 Атомная Распред масса Атом и ь ful~h] **-* 1 21 23l,078»t1 32 5f38d’7*2 а УРАН 2 еление Распрз й номер eделение
2 Li 3 Be 4 9,01218x1 3 2 БЕРИЛЛИЙ 2s 2 В 5 ЙГ С 6 «.0П±1 2$72р2 4 УГЛЕРОД 2 N 7 2*22рЗ 5 АШ 2 О 8 15-9394‘3 2*22p<8 КИСЛОРОД 2 p 3 11,936403:1 , ФТОР 2 Ne ’° X’ — 5
3 Na 11 22,01377:1 ' НАТРИЙ 2 Mg 12 S' -1 Al 13 26.3S154H ’ АЛЮМИИИЙ ° 2 Si 14 21.015513 з,2зРа j КРЕМНИЙ 2 р 15 зо.пт.г Э12 ’ ФОСФОР 2 s 16 329,959 3,IJp.« СГР1 2 Cl 17 ЭМ53*Л , „ 7 3sj3p5 в MOP 2 Ar 18 33,34111 . « 4** 30® о АРГОН 2 электронов электронов по эвстраивающийися по оболочкам и ближайшим подоболочкам
4 К 19, »««*-’ 4.» КЯЛМЙ г Ca *«”=* «• s КАЛЬЦИЙ 2 ,!l Sc J2 Т. 10 . , 47,В8»3 8 М*4»’ ’ и 2 ТИТАН г23 V V э^, 1 и9*'5’’ 2 ВАНАДИЙ ,24 Cr 1 5WX‘ 2 25 Mn ’2 ММ.» 54'9Ш!’ 2 МАРГАНЕЦ a26 Fe 14 > SS347*3 В 36е**2 -L?--- 2 ЖЕЛЕЗО г27 Со 1-“’ S г28 Ni 1— Х2
29 Си г— Л Zn * 3d’04«a B5,39t2 2 UHNK Ga 31 з 60,723:4 „ , ’J ГАЛЛИЙ ’ “ 2 Ge 32 4 W 4.14Р11 ГЕРМАНИЙ 3 As 33, ’’•’Я’1' 4,»4РЗ '5 МЫШЬЯК 2 Se 34 . 71,95*3 . 2Л , « <>24p4 9 СЕЛЕН 2 Вг 35 7 X’ — 1 Kr 36. iwn , ,, , ’J 4e*4p5 8 КРИЛГОИ 2
5 Rb 31 - •Mind » РУБИДИЙ 2 Sr 11. 17Д2И IS СТРОНЦИЙ 1 39 V 2 i“~ “S ,« Zr 10 — « , , B1,22<t2 2 4,1 * ЦИРКОНИЙ -4' Nb ,/2 Mo 2 МОЛИБДЕН ?3 Tc 14TS5.2 »W» 2 ТЕ1ИЕЦИИ .« Ru «4dl5„ Ю1.0712 2 РГЕЕНИЙ Rh 14а«5«< '02305511 2 РОЛМЙ .« Pd 1 46Ю5.0 ЮБ.42И 2 ПАЛЛАДИЙ
147 Ag L»S.W’KRt’ 2 СЕРЕБРО Л Cd K'0,,2 "2-,h' 2 кадмий In 49 3 18 IW,l2t| , , л ИНДИЙ 5*’6’’ ! Sn 50 < X7 1 Sb 51 л I2WJ . IK , 18 5s25o3 9 СУРЬМА 2 Те 52 a I27,BO±3 ' 5s*5p* 9 ТЕЛЛУР 2 I 53, ! Xe 54 a s —I
6 Cs ss; 132,Э054±1 H ' 9*1 fl М3 ИИ 2 Ba 561 127,1111 В БАРИЙ В,г ’ ?57 La* 1м<ЫВМ0И1 2 ИАШИ и’72 Hf * ' л 17в,4аи 8 5da8s* 2 ГАФНИЙ s” Ta 2 ТАНТАЛ ,P w e , IB],Bin 8 5048»2 2 ВОЛЬФРАМ л79 Re w , , ИБД07И a Sd5^*2 2 РЕНИИ 476 Os loa.6.1 2 ОСМИЙ ,i77 Ir 1^641 ”1И13. 2 ИРНОИЙ J71 Pt 2 ПЛАТИНА
»79 Au Ш ISBJBBBtl 9 5d»oe*i , 2 ЗОЛОТО -I90 Hg M0'5>i3 2 РТУТЬ T1 ",i ТАЛЛИЙ 2 РЬ 207'2*’ 6.2вр2 « C6HWEU 2 Bi 83« 2H.H04H w SKCMVT es2Sl>3 2 Po 84» »V«' в126О4« ПОЛОНИЙ 2 At 85-j 2"9-9вП .416,1 ’’ /СТАТ 2 Rn “4 sr •
7 Fr 87,? 222,0117 , w 7i’ a ФРАНЦИЙ 2 Ra 88 i 221,0251 =g _ 7*2 e РАДИЙ 2 Г9 Ac** 32 18 «-I, > 227,0276 9 86’7*2 2 АКТИНИЙ й’04 Db «•« ’ дтьвмй J105 JI » 6.37,1 12,21 2 ЖШЗГИЙ s«Rf ш , 12831 g 6d4/** 2 ГЕЗЕРМЩН sBh ? «.» 2 HPNN 4W8Hn To . , 17151 a 6d«7s2 B 2 ХДММЙ з1 109 Mt “в , 2 11 2 “ ” МЕЙЕЗЕНЙ ii 110 32 32 i 1 ’? 6d’M 1 1 2
* л а н т ;i н о и д ы
Се 581 U 0,12*1 АГ'бб'б»! в ЦЕЛИЙ 2 Pr 581 UMinil 4I36$2 g ЛРАЯ00ИИ 2 Nd”? UU*!3 22 4Г«в*г e KEOQMN 2 Pm6’i ю.жггв 2.1 406*2 nPOMUHH 2 Smi!i 150,J 84 2.1 406*2 в САМАРИЙ 2 Eu!3i 414s? ” ЕВРОПМЙ 2 Gd64? 157,2513 2,; 4lz5d’6s2 8 ГАЛОЛИЯИЙ 2 Tb“i 151,92544 27 41’641 1 ГЕРЕИЙ 2 Dv64 162,5013 2S 4t»6.1 в ОЯСЛГОЗН, 2 Ho8’? 15*530411 21 4f”6*2 (ОПЬМИЙ 2 Er681 16T,2it3 30 41«6*2 " ЭРЕИЙ 2 Tm89i 168,9342:1 2’ ««б,! . ППИЙ 2 Yb70? 173,04x3 32 4lu6s2 в ИШРИЙ 2 Lu 71 i 174,957x1 32 4|X5d’6s2 e ЛЮЦЦРР 2
*★ актиноиды
Th80s nZ03ll*l 32 6d27»2 g lUPVi 2 Pa 3’J 23W3M 32 5l26d’7s2 ПРШШШ 2 U 82J 23I.02I9M 32 5l36d’7*2 g УРАН 2 Np’M 237,0412 32 508d’7s2 g НЕПТУНИЙ 2 Pu 94J 244,0842 32 S07*2 в wmaft 2 Am18' 243,0614 32 5f7Ts2 АМ1РИТ1ИЙ 2 Cm88! 247,0101 32 sr'ea1?»2 5 1SHI 2 Bk"i 247.0703 32 506d’7s2 ’g НРКЛИ 2 Cf 98J 251.0796 32 51*>7*2 8 КАЛИФВРНМЙ 2 Es 88J 252,0121 32 5t”7s2 © ЭЙИШНЙШ 2 Fm"°J 257,0951 32 5f127s2 в Ф1РМИЙ 2 Md10’? 251,0916 32 51’37*2 78 мгндшвян з No’02j 259,1001 32 5tM7s7 1g Н06ЕЛИЙ 2 Lr,03» *-«*. за 260,1054 32 5fM6d«7s2 18 ЛОУРЕНСИЙ 2
РОСТ
вся химия
ISBN 5-7804-0063-6
9 785780 400639