Author: Егоров Н.С.
Tags: материальные основы жизни биохимия молекулярная биология биофизика общая биохимия медицина фармакология
Year: 1986
Text
Н. С. Егоров
ОСНОВЫ УЧЕНИЯ ОБ АНТИБИОТИКАХ
основы УЧЕНИЯ ОБ АНТИБИОТИКАХ
ИЗДАНИЕ ЧЕТВЕРТОЕ, ПЕРЕРАБОТАННОЕ И ДОПОЛНЕННОЕ
Допущено
Министерством высшего и среднего специального образования СССР в качестве учебника для студентов биологических специальностей университетов
Москва
«ВЫСШАЯ ШКОЛА» 1986
ББК 28.072 ЕЗО
УДК 577.18
Рецензенты.
кафедра микробиологии и вирусологии Одесского государственного университета им. И. И. Мечникова;
кафедра микробиологии Казахского государственного университета им. С. М. Кирова
Егоров Н. С.
Е 30 Основы учения об антибиотиках: Учеб, для студентов биолог, спец, ун-тов.—4-е изд., перераб. и доп.— М.: Высш, шк., 1986.—448 с.: ил.
Учебник посвящен рассмотрению основных вопросов науки об антибиотиках. Рассмотрены явление антагонизма в мире микроорганизмов, факторы, влияющие на образование антибиотических веществ, их классификация. Приведены материалы о наиболее ценных антибиотиках, условиях их биосинтеза, механизме биологического действия, применении в медицине и народном хозяйстве. 4-е издание (3-е — 1979 г.) дополнено современными данными, содержит анализ фнзнко-биохимических особенностей продуцентов антибиотиков, рассматривает закономерности обмена, позволяющие управлять процессом биосинтетической деятельности организмов.
Книга может быть использована студентами медицинских и технологических институтов, врачами, практическими работниками.
_ 2007020000—224
Е ----------------- 17—86
001(01)—86
ББК 28.072
57.А
© Издательство «Высшая школа», 1979
© Издательство «Высшая школа», 1986, с изменениями
ПРЕДИСЛОВИЕ К ЧЕТВЕРТОМУ ИЗДАНИЮ
В 1981 г. было принято постановление ЦК КПСС и Совета Министров СССР «О дальнейшем развитии физико-химической биологии и биотехнологии и использовании их достижений в медицине, сельском хозяйстве и промышленности», в котором определены меры по дальнейшему ускоренному развитию наиболее перспективных направлений современной биологии и биотехнологии.
Теоретические достижения физико-химической биологии находят широкое и многостороннее применение при изучении разнообразных вопросов, связанных с проблемой антибиотиков.
Наука об антибиотиках — это один из наиболее развитых разделов современной биотехнологии. На примере крупномасштабного промышленного получения антибиотических веществ разработаны основные биотехнологические приемы, сыгравшие значительную роль в производстве и других биологически активных ценных веществ, образуемых микроорганизмами.
Изучение многочисленных проблем, связанных с антибиотическими веществами, способствует решению большого числа практических задач здравоохранения, сельского хозяйства, некоторых отраслей промышленности. Это направление науки служит ныне обязательной составной частью в деле подготовки микробиологов, биохимиков и других специалистов. Поэтому студенты и аспиранты биологических и отдельных химико-технологических специальностей университетов и других вузов обязаны глубоко изучить основные закономерности, связанные с методами поиска продуцентов новых антибиотиков, селекции и генетики микроорганизмов, образующих эти биологически активные соединения, условиями и механизмом их биосинтеза, промышленным получением антибиотиков и применением их в народном хозяйстве. Они должны быть знакомы с механизмами биологического действия антибиотиков и с проблемами возникновения резистентности микроорганизмов к этим соединениям и методами предупреждения появления этого нежелательного явления и другими вопросами.
Предлагаемый читателям учебник написан с учетом освещения вышеназванных задач, стоящих перед подготовкой специалистов, и
3
в соответствии с программой курса «Антибиотики» по специальности 2041 (Микробиология), утвержденной Минвузом СССР в 1983 г. В отечественной и, насколько нам известно, в мировой литературе нет аналогичного учебника или учебного пособия.
Подготовленная к изданию рукопись дополнена и значительно переработана с учетом последних опубликованных данных по вопросам биосинтеза антибиотиков, их химической и биологической модификации с целью получения наиболее ценных препаратов, механизма биологического действия и по другим направлениям этой многоплановой науки.
Автор при написании Основ учения об антибиотиках и предлагаемого четвертого издания использовал свой более чем тридцатилетний опыт чтения курса «Антибиотики» для студентов микробиологов Московского государственного университета им. М. В. Ломоносова, а также большое число вышедшей в последние годы отечественной и зарубежной литературы по антибиотическим веществам. Все это дало возможность улучшить структуру изложения материала и его содержание, дополнить многие разделы новыми данными, сократить некоторые из них, тем самым обеспечить при том же объеме учебника освещение новых вопросов. Так, в четвертом издании расширены сведения о принципах классификации антибиотиков, включен новый раздел по образованию антибиотиков иммобилизованными клетками микроорганизмов, уточнены и развиты данные по изучению механизмов биосинтеза р-лактамных антибиотиков, более подробно рассмотрена группа антибиотиков ионофоров и механизм переноса ионов через мембрану, расширены сведения об антимикробном спектре ряда антибиотических веществ, уточнены и другие вопросы, рассматриваемые в учебнике. Вместе с тем существенно сокращен раздел об антагонизме микроорганизмов.
Наука об антибиотиках продолжает развиваться быстрыми темпами. Значительный вклад в ее развитие вносили и вносят советские ученые. Этот процесс сопровождается публикацией большого числа работ как в отечественной, так и в зарубежной литературе. Поэтому надо иметь в виду, что любая книга по названной проблеме к моменту своего выхода несколько отстает от того уровня исследований, который был достигнут к моменту ее подготовки. Исходя из сказанного, при работе над новым изданием «Основ учения об антибиотиках» автор стремился сосредоточить главное внимание на фундаментальных, принципиальных положениях науки об антибиотиках. Новейшую информацию по частным вопросам необходимо систематически получать из периодической печати и в первую очередь из отечественного журнала «Антибиотики и медицинская биотехнология», а также из зарубежных журналов.
Автор с благодарностью примет все замечания и предложения по предлагаемому читателям четвертому изданию «Основ учения об антибиотиках».
Н.Егоров
ВВЕДЕНИЕ
Учение (наука) об антибиотиках — молодая синтетическая ветвь современного естествознания. В 1980 г. исполнилось всего 40 лет с того периода, когда впервые в 1940 г. был получен в кристаллическом виде замечательный химиотерапевтический препарат микробного происхождения — пенициллин — антибиотик, открывший летоисчисление эры антибиотиков.
Многие ученые мечтали о создании таких препаратов, которые можно было бы использовать при лечении различных заболеваний человека, о препаратах, способных убивать патогенных бактерий, не оказывая вредного действия на организм больного.
Известный немецкий врач и естествоиспытатель Парацельс (1493—1541) пытался применять мышьяк в борьбе с сифилисом. Однако его опыты не имели успеха и дальнейшее испытание этого вещества было надолго приостановлено.
Спустя примерно 380 лет немецкий врач, бактериолог и биохимик, один из основоположников иммунологии и химиотерапии Пауль Эрлих (1854—1915) в результате многочисленных и кропотливых опытов синтеризовал в 1912 г. мышьяковистый препарат, убивающий in vitro возбудителя сифилиса. Эрлих назвал препарат сальварсаном и установил его химическую структуру:
As- =As
Сальварсан (Ns 606) (по Эрлиху)
Однако в 1949 г. советский химик М. Крафт показал, что арсеносоединения не содержат и не могут содержать связи As=As. Он установил, что сальварсан — это смесь полимергомологичных соединений и имеет следующее строение:
5
К сожалению, надо отметить, что даже в весьма солидных книгах и руководствах по химии строение молекулы сальварсана все еще изображается так, как это делал Эрлих.
Сравнительно длительное время сальварсан оставался единственным химиотерапевтическим средством, если не считать хинина, открытого индейцами Южной Америки еще в доисторические времена и используемого при лечении больных малярией.
В 30-х годах текущего столетия в результате химического синтеза были получены новые органические соединения—сульфамиды, среди которых красный стрептоцид (пронтозил) был первым эффективным препаратом, оказавшим терапевтическое действие при тяжелых стрептококковых инфекциях. Впервые противококковое действие стрептоцида в опытах на животных обнаружил в 1934 г. немецкий бактериолог Г. Домагк. Но уже в 1935 г. было показано, что пронтозил (красный стрептоцид) в организме животного расщепляется с образованием высокоактивного амида сульфаниловой кислоты и токсичного триаминобензола, не обладающего антибактериальной активностью:
В 1937 г. в нашей Стране был синтезирован сульфидин — соединение, близкое к пронтозилу. В дальнейшем этот препарат уступил место более эффективным сульфамидным соединениям, таким, как норсульфазол, этазол, фталазол и др.:
Норсульфазол
Этазол
Фталазол
6
Открытие сульфамидных препаратов и применение их в медицинской практике составило известную эпоху в химиотерапии многих инфекционных заболеваний, в том числе сепсиса, менингита, пневмонии, рожистого воспаления, гонорреи и некоторых других.
Однако наибольший интерес для медицины представили различные биологически активные вещества, полученные биосинтетическим путем, т. е. соединения, образующиеся в процессе жизнедеятельности разнообразных организмов.
Л. Пастер и С. Джеберт в 1877 г. сообщили, что аэробные бактерии подавляют рост Bacillus anthracis.
В конце XIX в. русский терапевт и общественный деятель В. А. Манассеин (1841—1901) и один из основоположников отечественной дерматологии А. Г. Полотебнов (1838—1908) показали, что грибы из рода Penicillium способны задерживать в условиях in vivo развитие возбудителей ряда кожных заболеваний человека.
И. И. Мечников (1845—1916), получивший в 1908 г. совместно с П. Эрлихом Нобелевскую премию за исследования по фагоцитозу, еще в 1894 г обратил внимание на возможность использования некоторых сапрофитных бактерий в борьбе с патогенными микроорганизмами.
В 1896 г. Р. Гозио из культурной жидкости Penicillium brevi-compactum выделил кристаллическое соединение—микофеноловую кислоту, подавляющее рост бактерий сибирской язвы.
Эммерих и Лоу в 1899 г. сообщили об антибиотическом веществе, образуемом Pseudomonas руосуапеа, они назвали его пиоциа-назой; препарат использовался в качестве лечебного фактора как местный антисептик.
В 1910—1913 гг. О. Black и U. Alsberg выделили из гриба рода Penicillium пеницилловую кислоту, обладающую антимикробными свойствами.
К сожалению, эти и некоторые другие наблюдения и открытия не получили в то время дальнейшего развития, но они оказали огромное положительное влияние на более поздние исследования в области изучения биологически активных продуктов жизнедеятельности организмов.
В 1929 г. А. Флемингом был открыт новый препарат пенициллин, который только в 1940 г. удалось выделить в кристаллическом виде. Это новое и весьма эффективное химиотерапевтическое вещество получено в результате жизнедеятельности плесневого гриба, т. е. биосинтетическим путем.
С получением пенициллина как препарата (1940) возникло новое направление в науке — учение об антибиотиках, которое необычайно быстро развивается в последние десятилетия.
Открытие пенициллина — огромная победа современных биологической, медицинской и химической наук, что особенно наглядно проявилось в годы Второй мировой войны. Применение пенициллина при лечении раненых на фронтах Второй мировой войны спасло многие тысячи жизней. С неменьшим успехом пенициллин
7
и прежде всего его производные применяются в медицинской практике и в настоящее время.
Успешное применение пенициллина в борьбе с различными инфекционными заболеваниями и воспалительными процессами явилось мощным стимулом поиска новых, еще более эффективных антибиотических веществ, образуемых различными группами микроорганизмов (бактериями, стрептомицетами), низшими растениями (дрожжами, водорослями, плесневыми грибами, высшими грибами), высшими растениями и животными организмами.
Настойчивые поиски продуцентов новых антибиотиков увенчались блестящими успехами.
Так, если проследить за динамикой роста числа описываемых в литературе антибиотиков, то можно заметить следующую закономерность. В 1896 г. Гозио выделил микофеноловую кислоту, в 1899 г. Эммерих и Лоу описали пиоцианазу. В 1937 г. Вельш описал первый антибиотик стрептомицетного происхождения акти-номицетин, в 1939 г. Красильниковым и Кореняко был получен мицетин и Дюбо—тиротрицин. Таким образом, к моменту получения пенициллина в очищенном виде (1940) было известно пять антибиотических веществ; в последующем число антибиотиков росло очень быстрыми темпами (табл. 1).
Таблица 1
Общее число антибиотиков, образуемых микроорганизмами и высшими формами жизни (по Вегду, 1980)
Годы Антибиотики, образуемые микроорганизмами Антибиотики, образуемые высшими формами ЖИЗНИ Общее число
Всего стрептомицетами редкими формами бактериями грибами
До 1940 5 2 2 1 1 6
1945 88 10 2 25 51 105 193
1950 316 72 10 94 140 218 534
1955 707 325 22 137 223 356 1063
1960 1275 760 40 181 294 465 1740
1965 1898 1177 75 223 423 627 2525
1970 2889 1745 136 328 680 990 3879
1975 4099 2361 250 518 970 1438 5537
1978 4973 2769 396 567 1151 1795 6368
Из шести с лишним тысяч антибиотиков, известных к настоящему времени, лишь примерно сто находят применение в медицинской практике: при лечении воспалительных процессов (пневмония, перитонит, фурункулез), различных форм туберкулеза, при борьбе со многими инфекционными заболеваниями, считавшимися ранее неизлечимыми или трудно излечимыми, и т. д. Применение
8
этих соединений привело к резкому снижению смертности при таких заболеваниях, как крупозное воспаление легких, сепсис, различные формы менингита и др.
Большинство описанных антибиотиков не находит применения в медицинской практике из-за их токсичности, инактивации в организме больного или других причин.
Работы по изысканию новых антибиотических веществ, эффективных при лечении вирусных и раковых заболеваний, борьба с которыми является одной из важнейших проблем современности, продолжаются с неослабной энергией. Открытие и изучение свойств нового антибиотика, применяемого в медицинской или сельскохозяйственной практике, — это огромный труд ученых различных направлений (микробиологов, биохимиков, генетиков, химиков, технологов, фармакологов, врачей и др.).
По подсчетам некоторых американских ученых над открытием лишь одного такого антибиотика широкого спектра 55 ученых непрерывно работали 2,5 года; было обследовало более 100 тыс. образцов почвы, израсходовано на это более 4 млн. долларов.
Итальянской фармацевтической компании «Лепетит» для производства нового противотуберкулезного антибиотика потребовалось одиннадцать лет научно-исследовательских работ, которые обошлись в несколько миллионов долларов.
В 70-х годах ежегодно описывалось более 300 новых антибиотиков.
Каковы же основные причины столь быстрого роста числа антибиотиков, происходящего за последние 25—30 лет, несмотря на огромные финансовые затраты и необходимость привлечения большого числа исследователей?
Среди них можно назвать следующие:
1. Многие антибиотические вещества или продукты их модификации— незаменимые лечебные препараты. Они широко применяются при лечении большого числа инфекционных заболеваний, которые ранее, до открытия антибиотиков, считались неизлечимыми или сопровождались высоким летальным исходом. К их числу следует отнести некоторые формы туберкулеза, чумы, азиатскую холеру, брюшной тиф, бруцеллез, пневмонию, различные септические процессы.
2. Антибиотики — вещества, очень полезные в сельском хозяйстве, прежде всего как лечебные препараты в животноводстве, птицеводстве, пчеловодстве и растениеводстве, а отдельные антибиотические вещества —и как стимуляторы роста животных.
3. При широком применении антибиотиков в качестве лечебных препаратов происходит быстрое накопление форм микроорганизмов, резистентных к этим соединениям. Проблема резистентности микроорганизмов ставит задачу замены одних антибиотиков другими, т. е. поиска все новых и новых более эффективных антибиотических веществ.
4. Некоторые антибиотики с успехом применяются в пищевой и консервной промышленности в качестве консервантов скоропортя
9
щихся продуктов (свежей рыбы, мяса, сыра, различных овощей).
5. Антибиотические вещества — новые, ранее неизвестные по химическому строению соединения — представляют огромный интерес для специалистов в области химии природных соединений. Изучение структуры этих веществ, а также синтез некоторых из них способствовали бурному развитию указанного направления в химии, а следовательно, и самой науки об антибиотиках. Достаточно указать, что к настоящему времени химическими методами синтезированы такие антибиотики, как пенициллины, хлорамфеникол, тетрациклины и др.
6. Антибиотики широко применяются в научных исследованиях в качестве веществ, используемых при изучении отдельных сторон метаболизма организмов, расшифровке тонких молекулярных механизмов биосинтеза белка, механизма функционирования мембран и других биохимических превращений как специфические ингибиторы определенных реакций. Например, одни антибиотики специфически ингибируют отдельные этапы синтеза белка на рибосомах (хлорамфеникол, пуромицин, тетрациклин), другие— синтез на разных уровнях нуклеиновых кислот (антибиотики азасерин и азотомицин ингибируют синтез предшественников нуклеиновых кислот; саркомицин подавляет активность полимераз; актиномицин, блеомицин, рубомицин, кардиномицин и другие нарушают функцию ДНК), третьи — образование клеточных стенок (пенициллины), четвертые — нарушают функцию мембран (грамицидин С, нистатин, валиномицин и др.) и т. д.
7. Изучение путей образования антибиотиков способствует глубокому проникновению в механизмы синтетической деятельности продуцентов этих биологически активных соединений, раскрытию основных этапов их метаболизма.
Таким образом, все эти факторы способствовали и продолжают способствовать тому, что к проблеме антибиотиков привлечено внимание огромных групп ученых различных направлений: микробиологов, микологов, биохимиков, химиков, генетиков, цитологов, фармацевтов, врачей, технологов и т. д. Изучение антибиотиков— типичный пример комплексного подхода к проблеме, что само по себе способствовало прогрессу в исследовании этих биологически активных соединений.
Большой вклад в развитие науки об антибиотиках и их промышленное получение внесли советские ученые и в первую очередь 3. В. Ермольева, Г. Ф. Гаузе, Н. А. Красильников, В. Н. Шапошников, X. X. Планельес, А. С. Хохлов, А. Б. Силаев, В. А. Шорин и др.
ЧАСТЬ
Антагонизм в мире микроорганизмов и образование антибиотических веществ
Первая часть книги посвящена рассмотрению общих вопросов, связанных с образованием антибиотиков микроорганизмами. Образование антибиотиков — это проявление одной из форм антагонизма между видами микроорганизмов, т. е. свойство, возникшее в процессе их эволюции. К настоящему времени описано более шести тысяч антибиотических веществ, синтезируемых различными группами организмов. Естественно поэтому, что вопросам классификации этих биологически активных природных соединений уделено определенное внимание. Рассмотрены условия культивирования микроорганизмов, обеспечивающие образование антибиотических веществ. Среди этих условий основное внимание уделено влиянию композиции сред, физическим и физико-химическим факторам, вопросам совместного культивирования микроорганизмов.
Образование антибиотиков происходит на определенном этапе развития продуцента — во вторую фазу. Эти биологически активные вещества оказывают определенное влияние на собственные продуценты, выступая иногда в качестве регуляторов ферментативных реакций.
Выделение продуцентов антибиотических веществ из природных источников, рассмотрение методов определения их биологической активности и индентификации образуемых антибиотиков — важнейший этап в поисках продуцентов новых антибиотических веществ.
Названные и другие вопросы науки об антибиотиках изложены в первой части учебника.
1
ВЗАИМООТНОШЕНИЯ I МИКРООРГАНИЗМОВ
Глава Л В ЕСТЕСТВЕННЫХ УСЛОВИЯХ
В естественных субстратах (почва, водоемы, растительные и животные остатки и др.) микроорганизмы существуют как сложные ассоциации, внутри которых складываются разнообразные взаимоотношения. Эти взаимоотношения определяются, в первую очередь, физиолого-биохимическими особенностями организмов, а также соответствующими экологическими факторами, зависящими от многих причин: физического и физико-химического состояния среды; природы, концентрации и доступности основных частей субстрата, используемых микроорганизмами в качестве питательных веществ; наличия определенных видов организмов, характера их действия и многих других факторов. Иными словами, в естественных местах обитания микроорганизмов их взаимоотношения определяются взаимодействием между отдельными видами и между микроорганизмами и абиотической средой.
Биологическая роль микроорганизмов и их значение в природных условиях определяются прежде всего характером биохимических процессов, осуществляемых этими организмами, спецификой наследственных свойств данного вида и экологическими факторами, в сфере действия которых развивается вид. Большое значение имеют также взаимоотношения между микроорганизмами, которые складываются в местах их естественного обитания; их формы могут быть весьма разнообразны: от мирного сожительства до явного антагонизма.
Факторы, определяющие различные типы связей, которые складываются внутри микробиологических сообществ, .можно условно объединить в две группы: трофическая (пищевая) и метаболическая, связанная с образованием разнообразных продуктов обмена веществ и выделением их в окружающую среду. Четкое разделение этих типов связей в мире микроорганизмов весьма затруднительно.
Трофическая группа связей у микроорганизмов может быть хорошо прослежена при так называемом метабиозе (последовательном использовании субстрата).
Метабиоз. В природе это явление распространено очень широко. При метабиозе продукты жизнедеятельности одного микроорганизма, содержащие еще значительное количество энергии, потребляются другими микроорганизмами в качестве питательного материала. Это почти всегда имеет место при последовательном
13
использовании какого-либо одного сложного субстрата. Так, например, при использовании белковых веществ последовательно могут принимать участие в этом процессе аммонификаторы, нитри-фикаторы и денитрификаторы. Метабиоз наблюдается также в процессе совместного использования субстрата (синтрофия). Синтрофными называют связи, при которых субстрат используется одновременно несколькими видами микробов.
Метаболическая группа связей характеризуется свойством микроорганизмов образовывать в процессе своей жизнедеятельности разнообразные продукты обмена веществ (метаболизма) и выделять их в окружающую среду. В результате этого одни микроорганизмы могут использовать отдельные продукты метаболизма (органические кислоты, аминокислоты, витамины и др.), для других организмов такие продукты обмена, как антибиотики, сероводород, пероксид водорода и др., являются ингибиторами роста.
Характер связи и определяет специфику взаимоотношений организмов.
Симбиоз. Симбиотические взаимоотношения микроорганизмов характеризуются тем, что два или более вида микробов при совместном развитии создают для себя взаимовыгодные условия. Типичным примером такого взаимоотношения является факт, описанный еще в 1863 г. Пастером в отношении совместного развития аэробных и анаэробных микроорганизмов. Развиваясь в аэробных условиях, микробы поглощают кислород и тем самым создают благоприятные условия для развития анаэробов. Имеются и другие примеры, иллюстрирующие это явление. Так, в кефирных зернах одновременно развиваются молочнокислые бактерии и дрожжи, получая при этом взаимовыгодные условия: молочнокислые бактерии, испытывая потребность в витаминах, получают их в результате развития дрожжей; в то же время дрожжи, благодаря подкислению среды молочнокислыми бактериями, получают благоприятные условия для своего развития.
Примерно то же самое происходит и в «чайном грибе», где совместно развивается несколько видов уксуснокислых бактерий и дрожжей. В этом случае уксуснокислые бактерии превращают сахарозу в глюкозу и фруктозу, которые затем этой же группой бактерий окисляются до глюконовой и 5-кетоглюконовой кислот. Образовавшиеся кислоты используются дрожжами. Дрожжи, синтезируя витамины, обеспечивают потребность в них уксуснокислых бактерий.
К симбиотическому типу взаимоотношений относят п р о т о к о-операцию, в основе которой лежит принцип совместного использования субстрата; комменсализм — мирное сожительство разных видов микроорганизмов; мутуализм — совместное сожительство микроорганизмов, не способных существовать раздельно.
Антагонизм. В естественных условиях развития микробов довольно часто могут наблюдаться явления не только взаимно благоприятные, но и такие, при которых один вид микроорганизмов
14
тем или иным способом угнетает или полностью подавляет рост и развитие других видов. Явление антагонизма широко распространено среди бактерий, актиномицетов, грибов и других организмов. Подробное рассмотрение антагонизма приведено ниже.
Паразитизм. Форма взаимоотношений, при которой развитие некоторых микробов происходит за счет веществ тела (клетки) других организмов, называется паразитизмом.
Например, бактерии-паразиты в своем эволюционном развитии утратили способность синтезировать многие вещества; они получают их в готовом виде за счет своего хозяина. Хозяин же никакой пользы взамен от такого сожительства не получает. Бактерии — это, как правило, внеклеточные паразиты, а риккетсии и фаги (вирусы) являются внутриклеточными паразитами.
Бактериофаг в клетке бактерии и, соответственно, актинофаг в клетке актиномицета развиваются, используя вещества этих микроорганизмов, иногда приводя своего хозяина к гибели. Нередко встречаются случаи, когда бактерии паразитируют на гифах грибов, имеется большая группа грибов-паразитов, развивающихся на других грибах.
Паразитизм следует отнести к одной из форм антагонизма, однако этот тип взаимоотношений имеет специфические черты, а поэтому более рационально его рассматривать в качестве самостоятельной формы.
Хищничество. Исходя из общего определения понятия антагонизма, хищничество также должно быть отнесено к антагонизму, однако в этом случае имеет место не только гибель клеток другого вида. Процесс хищничества состоит в том, что некоторые микробы поглощают клетки других видов микроорганизмов и используют их в качестве питательного материала. Часто подбор микробов для использования их как пищевых объектов носит избирательный характер.
К числу микроорганизмов-хищников относятся главным образом миксоформы (миксобактерии, миксоамебы, миксомицеты).
Имшенецкий и Кузюрина (1951) описали наиболее простой тип хищничества, характерный для миксококков. Последние могут использовать в качестве источника питания преимущественно продукты лизиса живых клеток других бактерий. Причем мертвые клетки бактерий менее пригодны для миксококка, чем живые клетки тех же видов.
Рассмотрев различные типы взаимоотношений, существующие в мире микроорганизмов, можно прийти к заключению, что они еще не могут исчерпать все то разнообразие связей, которое имеет место среди микроорганизмов в природе.
Надо полагать, что в естественных условиях таких четко очерченных форм взаимоотношений, о которых говорилось выше, вообще не наблюдается. На разных этапах роста организмов, а также в зависимости от условий их развития один тип взаимоотношения может сменяться другим, микробы, взаимодействующие в одном типе, могут меняться местами и т. д.
15
Распределение наиболее характерных форм взаимоотношений по вышеназванным типам безусловно облегчает рассмотрение этой проблемы. Однако оно еще не может полностью отразить всей сложности существующих в природе явлений.
В ассоциациях могут находиться организмы, развивающиеся относительно независимо друг от друга. Такое относительно независимое существование микробов возможно в том случае, когда потребности в питательных веществах у организмов, входящих в ассоциацию, не совпадают, а также тогда, когда вещества, образуемые в процессе жизнедеятельности одним из организмов, не оказывают угнетающего или, наоборот, стимулирующего влияния на другой организм.
В естественных условиях могут совместно существовать различные виды микроорганизмов, некоторые из которых способны даже вырабатывать антибиотические вещества. Такое существование может иметь место в том случае, если выделяемый антибиотик не оказывает вредного действия на своего соседа или если один из организмов активно защищается от угнетающего действия веществ, образуемых другим микробом. Известно, что многие микроорганизмы, способны активно разрушать токсические для них вещества, образуемые другими организмами.
Так, например, ряд бактерий Escherichia coli, Bacillus subtilis. Вас. cereus. Вас. megatherium и др.) при определенных условиях развития образует фермент пенициллиназу, который разрушает пенициллин, выделяемый Penicillium notatum, Р. chrisogenum и плесневыми грибами других видов.
Известны случаи, когда некоторые бактерии способны использовать антибиотики, образуемые другими микроорганизмами, в качестве питательных веществ. В результате эти антибиотики, подавляющие развитие одних видов, являются благоприятным источником питания для других видов. Из почв выделены бактерии, способные утилизировать стрептомицин (антибиотик, обладающий высокой биологической активностью по отношению ко многим видам микробов) в качестве единственного источника азота и углерода.
Все это свидетельствует о наличии довольно сложного и разнообразного характера взаимоотношений организмов, находящихся в естественных местах обитания.
АНТАГОНИЗМ В МИРЕ МИКРООРГАНИЗМОВ
Антагонистические взаимоотношения микроорганизмов характеризуются тем, что один вид микробов тем или иным путем подавляет развитие или задерживает рост других микроорганизмов.
На антагонистические свойства бактерий, стрептомицетов и плесневых грибов обращали внимание многие исследователи как у нас в стране, так и за рубежом еще в XIX в. Однако эти наблюдения носили разрозненный случайный характер, не могли быть обобщены в целостную систему учения об антагонизме, так как
16
это явление в тот период не имело практического применения. Позднее обобщение отдельных фактов микробного антагонизма осуществил И. И. Мечников. Он наметил пути использования этого явления на практике. Учение Мечникова о преждевременной старости человека в связи с постоянной интоксикацией организма продуктами жизнедеятельности гнилостных бактерий кишечника и использование молочнокислых палочек простокваши для вытеснения этих гнилостных бактерий заложили научные основы современного учения об антагонизме микроорганизмов.
Антагонизм широко распространен среди различных групп микроорганизмов. Его можно обнаружить у бактерий и стрепто-мицетов, грибов, водорослей и других групп.
В зависимости от наследственных особенностей, а также в зависимости от различных экологических факторов и условий культивирования микроорганизмы могут проявлять антагонистические свойства по отношению к другим организмам. Это явление широко распространено в природе.
Причины, вызывающие явление антагонизма, — самые разнообразные, и для оценки факторов, связанных с антагонизмом микроорганизмов, следует объединить эти явления в определенные группы.
Если в качестве основы для этого использовать главный критерий антагонизма, а именно: причину, вызывающую проявление антагонистических свойств организма, то можно все известные к настоящему времени формы микробного антагонизма объединить в две основные группы: «пассивный» и «активный» антагонизм.
Сущность «пассивного» антагонизма состоит в том, что угнетение роста одного вида микроорганизма другим может происходить только при определенных, иногда крайне ограниченных условиях развития этих организмов. Такие условия могут иметь место лишь при лабораторном культивировании микроорганизмов. В обычных естественных условиях роста подобного проявления антагонизма, как правило, не бывает.
При «активном» антагонизме угнетение роста или полное подавление жизнедеятельности одного вида микроба другим происходит в результате обогащения окружающей среды продуктами обмена, выделяемыми организмами при развитии. Однако при определенных концентрациях этих продуктов метаболизма организмы, их продуцирующие, могут развиваться свободно.
К группе «пассивного» антагонизма следует отнести: а) взаимоотношения микроорганизмов, складывающиеся при совместном развитии разных видов, которые нуждаются в одних и тех же питательных веществах:
б) насильственный антагонизм.
Антагонизм, обусловленный использованием разными организмами, развивающимися вместе, одних и тех же питательных веществ. При совместном развитии на одном и том же субстрате различных организмов, имеющих одинаковые потребности в пи-
17
гательных веществах, преимущественное положение в развитии будет у того микроорганизма, скорость роста которого выше скорости роста других организмов, его окружающих. Так, например, при одновременном высеве бактерий и актиноминетов на субстрат, вещества которого в равной степени необходимы для развития того и другого организма и при условии, что эти вещества находятся в ограниченном количестве, бактерии как организмы, имеющие наиболее высокий темп роста, овладевают быстрее субстратом и не дают возможности развиваться актиномицетам. Подобное явление можно наблюдать при одновременном высеве на МПА Е. coli или Pseudomonas fluorescens и некоторых видов актиноминетов. Однако угнетение роста актиномицета может иметь место лишь в том случае, если он не обладает способностью выделять специфические продукты жизнедеятельности, подавляющие развитие бактерий.
Насильственный антагонизм. Ассистент И. И. Мечникова И. Шиллер еще в 1914 г. обратил внимание на то, что при совместном засеве в бульон ацидофильной палочки и стрептококка последний полностью погибает примерно через 18 ч культивирования (превращается в аморфную массу). Изучение этого явления показало, что ацидофильная палочка выделяет бактерицидные вещества, лизирующие стрептококки, причем выделение таких веществ происходит только в присутствии стрептококка.
Шиллеру удалось вызвать антагонизм у организмов, обладающих протеолитической активностью (Bacillus mesentericus, Вас. subtilis. Вас. anthracis) по отношению к бактериям, не имеющим этих ферментов.
Если поместить, например, сенную (Вас. subtilis) или картофельную (Вас. mesentericus) палочку одновременно со стрептококком на водный агар или просто в воду, отмечает Шиллер (1952), то при этом произойдет размножение палочек с выделением специфических бактериолизинов и растворение стрептококка. Шиллеру удалось получить эти лизины в концентрированном виде путем упаривания при 37°С культуральной жидкости, в которой происходило, например, развитие Вас. mesentericus.
При добавлении бактериального лизина, предварительно разбавленного водой, к свежим клеткам стрептококков, находящимся в полноценной питательной среде, происходит лизис стрептококков.
Итак, если бактериям, которые в естественных условиях не проявляют никаких признаков антагонизма, создать условия недостатка в среде питательных веществ (азотных или углеродных), то одна из бактерий, обладающая протеолитическими ферментами, может использовать в качестве питательного материала клетки других бактерий, не имеющих этих ферментов. В этом состоит основное свойство насильственного антагонизма.
Шиллер показал, что при насильственном антагонизме использование живых клеток в качестве питательного материала происходит тем же способом, каким бактерии используют нераствори
18
мые белковые вещества, т. е. путем выделения в окружающую среду протеолитических ферментов. Количество лизинов1, по его мнению, зависит от количества клеток, подлежащих литическому действию.
Нам представляется весьма вероятным, что лизины, получающиеся при насильственном антагонизме, являются теми продуктами жизнедеятельности бактериальной клетки, которые, нарушая обмен и вызывая гибель бактерий другого вида, растворяют ее. По функции убивать живые клетки микроорганизмов другого вида эти лизины по существу являются антибиотическими веществами, а по функции растворения предварительно убитой специфическим веществом обмена и превращенную таким образом в субстрат клетку лизины выступают как адаптивные протеолитические энзимы.
Явление насильственного антагонизма наблюдали Надсон и Жолкевич (1922) при совместном выращивании гриба Spiaria purpurogenes и дрожжей. При таком культивировании дрожжи погибают в результате образования антагонистом пигмента, обладающего литическими свойствами.
Используя метод насильственного антагонизма актиномицета Streptomyces aureofaciens и дрожжей (производственный штамм «Шампанские»), Шурыгин (1972) получил новое антибиотическое вещество бализ.
В группу «а ктивного» антагонизма микроорганизмов следует включить взаимоотношения, обусловленные:
а) образованием микробами органических кислот, спиртов или других продуктов обмена, происходящим в результате использования отдельных компонентов субстрата;
б) образованием и выделением в окружающую среду антибиотических веществ.
К этой группе следует отнести явления паразитизма и хищничества, о которых говорилось выше.
Антагонизм, связанный с образованием органических кислот, спиртов или других продуктов обмена в результате использования отдельных компонентов среды. У ряда микроорганизмов способность образовывать те или иные продукты жизнедеятельности в процессе эволюционного развития сопровождалась параллельной адаптацией их к относительно высоким концентрациям этих веществ. В результате различные по свойствам и химической природе продукты, образующиеся в процессе жизнедеятельности микроорганизмов, служили им орудием в борьбе за существование, подавляя или тормозя рост конкурентных организмов.
Многие микроорганизмы (бактерии, плесневые грибы и др.) образуют в процессе развития из углеродсодержащих компонентов субстрата органические кислоты, которые резко изменяют активную кислотность среды и тем самым препятствуют развитию организмов других видов.
1 И. Шиллер под лизинами подразумевает литические факторы.
19
Такое явление может наблюдаться, например, в процессе смены микрофлоры свежего молока. В свежевыдоенном коровьем молоке содержатся как молочнокислые, так и гнилостные бактерии. При этом соотношение их при хранении молока меняется по данным Войткевич (1940) в определенной последовательности: вначале в молоке все бактериальные группы развиваются как бы независимо одна от другой, причем группа гнилостных бактерий преобладает над остальными микроорганизмами. Затем в результате развития молочнокислых бактерий происходит накопление молочной кислоты и среда (в данном случае молоко) значительно подкисляется. В этих условиях наблюдается угнетение развития гнилостных бактерий, а затем их полная гибель. Преобладающее место в молоке начинают занимать молочнокислые бактерии.
Отношение различных видов молочнокислых бактерий к подкислению субстрата также не одинаково. В первый период развития молочнокислых бактерий, когда значение pH молока еще не очень низкое, в большой степени развиваются стрептококки. Достигнув максимального развития, стрептококки подавляются палочковидными молочнокислыми бактериями, приспособленными к более высоким концентрациям молочной кислоты и, следовательно, к более низкому pH субстрата.
Образование лимонной кислоты грибами, как отмечал в 1947 г. В. Н. Шапошников, имеет двоякое значение. С одной стороны, образование кислоты является специфическим приспособлением к созданию среды, наиболее благоприятной для развития гриба. С другой — резкий сдвиг pH субстрата в кислую зону является средством устранения конкурентной микрофлоры, главным образом бактериальной, в большинстве случаев не способной развиваться в кислой среде.
Приведенные примеры показывают, что образование бактериями и плесневыми грибами органических кислот обеспечивает этим организмам преимущественные условия в острой конкурентной борьбе с другими микробами.
Борьба с конкурентной микрофлорой может также осуществляться путем резкого подщелачивания среды.
Некоторые виды бактерий благодаря специфическому использованию отдельных компонентов субстрата так подщелачивают среду, в которой они размножаются, что она становится неблагоприятной для развития других видов микробов.
Например, при развитии уробактерий на мясо-пептонном агаре (МПА), содержащем от 1 до 5% мочевины, происходит дезаминирование последней. При этом выделяется аммиак в таком количестве, которого достаточно для того, чтобы затормозить развитие других микроорганизмов. Отсутствие роста других микробов объясняется тем, что выделенный аммиак сильно (до pH 9,3) подщелачивает субстрат. Уробактерии в этих условиях растут хорошо. При совместном культивировании уробактерий с Sarcina aurantica или Е. coli на МПА или даже в почве происходит полное отмирание сарцин и кишечной палочки.
20
Таким образом, как при лабораторном культивировании, так и в естественных условиях развития уробактерий в присутствии мочевины происходит значительное подщелачивание среды в «результате образования аммиака. Это приводит к подавлению некоторых видов окружающей микрофлоры и вместе с тем не оказывает отрицательного влияния на развитие самих уробактерий.
Иногда наряду с кислыми продуктами обмена некоторые микроорганизмы (ацетоноэтиловые, ацетонобутиловые бактерии, дрожжи и др.) образуют нейтральные продукты обмена, например спирты, которые также могут тормозить развитие некоторых видов микробов.
Итак, значительное снижение активной кислотности (PH) среды в результате образования органических кислот или резкое подщелачивание субстрата при использовании мочевины и других веществ, или, наконец, образование нейтральных продуктов обмена приводит к подавлению роста некоторых видов микроора-низмов и в определенных границах не препятствует развитию тех организмов, которые образуют эти вещества.
Антагонизм, обусловленный образованием антибиотических веществ. Наиболее существенной и наиболее яркой формой антагонизма, широко распространенной в мире микроорганизмов, является образование специфических продуктов обмена, угнетающих или полностью подавляющих развитие организмов других видов. Такие вещества получили название антибиотиков.
Явление антагонизма в мире микроорганизмов может быть широко использовано в практике здравоохранения и сельского хозяйства, здесь для этого имеются большие перспективы.
Живые микробы-антагонисты находят применение в медицинской практике для борьбы с дисбактериозами и кандидомикоза-ми, возникающими иногда при применении антибиотиков широкого спектра действия, для терапии и профилактики различных инфекционных заболеваний. Антагонизм между микроорганизмами привлекает внимание .ученых и практиков сельского хозяйства для использования его в борьбе с фитопатогенными организмами, причиняющими немалый вред сельскохозяйственному производству.
Глава
ПОНЯТИЕ ОБ АНТИБИОТИКАХ И ИХ КЛАССИФИКАЦИЯ
ЧТО ТАКОЕ АНТИБИОТИКИ?
После открытия в 1940 г. пенициллина как ценного лекарственного препарата в науку и в повседневную жизнь людей прочно вошло понятие «антибиотик» или «антибиотическое вещество».
Впервые термин «антибиотик» ввел в 1942 г. 3. Ваксман. Несмотря на несовершенство этого термина («антибиотик» в переводе означает против жизни), его невозможно в настоящее время оспаривать или заменить другим.
Вместе с тем за сравнительно небольшую историю своего существования в определение понятия «антибиотик» разными авторами вкладывалась не вполне аналогичная трактовка. Так, например, Ваксман в 40-х и 60-х годах писал: «Антибиотики являются химическими веществами, образуемыми микроорганизмами, которые обладают способностью подавлять рост или даже разрушать бактерии и другие микроорганизмы».
Анализируя это-определение понятия «антибиотик», можно заметить, что оно, с одной стороны, не показывает различий между антибиотическими веществами и другими продуктами жизнедеятельности микроорганизмов, которые обладают также антимикробными свойствами, но не относятся к антибиотикам.
Никто, например, не относит к антибиотикам молочную или лимонную кислоты, образуемые в процессе жизнедеятельности соответственно молочнокислыми бактериями и Aspergillus niger и подавляющие развитие других микроорганизмов. К числу антибиотических веществ не может быть отнесен также аммиак, выделяемый уробактериями при развитии их на мочевине и препятствующий росту ряда других бактерий.
С другой стороны, вышеприведенное определение понятия антибиотики включает в число продуцентов этих веществ только микроорганизмы, хотя хорошо известно, что к антибиотическим веществам относятся продукты жизнедеятельности высших растений (аллицин, выделенный из чеснока; крепин, полученный из почек и цветков скреды; рафанин, изолированный из семян редиски, и др.) и животных (экмолин, полученный из рыб; эритрин, выделенный из эритроцитов крови, печени и плаценты, и другие вещества).
22
Другие авторы дают слишком расширенное толкование понятия «антибиотик», рассматривая его в качестве частного случая явления выделения фитонцидов в растительном мире или включая в число антибиотиков вещества, синтезируемые химическим путем и обладающие антимикробными свойствами. Таких соединений синтезируется очень много, однако причислять их к антибиотикам совершенно неправильно.
Третьи авторы значительно суживают это понятие, относя к антибиотикам лишь химиотерапевтические вещества, полученные из микроорганизмов или иных природных источников, а также их синтетические аналоги и производные, которые обладают способностью избирательно подавлять в организме больного возбудителей заболеваний и (или) задерживать развитие злокачественных новообразований.
Итак, что же такое антибиотики?
Мы предлагаем следующее определение понятия «антибиотик».
Антибиотики — специфические продукты жизнедеятельности или их модификации, обладающие высокой физиологической активностью по отношению к определенным группам микроорганизмов (вирусам, бактериям, актиномицетам, грибам, водорослям, протозоа) или к злокачественным опухолям, избирательно задерживая их рост или полностью подавляя развитие.
Антибиотики в отличие от некоторых других продуктов жизнедеятельности характеризуются двумя основными признаками.
Во-первых, антибиотики в отличие от органических кислот, спиртов и им подобных соединений обладают высокой биологической активностью по отношению к чувствительным к ним организмам. Это означает, что антибиотические вещества, даже в очень низких концентрациях, проявляют высокий физиологический эффект. Например, пенициллин в концентрации 0,000001 г/мл оказывает четко выраженное бактерицидное действие в отношении чувствительных к нему бактерий.
Во-вторых, характерная особенность антибиотических веществ — избирательность их действия. Это означает, что каждый антибиотик проявляет свое биологическое действие лишь по отношению к отдельным вполне определенным организмам или к группам организмов, не оказывая при этом заметного эффекта на другие формы живых существ. Так, бензилпенициллин задерживает развитие представителей только некоторых грамположительных бактерий (кокков, стрептококков и др.) и не оказывает действия на грамотрицательные бактерии, грибы или другие группы организмов. Он практически нетоксичен для организма человека и животных. В этом состоит отличие антибиотических веществ от общебиологических ядов — сулемы, фенола, мышьяка и других соединений, подавляющих жизнедеятельность любого организма, вступившего в контакт с ядом.
Антибиотические вещества в процессе развития их продуцентов могут выделяться и накапливаться в окружающей организм среде, они могут образовываться в виде летучих продуктов или же
23
накапливаться внутри клеток организма и освобождаться от них в результате экстракции или при разрушении клеток.
В соответствии с нашим определением понятия «антибиотик» к этим веществам относятся также химические или биологические модификации молекул природных соединений антибиотиков путем замены в них тех или иных свободных группировок (радикалов). В результате химической модификации молекул пенициллина, цефалоспорина, тетрациклина и некоторых других продуктов жизнедеятельности микроорганизмов, образующихся в процессе биосинтеза, получены новые соединения с более ценными свойствами.
Образование антибиотиков — это наследственно закрепленная особенность метаболизма организмов. Так, продуцент новобиоци-на Streptomyces spheroides может синтезировать новобиоции или (и) биологически неактивные его аналоги (изоновобиоцин и дес-карбамилновобиоцин) и ничего другого, какие бы мы условия для развития актиномицета ни создавали. Bacillus brevis может образовывать грамицидин и некоторые другие полипептидные антибиотики, но ни при каких условиях не будет синтезировать пенициллин, актиномицин или другой антибиотик.
Некоторые авторы за рубежом и у нас в стране рассматривают антибиотики как «микробные метаболиты», «вторичные метаболиты».
Если под метаболитами понимать все продукты обмена веществ (метаболизма), то, конечно, и антибиотики можно считать метаболитами. Исходя из подобного представления метаболитами будут и органические кислоты, и аминокислоты, и белки, и жиры, и полисахариды. Одним словом, при таком подходе метаболитами будут все вещества, создаваемые организмом. Но эти вещества нельзя признать метаболитами, если придерживаться общепринятого в науке понимания термина «метаболит».
Что же такое «метаболиты»?
Метаболиты — это естественно возникающие промежуточные продукты обмена веществ клетки организма (аминокислоты, жирные, кислоты, витамины, пурины, пиримидины и некоторые другие), которые постоянно вовлекаются в реакции метаболизма, участвуя в синтезе белков, нуклеиновых кислот, антибиотиков и других соединений, или превращаются в иные необходимые для организма продукты.
Необходимо отметить, что в цепи превращений веществ или в процессе их синтеза не существует ни «первичных», ни «вторичных» метаболитов.
Ни в одной из относительно полных схем метаболитических циклов, например циклов превращения углеводов, нельзя найти какого-либо антибиотика, образование которого связано с углеводным или иным обменом, в качестве участника цикла.
Наряду с метаболитами существуют вещества, обладающие ан-тиметаболитными свойствами (антиметаболиты), которые препятствуют вовлечению метаболитов в нормальный обмен клетки.
24
Антибиотики — конечные продукты обмена, никак не могут быть метаболитами. Скорее, наоборот, многие антибиотики — это своеобразные антиметаболиты.
Итак, антибиотики — не промежуточные продукты обмена веществ организмов (метаболиты), а конечные продукты обмена, накапливающиеся внутри клетки или выделяющиеся в окружающую среду.
Образование антибиотических веществ микроорганизмами является, как уже отмечалось выше, лишь одной из форм микробного антагонизма. Этот важный биологический процесс — неслучайное явление, проявляющееся только при лабораторном культивировании организмов. Биосинтез антибиотических веществ — специфическая особенность вида или даже штамма микроорганизмов, появившаяся в результате их эволюционного развития в качестве одной из приспособительных особенностей.
С общебиологической точки зрения, биосинтез антибиотиков принципиально не отличается от образования других продуктов обмена — таких, как органические кислоты, спирты, аминокислоты и тому подобные вещества. Однако пути биосинтеза антибиотиков, продуцируемых микроорганизмами, могут коренным образом отличаться от путей образования органических кислот, спиртов, аминокислот или других аналогичных продуктов метаболизма.
Известно, например, что антибиотические вещества не являются, как правило, прямыми и главными продуктами метаболизма углеводов; они часто не являются и продуктами непосредственного восстановления или окисления веществ, накапливающихся в значительном количестве в период первой фазы развития, как это наблюдается у многих бродильных организмов. Антибиотики в ряде случаев могут быть продуктами побочных звеньев сложнейшей цепи обмена углеродных, азотных и фосфорных соединений.
Несмотря на то что антибиотики образуются в малых количествах по сравнению с такими продуктами жизнедеятельности, как, например, органические кислоты или спирты, они наиболее физиологически активные продукты метаболизма.
Все вышеотмеченные особенности антибиотиков позволяют выделить их в самостоятельную группу соединений.
ЕДИНИЦЫ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
АНТИБИОТИКОВ
Выражение величин биологической активности антибиотиков обычно производят в условных единицах, содержащихся в 1 мл раствора (ед/мл) или в 1 мг препарата (ед/мг). За единицу антибиотической активности принимают минимальное количество антибиотика, способное подавить развитие или задержать рост определенного числа клеток стандартного штамма тест-микроба в единице объема питательной среды.
25
Единицей антибиотической активности пенициллина считают минимальное количество препарата, способное задерживать рост золотистого стафилококка штамм 209 в 50 мл питательного бульона.
Для стрептомицина единица активности будет иной, а именно: минимальное количество антибиотика, задерживающее рост Е. со-Н в одном миллилитре питательного бульона.
После того как многие антибиотики были получены в химически чистом виде, появилась возможность для ряда из них выразить условные единицы биологической активности в единицах массы.
Установлено, что 1 мг чистого основания стрептомицина эквивалентен 1000 единиц биологической активности. Следовательно, одна единица активности стрептомицина эквивалентна одному микрограмму (мкг) чистого основания этого антибиотика. В связи с этим в настоящее время в большинстве случаев количество стрептомицина выражают в мкг/мг или в мкг/мл. Чем ближе число мкг/мг в препаратах стрептомицина к 1000, тем, следовательно, чище'данный препарат, тем меньше он содержит балластных веществ.
У таких антибиотиков, как карбомицин, эритромицин, ново-биоцин, нистатин, трихотецин и некоторых других, одна единица активности эквивалентна или приблизительно эквивалентна 1 мкг вещества.
Однако у ряда антибиотиков единица биологической активности значительно отличается от 1 мкг вещества. Например, 1 мг чистого основания неомицина содержит 300 ед. активности. По-
Таблица 2
Соотношение единиц действия и единиц массы некоторых антибиотиков
Антибиотик -стандарт ед/мг Единица массы
Альбомицин (стандарт) 700000 Нет
Бацитрацин 52 »
Эритромицин (основание) 1000 1 мкг основания
Хлортетрациклин (хлоргидрат) . . . 1000 1 мкг чистого хлоргидрата
Карбомицин (основание) 1000 1 мкг основания
Окситетрацикли (дигидрат) 925 1 мкг чистой безводной амфотерной формы
Пенициллин (натриевая соль) 1667 0,587 мкг чистой кристаллической калиевой соли
Оксациллин 1000 1 мкг оксациллина-кислоты
Метициллин 1000 1 мкг метициллнна-кислоты
Ампициллин 1000 1 мкг а тициллина-кислоты
Полимиксин В (сульфат) 7200 0,1 мкг
Саркомицин 12 0,1 мкг
Тетрациклин (тригидрат) 890 1 мкг чистой безводной амфотерной формы
Стрептомицин (сульфат) 800 1 мкг чистого основания
Новобиоцин 1000 1 мкг новобиоцииа
26
этому 1 ед. активности данного антибиотика эквивалентна 3,3 мкг. Для бензилпенициллина (пенициллин G) 1 ед. активности эквивалентна примерно 0,59 мкг, так как 1 мг антибиотика содержит 1667 ед. (оксфордских). Для фумагиллина за единицу фагоцидного действия принято брать 0,1 мкг чистого вещества. 1 ед. бацитрацина эквивалентна 20 мкг вещества.
Соотношение единиц биологического действия (ед.) некоторых стандартных антибиотиков и единиц их массы приведено в табл. 2.
АНТИБИОТИЧЕСКАЯ ПРОДУКТИВНОСТЬ
ОРГАНИЗМОВ
В вопросах изучения условий образования антибиотиков, при исследовании влияния различных факторов среды на процесс биосинтеза антибиотиков важным критерием оценки биосинтетической активности является характеристика антибиотической продуктивности организма.
Иногда изменение одного или нескольких факторов среды приводит к значительному повышению процесса биосинтеза антибиотика, но существенно не влияет на увеличение биомассы организма. В других случаях, наоборот, при изменении условий культивирования резко увеличивается накопление биомассы организма, но не сопровождается заметным повышением выхода антибиотика. Наконец, наблюдаются случаи, когда увеличение выхода антибиотика связано с увеличением количества образовавшейся биомассы. Поэтому для определения фактора, повышающего биосинтез антибиотика в культуре, необходимо определить по ходу развития организма его антибиотическую продуктивность.
Антибиотической продуктивностью организма называется количество антибиотика в мкг или единицах, образованное 1 мг сухих клеток (мицелия) изучаемого организма за определенный промежуток времени (1 ч). Антибиотическая продуктивность организма выражается следующим образом: мкг или ед/мг/ч.
Продуктивность организмов нетрудно определить по формуле
/I _д
---------------мкг/мг/ч,
где At. и А1г — количество антибиотика, определенное ко времени h и t2, мкг/мл или ед/мл; Mt, и Mt, — количество биомассы, образовавшейся в результате развития организма ко времени t\ и t2, мг; ti и t2 — время взятия проб, ч.
Например, для одного штамма актиномицета были получены следующие данные по накоплению биомассы и антибиотика (табл. 3).
27
Рост Streptomyces rimosus ЛС-Т-118 и образование окситетрациклина в динамике развития актиномицета на синтетической среде
(по Зайцевой, 1959)
Таблица 3
Показатели
Время развития актиномицета. ч
О | 4 | 8 | 12 | 16 | 20 | 24 I 28
36 | 48 | 72 | 96 | 120
Масса мицелия, мг % . . .
Антибиотик, мкг/мл . . .
50 53 52 139
30 32 31 30
262 369 374
32 32 53
402 552
140 260
590 620 757
430 750 1480
760 741
1700 1890
Пользуясь приведенной формулой, антибиотическая продуктивность мицелия Str. rimosus в условиях данного опыта составляет:
Время, ч................. 0—16 16—20 20—24 24—28 28—32
Продуктивность, мкг/мг/ч 0 0,3 1,3 5,6 6,3
Время, ч ............... 32—36 36—48 48—72 72—96 96— 20
Продуктивность, мкг/мг/ч 6,2 6,3 4,2 1,25 1,1
Сравнивая три характеристики (накопление биомассы, биосинтез антибиотика и продуктивность мицелия актиномицета), можно сделать вывод о том, на какой стадии развития актиномицет обладает максимальной биосинтетической (образование антибиотика) активностью.
КЛАССИФИКАЦИЯ АНТИБИОТИКОВ
К настоящему времени описано более 6000 антибиотических веществ. Разобраться в таком многообразии антибиотиков возможно только при соответствующей классификации, распределении их в определенном порядке.
Сложилось несколько подходов к классификации антибиотиков, причем они определяются главным образом профессиональными интересами ученых. Так, для биологов, изучающих организмы-продуценты антибиотических веществ, условия образования этих соединений и другие интересующие их проблемы, наиболее приемлемой классификацией антибиотиков будет такая, в основу которой положен принцип биологического происхождения антибиотиков. Для специалистов, изучающих вопросы механизма физиологического действия антибиотиков, наиболее удобным принципом классификации антибиотических веществ, естественно, будут признаки их биологического действия. Для химиков, изучающих детальное строение молекул антибиотиков и разрабатывающих пути их химического синтеза, приемлема классификация, основанная на химическом строении антибиотиков.
Практические работники здравоохранения (врачи) предпочита
28
ют классифицировать антибиотики по принципу спектра их биологического действия.
Оценивая приведенные принципы классификации, в каждом из них можно найти определенные недостатки. Например, с точки зрения химиков классификация антибиотиков по биологическому происхождению имеет недостатки, связанные с тем, что иногда близкие по строению и биологическому действию вещества могут продуцироваться организмами, принадлежащими к различным группам. Например, антибиотик цитринин образуется некоторыми видами пенициллов и аспергиллов. Кроме того, он также обнаружен в австралийском растении Crotolaria crispata.
Галловая кислота содержится у многих высших растений, а также образуется грибом Phycomyces:
Галловая, или 3,4,5-триокси-бензойная, кислота
Нередко бывает и так, что организмы, принадлежащие к одной группе (например, актиномицеты), образуют самые разнообразные по химическому строению антибиотики.
Таким образом, при классификации антибиотиков по признаку их биологического происхождения, с одной стороны, близкие или даже идентичные вещества могут быть отнесены к различным группам, а, с другой стороны, совершенно различные по химическому строению и биологическому действию соединения должны объединяться в одну группу веществ. Все это, безусловно, затрудняет их рассмотрение с точки зрения химического строения и биологического действия.
С позиции биологов классификация антибиотиков по признаку химического строения также имеет недостатки: в одну группу антибиотиков, отнесенных к одному классу химических соединений, входят вещества, образующиеся различными группами организмов.
Среди основных принципов классификации антибиотиков рассмотрим следующие.
I. КЛАССИФИКАЦИЯ АНТИБИОТИКОВ ПО БИОЛОГИЧЕСКОМУ ПРОИСХОЖДЕНИЮ
1. Антибиотики, образуемые микроорганизмами, относящимися к эубактериям.
А. Образуемые представителями рода Pseudomonas:
29
пиоцианин — Ps. aeruginosa, вискозин — Ps. viscosa.
Б. Образуемые представителями родов Micrococcus, Streptococcus, Diplococcus, Chromobacterium, Escherichia, Proteus: низин — Str. lactis, дипломицин — Diplococcus X-5, продигиозин — Chromobacterium prodigiosum (Serratia mar-cescens), колиформин — E. coli, протаптины — Ps. vulgaris.
В. Образуемые бактериями рода Bacillus: грамицидины—Вас. brevis, субтилин — Вас. subtilis, полимиксины — Вас. polymyxa, колистатин — неидентифицированная споровая аэробная палочка.
2. Антибиотики, образуемые микроорганизмами, принадлежащими к роду Streptomyces: стрептомицин — Str. griseus, тетрациклины — Str. aureofaciens, Str. rimosus, новобиоцин — Str. spheroides, актиномицины — Str. antibioticus и др.
3. Антибиотики, образуемые несовершенными грибами: пенициллин — Penicillium chrysogenum, гризеофульвин — Penic. griseofulvum, трихотецин — Trichotecium roseum.
4. Антибиотики, образуемые грибами, относящимися к классам базидиомицетов и аскомицетов: термофиллин — базидиомицет Lenzites thermophila, лензитин — Lenzites sepiaria, хетомин — Chaetomium cochloides (аскомицет).
5. Антибиотики, образуемые лишайниками, водорослями и низшими растениями: усниновая кислота (бинан) — лишайником, хлореллин — Chlorella vulgaris.
6. Антибиотики, образуемые высшими растениями: аллицин — Allium sativum, рафанин — Raphanus sativum, фитоалексины: пизатин в горохе (Pisum sativum), фазеолин в фасоли (Phaseolus vulgaris).
7. Антибиотики животного происхождения: лизоцим, экмолин, круцин (Trypanosoma cruzi), интерферон.
II. КЛАССИФИКАЦИЯ АНТИБИОТИКОВ ПО МЕХАНИЗМУ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ
1. Антибиотики, ингибирующие синтез клеточной стенки (пенициллины, бацитрацин, ванкомицин, цефалоспорин, D-циклосе-рин).
30
2. Антибиотики, нарушающие функции мембран (альбомицин, аскозин, грамицидины, кандицидины, нистатин, трихомицин, эндо-мицин и др.).
3. Антибиотики, избирательно подавляющие синтез (обмен) нуклеиновых кислот:
а) подавляющие синтез РНК (актиномицин, гризеофульвин, ка-намицин, неомицин, новобиоцин, оливомицин и др.);
б) подавляющие синтез ДНК (актидион, брунеомицин, митомицины, новобиоцин, саркомицин, эдеин и др.).
4. Антибиотики — ингибиторы синтеза пуринов и пиримидинов (азасерин, декоинин, саркомицин и др.).
5. Антибиотики, подавляющие синтез белка (бацитрицин, биомицин, канамицин, метимицин, неомицин, тетрациклины, хлорамфеникол, эритромицин и др.).
6. Антибиотики — ингибиторы дыхания (антимицины, олигоми-цины, патулин, пиоцианин, уснпновая кислота и др.).
7. Антибиотики — ингибиторы окислительного фосфорилирования (валиномицин, грамицидины, колицины, олигомицин, тироци-дин и др.).
8. Антибиотики, обладающие антиметаболитньтми свойствами. Антибиотические вещества, образуемые некоторыми актиномице-тами и плесневыми грибами. Эти антибиотики выступают в качестве антиметаболитов аминокислот, витаминов, нуклеиновых кислот. К числу антибиотиков-антиметаболитов относятся: фураномицин — антиметаболит лейцина; антибиотик — антагонист метаболизма аргинина и орнитина, образуемый Str. griseovariabilis; антибиотик — антагонист метионина и тиамина, выделенный из культуры Str. globisporus-, антибиотическое вещество, обладающее антимета-болитными свойствами в отношении аргинина, лизина или гистидина, синтезируемое Str. macrosporus (термофилл).
9. Антибиотики — иммунодепрессанты: актиномицины С и D, оливомицин, бруномицин, рубомицин.
III. КЛАССИФИКАЦИЯ АНТИБИОТИКОВ ПО СПЕКТРУ
БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ
Условно все важнейшие в практическом отношении антибиотики можно разделить на несколько групп.
1. Противобактериальные антибиотики узкого спектра действия, активные преимущественно в отношении грамположительных организмов.
Группа пенициллина.
Биосинтетические пенициллины: бензилпенициллин и его соли (калиевая, натриевая, новокаиновая), бициллин, фенокси-метилпенициллин.
Полусинтетические пенициллины.
Кислотоустойчивые, неактивные в отношении пенициллина-
31
зообразующих стафилококков: пропициллин, фенетициллин. Кислотоустойчивые, активные в отношении пенициллиназообразующих стафилококков: оксациллин, клоксациллин, диклоксациллин.
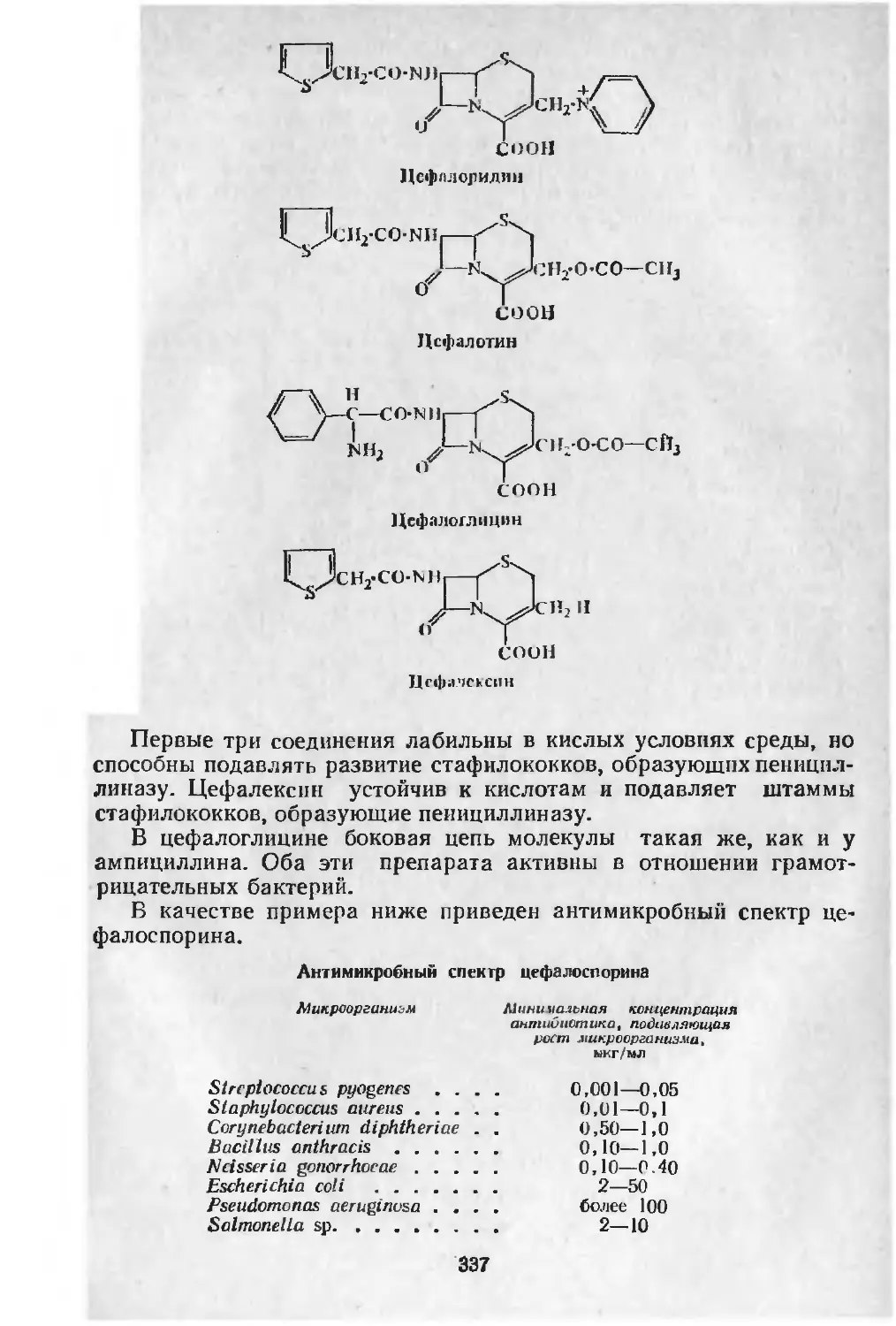
Полусинтетические цефалоспорины: цефалоридин, цефалотин, цефалоглицин, цефалексин.
Альбомицин
Бацитрацин
Ванкомицин, ристомицин
Линкомицин
Новобиоцин
Макролиды: эритромицин, олеандомицин, карбомицин, спирами-цин, лейкомицин.
Тилозин
Фузидин
2. Противобактериальные антибиотики широкого спектра действия
Тетрациклины биосинтетические: хлортетрациклии, окситетрациклин, тетрациклин, деметилхлортетрациклин, деметилтетр ациклин.
Полусинтетические тетрациклины: метациклин, доксициклин, моноциклин.
Хлорамфеникол (левомицетин)
Аминогликозиды: стрептомицин, неомицины, канамицин, гентамицин, фортимицины, гигромицин.
Полимиксины, колистин
Грамицидин С
Полусинтетические пенициллины: ампициллин, карбеницил-лин.
3. Противотуберкулезные антибиотики
Стрептомицин, канамицин, биомицин, циклосерин.
4. Противогрибные антибиотики
Нистатин
Гризеофульвин
Амфотерицин В
Леворин
Кандицин
Трихотецин
5. Противоопухолевые антибиотики
Актиномицин С
Митомицин С
Оливомицин
Бруиеомицин
Дауномицин, рубомицины
6. Противоамсбные антибиотики
Фумагиллин
32
IV. КЛАССИФИКАЦИЯ АНТИБИОТИКОВ ПО ХИМИЧЕСКОМУ СТРОЕНИЮ
Основываясь на принципах классификации антибиотиков, предложенных Шемякиным, Хохловым и др. (1961), и учитывая более поздние данные, можно выделить следующие основные группы антибиотических веществ.
Антибиотики ациклического строения (аллицин, бпформин, азасерин, рафанин, нистатин, аскозин, кандимицин, трихомипин, фума-гиллин и др.). В зависимости от строения в эту группу входят следующие основные группы: жирные кислоты, ацетилены (НС=СС= =ССН2), полиены, серо- и азотсодержащие соединения. Большое место среди названных соединений занимают полиеновые антибиотики, характерной особенностью которых является наличие системы, содержащей от трех до восьми сопряженных двойных связей, — (СН = СН)—.
К числу полиеновых антибиотиков относится большое число (более 150) веществ. Многие антибиотики этой группы содержат аминосахар (микозамин, перозамин), отдельные вещества в структуре имеют вторую азотсодержащую часть — ароматические кетоны (п-аминоацетофенон, п-аминофенилацетон):
Микозамин (дезоксиаминогексоза) Содержится во многих ангибиотиках-полиенах
Перозамин (амино-двудезокси-П-манноза) Входит в состав антибиотика перимицина (син. фунгимицин)
Полиеновые антибиотики в зависимости от наличия в их структуре числа сопряженных двойных связей подразделяются нашесть подгрупп:
1) триены (микротриен, триенин, триен);
2) тетраены (ареномицин, нистатин, фумагиллин и др.);
3) пентаены (группа включает более 40 антибиотиков, в том числе ректилавендомицин, розеофунгин, ауренин, микотицин, фла-вомицин, фунгохромин и др.);
4) гексаены (малочисленная группа, включающая лишь 8 антибиотиков, среди них дермостатин, эндомицин В (геликсин В), флавицид);
5) гептаены (группа, содержащая около 50 веществ, среди которых есть антибиотики, имеющие практическое значение в медицине. К числу гептаепов относятся: кандидин, кандицидин, трихо-мицин, леворин, перимицин (фунгимицин, аминомицин) и некоторые другие);
33
2—742
6) октаены (охрамицин).
Большинство противогрибных антибиотиков актиномицетного происхождения по химическому строению принадлежит к полиенам.
Антибиотики алициклического строения. Эта группа антибиотиков включает производные циклопентана (хаульмугровая кислота, саркомицин), циклогексана (актидион) и циклогептана (туевая кислота):
(сн2)12соон
Тетрациклины. К этой группе относятся соединения, близкие по своему строению. В основе их лежит структура антибиотика тетрациклина:
Ароматические антибиотики. Соединения, относящиеся к этой группе, являются производными бензола (галловая кислота, хлорамфеникол и другие антибиотики):
Т риоксибензойная, Или галловая, кислота
Н NHCOCHC12
но н
Хлорамфеникол
К этой группе относятся и небензоидные ароматические соеди-
34
нения (трополоны), среди которых туяплицины имеют следующее строение:
Туяплицины содержатся в древесине и эфирных маслах деревьев семейства кипарисовых.
Антибиотики-хиноны. Антибиотические вещества, относящиеся к этой группе соединений, как правило, не имеют практического значения. В группу входят бензохиноны (рапанон, фумигатин и др.), нафто хи ноны (плюмбагин, яваницин и др.) и антрахиноны (эндокроцин и др.):
К антибиотикам-хинонам относятся и ц е л и к о м и ц и н ы; в молекулах последних содержатся хромофорная, углеводная и пептидная группировки. Антибиотики, относящиеся к целикомицинам, представляют собой синие пигменты актиномицетов. Они содержат один и тот же хромофор, относящийся к хинонам, аминосахар глю-козампн и аминокислоту глипин.
Целикомицины принадлежат к новому классу антибиотических веществ — гликохромпептидам.
К этой группе антибиотических веществ относятся: целикомицины А, В и С, литмоцидин А, литмофунгин и пигмент 1321-В.
Антибиотики — кислородсодержащие гетероциклические соединения. В группу входит большое число антибиотиков, в том числе антимицины, пеницилловая кислота, гризеофульвин, усниновая кислота, цитринин, новобиоцин, трихотецин и многие другие соединения.
Среди них наибольший практический интерес представляют новобиоцин, гризеофульвин и трихотецин.
2*
35
Кислородсодержащие гетероциклические антибиотики можно разделить на три основные группы.
1. Антибиотики с одним пятичленным О-гетероциклом. Карли-на-оксид (производное фурана) содержится в эфирном масле корней растения Carlina ocaulis; пеницилловая кислота образуется Penicillium puberulum и гризеофульвин, образуемый Penic. griseofulvum и некоторыми другими видами из рода Penicillium.
гл
\/^с=ссн2с6н5
Карлина-оксид
Пеницилловая кислота
Гризеофульвин
2. Антибиотики с одним шестпчленным О-гетероциклом. Койе-вая кислота — одно из простейших природных производных у-пирона — выделена из мицелия Aspergillus еще в 1907 г., цитр и-нин и новобиоцин.
Коневая кислота
ОН
Новобиоцин
3. Антибиотики с несколькими О-гетероциклами. Трихотецин по» лучен из гриба Trichotecium roseum.
36
н
Антибиотики-олигомицины. К этой группе антибиотиков относятся соединения, содержащие в молекуле сопряженную диеновую систему. В качестве примера можно назвать олигомицины А, В и С, ботримицин, хондамицин, финомицин.
Олшомицин В (часшчная структура)
Олигомицины подавляют развитие грибов, в том числе и фито-патогенных, в результате ингибирования окислительного фосфорилирования.
Антибиотики-макролиды. Характерная особенность антибиотиков этой группы — присутствие в молекуле макроциклического лактонного кольца, связанного с одним или несколькими углеводными остатками (обычно аминосахарами). К антибиотикам-макролидам относятся метимицин, эритромицин, магнамицин и др.
Аминогликозидные антибиотики. К этой группе антибиотических веществ относятся соединения, содержащие в молекуле гли-
37
козидные связи. К ним принадлежат стрептомицины, гигромицин, неомицины, канамицины, гентамицины, фортимицины и др. Многие из этих антибиотиков широко применяются в медицине при лечении ряда заболеваний.
Антибиотики, азотсодержащие гетероциклические соединения. В эту группу входит большое число антибиотиков, молекулы которых содержат самые различные, часто очень сложные кольчатые системы. Антибиотики этой группы образуются бактериями (продигиозин), нокардиями (азомицин, нокардамин), актиноми-цетами (пуромицин, циклосерин) и плесневыми грибами (пенициллины):
H(j:=ch
С
I
NOj Азомицин
38
Продигиозин (производное пиррил-дипиррилметена) образуется грамотрицательными бактериями Bacterium prodigiosum (синоним Serratia marcescens) и некоторыми актиномицетами:
Антибиотики-полипептиды. Среди изученных в химическом отношении антибиотиков этой группы наиболее распространены циклопептиды, состоящие из остатков L- и £)-аминокислот. К ним относятся антибиотики, образуемые бактериями (тироцидины, грамицидины, бацитрацины, полимиксины, низины, бацилломицины и др.) и актиномицетами (этамицин, эхиномицины и др.).
1-Орн^
L-Вал 1-Лей
1-Тир D-Фен
1-Глу. 1-Про
1-Асп 1-Фен
D-Фен
Ь-Лёй
Ь-Орн D-Фен
1-Вал 1-Про
I I
1-Про ^D-Вал
D-Фён 1-Орн
L-Лей
Тироцидин А'
Грамицидин С
ОН
СО—*~1-Тре —*~О-Лсй—^•-О-А-оксипро —*тСарк
О-*-1-а-Фенсарк~*—1-Ала-*—1-ди-м-лей
Этамицин
А-оксипро — алло-оксипролин; Ди-м-лей—дим ети Л лейцин J Фенсарк—фенилсаркозин; С арк — саркозин
Антибиотики-депсипептиды. Характерной особенностью этих антибиотиков (валиномицин, амидомицин и др.) является то, что они построены из остатков а-окси- и а-аминокислот, соединенных между собой сложноэфирными и амидными связями:
—OCHCONHCHCOOCHCONHCHCO— 1111
R R R R
Ранее такие соединения в природе не были обнаружены.
Сравнительно полно изученными антибиотиками этой группы соединений являются энниатин В — вещество, образуемое некото
39
рыми грибами из рода Fusarium, и валиномицин, образуемый Streptomyces fulvissimus.
сн(сн3)2 сн3 сн(сн3)2
CH-------CO • N----CH------CO
О CH, о
I I I
ОС----CH-------N------CO----CH
I I
CH(CHj)2 CH(CHj)2
Энниатин В
Актиномицины. К группе актиномицинов принадлежат антибиотики, в состав которых входят одинаковая для этих веществ феноксазиновая хромофорная группа и различные депсппептидные цепи.
Стрептотрицины (стрептотрицин, геомицины, стрептолипы, ви-русин, лавендулин и др.). В группу входит около 70 препаратов, образуемых различными видами стрептомицетов (Str. xanthophae-us, Str. griseolavendus, Stf. lavendulae и др.).
Советские исследователи (Решетов, Хохлов, 1965) на основании изучения различных препаратов, относящихся к стрептотрицинам, пришли к заключению, что все известные к настоящему времени стрептотрицины можно объединить в шесть групп (А, В, С, D, Е, F):
40
Стрептотрицин Суммарная формула Число свободных аминогрупп М олек иляр ноя масса
А СлдНдфМ^СЬз 7 1520
В C43H82N16O12 6 1347
с C37H70N14O12 5 1174
D C31H58N12O10 4 1001
Е С25Н4бМ]0Од 3 828
F С1эНз4М8О8 2 655
Показано, что стрептотрицины отличаются один от другого
лишь числом остатков р-лизина.
Решетов, Егоров и Хохлов (1965) предложили общую формулу для стрептотрицинов:
для стрептотрицина А л—б, для стрептотрицина В п —5, для стрептотрицина С п—4, для стрептотрицина D л—3, для стрептотрицина Е и =2, для стрептотрицина F п “1
Весьма интересно, что биологическая активность этих антибиотиков по отношению к бактериям и грибам возрастает по мере увеличения числа остатков р-лизнна в молекуле. Так, наиболее активным оказался стрептотрицин А, подавляющий развитие Saccha.ro-myces cerevisiae в концентрации 0,1—0,5 мкг/мл, а стрептотрицин F проявляет аналогичное действие лишь при концентрации 50 мкг/мл (Рябова, Решетов, Жданов, Хохлов, 1965).
Металлсодержащие соединения. Среди антибиотиков имеются железо- и медьсодержащие соединения. К первым веществам, зи-деромицинам, принадлежат гризеин и близкий к нему альбомицин, содержащие трехвалентное железо, связанное с органической частью молекулы вещества. В гризеине и альбомицине железо связано с полипептидом. При обработке этих антибиотиков НС1 или НВг железо можно удалить из молекулы, но биологическая активность их при этом уменьшается в 12—14 раз.
Строение железосодержащих биологически активных веществ может быть представлено схемой (см. с. 42).
В качестве примера медьсодержащего антибиотика можно назвать флеомицин (C53H91N17O32CU). Медь может быть удалена из молекулы при обработке вещества 8-оксихинолином без потери биологической активности. Предполагается, что молекула основания флеомицина, продуцируемого актиномицетом, состоит из углеводной и пептидной частей. Эти антибиотики являются весьма устойчивыми соединениями: они не инактивируются в интервале pH
41
Схема структуры феррихромов*
между 2,0—7,0 даже при нагревании. В более кислой и щелочной зонах полимиксины инактивируются даже при комнатной температуре. Они не подвергаются действию протеаз (пепсина, трипсина, панкреатина).
* * *
Предложенная классификация антибиотиков имеет важное значение для изучения химии антибиотических веществ.
Классификация антибиотиков по принципу их химического строения более обоснована.
Приведенная классификация антибиотиков показывает, что эти физиологически активные продукты жизнедеятельности организмов представляют собой самые разнообразные по химической природе вещества: от простых ациклических соединений до очень сложных полипептидных структур типа полимиксинов и актиномицинов.
Поскольку настоящий учебник рассчитан преимущественно на биологов и в нем ставится задача познакомить студентов не со всеми известными антибиотиками, а лишь только с теми, которые имеют важное практическое или теоретическое значение, то, по-видимому, будет наиболее рациональным рассматривать антибиотические вещества в связи с теми группами организмов, которые их образуют. Иными словами, в основу рассмотрения антибиотиков в данной книге положен принцип биологического происхождения этих веществ.
* Феррихромы относятся к железосодержащим биологически активным соединениям зидероаминам, способным стимулировать рост микроорганизмов и лишенных антибиотического действия.
Глава
ОБРАЗОВАНИЕ АНТИБИОТИКОВ В ПРИРОДЕ И ИХ БИОЛОГИЧЕСКАЯ РОЛЬ
ОБРАЗОВАНИЕ АНТИБИОТИЧЕСКИХ ВЕЩЕСТВ
В ЕСТЕСТВЕННЫХ УСЛОВИЯХ РАЗВИТИЯ ОРГАНИЗМОВ
Антибиотические свойства, проявляющиеся у многих групп микроорганизмов, встречающихся в различных экологических условиях, — широко распространенное явление. Микробы-продуценты этих биологически активных веществ встречаются среди морской микрофлоры, выделяются из рек и озер, из растительных и животных остатков, непосредственно из организмов животных и растений и т. д. Однако наибольшее количество микроорганизмов, обладающих антибиотическими свойствами, обнаруживается в различных почвах.
Способность образовывать антибиотические вещества микроорганизмами изучается, как правило, в условиях искусственного их культивирования, в условиях лабораторных опытов. Однако возникает вопрос, проявляется ли антагонизм и особенно антагонизм, связанный с образованием антибиотиков, у микроорганизмов в условиях их естественного местообитания.
Имеющийся фактический материал дает возможность ответить на этот вопрос положительно.
Установлено, что бактерии кишечной группы — Е. coll, Bad. typhi, Bad. dysertteriae и др., попадая в свежую морскую воду, отмирают в ней через несколько дней. Количество гноеродных стафилококков в свежей морской воде Черного моря через 10 дней уменьшается в 2—3 раза. В прокипяченной черноморской воде этот микроб заметно развивается.
Аналогичные наблюдения получены и при изучении пресной воды.
Следовательно, в водоемах в результате жизнедеятельности различных организмов, характерных для этой среды, накапливаются вещества, препятствующие развитию многих видов микробов, попадающих в эти водоемы.
Безусловно, наряду с биотическими факторами существенную роль в угнетении развития несвойственных этой среде микроорганизмов оказывают и абиотические факторы — такие, как концен
43
трация солей и иных растворимых веществ, температура, отсутствие некоторых компонентов, необходимых для питания, и т. д.
Большое число исследований посвящено изучению возможностей образования антибиотических веществ в почвах, в основном естественном месте обитания большинства микроорганизмов.
Многие патогенные для человека и животных бактерии (кишечная, брюшнотифозная, дизентерийная палочки и др.), а также фи-топатогенные грибы и бактерии, попадая в почву, быстро в ней погибают. Однако в стерильной почве те же самые организмы сохраняются в течение длительного времени. Иными словами, в почве наблюдаются те же явления, что и в водоемах.
Различные патогенные бактерии, попадая в почву, сохраняются в ней в течение различного времени (табл. 4).
Таблица 4
Выживаемость патогенных бактерий в различных почвах (по Красильникову, 1958)
Выживаемость, сут
Выживаемость, сут
Бактерии
Бактерии
x я
я X
Bacterium typhi . Bad. dysenteriae . Vibrio cholerae Mycob. tuberculosis
15—20 6—10 6—12
60
360
270
120
210
Bad. necrosis...............
Bad. melitensis . . . .
Bad. pestis ......
Bad. tularense..............
10
3—10 3
75
90
30
75
Возбудитель туберкулеза свеклы Xanthomonos beticola, попадая в почву, погибает в ней через 3—10 дней, а из стерильной почвы этот организм выделяется в течение 32—60 дней.
Таким образом, в почвах и в водоемах, т. е. основных естественных местах обитания микрофлоры, создаются определенные условия, препятствующие развитию некоторых посторонних видов микробов, не приспособленных к данным условиям.
Связано это с тем, что, во-первых, в естественных условиях неблагоприятное влияние на постороннюю микрофлору оказывают физические и физико-химические (абиотические) факторы среды, в том числе температура, влажность, pH, осмотическое давление и др. Во-вторых, наиболее существенную роль, по-видимому, играют биотические факторы: наличие мико- и микрофлоры, бактерио-и актинофагов, почвенных (водных) животных и растений, а также разнообразных продуктов их жизнедеятельности, в том числе и веществ типа антибиотиков.
Изучение взаимоотношений бактерий и актиномицетов, выделенных из ограниченного по объему участка подмосковной почвы, показало, что среди изолированных организмов (27 штаммов ак-
44
тиномицетов и 39 штаммов бактерий) наблюдаются самые разнообразные взаимоотношения. Так, под действием бактерий в одиннадцати случаях отмечено усиление уже имеющейся или появление вновь антибиотической активности актиномицетов. В 8 случаях развитие аткиномицетов подавлялось действием бактерий, в ряде случаев наблюдалось исчезновение воздушного мицелия, задержка спорообразования и т. д.
Приведенные данные показывают, что среди микроорганизмов, обитающих в небольшом кусочке почвы, существуют различные формы взаимоотношений, в том числе и ярко выраженный антагонизм. Однако эти данные еще не доказывают способности организмов образовывать антибиотики при развитии микроорганизмов в почве, так как результаты получены только на лабораторных средах.
О возможности образования в почвах антибиотиков и проявления ими антибиотических свойств непосредственно в этих условиях существуют два противоположных взгляда.
Одни авторы считают, что антибиотики могут образовываться и образуются при развитии микроорганизмов непосредственно в почвах, где они проявляют свою биологическую активность. Другие исследователи полагают, что антибиотики не образуются в почве, а если и образуются, то их биологическая роль, по существу, сводится к нулю.
Сторонники невозможности образования антибиотиков в почвах основывают свои выводы, в частности, на том, что в почве якобы недостаточно питательных веществ, необходимых продуценту для активного развития и образования антибиотиков.
Непосредственно проблеме возможности образования антибиотиков в почвах носвяшено значительное число исследований.
Изучение вопроса об образовании антибиотиков микроорганизмами в почве представляет ряд трудностей. Главные из них связаны с определением антибиотических веществ в почве: во-первых, антибиотики менее стабильны в почве, чем в других субстратах; во-вторых, многие антибиотики и, в первую очередь, антибиотики-основания легко адсорбируются коллоидами почвы и инактивируются почвенным комплексом.
Поскольку к настоящему времени еще нет надежных методов определения антибиотиков в почве, поэтому действительно довольно трудно разобраться в вопросе о том, образует ли изучаемый организм антибиотическое вещество или нет при развитии в натуральной почве.
Пытаясь решить эту проблему, ряд исследователей, изучавших возможность образования антибиотиков в почвах, использовали при этом стерильную «почву» с добавлением к ней разнообразных питательных веществ (глюкоза, пептон, рыбный экстракт, сахарная свекла, солома и др.).
В результате этого удалось установить, что некоторые микроскопические грибы и актиномицеты в этих условиях могут образовывать антибиотические вещества (табл. 5).
45
Образование антибиотиков грибами Aspergillus clavatus и Aspergillus terreus при росте в стерильной почве с добавлением различных субстратов
Таблица 5
Субстрат, добавленный к стерильной почве
Свежая пшеничная солома..............
То же + глюкоза (3—5%)...............
Сахарная свекла .....................
Тимофеевка...........................
Люцерна..............................
Конский навоз........................
Asp. lavatus Asp. terreus
Антибиотическая активность* против
Bacillus Bacterium Bacillus Bacterium
mycoid.es caroto-vorum mycoldes caroto-vorum
28 30 11 0
ПО 117 38 6
49 50 21 3
40 41 13 0
0 0 0 0
0 0 0 0
* Антибиотическая активность выражена в единицах, эквивалентных единицам антибиотика экспансию, образуемого Asp. clavatus.
Приведенные в табл. 5 данные показывают, что в стерильной почве при добавлении к ней пшеничной соломы и 3—5% глюкозы или некоторых растительных остатков (пшеничная солома, сахарная свекла, тимофеевка) грибы образуют антибиотики.
Однако ряд других экспериментов, проведенных с почвами без внесения в них дополнительных питательных веществ, также показали возможность накопления антибиотиков в этих условиях.
Так, например, Str. venezuelae, развиваясь в стерильной почве, не содержащей дополнительных питательных веществ, образует хлорамфеникол. В автоклавированных почвах, как обогащенных, так и не обогащенных источниками азота и углерода, происходит образование актидиона при выращивании в этих условиях Str. griseus.
В стерильной почве без внесения в нее дополнительных питательных веществ образуются также глиотоксин и актиномицин.
Однако при использовании стерильной почвы как субстрата с дополнительным внесением в нее разнообразных источников питания создаются совершенно иные условия, весьма далекие от естественных. Прежде всего, при стерилизации почвы в ней убивается вся флора и фауна, в результате чего почва обогащается дополнительными веществами. Кроме того, в стерильной почве исключается всякая конкуренция за питательные вещества. Под действием высоких температур при стерилизации меняются коллоиды почвы. Одним словом, при стерилизации почва превращается в субстрат с новыми свойствами, только внешне похожий на почву. Поэтому опыты, в которых использовались простерилизованные почвы с добавлением к ним самых разнообразных питательных веществ, порой никогда не встречающихся в естественных условиях (например, рыбный экстракт, кукурузный экстракт и т. п.), не
46
могут доказать возможности или, наоборот, отсутствия способности к образованию антибиотиков микроорганизмами в естественных почвах.
Ряд авторов показал возможность образования антибиотиков в натуральных почвах, но при условии внесения туда дополнительных питательных веществ, объясняя это недостатком в естественной почве необходимых питательных веществ.
Действительно ли в естественной почве не хватает питательных веществ, необходимых для развития микроорганизмов и образования антибиотиков?
Для ответа на этот вопрос нами еще в 1960 г. были проведены специальные эксперименты. Из трех различных образцов почв, взятых из Ботанического сада и Звенигородской биологической станции Московского университета, были выделены актиномицеты и обычным методом отобраны наиболее активные штаммы. Штаммы-антагонисты поддерживались на агаризованной синтетической среде. Была поставлена задача выяснить возможность развития выделенных штаммов актиноминетов и образования ими антибиотиков при культивировании их только на веществах тех почв, из которых они были изолированы. С этой целью были проведены три серии опытов: 1. Выращивание актиномицетов на водных почвенных вытяжках, полученных по методу Виноградского. 2. Культивирование изученных штаммов актиномицетов на водной почвенной вытяжке с добавлением гуматов, выделенных из тех же почв. 3. Культивирование актиномицетов на поверхности агаровых блочков, приготовленных из выщелоченного агара и дистиллированной воды; агаровые блочки помещались на поверхность почвы, покрытой холстиной. Почва находилась в чашках Коха. Предполагалось, что вещества почвы будут диффундировать в толщу агаровых блочков и использоваться актиномицетами, находящимися на их поверхностях.
Антибиотические свойства в первых двух случаях определялись методом диффузии в агар с использованием металлических цилиндров, в третьем — методом наложения кусочков агарового блока на поверхность агаровой пластинки, предварительно засеянной тест-организмом.
Во всех случаях использовалась «оживленная» почва, т. е. почва, которая выдерживалась в течение 48 ч в термостате при 26°С и при достаточной влажности.
Результаты опытов показали, что почти все изучаемые штаммы актиномицетов могут расти (хотя и не так обильно) и образовывать при этом антибиотики только на веществах почвы без добавления дополнительных компонентов.
Таким образом, только на веществах почвы, в которой непрерывно происходят разнообразные биологические процессы, актиномицеты, выделенные из этой же почвы, могут развиваться и образовывать антибиотические вещества.
Можно привести значительное число примеров, указывающих
47
на возможность образования антибиотиков микроорганизмами в естественных местах обитания.
Брайэн с сотрудниками в 1945 г. обратил внимание на очень плохой рост елей в одном из хвойных лесов. Проведенные исследования показали, что угнетение роста елей связано с образованием в почве этого участка веществ, оказывающих ядовитое действие по отношению к микоризе хвойных деревьев. Дальнейшие работы показали, что такими ядовитыми для микоризных грибов веществами являются антибиотики, образуемые некоторыми грибами из рода Penicillium, характерными для этих почв. Позднее Брайэн выделил из гриба Penic. terlikowskii антибиотик глиотоксин, оказавшийся весьма токсичным для микоризных грибов хвойных растений.
Довольно быстрая гибель фитопатогенных микробов в естественной почве позволила Брайэну высказать предположение, что исчезновение возбудителей заболеваний растений связано с антагонистическим действием определенных сапрофитов.
Это предположение было подтверждено рядом экспериментов. Так, если в почву одновременно с фитопатогенным грибом Ophio-bolus graminis внести некоторых сапрофитов, то заражение пшеницы этим грибом резко снижалось или же совсем не наблюдалось. Исследование этого явления показало, что сапрофиты образуют антибиотическое вещество, подавляющее развитие гриба.
Известно, что гриб Trichothecium roseum проникает в плоды яблок лишь через повреждения эпидермы. Как правило, первичным паразитом плодов является гриб Fusicladium dendriticum, затем вытесняемый Trich. roseum. Установлено, что подавление развития Fus. dendriticum происходит в результате выделения Trich. roseum антибиотика трихотецина.
В яблоках, естественно зараженных Trich. roseum, был обнаружен трихотепин в высокой концентрации. Значение образования антибиотика в данном случае, по-видимому, не ограничено только вытеснением первичного паразита, но служит также для защиты субстрата от захвата его другими грибами-конкурентами.
Выделенный из почвы актиномицет Str. melanochromogenes в естественных условиях задерживал разложение целлюлозы, интенсивно осуществляемое Vibrio vulgaris. Антибиотические свойства изученного в лабораторных условиях актиномицета проявлялись как раз по отношению к целлюлозоразрушающим микроорганизмам, в том числе и к V. vulgaris.
Все эти примеры, а их можно привести очень много, показывают, что различные микроорганизмы (бактерии, актиномицеты, грибы), проявляющие антибиотические свойства в лабораторных условиях, угнетают развитие некоторых микроорганизмов и в естественных почвах.
Прямыми анализами показано, что антибиотик, образуемый Str. antibioticus, может синтезироваться непосредственно в почве. Микроскопические грибы рода Penicillium (Р. cyclopium, Р. lapidosum, Р. citrinum), образующие антибиотики — пеницилловую кислоту, патулин и цитринип, синтезируют эти вещества при развитии в поч
48
вах, в которые внесено измельченное сено. В естественных почвах без внесения в них добавок образование названных антибиотиков происходит, но в меньших количествах.
Виноградова (1975), используя метод люминесцентной микроскопии, разработала способ непосредственного наблюдения за развитием актиномицета и образованием антибиотика в натуральной почве. В качестве объекта изучения был использован Streptomyces olivocinereus — продуцент антибиотика гелиомицина (резистомици-на), который оказался хорошей моделью для этих целей; гелиоми-цин способен к яркой люминесценции при фотовозбуждении.
Метод прямого наблюдения за образованием гелиомицина и его состоянием в почве показал, что Str. olivocinereus способен образовывать большое количество гелиомицина в каштановой почве и черноземе без внесения в них дополнительных питательных веществ. Установлено, что антибиотик первоначально образуется небольшими участками гиф, которые затем удлиняются. Затем гифы распадаются, и гелиомицин обнаруживается в виде светящихся «гранул» и их скоплений в почве. В виде этих «гранул» антибиотик может сохраняться в активном состоянии длительное время (более двух месяцев).
Приведенный материал показывает, что антибиотические вещества как продукты жизнедеятельности организмов могут образовываться и накапливаться непосредственно в почвах.
Искусственно внесенные в почву антибиотики сохраняются в ней в течение различного периода времени в зависимости от характера антибиотического вещества и типа почвы (табл. 6). •
Таблица 6
Длительность сохранения нативных антибиотических веществ в натуральных почвах
(по Кореняко с соавт., 1955)
Вид актиномицета Поч вы
подзол серозем чернозем краснозем
Streptomyces violaceus 1806 4 3 3 2
Streptomyces aurantiacus 1149 6 5 5 5
Streptomyces aurantiacus 1306 8 8 8 8
Streptomyces globisporus sp. 2302 . . . 6 5 7 0
Streptomyces globisporus sp. 81 .... 7 6 7 0
Streptomyces sp. 76 20 20 22 20
Streptomyces griseus 2535 1 1 1 1
Streptomyces variabilis 2343 12 12 12 II
Примечание. Цифры — время сохранения антибиотиков в сутках.
Длительность сохранения антибиотиков в почве зависит, как следует из приведенных данных, от типа почвы, ее свойств, а также от природы антибиотического вещества, образуемого тем или другим видом актиномицета.
По-видимому, весьма быстрая инактивация некоторых антибио
49
тиков в красноземе связана с его кислотностью (pH краснозема 4,39—4,84).
Инактивация антибиотических веществ в почве может происходить под действием как биотических, так и абиотических факторов.
Антибиотики основной природы (стрептомицин, эритромицин и некоторые другие) необратимо адсорбируются коллоидами почвы, что иногда приводит к потере ими биологической активности.
В табл. 7 приведены данные о минимальном количестве антибиотиков различной химической природы, которые возможно определить в растворе (контроль) и глине.
Таблица 7
Влияние глины на минимально определяемую концентрацию антибиотиков (по Williams a. Khan, 1974)
Антибиотики Раствор, мкг/мл Глина, мкг/г
тип строения название
Основные Стрептомицин 1,00 25,00
Неомицин 2,50 800,00
Канамицин 0,50 200,00
Полипептиды основные Полимиксин 6,0 800,00
Биомицин 7,5 2000,00
Амфотерные Хлортетрациклин 0,02 0,05
Окситетрациклин 0,10 0,40
Макролиды Карбомицин 0,6 25,00
Эритромицин 2,0 500,00
Из данных, приведенных в табл. 7, следует, что антибиотики — основания и макролиды — в большой степени адсорбируются глиной, в то время как амфотерные антибиотики (тетрациклины) практически не связываются глиной.
Антибиотики, адсорбированные почвенными частицами, тем не менее обладают биологической активностью. Так, адсорбированные почвой стрептомицин и хлортетрациклин подавляют развитие как адсорбированных, так и свободных клеток микроорганизмов. Связанный с почвенными частицами грамицидин оказывает антимикробное действие лишь на адсорбированные клетки микробов, не влияя на свободные.
Основным фактором инактивации антибиотиков в почве является ее микробиологическое население. Во-первых, микроорганизмы, синтезируя кислые или щелочные продукты, могут инактивировать отдельные антибиотические вещества, образующиеся в почве или попадающие туда извне. Во-вторых, почвенные микробы способны образовывать и выделять ферменты, разрушающие антибиотики. Известно, что пенициллин легко разрушается ферментом пенициллиназой, образуемым многими видами сапрофитных почвенных бактерий. Есть также указания на то, что актиномицины могут разрушаться ферментом актиномициназой, образуемым
50
почвенной бактерией из рода Achrotnobacier, и т. д. В-третьих, исчезновение антибиотиков в почве может, по-видимому, также происходить и в результате использования этих соединений микроорганизмами в качестве питательных веществ как источников азота и углерода. Такое предположение основано на том, что почвенные бактерии, относящиеся к Pseudomonas, способны использовать стрептомицин в качестве единственного источника углерода и азота.
Имеются данные о том, что широкоспектровый и сильный антибиотик хлорамфеникол может использоваться некоторыми видами Flavobacterium, устойчивыми к его действию. Ферменты, участвующие в метаболизме фенилаланина, включаются в процесс деградации хлорамфеникола.
БИОЛОГИЧЕСКАЯ РОЛЬ АНТИБИОТИКОВ В ПРИРОДЕ
Результаты, получаемые в лабораторных условиях, нельзя непосредственно переносить на явления, имеющие место в естественных местах обитания микроорганизмов.
Микробный антагонизм в почве протекает своеобразно, иногда значительно отличаясь от антагонизма тех же микробов при развитии на искусственных питательных средах. Это положение имеет особенно важное значение при рассмотрении вопроса о биологической роли антибиотиков, т. е. о той роли этих веществ, какую они играют в естественных местах нахождения микроорганизмов, их образующих.
О биологической роли антибиотиков не существует единого мнения. Это говорит о том, что обсуждаемый вопрос представляет собой не простое явление.
Имеются две противоположные концепции о биологической роли антибиотиков.
Первая исходит из того, что образование антибиотиков следует рассматривать как специфическую особенность обмена веществ организмов, возникшую и закрепленную, у них в процессе эволюционного развития. Образование и выделение антибиотиков в окружающую среду при жизни организмов или после их отмирания— могущественный фактор в борьбе за существование видов.
Биосинтез антибиотиков — наследственная особенность организмов, проявляющаяся в том, что каждый вид (штамм) способен образовывать один или несколько определенных, строго специфичных для него антибиотических веществ.
Вместе с тем известно, что одинаковые антибиотики могут образовываться несколькими видами организмов. И это нисколько не противоречит мысли о наследственно закрепленном свойстве микроорганизмов продуцировать определенные антибиотические вещества.
Выявление потенциальной возможности образовывать в процессе жизнедеятельности антибиотики связано с условиями культивирования организмов. В одних условиях организм образует антибиотик, в других же условиях тот же организм при хорошем росте не
51
будет обладать способностью синтезировать антибиотическое вещество. Однако такие явления наблюдаются в лабораторных условиях культивирования изучаемого организма, в условиях ограниченного или слишком богатого выбора источников питания, измененных условий выращивания.
Вторая концепция состоит в том, что антибиотические вещества, образуемые микроорганизмами, носят случайный характер, зависящий лишь от условий культивирования. По мнению Ваксмана и некоторых других авторов, образование антибиотиков — это незакрепленное свойство организма, проявляющееся только при развитии организма в специфической среде и при наличии особых внешних условий. Поэтому антибиотики не имеют для продуцентов приспособительного значения, их образование не связано с эволюцией микроорганизмов. Эта точка зрения основывается на двух положениях:
1. Не все микроорганизмы образуют антибиотические вещества, что, однако, не мешает их широкому распространению в природе.
2. Антибиотические вещества, даже самые устойчивые, довольно быстро инактивируются в почве, в этом естественном местообитании большинства микроорганизмов. Только при максимальном насыщении почвы антибиотиками можно получить соответствующий биологический эффект.
Как пишут Ваксман и Лешевалье (1962), антибиотики являются «лабораторными продуктами, образуемыми растущими чистыми (подчеркнуто нами. — Н. Е.) культурами микроорганизмов в условиях богатой питательными веществами среды при хорошей аэрации, но они не обнаруживаются в почве».
Итак, по мнению названных авторов, следует, что антибиотики, образуемые микроорганизмами, носят случайный характер, зависящий только от условий культивирования. Если бы это действительно имело место, то мы были бы вправе ожидать, что при изменении условий культивирования для продуцента стрептомицина, можно было бы получить образование, например, хлортетрацикли-на или пенициллина. Но ведь этого никогда не бывает, как бы ни менялись условия культивирования, как бы серьезно ни менялся состав среды для культивирования.
Экспериментатору удается путем изменения условий культивирования получить больший или меньший выход антибиотика или создать условия, при которых антибиотик вообще не образуется. Можно также путем изменения условий культивирования продуцента добиться преимущественного биосинтеза одного из антибиотиков, при условии образования изучаемым организмом нескольких антибиотических веществ, или же получить новые формы антибиотиков, но только в пределах тех соединений, которые способны синтезироваться этим организмом. Но экспериментатору, по-видимому, никогда не удастся достичь того, чтобы продуцент стрептомицина Str. griseus путем изменения условий культивирования начал образовывать хлортетрациклин или пенициллин. Наследственная особенность продуцента стрептомицина состоит в том, что он
52
может образовывать стрептомицин, гризеин или другие антибиотики, свойственные данному виду, и только их, но не пенициллин, не антибиотики тетрациклиновой группы, не актиномицины и никакие другие антибиотики.
Образование антибиотиков нельзя считать случайным явлением в жизнедеятельности микроорганизмов. Этот процесс обусловлен определенным характером обмена веществ, возникшим и закрепленным в процессе эволюции организма. Однако нельзя отрицать того факта, что в отдельных случаях проявление антагонизма у микроорганизмов связано с образованием продуктов обмена, не являющихся специфическими веществами их метаболизма. Такой характер имеет антагонизм у уробактерий, обусловленный выделением аммиака при использовании мочевины, или антагонизм некоторых молочнокислых бактерий, связанный с выделением ими пероксид водорода, и т. д. Но такие продукты жизнедеятельности микроорганизмов мы не называем антибиотиками.
Положение о том, что антибиотики образуются только чистыми культурами, далеко не обязательно. Многие виды микроорганизмов (в частности, актиномицеты) способны образовывать антибиотические вещества только в присутствии других организмов (табл. 8).
Таблица 8
Влияние почвенной микрофлоры (при совместном выращивании) на антагонистические свойства стрептомицетов
(по Макаровской, 1956)
Актиномицеты
Антагонистические свойства актиномицетов
при совместном выращивании с
275
255
555
285
39
152
195
Streptomyces griseus...............
Streptomyces albus.................
Streptomyces globisporus...........
Streptomyces coelicolor............
Streptomyces griseus...............
Streptomyces violaceus.............
Streptomyces violaceus.............
10
8
2
6
6
5
12
6
5
4
4
Обозначения: вне зоны.
цифры — размер зоны просветления в
мм: минус — отсутст-
s
а
4
9
4
7
При описании форм антагонизма (с. 17—21) отмечалось, что образование антибиотиков — лишь одна из форм антагонистических взаимоотношений, существующих в мире микроорганизмов. В борьбе за распространение в природе микроорганизмы «используют» не только фактор антибиотикообразования, но и многие дру
53
гие эволюционно закрепленные особенности, дающие им преимущество в острой конкурентной борьбе с другими видами.
Образование антибиотиков микроорганизмами при культивировании их в условиях лаборатории действительно, по мнению многих исследователей, проявляется далеко не у всех организмов. Так, в ряде работ отмечается, что всего лишь 40—70% штаммов акти-номицетов обладают антибиотической активностью, а остальные штаммы не активны. Однако при соответствующих условиях культивирования все так называемые неактивные штаммы актиноми-цетов способны в той или иной степени образовывать антибиотические вещества и в лабораторных условиях.
Продукты жизнедеятельности ряда микроорганизмов способствуют проявлению антибиотических свойств у так называемых неактивных штаммов актиномицетов; они также вызывают усиление уже ранее определенных антагонистических свойств актиномицетов (табл. 8, 9).
Таблица 9 Влияние продуктов жизнедеятельности различных видов бактерий на антибиотическую активность1 Streptomyces coelicolor штамм 31, обладающего слабыми антагонистическими свойствами
(по Егорову, Поповой и др., 1960)
Вариант опыта
МПБ (контроль)2 . .
Bacillus rusticus . .
Bacterium liquefaciens
Bacterium nitrificans
Achromobacter agile .
Время культивирования актиномицета, сут
4 | 8 I 12
Количество внесенного фильтрата, %
0 1 5 10 0 I 5 Ю 0 1 5 10
— 0—6 18 18 0 0—6 18 0 0 0—6 6 0 0
1 162 54 0 54 18 0 54 0 0
2 162 18 0 54 18 0 54 0 0
3 54 18 0 54 0 0 18 0 0
1 54 18 0 18 0 0 0 0 0
2 18 0 0 18 0 0 0 0 0
3 18 0 0 0 0 0 0 0 0
1 162 54 0 54 54 0 54 18 0
2 162 54 0 54 18 0 54 18 0
3 54 18 0 54 18 0 18 18 0
1 162 54 0 162 54 0 18 18 0
2 162 162 0 54 54 0 18 18 0
3 54 54 0 54 18 0 6 6 0
1 Активность приводится в единицах разведения.
2 В качестве контроля использовалась та же синтетическая среда, что и для опытных вари-антов, ио бактериальные фильтраты заменены тем же количеством МПБ.
Данные, приведенные в табл. 8 и 9, вполне определенно показывают, что число антагонистов, встречаемых среди антиномицетов, определяемых обычными методами, следует признать заниженным. Этот вывод подтверждается результатами более поздних исследований. Применяя при поиске продуцентов антибиотических
54
веществ новые тесторганизмы (например, штаммы микробов с дефектом окисления, актиномицеты), а также используя метод выращивания актиномицетов на средах, содержащих некоторые антибиотики, получены ранее неизвестные антибиотические вещества с ценными свойствами (например, со свойствами антиметаболитов и др.).
Наконец, сторонники второй концепции основываются на том, что антибиотические вещества в почве быстро инактивируются, а поэтому не могут играть какой-либо биологической роли.
Действительно, многие антибиотики, искусственно внесенные в почву, довольно быстро в ней исчезают. Известно также, что многие антибиотики при тех же условиях могут сохраняться в почве довольно длительное время (до нескольких недель).
При рассмотрении вопроса о биологической роли антибиотиков, образуемых в почве, следует иметь в виду, что в почве микроорганизмы расселяются не диффузно, а живут отдельными очагами, колониями.
Микроорганизмы и продукты их жизнедеятельности, в том числе и антибиотики, адсорбируются на частицах почвы. В естественных местах обитания (почва) микроорганизмов происходит своеобразная иммобилизация клеток и образующихся продуктов метаболизма (антибиотиков, ферментов, токсинов и др.) твердыми частицами и коллоидами почвы, что играет огромную роль в проявлении биологической активности у микроорганизмов. В тех местах, где больше органических остатков, микробы развиваются обильнее и образуемые ими очаги имеют большие размеры.
При развитии микробного очага, который может состоять из представителей одного или нескольких (не антагонистичных) видов, образуются продукты жизнедеятельности, в том числе и антибиотические вещества, которые, диффундируя в соседние поры, могут играть там важную биологическую роль.
Итак, приведенный выше фактический материал и, в первую очередь, результаты исследований советских авторов, выполненные в последние годы, с достоверностью показывают, что антибиотики могут образовываться и образуются при развитии микроорганизмов в естественных местах их обитания (почва) без внесения туда дополнительных питательных веществ.
Образовавшиеся в почве антибиотики в зависимости от их химического строения способны сохраняться там определенное время и проявлять свое биологическое действие.
Положения, из которых исходят противники активной биологической роли антибиотиков, ошибочны, а поэтому не могут ни в какой степени поколебать единственно правильный взгляд об активной биологической роли антибиотиков, развиваемый советскими микробиологами и поддержанный рядом зарубежных исследователей, рассматривающих образование антибиотических веществ как средство приспособления, выработавшееся в процессе эволюции.
Разумеется, биологическую роль антибиотиков подробно можно выяснить лишь при детальном изучении отдельных веществ.
4 АНТИБИОТИЧЕСКИЕ СВОЙСТВА МИКРООРГАНИЗМОВ ПРИ ЛАБОРАТОРНОМ КУЛЬТИВИРОВАНИИ
На проявление антибиотических свойств микроорганизмов,как уже отмечалось, оказывают влияние многие факторы. Поэтому необходимо, хотя бы в общих чертах, рассмотреть некоторые из тех, которые могут оказывать наиболее существенное влияние на образование антибиотиков микроорганизмами при культивировании их в лабораторных условиях.
УСЛОВИЯ, НЕОБХОДИМЫЕ ДЛЯ ПРОЯВЛЕНИЯ МИКРООРГАНИЗМАМИ АНТИБИОТИЧЕСКИХ СВОЙСТВ ПРИ ЛАБОРАТОРНОМ КУЛЬТИВИРОВАНИИ
Микроорганизмы, выделенные из естественных мест обитания и культивируемые затем в лабораториях, попадают при этом, как правило, в не свойственные для них условия существования. В лабораториях большинство микроорганизмов поддерживается и изучается в виде чистых культур. В таком состоянии микробы в природе никогда не встречаются. Развитие микроорганизмов, например в почве, происходит зонами, микроколониями, в окружении организмов других видов. Многие клетки микробов адсорбируются почвенными частицами, находятся в иммобилизованном состоянии, обладая при этом свойствами, отличными от свободно живущих клеток.
Отличие состоит также и в том, что при культивировании организмов в виде чистых культур исключается возможность влияния на них других организмов, не проявляется благоприятное или, наоборот, вредное действие продуктов жизнедеятельности других организмов, продуктов распада отмерших клеток других видов и т. п.
В условиях лабораторного культивирования микроорганизмы нередко попадают в исключительно благоприятные условия питания; для них подбираются оптимальная температура развития, благоприятная для роста влажность, кислотность среды и другие факторы, которых организм обычно не имеет в естественных местах обитания.
Организмы, выделенные из природы и перенесенные в лабораторные условия, — это, по выражению Виноградского, «одомашненные, тепличные организмы».
56
При культивировании микроорганизмов в лабораториях обычно имеет место массовое развитие их в ограниченном пространстве. Все это способствует тому, что физиологическая деятельность микроорганизмов, находящихся в условиях лабораторного культивирования, значительно отличается от их деятельности при развитии, например, в почве.
Приведенные примеры показывают, что при лабораторном культивировании микроорганизмов на проявление их антибиотических свойств могут влиять совершенно иные факторы, другие закономерности по сравнению с теми, которые имеют место в природе. Условия, искусственно создаваемые для развития организмов, можно легко контролировать, что позволяет определять роль и влияние отдельных факторов на рост и развитие изучаемого микроба и проявление им различных биохимических, в том числе и антибиотических свойств.
К числу наиболее существенных факторов, оказывающих влияние на проявление антибиотических свойств микроорганизмов, относятся состав среды, ее активная кислотность, окислительно-восстановительные условия, температура культивирования, методы совместного выращивания двух или большего числа видов микроорганизмов и другие факторы, иными словами, весь сложный комплекс условий культивирования микроорганизмов.
СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ
МИКРООРГАНИЗМОВ
Выяснение характера определенного физиолого-биохимического процесса, осуществляемого микроорганизмом, возможно только при тщательном подборе соответствующих питательных сред, использование которых позволит удовлетворительно решить поставленную задачу. При этом нельзя иметь какие-то универсальные среды, пригодные для изучения любого явления или всех закономерностей, связанных с развитием микроорганизма.
При выявлении потенциальных возможностей микроорганизмов образовывать антибиотические вещества подбору сред необходимо уделять самое серьезное внимание.
Понятие «среда для культивирования» включает не только определенный качественный и количественный состав компонентов или отдельных элементов, необходимых для конструктивного и энергетического обмена, организма (источники азота, углерода, фосфора, источники ряда микроэлементов, витамины и ростовые вещества), но также и физико-химические и физические факторы (активная кислотность, окислительно-восстановительный потенциал, температура, аэрация и др.). Все эти факторы, взятые вместе и каждый в отдельности, играют существенную роль при развитии микроорганизма и в проявлении им отдельных физиологических и биохимических функций. Обычно изменение одного из факторов среды влечет за собой изменение другого. Например, внесение в среду в качестве источника азота физиологически кислого соеди
57
нения (NH4)zSO4 может привести в процессе развития организма к резкому изменению pH субстрата, что, в свою очередь, будет сказываться на окислительно-восстановительном потенциале и т. д. В итоге это может резко изменить процесс развития микро-оргайизма, изменить характер протекаемых реакций обмена веществ.
Все это ставит перед исследователями проблему самого внимательного и серьезного отношения к выбору сред для культивирования изучаемых микроорганизмов.
Все известные среды для культивирования микроорганизмов, используемые в микробиологической практике, по характеристике их состава можно разделить на две основные группы: натуральные среды неопределенного состава и синтетические среды, а по физическому состоянию — на три группы: твердые (приготовленные с агаром, желатиной или на кремниевых пластинках), жидкие и сыпучие (увлажненные отруби, зерно).
Натуральные среды неопределенного состава. Натуральными обычно называют среды, состоящие из природных соединений, продуктов животного или растительного происхождения, имеющих сложный неопределенный химический состав. В качестве природных соединений или продуктов, издавна используемых в микробиологии, применяются различные части зеленых растений, животные ткани, солод, дрожжи, фрукты и овощи, а также навоз, почва и т. д. Большинство из них используется в виде экстрактов или настоек.
Преимуществом натуральных сред неопределенного состава является то, что на них хорошо развиваются микроорганизмы большинства видов, так как в составе таких сред имеются, как правило, все компоненты, необходимые для роста и развития. Эти среды, как правило, содержат ряд аминокислот, некоторые витамины и другие ценные для роста микроорганизмов вещества, а также комплексообразующие соединения, способствующие связыванию микроэлементов и, таким образом, препятствующие их осаждению. Кроме того, эти среды легко приготовлять; материал для них дешев и доступен.
Однако не всякая натуральная среда неопределенного состава пригодна для выявления антибиотических свойств микроорганизмов. Например, некоторые актиномицеты хорошо развиваются на разных по составу натуральных средах, но не образуют в этих условиях антибиотических веществ. Кроме того, среды с неопределенным составом мало пригодны или почти непригодны для изучения обмена веществ микробов — они не позволяют учесть потребление многих основных компонентов среды и выяснить, какие вещества образуются по ходу развития организма и т. д.
Натуральные среды неопределенного состава используются для поддержания организмов, для накопления биомассы или для диагностических целей.
К числу натуральных сред с неопределенным составом следует
58
отнести и все среды, в состав которых наряду с соединениями известной химической природы входят вещества неопределенного состава. Широкое применение такие среды находят в микробиологической практике, некоторые из них широко используются в промышленной микробиологии для получения антибиотиков, аминокислот, витаминов и других ценных продуктов жизнедеятельности микроорганизмов. В качестве примера можно привести несколько типов сред.
Мясо-пептонная среда, в состав которой одновременно с мясным экстрактом и пептоном, имеющим сложный, до конца не определенный химический состав, входят поваренная соль, фосфорнокислый калий, иногда глюкоза или сахароза.
Картофельные среды с глюкозой и пептоном, часто используемые для культивирования многих видов актиномицетов и бактерий.
Мясо-пептонные и картофельные среды используются преимущественно в лабораторной практике.
Среды с кукурузным экстрактом, соевой мукой, бардой и другими веществами, в состав которых наряду с названными продуктами неопределенного состава входят и соединения (NH4)2SO4, СаСОз, фосфаты, глюкоза, сахароза, лактоза или иной углевод и ряд других соединений. Эти среды с успехом применяются в про-мыштенных условиях, так как они дешевы по составу и обеспечивают хорошее развитие многих видов микроорганизмов с высоким выходом ценных конечных продуктов жизнедеятельности, в том числе и антибиотиков.
Все среды, приготовленные на агаре или желатине, строго говоря, следует отнести к натуральным средам неопределенного состава. Агар, получаемый из различных видов морских водорослей, по химическому составу является сложным эфирным комплексом полисахарида с серной кислотой с включением разнообразных элементов. По составу агар близок к пектину, содержит некоторые жирные кислоты, определенные количества биотина и тиамина или его компонентов. Все это свидетельствует о неопределенном составе агара как компонента субстрата. Поэтому добавление агара или желатины к любым средам, в том числе и к синтетическим, позволяет причислить их к натуральным средам неопределенного состава.
Композиция натуральных сред неопределенного состава не является также постоянной и потому, что входящие в них растительные или животные продукты не имеют строго постоянного состава, что связано с различными причинами. Так, например, в картофельной среде с глюкозой и пептоном при одной и той же партии пептона и химически чистой глюкозе состав картофельного экстракта будет зависеть не только от сорта картофеля, но и от времени его уборки, от места, где вырос картофель, от срока и режима его хранения и других причин. Следовательно, даже при наличии картофеля одного сорта нельзя приготовить совершенно одинаковые среды для проведения повторных опытов. Тем более нельзя по«
59
лучить одинаковые результаты от опытов, проводимых в различных лабораториях при использовании натуральных сред. Поэтому для получения сопоставимых результатов и особенно для изучения физиологических и биохимических особенностей организма применяются синтетические среды.
Синтетические среды. Под синтетическими следует иметь в виду такие среды для культивирования микроорганизмов, в состав которых входят определенные, химически чистые соединения, взятые в точно указанных концентрациях. Приготовлять синтетические среды следует только на дистиллированной воде.
Синтетические среды по своей композиции могут быть довольно простыми, т. е. они могут состоять из небольшого числа веществ. Вместе с тем они могут быть составлены из большого числа различных компонентов, иметь сложный состав, т. е. быть комплексными средами. Однако если в состав таких комплексных (сложных) сред входят компоненты известного химического состава и в учитываемом количестве, то от этого они не перестают быть синтетическими.
Синтетические среды очень удобны для целей изучения обмена веществ микроорганизмов. Зная точный состав входящих в среду компонентов и их количество, можно, наблюдая за динамикой развития культуры, изучить их потребление и различные превращения в соответствующие продукты обмена.
При правильном подборе необходимых веществ многие организмы способны развиваться на относительно простых по составу средах. Способность расти на простых средах не следует объяснять примитивной организацией микроорганизмов. Наоборот, это скорее свидетельство чрезвычайно сложной ферментативной организации микроба и характеризует его способность синтезировать из элементарных соединений субстрата все в высшей степени сложнейшие белки, витамины и другие компоненты, необходимые для жизнедеятельности организма.
Следует подчеркнуть, что разработать хорошую синтетическую среду, обеспечивающую нормальный рост изучаемого организма и достаточный уровень биосинтеза антибиотика или другого продукта жизнедеятельности,— дело весьма нелегкое, требующее от исследователя много времени и умения для правильной оценки роли и значения того или иного компонента субстрата.
В последнее время все чаще при изучении условий образования антибиотиков и других биологически активных соединений применяются методы математического планирования эксперимента и, в частности, методы математического расчета соотношения компонентов субстрата н их состава. Это обеспечивает значительное повышение выхода нужного продукта, образуемого микроорганизмом. В настоящее время ставится задача с помощью вычислительной техники моделировать опыты, выбирать наиболее рациональное соотношение разнообразных условий культивирования продуцента антибиотика.
Несмотря на ряд трудностей, связанных с разработкой синте
60
тических сред, в распоряжении микробиологов и микологов имеется достаточное количество таких синтетических сред, которые по своему качеству не уступают сложным натуральным средам неизвестного состава.
Для изучения различных вопросов процесса обмена веществ микроорганизмов наиболее подходящими считаются жидкие среды. Плотные (агаризованные) среды с успехом могут быть использованы для изучения цикла развития микроорганизма, архитектоники микробных колоний, диссоциации культур, для очистки культур от сопутствующих организмов и проверки чистоты культуры. Агаризованные среды можно широко использовать во многих предварительных исследованиях. Такие среды широко применяются для выделения микробов-антагонистов из почвы и других естественных субстратов.
Сыпучие среды применяются для сохранения и поддержания многих микроорганизмов — продуцентов антибиотиков, в частности актиномицетов и плесневых грибов.
КАЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА КОМПОНЕНТОВ СРЕДЫ
При использовании тех или иных сред для культивирования организмов с целью выяснения их антибиотических свойств важное значение имеет качественная характеристика отдельных компонентов среды. Под качественной характеристикой входящих в среду компонентов имеют в виду форму основных соединений, в которой они используются. Например, азот может использоваться в среде в окисленной (NOg, NOJ) или в восстановленной (NH*, —NH2) формах.
Источники углерода также могут быть различными: органические кислоты, спирты, сахара и полисахариды, сочетания различных углеродсодержащих соединений и т. д.
Присутствие в среде той или другой формы источника азота нли источника углерода или другого компонента провоцирует организм, естественно, по-разному на них реагировать в зависимости от наличия у микроба тех или иных ферментативных систем и их активности и как результат определенно направлять реакции обмена веществ. Это может способствовать выявлению потенциальных антибиотических свойств микроорганизмов или, наоборот, тормозить их образование.
Подбирая среды нужного состава, следует учитывать специфику культивируемого организма. Это необходимо для создания оптимальных условий (с учетом специфики организма), которые бы способствовали наилучшему росту микроба и биосинтезу необходимых продуктов жизнедеятельности. Например, если организм не может синтезировать некоторые существенные для его жизнедеятельности соединения (как например, аминокислоты или витамины) из простых веществ субстрата, то для его развития следует в состав среды ввести готовые аминокислоты или витамины. К таким «требовательным» организмам относятся некоторые виды бак
61
терий (молочнокислые и др.). Актиномицеты и преимущественно почвенные плесневые грибы, как правило, строят вещества своего тела и довольно сложные по химическому составу конечные продукты обмена из соединений, образуемых из простых компонентов субстрата.
Источники азота
Источники азота оказывают важное влияние на образование антибиотических веществ микроорганизмами. На средах с одними источниками азота организмы могут хорошо развиваться, но не осуществляют в данных условиях биосинтеза антибиотика. Например, продуцент антиопухолевого антибиотика аурантина Str. auranticus прекрасно развивается на среде, содержащей в качестве единственного источника азота пептон, но при этом не образует антибиотика. Биосинтез аурантина идет на среде с нитратом в качестве источника азота. Обычно в средах для культивирования микроорганизмов в качестве источника азота используют соли азотной (HNO3) или реже соли азотистой ( HNO2) кислот, аммонийные соли органических или неорганических кислот (—NH4) или аминокислоты (—NH2), белки и продукты их гидролиза (пептоны, гидролизаты). Как видно, в этих источниках азот находится или в виде окисленной формы (—NO3, —NO2), или в восстановленной форме (ЫЩ, —NH2).
В натуральных средах неопределенного состава, содержащих соевую муку, кукурузный экстракт и другие подобные компоненты, азот содержится главным образом в форме белков, питательная ценность которых зависит от наличия у микроорганизмов соответствующих протеаз, расщепляющих эти белки, и определяется тем, насколько легко в процессе ферментативного гидролиза из белков освобождается азот в виде аминокислот и несложных полипептидов, а в конечном счете в форме —NH2.
Для многих организмов наиболее легко усвояемыми формами азота являются аммонийные соли и аминокислоты, в которых азот находится в восстановленной форме. Так, Str. griseus хорошо развивается на средах, содержащих аммонийные источники азота, но не может использовать нитраты в качестве единственного источника азота.
Аминокислоты играют существенную роль в метаболизме микроорганизмов. Эго объясняется, во-первых, тем, что аминокислоты непосредственно участвуют в синтезе белка (структурного и ферментов) и различных полипептидов; во-вторых, они могут принимать участие в образовании антибиотиков, в том числе и небелковой природы.
Аминокислоты могут оказывать заметное влияние на активность ферментов (индуцировать их образование или репрессировать, подавлять активность). Присутствие в среде одних аминокислот может приводить к образованию других.
62
Однако многие микроорганизмы с успехом могут использовать и окисленные формы азота, некоторые из них для биосинтеза антибиотика нуждаются именно в нитратном источнике азота (Str. auranticus, Str. subtropicus и некоторые другие). По всей вероятности, процесс использования нитратов идет через следующие этапы:
NO^ -> NO^ -> NH3 —>- Аминокислоты —>- Белок
Процесс восстановления нитрата до нитрита идет при участии молибденсодержащего фермента нитратредуктазы. По-видимому, процесс превращения NO2 в NH3 происходит через образование азотноватистой кислоты (H2N2O2), гидроксиламина (NH2OH) и гидрозина (NH2 — NH2). Поэтому схему восстановления нитрата до аммония можно представить следующим образом:
NO3 -> NO, -> H2N2O2 -> NH,OH -> NH2NH2 -> NH, (нитрат) (нитрит) (азотноватис- (гидроксила- (гидрозии) (аммоний! тая кислота) мин)
Для ряда актиномицетов нитраты как источники азота иногда усваиваются лучше, чем аммонийные соли. Даже нитриты, если их вносят в среду в небольших количествах (не более 50 мг Na2NO2 на 1 л среды), могут использоваться актиномицетами в качестве источников азота. Важно отметить, что использование нитритов тесно связано с источником углерода в среде. Например, в присутствии глицерина нитриты используются гораздо лучше по сравнению с тем, когда в среде присутствует глюкоза.
Доступность того или иного источника азота зависит в основном от химической природы используемого углерода. Так, при развитии Str. coelicolor на среде с глюкозой происходит образование органических кислот, в силу чего нитрит, образующийся при восстановлении нитрата, оказывается особенно ядовитым. Если же в среде присутствует аспарагиновая кислота, то ее аминогруппа связывает нитриты и они не оказывают токсического действия.
Использование аммония и некоторых органических источников азота плесневыми грибами в большой степени зависит от наличия в среде органических кислот. Небольшие количества (0,1 — 0,2%) дикарбоновых кислот с четырьмя углеродными атомами (например, янтарная, фумаровая) способствуют лучшему усвоению азота. Это, по всей вероятности, связано с тем, что в данном случае легче образуются кетокислоты, которые, в свою очередь, связывают аммиак. В этом виде значительно упрощается включение аммиака в метаболизм грибов.
Определенную роль в развитии организмов и образовании антибиотиков играют также катионы и анионы солей используемых источников азота Например, при одной и той же форме азота могут получиться разные результаты как в развитии организма, так
63
и в образовании антибиотика. Зависит это от тех особенностей солей, в которых находится данная форма азота (NO~), а также от имеющихся в них катионов (KNO3 и Са(ЬЮ3)г- Влияние ионов калия и кальция (К+ и Са2+) будет различным — непосредственно на организм и через изменение субстрата. Ионы Са2+ могут, например, связывать ионы фосфорной кислоты с образованием нерастворимых соединений, что, в свою очередь, может создать недостаток фосфора в среде.
Или другой пример. Если организм хорошо использует аммонийную форму азота, то для его развития небезразлично, в какой форме этот аммоний вводится в среду. При использовании, например, сернокислого и молочнокислого аммония можно получить различные результаты, несмотря на то, что азот представлен одной и той же формой. При использовании сернокислого аммония среда будет сильно подкисляться в результате накопления ионов серной кислоты. Если же будет использоваться молочнокислый аммоний, то резкого сдвига в значении pH субстрата может не произойти, так как освобождающаяся молочная кислота легко может быть использована организмом в качестве источника углерода.
Таким образом, в данном случае роль аниона при одной и той же форме азота (NH*) будет также различной.
Все эти факторы необходимо учитывать при изучении развития микроорганизмов и возможностей образования ими антибиотиков.
В зависимости от источника азота и формы, в которой он присутствует в среде, микроорганизм будет в состоянии синтезировать антибиотическое вещество или он будет лишен этой способности.
Так, продуцент стрептомицина не образует антибиотика при развитии на средах с нитратами или нитритами в тех случаях, когда они являются единственными источниками азота. Образование стрептомицина происходит на средах с аммонийными источниками азота. То же самое можно сказать и в отношении продуцента хлортетрациклнна — Str. aureofaciens.
Биосинтез пенициллина идет более энергично, если в среде наряду с аммонийным источником азота имеется нитратный источник азота.
Альбомицин, выделяемый из культуры Str. subtropicus, образуется на среде, содержащей в качестве единственного источника азота KNO3.
Источники углерода
Как уже отмечалось выше, использование того или иного источника азота во многом зависит от источника углерода, находящегося в среде. Благодаря различной химической природе, благодаря неодинаковой степени окисленности, источники углерода сами по себе также оказывают существенное влияние на развитие микроорганизмов и, следовательно, на образование ими антибиотических веществ.
64
Иногда на одних источниках углерода развитие организма и биосинтез антибиотика происходят хорошо, на других — организм или совсем не развивается, или развивается, но без биосинтеза антибиотика.
Например, нами было показано, что Bacillus mesentericus, выделенный из ризосферы кукурузы, лучше развивается в жидкой синтетической среде при единственном источнике углерода — глюкозе. Щавелевая, яблочная, лимонная и уксусная кислоты непригодны для развития Вас. mesentericus и образования антибиотика. Установлено, что наилучшим источником углерода в среде является комбинация двух веществ: глюкозы и аспарагиновой кислоты или глюкозы и молочной кислоты. При раздельном использовании глюкозы, аспарагиновой кислоты или молочной кислоты антибиотическая активность этой культуры значительно ниже.
Изучая влияние различных источников углерода на биосинтез грамицидина С культурой Вас. brevis var. G. В. в условиях глубинного выращивания, установлено, что этот организм также по-разному относится к источникам углерода при развитии и образовании грамицидина С (табл. 10).
Таблица 10
Влияние источников углерода на рост Bacillus brevis var. G. В. и биосинтез грамицидина С
(по Коршунову и Егорову, 1962)
100
120
180
95
80
160
Глюкоза . . 300 220 Маннит 0
Галактоза . 250 300 Этанол 0
Мальтоза 250 250 Янтарная кислота .... 350
Сахароза . . 0 140 Пировиноградная кислота 0
Лактоза . . 0 160 Уксусная кислота .... 25
Крахмал . . 250 160 Молочная кислота .... 250
Глицерин 1000 460
Из данных, приведенных в табл. 10, следует, что на среде, содержащей янтарнокислый аммоний (0,5%), такие сахара, как глюкоза, галактоза и мальтоза, способствуют сравнительно хорошему росту организма и относительно высокому уровню биосинтеза грамицидина С (до 250—300 мкг/мл). Лактоза и сахароза в тех же условиях среды не оказывают благоприятного влияния на рост Вас. brevis и в этих условиях не способствуют образованию антибиотика.
При испытании спиртов удалось установить, что только на глицерине происходит хорошее развитие организма и наблюдается относительно высокий выход грамицидина (до 1000 мкг/мл). В слу
3—742
65
чаях с кислотами сравнительно хорошее развитие бактерий и биосинтез грамицидина С происходит только на янтарной и молочной кислотах.
При развитии Penicillium chrysogenum—продуцента пенициллина — лактоза используется организмом медленнее, чем глюкоза, и это сказывается на выходе антибиотика. Если в среде в качестве источника углерода присутствует только глюкоза, то все обменные процессы, осуществляемые грибом, ускоряются. В этих условиях максимум образования пенициллина происходит приблизительно через 50 ч развития культуры, вследствие чего уровень биосинтеза антибиотика остается низким. В присутствии же лактозы максимум образования антибиотика происходит через 150—160 ч и это способствует повышению выхода пенициллина. Поэтому на практике для получения пенициллина обычно используют одновременно и глюкозу и лактозу, что обеспечивает хорошее развитие гриба и высокий уровень биосинтеза пенициллина.
КОЛИЧЕСТВЕННОЕ СООТНОШЕНИЕ ИСТОЧНИКОВ УГЛЕРОДА И АЗОТА В СРЕДЕ
Важное значение для развития организмов и образования ими антибиотиков имеет количественное соотношение источников углерода и азота, содержащихся в среде.
Установлено, что для наиболее благоприятного развития микроорганизма в среде должно существовать определенное соотношение между углеродом и азотом, выражающееся соотношением примерно 20: 1 (C:N = 20).
Однако такое соотношение углерода и азота не всегда благоприятно для образования антибиотика. Далеко не во всех случаях биосинтез антибиотика происходит пропорционально накоплению биомассы микроба. Иногда при хорошем росте организма не наблюдается образования антибиотика или он синтезируется в небольшом количестве.
Поэтому для образования организмом антибиотических веществ необходимо в каждом конкретном случае подбирать соответствующие соотношения углерода и азота в среде.
Для биосинтеза, например, хлортетрациклина культурой Sir. aureofaciens лучшим источником углерода в среде является глюкоза, причем увеличение содержания глюкозы в среде выше 3% при неизменной концентрации других компонентов приводит к заметному снижению выхода антибиотика.
Имеется и ряд других примеров, показывающих, что при изменении в среде определенного соотношения отдельных компонентов происходит изменение биосинтетической активности организма. Так, для продуцента тетрациклина Str. aureofaciens концентрация глюкозы в среде, равная 50 мг/мл (при содержании 2,4 мг/мл аммонийного азота), способствует максимальному росту актиноми-цета (около 20 мг/мл) с образованием почти 200 мкг/мл антибиоти
66
ка. Увеличение концентрации глюкозы до 80—85 мг/мл тормозит рост актиномицета, а 26 мг/мл сахара не обеспечивает нормального роста микроорганизма.
Для продуцента антибиотика альбомицина Str. subtropicus установлено, что при создании в среде избытка углерода и недостатка азота (KNO3) наблюдается значительное изменение характера протекаемого процесса. Уменьшение количества азота не сказывается отрицательно на росте актиномицета. Однако при этом условии происходит очень быстрое использование азота нитрата, а время полного потребления углевода значительно растягивается, наблюдается существенное ослабление протеолитического процесса. При таких условиях развития актиномицета происходило снижение образования антибиотика.
Совсем иная картина наблюдается при изменении соотношения источника углерода и азота в среде в сторону значительного снижения концентрации углерода. При недостатке углевода в среде происходит его быстрое потребление, в то время как нитрат еще содержится в среде. Эти условия оказывают благоприятное действие на биосинтез альбомицина.
ИСТОЧНИКИ МИНЕРАЛЬНОГО ПИТАНИЯ И ИХ РОЛЬ В РАЗВИТИИ МИКРООРГАНИЗМОВ
Жизнь микроорганизмов и их биохимическая деятельность во многом зависит от наличия в протоплазме клеток и в окружающей среде неорганических соединений, содержащих такие элементы, как фосфор, калий, кальций, магний, сера, железо, марганец, цинк, медь, молибден и др.
Макро- и микроэлементы играют важную роль в жизнедеятельности микроорганизмов. Многие из них входят в состав протоплазмы микробной клетки в качестве составных частей некоторых ферментов, другие элементы выступают в качестве компонентов, регулирующих осмотическое давление или изменяющих гидрофильность протоплазмы клеток.
В золе микроорганизмов обнаруживаются фосфор, калий, магний, кальций, натрий, сера, железо, марганец, медь, цинк, бор, висмут и некоторые другие элементы. В расчете на массу сухого вещества фосфор составляет до 4,5%, калий — до 1,3, магний — до 0,5, кальций — до 0,8, натрий — до 1,0, сера — до 1,0, железо — до 0,2% и т. д.
Однако присутствие того или иного элемента в золе микроба еще не указывает на то, что этот элемент действительно необходим микроорганизму. В золе могут обнаруживаться элементы, которые в процессе жизнедеятельности микроба адсорбировались на его поверхности. Вместе с тем теперь точно установлено, что большинству указанных элементов принадлежит активная роль в биохимической деятельности микроба.
3*
67
Макроэлементы и их значение в жизнедеятельности микроорганизмов
Макроэлементы (фосфор, сера, калий, кальций и магний) входят в состав клетки как структурные элементы или же являются частью ферментных систем. И в том и в другом случае они выполняют важнейшие физиологические функции клетки: регулируют проницаемость клеточной мембраны, участвуют в переносе энергии, выполняют роль активаторов ряда ферментов и т. д.
Фосфор. Фосфор необходим для жизнедеятельности всех организмов, так как он входит в состав важнейших соединений клетки: нуклеопротеидов, нуклеиновых кислот, полифосфатов, фосфолипидов, а также обнаруживается в некоторых промежуточных продуктах обмена. Помимо этого соединения фосфора играют определенную роль в различных химических превращениях и в особенности в углеводном обмене и в переносе энергии.
Большинство микроорганизмов легко использует в качестве источников фосфора неорганические ортофосфаты. Отдельные виды могут наряду с использованием фосфатов потреблять и фитаты (соли инозитфосфорных кислот). К числу таких организмов относятся некоторые грибы, например Penicillium chrysogenum.
Недостаток фосфора в среде приводит к резкому изменению у актиномицетов обмена веществ, связанного с нарушением потребления и усвоения углеводов и азота. В свою очередь избыток фосфора в среде также резко влияет на метаболизм организмов.
При избытке минерального источника фосфора в среде происходит изменение в биохимическом составе протоплазмы мицелия актиномицетов, нарушаются физиологические функции клетки; иногда это резко сказывается на процессе образования антибиотиков.
Продуцент стрептомицина Streptomyces griseus весьма чутко реагирует на изменение концентрации фосфора в среде; изменяется содержание в цитоплазме рибонуклеиновой кислоты (РНК) и дезоксирибонуклеиновой кислоты (ДНК) в ядерном веществе, что приводит к смещениям в жизненном цикле актиномицета.
Оптимальное содержание фосфора в среде, в зависимости от ее состава, от 14 до 140 мкг/мл обеспечивает хорошее развитие актиномицета и образование стрептомицина. При повышении концентрации фосфора происходит резкое снижение выхода антибиотика.
Аналогичные закономерности наблюдаются у продуцентов антибиотиков тетрациклиновой природы {Streptomyces aureofaciens. Str. rimosus), у продуцента аурантина (Str. auranticus) и ряда других организмов. Однако продуцент грамицидина С Bacillus brevis не реагирует заметно на изменения концентрации фосфора в среде в пределах от 0,2 до 1% двузамещенного фосфата калия. То же самое можно сказать и о продуценте новобиоцина.
Все это дало основание Левитову и Бринберг (1967) условно разделить продуценты антибиотиков по отношению к концентрации фосфора в среде на три группы:
68
1. Высокочувствительные продуценты, для которых оптимальная концентрация фосфора в среде составляет менее 10 мг% (продуценты нистатина, тетрациклинов, флоримицина, ванкомицина).
2. Продуценты средней чувствительности, для которых оптимальная концентрация фосфора составляет 10—15 мг % (продуценты стрептомицина, эритромицина, циклосерина, неомицина).
3. Малочувствительные продуценты, для которых оптимальная концентрация фосфора составляет 18—20 мг % (продуценты ново-биоцина, грамицидина, олеандомицина).
Содержание фосфора в среде оказывает большое влияние на развитие плесневых грибов. Повышение концентрации этого элемента способствует преимущественному развитию мицелия Penicillium chrysogenum, соответствующего I—III возрастным фазам. Уменьшение концентрации фосфора в среде приводит к образованию мицелия IV—VI возрастных фаз (табл. 11).
Таблица 11
Влияние концентрации фосфора в среде на изменение мицелия Penicillium chrysogenum штамма 369 (% к общему объему биомассы) и образование пенициллина
(по Дмитриевой, 1966)
Концентрация фосфора, мг % Общий объем биомассы, г % за 144 ч Фаза мицелия Антибиотическая активность, ед/мл
I—III IV-VI
365 2,7 64 36 2000
90 2,2 40 60 1400
23 1,0 39 61 600
Примерно 30—50% фосфора среды потребляется плесневыми грибами за первые 24 ч роста.
Сера. Белок и простетические группы (—SH) некоторых ферментов и коэнзима А содержат серу; без ее наличия в среде не происходит полноценного синтеза белка, нарушаются процессы обмена. Обычно источниками серы в среде являются неорганические сульфаты; поэтому для включения серы в органическую молекулу, входящую в состав белка или витаминов, сульфат должен быть восстановлен.
Наиболее важным серосодержащим компонентом клетки является аминокислота цистеин, присутствующая главным образом в белках в виде аминокислотного остатка. Восстановление сульфата в цистеин в микробной клетке идет с участием ряда ферментов (сульфурилазы, пирофосфатазы, сульфитредуктазы) через образование сложных серосодержащих фосфорных соединений. На последнем этапе сульфитредуктаза катализирует перенос шести электронов от ЗНАДФН2 на сульфит, который образуется в результате восстановления аденозин-З-фосфат-5-фосфосульфата с участием тиолового соединения (тиоредоксина), с выходом H2S. Серово
69
дород, соединение очень токсичное для большинства микроорганизмов, немедленно включается в О-ацетилсерин. Образующийся при этом L-цистеин — самый важный предшественник серосодержащих соединений клетки;
соон
I h2n-ch I CH2SH L-цистеин
Образование большинства других серосодержащих компонентов клетки связано с —SH группой цистеина.
Схематически восстановление сульфата до цистеина можно выразить следующим образом (Готтшлак, 1982);
Активный транспорт
Сульфат (снаружи)---------------> Сульфат (внутри)
АТФ-сульфурилаза
АТФ + сульфат------------------> Аденозин-5-фосфосульфат (АФС) +
4-ПФ (пирофосфат)
АФС-фосфокиназа
АТФ + АФС----------------> Аденозин-3'-фосфат-5'-фосфосульфат
(АФФС) + АДФ
АФФС-редуктаза
2R—SH + АФФС------------------>- Сульфит 4- АМФ-З'-фосфат 4-
+ R—SS-R
Сульфитредуктаза
Сульфит + ЗНАДФН2---------------->- H2S 4- ЗНАДФ
О-ацетил—серин—ацетатлиаза
О-ацетил-Ь-серин 4- H2S-----------------------> L-цистеин 4-
4- ацетат 4- Н2О
Соединения серы участвуют в энергетических процессах микроорганизмов, входят в состав многих физиологически активных соединений.
Сера входит в состав некоторых антибиотиков, образуемых грибами (например, пенициллин, цефалоспорин, глиотоксин), бактериями (бацитрацины, субтилины, низины), актиномицетами (эхи-номицины, группа тиострептона), и в другие компоненты, такие, как тиомочевина, метилмеркаптан и др.
Характерной особенностью антибиотиков, относящихся к группе тиострептона (объединяет более 25 антибиотиков, в том числе тиострептон, сиомицин, тиопептин, актинотиоцин и др.), является то, что в составе их молекул содержится до 16% серы. Сера входит в состав тиазольного цикла, образующегося путем конденсации и последующих превращений цистеиновых остатков.
70
Сера стимулирует образование протеолитических ферментов у Penicillium chrysogenum, что сопровождается параллельным биосинтезом пенициллина. При биосинтезе пенициллина лучшим источником серы для продуцента антибиотика является тиосульфат натрия.
Изменение концентрации серы в среде приводит к изменению физиологического состояния мицелия Р. chrysogenum и уровня биосинтеза пенициллина. Причем сера выступает в качестве своеобразного конкурента фосфора при воздействии их на мицелий гриба. При повышении концентрации фосфора, как отмечалось, наблюдается развитие не продуцирующего антибиотик мицелия гриба 1— III возрастных фаз. Увеличение же концентрации серы, наоборот, способствует тому, что наибольшее число биомассы гриба составляет продуктивный мицелий IV—VI возрастных фаз.
Калий. В организме калий выполняет прежде всего каталитическую роль. К сожалению, точная роль калия пока еще не вполне выяснена. Известно, например, что недостаток калия способствует накоплению щавелевой кислоты у Aspergillius niger. Очень низкая концентрация калия в среде вызывает снижение потребления сахара этим грибом.
Калий выступает в качестве активатора некоторых ферментов (амилазы, инвертазы), он способствует увеличению гидратации протоплазмы клетки.
Кальций. Ионы кальция регулируют активную кислотность (pH) среды, а также выступают в качестве фактора, связывающего остатки фосфорной кислоты. Вместе с тем, не входя в состав про-стетической группы ферментов, ионы Са активируют некоторые из них (липазы, аденозинтрифосфатазы и др.). Кальций может выступать в качестве ингибитора некоторых ферментов, активируемых магнием. Он является кофактором а-амилазы.
При наличии в среде ионов Са наблюдается снижение лизиса некоторых бактериальных клеток.
Термоустойчивость бактериальных спор связана с наличием в спорах дипиколиновой (пиридин-2,6-дикарбоновой) кислоты, которая в процессе прорастания спор полностью из них исчезает.
Дипиколиновая кислота
Ионы Са играют каталитическую роль в синтезе дипиколиновой кислоты и, таким образом, определяют термостабильность спор.
Несмотря на ограниченные сведения о роли кальция в жизнедеятельности микробной клетки, известно, что он оказывает существенное влияние на азотный, углеводный и фосфорный обмен микроорганизмов.
71
Магний. Основная функция магния — активация ферментов, необходимых для нормального обмена веществ и роста микроорганизмов.
Ведущая роль Mg2+ связана с гликолитическим циклом, где важное значение отводится переносу фосфатов. Довольно часто Mg2+ выступает как связующее звено между ферментом (энзимом) и субстратом. Он принимает участие в стабилизации двойной спирали ДНК. Ионы магния играют важную роль в процессе фосфорилирования. Оптимальный эффект действия магния зависит от концентрации источников углерода, от образования организмом оксикислот, от концентрации других ионов, в отношении которых магний является антагонистом.
Магний принадлежит к числу весьма физиологически активных металлов. Поэтому его значению в процессе биосинтеза антибиотических веществ должно быть уделено серьезное внимание.
Микроэлементы и их физиологическая роль
Микроэлементы (Fe, Си, Zn, Мп, Мо, Со и др.) также играют существенную роль в жизнедеятельности микроорганизмов. Эти микроэлементы входят в состав ряда ферментов, участвующих з процессах метаболизма.
Названные элементы обладают высокой каталитической активностью в процессах внутриклеточного обмена. Их каталитическая активность возрастает в тысячи и миллионы раз в тех случаях, когда ионы металлов соединятся с молекулами органических веществ и образуют так называемые органоминеральные комплексы. Эти внутрикомплексные металлорганические соединения (хелаты) играют важную роль в реакциях фермент — субстрат.
У микроорганизмов в образовании хелатов принимают активное, участие дикарбоновые аминокислоты и белки.
Железо. Ионы железа играют в жизнедеятельности микроорганизмов главным образом каталитическую роль. Железо входит в состав ферментов — активаторов кислорода, первое место среди которых занимает система цитохромов. Недостаток или избыток железа в среде приводит к нарушению тех или иных сторон метаболизма.
Установлено, что существует конкуренция между железом и марганцем за положение в геме железосодержащих ферментов.
Железо наряду с другими металлами, входя в состав окислительно-восстановительных ферментов, играет большую роль в окислительно-восстановительных процессах.
Ионы железа входят в состав некоторых антибиотических веществ. Так, например, продуцент альбомицина Str. subtropicus образует антибиотик при наличии в среде значительной концентрации железа, железо также входит в состав молекулы этого антибиотика.
Железо необходимо для образования хлорамфеникола и других антибиотиков. Показано, что железо играет важную роль в процессе биосинтеза стрептомицина. Ионы железа наряду с ионами нике
72
ля и цинка подавляют активность фермента маннозидострептоми-циназы, способствующего в процессе развития актиномицета превращению малоактивного маннозидострептомицина в стрептомицин.
Однако ионы железа оказывают угнетающее действие на биосинтез хлортетрациклина вследствие образования комплекса (Fe-антибиотик), который вступает в связь с клетками мицелия актиномицета.
Влияние железа на биосинтез тетрациклина культурой Str. aureofaciens зависит как от концентрации этого элемента в среде и ее состава, так и от особенностей штамма. Концентрация железа, равная 25—35 мкг/мл, не меняется в течение всего процесса развития актиномицета. Добавление к среде магния стимулирует образование тетрациклина, а микроэлементы бор, кобальт, литий, цинк, молибден, вольфрам, алюминий, олово угнетают биосинтез этого антибиотика.
Есть данные о том, что железо и медь угнетают процесс спорообразования у бактерий.
Медь. Наряду с железом существенную роль в метаболизме микроорганизмов играет медь. В сочетании со специфическими белками она образует ряд ферментных систем. Представителями этой группы ферментов являются полифенолоксидазы и аскарбинокси-дазы, нитратредуктаза, альдегидоксидаза и др. Недостаток Си резко снижает активность названных медьсодержащих ферментов.
Установлено, что в процессе биосинтеза некоторых антибиотиков ионы железа и меди иногда выступают как антагонисты. Известно, что ионы железа необходимы для биосинтеза пенициллина. Однако добавление меди (CuSO4) к среде тормозит процесс образования антибиотика, но не оказывает влияния на рост гриба.
Внесение в среду железа (Ре2(5О4)з) снимает вредное для биосинтеза пенициллина действие меди.
Цинк. Как и другие элементы минерального питания, цинк играет важную роль в биохимической деятельности микроорганизмов. Он участвует в построении некоторых ферментных систем (фосфатаз, энолаз, полипептидаз). Известно, что ионы цинка оказывают влияние на углеводный, азотный и фосфорный обмены ряда организмов и участвуют в окислительно-восстановительных процессах.
Ионы цинка играют каталитическую роль в РНК-полимеразах микроорганизмов. Поэтому при недостатке ионов цинка в среде может происходить непосредственное нарушение информационной РНК при синтезе белков, в том числе и ферментных систем. А это, в свою очередь, может приводить к изменению синтеза антибиотиков.
Цинк оказывает влияние на процесс накопления грибами органических кислот, в частности лимонной кислоты. Этот элемент способствует биосинтезу ряда антибиотических веществ (хлорамфеникола, стрептомицина, пенициллина и др.). Например, недостаток цинка в среде для развития продуцента стрептомицина приводит к значительному замедлению роста актиномицета. Отсутствие в среде ионов цинка резко снижает образование неомицина.
73
Марганец. Элемент входит в состав многих ферментных систем и, в первую очередь, в состав карбоксилаз. Он принимает, по-видимому, участие в синтезе протеиназ. Марганец входит также в состав фосфорилаз, которые участвуют в переносе фосфорной кислоты от аденозинтрифосфата.
Установлено, что Мп способствует сохранению внутриклеточных энзимов, участвующих в синтетических процессах при образовании спор некоторыми аэробными бактериями. Таким образом, в присутствии ионов марганца происходит стимулирование процесса спорообразования у бактерий.
Кобальт. Определенное влияние на различные стороны метаболизма микроорганизмов, в том числе на процессы биосинтеза некоторых антибиотиков, оказывает кобальт. Установлено, например, что ионы кобальта повышают биосинтез таких антибиотиков, как гентамицин, курамицин А, фосфономицин. Минимальная концентрация СоС12-6Н2О, обеспечивающая максимальное образование гентамицина культурой Micromonospora purpurea var. violacea, равна 0,8 мкг/мл. Недостаток кобальта в среде снижает процесс образования антибиотика, а его избыток подавляет биосинтез гентамицина.
РОЛЬ ГАЛОГЕНОВ И ВОДЫ В ЖИЗНЕДЕЯТЕЛЬНОСТИ МИКРООРГАНИЗМОВ
Хлор, иод, бром, фтор. Роль галогенов в жизни микробов и их биохимической деятельности неизвестна. Показано, что эти элементы входят в состав некоторых тетрациклиновых антибиотиков и хлорамфеникола. Нередко хлор и бром выступают в качестве антагонистов в процессе биосинтеза названных антибиотиков.
Вода. Известно, что вода играет чрезвычайно важную роль во всех жизненных процессах, хотя сама по себе она не является питательным веществом или источником энергии. Она входит в живую клетку как важнейшая ее часть и составляет единую систему с элементами клетки. Вода — растворитель, способствующий проникновению в клетку необходимых веществ и выводу из клетки продуктов обмена. В клетках вода находится не только в виде чистого растворителя, но также в виде соединений с углеводами, белками и другими веществами, тесно взаимодействуя с макромолекулами клетки. Гидратирование и дегидратирование органических молекул — важнейший этап в превращении химических компонентов протоплазмы.
Накоплено множество данных о роли воды в жизни растений и животных, но очень мало сведений о водном метаболизме у микроорганизмов.
Поступление воды в бактериальную клетку регулируется цитоплазматической мембраной.
Неизвестно, какую роль в метаболизме микроорганизмов имеют связанная вода, тяжелая вода и различные полимеры воды (Н2О; (Н2О)2; (Н2О)3 и т. д.). Есть некоторые данные о том, что связан
74
ная вода влияет на устойчивость бактериальных спор к действию неблагоприятных условий. Установлено, что скорость роста Е. coli более низкая в среде, приготовленной на свежей дистиллированной воде (преимущественно моно- и дигидрол), чем в среде, приготовленной на воде свежерастопленного льда (преимущественно три-гидрол).
Высокополимеризированные молекулы воды являются весьма важными во многих физиологических процессах. Этим самым, по мнению некоторых авторов, объясняется богатство микрофлоры в Северном океане.
Сведения о влиянии воды различных форм на процесс антибио-тикообразования у микроорганизмов отсутствуют.
* * *
Приведенные выше данные со всей определенностью показывают, что специфика отдельных компонентов субстрата и их количественные соотношения имеют существенное значение для развития микроорганизмов и биосинтеаа ими антибиотических веществ. Но, как уже отмечалось, наряду с качественной и количественной характеристиками отдельных компонентов среды важную роль в жизнедеятельности микроорганизмов играют также активная кислотность (pH) среды, окислительно-восстановительный потенциал, температура, аэрация субстрата.
ВЛИЯНИЕ pH СРЕДЫ
Активная кислотность (pH) среды оказывает существенное влияние на развитие микроорганизмов, на характер их обмена и, следовательно, на процесс образования антибиотиков. Влияние pH может проявляться как непосредственное воздействие ионов водорода или гидроксильных ионов на клетку или как косвенное действие через изменение степени диссоциации веществ субстрата. Изменения pH среды заметно сказываются на активности ферментов микроорганизмов, состоянии промежуточных продуктов, их диссоциации, растворимости и т. д. Таким образом изменение активной кислотности среды оказывает значительное влияние на выход конечных продуктов метаболизма микроорганизмов.
Каждый исследователь перед посевом микроорганизма, обязан в первую очередь проверить значение pH среды.
Многие бактериальные организмы, образующие антибиотики, развиваются лучше при нейтральном значении исходной активной кислотности среды (pH около 7,0). Хотя некоторые бактерии, например молочнокислые стрептококки, синтезирующие низин, развиваются в среде при pH, равном 5,5—6,0.
Большинство актиномицетов-антагонистов хорошо развивается в тех случаях, когда начальное значение pH среды находится в пределах от 6,7 до 7,8. В подавляющем большинстве случаев актино-мицеты не развиваются при pH ниже 4,5—4.
75
В последние годы выделены ацидофильные стрептомицеты, оптимум pH развития которых лежит в пределах 3,5—6,5.
Грибы, как правило, могут развиваться при слабокислой начальной реакции среды (pH=4,5—5).
В ходе развития организмов происходит изменение pH среды, которое зависит как от состава субстрата, так и от физиологических особенностей самого организма.
Иногда можно заранее сказать, в какую сторону будет идти изменение pH субстрата при развитии иа нем того или иного микроорганизма. Так, если в среде в качестве единственного источника азота присутствует физиологически кислая соль (например, аммоний сернокислый) и отсутствуют в достаточном количестве, например, ионы кальция, то при развитии любых организмов, использующих азот аммония, будет идти довольно сильное подкисление субстрата. И, наоборот, если в среде имеется в качестве единственного источника азота физиологически щелочная соль (например, KNO3), то при использовании азота этого соединения будет идти подщелачивание субстрата. Среда, как правило, будет подщелачиваться и в том случае, если организм при развитии в качестве источников углерода активно использует соли органических кислот.
Необходимо подчеркнуть, что как сильное подкисление, так и значительное подщелачивание субстрата может приостановить развитие организма, прекратить процесс образования антибиотика.
Следовательно, составлять среды надо с таким расчетом, чтобы при развитии организмов в них pH среды по возможности остался в пределах нормы, необходимой для развития микроба и биосинтеза антибиотического вещества.
ТЕМПЕРАТУРА
Для нормального развития микроорганизмов и образования ими антибиотических веществ необходима определенная температура.
Различные группы микроорганизмов для своего развития с образованием антибиотиков нуждаются в различных оптимальных температурах. Для большинства бактериальных организмов температурный оптимум развития лежит в границах 30—37°С. Для Bacillus brevis — продуцента грамицидина С — оптимальной температурой для развития и биосинтеза антибиотика является 40°С. Хотя этот же организм может нормально развиваться и синтезировать антибиотик и при температуре 28°С, при этом лишь максимум накопления грамицидина запаздывает примерно на 24 ч. Актино-мицеты — продуценты антибиотиков, как правило, культивируются при температуре 26—30°С, хотя некоторые виды стрептомицетов могут развиваться как при пониженных температурах (от 0 до 18°С), так и при повышенных (55—60°С). Для большинства плесневых грибов оптимальной признана температура 25—28°С. Для термофильных микроорганизмов температурный оптимум лежит в пределах 50—65°С.
76
Отклонение температуры развития в ту или другую сторону обычно вызывает замедление роста микроорганизма и снижение выхода антибиотика. Обусловлено это тем, что температура оказывает существенное влияние на активность ферментов продуцентов антибиотиков, активность транспортных систем и на другие важные физиолого-биохимические функции микробной клетки. Так, транспорт нейтральных аминокислот в клетки актиномицетов осуществляется стереоспецифической транспортной системой, единой для всех этих аминокислот. Поступление в клетки актиномицета L-ва-лина — основного компонента биосинтеза остатков N-метил-Ь-ва-лина и D-валина в полипептидных цепях актиномицинов — происходит с помощью системы активного транспорта. Активность этой системы заметно изменяется в зависимости от температуры, проявляя максимум в пределах 18—23°С.
АЭРАЦИЯ
Аэрация — один из существенных факторов условий культивирования, определяющих характер развития микроорганизмов и их биосинтетическую активность.
Большинство изученных продуцентов антибиотиков — аэробы, а потому для их оптимального развития необходима определенная степень аэрации среды. Известно, что степень аэрации служит одним из обычных способов изменения окислительно-восстановительных условий, которые являются основным средством изменения процессов обмена веществ у микроорганизмов, в том числе и процессов, связанных с образованием антибиотиков.
Аэрирование культур осуществляется в основном тремя способами: а) путем продувания определенного объема воздуха через культуральную жидкость с одновременным ее перемешиванием или без него; б) путем встряхивания культуральной жидкости, находящейся в колбах, на специальных аппаратах (качалки, шюттель-ап-параты) и в) путем выращивания микроорганизмов в виде пленки на поверхности питательной среды.
Наиболее совершенным методом аэрации следует признать метод продувания воздуха через культуральную жидкость с одновременным ее перемешиванием. В этом случае степень аэрации культуры можно учитывать количественно.
Степенью аэрации культуры, равной единице, является такая аэрация, при которой через определенный объем среды за одну минуту продувается такой же объем воздуха. Иными словами, степень аэрации равна единице, если через 100 л культуральной среды пропускается за одну минуту 100 л воздуха. Если степень аэрации равна 0,5, то это означает, что через 100 л культуральной жидкости пропускается в минуту 50 л воздуха:
„ объем воздуха, л ,
Степень аэрации=----------------в 1 мин.
объем среды, л
77
Установлено, что если степень аэрации близка к единице, происходит максимальное накопление ряда антибиотиков (пенициллина, стрептомицина и др.). Уменьшение степени аэрации среды или ее чрезмерное увеличение приводит к уменьшению выхода антибиотика.
Интенсивность аэрации определяется скоростью поступления в реакцию кислорода, растворенного в единице объема среды. Для количественных результатов определения растворенного в среде кислорода часто используют специальные датчики. Наиболее удобны платиновые электроды, защищенные от окружающей среды газопроницаемой пленкой.
Применение сульфитного метода при определении интенсивности аэрации позволяет получить лишь сравнительную оценку, НО' не дает данных по количественному содержанию кислорода в субстрате.
Степень аэрации существенным образом влияет на биосинтез грамицидина С культурой Вас. brevis var. G. В. при выращивании ее в стеклянном сосуде при перемешивании среды с помощью магнитной мешалки (табл. 12).
Таб шЦа 12
Влияние аэрации на биосинтез грамицидина С при продувании стерильного атмосферного воздуха через среду для культивирования и перемешивании магнитной мешалкой
(по Коршунову, 1962)
Концентрация антибиотика, мкг/ МЛ Сухая биомасса, мг на 100 мл среды pH среды
Степень аэрации среды Время культивирования , ч
24 48 72 24 48 72 24 48 72
0,8 1600 1600 1500 650 600 550 6,0 5,8 5,6
1,0 500 500 450 300 300 250 6,0 5,5 6,9
1,5 250 200 200 200 200 180 7,1 6,0 5,8
Следовательно, наилучшей в данных условиях опыта будет степень аэрации, равная 0,8. В этом случае отмечается хороший рост бактерий и высокий уровень образования грамицидина (до 1600 мкг/мл). С увеличением степени аэрации до 1,0 и 1,5 наблюдается значительное снижение роста бактерий и уменьшение биосинтеза антибиотика.
Насыщение культуральной среды кислородом зависит не только от количества воздуха, пропускаемого через единицу объема среды, но и от способа перемешивания, скорости работы мешалок, состава среды и концентрации растворенных в ней веществ (табл. 13), а также от температуры культивирования.
Для большего насыщения жидкости кислородом воздуха используются барботеры и различные типы мешалок. Через барботеры воздух проходит одной или несколькими тонкими струями и под
78
Таблица 13
Влияние концентрации растворенных в среде веществ на скорость растворения кислорода
(по Гринюк, Бинбернг, 1960)
Растворенное вещество Концентрация растворенных веществ, % Максимальная скорость растворения кислорода, мг/л/мин
Вода 13,5
Глюкоза 2,00 10,0
Глюкоза 20,00 6,3
(NH4)2SO4 0,35 10,3
(NH4)2^^4 0,50 8,3
NaCl 0,20 11,0
NaCI 2,00 10,1
действием мешалки (обычно скорость вращения мешалки 200— 400 об/мин) распыляется, что создает условия для большего насыщения среды кислородом. Чем выше скорость вращения мешалки, тем значительнее насыщение культуральной жидкости кислородом воздуха.
Перемешивание культуральной жидкости способствует равномерному распределению питательных веществ и перемещению их к клеткам микроорганизма. Перемешивание обеспечивает также удаление с поверхности клеток продуктов обмена и лизиса клеток, более равномерное распределение кислорода в культуральной жидкости. Все это улучшает условия развития микроорганизмов и повышает их физиолого-биологическую активность, связанную с биосинтезом антибиотиков.
При культивировании микроорганизмов в колбах на качалках степень аэрации среды зависит от числа оборотов качалки в минуту и объема культуральной жидкости: чем меньше объем среды в колбе, тем выше ее аэрация. Поглощение кислорода средой увеличивается, если вместо обычных конических колб применяются колбы с отбойниками (табл. 14).
Таблица 14
Интенсивность аэрации в зависимости от объема среды и типа колб
Условия культивирования Тип колб Объем среды, мл Поглощение раствором Сульфата, мг/л/ч
На качалках Обычные на 750 мл 200 340
190—200 об/мин 100 670
50 1220
Те же С четырьмя отбойниками 150 1920
100 2930
50 4280
Стационарные Обычные на 750 мл 100 90
79
Степень аэрации культур, выращиваемых в виде пленки на поверхности жидкой среды, можно регулировать изменением площади развития организма и толщины слоя жидкости. С увеличением площади развития организма и уменьшением слоя жидкости аэрация культуры будет большей.
Интенсивность аэрации (скорость, с которой кислород вступает в реакцию) зависит от объема среды, условий перемешивания культуральной жидкости и температуры (табл. 15).
Таблица 15
Влияние температуры и степени перемешивания среды для культивирования на интенсивность аэрации
(по Егоровой, 1967)
Интенсивность аэра-
Количество раство- ции, выраженная
рениого кислорода. скоростью окисления
>> мг/л раствора сульфита.
ь ЛЗ Условия культивирования мг О2 л/ч
с с г Объем среды, мл
CJ F— 2П 45 20 45
30 Стационарные 8,82 8,66 500 400
При качании:
160 об/мин 8,82 8,82 920 700
200 об/мин 8,66 8,66 1300 1200
280 об/мин 8,82 8,82 2000 1400
35 Стационарные 7,02 6,86 690 580
При качании 280 об/мин 7,02 7,02 2460 1800
40 Стационарные 6,04 6,04 900 800
При качании 280 об/мин 6.20 6,20 2900 2100
55 Стационарные 5,22 5,06 1200 1100
При качании 270 об/мин 5,22 5,22 3170 2400
Приведенные в табл. 15 данные показывают, что растворимость кислорода в среде зависит только от температуры культивирования микроорганизмов: с повышением температуры растворимость кислорода уменьшается. Однако интенсивность аэрации существенно изменяется в зависимости от объема среды (с увеличением объема среды интенсивность аэрации уменьшается), условий перемешивания (повышение числа оборотов качалки способствует увеличению интенсивности аэрации) и температуры (с повышением температуры возрастает скорость вступления кислорода в реакцию). Таким образом, с повышением температуры в условиях глубинного культивирования микроорганизмов интенсивность аэрации среды резко возрастает.
Интенсивность аэрации культуры продуцента того или иного антибиотика должна коррелировать с составом среды. С повышением концентрации компонентов среды для развития продуцентов ряда антибиотиков (пенициллина, стрептомицина, новобиоцина, хлортетрациклина, окситетрациклина и др.) интенсивность аэрации культуры необходимо повышать.
80
Изменения условий аэрации приводит не только к изменению процесса обеспечения продуцента антибиотика кислородом, удалению из среды углекислого газа и других летучих продуктов метаболизма, но и к изменению характера обмена веществ организма. Так, например, в условиях ухудшения аэрации среды для развития Str. aureofaciens в культуральной жидкости повышается содержание летучих органических кислот и снижается биосинтез тетрациклина.
Следовательно, только при учете всех особенностей культивирования организма, при изучении влияния различных компонентов субстрата, физико-химических и физических факторов среды можно определить способность микроорганизма образовывать антибиотическое вещество. Создавая организму разнообразные условия культивирования, мы тем самым выясняем, какие из них наиболее благоприятны для выявления потенциальных возможностей биосинтеза антибиотиков.
Вмешиваясь в процесс развития продуцентов антибиотиков путем изменения условий их культивирования, мы добиваемся более высокого уровня биосинтеза этих биологически активных веществ. Однако необходимо иметь в виду, что у высокопродуктивных штаммов микроорганизмов может иметь место ретроингибирование, или ингибирование биосинтеза антибиотика по принципу обратной связи. Это явление может быть связано с ингибированием одного из ферментов начальной стадии биосинтеза молекулы антибиотика или же с подавлением образования иРНК для вполне определенного фермента.
Указанные процессы следует иметь в виду при изучении условий биосинтеза антибиотиков и находить пути их устранения.
О ДВУХФАЗНОМ ХАРАКТЕРЕ РАЗВИТИЯ
ПРОДУЦЕНТОВ РЯДА АНТИБИОТИКОВ
Еще в 1929 г. В. Н. Шапошников на примере ацетонобутилового брожения впервые показал, что многие бродильные процессы, осуществляемые бактериями, протекают в две фазы. В первую фазу брожения в связи с интенсивным размножением бактерий происходит накопление в субстрате относительно окисленных продуктов (уксусной, масляной кислот). Во вторую фазу, когда в культуре автолитические процессы начинают преобладать над процессами роста, в субстрате накапливаются относительно восстановленные продукты (ацетон, бутиловый спирт). При этом во второй фазе наблюдается потребление организмом ряда веществ, образовавшихся в первую фазу развития.
Открытие двухфазности в процессах брожения имеет важное теоретическое и практическое значение. Результаты, полученные при изучении различных типов брожения в динамике развития культур, показали, что продукты жизнедеятельности микроорганизмов по ходу их развития претерпевают изменения как в качественном, так и в количественном отношении. На разных этапах раз
81
вития культуры наблюдаются различные соотношения продуктов обмена. Знание закономерностей микробиологического процесса позволяет сознательно вмешиваться в него на определенных этапах развития культуры и изменять течение процесса в направлении, нужном для экспериментатора или практики.
Основные закономерности двух фаз процессов брожения, открытые Шапошниковым, характерны и для многих микроорганизмов, образующих антибиотики. Однако необходимо сразу же отметить, что двухфазный характер процессов развития микроорганизмов и образования ими антибиотических веществ имеет свои особенности.
Биосинтез многих антибиотиков осуществляется микроорганизмами на определенном этапе их развития. Эта закономерность характерна для бактерий {Bacillus brevis, Вас. subtilis и др.), микроскопических грибов {Penicillium chrysogenum, Aspergillus fumiga-tus и др.) и для большинства актиномицетов, образующих ценные антибиотики — стрептомицин, хлортетрациклин, окситетрациклин,
новобиоцин, аурантин и др. В условиях глубинной культуры процесс развития организма и биосинтеза антибиотика проходит в две фазы (рис. 1).
В первой фазе развития культуры, или, как ее иногда называют, тропофазе (фаза сбалансированного роста микроорганизма), наблюдается интенсивное накопление биомассы продуцента (образование белков, нуклеиновых кислот, углеводов; происходит био
синтез ферментов и других соединений,
Время культивирования, ч
Рис. 1. Схема двухфазного процесса развития Streptomyces griseus и образование стрептомицина:
1 — образование биомассы актиномицета, 2 — биосинтез стрептомицина, 3 — использование углеводов.
4— потребление азота аммония, 5 — изменение pH среды
принимающих участие в росте микроорганизма), связанное с быстрым потреблением основных компонентов субстрата (источники углерода, азота, фосфора и др.) и с высоким уровнем поглощения кислорода. Одновременно с быстрым потреблением углеводов происходит образование некоторых органических кислот, что приводит иногда к снижению pH субстрата. В этот период развития протоплазма мицелия актиномицетов содержит значительное количество рибонуклеиновой кислоты (РНК). Образования антибиотика, как правило, не наблюдается, а если антибиотическое вещество и обнаруживается, то в
62
незначительном количестве. По-видимому, это связано с тем, что в фазе сбалансированного роста синтез ферментов, прини-мающих участие в образовании антибиотика, подавлен.
Во второй фазе развития, g именуемой в настоящее время -5, идиофазой (фаза несба- g лансированного роста микро-организма), наблюдается за- £ медление накопления биомас- ,=> «а
Фаза!', Фаза 2 2
1
\
сы или даже ее уменьшение, обусловленное тем, что основные компоненты среды использованы организмом, а среда обогатилась рядом продуктов жизнедеятельности. В культуре начинают преобладать протеолитические процессы, среда обогащается продуктами автолитического распада клеток, что приводит к ее подщелачиванию.
У актиномицетов во второй фазе базифилия протоплазмы
1 х
-J U------1---]___л____г 1 t
72 96 120 /44 168 192
Время культивирования, ч
Рис. 2. Схема формирования биомассы стрептомицета в период второй фазы развития:
1— истинная биомасса стрептомицета, 2— возможная биомасса стрептомицета в случае отсутствия автолиза мицелия, 3 — возможная биомасса стрептомицета в случае отсутствия роста стрептомицета
отчетливо снижается, содержание РНК в мицелии падает. Бази-филия ядерного вещества, наоборот, повышается, содержание ДНК в нем увеличивается.
Анализ кривой, определяющей биомассу актиномицета во вторую фазу развития продуцента антибиотика, позволяет констатировать, что она образуется в виде средней величины теоретически возможной биомассы актиномицета, в случае отсутствия автолиза его мицелия, и теоретически возможной биомассы при полном автолизе клеток актиномицета (рис. 2).
Следовательно, в культуре наряду с автолизирующимся мицелием происходит развитие гиф молодого мицелия актиномицета. Эти развивающиеся клетки микроба находятся в совершенно иных условиях среды по сравнению с условиями, в которых они находились в первой фазе. Отличие определяется тем, что в субстрате в этот период почти полностью отсутствуют многие исходные компоненты питания и среда во вторую фазу сильно обогащена определенными продуктами жизнедеятельности организма и продуктами автолиза клеток. В период идиофазы происходит дерепрессия ферментов, участвующих в процессе биосинтеза антибиотика.
Все эти факторы вместе взятые и определяют условия, способствующие максимальному биосинтезу антибиотика.
У ряда актиномицетов процесс образования антибиотика связав
83
с развитием вторичного мицелия и его жизнедеятельности в иных условиях среды, о которых говорилось выше.
В большинстве случаев максимум накопления антибиотика в среде наступает после максимума накопления биомассы. Разрыв в максимумах у разных организмов и в разных условиях культивирования бывает различным.
Необходимо подчеркнуть, что принцип двухфазности развития большинства микроорганизмов — продуцентов антибиотических веществ— характерен для нормально развивающихся культур. Иными словами, эта закономерность имеет место при развитии микроорганизмов в условиях периодического культивирования в среде, которая в процессе роста продуцента антибиотика изменяется самим организмом, а не экспериментатором, и организм засевается в субстрат не на стадии биосинтетической активности (40—96 ч), а спорами или молодыми (не более 20—24 ч) вегетативными клетками (мицелием). При засеве среды большими объемами уже относительно старого по возрасту посевного материала (40 ч и более) можно не получить двухфазного характера развития продуцента антибиотика. При внесении больших объемов уже продуцирующего антибиотик мицелия и культуральной жидкости, обогащенной продуктами жизнедеятельности организма, естественно, трудно ожидать наличия первой фазы, так как она уже прошла (закончилась) в процессе подготовки посевного материала.
Отсутствие способности к синтезу пенициллина у молодого мицелия Penic. chrysogenum связано с тем, что условия среды, в которых он развивается, существенно отличаются от условий, в которых находится мицелий гриба во вторую фазу развития, в течение которой и осуществляется биосинтез пенициллина. Отличие состоит в том, что в период первой фазы развития гриба в среде присутствует легкоусвояемый источник углерода, вызывающий катаболитную репрессию ферментов, участвующих в биосинтезе антибиотика. К началу второй фазы развития эти источники углерода, как правило, полностью потребляются грибом. Изучение закономерностей образования антибиотика культурой Str. violaceus и возможности регулирования этого процесса показали, что образование антибиотика в этом случае происходит также во вторую фазу раз-
Таблица 16
Способность разновозрастного мицелия образовывать антибиотическое вещество иа средах с азотом и без азота в краткосрочных опытах
(по Шапошникову, Бехтеревой и др., 1959)
Возраст мицелия, ч Продуктивность мицелия, ед/г-ч (условно)
на Среде с азотом на среде без азота
56 0 117
90 350 26 340
216 150 4 025
84
вития актиномицета, т. е. в период исчерпания некоторых компонентов среды. Выяснение причин биосинтеза антибиотика в период второй фазы в острых (краткосрочных) опытах показало, что образованию антибиотика способствует отсутствие азота в среде (табл. 16).
Выяснение причин, способствующих образованию антибиотика в период второй фазы развития микроба, позволило установить, что в эти процессы возможно вмешиваться и направлять их в нужную сторону.
Следовательно, можно сделать вывод, что биосинтез антибиотика культурой продуцента в большинстве известных случаев происходит в определенный период развития организма и при наличии определенного состояния субстрата, создаваемого самим микробом в период первой фазы его развития. Этим определяется биологическая сущность двухфазного процесса развития микроорганизмов — продуцентов антибиотических веществ.
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ
МИКРООРГАНИЗМОВ И ЕГО РОЛЬ В БИОСИНТЕЗЕ АНТИБИОТИКОВ
Со времени Р. Коха (1843—1910) и до настоящих дней микробиология базируется на одном из основных ее принципов — работы с чистыми культурами микроорганизмов. Благодаря этому принципу в микробиологии решены многие крупные теоретические и практические проблемы. Вместе с тем современная микробиология, в первую очередь промышленная, накопила значительное число примеров, свидетельствующих, что процесс получения того или иного продукта жизнедеятельности или разложение ряда сложных веществ, в том числе и искусственно синтезириованных полимеров, активнее происходит в смешанных культурах, т. е. при совместном развитии нескольких (чаще двух) видов микроорганизмов.
Проявление антимикробных свойств у отдельных видов бактерий при совместном их культивировании с другими организмами было обнаружено в начале XX века. Так, Фрост еще в 1904 г. показал, что смешанные культуры Bacterium fluorescens проявляют наиболее заметное антагонистическое действие по отношению к ряду тестмикробов по сравнению с чистыми культурами.
При изучении антагонистов по отношению к сибиреязвенному микробу было установлено, что смешанная культура стафилококка и стрептококка является антагонистом изучаемого микроба. Некоторые актиномицеты способны проявлять антагонизм по отношению к грамположительным бактериям только в смешанных культурах.
Большое число работ выполнено для определения влияния совместного культивирования молочнокислых бактерий с другими бактериальными организмами на сохранение и биохимическую активность первых, а также по совместному культивированию дрожжей и бактерий.
85
В одних случаях при совместном культивировании наблюдается взаимное угнетение испытуемых организмов, в других — происходит активизация роста и биохимической активности молочнокислых бактерий.
Изучение взаимоотношений между гомо- и гетероферментатив-иыми молочнокислыми бактериями в смешанной культуре показало, что синергическое действие наблюдается только при одновременном посеве обоих организмов. Добавление фильтрата одного компонента к чистой культуре другого не активизировало последнюю.
Продукты жизнедеятельности некоторых актиномицетов стимулируют образование спор плесневыми грибами, а совместное культивирование ряда бактерий с Bacillus sphaericus, у которого была потеряна способность к спорообразованию, восстанавливало эту способность.
Ряд организмов (Torula rosea, Streptomyces coelicolor, Bacterium denitrofluorescens, Bacillus mycoides, Pseudomonas radiobacter) при совместном культивировании с азотобактером (штамм К) стимулировали образование гетероауксина. Образование гетероауксина стимулировали и фильтраты этих культур. В то же время фильтрат Penicillium nigricans угнетает образование гетероауксина.
Примеров совместного выращивания ряда микроорганизмов, при котором происходит стимулирование образования различных продуктов жизнедеятельности, можно привести много.
В настоящее время проявляется все больший интерес к проблеме совместного культивирования микроорганизмов с целью повышения образования ряда биологически активных веществ: витаминов, ферментов, и для более эффективного процесса микробиологической трансформации некоторых органических соединений.
Образование витамина В12 пропионовокислыми бактериями повышается, если микроорганизмы культивировать на средах, содержащих продукты жизнедеятельности молочнокислых бактерий или микобактерий. Биосинтез указанного витамина увеличивается в два раза при совместном культивировании Propionobact. shermanii и Mycobact. luteum.
Процесс образования протеолитических ферментов, обладающих фибринолитическим действием, в смешанной культуре двух актиномицетов (Str. rimosus и Str. violaceus) без увеличения биомассы происходит в три раза больше, чем в чистой культуре Str. rimosus. Способностью повышать образование протеаз культурой Str. rimosus обладает культуральная жидкость Str. violaceus.
Аналогичные результаты наблюдаются и при совместном культивировании Aspergillus kanagawaensis и Asp. wentii. В этом случае способностью образовывать протеазы обладает лишь первый гриб.
Процесс интенсификации антибиотикообразования кроме известных приемов (получение мутантных штаммов с повышенным синтезом антибиотика, подбор соответствующих сред для культивирования, улучшение технологического процесса развития проду
86
цента) можно осуществлять путем совместного культивирования продуцента антибиотика с другими специально подобранными видами микроорганизмов. Показано, что один из штаммов Вас. subtilis не образует антибиотическое вещество при росте в чистой культуре. Антибиотик синтезируется только в смешанных культурах при совместном развитии Вас. subtilis и Pettie, notatum.
При совместном культивировании Вас. mesentericus с бактериями мышиного тифа — Bacterium typhi murium удалось получить направленное образование антибиотика, активного в отношении этих бактерий. При культивировании же картофельной палочки на мертвых, убитых нагреванием микробных телах антагонистические свойства у нее не обнаруживаются. Это также указывает на то, чго продукты жизнедеятельности бактерий мышиного тифа оказывают благоприятное влияние на образование антибиотика культурой Вас. mesentericus. Смешанная культура термофильных молочнокислых стрептококков и палочек, составляющих микрофлору югур-та (кислого молока), обладает большим антибиотическим действи ем, чем каждый из этих микроорганизмов в отдельности.
Впервые метод совместного культивирования Trichothecium roseum и Penicillium для увеличения образования трихотецина в промышленных условиях разработан и предложен в 1959 г. венгерскими учеными (Johan, Szabo, Ketesztessy). Было замечено, что штаммы продуцентов трихотецина проявляют наибольшую биологическую активность при совместном развитии с микроскопическими грибами рода Penicillium. Культивируя продуцент трихотецина Trich. roseum вместе с Penicillium sp., удается повысить выход антибиотика в несколько раз. Наилучший эффект получается в том случае, если к 24-часовой культуре Trich. roseum добавить 2— 10% односуточного мицелия Penicillium sp.
Убитый мицелий пеницилла или его культуральная жидкость, отделенная от мицелия, не обладает способностью стимулировать образование трихотецина. Эффект стимуляции наблюдается только в условиях совместного выращивания грибов двух видов. Следовательно, увеличение образования трихотецина в смешанной культуре происходит в результате проявления определенных антагонистических взамоотношений между продуцентом антибиотика и Ре-nicillium sp.
Аналогичные результаты были получены в лаборатории антибиотиков МГУ. Выделен штамм Penic. chrysogenum, стимулирующий образование трихотецина. При подсеве к 36—48-часовой культуре Trich. roseum 5—7,5% (по объему) Penic. chrysogenum в возрасте 48 ч образование трихотецина увеличивалось на 170% (от 170 до 300 мкг/мл).
Описан и запатентован способ получения антибиотического вещества, образуемого Aspergillus flavus при культивировании гриба совместно с Mycobacterium tuberculosis.
Значительное увеличение антибиотической активности Strep-tomyces sp. происходит при выращивании его вместе с Corynebac-ierium equi.
87
Увеличение образования бацитрацина наблюдается в том случае, если продуцент антибиотика Вас. subtilis культивируется совместно с Pseudomonas sp.
Повышение биосинтеза леворина культурой Str. levoris наблюдается при совместном культивировании актиномицета с дрожжеподобным грибом Candida tropicalis.
Совместное культивирование продуцента микогептина Str. mycoheptinicum штамм 44 в/1 с различными микроорганизмами (изучено 50 культур) показало, что характер взаимоотношений между ними может быть различным: 60% из изученных микроорганизмов полностью подавляли развитие продуцента микогептина, 30%—резко снижали его антибиотическую активность и лишь 10% — стимулировали на 15—20% образование антибиотика. К числу последних относились Schizosaccharomyces romys, Rhodotorula muciloginosum, Candida tropicalis. Monilia nivea.
Изучение вопросов, связанных с механизмом биосинтеза микроорганизмами различных биологически активных соединений, в том числе и антибиотиков, осуществляется различными методами. В последние годы для указанных целей нередко применяется метод сравнительного анализа путей метаболизма продуцентов антибиотических веществ и соответствующих им мутантов. В качестве мутантов используются штаммы, у которых процесс биосинтеза антибиотика нарушен в разных звеньях цепи реакций, связанных с образованием изученного соединения (такие мутанты часто могут образовывать неполностью завершенные молекулы этих веществ), или мутанты, полностью лишенные способности образовывать соответствующие биологически активные соединения.
Применение метода сравнительного анализа позволило получить интересные результаты при изучении биосинтеза таких антибиотиков, как тетрациклин, новобиоцин, хлортетрациклин, нистатин, пенициллин, окситетрациклин, стрептомицин, и некоторых Других.
Использование метода совместного культивирования двух мутантных штаммов продуцента окситетрациклина Str. rimosus, потерявших способность к образованию антибиотика, показало, что «белые» мутанты выделяют в среду в процессе их развития какое-то вещество или вещества, позволяющие «черному» мутанту осуществлять биосинтез окситетрациклина. Таким образом, совместное культивирование этих мутантов актиномицета или добавление культуральной жидкости, освобожденной от мицелия «белого» мутанта, к культуре «черного» способствует образованию последним окситетрациклина.
При совместном культивировании двух мутантных штаммов продуцента стрептомицина, один из которых не образовывал антибиотик, а другой синтезировал его в небольшом количестве (см. с. 220), происходит биосинтез стрептомицина в том же количестве, что и при развитии исходного высокопродуктивного штамма Str. griseus.
Аналогичные результаты получены при совместном выращива
88
нии двух мутантов Sir. noursei, потерявших способность к биосинтезу нистатина (табл. 17).
Таблица 17
Образование нистатина при совместном выращивании двух неактивных штаммов Streptomyces noursei (4-е сут)
(по Тороповой, Побединскому, Егорову, 1976)
Штамм актиномицета Образование нистатина
в культуральной жидкости, ед/мл в мицелии, ед/мг
Штамм № 149 0 0
Штамм № 368 0 0
Штамм № 149 штамм № 368 310 100
Исходный штамм актиномицета (контроль) .... 350 80
Совместное культивирование двух неактивных штаммов (№ 149 и 368) обеспечивает образование нистатина в том же количестве, что и при развитии исходного активного штамма Str. noursei.
При лабораторном хранении актиномицетов-антагонистов, выделенных из естественных субстратов, довольно часто наблюдается значительное снижение антибиотической активности или ее полная потеря. Совместное культивирование штаммов актиномицетов, неактивных в обычных условиях культивирования, с некоторыми грибами из рода Penicillium или с почвенными бактериями восстанавливает способность к антибиотикообразованию или же способствует выделению антибиотика теми штаммами, которые его не образовывали. При выделении бактерий и актиномицетов из ограниченного почвенного образца и выяснения влияния этих бактерий на изученные штаммы актиномицетов показано, что исследованные бактерии могут оказывать различное влияние на антибиотическую активность актиномицетов. Некоторые штаммы бактерий значительно повышают ее или способствуют образованию антибиотического вещества у актиномицетов, которые в обычных условиях культивирования его не обнаруживают.
Из 27 штаммов актиномицетов и 39 штаммов бактерий, использованных в опытах, в 11 случаях отмечено усиление имеющейся или появление вновь антибиотической активности актиномицетов. Однако довольно часты случаи, когда продукты жизнедеятельности бактерий не оказывают никакого влияния на антибиотические свойства актиномицетов. В 18 случаях влияние продуктов жизнедеятельности бактерий на антибиотическую активность актиномицетов было отрицательным, т. е. антибиотикообразование у актиномицетов в присутствии бактериальных организмов или значительно снижалось, или совсем исчезало.
Во многих случаях продукты жизнедеятельности бактерий, не вызывая заметного изменения антибиотической активности актиномицетов, стимулировали развитие мицелия, спорообразование, об-
89
разевание пигментов (23 случая). Иногда развитие актиномицета подавлялось, воздушный мицелий исчезал, спорообразование задерживалось (8 случаев).
Изучение причин стимуляции образования антибиотиков одним штаммом актиномицета под влиянием жизнедеятельности бактерий показало, что стимуляция образования антибиотика культурой Str. coelicolor при добавлении культуральной жидкости Вас. rusticus и ее фракций связана с фракцией летучих кислот .(табл. 18).
Таблица 18
Влияние различных фракций культуральной жидкости Bacillus rusticus штамм 22 на образование антибиотика культурой Streptomyces coelicolor и его рост (антибиотическая активность в единицах разведения)
(по Егорову, Поповой и др., 1960)
Время культивирования актиномицета
Рост актиномицета
Вариант опыта
5 сут 1 8 сут
Количество добавленного фильтрата. %
1 5
Синтетическая среда . . 0
То же -f- МПБ .... 16
То же 4- односуточный фильтрат ..............
То же + летучие вещества , отогнанные при pH 7,0.............
То же -f- соли летучих кислот ................
162
0
162
То же + остаток от отгона ...................... 0
То же + солн летучих кислот + остаток от отгона.................... 54
0 0
18 18
0
0
18
0
162
0
0
Хороший
Очень хороший
То же
Слабый
Очень хороший
Слабый
Хороший
Хороший Слабый
Хороший
Очень слабый
Очень хороший
Слабый
Хороший
Таким образом, в этом исследовании вполне определенно установлено, что для биосинтеза антибиотического вещества, образуемого малоактивным штаммом Str. coelicolor, необходимо наличие некоторых летучих органических кислот, которые образуются в процессе развития Вас. rusticus.
Следовательно, штаммы микроорганизмов с различными типами обмена веществ в смешанной культуре оказывают определенное влияние друг на друга.
Приведенные примеры показывают, что совместным культивированием специально подобранных организмов можно создать та
90
кие условия, при которых значительно увеличится образование антибиотиков.
Активация ряда биохимических процессов, наблюдаемая в смешанных культурах микроорганизмов, может происходить в результате различных причин. Одним из основных факторов влияния одного организма на другой при совместном выращивании можно назвать образование и выделение в окружающую среду определенных продуктов жизнедеятельности. Эти продукты обмена (у разных организмов различные) могут образовываться и выделяться в среду или по ходу развития микроорганизма, или на определенных этапах его жизнедеятельности.
Влияние продуктов метаболизма одного организма на другой в смешанных культурах может осуществляться, по крайней мере, тремя путями. Во-первых, образовавшиеся продукты обмена одного организма могут быть использованы другим организмом в качестве источника азота, углерода или иного компонента или же в качестве предшественника биосинтеза какого-то соединения. Во-вторых, в смешанных культурах ферментативная реакция, осуществляемая одним из микроорганизмов, может служить естественным продолжением энзиматической реакции, свойственной другому компоненту смешанной культуры. В-третьих, образующиеся продукты жизнедеятельности одного из компонентов бинарной ассоциации (как правило, организма, не образующего нужный для практики продукт) несколько притормаживает развитие продуцента, который в ответ на это начинает активнее синтезировать и выделять в окружающую среду соответствующие ферменты. Такое явление наблюдается при биосинтезе протеолитических ферментов некоторыми штаммами стрептомицетов и плесневых грибов при их совместном культивировании с другими организмами.
Ответом на проявление определенных антагонистических взаимоотношений одним из компонентов смешанной культуры служит повышение биосинтеза антибиотического вещества (например, при совместном выращивании продуцента трихотецина Trichothecium roseum с определенными видами Penicillium).
При совместном культивировании различных микробов могут возникать своеобразные гибриды этих организмов, обладающие иными свойствами по сравнению с исходными чистыми культурами.
При подборе компонентов смешанной культуры существенное значение имеет не только подбор партнеров, но и их количественное соотношение в среде. Так, при совместном культивировании Aspergillus oryzae и Bacillus subtilis наибольший выход протеаз происходит в том случае, если количество спор Asp. oryzae в ассоциации в два раза меньше числа клеток Вас. subtilis. А в смешанной культуре Вас. subtilis и Pseudomonas sp. 162 для получения большего выхода бацитрацина следует сформировать ассоциацию в отношении 1 : 100. Иными словами, на одну клетку Вас. subtilis следует вносить сто клеток Pseudomonas sp. Повышение образования леворина примерно на 40—50% наблюдается в том случае, если к продуценту антибиотика Str. levoris добавляют 1—4% пред
91
варительно выращенных в течение 48 ч дрожжеподобных организмов (Candida).
Необходимо подчеркнуть, что указанные факторы не имеют универсального характера. В каждом конкретном случае необходимо подбирать соответствующие организмы, устанавливать их соотношение и находить наиболее благоприятные условия культивирования.
Возможно, что в ряде микробиологических процессов замена чистых культур смесью организмов определенных видов даст наилучшую интенсификацию биосинтеза нужных продуктов.
ОБРАЗОВАНИЕ АНТИБИОТИКОВ
ИММОБИЛИЗОВАННЫМИ КЛЕТКАМИ
МИКРООРГАНИЗМОВ
Последнее десятилетие характеризуется широким размахом работ по иммобилизации ферментов и использованием их в таком состоянии- в качестве стабильных биокатализаторов при получении ряда очень ценных веществ (аминокислот, органических кислот, полусинтетических антибиотиков и других соединений). Направление биотехнологии с применением иммобилизованных ферментов получило название инженерной энзимологии.
Наряду с иммобилизацией отдельных ферментов оказалось возможным иммобилизовать и клетки микроорганизмов, которые в этом состоянии способны относительно длительное время осуществлять характерные для них биохимические процессы. Свойство микроорганизмов функционировать в иммобилизованном состоянии присуще многим видам, находящимся в естественных местах их обитания: в почве, илах, водоемах.
Иммобилизация клеток микроорганизмов в лабораторных и производственных условиях осуществляется в основном тремя методами.
1. Физические методы, в основе которых лежат факторы, связанные с действием электростатических сил, и силы поверхностного натяжения. Наиболее характерным способом закрепления клеток является адсорбция их на определенном носителе.
2. Химические методы иммобилизации клеток основаны на использовании бифункциональных реагентов для прикрепления клеток к носителю либо на смешивании клеток между собой, в результате чего образуются бактериальные пленки или определенные конгломераты. При иммобилизации химическими методами используется способ ковалентного связывания клеток с силикагелем, активированным хлоридом хрома или титана; применяется метод закрепления клеток на желатиноподобном матриксе гидроокисей титана и циркония.
3. Механические методы иммобилизации основаны на включении микробных клеток в различные гели, мембраны.
При выборе метода иммобилизации клеток необходимо учиты
92
вать характер влияния применяемого метода на жизнедеятельность микроорганизмов.
Иммобилизованными клетками микроорганизмов можно осуществлять процесс биосинтеза ряда антибиотиков. Следует, однако, подчеркнуть, что эти процессы пока носят поисковый характер и еще не применяются в промышленных условиях.
Так, клетки Streptococcus lactis, иммобилизованные в полиакриламидном геле, способны осуществлять процесс биосинтеза низина. При этом отмечено, что количество образовавшегося антибиотика составляет не более 30% того количества, которое образуется в обычной культуре стрептококка. Однако при иммобилизации клеток продуцента низина их способность к биосинтезу антибиотика сохраняется в течение 15—20 дней.
Клетки Bacillus sp., иммобилизованные в полиакриламидном геле, способны синтезировать бацитрацин, но в этих условиях период полужизни клеток бактерий продолжается не более 10 сут. Иммобилизованные клетки Cephalosporium acremonium могут образовывать цефалоспорин, клетки Streptomyces griseus — канди-цидин, клетки Penicillium chrysogenum синтезируют пенициллин.
Таким образом, приведенные примеры показывают, что иммобилизованные клетки бактерий, стрептомицетов и микроскопических грибов обладают способностью синтезировать соответствующие антибиотики. Главная задача предстоящих в этом направлении исследований — подбор метода иммобилизации клеток продуцентов антибиотиков, который позволял бы сохранить способность клеток продуцента синтезировать большие количества того или иного антибиотика в течение длительного времени.
Глава
ЗНАЧЕНИЕ АНТИБИОТИКОВ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМОВ, ПРОДУЦИРУЮЩИХ эти БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА
Изучение роли антибиотиков в жизнедеятельности организмов, продуцирующих эти важные физиологически активные вещества, имеет большое общебиологическое значение. Выяснение вопроса о взаимоотношении продуцента и образуемого им антибиотика может также помочь раскрытию некоторых сторон биосинтеза этих веществ и выяснению механизма их биологического действия.
При изучении процесса ангибиотикообразования возникает ряд вопросов: оказывают ли антибиотики какое-либо влияние на собственные продуценты, выполняют ли эти вещества лишь защитные функции и т. п.?
В последнее время все чаще и чаще появляются сообщения, относящиеся к проблеме роли антибиотиков в жизнедеятельности организмов, образующих их. Эта проблема привлекает внимание многих исследователей у нас в стране и за рубежом.
Подход к оценке роли антибиотиков в жизнедеятельности организмов, их образующих, зависит в первую очередь от того, насколько правильно наше представление о самом явлении антибио-тикообразования. Если придерживаться взгляда, что образование антибиотиков есть удаление клеткой «продуктов отхода» (waste products), то представление о роли этих веществ для продуцентов будет иметь один аспект. Если же признать за процессом образования антибиотиков приспособительное значение, то их роль в жизнедеятельности организмов-продуцентов будет иметь другой смысл. Рассмотрим кратко обе точки зрения.
Ваксман и другие считают, что антибиотики образуются только при условии наличия в среде питательных веществ, благоприятных для данного процесса. Это положение само по себе совершенно правильно и подтверждается множеством фактов. Образование антибиотиков определяется ими как побочный метаболизм, происходящий при «патологических» условиях, как «прямой результат влияния ненормальных условий внешней среды». Образование антибиотиков, по мнению этих авторов, — не закрепленное эволюцией свойство организма, а проявляющееся только при развитии микроба в специфической среде и при наличии особых внешних условий. Исходя из этих положений, не подкрепленных экспериментальными данными, Ваксман и его единомышленники отрица
94
ют всякую приспособительную роль антибиотиков для их продуцентов, не считают возможным признать, что антибиотики оказывают какое-либо влияние на организмы, их продуцирующие. Такой вывод о процессе антибиотикообразования нельзя признать правильным, он противоречит многим убедительным фактам.
Согласно другой теории процесс биосинтеза антибиотиков является по своей сути фактором биологическим, имеющим определенное приспособительное значение. Способность к образованию антибиотиков появилась и закрепилась у организмов в результате их длительной эволюции. Образование того или иного антибиотического вещества — наследственно закрепленная особенность одного или нескольких видов (штаммов) организмов.
Исходя из второй, на наш взгляд, единственно правильной концепции о процессе образования антибиотиков, мы и рассмотрим более подробно их роль в жизнедеятельности организмов-продуцентов.
Большое разнообразие антибиотиков с точки зрения их химического строения и механизма физиологического действия дает основание предполагать, что в числе приспособительных реакций кроме защитной функции эти биологически активные вещества могут оказывать влияние на отдельные звенья процесса метаболизма тех организмов, которые их синтезируют, через активацию или ингибирование ряда ферментных систем.
Известно, что в процессе жизнедеятельности организмов одни антибиотики (пенициллины, стрептомицин, тетрациклины и др.) в основном выделяются в окружающую организм среду, другие (кан-дицидин, ристомицин и др.) выделяются в среду лишь частично, значительное же их количество находится в клетках продуцента, третья группа антибиотических веществ (грамицидины, эндомицин, римоцидин и др.) почти целиком связана с клетками продуцентов и в окружающую среду при жизни организмов практически не выделяется. По-видимому, в каждом из указанных случаев роль антибиотика в жизнедеятельности организмов, их продуцирующих, неодинакова.
В процессе развития организмы приспособились к действию тех концентраций антибиотических веществ, которые образуются их продуцентами, но если концентрацию антибиотика в среде искусственно увеличить, то микроорганизм, образующий этот антибиотик, начинает реагировать на это. Так, например, некоторые актиномицеты в присутствии определенных концентраций образуемых ими антибиотиков прекращают рост. По данным Teillon (1953), актиномицеты могут развиваться на средах, содержащих антибиотики, которые они образуют, в концентрациях, не превышающих следующие значения:
Streptomyces griseus ...... 0,5 % сернокислого стрептомицина
Str. lavendulae............. 1,0 % сернокислого стрептотрицина
Str. fradiae..................0,25 % сернокислого неомицина
Str. rimosus ....... 0,50 % солянокислого окситетрациклина
Str. aureofaciens.......... 0,25 %солянокислого хлортетрациклнна
Str. venezuelae.............. 0,25 % солянокислого хлорамфеникола
95
Более высокие концентрации антибиотиков начинают угнетать развитие собственных продуцентов.
Существует определенная взаимосвязь между образованием антибиотика и устойчивостью к нему продуцента этого антибиотика. Имеются указания на то, что продуценты аминогликозидов находят, как правило, среди актиномицетов, устойчивых к этим антибиотикам.
Различные штаммы Str. griseus отличаются друг от друга по чувствительности к стрептомицину. Штаммы, обладающие способностью образовывать более высокие концентрации антибиотика, выдерживают присутствие в среде больших количеств стрептомицина; менее активные штаммы при этих же концентрациях антибиотика в среде не будут расти и совсем не развиваются штаммы, не образующие стрептомицина (табл. 19).
Таблица 19
Действие стрептомицина на активные и неактивные штаммы Streptomyces griseus (по Гаузе, 1959)
Штаммы актиномицета Образование стрептомицина Рост в присутствии стрептомицина (50 мкг/мл) в среде
3326 Не происходит _
3378 » .—
3463 Происходит +++
3464 » +++
Обозначения: знак «—» означает отсутствие роста, знак «-j—|—р»—на личие роста актиномицета.
Это свойство актиномицетов было использовано для селекции наиболее продуктивных по образованию антибиотика штаммов Str. griseus, так как добавление к среде определенных концентраций стрептомицина способствует развитию наиболее активных форм актиномицета.
В последнее время подтверждено, что организмы, продуцирующие антибиотики, устойчивы к их действию. Причем, микроорганизмы, выделенные из природных источников («дикие» штаммы), т. е. не мутанты, имеющие невысокую биосинтетическую активность, обладают резистентностью к собственному антибиотику на уровне мембран. Высокопродуктивные мутанты микроорганизмов защищаются от антибиотиков, синтезируемых ими, в результате инактивации ферментами.
Следовательно, действительно существует определенное воздействие антибиотика на продуцирующий его организм, проявляющееся в данном случае в резком нарушении каких-то важных сторон жизнедеятельности, что в конечном итоге препятствует росту и развитию организма.
К настоящему времени опубликованы результаты о влиянии
96
отдельных антибиотиков на собственные продуценты. Однако анализ литературных данных по названной проблеме показывает, что систематических, целенаправленных исследований в этой области еще мало и работы носят преимущественно разрозненный характер.
На кафедре микробиологии Московского университета в течение последних пятнадцати лет проводились исследования по изучению физиологической роли антибиотиков: грамицидина С, новобпо-цнна, ристомицина и нистатина, имеющих, как известно, большое практическое значение. Для решения этой проблемы были использованы различные подходы:
1. Изучение условий образования антибиотиков при культивировании микроорганизмов преимущественно на синтетических средах. При этом определялись: место накопления антибиотика (в культуральной жидкости или внутриклеточно), период его максимального образования и другие факторы. Подбирались условия культивирования, при которых прекращается биосинтез антибиотика при нормальном росте продуцента (эт.о обстоятельство имеет существенное значение для изучения организмов, образующих внутриклеточные антибиотические вещества). Сравнение физиологических и биохимических свойств клеток, содержащих антибиотик и не имеющих его, может помочь выяснению влияния антибиотика на метаболизм изучаемого организма.
2. Получение мутантных форм микроорганизма, не образующих антибиотик, и сравнительное изучение характеров обмена веществ этих штаммов и исходного организма (продуцента антибиотика).
3. Непосредственное изучение влияния исследуемых антибиотиков, вносимых в среду для культивирования перед засевом ее продуцентом, на различные стороны обмена веществ этого микроорганизма, а также штаммов того же организма, не синтезирующих антибиотик.
К настоящему времени получен большой экспериментальный материал, который дает основание несколько глубже оценить влияние изученных антибиотиков на продуцирующие их организмы, подойти вплотную к выяснению биологической роли антибиотиков.
Остановимся на рассмотрении результатов, полученных на кафедре микробиологии Московского университета и в лабораториях других стран, по выяснению влияния антибиотиков на собственные продуценты применительно к отдельным организмам и антибиотическим веществам.
Стрептомицин. Подмечено, что мицелий 12- и 24-часовой культуры продуцента стрептомицина поглощает кислород интенсивнее, чем мицелий 36-часовой и старших по возрасту культур, в которых начинает уже накапливаться стрептомицин. Антибиотик подавляет развитие собственного продуцента в зависимости от ряда факторов среды, концентрации стрептомицина, возраста спор актиномицета и др.
Устойчивость к стрептомицину у Streptomyces griseus проявляется в виде определенной ступенчатости.
4—742
97
Выращивание спор продуцента стрептомицина в среде, содержащей этот же антибиотик, позволяет установить, что их резистентность .к стрептомицину не одинакова. Большинство спор актиномицета в присутствии стрептомицина, синтезированного мицелием актиномицета, из которого образованы споры, не прорастает. Споры Str. griseus, не образующие при развитии макроскопические колонии, способны прорастать при более высоких концентрациях стрептомицина.
Отмытый 110-часовой мицелий Str. griseus обладает повышенным эндогенным дыханием в присутствии стрептомицина, но не способен расти в синтетической среде, содержащей антибиотик в качестве единственного органического компонента.
В условиях, благоприятных для развития актиномицета и образования стрептомицина, наблюдается повышение активности ферментов пентозного цикла и снижение активности ферментов гликолиза. Str. griseus чувствителен к стрептомицину в период экспоненциальной фазы роста. Однако актиномицет устойчив к действию антибиотика в период, когда стрептомицин начинает синтезироваться. При использовании в экспериментах меченого стрептоцина показано, что антибиотик в меньшей степени проникает в клетки актиномицета в период образования стрептомицина, чем в период экспоненциальной фазы роста. При интенсивном росте Str. griseus наблюдается некоторая инактивация стрептомицина.
Приведенные примеры показывают, что стрептомицин определенным образом влияет па отдельные стороны метаболизма актиномицета, синтезирующего этот антибиотик.
Хлорамфеникол. Добавление хлорамфеникола к среде, где развивается Str. venezuelae, в количествах, не превышающих образование его данной культурой, препятствует биосинтезу антибиотика, но не оказывает заметного влияния на развитие актиномицета. По-видимому, хлорамфеникол блокирует определенные энзиматические системы организма, принимающие участие в биосинтезе этого антибиотика, без влияния на функцию роста актиномицета.
Хлорамфеникол в концентрации 100 мкг/мл, добавленный в среду перед началом ее засева продуцентом этого антибиотика, способствует удлинению лаг-фазы актиномицета пропорционально количеству внесенного хлорамфеникола. Продуцент антибиотика имеет фермент гидролазу, расщепляющий хлорамфеникол; фермент является конститутивной амидазой, действие на хлорамфеникол не представляет его главную функцию. В конце лаг-фазы происходит снижение поглощения внесенного в среду антибиотика его продуцентом. Вероятно, это связано с тем, что после эндогенного биосинтеза хлорамфеникола, когда его концентрация внутри клетки достигает 20—30 мкг/мл, происходит индуцированное изменение проницаемости клеточной мембраны, что приводит к прекращению проникновения антибиотика из среды. Физиологическое значение отмеченного явления связано, по-видимому, с функцией защиты актиномицета от вредного действия собственного продукта
98
жизнедеятельности, нахо-
дящегося вне мицелия: микроорганизм избирательно выделяет антибиотик, но не поглощает его.
Тетрацикл и ны. Показано, что хлортетра-циклин подавляет аэробное и анаэробное дыхание Str. aureofaciens.
АктиВный. Вариант Неактивный вариант
Образование антибно- Рис. 3. Действие окситетрациклина на окнсле-
тика культурой Str. aureofaciens обратно пропорционально активности ферментов цикла трикар-
ние мальтозы первой генерацией гнф Strepto-myces rimosus активного н неактивного вариантов (по Nyirt, Lengvel, Erdelyi, 1963):
I — контроль, 2 — добавлено 100 мкг/мл окситетрациклина (ОТЦ)
боновых кислот (ЦТК).
Снижение окислительной способности ферментов ЦТК связано, по-видимому, с использованием КоА для синтеза углеродной цепочки.
из которой образуется молекула хлортетрациклина. Активность
ферментов ЦТК у образующих антибиотик штаммов Str. aureofaciens в 2—3 раза ниже, чем у штаммов, не образующих антибиотик. Хлортетрациклин подавляет активность ацетил-КоА-карбоксилазы у активного штамма Str. aureofaciens почти на 70%, а у неактивного штамма — на 57%.
При добавлении тетрациклина к среде, в которой развивается продуцент этого антибиотика, наблюдается подавление образования тетрациклина, но антибиотик не оказывает заметного влияния
на рост актиномицета.
Изучая влияние окситетрацпклииа на углеводный обмен вариантов Str. rimosus, образующих и не образующих антибиотик, показано, что окситетрациклин подавляет потребление мальтозы и пировиноградной кислоты первым поколением клеток (мицелий этой генерации еще не продуцирует антибиотик, метаболизм мальтозы идет по пути образования мальтозофосфата) у обоих варнак* тов актиномицетов (рис. 3). Повышение концентрации антибиотик
Рис. 4. Зависимость подавляющего эффекта окситетрациклина от его концентрации на первую генерацию Streptomy-ces rimosus (по Nyiri, Lengvel, Erdelyt, 1963):
1— активный вариант, 2—неактивный вариант
ка вызывает усиление его подавляющего эффекта, что особенно заметно проявляется в варианте, не образующем окси-тетрациклин (рис. 4). Окситетрациклин подавлял окислительное фосфорилирование в первом поколении клеток у обоих вариантов, а в последующем поколении клеток—у варианта, не образующего антибиотик.
Полипептиды. Многие ан-тибиотики-полипептиды, обра-
4*
99
зуемые бактериями, накапливаются внутри клеток микробов. Надо полагать, что внутриклеточные антибиотики могут проявлять наиболее заметное влияние на организмы, продуцирующие их.
Бацитрацин. Процесс образования бацитрацина культурой Bacillus licheniformis тесно связан со спорообразованием этих бактерий. Ингибирование процесса спорообразования тормозит биосинтез антибиотика. При внесении в среду для развития бактерий меченого бацитрацина последний обнаруживается (до 15% от внесенного антибиотика) в спорах бактерий. Бацитрацин образуется в конце цикла развития Вас. licheniformis как составная часть спор. Однако имеются мутанты Вас. licheniformis, не продуцирующие бацитрацин, ио нормально образующие споры. Следовательно, не во всех случаях бацитрацин необходим для образования спор у клеток Вас. licheniformis.
Имеются указания на то, что этот антибиотик в определенных условиях может подавлять рост Вас. licheniformis, вызывая лизис протопластов клеток бактерий.
При этом лизис протопластов зависит от концентрации бацитрацина и наличия в среде ионов Мп, Cd или Zn.
Надо полагать, что роль бацитрацина в жизнедеятельности образующих его бактерий связана с ионофорными свойствами антибиотика, принимающего участие в транспорте ионов Мп.
Бацитрацин синтезируется при участии фермента серинпротеа-зы, который образуется Вас. licheniformis. Высказана гипотеза о том, что бацитрацин может принимать участие в регуляции синтеза самого антибиотика через ингибирование активности серинпро-теазы.
Приведенные результаты исследований показывают, что бацитрацин принимает определенное участие в процессе развития собственного продуцента.
Грамицидин. В процессе развития Bacillus brevis происходит внутриклеточное образование антибиотика грамицидина С. Детальное изучение этого вопроса показало, что грамицидин С оказывает заметное влияние на такие процессы, как спорообразование, биосинтез антибиотика собственным продуцентом.
Под действием определенных веществ удается блокировать синтез грамицидина С без серьезного нарушения роста культуры. Эти данные вроде бы указывают на то, что антибиотик не оказывает какого-либо физиологического влияния на рост продуцента. Однако полученные результаты свидетельствуют, что у Вас. brevis пути синтеза молекулы грамицидина и молекулы белка клеток различны.
Грамицидин С, добавленный в среду, стимулирует биосинтез этого антибиотика культурой Вас. brevis вар. Р+. Даже на среде, содержащей ингибитор образования грамицидина С (0-фенил-р-аланин), антибиотик в концентрации 100 мкг/мл снимает ингибирующее действие указанного вещества, и культура начинает синтезировать грамицидин.
В процессе формирования спор происходит резкое уменьшение
100
антибиотика, находящегося в культуральной жидкости. При формировании спор бактерий не образующим грамицидин С штаммом (Р~-варнант) также наблюдается уменьшение внесенного в среду антибиотика. В этих условиях грамицидин С, добавленный к субстрату в концентрации 30 мкг/мл, уже через 23—24 ч культивирования бактерий не обнаруживается в среде. В процессе спорообразования Вас. brevis до 50% грамицидина, содержащегося в вегетативных клетках бактерий, переходит в споры. Например, концентрация грамицидина С в вегетативных клетках перед спорообразованием равна 190 мкг, а в спорах — 95 мкг (на 1 мг сухой биомассы).
Динамика изменения концентрации грамицидина С в спорах при прорастании их в синтетической среде, в среде с бульоном Хоттпнгера и в физиологическом растворе показана в табл. 20.
Таблица 20
Изменение концентрации грамицидина С в процессе прорастания спор и дальнейшего развития клеток Bacillus brevis
(по Егорову и Коршунову, 1963)
Время культивирования , ч Синтетическая среда Бульон Хеттингера Физиологический раствор
биомасса в мг/100 мл культуральной жидкости грамицидин, мкг/мг биомассы биомасса в мг/100 мл культуральной жидкости грамицидин, мкг/мг биомассы биомасса в мг/100 мл культуральной жидкости грамицидин, мкг/мг биомассы
0 12 95 12 95 12 95
6 4 60 13 0 12 93
8 — — 45 6 -— —
9 8 8 113 16 — —
10 — — 172 24 1 —
12 108 19 260 60 — —
15 255 50 362 102 — -—-
18 383 95 450 144 10 80
21 493 137 550 192 — —
24 584 183 532 185 — —
Приведенные в табл. 20 данные убедительно показывают, что споры Вас. brevis, помещенные в питательные среды, уже в первые 6—9 ч теряют практически нацело весь антибиотик, в них содержащийся. На более богатой по составу среде (бульон Хоттинге-ра) грамицидин в спорах не обнаруживается уже к 6 ч после начала инкубации спор, затем количество антибиотика в вегетативных клетках начинает вновь накапливаться, и уже к 21 ч его содержится в 2 раза больше, чем в исходных спорах. На синтетической среде этот процесс несколько растянут, но имеет ту же тенденцию (рис. 5).
При помещении спор в физиологический раствор (0,8%-ный раствор NaCl) прорастания их не наблюдается, количество антибиотика в этих условиях уменьшается всего лишь на 16%. При этом и масса спор снижается на 16,5%. Грамицидин С не выделя-
101
Рис. 5. Динамика изменения грамицидина С при прорастании спор и развитии вегетативных клеток Bacillus brevis па бульоне Хеттингера (по Егорова' и Коршунову, 1963)
ется в окружающую среду прорастающими спорами, и антибиотик не удается обнаружить в среде.
Грамицидин С в синхронно прорастающих спорах Вас. brevis R-варианта через 4 ч инкубации не обнаруживается ни в спорах, ни в окружающей их среде. Однако он присутствует в разрушенных ультразвуком проросших спорах. Это указывает на то, что, во-первых, при инкубации спор часть антибиотика разрушается и, во-вторых, по-видимому, часть грамидицина С прочно связывается с клеточной мембраной и не экстрагируется спиртом.
Грамиднцин С, добавленный к среде для культивирования Вас. brevis в концентрации от 30 до 100 мкг/мл, тормозит или, наоборот, ускоряет процесс спорообразования клеток этого организма. Например, при внесении антибиотика в концентрации 30 мкг/мл в среду, в которой происходит нормальный синтез грамицидина С культурой Вас. brevis Рт-варпанта, или при ингибировании процесса биосинтеза (среда с р-фенил-р-аланином), через 13 ч развития бактерий наблюдается заметная стимуляция спорообразования изучаемой культурой. Но такая же концентрация грамицидина С при добавлении к среде, содержащей стимулятор биосинтеза антибиотика (р-фенил-а-аланин), задерживает процесс спорообразования при нормальном росте бактерий.
Содержащийся в спорах Вас. brevis R-варпанта грамицидин С (примерно 35—50% от количества антибиотика, накапливающегося в вегетативных клетках) задерживает их прорастание на 4— 5 ч по сравнению со временем прорастания спор Р_ и S-вариантов Вас. brevis, не синтезирующих грамицидин С, а также по сравнению со временем прорастания спор R-варпанта, полученными в
102
результате развития бактерий на синтетической среде с р-феиил-р-алаиином (ингибитор образования грамицидина С).
Ранее считалось, что молекула грамицидина С, благодаря наличию в ее структуре двух остатков Л-фенилаланипа, устойчива к протеолитическим ферментам. Однако в 1960 г. из культуры Вас. subtilis была выделена протеиназа, способная расщеплять некоторые полипептидные антибиотики, в том числе и грамицидин. Под действием этой протеиназы молекула грамицидина С подвергается гидролизу в звене £-валин-£-орнитин.
Комплексный ферментный препарат проназа, образуемый одним видом актиномицета, и нейтральная протеиназа фирмы Nagaso, выделенная из Вас. subtilis, инактивируют грамицидин (на 50%). Субтилизин таким действием не обладает (табл. 21).
Таблица 21
Действие некоторых протеолитических ферментов на грамицидин С при 37 С (исходная концентрация антибиотика 1214 мкг/мл) (по Егорову, Выпияч, Жариковой и др., 1975)
Фермент Бремя инкубаи»111 • 4 Количество разрушенного грамицидина, %
название продуцент
Протеиназа Nagaso Bacillus subtilis 24 55
48 55
Проназа Streptomyces griseus 24 50
48 50
Субтилизин Bacillus subtilis 24 0
48 0
Контроль (без фермента) —• 24 0
48 0
Наши настойчивые исследования показали, что сами клетки и прорастающие споры продуцента грамицидина С способны образовывать фермент грамнцидиназу, инактивирующий этот антибиотик.
Приведенные в табл. 22 данные наглядно указывают на то, что более 45% грамицидина С под действием фермента, изолнрованно-
Таблица 22
Разрушение грамицидина С ферментом грамицидиназой, выделенным из прорастающих спор Bacillus brevis
-вариант) в течение 24 ч при 37СС
Грамицидин С» мкг/мл Фермент граммцмдипаза
контроль (без фермента) опыт (добавлен фермент)
Исходная концентрация 60 60
Количество антибиотика после 24 ч 60 28
Разрушение грамицидина, % 0 45,7
J03
го из прорастающих спор Вас. brevis, разрушается в течение 24 ч при 37°С.
С помощью электрофореза в полиакриламидном геле из белкового комплекса Вас. brevis var. G. В. была выделена фракция, инактивирующая молекулу грамицидина С (табл. 23).
Таблица 23
Инактивация грамицидина С фракцией белкового ко п е са культуральной жидкост! Bacillus brevis var. G. В.
Вариант ®пыта Опыт Контроль
Грамицидин С в инкубационной смеси, мкг/мл . . . 50 50
Белок в инкубационной смеси, мкг/мл Грамицид и С в смеси через 24 ч инкубации. 50 —
мкг/мл Следы 50
Фермент грамицидиназа действует по типу химотрипсин-протеа-зы, разрывая пептидные связи, образованные карбоксильными группами фенилаланина и лейцина.
Интересным оказался факт, что грамнциднназу образуют развивающиеся культуры всех вариантов (R, S, Рт, Р_) Вас. brevis (табл. 24).
Таблица 24
Разрушение грамицидина С ферментом грамицидииазой, выделенным из культуральной жидкости четырех вариантов
Bacillus brevis (24 ч, t 37-С»
Вариант Bacillus brevis Грамицидин С. мкг/мл Разрушение антибиотика, %
начало опыта после 24 ч
R 1300 170 87
S 1400 500 65
P+ 1000 370 63
p- 1000 120 88
Таким образом, теперь мы с полным основанием можем сказать, что исчезновение части антибиотика, находящегося в большом количестве в спорах Вас. brevis, в процессе их прорастания связано с действием фермента грамицидиназы, образуемого прорастающими спорами. Ферментативную инактивацию антибиотика в момент прорастания спор следует рассматривать в качестве определенного приспособления, обеспечивающего снятие ингибирующего действия грамицидина С на процесс прорастания спор.
Одновременно с ферментативной инактивацией грамицидина С в прорастающих спорах Вас. brevis происходит связывание анти-
104
бпотнка фосфолипидами. Взаимодействие антибиотика с фракцией фосфолипидов, выделенных из клеток 24-часовой культуры, показало в табл. 25.
Таблица 25
Взаимодействие грамицидина С с фосфолипидами собственного продуцента (по Маркеловой, Юлиной и Егорову, 1981)
Вариант J&tCi Hus brevis Фосфолипиды в растворе, мкг/мл Грамицидин С в растворе фосфолипидов Грамицидин С, контроль
до инкубации после ннкубаиин до инкубации, мкг/мл после инкубации, мкг/мл
мкг /мл % мкг/мл %
R 120 85 100 40 42 85 85
S 220 85 100 42 41 85 83
P+ 100 85 100 40 42 85 87
P- 80 85 100 65 76 85 85
Приведенные данные определенно показывают, что грамицидин С, образовавшийся в клетках Вас. brevis или добавленный к среде, не безразличен для клеток собственного продуцента. Он играет определенную роль в жизнедеятельности образующего его организма, включая процессы дифференциации клеток Вас. brevis. Грамицидин С, внесенный в среду, усиливает процесс биосинтеза антибиотика, в зависимости от концентрации и стадии развития бактерий он тормозит или ускоряет процесс образования спор.
Низин. При засеве свежей питательной среды культурой Streptococcus lactis вместе с посевным материалом вносится и низин. Отмечено, что количество общего низина (внутриклеточного и антибиотика, содержащегося в культуральной жидкости) в процессе развития бактерий снижается и к концу периода лаг-фазы клетки стрептококка практически не содержат антибиотика. Синтез низина происходит после экспоненциального роста бактерий,.в период ранней стационарной фазы.
Снижение синтеза антибиотика в указанный период развития бактерий обусловлено изменением третичной структуры или степени полимеризации антибиотика. Однако не следует исключать в процессе инактивации низина и участие определенных энзиматических систем типа низиназ, так как уменьшение количества низина происходит как в клетках стрептококка, так и в культуральной жидкости. Есть указания о том, что некоторые штаммы бактерий способны разрушать этот антибиотик.
Длительность лаг-фазы клеток, взятых в качестве посевного материала в разные периоды их развития, зависит от количества внутриклеточного низина: чем меньше клетки стрептококка содержат антибиотика, тем короче у них лаг-фаза, п, наоборот, с увеличением внутриклеточного ннзина наблюдается удлинение лаг-фазы роста бактерий.
105
Снижение общего количества низина в лаг-период развития Streptococcus lactis и синтез антибиотика в более поздний период роста подтверждает значение низина в качестве важной части бактериального ростового цикла стрептококка. Низин, по-видимому, связан с контролирующим механизмом, который не оказывает влияния на скорость роста продуцента антибиотика, но задерживает начало роста новых клеток.
Низин в концентрации 1500 и 2000 ед. R/мл среды (37 и 50 мкг/мл) снижает в течение первых двух суток рост биомассы Str. lactis в 2,5 и 4 раза соответственно. Значительно при этом снижается и биосинтез антибиотика.
В средах, содержащих недостаточное для нормального развития количество азота (1—2 мг% NH2 при норме 29 мг°/о), сильно снижается рост стрептококка и образование антибиотика. Добавление в этих условиях к среде низина способствует увеличению роста биомассы Sir. lactis и некоторому повышению образования антибиотика. Указанный факт дает основание предполагать, что в условиях недостатка азота в среде и добавления к ней низина последний может потребляться стрептококком как источник азота.
Полипептидные антибиотики могут подавлять рост организмов-продуцентов этих биологически активных веществ в тех концентрациях, которые образуются в процессе развития организмов. Эти антибиотики, по-видимому, выполняют регуляторную функцию в процессе перехода вегетативных клеток в споры, оказывая влияние на ДНК-репликацию, синтез клеточной стенки, функцию мембран и другие процессы.
У продуцента тироцидииа Bacillus brevis АТСС 8185 ферменты, участвующие в его биосинтезе, обнаруживаются в экспоненциальной фазе развития бактерий, а в стационарной фазе их количество резко снижается. При формировании спор основная часть тироци-дин-синтезпрующей активности фермента обнаруживается в проспорах Вас. brevis, куда фермент переходит из цитоплазмы вегетативных клеток. Эго указывает на то, что тироцидии участвует в процессах перехода вегетативных клеток в споры.
Высказано предположение (Katz, Demain. 1977), что процессы спорообразования и синтеза антибиотиков независимы друг от друга, но регулируются общими пли близкими механизмами, что и определяет их тесную взаимосвязь. Эта интересная гипотеза нуждается, однако, в экспериментальных доказательствах.
Актиномицины. Добавление актиномицина к среде одновременно с засевом ее актпномицетом — продуцентом этого антибиотика — подавляет рост актиномицета в первые 24 ч. Антибиотик в концентрации 4,2 мкг/мл среды подавляет рост актиномицета на 50%, а в концентрации 50 мкг/мл полностью угнетает развитие Streptomyces antibioticus.
Активно развивающийся мицелий актиномицета (в возрасте до 20—22 ч) наиболее чувствителен к актиномицину. Антибиотик ингибирует включение в белки ряда аминокислот: L-пролина, L-ва-лина, DL-триптофана, L-треонина и др. 24-часовой мицелий акти-
106
помпцета способен осуществлять биосинтез актиномицина, но обладает меньшей чувствительностью к антибиотику, а на 48-часовой мицелий актиномицин не оказывает заметного ингибирующего действия.
Если в культуре Str. antibioticus подавить биосинтез актиномицина ингибитором (З-метил-ПЬ-пролин), то рост актиномицета усиливается в 4—5 раз. Аурантин (антибиотик актиномициновой группы), образуя комплекс с ДНК, нарушает реплпкавионный синтез РНК, а затем и синтез белка у продуцента.
Все это подтверждает, что актиномицины оказывают заметное действие на различные стороны жизнедеятельности собственных продуцентов.
Тр и хотеци н. Антибиотик играет значительную роль в жизнедеятельности синтезирующего его гриба. По всей вероятности, он обусловливает мпкропаразитпзм Trichothecium roseum, обеспечивая грибу возможность использования поврежденных или убитых антибиотиком других грибов в качестве источника питания.
Изучение влияния трихотецина на продуцент этого антибиотика показало, что в концентрации 200 мкг/мл происходит угнетение роста гриба в первые часы культивирования. Наиболее остро токсическое действие трихотецина проявляется в том случае, если антибиотик вводится в 48-часовую культуру гриба. Антибиотик адсорбируется поверхностью мицелия, нарушает проницаемость клеточных стенок гриба и угнетает образование трихотецина.
Поскольку мы предполагаем, что антибиотики, выделяющиеся в среду или преимущественно накапливающиеся в клетках организма-продуцента, могут по-разному влиять на физиологические функции образующих их микроорганизмов, то для работы были взяты антибиотики (новобпоцин, рпстомицнн и нистатин), отличающиеся по их содержанию и культуральной жидкости и в мицелии. Процесс образования и накопления изучаемых антибиотиков
Таблица 26
Содержание антибиотиков в культуральной жидкости и мицелии продуцентов в динамике их развития
Продуцент
Streptomyces spheroides | Nocardia fructiferi | Steptomyces noursei
Время роста, сут
Антибиотик
НОВОбНОЦШ! ристомнцин нистатин
в к. Ж. в миц. в к. ж. в мвц. в к. ж. в мпц.
мкг/ мл мкг/мг мкг/мг мкг/мл мкг/мг мкг/мг мкг/мл мкг/мг мкг/мг
10—20 150—200 250—300 5—7 0,1—0,2 15—20 2,0—3,0 30—35 5,0—6,0 250—300 500—600 500—600 60—80 60—80 60—80 100—150 150—200 100—150 300—400 100—150 300—350 40—50 25—30 80—90 700—750 150—170 400—450
Обозначения: к. ж. — культуральная жидкость, .миц. — мицелий.
J07
в мицелии и в культуральной жидкости продуцентов представлен в табл. 26.
Из данных табл. 26 следует, что основное количество новобио-цина выделяется в среду и лишь небольшое количество содержится в мицелии продуцента. Ристомицин содержится в мицелии и в культуральной жидкости нокардии практически в одинаковом количестве. Нистатин в основном содержится в мицелии продуцента п лишь небольшое его количество выделяется в среду.
Новобиоцин оказывает определенное влияние на актиноми-цет, который его продуцирует. В концентрации 400 мкг/мл антибиотик, внесенный в среду перед началом развития актиномицета, полностью останавливает рост и развитие Str. spheroides. Иными словами, количество антибиотика, образуемое актпномицетом к 7—8-м суткам, оказывается резко неблагоприятным для того же организма в начале его развития.
Исходная концентрация новобиоцина в среде, равная 100 мкг/мл, значительно тормозит рост продуцента, потребление им глюкозы, лимонной кислоты, фосфора и азота, а также снижает биосинтез антибиотика.
Необходимо отметить, что угнетающее действие новобиоцина на рост актиномицета и его метаболизм проявляется в первые три дня развития организма. Наиболее чувствительным к действию новобиоцина оказался углеродный обмен (потребление глюкозы и лимонной кислоты). Так, новобиоцин в концентрации 200 мкг/мл полностью тормозит потребление культурой Str. spheroides лимонной кислоты и в 4—6 раз снижает потребление глюкозы, резко снижается также использование актпномицетом азота и фосфора (табл. 27).
Развитие актиномицета в присутствии 100 мкг/мл новобиоцина сопровождается значительным накоплением в среде ацетоуксусной, пировиноградной и оксипировиноградной кислот.
Таблица 27
Влияние различных концентраций новобиоцина на развитие Streptomyces spheroides и биосинтез антибиотика (данные на 7-е сутки развития культуры) (по Тороповой и Егорову, 1966)
Количество иовобиоцииа в среде, мкг/мл Потребление актпномицетом, мг/г мицелия Биомасса Биосинтез новобиоцина
азота ГЛЮКО- ЗЫ лимонной КИСЛОТЫ фос-4юра г/л % мкг/г %
0 80 3500 Вся на 5-е 30 11,0 100 4000 100
(контроль) сутки
50 80 3500 Вся 30 11,0 100 4000 100
100 80 1000 100 30 7.0 64 1000 25
200 25 800 0 0 3,0 27 1000 25
400 0 0 0 0 0,2 2 0 0
108
При добавлении новобиоцпна (100 и 200 мкг/мл) к среде перед началом развития актиномицета происходит заметное снижение биосинтеза антибиотика: образование новобиоцпна на 5-е сутки развития актиномицета снижается в 5—7 раз, а на 7-е сутки — в 4 раза.
Сразу же после засева мицелием актиномицета среды, содержа* щей 100—400 мкг/мл новобиоцина, часть антибиотика адсорбируется мицелием, однако в клетку он еще не проникает, и количество его в мицелии не изменяется (табл. 28).
Таблица 28
Адсорбция новобиоцина из среды мицелием Strepiomyces spheroides
Длительность выращивания, ч
0 до посева 0 после посева 3 G 24
в среде, мкг/мл В МИЦ., мкг/мг в среде, мкг/мл В миц., мкг/мг в Среде, мкг/ мл ЙЕ S - S t-X S3 X в среде, мкг мл в миц., мкг/мг в среде, мкг/мл а миц,. мкг/мг
100 400 0,1 0,1 50 280 0,1 0,1 240 0,4 45 220 0,2 0.5 45 360 2 4
Через 3 и 6 ч роста актиномицета некоторое количество новобиоцина, находящееся в среде, еще адсорбируется мицелием, и за это время антибиотик успевает проникнуть в клетку, где его содержание увеличивается от 0,2 до 0,4—0.5 мкг/мг. Через 24 ч содержание новобиоцина в мицелии увеличилось до 2 мкг/мг (при начальном содержании его в среде 100 мкг/мл) и до 4—5 мкг/мг (при начальном содержании в среде 400 мкг/мл). Иными словами, количество новобиоцина в мицелии увеличивается в 20 и 40— 50 раз по сравнению с контролем. Следовательно, содержание но-вобиоципа в мицелии зависит от концентрации его в окружающей среде.
Под влиянием новобиоцина (100 мкг/Лл) у Str. spheroides происходит подавление синтеза нуклеиновых кислот. Причем подавление синтеза РНК происходит в большей степени, чем торможение синтеза ДНК- Действие антибиотика, добавленного к среде перед началом опыта, и синтезированного в процессе развития актиномицета на метаболизм нуклеиновых кислот Sir. spheroides аналогично.
Добавление новобиоцпна к среде перед началом развития актиномицета не оказывает влияния на содержание в мицелии Str. spheroides общего и неорганического фосфора, но вызывает существенные изменения в содержании лабильного и стабйльного фосфо-
109
О ] 2 J 4 5
Время купыпивироБс/шя, гут
Рис. 6. Изменение активности дегидрогеназы и каталазы у Streptomyces spheroides и его неактивного мутанта:
1 — новобиоцин. i — дегидроге-назная активность продуцента антибиотика, 3 — то же, неактивного штамма. 4 — каталазная активность продуцента, 5 — то же, неактнвного мутанта
образующего новобиоцин
ра. Добавление в среду 100 мкг/мл антибиотика повышает в 2 раза содержание в мицелии лабильного фос-фора и снижает содержание стабильного Р по сравнению с контролем.
Сравнение окислительной способности продуцирующего новобиоцин и не образующего антибиотик штаммов Sir. spheroides показало, что продуцент новобиоцина наиболее интенсивно окисляет пировиноградную кислоту в период своего развития, когда происходит активный биосинтез антибиотика (4-е сутки роста). Добавленный к субстрату новобиоцин (100 мкг/мл) оказывает ингибирующее действие на окислительную способность мицелия Str. spheroides. Наиболее чувствительно к действию антибиотика окисление янтарной кислоты, а наименее чувствительно окисление уксусной кислоты.
Сравнительное изучение физиологии образующего и не обазующего новобиоцин штаммов Str. spheroides показало, что активность дегидрогеназ и каталазы штамма, не продуцирующего антибиотик (неактивного), ниже, чему (активного) (рис. 6), а глюкозоксидазпая
активность, наоборот, в 30—60 раз ниже у активного штамма, чем у неактивного штамма Str. spheroides (рис. 7). При этом отмечено, что у активного штамма во вторую фазу роста актиномицета (фаза
Рис. 7. Изменение глюкозоксидазной активности в процессе развития Streptomyces spheroides (штамм 35) и его неактивного мутанта (штамм 144)
ПО
начала биосинтеза и накопления в среде новобиоцина) активность глюкозоксидазы и некоторых дегидрогеназ резко снижается.
Полученные данные позволили сделать предположение о том, что новобиоцин, по-видимому, ингибирует активность некоторых ферментов собственного продуцента. Для проверки этого предположения новобиоцин в концентрации 100 мкг/мл добавили в среду перед началом развития продуцента и изучили влияние его на активность каталазы, дегид-ронеиаз и глюкозоксидазы. Результаты опытов показали, что к ново-биоцину очень чувствительна глюко-зоксидаза (рис. 8), некоторые дегидрогеназы и практически не чувствительны каталаза (рис. 9) и пе-
Рис. 8. Влияние новобиоцина иа глюкозоксидазную активность необразующего антибиотик штамма (144) Streptomy-ces spheroides:
/ — активность фермента без новобиоцина, 2 — активность фермента при добавлении антибиотика (100 мкг/мл)
рокспдаза.
Таким образом, полученные экспериментальные данные и прежде всего в отношении дегидрогеназ и глюкозоксидазы при сравни-
Время культивировании, сут
Рис. 9. Влияние новобиоцина (100 мкг/мл) на активность каталазы у Streptomyces spheroides (штамм 35) н его неактивного мутанта (штамм 144):
1.3 — активность фермента без новобиоцина. 2. 4 — активность фермента с добавкой антибиотика
III
тельном изучении их активности у образующего и не образующего антибиотик штаммов Str. spheroides, а также результаты изучения действия новобноццна на активность (чувствительность) этих ферментов у неактивного штамма четко показывают, что новобио-цин оказывает ингибирующее действие на активность некоторых дегидрогеназ и глюкозрксидазы и, возможно, выполняет роль регулятора их активности. • •
РнстоМинин. Количество ристомицина от 500 до 800мкг/мл, образуемое нокардиен ,*1ерез 4—5 сут нормального роста, при внесении в среду непосредственно перед ее засевом мицелием Nocardia fructiferi var. ristomycini полностью подавляет развитие продуцента антибиотика.
Ристомицин в концентрации 400 мкг/мл, добавленный в синтетическую среду перед засевом ее мицелием нокарднн, в четыре раза тормозит образование антибиотика на 5-е сутки роста нокар-дии. Одиако рост микроорганизма при этом даже несколько возрастает. *
Наиболее чувствительны к действию рпстомпцвна процессы, связанные с потреблением азота, фосфора и биосинтезом антибиотика.
Как показали наши исследования, уже через 30 мин сравнительно небольшое количество ристомицина сорбируется на мицелии, откуда он довольно легко н быстро переходит в физиологический раствор при смывании. При этом чем выше концентрация ристомицина в среде, тем больше его сорбируется мицелием. В дальнейшем через 6, 12 ч роста нокардии изменений не наблюдается. Полученные данные показывают, что ристо-мнцпн, по-видимому, не проникает внутрь мицелия нокарднн. Действие на продуцент он оказывает, находясь на поверхности клеток продуцента антибиотика.
Ристомицин, добавленный в среду в количестве 400 мкг/мл, оказывает существенное влияние на фосфорный обмен Noc. fructiferi var. ristomycini. Антибиотик изменяет содержание всех форм фосфора в мицелии продуцента рпстомицн-на. В его присутствии происходит резкое (почти в 4 раза) увеличение содержания стабильного фосфора по сравнению с контролем (рис. 10). Содержание лабильного фосфора в мицелии нокарднн в опыте (в присутствии ристомицина) существенно.отличается от количества лабильного фосфора, содержащегося в мицелии, развивающегося в среде без внесения в нее антибиотика (контроль). Если в контроле в первые сутки роста лабильного фосфора мало, после чего наблюдается его
Рис. 10. Влияние ристомицина (400 мкг/мл) на содержание стабильного и лабильного фосфора в мицелии Nocardia fructiferi var. ristomycini:
J — фосфор лабильный без антибиотика, 2 — то же, плюс антибиотик, 3 — фосфор стабильный без ристомицина, 4— то же, плюс ристомицин
112
Рис. И. Влияние ристомицпна (400 мкг/мл) иа образование органических кислот в культуре Nocardia {ructiferi var. ristomycini. I — летучие кислоты. Il — кетокислоты. 111 — антибиотическая продуктивность: 1— контроль (без антибиотика), 2 —в среду добавлен антибиотик
увеличение и затем опять уменьшение, то в опыте содержание лабильного фосфора прямо противоположно контролю, т. е. в первые сутки его содержание в мицелии высокое, затем снижается и вновь повышается.
Таким образом, изучение влияния ристомицпна на фосфорный обмен его продуцента Noc. fructijeri var. ristomycini показало, что этот антибиотик способствует увеличению содержания в мицелии собственного продуцента всех форм фосфора: общего, минерального, лабильного и особенно стабильного.
Вместе с этим при развитии нокардии в среде, в которую добавлено 400 мкг/мл ристомицина (рис. 11), наблюдается уменьшение образования кетокнслот (пировиноградной, ацетоуксусной) примерно в 2 раза по сравнению с контролем.
Ристомицнн оказывает определенное влияние на синтез нуклеиновых кислот Noc. fructiferi (табл. 29). Из данных, приведенных в табл. 29, следует, что ристомицнн, добавленный в среду в концентрации 400 мкг/мл, с первых суток и до конца роста нокардии немного ингибирует синтез ДНК, практически не оказывает влияния на содержание РНК в первые двое суток роста и способствует увеличению РНК во вторую фазу роста продуцента (3—4-е сутки). Эта же концентрация ристомицпна снижает у Noc. f ructiferi var. ristomycini активность таких ферментов, как глпцеральдегид-рофосфатдегидрогеназа, транскетолаза, изоцнтратдегидрогеназа и сукцинатдегидрогеназа. Ингибирование этих ферментов в присутствии ристомицпна приводит к резкому снижению биосинтеза антибиотика.
113
Влияние ристомнцииа на синтез нуклеиновых кислот Nocardia fructiferi var. ristomiicini
Таблица 29
Содержание нуклеиновых кислот, мг/г
РНК 1 ДНК
Время роста.
сут Добавление.в среду рпстоммцина, мкр/мл
0 100 и 400
1 30,0 28,0 15,3 13,0
2 19,7 19,8 11.0 9,0
3 18,1 19,4 И .4 8,6
4 11,0 18,2 9,0 7.5
5 9,0 14,4 6,0 5,4
Нистатин. Антибиотик нистатин в процессе развития актиномицета в основном содержится в мицелии, по-видимому, клеточные стенки Streptomyces noursei с трудом пропускают его молекулу. Для выяснения влияния нистатина на собственный продуцент нам пришлось использовать довольно высокие концентрации антибиотика, а также получить неактивный (не образующий антибиотик) штамм и сравнивать их биохимические особенности. Нистатин в концентрации 8000 ед/мл, внесенный в среду перед началом развития актиномицета, полностью подавляет синтез антибиотика, угнетая при этом образование биомассы продуцента лишь на 10— 20%, в концентрации 4000 ед/мл никакого заметного влияния на биосинтез нистатина не наблюдается.
Изучение активности фермента пентозного цикла расщепления углеводов (глюкозо-6-фосфатдегидрогеназа) у активного и неактивного штаммов Str. noursei показало, что у штамма, образующего нистатин, активность фермента глюкозо-6-фосфатдегндрогена-зы на 4-е сутки роста в 4 раза ниже, чем у штамма, не образующего антибиотик (табл. 30). Резкое снижение активности фермента
Таблица 30
Активность фермента глюкозо-6-фосфатдегидрогеназы у двух штаммов Streptomyces noursei (Торопова, Нугуманов, Егоров, 1974)
Время роста, сут Активный штамм Неактивный штамм
биомасса, мг % активность фермента, мк моль/мнн на 1 мг белках 10э биомасса, мг % активность фермента, мк моль/мин на 1 мг белках 103
1 275 156 216 208
2 411 152 380 250
4 557 69 495 272
6 430 44 402 146
114
происходит именно в тот период, когда актиномнцет начинает образовывать нистатин. Эта закономерность дает основание высказать предположение, что антибиотик оказывает регулирующее влияние на активность глюкозо-6-фосфатдегидрогеназы.
Непосредственное влияние добавок нистанпна на активность некоторых ферментов у активного и неактивного штаммов Str. noursei подтвердило это предположение (табл. 31).
Таблица 31
Действие нистатина (8000 ед/мл) на активность некоторых ферментов у двух штаммов Streptomyces noursei (Торопова, Нугуманов, Егоров, 1974)
Вариант опыта Время развития, сут Биомасса, мг % Фермент
пируватдекарбоксилаза, ед/мин на 1 мг белка сунцинат-дегидрогеяа-за, ммоль/ммн на 1 мг белка ГЛЮКОЗО-6-фосфатдегид-рогеиаза, мкмоль/мин на I ыг белках 10“
Активный штамм без 1 299 392 1360 156
нистатина 2 465 875 1175 152
4 563 690 870 69
6 501 666 293 44
Активный штамм -}- 1 225 410 1005 37
нистатин 2 397 663 860 38
4 504 501 631 20
6 447 420 201 0
Неактивный мутант 1 216 242 — 208
без нистатина 2 380 271 .— 250
4 495 143 «— 272
6 402 69 — 146
Неактивный мутант -)- 1 159 230 — 41
нистатин 2 291 207 — 49
4 435 102 .— 51
6 387 57 — 35
Как показали наши исследования, нистатин оказывает действие только на живую, развивающуюся культуру актиномицета.
Полученные результаты о влиянии нистатина на некоторые ферменты Str. noursei указывают, что ферменты пентозного цикла превращения углеводов более чувствительны к антибиотику, чем ферменты гликолиза и цикла трикарбоновых кислот. Нистатин, по-видимому, выполняет в метаболизме организма-продуцента определенную регулирующую функцию: подавляя ферменты пентозного цикла, он как бы направляет обмен веществ по более «экономичному» пути Эмбдена — Мейергофа — Парнаса (ЭМП) и способствует большему накоплению энергии для процессов биосинтеза.
Не исключено, что в первой фазе развития актиномицета, когда происходят энергичные конструктивные процессы, функционирует пентозный цикл превращения углеводов. Однако с началом
115
образования и накопления в клетках актиномицета антибиотика метаболизм переключается на другой путь — путь ЭМП.
Возможен вместе с тем и несколько иной путь воздействия нистатина на метаболизм собственного продуцента. Добавление 8000 ед/мл нистатина в среду значительно подавляет (на 50— 100%) у актиномицета активность альдолазы, не оказывая влияния на транскетолазную активность.
Эти данные дают основание предполагать, что нистатин выполняет роль регулятора, направляющего метаболизм по гексозомоно-фосфатному пути (ГМФ).
Если сравнить два эти пути (ЭМП и ГМФ) превращения углеводов с точки зрения механизма получения энергии, то ГМФ-путь в два раза менее эффективен, чем путь ЭМП.
Таким образом, приведенные материалы показывают, что нистатин выступает в роли фактора, регулирующего обмен веществ, своего продуцента, направляя метаболизм по определенному пути.
* * *
Анализ результатов изучения влияния отдельных антибиотиков на продуцирующие их микроорганизмы со всей очевидностью свидетельствует, что эти биологически активные соединения действительно оказывают заметное влияние на собственные продуценты.
Во всех изученных случаях антибиотики, вносимые в среду для культивирования собственных продуцентов перед началом их посева в концентрациях, которые обычно характерны для них в условиях нормального развития, угнетают рост продуцентов. В других случаях антибиотики (бацитрацин) принимают непосредственное участие в образовании спор собственного продуцента, в-третьих, антибиотики оказывают в зависимости от концентрации и времени внесения в среду ингибирующее или, наоборот, стимулирующее действие на процесс споруляции клеток, задерживают прорастание спор, усиливают биосинтез собственного антибиотика (грамицидина С), в-четвертых, — антибиотики выступают в качестве своеобразных регуляторов энзиматических процессов (новобиоцин, ристомицнн, нистатин и др.).
ВЫДЕЛЕНИЕ ПРОДУЦЕНТОВ АНТИБИОТИЧЕСКИХ ВЕЩЕСТВ И МЕТОДЫ ОПРЕДЕЛЕНИЯ ИХ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ
Выделение продуцентов антибиотиков может производиться из самых разнообразных субстратов: почвы, гниющих растительных и животных остатков, илов, воды озер и рек, воздуха и из других источников. Наиболее же богата микроорганизмами, продуцирующими антибиотики, почва. Из нее большей частью и выделяют организмы-продуценты антибиотических веществ.
Перед тем, как начинать поиски продуцентов антибиотических веществ, перед тем, как приступать к выделению микробов-антагонистов, образующих антибиотики, из естественных мест их обитания, перед исследователем должна быть поставлена ясная цель. При этом возможны две основные задачи: во первых, поиски продуцентов уже известных, описанных в литературе н используемых на практике антибиотиков, во-вторых, поиски новых антибиотиков, .способных проявлять биологическое действие по отношению к конкретным организмам.
В зависимости от поставленной цели должны быть использованы и соответствующие методы поисков организмов-продуцентов тек или иных антибиотических веществ.
Итак, если перед исследователем стоит задача выделить микроорганизм, образующий уже известный антибиотик, то при этом необходимо руководствоваться следующими основными принципами.
1. Каждый антибиотик образуется одним или несколькими определенными видами организмов.
2. Каждый микроорганизм образует один или несколько вполне конкретных антибиотиков.
Образование антибиотиков есть видовая специфика или, точнее, особенность отдельных штаммов микроорганизмов.
Так, для поиска продуцента грамицидина С изучают не все бактериальные штаммы, а лишь штаммы спорообразующих бактерий, принадлежащие к Bacillus brevis; для выделения продуцента стрептомицина надо искать актиномпцеты, относящиеся к Streptomyces griseus; если надо выделить продуцент фумагиллина, необходимо найти плесневые грибы, принадлежащие к Aspergillus fti-migatus и т. д.
Следовательно, при поиске продуцентов известных антибиотиков нет надобности выделять все организмы и изучать их антибио
117
тические особенности. Достаточно при этом выделить микроорганизмы, принадлежащие к определенному виду (или видам). Надо иметь в виду, что некоторые антибиотики, например, относящиеся к р-лактамам (пенициллины, цефалоспорины и др.), могут образовываться как плесневыми грибами, так и некоторыми видами стрептомицетов в собственно бактерий. Однако этот пример не противоречит вышесказанному, а, наоборот, подтверждает положение о том, что известные антибиотики образуются вполне определенными видами (или штаммами) организмов, которые могут принадлежать к различным систематическим группам.
Иной подход должен быть при решении второй задачи — поисков продуцентов новых антибиотиков, активных в отношении определенных организмов. В данном случае продуценты антибиотических веществ следует пытаться выделить из всех групп организмов.
' Изолированные штаммы изучаются в отношении их антибиотического действия к тем тест-организм а м, для которых необходимо найти антибиотик.
При необходимости поиска среди микроорганизмов штамма, подавляющего развитие, например дрожжеподобного организма Candida albicans, в качестве тест-микроба используют С. albicails или другой организм, близкий к нему по физиологическим свойствам.
Выделяя микроб-антагонист, активный по отношению к какому-либо возбудителю болезней растений, в качестве тест-организма необходимо использовать данный фптопатогенный организм. В этих случаях испытывают все выделяемые штаммы микроорганизмов, с тем чтобы не пропустить организм, нужный для решения поставленной задачи.
Гораздо сложнее обстоит дело с поиском продуцентов антибиотиков, активных в отношении вирусов и злокачественных новообразований.
Если бактерии, актипомицеты, грибы пли протозоа — возбудители тех или иных заболеваний — могут быть непосредственно использованы в опытах как тест-органпзмы при культивировании их на обычных лабораторных средах, то вирусы как внутриклеточные паразиты не могут культивироваться на таких средах. Для их развития нужны живые клетки, живые ткани. Аналогичные трудности возникают и при поисках противораковых антибиотиков. Рассмотрение этих вопросов сделано ниже.
Итак, первая задача исследователей при поиске продуцентов антибиотиков — выделение их из природных источников. Вместе с тем для этих целей широко применяется метод изменения генома выделенного продуцента антибиотика путем мутагенеза и генной инженерии.
Наконец, для получения наиболее эффективного по биологическому действию антибиотика используют метод химической или биологической трансформации природных соединений.
118
ВЫДЕЛЕНИЕ МИКРОБОВ-АНТАГОНИСТОВ
Для выделения микроорганизмов — продуцентов антибиотиков из естественных мест их обитания применяется большое число разнообразных методов. Здесь же следует остановиться лишь на са-. мой общей характеристике этих методов. В основу большинства приемов положен принцип выделения чистой культуры микроба и непосредственного испытания его по отношению к используемым тест-организмам.
Однако, как отмечалось выше, существенное значение при образовании антибиотических веществ имеют и смешанные культуры. Это обстоятельство также необходимо помнить при поиске продуцентов антибиотических веществ.
Важное значение при выделенки микроба-антагониста из той или иной группы организмов имеет специфичность условий его культивирования. Как уже отмечалось выше, выделение микробов-продуцентов антибиотических веществ производят из субстратов, где обильно развиваются разнообразные формы микроорганизмов (бактерии, актиномицеты, дрожжи, грибы), поэтому очень важно знать и учитывать специфику условий развития тех организмов, которые необходимо выделить.
Например, большинство сапрофитных бактерий хорошо развивается на богатых по составу натуральных средах (мясопептонный агар, картофельный агар, сусло-агар и др.) при pH около 7,0 и при температуре в пределах от -f-ЗО до 4-37°С. При этих условиях развиваются также актиномицеты и некоторые грибы, но для них такие условия менее благоприятны, чем для бактерий.
При выделении актиномицетов пли грибов следует также учитывать особенности их развития. Актиномицеты растут медленнее, чем бактерии; они могут использовать такие источники питания, ксгорые не очень хорошо используются бактериями.
Учитывая особенности развития актиномицетов, для выделения их из естественных субстратов рекомендуются следующие среды:
Среда t-я Среда 2-я
(NH4),SO4................1г
К2НРО4...................1г
NaCl.....................1г
MgSO,....................1г
Крахмал.................10 г
Вода водопроводная . 1000 мл
Агар-агар...............15 г
КМОз...................1г
К2НРО4...............3 г
NaCl.................0,2 г
MgCO3....................0,3 г
Крахмал...................10 г
FeSO4.................0,001 г
СаСО3....................0,5 г
Вода водопроводная . . 1000 мл
Агар-агар . .............15 г
pH сред устанавливается в пределах 6,8—7,1 после их стерилизации.
Для выделения термофильных актиномицетов удобно использовать среду следующего состава: пептон — 5 г, кукурузный экстракт— 5 мл, глюкоза—10 г, NaCl — 5 г, СаС12 — 0,5 г, агар—• 15 г, вода водопроводная — до 1 л. Выращивание термофильных культур следует производить при температуре 55—60°С.
119
Однако поиски продуцентов новых антибиотиков из группы ак-тппомпцстов требуют выделения из природных источников новых форм этих микроорганизмов, обладающих иными физиолого-биохимическими свойствами. Применяя новые ие стандартные методы выделения актиномицетов, используя необычные субстраты и- образцы почв, отобранные в разнообразных экологических условиях и географических зонах, в последнее время удалось показать, что действительно в природе имеются формы актиномицетов, о которых ранее не было известно. Изолированы, например, актиноми-цеты, способные развиваться при пониженных температурах. Среди этих форм обнаружены продуценты антибиотиков, например криомпцпна.
В природе существуют ацидофильные актиномицеты, которые лучше растут в условиях кислой среды (pH 3,5—6,5). Ацидофильные актиномицеты образуют антибиотические вещества, обладающие противогрпбным действием.
Выделены новые формы актиномицетов, предпочитающие для своего развития щелочные условия, — это так называемые алкало-фильиые организмы. >•
Среди новых форм актиномицетов встречаются и галофильные виды, способные расти лишь в средах, содержащих высокие-концентрации минеральных солей (например, ие менее 10% NaCl)^
Приведенные примеры значительно расширяют имеющиеся представления о физиолого-биохимических особенностях группы актиномицетов. Исследователи, занимающиеся поисками продуцентов новых антибиотических веществ, должны иметь в виду эти особенности, с тем чтобы обеспечить максимально возможные условия для развития всех имеющихся в природе форм актиноМйце-тов. Выделение новых форм микроорганизмов позволяет надеяться на получение новых антибиотических веществ с ценными свойствами. г
Микроскопические грибы предпочтительнее развиваются на средах с несколько пониженным значением pH (4,5—5), на которых плохо растут многие бактерии и актиномицеты.
Выделение грибов можно производить как на синтетических (например, среда Чапека), так и на сложных по составу натуральных средах (например, сусло-агар) с начальным рН = 4,5—5.
Для выделения микроскопических грибов-продуцентов антибиотиков можно рекомендовать следующие среды. -
Первая среда (в процентах): глюкоза — 2; сахароза — 2; NH4NO3 — 0,02; К2НРО4 — 0,1; кукурузный экстракт (сухое вещество) — 0,1; MgSO„.7H2O—0,05; ZnSO4 —0,01; FeSOi — 0,001.
Вторая среда (в процентах): глюкоза—1, сахароза — 1; перевар Хоттингера (объемные проценты) — 4; К2НРО4 — 0,05; MgSO4-7H2O— 0,05; ZnSO4 — 0,001; FeSO4 — 0,001.
Среды, пригодные для выделения микроорганизмов, не всегда благоприятны для образования ими антибиотических веществ. Так, многие актиномицеты хорошо растут на простых синтетических средах, но не все штаммы синтезируют на этих средах аптибнотц-
120
ческпе вещества. Иногда для образования антибиотика необходимо организм культивировать на натуральных средах, таких, как бульон Хоттингера, картофельный отвар и т. п. Аналогичное явление может иметь место п в отношении некоторых видов бактерий и плесневых грибов. Например, дтя выяснения антибиотического действия актиномнцетов рекомендуется среда следующего состава:
Соевая мука..................10 г
Глюкоза......................10 г
NaCI....................., . . 5 г
СаСО3...........................1г
Вода..................... 1000 мл
pH такой среды следует поддерживать на уровне 6,8.
При выделении продуцентов новых антибиотиков для культивирования микроорганизмов следует шире применять различные селективные среды, в том числе и среды, содержащие антибиотики.
ОСНОВНЫЕ МЕТОДЫ ВЫДЕЛЕНИЯ
МИКРОБОВ-ПРОДУЦЕНТОВ АНТИБИОТИКОВ
Высев почвенной взвеси в воде на поверхность агаровой пластинки. Определенная навеска почвы, тщательно растертая в ступке с небольшим объемом воды, количественно переносится в колбу со стерильной водой. Содержимое колбы встряхивается в течение 5 мни, а затем пз водной суспензии делается ряд последовательных разведений, которые высеваются на соответствующую агаризнрованную среду.
Для получения в дальнейшем чистых культур отдельные колонии после инкубации в термостате при нужной температуре пересеваются в пробирки со скошенным питательным агаром.
Каждая чистая культура микроорганизма пересевается на различные по составу среды и после достаточно хорошего развития проверяются ее антибиотические свойства.
Высев почвы на питательный агар, предварительно засеянный тест-организмом. Поверхность питательного агара засевается тест-культурой необходимого организма, после чего на агаровую пластинку раскладывают небольшие, не более просяного зерна, комочки почвы пли же почву наносят в виде пыли, распределяя ее по всей поверхности пластинки. Затем чашки помещают в термостат п через определенный промежуток времени (24—48 ч, а иногда и более) просматривают кусочки почвы или отдельные ее участки, вокруг которых образовались зоны задержки роста тест-организма. Из этих участков выделяют чистые культуры организмов и подвергают их дальнейшему изучению.
Метод можно модифицировать. На чашки Петри с мясопептонным агаром, предварительно засеянным тест-организмом, микробиологической петлей наносят отдельными каплями взвесь почвы. На каждую чашку наносят 10—20 капель, которые, подсыхая, оставляют после себя изолированные комочки почвы. Через 1—2 суток нахождения чашек в термостате при 26—35°С комочки почвы
121
обрастают колониями, вокруг некоторых из них обнаруживаются воны задержки роста тест-организма. Комочки, окруженные зонами, рассевают на свежие чашки с агаром и после того, как вырастут отдельные колонии, их отвивают для получения чистых культур, которые подвергают дальнейшему исследованию.
Метод обогащения почвы. Почву, из которой предполагают выделить антагонистов, обогащают организмами тех видов, по отношению к которым хотят получить антагонист. С этой целью к образцам почвы, помешенным в стеклянные сосуды, систематически добавляют отмытую суспензию нужных микроорганизмов.
Затем через определенные промежутки времени такая почва высевается в виде отдельных комочков на агаровые пластинки в чашках Петри, предварительно засеянные тем же самым организмом, который использовался для обогащения почвы.
Метод центрифугирования почвенной суспензии. Для выделения актиномицетов из почв и особенно из почв в весеннее время, когда в ней развивается большое число грибов и бактерий, применяется метод центрифугирования почвенной взвеси. Метод основан на различии скорости оседания отдельных видов микроорганизмов в центробежном поле. При 3000 об/мин в течение 20 мин частицы, соответствующие по размерам спорам плесеней или клеткам бактерий типа Вас. mesentericus, Вас. mycoides, Вас. subtilis, осаждаются на дно пробирки. Частицы же, соответствующие по размерам спорам актиномицетов, оказываются при данной скорости центрифугирования в поверхностном слое жидкости.
Высевая надосадочпую жидкость, удается в большинстве случаев (до 92%) получить на пластинках питательного агара только колонии актиномицетов.
Метод замораживания — оттаивания почвы. Известно, что микроорганизмы в почве находя гея в адсорбированном на почвенных частицах состоянии. Для полноты десорбции микроорганизмов с почвенных частиц применяются различные методы: химические, при которых почвенные образцы обрабатывают различными детергентами, физические, в основе которых лежит метод механического растирания образцов почвы.
Для лучшей десорбции микроорганизмов с почвенных частиц рекомендуется использовать метод замораживания — оттаивания почвы. Суть метода состоит в следующем. Отобранный для выделения актиномицетов образец почвы помещается в испаритель бытового холодильника при температуре—8°. Через час образец извлекается из холодильника и выдерживается при комнатной температуре до полного оттаивания. Процедуру замораживания— оттаивания повторяют дважды. Затем навеску почвы помещают в стерильную водопроводную воду, взбалтывают суспензию в течение 15 мин на круговой качалке при 230 об/мин, после чего различные разведения суспензии высевают па питательную агаровую пластинку в чашках Петри.
Метод замораживания — оттаивания образцов почвы позволяет обнаружить в них в 1,2—3,6 раза больше актиномицетов, чем в
122
тех же образцах без замораживания. Это, по-видимому, связано с повышением десорбции актиномицетов с поверхности почвенных частиц.
Применение питательных сред, содержащих антибиотики. При высеве почвенной суспензии на агаровые пластинки создаются трудности для развития редко встречающихся видов актиномицетов в результате быстрого развития бактерий и широко распространенных в почвах видов актиномицетов. Поэтому для целей направленного выделения определенных групп микроорганизмов в среды для высева почвенной суспсзии добавляют различные антибиотики. При добавлении антибиотиков к среде для культивирования микроорганизмов происходит подавление обычной микрофлоры, создаются условия для развития устойчивых к этим антибиотикам форм микробов; последние могут оказаться новыми или редкими видами, способными образовывать и новые антибиотики. Для этих целей часто используют антибактериальные и протнвогрпбные препараты.
Для выделения актиномицетов применяют среды, содержащие в своем составе такие антибиотики, как тетрациклины, неомицин, нистатин, стрептомицин, хлорамфеникол, пенициллин и др.
При выделении продуцентов новых антибиотических веществ используют среды, содержащие стрептомицин в концентрациях от 25 до 100 мкг/мл и рубомпцин — от 5 до 20 мкг/мл.
В случае добавления к среде стрептомицина наблюдается значительное подавление роста наиболее часто встречающихся видов — Streptomyces griseovariabilis, Str. flavochromogenes, Str. griseolis, Str. aureofaciens. Str. griseus и др.— и выделение культур актиномицетов, которые не обнаруживались на тон же среде без стрептомицина. С повышением концентрации стрептомицина в среде общее количество выделяемых актиномицетов уменьшается, однако прп этом происходит выделение новых культур актиномицетов.
Внесение в среду для высева почвенной суспензии рубомицина в значительной степени подавляет рост культур актиномицетов и нокардпа. Довольно устойчивыми к этому антибиотику оказались представители секций Roseus, Helvolo-Flavus и Albus. В указанных условиях в значительном числе вырастают культуры актиномицетов, не образующие воздушный мицелий.
В последнее время показано, что продуценты, например, амино-глпкозидных антибиотиков могут быть найдены, как правило, только среди стрептомицетов, устойчивых к действию этих антибиотиков.
Известны и другие методы выделения микробов-антагонистов из естественных мест их обитания.
По мнению некоторых микробнологов, к настоящему времени выделено и изучено не более 10 процентов всех имеющихся в природе микроорганизмов. Поэтому необходимо изучать и разрабатывать новые приемы выделения микробов, которые бы способствовали максимальному обнаружению их в природе.
123
МЕТОДЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ-ПРОДУЦЕНТОВ АНТИБИОТИЧЕСКИХ ВЕЩЕСТВ
' После того как микроорганизм, обладающий ценными антибиотическими свойствами, тем пли иным способом выделен из субстрата, необходимо определить принадлежность этого организма к определенному виду.
Следовательно, исследователи должны владеть методами идентификации микроорганизмов-продуцентов антибиотиков. Известно, что определение видовой принадлежности микроорганизмов—задача нелегкая, требующая больших навыков и умения.
При определении вида микроорганизма-продуцента антибиотического вещества используется большой комплекс признаков. В первую очередь используются признаки, легко наблюдаемые при культивировании организмов визуально пли с помощью микроскопа. Исследуются морфологические признаки (форма колоний на твердых средах, форма и размеры клеток, спор и споро-носцев, характер спорообразования, наличие жгутиков, капсул или слизи вокруг клеток и другие признаки) и культуральные признаки (характер роста организма на различных средах, наличие или отсутствие окраски субстрата и самих клеток, развитие в аэробных или анаэробных условиях, температурный оптимум развития п т. д.).
Однако установлено, что морфологических и культуральных признаков микроорганизмов часто бывает недостаточно для определения вида микроорганизма. Тем более это трудно сделать в группах микробов, близко стоящих друг к другу.
Поэтому наряду с морфологическими и культуральными признаками для идентификации выделенных микроорганизмов используют и другие признаки; к их числу относятся физиологические и б и ох и м нческие особенности организмов.
Под физиологическими свойствами микроорганизмов необходимо иметь в виду биохимическую сущность и биологическое значение тех процессов, которые совершаются в культуре, а не простую констатацию явлений (например, разжижение желатины, пепто-низация молока и т. п.), которые иногда обнаруживаются на случайно взятых и часто неизвестных по составу средах.
К биохимическим особенностям организма относятся характер и пути превращения компонентов субстрата с образованием типичных для данного вида продуктов обмена (кислот, спиртов, пигментов, витаминов, антибиотиков, аминокислот и др.), типичные реакции метаболизма, характеризующие биосинтетические процессы в клетке, последовательность оснований нуклеиновых кислот, специфичная для разных видов организмов, а также другие признаки.
В последнее время все чаще и чаще для определения видов используют серологические реакции, которые весьма специфичны п позволяют дифференцировать виды, близко стоящие друг к другу. Реакции агглютинации и преципитации находят прп-
124
менение для идентификации не только бактериальных организмов, но и актиномицетов.
Для дифференциации видов бактерий и актиномицетов с успехом используют бактериофаги и а к т и но ф аг и. Для распознавания видов актиномицетов лучшими признаны актинофаги, выделенные из лизогенных культур актиномицетов. Обычно такие фаги оказываются более специфичными по характеру и спектру их действия.
Однако при использовании актинофагов для целей дифференцирования видов следует иметь в виду и те трудности, которые обнаруживаются при этом. Необходимо помнить, что среди актиномицетов нередко встречаются штаммы, устойчивые к фагам, а средн актинофагов имеются и полифаги, лизирующие клетки многих видов актиномицетов. Все это свидетельствует о том, что использование фагов для идентификации видов может иметь лишь вспомогательное значение, служить дополнительным признаком.
Определенное значение при идентификации видов актиномице-тов-антагонистов, принадлежащих к одной группе, имеет метод, основанный на специфическом действии микробов-антагонистов. Специфичность действия микробов-антагонистов состоит в том, что, например, продуценты стрептомицина, выделенные из различных районов земного шара, не подавляют развитие друг друга. Такая закономерность характерна и для других видов актиномицетов.
Исходя из этого, предложено для целей идентификации внешне сходных культур актиномицетов применять метод так называемого перекрестного антагонизма.
Перекрестный антагонизм. Сущность метода состоит в следующем. Агаровые блочки с одним видом выращенного актиномицета помещают на поверхность агаровой пластинки, засеянной другим видом актиномицета. В качестве тест-культуры используется тот же штамм организма. При этом обнаруживается, что один вид ак-тиномицета-антагониста подавляет рост других видов актиномицетов и не подавляет развитие своего вида (табл. 32).
Метод специфики межвидового антагонизма может быть использован лишь при идентификации внешне очень близких видов актиномицетов и, по-видимому, не может оказать существенной помощи при систематике далеко стоящих видов.
Однако необходимо иметь в виду, что при перекрестном антагонизме изучаемый штамм актиномицета иногда не подавляет роста других известных видов, но ои может не принадлежать ни к одному из этих видов. Так, Str. griseus не подавляет роста Str. rimosus, хотя это совершенно различные виды. Или в присутствии Sir. lavendulae не происходит подавления развития Str. griseus (табл. 33).
При использовании метода перекрестного антагонизма следует иметь в виду также возможность самоугнетения, которое иногда имеет место среди некоторых штаммов актиномицетов. Культура Str. lavendulae штамм 2335 выделяет вещества, вызывающие са-
125
Таблица 32
Перекрестный антагонизм у некоторых видов актнномицетов (по Красильникову, 1951)
Таблица 33
Явления перекрестного антагонизма между отдельными видами актиномицетов (по Teillon, 1953)
моугнетение, напоминающее действие лизинов. Вокруг агаровых блочков этой культуры образуются зоны отсутствия роста Str. lavendulae. Природа этих веществ пока неизвестна.
Оценивая все случаи, которые могут иметь место при использовании метода перекрестного антагонизма, следует заметить, что данный метод не помогает решению вопроса идентификации видов, но может оказать большую помощь при подразделении на виды
126
культур внутри отдельных групп актиномицетов. Широкое применение при идентификации микроорганизмов-продуцентов антибиотиков нашли и другие методы.
Использование форм организмов, устойчивых к определенному антибиотическому веществу. В основу этого метода положены два основных признака, связанных с образоЬанием и действием антибиотиков.
1. Каждый антибиотик образуется одним или несколькими определенными видами микробов. .
2. Микроорганизмы, устойчивые к определенному антибиотику, устойчивы также к антибиотическим веществам, близким по химическому строению и биологическим свойствам к первому антибиотику. Вместе с тем они могут обладать чувствительностью к антибиотикам, имеющим другую химическую природу и, следовательно, другое биологическое действие.
Определение антибиотика, образуемого неизвестным организмом, может быть проведено путем испытания его биологического действия на ряд микроорганизмов, чувствительных и устойчивых к известным антибиотикам. Таким путем можно выяснить сходство или различие биологического действия изучаемого вещества и известных антибиотиков и тем самым решить вопрос о химическом сходстве или различии этих веществ.
Для исследования этого явления изучаемый организм высевают на поверхность питательного агара в виде штриха или в виде отдельной макроколонип в центре чашки Петри. Образуемое организмом антибиологическое вещество диффундирует в окружающий агар и создает определенную зону. Пересекая эту зону чувствительными и устойчивыми к определенному антибиотику микроорганизмами, можно выяснить сходство биологического действия изучаемого препарата е известным антибиотиком.
Установив сходство биологического действия исследуемого вещества с известным антибиотиком, можно предположить, что изучаемое соединение относится к определенной группе антибиотических веществ и образуется соответствующими организмами. Однако следует иметь в виду, что оценка принадлежности изучаемого организма к тому или иному виду продуцентов может быть лишь ориентировочной. Так, было известно, что р-лактамные антибиотики образуются только плесневыми грибами, но последующие исследования показали, что антибиотические вещества этой природы образуют некоторые виды стрептомнцетов и собственно бактерий.
Метод хроматографии. Хорошим методом для идентификации антибиотиков и их продуцентов является метод хроматографии, открытый выдающимся русским ученым Цветом еще в 1903 г. и теперь очень широко используемый в лабораторной практике. Метод широко применяется при идентификации антибиотиков на ранних стадиях исследования, что имеет весьма важное значение. Определение антибиотика на ранних стадиях работы может значительно сократить время его изучения.
Иногда метод хроматографии бывает необходимо дополнить
127
Рис. 12. Использование метода бумажной хроматографии для разделения пенициллинов, образуемых штаммом Q-176 на кукурузной среде с лактозой. А — стандартный раствор пенициллина G; Б, В — хроматограмма производственных образцов 1950 г.; Г — хроматограмма конечного препарата калиевой соли (1950) (по Herold, 1957).
За пятном пенициллина G (вверху) следу-ют: пенициллин F, дигцдро F и самая мнжнян зона — пешщиллин К-
данными методов электрофореза, которые помогают выяснить прежде всего ионный характер антибиотика.
Метод бумажной хроматографии антибиотиков состоит в следующем. На полоски хроматографической бумаги длиной 20—30 см и шириной в 1 см наносится испытуемый антибиотик. Подсушенные на воздухе полоски хроматографической бумаги с папссенным антибиотиком помещают затем в хроматографический бак или цилиндр с соответствующим растворителем па 10—20 ч. Время выбирается в зависимости от скорости прохождения растворителя и от высоты используемого сосуда для хроматографии.
Для обнаружения антибиотиков иа хроматограммах могут применяться биологические, химические и физические методы.
Наиболее распространенным методом обнаружения антибиотиков на хроматограммах является биоавтографический метод. С этой целью высушенные в вытяжном шкафу полоски бумаги накладываются на агаровую пластинку, предварительно засеянную культурой тест-организма, чувствительной к изучаемому антибиотику. Кюветы с полосками бумаги помещают в термостат иа 18—20 ч при температуре, оптимальной для роста тест-организма.
По зонам отсутствия роста тест-микроба, образующимся вокруг тех мест на хроматограмме, где находится пятно антибиотика, судят, во-первых, об однородности антибиотика; во-вторых, сравнивают полученные хроматограммы с хроматограммами известных антибиотических веществ (рис. 12).
Химические методы обнаружения антибиотиков иа хроматограммах основаны на реакциях, в результате которых образуются соединения, выявляемые по соответствующей окраске или обесцвечиванию реактива в месте расположения пятна антибиотика.
Физические методы обнаружения антибиотиков включают в себя способы, связанные: а) с выявлением люминесценции антибиотического пятна в ультрафиолетовом (УФ) возбуждении; б) с поглощением УФ излучения и в) с определением радиоактивной метеки антибиотика.
Для целей бумажной хроматографии антибиотиков с успехом можно использовать и круговые хроматограммы.
128
Важное значение при оценке результатов хроматографии имеет положение пятен исследуемых веществ, характеризуемое коэффициентом Rf. Коэффициент определяется отношением расстояния, которое проходит пятно изучаемого вещества от линии старта за определенное время, к расстоянию фронта растворителя, прошедшего от линии старта:
D расстояние, пройденное пятном изучаемого вещества ----------------------------------------------------- . расстояние фронта растворителя, пройденное от старта
Воспроизводимость значений Rf зависит от постоянства следующих факторов: качества бумаги, температуры, степени чистоты растворителей, состава газов атмосферы, в которую помещена бумага, однотипности процедур и аппаратуры.
При использовании метода хроматографии на бумаге для идентификации антибиотиков было показано, что значение Rf зависит также и от системы растворителей, от степени очистки изучаемого антибиотика и от состава культуральной жидкости.
По спектру значений Rf или, как его иногда называют, по хроматографическому спектру.* можно четко различать группы химически родственных антибиотиков и до некоторой степени отличать также антибиотики внутри групп (рис. 13).
Существенное значение при использовании бумажной хроматографии для! идентификации антибиотиков имеет разработка методов, позволяющих проводить эти исследования на ранних этапах изучения антибиотических веществ, т. е. на стадии культуральных жидкостей. Однако при этом встречаются большие затруднения в разгонке антибиотиков, так как факторы, оказывающие влияние па значение Rf, часто встречаются при использовании культуральных жидкостей.
Преодолеть эти затруднения удалось с помощью методов лиофилизации фильтратов культуральных жидкостей и экстрагирования их соответствующими растворителями. Сущность схемы хроматографической идентификации антибиотиков из культур на стадии малоактивных культуральных жидкостей состоит в следующем.
Культуральную жидкость, обладающую антибиотическими свойствами, фильтруют и измеряют pH. Точно взятый объем фильтрата подвергают лиофильной сушке, затем лиофилизат взвешивают и разделяют на две части, одну из которых растворяют в воде, а другую экстрагируют безводным этанолом при встряхивании в течение часа. Растворители берут в таком количестве, которое, как правило, позволяет получить 5—10-кратные концентрации по сравнению с исходной культуральной жидкостью. Антибиотическую активность водного раствора и спиртового экстракта определяют методом бумажных дисков.
В случае, если спиртовой экстракт обладает антибиотической
1 Хроматографический спектр представляет собой ломаную линию, характеризующую подвижность антибиотика при хроматографировании с использованием определенного набора систем растворителей.
5-742
129
Рис. 13. Хроматографические спектры некоторых известных антибиотиков (по Доскачиловой и
Вондрачек, 1961)
активностью, схожей с активностью водного раствора лиофилизата, то проводят хроматографирование в соответствующей системе. Хроматограммы проявляют биоавтографически на чашках с Bacil-luc subtilis. Одновременно производят электрофорез в ацетатном и фосфатном буферах.
Если для изучаемого антибиотика во всех системах 1-го типа значение Rf будет около 0,8 и выше, то спиртовой экстракт хроматографируют в другой системе. При помощи набора этой системы можно наиболее уверенно отличить антибиотики типа эритромиии-на-олеандомпцина, типа карбомпцииа, типа актиномицина и хлорамфеникола.
Полученные данные позволяют в определенной степени идентифицировать антибиотик или включить его в определенную группу химически близких веществ, или, наконец, определить его как новый антибиотик.
130
При отнесении антибиотика к группе макролидных веществ наиболее детальную идентификацию его можно проводить нисходящей хроматографией в системах типа Заффарони: бензол-форма-мид и хлороформ-формамид. Если же антибиотик принадлежит к другим группам соединений, то необходимо использовать групповые системы.
Итак, если в результате проведенной работы по идентификации выделенного микроорганизма установлено, что он является новым видом, и антибиотическое вещество, образуемое им, не принадлежит к уже описанным соединениям, то, естественно, и организм и антибиотик должны быть подвергнуты детальному исследованию. С этой целью прежде всего изучаются условия культивирования микроба, обеспечивающие максимальное образование антибиотика.
Рис. 14. Схема выделения актиномицетов — продуцентов антибиотиков (по Коневу, 1981)
5* 131
При подборе сред необходимо иметь в виду, что чем сложнее среда, тем труднее производить выделение и очистку антибиотика, поэтому среда для культивирования должна быть по возможности простой по составу и обеспечивать максимальное образование антибиотического вешества.
Пути выделения продуцентов антибиотических веществ из естественных мест их обитания и первичной идентификации антибиотиков можно проиллюстрировать схемой (рис. 14).
МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ АНТИБИОТИКОВ
Выделение антибиотиков и их очистка осуществляются разными способами, выбор которых зависит от химической природы антибиотика, характера сопутствующих антибиотику продуктов жизнедеятельности организма (органические кислоты, аминокислоты, пигменты и другие соединения), неиспользованных компонентов среды (углеводы, масла, азотсодержащие вещества, неорганические соли и др.), а также и от того, где накапливается это вещество — в культуральной жидкости или в клетках продуцента.
Основная задача первых этапов выделения антибиотического вещества — концентрирование биологически активного соединения и очистка от сопутствующих балластных веществ.
Основными методами выделения антибиотиков пз нативных растворов (культуральная жидкость, освобожденная от биологической массы продуцента) можно назвать следующие: осаждение антибиотика, методы экстракции антибиотиков ограническими растворителями, сорбционные методы с использованием поверхностноактивных веществ (активированный уголь, активированная окись алюминия и др.) или ионообменных материалов (ионообменные смолы). При применении сорбционных методов выделения антибиотиков наиболее трудной задачей является десорбция (элюирование) препарата.
Антибиотик, выделенный одним из указанных способов, представляет собой лишь технически чистый препарат, который не может еще использоваться в медицинской практике. Дальнейшая очистка препарата осуществляется или путем повторной сорбции, перекристаллизации, растворением антибиотика в органических растворителях, или иными методами.
АНТИМИКРОБНЫЙ спектр и токсичность
После того как антибиотическое вещество с помощью того или иного метода выделено и хорошо очищено, проверяют его биологическую активность по отношению к широкому ряду микроорганизмов (проверяют широкий антимикробный спектр). Кроме того, антибиотик исследуют иа стерильность, токсичность, пирогенность, испытывают в отношении действия на лейкоциты крови и определяют другие показатели.
Цель выяснения стерильности готового препарата — установле-
132
иие отсутствия в нем спор микроорганизмов и, прежде всего, патогенных. Для этого необходимо, если это возможно, инактивировать антибиотические вещества, а затем произвести посев его па-разнообразные по составу питательные среды (мясопентонный бульон, печеночный бульон, кровяной агар и т. п.).
Инактивацию пенициллина осуществляют с помощью фермента пенициллиназы (пепициллин-р-лактамазы), или пенициллинацила-зы, или солянокислым гидрокснламипом.
Стрептомицин инактивируют при помощи гидроксиламина или цистеина.
Многие антибиотики не удается инактивировать, поэтому их стерильность определяют лишь в отношении форм микроорганизмов, устойчивых к этим антибиотикам.
Токсичность антибиотика определяют на экспериментальных животных, которым в течение определенного периода времени внутривенно, внутрибрюшинно, внутримышечно, подкожно или иными путями вводят различные дозы изучаемого антибиотика. За такими животными ведут тщательные наблюдения. При отсутствии внешних изменений в поведении животных в течение 12—15 сут считают, что испытуемый антибиотик не обладает заметными токсическими свойствами. Это, разумеется, первый и предварительный этап в изучении токсичности антибиотика. При более глубоком исследовании этого вопроса выясняется влияние препарата на отдельные ткани и органы животных.
Некоторые антибиотики обладают кумулятивной токсичностью, проявляющейся в том, что токсические свойства его при введении в организм изо дня в день накапливаются, не обнаруживая каких-либо внешних проявлений, но в итоге приводят организм к гибели. Это скрытая токсичность, которая противоположна остров, вполне четкой токсичности препарата, проявляющейся сразу же после первого введения антибиотика.
Отсутствие местной и обшей токсичности антибиотика, отсутствие пирогенности и угнетения деятельности лейкоцитов, сохранение антибиотической активности препарата в присутствии сыворотки крови, гноя и других веществ, необходимый спектр антимикробного действия дают основание проводить дальнейшие испытания изучаемого препарата как лечебного вещества.
Вместе с этим необходимо определить характер биологического действия антибиотика, иными словами, выяснить, является ли антибиотик бактериостатическим пли бактерицидным. Знание характера действия препарата может создать определенное представление о механизме его антибактериальных свойств.
ЛЕЧЕБНЫЕ СВОЙСТВА АНТИБИОТИКОВ
Следующий этап изучения антибиотика — определение его фармакологических и терапевтических свойств.
Лечебные свойства антибиотиков проверяют на экспериментальных животных, зараженных соответствующей дозой определенного
133
вида патогенного микроба. Обычно используют дозы инфекции с таким расчетом, чтобы вызвать гибель 50% животных (LD5o) и гибель 100% животных (LDioo). LD3o — минимальная смертельная доза. Животных делят на 3 группы. Одной группе животных антибиотик вводят сразу же после заражения; вторая группа животных подвергается обработке антибиотиком через некоторое время после заражения (через 5 ч или позже). Во всех случаях применяют такие максимальные дозы антибиотика, которые переносятся животными. Третья группа подопытных животных не подвергается обработке антибиотиком — это контроль.
По количеству выживших особей в опытных группах судят о терапевтической ценности изучаемого антибиотического вещества.
Минимальное количество антибиотика, способствующее предохранению животного от смертельной дозы инфекции, составляет минимальную терапевтическую дозу.
Отдельные антибиотические вещества, имеющие лечебные свойства, проявляют вместе с тем в определенных концентрациях токсичность по отношению к макроорганпзму. Если лечебная доза антибиотика ниже токсичной, то такой препарат может быть использован в медицинской практике.
Если терапевтическая доза равна токсичной пли приближается к ней, то широкое применение такого антибиотика в лечебной практике не разрешается.
Часто изучаемый антибиотик по тем или иным причинам не может быть использован в медицинской практике, тогда его следует испытать в сельскохозяйственном производстве пли в отдельных отраслях пищевой и консервной промышленности.
Только после всестороннего п глубокого изучения антибиотика можно говорить о перспективности или, наоборот, о непригодности его для практических целей.
ЛАБОРАТОРНЫЙ РЕГЛАМЕНТ
Антибиотическое вещество, имеющее практическую значимость и являющееся новым препаратом, должно выпускаться в промышленных масштабах. Поэтому при изучении продуцента и образуемого им антибиотика в лабораторных условиях разрабатывается так называемый лабораторный регламент.
«Лабораторный регламент — это технологический документ, которым завершаются научные исследования в лабораторных усчовиях по разработке метода получения антибиотика. Он служит основой для разработки промышленного регламента. Задача лабораторного регламента — разработка оптимального метода производства антибиотического вещества.
Лабораторный регламент получения антибиотика должен включать следующие разделы.
1. Характеристика антибиотика. Отражает название антибиотика, основное назначение, краткое описание свойств препарата, опи
134
сание организма, образующего антибиотик, методы определения биологической активности, условия хранения.
2. Технологическая схема производства. В схеме указаны последовательность работ по производству антибиотика с подразделением на стадии. Технологическая схема —основа будущей технологии промышленного получения препарата.
3. Сырье и материалы. Сообщаются требования, предъявляемые к качеству сырья и материалам, используемым при получении антибиотика с целью его максимального выхода и обеспечения повторяемости результатов. При этом необходимо ориентироваться на сырье и материалы, выпускаемые отечественной промышленностью.
4. Аппаратурная схема производства. Приводится схема процесса получения антибиотика с указанием аппаратов и приборов, их конструкции, размера и других характеристик, которые могут иметь значение при производстве антибиотика.
5. Изложение технологического процесса. Описание процесса получения антибиотика па основе завершенных научных и экспериментальных результатов, выполненных в лабораторных условиях. Процесс включается в регламент в том случае, если удается получить воспроизводимые результаты по качеству антибиотика и по его выходу.
Технологический процесс описывают по стадиям. Подробно указываются объемы, концентрации веществ, входящих в среду, pH среды, степень аэрации, растворители, пеногасители, условия перемешивания, продолжительность процесса развития продуцента, температура и другие показатели.
6. Отходы производства, технологические и вентиляционные выбросы в атмосферу, их использование и обезвреживание. Приводится перечень возможных отходов и выбросов в атмосферу, наличие в отходах ценных веществ и рекомендации к их использованию, наличие веществ, вредных с точки зрения загрязнения окружающей среды, и способы их обезвреживания.
7. Контроль производства. Указываются особые требования к оборудованию (герметичность ферментера и всех коммуникаций, исправность и надежность работы мешалки и т. д.). Анализ качества сырья, соответствующего определенным стандартам. Режимы стерилизации сред и отдельных веществ, воздуха. Методы анализа процесса биосинтеза антибиотика и готовой продукции.
8. Техника безопасности, пожарная безопасность и производственная санитария. Приводится перечень веществ, способных воспламеняться и взрываться. Все вещества, применяемые в процессе получения антибиотика, должны быть изучены с позиций техники безопасности, пожарной опасности и производственной санитарии.
9. Перечень производственных инструкций. Приводятся все инструкции, которые должны быть разработаны на основе лабораторного регламента.
10. Технико-экономические нормативы. Выходы конечного про
185
дукта и промежуточных продуктов; удельные нормы расхода сырья и материалов, удельные нормы расхода технологических энергозатрат (пара, воды, электроэнергии, сжатого воздуха).
11. ^Информационные материалы». В разделе должны быть указаны биологические и физико-химические свойства вещества, степень очистки. Фармакологические свойства (преимущества и особенности), сравнение с показателями идентичных зарубежных препаратов, сведения о патентной чистоте антибиотика и методе его получения с перечислением охраняющих авторских свидетельств (патентов), сведения о вредности веществ, применяемых при получении препарата, и мерах предосторожности при работе с ними.
ПУТИ ПОВЫШЕНИЯ АНТИБИОТИКООБРАЗУЮЩЕЙ СПОСОБНОСТИ МИКРООРГАНИЗМОВ
Микроорганизмы-продуценты антибиотиков, выделенные из природных субстратов, обычно обладают низкой антибиотической активностью. Так, например, различные штаммы Penicillium, выделенные из почв, образуют пенициллин при глубинном их выращивании в количестве от 10 до 30 ед/мл культуральной жидкости. Продуцент стрептомицина Streptomyces griseus, впервые выделенный Ваксманом с сотрудниками в 1944 г. из сильно унавоженной почвы, образовывал до 100 мкг/мл стрептомицина.
Понятно, что потребности медицины, сельского хозяйства и некоторых отраслей промышленности не могут быть удовлетворены без получения наиболее продуктивных штаммов организмов, образующих антибиотические вещества.
Поэтому перед наукой была поставлена задача разработать пути повышения биосинтеза практически ценных антибиотических веществ. При решении этой задачи необходимо применять два тесно связанных метода: селекцию наиболее активных форм продуцентов антибиотиков и изучение условий культивирования полученных вариантов с целью определения наиболее оптимальной биосинтетической активности.
СЕЛЕКЦИЯ НАИБОЛЕЕ АКТИВНЫХ ФОРМ ПРОДУЦЕНТОВ АНТИБИОТИКОВ
В селекционной работе по получению активных продуцентов антибиотических веществ используют различные приемы, в основе которых лежат методы и законы генетики.
Прежде всего при изучении вновь выделенных микроорганизмов— продуцентов антибиотиков стремятся отобрать наиболее активные варианты, имеющиеся в культуре.
Микроорганизмы обладают естественной изменчивостью, т. е. среди клеток или спор одного и того же штамма могут обнаружиться формы, отличающиеся по морфологическим или биохимическим, в том числе и по антибиотическим признакам. Остановимся на раз-
136
Рис. 15. Схема опыта по определению антибиотической активности колоний микроорганизмов методом заливки их питательным агаром, содержащим тест-организм;
1 — питательный агар с тест-организмом, 2 — питательный агар для развития колоний продуцента антибиотика, 3 — колония, 4 — зона диффузии антибиотика
боре метода отбора наиболее активных антибиотикообразующих вариантов микроба.
Продуцент антибиотика высевают на пластинку питательного агара в чашке Петри с таким расчетом, чтобы получить на ней развитие не более 40—50 изолированных колоний. После достаточно хорошего развития колоний проверяют их способность к образованию антибиотика (в основном двумя методами).
Первый метод. Выросшие колонии заливают расплавленным и охлажденным до 50—55°С питательным агаром, содержащим тест-организм, чувствительный к изучаемому антибиотику. Затем чашки помещают на 20—24 ч в термостат при температуре, оптимальной для развития тест-культуры. За это время вокруг колоний образуются зоны отсутствия роста тест-организма. Размеры диаметра зон отсутствия роста вокруг колоний микроорганизма бывают различными. Чем больше колония образует антибиотика, тем большей будет зона отсутствия роста тест-организма. Такие наиболее активные колонии легко обнаружить (рис. 15).
Для выявления изменчивости, связанный с образованием антибиотиков у бактериальных организмов (споровых), на колонии перед заливкой расплавленного агара можно помещать стерильные диски фильтровальной бумаги, диаметр которых равен внутреннему диаметру чашки Петри. Таким диском фильтровальной бумаги прикрываются выросшие колонии бактерий, а расплавленный агар наливается на поверхность бумажного диска. Это облегчает последующее выделение наиболее активной колонии в чистом виде.
Для более объективного решения вопроса о возможности образования антибиотического вещества выросшими колониями иногда используют другой метод.
Второй метод. Подготавливают чашки Петри с питательным агаром, поверхность агаровой пластинки засевают тест-организмом. Затем в толще агаровой пластинки с помощью пробочного сверла или другого подобного приспособления делают лунки диаметром 6—8 мм. Из центра колонии изучаемого микроба вырезают агаровый блочек пробочным сверлом с внутренним диаметром, равным диаметру лунок. Агаровый блочек вставляют в лунку. На каждой чашке может быть сделано 6—7 лунок и, следовательно, испытано 6—7 различных колоний. Чашки с блочками, помещенными в лунки, переносят в термостат на 20—24 ч, после чего измеряют
137
диаметры зон, образовавшихся вокруг блочков. Чем больше диаметр зоны задержки роста тест-органпзма, тем активнее колония изучаемого организма.
При селекции наиболее активных штаммов продуцентов ряда антибиотиков, выделенных из естественных мест их обитания, используют антибиотики. Например, для выделения из почвы наиболее активных штаммов продуцента стрептомицина в агаровую среду, используемую для их высева, добавляют определенную концентрацию стрептомицина. Штаммы Str. griseus, образующие большие количества антибиотика, способны выдерживать такую концентрацию стрептомицина и нормально развиваться в его присутствии. Менее активные штаммы не приспособлены к высоким концентрациям стрептомицина и в его присутствии не развиваются.
В питательную агаровую среду вносят стрептомицин в количестве 100 мкг/мл субстрата, а затем высевают выделенные штаммы актиномицетов, относящиеся к Str. griseus. В результате культуры, чувствительные к этой концентрации стрептомицина, не давали развития примерно в 80% случаев. Остальные 20% штаммов, среди которых были и довольно активные, вырастали на этой среде. Приведенный метод оказался полезным для первичного исследования почвенных культур актиномицетов.
. Методы выделения наиболее активных форм, получающихся в результате естественной изменчивости, не дали значительного повышения образования антибиотиков.
Решающим приемом, обеспечивающим успех селекции многих продуцентов антибиотиков, является метод получения мутаций под влиянием сильнодействующих факторов — рентгеновских и ультрафиолетовых излучений, некоторых химических соединений (азотистой формы иприта, этпленимина и др.). При действии таких факторов в течение определенного периода времени происходит полная гибель микроорганизмов. Однако можно подобрать экспозицию (концентрацию) и силу воздействия, при которых часть клеток или спор изучаемого вида может выжить.
У таких переживших особей под влиянием сильнодействующих факторов могут появляться формы с измененным характером отдельных звеньев обмена веществ, появиться варианты с измененными свойствами. Наряду с формами, потерявшими способность образовывать антибиотик, а их обычно бывает большинство, появляются такие, у которых обнаруживается значительное повышение аитибиотпкообразовання.
Выявление высокоактивных штаммов осуществляется теми же методами, которые используются и при отборе вариантов, возникающих в результате естественной изменчивости.
Довольно часто в селекционной работе применяют последовательное воздействие на организм различных факторов. В результате применения различных методов селекции удалось значительно (в 50—100 и более раз) увеличить образование таких важных антибиотиков, как пенициллин, стрептомицин, антибиотики тетрациклиновой группы и др. (табл. 34).
138
Результаты селекции продуцентов некоторых антибиотиков (по Захарову и Китко, 1967)
Таблица 34
Продуцент Мутаген Образование анпгбпотт., ед/мл
«сходным штаммом полученным штаммом
Пенициллина Р, УФ, АН, ЭИ 220 5200
Стрептомицина Р, УФ 250 4200
Хлортетрациклпиа Р, УФ 600 2200
Эритромицина УФ, ЭИ 500 1000
Альбомицнна Р — 600% к ис-
ходиому
Примечание. Р — рентгеновское iэлученве, УФ — ультрафио етовое излучение, АН— азотистый иприт, ЭИ— этнленимин.
Результаты селекции продуцента пенициллина с последовательным применением различных мутагенных факторов на отобранные штаммы плесневого гриба (ступенчатая селекция) приведены в табл. 35.
Таблица 35
Результаты селекции штаммов продуцента пенициллина (no Perlman, 1950)
Культура Исходная культура Мутагенный фактор Максимальная активность при развитии штамма в лабораторных условиях, ед/мл
NRRL, 1951 .... Выделен с поверхности дыни 100
NRRL, 1951—В25 . . NRRL,1951 Естественный вариант 250
Х-1612 NRRL Облучение рентгеновским излучением . . . 350
Q-176 Х-1612 Облучение ультрафиолетовым излучением 1300
Q-176 То же 3050
Существенное значение в селекционно-генетической работе имеет выход образующихся мутаций, который зависит от применяемого мутагена, его концентрации, времени воздействия, а также от свойств самого организма. При селекции наиболее активных штаммов продуцентов антибиотиков необходимо иметь в виду, что частота морфологических мутаций микроорганизмов не всегда совпадает с частотой биосинтетических мутаций.
Иногда при селекции продуцентов антибиотиков, относящихся к плесневым грибам, используют анастомозные культуры, т. е. культуры, полученные в результате соединения двух развивающих
1Э8
ся конидий перемычками, анастомозами. Образовавшиеся таким образом гибридные формы продуцента пенициллина при действии на них ультрафиолетовых излучений или этиленимина давали большую частому изменчивости.
В результате использования анастомозных штаммов гриба Penicillium и при обработке их ультрафиолетовым излучением или этиленимином был получен вариант «новый гибрид», образующий в соответствующих условиях культивирования до 4000—5000 единиц пенициллина.
Селекцию актиномицетов-продуцентов антибиотиков проводят, преследуя разные цели. Так, при селекции продуцента стрептомицина необходимо было получить штамм с высокими биосинтетическими свойствами и как можно меньшей способностью к образованию маннозндострептомицииа, значительно снижающего биологическую активность стрептомицина в пересчете на единицу биомассы (мг).
Для получения высокоактивных штаммов продуцентов стрептомицина были использованы различные воздействия на актиноми-цет. Вначале исходная культура, образующая до 200 мкг/мл стрептомицина, пересевалась на среды, содержащие постепенно увеличивающиеся дозы стрептомицина. Удалось получить штамм, адаптированный к 400 мкг/мл антибиотика. Затем взвесь спор актино-мпцета в дистиллированной воде подвергалась облучению ультрафиолетовым и рентгеновским излучениями в экспозиции, при которой гибель спор составляла 99%. Облученная суспензия с 1% выживших спор высевалась на чашки, и каждая выросшая при этом колония изучалась на образование стрептомицина. В результате этого был выделен вариант актиномицета, образующий до 2000 мкг/мл стрептомицина (табл. 36). .
Необходимо отметить, что селекция продуцента стрептомицина более сложна. Хорошие результаты получаются при многократном
Таблица 36
Схема селекции высокопродуктивного штамма продуцента стрептомицина (но Dylaney, 1953)
№ п/п Мутагенный фактор Максимальный выход антибиотика , мкг/мл № п/п Мутагенный фактор Максимальный выход антибиотика, мкг/мл
1 • Ультрафиолетовое излучение 250 5 Рентгеновское излучение 1000 1500
2 Естественная селекция 400 6 Ультрафиолетовое излучение 1000 1500
3 Ультрафиолетовое излучение 600 7 Естественная селекция 1000 1500
4 Ультрафиолетовое излучение 1000 1500 8 Ультрафиолетовое излучение 2000
140
облучении актиномицета ультрафиолетовым излучением при высокой плотности облучения, доходящей до 10000—20 000 эрг/мм2 (летальные дозы). Для повышения выживаемости облученных спор применяется выдержка их на видимом свете. В итоге работ по селекции продуцента стрептомицина удалось получить штаммы, способные образовывать до 6000 мкг стрептомицина в 1 мл среды.
В настоящее время получены штаммы продуцентов стрептомицина, пенициллина, тетрациклинов, эритромицина и других антибиотиков, в несколько раз более продуктивные (иногда на порядок выше), чем это было, например, 15—20 лет назад.
В последние годы при создании новых высокопродуктивных штаммов микроорганизмов используется ряд новых приемов, в их числе конъюгация плазмидами, слияние протопластов (даже межвидовых), трансформация хромосомных генов и др. Метод слияния протопластов позволяет получать гибриды промышленных штаммов стрептомицетов, а облучение клеток донора и реципиента дает в этом случае увеличение частоты рекомбинаций. Трансформация протопластов хромосомальной ДНК возможна лишь в том случае, если протопласты заключены в липосомы; при этом методе также возрастает частота рекомбинантов.
Таким образом, при использовании различных методов селекции имеется возможность значительно повысить биосинтез ценных антибиотических веществ, образуемых плесенями, актииомицетами и бактериями.
ИЗУЧЕНИЕ УСЛОВИИ КУЛЬТИВИРОВАНИЯ
ВЫДЕЛЕННЫХ ШТАММОВ МИКРООРГАНИЗМОВ-ПРОДУЦЕНТОВ АНТИБИОТИКОВ
Не менее важную роль в увеличении выхода антибиотиков играют условия культивирования — состав среды, аэрация, температура и др. Так, подбор оптимальной среды для каждого полученного в процессе селекции варианта иногда дает возможность увеличить выход антибиотика в 3 и более раза.
Обычно с выделением нового варианта продуцента антибиотика довольно резко меняется его потребность к условиям культивирования: условия аэрации среды, температура культивирования, удлиняется период процесса антибиотикообразования; могут меняться и другие параметры.
При получении нового варианта продуцента антибиотика важно выявить экономический эффект от внедрения его в практику. Иногда увеличение выхода антибиотика на 10—20% может оказаться экономически невыгодным, если изменившиеся условия культивирования потребуют применения более дорогой среды или более жестких условий регулирования процесса.
Следовательно, в вопросе увеличения выхода нужных антибиотиков существенную роль играют два тесно связанных фактора: селекция наиболее активных штаммов и изучение условий культивирования этих штаммов.
141
СОХРАНЕНИЕ ШТАММОВ ПРОДУЦЕНТОВ АНТИБИОТИКОВ В АКТИВНОМ СОСТОЯНИИ
Важное значение для промышленного получения антибиотиков, а также для лабораторных исследований продуцентов антибиотических веществ имеют методы поддержания жизнеспособности организмов, позволяющие сохранить их антибиотическую активность на постоянном уровне.
Известно, что микроорганизмы и в особенности актиномицеты легко изменяются при обычных методах их хранения. Причем довольно часто при этом наблюдается полная пли частичная потеря антибиотических свойств.
Потеря антибиотических свойств зависит, по-видимому, от того, что мы ие умеем в обычных условиях культивирования создать такие условия, которые бы способствовали сохранению организмом его основных физиологических особенностей. Нередко потеря активности наблюдается при культивировании микроорганизмов на богатых по составу средах и при частых пересевах.
Вместе с тем изменение физиологических или биохимических свойств продуцентов антибиотических веществ может определяться их генетическими закономерностями. Известно, например, что продуцент грамицидина С в процессе развития диссоциирует на ряд вариантов, некоторые из которых не образуют этот антибиотик. Причем процесс диссоциации культуры идет в направлении образования в большом количестве биологически неактивных вариантов, что в конечном итоге приводит к полной потере культурой способности образования грамицидина.
В настоящее время используется ряд методов сохранения культур продуцентов антибиотиков, обеспечивающий их длительное пребывание в активном состоянии. В основу этих методов положен принцип задержки развития микроорганизмов, принцип консервации. Для каждого вида продуцента антибиотических веществ должен быть подобран свой, наиболее подходящий метод консервирования, позволяющий сохранить культуры в активном состоянии в течение относительно длительного времени.
Наиболее распространенными методами сохранения культур микроорганизмов-продуцентов антибиотиков в активном состоянии являются следующие.
1. Лиофилизация культур.
2. Хранение вегетативных клеток или спор организмов в стерильной почве, стерильном песке или на семенах некоторых растений (например, просе). По данным ряда авторов, культуры акти-номицетов, находящихся в стерильной почве, сохраняют жизнеспособность в течение 30 лет и более.
3. Хранение спор в виде водных суспензий в запаянных ампулах.
4. Хранение спор в стерильном кварцевом песке.
5. Хранение культур на агаровом косячке под минеральным маслом.
6. Хранение культур при низких температурах (4-4, 4~5°С).
142
7. В последнее время для сохранения различных микроорганизмов в активном состоянии используют жидкий азот, в который помещают отмытую от среды суспензию клеток. Иногда в газообразной фазе жидкого азота сохраняют культуры актиномицетов, находящиеся на агаровых блочках, вырезанных из агаровой пластинки в чашках Петри.
Наилучшей формой сохранения организмов, при которой не наблюдается потери антибиотической активности, является их лиофилизация — метод пригоден как для спорообразующих, так и для бесспоровых культур микроорганизмов. Сущность этого метода состоит в том, что суспензия клеток или спор микроорганизма, приготовленная на среде, богатой белками (часто используется для этих целей кровяная сыворотка), быстро замораживается при температуре от —40 до —60°С и высушивается под вакуумом до остаточной влажности (0,5—0,7%). После такой обработки ампулы со спорами пли клетками лиофилизированного микроба запаивают. Лиофилизированные формы бактерий могут сохраняться в течение 16—18 лет, споры грибов не теряют основных свойств при хранении их в лиофилизированном виде в течение 10 лет.
ОПРЕДЕЛЕНИЕ АНТИБИОТИЧЕСКОЙ АКТИВНОСТИ
МИКРООРГАНИЗМОВ
После того как микроб-антагонист выделен из естественного субстрата, его антибиотическую активность по отношению к различным тест-объектам определяют одним из существующих методов.
При определении антибиотических свойств микробов важно учитывать те факторы, которые влияют на образование антибиотиков (см. гл. IV).
Изучение антибиотических свойств микроорганизмов осуществляют при культивировании их на твердых (агаризированных) или в жидких средах.
МЕТОДЫ ОПРЕДЕЛЕНИЯ АНТИБИОТИЧЕСКОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ, ВЫРОСШИХ НА ТВЕРДЫХ СРЕДАХ
Большинство методов определения антибиотической активности связано с культивированием изучаемого организма на агарпзиро-ванных средах. Здесь мы остановимся лишь на наиболее распространенных методах выявления антибиотических свойств микробов.
Метод перпендикулярных штрихов. Испытуемый организм высевается штрихом (полоской) на поверхность агаровой пластинки чашки Петри. После того как микроорганизм разовьется, перпендикулярно его штриху подсеваются различные тест-организмы. Чашки помещаются в термостат на 20—24 ч. Если изучаемый организм оказывает антимикробное действие в отношении ряда тест-микробов, то последние будут расти вдали от штриха антагониста. Нечувствительные микробы будут развиваться в непосредственной близости от штриха изучаемого организма (рис. 16).
143
Рис. 16. Метод перпендикулярных штрихов для определения антагонистических свойств микроорганизмов
Метод штриха широко используется в практике поиска продуцентов антибиотических веществ, однако он имеет один существенный недостаток.
При методе штриха используется одна и та же среда для культивирования изучаемого организма и для роста тест-микробов.
Например, если для образования антибиотика необходима среда с нитратным источником азота, то такая среда может быть совершенно непригодной для развития ряда тест-организ-мов. И наоборот, многие тест-организмы хорошо растут на среде, состоящей из бульона Хоттингера (эта среда довольно часто применяется), но не все организмы могут продуцировать антибиотик на этой среде. В этом случае можно не определись антибиотическую активность организма, хотя он и обладает этой способностью.
Метод агаровых блочков. Изучаемый организм высевают сплошным «газоном» на поверхность агаровой пластинки в чашке Петри. Среда используется такая, которая благоприятна не только для роста организма, но, самое главное, для образования им антибиотика. Иногда целесообразно высевать организм на разные по составу среды.
После того как организм хорошо вырастет, пробочным сверлом (диаметр примерно 8 мм) вырезают агаровые блочки, которые переносят на поверхность другой агаровой пластинки, предварительно засеянной одним тест-организмом. На одну чашку Петри можно разместить 5—7 агаровых блочков.
Чашки с агаровыми блочками помещают в термостат на 20— 24 ч при температуре, благоприятной для развития тест-организма. Если выделяемый организмом антибиотик подавляет развитие тест-микроба, то вокруг агарового блочка образуется зона отсутствия роста. Чем больше выделяется антибиотика или чем активнее образуемое антибиотическое вещество, тем больше будет диаметр зоны отсутствия роста тест-микроба (рис. 17).
Метод высева антагониста на одной половине агаровой пластинки с последующим подсевом тест-микробов штрихами на другой половине агаровой пластинки. Чашка Петри разделяется стеклянной перегородкой пополам. В одну половину наливают питательный агар, благоприятный для развития изучаемого организма и вбразования антибиотика; другая половина чашки остается -сво-
144
Рис. 17. Использование агаровых блочков с выросшей культурой микроба для определения ее антибиотических свойств
Рис. 18. Определение антибиотических свойств микробов, выросших на воловине агаровой иластинии в чашке Петри
бодной. Иногда поступают иначе. В чашку Петри (без перегородки) наливают питательный агар, затем, когда агар застынет, стерильным скальпелем удаляют одну половину агаровой пластинки.
На половину агаровой пластинки высевают сплошным «газоном» изучаемый организм, и засеянные чашки помещают в термостат для получения хорошего развития микроба. После этого на оставшуюся свободную часть пластинки в чашке наливают расплавленный питательный агар, пригодный для развития тест-орга-
низмов, которые высевают штрихами, перпендикулярными границе развития антагониста. Чашки вновь помещают в термостат на 20—24 ч при температуре, благоприятной для развития тест-орга-
низмов.
Чувствительные тест-микробы будут расти на определенном расстоянии от антагониста, устойчивые же формы развиваются на протяжении всего штриха (рис. 18).
Метод агарового блочка, находящегося в центре чашки Петри. Так же, как и в предыдущем методе, в чашке создаются благоприятные условия как для развития антагониста, так и для развития тест-микроба.
В чашку Петри наливают питательный агар, пригодный для развития изучаемого организма с образованием антибиотического вещества, из расчета 20—25 мл на стандартную чашку. В застывшем агаре стерильным пробочным сверлом (дна-
Рис. 19. Схема приготовления чашек Петри для определения антибиотических свойств микроорганизмов, выросших па поверхности агарового блочка, находящегося в центре чашки (по Егорову, 1957):
1 — агаровый блочек, 2 — агаровая средр, благоприятная для роста тест-организма
145
метр 20—22 мм) вырезают агаровые блочки, которые затем переносят в другие стерильные чашки Петри. В центр каждой чашки помещают по одному такому блоку (рис. 19./), затем в эти же чашки на свободную их часть наливают питательный агар, пригодный для развития тест-микробов, с тем расчетом, чтобы уровень этого агара был на 1—1,5 мм ниже уровня блочка (рис. 19.2). В случае изучения бактериальных организмов приготовленные таким способом чашки необходимо немного подсушить, с тем чтобы удалить конденсационную влагу.
После того как чашки подготовлены, изучаемый организм высевают микробиологической петлей иа по-
Рис. 20. Определение антибиотических свойств микроорганизмов методом агарового блочка, находящегося в центре чашки Петри (по Егорову, 1957)
верхность агарового блочка, и чашки помещают в термостат на срок, обеспечивающий нормальное развитие организма. Затем по радиусам агаровой пластинки высевают штрихами тест-организмы, и чашки вновь на 20—24 ч помещают в термостат.
Отсутствие роста штриха тест-микроба на том или ином расстоянии от блочка будет указывать на угнетение его антибиотическим веществом изучаемого организма. Если же штрих тест-микроба развивается в непосредственной близости от агарового блочка, то это означает, что данный организм устойчив к действию антибиотика изучаемого антагониста (рис. 20).
Для изучения актиномицетов рационально агаровые блочки того же диаметра вырезать из среды, на которой уже вырос актино-мицет. Посев тест-мпкробов производят сразу же после внесения агаровой среды в чашку пли же чашку предварительно помещают на 18—20 ч в термостат при 26—30°С, с тем чтобы накопившийся в блочке антибиотик лучше продиффундировал в окружающий
агар.
ОПРЕДЕЛЕНИЕ АНТИБИОТИЧЕСКОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ ПРИ КУЛЬТИВИРОВАНИИ ИХ В ЖИДКИХ ПИТАТЕЛЬНЫХ СРЕДАХ
При определении антибиотических свойств микроорганизмов, культивируемых в жидких средах, необходимо иметь в виду, что некоторые антибиотики в процессе развития микробов накаплива-
146
•ются внутри клеток продуцента, практически не выделяясь в окружающую среду. Поэтому определение антибиотических свойств организмов следует проводить как в культуральной жидкости, так и в экстрактах. Обычно для экстракции антибиотика из клеток продуцента применяют органические растворители (этиловый спирт, подкисленный этиловый спирт, ацетон и другие вещества).
Для оценки антибиотических свойств микроорганизмов, выросших в жидких средах, можно использовать метод последовательных разведений (с. 154) и метод бумажных дисков.
Метод бумажных дисков. На агаровую пластинку в чашке Петри высевают соответствующий тест-организм. Затем чашки с засеянным тест-мпкробом подсушивают в термостате при 37°С в течение 15—20 мин. На одной чашке, т. е. в отношении одного тест-организма, может быть испытано одновременно 6—7 культуральных жидкостей.
Диски из фильтровальной бумаги диаметром 8 мм заготавливают впрок, стерилизуют в автоклаве под давлением выше нормального на одну атмосферу в течение 20—30 мин.
Стерильный диск фильтровальной бумаги захватывают стерильным пинцетом и смачивают в испытуемой культуральной жидкости, затем накладывают на поверхность питательного агара, засеянного тест-микробом. Чашку с тест-организмом и бумажными дисками помещают в термостат при температуре, оптимальной для роста тест-организма, на 24 ч, если это бактериальные формы тест-микроба, и на 48—72 ч для грибных или дрожжеподобных форм.
При наличии антибиотического вещества в испытуемой культуральной жидкости вокруг диска образуется зона задержки роста тест-микроба.
Приведенные методы пригодны для определения антибиотической активности микроорганизмов только в отношении бактерий, актиномицетов, дрожжевых и дрожжеподобных организмов и грибов. Для выяснения антивирусного или антпопухолевого действия организмов в силу специфичности этих объектов используют другие методы.
ОПРЕДЕЛЕНИЕ АНТИВИРУСНОГО ДЕЙСТВИЯ
АНТИБИОТИКОВ
Вирусы — внутриклеточные паразиты и поэтому не могут развиваться в виде «чистой культуры» вне клеток своего хозяина. Это обстоятельство и заставляет применять другие методы первоначального отбора активных веществ, отвечающие особенностям развития вирусов.
Метод тканевых культур. Существует несколько вариантов метода тканевых культур, но наиболее удобен метод использования переживающих кусочков хорионаллантоисной ткани куриного эмбриона в модификации Тама, Фалкерса и Хорсфолла (1953).
Из верхней части куриного яйца с 10—11-дневным эмбрионом вырезают стерильными ножницами шесть кусочков скорлупы с
J47
прилегающей к ней тканью хорионаллантоисной оболочки. Кусочки ткани осторожно отделяют от скорлупы н промывают буферным раствором. Каждый такой кусочек ткани помещают в пробирку с 1 мл среды следующего состава (%):
NaCI.........0,68 NaH.PO* ... 0,0125
KCI..........0,04 NaHCO3 ... 0,22
CaCI,........0,02 Глюкоза .... 1,0
MgSO* .... 0,01
Рис. 21. Использование листьев дурмана для определения антивирусного действия антибиотиков (по Шорину н др., 1956): 1— очаги некроза, вызванные вирусом табачной мозаики. 2 — наличие противовирусного действия, 3 — отсутствие действия на вирусы
Кроме того, в каждую пробирку добавляют пенициллин (100 ед/мл), с тем чтобы предохранить ткань от загрязнения (развития микроорганизмов). Пробирки устанавливают в специальный медленно (около 12 об/ч) вращающийся барабан.
Для выяснения антивирусного действия продуктов жизнедеятельности определенного организма кусочки ткани заражают соответствующим видом вирусов и вносят в пробирки, содержащие культуральную жидкость (при pH 7,0) исследуемого организма. Пробирки помещают в барабан на 48 ч.
Если культуральная жидкость обладает антивирусным действием, то в среде, окружающей ткань, не будет обнаружено вируса. При отсутствии антивирусного действия вирусы будут интенсивно размножаться в клетках ткани, что может быть легко обнаружено методом титрования на эритроцитах.
Метод оценки антивирусных свойств культуральных жидкостей различных микроорганизмов прост, удобен и позволяет сравнительно быстро получить необходимый ответ при массовых испытаниях.
Метод с использованием листьев растений. Разработан относительно простой метод выяснения антивирусного действия антибиотиков по отношению к вирусу табачной мозаики.
Микроорганизм выращивает на агаровой пластинке в чашке Петри. После достаточно хорошего развития микроба из агара вырезают блочки, которые затем прикрепляют с помощью расплавленной желатины к листьям дурмана, предварительно зараженным вирусом табачной мозаики. Для предохранения от инфекции К желатине добавляют пенициллин. Листья дурмана с агаровыми блочками помещают на несколько дней во влажные камеры. В течение этого периода поверхность листа дурмана покрывается очагами некроза. Но если находящееся в агаровом блочке антибиотическое вещество, образуемое изучаемым организмом, подавляет
148
развитие вируса, то вокруг такого блочка не будет некротических образований. Поверхность листа в зоне действия антибиотиков будет свободной от поражения вирусом табачной мозаики (рис.21).
Для окончательной оценки противовирусного действия антибиотических препаратов необходимо использовать животных (чаще всего мышей) или куриные эмбрионы, зараженные вирусами.
ОПРЕДЕЛЕНИЕ ПРОТИВОФАГОВОЙ АКТИВНОСТИ
Бактерио- и актинофаги обладают рядом свойств, общих с вирусами растений и животных. Фаги — это вирусы микроорганизмов.
Определение противофаговой активности микроорганизмов основано на тех же принципах, что и определение противобактери-альных свойств организмов.
Культуру, изучаемую на антифаговые свойства, высевают на агаровую или в жидкую среду, благоприятную для образования антибиотического вещества. В качестве тест-объекта используют смесь бактерий и специфического для этой бактерии фага.
При использовании одного из диффузионных методов (метода агаровых блочков, лунок в толще агаровой пластинки, штрихов и т. д.) наблюдается следующая картина. Если антибиотическое вещество подавляет рост фага, то в зоне диффузии антибиотика будет происходить рост используемой бактерии, на остальной же поверхности агаровой пластинки под действием развивающегося фага бактерии будут лизированы, и поверхность пластинки останется чистой.
Если же под действием изучаемого биологически активного вещества не произойдет развития бактерий и в зоне его диффузии, то это может означать, что используемый в опытах организм не образует противофагового вещества или же образуемое антибиотическое вещество подавляет развитие как фага, так и бактерии. Последнее легко проверить, если в качестве тест-организма взять только бактерию.
Противовирусным действием обладает ряд антибиотических веществ (эрлихин, лурнднн, фумагпллин, гелиомицин, вирусни и др.).
ОПРЕДЕЛЕНИЕ ПРОТИВОРАКОВОГО ДЕЙСТВИЯ
АНТИБИОТИКОВ
Не всегда антпраковое действие препарата совпадает с антибактериальным или антпгрпбным действием. Поэтому для определения противораковой активности культуральных жидкостей или очищенных препаратов в качестве тест-объектов используют непосредственно раковые клетки. С этой целью применяют методы, основанные на использовании экспериментальных животных, культуры тканей или свободноплавающих в отдельных полостях организма опухолевых клеток (асцитные клетки), но окончательная
149
оценка антиопухолевого действия испытуемого вещества проводится в опытах на животных.
Методы с использованием экспериментальных животных. В качестве тест-объекта используются клетки асцитного рака Эрлиха у мышей (клетки находятся в виде взвеси в асцитической жидкости животных). Взвесь асцитных раковых клеток смешивается с равным объемом изучаемого антибиотического препарата и смесь помещается в рефрижератор при 4°С на четыре часа, после чего ее прививают мышам (подкожно).
Для контрольных животных вместо исследуемого препарата используется физиологический раствор. Через 10 дней мышей убивают и определяют наличие опухолей и их размеры. Если изучаемый препарат убивает асцитные раковые клетки, то они, естественно, не дадут образования опухолей.
Тест-объектом могут служить не только клетки асцитногр рака Эрлиха, но и других опухолей, полученных экспериментальным путем у мышей и крыс. Использование клеток различных опудолей связано с необходимостью более широкого изучения противоопухолевого действия исследуемых препаратов, для более точного определения значения изучаемой культуральной жидкости или антибиотика в отношении их действия на раковые клетки.
Прежде чем использовать опухоль в качестве тест-материала, необходимо из опухолевых тканей получить тонкую взвесь. С этой целью применяется следующий метод.
В стерильных условиях вылущивают опухоль, тщательно, очищают от некротических участков и несколько раз промывают стерильным физиологическим раствором. После этого отобранные в чашки Петри кусочки опухоли измельчают ножницами до получения гомогенной кашицы и разводят примерно в 2 раза стерильным физиологическим раствором. После тщательного размешивания взвесь фильтруют через 2 слоя стерильной марли. Затем рпре-деляют количество опухолевых частиц, содержащихся в 1 мм3 взвеси (подсчет проводят в камере Горяева). Если при подсчете оказывается, что количество частиц в 1 мм3 незначительно, то полученную взвесь концентрируют методом центрифугирования. Надосадочную жидкость отсасывают, а опухолевые клетки, осевшие на дно пробирки, разводят нужным объемом стерильного физиологического раствора.
В дальнейшем постановка опыта со взвесью опухолевых клеток, приготовленной из опухоли животных, такая же, как и с клетками асцитного рака Эрлиха. Различие лишь в некотором удлинении срока наблюдения (до 12 дней). В опыте с клетками асцитного рака Эрлиха наблюдение ведут в течение 10 дней.
Чашечный метод. Разработан чашечный метод определения действия изучаемых антибиотических препаратов на раковые клетки.
Тест-объектом служат клетки асцитного рака, которые смешиваются с теплой агаровой средой (пептон, глюкоза, плазма крови) и разливаются в чашки Петри. На застывшую агаровую пластинку, содержащую клетки асцитного рака, накладывают агаровые
150
блочки с выросшей культурой микроорганизма или диски фильтровальной бумаги, предварительно смоченные культуральной жидкостью или раствором очищенного препарата. Чашки помещают в холодильник на несколько часов для диффузии изучаемых веществ в толщу агара, содержащего асцитные раковые клетки (2-107 клеток в 1 мл). После этого чашки помещают в термостат при 37°С на несколько часов и затем, вынув их из термостата, освобождают от агаровых блочков или дисков фильтровальной бумаги. Поверхность агаровых пластинок заливают 0,05%-ным раствором метиленового синего. Чашки покрывают стеклянными пластинками ненова помещают в термостат на несколько часов. При отсутствии действия антибиотика на раковые клетки асцитного рака вся поверхность агаровой пластинки будет бесцветной. Если же изучаемые препараты убивают клетки асцитного рака, то на месте агаровых блочков или дисков фильтровальной бумаги появятся голубые зоны. Свойство обесцвечивать метиленовый синий, т. е. превращать его в лейкосоединение. связано с выделением живыми асцитными клетками ферментов дегидраз. Убитые клетки не выделяют дегидразы и метиловый синий не обесцвечивается.
Следует отметить, что дегидразная активность раковых клеток может обнаруживаться не только с помощью метиленового синего, но и с помощью ряда других веществ, например 2,6-дихлорфе-нолиндофенола, солей тетразола. Способностью восстанавливать метиленовый синий обладают взвеси клеток различных опухолей животных н человека. Однако в случае использования взвеси клеток солидных опухолей их количество в 1 мл взвеси, необходимое для восстановления метиленового синего, различно (табл. 37).
Таблица 37
Количество клеток различных солидных опухолей животных и человека, необходимое для восстановленяя метиленового синего
(по Талызиной, 1960)
Время восстановления метиленового синего, ч
Опухоль
Количество клеток в 1 мл взвеси, необходимое для восстановления метиленового синего
Саркома Крокера у мышей 1 000 000—1 100 000 4
То же 350 000— 400 000 24
Опухоль ОЖ-5 v мышей 1 000 000—1 100 000 24
Саркома М-1 у крыс 5 000 000—5 500 000 24
То же 1 000 000—1 500 000 72
Рак молочной железы у человека . . 1 500 000—2 000 000 45
Саркома голени у человека 1 500 000—2 000 000 72
Примечание. Для асцитных раковых клеток — 2-I07 в L мл.
Приведенные данные показывают, что, пользуясь чашечным методом, вполне возможно вести отбор противораковых веществ
151
на раковых клетках человека, так как взвеси последних, как и. клетки асцитного рака, восстанавливают метиленовый синий.
Препараты, подавляющие или тормозящие рост опухоли, обычно подавляют и дегидразную активность соответствующей опухоли.
Пробирочный метод. В качестве определенной модификации чашечного метода является метод испытания противораковой активности антибиотиков в пробирках. Метод состоит в следующем. В стандартные пробирки вносят 0,5 мл испытуемой культуральной жидкости п 0,5 мл взвеси клеток асцитного рака Эрлиха (конечная концентрация клеток 500 тыс/мл), затем добавляют 2 мл расплавленной агаровой среды, содержащей метиленовый синий. В контрольные пробирки вместо испытуемой культуральной жидкости добавляют 0,5 мл среды, на которой выращивается изучаемый организм. После перемешивания пробирки помещают на 3— 4 ч в термостат при 36—37°С.
Если содержимое пробирок окрашивается метиленовым синим, то это указывает на то, что испытуемый препарат подавляет дегидразную активность клеток асцитного рака.
Преимущество пробирочного метода по сравнению с чашечным в том, что при этом происходит непосредственный контакт антибиотика с асцитными клетками Эрлиха независимо от степени диффузии изучаемого препарата в агар.
Использование микроорганизмов при изыскании противораковых антибиотиков. Обмен веществ в опухолевых клетках отличается от обмена нормальных клеток; различие, в частности, определяется интенсивностью дыхания; в опухолевых клетках оно значительно снижено. Исходя из этого, высказано предположение о возможности использования мутантов микроорганизмов, имеющих пониженный коэффициент дыхания, в качестве тест-объектов для поисков противораковых антибиотиков.
В результате ультрафиолетового облучения и действия уретана удалось получить мутанты стафилококков, бактерий кишечной группы и других организмов с пониженным коэффициентом окисления. Поглощение Кислорода у таких микроорганизмов может составлять 20—80% по сравнению с дыханием исходных родительских культур. В качестве тест-организмов для определения анти-опухолевого действия культуральных жидкостей микроорганизмов можно также применять мутанты дрожжевых организмов с пониженным коэффициентом дыхания.
Сравнивая чувствительность метода с использованием асцитных клеток Эрлиха и метода с биохимическими мутантами микроорганизмов, следует заключить, что биохимические мутанты — более чувствительные тесты при определении противоопухолевого действия микроорганизмов.
Использование опухолевых клеток, выращенных in vitro, для отбора организмов, образующих противоопухолевые антибиотики. В последнее время оказалось возможным культивировать некоторые опухолевые клетки в искусственных условиях (in vitro) подоб
152
но тому, как это осуществляется в отношении микроорганизмов. Лейкемические клетки мышей могут расти и размножаться в среде, содержащей пептон, диализированную лошадиную сыворотку и фолиевую кислоту (10 мкг/мл).
Это позволяет использовать перевиваемые штаммы клеток рака человека для изучения противоопухолевого действия некоторых антибиотиков. С этой целью клетки перевиваемых штаммов выращивают в матрацах Ру на специальной среде с добавлением 10% телячьей сыворотки. Культивирование проводят при 36°С. Через 6— 7 суток среду удаляют и слой клеток снимают с поверхности стекла 0,02%-ным раствором этилепдиаминтетрауксусной кислоты. Через 15—20 мин инкубации в термостате клетки переходят в суспензию.
Способность некоторых опухолевых клеток размножаться в пробирках позволяет применять их в качестве тест-объекта при поиске, выделении и очистке новых антибиотических веществ, обладающих противоопухолевой активностью.
С этой целью можно использовать опухолевые клетки лимфо-лимы. Для получения асцита клеток лимфолимы белым мышам вводят внутрибрюшинно по 0,3 мл взвеси асцитных клеток. Через 10—12 дней асцит стерильно отбирается и сразу же вносится в пробирки с вышеназванной средой для выращивания клеток в пробирках. Количество среды в каждой пробирке равняется 2 мл. Оптимальная концентрация опухолевых клеток составляет 3-10е— 5-10® в 1 мл среды. При этих условиях через 48 ч инкубации при 36,5°С в пробирках без перемешивания происходит увеличение числа клеток в 1,5—2 раза. Размножение клеток в культуре учитывается подсчетом в камере Горяева.
Если исследуемый препарат тормозит развитие и размножение клеток асцита, то это указывает на его антиопухолевое действие.
Применение этого метода позволяет производить первичный отбор противоопухолевых антибиотиков на стадии культуральной жидкости, осуществлять выделение и химическую очистку отобранных антибиотиков. Причем удается обнаружить и выделить противоопухолевые антибиотики, не обладающие подавляющим действием в отношении обычных тест-организмов, биохимического мутанта стафилококка и не действующие на дегидразную активность опухолевых клеток лимфолимы.
МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ
АНТИБИОТИКОВ
Количественное определение антибиотиков в культуральных жидкостях, готовых препаратах или в разнообразных растворах осуществляют различными методами: биологическими, химическими и физико-химическими. Наиболее распространены биологические методы; они не требуют специального дорогостоящего оборудования и дают довольно точные результаты.
153
БИОЛОГИЧЕСКИЕ МЕТОДЫ
Биологические методы количественного определения антибиотиков нашли широкое применение на практике. Они основаны на непосредственном биологическом действии антибиотика на используемый тест-организм, чувствительный к данному препарату, а поэтому считаются наиболее объективными.
Омелянский еще в 1906 г. указывал на преимущества биологических методов при количественном учете разных веществ. Он писал: «В лице бактерий химия приобретает новый и поистине неисчерпаемый источник разнообразнейших реактивов, во много раз более точных и более специализированных, чем те, какими располагала эта наука до сих пор».
Однако биологические методы определения антибиотиков имеют и недостатки: длительность проведения анализов, зависимость точности результатов от многих внешних факторов и т. п. Точность биологических методов обычно составляет ± 10%.
Наиболее широкое распространение среди биологических методов количественного определения антибиотиков получили метод последовательных разведений, диффузионный и турбидиметрический методы.
Метод последовательных разведений. Метод используется для определения количества антибиотика в культуральных жидкостях, растворах или в экстрактах. Для работы подготавливают питательный бульон, пригодный для развития выбранного тест-организма. Непременное условие — бульон должен быть прозрачным. Одновременно с этим подготавливают и культуру тест-организма. Стерильный питательный бульон разливают в чистые стерильные пробирки; количество бульона должно обеспечивать нужную степень разведения изучаемого антибиотика.
В тех случаях, когда антибиотик обладает высокой биологической активностью и в испытуемом растворе содержится в большом количестве, необходимо подготовить ряд пробирок с питательным бульоном таким образом, чтобы обеспечивалось получение относительно большого разведения. Например, в две пробирки вносят по 9 мл бульона в каждую. В первую пробирку вносят 1 мл испытуемого раствора антибиотика (разведение 1 : 10), тщательно перемешивают и 1 мл смеси переносят во вторую пробирку (разведение 1 : 100). Затем 1 мл раствора разведения 1 : 100 смешивают с 1, 2, 3, 4, 5, 6 и 7 мл бульона — получают разведения 1 : 200, 1 : 300, 1 : 400, 1 : 500, 1 :600; 1 : 700 и 1 :800. Для дальнейшего увеличения разведения испытуемого антибиотика, последовательно отличающегося на 100, берут 0,5 мл раствора с разведением 1 : 100, смешивают с 4; 4,5; 5 и 5,5 мл бульона и получают разведения 1 : 900; 1 : 1000; 1 : 1100 и 1 : 1200. При желании можно данный ряд разведения увеличить до необходимого значения. Иногда используют и другие ряды разведений, например 1 : 10, 1 : 20, 1 :40, 1 :80, 1 : 160 и т. д. или 1 : 2, 1 : 4, 1 : 8, 1 : 16; 1 :32 и т. д.
В полученном ряду разведений антибиотического вещества в
154
каждую пробирку вносят определенное количество клеток тест-микроба. Затем пробирки помещают в термостат на 20—24 ч при температуре, оптимальной для роста тест-микроба. После этого в пробирках определяется наличие или отсутствие роста тест-орга-иизма.
Допустим, что в нашем случае развитие организма начинается при разведении 1 : 1100 и далее, а во всех предыдущих разведениях, кончая 1 : 1000, рост тест-микроба отсутствует. Это означает, что в испытуемом растворе содержится 1000 ед. разведения антибиотика. Или для более точного расчета берут среднее значение максимального разведения, при котором отсутствует развитие тест-органнзма, и минимальное разведение, при котором начинается развитие.
В данном случае это будет (1000-f-l 100) : 2= 1050 ед. разведения.
Методом последовательных разведений можно определить количество антибиотика не только в условных единицах разведения, но и в весовых или стандартных единицах. Для этой цели титрование (разведение) должно проводиться стандартным раствором данного антибиотика, имеющего известную активность, выраженную в мкг/мг или в ед/мг препарата.
Например, необходимо определить концентрацию стрептомицина, содержащуюся в культуральной жидкости Str. griseus. Делают ряд разведений культуральной жидкости, освобожденной от мицелия, а параллельно таким же способом делают разведение стандартного раствора стрептомицина, содержащего, например, 10 мкг/мл.
Разведение испытуемой жидкости н разведение стандартного раствора антибиотика необходимо проводить в бульоне с фосфатным буфером при pH 7,8—8,0.
Пример расчета приведен в табл. 38,
Таблица 38
Определение концентрации стрептомицина методом последовательных разведений
Номер пробирки
Объект нсследопанкя
1 2 3 4 5 6 7 8 9 10 И 12
Разведение . . . Стандарт
(10 мкг/мл) . . Испытуемый материал ...........
1:2 1:4 1:8 1:16 1:32
1:128 1:256
+ ч-
1:512 1:1024
+ +
1:2048 1:4096
Примечание. Знак «—> —отсутствие роста тест-микроба; знак — наличие роста.
В данном случае (табл. 38) 10 мкг/мл стрептомицина подавляют развитие тест-культуры в наибольшем разведении, соответ
155
ствующем 5-й пробирке. Следовательно, 5 мкг/мл вызвали бы подавление роста микроба только в 4-й пробирке, но не в 5-й, а 20 мкг/мл задержат рост в 6-й пробирке, 40 мкг/мл — в 7-й; 80 мкг/мл — в 8-й; 160 мкг/мл — в 9-й; 320 мкг/мл — в 10-й пробирке и т. д.
Сравнивая эти величины, устанавливают, что испытуемый раствор, задерживающий развитие тест-организма в 10-й пробирке (разведение 1 : 1024), содержит 320 мкг/мл стрептомицина.
Расчет антибиотической активности испытуемого раствора при работе по методу последовательных разведений при наличии стандарта можно производить по следующей формуле:
X = Рп : Рс - С,
где Ри — максимальная степень разведения испытуемого раствора, при которой отсутствует рост тест-организма; Рс — максимальная степень разведения стандартного раствора, обеспечивающая отсутствие роста тест-микроба; С — исходная концентрация стандартного раствора антибиотика; Л’ — искомая концентрация антибиотика в исследуемом растворе.
В нашем примере Ри=1024; Рс=32; С=10 мкг/мл; искомая концентрации антибиотика
X = 1024 : 32 • 10 = 320 мкг/мл.
Метод последовательных разведений может дать сопоставимые результаты лишь при соблюдении определенных условий, а именно:
1. Тщательная стерильность проведения анализов.
2. Использование постоянных сред для разведения одного итого же антибиотика.
3. Внесение определенного количества клеток или спор тест-организма.
4. Определенная длительность инкубации пробирок, засеянных тест-культурой.
Иногда под действием испытуемого антибиотика возникают устойчивые к нему формы тест-микроба. Появление даже единичных резистентных клеток, которые могут дать затем развитие, приведет к ошибочным результатам при определении биологической активности препарата.
Чтобы избежать подобного явления, для разведений используют не бульон, а агаризованные среды, разлитые в пробирки. После проведения процесса разведения пробирки размещают в наклонном положении, с тем чтобы получить косячки застывшего агара. На поверхность скошенного агара микробиологической петлей высевают суспензию тест-микроба. После этого пробирки помещают в термостат на 24 ч при температуре, оптимальной для развития тест-организма. Расчет активности ведут тем же способом, что и при разведении антибиотика (культуральной жидкости) в жидкой среде. Появление одиночных колоний, образовавшихся из резистентных форм, в расчет не принимается.
Определение антибиотической активности методом серийных
156
разведений можно производить и на чашках Петри. В пробирки, содержащие по 9 мл расплавленного питательного агара, вносят по 1 мл определенного разведения изучаемого антибиотика или культуральной жидкости. После тщательного перемешивания содержимое пробирки выливают в чашку Петри и дают агару застыть. Затем по поверхности пластинки штрихами производят посев тест-организмов. Чашки выдерживают в термостате при оптимальной для используемых тест-организмов температуре в течение 20—21ч.
Преимущество этого метода по сравнению с пробирочным методом разведения состоит в том, что в данном случае каждое разведение изучаемого препарата может быть использовано для многих тест-организмов.
Диффузионные методы. Количественное определение антибиотиков диффузионными методами основано на способности антибиотических веществ диффундировать в агаровых средах и образовывать зоны, в которых не развиваются используемые тест-орга-низмы.
Величина зоны диффузии антибиотика зависит прежде всего от химической природы антибиотического вещества и его концентрации, состава агаровой среды, ее pH, температуры и других факторов, которые необходимо учитывать при проведении анализов.
Антибиотики-полипептиды, обладающие большой и сложной молекулой, диффундируют гораздо медленнее, чем, например, антибиотики ациклического строения или антибиотики тетрациклиновой природы н гетероциклического строения. Поэтому для количественного определения антибиотиков, трудно диффундирующих в агаризованных средах, необходимо подбирать условия, обеспечивающие лучшую их диффузию. К таким условиям можно, например, отнести добавление к среде отдельных веществ, повышающих диффузию антибиотиков. Так, СаС12 способствует повышению диффузии грамицидина С. Иногда чашки с агаром, тест-культурой и антибиотиком помещают на 20—24 ч в холодильник (+4°); тест-организм в это время не развивается, а антибиотик диффундирует. Используя этот метод, можно примерно в два раза увеличить скорость диффузии антибиотика при нормальном периоде роста тест-организма.
Концентрации испытуемых антибиотиков не должны быть слишком высокими, так как установлено, что диаметр зоны задержки роста тест-организма есть линейная функция логарифмов концентрации антибиотика, но лишь в определенных пределах концентрации. Так, увеличение концентрации неомицина выше 5% по существу не сказывается на величине зоны задержки роста тест-микроба.
Величина зоны задержки роста тест-организма зависит в определенной степени от длительности контакта антибиотика со средой (табл. 39).
Анализы необходимо проводить через определенный интервал времени, так как между моментом посева тест-организма и началом его прорастания проходит какой-то промежуток времени, в
•157
Таблица 39
Величина зон угнетения роста Streptomgces aureofaciens в зависимости от времени контакта антибиотика (на бумажном диске с агаром)
(по Teillon, 1953, 1953а)
Длительность конгжта бумажного диска с агаром перед посевом актиномицета Всчичина зоны угнетения роста, мм Длительность контакта бумажного диска с агаром перед посевом актино-мнцета Величина зоны угнетения роста, мм
сернокислый стрептомицин, 0,5% хлорамфеникол, насыщенный раствор сернокислый стрептомицин, 0,5% хлорамфеникол, насыщенный раствор
1 мин 13,0 22 5 ч 15,0 22
20 мин 13,0 21 24 ч 17,0 30
2 ч 12,5 23
течение которого антибиотик продолжает диффундировать в агар и оказывать биологическое действие.
Состав агаровой среды и ее pH также существенно влияют на величину образования зон задержки и рост тест-микроба (рис. 22). Стрептомицин, стрептотрпцин, неомицин проявляют антибиотические свойства более сильно в щелочной среде (pH 7,5—8,0); тетрациклиновые антибиотики наиболее активны в слабокислой зоне (pH среды 6,3—6,4).
Наличие в среде ароматических аминокислот снимает биологическую активность антибиотика азасерина по отношению к Е. coli.
Плотность используемой культуры тест-организма должна быть постоянной для каждой серии опытов, ибо с повышением плотности клеток тест-культуры уменьшается величина зоны задержки ее роста, так как бактерии заметно влияют на процесс диффузии антибиотика ввиду того, что антибиотические вещества в определенной мере связываются этими организмами.
Применение в опытах постоянной плотности вегетативных микробных клеток и спор тест-организма в агаровой среде дает воз-
Рис. 22. Зависимость биологической активности антибиотиков от состава среды и ее pH
158
можность получать зоны угнетения роста используемой тест-куль-туры соответствующей величины с резко очерченными краями.
Чаще всего для определения плотности микробных клеток и спор бактерий используют фотоэлектрокалориметр или стеклянный оптический стандарт, выпускаемый Государственным контрольным институтом им. Л. А. Тарасевича (ГКИ); стандарты соответствуют 5, 9, 10 и 11 единицам мутности. В качестве единицы мутности условно принята мутность взвеси тифозных бактерий, содержащая 100 млн. микробных тел в 1 мл. Однако при определении биологической активности антибиотиков в качестве тест-организмов чаще всего используют другие микробы, величина числового эквивалента мутности которых обычно ие соответствует величине числового эквивалента мутности тифозных бактерий.
Разработаны соответствующие поправки, которые необходимо вносить при использовании взвеси спор тест-органпзмов в процессе определения биологической активности антибиотиков. Поправки по отношению к числовому эквиваленту мутности для взвесей тифозных бактерий следующие:
Споры L2 (типа Вас.subtilis) ....... 1/12
Споры Вас. mycoides.............................1/6
Споры Вас. mycoides (гладкий вариант) . . 1/5
Зная эти поправки, можно рассчитать число спор в 1 мл суспензии.
Пример расчета. Допустим, что плотность взвеси спор Вас. subtilis соответствует 5 единицам мутности стандарта ГКИ. Зная, что числовой эквивалент указанной мутности для взвесей тифозных бактерий составляет 100 млн/млХ5=500 млн/мл и что соответствующий эквивалент для взвесей спор Вас. subtilis в 12 раз меньше, находим, что концентрация спор в исследуемой суспензии равна
500 млн/мл: 12 «42 млн/мл.
Соблюдение указанных основных правил постановки опыта при определении биологической активности антибиотиков методом диффузии в агар позволяет получить вполне сравнимые результаты.
Среди диффузионных методов определения биологической активности наиболее широкое применение нашли три метода, рассматриваемые ниже.
Метод с использованием металлических цилиндриков. На поверхность питательного агара в чашках Петри или в специальных кюветах расставляют металлические цилиндрики (с внешним диаметром 8 мм, внутренним диаметром 6 мм и высотой 10 мм) из алюминия или нержавеющей стали. Как правило, питательный агар используют двухслойный: 1-й слой агара наливают из расчета 15 мл на одну чашку Петри (диаметр 9 см); 2-н слой агара, содержащий определенной плотности суспензию тест-организма, разливают на застывшую поверхность первого слоя агара по 5 мл
159
Рис. 23. Определение биологической активности антибиотиков диффузионным методом с использованием металлических цилиндриков
Рнс. 24. Приспособление для получения лупок в толще агаровой пластинки
на чашку. На застывшую поверхность второго слоя агара по специальному трафарету расставляют предварительно простерплизо-ванные металлические цилиндрики (5—6 цилиндриков на чашку)'.
В одни цилиндрики вносят испытуемый раствор антибиотика, в другие — стандартный раствор того же антибиотика с известным числом мкг пли единиц активности в 1 мл раствора. Обычно цилиндрики с испытуемым и стандартным растворами чередуют. Затем чашки или кюветы помещают в термостат при температуре, оптимальной для роста тест-организма на 20—24 ч, после чего измеряют диаметры зон задержки роста тест-микроба (рис. 23). Расчет количества антибиотика в 1 мл раствора ведут или по стандартной кривой, полученной на полулогарифмической сетке, пли по таблицам Дмитриевой (1958).
Метод с применением лунок в толще агара. В толще агаровой пластинки делают лунки диаметром 8 мм. используя пробочное сверло соответствующего диаметра или специально сделанное приспособление, состоящее из резиновой груши, в которую вставляют заостренную с одного конца металлическую трубочку с внешним диаметром 8 мм (рис. 24). Блочки, надрезанные пробочным сверлом на всю глубину агаровой пластинки, удаляют с помощью стерильного скальпеля или специального крючка. В одни лунки вносят раствор испытуемого антибиотика, а в другие — стандартный раствор антибиотика (рис. 25).
Метод лунок имеет некоторые преимущества по сравнению с первым методом (нет необходимости в очистке и стерилизации цилиндриков). При использовании цилиндриков, сделанных из алюминия, иногда может происходить взаимодействие кислых антибиотиков с металлом, что приводит к частичной или полной
160
Рис. 25. Определение антибиотической активности препаратов в кюветах с использованием лунок в толще агара
инактивации препарата. При работе с лунками это полностью ис-хлючено.
При работе с цилиндриками возможно (особенно у начинающих исследователей) подтекание раствора антибиотика из-под неправильно поставленных цилиндриков, что приводит к образованию расплывчатых зон неправильной формы. Метод лунок не дает подобных эффектов.
Метод использования дисков фильтровальной бумаги. На поверхность питательного агара, засеянного тест-организмом, помещают диски фильтровальной бумаги, пропитанные испытуемым раствором антибиотика. В качестве стандарта используют диски, смоченные раствором антибиотика известной концентрации, или специально приготовленные диски, содержащие уже известное количество антибиотиков. Дальнейшие операции проводят так же, как и при работе с применением лунок в толще агара.
В некоторых случаях при использовании бумажных дисков получаются зоны неправильной формы. Это связано с тем, что в данном случае диск фильтровальной бумаги оказывается хроматограммой изучаемого антибиотика и препарат концентрируется в одном участке диска.
Турбидиметрические методы. Широкое распространение в практике количественного определения антибиотиков нашли турбидиметрические методы, в основу которых положена логарифмическая зависимость степени угнетения роста тест-организма от концентрации антибиотика. Метод основан на измерении концентрации клеток тест-микроба, образующих определенную оптиче
6—742
161
скую плотность среды (мутность) в результате роста в присутствии небольших количеств антибиотика. В присутствии небольших количеств антибиотика не происходит полного подавления роста тест-микроба, а лишь задержка темпа их роста, что и сказывается на оптической плотности бульона.
Турбидиметрические методы определения антибиотиков обычно неприемлемы для плотно окрашенных растворов. Но, учитывая высокую чувствительность этих методов, применяются довольно большие разведения исследуемых жидкостей, что приводит к значительному снижению концентрации пигментных веществ, мешающих проведению анализа; в ряде случаев можно использовать турбидиметрический метод и для окрашенных растворов. Оптическую плотность жидкостей определяют с помощью фотоэлектрокалориметра (ФЭК) или обычного турбидиметра.
Эти методы пригодны для количественного определения любых антибиотиков при условии наличия стандартного раствора изучаемого препарата.
При подборе быстрорастущих организмов, используемых в качестве тест-объектов, турбидиметрический метод можно использовать как экспресс-метод — ответ получают через 3,5—4 ч.
ХИМИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
Химические и физико-химические методы определения различных групп антибиотиков все шире и шире используются в лабораторной практике. Их преимущество по сравнению с биологическими методами состоит в быстром проведении анализов и, следовательно, в быстром получении ответа. В ряде случаев химические и физико-химические методы несколько уступают по точности биологическим методам. Однако их основное свойство — высокая скорость определения — способствует широкому практическому использованию.
К химическим и физико-химическим методам относят колориметрические и спектрофотометрические методы, основанные на образовании различных соединений или использовании определенных свойств антибиотиков: цветные реакции, исчезновение характерных полос в ультрафиолетовой или инфракрасной частях спектра под действием различных веществ (кислот, щелочей и др.).
Чисто химические методы определения количества антибиотиков применяются очень редко. Описано несколько модификаций определения пенициллинов, в основу которых положено поглощение иода продуктами гидролиза этого вещества. Определение пенициллина можно также производить ацидометрическим способом. При расщеплении молекулы пенициллина с помощью пени-циллинацилазы или щелочи с образованием пенициллановой кислоты происходит освобождение одной карбоксильной группы, которую можно учесть титрованием.
Чаще применяют колориметрические и спектрофотометрические методы определения концентрации антибиотиков. В основу
162
колориметрических методов положен принцип превращения препарата или его отдельных группировок в окрашенные соединения. Спектрофотометрические методы основаны на свойстве многих антибиотиков давать характерный спектр поглощения в видимом свете или в ультрафиолетовой области.
Определение стрептомицина основано на характерных реакциях различных функциональных групп молекулы антибиотика. Чаще всего применяется мальтольный метод, который состоит в том, что при щелочном гидролизе стрептомицина из стрептозной части молекулы образуется мальтол, который с солями трехвалентного
О
Мальтол
железа дает окрашенное соединение. Этим методом можно определять стрептомицин в растворах товарных препаратов и в культуральных жидкостях после соответствующей их очистки.
Для получения вполне воспроизводимых результатов при работе указанным методом рекомендуется использовать следующую методику: к 10 мл стрептомицина (концентрация 100—300 мкг/мл) добавить 2 мл 0,2 н. едкого натра, опустить сосуд в кипящую водяную баню на 4 мин, затем охладить в водопроводной воде в течение 3 мин, добавить 8 мл 1%-ного раствора железоаммиачных квасцов в 0,55 н. серной кислоте и точно через 3 мин после этого измерить удельную экстинкцию (оптическую плотность, или поглощение) .
Для определения маннозидострептомицина, который обычно образуется в определенном количестве вместе со стрептомицином, применяют антрон — вещество, обладающее способностью давать с углеводами в крепких растворах серной кислоты соединение интенсивно зеленого цвета. Определение оптической плотности этого окрашенного соединения обычно проводят на фотоэлектроколориметре.
Определение тетрациклиновых антибиотиков физико-химическими методами также основано на образовании окрашиваемых соединений при взаимодействии этих антибиотиков с хлористым железом, солями меди, азотной или серной кислотами. Тетрациклиновые антибиотики количественно могут определяться спектрофотометрическим методом. Метод основан на исчезновении одного из характерных максимумов поглощения раствора антибиотика после щелочного гидролиза.
Описано несколько физико-химических методов определения эритромицина, из которых наиболее широко распространенными являются колориметрический и спектрофотометрический методы.
Колориметрический метод определения эритромицина основан 6*
163
на изменении оптической плотности раствора антибиотика после реакции его с серной кислотой (27 н.). При взаимодействии эритромицина с серной кислотой образуются продукты, окрашенные в желтый цвет.
Замечено, что оптическая плотность испытуемого раствора антибиотика и серной кислоты зависит от температуры сливаемых растворов. Чтобы исключить это влияние, необходимо измерять оптическую плотность раствора антибиотика после нагревания его с 18 н. H2SO4 при 100°С.
Физико-химический метод нашел широкое практическое применение при определении циклосерина. Метод основан на реакции циклосерина с нитропруссидным реагентом в кислой среде. В результате реакции образуется комплексное соединение голубого цвета, концентрацию которого легко измерить колориметрически.
Нитропруссидный реагент представляет собой смесь равных объемов 4-х процентного раствора нитропруссида натрия (Na«Fe(CN)sNO2) и 4 н. раствора едкого натра. Реагент можно готовить за 16—24 ч до начала определения и хранить в холодильнике, лучше же готовить реагент перед началом определения.
Метод определения циклосерина состоит в следующем. К 1 мл раствора циклосерина (концентрация 50—200 мкг/мл) добавляют 3 мл 1 н. раствора уксусной кислоты и 1 мл нитропруссидного реагента. После перемешивания раствор оставляют при комнатной температуре в течение 10 мин и измеряют величину оптической плотности.
* * *
Для изложения основ науки об антибиотиках и, в основном, для рассмотрения условий образования наиболее ценных в практическом и теоретическом отношении препаратов и других, главным образом биологических, проблем, связанных с этими соединениями, рационально с нашей точки зрения рассматривать антибиотические вещества по тем группам организмов, которые их продуцируют.
Каждая группа организмов образует большое число разнообразных антибиотиков. Подробно познакомиться со всеми этими веществами не представляется в данном случае никакой возможности. Во второй части учебника будут рассмотрены лишь антибиотики, представляющие тот или иной практический или теоретический интерес.
ЧАСТЬ
II
Антибиотики, образуемые различными группами организмов, условия их биосинтеза, механизм действия и применение
Вторая часть учебника посвящена рассмотрению основных групп антибиотиков. Главный акцент при этом был сделан на описании условий биосинтеза, химического строения, антимикробных спектров действия и практическом использовании рассматриваемых антибиотических веществ в медицине. Особое внимание уделено вопросам, связанным с направленным биосинтезом ценных антибиотиков, что дает возможность управлять процессом образования антибиотических веществ.
Большое теоретическое и существенное практическое значение имеют проблемы изучения механизма биологического действия антибиотиков, борьбы с возникновением резистентных форм микроорганизмов к этим биологически активным соединениям.
Во второй части книги также рассмотрены основные этапы промышленного получения антибиотиков и дан анализ применения их в сельском хозяйстве как важнейших лечебных веществ, используемых в ветеринарии, и как факторов борьбы с фитопатогенными организмами в растениеводстве. Приведены данные по использованию этих биологически активных веществ в пищевой промышленности.
АНТИБИОТИКИ, ОБРАЗУЕМЫЕ СОБСТВЕННО БАКТЕРИЯМИ
Среди многочисленных антибиотических веществ, образуемых различными группами организмов, большое число антибиотиков является продуктами жизнедеятельности собственно бактерий, но' среди этих антибиотиков лишь немногие нашли пока практическое применение. Это связано главным образом с тем, что большинство бактериальных антибиотиков токсичны для макроорганизмов. Часть этих антибиотиков (грамицидин С, полимиксины, бацитрацины и др.) используется в медицинской практике, другие антибиотики этой группы (субтилин, низины) нашли применение в пищевой и консервной промышленности. Они предохраняют от порчи мясные, рыбные, молочные и другие скоропортящиеся продукты. Некоторые из них, например бацитрацины, применяются в сельском хозяйстве как добавки к корму домашних животных.
Все это указывает на необходимость дальнейшего изучения антибиотиков бактериального происхождения.
Почти все бактериальные антибиотики по химической природе полипептиды или белки. Это представляет особый интерес в связи с изучением путей биосинтеза названных веществ и использованием этих путей в качестве моделей при изучении проблем биосинтеза полипептидов вообще, что имеет большое теоретическое значение.
К настоящему времени известно более 560 антибиотиков бактериального происхождения, но мы остановимся лишь на некоторых наиболее характерных представителях этой группы, имеющих определенное практическое или теоретическое значение; к ним относятся тиротрицин, грамицидины, полимиксины, лихениформины, низины, бацитрацины и некоторые другие.
Следует заметить, что в большинстве случаев при изучении бактериальных антибиотиков приходится иметь дело не с одиночными веществами, а с группой близких друг другу по химическим и биологическим свойствам веществ, образуемых одним видом бактерий.
Известно, что Bacillus subtilis способен образовывать около 70 различных полипептидных антибиотиков, Вас. polymyxa образует более 20 полимиксинов, Вас. brevis синтезирует 23 антибиотических вещества полипептидной природы и т. д.
167
Образование антибиотиков-полипептидов идет, по всей вероятности, по аналогичному плану у разных бактерий. Процесс биосинтеза активируется полиферментными комплексами, близкими по типу действия.
Особенность полипептидных антибиотиков, образуемых бактериями, и в том, что в их состав наряду с L-формами аминокислот входят D-аминокислоты, а также метилированные аминокислоты, иминокислоты.
ТИРОТРИЦИН (TYROTHRICIN)
Тиротрицин впервые получен Дюбо в 1939 г. при развитии бактерии Bacillus brevis, выделенной из почвы. Продуцент тиротрици-на — Вас. brevis — аэробная, спорообразующая палочка. Споры образуются по бациллярному типу и расположены обычно в центральной части бактериальной клетки. Бактерии благодаря перет-рихиально расположенным жгутикам подвижны, окрашиваются по Граму, разжижают желатину, гидролизуют крахмал. Температурный оптимум развития около 37°С.
Для получения антибиотика бактерии выращивались в течение 4—5 сут при 37°С на жидкой питательной среде (обычно мясопептонный бульон), разлитой тонким слоем в матрацы. В процессе развития культуры происходит образование антибиотика, который в небольшом количестве выделяется в окружающую среду, а основная масса тиротрицина находится в бактериальных клетках. Затруднение выделения антибиотика из клетки связано, по-видимому, с его химической природой.
Тиротрицин — полипептид с большим числом аминокислотных остатков, что затрудняет его диффузию через бактериальную оболочку, но, возможно, имеются и другие причины, удерживающие антибиотик внутри клетки.
При выделении антибиотика необходимо помнить, что большая часть его содержится в клетках бактерий, а следовательно, обрабатывать следует как культуральную жидкость, так и бактериальную массу. Схема выделения тиротрицина представлена на рис. 26.
Культуральная жидкость вместе с бактериями подкисляется соляной кислотой до pH 4,5. При этом выпадает осадок, состоящий из бактериальных тел и антибиотика. Фильтрацией отделяют осадок от жидкости и подвергают обработке кислым спиртом в течение суток. За этот промежуток времени антибиотик извлекается из бактериальных клеток и переходит в спиртовой раствор. Спиртовой раствор отделяют от бактериальной массы. Спиртовой экстракт упаривают в вакууме и остаток переносят в раствор NaCl. Тиротрицин при этом выпадает в виде хлопьевидного осадка. «Свободный» антибиотик, т. е. антибиотик, выделенный бактериями в окружающую среду, может извлекаться нейтральным буфером непосредственно из осадка, полученного при обработке НС1.
Тиротрицин обладает бактериостатическим и бактерицидным
168
Рис. 26. Схема выделения тиротрицина
действием по отношению к грамположительным бактериям и главным образом в отношении гноеродных кокков. Преимущество тиротрицина в том, что он действует на некоторые патогенные микробы (например, фекальный стрептококк), на которые не оказывают влияния ни пенициллин, ни сульфамидные препараты. Грам-отрицательные бактерии устойчивы к действию антибиотика.
Тиротрицин в виде растворов и стойких эмульсий находит применение в медицинской практике преимущественно в качестве антисептического средства. Антибиотик плохо диффундирует, что позволяет использовать его в случаях необходимости для длительного бактериостатического действия при местном использовании.
В 1941 г. было установлено, что тиротрицин состоит из двух различных полипептидов. Их разделили и дали самостоятельные названия — тироцидин и грамицидин. Молекулярная масса тироцидина равняется 1300.
При обработке тиротрицина смесью равных объемов ацетона и эфира или одним эфиром в раствор переходит только грамицидин (15—20% от массы тиротрицина). Тироцидин остается нерастворимым препаратом.
В 1950 г. было установлено, что фракция тироцидина не одно
169
родна и состоит из трех близких по аминокислотному составу полипептидов, получивших названия тироцидинов А, В и С (табл. 40).
Грамицидиновая фракция тиротрицина также оказалась неоднородной; были выделены четыре полипептида: грамицидины А, В, Cd и D. Аминокислотный состав этих антибиотиков приведен в табл. 40.
Таблица 40
Аминокислотный состав антибиотиков-полипептидов, образуемых различными штаммами Bacillus brevis
Аминокислоты
Грамицидины
Тироцидины
АВ С
Треонин ....................
Серин ......................
Валин . . ................. Орнитин .................... Глутаминовая кислота . . . . Пролин...................... Изолейцин................... Лейцин ..................... Аспарагиновая кислота .... Аланин...................... Глицин ..................... Фенилаланин ................
Тирозин .................... Триптофан .................. Аргинин .................... Гистидин ...................
4
4
2
1 1
3
4
4
2
1
1
3
2L
2L
2L
2L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
1L
2D 2D 2D
1D
1L 1L1D
1
1 2
1
1 6
2 —
2 6
2 —
4 1
6 1
8 —
Примечание. Знак «+» — наличие аминокислотного остатка в молекуле; знак «—» — отсутствие аминокислотного остатка; числа — количество аминокислотных остатков; латинские буквы L или D — форма аминокислотного остатка.
В процессе разделения грамицидиновой фракции установлено, что грамицидин А находится в преобладающем количестве. В отдельных препаратах грамицидиновой фракции содержится 85% грамицидина А, 9% грамицидина В, 6% грамицидина Cd и следы грамицидина D. Грамицидины А, В, Cd имеют линейное строение и состоят из двух цепей.
ГРАМИЦИДИНЫ (GRAMICIDINS)
Из грамицидиновой фракции тиротрицина, образуемого Bacillus brevis, выделены четыре полипептидных антибиотика: грамицидины А, В, Cd, D. Кроме того, из штамма Вас. brevis, выделенно
го
го из почв Подмосковья, получен новый полипептидный антибиотик— грамицидин С (советский грамицидин).
Таким образом, к настоящему времени известно пять грамицидинов: грамицидин А, грамицидин В, грамицидин Cd, грамицидин С и грамицидин D; аминокислотный состав их приведен в табл. 40.
ГРАМИЦИДИН С (GRAMICIDIN S)
В 1942 г. Г. Ф. Гаузе и М. Г. Бражникова выделили из подмосковных почв штамм Bacillus brevis, образующий антибиотик, который они назвали грамицидином С. Бактерия-продуцент грамицидина С по культуральным и морфологическим свойствам напоминает бактерию Вас. brevis, образующую тиротрицин. Однако выделенный советскими учеными штамм отличается от штамма Дюбо тем, что не разжижает желатину и не гидролизует крахмал. Организм, продуцирующий грамицидин С, назван Вас. brevis var. G. В.
Продуцент грамицидина С Bacillus brevis var. G. В. в процессе развития в жидкой питательной среде спонтанно диссоциирует на ряд форм, отличающихся морфологией колоний и другими свойствами при высеве их на твердые питательные среды с дрожжевым экстрактом.
Образующиеся варианты представлены следующими формами; складчатая (R), гладкая (S) и две плоские формы (Р+ и Р_). Плоские формы впервые были выделены Жариковой с сотрудниками в 1963 г.
Процесс диссоциации Вас. brevis в большой степени зависит от условий культивирования: состава среды, источников углерода, азота, pH и других факторов. Однако любое изменение условий культивирования всегда приводит к возникновению четырех вариантов Вас. brevis: R, S, Р+ и Р~.
Новые варианты Вас. brevis, появившиеся в процессе диссоциации, имеют признаки, отличные от признаков исходной культуры, и в том числе способность к образованию антибиотиков.
Образовывать грамицидин С могут лишь две формы: R и Р+, формы S и Р_ не способны продуцировать этот антибиотик.
Биосинтез грамицидина С антибиотикообразующими вариантами (R и Р+) Вас. brevis происходит независимо от процесса спорообразования: антибиотик синтезируется как в процессе спорообразования (по-видимому, на стадии проспоры), так и активно размножающимися клетками. В период, когда культура переходит к массовому спорообразованию, биосинтез грамицидина не происходит.
Отличие грамицидина С от тиротрицина обнаруживается уже при выделении антибиотика. Грамицидин С при упаривании спиртового экстракта, полученного из бактериальной массы, легко превращается в игольчатые кристаллы. Тиротрицин в аналогичных условиях — аморфный препарат.
171
Грамицидин С существенно отличается от грамицидина Cd по аминокислотному составу. Так, в грамицидине С имеется 10 аминокислотных остатков пяти аминокислот, составляющих замкнутый цикл, а грамицидин Cd состоит из 15 аминокислотных остатков шести аминокислот, расположенных линейно (не циклически).
Условия образования
Грамицидин С длительное время получали при выращивании Вас. brevis var. G. В. на средах, содержащих мясной гидролизат, или на 10%-ном дрожжевом гидролизате при поверхностном культивировании организма при температуре около 40°С. В этих условиях образуется до 2000 мкг/мл грамицидина.
Коршуновым еще в 1962 г. была установлена принципиальная возможность хорошего роста организма с образованием антибиотика при глубинном культивировании бактерии в колбах на качалках или при продувании воздуха в опытных стеклянных ферментерах.
Интенсивность аэрации среды для развития Вас. brevis var. G. В. играет существенную роль в образовании грамицидина С. При низкой степени аэрации среды (0,38 г/О2/л/ч) культура бактерий плохо развивается и слабо синтезирует антибиотик. Это связано, по-видимому, с недостатком кислорода в среде. Повышение интенсивности азрации до 4,38 г/О2/л/ч способствует увеличению скорости роста бактерий и активному потреблению основных компонентов субстрата, что в итоге также приводит к снижению образования грамицидина С.
Для максимального накопления биомассы бактерий и биосинтеза антибиотика необходимо подобрать сбалансированное сочетание интенсивности аэрации среды и концентрации входящих в нее веществ. Источники азота и углерода при этом должны содержаться в среде в некотором избытке.
Было показано, что Вас. brevis на высоком уровне образует грамицидин (до 2500 мкг/мл) при культивировании его на относительно простой синтетической среде (янтарнокислый аммоний — 0,5%; глицерин — 1,5%; MgSO4—0,02%; К2НРО4—0,2%; вода дистиллированная; pH среды перед посевом 7,0—7,3). Увеличение концентрации неорганического источника фосфора в среде существенно не влияет на биосинтез грамицидина.
Развитие Вас. brevis и образование грамицидина С может происходить как при температуре 28°С, так и при 40°С. Однако в последнем случае максимальное образование антибиотика происходит в первые 24 ч развития культуры, а при температуре 28°С — в период между 24 и 48 ч.
Добавление к натуральной среде неопределенного состава, состоящей из дрожжевого экстракта, мясного экстракта, бактопеп-тона и глюкозы, меченых по углероду 14С аминокислот, входящих в состав молекулы грамицидина С, показало, что каждая из пяти аминокислот довольно быстро включается в пептидный цикл моле
172
кулы антибиотика. Структурные аналоги этих аминокислот подавляли образование антибиотической активности, мало затрагивая при этом рост организма и синтез белка. На синтетической среде в присутствии фенилаланина происходит увеличение биомассы бактерий в 1,5—2 раза и повышение биосинтеза грамицидина С в 5,4 раза у R-формы по сравнению с контролем (среда без фенилаланина) и в 3,8 раза у Р+-формы. Интересно, что аналог фенилаланина р-фенил-р-аланин полностью подавляет антибиотикообра-зование у R-форм и значительно угнетает рост всех форм изученной бактерии.
С другой стороны, дериваты пиримидина (в особенности 5-бром-уридин) и 5-флуоротриптофан разъединяли синтез белка и грамицидина в другом направлении, т. е. в культурах, которые содержали эти компоненты, продолжалось накопление антибиотика, а рост и синтез белка почти приостанавливался. Следовательно, механизмы синтеза грамицидина и белка в организме различны.
Некоторые аминокислоты (лейцин и пролин), внесенные в казеиново-дрожжевую среду, содержащую 30 мг% N, несколько повышают выход антибиотика. Однако образование грамицидина в этом случае не достигает уровня биосинтеза антибиотика на той же среде, но содержащей 120 мг% азота. Валин и орнитин способствуют в условиях обедненной по азоту среде более высокому уровню образования антибиотика по сравнению со средой, содержащей лейцин и пролин. На синтетической среде с глицерином (2%) внесение в субстрат сочетаний яблочной и фумаровой кислот с р-фенил-а-аланином обеспечивает наибольший биосинтез грамицидина С.
Добавление к среде треонина приводило к некоторому снижению роста R-формы и одновременному повышению биосинтеза антибиотика этой формой Вас. brevis примерно на 20%, а у Р+-форм в присутствии треонина происходит полное угнетение образования грамицидина.
Приведенные наблюдения показывают, что на биосинтез грамицидина С существенное влияние оказывают некоторые аминокислоты. Так, р-фенил-а-аланин заметно стимулирует образование антибиотика, тогда как ее ближайший аналог р-фенил-р-аланин выступает в роли мощного ингибитора биосинтеза молекулы грамицидина С. Одна и та же аминокислота в зависимости от штамма продуцента оказывает стимулирующее или ингибирующее действие.
Грамицидин С синтезируется клетками Вас. brevis при участии двух ферментов (грамицидин-синтетазы I и II) в присутствии АТФ и ионов Mg2+.
Компонент I осуществляет активацию четырех аминокислот, входящих в молекулу грамицидина С. Для каждой аминокислоты у этого фермента имеется свой активный центр. Процесс активации аминокислот происходит по следующей схеме: вначале идет образование аминоациладенилатов, связанных с компонентом I, затем происходит отщепление АМФ, и аминокислоты переносятся на сульфгидрильные группы фермента.
173
Компонент II — ранемаза фенилаланина активирует фенилаланин также в присутствии АТФ и ионов магния, в результате чего образуется аминоациладенилат, который переносится на сульфгидрильную группу компонента II с образованием тиоэфира D-фенилаланина.
Образование пептидных связей между активированными аминокислотами происходит с участием фосфопантетенна, ковалентно связанного с компонентом I. Перенос D-фенилаланина с компонента II на иминную группу L-пролина идет без участия фосфопантетеина. Биосинтез дипептида (фенилаланин—пролин)—это первая стадия образования полипептидного антибиотика. Образовавшийся дипептид переносится на фосфопантетеин, с помощью которого осуществляется перенос этого дипептида на аминную группу L-ва-лина. Образуется трипептид: фен — про — вал. Трипептид переносится на аминную группу орнитина с образованием тетрапептида: фен — про — вал — орн, который тем же путем переносится на аминную группу лейцина с образованием пентапептида: фен — про—вал—орн—лей.
В результате процесса происходит циклизация пентопептида с образованием грамицидина С.
Грамицидин-синтетазы образуются в период развития культуры, следующий за лаг-фазой, и активность их быстро уменьшается, когда клетки переходят к стационарной фазе развития. Грамицидин С начинает обнаруживаться через несколько часов после начала проявления активности ферментов. Образование антибиотика продолжается и после прекращения активности ферментов в культуральной жидкости.
Грамицидин-синтетазы могут находиться как в растворимой, так и в связанной с мембранами формах. Последняя форма более устойчива, и она, по-видимому, ответственна за образование антибиотика после инактивации растворимой синтетазы.
Выделение грамицидина С
Выделение грамицидина С производят следующим способом. Культуральную жидкость подкисляют соляной кислотой до pH 4,5—5. При этом в осадок выпадают дихлоргидрат грамицидина С и бактериальные клетки продуцента, затем антибиотик из осадка экстрагируют спиртом. Полученный концентрат, содержащий до 4% грамицидина, используют в медицинской практике. Спиртовой концентрат содержит помимо грамицидина С еще несколько близких соединений.
Антимикробный спектр и применение
Грамицидин С обладает довольно высокой антибиотической активностью в отношении грамположительных и некоторых грам-отрицательных бактерий.
174
Микроорганизм
Бактериостати ческа я концентрация, мкг/ыл
Bacillus subtilis............ 10—16
Escherichia coll............. 2
Bacterium dysenteria: ... 12
Bacterium paratyphi A. . . 50
Bacterium typhi ...... 50
Clostridium welchii .... 7
Diplococcus pneumoniae . . 10
Micrococcus gonorrhoeas . . 5
Micrococcus meningitidis . . 5
Proteus vulgaris............. 50
Staphilococcus aureus . . . 3—12
Staphilococcus pyogenes . . 3—12
Антимикробный спектр грамицидина С отличается от спектра тиротрицина и его компонентов широтой действия.
Антибиотические свойства грамицидина С сохраняются в присутствии лимфы, сыворотки крови и гноя. Грамицидин С находит применение в хирургии при первичной обработке ран, при лечении инфицированных ран, ожогов и других нагноительных процессов. Антибиотик применяют в акушерско-гинекологической практике при лечении эрозий шейки матки и кольпитов.
Химическое строение и синтез
Химическая природа грамицидина С хорошо изучена. Это позволило Швайзеру и Зиберу в 1956 г. осуществить полный синтез антибиотика.
Группа сотрудников Массачусетского технологического института (США) разработала в 1973 г. метод ферментативного синтеза грамицидина С. Для синтеза этого антибиотика-полипептида потребовалась иммобилизация нескольких ферментов и разработка АТФ-системы, функционирующей в качестве легко возобновляемого энергетического источника.
Использование многоэтажных ферментных систем для получения некоторых биологически активных полипептидов — метод весьма перспективный.
Впервые в 1945 г. химическое строение грамицидина С было детально изучено Белозерским и Пасхиной, которые дали убедительное доказательство отличия его от полипептидов Дюбо.
Грамицидин С — пептид, в состав которого входят пять аминокислот: L-валин, L-орнитин, L-лейцин, D-пролин и D-фенилаланин. В состав грамицидина Дюбо, как уже отмечалось, входят 15 аминокислотных остатков шести аминокислот. При дальнейшем изучении химии грамицидина С и, в частности, при определении его молекулярной массы (равна 1141) было установлено, что грамицидин С — декапептид, содержащий в определенной последовательности десять аминокислотных остатков тех же пяти аминокислот:
175
L-Вал —»-L-O рн —►L-Л ей —D-Ф ен —►L-П ро
♦ ♦
L-IIpo-*—D-Фен-*—L-Лей L-Орн—г— L-Вал
Приведенная структурная формула грамицидина С показывает, что в нем имеется свободная аминная группа, представленная б-аминогруппой орнитина. Изучение взаимосвязи между химической структурой грамицидина С и его биологической активностью показало, что наличие свободной аминной группы весьма важно для проявления антибиотической активности. Блокирование аминогруппы путем ацилирования или ее снятие путем дезаминирования приводит к значительному снижению, а в некоторых случаях к полному уничтожению антибиотической активности.
Уровень антибактериальной активности производных грамицидина С зависит не только от присутствия аминной группы, но и от
176
группы орнитина на карбоксильную
приводит к полной потере биологической актив-
группу! R—С
ее положения в молекуле. Если удалить эти основные, биологически активные группы по отношению к циклопептидной части молекулы грамицидина на 2, 5 и 9 атомов углерода от положения их в природном антибиотике, происходит снижение биологической активности в 7 раз. При ацилировании (замещении кислотными
остатками типаК—С /6-аминных групп орнитина антибиотическая активность грамицидина С уменьшается в 100—150 раз, и грамицидин в этом случае полностью теряет свойства антибиотика.
Замещение б-а Z \он
ности грамицидина С.
Все это указывает на то, что молекула грамицидина С, образующаяся в процессе биосинтеза, обладает оптимальной с точки зрения антибактериального действия структурой и определенной жесткостью конформации. С ослаблением жесткости конформации молекулы уменьшается или полностью исчезает антибиотическая активность.
Различные штаммы Вас. brevis кроме вышеназванных антибиотиков способны синтезировать и другие полипептидные антибиотические вещества. К их числу относятся эдеин, бреволин и бре-вин, выделенные из культуральной жидкости Вас. brevis, а также
Таблица 41
Образование антибиотиков различными штаммами Bacillus brevis
Антибиотик Продуц ент Число аминокислотных остатков
Бревиген Вас. brevis 6
Бревин Вас. brevis 27
Бреволин Вас. brevis 9
Бресеин Вас. brevis 22
Грамицидин А Вас. brevis Dubos 15
Грамицидин В Вас. brevis Dubos 15
Грамицидин С Вас. brevis R, P* 10
Грамицидин CD Вас. brevis Dubos 15
Грамицидин D Вас. brevis Dubos 20—21
Гратизин Вас. brevis V-33 12
Грацейлин Вас. brevis P” 34
Комисан Вас. brevis RB-103 12
Мемориалин Вас. brevis He установлено
Тироцидин А Вас. brevis Dubos 10
Тироцидин В Вас. brevis Dubos 10
Тироцидин С Вас. brevis Dubos 10
Эдеин Вас. brevis vm-4 4
Эсеин и др. Вас. brevis S 29
177
бревиген, гратизин, грацейлин, комисан, мемориалин, эсеин, бресе-ин и др.
Штаммы Вас. brevis, полученные в результате естественной изменчивости и индуцированным путем, образуют 23 полипептидных антибиотика, отличающихся строением молекулы и аминокислотным составом (табл. 41).
ПОЛИМИКСИНЫ (POLYMYXINS)
В группу полимиксинов входят родственные антибиотические вещества полипептидной природы, образуемые различными штаммами Bacillus polymyxa и Bacillus circulans. Об антибиотическом веществе, образуемом Вас. polymyxa, впервые было сообщено в 1947 г. Бенедиктом и Лангликком. Стенсли с сотрудниками описал некоторые свойства антибиотика, активного по отношению к грам-отрицательным организмам. Эти же авторы предложили назвать выделенный антибиотик полимиксином и определили продуцирующий его организм.
Примерно в то же самое время английские исследователи опубликовали данные об антибиотике аэроспорине, образуемом Bacillus aerosporus. Позднее было установлено, что Вас. aerosporus близок Вас. polymyxa, и антибиотик, образуемый им, подобен полимиксину.
В дальнейшем методом бумажной хроматографии было показано, что различные штаммы Вас. polymyxa образуют различные варианты полимиксина, отличающиеся аминокислотным составом. Вначале было определено пять разных полимиксинов: полимиксин А (ранее этот антибиотик назывался аэроспорином), полимиксин В, полимиксин С, полимиксин D и полимиксин Е (колистин). Россовская в 1956 г. выделила из почв Москвы штамм Вас. polymyxa Ross., образующий полимиксин М.
Японские ученые Кимура, Мураи и другие в 1969 г. сообщили о новом полипептидном антибиотике полимиксине Р, который затем был разделен на два полипептида: полимиксин Pi и полимиксин Р2. К этой группе антибиотиков относятся также циркулины (циркулин А и циркулин В) и октапентины.
К настоящему времени описано 35 антибиотиков полимиксинового ряда, в том числе 22 антибиотика, относящиеся, собственно, к полимиксинам, и 13 — к октапентинам.
Все известные полимиксины различаются аминокислотным составом. Однако в структуре всех этих антибиотиков присутствуют треонин, а, у-диаминомасляная кислота (ДА1К) и одна из жирных кислот (табл. 42).
Особенностью группы полимиксинов является то, что в составе их молекул имеется 4—5 свободных у-аминных групп а, у-диами-номасляной кислоты, что придает полимиксинам свойство катионных детергентов, способных образовывать комплексы с фосфолипидами клеточных мембран.
178
Таблица 42
Аминокислотный состав антибиотиков группы полимиксинов
Антибиотик Треонин Лейцин Фенил- аланин Серин Изолейцин ДМК Жирная кислота
Полимиксины:
At 3L ID 5L, ID 6-МОК
а2 3L ID 5L, ID 6-МГЕП
Bt 2L IL ID 6L 6-МОК
в2 2L IL ID 6L 6-МГЕП
Вз 2L IL ID 6L Октанонл
Ct(Pt) 3 1 6 6-МОК
C2(P.J 3 1 6 6-МГЕП
Dt 3L IL ID 5L 6-МОК
d2 3L IL ID 5L 6-МГЕП
Ej (Колистин A) 2L IL,ID 6L 6-МОК
E2 (Колистин В) 2L IL,ID 6L 6-МГЕП
Ft 1 2 I 1 5 6-МОК
f2 1 2 1 1 5 6-МГЕП
F3 1 2 1 1 5 Октаноил
К 3L ID 6L Алифатическа » кислота
M 3L ID 6L 6-МОК
St 3L ID ID 5L 6-МОК
Ti IL 2L ID 6L 6-мок
T2 IL 2L ID 6L 6-МГЕП
Циркулин A 2L ID IL 6L 6-мок
Циркулин В 2L ID IL 6L 6-МГЕП
Октапентины: At в, Ct 2L.ID IL,ID 2L IL ID 4L, ID 4L, ID 4L, ID ОМДЕК ОМДЕК ОМОК
Примечании: октапентины близки по аминокислотному составу, но различаются по строению липидной части молекулы.
ДМК — остаток а, т-диаминомасляной кислоты; 6-МОК — 6-метилоктаноил; 6-МГЕП — 6-ыетилгептаноил; ОМДЕК — оксимстидцеканоил; ОМОК — оксиметилоктанои л.
Полимиксины отличаются характером побочных реакций. Так, полимиксины А и D обладают высокой нефротоксичностью, в то время как полимиксины В и Е (колистины) — препараты наименее токсичные.
Известно, что одни штаммы Вас. polymyxa в процессе развития образуют лишь полимиксины А и С, другие штаммы синтезируют только полимиксины В и D.
179
Полимиксины по-разному относятся к действию ферментов. Например, полимиксины А и D устойчивы к действию липазы, а полимиксины В (Bi и В2) быстро инактивируются под действием этого фермента.
В последнее время установлено, что полимиксины и циркулин А — гептапептиды с молекулярной массой около 1200. Молекулярная масса полимиксина В и колистинов А и В в среднем около 1150.
Полимиксин Bi состоит из кольца, включающего три аминокислоты (D-фенилаланин, L-лейцин и L-треонин), четырех остатков L-диаминомасляной кислоты (ДМК) и цепи, состоящей из L-трео-нина и двух остатков ДМК и метилоктановой кислоты. Аналогичное строение имеют колистин А и циркулин А:
' Лей—ДМК
Фен ДМК
I (
ДМК Тре
^ДМК f ДМК
I
Тре
I
ДМК
I
мок
Лей—ДМК
Лей ДМК
ДМК Тре
ДМК
I
ДМК
4.
I
ДМК
I мок
Иле—ДМК
Лей ДМК
I I
ДМК Тре
ДМК
I
ДМК
т» д1к
I
мок
-Полимиксин Колистин А Циркулин А
ДМК-остаток а,У-диаминомасляной кислоты; МОК-остаток 6-метилоктаново.й кислоты
Химическая природа полимиксина М изучена Силаевым и его сотрудниками. Методом хроматографии на бумаге установлено, что в состав этого антибиотика входят а, у-диаминомасляная кислота, треонин, лейцин и одна жирная кислота. Определено, что в молекуле этого антибиотика содержится 6 остатков а,у-диаминомасля-ной кислоты, 3 остатка треонина, 1 остаток D-лейцина и 1 остаток 6-метилоктановой кислоты.
Установлено, что биологическая активность полимиксина М не связана ни с размером конца молекулы, ни с конфигурацией аминокислот, но зависит от присутствия в молекуле остатков жирных кислот.
180
Лей —ДМК
.дм к
Тре
Тре
ДМК
ДМК
Тре
ДМК
<€-метилоктановая
кислота
I сн2
сн2
г2
С Н3
Предполагаемая структура полимиксина М
181
Установлено, что полимиксин М, помещенный в 0,1 н. раствор аммиака (pH 10,3) при 37°С, быстро теряет антибиотическую активность.
Условия образования и выделение
Время хультиВироЪания, У.
Рис. 27. Динамика потребления питательных веществ субстрата и образование полимиксина культурой Bacillus polymyxa Ross, (по Ильинской и Россовской, 1958):
/ — образование антибиотика, 2— потребление углевода, 3 — потребление аминного азота, 4 — изменение pH
Обычно для получения полимиксинов используют среды, в состав которых входят кроме неорганических солей дрожжевой экстракт, глюкоза, а иногда и другие компоненты.
Продуцентам полимиксинов в процессе биосинтеза антибиотиков требуется присутствие в среде для развития сложных растительных компонентов (кукурузный или дрожжевой экстракты, соевая, арахисовая или овсяная мука и другие аналогичные компоненты) или витаминов (биотин, тиамин, никотиновая кислота).
В качестве примера среды, пригодной для развития продуцента полимиксина и образования антибиотика, можно рекомендовать среду следующего состава (г/л): глюкоза — 20; поваренная соль — 0,1; мел—3; кукурузный экстракт—2 мл/л или биотин — 0,5 мкг/мл. Вода водопроводная, pH 7,0—7,2.
Культура Вас. polymyxa хорошо растет и образует антибиотик при глубинном ее выращивании на среде, содержащей кукурузный экстракт.
В качестве дополнительного источника азота можно использовать сернокислый аммоний. Из источников углерода организм хорошо использует глюкозу, сахарозу, крахмал. Основная масса углеводов потребляется Вас. polymyxa в условиях глубинного культивирования к 10—15 ч роста, аминного азота — к 20—30 ч. Антибиотик образуется довольно быстро, достигая максимума к 24—30 ч с последующим сохранением этого уровня в течение 10—15 ч (рис. 27). Вас. polymyxa может образовывать полимиксин D, содержащий D-лейцин, D-серин и другие аминокислоты (табл. 42), и на простой синтетической среде.
Добавление к среде D-лейцина вызывает прекращение образования антибиотика, но рост бактерии при этом не прекращается. D-серин, L-лейцин и L-треонин не оказывают влияния, а L-a, у-диаминомасляная кислота стимулирует биосинтез полимиксина D.
Биосинтез полимиксина В культурой Вас. polymyxa Pfeizer 2459 связан со спорообразованием бактерий. Образование антибиотика прекращается при нарушении процесса образования
182
спор. Однако в оболочке спор Вас. polymyxa а,у-диаминомасляная кислота — основной структурный компонент полимиксина — не найдена.
Продуцент полимиксина В (Вас. polymyxa 153), развивающийся в условиях, способствующих спорообразованию, синтезирует значительно больше антибиотика, чем клетки безспорового типа развития. Вместе с тем у этой же культуры наблюдается явление подавления процесса образования спор глюкозой, но в этом случае не происходит нарушения процесса биосинтеза полимиксина.
Специфические ингибиторы биосинтеза полимиксина (D-лейцин, D-треонин) при подавлении процесса образования антибиотика угнетают и процесс спорообразования у Вас. polymyxa.
Добавление полимиксина к среде, благоприятной для образования спор культурой Вас. polymyxa, приводит к тому, что процесс споруляции клеток бактерий ускоряется и количество образующихся спор возрастает.
Приведенные примеры говорят о довольно сложном и до конца не раскрытом механизме взаимоотношения процессов спорообразования и биосинтеза полимиксина. Вместе с тем они позволяют прийти к выводу, что биосинтез полимиксинов не зависит от процесса спорообразования клеток продуцента. Однако образование спор в определенной степени связано с биосинтезом антибиотика.
Выделение полимиксинов осуществляется разными способами. В одних случаях антибиотики адсорбируют углем и элюируют подкисленным водным ацетоном, метиловым и этиловым спиртами. Выделять антибиотики можно также путем экстракции их из нефильтрованной культуральной среды изопропиловым спиртом (0,25 объема спирта на объем культуральной жидкости) в присутствии сульфата аммония. Для выделения полимиксинов используют и ионообменные смолы. По химической природе полимиксины — основания, поэтому для их выделения используют катиониты.
Принцип выделения веществ с помощью ионообменных смол может быть в общих чертах выражен следующей схемой:
RM। хЛ42 /?А12 “I- хМ},
где RMi — смола, у которой ион Мх способен обмениваться, М2— ион выделяемого вещества хМ2.
Антимикробный спектр и применение
Полимиксины избирательно действуют на грамотрицательные бактерии. В отношении Pseudomonas aeruginosa полимиксины значительно активнее in vitro, чем такие антибиотики, как хлорамфеникол, тетрациклиновые антибиотики, стрептомицин, неомицин и др. На грамположительные формы бактерий полимиксины действуют очень слабо. Установлено, что многие полимиксины обладают фунгицидной активностью. Антимикробный спектр некоторых полимиксинов приведен в табл. 43. »
183
Антимикробный спектр полимиксинов
Таблица 49
Микроорганизм
Полимиксины
А | В | Е
Минимальная концентрация полимиксина, подавляющая рост микроорганизмов, мкг/мл
Aerobacter aerogenes................
Brucella bronchise plica ...........
Brucella abortis....................
Escherichia coli ............
Haemophilus pertussis...............
Klepsiella pneumoniae...............
Pseudomonas aeruginosa..............
Salmonella typhi....................
Vibrio comma........................
0,25 0,25 0,45
0,125 0,125 0,15
1,00 1,00 1,25
0,25 0,25 0,30
0,25 0,25 0,15
2,00 2,00 2,50
1,00 2,00 1,50
0,25 0,25 0,30
0,25 0,25 0,30
Антимикробная активность полимиксинов связана с тем, что эти антибиотики обладают сродством к отрицательно заряженным фосфолипидам клеточных мембран. Под действием полимиксинов нарушается деятельность ферментов дыхательной цепи чувствительных микробов, изменяется ионная проницаемость мембран, в результате чего происходит потеря клеткой ионов калия (К+).
По антибиотическому действию все полимиксины сходны. Антибиотики обладают химиотерапевтическими свойствами в опытах на животных, зараженных грамотринательными бактериями. Так, дозы 0,3—0,7 мг полимиксинов В и D на 1 кг массы животных достаточны для выживания 50% подопытных мышей, зараженных возбудителем пневмонии (соответствующие дозы стрептомицина и хлорамфеникола 2,3—и 42 мг/кг). Полимиксин В в комбинациях с тетрациклином, бацитрацином и некоторыми другими антибиотиками проявляет синергидное действие.
Полимиксины в виде мазей могут с успехом использоваться при лечении некоторых форм экзем, фурункулов, гидрогенитов и некоторых других кожных заболеваний.
Полимиксины В и Е применяются при личении менингитов, инфекций дыхательных путей и мочеполового тракта, наружного отита. Их часто используют в сочетании с другими антибиотиками.
БАЦИТРАЦИНЫ (BACITRACINS)
Бацитрацины — полипептидные антибиотики, выделенные Джонсоном с соавт. в 1945 г. из культуры Bacillus licheniformis, принадлежащей к группе Вас. subtilis.
Немного позже (1949) из культуры Вас. subtilis выделена смесь антибиотиков, которая получила название эйфайвин. Позднее было выяснено, что полипептиды, входящие в эйфайвин, идентичны полипептидам бацитрацина, поэтому было принято решение упразднить название эйфайвин и сохранить лишь название бацитрацин»
184
Условия образования
Бацитрацины получают при поверхностном или глубинном росте бактерий на соответствующих средах, содержащих глюкозу, лактат аммония и неорганические соли или соевую муку и глюкозу. Весьма важно при развитии Вас. licheniformis и образовании бацитрацина наличие в среде определенного соотношения углерода и азота. При высоком показателе отношения углерод/азот в среде происходит образование бацитрацинов, при снижении этого соотношения наблюдается преимущественное образование новой группы антибиотиков — лихениформинов.
Процесс образования бацитрацина Вас. licheniformis связан со спорообразованием культуры. Антибиотик образуется только при таких условиях развития бактерий, которые способствуют их споруляции. Ингибирование процесса спорообразования тормозит биосинтез бацитрацина.
Применение радиоактивного антибиотика позволило показать, что бацитрацин в процессе спорообразования включается в споры. Концентрация его в спорах достигает 15% от общего количества образовавшегося антибиотика.
В связи с этим высказывается мысль, что биосинтез бацитрацина происходит в конце цикла развитсия бактерий, антибиотик входит в состав спор как их необходимая составная часть.
Антимикробный спектр и применение
Бацитрацины обладают высокой антибиотической активностью в отношении грамположительных бактерий и почти не действуют на грамотрицательные формы:
Антибактериальный спектр бацитрацина
Микроорганизм Минимальная подавляю-
щая концентрация антибиотика, мкг/мл
Bacillus anthrads . ...... 80,0—250,0
Corynebacterium diphteriae...........0,3—0,08
Clostridium perfringens............ . 0,5—0,04
Flavobacterium ........................ 0,05
Micrococcus pyogenes.................100—1,0
Micrococci (аэробные) ...............100—0,10
Neisseria gonorrhoeae.................. 0,12
Pneumococcus ........... 2,0—0,04
Streptococcus haemolyticus beta
(А, В, C, F, G) ...................0,5—0,1
Streptococcus haemolyticus (D) . . 60—0,16
Streptococcus haemolyticus (анаэроб.) 0,2—0,02
Troponema pallidum..................... 0,08
По спектру действия эти антибиотики близки к пенициллинам. Вместе с тем бацитрацины оказывают действие на многие микробы, устойчивые к пенициллинам. Бацитрацины проявляют опреде
185
ленное синергидное действие с другими антибиотиками и, в частности, с пенициллинами, стрептомицином, хлортетрациклином.
Препараты бацитрацинов, полученные в результате высокой степени очистки, обладают активностью около 60 ед. на 1 мг. При хранении таких препаратов их активность падает примерно до 45ед/мг. Более устойчивыми формами этих антибиотиков являются цинковые соли бацитрацина. В сухом состоянии бацитрацины могут сохраняться при комнатной температуре довольно длительное время (до 2 лет), не теряя своей активности.
В медицинской практике бацитрацины используются преимущественно при местном лечении некоторых гнойных процессов. Их с успехом применяют в целях профилактики и лечения ряда хирургических инфекций, для лечения кожных заболеваний, пневмонии, бациллярной дизентерии и других заболеваний.
Бацитрацины при добавке непосредственно к кормам сельскохозяйственных животных могут способствовать стимулированию роста. Однако использование антибиотических веществ в пищевых продуктах должно быть резко ограничено и находиться под строгим контролем компетентных органов.
Методом противоточного распределения получено десять индивидуальных бацитрацинов: А, Аь В, С, D, Е, Fb F2, F3 и G. Бацитрацин А составляет основную часть выделенных фракций—до37%.
Важно подчеркнуть, что не все выделенные бацитрацины являются непосредственными продуктами жизнедеятельности бактерий. Например, бацитрацины группы F образуются из бацитрацина А и бацитрацина В в период процесса разделения смеси антибиотиков.
Изучены антибиотические свойства различных бацитрацинов и показано, что эти свойства в отношении Corynebacterium xerosis заметно отличаются:
Бацитрацин Относительная активность Бацитрацин Относительная активность
А ... 1 Fj . . . 0,055
В ... 0,375 F2 . . . 0,028
С ... 0,500 F3 . . . 0,014
D ... 0,014 G . . . 0,140
Е ... 0,008
Кроме различий в антибиотической активности бацитрацины различаются и по степени токсичности. Бацитрацин В, например, менее токсичен, чем бацитрацин А. Бацитрацин С токсичнее, чем бацитрацины А и В. Наименее токсичны бацитрацины группы F.
Строение бацитрацина А
С помощью метода хроматографии на бумаге изучен кислотный гидролизат бацитрацина А и установлено, что он состоит из 10 аминокислот: трех остатков L-изолейцина и по одному остатку L-лейцина, L-цистеина, L-гистидина, L-лизина, L-аспарагиновой
186
кислоты, D-фенилаланина, D-орнитина, D-аспарагиновой кислоты и D-глутаминовой кислоты. В добавление к этому выделяется также одна молекула аммиака. Молекулярная масса бацитрацина А равна ~1410.
Строение бацитрацина А можно представить следующим образом:
NH, I D-Acn
L-Acn
С2Ну
L-.Tiu
D-Фен Н—С—СН3
D-Орн
L-И ле
H,N—CH
О
L-Лей
D-Г лу
L-Лей
'С----S
Бацитрацин A
Химическое строение других бацитрацинов изучено менее подробно. Молекулы всех бацитрацинов имеют в своем составе тиазолиновое кольцо.
ЛИХЕНИФОРМИНЫ (LICHENIFORMINS)
Лихениформины — группа сходных полипептидных антибиотиков, образуемых культурой споровой аэробной палочки Bacillus licheniformis при развитии ее на среде с лактатом аммония. Если среда содержит глюкозу и небольшое количество аммония, то происходит образование бацитрацинов.
Методом противоточного распределения (в системе вода — фенол), а также методом хроматографии на бумаге лихениформины разделяются на три антибиотика: лихениформин А, В и С. Они могут быть выделены в индивидуальном виде. По физическим свойствам лихениформины близки между собой, но отличаются по характеру биологического действия.
Смесь всех лихениформинов обладает высокой антибиотической активностью. Так, эта смесь подавляет in vitro Corynebacterium renale в концентрации 0,025 мкг/мл, Corynebact. diphteriae — в концентрации 0,1—0,8 мкг/мл, Staph, aureus — в концентрации 1,3— 6 мкг/мл.
Лихениформины А и В по сравнению с лихениформином С более активны и, вместе с тем, менее токсичны.
Антибиотическое действие лихениформины проявляют также в опытах in vivo, но они оказывают сильное токсическое действие главным образом на почки животных.
187
НИЗИНЫ (NISINS)
Из культуры молочнокислого стрептококка Streptococcus lactis в 1944 г. выделено антибиотическое вещество, названное низином.
Из культур стрептококка, выделенных из естественных мест обитания (молоко), можно получить более активные штаммы путем высева суспензии клеток продуцента на среды, содержащие в своем составе определенные концентрации низина, а также в результате получения мутантов, образующихся в процессе облучения клеток стрептококка ультрафиолетовым, рентгеновским излучением, у-из-лучением.
В группу низинов входят пять форм антибиотиков — низины А, В, С, D и Е. Низины А, В и С кроме общих для всех вариантов аминокислот имеют по два остатка валина и метионина, а в низине D эти аминокислоты отсутствуют.
Низины А, В, С и Е чувствительны к ферменту низиназе, образуемому культурой Bacillus cereus, а низин D устойчив к этому ферменту.
Наиболее биологически активный вариант — низин А.
Низин подавляет развитие ряда грамположительных и некоторых кислотоустойчивых бактерий, не оказывает влияния на грам-отрицательные бактерии, дрожжи и плесневые грибы.
Антибиотик подавляет развитие многих микроорганизмов: группу стрептококков, пневмококки, Micrococcus pyogenes, различные виды Bacillus, Clostridium, Mycobacterium tuberculosis. Lactobacillus, Corynebacterium, некоторые виды Streptomyces. Низин не оказывает антимикробного действия на Escherichia coli. Salmonella typhi, Shigella, некоторые виды Neisseria.
Низин впервые был получен в Англии под торговой маркой «Ни-заплин»; препарат содержит лишь 2,5% низина. Указанный антибиотик нашел применение в пищевой промышленности в качестве консерванта некоторых скоропортящихся продуктов (томаты, зеленый горошек и др.), а также для предупреждения порчи сыров.
Сыр, не содержащий низин, полностью портится в течение 25— 50 дней хранения. При добавлении к сыру 50 ед/г низина за 200 дней хранения было испорчено всего лишь 27% банок с сыром, взятых в опыт.
Низин не используется в медицинской практике, но с успехом применяется в ветеринарии для лечения маститов у коров.
Есть сообщения об активности низина в отношении малярийного плазмодия.
Свойства низина, а также особенности его химического строения привлекли к этому антибиотику внимание ученых ряда лабораторий как у нас в стране, так и за рубежом.
Условия образования
Изучению условий образования низина культурой Streptococcus lactis штамм МГУ посвящен ряд работ, выполненный на биологи
188
ческом факультете Московского университета. Наши исследования показали, что интенсивная аэрация культуры молочнокислого стрептококка не оказывает благоприятного влияния ни на рост бактерий, ни на образование иизина.
Более существенное влияние на развитие продуцента низина и биосинтез антибиотика оказывает pH среды для культивирования. Активная кислотность среды существенно влияет на выделение низина из клеток бактерий в культуральную жидкость. С понижением pH среды увеличивается выделение низина из клеток в культуральную жидкость. Так, при pH 4,3 более 90% низина выделяется в среду, а при pH 6,8 в субстрат выделяется лишь 40% антибиотика. При этом необходимо иметь в виду, что оптимальным для роста стрептококка и образования им низина будет pH, равный 6,5—6,8.
Быстрый синтез низина культурой молочнокислого стрептококка начинается в период ранней стационарной фазы развития продуцента.
Изучение влияния источников азота на рост Strept. lactis и образование низина показало, что лучшими азотсодержащими компонентами в средах следует признать дрожжевой автолизат, пептон или казеиновый гидролизат.
Относительно высокий выход антибиотика наблюдается при развитии молочнокислого стрептококка на средах, содержащих аммонийные соли органических кислот.
Хорошим источником углерода для роста стрептококка и биосинтеза низина служит глюкоза. Добавление к среде с глюкозой двух-, трех-, четырех- и пятиуглеродных органических кислот способствует повышению роста продуцента антибиотика и некоторому увеличению образования им низина.
В процессе развития Strept. lactis нередко наблюдается значительная инактивация низина, находящегося как в культуральной жидкости, так и связанного с клетками стрептококка. Фермента низиназы, разрушающего антибиотик и образуемого клетками Strept. lactis, не обнаружено. Инактивация низина, по-видимому,
Таблица 44
Определение концентрации низина (МЕ/мл), образуемого Streptococcus lactis штамм МГУ, при различных условиях культивирования с рН-статированием
Низин Время культивирования стрептококка, ч
9 24
Без стабилизации pH Стабилизация pH Без стабилизация pH Стабилизация pH
без казеина с казеином, 1% с казеином, 3% без казеина с казеином, 1% е казеином, 3%
Общий 3400 4100 5000 5300 2050 800 2650 3300
В фильтрате 2400 2400 3000 3000 1300 200 1600 2250
В клетках 1000 1700 3000 2300 750 600 1050 1050
189
твязана с изменением структуры молекулы антибиотика, со степенью его полимеризации или с образованием биологически неактивных компонентов низина с солями кальция, входящими в состав клеточных стенок стрептококка.
Есть данные о том, что белок и, в частности, казеин уменьшают инактивацию низина, обладают защитными свойствами. Эти указания подтверждаются результатами исследований, проведенными в нашей лаборатории. Было показано, что в процессе культивирования Strept. lactis штамм МГУ с рН-статированием и при внесении в среду казеина наблюдается не только стабилизация антибиотической активности, но и его большее образование (табл. 44).
Строение низина
В конце 60-х годов началось активное изучение химии низина. Было установлено, что низин имеет молекулярную массу, равную 3500. Причем антибиотик может полимеризоваться и образовывать из мономера димер (молекулярная масса 7000) и тетрамер с молекулярной, массой 14 000. Полимеризацию низина связывают с наличием в его молекуле дегидроаланина.
В состав молекулы низина входит 30 аминокислотных остатков следующих аминокислот: лизин, гистидин, аспарагиновая кислота, серин, пролин, глицин, аланин, валин, метионин, изолейцин, лейцин, а также остатки редко встречающихся серосодержащих аминокислот: лантионин и р-метиллантионин; ненасыщенные аминокислоты — дегидроаланин и р-метилдегидроаланин:
сн3 сн. 1 *
сн, II • с—NH, - г СН2—S—сн2 СН—S—сн2
с—nh2 1 chnh2 chnh2 сн—nh2 сн—nh2
соон соон СООН СООН 1 соон соон
Дегидроаланин ^-Метил дегидроаланин Лантионин /7-Метиллантиоиин
Гросс с сотрудниками в 1970 г. установили следующую структуру молекулы низина:
HjN—Иле—Мга—А па—Иле—Д га—Лей—Ала—Амк—Про—Глу—Ала—
—Лиз-—Амк—Гли—Ала—Лей—Мег—Гли—Ала—Леи—Mei—-Лиз—
S
—А м к—А ла—Ам к—А ла—Г не —А ла —С ер—Иле—Гис—Вал—Д га—Л к з —СО ОИ
Дга—дегидроаланин; Амк—амипомасляная кислота; Мга—/?-мегилдегидроалаиин
Определено положение двух сульфидных мостиков, образованных остатками р-метиллантионииа. Этот фрагмент молекулы низина имеет бициклическую структуру следующего строения:
190
Биологическая активность низина обусловлена наличием в его молекуле а, p-ненасыщенных аминокислот (дегидроаланин, р-ме-тилдегидроаланин). Это подтверждается тем, что аналоги низина, не содержащие дегидраланиллизина, а также пирувиллизин не активны по отношению к Staphilococcus aureus.
Димеры и тетрамеры низина с молекулярной массой соответственно 7000 и 14 000, подобно мономеру, обладают биологической активностью.
Фермент низиназа, образуемый культурой Bacillus polymyxa, инактивирующий низин, по-видимому, специфически действует на пептиды, содержащие дегидроаланин.
Показано, что низин влияет на споры чувствительных к нему бактерий, которые более богаты катионами по сравнению с вегетативными клетками, и выступает как катионитный детергент. Антибиотик не уменьшает терморезистентность спор, как об этом предполагали ранее, а, адсорбируясь на их поверхности, в момент прорастания спор нарушает проницаемость цитоплазматической мембраны и таким образом, подавляет рост развивающихся клеток бактерий.
Низин способен также реагировать с сульфгидрильными группами биологически важных соединений, выводя их из реакций метаболизма.
Механизм биосинтеза низина
Изучение механизма биосинтеза таких полипептидных антибиотиков, как актиномицины, грамицидины, полимиксины, бацитрацины и др., показало, что их образование принципиально отличается от синтеза белка. Ингибирование синтеза белка у микроорганизмов — продуцентов названных антибиотиков — не приостанавливает образования антибиотиков-полипептидов.
Однако в отношении низина получены другие результаты. Изучая влияние ингибиторов белкового синтеза (хлорамфеникола и
191
пуромицина), а также ингибитора синтеза РНК актиномицина D в культуре Strept. lactis обнаружено, что ингибиторы синтеза белка независимо от времени их введения подавляют и синтез низина. Причем биосинтез низина более чувствителен к действию этих ингибиторов, чем белковый синтез. Актиномицин D также подавляет образование антибиотика.
Эти факты дают основание высказать предположение, что у низина в отличие от других полипептидных антибиотиков путь синтеза сходен с путем образования белков, т. е. связан с рибосомным механизмом. Синтез низина идет через образование низиноподобных белков-предшественников биосинтеза антибиотика, причем превращение пренизина в низин происходит под действием фермента на внешней поверхности клетки стрептококка.
Процесс включения меченой серы (35S) цистеина в лантионин и р-метиллантионин ингибируется хлорамфениколом в большей степени, чем включение цистеина в белок. Возможно, низин может частично синтезироваться с участием рибосомного механизма.
Есть предположение и о том, что ответственность за биосинтез низина несут определенные плазмиды, в которых локализованы соответствующие гены (ген) образования молекулы антибиотика.
Механизм биосинтеза низина и его молекулярная масса позволяют рассматривать этот антибиотик не как полипептид, а как низкомолекулярный основной белок.
Strept. lactis кроме низина синтезирует шесть других основных белков, не обладающих антибиотическими свойствами. Низин составляет лишь 20% от основных белков, образуемых стрептококком.
БАКТЕРИОЦИНЫ (BACTERIOCINS)
Бактерии, относящиеся к группе протеев, способны образовывать антибиотические вещества, которые получили название б а к-териоцинов, или протесцинов. Протесцины относятся к типу антибиотиков колицинов (колицины — антибиотические вещества, продуцируемые различными штаммами Escherichia coli).
Бактериоцины (протесцины) — экстрацеллюлярные биологически активные продукты метаболизма белковой природы. Они инактивируются протеазами (пепсином и трипсином).
Бактериоцины способны подавлять рост кишечной палочки, стафилококков, стрептококков и оказывают бактерицидное действие внутри своего вида и рода.
ОБРАЗОВАНИЕ D-АМИНОКИСЛОТ, ВХОДЯЩИХ
В СОСТАВ ПОЛИПЕПТИДНЫХ АНТИБИОТИКОВ
Известно, что в состав многих антибиотиков-полипептидов бактериального происхождения (грамицидины, полимиксины, бацитрацины, лихениформины и др.), а также антибиотических веществ,
192
образуемых актиномицетами (актиномицины, эхиномицин, этами-цин, валиномицип и др.), наряду с аминокислотами, имеющими L-конфнгурацию, входят D-аминокислоты. К числу последних относится глутаминовая и аспарагиновая кислоты, фенилаланин, орнитин, лейцин. D-Аминокислоты включаются также в состав гликопептидов и тейхоевых кислот, входящих в клеточные стенки бактерий и актиномицетов.
Образование D-аминокислот происходит при развитии организмов на средах, не содержащих указанных D-аминокислот. Более того, продуцент грамицидина С, например, образует антибиотик при развитии бактерий на простой синтетической среде, где в качестве источника азота присутствует только янтарнокислый аммоний, а полимиксин М синтезируется бактериями при развитии их на среде, содержащей в качестве единственного источника азота лишь (NH4)2SO4. Аналогичное положение наблюдается и в случае образования полипептидных антибиотиков актиномицетами. Внесение в субстрат D-аминокислот, входящих в состав образуемого микроорганизмом антибиотика, в ряде случаев тормозит развитие продуцента и биосинтез антибиотика.
Какие же существуют механизмы, обеспечивающие образование организмами D-аминокислот? В настоящее время известны два механизма (и оба у микроорганизмов) образования D-аминокислот:
1) непосредственная рацемизация L-аминокислоты в D-аминокислоту;
2) трансаминация между D-аминокислотой и соответствующей а-кетокислотой с образованием других D-аминокислот. Эти два процесса могут идти последовательно: второй за первым по следующей схеме:
L-аминокислота D-аминокислота
О-аминокислота, + а-кетокислота2 =₽* а-кетокислота1 Ц- О-аминокислота2
Если в результате рацемизации образовалась лишь одна D-аминокислота (например, D-аланин из L-аланина)
<j;ooh соон
H2n—с—и н—nh2
сн3 сн3
1-аланин D-аланин
то в процессе трансаминации (переаминирования) с соответствующими а-кетокислотами может образоваться несколько D-аминокислот. Например, из а-кетоглютаровой кислоты и D-аланина могут образоваться D-глутаминовая и пировиноградная кислоты:
7—742
193
соон соон
I I
сн, сн,
I I
соон сн2 соон сн2
н—с—nh2 + С=О т*" С=О + Н—С—NH, I I I I
СН3 СООН СН3 СООН
D-аланин
а-Кетоглю-тарорая кислота
Пировино- D-глутаминовая градная кислота
кислота
При изучении Вас. licheniformis установлено, что бесклеточные бактериальные экстракты исследуемого организма обладают аланин-рацемазной активностью.
Кроме того, Вас. licheniformis, а также Вас. subtilis и Вас. anth-racis образуют фермент трансаминазу, способный катализировать реакцию переноса аминогруппы от D-аланина на соответствующие а-кетокислоты с образованием D-глутаминовой кислоты, D-аспарагиновой кислоты, D-аспарагина и D-орнитина. Трансаминация между D-глутаминовой кислотой и соответствующими а-кетокислота-ми приводит к образованию D-орнитина, D-аспарагиновой кислоты, D-аспарагина и D-фенилаланина.
194
Глава
АНТИБИОТИКИ, ОБРАЗУЕМЫЕ АКТИНОМИЦЕТАМИ
Наибольшее количество антибиотиков, нашедших широкое применение в практике, относится к веществам, образуемым актиномицетами. Выделение и изучение антибиотических веществ акти-номицетного происхождения приняло за последние годы очень широкие размеры. В результате настойчивых поисков получено много ценных препаратов, применяемых в химиотерапии, в сельскохозяйственной практике и в пищевой промышленности. Один из первых антибиотиков актиномицетного происхождения — мицетин открыт советскими учеными Красильниковым и Кореняко еще в 1939 г.
К 1940 г. были описаны и сравнительно подробно изучены два антибиотических вещества, образуемых актиномицетами: акти-номицетин (Вельш, 1937) и мицетин.
Следовательно, к моменту открытия пенициллина (1940) и обнаружения его замечательных лечебных свойств уже было известно, что и среди актиномицетов имеются штаммы, способные образовывать антибиотические вещества, а многие актиномицеты обладают сильными антагонистическими свойствами по отношению к разнообразным микроорганизмам. Указанное обстоятельство, безусловно, не могло не привлечь внимание исследователей к этой группе микроорганизмов.
В 1941 г. в лаборатории Ваксмана был выделен антибиотик актиномицин, образуемый Streptomyces antibioticus. Спустя год под руководством Ваксмана был выделен стр епт от р и ц и н, образуемый Str. lavendulae. Однако эти антибиотические вещества не привлекли к себе широкого внимания практиков, так как обладали сильными токсическими свойствами. Выделение и изучение этих антибиотиков явилось преддверием к открытию Ваксманом и его сотрудниками в 1944 г. замечательного антибиотического препарата стрептомицина, образуемого культурой Str. griseus.
Открытие стрептомицина и выяснение его ценных лечебных качеств послужили мощным толчком в исследовании актиномицетов и поисков среди них продуцентов новых антибиотических веществ. Широкие поиски увенчались открытием таких ценных антибиотиков, как хлоромицетин (хлорамфеникол), неомицин, хлортетрациклин, тетрациклин и многих других замечательных биологически активных соединений, образуемых актиномицетами.
7*
195
Изучение антибиотических свойств актиномицетов, их распространения в природе продолжается и до настоящего времени, обогащая науку и практику все новыми и новыми весьма интересными антибиотиками, находящими применение в различных областях медицины, сельского хозяйства и промышленности.
Достаточно указать на то, что в последнее время обнаружены антибиотические вещества актиномицетов, обладающие антимета-болитными свойствами. В качестве примера можно привести термофильный актиномицет Str. macrosporus, образующий антибиотик со свойствами антиметаболита по отношению к аргинину, лизину и гистидину.
Антиметаболитные свойства в данном случае проявляются в том, что чувствительные к антибиотику организмы (преимущественно мезофильные актиномицеты) в присутствии одной из названных аминокислот теряют эту особенность. Интерес к группе антимета-болитных антибиотиков в последние годы значительно возрос.
В настоящее время описано большое число (более 6000) антибиотиков, образуемых бактериями, грибами, водорослями, высшими растениями и животными. Однако наибольшее их количество, нашедшее практическое применение, выделено из группы актиномицетов.
Ценные антибиотики образуются также представителями Nocardia, Actinomadura, Micromonospora и др.
Выделение новых антибиотиков, образуемых актиномицетами, и их промышленный выпуск продолжаются (табл. 45). Толь-
Таблица 45
Антибиотики актиномицетного происхождения, выделенные за период 1969—1975 гг. и выпускаемые промышленностью (по Преображенской,
Агре, Калакуцкому, 1978)
Название антибиотиков Продуцент Год описания продуцента или упоминание его в литературе
Адриамицин Streptomyces peucetius var. caesius 1969
Бицикломицин Streptomyces aizunensis 1972
Валидомицин Str. hygroscopicus var. limoneus 1971
Виргиниамицин Str. virginiae 1972
Карминомицин Actinomadura carminata 1973
Лазал оцид Streptomyces lasaliensis 1974
Ливидомицин Str. lividus 1971
Макарбомицин Str. phaeochromogenes 1970
Мидекамицин Str. mycarofaciens 1971
Рибостамипин Str. ribosidi ficus 1970
Сагамицин Micromonospora sagamicus 1975
Сизомицин Micromonospora injoensis 1970
Солиномицин Streptomyces albus 1974
Тетранактин Str. aureus 1970
Фортимицины Micromonospora olivoasterospora 1974
Эндурацидин Streptomyces fungicidicus 1969
196
ко за последние 15 лет выделено и освоено промышленностью более 20 новых антибиотических веществ.
Мы не имеем, естественно, возможности рассмотреть все антибиотики (их к настоящему времени известно около 3000), образуемые этой группой микроорганизмов. Поэтому здесь будут рассмотрены лишь те, которые имеют наиболее важное практическое значение.
Одним из первых актиномицетных антибиотиков, завоевавших широкую известность, как уже отмечалось, был стрептомицин, принадлежащий к группе аминогликозидных антибиотиков.
АМИНОГЛИКОЗИДНЫЕ АНТИБИОТИКИ,
ИЛИ АМИНОЦИКЛИТОЛЫ
В группу аминогликозидных антибиотиков (аминоциклитолов) включаются биологически активные соединения, содержащие в молекулах гликозидные связи. К этим антибиотикам относятся стрептомицины, неомицины, фортимицины, канамицины, гентамицины, сизомицин, гигромицин и некоторые другие вещества. Антибиотики этой группы имеют большое практическое значение, многие из них применяются в медицинской практике. К настоящему времени известно около 100 антибиотиков, относящихся к этой группе соединений.
СТРЕПТОМИЦИН (STREPTOMYCIN)
Актиномицет, образующий стрептомицин, впервые выделен в лаборатории микробиологии Ратжерского университета в 1943 г.
Первое сообщение о выделении антибиотика было сделано Шатц, Буги и Ваксманом в январе 1944 г. Антибиотик получил название стрептомицин (от родового названия актиномицетов Streptomyces1, а организм, образующий этот антибиотик, был определен как Streptomyces griseus.
Стрептомицин образуют не только штаммы Str. griseus, но и другие актиномицеты — Str. bikiniensis. Str. raneus, Str. humidus. Str. reticuli, Str. griseocarneus. Str. mashuensis. Однако основным продуцентом стрептомицина признан Str. griseus, на характеристике свойств которого мы и остановимся.
Актиномицет, продуцирующий стрептомицин, как и другие виды актиномицетов, размножается с помощью спор или отдельных участков мицелия.
1 Ваксман н Генрици (1943) предложили называть актиномицеты стрепто-мицетами и объединили их в особый ряд Streptomyces. Как отмечал Красильников (1965), нет необходимости для этой группы лучистых грибков вводить новое родовое название, а необходимо сохранить за ними термин Actinomyces. Однако в последнее время в соответствии с Международной таксаномией микроорганизмов признано ц< есообразным называть актиномицеты стрептомицетами и отнести их к роду Streptomyces.
197
Культуры актиномицетов вообще и Str. griseus в частности весьма вариабельны. На изменчивость актиномицетов оказывают влияние условия их культивирования и, в особенности, состав среды. На более богатых по составу средах наблюдается и более быстрая изменчивость актиномицетов.
В результате изменчивости продуцента стрептомицина нередко появляются аспорогенные формы, т. е. формы, лишенные воздушного спороносного мицелия. Как правило, эти варианты или вообще неактивны, или образуют незначительное количество стрептомицина. Снижение образования антибиотика наблюдается и у вариантов с усиленной споруляцией.
Образующиеся в результате изменчивости Str. griseus варианты могут отличаться от исходной культуры окраской воздушного мицелия; последний может быть белым, беловато-палевым, светлосерым, серым и серо-зеленым. Различные варианты отличаются величиной и формой колоний; встречаются также формы, не способные образовывать стрептомицин. Однако установить какие-либо цитологические различия между активными и неактивными вариантами пока не удалось.
Условия биосинтеза стрептомицина
Образование стрептомицина может происходить при развитии Str. griseus как в условиях глубинного культивирования, так и при поверхностном росте. Поэтому в первые годы изучения продуцента стрептомицина использовались оба метода культивирования. В настоящее время условия образования стрептомицина изучаются только при глубинном культивировании актиномицета.
Ваксман с сотрудниками в 1946 г. установил, что стрептомицин образуется лишь на средах, содержащих в своем составе мясной экстракт, и рекомендовал для образования антибиотика следующую среду:
Компоненты
Количество в / л водопроводной воды, г
Глюкоза.................. 10
Пептон.................... 5
Мясной экстракт........... 5
Хлористый натрий ..... 5
pH перед посевом актиномицета 6,5—7,0
Мясной экстракт Ваксман рассматривал не только как источник азота, но как продукт, содержащий какое-то «пробиотическое» вещество, без которого, якобы, не образуется антибиотик.
Однако уже в том же 1946 г. было показано, что мясной экстракт можно с успехом заменить дрожжевым экстрактом, а позднее появились работы, показавшие, что образование стрептомицина происходит на средах, где мясной экстракт заменен соевой мукой или кукурузным экстрактом, или гидролизатами, полученными из
198
этих веществ. Более того, было установлено, что образование антибиотика может происходить и на простых по составу синтетических средах.
Таким образом, предположение Ваксмана и его коллег о возможности образования стрептомицина только при наличии в среде некоего «пробиотического» вещества, содержащегося в мясном экстракте, не подтвердилось.
Приведенные примеры показывают, что в самом начале изучения условий образования стрептомицина исследователи столкнулись с вопросом влияния на процесс биосинтеза антибиотика различных компонентов сред и, в первую очередь, источников азота и углерода.
Источники азота. Наиболее благоприятным источником азота для развития актиномицета и биосинтеза стрептомицина в синтетических средах являются аммонийные соли. Нитраты в качестве единственных источников азота продуцентом стрептомицина не используются, но при добавлении к среде дрожжевого экстракта они начинают потребляться актиномицетом. По-видимому, невозможность использования нитратов актиномицетом связана с отсутствием у него донаторов водорода, что восполняется добавлением к среде дрожжевого автолизата.
Вместе с тем присутствие нитрата натрия в среде, содержащей кукурузный экстракт, приводит к изменению всего процесса обмена веществ актиномицета. Так, концентрация KNO3, равная 0,25%, препятствует вовлечению в обмен веществ актиномицета молочной кислоты, содержащейся в кукурузном экстракте; при 0,5% KNO3 кислота потребляется, а при 1 % — она не только используется организмом, но и образуется им вновь.
Источники углерода. Наилучшим источником углерода для развития Str. griseus и образования антибиотика, по данным большинства авторов, считается глюкоза. Актиномицет хорошо растет на средах с глюкозой, фруктозой, галактозой, ксилозой, мальтозой, лактозой или крахмалом, но не растет на средах с арабинозой, рамнозой, сахарозой, рафинозой, сорбитом, дульцитом или инозитом. Продуцент стрептомицина не способен гидролизовать сахарозу и рафинозу.
В условиях развития актиномицета на натуральных средах обнаруживается, что некоторые его штаммы образуют больше стрептомицина при наличии в среде смеси глюкозы (0,5%) и крахмала (1%), но этого не наблюдается у других штаммов, образующих больше антибиотика на одной глюкозе, чем на смеси глюкоза — крахмал.
Способность использовать тот или другой источник углерода и синтезировать антибиотическое вещество зависит от свойств штамма актиномицета.
Почти все штаммы, образующие стрептомицин, могут использовать животные жиры, растительные масла или определенные жирные кислоты (олеиновая, пальмитиновая) на средах, не содержащих глюкозу.
199
Масла способствуют увеличению биомассы актиномицета, ускоряют потребление источников азота и вместе с тем замедляют использование глюкозы. Влияние масел зависит, прежде всего, от вида масла, состава среды и штамма актиномицета. Путь использования масла актиномицетом, по-видимому, тот же, что и для других организмов, а именно: гидролиз до глицерина и жирных кислот с последующим р-окислением их.
Все спирты, за исключением маннита и глицерина, непригодны для роста актиномицета и образования антибиотика.
Из органических кислот молочная, пировиноградная и лимонная на синтетических средах стимулируют образование стрептомицина. Использование смеси яблочной и янтарной кислот на среде, содержащей основные аминокислоты, способствует значительному увеличению образования антибиотика. Вместе с тем винная кислота, не повышая выхода стрептомицина, способствует росту актиио-мицета.
В опытах с отмытым мицелием Str. griseus различного возраста (24, 38 и 72 ч) установлено, что молодой мицелий образует большие количества стрептомицина в присутствии глюкозы. Добавление 0,02% СаС12, особенно к мицелию в возрасте 48 ч, значительно стимулирует биосинтез антибиотика.
Кроме глюкозы образованию стрептомицина способствуют фруктоза, глицерин, молочная кислота, глюкозамин, стрептидин и инозит.
Источники минерального питания и их роль в процессе биосинтеза стрептомицина. Применение естественных субстратов для культивирования микроорганизмов обеспечивает их большинством зольных элементов. В определенной степени потребность в этих элементах восполняется применением водопроводной воды.
Использование синтетических сред выдвигает задачу обеспечения развивающихся организмов макро- и микроэлементами (см. гл. IV). Процессы жизнедеятельности продуцента стрептомицина, естественно, не могут протекать без наличия в среде таких компонентов, как фосфор, железо, кальций и других минеральных веществ.
Фосфор. Изучение роли фосфора показало, что он имеет важное значение в развитии Str. griseus и образовании антибиотика.
Увеличение концентрации фосфора в среде до определенного предела приводит к увеличению образования стрептомицина, дальнейшее повышение содержания фосфора в среде, не оказывая заметного влияния на рост мицелия, снижает образование антибиотика. Избыток фосфора в среде влияет на биохимический состав протоплазмы, изменяет цикл развития актиномицета и нарушает некоторые физиологические функции клеток.
При избытке фосфора в среде, содержащей глюкозу, увеличивается накопление пировиноградной кислоты, но такой закономерности не наблюдается в случае использования крахмала. Зависимость образования стрептомицина от концентрации фосфора в среде может быть проиллюстрирована данными об образовании
200
антибиотика при определенных концентрациях фосфорно-кислого аммония в среде с пролином:
Концентрация (ЫН4)2НРО4, мг/мл
2,000 0,600 0,200 0,060
Стрептомицин, мкг/мл, на 8-е сут
170
570
675
530
Концентрация (NH4)sHPO4, мг/мл
0,020
0,006
0,002
0,000
Стрептом ицин мкг/мл, на 8-е сут
300
200
130
25
При недостатке в среде фосфора происходит значительное изменение процесса жизнедеятельности актиномицета, связанное с нарушением усвоения углеводов, азота и с потребностями в кислороде. Все это приводит к ограничению роста мицелия актиномицета, содержание фосфора в мицелии уменьшается, снижается способность к биосинтезу антибиотика. Снижение образования стрептомицина связано в основном с физиологической неполноценностью мицелия. Можно определенно сказать, что свойство мицелия образовывать антибиотик тесно связано с количеством фосфора в нем.
При развитии актиномицета на среде, содержащей глюкозу, мясной экстракт и пептон, происходит быстрое потребление неорганического фосфора; количество его за период развития культуры снижается с 118 до 1 мкг/мл.
Потребление фосфора актиномицетом в большей мере зависит от исходной концентрации этого элемента в субстрате. Так, на среде с исходным количеством фосфора, равным 29 мкг/мл, к 48 ч потребляется 21 мкг/мл, а при исходной концентрации, равной 128 мкг/мл, количество потребленного фосфора возрастает до 118 мкг/мл за тот же период. Эти данные указывают на то, что в зависимости от начальной концентрации фосфора в среде существенно меняется качество выросшего мицелия актиномицета, а следовательно, и условия образования стрептомицина.
Увеличение содержания неорганического источника фосфора ускоряет потребление углеводов и способствует сокращению процесса развития актиномицета. Образование стрептомицина при этом подавляется.
Изменения в углеводном и фосфорном питании вызывают в свою очередь изменения в нуклеиновом обмене культуры и в общем процессе развития продуцента стрептомицина.
Оптимальное содержание фосфора, равное 0,04—0,07 мг/мл, способствует хорошему росту и развитию актиномицета и высокому уровню биосинтеза стрептомицина.
Железо, цинк, медь, магний. Важное значение в процессе развития Str. griseus и образования антибиотика имеют такие элементы, как железо, цинк, медь, магний и др.
Максимальный выход стрептомицина наблюдается при условии содержания FeSO4-7H2O в среде в количестве 0,0007—0,005’’/о-Увеличение концентрации сернокислого железа до 0,05% приводит к подавлению биосинтеза антибиотика, снижению скорости потребления углеводов и к задержке развития актиномицета.
201
Добавление соответствующего количества фосфора к среде для развития актиномицета, имеющей избыток железа, снимает неблагоприятное действие ионов железа на биосинтез стрептомицина. Вероятно, отрицательный эффект от избытка железа в среде определяется тем, что он связывает ионы фосфора.
Ионы магния играют важную роль в азотном обмене актиномицета, а также в реакциях фосфорилирования.
Что касается меди, то роль этого элемента в жизнедеятельности продуцента стрептомицина и образовании антибиотика не вполне ясна. Но тем не менее известно, что увеличение концентрации меди до 50 мг°/о не оказывает существенного влияния на образование стрептомицина, но угнетает рост актиномицета.
Увеличение концентрации цинка и железа до 50 мг% сильно угнетает образование стрептомицина (до 50% по сравнению с контролем).
Хлористый натрий. В состав всех сред, используемых для образования стрептомицина, входит хлористый натрий (NaCl). Было замечено, что без поваренной соли антибиотическая активность культуральной жидкости ниже по сравнению с активностью культуральной жидкости, содержащей NaCl.
В присутствии хлористого натрия увеличивается проницаемость клеточной стенки, и при этом происходит более легкий переход стрептомицина в окружающую среду. Образующийся стрептомицин не полностью выделяется в среду; определенная часть его прочно связана с клеточными стенками мицелия актиномицета и может быть извлечена при обработке мицелия кислотой, щелочью или солью. С целью выяснения роли поваренной соли в процессе биосинтеза стрептомицина были проведены опыты по выращиванию Str. griseus на средах с хлористым натрием и без него, которые показали, то содержание антибиотика действительно несколько выше в среде с NaCl. Однако при кислотной обработке мицелия с целью извлечения связанного стрептомицина оказалось, что общий выход антибиотика выше на среде, не содержащей NaCl.
Следовательно, наличие хлористого натрия в среде не способствует биосинтезу стрептомицина, а лишь облегчает выделение образовавшегося антибиотика из мицелия в среду.
Кальций. Как элемент минерального питания кальций сам по себе не оказывает существенного влияния на биосинтез стрептомицина, однако в зависимости от состава среды он может играть положительную или отрицательную роль. Так, при стерилизации сред, содержащих фосфаты, при наличии ионов кальция обычно происходит связывание ионов фосфорной кислоты и Са в виде нерастворимых соединений. Это может привести к снижению биосинтеза стрептомицина, если в среде фосфор находится в ограниченном количестве, но при использовании сред с избыточным содержанием фосфатов внесение кальциевых солей перед стерилизацией может перевести часть фосфора в нерастворимые кальциевые соединения, т. е. создаются условия, благоприятные для биосинтеза стрептомицина.
202
Кроме того, ионы кальция и магния регулируют значение pH среды при подкислении ее за счет остатков серной, фосфорной или других минеральных кислот при использовании физиологически кислых солей (например, (NH4)2SO4, (NH4)2HPO4).
Учитывая роль отдельных компонентов субстрата в образовании антибиотика, был предложен ряд химически известных синтетических сред. Синтетические среды с успехом могут использоваться для экспериментальных исследований продуцента стрептомицина, но они пока еще непригодны для промышленного получения антибиотика. Невозможность использования синтетических сред для получения стрептомицина в промышленных условиях в основном связана с тем, что они, как правило, дороже натуральных сред и при развитии актиномицета на известных синтетических средах выход стрептомицина ниже, чем на натуральных средах.
Для промышленного получения антибиотика среда должна быть дешевой и вместе с тем обеспечивать высокий уровень образования препарата и относительно легкое его выделение. С этой целью эмпирически были предложены среды, в состав которых входят такие вещества, как соевая мука, кукурузный экстракт, сухая барда с нитратом натрия или другим неорганическим источником азота, жмыхи, земляные орехи, отходы пенициллинового производства и другие вещества. Выбор основного компонента среды зависит от района, где производится стрептомицин, того сырья, которое может быть в данном случае наиболее подходящим для этих целей. Однако в большинстве случаев производство стрептомицина в настоящее время осуществляется на средах с соевой мукой примерно следующего состава (%): глюкоза 2,0; соевая мука 2,0; сульфат аммония 0,3; фосфат калия однозамещенный 0,05; хлористый натрий 0,25; карбонат кальция 0,3.
Изучение влияния отдельных фракций соевой муки на рост Str. griseus и образование антибиотика показали, что существенную роль при этом играют жиры и зольная часть соевой муки. Белок сои и его кислотный гидролизат—компоненты, мало пригодные для биосинтеза стрептомицина (табл. 46, 47).
Таблица 46
Влияние белка, золы и жиров соевой муки на биосинтез стрептомицина культурой Streptomyces griseus штамм ЛС-1 (по Егорову и Удаловой, 1962)
Вариант опыта
Натуральная соевая мука ..........................
Обезжиренная соевая мука..........................
Белок соевой муки.................................
Белок -J- зола соевой муки........................
Белок + вода + жир ...............................
Максимальное количество стрептомицина
мкг/МЛ %
1770 100
552 31
109 6
540 30
781 44
203
Таблица 47
Влияние гидролизата белка сои в сочетании с золой и жирами соевой муки на образование стрептомицина (по Егорову и Удаловой, 1962)
Вариант опыта
Максимальное количество стрептомицина
мкг/мл
Соевая мука (контроль)...............................
Гидролизат белка сои ................................
Гидролизат белка -f- зола............................
Гидролизат белка -|- зола + жир .....................
1400
166
513
938
100 И
35 65
Температура. В развитии актиномицета и биосинтезе стрептомицина большое значение имеет температура культивирования организма. Повышение температуры выше 30°С приводит практически к прекращению образования антибиотика. Границы оптимума температуры для образования антибиотика определяются 27—29еС.
Приведем данные о влиянии температуры культивирования на образование стрептомицина и время его максимального выхода:
Температура^ °C Максимальный выход стр ептомицина, мкг/мл Время максимального образования антибиотика , ч
25 1180 118
27 2041 118
29 2194 104
31 414 72
Оптимальная температура для биосинтеза стрептомицина может меняться в зависимости от штамма актиномицета и состава среды.
pH среды. Лучшим начальным pH среды для развития актиномицета является pH = 7,0. Образование стрептомицина происходит при значении pH, находящимся между 7,5—8,5.
Аэрация. Как уже отмечалось, стрептомицин образуется как при поверхностном росте, так и при глубинном культивировании актиномицета. Однако скорость образования антибиотика при глубинном росте актиномицета в 2—3 раза выше, чем при поверхностном. Str. griseus — организм высокоаэробный, он поглощает значительное количество кислорода, в большей степени изменяющееся в зависимости от состава среды для культивирования актиномицета и стадии его развития. Так, на среде, содержащей мясной экстракт и глюкозу, поглощение кислорода одним миллилитром культуры актиномицета может достигать 120 мл/ч. Потребление кислорода молодым (24 ч) и старым (48—120 ч) мицелием не одинаковое. В ранний период развития актиномицета происходит более интенсивное потребление кислорода воздуха, затем падает
204
Рис. 28. Потребление кислорода культурой Streptomyces griseus по ходу ее развития в зависимости от концентрации глюкозы в среде (по Gottlieb, Anderson, 1948)
Рис. 29. Изменение потребления кислорода при обмене культуральной жидкости между молодым и старым мицелием (по Inoue, 1958):
1 — 24 ч мицелий + 24 ч культуральная жидкость, 2 — 24 ч мицелий + 48 ч культуральная жидкость, 3 — 24 ч мицелий + 48 q культуральная жидкость, 4—48 ч мицелий + 24 ч культуральная жидкость
почти до нуля (рис. 28). Увеличение степени аэрации способствует увеличению выхода стрептомицина; система обмена у молодого и старого мицелия различна (рис. 29). Если бы молодой и зрелый мицелий актиномицета имели аналогичную систему обмена, если бы их физиолого-биологические свойства были идентичными, то кривая 4 была бы аналогична кривой 1 (рис. 29). Но этого в действительности не происходит.
Установлено, что молодой мицелий Str. griseus содержит, как правило, в 2—3 раза больше нуклеиновых кислот, чем более старый мицелий.
При увеличении аэрации культуры увеличивается значение pH среды, т. е. происходит более быстрое разрушение протеинов.
Изучение количества потребленного кислорода и количества окисленного за это время углерода культурой Str. griseus показало, что количество кислорода, потребленного в течение опыта, в несколько раз меньше величины, необходимой для полного окисления сахара, использованного за это время (табл. 48).
По-видимому, только часть углеводов окисляется до конечных продуктов, а большая часть остается в организме в виде запасных питательных веществ или используется на построение различных клеточных структур организма.
205
Таблица 48
Степень окисления различных углеводов Streptomyces griseus штамм ЛС-1 (по Горской, 1961)
Субстрат (0,2%) Потребление Количество О2, необходимое для полного окисления использованного углевода, мм3 Полное окисление углеводов, %
О? в течение опыта, мм3 углеводов в течение опыта, мг
Глюкоза 272 2,0 1500 18
Крахмал 264 2,3 1723 15
Лактоза 65 0,6 450 14
Итак, стрептомицин образуется в условиях определенной аэрации культуры актиномицета. Возможны ли развитие актиномицета и биосинтез антибиотика в анаэробных условиях?
Наблюдения ряда авторов показали, что в анаэробных условиях происходит очень слабое развитие грибка. Мицелий, выращенный в аэробных условиях и перенесенный затем в анаэробные, не образует антибиотика. Для максимального накопления антибиотика культура должна находиться в условиях непрерывной аэрации.
В процессе контроля биосинтеза антибиотиков, образуемых стрептомицетами, принимают участие плазмиды (плазмидная ДНК), которые широко распространены у этой группы микроорганизмов.
Физиолого-биохимические особенности развития
Streptomyces griseus
Процесс развития продуцента стрептомицина и физиолого-биохимические изменения, происходящие в это время в среде и в самом организме, носят явно выраженный двухфазный характер.
Развитие на соевой среде отличается от развития на глюкозопептонной среде. На соевой среде развитие происходит не в две, а в три фазы. Первая стадия характеризуется ростом культуры; в этот период и происходит некоторое увеличение аммонийного и растворимого азота, что, по-видимому, связано с разложением белков соевой муки. Изменение pH культуральной жидкости за 48 ч возрастает с 6,8 до 7,9 (табл. 49).
Через 48 ч развития не наблюдается увеличения массы мицелия. С этого момента начинается процесс образования стрептомицина, pH среды падает до 6,8 на третьи сутки развития и до 6,7 на четвертые сутки, после чего значения pH вновь возрастают до 7,7 к пятым суткам; количество стрептомицина увеличивается, содержание восстанавливающего сахара в среде падает, достигая 10% от исходного количества (вторая стадия).
206
Таблица 49
Изменения, возникающие по ходу развития' культуры на соевой среде (по Hockenhull et al., 1954)
Продолжительность развития, су?
Показатели 0 1 2 3 4 5 О 7 S
pH 6,80 7,40 7,90 6,80 6,70 7,70 8,30 —
Сахар восстанавливающий, мг/мл 26 25 15 10 7,50 2,50 1,50 1,30 1,30
Сахар общий, мг/мл 30 29 22 14 12,50 10 9,00 9,30 8,80
Сахар невосстанавливающий, мг/мл 3,60 4,50 5,0 4,00 5,20 7,50 7,70 8,00 7,50
Растворимый N, мг/мл 0,70 0,80 1,15 1,50 1,80 2,00 2,00 2,00
Аммонийный N, мг/мл 0,70 0,10 0,15 0,20 0,25 0,35 0,45 0,60 0,70
Стрептомицин, мкг/мл .... — — Сле- 300 300 1100 1400 1500 1450
ды
Третья стадия характеризуется наличием небольшого количества сахара в среде и незначительным увеличением образования антибиотика. Количество аммонийного азота продолжает возрастать, что, по всей вероятности, связано с разложением белков соевой муки и автолизом мицелия.
По мнению отдельных исследователей, число фаз развития у Str. griseus зависит в значительной степени от условий культивирования. Обнаружено, что при развитии актиномицета на соевой среде наблюдается четыре фазы. В третьей фазе рост мицелия, после некоторой остановки в период второй фазы, достигает максимума, т. е. наблюдается вторичный рост мицелия, обусловленный использованием нерастворимых компонентов субстрата. При развитии же организма на средах, не содержащих нерастворимых веществ, процесс имеет типичный двухфазный характер.
Сравнивая приведенные выше результаты, можно заметить, что между ними нет принципиальной разницы. Процесс развития актиномицета как в первом случае, так и во втором — характерный двухфазный процесс. Три стадии развития, отмеченные одними авторами, или четыре фазы, отмеченные другими, с физиологической точки зрения при нормальных лабораторных условиях развития организма мало оправданы. Третья или четвертая фазы, по-видимому, являются отдельными этапами 1-й и 2-й фаз развития, что связано с различными условиями культивирования актиномицета.
Характеризуя; общие закономерности в развитии Str. griseus и биохимические процессы, происходящие при этом, можно отметить две реальные фазы развития актиномицета. Дулани и Перлман (1947) дают следующую схему двухфазного процесса развития актиномицета:
207
Первая фаза
Вторая фаза
Мицелий
Глюкоза
рн
Стрептомицин
Растворимый С
Молочная кислота
Потребление О2
Растворимый N Неорганический Р
Быстрый рост
Быстрое потребление
Постепенное повышение Медленное образование
Постепенное использование
Медленное образование и использование
Максимальное
Потребляется интенсивно
Максимальное потребление
Постепенный автолиз
Использование небольших оставшихся количеств
Достигает максимума
Макси альная скорость образования
Концентрация остается постоянной
Медленное использование
Снижается до минимума
Концентрация увеличивается
Выделяется в среду
Первая фаза. Для фазы характерны быстрые рост и развитие актиномицета с энергичным использованием основных компонентов субстрата и максимальным потреблением кислорода. Масса мицелия достигает максимума, протоплазма клеток базофильная с высоким содержанием рибонуклеиновой кислоты (РНК), ДНК на ранних стадиях развития отсутствует, обнаруживается только через 12 ч развития.
pH среды вначале несколько снижается, затем постепенно повышается. Образование стрептомицина незначительное.
Вторая фаза. Для этой фазы характерно медленное потребление оставшихся в среде питательных веществ. Рост актиномицета замедляется, резко снижается потребление кислорода. Содержание РНК в мицелии падает, базофилия ядерного вещества повышается, содержание ДНК в нем увеличивается.
Основная масса мицелия подвергается автолизу, что приводит к увеличению аммиачного азота и неорганического фосфора. В период второй фазы происходит максимальное образование стрептомицина, как правило, при достижении максимума биомассы. Иными словами, максимальное накопление антибиотика в культуральной жидкости происходит в период, когда в культуре автолитические процессы начинают преобладать над процессами роста.
Однако было бы неправильно считать, что выделение стрептомицина в окружающую среду связано с тем, что он освобождается из клеток мицелия в результате их автолиза. Если бы это было так, то следовало бы ожидать, что в процессе развития актиномицета в его мицелии накапливается стрептомицин. Но прямые опыты показали, что количество антибиотика, связанное с клетками мицелия, по ходу развития организма мало меняется. Содержание стрептомицина в мицелии может меняться в зависимости от состояния мицелия.
Таким образом, можно считать вполне доказанным, что биосинтез стрептомицина осуществляется развивающимся мицелием во вторую фазу роста актиномицета (в специфических условиях среды, характеризующейся, с одной стороны, истощением основных питательных компонентов и, с другой, обогащением субстрата продуктами жизнедеятельности актиномицета и продуктами авто
208
лиза клеток). Определение наличия веществ, содержащихся в культуральной жидкости продуцента стрептомицина Str. griseus в конце процесса биосинтеза антибиотика, показало, что в культуральной жидкости находятся минеральные (зольные) элементы, белки, нуклеиновые кислоты, жиры, стрептомицин, аминокислоты,, полисахариды и другие вещества.
Ферментативная деятельность продуцента стрептомицина
Способность актиномицета — продуцента стрептомицина — использовать сложные белковые соединения связана с его возможностью превращать эти соединения в более простые азот- и углеродсодержащие вещества с помощью мощного ферментного аппарата.
Изучение ферментативной деятельности Str. griseus показало, что он содержит фермент амилазу, образующийся как на среде с глюкозой, так и на среде с крахмалом. Однако на среде, содержащей крахмал, активность амилазы несколько выше, чем на среде с глюкозой.
Использование сложных белковых соединений, содержащихся в растительных и животных продуктах (соевая мука, жмых, казеин и др.), связано с наличием у актиномицета активных протеолитических ферментов, которые образуются актиномицетом в значительных количествах одновременно с биосинтезом стрептомицина.
Наряду с образованием протеолитических (казеинолитических) ферментов Str. griseus способен синтезировать фибринолитические вещества — специфические протеазы, обладающие способностью лизировать тромбы крови.
Образование протеолитических ферментов зависит от скорости роста актиномицета, состава применяемой среды и от штамма продуцента стрептомицина. Так, на среде с крахмалом протеаз образуется больше, чем на среде с глюкозой. При наличии в среде 4% глюкозы протеолитическая активность культуральной жидкости актиномицета в течение всего процесса развития остается на более высоком уровне, чем на среде с 1 %-ной глюкозой.
В процессе развития организма основная масса этих ферментов выделяется в окружающую среду.
Оптимальной реакцией среды, при которой проявляется активность протеолитических ферментов продуцента стрептомицина, будет реакция при pH в пределах 8—8,2. Кислая реакция (pH 4,5— 5,5) подавляет активность ферментов; аналогичное действие происходит и в сильнощелочной среде (pH около 9).
При глубинном выращивании Str. griseus выделяет значительно больше протеаз в среде с низким содержанием азота. Явление это, по всей вероятности, связано со специфической реакцией актиномицета на понижение содержания усвояемых форм азота в среде. Кроме того, выделение протеаз зависит от источника азота. При наличии в среде белка образование протеаз наиболее низкое, высокое — на среде с пептидами и еще выше — на средах, содержащих аминокислоты.
209
Катионы калия стимулируют рост актиномицета и образование протеаз. Выделенные из культуральной жидкости Str. griseus протеолитические ферменты содержат трипсин и пепсин. Из продуцента стрептомицина удалось выделить протеазу, способную гидролизовать почти все пептидные связи белков, осуществляя их гидролиз до свободных аминокислот.
Необходимо отметить, что прямой зависимости между образованием стрептомицина и накоплением актиномицетом гидролитических ферментов — протеаз и амилаз — нет.
При выращивании актиномицета на средах, содержащих мочевину, или на соевых средах без мочевины удается обнаружить фермент уреазу.
Культура Str. griseus кроме указанных ферментов образует фенилманнозидазу — фермент, гидролизующий фенил-а-П-манно-зу. Фенилманнозидаза в основном выделяется в среду, окружающую актиномицет, но в небольших количествах Может содержаться и в мицелии актиномицета.
X a-D-Фенилманноза
Предполагают, что фенилманнозидаза способна также гидролизовать в культуре актиномицета маннозидострептомицин с отделением от него маннозы:
стрептомицин
Маннозидострептомицин
210
Рис. 30. Действие pH на гидролиз фенилманнозы (Л) и манно-зидострептомицина (Б) под действием фенилманнозидазы (по Hockenhull et al., 1954)
Оптимальное значение pH, необходимое для активности фермента фенилманнозидазы, равно 8,0 (рис. 30), температурный оптимум около 40°С, а при 50°С фермент почти полностью инактивируется (рис. 31).
Фермент чувствителен к условиям аэрации — ухудшение аэра-
ции культуры вызывает заметное снижение его активности.
Способность фенилманнозидазы осуществлять гидролиз манно-зидострептомицина оказывает существенное влияние на выход
стрептомицина в процессе развития актиномицета.
Молекула маннозидострептомицина состоит из остатка стрептомицина и D-маннозы, причем ман
ноза присоединена к четвертому атому углерода Г<-метил-Е-глюкозамин-ного остатка стрептомицина. Процесс превращения маннозидострептомицина в стрептомицин может осуществляться как в аэробных, так и в анаэробных условиях. Но поскольку анаэробиоз снижает активность фермента, то, по-видимому, и процесс превращения маннозидной формы стрептомицина в стрептомицин будет затруднен.
Однако было показано, что при биосинтезе стрептомицина маннози-дострептомицин не является предшественником стрептомицина, так же, как и последний, не может рассматриваться предшественником ди-гидрострептомицина.
Рис. 31. Влияние температуры на активность фенилманнозидазы (по Hockenhull et al., 1954)
211
У Str. griseus открыт фермент трансамидиназа, который может переносить группы мочевины от аргинина или канаванина к орнитину или гидроксиламину, но не может превращать глицин в гликоциамин. Позднее было показано, что специфическая активность трансамидииазы, выделенной из мицелия актиномицета, прямо пропорциональна скорости образования стрептомицина микроорганизмом.
В 1956 г. была описана система дегуанидаз у продуцента стрептомицина: система проявляет активность при pH 7,5. Эта ферментная система обладает способностью отщеплять гуанидиновые группировки от L-аргинина, гуанидоуксусной, гуанидопропионовой и гуанидомасляной кислот, а также от стрептидина и стрептомицина. Предполагают, что эта система способна принимать участие в разрушении стрептомицина, которое иногда имеет место в конце процесса развития продуцента антибиотика.
Изучение путей биосинтеза стрептомицина
Изучение путей биосинтеза того или другого вещества может осуществляться успешно при условии знания химической природы изучаемого соединения.
Стрептам ин.
ОН Н
Стрептомицин (!)
(А) СНО—*-СН2ОН в дигидрострептомицине
(В) CHj —*~СН2ОН в гидроксистрептомицине
212
При гидролизе стрептомицина разбавленными кислотами он распадается на два вещества (стрептидин и стрептобиозамин).
C2iH38O12N7 + Н2О —>• C8H18O4Na + CjgH23O9N
Стрептомицин Стрептидин Стрептобиозамин
Стрептидин— 1,3-дигуанидино-2,4,5,6-тетраоксицнклогексан — сильное основание. Стрептидин (//) не обладает антибиотической активностью. Стрептобиозамин — своеобразный дисахарид (III)-, в его составе имеется азотсодержащая часть, получившая название N-метил-Е-глюкозамин (IV), и вторая (не содержащая азота) часть — стрептоза (V).
В результате химического изучения стрептомицина накопился материал, позволивший установить пространственную конфигурацию молекулы стрептомицина (/). Установлено, что остаток стрептобиозамина присоединен к 4 углеродному атому стрептидина.
Рассматривая химическую структуру стрептомицина, нетрудно заметить, что стрептидиновая часть сильно насыщена азотом. Простой расчет показал, что в стрептидине отношение азота к углероду в 2,5 раза выше, чем в белках (в белках это отношение равно примерно 0,30, а в стрептидине — 0,75, во всей молекуле стрептомицина — 0,33). Эти данные позволяют рассматривать стрептидин как своеобразный «коллектор» избыточного азота, образуемого в процессе жизнедеятельности актиномицета.
Исходя из этой гипотезы, Егоровым еще в 1951 г. было сделано предположение, что использование в процессе жизнедеятельности актиномицета веществ, «перегруженных» азотом по сравнению с белками и содержащих азот в виде гуанидиновых группировок, должно приводить к повышению выхода стрептомицина. В качестве таких веществ были использованы соединения, содержащие гуанидиновую группировку—L-аргинин (VI); креатин (VII), гуанидин (VIII), а также мочевина (IX). Кроме того, был использован инозит (X) — соединение, входящее в молекулу стрептидина.
h2n—c=nh h2n—с—NH
NH N—CH,
' I
CH2
chnh2 cooh
COOH Креатин (VII)
Аргинин (VI)
H2N—C=NH H C—
Ан ' Ин
NH2 |\ои
Гуанидин (VIII) HOC—
H2N—C=^0 H
И ноли (X)
Мочевина (IX)
(CH2)
213
Результаты опытов, проведенных на синтетической среде с малоактивным штаммом Str. griseus ВНИИП-10, показали, что при добавлении к среде 0,05% L-аргининмоногидрохлорида биосинтез стрептомицина возрастает более чем в 2,3 раза. Но если аргинин добавлять одновременно с инозитом, то биосинтез антибиотика можно увеличить почти в 3 раза. Увеличение образования стрептомицина происходит и в том случае, если в среду добавлялась навеска креатина, гуанидина или мочевины, равноценная аргинину по количеству азота. Во всех случаях лучший стимулирующий эффект наблюдался при добавлении к среде названных веществ вместе с инозитом.
Таким образом, используя обычные (не меченые) гуанидинсодержащие соединения (аргинин, гуанидин), мочевину и инозит, мы с достоверностью показали, что добавление их к среде для культивирования Str. griseus значительно повышает выход стрептомицина.
Последующие исследования, проведенные рядом авторов с применением в опытах меченых соединений, расшифровали основные пути биогенеза молекулы стрептомицина. Прежде всего было показано, что все углеродные атомы молекулы стрептомицина, за исключением атомов углерода гуанидиновых групп, образуются за счет глюкозы. Культивируя Str. griseus на среде с соевой мукой и меченой глюкозой, было установлено, что радиоактивная глюкоза (,4С) включается в молекулу стрептомицина. Разложив полученный таким образом стрептомицин на составляющие его группировки, было показано, что радиоактивность наблюдается в стрептамине, стрептозе и в N-метил- L-глюкозамине (табл. 50).
Таблица 50
Распределение меченной глюкозы 14С в стрептомицине (по Hunter, Hockenhull, 1955)
Вещества Специфическая активность
мкг/мм мкг/г углерода
Глюкоза 9,10 126
Стрептомицин 29,00 116
Стрептидин 9,90 104
Стрелтамин 8,80 123
ВаСО3 (из гаунидиновых групп) 0,55 45
М-метил-Ь-глкжозамин 10,10 122
Стрептоза 9,20 128
Примечание. Меченая глюкоза добавлена к среде с соевой мукой и глюкозой через 60 ч после посева актиномицета.
Глютамин и D-глюкозамин — источники аминогрупп стрепта-мина. D-стрептоза образуется из D-глюкозы в результате ряда ее превращений. Используя меченую глюкозу и изучая распределение радиоактивности среди отдельных углеродных атомов, было
214
установлено, что 1\т-метил-Ь-глюкозамин в молекуле стрептомицина образуется из D-глюкозы.
При применении О-глюкозы-1-14С основная часть радиоактивности включалась в углеродную цепь аминосахара по первому углероду. При использовании О-глюкозы-6-14С накопление метки наблюдалось в шестом углероде аминосахара. Таким образом, можно предполагать, чго возможный механизм превращения асимметричных углеродов D-глюкозы — один из многочисленных способов эпимеризации. Применение меченого метионина (14CH3-L-метионин) позволило показать, что N-метил группы глюкозамина образуется из L-метионина.
Углерод гуанидиновых групп стрептомицина образуется из углерода СО2. Используя радиоактивный углерод двуокиси углерода 14СО2, выяснено, что почти весь углерод СО2 включается в гуанидиновые боковые цепочки.
Вещества
Специфическая активность, мкг/мм
Стрептомицин сульфат............... 2,91
Стрептидин сульфат ...................... 3,06
Стрептоза 4- N-метил-L-глюкозамин . 0
Стрептамин сульфат..................... 0,028
ВаСОз из гуанидиновых боковых цепей ............................... 1,56
При этом было установлено, что более интенсивное включение радиоактивного углерода двуокиси углерода происходит в том случае, если СО2 добавляется через 2 или 3 сут после посева актиномицета.
При добавлении к среде хлоргидрата L-аргинина (по 200 мг на колбу) наблюдается заметное снижение включения 14С в молекулу стрептомицина, хотя и не происходит значительного увеличения выхода стрептомицина; последнее подтверждает наши результаты о том, что присутствие аргинина в богатых по составу средах может и не оказывать стимулирующего влияния на биосинтез антибиотика.
Высказано предположение, что аргинин играет роль переносчика гуанидиновых групп или групп мочевины при биосинтезе стрептомицина. Возможно, что L-аргинин — промежуточное соединение при биосинтезе гуанидиновой части молекулы стрептомицина, что вполне согласуется с нашим предположением.
В опытах с отмытым мицелием актиномицета показано, что вещества, содержащие гуанидиновые группировки (L-аргинин, креатин, креатинин, гуанидин), или легко превращающиеся в такие соединения вещества (цитрулин, орнитин) у Str. griseus переводятся в соединение, имеющее, по крайней мере, одну гуанидиновую группировку. Это соединение, по-видимому, используется продуцентом в процессе биосинтеза стрептомицина.
Гуанидиновые группы L-аргинина, меченые по углероду, принимают непосредственное участие в биосинтезе молекулы стрепто
215
мицина. Вся радиоактивность стрептидина локализуется в гуанидиновых группировках (табл. 51).
Таблица 5t
Распределение 14С в отдельных частях молекулы стрептомицина, синтезированной Streptomyces griseus в присутствии Ь-(14С-гуанидииа)-аргинина (по Horner, 1964)
Специфическая активность (с. р. m.XIO-5 мкмоль) Специфическая активность (с. р. m.XIO-® мкмоль)
стрептомицин стрептидин гуанидиновые группы стрептомицин стрептидин гуанидиновые группы
2,1 1,9 2,2 1,0 1,0 1,0
1,5 1,3 1,4 0,7 0,0 0,6
По-видимому, процесс образования гуанидиновых групп стрептомицина- сводится к тому, что под действием ферментов транс-
дона-
амидиназ происходит перенос амидиновой группы!—
тора L-аргинина на молекулу акцептора.
По данным ряда авторов, у продуцента стрептомицина обнаружена трансамидиназная активность, имеющая непосредственную связь с биосинтезом антибиотика.
Трансамидиназную активность имеют лишь те штаммы актиномицетов, которые обладают способностью синтезировать стрептомицин или гидроксистрептомицин.
Участие инозита (мезо-инозита) в биосинтезе молекулы стрептомицина показано прямыми опытами; использование в опытах инозита равномерно меченного 14С, который добавлялся к 96-часовой культуре Str. griseus, показало, что в стрептомицине, образовавшемся за 24 ч, основное количество 14С концентрируется в циклогекситоловом кольце стрептидина. В гуанидиновых цепочках 14С полностью отсутствовал (табл. 52).
Таблица 52
Распределение ,4С мезо-инозита в стрептомицине после введения в среду меченого инозита
(по Horner, 1964)
Специфическая активность (с. р. ш.Х10"ь мкмоль) Специфическая активность (с. р- т.Х10“ь мкмоль)
стрептомицин стрептидин гуанидиновые группы стрептомицин стрептидин гуанидиновые группы
0,45 0,55 0,50 0,60 0 0 1,08 2,83 1,15 2,85 0 0
216
Эти выводы подтверждаются данными ряда исследователей, которые также показали, что инозит и особенно инозит в комбинации с аргинином увеличивают выход стрептомицина. Следовательно, можно предполагать, что инозит является предшественником стрептидина.
Установлено, что хинная и шикимовая кислоты подобно инозиту также стимулируют биосинтез стрептомицина (табл. 53).
сноп ноне-'' '''снон
Н2С\ /СН, с—он
соон
СНОН
НОНС-^ ^СНОН
I I
Н/. .сн
соон
Хинная кислота
Шикимовая кислота
Влияние хинной и шикимовой кислот (100 мг %) на рост Streptomyces griseus штамм ЛС-1 (по Галаниной, 1966)
Таблица 53
Добавленное вещество
Биомасса, мг%
Антибиотик, мкг/мл
Продуктивность мицелия, мкг/мг
Хинная кислота.......................
Шикимовая кислота....................
Инозит...............................
690
724
692
2168
2010
2144
313
280
311
Повышение биосинтеза стрептомицина при добавке аргинина к синтетической среде происходит и у высокопродуктивного штамма актиномицета ЛС-1. Однако это повышение образования антибиотика по сравнению с контролем меньше, чем у слабо активного продуцента.
Изучая азотсодержащую часть кукурузного экстракта, Шапошников с сотрудниками в 1954 г. показал, что стимулирование биосинтеза стрептомицина происходит за счет катодной фракции, состоящей преимущественно из основных аминокислот: аргинина, гистидина и лизина. Смесь указанных кислот, взятая в тех же соотношениях, что и в кукурузном экстракте, обладает почти тем же действием, что и экстракт кукурузы. Аргинин и гистидин увеличивает выход стрептомицина у актиномицета штамма ЛС-1 на 50—100% при развитии его на синтетической среде с сульфатом аммония.
Интенсивность синтеза стрептомицина связана, по-видимому, с процессом перехода азотсодержащих веществ кислотонерастворимой фракции мицелия в азотсодержащие вещества его кислоторастворимой фракции, т. е. связана с образованием более мобильных веществ.
217
Гидролизат белка мицелия актиномицета, интенсивно синтезирующего антибиотик, содержит значительно меньше основных аминокислот, в особенности аргинина, чем гидролизат белка мицелия, обладающего низкой способностью к синтезу антибиотика. Аргинин используется преимущественно на построение молекулы стрептомицина, а не на построение белка мицелия.
Кислотный гидролизат белка сои, являющийся единственным источником азота в среде, способствует образованию определенного, хотя и не очень высокого по сравнению с соевой мукой, количества стрептомицина. При удалении из гидролизата гексоновых оснований (аргинин, лизин и гистидин) биосинтез антибиотика при вполне нормальном росте актиномицета снижается примерно на 50%.
Фракции, содержащие основания и пролин, наиболее благоприятны для биосинтеза антибиотика, а фракции моноаминокислот— для роста актиномицета.
При использовании высокоактивного штамма продуцента стрептомицина (ЛС-1) фракция основных аминокислот кислотного гидролизата-белка сои оказывает более благоприятное влияние на биосинтез стрептомицина, чем фракция моноаминокислот:
Влияние фракций моноаминокислот и основных аминокислот кислотного гидролизата белка сои на образование стрептомицина (по Егорову, 1959)
Максимальное количество Вариант опыта стрептомицина, мкг/мл
Гидролизат белка сои .......... 179
Фракция моноаминокислот........ 342
Фракция основных аминокислот . . . 754
По влиянию на процесс образования стрептомицина аминокислоты можно разделить на три группы.
Первая группа. Аминокислоты, не оказывающие влияния на рост актиномицета, но стимулирующие биосинтез антибиотика (аргинин, гистидин, лизин, глицин, а-аланин, валин, фенилаланин, изолейцин).
Вторая группа. Аминокислоты, не оказывающие влияния на образование антибиотика (аспарагиновая кислота, серин, треонин, метионин,тирозин, лейцин).
Третья группа. Аминокислоты, подавляющие рост актиномицета и тормозящие процесс биосинтеза стрептомицина (цистин, триптофан).
Энзиматический экстракт, выделенный из разрушенного лизоцимом мицелия Str. griseus, обладает способностью образовывать глюкозамин в опытах in vitro. В этом экстракте обнаружена уреазная активность, чем, по-видимому, объясняется стимулирующее-влияние мочевины как донатора аминогрупп в синтезе глюкоза-мина.
По-видимому, образование N-метильной группы в глюкозами-не связано с процессом метилирования. Известно, что основным
218
донатором метильной группы при биосинтезе многих биологически активных веществ является аминокислота метионин:
СН3—S—СН2—СН2—CH(NH2)COOH
Метионин
Вместе с тем имеются данные, показывающие, что витамин В.> стимулирует процесс биосинтеза ряда веществ, содержащих метильную группу. Витамин В12 в сочетании с метионином способствует повышению выхода стрептомицина культурой Str. griseus штамм ЛС-1 до 25% (табл. 54).
Таблица 54
Влияние метионина и витамина В]2 на рост Streptomyces griseus штамм ЛС-1 и образование стрептомицина (по Галаниной, 1966)
Среда Биомасса, мг % Стрептомицин, мкг/мл Продуктивность
мкг/мг % К КОИ тролю
Синтетическая среда (контроль) .... 650 2130 328 100
Та же среда + метионин 705 2032 288 88
Та же среда 4- витамин В12 692 2616 377 115
Та же среда ~|- метионин -f- витамин В12 720 2960 410 125
Анализируя полученные экспериментальные результаты, можно констатировать, что к настоящему времени установлены последовательные этапы образования стрептидина, а также выяснены основные пути образования стрептозы. Тем не менее полная картина биосинтеза молекулы стрептомицина остается до конца не изученной. Исследования в этом направлении продолжаются.
В последнее время при изучении путей биосинтеза ряда антибиотических веществ широкое распространение получило применение мутантов микроорганизмов с измененными свойствами, связанными с определенным блокированием некоторых звеньев в цепи образования молекулы антибиотика. Такой подход в изучении биосинтеза антибиотиков дает возможность вскрывать и познавать системы регуляции биосинтетической активности микроорганизмов.
При изучении биогенеза стрептомицина были использованы различные мутанты Streptomyces griseus: неактивные (неспособные образовывать антибиотик) и малоактивные варианты высокопродуктивного штамма Str. griseus.
Рядом авторов получено большое число мутантов продуцента стрептомицина, блокированных по биосинтезу A-фактора, и подробно изучено участие этого фактора в биосинтезе молекулы стрептомицина.
219
Совместное культивирование неактивного мутанта № 1200 и малоактивного мутанта № 1211 способствует восстановлению нарушенной в процессе мутагенеза биосинтетической активности у мутанта 1200 актиномицета:
Образование стрептомицина мутантными штаммами Streptomyces griseus и их комбинациями (по Пензиковой, Левитову и др., 1971)
Вариант опыта Образование стреп-
томицина На 6-е сут, развития, мкг/мл
Штамм 1200 ..................................... 0
Штамм 1211.......................................... 200—600
Штамм 1200 штамм 1211 .......................... 2500—5000
Штамм 1211 фильтрат культуральной жидкости штамма 1200 ............................... 200 —600
Штамм 1200 фильтрат культуральной жидкости штамма 1211 ............................... 1500— 000
Тот же, но фильтрат прокипячен.................. 1500—3700
Примечание. Фильтраты использовались из суточной культуры и добавлялись к суточной культуре актиномицетов.
Приведенные данные показывают, что у неактивного мутанта 1200 биосинтез стрептомицина осуществляется под влиянием какого-то вещества (или веществ), содержащегося в культуральной жидкости малоактивного мутанта 1211; это вещество неферментной природы, т. е. при кипячении оно не инактивируется.
Стимулирующий эффект со стороны штамма 1211 наблюдается в том случае, если 24—48-часовая культуральная жидкость добавляется к односуточному мицелию актиномицета штамм 1200.
В дальнейшем из мутанта 1211 Str. griseus был выделен фактор А, специфически стимулирующий синтез стрептомицина биологически неактивным мутантом 1200. Фактор А принимает участие в образовании стрептидиновой части молекулы стрептомицина и оказывает влияние на процесс спорообразования, восстанавливая споруляцию актиномицета.
Добавление стимулирующего фактора к мутанту, не образующему стрептомицин, способствует биосинтезу антибиотика и началу процесса трансамидинирования.
Трансамидиназная активность мицелия предшествует биосинтезу стрептомицина примерно на 10 ч. По-видимому, действие активатора связано с индукцией трансамидиназы.
A-фактор выделен из культуральной жидкости Str. griseus штамм 751; ему дана первичная характеристика, определены молекулярная масса (она равна 342) и империческая формула (С13Н22О4).
В 1976 г. Клейнер с сотрудниками установил структурную формулу A-фактора, обеспечивающего нормальное развитие Str. griseus и биосинтез им стрептомицина. В 1977 г. Клейнер с сотрудниками осуществил химический синтез рецемического А-фактора и его гомологов. Авторы показали, что синтезированный биорегу-
220
лятор обладает такой же биологической активностью, как и природный фактор. Два гомолога A-фактора имеют следующее строение:
A-фактор представляет собой 25-изокаприлоил-35-оксиметил-у-бутиролактон. Актиномицет одновременно синтезирует два гомолога.
A-фактор оказывает не только стимулирующее влияние на биосинтез стрептомицина у недостающих по A-фактору мутантов Str. griseus, но он также принимает участие в образовании стрептомицина активными продуцентами этого антибиотика.
Нарушение образования A-фактора оказывает влияние на процессы, связанные с биосинтезом молекулы стрептомицина, — резко уменьшается активность амидинотрансферазы — фермента, участвующего в образовании стрептомицина.
Получен мутант продуцента стрептомицина, блокированный по биосинтезу стрептидина (такие мутанты называют идиотрофами). Образование антибиотика этим мутантом происходит лишь в том случае, если к среде добавлен стрептидин. С увеличением добавленного стрептидина синтез стрептомицина возрастает. Это указывает на то, что стрептидин целиком включается в молекулу стрептомицина, т. е. является ее предшественником.
Образование стрептомицина мутантом Streptomyces griseus, блокированным по биосинтезу стрептидина, при добавлении последнего в среду одновременно с посевом актиномицета (по Анисовой, Коваленко, Корницкой н др., 1976)
Количество добавленного стрептидина, мкг/мл
250
500
1000
Образование стрептомицина на 5-е сут, мкг/мл
62
120
350
В культуральной жидкости актиномицета, развивающегося без A-фактора, образуется другое вещество регуляторного характера, способное индуцировать переход развития актиномицета в стадию активного образования стрептомицина. Получен ряд мутантов Str. griseus с блоками биосинтеза стрептидина на разных этапах. Выделены мутанты продуцента стрептомицина, блокированные по биосинтезу стрептобиозамина. Добавление стрептобиозамина в среду, где развиваются полученные мутанты, способствовало увеличению образования стрептомицина в 3—6 раз. Использование стрептобиозамина происходит на относительно поздних стадиях
221
развития актиномицета. Аналогичные приемы, широко применяемые при изучении процессов биосинтеза антибиотиков, получили название мутосинтез или мутационный синтез.
Приведенные результаты показывают, что в процессе образования стрептомицина участвует ряд регуляторных механизмов, выявление которых с помощью мутантных штаммов актиномицета поможет вскрыть истинные пути механизма биосинтеза молекулы стрептомицина.
Промышленное получение стрептомицина
Производство стрептомицина в настоящее время исчисляется тоннами. Увеличение производства антибиотика осуществлялось не только за счет расширения и увеличения числа промышленных предприятий, но и за счет, в основном, следующих трех мероприятий; 1) получение наиболее активных штаммов актиномицета — продуцента стрептомицина; 2) подбор наиболее благоприятных сред и других условий культивирования продуцента, обеспечивающих максимальный биосинтез стрептомицина, 3) разработка наиболее рациональных методов выделения и очистки антибиотика.
Получение наиболее активных штаммов актиномицета — продуцента стрептомицина. Селекция наиболее продуктивных штаммов Str. griseus — одна из первостепенных задач в деле увеличения выходов стрептомицина. Достаточно указать, что если раньше только что выделенные штаммы актиномицета — продуцента стрептомицина образовывали не более 50—100 мкг/мл антибиотика, то теперь получены штаммы, которые даже на синтетических средах образуют до 6000 мкг/мл стрептомицина. Только за счет селекции штамма удается увеличить выход стрептомицина в 60— 100 раз.
Нетрудно себе представить, что для достижения того же уровня производства стрептомицина путем увеличения числа предприятий их следовало бы увеличить в десятки раз. А это подняло бы стоимость стрептомицина в сотни раз выше той стоимости, которую имеет антибиотик в настоящее время, что в свою очередь привело бы к невозможности использования препарата в широких масштабах.
Важную роль в селекции продуцентов стрептомицина играют индуцированный мутагенез и ступенчатый отбор. С целью получения мутантов широко применяются мутагенные факторы; рентгеновское и ультрафиолетовое излучения. Необходимо отметить, что различные варианты культуры могут возникать и без применения мутагенных факторов, однако частота мутаций в этом случае гораздо меньше, чем при облучении. Например, при облучении спор Str. griseus штамм ЛС-1 ультрафиолетовым излучением (2000 эрг/мм2) возникает в 8 раз больше морфологических мутаций, чем от необлученных спор, но эта же доза облучения не вызывает увеличения числа мутаций по признаку антибиотикообразования. Поэтому для целей селекции по признаку образования стрептоми
222
цина был использован метод многократного облучения спор ультрафиолетовым излучением с доведением общей дозы до 10 000— 20 000 эрг/мм2 с последующим применением видимого света.
В результате были получены новые штаммы, сохраняющих, высокую антибиотическую активность:
Штамм Средняя активность,
ыкг/мл
ЛС-1 ............................... 3000
«Новый 66».......................... 4000
Новый вариант штамма «Новый 66» . 4500
Подбор наиболее подходящей среды и установление режима развития актиномицета играют существенную роль в увеличении выхода стрептомицина. В настоящее время большинство заводов, производящих стрептомицин, работают на так называемых соевых средах, в состав которых входят соевая мука, гидрол, аммонийные соли и некоторые другие компоненты. На этих средах и при современных условиях развития актиномицета удается достичь высоких выходов стрептомицина. Важно отметить, что каждому вновь выделенному в результате селекции штамму актиномицета должна соответствовать определенная среда и свой режим для развития актиномицета. Некоторое время тому назад для получения антибиотика на наших заводах применялся штамм В-178, продуцирующий большее количество стрептомицина на среде с кукурузным экстрактом. На среде же с соевой мукой выход антибиотика, образуемого этим штаммом, снижался. Затем стал применяться штамм ЛС-1, который лучше образует стрептомицин на среде с соевой мукой и глюкозой.
Метод выделения и очистки стрептомицина определяет как количество получаемого антибиотика, так и его качество. Чем лучше очищен препарат от различных балластных веществ, тем выше его миллиграммовая активность, тем выше его лечебные качества.
В настоящее время благодаря использованию совершенных методов выделения и очистки стрептомицина удается получить препараты, содержащие до 800 мкг/мг и более стрептомицина с выходом антибиотика до 95—97%.
Выделение стрептомицина
из культуральной жидкости
Стрептомицин — сильно полярное органическое основание. По структуре стрептомицин (с. 212) представляет собой сложную молекулу с большим числом гидрофильных и функциональных групп. Гуанидиновые группы в стрептидиновой части молекулы и метилиминная группа в N-метилглюкозаминной части молекулы стрептомицина обусловливают сильные основные свойства этого антибиотика.
Стрептомицин в виде свободного основания или в виде солей неорганических кислот очень хорошо растворим в воде. Однако
223
соли неорганических кислот стрептомицина нерастворимы почти во всех органических растворителях. Это обстоятельство имеет важное значение при разработке метода выделения антибиотика. Так, попытки экстрагировать стрептомицин из водных растворов при pH от 2 до 9 бутиловым спиртом или другими известными не смешивающимися с водой растворителями не увенчались успехом. Поэтому метод экстракции данного антибиотика не нашел применения.
Прежде чем перейти к рассмотрению основных методов выделения стрептомицина, необходимо остановиться иа приемах, используемых для предварительной обработки культуральной жидкости.
Основная масса антибиотика выделяется в культуральную жидкость. Однако часть стрептомицина остается в мицелии и на его поверхности. Поэтому культуральную жидкость вместе с биомассой обрабатывают минеральной кислотой для того, чтобы весь антибиотик перевести в раствор. После этого мицелий отделяют с помощью фильтр-прессов или центрифуг, а свободную от мицелия культуральную жидкость обрабатывают щавелевой кислотой для удаления белков и органических оснований, а также ионов металлов (кальция, железа, магния и др.). Из полученных таким образом растворов выделяют стрептомицин.
Метод адсорбции на активированном угле. В основу метода положено то, что при кислой реакции жидкости (pH 2—4) стрептомицин не адсорбируется на частицах активированного угля, в то время как ряд примесей при таком значении pH адсорбируются. Стрептомицин садится на уголь при нейтральном или слабощелочном значении pH.
Концентрирование стрептомицина методом адсорбции на угле проводят следующим способом. Культуральную жидкость подкисляют до pH 2—4 и смешивают с активированным углем. Затем уголь отделяется, а обесцвеченную жидкость нейтрализуют щелочью до pH 7—7,5 и снова смешивают с новой порцией активированного угля, который после этого автоматически подается на фильтр-пресс. Остатки неактивной жидкости отделяются, а адсорбированный на угле стрептомицин промывают при нейтральной реакции водой и нейтральным спиртом для удаления растворимых в спирту примесей.
Десорбция (элюция) стрептомицина с угля производится с помощью кислого спирта, приготовленного с соляной кислотой. В этих условиях многие примеси остаются адсорбированными на угле. После элюции к раствору добавляют сухой серный эфир — в осадок выпадает солянокислая соль стрептомицина.
Существуют и другие модификации адсорбционного метода выделения стрептомицина.
Метод с применением ионообменных смол. В настоящее время все шире и шире для выделения стрептомицина используются ионообменные смолы. Метод основан на использовании катионообменных смол (катионитов) типа сополимеров акриловой или
224
метакриловой кислот и дизииилбензола. Раствор стрептомицина пропускают через ряд колонн, заполненных катионитом. Стрептомицин садится на смолу. Вытеснение адсорбированного антибиотика проводят обычно водными растворами минеральных кислот. В растворе содержится высококонцентрированный и весьма очищенный препарат стрептомицина.
Дальнейшая очистка препаратов стрептомицина осуществляется разными методами. Одним из наиболее эффективных методов очистки антибиотика, по-видимому, является хроматографический метод с использованием окиси алюминия или ионообменных смол. Нередко используют соль с хлористым кальцием с последующей перекристаллизацией.
Метод превращения стрептомицина в хлоркальциевый комплекс позволяет полностью освободиться от примесей маннозидо-стрептомицина; последний как нежелательный компонент обычно образуется (до 5%) при развитии Str. griseus. Стрептомицин образует комплексную соль с СаСЬ, а маннозидострептомицин этой соли не образует.
Стабильность стрептомицина
Изучение стабильности стрептомицина имеет значение как для производства, так и для хранения антибиотика. Стабильность стрептомицина зависит от чистоты препарата, влажности, температуры, кислотности растворителя.
Установлено, что химически чистый стрептомицин устойчив как в сухом состоянии, так и в виде растворов. Соли стрептомицина при хранении их при комнатной температуре инактивируются лишь в незначительной степени и притом на протяжении нескольких лет. Даже при температуре 50°С соли стрептомицина сохраняются в течение длительного времени.
Максимум стабильности растворов гидрохлорида и сульфата
Таблица 55
Влияние pH среды и температуры на устойчивость стрептомицина (по Regna, Wasselle, Solomons, 1946)
pH Период полураспада стрептомицина (ч) при разных температурах
°C 28°С 50-С 95“С
0,8 1200 по 8
1,7 Устойчив 1500 90 —
2,7 » Устойчив 990 —
5,5 » » 4600 37
7,0 ъ » -— —
8,6 » 1100 50 —
9.5 3000 300 28 —
H.2 — 16 — —
8—742
225
стрептомицина находится при значении pH в пределах от 3,0 до 7,0 при температуре от 7 до 25°С (табл. 55).
Имеются данные о том, что сухая нейтральная соль стрептомицина даже при температуре 50°С устойчива в течение длительного времени.
Показано, что растворы стрептомицина в концентрации 100 и 1000 мкг/мл ие теряли активности в течение трех месяцев при pH 6,0; 7,0 и 8,0.
Соли стрептомицина, поступающие в продажу, содержат менее 3°/о влаги и устойчивы при хранении в условиях комнатной температуры в течение длительного времени (до 3 лет), считая со дня их выпуска, а растворы сульфата стрептомицина — до 18 месяцев.
Зависимость антибиотической активности стрептомицина
от pH среды и ее состава
Антибиотическая активность стрептомицина в большой степени зависит от концентрации водородных ионов (pH) среды и ее состава. В кислых средах действие стрептомицина значительно снижается. В щелочных условиях среды проявляется максимальная биологическая активность стрептомицина. Так, например, активность при pH 5,8 примерно в 20—80 раз меньше, чем при pH 8,0.
Данные, представленные в табл. 56, показывают, что для подавления развития определенного количества клеток какого-либо чувствительного к стрептомицину микроба в условиях слабокислой среды необходимо в 4 раза больше, а для Bacterium typhi в 70 раз больше антибиотика по сравнению с количеством стрептомицина, действующим при щелочных условиях (pH 8,0).
Наличие некоторых веществ в среде может иногда в значительной степени влиять на антибиотическую активность стрептомицина.
Так, если к мясо-пептонному бульону прибавить 0,5—3% хлористого натрия, хлористого калия или сульфата натрия, то кишечная палочка — Е. coli развивается в среде при наличии 10 мкг/мл
Таблица 56
Влияние pH среды на антибиотические свойства стрептомицина (по Abraham, Duthic, 1946)
Микроорганизм Бактериостатическая концентрация стрептомицина (мкг/мл) при разном значении pH среды
6,0 7.4 8,0
Escherichia coli ............ 150 25,0 3
Bacterium typhi ............ 200 12,0 3
Proteus vulgaris ............ 100 25,0 25
Staphylococcus aureus 100 25,0 12
Streptococcus pyogenes 5 2,5 1
226
стрептомицина, тогда как без добавки этих веществ она подавляется дозой 0,3 мкг/мл антибиотика.
При наличии в среде поваренной соли, по мнению одних авторов, происходит уменьшение скорости и степени диффузии стрептомицина; по мнению других, хлористый натрий снижает адсорбцию антибиотика бактериальной клеткой.
Ряд органических соединений, присутствующих в среде, снижает антибактериальные свойства стрептомицина. К ним относятся нуклеиновые кислоты, пептон, сыворотка крови, аминокислоты, глюкоза, некоторые соли органических и неорганических кислот. Например, добавление к среде солей пировиноградной или фумаровой кислот в концентрации 1 % создает условия, при которых Е. coli развивается при наличии 10 мкг/мл стрептомицина, а если концентрацию солей повысить до 3%, торост бактерий наблюдается и в присутствии 150 мкг/мл антибиотика. Защитное действие этих и некоторых других кислот оказывается специфичным. Стрептомицин в этих условиях не разрушается, но возрастает устойчивость бактерий к нему. У Е. coli такая устойчивость проявляется в большой степени, в то время как у Staph, aureus эти кислоты почти не вызывают защитных свойств.
Очень сильное снижение антибиотической активности происходит в присутствии цистеина и гидроксиламина. Так, цистеин полностью инактивирует стрептомицин в течение нескольких часов.
В анаэробных условиях также наблюдается снижение антибиотических свойств стрептомицина в отношении таких организмов, как Е. coli, Proteus vulgaris, Aerobacter aerogenes и некоторых других. По всей вероятности, ослабление действия стрептомицина в данных условиях в определенной степени связано с образованием кислот и, следовательно, с понижением значения pH среды.
Подавление антибиотического действия стрептомицина in vitro происходит также под действием вещества, образуемого в культурах Pseudomonas aeruginosa. Это вещество оказалось ингибитором неомицина и дигидрострептомицина. Влияние ингибитора ие связано с разрушением молекулы стрептомицина. В опытах на животных ингибитор не проявляет своего действия на активность стрептомицина.
Таким образом, антибиотические свойства стрептомицина в большей степени определяются кислотностью среды и ее составом. Поэтому определение чувствительности микроорганизмов к действию данного антибиотика или количественное определение антибиотика биологическими методами необходимо проводить при строго определенных условиях среды, способствующих наивысшему проявлению антибиотических свойств стрептомицина.
Антибиотические свойства стрептомицина
По отношению к стрептомицину все микроорганизмы условно можно разделить на три группы.
1. Весьма чувствительные микроорганизмы, которые подав
♦
8*
227
ляются в большинстве случаев при концентрации стрептомицина 10 мкг/мл. Сюда можно отнести организмы, принадлежащие к родам Bacillus, Bordetella, Brucella, Klebsiella, Mycobacterium, Bacterium и некоторые другие.
2. Умеренно чувствительные микроорганизмы, для подавления которых in vitro необходима концентрация стрептомицина в пределах 10—100 мкг/мл. К этой группе могут быть отнесены многие бактерии из родов Aerobacter, Corynebacterium, Diplococcus, Proteus, Staphylococcus, Streptococcus, Vibrio.
3. Устойчивые формы микробов, для подавления которых необходима концентрация антибиотика, превышающая 100 мкг/мл. К этой группе относятся роды Bacteroides, Clostridium, некоторые виды Proteus, многие виды грибов, дрожжей, риккетсии, вирусы.
Итак, различные организмы по-разному реагируют на присутствие в среде стрептомицина. Степень антимикробного действия антибиотика различна и в отношении различных видов организмов (табл. 57).
Наряду с тем, что стрептомицин подавляет рост многих видов микроорганизмов, к нему довольно легко появляется устойчивость, возникают формы бактерий, резистентные к стрептомицину. Повышение устойчивости к стрептомицину в 1000 раз возникает у золотистого стафилококка всего лишь через три пассажа на бульоне с возрастающими концентрациями антибиотика, а у Bad. typhi повышение устойчивости в 22 600 раз происходило после 14 пассажей.
Образование устойчивых форм бактерий к стрептомицину происходит также in vivo. Приобретенная к стрептомицину устойчи-
Таблица 57
Антибиотическая активность стрептомицина ir vitro
Микроорганизм Концентрация стрептомицина, вызывающая подавление, мкг/мл
наиболее чувствительных штаммов наиболее устойчивых штаммов большинства штаммов
Aerobacter aerogenes .......... 0,300 1000 25
Bacillus anthrads 0,250 10 5
Bacillus cercus 0,830 2 1
Bacillus megatherium ......... 0,250 4 2
Bacillus subtilis 0,056 128 25
Candida albicans -— — Устойчивы
Clostridium botulinum — — »
Corynebacterium diphtheriae 0,400 200 20
Diplococcus pneumoniae 0,500 50 25
Escherichia coli 0,015 >1000 25
Mycobacterium tuberculosis 0,100 12,5 5
Proteus vulgaris ............ 1,000 >1000 15
Pseudcminas aeroginosa 0,100 1000 50
Bacterium typhi ............ 0,004 20 5
Bacterium dysenteriae ......... 2,000 8 5
228
чивость сохраняется у организмов довольно длительное время. С возникновением устойчивости появляются некоторые изменения в характере обмена веществ. Так, у резистентного к стрептомицину хромогенного микроорганизма происходит резкое изменение его окраски. Стрептомициноустойчивая форма синегнойной палочки теряет способность образовывать пигмент, изменяются и некоторые другие особенности обмена. Однако у устойчивых и чувствительных к стрептомицину штаммов бактерий не наблюдается заметных различий в вирулентно-
Рис. 32. Развитие чувствительного к стрептомицину (Л), стрептомициноустойчивого (В) и стрептомицинозависимого (С) штаммов:
1 — вона диффузии стрептомицина, 2— колония Actinomyces streptomycini
сти.
В ряде случаев под действием стрептомицина в опытах in vitro
возникают не только устойчивые к нему штаммы, но и зависимые от стрептомицина формы, способные развиваться только в присутствии данного антибиотика.
Описаны случаи, когда штаммы менингококка, МусоЬ. гапае и другие микроорганизмы развиваются лишь иа среде, содержащей от 100 до 150 мкг/мл стрептомицина.
Стрептомициноустойчивые и зависимые от стрептомицина штаммы обычно получаются из чувствительных форм микроорганизмов. Соотношение между чувствительными, устойчивыми и зависимыми от стрептомицина штаммами изображено на рис. 32.
Токсические и лечебные свойства стрептомицина
Токсичность стрептомицина сравнительно невелика. Для человека с массой 60 кг токсическая доза этого антибиотика составляет около 6 г. Обычно в клинике больному вводят единовременно около 1 г препарата. Длительное лечение больных большими дозами стрептомицина оказывает токсическое действие на VIII пару черепно-мозговых нервов, что приводит к расстройству (иногда очень сильному) равновесия. Нередко расстройство равновесия сопровождается частичной или полной потерей слуха.
Развитие вестибулярных нарушений и глухоты определяется не только длительностью периода лечения, но и дозой антибиотика, методами его введения, а также степенью очистки препарата.
Токсичность менее очищенных препаратов, применяемых в первый период получения стрептомицина, была более высокой; была связана с наличием в препаратах гистаминоподобных веществ, которые сами по себе довольно токсичны.
Стрептомицин в малых дозах не оказывает невротического действия. Поэтому использование антибиотика в небольших дозах в
229
сочетании с другими препаратами по существу снимает токсические действия стрептомицина.
Есть указания, что стрептомицин может оказывать определенное действие на эндокринную систему. Иногда при введении стрептомицина у больных наблюдается анафилактический шок. Хотя эти тяжелые осложнения, имеющие аллергический механизм, встречаются редко, о них необходимо знать.
Различные нарушения, связанные с токсичностью стрептомицина, не могут идти ни в какое сравнение с тем огромным лечебным эффектом, который имеет этот антибиотик. Основное применение антибиотика направлено на лечение заболеваний, вызываемых грамотрицательными и кислотоустойчивыми формами бактерий и, прежде всего, возбудителями разных форм туберкулеза.
Стрептомицин сравнительно быстро выводится из организма. Так, уже через 30 мин после подкожного введения с мочой выделяется около 35—40% введенного препарата; антибиотик необходимо вводить больному не менее 3—4 раз в сутки. Стрептомицин совершенно не всасывается из желудочно-кишечного тракта. При приеме его per os он не обнаруживается ни в крови, ни в моче больного. Однако в этом случае антибиотик оказывает сильный антибактериальный эффект на микрофлору кишечника.
Для того чтобы стрептомицин попадал в кровь больного, его необходимо вводить подкожно или внутримышечно.
Положительные результаты получены при лечении стрептомицином таких заболеваний, как туляремия, чума, коклюш и некоторые другие. Но наибольший эффект стрептомицина проявляется при лечении туберкулезных заболеваний (туберкулез верхних дыхательных путей, менингитный туберкулез, милиарный и инфильт-ратный туберкулез легких, туберкулез кожи и др.).
Следует подчеркнуть, что, пожалуй, ни в одной из областей педиатрии не достигнуты такие большие успехи в результате применения антибиотиков, как при лечении туберкулезного менингита. Применение стрептомицина в корне изменило течение и исход этого тяжелого заболевания. Если до использования стрептомицина смертность при туберкулезном менингите составляла 100%, то с появлением стрептомицина при своевременно начатом лечении значительная часть больных выживает. Обычно при лечении ту-беркулензого менингита стрептомицин применяется в сочетании с изониазидом (гидразид изоникотиновой кислоты). При лечении больных туберкулезом стрептомицин используется в комбинации с ПАСК (п-аминосалициловая кислота), фтивазидом, изониазидом, промизолом.
По данным Линкольна (1954), с 1930 по 1946 г. из 980 детей, больных туберкулезом, умерло 21,5%. С 1947 по 1951 г., после того как в практику вошли стрептомицин, ПАСК и промизол, из 421 больного умерло 5%, после 1952 г., когда дополнительно к стрептомицину и ПАСК начали применять изониазид, из 129 больных умерло 1,5%.
Большой интерес представляют данные по хирургическому ле
230
чению туберкулеза легких. Анализ 437 резекций легких, проведенных с 1934 по 1950 г., показал, что до применения стрептомицина послеоперационная смертность составляла в среднем 50%, после введения в хирургическую практику стрептомицина она снизилась до 11% (Okerholt et al., 1952). Применение стрептомицина особенно эффективно при туберкулезе верхних дыхательных путей, заболеваниях менингеальных и других серозных и слизистых оболочек.
При всех видах туберкулеза наибольший эффект получен при использовании стрептомицина в ранней или острой фазе процесса и наименьший — при обширных деструктивных изменениях в пораженных органах.
МАННОЗИДОСТРЕПТОМИЦИН (MANNOSIDOSTREPTOMYCIN) (Стрептомицин В)
Маннозидострептомицин выделен в 1947 г. из культуры актиномицета, образующего стрептомицин, методом противоточного распределения. По химическому строению антибиотик очень близок стрептомицину, но отличается от последнего наличием в молекуле маннозы.
стрептомицин
Маннозидострептомицин
Маннозидострептомицин образуется при определенных условиях развития культуры Str. griseus; антибиотик менее активен, чем стрептомицин (табл. 58).
Культуры Str. griseus, образующие стрептомицин, содержат фермент, способный превращать маннозидострептомицин в стрептомицин.
При соответствующем контроле процесса развития актиномицета — продуцента стрептомицина можно добиться минимального образования маннозидострептомицина, так как последний — менее активный препарат.
231
Таблица 58
Антибиотическая активность стрептомицина и маннозидострептомицина (из книги Шемякина, Хохлова и др., 1961)
Микроорганизм Минимальная подавляющая концентрация, мкг/мл Отношение активностей стрептомицина н маннозидострептомицина
трихлоргид-рата стрептомицин. трнхлоргид-рата маино-зидостреп-•смицина
Bacterium pneumoniae 1,53 5,70 0,27
Bacterium schottmulleri ...... 8,42 13,05 0,62
Bacterium typhi 9,94 12,20 0,81
Mycobacterium smegmatis ...... 1,38 6,80 0,20
Mycobacterium tuberculosis ...... 1,01 3,73 0,27
Staphylococcus aureus ........ 1,50 7,80 0,19
ДИГИДРОСТРЕПТОМИЦИН (DIHYDROSTREPTOMYCIN) (Антибиотик № 23572)
Стрептомицин при каталитическом гидрировании присоединяет два атома водорода и переходит в дигидрострептомицин (см. формулу / (Л) на с. 212).
Дигидрострептомицин по химиотерапевтическому и фармакологическому действию близок к стрептомицину. Соединение приобрело особое значение после того, как было установлено, что оно менее токсично, чем стрептомицин. Дигидрострептомицин не образует мальтола при обработке щелочью, стрептомицин в этих условиях образует мальтол:
firOH
М альтол
В настоящее время дигидрострептомицин получают в промышленных условиях в виде сульфата или гидрохлорида. До 1957 г. этот антибиотик получали только методом каталитического гидрирования стрептомицина. В 1957 г. японскими исследователями Имамура, Хори, Татсуока и другими было установлено, что Streptomyces humidus продуцирует антибиотик, идентичный дигидрострептомицину.
В качестве лечебного препарата применяют парааминосалициловую соль дигидрострептомицина (пасомицин). Пасомицин используют при лечении различных форм туберкулеза, гнойных процессов и других заболеваний.
Другими практически ценными препаратами дигидрострептомицина являются пантомицин (пантотеновокислая соль дигидрострептомицина) и аскорбиновокислая соль дигидрострептомицина.
232
НЕОМИЦИНЫ (NEOMYCINS) (Мицифрадин, фрадиомицин)
Ваксман и Лешевалье в 1949 г. из культуры Streptomyces fradiae, изолированной из почвенного образца, выделили новый широ-коспектровый антибиотик неомицин. При его изучении было установлено, что неомицин состоит из смеси антибиотиков, которая получила название «неомицинового комплекса». Комплекс включает неомицин А (неамин), неомицины В, С, D, Е и F. Неамин не обнаруживает антибиотических свойств в опытах in vitro.
В группу неомицинов входят родственные антибиотические вещества олигосахаридной природы: собственно неомицины, в том числе колимицин, мицерин, софрамицин, флавомицин, а также канамицины, синтезируемые Streptomyces kanamyceticus; группа фортимицинов, к которой относится собственно фортимицин, образуемый Micromonospora olivoasterospora. спорарицин, продуцируемый Saccharopolyspora hirsuta subsp. kobensis, саннамицины, продуцентом которых является Str. sannanensis, гентамицины и некото
рые другие вещества.
Продуцент неомицина Str. fradiae при росте на натуральных
средах неопределенного состава или на синтетических средах име-
ет желтовато-коричневый цвет, но растворимого пигмента не образует. При развитии на синтетических средах вначале образуется белый воздушный мицелий, который затем окрашивается в свет-
лый красновато-коричневый цвет. Спороносны обычно прямые без
спиралей, изредка лишь образуя отдельные случайные завитки.
Неомицин образуется как при поверхностном, так и при глубинном культивировании актиномицета на различных по составу средах. При поверхностном культивировании антибиотика образуется гораздо меньше, чем при глубинном выращивании. Антибиотик образуется при развитии Str. fradiae на синтетических средах, однако более высокий выход антибиотика наблюдается при росте актиномицета на средах с соевой мукой (рис. 33).
На синтетической среде ак-
Время культибироВания, сут
Рис. 33. Отношение между ростом Streptomyces fradiae, образованием неомицина и изменением pH культуры на натуральной и синтетической средах (по Villiemin et al., 1953):
1 — pH, t — неомицин на натуральной среде. S — неомицин на синтетической среде, 4 — мицелий на синтетической среде, б — мицелий на натуральной среде
тиномицет развивается лучше, чем на среде, содержащей соевую муку. Но биосинтез неомицина на синтетической среде почти в 8 раз ниже, чем на натуральной среде неопределенного состава.
233
На среде с повышенным содержанием соевой муки, глюкозы и крахмала биосинтез неомицина составляет до 8,8 мг/мл.
Некоторые ростовые вещества способствуют увеличению выхода неомицина на 50%. К таким веществам относятся ауксин и а-нафтилуксусная кислота, растворимые в смеси, состоящей из 90,5% этанола, 5% метанола и 4,5% воды. Наиболее эффективная доза ауксинов составляет 7 частей на миллион, внесенная в среду перед стерилизацией.
Стимулирующий эффект ауксинов проявляется в том случае, если процесс продолжается до 138—162 ч; в ранние сроки развития культуры этот эффект не проявляется.
Рнс. 34. Влияние следов ионов различных металлов на образование неомицина в среде с пептоном (по Waksman, 1953)
Установлено, что цинк играет существенную роль в процессе образования антибиотика. Оптимальная концентрация Zn в среде— 1 мг/л, поэтому использование дистиллированной воды для приготовления сред оказывает отрицательное действие на выход неомицина (рис. 34).
Степень аэрации культуры при биосинтезе неомицина должна быть несколько ниже, чем при образовании стрептомицина. Str. fradiae наряду с образованием неомицинового комплекса выделяет антибиотик фрадицин (C30H34N4O3), подавляющий развитие грибов, но неактивный в отношении бактерий.
Кроме Sir. fradiae неомициновый комплекс образует и Str. al-bogriseolus, но он не выделяет фрадицина.
Неомицины — основания, хорошо растворимые в воде и нерастворимые в органических растворителях. Наибольшая антибиотическая активность их проявляется при щелочной реакции среды.
В настоящее время установлена структура неомицина А, неомицина В и неомицина С.
234
о.
Неомицин В: Rj = H; R2-CH2NH2
Неомицин С; Rj—CH2NH2; R2=H
Неомициновый комплекс не теряет антимикробных свойств при длительном (до 2 лет) хранении как в виде растворов, так и в твердом состоянии. Неомицин активен против многих грамположи-тельных и грамотрицательных бактерий. Его антимикробный спектр сходен со спектром стрептомицина, однако действие неомицина отличается от действия стрептомицина. Так, например, неомицин подавляет развитие устойчивых к стрептомицину штаммов Mycobacterium tuberculosis, мало активен в отношении большинства видов Clostridium, Streptococcus, грибов, а также против вирусов и протозоа.
Антимикробный спектр неомицина
Л1 икроорганизм
Минимальная концентрация неомицина, подавляющая рост микроорганизма, мкг/мл
Streptococcus pyogenes................2,5—100
Streptococcus facealis ....... 10—100
Staphylococcus aureus ................0>4—10
Escherichia coli .....................1,0—10
Haemophilus influenzae................1,0—10
Pseudomonas aeruginosa ...............3,0—200
Salmonella sp.........................0,5—10
Shigella sp...........................0,2—10
Bacillus anthracis ......... 0,5—10
Характерно, что чувствительные к неомицину микроорганизмы приобретают устойчивость к нему в меньшей степени, чем к стрептомицину.
Антибиотический эффект неомицина в отношении многих видов бактерий выше, чем у стрептомицина (табл. 59).
235
Таблица 59
Бактериостатические н бактериоцидные свойства неомицина и стрептомицина по отношению к Escherichia coli
(по Waksman, 1953)
Концентрация антибиотика, мкг/мл бульона Число жизнеспособных клеток (млн.) на 1 мл после инкубации в течение
14 ч 28 ч
Без антибиотика 800,000 700
Стрептомицин, 5 80,000 40
Стрептомицин, 20 0,000 0
Неомицин,3 0,005 1,5
Неомицин, 15 0,000 0
Инокулят: 180 000 клеток Е. coli определялись чашечным методом.
в 1 мл бульона; жизнеспособные клетки
Результаты, приведенные в табл. 59, прежде всего показывают, что стрептомицин в концентрации 5 мкг/мл и неомицин в количестве 3 мкг/мл в отношении Е. coli выступают как бактериостатические антибиотики. Бактерицидные свойства этих веществ проявляются при более высокой концентрации. Эти данные свидетельствуют также о том, что неомицин даже в меньших концентрациях, чем стрептомицин, проявляет более сильное антимикробное действие в отношении Е. coli.
Терапевтические свойства неомицина более высокие, чем стрептомицина. Например, если для предохранения от гибели мышей, зараженных золотистым стафилококком, требуется 50 мкг стрептомицина на одну мышь, то неомицина при тех же условиях — всего лишь 3,5 единицы. При лечении заболевания, экспериментально вызванного культурой паратифозной палочки (Bad. schottmillleri), стрептомицином и неомицином получены следующие результаты (табл. 60).
Таким образом, из данных, приведенных в табл. 60, следует, что для получения лечебного эффекта при паратифозной инфекции
Таблица 60
Лечебные свойства стрептомицина и неомицина, выявленные в опытах на животных при лечении заболевания, вызванного паратифозной палочкой
Антибиотик
Доза на мышь, ед.
Выживаемость. %
Антибиотик
Стрептомицин
D »
75 100 200 400
0
27
86
100
Неомнцнн .........
»..............
»..............
Доза на мышь, ед. Выживаемость, %
25 0
50 90
75 100
236
стрептомицина требуется более чем в пять раз больше, чем неомицина.
Неомицин нашел определенное применение в медицинской практике. Он используется в качестве местного препарата в дерматологии, хирургии, оториноларингологии (для лечения заболеваний наружного и среднего уха, различных инфекций полости рта), при лечении некоторых заболеваний глаз, а также для борьбы со стафилококковым носительством среди медицинского персонала родильных домов.
Однако при применении неомицина в клинике следует иметь в виду его токсичность. По вопросу о токсических свойствах неомицина опубликовано много работ. Эти данные обнаруживают значительные колебания, которые, по-видимому, связаны с различным составом и степенью чистоты использованных препаратов.
Для мышей при подкожном введении LD50 для неомицина составляет 278 мг/кг, а при внутривенном введении — 55,6 мг/кг.
Применение неомицина вызывает глухоту и другие побочные явления, однако эти расстройства, как правило, обратимы и при прекращении применения антибиотика исчезают. Для организма человека неомицин более токсичен, чем стрептомицин.
К неомицинам следует отнести колимицин, образуемый Streptomyces fradiae var. spiralis, мицерин и некоторые другие антибиотики. Колимицин и мицерин по химической природе и по биологическим свойствам близки неомицину (колимицин идентичен неомицину В).
КАНАМИЦИНЫ (KANAMYCINS)
Умезава с сотрудниками в 1957 г. описал антибиотик канамицин, образуемый Streptomyces kanamyceticus. Позднее было установлено, что этот актиномицет образует три антибиотика: канамицин А, канамицин В и канамицин С.
По биологическим свойствам канамицин А (обычно канамици-ном называют его) сходен со стрептомицином и неомицинами. Его антибиотическая активность по отношению к Mycob. tuberculosis близка к стрептомицину, однако канамицин более активен в отношении Е. coli.
Антимикробный спектр канамицина
Микроорганизм
Staphylococcus aureus . . Streptococcus pyogenes . . Mycobacterium tuberculosis Bacillus anthracis . . . . Escherichia coli ..........
Haemophilus influenzae . . Salmonella sp..............
Vibrio cholerae............
Минина юная концентрация канамицина. подавляющая рост микроорганизма, мкг/мл
0,5—5,0 1,0—25 0,4—10 0,5—5,0 0,5—10 0,2—1,0 2,0—10
0,3—3,0
237
Положительным свойством канамицина является то, что устойчивость к нему у большинства чувствительных организмов развивается гораздо медленнее, чем к стрептомицину. Токсичность его ниже, чем у стрептомицина, и значительно ниже, чем у неомицинового комплекса.
Строение канамицина А, выясненное в 1958 г., может быть представлено следующей структурной формулой:
Канамицин А благодаря своим положительным свойствам нашел применение в медицине. Он используется в качестве противотуберкулезного препарата; с успехом может применяться для борьбы со стафилококковыми заболеваниями, а также для лечения сибирской язвы, гонореи и других инфекций, ие поддающихся лечению дугими антибиотиками.
В 1972 г. получена химическая модификация канамицина — амикацин — полусинтетический антибиотик, подавляющий рост патогенных бактерий, чувствительных и резистентных к канамици-ну, гентамицину и некоторым другим аминогликозидам.
238
ФОРТИМИЦИНЫ (FORTIMYCINS)
В 1976 г. из культуры Micromonospora olivoasterospora, изолированной из почв окрестностей города Хиросимы, выделены антибиотики фортимицин А и фортимицин В, из которых первый обладает наибольшей антибиотической активностью. Фортимицин А подавляет рост большинства грамотрицательных патогенных бактерий, устойчивых к другим аминогликозидам.
К группе фортимицинов относится спорарацин — аминогликозид, образуемый новым и редким подвидом лучистого грибка Saccharopolyspora hirsuta subsp. kobensis, выделенным в 1979 г. Строение спорарицина А аналогично строению фортимицина А.
К антибиотикам фортимицинам относятся саннамицин А и сан-намицин В, образуемые культурой нового вида Str. sannanensis.
Саннамицин А
ГЕНТАМИЦИНЫ (GENTAMYC1NS)
Гентамицины (А, Сь Си и Сг) образуются культурой Micromonospora purpurea. Комплекс антибиотиков обладает широким спектром биологического действия; он подавляет развитие грампо-ложительных и грамотрицательных бактерий, в том числе Proteus, Pseudomonas, не оказывает действия на грибы. Устойчивость к
239
гентамицинам проявляется относительно медленно и скачкообразно.
Все вышерассмотренные антибиотики (стрептомицины, группа неомицинов) относятся к аминогликозидным соединениям. Их
объединяет не только близкое строение, но и механизм биологического действия, связанный с нарушением считывания генетического кода.
К аминогликозидным антибиотикам относится также сизомицин.
СИЗОМИЦИН (SISOMYCIN)
Одним из перспективных антибиотиков, относящихся к группе аминогликозидов, является сизомицин. Этот антибиотик образуется культурой Micromonospora inyoensis и обладает широким спектром антимикробного действия. Причем, подобно стрептомицину, сизомицин проявляет наибольшую активность в щелочных условиях. Наивысшая антибиотическая активность антибиотика обнаруживается против штаммов Serratia sp. и индол-позитивных штаммов Proteus sp. Высокой чувствительностью к сизомицину обладают штаммы Pseudomonas aeruginosa.
Сизомицин по строению относится к группе гентомицина и имеет следующую структуру:
гарозамин
Сизомицин
240
Антимикробный спектр сизомицина
Микроорганизм
Staphylococcus aureus Streptococcus pneumoniae Escherichia coli . . . .
Proteus vulgaris . . . . Pseudomonas aeruginosa . Serratia sp.............
Минимальная концентрация, подавляющая рост микроорганизма. мкт]мл
0,4—0,5
0,06—0,3
0,5—4,0
0,5—4,0
0,3—25,0
0,5—12,0
Антибиотическая активность сизомицина аналогична антимикробной активности гигромицина, однако последний менее активен в отношении ряда микроорганизмов.
ГИГРОМИЦИН (HYGROMYCIN)
Питтенжер с сотрудниками в 1953 г. выделил из культуры Streptomyces hygroscopicus антибиотик гигромицин, также принадлежащий к группе аминогликозидов. Это антибиотическое вещество обладает широким антимикробным спектром: подавляет развитие грамположительных, грамотрицательных и кислотоустойчивых бактерий, а также некоторых актиномицетов.
Штаммы ряда бактерий, приобретшие устойчивость к стрептомицину или пенициллину, остаются чувствительными к гигромици-ну. Появляются также формы бактерий, резистентные к этому антибиотику.
В состав гигромицина входит дезоксисахар, соединенный гликозидной связью с гидроксильной группой производного дигидрок-сицинамановой кислоты, в свою очередь соединенной с инозамином.
ТЕТРАЦИКЛИНЫ И ХЛОРАМФЕНИКОЛ
В группу антибиотиков тетрациклинового ряда входят вещества, имеющие близкое химическое строение. Тетрациклиновые антибиотики привлекли большое внимание исследователей благодаря их важному практическому значению. Обладая широким антибиотическим спектром в отношении грамположительных и грамотрица-
241
тельных бактерий, риккетсий и ряда крупных вирусов, эти соединения нашли широкое применение в медицинской практике. Кроме того, некоторые из этих антибиотиков с успехом применяются в животноводстве как стимуляторы роста сельскохозяйственных животных и птиц. Ценность тетрациклиновых антибиотиков определяется их высокой биологической активностью и относительно низкой токсичностью.
К тетрациклиновым антибиотикам и родственным им соединениям, образуемым в процессе биосинтеза тремя микроорганизмами (Streptomyces aureofaciens, Str. rimosus, Nocardia sulphurea), относится не менее 34 соединений. На основе тетрациклиновых продуктов жизнедеятельности получен ряд полусинтетических препаратов, нашедших применение в медицинской практике.
К наиболее широко известным тетрациклиновым антибиотикам принадлежат тетрациклин, 6-деметилтетрациклин, 7-хлортетра-циклин, 7-хлор-6-деметилхлортетрациклин, 7-бромтетрациклин, 5-окситетрациклин, а также метациклин и доксициклин, полученные в результате химической модификации молекулы окситетрациклина. •
Первым был открыт 7-хлортетрациклин, с которого мы и начнем рассмотрение этой группы антибиотических веществ.
ХЛОРТЕТРАЦИКЛ ИН (CHLORTETRACYCLIN) (Ауреомицин, биомицин, дуомицин, ауреомикоин, антибиотик А-377)
В 1948 г. из почв Миссури Дуггаром был выделен новый вид актиномицета — Streptomyces aureofaciens, образующий антибиотик ауреомицин. Ауреомицин получил свое наименование по видовому названию актиномицета продуцента этого антибиотика aureofaciens и золотистой окраски кристаллического продукта. В настоящее время этому антибиотику, исходя из его химического строения, дано общепринятое название — хлортетрацикли н.
В промышленности хлортетрациклин выпускается под названиями биомицин, ауреомицин и дуомицин.
Streptomyces aureofaciens — аэробный организм, хорошо развивающийся при температуре 26—28°С как на твердых агаризован-ных, так и в жидких средах.
Кроме хлортетрациклина этот организм в значительном количестве (до 0,5—0,7 мкг/мл) образует витамин Bi2, тетрациклин, а также некоторые другие антибиотические вещества.
Условия образования хлортетрациклина
В составе сред для образования хлортетрациклина могут быть использованы различные источники углерода (сахароза, мальтоза, глюкоза, крахмал или другие водорастворимые углеводы).
При получении кормовых препаратов хлортетрациклина рекомендуется использовать в качестве источника углерода в среде
242
гидролизованную в течение часа картофельную мезгу (продукт отхода картофельно-крахмальных заводов).
Наилучшим среди источников углерода, обеспечивающих хороший рост актиномицета и образование хлортетрациклина, считается глюкоза, которая почти полностью потребляется организмом через 40—45 ч развития. В качестве источников углерода Str. aureofaciens использует также жиры, некоторые органические кислоты (например, молочную), добавление которых к среде с кукурузным экстрактом способствует повышению образования хлортетрациклина, а также крахмал и глицерин. Лактоза, сахароза, галактоза и арабиноза некоторыми штаммами актиномицета не используются.
В качестве источников азота, оказывающих благоприятное действие на развитие актиномицета и биосинтез антибиотика, могут применяться аммонийные соли, некоторые аминокислоты, а также различные азотсодержащие вещества растительного и животного происхождения (кукурузный экстракт, мясной экстракт и др-).
На средах, содержащих 50 мг/мл глюкозы, повышение источника азота до 4,0 мг/мл оказывает токсическое действие на рост актиномицета. Обычно для получения хлортетрациклина используют среду следующего состава (%):
Сахароза ............... 3,0
Кукурузный экстракт .... 1,0
СаСО3 .................. 1,0
(NH4)2SO4............... 0,2
NH4CI .................. 0,1
Установлено, что лучшим начальным pH является 6,0—7,0. Дли-
тельность процесса развития актиномицета, дающая максимальное образование антибиотика, составляет 30—40 ч.
При культивировании Str. aureofaciens на среде с соевой мукой, кукурузным экстрактом и углеводами стимулирующее влияние на выход хлортетрациклина оказывают отдельные аминокислоты. Наибольшее стимулирующее действие на биосинтез антибиотика оказывают валин, оксипролин и тирозин.
В процессе развития продуцента хлортетрациклина в среде наблюдается изменение содержания аминокислот: примерно к 15 ч явно
О 26 68 72 96 120 166
Время культиВироВания, ч
Рис. 35. Сравнение образования летучих
падает содержание основных аминокислот, содержание глутаминовой кислоты понижается незначительно; к
кислот н накопления хлортетрациклина мицелием, полученным при различных посевных средах при различном значении исходного pH:
1 — хлортетрациклин, 2 — летучие кислоты
243
20-му часу наблюдается падение количества аспарангиновой кислоты. Интенсивный биосинтез антибиотика происходит после заметного падения содержания в среде основных аминокислот.
Существенное значение на ход развития продуцента и биосинтеза хлортетрациклина оказывает состав среды, на которой выращивается посевной материал актиномицета. Образование антибиотика культурой Str. aureofaciens зависит не только от состава посевной среды, но и от ее начального pH (рис. 35).
На выход антибиотика существенное влияние оказывает также возраст посевного мицелия актиномицета; образование хлортетрациклина значительно снижается, если мицелий выращивается более 30 ч (табл. 61).
Таблица 61
Влияние возраста инокулята на биосинтез хлортетрациклина
(по Макаревич и Лазниковой, 1961)
Среда для образования антибиотика
Возраст инокулата (Ч) 24 | 30 | 44
количество хлортетрациклина (мкг/мл)
Кукурузная ...........................
Кукурузная (обогащенная)..............
Арахисовая............................
Подсолнечная..........................
1710 1650 1590
3040 3260 2660
4045 3660 3530
4120 4030 3555
Данные, приведенные в табл. 61, свидетельствуют, что оптимальный возраст посевного мицелия находится в пределах 24—30 ч. Количество посевного материала, обеспечивающее высокий уровень биосинтеза хлортетрациклина, должно составлять 5—6 объемных процентов.
Влияние посевной среды сказывается не только на образовании антибиотика, но и на всем процессе обмена веществ актиномицета, что в свою очередь отражается на характере и скорости потребления углеводов, окислительной способности мицелия, образовании органических кислот и самом характере биосинтеза антибиотика (рис. 35).
Важное значение в биосинтезе хлортетрациклина имеет фосфор, существенно влияющий на рост и развитие актиномицета. При добавлении к среде фосфата калия (К2НРО4) происходит резкое изменение обмена веществ актиномицета: усиливается потребление сахара и аммония, снижается активная кислотность субстрата, в среде накапливается пировиноградная кислота. Рост мицелия вначале ускоряется, но после использования аммиака замедляется; образование антибиотика подавляется, причем подавление анти-биотикообразования происходит значительно сильнее угнетения роста биомассы актиномицета. Некоторые данные по влиянию раз
244
личных концентраций фосфора на рост актиномицета и образование хлортетрациклина приведены в табл. 62 и на рис. 37.
Таблица 62
Изменения роста, образования антибиотика и содержания нуклеиновых кислот культуры Streptomyces aureofaciens в зависимости от концентрации фосфора (по Biffi et al., 1954)
КгНРО., % Увеличение количества мицелия за период от 24 до 48 ч, % Количество антибиотика, % Количество мицелия через 48 ч, % РНК. мкг/мл ДНК. мкг/мл
через 24 ч через 48 ч через 24 ч через 48 ч
0 48 100 100 495 380 105 140
0,3 29 50 83 720 510 130 165
0,5 11,5 21 68 900 780 160 190
Избыток фосфора в среде определенным образом сказывается на содержании нуклеиновых кислот в мицелии актиномицета, а также тормозит окисление пировиноградной кислоты, которая в результате этого накапливается в культуральной жидкости.
Избыток ортофосфата в среде оказывает угнетающее действие на поглощение кислорода отмытым мицелием Str. aureofaciens. Мицелий, выросший на среде с 15 мг% фосфора, имел более высокую окислительную способность, чем мицелий, выросший при избытке фосфора (35 мг%). В первом случае мицелий поглощает 68% кислорода от контроля и 62% идет на окисление пировиноградной кислоты, во втором случае — соответственно 34 и 51%.
Наиболее заметное действие фосфора на биосинтез антибиотика наблюдается в первую фазу развития актиномицета, в период интенсивного роста организма и бурно протекающей синтетической деятельности. В этот период развития актиномицета избыток фосфора способствует значительному увеличению содержания нуклеиновых кислот в мицелии актиномицета.
При внесении фосфора в среду в период замедленного роста актиномицета, сопровождающегося затуханием синтетической деятельности, снижение биосинтеза антибиотика относительно невелико. В данных условиях фосфор в мицелии накапливается в виде лабильных и стабильных фосфорных соединений с образованием больших количеств волютина.
Оптимальная концентрация фосфора в среде, обеспечивающая наибольший выход хлортетрациклина, составляет 50—100 мкг/мл и зависит от штамма актиномицета.
В среде с 1% кукурузного экстракта содержится около 0,008% фосфора, что вполне достаточно для нормального роста актиномицета и биосинтеза антибиотика.
В ряде лабораторий мира были проведены исследования по изучению большого числа веществ с целью выяснения их стимулирующего действия на биосинтез хлортетрациклина. Установлено наличие некоторых соединений, специфически стимулирующих биосин-
245
тез изучаемого антибиотика. Так, п-диметиламинобензоальдегид, добавленный к синтетической среде в количестве 100 мкг/мл, увеличивает биосинтез хлортетрациклина культурой Str. aureofaciens 536 в среднем на 40%.
(CH3)2N
сно
п-Димегиламинобензоальдегид
При этом показано, что п-диметиламинобензоальдегид не оказывает существенного влияния на физиологические показатели культуры актиномицета: потребление источников азота и углерода, изменение pH и гН2 среды, накопление биомассы (рис. 36). Следовательно, п-диметиламинобензоальдегид обладает специфическим действием именно на процесс биосинтеза молекулы хлортетрациклина.
п-Диметиламинобензоальдегид в концентрации 4 мкг/мл, как показали Вёлвард и Галяма в 1974 г., стимулирует выход хлортетрациклина и высокоактивным производственным штаммом Str. aureofaciens NMU. Одновременно с этим содержание хлортетрациклина в смеси тетрациклиновых антибиотиков повышается с 86,5 до 88—100%.
А
^180 | 160 -^140
- 120
Is - § 100 S 4-i
8 Я «7 53 S 6
80
60
60
20
-30
-10
-20 §
0 10 20 30 W 50 ВО 70 Время купыпиВиродания, у
X-----ХЗ
•x----x \ Контроль
x-----x i
о------о l Опыт p-0,02% п-диметиламино-
o—o J бензо альдегида)
е
Рис. 36. Влияние п-диметиламинобензоальдегида на рост Streptomyces aureofaciens, потребление азота и изменение гН2 среды (Л) и образование хлортетрациклина (5) (по Егорову и Барановой, 1959):
/ — биомасса, И — общий азот, III— rHj
246
Специфически стимулирует биосинтез хлортетрациклина и роданистый бензил:
ch2scn
Роданистый бензил
Неорганический фосфор [мг^мп] Рис. 37. Зависимость образования хлортетрациклина от содержания фосфора и роданистого бензила в среде (по Гоштялек, Янечек и др., 1959):
1— среда с 2*10—6 М роданистого бензила, 2 — среда без роданистого бен-аила
Это соединение в концентрации 1 -10-57W способствует повышению выхода антибиотика (штамм В. и G. Str. aureofaciens) почти на 200% по сравнению с контролем.
Повышение концентрации фосфора в среде приводит к снижению биосинтеза хлортетрациклина как в среде, не содержащей роданистого бензила, так и при наличии последнего (рис. 37). Следовательно роданистый бензин не устраняет угнетающего действия избытка фосфата на биосинтез хлортетрациклина. Стимулирующее действие его проявляется лишь в условиях нормального развития актиномицета и нормально протекающей биосинтетической деятельности.
Ионы железа снижают биосинтез хлортетрациклина, что, по-видимому, связано со способностью ионов железа образовывать с антибиотиком комплекс, который связывается с клетками продуцента, что в свою очередь и тормозит биосинтез антибиотика.
В процессе биосинтеза молекулы хлортетрациклина существенную роль играет превращение пировиноградной кислоты в уксусную.
Согласно гипотезе, высказанной Робинсоном (1955) и Вудвордом (1956), биосинтез молекулы тетрациклинов осуществляется в результате конденсации и последующей циклизации 9 молекул уксусной кислоты. Работами ряда авторов показаны возможность непосредственного включения ацетата в молекулу окситетрациклина. В соответствии с этими данными процесс окислительного декарбоксилирования пировиноградной кислоты следует рассматривать как одно из звеньев в цепи реакций, приводящих к образованию ряда циклических антибиотиков.
Изучение физиологического механизма процесса биосинтеза молекулы хлортетрациклина позволило нам заметить ряд интересных закономерностей.
В процессе развития актиномицета на синтетической среде, где в ка-
247
честве источника углерода использовалась глюкоза, методом хроматографии на бумаге был обнаружен ряд органических кислот: уксусная, пировиноградная, янтарная, молочная, а-кетоглютаровая, яблочная и др. Вместе с тем каких-либо закономерностей в образовании этих кислот и их изменений в среде по ходу развития'актиномицета установить не удалось. Исключением из этого факта была пировиноградная кислота (рис. 38 и 39).
На графиках показано, что в период первой фазы развития актиномицета (до 23 ч) в среде наблюдается максимальное накопление пировиноградной кислоты, антибиотик образуется в небольшом количестве. Во вторую фазу развития количество пировиноградной кислоты снижается, но резко возрастает биосинтез хлортетрациклина. Таким образом, падение количества пировиноградной кислоты в среде сопровождается увеличением концентрации антибиотика.
Зная указанную закономерность, мы решили затормозить превращение кислоты в культуре актиномицета с помощью арсенита натрия (мышьяковистокислый натрий), который, как известно, специфически блокирует процесс окислительного декарбоксилирования пировиноградной кислоты, и проследить дальнейший процесс биосинтеза хлортетрациклина.
Опыты показали, что с повышением концентрации арсенита натрия образование антибиотика резко снижается (табл. 63). Вместе с тем повышение концентрации арсенита натрия тормозит и развитие актиномицета.
Таблица 63 Влияние различных концентраций мышьяковистокислого натрия
на биосинтез хлортетрациклина
(по Барановой и Егорову, 1963)
Антибиотик Концентрация NaaAsO4> М
0 ыо-* 5-10-» 7- 1и-• 3-I0-*
мкг/мл 810 510 135 57 25 10
% от контроля .... 100 63 17 7 3 1.1
При концентрации арсенита натрия в среде, равной Ы0~5М, биосинтез антибиотика к 48—72 ч развития составляет около 65% от контроля. Однако такая концентрация арсенита практически не влияет на рост актиномицета. Присутствие арсенита в субстрате резко тормозит дальнейшее превращение пировиноградной кислоты; накопление ее в среде достигает ПО мг%. В контроле пировиноградная кислота практически отсутствует (рис. 38).
Увеличение концентрации мышьяковистокислого натрия в 5 раз весьма резко тормозит включение в обмен актиномицета пировиноградной кислоты, которая в результате этого в значительно большом количестве (до 300 мг%) накапливается в среде (рис. 39).
248
Б
Биомасса через 48 ч
Рис. 38. Влияние арсенита натрия (1-Ю-5 М) на биосинтез хлортетрациклина (А) и развитие Streptomyces aureofaciens (Б) (по Барановой и Егорову, 1963):
1 — хлортетрациклнн (контроль), 2 — пировиноградная кислота (контроль), 3 — хлортетрацикл ин (среда с As), 4 — пировиноградная кислота (среда с As)
5
Рис. 39. Влияние арсенита натрия (5- 10~в М) иа биосинтез хлортетрациклина (А) и развитие Streptomyces aureofaciens (Б) (по Барановой и Егорову, 1963).
Обозначения см. на рис. 38
В связи с этим биосинтез хлортетрациклина резко снижен, количество антибиотика составляет всего 8% от контроля.
Известно, что при избытке фосфора в среде также происходит нарушение углеродного обмена, в результате чего в субстрате накапливается пировиноградная кислота и значительно снижается образование антибиотика.
Наши результаты (габл. 64) подтвердили эти выводы.
Таблица 64
Влияние концентрации фосфора (КН„РО4) в среде иа рост актиномицета и биосинтез хлортетрациклина
(по Барановой н Егорову, 1963)
Концентрация фосфора ь среде, мг % Время, культивирования, ч Масса сухого мицелия, мг % Пировиноградная кислота, мг % Количество антибиотика
мкг/мл % к контролю
5 (контроль) 24 875 2,6 160 100
48 790 —- 720 100
72 750 — 800 100
15 24 810 20 60 37
48 666 2 235 32
72 655 2 204 25
25 24 838 24 60 37
48 695 2 НО 15
72 680 2 120 15
35 24 770 30 60 37
48 682 2 60 8
72 668 2 80 10
Избыток фосфора в среде не влияет на рост актиномицета, но резко снижает выход антибиотика. Снижение образования антибиотика прямо пропорционально концентрации фосфора.
Сравнение динамики изменения содержания пировиноградной кислоты в среде при наличии в субстрате избытка фосфора и арсенита натрия позволяет заметить, что в первом случае пировиноградная кислота накапливается в субстрате в первую фазу развития актиномицета (до 24 ч), а затем ее содержание резко падает, тогда как при наличии в среде арсенита натрия количество пировиноградной кислоты возрастает по ходу развития актиномицета, достигая к 72 ч роста 100—260 мг %.
Непосредственные опыты по влиянию арсенита натрия на окислительное декарбоксилирование пировиноградной кислоты отмытым от среды мицелием актиномицета Str. aureofaciens показали, что в присутствии этого ингибитора (например, при концентрации в Ы0~4М) происходит полная остановка окисления кислоты мицелием.
Следовательно, блокирование участия пировиноградной кислоты, образующейся в процессе жизнедеятельности актиномицета, в обмене продуцента хлортетрациклина приводит к остановке образования антибиотика.
250
Использование меченых соединений показало, что биосинтез тетрациклиновых структур происходит через малонил-КоА. Последний образуется из уксусной кислоты (ацетил-КоА) и бикарбоната при участии АТФ:
СН3—СО—SKoA + НСО7 + АТФ — ООС—СН2—СО—SKoA +
+ Н+ + АДФ + НРО4
Таким образом, уксусная кислота является исходным «кирпичиком» для построения тетрациклиновой молекулы. Схематически этот процесс можно изложить следующим образом.
Образовавшийся из ацетил-КоА малонил-КоА подвергается процессу конденсации и циклизации. Конденсация молекул малонила происходит с одновременным процессом декарбоксилирования:
Примечание. Ч. -места декарбоксилирования
Затем идут реакции, связанные с формированием функциональных групп (метильных, гидроксильных и др.).
Существенное значение в процессе образования хлортетрациклина имеет хлор. Обычно источником хлора служат неорганические соли (NaCl, MgCl3 и др.). Однако продуцент хлортетрациклина может использовать для биосинтеза антибиотика хлор органических соединений (например, хлор жирных кислот).
Изменение концентрации хлора в среде оказывает заметное влияние на биосинтез хлортетрациклина. Так, увеличение концентрации NaCl от 0 до 0,4% способствует образованию от 2800 до 6000 мкг/мл антибиотика культурой Str. aureofaciens ЛСБ-2201.
Важную роль в процессе биосинтеза хлортетрациклина играет аэрация. При глубинном выращивании актиномицета непрерывная
251
аэрация культуры позволяет получить высокий уровень биосинтеза хлортетрациклина (до 5 мг/мл). Короткие перерывы в аэрации культуры приводят к резкому снижению образования антибиотика. Культура наиболее чувствительна к перерывам в аэрации в период между 6-м и 12-м часом развития. Один десятиминутный перерыв в этот период развития актиномицета понижает выход хлортетрациклина до 50% по сравнению с контролем. Роданистый бензил, добавленный к среде в концентрации 2,5-10~5М, снимает вредное действие перерывов аэрации на биосинтез этого антибиотика.
Ухудшение аэрации культуры или увеличение концентрации источника неорганического фосфора в среде способствует образованию изохлортетрацикл ина; биосинтез хлортетрациклина при этих условиях уменьшается.
При развитии Str. aureofaciens на средах, содержащих хлор, происходит образование промежуточного продукта биосинтеза молекулы хлортетрациклина. Это вещество по ряду признаков близко к соединению 7-хлор-5-а (11-а)-дегидротетрациклину; биологической активностью оно не обладает.
Образование хлортетрациклина культурой Str. aureofaciens обратно пропорционально активности ферментов цикла трикарбоновых кислот (ЦТК). Снижение окислительной способности ферментов цикла трикарбоновых кислот, по-видимому, связано с использование КоА для синтеза углеродной цепочки, из которой образуется молекула хлортетрациклина.
Изучая активность ферментов ЦТК у образующих антибиотик и неактивных штаммов Str. aureofaciens, установлено, что у неактивного штамма ферментная активность в 2—5 раз выше, чем у активного штамма. Хлортетрациклнн подавляет активность аце-тил-КоА-карбоксилазы у активного штамма продуцента этого антибиотика почти на 70%, а у неактивного штамма — на 57%.
Хлортетрациклнн выделяют из культуральной жидкости после отделения от нее мицелия экстракцией, осаждением или адсорбцией.
Впервые химическое строение хлортетрациклина установлено в 1952 г. Стефенс с сотрудниками.
Хлортетрациклнн слабо растворим в обычных органических растворителях, растворим в воде (0,55 мг/мл при 25°С) и нерастворим в эфире.
252
Антибиотические свойства хлортетрациклина
Хлортетрациклин обладает наибольшей антибиотической активностью в кислой среде (pH 3,5—4). В щелочной среде антибиотик быстро разрушается и, следовательно, его антимикробные свойства резко снижаются. При pH 14,0 хлортетрациклин инактивируется на 50% уже через 40 с, а при pH 7,6— через 12 ч. При хранении антибиотика в воде в течение 7 сут при 37°С сохраняется около 68,5% первоначальной активности.
Стабильность хлортетрациклина зависит от солей, в виде которых он приготовлен. Солянокислый хлортетрациклин в герметически закрытом состоянии сохраняется при 20—24°С в течение 36 месяцев. Эта же соль антибиотика в виде таблеток стабильна в течение 48 месяцев хранения.
Хлортетрациклин обладает in vitro высокой активностью в отношении многих видов грамположительных, грамотрицательных и кислотоустойчивых бактерий, ряда риккетсий, крупных вирусов и простейших, т. е. имеет широкий спектр биологического действия.
В большинстве известных случаев хлортетрациклин обладает бактериостатическим действием. Следовательно, если антибиотик длительное время присутствует в среде одновременно с чувствительными к нему микроорганизмами, то после разрушения препарата или отделения клеток микроба от антибиотика основная масса бактерий вновь начинает развиваться. Бактериостатическое действие антибиотика проявляется лишь при определенных концентрациях препарата. При увеличении концентрации хлортетрациклина в среде он может оказывать и бактерицидное действие.
У чувствительных к хлортетрациклину микроорганизмов обнаруживается устойчивость к его действию. Однако эта резистентность развивается довольно медленно, гораздо медленнее, чем, например, по отношению к стрептомицину. Широкое применение хлортетрациклина в клинической практике способствует возникновению и нарастанию числа устойчивых к нему форм микробов.
Применение хлортетрациклина
Хлортетрациклин — наиболее ценный препарат для медицинской практики по сравнению с такими антибиотиками, как стрептомицин и пенициллин. Наиболее рационально применение его при лечении заболеваний, возбудители которых устойчивы к действию пенициллина или стрептомицина. Хлортетрациклин с успехом применяется при лечении бактериальных пневмоний, бруцеллеза, туляремии, коклюша, скарлатины, сибирской язвы и других бактериальных заболеваний. Кроме того, хлортетрациклин может использоваться при терапии различных форм сыпного тифа, пятнистой лихорадки и других риккетсиозов, а также некоторых вирусных заболеваний (трахомы, венерической лимфогранулемы и др.).
Хлортетрациклин назначают per os равными дозами 3—4 раза
253
в сутки. Каждая доза антибиотика не должна превышать 500 мг, т. е. ежедневная доза равна 1,5—2 г.
При применении хлортетрациклина не наблюдается серьезных осложнений или побочных реакций, связанных с токсичностью. Однако у некоторых больных хлортетрациклин может вызывать боли в кишечике, понос, рвоту.
В последнее время появился ряд сообщений о тяжелых случаях поражения печени после приема больших доз хлортетрациклина или других антибиотиков этой группы.
Хлортетрациклин иногда применяется в сельском хозяйстве. Добавление небольших доз хлортетрациклина к корму птиц и сельскохозяйственных животных (телята, ягнята, свиньи и др.) увеличивает у них скорость роста и, следовательно, массу.
ОКСИТЕТРАЦИКЛИН (OXYTETRACYCLIN)
(Террамицин, оксимикоин, риомицин)
Окситетрациклин или, как впервые этот антибиотик был назван, террамицин, образуется актиномицетом Streptomyces rimosus. Актиномицет выделен Финли, Хобби и другими в 1950 г. из почвы и был назван rimosus (щелистый, с трещинами), потому что при развитии на поверхности агаровой среды образуются колонии с трещинами, края которых несколько приподняты. Окраска колоний актиномицета бледно-желтая.
Кроме Str. rimosus окситетрациклин образуется и другими видами актиномицетов: Str. griseoflavus, Str. armilatus, Sir. aureofaciens var. oxytetracyclini. Однако получение антибиотика и все сведения о его образовании связаны с Str. rimosus.
Окситетрациклин образуется актиномицетом при культивировании его в жидкой среде в условиях достаточной аэрации. Обычно для образования антибиотика используют среду следующего состава (%):
Кукурузный экстракт (сухое вещество) 0,5
Крахмал ........................... 3,0
Аммоний сернокислый ............... 0,4
Натрий хлористый................... 0,5
Карбонат кальция .................. 0,5
При развитии Str. rimosus через 24—48 ч происходит образование глубинных спор актиномицета, после чего наблюдается развитие вторичного мицелия. Рост актиномицета продолжается в течение 96—120 ч. Образование глубинных спор у Str. rimosus сопровождается автолизом части гиф и выделением в среду определенного количества белкового азота. Раннее образование спор в культуре с последующей сменой вегетативных поколений гиф не может не отразиться на качестве посевного материала, используемого в опытах и на производстве.
Количество посевного материала оказывает существенное влияние на рост и развитие Str. rimosus и образование окситетрациклина; возраст посевного материала практически не влияет на рост и
254
развитие актиномицета и на биосинтез антибиотика. Увеличение количества посевного материала до 5—8 объемных процентов способствует накоплению большого количества мицелия актиномицета в период между 40—48 ч развития и большому потреблению аммонийного источника азота. Все это приводит к увеличению процесса биосинтеза антибиотика.
Известно, что максимальный биосинтез антибиотика у многих
0 10 20 30 W 50 60 70 80 90 100 110
время культивирования, Ч
Рис. 40. Сравнение динамики образования окситетрациклина (/) и хлортетрациклина (2) (по Орловой и др., 1959)
актиномицетов происходит в период общего замедленного роста микроорганизма. Сравнивая максимум накопления антибиотиков у Str. aureofaciens и Str. rimosus, можно установить, что максимум наступает позже, чем максимум
накопления окситетрациклина образования хлортетрациклина
(рис. 40). Продуктивность мицелия Str. rimosus выше, чем продуктивность мицелия Str. aureofaciens.
Продуцент окситетрациклина в качестве источника азота может
использовать аммонийные соли и нитраты. Причем аммонийная форма азота потребляется организмом лучше, чем нитратная. Str. rimosus, как и многие другие актиномицеты, способен синте-
зировать необходимые для роста и развития аминокислоты из аммонийной или нитратной форм азота. Аминокислоты, добавлен-
ные к среде, хорошо используются организмом, но это существенно не влияет на процесс биосинтеза окситетрациклина.
Из источников углерода Str. rimosus использует крахмал, глюкозу, мальтозу, галактозу, глицерин и др., но не потребляет лакто-
зу и сахарозу.
Продуцент окситетрациклина достаточно хорошо использует некоторые органические кислоты (молочная, пировиноградная, янтарная, фумаровая, лимонная); молочная кислота оказывает наиболее сильное стимулирующее действие на биосинтез окситетрациклина. Молочная кислота, содержащаяся в кукурузном экстракте, по-видимому, имеет благоприятное значение для образования окситетрациклина. Добавление молочной кислоты к среде с кукурузным экстрактом оказывает еше большее влияние на образование антибиотика. По-видимому, это связано с тем, что из молочной кислоты в процессе ее дегидрирования в присутствии фермента коде-гидразы легко образуется пировиноградная кислота:
СН3СНОНСООН + Ко СН3СОСООН + КоН2
Дальнейшее декарбоксилирование пировиноградной кислоты приводит к образованию уксусной кислоты
СН3СОСООН СН3СООН + СО2
255
которая и принимает непосредственное участие в образовании тетрациклиновых структур.
Продуцент окситетрациклина может использовать жиры, причем Str. rimosus использует жиры интенсивнее, чем Str. aureofaciens.
Важную роль в процессе развития актиномицета и биосинтеза окситетрациклина играют фосфор и железо. От концентрации фосфора в среде зависят скорость потребления углеводов, образование органических кислот, характер развития продуцента (накопление нуклеиновых кислот и волютина в мицелии актиномицета) — все это приводит к изменению процесса биосинтеза антибиотика. Str. rimosus довольно быстро использует внесенный в среду фосфор. Увеличение концентрации фосфора в среде по сравнению с его оптимальным количеством (около 6 мг %) приводит к возрастанию биомассы мицелия актиномицета, к увеличению скорости потребления углеводов, снижению pH среды и тормозит образование антибиотика. Внесение дополнительных количеств фосфора по ходу развития культуры приводит к резкому снижению выхода антибиотика (рис. 41). Установлено, что внесение дополнительных количеств фосфора в более ранние периоды развития актиномицета оказывает наибольшее воздействие.
Повышение содержания в среде минерального источника фосфора (К2НРО4) на ранних стадиях развития актиномицета (16—24 ч) стимулирует интенсивный синтез нуклеиновых кислот, в особенности ДНК, и усиливает процесс спорообразования.
Действие железа на биосинтез окситетрациклина в значительной степени зависит от присутствия в среде ненасыщенных масел.
Рис. 41. Влияние избыточного количества фосфора, внесенного в среду на разных стадиях развития Streptomyces rimosus, на рост актиномицета (Л) и образование окситетрациклина (Б)
(по Зайцевой и Михайловой, 1961):
/—контроль (6 мг% Р), 2 — добавка 5 мг% Р через 16 ч; 3 — добавка 5 мг% Р через 24 ч, 4 — добавка 5 мг% через 48 ч, 5 — трехкратная добавка 15 мг% Р
256
Ионы железа катализируют образование из масел пероксидных веществ, которые и оказывают токсическое влияние на процесс биосинтеза антибиотика.
Получение методом индуцированного мутагенеза и селекции наиболее продуктивного штамма, а также изучение условий биосинтеза антибиотика обеспечили выход окситетрациклина до 10— 12 тыс. мкг/мл.
Пути образования молекулы окситетрациклина аналогичны путям биогенеза молекулы хлортетрациклина (с. 251). Использование мутантов микроорганизмов, потерявших способность к биосинтезу того или иного вещества, может оказать помощь в раскрытии путей биосинтеза определенных микробных продуктов жизнедеятельности.
Попытка использовать неактивные мутанты была предпринята для выяснения механизма биосинтеза 7-хлортетрациклина. Из неактивного мутанта Str. aureofaciens выделено вещество (кофактор 1), обладающее высокой активирующей способностью при биосинтезе хлортетрациклина.
В результате действия мутагенных факторов (рентгеновское и ультрафиолетовое излучение, этиленимин) на высокоактивные штаммы Str. rimosus удалось получить мутанты, потерявшие способность к биосинтезу окситетрациклина. При совместном культивировании двух таких мутантов, условно названных «белым» и «черным», удается получить образование антибиотика. Образование окситетрациклина этими мутантами происходит при переносе мицелия «черного» мутанта в культуральную жидкость «белого» мутанта. Результаты опыта показали, что «белый» мутант способен образовывать и выделять в окружающую среду какое-то вещество (или несколько веществ), позволяющих «черному» мутанту осуществлять биосинтез окситетрациклина.
Образование антибиотика «черным» мутантом стимулируют также культуральные жидкости многих видов актиномицетов, но не плесневых грибов, дрожжей и ряда видов бактерий. По всей вероятности, эти вещества имеют характер кофермента, участвующего в биосинтезе антибиотика.
Структура окситетрациклина была установлена Хокстейн, Стефенс и другими в 1952—1953 гг. Они впервые показали тетрациклиновый характер антибиотиков как новый тип химической структуры.
Окситетрациклин
Строение окситетрациклина отличается от строения хлортетра-
9—742
257
циклина тем, что, во-первых, в его молекуле ион хлора в положении 7 отсутствует, как это имеет место в молекуле хлортетрациклина; во-вторых, молекула окситетрациклина в положении 5 содержит оксигруппу (ОН), а у хлортетрациклина в этом положении находится водород (Н).
По биологическим и фармакологическим свойствам окситетрациклин близок хлортетрациклину.
Антимикробный спектр окситетрациклина весьма близок спектру тетрациклина.
Антимикробный спектр окситетрациклина
Микроорганизм Минимальная концентрация
антибиотика, подселяющая рост микроорганизма, мкг/мл
Staphylococcus aureus.......... 0,1—2,0
Streptococcus pneumoniae . . . 0,05—1,6
Neisseria gonorrhoeae.......... 0,4—6,0
Haemophilias influenzae . . . 0,3—10
- Escherichia coli ....... 0,5—100
Proteus vulgaris ....... 10—100
Salmonella sp.................. 0,5—10
Brucella sp.................... 0,5—2
Rickettsia sp.................. 1,0—10
Mycoplasma pneumoniae ... 0,4
Vibrio cholerae................ 0,2—8,0
Таблица 65
Стабильность различных солей окситетрациклииа и его лекарственных форм (по Тебякиной и Дружининой, 1961)
Препарат окситетрациклииа Исходная активность, ед/мг или ед/мл Стабильность за время наблюдения (месяцы)4
Хлоргидрат 845—860 36—48
Основание из хлоргидрата 845—931 36—48
Основание из культуральной жидкости (экспериментальная серия) 840 3
Таблетки из основания 460—550 36—48
Таблетки из хлоргидрата 357—528 24—36
Драже из хлоргидрата -f- нистатин 254—255 12
1 Стабильность проверялась в герметически закрытых ампулах при хранении в темном помещении прн 20—24°С.
В отличие от хлортетрациклина окситетрациклин не так быстро разрушается при щелочной реакции среды, более устойчив он и в кислых условиях. Препараты окситетрациклина солянокислого и чистого основания — стабильные соединения и сохраняют активность в течение 36—48 месяцев хранения. Стабильность различных солей окситетрациклина приведена в табл. 65.
258
ТЕТРАЦИКЛИН (TETRACYCLIN) (Амбрамиции, ахромицин, панмицин, полициклин, тетрацин, цикломицин)
Тетрациклин — производное хлортетрациклина, полученное путем удаления из его молекул атома хлора.
Первые сообщения о получении тетрациклина путем каталитического гидрирования хлортетрациклина относятся к 1953 г. Затем было показано, что антибиотик может быть получен в результате биосинтеза, осуществляемого актиномицетом Streptomyces viridifa-ciens, выделенным из почвы, а также мутантом Str. aureofaciens.
Str. aureofaciens при развитии на обычных средах образует главным образом хлортетрациклин и в небольшом количестве тетрациклин. Однако путем подбора определенных условий культивирования актиномицета можно осуществлять преимущественно биосинтез тетрациклина. При общем низком уровне биологической активности культуральной жидкости тетрациклин образуется в большем количестве. Так, например, при общей активности, равной €125 мкг/мл, тетрациклин составляет 13%, а при активности 4500 мкг/мл — 22%.
Str. aureofaciens и Str. rimosus наряду с образованием тетрациклина и окситетрациклина могут синтезировать и аналоги этих соединений; 2-ацетил-2-декарбоксиамидотетрациклин (АДТ) и 2-ацетил-2-декарбоксиамидоокситетрациклин (АДОТ):
АДТ
АДОТ
Эти соединения обладают низкой антибиотической активностью.
Количество АДТ, образуемое в процессе биосинтеза тетрациклина, составляет 0,5—5,0%, а АДОТ в процессе развития Str. rimosus— от 3 до 10%. Образование аналогов зависит от условий культивирования актиномицетов и от особенностей штаммов.
В процессе развития Str. aureofaciens наряду с хлортетрацик-лином и тетрациклином происходит образование изомеров этих антибиотиков — изохлортетрациклина и изотетрациклина:
9*
259
Биосинтез этих изоформ увеличивается при условии снижения степени аэрации культуры, а также при повышении концентрации источника неорганического фосфора в среде. Антибиотические свойства указанных изомеров во много раз ниже по сравнению с исходными формами антибиотиков.
Известно, что концентрация углеводов и источника азота в среде существенно влияет на рост микроорганизмов и образование ими антибиотических веществ. Так, для продуцента тетрациклина концентрация глюкозы в среде, равная 50 мг/мл (при содержании 2,4 мг/мл аммонийного азота), способствует максимальному росту актиномицета (биомасса около 20 мг/мл) с образованием почти 2000 мкг/мл антибиотика. Увеличение концентрации глюкозы до 80—85 мг/мл тормозит рост актиномицета, а 26 мг/мл сахара не обеспечивает нормальный рост микроорганизма.
Влияние железа на биосинтез тетрациклина культурой Str. aureofaciens зависит как от концентрации этого элемента в среде и ее состава, так и от особенностей штамма актиномицета. Добавление к субстрату магния стимулирует образование тетрациклина, а такие микроэлементы, как бор, кобальт, литий, цинк, молибден, вольфрам, алюминий, олово, угнетают биосинтез тетрациклина.
Существенное значение на рост Str. aureofaciens и биосинтез тетрациклина оказывает pH среды. Оптимальное значение pH среды для роста актиномицета 6,0—6,8, а для образования антибиотика 5,8—6,0.
Увеличение концентрации фосфора в среде, снижение аэрации, избыток подсолнечного масла (используемого в качестве пеногасителя) приводят к увеличению содержания тетрациклина.
Преимущественный биосинтез тетрациклина в процессе развития Str. aureofaciens можно получить также при дехлорировании питательной среды (при помощи диализа, обработки среды анионитами и другими методами) или при культивировании актиномицета иа обычной среде в присутствии веществ, подавляющих процесс биохимического хлорирования у Str. aureofaciens. К таким соединениям относятся бромиды, иодиды, роданиды и некоторые другие. В присутствии этих веществ биосинтез тетрациклина достигает 99% от общего количества антибиотиков, образуемых актиномицетом. На возможность бромида и тиоцианата подавлять процесс хлорирования, ведущий к образованию тетрациклина, указывали Гуревич, Мизик и Лайн (1955), Доршук, Мак Кормик и др. (1956), Макаревич и Орлова (1970).
260
Некоторые штаммы Str. aureofaciens при развитии на основной среде (без хлора или брома) продуцируют до 70% хлортетрациклина и до 30% тетрациклина. При увеличении концентрации хлора в среде наблюдается снижение биосинтеза тетрациклина; увеличение выхода хлортетрациклина достигает определенного уровня и дальнейшее увеличение концентрации хлора не оказывает влияния.
Добавление к среде брома (NaBr)
способствует повышению биосинтеза тетрациклина. При отношении брома к хлору в среде, равном 0,5, количество тетрациклина равно количеству хлортетрациклина. Однако при увеличении концентрации брома в среде наблюдается снижение биосинтеза тетрациклина и увеличение образования бромтет-рациклина. Таким образом, при высоких
[ДД 2
Рис. 42. Соотношения хлортетрациклина (/) и тетрациклина (2) при развитии Streptomyces aureofaciens на обычных средах и в присутствии ингибиторов биологического хлорирования
концентрациях брома в
среде он не только подавляет реакцию хлорирования, но и сам включается в молекулу антибиотика. Способностью подавлять процесс хлорирования с образованием тетрациклина обладают также тиомочевина, тиоурацил, меркаптобензотиазол и другие соедине
ния.
Исследование влияния отдельных ингибиторов процесса биохимического хлорирования у Str. aureofaciens штамм ВС-41 показало, что многие вещества из групп тиадиазолов, оксидиазолов, пи-радазинов, триазолов, тиадиазинов, бензотиазолов и других обладают способностью подавлять биохимическое хлорирование, чтоб большинстве случаев приводит к образованию до 90% тетрациклина от общего количества синтезирующих антибиотиков (рис. 42 и табл. 66).
Таблица 66
Влияние концентрации фосфора на биосинтез тетрациклинов при развитии актиномицета на кукурузной среде, содержащей ингибиторы хлорирования (по Макаревич и Орловой, 1970)
Содержание фосфора в среде, мкг/мл Суммарная активность, ЕД/мл Тетрациклин Клортетрацик лин
ЕД/мл % ЕД/мл %
37 2852 2808 98,4 46 1.6
237 1564 1506 96,2 58 3.8
808 1035 948 91,6 87 8,4
1540 651 575 88,4 76 11,6
2900 507 430 85,0 77 15,0
261
Вместе с тем имеются вещества, способные снимать ингибирование процесса хлорирования.
Ионы меди — Cu2+ (CuSO4-5H2O) и ионы серебра — Ag+(AgNO3) в различной степени обладают способностью снимать подавление процесса хлорирования. Однако такие металлы, как Fe2+, Zn2+, Mn2+, Mg2+, такой способностью не обладают.
Влияние различных концентраций металлов Си2+ и Ag+ на снятие подавляющего действия в процессе хлорирования 2,5-димеркап-то-1,3,4-тиодиазолом (ДМТД), 2-фенол-5-меркапто-1,3,4-оксадиазолом (ФМОД) и 2-(2-фурол)-5-меркаптооксадиазолом (Фур МОД) приведено в табл. 67.
Таблица 67
Действие Сп2+ и Ag* на снятие влияния подавления процесса хлорирования (по Goodman, Martishin et. al., 1959)
Использованный металл, мг % Ингибиторы хлорирования
нет дмтд (5 мг %) ФМОД (0,5 мг %) Фур МОД (1 «г %)
ГЦ*. % ИТ“ ТЦ. % ИТ ТЦ. % ИТ ТЦ, % ИТ
CuSOj
0,0 12,5 1,00 97,4 1,00 97,2 1,00 96,0 1,00
5,0 — — •—. — 94,5 1,30 95,0 0,98
7,5 9,9 0,96 90,0 0,99 — — — —
10,0 — — — — 78,7 1,06 90,8 1,19
12,0 9,0 0,94 45,7 0,99 — — — —
15,0 8,8 0,93 18,6 0.87 — .— — .—.
20,0 7,0 0,96 11,2 0,92 77,4 1,00 82,9 1,22
40,0 AgNO3 9,2 6,88 7,8 1,01 — — — —
0,0 11,6 1,00 96,4 1,00 97,2 1,00 96,1 1,00
1,0 10,9 1,00 95,5 1,11 96,0 1,25 96,1 0,96
10,0 10,4 0,93 93,3 1,26 97,2 1,30 96,0 0,81
20,0 10,2 1,15 62,8 1,02 94,2 1,65 90,0 1,50
40,0 3,1 4,38 33,6 1,41 75,8 2,00 15,0 28,60
* ТЦ — тетрациклин.
** ИТ —индекс токсичности, выраженный отношением общей способности
- __________ образования анти-
биотиков в контроле к общей способности образования антибиотика с подавлением хлорирования.
Из данных таблицы следует, что ионы меди довольно быстро снимают ингибирующее действие биологического хлорирования димеркаптотиадиазолом. Два других ингибитора уменьшают свое действие под влиянием меди медленнее. Серебро менее эффективно, чем медь.
Приведенные данные вместе с тем показывают, что процесс биосинтеза, осуществляемый Str. aureofaciens, можно по желанию экспериментатора направлять или по пути синтеза хлортетрациклина, или по пути синтеза тетрациклина. Изучение закономерностей физиологических и биохимических особенностей организма позволяет управлять его биосинтетической активностью (см. гл. 11).
262
Тетрациклин по своим свойствам мало отличается от хлортетрациклина и окситетрациклина, но тетрациклин лучше растворим и более устойчив. По антибактериальным свойствам эти антибиотики близки между собой, но их биологическая активность имеет некоторые различия.
Изучение in vitro антибактериальной активности трех тетрациклиновых антибиотиков (хлортетрациклин, окситетрациклин и тетрациклин) по отношению к 1108 свежевыделенным от больных штаммов бактерий методом бумажных дисков, смоченных антибиотиками в концентрации 10 мкг/мл, показало (табл. 68), что тетрациклин при действии в обычных концентрациях — бактериостатический антибиотик. Однако увеличение концентрации антибиотика в десятки раз приводит к бактерицидному эффекту.
Таблица 68
Сравнительная характеристика антибиотических свойств хлортетрациклина, окситетрациклина и тетрациклина в опытах in vitro
(по Koch, 1955)
Вид микроба
Число изучаемых штаммов
Количество штаммов, чувствительных к
хлортетра- окситет- тетра-
циклин^ рациклину циклину
Aerobacter aerogenes....................
Escherichia coli .......................
Bacterium paracoli .....................
Синегнойная палочка ....................
Proteus vulgaris........................
Staphylococcus aureus...................
Фекальный стрептококк...................
Р-Стрептококк гр. Д ....................
Стрептококк гр. А ......................
Пневмококк .............................
150
60
43
113
116
364
95
96
31
40
42 43 32
29 25 30
15 11 16
32 8 22
1 0 2
230 158 196
64 41 49
34 12 21
31 31 31
40 40 40
Фармакологические свойства тетрациклина близки другим тетрациклиновым антибиотикам. Установлено, что тетрациклин вызывает меньше побочных реакций, чем, например, хлортетрациклин и окситетрациклин.
БРОМТЕТРАЦИКЛИН (BROMTETRACYCLIN)
В 1955 г. появилось сообщение Сенси, Де Феррари и других исследователей о новом антибиотике тетрациклиновой природы — бромтетрациклине, который был выделен из культуральной жидкости Str. aureofaciens, выращенного на среде, содержащей NaBr.
Установлено, что продуцент хлортетрациклина при наличии в среде ионов брома (100 мкг/мл) в отсутствие или присутствии хлоридов образует антибиотик, в молекулу которого вместо иона хлора включается бром.
263
При изучении антибактериальных свойств бромтетрациклина установлено, что его эффект in vitro очень близок к другим антибиотикам тетрациклиновой структуры и в особенности тетрациклину. От последнего бромтетрациклин отличается более высокой активностью в отношении ряда микроорганизмов. Так, в отношении Sarcina lutea он активнее тетрациклина в 2 раза, в отношении Proteus vulgaris — в 2,5 раза, Bacillus cereus — в 6 раз и т. д.
ДЕМЕТИЛХЛОРТЕТРАЦИКЛИН И ДЕМЕТИЛТЕТРАЦИКЛ ИН (DEMETHYLCHLORTETRACYCLIN, DEMETHYLTETRACYCL1N)
Деметилхлортетрациклин и деметилтетрациклин выделены и идентифицированы Мак Кормиком и другими в 1957 г. Эти антибиотики образуются мутантным штаммом Str. aureofaciens, у которого нарушен механизм переноса метильных групп. Однако деме-тилпроизводные хлортетрациклина и тетрациклина можно получить и при развитии обычного штамма Str. aureofaciens. Для этого достаточно в среду для развития актиномицета ввести антиметаболиты метионина — основного донатора метильных групп молекулы тетрациклинов. В качестве таких антиметаболитов метионина могут быть использованы этионин, D-норлейцин и D-метионин. Деме-тилпроизводные отличаются от хлортетрациклина, окситетрациклина, тетрациклина и бромтетрациклина отсутствием метильной группы в шестом положении основной тетрациклиновой молекулы. Структурные отношения тетрациклинов показаны в следующих формулах:
264
Деметилтетрациклины обладают более высокой устойчивостью к кислотам и щелочам по сравнению с их метильными гомологами.
Соотношение антимикробной активности in vitro у тетрациклиновых антибиотиков, используемых в клинической практике, может быть представлено активностью некоторых из них по отношению к Staphylococcus aureus (турбидеметрический метод):
Антибиотик Активности, %
Хлортетрациклин............100
Деметнлхлортетрациклин . . 75
Тетрациклин..................25
Окснтетрациклин..............24
Длительное и активное применение тетрациклиновых антибиотиков в медицинской практике привело к широкому распространению микроорганизмов, устойчивых к тетрациклинам. Это побудило исследователей получить на основе молекул природных тетрациклинов синтетические производные с повышенными антимикробными свойствами.
В результате химической модификации молекулы окситетрациклина получены новые формы тетрациклиновых антибиотиков: ме-тациклин (рондомицин) и доксициклин, а в результате изменения молекулы 6-деметилтетрациклина получен миноциклин:
Ri
R3 r4
Метациклин
н
I сн2
он
Доксициклин
Н
Н
СН3
ОН
Миноциклин м-(сн3)2 Н
Н
Н
Новые антибиотические препараты обладают рядом ценных свойств. Так, устойчивые к тетрациклину патогенные формы бактерий чувствительны к миноциклину.
Тетрациклиновые антибиотики обладают способностью избирательно накапливаться в опухолевых тканях. При облучении опухолевых тканей, содержащих тетрациклины, они начинают флуоресцировать. Этот метод нашел применение при диагностике больных раком желудка. Наиболее эффективным для приема внутрь оказал
265
ся деметилхлортетрациклин, а для внутривенного введения — окситетрациклин.
В лаборатории Бартона (Англия) в 1968 г. осуществлен синтез молекулы тетрациклина, а в лаборатории, руководимой Шемякиным (Москва), в то же время — химический синтез окситетрациклина.
ХЛОРАМФЕНИКОЛ (CHLORAMPHENICOL)
(Хлоромицетин, левомицетин, лейкомицин, параксин, хлороннтрин, альфицетин, фармицетин, хемиоцетин, берлицетин)
Из обработанных почв Венесуэлы в 1947 г. группой сотрудников во главе с Эрлихом был выделен штамм актиномицета, образующий антибиотик с широким антимикробным спектром действия. Этот антибиотик — хлорамфеникол, а организм, продуцирующий его, — Streptomyces venezuelae.
Культура актиномицета — продуцента хлорамфеникола — хорошо растет на обычных питательных средах. Колонии Str. venezuelae обычно бесцветные, иногда с нижней стороны желтовато-бурые или бурые в зависимости от состава среды. Микроскопическое строение актиномицета напоминает строение нокардиа. Молодой растущий мицелий образуется тонкими несептированными нитями, которые затем распадаются на отдельные участки различной длины, как это наблюдается и у нокардиа.
Хлорамфеникол образуется при развитии актиномицета на различных по составу средах. Наилучшие выходы антибиотика получаются при глубинном росте Str. venezuelae при 27—28°С на среде, содержащей пептон, глицерин и поваренную соль. Антибиотик образуется также и при развитии актиномицета на синтетических средах, в состав которых входят в качестве источника азота серин, а в качестве источника углерода глицерин и лактат натрия. Определенную положительную роль в биосинтезе антибиотика играют ионы железа, цинка и магния.
Образование хлорамфеникола на синтетической среде значительно повышается при добавлении к среде п-нитрофенилсерина или фенилаланина.
on2— с6н4 • снонсн • соон С6Н5—СН2СН • соон
nh2 nh2
П-Нитрофенилсерин Фенилаланин
Наилучший стимулирующий эффект наблюдается в том случае, если фенилаланин добавляют в среду перед началом фазы активного роста актиномицета. Некоторой способностью стимулировать образование антибиотика обладают также отдельные аминокисло
266
ты: лейцин, изолейцин, метионин, триптофан, глутаминовая кислота, норвалин и треонин.
Интересно, что общие физиологические проявления у Str. venezuelae в основном остаются неизменными как в условиях, благоприятных для биосинтеза хлорамфеникола, так и при развитии в средах, где биосинтез антибиотика не происходит. Следовательно, вещества субстрата, способствующие образованию антибиотика, непосредственно оказывают влияние на процесс биосинтеза хлорамфеникола.
Изучая процесс биосинтеза антибиотика и характер обмена веществ актиномицета в динамике его развития, Готтлиб с сотрудниками показал, что развитие Str. venezuelae носит двухфазный характер. К 72 часам развития актиномицета на синтетической среде биомасса достигает максимума, а затем в результате преобладания лизиса мицелия над процессом его развития общая масса
ZU W 60 80 100 120
Время культивирования, ч
Рис. 43. Процесс развития Streptomyces аигео-faciens и образования хлорамфеникола (по Legator, Gottlieb. 1953)
мицелия медленно снижается (до 60—70%) (рис. 43). После 72 ч роста культуры глицерин больше не используется актиномицетом; молочная кислота потребляется только одновременно с потреблением глицерина.
Как на синтетической, так и на триптон-глицериновой средах максимум образования хлорамфеникола обнаруживается в среде спустя определенное время после максимума роста актиномицета.
В процессе развития Str. venezuelae основное количество хлорамфеникола выделяется в окружающую среду и лишь небольшая часть антибиотика связывается гифами мицелия актиномицета. Например, за 36 ч развития из мицелия актиномицета, полученного из 100 мл культуры, экстрагировано всего 0,6 мкг антибиотика, в то время как в фильтрате содержалось 4000 мкг хлорамфеникола. Иными словами, количество антибиотика, связанного с мицелием, составляет примерно 0,015% от общего количества образовавшегося антибиотика.
267
Добавление в среду хлорамфеникола в процессе развития актиномицета или внесение его в субстрат до засева продуцента в количествах, соответствующих тому уровню, который образуется при нормальных условиях развития культуры, прекращает биосинтез антибиотика, хотя организм в этих условиях развивается нормально. Возможно, хлорамфеникол блокирует ферментативные системы организма, участвующие в биосинтезе антибиотика.
При культивировании актиномицета в среде, не содержащей ионы хлора, вместо хлорамфеникола происходит синтез его аналогов, у которых дихлорацетильная группа заменена остатком уксусной, пропионовой, масляной или валерьяновой кислот.
Химическая природа хлорамфеникола и его синтез
В результате изучения химического строения хлорамфеникола удалось установить его структурную формулу, которая оказалась не слишком сложной — это П-трео-1-(п-нитрофенол)-2-дихлораце-тиламинопропан-1-З-диол.
н nhcochci2
он н
D -трео-хлорамфеникол
ОН Н
q2n——с—с—СН2ОН
Н NHCOCHCf2
L-трео-хлорамфеникол
Антибиотик, образующийся в процессе биосинтеза, является D-трео-формой. Следует подчеркнуть, что антибиотические свойства хлорамфеникола в большой степени зависят от пространственной конфигурации молекулы. Например, L-трео-изомер не обладает биологической активностью.
Вскоре после выяснения химического строения хлорамфеникола был осуществлен его химический синтез. Синтез произведен независимо друг от друга в Соединенных Штатах Америки (Controu-lis et aL, 1949) и в Советском Союзе (Авт. свид. СССР, 1950). Это был первый пример химического синтеза антибиотика, осуществляемого в промышленных масштабах. В настоящее время хлорамфеникол получают только путем химического синтеза.
Однако при химическом синтезе получается рацемический препарат, т. е. соединение, содержащее L-трео- и D-трео-формы хлорамфеникола. Рацемический препарат, синтезированный советскими учеными, получил название синтомицина.
При соответствующих методах рацемический продукт хлорамфеникола удается разделить на L-трео- и D-трео-изомеры. D-трео-изомер хлорамфеникола получил название левомицетина.
268
Антибиотические свойства хлорамфеникола
Хлорамфеникол обладает бактериостатическим действием в отношении многих видов грамположительных и грамотрицательных бактерий. Он подавляет развитие бактерий, относящихся к родам Aerobacter, Staphylococcus, Streptococcus, Diplococcus, Proteus, Bacillus, Vibrio и др., подавляет также развитие риккетсий, в том числе риккетсий сыпного тифа, и некоторых крупных вирусов (возбудителей трахомы, венерической лимфогранулемы, атипической пневмонии и др.).
Некоторые микроорганизмы способны приобретать устойчивость к хлорамфениколу, но резистентность развивается довольно медленно и, по существу, не имеет практического значения. Хлорамфеникол подавляет формы бактерий, устойчивые к пенициллину и стрептомицину.
Применение хлорамфеникола
Хлорамфеникол имеет широкий спектр биологического действия, что позволило активно применить его в медицинской практике. Антибиотик — специфическое средство лечения брюшного тифа и паратифов, дизентерии, бруцеллеза, токсической диспепсии, трахомы и других заболеваний.
Синтомицин с большим успехом применяется при лечении бациллярной дизентерии у детей. При приеме через рот он хорошо всасывается и поступает в кровь и в тканевые жидкости.
АКТИНОМИЦИНЫ (ACTINOMYCINS)
Актиномицин принадлежит к числу первых антибиотиков акти-номицетного происхождения, полученных в кристаллическом виде. Он был открыт и частично изучен Ваксманом и Вудруфом еще в 1940 г. Этими же авторами антибиотик, выделенный из культуральной жидкости Streptomyces antibioticus, был назван актиномицином.
Актиномицин — красно-оранжевое вещество с высокой антибиотической активностью в отношении грамположительных бактерий и в меньшей степени активен по отношению к грамотрицательным бактериям.
Открытие актиномицина и получение его в кристаллическом виде в 40-х годах не привлекло к себе большого внимания, так как антибиотик был чрезвычайно токсичным в отношении экспериментальных животных.
Однако спустя примерно 15 лет после открытия актиномицина, (впоследствии актиномицин А), интерес к нему значительно возрос. Было установлено, что антибиотик образуется различными видами актиномицетов и что это не единственное соединение, а боль
269
шая группа близких по своим свойствам антибиотических веществ, часть из которых обладает противоопухолевым действием. В качестве продуцентов актиномицинов описано, около 20 видов актиномицетов: Str. antibioticus, Str. chrysomallus, Str. flavus, Str. flaveolus, Str. parvus, Str. parvulus, Str. griseus, Str. fradiae, Str. melanochromogenes и др., а также некоторые виды микромоноспора и Actinoplanes.
Брокман в 1949—1950 гг. выделил из культуры Str. chrysomallus актиномицин С. Затем он же с сотрудниками в 1952 г. описал актиномицин X. В 1954 г. Манакер с соавторами выделил актиномицин D из культуры одного штамма актиномицета. К настоящему времени выделено и описано более 100 различных актиномицинов, однако установлено, что многие препараты, имеющие различные названия, являются одними и теми же соединениями. Следует отметить, что образование различных типов актиномицинов в процессе развития актиномицетов зависит от вида (штамма) продуцента, состава среды, на которой он развивается, и от времени культивирования. В процессе биосинтеза образуются не единичные актиномицины, а смеси этих антибиотиков.
Все актиномицины принадлежат к группе очень сходных между собой хромапептидов, состоящих из феноксазиновой хромафорпой группировки (одинаковой для всех актиномицинов) и двух депси-пептидных боковых цепей, являющихся, как правило, пентапептидами. Каждый полипептид содержит лактонный цикл, образуемый гидроксильной группой L-треонина, который входит в состав всех актиномицинов, и карбоксилом С-концевой аминокислоты. Раскрытие лактонного цикла в молекуле антибиотика приводит к потере его биологической активности.
Разнообразие типов актиномицинов обусловлено различием аминокислотного состава их полипептидных цепочек.
У всех известных к настоящему времени актиномицинов в первом положении от хромофорной части молекулы находятся два остатка L-треонина. Наиболее лабильно второе и третье положения от гетероцикла. Во втором положении могут быть D-амино-кислоты; D-валин (актиномицины А, В, Ci) или D-аллоизолейцин (актиномицины С2, С3, Е) или их сочетания (актиномицины С2, F(, F2). В третьем положении могут быть L-пролин (актиномицины Ci, С2, С3, D и др.), гидроксипролин (актиномицины А, В), L-ке-топролин (актиномицины А5, В5, Х2), саркозин (актиномицины А2, В2 и др.). В четвертом положении всегда два остатка саркозина и в пятом — два остатка L-N-метилвалина.
В состав актиномицинов могут входить следующие аминокислоты: L-треонин, D-валин, L-пролин, саркозин, N-метил-Е-валин, D-аллоизолейцин, N-метилизолейцин, гидроксипролин и кетопролин. Но в молекуле актиномицинов не встречаются L-аланин, L-аргинин, L-цистеин, L-гистидин, L-лейцин, L-лизин, L-метионин, L-фенилаланин и некоторые другие аминокислоты.
Для актиномицина D (CJ предложена следующая структурная формула:
270
о
----С=О
СН3 I
НС—СН
СН3 N—СН3
---------0=0
L-N-метил-валин
5
H3C—N
нс—сн
сн3
о=<
н2
саркозин 4
:=о
Н2С
H3C-N_ о=с
N—СН3
нс-сн.
L-пролин
3
:=о
<н,с-сн
о
N—СН2
I---L--------
q—q D-валин
I /снз
«гС-N
с=о сн3 | нс—сн
2
н
‘з
HN
Н |
СН3 NH
СН3
HN
о=с
с=о
NH --------------1 о=с L-треонин | ц Н—С—С-
nh2
СН3 сн3
Актиномицин D (Ct)
Брокман с сотрудниками осуществил полный синтез актиномицина С3; препарат оказался идентичным природному актиномицину.
Образование актиномицинов
Как уже отмечалось, актиномицины могут образовываться различными видами актиномицетов, микромоноспора и актиноплана, которые обычно синтезируют несколько типов актиномицинов. Вместе с тем довольно часто наблюдается образование различных актиномицинов одним видом микроорганизма. Это явление связано, с одной стороны, с биосинтетическими особенностями актиномицета, а с другой — с условиями культивирования организма. Последнее имеет важное значение с точки зрения управления процессами биосинтеза.
271
5 12 30 45 56 66 78 98
Концентрация актиномицина, мкг/мл
Рис. 44. Относительное процентное содержание компонентов в препарате актиномицина, образуемого культурой Streptomyces antibioticus 3720, выросшей иа среде, содержащей глюкозу и глутаминовую кислоту (по Waksman et al., 1958):
1 — компонент А, 2 — компонент Ату. 3 — компонент Av
Образование различных компонентов в актиномициновом комплексе меняется по ходу развития Str. antibioticus (рис. 44). Так, с увеличением времени культивирования образование компонента Ajv возрастает до 70— 80% и более от общего количества антибиотика в среде, компонента Aj образуется до 5% и Av — до 10—20%. На ранних стадиях развития Str. antibioticus способен образовывать актиномицин В (до 30 мкг/мл). На более поздних стадиях развития образуется комплекс A-типа (до 30— 150 мкг/мл).
Биосинтез актиноми
цинов происходит при развитии актиномицетов как на синтетических, так и на натуральных средах неопределенного состава. Однако лучшее образование этих антибиотиков происходит в средах, содержащих в качестве источников азота нитраты. При наличии в среде аммонийных источников азота или пептона биосинтез актиномицинов резко снижается.
В этой связи представляют интерес данные о влиянии различных источников азота на образование аурантина, относящегося к актиномицинам. Различные источники азота, в том числе и аминокислоты, являющиеся единственными источниками азота в среде,
Таблица 69
Рост актиномицета и образование аурантина в присутствии различных источников азота
(по Нефедовой и Несмеяновой, 1966)
Источники азота Максимальная биомасса, мг % Максимальная концентрация аурантина, мкг/мл Источники азота Максимальная биомасса, мг % Максимальная концентрация аурантина, мкг/мл
KNO3 .... 820 650 L-Лейцин .... 805 10
(NH4)2SO4 . . 935 70 Саркозин .... 815 0
Пептон . . . ИЗО 100 D-L-аргинии . . . 795 0
Гликокол . . 900 70 D-L-серин .... 805 0
L-пролин . . 800 20 D-L-гистидин . . 710 0
D-L-валин . . 600 20
272
обеспечивают хороший рост актиномицета. Но лишь нитрат калия способствует высокому уровню биосинтеза аурантина (табл. 69).
Продуцент аурантина может развиваться на синтетической среде, содержащей D-L-валин в качестве единственного источника азота, однако образования антибиотика при этом также не происходит. Биосинтез антибиотика наблюдается в том случае, если одновременно с валином в среде присутствует KNO3.
В относительно небольшом количестве аурантин может синтезироваться также и в том случае, если в среде в качестве единственного источника азота имеется L-глутаминовая, L-аспарагиновая кислоты, глицин или а- и 0-аланин, т. е. те аминокислоты, которые активнее других вовлекаются в обмен веществ актиномицета — продуцента этого антибиотика.
Аурантин способен в больших количествах синтезироваться мицелием актиномицета в возрасте 36 ч. Интересно, что такой мицелий, перенесенный в среду, не содержащую фосфора, синтезирует антибиотик в том же количестве, что и в обычных условиях; 24-ча-собой мицелий биосинтез аурантина в отсутствие фосфора не осуществляет.
Состав среды для культивирования актиномицета оказывает существенное влияние на биосинтез того или другого актиномицина, на соотношение различных форм актиномицинов по ходу развития актиномицета. Так, на синтетической среде с KNO3 и глицином добавление D-L-валина способствует биосинтезу смеси трех актиномицинов (Сь С2 и С3) с преобладанием Ci- При развитии актиномицета на той же среде без D-L-валина происходило образование только актиномицинов С2 и С3. Биосинтез актиномицина С] не наблюдается.
Известно, что в состав многих актиномицинов входит D-валин. Так, Str. antibioticus образует смесь антибиотиков, состоящую иногда из пяти актиномицинов, каждый из которых содержит по два моля D-валина на один моль антибиотика. Однако Str. chrysomallus образует смесь актиномицинов, одна группа которых содержит два моля D-валина на один моль антибиотика, другая группа — один моль D-валина и один моль D-аллоизолейцина и третья группа — два моля D-аллоизолейцина на моль актиномицина.
Попытка облегчить биосинтез антибиотиков путем добавления к синтетической среде D-валина, D-изолейцина и D-аллоизолейцина привела к тому, что в присутствии D-аминокислот биосинтез актиномицинов культурой Str. antibioticus подавляется. Однако добавка L-валина к среде снимает тормозящее действие D-валина на биосинтез актиномицина. По-видимому, L-валин гораздо легче используется актиномицетом и, перед тем, как включиться в пептид актиномицина, он превращается в D-изомер.
Добавка D-L-изолейцина к синтетической среде, в которой развивается Str. chrysomallus или другой актиномицинобразующий штамм актиномицета, приводит к образованию новых биосинтетических актиномицинов. Два антибиотика (Е] и Е2), синтезированные Str. chrysomallus, содержали а-метилизолейцин вместо N-ме-
273
тилвалина, который образуется при отсутствии в среде D-L-изо-лейцина. На среде же, содержащей саркозин, происходит образование шести новых актиномицинов.
Добавление саркозина к синтетической среде с галактозой и глутаминовой кислотой способствует тому, что Str. antibioticus значительно увеличивает синтез актиномицинов II (Ац и Вп) и III (Аш и Вш) групп. Добавка L-пролина к среде, содержащей саркозин, снимает стимулирующий эффект саркозина, однако при увеличении концентрации саркозина можно снять тормозящее действие пролина на биосинтез актиномицина. Введение в состав среды D-L-пипеколовой кислоты (аналог пролина) способствует синтезу нескольких новых форм актиномицина.
Присутствие D-L-изолейцина в среде (крахмал — глутаминовая кислота — соли) подавляет образование актиномицина, не оказывая отрицательного влияния на рост актиномицета. Изолейцин в концентрации 0,1 мг/мл почти полностью приостанавливает биосинтез антибиотика. Однако D-L-треонин, присутствующий в среде, нацело снимает тормозящее действие изолейцина (табл. 70).
Таблица 70
Устранение D-L-треонином подавляющего действия D-L-изолейцииа при образовании актиномицина
(по Kawamata et al., 1960)
Образование актиномицина
Время развития актиномицета, сут
контроль
D-L-нзолейцин, 100 мкг/мл
D-L- изолейцнн, 100 мкг/мл + D-L-треонин, 100 мкг/мл
2
4
6
7
8
9
0
100
400
2000
4000
4000
0
200
400
800
1000
4000
Аминокислоты, добавленные к среде, по-разному влияют на биосинтез аурантина. D-Валин и D-изолейцин заметно подавляют синтез антибиотика. Лейцин, норвалин и норлейцин в D-форме не только не ингибируют образование актиномицина, а даже включаются в его молекулу. Аминокислоты в L-форме более активно включаются в биосинтез молекулы актиномицина и, по-видимому, легче проникают через клеточную стенку, чем D-аминокислоты.
Изменение биосинтеза различных фракций аурантина, образуемого культурой Str. auranticus, наблюдается при изменении соотношения валина (D-L-валина) и KNO3 в среде. Увеличение концентрации валина приводит к снижению общего выхода антибиотика с одновременным относительным повышением количества фракций, содержащих в своей структуре валин (Ау3 и Ау2).
Актиномицин V образуется в большом количестве при развитии Str. antibioticus на среде с L-треонином в качестве единственного источника азота. Но если к среде добавить L-глутаминовую кислоту, то этот же организм начинает образовывать преимущественно актиномицин IV. Биосинтез актиномицина IV культурой Str. chysotnallus возрастает с 10 до 83% от общей смеси актиномицинов в том случае, если в среду, содержащую в качестве источника азота нитрат и в качестве источника углерода глицерин, добавить 0,5% D-L-валина.
Приведенные выше примеры свидетельствуют, что образование тех или иных вариантов актиномицинов происходит в результате воздействия аминокислот, вносимых в среду, на механизм биосинтеза антибиотика. Аминокислоты, попадая в клетки актиномицета, включаются в пул свободных аминокислот, из которых идет образование белка микроорганизма и актиномицина. Образование молекулы антибиотика в основном зависит не от уровня аминокислот в пуле, а от того, насколько легко те или иные аминокислоты могут быть включены в молекулу актиномицина.
Таким образом, путем изменения состава среды для культивирования актиномицета — продуцента актиномицинов — можно направлять его биосинтетическую деятельность в нужную сторону и получать заранее известные антибиотики, изменять количественное соотношение различных актиномицинов.
Существенное значение в образовании актиномицинов имеет биосинтез феноксазинового хромафора. По-видимому, хромафор актиномицинов образуется в процессе синтеза антибиотика в результате оксидативной конденсации двух молекул З-гидрокси-4-ме-тилантранилоилпептида:
Актиномицин (Rj и R2—пептиды)
Эта реакция представляет большой интерес, так как рядом авторов было подтверждено, что З-гидрокси-4-метилантраниловая кислота выступает в роли предшественников в процессе биосинтеза актиномицинов.
По всей вероятности реакция конденсации может осуществляться в две стадии:
1. С участием фермента аминофеноксазинонсинтетазы, обнаруженного у Str. antibioticus и способного превращать аминофенолы (в том числе и метилантраниловую кислоту) в хинонимины:
275
R—ОН, пептид, пептидолактон
2. Две молекулы хиионимина превращаются в аминофеноксази-нон. Реакция идет без участия фермента.
Биосинтез актиномицина культурой Str. antibioticus зависит от количества фенолоксидазы, присутствующей в мицелии актиномицета.
Характер пути конденсации двух молекул метилантраниловой кислоты определяется видом актиномицета или условиями его культивирования.
В процессе развития Str. sp. 2 в культуральную жидкость выделяется вещество, представляющее собой К-ацетил-4-метил-3-окси-антраниловую кислоту (N-ацетил-МОАК):
соон
NHCOCH) ILxjU—°И
сн3
N -ацетил-М О А К
Удалось получить доказательства образования пептидов с N-ацетил-МОАК в процессе развития стрептомицета — продуцента актиномицина. По-видимому, N-ацетил-МОАК принимает участие в биосинтезе молекулы актиномицина, пептид N-ацетил-МОАК является предшественником биосинтеза этого антибиотика.
В процессе биосинтеза феноксазина определенную роль играет триптофан:
Триптофан
276
Установлено, что Str. antibioticus включает меченный 14С D-L-триптофан в актиномициновый хромафор. В аминокислотах, входящих в пептиды актиномицина, радиоактивность не обнаружена. Таким образом, триптофан — важнейший предшественник биосинтеза хромафора актиномицина.
Изучение механизма биосинтеза полипептидной части молекулы актиномицинов имеет практическое и теоретическое значение.
Изменяя в процессе развития актиномицета структуру полипептидных цепочек, можно получить антибиотики с новыми биологическими свойствами. Биосинтез полипептидов актиномицинов находится в определенной зависимости от синтеза белка мицелия актиномицета. Вместе с тем установлено, что механизмы синтеза белка мицелия и синтеза полипептидов антибиотика различны. Например, рибосомы клетки актиномицета не принимают участия в процессе биосинтеза актиномицинов.
Работами ряда авторов в кратковременных опытах показано, что скорость включения меченых аминокислот в актиномицин в присутствии левомицетина (ингибитора синтеза белка) возрастает, а в белках мицелия Str. antibioticus резко уменьшается. Эти результаты дали основание предположить, что механизмы биосинтеза актиномицина и белка актиномицета различны, однако между ними существует определенное равновесие. Стрептомицет в процессе развития, по-видимому, на биосинтез белка своего тела и образование актиномицинов использует общий запас свободных аминокислот. Высказано предположение, что биосинтез антибиотика — своеобразный контролирующий механизм стрептомицета, позволяющий клетке удалять избыток свободных аминокислот в период фазы замедленного роста.
Кратковременное воздействие левомицетина на актиномицет оказывает наиболее сильное воздействие как на характер развития организма, так и на биосинтез аурантина. При этом происходит ингибирование синтеза белка и нуклеиновых кислот актиномицета, а также подавление образования антибиотика.
Левомицетин оказывает определенное влияние на углеводный обмен продуцента актиномицина: во второй фазе развития актиномицета происходит значительное накопление в культуральной жидкости пировиноградной кислоты.
В биосинтезе молекулы актиномицинов стрептомицетами принимают определенное участие плазмиды. Если с помощью акрифлавина и новобиоцина освободить клетки продуцентов актиномицинов от плазмид, то продуцирующие антибиотик микроорганизмы становятся неактивными в смысле биосинтеза актиномицинов. Вместе с тем такие бесплазмидные штаммы стрептомицетов способны синтезировать ферменты (в частности, аминофеноксазинон-синтетазу), которые принимают участие в образовании хромафора актиномицина, но они не образуют из триптофана метилокси-антраниловую кислоту. Бесплазмидные штаммы не способны также включать в молекулу актиномицина метилоксиантраниловую кислоту, добавленную к среде.
277
Механизм действия актиномицинов
Актиномицины подавляют в клетке синтез РНК в результате образования комплекса с ДНК-матрицей. Установлено, что антибиотик препятствует продвижению РНК-полимеразы вдоль ДНК-матрицы.
В образовавшемся комплексе актиномицин — ДНК пептидная часть молекулы антибиотика размещается в малой борозде двойной спирали ДНК.
Имеются указания и на другой механизм действия актиномицинов. Под действием ферментов клетки антибиотик превращается в свободный радикал, способный вызывать изменения белков мембран. В результате этого происходит нарушение транспортных функций мембран и, в конечном счете, гибель клеток.
В медицинской практике находят применение пока лишь два типа актиномицинов: актиномицин D (препараты космоген и дактиномицин) и некоторые препараты актиномицина С (саннамицин, актиномицин, хризомаллин, аурантин). Препараты актиномицина D эффективны при лечении рака Вильямса, эмбриональной ра-домиосаркомы. Препараты актиномицина С применяются при лечении лейкозов, лимфогранулематоза, рака яичников.
Однако высокая токсичность актиномицинов оказывается весьма ограничивающим фактором.
Получение в процессе направленного биосинтеза новых форм актиномицинов, обладающих антиопухолевыми свойствами и вместе с тем пониженной токсичностью, имеет существенное практическое значение.
МАКРОЛИДЫ
Исследователи проявляют большой интерес к антибактериальным продуктам метаболизма различных видов актиномицетов, имеющим слабощелочные свойства и большую молекулярную массу. Вудвард в 1957 г. назвал эту группу соединений макролидами.
Антибиотики-макролиды характеризуются наличием в их молекулах макроциклического лактонного кольца, связанного с одним или несколькими углеводными остатками. Углеводными остатками обычно являются аминосахара.
В группу макролидных антибиотиков входит значительное число (около 100) соединений, из которых наиболее хорошо изучены пикромицин, эритромицин, магнамицин, метимицин, спирамицин, олеандомицин и др.
Группа макролидных антибиотиков в основном подавляет развитие грамположительных бактерий; некоторые из них подавляют развитие грибов и грамотрицательных форм бактерий. Многие соединения этой группы оказывают бактериостатическое действие в отношении устойчивых форм бактерий к таким широко используе
278
мым антибиотикам, как стрептомицин, пенициллин, тетрациклины, что имеет существенное практическое значение. Антибиотики-макролиды находят применение в качестве резервных антибиотиков при лечении ряда заболеваний, вызываемых возбудителями, устойчивыми к другим антибиотикам. Микроорганизмы, чувствительные к макролидным антибиотикам, образуют устойчивые к ним формы. Для появления резистентных форм обычно требуется значительное число пересевов культур в среды с постепенно возрастающим количеством антибиотика.
По биологическому действию антибиотики-макролиды делятся на две группы. Вещества первой группы (эритромицин, олеандо-мицин, магнамицин, тилозин и др.) обладают значительной бактериостатической активностью по отношению к большинству грамположительных бактерий, но, как правило, слабо действуют на грибы. Ко второй группе относятся филипин, пимарицин и другие соединения, в состав которых входят сопряженные полиеновые системы. Антибиотики второй группы характеризуются значительной антигрибной активностью и мало влияют на рост бактерий.
Мы не имеем возможности остановиться на рассмотрении многих представителей этой большой группы антибиотиков, поэтому рассмотрим лишь некоторые, имеющие наиболее важное значение.
ЭРИТРОМИЦИНЫ (ERYTHROMYCINS)
(Илотицин, эрицин, эритроцин, пантомицнн)
В группу эритромицинов входят макролидные антибиотики, близкие по строению и свойствам. Сюда относятся эритромицин А (илотицин), эритромицин В и эритромицин С.
Впервые эритромицин А (илотицин) получен из культуральной жидкости Str. erythreus, выделенного из образца почв Филиппин Мак Гуире и другими в 1952 г. Эритромицин В как кристаллический антибиотик был описан в 1954 г. так же, как продукт жизнедеятельности Str. erythreus. После извлечения из маточного раствора эритромицина А и эритромицина В в нем был обнаружен третий антибиотик — эритромицин С. Возможно, что эритромицин В следует рассматривать как предшественник биосинтеза эритромицина А.
Эти формы антибиотиков разделяются методом бумажной хроматографии.
Свойства эритромицина В идентичны свойствам эритромицина А, однако антибактериальная активность первого на 15—25% ниже активности второго и вместе с тем эритромицин В обладает почти в 2 раза более высокой токсичностью.
Механизм биологического действия рассматриваемых антибиотиков обусловлен подавлением трансляции в процессе биосинтеза молекулы белка, связанного с 50 S-субединицей рибосом. В присутствии полиуридиновой кислоты как матрикса эритромицин подавляет синтез ди- и три-пептидов.
279
Эритромицин А
К настоящему времени установлено также строение эритромицина В и эритромицина С. Эритромицин В отличается от эритромицина А тем, что в положении 12 находится Н вместо ОН эритромицина А.
Эритромицин С
280
Эритромицин С отличается от эритромицина А тем, что содержит вместо кладинозы остаток другого нейтрального углевода — мика-розы.
Условия биосинтеза эритромицина
Эритромицин образуется только биологическим путем в результате биосинтеза. Методом селекции активных штаммов Str. erythreus получены продуценты, образующие не менее 2000 мкг/мл антибиотика. Условия биосинтеза эритромицина, как и других антибиотиков, зависят от состава питательных сред, различных специфических стимуляторов биосинтеза, температуры и аэрации культуры.
В качестве среды для образования эритромицина может быть использована кукурузная среда (%):
Кукурузный экстракт..........0,50
Сульфат аммония ............ 0,30
Глюкоза......................2,00
Хлористый натрий.............0,25
• Углекислый кальций............0,50
Жир кашалота.................0,30
Влияние температуры культивирования различных штаммов Str. erythreus на процесс биосинтеза антибиотика зависит от состава среды и от свойств штамма. Так, например, на соевой или арахисовой средах развитие актиномицета несколько замедляется по сравнению с кукурузной средой. Для первых двух сред повышение температуры культивирования актиномицета до 34°С приводит к некоторому повышению биосинтеза эритромицина. Такое же повышение температуры при культивировании актиномицета на кукурузной среде снижает уровень биосинтеза антибиотика.
Таблица 71
Влияние температуры культивирования разных штаммов Streptomyces erythreus на биосинтез эритромицина
№ штамма
581 СО 8594 2577
Температура культивирования, fJC
Среда 28 | 34 | 28 | 34 | 28 | 34 |
Концентрация эритромицина в среде
мкг/мл %* мкг/мл %* мкг/мл %*
Арахисовая . . 430 525 122,1 463 467 100,7 — —
Соевая .... 485 655 135,0 552 596 108,0 860 822 95,6
Кукурузная . . 465 305 65,3 _ — — — — —
* Отношение содержания эритромицина при 34°С к содержанию эритромицина при 28°С.
281
Различные штаммы также по-разному реагируют на изменение температуры культивирования актиномицета на одной и той же среде (табл. 71).
Лактонная часть молекулы эритромицина (см. формулу эритромицина А) состоит из метилированной углеродной цепи, структура которой указывает на возможное участие пропионовой кислоты при биосинтезе этого антибиотика.
Действительно, добавление к культуральной жидкости актиномицета пропионовой кислоты, пропилового спирта или пропионамида повышает образование эритромицина. Этому способствуют также добавки к среде уксусной и муравьиной кислот. При добавке ацетата максимум образования антибиотика повышается на 27%. в случае формиата — на 84%, а в случае пропионата — на 129% по сравнению с результатами, полученными на средах без добавки этих солей. Повышение процесса биосинтеза антибиотика не сопровождается увеличением накопления биомассы актиномицета, что указывает на специфическое действие названных веществ на процесс биосинтеза эритромицина.
Биосинтез молекулы эритромицина культурой Str. erythreus связан с образованием специфической киназы, активирующей пропионовую кислоту, которая участвует в синтезе эритронолида — продукта конденсации остатков пропионовой кислоты.
В процессе развития Str. erythreus биосинтез антибиотика обусловлен бесперебойным течением окислительного декарбоксилирования пировиноградной кислоты в уксусную.
При торможении окислительного декарбоксилирования пировиноградной кислоты подавляется процесс окисления ацетальдегида (СНзСНО) в уксусную кислоту (СНзСООН), в результате чего биосинтез эритромицина почти полностью прекращается.
Использование в экспериментах меченой пропионовой кислоты показало, что в биосинтезе эритромицина имеет место ацетатно-пропионатный механизм. Вероятно, что биосинтез эритромицина осуществляется благодаря тому же механизму, что и синтез жирных кислот, имеющих длинные цепочки, а именно: путем конденсации коэнзимактивированных остатков уксусной или пропионовой кислоты в поликетокислоты, которые затем восстанавливаются.
В настоящее время можно констатировать, что макролидное кольцо (эритронолид) эритромицина образуется путем конденсации пропионовой кислоты, сахара — в результате превращения глюкозы; метионин является донором метильных групп для обоих, сахаров (дезозамина и кладинозы).
Существенное значение в процессе развития актиномицета и биосинтеза эритромицина имеет концентрация фосфора. Избыток фосфора в среде оказывает заметное действие как на развитие культуры, так и на процесс образования антибиотика, но только в том случае, если избыток Р имеется в период интенсивного роста актиномицета (между 24 и 48 ч). Избыток фосфора во второй фазе развития культуры не оказывает заметного влияния.
Характер действия избытка фосфора на образование эритро
282
мицина зависит от состава среды. Так, на соевой среде избыток фосфора вызывает снижение интенсивности биосинтеза антибиотика. На кукурузной среде с сульфатом аммония избыток фосфора приостанавливает развитие актиномицета и полностью подавляет образование эритромицина. Ухудшение аэрации культуры усиливает подавляющее действие избытка фосфора на процесс биосинтеза антибиотика.
Избыток железа в среде подавляет биосинтез эритромицина. Так, например, 20 мг% железа на кукурузной среде подавляет образование антибиотика до 62%.
По-видимому, подавляющее влияние железа на биосинтез эритромицина связано с образованием из ненасыщенных масел перекисных веществ, приводящих к нарушению окислительно-восстановительных условий в среде. Это положение подтверждается тем, что добавление метиленового синего снимает токсическое действие железа на развитие продуцента эритромицина и частично восстанавливает способность организма к биосинтезу антибиотика.
Антимикробный спектр
Эритромицин проявляет антибиотическую активность в отношении грамположительных и грамотрицательных кокков, некоторых грамположительных бактерий, бруцелл и ряда простейших.
Антимикробный спектр эритромицина
Микроорганизм Минимальная концентрация
эритромицина, подавляющая рост микроорганизма» мкг/мл
Staphylococcus aureus....... 0,01—1,0
Streptococcus pyogenes .... 0,001—0,1
Streptococcus pneumoniae . . . 0,003—0,4
Neisseria gonorrhoeae....... .0,04—5,0
Clostridium perfringens .... 0,20—0,7
Escherichia coli ...................... 100
Salmonella sp.......................... 100
Применение эритромицина
Эритромицин находит широкое применение в клинической практике при лечении многих инфекций, вызываемых стафилококками, стрептококками и пневмококками. Он с успехом применяется при лечении пневмоний, скарлатины, тонзиллитов, сепсиса, раневых инфекций, дифтерии, ожогов и других заболеваний.
Эритромицин хорошо всасывается из желудочно-кишечного тракта, поэтому возможно применение его per os. В случаях тяжелых течений заболевания эритромицин может применяться также внутривенно. Антибиотик не оказывает серьезных побочных реакций. Иногда при его приеме в виде таблеток могут появиться тошнота, рвота, понос.
283
МАГНАМИЦИН (MAGNAMYCIN) (Карбомицнн, антибиотик М-4209, антибиотик РА-97)
Магнамицин (карбомицнн) выделен из культуры актиномицета Streptomyces halstedii в 1952 г. Этот актнномицет образует также компонент В (магнамицин В) — вещество, близкое по свойствам магнамицину. Магнамицин подавляет развитие многих грамположительных бактерий, иногда он активен и в отношении некоторых видов грамотрицательных бактерий. Бактерии под действием маг-намицина приобретают устойчивость к нему, но устойчивость развивается довольно медленно и ступенчато. Микроорганизмы, устойчивые к пенициллину, тетрациклиновым антибиотикам, полимиксину Вик другим антибиотикам, остаются чувствительными к магнамицину.
Магнамицин применяется в медицинской практике при лечении заболеваний дыхательных путей, мочеполовых органов, а также некоторых кожных заболеваний; обычно антибиотик принимают по 2 г в течение 5—10 сут.
Структурная формула магнамицина установлена Вудвардом в 1957 г.
Магнамицин В в отличие от магнамицина содержит на один атом кислорода меньше, а поэтому связь между 14-м и 15-м атомами углерода двойная:
СН3
1« 17 16 15 14 В 12. I
СЯ1—СН—СН,—СП'=СН—сн—сн—-с—сн—сн2—
I II
о о
284
Вся остальная структура будет такой же, как и у магнамицина. Вудвард высказал предположение, что магнамицин В — предшественник магнамицина.
ОЛЕАНДОМИЦИН (OLEANDOMYCIN)
(Амнмицин, олеандоцин, ромнцнл, матромицнн)
Streptomyces antibioticus в аэробных условиях культуры образует антибиотик олеандомицин, впервые описанный в 1954 г. как антибиотик РА-105. Олеандомицин действует преимущественно против грамположительных бактерий, микобактерий, риккетсий, крупных вирусов, но неактивен против грамотрицательных бактерий (за исключением некоторых форм).
Этот антибиотик по спектру биологического действия аналогичен эритромицину, но несколько менее активен.
Олеандомицин обладает биологической активностью в отношении бактерий, устойчивых к пенициллину, стрептомицину, тетрациклинам и другим антибиотикам. Он также подавляет развитие многих штаммов бактерий, устойчивых к эритромицину.
Олеандомицин применяют при лечении пневмоний, гнойных плевритов, тонзиллитов, ларингитов, скарлатины, гонореи, раневых инфекций. У больных, принимающих олеандомицин, побочные реакции наблюдаются редко.
В клинической практике олеандомицин используется в виде хлоргйдрата или в смеси с другими антибиотиками (пенициллином, тетрациклинами). Олеандомицин имеет следующее строение:
Олеандомицин
Специфическим компонентом среды при биосинтезе олеандоми-цина культурой Str. antibioticus являются пропиловый спирт и жирные кислоты (жир кашалота). Наличие в среде пропилового спирта и жира усиливает биосинтез антибиотика более чем в три раза по сравнению с контролем. Избыток фосфора в среде тормозит рост актиномицета и снижает биосинтез олеандомицина.
285
ТИЛ03ИН (TYLOSIN)
Антибиотик тилозин образуется культурой Streptomyces fradiae. Первое описание тилозина сделал Мак Гуир в 1961 г. Строение тилозина было установлено в 1970 г. Антибиотик имеет следующую структуру:
При кислотном гидролизе от молекулы тилозина отщепляется сахар микароза, в результате чего образуется новый антибиотик десмикозин.
Два антибиотических вещества — тилозин и десмикозин обладают аналогичными антибиотическими спектрами. Они подавляют развитие грамположительных и некоторых грамотрицательных бактерий. Резистентность чувствительных микроорганизмов к тилози-ну проявляется примерно так же, как к эритромицину и пенициллину. Между тилозином и десмикозином имеет место перекрестная устойчивость.
Показано, что тилозин подавляет развитие Micrococcus pyogenes var. aureus в концентрации 1,56 мкг/мл. Наибольшая биологическая активность тилозина и десмикозина проявляется при слабощелочной реакции среды (pH 8,0). Антибиотики активны и в опытах in vivo. Так, при подкожном введении мышам указанных препаратов в концентрации 1,8—74 мг/кг они проявляют лечебное действие против Streptococcus pyogenes, Micrococcus pyogenes var. aureus, Diplococcus pneumoniae, Haemophilus influenzae. При введении препаратов per os положительный эффект наблюдается при увеличении их концентрации до 50—132 мг/кг. При заражении животных Mycobacterium tuberculosis для их лечения необходимо вводить тилозин в количестве 500 мг/кг.
286
Тилозин не используется в медицинской практике, но он имеет перспективу применения в ветеринарии.
ПОЛИЕНЫ
В группу полиеновых антибиотиков входит большое число про-тивогрибных соединений, образуемых актиномицетами. К их числу относятся отечественные препараты микогептин и леворин.
МИКОГЕПТИН (MYCOHEPTIN)
Микогептин образуется мутовчатым актиномицетом, относящимся к роду Streptoverticillum (Str. mycoheptinium). Антибиотик получен ленинградскими микробиологами Цыгановым и Коневым в 1965 г.
Актиномицет в процессе жизнедеятельности образует два полиена: пентаен и гептаен. Первый менее активен и его образуется в 2—3 раза больше, чем гептаена.
Микогептин подавляет рост большого числа грибов, в том числе дрожжеподобные грибы рода Candida, криптококки, аспергиллы, пенициллы.
Ценным свойством этого антибиотика является способность подавлять рост возбудителя кокцидоидоза — одного из наиболее опасных грибных заболеваний. Антибиотик подавляет рост дерматофитов и трихомонад (простейших). Микогептин, как и другие полиены, — фунгистатик. Он обладает высокой эффективностью при лечении микозов. Причем в случаях лечения глубоких микозов микогептин более эффективен при оральном способе введения, чем амфотерицин В.
ЛЕВОРИН (LEVORIN)
Леворин образуется в процессе развития Streptomyces levoris. Актиномицет — продуцент этого антибиотика, выделен из почвы в 1956 г. Цыгановым и др.
Леворин относится к группе полиеновых ароматических макролидов, макролактонное кольцо которого состоит из полиенового хромофора с семью сопряженными двойными связями.
287
Молекула леворина содержит аминосахар микозамин и ароматический кетон п-аминоацетофенон.
Микозамин
п-ам иноацетофенон
Показано, что п-аминоацетофенон образуется в процессе развития стрептомицета из глюкозы, а непосредственным промежуточным соединением его образования является п-аминобензойная кислота. Синтез последней идет через метаболический путь образования ароматических аминокислот, в частности тирозина.
Уровень связанного с мицелием стрептомицета п-аминоацето-фенона в монокультуре Str. levoris значительно ниже, чем при развитии этого стрептомицета в смешанной культуре с Candida utilis. Образование левроина в аналогичном случае так же гораздо выше. При внесении в среду п-аминобензойной кислоты биосинтез леворина возрастает незначительно, но наблюдается повышение образования свободного аминоацетофенона. Добавление предшественника макролидного кольца леворина (ацетата или пропионата) одновременно с добавлением п-аминобензойной кислоты повышает выход леворина в большей степени, чем добавление каждого из названных веществ в отдельности.
Str. levoris в процессе развития образует комплекс антибиотиков, состоящий из пяти гептаенов. Методом противоточного распределения комплекс леворина был разделен на два близких антибиотика — леворин А и леворин В.
Основной компонент промышленного препарата—леворин А также оказался неиндивидуальным веществом. Он состоит из четырех близких по свойствам гептаеновых антибиотиков, обозначенных леворинами Ао, Ai, А2 и А3.
В процессе селекции продуцента леворина получен штамм актиномицета с повышенной антибиотической активностью. При этом оказалось, что в мицелии этого штамма синтезируется второй антибиотик неполиеновой природы — левористатин. Наиболее благоприятными условиями для образования леворина являются среды, содержащие соевую муку или хлопковый жмых. Добавка цитрата в количестве 5—9 мг/л в 24- и 48-часовую культуру актиномицета стимулирует биосинтез антибиотика в среднем-на 30—40%.
Леворин наряду с другими антибиотиками (нистатин, кандици-дин, трихомицин) обладает высокой противогрибной активностью, подавляя развитие дрожжей и дрожжеподобных организмов; менее активен в отношении мицелиальных грибов.
Леворин нашел применение при заболеваниях, вызываемых дрожжеподобными грибами (при межпальцевых эрозиях, пора
288
жениях складок кожи, слизистых оболочек рта, при кандидозе желудочно-кишечного тракта).
Для лечения наружных заболеваний леворин применяют в виде мазей, при лечении желудочно-кишечного тракта антибиотик используют в виде таблеток или капсул. В ряде случаев леворин применяют в виде ингаляций.
МАКРОТЕТРАЛИДЫ (MACROTETRALIDS)
В группу антибиотиков макротетралидов входят вещества, которые представляют собой крупные (32-членные) циклы, включающие 4 простые, 4 сложноэфирные связи и 4 тетрагидрофурановых кольца (см. строение). Биологическое действие этих антибиотиков аналогично действию грамицидинов и ванкомицина.
Первый представитель этой группы антибиотических веществ был выделен Корбазом с соавторами в 1955 г. из мицелия Strepto-tnyces viridochromogenes и назван нонактином (авторам не удалось обнаружить его антимикробных свойств). При установлении структуры нонактина было показано, что в мицелии актиномицета-продуцента содержится несколько гомологичных соединений, в которых один или несколько метильных радикалов заменены на этильные.
Строение антибиотиков группы макротетралидов можно представить следующей обшей формулой:
Нонактин М онактин Динактин Тринактин Тетранактин
Ri сн3 сн3 сн3 СН3 С2Н5
Кг сн3-СН3 С2Н5 С2Н5 С2Н5
R3 сн3 СНз СНз С2Н5 С2Н5
r4 СН3 С2Н5 С2Ну С2Н5 с2н5
Макротетралиды — нейтральные, оптически неактивные, бесцветные кристаллические гидрофобные вещества, хорошо растворимые в органических растворителях (ацетон, спирты, эфиры, хлороформ) и почти нерастворимые в воде. Последнее свойство затрудняет определение их антимикробного действия и служит препятствием, несмотря на низкую токсичность, для медицинского применения этой группы антибиотиков.
10— 742
289
В настоящее время описано около 20 видов актиномицетов, образующих в процессе развития макротетралиды, среди которых основными продуцентами можно назвать Str. viridochromogen.es, Str. griseus, Str. vididovulgaris, Str. chryzomallus.
При правильном подборе растворителей группы этих антибиотиков показано, что макротетралиды проявляют антимикробную и цитостатическую активность. Они, в частности, подавляют развитие стафилококков, в том числе устойчивых к пенициллину, стрептомицину, эритромицину; гемолитического стрептококка, микобактерий и некоторых других организмов.
По механизму биологического действия макротетралиды относятся к мембраноактивным соединениям, нарушающим проницаемость мембран, способствующим транспорту определенных ионов в клетку, аккумулируя там катионы. Как следствие такого действия они могут индуцировать набухание митохондрий, нарушение окислительного фосфорилирования. Они вызывают индукцию гидролиза АТФ, стимулируют процессы дыхания.
Макротетралиды — активные ионофоры, они используются в качестве инструмента при изучении проницаемости искусственных и естественных мембран. Специфическая структура этих соединений обусловливает их способность образовывать комплексы с рядом однозарядных катионов: аммоний, калий, натрий, таллий, рубидий, цезий при большей избирательности к ионам аммония. Это свойство, а также плохая растворимость макротетралидов в воде послужили основой для использования их при производстве аммо-нийселективных электродов, в искусственные мембраны которых макротетралиды включаются в качестве специфических датчиков. Гомологичные отличия при этом значении не имеют. Однако изучение антибиотического действия показало, что эта величина наименьшая у нонактина и повышается с увеличением числа этильных радикалов у других гомологов.
НОВОБИОЦИН (NOVOBIOCIN)
(Альбомицин, антибиотик РА-93, биотексин, вулкамицин, гризеофлавин, инамицин, кардельмицин, катомицин, катоцин, кристаллиновая кислота, стрептонивицин)
Новобиоцин — антибиотик актиномицетного происхождения, относящийся к группе кислородсодержащих гетероциклических соединений. Новобиоцин по существу был впервые открыт и описан в 1953 г. Уага под названием гризеофлавин. Затем антибиотик был описан почти одновременно под различными названиями (катомицин, стрептонивицин, кардельмицин) в лабораториях, принадлежащих трем фирмам. Лишь некоторое время спустя было установлено, что эти антибиотики одно и то же соединение — новобиоцин.
Одни авторы определяли продуцент новобпоцина как Streptomyces spheroides. Другие описали продуцент новобиоцина как Streptomyces niveus. Затем было установлено, что этот антибиотик об-
290
разуется также культурами Streptomyces griseoflavus и Streptomyces sp.
По данным Кузнецова и др., продуценты новобиоцина Str. spheroides, Str. niveus и Str. griseoflavus относятся к одному виду, который следует обозначить видовым названием Str. spheroides или Str. niveus, но не Str. griseoflavus, так как последний резко отличается от истинного Str. griseoflavus Krainsky рядом свойств.
Образование новобиоцина происходит при развитии актиноми-пета как на относительно простых синтетических средах, так и на натуральных средах неопределенного состава, где в качестве компонентов используются соевая мука, кукурузный экстракт, ржаная сечка, дрожжевые продукты, хлопковая мука или барда.
В качестве синтетической среды для развития актиномицета и образования новобиоцина можно использовать среду следующего состава:
Глюкоза...................5%
Аммоний лимоннокислый ... 1%
К2НРО4....................0,2%
MgSO4 ...................0,05%
СаС12....................0.04%
FeSO4.....................2 мг/л
ZnSO4.....................1 мг/л
На указанной среде происходит биосинтез антибиотика в количестве 350 мкг/мл, т. е. примерно столько же или больше, чем на сложных натуральных средах.
Антимикробный спектр
Новобиоцин обладает относительно узким антимикробным спектром действия — подавляет развитие грамположительных и некоторых грамотрицательных бактерий. Однако основное биологическое действие антибиотика проявляется в отношении грамположительных форм бактерий.
Микроорганизм Минимальная концентрация
новобиоцина, подавляющая рост микроорганизма, мкг/мл
Micrococcus pyogenes........ 0,19
Corynebacterium diphtheriae . . 0,39
Neisseria intercellularis .... 0,39
Diplococcus pneumoniae .... 0,7—12,0
Streptococcus pyogenes .... 3,12
Proteus vulgaris.............. 25
Другие грамотрицательные микроорганизмы ............................... более 200
Весьма важно, что новобиоцин активен в отношении микроорганизмов, которые приобрели устойчивость к пенициллинам, стрептомицину, эритромицину, бацитрацинам, неомицинам, тетрациклинам и хлорамфениколу. Новобиоин мало токсичен, при его применении иногда наблюдаются побочные явления в виде аллер-10* 291 *
гических реакций (сыпь на коже, зуд). В отдельных случаях при повторном применении антибиотика появляются тошнота, боли в области желудка.
Все вышеотмеченные свойства новобиоцина способствуют успешному использованию его в медицинской практике. Антибиотик применяется при лечении заболеваний, вызываемых формами микробов, устойчивыми к другим антибиотикам.
Так, новобиоцин успешно применяется при лечении различных форм пневмонии, энтероколитов, флегмон, ангин, раневых инфекций и других заболеваний.
Условия образования новобиоцина
Как уже отмечалось, новобиоцин может образовываться при развитии актиномицета как на сложных натуральных, так и на относительно простых синтетических средах.
В зависимости от состава среды актиномицет может синтезировать как биологически активное вещество (новобиоцин), так и биологически неактивные соединения (изоновобиоцин и дескарба-милновобиоцин), строение которых очень близко новобиоцину.
Влияние источников азота. Изучение влияния различных источников азота на фоне среды, состоящей из 20 г/л барды и 25 г/л глюкозы (pH перед стерилизацией 7,8), показало, что добавка к среде с бардой (20 г/л) дополнительного источника азота в виде дрожжей, KNO3, сульфата аммония и белка сои снижает образование антибиотика. Если в среде с бардой сульфат аммония и нитрат калия угнетают биосинтез новобиоцина, то в синтетических средах эти вещества, являясь единственными источниками азота, обеспечивают достаточно высокий выход антибиотика (табл. 72).
Таблица 72
Образование новобиоцина на фоне различных источников азота, добавленных к среде с бардой (по Smith, 1956)
Источник азота Наибольший выход новобиоцина, мкг/мл Источник азота Наибольший выход новобиоцина, мкг/мл
добавленный к основной среде концентрация, г/л основной среде концентрация , г/л
Без дополнительных доба- KNO3 (NH4)2SO4 . . . 5,0 7,5 225 100
РСК .... — 380 Мясной экстракт 10,0 395
Барда .... Дрожжи . . . 20,0 12,0 475 270 Соевый белок . 10,0 145
Изучение влияния различных источников азота на рост актиномицета и образование новобиоцина было проведено на фоне синтетической среды (табл. 73).
292
Таблица 73
Влияние различных источников азота на рост Streptomyces spheroides и образование новобноцина
(по Егорову и Ушаковой, 1962)
Источник азота Максимальная биомасса, г/ 1С0 мл Наибольший аыход антибиотика (мкг/мл)
вариант опыта количество, %
Аммоний лимоннокислый 1,00 1,6 228
Гидролизат казеина 0,75 1,6 176
Гидролизат казеина 1,25 1,9 255
Казеин 1,00 1,6 234
Желатин 1,00 2,2 188
Белок сои 0,50 1,3 108
Белок сои 1,00 1,9 264
Пептон 0,50 1,2 125
Пептон 1,00 1,4 115
Данные, приведенные в табл. 73, показывают, что на фоне синтетической среды Str. spheroides может использовать для роста, развития и образования антибиотика разнообразные источники азота. Лучшими из испытанных источников азота были гидролизат казеина (1,25%) и белок соевой муки (1,0%). Хорошим источником азота следует признать и аммоний лимоннокислый. Str. spheroides с успехом использует также нитратную форму азота.
При внесении в синтетическую среду с крахмалом (4%) в качестве единственного источника азота некоторых аминокислот, например глицина (1%), аспарагина (0,5%), глутаминовой кислоты (0,5%), аргинина (1%), образование антибиотика доходит до 70— 80 мкг/мл.
По ходу развития актиномицета на синтетической среде, уже начиная с 48 ч роста, в субстрате обнаруживаются свободные аминокислоты: аланин, глутаминовая кислота, аспарагиновая кислота, метионин, валин, триптофан, фенилаланин, лейцин, изолейцин. Пролин в свободном виде не обнаруживается.
Изучение влияния на биосинтез новобноцина ряда аминокислот позволило установить, что только пролин способствует увеличению выхода антибиотика почти в два раза и при этом происходит стимулирование синтеза биологически активных форм новобноцина. Так, в отсутствие пролина биологически активная форма составляет 69% от общего выхода антибиотика, а в присутствии 0,2% пролина — 97%.
Добавка фенилаланина тирозина в количестве 0,2% приводит к снижению образования новобноцина. Триптофан и гистидин особенно снижают синтез новобноцина при внесении их в 72-часовую культуру, т. е. в момент перехода культуры к образованию ново-биоцина.
Источники углерода. Продуцент новобноцина для роста и биосинтеза антибиотика может использовать различные источники
293
углерода: глюкозу, крахмал, мальтозу, органические кислоты. Хороший выход антибиотика наблюдается на средах, содержащих в качестве источников углерода глюкозу или крахмал. В зависимости от характера источника углерода в среде Str. spheroides образует не только различные количества антибиотика, но и разные варианты его (табл. 74).
Таблица 74
Действие углерода на образование различных вариантов новобиоцина1 (no Hoeksema, Smith, 1961)
Углеводы Концентрация» г/л Новоби-оцнн, мкг/мл % от общего
новобиоцин изоново-биоцин дескарба-милново-биоцин
Глюкоза 40 1065 70 24 6
Мальтоза 40 825 94 3 3
» .......... 50 750 95 3 2
Крахмал 40 1040 75 20 5
1 Углеводы добавлялись к среде с бардой (40 г/л)
Приведенные в табл. 74 данные показывают, что при использовании в качестве источника углерода мальтозы 95% общей антибиотической активности составляет новобиоцин, но наряду с этим происходит образование небольшого количества изоновобиоцина и дескарбамилновобиоцина. Два последних варианта антибиотика образуются в большом количестве при наличии в среде глюкозы или крахмала.
В развитии Str. spheroides на среде, содержащей в качестве единственного источника углерода глюкозу, образования неактивных форм новобиоцина не наблюдается. При частичной или полной замене глюкозы гидролом к концу процесса развития актиномицета обнаруживаются неактивные формы.
Вместе с тем показано, что при использовании глюкозы в качестве единственного источника углерода биосинтез антибиотика снижается почти в два раза по сравнению с тем, что имеет место на среде с глюкозой вместе с гидролом.
Установлено, что на среде с бардой почти все испытанные органические кислоты стимулируют биосинтез антибиотика. Однако иные результаты получаются при добавлении органических кислот к синтетической среде, содержащей крахмал и лимоннокислый аммоний. В этих условиях лишь молочная, янтарная и яблочная кислоты стимулируют выход антибиотика, а присутствие фумаровой кислоты даже снижает образование новобиоцина.
Использование в опытах более активного штамма Str. spheroides (№ 35) позволило установить, что концентрация натрия лимоннокислого 0,3% является наилучшей в условиях проведенных опытов, она обеспечивает хорошее развитие актиномицета и нако
294
пление антибиотика (более 500 мгк/мл). Причем при этой концентрации образуется 90% биологически активного вещества, в то время как при других концентрациях лимоннокислого натрия биологически активное соединение составляет 75—80% от общего количества (табл. 75).
• Таблица 75
Влияние различных концентраций лимоннокислого натрия на рост актиномицета и образование новобиоцина (через 168 ч)
(по Егорову и Ушаковой, 1964)
Концентрация натрия лимоннокислого, % pH Биомасса, МГ % Новобиоцин, мкг/мл, определенный Биологически активная форма (от общего количества антибиотика), %
микробиологическим методом спектрофотометрическим методом
0,0 6,85 270 22,6 30,3 73
0,1 7,90 530 210,0 241,0 87
0,3 8,30 1058 502,0 555,0 90
0,7 8,50 1094 368,0 489,0 75
1.4 9,00 838 318,0 419,0 75
При замене лимонной кислоты солями уксусной, молочной, пировиноградной и янтарной кислот наблюдается снижение накопления биомассы и образования новобиоцина (табл. 76).
Таблица 76
Влияние органических кислот на биосинтез новобиоцина через 168 ч (по Егорову и Ушаковой, 1964)
Органическая кислота, добавленная в среду (натриевые соли) pH Биомасса, мг% Новобиоцин, мкг/мл, определенный Биологически активная форма (от общего количества антибиотика). %
микробиологическим методом спектрофотометрическим методом
Без добавки 6,85 270 23 30 73
Уксусная 8,30 748 308 458 67
Молочная 8,20 696 312 385 81
Пировиноградная .... 8,25 604 226 303 74
Янтарная 8,30 874 402 533 75
Фумаровая 8,50 1058 367 658 56
Яблочная 8,30 1124 391 577 67
Лимонная 8,30 1058 502 555 90
Среды с солями фумаровой и яблочной хорошее развитие культуры актиномицета и
кислот обеспечивают высокий уровень вы-
295
хода антибиотика, однако при этом активная форма новобноцина составляет 56—67% от общего количества образовавшегося антибиотика.
Изменение концентрации нитрата натрия (NaNOa), являющегося единственным источником азота в среде, а также источника углерода позволяет существенно изменить процесс биосинтеза, осуществляемый актиномицетом. Так, при содержании в среде 0,3% NaNO3 и 5% глюкозы актиномицет синтезирует всего 61% активного антибиотика; если же соотношение источников азота и углерода изменить и взять соответственно 0,6 и 4%, то количество биологически активного препарата составит 86%. При замене глюкозы на мальтозу (5%) выход биологически активного вещества доходит до 93%.
Изучая влияние некоторых жиров на рост актиномицета и образование антибиотика, мы показали, что через 24 ч после добавки жира к среде развитие актиномицета и рост организма остаются примерно на том же уровне, что и на среде без жира (за исключением подсолнечного масла). При добавлении 0,4% жира не наблюдается увеличения выхода антибиотика. Кукурузное масло (0,2%) и подсолнечное масло (0,5%) резко тормозят биосинтез новобио-цина, хотя в присутствии подсолнечного масла наблюдается усиление роста актиномицета.
Влияние фосфора. Известно, что фосфор существенно влияет на рост организмов и образование ими антибиотических веществ.
Изучение влияния различных концентраций неорганического источника фосфора на рост актиномицета и образование новобио-цина показало, что концентрации фосфата калия, равные 0,02, 0,05, 0,10 и 1,0%, на среде с крахмалом практически не влияют нарост актиномицета и биосинтез антибиотика (табл. 77).
Таблица 77
Влияние различных концентраций неорганического источника фосфора на развитие Streptomyces spheroides и образование новобноцина (по Ушаковой и Егорову, 1963)
Источник углерода в синтетической среде Содержание КН,Р04 в среде, % Биомасса через 120 ч, г/100 мл Количество новобио-цмна через 120 ч. мкг/мл
Крахмал, 5% 0,02 1,426 102
0,05 1,592 158
0,10 1,308 210
1,00 1,634 160
Глюкоза, 5% 0,02 0,474 24
0,05 0,780 96
0,10 1,144 225
1,00 1,026 290
Однако эти же концентрации фосфата на синтетической среде с глюкозой дают иной эффект: 0,02 и 0,05% КН2РО4 не обеспечи
296
вают нормального роста актиномицета, что в свою очередь приводит к значительному снижению выхода антибиотика. При более высоких концентрациях фосфора улучшается рост актиномицета и возрастает биосинтез новобиоцина.
Установлено, что для получения хороших выходов новобиоцина необходимо наличие в субстрате определенной концентрации ионов цинка. Ионы кобальта значительно угнетают рост актиномицета и образование антибиотика.
Аэрация среды. Степень аэрации среды оказывает существенное влияние на процесс образования новобиоцина — увеличение аэрации способствует повышению биосинтеза антибиотика.
Снижение выхода новобиоцина происходит при добавлении к среде для развития Str. spheroides небольших концентраций (от 0,02 до 0,10%) ряда восстановителей (цистеина, глутатиона, меркаптоэтанола). В присутствии в среде 0,1% глутатиона образование антибиотика снижается примерно в четыре раза, а добавление к среде 0,1% цистеина или меркаптоэтанола полностью тормозит биосинтез этого антибиотика.
Специфические стимуляторы биосинтеза новобиоцина
Продукты разложения новобиоцина (4-гидрокси-З-(З-метил-2-бутенил)-бензойная кислота, 0,05 мг/мл; новобиоциновая кислота, 0,05 мг/мл и п-аминосалициловая кислота) на синтетической среде с глюкозой (30 г/л), L-пролином (10 г/л) и минеральными солями стимулируют биосинтез новобиоцина. Другие компоненты молекулы новобиоцина таким действием не обладают. На сложных натуральных средах, содержащих, например, барду или другие компоненты неопределенного состава, стимуляции образования новобиоцина вышеназванными веществами не наблюдается.
Учитывая, что в молекулу новобиоцина входят аминогидроксикумарин и производное бензойной кислоты, нами в качестве возможных стимуляторов образования новобиоцина были изучены следующие соединения: кумарин, дикумарин и ряд производных сали
н
Салициловая КИСЛ013
сооп
-сн
циловой кислоты. Однако эти вещества как на среде с пролином, так и без него не дали ожидаемого эффекта стимуляции синтеза новобиоцина.
297
Биохимические изменения в мицелии актиномицета и в среде в процессе образования новобиоцина
Биохимические изменения, происходящие в субстрате и в мицелии актиномицета, изучены на среде, содержащей глюкозу (25г/л), яичный пептон (20 г/л) и мясной экстракт (10 г/л).
Данные, представленные на рис. 45, показывают, что биосинтез новобиоцина культурой актиномицета на такой среде начинается спустя примерно 48 ч после начала развития организма.
Фаза быстрого образования антибиотика наблюдается в период между 40 и 75 ч. Рост актиномицета происходит в первые 65 ч после посева. Таким образом, основная масса антибиотика образуется в последующий период фазы роста актиномицета. В течение пер-
Рис. 45. Биохимические изменения по ходу развития продуцента новобиоцина (по Smith, 1956)
298
вых 24 ч роста актиномицет использует незначительное количество углеводов, затем потребление углеводов из среды происходит довольно быстро и сопровождается интенсивным накоплением биомассы актиномицета; pH субстрата в первый период меняется от 6,8 до 7,6, а затем возрастает примерно до 8,5—8,7.
Химическое строение новобноцина
Строение новобноцина было показано одновременно несколькими авторами, которые установили структурную формулу антибиотика. В 1964 г. был осуществлен синтез новобноцина.
Новобиоцин
В состав молекулы новобноцина входят: А — замещенная бензойная кислота; В — аминогидроксикумарин; С — разветвленный (две СНз-группы) сахар новиоза.
В щелочной среде происходит почти полная инактивация ново-биоцина с образованием практически неактивного изоновобиоцина, имеющего ту же общую формулу С31НзбМ2О4.
При помещении новобноцина в щелочной буфер при pH 10 наблюдается быстрое снижение его антибиотической активности (рис. 46).
В процессе развития актиномицета-продуцента новобноцина на среде, содержащей 4-окси-З-изоамилбензойную кислоту, происходит биосинтез дигидроновобиоцина, который имеет такую же антибиотическую активность, как и новобиоцин. Но если в среде присутствует диметил-хроман-6-карбоновая кислота, актиномицет синтезирует изомер новобноцина, обладающий примерно в 25 раз меньшей активностью.
299
Рис. 46. Разрушение новобиоцина при pH 10 в водном растворе при температуре 25°С (по Hoecksema a. Smith, 1961)
Нами в 1974 г. установление», что образование биологически неактивных аналогов новобиоцина и в первую очередь изоновобиоцина в процессе развития актиномицета связано с ферментативной активностью продуцента антибиотика. Фермент, изомеризующий новобиоцин, образуется Str. spheroides уже ко вторым суткам роста актиномицета. Основная масса фермента выделяется в культуральную жидкость. Наиболее активен фермент при pH 8,0— 8,5 и температуре 28°С. Известно, что эти же условия наиболее благо
приятны и для образования новобиоцина.
В присутствии в среде малата натрия как дополнительного ис-
точника углерода активность фермента значительно возрастает и
превышает активность, характерную для развития актиномицета на среде с цитратом натрия. Указанный факт объясняет образование повышенных концентраций новобиоцина в процессе развития актиномицета в среде, содержащей лимоннокислый натрий (см. табл. 75).
В молекулу новобиоцина входит сахар новиоза (гем-метил-О-карбамил-4-О-метилновопиранозид). Основная углеродная цепь но-виозы образуется в процессе развития актиномицета непосредственно из D-глюкозы. Изучение синтеза новиозы показало, что образование подобного разветвленного сахара происходит в результате
метилирования гексозного скелета.
Наличие в молекуле новобиоцина соединения фенольной природы позволило предположить, что биосинтез этого антибиотика, подобно хлортетрациклину, в какой-то степени может зависеть от обмена пировиноградной кислоты. В связи с этим нами было изучено влияние мышьяковистокислого натрия на развитие актиномицета, образование пировиноградной кислоты и биосинтез антибиотика.
Арсенит натрия в концентрации 5-10~4 М резко снижает образование новобиоцина и в небольшой степени (всего на 14%) угнетает рост актиномицета. Увеличение концентрации арсенита в 1,5 и 2 раза сильно угнетает рост продуцента новобиоцина и полностью подавляет биосинтез антибиотика (табл. 78).
Более подробно было изучено влияние концентрации арсенита, равной 5-Ю~4 М. Результаты показали (табл. 79), что данная концентрация арсенита в среде приводит к значительному накоплению пировиноградной кислоты в культуральной жидкости уже после 3 сут развития актиномицета. В то же время при вполне хорошем росте актиномицета биосинтез новобиоцина прекращается практически полностью.
Интересно подчеркнуть, что уксусная, лимонная, янтарная и
300
Таблица 78
Влияние различных концентраций арсенита натрия иа рост актиномицета н образование новобноцина (результаты после 7-суточного культивирования) (по Миронову и Егорову, 1964)
Концентрация арсенита, М pH Масса сухого мицелия Новобиоцин
МГ % % к контролю мкг/мл % к контролю мкг/10 мг сухого мицелия
0 (контроль) 8,35 1300 100 208 100 156,4
ЫО-1 8,40 1285 97 207 100 161,0
5-Ю-1 7,80 1144 86 12,5 6 10,6
7,5-10-4 7,10 583 44 4,5 2 7,7
1 • ю-3 6,00 276 21 0,0 0 —
фумаровая кислоты, а также пролин и глутаминовая кислота снимают подавляющее действие арсенита на биосинтез новобноцина. Фенилаланин, салициловая и пировиноградная кислоты не оказывают влияния на процесс торможения образования антибиотика в присутствии ингибитора. Следовательно, кислоты, входящие в цикл Крепса, и аминокислоты, метаболически связанные с ним, могут служить источником уксусной кислоты и обеспечивать биосинтез антибиотика в присутствии арсенита натрия.
Таблица 79
Влияние арсенита натрия (5-10-1 М) иа развитие актиномицета и биосинтез новобноцина
(по Миронову и Егорову, 1964)
Вариант опыта Время культивирования, сут pH Масса сухого мицелия Пировиноградная кислота, мг % Новобиоцин, мкг /МЛ
МГ % % к контролю
Среда без арсенита 0 6,70 98 100 11,9
натрия (контроль) . 2 7,00 — — 20,5 —-
3 7,30 — — 28,2 22,5
4 7,70 648 100 33,7 42,5
5 8,30 1102 100 —- 75,5
6 8,40 1238 100 25,8 142,0
7 8,45 1261 100 14,2 177,5
Среда с арсенитом 0 6,80 95 97,5 10,8 —
натрия (5-10~4 М) 2 6,80 — — 62,0 —
3 6,90 — •— 120,0 6,0
4 7,45 621 96,0 180,0 6,5
5 7,80 810 73,5 — 7,0
6 7,70 1006 81,0 95,5 —
7 7,40 1040 82,5 112,5 8,5
301
Мышьяковистокислый натрий тормозит окисление пировиноградной кислоты также и отмытым мицелием актиномицета.
РИФАМИЦИНЫ (RIFAMYCINS)
Из культуры Streptomyces mediterranei n. sp. в 1959 г. Сенси с соавторами выделен противобактериальный антибиотик р и фа-ми ц и н.
При развитии актиномицета в натуральной среде, содержащей кукурузный экстракт, соевую муку и другие компоненты, образуется одновременно не менее пяти антибиотиков — рифамицины А, В, С, D и Е. Эта смесь антибиотических веществ, которая весьма нестабильна, получила название рифамициновый комплекс. В комплексе наиболее стабильный компонент рифамацин В (кислота).
Мутант, полученный из исходной культуры Str. mediterranei, способен образовывать преимущественно рифамицины С и D. Если к питательной среде, в которой развивается мутант, добавить бар-
NH
о=сх’ ^с=о I I
С2н5—с NH
о
Барбитрл
битол (диэтилбарбитурат натрия) в концентрации 0,2%, то происходит биосинтез почти чистого рифамицина В.
Водный раствор рифамицина В в условиях аэрации превращается в новое производное — рифамицин S; последний обладает значительно большей биологической активностью in vivo и in vitro, чем рифамицин В. Промежуточным продуктом «активации» рифамицина В будет рифамицин О, который под влиянием ряда восстанавливающих веществ (аскорбиновая кислота и др.) может вновь превращаться в рифамицин В.
Рифамицин S — высокоактивный препарат по отношению к грамположительным бактериям и Mycobacterium tuberculosis. Легко восстанавливается с образованием рифамицина SV.
Взаимосвязь между различными формами рифамицина представлена на схеме (по Prelog, 1964):
окисление
Рифамицин SV"* Рифамицин S
окисление
302
Установлено химическое строение всех четырех вариантов рифа-мицина. Их структура необычна. Строение этих антибиотиков резко отличается от строения других известных антибиотических веществ.
По характеру алифатической части рифамицин SV напоминает макролиды. Строение рифамицинов дает основание предполагать, что основой их биогенеза служат уксусная и пропионовая кислоты.
Наиболее биологически активный и ценный вариант — рифамицин SV; он весьма активен в отношении грамположительных бактерий (минимальная концентрация, подавляющая развитие Staphylococcus aureus, Staph, haemolyticus и др., 0,005—0,0025 мкг/мл), Mycobacterium tuberculosis (минимальная концентрация, угнетающая развитие туберкулезной палочки, 0,05 мкг/мл). Рифамицин SV подавляет развитие и грамотрицательных форм бактерий, но в значительно более высоких концентрациях (25—250 мкг/мл). Препарат не действует на грибы. Относительно плохо растворим. Ценным свойством рифамицина SV является способность подавлять развитие грамположительных форм бактерий, приобретших устойчивость к другим антибиотикам (пенициллин, эритромицин, новобиоцин, олеандомицин, стрептомицин). У него не обнаружено перекрестной устойчивости с другими противотуберкулезными антибиотиками. Рифамицин SV имеет низкую токсичность.
Основа механизма биологического действия рифамицинов и прежде всего рифамицина SV — подавление бактериальной РНК-полимеразы.
В результате химической модификации рифамицина SV удалось получить полусинтетический препарат рифампицин (римак-тан) с более ценными свойствами по сравнению с исходным антибиотиком.
В молекуле рифампицина атом водорода (R) замещен t(cM. формулу рифамицина SV) на —CH=N—N<^ '/N—СН3
303
Рифампицин
R= — С H=N—N N—С H3
Структура различных форм рифамицина
Рифампицин — один из наиболее ценных антибиотических препаратов, применяемых в медицинской практике в последние годы.
• *
Завершая рассмотрение антибиотиков, образуемых группой актиномицетов, необходимо остановиться на вопросе о том, где и как образуются эти биологически активные вещества. Большое внимание этим вопросам уделено польскими учеными во главе с В. Ку-рыловичем. Изучая изменения, происходящие на поверхности и в ультраструктуре мицелия некоторых актиномицетов, образующих антибиотики, основное внимание обращалось на определенную роль различных клеточных структур в процессах образования, накопления и выделения антибиотиков.
Для изучения определенного вида актномицета использовались два штамма: высокоактивный и малоактивный продуценты антибиотика. Как показали наблюдения поверхности мицелия актиномицетов с помощью сканнирующего микроскопа, на гифах мицелия встречаются различных форм утолщения, выпячивания и деформации.
Так, на поверхности мицелия Str. erythreus, Str. aureofaciens. Str. vinaceus наблюдаются аморфные пузырьки или сферические субструктуры, причем в большем числе эти образования обнаруживаются у высокопродуктивных штаммов (рис. 47, 48).
На поверхности мицелия штамма Str. noursei, образующего кан-дистин, электрон-плотные аморфные субструктуры имеют сходство с кристаллами различной формы и различного размера (рис. 49). Эти субструктуры смываются при обработке мицелия метанолом.
304
Рис. 47. Везикулярные субструктуры на поверхности мипелия Streptomyces aureofaciens высокопродуктивного штамма (по Kurylowicz et al., 1974).
Увеличение в 70 000 раз
Спектрофотометрический анализ полученного раствора метанола в ультрафиолетовом спектре идентичен раствору стандарта канди-стина.
У продуцента тетрациклина Str. aureofaciens в процессе развития и образования антибиотика на поверхности мицелия образуются субструктуры размером 3000—6000 нм, причем образование этих субструктур тесно связано с биосинтезом тетрациклина.
305
Рис. 48. Вспучивание на гифах Streptomyces aureofaciens высокопродуктивного штамма (по Kurylowicz et al., 1974).
Увеличение в 15 000 раз
Таким образом, по мнению Курыловича и др. (1974), биосинтез антибиотиков высокопродуктивными штаммами актиномицетов может быть связан с образованием в клетках многочисленных мембранных структур типа мезосом, трубочек и «цистерн» (рис. 50).
Наблюдения ультраструктуры Str. vinaceus — продуцента Биомицина — дает основание полагать, что антибиотик образуется на
306
Рис. 49. Мицелий высокопродуктивного штамма Streptomyces noursei, покрытый субструктурами (no Kurylowicz et al., 1974).
Увеличение в 10 000 раз
внешней поверхности клеточной мембраны и аккумулируется между мембраной и клеточной стенкой, откуда выделяется на наружную сторону клетки.
Проведенные под руководством Курыловича наблюдения образования антибиотических веществ актиномицетами и их выделения из клетки и выводы, которые они делают, имеют большой научный интерес.
307
Рис. 50. Мембранные структуры типа трубочек (каналец) в клетках высокопродуктивного штамма Streptomyces aureofaciens, Увеличение в 90 000 раз
Глава
АНТИБИОТИКИ, ОБРАЗУЕМЫЕ ГРИБАМИ И ЛИШАЙНИКАМИ
Огромная группа организмов, принадлежащих к грибам, образует большое число (более 1150) разнообразных антибиотических веществ, отдельные представители которых завоевали всеобщее признание в качестве лечебных средств. Основная же часть грибных антибиотиков не нашла еще практического применения главным образом в силу своей высокой токсичности. Поэтому мы рассмотрим ограниченное число антибиотиков, образуемых некоторыми видами грибов, а именно: пенициллин, цефалоспорин, гризео-фульвин, трихотецин, фумагиллин и др., нашедших применение в медицинской и сельскохозяйственной практике.
ПЕНИЦИЛЛИН (PENICILLIN)
Известный английский бактериолог Александр Флеминг опубликовал в 1929 г. сообщение о литическом действии зеленой плесени на стафилококки. Флеминг выделил гриб, который оказался Penicillium notatum, и установил, что культуральная жидкость этой плесени способна оказывать антибактериальное действие по отношению к патогенным коккам.
Культуральная жидкость гриба, содержащая антибактериальное вещество, названа Флемингом пенициллином.
Попытки Флеминга выделить активное начало, образуемое Penicillium, не увенчались успехом. Несмотря на это, Флеминг указал на перспективы практического применения обнаруженного им фактора.
Спустя примерно десять лет после сообщения Флеминга пенициллин начал изучать Чейн. Он был убежден, что это вещество — фермент. В 1940 г. Флори и Чейн получили индивидуальное соединение пенициллина, который оказался не ферментом, а низкомолекулярным веществом.
Об антагонистических свойствах зеленой плесени (Penicillium) было известно задолго до наблюдений Флеминга. Еще в глубокой древности индейцы из племени майа использовали зеленую плесень, выращенную на зернах кукурузы, для лечения ран. Философ,
309
врач и естествоиспытатель Абу-Али Ибн-Сина (Авиценна)1 рекомендовал использовать плесень при гнойных заболеваниях.
В русской народной медицине с давних времен применялись для лечения ран присыпки, состоящие из зеленой плесени.
В работах русских ученых Манассеина и Полотебнова в 1871— 1872 гг. указывалось на отношение Penicillium glaucum к разным бактериям. Полотебнов впервые в научно-клинической обстановке изучил применение зеленой плесени, показав при этом практически ценные результаты. Манассеин установил, что молодая культура плесени подавляет рост некоторых бактерий. В 1877 г. русский врач Лебединский доложил о подавлении плесенью бактерий желудочно-кишечного тракта. Английский физик Тиндаль описал в 1876 г. способность Penicillium подавлять бактерии, находящиеся в жидкости, но объяснял он это явление чисто физическими причинами.
Таким образом, приведенные данные показывают, что человечество на разных уровнях своего развития знало о целебных свойствах зеленой плесени. Однако эти сведения носили разрозненный характер и касались лишь воздействия самого гриба на микроорганизмы. В то время не могло быть и речи о выделении и изучении активного начала, образуемого плесенью.
И только после 1940 г., когда Флори и Чейн получили препарат (пенициллин) в очищенном виде, появился широкий научный интерес к этому антибиотическому веществу.
Изучение пенициллина в Советском Союзе было начато 3. В. Ермольевой. В 1942 г. под ее руководством в лаборатории биохимии микробов Всесоюзного института экспериментальной медицины в Москве был получен первый отечественный пенициллин — крусто-зин, сыгравший огромную роль в спасении жизней воинов Советской Армии, раненных на полях сражений Великой Отечественной войны.
В январе 1944 г. Москву посетила группа иностранных ученых, среди которых был профессор Флори, привезший с собой английский штамм продуцента пенициллина. Сравнение двух штаммов (советского и английского) показало, что советский штамм образует 28 ед/мл, а английский — 20 ед/мл.
После того как было установлено, что пенициллин обладает мощными лечебными свойствами, начались интенсивные поиски продуцентов этого антибиотика. В результате большого числа работ удалось установить, что пенициллин могут образовывать многие виды Penicillium (Р. chrysogenum, Р. brevicompactum, Р. nigricans, Р. turbatum, Р. steckii, Р. corylophilum), а также некоторые виды Aspergillus (Asp. flavus, Asp. flavipes, Asp. janus, Asp. nidulans и др.). Есть указания, что пенициллин образуется также термофильным организмом Malbranchia pulchella.
Первые выделенные из естественных субстратов штаммы Peni-
1 Авиценна — таджик по национальности; умер в возрасте 57 лет (980—> 1037). Похоронен Авиценна в Хамадане (Иран).
310
cilliutn как наиболее активные продуценты пенициллина образовывали не более 20 единиц (12 мкг) антибиотика на 1 мл культуральной жидкости. Даже промышленное производство этого ценнейшего препарата было начато при активности культуральной жидкости не выше 30 мкг/мл или 50 ед/мл. Насколько низка эта активность, можно судить по тому факту, что в настоящее время в промышленных условиях получают культуральные жидкости с содержанием пенициллина более 15000 ед/мл, а отдельные штаммы способны синтезировать до 25 тыс. ед/мл.
Получение высоких выходов антибиотика достигнуто в результате изучения условий его образования и селекции наиболее активных штаммов продуцента пенициллина.
Условия образования пенициллина
Пенициллин относится к группе р-лактамных антибиотиков. В последние годы установлено, что антибиотики этой группы образуются не только плесневыми грибами, но и некоторыми видами актиномицетов и собственно бактерий.
Получение пенициллина — замечательная веха в развитии микробиологии, химии и медицины. С производством этого антибиотика связано создание вначале довольно скромной, а затем весьма мощной антибиотической промышленности.
В течение ряда лет пенициллин получали путем выращивания гриба в стеклянных матрацах на жидкой питательной среде. Это создавало огромные трудности в поддержании стерильности при засевах каждого матраца и требовало большой затраты рабочей силы. Учитывая, что выход антибиотика составлял всего несколько десятков единиц на 1 мл среды, себестоимость пенициллина была чрезвычайно высокой. Так, например, стоимость 1 кг пенициллина в США, как отмечал в 1959 г. Гольдберг, составляла в 1943 г. 227 270 долларов, а в 1953 г. — всего 169 долларов, т. е. за 10 лет стоимость 1 кг пенициллина снизилась более чем в 1340 раз. В настоящее время ежегодно получают около 17 тыс. т пенициллина (Kieslich, 1984) на общую сумму более 272 млн. долларов (Love a. Elander, 1983).
Важным этапом в увеличении выхода пенициллина было изучение условий образования антибиотика.
Первая среда для глубинного образования пенициллина была разработана Мойером и Кохиллом в 1946 г., в ее состав входил кукурузный экстракт, лактоза, NaNOa, глюкоза, однозамещенный фосфорнокислый калий и другие соли. Эта среда была основной, на ее базе были разработаны среды, используемые при промышленном производстве пенициллина. Например, в качестве посевной среды часто применяют среду следующего состава:
Кукурузный экстракт (твердый) ... 20 г
Глюкоза........................ 40 г
КН2РО4......................... 0,5г
NaNO3 ......................... 3 г
311
MgSO4-7H2O .........................0,125 г
Мел .............................. 5 г
Вода водопроводная ................до 1000 мл
pH после стерилизации.............6,0—6,1
Для промышленного производства антибиотика используют среду следующего состава (%):
Кукурузный экстракт (по сухому остатку) ... 0,3
Гндрол.................................... 0,5
Лактоза................................... 0,3
NH4NO3................................... 0,125
Na2SO3-5H2O............................... 0,1
Na2SO4- ЮН2О.............................. 0,05
MgSO4-7H2O ............................... 0,025
MnSO4-5H2O .............................. 0,002
ZnSO4 .................................... 0,002
KH2PO4.................................... 0,2
CaCO3 .................................... 0,3
Фенилуксусиая кислота..................... 0,1
Довольно часто в средах используют смесь лактозы с глюкозой в отношении 1 : 1. В ряде случаев вместо кукурузного экстракта применяют арахисовую муку, жмыхи, муку из хлопковых семян и другие растительные материалы.
Возможность широко применять в качестве компонентов сред различные продукты растительного происхождения обусловлена тем, что продуцент пенициллина Р. chrysogenum образует сильные протеолитические ферменты. По интенсивности действия могут быть выделены три фермента, различающиеся значением pH среды, обеспечивающим их оптимальное действие: 1) протеиназа с оптимальным действием при pH 5,0—6,5; 2) протеиназа типа триптаз с оптимумом действия при pH 7,0—7,5; 3) пептидазы с оптимальным действием при pH 8,0—8,4. Протеолитические ферменты гриба способны производить дезагрегацию и протеолиз белка. Обычно максимальная протеолитическая активность гриба совпадает с максимумом выхода пенициллина.
Благодаря высоким протеолитическим свойствам гриба наличие кукурузного экстракта или другого растительного материала в среде полностью обеспечивает продуцент пенициллина азотом.
В результате изучения обмена азота в связи с образованием пенициллина было сделано предположение, что большая часть антибиотика образуется на ранних стадиях роста гриба из азотистых запасов мицелия и что образование белков может быть конкурирующим фактором, лимитирующим образование пенициллина.
Сравнительное изучение азотного обмена у продуцента пенициллина Р. chrysogenum и его неактивного мутанта показало, что действительно основная часть азота среды, начиная со 2 сут развития, используется продуцентом антибиотика на биосинтез пенициллина, а у неактивного мутанта азот продолжает использоваться на интенсивный рост биомассы. Химический состав мицелия и его отдельных азотсодержащих фракций существенно не отличается у этих штаммов.
312
В качестве единственного источника углерода среды лучшим соединением для биосинтеза пенициллина признана лактоза, так как она используется грибом медленнее, чем, например, глюкоза, в результате чего в период максимального образования антибиотика лактоза еще содержится в среде. Это создает наиболее благоприятные условия для образования пенициллина.
На среде с глюкозой происходит ускорение всех обменных процессов. Максимум образования
-----1______f___- - - ____X
О 0,5 1,0 $0 10,0
Подсолнечное масло, %
Рис. 51. Влияние подсолнечного масла на биосинтез пенициллина (Ннири, Ленгель, 1965)
пенициллина наблюдается при-
близительно через 50 ч, т. е. через 2 сут после начала развития гри-
ба, а глюкоза используется организмом за первые 30—40 ч роста. В присутствии же лактозы максимальное образование пенициллина происходит через 6—7 сут, а лактоза потребляется грибом приблизительно за 6 сут. Однако в среде для развития Р. chrysogenum
лактозу можно заменять легко используемыми углеводами — глюкозой, сахарозой, галактозой, ксилозой, крахмалом (гидролизованным) при условии их непрерывного введения в среду. Если глюкозу, например, подавать в среду непрерывно со скоростью 0,032% в 1 ч, выход пенициллина на кукурузной среде по сравнению с лактозной повышается на 15%, а на синтетической — на 65%.
В процессе развития гриба при заводском получении пенициллина для борьбы со вспениванием среды используют, как правило, растительные масла. Однако было замечено, что эти вещества не являются инертными компонентами субстрата; определенные концентрации, например, подсолнечного масла оказывают влияние на биосинтез пенициллина. Добавление подсолнечного масла к среде в концентрации, не превышающей 1%, не оказывает влияния на образование антибиотика. Повышение концентрации масла приводит к резкому снижению выхода бензилпенициллина (рис. 51).
Токсический эффект масла на процесс образования пенициллина, по-видимому, носит косвенный характер, связанный с нарушением диффузии кислорода в клетки мицелия, обусловленным образованием масляной пленки между стенкой клетки и газообразной фазой культуральной жидкости.
Подсолнечное масло в концентрации от 0,1 до 10% не оказывает токсического воздействия на рост мицелия гриба.
При развитии продуцента антибиотика во встряхиваемых колбах без добавления масел выход пенициллина резко снижается. Добавление органических кислот (малеиновой в количестве 1 г/л один раз в сутки или янтарной 1 г/л два раза в сутки) в опытах на качалках дает возможность получить выход антибиотика до 3000 ед/мл. Ненасыщенные жирные кислоты, этанол, молочная и лимонная кислоты также способствуют повышению образования
313
пенициллина. В ферментерах с перемешиванием после добавления сахара, малеиновой и янтарной кислот и при регулировании вспенивания посредством небольших количеств смеси растительных и углеводородных масел выходы антибиотика достигали 5000 ед/мл. Некоторые масла не используются грибом, часть масел окисляется до СО2, а некоторое количество их включается в различные фракции плесени. Только следы масла, меченного 14С, включаются в пенициллин.
Важное значение в процессе биосинтеза пенициллина имеет сера. Продуценты антибиотика хорошо используют в качестве источников серы сульфаты (например, Na2SC>4) и тиосульфаты (например, Na2S2O3).
Ионы меди, взятые в концентрации большей чем 2 мг на 1 л, полностью подавляют образование пенициллина, но не влияют на рост гриба. Если же к среде, содержащей медь в концентрации, которая тормозит биосинтез антибиотика, добавить железо (1 мг/л), эффект торможения снимается.
Тяжелые металлы в нейтральных и щелочных средах могут вступать в реакцию с фосфатами, образуя нерастворимые соли; вместе с тем они могут образовывать хелаты с аминокислотами, ди-и трикарбоновыми кислотами, имеющимися в среде.
В качестве источников фосфора Р. chrysogenum может использовать как фосфаты (КН2РО4), так и фитаты (соли инозитфосфорных кислот). Продуцент пенициллина содержит фермент, разрушающий фитин с освобождением неорганического фосфора.
Оптимальной температурой для развития гриба и биосинтеза пенициллина в первой фазе является температура 30°С, во второй фазе — 20°С.
Большое значение для образования пенициллина имеет аэрация культуры; максимальное накопление пенициллина происходит при интенсивности аэрации, близкой к 1.
Уменьшение интенсивности аэрации или ее чрезмерное увеличение приводят к снижению биосинтеза антибиотика. Существенную роль при этом имеет перемешивание культуры. Так, с увеличением мощности, затрачиваемой на вращение мешалки в ферментере на 7500 л, скорость потребления лактозы увеличивается и биосинтез антибиоти-
J.ZW0
I 1600
I 1 1200
Сг § 800 g-t W0
Время купьтЗщюВания, У
Рис. 52. Влияние мощности, затрачиваемой на вращение мешалки, на образование пенициллина культурой Penicillium chrysogenum Wiss.
Q-176 (no Wegrich a Shurter, 1953)
314
,ка возрастает (рис. 52). От способа перемешивания культуральной жидкости зависят форма и величина глубинных колоний, состояние которых определяет степень способности мицелия образовывать пенициллин. В процессе развития Р. chrysogenum штамм 194 в среде накапливаются продукты обмена гриба, токсичные для биосинтеза пенициллина. Причиной образования этих продуктов, вероятно, является автолиз мицелия. Добавки питательных веществ по ходу развития продуцента антибиотика снижают процесс автолиза мицелия гриба и способствуют минимальному образованию токсических веществ.
Высокий выход пенициллина, таким образом, может быть получен при следующих условиях развития гриба: хороший рост мицелия, достаточное обеспечение культуры питательными веществами и кислородом, оптимальная температура (в период первой фазы 30°С, в период второй фазы 20°С), уровень pH ниже 8,0 (но не ниже 7,0), медленное потребление углеводов, наличие подходящего предшественника. Для периода фазы роста гриба желательно иметь pH среды ниже 7,0 и обязательно присутствие в среде легкодоступного источника углерода. Медленное потребление углеводов во время фазы образования пенициллина достигается либо использованием лактозы, либо дробным внесением глюкозы или другого сахара.
Предшественники биосинтеза пенициллина
Penicillium chrysogenum в процессе жизнедеятельности образует различные типы пенициллинов (пенициллины G, X, F и К), отличающиеся строением радикала молекулы, величиной антибиотической активности и спектром биологического действия.
Большую роль в процессе биосинтеза пенициллина определенного типа и в увеличении его выхода играют так называемые предшественники. Предшественниками могут служить только те органические вещества субстрата, которые в процессе биосинтеза антибиотика тем или иным путем включаются в его молекулу. Организм-продуцент пенициллина включает в молекулу антибиотика некоторые органические соединения или часть их без предварительного расщепления на отдельные фрагменты и последующего ресинтеза.
В работах Левитова с сотрудниками показано, что в отдельных случаях при введении одного предшественника в среду происходит образование нескольких пенициллинов. Эти наблюдения указывают, что вещества, применяемые в качестве предшественников, в процессе развития гриба также могут под действием ферментов, образуемых им, изменяться, а затем включаться в биосинтез молекулы пенициллина наряду с другими компонентами среды. Предшественники под воздействием гриба способны окисляться до СО2 и воды. Различные типы пенициллинов, образуемые грибом, близки по химическому строению. Отличие в их структуре определяется лишь строением радикала. Состав и название некоторых типов пенициллинов приведены в табл. 80.
315
Таблица 80
Различные типы пенициллинов и строение их радикалов
Название пенициллина Строение радикала (R) Активность натриевых солей, ед/мг
общепринятое условное
Бензилпенициллин . . . G СН2— 1667
л-Оксибензилпенициллин X но——СН,— 900
2-Пентенилпенициллин F СН3СН2СН=СНСН2— 1600
л-Гептилпенициллин . . К CHj(CH2)5CH2—• CHj(CH2)3CH2— 2300
л-Амилпенициллин . . . Днгидро 1500
F
Феноксиметилпенициллин V 0—СНг-т- 1670
Аллилмеркаптометилпени-
циллин О CH2=CHCH2SCH2— 1630
Радикал соединяется с общим для всех типов ядром молекулы пенициллина, называемым 6-аминопенициллановой кислотой, состоящей из р-лактамного и тиазолидинового колец:
/(-лактамное тиазолидиновос
кольцо / кольцо
\
R—СО—HN—CH—СН С(СН3)2
Боковая: | I
цепь • О=С—rN----СНСООН
6- аминопенициллановая кислота-
Мойер и Когхил (1947) одними из первых установили, что при добавлении к культуре гриба фенилуксусной кислоты выход пени-
фенилуксусная кислота
циллина повышается на 30—50%. Позднее было показано, что фенилуксусная кислота и многие ее производные — предшественники биосинтеза пенициллина. Присутствие в кукурузном экстракте фе-нилэтиламина (C6H5CH2CH2NH2) способствует образованию бен-
316
зилпенициллина; в данном случае фенилэтиламин выступает также в качестве предшественника бензилпенициллина (пенициллин G).
Зависимость образования того или другого типа пенициллина от наличия в среде предшественника представлена в табл. 81.
Таблица 8t
Влияние добавления предшественников к кукурузной среде на образование пенициллина культурой Penicillium chrysogenum (по Higuchi et al., 1946)
Предшественник Возраст культуры Общее содержание пенициллинов, ед/мл Содержание различных пенициллинов в смеси, %
G X К
Без предшественника 60 161 44 3 53
108 559 22 8 70
Р-Фенилэтиламин 60 267 93 2 5
(CeHs-CHs-CH^NHJ 108 726 78 5 17
Фенилацетамид 60 335 99 1 —
(С6Н5СН.2С^ ) xnh2 108 616 78 2 20
Фенилуксусная кислота 60 448 97 3 —
(С6Н6СН2СООН) 108 673 75 — 25
n-Оксифенилуксусная кислота 60 209 39 26 35
(НОС6Н4-СН2СООН) 108 462 34 10 56
Приведенные в табл. 81 данные позволяют сделать следующие выводы: 1) при развитии гриба в среде без дополнительного внесения предшественника образуется около 45% бензилпенициллина и около 53% пенициллина К, с возрастом культуры биосинтез сдвигается в сторону образования пенициллина К (до 70%); 2) при добавлении к среде производных фенилуксусной кислоты наблюдается увеличение выхода пенициллина и меняется соотношение образующихся компонентов в сторону увеличения G-пенициллина, количество которого в зависимости от возраста мицелия достигает 75— 99%от общего содержания в культуральной жидкости смеси пенициллинов и уменьшения К-пенициллина. В процессе культивирования Р. chrysogenum в среде, не содержащей фенилуксусной кислоты, в культуральной жидкости накапливаются серосодержащие соединения не р-лактамного характера. По хроматографической активности они близки к цистеину (CH2SH—CHNH2—СООН) и метионину (CH2SCH3—СН2—CHNH2—СООН).
Добавление к среде для культивирования гриба фенилуксусной кислоты приводит к более интенсивному превращению серосодержащих компонентов в соединении р-лактамного характера.
Различные штаммы Р. chrysogenum по-разному относятся к предшественнику: чем активнее штамм, тем «экономичнее» он использует такой предшественник, как фенилацетамид.
317
В зависимости от штамма происходит использование различных количеств предшественников (от 0,1 до 10%) для синтеза антибиотика. При этом от 5 до 30% предшественника остается в среде, а большая часть его окисляется организмом до СО2 и воды, т. е. используется по другим путям обмена веществ. Однако отдельные штаммы в определенных условиях превращают в антибиотик практически весь объем предшественника (фенилацетамид), если его начальная концентрация не превышает 1 мг/мл. Штамм Wis-51—20 превращает в пенициллин только около 40% предшественника.
При добавлении к синтетической среде 0,1% феноксиуксусной кислоты Р. chrysogenum образует феноксиметилпенициллин (пенициллин V). На среде с кукурузным экстрактом в присутствии того же предшественника наряду с пенициллином V образуются также пенициллины других типов (до 25% от общего выхода антибиотиков).
Среди различных пенициллинов феноксиметилпенициллин обладает значительно более высокой устойчивостью в кислой среде, что существенно отличает его от бензилпенициллина и других пенициллинов.
Отмечено, что предшественники биосинтеза пенициллина (фенилуксусная кислота, фенилацетамид, феноксиуксусная кислота) при определенных концентрациях и pH среды оказывают токсиче-
Фенцпдксусная кислота, мкг/мп
2000
Рис. 53. Влияние фенилуксусиой кислоты на развитие мнцелия Penicillium chrysogenum (Ниири, Ленгель, 1965)
2100
WOO <
/ / / / *250
^300
о КО 500 Ш 5000
Фенипуксусная кислота, мкг/мп
Рис. 54. Влияние фенилуксусной кислоты, добавленной через 24 ч на биосинтез пенициллина грибом Penicillium chrysogenum (Ниири, Ленгель, 1965)
318
ское действие на Р. chrysogenum. Из названных предшественников фенилуксусная кислота обладает наименьшей токсичностью. Добавление фенилуксусной кислоты в среду при концентрации выше 500 мкг/мл угнетает рост мицелия гриба особенно в первые 24 ч его развития. Добавление же этой кислоты к субстрату в количестве от 100 до 500 мкг/мл, наоборот, стимулирует рост мицелия плесневого гриба (рис. 53). Оптимальной концентрацией фенилуксусной кислоты, добавленной через 24 ч после начала развития Р. chrysogenum, обеспечивающей наибольший выход пенициллина (по данным через 72 ч развития гриба), будет 500—1000 мкг/мл (рис. 54). Одновременное внесение в среду фенилуксусной кислоты в концентрации 1000 мкг/мл и 1% подсолнечного масла приводит к полному прекращению процесса биосинтеза пенициллина при нормальном росте гриба.
По мнению Левитова (1957), процесс биосинтеза определенного пенициллина при добавлении к среде «предшественника» с биологической точки зрения — процесс обезвреживания токсического для организма вещества путем связывания его продуктами обмена гриба в результате «защитного синтеза». Этим и объясняется эффект образования пенициллина при повторном введении в среду, например, фенилуксусной кислоты; повторное введение предшественника вызывает ответную реакцию организма, характеризуемую усиленным процессом связывания предшественника.
Идею образования антибиотиков, связанную с защитным синтезом, в результате которого происходит детоксикация вредного (вредных) для микроорганизма продукта метаболизма, позднее была развита Даром и Кэном. Образование таких «двухкомпонентных» антибиотиков, как актиномицины, макролиды и др., происходит, по мнению этих авторов, в результате обезвреживания некоторых токсичных для организмов веществ путем связывания их с другими веществами, позволяющего образоваться продукту, нейтральному для продуцента. Например, в состав макролидных антибиотиков входит углеводный компонент пираноза. Дар и Кэн предполагают, что образование указанных антибиотиков обусловлено реакцией обезвреживания этого сахара, с образованием дезо-заминов. Биосинтез же актиномицинов, по их мнению, связан с обезвреживанием гетероциклических фрагментов путем их пепти-дизации.
Таблица 82
Содержание пенициллина в фильтрате, экстракте из клеток и в стенках клеток в процессе развития гриба
Время инкубации, ч Содержание пенициллина, ед. Содержание пенициллина в экстракте и стейках клеток, % от общего количества
фильтрат экстракт стенки клеток
24 2 520 10 10 0,79
64 56 600 288 71 0,63
93 70 300 425 87 0,73
319
Основная масса пенициллина в процессе биосинтеза выделяется в окружающую среду и лишь небольшое количество антибиотика содержится внутри мицелия гриба и в клеточной стенке (табл. 82).
Приведенные в табл. 82 данные показывают, что относительное содержание пенициллина в экстракте и стенках клеток по отношению к общему количеству антибиотика остается постоянным и не превышает 0,8%.
Полусинтетический способ получения пенициллинов
Большое значение в настоящее время имеет так называемый полусинтетический (биологический+химический) способ получения аналогов природного пенициллина, обладающих рядом ценных свойств.
Исходным продуктом в указанном синтезе служит 6-аминопени-диллановая кислота (6-АПК):
ZS\
NH2—СН—СН С(СН3), III’ О=С------N----СНСООН
6-аминопенициллановая кислота
Кислоту получают в результате биосинтеза при развитии Р. chrysogenum в специфических условиях его культивирования (при отсутствии предшественника в среде) или чаще путем ферментативного дезацилирования бензилпенициллина или фенокси-метилпенициллина с участием пенициллинацилазы (пенициллина-мидазы). Впервые на возможность получения 6-АПК в результате изменения условий культивирования гриба указал Като (1953). Это соединение позже было предложено получать из культуральной жидкости Р. chrysogenum, выращенного в среде без предшественника. Однако наиболее перспективным способом получения 6-АПК являются ферментативный метод гидролиза молекулы бензилпенициллина с участием иммобилизованной пенициллинацилазы.
Фермент пенициллинацилаза осуществляет гидролиз бензилпенициллина с образованием 6-аминопенициллановой кислоты и фенилуксусной кислоты, соединенных в молекуле антибиотика карбоксиламидной связью.
Образование пенициллинацилазы широко распространено среди различных групп микроорганизмов. Все продуцирующие пенициллин грибы способны образовывать этот фермент. Пенициллинацилаза, выделенная из плесневых грибов, дрожжей и актиномицетов, обладает более высокой активностью по отношению к феноксиметил-, n-гептил- и n-аминопенициллинам; фермент же, полученный из бактерий и нокардиа, осуществляет гидролиз бензилпенициллина быстрее, чем других пенициллинов. В последнее время предложен способ получения клеток Escherichia coli, обладающих высо-
320
кой пенициллинацнлазной активностью и пригодных для многократного применения при ферментативном получении 6-аминопеницил-лановой кислоты.
Пенициллины, полученные в результате смешанного (биологический н химический) синтеза (полусннтетическне пенициллины;
Таблица 83
Тип пенициллина Общепринятое название Строение радикала (R)
Кислотоустойчивые препараты
я-Феноксиэтилп енициллии Фенетицнллин
я-Фенокснпропил пенициллин я-Феноксибензилпеиицил-адв Пенс Пропициллии Фенбенициллии циллиназоустойчивые препс 1раты
2-6-Диметокснфенилпени-цнллин Метициллин
Кислота- и пенициллиназоустойчивые препараты
5-Метнл-3-фенил-4-изок-сиазолилпен (циллип
1-Этоксн- 1-нафтилпени-циллин
Оксациллин
Нафцкллнн
И—742
321
Продолжение табл. 83
Тип пенициллина
Общепринятое плавание
Строение радикала (R)
2-Бифенилилпенициллии
Дифепицмллнн
З-О-хлорфенил-5-метил- 4-изооксазолиль
Клоксациллин
Кислотоустойчивые и широкоспектровые препараты
a-D-(-) Аминобензилпени- Ампициллин циллни I
Наряду с пенициллннацплазой имеется фермент пенициллиназа’ (пенициллин-р-лактамаза), который вызывает у бензилпенициллина гидролитическое расщепление р-лактамного кольца с образованием биологически неактивной бензилпенициллоиновон кислоты.
Пенициллиназа и пенициллинацилаза могут одновременно продуцироваться различными видами микроорганизмов (Е. coli, No-cardia, Str. lavendulae и др.). Среди изученных штаммов Е. coli 79% оказались способными образовывать пенициллиназу, 72% — ацилазу, 59% — продуцировали оба фермента одновременно, 6% штаммов не образовывали указанные ферменты.
Необходимо отметить, что 6-аминопенициллановая кислота практически лишена антибиотических свойств; ее биологическая активность составляет примерно одну двухтысячную активность бензилпенициллина.
В настоящий период наиболее широкое применение в медицинской практике находят полусинтетические пенициллины, полученные на основе 6-аминопенициллановой кислоты.
1 Термин «пенициллиназа» был использован впервые Абрагамом и Чейном в 1940 г., которые показали, что экстракты, выделенные из клеток бактерий различных видов, способны инактивировать (разрушать) пенициллин.
322
Получение 6-аминопенициллановой кислоты в широких мас-табах осуществляется с помощью иммобилизованной пенпцилли-намндазы *. Ферментативный метод гидролиза бензилпенициллина по сравнению с кислотным гидролизом имеет ряд преимуществ в выходе и чистоте основного продукта.
6-Аминопенициллановую кислоту подвергают химическому ацилированию и получают соответствующие аналоги пенициллина, обладающие иными свойствами по сравнению с природными пенициллинами. В результате удалось получить около 30 тыс. полу-синтетических пенициллинов, из них около 35 антибиотиков притеняются в клинике, часть из них приведена в табл. 83.
В настоящее время пенициллин (бензилпенициллин) весьма необходим не только как химиотерапевтический препарат, но и как исходный материал для получения 6-аминопенициллановой кислоты.
Все известные пенициллины, подобно бензилпенициллину, подавляют синтез клеточной стенкн бактерий.
Наиболее ценными с практической точки зрения полусинтетиче-скими препаратами пенициллина следует считать ампициллин, оксациллин, клоксациллин, нафциллнн и метициллин.
Химический синтез пенициллина
После открытия лечебных свойств пенициллина были предприняты попытки осуществить химический синтез молекулы пенициллина.
В 1957 г. Шеан с сотрудниками синтезировал природный пенициллин (феноксиметилпеницпллин), но полученные таким путем препараты пенициллина практического значения не имели. Позднее под руководством Шеана был получен новый синтетический пенициллин— стафциллин, эффективный против форм стафилококков, устойчивых к пенициллину.
Фазы процесса развития гриба
и биосинтеза пенициллина
Изменения, происходящие в мицелии гриба Р. chrysogenum и в культурной жидкости в процессе биосинтеза пенициллина, имеют определенный фазовый характер.
’ Иммобилизованные ферменты биологические катализаторы, связанные с определенными нейтральными носителями. В качестве носителей могут использоваться различные полимерные (декстраны, акриламид, винилацетат и др.), а также селикатные (стекло, силикагель) материалы. Иммобилизация может осуществляться тремя основными методами: 1) включением фермента в поры носителя и микрокапсулированием; 2) ковалентным связыванием с носителем; 3) сорбцией (нековалентной) нативных и модифицированных белков.
П*
323
Рис. 55. Развитие Penicillium notaium и биохимические изменения субстрата при росте гриба на качалке в среде, содержащей 2% лактата и 2% кукурузного экстракта (по Chain, 1949):
1 — pH—0,1, 2—пенициллин (елмлХЮ), 3 — масса сухого мицелия (мг/мл), 4 — оставшаяся лактоза (%). 5 — оставшаяся
молочная кислота (%)
йреня купьтиХироЪания. сут
Рис. 56. Типичные метаболические изменения в культуре Penicillium notaium на качалках при образовании пенициллина в среде, содержащей 2% лактозы и 2% кукурузного экстракта (по Chain, 1949):
7—% азота в мицелии (ХОД), 2 — масса сухого мицелия (мг/мл), 3—аммиачный азот (мг/100 мл), 4 — ЬЮз— N (мг/100 мл), 5 — общий неаммначнын азот (мг/100 мл)
По данным ряда авторов, при развитии гриба на кукурузно-лактозной среде можно выделить три фазы (рис. 55).
Первая фаза—рост мицелия; выход антибиотика довольно низок. Молочная кислота, всегда присутствующая в кукурузном экстракте, потребляется организмом с максимальной скоростью. Лактоза в этот период развития гриба используется медленно. В среду выделяется аммиак, резко поднимающий значение pH среды.
Вторая фаза — максимальное образование пенициллина, связанное с быстрым потреблением лактозы и аммонийного азота (рис. 56). Увеличение массы мицелия незначительное; pH среды остается почти без изменений.
Третья фаза — снижение концентрации антибиотика в среде. В связи с начавшимся автолизом мицелия происходит выделение аммиака, сопровождающееся некоторым повышением pH среды.
Исходя из положения Шапошникова о двухфазности ряда микробиологических процессов, характер развития Р. chrysogenum, биохимические изменения в субстрате и биосинтез пенициллина при условии, что гриб начинает развиваться при засеве среды спорами или мицелием, не перешедшим еще в стадию антибиотикооб-разования, могут быть также разделены на две фазы.
В первой фазе развития наблюдается усиленный рост гриба, происходит энергичное потребление источников углерода, усилива
324
ется азотный обмен, pH среды значительно возрастает, потребле-' ние кислорода высокое. Образования антибиотика в первой фазе, практически не происходит.
Во второй фазе значительно
снижается прирост мицелия гриба, снижается интенсивность поглощения кислорода, pH среды почти не изменяется. Основная масса источника углерода уже использована. В этот период происходит образование основного количества пенициллина (рис. 57).
Беккер, Смирнова и др. (1956—1957) описали наличие шести условно выраженных возрастных фаз, определяемых при цитологическом и цитохимическом изучении продуцентов пенициллина.
Установлено, что в заметном количестве пенициллин начинает образовываться лишь с IV возрастной фазы гриба. Максимум накопления антибиотика в культуральной среде приходится на VI фазу в период автолиза.
Определение возрастных фаз и связанного с ними биосинтеза пенициллина путем микроскопического контроля за культурой поз-
Вреня lyrtmuBupolaHUS, ч
Рис. 57. Биохимические изменения в связи с образованием пеницилл на при развитии гриба в ферментере (по
Herold, 1957):
1 — содержание пенициллина в среде ед/мл Х1000 (шкала А), 2—масса сухого мицелия, г/100 мл (шкала Д), 3 — лактоза, мг/мл (шкала В), 4— pH—10 (шкала D), 5 — SOj (сульфат) мг/мл (шкала С), 6 — аммиачный азот, мг/мл (шкала Р), 7 — аминный азот, мг/мл (шкала D)
воляет установить: 1) ход общего темпа развития гриба с выясне-
нием его возрастного состояния, пригодного для использования посевного материала, и контроля за ходом образования антибиотика;
Изменения химического состава мицелия Penicillium chrysogenum в динамике его развития (по Баскаковой и Якимову, 1965)
Таблица 84
Возраст дшнелия, ч Биомасса, г/100 мл культуральной жидкости Общий азот, % ©т сухого * мицелия Белок, % от сухого вещества Содержание углеводов. % от сухого вещества Жир, % от сухого вещества
моносахара дисахара клетчатка
24 0,82 8,8 49,2 0,3 1,5 7,0 4,1
48 1,40 7,2 41,9 0,4 1.0 6,6 3,2
72 1,62 7,3 42,8 0,6 0,5 7,9 3,2
96 1,40 6,2 34,6 1,8 — 7,2 1,8
120 1,23 4,9 26,8 1,2 — 7,1 1,5
325
2) наличие дефектов развития и возможных причин этих дефектов; 3) момент окончания развития гриба в ферментерах. Изменения химического состава мицелия Р. chrysogenum изучены в процессе его развития на среде, указанной на с. 312. Данные по изменению содержания общего азота, белка, углеводов и жира представлены в табл. 84.
Количество общего азота и содержание белка в мицелии по ходу развития гриба уменьшаются. Содержание моносахаров в мицелии к периоду максимального биосинтеза пенициллина (96 ч) увеличивается примерно в 6 раз по сравнению с начальным периодом развития Р. chrysogenum, количество дисахаров уменьшается.
Аминокислотный состав белков мицелия пенпцнлла в качественном отношении не зависит ни от среды, на которой развивается гриб, ни от возраста мицелия. Однако количество отдельных аминокислот значительно изменяется как по ходу развития пенпцнлла, так и в зависимости от состава среды. Всего в мицелии гриба определено 12 аминокислот (иистеин + цистин, лизин, гистидин, аргинин, гликокол, глутаминовая кислота, аспарагиновая кислота, аланин, тирозин, валин. фенилаланин, лейцин). Изменение содержания указанных аминокислот в гидролизатах белка мицелия Р. chrysogenum по ходу развития гриба приведено в табл. 85.
Таблица 85
Изменение содержания аминокислот белка мицелия (% от сухого вещества) в динамике роста гриба
(по Баскаковой и Якимову, 1965»
Аминокислота Время культивирования гриба, ч
24 48 72 96 120
Цистеин цистин 3,85 1,16 2,42 0,59 0,40
Лизин 4.40 2.16 2,72 2,18 1,52
Гистидин 1,95 0.44 0,49 0,57 0,44
Аргинин 4,39 2.61 1,90 0,98 1.69
Гликокап 0.29 0.91 0,62 0,52 0,35
Глутаминовая кислота 2,23 0,78 0,58 0.60 0,18
Аспарагиновая кислота 0.25 1.06 1,18 0.83 0,61
Аланин 5,08 1,79 1,58 1,58 0,88
Тирозин 2.17 0,56 0,46 0.44 0.25
Валки .... 1,13 0,75 0.78 0.56 0,49
Фенилаланин 2,29 2,45 1,36 1,06 1,01
Лейцин 1,76 0,96 0,69 0.86 0,63
Лизин, содержащийся в мицелии гриба в значительном количестве по ходу развития пенициллина, оказывает угнетающее действие на биосинтез пенициллина покоящимися клетками гриба. Вместе с тем еще ранее было показано, что примерно четверть штаммов Р. notatum, не содержащих лизина, оказалась неспособ
326
ной к биосинтезу пенициллина.
H2N—(СН2)4—CHNH2—СООН НООС—(СН2)3—CHNH2—СООН
Лизин а-Аминоадппиновая кислота
Действие лизина, угнетающее биосинтез пенициллина, может быть снято добавлением к субстрату а-аминоадипиновой кислоты.
Процесс биосинтеза пенициллина необходимо проводить при самом тщательном соблюдении стерильности всех операций — загрязнение культур посторонней микрофлорой вызывает резкое снижение накопления антибиотика. Известно, что многие бактерии, обычно встречающиеся в воздухе (Вас. subtilis, Вас. mesentericus, Вас. megatherium, Вас. cereus, Е. coli и др.), способны образовывать фермент пенициллиназу, расщепляющий пенициллин. Пенициллиназа инактивирует пенициллин вследствие разрыва р-лактамного кольца молекулы антибиотика. Особенно активно продуцируют пенициллиназу Вас. subtilis и Вас. cereus. Загрязнение культуры гриба одной из этих бактерий может привести к резкому снижению количества антибиотика в культуральной жидкости.
Температурный оптимум действия пенициллиназы 37°С. Одним из активных продуцентов пенициллиназы оказалась туберкулезная палочка Mycob, tuberculosis. Возможно, именно с этим свойством связана нечувствительность туберкулезных палочек к пенициллину.
Пути биосинтеза молекулы пенициллина
Как уже отмечалось (с. 316), направленный биосинтез того пли иного типа пенициллина обеспечивается добавлением к среде для культивирования Р. chrysogenum фенплуксусной кислоты или ее производных, а также других соединений — предшественников молекулы пенициллина. Следовательно, эти соединения, включающиеся в боковую цепь молекулы пенициллина, определяют направленность биосинтеза антибиотика. В настоящее время получены данные, способствующие раскрытию путей биосинтеза основной бициклической структуры пенициллина — 6-аминопенициллановой кислоты и всей молекулы антибиотика.
Использование современных высокоэффективных методов исследования путей биосинтеза молекулы пенициллина, в том числе применение протопластов грибов (клеток, лишенных стенок) и их лизатов, мутантов грибов-продуцентов этих антибиотиков, блокированных по различным этапам биосинтеза молекулы пенициллина, а также широкое использование меченых соединений, в частности аминокислот, входящих в молекулу антибиотика, позволяет с большой достоверностью определить основные пути биосинтеза молекулы пенициллина.
Установлено, что молекула пенициллина образуется из L-цис-теина, L-валина и неполярных карбоновых кислот—предшественников бокового радикала молекулы пенициллина. Кроме указан
327
ных соединений обязательным компонентом процесса биосинтеза пенициллина является L-a-аминоаднпиновая кислота (L-a-AAK).
Образование аминоадипиновой кислоты происходит из кетоглутарата и ацетил-КоА по следующей схеме:
о=с—соон о=с—соон СН2 H.N—СН—СООН СН,
сн, + 1 * сн,соон —— сн2 СН,
сн.—соон сн,—соон СН,—соон
Кетогтутаровая Кетоалипиновая Аминоадипиновая
кислота кислота кислота
Первым этапом биосинтеза молекулы пенициллина следует считать образование трипептида: L-ампноаднпнл-Е-цистепнил-D-валин (LLD). Отмечено, что в начале процесса образуется дипеп-тпд (L-a-амнноаднпил-Е-цистеин), который затем, взаимодействуя с L-валином, образует трипептид. LLD-трнпептид превращается в изопенициллин N через моноциклический р-лактам:
z$((
R—I О — \и—си—СК
LLD -тршюитид
СН—СН
I хсц
CCHHI
I I /сн-
,С---N—C-J[—С([
Монодиыическиц Д-.имям
Образование р-лактама происходит в результате замыкания кольца между С-З-цистеина и NH-группой валина. Этот процесс — первая стадия циклизации LLD-трипептида в первичный антибиотик — изопенициллин N.
Первоначально образование основного ядра молекулы пенициллина— 6-аминопенициллановой кислоты (6-АПК) было показано при культивировании гриба в среде, не содержащей предшественника, а затем 6-АПК была выделена из культуральной жидкости продуцента пенициллина и определено ее строение.
Позднее многие исследователи искали у Р. chrysogenum фермент, превращающий молекулу 6-АПК в пенициллин, т. е. осуществляющий ее ацилирование. В результате в 1968 г. появилось сообщение о наличии в мицелии гриба фермента пенициллинацилтранс-феразы, способного осуществлять перенос ацильной группы различных пенициллинов на 6-АПК. Причем было показано, что образование фермента совпадает с периодом активного процесса биосинтеза пенициллина; следовательно, фермент принимает непосредственное участие в процессе биосинтеза молекулы пенициллина.
328
Таким образом, можно утверждать, что в процессе образования пенициллина изопенпциллин N и 6-АПК и есть непосредственные предшественники.
На основе данных о механизме биосинтеза молекулы пенициллина весь процесс можно представить схематическп:
tt-кетоалипнновая хяслота
I
L-я -ам иноадмшшовая кислота fL-a-4 4К) Тз-ЦйстСШГ
1- а - А А К- L -цис гепв(ЬЬ-Д цпсппгл) l^L-валин
L- а-А АК-1лц11сгсин<0 -валик (ILD-трипептид)
I
Моноцикл и ясский /3-лактам
I
Мзопеимцил.лпн N. (L-и-ААК-б-ДПК)
«'„ЩСНдСООН—
Еензилпипщоллив (С4П3СЦ2СО-6-А ПК)
Схема биосинтеза пспицплзинi
Обозначени я:6-ЛПК-ь-аыипошш1даллш1ов<1Я xuc-ioia
Выделение пенициллина
Первый этап прн выделении пенициллина, как и многих других антибиотиков, накапливающихся в культуральной среде, — отделение мицелия гриба от культуральной жидкости путем фильтрации или центрифугирования. Во избежание потерь антибиотика мицелий гриба отделяют п промывают.
Извлечение пенициллина из культуральной жидкости в настоящее время обычно проводят методом экстракции антибиотика органическими растворителями, не смешивающимися с водой (амилацетат, хлороформ, бутилацетат, бутиловый спирт и др.).
Процесс экстракции антибиотика из культуральной жидкости основан на методе замены растворителей, состоящем в том, что пенициллин в виде свободной кислоты может быть экстрагирован каким-либо растворителем, а затем снова переведен в водный рас
329
твор в виде соли путем добавления определенного количества щелочи. Соли пенициллина плохо растворимы в указанных органических растворителях, поэтому их можно почти количественно перевести из органического растворителя в водный раствор. Повторение таких операций способствует концентрации и очистке препарата.
Действие пенициллина на бактерии
Вопросу рассмотрения антибиотической активности пенициллина 1 в отношении ряда микроорганизмов уделено достаточно много внимания. Установлено, что пенициллин оказываем антимикробное действие в отношении некоторых грамположительных бактерий (стафилококки, стрептококки, диплококки и некоторые другие) и практически неактивен в отношении грамотрицательных бактерий и дрожжей.
Высокие концентрации пенициллина (10 мг/мл) вызывают гибель клеток гаплоидного штамма дрожжей Saccharomyces cerevi-siae и Escherichia coli.
Антимикробный спектр бензилпенициллина
М икраорганизм
Минимальная концентрация антибиотика, подавляющая
роет микроорганизма, мкг/мл
Streptococcus pyogenes . . Streptococcus pneumoniae . Staphylococcus aureus . . .
Clostridium tetani . . . .
Corynebacterium diphtheriae Streptomyces Israeli . . .
Nocardia asteroides . . . .
Escherichia coli ............
Klebsiella pneumoniae . .
0.004—0,03 0,006—0,06 0,006—0,30 0,02—0,30 0,02—0,30 0,06—0.30
30—100 20
100
По характеру действия на микроорганизмы пенициллин — бактериостатический, а в определенных концентрациях бактериоцид-ный антибиотик.
Различные типы пенициллинов обладают различной степенью биологической активности. Различие особенно заметно в опытах in vivo (табл. 86).
Как следует из данных таблицы, наименьшей активностью характеризуется п-гептилпенициллин. По-видимому, это связано с тем, что n-гептилпенициллин значительно быстрее инактивируется в организме.
Чувствительные к пенициллину микроорганизмы относительно легко и быстро приобретают устойчивость к антибиотику. Так Staph, aureus прекращает развитие при концентрации пеницилли-
1 В этом случае имеется в виду бензилпенициллин.
330
Таблица (б
Сравнение биологической активности различных типов пенициллинов в отношении некоторых микроорганизмов в опытах in vivo
Тест-оргзннзм Относительная активность
бен зил пенициллин (G) 2-лентнлпе-ницшишн (F) л-гептнлпе-шщиллнн (К) океибензнт-пеннцнллии (X)
Spirochaeta novyi 100 55 35 22
Pneumococcus типа 1 ... 100 В5 17 140
Streptococcus haemolitycus . 100 100 60 500
Streptococcus pyogenes . . . 100 50 9 260
Treponema pallidum .... 100 17 9 5
на 0,05—0,06 ед/мл в среде, но уже при 20 последовательных пересевах с постепенно увеличивающимися концентрациями антибиотика устойчивость стафилококка возрастает в 700 раз, т. е. для остановки роста бактерии требуется концентрация пенициллина, равная 42 ед/мл, а после 40 пересевов его устойчивость возрастает более чем в 5500 раз.
Микроорганизмы, приобретшие устойчивость к определенному типу пенициллина, как правило, резистентны и к другим типам пенициллина.
У бактерий устойчивость к пенициллинам сопровождается способностью образовывать фермент пенициллиназу.
В ряде случаев микроорганизмы с приобретением устойчивости к пенициллину теряют вирулентность. Но вирулентность восстанавливается после нескольких пассажей через животных и при этом резистентность к антибиотику сохраняется.
Применение в медицине
Многочисленные наблюдения показывают, что пенициллин — наиболее ценное и мощное из известных средств для лечения заболеваний, вызываемых кокками и некоторыми анаэробными палочками. Преимущество пенициллина состоит в том, что этот препарат — один из наименее токсичных антибиотиков, используемых ,в медицинской практике. Достаточно указать, что из 4200 больных, получавших пенициллин, только у 7 больных отмечены клинически выраженные токсические реакции: температурная реакция у 4 больных, некротоксическпе реакции со стороны центральной нервной системы у 2 больных и местная реакция со стороны слизистой .оболочки полости рта у 1 больного. Вместе с тем в последние годы наблюдаются случаи анафилактического шока после внутримышечного введения пенициллина, иногда заканчивающиеся.смертью больного.
331
В целях избежания подобных явлений больным перед введением пенициллина необходимо делать накожные пробы для выяснения возможной чувствительности к антибиотику.
Высокие лечебные свойства и чрезвычайно низкая токсичность способствовали широкому применению пенициллина в медицине. Одним из первых заболеваний, при котором стали применять этот антибиотик, был сепсис (общая гнойная инфекция). Сепсис чаще всего вызывается стафилококками, стрептококками, а иногда и пневмококками. До открытия пенициллина в 90% случаев септические заболевания кончались летально. В настоящее время процент смертности от сепсиса резко сокращен.
Пенициллин широко применяется в хирургии, он с успехом используется при лечении остеомиэлитов (особенно при острых остеомиэлитах), карбункулов, инфицированных ран и других заболеваний. Использование пенициллина создало широкие возможности при лечении таких заболеваний, как перитонит и пневмония.
В педиатрической практике пенициллин имеет большое значение при лечении гнойных осложнений после скарлатины (острые лимфадениты, отиты и др.).
Пенициллинотерапия занимает важное место в лечении сифилиса (в особенности его ранних форм).
Чаще бензилпенициллин применяют внутримышечно (посредством инъекций). Бензилпенициллин при применении в виде таблеток разрушается под действием желудочного сока.
Применение кислотоустойчивого типа пенициллина — фенокси-метилпенициллина позволяет использовать антибиотик в виде таблеток, что имеет большое значение при лечении детей.
В зависимости от характера заболевания суточная доза антибиотика составляет от 200000 до 1 000000 единиц.
В последнее время наиболее широкое применение в медицинской практике находят полусинтетнческие пенициллины, полученные на основе 6-аминопенициллановой кислоты.
ЦЕФАЛОСПОРИН (CEPHALOSPORIN)
Цефалоспорин—антибиотик, образуемый грибами из рода Ceph^ alosporiutn. Основной продуцент этого антибиотика—гриб Cepha-losporium acremonium.
По химическому строению антибиотик принадлежит к группе Р-лактамных соединений, близких к пенициллинам. Цефалоспорин по биологическим свойствам несколько отличается от пенициллина. Цефалоспорин подавляет развитие грамположительных и грамотрицательных бактерий, но антибиотическая активность цефалоспорина гораздо ниже, чем у пенициллина.
Цефалоспорин, подобно пенициллину, содержит р-лактамное кольцо, но он не инактивируется пенициллиназой.
832
Молекула цефалоспорина содержит D-a-аминоадипиновую кислоту. При развитии Cephalosporium sp. как на синтетической, так и на натуральной среде неопределенного состава происходит образование трех форм антибиотика: цефалоспорина С, цефалоспорина N (пенициллина N) и цефалоспорина Р. Пенициллин N впервые получен из культуры гриба Cephalosporium sp. в 1951 г. Позднее было установлено, что некоторые актпномицеты (Str. clautiligerus, Str. lipmanii, Str. lactamdurans) наряду с биосинтезом цефамицина образуют и пенициллин N, Str. cineriorectus sp. nov. синтезирует только пенициллин N.
/SX
ноос—chnh2—(СН2)2—CO—NH—CH—CH CH2 O=C---------------------------N C—CH2O—CO—CHj
COOH
Цефалоспорин C
xCHj
' HOOC—CHNH2—(CH2J —CO—NH—CH—CH C
I I l(1}
O==C---N---С—H
I
COOH
Цефалоспорин N
(О -4-амино-4-клрбок».и- a -бутилпенициилин)
Избыток ионов аммония в среде меняет клеточную дифференциацию продуцента цефалоспорина С. У этого организма синтез щелочных экзопротеаз, пептидною антибиотика и конидиогенез контролируются единым механизмом — азотметаболнтной репрессией.
По-видимому, репрессирующее действие аминокислот у продуцента этого антибиотика осуществляется путем влияния ионов аммония.
Соли аммония подавляют фрагментацию мицелия гриба в артроспоры и конидиогенез в глубинной культуре продуцента цефалоспорина С. При добавлении к синтетической среде D-L-метионина или D-L-норлейцина не позднее чем через 24 ч после начала развития гриба, т. е. в период максимального роста организма, а не в период биосинтеза антибиотика, наблюдается максимальное образование цефалоспорина С. Исключение из среды для развития указанных аминокислот приводит к снижению биосинтеза антибиотика. Лизин подавчял образование цефалоспорина, тогда как близкие к нему е-М-ацетил-Ь-лизин и в-амино-н-капроновая кислота стимулировали биосинтез антибиотика. Однако одновременное добавление к среде D-L-метионина (0,3%) и L-лизина (0,2%) повышает выход цефалоспорина С на 40%.
333
По-видимому, основная роль метионина — стимулятора образования цефалоспорина — состоит в том, что аминокислота является источником серы для биосинтеза молекулы антибиотика.
Добавление к среде бетаина ((СНз)зМ+-СН2СООН) или близкого к нему холина ((СНз)зК+-СН2СН2ОН), в особенности одновременно с метионином, стимулирует образование цефалоспорина С.
Крахмал и декстрины оказались лучшими источниками углерода в среде.
Механизм биосинтеза цефалоспорина
Установлено, что в процессе развития С. acremoniurn наряду с цефалоспорином С образуется пенициллин N, причем биосинтез последнего идет тем же путем, что и образование изопеницнллина N в процессе биосинтеза бензилпенициллина. Следовательно, первичные стадии биосинтеза пенициллина и цефалоспорина идентичны.
Дальнейшие исследования показали, что пенициллин N способен превращаться в цефалоспорин. При этом первым продуктом реакции является деацетоксицефалоспорнн:
ИООС—СН—(СН,).—СО—NH—сн—СН СН2
I III
МН2 О=С--N С—СН3
I соон
Деацетоксицефалоспорнн
Затем было выяснено, что продуцент цефалоспорина образует фермент, гидроксилирующий деацетоксицефалоспорнн в деацетпл-цефалоспорин, который в результате ацетилирования ферментом ацетил-Ко-трансферазой превращается в цефалоспорин С.
HOOC—СН—(СН2)3—СО—JNH—сн—сн сн2 Ml, О=с----N с—сн,—ОН
соон Деацетилцефалоспорин
Весь процесс механизма биосинтеза цефалоспорина С можно представить, следующей схемой:
334
Кетоглутараг Ацетил-КоА
Гомоцитраг
et-кетоадипиновая кислота
L-a-аминоадипиновая кислота (L-a-AAK) L-цистеин
L-a-AAK-L-цистеин (СКтДИпептид) L -валин
L-a-AAK-L -цистеин-D-валин ( LLD-трипептид)
Моноциклический -л актам
Изопеницил'Гин N
Пенициллин N
Деацетоксицеф апоспории
гидроксилаза
Деацетилцефалоспорин
КоА-ацетилтрансфе аза
Цефалоспорин С
Схема биосинтеза цеф, оспорила С
Примечание: И зопеницилтин N содержит в качестве бокового радикала остаток L-a-аминоадипиновой кислоты (L-a-AAK), тогда как пенициллин N содержит D-a-AAK (образуется культурой C.acremonium)
335
Полусинтетические аналоги цефалоспорина
В последнее время методом смешанного (биологического и химического) синтеза получено большое число (около 25 тыс.) аналогов цефалоспорина. Спектры биологического действия этих аналогов весьма разнообразны. Многие из этих соединений (25—30) имеют важное практическое (клиническое) значение.
В результате химической модификации основного ядра цефалоспорина — 7-аминоцефалоспорановой кислоты удалось получить ценные лечебные препараты.
соон
7-аминоцефалоспораиовая кислота
7-Аминоцефалоспорановую кислоту легко получают в результате отщепления остатка аминоадипиновой кислоты от молекулы цефалоспорина С под действием фермента ацилазы или химическим путем.
Модификация основного ядра цефалоспорина может происходить с двух сторон молекулы. Химическим или биокаталитическпм (под действием фермента эстеразы) путем можно отщепить пра-О II
вую акетокси(—ОС—СН3) группировку 7-аминоцефалоспорановой кислоты с образованием 7-аминодезацетоксицефалослорановой кислоты:
соон
7-аминодезацетоксииефалоспорановая кислота
На основе 7-аминоцефалоспорановой и 7-ампнодезацетоксице-фалоспорановой кислот удается получить большое число полусин-тетических продуктов: цефалоридин, цефалотин, цефалоглицин, цефалексин и др.:
336
Цсфплорилин
Дсфалотин
Цефалоглпцин
Цефалексин
Первые три соединения лабильны в кислых условиях среды, но способны подавлять развитие стафилококков, образующих пенициллиназу. Цефалексин устойчив к кислотам и подавляет штаммы стафилококков, образующие пенициллиназу.
В цефалоглицине боковая цепь молекулы такая же, как и у ампициллина. Оба эти препарата активны в отношении грамот-рицательных бактерий.
В качестве примера ниже приведен антимикробный спектр цефалоспорина.
Антимикробный спектр цефалоспорина
Микроорганизм
Минимальная концентрация антибиотика, подавляющая рост микроорганизма, ыкг/мл
Streptococcus pyogenes .... 0,001—0,05
Staphylococcus aureus..... 0,01—0,1
Corynebacterium diphtheriae . . 0,50—1,0
Bacillus anthracis........ 0,10—1,0
Neisseria gonorrhoeae..... 0,10—0.40
Escherichia coli .............. 2—50
Pseudomonas aeruginosa .... более 100
Salmonella sp............... 2—10
337
Интерес к полусинтетическнм антибиотикам значительно усилился во второй половине 60-х годов. В последнее время достигнуты большие успехи в получении ценных препаратов путем химической модификации многих естественно образующихся антибиотиков (табл. 87). Следует отметить, что полусинтетические антибиотики постепенно вытесняют многие биологически активные соединения, образуемые микроорганизмами. К настоящему времени получено около 60—70 тыс. таких препаратов!
Таблица 87
Общее количество полусинтетических антибиотиков
(no, Berd у, 1980)
Исходный антибиотик Число производных Клиническое применение
Пенициллин 25—30 000 30—35
Цафалоспории 20—25 000 25—30
Другие ₽-лактамы 1500—2000 ?
Тетрациклины" -2500 5—6
Аминогликозиды 2500—3000 4—5
Рифамицин 1500—2000 3-4
Макролиды 800—1000 2—3
Линкомиш н -500 1
Хлорамфеникол -500 1
Антрациклин 200—400 1—2
Блеомицин 200—400 1—2
Коумермицин-новобпоцин 200—300 —
Полиеновые макро гиды 200—300 1—2
Гризеофульвин ' 100—200 —
ФУМАГИЛЛИН (FUMAGILLIN) (Фугиллин, фумидил, фагопедин)
Фумагиллин — один из немногих грибных антибиотиков, относящихся к группе полиеновых антибиотиков, химическое строение которых определяется наличием системы сопряженных двойных связей. Фумагиллин — тетраен, т. е. в его составе имеются четыре двойные связи:
—СН=СНСН=СНСН=СНСН=СН—
В 1960 г. была установлена структурная формула антибиотика:
Фумагпллин образуется культурой Aspergillus fuinigatus. Впервые антибиотик был описан Хансоном и Иблом в 1949 г.; выделен из культуры гриба Мак Коуэном с сотрудниками в 1951 г., а затем Ашешовым с соавторами в 1952 г.
Антибиотик обладает противоамебным действием, он также активен против бактериофага стафилококка. Фумагпллин практически не действует на бактерии и грибы. Есть указания на то, что фумагпллин обладает широким спектром противоопухолевого действия и значительной активностью. Нетокспческпе дозы антибиотика (5 мг/кг в сут) полностью разрушали клетки асцитного рака Эрлиха, сильно угнетали рост саркомы МА 387 и др. В концентрациях 10—100 мкг/мл и выше антибиотик оказывает подавляющее действие на рост и размножение опухолевых клеток асцитной формы и лимфолимы NK/Ly.
В 1956 г. Беккер с сотрудниками выделила отечественный штамм Asp. fuinigatus и разработала среду для биосинтеза антибиотика. В состав среды входят кукурузный экстракт и крахмал. Среда позволяет получать в условиях аэрируемых аппаратов до 100 ед/мл фумагиллина. Антибиотик выделяют из культуральной жидкости экстракцией хлороформом или бутилацетатом с последующей очисткой методом кристаллизации из соответствующих растворителей. В последнее время разработан способ выделения антибиотика путем осаждения его кислотой с последующей перекристаллизацией из органического растворителя.
Фумагпллин находит применение для лечения амебноза и для профилактики ноземы («поноса») пчел, вызываемой Nosema apis, а также при лечении шелковичных червей.
Антибиотик слабо токсичен.
ГРИЗЕОФУЛЬВИН (GRISEOFULVIN) (Гризовин, фульвицин, фульцин, грифульвин)
Гризеофульвнн относится к группе кислородсодержащих гетероциклических соединений. Антибиотик образуется плесневыми грибами из рода Penicillium (Р. urticae, Р. nigricans, Р. raislrichi и др.). Установлено строение гризеофульвина, молекула которого имеет следующую структуру:
Гризеофулышн
Важное значение в процессе биосинтеза молекулы гризеофульвина имеет хлорирование. Подавление реакции хлорирования приводит к образованию гризеофенона С, который в процессе хлориро-
339
вания превращается в гризеофенон В; последний в результате метилирования переходит в гризеофенон А, а затем в гризеофульвин:
Гризеофенон С: R — Rj — W
ГризеофенонВ: R —CI, Rj~H
Гризеофульвин получают в промышленных условиях при развитии гриба Р. urticae (синоним Р. paiulum) в глубинных условиях в среде, содержащей кукурузный экстракт, лактозу, КН2РО4 и КС1. Стимуляция образования антибиотика наблюдается при добавке к среде виннокислого аммония.
В СССР для получения гризеофульвина используется Р. nigricans, который в процессе развития не образует весьма токсичного патулина.
Антибиотик обладает высокой биологической активностью против грибов, имеющих хитиновую оболочку, вызывая у них ненормальный рост с характерным закручиванием.
Антимикробный спектр гризеофульвина
Грибы Минимальная концентрация
антибиотика, подавляющая рост гриба, мкг/мл
Microsporutn cams ...... 0,22—0,24
Microsporum attdouinii .... 0,40—0,46
Epidermophyton floccosutn . . . 0,38—0,42
Trichophyton rubruin.......... 0,14—0,18
Другие патогенные грибы . . . 25—30
Гризеофульвин — мало токсичный препарат. Антибиотик оказался хорошим средством против стригущего лишая, вызываемого грибом Trichophyton rubriim. Он проявляет положительное действие при лечении ряда кожных заболеваний и болезней ногтей.
Гризеофульвин — эффективный препарат для борьбы с мучнистой росой клубники, огурцов, с возбудителем увядания цитрусовых; он проявляет биологическое действие против возбудителя килы капусты.
В связи с широким применением гризеофульвина на практике интерес к нему за последнее время значительно возрос.
ТРИХОТЕЦИН (TRICHOTHECIN)
Антибиотик трихотецин впервые получен Фриманом и Моррисом в 1948 г. Трихотецин образуется одним из штаммов плесневого гриба Trichothecium roseum (гриб широко распространен в природе и его легко можно выделить из различных растительных остатков).
340
Антагонистические свойства Tr. roseuin были известны почти шестьдесят лет назад, однако антибиотическое вещество было выделено спустя почти четыре десятилетия. Tr. roseum, образующий антибиотик, — спорулирующая разновидность этого вида. При развитии на среде Чапека грибы этого штамма, как отмечается в сообщении Силаева, Беккер и др. (1966), «образуют широко растущую шерстистую колонию, приобретающую розовый оттенок при спорообразовании».
Вместе с биологически активной формой гриба в природе встречается другая разновидность, обладающая обильным ростом воздушного ватообразного белого мицелия, не способная к образованию трихотецина.
Трихотецин характеризуется широким противогрибным и антивирусным действием без проявления антибактериальных свойств. Ценное свойство антибиотика — способность подавлять развитие некоторых фитопатогеиных грибов, а также грибов, вызывающих церматомикозы у животных. Антибиотик имеет относительно низкую токсичность.
Строение молекулы трихотецина было выяснено Фриманом с сотрудниками в 1959 г.; антибиотик принадлежит к группе соединений, содержащих в молекуле несколько О-гетероциклов.
Трихотецин, как и близкие к нему соединения (трихотецин Р), образуемый Cephalosporium; розеины 1, II и III, выделенные из Trichothecium; триходермин, полученный из Trichoderma; рориди-ны, веррукарины, синтезируемые Myrothecium verrucaria, а также гиббереллины, продуцируемые рядом видов грибов, имеют терпеноидное строение и общий путь биосинтеза.
Строение трихотецина может быть представлено следующей формулой;
В состав антибиотика с эмпирической формулой Ci9H24O5 входит циклическая структура кетоноспирт — трихотекол С15Н19О3 и изо-кротоновая кислота (СНзСН = СНСООН).
Трихотецин образуется при развитии гриба Tr. roseum на среде, содержащей кукурузный экстракт, сахарозу, сернокислый аммоний и другие минеральные соли. Добавление к среде глицерина (0,5 или 1,0%) значительно повышает выход антибиотического вещества (табл. 88).
В присутствии глицерина (1%) в среде почти вдвое увеличивается потребление сахарозы единицей биомассы гриба; увеличения
341
Таб.ища 88
Влияние глицерина на рост Trichothecium roseum и образование трихотецина (по Максимовой, Беккер и др., 1966)
Концентрация глицерина, % Количество трихотецина, мкг/мл Масса мицелия, мг/л
0 (контроль) 380 960
0,5 420 900
1,0 900 810
массы мицелия не происходит. При добавлении к среде глицерина наибольшее количество сахара потребляется грибом непосредственно в период образования трихотецина; роста мицелия в это время не происходит.
На биосинтез антибиотика существенное влияние оказывает возраст посевного материала. Наилучшее образование трихотецина культурой Tr. roseum происходит при использовании инокулята в возрасте 36—40 ч.
Максимальный выход антибиотика происходит в период 72— 80 ч роста гриба на среде, содержащей в качестве источников углерода 1% глицерина и 3% сахарозы.
Повышение выхода трихотецина в 1,5—2,0 раза происходит при совместном культивировании продуцента антибиотика и гриба- из рода Penicillium (подробнее см. с. 87). Трихотецин играет значительную роль в жизнедеятельности гриба, его синтезирующего. По всей вероятности, он обусловливает микропаразитпзм Tr. roseum, обеспечивая грибу возможность использования поврежденных или убитых антибиотиком других грибов в качестве источника питания.
Изучая влияние трихотецина на продуцент этого антибиотика, было показано, что в концентрации 200 мкг/мл он угнетает рост гриба в первые часы культивирования. Наиболее остро токсическое действие трихотецина проявляется в том случае, если антибиотик вводить в 48-часовую культуру гриба. Антибиотик адсорбируется поверхностью мицелия, нарушает проницаемость клеточных стенок гриба и угнетает образование трихотецина.
В процессе развития гриба антибиотик в основной массе выделяется в окружающую среду. Поэтому выделение трихотецина проводят по схеме: отделение культуральной жидкости от мицелия фильтрацией, экстракция трихотецина четыреххлористым углеродом и выделение антибиотика перекристаллизацией из спирта.
Трихотецин — антибиотик антвфунгального действия. Его применение дает положительные результаты в ветеринарии при борьбе с болезнями сельскохозяйственных животных, вызываемыми патогенными грибами (трихофития крупного рогатого скота и пушного зверя). Он также применяется в растениеводстве против заболева-
.342
нпй, вызываемых Fusarium, отдельными видами Penicillium и А$-pergillus.
Трихотецин может инактивироваться в почве под действием почвенных грибов, образующих фермент трихотециназу.
Из других антибиотиков грибного происхождения, имеющих определенное значение, можно назвать цитринин, выделенный из культуры Aspergillus niger; аспергиллин, полученный из гриба Asp. niger, и ряд других.
АНТИБИОТИКИ ИЗ ЛИШАЙНИКОВ
Лишайники продуцируют многие антибиотические вещества, свойства которых существенно отличаются от всех известных до настоящего времени антибиотиков растительного происхождения.
Начиная с 1946 г. исследователями было обращено внимание на лишайниковые кислоты и в особенности на усниновую кислоту, обладающую сильными антибиотическими свойствами.
он
I с
Х X—СП
. J— он
V*
со—сн3
Усни новая кислота
В 1948 г. была получена растворимая натриевая соль уснино-вой кислоты — бинан. Изучение антимикробных свойств бинана показало, что он обладает избирательным действием по отношению к грамположительным бактериям (Вас. subtilis, Вас. mesentericus. Staph, albus и др.) и некоторым анаэробным формам. Особенно чувствительны к бинану дифтерийные палочки. По действию на организмы натриевая соль усиновой кислоты обладает бактериостатическим свойством.
in—_
I Ж > ВЫСШИМИ РАСТЕНИЯМИ ^aBa_JL.V^ И ЖИВОТНЫМИ
АНТИБИОТИЧЕСКИЕ ВЕЩЕСТВА ВЫСШИХ РАСТЕНИЙ
Многие отечественные исследователи, изучавшие высшие растения, обращали внимание на то, что сок некоторых из них обладает бактерицидными свойствами или инактивирует токсическое действие других организмов. Однако наиболее подробное изучение антибиотических веществ высших растений было проведено Б. П. Тониным. Еще в 1928 г. он обратил внимание на то, что если под стеклянный колпак поместить ветку черемухи (весной или летом) и рядом с ней поставить стакан с протозоа в воде, то через 15—20 мин все протозоа погибают. Следовательно, летучие вещества, выделяемые черемухой, обладают антнпротозойным действием.
Биологически активные вещества высших растений Токин назвал фитонцидами. Фитонциды — продукты жизнедеятельности растений, обнаружены у представителей всех групп высших растений. Наибольшим антибиотическим свойством обладают фитонциды лука, чеснока и некоторых других растений.
Известно, что фитонциды представляют собой не отдельные вещества, а комплексы соединений. Фитонцидными свойствами обладают бальзамы, смолы, вещества хиноидного строения, дубильные вещества, содержащие лактонное кольцо, глюкозиды, антоцианы и другие соединения.
Фитонциды некоторых растений способны стимулировать или подавлять развитие других растений на расстоянии. Обнаружены летучие фитонциды, способные убивать пыльцу других растений или стимулировать ее развитие.
Внешние повреждения растений (ранения) способствуют образованию летучих фитонцидов. Этот факт указывает на приспособительное значение фитонцидов.
Растения одного вида, выращенные в различных условиях, образуют несколько отличные друг от друга фитонциды. Биологическая активность фитонцидов меняется у одного и того же растения в зависимости от сезона года, например осенью хвоя сосны менее бактерицидна, чем хвоя, собранная в мае или в июне.
К настоящему времени изучено большое число различных антибиотиков, образуемых высшими растениями, некоторые из них получены в химически чистом виде.
К числу наиболее изученных растительных антибиотиков относятся аллицин, рафаиин и некоторые другие.
344
АЛЛИЦИН (ALLICIN)
Аллицин — продукт жизнедеятельности чеснока (Allium sativum), выделен и подробно изучен Каваллито с сотрудниками в 1944 г. Антибиотик выделяют из чеснока экстракцией органическими растворителями и очищают перегонкой с водяным паром.
Аллицин, выделенный из чеснока, — очень неустойчивое соединение: при комнатной температуре он разрушается в течение нескольких суток. Однако неповрежденный чеснок сохраняет антибиотическую активность в течение года и более. Изучение этого явления показало, что в чесноке аллицин содержится не в виде свободного соединения, а в виде вещества, которое может переходить в антибиотик. Это вещество было названо аллиином:
С Н ,=С Н—С Н,—S—с н ,сн—соон
II I
О NH,
Алли ин
Аллиин не имеет запаха чеснока и не обладает антибиотическими свойствами.
Превращение аллиина в аллицин происходит под влиянием специфического фермента — аллинназы, содержащегося в соке чеснока.
Из чеснока, охлажденного до —40°С, аллиин можно выделить методом экстракции 80—85%-ным этиловым или метиловым спиртом; экстракт затем смешивают с твердой СОг. В этих условиях аллиин выпадает в виде игольчатых кристаллов. Под действием аллинназы аллиин превращается в аллицин с выделением пировиноградной кислоты и аммиака:
аялишта 2СН,=СНСН.—S—CIbCHCOOH + н.о ----------
’ ! к
Аллиин
---— СН2=СНСН;—S—S—CH2CH=CfL + 2СИ3СОСООН + 2Nttj
° 1
Аллицин Пировиноградная
кислота .
Аллицин подавляет развитие грамположительных и грамотрица-тельных микробов и развитие туберкулезной палочки. Аллицин обладает относительно высокой токсичностью. Летальная доза его при внутривенном введении мышам составляет 60 мг/кг, при подкожном — 120 мг/кг. Высокая токсичность аллицина и неустойчивость препарата делают невозможным его применение в медицине.
345
РАФАНИН (RAPHANIN)
Водные экстракты семян редиса (Raphanus sativum) содержат антибиотик рафанин; корни и листья редиса не содержат антибиотика. Рафаиин был выделен в 1947 г. Из 1 кг семян можно получить до 3 г чистого антибиотика. Рафанин, подобно аллицину, содержится в семенах не как свободное соединение, а в виде проантибиотика; превращается в рафанин под действием энзима, содержащегося в семенах редиса.
Рафанин подавляет развитие грамположительных и грамотрицательных бактерий при относительно высокой концентрации антибиотика (40—200 мкг/мл). Невысокие концентрации антибиотика задерживают прорастание семян многих растений, кроме семян редиса.
Молекула рафанина имеет следующее строение:
СН3—SO—СН=СН—СНа—CH2NCS
Рафанин относится к группе изотиоцианатов.
ФИТОАЛЕКСИНЫ
К антибиотическим веществам, образуемым высшими растениями, относятся также соединения, получившие название фитоалексины. Образование фитоалексинов происходит в результате проникновения в растение определенного паразита. Процесс образования этих соединений стимулируется одним пли несколькими продуктами жизнедеятельности, которые паразит вводит в клетки растения-хозяина.
Характерно, что образовавшийся под влиянием определенного паразита фитоалексин обладает антибиотическим действием по отношению к этому паразиту. По-видимому, устойчивость ряда высших растений к некоторым грибным заболеваниям связана с образованием растениями указанных веществ.
В настоящее время изучено строение некоторых фитоалексинов. К их числу относятся 6-метоксибензоксазолин, пизатин и фазеолин. Поврежденные ткани пшеницы, ржи и кукурузы образуют аналогичные вещества, угнетающие развитие некоторых видов бактерий, грибов, а также насекомых, повреждающих эти растения. Антибиотическое вещество, изолированное из кукурузы, представляет собой 6-метоксибензоксазолин и имеет следующее строение:
N—Н б-Метоксибснзоксаэолпн
В растениях гороха (Pisum sativum) под влиянием некоторых видов фитопатогенных грибов образуется антибиотическое вещество пизатин, подавляющее развитие этих же фитопатогенных грибов.
346
В клетках фасоли (Pfiaseolas vulgaris), в которые попадает фп-топатогенный гриб, образуется антибиотик фазеолин. Строение этого соединения близко структуре ппзатина.
АНТИБИОТИКИ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
Антибиотики животного происхождения характеризуются свойствами, отличающими их от других антибиотиков. Обладая антибиотическими свойствами, они в то же время активизируют защитные силы макроорганизма. Сочетание этих свойств делает возможным применение их для профилактики и лечения ряда заболеваний.
ЛИЗОЦИМ (LYSOZYME)
Еще в самом начале XX в. русский ученый Лященко в 1909 г. обратил внимание на то, что белок куриного яйца обладает антибактериальным действием, что вещество белка, характеризующееся антибактериальными свойствами, относится к энзимам. Спустя 13 лет после опубликования наблюдений Лященко английский ученый Флеминг обнаружил, что аналогичным действием обладают выделения ряда тканей человека и животных, растений и микробов. Флеминг назвал эти антибиотические вещества лизоцимом. Лизоцим обнаружен в белке куриного яйца, селезенке, сердце, печени, легком, в различных секреторных выделениях (слеза, слизи носа, слюна и др.), в соках некоторых растений, у микроорганизмов и бактериофагов. Приведем некоторые данные о наличии лизоцима в тканях и выделениях животных (по Ермольевой и Грищенко, 1952):
Источник получения лизоцима Концентрация. сд/р
или ед/мл
Яичный белок................ 12 500
Выделение слизистой носа . . 1800
Слезы....................... 950
Слюна ...................... 80—100
Плацента.................... 110
Ткань зародыша.............. 13 100
Хрящ........................ 40
Гранулирующая ткань .... 23—564
Слизистая влагалища......... 8—27
Сыворотка крови............. 1,0
Слизистая толстых кишок ... 3.5
Моча.......................... 17
Выделения кожи................ 10
347
Более полно изучен лизоцим, выделенный из белка куриного яйца. В настоящее время кристаллический лизоцим получают непосредственно из яичного белка путем адсорбции на бентонитной глине. С глины лизоцим элюируют 5%-ным водным пиридином при pH 5, затем фермент осаждают сернокислым аммонием, подвергают диализу и лпофпльно сушат.
Лизоцим белка куриного яйца активен в отношении грамположительных бактерий (Bacillus, Micrococcus, Streptococcus, Sarcina). Менее чувствительны к лизоциму грамотрицательные бактерии. При действии лизоцима на микроорганизмы происходит лизис чувствительных к нему клеток, что связано прежде всего с действием этого вещества на клеточные стенки, которые под влиянием антибиотика разрушаются и при этом происходит «излияние» цитоплазматического содержимого клеток.
Лизоцим, выделенный из белка куриного яйца, а также лизоцим бактериофагов гидролизуют р-гликозпдные связи между остатками N-ацетилмурамовой кислоты и N-ацетплглюкозампна в пептидогликане бактериальной стенки.
Под влиянием лизоцима происходит выделение нуклеиновых кислот некоторыми видами грамположительных бактерий.
Лизоцим — белок с относительно невысокой молекулярной массой (14 700—14900), обладающий энзиматическими свойствами. За последнее десятилетие проведено много исследований по изучению аминокислотного состава лизоцимов, выделенных из различных источников (куриные япца, селезенка кролика, селезенка собаки, млечный сок дынного дерева и др.). Установлено, что молекула лизоцима белка куриного яйца содержит около 130 аминокислотных остатков 18 аминокислот.
Лизоцим не проявляет токсических свойств в отношении организма человека или животных, наоборот, он, подобно б юстимуля-тору, активирует защитные свойства макроорганизма. В организме животных лизоцим выполняет защитную функцию в отношении проникновения сапрофитных и патогенных микроорганизмов.
Лизоцим изучался и продолжает изучаться как лечебный фактор, применяемый при инфекционных болезнях, в дерматологии, офтальмологии, хирургии и при действии на злокачественные опухоли. Как показали исследования, лизоцим и лизоцим в сочетании с экмолином оказались эффективным средством в борьбе с носительством патогенных и устойчивых к другим антибиотикам стафилококков среди медицинского персонала.
ЭРИТРИН (ERITR1N)
Из водных экстрактов некоторых тканей (печень кролика, плацента человека и др.) экстрагируется антибактериальное вещество. Особенно много такого бактериостатического вещества содержится в эритроцитах крови животных и человека.
348
Антибиотическое вещество, полученное из эритроцитов крови, было названо эритрином. В очищенном виде эритрин еще не удалось получить, поэтому его химические-и физические свойства пока не изучены. Установлено, что эритрин — термостабильное вещество, хорошо растворимое в воде. Антибиотик подавляет развитие дифтерийной палочки, стрептококков и стафилококков.
Эритрин использовался при лечении и профилактике дифтерии. Однако для более широкого использования необходимы очищенные и более активные препараты.
ЭКМОЛИН (ECMOL1N)
Антибиотический препарат экмолин выделен Ермольевой и ее сотрудниками в 1950 г. из рыб. Установлено, что органы и ткани некоторых рыб оказывают антибактериальное действие в отношении грамположительной и грамотрицательной микрофлоры.
Экмолин подавляет развитие грамположительных и грамотрица-тельных бактерий, активен в отношении дизентерийных и тифозных палочек, кишечной палочки и холерного вибриона, стафилококков, стрептококков и вируса гриппа.
Экмолин — смесь белков протаминов (молекулярная масса не более 10 000), богатых диамнномонокарбоновыми кислотами. Он мало токсичен. В сочетании с пенициллином и новокаином способствует увеличению антибиотической деятельности пенициллина в организме больного.
СПЕРМИН И СПЕРМИДИН (SPERMIN, SPERM1DIN)
Из спермы и различных органов человека и животных выделено два препарата, обладающих антибиотической активностью в отношении грамположительных и грамотрицательных бактерий. Спермин и спермидин — довольно токсичные антибиотики. Спермин более активен, чём спермидин. Первый обладает активностью в отношении Mycobacterium, Neisseria, Staphylococcus, Bacillus anthracis и других видов. Плазма крови резко снижает антибиотические свойства этих препаратов, так как в плазме имеется специфический фермент сперминокспдаза, расщепляющий эти антибиотики. В организме животных образуются и другие антибиотические вещества.
ИРИДОМИРМЕЦИН И ИЗОИРИДОМИРМЕЦИН
(IRIDOMYRMLC1N, 1SO-IRIDOMYRMEC1N)
В литературе описаны вещества, обладающие антимикробными свойствами, которые образуются насекомыми. Еще в старых медицинских трактатах (Venturini, 1708) имелись указания на использование сока муравьев при лечении некоторых заболеваний. Однако более пристальное внимание к этим вопросам было обращено в 40—
349
50-х годах нашего столетия. Исследования показали, что из 51 вида обследованных насекомых 25 видов способны образовывать антимикробные вещества, главным образом путем использования му» равьпнон кислоты.
Из аргентинского муравья удалось выделить вещество, обладающее бактерицидными свойствами в отношении ряда видов бактерий (Bacillus anthracis. Brucella abortis, Mycobacterium avium, Proteus vulgaris и др.). Антибиотическое вещество выделено в чистом виде из анальных желез рабочих особей — это иридомирмецин (от латинского названия аргентинского муравья Iridomyrmex prui-nosus htimilis). Из желез одной особи можно выделить 2,9—3,3 мкг вещества. Мужские особи муравьев иридомнрмецина не содержат.
Австралийские муравьи Iridomyrmex nitidus содержат аналогичное вещество — изоиридомирмецнн.
Иридомирмецин и изоиридомирмецнн мало токсичны, обладают высокой инсектицидной активностью. По-видимому, эти вещества, как и другие антимикробные продукты животного происхождения, можно считать защитными средствами продуцирующих их организмов.
КРУЦИН (CRUZIN)
Противораковый антибиотик круцин впервые получен Клюевой к Роскнным в 1946 г. из культуры Trypanosoma cruzi. Мысль об использовании Т. cruzi в терапии рака была высказана Роскнным еще в 1931 г.
Т. cruzi — паразитическое простейшее, непосредственно связанное с человеком. Этот организм вызывает заболевание трппанозо-мноз, широко распространенное в Латинской Америке под названием болезни Чагаса.
Круцин образуется в клетках паразита, причем величина анти-бластомпой активности зависит от цикла развития Т. cruzi.
Работами Роскнна и его сотрудников показано, что наиболее чувствительны к действию круипна опухоли эпителиального происхождения. Круцин не токсичен.
ИНТЕРФЕРОН (INTERFERON)
К антибиотикам животного происхождения следует отнести также белковое вещество интерферон, образующееся в клетках под действием вирусов, а также некоторых видов бактерий пли бакте
массой при-
риальных эндотоксинов.
К настоящем}' времени известно несколько видов интерферона, определяемых характером индуцирующего фактора. Однако все эти препараты — слабокислые белки с молекулярной мерно 30 000.
Для получения больших количеств интерферона шестидневные однослойные культуры клеток куриного эмбриона или культивируемые лейкоциты крови человека, зараженные опре
используют
350
деленным видом вируса. Иными словами, для получения этого вещества создают определенную систему вирус — клетка.
В последнее время благодаря успехам генетической инженерии удалось изолировать из клеток человека ген, ответственный за биосинтез интерферона, и встроить его в ДНК соответствующего вида микроорганизма. В результате получен микроб, способный в процессе своего развития осуществлять биосинтез этого ценнейшего бнорегуляторного белка.
Интерферон подавляет размножение вирусов. В связи с этим в последнее время он привлекает внимание исследователей как лекарственный препарат при вирусных инфекциях.
Животный организм может вырабатывать интерферон в ответ на введение определенных стимуляторов иптерферонообразования. Это явление представляет большой интерес и может быть использовано в качестве профилактического фактора при заболеваниях, вызываемых вирусами.
11
направленный биосинтез
Глава Л_АНТИБИОТИКОВ
В современных условиях быстрых темпов развития науки и техники, в том числе науки об антибиотиках, продолжаются работы по дальнейшему выделению из природных источников новых продуцентов антибиотических веществ. Однако, как показывает практика, за последние 15—20 лет обнаружить среди продуктов жизнедеятельности организмов совершенно новые классы соединений антибиотиков практически не удается. Выделяемые новые биологически активные соединения, как правило, — представители уже известных основных групп антибиотиков.
Поэтому в настоящее время ученые многих лабораторий мира изучают пути и способы направленного биосинтеза антибиотических веществ с целью получения биологическим путем различных модификаций уже известных антибиотиков с более ценными свойствами.
Под направленным биосинтезом антибиотиков необходимо понимать целенаправленное вмешательство экспериментатора в метаболизм организма-продуцента (главным образом микроорганизма) для преимущественного образования им одного или нескольких антибиотиков или же получения новых по сравнению с обычно образующимися соединениями форм антибиотических веществ.
В результате направленного биосинтеза удается получить модификации известных антибиотиков, отличающиеся от исходных веществ рядом ценных свойств, которые не могут быть синтезированы чисто химическим путем. В этой связи изучение вопросов, связанных с названной проблемой, имеет существенное теоретическое и практическое значение.
Многие микроорганизмы способны в процессе своей жизнедеятельности одновременно образовывать не одно антибиотическое вещество, а два или более близких по химическому строению и биологическому действию соединений или же значительно отличающихся по структуре веществ. Например, Streptomyces albireticull образует 3 антибиотика - эйромицин, энтеромицин и карбомицнн. В культуре Str. showdoensis одновременно образуется 4 антибиотика: актиномицин в мицелии и 3 антибиотика в культуральной жидкости: макролид, шоудомицин и антибиотик неизвестной прн-
352
Таблица 89
Способность некоторых актиномицетов образовывать несколько антибиотиков (по Виноградовой, 1966)
Продуцент Образуемые антибиотики
/. Продуцент, образует две химические модификации одчого антибиотика
Streptomyces capreolus Капреомицин I Капреомицин И
Streptomyces hclsted.lt Карбомицин А Карбоыици В
Streptomyces mitakaensls Микомицин А Микомицин В
II. Продуцент образует три химические модификации одного антибиотика
Streptomyces gratninofaciens Стрептограмин Стрептограмин А Стрептограмин В
III. Продуцент образует 2 антибиотика
Streptomyces acidomyceticus Актитиазовая кислота Алиомицин
Streptomyces olivochromogcnes ч Олеандомицин Хромомицин
Streptomyces tsusimaensis Валииомицин Нонактин
IV. Продуцент образует 3 антибиотика
Streptomyces achromogenes Ахромовиромицин Сарцядин Стрептозотоц ин
Streptomyces thioluteus Ауреотрицин Диоксифеназин Тиомотин
V. Продуцент образует 4 антибиотика
Streptomyces aureus Актинолейкин Антибиотик SAX-10 Антимикоин Антифлей-фактор
Streptomyces showdoensis Актиномицин Макролид Неизвестный антибиотик Тодуомицин
12—742
353
Продолжение табл. 89
Продуцент
Образуемые антибиотики
VI. Продуцент образует 5 антибиотиков, из которых 2 являются химическими модификациями одного вещества
Streptomyces aureocidicus
Азомицин Метилмицин Тетриомицин Териомишш В Эуроцидин
VII. Продуцент образует более 5 антибиотиков
Bacillus brevis
Bacillus subtilis
Грамицидины A, В, CD , D, S(C)
Эденн
Бреволин
Бревин
Эсеин
Бресеин я др. (всего 23 антибиотика)
Синтезирует около 65 антибиотиков
роды. В культуре Streptomyces netropsis одновременно образуются антпгрибные полиеновые антибиотики (смесь тетраена, пентаена и (гептаена) и антибактериальное вещество (табл. 89).
К числу антибиотиков, близких по своей природе и биологическим свойствам и образуемых организмом одновременно, можно отнести такие соединения, как пенициллины, стрептомицины, тетрациклины, полимиксины, бацитрацины, цефалоспорины, низины, неомицины, родомицины, кандицидины, актиномицины и другие вещества.
Одновременное образование одним организмом антибиотиков, отличающихся по химической структуре и по биологическим свойствам, можно показать на следующих примерах: Str. griseus наряду с биосинтезом стрептомицина может продуцировать маннозидо-стрептомпцин, актидион и грнзеин; Aspergillius fumigatus одновременно может образовывать спянулознн, глпотоксин и фумигатнн; Str. fradiae синтезирует неомицин и фрадицин; Str. aureofaciens наряду с биосинтезом тетрациклинов (хлортетрациклин и тетрациклин) образует антигрибное вещество; Str. rimosus одновременно может продуцировать окситетрациклин и римоцидин; Вас. brevis способен одновременно синтезировать пять различных форм грамицидинов (А, В, Cd, D, S), а также более восемнадцати других полипептидных антибиотиков.
Сводка о способности некоторых видов автиномицетов и бактерий образовывать несколько антибиотических веществ приведена
354
в табл. 89. О способности бактериальных культур, например Вас. brevis, синтезировать разные по химическому составу пол и пептидные антибиотики см. табл. 41.
Изучение закономерностей биосинтеза того или иного антибиотического вещества, выяснение условий развития организма, обеспечивающих преимущественное образование одного пз возможных антибиотиков, дает в руки исследователя ключ, с помощью которого можно вмешиваться в процесс биосинтетической деятельности микроба п вести его в нужном направлении. Так, достаточная аэрация культуры Str. griseus обеспечивает благоприятные условия для преимущественного накопления стрептомицина и тормозит образование маннозидострептомицина. При хорошей аэрации среды создаются условия оптимальной деятельности фермента маннозидо-счрептомпциназы, расщепляющего менее активный антибиотик маннозндострептомицкн на стрептомицин и маннозу.
Отсутствие в среде ионов хлора или наличие в субстрате наряду с хлором веществ, ингибирующих процесс биологического хлорирования, приводит к накоплению в культуре Str. aureofaciens не хлортетрациклина, а тетрациклина пли другого аналога этой группы антибиотиков.
Однако, как уже отмечалось выше, наряду с изменением условий культивирования микроба не менее важную роль в проблеме получения того или другого антибиотика играет селекция организмов. В результате селекции получены штаммы продуцентов, образующие нежелательный для нас антибиотик в небольшом количестве, а нужный препарат составляет при биосинтезе основную часть его продукции. Так, например, продуцент стрептомицина Str. griseus может образовывать одновременно со стрептомицином и значительное количество нежелательного антибиотика маннозидострептомицина. В результате селекции получены штаммы Str. griseus, образующие маннозидострептомицина не более 5% от общего выхода антибиотика.
Для направленного образования преимущественно одного из ряда естественно синтезируемых антибиотиков или их модификации применяются различные методы вмешательства в обмен веществ микроорганизмов.
Во-первых, это достигается соответствующим изменением условий культивирования продуцентов антибиотиков и прежде всего изменением состава среды.
Во-вторых, введением в среду для культивирования микроорганизма — продуцента антибиотического вещества специфического ингибитора.
В-третьих, изменение характера обмена веществ микроорганизма, связанного с модификацией структуры образуемого антибиотика, может быть осуществлено в результате получения от исходного штамма — продуцента соответствующих мутантов.
В-четвертых, изменение свойств известных антибиотических веществ можно получить в результате воздействия на эти антибиотики одного из микроорганизмов или фермента, образуемого им.
12* 355
В-пятых, изменение характера метаболизма, связанного с биосинтезом антибиотика, можно вызвать применением комбинации перечисленных выше факторов. Например, получением соответствующих мутантов с одновременным внесением в среду для их развития специфических предшественников или ингибиторов.
ИЗМЕНЕНИЕ СОСТАВА ПИТАТЕЛЬНОЙ СРЕДЫ
Управление биосинтетической деятельностью микроорганизмов может осуществляться, как уже указывалось, путем изменения условий культивирования организма и в первую очередь изменением состава питательной среды. Можно указать на ряд основных способов изменения условий культивирования микроорганизмов, позволяющих осуществлять направленный биосинтез антибиотиков.
1. Введение в среду веществ, которые, включаясь в молекулу антибиотика, обеспечивают получение препарата с новыми свойствами.
Введение в среду специфических веществ для направленного получения антибиотиков нашло широкое применение при биосинтезе различных форм пенициллинов. Так, если в среду добавить фенил-уксусную кислоту
то Penicillium chrysogenum образует преимущественно бензнлпени-ццллин, содержащий в качестве радикала молекулы антибиотика фенилуксусную кислоту. Если же в качестве предшественника ввести в среду феноксиуксусную кислоту
то гриб начинает синтезировать новый тип пенициллина — фенок-симетилпеницпллин, отличающийся от бензилпенициллина рядом свойств.
В настоящее время в результате подобного вмешательства в процесс биосинтеза пенициллина удалось получить несколько десятков различных пенициллинов (с. 316—317).
2. Добавление в среду отдельных аминокислот, органических кислот (в виде солей) или иных компонентов, принимающих участие в обмене веществ организма, позволяет целенаправленно изменять биохимическую деятельность микроба и получать преимущественный биосинтез одного нз ряда возможных антибиотиков или получать препарат с новыми свойствами.
В этом случае введенное в среду вещество может непосредствен-
356
ио не включаться в молекулу антибиотика, как это имее^ место в случае биосинтеза различных типов пенициллина. Иногда такое вещество не входит в состав молекулы антибиотика, но способствует изменению характера некоторых реакций обмена, ведущих к образованию антибиотика с измененной структурой.
Указанный принцип находит применение при направленном биосинтезе ряда антибиотиков и прежде всего антибиотиков, имеющих полипептидную структуру.
Образование различных актиномицинов в процессе развития актиномицетов во многом зависит от источника азотного питания в среде. Если в среде присутствует треонин, то Streptomyces antibioticus образует только В-комплекс актиномицина. Однако при наличии в субстрате глутаминовой кислоты в качестве единственного источника азота вначале образуется В-тип, а затем происходит синтез A-типа актиномицинов.
Streptomyces chrysomallus, образующий комплекс С-типа, содержит в качестве основного компонента актиномицин С2 в том случае, если этот организм развивается в среде с нитратным (KNO3) источником азота. Но этот же актиномицет синтезирует актиномицин Сз, если он развивается в среде с единственным источником азота в виде глицина (CH2NH2COOH).
Направление биосинтеза актиномицина культурами актиномицета может быть изменено добавлением к синтетической среде некоторых аминокислот. Так, добавка D-L-изолейцина вызывает биосинтез нового вида актиномицина (Ег и Е2-тип), в которых обнаружено содержание N-метилизолейцина вместо N-метилвалина. Новые компоненты актиномицинов синтезируются культурой Str. antibioticus при добавлении к среде L-изолейцина, Но аминокислота может быть введена в пептид актиномицина в форме N-метилизолейцина. В зависимости от присутствия в среде той или иной ами-
Таблица 90
Влияние аминокислот на синтез актиномицинов
(по Katz and Goss, 1958)
Среда Концентрация добавленной аминокислоты. % Относительное процентное содержание актиномициновых компонентов
1 II Hi IV V *
Глутам!новая кислота . . . 0,0 6,4 2,3 3,2 68,3 17,2 2,6
Глутаминовая кислота-|-гид-роксил-Ь-пролин .... 0,25 31,0 3,8 7,1 25,3 30,0 3,0
Глутаминовая кислота -)- саркозин 0,05 9,1 25,6 35,0 24,4 5,9 0,0
Глутаминовая кислота -|-N-ацетнлглицин 0,25 8,1 2,0 3,2 32,7 51,1 3,0
Глутаминовая кислота -|-L-иаолейции 0,25 4,7 2,8 5,8 17,2 30,6 38,9
* Неидентифицпрованный компонент, передвигающийся на круговой бумажной хромата* грамме быстрее, чем компонент V..
357
иокислоты происходят изменения в соотношении различных компонентов актиномицинов при синтезе антибиотика (табл. 90).
Изучая влияние валина на биосинтез аурантина, образуемого культурой Str. auranlicus, показано, что при развитии актиномицета на среде с KNO3 антибиотик состоит нз 65% аурантина । (АУ() и 35% аурантппа2 (АУ2). Если актиномицет культивировать на среде с валином и через 48 ч от начала развития добавить KNO3, количество фракций АУ, снижается до 33% и увеличивается количество фракций, содержащих валин: АУг— 43% и АУз — 24%. Таким образом, влияя на процесс биосинтеза, можно получать преимущественно образование аурантина той или иной формы, существенно отличающейся по токсичности:
Токсичность различных форм аурантина
(по Силаеву и Катруха, 1977)
Форма аурантина
Аурантин
АУ! АУ, АУ, ау5 АУв АУ,
LDS„, мкг/кг
1000+115 1480+160
780—144
750+178
2650—297 2800±530 2450+696
Из приведенных данных следует, что наименее токсичны формы аурантина, содержащие D-лейцин (АУ5, АУ6 и АУ7), более токсичны формы, содержащие D-алло-пзолейции (АУ[), и особенно токсичны формы аурантина, в состав которых входит D-валин (АУ2 п АУ3).
Обобщенные данные изучения влияния аминокислот лейциновой группы на рост актиномицета и биосинтез им аурантина приведены в табл. 91.
Из приведенных в табл. 91 результатов видно, что изученные аминокислоты не оказывали влияния на рост актиномицета, незаметно влияли на биосинтез актиномицина. Так, валин в D-форме и изолейцин в DL-форме подавляли биосинтез антибиотика. Однако такие аминокислоты, как лейцин, норвалин и норлейцин, вносимые в культуру также в D-форме, не проявляли действия, ингибирующего образование актиномицина.
Под влиянием различных аминокислот, вносимых в среду, происходило образование актиномицетом новых компонентов антибиотика. Наибольший синтез этих компонентов наблюдался в случае присутствия в среде кзолейцпна (DL-форма) и норвалпна (L-форма).
Подобный путь получения новых актиномицинов с измененными свойствами имеет важное значение. Известно, что некоторые актиномицины из С-комплекса обладают аитпраковым действием и вместе с тем эти антибиотики проявляют высокую токсичность в отношении макроорганизма.
358
Таблица 91
Влияние аминокислот лейциновой группы на рост актиномицета и биосинтез актиномицина
(Нефедова, 1975)
Аминокислота Биомасса, МГ/ мл Актиномицин Новые компоненты, %
мкг МП %
Контроль 0,70 450 100 0
Валин L 0,75 480 109 30
D 0,80 70 15 10
DL 0,78 175 26
Изолейшш L 0,72 540 120 31
D 0,70 275 61 46
Лейцин L 0,71 465 103 38
D 0,70 505 112 15
DL 0,72 490 ПО
Норлейннн L 0,70 450 НО 8
DL 0,75 4‘Ю ПО 4,2
Норвачнн L 0,69 500 по 42
DL 0,71 520 120 31
Получение новых форм актиномицинов, обладающих антиопу-холевым действием с одновременным понижением их токсичности в ходе направленного биосинтеза, имеет важное практическое и теоретическое значение.
Изучая условия образования новобиоцина культурой Str. spheroides штамм 35, было показано, что биосинтез биологически активных и неактивных форм антибиотика зависит от ряда факторов среды. Так, изменение концентраций лимоннокислого натрия в среде, содержащей в качестве источника углерода глюкозу (5%) и б качестве источника азота азотнокислый натрий (0,6%), приводит к значительному изменению биосинтеза не только общего количества антибиотика, по и его форм (см. табл. 75).
Изменение соотношения форм новобиоцпна, синтезируемых ак-тпномицетом, происходит также при добавлении к среде различных органических кислот в количестве 0,25% перед началом развития продуцента антибиотика (см. табл. 76).
Таким образом, используя различные концентрации лимонной кислоты в среде или заменяя ее другими органическими кислотами, можно стимулировать или же, наоборот, тормозить как общий выход новобиоцпна, так и его биологически неактивных форм.
3. Изменение направления биосинтетической деятельности микроорганизма можно получить путем изменения соотношения концентрации источников углерода и азота в среде или же изменением степени аэрации культуры.
359
Культура Bacillus licheniformis, близкая по свойствам к Вас. subtilis, образует группу полипептидных антибиотиков лпхенифор-мпнов. Однако в зависимости от состава среды этот организм может образовывать другие полипептиды — бацитрацины. Если в составе среды имеется лактат аммония и отношение углерода к азоту невысокое, то бактерии осуществляют биосинтез лихениформи-нов. В случае содержания в субстрате небольшого количества аммония, п главным образом аммония минеральных солей, т. е. при создании условий повышенного соотношения углерод — азот, организм начинает продуцировать бацитрацины. Результаты влияния аэрации см. с. 211.
4. Изменение активной кислотности (pH) среды. В результате изменения pH среды для культивирования микроорганизмов можно направленно получать биосинтез различных форм антибиотиков. Так, при изменении pH среды для культивирования Nocardia {ructiferi var. ristomycini происходит образование двух основных антибиотиков: ристомицпна А и ристомицпна Б. Биологическая активность ристомицпна Б примерно в два раза выше биологической активности ристомицина А.
Отклонение биосинтеза в сторону образования ристомицпна определенного типа зависит от активной кислотности среды. При реакции среды, близкой к нейтральной, происходит преимущественное образование ристомицпна А, повышение pH среды до 7,4—8,8 способствует одновременному биосинтезу ристомицпна А и ристо-мпцпна Б. Дальнейшее подщелачивание среды, обычно происходящее к концу процесса развития проактнномицета, приводит к образованию менее биологически активных форм антибиотика: ристо-мпцпна I и ристомицпна II, в которые превращаются исходные формы ристомицпна А и Б.
В процессе развития Actinomadura carminala в мицелии актиномицета образуется антибиотик карминомпцин, впервые выделенный в СССР Гаузе с сотрудниками в 1973 г. Антибиотик относится к антрацпклинам и состоит из семи компонентов, пять из них обладают протнвобактерпалыюй активностью. Наибольшей биологической активностью обладают компоненты I, II и III.
Компоненты II и III кармпномпцпна, образующиеся в наибольшем количестве, могут в ходе развития актиномицета превращаться в компонент I. Последний представляет наибольшую ценность, так как именно он используется в качестве противоопухолевого препарата.
Соотношение компонентов комплекса кармпномпцпна в процессе развития актиномицета зависит от длительности культивирования продуцента, значения pH исходной среды и pH культуральной жидкости. Содержание компонента I карминомицинового комплекса составляет 3—4% на протяжении всего периода развития организма. Содержание компонента II по ходу развития актиномицета постепенно увеличивается (от 39% в первые 4 сут до 53% к 10-м сут), а содержание компонента III уменьшается (от 57—59% на 4—5-е сут до 44,5% к 10-м сут). Активная кислотность среды
860
(pH), равная 6,9—7,2, обеспечивает наивысший уровень биосинтеза кармнномпцпнового комплекса в целом п его активных (I, II и III) компонентов.
ВВЕДЕНИЕ СПЕЦИФИЧЕСКОГО ИНГИБИТОРА
Введение в среду для культивирования продуцента антибиотического вещества специфического ингибитора, например добавление к среде сульфадиазпна, способствует образованию культурой Str. aureofaciens наряду с 7-хлортетрацпклнном и 7-хлор-6-деме-тилтетрациклина.
Сульфаниламид, добавленный к культуре Str. lincotnensis, селективно подавляет N-метилированпе в процессе образования антибиотиков лпнкомпцинового комплекса с выходом N-деметпллпн-компцпна.
Таким образом, сульфадиазин и сульфаниламид выступают й этих случаях в качестве ингибиторов метилирования молекулы соответствующих антибиотиков с образованием модифицированных биологически активных соединений.
Str. venezuelae при развитии на обычных питательный средах1, содержащих хлориды, образует хлорамфеникол. Однако прикуль; тпвировании актиномицета на среде, свободной от хлора, вместо хлорамфеникола происходит биосинтез ряда его аналогов. У таких аналогов дихлорацетильная группа заменяется остатками уйсус-ной, пропионовой, масляной или валерьяновой кислот. ' : ’
Добавление к питательной среде, содержащей хлориды;бромидов (NaBr) способствует наряду с образованием’ хлорамфеникола синтезу вышеперечисленных ацильных производных, а такЖе образованию других аналогов, содержащих в своем составе иона Вг (CIBrCHCO- и Вг2СНСО-групп вместо С12СНСО-группы хлорамфеникола).
Ионы брома в данном случае являются ингибиторами биологического хлорирования в процессе биосинтеза молекулы хлорамфеникола.
При выращивании Str. aureofaciens штамм ВС-41 на среде следующего состава:
Крахмал................... 55 г
Кукурузный экстракт ... 25 г
СаСОд...................... 9 г
(NH4)„SO4.................. 5 г
NH4C1...................1,5 г
FeSO4-7H2O .............0,06 г
MnSO4-4H.,O.............0,05 г
ZnSO4-7H2O..............0,1 г
Лярд....................20 мг
Вода.................... 1000 мл
происходит биосинтез антиб готиков в пределах 5000—6000 мкг/мл* причем содержание хлортетрациклина составляет’ 90—95% п тетрациклина— 5—10%- Однако если культивировать тот же орга-
361
оооо
1000
5000 § WOO < 3000
CuSOi
_____2
5ез
- SO, I
5цг%ДЧГД it ! бе> CuSOf
I
i0№ % 'СиС-Оь
? Ь0нг%
—" CuSOt
f Oes CuSOf.
М 120 W 120
Время м/патибиройания, Ч
Рис. 58. Соотношения хлортетрациклина и тетрациклина в среде при развитии Streptomyces aureofaciens в присутствии ингибитора хлорирования (5 мг% димеркапто-тпадиазола), без него н влияние на этот процесс CuSQ» (по Goodman et al.. 1959):
1 — хлортетрациклин. 2 — тетрациклин
низм на среде, свободной от хлоридов, то происходит увеличение выхода тетрациклина за счет уменьшения образования хлортетрациклина. Образование тетрациклина может происходить и на обычных средах с хлоридами, но в присутствии специфических веществ, подавляющих процесс хлорирования (бромиды и тиоцианиты, а также тиомочевина, тиоурацил и меркаптобензотиазол).
При применении веществ, тормозящих процесс хлорирования, во многих случаях наблюдается образование тетрациклина — до 90% и более от общего количества антибиотиков, т. е. соотношение хлортетра-циклииа и тетрациклина диаметрально противоположно тому соотношению этих антибиотиков, которое имеет место при развитии актиномицета на обычных средах (см. рис. 42).
Димеркаптотпадпазол является активным веществом, тормозящим процесс хлорирования при развитии Str. aureofaciens. Торможение быстро приостанавливается в присутствии ионов меди (Си2+) и несколько слабее в присутствии ионов серебра (Ag+).
На рис. 58 приведен результат опыта, в котором CuSO4 был добавлен через 48 ч от начала развития актиномицета на средах, содержащих и не содержащих димеркаптотпадпазол (ДМТД).
Из кривых рисунка следует, что в отсутствие ДЛТГД актпноми-цет синтезирует главным образом хлортетрациклин, тетрациклин образуется в неботьшом количестве. Добавка CuSO4 примерно в 2 раза снижает выход хлортетрациклина, но практически не влияет на выход тетрациклина.
Другая картина наблюдается при развитии актиномицета в среде с ДМТД (5 мг%). В этих условиях образуется преимущественно антибиотик тетрациклин, но после добавления 40 мг% CuSO4 направление биосинтеза меняется: резко снижается образование тетрациклина п значительно возрастает выход хлортетрацпк-лнна.
Приведенные примеры указывают, что тиомочевина, 2-тпоура-цмл, 2-меркаптобензотпазол и тионамид действуют как ингибиторы хлорирования, по-видимому, посредством влияния на медьсодержащую оксидазу.
Ионы брома не только подавляют процесс хлорирования и, следовательно, резко снижают образование хлортетрациклина, но избыток их в среде приводит к образованию нового аналога тетрациклиновых антибиотиков — бромтетрациклина.
362
Следовательно, зная факторы, влияющие на биосинтез того или иного тетрациклинового антибиотика культурой Str. aureofaciens, возможно направлять этот процесс в нужную сторону.
ИСПОЛЬЗОВАНИЕ МУТАНТА ИСХОДНОГО ШТАММА
Получение модификации структуры синтезируемого антибиотика возможно в результате выделения от исходного штамма продуцента антибиотика соответствующего мутанта. Применение мутантов от исходных штаммов микроорганизмов дает возможность вести направленный биосинтез ряда антибиотических веществ.
Streptomyces caelestis образует антибиотик целестицетин. Мутант, полученный при обработке этого штамма нптрозогуанидином, способен синтезировать 7-О-деметплцелестицетин (последний не образуется исходным штаммом продуцента).
От продуцента хлортетрациклина получен мутант, способный синтезировать преимущественно тетрациклин. В литературе об антибиотиках имеется ряд аналогичных примеров.
ВОЗДЕЙСТВИЕ МИКРООРГАНИЗМА
ИЛИ ЕГО ФЕРМЕНТА
Направленно изменять свойства антибиотиков можно, воздействуя на них определенным микроорганизмом или образуемым им ферментом. Применение микроорганизмов для целей трансформации различных органических соединений, в том числе и антибиотиков,— широко распространенное явление. Трансформация веществ может осуществляться развивающейся культурой соответствующих микроорганизмов, экстрактами, выделенными из клеток, или чистыми ферментными системами.
Реакции, которые могут осуществлять микроорганизмы в отношении антибиотических веществ, весьма разнообразны.
В большинстве случаев антибиотики, модифицированные биологическим способом, существенно теряют биологическую активность in vitro. Однако в организме больного они могут проявлять антибиотические свойства. Антибиотик клиндамицин (хлоролинкоми-цин) в виде соли гидрохлорида весьма неприятен для применения. Клиндампцпн-2-фосфат и клиидамицин-3-фосфат не обладают биологической активностью in vitro, но, попадая в организм, легко гидролизуются с образованием биологически активного соединения клмндомпцииа.
При добавлении клиндамицина к среде, в которой развивается Streptomyces punipalus, он в основной массе превращается в де-метплклвндампцпн. Аналогичный процесс происходит и в случае линкомицина, который в результате воздействия Str. punipalus превращается в деметил-соединенпе. При этом необходимо отметить, что активность деметиллинкомицина гораздо ниже активности линкомицина.
363
МУТОСИНТЕЗ
Использование комбинации мутантов продуцентов антибиотических веществ и предшественников позволяет направлять биосинтез антибиотиков по нужному пути и получать в результате вещества с измененными свойствами (метод мутосинтеза).
Мутосинтез — один из перспективных методов получения новых антибиотиков методом направленного биосинтеза. Суть его состоит в том, что в результате генетических манипуляций получают мутант продуцента, который потерял способность синтезировать один или несколько фрагментов молекулы антибиотика. При внесении в среду для культивирования такого мутанта недостающих фрагментов, синтезированных химическим путем, мутант способен включать их в молекулу образуемого антибиотика.
Так, в лаборатории Готтлиба (США) в 1969 г. был получен мутант Str. fradiae — продуцент неомицина, который способен синтезировать молекулу антибиотика, за исключением ее 2-деоксист-рептаминовой части.
Образование неомицина этим мутантом отмечается только в том случае, если в среду для его развития добавлялся 2-деокси-стрептамин. При замене этого соединения его аналогами удалось получить новые биологически активные неомицины.
Аналогичный метод был использован и для получения аналогов других антибиотиков (новобноцина, капимицина и некоторых других).
* * *
Следовательно, пути регулирования обмена веществ у синтезирующих антибиотики микроорганизмов связаны в основном с изменениями условий их культивирования, с характером их развития. При этом следует иметь в виду, что продукты жизнедеятельности микроорганизмов или так называемые конечные продукты метаболизма оказывают, по-видимому, на процессы биосинтеза антибиотиков большее влияние, чем, например, предшественники образования антибиотических веществ.
Рассмотренные здесь основные способы вмешательства в био-ci нтетическую деятельность микроорганизмов, позволяющие осуществить направленный синтез антибиотиков, и отдельные примеры такого биосинтеза показывают, что проблема направленного получения антибиотических веществ имеет огромное теоретическое и практическое значение. Однако успешное развитие этой проблемы возможно только на основе глубокого изучения физиологии обмена веществ организма и путей биосинтеза антибиотиков.
Вместе с тем необходимо иметь в виду, что направлять биосинтетическую деятельность того или иного организма можно только в пределах его наследственной способности образовывать в процессе жизнедеятельности те или иные антибиотики. Иными словами, создание различных условий культивирования, например Penicil-
364
Hum chrysogenum или любого другого продуцента пенициллина, и введение в субстрат предшественников позволяет ожидать биосинтез антибиотиков, относящихся только к пенициллина^. Такой организм, по-видимому, никогда не сможет синтезировать антибиотики типа стрептомицина, фумагпллнна или полимиксина. Те же самые закономерности имеют место и в отношении любых других продуцентов антибиотиков.
Продуцент хлортетрациклина — Sir. aureofaciens способен под влиянием изменения условий культивирования (состав среды) изменять свою биосинтетическую способность, но только в пределах образования тетрациклиновых антибиотиков.
Эти примеры еще раз показывают, что образование антибиотиков носит не случайный характер, зависящий только от условий культивирования организма. Биосинтез антибиотиков — это биологическое свойство организма, возникшее в ходе эволюционного развития вида и наследственно закрепленное. Условиями культивирования можно стимулировать или, наоборот, подавлять способность к биосинтезу антибиотика, но нельзя вызвать образование вещества, не свойственного характеру обмена определенного организма.
Изменение биосинтетической деятельности организма с целью получения нового, не свойственного данному штамму антибиотика теоретически возможно лишь в том случае, если изменением влияния внешних условий коренным образом будет изменена природа организма; в этом случае образуется новый вид микроорганизма с новым типом обмена веществ, .
ХАРАКТЕР И МЕХАНИЗМ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ
АНТИБИОТИКОВ
ОБЩИЕ СВЕДЕНИЯ О ДЕЙСТВИИ АНТИБИОТИКОВ
Характер и механизм биологического действия антибиотиков различен и зависит прежде всего от их химической природы, от концентрации препарата, вида организма п микроструктуры его клеток, от условий проявления действия и других факторов.
Уже первое знакомство с действием антибиотиков на микроорганизмы показывает, что одни из них — бензилпенициллин, фума-гиллнн, бацитрацин, сарцидин и др. — подавляют развитие сравнительно ограниченного числа видов бактерий, другие — тетрациклины, хлорамфеникол, эритромицин, карбомицин и другие антибиотики— подавляют рост многих видов грамположительных и грамотрицательных бактерий, риккетсий, крупных вирусов и некоторых других групп организмов. Таким образом, антибиотики не обладают универсальным свойством убивать все живое, что находится в контакте с ними. Одни организмы оказываются чувствительными, а другие — устойчивыми к действию антибиотиков. Иногда под влиянием антибиотиков (например, стрептомицина) возникают из числа вначале чувствительных форм бактерий антнбпотпкозавпси-мые варианты, не развивающиеся в отсутствие этого антибиотика (см. рис. 32).
Действие антибиотика на определенные организмы характеризуется его антимикробным спектром (табл. 92).
В зависимости от природы антибиотика, его концентрации, времени действия, микроструктуры клетки организма и внешних условий — температуры, pH, гН2 и других факторов антибиотические вещества могут проявлять цитостатическое (задерживать рост клеток), цнтоцидное (убивать клетки) или цитолитическое (растворять клеточную стенку и в результате этого приводить клетки к гибели) действие. Антибиотики близкого химического строения обычно имеют сходный антимикробный спектр (см. данные о тетрациклинах, полиенах н др.; табл. 92).
Большое влияние на характер действия антибиотиков оказывает их концентрация. Суббактериостатические дозы некоторых антибиотических веществ не только не угнетают рост чувствительных к ним микробов, но, наоборот, стимулируют их развитие. Как правило, при повышении концентрации антибиотика выше дозы, вы-
366
Таблица 92
Антимикробный спектр отдельных антибиотиков (по Goldberg, 1959)
Организмы
Вирусы (крупные)
Реккетсии .... Бактерии:
грамположи-тельные . . . грамотрица-тельные . . . кислотоустойчивые ....
Грибы:
патогенные для растений . . . для животных сапрофиты . . дрожжи . . . Простейшие . . .
о
о
о
3
1
I I 1 1 2
Полипептиды
Разные
1 О
О О
3 2
1 3
- 2
1
О
3
1
1
2
3
2
3
1
О
О
3 о о
о
о
2
3
3
- о - о - о о о о —
о
о
о
2
Примечание. Цифрами показана степень эффективность антибиотика: 0 — полностью неэффективные; 1 — эффективные в отношении отдельных представителей; 2 — эффективные и отношении нескольких представителей; 3 — эффективные в отношении большинства форм.
зывающей бактериостатический эффект, наблюдается бактерицидное действие препарата.
Если вещество обладает бактериостатическим, бактерицидным или бактериолитическим свойствами, то это лишь указывает на конечный результат действия антибиотика, а не на механизм, при помощи которого получен тот или другой биологический эффект.
Под механизмом биологического действия антибиотика необходимо понимать те изменения в биохимической деятельности клетки или, точнее, те нарушения путей обмена веществ микроорганизма, вызываемые данным препаратом, которые в конечном счете приводят к остановке развития или к гибели организма. Изучение механизма действия антибиотика помогает вскрыть причины его биологического эффекта как в отношении микробной клетки, так и макроорганизма.
Изучение механизма биологического действия антибиотических веществ ставит своей целью определение нарушений обмена веществ, вызываемых антибиотиком в микробной клетке, установ-
367
ленпе точки или точек его главного, основного приложения в цели обменных реакций, определение мишени действия антибиотика, выявление молекулярных основ действия антибиотического вещества, а также установление причин отсутствия аналогичного действия антибиотика на резистентные к нему формы микробов и микроорганизмы. Как отмечает Хаи, при определении механизма биологического действия антибиотика необходимо учитывать ряд критериев.
;1. Подавляемая реакция должна быть жизненно необходимой для клетки.
>2. Подавление должно быть специфичным, т. е. оно должно обнаруживаться только у организмов, чувствительных к действию определенного антибиотика.
3. Антибиотик должен подавлять реакцию примерно в тех же концентрациях, в которых он вызывает подавление роста.
,4. Подавление должир следовать закону «все или ничего».
5. Подавление данной реакции должно определяться химической структурой антибиотиков точно таким же образом, как и подавление роста. i
Несмотря на многообразие химического строения антибиотиков, образуемых различным^ группами организмов, можно отметить, что все они обладают некоторой общностью первичного действий’ На микробные клетки: I)1 все антибиотики в той или иной степени адсорбируются клеткой (клеточной стенкой), 2) все антибиотики подавляют рост чувствительных .культур, даже присутствуя в очень низких концентрациях, 3) все антибиотики обладают избиратель? ным биологическим действием.
Вместе с тем характер и в особенности механизм биологического действия каждого антибиотического вещества специфичны. Даже биологическое действие одного и того же препарата в зави-' симости от условий среды, в которой он проявляет эффект, неодинаково.
Взаимодействие антибиотика с микробной клеткой может вызы-вать определенные нарушения ее жизнедеятельности. Антибиотик может изменить проницаемость клеточной стенки или вызвать лизис клетки в результате нарушения осмотических свойств на ее поверхности; антибиотик может нарушить один или несколько энзиматических процессов, оказывающих влияние на метаболизм клетки в разных его звеньях (адсорбция, дыхание, энергетический обмен, синтез различных структур, реакции обезвреживания пли поддержание баланса между энзимами и продуктами метаболизма). Антибиотическое вещество может оказать влияние на функцию роста пли способность поглощения наиболее важных для жизни клеток веществ, нарушить репродуктивные процессы, процессы удаления продуктов обмена и другие функции.
Антибиотические вещества и прежде всего антибиотики-основания могут вступать во взаимодействие с белками, образуя комплексы антибиотик—белок. Образовавшийся комплекс нарушает функции белка, вызывая изменения в метаболизме клетки и всего
368
организма. В комплексообразовании принимают участие основные группы антибиотиков, имеющие свободные амино- и гуанидогр^н-пы, п кислые группы белков.
ПОГЛОЩЕНИЕ АНТИБИОТИКОВ КЛЕТКАМИ МИКРОБОВ
Первый этап во взаимодействии микроорганизмов с антибиотиком— адсорбция его клетками. Пасынский в Косторская в 1947 г. впервые установили, что одна клетка Staphylococcus aureus поглощает примерно 1000 молекул пенициллина. В последующих исследованиях эти расчеты были подтверждены. Так, по данным /Мааса л Джонсона, приблизительно 2-10~9 М пенициллина поглощается 1 мл стафилококков, причем около 750 молекул антибиотика необратимо связываются одной клеткой микроорганизма без видимого эффекта на ее рост.
Игл с сотрудниками в 1955 г. определил, что при связывании бактериальной клеткой 1200 молекул пенициллина угнетения роста бактерий не наблюдается. Угнетение роста микроорганизма на 90% наблюдается в тех случаях, когда клеткой будет связано от 1500 до 1700 молекул пенициллина, а при поглощении клеткой до 2400 молекул происходит быстрая гибель культуры.
Установлено, что процесс адсорбции пенициллина не зависит от концентрации антибиотика в среде. При низких концентрациях препарата (порядка 0,03 мкг/мл) он может весь адсорбироваться клетками, и дальнейшее повышение концентрации вещества не вызывает повышения количества связанного антибиотика.
Имеются данные о том, что фенол препятствует поглощению пенициллина клетками бактерий, однако он не обладает способностью освобождать клетки от антибиотика.
Пенициллин, стрептомицин, грамицидин С, эритрин и другие антибиотики связываются различными бактериями в заметных количествах. Причем антибиотики-полипептиды адсорбируются микробными клетками в большей степени, чем, например, пенициллины и стрептомицин.
Грамицидин С адсорбируется как чувствительными, так и устойчивыми к нему бактериями. Причем адсорбция происходит сразу же после внесения антибиотика в суспензию клеток и достигает значительных величин (до 500 мкг/мг сухой биомассы).
В присутствии положительно заряженных ионов (Na+, К+, NH*, Mg2+), а также при pH среды, равном 4, поглощение грамицидина С бактериальными клетками заметно снижается.
Адсорбированный чувствительными клетками грамицидин С прочно связывается с бактериями и снимается с них лишь при длительной экстракции подкисленной спиртово-водной смесью.
У устойчивого штамма Escherichia coli при промывании клеток раствором NaCl удается удалить лишь до 30% адсорбированного грамицидина С.
369
Ванкомицин, образуемый Streptomyces orientalis. необратимо и относительно быстро связывается клетками бактерий, чувствительными к нему. При концентрации антибиотика в среде, равной 30 мкг/мг массы сухих бактерий, около 90% ванкомицина связывается с бактериями. Показано, что максимальное связывание ванкомицина бактериальными клетками достигает 107 молекул антибиотика на клетку.
Связанные клеткой антибиотики способны проявлять двоякое действие: с одной стороны, некоторые из них могут действовать как поверхностно-активные вещества, а с другой стороны, антибиотики, проникая в глубь клетки, нарушают отдельные стороны метаболизма.
Гибель клеток под воздействием поверхностно-активных антибиотиков может быть связана с нарушением механизма осмотического равновесия, имеющего место на поверхности микробной клетки; гибель может также наступить в результате способности этих веществ, скапливающихся у поверхности раздела жидкая фаза — микробная клетка, связанная с определенными компонентами клеток, и нарушать их обычные функции.
Экспериментальные данные в этом отношении показали, что изменения в регулировании осмотического давления сопровождаются разрушением систем клеточной стенки микроба. Нарушение проницаемости клеточной стенки является или результатом прямого влияния антибиотических веществ, пли результатом вторичных процессов.
Действие антибиотиков как поверхностно-активных веществ может вызывать диссоциацию белка с отделением от него простети-ческих групп или нуклеиновых кислот. Такие антибиотики могут также приводить к денатурации белков и таким образом непосредственно влиять на энзиматические системы, связанные с клеточной стенкой (инвертазы, фосфотазы, различные дегидрогеназы, цитохромные системы).
Таким образом, если антибиотик обладает способностью нарушать системы, регулирующие осмотические свойства клеточной стенки, иными словами, если антибиотик выступает в качестве поверхностно-активного соединения, то он может оказывать бактерицидное действие. К числу антибиотических веществ, механизм действия которых связан с поверхностно-активными свойствами, следует отнести грамицидин С, тироцидин, полимиксины, а также тетрациклины, если последние применяются в концентрациях, во много раз превышающих бактериостатические.
Вместе с тем, как уже отмечалось выше, антибиотики, попадая в микробную клетку, могут нарушать отдельные этапы метаболизма организма, подавлять некоторые звенья в цепи биохимических процессов. Подавление отдельных звеньев в биохимической цепи превращений может происходить как путем необратимого связывания антибиотиком одного из компонентов реакции, так и в результате конкурентного подавления биологически важных метабо-’ литов клетки.
370
Конкурентное подавление
Если в организме пли в среде одновременно присутствуют два вещества — обычный для организма субстрат S и ингибитор I, сходный по структуре с субстратом, л оба они могут вступать в связь с энзимом (Е), как это показано в уравнениях (1 и 2);
s + Е SE (1)
I + Е Z7-7 1Е (2)
то мы имеем типичный пример конкурентного подавления, или конкурентного обмена. В качестве примера конкурентного обмена можно привести участие сульфанилампна как антпметаболита п-амино-бензойной кислоты в витамине фолевая кислота.
И ?
с—с °
IbN_/
с=с
I I
н И
п-Аминобензойная кислота (ПАЕК)
О
II
S—NIK
II
О
Сульфаниламид (прсптоцнд!
Как только сульфаниламид в случае его присутствия в клетке включается в фолевую кислоту вместо ПАБК, ферментативные функции бактериальной клетки блокируются. Это в свою очередь приводит к нарушению механизма обмена веществ клетки и, вслед за этим, к ее гибели.
и н
н н
Сульфаниламид
птеридин
глутаминовая кислота
фолевая кислота
371
В качестве примера конкурентного действия антибиотика при биосинтезе белка можно назвать пуромицин. Этот антибиотик образуется культурой Streptomyces alboniger. По химическому строению пуромицин — нуклеозидное производное пурина. Пуромпцину соответствует следующая формула:
Анализ химической структуры пуромицина показал, что он представляет собой структурный аналог 3-конечной аминоацилированной группировки тРНК.
Суммирование имеющихся данных по механизму биологического действия пуромицина дает возможность заключить, что он выступает в качестве конкурентного аналога аминоацил-тРНК, заменяя последнюю в реакции с пептидил-тРНК, что приводит к освобождению из рибосомы пептидила в виде пептидил-пуромицина и таким образом прекращает синтез белка.
Есть указания на то, что окситетрациклин выступает в качестве конкурентного ингибитора дифосфоппридиннуклеотпда при действии его на Е. coli.
Установлено, что актитиазовая кислота (антибиотик актиноми-цетного происхождения) — конкурент витамина биотина, сходного по строению с кислотой.
Антибиотик хадацпдин, образуемый определенным штаммом Peniclltium frequentans, выступает в качестве конкурентного вещества по отношению к L-аспарагиновой кислоте, а D-циклосе-рин — D-аланина.
Н.С^ ^CHtCHj^COOH нс-----сн
I I
HN. NH
С
II
о
Н2С^ ЧН(СН2). СООН
О=С-----NH
Актитиазовая кислота.
Биотин
СООН
CHNH,
соон
L-аспарагиновая кислота
сно
I нон соон
ХадацчдиН
н^ xnh+ пх ^NH?
н—С—с—н н—С—с—Н
н/ ^с~~° * О Jc—О'
Р-аланин Р-цикдосерин
Хадацидин подавляет биосинтез нуклеотидов. Он активен против некоторых раковых опухолей (аденокарциномы яичек, эпидермальной карциномы, саркомы). Антибиотик обладает низкой токсичностью.
Однако необходимо подчеркнуть, что явление конкурентного ингибирования не имеет широкого распространения в механизме действия антибиотических веществ.
Инактивация сульфгидрильных групп ферментов
Существует гипотеза, впервые высказанная Кэвеллнто, что биологическая активность многих антибиотиков (бензилпенициллина, стрептомицина, аллицина, пиоцпанина и др.) обусловлена тем, что они вступают в связь с сульфгидрильными группами (—SH) ферментов, превращая их в неактивные вещества, но такая точка зрения на механизм действия антибиотиков не была строго обоснованной. •
Однако в литературе появились указания на то, что механизм биологического действия антибиотика низина связан с взаимодействием его с сульфгидрильными группами метаболически важных ферментов (глютатин, ацетнлкоэнзпм А).
ОСНОВНЫЕ МЕХАНИЗМЫ
БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ АНТИБИОТИКОВ
Антибиотические вещества по механизму их биологического действия условно можно разделить на несколько основных групп.
1. Антибиотики, ингибирующие синтез клеточной стенки (пенициллины, бацитрацин, ванкомицин, цефалоспорин, D-циклосе-рин).
2. Антибиотики, нарушающие функции мембран (альбомиццн, аскозин, грамицидины, кандициднны, нистатин, трпхомицин, эндо-мицин и др.).
3. Антибиотики, избирательно подавляющие синтез (обмен) нуклеиновых кислот:
а) антибиотики, ингибирующие синтез РНК (актиномицин, гри-зеофульвин, канамицпн, неомицин, новобиоцин, оливомицин и др.);
б) антибиотики, подавляющие синтез ДНК (актпдпон, брунео-мицины, новобиоцин, саркомицин, эденн и др.).
4. Антибиотики — ингибиторы синтеза пуринов и пиримидинов (азасерин, декоипнн, саркомицин и др.).
5. Антибиотики, подавляющие синтез белка (бацитрицин, вйо-мицин, канамицин, метимицин, неомицин, тетрациклины, хлорамфеникол, эритромицин и др.).
6. Антибиотики — ингибиторы дыхания (антимицины, олигомицины, патулин, пиоцианин, усниновая кислота и др }.
7. Антибиотики — ингибиторы окислительного фосфорилирования (валпномицин, грамицидины, колицины, олигомицин, тироцидин и др.).
373
8. Антибиотики, обладающие антпметаболнтнымп свойствами (антибиотические вещества, образуемые некоторыми актиномице-тамп).
9. Антибиотики, обладающие иммунодепрессивными свойствами (актиномицины С и D, оливомицин, брунеомицпн, рубомицин и др.).
Объединение антибиотических веществ в указанные группы не означает, что только эти жизненно важные процессы в клетке подавляются антибиотиками. Некоторые антибиотики могут выступать в качестве поверхностно-актзвных веществ, другие — как антагонисты биологически важных метаболитов клетки и т. д.
Вместе с тем каждый антибиотик, включенный в ту или иную группу на основе специфики механизма биологического действия, в зависимости от концентрации препарата и других условий может выступать в роли ингибитора других процессов.
Например, тетрациклин в небольших концентрациях оказывает специфическое действие на рибосомы бактерий. Но если концентрацию антибиотика увеличить в 100 и 1000 раз, то он будет выступать в качестве разобщителя окислительного фосфорилирования.
Следовательно, приведенное выше деление антибиотиков на группы условное.
Для наиболее полного представления о специфике механизма действия различных .антибиотиков рассмотрим эти механизмы у отдельных препаратов, для которых они изучены наиболее полно.
I. АНТИБИОТИКИ, ПОДАВЛЯЮЩИЕ СИНТЕЗ клеточной стенки бактерии
Клеточная стенка бактерий не имеет аналога у клеток животных. В ходе развития бактерии происходит непрерывный процесс синтеза клеточной стенки; состав последней у разных видов различен. Особенно существенные отличия наблюдаются у грамположительных и грамотрицательных бактерий (табл. 93).
Таблица 93
Состав клеточной стенки некоторых микроорганизмов (по Флинну и Годзецкому, 1969)
Микрооргани змы Содержание (масса сухого вещества)» %
восстанавливающее вещество гексо-эамин ЛТШИДЫ ОбЩ1’Й а 301
Г раыположительные: Sarcina lutea 46,5 16,3 1,1 7,6
Bacillus subtilis 34.0 8,5 2,6 5,1
Г рамотрицательные: Escherichia coli 16,0 3,0 20.8 10,1
Salmonella pullorwn ........ 46,0 4,3 19,0 6,4
Грамотрицательные бактерии имеют сложно организованную клеточную стенку, составляющую от 6 до 9% массы клетки.
374
В клеточной стенке этих бактерий пептидогликан содержится в небольшом количестве, которое не превышает 5—10% от массы стенки. Пептидогликан образует тонкую (до 2 нм) непрерывную сетку, состоящую, как правило, из мономолекулярного слоя. Между слоем пептидогликана и цитоплазматической мембраной расположен липопротеидный слой.
Грамположительные бактерии имеют более просто устроенную клеточную стенку, которая составляет от 20 до 35% массы клетки. Основную массу (от 40 до 90%) клеточной стенки составляет пептидогликан; толщина его слоя достигает 10 нм. Пептидогликан образует многослойную структуру с поперечными сшивками. В состав пептидогликана грамположительных бактерий входят олигосахарпдные цепи, включающие аминосахара, тейхоевые (иногда тейхуроновые) кислоты, белки (табл. 94).
Таблица 94
Состав полимеров клеточных стенок бактерий
Полимер Бактерии
грамположительные грамотрица-тельные
Пептидогликан +
Тейхоевая кислота и (или; тейхсромовая кислота . . + —
Липополисахарид —. +
Липопротеид +
Бе юк 4-
Полисахарид + +
С пептидогликаном ковалентно связан кислый полимер, в состав которого входят тейхоевые и тейхуроновые кислоты. В клеточные стенки грамотрицательных бактерий пептидогликан входит в качестве минорного компонента. Образование последнего — хорошо сбалансированный процесс, где наряду с включением определенных субъединиц происходят реакции, связанные с действием специфических литических ферментов. Эти реакции способствуют образованию новых точек роста клеточной стенки.
и и I • ,
С—С—6—СП.—о
он
но—г— о—н.с
OR О р СОН
0(1
I
—о—н.с I!
о
I СНИЩ
CHj
ГГс-сил--0-OR О »
СОН
СПЫГГг
CHj
375
I lit
H2c—с—с—( —ей OH
II III'
O UR О »l
con
I
CHNJr, I ' CH,
T ей * nc р;.я кислота и i Staplnhi •»< ut? <ji< rcu t
Бактериальные клеточные стенки — это нерастворимые полимеры. Сшитые пептидные боковые цепи пептидогликана имеют меньше степеней свободы, чем точки роста пептидогликанов, содержащие несшитые пептидные цепи; последние и служат центрами комплексообразования с антибиотиками.
Необходимо отметить, что в действии большинства антибиотиков, в том числе и типично бактериоцпдных, на чувствительные микробные клетки у микроорганизмов существует определенный период, когда освобождение клеток от действия препарата восстанавливает их жизнеспособность.
К числу антибиотиков, подавляющих синтез клеточной стенки чувствительных бактерий, относятся D-цнклосерин, пенициллины и цефалоспорины и др.
D-Ц и к л о с е р и п, образуемый некоторыми видами актиномп-цетов (Str. roseochromogenes, Str. lavendulae и др.), является ан7 тагонпстом D-аланпна — аминокислоты, входящей в состав педтд.-догликана. Этот антибиотик подавляет работу ферментов: аланин* рацемазы, превращающего L-аланин в D-аланпн, и О-аланил-Э* аланинспнтетазы, катализирующего образование пептидной связи между двумя молекулами D-аланина. Иными словами, D-циклосе-рин подавляет ферменты, которые катализируют процесс включения D-аланпна в пептидогликан.
Пенициллин. Высокой антибиотической активностью в отношении некоторых грамположительных бактерий обладает бензилпенициллин. В очень малой степени он влияет на отдельные грам-отрицательные бактерии и не проявляет заметного действия на клетки животных, высших растений, грибов и протозоа.
При действии бензилпенициллина на чувствительные к нему микробы наблюдаются изменения как в морфологии клеток (удлинение и набухание бактериальных клеток, их искривление, образование длинных цепочек или шаров, лизис), так и в характере биохимических процессов, в нарушении путей обмена веществ организма.
В ,присутствии антибиотика клетки бактерий, как вначале полагали, теряют способность к делению, образуя так называемые сферрпласты. Позднее было установлено, что под действием пенициллина прекращается синтез клеточной стенки, но синтез цитоплазматического белка продолжается. Этот разрыв в синтезе указанных веществ и приводит к увеличению размеров клетки.
Некоторые организмы, например Staphylococcus aureus, утрачи
376
вают характерное для них свойство окрашиваться по Граму, превращаясь при этом в грамотрпцательные формы. Микроорганизмы, находящиеся в периоде логарифмической фазы роста, более восприимчивы к действию этого антибиотика.
Под действием пенициллина происходит изменение фиксации витальных красителей. При нормальных условиях развития культуры бактериальная клетка прокрашивается нейтральным красным и другими витальными красителями равномерно. В бактериальной клетке, которая находилась в течение 1—2 ч вместе с пенициллином (известно, что скорость поглощения антибиотика клеточной стенкой составляет всего 2 мин), окрашиваются только отдельные гранулы, находящиеся на противоположных полюсах. Это явление указывает на то, что под влиянием пенициллина некоторые грам-положнтельные бактерии за сравнительно короткий период (I—2 ч) приобретают признаки погибающих клеток.
Под действием пенициллина чувствительные к нему микробы теряют способность поглощать из среды и усваивать отдельные аминокислоты, в особенности глутаминовую, и различные неорганические вещества, легко поглощаемые и усваиваемые неповрежденными клетками. Однако пенициллин не влияет на синтез белков и нуклеиновых кислот. Вместе с этим под влиянием антибиотика микробы теряют способность удерживать содержащиеся в них растворимые вещества, в результате чего из бактериальной клетки удаляются липиды и продукты гидролиза жирных кислот, а также нуклеотиды и их составные части. Все эти факты также указывают на то, что под действием пенициллина происходит изменение клеточной стенки чувствительных к нему бактерий.
Пенициллин препятствует образованию культурой Staphylococcus auretts p-галактозидазы.
Имеются данные, позволяющие сделать более конкретное заключение о первичном этапе механизма действия пенициллина. Показано, что пенициллин специфически тормозит синтез некоторых аминокислот, входящих в мукокомплекс клеточной стенкп бактерий, и подавляет синтез полимеров, входящих в состав бактериальной стенки. Антибиотик блокирует реакцию транспептпдирова-ння, приводящую к образованию новых полпглпциновых поперечных связей в клеточной стенке. В результате нарушается синтез пептидогликана и происходит подавление роста бактерий.
Избирательность антимикробного действия пенициллина, по-видимому, связана с тем, что состав клеток грамположительных и грамотрицательных бактерий неодинаков — клеточные стенки грамположительных бактерий содержат 2—3% липидов от массы клеточной стенкп, при гидролизе выделяют ряд аминокислот, среди которых редко встречаются ароматические и серосодержащие.
Клеточные стенкп грамотрицательных бактерий содержат 18—• 20% липидов (от массы клеточной стенки) и при гидролизе выделяют большее число аминокислот, среди которых присутствуют серосодержащие. В состав стенок грамположительных бактерий входит четыре сахара, N-ацетилмурамовая кислота (эфир молочной
377
кислоты и ацетплглюкозамина), аминосахара (глюкозамии, галактозамин п производное глюкозампна — мурамовая кислота), а-глу-тампновая кислота, аланин, лизин или диаминопимелиновая кислота.
сн .он
КН;
Мурамовая кислота
Под действием пенициллина в клетках стафилококка происходит накопление трех уридиннуклеотпдов, что позволило высказать предположение о том, что эти нуклеотиды играют роль переносчиков пептида ацетилмурамовой кислоты, входящего в состав полимеров клеточной стенки. Пенициллин препятствует образованию названного полимера клеточной стенки на определенной стадии ее синтеза (рис. 59).
Таким образом, нарушение синтеза клеточной стенки под действием пенициллина вызывает лизис обнаженной протоплазмы п гибель клетки, что является основным фактором в механизме действия пенициллина.
Клеточная стенка бактерий имеет специфическую структуру, отлпчаюшуюся по составу от стенок других клеток, и поэтому ее синтез обеспечивает возможность избирательного действия антибиотика. Вместе с тем структура клеточных стенок, включающая
УДФАГ-ЛАКГ
УДФАГ-ЛАКТ-2-afl
УДФАГ-ПВ
и
УДФАГ
U
УТФ
УДФ^
УДФАГ-ЛАКТ-2~ ал-Д-ггут
\\
УДФАГ- ПАКТ- 2-оп-Д-гчут-с-тз -2-ол -Д -Л7
I-— Место действия
Д пенициллина
/ \+ Акцептор
/ клеточная стенка
Предшественники пирими диннук пеотида
Рис. 59. Действие пенициллина па образование полимера клеточной стенки на определенной стадии предполагаемого синтеза:
УДФ — уридппдвфосфат. УТФ — урвдннтрифосфат, УДФАГ'ЛАКТ — уридпнфосфоацетнлглюкозаъшновый эфир молочнсЖ кислоты, ПВ — пировиноградная кислота, ал — аланин, глут — глутаминовая кислота, лиз —лизни. Пунктирные линии — возможные реакции
37g
своеобразные полисахариды, белки, липиды, полипептиды, обеспечивает устойчивость ряда бактерий к действию этих антибиотических веществ.
Цефалоспорины имеют сходный с пенициллинами механизм биологического действия. Следовательно, в основе механизма биологического действия пенициллинов и цефалоспоринов находится процесс подавления активности двух ферментов (транспептидазы муреина и D-аланинкарбоксипептидазы), которые участвуют в образовании основного полимера клеточной стенки бактерий на его заключительном этапе. Под действием 0-лактамов на бактериальные клетки происходит освобождение теихоевых кислот в среду, в результате чего активируются ферменты (фермент), гидролизующие пептидогликан. В итоге это приводит к тому, что клеточная мембрана остается без механической опоры и наступает лизис клетки. В клетках животных и человека указанный полимер отсутствует, и там нет названных выше ферментов. Поэтому пенициллины и цефалоспорины не оказывают действия на животные организмы; основная точка их приложения — биосинтез клеточных стенок бактерий.
II. АНТИБИОТИКИ, НАРУШАЮЩИЕ ФУНКЦИИ МЕМБРАН
По составу мембраны бактериальных клеток — липопротеидные структуры, в которые включены молекулы белка. Мембраны выполняют основную функцию барьера между окружающей средой и цитоплазмой клетки и контролируют перенос веществ из окружающей среды в клетку.
Перенос (транспорт) веществ через цитоплазматическую мембрану может осуществляться тремя основными путями.
1. Пассивная диффузия — переносимые вещества должны быть растворимы в гидрофобной среде мембраны.
2. Облегченная диффузия. Вещества, взаимодействуя со специфическим переносчиком, образуют комплекс переносчик — вещество, который и может проходить через мембрану.
3. Энергозависимый транспорт — для переноса вещества необходимо наличие источника энергии. При этом транспорт вещества может происходить против градиента концентрации. Иногда концентрация веществ в клетке на два-три порядка выше концентрации веществ во внешней среде, но и в этом случае происходит транспорт веществ из среды в клетку.
Поступление антибиотиков в клетку микроорганизмов является процессом активного транспорта. Следует при этом подчеркнуть, что на транспортные нужды бактериальная клетка расходует в среднем 20—30% энергии, образуемой в процессе обмена веществ.
Накопление внутри клеток микроорганизмов антибиотика — этого неметаболизирующего ингибитора — объясняется тем, что антибиотики «пользуются» темп же транспортными системами, которые предназначаются для переноса обычных метаболитов, «подменяя» последние. Такая «подмена» возможна благодаря опреде
379
ленному химическому сходству антибиотиков и нормальных продуктов обмена.
Плакунов, в частности, показал, что тетрациклиновые антибиотики переносятся в клетки микроорганизмов с помощью транспортной системы, предназначенной для кислых аминокислот: аспарагиновой и глутаминовой.
Устойчивые к тетрациклинам штаммы Escherichia coli К-12, Staphylococcus aureus 209 и Mycobacterium citreuni поглощают значительно меньшее количество ]4С-хлортетрациклина, чем исходные чувствительные штаммы.
Устойчивые к тетрациклинам микроорганизмы сохраняют типичную для чувствительных штаммов систему транспорта антибиотика с неизменной стереоспецифичностью. Однако они способны (в отличие от чувствительных штаммов) длительное время поддерживать внутриклеточную концентрацию антибиотика на уровне более низком, чем концентрация его в среде. Такое «противодействие» поглощению антибиотика требует затраты энергии и подавляется в присутствии цианида и 2,4-динитрофенола.
Антибиотические вещества, оказывающие действие на цитоплазматическую мембрану, можно разделить на три группы.
1. Вещества, вызывающие дезорганизацию структуры мембран.
В группу входят грамицидин С, полимиксины, полиены.
Грамицидин С — антибиотик, нарушающий организацию липопротеидных систем и проницаемость клеток, создаваемую мембраной. Степень этих нарушений зависит от концентрации антибиотика. Грамицидин медленно снижает поверхностное натяжение.
Грамицидин С может вступать в связь с клеточными мембранами. В основе механизма биологического действия грамицидина С лежит нарушение им состояния и функционирования мембран клеток в результате связывания антибиотика с мембранными компонентами. Это вызывает, с одной стороны, резкое изменение проницаемости мембран и быструю потерю клетками жизненно важных соединений типа нуклеотидов, неорганического фосфора, аминокислот и, с другой стороны, угнетение процесса энергетического обмена, особенно его начальной стадии — дегидрирования.
Полимиксин ы. Под влиянием антибиотиков этой группы при относительно невысоких концентрациях (25 мкг на 1 мг массы сухих клеток) происходит выход из клеток низкомолекулярных веществ (фосфора, пентоз) и распад нуклеиновых кислот.
Полиеновые антибиотики (нистатин, рпмоцндин, фи-лпппн, эндомицпн, кандицидин, трихомицин и др.) — биологически активные соединения, способные изменять проницаемость клеток, чувствительных к их действию. Как известно, проницаемость клетки зависит прежде всего от цитоплазматической мембраны. Поэтому высказано предположение о том, что полиены, специфически присоединяясь к цитоплазматической мембране клетки гриба, лишают мембрану способности функционировать в качестве барьера, обеспечивающего избирательную проницаемость.
380
Рис. 60. Основные принципы действия ионофоров на мембранах (по Овчинникову, 1981)
Специфическая токсичность полиеновых антибиотиков обусловлена их взаимодействием с одним из компонентов цитоплазматической мембраны чувствительных клеток, принадлежащим к стери-нам.
Имеются указания о том, что актиномицины в животном организме превращаются в свободный радикал. В виде свободного радикала молекула антибиотика вызывает изменения белков мембран. В результате этого происходит нарушение транспортных функций мембран, в конечном счете приводящее к гибели клеток.
2. Антибиотики, ингибирующие связанный с мембраной белок (фермент), принимающий участие в процессах транспорта. К этой группе веществ следует отнести олигомицин. Антибиотик подавляет митохондриальную аденозинтрифосфатазу (АТФ-азу), которая связана с бактериальными мембранами и участвует в синтезе АТФ или его использовании.
3. Антибиотические вещества—ионофоры. Некоторые антибиотики (валиномицин, эннпатины, нонактин, грамицидины) обладают способностью индуцировать проницаемость ионов через мембраны клеток; это послужило основой их названия — антибиотики ионофоры. Антибиотики ионофоры в настоящее время широко используются биохимиками, микробиологами и другими специалистами в качестве соединений, применяемых при изучении процессов транспорта ионов через мембраны.
Известны два основных принципа действия ионофоров: 1) ионофоры-переносчики (валиномицин, нонактин, эннпатины), 2) ионофоры, образующие ион-проницаемые поры («каналы»); к последним относятся грамицидины А, В и С. Основные принципы действия ионофоров можно представить схематически (рис. 60).
Валиномицин — макроциклический депсипептид, в состав которого входят 12 аминокислотных остатков, состоящих из трех идентичных фрагментов:
381
^D-Вал—L-лик—
D-Гов D-Гой
L-lUii D-Влд
L* -Uf L-jijk
'4'X'D-Ban—D-Гов—L-Вл
Влаиномицин
Вы—валищ Гов — ж-гидро-окс4шMB.i.iepiv-u<OB.iR кислогд;
пак—лакгат
Валнномицпн способен связывать многие катионы, образуя соответствующие комплексы (валиномнцин-ион). Однако наибольшей специфичностью к комплексообразованию этот антибиотик обладает к иону калия. Причем высокую индуцирующую способность проводить калин через мембраны валнномицпн проявляет да-
О Вал ином ич«« ® Вапиномицин'К*
Рас. 61. Схема переноса валнномицнном ионов калия через липидную мембрану (по Овчинникову, 1981)
же в очень низких концентрациях (10-s М и ниже). После выполнения функции переноса калия антибиотик восстанавливается в прежнюю форму- (рис. 61). Антибиотик обладает универсальностью действия на мембранах: индуцирует проводимость ионов калия на природных и искусственных мембранах.
В присутствии типичного ионофора валпномпцина мембраны чувствительных избирательно проницаемыми именно ионы калия и
бактериальных клеток становятся для ионов калия. Валнномицпн связывает
транспортирует пх через мембрану в тысячу раз активнее, чем
ионы натрия.
Аналогичное действие проявляют макротетралиды н эннватпны.
Э н н и а т и н ы. Структура эннпатинов близка структуре вали-номпцпна. Они образуются плесневыми грибами из рода Fusarium: энниатнн А — культурой Fusarium orthocerus var. enniatinum. другие штаммы Fusarium sp. синтезируют энниатпны В и С.
Строение молекулы энниатнна А представлено следующей схемой:
382
Мет-нлс--------D-Гов
I I
D-Гов Mei-и.ие
I I
M ет-иле-------D-Гов
Энниагкн A
Мет-и ле—N-метил mo лейцин; D- Г on—D- а- гилроксин товалериановая кислота
Комплексы эннатин — К+ менее устойчивы, чем комплекс вапи-номицнн — К+-
Все указанные выше антибиотики выступают в роли специфических «проводников» катионов через мембраны.
III. АНТИБИОТИЧЕСКИЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ СИНТЕЗ БЕЛКА
Установлено, что синтез белка у организмов происходит в основном в цитоплазме на рибосомах.
Рибосомы — это рнбонуклеопротеидные частицы, в состав которых входят высокополпмерная РНК и структурный белок. Обычно в клетках микроорганизмов рибосомы находятся в цитоплазме в свободном состоянии.
Биохимическая роль рибосом — биосинтез белка. Это, по-впди-мому, их единственная функция. Именно на рибосомах происходит соединение отдельных аминокислот в полипептиды, завершающиеся образованием вторичной и третичной структуры белков.
Первичной стадией образования полипептидной цепи белка является процесс активации аминокислот с помощью аденозпнтри-фосфата (АТФ). Процесс активации происходит при участии ферментов pH 5-й фракции. В результате этого процесса первоначально образуются ампноацпладенилаты:
г,.
R—СИ—СООН + АТФ R—СП—СО~АМФ + ФФ
Затем под действием фермента ампноацил-тРНК-синтетазы (для каждой из 20 аминокислот имеется свой особый фермент) «активированная» аминокислота соединяется с адапторноп или транспортной РНК (тРНК):
R—СИ—СО-АМФ + 1П1К
К—СИ—СО-П'ИК
+ АМФ
NHj
NH, Ammiwhuivi*^ iFH К
После этого комплекс аминоацпл-тРНК переносится на рибосомы, где и происходит синтез полипептида. Сформировавшиеся бел-
383
кп освобождаются из рибосом, а рибосомы после этого могут присоединять новые комплексы аминоацпл-тРНК и синтезировать новые белковые молекулы. Рибосомы связаны с информационной или матричной РНК (мРНК), которая и определяет порядок чередования аминокислот в почипептидных цепочках.
Таким образом, целостность и функциональная активность рибосом в клетках — одно из необходимых условий процесса синтеза белковых молекул.
Стрептомицин. По антибактериальному спектру стрептомицин существенно отличается от пенициллина — его биологическое действие проявляется не только в отношении грамположительных бактерий, но и в отношении грамотрицательных и кислотоустойчивых микробов. В отличие от пенициллина стрептомицин проявляет антибиотическое действие на бактерии как в фазе нх логарифмического. роста, так и в фазе покоя, но клетки Е. coli более чувствительны к стрептомицину в период логарифмической фазы роста. Различие в био топическом действии пенициллина и стрептомицина и в том, что, как правило, устойчивые к пенициллину микробы оказываются чувствительными к стрептомицину.
В отличие от пенициллина стрептомицин поглощается клетками микробов в зависимости от его концентрации в среде: чем выше концентрация антибиотика, тем больше его поглощает клетка. При поглощении одной клеткой Вас. megatherium приблизительно 104 молекул антибиотика погибает 99% клеток. Резистентные к стрептомицину штаммы поглощают антибиотик со скоростью, составляющей менее 1% от скорости поглощения его чувствительными организмами.
Связь стрептомицина с бактериальной клеткой неустойчива, антибиотик легко удаляется с поверхности клеток при обработке их растворами неорганических солей (NH4C1, NaCl, КгНРО4ндр.}, что может указывать на ионный характер связи стрептомицина с метаболитами клеток.
Однако освободить клетки от стрептомицина удается лишь в том случае, если бактериальная клетка находилась в контакте с антибиотиком не более 5 мин. При более длительном периоде контакта неорганические соли не могут снять полностью антибиотик с клеток.
Если пенициллин связывается клетками бактерии довольно быстро (через 2 мин), то поглощение стрептомицина по некоторым данным происходит гораздо медленнее. Максимум; поглощения происходит через 4 ч после начала контакта культуры микроорганизма с антибиотиком.
Поглощенный стрептомицин проникает в глубь клетки и связывается различными внутриклеточными соединениями, что и обусловливает его биологическую активность.
Как отмечалось (с. 226—227), с повышением pH среды возрастает биологическая активность стрептомицина, связанная в первую очередь с тем, что при этом возрастает степень поглощения стрептомицина бактериальной клеткой.
384
Установлено, что стрептомицин оказывает глубокое и разнообразное влияние на обмен веществ чувствительных к нему микроорганизмов. Антимикробное действие препарата в основном состоит в том, что он тормозит синтез белка в клетке бактерий. Этому процессу уделяется большое внимание при изучении механизма действия стрептомицина.
Стрептомицин подавляет включение ,4С D-L-тирозина в белки размножающихся клеток Mycobacterium friburgen.se. Причем подавление включения тирозина наблюдалось только во фракции белков, не осаждающихся при центрифугировании на суперцентрифуге. Во фракциях, содержащих клеточные стенки и фрагменты мембран, действия стрептомицина не наблюдалось.
При добавлении бактерицидных концентраций стрептомицина к развивающейся культуре Е. coli наблюдается быстрая остановка развития, однако синтез нуклеиновых кислот продолжается.
В настоящее время можно считать установленным, что стрептомицин ингибирует синтез белка на конечных этапах этого процесса— он тормозит образование белковой молекулы на стадии переноса аминоацил-тРНК к рибосомам, не затрагивая начальную стадию, т. е. стадию активации аминокислот.
Антибиотик, присоединяясь к рибосоме, препятствует синтезу белка. Подтверждением этого может служить то, что стрептомицин в значительной степени ингибирует включение некоторых аминокислот (14С) в белки рибосом, нарушая их функции, но не оказывает воздействия на структуру и физико-химические свойства рибосом.
Стрептомицин в определенных концентрациях может угнетать рост и размножение дрожжевых организмов. Он также нарушает процесс синтеза белка у этих организмов. При этом антибиотик не изменяет строения и состава рибосом дрожжевой клетки. Наиболее заметные изменения наблюдаются в митохондриях (происходит их укрупнение) и ядрах дрожжевых клеток.
Под действием стрептомицина в клетке Endomyces magnussii появляется до 20 гипертрофированных ядер. По-видимому, под действием антибиотика происходит временная активация процесса синтеза ДНК-
Изучение действия стрептомицина на ферменты так называемого зимазного комплекса показало, что антибиотик примерно наполовину снижает активность указанного ферментного комплекса.
Приведенные данные расширяют представления об избиратель’ ностп биологического действия стрептомицина.
Имеются указания на то, что стрептомицин наряду с ингибированием белкового синтеза может подавлять также окислительные процессы. В частности, он ингибирует ферменты сукцинатдегидрогеназу и фумаразу.
Анализ многочисленных и довольно противоречивых данных по механизму действия стрептомицина позволяет сделать вывод, что его биологическая активность связана прежде всего с подавлением синтеза белка. Антибиотик ингибирует синтез белка благодаря
13—742
385
избирательному взаимодействию с 30 S-субчастицей рибосомы, вызывая изменение A-участка ее и нарушая таким образом процесс поступления аминоацил-тРНК в рибосому и его правильную ориентацию. При таком вмешательстве стрептомицина происходит ошибочное считывание генетического кода (матрицы).
Тетрациклины. Химическое родство тетрациклина, хлортетрациклина, окситетрациклина и других антибиотиков тетрациклиновой группы дает основание считать, что механизм их биологического действия очень близок. Подтверждается это и тем, что формы микробов, устойчивые к одному из тетрациклинов, резистентны и к другим антибиотикам этой группы. Однако имеются данные, указывающие на некоторые количественные различия в физиологическом действии антибиотиков этой группы.
Установлено, что при низких концентрациях тетрациклиновые антибиотики проявляют бактериостатический эффект, а при повышении концентрации примерно в 10 раз наблюдается бактерицидное действие. Такие вещества, как глицин и цистеин, в определенной степени снимают действие тетрациклинов. Некоторые грам-отрицательные бактерии способны образовывать вещества, инактивирующие бактериостатическое действие хлортетрациклина.
В литературе отсутствуют данные о наличии бактерий, зависимых от тетрациклинов.
Несмотря на значительное число работ, посвященных изучению механизма биологического действия тетрациклинов, вопрос этот окончательно не выяснен. Имеются лишь данные о влиянии тетрациклинов на отдельные стороны метаболизма микробов.
Тетрациклины угнетают процесс дыхания бактерий, уменьшают окисление углеводов, но нарушение этих процессов, по-видимому, не связано с первичным механизмом действия тетрациклинов, а является производным (вторичным) результатом действия антибиотика. Хлортетрациклин и окситетрациклин тормозят процесс фосфорилирования, в частности они препятствуют включению фосфора в нуклеиновые кислоты.
Тетрациклины тормозят активность некоторых ферментов (пептидаз, D-амилаз, сукцинатдегидрогеназ, фумараз, триптофаиаз). Концентрации окситетрациклина, угнетающие развитие бактерий, подавляют адаптивное образование фермента у кишечной палочки при культивировании ее на среде с лактазой. Однако подавление активности ферментов, вероятно,— не основное звено в механизме биологического действия тетрациклинов. Окситетрациклин в концентрации 25 мкг/мл избирательно подавляет синтез белка клетками Staphylococcus aureus, в то время как синтез РНК и ДНК продолжается.
Общее количество белка в клетках культуры Staph, aureus через 90 мин после добавления антибиотика увеличивается примерно на 13%, количество РНК возрастает на 140%, а ДНК — на 55% (табл. 95).
Данные, представленные в таблице, подтверждают предположение о том, что бактериостатические концентрации тетрациклинов
386
Таблица 95
Действие окситетрациклина на синтез белка и нуклеиновых кислот в клетках Staphylococcus aureus, находящихся в питательной среде
(по Сазыкину и Борисовой, 1962)
Время после добавления 25 мкг/мл антибиотика, мин Содержание белка и нукленионых кислот в 1 мл культуры
белок, % РНК. % ДНК. %
0 100 100 100
15 109 139 121
30 115 152 122
60 119 230 —
90 113 239 155
нарушают клеточный обмен чувствительных микроорганизмов, приводя к разобщению биосинтеза белка и нуклеиновых кислот: синтез белка, по существу, приостанавливается в клетках, а биосинтез нуклеиновых кислот продолжается, иногда даже стимулируется.
Тетрациклин, накапливаясь в устойчивых к его действию клетках, не подвергается деградации, а сохраняется в активной форме. Вместе с тем в этих условиях антибиотик не способен подавлять синтез белка. По-видимому, в механизм такого действия антибиотика вовлечен внутриклеточный «ингибитор».
У ряда устойчивых к тетрациклину микроорганизмов выделены мутанты по детерминантам устойчивости к этому антибиотику.
По мнению Плакунова, тетрациклиновые антибиотики в суббактериостатических и бактериостатических концентрациях оказывают биологическое действие прежде всего на биосинтез и функцию таких систем в клетках, которые зависят от витаминов К и флавинов. Подавление же биосинтеза белка имеет вторичный характер.
Тетрациклиновые антибиотики в концентрациях от 100 до 300 мкг/мл тормозят окисление глутаминовой кислоты. По-видимому, с этим явлением связано подавление антибиотиками in vitro дыхания у риккетсий, вызывающих сыпной тиф.
Ряд исследователей связывают биологическую активность тетрациклинов с их способностью образовывать прочные соединения (хелаты) с двух- и трехвалентными металлами (магний, марганец, железо и др.). Эти реакции антибиотика с металлами вызывают инактивацию ряда ферментов, что, в свою очередь, влияет на синтез белков. Так, угнетение нитратредуктазы под действием тетрациклинов объясняется взаимодействием антибиотика с ионами марганца, а подавление процессов фосфорилирования — связыванием ионов магния.
Существует предположение, что подавление хлортетрациклином активности ферментов может быть результатом образования неактивного комплекса фермент — металл — антибиотик. При удалении
13*
387
металла, например при помощи нитрата натрия, исходная активность фермента восстанавливается.
Тетрациклиновые структуры благодаря наличию большого количества функциональных групп способны образовывать комплексные соединения не только с металлами, но и с флавинами и, возможно, с другими веществами клетки.
Есть указания на то, что окситетрациклин избирательно катализирует окисление аскорбиновой кислоты, и если при этом в качестве конечного продукта образуется пероксид водорода (Н2О2), то такой процесс может приводить клетки к гибели.
Подводя итог многочисленным и подчас противоречивым данным о механизме биологического действия тетрациклиновых антибиотиков, можно все же установить, что наиболее существенный момент их биологической активности — подавление синтеза белка на рибосомах. Главное в действии тетрациклинов — это подавление синтеза белка на одной из поздних стадий указанного процесса — на стадии связывания аминоацнл-тРНК с 30 S-субчастицами рибосом. Тетрациклины не могут проникать через мембраны эукариотических клеток — в этом их избирательность антимикробного действия.
Изучение влияния на макроорганизм хлортетрациклина показало, что он влияет на кровяное давление: при быстром введении хлортетрациклин понижает давление крови, а затем повышает его, по-видимому, непосредственно влияя на выделение адреналина. Антибиотик производит определенный эффект на условные рефлексы. Хлортетрациклин увеличивает рост животных независимо от качества пищи.
Тетрациклины оказывают действие на каталазу крови. В больших дозах они вызывают у животных стойкое нарушение регенерации клеток крови.
Окситетрациклин снижает активность каталазы, под действием хлортетрациклина наблюдается повышение активности фермента, а тетрациклин не изменяет активности каталазы крови.
Хлорамфеникол. В результате изучения различных сторон биологического действия хлорамфеникола было установлено, что основа антибиотического действия его — подавление синтеза белка. Это позволяет использовать хлорамфеникол в качестве ингибитора белкового синтеза при различных лабораторных исследованиях, связанных с этим процессом (изучение системы фаг — хозяин, синтез адаптивных ферментов и др.).
При низких концентрациях хлорамфеникол в значительной степени тормозит синтез белка у чувствительных к нему бактерий, высокие концентрации антибиотика подавляют процессы дыхания, образования и накопления глутаминовой кислоты и фенилаланина, блокируют синтез нуклеиновых кислот. Антибиотик препятствует усвоению аминокислот и аммиака бактериями.
Хлорамфеникол, с одной стороны, подавляет синтез белка у бактерий на стадии переноса аминокислот от аминоацил-тРНК к рибосоме, т. е. на конечном этапе биосинтеза белковой молекулы,
388
а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Антибиотик блокирует связывание аминоацилолигонуклеотидного фрагмента аминоа-цил-тРНК с 50 S-субчастицей рибосомы.
Хлорамфеникол не нарушает процесс биосинтеза аминокислот, но тормозит процесс образования из них полипептидной цепочки и в конечном счете белков. В результате ингибирования биосинтеза белков у чувствительных к хлорамфениколу клеток происходит накопление свободных аминокислот и выделение их в окружающую среду.
Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка.
Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом.
Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков (стрептограмина, эритромицина), но пуромицин и тетрациклины не оказывают такого воздействия на эту взаимосвязь.
Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии.
Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им.
У резистентных к хлорамфениколу форм кишечной палочки (Е. coli) процесс синтеза белка протекает с пониженной скоростью. Белковый обмен резистентных и устойчивых клеток в присутствии антибиотика сходен.
Существуют указания, что хлорамфеникол тормозит некоторые звенья энергетического обмена. Аэробные реакции энергетического обмена подавляются антибиотиком в большей степени, чем ана
389
эробные. По-видимому, действие хлорамфеникола на дизентерийные бактерии связано с нарушением окислительно-восстановительного процесса в аэробной стадии их развития.
Хлорамфеникол не оказывает влияния на активность ферментов ацетилфосфотазы и фосфотрансацетилазы у Е. coli, которые у микроорганизмов принимают участие в превращениях пировиноградной кислоты.
Хлорамфеникол избирательно подавляет рост многих видов бактерий, но в тех же концентрациях не оказывает заметного действия на развитие дрожжей, грибов, протозоа и клеток животных. Устойчивость этих организмов может быть объяснена, с одной стороны, способностью их мембран не пропускать антибиотик, с другой — отличием путей биосинтеза белка у бактерий.
IV. АНТИБИОТИКИ —ИНГИБИТОРЫ СИНТЕЗА ПУРИНОВ
И ПИРИМИДИНОВ
Подавление синтеза нуклеотидов (пуриновых и пиримидиновых оснований) необходимо рассматривать как определенный этап (стадию) подавления синтеза нуклеиновых кислот. К числу антибиотиков, блокирующих синтез нуклеотидов, относятся такие соединения, как азасерин, саркомицин и некоторые другие.
Азасерин — антибиотик противоопухолевого действия, образуемый Streptomyces fragilis,— подавляет включение глицина в процессе биосинтеза пуринов. Азасерин — структурный аналог глутамина:
соон соон
I I
HCNH2 HCNH2
СН2 сн2
о сн,
С=О С—О
НС NH,
N==N
Азассрин Глутамин
Антибиотик, по-видимому, вступает в конкуренцию с глутамином за связывание с ферментом, который он необратимо инактивирует.
Группа — N = N — молекулы азасерина вступает в связь с группой фермента, ответственного за перенос =NH от амидной группы глутамина к субстрату.
Азасерин подавляет биосинтез пуринов в результате связывания с ферментом, обеспечивающим превращение формилглицинамид-
390
рибонуклеотида в формилглицинамидин-рибонуклеотид. Цистеин — основная мишень для действия азасерина.
Азасерин проявляет мутагенные свойства; практического применения в медицине антибиотик не имеет.
Саркомицин обладает множественным действием на обмен клеток асцитной опухоли: подавляет включение 14С глицина в белок, подавляет синтез пиридиннуклеотидов, включение фосфора в нуклеотиды и нуклеиновые кислоты.
V. АНТИБИОТИКИ, ИНГИБИРУЮЩИЕ СИНТЕЗ
НУКЛЕИНОВЫХ КИСЛОТ
Актиномицины. Способность актиномицинов подавлять синтез белка и РНК, но не оказывать влияния на образование ДНК привлекла внимание многих исследователей. Так, актиномицин D в концентрации 5 мкг/мл полностью приостанавливает у Вас. subtilis синтез белка и РНК и не влияет на синтез ДНК- При использовании суббактериостатических количеств актиномицина С происходит даже повышение концентрации ДНК у Вас. subtilis.
Таким образом, под действием актиномицинов происходит лишь ингибирование синтеза белка и РНК. Возможно, однако, что подавление синтеза белка является функцией подавления синтеза РНК.
Аурантин (один из актиномицинов) немедленно подавляет образование РНК у Staph, aureus. Остановка синтеза РНК, а следовательно, и мРНК непосредственно отражается на синтезе белка.
Актиномицины тормозят также синтез РНК в клетках животной ткани и в опухолевых клетках.
Актиномицины подавляют в клетках синтез РНК в результате образования высокоспецифичного комплекса с ДНК-матрицей. Установлено, что антибиотик препятствует продвижению РНК-поли-меразы вдоль молекулы ДНК-матрицы. В образовавшемся комплексе актиномицин — ДНК пептидная часть молекулы антибиотика размещается в малой борозде двойной спирали ДНК.
Образование комплекса актиномицин — ДНК обусловливает биологическое действие этого антибиотика, связанное с изменением функции нуклеиновых кислот.
Митомицины — антибиотики широкого спектра антибиотического действия; подавляют развитие многих видов бактерий, простейших, а также задерживают рост опухолевых клеток.
О
Митомицин С
391
Механизм биохимического действия этих биологически активных веществ противоположен действию актиномицинов: митомицины приостанавливают синтез ДНК, практически не влияя на синтез РНК и белка. Бактерицидное действие антибиотика очень быстрое. Однако синтез вирусной ДНК весьма устойчив к действию митомицина.
Более того, имеются данные, указывающие, что под действием митомицинов происходит расщепление ДНК на кислоторастворимые фрагменты. Причина расщепления ДНК под действием митомицинов окончательно еще не выявлена. Вместе с тем имеются указания на то, что митомицин С способен образовывать поперечные сшивки в молекуле ДНК-
Митомицин С обладает способностью индуцировать (активизировать) фаги бактерий.
Дуаномицин и близкие к нему рубомицины (А, Во, Bt и Сь наиболее активны рубомицин Bi и рубомицин Ci) образуются стрептомицетами. Дуаномицин синтезируется Streptomyces peuceti-cus, а рубомицины — Str. coeruleorubidus.
Антибиотики проявляют противоопухолевое действие. Показано, что механизм биологического действия дуаномицина определяется способностью «встраиваться» между парами оснований ДНК-Антибиотик связывается с теми участками ДНК, где есть Г—Ц-па-ры. Хромофор дуаномицина как бы раздвигает пары оснований в ДНК и располагается между ними. Дуаномицин имеет следующее строение:
Блеомицины — группа гликопептидных антибиотиков; образуются Streptomyces verticillus. Группа объединяет не менее 16 близких по химическому строению антибиотиков. В состав блеомицинов входят аминокислоты, амины, L-глюкоза и карбамоил-D-манноза.
392
Основная структура блеомицина
R—терминальный амин
Блеомицин А2: R—NH2—(CHj)/—S+=(CH3)2C1^ (3-аминолропилдиметилсулъфонат)
NH
V . II
Блеомицин В2- R=“NH2—(СНз)^—NH—С—NH2 (агматин)
Группа блеомицинов — противоопухолевые антибиотики, основной механизм их биологического действия — деградация молекулы ДНК. Блеомицины тормозят синтез ДНК в зависимости от концентрации. Высокая концентрация антибиотика (300 мкг/мл) приводит клетки к гибели.
Новобиоцин. Имеются указания на то, что новобиоцин, подобно пенициллину, нарушает нормальный процесс синтеза клеточных стенок. Подтверждается это тем, что под действием новобиоцина происходит накопление в клетках чувствительных бактерий фрагмента мукопептида клеточной стенки.
Под действием новобиоцина у чувствительных к нему бактерий (Е. coZt, Staph, aureus и др.) наблюдается увеличение фосфора кислоторастворимой фракции, входящей в состав клеточных стенок.
Имеются данные о том, что под действием новобиоцина происходит внутриклеточное накопление уридин-нуклеотидов и подавление синтеза РНК. Антибиотик также подавляет клеточное деление и снижает содержание ДНК в растущих клетках.
Ряд авторов приходит к выводу, что основным процессом в механизме биологического действия новобиоцина является в первую
393
очередь подавление синтеза ДНК и в меньшей степени синтеза РНК. Подавление синтеза белка, роста культуры и увеличение проницаемости клеточной мембраны происходит на более поздней стадии биохимического воздействия новобноцина и, возможно, является вторичным процессом, связанным с нарушением синтеза ДНК. Первичным воздействием новобноцина на чувствительные бактерии является подавление синтеза ДНК-полимеразной системы.
Новобиоцин обладает способностью подавлять те процессы в клетках бактерий, которые связаны прежде всего с ионами магния, нарушает деятельность многих ферментов, для которых ионы магния служат кофактором. К числу магний-зависимых процессов относится деятельность синтеза нуклеиновых кислот, ферментов, участвующих в активации аминокислот, гликолитических ферментов, АТФ-аз и др. Связывание ионов магния новобиоцином выводит их из реакций обмена и создает тем самым дефицит этих ионов, в результате чего могут нарушиться функции клеточных мембран, стабилизация спиралей ДНК и другие процессы.
Новобйцин не оказывает действия на процессы, осуществляемые без участия ионов магния. Однако это предположение окончательно еще не доказано.
VI. АНТИБИОТИКИ — ИНГИБИТОРЫ ДЫХАНИЯ
Антимицины образуются определенными видами стрептоми-цетов, в том числе Streptomyces kitazawaensis, Str. blastomyceticus и некоторыми другими. Пристальное внимание привлекла их способность подавлять рост ряда грибов и, в первую очередь, фитопа-тогенных (Piricularia oryzae, Р. grisea).
Интерес к ним проявился после того, как была установлена способность этих антибиотиков ингибировать аэробное дыхание.
Антимицины имеют общую структурную формулу:
Антимицин Aji R—н-гексил (мол. масса—548)
Антимицин Ay R—н-бутил (мол. масса—520)
Антимицин А — мощный ингибитор окисления сукцината; подавляет активность сукцинатдегидрогеназы. Антибиотик действует на компонент дыхательной цепи, общей для сукцинатоксидазной и НАД-Нг-оксидазной систем.
Чувствительность к антимицину А обнаруживают лишь те дыха
394
тельные системы, которые чувствительны к цианиду (цитохромы Ь, с, Ci и а).
О л игом ицины (образуются актиномицетами) подавляют рост некоторых грибов. Они ингибируют отдельные этапы трансформации энергии, связанные с терминальными системами переноса электронов. Олигомицины ингибируют митохондриальную аденозинтрифосфатазу. Однако это, по-видимому, не прямое действие антибиотиков на фермент, а вторичный эффект. Эти антибиотики можно назвать ингибиторами митохондриального дыхания, так как они угнетают лишь аэробные организмы.
В основном эксперименты были проведены с интактными митохондриями.
П а т у л и н (синтезируется Penicillium и Aspergillus) обладает весьма широким спектром биологического действия — подавляет аэробное дыхание бактерий, грибов и фагоцитов. Непосредственное место приложения действия патулина и механизм его действия пока еще не установлены. Известно лишь, что терминальный перенос электронов представляет один из уязвимых участков.
VII. АНТИБИОТИКИ — ИНГИБИТОРЫ ОКИСЛИТЕЛЬНОГО
ФОСФОРИЛИРОВАНИЯ
Валиномицин образуется культурой Streptomyces fulvissi-mus. Антибиотик содержится в мицелии стрептомицета; экстрагируется из мицелия органическими растворителями (петролейным эфиром, метанолом, ацетоном).
Валиномицин подавляет рост грамположительных бактерий, особенно активен против кислотоустойчивых бацилл. Антибиотик обладает способностью разобщать окислительное фосфорилирование, не оказывая практически никакого влияния на потребление кислорода в присутствии АТФ, гексокиназы и глюкозы.
Процесс переноса электронов в присутствии валиномицина сопровождается выходом ионов водорода из митохондрий.
Способность валиномицина разобщать окислительное фосфорилирование зависит от наличия ионов калия. В присутствии антибиотика митохондрии поглощают большое количество ионов калия, в 104 раза больше, чем ионов натрия, так как валиномицин является мощным ионофором К+.
К ингибиторам окислительного фосфорилирования относятся также линейные грамицидины и другие антибиотики.
VIII. АНТИБИОТИКИ — АНТИМЕТАБОЛИТЫ
Антибиотические вещества — антиметаболиты впервые получены Коробковой с соавторами в 1970 г. при изучении актиномицетов. Вначале был выделен продуцент антибиотика — антагониста лейцина. Позднее Коробкова и другие обнаружили ряд культур актиномицетов, способных образовывать антибиотики — антагонисты ряда аминокислот и витаминов: Str. griseovariabilis штамм 1336
395
продуцирует антибиотик — антагонист аргинина и орнитина; Str. fumeus штамм 2989 — антагонист метионина; Str. globisporus штамм 46 — антагонист тиамина и метионина; Str. globisporus var. caucasicus штамм 3865 — антагонист аланина, глицина, метионина и витамина Be.
В 1973 г. Агре сообщила о том, что термофильный актиномицет Str. macrosporus также образует антибиотик — антиметаболит в отношении аргинина, лизина или гистидина.
Антиметаболитные свойства указанных актиномицетов состоят в том, что образуемые ими антибиотики подавляют развитие чувствительных организмов (бактерий, актиномицетов) лишь в том случае, если в среде отсутствует один из вышеуказанных метаболитов (аминокислота или витамин). Так, антибиотик, образуемый Str. griseovariabilis штамм 1336, подавляет развитие Е. coli, Bad. paracoli, но антимикробное действие антибиотика снимается в присутствии L-аргинина или DL-орнитина.
Интерес к группе антибиотиков — антиметаболитов в последние годы значительно возрос; к антиметаболитам относятся такие антибиотики как циклосерин, пуромицин, кардицин и некоторые другие.
К настоящему времени известно более 50 антибиотических веществ, обладающих антиметаболитными свойствами по отношению к аминокислотам, основаниям нуклеиновых кислот, витаминам.
IX. АНТИБИОТИКИ — ИММУНОДЕПРЕССАНТЫ
К веществам (стероиды, антиметаболиты), способным подавлять иммунологическую реактивность организма, относятся и некоторые антибиотические вещества, в том числе актиномицины С и D, оливомицин, брунеомицин, рубомицин и др.
Ценность этих соединений определяется тем, что они обладают в той или иной степени противоаллергическим эффектом.
УСТОЙЧИВОСТЬ МИКРООРГАНИЗМОВ
К ДЕЙСТВИЮ АНТИБИОТИКОВ
При воздействии ряда антибиотиков на чувствительные к ним микроорганизмы нередко возникают формы, устойчивые к их действию. Особенно быстрая адаптация наблюдается под влиянием стрептомицина и пенициллина. Так, например, для повышения устойчивости к стрептомицину у Bacterium carotovorum в 1000 раз (с 0,25 до 250 мкг/мл) потребовалось всего 16 пассажей, а для повышения устойчивости Xanthomonas vesicatoria в 3125 раз необходимо 22 пассажа в средах с постепенно возрастающими концентрациями антибиотика.
В связи с широким использованием антибиотиков в различных сферах практической деятельности возникновение устойчивых форм микробов приобретает важное теоретическое и еще больше практическое значение.
396
Рис. 62. Система дисков фильтровальной бумаги, пропитанных различными антибиотиками
в отношении воз-
Теоретический смысл изучения факторов приспособления микроорганизмов к антибиотикам определяется необходимостью выявления механизма этого явления, вскрытием причин адаптации микроорганизмов к новым условиям существования.
Практическое значение проблемы адаптации микробов к действию антибиотиков обусловлено тем, что появление резистентных форм in vivo при применении этих веществ в лечебной практике или в борьбе с фитопатогенными организмами может привести и приводит к существенному снижению лечебных свойств антибиотиков.
Поэтому применение антибиотиков в клинике и в особенности выбор того или иного препарата для назначения больному должны сочетаться с учетом эффективности антибиотика
будителя заболевания и индивидуальных особенностей больного. Для выяснения этого вопроса обычно используют диски бумаги, пропитанные антибиотиками (рис. 62). Диски накладывают на питательную агаровую пластинку, засеянную выделенным возбудителем, и после определения чувствительности выделенного организма к одному из антибиотиков последний следует назначать больному, разумеется, при условии, что препарат не противопоказан по каким-либо другим причинам. При применении дисков фильтровальной бумаги для определения чувствительности микроорганизмов к антибиотикам необходимо соблюдать стандартные условия постановки опытов и в первую очередь применять необходимый состав питательной среды и соответствующую концентрацию испытуемого антибиотика.
Возникновение форм, устойчивых к антибиотикам, делает проблему адаптации весьма важной.
Высказываются различные точки зрения на возможность появления из чувствительной к антибиотикам культуры микроорганизмов устойчивых форм. По мнению некоторых авторов, одним из факторов, определяющих развитие устойчивости микроорганизмов к антибиотикам, является мутационно-селекционный процесс. В основе этого механизма лежит селекция антибиотическими веществами мутантов, устойчивых к ним. Известно, что мутагенным свойством обладают некоторые антибиотики (стрептомицин, мицерин, азасерин и др.).
Однако вряд ли такой механизм появления устойчивости можно считать основным, так как процесс появления мутаций идет весьма медленно.
Известно, что спонтанные мутации возникают довольно редко, частота их составляет 1-Ю-4—1-10~10. Так, у микобактерий частота спонтанных мутаций, связанных с устойчивостью к антибиотикам, составляет 1 • 10“1—1-10“8. Кроме того, хромосомные мутанты
397
устойчивы обычно к одному или нескольким препаратам, имеющим близкое химическое строение и однотипный механизм биологического действия.
Имеются данные, объясняющие возможность появления форм, резистентных к антибиотикам, свойством гетерогенности культур микроорганизмов. В культуре микроба наряду с чувствительными клетками могут быть клетки, обладающие определенной устойчивостью к антибиотику. В этом случае антибиотическое вещество может выступать в роли фактора отбора устойчивых форм. Однако единой точки зрения, объясняющей механизм этого явления, нет. Одни авторы .указывают, что гетерогенность микробной культуры обусловлена частым появлением устойчивых к антибиотику мутантов. Другие авторы рассматривают явление гетерогенности в отношении некоторых производных пенициллина (метициллин, оксациллин) в качестве фенотипического фактора, определяемого условиями среды. Особое внимание в связи с этим уделяется механизму возникновения устойчивости, приобретенной к действию антибиотических препаратов.
Если обобщить имеющиеся сведения о причинах возникновения устойчивости микроорганизмов к антибиотикам, то можно указать следующие основные факторы:
1. Изменение свойства клеточной стенки задерживать антибиотик на поверхности клетки и препятствовать его проникновению внутрь.
2. Возможность клетки разрушать лекарственный препарат раньше, чем он сможет проявить биологическое действие, посредством конститутивных либо индуцируемых ферментов, усиленно синтезированных клеткой в присутствии антибиотика.
3. Изменение клеточных структур (например, рибосом), на которые действует антибиотическое вещество.
4. Способность клеток снижать концентрацию антибиотиков (например, тетрациклинов) внутри их путем усиления процесса выноса антибиотика.
5. Нарушение определенного звена в обмене веществ микробной клетки, отвечающего за чувствительность микроорганизма к антибиотику.
6. Передача фактора устойчивости (R-фактора) от одной клетки к другой.
Устойчивость микроорганизмов к антибиотикам в результате отсутствия реакций в цепи обмена, которые бы поражались препаратом, по-видимому, и определяет наиболее важный и часто встречающийся механизм резистентности.
Свойство клеточной стенки задерживать проникновение антибиотических веществ внутрь клетки иллюстрируется на примере пенициллиноустойчивых стафилококков. Количество антибиотика, связанного клетками, определяется степенью чувствительности бактерий —- чем чувствительнее организм, тем больше он связывает пенициллина.
Возможность образования веществ, разрушающих пенициллин,
398
свойственна многим штаммам стафилококков и особенно бактериям из рода Bacillus, образующим фермент пенициллиназу, а также фермент пенициллинамидазу, образуемый многими грамотрица-тельными бактериями.
Появление устойчивости к пенициллину у различных штаммов Вас. cereus связано с количеством образованной ими пенициллиназы (табл. 96).
Таблица 96
Отношение устойчивости к пенициллину и скорости синтеза пенициллиназы штаммами Bacillus cereus
(по Pollock, 1960)
Устойчивость к пенициллину*
0,01
0,30
3,00
Штамм
Скорость образования пенициллиназы (среднее число молекул, образованных клеткой)
5 (рсу птельский)........................
5/Р (мутант) ............................
5/В (мутант) ............................
15
9 500 75С00
* Максимальная концентрация пенициллина (ед/мл). позволяющая образовывать колонии в питательном агаре п® крайней мере от 50% выживших спор.
Повышение устойчивости к бензилпенициллину и ампициллину (полусинтетическому пенициллину) наблюдается у штаммов Е. coll, способных образовывать пенициллиназу.
Существует корреляция между количеством пенициллиназы, образуемой штаммами Е. coli, и степенью их устойчивости к пенициллинам.
Таким образом, можно с уверенностью считать, что устойчивость многих видов бактерий к пенициллину связана с образованием ими ферментов, разрушающих молекулу антибиотика (пенициллиназы или пенициллинамидазы, или того и другого вместе).
Позднее было показано, что образование пенициллиназы, например, у Staph, aureus детерминируется плазмидой, перенос которой от одной клетки стафилококка к другой способствует распространению устойчивости. В последнее время появились сообщения о том, что под действием R-плазмидных генов в клетках бактерий происходит кодирование белков, входящих во внешнюю мембрану, которые могут выполнять функцию поринов.
Вместе с тем механизм устойчивости бактерий к пенициллину связан не только с образованием ферментов, инактивирующих антибиотик, и их переносом от одной клетки к другой. В устойчивости бактериальных клеток к пенициллину заметную роль играют и другие механизмы.
Одним из факторов устойчивости микробных клеток к пенициллинам следует считать особенности их обмена, а также характер строения стенок бактерий. Например, стенки грамотрицательных
399
бактерий содержат жировое вещество, создающее определенный барьер проницаемости для антибиотика.
Факторы устойчивости микроорганизмов к антибиотикам впервые были обнаружены на примере Shigella в 1957 г. японскими исследователями. Позднее было установлено, что устойчивость штаммов бактерий к лекарственным препаратам определяется наличием плазмид1, передаваемых при конъюгации.
Фактор устойчивости (R-фактор)2— комплекс генов, часть из них ответственна за устойчивость к одному антибиотику, например гентамицину, другие определяют устойчивость к другому антибиотику (стрептомицину), третьи — облегчают «заражение» фактором устойчивости одной микробной клетки от другой.
Еще 30 лет назад «инфекционная» устойчивость к антибиотикам встречалась редко. Но уже к 1965 г. до 60—70% всех широко распространенных бактерий кишечной группы были носителями R-фак-торов и проявляли устойчивость к трем или большему числу антибиотиков, Более того, R-факторы обладают свойством сообщать устойчивость одновременно к нескольким химически различным препаратам, например к сульфонамиду, пенициллину и стрептомицину.
В настоящее время в результате широкого применения химиотерапевтических средств происходит повсеместное распространение R-факторов, так как они обладают мощными селекционными преимуществами, связанными со способностью придавать устойчивость одновременно ко многим (до восьми) лекарственным препаратам. Поэтому с прекращением использования на практике того или иного лекарственного препарата снижается и возможность появления устойчивых к нему форм бактерий.
Устойчивость бактерий к антибиотикам, обусловленная R-фак-торами, обнаруживается не только у микроорганизмов, выделенных из животных, от больных людей, но и из природных мест обитания (загрязненных рек). Отмечается, однако, что природные штаммы бактерий передают свои плазмиды с очень низкой частотой.
Наряду с плазмидами, ответственными за устойчивость бактерий к антибиотикам, в бактериальных клетках имеются так называемые мигрирующие элементы, одни из которых — транспозоны — сложные структуры, иногда содержащие дополнительные гены, связанные с резистентностью к антибиотикам.
Весьма интересно мнение ряда авторов о том, что сами продуценты многих антибиотиков способны служить источниками генов резистентности, передавая их с помощью различных механизмов другим микроорганизмам, в том числе и патогенным.
Приведенные данные подтверждают, что явление возникновения
1 Плазмида — генетический элемент, существующий во внехромосомном (автономном) состоянии.
2 R-фактор — от английского слова resistance.
400
устойчивости бактерий к антибиотикам — сложный и многоплановый механизм.
Большой фактический материал свидетельствует, что организмы, приобретшие устойчивость к одному из антибиотиков, могут оставаться чувствительными к действию других препаратов. Такое явление наблюдается в отношении антибиотиков, обладающих различным механизмом действия: пенициллиноустойчивые бактерии оказываются чувствительными к действию стрептомицина; стрептомициноустойчивые формы подавляются неомицином, хлортетрацик-лином и полимиксином; формы, резистентные к пенициллину и стрептомицину, восприимчивы к действию новобиоцина и т. д. Следовательно, антибиотики, отличающиеся химическим составом и образуемые различными видами микробов, обладают разным механизмом биологического действия. Отличие в биохимической активности антибиотических веществ широко используется в химиотерапии: для предупреждения возникновения устойчивых форм применяют одновременно два или более антибиотика.
Однако бывают случаи, когда микробы, приобретшие устойчивость к одному из антибиотиков, становятся резистентными к действию других препаратов. Это — перекрестная устойчивость, отмеченная для таких антибиотиков, как хлорамфеникол и тетрациклины, для всех пенициллинов, полученных биосинтетическим путем, и некоторых других биологически активных веществ.
Наличие перекрестной устойчивости у отдельных видов микроорганизмов в отношении различных антибиотиков указывает на то, что механизм биологического действия этих веществ идентичен. Как правило, явление перекрестной устойчивости микробов обнаруживается у антибиотиков, близких по химическому составу, хотя имеются и исключения, например хлорамфеникол и тетрациклины.
Нередко при концентрациях некоторых антибиотиков, значительно превышающих минимальные бактериостатические, не происходит остановки роста всех клеток чувствительного к антибиотику микроорганизма. Часть клеток при этом способна расти, размножаться, наблюдается увеличение числа клеток и биомассы. В этом случае говорят о явлении «остаточного роста».
«Остаточный рост» не обусловлен возникновением устойчивых мутантов или популяционными сдвигами в сторону менее чувствительных клеток, а связан с медленным размножением большой части популяции. В этих условиях продолжают идти процессы, непосредственно не затрагиваемые антибиотиками (синтез полисахаридов, липидов).
Известно, что антибиотики (хлортетрациклин, хлорамфеникол, эритромицин и др.), обладающие способностью подавлять белковый синтез, ингибируют этот процесс в клетках на уровне рибосом. Однако при относительно высоких концентрациях этих антибиотиков полного подавления синтеза белка не происходит; «остаточный синтез» белка составляет от 2 до 10%.
В последние годы появилось сообщение о том, что синтез неко
401
торых белков, в частности цитохромов а и Ь, по-видимому, локализованных в цитоплазматической мембране, устойчив к действию хлортетрациклина, хлорамфеникола и других антибиотиков, подавляющих синтез белка.
По всей вероятности, одной из причин «остаточного роста» чувствительных микроорганизмов в присутствии высоких концентраций антибиотиков, обладающих способностью подавлять белковый синтез, может быть наличие «остаточного синтеза» белка в клетках.
ПУТИ ПРИМЕНЕНИЯ АНТИБИОТИКОВ, СДЕРЖИВАЮЩИЕ ВОЗНИКНОВЕНИЕ УСТОЙЧИВЫХ К НИМ ФОРМ МИКРООРГАНИЗМОВ
В медицинской практике в целях борьбы с возникновением форм микроорганизмов, устойчивых к используемым антибиотикам, наметились в последнее время следующие тенденции:
1. Резкое сокращение использования антибиотиков в качестве профилактических средств.
2. Повышение лечебных доз антибиотика. Однако это делать необходимо очень осторожно. В целях создания в очаге поражения высоких концентраций антибиотиков их вводят непосредственно в эти очаги (внутриплевральное, внутрисуставное, внутричерепное, внутрисосудистое и т. п.).
3. Применение антибиотиков в сочетании с другими препаратами.
Использование антибиотиков в сочетании с сульфонамидами, нитрофуранами, гормонами, а также с некоторыми другими биологически активными веществами (продигиозин, лизоцим, у-глобулин и др.) способствует повышению их физиологического эффекта. Повышение эффективности антибиотиков в терапии достигается также совместным применением их с ферментами, в частности с протеаза-ми. Так, химотрипсин резко усиливает антимикробное действие мономицина в отношении патогенных штаммов стафилококка и кишечной палочки. Предварительное внутримышечное введение животным (крысы) трипсина и химотрипсина в дозе 10 мг/кг вызывает повышение концентрации пенициллинов (бензилпенициллин, ампициллин и оксациллин) в организме животных.
При лечении сифилиса целесообразно использовать пенициллин в сочетании с препаратами висмута, кобальта, а также с методами неспецифической терапии (пирогенные препараты, оксигенотера-ция). Хорошие результаты дает применение пенициллина с висмутом в сочетании с иммуностимулирующими веществами (продигио-зан, коамид).
Все это заметно повышает результативность пенициллинотерапии.
Основные белки, протамины, гистоны и некоторые другие биологически активные соединения (этилендиаминтетраацетат, лизоцим) при совместном применении с антибиотиками (стрептомицином,
402
хлорамфениколом, тетрациклином, эритромицином) способны повышать чувствительность штамма Е. coli, Staph, aureus к антибиотическим веществам и ингибировать передачу лекарственной устойчивости при конъюгации.
Применение антибиотиков в смеси с полимерами или получение модификаций антибиотических веществ в результате химического присоединения их к полимерным материалам также способствует увеличению продолжительности биологического действия антибиотиков в организме человека, уменьшению их токсичности, улучшению растворимости, повышению устойчивости к действию ферментов.
При внутривенном введении аурантина в физиологическом растворе содержание его в организме обнаруживается в течение 3 ч. Но если этот антибиотик ввести в 2 %-ном растворе поливинилпир-ролидона, то время содержания антибиотика в организме увеличивается в 56 раз и достигает 7 сут.
Одновременное введение стрептомицина и мономицина с поли-винилпирролидоном или полимиксина В, стрептомицина, неомицина с гепарином существенно снижает их токсичность.
Полимерные производные бензилпенициллина обладают устойчивостью к пенициллиназе.
Эффект пролонгирующего действия полимера на антибиотик зависит как от молекулярной массы полимера, так и от химической природы антибиотического вещества.
В целях повышения эффективности антибиотикотерапии в медицинской практике применяют комбинации антибиотиков, обладающих различными механизмами биологического действия. В медицинской практике широко используются сочетания пенициллина со стрептомицином (стрептомициллин), олеандомицина с тетрациклином (олететрин, сигмамицин) и др. Комбинированные антибиотики применяют и в том случае, если препарат имеет высокую биологическую активность, но вызывает нежелательные побочные реакции.
При одновременном применении нескольких антибиотиков могут наблюдаться четыре формы действия используемых комбинаций в отношении микроорганизмов: индифферентная, аддитивная, синергидная и антагонистическая.
Индифферентность совместного биологического действия антибиотиков характеризуется тем, что биохимический эффект каждого из применяемых антибиотических веществ проявляется независимо один от другого.
Аддитивное действие (addito (лат.)—прибавление). При комбинированном применении антибиотиков наблюдается суммарный эффект каждого из используемых препаратов (арифметическое сложение действия препаратов). При аддитивном характере действия антибиотики блокируют (нарушают) в цепи метаболизма чувствительного организма одни и те же реакции.
Синергидное действие (synergeia (гр.)—содружество). При совместном применении ряда антибиотиков происходит усиление антимикробного эффекта по сравнению с суммой биологических
403
действий отдельно взятых препаратов. Синергидное действие антибиотиков проявляется в том случае, если препараты способны одновременно поражать важные реакции метаболизма клетки или же если один из антибиотиков своим действием обеспечивает (способствует) повышение проницаемости в клетку другого антибиотика.
Синергидное действие проявляется при сочетании различных антибиотиков. Так, совместное применение пенициллина и стрептомицина повышает скорость гибели ряда микроорганизмов, в том числе и энтерококков. Синергидное действие этих антибиотиков связано с тем, что в результате действия пенициллина происходит повреждение клеточной стенки микроорганизмов, что, в свою очередь, облегчает проникновение стрептомицина в клетки.
Эффективной оказалась комбинация тетрациклинов и стрептомицина при лечении острого и хронического бруцеллеза.
Высокий эффект обнаруживается при совместном применении олеандомицина и окситетрациклина. Синергидным действием обладают многие другие сочетания антибиотиков.
Антагонизм антибиотиков. Антибиотический эффект комбинации препаратов может уменьшаться по сравнению с действием любого отдельно взятого антибиотика. Такое явление может произойти в том случае, если один из компонентов раньше, чем другой, блокирует или подавляет одну из менее важных реакций общей цепи обмена веществ организма. Антагонизм хлортетрациклина, окситетрациклина и хлорамфеникола к пенициллину in vitro и in vivo проявляется в отношении стрептококка группы А и палочки Фридлендера.
Это, по-видпмому, связано с тем, что в присутствии, например, тетрациклиновых антибиотиков бактерии перестают размножаться (эти вещества подавляют главным образом белковый синтез), благодаря чему приостанавливается действие пенициллина, который специфически подавляет синтез клеточной стенки. Однако синтез компонентов клеточной стенки происходит лишь в растущей культуре.
Вместе с тем, как отмечает Нейман (см. ж. Антибиотики и мед. биотехнология, 1986, 2, с. 156), хлорамфеникол в сочетании с пенициллином, может проявлять синергидное действие в отношении стафилококков, образующих р-л актамазы. Такое действие связано с тем, что хлорамфеникол способен подавлять секрецию лактамаз клетками стафилококков.
Возможные результаты совместного применения, например, двух антибиотиков (А и Б) можно выразить обобщенно.
Индифферентное действие: А и Б равняется биологической активности А или Б.
Аддитивный эффект: АиБ равно сумме биологических активностей используемых антибиотиков (А + Б).
Синергидное действие: АиБ больше суммы биологических активностей (А+Б).
404
Антагонистичный эффект: А и Б меньше биологического действия А или Б.
4. Применение ингибиторов ферментов, инактивирующих антибиотики, — один из методов борьбы с устойчивыми к антибиотикам формами микроорганизмов.
Культура Streptomyces fulvoviridis образует вещество, обладающее свойством ингибировать пенициллиназу. Добавляя ингибитор пенициллиназы к пенициллину, мы ликвидируем возможность чувствительного микроорганизма, способного образовывать пенициллиназу, разрушать антибиотик.
В последнее время на практике широко применяются ингибиторы р-лактамаз с антибиотиками, относящимися к группе 0-лак-таматов.
ПОБОЧНЫЕ РЕАКЦИИ, ВОЗНИКАЮЩИЕ
ПРИ ПРИМЕНЕНИИ АНТИБИОТИКОВ
Антибиотики нашли весьма широкое применение в медицинской практике в качестве химиотерапевтических веществ. Незаменимы они при лечении почти всех инфекционных и многих других, часто тяжелых, заболеваний.
В последние годы наряду с применением природных антибиотиков все большее значение приобретают полусинтетические препараты, полученные в результате химической модификации основных структур антибиотиков. Среди них ценными оказались полусинтетические пенициллины (оксациллин, диклоксациллин, карбенициллин и др.), полусинтетические производные цефалоспорина (цефалотин, цефалоридин, цефазолин и некоторые другие). С успехом применяются в медицинской практике смеси антибиотиков, различные препараты пролонгированного действия и т. д.
Наиболее активно используются в настоящее время более 90 антибиотиков, а вместе с их производными (полусинтетические, комбинированные препараты) — около 200.
Широкое и активное применение антибиотиков в качестве химиотерапевтических веществ на протяжении более 40 лет способствовало накоплению экспериментального материала о побочных реакциях, вызываемых ими. По ходу рассмотрения отдельных антибиотиков мы кратко останавливались на тех побочных реакциях, которые могут появиться при их применении в медицинской практике. Здесь рассмотрим обобщенные данные по некоторым негативным реакциям, которые наблюдаются при антибиотикотерапии.
Кассирский и Милевская еще в 1966 г. указали на три основные группы побочных реакций при применении антибиотиков: аллергические, токсические и обусловленные специфическим действием антибиотических веществ (табл. 97).
Аллергические реакции — наиболее частое проявление побочного действия антибиотиков. Эти реакции наблюдаются при применении практически всех антибиотиков. Однако наиболее часто они возникают при применении антибиотиков пенициллиновой группы.
405
Таблица 97
Побочные реакции при терапии антибиотиками
(по Кассирскому и Милевской, 1966)*
Реакции
Реакции и механизм их возникновения опасные для жизни ие опасные для жизни
Аллергические реакции. Развиваются как осложнение на аллерген (антибиотик); возникновение не зависит от дозы введенного антибиотика; могут последовать за первым введением антибиотика, сенсибилизация нарастает при повторных курсах лечения Токсические реакции Возникновение связано с органотропным фармакодинамическим действием антибиотиков. Степень выраженности зависит от продолжительности лечения и дозы препарата Дисбактериозы и другие явления, связанные с химиотерапевтическим действием антибиотиков Анафилактический шок, ангиноневротический отек гортани Токсическое действие на кровь. Агранулоцитоз, ап пластическая анемия Генерализованный кан-дидосепсис. Стафилококковые энтероколиты, вторичные пневмонии , вызываемые грамотрицательными микроорганизмами Кожный зуд, крапивница, сыпь, астматические приступы, реиит, конъюнктивит, эозинофилия Поражение VIII пары черепно-мозговых нервов , периферических нервов. Нефротокси- ческое действие; тошнота , рвота, понос Местные кандидозы—молочница и др;
• Таблица заимствована из работы Навашнна и др. (1977) (ж. Антибиотики, 1979, 22, 9, с, 781).
Токсические реакции характерны для многих групп антибиотиков. Аминогликозиды (стрептомицин, неомицин, мономицин) обладают относительно высокой токсичностью. Такие антибиотики, как хлорамфеникол, группа ванкомицина — ристомицина и некоторые другие, проявляют токсическое действие, связанное с кроветворением. Тетрациклиновые антибиотики, макролиды проявляют гепатоксическое действие.
Осложнения, связанные со специфическим антимикробным действием антибиотиков, происходят в результате нарушения равновесных экосистем организма человека. С этим связаны появление дисбактериозов и нарушение витаминного баланса организма, вторичные инфекции, вызываемые резистентными к антибиотикам формами возбудителей.
В целях уменьшения числа серьезных побочных реакций, вызываемых антибиотическими веществами, необходимо строго соблю
406
дать оправдавшие себя основные принципы рационального применения антибиотиков, заменять препараты, обладающие токсичным действием, менее токсичными.
Рациональная и безопасная антибиотикотерапия предусматривает всесторонний учет свойств антибиотических веществ, применяемых на практике, особенностей микроорганизма, вызывающего заболевание, и организма больного.
Основной путь предупреждения побочного действия антибиотиков связан с применением рациональной антибиотикотерапии, которая, по мнению Бабаяна (1977), определяется тремя основными факторами: 1) выбором препарата с учетом его фармакологических свойств и спектра действия; 2) выделением, идентификацией и определением чувствительности бактериальной флоры к антибиотику; 3) выявлением или предупреждением повышенной чувствительности больных к выбранному антибиотику.
При применении антибиотиков в качестве лечебных препаратов необходимо, как уже отмечалось, учитывать индивидуальные особенности больного. Игнорирование этого важнейшего правила приводит в отдельных случаях к различным нежелательным последствиям, связанным с тяжелыми побочными явлениями.
Подробное изучение всех характеристик антибиотических веществ, применяемых на практике, выяснение путей возникновения возможных побочных реакций позволит смелее и увереннее с большим успехом использовать эти биологически активные вещества в медицинской практике.
Н
ОСНОВНЫЕ ЭТАПЫ
I I ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ
Глава АНТИБИОТИКОВ
ОБЩИЕ СВЕДЕНИЯ О ПРОИЗВОДСТВЕ АНТИБИОТИКОВ
После установления высоких лечебных свойств первого антибиотика — пенициллина сразу же возникла задача организации производства его в больших количествах.
На первом этапе промышленное получение этого препарата носило примитивный, экономически нерентабельный характер. Выращивание продуцента антибиотика осуществлялось на средах, находящихся в небольших сосудах (матрацы, молочные бутылки, колбы и др-), при поверхностном культивировании гриба. Процесс развития гриба продолжался 8—10 сут. Такой способ культивирования гриба при большой затрате труда давал весьма низкий выход антибиотика, и себестоимость препарата была соответственно очень высокой. Безусловно, такое получение антибиотика не могло удовлетворить всевозрастающие запросы медицины. В результате поисков путей наиболее рационального способа производства антибиотика был предложен метод глубинного выращивания гриба в специальных емкостях — ферментерах или танках — при продувании воздуха и перемешивании культуральной жидкости.
Производство антибиотиков — хорошо развитая отрасль, входящая в фармацевтическую (в СССР медицинскую) промышленность. В настоящее время она занимает одно из ведущих мест в производстве лекарственных препаратов. В ряде стран (США, Япония, Англия, Франция и др.) производство антибиотических веществ — одна из прибыльных отраслей химико-фармацевтической промышленности. Так, например, в США ежегодно выпускается антибиотиков и их производных на сумму более 400 млн. долларов.
Огромный спрос на антибиотические препараты со стороны медицины, сельского хозяйства и пищевой промышленности способствовал усиленному росту поисков новых антибиотиков и получению их в промышленных масштабах.
Если в начале 40-х годов мировая промышленность выпускала всего лишь 2—3 антибиотика, то теперь это число превышает 200 названий.
408
Таблица 98
Производство антибиотиков в США в 1948—1961 гг. (по Goldberg, 1959, и Збигневу Котуля, 1963)
Производство, т
Антибиотик
Пенициллин . . .
Стрептомицин . .
Дигидрострептомицин . . . .
Неомицин .... Тетрациклин . . Антибиотики широкого спектра действия . . .
Антибиотики, применяемые в ветеринарии и с кормами . . .
Антибиотики, применяемые в медицине ....
1943
0,013
1,7*
1950 1951 1952 1953 1954 1955 1956 1957 1958
195 284 304 342 286 206 285 346 315
21 18 23 57 64 70 59 90 78
72 1143 153 138 202 167 223 264 54
— — — — 7 7 8 11 —
— — — — — —- 100 184 —•
100 139 193 200 271 283 216 211 —
— 107 117 197 217 236 253 394 —
388 584 673 737 830 733 891 1076 1250
1959
213
139
300
635
1035
257
127
1960
1961
299
274
390
286
178
130
356
544
1260
• Сведения 1946 г.
Одновременно с ростом числа новых антибиотиков быстро росло промышленное производство ценных препаратов (табл. 98) и снижалась их стоимость (табл. 99).
Таблица 99
Цены i-a антибиотики в США в 1943—1960 гг.
(по Збигневу Котули, 1963, и Воеводину, 1963)
Антибиотик Цена в долларах
1943 г. 1944 г. 1948 г. 1952 г. 1954 г. 1958 г. 1959 г. 1960 г.
Пенициллин (за 1 млн. ед.) 18 4,99 0,3 0,15 0,08 0,05 0,03 0,02
Стрептомицин (за 1 г основания) 15,00 0,15 0,08 0,03 0.03
Антибиотики широкого спектра* (за 16 капсул по 250 мг) — — — 5,10 5,10 5,10 5.10 5,10
* Хлортетрациклин, окситетрациклии, хлорамфеникол, а с 1954 г. н тетрациклин.
При массовом промышленном выпуске пенициллина стоимость его в 1960 г. снизилась в США до 0,02 доллара за 1 млн. ед. против 18 долларов в 1943 г., т. е. за 17 лет снизилась в 900 раз. Аналогич
409
ные данные имеются и в отношении других антибиотиков. Так, 1 г основания стрептомицина в 1944 г. в США стоил 15 долларов, а уже в 1959 г. — 0,03 доллара.
Количество выпускаемого пенициллина с 13 кг в 1943 г. возросло в 1979 г. до 14 800 т (Lowe and Elander, 1983). Как отмечает Спалла (Spalla, 1978), более 92 фирм мира осуществляют производство антибиотиков. В последнее время ежегодно производится 25 тыс. т антибиотиков, в том числе: 17 тыс. т пенициллинов, 5 тыс. т тетрациклинов, 1200 т цефалоспоринов, 800 т эритромицинов и 1000 т других антибиотиков (Kieslich, 1984).
В 1960 г. более 30% всех антибиотиков, выпускаемых в США, использовалось в ветеринарии и в сельском хозяйстве в качестве добавок к корму животным.
В Советском Союзе выпуск антибиотических веществ увеличивается из года в год; по производству антибиотиков мы занимаем одно из ведущих мест в мире.
Описанию разнообразных и сложных процессов, связанных с промышленным получением антибиотиков, различных аппаратов и приборов, рассмотрению отдельных этапов технологии производства антибиотических веществ посвящен ряд книг, в том числе «Производство антибиотиков», написанная группой авторов под редакцией С. М. Навашина и др. (1970).
Поэтому здесь мы рассмотрим лишь наиболее принципиальные и общие вопросы, связанные с производством антибиотиков.
Успехи антибиотической отрасли промышленности и качество выпускаемой продукции определяются уровнем основных стадий технологического процесса. Современное промышленное получение антибиотиков — это сложная многоступенчатая биотехнологическая система, состоящая из ряда последовательных стадий.
1. Стадия биосинтеза (образования) антибиотика. Это основная биологическая стадия сложного процесса получения антибиотического вещества. Главная задача на этой стадии — создание оптимальных условий для развития продуцента и максимально возможного биосинтеза антибиотика.
Высокая результативность стадии зависит от уровня биосинтетической активности продуцента антибиотика, времени его максимального накопления, стоимости сред для культивирования организма, в том числе стоимости применяемых предшественников, а также общих энергетических затрат на процессы, связанные с развитием продуцента антибиотического вещества.
2. Стадия предварительной обработки культуральной жидкости, клеток (мицелия) микроорганизма и фильтрации (отделения культуральной жидкости от биомассы продуцента). Эффективность стадии во многом определяется составом среды для выращивания продуцента антибиотика, характером его роста, местом основного накопления биологически активного вещества (в культуральной жидкости или внутриклеточно).
3. Стадия выделения и очистки антибиотика. На этой стадии в зависимости от свойств антибиотика, его химического строения
410
и основного места накопления антибиотического вещества применяются различные методы выделения и очистки. В качестве основных методов используются следующие: экстракция, осаждение, сорбция на ионообменных материалах, упаривание, сушка.
Особенность этой технологической стадии определяется тем, что на первом этапе работы приходится иметь дело с небольшой концентрацией (не более 1%) антибиотика в обрабатываемом растворе, тогда как на последующих этапах концентрация антибиотического вещества увеличивается до 20—30%. Все это требует применения различных емкостей и различных объемов используемых реагентов.
4. Стадия получения готовой продукции, изготовление лекарственных форм, расфасовка. Особенность стадии определяется очень высокими требованиями к качеству конечного продукта. При химической очистке антибиотических веществ необходимо соблюдать высокую чистоту помещений, оборудования, проводить систематическую дезинфекцию их. В случае выпуска антибиотиков, предназначенных для инъекций, препараты должны быть стерильными: получение таких антибиотических препаратов, приготовление различных лекарственных форм, дозировка (расфасовка) и упаковка должны осуществляться в асептических условиях. В основу принципа расфасовки необходимо положить запросы медицинских работников, связанные с удобством применения антибиотиков на практике.
В современных условиях производства антибиотиков необходимо принимать меры к максимальному снижению себестоимости препаратов. Резервы для этого имеются — это интенсификация всех стадий технологического процесса и прежде всего повышение эффективности первой стадии — процесса биосинтеза антибиотического вещества. Для этого необходимо:
а) внедрение в производство наиболее высокопродуктивных штаммов микроорганизмов — продуцентов антибиотиков;
б) создание и обеспечение самых благоприятных условий развития продуцента антибиотика на относительно дешевых средах;
в) широкое использование математич;ских методов планирования процесса развития организма и электронно-вычислительной техники с целью оптимизации и моделирования условий его культивирования, обеспечивающих максимальный выход антибиотика;
г) применение современного оборудования на всех стадиях технологического процесса с автоматизированными контролирующими устройствами основных параметров развития организма и стадий биосинтеза антибиотика.
Указанные факторы в сочетании с научной организацией труда обеспечат снижение себестоимости выпускаемых антибиотиков.
Вместе с этим необходимы повышение качества выпускаемых антибиотиков, их стандартизация.
411
МЕТОДЫ КУЛЬТИВИРОВАНИЯ ПРОДУЦЕНТОВ АНТИБИОТИКОВ
В современных условиях наиболее перспективным методом выращивания микроорганизмов — продуцентов антибиотиков или других биологически активных соединений признан метод глубинного культивирования. Метод состоит в том, что микроорганизм развивается в толще жидкой питательной среды, через которую непрерывно пропускается стерильный воздух, и среда перемешивается.
Можно указать четыре основные модификации глубинного способа выращивания микроорганизмов.
1. Периодическое культивирование. При этом способе весь процесс развития микроорганизмов полностью завершается в одном ферментере, после чего ферментер освобождается от культуральной жидкости, тщательно промывается, стерилизуется и вновь заполняется свежей питательной средой. Среда засевается изучаемым микроорганизмом, и процесс возобновляется.
2. Отъемный метод. Культивирование микроорганизмов осуществляется в ферментерах с периодическим отбором части объема культуральной жидкости (от 30 до 60% общего объема). Объем культуральной жидкости в ферментере при этом доводится свежей питательной средой до исходного уровня.
3. Батарейный способ. Развитие микроорганизмов проходит в ряду последовательно соединенных ферментеров. Культуральная жидкость на определенной стадии развития микроорганизма перекачивается из первого ферментера во второй, затем из второго — в третий и т. д.
Освобожденный ферментер немедленно заполняется свежей питательной средой, засеянной микроорганизмом. При этом способе выращивания микроорганизмов происходит более рациональное использование емкостей.
4. Непрерывное культивирование. Метод принципиально отличен от указанных модификаций глубинного культивирования продуцентов антибиотиков.
В основе этого метода лежит то, что развитие микроорганизма происходит в условиях непрерывного протока питательной среды, что позволяет поддерживать развитие микроорганизма на определенной стадии его роста. Стадия развития микроорганизма определяется исходя из наиболее выгодного для максимального биосинтеза антибиотика или другого биологически активного соединения.
ФЕРМЕНТЕРЫ
Для изучения условий образования антибиотиков и производства этих биологически активных веществ в промышленных масштабах применяются ферментеры — специальные герметически закрытые емкости, обеспечивающие глубинное выращивание продуцентов антибиотиков.
412
Ферментер — это довольно сложный аппарат, в котором создаются хорошие условия для глубинного развития продуцента и биосинтеза им антибиотика. В этих целях ферментер снабжен приспособлениями для достаточной аэрации и перемешивания культуры, поддержания необходимой температуры, а также контрольно-измерительными приборами (рис. 63).
Аэрирование культуры происходит в результате подачи стерильного подогретого до необходимой температуры воздуха через специальные приспособления — барботеры и перемешивания культуральной жидкости различного типа мешалками (пропеллерными, турбинными и др.), а также использования отбойников.
Повышение аэрации культуры в ферментере может быть достигнуто в результате применения мешалок новых конструкций. Такие мешалки во время работы засасывают воздух, который затем струями выталкивается вместе с культуральной жидко
стью на поверхность среды. При этом происходит большее растворение воздуха благодаря его лучшему
диспергированию в среде. .
Поддержание температуры, оптимальной для хорошего роста продуцента антибиотика и проявления им повышенной физиолого-биохимиче-
Рис. 63. Ферментер емкостью 50 мэ (по Былинкиной, 1970):
1 — корпус аппарата, 2 — теплообменник. 3 — гнльза для термометра, 4 — барботер, 5 — растяжки для центровки вала, 6—вал мешалки, 7 — лопасть мешалки, 8— стойка ферментера, 5 — соединительная муфта вала, 10 — привод мешалки, 11— мотор
ской активности, обеспечивается ру-
башкой ферментера или системой змеевиков. Змеевики используют-
ся также для подачи пара в процессе стерилизации или воды для охлаждения.
Наблюдение за основными процессами жизнедеятельности организма осуществляется контрольно-измерительной аппаратурой. Это позволяет поддерживать на заданном уровне температуру внутри ферментера, pH среды, количество пропускаемого воздуха, давление внутри ферментера и другие параметры. Применяются
установки, позволяющие автоматически определять содержание азота в среде по ходу развития организма. Ферментеры снабжены приспособлениями для переноса инокулята, внесения дбполнитель-
413
ных питательных веществ, необходимых для лучшего развития культуры, пеногасителя и устройством для взятия проб.
В современных ферментерах контрольно-измерительная аппаратура соединена с электронно-вычислительной машиной, что позволяет автоматически контролировать весь биосинтетический процесс по заданной программе.
В зависимости от характера проводимых работ используются различного типа ферментеры: лабораторные, полупроизводствен-ные, производственные.
Лабораторные ферментеры изготовляются из стекла или нержавеющей стали и имеют, как правило, емкость не более 30 л. Обычно стерилизацию таких ферментеров производят в автоклавах. Питательную среду, как правило, стерилизуют отдельно, а затем переносят в стерильный ферментер.
Полупроизводственные ферментеры имеют емкость 100 л, выполнены из нержавеющей стали.
Производственные ферментеры. В промышленных условиях получения антибиотиков применяют ферментеры различной емкости — от 500 л до 50 и 100 м3.
Стерилизация полупроизводственных и производственных ферментеров, а также всех обслуживающих их коммуникаций осуществляется перегретым паром. Воздух, необходимый для аэрации, стерилизуется путем фильтрации через специальные фильтры, заполненные стеклянной ватой или активированным древесным углем.
Использование волокнистых фильтров (типа стеклянной ваты) — широко распространенный и экономически наиболее выгодный механический способ стерилизации воздуха, причем чем меньший диаметр имеют волокна материала, тем лучше их фильтрующая способность.
Интересно, что проникновение в фильтр бактериальных клеток или спор, перемещающихся с воздушным потоком, зависит от скорости движения воздуха. Проникновение увеличивается с увеличением скорости воздуха и достигает максимума в границах 10— 25 см/с (в зависимости от плотности упаковки фильтра); при дальнейшем увеличении скорости движения воздуха проникновение частиц уменьшается.
СТЕРИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД
Для каждого продуцента антибиотика разрабатывается оптимальная питательная среда. Среда должна соответствовать определенным требованиям: а) обеспечивать максимальное образование антибиотика, б) состоять из относительно дешевых компонентов, в) иметь хорошую фильтрующую способность и г) обеспечивать применение наиболее экономичных приемов выделения и очистки антибиотиков.
Стерилизация питательных сред в промышленных условиях
414
осуществляется двумя основными методами: периодическим и непрерывным.
Периодический метод стерилизации применяется при использовании небольших объемов среды и состоит в том, что среда нагревается до определенной температуры (120—130°С) непосредственно в ферментерах или в специальных котлах-стерилизаторах, выдерживается при этой температуре в течение 30—60 мин (в зависимости от объема среды и ее состава), после чего охлаждается до 27—30°С.
За время, затрачиваемое на нагрев среды до температуры, необходимой для стерилизации, и ее охлаждение, происходит разрушение значительного числа микроорганизмов. Хорошо известно, что для нагревания до температуры стерилизации больших объемов среды и затем ее охлаждения требуется больше времени, чем для маленьких объемов, а поэтому время, затрачиваемое на поддержание наиболее высокой стерилизующей температуры в больших объемах, может быть меньшим, чем для небольшие объемов с тем же эффектом стерилизации (табл. 100).
Таблица 100
Длительность экспозиции при наивысшей температуре стерилизации различных объемов среды
(по Deindoerfer, 1957)
Размер ферментера, л Длительность экспозиции, мин Размер ферментера. л Длительность экспозиции, мин
при температуре 105°С при температуре 121 °C при температуре 105' С при температуре 12 ГС
230 28,0 17,5 9 800 41,3 11,3
980 33,7 12,5 98000 51.5 8,8
Наилучший эффект стерилизации и сохранения, термолабильных веществ среды получается в том случае, если'стерилизация проводится при более высокой температуре и за более короткое время.
Непрерывный метод стерилизации целесообразно применять при использовании больших объемов среды. Приготовленная среда из специального сосуда с помощью насоса подается в стерилизационную колонку, через которую пропускается острый пар (давление пара около 5 атм). Пар подается сверху по внутренней трубе, имеющей щелевидные прорези, благодаря чему пар поступает в среду и происходит быстрый ее нагрев. Среда в колонку подается снизу и движется по спирали вокруг внутренней трубы.
Среда, нагретая в колонке до необходимой для стерилизации температуры (около 130°), поступает в специальный аппарат (вы-держиватель), где она выдерживается определенное время при температуре 125—130°С. Время выдержки зависит от состава среды и составляет 5—10 мин. Из выдерживателя стерильная среда
415
поступает в змеевиковый холодильник, охлаждается до 30—35°С (на выходе) и поступает в ферментер.
Непрерывный метод стерилизации имеет ряд преимуществ: возможность автоматического регулирования процесса, быстрый и равномерный нагрев среды, обеспечение более полной стерильности среды и др.
При применении в качестве отдельных компонентов субстрата термолабильных веществ их, как правило, следует стерилизовать отдельно в условиях более мягкого режима.
ПОДГОТОВКА ПОСЕВНОГО МАТЕРИАЛА
Подготовка посевного материала — одна из ответственнейших операций в цикле биотехнологического метода получения антибиотиков. От количества и качества посевного материала зависит как развитие культуры в ферментере, так и биосинтез антибиотика. Продуцент антибиотика обычно выращивается на богатых по составу натуральных средах, способных обеспечить наивысшую физиологическую активность микроорганизмов. Подготовка посевного материала — процесс многоступенчатый (рис. 64).
Микроорганизм предварительно выращивают на агаризирован-ной среде в пробирке (рис. 64, 2), затем из пробирки делают высев в колбы с жидкой питательной средой и проводят две генерации при глубинном выращивании на качалках в течение 2—3 сут для каждой генерации За, 36. Из второй генерации культуры в колбе делают посев в небольшой (10 л) инокулятор 4, после чего хорошо развившуюся культуру переносят в более крупный инокулятор 5
А
1 2 з
Рис. 64. Схема многоступенчатого приготовления посевного материала. А — выращивание во флаконах, Б — в колбах на качалках (по Herold, 1957):
1 — законсервированный исходный материал, 2 — стопоровая генерация на косом агаре в пробирке, 3 — II споровая генерация на твердой среде в Сосуде Ру, За, 36 — I и III генерации на жидкой среде в колбе, 4 — ферментер предварительного ииокулирования, 5 — ферментер инокулирования.
6 — основной ферментер
416
(100—500 л), откуда и производят посев в основной ферментер 6. Для посева в основной ферментер используют от 5 до 10 объемных процентов посевного материала (инокулята). Однако в случае получения пенициллина споровый материал гриба, приготовленный на отрубях, рисовых зернах или пшене, засевают сразу в иноку-лятор.
РАЗВИТИЕ ПРОДУЦЕНТА АНТИБИОТИКА В ФЕРМЕНТЕРАХ
Процесс развития микроорганизма в ферментерах проходит при строгом контроле всех его стадий, очень точно выполняется разработанный регламент условий развития организма — продуцента антибиотика. Большое внимание уделяется поддержанию заданной температуры культивирования, активной кислотности среды (pH), степени аэрации и скорости работы мешалки. В процессе развития организма осуществляется биологический контроль, учитывается потребление организмом основных питательных компонентов субстрата (источников углерода, азота, фосфора), внимательно следят за образованием антибиотика. В последнее время все чаще биологический контроль проводится с помощью ЭВМ.
Существенное внимание при развитии продуцента в ферментерах обращают на процесс пеногашения. При продувании воздуха через культуру микроорганизма происходит обильное образование пены, которая существенно нарушает протекание всего процесса развития продуцента антибиотика в ферментере. Основная причина появления большого количества пены — наличие белковых веществ в среде и ее высокая вязкость, обусловленная обильным накоплением биомассы.
Для борьбы с пеной в ферментерах при антибиотикообразова-нии используют различные поверхностно-активные вещества: растительные масла (соевое, подсолнечное), животный жир (лярд, кашалотовый жир), а иногда минеральные масла (вазелиновое, парафиновое), спирты и высшие жирные кислоты. Нередко в качестве пеногасителей используют специально синтезированные вещества (силиконы, диазобуталкарбамил и другие соединения).
Многие вещества (масла, жиры, спирты и др.), используемые в качестве пеногасителей, потребляются продуцентами антибиотиков как дополнительные источники углеродного питания. При этом часто наблюдается повышение выхода антибиотика. Однако внесение пеногасителя может снижать скорость растворения кислорода, что, в свою очередь, может отрицательно сказаться на развитии микроорганизма и его биосинтетической активности.
Иногда используются механические способы пеногашения (отсасывание пены через специальные трубы, разрушение пузырьков пены сильными струями жидкости, пара или газа).
Общая схема производства антибиотиков до стадии выделения и химической очистки представлена на рис. 65.
14—742
417
Рис. 65. Схема производства антибиотиков: / — приготовление посевного материала, II — инокуляторы для наращивания посевного материала. III — стерилизатор среды для большого ферментера, IV — установка для биосинтеза
антибиотика (по Kohler, 1956):
а — стерилизация среды в колбах, б — охлаждение н посев культуры продуцента в колбу, в — рост культуры в покое, г — рост культуры в качалке, д — инокулятор со стерильной средой, е — ииокулятор со средой, засеянной культурой продуцента, ж — фильтры и компрессор, з—резервуар со сжатым воздухом, и — нагрев воздуха, к — ферментер, л — рубашка для охлаждения ферментера
ПРЕДВАРИТЕЛЬНАЯ ОБРАБОТКА
КУЛЬТУРАЛЬНОЙ ЖИДКОСТИ, ВЫДЕЛЕНИЕ
И ХИМИЧЕСКАЯ ОЧИСТКА АНТИБИОТИКОВ
В процессе развития микроорганизмов образуемые ими антибиотики в большинстве случаев почти полностью выделяются из клеток в окружающую среду. Однако в ряде случаев в культуральную жидкость выделяется лишь часть антибиотика, а другая часть сохраняется внутри клеток.
У ряда продуцентов антибиотик почти полностью содержится в клетках организма.
В зависимости от того, где антибиотическое вещество сосредоточено, применяют соответствующие методы его извлечения. Так, если антибиотик находится в культуральной жидкости, его выделяют методами экстракции растворителями, не смешивающимися с жидкой фазой, осаждают в виде нерастворимого соединения или сорбируют ионообменными смолами. Выделение антибиотика из клеток микроорганизмов осуществляют с помощью экстракции органическими растворителями. В случае, если антибиотик содержится в культуральной жидкости и в клетках продуцента, первичной операцией его выделения является перевод антибиотика в фазу, из которой наиболее целесообразно его изолировать. Например, антибиотик, содержащийся в культуральной жидкости, и клетки с антибиотическим веществом переводят в осадок, из которого антибиотик экстрагируют.
Отделение нативного раствора от биомассы и взвешенных частиц проводят методами фильтрации или центрифугирования. Для процесса фильтрации применяют фильтрующие аппараты: фильтрпресс, нутч-фильтр, друк-фильтр, центрифуги, сепараторы.
Фильтр-прессы применяются для обработки больших объемов культуральной жидкости.
Аппараты состоят из ряда чередующихся плит и рам и фильтрующих перегородок между ними. Процесс фильтрации осуществляется под давлением.
Для фильтрации небольших объемов культуральной жидкости обычно используют нутч-фильтры или друк-фильтры. Первый аппарат работает под вакуумом, а в друк-фильтре процесс фильтрации осуществляется благодаря созданию давления над фильтрующей жидкостью.
Широкое распространение в получении жидкости, освобожденной от взвешенных частиц, получил способ центрифугирования. Хорошие результаты получаются в том случае, когда при правильном выборе скорости подачи жидкости скорость вращения центрифуги достигает 15 000 об/мин.
Отделение мицелия или других взвешенных частиц можно также производить в сепараторах.
При скорости вращения барабана сепаратора 7000—7500 об/ /мин, благодаря центробежной силе твердые частицы устремляются к стенкам барабана и осаждаются там, а отсепарированная жид
14*
419
кость стремится к центру барабана и поднимается вверх в специальную камеру.
Цель химической очистки — извлечение антибиотика из нативной жидкости или из клеток продуцента, его концентрация и освобождение (собственно очистка) от сопутствующих примесей и в конечном счете получение высокоочищенного препарата, пригодного для соответствующего применения.
Антибиотические вещества под влиянием жестких внешних факторов (повышенной температуры, высокой кислотности или щелочности и др.) в ряде случаев теряют свои свойства, инактивируются. Поэтому при их выделении и очистке необходимо соблюдать максимум осторожности.
Основными методами очистки антибиотиков являются следующие.
Метод экстракции. Нередко в целях очистки антибиотика от различных примесей его многократно переводят из одного растворителя в другой с предварительным осаждением (кристаллизацией). Такой прием носит название перекристаллизации.
Ионообменная сорбция. Метод состоит в том, что при пропускании водных растворов антибиотиков, являющихся по химической природе кислотами, основаниями или амфотерными соединениями, через колонки с соответствующими ионообменными смолами они сорбируются на них, а раствор с частью примесей, имеющих противоположный антибиотику заряд, проходит через колонку. Смолы в зависимости от положительного или отрицательного заряда их ионов называют катионитами или анионитами. Антибиотик (как отрицательно заряженный ион) будет сорбироваться на катионитной смоле и наоборот. Адсорбированный на смоле антибиотик элюируют (десорбируют), в результате чего получают значительно очищенный и концентрированный препарат. Затем раствор этого препарата можно вновь пропустить через ионообменную смолу, но имеющую противоположный заряд. При этом на смоле осядут примеси, а раствор более очищенного антибиотика пройдет через колонку.
Метод осаждения. Антибиотик связывают с органическими или неорганическими веществами с целью получения соединения, выпадающего в осадок; последний с помощью фильтров или центрифугирования отделяют от нативного раствора, промывают и в ряде случаев высушивают. Образовавшееся соединение растворяют и антибиотик экстрагируют или вновь осаждают (кристаллизуют) .
Одна из стадий химической очистки антибиотиков — концентрирование полученных растворов; достигается отгонкой большей части растворителя, как правило, в высоком вакууме.
Применяемые методы выделения и химической очистки, а также качество оборудования и используемых реактивов имеют большое значение прежде всего для улучшения качества получаемого антибиотика и увеличения выхода препарата.
420
СУШКА, КОНТРОЛЬ И РАСФАСОВКА ПРЕПАРАТА
После выделения и химической очистки антибиотика его необходимо высушить, т. е. удалить из полученного препарата свободную и связанную воду.
Поскольку большинство антибиотиков в той или иной степени термолабильны, для их высушивания необходимо применять методы, не приводящие к потере биологической активности, не изменяющие цвета препарата. На современном этапе промышленного получения антибиотиков используют методы обезвоживания препаратов.
Лиофильная сушка антибиотиков — широко распространенный прием; проводится при сравнительно низких температурах (—8, —12°С).
Высушивание с применением распылительной сушилки — прогрессивный метод при работе с большими количествами антибиотика; раствор антибиотика пневматически распыляется до мельчайших капель в камере с потоком нагретого воздуха. Процесс высушивания антибиотиков протекает в течение нескольких секунд. При этом даже термолабильные препараты не меняют свойств.
Метод взвешенного слоя или сушка в вакуум-сушильных шкафах применяется для высушивания зернистых и пастообразных антибиотических препаратов.
Контроль препарата. Готовый антибиотик подвергается тщательному контролю: биологическому и фармакологическому.
Биологический контроль ставит задачей выяснение стерильности готового препарата. Для этого используют, как правило, два метода.
Первый — связан с инактивацией антибиотика и высевом его в соответствующую питательную среду. Например, биологический контроль бензилпенициллина и полусинтетнческих препаратов, полученных на его основе, производится следующим образом. В пробирки, содержащие тиогликолевую среду, вносят фермент пенициллиназу в количестве, способном полностью инактивировать пенициллин. Пробирки с пенициллиназой выдерживают 2—3 сут при температуре 37°С для контроля стерильности фермента, затем в них вносят раствор пенициллина. Пробирки- разделяют на две группы: одну выдерживают при 37°, а другую — при 24° в течение 5 сут. Ведут ежедневное наблюдение за возможным развитием микроорганизмов.
Второй метод выяснения стерильности антибиотиков определяется тем, что для большинства этих соединений не имеется биологических инактиваторов их биологической активности. Поэтому у изучаемых препаратов выявляют наличие устойчивых к ним форм микроорганизмов, а также определяют возможное присутствие чувствительной микрофлоры. Для определения возможного присутствия в таких препаратах чувствительной к ним микрофлоры раствор антибиотиков пропускают через мембранные фильтры с диаметром пор не более 0,75 мк.
421
Необходимо подчеркнуть, что стерильность готового антибиотика обеспечивается соблюдением стерильных условий работы на всех стадиях процесса развития продуцента, выделения и очистки препарата.
Фармакологический контроль. К антибиотическим веществам, используемым в медицинской практике, в соответствии с Государственной фармакопеей СССР предъявляются очень строгие требования. Каждый новый лекарственный препарат, прежде чем он будет разрешен к практическому применению, должен пройти всесторонние испытания на токсичность, пирогенность и на другие жизненно важные функции организма. Препарат изучают на разных видах животных в отношении его острой и хронической токсичности (влияние на кровь, центральную нервную систему, дыхание и т. д.). Показатели острой токсичности являются одним из критериев качества антибиотического вещества. Устанавливают максимально переносимую дозу (МПД) антибиотика, дозу, вызывающую гибель 50% подопытных животных (LD50), и смертельную дозу (LDioo). Только после всестороннего и тщательного изучения препарата он может быть рекомендован к практическому применению.
Расфасовка и упаковка антибиотика — следующий этап работы. Расфасованный и упакованный антибиотик с указанием показателя биологической активности, даты выпуска и срока годности поступает в продажу.
АКТИНОФАГИЯ И ЕЕ ЗНАЧЕНИЕ В ПРОИЗВОДСТВЕ АНТИБИОТИКОВ
В природе широко распространены фаги, вызывающие лизис актиномицетов, или актинофаги. Они довольно легко обнаруживаются в различных типах почв. Наибольшее количество актинофагов выделяется из черноземной, перегнойной и подзолистой почв.
Впервые явление лизиса актиномицета под действием фагов было обнаружено Дмитриевым в 1934 г.; исследователь наблюдал лизис мицелия Streptomyces boots при выращивании его на жидких средах. При дальнейшем изучении этого явления было установлено, что лизис в культурах актиномицетов могут вызывать не только фаги, но и другие причины (Дмитриев, Бирюкова, 1935), например автолиз, или самопереваривание, клеток.
Интенсивное изучение актинофагии началось в связи с промышленным получением антибиотиков, образуемых актиномицетами. В 1947 г. Рогинская и Любимов доложили в Академии наук СССР об обнаружении фага, лизирующего культуру продуцента стрептомицина. Было показано, что фаг, выделенный из культуры Str. griseus, обладает высокой специфичностью и поражает только продуцент стрептомицина, не лизируя другие штаммы Str. griseus.
Фаг, вызывающий лизис культуры актиномицета — продуцента стрептомицина, не инактивируется при содержании его в течение часа при температуре 75°С, но полностью теряет активность в течение 10 мин при нагревании до 100°С.
422
Актпнофаги, как и бактериофаги, способны лизировать только молодую, активно развивающуюся культуру микроорганизма. Технологический процесс получения антибиотиков весьма благоприятен для развития фагов в случае попадания их в ферментеры. При заражении культуры актинофагом происходит почти полный лизис мицелия актиномицета и резкое снижение биосинтеза стрептомицина. Лизис культур актиномицетов под действием фагов в заводских условиях причиняет значительный материальный ущерб антибиотической промышленности. Фаголизис актиномицетов —продуцентов антибиотиков наблюдается при промышленном получении стрептомицина, тетрациклинов, эритромицина, новобиоцина. Он может иметь место при производстве и других антибиотических веществ.
Активность фага зависит от особенностей культуры, состава среды культивирования актиномицета и стадии процесса развития организма.
Об источниках попадания фага в ферментеры при развитии актиномицета существуют различные взгляды. Одни авторы считают, что фаг не может попасть в ферментер с культурой актиномицета, так как ни одна из изученных культур Str. griseus не содержала фаг. По их мнению, заражение фагом происходит на каком-то этапе производства, в частности, фаги проникают с загрязненным воздухом. Однако данные других исследователей указывают на возможность выделения фага из музейных культур актиномицетов — продуцентов стрептомицина.
Среди разнообразных видов актиномицетов, выделенных из почв, встречаются культуры, содержащие в себе фаг, т. е. эти культуры лизогенны. Один из возможных путей попадания фага при производстве антибиотика — занос его самой культурой актиномицета. Лизогенная культура устойчива к носимому ею фагу, поэтому освобождаемый культурой фаг обычно не находит условий для массового размножения. Однако в отдельных случаях из лизогенных культур актиномицетов выделяются актинофаги, способные лизировать культуру хозяина. Это, по-видимому, следствие того, что некоторые симбиотические фаги сравнительно легко изменяют свои литические свойства и становятся вирулентными по отношению к культуре хозяина. Следовательно, создаются условия для массового размножения видоизмененного фага, а это в свою очередь способствует накоплению фага в воздухе и на предметах оборудования производственных помещений, что может приводить к заражению фагом ферментеров.
Таким образом, инфицирование фагом может, по-видимому, происходить как путем внесения фага одновременно с культурой актиномицета (при наличии лизогенных форм), так и на определенных этапах производственного процесса получения антибиотика.
Исходя из изложенного, меры борьбы с фаговой инфекцией должны осуществляться комплексом мероприятий.
1. Выведение высокоактивных фагоустойчивых культур актиномицетов.
423
2. Борьба с распространением фага в производственных цехах и лабораториях.
3. Защита производственной культуры от фаговой инфекции.
Селекция фагоустойчивых культур актиномицетов основана на том, что под влиянием фагов у актиномицета возникают варианты, обладающие различными свойствами, в том числе и фагоустойчи-востью.
Метод получения фагоустойчивых культур актиномицетов состоит в следующем. На поверхность агаровой пластинки, содержащей фаг, высевают актиномицет. В этих условиях вырастут лишь отдельные фагоустойчивые колонии актиномицета.
При отборе фагоустойчивых вариантов необходимо иметь в виду, что отдельные формы могут быть лизогенными, т. е. содержать фаг. Такие варианты при всех остальных положительных оценках не могут рекомендоваться для производственных целей.
Актиномицеты, устойчивые к одному фагу, часто приобретают устойчивость и к другим фагам. Вместе с тем фаги, лизирующие Str. griseus, обладают литической активностью и в отношении других видов актиномицетов (Str. viridis, Str. olivaceus, Str. griseolis).
Большинство фагов, выделенных из почвы, — полифаги, т. е. способны лизировать от 45 до 90% культур актиномицетов разных видов.
Для борьбы с распространением фага в производственных помещениях рекомендуется систематическая обработка стен, оборудования и пола заводских помещений дезинфицирующими средствами, убивающими фаг (гипохлориды, соли хлорноватистой кислоты и др.).
Лизис культуры Str. griseus под действием фага при выращивании актиномицета в ферментерах можно предотвратить добавлением к среде цитратов и оксалатов.
Защита производственной культуры от фаговой инфекции осуществляется тщательной стерилизацией сред, аппаратуры, оборудования и коммуникаций, строгим соблюдением стерильности на всех производственных этапах.
М ПРИМЕНЕНИЕ АНТИБИОТИКОВ В СЕЛЬСКОМ ХОЗЯЙСТВЕ, В ПИЩЕВОЙ И КОНСЕРВНОЙ ПРОМЫШЛЕННОСТИ
Антибиотики нашли применение не только в медицинской практике, но и в сельском хозяйстве, в пищевой и консервной промышленности. Что касается использования антибиотических веществ в медицине, то об этом указывалось при рассмотрении отдельных антибиотиков. В настоящей главе будет кратко рассмотрен вопрос о применении этих физиологически активных веществ в растениеводстве, животноводстве, в пищевой и консервной промышленности.
АНТИБИОТИКИ В РАСТЕНИЕВОДСТВЕ
За последние тридцать лет проведено много исследований, посвященных использованию антибиотиков в борьбе с фитопатоген-ными организмами, наносящими ущерб сельскому хозяйству.
Известно, что заболевания растений вызываются различными группами фитопатогенных организмов: вирусами, бактериями, грибами, протозоа и др. Поражение растений происходит как при развитии в полевых условиях, в садах, так и в теплицах и оранжереях.
Источниками заражения растений фитопатогенными организмами могут быть семена (с наружной и внутренней инфекцией), растительные остатки, посадочный материал (черенки, саженцы, клубни, корнеплоды) и сама почва.
Выбор антибиотика для борьбы с определенным возбудителем заболевания и очагом его распространения, а также способ применения препарата в каждом отдельном случае могут быть различными. При этом основное внимание должно быть обращено не только на биологический эффект, но и на экономическую сторону. Назначение препарата и метод его применения должны быть экономически выгодными.
Основные требования, предъявляемые к антибиотикам, используемым в борьбе с фитопатогенными организмами, сводятся к следующему: I) антибиотик должен быть активным против возбудителя заболевания, т. е. обладать специфичностью биологического действия, 2) способность легко проникать в ткани растений, 3) лечебные дозы должны быть безвредными для растения, 4) антибиотик на поверхности и внутри растения не должен быст
425
ро инактивироваться, но, попадая в почву, — легко разлагаться там, 5) обладать биологическим действием внутри тканей растения.
Одно из существенных требований к антибиотикам, применяемым в сельском хозяйстве, то, что они не должны использоваться в медицинской практике.
Методы использования антибиотиков выбираются в зависимости от вида заболевания (сосудистый вилт, поражение листьев и др.), стадии развития растения, размеров растения, места произрастания и способа посадки. Наиболее широкое применение имеют непосредственная обработка почвы, обрызгивание или опыливание антибиотиком наземных частей растений, смачивание семян, корней или других органов растворами антибиотиков и др.
Все приемы использования антибиотиков основаны на том, что препарат, нанесенный на поверхность листьев, ствола (стебля), семян или же внесенный в почву, задерживает рост или убивает фитопатогенные организмы, находящиеся как на поверхности, так и внутри органов и тканей растения.
Антибиотики, нанесенные на наземные части растений или внесенные в почву, проникают в растение через корневую систему, стебель или листья и довольно быстро распространяются по растению. Однако такие антибиотики, как глобиспорин и гризеофуль-вин, распространяются по тканям и органам растения очень медленно.
Попав в растение, антибиотики сохраняются в его тканях сравнительно долго — от 5 до 20 сут.
Внесение антибиотиков в почву. Растворы антибиотиков, внесенные в почву, поглощаются корневой системой растений и через
Таблица 101
Поступление из почвы в растения антибиотиков, внесенных извне (ед. на 1 г ткани)
(по Красильникову, 1961)
Антибиотик Фасоль Пшеница Горох
корни листья корни ЛИСТЬЯ корни ЛИСТЬЯ
Гризин 20 10 30 10 30 20
Стрептомицин . . . 30 10 20 6 40 20
Хлортетрациклин . . — — 20 4 20 6
Окситетрациклин . . — — 30 10 20 6
Контрольные расте-
НИЯ 0 0 0 0 0 0
некоторое время в зависимости от вида растения и свойств антибиотика обнаруживаются как в тканях корней, так и в наземных частях (табл. 101).
Приведенные в табл. 101 данные свидетельствуют о том, что ткани растений могут содержать значительные концентрации ан-
426
тибпотика, поступившего через корневую систему. Такого количества вполне достаточно для задержки роста или подавления развития патогенных форм микробов.
При погружении корневых систем в растворы антибиотиков уже через 10—20 мин препараты обнаруживаются в различных органах растений.
Установлено, что пенициллин накапливается в листьях избирательно. При обработке семян антибиотиками последние быстро проникают в оболочку и зародыш и сохраняются там продолжительное время.
При внесении антибиотиков в почву с целью борьбы с фитопа-тогенными организмами встречается ряд серьезных препятствий. Прежде всего в почве антибиотики быстро разрушаются под влиянием различных продуктов жизнедеятельности почвенных микробов и по другим причинам. Кроме того, антибиотики, потребляются почвенными организмами в качестве питательных веществ. Многие антибиотики основной природы необратимо адсорбируются коллоидами почвы, поэтому внесение антибиотиков непосредственно в почву может оказаться в ряде случаев нерентабельным мероприятием.
Опрыскивание пораженных растений растворами антибиотиков. Метод может быть использован на протяжении всего периода вегетации таких растений, как фруктовые деревья, овощи, и других сельскохозяйственных культур. Опрыскивание растений антибиотиками оказывает защитное действие против мучнистой росы огурцов. Опрыскивание применяют в борьбе с Xanthomonas jug-landis, вызывающим заболевание грецкого ореха, и с Xanth. vesi-catoria, поражающим томаты и перец.
Метод опрыскивания — один из наиболее эффективных в борьбе с болезнями растений, возбудители которых развиваются как на поверхности наземных органов, так и в тканях растений.
Опыление пораженных растений антибиотиками также находит широкое применение в растениеводстве, однако он менее эффективен по сравнению с методами опрыскивания.
Погружение зараженных органов растений в раствор антибиотика — метод, широко распространенный, например, в борьбе с поражениями семян, фруктов, клубне- и корнеплодов.
Интересные результаты при применении этого метода получены при обработке семян хлопчатника для защиты растений от гаммоза, вызываемого Xanth. malvacearum.
Иногда при лечении отдельных древесных пород используют метод инъекций, или метод штамбов. В стволе дерева просверливают отверстие и в него вставляют конец фитиля, а другой конец помещают в раствор антибиотика. По фитилю антибиотик поступает в ткань дерева и распространяется по всему растению. Впервые метод штамбов был предложен Шевыревым в 1903 г.
Антибиотики, попадая в ткань растений, действуют не только как бактерициды, но могут также изменить метаболизм и иммуннобиологические свойства растений.
427
Из большого числа различных антибиотиков, испытанных с целью применения их для борьбы с различными заболеваниями растений, вызываемыми бактериями и грибами, наилучший эффект наблюдался при использовании стрептомицина, гризеофульвина, циклогексамида (актидиона) и некоторых других антибиотиков.
В растениеводстве антибиотики используются в качестве гербицидов, инсектицидов, стимуляторов роста растений. Преимущество антибиотиков как продуктов жизнедеятельности организмов по сравнению с биологически активными препаратами, полученными в результате химического синтеза, состоит в том, что первые не загрязняют окружающей среды. Антибиотики в природе быстро разлагаются. Вместе с тем проблема возникновения резистентных форм микроорганизмов к антибиотическим веществам и их распространения ставит задачу поиска и подбора для растениеводства таких антибиотиков, которые не применяются в медицинской практике.
В настоящее время для борьбы с фитопатогенными организмами в разных странах применяют разные антибиотические вещества или их сочетания.
Стрептомицин применяется для борьбы с заболеваниями, вызывающими бактериальное увядание фасоли и сои, болезнями яблонь, груш, ореха, томата (в США), хлопка, риса, лимонов (в Индии), а также с рядом других заболеваний сельскохозяйственных растений.
В США, Чехословакии и в других странах для этих целей выпускают препараты стрептомицина в сочетании с другими антибиотиками, в частности с окситетрациклином. Известны такие препараты стрептомицина с названным антибиотиком, как «агри-мицин», «фитомицин», «фитостреп» и др.
Гризеофульвин используется в борьбе против заболеваний растений, вызываемых грибами, и прежде всего Botrytis. Антибиотик активен в отношении возбудителей ржавчины, мучнистой росы.
Трихотецин обладает способностью подавлять развитие ряда фитопатогенных организмов, в том числе Botrytis cinerea, Н elmintosporium. Однако в ряде случаев трихотецин не дает положительного эффекта. Так, он не проявляет заметного защитного действия при вертициллезном вилте хлопчатника. Это связано с тем, что фитопатогенные грибы, устойчивые к действию трихотецина, образуют во многих случаях эндогенный фермент трихо-тециназу, инактивирующий антибиотик. Наиболее сильно свойством инактивировать трихотецин обладают грибы родов Fusarium, Aspergillus, Penicillium.
Бластицидин S — антибиотик, образуемый Streptomyces griseochromogenes, подавляет рост многих микроорганизмов в концентрации 50—100 мкг/мл. Антибиотик оказался эффективным в борьбе с пирикуляриозом, распространенной в Японии опасной грибной болезнью риса, вызываемой Piricularia oryzae. Однако
428
антибиотик оказался в определенной степени токсичным для человека.
В настоящее время бластицидин в борьбе с пирикуляриозом заменен более эффективным и безвредным для человека антибиотиком касугамицином, продуцируемым Streptomyces kasuga-ensis. Минимальная концентрация касугамицина, необходимая для подавления гриба Piricularia oryzae, при pH окружающей среды ниже 6,0 составляет менее 1 мкг/мл, т. е. по сравнению с бластицидином S она ниже в 50—100 раз.
Полиоксины — группа, включающая девять антибиотиков. Эти антибиотики имеют своеобразное химическое строение и относятся к пептидил-пиримидин-нуклеозидным соединениям.
Полиоксины образуются культурой Str. cacaoi и обладают про-тивогрибной активностью. Антибиотики подавляют рост фитопатогенных грибов, относящихся к Alternaria, Cochliobalus, Piricularia. Механизм действия полиоксинов основан на подавлении синтеза клеточной стенки чувствительных грибов.
Валидомицин А образуется Str. hygroscopicus var. limone-us. Антибиотик применяется в Японии для борьбы с заболеваниями риса, вызываемыми грибом Pizoctonia solani. Валидомицин легко разлагается почвенными микроорганизмами. Время его полураспада в почве — менее 4 ч.
Тетранастин А — антибиотик, образуемый Str. aureus, накапливается в мицелии продуцента. Это антибиотическое вещество принадлежит к классу макротетролидных антибиотиков. Тетранастин А обладает специфичной активностью против паразитарных паучков и клещей плодовых деревьев. Он проявляет, вместе с тем, очень слабую токсичность в отношении теплокровных животных.
К антибиотикам, обладающим гербицидной активностью, относятся гербицидины А и В, образуемые Str. saganoensis. Эти антибиотики подавляют развитие возбудителя болезни риса Xanthomonasoryzae. Гербицидин А инактивирует прорастание семян риса и китайской капусты, обладает избирательной гербицидной активностью против двудольных растений.
Гербицидины А и В по химическому строению и гербицидной активности близки к тойокамицину (пиромицин, наритера-цин), образуемому культурой Str. toyocaensis.
АНТИБИОТИКИ В ЖИВОТНОВОДСТВЕ
Антибиотики начали применять в животноводстве вскоре после их открытия. Прежде всего они нашли широкое применение в ветеринарии как лечебные средства против многих заболеваний сельскохозяйственных животных (копытная болезнь оленей, мыт лошадей, рожа поросят, мастит крупного рогатого скота, сибирская язва, пневмония и многие другие). С-реди антибиотиков, используемых в ветеринарии, очень эффективным препаратом оказался гризеовиридин, применяемый при лечении маститов у
429
рогатого скота и бронхитов цыплят. Метимицин лишь подавляет развитие возбудителя бруцеллеза, но полностью не излечивает его. Авермиктины — новая группа антибиотиков, образуемая стрептомицетом, — по строению относится к макроциклическим лактонам. Авермиктины обладают способностью подавлять развитие паразитов животных, в том числе нематод и антипод.
Антибиотики используют при лечении заболеваний птиц и пчел. Так, для лечения индеек, больных синуситами, применяют стрептомицин, хлорамфеникол, хлортетрациклин; при ларинготрахеите цыплят используют магнамицин. Для лечения пчелиных семей, пораженных американским или европейским гнильцом, применяют окситетрациклин, а при ноземе (понос) пчел — фумагил-лин.
Монензин — антибиотическое вещество, образуемое Streptomyces cinnamonensis, обладает широким спектром антипротозой-ной активности. Этот антибиотик наряду с салиномицином, образуемым культурой определенного штамма Str. albas, находит применение при лечении кокцидоза домашней птицы. Салиноми-цин обладает также антибиотической активностью против грамположительных бактерий, микобактерий и грибов.
Антибиотики используются в животноводстве как стимуляторы роста ряда сельскохозяйственных животных и птиц.
Установлено, что при добавке небольших количеств антибиотиков в корм происходит прежде всего значительное сокращение отхода молодняка в результате различных заболеваний. Антибиотики ускоряют рост и развитие животных и птиц, что, в свою очередь, связано с сокращением расхода кормов на 5—10%.
Небольшие концентрации антибиотиков, используемые в качестве добавок к корму животным, не оказывают отрицательного влияния на организм и качество продукции.
Использование антибиотиков в кормлении животных дает положительный эффект в птицеводстве, свиноводстве, при выращивании телят и других сельскохозяйственных животных.
Добавление этих веществ к рациону птиц способствует ускорению их роста, снижению отхода молодняка; антибиотики стимулируют яйценоскость и повышают оплодотворяемость и выводимость яиц. Введение небольшого количества антибиотиков в корм способствует повышению массы тела за период выращивания на 200—250 г на каждого цыпленка и до 350 г на каждого утенка. При использовании антибиотиков в птицеводстве можно получить заметное увеличение продукции, а от 1000 кур получить в год дополнительно до 15 тыс. яиц.
Аналогичные результаты получены при использовании антибиотиков в кормлении свиней, телят и других животных. Так, поросята, получавшие в корм антибиотики, в двухмесячном возрасте весят на 1,5—1,7 кг больше, чем контрольные.
Применение антибиотиков при откорме свиней способствует получению дополнительно 100—120 ц свинины от каждой тысячи животных.
430
В качестве стимулятора роста сельскохозяйственных животных используется монензин. Антибиотик обладает способностью понижать образование метана метаногенными бактериями, размножающимися в рубце жвачных животных. В результате этого увеличивается количество летучих кислот, особенно пропионовой, легко и быстро усваиваемых животными.
Для целей сельского хозяйства организовано производство кормовых антибиотиков на базе отходов (барда) спиртовых заводов с добавкой развара пшеничной муки. Получаемые препараты называются БКВ (биомицин1 кормовой витаминизированный).
Вопросам влияния низких концентраций антибиотиков на рост животных посвящено большое число исследований. Однако механизм стимулирующего действия этих веществ до конца еще не выяснен. По-видимому, стимулирующий эффект низких концентраций антибиотиков на организм животного связан в основном с двумя факторами: 1) действием на микрофлору кишечника и 2) непосредственным влиянием на организм животного.
ДЕЙСТВИЕ АНТИБИОТИКОВ НА МИКРОФЛОРУ КИШЕЧНИКА ЖИВОТНЫХ
1. Антибиотики способствуют увеличению числа полезных микроорганизмов, синтезирующих витамины и преобладающих над патогенными формами.
2. Уменьшают число вредных для организма микробов, использующих витамины, образующих токсины и обладающих способностью быть патогенными или условно патогенными формами.
3. Антибиотики оказывают влияние на микроорганизмы, присутствующие в кишечнике, способствуя образованию устойчивых штаммов, которые оказываются менее вредными для животного, изменяют метаболизм присутствующих микробов, изменяют энергию потребления веществ в рубце, снижают активность нормальной флоры и повышают чувствительность к фагоцитозу.
4. Антибиотики способствуют перемещению микроорганизмов в кишечнике животного.
5. Под влиянием антибиотиков наблюдается снижение субклинических инфекций, нередко замедляющих развитие молодняка. Эти соединения повышают общий тонус защитных реакций организма.
6. Антибиотики снижают pH кишечного содержимого, уменьшают поверхностное натяжение клеток организма и ускоряют их деление.
Все это может оказывать благоприятное действие на организм животного и способствовать более быстрому росту при одних и тех же затратах кормовых единиц.
1 Биомицин — хлортетрациклнн, выпускаемый в СССР.
431
НЕПОСРЕДСТВЕННОЕ ДЕЙСТВИЕ АНТИБИОТИКОВ
НА ОРГАНИЗМ ЖИВОТНОГО
Действие антибиотиков на рост животных связано прежде всего с изменением кишечной микрофлоры под влиянием этих веществ.
Однако данные более позднего периода исследований указывают на непосредственное влияние антибиотиков на организм животного. Прямое действие этих веществ на организм проявляется в многообразных формах.
1. Ткани увеличивают скорость абсорбции и стимулируют потребление метаболитов, одновременно с этим наблюдается снижение расхода кормов.
2. В организме отмечается синергизм гормонов, увеличивается количество ростовых гормонов, усиливается процесс потребления пищи, возрастает приспособляемость организмов к неблагоприятным условиям.
3. Под влиянием антибиотиков снижается потребность животного в витаминах, увеличивается синтез витаминов тканями, происходит стимуляция синтеза сахаров и витамина А из каротина. Организм меньше образует побочных продуктов, увеличивается скорость синтеза ферментов.
Таким образом, стимулирующее действие суббактериостатических доз антибиотиков на организм животных и в особенности на молодняк связано со многими факторами. Специфической же особенностью этих физиологически активных веществ следует считать их действие на микробный метаболизм пищевого тракта животных. Но эффективность антибиотиков и других микробных продуктов метаболизма обусловлена особыми веществами роста, или стимуляторами.
АНТИБИОТИКИ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Сохранение скоропортящихся продуктов питания — одна из важнейших проблем, стоящих перед работниками пищевой и консервной промышленности.
Различные методы сохранения продуктов (консервирование, сквашивание, кипячение, замораживание и охлаждение) применялись человеком еще на заре его развития. Эти методы находят широкое применение и теперь.
Однако известно, что при кипячении, консервировании, сквашивании и в меньшей мере при охлаждении и замораживании продуктов питания изменяются их ценные свойства и в особенности аромат, структура, питательная ценность и др. Порча пищевых продуктов при хранении может вызываться различными факторами, в том числе развитием микроорганизмов (плесневых грибов, дрожжей, бактерий); действием ферментов и влиянием окислительных процессов, стимулируемых кислородом воздуха.
Наибольшую роль в порче продуктов играют, несомненно, мик
432
роорганизмы, выделяющие разнообразные продукты обмена, многие из которых или нарушают качество продуктов, или делают их совершенно непригодными для употребления в результате образования сильных ядов (ботулин и др.). Таким образом, борьба с микроорганизмами, участвующими в порче продуктов питания, — одна из основных задач создания рациональных методов сохранения этих продуктов без изменения их качества и свойств.
Для борьбы с вредной микрофлорой используются различные физические и химические методы.
К числу физических методов уничтожения микроорганизмов относятся: термическая обработка (автоклавирование, пастеризация и др.), замораживание, действие ультрафиолетовых и рентгеновских излучений и др.
При химических методах борьбы с микробами, вызывающими порчу продуктов, применяются различные бактериостатические или бактерицидные вещества (сернистый ангидрид, бензойная кислота, сорбиновая кислота и др.).
Идеальным в этом отношении можно считать соединение, которое в очень низких концентрациях обладало бы мощным биологическим действием, не проявляя токсичности в отношении человека и животных и не вызывая порчи продуктов. Такими свойствами обладают некоторые антибиотики.
АНТИБИОТИКИ В КОНСЕРВНОЙ ПРОМЫШЛЕННОСТИ
Первые сведения об использовании антибиотиков в консервной промышленности относятся к 1943 г.
Среди антибиотиков, применяемых в консервной промышленности, можно назвать субтилин, низин и некоторые другие. Фитонциды высших растений также нередко используются при консервировании ряда продуктов питания.
Антибиотические вещества нашли применение в консервной промышленности, при сохранении свежего мяса, рыбы и птицы, при хранении сыра и молочных продуктов, фруктов и овощей.
Известно, что при консервировании продуктов питания стерилизация — один из самых важных участков технологии этого процесса. Продолжительность действия высоких температур при стерилизации зависит от вида продукта и сопутствующей микрофлоры.
Под действием термической обработки погибает большинство видов микроорганизмов, но одновременно с этим происходит потеря некоторых ценных свойств продукта питания: разрушаются витамины, изменяются вкусовые качества и консистенция продукта и т. п.
Применение антибиотиков при консервировании продуктов питания позволяет значительно снизить время термической обработки того или иного продукта.
Так, для консервирования овощей предложено использовать субтилин. Применение этого антибиотика дает возможность про
433
водить мягкую термическую обработку. Под действием субтилина происходит гибель клостридиальных и термофильных бактерий, устойчивых к нагреванию.
Хорошие результаты получены при использовании в консервной промышленности низина — антибиотика, образуемого молочнокислым стрептококком. Этот антибиотик не используется в медицинской практике. Его применяют при консервировании томатов, зеленого горошка, цветной капусты, мяса, рыбы, молока и других продуктов. Низин подавляет развитие ряда термофильных спорообразующих бактерий, не оказывая токсического действия на человека. Применение низина при консервировании позволяет уменьшить продолжительность термической обработки продуктов в два раза.
Антибиотические вещества высших растений (лука, моркови, лаврового листа, кориандра, перца красного, можжевеловых ягод и др.) значительно снижают количество спор микроорганизмов в консервируемой массе. Использование этих веществ при консервировании мясных и рыбных продуктов, различных овощей способствует уменьшению времени термической обработки и повышает качество продуктов.
ИСПОЛЬЗОВАНИЕ АНТИБИОТИКОВ
ПРИ СОХРАНЕНИИ СВЕЖЕГО МЯСА, РЫБЫ И ПТИЦЫ
Быстрая порча мясных туш происходит под влиянием микрофлоры, содержащейся в пищевом тракте животного и попадающей в тушу при разделке ее после убоя или в кровеносную систему и лимфатические узлы в результате использованиия средств убоя. Для борьбы с нежелательной микрофлорой, попадающей в тушу и вызывающей ее преждевременную порчу, применяют два основных метода: 1) антибиотик добавляют в пищу животному непосредственно перед убоем; 2) антибиотик вводят в кровеносную систему сразу же после того, как животное забито и спущена кровь. Обработка антибиотиками позволяет значительно увеличить срок сохранности свежего мяса (до 2—3 сут) и улучшить его качество.
Микроорганизмы, вызывающие порчу мяса, могут попасть на поверхность туш из воздуха. Поэтому опрыскивание разделанных и охлажденных говяжьих туш раствором антибиотика или обработка антибиотиком брюшной полости свиней также способствует удлинению сроков хранения мяса.
Иногда для упаковки скоропортящихся продуктов применяют пленки и другие материалы, содержащие антибиотики. Это также способствует удлинению сроков хранения таких продуктов.
Огромное значение для народного хозяйства имеет проблема удлинения сроков хранения свежей рыбы, особенно при промысле в районах, расположенных далеко от берега и баз. Использование антибиотиков для удлинения сроков хранения рыбы нашло широкое распространение. Применение антибиотиков при этом может осуществляться различными способами.
434
1. Погружение рыбы на 1—5 мин в морскую воду, содержащую хлортетрациклин в концентрации 5—100 мг/л, способствует значительному удлинению сроков сохранения ее.
2. Хорошие результаты получаются при погружении рыбы в охлажденную до 1—1,5°С морскую воду с содержанием в ней всего 2 мг/л хлортетрациклина.
3. Удлинение сроков хранения свежей рыбы на 5 суток и более при содержании рыбы на льду, в составе которого имеется хлор-тетрациклин в концентрации 1—2 мг/л воды.
АНТИБИОТИКИ И СОХРАНЕНИЕ МОЛОКА
И МОЛОЧНЫХ ПРОДУКТОВ
В производстве и хранении сыров, а также при хранении молока используется антибиотик низин, образуемый различными штаммами молочнокислых стрептококков. Низин обладает узким спектром антимикробного действия, подавляет развитие клостридиальных и других форм бактерий, участвующих в порче сыров.
При пастеризации молочных продуктов, используемых для приготовления сыров, создаются благоприятные условия для развития клостридиев, приводящих к порче сыра в результате образования газа или выделении токсинов.
Использование низина или непосредственно культур, образующих его, предохраняет сыры от преждевременной порчи.
* * *
Несмотря на заманчивые перспективы использования антибиотиков в кормлении животных, при сохранении продуктов питания, необходимо очень осторожно и внимательно относиться к их применению. Попадание незначительных концентраций этих биологически активных веществ с продуктами питания в организм человека может вызвать у него появление резистентных форм микроорганизмов, что затруднит применение антибиотиков в случае заболевания.
При использовании антибиотиков в указанных целях необходимо иметь в виду, что антибиотические вещества, применяемые в медицинской практике, не могут быть включены в число добавок к кормам сельскохозяйственных животных, использоваться в пищевой и консервной промышленности. Это правило, введенное в нашей стране и в ряде других государств, связано с предупреждением процесса возникновения и распространения резистентных к антибиотикам форм микроорганизмов.
Применение антибиотиков в животноводстве, растениеводстве, в пищевой и консервной промышленности должно проводиться под строгим и тщательным контролем соответствующих компетентных органов. В этом важном деле не может быть какой-либо самодеятельности, связанной с отсутствием элементарных знаний о проблемах возникновения форм микроорганизмов, устойчивых к антибиотикам.
435
ЗАКЛЮЧЕНИЕ
Проблема антибиотиков — один из самых больших и, по существу, комплексных разделов науки, успешно развивается во всех ее разнообразных направлениях. С одной стороны, продолжаются поиски новых, еще более эффективных препаратов, образуемых различными группами организмов, а с другой стороны, интенсивно развиваются исследования по направленному биосинтезу разнообразных антибиотиков; расширяются работы по химическому синтезу производных этих веществ, химической модификации природных антибиотиков.
Получение новых антибиотиков при направленном биосинтезе — один из важнейших разделов современной микробиологии. Для успешного развития этого направления важное значение приобретает изучение путей биосинтеза антибиотиков, изучение факторов, оказывающих влияние на этот процесс.
Большую роль в производстве необходимых количеств ценных антибиотических веществ имеет проблема получения высокопродуктивных штаммов продуцентов этих биологически активных соединений с использованием современных методов селекции и генной инженерии, а также разработка наиболее эффективных способов выделения, очистки и стабилизации антибиотиков.
В науке об антибиотиках большую роль призваны сыграть исследования химиков и биохимиков в тесном содружестве с микробиологами и микологами.
При широком применении антибиотиков в медицине, сельском хозяйстве, в пищевой и консервной промышленности возникает первоочередная необходимость точного определения механизмов действия этих физиологически активных веществ. Для большинства антибиотиков, уже нашедших практическое использование, механизм их биологического действия остается пока не до конца выясненным.
Глубокое и всестороннее изучение физиологии и биохимии продуцентов антибиотиков и самих препаратов — актуальный вопрос учения об антибиотических веществах. Успешное решение всех проблем, относящихся к антибиотикам, возможно лишь при совместной работе специалистов различных направлений.
Учение об антибиотиках остается и еще длительное время будет оставаться одним из интереснейших разделов естествознания как в теоретическом, так и в практическом отношении.
ЛИТЕРАТУРА
Основная
Антибиотики и их продуценты (сборник работ).— М.: Наука, 1975.
Гейл И. Ф. и др. Молекулярные основы действия антибиотиков: Пер. с •англ./Под ред. Г. Ф. Гаузе. — М.: Мир, 1975.
Производство антибиотиков/Под ред. С. М. Навашина и др. — М.: Медицина, 1970.
Ланчини Д., Паренти Ф. Антибиотики: Пер. с англ. — М.: Мир, 1985.
Смирнов В. В., Василевская И. А., Резник С. Р. Антибиотики. — Киев: Вища школа, 1985.
Дополнительная
Егоров И. С. Микробы-антагонисты и биологические методы определения антибиотической активности. — М.: Высшая школа, 1965.
Навашин С. М., Фомина И. П. Рациональная антибиотикотерапия. — М.: Медицина, 1982.
Сазыкин Ю. О. Антибиотики как ингибиторы биохимических процессов.— М.: Наука, 1968.
Сазыкин Ю. О. Антибиотики как биохимические реагенты. Итоги науки и техники, сер. Биологическая химия, т. 20. — М„ 1984.
Korzybski Т., Kowsyk-Gindifer Z., Kurylowiez W. Antibiotics (Origin, nature and properties), v. I—III, Am. Soc. of Microbiology. — Washington, 1978.
УКАЗАТЕЛЬ АНТИБИОТИКОВ
Авермиктины 430
Адриамицин 196
Азасерин 10, 31, 33, 158, 373, 390, 391, 397
Азомицин 38, 354
Азотомицин 10
Актидион (циклогексамид) 31, 34, 46, 354, 373, 428
Актинолейкнн 353
Актиномицетин 8, 195
Актиномицин 10, 24, 31, 46, 130, 195, 269, 272, 276, 277, 353, 357, 373
Актиномицин II (Ап, Ъп) 274
Актиномицин III (A/и, B;//) 274
Актиномицин IV 275
Актиномицин V 275
Актиномицины 30, 31, 40, 50, 53, 77, 106, 107, 191, 193, 269—278*, 319, 354, 357, 358, 359, 381, 391, 392
Актиномицин А 269, 270
Актиномицин А2 270
Актиномицин As 270
Актиномицин В 270
Актиномицин В2 270
Актиномицин В5 270
Актиномицин С 32, 40, 270, 278, 357, 374, 391, 396
Актиномицин Ci 270, 273
Актиномицин С2 270, 273, 357
Актиномицин С3 270, 273, 357
Актиномицин D 192, 270, 278, 374, 391, 396
Актиномицин D (Ci) 271
Актиномицин Е 270
Актиномицин Fj 270
Актиномицин F2 270
Актиномицин X 270
Актиномицин Х2 270
Актинотиоцин 70
Актитиазовая кислота 353, 372
Алиомицин 353
Аллилмеркаптометилпенициллин 316
Аллицин 22, 30, 33, 344, 345, 373
Альбомицин (новобиоцин) 31, 32, 41, 64, 67, 72, 139, 290, 373
Альфицетин (хлорамфенилкол) 266
Амбрамицин (тетрациклин) 259
Амидомицин 39
Амикацин 238
Амилпенициллин 316
Амиминин (олеандомицин) 285
Аминогликозиды (аминоциклитолы)
197, 338, 406
Ампициллин 32, 322, 323, 337, 399, 402
Амфотерицин В 32, 287
Антибиотик А-377 (хлортетрациклин) 242
Антибиотик М-4209 (магнамицин) 284
Антибиотик РА-93 (новобиоцин) 290
Антибиотик РА-97 (магнамицин) 284
Антибиотик SAX-10 353
Антимикоин 353
Антимицины 31, 35, 373, 394
Антимицин А1 394
Антимицин А3 394
Антифлей-фактор 353
Антрациклин 338
Ареномицин 33
Аскозин 31, 33, 373
Аспергиллин 343
Аурантин 62, 68, 82, 107, 272—274, 277, 278, 358, 391
Аурантин 1 (АуО 358
Аурантин 2 (Ау2) 358
Аураитнн 3 (Ау3) 358
Аурантин 5 (Ау3) 358
Аурантин 6 (Ays) 358
Аурантин 7 (Ау7) 358
Ауренин 33
Ауреомикоин (хлортетрациклин) 242
Ауреомицин (хлортетрациклин) 242
Ауреотрицин 353
Ахромицин (тетрациклин) 259
Ахромовиромицин 353
Бактериоцины (протесцины) 192
Бализ 19
Бацитрацин 27, 30—32, 88, 91, 93, 116, 184, 366, 373
Бацитрацины 39, 70, 167, 184—187, 191, 192, 291, 354, 360
Бацитрацин А 186, 187
Бацитрацин Ai 186, 187
Бацитрацин В 186
Бацитрацин С 186
Бацитрацин D 186
Бацитрацин Е 186
Бацитрацин Fi 186
Бацитрацин F2 186
Бацитрацин F3 186
Бацитрацин G 186
Бацилломицины 39
* Жирным шрифтом отмечены санце.
страницы, на которых дано основное опн-
438
Бензилпенициллин 23, 27, 31, SISSIS, 320, 323, 330, 332, 334, 356, 366, 373, 376, 399, 402, 403, 421
Берлицетин (хлорамфеникол) 266 Бинан 30, 343
Биомицин (хлортетрациклин) 242, 431
Биотексин (новобиоцин) 290
Бицикломицин 196
Биформин 33
Бицилин 31
Бластицидин S 428, 429
Блеомицин 10, 338, 392, 393
Ботримицин 37
Бревнн 177, 354
Бревиген 177, 178
Бреволин 177, 354
Бресеин 177, 178, 354
Бромтетрациклин 242, 261, 263, 264, 362
Брунеомицин 31, 32, 373, 374, 396
Валидомицин 196, 429
Валиномицин 10, 31, 39, 40, 193, 353, 373, 381, 382, 395
Ванкомицин 32, 69, 289, 370, 373, 406
Веррукарины 341
Биомицин 31, 32, 50, 373
Виргиниамицпн 196
Вирусин 40, 149
Вискозин 30
Вулкамицнн (новобиоцин) 290
Галловая кислота 29, 34
Гелиомицин (резистомицин) 49, 149
Гентамицин 32, 74, 238, 400
Гентамицины 38. 197, 233, 239, 240
Гентамицин А 239, 240
Гентамицин Ci 239
Гентамицин С1а 239
Гентамицин Cj 239
Геомнцин 40
Гептилпенициллин 316, 331
Гербицидин А 429
Гербицидин В 429
Гигромицин 32, 38, 197, 241
Гигромицин А (гомомицин) 241
Гидроксистрептомицин 212, 216
Глиотоксин 46, 48, 70, 354
Глобиспорин 426
Гомомицин (гигромицин А) 241
Грамицидин 24, 50, 69, 169
Грамицидины 30, 31, 39, 95, 170, 191, 192, 289, 373, 381, 395
Грамицидин А 170, 177, 354
Грамицидин В 170, 177, 354
Грамицидин Cd 170, 172, 177, 354
Грамицидин D 170, 177, 354
Грамицидин С 10, 32, 39, 65, 68, 78, 97, 100, 102—105, 116, 117, 157, 167, 170, 171—177, 193, 354, 369, 370, 380
Гратизин 177, 178
Грацейлин 177, 178
Гризеин 41, 53, 354, 426
Гризеовиридин 429
Гризеофлавин (новобиоцин) 290
Гризеофульвин (гризовин, фульвицин, фульцин, грифульвин) 30—32, 35, 36, 338, 339, 340, 373, 426, 428
Гризовин (гризеофульвин) 339
Грифульвин (гризеофульвин) 339
D-циклосерин 30
Дактиномицин 278
Дауномицин 32
Деацетилцефалоспорин 334, 335
Деацетоксицефалоспорин 334, 335
Декоинин 31, 373
Деметилклиндамицин 363
Деметиллинкомицин 361, 363
Деметилтетрациклин 32, 242, 264, 265
Деметилхлортетрациклин 32, 242, 264, 265, 266
Деметилцелестицетин 363
Дермостатин 33
Дескарбамилновобиоцин 24, 292, 294, 299
Десмикозин 286
Дигидроновобиоцин 299
Дигидрострептомицин (антибиотик №23572) 212, 227, 232, 409
Диклоксациллин 32, 406
Динактин 289
Диоксифеназин 353
Дипломицин 30
Дифенициллин 322
Доксициклин 32, 242, 265
Дуаномицин 392
Дуомицин (хлортетрациклин) 242
Зидеромицины 41
Изоиридомирмецин 349, 350
Изоновобиоцин 24, 292, 294, 299, 300
Изопенициллин N 334, 335
Изотетрациклин 259, 260
Изохлортетрациклин 252, 259, 260
Илотицин (эритромицин А) 279
Инамицин (новобиоцин) 290
Интерферон 30, 350, 351
Иридомирмецин 349, 350
Канамицин 31, 32, 50, 237, 238, 373
Канамицин А 237, 238
Канамицин В 237
Канамицин С 237
Канамицины 38, 197, 233, 237
Кандидин 33
Кандимицин 33
Кандистин 304, 305
Кандицидины 31, 354, 373
Каидицидин 33, 93, 95, 288, 380
Кандицин 32
439
Капреомицин I, II 353
Карбенициллин 32, 405
Карбомицнн (магнамицин) 26, 32, 50,
130, 284, 352, 366
Карбомицнн А 353
Карбомицнн В 353
Кардельмицин (новобиоцин) 290
Кардиномицин 10
Кардицин 396
Карлииа-оксид 36
Кармииомицин 196, 360
Касугамицин 429
Катомицин (новобиоцин) 290
Катоцпн (новобиоцин) 290
Клоксациллин 32, 322, 323
Клиндамицин (хлорлинкомицин) 363
Койевая кислота 36
Колимицин 233, 237
Колнстатин 30
Колистин 32, 178
Колистины (полимиксины В, Е) 178
Колистин А (полимиксин Ei) 179, 180
Колистин В (полимиксин Е2) 179, 180
Колиформин 30
Колицины 31, 192, 373
Комисан 177, 178
Космоген 278
Крепин 22
Коумермицин-иовобиоцин 338
Криомицин 120
Кристаллиновая кислота (новобиоцин) 290
Круцин 30, 350
Курамицин 74
Лавендулин 40
Лазалоцид 196
Левомицетин (хлорамфеникол) 32, 266, 268, 277
Леворнн 32, 33, 88, 91, 287—289
Леворин А 288
Леворин Ao, Ai, А2, А3 288
Леворин В 288
Левористатин 288
Лейкомицин (хлорамфеникол) 32, 266
Лензитин 30
Ливпдомицин 196
Лизоцим 30, 347, 348
Линкомицин 32, 338, 363
Литмофунгин 35
Литмоцидин А 35
Лихениформины 167, 185, 187, 192, 360
Лнхениформин А 187
Лихеннформин В 187
Лихеннформнн С 187
Луридин 149
Магнамицин (карбомицнн, антибиотик М-4209, антибиотик РА-97) 37, 278, 279, 284, 285, 430
Магнамицин В 284, 285
Макролиды 278, 279, 319, 338, 352, 353, 406
Макротетралиды 289, 290, 382
Маннозидострептомицин (стрептомицин В) 73, 140, 163, 210, 211, 231, 232, 354, 355
Макарбомицнн 196
Матромицин (олеандомицин) 285
Мемориалин 177, 178
Метациклин (рондомнцин) 32, 242, 265
Метимицнн 31, 37, 278, 373, 430
Метилмицин 354
Метициллин 321, 323, 398
Метоксибензоксазолин 346
Мидекамицин 196
Микогептин 88, 287
Микомицин А 353
Микомнцин В 353
Микотицин 33
Микофеноловая кислота 7, 8
Микротриен 33
Миноциклин 265
Митомицины 31, 391, 392
Митомицин С 32, 391, 392
Мицернн 233, 237, 397
Мицетин 8, 195
Монактин 289
Монензнн 430, 431
Мономицин 402, 403, 406
Моноциклин 32
Нафциллин 321, 323
Неамин (неомицин А) 233, 235
Неомицин 26, 31, 50, 73, 95, 123, 157, 158, 183, 195, 227, 233, 234—237, 354, 364, 373, 401, 403, 406
Неомицины (мицифраднн, фрадиоми-цин) 32, 38, 69, 197, 233, 240, 291, 354
Неомицин А (неамин) 233—235
Неомицин В 233—235
Неомицин С 233—235
Неомицин D 233
Неомицин Е 233
Неомицин F 233
Низин 30, 93, 105, 106, 188, 189, 190» 191, 373, 433—435
Низины 39, 70, 167, 188, 354
Низин А 188
Низин В 188
Низин С 188
Низин D 188
Низин Е 188
Нистатин 10, 26, 31—33, 69, 88, 89, 97, 107, 108, 114—116, 123, 288, 373, 380
Новобиоцин (альбомицин, антибиотик РА-93, биотексин, вулкамнцин, гризеофлавин, инамицин, кардельмицин, катомицин, катоцнн, кристаллиновая кислота, стрептонивицин)
440
24, 26, 30—32, 35, 36, 68, 69, 80, 82, 88, 97, 107—112, 116, 277, 290—301, 359, 364, 373, 393, 394, 401, 423
Нокардамин 38
Нонактин 289, 353, 381
Оксациллин 32, 321, 323, 398, 402— 406
Оксимикоин (окситетрациклин) 254 Оксибензилпенициллин 316 Окситетрациклин (террамицин, оксн-микоин, рномицин) 32, 50, 80, 82, 88, 95, 99, 242, 254—259, 263—266, 354, 372, 386—388, 404, 426, 428, 430
Октапентины 178, 179
Октапентин Ai 179
Октапентин Bi 179
Октапентин Ci 179
Олеандоцин (олеандомиции) 285
Олеандомицин (амимнцин, олеандоцин, ромицил, матромицин) 32, 69, 130, 278, 279, 285, 353, 403, 404
Олететрин (сигмамицин) 403
Оливомицин 31, 32, 373, 374, 396
Олигомицин 31, 381
Олигомнцины 31, 373, 395
Олигомицин А 37
Олигомицин В 37
Олигомицин С 37
Охрам иц ин 34
Панмпцин (тетрациклин) 259
Пантомицин (эритромицин) 279 Параксин (хлорамфеникол) 266 Патулин 31, 48, 373, 395
Пенициллин 5, 7, 8, 16, 22—24, 26, 27, 30, 50, 53, 64, 66, 70, 71, 73, 78, 80, 84, 88, 93, 95, 123, 133, 136, 138— 141, 169, 241, 253, 269, 284—286, 290,291,309—332,311, 317, 334,. 338, 349, 357, 377, 378, 393, 398— 401, 404, 408—410, 417, 421, 427
Пенициллины 10, 38, 118, 186, 291, 316, 321, 324, 354, 356, 373, 376, 379, 401, 406, 410
Пенициллин N (цефалоспорин N) 333—335
Пеницилловая кислота 7, 35, 36, 48 2-Пентенилпенициллин 316 Перимицин (фунгимицин, амином и-цин) 33
Пизатин 30, 346, 347
Пикромицин 278
Пимарицин 279
Пноцианаза 7, 8
Пиоцианин 30, 31, 373
Плюмбагин 35
Полиены 287, 380
Полиеновые макролиды 338
Полимиксин 50, 365
Полимиксины 30, 32, 39, 167, 178—
184, 191, 192, 354, 370, 380, 401
Полимиксин А (аэроспорин) 178—180
Полимиксин Ai 179
Полимиксин А2 179
Полимиксин В 178—180. 182—184,
284, 403
Полимиксин Bi 179, 180
Полимиксин В2 179, 180
Полимиксин В3 179
Полимиксин С 178
Полимиксин Ci (Pi) 179
Полимиксин С2(Р2) 179
Полимиксин D 178, 180, 182
Полимиксин D) 179
Полимиксин D2 179
Полимиксин Е (колистин) 178, 184
Полимиксин Ei (колистин А) 179
Полимиксин Е2 (колистин В) 179
Полимиксин Fi 179
Полимиксин F2 179
Полимиксин F3 179
Полимиксин К 179
Полимиксин М 178, 179, 181, 182, 193
Полимиксин Р 178
Полимиксин Pi(Ci) 178, 179
Полимиксин Р2(С2) 178, 179
Полимиксин Si 179
Полимиксин Ti 179
Полимиксин Т2 179
Полиоксины 429
Полициклин (тетрациклин) 259
Продигнозин 30, 38, 39
Пропициллин 32, 321
Протаптины 30
Пуромицин 10, 38, 192, 389, 396
Рапанон 35
Рафанин 22, 30, 33, 344, 346
Резистомицин (гелиомицнн) 49
Ректилавендомицин 33
Рибостамицнн 196
Рнмактан (рифампицин) 303
Римодицнн 95, 354, 380
Риомицин (окситетрациклин) 254
Ристомицин 32, 95, 97, 107, 108, 112—
114, 116, 406
Ристомицин А 360
Ристомицин В 360
Рифамицины 302, 338
Рифамицин А 302
Рифамицин В 302, 303
Рифамицин С 302
Рифамицин D 302
Рифамицин Е 302
Рифамицин S 302
Рифамицин О 302, 303
Риоамицин SV 302, 303
Рифампицин (римактап) 303, 304
Родомицины 354
Розеины I, II, III 341
Розеофунгин 33
Ромицил (олеандомицин) 285
441
Рондомицин (метациклии) 265
Роридины 341
Рубомицины 32, 392
Рубомицин 10, 31, 123, 374, 396
Рубомицин А 392
Рубомицин Во 392
Рубомицин Bi 392
Рубомицин Ci 392
Сагамицин 196
Салиномицин 430
Саннамицины 233
Саннамиции А 239
Саннамицин В 239
Саннамицин 278
Саркомицнн 10, 31, 34, 373, 390, 391
Сарцидин 353, 366
Сигмамицин (олететрин) 403
Сизомицин 196, 197, 240, 241
Синтомицин 268, 269
Сиомицин 70
Солиномнцин 196
Софрамицин 233
Спермидин 349
Спермин 349
Спинулознн 354
Спирамицин 32, 278
Спорарицин 233
Спорарицин А 239
Стафциллин 323
Стрептограмин 353, 389
Стрептограмин А 353
Стрептограмин В 353
Стрептозотоцин 353
Стрептолнны 40
Стрептомициллин 403
Стрептомицин 16, 26, 30, 32, 50, 51, 53, 64, 68, 69, 72, 73, 78, 80, 82, 88, 95—98, 117, 123, 133, 136, 138—141, 155—158, 183, 184, 186, 195, 197— 232, 235—237, 241, 253, 269, 285, 290, 291, 354, 355, 365, 366, 369, 373, 384, 385, 397, 400—404, 406, 409, 410, 422, 423, 426, 428, 430
Стрептомицины 38, 197, 240, 354 Стрептонивицин (новобиоцин) 290 Стрептотрицин 40, 95, 158, 195 Стрептотрицины 40, 41 Стрептотрицин А 40, 41 Стрептотрицин В 40, 41 Стрептотрицин С 40, 41 Стрептотрицин D 40, 41 Стрептотрицин Е 40, 41 Стрептотрицин F 40, 41 Субтилин 30, 167, 433, 434 Субтилины 70
Териомицин В 354
Термофиллин 30
Террамицин (окситетрациклин) 254
Тетранактин 196, 289
Тетранастин А 429
Тетрациклин (амбрамицин, ахроми-цпн, панмиции, полициклин, тетра-цпи, цикломицнн) 10, 24, 32, 34, 66, 73, 81, 88, 99, 184, 195, 242, 259— 263, 264—266, 291, 305, 354, 355, 361—363, 366. 374, 380, 386—388, 403. 409
Тетрациклины 10, 30—32, 69, 95, 99, 123, 138, 141, 163, 183, 241, 247, 284, 285, 291, 338, 354, 373, 386, 388, 389, 398, 401, 404, 406, 410, 423
Тетрацин (тетрациклин) 259
Тетриомицнн 354
Тилозин 32, 279, 286, 287
Тиомотин 353
Тиопептин 70
Тиострептон 70
Тиротрицин 8, 167, 168, 169, 171, 175
Тироцидии 31, 106, 169, 170, 370, 373
Тироцидин А 39, 170, 177
Тироцидин В 170, 177
Тироцидии С 170, 177
Тироцидииы 39
Тодуомицин 353
Тойокомицин 429
Триен 33
Триенин 33
Тринактин 289
Трихомицин 31, 33, 288. 373, 380 Триходермин 341
Трихотецин 26, 30, 32, 35—37, 48, 87, 91, 107, 340, 341—343, 428
Трихотецин Р 341
Трополоны 35
Туяплицины 35
Туевая кислота 34
Усниновая кислота (бинан) 30, 31, 35, 343, 373
Фагопедин (фумагиллин) 338
Фазеолин 30, 346, 347
Фармицетин (хлорамфеникол) 266
Фенбенициллин 321
Фенетициллин 32, 321
Феноксиметилпенициллин 31, 316, 318, 320, 323, 356
Филипин 279, 380
Финомицин 37
Фитоалексины 30, 346
Фитонциды 344
Флавицид 33
Флавомицин 33, 233
Флеомицин 41
Флоримицин 69
Фортимнцины 32, 38, 196, 197, 233, 239
Фортимицин 233
Фортимицин А 239
Фортимицин В 239
Фосфономицин 74
Фрадицин 234, 354
Фугиллнн (фумагиллии) 338
442
Фузидин 32
Фульвицин (гризеофульвин) 339
Фульцин (гризеофульвин) 339
Фумигатин 35, 354
Фумагиллин (фугиллин, фумидил, фа-гопедин) 27, 32, 33, 117, 149, 318, 339, 365, 366, 430
Фумидил (фумагиллин) 338
Фунгохромин 33
Фураномицин 31
Хадацидин 372, 373
Хальмугровая кислота 34
Хемиоцетин (хлорамфеникол) 266
Хетомин 30
Хлорамфеникол (хлоромицетин, левомицетин, лейкомицин, паракснн, хлоронитрин, альфицетин, фармице-тнн, хемиоцетин, берлицетин) 10, 31, 32, 34, 46, 51, 72—74, 95, 98, 123, 130, 183, 184, 191, 195, 241, 266—269, 291, 338, 361, 366, 373, 388—390, 401—404, 406, 430
Хлордеметилтетрациклин 361
Хлореллин 30
Хлорнитрин (хлорамфеникол) 266
Хлоролинкомицин (клиндамицин) 363
Хлоромицетин (хлорамфеникол) 195, 266
Хлортетрациклнн (ауреомицин, биомицин, дуомицин, ауреомикоин, антибиотик А-377) 32, 50, 64, 66, 73, 80, 82, 88, 95, 99, 139, 186, 195, 242—254, 257—259, 261—265, 300, 354, 355, 361, 362, 380, 386, 388, 401, 402, 404, 426, 430, 435
Хондамицин 37
Хризомаллин 278
Хромомицин 353
Целестицетин 363
Целикомицнны 35
Цефалексин 32, 336, 337
Цефалоглицнн 32, 336, 337
Цефазолин 405
Цефалоспорин 24, 30, 70, 93, 332—338, 373, 406
Цефалоспорины 32, 118, 354, 376, 379, 410
Цефалоспорин С 333—335
Цефалоспорин N (пенициллин N) 333
Цефалоспорин Р 333
Цефалоридин 32, 336, 337, 405
Цефалотин 32, 336, 337, 405
Циклогексамид (актиднон) 428
Цикломицин (тетрациклин) 259
Циклосерин 32, 38, 69, 164, 372, 373,
376, 396
Циркулииы 178
Циркулин А 178, 179, 180
Цнркулии В 178, 179
Цитринин 29, 35, 36, 48, 343
Шоудомицин 352
Эдеин 31, 177, 354, 373
Эйромицнн 352
Экмолин 22, 30, 349
Эндокроцин 35
Эндомицин 31, 95, 373, 380
Эндомицин В (геликсин В) 33
Эндурациднн 196
Энниатин А 382, 383
Энниатин В 39, 40, 382
Энниатин С 382
Энниатины 381, 382
Энтеромицин 352
Эритрин 22, 348, 349, 369
Эритромицин 26, 31, 32, 37, 50, 69. 130, 139, 141, 163, 164, 278, 279, 281—283, 285, 286, 290, 291, 366, 373, 389, 401, 403, 423
Эритромицин А (илотицин) 279—282
Эритромицин В 279, 280
Эритромицин С 279—281
Эритромицины (илотицин, эрицин, эритроцин, пантомицин) 279, 410
Эритроцин (эритромицин) 279
Эрицин (эритромицин) 279
Эрлихип 149
Эсеин 177, 178, 354
Этамицин 39, 193
Эхиномицины 39, 70, 193
Эуроцидин 354
Яваницин 35
ОГЛАВЛЕНИЕ
СО 1О
Предисловие к четвертому изданию...................................
Введение...........................................................
ЧАСТЬ ПЕРВАЯ АНТАГОНИЗМ В МИРЕ МИКРООРГАНИЗМОВ И ОБРАЗОВАНИЕ АНТИБИОТИЧЕСКИХ ВЕЩЕСТВ
Глава первая. Взаимоотношения микроорганизмов в естественных условиях ......................................................... . . 13-
Антагонизм в мире микроорганизмов..................................... 16
Глава вторая. Понятие об антибиотиках и их классификация. Что такое антибиотики? ....................................................... 22
Единицы биологической активности антибиотиков........................ 25
Антибиотическая продуктивность организмов ............................ 27
Классификация антибиотиков............................................ 28
I. Классификация антибиотиков по биологическому происхождению 29
II. Классификация антибиотиков по механизму биологического действия ........................................................... 30
III. Классификация антибиотиков по спектру биологического действия 31
IV. Классификация антибиотиков по химическому строению............. 33
Глава третья. Образование антибиотиков в природе и их биологическая роль............................................................... 43
Образование антибиотических веществ в естественных условиях развития организмов................................................ 43-
Биологическая роль антибиотиков в природе...................... 51
Глава четвертая. Антибиотические свойства микроорганизмов при лабораторном культивировании ............................................. 56
Условия, необходимые для проявления микроорганизмами антибиотических свойств при лабораторном культивировании ................... 56
Среды для культивирования микроорганизмов .......... 57
Качественная характеристика компонентов среды..................... 61
Источники азота.................................................. 62
Источники углерода............................................... 64
Количественное соотношение источников углерода и азота в среде . . 66
Источники минерального питания и их роль в развитии микроорганизмов ............................................................ 67
Макроэлементы и их значение в жизнедеятельности микроорганизмов 68
Микроэлементы и их физиологическая роль.................. 72
Роль галогенов и воды в жизнедеятельности микроорганизмов ... 74
Влияние pH среды........................................... 75
Температура ....................................................... 76
Аэрация.................................................... 77
О двухфазном характере развития продуцентов ряда антибиотиков ... 81
Совместное культивирование микроорганизмов и его роль в биосинтезе антибиотиков ..................................................... 85-
444
Образование антибиотиков иммобилизованными клетками микроорганизмов .............................................................. 92
Глава пятая. Значение антибиотиков в жизнедеятельности организмов, продуцирующих эти биологически активные вещества ..................... 94
Глава шестая. Выделение продуцентов антибиотических веществ и методы определения их биологического действия .......................... 117
Выделение микробов-антагонистов...................................... 119
Основные методы выделения микробов-продуцентов антибиотиков . . 121
Методы идентификации микроорганизмов-продуцентов антибиотических веществ.................................................... 124
Методы выделения и очистки антибиотиков........................... 132
Антимикробный спектр и токсичность............................... 132
Лечебные свойства антибиотиков ........................... ..... 133
Лабораторный регламент.......................................... 134
Пути повышения антибнотикообразующей способности микроорганизмов 136
Селекция наиболее активных форм продуцентов антибиотиков ... 136
Изучение условий культивирования выделенных штаммов микроорганизмов-продуцентов антибиотиков.................................. 141
Сохранение штаммов продуцентов антибиотиков в активном состоянии 142
Определение антибиотической активности микроорганизмов .............. 143
Методы определения антибиотической активности микроорганизмов, выросших на твердых средах........................................ 143
Определение антибиотической активности микроорганизмов при культивировании их в жидких питательных средах . ..................... 146
Определение антивирусного действия антибиотиков .................. 147
Определение противофаговой активности............................. 149
Определение противоракового действия антибиотиков ................ 149
Методы количественного определения антибиотиков..................... 153
Биологические методы........................................... 154
Химические и физико-химические методы............................. 162
ЧАСТЬ ВТОРАЯ
АНТИБИОТИКИ, ОБРАЗУЕМЫЕ РАЗЛИЧНЫМИ ГРУППАМИ ОРГАНИЗМОВ, УСЛОВИЯ ИХ БИОСИНТЕЗА.
МЕХАНИЗМ ДЕЙСТВИЯ И ПРИМЕНЕНИЕ
Глава седьмая. Антибиотики, образуемые собственно бактериями . . . 167
Тиротрицин (Tirothricin)............................................ 168
Грамицидины (Gramicidins)............................................ 170
Грамицидин С (Gramicidin S)....................................... 171
Условия образования ............................................ 172
Выделение грамицидина С........................................ 174
Антимикробный спектр и применение............................... 174
Химическое строение и синтез.................................... 175
Полимиксины (Polymyxins)............................................. 178
Условия образования и выделение................................. 182
Антимикробный спектр и применение............................... 183
Бацитрацины (Bacitracins)............................................ 184
Условия образования ............................................ 185
Антимикробный спектр и применение............................... 185
Строение бацитрацина А......................................... 186
Лихениформины (Licheniformins) ...................................... 187
Низины (Nisins)...................................................... 188
Условия образования .. ......................................... 188
Строение ннзнна ..... .......................................... 190
Механизм биосинтеза низина..................................... 191
Бактерноцииы (Bacteriocins).......................................... 192
445
Образование D-ампнокислот. входящих в состав полипептидных антибиотиков ................................................................. 192
Глава восьмая. Антибиотики, образуемые актиномицетами ...... 195
Ампногликозидные антибиотики, или аминоциклитолы................... . 197
Стрептомицин (Streptomycin)......................................... 197
Условия биосинтеза стрептомицина.................................. 198
Физиолого-биохимические особенности развития Streptomyces griseus ............................................................. 206
Ферментативная деятельность продуцента стрептомицина .... 209
Изучение путей биосинтеза стрептомицина........................... 212
Промышленное получение стрептомицина ............................. 222
Выделение стрептомицина из культуральной жидкости................. 223
Стабильность стрептомицина........................................ 225
Зависимость антибиотической активности стрептомицина от pH среды и ее состава................................................... 226
Антибиотические свойства стрептомицина............................ 227
Токсические и лечебные свойства стрептомицина..................... 229
Маннозидострептомицин (Mannosidostreptomycin) .... ... 231
Дигидрострептомицин (Dihydrostreptoniycin).......................... 232
Неомицины (Neomycins).................................... . . 233
Канамицины (Kanamycins)............................................. 237
Фортимицины (Fortimycins)........................................... 239
Гентамицины (Gentamycins)........................................... 239
Сизомицин (Sisomycin)............................................... 240
Гигромицин (Hygromycin)............................................. 241
Тетрациклины и хлорамфеникол......................................... 241
Хлортетрациклнн (Chlortetracyclin).................................. 242
Условия образования хлортетрациклина ............................. 242
Антибиотические свойства хлортетрациклина . . 253
Применение хлортетрациклина ........................ ... 253
Окситетрацнклнн (Oxytetracyclin).................................... 254
Тетрациклин (Tetracyclin)........................................... 259
Бромтетрациклин (Bromtetracyclin) .................................. 263
Деметилхлортетрациклин и деметилтетрациклин (Demethylchlortetra-cyclin, demethyltetraciclin)........................................ 264
Хлорамфеникол (Chloramphenicol)..................................... 266
Химическая природа хлорамфеникола и его синтез.................... 268
Антибиотические свойства хлорамфеникола........................... 269
Применение хлорамфеникола......................................... 269
Актиномицины (Actinomycins)............................................ 269
Образование актиномицинов......................................... 271
Механизм действия актиномицинов .... 278
Макролиды............................................................ 278
Эритромицины (Erythromycins)........................................ 279
Условия биосинтеза эритромицина................................... 28]
Антимикробный спектр.............................................. 283
Применение эритромицина........................................... 283
Магнамицин (Magnamycin)............................................. 284
Олеандомицин (Oleandomycin)......................................... 285
Тилозин (Tylosin)................................................... 286
Полнены................................................................ 287
Микогептин (Mycoheptin) ............................................ 287
Леворин (Levorin)................................................... 287
Макротетралиды (Macrotetralids) ....................................... 289
Новобиоцин (Novobiocin)................................................ 290
Антимикробный спектр.............................................. 291
Условия образования новобноцина .................................. 292
Специфические стимуляторы биосинтеза новобноцина.................. 297
Биохимические изменения в мицелии актиномицета и в среде в процессе образования новобноцина ................................. . 298
446
Химическое строение новобиоцина ................................... 299
Рифамицииы (Rifamycins)................................................. 302
Глава девятая. Антибиотики, образуемые грибами и лишайниками . . . 309
Пенициллин (Penicillin)............................................... 309
Условия образования пенициллина ................................... 311
Предшественники биосинтеза пенициллина............................. 315
Полусинтетический способ получения пенициллинов.................... 320
Химический синтез пенициллина...................................... 323
Фазы процесса развития гриба и биосинтеза пенициллина .... 323
Пути биосинтеза молекулы пенициллина............................... 327
Выделение пенициллина.............................................. 329
Действие пенициллина на бактерии................................... 330
Применение в медицине.............................................. 331
Цефалоспорин (Cephalosporin)............................................ 332
Механизм биосинтеза цефалоспорина.................................. 334
Полусинтетические аналоги цефалоспорина............................ 336
Фумагиллин (Fumagillin)................................................. 338
Гризеофульвин (Griseofulvin)............................................ 339
Трихотецин (Trichothecin) .............................................. 340
Антибиотики из лишайников............................................... 343
Глава десятая. Антибиотики, образуемые высшими растениями и животными ................................................................ 344
Антибиотические вещества высших растений................................ 344
Аллицин (Allicin) ................................................. 345
Рафанин (Raphanin)................................................ 346
Фитоалексины ........................................................ 346
Антибиотики животного происхождения..................................... 347
Лизоцим (Lysozyme)................................................ 347
Эритрин (Eritrin) ................................................. 348
Экмолин (Ecmolin).................................................. 349
Спермин и спермидин (Spermin, Spermidin)............................. 349
Иридомирмецин и изоиридомирмецин (Iridomyrmecin, Iso-Iridomyr-mecin) .............................................................. 349
Круцин (Cruzin)...................................................... 350
Интерферон (Interferon).............................................. 350
Глава одиннадцатая. Направленный биосинтез антибиотиков................. 352
Изменение состава питательной среды .................................... 356
Введение специфического ингибитора...................................... 361
Использование мутанта исходного штамма.................................. 363
Воздействие микроорганизма или его фермента.......................... 363
Мутосннтез.............................................................. 364
Глава двенадцатая. Характер и механизм биологического действия антибиотиков ............................................................... 366
Обшие сведения о действии антибиотиков.................................. 366
Поглощение антибиотиков клетками микробов............................... 369
Конкурентное подавление ... ....................................... 371
Инактивация сульфгидрильных групп ферментов........................ 373
Основные механизмы биологического действия антибиотиков................. 373
I. Антибиотики, подавляющие синтез клеточной стенки бактерий 374
II. Антибиотики, нарушающие функции мембран........................ 379
III. Антибиотические вещества, подавляющие синтез белка .... 383
IV. Антибиотики — ингибиторы синтеза пуринов и пиримидинов . . 390
V. Антибиотики, ингибирующие синтез нуклеиновых кислот .... 391
VI. Антибиотики — ингибиторы дыхания............................... 394
VII. Антибиотики — ингибиторы окислительного фосфорилирования 395
447
VIII. Антибиотики — антиметаболиты................................ 395
IX. Антибиотики — иммунодепрессанты .............................. 396
Устойчивость микроорганизмов к действию антибиотиков.................. 396
Пути применения антибиотиков, сдерживающие возникновение устойчивых к ним форм микроорганизмов ...................................... 402
Побочные реакции, возникающие при применении антибиотиков .... 405
Глава тринадцатая. Основные этапы промышленного получения антибиотиков ..................................................... ....... 408
Общие сведения о производстве антибиотиков............................ 408
Методы культивирования продуцентов антибиотиков ...................... 412
Ферментеры ..................................................... 412
Стерилизация питательных сред..................................... 414
Подготовка посевного материала................................... 416
Развитие продуцента антибиотика в ферментерах ..................... 417
Предварительная обработка культуральной жидкости, выделение и химическая очистка антибиотиков ........... ......................... . 419
Сушка, контроль и расфасовка препарата................................ 421
Актинофагия и ее значение в производстве антибиотиков ....... 422
Глава четырнадцатая. Применение антибиотиков в сельском хозяйстве, в пищевой и консервной промышленности............................ 425
Антибиотики в растениеводстве ........................................ 425
Антибиотики в животноводстве..................................... 429
Действие антибиотиков на микрофлору кишечника животных .... 431
Непосредственное действие антибиотиков на организм животного . . 432
Антибиотики в пищевой промышленности............................ 432
Антибиотики в консервной промышленности....................... 433
Использование антибиотиков при сохранении свежего мяса, рыбы и птицы....................................................... 434
Антибиотики и сохранение молока и молочных продуктов ..... 435
Заключение....................................................... 436
Литература....................................................... 437
Указатель антибиотиков........................................... 438
Учебное издание
Николай Сергеевич Егоров
ОСНОВЫ УЧЕНИЯ ОБ АНТИБИОТИКАХ
Заведующий редакцией А. Г. Гаврилов
Редактор К. Г. Парсаданова
Младшие редакторы И. М. Павлова, Е. И. Попова
Художник В. Н. Хомяков
Художественный редактор Т. А. Колеикова
Технический редактор А. К- Нестерова
Корректор С. К. Завьялова
ИВ № 5720
Изд. № Е—464. Сдано в набор 02.10.85. Поди, в печать 21.03.86. Т-09502. Формат 60 X 90*/ie. Бум. офс. № 2. Гарнитура литературная. Печать высокая. Объем 28 усл. печ. л. 4- 0,25 усл. леч. л. форзац 28.25 усл. кр.-отт. 30.12 уч.-изд. л. + форзац 0,43 уч.-изд. л. Тираж 15 000 экз. Зак. № 742. Цена 1 р. 30 к.
Издательство «Высшая школа». 101430, Москва, ГСП-4, Неглиииая ул., д. 29/14.
Ярославский полиграфкомбинат Союзполиграфпрома при Государственном комитете СССР ло делам издательств, полиграфии и книжной торговли. 150014, Ярославль, ул. Свободы. 97.