Author: Луценко И.Ф.
Tags: химия органическая химия переводная литература издательство иностранной литературы органические реакции
Year: 1963
Text
ORGANIC REACTIONS
Volume 10
EDITORIAL BOARD
ROGER ADAMS, Edltor-ln-Chlef
К. H. BLATT DAVID Y. CURTIN
VIRGIL BOEKELHEIDE FRANK C. McGREW
ARTHUR C. COPE CARL NIEMANN
ADVISORY BOARD
LOUIS F. FIESER JOHN R. JOHNSON
HAROLD R. SNYDER
ASSOCIATE EDITORS
ERNST D. BERGMANN RAPHAEL PAPPO
DAVID GINSBURG STANLEY M. PARMERTER
ROBERT R. PHILLIPS
FORMER MEMBERS OF THE BOARD
HOW DECEASED
HOMER ADKINS WERNER E. BACHMANN
New York
John Wiley & Sons, Inc.
London • Chapman & Hall, Limited
ОРГАНИЧЕСКИЕ
РЕАКЦИИ
Сборник 10
ПЕРЕВОД С АНГЛИЙСКОГО
ДОКТОРА ХИМ. НАУК ПРОФ. А. Ф. ПЛАТЭ
ПОД РЕДАКЦИЕЙ
ДОКТОРА ХИМ. НАУК ПРОФ. И. Ф. ЛУЦЕНКО
1963
И здателъство
ИНОСТРАНЙОЙ ЛИТЕРАТУРЫ
Москва
Книга представляет собой десятый том серии сборников «Ор-
ганические реакции» и содержит три главы, посвященные реак-
циям сочетания солей диазоиия с соединениями алифатического
ряда, реакциям Яппа и Клингемана и реакциям конденсации Ми-
хаэля.
Книга предназначена для широкого круга химиков-органи-
ков.
Редакция литературы по химии
ОТ РЕДАКЦИИ
Десятый том сборника «Органические реакции» продолжает
серию переводов американского издания ’«Organic Reactions»,
выпускаемую Издательством Иностраннойлитературы. Нача-
тое 20 лет назад издание этой серии завоевало широкое при-
знание среди химиков-органиков. Обзоры по наиболее важным
реакциям органической химии, опубликованные в предыдущих
выпусках (свыше 70 обзоров), оказывают большую помощь в
работе, так как исследователю часто бывает"необходимо приме-
нить некоторые из хорошо известных реакций синтеза. Нали-
чие полных, с исчерпывающей библиографией обзоров намного
упрощает задачу проведения экспериментов в оптимальных
условиях.
Книга содержит три обзорные статьи. В первой главе изло-
жен материал по реакциям сочетания солей диазония с соеди-
нениями алифатического ряда. Эта реакция, открытая Викто-
ром Мейером еще в конце прошлого века, получила в дальней-
шем значительное распространение. В ней рассматриваются
реакции с различными классами алифатических соединений,
которые содержат относительно подвижный атом водорода.
Частный случай этой реакции — реакция Яппа — Клингемана,
описанная в небольшой второй главе. В этой главе собран ма-
териал по реакциям сочетания солей диазония с алифатиче-
скими соединениями, при которых происходит сольволиз про--
дукта реакции с образованием замещенного гидразина.
Наконец, в третьей главе содержится обширный материал
по реакции Михаэля, впервые представленный с такой полно-
той. Достаточно указать,'что в списке литературы приведено
более 1000 ссылок, а таблицы занимают около половины всего
тома. В обзоре эта важная реакция конденсации подробно рас-
смотрена для самых различных типов органических соединений.
Во всех трех главах весь известный материал, сгруппирован-
ный в таблицах, расположен в таком же порядке, как и в пре-
дыдущих обзорах. В конце каждой главы приведены сводные
таблицы синтезированных соединений. Это очень помогает ис-
следователю, позволяя быстро и достаточно полно получить не-
обходимые.сведения по интересующему вопросу.
Очередной сборник «Органические реакции» представляет
несомненный интерес для химиков, работающих в исследова-
тельских лабораториях, преподавателей, аспирантов и студен-
тов старших курсов химических вузов.
Книга переведена проф. А. Ф. Платэ. Редактирование сбор-
ника провел проф. И. Ф. Луценко, .
1
СОЧЕТАНИЕ СОЛЕИ ДИАЗОНИЯ С СОЕДИНЕНИЯМИ
АЛИФАТИЧЕСКОГО РЯДА
С. М. ПАРМЕРТЕР
ВВЕДЕНИЕ
Соль диазония вступает в реакцию сочетания с алифатиче-
ским соединением, содержащим активированную углерод-водо-
родную связь. В настоящей главе рассматриваются лишь те
реакции, в которых оба атома азота, находящиеся в соли ди-
азония, сохраняются в образовавшейся молекуле. Реакции со-
четания, протекающие с отщеплением какой-либо группы от
активированного метинового соединения (реакция Яппа—Клин-
гемана), рассматриваются в гл. II.
Впервые о сочетании соли диазония с алифатическим соеди-
нением, содержащим активированную связь, сообщил Мейер [1].
Он нашел, что сернокислый фенилдиазоний вступает в реакцию
с натриевой солью нитроэтана с образованием окрашенного сое-
динения, которому было приписано строение азосоединения I.
CeH6N=NCHNO2
I
СН3
I
Вскоре появились сообщения о реакциях сочетания с дру-
гими нитропарафинамй [2—5], а также с ацетоуксусным эфи-
ром [6, 7]. Вопрос о строении продуктов реакции возник после
того, как было обнаружено, что хлористый фенилдиазоний взаи-
модействует с малоновым эфиром с образованием продукта,
идентичного фенилгидразону диэтилового эфира мезоксале-
вой кислоты (II) [8].
C6H5N2C1 + СН2 (СООС2Н5)2
C6H6NHNH2 4- СО (СООС2Н5)2
C6H5NHN=C (СООС2Н6)2
II
Проведение большинства ранних работ по реакциям соче-
тания было вызвано желанием выяснить, какое строение имеют
продукты реакций: азосоединений или гидразонов. В тех слу-
чаях, когда возможны две таутомерные формы, строение соеди-
нений - трудно установить с полной определенностью. Однако
обычно полагают, что гидразон устойчив в тех случаях, когда
реакция сочетания протекает по метильному или метиленовому
8 I. Сочетание солей диазония с соединениями алифатического ряда
атому углерода. Недавно Уилей и Джарбо представили данные
о спектрах поглощения в ультрафиолетовой и инфракрасной об-
ластях, которые подтвердили эту точку зрения [9]. Для некото-
рых соединений, когда реакция сочетания протекает по метино-
вому атому углерода без отщепления какой-либо группы, про-
дукту реакции можно приписать строение только азосоединения.
МЕХАНИЗМ РЕАКЦИИ
Были предложены различные механизмы реакции сочетания.
Димрот заметил, что в эту реакцию вступают только енольные
формы различных кетонов [10]. Он высказал предположение
о том, что первичным продуктом реакции является простой
эфир енола, в результате перегруппировки которого образуется
конечный продукт. Выделение в некоторых случаях промежу-
точных О-азосоединений подтверждает это предположение
ОН
I
C6H6N=NOH СН=С---------> —СН=С— —> —С=С—
I I I
он on=nc6h5 n=nc6h6
[11—13]. Однако такие промежуточные соединения были выде-
лены только в случае реакции высокозамещенных алифатиче-
ских соединений, например трибензоилметана. Возможно, по
этому механизму реакции протекают в особых случаях.
При реакции некоторых а,а-диарилэтиленов с солями ди-
азония может быть выделено кристаллическое промежуточное
соединение [14, 15], которое рассматривают как соль карбо-
ния III. Эта соль легко отщепляет галоидоводород с образова-
нием азосоединения. Эти промежуточные соединения были вы-
делены только в случае очень сложных молекул, так что их
образование нельзя считать частью общего механизма реакции
сочетания со всеми непредельными углеводородами и енолами.
Ar2C=CH2 + Ar'N2X —> (Ar2CCH2N2Ar')+X~ —>
—> Ar2C=CHN=NAr' 4- НХ
III
Буш изучал механизм реакции солей диазония с гидразо-
нами [16—19]. На основании того, что первичные гидразоны (IV)
легко сочетаются с солями диазония, тогда как вторичные ги-
дразоны (V) в такую реакцию не вступают [20], он сделал
предположение, что в результате реакции образуется N-азосое-
динение (VI), которое перегруппировывается затем в произвол-
Механизм реакции
9
ное формазана VII *. В качестве продукта реакции хлористого
фенилдиазония с фенилгидразоном бензальдегида в спиртовом
RNHN=CHR + ArN2X —> RNN=CHR —> RNHN=CR
IV I I
N=NAr N=NAr
VI VII
R2NN=CHR -f- ArN2X —> Реакция не идет
V
растворе ацетата натрия выделено кристаллическое промежу-
точное соединение, которое принято за N-азосоединение [19].
После выпаривания эфирного раствора этого соединения полу-
чен формазан.
В более позднем исследовании реакции между фенилгидра-
зоном бензальдегида и хлористым фенилдиазонием установлено,
что строение продукта реакции зависит от pH реакционной
среды [21, 22]. Из раствора с pH 3 был выделен п-фенилазофе-
нилгидразон бензальдегида. В случае реакции при pH 4—8
получен 4-бензилиден-1, З-дифенилтетразен-1 с выходом до66%,
тогда как при pH > 9 продуктом реакции оказался N, N', С-три-
фенилформазан. При комнатной температуре тетразен превра-
щается в формазан за несколько часов, при нагревании до 90°
это превращение протекает быстрее. Перегруппировка происхо-
дит также в пиридине или в спиртовом растворе едкого кали.
Если перегруппировку проводить в спиртовом растворе едкого
кали в присутствии (3-нафтола, то 1-фенилазо-2-нафтол не обра-
зуется; это свидетельствует о том, что реакция протекает по
внутримолекулярному механизму. Однако при растворении
тетразена в холодном спиртовом растворе хлористого водорода
были выделены обратно фенилгидразон бензальдегида и хлори-
стый фенилдиазоний.
C6H6CH=NNHC6H6 + C6H5N2C1
Р -> C6H5CH=NNHC6H4 (N=NCeH5)-n
c6H6CH=NNC6H5
N=NC6H6
C6H6C=NNHC6H6
N=NC6H6
В большинстве существующих теорий эту реакцию принято
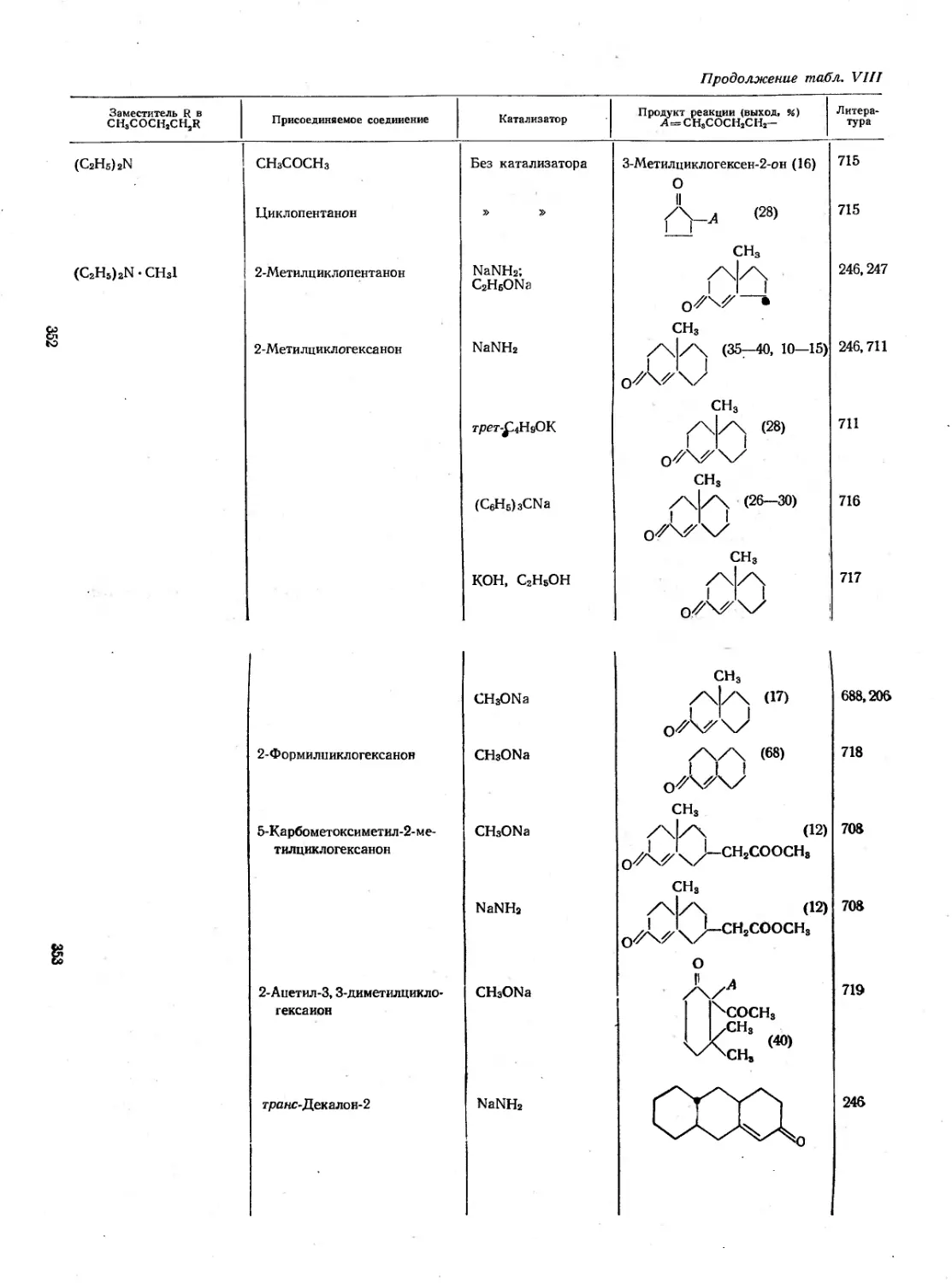
рассматривать как прямую атаку катиона диазония на карб-
* Эти соединения являются производными гипотетического соединения
формазана H2NN=CHN=NH,
10 /. Сочетание солей диазония с соединениями алифатического ряда
анион или на атом углерода с высокой электронной плотностью
[23, 24]. Тарбелл предложил такой механизм для реакции ме-
жду солью диазония и нитрометаном [25]. Считалось, что реак-
ция конечного продукта со второй молекулой соли диазония
также имеет ионный характер.
ArN+ + (CH2NO2)" —> ArN=NCH2NO2 ArNHN=CHNO2
ArN2++ (ArN=NCHNO2)’ —> ArN=NC=NNHAr
NO2
Хотя вторая реакция, по-видимому, находится в противоре-
чии с описанными выше опытами Буша, следует отметить, что
приводимые Бушем факты не исключают возможности ионного
механизма для рассматриваемой реакции. Поскольку реакции в
системе, по-видимому, обратимы, выделение азосоединений и
тот факт, что они могут образовать конечный продукт, не дока-
зывают, что они являются промежуточными соединениями. На-
блюдение, что вторичные гидразоны, например V (см. выше),
не вступают в реакцию, можно объяснить также тем, что для
реакции сочетания требуется карбанион со стабилизированным
резонансом Villa <—> VII16 [26].
RNHN=CHR Основание-> rn=NCHR <-> RNN=CHR
VIII а VIII б
Соли диазония, получаемые из о-аминофенилацетиленов,
претерпевают внутримолекулярное сочетание с образованием
4-оксициннолинов. Шофильд и его сотрудники полагают, что
первой стадией этой реакции является координация катиона
диазония с одним из атомов углерода в ацетилене с последую-
щим присоединением гидроксильного иона к другому атому
углерода [27, 28].
Диазотированные о-аминоацетофеноны также сочетаются
внутримолекулярно с образованием 4-оксициннолинов. Предпо-
лагают, что эта реакция, которой благоприятствует сильноки-
слая реакционная среда, протекает через стадию енолизации
Область применения реакции
11
карбонильной группы [29], катализируемую кислотой.
ОБЛАСТЬ ПРИМЕНЕНИЯ РЕАКЦИИ
Так как данная реакция в основном зависит от характера
алифатического соединения, участвующего в реакции, а не соли
диазония, в дальнейшем изложении за основу принимаются
классы органических соединений, вступающих в реакцию со-
четания.
КЕТОНЫ
В литературе приводится мало примеров реакций простых
кетонов с солью диазония. Ацетон вступает в реакцию с хлори-
стым фенилдиазонием в щелочном растворе с образованием
продукта [30], который позднее был идентифицирован как ме-
тилформазилкетон (IX) [31]. Метильная группа в пировиноград-
ной кислоте также реагирует с двумя молекулами соли ди-
азония [32]. Если один из атомов водорода в ацетоне замещен
активирующей группой, атаке подвергается атом углерода ме-
тиленовой группы.
CH3COCH34-2C6H5N2C1 —> C6H5N=NC=NNHC6H5
I
СОСН3
IX
Из соединений этого класса изучены хлорацетон [33], 2,4-ди-
нитрофенилацетон [34], бромистый ацетонилпиридиний [35] и
ряд З-ацетонил-1,2,4-оксадиазолов [36, 37]. Продукт реакции
бромистого ацетонилпиридиния имеет бетаиновое строение X.
(CH3COCH2NC6H5)+Br~ 4-C6H5N2Cl —> CH3COCNC6HS
II
NNC6H6
e
x
12 I. Сочетание солей диазония с соединениями алифатического ряда
Дикман сообщил, что циклопентандион-1,2 реагирует с хло-
ристым фенилдиазонием с образованием 1-фенилгидразона цик-
лопентантриона-1,2,3 [38]. Единственным примером сочетания
2 молей соли диазония с циклическим кетоном является реакция,
которую Вильштеттер применил для доказательства наличия
двух активированных метиленовых групп в пропиноне (XI) [39].
СН2—СН—СН2 СН2—СН—C=NNHC6H6
II II
NCH3 СО + 2C6H6N2C1 —> NCH3 СО
II II
СН2—СН—СН2 СН2—СН—C=NNHC6HS
XI
При реакции соли диазония с 1-этоксалилинденом (XII) об-
разуется 1-арилазосоединение [40]. Это противоречит наблюде-
нию, согласно которому этоксалильная группа отщепляется
при действии соли диазония на 9-этоксалилфлуорен (XIII) [41].
I II II + ArN2X —> | || ||
\/\/ ^Z/\
Н СОСООС2Н5 ArN=N СОСООС2Н5
XII
ZYnA + ArN2X —> f XiT“A
/\ . II
H СОСООС2НБ . NNHAr
XIII
Реакцию гетероциклических сложных эфиров с 2 молями соли
диазония можно использовать для получения С-гетероцикличе-
ских формазанов [42]. Например, при реакции этилового эфира
2-хинолилпировиноградной кислоты с хлористым п-бромфенил-
диазонием образуется формазан с выходом 79%.
\Y j
'4/\Ni<’XcH2COCOOC2H6 + 2n-BrCeH4N2Cl —>
—>i х ।
XZXN^\c=NNHCeH4Br-n
N=NC6H4Br-n
Было показано, что из производных ацетофенона в реакцию
сочетания вступают только о-аминоацетофеноны. При диазоти-
ровании этих аминов реакция протекает внутримолекулярно,
при этом образуются 4-оксициннолины. Хотя протеканию этой
реакции благоприятствует наличие электроотрицательных групп,
Область применения реакции
13
находящихся в орто- или пара-положении по отношению к ами-
ногруппе, при нагревании раствора диазотированного о-амино-
ацетофенона в соляной кислоте можно получить 4-оксициннолин
(XIV) с выходом 70—75% [43]. Это превращение протекает глад-
ко с различными замещенными о-аминоацетофенонами. Область
ОН
"Ч/ xNH2 4^/\n^
XIV
применения этой реакции была распространена также на о-ами-
нофенацилгалогениды, из которых образуются З-галоид-4-окси-
циннолины [29, 44]. Высшие гомологи о-аминоацетофенона об-
разуют соответствующие З-алкил-4-оксициннолины [45—47].
Метиленовая группа в р-дикетонах легко взаимодействует
с солями диазония. Продукту реакции можно приписать фор-
мулу моногидразона трикетона. Например, бензоилацетон пре-
вращается в монофенилгидразон XV с выходом 90% [48]. В той
C6H6COCH2COCH3-f-C6H6N2Cl —> С6Н6СОССОСН3
II
nnhc6h5
XV
же общей реакции были использованы и другие (3-дикетоны.
Такие циклические р-дикетоны, как циклогександион-1, 3 [49],
метон [50—52] и индандион-1,3 [53, 54], взаимодействуют так
же легко, как и их ациклические аналоги. Из (3-кетоальдегидов
изучены немногие соединения [55—57]. В этих соединениях ме-
тиленовая группа реагирует так же, как и в р-дикетонах.
Р-КЕТОКИСЛОТЫ, СЛОЖНЫЕ ЭФИРЫ И АМИДЫ
При действии на p-кетокарбоновую кислоту соли диазония
выделяется двуокись углерода. В результате взаимодействия
хлористого фенилдиазония с ацетоуксусной кислотой образуется
1-фенилгидразон пировиноградного альдегида (XVI). Если взять
2 моля соли диазония, то продуктом реакции будет метилформа-
зилкетон (XVII) [58]. При проведении этой реакции обычно омы-
ляют р-кетоэфир, а затем к гидролизуемой смеси, не выделяя не-
стойкую р-кислоту, приливают раствор соли диазония [59—61].
СН3СОСН2СООН -|- С6Н5Ы2С1 —> CH3COCH=NNHC6HS
XVI
CH3COCH=NNHC6H6 -J- C6H6N2C1 —> CeH6N=NC=NNHC6H6.
I
COCH3
XVII
14 1. Сочетание солей диазония с соединениями алифатического ряда
Ацетондикарбоновая кислота реагирует с 2 молями соли
диазония с отщеплением обеих карбоксильных групп [62, 63].
Продукт реакции представляет собой диарилгидразон мезокс-
альдегида (XVIII).
СО (СН2СООН)2 + 2ArN2Cl —> СО (CH=NNHAr)2
XVIII
При сочетании р-кетосульфокислот с солью диазония кислот-
ная группа сохраняется [64, 65]. Например, фенилгидразон XIX
получен с выходом 60% из фенацилсульфокислоты.
C6H6COCH2SO3H + C6H5N2CI —> C6H6COCSO3H
II
nnhc6h5
XIX
Реакции p-кетоэфиров с солями диазония изучены довольно
широко. Описано получение продуктов реакций ацетоуксусного
эфира и более чем пятидесяти различных солей диазония. Хо-
рошие выходы а-гидразонов а, p-дикетоэфиров получают, исполь-
зуя 1 моль соли диазония. При реакции с 2 молями хлористого
фенилдиазония отщепляется ацетильная группа и образуется
С-карбэтокси-N, N'-дифенилформазан (XX) с выходом 80% [66].
СН3СОСН2СООС2Н6 + C6H5N2C1 -—> СН3СОССООС2Н6
II
NNHC6H6
СН3СОССООС2НВ 4- C6H5N2C1 .—> C6H6N=NCCOOC2H6
1Г II
NNHC6H6 NNHC6H5
XX
Диэтиловый эфир щавелевоуксусной кислоты также может
реагировать с 1 или 2 молями хлористого фенилдиазония
[67—69]. Если используется 1 моль соли диазония, то продук-
том реакции оказывается фенилгидразон диэтилового эфира
дикетоянтарной кислоты (XXI). При добавлении 2 молей соли
диазония в сильнощелочном растворе происходит замещение
этоксалильной группы.
С2Н6ООССН2СОСООС2Н6 + C6H6N2C1 -—> С2Н6ООСССОСООС2Н6
II
NNHC6H6
XXI
C2H6OOCCCOCOOC2H6+C6H6N2C1 —> C2H6OOCCN=NC6H6
II II
NNHC6H6 NNHC6H6
Область применения реакции
15
! Имеются сообщения об отщеплении только ацетильной и
Этоксалильной групп при реакции 2 молей соли диазония с
p-кетоэфиром, содержащим метиленовую группу. Однако по
аналогии с реакцией Яппа—Клингемана (стр. 148) можно было
бы ожидать, что другие ацильные группы также будут отще-
пляться.
Диэтиловый эфир ацетондикарбоновой кислоты (XXII) глад-
ко реагирует с 1 молем соли диазония [70, 71]. Сообщений о
том, что в дальнейшем может реагировать и вторая метилено-
вая группа, содержащаяся в молекуле, не имеется.
C2H5OOCCH2COCH2COOC2H6+C6HSN2C1 —> С2Н5ООСССОСН2СООС2Н5
NNHC6HS
XXII
Диэтиловый эфир щавелевокротоновой кислоты (XXIII) мож-
но рассматривать как винилог диэтилового эфира щавелевоук-
сусной кислоты. Его взаимодействие с солями диазония за-
висит от pH реакционной смеси [72]. При действии на сложный
эфир избытка хлористого п-бромфенилдиазония в спиртовом
растворе хлористого водорода единственным продуктом реак-
ции оказывается монофенилгидразон XXIV. При добавлении
уксуснокислого натрия этот продукт превращается в азопроиз-
водное XXV. Исходный сложный эфир взаимодействует с 2 мо-
лями соли диазония в разбавленном водном растворе аммиака
с отщеплением этоксалильной группы.
СОСООС2Н5 СОСООС2Н5 СОСООС2Н, 1
1 сн2 C=NNHAr 1 1 C=NNHAr
СН 1 ArN2X СН ArN2X СН
II (НС1) ]| (CH,COONa) ? ||
СН СН С—N^NAr
СООС2Н5 СООС2Н5 СООС2Н6
XXIII XXIV XXV
ArN2X
(NH.0H)
ArN=NC=NNHAr
I
СН
II
СН
I
COOCjHg
16 I. Сочетанце солей диазония с соединениями алифатического ряда
Широко изучены реакции сочетания солей диазония с ани-
лидами р-кетокислот, так как продукты этих реакций нашли
применение в качестве желтых красителей и пигментов. «Жел-
тые ханза» получают в результате реакций ацетоацетанилидов
с различными солями [73—75]. С целью улучшения цвета, стой»
кости и растворимости получаемых красителей изучались реак-
ции различных анилидов и солей диазония. В данной главе не
представляется возможным дать обзор обширной патентной ли-
тературы по этому вопросу. |3-Кетокислоты, о реакциях сочета-
ния которых сообщается в литературе, приведены в табл. ПВ.
Можно считать, что эти красители существуют в обеих тауто-
мерных формах: гидразонов (XXVI) и азосоединений (XXVIIa
и XXVII6).
ОН
I
RCOCCONHAr RC=CCONHAr RCOCHCONHAr
II I I
NNHAr N=NAr N=NAr
XXVI XXVIIa XXVII6
МАЛОНОВЫЕ КИСЛОТЫ, ИХ ЭФИРЫ И АМИДЫ
Малоновая кислота может реагировать с 1, 2 или 3 молями
соли диазония. По-видимому, реакция протекает через следую-
щие стадии, причем на первой и второй стадиях происходит
декарбоксилирование [76]. Даже в тех случаях, когда кислоту
и соль берут в эквимолярных количествах, в результате реакции
обычно получают смесь первых двух продуктов. Относительные
СН2 (СООН)2 4- ArN2X —> ArNHN=CHCOOH
ArNHN=CHCOOH + ArN2X —> ArNHN=CHN=NAr
ArNHN=CHN=NAr + ArN2X —> ArNHN=C (N=NAr)2
количества этих веществ зависят от природы соли диазония.
Бушу и Вольбрингу в результате взаимодействия малоновой
кислоты с хлористым о-нитрофенилдиазонием удалось вы-
делить фенилгидразон XXVIII с выходом 50%. Из хлористого
n-бромфенилдиазония в тех же условиях был получен в основ-
ном N Й'-ди-(п-бромфенил) формазан (XXIX) [77]. При исполь-
зовании 1 или 2 молей большинства солей диазония основным
продуктом реакции является производное формазана.
0-O2NC6H4NHN=CHC0OH n-BrCeH4NHN=CHN=NC6H4Br-n
XXVIII XXIX
Область применения реакции
При добавлении к раствору калиевой соли малоновой ки-
слоты и нитрита натрия кислого раствора соли диазония про-
исходят нитрозирование и сочетание с образованием азопроиз-
водного формальдоксима [77].
ArN2X 4- СН2 (СООК)2 сй.соон ArN=NCH=NOH
При взаимодействии 2 молей хлористого фенилдиазония с
хлормалоновой кислотой образуется хлористый формазил
(XXX) [78]. Алкилмалоновые кислоты по аналогичной реакции
превращаются в формазилалканы (XXXI) [79].
C6HSNHN=CN=NC6H6 CeH6NHN=CN=NC6Hs
I I
Cl R
XXX XXXI
При взаимодействии кислого этилового эфира малоновой
кислоты с солью диазония отщепляется двуокись углерода и
образуется арилгидразон этилового эфира глиоксалевой ки-
слоты (XXXII) [80]. Этот гидразон может реагировать со вто-
рым молем соли диазония с образованием формазана ХХХПа.
По-видимому, этот формазан является единственным выделен-
ным продуктом реакции при отсутствии в соли диазония орто-
заместителя [23, 81]. С другой стороны, диэтиловый эфир мало-
новой кислоты образует арилгидразон диэтилового эфира мезо-
ксалевой кислоты (XXXIII) [82]. Аналогичным путем амид
малоновой кислоты и его N-замещенные производные превра-
щаются в гидразоны соответствующих амидов мезоксалевой
кислоты [83].
НООССН2СООС2Н8 + ArN2X —> ArNHN=CHCOOC2H6 —>
XXXII
—> ArNHN=C (СООС2НБ) N=NAr
ХХХПа
СН2 (СООС2Н5)2 -f- ArN2X —> ArNHN=C (COOCSH6)2
XXXIII
Диэтиловый эфир глутаконовой кислоты (XXXIV) можно
рассматривать как винилог диэтилового эфира малоновой кисло-
ты. Генрих изучил взаимодействие этого соединения с 1 и 2 же
соли диазония [84]. При использовании 1 же соли получают
фенилгидразон диэтилового эфира кетоглутаконовой кислоты
2 Зак. 794
18 /. Сочетание солей диазония с соединениями алифатического ряда
(XXXV). Второй эквивалент вступает в реакцию сочетания прй
другом а-углеродном атоме.
С2Н6ООССН2СН=СНСООС2Н6 4- C6H5N2C1 —>
XXXIV
—> C2HSOOCCCH=CHCOOC2H6
NNHC6H5
XXXV
nnhc6h5 *.
II
С2Н6ООСС=СНССООС2Н6 <-Ce^N,CI CjH5OOCC=CHCH2COOC2Hs
N=NC6H6
N=NC6H6
АРИЛУКСУСНЫЕ КИСЛОТЫ И ИХ ЭФИРЫ
Из арилуксусных кислот изучена реакция сочетания с со-
лями диазония только 2,4-динитрофенилуксусной кислоты [85].
При атаке а-углеродного атома двумя молекулами соли диазо-
ния происходит декарбоксилирование и образуется производное
формазана XXXVI.
'2
\_c/N=NAr
х=/ ^NNHAr
XNO2
XXXVI
При взаимодействии различных солей диазония с метиловым
эфиром 2,4-Динитрофенилуксусной кислоты с хорошими выхода-
ми получены гидразоны метилового эфира 2,4-динитрофенилгли-
оксалевой кислоты (XXXVII) [86, 87]. В присутствии щелочи
эти гидразоны претерпевают замыкание цикла, в результате
чего образуются 1-арилиндазолы (XXXVIII) [86—88].
O2N—СН2СООСН3 —— > O2N—Ч-----------ССООСН3
no2
NO2 NNHAr
XXXVII
N
COONa
+ NaNO2
O2N
Ar
XXXVIII
Область применения реакции
19
, Диэтиловый эфир гомофталевой кислоты не реагирует с
хлористым фенилдиазонием, тогда как ангидрид этой кислоты
в смеси спирта и хлороформа превращается в а-фенилгидра-
зон [89]. Диметиловый эфир 5-нитрогомофталевой кислоты
(XXXIX) также вступает в реакцию сочетания, причем одновре-
менно происходит замыкание цикла и образуется замещенный
дигидрофталазон XL [87].
o2n соосн3
+ C6H6N2C1 —>
XXXIX XL
НИТРИЛЫ
В результате взаимодействия циануксусного эфира с хлори-
стым фенилдиазонием в присутствии уксуснокислого натрия или
соды [90] образуется почти с количественным выходом фенил-
гидразон этилового эфира цианглиоксалевой кислоты (XLI).
C6H5N2CI + СН2СООС2НБ -—> CeH5NHN=CCOOC2HE
I I
CN CN
XLI
Было изучено взаимодействие различных солей диазония с циан-
уксусными эфирами. Другие нитрилы, которые вступают в реак-
цию сочетания того же типа, между циангруппой и какой-либо
другой активирующей группой содержат метиленовую группу.
Примерами могут служить нитрил малоновой кислоты [91, 92],
цианацетальдегид [93, 94], цианацетанилид [80], этиловый эфир
цианпировиноградной кислоты [94, 95], нитроацетонитрил [96,
97], (3-иминонитрилы [98, 99] и р-сульфонитрилы [100, 101]. Про-
дукты реакции сочетания, полученные из p-кетонитрилов, обра-
зуют комплексные соединения хрома, которые являются краси-
телями [102]. Циануксусная кислота вступает в реакцию сочета-
ния с 2 же хлористого фенйлдиазония с образованием циани-
стого формазила [103].
При диазотировании о-аминофенилацетонитрила происходит
замыкание цикла с образованием 3-цианинди азол a (XLII)
2*
20 I. Сочетание солей диазония с соединениями алифатического ряда
с выходом 71% [Ю4]. Циклизация о-аминофенилацетонитрилов,
замещенных в ядре, не изучалась.
,CH2CN
--------------------------------рм
I || NaNOi+HCl ? ||
'^/'xnh2 \/\n/
н
XLII
Нитрилы, в которых циангруппа находится по соседству с
метиновым атомом углерода, взаимодействуют с солями диазо-
ния по-разному. Бензилмалононитрил (XLIII) [105], лактон
а-циан-^-оксимасляной кислоты (XLIV) [106], 1,2,3,4-тетра-
гидроакридин-4-карбонитрил (XLV) [107] и а-арилсульфонилпро-
пионитрилы (XLVI) [101] образуют азосоединения. Согласно
С6Н5СН2СН (CN)j
XLIV
CN
XLV
XLIII
ArSO2CHCN
I
CH3
XLVI
имеющимся данным, этиловый эфир а-цианмасляной кислоты
вступает в две различные реакции. В случае этого эфира Фав-
рель выделил гидразон XLVII, который образовался в резуль-
тате миграции этильной группы, и ожидаемое азосоединение
CsHsCHCOOCjHs + C6H5N2C1 —>
CN
С2Н8 С2НВ
1 I
—> C6H6NN=CCOOC2H54- c6h6n=nccooc2h5
I I
CN CN
XLVII XLVIII
XLVIII [108]. Если ацетильная группа присоединена к метано-
вому атому углерода, как, например, в этиловом эфире а-циан-
ацетоуксусной кислоты, то происходит реакция Яппа — Клинге-
мана с отщеплением ацетильной группы [109].
Известен один пример, когда при реакции сочетания проис-
ходит отщепление циангруппы [42]. Продуктами, выделенными
при реакции З-метилхиноксалин-2-ацетонитрила с хлористым
Область применения реакции
21
n-хлорфенилдиазонием в разбавленном водном растворе ам-
миака, оказались формазан (XLVIHa) и мочевина.
<3
-f-2n-ClC6H4N2Cl
CH2CN
NH.OH „ ^YN\_CHa
C=NNHC6H4Cl-n
I
N=NC6H4Cl-«
XLVIII a
СУЛЬФОНЫ
Метиленовая группа, связанная с двумя сульфонильными
группами, способна вступать в реакцию с солью диазония.
Обычным продуктом реакции является монофенилгидразон
XLIXa, образующийся даже в том случае, когда соль берется
в избытке [НО]. При взаимодействии борофторида м-нитрофенил-
диазония с различными сульфонами были выделены два других
продукта реакции — арилазосульфон XLIX6 и тетразолийбетаин
XLIXb [23].
ф ф
ArN2 -р (RSO2)2 СН2 —> (RSO2)2 C=NNHAr + ArN=NSO2R -f- ArN-N
II II ©
N CO
XLIXa XLIX6 XN/
Ar
XLIXb
В других сульфонах, которые вступают в реакцию сочета-
ния с солями диазония, метиленовая группа находится между
сульфонильной и какой-либо другой активирующей группой, на-
пример нитрогруппой [23, 111], циангруппой [23, 100, 101], кар-
боксильной группой [23, 100], карбэтоксигруппой [23, 100] или
карбоксамидогруппой [23, 100]. Клаасе получил ряд красителей
из циклического амида о-аминофенилсульфонилуксусной кисло-
ты (сульфазона) (XLIXr) и различных солей диазония [112].
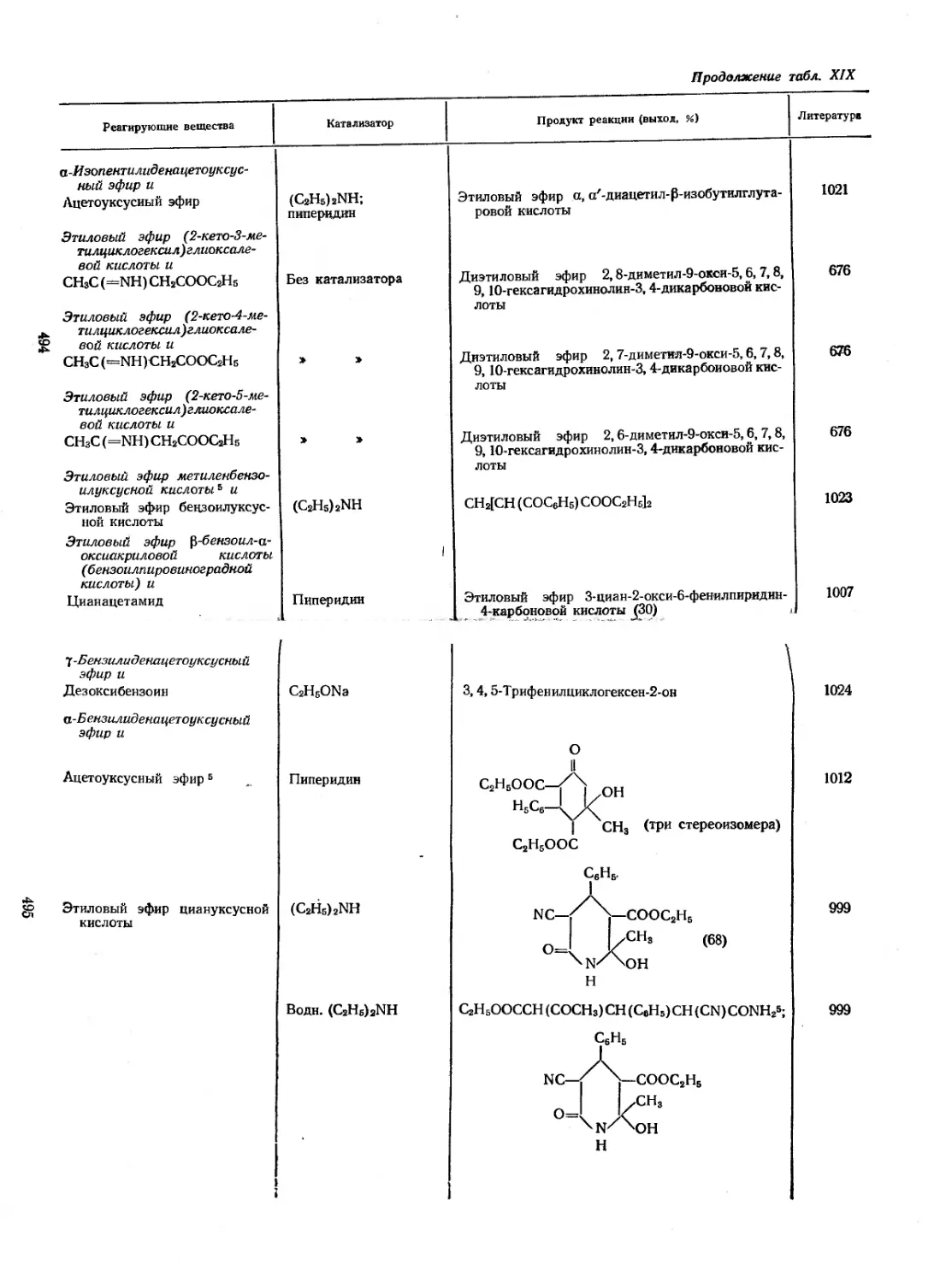
Н
О2
XLIXr
22 Z. Сочетание солей диазония с соединениями алифатического ряда
НИТРОСОЕДИНЕНИЯ
Нитропарафин, который имеет один или больше атомов во-
дорода при а-углеродном атоме, может вступать в реакцию со-
четания с солью диазония. При взаимодействии нитрометана с
хлористым фенилдиазонием [113] образуется смесь продуктов
реакции. При проведении реакции в разбавленной соляной кис-
лоте [114] образуется фенилгидразон нитроформальдегида (L).
В слабощелочном растворе и даже при pH 4,5 основным про-
дуктом реакции является М.М'-дифенил-С-нитроформазан (LI)
[25]. В щелочном растворе при реакции с третьей молекулой
соли диазония нитрогруппа замещается на фенильную группу.
CH3NO2 C6H6NHN=CHNO2 -с^Н|№С1->
L
—> C6H5NHN=CNO2 C,HtN,C1 > C6HSNHN=CC6HS
C6H6N=N C6H5N=N
LI
При взаимодействии нитрометана с другими солями диазо-
ния продуктом реакции обычно является производное нитро-
формазана [25, 115]. Другие первичные нйтропарафины всту-
пают в реакцию сочетания только с 1 молем соли диазония, при
этом образуются гидразоны 1-нитроальдегидов; из вторичных
нитропарафинов образуются азосоединения.
RCH2NO2 + ArN2X —> RCNO2
NNHAr
R2CHNO2 4- ArN2X —> R2CNO2
N=NAr
При взаимодействии нитроспирта с солью диазония иногда
происходит разложение молекулы. Например, из 2-нитропропа-
нола и хлористого фенилдиазония образуются формальдегид и
с выходом 78% фенилгидразон 1-нитроацетальдегида [116]. Ана-
логичным путем 2-нитробутанол-1 превращается в фенилгидра-
зон 1-нитропропионового альдегида. Если реакционную смесь,
N=NAr
I
СН3СН2СНСН2ОН 4- ArN2X —> СН3СН2ССН2ОН —>
I I
no2 no2
LII
—> CH3CH2C=NNHAr 4- CH2O
NOa
Область применения реакции
23
состоящую из 2-нитробутанола-1 и соли диазония, сразу же под-
кислить, то можно выделить 2-арилазо-2-нитробутанол-1
(LI1) [117]. 2-Окси-1-нитропарафины вступают в реакцию соче-
тания обычно с образованием фенилгидразонов 2-окси-1-нитро-
альдегидов. При добавлении второго моля соли диазония про-
исходит отщепление альдегида от этих продуктов [116].
RCHCH2NO2 c°HsN’x-> RCHC=NNHC6H6 -
I I I
OH HO NOj
—> C6H5N=NC=NNHCeH5 + RCHO
I
no2
Если у а-углеродного атома имеются два других электроно-
акцепторных заместителя, одним из которых является фениль-
ная группа, то наблюдается миграция нитрогруппы. В этих слу-
чаях нитрогруппа мигрирует в пара-положение по отношению
к гидразонной группе. (Если пара-положение -занято, то нитро-
группа вступает в орто-положение.) В литературе описаны реак-
ции фенилдинитрометана (LIII) [118—120], дифенилнитрометана
[121, 122] и нитрила а-нитрофенилуксусной кислоты [123].
С6Н5СН (NO2)2 + C6HsN2C1 —> C6H6C=NNH—NO2
УГЛЕВОДОРОДЫ
В данном разделе рассмотрены алифатические углеводороды
и соединения, содержащие реакционноспособный углеводород-
ный радикал, связанный с ароматическим кольцом.
При сочетании многих алифатических углеводородов с со-
пряженными двойными связями с солями диазония образуются
моноазопроизводные [124, 125]. Выходы продуктов обычно низ-
кие даже при использовании реакционноспособных солей ди-
азония, получаемых из n-нитроанилина или 2,4-динитроаиилина.
Сочетание происходит по атому углерода, имеющему наиболее
высокую электронную плотность. Так, в бутадиене-1,3 сочета-
ние происходит по углероду 1, а в пентадиене-1,3 — по угле-
роду 4. Из моноолефинов в реакцию сочетания вступают только
n-O2NC6H4N2X + СН2=СНСН=СН2 —> n-O2NC6H4N=NCH=CHCH=CH2
СН3
I
n-O2NC6H4N2X -р СН3СН=СНСН=СН2 —> n-O2NC6H4N=NC=CHCH=CH8
24 I. Сочетание солей диазония с соединениями алифатического ряда
два соединения — 2-метилпропен и 2-метилбутен-2 [125]. Цикли-
ческие углеводороды, например циклопентадиен [126, 127] и ин-
ден [127] также образуют моноазопроизводные.
Реакции сочетания а, а-диарилэтилёновых соединений с со-
лями диазония рассматривались выше (стр. 8). Аналогичный
реакцией, которая при диазотировании о-аминофенилэтиленов
протекает внутримолекулярно, является синтез циннолинов по
Видману—Штёрмеру [128—130]. Область применения этой ре-
акции изучали Симпсон и Стефенсон [131], а также Шофильд
[132] . Они нашли, что хорошие выходы циннолина получаются
в тех случаях, когда R'—метил или арил, a R— водород. Об-
разование циннолинов происходит и в том случае, если R и
R'—ароматические радикалы. Однако если R'—водород или
карбоксильная группа, a R — ароматический радикал, то диазо-
тированный амин вступает в реакцию Пшорра, в результате
которой образуется производное фенантрена.
При реакции сочетания л-метоксифенилацетилена с серно-
кислым 2,4-динитрофенилдиазонием образуется р-2,4-динитро-
фенилгидразон а-п-анизилглиоксаля (LIV) с выходом 69% [133].
СН3О—С=СН + HO4SN2—КО2 —>
Г
NO2
—> СН3О-^—S—COCH=NNH—NO2
Г
no2
LIV
Эта реакция аналогична синтезу 4-оксициннолина (LV) из ди-
азотированного о-аминофеиилацетилена [134]. В каждом из этих
случаев в продукте реакции появляются гидроксильные группы
из водной реакционной среды. Замыкание цикла впервые осу-
ОН
LV
Область применения реакции
25
ществил Рихтер с целью получения 4-оксициннолин-З-карбоно-
вой кислоты из о-аминофенилпропиоловой кислоты [135]. За по-
следнее время были проведены аналогичные реакции замещен-
ных в ядре о-аминофенилацетилеиов, о-аминофенилпропиоло-
вых кислот и о-аминодифенилацетилена [28, 134].
Стирол не реагирует с сернокислым 2,4-динитрофенилди-
азонием, однако и-метоксистирол (LVI) при действии этого ре-
агента превращается в 2,4-динитрофенилгидразон анисового аль-
дегида [133]. При добавлении сухой соли диазония к спиртовому
раствору анетола (LV11) образуется тот же продукт [136]. В ре-
зультате вторичной реакции отщепляется ацетальдегид. Из дру-
гих соединений в такую же реакцию сочетания с отщеплением
ацетальдегида вступают изоэвгенол [137], изосафрол [136], изо-
апиол [136] и п-пропеиилдиметиланилин [138]. При добавлении
сухого сернокислого и-нитрофенилдиазония к спиртовому рас-
твору n-пропенилфенола можно получить и-нитрофенилгидра-
зон n-оксибензальдегида с выходом 60% [139].
СН3О-<О>-СН=СН2 ^^н,^о.н
LV1
СН3О—\ СН=СНСН3 (OaN)a C*H»N*S.O<»_
LVI1
Реакция а, p-ненасыщенного третичного амина с солью ди-
азония аналогична реакции непредельного углеводорода. Соче-
тание происходит пр p-углеродному атому, при этом отщепляет-
ся аминогруппа. Если у p-углеродного атома находится атом
водорода, то образуется p-арилгидразон соответствующего гли-
оксаля. Если же p-углеродный атом не имеет водорода, то ен-
амин расщепляется с образованием гидразона соответствую-
щего кетона [140].
RCH=CHNR2 + ArN2X —>RCCHO + R2NH
NNHAr
R2C=CHNR2 + ArN2X —> R2Ci=NNHAr + R2NCHO
Метильные группы, находящиеся в а- или -^-положении в не-
которых гетероциклических соединениях, взаимодействуют с
солями диазония. Например, проведены реакции сочетания
2в /. Сочетание солей диазония с соединениями алифатического ряда
9-метилакридина (LVIII) с рядом солей, в результате которых
получены арилгидразоны акридин-9-карбоксальдегида [141].
Если гетероатом превратить в ониевую соль, то реакционная
способность метильной группы повышается [142]. 2,3,3-Триме-
тилиндоленин является исключением, так как в этом случае
основание более реакционноспособно, чем его соли [143]. Изу-
чались следующие гетероциклические соединения: а-пиколин
[142], перхлорат 9-метилксантилия [16], перхлорат 9-метилтио-
ксантилия [15], соли 2,3-диметилбензотиазолия [143—149], соли
хинальдиния [149—151] и соли 2,3,3-триметилиндоления [143,
150, 152]. Метильная группа 2,4,6-тринитротолуола также реа-
гирует с хлористым п-нитрофенилдиазонием в пиридине [142]. .
Этилиденовая группа в 1-фенил-3-метил-4-этилиден-5-пиразолю-
нах также реакционноспособна в отношении солей диазо-
ния [153].
При замыкании цикла, в котором участвует метильная груп-
па, в результате внутримолекулярной реакции сочетания диазо-
тированных о-толуидинов образуется индазол. Из о-толуидина
индазол получают лишь с небольшим выходом [154], но многие
замещенные о-толуидины дают высокие выходы замещенных
индазолов [155]. Типичным примером является получение 5-ни-
троиндазола (LIX) [156].
Н
LIX
ГИДРАЗОНЫ
Арилгидразоны многих алифатических и ароматических аль-
дегидов вводились в реакции сочетания с солями диазония,
в результате которых образовывались производные формазана.
CH3CH=NNHCeH6 + C6H5N2C1 —> CH3C=NNHC6H6
I
N=NC6H5
LX
Примером может служить получение М,М'-дифенил-С-метил-
формазана (LX) из фенилгидразона ацетальдегида с выходом
Область применения реакции
27
88% [157]. Как указано на стр. 8 [20], в такую реакцию вто-
ричные гидразоны не вступают. При рассмотрении нитросоеди-
нений упоминалась реакция фенилгидразонов 2-окси-1-нитро-
альдегидов с расщеплением молекулы и с образованием альде-
гида и нитроформазана. Формазаны, полученные из фенилги-
дразонов альдоз, оказались весьма интересными производными
этих сахаров [158—163].
В формазаны были превращены гидразоны только двух ти-
пов кетонов: арилгидразоны а-кетокиблот (LXI) [20, 164—169] и
а-арилгидразоны эфиров а, р-дикетомасляной кислоты (LXII)
[20, 66, 166, 170]. При сочетании гидразонов первого типа про-
исходит декарбоксилирование, а гидразонов второго типа—за-
мещение ацетильной группы. Эти реакции отщепления напоми-
нают реакцию Яппа — Клингемана.
RCCOOH + C6H5N2X —> RCN=NC6H6 + СО2
II II
nnhc6h5 NNHC6Hs
LXI
CH3COCCOOR + C6H5N2X —> C6H5N=NCCOOR4-CH3COOH
II II
NNHC6H6 NNHC6H3
LXII
Сообщения о том, что удалось выделить две изомерные фор-
мы несимметрических формазанов [19, 171], оказались ошибоч-
ными [172—174]. Несимметрические формазаны, полученные
двумя возможными путями (А и Б), идентичны. Образование
одного и того же соединения в обеих этих реакциях объясняет-
ся тем, что продукт реакции, очевидно, имеет строение резонанс-
ного гибрида хелатных форм (LXIII) [172, 173].
Аг
уА
Путь A: RCH=NNHAr+Ar'NjCl —> RC Н
\n=n/
I
Аг'
Ar'
zA
Путь Б: RCH=NNHAr' + ArN2Cl —> RC H
\n=n/
I
Ar
LXIII
28 /. Сочетание солей диазония с соединениями алифатического ряда
При сочетании формазана, в котором атом углерода соеди-
нен с карбоксильной [20, 76, 164, 175, 176], ацетильной [58, 166]
или оксалильной [177] группой, со второй молекулой соли ди-
азония происходит отщепление этой группы.
RNHN=CN=NR + ArN2Cl —> RNHN=CN=NR
X N=NAr
(X=—COOH, — COCH3, —COCOOH)
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
В этот раздел включены гетероциклические соединения, в
которых метиленовая группа в кольце находится рядом с кар-
бонильной группой. Такие соединения могут существовать так-
же в таутомерной енольной форме.
Из соединений этой группы наиболее подробно изучены 5-пи-
разолоны, так как их азопроизводные нашли широкое примене-
ние в качестве красителей. Здесь рассмотрены не все пиразо-
лоны, описанные в патентной литературе. Обзор более ранних
патентов в этой области опубликовали Ру и Мартине [178], а
некоторые более поздние патенты рассмотрены Венкатарама-
ном [179]. Для получения красителей чаще всего применялись
1-арил-3-метил-5-пиразолоны (LXIV). Пиразолоны, у которых
метильная группа находится в положении 4, не реагируют с со-
лями диазония [180]. С другой стороны, пиразолоны с виниль-
ной, изопропилиденовой или бензалыюй группой в положении 4
вступают в реакцию сочетания с солями диазония, в результате
которой эти группы отщепляются [181, 182].
Н2С—ссн3 1 II ОС N Н2С СО 1 1 ОС NH Н2С—CR 1 II ОС N Н2С—N 1 II ОС N
\N/ \к/ \о/- \Nz 1
Аг Аг 1 R
LXIV LXV LXVI LXV11
К числу других гетероциклических соединений, в которых
имеется метиленовая группа, активная по отношению к солям
диазония, относятся 3,5-пиразолидиндионы (LXV), 5-изоксазо-
лоны (LXVI), 1,2,3-триазолоны-5 (LXVII), 2(3)-тианафтенон
LXVIII
ГП
LXIX
Синтетические возможности метода
29
(LXVIH), 3(2)-тианафтенон (LXIX), 1-фенилоксиндол (LXX),
индоксил (LXXI), барбитуровая кислота и гомофталимид.
Н
LXXI
ПРИМЕНЕНИЕ В СИНТЕЗАХ
Реакции солей диазония с многими алифатическими соеди-
нениями используют только для получения производных, чтобы
охарактеризовать эти соединения. Применимость этой реакции
для крупномасштабных синтезов совершенно очевидна, если
принять во внимание значительное количество красителей, кото-
рые были получены из амидов р-кетокислот и 5-пиразолонов.
Синтез Пшорра и родственные ему реакции циклизации диазо-
ниевых соединений рассмотрены в гл. 7 сб. 9 «Органические
реакции».
ЦИННОЛИНЫ *
Во всех общих методах получения циннолинов используется
внутримолекулярная реакция сочетания соли диазония с каким-
либо алифатическим заместителем в орто-положении. Синтез
Борше [183] из о-аминофенилкетонов (LXXI1) был использован
ОН
LXXH
для получения 3-, 5-, 6-, 7- и 8-замещенных 4-оксициннолинов
[27, 29, 43—47, 183—192]. Метод Рихтера [135], исходными ве-
ществами для которого служат о-аминофейилацетилены
* Обзор по циннолинам см. сб. «Гетероциклические соединения», т. 6, Из-
цатинлит, 1960. — Прим. ред.
30 I. Сочетание солей диазония с соединениями алифатического ряда
(LXXIII), дает возможность получать 3-карбокси- или 3-фенил-
4-оксициннолины [28, 134]. Циннолины с алкильными или ариль-
ными заместителями в положении 4 были получены по методу
синтеза Видмана — Штёрмера из о-аминоарилэтиленов (LXXIV)
[128—130, 193].
R
\/\nh2
LXXIV
З-Нитроциннолины получены в результате реакций сочета-
ния диазотированного о-аминобензальдегида или о-аминоацето-
фенона с нитрометаном с последующей циклизацией арилгидра-
зона нитроформальдегида [194].
o-RCOC6H4N2X + CH3NO2 —> o-RCOC6H4NHN=CHNO2 —>
R
(R=H или CH3)
ИНДАЗОЛЫ
Внутримолекулярная реакция сочетания диазотированных
о-толуидинов использовалась для получения ряда замещенных
индазолов. Этот метод является наилучшим для синтеза нитро-
индазолов (LIX).Хороший выход индазол-3-карбоновойкислоты
получают при проведении реакции через стадию образования
нитрила XLII, исходя из о-аминофенилацетонитрила [104, 195].
Для получения 1-арил-6-нитроиндазолов (XXXVIII) исполь-
зуется реакция соли диазония с метиловым эфиром 2,4-дини-
трофенилуксусной кислоты. Если полученный в результате реак-
ции гидразон обработать щелочью, то он претерпевает реакцию
циклизации с отщеплением одной нитрогруппы [86—88].
Синтетические возможности метода
31
СОЛИ ТЕТРАЗОЛИЯ
При окислении формазана тетраацетатом свинца образуется
соль тетразолия (LXXV). Формазаны, в свою очередь, можно
синтезировать при сочетании соли диазония с арилгидразоном.
Это, по-видимому, единственный хороший метод получения со-
лей’тетразолия. Обзоры по методам получения и применению
формазанов и солей тетразолия опубликованы Ридом [196] и
Найнхэмом [196].
RCH=NNHAr + Ar'N2X —>
—> RC=NNHAr
I
N=NAr'
РЬ (OCOCH;)4,
затем HX
- ^.N—NAr я +
RC | X"
. \N=NAr'_
LXXV
ТИОКАРБАЗОНЫ
Первой стадией синтеза тиокарбазонов является взаимодей-
ствие нитрометана с 2 же соли диазония [25, 115, 197]. Полу-
ченный нитроформазан восстанавливают сернистым аммонием
до тиокарбазида LXXVI, который легко окисляется до тио-
карбазона.
NO2
2ArN2X + CH3NO2 —> ArNHN=CN=NAr (NH,)aS-> (ArNHNH)2 CS —
LXXVI
s
II
—> ArNHNHCN=NAr
При синтезе по другому методу исходят из хлормалоновой
кислоты [198]. Согласно этому методу хлорформазан непо-
средственно превращают в тиокарбазон при действии кислого
сернистого натрия.
С1
2ArN2X + С1СН (СООН)2 —> ArNHN=CN=NAr
S
II
—> ArNHNHCN=NAr
32 I. Сочетание солей диазония с соединениями алифатического ряда
АМИДРАЗОНЫ *
Каталитическое восстановление арилгидразонов а-нитробен
альдегида (LXXVII) представляет собой удобный метод chhi
за амидразонов [199]. В результате реакции сочетания сш
диазония с фенилнитрометаном получают исходный гидраз^
Понцио получил амидразоны в результате взаимодейств|
арилгидразона а-нитробензальдегида с аммиаком [200].
ArN2X + C6H5CH2NO2 —> C6H6C=NNHAr • На-° -> C6H6C=NNHAr
I I
no2 nh2
LXXVII
АМИНЫ
В патентной литературе имеется только одно сообщение d
использовании реакции сочетания с целью введения амин]
группы в соединения с активными метиленовыми группами [201
По этому методу фенилгидразоны, полученные из ацетоуксу]
ного и циануксусного эфиров или из ацетилацетона и хлор]
стого фенилдиазония, восстанавливают цинком в среде уксу!
ной кислоты и получают а-ацетамидосоединения.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
Соли диазония взаимодействуют с различными классам
алифатических соединений, так что сделать какие-либо обобпи
ния относительно экспериментальных условий довольно трудн|
Тем не менее некоторые выводы, приводимые ниже, могут ок!
заться полезными.
СОЛИ ДИАЗОНИЯ
При диазотировании большинства ариламинов раствор ни
рита натрия добавляют к холодному раствору ариламина в ра,
бавленной минеральной кислоте. В случае аминов, облада»
щих слабоосновными свойствами, или аминокислот необходим
применять особые приемы. Обзор таких методов опубликова
Сондерс [202].
* Амидразоны можно представить общей формулой RC(NH2) ==NNHI
В Chemical Abstracts они рассматриваются как гидразоны амидов.
Экспериментальные условия
33
РАСТВОРИТЕЛИ
Реакции сочетания чаще всего проводились в холодных раз-
бавленных водных растворах, содержащих в качестве буфера
уксуснокислый натрий. Если реагенты мало растворимы в
воде, то добавляют спирт, а иногда пиридин или уксусную кис-
лоту. Реакции, которые проводились в безводных условиях,
рассмотрены в разделе «Область применения реакции»
(стр. 25).
pH СРЕДЫ
Реакции сочетания солей диазония с различными соедине-
ниями, содержащими активные метиленовые группы, могут
протекать в широких пределах pH среды. Реакции сочетания
в разбавленной соляной кислоте [72, 90] или в разбавлен-
ном растворе едкого натра [203] обычно протекают хуже, чем
в присутствии буфера — соды или уксуснокислого натрия
[90]. Обычно используют большой избыток уксуснокислого
натрия.
Хюниг и Бёс тщательно изучили относительную реакцион-
ную способность различных метиленовых соединений (XCH2Y)
по отношению к борофториду n-нитрофенилдиазония при pH
2—10 [23]. Самую низкую величину pH. при которой соедине-
ние вступало в реакцию сочетания, принимали за показатель
его реакционной способности. Заместители X и Y можно распо-
ложить в порядке уменьшения их способности к активирова-
нию соединения: NO2, СНО, СОСН3, CN, COOC2Hs, CONH2,
СООСНз, SO2C2H5, SOCH3, СеНй. В кислом растворе в реакцию
сочетания вступают лишь наиболее активные соединения, то-
гда как наименее активные соединения не реагируют даже
в щелочном растворе.
Внутримолекулярные реакции сочетания, которые исполь-
зуются для получения циннолинов или индазолов, проводятся
в сильнокислом растворе. Это способствует протеканию реак-
ции сочетания и уменьшает происходящее одновременно раз-
ложение соли диазония с образованием фенола. По тем же при-
чинам применяют кислые растворы в случае реакций солей
диазония с углеводородами.
Оптимальные условия реакции для нитросоединений могут
быть весьма различными. Обычно применяют водный раствор
натриевой соли ацинитросоединения. С другой стороны, реак-
ция сочетания ’ нитрометана протекает при pH 4,5 [25]. Реак-
ции. нитроспиртов протекают в среде с довольно высоким pH.
Так, реакция 2-нитробутанола-1 с хлористым п-хлорфенилди-
азонием при pH 10,8 вообще не идет, а при pH 13,9 получаются
3 Зак. 794.
34 Z. Сочетание солей диазония с соединениями алифатического ряда
самые хорошие выходы [117]. Имеется сообщение о том, что в;
растворах 1-М-морфолино-2-нитропропана при pH 7—10 eoi
время реакции сочетания происходят сильные взрывы [204].
СООТНОШЕНИЯ РЕАГЕНТОВ
В большинстве случаев применяют эквивалентные количе-j
ства реагента и соли диазония. Избытка соли диазония следует
избегать, так как в результате реакции часто образуется гидр-
азон, который может вступать в реакцию сочетания со второй
молекулой соли диазония с образованием производного форм-
азана. Последней реакции благоприятствует сильнощелочная
среда.
ПРОДОЛЖИТЕЛЬНОСТЬ РЕАКЦИИ
Так как большая часть реакций сочетания протекает бы-
стро. продукт реакции можно выделить вскоре после добавле-
ния соли диазония. Для завершения внутримолекулярных реак-
ций сочетания требуется больше времени. При получении инд-
азолов диазотированное производное о-толундина следует оста-
влять на несколько суток для того, чтобы произошла циклиза-
ция [155, 156]. Образование циннолинов также часто протекает
медленно [28, 44, 45, 188—194]. Для некоторых циннолинов ци-
клизацию можно ускорить, если реакцию проводить в теплой
сильнокислой реакционной среде [43, 46].
ПРЕПАРАТИВНЫЕ СИНТЕЗЫ
Получение 1-фенилгидразона пировиноградного альдегида из
ацетоуксусной кислоты и хлористого фенилдиазония с выходом
73—82% описано в сборнике [61].
Методика получения 5-нитроиндазола с выходом 72—80%
при внутримолекулярной реакции сочетания диазотированного
2-метил-4-нитроанилина также описана [156].
Получение а-фенилгидразона этилового эфира а, р-дикето-
масляной кислоты [267]. Раствор 73 г (1,06 моля) нитрита нат-
рия в 250 мл воды при перемешивании медленно приливают
под поверхность холодного раствора 93 г (1,0 моля) анилина
в 500 мл 5 н. соляной кислоты. Во время приливания темпера-
туру раствора поддерживают при 0—5°. Через 10 мин раствор
подщелачивают по конго красному, добавляя насыщенный рас-
твор уксуснокислого натрия. Полученный раствор соли диазония
при перемешивании медленно приливают к холодной взвеси,
Препаративные синтезы
35
состоящей из 130 г (1,0 моля) ацетоуксусного эфира, 120 г
(1,46 моля) уксуснокислого натрия и 200 мл воды в 750 мл
спирта. Во время приливания температуру поддерживают ниже
1'0°. Смесь перемешивают 30 мин при 5—10° и 1,5 час при ком-
натной температуре. Затем смесь разбавляют ~1 л воды и от-
фильтровывают выпавшее в осадок Твердое вещество желтого
цвета. Выход продукта 229 г (98%), т. пл. около 70°; темпера-
тура плавления продукта изменяется в зависимости от скоро-
сти нагревания.
Получение лг -хлорфенил гидразона этилового эфира циан-
глиоксалевой кислоты [80]. Раствор 38 г (0,30 моля) м-хлор-
анилина в 85 мл концентрированной соляной кислоты и 300 мл
воды при перемешивании охлаждают до 5°. м-Хлоранилин ди-
азотируют, медленно приливая раствор 23 г (0,33 моля) нитри-
та натрия в 50 мл воды, при температуре ниже 5°. Раствор пе-
ремешивают еще 10 мин с активированным углем (при темпе-
ратуре ниже 10°) и фильтруют. Фильтрат в течение 1 час при
перемешивании приливают по каплям к'смеси 33,9 г (0,30 мо-
ля) этилового эфира циануксусной кислоты в 300 'мл воды при
5—10°. Для того чтобы смесь оставалась щелочной по лакмусо-
вой бумажке, к ней добавляют небольшими порциями соду
(100 г). Затем смесь экстрагируют эфиром до тех пор, пока
вытяжки не станут бесцветными. Эфирные вытяжки объеди-
няют, сушат сернокислым магнием и отгоняют эфир. Остаток
перекристаллизовывают из спирта и получают 73 г (97%) кри-
сталлов светло-оранжевого цвета с т. пл. 89—90°.
По той же методике малоновый эфир превращают в м-хлор-
фенилгидразон диэтилового эфира мезоксалевой кислоты с вы-
ходом 78%. Аналогичным путем ацетоуксусный эфир превра-
щают в а-м-хлорфенилгидразон этилового эфира а, р -дикетомас-
ляной кислоты с выходом 78%.
Получение 1-нитро-1-и-хлорфенилгидразоноэтана [205]. К хо-
лодному раствору 8,4 г (0,066 моля) и-хлоранилина в 17 мл
концентрированной соляной кислоты и 200 мл воды при пере-
мешивании медленно приливают 4,7 г (0,068 моля) нитрита
натрия в 50 мл воды. Во время приливания температуру рас-
твора поддерживают при 0—5°. Через 10 мин раствор разба-
вляют 1,7 л холодной воды и добавляют к нему 30 г кристал-
лического уксуснокислого натрия. Одновременно с этим 5 г
(0,066 моля) нитроэтана растворяют в растворе 2,6 г едкого
натра в 20 мл воды, охлажденном льдом. Затем раствор нитро-
этана в течение 10 мин приливают по каплям при переме-
шивании к раствору соли диазония. Во время приливания
температуру смеси поддерживают при 5—10°. Через 30 мин
3*
36 I. Сочетание солей диазония с соединениями алифатического ряда
Таблицы по реакциям
сочетания солей диазония
37
отфильтровывают выпавший осадок оранжевого цвета. ВыхоЬ
продукта с т. пл. 116—118° составляет 14 г (100%). После пере],
кристаллизации из спирта получают кристаллы аранжево-жел-]
того цвета, которые при нагревании на бане, предварительна
нагретой до 120°, разлагаются при 126—127°. j
Получение 1-(п-нитрофенилазо)-2, З-дчметилбутадиена-1, J
[124]. Теплый раствор 13,8 г (0,10 моля) n-нитроанилина в
25 мл концентрированной соляной кислоты и 25 мл воды выли-;
вают на 100 г льда. Смесь перемешивают с раствором 7 i
(0,10 моля) нитрита натрия в 50 мл воды до тех пор, пока не
растворится все твердое вещество. Раствор разбавляют 100 мА
воды и встряхивают в течение 2 час с 9 г (0,11 моля) 2,3-ди-
метилбутадиена-1,3 [206]. Выпавший осадок отфильтровывают
и сушат; выход продукта 12 г (47%). После перекристаллиза-
ции из уксусной кислоты с небольшим количеством активиро-
ванного угля получают продукт с т. пл. 177°.
После перекристаллизации из 50%-него водного спирта полу-
чают тонкие серебристые иглы с т. пл. 241—242°.
ТАБЛИЦЫ ПО РЕАКЦИЯМ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ
С СОЕДИНЕНИЯМИ АЛИФАТИЧЕСКОГО РЯДА
В таблицы включены реакции, сообщения о которых опу-
бликованы в Chemical Abstracts до января 1956 г. Приводятся
также некоторые более поздние примеры. Реагенты в таблицах
расположены, как правило, в порядке увеличения молекуляр-
ного веса и усложнения молекулы.
В тех случаях, когда приводится несколько литературных
ссылок, в таблицах указан выход, взятый из первой работы.
Если в колонке «Продукт реакции» цифры в скобках отсут-
ствуют, это значит, что выход в работе не сообщался.
Получение N, N'-дифенил-С-метилформазана [157]. Водный
раствор хлористого фенилдиазония приготовляют, приливая рас-
твор 7 г (0,1 моля) нитрита натрия в 15 мл воды к 9,3 г (0,1
моля) анилина, растворенного в 25 мл концентрированной со-
ляной кислоты и 25 мл воды. Теплый раствор 13,4 г (0,1 моля)
фенилгидразона ацетальдегида (а- или 0 формы) в 100 мл
спирта смешивают с теплым раствором 30 г кристаллического
уксуснокислого натрия в 150 мл спирта. Смесь охлаждают до
5° при энергичном перемешивании, после чего по каплям при-
ливают раствор соли диазония. Продукт выделяется в виде
масла, которое вскоре затвердевает. Твердое вещество отфиль-
тровывают и промывают небольшим количеством холодного
спирта; выход 21 г (88%), т. пл. 123°. После перекристаллиза-
ции из спирта температура плавления повышается до 125°.
Получение 4-окси-З-метилциннолина [46]. К холодному рас-
твору 45,5 г (0,31 моля) о-аминопропиофенона в 1,2 л концен-
трированной соляной кислоты при перемешивании медленно
приливают раствор 23 г (0,33 моля) нитрита натрия в 30 мл
воды. Температуру во время приливания поддерживают при
5—10°. Затем раствор фильтруют и фильтрат разбавляют 4 л
концентрированной соляной кислоты. Реакционную смесь в те-
чение 4 час нагревают при 60°, после чего выпаривают ее при
пониженном давлении до небольшого объема. Продукт реакции1
осаждают, добавляя избыток насыщенного -раствора уксусно-
кислого натрия, выпавший осадок отфильтровывают, сушат и
получают 40,7 г (83%) почти чистого 4-окси-З-метилциннолина.
Таблица I
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С КЕТОНАМИ
А. Монокетоны
Кетон Заместители в анилине 1 Продукт реакции (выход, %) «Литература
Ацетон — CeHsNHN=С (СОСНз) N=NCeH6 30
Хлорацетон — CH3COC(C1)=NNHC6H6 (30) 33
2-Метил СНзСОС(Cl) = NNHC6H4CH3-o (25) 33
о, о'-Дихлорацетон 4-Метил СН3СОС (Cl) = NNHCeH4CH3-n (15) 33
— С1СН2СОС (Cl) = NNHC6H6 207
2-Метил С1СН2СОС (С 1) = NNHC6H4CH3-o 207
о, а-Дихлорацетон 4-Метил С1СН2СОС (С!) =NNHCbH4CH3-« 207
—— (C6H6N = N)2CC12 207
4-Метил (n-CH3C6H4N=N)2CC12 207
сыАА-Тетрахлорацетон — (C6H5N=N)2CC!2 207
Нитроацетон 4-Метил (/1-CH3C6H4N=N) 2CCI2 207
4-Нитро СНзСОС (NO2) = NNHC6H4NO2-n (59) 23
Метилсульфонил ацетон 4-Нитро CH3SO2C (СОСНз) = NNHC6H4NO2-n (70) 23
4-И мииопеитанон- 2 — СНзСОС (N=NC6H5) = C (NH2) CH3 208
Пировиноградная кислота —, C6H5NHN=C(N=NC6H5)COCOOH (57) 177, 258
Левулиновая кислота — Диформазил 2 (88) 209, 177, 210
Т-Кетопимелиновая кислота — Диформазнл 2-3 (13—17) 177, 210
Циклопеитандион-1,2 — 1-Феннлгидразои циклопентантриона-1,2,3 38
Лактон а-окси-а-метил-7-кетоглутаро- вой кислоты — З-Фенилгидразон лактона я-окси-а-метил- р. 7-дикетоглутаровой кислоты 211
Этиловый эфир З-окси-2,5-дикето- — Этиловый эфир З-окси-2.5-дикето-4-фенилазо- 212
З-циклопентен-1-карбоновой кислоты З-циклопентен-1 -карбоновой кислоты
2, 4-Дннитрофеиилацетон — 1-Фенилгидразон 1-(2, 4-динитрофенил)пропан- диона-1,2 34
Заместитель R в N CR CH3COCH5(!J N >0/ Заместители в анилине 1 Заместители в продукте реакции ' Выход, % Литера- тура
СНзСОС II R'HNN Ч CR J! II С N
«' 1 R
Фенил Фенил Фенил 40 36, 37
п-Толил — Фенил п-Толил 35 36, 37
2-Метил о-Толил п-Толил 55 36, 37
4-Метил п-Толил п-Толил 40 36, 37
2,4-Диметил 2,4-Диметилфенил п-Толил 40 36, 37
2, 5-Диметил 2,5-Диметилфенил п-Толил —— 37
2-Метокси о-Анизил п-Толил 35 36, 37
З-Метокси а-Анизил п-Толил 35 36, 37
З-Хлор А-Хлорфеннл п-Толил 55 36. 37
88 4-Хлор п-Хлорфенил п-Толил 30 36, 37
2-Нитро о-Нитрофеннл п-Толил 45 36, 37
З-Нитро А-Ннтрофенил п-Толил 20 36, 37
4-Нитро п-Нитрофенил п-Толил 20 36, 37
4-Диметил амнно п- Диметиламинофенил п-Толил 25 36, 37
2-Карбокси о-К арбокснфен ил п-Толил 50 36, 37
4-Карбокси п-Карбоксифенил п-Толил 45 36, 37
а-Нафтиламин «-Нафтил п-Толнл 40 36, 37
р-Нафтиламнн Р-Нафтил п-Толил 35 36, 37
4-Фенил п-Бифенил п-Толил 40 36, 37
4-Бензнл п-Бензилфенил п-Толил 45 36, 37
3,3-Диметоксибензиднн 3, З-Диметоксибифени- леи п-Толил 20 37
А-Нитрофенил — Фенил А-Нитрофенил 80 36, 37
2-Метокси о-Анизил л-Нитрофенил 50 36, 37
Продолжение табл. Т
Литература
Кетон
Заместители
в анилине 1
Продукт реакции (выход, %)
Апетоиилпиридиний бромистый — CH3COC(NC6H6)=NNC6H5 (84) 35
Фенацил хлористый —- СеНзСОС (С1) = nnhc6h5 207
4-Карбометокси-3-метил-5-фенилцикло- — 2-Фенилгидразон 4-карбометокси-3-метил-5-фе- 309
гексен-З-он-1 нилциклогексеи-З-диона-1, 2
4-Карбэтокси-3-метил-5-фенилцикло- — 2-Фенилгидразон 4-карбэтоксн-3-метил-5-фенил- 309
гексен-З-он-1 циклогексен-З-диона-1, 2
4-Карбэтокси-3,5-дифенилциклогекса- — 2-Фенилгидразон 4-карбэтокси-3,5-дифенилцик- 310
днен-1, З-ол-1 логексен-З-диона-1,2
Фенил-2, 4-динитробензилкетон — 2,4-(NO2)2C6H3COC(C6H6) =NNHC6H5 (количе- 86
ственный)
Фенацилпиридииий бромистый — C6H5COC(NC5H5)=NNC6H6 (89) 35
С 2-Нитро CeHsCOC (NC6H5) =NNC6H4NO2-o 35
З-Нитро СзНзСОС (NC5H6) =NNC6H4NO2-jm 35
4-Нитро CeHsCOCfNCsHs) =NNC6H4NO2-h 35
л-Бромфенацилпиридииий бромистый — n-BrC6H4COC(NC5H6)=NNC6H5 (74) 214
5-л-Нитрофенацил-3-л-толил-1,2,4-окса- — 1 -Фенилгидразон 1 - (3-л-толил-1,2,4-окса диазо- 37
диазол лил-5)-3-л-нитрофенилэтандиона-1, 2 (65)
2-Метокси 1-о-Метоксифенилгидразои 1-(3-л-толил-1,2,4- 37
оксадиазолил-5) -3-л-нитрофенилэтандиона-1,2
(20)
- 4-Нитро 1-л-Нитрофенилгндразон 1-(3-л-толил-1,2,4- 37
оксадиазолил-5)-3-л-нитрофенилэтаидиона-1,2
(20)
Тропинон — Дифенилгидразои 2,4-дикетотропинона (80), 39
сн2
2
( Мети ленбисметон)
3-Нитро
4-Ннтро
2-Метил
2,3-Диметил
2,5-Диметил
4-Бром
а-Нафтиламин
р-Нафтиламин
1 -Л4-Нитрофенил азо-1 -этоксалилинден
1 -п-Нитрофенилазо-1 -этоксал и лииден
2, 2'-Метилен-б«с-(З-окси-5,5-диметил-6-фенил-
азоциклогексен-2-он-1) (количественный)
\ 40
40
216, 215
Этиловый эфир 2-хииолилпировино-
градной кислоты
Этиловый эфир 2-хиноксалилпировино-
градной кислоты
Этиловый эфир 2-хиназолилпировино-
градной кислоты
Этиловый эфир 2-бензоксазолилпиро-
виноградной кислоты
Этиловый эфир бензотиазолилпировино-
градной кислоты
Этиловый эфир 2-кето-5-(2-бензоксазо-
лил) -4-пентеновой кислоты
Этиловый эфир 2-кето-5-(2-бензотиазо-
лил) -4-пентеновой кислоты
Бензидин
4-Бром
4-Бром
4-Бром
4-Бром
4-Бром
4-Бром
4-Бром
2,2'-Метилен-б«с- (З-окси-5,5-диметил-6-о-толил-
азоциклогексен-2-он-1)
2,2'-Метилен-бис-[3-окси-5,5-диметил-6-(2, 3-кси-
лилазо)ииклогексен-2-он-1]
2,2'-Метилен-б«с-(З-окси-5, 5-диметил-6-л-кси-
лилазоциклогексен-2-он-1)
2,2'-Метилен-бис- (З-окси-5,5-диметил-6-л-бром-
фенилазоциклогексен-2-он-1)
2,2-Метилен-бис- (З-окси-5,5-диметил-6-а-наф-
тилазоциклогексен-2-он-1)
2,2'-Метилен-бис-(З-окси-5,5-диметил-6-р-наф-
тилазоциклогексен-2-он-1);
?
N, N'-Ди-(л-бромфенил)-С-2-хинолилформазан 4
(79)
N, N'-Ди- (л-бромфенил) -С-2-хиноксалилформа-
зан (78)
N, N'-Ди- (л-бромфенил) -С-2-хиназолилформазан
N, N'-Ди- (л-бромфенил)' -С-2-бензоксазолилфор-
мазан (76)
N, N'-Ди- (л-бромфенил) -С-2-бензотиазолилфор-
мазан (62)
N, N'-Ди- (л-бромфенил) -С-[2- (2-бензоксазолил) -
винил]формазан
N, N'-Ди- (л-бромфенил) -С-[2- (2-бензотиазолил) -
винил]формазан (46)
215, 216
215, 216
215
215, 216
215, 216
215, 216
216
42
42
42
42
42
42
42
Продолжение табл. 1
Б. fi-Кетоальдегиды
₽-Кетоальдегид Заместители в анилине 1 Продукт реакции (выход, %) Литература
fi-Кетомасляный альдегид — СНзСОС (СНО) =NNHC8H8 55
Р-Кетовалериановый альдегид 4-Нитро CH3COC(CHO)=NNHC8H4NO2-n (17) 23
— С2Н8СОС(СНО) =NNHC8H8 56
5-Метил-3-кето-4-гексеналь — (СНз)2С=СНСОС (СНО) =nnhc6h8 57
₽-Кето-0-фенилпропионовый альдегид — С8Н8СОС (СНО) =nnhc6h8 55
( ₽-Кето-Р-п-толилпропионовый альдегид •л. Р-Кето-Р-л-анизилпропноно- — n-СНзСб' Н4СОС (СНО) = NNHCeHs 56
вый альдегид л-СНзОС8Н4СОС(СНО) =nnhc8h8 56
В. ^-Дикетоны
р-Дикетон Заместители в анилине 1 Продукт реакции (выход, %) Литература
Пеитандион-2, 4 4-Метил * 4-Бррм 2, 4-Дибром 2, 4, 6-Трибром СНзСОС (СОСНз) =nnhc8h8 СНзСОС (COCH3)=NNHC8H4CH3-n (92) СНзСОС (СОСНз) =NNHC6H4Br-n СНзСОС (СОСНз) =NNHC8H3Br2-2,4 СНзСОС (СОСНз) =NNHC8H2Br3-2,4,6 13, 217, 218 219 220 220 220
4-Нитро СНзСОС (СОСНз) =NNHC6H,NO2-n V П», Z2»
4-Метил-З-нитро СНзСОС (СОСНз) =NNHCeH3CH3-4-NO2-3 219
4-Бром-2-нитро СНзСОС (СОСНз) =Ь1Ь1НС8Н3Вг-4-Ь1О2-2 220
2, 4-Дибром-6-нитро СНзСОС (СОСНз) =NNHC8H2Bt2-2, 4-NO2-6 220
Бензидин 3, 3'- (4,4'-Бифенилеидигидразоно) -бис- 221, 222
(пеитантриои-2,3,4) 221, 222
3, З'-Диметилбензидии 3, 3'- (3,3'-Диметил-4,4'-бифеиилендигидра-
зоно) -бис- (пентаитрион-2,3,4) 221, 222
3, З'-Диметоксибеизидин 3,3'-(3, 3'-Диметокси-4, 4'-бифенилендигид-
разоно) -бис- (пеитантрион-2, 3,4) 223
4- (З-Метил-5-фенилпиразо- З-Арилгидразон пентантриона-2, 3,4
лил-1) 1-Фенил-2,З-диметил-4-ами- З-Арилгидразои пеитаитриоиа-2,3,4 224
ио-5-изопиразолон 1-Фенил-3,5-диметил-4-ами- З-Арилгидразои пентантриона-2, 3, 4 225.
иопиразол 3,5-Диметил-4-амииопиразол З-Арилгидразон пентантриона-2, 3,4 226.
5-Ам иио-3- изоп ропилтриазол - З-Арилгидразон пентантриона-2, 3,4 227
Этиловый эфир еиола пеитаи- 1, 2, 4 4-Нитро СНзСОС (СОСНз) =NNHC8H4NO2-n 226
диона-2,4 1, 5-Дихлорпеитандион-2,4 4-Нитро С1СН2СОС (СОСН2С1) =NNHC8H4NO2-n 229-
Гексаидион-2, 4 4-Нитро «СНзСОС (СОС2Н8) =NNHC6H4NO2-n 229*
Гептандион-2, 4 — СНзСОС (СОСН2С2Н8) =NNHC8H8 230.
6-Метилгептаидион-2, 4 4-Нитро (СНз)2СНСН2СОС (СОСНз) = 229>
=NNHC6H4NO2-n 229»
Гептаидион-3,5 4-Хлор С2Н8СОС (СОС2Н8) =NNHC6H4Cl-n
Гептантр ион-2,4,6 — (C8H5NHN=CHCOCHN=NC8H8) 2со 231
— 2,6-Диметил-З, 5-дифенилазопирон 232
Нонандион-4,6 4-Хлор н-СзН7СОС (СОС3Н7-н) =NNHC6H4C1-zi 229
4-Нитро н-С3Н7СОС (СОС3Н7-«) =NNHC8H4NO2-n 229
Продолжение табл, /
₽-Дикетон Заместители в анилине 1 Продукт реакции (выход, %) Литература
1-Фенилбутандион-1, 3 — С6Н5СОС (СОСНз) =NNHCcHs (90) 48, 217
— CeH5N=NC(COC6H6) = NNHCeHe 6(25) 233, 234
2-Нитро CeHgCOC (СОСНз) =NNHCfiH4NO2-o 235
4-Нитро C6H5<JOC (СОСНз) =NNHC3H4NO2-n 235, 236
4-Ацет- амидо (количественный)
С6Н5СОС (СОСНз) =NNHC6H4NHCOCH3-n 237
2,4-Дибром С6Н6СОС (СОСНз) =NNHC6H3Br2-2, 4 48
2, 4,6-Три- бром СбН6СОС (СОСНз) =NNHCeH2Br3-2, 4, 6 > 48
3,5-Диме- тил-4-амино- пиразол 4-Нитро 4-Нитро 2- (3, 5-Диметил-4-пиразолил) гидразон 1 -фенил- бутантриона-1,2, 3 226
1-о-Аиизилбутаидион-1, 3 1-(2, 4-Диметоксифенил)бутаидион-1, 3 1-(2, 4-Диэтоксифенил)бутандион-1, 3 о-СНзОС6Н4СОС (СОСНз) =NNHCeH4NO2-n 2, 4- (СН3О) 2С6Н3СОС (СОСНз) =NNHCeH4NO2-n 2 4- (С2Н5О)2СвН3СОС (СОСНз) =NNHC6HS (хороший) С6Н5СН2СОС (СОСНз) =NNHC6H4NO2-n 1 (СНз) 2СНСН2СО]2С = NNHC6H4NO2-n С6Н5СН2СН2СОС (СОСНз) ==NNHC6H4NO2-n (70) (C6H5CO)2C=NNHC6H6 238 238 240, 239
1-Фенилпентандион-2, 4 2, 8-Диметилноиандиои-4, 6 1-Фенилгександион-З, 5 1, З-Днфенилпропандион-1, 3 4-Ннтро 4-Нитро 4-Нитро 229 229 241 217
4-Нитро (C6H5CO)2C=NNHC6H4NO2-n 229
1, З-Ди-л-иитрофенилпропандион-1, 3 1" (3, 5-Диметоксифенил) -3-фенилпропан- дион-1, 3 4-Сульфо 4-Нитро (C6H6CO)2C=NNHC6H4SO3H-n (n-O2NCeH4CO) 2C=NNHC6H4NO2-n J, 5-(СН3О)2СбН3СОС(СОС6Н6) = NNHC6HS 217 229 242
l-(2, 4, б-Триметоксифенил) -3-п-анизилпро- — 2, 4, 6- (CHSO) зС6Н2СОС (СОС6Н4ОСН3-п) = =NNHC6H5 239
пандион-1, 3 1- (2, 4, б-Триметоксифенил) -3- (2-этокси- — 2,4, 6-(СНзО)3С6Н2СОС(СОС6Н4ОС2Н5-п) = =NNHC6H5 2 4, 6-(СНзО)зС6Н2СОС(СОС6НзОСНз-3-ОС2Н5- 4)-=NNHCeH5 С6Н5СН2СОС (СОС6НБ) =NNHC6H6 (количествен- ный) 239
фенил)пропандион-1, 3 1-(2, 4,6-Триметоксифеиил)-3-(3-метокси- — 239
4-этоксифенил)пропаидион-1, 3 1, 4-Дифенилбутандион-1, 3 — 243
1, 5-Дифенилпеитандион-2, 4 1 - (2-Окси-1 -нафтил) -3-фенилпропаи- диои-1, 3 а, 7-Дикетовалериановая кислота Этиловый эфир а, -f-дикетовалериановой 4-Нитро (С6Н3СН2СО) 2C=NNHC6H4NO2-n 2-Фенилгидразон 1 - (2-окси-1 -нафтил) -3-фенил- пропантриона-1,2, 3 (79) СНзСОС (СОСООН) =NNHC6HS СНзСОС (COCOOC2H6)=NNHCeH6 (96) 229 244 245 246, 217
кислоты 2-Метил СНзСОС (СОСООС2Н6) =NNHC6H4CH3-o (78) 246
4-Метил СНзСОС (СОСООС2Н5) =NNHC6H4CH3-n (98) 246
З-Хлор СНзСОС (СОСООС2Н6) =NNHC6H4C1-jw (99) 246
З-Бром СНзСОС (СОСООС2Н6) =NNHC6H4Br-xi (99) 246.
2-Нитро СНзСОС (СОСООС2Н6) =NNHC6H4NO2-o (73) 246
З-Нитро СНзСОС (СОСООС2Н5) ==NNHC6H4NO2-jh (90) 246
4-Нитро СНзСОС (СОСООС2Н6) =NNHC6H4NO2-n (76) 246
Этиловый эфир ксаитохелидоновой кис- — Этиловый эфир р, В-дифенил азоксантохелидоно- 232
тт лты вой кислоты 6 247 217, 247
J1U1 гм а, 7-Дикето-7-фенилмасляная кислота — С6Н5СОС (СОСООН) =NNHC6H6
Этиловый эфир а, 7~дикето-7-фенилмасля- — СбН6СОС (СОСООС2Н6) =NNHC6H6
ной кислоты 2-Карбокси СеН5СОС (СОСООСгНб) =NNHC6H4COOH-o 247
Бензидин 0, ₽'-(4,4'-Бифенилендигидразоио)-быс-(этило- 247
вый эфир а, Р, 7-трикето-7-фенилмасляиой ки- слоты) 248
Этиловый эфир а, 7-дикето-7-(п-ацетамидо- Р-Фенилгидразон этилового эфира а, Р,7-трике-
фенил)масляной кислоты — то-7- (n-ацетамидофеиил) масляной кислоты
Продолжение табл I
₽-Ди кетон Этиловый эфир 2,4-дикето-6-метил- гептен-5-овой кислоты Этиловый эфир а, ц-дикето-'(-[п-(3, 4- дикарбэтокси-2, 5-диметилпиразо- лил-1)фенил]масляной кислоты Циклогександион-1. 3 5,5-Диметилциклогександион-1, 3 Й (метон) 5-Фенилциклогександион-1, 3 4-Циаи-5-фенилциклогександиои-1,3 4-Карбэтокси-5-фенилциклогексан- дион-1, 3 5-(2-Фурил)циклогексаидион-1,3 Sj Филициновая кислота 2-Бутирил-6,6-диметилциклогексан- трион-1, 3, 5 2, 2'-Метилен-бас-(6, 6-диметилцикло- гексантрион-1, 3,5) Индандион-1, 3 2,4-Дикето-1, 2, 3,4, 4а, 9, 10,10а-ок- тагидрофенантрен Заместители в анилине 1 4-Нитро Г. Циклические | 4-Метил 2-Метил З-Метил 4-Метил 4-Нитро 2-Арсоно 3-Арсоно 4-Арсоно а-Нафтиламин | ₽-Нафтиламин Бензидин 3, З'-Диметилбензидии 3,З'-Диметоксибенз- идин , 4-Метил 4-Нитро ₽-Нафтиламин Бензидин Продукт реакции (выход, %} З-л-Нитрофенилгидразои этилового эфира 2,3,4- трикето-6-метилгептеи-5-овой кислоты Р-Феиилгидразон этилового эфира а, Р, у-трике- то-у-[п-(3,4-дикарбэтокси-2, 5-диметилпиразо- лил-1)фенил]масляной кислоты -дикетоны 2-л-Тблилгидразои циклогексантриоиа-1, 2, 3 2-Феиилгидразон 5,5-диметйлциклогексантри- оиа-1,2.3 2-о-Толилгидразон 5,5-диметилциклогексантри- она-1,2. 3 2-л-Толилгидразон 5,5-диметилциклогексантри- она-1,2,3 2-л-Толилгидразон 5,5-диметилциклогексантри- она-1,2,3 2-л-Нитрофенилгидразон 5,5-диметилциклогек- саитриона-1, 2. 3 2-о-Арсоиофенилгидразон 5,5-диметилциклогек- сантриоиа-1, 2, 3 2-л-Арсонофенилгидразон 5,5-диметилциклогек- саитриоиа-1, 2,3 2-п-Арсонофенилгидразои 5,5-диметилциклогек- сантриона-1, 2, 3 2-а-Нафтилгидразон 5,5-диметилциклогексантри- ^»лио.1 О Л 2-Р-Нафтилгидразон 5,5-диметилциклогексаи- \b триоиа-1, 2, 3 2, 2'- (4. 4'-Бнфенилендигидразоно) -бис-[5, 5-диме- тилциклогексантрион-1,2, 3] 2, 2'-(3, 3'-Диметил-4, 4'-бифеиилендигидразоно)- бис-[5,5-диметилциклогексантриои-1,2, 3] 2, 2'-(3, 3'-Диметокси-4, 4'-бнфенилендигидразо- но)-быс-[5,5-диметилциклогексантрион-1,2, 3] 2-Феиилгидразон 5-феиилциклогексантриона- 1,2,3 (количественный) 2-Фенилгидразон 4-циан-5-феиилциклогексан- триона-1, 2, 3 2-Феиилгидразон 4-карбэтокси-5-фенилциклогек- сантриона-1, 2, 3 2-Фенилгидразон 5- (2-фурил) циклогексантри- она-1, 2, 3 2, 4-Дифеиилгидразон 6,6-диметилциклогексан- пентаона-1,2, 3,4,5 4-Феиилгидразои 2-бутирил-6,6-диметилцикло- гексантетраоиа-1, 3, 4, 5 бас-4-Фенилгидразон 2,2Л-метилен-бас- (6,6-ди- метилциклогексантетраона-1,3, 4, 5) 2-Фенилгидразон индантриоиа-1, 2, 3 (35) 2-п-Толилгидразон индаитриоиа-1, 2, 3 1 2-п-Нитрофенилгидразон индантриона-1,2, 3 । 2-Р-Нафтилгидразон индантриона-1,2, 3 2, 2'-(4, 4'-Бифенилендигидразоно) -бис- (индан- трион-1,2, 3) З-Фенилгидразон 2,3, 4-трикето-1,2, 3,4, 4а, 9,10, 10а-октагидрофенантрена Лите- ратура 10 249 49 50,51 51 51 51 52 250 250 250 51 1 52 52 52 251 49 49 251 252 252 253 53 54 54 54 54 254 i 1
Продолжение табл. I
Зак. 794.
Д. 4-Оксициннолины из о-аминокетонов
Реагирующее вещество Заместители в 4-оксиииннолине (выход* %) ОН Г6 || з) Литература
Ацетофенон 2-Лмино — (70—75) 43, 27, 45
2-Амино-4-метил 7-Метил (58),. 188
2-А мино-3-метил 8-Мстил (78) 188
2-Амиио-6-метокси 5-Метокси (55) 255
2-Амино-5-метокси 6-Метокси (53) 255
2-Ам ино-4-метоксн 7-Метокси (63) 255
2-Амино-З-метокси 8-Метокси (92) 191
2-Амино-5-хлор 6-Хлор (74) 27, 45
2-Амино-4-хлор 7-Хлор (90—95) 43, 45, 185
2-Амино-З-хлор 8-Хлор (69), 27
2-Амино-5-бром 6-Бром (95) 45, 27
2-Амино-З-бром 8-Бром (57) 27
2-Амино-5-иод 6-И од 45
2-Амино-6-нитро 5-Нитро (70) 189
2-Амино-5-иитро 6-Нитро (87) 45, 27, 183
2-Амино-4-нитро 7-Нитро (76) 189, 190
2-Амиио-З-нитро 8-Нитро (70) 187, 188
2-Амино-5-циан _ ... 8-Хлор7 (45) 188 » ГМВл- .... - --
2-Амиио-4-ацетил 7-Ацетил (47) 189
2-Амино-5-апетамидо 6-Ацетамидо (33) 45
2-Аминофенилазо 6-Фенилазо (60) 190
2-Амино-5- (3-ацетилфенилазо) б-(З-Ацетилфеиилазо) (50) 190
2-Амино-4, 5-диметил 6, 7-Диметнл (91) 44
2-Амино-4, 5-диметокси 6, 7-Диметокси (67) 192
2-Амино-4, 5-дихлор 6, 7-Дихлор (91) 186
2-Амиио-3,4-дихлор 7,8-Дихлор (59) 186
2-Амиио-З, 5-дибром 6,8-Дибром (65) 45
2-Амино-5-хлор-4-метил 6-Хлор-7-метил (90) 186, 29
2-Амино-3-хлор-4-метил 8-Хлор-7-метил (75) 186
2-Амино-5-бром-4-метил 6-Бром-7-метил (37) 186
2-Амиио-4-метил-5-иитро 7-Метил-6-иитро (76) 188
2-Амиио-4-хлор-5-нитро 7-Хлор-6-нитро (57) 185
2-Амиио-4-хлор-3-иитро 7-Хлор-8-нитро (57) 185
Фенацил хлористый 2-Амиио З-Хлор (85) 29
2-Амиио-5-метил З-Хлор-6-мётил (87) 44
2-Амино-5-хлор 3, 6-Дихлор (73) 29
2-Амиио-4, 5-диметил З-Хлор-6, 7-диметил (80) 44
Фенацил бромистый 29
2-Амино З-Бром (73)
2-Амино-5-хлор З-Бром-6-хлор (77) 29
2-Амиио-5-бром 3,6-Дибром (76) 29
Пропиофенон 2-Амино З-Метил (83) 46, 45
2-Амино-5-хлор 6-Хлор-З-метил (94) 46
2-Амино-5-бром 6-Бром-З-метил (76) 45, 46
2-Амино-5-нитро З-Метил-6-иитро (65) 45, 46
2-Амино-3-иитро З-Метил-8-нитро (96) 46
Продолжение табл. I
Реагирующее вещество Заместители в 4-оксициннолине (выход, %) ОН Г II 3| L А > А Литература
Различные о-аминокетоны 2-Аминобутирофенон V-(2-Аминобензоил) масляная кислота ₽ - (2-Амино-4,5-диметоксибензоил) пропионовая кислота Этиловый эфир Р-(2-амино-4-карбэтоксибензоил)- пропионовой кислоты 3, 3'-Диацетил-4, 4'-диаминоазобензол 5-Амино-6-ацетилиндан 4-Амино-5-ацетилиндаи 5-Амино-6-хлорацстилиндан 1, 2, 3, 4-Тетрагидро-6-амино-7-ацетилнафталпн 1, 2, 3, 4-Тетрагидро-5-амино-6-ацетилиафталин 1, 2,3, 4-Тетрагидро-6-амино-7-хлорацетилнафта- лин З-Этил (68) З-Карбоксиэтил (53) З-Карбоксиметил-6,7-диметокси (71) З-Карбэтоксиметил-7-карбэтокси (13) 4, 4'-Диокси-6, б'-азоциннолин (69) 6, 7-Циклопентено (60) 7,8-Циклопентено З-Хлор-6, 7-цнклопентено (57) 6, 7-Циклогексено (70), 7, 8-Циклогексено З-Хлор-6,7-циклогексеио (67) 47 47 27 184 190 44 44 44 44 44 44
1 Полное название дается в тех случаях, когда ариламин трудно назвать как производное анилина.
Формула радикала формазила: CBHBNHN=CN=NCeH..
• Выделилась янтарная кислота.
4 Эти соединения названы как производные гипотетического соединения формазана H,NN=CHN=NH.
6 Этот продукт реакции получают при избытке соли диазония.
• Из реакционной смеси были выделемырАрусмс црддужтви^.,.
Таблица \\
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С Р-КЕТОКИСЛОТАМИ, СЛОЖНЫМИ ЭФИРАМИ И АМИДА А. $-Кетокислоты МИ
р-Кетокислота Заместители в анилине 1 Продукт реакции (выход, %) Литература
Ацетоуксусная кислота Пропионилуксусиая кислота а-Ацетопропиоиовая кислота Тетроиовая кислота Бензоилуксусиая кислота 4-Метил 2-Метокси 2-Нитро З-Нитро 4-Нитро 2,4-Дибром 2-Бром-4-нитро 2,4,6-Трихлор 2, 4,6-Трибром 2,6-Дибром-4-нитро а-Нафтиламин 4-Нитро 4-Метокси 4-Хлор CH3COCH=NNHC6HS (73-82) CH3COC(N=NC6H5)=NNHC6H62 (41) C6H5C(N=NC6H5) =nnhc6h5 3 СНзСОС (N=NC6H4CH5-n)==NNHC6H4CH3-n 2 CH3COCH=NNHCeH4OCH3-o CH3COCH= NNHCeH4NO2-o CH3COCH=NNHC6H4NO2-a« СНзСОСН=NNHC6H4NO2-/i CH3COCH=NNHCeH3Br2-2,4 CH3COCH=NNHC3H3Br-2-NO2-4 CH3COCH=NNHC6H2Cl3-2,4,6 CH3COCH=NNHC6H2Br3-2,4, 6 СНзСОСН = NNHCeH2Br2-2,6-NO2-4 CH3COCH=NNHCioHT-a CH3COC(N = NCioHr-a) =NNHCioHt-cc 2 C2HsCOCH=NNHC6H4NO2-n CH3C (N=NCeH6) =NNHCeH8 2 (З-Феиилгидразон лактона f0KCH"a’ Р-Дикето- масляной кислоты CeHsCOCH=NNHC6Hs С6Н6СОС (N=NC6HS) = NNHCeHa 2 (39) C6H5COCH-NNHC6H4OCH3-n C6H6COCH=NNHC6H4Cl-n 61, 59, 60, 256 58, 257 164 58 258 259, 260 259 259 176 259 261 261 259 256 58 140 177 262 263 234, 233 140 140 .
₽-Кетокислота Бензоилуксусная кислота о-Карбоксибензоилуксусная кислота Ацетондикарбоновая кислота й 2'-Кето-1 -пропансульфокислота 2-Кето-2-фенил-1-этансульфо- кислота 1 1 Заместители 1 в анилине 1 1 2-Нитро 1 З-Нитро 4-Нитро 4-Карбокси 4-Окси-5-хлор 4-Метил 1 4-Хлор 4-Хлор 4-Бром 2-Нитро З-Нитро 4-Ннтро 2, 4-Дихлор 2,4-Дибром 1 4-Хлор 4-Бром 2-Нитро 4-Нитро 2, 4-Дихлор 2,4-Дибром J —1 Пре 1 Продукт реакции (выход, %) C6H5COCH=NNHC6H4NO2-o CeH6COCH=NNHC6H4NO2-ju C6H5COCH=NNHC6H4NO2-n C6H5COCH=NNHC6H4COOH-n ° ‘Н°ОССбН4СОС (n=NC6H3OH-2-CI-5) = , —NNHC6H3OH-2-Cl-5 ' CO(CH=NNHC6HS)2 (39) CO(CH=NNHC6H4CH3-n)2 (80) COvCH=NNHCeH4Cl-n)2}(70) СНзСОС (SO3H) =nnhc6h5 ch3™C (S°3H) =NNHCeH4Cl-n c (S°3H) =NNHCeH4Br-n S3cnr!^3H)=NNHC6H4NO^° CH3cScS3H)=NNHC6H4N°2^ 1 С.нтскп H)=NNHCtH<N°2-n CH3XC °3H) =NNHC<=H3Cl2-2, 4 c S°3H)=NNHCeH3Br2-2, 4 eH6COC(SO3H)=NNHCeH6 (60) r6u5™C (S°3H) = NNHC6H4Cl-n СбН5СОС (SQ3H) =NNHC6H4Br-n r (S°aH) =NNHC6H4NO2-o r (SOaH) =NNHC6H4NO2-n ?MSr^(S°3H)=NNHC6H3c|2-2, 4 CeHsCQC (8ОзН) —NNHC6H3Br2-2, 4 должение табл. IT •Литература 263 263 263, 140 140 264 62' 63 63 64 64 64 64 64 64 64 64 65 65 65 65 65 65 65
2,4, 6-Трихлор CaHsCOC(SO3H) =NNHC6H2Cl3-2, 4.6 \ 65
2, 4, 6-Трибром C6H5COC (SO3H) =NNHC6H2Br3-2,4,6 \ 65
4-Бром-2-нитро CeHsCOC (SO3H) =NNHC6H3Br-4-NO2-2 1 65
Б. Эфиры ^-кетокислот
Эфир fi-кето к и слоты Заместители в анилине 1 Продукт реакции (выход, %) Литература
Этиловый эфир формилуксус- — НСОС (СООС2Н5) =NNHC6H6 265
ной кислоты Ацетоуксусный эфир — СНзСОС (СООС2Н5)=НМНСбН5 (94—98) 268, 6, 7, 266, 267
2-Метил C6H5N=NC (COOC2Hs) =NNHC6H5 2 (80) СНзСОС (COOC2HS) =NNHC6H4CH3-o (80—90) 66, 164 269, 270
4-Метил СНзСОС (COOC2HS) =NNHC6H4CH3-n (95) 270, 7, 266, 269
2-Хлор СНзСОС (СООС2Н5) =NNHC6H4C1-o 271
З-Хлор СНзСОС (COOC2Hs)=NNHC6H4C1-m (78) 80, 271
4-Хлор СНзСОС (СООС2Н5) =NNHC6H4Cl-n 271
4-Хлор n-ClC6H4N=NC (СООС2Н6) =NNHC6H4C1-п * 272
2-Бром СНзСОС (СООС2Н5) =NNHC6H4Br-o 271
2-Нитро СНзСОС (СООС2Н5) =NNHC6H4NO2-o 259, 260, 271
З-Нитро СНзСОС (COOC2Hs)=NNHC6H4NO2-4i 259
4-Нитро /i-O2NC6H4N=NC (COOC2Hs)=NNHC6H4NO2-4( 2 СНзСОС (СООС2Н5) =NNHC6H4NO2-n (количе- 273 274, 259, 271
4-Этокси ственный) n-C2H5OCeH4N=NC (СООС2Н6) = 273
2-Карбокси = NNHC6H4OC2Hs-n 2 (57) СНзСОС (COOC2Hs)=NNHC6H4COOH-o (90) 269
З-Карбокси СН3СОС (СООС2Н5) =NNHC6H4COOH-*i 275
4-Ацетамидо СНзСОС (СООС2Ц5) =NNHC6H4NHCOCH3-n 276
Продолжение табл. II
Эфир р-кетокислоты Заместители в анилине 1 Продукт реакции (выход, %) Литература
Ацетоуксусный эфир 4-Сульфамил СНзСОС (COOC2HS) =NNHC6H4SO2NH2-n 277
2, 4-Диметил СНзСОС (СООС2Н6) = NNHC6H3 (СН3)2-2,4 (75) 269
2, 4-Дихлор СНзСОС (СООС2Н5) =NNHC6H3Cl2-2, 4 (85) 267
3, 5-Дихлор СНзСОС (COOC2Hg) =NNHC«H3Cl2-3, 5 278
3, 5-Дибром СНзСОС (COOC2H5)=NNHC6H3Br2-3, 5 278
2, 4,6-Трихлор СНзСОС (СООС2Нз) =NNHC6H2Cl3-2,4, 6 (коли- 261, 279
чественный)
2,4, 6-Трибром СН3СОС (COOCaHs) “NNHCeHaBrg-S, 4, 6 (коли- 261, 271
чественный)
3, 4, 5-Трибром СНзСОС (COOC2H5)=NNHC6H2Br3-3,4, 5 278
2-Метил-4-нитро СНзСОС (СООС2Н5) = NNHC6H3CH3-2-NO2-4 280
2-Метил-5-нитро СНзСОС (СООС2Н5) =NNHC6H3CH3-2-NO2-5 280
2-Метил-6-нитро СНзСОС (СООС2Н5) = NNHC6HsCH3-2-NO2 6 280
4-Метнл-2-нитро СНзСОС (COOC2HS) =NNHC6H3CH3-4-NO2-2 (90)' 280, 260
4-Метпл-З-иитро СНзСОС (СООС2Н5) = NNHC6H3CH3-4-NO2-3 280
2-Хлор-4-нитро СНзСОС (COOC2Hs) =NNHC6H3Cl-2-NO2-4 281
4-Хлор-2-нитро СНзСОС (СООС2Н5) =NNHC6H3Cl-4-NO2-2 281
2-Бром-4-нитро СНзСОС (СООС2Н5) =NNHC6H3Br-2-NO2-4 281
3, 5-Дихлор-4-бром а-(3,5-Дихлор-4-бромфенилгидразон) этилового 278
эфира а, Р-дикетомасляной кислоты
2,6-Дихлор-4-иитро
2, 6-Дибром-4-иитро
2-Бром-4-метил-5-нитро
2 -Б ро м -4- мети л -6- н итро
2-Бром-6-метил-4-иитро
4-Бром-2-метил-6-нитро
2,6-Дибром-3-иитро-4-метил
4, 6-Дибром-2-метил-5-иитро
а-Нафтиламин
р-Нафтиламин
2-Амииоантрахинон
| З-Аминокарбазол
а- (2, 6-Дихлор-4-иитрофенилгидразон) этилового 1
эфира а, р -дикетомасляной кислоты 1
а- (2, 6-Дибром-4-нитрофснилгидразон) этилового I
эфира а, р-дикетомасляной кислоты
а- (2-Бром-4-метил-5-иитрофеиилгидразон) этило-
вого эфира а ,Р-дикетомасляной кислоты
а-(2-Бром-4-метил-6-иитрофеиилгидразои) эти-
лового эфира а, Р-дикетомасляной кислоты
а- (2-Бром-6-метил-4-нитрофеиилгидразон) этило-
вого эфира а, Р-дикетомасляной кислоты
а - (4-Бром-2-метил-6-нитрофеиилгидразои) эти-
лового эфира а, Р -дикетомасляной кислоты
«- (2,6-Дибром-3-нитро-4-метилфенилгидразои)
этилового эфира а, р-днкетомасляиой кислоты
а - (4, 6-Дибром-2-метил-5-нитрофенилгидразон)
этилового эфира а, р-дикетомасляной кислоты
а-(а-Нафтилгидразон) этилового эфира а, р-ди-
кетомасляной кислоты (количественный)
а-(р -Нафтилгидразои) этилового эфира а, р-ди-
кетомасляиой кислоты
а-(2-Аитрахиионилгидразои) этилового эфира
а, Р-дикетомасляиой кислоты (количествен-
ный)
а-(З-Карбазолилгидразон)' этилового эфира
а, р -дикетомасляной кислоты
384
259
280
280
280
280
280
280
282, 269
269, 282
283
284
Продолжение табл. П
Эфир ₽-кето кислоты Заместители в анилине1 Продукт реакции (выход, %) Литература
Ацетоуксусный эфир N-Этил-З-аминокарб- азол а-(N-Этил-З-карбазолилгидразон) этилового эфира а, р-дикетомасляиой кислоты 284
л- (З-Карбокси-4-окси- фенилазо) а-[п- (З-Карбокси-4-оксифенилазо) фенилгидразон] этилового эфира а, р-дикетомасляиой кислоты 285
л- (л-Диметилсульф- ' амилфенилсульф- амил) а-[л- (л-Диметилсульфамилфенилсульфамил) фе- нилгидразон] этилового эфира а, Р-днкето- масляной кислоты 277
3, 5-Диметил-4-амино- пиразол я- (3, 5-Диметил-4-пиразолилгидразон) этилового эфира а, р -дикетомасляиой кислоты 226
1-Фенил-3, 5-диметил- 4-аминопиразОл а-(1 -Фенил-3, 5-диметил-4-пиразолилгидразон)) этилового эфира а, Р-дикетомасляиой кислоты 225
л- (3,4-Дикарбомет- окси-5-метил-1 -пир- азолил) а-[п- (3, 4-Дикарбометокси-5-метил-1-пиразолил)- фенилгидразон этилового эфира а, Р-дикето- масляной кислоты 286
З-Амино-5-изопропил- 1,2,4-триазол «- (5-Изопропил-1, 2, 4-триазолил-З) гидразон эти- лоного эфира а, р-дикетомасляной кислоты 227
Бензидин я, а'-(4, 4'-Бифенилендигидразоно) -бис- (этило- вый эфир я, Р-дикетомасляной кислоты) (98) 287, 288
?-Меитиловый эфир ацето- уксусной кислоты 3, 3'-Дикарбоксибензи- дин я, а'- (3, 3'-Дикарбокси-4, 4<-бифсийлендигидразо- ио)-бис- (этиловый эфир а, Р-дикетомасляной кислоты) 289
СН3СОС (COOCwHis-/) =NNHC6H5 170
4-Мет ил СН3СОС (COOCioflis-/) =NNHCcH4CH3-n n-CH3C6H4N=NC (СООСюН1э-/)= 170 170
• 4-Хлор
Метиловый эфир f-хлор- 4-Бром
ацетоуксусной кислоты 2-Метил
Этиловый эфир f-хлораце- 4-Метил
тоуксусной кислоты 2-Метил
СЛ 4-Метил 4-Хлор 4-Нитро 2, 4-Дпхлор 2, 4,6-Трихлор 2,4,6-Трибром 2-Хлор-4-нитро 2,6-Дихлор-4-нитро
Метиловый эфир 7-бром- —
ацетоуксусной кислоты 2-Метил
Этиловый эфир 7-бром- 4-Метил
ацетоуксусной кислоты 2-Метил
4-Метил 4-Бром 2,-Нитро З-Нитро 4-Нитро 2,4-Дибром 2,4, 6-Трихлор 2, 4,6-Трибром
2-Бром-4-иитро 2,6-Дибром-4-нитро
СН3СОС(СООСюН19-/) = NNHCeH4Cl-n
СНзСОС (COOCioH19-0 =NNHC6H4Br-n
CICH2COC (COOCH3)=NNHCeH5
CICHsCOC (СООСНз) =NNHC6H4CH3-o
CICH2COC (СООСНз) =NNHC6H4CH3-n
CICH2COC (COOC2H5) =NNHC6H3
CICH2COC (COOC2H5) =NNHC6H4CH3-o
CICH2COC (COOC2H5) =NNHC6H4CH3-n
CICH2COC (COOC2H6) =N NHC6H4Cl-n
CICH2COC (COOC2H5) =NNHC6H4NO2-n
CICH2COC (COOC2H5) =NNHC6H3C12-2,4
ClCH2COC(COOC2H5)=NNHC6H2Cl3-2,4,6
CICH2COC (COOC2H5) =NNHC6H2Br3-2,4,6
CICH2COC (COOC2H5) =NNHC6H3Cl-2-NO2-4
CICH2COC (COOC2H6) =NNHC6H2C12-2,6-NO2-4
ВгСНгСОС (COOCH3)==NNHC6H6
ВгСНгСОС (COOCH3) =NNHC6H4CH3-o
ВгСНгСОС (СООСНз) =NNHC6H4CH3-n
ВгСНгСОС (СООС2Н5) =NNHC6H6 (хороший)
ВгСНгСОС (СООС2Н6) =NNHC6H4CH3-o
ВгСНгСОС (СООС2Н5) =NNHC6H4CH3-n
ВгСНгСОС (СООС2Н5) —NNHC6H4Br-n
ВгСНгСОС (СООС2Н5) =NNHC6H4NO2-o
ВгСНгСОС (СООС2Н5) =NNHC6H4NO2^i
ВгСНгСОС (СООС2Н5) =NNHCeH4NO2-n
ВгСНгСОС (СООСгН6) =NNHC6H3Br2-2,4
ВгСНгСОС (СООСгНб) =NNHC6H2Cl3-2, 4,6
ВгСНгСОС (СООСгН5) =NNHC6H2Br3-2,4,6 (80)
ВгСНгСОС (СООС2Н5) =NNHC6H3Br-2-NO2-4
ВгСНгСОС (СООСгНб) =NNHC6H2Br2-2, 6-NO2-4
470
170
290
290
290
176, 290
290
290
176
281
176
261
261
281
281
291
291
291
292, 261, 291
291
291
176
259
259
259
176
261
261
259
259
Продолжение табл. П
Эфир 0-кетокислоты Заместители в анилине 1 Продукт реакции (выход, %) Литература
Этиловый эфир 3-кетокапро- — н-СзН7СОС (COOC2HS) ==NNHC6H6 293
НОВОЙ кислоты 4-Нитро Н-С3Н7СОС (СООС2Н5) =NNHC6H4NO2-n 293
Этиловый эфир 3-кетопелар- гоновой кислоты — н-СбН)3СОС (СООС2Н5) = NNHC6H6 293
Метиловый эфир бензоил- — СзНзСОС (СООСНз) =NNHC6HS 294, 295
уксусной кислоты 4-Нитро С6Н5СОС (СООСН3) =NNHCeH4NO2-n 294, 295
Этиловый эфир бензоилуксус- ной кислоты — C6H5COC(COOC2Hs)=NNHCeHs (70) 298, 164,
4-Метил • 296, 297
C6HsCOC (СООС2Н6) =NNHC6H4CH3-n 297
2-Нитро СзНзСОС (СООС2Н5) =NNHC6H4NO2-o 296, 299
З-Нитро СзНзСОС (СООС2Н6) =NNHCeH4NO2-JH 299
4-Нитро C6HSCOC (СООС2Н6) =NNHC6H4NO2-n 297
4-Ацетамидо СзНзСОС (COOC2H5)=NNHC6H4NHCOCH3-n 300
Метиловый эфир о-метокси- 4-Мет ил-2-нитро СзНзСОС (СООС2Н6) =NNHC6H3CH3-4-NO2-2 296
— о-СНзОС6Н4СОС (СООСНз) =NNHCeHs 301
бензоилуксусиой кислоты Метиловый эфир .и-метокси- 4-Нитро о-СНзОС6Н4СОС (СООСНз) =NNHC6H4NO2-n 301
— л-СНзОСбН4СОС (СООСНз) ==NNHC6H5 301
бензоилуксусиой кислоты Метиловый эфир л-метокси- 4-Нитро /(-СНзОСзН4СОС (СООСНз) =NNHC6H4NO2-n 301
— /г-СНзОСзН4СОС (СООСНз) =NNHC6H6 301
бензоилуксусной кислоты 4-Нитро п-СНзОС6Н4СОС (СООСНз) =NNHC6H4NO2-n 301
Метиловый эфир о-хлорбен- — о-С1СзН4СОС (СООСНз) =NNHCeHs 302
зоилуксусной кислоты 4-Нитро О-С1С6Н4СОС (СООСНз) =NNHC6H4NO2-n 302
Метиловый эфир л-хлорбен- — л-С1С6Н4СОС (СООСНз) =NNHC6Hb 302
зоилуксусной кислоты 4-Ннтро Л-С1С6Н4СОС (СООСНз) =NNHC6H4NO2-n 302
Метиловый эфир л-хлорбеи- — /г-С1СзН4СОС (СООСНз) =NNHCeHs 302
Диметнловый эфир щавелево-
уксусиой кислоты
Диэтиловый эфир щавелево-
уксусной кислоты
Диэтиловый эфир ацетонди-
карбоновой кислоты
Бензидин
2-Метил
4-Бром
2,4-Дибром
Беизидии
3,3'-Диметилбензидин
3, 3'-Диметоксибенз-
идин
2-Метил
4-Метил
4-Нитро
2-Карбокси
2, 4-Диметил
4- (л-Фенилмеркапто-
бензоил)
4- (3,4-Дикарбэтокси-5-
метил-1-пиразолил)
I
СНзООССОС (СООСНз) =NNHC6H5 (40) \ 68
[СНзООССОС(СООСНз) =КМНСбН4—12 (65) 1 303
С2Н5ООССОС (СООС2Н5) =NNHC6H5 (75) 1 68, 67
CeHsN=NC (СООС2Н5) = NNHC6H£ 2 (76) 69, 67
C2HSOOCCOC (СООС2Н8) =NNHC6H4CHs-o 68,'304
o-CH3C6H4N=NC(COOC2Hs)=NNHC6H4CH3-o 2(81) 69
C2H5OOCCOC(COOC2Hs)=NNHC6H4Br-n (62) 72
n-BrC6H4N = NC (COOC2H5) = NNHC6H4Br-n 2 (41) 72
C2H6OOCCOC (COOC2HS) =NNHC6H3Br2-2,4 | 305
4,4'-Бифенилендигидразоно-быс- (диэтиловый 303, 306
эфир дикетоянтариой кислоты) (76) 3, 3'-Диметил-4, 4'-бифенилендигидразоио-быс- 306, 303
(диэтиловый эфир дикетояитарной кислоты)
(60) 3, 3'-Диметокси-4. 4/-бифенилеидигидразоно-бис- 306, 303
(диэтиловый эфир дикетояитарной кислоты) (55—60) 71, 307
C2HSOOCCH2COC (СООС2Н5) = NNHC6H6 (86)
С2Н5ООССН2СОС (СООС2Н6) =NNHC6H4CH3-o (94) 71
С2Н5ООССН2СОС(СООС2Н5) =NNHC6H4CH3-n (90) i 71
С2Н5ООССН2СОС (СООС2Н5) = NNHC6H4NO2-n 70
C2H8OOCCH2COC(COOC2H6)=NNHC6H4COOH-o 71
(70) С2Н5ООССН2СОС (СООС2НБ) = 71
=NNHC6H3(CH3)2-2,4 a-[n- (n-Фенилмеркаптобеизоил) фенилгидразон] 14
диэтилового эфира а, Р-дикетоглутаровой кис- лоты (27)
а-[п- (3,4-Дикарбэтокси-5-метил-1-пиразолил) - 286
фенилгидразон] диэтилового эфира а, р-дике- тоглутаровой кислоты
Продолжение табл. II
Эфир ₽-кетокислоты Заместители в анилине1 Продукт реакции (выход, %) Литература
Диэтиловый эфир а, а-ДИЭТИЛ- — у-Феиилгидразон диэтилового эфира а, а-ди- 307
Р-кетоглутаровой кислоты Лактон 5-окси-З-кетогексен- — этил-р, f-дикетоглутаровой кислоты Лактон 5-окси-3-кето-2-фенилгидразоногексен- 308
4-овой кислоты Диэтиловый эфир 5-кето-2- — 4-овой кислоты (60) C6HSN=NC(CH=CHCOOC2H5) = NNHC6H54 (18) 72
гексендикислоты 4-Бром CsHsOOCCOC (СН=СНСООС2Н6) = 72
Оксальдигидразоно-быс- (эти- 4-Этокси = NNHC6H4Br-n 6 (65) n-BrC6H4N=NC (СН=СНСООС2Н5) = = NNHC6H4Br-n 4 n-BrCeH4N=NC(COOC2Hs) = =CHC (COCOOC2Hs) =NNHC6H4Br-n C2H5OOCCOC (CH=CHCOOC2H6) = = NNHC6H4OC2H6-h6 (36—43) a, a'-Днфенилгидразон P, р’-оксальдигидразоно- 72 72 72 311
ловый эфир ацетоуксусной кислоты) Малонодигидразоно-бис- (эти- — бис- (этилового эфира а, Р-дикетомасляной кислоты)7 • а, а, а"-Трифенилгидразон Р, Р'-мезоксальдигид- 313, 312
ловый эфир ацетоуксусной кислоты) 1 4-Метил разоно-бис-(этилового эфира а, Р-дикетомасля- ной кислоты) (72) а, а', а"-Три-п-толилгидразон р, Р'-мезоксальди- гидразоно-бис-(этилового эфира а, Р-двкето- 313
ts. Амиоы р-кетокислот
Амид р-кетокислоты Заместители в анилине 1 Продукт реакции (выход, %) Литература
Ацетоацетанилид — СНзСОС (CONHCeHs) =NNHC6H5 314, 315
2-Метил СНзСОС (CONHQHs) =NNHC6H4CH3-o 316
4-Метил СНзСОС (CONHCeHs) =NNHC6H4CH3-n 316
2-Метокси СНзСОС (CONHC6HS) =NNHC6H4OCH3-o 316
4-Метокси СНзСОС (CONHCeHs) =NNHC6H4OCH3-n 316
4-Этокси CH3COC (CONHC6HS) =NNHCeH4OC2Hs-n 316
З-Хлор СНзСОС (CONHC6HS) =NNHC6H4C1-jw 316
4-Хлор СНзСОС (CONHC6He) =NNHC6H4Cl-n 316
4-Бром СНзСОС (CONHCeHs) =N NHC6H4Br-n 316
2-Нитро CH3COC (CONHCbHj) =NNHC6H4NO2-o 73, 74
4-Метил-2-иитро СНзСОС (CONHC6HS) =NNHC6H3CH3-4-NO2-2 73, 75
4-Хлор-2-иитро CH3COC (CONHCeHf.) =NNHC6H3Cl-4-NO2-2 73, 74
2,4, 6-Триметил-З-нит- CH3COC(CONHC6H5) =NNHC6H(CH3)3-2,4,6- 317
2 ро NO2-3
а-Нафтиламин СНзСОС (CONHC6HS) =NNHCi0H7-a 316
р-Нафтиламин СНзСОС (CONHCeHs) =NNHCioH7-P 316
Ангидро-трис-о-амино- бензальдегвд СНзСОС (CONHCeHs) =NNHC6H4CHO-o 318
4- (3,4-Дикарбэтокси- 2, 5-диметилпирро- лил) a-[n- (3,4-Дикарбэтокси-2, 5-диметилпирролил) - фенилгидразон] a, p-дикетобутиранилида 319
4- (3, 4-Дикарбэтокси-5- метил-1 -пиразолил) a-[n- (3,4-Дикарбэтокси-5-метил-1 -пиразолил)фе- иилгидразон] а, р дикетобутиранилида 286
Бензидии а, а'-(4, 4'-Бифенилеидигидразоно)-бис-(а, р-ди- кетобутиранилид) 320
о-Ацетоацетотолуид — СНзСОС (CONHC6H4CH3-o) =nnhc6h5 315
Бензидин [СНзСОС (CONHC6H4CH3-o) =nnhc6h4—]2 320
Продолжение табл. //
Амид р-кетокислоты Заместители в анилине 1 Продукт реакции (выход, %) Литература
n-Ацетоацетотолуид — СНзСОС (CONHC6H4CH3-n) =NNHC6H6 315
о-Ацетоацетанизид Бензидин [СН3СОС (CONHCs^CHs-n) = NNHC6H4—12 320
— СНзСОС (CONHCs^OCHs-o) =NNHCsHs 315
n-Ацетоацетанизид Бензидин [СНзСОС (CONHCsH4OCHs-o) = NNHC6H4—}2 320
— СНзСОС (CONHCsH4OCH3-n) =NNHC6Hs 315
n-Этоксиацетоацетанилид Бензидин [СНзСОС (CONHC6H4OCH3-n) =NNHCsH4-]2 320
— СНзСОС (CONHCsH4OC2H5-n) =NNHC6H6 315
«-(3,4-Дикарбэтокси- a-[n-(3,4-Дикарбэтокси-2,5-диметилпирролил) - 319
2,5-диметилпирро- фенилгидразои] л-этокси-а, р -дикетобутирани-
лил) лида
о-Хлорацетоацетаиилид ж-Хлорацетоацетаиилид Бензидии 4-Хлор-2-нитро [СНзСОС (CONHCsH4OC2Hs-n) =NNHC6H4—]2 СНзСОС (СО NHC6H4C1-O) =NNHC6HsCI-4-N02-2 СНзСОС (CONHC6H4C1-jh) =NNHC6Hs 320 73, 74 315
п-Хлорацетоацетанилид Беизидии [СНзСОС (CONHCsH4Cl-3<) =NNHCsH4-]2 СНзСОС (CONHCsH4C1-«) = NNHCsHs 320 315
п-Бромацетоацетаиилид Бензидии [СНзСОС (CONHCeH4Cl-n) = NNHC6H4-]2 320
— СНзСОС (CONHCsH4Br-n) =NNHCeHs 315
я-Сульф амил ацетоацетанилид Бензидин 2-Нитро [СНзСОС (CONHC6H4Br-n) =NNHCsH4-]2 CH3COC (CONHC6H4SO2NH2-n) =NNHC6H4NO2-o 320 321
З-Нитро СНзСОС (CONHC6H4SO2NH2-n) =NNHC6H4NO2-hi 321
4-Нитро CHaCOCtCONHCsHsSOjJJH^nj^NNHCsH^Oa-n 321
1 Бензидин
N- (P-Нафтил) ацетоацетамид Бензидин
N, N-Дифенил ацетоацетамид 2-Нитро З-Нитро 4-Нитро
N-Сул ьфоацетоацетам ид 4-Нитро
N-Сульфамил ацетоацетамид Фенилгидразои ацетоацетани- 4-Нитро
лида
Бензоилацетаиилид 4-Метил 4-Метокси 4-Этокси 4-Хлор Беизидии
п-Беизоил ацетотолуид
• Беизидин
п-Бензоилацетанизид Бензидин
п-Бензоилацетофенетид Бензидин
N-n-Хлорфенилбеизоил ацет-
амид Беизидин
[СНзСОС (CONHCwHt-<x) = NNHC6H4—\2
СНзСОС (CONHCioHt₽) =nnhc6h5
[CH3COC(CONHCioHt-P) =nnhc6h4—Is
(C6H5)2NCOC(СОСНз) =NNHC6H4NOs-o (80—90)
(C6H5)2NCOC (СОСНз) = NNHC6H4NO2-m (80—90)
(C6H5) 2NCOC (СОСНз) =NNHC6H4NO2-n (80—90)
СНзСОС (CONHSO3H) =NNHC6H4NO2-n
СНзСОС (CONHSO2NH2) =NNHCsH4NO2-«
CH3C (=NNHC6H5) C (=NNHC6Hs) conhc6h5
CsHsCOC (CONHCsHs) =NNHC6HB
C6H5COC (CONHCeHs) =NNHC6H4CH3-n
C6H5COC (CONHCsHs) =NNHC6H4OCH3-n
CsHsCOC (CONHCsHs)=NNHC6H4OC2H6-n
CsHsCOC (CONHC6H5) =NNHC6H4Cl-n
[C6H5COC (CONHCeHs) =NNHC6H4—]2
CsHsCOC (CONHC6H4CH3-n) =NNHC6H5
[CsHsCOC (CONHC6H4CH3-n) =NNHC6H4—]2
CeHsCOC (CONHC6H4OCH3-n) =NNHC6H6
[CeHsCOC (CONHCsH4OCH3-n) =NNHC6H4—]2
CsHsCOC (CONHCsH4OC2H5-n) =NNHCsH5
[CsHsCOC (CONHCsH4OC2Hs-n) =NNHC6H4—h
C6H5COC (CONHCsH4Cl-n) =NNHC6HS
[CsHsCOC (CONHC6H4Cl-n) =NNHC6H4—]2
318
315
318
321
321
321
322
322
314
315
316
316
316
316
320
315
320
315
320
315
320
315
320
Реагирующее вещество Заместитель R в qJL-coi :h5conhr Заместители в анилине Заместители в R Прод продукте реакции COCCONHR II NNHR' олжение табл. II Литература
Фенил • о-Толил п-Толил о-Анизил п-Анизил п-Этоксифеиил ж-Хлорфеиил п-Хлорфенил п-Бромфенил «-Нафтил ₽-Нафтил 1 2-Метил 4-Метил 2-Метокси 4-Метокси 4-Этокси З-Хлор 4-Хлор 4-Бром а-Нафтиламин ₽-Нафтиламин Бензидин Бензидин Бензидин Бензидин Бензидин Бензидин Бензидин Бензидин Бензидин Бензидин Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил Фенил о-Толил о-Толил п-Толил п-Толил о-Анизил о-Анизил п-Анизил п-Аиизил п-Этоксифенил п-Этоксифенил ж-Хлорфенил ж-Хлорфенил п-Хлорфенил п-Хлорфенил п-Бромфеиил п-Бромфенил «Нафтил «-Нафтил §-Нафтил , , Фенил о-Толил п-Толил о-Анизил п-Аиизил п-Этоксифенил ж-Хлорфенил п-Хлорфенил п-Бромфенил «-Нафтил ₽-Нафтил Бифенилен Феиил Бифенилен Фенил Бифеиилен Феиил Бифенилен Фенил Бифеиилен Фенил Бифеиилен Фенил Бифеиилен Фенил Бифенилен Фенил Бифеиилен Фенил Бифенилен *Фсннл.. .. 315 ~ 316 316 316 316 316 316 316 316 316 316 320 315 320 315 320 315 320 315 320 315 320 315 320 315 320 315 320 315 320
Зак. 794.
Реагирующее вещество Заместитель R в н3сД J-coch2conhr XOZ Заместители в анилине Заместители в продукте реакции \
ИзсДоХ1- COCCONHR NNHR' Литература
R R' •
Фенил Феиил Фенил 323
2-Метил Феиил о-Толил 323
4-Метил Фенил п-Толил 323
2-Метокси Фенил о-Анизил 323
4-Метокси Фенил п-Анизил 323
4-Этокси Фенил п-Этоксифеиил 323
З-Хлор Феиил ж-Хлорфеиил 323
4-Хлор Феиил п-Хлорфенил 323
4-Бром Феиил п-Бромфенил 323
а-Нафтиламин Фенил а-Нафтил 323
₽-Нафтиламин Фенил ₽-Нафтил 323
О-Толил — о-Толил Феиил 323
.— п-Толил Фенил 323
о-Анизил — о-Анизил Фенил 323
/г-Аиизил — п-Анизил Фенил 323
п-Этоксифеиил — п-Этоксифенил Фенил 323
лг-Хлорфенил п-Хлорфенил п-Бромфеиил а-Нафтил ₽-Нафтил . — ж-Хлорфенил п-Хлорфенил п-Бромфенил а-Нафтил ₽-Нафтил ч Фенил Феиил Фенил Фенил Феиил 323 323 323 323 323
1 Полное название дается в тех случаях, когда ариламии трудно назвать как производное анилина.
2 Этот продукт получен при использовании 2 экв соли диазония.
« Этот продукт получен при использовании 3 экв соли диазония.
4 Этот продукт получен при проведении сочетания в присутствии аммиака.
5 Этот продукт получен при проведении реакции в спиртовом растроре хлористого водорода.
6 Этот продукт получен при проведении реакции в присутствии соды.
2Было выделено некоторое количество монофенилгидразона.
Таблица III
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С МАЛОНОВЫМИ КИСЛОТАМИ, ИХ ЭФИРАМИ И АМИДАМИ
А. Малоновые кислоты
Малоновая кислота Заместители в анилине 1 Продукт реакции (выход, %) Литература
Малоновая кислота .— CBHBN=NCH=NNHCBHB (46) 76
CBHBN=NC (С6НВ) =NNHC6HB 2 76
2-Метокси o-CH3OCbH4N=NCH=NNHCbH4OCH3-o (67), 324
4-Метокси n-CH3OCBH4N=NCH=NNHCBH4OCH3-n 273
2-Бром o-BrC6H4NHN=CHCOOH (30—40) 77
4-Бром n-BrCBH4N=NCH=NNHCBH4Br-n 77, 198
8 2-Иод o-ICBH4N=NCH=NNHCBH4I-o 3 77
2-Нитро o-O2NCbH4NHN=CHCOOH 4 (50) 77, 325
З-Нитро m-O2NC6H4N=NCH=NNHC6H4NO2-jh 273
4-Нитро n-O2NCBH4N=NCH=NNHCBH4NO2-n 77, 273
Малоновая кислота и .— CBHBN=NCH=NOH 77
нитрит натрия
2-Метокси o-CH3OC6H4N=NCH=NOH 77
2-Хлор o-C1CbH4N=NCH=NOH 77
2, 4-Диметил 2, 4-(CH3)2CBH3N=NCH=NOH 77
а-Нафтил a-C10H7N=NCH=NOH 77
Р-Нафтил P-C,oH7N=NCH=NOH 77
Хлормалоновая кислота — CBHBN=NC (Cl) = NNHC6HB 5 (40—50). 78, 198
4-Метил n-CH3CBH4N=NC (Cl) =NNHCBH4CH3-n (40—50) 78
4-Нитро n-O2NC6H4N=NC (Cl) =NNHCBH4NO2-n (хороший)) 78
р-Нафтиламин P-Ci0H7N=NC (Cl) = NNHC10H7-p (плохой) 78, 198
Аллилмалоновая кис-
лота
сд Беизилмалоновая кис-
* лота
Феиацилмалоновая кис-
4-Метил
n-CH3C6H4N=NC (СН2СН=СН2) = NNHC6H4CH3-n
(50)
CbHbN=NC(CH2C6Hb)=NNHCbHb (50)
C6HSN=NC (СН2СОСвНв) =nnhc5h6
T9
79
326
лота
Б. Эфиры малоновых кислот
Эфир малоновой кислоты Заместители в аиилиие 1 Продукт реакции (выход, %) Литература
Кислый этиловый эфир малоновой кислоты Диметиловый эфир ма- лоновой кислоты 4-Нитро 2-Карбокси-4-хлор 2-Карбокси-5-хлор 2-Метил З-Метил 4-Метил 2-Метокси 4-Метокси 2-Нитро З-Нитро 4-Нитро 2-Карбокси З-Карбокси 4-Карбокси n-O2NCBH4N=NC (СООС2Н5) =NNHC6H4NO2-n (52) 2,4-HOOC(Cl)CBH3NHN=CHCOOC2HB (52) 2,5-HOOC(Cl)CBH3NHN=CHCOOC2HB (72) CBHBNHN=C (СООСНз) 2 o-CH3CbH4NHN=C (СООСНз) 2 jh-CH3C6H4NHN=C (СООСНз) 2 n-CH3CBH4NHN=C (СООСНз) 2 o-CH3OCbH4NHN=C (СООСНз) 2 n-CHsOCeHiNHN=C (СООСНз) 2 o-O2NC6H4NHN=C (СООСНз)2 jh-O2NC6H4NHN=C (СООСНз) 2 n-O2NCBH4NHN=C (СООСНз) a o-HOOCCbH4NHN=C (СООСНз) a jh-HOOCC6H4NHN=C (СООСНз) a n-HOOCCBH4NHN=C (СООСНз) 2 23 80 80 81, 327 327 327 327 327 327 327 327 327 327 327 327
Продолжение табл.111
Эфир малоновой кислоты Заместители в анилине 1 Продукт реакции (выход, %) Литература
Диметиловый эфир ма- 2,4-Диметил 2,4- (СН3) 2C6H3NHN=C (СООСНз) 2 327
лоновой кислоты Бензидин 4,4'-Бифенилеидигидразоио-бис- (диметиловый эфир 328, 329
3,3'-Диметилбензи - мезоксалевой кислоты) 3, 3'-Диметил-4, 4'-бифенилендигидразоно-бнс- (димети- 328, 329
дин 3,3'-Диметоксибензи- левый эфир мезоксалевой кислоты) (84) 3,3'-Диметокси-4,4'-бифенилеидигидразоно-бнс-(диме- 328, 329
Малоновый эфир дин тиловый эфир мезоксалевой кислоты) (71) C6HSNHN==C (СООС2Не)2 8, 9, 82, 330
З-Хлор m-C1C6H4NHN=C(COOC2He)2 (78) 80
4-Бром n-BrC6H4NHN=C (СООС2НЕ) 2 82
4-Нитро n-O2NC6H4NHN=C(COOC2H5)2 (71) 23
З-Карбокси м- HOOCC6H4NH№C (СООС2Не) 2 275
4-Фенил n-C6H5C6H4NHN=C(COOC2HE)2 (50)') 105
4-Метокси-2-иитро 4-CH3O-2-O2NC6H3NHN=C (СООС2Не) s (47) 80
2-Карбокси-5-хлор 2-HOOC-5-ClC6H3NHN=C (СООС2Н5) s (67) 80
Бензидин 4,4'-Бифенилендигидразоно-бис-(диэтиловый эфир мез- 328
3,З'-Диметилбензи- оксалевой кислоты) 3,3'-Диметил-4, 4'-бифенилеидигидразоио-бдс-(диэтило- 328
- дин 3,3'-Диметоксибен- вый эфир мезоксалевой кислоты) (80) 3,3'-Диметокси-4,4'-бифенилеидигидразоио-б«с- (ди- 328
Хлормалоновый эфир зидин 4-Нитро этиловый эфир мезоксалевой кислоты) n-O2NCeH4N=NCCl (СООС2НЕ)2 (количественный) 78
Глутакоиовая кислота — C6H5N=NC (СН=СНСООН) =NNHC6Hs 331
Диэтиловый эфир глута- — C6HSNHN=C (СООС2Не) CH=CHCOOC2Hs (77)) 332, 84
КОНОВОЙ кислоты 2-Метил C6HSNHN=C (СООС2Н5) СН=С (СООС2Н5) N=NC6HS6(62) O-CH3C6H4NHN=C (COOC2Hs) CH=C (COOC2H5) n= 331, 84, 333 84
4-Метил =NC6H4CH3-o 6 n-CH3C6H4NHN=C (COOC2H6) CH=C (COOC2H5) N= 84
2-Этокси =NC6H4CH3-n 6 o-C2H5OC6H4NHN=C (COOC2H5) CH=CHCOOC2H5 84
4-Хлор o-C2H5OC6H4NHN=C (COOC2Hs) CH=C (COOCjHs) n= =NC6H4OC2Hs-o 6 n-ClC6H4NHN=C (COOC2H6) CH=C (COOC2H5) N= 84 84
2-Бром =NC6H4Cl-n6 o-BrC6H4NHN=C (COOC2HB) CH=C (COOC2H5) N= 84
З-Бром =NC6H4Br-o s M-BrCeH4NHN=C (COOC2H5) CH=C (COOC2HS) N= 84
4-Бром =NC3H4Br-M 6 n-BrC6H4NHN=C (COOC2Hfi) CH=C (COOC2H5) N= 84
4-Нитро =NC6H4Br-n 6 n-O2NC6H4NHN=C (COOC2H6) CH=CHCOOC2H6 84
2,4-Диметил 2,4- (CH3) 2CeH3NHN=C (COOC2H5) CH=CHCOOC2H5 84
2,4, 6-Триметил 2,4-(CHs)2C6H3NHN=C(COOC2H5)CH= =C (COOC2H5) N=NC6H3 (CH3) 2-2,4 6 2,4, 6-(CH3)3C6H2NHN=C(COOC2H5)CH=CHCOOC2HE 84 84
2,4, 6-(CH3)3C6H2NHN=C (COOC2HE)CH= C(COOC2H5)N=NCeH2(CH3)3-2,4,66 84
Продолжение табл. III
В. Амиды, малоновых кислот
Амид малоновой кислоты Заместитель в анилине Продукт реакции (выход, %) Лите- ратура
Амид малоновой кислоты .— CBHBNHN=C (CONH2) 2 83
Этиловый» эфир N, N'-малонилди- карбаминовой кислоты -— C6H5NHN=C(CONHCOOC2H5)2 (67) CBHBNHN=C (CONHCOOC2H5) N=NCbHb i (74) 83 83
4-Метил n-CH3C6H4NHN=C (CONHCOOC2HB) 2 n-CH3CBH4NHN=C (CONHCOOC2HB) N=NC6H4CH3-n ' 83 83
2-Нитро o-O2NCbH4NHN=C (CONHCOOC2Hb) 2 o-O2NC6H4NHN=C (CONHCOOC2Hb) N=NCbH4NO2-o 7 83 83
З-Нитро jh-O2NC6H4NHN=C (CONHCOOC2Hb) 2 83
4-Нитро n-O2NCBH4NHN=C (CONHCOOC2Hb) 2 83
Амидии малоновой кислоты — CBHBNHN=C[C (=NH) NH2]2 334
CH2[CONHN=C (СНз) С (СООСеНв)= =NNHCbHb]2 — CBHBNHN=C[CONHN=С (CH3) C (COOC2H5) = =NNHC6Hb]2 313
Этиловый эфир малонаниловой кислоты — C6HBNHN=C (COOC2HB) CONHC6HB 335
Метиловый эфир полуамида N-(a- пиридил)малоновой кислоты — CeHBNHN=C(COOCH3)CONHCBH4N-a (количествен- ный) 335
Этиловый эфир полуамида N- (Y-пиридил)малоновой кислоты — C6HBNHN=C (COOC2HB) CONHCbH4N- -y 336
Полуамид малоновой кислоты 4-Нитро n-O2NCBH4N=NC (CONH2) =NNHCBH4NO2-n (89) 23
Этиловый эфир полуамида мало- новой кислоты 4-Нитро n-O2NCBH4NHN=C (COOC2HB) CONH2 (36) 23
1 Полное название дается в тех случаях, когда ариламии трудно назвать как производное анилина.
3 Этот продукт получен при проведении реакции с избытком соли диазония.
® Образуется также о-иодфенилгидразон глиоксиловой кислоты с выходом 8%.
4 Образуется также N, N'-ди-о-иитрофенилформазан с выходом 5%.
8 При избытке хлормалоновой кислоты получен соответствующий 3-арил-1,3,4-оксадиазолои-2.
• Этот продукт получен при проведении реакции с 2 &кв срли диазония.
Таблица W
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С АРИЛУКСУСНЫМИ КИСЛОТАМИ И ИХ ЭФИРАМИ
Кислота или эфир Заместители в анилине 1 Продукт реакции (выход, %) Литература
2,4-Дииитрофенилуксусиая кислота — 2, 4- (O2N) 2С6Н3С (N=NCBHB) =NNHC6HB 85
4-Бром 2, 4- (O2N) 2СвН3С (N=NC6H4Br-n) =NNHCeH4Br-n 85
2, 4-Дихлор 2, 4-(O2N)2C6H3C(N=NC6H3Cl2-2, 4) =NNHC6H3Ch-2,4 85
2,4-Дибром 2,4-(O2N)2C6H3C(N=NC6H3Br2-2, 4) =NNHC6H3Br2-2,4 85
Метиловый эфир 2,4-дииитро- фенилуксусиой кислоты — 2,4- (O2N) 2CbH3C (COOCH3) =NNHC6Hs 87. 88, 337
2-Метил 2,4- (O2N) 2СбН3С (СООСНз) =NNHC6H4CH3-o (98) 87
4-Метил 2,4- (O2N) 2C6H3C (СООСНз) =NNHC6H4CH3-n (75) 86, 338
- 4-Метокси 2,4- (O2N) 2СбНзС (COOCH3) =NNHC6H4OCH3-n 87
4-Хлор 2, 4-(O2N)2CbH3C (СООСНз) =NNHC6H4Cl-n 85
4-Бром 2,4- (O2N) 2C6H3C (СООСНз) =NNHC6H4Br-n 85
4-Ацетил 2,4-(O2N)2CBH3C (COOCH3) = NNHC6H4COCH3-n 86
2-Нитро 2,4- (O2N) 2C6H3C (СООСНз) =NNHC6H4NO2-o (30) 87
З-Нитро 2,4- (O2N) 2C6H3C (СООСНз) =NNHC6H4NO2-jh (15) 87
4-Нитро 2,4- (O2N) 2CbH3C (СООСНз) =NNHCBH4NO2-n 87
2-Карбокси 2,4- (O2N) 2СбН3С (COOCH3) =NNHCeH4COOH-o (ко- личественный) 87
4-Карбокси 2,4- (O2N) 2CbH3C (СООСНз) =NNHCsH4COOH-n (ко- личественный) 86
Продолжение табл. IV
Кислота или эфир Заместители в анилине1 Продукт реакции (выход, %) Литература
Метиловый эфир 2,4-ДИнитро- 4-Сульфо 2,4- (O2N) 2С6Н3С (СООСНз) =NNHC6H4SO3H-n 338
фенилуксусной кислоты 2, 4-Диметил 2, 4- (O2N) 2С6Н3С (СООСН3) =NNHC6H3 (СН3) 2-2,4 338
2. 4-Дихлор 2,4-(02N)2C6H3C(COOCH3) =NNHC6H3Cl2-2,4 (55) 86, 85
2,4-Дибром 2, 4-(O2N)2C6H3C (СООСНз) =NNHC6H3Br2-2, 4 85
2, 4,6-Триметил 2,4- (O2N) 2С6Н3С (СООСНз) =NNHC6H2 (СН3) 3-2,4,6 (80) 86
2, 4, 6-Трихлор 2, 4- (O2N) 2С6НзС (СООСНз) =NNHC6H2Cl3-2, 4,6 (45) 86
«-Нафтил 2,4- (O2N)2C6H3C (СООСНз) =NNHC1oH7- а 338
Р-Нафтил 2, 4- (O2N) 2СеНзС (COOCH3) =NNHCi0H7- ₽ СООСНз 87
Диметиловый эфир 4-иитро- гомофталевой кислоты II N 1 II NC6HB /'Ч/Х/ O2N II о 87
Метиловый эфир 4-карбоме- токси-2-иитрофеиилуксусной кислоты C6H5NHN=C (СООСНз) C6H3COOCH3-4-NO2-2 87
Ангидрид гомофталевой кис- лоты — Ангидрид а-фенилгидразоногомофталевой кислоты 89
Таблица V
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С НИТРИЛАМИ
Нитрил Заместители в анилине 1 Продукт реакции (выход, %) Л итература
Цианацетальдегид CNC(CHO)=NNHC6HS (15) 94, 93
4-Бром CNC (СНО) =NNHC6H4Br-n 94
4-Нитро CNC(CHO)=NNHC6H4NO2-n (11) 23
Циануксусная кислота — C6H5N=NC (CN) =NNHC6HS 103
2-Карбокси o-HOOCC6H4N=NC (CN) =NNHC6H4COOH-o (65), 339
4-Нитро n-O2NC6H4N=NC (CN) =NNHC6H4NO2-n 23
2-Окси-5-хлор 2-HO-5-ClC6H3N=NC (CN) =NNHC6H3Cl-5-OH-2 264
Метиловый эфир циаи- — CNC (COOCH3) =NNHC6HS 340
уксусной кислоты 2-Метил CNC (СООСНз) =NNHC6H4CHs-o 340
4-Метил CNC (СООСНз) = NNHCeH4CH3-n 340
Бензидин 4,4'-Бифеинлендигидразоно-быс- (метиловый эфир цианглиоксиловой кислоты) 341, 342
3,3'-Диметилбеизидин 3, 3'-Диметил-4,4/-бифеиилендигидразоно-бис- (мети- ловый эфир цианглиоксиловой кислоты) 341, 342
3, З'-Диметоксибеизи- ДИН 3,3'-Диметокси-4, 4'-бифеиилендигидразоно-бдс- (мети- ловый эфир цианглиоксиловой кислоты) 341, 342
Циануксусиый эфир — CNC (СООС2Н5) =NNHC6H5 (количественный) 90,82,203,340, 343—345
2-Метил CNC (СООСгНз) =NNHC6H4CH3-o 90, 340
4-Метил CNC (СООС2Н5) =NNHC6H4CH3-n 90, 340
2-Метокси CNC (СООСгНз) =NNHC6H4OCH3-o 346
4-Метокси CNC(COOC2H5) =NNHCeH4OCH3-n 346
Продолжение табл. V
Нитрил Заместители в анилине1 Продукт реакции (выход, %) Литература
Циануксусный эфир 4-Этокси CNC (СООС2Н5) =NNHC6H4OC2H5-n 346
2-Окси CNC (СООС2Н5) =NNHC6H4OH-o 347
З-Окси CNC (СООС2Н5) ==NNHC6H4OH-jh 347
4-Окси CNC (COOC2H5) =NNHC6H4OH-n 347
З-Хлор CNC(COOC2H5)=NNHC€H4Cl-/1 (97) 80
З-Бром CNC (COOC2H5) =NNHC6H4Bt-jw 347
2-Нитро CNC (COOC2H5) =NNHC6H4NO2-o 348
З-Нитро CNC(COOC2H5)=NNHC6H4NO2-a( (76) 348
4-Нитро CNC(COOC2H5)=NNHCeH4NO2-n (97) 348
2-Карбокси CNC (COOC2H6) =NNHC6H4COOH-o 90
З-Карбокси CNC(COOC2H5) = NNHC6H4COOH-Jw 347
2-Карбометокси CNC (COOC2H5) =NNHCeH4COOCHs-o 346
4-Сульфо CNC (COOC2Hs) =NNHC6H4SO3H-n 347
2, 4-Диметил CNC(COOC2H5) =NNHCeHs(CH3)2-2,4 90
2,4, 5-Триметил CNC(COOC2H5)=NNHCsH2(CH3)3-2,4, 5 90
2,4-Дихлор CNC (COOC2H5) =NNHCeH3C12-2,4 (96) 349
2, 5-Дихлор CNC(COOC2Hs)=NNHC6H3C12-2, 5 (99) 349
2, 5-Дибром CNC (COOCsH5) =NNHC6H3Br2-2, 5 347
2,4, 6-Трибром CNC(COOC2H5)=NNHC6H2Br3-2,4, 6 347
2-Хлор-4-метил CNC (COOC2H5) =NNHCsH3Cl-2-CH3-4 (71) 270
4-Хлор-2-метил CNC (COOC2H5) =NNHC6H3Cl-4-CH3-2 (92) 270
а -Нафтиламин CNC (COOC2H5) =NNHCi0H7-a 347
р-Нафтиламин CNC (COOC2H5) =NNHC10H7-P 347
Беизидин 4,4/-Бифенилендигидразоно-бос- (этиловый эфир циан- глиоксиловой кислоты) 341, 346
3, З'-Диметилбензидин 3, 3'-Диметил-4,4'-бифеиилеидигидразоно-б«с- (этиле- 341*. 3#L..
3, З'-Диметоксибензи- 3, 3'-Диметокси-4,4'-бифенилендигидразоно-бис- (эти- 341, 346
ДИН левый эфир циаиглиоксиловой кислоты) 350
н-Пропиловый эфир ЦИ- CNC (COOC3H7-w) =NNHC6He
ануксусиой кислоты н-Бутилоный эфир циаи- — CNC (СООС4Н9-н) =NNHC6HS 350
уксусной кислоты н-Амиловый эфир циан- — CNC (COOC5Hh-h)=NNHC6H5 350
уксусной кислоты Z-Ментиловый эфир ци- 4-Метил CNC (COOCioHig-Z) =NNHCsH4CH3-n 351
ануксусной кислоты 4-Бром CNC (COOC|0HI9-0 =NNHC6H4Br-n 351
Циан ацетамид 4-Нитро CNC(CONH2)=NNHC6H4NO2-n (56) 23
Цианацетанилид 4-Метокси-2-иитро CNC (CONHCeHs) = NNHCeH3OCH3-4-NO2-2 80
Этиловый эфир а-циаи- 4-Нитро n-O2NCsH4N=NC(CH3) (CN)COOC2HE2 108
пропионовой кислоты Этиловый эфир о -циан- — C6H5N=NC (C2HB) (CN) COOC2H5 3 108
масляибй кислоты 4-Бром n-BrC6H4N=NC (C2H6) (CN)COOC2H6 4 108
Этиловый эфир циаи- C6HsNHN=C(CN)COCOOC2H5 (72) 94, 95
пировиноградиой кис- лоты 4-Бром n-BrC6H4NHN=C(CN)COCOOC2HE (83) 94, 95
Малононитрил 4-Нитро C6HsNHN=C(CN)2 n-O2NC6H4NHN=C(CN)2 (75). 81, 91 92, 23
Бензилмалононитрил — C6HsN=NC(CN)2CH2CsHs (84) 105 105
4-Нитро n-O2NC6H4N—NC(CN)2CH2C6Hs (87)
4-Феиил n-C6HsC6H4N=NC(CN)2CH2C6Hs (87) 105
Нитроацетоиитрил 4-Нитро CeH5NHN=C(NO2)CN n-O2NCsH4NHN=C(NO2)CN (59) 96, 97 23
Метил сульфинил ацето- 4-Нитро n-O2NC6H4N=NC (CN) =NNHC6H4NO2-n (72); 23
нитрил
I
Продолжение табл. V
Нитрил Заместители в анилине 1 Продукт реакпии (выход, %) Литература
Метил сул ьфонил ацето- 4-Нитро n-O2NC6H4NHN=C(CN)SO2CH3 (63) 23
нитрил п-Нитрофенилацетони- — rt-O2NCeH4C (CN) =NNHC6HS 352
трил
₽-Иминобутиронитрил — CH3COC (CN) =NNHC6HS 98
₽-Оксиминобутирони- — СНзСОС (CN) =NNHC6HG 98
Трил
₽-Иминовалероиитрил — ? 98
₽-Имиио- Р -фенилпро- — СзНзСОС (CN) =NNHC6H5 98
пионитрил
₽-Фенилиминобутиро- — C6HSN=C (CH3) C (CN) =NNHC6HS 99
нитрил
Бензоилацетонитрил — СзНзСОС (CN) =NNHC6H5 353
2-Метил СзНзСОС (CN) =NNHC6H4CH3-o 353
2-Окси-5-сульфо СзНзСОС (CN) =NNHCeH3OH-2-SO3H-5 102
2-Карбокси-4-сульфо СзНзСОС (CN) =NNHC6H3COOH-2-SO3H-4 102
2-Окси-4-сульфо-5-ме- СзНзСОС (CN) =NNHCeH2OH-2-SO3H-4-CH3-5 102
ТИЛ 2-Окси-3-сульфо-5-хлор СзНзСОС (CN) =NNHC6H2OH-2-SO3H-3-Cl-5 102
2-Окси-3-сульфо-5-ни- СзНзСОС (CN) =NNHCeH2OH-2-SO3H-3-NO2-5 102
тро 2-Окси-3-карбокси-5- СзНзСОС (CN) =NNHC6H2OH-2-COOH-3-SO3H-5 102
сульфо 2-Окси-4-сульфо-1 -наф- “-(2-Окси-4-сульфо-1-нафтилгидразон) a, p-дикето- 102
тиламин 2-Окси-4-сульфо-6-ии- ₽-фенилпропиоиитрила a - (2-Окси-4-сульфо-6-иитро-1-нафтилгидразон) 102
л-Толуоилацетонитрил
о-Анизоилацетонитрил
о-Этоксибензоилацето-
нитрил
о-Пропоксибеизоил аце-
тонитрил
о-Бензилоксибеизоил-
ацетонитрил
П-Хлорбензоилацетони-
трил
ж-Аминобензоилацето-
нитрил
л-Нитробензоил ацето-
нитрил
У Л1-Карбоксибензоилаце-
тонитрил
2, 4-Днметоксибензоил-
ацетонитрил
3,4-Дихлорбензоилаце-
тонитрил
3, 4, 5-Триметокснбен-
зоил ацетонитрил
3,4,5-Триэтоксибен-
зоилацетонитрил
п- (л-Цианацетофенил) -
бензоилацетонитрил
Гексагидробеизоилаце-
тонитрил
2-Окси-4-сульфо-1-наф- а-(2-Окси-4-сульфо-1-нафтилгидразои) а,? -дикето- 102
тиламин п-толилпропионитрил а 102
2-Окси-4-сульфо-1 -наф- тиламии а-(2-Окси-4-сульфо-1-нафтилгидразон)' -дикето- о-анизилпропионитрила
2-Окси-4-сульфо-1 -наф- тиламин а-(2-Окси-4-сульфо-1-нафтилгидразон) а,₽-дикето- о-этокснфенилпропиоинтрил а 102
2-Окси-4-сульфо-1 -наф- тиламин 2-Окси-4-сульфо-1 -наф- тил амин а-(2-Окси-4-сульфо-1-нафтилгидразон) а,₽-дикето- о-пропоксифенилпропионитрила а- (2-Окси-4-сульфо- 1-нафтилгидразои) -дикето- о-бензилоксифенилпропиоиитрил а 102 102
2-Окси-4-сульфо-1-иаф- тиламин 2-Окси-4-сульфо-1 -наф- тил амин а-(2-Окси-4-сульфо-1-иафтилгидразои) а,₽-дикето- п-хлорфеиилпропионитрила а-(2-Окси-4-сульфо-1-нафтилгидразон) «,р-дикето- м-аминофеиилпропиоиитрила 102 102
2-Окси-4-сульфо-1 -наф- тиламин 2-Окси-4-сульфо-1 -иаф- тиламин а-(2-Окси-4-сульфо-1-нафтилгидразои) -дикето- л-нитрофенилпропионитрила а-(2-Окси-4-сульфо-1-нафтилгидразон) а,р -дикето- м-карбоксифенилпропиоиитрила 102 102
2-Окси-4-сульфо-1-наф- тиламин а-(2-Окси-4-сульфо-1-иафтилгидразон) -дикето- 2,4-диметоксифеннлпропионитрнла 102
2-Окси-4-сульфо-1 -наф- тиламин а- (2-Окси-4-сульфо- 1-нафтилгидразон) а,₽ -дикето- 3, 4-дихлорфенилпропионитрила 102
2-Окси-4-сульфо-1 -наф- тиламин а - (2-Окси-4-сульфо-1-иафтилгидразои) “,₽-дикето- 3, 4, 5-триметоксифеиилпропионитрила 102
2-Окси-4-сульфо-1 -иаф- тиламин а - (2-Окси-4-сульфо-1 -нафтилгидразон) «,Р -дикето- 3, 4, 5-триэтоксифеиилпропиоиитрила 102
2-Окси-4-сульфо-1 -наф- тил амин а - (2-Окси-4-сульфо-1 -нафтилгидразон) -дикето- п- (n-цианацетофеиил) феиилпропионитрила 102
2-Окси-4-сульфо-1-наф- тиламин а-(2-Окси-4-сульфо-1-иафтилгидразон) а,₽-дикето- циклогексил пропионитрила 102
Продолжение табл. V
Нитрил Заместители в аиилиие 1 Продукт реакции (выход, %) Литература
а-Нафтоил ацетонитрил 2-Окси-4-сульфо-1 -наф- тиламии °-(2-Окси-4-сульфо-1-нафтилгидразои) а, р-дикето- 1 -иафтилпропиоиитрила 102
Р-Нафтоилацетоиитрил 2-Окси-4-сульфо-1-иаф-. тиламин а-(2-Окси-4-сульфо-1-нафтилгидразон) а, ₽-дикето- 2-нафтилпропионитрила 102
З-Метокси-2-нафтоил - ацетонитрил 2-Окси-4-сульфо-1 -наф- тиламин 2-Окси-4-сульфо- 6-нитро-1 -нафтил- амии 2-Окси-3-нитро-4-суль- фо а-(2-Окси-4-сульфо-1-нафтилгидразои) а, р-дикето- З-метокси-2-нафтилпропионитрила а-(2-Окси-4-сульфо-6-иитро-1-иафтилгидразои) а, 0-ди- кето-З-метокси-2-иафтилпропионитрила «-(2-Окси-3-нитро-4-сульфофеиилгидразон) а, ₽ -ди- кето-З-метокси-2-нафтилпропиоиитрила 102 102 102
5, 6,7,8-Тетрагидро- 2-иафтоил ацетонитрил 2-Окси-4-сульфо- 1-иафтиламин «•(2-Окси-4-сульфо-1-нафтилгидразои) а, р-дикето- ₽-(5.6,7,8-тетрагидро-2-нафтил) пропионитрила 102
5-Апенафтеиои л ацето- нитрил 2-Окси-4-сульфо-1 -наф- тил амии “-(2-Окси-4-сульфо-1-нафтилгидразои) а, ₽-дикето- ₽- (5-ацеиафтил) пропиоиитрила 102
2-Теноил ацетонитрил 2-Окси-4-сульфо-1 - наф- тил амин о-(2-Окси-4-сульфо-1-нафтилгидразои)' а, ₽ -дикето- ₽ -(2-тиенил) пропионитрила 102
2-Фуроилацетонитрил х 2-Окси-4-сульфо-1 -наф- тиламии 2-Карбокси-4-сульфо 2-Карбокси-З-сульфо- 4-хлор 2-Окси-4-сульфо- 6-нитро-1 -иафтиламин «-(2-Окси-4-сульфо-1-нафтилгидразои) а, р-дикето- ₽- (2-фурил) пропионитрила а- (2-Карбокси-4-сульфофеиилгидразои) а, 0-дикето- Р- (2-фурил) пропиоиитрила а-(2-Карбокси-3-сульфо-4-хлорфеиилгидразон) а, р-ди- кето- р- (2-фурил) пропионитрила а-(2-Окси-4-сульфо-6-нитро-1-иафтилгидразон) а, р-дикето-р - (2-фурил) пропионитрила 102 102 102 102
Фенилсульфонилацето-
нитрил
п-Толилсульфонилаце'
тоиитрил
n-Бромфенил сульфонил-
ацетонитрил.
а -Нафтилсульфоиил-
ацетонитрил
Р -Нафтилсульфонил-
ацетоиитрил
а -Фенилсульфоиилпро-
пиоиитрил
а -п-Хлорфенилсульфо-
нилпропиоиитрил
2-Метил
З-Метил
2-Метокси
4-Метокси
4-Этокси
2,4-Диметил
2-Метил
З-Метил
4-Метил
2-Метокси
4-Метокси
4-Этокси
2,4-Диметил
4-Этокси
2-Метил
4-Метил
4-Метокси
З-Метил
4-Метил
4-Этокси
4-Метил
4-Метокси
4-Этокси
Р-Нафтиламин
CeHsSO2C (CN) =NNHC6Hs
C6H8SO2C (CN) =NNHC8H4CH3-o
CeHsSOaC (CN) =NNHC6H4CH3-jh
CsH8SO2C(CN) = NNHC8H4OCH3-o
C6H8SO2C (CN) =NNHC6H4OCH3-n
C6H8SO2C (CN) =NNHC6H4OC2H8-n
CeHsSOaC (CN) =NNHC6H3 (CH3) 2-2,4
n-CH3C6H4SO2C (CN) =NNHC6H8
n-CH3C6H4SO2C (CN) =NNHC6H4CH3-o
n-CH3C6H4SO2C (CN) =NNHC6H4CH3-JH
n-CH3C8H4SO2C (CN) =NNHC6H4CH3-n
n-CH3C6H4SO2C (CN) =NNHC6H4OCH3-O
n-CH3CeH4SO2C(CN) =NNHCeH4OCH3-n
n-CH3C6H4SO2C (CN) ==NNHC6H4OC2H5-n
n-CH3C6H4SO2C (CN) =NNHC6H3 (CH3) 2-2,4
n-BrC6H4SO2C (CN) =NNHC6H8
n-BrC6H4SO2C (CN) =NNHC8H4OC2H8-n
a-C,0H7SO2C (CN) =NNHC6HS (67)
a-CioH?S02C (CN) =NNHC6H4CH3-o
a-CioH7S02C(CN) =NNHC6H4CH3-n
a-Ci0H7SO2C(CN) =NNHC6H4OCH3-n
₽-CioH7S02C (CN) =NNHC6HS
₽-CioH7S02C (CN) =NNHC6H4CH3-m
₽.Ci0H7SO2C (CN) = NNHC6H4CHa-n
₽-CioH7S02C (CN) =NNHC6H4OC2H5-n
C6H8SO2C (CN) (CH3) N=NC6H8
C6H8SO2C(CN) (CH3)N=NC6H4CH3-n
C6H8SO2C(CN) (CH3)N=NC8H4OCH3-n
C6H8SO2C(CN) (CH3)N=NC8H4OC2H8-n
n-ClC6H4SO2C(CN) (CH3)N=NC6HS
n-ClC6H4SO2C(CN) (CH3)N=NCioH7- P
100
100
100
100
100
100
100
100
100
100
100
100
100
100
100
101
101
101
101
101
101
101
101
101
101^
101
101
101
101
101
101
Продолжение табл. V
Нитрил Заместители в анилине 1 Продукт реакции (выход, %) Литература
а -п-Бромфенилсульфо- 4-Метил n-BrCeH4SO2C (CN) (СН3) N=NC6H4CH3-n 101
нилпропионитрил 4-Метокси п-ВгСбН4БО2С (CN) (CH3)N=NC3H4OCH3-n 101
а- (Р-Нафтилсульфо- — ₽-Ci0H7SO2C(CN) (CH3)N=NC6Hs 101
нил)пропионитрил 4-Метил ₽ -CioH7S02C (CN) (CH3) N=NC6H4CH3-n 101
а -Феиоксиацетил- fl- имино- р -феиилпро- пионитрил — C6HSOCH2COC (CN) (N=NCGHG) C (=NH) СбН5 354
₽ -Феноксиацетимидо- ₽-феиилпропионитрил — C6H5OCH2CON=C (C6H5) C (CN) =nnhc6h5 355
Нитрил Заместитель в анилине N NCC-I II RHNN R II R' \ N OZ R' Выход, % Литера- тура
(З-п-Толил-1,2, 4-оксадиазолил-5)- —. Фенил п-Толил 20 37
ацетонитрил 2-Метокси о-Анизил п-Толил 20 37
(З-м-Нитрофеиил-!, 2,4-оксадиазо- 4-Нитро п-Нитрофенил п-Толил 20 37
4-Диэтиламино п-Диэтиламинофеиил п-Толил 20 37
лил-5)ацетонитрил 4-Диэтиламино n-Д иэтил аминофенил .и-Нитрофенил 20 37
Нитрил 1,2,3,4-тетрагидроакридин- 4-карбоновой кислоты 4-Метокси 50 170
4-Бром
Зак. 794.
Нитрил 2,3-дигидро-1-циклопента[5]-
хинолин-3-карбоновоц. кислоты
4-Бром
CN N=NC6H4Br-n
Бензотиазол-2-ацетонитрил
4-Бром
З-Метилхиноксалии-2-ацетонитрил
4-Хлор
—СН3
—C=NNHC6H4C1-m
56 107
61 107
(47) 42
(67) 42
N=NC6H4Cl-n
1 Полное название дается в тех случаях, когда ариламин трудно назвать как производное анилина,
а Образуется также некоторое количество tz-O2NC6H4N (СН3) N=C (CN) СООС2Н6.
s Образуется также некоторое количество CBHHN (C2H5)N=C (CN) СООС2НБ.
< Образуется также некоторое количество /?-BrC6H4N (C2HS) N=C (CN) СООС2НБ.
Таблица VI
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С СУЛЬФОНАМИ
Сульфон Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
•бис- (Метилсульфонил) ме- (CH3SO2)2C=NNHC6H5 (56) 110
тан 2-Метил (CH2SO2)2C=NNHC6H4CH3-o (43) 110
4-Метил (CH3SO2)2C=NNHC6H4CH3-n (36) 110
4-Нитро (CH3SO2)2C=NNHC6H4NO2-n 2 23
бис- (Этилсульфонил) метан — (C2H5SO2)2C==NNHC6H5 (43) 110
2-Метил (C2H5SO2)2C=NNHC6H4CH3-o (48) 110
4-Метил (C2H6SO2)2C=NNHC6H4CH3-n (33) 110
4-Нитро (C2H5SO2) 2C=NNHC6H4NO2-n 2 23
8 Метил (метилсульфонил) - 4-Нитро n-O2NC6H4N=NC (SO2CH3)=NNHC6H4NO2-n2 23
метилсульфоксид
Этиловый эфир метилсуль- 4-Нитро CH3SO2C (COOC2H5) =NNHC6H4NO2-n (79) 23
фонилуксусной кислоты
2- (Метилсульфонил) ацет- 4-Нитро n-O2NC6H4N=NC (SO2CH3) =NNHC6H4NO2-n (54) 23
амид
Метилнитрометилсульфон 4-Нитро CH3SO2C(NO2)=NNHC6H4NO2-n (35) . 23
бис- (Фенилсульфонил) ме- 4-Нитро (C6H5SO2)2C=NNHC6H4NO2-n 2 23
тан
•бис-(Метилсульфонил) ме- — (CH3SO2)2C(SCH3)N=NC6Hb (66) 356
тилтиометан
•Фенил сульфонил уксусная 2-Метил C6H5SO2C (N=NC6H4CH3-o) =NNHC6H4CH3-o 100
кислота 2-Метокси C6HBSO2C (N=NC6H4OCH3-o) = NNHC6H4OCH3-o 100
Этиловый эфир фенилсуль- — C6HBSO2C (СООС2Н5) =NNHCeHB 100
фонилуксусной кислоты 2-Метил C6H5SO2C (COOC2H5) =NNHC6H4CH3-o 100
З-Метил C6H5SO2C(COOC2H6) =NNHC6H4CH3-jm 100
2-Метокси \ C6HBSO2C(COOC2HB) =NNHC6H4OCH3-o 100
4-Метокси C6HBSO2C (COOC2HE) = NNHC6H4OCH3-n 100
4-Этокси C6H5SO2C (COOCsHs) =NNHC6H4OC2Hs-n 100
2, 4-Диметил CeHsSOsC (COOC2HE) =NNHCBH3 (CH3) 2-2,4 100
Этиловый эфир п-толил- — n-CH3C6H4SO2C(COOC2H5) =NNHC6Hs 100
сульфонилуксусной кис- 2-Метил n-CH3CBH4SO2C (СООС2Н5) =NNHC6H4CH3-O 100
лоты З-Метил n-CH3C6H4SO2C (СООС2Н5) =NNHC6H4CH3-JM 100
4-Метил n-CH3C6H4SO2C (СООС2Н5) =NNHC6H4CH3-n 100
2-Метокси n-CH3C6H4SO2C (COOCsHs) =NNHC6H4OCH3-O 100
4-Метокси n-CH3C6H4SO2C (СООС2Н5) =NNHC6H4OCH3-n 100
4-Этокси n-CH3C6H4SO2C (COOC2H5) =NNHC6H4OC2HE-n 100
2,4-Диметил n-CH3C6H4SO2C (COOCzHs) =NNHC6H3(CH3)2-2,4 100
Фенилсульфоиилацетамид — CeHsSOsC (CONH2) =NNHCBHB 100
2-Метил CBHBSO2C (CONH2) =NNHCbH4CH3-o 100
З-Метил CBHBSO2C (CONH2) =NNHC6H4CH3-At 100
4-Метил С6Нв8О2С (CONH2) =NNHCBH4CH3-n 100
с£ 2-Метокси C6HBSO2C (CONH2) =NNHC6H4OCH3-o * 100
4-Метокси CeHsSOsC (CONH2) =NNHCBH4OCH3-n 100
4-Этокси CBHBSO2C (CONH2) =NNHC6H4OC2HB-n 100
2, 4-Диметил CeHsSOsC (CONH2) =NNHCBH3 (CH3) 2-2,4 100 .
n-Т олилсульфонил ацетамид — п-СН3СвН48О2С (CONH2) =NNHCBHB 100
2-Метил n-CH3C6H4SO2C (CONH2) =NNHC6H4CH3-o 100
З-Метил п-СН3С6Н48О2С (CONH2) =NNHCbH4CH3-jm 100
4-Метил n-CH3CBH4SO2C (CONH2) =NNHC6H4CH3-n 100
2-Метокси п-СН3С6Н48О2С (CONH2) =NNHC6H4OCH3-o 100
4-Метокси n-CH3CBH4SO2C (CONH2) =NNHC6H4OCH3-n 100
4-Этокси п-СН3С6Н48О2С (CONH2) =NNHCBH4OC2HB-n 100
2,4-Диметил n-CH3C6H4SC>2C (CONH2)=NNHC6H3(CH3)2-2,4 100
Продолжение табл. VI
Сульфон Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
Фенилсульфонилнитрометан C6H6SO2C (NO2) =NNHC6H6 111
n-Т олилсульфонилиитро- 4-Нитро n-CH3C6H4SO2C (NO2) =NNHC6H4NO2-n (22) 23
метан
п-Бромфенилсульфонил- — n-BrC6H4SO2C (NO2) =nnhc6h5 111
нитрометан
.и-Нитробензилфеиилсуль- — jw-O2NC6H4C (SO2C6H6) =NNHC6He 111
фон
Сульфазои, т. е. 5-Сульфо- 1-нафтиламин 2- (5-Сульфо-1 -нафтил азо) сульфазон 112
8-Окси-6-сульфо-1 -на- 2- (8-Окси-6-сульфо-1 -нафтил азо) сульфазон 112
Н фтиламин
(^"\Х4'зСО З-Сульфо-4- (п-сульфо- 2-[3-Сульфо-4- (n-сульфофеиилазо) фенилазо]сульфазон 112
Г 1 фенил азо)
4-[п- (4-Окси-З-карб- 2-{п-[п- (4-Окси-З-карбокси фенилазо) фенил]фенилазо}- 112
о2 оксифенилазо) фенил] сульфазон
Сульфазон-7-сульфонил- 4-Сульфо 2- (п-Сульфофенилазо) сульфазон-7-сульфонилуксусная 357
уксусная кислота кислота
З-Карбокси-4-окси 2- (З-Карбокси-4-оксифенилазо) сульфазон-7-сульфонил- 357
уксусная кислота
4-Сульфо-1 -нафтил амин 2- (4-Сульфо-1-нафтилазо)сульфазон-7-сульфонилуксус- 357
ная кислота
* Полное название дается в
тех случаях, когда ариламии трудно назвать как производное .анилина.
Таблица VII
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С НИТРОСОЕДИНЕНИЯМИ
Нитросоедииение Заместители в анилине 1 Продукт реакции (выход, %) Литература
Нитрометан 8 2-Метил 4-Метил 2-Этокси 4-Бром 2-Нитро 4-Нитро 2-Формил 2-Ацетил 2-Карбокси 2-Карбометокси 4-Карбэтокси 4-Сульфо 4-Сульфамил 2, 4-Диметил 2-Фенил З-Фенил 4-Фенил 4-Фенокси а -Нафтиламин Р-Нафтиламин c6h5nhn=chno2 C6HsN=NC(NO2)=NNHC6H5 (56) o-CH3C6H4N=NC (NO2) =NNHC6H4CH3-o n-CH3C6H4N=NC (NO2) =NNHC6H4CH3-n o-C2H5OC6H4N=NC (NO2) =NNHC6H4OC2H6-O n-BrC6H4N=NC (NO2) =NNHC6H4Br-n o-O2NC6H4NHN=CHNO2 (77) n-O2NC6H:N=NC (NO2) =NNHC6H4NO2-n n-O2NC6H4NHN=CHNO2 (6) o-HCOC6H4NHN=CHNOj (57) o-CH3COC6H4NHN=CHNO2 (98) o-HOOCC6H4NHN=CHNO2 (73) o-CH3OOCC6H4NHN=CHNO2 (95) n-C2H5OOCC6H4NHN=CHNO2 (80) n-HO3SC6H4N=NC (NO2) =NNHC6H4SO3H-n n-H2NSO2C6H4N=NC (NO2) =NNHC6H4SO2NH2-n 2, 4- (CH3)2C6H3N=NC (NO2)=NNHC6H3(CH3)2-2,4 (20) o-C6HbC6H4N=NC (NO2) =NNHC6H4C6H5-o jm-C6HeC6H4N=NC (NO2) =NNHC6H4C6H5-jm n-C6HEC6H4N=NC (NO2) =NNHC6H4C6H5-n n-C6H6OC6H4N=NC (NO2) =NNHC6H4OC6H5-n ct-CioH7N = NC (NO2) =NNHCi0H7-« ₽-CwH7N=NC(NO2)=NNHCi<H7-₽ (63) 113, 114, 116, 358 25, 3, 113—116, 359 115 115 25 115 360, 361 115 199, 362 194 194 194 194 199 363 115 197 25 25 115 25 115 115
Продолжение табл VTI
Нитросоединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
Нитрометан Нитроэтан 1-Нитропропан 2-Нитропропан 2-Фенилтио 2- (п- Анизилокси) 2-Фенокси-4-фенил 2-Фенилтио-4-фенил 2-Метил 4-Метил 4-Хлор 4-Бром З-Нитро 4-Нитро 4-Сульфо 2,4-Дихлор 2,4, 6-Трихлор 2,4, 6-Трибром а-Нафтиламин Р-Нафтиламин 4-Метил 4-Нитро р-Нафтиламин o-C6H6SC6H4N=NC (NO2) =NNHC6H4SC6H6-o N, N'-Ди-о- (n-анизилокси) фенил-С-нитроформазан 2 N, N'-Ди- (2-феиокси-4-фенил) фенил-С-нитроформазан 2 N, N'-Ди- (2-феиилтио-4-фенил) фенил-С-нитроформ- азаи 2 СНзС (NO2) =NNHC6Hs (количественный) СН3С (NO2) =NNHC6H4CH3-o СНзС (NO2) =NNHC6H4CH3-n . CH3C(NO2)=NNHCsH4CI-n (количественный) CH3C (NOj) =NNHC6H4Br-n CH3C (NO2)=NNHCsH4NO2-jm CH3C (NO2) =NNHC6H4NO2-n CH3C (NO2) =NNHC6H4SO3H-n CH3C(NO2)=NNHC6H3Cl2-2, 4 (95) CH3C(NO2)=NNHC6H2Cl3-2, 4, 6 3 CH3C (NO2) =NNHC6H2Br3-2,4, 6 3 (49) CH3C(NO2)=NNHCi0H7-a (5) CH3C (NO2) =NNHCioH7-p C2HeC(NO2)=NNHC6Hs (87) C2H6C (NO2) =NNHCcH4CH3-n C2H6C (NO2) =NNHC6H4NO2-n C2HSC (NO2) =NNHCi0H7- p (CH3)2C(NO2)N=NC6Hs 25 25 25 25 364, 1, 2, 116, 199, 362 365 362, 365 205 366 367 362 363 368 368, 369 369 370 362, 370 364, 4, 116,362 362 362 362 2, 371
1-Нитропропеи-2
1 -Нитро-н-бутан
2-Нитро-н-бутан
4-Бром (СН3) 2C (NO2) N=NCeH4Br-n \ 371
2-Нитро (СН3) 2С (NO2) N=NC6H4NO2-o 371
З-Нитро (СН3)2С (NO2)N=NCcH4NO2-ai 371
4-Нитро (СН3)2С (NO2) N=NCeH4NO2-n 362, 371
2-Карбокси (СН3) 2С (NO2) N=NC6H4COOH-o 371
4-Карбокси (СН3) 2C (NO2) N=NC6H4COOH-n 371
4-Сульфо (CH3) 2C (NO2) N=NC6H4SO3H-n 363
4-Ацетамидо (CH3) 2C (NO2) N=NC6H4NHCOCH3-n 371
2, 5-Дихлор (CH3)2C (NO2) N=NC6H3Cl2-2, 5 371
2-Метил-5-нитро (CH3) 2C (NO2) N=NC6H3CHs-2-NO2-5 371
2, 4, 6-Трибром (CH3)2C(NO2)N = NCeH2Br3-2, 4, 6 371
Р-Нафтиламин (CH3) 2C (NO2) N=NCioH7-P 362, 371
Беизидин [ (CH3) 2C (NO2) N=NC6H4—]2 371
4-Феи илазо n- (C6HSN =N)C6H4N = NC (CH3)2NO2 371
— CH2=CHC (NO2) =nnhc6h5 372
2-Метил CH2=CHC (NO2) =NNHCcH4CH3-o 372
4-Метил CH2=CHC (NO2) =NNHC6H4CH3-n 372
4-Метокси CH2=CHC (NO2) =NNHC6H4OCH3-n 372
4-Этокси CH2=CHC (NO2) =NNHC6H4OC2H5-n 372
4-Хлор CH2=CHC (NO2) =NNHC6H4Cl-n 372
З-Бром CH2=CHC (NO2) =NNHC6H4Br-JU 372
4-Карбокси CH2=CHC (NO2) =NNHC6H4COOH-n 372
— я-С3Н7С (NO2) =NNHCcHs 116
З-Нитро C2HsC(NO2) (CH3)N=NC6H4NO2-jm 371
4-Карбокси C2H5C(NO2) (CH3)N=NCcH4COOH-n 371
2, 5-Дихлор C2H6C(NO2) (CH3)N=NC6H3C12-2,5 371
2-Метил-5-нитро C2HSC (NO2) (CH3) N=NC6HsCH3-2-NO2-5 371
2, 4, 6-Трибром C2HeC(NO2) (CH3)N=NC6H2Br3-2,4, 6 371
4-Фенилазо C2H6C (NO2) (CH3) N=NC6H4 (N=NC6He) -n 371
Продолжение табл. VII
Нитросое дине ни е Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
2-Метил-1 -нитроп роп ан — (СН3)2СНС (NO2) =nnhc6h5 5
4-Сульфо (СН3) 2СНС (NO2) =NNHC6H4SO3H-n 363
1 -Нитро-н-пентан — h-C4H9C(NO2)=NNHC6H5 (90—100) 364
Дииитрометан — C6H6N=NCH(NO2)2 373
4-Нитро n-O2NC6H4NHN=C(NO2)2 (37) 23
1, 3-Динитропропан — C6H6NHN=C (NO2) CH2C (NO2) = NNHC6H6 374
4-Метил n-CH3C6H4NHN=C (NO2) CH2C (NO2) =NNHC6H4CH3-n 374
4-Метокси n-CH3OC6H4NHN=C (NO2) CH2C (NO2) = 374
СО =NNHC6H4OCH3-n
°0 1,5-Дннитро-н-пентан — C6HSNHN=C (NO2) (CH2) 3C (NO2) =NNHC6H5 375
1,7-Диинтро-н-гептан — C6H5NHN=C (NO2) (CH2) 6C (NO2) =nnhc6h5 376
Иоднитрометан — IC(NO2)=NNHC6H5 377
4-Метил IC (NO2) =NNHC6H4CH3-n 377
Метазоновая кислота — C6HeNHN=C (NO,) ch=noh 378
4-Метил n-CH3C6H4NHN=C (NO2) CH=NOH 378
Нитроацетамид — C6H5NHN=C(NO2)CONH2 97
4-Нитро n-O2NC6H4NHN=C(NO2)CONH2 (66) 23
Метиловый эфир нитро- — C6H5NHN=C(NO2) COOCHs (56) 379
уксусной кислоты Этиловый эфир нитро- — CeHsNHN = C (NO2) COOC2H6 380
уксусной кислоты 4-Нитро n-O2NC6H4NHN=C (NO2) СООС2Нб 380
4-Фенилазо n(C6H5N=N)C6H4N=NC(NO2)(C2H5)CH2SO3H (56) \ 361
3,З'-Диметоксибензи- днн 2,2'- (3, 3'-Диметокси-4, 4'-бифенилеидисазо) -бис-[2-иит- ро-1-бутансульфокислота] (77) 381
2-Нитроэтанол — HOCH2C(NO2)=NNHC6H5 (94) 116, 382
4-Сульфо HOCH2C(NO2) =NNHC6H4SO3H-n 382
2-Нитропропанол — CH3C(NO2)=NNHC6Hs (78) 116
1-Нитропропаиол-2 — СНзСНОНС (NO2) =nnhc6h5 116
2-Нитробутанол-1 — C2H5C (NO2) =nnhc6h5 116
4-Метил HOCH2C(NO2) (C2H5)N=NC6H4CH3-n 4 117
2-Хлор HOCH2C(NO2) (C2H5)N=NC6H4C1-O 4 117
4-Хлор HOCH2C (NO2) (C2H6)N=NC6H4Cl-n 4 (56) 117
C2H5C (NO2) =NNHC6H4Cl-n 5 117
2-Бром HOCH2C(NO2) (C2H5)N=NC6H4Br-o 4 117
ее 4-Бром HOCH2C (NO2) (C2H5) N=NC6H4Br-n 4 117
«О C2H5C (NO2) =NNHCcH4Br-n = 117
2, 5-Дихлор HOCH2C(NO2) (C2H5)N=NC6H3Cl2-2, 5 4 117
2-Метил-4-иитро С2НБС (NO2) =NNHC6H3CHs-2-NO2-4 117
5-Метил-З-нитро HOCH2C(NO2) (C2H6)N=NC6H3CH3-5-NO2-34 117
1-Нитробутаиол-2 — C2H6CHOHC (NO2) =nnhc6h6 116
З-Нитробутанол-2 — CH3C (NO2) =NNHCcH5 116
1,1,1,-Трихлор-З-нитро- пропанол-2 — CkCCHOHC (NO2) =NNHC6H5 116
Ацетат 1,1, 1-трихлор- — C13CCH (OOCCHs) C (NO2) =nnhc6h5 383
З-ннтропропанола-2 2-Метил C13CCH (OOCCHs) C (NO2) =NNHC6H4CH3-o 383
З-Метил C13CCH (OOCCHs) C (NO2) =NNHC6H4CH3-jh 383
4-Метил CiaCCH (ООССНз) C (NO2) =NNHC6H4CH3-n 383
Продолжение табл. VII
Нитросоединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
Ацетат 1, 1,1-трихлор- 4-Хлор С1зССН (ООССНз) С (NO2) =NNHC6H4Cl-n 383
З-нитропропанола-2 4-Нитро CI3CCH (ООССНз) С (NO2) =NNHC6H4NO2-n 383
2,4-Дихлор CI3CCH (ООССНз) С (NO2) =NNHC6H3Cl2-2,4 383
2-Нитропропандиол-1, 3 — HOCH2C(NO2)=NNHC6H5 (97) 116
2-Нитропентанол-1 — h-C3H7C(NO2)=NNHC6H5 116
1-Нитропеитанол-2 — H-C3H7CHOHC (NO2) =nnhc6h5 116
1-Нитрогексанол-2 — h-C4H9CHOHC (NO2) =nnhc6h5 116
2-Н итро-1 -фенилэтанол — CsHsCHOHC (NO2) =nnhc6h6 116
Ацетат 3, 3, 4-трихлор-1-ни- — CHsCHC1CC12C (ООССНз) C (NO2) =nnhc6h5 383
тропентанола-2 4-Метил СНзСНС1СС12С (ООССНз) C (NO2) = NNHC6H4CHs-n 383
4-Хлор СНзСНС1'СС12С (ООССНз) C (NO2) =NNHC6H4Cl-n 383
4-Нитро СНзСНС1СС12С (ООССНз) с (NO2) =NNHC6H4NO2-n 383
1 -Бензо ил-2-нитроэтанол 4-Нитро n-O2NC6H4N = NC (NO2) =NNHC6H4NO2-n 384
2,4-Дииитро-1, 3-дифенил- бутанол-1 — CeHsCHOHCH (NO2) CH (CeHs) C (NO2) =nnhc6h5 385
а -Нитротолуол — C6H5C(NO2)=NNHC6He (80) 199, 386, 387
4-Метил C6H5C(NO2)=NNHC6H4CH3-n (40) 199
4-Метокси CeHgC (NO2) =NNHC6H4OCH3-n (33) 199
4-Бутокси C6H5C(NO2)=NNHC6H4OC4H9-n (34) 199
4-Бензилокси C6H5C (NO2)=NNHC6H4OCH2C6H5-n (39) 199
З-Нитро CeHsC (NO2) =NNHCeH4NO2-jw (количественный) 388
4-Фенил CeH5C(NO2)=NNHC6H4C6Hs-n (33) \
2, 4-Дииитро C6H6C(NO2)=NNHC6H3(NO2)2-2,4 388
2-Метил-4-нитро CeHsC (NO2) =NNHCeHsCH3-2-NO2-4 200
4-Метил-2-иитро CeHsC (NO2) =NNHCeH3CH3-4-NO2-2 200
2-Хлор-4-нитро C6H6C (NO2) =NNHC6H3Cl-2-NO2-4 200
₽-Нафтиламин C6H5C(N02)=NNHCioH7-₽ (34) 199
2- (о-Нитрофеиил) C6H5C (NO2) =NNHC6H4 (C6H4NO2-o) -o (55) 360
4- X лор-2-(4-х лор - 2-нптрофенил) CeHsC (NO2) =NNHC6H3Cl-4- (CeHsCl-4-NO2-2) -2 (35) 360
4-Бром-2- (4-бром- 2-нитрофенил) C6H5C (NO2) =NNHC6H3Br-4- (CcH5Br-4-NO2-2) -2 360
я -Нитробензилцианид — C6H5C (CN) =NNHC6H4NO2-n 123
2-Метил CeHsC (CN) =NNHC6H3CH3-2-NO2-4 123
4-Метил C6H6C (CN) =NNHCeH3CH3-4-NO2-2 123
2-Хлор CeH5C (CN) =NNHC6H3Cl-2-NO2-4 123
4-Хлор CeHsC (CN) =NNHC6H3Cl-4-NO2-2 123
2-Нитро CeHsC (CN) =NNHC6H3 (NO2) 2-2,4 123
4-Нитро CeHsC (CN) =NNHCeH3(NO2)2-2,4 123
n-Метокси- а -н итротолуол — n-CHsOCeH4C (NO2) =NNHCeHs 389
n-Хлор- а -нитротолуол 2- (о-Нитрофеиил) n-ClC6H4C (NO2) =NNHC6H4 (C6H4NO2-o) -o (75) 360
я, м-Динитротолуол — ju-O2NC6H4C (NO2) =NNHCeHs (количественный) 390
а, п-Динитротолуол — n-O2NC6H4C (NO2) =NNHC6Hs 390
4-Нитро n-O2NCsH4C(NO2) =NNHC6H4NO2-n 380
я-Нитроацетофенон ’ — C6H5COC(NO2)=NNHC6H6 (60)) 391
4-Хлор CeHsCOC (NO2) =NNHC6H4Cl-n 391
Продолжение табл. VII
Нитросоединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
а-Нитроацетофенон 4-Бром CeHsCOC (NO2) =NNHC6H4Br-n 391
2-Нитро CeHsCOC (NO2) =NNHC6H4NO2-o 391
4-Нитро CeHsCOC (NO2) =NNHC6H4NO2-n 380, 391
2, 4-Дихлор CeHsCOC (NO2)=NNHCeH3C12-2, 4 391
2, 5-Дихлор CeHsCOC (NO2) =NNHC6H3Cl2-2,5 391
2, 4-Дибром CeHsCOC (NO2) =NNHC6H3Br2-2,4 391
2,4, 6-Трибром CeHsCOC (NO2) =NNHC6H2Br3-2,4, 6 391
2,4,5-Трибром CeHsCOC (NO2) =NNHC6H2Br3-2,4,5 391
40 ю 1 -Нитро-З-фенилпропан — CeHe(CH2)2C(NO2) =NNHC6HS 392
Дифенилнитрометан — (C6H5)2C=NNHC6H4NO2-n 121, 122
а, а -Дннитротолуол — CeH5C (NO2) =NNHCeH4NO2-n 118, 120, 393
2-Метил CeHsC (NO2) =NNHC6H3CH3-2-NO2-4 118, 394
4-Метил C6H5CON=NC6H4CH3-n 394
2-Хлор CeHsC (NO2) =NNHCeH3Cl-2-NO2-4 118, 394
4-Хлор CeH5CON=NCeH4Cl-n 394
2-Бром CeH5C (NO2) =NNHC6H3Br-2-NO2-4 118, 394
4-Бром C6H5CON=NCeH4Br-n 394, 395
2, 4-Диметил C6HsCON=NCeH3(CH3)2-2, 4 119
2-Метил-4-нитро CeHsCON=NC6H3CH3-2-NO2-4 119
4-Метил-2-нитро CeHeCON=NC6H3CH3-4-NO2-2 119
4-Метил-З-нитро KIRx
а, а-Днннтро-П-ксилол n-CH3CBH4C(NO2)==NNHC6H4NO2-n \ 118, 396
о, а -Динитро-п-метокси- — n-CH3OC6H4C (NO2) =NNHC6H4NO2-n 118, 396
толуол
4- (2-Нитропропил) морфо- — 4- (2-Нитро-2-фенилазопропил) морфолин (22) 204
ЛИН 4-Хлор 4-[2-Нитро-2- (n-хлорфенилазо) пропил]морфолин (26) 204
2-Нитро 4-[2-Нитро-2- (о-нитрофенилазо) пропил]морфолин (32) 204
З-Нитро 4-[2-Нитро-2- (jn-нитрофенилазо) пропил]морфолин (41) 204
4-Нитро 4-[2-Нитро-2- (n-нитрофенилазо) пропил]морфолин (46) 204
2-Карбокси 4-[2-Нитро-2- (о-карбокси фенилазо) пропил]морфолин (13) 204
4-Карбокси 4-[2-Нитро-2- (n-карбоксифенилазо) пропил]морфолин(26) 204
2,4-Дихлор 4-[2-Нитро-2- (2,4-дихлорфенилазо) пропил]морфолин (48) 204
₽-Нафтиламин 4- (2-Нитро-2-р-нафтилазопропил) морфолин (25) 204
4-Фенилазо 4-[2-Нитро-2- (n-фенилазофенилазо) пропил]морфолин(80) 204
со 1 - Ди-н-бутиламино-2-нитро- 4-Хлор 2- (n-Хлорфенилазо) -2-нитротрибутиламин (7)' 204
бутан Р -Нафтиламин 2-₽-Нафтилазо-2-нитротрибутиламин (17) 204
2, 3-Дифенил-1,4-динитро- — 2, 3-Дифенил-1,4-дигидразоно-1, 4-динитробутан (89) 397
бутан
2, З-Ди- (3, 4-метилендиокси- — 2, 3-Ди-(3, 4-метилендиоксифенил)-1,4-дигидразоно- 397
фенил)-1,4-динитробу- 1,4-динитробутаи
тан
Нитрометил-п-толилсульф- 4-Нитро n-CH3C6H4SOC (NO2) =NNHC6H4NO2-n (43) 23
ОКСИД
1 Полное название дается в тех случаях, когда ариламин трудно назвать как производное анилина.
2 Строение формазаиа: H2NN=CHN=NH.
в Кроме того, образуется некоторое количество диарилазонитроэтана.
4 Этот продукт получен при подкислении реакционной смеси.
в Этот продукт получен после стояния щелочной реакционной смеси в течение нескольких суток.
Таблица VIII
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С УГЛЕВОДОРОДАМИ
А. Непредельные углеводороды
Углеводород Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
2-Метилпропен 4-Амино 2,4-Дииитро (CH3)2C=CHN=NC6H4N=NCH=C (СН3)2 2, 4- (O2N)2C6H3N=NCH=C (СНз)2 125 125
Бутадиен-1, 3 4-Нитро 2,4-Динитро n-O2NC6H4N=NCH=CHCH=CH2 2,4-(O2N)2C6H3N=NCH=CHCH=CH2 (13) 398 124
2-Метилбутен-2 4-Амиио 2,4-Динитро (СН3)2С=С (СН3) N=NC6H4N=NC (СН3) =С (СН3) 2 2, 4-(O2N)2C6H3N=NC(CH3)=C(CH3)2 125 125
Пентадиен-1,3 4-Амино 4-Нитро 2, 4-Динитро СН2=СНСН=С (СН3) N=NC6H4N=NC (СН3) = =снсн=сн2 n-O2NC6H4N=NC(CH3)=CHCH=CH2 2,4- (O2N) 2CcH3N=NC (СН3) =СНСН=СН2 125 124, 125 124, 125
2-Метил бутаднеи-1, 3 4-Нитро 2, 4-Динитро n-O2NCBH4N=NCH=C (СН3) СН=СН2 2.4-(O2N)2C6H3N=NC (СН3)=СНСН=СН2 399 124
Гексадиен-2,4 4-Нитро 2, 4-Динитро n-O2NC6H4N=NC (СН3) =СНСН=СНСН3 2,4- (O2N)2CeH3N=NC (СН3) =СНСН=СНСН3 125, 398 125
2-Метилпентадиен-2, 4 2, 4-Динитро 2,4-(O2N)2C6H3N=NCH=CHCH=C(CH3)2 (49) 400
2,3-Диметилбутадиен-1,3 4-Нитро 2, 4-Динитро n-O2NC6H4N=NCH=C (СН3) С (СН3) =СН2 (47) 2, 4- (O2N) 2C6H3N=NCH=C (СН3) С (СН3) =СН2 124 124
Циклопентадиен 4-Нитро 2, 4-Динитро 1-Фенилазоциклопентадиеи (небольшой) 1- (n-Нитрофеиилазо) циклопентадиен 1- (2, 4-Динитрофенилазо) циклопентадиен 126, 401 127 127
2,4-Циклопентадиеи-1-кар- боновая кислота 2-Окси-5-сульфо 4-Нитро 2, 4-Динитро 1- (2-Окси-5-сульфофенилазо) -2,4-циклопентадиен- I-карбоновая кислота (40) 3-(п-Нитрофенилазо)-2, 5-диметилгексадиен-2,4 3- (2,4-Динитрофенилазо) -2,5-диметилгексадиен-2,4 402 125 125 127'
Инден 2, 4-Динитро 1- (2,4-Динитрофенилазо) индеи
п-Метоксистирол 2, 4-Динитро n-CH3OC6H4CH=NNHC6H3(NO2)2-2,4 (21) 133
Фенил ацетилен 4-Нитро C6H5COCH=NNHC6H4NO2-n (13) 133
n-Метоксифенил ацетилен 4-Нитро 2, 4-Дннитро n-CH3OC6H4COCH=NNHC6H4NO2-n (33) n-CH3OC6H4COCH=NNHC6H3(NO2)2-2, 4 (69) 133 133
Анетол 4-Нитро 2, 4-Динитро n-CH3OC6H4CH=NNHC6H4NO2-n 2 (71) n-CH3OC6H4CH=NNHC6H3(NO2)2-2,4 2 (62) 136 136
о-Пропевил фенол 4-Нитро o-HOC6H4CH=NNHC6H4NO2-n2 (25) 139
n-Пропеиил фенол 4-Нитро n-HOC6H4CH=NNHC6H4NO2-n 2 (60) 139
Изосафрол 4-Нитро 2, 4-Динитро n-Нитрофенилгидразои пиперонала2 (72) 2,4-Динитрофенилгидразон пиперонала 2 136 136
Изоэвгенол 4-Нитро n-Нитрофенилгидразои ванилина 2 (86) 137
2, 4-Динитро 2,4-Динитрофенилгидразон ванилина 2 137
Изоапиол 4-Нитро n-Нитрофеиилгидразон ап иол альдегида 2 136
п-Пропеиилдиметиланилин 4-Нитро п- (CH3)2NC6H4CH=NNHC6H4NO2-n 2.3 138
1,1-Дифенилэтилеи 2, 4-Динитро (C6H5)2C=CHN=NC6H3(NO2)2-2,4 15
1, 1 -бис- (n-Т олил) этилен 4- (п-Фенилмеркапто- бензоил) (n-CH3C6H4)2C=CHN=NC6H4(COC6H4SC6H5-n)-n 14
1, 1 -бис- (n-Аиизил) этилен 4-Нитро 4- (п-Фенилмеркапто- беизоил) (n-CH3OC6H4)2C=CHN=NC6H4NO2-n (40) (n-CH3OC6H4)2C=CHN=NC6H4(COC6H4SC6H5-n)-n 15 14
1-Фенил-1-(п-анизил)этилен 2,4-Динитро n-CH3OC6H4C (C6H5) =CHN=NC6HS n-CH3OC6H4C(C6H5)=CHN=NC6H3(NO2)2-2,4 (40) 15 15
1,1-бис- (п- Диметиламино- — [n- (CH3)2NC6H4]2C=CHN=NC6H5 15
фенил)этилен 4-Нитро 2, 4-Дннитро 1 - Аминоантрахинон [n- (CH3) 2NC6H4]2C=CHN=NC6H4NO2-n [n- (CH3) 2NC6H4]2C=CHN=NC6H3 (NO2) 2-2,4 [n- (CH3) 2NC6H4]2C=CHK=NC i4H7O2 (88) 15 15 15
Продолжение табл. Vllf
Углеводород Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
1 -Фенил-1 - (п-диметиламн- п- (CH3)2NC6H4C (С6Н5) =chn=nc6hs 15
иофенил)этилен 4-Нитро п- (CH3)2NC6H4C (С6Н5) =CHN=NC6H4NO2-n 15
2,4-Динитро п- (СН3) 2NC6H4C (С6Н5) =CHN=NC6H3 (NO2) 2-2,4 15
1-Фенилбутадиен-1, 3 4-Нитро QH5CH=CHCH=CHN=NC6H4NO2-n 404
2,3-Днфенилбутадиен-1, 3 2,4-Динитро 2, 4- (O2N) 2CeH3N=NCH=С (C6H5) C (C6H6) = CH2 405
Б. Соединения, содержащие реакционноспособную метильную группу
Реакционноспособное метильное соединение Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
-Пиколин ' 4-Нитро n-Нитрофенилгидразон а-пнколинальдегида (58) 142
2,4, 6-Тринитротолуол 4-Нитро n-Нитрофенилгидразон 2,4,6-трннитробензальдегида (86) 142
2-Метилимидазол 4-Нитро п-Нитрофенилгидразон нмндазол-2-карбоксальдегида (64) 142
2, 6-Диметил-3,5-дикарб- 4-Нитро n-Нитрофенилгидразон 3,5-дикарбокси-6-метилпири- 142
оксипиридин N-Метилхинальдиний иоди- — дин-2-карбоксальдегида (94) 1,2-Дигидро- 1-метил-2-фенилазометиленхинолин 150, 151
стый 4-Нитро 1,2-Дигидро-1-метил-2- (п-нитрофенилазометилен)хино- 150, 151
N-Метилхинальдиниймето- 4-Нитро ЛИН 1,2-Дигидро-1 -метил-2- (n-нитрофенил азометил ен)хино- 149
сульфат 2,5-Дихлор ЛИН 1,2-Дигидро-1-метил-2- (2,5-дихлорфенил азометилен) - 149
2-Метокси-5-хлор хинолин 1,2-Днгидро-1-метил-2- (2-метокси-5-хлорфенилазомети- 149
Зак. 794.
2-Метокси-4-нитро
N-Этиллепидиний иодистый 4-Нитро
2. 5-Дихлор
2-Метокси-5-хлор
2-Метокси-4-нитро
2, 3,3-Триметнлиндолении —
4-Хлор
о 1, 2, 3, З-Тетраметилиндоле- 4-Нитро
ний иодистый 4-Нитро
4-Иод
2-Метокси-4-иитро
2-Метилбензотиазол 4-Нитро
2,3-Диметилбензотиазолий —
иодистый
4-Нитро
1, 2-Дигидро-1 -метил-2- (2-метокси-4-нитрофенилазоме-
тилен)хинолин
1, 4-Дигидро-1-этил-4-(n-нитрофенилазометилен) хино-
лин
1, 4-Дигидро-1-этил-4-(2, 5-дихлорфеиилазометилен) хи-
нолин
1, 4-Дигидро-1 -этил-4- (2-метокси-5-хлорфенилазомети-
лен) хинолин
1,4-Дигидро-1-этил-4- (2-метокси-4-нитрофенилазометн-
лен)хинолин
Фенилгидразои 3,З-днметилиндоленин-2-карбоксальде-
гида (60—90)
п-Хлорфенилгидразон 3.З-диметилиндоленин-2-карб-
оксальдегида (60—90)
п-Нитрофенилгидразон 3,3-диметилиндоленин-2-карб-
оксальдегида
1,2-Дигидро-2-фенилазометилен-1,3,3-триметилиндолин
1,2-Дигидро-2-(п-нитрофенилазометилен)-1,3, 3-триме-
тилиидолии
I, 2-Дигидро-2-(п-иодфенилазометилен)-1,3. 3-триме-
тилиндолин
1, 2-Дигидро-2- (2-метоксн-4-ннтрофеиилазометилеи)' -
1, 3, 3-триметилиндолин
п-Нитрофеиилгидразои бензотиазол-2-карбоксальдеги-
да (30)
2-[бис- (Фенилазо) метилен]-3-метилбензотиазолин
2-[бис- (п-Нитрофенилазо) метилен]-3-метилбензотиазо-
лин
149
149
149
149
149
143
143
143
150, 152
150, 152
150
152
406, 407
145
145
• Продолжение табл. VIII
Реа кционноспособное метильное соединение Заместители в анилине 1 « Продукт реакции (выход, Литера- тура
2, З-Диметилбензотиазолий — 2-[бис- (Фенилазо) метилен]-3-метилбензотиазолин (80) 146
метосульфат 4-Метил 2-[бис- (n-Толилазо) метилен]-3-метилбензотиазолин 146
4-Метокси 2-[бис- (п- Анизилазо) метилен]-3-метилбензотиазолин 146
4-Хлор 2-[бис- (п-Хлорфенилазо) метилен]-3-метилбензотиазолин 144. 146
2-Нитро 2-[бпс- (о-Нитрофенилазо) метилен]-3-м ети л бензотиазо- лин 146
4-Нитро 2-(п-Нитрофенилазометилен)-3-метилбензотиазолии 2-[бис- (п-Нитрофенилазо) метилеи]-3-метилбензотиазо- лин 149 144, 146
4-Сульфо 2-[бпс- (п-Сульфофенилазо) метилен]-3-метилбензотиазо- лин 146
2,5-Дихлор 2-[бас- (2,5-Дихлорфенилазо) метилен]-3-метилбензо- тиазолин 146
2-Метокси-4-нитро 2- (2-Метокси Л-нитрофенил азометилен) -3-метилбеизо- тиазолин 149
2-Метил-З-этилбензотиазо- 4-Хлор 2-[бис- (п-Хлорфенилазо) метилен]-3-этилбензотиазолин 144
ЛИЙ иодистый 4-Нитро 2-[бис- (п-Нитрофенилазо) метилеи]-3-этилбензотиазолин 144. 145
2,3, 6-Триметилбензотиазо- лий метосульфат 4-Нитро 2-[бис- (п-Нитрофенилазо) метилен]-3,6-диметилбензо- тиазолин 147
2, З-Диметил-6-метоксибен- зоти а зо лийметосульфа т 4-Нитро 2-[бис- (п-Нитрофенилазо) метилен]-6-метокси-3-метил- бензотиазолин 147
2-Метил-З-этил-5, 6-димет- оксибензотиазолиймето- 4-Нитро 2-[бис- (п-Нитрофенилазо) метилен]-3-этил-5,6-димет- оксибензотиазолин 147
1,2, З-Триметилбензимид-
азолийметосульфат
* 1,2, З-Триметил-5-нитро-
беизимидазолий иодистый
1-Фенил-2, З-диметил-5-ни-
тробензимидазолий иоди-
стый
1-Феиил-2-метил-3-этил-5-
нитробензимидазолий
иодистый
2, З-Диметилбензоселеназо-
лийметосульф ат
1,2-Диметилиафто[1,2]ти-
азолийметосульфат
3, З-Диэтил-1, 2-днметилин-
долений иодистый
9-Метил акридин
4-Хлор
4-Нитро
4-Нитро
4-Нитро
4-Хлор
4-Нитро
4-Хлор
4-Нитро
4-Нитро
2-Метил
3-Мет ил
4-Метил
2-Метокси
4-Метокси
4-Окси
4-Хлор
2-[бис- (Фенилазо) метилен]-!, 3-диметилбеизимидазолин I 147
2-[бис- (п-Хлорфенил азо) метилен]-!, 3-диметил бенз- 147
имидазолин
1-Метил-2- (п-нитрофенилазометил) -5-нитробензимид- 148
азол (50)
1-Фенил-2- (п-нитрофенилазометил) -5-нитробензимид- 148
азол
1-Фенил-2- (п-нитрофенилазометил) -5-нитробензимид-
азол
2-[б«с- (Фенилазо) метилен]-3-метилбензоселеназолин
2-[бпс- (п-Хлорфенилазо) метил ен]-3-метилбензоселен-
азолин
2-[б«с- (п-Нитрофенилазо) метилеи]-3-метилбеизоселен-
азолин
2-[бпс-(Фенилазо) метилен]-1-метилнафто[1, 2]тиазолин
2-[бис- (п-Хлорфенилазо) метилеи]-1 -метилиафто[1,21-
тиазол ин
2-[бис- (п-Нитрофенилазо) метилен]-! -метилнафто[1,2]-
тиазолин
1,2-Дигидро-1-метил-2-(п-нитрофенилазометилен)-3,3-
диэтилиидолин
Фенилгидразон акридин-9-карбоксальдегида
о-Толилгидразон акридин-9-карбоксальдегида
.и-Толилгидразон акридин-9-карбоксальдегида
п-Толилгидразон акридин-9-ка рбоксальдегида
о-Аиизилгидразои акридин-9-карбоксальдегида
п-Анизилгидразон акридин-9-карбоксальдегида
п-Оксифенилгидразон акридин-'9-карбоксальдегида
п-Хлорфенилгидразон акридин-9-карбоксальдегида
148
147
147
147
147
147
147
150, 152
141
141
141
141
141
141
141
141
Продолжение табл VIII
100
Реакционноспособное метильное соединение Заместители в анилине 1 Продукт реакции (выход, %) Литера- тура
9-Метил акридин 4-Иод п-Иодфенилгидразои акридин-9-карбоксальдегида 141
2-Нитро с-Нитрофеиилгидразои акридии-9-карбоксальдегида 141
З-Нитро .и-Нитрофенилгидразон акридин-9-карбоксальдегида 141
4-Нитро п-Нитрофенилгидразон акридин-9-карбоксальдегида 141
2-Карбокси о-Карбоксифенилгидразон акридин-9-карбоксальдегида 141
З-Карбокси и-Карбоксифенилгидразон акридин-9-карбоксальдегида 141
4-Карбокси п-Карбоксифенилгидразон акридин-9-карбоксальдегида 141
4-Сульфо п-Сульфофенилгидразон акридин-9-карбоксальдегида 141
2. 4-Диметил 2,4-Диметилфенилгидразои акридин-9-карбоксальдегида 141
2, 4-Дииитро 2,4-Динитрофенилгидразон акридии-9-карбоксальде- гида 141
2,5-Диметоксн-4-фе- ниламино 2, 5-Диметокси-4- (фениламино) фенилгидразои акри- дии-9-карбоксальдегида (43) 142
9,10-Диметилакридиний- метосульфат — 9, 10-Дигидро-9-метил-10-фенилазометилеиакридин 15
4-Нитро 9, 10-Дигидро-9-метил-10- (п-нитрофенилазометилен) - акридин 15, 149
2, 5-Дихлор 9,10-Дигндро-9-метил-10-(2, 5-дихлорфенилазомети- лен)акридин 149
2, 4-Динитро 9, 10-Дигидро-9-метил-10-(2, 4-дииитрофенилазомети- лен)акридин 15
2-Метокси-5-хлор 9, 10-Дигидро-9-метил-10- (2-метокси-5-хлорфейил- азометилен) акридин 149
2-Ацетамидо-9-метилакри- дин 2-Метокси-4-нитро 9,10-Дигидро-9-метил-10- (2-метокси-4-нитрофенилазо- метилен)акридин 149
— Фенилгидразои 2-ацетамидоакридин-9-карбоксальде- гида (66) 142
4-Нитро п-Ннтрофенилгидразон 2-ацетамидоакридии-9-карб- 142
9-Метилкса нтилийперхло- рат 4-Нитро 2, 4-Динитро
9-Метилтиоксантилийпер- хлорат 4-Нитро 2,4-Динитро
1-Феиил-3-метил-4-изопро- пилиден-2-пиразолинон-5 4-Нитро З-Карбокси
о 2, 5-Дихлор
1 -Фенил-З-метил-4- а-метил- бензилиден-2-пиразолин- ои-5 4-Нитро 2-Карбокси 2,5-Дихлор 4-Хлор-2-нитро
1-Феиил-З-метил-4- (а-ме- тил-ж-нитробеизилидён)- 2-пнразолинон-5 4-Ннтро
Фенилгидразои ксантен-9-карбоксальдегида
п-Нитрофенилгидразон ксантен-9-карбоксальдегида
2,4-Динитрофенилгидразон ксантен-9-карбоксальде-
гида
Фенилгидразои тиоксантен-9-карбоксальдегида
п-Нитрофенилгидразон тиоксантен-9-карбоксальдегида
2,4-Динитрофеиилгидразон тиоксантен-9-карбоксаль-
дегида
1 -Фенил-3-метил-4-«- (фенилазометил) этилиден-2-пнр-
азолиион-5 (57)
1-Фенил-3-метил-4-а - (п-нитрофенилазометил)этилиден-
2-пираз6линон-5 (76)
1 -Фенил-З-метил-4- а - (л-карбоксифенил азометил) эти-
лиден-2-пиразолинон-5 (62)
1 -Фенил-3-метил-4-«- (2,5-дихлорфенилазометил) эти-
’ лидеи-2-пиразолинон-5 (51)
1-Феннл-3-метил-4-«-фенилазометилбензилиден-2-пир-
азолинои-5 (70)
1 -Фенил -З-метил-4-а -(n-нитрофеиил азометил) бензили-
ден-2-пиразолинон-5 (73)
1-Фенил-З-метил-4 а - (о-карбоксифенилазометил) бен- •
зилиден-2-пиразолинои-5 (82)
1-Фенил-3-метил-4-а -(2,5-дихлорфенилазометил) беи-
зилиден-2-пиразолинон-5 (87)
1 -Фенил-З-метил-4-а- (4-хлор-2-нитрофенилазометил) -
бензилидеи-2-пиразолинои-5 (47)
1-Фенил-3-метил-4-[«- (n-нитрофенилазометил) -л-нитро-
бензилиден]-2-пиразолинон-5 (52)
15
15
15
15
15
15
153
153
153
153
153
153
153
153
153
153
Продолжение табл. VTTT
102
В. Циннолины из о-аминофенилэтиленов
Заместители в циннолиие (выход, Я)
Амин Гб |Т з| Литература
N
о-Амино-а -метилстирол 4-Метил (90) 409, 410
2- (2'-Амино-5'-хлорфснил) пропей 6-Хлор-4-метил (28) 410
2- (2'-Амино-4'-хлорфенил) пропен 7-Хлор-4-метил (55) 410
2- (2'-Амино-3'-хлорфенил) пропен 8-Хлор-4-метил (29) 411
2- (2'-Амино-3'-метоксифенил) пропен 8-Метокси-4-метил (72) 193, 191
2- (2'-Амино-4'-карбоксифенил) пропен 7-Карбокси-4-метил (79) 410, 128
а -(о-Аминофенил) стирол 4-Фенил (количественный) 129
а- (о-Аминофенил) -р-бромстирол 4-Феиил (22) 129
а - (о-Аминофенил) -п-метилстирол 4-(п-Толил) 129
а - (о-Аминофенил) -п-метоксистирол 4-(п- Анизил) 130.
а -(2-Пиридил)-о-аминостирол 4-(2'-Пиридил) (25) 132
а- (2-Амино-5-бромфенил) стирол 6-Бром-4-фенил 131
а - (2-Амино-З-метоксифенил) стирол 8-Метокси-4-фенил (86) 191
а -(2-Амино-5-хлорфенил) -2-оксистирол 6-Хлор-4- (п-оксифенил) 131
а - (2-Амино-5-хлорфенил) -2-окси-5-метилстирол 6-Хлор-4- (2-окси-5-метилфенил) 131
1 - (о-Аминофенил) -1-фенилпропен З-Метил-4-фенил (84) 412, 129
1- (о-Аминофенил) -1-п-анизилпропен 4- (п-Анизил) -3-метил (90) 412
а-(о-Аминофенил) - Р-фенилстирол 3,4-Дифенил (количественный) 413
р-(о-Аминофенил)- Р-(п-аниэил)стирол 4-(п-Аннзил)-3-фенйл (98) . , 413
а - (о-АминофЬнил)- ₽ - (1 -нафтил) стирол
а- (о-Аминофенил) (2-пиридил) стирол
а- (о-Аминофенил) Р- (2-пиридил) -л-метоксистирол
2-Окси-5-амннолепидин
3- ( о -Нафтил) -4-фенил 4
4-Фенил-З- (2-пиридил) (25)
4-(п-Анизил)-З-(2-пиридил) (70)
5-Окси-3-пиридо[4, 3, 2-de]
413
132
132
414
Г. 4-Окащиннолины из о-аминофенилацетиленов
Продукт реакции, заместители в
он
Амин г II з] L, JI (выход, %) Литература
о-Аминофенил ацетилен 2тАмино-5-метоксифенилацетилен 2-Амнно-5-хлорфенил ацетилен 2-Амино-5-бромфенилацетилен 1- (о-Аминофенил) -2-фенилацетилен 1- (2'-Амино-4'-метоксифеиил) -2-фенилацетилен о-Аминофенилпропиоловая кислота 2-Амино-5-хлорфенилпропиоловая кислота 2-Амино-5-бромфенилпропиоловая кислота 2-Амино-5-метоксифеиилпропиоловая кислота 2-Амино-4, 5-метилендиоксифенилпропноловая 6-Метокси 6-Хлор (20) в 6-Бром (20) Б З-Фенил (55) 6-Метокси-З-фенил З-Карбокси (60) З-Карбокси-6-хлор (66) З-Карбокси-6-бром (66) З-Карбокси-6-метокси (68) 6 З-Карбокси-6, 7-метиленднокси (37) 6 134 134 28 28 28 28 408,134,135 28 28 134 134
кислота
' Продолжение табл. VIII
Д. Индазолы из о-толуидинов
Реагирующее вещество, заместители в анилине Продукт реакции, заместители в индазоле н (выход* %) Литература
2-Метил — (3—5) 154, 156
2-Цианметил З-Циан (71) 104, 195
2-Мстил-З-иитро 4-Нитро (96—98) 155, 417
2,4-Диметил 5-Мет ил 154
2-Мет ил-4-нитро 5-Нитро (82—90) 155,156,417
2-Метил-5-нитро 6-Нитро (90—96) 155,415—417
2-Метил -6-иитро 7-Нитро (80) 155, 417
2,4,6-Триметил 5,7-Диметил (небольшой) 154
2, 4-Динитро-6-метил 5,7-Динитро (34—38) 419
2, З-Диметил-4-нитро 4-Метил-5-нитро (79—86) 155
2, З-Диметил-5-нитро 4-Метил-6-иитро (94) 155
2, З-Диметил-6-нитро 4-Метил-7-нитро (100) 155
2,4-Диметил-З-нитро 5-Метил-4-нитро (79) 155
2, 4-Диметил-5-нитро 5-Метил-6-нитро (75—80) 155
2, 4-Диметил-6-нитро 5-Метил-7-нитро (48—53) 155, 418
2, 5-Диметил-З-нитро 6-Метил-4-нитро (93) 155
2, 5-Диметил-4-нитро 6-Метил-5-нитро (83) 155
2,5-Диметил-6-нитро 6-Метил-7-нитро (81) 155
2, 6-Диметил-З-нитро 7-Метил-4-(или 6-) нитро (100) 155
3-Хлор-2-метил-4-нитро 4-Хлор-5-нитро (86) 421
3-Хлор-2-метил-6-нитро 4-Хлор-7-нитро 420
4-Хлор-2-метил-6-нитро 5-Хлор-7-нитро 420
2, З-Динитро-6-метил 7-Хлор-6-нитро 1 * * 4 * 6 (85) 421
3-Метокси-2-метил-6-нитро 4-Метокси -7-нитро 420
3-Метокси-6-метил-2-иитро 6-Метокси-7-нитро (83) 424
3-Диэтилсульфамил-2-метил-6-ннтро 4-Диэтилсульфамил-7-нитро 420
5,6-Диметид-4-.ннтро (58) 155
Реагирующее вещество
Продукт реакции (выход, %)
Литература
2,4, 6-Триметил-З-нитро
2,4-Диметил-3, 5-динитро
2,6-Диметил-3,5-динитро
3, 6-Диметил-2, 4-динитро
2, 4-Динитро-6-метил-3-сульфо
2,4, 6-Триметил-З-амиио
2, 5-Динитро-З, 4, 6-тримет,ил
3,5-Динитро-2, 4, 6-триметил
H2N СН3
5, 7-Диметил-4-(или 6-) нитро (100)
5-Метил-4,6-динитро (80)
7-Метил-4,6-динитро (86)
6-Метил-5, 7-дииитро (100)
5, 7-Динитро-6-сульфо
5,7-Диметил-4-триазо 7
5,6-Диметил-4, 7-динитро (75—85)
5, 7-Диметил-4, 6-динитро (100)
155
155
155
155
422
423
155
155
421
Заместители X в
бис- (2-Амино-4-хлорфенил) метай
бис- (2-Амино-4-цианфеиил) метай
бис- (2-Амино-4-ацетилфенил) метан
бис- (2-Амино-4-ацетамидофенил) метан
бис- (2-Амино-4-карбоксифенил)метан
бис- (2-Амино-4-'карбэтоксифенил) метан
Хлор
Циан
Ацетил
Ацетамидо
Карбокси
Карбэтокси
425
426
426
426
426
427
1 Полное название дается в тех случаях, когда ариламии трудно назвать как производное анилина.
' Эти продукты получены при добавлении сухой соли диазония к спиртовому раствору реагирующего вещества.
’ Если спиртовый раствор реагирующего вещества приливать к сухой соли диазония, то отщепляется вся боковая цепь и образуется
N.N-диметил л-(л-нитрофенилазо)анилин почти с количественным выходом [403].
4 Образуется также 2-фенилхризеи.
Б Это общий выход в расчете на нитросоединеиие.
6 Если диазотировать в соляной кислоте, то одна нитрогруппа замещается хлором.
1 Этот продукт получен тетразотироваиием амина с последующим взаимодействием соли тетразония с азидом натрия.
Таблица IX
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С ГИДРАЗОНАМИ
А. Простые гидразоны
RC=NNHR'
RCH=NNHR' + R"N2X -> |
N=NR"
R R’ R" Выход, % Литература
H ХОЛИЛ (С24НээОб) С6Н6 428
no2 с6н6 СбНб — 358
СНз С6Н6 СбНб 88 157,168,429
СНз С6Н6 О-О2МС6Н4 — 168
S СНз СбНб jw-O2NC6H4 — 168
35 СНз СзНб n-O2NC6H4 Количественный 157,168
СНз СбНб п-НОз5СбН4 » 130
СНз с6н5 п-(СбН5СН=СН)С6Н4 68 431
СНз с6н6 «-[CeHsC (CN) =СН]СвН4 — 132
СНз с6н6 п- (п-О2МСбН4СН=СН) СбН4 16 431
СНз с6н6 п- (п-СНзСОКНСбН4СН=СН) С6Н4 12 431
СНз СбНб n-(C6H5N=N)C6H4 28 433
СНз O-O2NC6H4 o-O2NC6H4 Небольшой 168
СНз /1-O2NC6H4 СбН6 — 168
СНз п-ОгМСбН4 o-O2NCeH4 — 168
СНз /1-O2NC6H4 л-О2МС6Н4 — 168
СНз /1-O2NC6H4 n-O2NC6H4 48 138, 168
СНз /Z-O2NC6H4 2, 4- (O2N)2C6H3 — 134
СНз 2,4-(O2N)2C6H3 СбНб — 135
СНз 2,4-(О2Ь1)2СвНз _ o-O2NC6H4 — 134
СНз 2, 4-(O2N)2C6H3 /1-O2NC6H4 — 434
СНз (CeH5)2NCO СбНб —• 448
СНзООС СбНб СбНб — 167
СНзООС СбН5 n-O2NCfiH4 —: 167
СНзООС 2,4-(СН3)2СбНз1 СбНб — 167
СНзООС 2,4-(СН3)2СбНз 1 п-ВгСбН4 — 167
СНзООС 2,4-(СНз)2СбН3 1 п-О2МСбН4 — 167
С2Н5ООС СвН5 СбНб 34 172
С2Н5ООС n-HO3SC6H42 СбНб 80 451
с2н5 CeHs СбНб 65 437, 438
СНзСО СбНб СбНб 68—71 58, 257
СНзСО СбН5 п-СНзСбН4 — 58
СНзСО СбНб n-O2NC6H4 — 58
H-C3H7 СбНб n-HO3SCeH4 75 430
H-C3H7 Холил (С24Н39Об) CeHs — 436
, . изо-Сан? СбНв СбНб — 428
3 СН2=С(СНа) С6Нб СбНб 72 438
(СН8)2СНСН2 СбНб СбНб — 436
W-C5H11 СбНб СбНб — 436
н-СбН1з СбНб СбНб 81 172
к-СзН1з СбНб n-HO3SC6H4 Коли чественный 430
Циклогексил H2N(HN=)C 5-Тетразол ил — 24
Н-С7Н15 СбНб СбНБ 46 437, 436;
н-С7Н15 СбНб 4-HO3SCeH4 93 430
н-С8Н17 С6н5 СвНб — 436
н-С9Н]9 СбНб СбНб — 436
Н-С11Н23 СбНб СбНб 77 172
н-СпНгз СбНб п-ВгСвН4 82 172
н-СпНгз СбНб П-О2МС6Н4 83 172
W-C11H23 СбНб n-HO3SCeH4 Количественный 430.
Продолжение табл. IX
R R' tT Выход, % Литература
W-C11H23 C6Hs ct -C40H7 67 172
Н-С11Н23 n-BrC6H4 CeHs 63 172
Н-С11Н23 /1-O2NC6H4 CeHs 60 172
CeHs CsHs CeH6 50 439, 19—22,
76, 440
СбНБ CeHB n-CH3C6H4 — 20
СбНз CeHs n-изо- СзН7СбН4 — 441
с6н6 C6Hs Я-Я-С^НйбСбН^ 83 441
с6н5 CeHs п-С1С6Н4 60 441, 437
с6н6 CeHs n-BrC6H4 50 19, 173
C6HS CeHs n-IC6H4 45-60 442
CGH5 CeHs o-HOC6H4 80 339
с6н5 CeHs 0-O2NC6H4 58 22
с6н5 CeHs /1-O2N СбН4 92 441, 19
с6н5 CeHs n-CH3CONHC6H4 55 443
C6HS C6H5 o-HOOCCeH4 75 339
с6н5 CeHs /1-HO3SC6H4 — 171
СбНБ CeH5 л-СбН5СбН4 44 441, 444
с6н5 CeHs 4-СНзСОМН-2-С1СеНз 76 441
свн5 C6Hs 4-CH3CONH-3-ClCeHs 44 441
с6н5 CeHs 4-CH3CONH-2-O2NC6H3 57 441
CeHs CeHg 4-СНзСОМН-2-СН3СООСбНз 39 441
CsHs CeH6 n-H-Ci2H2sCONHCeH4 — 441
CeHs CeHs n-CH3CONH (CH2) 12N (COCH3) C6H4 — 441
CeHs CeHs n-[ (C2H6) ,N (CH2) 2OOC]C6H4 64 441
CjHe CeHt n-HCoHHoN fCH.UCH ГСН.1МНГк,С1 Г.Н. 47 АЛУ
C6Hs CeHs n- (я-НОСеН4СН=СН) C6H4 32 431
С6Н5 C6H6 n- (n-BrCeH4CH=CH) C6H4 33 431
CeHs CeHs n- (n-O2NCeH4CH=CH) C6H4 33 431
CeHs C6Hs n- (n-CH3CONHCeH4CH=CH) C6H4 14 431
CeHs C6Hs zi-(CeHsN=N)C6H4 50 433
CeHs C6Hs n- (n-CH3CeH4N=N) C6H4 53 433
C6Hs CeHs n-(n-ClCeH4N=N)CeH4 12 433
C6Hs C6Hs n- (n-HOC6H4N=N) C6H4 28 433
C6Hs C6Hs n- (n-O2NCeH4N=N) C6H4 57 433
C6Hs C6Hs n-[n- (CH3) 2NC6H4N=N]CeH4 23 433
CeHs C6H5 n- (n-CH3CONHC6H4N=N) C6H4 35 433-
CeHs C6HS n- (2-Cl-4-HOCeH3N=N) C6H4 27 433
CeHs C6H5 n- (3-Cl-4-HOC6H3N=N) C6H4 8 433
CeHs CeHs 2, 5-(CH3)2-4-(CeHsN=N)CeH2 50 433
C6Hs C6Hs CC-C10H7 80 174, 171,
173, 434
C6Hs C6Hs ₽-CI0H7 47 174,173,434
CeHs C6Hs 4-(CeH5N=N)-l-CIOHe 9 433
C6Hs C6H5 З-Пиридил 53 441
CeHs CeH$ 6-Хинолил — 445
CeH5 CeHs 7-Хинолил — 445
CeHs CeHs 6-Этокси-2-хинолил — 445
CeHs CeHs 6-Метокси-8-хинолил 20 441
CeHs CeHs 2-Хин олилметил — 445
CeHs CeHs 2-Тиазолил — 445
CeHs CeH5 5-Метил-2-тиазолил 68 446
CeHs CeHs 4-Метил-2-тиазолил 1—3 446
CeHs CeHs 4,5-Диметил-2-тиазолил 69 446
CeHs CeHs 2, 5-Диметил-4- (2-тиазолилазо) фенил 25 433
CeHs CeHs п- (6-Метил-2-бензотиазолил) фенил — 445
CeHs o-CHgCeHe с6н5 85 22
П родолжение табл. /X
R R’ R" Выход. % Литература
с6н5 о-СНзСвНб Я-Огмсбрц 37 22
СбН5 п-СН3С6Н4 с6н6 — 20
СбНБ п-СНзСбНб п-СНзС6Н4 — 20
СбН5 п-СНзСвН4 а-СюН? — 434
СбН5 п-СНзС6Н4 Р-СюНт — 434
С6НБ о-СНзОС6Н4 о-СН3ОС6Н4 — 324
с(1нЕ п-СНзОСвН4 п-СНзОС6Н4 60 324
с6н6 о-С2НбОСвН4 СбНб 91 22
с6н6 О-С2Н5ОС6Н4 n-ogNGeHl 51 22
c6Hs ZI-C2H5OC6H4 СбНб 74 22
с6н5 о-С1СбН4 СбНб 26 22
с6н5 п-С1С6Н4 СбНб 55 22
СбНв п-С1С6Н4 п-С1СбН4 50 22
CGHS п-С1С6Н4 n-(C6HsN=N)C6H4 18 22
СбНб п-ВгСбН4 С6Нб 50 19. 173
с6н5 п-1С6Н4 п-1С6Н4 42—51 442.
с6н6 o-O2NC6H4 СбНб 10 22
C6HS n-OsNCeH* СбНб 46 22
С6Н6 n-O2NCeH4 П-1С6Н4 36—58 442
С6Не я-ОгМСбН* п-ОгНСбН4 8 361
СбН5 n-O2NC6H4 rt-CeHgCglHU 22 447
СбНв ZI-O2NC6H4 a-CioH? 41 174, 434
СбНб n-O2NC6H4 ₽-С,оН7 — 434
СбНв п-О2МСбН4 п-(п-С2НбОСбН4)СбН4 52 447
СбНб n-O2NC6H4 З-СНзО-4- (л-СНзОСбН4) СвНз 52 447
СбНб п-ОгМСбН4 2, 5- (СНзО) 2-4- (n-O2NC6H4N = N) С6Н2 5 447
СбНб о-НООССбН4 о-НООСС6Н4 75—80 339
СбНб л-НООСС6Н4 СбНб — 165
СбНв л-НООСС6Н4 о-С1С6Н4 — 165
СбНб л-НООСС6Н4 ж-ОгНСбН4 — 165
СбНб ж-НООСС6Н4 о-НООССбН4 — 165
СбНб Л1-НООСС6Н4 Ж-НООСС6Н4 — 165
СбНб Ж-НООСС6Н4 п-НООСС6Н4 — 165
-СбНб п-НООССбН4 n-(CeH5N=N)C6H4 10 433
СбНб n-CH3CONHC6H4 «-(CeHsN=N)C6H4 26 433
СбНб n-HOsSC6H4 СвНз — 171
СбНб n-H2NO2SC6H4 СбНб 37 22
СбНб (C6Hs)2NCO СбН5 — 478
СбНб а-СюН? СбНбЗ — 171,173,434
СбНб a -C10H7 и-СН3СсН4з — 434
СбНб a-CioH? «-О2МСбН4а — 434
СбНб P-CioH? СбН5 39* 174, 173
СбНб (₽-CioH7)2NCO СбНб — 448
СбНб ₽-CioH7(C6Hs)NCO СбНб — 448
СбНб п-СбН6СбН4 n-CgHsCeFU 13 444
СбНб Холил (С24Н3дОб) СбНб — 428
СбНб n-(CeH5N=N)CeH4 п-(СбНбСН=СН)СбН4 47 431
СбНб 2-Пиридил п-аСбНб — 445
СбНб 2-Хинолил СбНб — 24
СбНб 2-Хинолил п-С1СбНб — 445
СбНб 2-Тиазолил СвНз 66 446
СбНб 4-Метил-2-тиазолил СбНб 50 446
СбНб 4-Феиил-2-тиазолил СвНз 38 446
СбНб 4,5-Дифенил-2-тиазолил СбНб ' 22 446
СбНб H2N(NH=)C СбНб 61 452
Продол'нсенир табл. IX
R' R" Выход, % Литература
с6н5 H2N(NH = )C -м-ОгНСбН4 452
w-(CH3)2CHCeH4 H2N(NH=)C 5-Тетразолил — 24
п-СН3ОС6Н4 c6H6 СбНб — 16
и-СН3ОС6Н4 С6н6 п-(СбН5СН=СН)СбН4 83 431
п-СН3ОС6Н4 п-С1С6Н4 п-С1С6Н4 43 361
п-СН3ОС6Н4 ft-OgN С6Н4 n-O2NCsH4 15 361
п-СН3ОС6Н4 2-Пиридил п-С1С6Н4 — 445
П-СН3ОС6Н4 2-Хинолил п-С1СбН4 — 445
П-СН3ОС6Н4 H2N(NH=)C 5-Тетразолил — 24
*2 о-С1СбН4 2-Пиридил 5-Тетразолил — 445
о-С1СвН4 2-Хинолил 5-Тетразолил * — 445
п-С1СбН4 о-СН3ОС6Н4 о-СН3ОС6Н4 44 361
я-С1СбН4 H2N(NH=)C 5-Тетразолил — 24
п-ВгСбН4 с6н5 п-ВгС6Н4 80 441
•п-ВгСбН4 с6н6 2,4,6-Вг3СбН2 10 441
п-ВгС6Н4 с6н6 п-(СбН6СН=СН)СбН4 47 431
о-НОС6Н4 (C6Hs)2NCO CeHs — 448
о-НОС6Н4 2-Пиридил п-С1С6Н4 — 445
о-НОС6Н4 2-Хинолил п-С1СбН4 — 445
л-НОС6Н4 С6Н5 п-(СбНбН=М)СбН4 50 433
л-Ь1ССбН4 CeHg СбНб 65 441
n-NCC6H4 С6н6 n-NCC6H4 80 441
o-O2NCeH4 2-Пиридил п-С1С6Н4 — 445
о-Ог1^СбН4 2-Хинолил п-С1С6Н4 — 445
n-O2NC6H4 С6Н6 CeHs 40 22, 441
/г-О2Л1С6Н4 гс-О2ЫСбН4 п-С6Н5СбН4 447
n-O2NC6H4 п-ОгМСбН4 3-СН3О-4- (Л4-СН3ОС6Н4) CeHs 23 447
cc n-O2NC6H4 H2N(NH=)C СбНб — 452
n-HOOCC6H4 n-(C6H5N=N)C6H4 п-(СбН6СН=СН)С6Н4 33 431
“ и-СНэСООСбН4 n-(C6H6N=N)C6H4 п-(СбНбСН=СН)С6Н4 40 431
n-CH3CONHCsH4 С6Н5 СбНб 53 441
п-СН3СОЬШСбН4 С6Н5 n-CH3CONHC6H4 17 441
n-CH3CONHC6H4 n-CH3CONHC6H4 n- (n-HOC6H4N=N) СвН4 — 433
•M-HO3SCeH4 CeHs СбН5 — 171
3,4-(СН3О)2СбН3 СбНб п-СН3ОС6Н4 25 441
C6H5CH2 Холил (С24Н390б) СбНб 428
C6H6CO СбНб СбНб -— 76,234
п-СбН3СбН4 СбН5 СбНб 43 444
/г-СсНйСбНд п-СбНбСбН4 п-СбНбСбН4 23 444
2-Фурил CeHs СбН5 14 453
, 2-Фурил (C6H6)2NCO СбНб — 448
2-Фурил 2-Пиридил п-С1СбН4 — 445
2-Фурил 2-Хинолил П-С1С6Н4 — 445
2-Фурил Холил (С24Н39О6) СбНб — 428
2-Тиенил СбН5 М-РзССбН4 — 445
2-Пиридил CeHs СбНб 46 453
2-Пиридил CeHs п-СН3ОСбН4 95 453
2-Пиридил CeHs п-С1СбН4 40 453
2-Пиридил СбН5 o-H2NC6H4 35 454
2-Пиридил СбНб п-(СбН5СН=СН)СбН4 40 453
2-Пиридил СбН5 n- (C6H6N=N)C6H4 39 453
2-Пиридил 2-Пиридил п-С1СбН4 — 445
2-Пиридил 2-Хинолил п-С1С6Н4 — 445
2-Пиридил 2-Хинолил 6-Хинолил — 445
4-Пиридил 2-Хинолил п-С1СбН4 — 445
Продолжение табл. IX
R R' R" Выход, % Литература
4-Пиридил 2-Хинолил 6-Хииолил 445
2-Фенил-1,2,3-триазолнл-4 CeHs C6Hs 59 453
2,6-Диоксипиримидил-4 CeHs CeHs 76 449
2 Хинолил C6HS CeHs 50 455, 158
2-Хииолил CeHs o-HOOCCeH^ 65 450, 456
2-Бензотиазол ил CeHs C6H5 47 455, 457, 458
2-Бензотиазол ил CeHs «-C1C6H4 — 144, 457
2-Бензотиазолил CeHs /1-O2NC6H4 — 144, 457, 459
2-Бензоти азолил CeHs o-HOOCC6H4 56 455
_ 2-Бензотиазолил п-С1СбН4 СеН5 — 144, 457
К 2-Бензотиазолил п-С1С6Н4 п-С1С6Н4 — 144, 457
2-Бензотиазолил CeH5 — 144, 457, 459
2-Бензотиазолил /1-O2NC6H4 n-O2NC6H4 — 144, 457, 458
2-Бензо[Лхинолил C6Hs CeHs 48 460
2-Бензо[Лхинолил CeHs o-HOOCCeH4 65 460
Б. Гидразоны сахаров
Гидразон Заместитель в анилине Продукт реакции (выход, %) Литература
Фенилгидразои d-глюкозы Фенилозазон D-глюкозы Феиилозазои ангидро- D-глю- козы Фенилгидразои D-галактозы — Дифенилформазан D-глюкозы (64) Формазан фенилозазона d-глюкозы (20) Формазан фенилозазона ангидро-D-глюкозы (27). Дифеиилформазаи о-галактозы (73) 159, 160 158 161 159,160.162
п-Бромфенилгидразон D-га- лактозы — Фенил- (n-бромфенил) формазан D-галактозы 163
со Фенилгидразои D-маннозы — Дифенилформазан D-маннозы (68) 159, 160
* Фенилгидразои L-арабииозы — Дифенилформазан L-арабинозы (51) 159
Фенилгидразои L-рамнозы — Дифенилформазан L-рамнозы (45) 159, 162
Фенилгидразои D-ксилозы — Дифенилформазан D-ксилозы (55) 159
Фенилгидразои пентаацетил- D-маннозы — Дифенилформазан пентаацетил-D-маннозы (57) 162
В. Диформазаны из гидразонов и диаминов
RCH= NHNR' -J- XN2—N2X -> ~RC=NNHR' Г ~l । Z=\ Y Y N=N-/_\- 1 Y - 2
Сл R R' У Выход, % Литература
СН3 СеН5 • СеНБ CeHg CeHs CeHs CeH5 CeHs n-CH3OC6H4 O-ClCeH4 O-ClCeH4 CeHs CeH6 CeHs C6Hs n-O2NCeH4 n-O2NCeH4 2-Пириднл 2-Хинолил СеН5 2-Пиридил 2-Хинолил н н СНз СНзО н СНзО СНзО СНзО СНзО СНзО СНзО 1 I I 1 I ssssss 1 О О! СП 209 461 461 462, 461 447 447 445 445 462 445 445
Продолжение табл, рх
R R' Y Выход, % Литература
o-HOC6H4 C6HS СНзО 462
0-O2NC«H4 2-Пиридил СНзО — 445
o-OsNCeHi 2-Хинолил СН3О 445
n-aNCeHi n-O2NC6H4 н 49 447
n-OaNCeFU n-OaNCgFU СНзО 12 447
3, 4-(CHsO)2C6H:< CaHs СНзО 79 462
2-Фурил CeHs СНзО 70 462, 445
2-Фурил 2-Пириднл СНзО — 445
2-Фурил 2-Хинолил СНзО — 445
2-Пиридил CaHs СНзО — 445
2-Пиридил 2-Пиридил СНзО — 445
4-Пиридил с6н5 СНзО 49 462, 445
4-Пиридил 2-Пиридил СНзО — 445
2-Тиенил свн5 н 445
2-Тиенил С6НБ СНзО 61 462, 445
2-Тианафтенил с6н5 СНзО 64 462, 445
2-Тианафтенил 2-Пнридил СНзО — » 445
2-Бензотиазол ил С6Н5 СНзО — 445
Г. Диформазаны из дигидразонов
Заместитель
Гидразон в анилине Продукт реакции (выход, %) Литература
Дихолилгидразон глиоксаля — бис- (М-Холил-Ы'-феиилформазан) 428
Фенилгидразон днкетоянтар- — бис- (N, N'-Днфенилформаваи) (небольшой} 177, 210
бис-Фенилгидразон янтарного — С, С'-Этилеи-бис- (N, N'-дифенилформазан) (53) 209
альдегида 4-Фенил азо С, С'-Этилен-быс-[Ь1-фенил-Н'- (п-фенилазофе- нил) формазан] (29) 433
бис-Фенилгидразон вого альдегида суберило- 4-Фенил азо С, С'-Гексаметилен-б«с-(Н, N'-дифенилформ- азан) С, С'-Гексаметилен-б«с-[Н-фснил-М'- (п-феиил- азофенил) формазан] (39) 441 433
бис-Фенилгидразон вого альдегида терефтале- 4-Карбэтокси Д. Диформазаны из п-Февилен-бкс-(К, N'-дифенилформазан) (90) п-Фенилеи-бис-[М-фенил-М'-(п-карбэтоксифе- нил) формазан] (47) дибензальаминогуанидинов 209 209
RCH=NNHC (=NH) NHN=CHR + 2R'N2X -> RC=NNHC (=NH) NHN—CR
N=NR' R'N=N
R R' Литература
СбНд СбНб 463
С6Н6 O-O2NC6H4 24
с6н5 n-O2NCeH4 24
СбН6 n-HOaSCeH, 463
с6н6 4-СНз-2-(О2Н)СвНз 24
с6н5 2-CH3-6-(O2N)CeH3 24
C6HS 2-СН3-4-С1СбНз 24
СвНз ₽ -СюН7 24
СбНб 4-Антипирил 24
jn-O2NCeH4 СвНб 463
Продолжение табл. IX
Е. Гидразоны, которые вступают в реакцию сочетания с отщеплением заместителя
RC=NNHR" + R"'N2X RC=NNHR" + R'OH
R' N=NR'"
R R' R" Rw Выход, % Литература
Н соон CeHs CeHs 20 167
Н соон CeHs 2,4-Br2C6H3 — 198
С1 соон 0-С1СеН4 п-ОгМСеН, Количе- ственный 169
С1 соон о-СН3ООССеН4 n-O2NCeH4 — 169
С1 соон 2, 4-(СН3)2СеН3 n-OsNCetU — 169
СНз соон CeHs CeHs 87—89 32, 177, 103
СНз соон CeHs o-OsNCeHi — 168
СНз соон o-CHsOC6H4 O-CH3OC6H4 70 324
СНз соон n-СНзОСеЩ n-CH3OC6H4 324
СНзООС соон . СеНБ CeHs 76
С2Н5ООС соон CeHs CeHs Количе- ственный 76
С2Н5ООС соон CeHs n-CH3CeH4 20
СНзСО соон CeHs C6Hs 75 58, 166
CeHs соон CeHs CeH5 —— 20
CeHs соон CeHs o-CH3C6H4 — 165
CeHs соон CeHs o-O2NC6H4 — 165
СеНе соон CeHs л-ОгМСбН4 — 165
CeHs соон CeHs ZZ-O2NC6H4 — 165
CeHs соон CeHs 2,4-(CH3)2CeH3 — 165
CeHs ... 12&T
CeH5N=N COOH CeHs CeHs 56 66, 76, 164, 175
C6H6N=N C6HSN=N COOH COOH CeHs п-СНзС6Н4 n-CH3CeH4 CeHs -f— 20 20
HOCH2CH2 7 COOH о-СН3СеН4 0-ClCeH4 23 464
HOCH2CH27 COOH 0-С1СеН4 o-CH3CeH4 7 464
НОСН2СН27 COOH о-С1СеН4 o-ClC6H4 38 464
НОСН2СН2 7 COOH o-O2N С6Н4 o-O2NC6H4 4 A 464 ЛАЛ
СН3СНОНСН2в COOH СеН5 CeHs 4 464 20 66, 175
СН3СНОНСН2в COOH о-С1С6Н4 o-ClC6H4 15
СНзООС СНзСО п-СН3СеН4 CeHs —
С2Н6ООС СНзСО СеН6 CeHs
С2Н5ООС СНзСО п-СН3СеН4 CeHs — 20
1-Карбоментилокси СНзСО и-СНзСеН4 я-С1СеН4 —. 170 170 58, 166 177
Z-Карбоментилокси СНзСО п-ВгСвН4 n-CH3CeH4
CeH6N=N СНзСО Се Не CeHs
CeHsN=N нооссо С«Н6 CeHs —
С2Н5ООС С2Н6ООССО п-ВгСбН4 n-BrCeH4 —~ 72 116
no2 носн2 СеН5 CeHs ”—
no2 СНзСН(ОН) CeHs CeHs — 116 116 116 116 116
no2 ClsCCH(OH) СеНб CeHs —
no2 СНзСН2СН(ОН) CeHs CeHs —
no2 СНз(СН2)2СН(ОН) СеНб CeHs —
no2 СН3(СН2)3СН(ОН) CeH6 CeHs
no2 СеН6СН(ОН) CeHs CeHs — 1 116
Формазан образует только сын-изомер 2,4-днметилфенилгидразона метилового эфира глиоксиловой кислоты. акти-Изомер реагирует
цеплением азота. . м „ -
2 При реакции сочетания фенилсульфамильная группа замешается фенильной группой. П7Д1.
8 Вероятно, эти продукты представляют собой 4-арилазоиафтилгидразоиы, а ие формазаны (см. [и1»];.
4 Образуется также 1-фенилазо-2-нафтилгидразои бензальдегида с выходом 35% -
8 Исходное вещество —фенилгидразои фенилглиоксиловой кислоты.
8 Продукт получен также из фенилгидразоиа феиилглиоксиловой кислоты с выходом оил.
7 Исходное вещество — гидразон а-кето-у-бутиролактона.
в Исходное вещество — гидразон а-кето-у-валеролактона.
Таблица X
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С ГЕТЕРОЦИКЛИЧЕСКИМИ СОЕДИНЕНИЯМИ
А. 5-Пиразолоны
to
Гетероциклическое соединение, заместители в Н O=Cs 1 7n H2(L? ^СН Заместители в анилиие 1 Продукт реакции (выход, %), заместители в Н N О=С5 1 2N L з н2с-—^сн Литература
— — 4-Фен илазо (количественный) 466, 465
4-Метил 4-(п-Толилазо) (количественный) 466,465,467,468
З-Метил — З-Метил-4-фенилазо 465, 468, 469
2-Аминоантрахинон 3-Метил-4-(2-аитрахинонилазо) (количествен- ный) 283
З-Карбоксн — З-Карбокси-4-фенилазо 465
2-Карбокси 3-Карбокси-4-(о-карбоксифенилазо) 465
2-Карбэтокси 3-Карбокси-4-(о-карбэтоксифенилазо) 470
З-Карбометокси — З-Карбометокси-4-фен илазо 465
З-Карбэтокси — З-Карбэтокси-4-фенилазо 465
2-Карбокси 3-Карбэтокси-4-(о-карбокси фенилазо) 465
2-Карбэтокси 3-Карбэтокси-4-(о-карбэтоксифенилазо) 470
З-Карбэтоксиметил 4-Мстил З-Карбэтоксиметил-4- (п-толилазо) (98) 71
З-Фенил — З-Фенил-4-фенилазо 465, 468—470
2-Метил З-Фенил-4- (о-толилазо) 465, 470
4-Метил З-Феиил-4-(п-толилазо) 465, 470
а-Нафтиламин З-Фенил-4- (а-нафтилазо) 465, 470
Р-Нафтиламин З-Фенил-4- (Р-нафтилазо) 465, 470
to
I -Метил-З-а мино
1-Метил-З-карбэтокси
1 -Метил-З-фенил
1 -Ацетил-З-фенил
1-Фенил
1 -Фенил-З-метил
4-Метокси 1-Метил-3-амиио-4-(п-анизилазо) (41) ) 472
4-Метокси 1-Метил-3-карбэтокси-4- (п-анизилазо) (88) 472
— 1-Мет ил-З-фенил-4-фенилазо 473
— 1 -Ацетил-З-фенил-4-фенилазо 469
— 1 -Фенил-4-фенилазо 181
— 1-Фенил-3-метил-4-фенилазо 474—476
2-Метил 1 -Фенил-З-метил-4- (о-толилазо) 476—478
З-Метил 1-Фенил-З-метил-4-(At-тол илазо) 476, 478
4-Метил 1-Фенил-3-метил-4- (п-толилазо) 476, 478
2-Метокси 1-Феиил-3-метил-4- (о-аиизилазо) 476, 478
4-Метокси 1-Фенил-З-метил-4-(п-анизилазо) 476, 478
2-Этокси 1-Фенил-3-метил-4- (о-этоксифенилазо) 476, 478
4-Этокси 1-Феиил-3-метил-4-(п-этоксифенилазо) 476, 478
2-Хлор 1-Фенил-3-метил-4- (о-хлорфенилазо) 74, 476
З-Хлор 1-Фенил-3-метил-4-(м-хлорфенилазо) 476
4-Хлор 1-Феи ил-3-метил-4-(п-хлорфенилазо)'. 476, 478
4-Бром 1-Фенил-3-метил-4-(п-бромфенилазо) 476, 478
4-Ацетил 1-Фенил-З-метил-4-(п-ацетил фенил азо) 478
2-Нитро 1 -Феиил-З-метил-4- (о-иитрофенилазо) 476, 478
З-Нитро 1 -Феиил-З-метил -4- (м-нитрофеиилазо) 476, 478
• 4-Нитро 1 -Феиил-З-метил-4- (п-иитрофеиилазо)' 476, 478
4-Ацетамидо 1-Фенил-3-метил-4-(п-аиетамидофенилазо) 478
4-Бензамидо 1-Фенил-З-метил-4- (п-бензамидофенилазо) 478
З-Сульфо 1-Фенил-З-метил-4-(м-сульфофенил азо) 479
4-Сульфо 1 -Фенил-З-метил -4- (п-сульфофенилазо) 479
2, 4-Диметил 1 -Фенил-З-метил-4- (2,4-диметилфенилазо) 478
2, 5-Диметил 1 -Фенил-З-метил-4- (2,5-диметилфенилазо)' 478
2,5-Дихлор 1 -Фенил-З-метил-4- (2, 5-дихлорфенилазо) 73, 476
4-Хлор-2-метил 1-Фенил-З-метил-4-(4-хлор-2-мет ил фенилазо) 476
5-Хлор-2-метил I -Фенил-З-метил-4- (5-хлор-2-метилфенилазо) 476
Продолжение табл. X
Г ею рецикл ическое соединение, заместители в Н 1 А oil н2с- -СН Заместители в анилине 1 Продукт реакции (выход, %), заместители в Н 0=t ’ JI Н,С! fcH Литература
1 -Фенил-З-метил 4-Хлор-2-нитро З-Метил-4-сульфо 4-Хлор-З-сульфо З-Хлор-5-сульфо а-Нафтиламин Р-Нафтиламии 1 -Нитро-2-иафти ламин 4-Нитро- 1-нафтиламии 1-Сульфо-2-иафтиламин 1 - (п-Аминофенил) пипе- разин б-Амино-2, З-дигидро-З- кетобензотиазин-1,4 Бензидин 1-Фенил-3-метил-4- (4-хлор-2-нитрофеиилазо) 1 -Феиил-З-метил-4- (З-метил-4-сульфофенилазо) 1 -Фенил-З-метил-4- (4-хлор-З-сульфофенилазо), 1-Фенил-3-метил-4-(3-хлор-5-сульфофеиилазо) 1-Фенил-З-метил-4- (а-нафтилазо) 1-Фенил-З-метил-4- (Р-нафтилазо) 1-Фенил-3-метил-4- (1 -нитро-2-иафтилазо) 1-Фенил-З-метил-4- (4-нитро-Г-иафтилазо) 1-Феиил-3-метил-4- (1-сульфо-2-иафтилазо) 1 -Фенил-З-метил-4- (п-1 -пиперазилфеиилазо) (66) 1-Феиил-3-метил-4- (2, З-дигидро-З-кетобензотиазинил- 1,4-азо-6) (88) 4,4'- (4, 4'-Бифенилендисазо) -бис-[1-фенил-3-метилпира- золон-5] 476 479 479 480 476, 478 476, 478 478 478 479 481 482 478
1-Фенил-З-карб- 4-Метил 1-Фенил-3-карбэтоксиметил-4- (п-толилазо) (89) 71
этоксиметил 4-Нитро 1-Феиил-3-карбэтоксиметил-4- (п-нитрофеиилазо) (85) 71
1, З-Дифеиил 2-Метил 1, З-Дифенил-4-фенилазо 1,3-Дифеиил-4-(о-толилазо) 470, 476, 483 470, 476
i “ 3-Ме:тил 1,З-Дифеиил-4- (л-толилазо), 476
2-Метокси 1, З-Дифенил-4- (о-анизилазо) 476
4-Метокси 1, З-Дифенил-4- (п-анизилазо) 476
2-Этокси 1, З-Дифенил-4- (о-этоксифенилазо)) 476
4-Этокси 1, З-Дифеиил-4- (п-этоксифенилазо) 476
2-Хлор 1, З-Дифенил-4-(о-хлорфенилазо) 476
З-Хлор 1, З-Дифенил-4- (л-хлорфенилазо) 476
4-Хлор 1, З-Дифенил-4-(п-хлорфенилазо) 476
4-Бром 1, З-Дифенил-4- (п-бромфенилазо) 476
2-Нитро 1, З-Дифенил-4- (о-нитрофенилазо) 476
З-Нитро 1, З-Дифенил-4- (jn-нитрофеиилазо) 476
4-Нитро 1, З-Дифенил-4-(п-нитрофенилазо) 476
З-Сульфо 1, З-Дифенил-4- (льсульфофенилазо) 479
4-Сульфо 1, З-Дифенил-4- (п-сульфофенилазо)1 479
2, 5-Дихлор 1, З-Дифенил-4- (2,5-дихлорфенилазо) 476
4-Хлор-2-метил 1, З-Дифеиил-4- (4-хлор-2-метилфенилазо) 476
5-Хлор-2-метил 1, З-Дифенил-4- (5-хлор-2-метилфенилазо) 476
В 4-Хлор-2-нитро 1, З-Дифенил-4- (4-хлор-2-нитрофенилазо)' 476
З-Метил-4-сульфо 1, З-Дифенил-4- (З-метил-4-сульфофенилазо) 418
4-Хлор-З-сульфо 1, З-Дифенил-4- (4-хлор-З-сульфофенилазо) 418
а-Нафтиламин 1, З-Дифенил-4-(а-иафтилазо) 470, 476
Р-Нафтиламин 1, З-Дифенил-4- (Р-нафтилазо) 470, 476
1 -Сульфо-2-нафтиламии 1, З-Дифенил-4- (1-сульфо-2-нафтилазо) 479
1-Фенил-3-(2-фу- — 1 -Фенил-3- (2-фурил) -4-фенилазо 471, 476
рил)
2-Метил 1 -Фенил-3- (2-фурил) -4- (о-толилазо)) 471, 476
З-Метил 1 -Фенил-3- (2-фурил) -4- (.и-толилазо) 471, 476
4-Метил 1 -Фенил-3- (2-фурил) -4- (п-толилазо) 471, 476
2-Метокси 1 -Фенил-3- (2-фурил) -4- (о-анизилазо) 471, 476
4-Метокси 1-Фенил-3- (2-фурил) -4- (п-анизилазо) 471, 476
2-Этокси 1 -Фенил-3- (2-фурил) -4- (о-этоксифенилазо) 471, 476
4-Этокси 1-Фенил-З- (2-фурил),-4- (п-этоксифенилазо) 471, 476
Продолжение табл. X
Iетероциклич еское Продукт реакции (выход, %),
соединение, заместители в заместители в
н .N. Заместители в анилине 1 н Литература
О=С5 ' 2N О=С5^1 ?N L з11 н2с~—ч:н
н2с-—А
2-Хлор 1-Фенил-3- (2-фурил) -4- (о-хлорфенилазо) 471, 476
З-Хлор 1-Феиил-З- (2-фурил) -4- (ж-хлорфенилазо), 471, 476
4-Хлор 1-Фенил-3- (2-фурил) -4-(п-хлорфеиилазо) 471, 476
4-Бром 1-Феиил-З- (2-фурил) -4- (п-бромфенилазо) 471, 476
2-Нитро 1-Фенил-З- (2-фурил) -4- (о-нитрофеиил азо) 471, 476
З-Нитро 1-Фенил-З- (2-фурил) -4- (ж-нитрофенилазо)' 471, 476
4-Нитро 1 -Фенил -3- (2-фурил) -4- (п-иитрофенилазо) 471, 476
З-Сульфо 1-Фенил-З-(2-фурил)-4-(ж-сульфофенил азо) 479
4-Сульфо 1-Фенил-З- (2-фурил) -4- (п-сульфофенилазо) 479
2,5-Дихлор 1-Фенил-З- (2-фурил) -4- (2,5-дихлорфенилазо)' 476
4-Хлор-2-метил 1-Фенил-З- (2-фурил) -4- (4-Хлор-2-метилфенилазо) 476
5-Хлор-2-метил 1 -Фенил-3- (2-фурил) -4- (5-хлор-2- метилфенилазо) 476
4-Хлор-2-нитро 1-Феиил-З- (2-фурил) -4- (4-хлор-2-нитрофенилазо) 476
З-Метил -4-сульфо 1-Фенил-З- (2-фурил) -4- (З-метил-4-сульфофенилазо)' 479
4-Хлор-З-сульфо 1-Фенил-З- (2-фурил) -4- (4-хлор-З-сульфофенилазо) 479
а-Нафтиламин 1-Фенил-З- (2-фурил) -4- (а-нафтил азо) 476
р-Нафтиламин 1-Фенил-З- (2-фурил) -4- (Р-нафтилазо) 471, 476
1 -Сульфо-2-нафтиламин 1-Фенил-З- (2-фурил)-4- (1-сульфо-2-нафтилазо) 479
1 -Фенил-3- (а-фенил- 4-Метокси 1-Фенил-З- (а-фенилбутирамидо) -4- (п-анизилазо) (80) 484
бутирамидо) l-n-Толил-З-метил 1-л-Толил-3-метил-4-фенилазо 477
4-Метил о А
I-(о-ХлорфеннлТ -3-ме- 2-Хлор 5 1- (о-Хлорфенил) -З-метил-4- (о-хлорфенилазоУ 485
ТИЛ 1 - (ж-Хлорфенил) -3-ме- 2, 4-Дихлор 1-(ж-Хлорфенил) -З-метил-4- (2,4-Дихлорфенилазо) 485
ТИЛ 1 - (п-Хлорфенил) -3-ме- 4-Хлор 1- (п-Хлорфенил) -З-метил-4- (п-хлорфенилазо)) 485
ТИЛ 1- (2,4-Дихлорфенил)- — 1- (2, 4-Дихлорфенил) -З-метил-4-фенилазо 485
З-метил 486
1- (ж-Нитрофенил) -3-фе- — 1- (ж-Нитрофенил) -З-фенил-4-фенил азо
НИЛ 1 - (п-Нитрофенил) -3-ме- 4-Метокси 1-(п-Нитрофенил)-З-метил-4- (п-анизилазо) (52) 484
ТИЛ 2-Хлор 1 - (п- Нитрофеиил )' -3- мети л -4- (о-х лорфенил азо) 74 487
1- (о-Карбоксифенил) - — 1-(о-Карбоксифенил)-З-метил-4-фенилазо
З-метил 488 488 489
1- (о-Карбоксифенил) - — 1-(о-Карбоксифенил) -З-фенил-4-фенилазо
3-фенил 4-Метил 1- (о-Карбоксифенил)'-З-феиил-4- (п-толилазо)
1 - (ж-Карбоксифенил) - — 1- (ж-Карбоксифенил) -З-метил-4-фенилазо
З-метил 489
1-(п-Карбоксифенил)- — 1- (п-Карбокси фенил) -З-метил-4-фенил азо
З-метил 490
1-(о-Сульфо фенил)- — 1- (о-Сульфофенил) -З-метил-4-фенил азо
З-метил 1- (п-Сульфофенил) - — 1- (п-Сульфофенил) -З-метил-4-фенилазо 491, 492
З-метил 4-Нитро 1-(п-Сульфофенил) -З-метил-4-(п-нитрофенилазо)1 491, 49о
2,5-Дихлор 1 - (п-Сульфофенил) -З-метил-4- (2,5-дихлорфеиилазо)' 491 491
4-Хлор-2-метил 1- (п-Сульфофенил) -З-метил-4- (4-хлор-2-метилфенил-
5-Хлор-2-метил азо) 1- (п-Сульфофенил) -З-метил-4- (5-хлор-2-метилфенил- 491
азо)
Продолжение табл. X
Г етероциклическое соединение, заместители в Н О=С5 1 XJb Н2С СИ Заместители в анилине1 » Продукт реакции (выход, %), заместители в Н O=C^/Z^ zN HjC1 Литература
1 - (п-Сульфофенил) - — 1- (п-Сульфофенил) -3-фенил-4-фенилазо 491
3-фенил 2-Нитро 1 - (п-Сульфофенил) -З-фенил-4- (о-нитрофенилазо) 491
4-Нитро 1 - (п-Сульфофенил) -З-фенил-4- (п-нитрофеиилазо) 491
2,5-Дихлор 1 - (п-Сульфофенил) -З-феиил-4- (2,5-дихлорфенилазо) 491
4-Хлор-2-метил 1 - (п-Сульфофенил) -З-фенил-4- (4-хлор-2-метилфенил- 491
5-Хлор-2-метил азо) 1 - (п-Сульфофенил) -З-фенил-4- (5-хлор-2-метилфенил- 491
1 - (п-Сульфофенил) -3- — азо) 1 - (п-Сульфофенил) -3- (2-фурил) -4-фенилазо 491
(2-фурил) 2-Нитро 1- (п-Сульфофенил) -3- (2-фурил) -4- (о-нитрофенилазо) 491
4-Нитро 1 - (п-Сульфофенил) -3- (2-фурил) -4- (п-нитрофеиилазо) 491
2,5-Дихлор 1 - (п-Сульфофенил) -3- (2-фурил) -4- (2,5-дихлорфенил- 491
* 4-Хлор-2-метил азо) 1- (п-Сульфофенил) -3- (2-фурил) -4- (4-хлор-2-метилфе- 491
5-Хлор-2-метил нилазо) 1 - (п-Сульфофенил) -3- (2-фурил) -4- (5-хлор-2-метилфе- 491
1 - (л-Сульфамилфенил) - 2-Окси-4-сульфо-1-на- нилазо) 1-(л«-Сульфамилфенил)-З-метил-4- (2-окси-4-сульфо- 494
3-метил фтиламин 1-нафтилазо)
2-Окси -4-сульфо-6-нит- 1 - (х-Сульфамилфеиил) -З-метил-4- (2-окси-4-сульфо- . 494
1 -Дифенилметил-З-ме- 4-Метил 1 -Дифенилметил-З-метил-4- (п-толил aaoj 495
ТИЛ 1 - (2-Нафтил) -3-метил 2-Аминоаитрахинон 1- (2-Нафтил) -З-метил-4- (2-антрахинонилазо) (количе- 283
1- (2-Антрахинонил)'- — ственный) 1- (2-Антрахинонил) -З-метил-4-фенилазо 283
3-метил а-Нафтиламин 1- (2-Антрахинонил) -З-метил-4- (а-нафтилазо) 283
Р-Нафтиламин 1- (2-Антрахинонил) -З-метил-4- (Р-нафтилазо) 283
2-Аминоантрахииои 1- (2-Антрахинонил) -З-метил-4- (2-аитрахиионилазо)) 283
1 - (2-Бензотиазолил) -3- — 1- (2-Бензотиазолил) -3-метил-4-фенилазо 496
метил 4-Сульфо 1- (2-Бензотиазолил) -З-метил-4- (п-сульфофенилазо)) 496
Б. Различные гетероциклические соединения
Гетероциклическое соединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
1-Метил-3-окси-5-пира- 4-Метокси 1 -Метил-З-окси-4- (п- метоксифеиилазо) -5-пиразолои- 472
золоиимид имид (35)
3- (п-Толил) -5-пиразо- — 3- (n-Толил) -4-фенил азо-5-пиразолонимид 354
лонимид
1 - Фенил-З-метил-5-пира- — 1 -Фенил-3-метил-4-феиилазо-5-пиразолонимид (59) 498, 497
золонимид 4-Сульфо 1-Фенил-3-метил-4- (n-сульфофенилазо) -5-пиразолои- 499
ИМИД
Р-Нафтиламин 1 -Феиил-З-метил-4- (Р-иафти л азо) -5-пиразолоиимид 500
1- (о-Толил) -З-метил-5- — 1- (о-Толил) -3-метил-4-феиилазо-5-пиразолонимид 501
пиразолонимид 1-ч>еиил-3-метил -5-тио- — 1-Фенил-3-метил-4-фенилазо-5-тиопиразолон 502, 503
сиразолои
Продолжение табл. X
Г етероциклическое соединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
1 -Фенил-5-метил-З-пир- азолои — -1 -Фенил-4-фенилазо-5-метил-3-пиразолон 504, 505
1- (о-Толил) -5-метил-З- пиразолон — 1 - (о-Толил) -4-фенилазо-5-метил-3-пиразолон 505
1 - (п-Толил) -5-метил-З- пиразолон — 1-(п-Толил)-4-фенилазо-5-метил-3-пиразолон 505
1 - (n-Бромфенил) -5-ме- тил-3-пиразолон — 1- (n-Бромфенил) -4-фенилазо-5-метил-3-пиразолон 506
1 - (о-Карбоксифенил) -5- метил-3-пиразолон — 1- (о-Карбоксифенил) -4-феиилазо-5-метил-3-пиразолон 507
Пиразолидиндиои-3,5 4-Метил 4- (n-Толилазо) пиразолидиндион-3, 5 465
1 -Фенилпиразолидин- — 1 -Фенил-4-фенилазопиразолидиндион-З, 5 508
диои-3, 5 4-Метил 1-Фенил-4-(п-толил’азо)пиразолидиндион-3, 5 509
1 -Фенил-4-этилпиразол- идиндион-3, 5 — 1-Фенил-4-этил-4-фенилазопиразолидиндион-3.5 510
1-п-Толилпиразолидии- дион-3, 5 *— 1- (n-Толил) -4-фенилазопиразолидиндион-З,5 511
З-Метилизоксазолон-5 — 3-Метил-4-фенилазоизоксазолон-5 (количественный) 512,258,513
2-Метил З-Метил-4- (о-толил азо) изоксазолон-5 258
4-Метил- З-Метил-4- (n-толил азо) изоксазолон-5 258
2-Метокси З-Метил-4- (о-анизилазо) изоксазолон-5 258
а-Нафтиламин З-Метил-4- (а-нафтилазо) изоксазолон-5 258
Р-Нафтиламин З-Метил-4- (Р-нафтилазо) изоксазолон-5 258
З-Фенилизоксазолон-5 — 3-Фенил-4-фенилазоизоксазолон-5 514
3- (л-Толил) изоксазо- лов-5 — 3- (л-Толил) -4-фенилазоизоксазолон-5 515
3- (n-Толил) изоксазол-
он-5
to 3- (л-Хлорфенил) изокс-
азолон-5
3- (л-Нитрофенил) из-
оксазолон-5
З-Анилиноизоксазолон-5
З-Метилимииоизокс-
азол-5
2-Бензилимидазолои-4
1,2,3-Триазолои-5
1-Карбоксиметил-1,2, 3-
<о триазолои-5
1-Фенил-1,2,3-триазол-
он-5
1 -Ацетилбензальгидр-
азид-1,2,3-триазол-
он-5
1 -Ацетилглицинбензаль-
гидразид-1,2, 3-три-
азолон-5
Барбитуровая кислота
Зак. 794.
N, N'-Дифеиилбарбиту-
ровая кислота
—- 3- (n-Толил) -4-фенилазоизоксазолон-5 515
4-Нитро 3- (л-Хлорфенил) -4- (п-нитрофеиилазо) изоксазолон-5 516
4-Нитро 3- (л-Нитрофеиил) -4- (п-нитрофенилазо) изоксазолон-5 516
— 3-Анилино-4-фенилазоизоксазолон-5 517
— 3-Метил-4-фенилазоиминоизоксазол-5 98
4-Нитро З-Беизил-5- (п-иитрофенилазо) имидазолон-4 518
4-Метил 4-(п-Толилазо)-1,2, З-триазолон-5 519
4-Метил 1-Карбоксиметил-4-(п-толилазо)-1,2, З-триазолон-5 519
— 1-Феиил-4-фенилазо-1,2, З-триазолон-5 520
4-Метил 1-Ацетилбензальгидразид-4-(п-толилазо)-1,2, 3-триазо- лон-5 521
4-Метил 1 -Ацетилглицинбензальгидразид-4- (п-толилазо) - 1,2, З-триазолон-5 521
— Фенилгидразои 5-кетобарбитуровой кислоты (количе- ственный) 522
2-Нитро о-Нитрофенилгидразои 5-кетобарбитуровой кислоты 522
4-Нитро п-НитрофенйлгиДразон 5-кетобарбитуровой кислоты 522
4-Сульфамил п-Сульфамилфенилгидразои 5-кетобарбитуровой кис- лоты 277
4- (п-Диметилсульф- п-(п-Диметилсульфамилфенил)сульфамйлфенилгидра- 277
амиЛфенил)сульф амил зон 5-кетобарбитуровой кислоты
—- Фенилгидразои N, N'-дифенил-б-кетобарбитуровой кис- лоты 523
Продолжение табл. X
Г етероциклнческое соединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
N, N'-Дифенилбарбиту- 4-Нитро ‘ п-Нитрофенилгидразон N, М'-дифенил-б-кетобарбиту- 523
ровая кислота ровой кислоты
N, N'-Дифенил-б-бензил- барбитуровая кислота — N, ЬГ-Дифенил-5-бензил-5-фенилазобарбитуровая кис- лота 523
4-Нитро N, №-Дифенил-5-бензил-5- (п-нитрофенилазо) барбиту- ровая кислота 523
N, N'-Дифенил-б-дифе- нилметилбарбитуровая 4-Нитро N, N'-Дифенил-б-дифенилметил-б- (п-нитрофенилазо) - барбитуровая кислота 523
кислота
N, N'-Дифеиилтиобар- — N, N'-Дифенил-б-фенилазотиобарбитуровая кислота 524
битуровая кислота 4-Нитро N, N'-Дифенил-б- (п-нитрофенилазо) тиобарбитуровая кислота 524
N, N'-Дифенил-б-дифе- нилметилтиобарбиту- — N, №-Дифенил-5-дифенилметил-5-феиилазотиобарбиту- ровая кислота 524
ровая кислота
2-Тианафтенон — З-Феиилазо-2-тианафтенон 525
4-Нитро 3- (п-Нитрофенилазо) -2-тианафтеион 525
а-Нафтиламин 3-(а-Нафтилазо)-2-тиаиафтеион 525
Р-Нафтиламин 3- (|3-Нафтилазо) -2-тианафтенон 525
З-Тианафтенон 4-Нитро 2- (п-Нитрофенилазо) -3-тианафтенон 526
5-Метил-З-тианафтенон — 2-Фенилазо-5-метил-3-тианафтенон 527
З-Селеннафтенон — 2-Феиилазо-З-селениафтеиои 528
6-Нитрооксиндол 4-Бром 3- (п-Бромфенилазо)-б-нитрооксиидол 85
1 -Фенилоксиндол — 1-Фенил-З-фенилазооксиндол 529
Индоксил — 2-Фенилазоиндоксил 530
Гомофталимид — : а-Фенилазогомофталимид , 531—533
N-Феиилгомофталимид
4-Оксикумарин
З-Метил
4-Метил
2-Хлор
2-Нитро
4-Нитро
2-Карбокси
З-Карбокси
4-Сульфо
2,4-Диметил
4-Метил-2-нитро
4-Метил-З-нитро
а-Нафтиламин
Р-Нафтиламин
4-Сульфо-1 -нафтил-
амин
6, 8-Дисульфо-2-наф-
тиламин
2-Окси-4-сульфо-1 -иаф-
тиламин
Бензидин
3,3'-Диметилбензидин
3, З'-Диметоксибеизи-
дин
4-Метил
4-Нитро
4-Сульфо
4-Сульфамил
а- (л-Толилазо) гомофталимид
а- (n-Толилазо) гомофталимид
а- (о-Хлорфенилазо)гомофталимид
а- (о-Нитрофенил азо) гомофталимид
а- (п-Нитрофенилазо) гомофталимид
а- (о-Карбоксифенилазо) гомофталимид
а-(л1-Карбоксифенилазо)гомофталимид
а- (п-Сульфофенилазо) гомофталимид
а- (2,4-Диметилфеиилазо) гомофталимид
а- (4-Метил-2-нитрофенилазо) гомофталимид
а- (4-Метил-З-нитрофенилазо) гомофталимид
а- (1 -Нафтилазо) гомофталимид
а- (2-Нафтилазо) гомофталимид
а-(4-Сульфо-1-нафтилазо)гомофталимид
а- (6,8-Дисульфо-2-нафтилазо) гомофталимид
а- (2-Окси-4-сульфо-1 -нафтилазо) гомофталимид
а, а'- (4,4'-Бифенилендисазо) -бис- (гомофталимид)
а, а'-(3,3'-Диметил-4,4'бифенилендисазо) -бис- (гомо-
фталимид)
а, а'- (3,3'-Диметокси-4,4'-бифенилендисазо) -бис- (го-
мофталимид)
а-Фенил азо-М-фенилгомофталимид
З-Феиилазо-4-оксикумарин (91)
3- (п-Толилазо) -4-оксикумарин (88).
3- (п-Нитрофенилазо) -4-оксикумарин (75)
3- (п-Сульфофенилазо) -4-оксикумарии (10)
3- (п-Сульфамилфенилазо) -4-оксикумарин (50)
533
533
533
533
533
533
533
534
533
533
533
533
533
534
534
534
533
533
533
535
536
536
536
536
536
Продолжение табл. X
Г етероциклическое соединение Заместители в анилине 1 Продукт реакции (выход, %) Литература
1 -Метил-4-оксикарбо- стирол З-Нитро 1-Метил-3- (л-нитрофеиилазо) -4-оксикарбостирол 538
Глутакоиовый ангидрид — Фенилгидразон у-кетоглутаконового ангидрида (87) 537
2-Метил о-Толилгидразон у-кетоглутакоионого ангидрида (57) 537
4-Метил n-Толилгидразон у-кетоглутаконового ангидрида (79) 537
2-Метокси о-Анизилгидразон у-кетоглутаконового ангидрида (56) 537
4-Диметиламино n-Диметиламинофеиилгидразон у-кетоглутакононого ангидрида (64) 537
2-Карбокси о-Карбоксифенилгидразон у-кетоглутаконового анги- дрида (80) 537
а-Нафтиламии а-Нафтилгидразон у-кетоглутаконового ангидрида (86) 537
Р-Метилглу 1 коновый ангидрид Р-Нафтиламии Р-Нафтилгидразон у-кетоглутаконового ангидрида (87) 537
—* Фенилгидразон у-кето-Р-метилглутаконового анги- дрида (70) 9
2-Метокси о-Анизилгидразон у-кето-р-метилглутаконового анги- дрида (62) 9
4-Метокси n-Анизилгидразон у-кето-Р-метилглутаконового анги- дрида (40) 9
2-Нитро о-Нитрофенилгидразон у-кето-Р-метилглутаконового ангидрида (64) 9
4-Диметиламино n-Диметиламинофенилгидразон у-кето-Р-метилглутако- нового ангидрида (72) 9
4-Диэтиламино n-Диэтиламинофенилгидразои у-кето-р-метилглутако- нового ангидрида (71) 9
4-Сульфо п-Сульфофеиилгидразон у-кето-Р-метилглутакононого ангидрида (85) 9
З-Трифторметил
2,4-Динитро
а-Нафтиламии
Р-Нафтиламин
Р-Хлорглутакоиовый ангидрид
Р-Карбоксиглутакоио-
вый ангидрид (транс- аконитовый анги- дрид) Р-Карбометоксиглута-
g. коиовый ангидрид о» Малонил-а-амииопири- —
дин 4-Карбокси
льТрифторметилфенилгидразои у-кето-Р-метилглутако-
иового ангидрида (65)
2,4-Динитрофенилгидразон у-кето-р-метилглутаконо-
вого ангидрида (69)
а-Нафтилгидразон у-кето-р-метилглутакоиового анги-
дрида (85)
Р-Нафтилгидразои у-кето-Р-метилглутаконового анги-
дрида (85)
Фенилгидразон ₽-хлор-у-кетоглутакоионого ангидрида
Фенилгидразон
дрида (84)
p-карбокси-у-кетоглутаконового анги-
4-Карбометокси
4-Карбэтокси
4-Сульфо
Фенилгидразон Р-карбометокси-у-кетоглутаконового
ангидрида (70)
3-Фенилазо-4Н-пиридо[1, 2-а]пиримидинон-4 (85)
3-(п-Карбоксифенилазо)-4Н-пиридо[1,2-<з]пиримидин-
ои-4 (96)
3- (n-Карбометоксифенилазо) -4Н-пиридо[1,2-а]пирими-
динон-4 (70)
3- (л-Карбэтоксифенилазо) -4Н-пиридо11,2-а]пиримидин-
он-4
3- (л-Сульфофеиилазо) -4Н-пиридо[1,2-а]пиримидин-
он-4 (93)
9
9
9
9
539
540
540
335
335
335
335
335
> Полное название дается в тех случаях» когда ариламии трудно назвать как производное анилина.
РЕАКЦИИ СОЧЕТАНИЯ СОЛЕЙ ДИАЗОНИЯ С РАЗЛИЧНЫМИ СОЕДИНЕНИЯМИ
Таблица XI
Реагирующее вещество Заместитель в анилине Продукт реакции (выход, %) Литература
Диазометан Ацетальдегид Диэтилацеталь кетена Этиловый эфир 0-ами- нокротоновой кислоты Этиловый эфир 0-ме- тиламинокротоновой кислоты Этиловый эфир (3-ди- этиламинокротоновой кислоты бис- (Фенилсульфииил) - метан 1- (2-Метилпропенил) - пиперидин 1 • (Бутенил-1) пиперидин N, N'-Диэтилстирил- . амин 1-(Р-Метилстир ил) пипе- ридин 4-Нитро 4-Этокси 4-Нитро 4-Карбэтокси 4-Хлор 4-Нитро 4-Метокси 4-Хлор 4-Нитро 4-Метокси 4-Хлор 4-Нитро 4-Карбоксн 4-Нитро 4-Карбокси 2,4-Диинтро n-Нитрофенилгидразон хлорформальдегида 1 (85) N, ЬГ-Днфенил-С-феиилазоформазан (20—30) 1 -Фенил-4-этокси-6-пиридазон (35) 1-п-Этоксифенил-4-этокси-р-пиридазон2 (21) 1 -п-Ннтрофенил-4-этоксн-6-пнридазон (25) 1-л-Карбэтоксифенил-4-этокси-6-пиридазон (33) Этиловый эфир а-фенилазо-р-аминокротоновой кис- лоты (52) Этиловый эфир а-фенилазо-Р-метиламинокротоновой кислоты (51) 1-Фенил-3-диэтиламнно-3-метил-4-фенилазо-5-этокси- пнразолин (75) Фенилгидразои бис- (фенилсульфинил) формальдегида n-Хлорфеннлгидразон ацетона п-Нитрофенилгидразон ацетона 2-п-Анизилгидразон бутандиона-1, 2 (53) 2-п-Хлорфенилгидразон бутандиона-1,2 (65) 2п-Нитрофенилгидразон бутандиона-1, 2 (41) Р-п-Анизилгидразон фенилглноксаля (76) p-n-Хлорфенилгидразон фенилглиоксаля (90) Р-п-Нитрофенилгидразон фенилглиоксаля (94) p-n-Карбоксифенилгидразон фенилглиоксаля (89) п-Нитрофенилгидразон ацетофенона (87) п-Карбоксифенилгидразон ацетофенона (95) 2,4-Динитрофенилгидразон ацетофенона (97) 541 177, 32 542 542 542 542 543 543 544 545 140 140 140 140 140 140 140 140 140 14© 140 140
1 Реакция проводилась в метиловом спирте, насыщенном хлористым литием.
2 Образуется также N, М'-ди-я-этоксифеиил-С-карбэтоксиформазан с выходом 19%.
ьэ
о
СЛ
S
СЛ
о
О
сл
- со
я
13 ’
3
сл
о
о
nd
СЛ
Я
° 2
СО
О
ND
ND
nd
ND
СО
3
аз
я
сл 3
СЛ
'сл
ND П
~ Я*
(ТЭ
3
~ ет
2
5 * •
— оо
00
со
СО
СЛ
со аз
Л>
СО
сл
3
аз
со
Я
со
2.
; -м
СЛ
05
гч
аз
03
СО
сл
я
со
CJ
о*
э’
00
оз
СЛ
сл
сл
N “
3
(ТЗ
О
3
и
3
и
3
3
— п>
N 2
Е’ л
СП
N
4. СО JO —
2 "? S S
о
о
о
СЛ
<13
сл
э
со
СЛ ЛЭ
э
со
о
СО
оз
Z п
"*» ч-
(Т> -т
СО
со
*
со
00
ND
т СО
Ди <Т)
> >
3 3
о
со
оо
СЛ
03 се
« •
я =
<73
< У3
3
03
ND
ND
00
я
со
>
В
СЛ
СО
~ 2$ а
—00
Cft КС
00 СО
о
со
СЛ м
СП
“ &
о
СО
СЛ
со
3 °~
- Z-Ч О
S 8®
СО . ^2 *
ND •
.... СО
со ’
ND —
СП
5
м
э
3
сл
о
СЛ
W
аз
№
3
ND
ND
= 5
oS 3
5IS!
ь
S
н
и
•и
>
н
«<
33
>
С5 с©
СЛ
0J
СО
8
>
в
>-*
136 I. Сочетание солей диазония с Соединениями алифатического ряда
43. К en eford, Simpson, J. Chem. Soc., 1947, 917,
44. Schofield, Swain, Theobald, J. Chem. Soc., 1949, 2399.
45. Leonard, Boyd, J. Org. Chem., 11, 419 (1946).
46. Keneford, Simpson, J. Chem. Soc., 1948, 354.
47. Keneford, Simpson, J. Chem. Soc., 1948, 2318,
48. Chattaway, Lye, J. Chem. Soc., 1933, 480.
49. Vorlander, Ann., 294, 253 (1897).
50. Lifsehitz, Ber„ 47, 1401 (1914).
51. Iyer, Chakravartl, J. Indian Inst. Sci., 17A, 41 (1934) [C, A., 28,
4390 (1934)].
52. Iyer, J. Indian Inst. Sci., 21 A, Pt. 6, 65 (1938) [C. A., 33, 148 (1939)].
53. Wislicenus, Reitzenstein, Ann., 277, 362 (1893).
54 Das, Ghosh, J. Am. Chem. Soc., 43, 1739 (1921).
55 Beyer, Claisen, Ber., 21, 1697 (1888).
56 Benary, Meyer, Charisius. Ber., 59, 108 (1926).
57. Benary, Ber., 60, 914 (1927).
58 Bamberger, Lorenzen, Ber., 25, 3539 (1892).
59. Japp, Klingemann, J. Chem. Soc., 53, 519 (1888).
60. Japp, Klingemann, Ann., 247, 190 (1888).
61. Рейнольдс, Ваи Аллан, Смит. орг. пред., сб. 4, Издатинлит, 1953,
стр. 508.
62. Pechmann, Jenisch, Ber., 24, 3255 (1891).
63. Pechmann, Vanino, Ber., 27, 219 (1894).
64. Parkes, Fisher, J. Chem. Soc., 1936, 83.
65. Parkes, Tinsley, J. Chem. Soc., 1934, 1861.
66 Bamberger, Wheelwright. J. prakt. Chem., [2] 65, 125 (1902}.
67 Wislicenus, Jensen, Ber., 25, 3448 (1892).
68 Rabischоng. Bull. soc. chim France, [3] 31, 76 (1904).
69 Rabischong, Bull. soc. chim. France, [3] 31, 83 (1904).
70. Bulow, Hopf пег, Ber., 34, 71 (1901),
71 Bulow, Go Her, Ber., 44, 2835 (1911).
72. Prager, Ann., 338, 360 (1905).
73. Fierz-David, Ziegler, Helv. Chim. Acta. 11, 776 (1928).
74. Burr, Rowe, J. Soc. Dyers Colourists, 44, 205 (1928) [C. A., 22, 3400
(1928)].
75 Rowe, Burr, Corbishley, J. Soc. Dyers Colourists, 42, 80 (1926)
[C. A., 20, 1718 (1926)].
76 Pechmann, Ber., 25, 3175 (1892).
77. Busch, Wo 1 bring, J. prakt. Chem., [2] 71, 366 (1905),
78. Fusco, Romani, Gazz. chim. ital., 76, 419 (1946).
79. Walker, J. Chem. Soc., 123, 2775 (1923).
80 Leonard, Boyd, Herbrandson, J Org. Chem., 12. 47 (1947),
81 Parmerter S., Hodges E. J., неопубликованные наблюдения.
82 Hantzsch, Thompson. Ber.. 3b. 2266 (1905).
83 Whiteley, Yapp, J. Chem Soc., 1927, 521.
84. Henrich et al„ Ann., 376, 121 (1910),
Литература
137
85. Parkes, Al dis, J. Chem. Soc., 1938, 1841,
86. Borsch e, Biitschli, Ann. 622, 285 (1936),
87. Borsche, Diacont, Ann., 510, 287 (1934).
88. Meyer, Ber., 22, 319 (1889).
89. Dieckmann, Meiser, Ber., 41, 3253 (1908),
90. Krfickeberg, J. prakt. Chem., [2] 49, 321 (1894)
91. Schmidtmann, Ber., 29, 1168 (1896).
92. Lythgoe, Todd, Top ham, J. Chem. Soc., 1944, 31Б.
93. Cl a Isen, Ber., 36, 3664 (1903).
94. Borsche, Manteuffel, Ann., 512, 97 (1934).
95. F1 ei s ch h a u er, J. prakt. Chem., [2] 47, 375 (1893).
96. Stein kopf, В oh rm a nn, Ber., 41, 1044 (1908).
97. S t e i п к о p f, J. prakt Chem., [2] 81, 193 (1910).
98. Meyer, J. prakt. Chem., [2] 52, 81 (1895).
99. Meyer, J. prakt. Chem., [2] 78. 497 (1908).
100. Troger, Berndt, J. prakt. Chem., [2] 102, 1 (1921).
101. Troger, Wunderlich, J. prakt. Chem., [2] 101, 157 (1921).
102. Long, J. Am. Chem. Soc., 69, 990 (1947).
103. Wedekind, Ber., 30, 2993 (1897).
104. Pschorr, Hoppe, Ber., 43, 2543 (1910).
105. Curtin, Russell, J. Am. Chem. Soc., 73, 4975 (1951).
106. Феофилактов, Онищенко, ЖОХ, 9, 325 (1939).
107. Borsche, Manteuffel, Ann., 534, 56 (1938).
108. Favre J, Bull. soc. chim. France, [4] 47, 1290 (1930).
109 Favrel, Bull. soc. chim. France, [3] 27, 200 (1902).
110. Backer, Rec. trav. chim., 70, 733 (1951).
111. Troger, Nolte, J. prakt. chem., [2] 101, 136 (1921).
112. С 1 a a s s, Ber., 45, 747 (1912).
113. Bamberger, Schmidt, Levinstein, Ber., 33, 2043 (1900).
114. Bamberger, Ber., 27, 155 (1894).
115. Hubbard, Scott, J. Am. Chem. Soc., 65, 2390 (1943).
116. Jones, Kenner, J. Chem. Soc., 1930, 919,
117. Gochenour, Degering, Proc. Indiana Acad. Sci., 57, 88 (1948)
[C. A., 43, 4646 (1949)].
118. Ponzlo, Gazz. chim. ital., 39, II, 535 (1909).
119. Ponzio, Macciotta, Gazz. chim. ital., 44, I, 269 (1914).
120. Ponzio, Macciotta, Gaz. chim. ital., 44, II, 63 (1914).
121. Ponzio, Gazz. chim. ital., 42, I, 525 (1912).
122. Busch, Schaffner, Ber., 56, 1612 (1923).
123. Ponzio, Giovetti, Gazz. chim. ital., 39, II, 546 (1909).
124. Meyer, Ber., 52, 1468 (1919).
125. Терентьев, Демидова, ЖОХ, 7, 2464 (1937).
126. Eibner, Laue, Ber., 39, 2022 (1906).
127. Терентьев,. Гомберг, ЖОХ, 8, 662 (1938).
128. Widman, Ber., 17, 722 (1884).
129. Stoermer, Fincke, Ber., 42, 3115 (1909).
138 1. Сочетание солей диазония с соединениями алифатического ряда
130. Stoermer, Gaus, Вег., 45, 3104 (1912).
131. Simpson, Stephenson, J. Chem. Soc., 1942, 353.
132. Schofield, J. Chem. Soc., 1949, 2408.
133. Ainley, Robinson, J. Chem. Soc., 1937, 369.
134. Schofield, Simpson, J. Chem. Soc., 1945, 512.
135. Richter, Ber., 16, 677 (1883).
136. Quilico, Freri, Gazz. chim. ital., 58, 380 (1928).
137. Quilico, Fieischner, Gazz. chim. ital., 59, 39 (1929).
138. Quilico, Freri, Gazz. chim. ital., 60, 606 (1930).
139. Quilico, Freri, Gazz. chim. ital., 59, 600 (1929).
140. Crary, Quayle, Lester, J. Am. Chem. Soc., 78, 5584 (1956).
141. Порай-Кошиц, Хархаров, Изв. АН СССР, OXH, 1944, 143.
142. Хархаров, ЖОХ, 23, 1175—1181 (1953).
143. Gault, Wahl, Compt. rend., 240, 983 (1955).
144. Wahl, Le Bris, Bull. soc. chim. France, 1954, 587.
145. Wahl, Le Bris, Compt. rend., 234, 631 (1952).
146. Le В ri s, W.a h 1, Bull. soc. chim. France, 1954, 248.
147. Wahl, Bull. soc. chim. France, 1954, 251.
148. Порай-Кошиц, Муравич, ЖОХ, 23, 1583—1593 (1953)
149. Wizinger, A t a k a n, Helv. Chim. Acta, 39, 1330 (1956).
\50. Ko nig, Ber., 57, 891 (1921).
/51. Ko nig, Ber., 56, 1543 (1923).
152. Konig, Muller, Ber., 57, 144 (1924).
153. Порай-Кошиц, Динабург, ЖОХ, 24, 2208 (1954).
154. Bamberger, Ann., 305, 289 (1899).
155. Nolting, Ber., 37, 2556 (1904).
156. Портер, Петерсон, Синт. орг. преп., сб. 3, Пздатинлйт, 1952,
стр. 357. ,
157. Bamberger, Billeter, Helv. Chim. Acta, 14, 219 (1931).
158. Mester, J. Am. Chem. Soc., 77, 4301 (1955).
159. Mester, Major, J. Am. Chem. Soc., 78, 1403 (1956).
160. Zemple n, Mester, Acta Chim. Acad. Sci. Hung., 2, 9 (1952) [C. A.,
48, 1966 (1954)].
161. Mester, Major, J. Am. Chem. Soc., 77, 4305 (1955).
162. Mester, Major, J. Am. Chem. Soc., 77, 4297 (1955).
163. Zemplen, Mester, Messmer, Eckhart, Acta Chim. Acad. Sci.
Hung., 2, 25 (1952) [C. A., 48, 1966 (1954)].
164. Bamberger, Ber., 25, 3547 (1892).
465. Wedekind, Stauwe, Ber., 31, 1746 (1898).
466. В amberger, de Gruyter, J. prakt. Chem., [2] 64, 222 (1901),'
167. Busch, Beust, Ber., 58, 442 (1925).
168. R a gno, Brun o„Gazz. chim. ftal., 76, 485 (1946).
169. F u s co, :R о m a n i, Gazz. chim. ital., 78, 342 .(1948),
170. Lapworth, J. Chem. Soc., 83, 1114 (1903). x
171. Fichter, Schiess, Ber., 33, 747 (1900).
172. К u h n, J er c h e 1, Ber., 74, 941 (1941).
Литература
139
173. Hunter, Robert Si J. Chem. Soc., 1941, 820.
174. Hausser, Jerchel, Kuhn, Chem. Ber., 84, 651 (1951).
175. Bamberger, Wheelwright, Ber., 25, 3201 (1892).
176. Chattaway, Lye, Proc. Roy. Soc., A137, 489 (1932) [C. A., 26, 5555
(1932)].
177. Bamberger, Muller, J. prakt. Chem., [2] 64, 199 (1901).
178. Roux, Martinet, Rev. gen. mat. color., 27, 115—120, 134—139, 152—
155 (1923); 28, 13—14, 74—77 (1924).
179. V e n к a t a r a m a n, The Chemistry of Synthetic Dyes, Academic Press,
New York, 1952, Chap. XVIII.
180. Verkade, Dhont, Rec. trav. chim., 64, 165 (1945).
181. Stolz, Ber., 28, 623 (1895).
182. Sawdey, Ruoff, Vittum, J. Am. Chem. Soc., 72, 4947 (1950).
183. Borsche, Herbert, Ann., 546, 293 (1941).
184. Koelsch, J. Org Chem., 8, 295 (1943).
185. Atkinson, Simpson, J. Chem. Soc., 1947, 232.
•186. Keneford, Simpson, J. Chem. Soc., 1947, 227.
187. Simpson, J. Chem. Soc., 1947, 237.
188. Keneford, Morley, Simpson, J. Chem. Soc., 1948, 1702.
189. Schofield, Theobald, J. Chem Soc.. 1949, 2404.
190. McIntyre, Simpson, J. Chem. Soc., 1952, 2606.
191. Alford, Irving, Marsh; Schofield, J. Chem. Soc., 1952,
3009.
192. Castle, Kruse, J. org. Chem., 17, 1571 (1952).
193. Albert, Hampton, J. Chem. Soc., 1952, 4985.
194. Baumgarten, DeBrunner, J. Am. Chem. Soc., 76, 3489 (1954).
195. Rousseau, Lindwall, J. Am. Chem. Soc., 72, 3047 (1950).
196. Ried, Angew. Chem., 64, 391 (1952); Nineham, Chem. Revs., 55, 355
(1955).
197. Oesper, Klingenberg, J. Org. Chem., 13, 309 (1948).
198. Irving, В e 11, J. Chem. Soc., 1953, 3538.
199. Jerchel, Fischer, Ann., 574, 85 (1951).
200. Po.nzio, Gazz. chim. ital., 40, I, 312 (1910).
201. Pfister, Ti shier, пат. США 2489927 [С. A., 44, 2552 (1950)].
202. Saunders, The Aromatic Diazo-Compounds, Edward Arnold and Co.,
London, 1949.
'203. Rothenburg, Ber., 27, 685 (1894).
204. Van Biema, Degering, J Am. Chem. Soc., 66, 1514 (1944).
205. 'В a mb er ge r, Grob, Ber., 35, 67 (1902).
206. Аллен, Белл, Синт. орг. преп., сб. 3, Издатинлит, 1952, стр. 186.
207. Fa vre 1, Bull. soc. chim. France, [5] 1, 981 (1934).
208. Benary, Reiter, Soenderop, Ber., 50, 65 (1917).
209. Jerchel, Fischer, Ann., 563, 208 (1949).
210. Bamberger, Kuhlemann, Ber., 26, 2978 (1893).
211. Wolf f, Ann., 317, 1 (1901).
212. Wislicenus, Schoilkopf, J. prakt. Chem., [2] 95, 269 (1917).
140 I. Сочетание солей диазония с соединениями алифатического ряда
213. Borsche, Stackman n, Makaroff-Semljanski, Ber., 49, 2222
(1916).
214. Krohnke, Kfibler, Ber., 70, 538 (1937).
215. Kowjalgi, Iyer, Current Sci. India, 19, 210 (1950) [C. A., 45, 863
(1951)].
216. Iyer, Kowjalgi, J. Indian Inst. SCi., 34, 81 (1952) [C. A., 46, 8857
(1952)].
217. Beyer, Claisen, Ber., 21, 1697 (1888).
218. Bulow, Schlotterbeck, Ber., 35, 2187 (1902).
219. Bulow, Spengler, Ber, 58, 1375 (1925).
220. Chattaway, Ashworth, J. Chem. Soc, 1934, 980.
221. Fa vrel, Bull. soc. chim. France, [3] 27, 328 (1902).
222. Fa vrel, Compt. rend, 128, 318 (1899).
223. Reilly, Daly, Drumm, Proc. Roy. Irish Acad, 40B, 94 (1931) [C. A,
26, 452 (1932)].
224. M о r g a n, R e i 11 y, J. Chem. Soc., 103, 808 (1913).
225. Reilly, MacSweeney, Proc. Roy. Irish Acad, 39B, 497 (1930) [C. A,
25, 1523 (1931)].
226. Morgan, Ackerman, J. Chem. Soc., 123, 1308 (1923).
227. Reilly, Drumm, J. Chem. Soc, 1926, 1729.
228. Morgan, Drew, J. Chem. Soc, 119, 610 (1921).
229. Sieglitz, Horn, Chem. Ber, 84, 607 (1951).
230. Claisen, Ehrhardt, Ber., 22, 1009 (1889).
231. Feist, В el art, Ber, 28, 1817 (1895).
232. Mullen, Crowe, J. Chem. Soc, 1927, 1751.
233. Bamberger, Witter, Ber., 26, 2786 (1893).
234. Bamberger, Witter, J. prakt. Chem, [2] 65, 139 (1902).
235. Chattaway, Ashworth, J. Chem. Soc, 1933, 1624.
236. Bulow, Ber, 32, 2637 (1899).
237. Biilow, Busse, Ber, 39, 2499 (1906),
238. Sachs, Herold, Ber, 40, 2714 (1907).
239. Kostanecki, Tambor, Ber, 35, 1679 (1902).
240. Biilow, S a utermeister, Ber, 37, 354 (1904).
241. Mftrgan, Porter, J. Chem. Soc, 125, 1269 (1924).
242. В ii 1 о w, Riess, Ber, 35, 3900 (1902).
243. Biilow, Grotowsky, Ber, 34, 1479 (1901).
244. Anand, Patel, Venkataraman, Proc. Indian Acad. Sci, 28A, 545
(1948) [C. A, 43, 5778 (1949)].
245. Claisen, Roosen, Ann, 278, 274 (1894).
246. Favre 1, Jean, Bull. soc. chim. France, [4] 37, 1238 (1925).
247. Bulow, Ber, 37, 2198 (1904).
248. Bulow, Nottbohm, Ber., 36, 2695 (1903).
249. Biilow, Nottbohm, Ber, 36, 392 (1903).
250. Krishnan, Iyer, Cuba, Science and Culture India, 11, 567 (1946)
[C. A, 40, 5712 (1946)]
251. Vorlander, Erig, Ann, 294, 302 (1897),
Литература
141
252. Boehm, Ann., 318, 230 (1901).
253. Boehm, Ann., 329, 269 (1903).
254. Rabe, Ber., 31, 1896 (1898).
255. Osborn, Schofield, J. Chem. Soc., 1955, 2100,
256. Otter, Rec. trav. chim., 57, 427 (1938).
257. Bamberger, Ber., 24, 3260 (1891).
258. Schiff, Viciani, Gazz. chim. ital., 27, II, 70 (1897).
259. Chattaway, Ashworth, J. Chem. Soc., 1933, 475.
260. Bamberger, Ber., 17, 2415 (1884).
261. Chattaway, Lye, Proc. Roy. Soc., A135, 282 (1932) [C. A., 26, 5074
(1932)].
262. Wolff, LOttringhaus, Ann., 312, 155 (1900).
263. Bamberger, Schmidt, Ber., 34, 2001 (1901).
264. Wizinger, Herzog, Helv. Chim. Acta, 36, 531 (1953).
265. Michael, Ber., 38, 2096 (1905).
266. Richter, Miinzer, Ber., 17, 1926 (1884),
267. Bulow, Neber, Ber., 45, 3732 (1912).
268. Goldberg, Kelly, J. Chem. Soc., 1948, 1919.
269. Biilow, Schaub, Ber., 41, 2355 (1908).
270. Biilow, Engler, Ber., 51, 1246 (1918).
271. Kjellin, Ber., 30, 1965 (1897).
272. Le Bris, Wahl, Compt. rend., 241, 1143 (1955).
273. Pechmann, Wedekind, Ber., 28, 1688 (1895).
274. Biilow, Ber., 31, 3122 (1898),
275. Griess, Ber., 18, 960 (1885).
276. Biilow, Ber., 33, 187 (1900).
277. Moss ini, Ann. chim. farm., Dec. 1939, 47 [C. A., 34, 2175 (1940)],
278. Chattaway, Parkes, J. Chem. Soc., 1935, 1005.
279. Chattaway, Daldy, J. Chem. Soc., 1928, 2756.
280. Chattaway, Ashworth, Grimwade, J. Chem. Soc., 1935, 117,
281. Chattaway, Ashworth, J. Chem. Soc., 1933, 475.
282. Oddo, Gazz. chim. ital., 21, I, 264 (1891).
283. Saunders, J. Chem. Soc., 117, 1264 (1920).
284. Morgan, Read, J. Chem. Soc., 121, 2709 (1922).-
285. Bulow, Ber., 44, 601 (1911).
286. Biilow, Baur, Ber., 58, 1926 (1925).
287. Wedekind, Ann., 295, 324 (1897).
288. Wizinger, Herzog, Helv. Chim. Acta, 34, 1202 (1951)i
289. Bulow, Reden, Ber., 31, 2574 (1898).
290. Favrel, Compt. rend., 145, 194 (1907).
291. Fa vrel, Bull. soc. chim. France, [4] 1, 1238 (1907).
292. Wolff, Fertig, Ann., 313, 12 (1900).
293. Wahl, Doll, Bull. soc. chim. France, [4] 13, 265 (1913).’
294. Wahl, Compt. rend., 147, 72 (1908).
295. Wahl, Bull. soc. chim France, [4] 3, 946 (1908).
296. Bamberger, Caiman, Ber., 18, 2563 (1885),
142 1. Сочетание солей диазония с соединениями алифатического ряда
297. Stier Ни, Вег., 21,2120 (1888).
298. Wahl, Bull. soc. chim. France, [4] 1, 729 (1907).
299. C i u s a, Gazz. chun. ital., 50, I, 194 (1920).
300. Bulow, Busse, Ber., 39, 3861 (1906).
301. Wahl, Si lb er zweig, Bull. soc. chim. France, [4] 11, 61 (1912).
302. Wahl, Rolland, Ann. chim. Paris, [10] 10, 5 (1928).
303. Rabischong, Bull. soc. chim. France, [3] 31, 87 (1904).
304. Chattaway, Humphrey, J. Chem. Soc., 1927, 2793.
305. Chattaway, Hu m p h r e y, J. Chem. Soc., 1927, 1323.
306. -R a b i s c h о n g. Bull. soc. chim. France, [3] 27, 982 (1902).
307. Sonn, Ann., 518, 290 (1935).
308. T a mb ur e 11 о, C a r a p e 11 e, Gazz. chim. ital., 37, I, 561 (1907).
309. Dieckmann, Ber., 45, 2689 (1912).
310. Dieckmann, Ber., 44, 975 (1911),
311. Bulow, Ber., 40, 3787 (1907).
312. Billow, Ber., 41, 641 (1908).
313. Billow, Bozenhardt, Ber., 43, 234 (1910).
314. Knorr, Reuter, Ber., 27, 1169 (1894).
315. Andrisano, Pentimalli, Ann. chim. Rome, 40, 292 (1950) [C. A., 45,
6384 (1951)].
316. Andrisano, Boll. sci. fac. chim. ind. Bologna, 7, 58 (1949) [C. A.,
44, 9404 (1950)].
317, Morgan, Davies, J. Chem. Soc., 123, 228 (1923).
318. Seidel, Ber., 59, 1894 (1926).
319. Biilow, Dick, Ber., 57, 1281 (1924).
320. Andrisano, Passerin i, Ann. chim. Rome, 40, 439 (1950) [C. A.,
45, 8775 (1951)].
321. Челинцев, ЖОХ, 14, 941 (1944).
322. Petersen, Chem. Ber., 83, 551 (1950).
323. Andrisano, M aioli, Ann. chim. Rome, 40, 442 (1950) [C. A., 45,
8775 (1951)].
324. Abra m ovitch, Schofield, J. Chem. Soc., 1955, 2326.
325. Busch, Frey, Ber., 36, 1362 (1903)..
326. Fusco, Romani, Gazz. chim. ital., 78, 332 (1948).
327. Biilow, Ganghofer, Ber., 37, 4169 (1904).
328. Favrel, Bull. soc. chim. France, [3] 27, 313 (1902),
329. Favrel, Compt. rend., 128, 829 (1899).
330. Meyer, Ber., 24, 1241 (1891).
331. Henrich, Thomas, Ber., 40, 4924 (1907).
332. Henrich, Monatsh., 20, 537 (1899).
333. Henrich, Ber., 35, 1663 (1902).
334. Shaw, J. Bipl. Chem., 185, 439 (1950).
335. Snyder, Robison, J. Am. Chem. Soc., 74, 4910 (1952),
336. Snyder, Robison, J. Am. Chem. Soc., 74, 5945 (1952),
337. Meyer, Ber., 21, 1306 (1888).
338, Hausknecht, Ber., 22, 324 (1889).
Литература
143
339. W i z i n g е г, Biro, Helv. Chim. Acta, 32, 901 (949).
340. Haller, Compt. rend.. 106, 1171 (1888).
341. Favrel, Bull. soc. chim. France, [3] 27, 104 (1902).
342. Favrel, Compt. rend., 127, 116 (1898).
343. Kriickeberg, J. prakt. Chem., [2] 46, 579 (1892).
344. Kriickeberg, J. prakt. Chem., [2] 47, 591 (1893).
345. Weissbach, J. prakt. Chem., [2] 57, 206 (1898).
346. Lax, J. prakt. Chem., [2] 63, 1 (1901).
347. Marquardt, J. prakt. Chem., [2] 52, 160 (1895).
348. Uhlmann, J. prakt. Chem., [2] 51, 217 (1895).
349. Biilow, Neber, Ber., 49, 2179 (1916).
350. Favrel, Compt. rend., 122, 844 (1896).
351. Bowack, Lapworth, J. Chem. Soc., 85, 42 (1904).
352. Perkin, J. Chem. Soc., 43, 111 (1883).
353. Haller, Compt. rend., 108, 1116 (1889).
354. Meyer, J. prakt. Chem., [2] 90, 1 (1914).
355. Be nary, Hosenfeld, Ber., 55, 3417 (1922).
356. Backer, Rec. trav. chim., 70, 892 (1951).
357. Finzi, Bottiglieri, Gazz. chim. ital., 48, II, 113 (1918).
358. Bamberger, Schmidt, Ber., 34, 574 (1901).
359. Bamberger, Padova, Ormerod, Ann., 446, 260 (1925).
360. Jerchel, Elder, Chem. Ber., 88, 1284 (1955).
361. Robbins, Schofield, J. Chem. Soc., 1957, 3186.
362. Dermer, Hutcheson, Proc. Oklahoma Acad. Sci., 23, 60 (1943).
[C. A., 38, 2006 (1944)].
363. Kappeler, Ber., 12, 2285 (1879).
364. Bamberger, Ber., 31, 2626 (1898).
365. Barbieri, Ber., 9, 368 (1876).
366. Wald, Ber., 9, 393 (1876).
367. H a 11 m a n n, Ber., 9, 389 (1876).
368. Bamberger, Frei, Ber., 35, 82 (1902).
369. Bamberger, Frei, Ber., 36, 3833 (1903).
370. Oddo, Ampola, Gazz. chim. ital., 23, I, 257 (1893).
371. Feasley, Degering, J. Org. Chem., 8, 12 (1943),
372. Askenasi, Meyer, Ber., 25, 1701 (1892).
373. Duden, Ber., 26, 3003 (1893).
374. Keppler, Meyer, Ber., 25, 1709 (1892).
375. Braun, Sobecki, Ber., 44, 2526 (1911).
376. Braun, Danziger, Ber., 46, 103 (1913).
377. Russanow, Ber., 25, 2635 (1892).
3i8. Ki mi ch, Ber., 10, 140 (1877).
379. Wieland, Ann., 328, 250 (1903).
380. Meyer, Wertheimer, Ber., 47, 2374 (1914).
381. Gold, Levine, J. Org. Chem., 16, 1507 (1951).
382. D e m u t h, Meyer, Ann., 256, 28 (1890)
383. Chattaway, Drewitt, Parkes, J. Chem. Soc., 1936, 1693,
144 I. Сочетание солей диазония с соединениями алифатического ряда
384. Canonica, Gazz. chim. ital., 79, 738 (1949).
385 Meisenheimer, Heim, Ber., 38, 466 (1905).
386. Holleman, Rec. trav. chim., 13, 403 (1894).
387 Bamberger, Ber., 33, 1781 (1900).
388 Ponzio, Gazz. chim. ital., 42, I, 525 (1912).
389. Bamberger, Scheutz, Ber., 34, 2023 (1901).
390 Bamberger, Pemsel, Ber., 36, 57 (1903).
391. Parkes, Williams, J. Chem. Soc., 1934, 67.
392 Braun, Kruber, Ber., 45, 384 (1912).
393 Ponzio, Gazz. chim. ital., 38, 1, 509 (1908).
394 Ponzio, Charrier, Gazz. chim. ital., 39, I, 625 (1909).
395. Ponzio, Gazz. chim. ital., 39, I, 559 (1909).
396. Ponzio, Charrier, Gazz. chim. ital., 38, I, 526 (1908).
397. Sonn, Schellenberg, Ber., 50, 1513 (1917).
398 A p б у з о в, P а ф и к о в, ЖОХ, 7, 2195 (1937).
399. Meyer, Irschick, Schlosser, Ber., 47, 1741 (1914).
400. Bachman, Hatton, J. Am. Chem. Soc., 66, 1513 (1944).
401. Thiele, Ber., 33, 666 (1900).
402. Sfis, Ann., 556, 85 (1944).
403. Quilico, Freri, Gazz. chim. ital., 62, 253 (1932).
404. Терентьев, Зегельман, Уч. зап. Моск. гос. унив., № 6, 257 (1936).
405. Allen, Eliot, Bell, Can. J. Res., 17B, 75 (1939).
406. Pierrot, Wahl, Compt. rend., 240, 879 (1955).
407. Pierrot, Wahl, Compt. rend., 239, 1049 (1954).
408. Busch, Klett, Ber., 25, 2847 (1892).
409. Jacobs, Winstein, Henderson, Spaeth, J. Am. Chem. Soc.,
68, 1310 (1946).
410. Atkinson, Simpson, J. Chem. Soc., 1947, 808.
411- Schofield, Swain, J. Chem. Soc., 1949, 1367.
412. Simpson, J. Chem. Soc., 1946, 673.
413. Simpson, J. Chem. Soc., 1943, 447.
414. Krahler, Burger, J. Am. Chem. Soc., 63, 2367 (1941).
415. Witt, Nolting, Grandmougin, Ber., 23, 3635 (1890).
416. Michel, Grandmougin, Ber., 26, 2349 (1893).
417. Auwers, Schwegler, Ber., 53, 1211 (1920).
418. Gabriel, Stelzner, Ber., 29, 303 (1896).
419.. Zincke, Malkomesius, Ann., 339, 218 (1905).
42 O.i Sos. anon, de mat. color, et prod. chim. Francolor., англ. пат. 599834
[С. A., 42, 7538 (1948)].
421. Petitcolas, Sureau, Bull. soc. chim. France, 1950, 466.
422. Zincke, Kuchenbecker, Ann., 339, 226 (1905).
423. Morgan, Davies, J. Chem. Soc., 123, 228 (1923).
424. Dadswell, Kenner, J. Chem. Soc., 1927, 580.
425. Duval, Compt. rend., 154, 780 (1912).
426. Duval, Compt. rend., 146, 1407 (1908).
427. |Duval, Compt. rend., 144, 1222 (1907),
Литература
145
428. Сарка, Chem. Zvesti, 2, I (1948) [С. Л., 44, 1523 (I960)].
429. Bamberger, Pemsel, Вег., 36, 85 (1903).
430. Jerchel, Ber., 75В, 75 (1942).
431. Nineham, Pain, Slack, J. Chem. Soc., 1954, 1568.
432. Lettre, Haede, Schafer, Hoppe-Seyler’s Z. physiol. Chem., 289, 298
(1952) [C. A., 48, 10677 (1954)].
433. Libman, Nineham, Slack, J. Chem. Soc., 1954, 1565.
434. Ragno, Orest e, Gazz. chim. ital., 78, 228 (1948).
435. Ragno, Bruno, Gazz. chim. ital., 77, 12 (1947).
436. Breusch, Keskin, Rev. fac. sci. univ. Istanbul, 9A, № 1, 30 (1944)
[C. A., 40, 1319 (1946)].
437. Hausser, Jerchel, Kuhn, Chem. Ber., 82, 515 (1949).
438. Duffin, Kendall, J. Chem. Soc., 1954, 408.
439. Wislicenus, Ber., 25, 3456 (1892).
440. Mattson, Jensen, Dutcher, J. Am. Chem. Soc., 70, 1284 (1948),
441. Ashley, Davis, Nineham, Slack, J. Chem. Soc., 1953, 3881.
442. Fox, Atkinson, J. Am. Chem. Soc., 72, 3629 (1950).
443. Wedekind, Ber., 32, 1918 (1899).
444. Jerchel, Fischer, Ann., 563, 200 (1949).
445. Ried, Gick, Oertel, Ann., 581, 29 (1953).
446. Beyer, Ру 1, Chem. Ber., 87, 1505 (1954).
447. Tsou, Cheng, Nachlas, Seligman, J. Am. Chem. Soc., 78, 6139
(1956).
448. Ried, Hillenbrand, Ann., 581, 44 (1953).
449. Ludolphy, Chem. Ber., 84, 385 (1951).
450. Seyhan, Rev. fac. sci. univ. Istanbul, 17A, 182 (1952) [C. A., 47,
12390 (1953)].
451. Pechmann, Ber., 29, 2161 (1896).
452. Wedekind, Ber., 30, 444 (1897).
453. Cottrell, Pain, Slack, J. Chem. Soc., 1954, 2968.
454. Seyhan, Chem. Ber., 87, 1124 (1954).
455. Seyhan, Chem. Ber., 88, 646 (1955).
456. Seyhan, Chem. Ber., 87, 396 (1954).
457. Wahl, Le Bris, Bull. soc. chim. France, 1954, 1281,
458. W’ahl, Le Bris, Compt. rend., 235, 1405 (1952).
459. Wahl, Le Bris, Compt. rend., 236, 294 (1953).
460. Seyhan, Chem. Ber., 88, 212 (1955).
461. Seiler, Schmid, Helv. Chim. Acta, 37, 1 (1954).
462. Ried, Gick, Ann., 581, 16 (1953).
463. Scott, O’Sullivan, Reilly, J. Chem. Soc., 1951, 3508.
464. Duff in, К end all, J. Chem. Soc., 1955, 3470.
465. Rothenburg, J. prakt. Chem., [2] 51, 43 (1895).
466. Knorr, Ber., 29, 249 (1896).
467. Rothenburg, Ber., 26, 2972 (1893).
468. Rothenburg, Ber., 27, 790 (1894).
469. Rothenburg, J. prakt. Chem., [2] 52, 23 (1895).
10 Зак. 794.
146 I. Сочетание солей диазония с соединениями алифатического ряда
470. Rothenburg, Ber., 27, 763 (1894).
471. Torrey, Zanetti, Am. Chem. J., 44, 391 (1910).
472. Graham, Porter, Weissberger, J..Am. Chem. Soc., 71, 983 (1949).
473. Michaelis, Dorn, Ann., 352, 163 (1907).
474. Knorr, .Ann., 238, 183 (1887).
475. Eibner, Ber., 36, 2687 (1903).
476. Casoni, Boll. sci. fac. chim. ind. Bologna, 9, 4 (1951) [C. A., 45, 7353
(1951)].
477. Michaelis, Ann., 338, 183 (1905).
478. Crippa, Long, Perroncito, Gazz. chim. ital., 62, 944 (1932).
479. Casoni, Boll, sci. fac. chim ind Bologna, 9, 13 (1951) [C. A.. 45,
7355 (1951)].
480. Hayashi, Oshima, Tsuruoka, Seo, Rept. Japan Assoc. Advance
Sci., 17, 47 (1942) [C. A., 44, 3258 (1950)].
481. Kohl bach,. Arch. Hem. Farm., H, 99 (1937) [C. A., 33, 2897 (1939)].
482. Mackie, Cutler, Rec. trav. chim., 71, 1198 (1952).
483. Knorr, Klotz, Ber., 20, 2545 (1887).
484. Vittum, Sawdey, Herdle, Scholl, J. Am. Chem. Soc., 72, 1533
(1950).
485. Chattaway, Strouts, J. Chem. Soc., 125, 2423 (1924).
486. M i c h a¥ 1 i s, Willert, Ann., 358, 171 (1908).
487. Michaelis, Ann., 373, 129 (1910).
488. Michaelis, Ann., 373, 196 (1910).
489. Michaelis, Horn, Ann., 373, 213 (1910).
490. Шарвин, Арбузов, Варшавский, Ж. хим. пр., 6, 1409 (1929).
491. Casoni, Boll. sci. fac. chim. ind. Bologna, 9, 9 (1951) [C. A., 45, 7355
(1951)].
492. Mollenhoff, Ber., 25, 1941 (1892).
493. Иоффе, Хавин, ЖОХ, 17, 522 (1947).
494. Hayashi, Hagiyama, Seo, Rept. Japan Assoc. Advance Sci., 17,
253, 257 (1942) [C. A.. 44, 3259 (1950)].
495. Darapsky, J. prakt Chem., [2] 67, 175 (1903).
496. Эфрос, Давиденков, ЖОХ, 21, 2046 (1951).
497. Michaelis, Brust, Ann., 339, 134 (1905).
498. Mohr, J. prakt. Chem., [2] 79, 1 (1909).
499. Michaelis, Klopstock, Ann., 354, 102 (1907).
500. Michaelis, Schafer, Ann., 397, 119 (1913).
501. Michaelis, Klappert, Ann., 397, 149 (1913),
502. Michaelis, Pander, Ber., 37, 2774 (1904).
503. Michaelis, Pander, Ann., 361, 251 (1908).
504. Michaelis, Ber., 38, 154 (1905).
505. Michaelis, Behrens, Ann., 338, 228 (1905).
506. Michaelis, Ann., 358, 127 (1907),
507. Michaelis, Ann., 373, 209 (1910).
508. Michaelis, Burmeister, Ber., 25, 1502 (1892)
509. Michaelis, Simpn, Ann., 338, 217 (1905).
Литература
147
510. М i с h а е 1 i s, S с h е п к, Вег., 41, 3865 (1908),
511. Asher, Вег., 30, 1018 (1897).
512. Schiff, Вег., 28, 2731 (1895).
513. S с h i f f, V i c i a n i, Ber., 30, 1159 (1897).
514. Claisen, Zedel, Ber., 24, 140 (1891).
515. Posner, Schreiber, Ber., 57, 1127 (1924).
516. Хромов, Порай-Кошиц, ЖОХ, 17, 1828 (1947),
517. Worrall, J. Am. Chem. Soc., 44, 1551 (1922).
518. Finger, Z e h, J. prakt. Chem., [2] 82, 50 (1910).
519. Curtius, Thompson, Ber., 39, 4140 (1906).
520. Dimroth, Ann., 335, 86 (1904).
521. Curtius, Callan, Ber., 43, 2447 (1910).
522. Kuh ling, Ber., 31, 1972 (1898).
523. Whiteley, J. Chem. Soc., 91, 1330 (1907).
524. Whiteley, Mountain, Chem. News, 99, 234 (1909).
525. Marschalk, J. prakt. Chem., [2] 88, 227 (1913).
526. Friedlander, Monatsh., 30, 347 (1909).
527. Auwers, Arndt, Ann., 381, 299 (1911).
528. Lesser, Schoeller, Ber., 47, 2292 (1914).
529. Stoll e, Hecht, Becker, J. prakt. Chem., [2] 135, 345 (1932).
530. В a ey er, Ber., 16, 2188 (1883).
531. Gabriel, Ber., 20, 1198 (1887).
532. Pulvermacher, Ber., 20, 2492 (1887).
533. Meyer, Vittenet, Compt. rend., 192, 885 (1931).
534. Meyer, Vittenet, Compt. rend., 193, 344 (1931).
535. Dieckmann, Ber., 47, 1428 (1914).
536. Huebner, Link, J. Am. Chem. Soc., 67, 99 (1945).
537. Wiley, Ellert, J. Am. Chem. Soc., 77, 5187 (1955).
538. Waldmann, J. prakt. Chem., [2] 147, 321 (1937).
539. Malachowski, Kalinski, Roczniki Chem., 6, 768 (1926) [C. A.,
21, 3615 (1927)].
540. Malachowski, Giedroyc, Jerzm anowska, Ber., 61, 2525 (1928).
541. Huisgen, Koch, Naturwiss., 41, 16 (1954) [C. A., 49, 5344 (1955)].
542. McElvain, Jelinek, J. Am. Chem. Soc., 65, 2236 (1943).
543. Prager, Ber., 34, 3600 (1901).
544. Prager, Ber., 36, 1451 (1903). .
545. H i n s b e r g, J. prakt. Chem., [2] 85, 337 (1912).
II
РЕАКЦИЯ ЯППА—КЛИНГЕМАНА
Р. ФИЛЛИПС
ВВЕДЕНИЕ
При попытке получить азрэфир I в результате реакции со-
четания хлористого фенилдиазония с этиловым эфиром 2-метил-
ацетоуксуоной кислоты Япп и Клингеман [1] получили соедине-
ние, которое, как вскоре было показано [1—4], является фенил-
гидразоном этилового эфира пировиноградной кислоты (II).
СООС2Н6
СН3СОСНСООС2Н5+С6Н5Ь£СГ —> СНзСОС—N=NC6H6
СНз _ СНз
I
СООС2Н6
I
—► СНзСООН + CH3C=N—nhc6h5
II
н,0)
Таким образом, оказалось, что при реакции отщепляется аце-
тильная группа; действительно, продукт азосочетания I в усло-
виях его образования неустойчив и претерпевает гидролитиче-
ское отщепление ацетильной группы с последующей перегруп-
пировкой азоструктуры. Через год те же авторы обнаружили,
что если замещенный ацетоуксусный эфир предварительно омы-
лить и реакцию сочетания проводить с натриевой солью, то от-
щепляется не ацетильная, а сложноэфирная группа. В этом
случае в качестве продукта реакции был получен фенилгидра-
зон диацетила [4, 5].
СНзСОСНСОСГ
I
СНз
c6hsn+
СОО~
I
СНзСОС—N=NC6H6
I
СНз
—► CH3COC=NNHC6H5 + НСО^
СНз
В последующие годы реакция была распространена на дру-
гие системы, содержащие активированные метиновые группы.
Механизм реакции
149
Процесс можно обобщить, как это показано в следующем урав-
нении, где х и у — электроноакцепторные группы
—► уОН + х— C=N—NHAr
R
МЕХАНИЗМ РЕАКЦИИ
Из приведенного выше уравнения очевидно, что реакция
Яппа — Клингемана представляет собой частный случай соче-
тания солей диазония с алифатическими соединениями (см.
гл. I), отличающийся тем, что продукт азосочетания обычно
претерпевает сольволиз с такой же, или почти с такой же, ско-
ростью, с какой он образуется. Эта реакция очень напоминает
нитрозирование и расщепление соединений, содержащих актив-
ные‘метиновые группы, которые были рассмотрены в одном из
предыдущих сборников этой серии [6]. Первая стадия протекает,
несомненно, по тому же механизму, что и аналогичная реакция
сочетания с активным метиленовым соединением (см. стр. 10),
и, вероятно, ее лучше всего можно представить как непосред-
ственное соединение друг с другом аниона активного метино-
вого соединения с катионом диазония. Это можно видеть из
приведенного ниже уравнения, в котором полный заряд показан
у атомов, соединяющихся в ходе реакции друг с другом.
X X
I I
C6H6N=N® -f- е: С — у —> C6H6N=N—С—у
I I
К R
В прежних работах [7—9], касающихся механизма таких
реакций сочетания, рассматривался вопрос об участии еноль-
ных форм активных метиновых соединений и возможном обра-
зовании О-азосоединений в качестве промежуточных форм
(стр. 8). Указанный выше механизм, по-видимому, точно пред-
ставляет реакцию сочетания моно-₽-кетоэфиров, однако нет
сомнения в том, что из ди-^-кетоэфиров и трикетонов иногда
сначала образуются О-азосоединения. Так, из трибензоилме-
тана образуется продукт азосочетания, при взаимодействии ко-
торого с ^-нафтолом получается азокраситель, так что он не-
сомненно является производным соответствующего енола [10].
При нагревании до температуры плавления он превращается
150
II. Реакция Яппа — Клинге мана
в изомер, который не обладает таким свойством и является, по-
видимому, С-азосоединением.
С6Н5 СОС6Н5
(С6Н5СО)2 С=С—О—N=N—С6Н5 Нагревание ) (CeH5CO)2—C-N=N-C6HS
Стадия расщепления аналогична расщеплению триацилмета-
нов и нитрозопроизводных монозамещенных активных метиле-
новых соединений [7]. Расщеплению благоприятствует повыше-
ние щелочности раствора; например, азосоединение III можно
получить из соли диазония, полученной в результате сочетания
О
» /СООС2Н5 NNHCeH3(NO2)2
/ X II
I |\n=NC6H3(NO2)3 —> НООССН2СН2СН2ССООС2Н5
III IV
2,4-динитроанилина и этилового эфира циклопентанон-2-карбо-
новой кислоты в уксусной кислоте. В водном растворе основа-
ния это соединение быстро расщепляется с образованием со-
единения IV [11]. По аналогии’с расщеплением нитрозоэфиров,
катализируемым основаниями [6], вторую стадию реакции
Яппа—Кдингемана можно представить следующим образом:
О СООС2Н5 О* СООС2Н5
II I он- I I
R—С—С—R -----------> R—С—С—R
I. I I
N НО N
II II
NCeH6 NCeHs
—> RCOOH +
~ COOC2HS СООС2Н3~
I I
eC—R *-> C—R
I II
N N
11 e1
L NCeH5 eNC6H6 J
l“+
4-
COOC2HS
I
C-R
11
N
I
NHCeHs
Механизм реакции
151
При разложении продукта, полученного в результате, сочета-
ния с солью кетокислоты, резонирующий анион, который дает
фенилгидразон, образуется, вероятно, в результате отщепления
двуокиси углерода от сложноэфирного аниона.
Приведенный выше механизм процесса Яппа — Клингемана
подтверждается выделением многих промежуточных азосоеди-
нений [7, 11—14], хотя не все попытки получить эти промежу-
точные соединения оказались успешными [12]. Реакция сочета-
ния с солями ₽-кетокислот и малоновых кислот не протекает
непосредственно через стадию замещения карбоксильной груп-
пы. Об этом свидетельствует наблюдение, что соли замещенных
малоновых кислот типа V реагируют значительно медленнее,
чем продукты их декарбоксилирования VI [15]. Поэтому вполне
вероятно, что соль замещенной малоновой кислоты V вначале
декарбоксилируется, а затем вступает в реакцию с солью ди-
азония.
Азопроизводные анилида циклогексанон-2-карбоновой кис-
лоты — относительно стойкие соединения, которые могут быть
выделены при реакции сочетания [11]. Однако наряду с азоани-
ArN,X ...
-----* /N=NAr
\Z\CONHC6HS
лидом образуется некоторое количество моноарилгидразона
циклогександиона, по-видимому, в результате гидролиза и по-
следующего декарбоксилирования.
Фенилпиразолон, полученный из этилового эфира циклогек-
санон-2-карбоновой кислоты, вступает в реакцию сочетания с
диазотированным п-нитроанилином с образованием чрезвы-
чайно интересного азопроизводного VII. Хотя это соединение
N=NC6H4NOs
VII
N
\ceH5 + n-OaNC6H4N«N—(СН,),
152
II. Реакция Яппа — Клингемана
весьма нестойко, оно не претерпевает превращения по реакции
Яппа — Клингемана; вместо этого происходит отщепление азо-
группы по реакции, обратной сочетанию. Так, это соединение,
как показано выше, взаимодействует с диметиланилином; при
взаимодействии его с этиловым спиртом выделяется исходный
пиразолон и образуются нитробензол, ацетальдегид и азот [11].
В реакцию Яппа — Клингемана вступают главным образом
замещенные р-дикетоны, p-кетоэфиры (ациклические и цикличе-
ские), эфиры циануксусной кислоты и соли соответствующих
кислот. Расщепление продуктов реакции сочетания, по-види-
мому, представляет частный случай расщепления дикетонов,
p-кетоэфиров и других соединений. Почти все известные при-
меры этих реакций относятся к производным p-кетоэфиров; как
указано выше, при расщеплении этих соединений алифатиче-
ская ацильная группа оказывается значительно подвижнее, чем
карбалкоксильная группа, однако если карбалкоксильную
группу предварительно омылить, то отщепляется не ацильная
группа, а сложноэфирный ион.
Поведение формильной и ацетильной групп при расщепле-
нии по Яппу—Клингеману, по-видимому, не сравнивалось, но
можно ожидать, что формильная группа более подвижна. При
реакции этилового эфира формилпропионовой кислоты [16], как
и следовало ожидать, происходит отщепление формильной груп-
пы, тогда как некоторые формильные производные цикланонов,
например 2-формилциклогексанон [17], в условиях, в которых
происходит размыкание цикла (альтернативное расщепление)
с образованием соответствующих ацетильных производных, реа-
гируют с отщеплением формильной группы.
СНО c6h6n+ /\=NNHC6Hs
\Z° *\J=°
/\-СОСН3 c6h5n2+ ? NNHCeH6
\/=° * СН3СОССН2СН2СН2СН2СООН
Об отщеплении ароматических ацильных групп мало изве-
стно, но, по-видимому, они связаны прочнее, чем их алифати-
ческие аналоги. Известно, что а, а-дибензоилацетон реагирует
с отщеплением ацетильной группы [19]. Этиловый эфир дибен-
зоилуксусной кислоты [9] взаимодействует с диазотированным
N—NHAr
ArNj II
(С6Н5СО)2 СНСОСНз---С6Н6СОССОС6Н6
анилином в буферном растворе (уксуснокислый натрий) с об-
разованием О-азосоединения IX в условиях, в которых проис-
Механизм реакции
153
ходит расщепление продукта азосочетания VIII, полученного
из этилового эфира бензоилацетоуксусной кислоты [18]. В теплой
разбавленной щелочи соединение IX расщепляется; поскольку
СОСН3 NNHC6H5
। C6H5N2 11
С8Н8СОСНСООС2Н8 -----С8Н8СОССООС2Н8
VIII
C6H5N? /СОС6Н5
(С8Н8СО)2 СНСООС2Н8 ---^->с8н8с=с<
I \соос2н5
ON=NC6H6
IX
при этом отщепляется бензойная кислота, гидролизу, вероятно,
предшествуют перегруппировка и расщепление; выделенный
продукт представляет собой кислоту, соответствующую указан-
ной ниже соли [9].
/СОС6Н8
С8Н8С=С<
. | \соос2н8
ON=NC8H8
IX
(С8Н8СО)2ССООС2Н5-^-
n==nc6h8
nnhc8h5
> C6H8COONa + C8H8COCCOOC2H8 .
NNHC6HS
—> C8H8COCCOONa
Известны также примеры легкого отщепления бензоильной
группы. Например, Ауверс и Поль [19] использовали реакцию
Яппа — Клингемана для получения производного 2-бензоил-6-
метилкумарапона-3. Особенно интересно то, что в этом случае
происходит отщепление бензоильной группы, а не размыкание
цикла.
154
11. Реакция Яппа— Клингемана
Бензоильная группа отщепляется легче, чем циангруппа.
Так, из этилового эфира бензоилциануксусной кислоты обра-
зуется производное мезоксалевой кислоты [20, 21].
NNHC6H6
C6H5N? 11
С6Н5СОСНСООС2Н5 - - N=C—CCOOC2HS
I
• CN
Бюлов и Хайлер применили реакцию Яппа — Клингемана
к этиловым эфирам нескольких диацилуксусных кислот [18].
Из этилового эфира пропионилацетоуксусной кислоты они по-
лучили фенилгидразои, который образуется при отщеплении
пропионильной группы. Продукт, полученный из этилового
эфира бензоилацетоуксусной кислоты, содержал бензоильную
группу (отщепилась ацетильная группа), а продукт, получен-
ный из этилового эфира фенацетилацетоуксусной кислоты, —
фенацетильную группу (отщепилась ацетильная группа). Был
сделан вывод, что в таких реакциях расщепления ацильная
группа, которая отвечает более слабой кислоте, отщепляется
легче (термодинамически исправленные константы диссоциации
[22] 105Ка соответствующих кислот следующие: пропионовая
кислота 1,33; уксусная кислота 1,75; фенилуксусная кислота 4,88;
бензойная кислота 6,27). При изучении реакций расщепления не-
симметрических 1,3-.дикетонов типа RCOCH2COR' Хаузер, Суо-
мер и Ринглер [23] обнаружили зависимость между относитель-
ными выходами кислот RCOOH и R'COOH и скоростями омыле-
ния их этиловых эфиров,, хотя в случае чисто алифатических
соединений эта зависимость строго не соблюдается. На
этом основании в противоположность полученным опытным дан-
ным можно было бы ожидать, что в этиловых эфирах бензоил-
ацетоуксусной и пропионилацетоуксусной кислот будут отщеп-
ляться ацетильные группы (константы скорости 104 k щелоч-
ного гидролиза этиловых эфиров этих кислот следующие [24]:
С6Н5СООС2Н5 5,50; СН3СН2СООС2Н5 35,5; СН3СООС2Н5 69,5).
При расщеплении замещенных циануксусных эфиров на вто-
рой стадии реакции Яппа — Клингемана неизменно происходят
омыление и декарбоксилирование, что приводит к образованию
фенилгидразонов а-кетонитрилов. По-видимому, случаев отщеп-
ления нитрильной группы не наблюдалось.
гы CN N—NHAr
I II
RCH —> R—C—N=N—Ar —> R—C—CN
I
COOC2H6
Возможно, отсутствие более точных данных о направлении
расщепления азодикетонов в реакции Яппа — Клингемана объ-
\соос2н5
Область применения реакции
1?5
ясняется тем, что образующиеся в этом случае арилгидразоны
обычно существуют в виде двух геометрических изомеров (на-
пример, X и XI). Поскольку часто образуются оба изомера, для
NNHCjH5
II
RCCOOCjH,
X
c6h5nhn
II
RCCOOC2H6
XI
проведения последующих реакций выгоднее использовать не-
очищенный продукт и не выделять арилгидразон в чистом виде.
Очистку можно будет осуществить на более поздней стадии.
Часто поэтому выходы арилгидразонов не приводятся.
ОБЛАСТЬ ПРИМЕНЕНИЯ РЕАКЦИИ
Для протекания реакции Яппа — Клингемана прежде всего
необходимо наличие достаточно активного атома водорода,
чтобы могло происходить сочетание с солью диазония. Обычно
в молекуле содержатся две или три электроноакцепторные
группы, например карбонильная, карбэтоксигруппа, циангруп-
па и т. д., но если имеются другие влияния, активирующие
данный атом водорода, то требуется только одна такая группа.
Типичным примером может служить реакция 9-этоксалилфлуо-
рена [25]. Особенно интересна реакция 9-нитрофлуорена [26];
при сочетании с диазотированным анилином замещаемая нитро-
группа переходит в пара-положение фенилгидразинового остат--
ка в продукте реакции.
Метиновая группа в a-положении пиридинового производно-
го также достаточно реакционноспособна, чтобы принимать
участие в процессе Яппа — Клингемана, если в соединении со-
держится еще одна активирующая группа. Например, 2-н-бути-
рилпиридин получен с хорошим выходом из 2-(2'-пиридил) пен-
тановой кислоты по реакции, приведенной ниже [15]. Эту
166
II. Реакция Яппа — Клингемана
реакцию несколько напоминают реакции 1-этоксалил-1, 2, 3, 4-
тетрагидроакридина и аналогичного циклопентенопроизвод-
ного [27].
1!^ N J—СНСН2СН2СН3
СООН
/ч NNHCeH4COOH-«
II I 11
\ J-cch2ch2ch3
н80 ?
Ws
СОСООС2Н5
В противоположность 9-нитрофлуорену, в а-нитропропионо-
вой кислоте при такой реакции нитрогруппа сохраняется. В ре-
зультате декарбоксилирования образуется фенилгидразон
CH3C(NO2)=NNHC6Hs, идентичный продукту, полученному из
нитроэтана и хлористого фенилдиазония [28].
Эта реакция проводилась со сложными эфирами различных
монозамещенных ацетоуксусных кислот. Атомы хлора и брома
могут служить в качестве третьего заместителя у углерода ме-
тиковой группы. При проведении сочетания эти атомы галои-
дов сохраняются в продуктах реакции, которые представляют
собой фенилгидразоны необычного строения, как это показы-
вает приведенное ниже уравнение [29, 30].
C6H5N^
CH3COCHCOOC2HS -> C«H6NHN=CCOOC2H5
I I
Cl Cl
Единственным исключением из того наблюдения, что атом
галоида не отщепляется в таких реакциях, является реакция
сочетания лактона 3-бромтриуксусной кислоты (XII). В резуль-
тате этой реакции образуется тот же арилгидразон XIII, кото-
рый получается и из самого лактона триуксусной кислоты [31].
Из метиленового производного лактона бис-(триуксусной) кис-
Область применения реакции
157
лоты (XIV) при реакции сочетания также образуется арил-
гидразон XIII.
XII XIII XIV
В большинстве случаев реакции проводились с алкилзаме-
щенными ацетоуксусными эфирами. Продукты, полученные из
таких эфиров, легко восстанавливаются и гидролизуются, и
этот метод синтеза а-аминокислот нашел широкое применение.
Примерами могут служить синтезы аланина [5, 32—35] и ме-
тионина [36].
Се Нс Ng* 4Н
СН3СОСНСООС2Н6 СН3ССООС2Н5 - затемню4, СН3СНСООН
сн3 nnhcbh5 nh2
4Н.
CH3SCH2CH2CHCOOC2H6 —> CH3SCH,CH2CCOOC2H5 -затем ню4,
сосн3 nnhc6h5
—> CH3SCH2CH2CHCOOH
I
NHj
Фенилгидразоны, полученные по реакции Яппа — Клинге-
мана из ацетоуксусных эфиров с простыми заместителями, ча-
сто использовались также для синтеза индолов. Путем цикли-
зации по Фишеру их можно превратить в эфиры замещенных
индол-2-карбоновых кислот. Примером может служить получе-
ние этилового эфира З-фенилиндол-2-карбоновой кислоты [37].
н+
СН3СОСНСООС2Н5 —> CeH5CH2CCOOC2Hs —
СН2С6Н5 NNHC6HS
— Л Гсоос н
\Z\N/~C25
н
Заместители в бензольное кольцо индола можно ввести,
если для сочетания использовать соль замещенного фенилди-
азония. Соли диазония, полученные из анилинов, замещенных в
положениях 2 и 4, при обычной циклизации по Фишеру могут
дать только один продукт. Из /«-замещенных анилинов можно
получить два различных индола [38], поэтому их использовали
158
И. Реакция Яппа — Клингемана
довольно редко. Продукты реакции, получаемые из 2- и 4-заме-
щенных анилинов, приведены ниже [39, 40].
. СН2СН3
o-O,NCfiH.N^ /Z\ |
СН3СОСНСООС2Н5 -- I II ссоос н —>
| . V^NHfZ 2 5
CH2CH3 ' J
Z4 CH2CH3
n-CHQOCfiH.N^ сн О_I
CH3COCHCOOC2H5 ---------c 3 I j ,.CCOOC2H5 —*
CH2CH3
Если заместитель в ацетоуксусном эфире имеет карбониль-
ную группу, связанную с первым атомом углерода, то фенил-
гидразон, получаемый в результате реакции Яппа — Клинге-
мана, легко циклизуется с образованием пиразола. Аналогич-
ное влияние оказывают ацетонильная [41] и фенацильная [42]
группы, которые могут содержать и дополнительные замести-
тели.
/°
СН3СОСН2СНСООС2Н5 —> СН3С NHC6HS —> Н3СС---NCeH5
I I I II I
СОСНз СН2 N СН N
\с^ \с^
I I
СООС2Н6 СООС2Н5
Можно применять также ацильные производные ацетоуксус-
ного эфира. Продуктами реакции в таком случае будут моно-
фенилгидразоны а, (3-дикетоэфиров. Так, этиловый эфир бензоил-
ацетоуксусной кислоты реагирует, как показано ниже [18].
О NNHCeHs
CfiH.N^ И И
CeH5COCHCOOC2H5 — --» С6Н6С—ССООС2Н5
СОСН3
Область применения реакции
159
Вероятно, 1,3-дикетоны не были широко использованы в
реакции Яппа — Клингемана потому, что они менее доступны,
чем ацетоуксусные эфиры. Были изучены реакции а-хлор- [43],
а-метил- [44] и а-этилацетилацетона [44]. В качестве продуктов
реакции получены монофенилгидразоны 1, 2-дикетонов, как это
NNHCeH5
II
СН3СОСНСОСН3 --> СН3СОССН3
I
сн3
показано для метильного производного. Такие же продукты
можно получить из замещенных g-кетоэфиров при условии, что
эфирная группа до сочетания будет подвергнута омылению
(стр. 148). Такие монофенилгидразоны получены из несколь-
ких замещенных ацетоуксусных эфиров.
Если реакцию Яппа — Клингемана проводить с цикличе-
ским p-кетоэфиром, то на второй стадии процесса происходит
размыкание кольца. Примером может служить реакция этило-
вого эфира циклогексанон-2-карбоновой кислоты [11, 45]. Про-
изводные циклопентанона претерпевают аналогичное размыка-
NNHC6H5
C6H5N? 11
- -» НООССН2СН2СН2СН2ССООН
ние кольца. Продукты реакции, полученные из производных
циклогексанона и циклопентанона, применялись для синтеза
аминокислот и индолов. Может происходить также размыкание
лактонного кольца, как в ацетобутиролактоне, из которого был
получен фенилгидразои кетобутиролактона [46]. Этот продукт
СН2—СНСОСНз СН2—C=NNHC6HS
сн2 со
сн2 со
также нашел применение для синтеза аминокислот [47, 48]. С
другой стороны, размыкаться может и лактамное кольцо, как
в случае изящного синтеза триптамина и серотонина (5-окси-
триптамина). Этот синтез основан на реакции сочетания с
солью а-карбокси-а-валеролактона и циклизации по Фишеру
полученных соединений [49].
Так же, как и в случае ациклических (3-кетоэфиров, при
реакции- будет происходить декарбоксилирование, если до со-
четания эфир омылить. Так, из этилового эфира циклогекса-
160
11. Реакция Яппа — Клингемана
нон-2-карбоновой кислоты образуется монофенилгидразон цию
логександиона-1,2 [11].
/\=О C6HSN? >
l^y-COOH "* l4/j=NNHCeHs
Из таких соединений можно получать производные со-аль-
дегидокислот. о-Нитрофенилгидразон, полученный из циклопен-
танон-2-карбоновой кислоты, при стоянии в течение 5 суток в
водно-спиртовом растворе едкого кали превращается в о-нитро-
фенилгидразон 8-формилмасляной кислоты с выходом около
35% [И].
:-i=NNHCeH4NO2-o
\/=О
—> HOOCCH2CH2CH2CH=NNHCeH4NO2-0
Монозамещенные циануксусные эфиры легко вступают в
реакцию сочетания. При гидролизе продукты реакции декар-
боксилируются и образуются гидразоны а-кетонитрилов. Из за-
мещенных малоновых эфиров получают фенилгидразоны а-кето-
кислот, идентичные тем, которые образуются из замещенных
аналогичным образом ацетоуксусных эфиров.
К солям диазония, применяемым в таких реакциях, отно-
сятся соли, получаемые из анилина, анилинов с простыми за-
местителями, полизамещенных анилинов, бензидина, замещен-
ных бензидинов и даже из антипирина. При сочетании соли
диазония, полученной из антипирина, с З-метилпентандионом-2,4
[50] получен гидразон, указанный в приведенном ниже урав-
нении.
H5C6N—СО
I ^CNjf СГ + СН3СОСНСОСН3 + н2о —>
H3CN—С сн3
сн3
HSC6N—СО
—> | ^>CNHN=CCOCH3 + НС1 + CH3COOH
H»CN-C сн3
сна
Можно ожидать, что соли диазония, в которых электроно-
акцепторные группы находятся в орто- или пара-положениях,
усиливая положительный характер катиона диазония, в реак-
ции сочетания будут наиболее активны. При сочетании с 2-пи-
ридилуксусной кислотой наилучшие результаты получены в
Экспериментальные условия
161
случае диазотированной п-аминобензойной кислоты. В резуль-
тате реакций диазотированных n-нитроанилина и сульфанило-
вой кислоты получены лучшие выходы и более высокая степень
чистоты продуктов, чем в случае диазотированного анилина
[15]. Известно мало работ, в которых проводилась реакция
Яппа — Клингемана с каким-либо одним активным метиновым
соединением и различными солями диазония в одинаковых
условиях, но все же, по-видимому, замещенные анилины дают
более высокие выходы, чем анилин. Возможно, что при таких
заместителях, как нитрогруппа и карбоксильная группа, обра-
зуются менее растворимые продукты реакции с более высо-
кой .температурой плавления, что обеспечивает более легкое
выделение конечного продукта и большую степень протекания
реакции.
Если ариламиновая часть продукта реакции Яппа — Клин-
-гемана должна быть удалена, как, например, при восстано-
влении до а-аминокислоты (стр. 157), то соль диазония следует
выбирать с учетом не только возможного выхода в реакции
сочетания, но и характера второго продукта последующей реак-
ции. Например, в результате сочетания диазотированной амино-
бензойной кислоты, проводимого с целью получения а-амино-
кислоты, образуется продукт, который трудно отделить от
аминобензойной кислоты, что ликвидирует любое преимуще-
ство, которое может быть получено при реакции сочетания.
При получении арилгидразонов, предназначаемых для син-
теза индолов и пиразолов, выбор соли диазония зависит от
того, какие заместители хотят иметь в конечном продукте.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
В большинстве случаев реакции проводились в водной сре-
де при температуре около 0°. Для увеличения растворимости
иногда добавляли спирт [51]. Сочетание 1-этоксалил-1, 2, 3, 4-
тетрагидроакридина (стр. 156) проводилось в пиридине, разба-
вленном водой, в которой была получена соль диазония [27].
При проведении реакций, в результате которых должна была
отщепляться ацильная группа, в водные растворы обычно в ка-
честве буфера добавляли уксуснокислый натрий [20, 52]. Однако
применялись и более сильные основания. При превращении
этилового эфира циклопентанон-2-карбоьовой кислоты в фенил-
гидразон моноэтилового эфира 2-кетоадипиновой кислоты
Манске и Робинсон [53] применяли едкое кали. Для получения
аналогичного продукта из диазотированной .«-аминобензойной
кислоты Кёльш [38] проводил реакцию сочетания в кислом
растворе. Полученное таким путем азосоединение он обрабаты-
вал в течение 2 мин 7%-ным водным раствором соды и получал
162
II. Реакция Яппа — Клингемана
в результате замещенный гидразон. Было найдено, что другие
реакции сочетания также протекают как в кислой, так и в ще-
лочной среде [8, 44, 54], причем в качестве основания приме-
няли даже этилат натрия [55].
Для отщепления ацильной группы от p-кетоэфира щелоч-
ной раствор эфира следует обрабатывать солью диазония не-
медленно [56]. Если такие щелочные растворы до обработки
солью диазония оставить в течение суток при 0°, то отщеп-
ляется эфирная группа и в качестве продукта реакции обра-
зуется производное 1,2-дикетона [11, 57, 58].
Время, необходимое для завершения реакции Яппа — Клин-
гемана, изменяется в зависимости от активности метиновой
группы от нескольких секунд до 4 суток [15]. При проведении
реакции в водной среде продукты реакции часто выпадают из
раствора и смесь можно перемешивать до тех пор, пока не
будет наблюдаться дальнейших изменений. Азосоединения, ко-
торые иногда могут быть промежуточными соединениями
(стр. 151), имеют более глубокую окраску (обычно красную),
чем арилгидразоны. Таким образом, по изменению окраски
иногда можно следить за протеканием реакции.
Большинство реакций проводилось с эквивалентными коли-
чествами метанового соединения и соли диазония. При из-
бытке соли диазония могут наблюдаться потери часта про-
дукта реакции в результате превращения его в формазил, как
это показано в приведенном ниже уравнении [34, 59]. По-види-
CH„COC=NNHC_H_ + CKHKN+C1~ —>
3 । Ъ О о & *
сн3
—> C6H6N=NC=NNHC6H5 + СНзСООН + НС1
I
СНз
мому, это единственная важная побочная реакция в процессе
Яппа — Клингемана, если не считать указанного выше расщеп-
ления кетоэфиров. Кроме того, при использовании избытка
соли диазония происходит образование окрашенных примесей
и смолистых веществ в результате ее разложения при возмож-
ном нагревании реакционной смеси.
Обычно продукты реакции Яппа — Клингемана перекри-
сталлизовывают из спирта или бензола; в некоторых случаях
применялась 80%-ная уксусная кислота [60].
ПРЕПАРАТИВНЫЕ СИНТЕЗЫ
о-Нитрофенилгидразон этилового эфира пировиноградной
кислоты [39]. К охлажденному льдом раствору 20,5 г (0,14 мо-
Препаративные синтезы
163
ля) этилового эфира 2-метилацетоуксусной кислоты в 150 мл
спирта приливают 51 мл 50 %-кого водного раствора едкого
кали. Затем смесь разбавляют 300 мл ледяной воды и быстро
приливают к ней при перемешивании холодный раствор соли
диазония, полученный из 20,0 г (0,14 моля) о-нитроанилина,
60 мл концентрированной соляной кислоты, 90 мл воды и
10,5 г нитрита натрия. Перемешивание продолжают в течение
5 мин, затем выделившийся о-нитрофенилгидразон этилового
эфира пировиноградной кислоты отфильтровывают. После пере-
кристаллизации из спирта гидразон плавится при 106°; выход
30,0 г (83%).
Монофенилгидразон циклогександиона-1,2 [58]. К охла-
жденному льдом раствору 36,0 г (0,21 моля) этилового эфира
циклогексанон-2-карбоновой кислоты в 40 мл спирта прили-
вают охлажденный льдом раствор 12,0 г едкого кали в 60 мл
воды. Реакционную смесь выдерживают при 0° в течение су-
ток, после чего разбавляют 1 л ледяной воды. Раствор хлори-
стого фенилдиазония получают из 18,6 г (0,2 моля) анилина,
50 мл концентрированной соляной кислоты в 100 мл воды и
13,8 г нитрита натрия. Затем холодный раствор соли диазония
при энергичном перемешивании и охлаждении льдом прили-
вают к первому раствору, после чего сразу же добавляют
30,0 г уксуснокислого натрия. При этом выделяется дву-
окись углерода; реакционную смесь выдерживают при 0° до тех
пор, пока не прекратится выделение газа. Выпавший в осадок
монофенилгидразон циклогександиона-1,2 отфильтровывают и
перекристаллизовывают из спирта; т. пл- 185—186°, выход почти
количественный.
ТАБЛИЦЫ ПО РЕАКЦИИ ЯППА—КЛИНГЕМАНА
В таблицах приведены многие примеры реакций Яппа—
Клингемана, продукты которых использовались для дальней-
шего синтеза, так что выходы не указаны. Использованы лите-
ратурные данные, опубликованные до 1 января 1956 г. Посколь-
ку найти в литературе случаи применения этой реакции, осо-
бенно когда продукты представляли интерес лишь как промежу-
точные соединения для последующих реакций, было довольно
трудно, в таблицу включены, очевидно, не все описанные реак-
ции Яппа — Клингемана. Для удобства реакции, при которых
происходит отщепление ацильной группы, помещены отдельно
(раздел А) от реакций, сопровождающихся декарбоксилирова-
нием (раздел Б). В связи с этим некоторые соединения при-
водятся в обоих разделах.
П*
164
II Реакция Яппа — Клингемана
Раздел А
I. Производные нитропропионовой, формилпропионовой и
галоидзамещенных ацетоуксусных кислот.
II. Монозамещенные ацетоуксусные эфиры.
III. Ацил ацетоуксусные эфиры.
IV. Ацилциануксусные эфиры.
V. Циклические соединения.
VI. 1,3-Дикарбонильные соединения.
VII. Другие соединения.
Раздел Б
VIII. Производные ацетоуксусной кислоты.
IX. Производные циануксусной кислоты,
X. Производные малоновой кислоты.
XI. Другие реакции.
А. Реакции, в которых отщепляется ацильная группа
Таблица 1
ПРОИЗВОДНЫЕ ФОРМИЛПРОПИОНОВОЙ И ГАЛОИДЗАМЕЩЕННЫХ
АЦЕТОУКСУСНЫХ КИСЛОТ
(отщепляющаяся группа набрана курсивом)
Вещество Заместитель в у—или [другой ион диазоиия] Выход, % Литера- тура Продукт превра- щения
СН3СНСООС2Н5 — — 16 —
сно
С773СОСНСООСН3 — 30 —
С1 — — 61 —
2-СН3 — 30 —
4-СН3 30 —
С/73СОСНСООС2Н5 — •— 29, 30 —
С1 1 — 61 —
2-СН3 — 29, 30 —
4-СН' — 29, 30 —
4-Вг 1 — 62 —
[Некоторые произвол- — 30 —
ные бензидина]
C7/3COCHCONHC6H3 4-СН3 80 63 —
Cl 3-СН3, 4-СН3 — 63 —
3-СН8, 5-СН3 — 63 —
[“-c10h7n+] — 63 —
[₽-c10h7n2+] — 63 —
С7/3СОСНСООС10Н1В2,3 — — 64 —-
Вг 4-Br — 64 —
4-CHs — 64 —
1 Эти реагирующие вещества вступали в реакцию сочетания также с этиловым эфиром
а-бромацетоуксусной кислоты [62].
2 (—)-Меитиловый эфир.
8 Некоторые реакции этилового сложного эфира приведены в колонке этилового эфира
а-хлорацетоуксусной кислоты.
165
Таблица II
МОНОЗАМЕШЕННЫЕ АЦЕТОУКСУСНЫЕ ЭФИРЫ В РЕАКЦИИ
СН3СОСНСООС2Н5 + ArN2+X~ ->
R
R NNHAr
1 CH3COCCOOC2HS но' 11 СН3СООН 4- RCCOOC2H5
Заместитель R в СН»СОСНСООС2Н5 R Заместитель в или [другой ион диазония] Выход, % Лите- ратура Продукт превра- щения
сн3 — 38 5,32—35 Амиио-
кислота
2-СН3 — 1, 5 «—
4-СН3 — 1, 5 —
2-NO2 83 39 Индол
3-NO2 — 12 —
84 65 —
4-NO2 78 . 65 «—
4-Вг — 40 Индол
4-ОСН3 — 40 »
2-ОС2Н5 — 40 »
4-ОС2Н5 — 40 »
4-СООС2Н5 — 40 »
- 3-ОСН3> 4-ОСН3 73 51 »
[a-C10H7N+] — 40 . »
[₽-c10h7n2+] — 40 »
С2Н5 — — 1, 5 —
2-NO2 90 39 Индол
3-NO2 — 12 —
4-Br — 40 —
4-OCH3 — 40 Индол
4-OC2H5 — 40 »
4-COOC2H5 — 40 »
3-OCH3, 4-OCH3 70 51 »
[a-C10H7N2+] — 40 »
[₽-CwH7N2+j — 40 »
CH3SCH2CH2 — 73 36, 119 Амино-
кислота
(С2Н5)2 nch2ch2 — 76 66 Индол
166
Продолжение табл. 11
Заместитель R в СН,СОСНСООСзН5 R Заместитель в ^2^ или [другой ион диазония] Выход, % Лите- ратура Продукт превра- щения
—
H-C3H7 — 35 67 Амино- кислота
4-СН3 43 67 »
2-NO2 97 39 Индол
ызо-С3Н7 — 55 68 Амино- кислота
СН3СОСН2 — ’— 41 Пиразол
4-NOJ — 69 »
С2Н6ООССН2СН2 — 74 115 —
2-CH3 88 115 —
з-сн3 34 115 —
2-С1 60 115 —
3-С1 72 115 —
4-С1 81 115 —-
2-СООН 90 115 —
4-SO3H 95 115 —
4-NO2 87 115 —
(a-C|0H7N2) 47 115 —
(₽-C10H7N2) 33 115 —
ncch2ch2 — 98 114, 115 Индол
4-NO2 . 98 115 —
С2Н6ООССН2СН2 — — 70, 71 Индол
2-C1 — 54 —
3-C1 — 54 —
4-C1 — 54 •—
2-CH3 — 113 Амино- кислота
2-OCH3 — 54 Индол
3-OCH3 54 »
4-OCH3 — 54 »
С6Н6ОСН2СН2СН2 — 15 72
С2Н3ООССНСН2СН2 nhcooc2h6 —‘ Хороший 73 »
н-С4Н6 — 65 74 Амино- кислота
2-NO2 — 39 Индол
4-Br — 40 »
167
Продолжение табл. II
Заместитель R в Заместитель в Продукт превра- щения
сн,соснсоосан, 1 R или [другой ион диазония] Выход, % Лите* ратура
н-С4Н2 4-ОСН3 — 40 Индол
2-ОС2Н6 — 40 »
4-ОС2Н5 — 40 »
4-СООС2Н5 — 40
[a-C10H7N2+] — 40 »
(СН3)2 СНСН2 — 72 32,33,75 Амино-
кислота
СН3СН2СН (СН3) — 63 32,33,75 »
СН3СОСН (СООС2НВ) •— Количе- ственный 76—78 Пиразол
4-СН3 » 79 »
4-CH3CONH2 — 80 »
4-(n-H2NC6H4)2 — 80 »
4-(«-CH3CONHC6H4)2 — 80
[P-c10h7n+] — 79
с6н6сн2 — 68 32,33,81 Амино-
кислота
— Количе- 82 Азоформ-
ственный альдок-
сим
2-NO2 90 39 Индол
4-Br — 40 »
4-OCH3 — 40 »
2-OC2H5 — 40 »
4-OC2H5 — 40 »
4-COOCjHj — 40 »
3-OCH3, 4-OCH3 70 51 »
[a-C10H7N2+] — 40 »
[₽-cI0h7n+] — 40 »
4-СН3ОСвН4СН2 — 75 83 Амино-
кислота
ОО-0”1 70 84 Индол
168
Продолжение табл. II
Заместитель R в СНаСОСНСООС,Н5 1 R Заместитель в ил" [другой ион диазония] Выход, • % «Лите- ратура Продукт превра- щения
Вг
^\/усн2 — 50 84 Индол
с6н5сосн2 —- — 42 Пиразол
2-СН3 — 41 »
4-СН3 — 41 »
С6Н5СОСН (С6Н6) — — 41 >
1 Выделено азосоединение; после стояния и обработки раствором щелочи в воде с после-
дующим подкислением от него отщепляется ацетильная группа и происходит циклизация
в пиразол.
2 Может быть выделено азосоединение.
Таблица III
АЦИЛАЦЕТОУКСУСНЫЕ ЭФИРЫ В РЕАКЦИИ
RCOCHCOOC2H5 4- ArNj'X" ->
СОСН3
СООС2Н5"
I
RCOCN=NAr
I
СОСНз
NNHAr
но 1
RCOCCOOC2H5 + СН3СООН (а)
- или NNHAr
II
____> СН3СОССООС2Н,+ RCOOH (б)
R в RCOCHCOOCjH- СОСН3 Заместитель в ^==^—N^* или [другой иои диазония] Выход, % Лите- ратура Продукт превра- щения
сн3 — — 18 —
сн3сн21 — — 18 —
С2Н5О2 2-СООН — 18 -—
С2Н5ОСО 2 — — 85 ——
С6НБ2 — — 18 —
2-СН3 —. 18 —
4-NO2 — 18 —
2-СООН — 18 —
2? 0 А у сч — 18 —
3-O2NC6H4 2 — — 18 —
4-O2NC6H4 2 — — 18 —
С6Н5СН2СО2 2-СООН — 18 —
1 Направление реакции б.
3 Направление реакции а.
169
Таблица IV
АЦИЛЦИАНУКСУСНЫЕ ЭФИРЫ В РЕАКЦИИ
RCOCfcICOOC2H5 + ArN2 Х~ ->
CN
сбос2н5
СООС2Н5
RCOC—N=N—Аг
RCOOH + C = NNHC6HS
CN
CN
R в эфире Заместитель в или [другой ион диазония] Выход, К Литера- тура Продукт превра- щения
СНз — — 20, 21 —
[ + N2—\ —\ N? ] — 20 —
СН3СН2 — — 20, 21 —
(СН3)2 СН — — 20, 21 —
[+ N2—С” N2+1 — 20 —
(СН3)2 снсн2 — 20, 21 —
Свн5 — — 20, 21 —
Таблица V
ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В РЕАКЦИЯХ РАЗМЫКАНИЯ ЦИКЛА
Циклическое соединение2 Заместитель в или [другой нон диазония] Выход, % Литера- тура Продукт превра- щения
о
A 4-NO2 Хоро- 86 —
НдС Х-- /X ший3
' ХООС2115
о
О
?СООС2Н5 — 96 11,53,55, Индол
87, 116
2-NO2 — 11 »
4-NO2 — 11, 14 »
з-соон 70 38 »
170
Продолжение табл. V
Циклическое соединение2 Заместитель в ^2^—NrJ* или [другой нон диазония] Выход, % Литера- тура продукт превра- щения
4-1 65 14 Индол
4-ОСНз 71 88 »
3-1, 4-1, 5-1 95 14 —
3-1, 4-ОСНз, 5-1 88 14 —
[a-CwH7N2+] 94 55 Индол
О
— — 89 —
О
— — 90 —
1 4
О
— — 45 Амино-
кислота
97 117, 120 Индол
4 87 И, 56 —
2-NO2 — 39 Индол
4-NO2 — 11 —
3-ОСНз, 4-ОСНз 90 51 Индол
сн3
ен^р^сс
1 н.чсссн..-|- 1 л. т j | — 89 91, 118 —
CI% 1 ^снсоос2нь
1 См. стр. 159.
2 Связь, которая разрывается при размыкании цикла, указана точками.
* Описанный продукт реакции представляет собой
CHS СН3
O2NC6H4N=N-(!—СО—^НСООС2Н8
io он
4 Метиловый эфир циклогексанои-2-карбоновой кислоты также вступает в реакцию соче-
тания.
171
Таблица VI
1, 3-ДИКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
(Группа, которая отщепляется, набрана курсивом)
Карбонильное соединение Заместитель в 71 N + или X. ’ 2 •* ЛИ (другой иои диазоиия| Выход» % Ли- тера- тура Про- дукт пре- вра- щения
СЛ/3СОСНСОСН3 — — 43 —
1 69 92 —
Cl
СН3СОСНСОСООС2Я6 — — 93 —
Cl
сн3сосНсос//3 1 — — 44 —
сн3 2-СН3 — 44 •—-
4-СН3 — 44 —
4-NO2 — 13 —
[+N2-C>-\Z/-N2+] — 44 —
+ м / \ // NX N + IN2 \ \„_/ 2 | | — 44 —
ч сн3 сн3 _
H5C6N— CCk — 50 —
1 z/CN2+
H3CN 07 |
сн3
СН3СОСНСОС/73 — — 44 —
1 2-CH3 44 —
СН2СН3
4-СНз — 44 —
4-NO2 — 13 —
4-С1 — 13 —
4-Br — 13 —
[ + N2-^Q-\Z/~N2 ] — 44
СН3СОСНСОС//3 — 90 115 —
1 (в виде
СН2СН2СООС2Н5 кислоты)
2-CH3 72 115 —
(в виде
кислоты)
172
Продолжение табл. VI
Карбонильное соединение Заместитель в или [другой ион диазония} Выход, % Литера- тура Продукт превра- щения
С6Н6СОСНС/7О С6Н5 СИз з-сн8 4-СНз 4-NO2 4-Вг 4-NO2 85 (в виде кислоты) 81 (в виде кислоты) 85 (в виде кислоты) 115 115 115 94, 95 9 8 1 1 1 III
П—Q ч :сн^ У ZHCHO :о — — 96 —
CHc°,Z J\/°\ 1 сисосн3 - — 19 —•
II о
СН3О— Y chcoc6hs — — 19 —
о
Н8С-У уО ¥hcoc67/s — — 19 —
¥ о
173
Таблица VII
ДРУГИЕ СОЕДИНЕНИЯ
Исходное вещество Заместитель в N^* \=Z 2 Выход, % Лите- ратура • Продукт превра- щения
ОСС 1 СОСООС2Н& 1 4-OCHs 1 2 4-Br 1 — 27 27 27 —
A А VW no2 2 — 26 —
3 — 97 —
4-NO2 3 — 25 —
COCH 90—96 46—48 Амино- кислота
- . uvCiiis \o/=o
j j- СОСНз C1CH2— — 83 98, 99 »
,CH2—co oz \co—CHCHS — — 100 —
‘ Реакция проводилась в пиридине.
2 Отщепляющаяся из положения 9 флуорена нитрогруппа, по-видимому, атакует продукт
реакции сочетания, так как был выделен л-нитрофенилгидразон флуоренона.
8 Отщепляется этоксалильная группа.
174
Б. Реакции, сопровождаемые декарбоксилированием
Таблица _VIII
ПРОИЗВОДНЫЕ АЦЕТОУКСУСНОЙ КИСЛОТЫ
R в RCHCOOH СОСН, Заместитель в ы + \=/ 2 Выход, % Литера- тура Продукт превра- щения
СНз — Количе- ственный 4, 5, 34 —*
С2Н5 — — 4, 5 —
кооссн2сн2 — 80 101 —
— 86 37 Индол
3-NO2 80 37 .—.
2-OCH3, 5-OCH3 80 37
3-OCH3, 4-OCH3 Количе- ственный 51 —
С6Н5СОСН2 о II — — 41 Пиразол
/с\ — 86 37 Индол
с6н; nch2ch2ch2 3-OCH3 85 37 »
11 0 3-С1 — 37 —
Таблица IX
ПРОИЗВОДНЫЕ ЦИАНУКСУСНОЙ кислоты
R в RCHCOOH AsN Заместитель в \_/ 2 Выход» % Литература Продукт превра- щения
СН3 — -— 102, 103 ‘ —
2-СНз 25 102, 103 —
4-СНз 28 102, 103 —
С2н6 — 31 102, 103 —
2-СНз 25 102, 103 —
4-СНз 15 102—104 —
4-С1 Количе- ственный 104 —
свн5 — — 104 —
с6н5сн2 — 30 60, 105 Амино- кислота
— Количе- ственный 104 —
4-СНз . 25 104 ' —
4-NO2 — 104 —
175
Таблица X
ПРОИЗВОДНЫЕ МАЛОНОВОЙ кислоты
рснссоонь Заместитель в O~N2+ Выход, % Литература Продукт превращения
CI — — 61
2-СООСН, — 61 —
СН, — — 106, 107 —
4-СН, — 106, 107 —
с,н5 — — 106, 107 —
2-СН, — 106, 107 —
НООССН2СН2 — 49 115 —
C6HSCH2 — — 60, 105 Амино-
кислота
— — 82 Азоформ- альдбксим
Таблица XI
ДРУГИЕ РЕАКЦИИ
Исходное вещество Заместитель в или [другой иои диазония] Выход, % Литера- тура Продукт превра- щения
СНзСНСООН 1 — — 28 —
1 no2
сн2 — Количе- ственный И, 58, 108 Индол
сн2 со 2-NO2 —- 11 —
1 1 4-NO2 11 —
сн2—снсоон сн2
Сн2\о 2-NO21 — 11 —
1 1 4-NO21 — 11 —
сн2—CHCONHC6H5
сн2 — Количе- ственный И, 58 Индол
сн2 со 4-СН, » 58 »
1 1 сн2 снсоон 4-NO2 11 »
58
\ / [a-C10H7N2+] — »
СН, [₽-C10H7N2+j Количе- ственный 58 »
176
Продолжение табл. XI
Исходное вещество • Заместитель в или [другой иои диазония] Выход, % Литера- тура Продукт превра- щения
СН 3
снГ 420 — — 109 —
1 нзс< :сн3
сн2 снсоон
4 :н
Z N СО 2 1 4-СООС2Н5 89 НО —
j снсн3 \со/
4-СООН 94 15 —
СНСН2СН2СН33 1
гоон
сн2 1 —CHCN । — 88 111 —
СН со \о^
СНз—СНСООН 1 1 сн2 со \о/ —. 83 47 Амино- кислота
—о Количе- 112
II
ственный
^As/ —соон
1 Выделено также азосоединение.
2 Продукт реакции a-C,,H4NNHCOCH (CHa)=NNHC6H4COOC!Hi-(«)-
Продукт реакции 2-н-бутирилпиридин
12 Зак. 794
177
178
//. Реакция Яппа — Клингемана
ЛИТЕРАТУРА
1. Japp, Klingemann, Вег., 20, 2942 (1887).
2. Japp, Klingemann, Вег., 20, 3284 (1887).
3. Japp, Klingemann, Вег., 20, 3398 (1887).
4. Japp, Klingemann, Ber., 21, 549 (1888).
5. Japp. Klingemann, Ann., 247, 190 (1888); J. Chem. Soc.,53,519 (1888).
6. Ту ст ер, Органические реакции, сб. 7, Издатинлит, 1956, гл. 6.
7. Dimroth, Hartmann, Ber., 41, 4012 (1908).
8. Dimroth, Ber., 40, 2404 (1907).
9. Dimroth, Hartmann, Ber., 40, 4460 (1907).
10. Dimroth, Leichtlin, Friedemann, Ber., 50, 1534 (1917).
11. L instead, Wang, J. Chem. Soc., 1937, 807.
12. Fa vrel, Bull. soc. chim. France, [4] 47, 1290 (1930).
13. Fa vrel, Compt. rend., 189, 335 (1927).
14. Kalb, Schweitzer, Zellner, Berthold, Ber., 59, 1860 (1926).
15. Frank, Phillips, J. Am. Chem. Soc., 71, 2804 (1949).
16. Michael, Ber., 38, 2096 (1905).
17. Coffey, Rec. trav. chim., 42, 528 (1923); Sen, Ghosh, J. Indian Chem.
Soc., 4, 477 (1927).
18. Bulow, Hailer, Ber., 35, 915 (1902).
19. Auwers, Pohl, Ann., 405, 243 (1914).
20. Fa vrel, Bull. soc. chim. France, [3] 27, 200 (1902).
21. Fa vrel, Compt. rend., 131, 190 (1900).
22. И н г о л ь д, Механизм реакций и строение органических соединений,
Издатинлит, 1959, стр. 590, 591.
23. Hauser, Swam er, Ringler, J. Am. Chem. Soc., 70, 4023 (1948).
24. Hammett, Physical Organic Chemistry, McGraw-Hill Book Co., New
York, 1940, p. 121.
25. Kuhn, Levy, Ber., 61, 2240 (1928).
26. P о n z i o, Gazz. chim. ital., 42, II, 55 (1912).
27. В о r s c h e, M a n t e u f f e 1, Ann., 534, 56 (1938).
28. S t e i n k о p f, S u p a n, Ber., 43, 3239 (1910).
29. F a v r e 1, Compt. rend., 134, 1312 (1902).
30. Fa vrel, Bull. soc. chim. France, [3] 31, 150 (1904).
31. Wiley, Jarboe, J. Am. Chem. Soc., 78, 624 (1956).
32. Феофилактов, ДАН СССР, 24, 755 (1939).
33. Феофилактов и др., Изв. АН СССР, ОХН, 1940, 259.
34. Bamberger, Вег., 25, 3547 (1892).
35. Феофилактов, Зайцева, ЖОХ, 10, 258 (1940).
36. Феофилактов, Иванова, ЖОХ, 21, 1684 (1951).
37. Manske, Perkin, Robinson, J. Chem. Soc., 1927, 1.
38. Koelsch, J. Org. Chem., 8, 295 (1943).
39. Hughes, Lions, Ritchie, J. Proc. Roy. Soc. N. S. Wales, 72, 209
(1938) [C. A., 33, 6837 (1939)].
40. Hughes et al., J. Proc. Roy. Soc. N. S. Wales, 71, 475 (1937) [C. A.,
33, 587 (1939)], ’
Литература
179
41. Bischler, Ber., 26, 1881 (1893).
42. Bischler, Ber., 25, 3143 (1892).
43. Dieckmann, Platz, Ber., 38, 2986 (1905).
44. Fa vrel, Bull. soc. chim. France, [3] 27, 336 (1902); Compt rend., 132,
41 (1901).
45. Феофилактов, Иванов, ЖОХ, 13, 457 (1943).
46. Harradence, Lions, J. Proc. Roy. Soc. N. S. Wales, 72, 221 (1938)
[C. A., 33, 6838 (1939)1.
47. Феофилактов, Онищенко, ЖОХ, fl, 314 (1939).
48. Snyder, Andree n, Cannon, Peters, J. Am. Chem. Soc., 64,
2082 (1942).
49. Abramovitch, Shapiro, Chem. a. Ind., 1955, 1255.
50. Morgan, Reilly, J. Chem. Soc., 103, 808 (1913).
51. Lions, Spruson, J. Proc. Roy. Soc. N. S. Wales, 66, 171 (1932)
[C. A., 27, 291 (1933)].
52. Fa vrel, Chrz, Bull. soc. chim. France, [41 37, 1238 (1925).
53. Manske, Robinson, J. Chem. Soc., 1927, 240.
54. Findlay, Dougherty, J. Org. Chem., 13, 560 (1948).
55. Феофилактов, ЖОХ, 17, 993 (1947).
56. Jackson, Manske, J. Am. Chem. Soc., 52, 5029 (1930).
57. Manske, Can. J. Research, 4, 591 (1931).
58. Lions, J. Proc. Roy. Soc. N. S. Wales, 66, 516 (1932) [C. A., 27, 2954
(1933)).
59. Walker, J. Chem. Soc., 123, 2775 (1923).
60. Феофилактов, Виноградова, ДАН СССР, 24, 759 (1939),
61. Fusco, Romani, Gazz. chim. ital., 76, 419 (1946); 78, 342 (1948).
62. Bowack, Lap worth, J. Chem. Soc., 87, 1854 (1905).
63. Billow, King, Ann., 439, 211 (1924).
64. Lap worth, J. Chem. Soc., 83, 1114 (1903).
65. Ry don, Sid dap pa, J. Chem. Soc., 1951, 2462.
66. Hegedus, Helv. Chim., Acta, 29, 1499 (1946).
67. Феофилактов, Зайцева, ЖОХ, 13, 358 (1943).
68. Феофилактов, Зайцева, ЖОХ, 10, 1391 (1940).
69. Eastman, Detert, J. Am. Chem. Soc., 70, 962 (1948).
70. Tanaka, J. Pharm. Soc., Japan, 60, 74 (1940) [C. A., 34, 3735 (1940)].
71. King, L’Ecuyer, J. Chem. Soc., 1934, 1901»
72. Manske, Can. J. Research, 4, 591 (1931).
73. Plieninger, Ber., 83, 268 (1950).
74. Феофилактов, Бланк о, ЖОХ, 11, 859 (1941).
75. Феофилактов, ЖОХ, 10, 247 (1940).
76. Biilow, Schlesinger, Ber., 32, 2880 (1899).
77. Bulow, Ber., 33, 3266 (1900).
78. Stolz, Ber., 33, 262 (1900).
79. Biilow, Schlesinger, Ber., 33, 3362 (1900).
80. Bulow, Baur, Ber., 58, 1926 (1925).
81. Феофилактов, Виноградова, ЖОХ, 10, 255 (1940).
12*
180
//. Реакция Яппа — Клингемана
82. Walker, J. Chem. Soc., 127, 1860 (1925).
83. Ф е о ф и л а к т о в, Зайцева, Сироткина, ЖОХ, 13, 362 (1943),
84. Sempronj, Gazz. chim. ital., 68, 263 (1938).
85. Rabischong, Bull. soc. chim France, [3] 31, 91 (1904).
86. Schroeter, Ber., 49, 2697 (1916).
87. Kalb, Schweitzer, Schimpf, Ber., 59, 1858 (1926).
88. Barrett, Perkin, Robinson, J. Chem. Soc., 1929, 2942
89. Феофилактов, Изв. АН СССР, ОХН, 1941, 521.
90. Wieland, Garbsch, Chavan, Ann., 461, 295 (1928).
91. Феофилактов, ЖОХ, 21, 362 (1951).
92. Neber, Worner, Ann., 526, 173 (1936).
93. Favrel, Chrz, Bull soc. chim France, [4] 41, 1603 (1927).
94. Wislicenus, Ru thing, Ann., 379, 229 (1911).
95. Roy, Sen, J. Indian Chem. Soc., 10, 347 (1933).
96. Bishop, Claisen, Sinclair, Ann., 281, 314 (1894).
97. Wislicenus, Denseh, Ber., 35, 759 (1902).
98. Ф e о ф и л а к то в, Онищенко, ДАН СССР, 20, 133 (1938),
99. Феофилактов, Онищенко, ЖОХ, 9, 331 (1939).
100. Wolff, Ann., 312, 119 (1900).
101. Cl emo, Welch, J. Chem. Soc., 1928, 2621.
102. Favrel, Compt. rend., 132, 983 (1901).
103. Favrel, Bull. soc. chim. France, [3] 27, 193 (1902).
104. Walker, J. Chem. Soc., 125, 1622 (1924).
105. Ф e о ф и л а к т о в, Виноградова, ДАН СССР, 24, 759 (1939);
ЖОХ, 10, 260 (1940).
106. Favrel, Compt. rend., 132, 1336 (1901).
107. Favrel, Bull. soc. chim. France, [3] 27, 324 (1902).
108. Dieckmann, Ann., 317, 27 (1901).
109. Betti, Ber., 32, 1995 (1899).
110. Snyder, Robinson, J. Am. Chem. Soc., 74, 4910 (1952).
111. Феофилактов, Онищенко, ЖОХ, 9, 325 (1939).
112. Friedlander, Monatsh., 30, 347 (1909).
113. Феофилактов, Семенова, Синтезы органических соединений,
Изд-во АН СССР, 1952, сб. 2, стр. 74.
114. Феофилактов, Семенова, Синтезы органических соединений,
Изд-во АН СССР, 1952, сб. 2, стр. 63.
115. Феофилактов, Семенова, ЖОХ, 23, 450 (1953).
116. Феофилактов, Синтезы органических соединений, Изд-во АН СССР,
1952, сб. 2, стр. 103.
117. Polaczkowa, Porowska, Przemsyl Chem., 6, 340 (1940) [С. A., 46,
3039 (1952)1.
118. Феофилактов, ЖОХ, 21, 399 (1951).
119. Феофилактов, Иванова, ЖОХ, 21, 1851 (1951).
120. Феофилактов, Семенова, Синтезы органических соединений.
Изд-во АН СССР, 1952, сб, 2, стр, 98.
Ill
РЕАКЦИЯ МИХАЭЛЯ
Э. Д. БЕРГМАН, Д. ГИНЗБУРГ, Р. ПАППО
ВВЕДЕНИЕ
Первоначально конденсация Михаэля [1—21] представляла
собой присоединение адденда или донора (А), содержащего в
системе О = С—СН а-водородный атом, к двойной углерод-угле-
родной связи, которая является частью сопряженной системы
общей формулы С = С—С = О в акцепторе (Б). Конденсация
R R1 R111 Rv RVI R R1 R111 Rv RVI
II III Основание I I I I I
O=C—CH 4- C=C—C=O o=C—C-C—C—C=O
II III
Rll RIV RI1 RIV H
А Б
происходит под влиянием щелочных реагентов, обычно алко-
голятов щелочных металлов.
Круг аддендов очень широк. Вообще говоря, все структуры
О=С—СН, водород в которых активен в реакции Церевити-
нова, могут служить донорами в конденсации Михаэля. Мно-
гие соединения, которые не дают этой реакции на активный
водород, например ацетофенон, также являются эффективны-
ми реагентами в реакции Михаэля.
Типичными акцепторами являются а, p-ненасыщенные аль-
дегиды, кетоны и производные кислот.
В дальнейшем первоначальное представление о конденса-
ции Михаэля было расширено, и теперь полагают, что в этой
реакции могут принимать участие адденды и акцепторы, акти-
вированные не только карбонильными и карбалкоксильными
группами. В настоящем обзоре в качестве доноров рассмотре-
ны нитрилы, нитросоединения, сульфоны и некоторые угле-
водороды, например циклопентадиен, инден и флуорен, в ко-
торых имеются достаточно реакционноспособные атомы водо-
рода. В качестве акцепторов в настоящий обзор включены
винилсульфонйевое соединение [22] и некоторые углеводороды,
имеющие постоянный полярный характер (определенный ди-
польный момент), например фульвены. Другим углеводород-
ным акцептором является тетраацетиленовое соединение с
182
111. Реакция Михаэля
сопряженными связями, которое присоединяет натриймалоновый
эфир, как показано ниже [23]. Рассмотрены также сравнитель-
СН3С=С—C~fC—С=С—С=ССН3 + СН2 (СООС2Н5)2 —>
—> СН3С=С—С=С—С=С—СН=С (СН3) СН (СООС2Н6)2
но немногочисленные конденсации Михаэля, в которых акцеп-
торами служат альдегиды, кетоны и сложные эфиры с ацети-
леновыми связями.
Интересным примером активации этиленовой двойной связи
соседней сульфониевой группой является присоединение к бро-
мистому винилдиметилсульфонию в присутствии водного рас-
твора едкого натра метилового эфира ацетоуксусной кислоты
и малонового эфира [22] в соответствии со следующим уравне-
нием:
(СН3)2 S—СН=СН2 + СН3СОСН2СООСН3 —>
—► (СН3)2 SCH2CH2CH (СОСНз) СООСНз
©
Этот пример хорошо иллюстрирует механизм реакции Михаэ-
ля, как это будет рассмотрено в следующем разделе.
Ненасыщенные циклические четвертичные аммониевые соли
также могут действовать как акцепторы в присутствии осно-
ваний *. Примером является присоединение малонового эфира
к галогенидам 2,7, 10-триметилакридиния в присутствии эти-
лата натрия, как это видно из следующего уравнения [24—26]:
СН2 (СООСгЩЬ
CsHBONa
сн3 сн3
МЕХАНИЗМЫ ПРОЦЕССОВ, ПРОТЕКАЮЩИХ ПРИ РЕАКЦИИ МИХАЭЛЯ
НОРМАЛЬНАЯ РЕАКЦИЯ
На основании природы щелочных реагентов, которые вызы-
вают конденсацию Михаэля, логично предположить, что их дей-
ствие заключается в отщеплении а-водородного атома донора
в виде протона. Остающийся анион, вероятно, следует рассма-
тривать как гибрид формы иона енолята и формы карбаниона,
* Эти реакции напоминают прежние наблюдения, сделанные прн прове-
дении реакций ненасыщенных циклических четвертичных аммониевых псевдо-
оснований с ацетоуксусным эфиром и ннтропарафннамн [27—29].
Механизмы процессов, протекающих при реакции Михаэля
183
как это показано ниже, хотя легче считать, что
конденсация происходит с участием карбаниона.
последующая
R R R R 1 1 R R । ।
0=С- -сн + с2н6ое ± 1 1 у С2Н6ОН-ЬО=С—се <-> е । । 0—с=с
R" R” R”
А В
Сама конденсация происходит тогда, когда образуется но-
вая связь между богатым электронами атомом углерода в этом
ионе и наиболее бедным электронами атомом углерода сопря-
женной системы в акцепторе, а именно (3-углеродным атомом.
В тех случаях, когда в акцепторе (как показано выше)' а, ₽-
двойная связь активирована карбонильной группой, карбанион-
ный продукт реакции В представляет собой резонансный гиб-
рид. Заслуживает внимания тот факт, что способность акцеп-
торов принимать участие в конденсации Михаэля повышается
при наличии полярных заместителей (R111, RIV, Rv), которые
стабилизируют ионы В.
R R1 R111 Rv RVI
О=С—Се + С=С—С=О —>
R» R1V
R R1 R111 Rv RVI R Rl Rin Rv RV1
I I I I I I I I I I
—> O=C—С—С—C—C=O O=C—C—C C^C 0е
II® II-
rHriv B r!I r!V
Протон, необходимый для превращения ионизированного
продукта В в кетоформу (Г), которую можно выделить, мо-
жет образовываться и из другой молекулы донора. Этим объяс-
няется, почему для осуществления конденсации часто доста-
точно значительно меньшее по сравнению с эквивалентным ко-
личество основного реагента. При использовании целого экви-
валента основания протон получается за счет нейтрализации
реакционной системы.
Таким образом, суммарная реакция заключается в присоеди-
нении донора (в виде частей 0 = С—С— и —Н) к сопряженной
184
UI Реакция Михаэля
системе акцептора в положение 1, 4.
R R1 R111 Rv RVI R Rl
I I I I I II
O=C—С—С—C=C—Oe + 0=C—CH у»
II I
Rll riv rii
В A
R Rl RIn Rv RVI R R1
I I I I I II
0=C—С—С—C—C=0 + o=c—ce
III I
Rn RiV H R«
Г
Все сказанное выше, очевидно, не применимо к таким кон-
денсациям, включающим реакции Михаэля в более широком
понимании, в которых акцептором является непредельный угле-
водород постоянного полярного характера. В этом случае со-
единение В следует рассматривать исключительно как карб-
анион, и суммарная реакция представляет собой присоедине-
ние донора RH (в виде R— и —Н) к поляризованной двойной
связи в положение 1, 2.
ПРИРОДА АНИОНА АДДУКТА
В тех случаях, когда R11 — водород, карбанион В может
претерпевать сдвиг протона. Следует предположить, что анион
легко принимает форму В7, если она устойчивее, чем В, как
это может быть в том случае, когда заместитель R1 придает
протону группы R'CH более кислотный характер по сравнению
с протоном группы RVCH.
R R1 R,n Rv RVI R R1 Rln Rv RVI
I I I I I I I I I I-
0=C—C—C—C—C=0 0=C—C—C— C—c=o
II© e I I
H R,v R,v H
в
В'
Хотя при непосредственном выделении из В и из В' полу-
чают одно и то же соединение, при проведении реакций с анио-
ном можно выяснить, когда происходит стадия обмена, как это
видно из приведенного ниже примера [30]. Соединение, полу-
ченное в результате реакции Михаэля из этилового эфира
Механизмы процессов, протекающих при реакции Михаэля
185
циануксусной кислоты и этилового эфира метакриловой кис-
лоты (при использовании 1 зкв основания), можно метилиро-
вать в спиртовом растворе иодистым метилом. После гидро-
лиза и декарбоксилирования получают а, а'-диметилглутаровую
кислоту (IV). Эта кислота должна была образоваться из III;
тогда анион лучше представить в виде II, а не I, который дол-
жен был явиться основным результатом реакции присоедине-
ния, как это указано выше.
еСН (CN) СООС2Н5 + СН2=С (СН3) СООС2Н5 —> СН (CN) COOC2HS
I 9 —
СН2С (СН3) СООС2Н6
1
9
С (CN) СООС2Н6 CHj1 СНзС (CN) соос2н5 Гилролиз
I — I —— >
СН2СН (СН3) СООС2Н5 СН2СН (СН3) СООС2Н5 ” 2
Il III
СНзСНСООН
—> I
СН2СН (СН3) соон
IV
При попытках установить механизм реакции Михаэля было
сделано много подобных наблюдений, касающихся такой пере-
группировки, которая сама по себе не является частью реак-
ции Михаэля [31].
Один такой частный пример показывает, что перегруппи-
ровка может быть затруднена в растворителях, не содержащих
гидроксильной группы [32, 33]. При взаимодействии этилового
эфира фенилпропиоловой кислоты (V) и натриймалонового
эфира в инертных растворителях образуется натриевая соль,
окрашенная в желтый цвет, а в спиртовом растворе — бесцвет-
ный изомер. Формулы VI (до перегруппировки) и VII (после
перегруппировки) были приписаны соответственно каждой из
этих солей. Натрий-метилмалоновый эфир в’бензоле также об-
разует с этиловым эфиром фенилпропиоловой кислоты соеди-
нение (VIII), окрашенное в желтый цвет. Бесцветный изомер
СвН5С=ССООС2Н5
V
С6Н5С=СНСООС2Н5
С2Н6ООСС=С (ОС2Н6) ONa
VII
С6Н5С=С=С (ОС2Н6) ONa
I
СН (СООС2Н6)2
VI
С6Н6С=С=С (ОС2Н6) ONa
СН3С (СООС2Н6)2
V111
186
14. Реакция Михаэля
не образуется. Это объясняют отсутствием а-водородного ато-
ма в соединении VIII, который сделал бы возможным переме-
щение с образованием формы, аналогичной структуре VII. Сле-
дует отметить, что структурные формулы, приведенные для со-
единений VI и VIII, не вполне объясняют желтую окраску этих
соединений.
КОНКУРИРУЮЩАЯ ПОБОЧНАЯ РЕАКЦИЯ
Соединения, являющиеся, согласно приведенному выше опре-
делению, акцепторами, обычно склонны к реакциям присоеди-
нения анионов, например анионов алкоголятов, которые часто
используют в реакции Михаэля в качестве катализаторов. В та-
ких случаях катализатор конкурирует с донором за молекулу
акцептора. Хотя эту возможность всегда следует иметь в виду,
R R1
I I
о=с—се
Rll RHIrV rvi
I I I
н + C=C—C=O —>
1
rVIIq© RIV
R R1 R111 Rv RVI
I I I I I
O=C—C—C— C=C—0е
I I
R1I riv
И
rIII RV rVI
I I I Q
rVII_0_c_c=c_o©
I
RIV
по-видимому, только те акцепторы, в которых RITI = RIV=H
(акрилаты, акрилонитрил), присоединяют анионы алкоголятов
достаточно энергично, так что это может помешать реакции
Михаэля. Используя такие акцепторы, конденсацию лучше про-
водить без растворителя или в среде, не содержащей гидро-
ксильных групп [34].
ОБРАТНАЯ РЕАКЦИЯ
Реакция Михаэля — процесс обратимый. Аддукты Г могут
расщепляться на исходные вещества А и Б под действием тех
же катализаторов, которые вызывают конденсацию [35]. Склон-
Механизмы процессов, протекающих при реакции Михаэля
187
ность к такой обратимости реакции можно до известной сте-
пени преодолеть, если один из реагентов брать в избытке; по-
видимому, это случай проявления закона действия масс, кото-
рый оказывает влияние на равновесие. Хотя количественных
данных о состоянии равновесия имеется мало, низкая темпе-
ратура, по-видимому, благоприятствует конденсации, а повы-
шенная температура — обратной реакции [36]. Кроме того, бо-
лее вероятно, что обратная реакция происходит в том случае,
когда конденсация протекает медленно. Одним из факторов,
вызывающих медленное протекание конденсации, является на-
личие большого количества заместителей . (RnI, RIV, Rv) при
а, |3-двойной связи молекулы акцептора (см. стр. 243). Примеры
реакций конденсации, протекающих при различных температу-
рах, приведены в таблице; выходы полученных продуктов кон-
денсации, возможно, отображают достигнутое равновесие.
Реакция между малоновым эфиром и Выход аддукта при
100° 25°
этиловым эфиром кротоновой кислоты 65 ?
этиловым эфиром коричной кислоты 35 ?
этиловым эфиром р, р-днметилакрнловой
кислоты 30 70
этиловым эфиром а, р, р-триметилакрн-
ловой кислоты Следы ? ?
Всякий раз, когда хотя бы один из заместителей (R1 или
R11) в доноре является водородом, общая формула продукта
конденсации приобретает симметрию 1,5-дикетопентана с ато-
R R1 Rni Rv RVI
I I I I I
O=C—С—С—C—C=O —>
I I I
H RIV H
R R1 RnI Rv RVI
III II
o=c—c=c + H2C—c=o
RIV
лгами водорода в положениях 2 и 4. При таком строении в ре-
зультате обратной реакции могут образоваться фрагменты, от-
личающиеся от исходных веществ. В таком случае разрывается
связь, которая первоначально была а, p-связью в акцепторе;
остаток этого конца молекулы выделяется тогда в виде фраг-
мента, имеющего строение О=С—СН («донор»). В то же время
первоначальный донор теперь имеет строение С=С—С = О
(«акцептор»). Суммарным результатом при протекании конден-
сации и обратной реакции является в таких случаях переход
алкилиденового заместителя от а-углеродного атома первона-
чального акцептора к а-углеродному атому первоначального до-
нора. Так, в результате конденсации Михаэля из фенилацетона
188
III. Реакция Михаэля
и а-нитростильбена наряду с другими соединениями образуется
3,4-дифенилбутен-3-он-2 (IX) [36], а при конденсации изопропил-
С6Н5СН2СОСН3+ C6H5CH=C(NO2)C6HS -----------------*-
—*- C6H5CHCH(C6H5)4-CH(NO2)C6H5 —*-
СОСНз
—С6Н5С=СНС6Н} + CH2(NO2)C6H5
сосн3
IX
n-метоксибензилиденметилкетона с малоновым эфиром, если
ее проводить в этиловом спирте, — n-метоксикоричная кис-
лота [37].
« ен3ск:6н4сн==снсо('.н(сн3)г + сщсоос^Нзк —
«^CHsOGeHLjCHhyCH^COCHif СНз)г
СН(,СООС2Н5)2
—— СНзСОСШСЬУг +
* "-С^ОС^ЩСН^СООСгН^^^^ ^С»3ОС6Н4СН^СНСООН
Расщепление, формально одинаковое с описанным выше,
молекулы соответствующего строения могут претерпевать даже
в том случае, если они образуются не только в результате
реакций Михаэля.
Ниже приводятся примеры реакций расщепления из химии
природных соединений, которые формально можно рассматри-
вать как реакции, обратные реакции Михаэля.
1. Диметиловый эфир кариофилленовой кислоты (X) пре-
вращается в результате последовательных обработок амидом
натрия в ксилоле при 130°, а затем .разбавленной соляной кис-
лотой в 4, 4-диметилциклогексен-2-он (XI) [38].
(СН3)2 ссн=снсоосн3
СН3^ /СНзСООСНз
сн/
х \соосн3
СН2СН2СООСН3
соосн3
XI
Механизмы процессов, протекающих при реакции Михаэля
189
2. Диметиловый эфир а-танацетондикарбоновой кислоты
(XII) аналогичным образом превращается в танацетофорон
(XIII). [39].
СООСНз
СН2СООСН3
(СН3)2 сн
XII
соосн
—> сн2
\с=снсоосн3
I
(СН3)2 сн
(СН3)2 сн
(СН3)2 сн
XIII
3. Превращение санторовой кислоты (XIV) в сантороновую
(гептан-2,3,6-трикарбоновую) кислоту (XV) можно предста-
вить следующим образом [40]:
СН3 СООН
СН2СООН
СН (СНз) соон
СНз соон
сн
н2с сн=снсоон
I I/СООН
Н2С—с<
ХСН (СНз) соон
-СН.СООН ?
СНз соон
сн
Н2С соон
I I /СООН
Н2С— с<
ХСН (СН3) соон
сн3 соон
сн
-со.
Н2С
| /СООН
Н2С—сн
\сн (СН3) соон
XV
190
III. Реакция Михаэля
4. Фенилкетон XVII, полученный из холестен-4-она-З (XVI),
превращается (через стадию образования внутримолекулярной
альдольной формы) при нагревании с щелочью при 200—240°
в соединение XVIII и винилфенилкетон, который затем разла-
гается на формальдегид и ацетофенон [41].
5. При пиролизе кетоальдегида XIX образуются соединение
XX и 2-додеценаль [42, 43].
+ С9Н|9СН=СНСНО
XX
6. Аналогичным образом соединение XXI превращается в
2-метилциклогексацон и соединение XXII [44].
Механизмы процессов, протекающих при реакции Михаэля
191
Другие обратные реакции этого типа могут протекать при
нагревании или в присутствии основных катализаторов [45—54].
«АНОМАЛЬНАЯ» КОНДЕНСАЦИЯ МИХАЭЛЯ
Если продукт реакции конденсации Михаэля, полученный из
этилового эфира р, р-диметилакриловой кислоты и этилового
эфира а-цианпропионовой кислоты метилировать (этилатом нат-
рия и иодистым метилом), то после гидролиза и частичного де-
карбоксилирования образуется а, а', р, р-тетраметилглутаровая
кислота (XXVI) [30]. Такой углеродный скелет показывает, что
продуктом метилирования до гидролиза является соединение
XXV. Соединение XXV могло образоваться в свою очередь
только в результате метилирования соединения XXIV, в кото-
ром замещаемый атом водорода дважды активирован (спосо-
бен к енолизации), так как обычно предполагается, что (одно-
кратно активированные) а-водородные атомы, подобные атомам
водорода в соединении XXIII (другой возможный предшествен-
ник соединения XXV), не могут метилироваться смесью эти-
лата натрия и йодистого метила *. При гидролизе первичного
аддукта образуется а, р, p-триметилглутаровая кислота [56];
в этом случае нельзя сделать различие между соединениями
XXIII и XXIV. Таким образом, первоначальным продуктом
(СН3)2 С=СНСООС2Н6 . (СН3)2 ССН2СООС2Н6
+ I
СН3СН (CN) СООС2Н6 СН3С (CN) СООС2Н6
j ххш
(СН3)2 ССН (СН3) СООС2Н6 г „ (СН3)2 ССН (СН3) СООС2Н5
СН (CN) СООС2Н5 CHjI СН3С (CN) СООС2Н6
XXIV j XXV
(СН3)2 ССН (СН3) соон
СН3СНСООН
XXVI
* Имеются также наблюдения, противоречащие этой точке зрения [55],
192
III. Реакция Михаэля
конденсации должно быть не ожидаемое («нормальное») соеди-
нение XXIII, а сложный эфир XXIV, который формально обра-
зуется в результате присоединения молекулы донора в виде
фрагментов СН3— и —CH(CN)COOC2H5. Такую реакцию на-
зывают «аномальной» реакцией Михаэля. Считается, что в этом
и в других подобных случаях, изученных Торпе и сотрудни-
ками, продукты конденсации образуются в результате непо-
средственного присоединения метильной группы как одной из
частей донора. «Аномальное» присоединение метилмалонового
эфира заключается в кажущемся присоединении фрагментов
С2Н5ОСО— и -СН(СН3)СООС2Н5.
Наблюдалось, что в случае некоторых систем ход реакции
можно изменять по желанию, изменяя количество конденси-
рующего агента. Например [57], малоновый эфир и этиловый
эфир кротоновой кислоты образуют нормальный аддукт — три-
этиловый эфир 2-метилпропан-1, 1,3-трикарбоновой кислоты
(XXVII), который, поскольку он имеет способный к енолиза-
ции атом водорода, можно метилировать до триэтилового
эфира З-метилбутан-2,2,4-трикарбоновой кислоты (XXVIII).
Аддукт XXVIII можно получить также из этилового эфира
кротоновой кислоты и леталмалонового эфира в присутствии
7е экв этилата натрия. Однако если взять целый эквивалент
конденсирующего агента, то образуется соединение, изомерное
соединению XXVIII. Это соединение должно иметь «аномаль-
ное» строение XXIX, поскольку оно содержит способный к ено-
лизации атом водорода и его можно метилировать этилатом
СН3СН=СНСООС2Н5 СН3СНСН2СООС2Н5 СН3СНСН2СООС2Н
+ —> I с-н^и I
СН2 (СООС2Н5)2
СН (СООС2Н6)2
XXVII
СН3С (СООС2Н6)2
XXVIII
C2H„ONa
1/6 моля
---СН3СНСН(СН3)СООС2Н5
9H>0Na СН3СН=СНСООС2Н5
CHSI
СН (СООС2Н6)2
XXIX
СН3СН=С (СН3) СООС2Н5
+
СН2 (СООС2Н6)2
СН3СН (СООС2Н6)2
4
СН3СНСН (СН3) СООС2Н5
СН3С (СООС2Н6)2
XXX
Механизмы процессов, протекающих при реакции Михаэля 193
натрия и иодистым метилом до соединения XXX. Изомер XXIX
можно получить также по реакции Михаэля конденсацией
этилового эфира тиглиновой кислоты и малонового эфира, хотя
этот синтез может служить веским доказательством только в
том случае, если конденсация протекает «нормально». В про-
тивоположность поведению соединения XXIX при обработке
соединения XXVIII этилатом натрия, а затем иодистым мети-
лом протекает обратная реакция и образуются этиловый эфир
кротоновой кислоты и метилмалоновый эфир, который метили-
руется далее до диметилмалонового эфира.
Наиболее общепринятое объяснение «аномальной» реакции
дали Холден и Лапуорз [58]. Первичный продукт конденсации
Михаэля всегда имеет строение, которому отвечает нормальная
формула (например, XXVIII для соединения, полученного из
этилового эфира кротоновой кислоты и метилмалонового эфи-
ра), но этот продукт конденсации устойчив только при исполь-
зовании небольших количеств катализатора. Полагают, что в
присутствии больших количеств катализатора происходит кон-
денсация Дикмана (XXVIII-*XXXI). Эта циклизация может
легче происходить при наличии относительно большого числа
заместителей, которые могут вызвать изменение углов между
направлениями валентностей, как это полагал Ингольд [59, 60]
в других случаях. Производное циклобутанона XXXI в свою
очередь также неустойчиво, особенно ввиду того, что оно имеет
строение p-кетоэфира; в соответствии с этим оно разлагается
при действии спирта с образованием соединения XXIX, кото-
рое и получают фактически в качестве конечного продукта.
CHaCHCHjCOOCjHj саН8ОН
сн3с(соос2н5)2
XXVIII
, сн3сн—снсо:ос2н5 c>Ht0H
CH3C-j-CO
COOCiHs
XXXI
СН^СНСНССООСгН^
‘ сн3снсооо>п5
XXIX
Позднее [61] было предложено видоизменение механизма
Холдена — Лапуорза, основанное на предположении, что про-
межуточным продуктом реакции является не производное
циклобутанона, а анион полуацеталя. В этом случае взаимо-
действие этилового эфира кротоновой кислоты с метилмалоно-
194
1П. Реакция Михаэля
вым эфиром можно представить следующим рядом реакций:
COOR COOR
I I '
СН3СН-СН, СН3СН--СН
I -н+ I я
сн3с--с=о ——> сн3с-----С—0е —>
I I II
COOR OR COOR OR
COOR COOR
CH3CH--CH CH3CH-CH
I I +h+ I I
—> CH3Ce c=o —> CH3CH c=o
II II
COOR OR COOR OR
Особое значение придавалось тому, что связь С—С, соединяю-
щая атом углерода полуацетальной группы с группой CHCOOR,
«сильно поляризована» (что обозначают | ), но смысл такого
утверждения не вполне ясен. Аналогичный механизм предпола-
гался и для аномальной реакции Михаэля между метилмало-
новым эфиром и этиловым эфиром тетроловой кислоты.
Установить различие между механизмами, предложенными
Торпе и Холденом и Лапуорзом, можно в том случае, если в ак-
цепторе вместо карбалкоксигруппы использовать ацильную
группу, т. е. взять ненасыщенный кетон, а не сложный эфир.
Однако установить различие этим путем не удалось, так как
продукт конденсации оказался неустойчивым. При взаимодей-
ствии бензилиденацетофенона с метилмалоновым эфиром, со-
гласно Торпе, должно образовываться соединение XXXII, а со-
гласно Холдену и Лапуорзу — соединение ХХХШ. В действи-
• —>С6Н6СНСН (СН3) СООС6Н6
| —>С6Н5СН=С (СООС2Н6)2
СН (СООС2Н5)2 +
С6Н6СН=СНСОС6Н6 XXXII СН3СН2СОС6Н5
СН3СН (СООС2НЬ)2
L»C6HSCHCH (СООС2Н6) СОС6Н6
| —>СсН6СН=С (СН3) СООС2Н6
СН3СНСООС2Н6 +
ХХХШ С6Н5СОСН2СООС2Н5
Механизмы процессов, протекающих при реакции Михаэля 195
тельности не было получено ни одно из этих соединений. Вме-
сто них была получена смесь продуктов, образовавшихся в ре-
зультате обратной реакции, — этиловый эфир а-метилкоричной
кислоты и этиловый эфир бензоилуксусной кислоты. Это ока-
залось совместимым только с формулой ХХХШ, как показы-
вает схема реакции, поскольку, если бы образовалось соедине-
ние XXXII, оно разложилось бы на бензилиденмалоновый эфир
и пропиофенон *.
Дополнительное доказательство механизма реакции пыта-
лись получить при изучении конденсации бензилмалонового
эфира с диэтиловым эфиром фумаровой кислоты [63, 64], бен-
зилмалонового эфира с транс-дибензоилэтиленом и а-хлорди-
бензоилэтиленом [65], метилмалонового эфира с этиловым эфи-
ром циклогексен-1-карбоновой кислоты и этиловым эфиром
а-этилкротоновой кислоты [66] и этилмалонового эфира с эти-
ловым эфиром тиглиновой кислоты [67]. Хотя прямого доказа-
тельства получено не было, очевидно, что эти исследова-
ния скорее поддерживают точку зрения Холдена — Лапуорза
[66, 68].
Недавно было обращено внимание [69] на тот факт, что
часто продукты с более высокими выходами образуются при
«аномальной» реакции Михаэля из обычных исходных веществ,
а не в тех случаях, когда «нормальный» продукт (синтезируе-
мый независимым путем) подвергается конденсации в условиях
реакции Михаэля. По-видимому, это означает, что «нормаль-
ный» продукт не всегда является промежуточным продуктом
при протекании «аномальной» реакции. На основании экспери-
ментальных результатов, полученных при конденсации этило-
вого эфира кротоновой кислоты и метилмалонового эфира,
установлен следующий предполагаемый ход реакции [70]. По-
скольку для аномальной реакции требуется целый эквивалент
основания, предполагается, что первоначально происходит об-
разование связи между реагирующими веществами по типу
конденсации Кляйзена с участием аниона (XXXIV), образую-
щегося из основания и акцептора. Отщепление молекулы эти-
лового спирта от промежуточного соединения XXXV, катализи-
руемое щелочью, будет приводить к образованию сложного
эфира XXXVI. Этот эфир может претерпевать внутримолеку- *•
*• Попытка Михаэля и Росса [62] поставить под сомнение это заключение
на основании того, что найденные продукты обратной реакции могли обра-
зоваться также из продукта присоединения двух молекул бензнлиденацето-
фенона и одной молекулы метнлмалонового эфира (см. стр. 301), оказалась
безуспешной. Им не удалось получить такое соединение из летилмалонового
эфира, хотя из малонового эфира его легко получить. ’
13*
196
III. Реакция Михаэля
лирную реакцию Михаэля с образованием промежуточного
циклобутаиона XXXI, что постулировали Холден и Лапуорз.
С2Н6Ое + СН3СН=СНСООС2Н6 СН3СНСНСООС2Н5
ОС2Н5
XXXIV
ОС2Н6 ОС2Н6 -с,н,ое
I I —L5--,
XXXIV + СНзСН (СООС2Н6)2 СН3СНСН—ССН (СН3) СООС2Н6
| о©
СООС2Н5
ОС2Н6
I
—► СН3СНСНСОСН(СН3)СООС2Н6
I
СООС2Н5
XXXV
Предполагалось [70] также, что циклическое промежуточное со-
единение может и не существовать как таковое, но что слож-
ный эфир XXXVI может превратиться непосредственно в ано-
мальный продукт конденсации XXXVII в результате реакций
алкоголиза и присоединения.
XXXV CHaCH^ICOOCjHjCO-T-CHfCH^COOCjHj —*-
XXXVI
СНзСНСН(СООС2Нъ)2
СН3СНСООС7НЛ
СН3
XXXVII
Изучение кинетики [71] аномальной реакции конденсации
диэтилового эфира фумаровой кислоты и этилмалонового эфи-
Механизмы процессов, протекающих при реакции Михаэля
197
ра показало, что анион донора и диэтиловый эфир фумаровой
кислоты быстро взаимодействуют с образованием аниона нор-
мального продукта реакции, который можно отличить от ано-
мального продукта по удельному весу. Затем наблюдалась
медленная стадия изомеризации этого аниона в анион аномаль-
ного продукта конденсации. Наблюдалось также, что при из-
бытке свободного этилмалонового эфира аномальная реакция
подавляется даже в присутствии этилата натрия, взятого в ко-
личестве, эквивалентном диэтиловому эфиру фумаровой кис-
лоты. Это привело к выводу, что первоначально образующийся
анион может быть стабилизирован путем отщепления иона во-
дорода от свободного этил малонового эфира, причем эта реак-
ция протекает с большой скоростью и конкурирует с реакцией
изомеризации.
Окончательное доказательство того, что при «аномальной»
реакции происходит миграция карбоксильной группы (в той
или другой форме), было получено при проведении опытов с ме-
чеными соединениями. Оказалось, что при конденсации этило-
вого эфира кротоновой кислоты, содержащего С14 в карбэток-
сигруппе, с метилмалоновым эфиром продукт реакции обра-
зуется в результате миграции меченого углеродного атома [72].
Обогащение карбэтоксигруппы в этиловом эфире кротоновой
кислоты, этиловом эфире коричной кислоты и метилмалоновом
эфире атомами О18 послужило дополнительным доказатель-
ством того, что при конденсации каждого из первых двух со-
единений с метилмалоновым эфиром (при использовании в ка-
честве' катализатора, способствующего протеканию «аномаль-
ной» реакции, 1 же основания) происходит миграция карбэток-
сигруппы [73—75].
Располагая этими данными, можно с уверенностью заклю-
чить, что предложенный Холденом и Лапуорзом механизм ре-
акции в своей основе правилен, хотя видоизменения этого ме-
ханизма, которые предложил Джонсон [70], представляют со-
бой наиболее вероятную картину протекания этой реакции.
ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ С МОСТИКОМ
В ЛЛРЛ-ПОЛОЖЕНИИ
Конденсация З-метилциклогексен-2-она (XXXVIII) с мало-
новым эфиром обладает характерными особенностями, которым
было дано объяснение [76, 77] в соответствии с предположением
Холдена — Лапуорза о промежуточном образовании циклобу-
танона и в поддержку этой точки зрения. Если эту реакцию
проводить при комнатной температуре с 1 же этилата натрия,
198
III. Реакция Михаэля
то в результате получается только один продукт, который
был идентифицирован (соединение XXXIX). Если реакцию про-
водить при температуре кипения этилового спирта, то помимо
указанного выше соединения получается продукт с открытой
цепью, образующийся в результате алкоголиза (XL).
В этой конденсации «аномальным», положением, в котором,
по-видимому, находится карбэтоксигруппа в молекуле донора,
является пара-положение, а не орто-положенйе (в алицикличе-
ском кольце). Для объяснения этого было сделано допущение,
что первичным продуктом реакции является соединение XLI,
образующееся в результате нормальной конденсации. Предпо-
лагалось, что это соединение по реакции Дикмана превра-
щается в бициклический дикетон XLII. Предполагалось также,
что в результате алкоголиза дикетона (указано точками) об-
разуется соединение XXXIX.
Этот механизм был выдвинут по аналогии с механизмом
Холдена — Лапуорза, но в предположении, что промежуточным
соединением является циклогексанон, а не циклобутанон, по-
скольку образование мостика в пара-положении там, где это
Механизмы процессов, протекающих при реакции Михаэля
199
возможно (как в данном примере), следует .считать более ве-
роятным, чем образование соединения XLIII.
Однако недавно было сделано предположение [70], соглас-
но которому промежуточное соединение с мостиком в пара-по-
ложении может в таких случаях и не образоваться. Вместо это-
го первоначально может образоваться продукт аномальной
реакции Михаэля XLIV. Он может подвергаться алкоголизу
(обратной реакции Дикмана) до полного эфира трикарбоновой
кислоты с открытой цепью XLV, который затем претерпевает
циклизацию (по известной реакции) с образованием соедине-
ния XXXIX. Во всяком случае, было показано, что нормальный
аддукт XLI не является предшественником соединения XXXIX,
СНз СН, сн3
ГСН2СООС2Н6 С^Н2 ССН2СООС2Н6 —> XXXIX
J—СООС2Н5 —* I I
z 2 С2Н6ООССН2 СН2СООС2Н6
XLV
XLIV
так как это соединение из З-метилциклогексен-2-она и малоно-
вого эфира образуется с более высоким выходом, чем из со-
единения XLI [70]. Высказано мнение [70], что так же, как и в
приведенном выше случае, первой стадией является эфирная
конденсация в положении 6 (что вызвало бы затем обра-
зование мостика в ппра-положении) или, что более вероятно,
200
П1. Реакция Михаэля
в положении 2 через стадию образования аниона XLVI. Это
/\-СН3 /V-сн, А-СН3
! 1© * сосн2соос2н6 или сосн2соос2н6
в Y и
о о о
XLVI
объяснение основано на аналогии с механизмом, предложен-
ным для реакции З-метилциклогексен-2-она с этиловым эфиром
циануксусной кислоты, который был установлен с полной оче-
видностью и согласно которому последовательно образуются
следующие промежуточные соединения:
СН3
/V-CHsCN
СООС2Н6 *
Y
о
сн2 сн3
CH?CCH2CN
I I
С2Н6ООССН2 СН2СООС2Н6
сн3
А-СН2СООС2Н6
U~cn
II
о
СТЕРЕОХИМИЯ КОНДЕНСАЦИИ МИХАЭЛЯ
О пространственном течении конденсации Михаэля из-
вестно очень мало, хотя из-за образования асимметрических
атомов углерода в продуктах реакций с открытой цепью и воз-
можности цис-транс-изомерии в алициклических аддуктах воз-
никает ряд стереохимических проблем. Часто отмечалось обра-
зование диастереомерных аддуктов, например при взаимодей-
ствии следующих реагирующих веществ: бензилиденацетона с
диметиловым эфиром малоновой кислоты [78], бензилиденаце-
тофенона с цианистым бензилом [79], диэтилового эфира янтар-
ной кислоты с л-толилбензилсульфоном [81], а-бензилиденпро-
пиофенона с диметиловым эфиром малоновой кислоты [82, 83],
этилового эфира коричной кислоты с метилмалоновым эфиром
[57, 84], этилового эфира p-изопропилакриловой кислоты с эти-
ловым эфиром циануксусной кислоты, этилового эфира корич-
ной кислоты с этиловым эфиром циануксусной кислоты [86, 87],
этиловым эфиром фенилуксусной кислоты [88, 89] или циани-
стым бензилом [34, 90, 91], нитрила коричной кислоты с циаии-
стым л«-аминобензилом [34], 2-нитробутена-2 с цианистым бен-
зилом [92], 2-нитро-1-фенилпропена-1 с малоновым эфиром [93],
а-нитростильбена с малоновым эфиром [93] и З-циан-1,2,5,6-
тетрагидропиридина с малоновым эфиром [94]. •
При конденсации этилиденацетона с 7-хлор-4,6-димет-
оксикумараноном-3 образуются одновременно два возможный
Механизмы процессов, протекающих при реакции Михаэля 201
изомера [95]. Подобный результат получен при конденсации
аналога, не содержащего хлора. Реакция между 4-метилцикло-
гексаноном и метилизопропенилкетоном также приводит к об-
разованию двух стереоизомерных форм 3,6-диметил-9-оксиде-
калона-2 [96].
Реакции бензилиденацетофенона с цианистым бензилом [79]
и а-бензилиденпропиофенона с диметиловым эфиром малоно-
вой кислоты [82, 83] представляют два разных пути, по кото-
рым в результате конденсации Михаэля могут образоваться
асимметрические атомы углерода. В аддукте XLVII а- и ₽-уг-
леродные атомы в акцепторе становятся асимметрическими;
в аддукте XLVIII атом углерода в акцепторе и атом углерода
в молекуле донора, связанный с акцептором, становятся цен-
трами асимметрии. Ввиду несомненной способности щелочного
конденсирующего агента обращать конфигурацию замещенных
углеродных атомов, как, например, в случае — СН(СН3)СОСеН5
и —СН(СМ)СбН5, выделенный продукт реакции должен быть
равновесной смесью всех возможных форм. Возможность выде-
ления диастереомеров из таких смесей в данном случае служит
доказательством того, что образовавшиеся формы с энергети-
ческой точки зрения приблизительно одинаковы.
СН3 СН3
I I
С6Н6СН=ССОС6Н5 С6Н6СНСНСОС6Н3
+ —> I
СН2(СООСН3)2 СН(СООСН3)2
XLV1I
C6H5CH=CHCOC6HS С6Н6СНСН2СОС6Н5
+ —* I
c6h6ch2cn c6h6chcn
XLVIII
При конденсации 1-нитроциклогексена с цианистым н-бром-
бензилом образуются цис- и транс-формы соединения XLIX
[92], тогда как из 1<ас-2-гидриндилиденацетонитрила и цианацет-
амида образуется только один изомер (L) [97].
Н NO2
Х/н
| |'S'CH (CN) С6Н4Вг-п
XLIX
Непредельный аддукт LI, полученный по реакции Михаэля,
может существовать в виде цис- и транс-изомерных форм; это
202
III. Реакция Михаэля
продукт реакции ацетилацетона и двух молекул 1-цианбута-
диена [98].
СН3СО CH2CH=CHCH2CN
/С\
СНзСО ch2ch=chch2cn
LI
В том случае, когда образуется только один аддукт, опре-
делить его конфигурацию обычно трудно из-за отсутствия
эталонных соединений установленной конфигурации. Однако до-
казано, что бициклические соединения, образующиеся из ацил-
или карбалкоксициклогексенов, если не всегда, то все же до-
вольно часто, имеют транс-конфигурацию. Это справедливо в
следующих случаях: при конденсации этилового эфира цикло-
пентенкарбоновой кислоты с этиловым эфиром циануксусной
кислоты или с малоновым эфиром (только транс-форма) [99];
ацетилциклогексена с ацетоуксусным эфиром (только транс-
форма) [100]; ацетилциклогексена с малоновым эфиром (цис- и
транс-формы) [101—103]; 2-метил-1-бутирилциклогексена с ма-
лоновым эфиром (только транс-форма) [103]; 2,6-диметилбу-
тирилциклогексена с малоновым эфиром (только транс-форма)
[103]; винилциклогексенилкетона с малоновым эфиром (только
транс-форма) [107]; 4-метокси- и 3,4-метилендиоксибензальацето-
фенона с 3-метилциклогексаноном (цис- и транс-формы) [108];
метилизопропенилкетона с 3- и 4-метилциклогексаноном (цис-
и транс-формы) [109] и ( + )-дигидрокарвона с иодометилатом
1-диэтиламинопентанона-З (цис- и транс-формы) [НО].
Изомеры образуются также при автоконденсации 1-ацетил-
циклогексена-1 и при конденсации I-ацетилциклогексена-1 с те-
тралоном-1 [106].
При полном синтезе сантонина [111] используется тот факт,
что при конденсации по Михаэлю метилмалонового эфира и
1,10-диметил-2-кето-2,3,4,5,6, 10-гексагидронафталина боковая
цепь вводится в /{ас-положение по отношению к метильной груп-
СНз СНз
С (СН3) (СООС2Н6)2
СНз СН3
пе у Сю [112]. Аналогичное наблюдение сделано и в случае хо-
лестадиен-3,5-она-7.
Присоединение* в qac-положение наблюдается при реакции
конденсации малонового эфира, метилмалонового эфира и аце-
* О других интересных наблюдениях^/гак^го типа сообщается в работах
Область применения реакции
203
тоуксусного эфира с метиловым эфиром бицикло[2.2.1]гептади-
ен-2,5-карбоновой-2 кислоты [113], а также малонового эфира
с этиловым эЛиром циклогексен-1-карбоновой-1 кислоты [114].
соосн3
+ СН2(СООС2Н5)2
сн(соос2н5;2
СООС2Н5
а—н
--Н
CHlCOOCyHjlj
аСООС2Н.,
+ СН.2(СООС2Н&)2
Склонность к присоединению в транс-положение проявляет-
ся и при конденсации по Михаэлю 2-арилциклогексен-2-онов-1.
В этом случае показано, что при конденсации с малоновым
эфиром образуется транс-соединение, так как продукт реакции
оказался родственным известной транс-2-фенилциклогексилук-
сусной кислоте (LII) [117, 118].
Установлено также, что реакция присоединения дибензило-
вого эфира малоновой кислоты к 4-фенил- или 5-фенилцикло-
гексен-2-ону [119] и метилового эфира нитроуксусной кислоты
к 2-фенилциклогексен-2-ону протекает стерически в том же
направлении [120].
ОБЛАСТЬ ПРИМЕНЕНИЯ РЕАКЦИИ
ДОНОРЫ
Все донорные молекулы, встречающиеся в табл. 1—XXIII,
приведены в табл. XXIV. Поскольку кинетика реакций кон-
денсации Михаэля мало изучена, провести точное сравнение
204
III. Реакция Михаэля
соединений, действующих в качестве доноров в конденсации,
невозможно. Тем не менее, в некоторых случаях, когда донор
имеет два активных атома водорода, эффективность активирую-
щих групп можно сравнивать непосредственно. Например, две
карбэтоксигруппы активируют водород больше, чем одна карб-
этоксигруппа [121] или одна альдегидная группа [122], но одна
карбонильная группа более эффективна, чем одна карб-
этоксигруппа [123]. Группы СН(СН3) и СН(СбНБ) активируют в
большей степени, чем метиленовая группа [124—127], а нитро-
группа— лучший активатор, чем карбэтоксигруппа [128] или
алкилсульфонильная группа [129]. По-видимому, ненасыщен-
ные кетоны вообще более реакционноспособны, чем нитрилы,
нитрилы более реакционноспособны, чем сложные эфиры, а
а, p-ненасыщенные сульфоны — наименее реакционноспособ-
ные соединения [130—134]. Поведение метил-р-цианэтилкетона
в реакциях конденсации Михаэля [135] подтверждает более
сильное активирующее действие карбонильной группы по срав-
нению с нитрильной группой. Недавнее исследование [136] по-
казало, что фосфонатная группа — PO(OR)2 также активирует
атомы водорода у соседнего углеродного атома. Подобно нит-
ро- и сульфоксидным функциональным группам, она активирует
соседние двойные связи, придавая им способность действовать
в качестве акцепторов (см. табл. XXIII).
Хотя можно было бы ожидать, что реакционная способ-
ность донора связана со степенью енолизации в реакционной
среде, простой зависимости между реакционной способностью
и склонностью донора к енолизации в чистом состоянии не
было установлено [137]. Аналогично этому реакционная способ-
ность метиленовой или метиновой группы по отношению к реак-
тиву Гриньяра (реакция Церевитинова), по-видимому, не от-
вечает ее активности в качестве* донора в реакции Ми-
хаэля [138].
Вообще говоря, можно было бы ожидать, что степень про-
текания реакции Михаэля так же, как и ее скорость, должна
в значительной степени зависеть от кислотности донора и по-
лярности двойной углерод-углеродной связи в акцепторе. Кис-
лотность атома водорода в группе RCH уменьшается в следую-
щем ряду: R = NO2 > SO3R > CN > COOR > СНО > COR [139].
Электромерное влияние активирующих групп, которое вызывает
полярность двойной свя’зи, уменьшается в ряду СНО > COR >
>CN>COOR>NO2. В зависимости от наличия соответствую-
щего сочетания этих групп некоторые соединения, например
р-дикетоны, p-кетоэфиры или этиловый эфир р-аминокротоно-
вой кислоты, могут действовать в качестве доноров или в ка-
Область применения реакции
205
честве акцепторов.
Доноры
СН3СОСН2СОСН3
f
СН3СОСН2СООС2Н5
СНЭССН2СООС2Н5
II —
NH
Акцепторы
СН3С=СНСОСН3
I
ОН
СН3С=СНСООС2Н6
I
он
СН3С=СНСООС2Н5
nh2
РЕАКЦИИ С ПРОИЗВОДНЫМИ ЦИКЛОПРОПАНА
Известно, что некоторые производные циклопропана всту-
пают в реакцию конденсации Михаэля. При реакции этилового
эфира 1-цианциклопропан-1-карбоновой кислоты (LIII) с эти-
ловым эфиром циануксусной кислоты [140] и с малоновым эфи-
ром [141] происходит размыкание цикла [141—145]. Промежу-
точные соединения LIV и LV циклизуются с образованием со-
ответствующих производных циклопентанонимида LVI и LVII;
последующее отщепление циангруппы и, соответственно, вто-
рой карбэтоксигруппы приводит к образованию диэтилового
эфира циклопентанон-2,5-дикар боновой кислоты (LVIII). При
аналогичной реакции между малоновым эфиром и диэтиловым
эфиром циклопропан-1,1-дикарбоновой кислоты может быть
выделено то же производное циклопентанона (LVIII). Это сое-
динение получается из промежуточно образующегося тетраэти-
лового эфира бутан-1,1,4,4-тетракарбоновой кислоты [142, 146].
Сходство между двойной связью и циклопропановым кольцом,
которое наглядно иллюстрируется этой реакцией, подтверждают
и другие данные [147—156], в частности результаты недавно
проведенных опытов, в которых было показано, что енолят ма-
лонового эфира вступает в реакцию Микаэля с диэтиловым
эфиром 2-винилциклопропан-1,1-дикарбо
[146]; эта реакция протекает частично
схеме, а частично — по концам «а
-CN
•СООС2Н5
вой кислоты (LIX)
по приводимой ниже
енной» системы. Обе
LIII
СН (CN) СООС2Н5
сн2
I
СН2СН (CN) СООС2Н5
LIV
СН (СООС2Н6)2
I
сн2
I
CH2CH(CN) СООС2Н,
LV
206
III. Реакция Михаэля
NC\TU
С2Н5ООС/\/Х
COOCjH
н
c2h5ooc\j I/Cooc-A
С2Н5ООС'/\'/\н
NH
LVII
LVIII
/COOC2H3 ,COOC2H5
CH2-=CH — „ —* CH2=CH—j—<
XCOOC2H5 >=O
LIX \ >-<
X \COOC2H5
(C2H6OOC)2 CHCH2CH=CHCH2CH (COOC2H5)2
реакции протекают и в случае производных а, ₽, 7,8-ненасыщен-
ной карбоновой кислоты с двумя двойными связями (см.
стр. 235).
Аналогичным образом изучалось [157] взаимодействие эти-
лового эфира циануксусной кислоты с этиловым эфиром 1-ци-
ан-2-винилциклопропан-1-карбоновой кислоты, полученным in
situ из транс- 1,4-дибромбутена-2 и этилового эфира цианук-
сусной кислоты. Продукт реакции, полученный с выходом 30%,
оказался смесью двух производных циклопентана (LX и LXI).
СН2=СНСН—CHCN
^=nh
СН2—CHCOOC2HS
LX
СН2—CHCN
C=NH
СН2=СНСН—CHCOOC2HS
LXI
СИСТЕМА C=C—C=N
Поведение системы C = C — C=N в реакции Михаэля анало-
гично поведению системы С = С —С=О. Обзор наиболее исчер-
пывающих исследований по присоединению реакционноспособ-
ных метиленовых соединений к хинонимидам был опубликован
[158]; отдельные примеры таких реакций приведены в табл. IX.
2-Винилпиридйн и 4-винилпиридин являются ПОДХОДЯЩИМИ
акцепторами в реакции Михаэля (табл. XXIII). Аналогичным
образом фенантридин-9-карбоксальдегид взаимодействует с
9-метилфенантридином (LXII) с образованием (что не вызы-
вает сомнения) 1, 2, З-три-(Э-фенантридил) пропана (LXIII) [159].
—> СН3СОСН2ССООС2НБ СН3С=СНССООС2НБ
II I I
NH OH NH
LXV LXVI
CH3 OH
//
CH
I
C2HSOOCC
NH
CH3 OH
CH2COCH3 CH2 CHCOCHg
+1 —> II
COCOOC2H5 C2H5OOCC COCOOC2H5
NH
•CH3
j^\-COCH3
C2H5OOC—!^NJ-COOC2H5
LXVIH
LXVII
208
111. Реакция Михаэля
Диэтиловый эфир 4-метил-5-ацетилпиридин-2,6-дикарбоновой
кислоты (LXVIII) образуется из этилового эфира ацетилциро-
виноградной кислоты (LXIV) и аммиака [160], по-видимому, в
результате реакции части сложного эфира с аммиаком. При
этом происходят образование имина его енольной формы и кон-
денсация по Михаэлю этого соединения с кетоформой исход-
ного сложного эфира или его имина.
В связи с этим следует отметить, что шиффовы основания
типа бензилиденанилина (но не анилы кетонов) присоединяют,
например, ацетоуксусный эфир [161—163], этиловый эфир ща-
велевоуксусной кислоты [161, 164], малоновый эфир [165], эти-
ловый эфир циклопентанон-2-карбоновой кислоты [164], этило-
вый эфир циануксусной кислоты, амид малоновой кислоты,
цианацетамид [166] и этиловый эфир нитроуксусной кислоты
[167] в соответствии со следующей схемой:
C6H6CH=NCeH5 + СН3СОСН2СООС2Н5 —> C6HSCHNHC6HS
I
СН3СОСНСООС2Н5
Группа C=N в шиффовых основаниях и азинах, по-видимому,
ведет себя как карбонильная группа, так как эти соединения
могут служить как доноры. В качестве примеров можно ука-
зать шиффовы основания алифатических альдегидов и кетонов
и циклоалканонов, которые могут быть цианэтилированы в а-по-
ложении к углеродному атому азометиновой группы [168]. При-
мером может служить реакция между азином циклогексанона и
метилакрилатом [169]. Кроме того, по крайней мере формально,
>=N—N=<
=N—N=<^
2CH2COOCH3 (Lh2CH2COOCH3
2СН2=СНСООСН3
можно объяснить реакцию атома водорода в положении 3 в
индоле (LXIX) с 1-этилтиометил-2-нафтолом [170], рассматри-
вая индол в виде таутомерной формы LXX. Аналогичная реак-
Н
LXIX
LXX
ция протекает между бромистым индолилмагнием и соедине-
ниями типа ю-нитростирола [171].
Область применения реакции
209
АКЦЕПТОРЫ
а,^-Ненасыщенные альдегиды (табл. 1). Конденсация
а, p-ненасыщенных альдегидов (акролеин, кротоновый аль-
дегид, коричный альдегид) с соответствующими производными
кислот [122, 172—177] (эфиры малоновой и циануксусной кис-
лот, этиловый эфир циклогексанон-2-карбоновой кислоты) при-
водит к образованию производных 3-альдегидокислот. Наличие
алкильной группы в a-положении, по-видимому, не оказы-
вает отрицательного влияния на способность альдегидов всту-
пать в конденсацию Михаэля; с другой стороны, р-замещение
изменяет течение реакции [172, 173]. (О дальнейшем примене-
нии продуктов конденсации для синтетических целей см.
стр. 245.)
Примеры конденсации а, p-ненасыщенных альдегидов с ке-
тонами или альдегидами очень немногочисленны. Конденсации
альдегида с а, p-ненасыщенным альдегидом постоянно сопро-
вождаются вторичными реакциями [178—180]. Например, про-
дукт, который образуется при взаимодействии коричного аль-
дегида с фенилацетальдегидом (диальдегид LXXI), в результа-
те внутримолекулярной реакции Канниццаро превращается в
8-окси-р,-у-дифенилвалериановую кислоту, которая была выде-
лена в виде ее лактона LXXII.
СаН5СН=СНСНО C6HSCHCH2CHO
+
СвН6СН2СНО
СвН5СНСНО
LXXI
«Димеризация» а, p-ненасыщенных альдегидов, например
2-этилгексен-2-аля, которая происходит под влиянием водно-
спиртового раствора щелочи, рассматривалась как реакция
Михаэля с последующей внутримолекулярной альдолизацией с
образованием циклического соединения [181].
С2Н5
I
СН
СН СНС3Н7-н
\ хсно
СНО
С2Н5
снон
В таб/i. I приведено
роксильная группа (или
несколько акцепторов, у которых гид-
алкокси- или аминогруппа) находится
14 Зак. 794.
210
III. Реакция Михаэля
у двойной связи, т. е. эти вещества являются енольными форма-
ми соединений, которые также могут быть донорами в реакции
Михаэля (см. стр. 205). Все первичные продукты конденсации,
образовавшиеся из доноров, у которых группа C = NH находится
в непосредственном соседстве с реакционноспособной метиле-
новой группой, самопроизвольно циклизуются с отщеплением
гидроксильных групп (алкокси- и аминогрупп) и образуют про-
изводные пиридина [182].
СН3. /ОС2Н5
СН3СОС2Н5
СН СН2СООС2Н5
I + I
СН ссн3
О HN
СН3 ОС2Н5
—> СН2 СНСООС2Н5
I I
СН ссн3
\ II
OHN
сн3
I
-санвон ? COOCjHj
\N^—снз
н;о
Однако циклизация иногда может протекать иначе. Из бен-
зоилацетальдегида и этилового эфира p-аминокротоновой кис-
лоты образуется не ожидаемый этиловый эфир 2-метил-4-фе-
нилпиридин-3-карбоновой кислоты, а его изомер LXXIV с фе-
нильной группой в положении 6 [183]. Вероятно, он образуется
в результате реакции бензоилацетальдегида в виде р-оксико-
ричного альдегида (LXXIII) или в виде оксиметиленацетофе-
нона.
СНО
СН
II
С6Н6С
\)Н
СН2СООС2Н5 /^-СООС2Н5
ССН3 Н5С6 \N#?—СН3
Jiff LXXIV
LXXIII
Алифатические а, р-ненасыщенпые кетоны (табл. II). Кон-
денсация Михаэля алифатических а,р-ненасыщенных кетонов
протекает нормально; по имеющимся данным, продукты реакции
часто получают с очень высокими выходами. Ненасыщенные ке-
тоны легко вступают в реакцию конденсации. Например, такие
соединения, как р-нафтол [184] и этиловый эфир З-окси-4,5-бензо-
фур ан-2-карбоновой кислоты [131] взаимодействуют с метилви-
нилкетоном в своих кетонных формах. То же самое справед-
Область применения реакции
211
лйво и для реакций - 4-оксикумарина с. этилиденацетоном и
окисью мезитила соответственно [185]. Можно сравнить также
реакцию койевой кислоты с акрилонитрилом [186].
СН2СН2СОСН3 СН2СН2СОСН3
г A-
Примером реакции оксиметиленкетонов является конденса-
ция производного метилэтилкетона LXXV с цианацетамидом
(при действии в качестве катализатора пиридина или пипери-
дина) [187, 188]. Первичный продукт реакции циклизуется са-
мопроизвольно, причем в зависимости от условий проведения
реакции образуется 2-кето-3-циан-4-окси-5,6-диметил-1,2,3,4-
тетрагидропиридин (LXXVI) или продукт его дегидратации
2-окси-3-циан-5,6-диметилпиридин (LXXVII).
LXXV1
LXXVII
212
III. Реакция Михаэля
Наконец, следует упомянуть о поведении ненасыщенных ке-
тонов с двумя двойными связями. Из этой группы довольно
поверхностно были исследованы два типа соединений. Кротил-
иденацетон (LXXVIII) дает с малоновым эфиром в присутствии
метилата натрия смесь двух соединений, причем образуется в
основном соединение LXXIX в результате присоединения в поло-
жении 1,6; изомерное соединение LXXX образуется в резуль-
тате присоединения в положении 1,4 [189]. 5-Метилгексадиен-1,4-
СН3СН=СНСН=СНСОСН3 СН3СНСН=СНСН2СОСН3
LXXVIII I
СН (COOC2HS)2
__Z LXXIX
(66%)
СН2 (COOC2HS)2 СН3СН=СНСНСН2СОСН3
I
СН(СООС2Н5)2
LXXX
(29%)
он-3 (LXXXI) взаимодействует под влиянием метилата натрия
с малоновым эфиром и а цетил ацетоном только по менее заме-
щенному концу молекулы с образованием соответственно соеди-
нений LXXXII и LXXXIII (190]. Форон (LXXXIV) реагирует
с малоновым эфиром в спиртовом растворе не так, как соеди-
нение LXXXI. В этом случае продукт реакции (LXXXV) (191]
оказался идентичным продукту, полученному из окиси мезитила
[192—195]. По-видимому, форон обратно превращается в окись
мезитила значительно быстрее, чем взаимодействует с малоно-
вым эфиром, или образовавшийся аддукт претерпевает обрат-
ное превращение.
(СН3)2 С=СНСОСН=СН2 —> (СН3)2 С=СНСОСН2СН2СН (СООС2Н5)2
LXXXI \ LXXXII
\ (75%)
(СН3)2 С=СНСОСН2СН2СН (СОСН3)2
(СН3)2 С=СНСОСН=С (СН3)2
LXXXIV
LXXXIII
(65-70%)
НзС^СНз
0=^=0
LXXXV
а,₽-Ненасыщенные кетоны ацетиленового ряда. Можно было
бы ожидать, что кетоны ацетиленового ряда с тройной связью
Область применения реакции
213
в а, p-положении в конденсации Михаэля будут образовывать
а, р-ненасышенные кетоны, как это показывает уравнение реак-
ции. Однако в исследованных случаях (ацетил-н-бутилацетилен
RC^CCOR' + СН2 (СООС2Н6)2 —> RC=CHCOR'
СН (СООС2Н6)2
[196], пропионилфенилацетилен [197], бензоилфенилацетилен
[198], бензоил-о-хлорфенилацетилен [199]) первичные продукты
реакции, полученные с малоновыми эфирами в присутствии со-
ответствующих алкоголятов натрия в качестве катализаторов,
оказались слишком реакционноспособными, чтобы их можно
было выделить. Вместо них были выделены продукты циклиза-
ции. Из ацетил-н-бутилацетилена было получено производное
а-пирона (LXXXVI), которое может быть превращено в 5-н-бу-
тилрезорцин. Производные фенилацетилена претерпевали цик-
лизацию с образованием а-пиронов LXXXVII [197, 198]. Анало-
СН
н-С4Н9С=ССОСН3 \
+ -R0Na> н-С4Н9С СОСНз —>
СН2 (COOR)2 1
СН (COOR)2
/\ /\ он
* >• «-С4Н9—\—СН3 «-С4Н9—У
I JW» | ||
ROOC/^jj7 2
о он
LXXXVI
// \ НвСб I I К
H5CeC COR' ROOC—
СН (COOR)2 £
LXXXVII
гичным образом реакция между цианацетамидом и пропионил-
фенилацетиленом [197] или бензоилфенилацетиленом [200] при-
водит к замещенным 2-пиридолам LXXXVIII. Из 5-метилгек-
сн
//\
Н5С6С COR
NCCH
„ CONHa
ОН
LXXXVIII
214
III. Реакция Михаэля
син-З-она-2 и малонового эфира в присутствии- небольшого ко-
личества этилата натрия получен 3-карбэтокси-4-изопропил-6-
метил-а-пирон (LXXXIX) с выходом 59% [201].
СН (СН3)2
(СН3)2 СНС=ССОСН3 I
+ /S—COOC2HS
СН2(СООС2Н5)2 * J. р_____|| _„
LXXXIX
Циклизация происходит также при реакции метилэтинил-
кетона и 2-метилциклогексанона. Под влиянием гидрида, на-
трия образуется 2-кето-10-метил-2, 5, 6, 7,8, 10-гексагидронафта-
лин [202].
СН
СН3
При конденсации по Михаэлю этилэтинилкетона и произ-
водного циклогексанона ХС под влиянием трифенилметилнат-
рия получено соединение XCI с очень низкими выходами [203]
СН
СН3
О=С + 0=^/1—СН (СН3) СООСНз —*
\н сн ХС
С>Г12С>г1з
СНз
СН
XCI
(ср. [204, 205]). Поскольку такие же неудовлетворительные ре-
зультаты получены при проведении и других аналогичных реак-
ций [206, 207], было предпринято систематическое изучение
реакции между 2-метилциклогексаноном (в виде его енолятов)
и этилэтинилкетоном, полученным in situ. Однако (3-хлорвииил- е
этилкетон, (3-этоксивинилэтилкетон и хлористый (3-пропионилви-
нилпиридиний дали почти такие же выходы, как и этилэтинил-
кетон, а р-диметиламиновинилэтилкетон совсем не вступил
Область применения реакции
215
в реакцию с енолятом натрия. Кроме того, помимо ожидаемого
1,10-диметил-2-кето-2,5,6,7,8,10-гексагидронафталина (ХСП)
был получен продукт реакции с открытой цепью — 2-метил-
2-((3-пропионилвинил) циклогексанон (ХСШ). Установлено, что
СН3
СН3
ХСП
СН3
СН
СН2СН3
хеш
лучше всего проводить конденсацию кальциевого или литиевого
производного енола 2-метилциклогексанона с р-хлорвинилэтил-
кетоном; при использовании енолятов кальция и лития выход
составляет 12—14 и 20% соответственно, а в случае енолята
натрия — только 3—4% •
а,f-Ненасыщенные кетоны ароматического ряда (табл. III,
IV). Введение ароматических радикалов в конечные положения
системы С = С—С = О, по-видимому, увеличивает ее полярный
характер, а следовательно, и ее склонность вступать в конденса-
цию Михаэля. Может быть, именно поэтому было проведено очень
большое число таких реакций. Те реакции, в которых кетон имеет
ненасыщенные связи только со стороны одного из радикалов,
сведены в -табл. III, причем они расположены в следующем
порядке: винилфенилкетоны, метилстирилкетоны, фенилстирил-
кетоны.
При обработке щелочью непредельный кетон дипнон (XCIV)
претерпевает автоконденсацию. Продукту этой реакции «дипно-
пинакону» была приписана формула XCV [207—209]. Хотя пред-
полагалось, что соединение XCVI является промежуточным
[207, 208], по-видимому, маловероятно, что метильная группа
обладает достаточно реакционноспособным атомом водорода,
чтобы служить в качестве донора. Авторы высказывают пред-
положение, что некоторая часть дипнона гидролизуется до аце-
тофенона аналогично известному случаю гидролиза окиси ме-
С6Н6СОСр=С (СН3) СвНБ СН3ч ,С6Н5
XCIV /Х^/СОСвНв
| |/с6н5
н6с/\/\он
С6Н6С (СН3)=С (ОН) С6Н6
сн2
I
Н6С6С=СНСОС(!Н5
XCV
XCVI
216
111. Реакция Михаэля
зитила. Далее из ацетофенона образуется дикетон XCVII в ре-
зультате конденсации Михаэля; дикетон конденсируется с дру-
гой молекулой ацетофенона, образуя альдоль XCVIII, который
нормально циклизуется в дипнопинакон.
С8Н8СОСН2С (СН3) CeH5 С8Н8СОСН2С (СН3) С8Н8
I I
СН2СОС8Н5 С6Н8 (СНз) ССНСОС8Н8
XCVIII
Изучены лишь немногие непредельные кетоны с двумя двой-
ными связями типа C6H5CH = CHCH = CHCOR. Если циннамили-
денацетон (XCIX) обработать малоновым эфиром и этилатом
натрия, то происходит присоединение в положении 1,4. Первич-
ный продукт реакции С циклизуется самопроизвольно, что при-
водит к образованию 4-карбэтокси-5-стирилциклогександиона-
С8Н8СН=СНСН=СНСОСН3
XCIX
+
СН2 (СООС2Н5)2
,СН2СОСН3
—> с8н8сн=снСн
\снсоос2н5
СООС2НВ
СООС2Н5
I*
1,3 (I) [194, 210, 211]. Циннамилиденацетофенон также обра-
зует продукты присоединения в положении 1,4: с малоновым
эфиром и этилатом натрия [212] соединение II, а с ацетофено-
ном и едким кали в этиловом спирте [213] соединение III. Это
С8Н8СН=СНСНСН2СОС6Н8 СвН8СН=СНСНСН2СОС8Н5
I I
СН (СООС2Н5)2 СН2СОС8Н5
II III
не совпадает с поведением диметилового эфира циннамилиден-
малоновой кислоты (стр. 483), который претерпевает конденса-
* Нумерация формул после С снова начинается с 1 во избежание слож-
ных чисел.
Область применения реакции
217
цию в положении 1,6. Помимо аддукта III из циннамилиден-
ацетофенона и ацетофенона получают продукт реакции, на
образование которого расходуется 2 моля ацетофенона. При
конденсации циннамилиденацетофенона с ацетоуксусным эфи-
ром образуется соединение С28Н22Оз невыясненного строения
[212].
Большое внимание было уделено реакциям конденсации Ми-
хаэля с непредельными кетонами с двумя двойными связями
типа RCH = CHCOCH = CHR, например с дибензилиденацето-
ном (IV) [214—216] и дициннамилиденацетоном (V) [214]. Име-
ющиеся экспериментальные данные, приведенные в табл. IV,
показывают, что две двойные связи в дибензилиденацетоне под-
вергаются конденсации Михаэля независимо друг от друга.
СЙН6СН=СНСОСН=СНС6Н5
IV
С6Н6СН=СНСН=СНСОСН=СНСН=СНС6Н5
V
Если донор содержит два способных к енолизации атома водо-
рода, то часто наблюдается вторичная внутримолекулярная
стадия, которая приводит к образованию шестичленного кольца
(VI) [214]. Вещества типа дициннамилиденацетона, по-види-
мому, претерпевают конденсацию Михаэля путем присоедине-
ния в положении 1,4, а не 1,6 [214].
О О
II II
СНа(СООС2Н5)г ) >
н5свсн снсвн5 н5с6сн снсвн5
СН (СООС2Н6)2
о
II
—* Н5С6-(^^-С6НБ
н5с2ооб/\оос2нв
VI
Интересно сравнить реакционную способность двойных свя-
зей в несимметрично замещенных дибензилиденацетонах. В ди-
бензилиденацетоне хлор в положении 2, 3 или 4 [217] и мето-
ксильная группа в положении 4 [214] дезактивируют соседнюю
двойную связь, так что реакция Михаэля протекает со стороны
незамещенного бензольного кольца. При наличии атома хлора
218
111. Реакция Михаэля
в а-(3- или 4-хлорбензилиден)-р-(4'-метоксибензилиден) ацетоне
реакция протекает по двойной связи, примыкающей к хлориро-
ванному ядру. С другой стороны, гидроксильная группа в поло-
жении 2 или 4 бензольного ядра оказывает более сильное акти-
вирующее влияние, чем 2-метоксигруппа или атом хлора в
положении 3 или 4 [218—220].
Следует отметить, как это ни странно, что ацетоуксусный
эфир конденсируется с а- (4-диметиламинобензилиден) -0- (2-ок-
сибензилиден)ацетоном в присутствии едкого кали,. применяе-
мого в качестве катализатора, со стороны диметиламиногруппы,
тогда как этиловый эфир циануксусной кислоты с едким нат-
ром в качестве катализатора присоединяется со стороны 2-окси-
фенильного радикала [221]. То же различие наблюдается и
в двух других случаях, приведенных в табл. IV.
Гетероциклические а, 0-ненасыщенные кетоны (табл. VhVI).
Ввиду ароматического характера систем фурана а, p-ненасы-
щенные кетоны, содержащие фурильную группу, должны вести
себя подобно своим фенильным аналогам [133, 222—226]. Это
положение подтверждается примерами, приведенными в табл. V.
Однако характерным отличием является то, что в этих случаях
почти не происходит вторичных реакций циклизации или изоме-
ризации. В табл. V включено также несколько гетероцикличе-
ских соединений, которые не являются производными фурана.
В табл. VI приводится ряд других гетероциклических а, ₽-
ненасыщенных кетонов, причем большей частью типа ацилку-
марина [227—229]. Включено также несколько реакций, прове-
денных с 2- (п-метоксибензилиден) -4, 5-бензо-2,3-дигидрофура-
ноном-31230, 231] и -{-пироном [232]. Реакция i-пирона с мало-
новым эфиром протекает довольно сложно, однако можно
предположить, что первой стадией является конденсация Миха-
эля с образованием соединения VII, за которой следуют размы-
кание цикла и новая циклизация. Отщепление одной из карбэто-
ксильных групп делает возможной реакцию ароматизации с об-
разованием соединения VIII.
,О. НО СН (СООС2Н5)2 СООС2Н5
/ X_____________.11 I
СН СНСН (СООС2Н6)2
II I
СН сн2
сн2
СН
II
СН
II
о
В табл. VI включены также реакции конденсации Михаэля
между роданином и алкилиденроданинами. В этой реакции, из
Область применения реакции
219
роданина и алифатических альдегидов образуются а, а-бмс-(2-
тио-4-кетотетрагидро-5-тиазолил) алканы [233].
Циклоалкеноны и ацилциклоалкены (табл. VII). Реакции
конденсации Михаэля циклоалкенонов и 1-ацилциклоалкенов при-
ведены в отдельной таблице (табл. VII) ввиду важности про-
дуктов этих реакций для синтеза гидроаром этических поли-
циклических веществ, родственных стероидам и стероидным ал-
калоидам.
Аддукты, получаемые из ацетилциклоалкенов [90—106, 233—
235] претерпевают внутримолекулярную конденсацию с образо-
ванием полициклических систем, как это показано ниже на
примере реакций 1-ацетилциклогексена (IX) [100, 105].
О
/СОСНз /\/\
+ СН3СОСН2СООС2Н6 —>||| гн
\/\/_смз
1Х СООС2СН6
о о
Кроме того, в. табл. VII включено несколько случаев, в ко-
торых циклоалкилиденацетоны были подвергнуты реакции кон-
денсации Михаэля [236—240]. Здесь циклизация первичного
аддукта также протекает самопроизвольно, как это показано
на примере образования соединения X [238]. Как и во многих
других реакциях, остающаяся карбэтоксильная группа во время
процесса часто отщепляется.
/^/СНСОСНз /^/CHjCOCHa
I I + СН2 (СООС2Н6)2 —> | |\снсоос2н6
— - I
СООС2Н5
—v°
— и\_2о
।
COOC2HS
X
Реакции конденсации Михаэля с бксиметилен- и алкоксиме-
тиленциклоалканонами приводят к образованию интересных
циклических продуктов. Например, от продукта реакции, по-
лученного из 2-оксиметиленциклогексанона и цианацетамида
220
П1. Реакция Михаэля
(в присутствии пиперидина или диэтиламина) [241], отщепляется
молекула воды за счет амидной группы и карбонильной группы
циклогексанона. Гидроксил из оксиметиленовой группы также
отщепляется в виде воды, в результате чего образуется соедине-
ние XI (R=H, СНз).
СНОН
• H2N XI
Димеризация пиперитона [242] (XII), по-видимому, пред-
ставляет собой частный случай конденсации Михаэля. Метиль-
ная группа одной молекулы предоставляет водород для насы-
щения другой молекулы; таким образом, первая молекула ведет
себя как винилог метилкетона и не использует водород, имею-
щийся в орто-положении, что, возможно, обусловлено простран-
ственными затруднениями, вызванными изопропильной группой.
При этом образуются два стереоизомера. Строение димера пи-
перитона, который стабилизируется за счет образования водо-
родной связи между карбонильной и гидроксильной группами
[243], можно .установить по аналогии с данными, полученными
при расщеплении димера 3,5-диметилциклогексен-2-она-1 [244].
Область применения реакции
221
Реакции конденсации Михаэля* (видоизменение Робинсона)
(табл. VIII). Использование скрытой формы а, ^-ненасыщенного
карбонильного соединения, из которого это соединение обра-
зуется in situ, имеет важное практическое значение при работе
с нестойкими кетонами и для реакций конденсации, протекаю-
щих в жестких условиях. Хотя предельные ₽-хлоркетоны все же
применялись в качестве предшественников соответствующих
л, p-ненасыщенных кетонов [245], Робинсон и его сотрудники
[105, 246—248] ввели применение р-диалкиламинокетонов или их
четвертичных солей. Эти четвертичные соли постепенно разла-
гаются на диалкиламин или соль триалкиламмония и желаемый
а,р-ненасыщенный кетон. Эти исходные вещества легко могут
быть получены по реакции Манниха [249] из предельных кето-
нов и, если это необходимо, превращены в четвертичные соеди-
нения, как это показано ниже.
СН3СОСН3 —> CH3COCH2CH2N (СН3)2 —>
—> СН3СОСН2СН2К(СНз)31 —> СНэСОСН=СН2 + (СНз)зНН1
Хотя эти реакции включены в. число реакций конденсации
Михаэля (табл. VIII), еще не вполне ясно, протекают ли они
через промежуточную стадию образования а, р-ненасыщенных
кетонов [250]. Недавно в результате изучения этих реакций при-
шли к выводу, что непредельное промежуточное соединение,
как считал Робинсон, образуется всякий раз, когда имеется
атом водорода у .углеродного атома в p-положении к атому
азота *.
Реакция Михаэля, видоизмененная Робинсоном, нашла более
широкое применение после того, как было сделано наблюдение
[269], что в реакциях Михаэля 1-диалкиламино-2-нитроалканы
(основания Манниха, полученные из нитроалкачов) можно за-
менить соответствующими нитроолефинами.
R2NCH2CH (NO2) СН2СН3 ~± R2NH + СН2=С (NO2) СН2СН3
Другой вариант включает применение алкилтиогруппы вме-
сто диалкиламиногруппы. Так, 1-этилтиометил-2-нафтол реаги-
* Следует отметить, однако, что Брэдфорд и др. [251] наблюдали раз-
личия в реакции цианэтилирования иодометилатом цианистого р-диэтилами-
иоэтила по сравнению с цианэтилированием акрилонитрилом. Они предполо-
жили, что промежуточной стадией является образование положительного иона
МССН2СН®. Это объяснение наводит на мысль о связи между конденсацией
Михаэля и реакциями типичных доноров в реакции Михаэля с грамином
(₽-Диметиламинометилиндолом) н его производными [252—267],
222
III. Реакция Михаэля
рует как 1-метиленовое производное кетоформы 2-нафтола [170].
n-Хиноны и их производные (табл. IX). Как и во многих
других реакциях, например в синтезе Дильса — Альдера, n-хи-
ноны ведут себя в конденсации Михаэля как а, ₽-ненасыщенные
кетоны. Однако, хотя енолы, образующиеся при конденсации по
Михаэлю большинства а, ^-ненасыщенных кетонов, самопроиз-
вольно кетонизируются, енолы, образующиеся из хинонов, пред-
ставляют собой гидрохиноны и являются устойчивыми.
Некоторые продукты реакции, имеющие гидрохиноновую
структуру, легко окисляются in situ под действием избытка
исходного хинона, так что вновь образовавшийся хинон можег
подвергаться вторичной конденсацишМихаэля [270].
Другие гидрохиноны претерпевают циклизацию, в которой
принимает участие гидроксильная группа гидрохинона; при этом
образуется конденсированная гетероциклическая система. При-
Область применения реакции
223
мерой может служить образование лактона XV [271].
СН3
XV
В других случаях образуются не только изокумароны, но и
производные кумарина, например соединение XVI [272]. Если
СН3 СН3 XVI
реакция n-бензохинона с ацетоуксусным эфиром катализируется
хлористым цинком, то может образоваться моно- (XVII) или
О ОН ОН
Н3С—у О
СзНзООС-J^^
XVIII
224
111. Реакция Михаэля
бис-производное (XVIII) [273—275]. Циклизация происходит и
в том случае, когда бензохинон реагирует с иминомасляным
эфиром (этиловым эфиром ₽-аминокротоновой кислоты).
Если в качестве растворителя взять ацетон или абсолютный эти-
ловый спирт, то образуется 2-метил-3-карбэтокси-5-оксииндол
I I
ЧАО
СН2СООС2Н5
I
ссн3
HN
-СНСООС2Н6
I
ССНз
^,СООС2Н5
н
XIX
(XIX) [276]. Тем же путем получен М-фенил-2-метил-З-карбэто-
кси-5-оксииндол из этилового эфира p-аминокротоновой кислоты
и соответствующее N-карбэтоксиметильное соединение из эти-
лового эфира |3-(карбэтоксиметиламино) кротоновой кислоты.
Обычно атаке аниона, который является донором, подвер-
гается лишь незамещенный атом углерода в кольце хинона, что,
возможно, зависит от пространственных затруднений. Так, три-
замещенные хиноны претерпевают только моноконденсацию [272,
277, 278]. Однако четырехзамещенный хинон может вступать в
реакцию конденсации Михаэля [279—281]. Вещество, подобное
дурохинону (XX), вероятно, реагирует в таутомерной форме (ко-
торая считается промежуточной в «димеризации» этого хинона)
[282]. Очевидно, в этом случае пространственные затруднения
будут меньше, чем при реакции в нормальной форме.
Было показано, что один из метиленхинонов (1-метилен-1,2-
нафтохинон, XXI) вступает в реакцию Михаэля с малоновым
эфиром, но выход продукта реакции при этом небольшой. В этом
случае также происходит циклизация и образуется этиловый
Область применения реакции
225
эфир 5,6-бензо-З,4-дигидрокумарин-З-карбоновой кислоты
(XXII) [283].
СООС2Н6
XXI XXII
Сложное видоизменение реакции Михаэля с участием и-хи-
нонов наблюдалось при конденсации 1,4-нафтохинона (см. [279])
с ацетоуксусным эфиром в присутствии пиридина и солянокис-
лой соли пиридиния [284] (ср. [285]) *. Конечный продукт реак-
ции образуется после отщепления ацетильной группы от остатка
ацетоуксусного эфира'; поэтому тот же продукт (1-карбэтокси-2,
3-фталоилпирроколин, XXIII) получен и при использовании эти-
лового эфира бензоилуксусной кислоты. Течение реакции можно
представить следующим образом:
О ОН О
II I II
//\/\ п J\/\
I II II > I II | СНСООС Н —Окисление | || || рыроор и
\/\„афтохиноном^ ~
|1 | I || I
О СОСНэ £ СОСН3
Окисление
ОДЛ-НС!
XXIII
Низкий выход (14%), а также образование из 2-бром- и
2,3-дихлорнафтохинона и 1,4-нафтохинон-2-сульфоната[287] од-
ного и того же продукта реакции в результате потери полярных
* Изохинолин обладает реакционной способностью, вполне сравнимой
с реакционной способностью пиридина. Хинолин сравнительно малоактивен, и
продукты реакции, которые, как описано в работе [284], образовались из хи-
нолина в действительности, как это было доказано, образовались из изо-
хинолина, который присутствовал в исходном хинолине в качестве примеси
226
///. Реакция Михаэля
заместителей объясняются сложностью течения реакции. Соглас-
но данным СурианарайанаиТилака [288] 2,3-дихлорнафтохинон
при конденсации с малоновым эфиром и с этиловым эфиром
бензоилуксусной кислоты образует одно и то же соединение
(XXIII). Первоначально авторы приписали этому соединению
формулу XXIV, но позднее отказались от нее в пользу фор-
мулы XXIII [289—292]. Далее они обнаружили, что при конден-
сации 2,3-дихлор- 1,4-нафтохинона с ацетоацетанилидом в пири-
дине в результате частичного расщепления боковой цепи может
отщепиться ацетильная или анилидная группа и, таким обра-
зом, образуются соединения XXV и XXVI. Соединение XXVI
образуется также, если вместо незамещенного анилида исполь-
зуется ацетоацет-о-хлоранилид, ацетоацет-о-толуид или 2-(аце-
тоацетамидо)-6-этоксибензотиазол.
Аналогичная реакция наблюдалась при конденсации ацето-
уксусного эфира в пиридине с хлоранилом или 2,6-дихлорхино-
ном. В результате этой реакции образовалась смесь соединений
XXVII А и XXVII Б. Строение соединения XXVII А было дока-
зано его синтезом из тетраэтилового эфира 2,5-дихлорхинон-3,6-
дималоновой кислоты и ацетоуксусного эфира в пиридине.
XXVII А
XXVII Б
Область применения реакции
Хлоранил вступает также в реакцию Михаэля с P-нафтолом
и 2-окси-З-нафтанилидом. Эти доноры реагируют в своих тау-
томерных кетоформах, как и в ряде других случаев (см.
стр. 210), и вызывают потерю атомов галоидов, что приводит
к образованию соединений следующего типа:
(R=H, CONHC6HS)
Акрилонитрил, другие «.^-ненасыщенные нитрилы и их амиды
(табл. X, XI, XII). Акрилонитрил более широко применялся в
качестве акцептора в синтезах Михаэля, чем какое-либо другое
производное а, p-ненасыщенных кислот. Реакция с акрилонитри-
лом использовалась не только для препаративных целей, но и
для исследования органических молекул на наличие енолизую-
щихся атомов водорода. Литература по этому вопросу приве-
дена в табл. X. В эту таблицу включены данные, начиная с ран-
него обзора реакции цианэтилирования [293] вплоть до послед-
него времени.
На основании данных табл. X можно сделать некоторые ин-
тересные обобщения. В алифатических метилкетонах метановая
группа, соседняя с карбонилом, более реакционноспособна, чем
метиленовая группа, а метиленовая группа более реакционно-
способна, чем метильная группа [294—296]. В циклогексаноне и
2-замещенных циклогексанонах первым реагирует с акрилони-
трилом водород в положении 2 [126, 294, 297, 298], когда же в
положении 2 не остается подвижного водорода, атака нитрила
направляется на положение 6 [294, 298]. В арилметилкетонах
все три водородных атома метильной группы реагируют с акри-
лонитрилом последовательно [296].
По имеющимся данным [129, 299—301], при взаимодействии
нитрометана и нитроэтана с акрилонитрилом продукты реакции
образуются с различными выходами. С другой стороны, дини-
трометан легко образует бис- (цианэтил) динитрометан, от кото-
рого отщепляется одна нитрогруппа, а продукт расщепления
вступает в реакцию с третьей молекулой акрилонитрила и обра-
зует три(цианэтил) нитрометан [838].
СН2 (NO2)2 —> (NCCH2CH2)2 С (NO2)2 Гидр0*"3-» (NCCH2CH2)2 CHNO2 —>
XXVIII
—>• (NCCH2CH2)3 cno2
15*
228
III. Реакция Михаэля
Способность некоторых а, P-ненасыщенных карбонильных и
карбоксильных соединений к таутомерии с образованием ₽, 7-не-
насыщенных форм при взаимодействии с акрилонитрилом увели-
чивается. Например, из окиси мезитила получаются моно- и бис-
аддукты [302, 303] (ср. [791]). Формула бис-аддукта XXIX была
установлена путем расщепления. Для моноаддукта Брусон и
Ринер предложили строение а, p-ненасыщенного соединения
XXX, так как при гидролизе из него образуется соединение
XXXI. Однако доказательство не исключает возможности того,
что при гидролизе двойная связь перемещается в а, (3-поло-
жение и что правильной структуре соответствует формула
XXXII. Во всяком случае, формула XXXII несомненно отвечает
структуре первичного продукта взаимодействия акрилонитрила
с окисью мезитила.
CH2CH2CN
СН2=С (СН3) ССОСНз
\hsch2cn
(СН3)2 с=ссосн3
I
ch2ch2cn
XXIX
(СН3)2 с=ссосн3
I
СН2СН2СООН
XXXI
XXX
СН2=С (СНз) СНСОСНз
ch2ch2cn
XXXII
Пересматривая свою первоначальную точку зрения [302] на
реакцию изофорона с акрилонитрилом, Брусон и Ринер полу-
чили моно-, бис- и трипианэтильные производные (XXXIII—
XXXV) изофорона, которым они приписали следующие струк-
туры (R = CH2CH2CN) [304]. Однако было показано [305], что
XXXIII XXXIV XXXV
XXXVI XXXVII XXXVIII
монопроизводному отвечает формула XXXVI, поскольку в ре-
зультате озонирования из него была получена 3,3-диметил-5-ке-
Область применения реакции
229
токапроновая кислота (XXXVII) (после омыления нитрильной
группы), тогда как соединение XXXIII должно было бы дать
соединение XXXVIII. Как и в случае с окисью мезитила
(стр. 228), в реакцию вступает таутомерная форма (XXXIX)
СНз^СНз СН3\/СН8
н2с=1ч/1=о к H2C=(^J=O
H/XR
XXXIX
XL
изофорона; первичным продуктом этой реакции является соеди-
нение XL, которое затем изомерйзуется в а, P-ненасыщенный ке-
тон. Брусон и Ринер на основании спектров поглощения в ин-
фракрасной области бис- и трис-продуктов этой реакции пред-
ложили следующие формулы [304] для моно-, ди- и трицианэти-
лированных продуктов этой реакции соответственно. Алкилиро-
вание изофорона протекает аналогичным образом [306].
СНзх/СН3 сн34/,сн3 СН3х/СН3
X = 6,05 X = 5,90 X «= 5,90
2-Этилгексен-2-аль (XLI) реагирует с нитрилом кротоновой
кислоты и р, p-диметилакрилонитрилом также в р, ^-изомерной
форме.
СН3СН2СН2СН=С (С2НБ) СНО СН3СН2СН=СНСН (С2Н5) СНО
XLI
Представляет интерес поведение таких соединений, как, на-
пример, инден (XLII) [307], который дает трицианэтильное
производное. Приходится предположить, что первичные продукты
реакции перегруппировываются с образованием новой реакци-
онноспособной метиленовой группы. Аналогичным образом из
циклопентадиена образуется гексацианэтильное производное.
XLU
R=—CH2CH2CN
230
III. Реакция Михаэля
Предполагалось, что реакции диметилбензофульвена (XLIII),
который образует монопроизводное XLIV, предшествует изоме-
ризация.
XLIV
Койевая кислота (XLV) представляет пример, в котором
енольная гидроксильная группа реагирует в таутомерной кето-
форме [186]; после гидролиза продуктом этой реакции является
производное койевой кислоты (XLVI) с остатком пропионовой
кислоты в положении 6.
XLVI
Значительно меньше изучены реакции Михаэля с другими
непредельными нитрилами. Имеющиеся данные, приведенные в
табл. XI, касаются главным образом нитрила коричной кислоты
[34, 308, 309] и цианистого аллила [34, 84, 129, 310], который изо-
меризуется в нитрил кротоновой кислоты под действием щелоч-
ных реагентов, применяемых в качестве катализаторов при кон-
Область применения реакции
231
денсации Михаэля. В табл. XI включены также некоторые дан-
ные о реакциях 1-цианбутадиена [98, 311, 312]. В противопо-
ложность а, р, 7,8-двуненасыщенным кетонам (см. стр. 216)
конденсация по Михаэлю l-цианбутадиена с нитроалканами
происходит в положении 1,6 с образованием нитрилов ₽,7-нена-
сыщенных кислот [312].
Можно было ожидать, что амиды а, (З-ненасышенных кислот
будут реагировать аналогично нитрилам. Акриламид в присут-
ствии гидроокиси бензилтриметиламмония присоединяет одну
молекулу 2-нитропропан% [313], а амид коричной кислоты кон-
денсируется с натриймалоновым эфиром с образованием нор-
мального аддукта 1:1, из которого в результате циклизации
образуется этиловый эфир 2,6-дикето-4-фенилпиперидин-3-кар-
боновой кислоты (XLVII) [314]. Однако в изученных реакциях
(табл. XII) акриламид, по-видимому, не обладает какими-либо
особыми преимуществами для использования его в синтезе [315].
C6H5CH=CHCONH2
+
СН2 (СООС2Н6)2
Эфиры а, [3-ненасыщенных кислот алифатического ряда
(табл. XIII, XIV, XV). Реакции конденсации Михаэля, которые
проводились с эфирами а, P-ненасыщенных кислот алифатиче-
ского ряда (табл. XIII), показали, что активация, вызываемая
карбалкоксигруппой, слабее активации нитрогруппой.
Целый ряд эфиров предельных а- и ₽-оксикислот реагирует
с этиловым эфиром циануксусной кислоты так, как-будто вна-
чале они дегидратируются с образованием эфиров а, р-ненасы-
щенных кислот, которые уже затем претерпевают конденсацию
Михаэля [316]. То же самое относится и к некоторым циангидри-
нам [317]. Поскольку механизм этих реакций точно не выяснен,
они не включены в табл. XIII. Формально можно считать
также, что димеризация метилакрилата и этилакрилата [5,
318—320] протекает по реакции Михаэля, но, вероятно, по дру-
гому механизму.
Наоборот, автоконденсация диэтилового эфира глутаконовой
кислоты (XLVIII) под влиянием этилата натрия представляет
собой типичную конденсацию Михаэля. Мо’жно считать, что та-
кая автоконденсация включает промежуточную стадию, на ко-
торой происходит перемещение двойной связи. Часть продукта
реакции ароматизируется в результате отщепления этилацетата
232
111. Реакция Михаэля
с образованием диэтилового эфира 4-оксиизофталевой кислоты
С2Н6ООССН2СНСН2СООС2Н6
2С2НБООССН2СН=СНСООС2НБ —> | ->
XLVIII С2Н6ООССНСН=СНСООС2Н5
С2Н6ООССН2СНСН2СООС2НБ
С2Н6ООСС=СНСН2СООС2Н6
СН2СООС2НБ
СН2СООС2НБ
СООС2Н6
СООС2Н6
XLIX
СООС2Н6
(XLIX) [321]. Таким образом, одна молекула глутаконовой кис-
лоты действует в качестве донора, а другая — в качестве акцеп-
тора. (Под влиянием металлического натрия происходит кон-
денсация Кляйзена [322].) Такое же толкование применимо и к
автоконденсации триметилового эфира пропилен-2, 3,3-трикар-
боновой кислоты. В этом случае автоконденсация состоит из
двух последовательных конденсаций Михаэля. В результате
первой конденсации образуется эфир с открытой цепью L, в то
время как вторая конденсация является внутримолекулярной и
приводит к образованию циклического соединения LI [323].
Н2С=С (СООСНз) СН (СООСН3)2
+
(СН3ООС)2 СНС (СООСН3)=СН2
сн2
СН3ООС(^ СН (СООСН3)2
(СН3ООС)2 С СНСООСНз
\112
/х /СООСНз
СН3ООС—f X
сн3оосч хсоосн3
>1 !—СООСНз
CH3OOCZ
При присоединении этилового эфира 5-метилциклопентанон-
2-карбоновой кислоты к этиловому эфиру кротоновой кислоты
происходит перемещение а-водородного атома, находящегося в
Область применения реакции
233
положении 2, а не в положении б, как это ошибочно указыва-
лось в рефератах [324, 325].
При конденсации ацетоуксусного эфира и диэтилового эфира
ацетон-1,3-дикарбоновой кислоты с образованием диэтилового
эфира 3,5-диокситолуол-2,4-дикарбоновой кислоты [326] реак-
ции Михаэля не происходит.
В табл. XIV приведены реакции эфиров р-окси-, р-этокси- и
p-аминопроизводных а, p-ненасыщенных кислот. Эти реакции
обычно сопровождаются отщеплением p-заместителя (в виде
воды, спирта или аммиака соответственно). Например, при кон-
денсации этилового эфира Р-этоксиакриловой кислоты с метил-
малоновым эфиром при каталитическом действии этилата бен-
зилтриметиламмония ожидаемый триэфир LII подвергается эта-
нолизу до диэтилового эфира угольной кислоты и диэфира LIII,
а диэфир разлагается далее на этиловый спирт и непредельный
эфир LIV [327].
СН2СООС2Н5
I
СНОС2Н6
I
СН3С (СООС2Н6)2
LII
СН2СООС2Н5 СНСООС2Н3
I II
СНОС2Н6 СН
I I
СН3СНСООС2Н5 CH3CHCOOC2HS
LIII LIV
Очень сходно и поведение диэтилового эфира 2-этоксиэтилен-
1,1-дикарбоновой кислоты LV [328—330]. С нитрометаном и вто-
ричными основаниями эфир LV претерпевает реакцию, которую
рассматривали как реакцию Михаэля с последующим расщеп-
лением продукта реакции согласно приведенной ниже схеме
[331]. В результате этой реакции получены 2-пиперидино- и 2-
морфолино-1-нитроэтилен с выходом 40 и 34% соответственно.
Аналогичным образом из диэтилового эфира 2-этоксипропилен-
1,1-дикарбоновой кислоты получены 2-пиперидино- и 2-морфо-
лино-1-нитропропен с выходом 21 и 40% соответственно.
С2Н6ОСН=С (СООС2Н6)2 + CH3NO2 —> C2HSOCHCH (СООС2Н6)2
I
LV CH2NO2
—> R2NCH=CHNO2 + CH2 (COOC2H6) + C2H6OH ,
p-Аминогруппа отщепляется не всегда. Этиловый эфир р-ами-
нокротоновой кислоты [332, 333] и этиловый эфир а-метил-р-ами-
нокротоновой кислоты [334] взаимодействуют с малоновым эфи-
ром в присутствии этилата натрия с образованием производны^
234
///. Реакция* Михаэля
пиридина LVL Однако это не реакция Михаэля.
Интересно отметить, что сухой этилат натрия или металли-
ческий натрий вызывают непосредственную конденсацию диэти-
лового эфира цитраконовой кислоты (LVII), тогда как в спир-
товом растворе этилата натрия вначале происходит изомериза-
ция с образованием диэтилового эфира итаконовой кислоты
С2Н5ООСС (СН3)=СНСООС2Н6 С2Н6ООСС (=СН2) СН2СООС2Н6
LVII LVIII
(LVIII), а затем уже конденсация Михаэля [335]. Следует отме-
тить также, что при присоединении ацетоуксусного эфира, ме-
тилацетоуксусного эфира или этилового эфира циануксусной
кислоты к диэтиловому эфиру цитраконовой кислоты а-водород-
ный атом донора присоединяется к неметилированной стороне
непредельного эфира [336], в то время как при присоединении
малонового эфира к непредельному эфиру водород присоеди-
няется по метилированной стороне. К диэтиловому эфиру меза-
коновой кислоты малоновый эфир присоединяется в том же на-
правлении. Эта реакция является единственным примером ис-
пользования этого транс-соединения в качестве акцептора [337]
в конденсации Михаэля.
В конденсации Михаэля эфиров поликарбоновых кислот вы-
являются две тенденции. Во-первых, высокозамещенные продук-
ты реакции склонны к диссоциации на более простые вещества
путем отщепления некоторых небольших молекул, например
этилового спирта или малонового эфира, с образованием двой-
ной связи [325, 328—341]. Во-вторых, такие аддукты, содержа-
щие енолизующийся водородный атом и подходящую структуру
акцептора, претерпевают внутримолекулярную конденсацию
Михаэля с образованием шестичленного цикла. По имеющимся
Область применения реакции
235
данным, из тетраэтилового эфира пропилен-1,1,3,3-тетракарбо-
новой кислоты под влиянием пиперидина или этилата натрия
образуется производное циклобутана LIX [341—343]. Пиперидин
превращает диэтиловый эфир З-цианпропилен-1, 3-дикарбоновой
кислоты и диэтиловый эфир 4-цианбутилен-2,4-дикарбоновой ки-
слоты соответственно в циклобутановые производные LX и LXI
[342, 343]. Однако недавно было показано [344, 345], что при
(С2Н6ООС)2 СНСН—С (СООС2Н6)2
I I
(С2Н6ООС)2 С--СНСН (СООС2Н6)2
LIX
С2Н5ООС (CN) С--СНСН2СООС2Н5
С2Н6ООССН2СН—С (CN) СООС2Н5
LX
С2Н5ООС (CN) С--СНСН (СНз) СООС2НБ
I I
С2Н5ООС (СНз) НССН—С (CN) СООС2Н5
LXI
реакции диэтилового эфира ацетилендикарбоновой кислоты с
тетраэтиловым эфиром этан-1, 1,2, 2-тетракарбоновой кислоты
образуется не производное циклобутана, а гексаэтиловый эфир
бутен-1, 1, 2, 2, 3,4-гексакарбоновой кислоты.
В табл. XV приводятся имеющиеся данные о поведении али-
фатических диеновых сложных эфиров и триенового эфира в
конденсации Михаэля. В случае диеновых эфиров преобладает
присоединение в положение 1,6 по сравнению с присоединением
в положение 1,4; в случае триеновогр эфира преобладает при-
соединение в положение 1,8. Однако это справедливо лишь для
тех эфиров, в которых полярные группы расположены несиммет-
рично по отношению к двойной связи; диалкиловые эфиры слизе-
вой кислоты ROOCCH = CHCH = CHCOOR претерпевают исклю-
чительно присоединение в положение 1,4 и образуют соединения
ROOCCH = CHCHR'CH2COOR [346].
Эфиры а, [3-ненасыщенных кислот алициклического и аро-
матического рядов (табл. XVI и XVII). С соединениями али-
циклического ряда было осуществлено небольшое число реак-
ций конденсации Михаэля (ъабл. XVI). Эти реакции протекают
нормально и представляют интерес только в том отношении, что
реакции этилового эфира циклопентенкарбоновой кислоты с
ацетоуксусным эфиром и с малоновым эфиром приводят к об-
разованию продуктов реакции исключительно транс-формы [99].
236
III. Реакция Михаэля
Как указано на стр. 200, о стереохимии реакции Михаэля из-
вестно сравнительно мало.
В ароматическом ряду изучено еще меньшее число реакций
(табл. XVII). Ацетофенон вступает в реакцию конденсации Ми-
хаэля с метиловым и этиловым эфирами коричной кислоты. Од-
нако с этой реакцией конкурирует конденсация Кляйзена между
теми же реагирующими веществами, протекающая под влия-
нием амида натрия или металлического натрия. Ацетон вступает
с алкильными эфирами коричной кислоты только в реакцию
Кляйзена [347, 348].
Три диеновых эфира, которые были изучены, не дают какой-
либо определенной картины. В двух из них происходит присое-
динение в положение 1,6, а в одном — в положение 1,4, хотя нет
никакого явного различия ни в строении непредельного эфира,
ни в условиях проведения реакции [63, 210, 211, 349].
Эфиры о-замещенных а, ^ненасыщенных кислот ароматиче-
ского ряда обладают идеальной структурой для внутримолеку-
лярной конденсации Михаэля. Если в орто-положение по отно-
шению к группе непредельного эфира ввести заместитель, со-
держащий способный к енолизации атом водорода на подходя-
щем расстоянии от кольца, то легко может образоваться бицик-
лическая система. Эта возможность была использована в случае
веществ общей формулы LXII для синтеза таких бициклических
систем, как LXIII, где X = О, S или N-алкил. Соответствующие
данные составляют вторую часть табл. XVIII, в которую вклю-
чен также аналогичный случай из алициклического ряда.
CHCOOR
11 CH2COOR
LXII LVIII
Эфиры ненасыщенных кетонокислот (табл. XIX). В табл.
XIX собраны весьма немногочисленные данные, относящиеся к
конденсации Михаэля непредельных кетоэфиров, в которых
двойная связь активирована как кетогруппой, так и сложно-
эфирной группировкой [8, 132, 330, 350, 351]. Интересно
отметить, что в эфирах типа RCOCH = CHCOOR' кетогруп-
па образует более устойчивый карбанион, чем сложноэфир-
ная группировка: конденсация Михаэля с донором R"H при-
водит к образованию продукта реакции, имеющего строение
RCOCH2CHR"COOR'.
Область применения реакции
237
С теоретической точки зрения внутримолекулярная конден-
сация Михаэля о-ацетильных производных коричной кислоты
вполне осуществима. Действительно, было установлено, что ме-
тиловый эфир о-ацетилкоричной кислоты реагирует с метилатом
натрия, но ожидаемый продукт реакции LXIV не удалось выде-
лить в чистом виде [352].
СН2СООСН3
И
О
LXIV
Ароматические а, р-ацетиленовые эфиры (табл. XX). В аро-
матическом ряду, как и в алифатическом, ацетиленовая связь
в сочетании со* сложноэфирной группировкой ведет себя в кон-
денсации Михаэля подобно двойной связи (табл. XX). В неко-
торых случаях нельзя точно установить строение аниона первич-
ного продукта реакции конденсации. Например, наблюдалось,
что конденсация этилового эфира фенилпропиоловой кислоты
с малоновым эфиром при использовании раствора этилата нат-
рия в этиловом спирте, а также металлического натрия в бен-
золе приводит к образованию различных анионов, для которых
приведены формулы LXV и LXVI [32, 33, 353, 354]. Этот вопрос
рассмотрен на стр. 185.
[с2Н6ООССН=С (C6HS) С (COOC2H6)J Na®
k2H6OOCC=C (С6Н6) СН (COOC2H5)J Na®
LXVI
Часто считалось, что реакция между ацетиленовыми эфирами
и такими веществами, как 2-пиколин или хинальдин, предста-
вляет собой особый случай конденсации Михаэля, хотя компо-
ненты реагируют друг с другом в соотношении 2:1. Диэтило-
вый эфир ацетилендикарбоновой кислоты и 2-пиколин образуют
диен с сопряженными связями LXVII; соответствующий димети-
сн2е—с(соое2н5) с=снсоос2н5
соос2н5 COOC2Hs
LXVU
238
П1. Реакция Михаэля
ловый эфир образует с 2-хинальдином аналогичный, но более
сложный продукт реакции LXVIII [355—357].
Известно, что в реакции Дильса — Альдера ацетиленовые
соединения часто образуют подобные димеры, которые фор-
мально считаются промежуточными продуктами реакции [358].
Олефины с заместителями у гетероатомов (N, S, Р;табл. XXI,
XXII и XXIII). Нитрогруппа активирует двойную связь, с кото-
рой она связана, так же, как и соседние атомы водорода.
В табл. XXI указаны реакции конденсации Михаэля с а, 0-нена-
сыщенными нитросоединениями. В эту таблицу включены также
данные, относящиеся к оксиметиленнитроацетальдегиду (еноль-
ная форма нитромалонового диальдегида LXIX). Это соедине-
ние реагирует с многими молекулами доноров, включая даже
алифатические кетоны, с образованием производных 4-нитрофе-
нола [123, 360—364]. Показательна реакция с метилэтилкетоном.
СНОН
//
O2NC
I +
сно
LXIX
СНОН
сн2сн3 —> o2n6h \нсн3 —>
I I I
со сно со
СНОН
Активирующая способность нитрогруппы настолько велика, что
о- и n-нитростиролы могут участвовать в реакциях Михаэля и
+ СН3СОСН2СООС2НБ —>
СН2СН2СН (СОСН3) СООС2НВ
NO2
в качестве акцепторов. Формально присоединение донора проис-
ходит соответственно в 7,8- и е, g-положения активированной не-
насыщенной системы [365].
По-видимому, связь S = О в сульфоокисях и сульфонах
(табл. XXII) обладает достаточной двоесвязностью, чтобы нахо-
диться в сопряжении и активировать соседние двойные углерод-
углеродные связи [366—377]. В свези с этим следует отметить,
что 112-бнс-(арилсульфонил)этилены представляют собой весь-
Область применения реакции
239
ма активные диенофилы [378] и что винилсульфоны присоеди-
няют ароматические углеводороды в присутствии хлористого
алюминия таким же образом, кек а, p-ненасыщенные кетоны
[379]. Магнийорганические и литийорганические соединения так-
же присоединяются к а, р-ненасыщенным сульфонам в 1,4-поло-
жение [380].
В табл. XXII указаны также реакции Михаэля N, N-диэтил-
винилсульфонанилида [381] и представляющие интерес реакции
конденсации бромистого винилдиметилсульфония с ацетоуксус-
ным и малоновым эфирами [22].
Реакции, в которые вступает диэтиловый эфир винилфосфи-
новой кислоты СН2 = СНРО(ОС2Нв)2— недавно открытый тип
акцептора в реакции Михаэля — собраны в табл. XXIII. Уже
было указано (стр. 204), что соединения, содержащие фосфо-
новую группу, обладают достаточно активными атомами водо-
рода, чтобы служить донорами в конденсации Михаэля. Реак-
ция, о которой идет речь, приводит к предположению, что связь
Р = О подобно связи S = О способна образовывать с соседней
двойной связью сопряженную систему.
2- и 4-Винилпиридины (табл. XXIII). Хотя по существу нет
исследований, в которых говорилось бы о способности системы
с открытой цепью С = С—C = N претерпевать конденсацию Ми-
хаэля (см. стр. 206), поведение 2- и 4-винилпиридинов показы-
вает, что по крайней мере в определенных условиях эта система
образует типичные продукты реакции Михаэля. Изученные реак-
ции * этого ^ипа помещены в табл. XXIII.
Фульвены. Расчеты, а также физические и химические дан-
ные показывают, что фульвены, представленные формулой LXX,
О
с®
II
с®
LXX
обладают полярной двойной связью [382, 383]. Поэтому не уди-
вительно, что фульвены являются акцепторами в конденсации
Михаэля. Экспериментальные данные по этому вопросу немно-
гочисленны [384, 385], и пока только флуорены были исследо-
ваны в качестве доноров. Так,^ дибифениленэтилен (LXXXI)
присоединяет флуорен под влиянием едкого натра, применяе-
мого в качестве катализатора, и образует трибифениленпропан
(LXXII) с выходом 82%. Такая же реакция может происходить
♦ О присоединении енолизующихся соединений к самой С=Ы-связи см.
₽ работах [166, 164].
240
/11. Реакция Михаэля
между 2,7-днбромфлуореном и 2,7,2', 7'-тетрабромдибифенилен-
Следует ожидать, что эти высокозамещенные системы будут
обладать большой склонностью к диссоциации (такого типа, по
которой декафенилбутан диссоциирует на пентафенилэтил) [386].
Таким образом можно объяснить сделанное наблюдение, что
9-аминофлуорен (LXXIII) реагирует с дибифениленэтиленом
(LXXV) в присутствии аммиака и образует дибифениленэтан
(LXXV) и имид флуоренона (LXXVI) по приведенному ниже
уравнению. Аналогично ведет себя 9-флуоренол. Было найдено,
что при реакции 2,7,2/,7'-тетрабромдибифениленэтилена и флуо-
рена образуются дибромпроизводное LXXVII и 2,7-дибромфлуо-
рен; эту реакцию можно представить как ряд реакций конден-
сации и стадий диспропорционирования.
2, 7-Дибромфлуорен и дибифениленэтилен дают при исполь-
зовании этилата натрия в качестве катализатора а-(2,7-ди-
LXXIII LXXIV
LXXV LXXVI
Область применения реакции
241
бромбифенилен)-р, i-ди^ифенилейпропан (LXXVII) с выходом
58%. Если же в качестве катализатора использовать едкое кали
и пиридин, то в результате реакции образуется а, р-бис- (2, 7-ди-
бромбифенилен) -7-бифениленпропан (LXXVIII). При термиче-
ском разложении этих двух соединений наряду с другими сое-
динениями образуются 2,7-дибромдибифениленэтилен, 2,7-ди-
бромдибифенилэтан, 2,7,2', 7'-тетрабромдибифениленэтилен и
2,7,2', 7'-тетрабромдибифениленэтан.
Второе,производное фульвена, применявшееся в конденсации
Михаэля в качестве акцептора, — это бензилиденфлуорен
(LXXIX), который присоединяет флуорен (реакция протекает
на 70%) под влиянием смеси пиридина и водного раствора
едкого натра. В соответствии с направлением дипольного мо-
мента в семициклической двойной связи фульвенов продуктом
реакции является ал-дибифенилен-р-фенилпропан (LXXX) [387].
СНС6Н6
LXXIX
LXXX
Не удивительно, что формилфлуорен, т. е. 9-оксиметилен-
флуорен, также способен вступать в конденсацию Михаэля
(см. стр. 219, 231). Формилфлуорен в результате реакции с ма-
лоновой кислотой превращается (с от(цеплением воды и дву-
окиси углерода) в р-(9-флуоренилиден)пропионовую кислоту
(LXXXI) с выходом 11% [388].
СНСН2СООН
LXXXJ х
242
III. Реакция Михаэля
СИСТЕМЫ, НЕ ВСТУПАЮЩИЕ В РЕАКЦИЮ КОНДЕНСАЦИИ
Ниже приводятся системы, которые не дали продуктов реак-
ции конденсации Михаэля. Соединения указаны в порядке уве-
личения числа атомов углерода в молекуле акцептора.
Акрилонитрил и диэтиловый эфир ацетоянтарной кислоты [389].
Метилвинилсульфон и этиловый эфир фенилуксусной кисло-
ты, ацетофенон или бензил-п-толилсульфон [130].
Метилвинилкетон и «кетон Инхоффена» [390].
Метилизопропенилкетон и циклопентанон [391].
Ацетилацетон и хлорацетамид, фенилацетамид, цианистый
бензил [392] или а-цианпропионамид [393].
Этиловый эфир акриловой кислоты и 3-ацетилоксиндол или
1-метил-З-ацетилоксиндол [394].
Метиловый эфир кротоновой кислоты и нитропропан в при-
сутствии диэтиламина [395].
. Окись мезитила и 2-хинальдин [396].
Кротоновый альдегид и N-(1,3-диметилбутил идеи)-1,3-диме-
тилбутиламин [397].
Этиловый эфир кротоновой кислоты и 2,7-дибромфлуорен
[398].
n-Бензохинон и этиловый эфир N-ацетил-р-аминокротоновой
кислоты или диэтиловый эфир аминометиленмалоновой кислоты
[399].
З-Метилциклопентен-2-он и ацетоуксусный эфир [400].
Этиловый эфир а-ацетамидоакриловой кислоты и оксин-
дол [401].
1-Ацетилциклогексен и 6-метокси-9-метил-1-кето-1,4,5,6,7,8,
9,10-октагидронафталин [402].
Метиловый эфир 5-метилгексен-2-овой кислоты или б-метил-
сорбиновой кислоты и диметиловый эфир малоновой кислоты
или метиловый эфир циануксусной кислоты [403].
' 1-Ацетил-2-метилциклогексен с различными реагентами
[404—409].
Триметилхинон и диацетил или его полуацеталь [410].
Метиловый эфир а-циан-р-метилсорбиновой кислоты и мети-
ловый эфир циануксусной кислоты [403].
Этил-р-диэтиламиновинилкетон и 2-метилциклогексанон [411].
Монометилимин триметилхинона и 3,3-диметоксибутанон-2
[4Ю].
Метил-2-оксистирилкетон и этиловый эфир щавелевоуксус-
ной кислоты, этиловый эфир циануксусной кислоты или малоно-
вый эфир [45].
Метил-а-циклогексилиденэтилкетон и малоновый эфир [412].
4-Фенил-2-метиламинобутен-2-он-4 и этиловый эфир цианук-
сусной кислоты [413]. /
Область применения реакции
243
Диэтиловый эфир пентен-1-дикарбоновой-1,3 кислоты и эти-
ловый эфир циануксусной кислоты [414].
Этиловый эфир коричной кислоты или бензилиденмалоновый
эфир и флуорен или 2,7-дибромфлуорен [398].
Диэтиловый эфир 2-ацетилгексен-2-диовой-1,6 кислоты и
тетралон-1 или 6-метокситетралон-1 [222, 415].
2-Диметиламино- или 2-морфолинобензосуберон или их
иодометилаты и диацетил или его моноксим [416].
З-Фенил-5,5-диметилциклогексен-2-он и малоновый эфир,
этиловый эфир циануксусной кислоты или нитрометан [417].
З-Бензилиден-6-формилциклогексанон и 5-диэтиламинопен-
тандион-2,3-моноксим-3 и его иодометилат [416].
Бензилиденацетофенон и диэтиловый эфир цианмалоновой
кислоты, этилмалоновый эфир [418], бутилмалоновый эфир или
фенилмалоновый эфир [137].
л4-или п-Нитробензилиденацетофенон и флуорен [398].
а-Цианстильбен и этиловый эфир фенилуксусной кислоты [89].
Диэтиловый эфир циннамилиденмалоновой кислоты и мети-
ловый эфир циануксусной кислоты [419].
ip/c-Дибензоилэтилен и бензилмалоновый эфир [65].
2-Ацетил-1,3-дифенилпропен-2-аль-1 и этиловый эфир тетра-
гидроантраниловой кислоты [420].
Этиловый эфир 2,4-дифенилбутадиен- 1-карбоновой кислоты
и этиловый эфир циануксусной кислоты [419].
2- (Триметилхинонил) метилен-3,5,6-триметил-2-ацетокси- (или
метокси-) циклогексадиен-3,5-он и малоновый эфир или этило-
вый эфир циануксусной кислоты [421].
Непредельная система с карбонильным мостиком
и малоновый эфир или цианацетамид [422].
Бензилиденмалоновый эфир и нитроэтан [93].
2,3-Дихлор-1,4-нафтохинон и ацетон [292].
Окись мезитила и циклогексанон [423].
Акрилонитрил и этиловый эфир триметилянтарной кислоты,
который образует, по-видимому, О-замещенное производное
енольной формы [424].
3-Метил-4-аминопентен-3-он-2 и цианацетамид [420].
2-Метилциклогептилиденацетонитрил и циднацетамид [425].
Рассматривая указанные примеры, нельзя сделать оконча-
тельный вывод о причинах неудачи реакций конденсации. Одна-
ко на этих примерах можно видеть, что многие заместители у
16*
244
III. Реакция Михаэля
реагирующих центров имеют склонность препятствовать реак-
ции. В случае доноров это можно приписать понижению кислот-
ности, но пространственные факторы несомненно также играют
некоторую роль и могут мешать конденсации. Например, именно
этими причинами можно объяснить почему фенилмалоновый
эфир не вступает в реакцию Михаэля [426].
ПРИМЕНЕНИЕ В СИНТЕЗАХ
Одни продукты реакции конденсации Михаэля можно ис-
пользовать для получения аминокислот, другие продукты могут
претерпевать самопроизвольные реакции циклизации или цик-
лоизомеризации, давая различные циклические соединения.
В частности, видоизменение Робинсона реакции Михаэля исполь-
зовалось для синтеза алициклических систем (табл. VIII).
СИНТЕЗ ЦИКЛИЧЕСКИХ СИСТЕМ
Производные циклопропана. Соединения, которые являются
промежуточными для образования продуктов, содержащих цик-
лопропановое кольцо, можно получить конденсацией по Ми-
хаэлю. Например, продукт реакции Михаэля между бензилиден-
ацетофеноном и диметиловым эфиром малоновой кислоты
можно бронировать, затем отщепить бромистый водород и по-
лучить производное циклопропана (LXXXII), как это показано
ниже. Таким путем можно получать многие полизамещенные
производные циклопропана.
CeH6CHCH2COCeH6 Bf!
С6Н6СНСНВгСОСвН6 Mg(OCHa)2
СН (СООСН3)2
Н5С0-
СН (СООСН3)2
сосвн6
СН3ООС СООСНз
LXXXI1
Производные циклобутана. Имеются указания на то, что
производные циклобутана могут образоваться в результате вну-
тримолекулярной конденсации Михаэля сложных эфиров неко-
торых поликарбоновых кислот [342, 343, 428]. Однако недавние
исследования [344, 345] показали, что при реакции диэтилового
эфира ацетилендикарбоновой кислоты, например, с тетраэтило-
вым эфиром этан-1,1,2,2-тетракарбоновой кислоты образуется
не гексаэтиловый эфир циклобутан-1,2,3,3,4,4-гексакарбоновой
Применение в синтезах
245
кислоты, а гексаэтиловый эфир бутен-1,1,2,2,3,4-гексакарбо-
новой кислоты.
Производные циклопентана. Производные циклопентанона
получают in situ путем конденсации Дикмана первичных аддук-
тов конденсации Михаэля из этилового эфира цитраконовой
(или итаконовой) кислоты и малоновых эфиров или замещенных
малоновых эфиров [6, 157, 429] (сравни аналогичный случай
образования циклопентанонов из производных циклопропана;
стр. 205—206).
Н2С=С (СООС2Н6) CH2COOC2HS
СН2 (СООС2Н6)2
C,H,ONa
Нагревание
О
II
С2Н6ООС—СООС2Н5
^2“СООС2Н6
Производные циклогексана и конденсированные алицикли-
ческие системы. Дивинилкетоны типа дибензилиденацетона взаи-
модействуют с донорами, содержащими активную метиленовую
группу, согласно приведенному ниже общему уравнению, обра-
зуя замещенные циклогексаноны (LXXXIII) [214—216].
О
II
__II II_+ H2CR3R4 —>
LXXX111
Образующиеся по реакции Михаэля между непредельными
альдегидами и кетонами и ацетоуксусным эфиром аддукты
легко вступают во вторичную конденсацию, которая происходит
между конечной метильной группой аддукта и карбонильной
группой молекулы исходного акцептора. В целом ряде случаев
эта реакция циклизации сопровождается отщеплением карб-
этоксигруппы. Иллюстрацией этой реакции может служить син-
тез кетоэфиров LXXXIV [246], LXXXV [15—17] и LXXXVI [430].
В последнем примере реакция останавливается на промежуточ-
ной стадии образования альдоля *, без дополнительной стадии
* В этой и следующих формулах точками
из которых образуются исходные вещества для
обозначены те компоненты,
реакции циклизации,
246
III. Реакция Михаэля
дегидратации.
СН,
1 3
^,СО
СН, СН,
СН3. 1 2 I 3
\>с. .• со
СНз СН
собсА
LXXXV
Очевидно, что та же реакция всегда будет происходить при
образовании 1,5-дикетонов указанного типа. Например, в случае
продукта конденсации этилового эфира циклогексанон-2-карбо-
новой кислоты с этилиденацетоном или бензилиденацетоном
образуется соединение LXXXVII (R = СН3 или СеН5) [431]. Ана-
Применение в синтезах
247
логичная реакция циклизации происходит и в случае аддукта
тетралона-1 и этилиденацетоуксусного эфира или ацетилцикло-
пентена, которые образуют трициклический кетоэфир LXXXVIII
[222] и (через соединение LXXXIX) тетрациклический кетон
ХС [105] соответственно.
Родственной реакцией является циклизация диэтиловых эфи-
ров алкилиден-бис-ацетоуксусной кислоты. Например, из диэти-
лового эфира метилен-бис-ацетоуксусной кислоты (XCI) обра-
зуется соединение ХСП. В результате отщепления молекулы
воды и одной карбэтоксигруппы образуется «эфир Хагемана»
XCIII. В других случаям отщепляются обе карбэтоксигруппы
и образуются 1-метил-5-алкилциклогексен-1-оны-З. Реакция
СООС2НБ СООС2Н6
I I
СН СН
/ \ / \ /СН3
Н2С сосн, Н2С с<
I —> I 1хон
С2Н5ООСНС СН3 С2Н6ООСНС сн2
\о Xl'O
XCI ХСП
натрийацетоуксусного эфира и этилового эфира этоксиметилен-
ацетоуксусной кислоты протекает более сложно [432—435]. Дру-
248
Hl. Реакция Михаэля
гими примерами могут служить продукты конденсации окиси
мезитила с этиловым эфиром бензоилуксусной кислоты [436],
ацетилацетоном [437] или дезоксибензоином [438]; 1 :2 аддукты
малонового эфира или продукты конденсации его однозамещен-
ных производных с акролеином и метакролеином [122, 439]; про-
дукты конденсации метилвинилкетона с 2-метилциклопентано-
ном [246, 247], 2-метилциклогексаноном [246] или с алифатиче-
скими кетонами [440, 441].
В некоторых случаях, когда метильная группа, входящая'в
состав ацетильной группы, если только она не входит в состав
ацетоуксусного эфира, служит источником водорода для отщеп-
ляемой молекулы воды, например при образовании циклогексе-
нонов XCIV [442] и XCV [100]. Эта циклизация возможна также
СООС2н5
xcv
в случае непредельных 1,5-дикетонов. Очевидно, для того чтобы
произошла циклизация, заместители у двойной^ связи должны
иметь цис-конфигурацию. Из продукта конденсации (XCVI)
ацетилацетилена и 2-метилциклогексанона образуется диенон
XCVII. Имеются указания на то, что при взаимодействии кар-
вона и ацетоуксусного эфира возможна циклизация и в мета-
положение.
Применение в синтезах
249
Продуктами присоединения малонового эфира и а, р-ненасы-
щенных неароматических кетонов являются 8-кетоэфиры, кото-
рые могут циклизоваться путем отщепления этоксигруппы и
?6Н5
СИ..
н2Г >снссос,н5
о==с. СОбС2Н5
СН2
сн2с6н5
НзСчСНСООС2Н5
\|/^ХСООС2Н5
—L ZCH3
хсо
атома водорода, находящегося в е-положении. Образуются цик-
лические 1,3-дионы,напримерXCVIII [444], XCIX [445], С [446]и
I * [446]. Аналогичные аддукты — производные этилового эфира
* Нумерация формул после С снова начинается с I во избежание слож-
ных чисел.
250
111. Реакция Михаэля
циануксусной кислоты (вместо малонового эфира) приводят к
тем же конечным продуктам, т. е. циклогександиону II [447].
Естественно, что аналогичным образом ведут себя и 8-кетоэфи-
ры, образующиеся, например, из p-кетоэфиров и а, р-ненасыщен-
ных эфиров [448].
Ароматические циклические системы. В тех случаях, когда
8-кетоэфир содержит двойную связь в р, ^-положении, конечным
продуктом реакции является замещенный резорцин. Таким обра-
зом, из аддукта малонового эфира и н-бутилацетилацетилена
образуется 5-н-бутилрезорцин (см. стр. 213). Ниже описаны
другие схемы реакций, в которых в результате конденсации Ми-
хаэля образуются ароматические соединения.
Эфиры стирилуксусной кислоты, которые можно получить из
арилацетатов и диэтилового эфира этоксиметиленмалоновой
кислоты, циклизуются с образованием производных а-нафто-
ла (III) [328] или оксифенантрена IV [329]. Аналогично этому в
результате конденсации енольных форм р-кетоальдегидов и р-ди-
CjH/JOC
CHCOOCjHs
s CHOICES
г"
COOC^Hg
4 CHOCjHj
C^HyOOGCH* ^HQOOCjH.
COOC^Hj
кетонов с диэтиловым эфиром ацетон-1, 3-дикарбоновой кисло-
ты (V) [449, 450] непосредственно образуются ароматические
соединения. В этом процессе диэтиловый эфир ацетон-1,3-ди-
Применение в синтезах
251
карбоновой кислоты можно заменить ацетоуксусным эфиром
[449]. Аналогичным образом енольная форма нитромалонового
диальдегида (VI) реагирует с кетонами, которые в реакции Ми-
хаэля могут играть роль доноров.
СНОН
СНОН
СН
СН2СООС2НБ
НзСС
%
о
СО
СН2СООС2НБ
V
Н3СС СО
% /
О СН2СООС2НБ
Н3с
//
н3с
jj—COOCjHg
Loh
он
н3с
СООС2Н6
он
СН2СООС2Н6
со
/ у у-СНСООС2Н5
I /=О
О СН2СООС2НБ
12
СН2СООС2НБ
V
сн3
UU-°h
:2Н5
СООС2Н6
O2NC=CHOH -I- С6НБСН2СОСН2С6НБ —>
СНО
VI
СНОН
OaNCH СНС6НБ OaN—
СНО с=о
сБнБ
i6H6
252
1П. Реакция Михаэля
Несколько более сложная реакция происходит при конденса-
ции формальдегида с малоновым эфиром [451]. Образующийся
вначале диэтил овый эфир этилен-1,1-дикарбоновой кисло-
ты (VIII) конденсируется с малоновым эфиром с образованием
тетраэтилового эфира метилен-бнс-малоновой кислоты (VII).
Этот эфир образует еще с одной молекулой диэтилового эфира
этилен-1,1-дикарбоновой кислоты гексаэтиловый эфир пентан-1,
1,3,3,5,5-гексакарбоновой кислоты (IX). Циклизация соедине-
ния IX в результате реакции Дикмана и отщепления одной карб-
этоксигруппы, находящейся в p-положении к кетогруппе, при-
водит к образованию тетраэтилового эфира циклогексанон-2,4,
(С2Н6ООС)2 CHCHjCH (СООС2Н6)2 + Н2С=С (СООС2Н5)2 —>
VII VIII
—> (С2Н5ООС)2 CHCHjC (СООС2Н5)2 CHjCH (СООСаН6)2
IX
4,6-тетракарбоновой кислоты (X), который может снова всту-
пить в реакцию Михаэля с диэтиловым эфиром этилен-1, 1-ди-
карбоновой кислоты и образовать соединение XI. Повторная
Н2С С(СООС2Н5)2
с2н5ооссн сн2 —*-
о=с-----|н
СООС2Н5
X
COOC2HS
Н2С —с2н5оосАн Н2С— —*» сгн6ооссн о=с 1 —ССООС2Н5 СН2 CH(COOC2H5)j —*- —С—f—СН2 соос2н5 XI СООС2Н5 —с с=о ^н2 <!:нсоосгн8 -с——Аь 1 соос,н5 XII
Применение в синтезах
253
реакция Дикмана и отщепление карбэтоксигруппы приводят к
образованию в качестве конечного продукта этой реакции те-
траэтилового эфира бицикло[3.3.1]нонандион-2,6-тетракарбо-
новой-1,3,5,7 кислоты (XII).
Циклические системы, содержащие кислород в кольце.
8-Кетоэфиры, имеющие двойную связь в а, [3-положении, цикли-
зуются иначе, чем их [3, ^-аналоги. Так, хотя [3, ^-соединения об-
разуют 5-алкилрезорцины (см. стр. 213), от аддуктов малоно-
вого эфира и производных оксиметиленкетонов при конденсации
отщепляется молекула воды или этилового спирта и образуются
такие производные а-пирона, как соединение XIII.
СООСНз
хсн
С2Н5ОСЙ ХОСНз
Wo^h
^СОООгНз
Другим примером может служить аддукт ацетоуксусного
эфира и этилового эфира этоксиметиленмалоновой или этокси-
метиленциануксусной кислоты [330]. Продукты конденсации эти-
лового эфира фенилпропиоловой кислоты с ацетоуксусным эфи-
ром [452, 453] и с ацетилацетоном [454, 455] ведут себя так же,
образуя соединение XIV (R = ОС2Н5 и СН3 соответственно).
/СНСООС2Н5
с 6н5(У.
•'сНСОСНз
!ов
Циклизация предельного 8-кеТоэфира путем енолизации кар-
бонильной группы происходит также в случае аддукта цик-
логексанона и бензилиденмалонового эфира. В этом случае
254
///. Реакция Михаэля
пространственные затруднения мешают метиленовой группе в
e-положении принять участие в образовании циклической си-
стемы, в результате чего за счет енольной формы кетона обра-
зуется лактон XV,
у- (о-Оксифенил) кетоны превращаются в условиях конден-
сации Михаэля в производные 2,3-бензо-1,4-дигидропираиа
(XVI, R = СН3, С6Н5) [219, 456].
Аналогичные реакции циклизации рассматривались в одном
из предыдущих сборников «Органические реакции» [457]. Аддукт,
образующийся из 3-хлорциклогексен-2-она-1 и метилмалонового
эфира отщепляет хлористый водород и циклизуется с образова-
нием предельного лактона XVII [458]. Дови и Робинсон [459]
предположили, что образование борофторида 2,4,6-трифенил-
пирилия из ацетофенона и трехфтористого бора протекает по
реакции Михаэля, однако недавно было доказано, что это не>
Так [460].
XVI)
Пиперидины и пиридины. 8-Кетоамиды, полученные в резуль-
тате конденсации Михаэля из цианацетамида и а, р-ненасыщен-
ных кетонов, циклизуются с образованием ненасыщенных циан*
вамещенных 2-кетопиперидинов (XIII). В приведенном примере
Применение в синтезах
255
показано образование промежуточного оксисоединения; произ-
водные такого типа были получены во многих реакциях [461].
Несколько иная схема применима для продуктов конденса-
ции цианацетамида и а-оксиметиленкетонов. При реакции этих
соединений в результате отщепления молекулы воды в кольцо
вводится вторая двойная связь и, следовательно, облегчается1
енолизация с образованием 2-оксипиридинов (XIX и XX) [187,
241]. Аналогичным образом ведут себя и аминометиленкетоны
[420], причем цианацетамид можно заменять амидом малоновой
кислоты [392]. Тот же результат получен с'аддуктами цианацет-
амида и ацетиленовых кетонов; при этом образуются соедине-
256
Ш. Реакция Михаэля
ния, имеющие строение XXI (Е = СгН5 или С6Н5) [197, 200],
Если соединение, которое является предшественником со-
единения XXI, изобразить в его таутомерной форме XXIA, то
будет очевидно, что соединения ХХ1Б также могут превращаться
в производные пиридина. Так, из «диацетонитрила» и бензили-
XXIA
ХХ1Б
денацетона в результате самопроизвольного отщепления водо-
рода от первичного продукта реакции образуется З-циан-4-фе-.
нил-2,6-диметилпиридин (XXII) [462]. Аналогично этому имин
ацетоуксусного эфира конденсируется с этиловым эфиром эток-
симетиленмалоновой кислоты, при этом отщепляется молекула
этилового спирта и образуется диэтиловый эфир 2-окси-б-метил-
пиридин-3,5-дикарбоновой кислоты (XXIII) [463].
CHOC2HS
с2н5ооссн' •• снсоос2н5
С2Н5ООС хССН3
HN~
ХХП]
Применение в Синтезах
25?
Вообще говоря, имины p-кетоэфиров и р-дикетонов реагируют
таким же образом с оксиметилен-, алкоксиметилен- и аминоме-
тиленкетонами и сложными эфирами [464—466]. Так, из 2-окси-
метиленциклопентанона и иминомасляного эфира можно not
лучить этиловый эфир 5-метил-4-азаинден-6-карбоновой кислоты
(XXIV) [467]. Этиловый эфир тетрагидроантраниловой кислоты
CONH2
XXIV XXV XXVI
(XXV) реагирует так же, как аминометиленовый эфир и обра-
зует с амидом малоновой кислоты $мид 1-окси-3-кёто-2,3,4,5,6,
7,8, 10-октагидроизохинолин-4-карбоновой кислоты (XXVI) [403].
Единственным исключением из этого правила является реакция
2-аминометиленциклогексанона (XXVII) с этиловым эфиром
циануксусной кислоты, в результате которой, по имеющимся
данным [468], образуется 3-кето-4-циан-2,3,5,6, 7,8-гёксагидро-
изохинолин (XXVIII). В связи с этим Берсон и Браун [469]
XXVII XXVIII
считают, что синтез Ганча 1,4-дигидропиридинов по существу
представляет собой реакцию Михаэля. Эти авторы предпола-
гают, что, например, при конденсации формальдегида, аммиака
и ацетоуксусного эфира образуются этиловый эфир р-аминокро-
тоновой кислоты и метиленацетоуксусный эфир, а затем реак-
ция протекает следующим образом:
ROOCCHj
Н3СС
NH
СН2 сн,
/ \
CCOOR ROOCCH CHCOOR
+ I —* I I
ссн3 Н3СС ссн3
258
III Реакция Михаэля
Для соединений пиридинового ряда возможен и другой путь
в случае всех реакций конденсации Михаэля, которые приводят
к образованию 1,5-дикетонов, способных циклизоваться под дей-
ствием аммиака. В этих реакциях в качестве катализатора кон-
денсации Михаэля можно применять аммиак. Частным случаем
этой общей закономерности является реакция этилового эфира
аминометиленацетоуксусной кислоты с ацетоуксусным эфиром
или циклогексаноном [132]: аммиак отщепляется от первичного
продукта реакции XXIX на первой стадии и используется на
второй стадии процесса.
СНСООС2Н{
HjNCff ^СОСНз
с^8оос'сн
'чсосн3
XXIX
CHCOOC?HS
> H|j »NH3 »
сгн5ооссв *
ХЮСНЭ
Пирролы. Кларк и Лапуорз [470] сделали предположение, что
синтез пиррола, который открыли Миллер и Плёхл, предста-
вляет собой реакцию Михаэля. Таким образом, синтез 1-(п-то-
лил) -2,3-дифенилпиррола из цианистого а-толуидинбензила и
коричного альдегида в присутствии едкого кали можно пред-
ставить следующим уравнением (ср. [472]):
С6НГ)СН=СНСНО 4- СБНБСН (CN) NHC6H4CHs-n —>
СН2—СНСБНБ
I I CN
—> нсо
JW С6НБ
СвН4СНз-л
II II СвНб
I
СБН,СН3-п
Однако Трейбс и Дерра [473] предполагают, что этот синтез
протекает через стадию образования полуацеталя непредельного
альдегида (образующегося в результате взаимодействия с рас-
творителем, например метиловым спиртом) и, следовательно
не является реакцией Михаэля.
Пирролизидины и родственные им циклические системы
Леонард использовал конденсацию Михаэля для получения пир
ролизидинов (XXX) путем восстановительной циклизации эфй
Применение в синтезах
259
ров 7-нитропимелиновой кислоты, которые получают из нитро-
парафинов и эфиров акриловой кислоты или замещенных эфи-
ров акриловой кислоты [474—479].
2СН2=СНСООСН3 [сан,сн,к <сн,>,] он
+ -----------------------
CH3NO2
СН2—СН—СН2
III н I-----------------i
—> СН2 NOj СН2 |
I I \/N\/
СООСНз СООСНз v
XXX
Эта реакция была распространена также на синтез 6-метил-
азабицикло[5.3.0]декана (XXXI) путем присоединения метило-
вого эфира 7-нитромасляной кислоты в положение 1,6 к метило-
вому эфиру сорбиновой кислоты с последующей восстановитель-
ной циклизацией [128].
СН3СН=СНСН=СНСООСН3
+
OjNCHjCHjCHjCOOCHj
СН2—СН—СНСНз
III
сн2 no2 СН
—> I II
СООСНз СН
I
СН2СООСН3
XXXI
Известен также синтез производного индола XXXII из хино-
на и иминомасляного эфира (этилового эфира ₽-аминокро-
тоновой кислоты) [307], который можно представить следующим
образом:
О О
XXXII
260
III. Реакция Михаэля
СИНТЕЗ АМИНОКИСЛОТ
Было замечено, что такие соединения, как этиловый эфир
ацетамидомалоновой кислоты и этиловый эфир фталимидомало-
новой или фталимидоциануксусной кислоты, реагируют в кон-
денсации Михаэля, в качестве доноров; это наблюдение открыло
широкий путь для Синтеза аминокислот [176, 480—484]. Показа-
тельным для этого метода может служить получение DL-глута-
миновой кислоты (ХХХШ) [485]. Большой интерес представляют
также продукты реакции между а, ^-ненасыщенными альдегида-
ми и эфирами N-ацилированных аминомалоновых кислот [175,
176, 482—484] и аминоацетоуксусных кислот [175, 482], которые
являются возможными промежуточными соединениями в по-
строении системы орнитина и, по-видимому, ключевыми веще-
ствами в биосинтезе различных алкалоидов [487].
СН2=СНСООСН3 + CH3CONHCH (СООС2Н5)2
—> CH3CONHC (СООС2Н6)2 СН2СН2СООСН3 -Г"дсо;^-»
—> НООССН (NH2) СН2СН2СООН
ХХХШ
Поскольку эфиры нитроуксусной кислоты становятся все бо-
лее доступными, их также можно использовать с целью полу-
чения исходных веществ для синтеза аминокислот по реакции
конденсации Михаэля [118, 488].
I
I
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
Растворители. Если продукты реакции чувствительны к ал-
коголизу или если наблюдается конкурирующее действие между
ионом алкоголята и анионом донора за молекулу акцептора, то
следует использовать растворитель, не содержащий гидроксиль-
ной группы, или проводить реакцию без растворителя (ср. [297]).
При наличии такого конкурирующего действия или в том слу-
чае, когда енолят донора образуется с трудом, можно приме-
нять натрий или амид натрия в инертном растворителе. Чаще
всего в конденсации Михаэля применяются следующие раство:
рители: метиловый, этиловый и трет-бутиловый спирты, эфир,
бензол, диоксан и смеси этих растворителей. В тех конденса-
циях, в которых в качестве реагирующих веществ использова-
лись сложные эфиры, наблюдалась реакция переэтерифика-
ции [199].
Экспериментальные условия
261
Катализаторы. В качестве катализаторов применялись мети-
лат натрия, этилат натрия, метилат калия, этилат калия, изо-
пропилат калия, н-бутилат калия, трет-бутилат калия, а, а-диме-
тилпропилат калия, сухие едкий натр и едкое кали или их
водные растворы, растворы едкого натра и едкого кали в мети-
ловом и этиловом спиртах, раствор едкого кали в трет-бутило-
вом спирте; металлические натрий и калий, аммиак, спирто-
вый раствор аммиака, аммиак с хлористым аммонием, амид
натрия как таковой или в жидком аммиаке; диэтиламин, ди-
изопропиламин, пиперидин, триэтиламин, трибутиламин и другие
триалкиламины; гидроокись метилтриэтиламмония, гидроокись
бензилтриметиламмония (тритон В) и его метилат или бу-
тилат.
Гидриды кальция или натрия применяли очень редко [202,
489, 490]. То же самое можно сказать об углекислом калии [222]
и трифенилметилнатрии [491], которые были использованы в
реакциях Михаэля в качестве конденсирующего агента в слу-
чае этиловых эфиров уксусной, изомасляной и фенилуксус-
ной кислот. Уксусноэтиловый эфир прежде чем вступить в реак-
цию Михаэля претерпевал в этих условиях конденсацию
Кляйзена.
В реакциях конденсации акрилонитрила с этиловым эфи-
ром циануксусной кислоты и с цианистым бензилом в качестве
катализатора использовался водный раствор цианистого на-
трия [492].
Следует отметить, что, по имеющимся данным, в результате
реакции между циклогексаноном или 2-метилциклогексаноном и
акрилонитрилом, проводимой в присутствии оптически активного
кварца, покрытого этилатом натрия, калия или лития, обра-
зуются продукты реакции, обладающие слабой оптической ак-
тивностью [493].
В литературе описано несколько примеров [170, 273, 494—
496] конденсаций типа конденсации Михаэля, которце были осу-
ществлены под действием таких кислотных катализаторов, как
трехфтористый бор, хлористый цинк и сернистый ангидрид.
Практически важное значение имеют реакции конденсации про-
изводных пиррола со свободными a-положениями, которые
вступают в реакции с а, ^-ненасыщенными альдегидами, кето-
нами, кислотами и производными кислот в присутствии таких
кислотных катализаторов, как эфират трехфтористого бора или
бромистоводородная кислота [497, 498]. Как и в случае индола
(см. стр. 208), можно предположить, что донором является тау-
томерная форма пиррола, в которой в a-положении находится
(активированная) метиленовая группа. В результате последую-
щей реакции из этого продукта образуется производное дипир-
262
III. Реакция Михаэля
рилтриметина
ROOC—।---|~СН3
h3c//Xn/
3 н
ГЕООС—f=f—CH3-
Н
Н3
н
сна=снсосн,,
HBr *
ROOC. >СН3
I “
Н3С/Х N Z\cH2CH2COCH3
н
Одна или две реакции конденсации были осуществлены в
отсутствие катализатора. Так, конденсация происходит при на-
гревании этилового эфира оксиметиленфенилуксусной кислоты
с малоновой или циануксусной кислотой [388, 499, 500] и при
пропускании паров метилвинилкетона через нагретую трубку
[441] вместе с ацетоном или метилэтилкетоном.
Особое вним-ание следует обратить на те возможности, которые
появились благодаря получившим за последнее время широкое
применение ионообменным смолам с сильнощелочными свой-
ствами. Эти смолы могут оказаться многообещающими конден-
сирующими агентами, особенно в тех случаях, когда реагирую-
щее вещество или продукт реакции чувствительны к присутствию
щелочи в растворе. Так, например, ацетон или метилэтилкетон
легко реагируют .с акрилонитрилом [501] в присутствии четвер-
тичной сшитой поливинил пиридиновой смолы. Таким путем мо-
гут быть осуществлены и более сложные реакции [502, 503].
На основании имеющегося экспериментального материала с
катализаторах, применяемых в реакциях Михаэля, можно сде-
лать лишь качественные выводы. Можно предположить, что ак-
тивность какого-либо катализатора в определенной реакции зал
висит от его способности енолизовать донор [491]. Однако пр|
выборе конденсирующего агента имеют значение и другие фак]
торы. Так, пиперидин, очевидно, менее способен вызвать вторичл
ные реакции циклизации, чем этилат натрия, но он реагируе1!
сравнительно медленно. Вторичных реакций можно избежать
также, если этилат брать в меньшем по сравнению с эквива]
лентным количестве (от ’/е До ’/з) или проводить реакцию пре
низкой температуре [65, 504]. С другой стороны, в растворах этй
лата калия в этиловом спирте может произойти размыканий
цикла в случае производных циклопентанона или циклогексанона
Иногда, если пиперидин оказывается неэффективным, реай
цию можно осуществить, применяя этилат натрия; напримеП
это относится к конденсации Михаэля между этиловым эфиров
коричной кислоты и этиловым эфиром фенилуксусной кислоти
Сухое едкое кали или смесь пиридина и водного раствора едкой
натра с успехом использовались в реакциях с флуореном и ег|
Препаративные синтезы
263
производными, т. е. с соединениями, в которых катализатор не
вызывает енолизации, а только замещает водород у атома угле-
рода [384, 505]. Однако применение сухого едкого кали не огра-
ничивается этой частной группой доноров. Было показано, что
суспензии мелкораздробленного едкого кали в ацеталях (кото-
рые, возможно, образуют с основанием нестойкие молекуляр-
ные соединения) являются очень хорошими катализаторами для
конденсации Михаэля [506]. Как это ни удивительно, сложно-
эфирные группировки в этих условиях не затрагиваются, хотя
применяемое едкое кали обычно содержит около 15% воды. Сле-
дует отметить, что в качестве катализатора в данном случае
можно применять только едкое кали, а не едкий натр, особенно
если учесть некоторые наблюдения о различном поведении этих
двух гидроокисей щелочных металлов, применяемых в конден-
сациях Михаэля в качестве катализаторов [221]. Было замечено
также, что 4-пиколин конденсируется с 4-винилпиридином и об-
разует 1, 3-ди-(4-пиридил) пропан в присутствии металлического
калия, но не вступает в эту реакцию в присутствии металличе-
ского натрия [507].
Температура. Обычно повышенная температура благоприят-
ствует перегруппировкам и обратной реакции (см. стр. 186), а
также вторичным реакциям циклизации. Эти процессы, конечно,
снижают выход нормального аддукта. При использовании в ка-
честве катализатора алкоголятов хорошие результаты были по-
лучены при комнатной температуре и продолжительности реак-
ции 20—150 час. Для получения продукта реакции с хорошим
выходом при использовании в качестве катализаторов вторич-
ных аминов смесь обычно необходимо кипятить от 20 до 48 час.
ПРЕПАРАТИВНЫЕ СИНТЕЗЫ
у-Ацетамидо-у-карбэтокси-у-цианмасляный альдегид [482].
Раствор 50 мг металлического натрия в 60 мл абсолютного эти-
лового спирта смешивают с 17 г этилового эфира ацетамидоци-
ануксусной кислоты. Полученную суспензию охлаждают на во-
дяной бане и приливают по каплям 7,5 мл акролеина. По окон-
чании приливания смесь перемешивают в течение 2 час, затем
нейтрализуют ледяной уксусной кислотой, фильтруют и фильтрат
охлаждают. Через 24 час выпадают кристаллы, которые от-
фильтровывают и получают 15 г (66%) продукта с т. пл. 106—
109°. После кристаллизации из 95%-ного этилового спирта тем-
пература плавления повышается до 113,5—114,5°.
5-Нитро-4,4-диметилпентанон-2 [225]. Смесь 1 Моля окиси
Мезитила, 10 молей нитрометана и 1 моля диэтиламина выдер-
264
III. Реакция Михаэля
живают в течение 30 суток при 30°. Непрореагировавшие ком-
поненты отгоняют при 55° (20 мм рт. ст.) и остаток фракциони-
руют. После головного погона, содержащего 4-днэтиламино-4-
метилпентанон-2 (10%). отгоняется продукт реакции в виде ма-
слянистой жидкости с т. кип. 112—113,5° (14 мм рт. ст.) (65%).
Полученный продукт можно полностью освободить от примесей
основного характера путем взбалтывания с 10%-ной соляной
кислотой. После двух перегонок получают чистый продукт с вы-
ходом 58% и т. кип. 128—129° (22 мм рт. ст.).
Тот же продукт можно получить с выходом 55—60% путем
нагревания реакционной смеси с обратным холодильником в т&-
чение 48 час и последующей обработки, как указано выше.
7-Кето-1-метокси-13-метил-5,6,7,9,10,13-гексагидрофенантрен
(видоизменение Робинсона). [338) 15,05 г диэтиламинобутанона
[508] помещают в колбу емкостью 1 л. При охлаждении льдом и
встряхивании к содержимому колбы в течение 30 мин отдель-
ными порциями добавляют 15,0 г йодистого метила. Содержимое
колбы взбалтывают таким образом, чтобы кристаллический
иодметилат отлагался на стенках колбы в виде ровного слоя.
Когда жидкости больше не останется, колбу оставляют на
30 мин во льду, а затем 45 мин под краном с проточной водой.
После этого приливают раствор 20,0 г 5-метокси-1-метилтетра-
лона-2 в 100 мл сухого бензола, не содержащего тиофена, вы-
тесняют сухим азотом воздух и в течение 5 мин при охлаждении
приливают раствор 6,5 г металлического калия в 100 мл абсо-
лютного этилового спирта. >
Взбалтывание продолжают до тех пор, пока иодметилат не
растворится (около 30 мин) и в осадок не выпадет иодистый
калий. Смесь еще 1 час держат во льду, кипятят в течение
25 мин, приливают к ней избыток 2 н. серной кислоты, а затем‘
такое количество воды, чтобы растворить сернокислый калий,-
Бензольный слой отделяют, а водный слой дважды экстраги-*
руют эфиром. Эфирный и бензольный слои объединяют, промЫ|
вают водой, сушат сульфатом магния и отгоняют растворители^
Остаток перегоняют и получают 23,2 г продукта с т. кип. 180э
(0,1 лои рт. ст.). После кристаллизации из эфира получают 17 |
продукта с т. пл. 115—117°. Дополнительно 1 г продукта можн$
получить после перегонки маточного раствора; общий выход 18 и
(71 % теоретического). |
Эта методика является общей для эффективного использсй
вания в качестве катализатора метилата или этилата натрия.J
тра«б>3-Кето-2-фенилциклогексануксусная кислота [120Л
Смесь 50 г 2-фенилциклогексен-2-она, 150 г дибензилового эфй
ра малоновой кислоты и раствора трет-бутилата калия, поли
ценного из 1,3 г калия и 20 мл трет-бутилового спирта, нагрЯ
Препаративные синтезы
265
вают в течение 3 час при 60° и выдерживают в течение ночи при
комнатной температуре. Затем смесь подкисляют 2,5 мл уксус-
ной кислоты и разбавляют до 250 мл этилацетатом. Добавляют
в качестве катализатора 13 г палладия на угле (10% Pd) и/ги-
дрируют смесь в течение 1 час при комнатной температуре и
начальном давлении 4 ат. Затем катализатор отфильтровывают,
растворитель отгоняют, а остаток нагревают 10 мин при 170—
180° с целью декарбоксилирования малоновой кислоты. Остаток
растворяют в эфире, несколько раз экстрагируют 10%-ным рас-
твором соды, после чего щелочные вытяжки подкисляют. Полу-
ченный продукт представляет собой твердое вещество с т. пл.
125° (55 а, 82% теоретического).
Если необходимо осуществить гидролиз аддукта, полученного
в результате конденсации Михаэля, то в качестве донора вместо
малонового эфира следует применять дибензиловый эфир мало-
новой кислоты.
Метиловый эфир З-кето-2-фенилциклогексил-а-нитроуксусной
кислоты [118, 120 [. Смесь 17,2 г 2-фенилциклогексен-2-она,
23,0 г метилового эфира ' нитроуксусной кислоты [509] и 0,025
моля 30%-него метанольного раствора метилата бензилтриме-
тиламмония [510] выдерживают в течение 12 час при 60°. Смесь
подкисляют уксусной кислотой, экстрагируют эфиром, после
чего вытяжки промывают водой и раствором бикарбоната натрия
для удаления большей части непрореагировавшего эфира. После
удаления оставшегося количества не вошедших в реакцию реа-
гирующих веществ путем перегонки в высоком вакууме получают
26,2 г продукта в виде маслянистой жидкости (выход 90%).
Триэтиловый эфир а-ацетилкарбаллиловой кислоты [506].
К раствору 20 г технического едкого кали в 150 мл дипропило-
вого ацеталя ацетальдегида приливают 51,6 г диэтилового эфи-
ра малеиновой кислоты и 52 г ацетоуксусного эфира, поддержи-
вая смесь при 20°. Затем после самопроизвольного повышения
температуры до 27° смесь в течение 1 час нагревают при 90°.
Смесь подкисляют разбавленной серной кислотой, слой ацеталя
отделяют, растворитель отгоняют, а остаток перегоняют в ва-
кууме. Некоторое количество ацетоуксусного эфира регенери-
руют, после чего получают 65 г продукта с т. кип. 189° (12 мм
рт.ст.) в виде маслянистой жидкости. Выход, считая на вошед-
шие в реакцию компоненты, составляет 72%.
Диэтиловый эфир 6-кето-4-метилгептен-2-дикарбоновой-1,5
кислоты [5111. К раствору 2,5 г металлического калия в 150 мл
абсолютного трет-бутилового спирта приливают 98 г ацетоук-
сусного эфира и 53 г этилового эфира сорбиновой кислоты.
Смесь нагревают в течение 12 час с обратным холодильником
266
///. Реакция Михаэля
на масляной бане при ПО—120°. После охлаждения раствор вы-
ливают в разбавленную серную кислоту и выделившееся масля-
нистое вещество растворяют в бензоле. Затем бензол и не-
прореагировавшие компоненты отгоняют и получают 78 г про-
дукта в виде почти бесцветной маслянистой жидкости с т. кип.
120° (0,5 мм рт. ст.) (выход 75% теоретического).
Гексаэтиловый эфир З-бутен-1, 1, 2, 2, 3, 4-гексакарбоновой
кислоты [344, 345, 512[. Смесь 34 г диэтилового эфира ацети-
лендикарбоновой кислоты, 66 г тетраэтилового эфира этан-1,1;
2,2-тетракарбоновой кислоты и 10 мл абсолютного этилового
спирта нагревают при перемешивании* до 45°, пока раствор не
станет прозрачный, защищая его от попадания влаги. Затем
при энергичном перемешивании по каплям приливают раствор
1,5 г металлического натрия в 24 мл абсолютного этилового
спирта. После добавления примерно 10 капель раствора этилата
температура реакционной смеси сразу повышается до 92°, а за-
тем, по мере добавления остального количества катализатора,
медленно падает. По мере повышения температуры раствор
приобретает темно-бурую окраску. Смесь выливают в 100 мл
1 н. соляной кислоты и тщательно экстрагируют эфиром. После
испарения эфира остается смесь твердого вещества и масляни-
стой жидкости. Твердое вещество отфильтровывают и кристал-
лизуют из 80%-ного этилового спирта. Выход продукта, полу-
ченного в виде нескольких порций, составляет 48,5 г (48% тео-
ретического); т. пл. 78°.
Диэтиловый эфир а, f-дифенилглутаровой кислоты [80,89].
100 г этилового эфира коричной кислоты и 100 г этилового эфи-
ра фенилуксусной кислоты смешивают с раствором 4 г метал-
лического натрия в 60 мл этилового спирта, а затем кипятят
2,5 час с обратным холодильником. Смесь нейтрализуют рас-
считанным количеством разбавленной соляной кислоты, после,
чего приливают воду в таком количестве, чтобы произошло по-
мутнение раствора. Продукт кристаллизуется при охлаждении
раствора; выход смеси изомеров количественный. После не-
скольких перекристаллизаций из разбавленного этилового спир-
та температура плавления продукта 92—93°.
Диметиловый эфир (а-фенил-р-нитроэтил)малоновой кисло-
ты [349]. К охлажденному до 0° раствору 26 г диметилового
эфира малоновой кислоты и 1 г металлического натрия в 30 мл
абсолютного метилового спирта добавляют 5 г тонкоизмельчен-
ного to-нитростирола. Смесь взбалтывают до полного растворе-
ния. Прозрачный раствор подкисляют ледяной уксусной кисло-
той, охлаждают льдом и насыщают хлористым водородом.-
Когда раствор становится бесцветным, его выливают в суспензию
Препаративные синтезы
267
льда в растворе соды. Выделившееся маслянистое вещество
после трения о стенки сосуда стеклянной палочкой кристалли-
зуется. Кристаллы промывают водой и перекристаллизовывают
из метилового спирта, после чего получают 8,7 г (92% теорети-
ческого) продукта с т. пл. 57°.
Этиловый эфир а-бензоил-у-(2-пиридил)масляной кислоты
(513]. К смеси 246 г свежеперегнанного этилового эфира бен-
зоилуксусной кислоты и 66 г свежеперегнанного 2-винилпири-
дина добавляют 1 г металлического натрия и кипятят смесь
в течение 5 час. Раствор охлаждают, подкисляют и экстраги-
руют эфиром, чтобы удалить вещества нейтрального характера.
Водный слой подщелачивают, выделившийся маслянистый слой
растворяют в эфире и вытяжки сушат безводным сульфатом
кальция. Эфир и 2-винилпиридин отгоняют в вакууме, а оста-
ток перегоняют и получают 135 г (70% теоретического) про-
дукта в виде бледно-оранжевой маслянистой жидкости с т. кип.
170—175° (0,3 мм рт. ст.).
ТАБЛИЦЫ СОЕДИНЕНИИ, ПОЛУЧЕННЫХ ПО РЕАКЦИИ
КОНДЕНСАЦИИ МИХАЭЛЯ
В приведенных ниже таблицах собраны литературные дан-
ные по октябрь 1955 г. В табл. I—XXIII материал расположен
по акцепторам непредельного характера. В табл. XXIV приве-
дены наиболее важные доноры, которые применялись в конден-
сации Михаэля.
Акцепторы в табл. I—XXIII расположены в порядке увели-
чения числа атомов углерода, если не указано другое их рас-
пол’ожение. Сложные эфиры алифатических спиртов (независи-
мо от числа атомов углерода в алкильной группе) расположены
после самого низкого члена данного ряда. При каждом акцепто-
ре доноры расположены в соответствии со следующей схемой:
Сложные эфиры и другие производные кислот (за исключе-
нием нитрилов).
Кетоэфиры.
Циансоединения.
Альдегиды и кетоны.
Нитросоединения.
Сульфоны.
Другие доноры.
Запятыми в колонке «Катализатор» отделены компоненты
сложного катализатора; точкой с запятой отделены различные
комбинации катализаторов.
В тех случаях, когда приводится несколько литературных
ссылок, в таблицах указан выход, взятый из первой работы.
Если в колонке «Продукт реакции» цифры в скобках отсут-
ствуют, это значит, что выход в работе не сообщался.
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С а, Р-НЕНАСЫЩЕННЫМИ АЛЬДЕГИДАМИ
Таблица I
Реагирующие вещества Катализатор Продукт реакции (выход, 5Ц Литература
Акролеин и А=—СН2СН2СНО
Малоновый эфир C2HEONa АСН(СООС2Не)2 (50) 174, 439, 514
(h-C4H9)3N Л2С(СООС2НЕ)2 515
Этилмалоновый эфир C2HsONa ЛС(С2НЕ)(СООС2НЕ)2 (40) 174, 176, 514
н-Г ексилмалоновый C2HsONa АС(С6Н13-я) (СООС2НЕ)2 174, 176, 514
эфир
н-Децилмалоиовый эфир C2HsONa АС(С10Н21-н) (СООС2НЕ)2 174, 176, 514
н-Г ексадецилмалоновый C2HsONa АС(С1вН33-я) (СООС2НЕ)2 514
эфир
Броммалоновый эфир (я-СдН^зМ; CsHgONa ДСВг(СООС2Нв)2 • 174, 516
Хлор малоновый эфир (h-C4H9)3N АСС1(СООС2НЕ)2 1 (76) 516
Формамидомалоновый C2HsONa AC(NHCHO) (СООС2НЕ)2 517
эфир
Ацетамндомалоновый Na AC(NHCOCH3)(COOC2HE)2 (87) 482
эфир
CH3ONa AC(NHCOCH3)(COOC2H6)2 (61) 483
C2HEONa AC(NHCOCH3)(COOC2HE)2 (56) 484, 517, 518
Ионообменная смола AC(NHCOCH3)(COOC2Hb)22 (62) 519
(ОН- или CN-форма) о
Фталимидомалоновый C2HsONa o-(^H4\c (COOC2HE)2 482, 517
эфир • \c/l,
|щето^симало]»овый CsHsONa СН3СООС(А) (СООСгНЕ)2 174, 520
CH(COOC2HE)2 C2HEONa Л2С(СООС2НЕ)2; 5,5-дикарбэтоксициклогексен- 122, 439
Г 1 -карбоксал ьдегид-1
СН2СН2СНО 521, 522
Ацетоуксусный эфир C2HEONa CH3COCH(A)COOC2Hs (40, 39); циклогексен-2-ои (20, 23)
C2HEONa CH3COCH (A)COOC2Hs 523
Не указан Цнклогексен-2-он 524
Метилацетоуксусный эфир C2H5ONa 6-Метилциклогексен-2-он (20) 522
Этиловый эфир цикло- гексанон-2-карбоновой кислоты C2H5ONa О А/л !ч/1хсоос2н5 177
Циаиуксусныи эфир C2HEONa ACH(CN)COOC2Hs (12); 5-карбэтокси-5-цианцикло- гексен-1-карбоксалвдегид-1 174, 439, 525, 526
Ацетамидоци аиуксусиый C2H5ONa AC(NHCOCH3)(CN)COOC2He (82, 60) 482, 517, 527
эфир 122, 439
CH(CN)COOC2Hs C2H3ONa A2C(CN)COOC2H5 (18)
СН2СН2СНО
Альдегид циклогексан- SO2 ЛЧ/СНО
карбоновой кислоты А (23) 495
Альдегид циклогексен- SO2 Л^СНО
З-карбоиовой-1 кис- 0 (27) 495
лоты
Дезоксибензоин C2H6ONa СбНЕСН(Д)СОС6НЕ (100)) 178
Продолжение табл. I
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Ацетил ацетон Пиридин СНзСОСН (А )СОСН3 (27); 6-ацетнлциклогексен- 528
Нитрометан [СзНзСНаЩСНзЫОН; 2-он (13); соединение СцНиОв (27); О А/л Ц^'ЛсОСНз при О’ ACH2NO2 (41) 529
Нитроэтаи CH3ONa [CeHsCH2N(CH3)3]OH; CH3CH(A)NO2 (51 J) 529
о 1-Нитропропаи CHsONa C2H5ONa CH3CH2CH(A)NO2 (30) 530
2-Нитропропан [C6H6CH2N(CH3)3]OH (CH3)2C(A)NO2 (49). 529
CH3ONa (CH3)2C(A)NO2 (33) 529
C2HEONa (CH3)2C(A)NO2 530
КзСОз (CH3)2C(A)NO2 (35)) 531
Нитроуксусный эфир C2H5ONa ACH(NO2)COOC2HB 532
Нитромалоновый эфир C2HEONa AC(NO2) (COOC2HE)2 533
Ионообменная смола AC(N02)(COOC2H5)2 (94) 519
(СНз)2СНСН2С(СНз)= (ОН- или CN-форма) Без катализатора NCH(CH3)CH2CH(CH8)2 /\ CH(CH3)2 (5) 397
-NCH (СН8) СН2СН (CHj)j Кротоновый альдегид и , (C2Hb)sNH \/ 1 А=СНзСНСН2СНО CH (COOCsHb) CH (СНз) CH-CHCH (COOC2H5)2 173 172 ,
C2HsONa C2HEONa ACH(COOC2H5)2 (12) A2C(COOC2H6)2 175, 514 515
.Этилмалоновый эфир C2H5ONa AC(C2He)(COOC2He)2 (38) 175, 514
н-Гексадецилмалоновый C2HEONa АС(С1бН33-н) (COOC2HE)2 514
эфир 516, 534
Хлормалоновый эфир (h-C4H9)3N ACC1(COOC2HS)2«
Ацетамидомалоновый C2HEONa AC(NHCOCHa) (COOC2H£)2 175, 517
эфир
Ацетокси м а лоиовый C2HEONa XC(OCOCH3)(COOC2HE)2 520
эфир
Ацетоуксусный эфир C2HEONa 6-Карбэтокси-5-метилциклогексеи-2-он 535
C2HEONa 5-Метилциклогексен-2-он (15—20, 35) 521, 522
Циануксусный эфир C2HEONa ACH(CN)COOC2HS 525
Ацетамидоциануксус- C2HEONa AC (NHCOCH3) (CN) СООС2НБ 175, 517
ный эфир 178
Дезоксибензоин CHaONa C6HeCH(A)COC6He (100)
Ci I-Нитропропан C2HsONa CH3CH2CH(A)NO2 (15) 530
2-Ннтропропан C2HEONa (CH3)2C(A)NO2 (34) 530
Нитроуксусный эфир C2HEONa ACH(NO2)COOC2Hs 532
Нитромалоновый эфир C2HEONa AC(NO2) (COOC2H5)2 533
Метакролеин и A = —СН2СН (СНз) CHO
Малоновый эфир C2HEONa ACH(COOC2HE)2 (42) 175, 514
C2HEONa X2C(COOC2H6)2 515
Этилмалоновый эфир C2HgONa AC(C2He) (COOGHsh (25) 175, 514
Хлормалоновый эфир (h-C4H9)3N ACC1 (СООС2НЕ)г. 516
Ацетамидомалоновый GHsONa <4C(NHCOCH3) (СООС2НЕ)2 (количественный) 175, 517
эфир Ацетоксималоиовый C2HEONa AC(OCOCH3) (COOC2HS)2 520
эфир
Ацетоуксусный эфир He указан 4-Метилциклогексен-2-он (15—20) 521
Продолжение табл. г
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Ацетоуксусный эфир <СН3СНСН2СН (СООС2НЕ)2 CsHsONa C2HsONa 4-Метилциклогексеи-2-он (35) СНз 522
СНО HsC^i^S^COOCgHg ’ ОНС'/'Ч/'ЧСООС2НЕ 122
'Циануксусный эфир Апетамидоциануксусный эфир Р-Метоксиизомасляный C2HsONa C2HEONa NaOH ACH(CN)COOC2H5 AC(NHCOCH3) (CN)COOC2H6 2-Метоксиметил-2,4-диметилпеитандиаль (59) 526 175, 5 536
альдегид 3 Р-Этоксиизомасляиый NaOH 2-Этоксиметил-2, 4-диметилпентандиаль (34) 536
альдегид 3 ₽-Аллилоксйизомасляный NaOH 2-Аллилоксиметил-2, 4-диметилпентандиаль (16) 536
альдегид 3 Р*н-БутоксййзомаслЯ- NaOH 2-н-Бутоксиметил-2, 4-диметилпентандиаль (23)' 536
ный альдегид3 1-Нитропропан 2-Нитропропаи Нитроуксусный эфир Нитромалоиовый эфир (СНз)2СНСН2С(СНз) = =NCH(CH3)CH2CH(CH3)2 C2H6ONa C2HEONa K2CO3 C2HEONa C2HEONa Без катализатора CH3CH2CH(A)NO2 (31) (CH3)2C(A)NO2 (20) (CH3)2C(A)NO2 (85) ACH(NO2) COOC2Hs AC(NO2) (COOC2He)2 NCH (СНз) СН2СН (CH3) s 4 II /\-CH (CH3)2 \z (5) 530 530 526 532 533 397
1 CH,
18 Зак. 794.
$-Оксйкротоновый альде- гид и H2NC(=NH)CH2COOC2He3 Без катализатора Этиловый эфир 2-амиио-6-метилпиридин-3-карбо- 537
[j, Q-Диметилакролеин и новой кислоты (13)
₽, ₽-Диметилакролеин \1-Этоксиакролеинь и NaNH2 4, 6, 6-Триметилциклогексадиен-1,3-карбоксальде- гид-4 539
H2NC(=NH)CH2COOC2Hes Без катализатора Этиловый эфир 2-амииопиридин-З-карбоновой кис- лоты (18) 537
СН3С (=NH) СН2СООС2Не » Этиловый эфир 2-метилпиридин-З-карбоновой кис- лоты (30) 538
CH3C(=NH)CH2CN » З-Циаи-2-метилпиридии (4) 538
СНзС (=NH) СН2СОСН3 З-Ацетил-2-метилпиридии (25) 538
CH3C(=NH)CH2COC6He ^-Этоксикротоновый альдегид 6 и » З-Бензоил-2-метилпиридии (5) ' 538
H2NC(=NH)CH2COOC2Hes » Этиловый эфир 2-амино-6-метилпиридин-3-карбо- новой кислоты 537
СН3С (=NH)CH2COOC2He » Этиловый эфир 2-6-диметилпиридин-З-карбоновой кислоты (40) 182
CHsC(=NH)CH2CN » З-Циан-2,6-диметилпиридин (40) 182
СН3С (=NH) СН2СОСН3 » З-Ацетил-2,6-диметилпиридин (40) 182
CH3C(=NH)CH2COC6He а-Метил-^-этилакролеин и » З-Бензоил-2,6-диметилпиридии (35)) 182
Изомасляный альдегид СНзОК, води. NaOH, 130—180° СН3СН2СНСН(СНз)С=О (42, 15) (СН3)2С—СН2—О 180, 179
Дезоксибеизоин CH3ONa СН3СН2СНСН (СНз) СНО СбНЕСНСОС6НЕ 178
Продолжение табл. I
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
a-Этил-р-н-пропилакролеин и Ацетоуксусный эфир КОН, ацеталь н-С3Н7СНСН(С2Н6)СНС (61) 506, 540, 541
Масляный альдегид7 Водн, NaOH, 200° СН3СОСНСООС2Н6 н-СаНтСНСН (С2НЕ) С=О 179
Коричный альдегид и Этилмалоновый эфир CH3ONa С2НЕСН—СН2—О А = СбН5СНСН2СНО АС(С2НЕ) (СООС2НЕ)2 542
Ацетамидомалоновый эфир C2H6ONa AC(NHCOCH3) (COOC2HS)2 486
Ацетоуксусный эфир QHsONa 6-Карбэтокси-5-фенилциклогексен-2-он 535
н-Бутилциануксусный эфир CH3ONa АС(С4Н9-н) (CN) (СООС2Н5) 542
Формамидоциануксусный эфир C2H5ONa AC(NHCHO) (CN)COOC2H5 486
Фенил ацетальдегид CH3ONa p, 7-Дифенилвалеролактон (18) 178
Дезоксибензони CH3ONa CeHgCH (A) COCeH5 (количественный) 178
1-Нитропропан C2HsONa CH3CH2CH(A)NO2 543
2-Нитропропан C2H5ONa (CH3)2C(A)NO2 543
p-Оксикоричный альдегид и H2NC (=NH) СН2СООС2Н6 * Без катализатора Этиловый эфир 2-амино-6-фенилпиридни-3-карбо- 544
2-Гептилиденгептаналь 3 и Гептаналь Водн. NaOH, 200° новой кислоты (31) З-н-Гексил-2, 4-ди-н-амилвалеролактои (9) 183
1 При использовании в качестве катализатора этилата натрия происходит дегидрогалоидирование.
2 Продукт выделен в виде фенилгидразоиа.
8 Алкоксиальдегид образовался in situ из метакролеина и соответствующего спирта.
4 Положение двойной связи в кольце ие установлено.
6 Был использован имииоэфир малонового эфира; он реагировал, как амидии.
• Альдегид вводился в реакцию в виде ацеталя.
рДсщецления в-этил-₽^-првцилакролеина.
Таблица II
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С АЛИФАТИЧЕСКИМИ а. ^-НЕНАСЫЩЕННЫМИ КЕТОНАМИ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метилвинилкетон и A = CH3COCH2CH2— 545, ср. 546
Малоновый эфир [C6H6CH2N(CH3)3]OH A2C(COOC2HE)2 (85)
Этилмалоновый эфир C2HEONa АС(СгНд) (COOC2HS)2 (42)) 547
CO
Z\ yCH3
а-Метил-₽-кето-у-бутн- CHsONa ?Hs K, (56) 548
ролактон 1 1 О—CO
о о II II
CH3ONa> 1 ll—CHjOH (14) f JI—CH2OH (4) 548
/\ 1 H3C СООСНз CH3
Ацетоуксусный эфир C2HEONa СНзСОС (A)2COOC2HE (92) 131
Этилацетоуксусный Na 4-Этил-3-метилциклогексен-2-он 442
эфир а- (Метил тиометил) аце- C2H6ONa CH3COC (CH2SCH3) (А) СООСгНв (47) 549
тоуксусный эфир Изопропилацетоуксус- CjHsONa 6-Карбэтоксн-6-изопропил-3-метилциклогексеи- 550
иый эфир 2-он4 (32) СНзСОС (А) (СзН?-«зо) СООС2Н5 (741 131
Продолжение табл. IT
Реагирующие вещества Катализатор Продукт реакции (выход, %) • Литература
Этиловый эфир цикло- гексанон-2-карбоно- вой кислоты 3 NaOH z\ Y\Y° (небольшой) 551
СООС2Н5
Не указан А^° Y ,73) 552
с о :оос2н6 !
О [C6HSCH2N(CH3)3]OH II /А (91) \соос2н5 553
Этиловый эфир 4-ме- тилциклогексен-3-он- 2-карбоновой кислоты CH3ONa С2Н. ООСч уА. » <84> и • 134
Этиловый эфир бен- зоилуксусиой кислоты [C6H5CH2N(CH3)3]OH о II Q 1 сн3 (55) -с6н5 о Л (21) j/Z^^/C6Hs Х^он 559
Этиловый эфир (а-фу- IW уютгярй ««слоты Не указан СООС2Н5 СООС2Н5 4-Карбэтоксн-З- (а-фурил) -3-окснциклогексанон 554
Метиловый эфир 1-кето- 1, 2, 3, 4-тетрагидро- фенантреи-2-карбоно- вой кислоты CHsONa
Метиловый эфир 4-кето- CH3ONa
1,2, 3,4-тетрагидро- фенантрен-З-карбоИо- вой кислоты Этиловый эфир фенил- Не указан
пировиноградной кис- лоты Нитрил малоновой кис- CH3ONa
лоты Цианистый бензил Na
Этиловый эфир фенил- Na
циануксусиой кислоты Метил-р-циан этил кетой KCN
/\/А (93)
I |хсоосн3
iVY%0
А /СООСН3
<ХХ О6)
Y\/W
3-Карбэтокси-3-окси-2-метил-4-фенилциклогексанон
(A)2C(CN)2 (74)
CeH5CH(A)CN
С6Н6С(А) (CN)COOC2Hb (90)
CH2CN
555
556
554
131, 134
133
133
135
Ацетон
Изомасляиый альдегид
Метилэтилкетон
Диэтил ацетальдегид
2-Этилгексаналь
Циклогексанон
СНзОК
_________5
СНзОК
СНзОК
Енамин из циклогекса-
нона
Н3С
З-Метилциклогексен-2-ои (3)
4, 4-Диметилцнклогексен-2-он 6 (40)
3,6-Диметилциклогексен-2-он (3)
4, 4-Диэтилциклогексен-2-он
4-н-Бутил-4-этилциклогексен-2-он
Z\Y\Y°
(30—40)
441
557
441
557
557
558, 554 >
Продолжение табл. 11
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Фенил ацетон [СбН5СН2Ы(СН3)3]ОН О А I II н6св— \АСНз О II Q-СН3 С40» 559
Циклогександион-1,3 CH3ONa с6н5 О II 555
КОН, СН3ОН \Z4O о II (38) / /=О о Ьь ь 1 561
2-Метилциклогексан- CH3ONa; (GHshN О 1 /СНз (64) 548, 562
дион-1,3 5,5-Днметнлциклогек- КОН, СН3ОН \/^о о 11 СНз^Л^ (52) о zV71 СН3х I |\ . (43) 561
сандион-1,3 сн3/\/'Ч) сн3/\/%о
5-Метилоктагидронаф-
талиндион-1, 6
ОН
ОН
6-Метокси-1 -метнл-
2-тетралон
З-Оксиметилен-4-кето-
1,2, 3,4-тетрагидро-
40 фенантрен
Н3С
О
II
-Нитрометан
CH3ONa
[C6H6CH2N(CH3)3]OH
Не указан
CH3ONa
C2H5ONa; трет-амины
[C6HSCH2N(CH3)3]OH;
CH3ONa
5-Метил-5- (у-кетобутил)-Д’“- 5“-октагидронафта-
лиидиои-1,6
(39)
H3i
//>
127
563, 564
554
СН3О—Ц'
V\A
А
и 3-формнльное производное
556
565
529, 546
Продолжение табл, fl
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Нитроэтаи СНзОЫа CH3CH(A)NO2 (49) 529
2-Нитропропан СНзОЫа (CH3)2C(A)NO2 (69) 529, 566
Метиловый эфир флуо- рен-9-карбоновой кис- кон <71) 567
ЛОТЫ А СООСНз
А
Нафтол-2 СгНЕОК ^VV-OH (24) 184
C2HEONa
Этиловый эфир 3-окси- 131
бензофур ан-2-карбо- 1 1 Гл <М)
новой кислоты 1 II \/А
• ^/^o/^COOCsHs
2'-Оксиметилеи-1 '-кето- CH3ONa 1'-Кето-2’-(у-кетобутил)-1/, 2', 3', 4'-тетрагидро- 568
Г, 2', 3'. 4'-тетрагидро- 1,2-бенз-З, 4-ацепери- 1,2-беиз-З, 4-ацеперийафтаи (70)
иафтан трет-С4Н9ОК 1'-Кето-2'-(у-кетобутил)-1', 2', 3', 4'-тетрагидро- 568
Оксиметиленацетон и 1,2-беиз-З, 4-ацеперинафтан (26)
Ацетоуксусный эфир C2HEONa 2-Окси-4-метилбеизойиая кислота (55) 449
Этиловый эфир ацетон- C2HEONa Этиловый эфир 2-окси-4-метилизофталевой кис- 449
1, 3-дикарбоновой кис- лоты (49)
ЛОТЫ
CHaCOCH=CHONa СНзСОСН2СНОНСН2ЬЮ2 (4); 569
Этиловый эфир полу-
амида малоновой кис-
лоты 7
Цианацетамид
Этилиденацетон и
Метилмалоновый эфир
Этиловый эфир цикло-
гексанон-2-карбоиовой
кислоты
g Метиловый эфир 1-кето-
**" 1,2, 3,4-тетрагидро-
фенантрен-2-карбоно-
вой кислоты
4-Оксикумарин
7-Хлор-4,6-днметокси-
кумараион-3
Без катализатора
Пиперидииацетат
C2H5ONa
С2НЕОК
i CH3ONa
Пиридин
C2HEONa
Этиловый эфир 2-амино-6-метилникотииовой кис-
лоты (32)
3-Циаи-2-окси-6-метилпиридии (55—62)
А=СН3СНСН2СОСН3
2, З-Диметилциклогександион-1, 5 (10)
/\^\^°
1 I
С2НЕООС сн3
(два изомера)
(неочищенный 83,
чистый 59)
544
570
444
431
571
185
Продолжение табл. II
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
4,6-Диметоксикумаран- он-3 2-Карбэтокси-4,6-димет- оксикумаранон-3 Этилвинилкетон и C2H6ONa » C2HsONa СН3О— ( СН3О— А =СН ОСН3 А два изоме ОСН3 ^/\о/ зСН2СОСЬ сн2 / 'со 1 сн2 V 1 СНз ра) =О /А Х)ООС2Н6 [2сн2— 95 95
Малоновый эфир 8 C2HsONa АСН(СООС2Н5)2 572
Ацетоуксусный эфир 8 C2HsONa СНзСОСН(Л)СООС2Нз 573
Ацетилацетон 8 Циклогексаидион-1, 3 C2H£ONa Пиперидин СНзСОСН(Л)СОСНз О II IJ=O 572 560
СНО
/\/\=О (транс)
СН3
rper-CiHsOK
A CHO
CH3
Дивинилкетон и
2-Метилциклогексаи-
дион-1, 3
Метилизопропенилке-
тон и
Ацетоуксусный эфир
Пропионилуксусный
эфир
Изобутирилуксусиый
эфир
Ацетон
Метил этил кетой
Циклогексанон
(45—57)
CH3ONa
Na
Na
KOH, C2H6OH
KOH, СНзОН
KOH, СНзОН
KOH, C2H5OH
A = CH3COCH (CH3)CH2—
3,4-Диметилциклогексеи-2-он
3-Этил-4-метилциклогексен-2-он
(CH3)2CHCOCH(A)COOC2H5 (75)
3, 6-Диметилциклогексеи-2-он (20)
3,4,6-Триметилциклогексен-2-ои 10 (49, 43)
(80, 90, 25)
ОН
(32)
574
561
442
442
131
440, 575»
440, 575
391
Продолжение табл. II
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
4-Метилциклогексаион ьэ $ 3-Метилциклогексанон КОН, С2Н5ОН КОН, С2Н5ОН /\^\=О НзС-i^J^J-CHs (13) ОН eh- с-, Н3С—СНз (два изомера) Н3С—(18) \/\/~ СНз ОН Н3С-/Ч/\^ (19) \/\/ СНз (два изомера) ОН 109, ср. 8 109
2-Метилциклогексаион Тетрагидрокарвон КОН, С2Н5ОН КОН, C2HSOH СНз «30-C3H7— сн, " (40) ,Х/!-сн3 СНз 109 109
4-Оксипентен-3-он-2 и Этиловый эфир ацетон- 1, 3-дикарбоновой кис- лоты Амид малоновой кислоты Нитрил малоновой кислоты H2NC (=NH)CH2COOC2Hs * C2H5ONa Без катализатора » » » »
ГО Оо Сл Цианацетамид Циаиацетамид 11 NCCH2CONHCH3 » NCCH2CONHC2H5 ч NCCH2CONHCH2CH=CH2 ч СНзСОСН2С (=NH)CH3 ч 4-Аминопентен-3-он-2 и Циануксусный эфир N-Метилциан ацетамид » » Пиперидин NH3 CH3NH2 c2h5nh2 ch2=chch2nh2 Без катализатора Без катализатора » »
Метил-а-оксиметилен- этилкетон и Цианацетамид Пиперидин
СНзС (=NH) СН2СООС2Н5 Без катализатора
З-Окшметиленпентан- дион-2,4 и Цианацетамид Окись мезитила и C2H5ONa
Диметиловый эфир ма- лоновой кислоты CH3ONa
Этиловый эфир
кислоты (92)
2-окси-4,6-диметилизофталевой 449
Амид 4,6-диметилпиридои-2-карбоновой-3 кислоты
4,6-Диметил-3-цианпиридон-2
Этиловый эфир 2-амино-4, 6-диметилпиридин-З-кар-
боновой кислоты (50, 69)
Амид 4,6-диметилпиридон-2-карбоновой-3 кислоты
З-Циан-4,6-диметилпиридои-2 (87, 100)
З-Циан-4,6-диметилпиридон-2
З-Циан-1,4,6-триметилпиридон-2
З-Циан-4, 6-диметил- 1-этилпиридон-2
1-Аллил-З-циан-4, 6-диметилпиридои-2
Метил-2, 4, 6-триметил-З-пиридилкетон (>75)
З-Циан-4, 6-диметилпиридон-2
З-Циан-1, 4,6-триметилпиридон-2
3-Циан-4-окси-5, 6-диметил-2, 3, 4, 5-тетрагидропири-
дон-2 или З-циан-5, 6-диметил-2-оксипиридин (23)
Этиловый эфир 2,5,6-триметилпиридин-З-карбоно-
вой кислоты
Соединение CgHeNsOs
А = СНзСОСН2С(СНа)г
4-Карбометокси-5,5-диметилциклогександион-1,3
(85)
392
392
537, 544
392
576, 393, 577
578
578
578
578
466
578
579
187, 188
580
272
581
Продолжение табл. if
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Малоновый эфир C2H£ONa 5,5-Диметилциклогексаидиои-1, 3 (67—85) или 4-карбэтокси-5,5-диметилциклогександион-1,3 (95—97) 581, 582
Метилмалоиовый эфир CsHsONa 4,5, 5-Триметилциклогексаидион-1, 3 335
Этиловый эфир феи ил- уксусной кислоты CsHsONa 5,5-Диметил-4-феиилциклогександион-1,3 89
Ацетоуксусный эфир C2H£ONa 3,5,5-Триметилциклогексеи-2-он (низкий) 15—17, ср. 131
Этиловый эфир беи- зоилуксусной кислоты CsHsONa 4-Карбэтокси-5,5-диметил-3-феиилциклогексен-2-он (44) 436
Метиловый эфир циан- уксусной кислоты Na NCCH (А) СООСНз 437
Циаиуксусиый эфир C2H£ONa 4-Циан-5, 5-диметилциклогексаидион-1,3 (50) 437, 447
Циаиацетамид C2H£ONa 3-Циаи-6-окси-4, 4,6-триметилпиперидон-2 (количе- ственный) 583
Дезоксибеизоин CsHsONa СбН5СОСН(А)СбН£ и 5,5-диметил-3, 4-дифенил- цикл огексеи-2-ои 436
Ацетилацетои Na 6-Ацетил-3,5,5-триметилциклогексен-2-он 437
Нитрометан CsHsONa ACH2NO2 (63) 584
(C2H£)2NH ACH2NO2 (65) 225
Флуореи KOH, пиридин 5-(9-Флуоренил)-4, 4-диметилпеитанои-2 (15—20) 585
4-Оксикумарии З-Этилбутен-З-он-2 и Пиридин 4- (4-Оксикумаринил) -4-метилпентанон-2 (43) 185
Метилпропилкетон 12 З-Мети.лпентен-З-он-2 и KOH, CH3OH 4,6-Диэтил-3-метилциклогексен-2-он 13 (7, 20) 575, 440
Малоновый эфир 2-Метилпентен-1-он-3 и C2H£ONa 4,5-Диметилциклогександион-1. 3 14 (10) 444
Этиловый эфир пропионил- He указан 2, 4-Диметил-3-этилциклогексен-2-он 442
Метилацетоуксусный эфир » » З-Этил -4,6-диметилциклогексен -2-он 442
Этилацетоуксусный эфир 4-Окси-З-метилпентен-З- он-2 и » » 3,6-Диэтил-4-метилциклогексен-2-ои 442
Циаиацетамид 11 Без катализатора Пиперидин З-Циаи-4, 5, 6-триметилпиридои-2 З-Циан-4,5, 6-триметилпиридои-2 578 586, ср. 587
NCCH2CONHCH3 » Этил-а-оксимепгиленэтил- кетон и Без катализатора З-Циан-1,4, 5, 6-тетраметилпиридон-2 578
Циаиацетамид втор-Амин 3-Циаи-6-этил-2-окси-5-метилпиридии 272
СНзС (=NH)CH2COOC2H£ Без катализатора Этиловый эфир б-этил-2,5-диметилпиридии-З-кар- боиовой кислоты (50) 464
СН3С (=NH) СН2СОСНз » » Метил-6-этил-2,5-диметил-З-пиридилкетои (46) 464
Нитрометан Метил-^-этоксивинилке- тон и СНзСН2СОС— (=CHONa)CH3 5-Окси-4-метил-6-ннтрогексанои-3 (54) 569
Циаиацетамид '"4 ^-Метоксивинилэтилке- тон и Пиперидин 3-Циаи-6-метилпиридои-2 (75) О СН3 588
2-Метилциклогексанон Гептпен-З-он-2 и Na Д /СН3 ' /\ ' у (небольшой) 1ч/)хсн=снсосгн£ СНз 411
Малоновый эфир 4-Метилгексен-3-он-2 и C2H£ONa 5-и-Пропилциклогександион-1,3 (16, 24) 589, 444
Циаиацетамид 5-Метилгексен-3-он-2 и C2H£ONa 3-Циан-4-этил-6-окси-4,6-диметилпиперидои-2 (63) 590
Малоновый эфир 3,4-Димети.лпентен-З- он-2 и C2H£ONa 5-Изопропилциклогександиои-1, 3 (80) 444, 591, 592
Малоновый эфир C2H£ONa 4,5,5-Триметилциклогексаидион-1, ? 593
Продолжение табл. If
Реагирующие вещества Катализатор Продукт реакции (выход, %} Литература
5-Оксигептен-4-он-3 и Цианацетамид Без катализатора З-Циан-4,6-диэтилпиридон-2 392
4- Окси-5-этоксипентен-З- он-2 и Цианацетамйд Пиперидин 3-Циан-4-этоксиметил-6-метилпиридон-2 (81) 500
4-Окси-3-этилпентен-3-он-2 и Цианацетамйд Без катализатора 3-Циан-5-этил-4,6-диметилпиридон-2 393
Метил-^-изопропоксивинил- кетон и Малоновый эфир Na СН3СОСН=СНСН(СООС2Н8)2 и 411
Метиловый эфир 4-кето-5- CH3ONa НзС-<°у° i^^!-cooc2hs /-^/СНз /ХСН2СН2СОСНгСН2СООСН8 ^0 5-Изопропил-2-метилциклогександион-1,3 (43) 548
гексеновой кислоты и 2-Метилциклогександирн-1, 3 6-Метилгептен-4-он-3 и Малоновый эфир CzHsONa 444
4-Этилгексен-3-он-2 и Малоновый эфир CzHsONa 5,5-Диэтилциклогександион-1, 3 (50) 594
Цианацетамид CzHsONa З-Циан-4,4-диэтил-6-окси-6-метилпиперидон-2 (75) 590
н-Пропил-^-этоксивинилке- тон и Циаиацетамид Пиперидив 3-Циаи-6-и-пропилпиридон-2 (64) 588
Изопропил-^-этоксивинил- кетон и 588
З-н-Амилбутен-З-он-212 и Метилгексилкетон 6-Метилнонен-5-он-4 и КОН, СНзОН 4, 6-Ди-(н-амил)-3-метилциклогексен-2-он (23, 33) 440, 575
Малоновый эфир C2H5ONa 2-Этил-5-метил-5-и-пропилциклогександион-1, 3 595
Декандион-2,4 (енол) и Цианацетамид 11 Без катализатора- CH3 С6Н13-н 578
^•Этоксивинил-н-амилкетон и Цианацетамид Пиперидин А-™ и“ А-™ «H„cPXNJ-o. h,c-;,J-0 н н 6-и-Амил-3-цианпиридон-2 (68) 588
8-Метилтридецен-7-он-6 и Малоновый эфир C2H8ONa А = m-CsHiiCOCH2C(CH3)CsHii-m 5-н-Амил-2-и-бутил-5-метилциклогександион-1, 3 (60) 596
Циаиацетамид C2H8ONa ACH(CN)CONH2 (64) 596
1-Оксиметиленгетадекан- g он-2 и Этиловый эфир ацетон- C2HsONa Этиловый эфир 2-окси-4-н-пентадецилизофталевой 449
1, 3-дикарбоиовой кислоты 13-Метилтрикосен-12-он-11 и Малоновый эфир C2H5ONa кислоты (52) А = н-СюН21С(СНз)СН2СОС1оН2]-н 5-н-Децил-5-метил-2-н-нонилциклогександиои-1,3 (60) 596
Циаиацетамид C2H5ONa АСН2СООС2Н8 is 596
1 В этой реакции использовалось вдвое большее количество катализатора, чем в предыдущей конденсации.
2 Использовался метилхлорэтилкетои.
• В данном опыте реагентами фактически были сложный эфир, ацетон и формальдегид.
4 После гидролиза аддукта общий выход (±)-пиперитоиа составил 26%.
8 Этот опыт проводился в паровой фазе в присутствии окисей элементов II—IV групп периодической системы.
6 Указывалось, что это вероятное строение продукта.
7 Использовался имииоэфир сложного эфира.
8 Использовался Р-хлор этил эти л кетон.
9 При испольвоваиии вместо насыщенного кетона З-окси-З-метилбутаиона-2 выход составлял 11%.
10 Тот же продукт получен из метилэтилкетона и формальдегида (49—52%) и из метилэтилкетоиа и З-окси-З-метилбутаиоиа-2 (43—49%).
” В этих опытах использовалась смесь циаиуксусного эфира и аммиака или соответствующий амин.
12 Использовалась смесь триоксиметилеиа и кетона.
13 Тот же цродукт получен из кетона и 3-этил-4-оксибутаноиа-2 с выходом 23% и из метил пропил кетона и формальдегида с выходом 20%.
14 Наименование, приведенное в литературной ссылке, ошибочно.
58 Этот продукт получен после кислотного гидролиза и этерификации.
Таблица III
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С АРОМАТИЧЕСКИМИ а, Р-НЕНАСЫГИЕННЫМИ КЕТОНАМИ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Винилфенилкетон1 и Диметиловый эфир малоно- вой кислоты Метиловый эфир флуорен- 9-карбоиовой кислоты CH3ONa КОН А = С6Н£СОСН2СН2— ЛСН(СООСН3)2 (70) (Л)2С(СООСН3)2 (небольшой) /А^/СООСНз Qi) (56) 597 567
Ацетоуксусный эфир Нитрил малоновой кислоты Метиловый эфир циануксус- ной кислоты Цианацетамид Метил бензилкетон Дезоксибензоин Дибензилкетон Бензил-п-бифенилкетон Нитрометан Фенилнитрометан Оксиметиленацетофенон и Ацетоуксусный эфир Диэтиловый эфир ацетон- 1,3-дикарбоновой кислоты СНзС (=NH)CH2COCH3 C2HsONa CH3ONa CH3ONa CH3ONa CH3ONa CH3ONa C2HsONa CH3ONa CH3ONa CH3ONa [CH3COCHCOOC2H£]Na C2H£ONa Без катализатора 6-Карбэтокси-3-фенилциклогексен-2-он (Л)2С(СИ)2 (A)2C(CN)COOCH3 (70) (A)2C(CN)CONH2 3,6-Дифенилциклогексен-2-он С6Н£СОСН(Л)С6Н£ (60) 2, 3,6-Трифеиилциклогексен-2-он C6HSCH (Л) COC£H4C6Hs-n (A)3CNO2 C6H£CH(A)NO2 (82) Этиловый эфир З-оксибифенил-4-карбо- новой кислоты (42) Диэтиловый эфир З-оксибифенил-2,4-ди- карбоновой кислоты (59) 3-Ацетил-2-метил-6-фенилпиридин 598 245 245 245 598 599 598 599 245 600 601 449 444
НитрОметан 1 CeHsCOCH=CHONa
{Метоксиметиленуацетофе-
, нон и
*2 Ацетоуксусный эфир [СНзСО,CHCOOC2H£]Na
Бензилиденацетон и
Диметиловый эфир малоно- CH3ONa
вой КИСЛОТЫ
Малоновый эфир Na, C2H£ONa
KOH, ацеталь
Этиловый эфир фенилуксус- C2H£ONa
ной кислоты
Этиловый эфир циклопента- C2H£OK
<о иои-2-карбоновой кислоты
Этиловый эфир циклогексан- C2H£OK
он-2-карбоновой кислоты
Циануксусный эфир C2HsONa
Этиловый эфир а-цианмасля- C2HsONa
ной кислоты
Этиловый эфир а-цианкапро- C2HsONa
новой кислоты
Цианацетамид втор-Амин
V C2H£ONa
Р-Окси-к-нитробутирофенон \ 567
Этиловый эфир З-оксибифенил-4-карбоно- вой кислоты (42) А = СНзСОСН2СНС6Н5 ЛСН(СООСН3)2 601 78
5-Феиилциклогександион-1,3 (75) или его 4-карбэтоксипроизводное ЛСН(СООС2Н£)2 (84) 4, 5-Дифенилциклогександион-1,3 О Д/Л |\соос2н6 о А/л |\cooc2H£ ЛСН(СИ)СООС2Н£ (91) СН3СН2С(Л)(СЫ)СООС2Н5 (23) 4, 602, 603 506, 540, 541, 604, 37 89 431 431 133 605
C4H9C(A)(CN)COOC2Hs (78) 133
3-Циан-6-окси-6-метил-4-фенилпипери- дон-2 3-Циан-2-кето-6-метил-4-фенил-2,3, 4,5- тетрагидропиридин 461 461, 241
Продолжение табл. Ill
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Ацетонитрил КОН, ацеталь ACH2CN (82) 506,540,541
CH3C(=NH)CH2CN C2HsONa З-Циан-2, 6-диметил-4-фенилп иридии (12) 462
Цианистый бензил CH3ONa C6HSCH(A)CN (87) 135
Дезоксибеизоин C2HsONa C6HsCOCH(A)C6H5 438
Циклогексанон NaNH2 /\Z\ZO (43) c6Hs 0 1! 105
2-Метилтетралон-1 NaNH2 = o \ I n » a Ж ел 105
Антрон Пиперидин 1 II II 1 (66) h/\a 606
Нитрометан (C2Hs)2NH ACH2NO2 (58) 225
1-Нитропропан (C2Hb)2NH . СНзСН2СН (71)NO2 (два изомера, общий ..JiUSSASfl) 225
Этиловый эфир нитроуксус- ной кислоты (C2Hs)2NH [C6H5CH2N (СН3)з]ОН
Флуорен C2H5ONa
2,7-Дибромфлуорен C2HsONa
2-Оксииафтохиион-1,4 Пиридин
4-Оксикумарин Пиперидин
NH3, трет-амины
Триэтиловый эфир фос- фонуксусной кислоты C2H5ONa
I
I O2NCH(A)COOC2HE2 (54)
O2NCH(A)COOC2H5
(И)
о
он
Lo (67)
он
| || |-71 (76-90)
'Ч/хо/%о
(C2H6O)2P(O)CH(A)COOC2Hs (48J
\ 167
398
398
607
185, 608
609
136
Продолжение табл. III
А. Замещенные бензилиденацетоны
Заместитель в 3__2 4^ ^-СН=СНСОСН3 >=в Присоединяемое соедииеиие Катализатор Продукт реакции (выход, %) A=ArCHCH2COCHs 1 Литера- тура
2-Окси Ацетоуксусный эфир C2HsONa 4-Ацетонил-2-метил-1, 4-бензопиран 456
Метилацетоуксусный эфир C2HsONa 4-Ацетонил-2, З-диметил-1, 4-бензопиран (52) 45 ’
1 ' Фенил ацетоуксусный эфир C2HsONa 4-Ацетонил-2-метил-3-фенил-1,4-бензопираи 45
2-Оксибензил идеи аце- тон « C2HsONa </ ^>—СН=СНС6Н4ОН-2 2-HOCJ4, 610
2-Метокси Ацетоуксусный эфир Водн. NaOH 2 (или 4)-Карбэтокси-5-(о-метоксифенил)-3-ме- тилциклогексен-2-он 456
Малоновый эфир C2HsONa 5- (о-Метоксифенил) циклогександион-1,3 611
4-Метокси Малоновый эфир CsHsONa 5- (л-Метоксифеиил) циклогександион-1,3 (59) 611
Ацетоуксусный эфир Пиперидин СН3СОСН(А)СООС2Н8 (55) 612
Триэтиловый эфир этан-1, 2,2-трикар- боновой кислоты C2HsONa °\/\-С6Н4ОСН3-л (40) LcOOCjHs \/\CH2COOC2Hs о 121
Этиловый эфир цикло- пентанои-2-карбоио- C2H8OK СН3СОСНаСН(СеН1ОСНа-л)СН(СООС!НБ)СН2СН5СН!СООН 431
СООС2Н6
Этиловый эфир цикло- гексанон-2-карбоно- вой кислоты С2Н5ОК
Циануксусный эфир C2H8ON а
Дезоксибензоин C2HsONa
4-Оксикумарин Пиридин
м З-Нитро сл 4-Нитро 2-Хлор Малоновый эфир Малоновый эфир Малоновый эфир C2HsONa C2HsONa C2H8ONa
4-Окси-З-метокси 4-Оксикумарнн Пиридин
2, З-Диметоксй 4-Диметиламиио 4-Изопропил Этиловый эфир а-ци- анмасляной кислоты Ацетоуксусный эфир Малоновый эфир C2HsONa Водн. NaOH C2HsONa
С6Н4ОСН3-я
\Z^Z4O
4-Циан-5- (я-мётоксифенил)циклогександион-1, 3
(90)
CeHsCOCH (A) C6HS
ОН
(С6Н4ОСН3-я) сн2сосн3 (45)
5- (лг-Нитрофенил) циклогександион-1,3
5- (я-Нитрофенил)циклогександион-!, 3
5-(о-Хлорфенил)циклогександион-1, 3 (27)
ОН
I /ОСН3
---СН—ОН
I II 1—о I
%/хО/ СН2СОСН3
CH3CH2C(CN) (Л)СООС2Н5
431
613
438
185
614
614
611
185
605
2-Карбэтокси-З- (я-диметиламинофенил) -5-окси- 304
5-метилциклогексаион-1
5-(л-Изопропилфенил)циклогександион-1,3 (60) 602
Продолжение табл III
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этилиденаиетофенон и Циаиацетамид C2H8ONa сн3 Д-CN 615
Оксиметилен-п-метилацетофе- нон и СН3С (=NH) СН2СООСгН5 Без катализатора HsCX^N^O Этиловый эфир 2-метил-6-(п-толил) пиридин- 580
СНзС (=NH) СН2СОСНз » » 3-карбоиовой кислоты 3-Ацетил-2-метил-6- (п-толил) пиридин 464, 580
СН3С (=NH) СНгСОСвНз > » З-Беизоил-2-метил-6- (п-толил) пиридин 464
а-Оксиметиленэтилфенилкетон и СНзС (=NH) СН2СООС2Н8 3> » Этиловый эфир 2,5-диметил-6-фенилпиридин- 580
Бензоилацетон(енол) и Диэтиловый эфир ацетон-1,3- дикарбоновой кислоты C2H8ONa 3-карбоновой кислоты Диэтиловый эфир 3-окси-5-метилбифенил-2, 4-ди- 449
Цианацетамид (C2H8)2NH карбоновой кислоты (47) 3-Циаи-6-метил-4-феиилпиридои-2 и З-циан-4-ме- 393, 616
Циануксусный эфир (CgHs^NH тил-6-фенилпиридои-2 3-Карбэтокси-4-метил-6-фенилпиридон-2 (низкий) 392
Нитрил малоновой кислоты (C2Hs)2NH 3-Циан-4-метил-6-фенилпиридон-2 392
3-Амино-1-фенилбутен-2-он-1 и Циануксусный эфир CzHsONa 3-Циан-6-метил-4-феиилпиридон-2 \ 413
Цианацетамид Без катализатора 3-Циан-4-метил-6-фенилпиридон-2 1 413
NCCH2CONHCH3 » » З-Циан-1, 4-диметил-6-фенилпиридон-2 и 3-циан- 413
Этилстирилкетон и Малоновый эфир C2HsONa 4-метил-6-фенилпиридон-2 4-Карбэтокси-2-метил-5-фенилциклогексан- 445
Этиловый эфир фенилуксус- C2H8ONa дион-1,3 (79) 2-Метил-5-феиилциклогексаидиои-1,3 (80) 2-Метил-4, 5-дифенилциклогександион-1,3 (21,32) 444 445, 444
ной кислоты Этилфенацилкетон (енол) и Циаиацетамид Без катализатора 3-Циан-4-этил-6-фенилпиридои-2 393
1-Окси-5-фенилпентен-1-он-3 и Циаиацетамид Пиперидин CuHi2N2O, 5-циаи-6-окси-2-феиилэтилпиридин (?) 188
1-Фенил-2-метилбутен-3-он-1 и Нитрометан C2H8ONa С6Н8СОСН(СНз)СН(СНз)СН2НО2 (63) 584
1-Фенил-3-метилбутен-2-он-1 и Нитрометан C2H8ONa C8H8COCH2C(CH3)2CH2NO2 (76) 584
5-Фенилпентен-3-он-2'л и Малоновый эфир C2H8ONa 5-Бензилциклогександиои-1, 3 617
4-ФеНил-4-метоксибутен-3-он-2 и Циаиацетамид C2H5ONa; (C2H8)2NH 3-Циаи-6-метил-4-фенилпиридон-2 (30) 616
1-Фенил-3-этоксибутен-2-он-1 и Цианацетамид C2HsONa 3-Циаи-4-метил-6-феиилпиридои-2 616
п-Метилбензоилацетон (енол) и Циаиацетамид (C2H5)2NH 3-Циан-4-метил-6-п-толилпиридон-2 (80) и 618
NCCH2CONHCH3 (C2Hb)2NH 3-циан-6-метил-4-п-толилпиридон-2 (в неболь- шом количестве нз изомерного енола) З-Циан-1,6-диметил-4-п-толилпиридон-2 618
Продолжение табл. Ill
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
1 - Фенил-З-метиламинобутен-2- он-1 и Цианацетамид Этоксиметиленацетофенон и Малоновый эфир Натрийенолят слож- 3-Циаи-2-метнл-6-фенилпиридон-2 и 3-циан- 1, 4-диметил-6-фенилпиридон-2 Этиловый эфир 6-фенилкумалин-З-карбоновой 413 601
н-Пропилстирилкетон и Малоновый эфир ного эфира C2HsONa кислоты (44) 4-Карбэтокси-2-этил-5-фенил циклогексан- 445
сП Изопропилстирилкетон и Малоновый эфир C2HsONa цион-1,3 (41) (СНз) 2СНСОСН2СН (С6Н5) СН (С6Н5) - 339
Оо Этил-п-метоксистирилкетон и Малоновый эфир C2HsONa CH(COOC2HS)2 (79) 4-Карбэтокси-5- (n-метоксифеиил) -2-метилцикло- 619
Циануксусный эфир CjHjONa гександион-1,3 (44) 4-Циан-5- (п-метоксифенил) циклогексан- 613
Триэтиловый эфир этаи-1,1,2- C2H3ONa дион-1,3 (55) О II 121
трикарбоновой кислоты Циклопропилстирилкетон и Ннталметан СНзОМа 1 (20) A J— С6Н4ОСН3-л CjH^OOC^ ХН2СООС2Н5 сн2—СНСОСН2СНС6Н5 \ Z 1 (42—52) 150
1-Фенил-З-циклопропилпропен- 2-он и Нитрометан CH3ONa СН2—СНСНСН2СОС6Н6 \ Z 1 (71) СН2 CH2NO2 150
1-А цетил-3,4-дигидронафталин и Ацетоуксусный эфир CjHsONa °ч/Ч-сн3 —СООС2Н6 620
3-Ацетил-4-фенилбутен-3-он-2 и Фенилнитрометан (C2HS)2NH 1 1 1 \z\z З-Ацетил-4, 5-дифеиил-5-нитропентанон-2 (84) 36
н-Бутилстирилкетон и Малоновый эфир C2H5ONa 4-Карбэтокси-5-фенил-2-н-пропилциклогексан- 445
КЗ Винил-п-н-пропоксифенилкетон и Нитрометан NaOH дион-1,3 (35) А =п-н-С3Н7ОС6Н4СОСН2СН2— (A)2CHNO2 (73) 621
о Феиилнитрометан CH3ONa C6H5CH(A)NO2 (71) 621
Цианацетамид CH3ONa NCC(A)2CONH2 (83) 621
Бензальпинаколин и Диметиловый эфир малоно- CH3ONa А= (СН3)зССОСН2СНС6Н6 ЛСН(СООСН3)2 (82) 622
ВОЙ кислоты Малоновый эфир CsHsONa ЛСН(СООС2Н3)24 (97, 70) 622, 623
Метиловый эфир п-нитрофе- CH3ONa n-O2NC6H4CH (А) СООСН3 624
нилуксусной кислоты Этиловый эфир п-нитрофенил- C2HsONa n-O2NC6H4CH (Л) СООС2Н5 624
уксусной кислоты Нитрометан CH3ONa ACH2NO2 (80—90) 625
Изопропил-п-метоксистирил- кетон и Малоновый эфир Енолят (СН3) 2СНСОСН2СН (С6Н4ОСН3-п) СН2СООН 37
Продолжение табл. Ill
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
3-Этокси-1 -n-толилбу тен-2-он- / и
Цианацетамйд 2-Бензилиденцик.логексанон и (C2H8)2NH 3-Циан-4-метил-6-п-толилпиридои-2 (количе- ственный) с6н5 г4/?—соос,н. 618
Малоновый эфир Еиолят 1 J -о <89> \Ао'_и 626
n-М етоксибензилиденцикло- гексанон и Этиловый эфир Р-(2-кетоциклогексил)гидроко- ричиой кислоты (70) С6Н4ОСН3-л рА-соос,н, 627
Малоновый эфир Na 626
н-Гексилстирилкетон и
Малоновый эфир 1,2-Дифенилпропен-2-он и CsHsONa 4-Карбэтокси-2-амил-5-фенилциклогексаи- дион-1,3 (45) А = С8Н8СОСН(С6Н8)СН2— 445
Бензил-п-хлорфеиил кетон КОН, СНзОН С6Н5СН(Л)СОС6Н4С1-п (88) 628 629, 630
Бёнзил-п-толилкетои КОН, СНзОН СбН5СН(Л)СОС6Н4СНз-п (85) 628
Беизил-п-аиизилкетон КОН, СНзОН С6Н5СН(Л)СОС6Н4ОСНз-л (74) 628
ДезокСибеизоии КОН, СНзОН С6Н5СН(Л)СОС6Н5 (80) 628
КОН, СНзОН &0&Н^Й1С^^77) 628
Феннл-п-метнлбензилкетон КОН, СНзОН п-СН3С6Н4СН (Л) СОСбНз (71) 628
Фенил-л-диметиламинобензил- КОН, СНзОН п-(СНз)2НСбН4СН(Д)СОС6Н5 (86) 628
кетон Дибензоилметан(енод) и
Циаиацетамид CsHsONa З-Циан-4,6-дифеиилпиридои-2 (5—20) 392, 616
(C2H8)2NH З-Циан-4,6-дифеиилпиридон-2 (55—70) 392, 616
Пиперидин З-Циан-4,6-дифенилпиридои-2 392, 616
Винил-п-бифенилилкетон и
Дезоксибензоин Халкон, СвН5СН=СНСОСбН5 и Диметиловый эфир малоновой CHsONa п-С6Н8С6Н4СОСН2СН2СН (С8Н8) СОС6Н8 А = С6Н8СНСН2СОС8Н8 1 599
КИСЛОТЫ CHsONa ЛСН (СООСНз) 2 (80, 94) 82, 427
Пиперидин ЛСН (СООСНз) 2 (плохой) 78
Малоновый эфир Пиперидин; 0,1 экв C2H8ONa; КОН, ацеталь ЛСН(СООС2Н8)2 (71, 93, 98) 37, 62, 137 505,540,541
1 зкв C2H5ONa Диэтиловый эфир 5-бензоил-2,4,6-трифенил- 4-циклогексенил-1,1-дикарбоноиой кислоты (70) 62
Метилмалоиовый эфир Пиперидин, C2H8ONa ДС(СН3)(СООС2Н8)2 (80) 62, 137, 58
Na Продукты обратной реакции 418, 631
Этилмалоновый эфир C2HsONa » » » 137
Фенилмалоиовый эфир C2HsONa ЛС(СбН8) (СООС2Н8)2 (94) 426
Этиловый эфир янтарной кис- лоты C2H8ONa ЛСНСООН® СН2СООН 80
Метиловый эфир фенилуксус- CHsONa С8Н8СН (Л) СООСНз 178, 632
НОЙ кислоты
Этиловый эфир фенилуксус- C2HsONa С8Н5СН(Л)СООС2Н5 (92); соединение С^Н^Оз 89, 137
НОЙ кислоты
Этиловый эфир а-фенилмасля- C2HsONa СбН5С(С2Н8)(СООС2Н8)Л (3) 137
ной кислоты
Продолжение табл. Ilf
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
n-OaNC6H4CH2COOCH3 CH3ONa n-OaNC6H4CH (А) СООСНз (95) 624
n-O2NC6H4CHaCOOC2H5 CaH5ONa n-O2NC6H4CH (А) COOCaHs 624
n-O2NC6H4CH2COOC4He-H Ацетоуксусный эфир CaHsONa C2H6ONa; пиперидин n-O2NC6H4CH (А) СООС4Н9-н О II /\-СООС2Н5 н5с6-(ч/!-с6н5 о 624 137, ср. 19
СНзСОСН (С2Н5) СООСаН5 CaH5ONa 11^ НБСБ— /СООС2Н5 ^С2Н5 (9) —с6н6 137
Этиловый эфир бензоилуксус- ной кислоты Пиперидин; C2H5ONa С6Н5СОСН(А)СООСаН5 (94) 137
C6HsCOCH2CH (С6Н5) СН (С6н5) - Na в C6H6 Соединение С4оН3408 426
СООСаН5
Метиловый эфир циануксус- CH3ONa ACH(CN)COOCH3 и (A)aC(CN)СООСНз (83) 633
НОЙ кислоты
Циануксусный эфир C2H5ONa (A)2C(CN)COOCaH5 (91) .133
Этиловый эфир н-бутилциан- уксусной кислоты CaHsONa АС(С4Н9-н) (CN)COOC2H5 (78) 133
Цианацетамид CH3ONa Пиперидин или (CaHg)aNH ACH(CN)CONHa (72) 3-Циан-6-окси-4, 6-дифенилпиперидои-2 (75) 634 461
€H3C(=NH)CH2CN
Нитрил малоновой кислоты
Цианистый бензил
Феиил ацетальдегид
Диэтилкетон
Пинаколин
Ацетофенон
Пропиофенон
н-Бутирофенон
Изобутирофенон
Дезоксибензоин
Дибензоилметан
Антрон
2-Фенил-2,3-дигидро-у-пирон
C2H5ONa
CHsONa
CH3ONa
СНзСЖа
CHsONa
CsHgONa
C2H5ONa
C2H5ONa
C2H5ONa
CaHsONa
CaH5ONa
CaH5ONa
CaH5ONa
CH3ONa; NaOH,
C2H5OH;
втор-амины
NaOH, CaHsOH
2- (3', 4'-Метилендиоксифенил) - Na
2,3-дигидро-у-пирон
5-Циан-6-метил-2,4-дифенилпиридин и его 462
1,4-дигидропроизводное
ACH(CN)a 634
СбНзСН(А)СН (два изомера: 87; 40 и 30) 79, 635
C6H5C(A)2CN (94) 636
СеНзСНОНСНаСН (С6НБ) СН (С6Н5) СООН (30) 178
СНзСН(А)СОСаНв и СНзС(А)2СОС2НБ (90—100) 223
(СНз)3ССОСН(А)а (69) 223
СвН5СОСН(А)2 (27); и С6НБСОС(А)3 (25) 137
СНзСН(А)СОС6Нз (54) и СН3С(А)2СОСвН5 (27) 223
СН3СНаСН(А)СОС6НБ (19) и 223
СНзСНаС(А)2СОС6НБ (58)4
(СНз) аС (СОС6НБ) СН (СБНБ) СН (А) СОС6НБ (30) 223
СбН6СН(А)СОСБНБ 13
(С6НБСО)2СНА (1) 137
О
II ^\/\/\ 178, 637
(77) н/\4
638
638
Продолжение табл. Ill
ё ё Сл Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
2-Фенил-2, 3-дигидробензо- у-пирон Циклопентаион Циклогексанон 3-Метилциклогексанон Ментон Водн. NaOH; NaNH2; Na NaOH, C2HSOH; (C2H5)2NH NaOH, C2H5OH C2H5ONa NaOH, C2H5OH; пиперидин C2H5ONa Пиперидин CH3ONa; NH3> C2H5OH (C2H6)2NH CaH2, CH3OH (C2H6)2NH; CH3ONa (C2H6)2NH CaH2, CH3OH (C2H5)2NH; CH3ONa CaH2, CH3OH (C2HS)2NH CH3ONa Натриевое про- изводное; пи- перидин Пиридин, NaOH, Н2О О II I 1 Uh 'Чх/х©/ 65 о И /V-л 1 | (83) О II А | | (72-80) Соединение СзбН^Оз О Jl^ U~CHs СН3 сн3 н5с6сн сн—снсн3 н5с6сн—с~сн2 1 II III СН2 СО СН2 или СН2 СО СН2 1 II III. Н5С6С С СН2 Н5С6С СН—снсн3 1 / \ 1 639 640 637, 641 637 637, 640 640
Циклогександион-1,3 Нитрометан Нитроэтан 1-Нитропропан 2-Нитропропан Этиловый эфир нитроуксус- ной кислоты Беизил-п-толилсульфои Циклопентадиен Флуорен ииывишив нКа о | Qlo <58> HCH2NO2 (75, 88) и (Л)2СННО2 (небольшой) (Л)2СНИО2 (два изомера, 77) /ICH2NO2 (65—92) CH3CH(/)NO2 (два изомера: 78+ 11; количе- ственный) СН3СН2СН (Л) NO2 (97) CH3CH2CH0)NO2 (65—92) (CH3)2C0)NO2 (92—96) O2NCH(/)COOC2Hs (94) C6H5CH (Л) SO2C6H4CH3-n (два изомера: 15, 11) | ^>—СН (С6Н5) СН (Л) СОС6Н6 (небольшой) Н\/Л \ if^4"! (количественный) 642 644, 225, 643 645 489 225, 644 225 489 225, 489 644 646 81 398 384, 647 1
Продолжение табл. Ill
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
•Флуорен 2,7-Дибромфлуо- рен 4-Оксикумарии 2-Метилпиридин 2-Метилхинолин 4-Метилхинолин C2H5ONa CaHsONa Пиридин NaNHa NaNHa NaNHa н\/л |1^1 (10-27) (22> он 1 ' (37) 'Ч/'^оАо Продукты три- и тетрамолекулярной конденсации X/*^N J~CHsCH (СвНв) СН (Л) СОСвН= или СН2СН(СбНв)сн<СОСеН5>сн(С6Н=)сн(Л)СОС6Н5 (60) СН2Л 398 398 185 396 396 396
Б. Замещенные халконы
Заместители в 3 2 22_3’ - Clb -CIICO- ^ ^r 5 6 6' 5' Присоединяемое соединение Катализатор Продукт реакции (выход, %) A=Соответственно замешенный CRHfiCHCH2COCRHs 1 Литература
З-Вг CH3NOa CH3ONa ЛСНаИОа 645
4-Вг CH3NOa CHsONa ЛСНаИОа 645
4'-Вг СН2(СООСНз)а CH3ONa ЛСН(СООСН3)а (92) 648
СНа(СООСаН6)2 C2H5ONa ЛСН(СООС2Н5)а 648
CHgNOa CaHsONa ЛСНаИОа (87) 649
Пентадиен-1,4 GaHsONa; (СН2=СН)2СНЛ (4) 398
NaNH2,
жидк. NH3 (СН2=СН)2СНЛ (11)
Н\/Л
Флуорен C2H5ONa 398
1 II 11^1 (15)
2,7-Дибромфлуорен CaHsONa Н Л Вг-^уу’у-Бг (48) 398
И лх/л
b'“QlQtb' «2>
4'-С1 СН2 (СООСНз) а CHsONa ЛСН(СООСН3)а 633
NCCH2COOCH3 CH3ONa NCCH(Л)СООСНз (87) 633
Продолжение табл. Ill
Заместители в 3_2 2_L3' 4^=^-СН=СНСО-^'^4' 5 6 6'7/ Присоединяемое соедииеиие Катализатор Продукт реакции (выход, %) Л= Соответственно замещенный С,Н5СНСН2СОС,Н£ 1 Литература
4'-С1 2-ОН CH3CH(CN) СООСНз Циклогексанон СНзСОСНгСООСгНз СНзСОСН (СН3)- СООС2Н5 СНзСОСН (С6Нз)- СООС2Н5 C6HSCOCH2COOC2H5 Дезоксибензоин Циклопентанон CH3ONa NaOH, СаН5ОН СгНаОИа CH3ONa C2H5ONa Води. NaOH C2HaONa (CaHahNH СН3С (CN) СООСНз А О II 0-л Н\ /CHj. z^\Zc\ \ сн2 со <1 СН, 2, 3-Диметил-4-фенацил-1, 4-бензопиран 2-Метил-4-фенацил-3-фенил-1,4-бензопиран 4-Фенацил-2-фенил-1,4-бензопиран СвН5СН(Д)СОСвНБ (65) О II (10) 633 637 610, ср. 218, 219 45 45 456 650 650
2'-0Н
4-СНгО
Циклогексанон
4-Оксикумарин
СНз (СООСНз) s
СНзСОСНгСООСгНз
NCCH2CONH2
Циклопентаион
3-Метилциклогексанон
Дезоксибензоин
NaOH,
С2Н5ОН
Пиридин
CH3ONa
C2HsONa
Na-Енолят
втор-
Амины
втор-
Амины;
КОН,
С2Н6ОН
КОН,
СНзОН;
CH3ONa
О
II
ОН
(34)
/СН (СООСНз) 2 (хороший)
2-Карбэтокси-3-п-метоксифенил-5-фенилци
клогексен-5-он
3-Циан-2-окси-4-п-метоксифенил-6-фенил-
4,5-дигидропиридин
1ч/!-снз
(два изомера)
СбН6СН(А)СОС6Н5 (42, небольшой)
650
185
651
652
618
640
640
628, 653
О
Продолжение табл. Ill
Заместители в 3_2 2'_3' СН=СНСО -€/<' 56 П Присоединяемое соединение Катализатор Продукт реакции (выход, %} A = Соответственно замещенный CeHt;CHCH2COC6H- 1 Литера- тура
4-СН3О 4'-СН3О Нитрометан 2-Фенил-2, 3-дигидро- 7-пирон CH3ONa C2H5ONa (A)2CHNO2 0 II (qJ-СвНз 645 638
СО О З'-СНз Циклогексанон NaOH, С2Н5ОН 0 II 637
4-СН3 4'-СН3 CHsNO2 2-Фенил-2, 3-дигидро- 7-пирон СНзСОСН2СООС2Нз NCCH2CONH2 CH3ONa NaOH, С2Н6ОН C2H5ONa Пиперидин C2H5ONa (A)2CHNO2 0 II iKh \о/ ъбП8 2-Карбэтокси-3-мстил-5-п-толилци- клогексеи-5-ои 3-Циан-6-окси-4-фенил-6-п-толилпи- перидои-2 (75) 3-Циан-2-кето-4-фенил-6-п-толил- 2,3,4,5-тетрагидропиридин (90) 645 638 654 461 461
3-NO2 З-Вг, 4-СНзО 4,4'-Диметоксн ch3no2 СН2(СООСН3)2 2-Фенил-2. 3-дигидро- 7-пирон CH3ONa CH3ONa Na (A)2CHNO2 АСН(СООСНз)2 О II М^н \0/—О6п5 о 1! —соос2н5 n-CH3H4C6J!4/!-CsH4OCH3-n 645 651 638
4-СНзО, 4'-СН3 CH3COCH2COOC2HS CsHsONa 652
СО *—* 2-Фенил-2, 3-дигидро- f-пирон Na О II Ох*, О II 638
3,4-Метиленднокси Циклопентанон втор-Амины II 640
3-Метилциклогексанон CH3NO2 втор-Амины; KOH, С2Н5ОН CH3ONa о II 1^-СНз (два изомера) ACH2NO2 и (A)2CHNO2 640 645
Продолжение табл. Ill
Реагирующие вещества Катализатор Продукты реакции (выход, %) Литера- тура
а-Бромбензилиденацетофенон и n-O2NC6H4CH2CN 3,4-Метилендиоксистирил-н- гексилкетон и Ацетоуксусный эфир СО транс-Дибензоилэтилен и Бензилмалоновый эфир Ацетофенон 1, 2-Дибензоилэтан 1,1-Дибензоилэтан (енол) и Циаиацетамид 3,4-Дифенилбутен-3-он-2 и Фенилнитрометан 2-Бензоил-1-фенилпропен и Диметиловый эфир малоновой кислоты 2-Метокси-1,3-дифенилпропен- 2-ОН-1 и Циаиацетамид CHsONa C2HsONa CsHsONa CH3ONa C6H5ONa (C2HS)2NH (C2Hs)2NH CHsONa CH3ONa H5C6CH—C (CN) C6H4NO2-/t CHCOC6H6 (смесь стереоизомеров) СН3СОСНСООС2Н5 1 3,4-СН2О2С6Н3СНСН2СОС6Н13-н (при 5°, 65%),. О д н-HuCe-J^J—С6Н3О2СН2-3,4 (при кипячении с обратным холодильником 50% вместе с некоторым количеством 6-карбэтокси- производного) А = С6Н5СОСН2^НСОС6Н5 С6Н5СН2С(Л)(СООС2Ц,)2 (20) 1,2,3-Трибензилпропан (1) C6HSCOCH2CH(A)COC6H5 (62) 3-Циан-5-метил-4, 6-дифенилпиридон-2 1-Нитро-1,2, З-трифенилпентанои-4 (68) С6Н5СОСН(СН3)СН(С6Н5)СН (СООСНз) 2 (два изо- мера: 52 + 10) 3-Циан-5-метокси-4,6-дифенилпиридон-2 655 505 656, 657 65 658 658 616 36 83 655
Бензоил-п-толуилметан (енол) и
Цианапетамид
(C2H5)2NH
2-Бензилидениндандион-1.3 и
Дезоксибензоин
Стирилфенилэтилкетон и
Диметиловый эфир малоновой
кислоты
Малоновый эфир
З-Бензоил-4-фенилбутен-З-он и
Феиилиитрометан
£5 „-CH3C6H4COCH2C(=NH)CH3
w
З-Метокси-З-фенил-1 -п-толил-
пропен-2-он и
Циаиацетамид
З-Метокси-1 -фенил-3-п-анизил-
пропен-2-он и
Цианацетамид
Флуоренилиденацетофенон? и
Ацетофенон
5-Мезитоилаценафтилен и
Малоновый эфир
C2H5ONa
CHsONa
C2H5ONa
(C2H5)2NH
Без катализатора
(C2H5)2NH
(C2H5)2NH
КОН, ацеталь
C2H5ONa
j 3-Циан-4-фенил-6-п-толилпиридон-2 (34) и 392
3-циан-6-фенил-4-п-толилпиридон-2 (17), О 11 I^Y\-CH (С6Н6) СН (С6Н6) СОС6Н5 438
\/\/ II о А = С6Н5СН2СН2СОСН2СНС6Н5 ЛСН (СООСНз) 2 445
4-Карбэтокси-2-бензил-5-фенилпиклогексан- 214
дион-1,3 (60) 3-Бензоил-5-нитро-4,5-дифенилпситанон-2 (38) 36
5-Ацетил-2-метил-4,6-дифенил-З-п-толуоил-3,4-ди- 420
гидропиридин 3-Циаи-4-фенил-6-п-толилпиридон-2 392
3-Циан-4-п-анизил-6-феиилпиридон-2 618
9,9-Дифенилацилфлуорен 659
5-Мезитоилаценафтеи-1-уксусная кислота7 (50) 660
1 В этих реакциях конденсации фактически использовался р-хлорпропиофеион.
3 Продукт реакции получен в виде соли аци-формы.
• Этот кетой образовался In situ в результате изомеризации 5-феиилпентеи-4-оиа-2.
4 В этом опыте была выделена кислота.
ь Получены две изомерные кислоты и соединение C2SH2BO4 некислотного характера неизвестного строения.
• Us флуоренона и ацетофенона образовался In situ непредельный кетон.
’ Кислота получена после гидролиза аддукта.
Таблица IV
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С НЕНАСЫЩЕННЫМИ КЕТОНАМИ
ТИПА ДИБЕНЗИЛИДЕН И ДИЦИННАМИЛИДЕНАЦЕТОНА
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Дибензилиденацетон и Диметиловый эфир ма- Пиперидин А = C6HSCH=CHCOCH2CHC6H5 АСН(СООСНз)2 (59) 1 214
лоновой кислоты CH3ONa Диметиловый эфир 2, 6-дифеиил-4-кетоциклогексан- 214
Малоновый эфир Пиперидин 1, 1-дикарбоновой кислоты АСЩСООСгНбЦ 214
CH3ONa Диэтиловый эфир 2,6-дифенил-4-кетоциклогексан- 214
Ацетоуксусный эфир (C2H5)2NH 1,1-дикарбоновой кислоты СН3СОСН(Д)СООС2Н5 (38) 21
Метиловый эфир циан- CH3ONa 4-Карбометокси-4-циаи-3,5-дифенилциклогексан- 214, 215
уксусной кислоты NaOH ои-1 (72) 4-Карбометокси-4-циан-3,5-дифенилциклогексан- 215
Этиловый эфир циан- C2HsONa он-1 4-Карбэтокси-4-циан-3,5-дифенилциклогексан- 216
уксусной кислоты З-Метилниклогексанон (C2Hs)2NH он-1 (88) О О II II I—А А— 640
Цианистый бензил CH3ONa IJ-сн, ™ М-сн, Нитрил 7-циннамоил-а, 0-дифенилмасляной кис- 982
Нитрометан, CHaONa лоты (два изомера) и 4-циан-3,4,5-трифенил- циклогексанон-1 (общий 44) или 4-циаи-3,4, 5-трифенилциклогексаион-1 (52) 4-Нйтро-3,5-дифенилциклогексанон-1 214
Замещенные дибензилиденацетоны
Заместители в 3_2 4^=^-СН=СНСОСН= 56 2' 3' =СН-^ '^4* 6’5' П рисое диняемое соединение Катализатор Заместители в продукте реакции (выход, %) О II 6^2 О 4 Литера- тура
2-С1 СНзСОСН2СООС2Нв C2H5ONa; пиперидин 3-о-С1С6Н4СН=СН—, 5-С6НБ—, 6-С2НБООС— (35) 217
3-С1 СН3СОСН2СООС2Н5 C2H6ONa; пиперидин 3-л1-С1СбН4СН=СН—, 5-СвН5—, 6-С2НбООС— (88)) 217
4-С1 СО СНзСОСН2СООС2Н6 C2H5ONa; пиперидин ’3-и-С1СбН4СН==СН—, 5-С6НБ—, 6-С2НБООС— 217
2,3'-Ди-С1 СНзСОСН2СООС2Н5 CH3ONa 3-о-С1С6Н4—, 5-л-С1С6Н4СН=СН—, 6-С2Н5ООС— 217
2, 4'-Ди-С1 СНзСОСН2СООС2Н5 CH3ONa 3-о-С1С6Н4—, 5-п-С1С6Н4СН=СН—, 6-С2НБООС— 217
3,4'-Ди-С1 СН3СОСН2СООС2НБ CH3ONa 3-л-С1СбН4—, 5-п-С1С6Н4СН==СН—, 6-С2Н5ООС— 214
4-СНзО СН2(СООСНз)2 Пиперидин CH3ONa га-СНзОС6Н4СН=СНСОСН2СН- (С6Н5)СН(СООСН3)2 З-п-Анизил-4,4-дикарбометокси- 5-фенилциклогексанон-1 214 214
Продолжение табл. IV
Заместители в 4^2^-СН=СНСОСН= 2^3' =СН-^ Ч»' Уб' П рисоедиияемое соединение Катализатор Заместители в продукте реакции (выход, %) О II я Ч/3 4 Литера- тура
2-ОН, 2'-С1 СН=СНС6Н4С1-о СН3СОСН2СООС2Н5 NaOH, води. C2HSOH 3-о-С1С6Н4СН=СН—, 5-о-НОС6Н4—, 6-С2НзООС— (28) 219
Г*4J 219
\7 II II °
'^/Х°/Хх-СН3 (15) СН2СОСН=СНС6Н4С1-О
C6HSCOCH2COOC2H5 C2H5ONa СООС2Н5 219
\/\о/—c®Hs
2-ОН, 3'-С1 СН=СНС6Н4С1-л СН3СОСН2СООС2Н5 NaOH, водя. С2Н5ОН 3-ж-С1С6Н4СН=СН—, 5-о-НОС6Н4—, 6-С2Н5ООС— (3) 219
Л
о " тй У Я 219
2-ОН, 4'-С1 СН=СНС6Н4С1-п I СН3СОСН2СООС2Н5 NaOH, водн. С2НзОН 3-п-С1СбН4СН=СН—, 5-о-НОС6Н4—. 6-С2Н5ООС— (33) 219
Чь ГУ । ч° (11) 3-С1, 4'-ОН СН3СОСН2СООС2НБ NaOH, водн. С2Н5ОН 3-л-С1СбН4СН=СН—, 219 220
4-С1, 4'-ОН СНзСОСН2СООС2Н5 NaOH, водн. C2HSOH 5-п-НОС6Н4—, 6-С2Н5ООС— (65) 3-п-С1С6Н4СН=СН—, 220
CJ *3 3-С1, 4'-СНзО СН3СОСН2СООС2НБ NaOH, води. С2Н5ОН 5-п-НОС6Н4—, 6-С2Н5ООС— (70) 3-н-СН3ОС6Н4СН=СН—, 220
4^01, 4-СНзО СН3СОСН2СООС2Н5 NaOH, водн. C2HSOH 5-jh-C1C6H4—, 6-С2Н5ООС— (55) 3-п-СН3ОСбН4СН=СН—, 220
2,2'-Ди-ОН СН3СОСН2СООС2НБ NaOH, водн. С2Н5ОН 5-п-С1С6Н4—, 6-С2Н5ООС— (45) 3-о-НОС6Н4СН=СН—, 218,610
2-ОН, 2'-СН3О СНзСОСН2СООС2Н5 NaOH, водн. С2Н5ОН 5-о-НОСвН4— (24) 3-о-СНзОС6Н4СН=СН—, 218
2,2'-Ди-СНзО СН3СОСН2СООС2Н5 NaOH, водн. C2HSOH 5-о-НОС6Н4— 3-о-СНзОСбН4СН=СН—, 218
1 5-о-СНзОС6Н4— (88)
Продолжение табл. IV
Заместители в 3_2 4^V-CH=CHCOCH= 5 6 2' 3' =СН-О' 6'~S' Присоединяемое соединение Катализатор Заместители в продукте реакции (выход, %) О II 9 Лите- ратура
2,2'-Ди-СН3О СН3СОСН2СООСН3 NaOH, водн. C2HsOH 3-о-СНзОС6Н4СН=СН—, 5-о-СНзОС6Н4—, 2-СНзСО— 218
4,4'-Ди-СН3 СН2 (СООСНз) 2 CHsONa 4,4-Дикарбометокси-3,5-ди-п-мет- оксифенилциклогексанон-1 214
NCCH2COOCH3 CHsONa 3,5-Ди- (n-метоксифенил) -4-карбо- метокси-4-цианциклогексанон-1 215
4,4'-Ди-(СН3)2М СН3СОСН2СООС2Н5 NaOH, водн. С2Н6ОН 3-n- (CHs)2NC6H4CH=CH—, 5-и- (СН3) 2NC6H4—, 6-С2Н5ООС— 221
2-ОН, 4'-(CH3)2N СН3СОСН2СООС2Н5 КОН, водн. С2Н5ОН 3-о-НОС6Н4СН=СН—, 5-п- (СН3) 2NCeH4—, 6-C2HsOOC— 221
г]ссн2соос2н5 NaOH, водн. С2Н5ОН п- (СНз) 2NC6H4CH=СНСОСН2- СН(С6Н4ОН-о)СН(СООН)2 1 221
2-СН3О, 4'-(CH3)2N СН3СОСН2СООС2Н5 NaOH, водн. C2HsOH 3-о-СНзОС6Н4СН=СН—, 5-n-(CH3)2NC6H4—, 6-С2Н5ООС— 221
2-ОН, 3-СНзО, 4'-(CHs)2N СНзСОСН2СООС2Н5 NaOH, водн. C2HsOH 3- (2-НО-3-СНзОС6Нз) СН=СН—, 5-n-(CH3)2NC6H4—, 6-С2Н5ООС— 221 221
2-ОН. 4-СНзО, 4'-(CH3)2N СН3СОСН2СООС2Н6 NaOH, водн. С2НзОН 3-п- (СНз) 2NCeH4CH=CH—, 5- (2-НО-4-СНзОСбН3) —, б-СгНвООС— 221
2-ОН, 5-СН3О, 4'-(CH3)2N СН3СОСН2СООС2Н5 NaOH, водн. С2Н5ОН 3- (2-НО-5-СНзОС6Нз) СН=СН—, 5-n-(CH3)2NC6H4—, 6-С2Н5ООС— 221
2-СНзО, 4'-С1 СН3СОСН2СООС2Н5 CH3ONa 3-п-С1С6Н4СН=СН—, 5-о-СН3ОСбН4—, 6-С2Н5ООС— (57) 219
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Бензилиденциннамилиденацетон и Диметиловый эфир малоновой кислоты CH3ONa 4, 4-Дикарбометокси-3-фенил-5-стирил- 214
п-Метоксибензилиденциннамилиденаце- тон и Диметиловый эфир малоновой кислоты CH3ONa циклогексанои-1 4,4-Дикарбометокси-З-п-метоксифенил- 214
Дициннамилиденацетон и Диметиловый эфир малоновой кислоты CH3ONa 5-стирилциклогексанои-1 4,4-Дикарбометокси-3,5-дистирилцикло- 214
2,6-Дибензилиденциклогексанон и Циаиацетамид C2H5ONa гексанон-1 Соединение С2зН22Н2О2
Кислота была получена после гидролиза аддукта.
Таблица V
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С НЕНАСЫЩЕННЫМИ КЕТОНАМИ, СОДЕРЖАЩИМИ ГЕТЕРОЦИКЛИЧЕСКИЕ КОЛЬЦА
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Фурфурилиденацетон и Л = |l^ oJI—СНСН2СОСН3
Цианистый бензил CH3ONa CeH5CH(A)CN (81) 133
1-Нитропропан (C2HB)2NH CH3CH2CH(A)NO2 (75) 225
2-Нитропропан (C2HB)2NH (CH3)2C(A)NO2 (95) 225
Триэтиловый эфир фосфоноуксусной кис- C2HBONa (C2H5O)2P(O)CH(A)COOC2H5 (9) 136
ЛОТЫ
Фурфурилиденацетофенон и A = o J!—снсн2сос6н5
Малоновый эфир C2H5ON a ACH(COOC2HB)2 (75) 226
Ацетофенон C2HBONa CBHBCOCH2A (25) 223
Нитрометан CH3ONa ACH2NO2 224
1-Нитропропан (C2HB)2NH CH3CH2CH(A)NO2 (79) 225
2-Нитропропан (C2Hb)2NH (CH3)2C(A)NO2 (90) 225
CHsONa CeHgCH (Д) NO2 224
21 Зак. 794.
Фурфурилиденацетофеноны, содержащие заместитель в фенильной группе
Заместитель в 2_3 II J!-CH=CHCO-^ ^4 Аддукт Катализатор Продукт реакции (выход, %) Л=|1 JI—CHCH2COC6HtR xoz 1 с заместителем R Литера- тура
4-Br 4-CH3O 4-Циклогексил CH3NO2 C6HbCH2NO2 СН2(СООС2Н8)2 СН2(СООСН3)2 CH3ONa CH3ONa CH3ONa CH3ONa ACH2NO2, R = 4-Вг (75) CbHbCH(A)NO2, R == 4-Вг (29)' ACH(COOH)2i, R = 4-CH3O АСН (СООСНз)2, R = 4-циклогексил (50) 224 224 226 226
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
2-Фурилидентетралон-1 и Ацетоуксусный эфир 2-Фурилиден-6-метокситетралон-1 и Ацетоуксусный эфир C2H5ONa C2HBONa о A .COOCsA Г iji 11 ^\Z\Z^oz 1 II 1 и \/\/ о 1хоос2нв 1 i_ii J 1 II 1 \/\/ о ^^COOCsHs 1 Ц II СН3О— 415 415
Продолжение табл. V
’ Реагирующие вещества Катализатор Продукт реакции «выход, %' Литера- тура
Бензилиденацетилкумарон-2 и
2-Ацетилкумарон 2 Водн. NaOH (l JI J—СОСН2—) CHC6HS и \^/^oz Л
Qk оJ—СОСН2СН(С„Н5) СНСО—1^ 661
Со ьэ J—COCH2CHC6HS
ю Оксиметилен-2-ацетилтиофен и
Диэтиловый эфир ацетои-1,3-дикарбоно- CsHsONa Этиловый эфир 2-окси-4-(а-тиенил)изо- 449
вой кислоты фталевой кислоты (61)
Оксиметилен-2-ацетилпиридин и
Диэтиловый эфир ацетов-1,3-дикарбоио- CsHsONa Этиловый эфир 2-окси-4-(а-пиридил)изо- 449
вой кислоты фталевой кислоты (76)
Фенил-$-(4-хинолил)винилк.етон и *
Ацетофенон 8 NaOH 1,5-Дифенил-3- (4-хинолил)пентандион-1,5 662
(87)
« м^5?^малонового эФиРа не может быть получен в кристаллическом виде, поэтому его гидролизовали до кислоты. ^Использовали смесь бензальдегида и 2 ацетилкумар »на.
Таблица VI
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С 3-АЦИЛКУМАРИНАМИ И РОДСТВЕННЫМИ СОЕДИНЕНИЯМИ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
З-Ацетилкумарин и Цианацетамид Без катализатора R А 1 N хАо^о R = З-Кумаринил1 (45—52)) 227
Ацетон Пиперидин НО\/СН3 АА 228
NH3(NCCH2CONH2) 2 чАо^о R = СНз (32) 227
Метилэтилкетов NH3(NCCH2CONH2) 2 R = С2Нв (42) 227
Ацетофенон NH3(NCCH2CONH2) 2 R = C6H5 (21) 227
З-Ацетилкумарин NH3(NCCH2CONH2) 2 R = З-Кумаринил 2'28
* Пиперидин i 1 А/ (X СХ (18) <✓ 1 он о
Продолжение табл. VI
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
З-Ацетилкумарин и
Циклогексанон NH3(NCCH2CONH2) 2
Л/°н
ДК" 1 II 1 227
З-Бензоилкумарин и Цианацетамид Пиперидин З-Бензоилдигидрокумарив-4-(а-цианацетамид) 229
7-Оксикумарин и Циаиацетамид 7-Метоксикумарин и Цианацетамид 2-(п-Метоксибензилиден )кума- ранон-23 и Пиперидин Пиперидин 7-Оксидигидрокумарин-4- (а-цианацетамид) (90) 7-Метоксидигидрокумарин-4- (а-цианацетамид) (90) л Z\z°X А = | 1| СНСНСвН4ОСН3-л 663 663
Ацетоуксусный эфир C2HsONa II О СНзСОСН (А) СООС2Н6 230
Дезоксибензоин C2H5ONa C6HSCOCH(A)C6HS 230
Циклогексанон C2HsONa II 0-Л 230
(-Пирон и Малоновый эфир CaH6ONa Этиловый эфир л-окснбенйойной кислоты 232
Алкиладенроданины и Роданин 4 NH4OH, NH4CI а, 0.-6 ис- (2-Тио-4-кетотетрагидро-5-тиазолил) этан н гомологи (22—55), 233
5-Этоксиметилен-З-метилрода-
нин и
З-Метилроданнн трет-Амины 5,5'-Метилидин-бис- (3-метилроданин) (34—69) 664
З-Фенилроданин (C2Hs)?N о о JJ-C=CH-CH-Cv HaCN 1 1 NCeH5 (88) \с—s s—с/ II II 664
5-Этоксиметилен-З-фенилрода- s s о о
нин и. З-Метилроданин (C2H5)3N II II /с-с=сн-сн-с. HSCN 1 1 NCHS (94) 664
^c-s s CZ Й 1
3,3'-Этилен-бис-(5-зтоксимети- ленроданин) и
З-Метилроданин (C2He)3N Соль 3,3'-этнлен-бис-5-(2"-тионо-4"-кето-3"-метил-5"- тиазолидилметиленроданина) (50) 664
З-Фенилроданин (C2Hs)3N Соль 3,3'-этилен-бнс-5-(2"-тионо-4"-кето-3"-фенил-5"- тиазолидилметиленродаиина) (37) 664
Пиразол синий и Г-Фенил-З-метил-2-пиразолин- он-5 Без катализатора 1, 1', 1"-Трнфенил-3,3',3"-триметил-(4,4', 4"-три-2-пи- разолин)трнон-5,5', 5" 665
Г-(п-Бромфенил) -З-метил-2- пиразолинои-5 1, Г-Дифенил- 1"- (н-бромфенил)-3,3', 3"-триметил- (4,4', 4"-три-2-пиразолин) трион-5,5', 5" 665
* Если "вместо цианацетамида использовать амид малоновой кислоты, формамид или мочевину, то образуется тот же продукт реакции.
Этот же продукт реакции получают, когда в качестве катализатора применяют пиперидин. Более раннее сообщение (229] о том, что при взаимо-
действии 3-ацетилкумарина с цианацетамидом и пиперидином образуется 3-ацетилдигндрокумарни-4-(а-цнаиацетамид), не подтверждается.
2 В этих опытах в реакционной смеси присутствовал циаиацетамид; в результате его разложения образовывался аммиак.
1 Соответствующее, 2-метоксисоедннение аналогичным образом ^взаимодействует с. ацетоуксусным эфиром^ дёзоксибензоииом и циклогексан-
оном [231]. ....
4 В действительности в качестве ингредиентов использовали родании и различные алифатические альдегиды. ... .
Таблица VI!
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С ЦИКЛОАЛКЕНОНАМИ И АЦИЛЦИКЛОАЛКЕНАМИ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
2-Оксиметиленциклопентанон и Ацетоуксусный эфир C2HsONa 5-Инданол-6-карбоиовая кислота (18) 449
Диэтиловый эфир ацетон-1,3-дикар- C2HsONa Диэтиловый эфир 5-индаиол-4,6-ди- 449
боновой кислоты Этиловый эфир Э-амииокротоновой — карбоновой кислоты (92) б-Метил-2, 3-дигидро-₽-пиридииден * 467
Со ЬО О кислоты Циклогексен-2-он и Малоновый эфир CaHsONa О II -0- АСН(СООС2Н5)2 (90) 666
Нитрометан CHaONa ACH2NO2 (50) 667
Нитроэтаи CHsONa CHsCH(A)NO2 (57) 667
З-Хлорциклогексен-2-он и Диметиловый эфир метилмалоиовой CH3ONa О A/Vo 458
кислоты 1-Ацетилциклопентен-1 и 1 II 1 г„ О II , fYj C_/YY
Тетралон-1
6-Метокситетралон-1
2-Этокситетралон-1
Циклогептанон
2-Метиленциклогексанон 2 и
Ацетоуксусный эфир
Метилэтилкетон
Циклогексанон
З-Метилциклогексен-2-он и
Малоновый эфир
Ацетоуксусный эфир
NaNH2
NaNH2
NaNHa
rper-CiHgOK
NaOH
KOH, СНзОН
KOH, СНзОН
[C6HsCH2N (СНз) з]ОСН3
C2HsONa
R = H
R = СНзО (55)
R = CaHsO
(«0
2-Кето-2,3,4, 5,6,7, 8,10-октагидро-
иафталин
О
II
COOC2HS
/СНз (50)
\/ХСН2СООС2Н5
1 -Метилбицикло[3.3.1 ]ноиаиол-5-он-7
105, 234
222
234
668
551
669
669, 670э
69,671, ср.
76, 191
672, 76
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
ЗтМетйлцИклбгексен-2-он и О II
Циануксусный эфир C2HEONa ™ : (13-21) ^•СНз ^CHaCOOCaHs СН (CN) CONHa /—к—NH 69, 671, ср. 18. 77
СО R5 00 NH3 . - У 'со (44) C?HCN сн3 он z—L NH 673
Цианацетамид Пиперидин У СО (77) 4 р dHCN сн3 о II 673 1
Нитрометан [C6HSCH2N(CH3)3]OCH3 <65> 69
Пиперидин, */1в моля
1, 3-Диметилиндо л НС1
2-Оксиметиленциклогексанон и Ацетоуксусный эфир C2H6ONa
СР to Диэтиловый эфир ацетон-1,3-дикар- C2HsONa
боновой кислоты Цианацетамид Пиперидин; (СгНвЦЫН
СН3С (=NH) СН2СООС2Н5 Без катализатора
CH3C(=NH)CH2CN
CHSC(=NH) СН2СОСНа » »
CH3C (=NH) СН2СОС6Н5 » »
2-АминометиленциклогеКсанон и Циаиуксусный эфир Na
О
II
I 1/СНз
'''/'^CHaNOa
(37)
Этиловый эфир 6-оксйтетралии-7-кар-
боиовой кислоты (50)
Диэтиловый эфир 6-окситетралии-
5,7-дикарбоиовой кислоты (83)'
З-Циаи-5,6,7, 8-тетрагидрохинолинол-2
Этиловый эфир 2-метил-5,6,7, 8-тетра-.
гидрохинолии-3-карбо новой кисло-
ты4
3-Циан-2-метил-5,6,7,8-тетрагидрохи-
нрлин
3-Ацетил-2-метил-5,6, 7,8-тетрагидро-
хинолии
3-Бензоил-2-метил-5,6, 7, 8-тетрагидро-
хинолин
675 '
449
449
241
465, 676
677
677
677
4-Циан-3-кето-2.3,5,6,7,8-гексагидро-: 468
изохинолин
Продолжение табл. VII
Реагирующие вещества
Катализатор
Продукт реакции (выход, %)
Литература
1-Ацетил-2-метилциклопентен-1 и
Малоновый эфир
Фенилэтилмалоновый эфир
§
Циклопентилиденацетон и
Малоновый эфир
1-Ацетилциклогексен-1 и
Малоновый эфир
Ацетоуксусный эфир
Циклогексанон
Циклогептанон
1 -Ацетилциклогексеи- 1
8»
Тетралон-1
6-Метокситетралон-1
C2HsONa
CsHsONa
CsHsONa
C2HsONa
CsHsONa
NaNH2
rper-QHgOK
NaNH2
NaNH2
NaNHa
Кислота CisHseOa (плохой)
О
//
COOC2HS
(80)
цис- и тракс-4-Карбэтоксидекалиидион-1,3
(7. 87, 60)
446
235
238
101—103,
678
100
106, ср. 105
668
104
228
105
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
цис-Декалон-1 NaNH2 О II . /X /\/Х 1 I 679
1-Кето-9-метил-1,2.5,6,7,8,9,10- NaNH2 1 1 1 С35) \/\^ 1 СОСНз Н3С о II /\ .f\/\ 1 1 679
октагидронафталин 3, 8-Диметил-4,7,8,9-тетрагидро- NaNH2 1 1 (30) \/\^ 1 СОСНз Н3С о 11 Z\ /\ >/\ II (35) 679
ииданон-1 2-Метоксиметиленциклогексанон-1 и Ацетоуксусный эфир QHsONa v—Lch3 Y СОСНз 2-Окси-5,6,7, 8-тетрагидро-З-иафтой- 680
ная кислота и этиловый эфир а-аце- тил-₽- (2-кетоциклогекси л) акриловой кислоты
2- (а- Оксизтилиден) циклогексанон-1 и
Диэтиловый эфир ацетон-1,3-ди- C2HsONa 5,7-Дикарбэтокси-8-метил-6-окси- 449
Цианацетамид
Пиперидин; C2HsONa
N-Метилцианацетамид
3,5-Диметилциклогексен-2-он и
Ацетоуксусный эфир
2-Оксиметилен-5-меп1лциклогексан-
он и
Циануксусный эфир
Циаиацетамид
Пиперидин; C2H6ONa
C2H5ONa
(C2H5)2NH
Пиперидин; (CsHs^NH
снэ
1,3-Диметил-5-оксибицнкло[3. 3.1]ноиан-
ои-7
971
971
681
241
241
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
2-Амино метилен-3-метилциклогексан- он и
Циануксусный эфир 2-Оксиметилен-4-метилциклогексан- он и Na Амид 5-метил-3-кето-2, 3, 5.6,7. 8-гекса- гидроизохинолин-4-карбоновой кис- лоты Н3С—f^X-GN 468
Цианацетамид втор-Амин \/ ^N^O НО Н И НзС—Z^Y^y-CN \/X\nAo 241
СНзС (=NH) СН2СООС2Н6 Без катализатора Этиловый эфир 2, 6-диметил-5,6,7,8-те- трагидрохинолин-3-карбоиовой кис- лоты 465
СНзС (=NH) СНгСОСНз 3-Ацетил-2,6-диметил-5,6, 7,8-тетра- гидрохинолии 677
СНзС (=NH) СН2СОС6Н6 2-Аминометилен-4-метилцик.логексан- он и 3-Бензоил-2, 6-диметил-5,6, 7,8-тетра- гидрохинолин 465
Циануксусный эфир Na Нитрил 6-метил-3-кето-2,3,5,6,7,8-ге- ксагидронзохинолии-4-карбоновой 1 кислоты 468
2-Оксиметилен-5-метилциклогек.сан- он и СНзС (== NH) СНзСООС2Н5 Без катализатора
CH3C(=NH)CH2COCH3 » »
СНзС (=NH) СН2СОС6Н5
2-Аминометилен-5-метилциклогексан-
он и
Циануксусный эфир Na
8
2-Оксиметилен-б-метилциклогексан-
он и
Цианацетамид втор-Амин
СНзС (=NH) СН2СООС2Н5 Без катализатора
Этиловый эфир 2,7-диметил-5,6,7,8-те-
трагидрохинолин-3-карбоновой кис-
лоты
3-Ацетил-2,7-диметил-5, 6,7, 8-тетра-
гидрохинолин
З-Беизоил-2,7-диметил-5,6,7,8-тетра-
гидрохинолин
Нитрил 7-метил-3-кето-2,3,5,6,7,8-ге-
ксагидроизохинолин-4-карбоновой
кислоты
Этиловый эфир 2, 8-диметил-5,6,7,8-
тетрагидрохинолин-3-карбоновоп кис-
лоты (42)
468
241
677
2-М етилен-3-метилциклогексанон-1 и 3-Метилциклогексанон КОН, C2HsOH
670
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
СНз CN
2- (а-Оксиэтилиден) -4-метилцикло- гексанон-1 и Циаиацетамид Пиперидин; C2HsONa H3C-/\X_CN /YY0 II и н с J 1 N 3 СНз СН3 CN 971
2-(а-Оксиэтилиден)-5-метилцикло- со гексанон-1 и Циаиацетамид Пиперидин; C2HsONa azv_cn нзс~^YY i_i р 1 I I и | 1 N 3 Х/'мАо сн3 СНз СНз CN 971
2-( а-0ксизтилиден) -6-метилцикло- гексанон-1 и Циаиацетамид Пиперидин; C2HsONa Z\A_CN Z\Z\Z° 1 1 1 и 1 М \/^N/xo \/XZ 971
2-Оксиметиленциклогептанон и Диэтиловый эфир ацетон-1, 3-ди- карбоиовой кислоты СН3С (=NH) CH2COOC2HS C2H6ONa Без катализатора СНз СН3 Диэтиловый эфир 3-оксибицикло[5.4.0]- гендека-1 (6), 2,4-триеи-2,4-дикарбо- новой кислоты (61) Этиловый эфир 6-метил-2,3-дигидро- пиридинден-7-карбоновой кислоты 450 676
Метил-а-циклопентилиденэтилкетон « Малоновый эфир З-Метилциклопентилиденацетон и Малоновый эфир Циклогексилиденацетон и Малоновый эфир C2HsONa C2HsONa C2H5ONa CHsONa 1-Метилспиро[5.4]декаидион-2,4 (низкий) 8-Метилспиро[5.4]декаидиои-2,4 1-Карбэтоксиспиро[5.5]гендекаи- диои-2,4 (84) Сииро[5.5]гендекандион-2,4 (70—80) Н3Сх ,СН3 237 682 238, 412 678
2-Метилен-З-З-диметилциклогексан- он и Ацетоуксусный эфир Й 2-Оксиметилен-4,5-диметилцикло- гексанон и СНзС (=NH) СН2СООС2Н5 CgHsONa Без катализатора А-С1 V%o ИЛИ НзС^/ Этиловый э 8-тетрагид кислоты Н2СН (СОСН3) СООС2Н6 (8—20) СН3 /\_СООС,Н, DH фир 2, 6, 7-триметил-5, 6,7, рохинолин-3-карбоновой 683 677
Изофорон и Нитрометан 1-Ацетил-2-метилциклогексен-1 и Малоновый эфир Пиперидин C2HsONa 5-Нитрометил-3,3,5-триметилцикло- гексаиои (9) 10-Метилдекалиндион-1, 3 (низкий) 4-Карбэтокси- 10-метилдекалиндион-1,3 (хороший) 674 103 684
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
1-Ацетил-2-метилциклогексен-1 и Циклогексанон zper-CiHgOK 2Н3 423, 406
1-Ацетил-6-метилциклогексен-1 и °0 Циклогексанои 2-Метил-3-винйлциклогексен-2-он-1 и 2-Метилциклогексаидион-1, 3 трет-С^дОК (C2H5)2NH (смесь изоме % СН8 С (смесь изоме НзС 1 н II э ров, 22 5) 9 У ров, 19 6) О J (42) 7 6н 423 685
1-Ацетилциклогептен и
Циклопентанон
Циклогексанои
CH3ONa
трет-СЛдОК
Циклогептанон трет-С^дОК
К «о 2-Оксиметиленциклооктанон и Диэтиловый эфир ацетон-1,3-дикар- C2H5ONa
боиовой кислоты 2-Метил-5-н-пропилциклогексен-2-он и Нитрометан Пиперидин .
2-Метилциклогексилиденацетон и Малоновый эфир C2HsONa
З-Метилциклогексилиденацетон и Малоновый эфир CsHsONa
(неочищенный 26)
(55)
(41)
Диэтиловый эфир 3-оксибицикло[6.4.0]-
додека-1 (6), 2,4-триен-2,4-дикарбо-
новой кислоты (59)
З-Метил-З-нитрометил-5-н-пропил-
циклогексанон (25)
1-Карбэтокси-7-метилспиро[5. 5]генде-
кандиои-2, 4
8-Метилспиро[5.5]гендекандиои-2,4
668
668
668
450
674
237
237
Продолжение табл. VII
341
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
S-Метилциклогексилиденацетон и Циаиацетамид 4-Метилциклогексилиденацетон и Циануксусный эфир Цианацетамид Карвон и Ацетоуксусный эфир Циануксусный эфир Умбеллулон и Малоновый эфир ?-Ацетил-2,6-диметилциклогексен и Малоновый эфир 1-Ацетил-6,6-диметилциклогексен и Этиловый эфир а-ацетиладипиновой кислоты 6-Карбэтокси-6-метилциклогексен-2- он и Малоновый эфир Метилмалоновый эфир 1-Бутирил-2-метилциклогексен-1 и Малоновый эфир 2-Оксиметиленментон и Цианацетамид 2-Оксиметиленкамфора и Малоновая кислота C2H5ONa C2H6ONa CjHsONa CaHsONa (C2H6)aNH C2H6ONa C2HsONa Na CsHsONa C2H5ONa CzHsONa втор- Амин Без катализатора сн3 ,—\ —L—он \ NH \ Z\ z (58) 1 / \ СН3 CN О 9-Метилспиро[5.5]гендекандион-2,4 СНз /—\ /—к—он н3с~/ \н / У CN О 5-Окси-3-изопропенил-9-метилбицикло- [3,3.1]ноианон-7 (54) Этиловый эфир 2-метил-5-изопропенил- циклогексанон-3-циануксусной кис- лоты (25—33) QH3 СН(СООС2Н5)2 Цао (85) тракс(?)-8,10-Диметилдекалии- диои-1,3 4-Карбэтокси-8, 10-диметилдекалин- дион-1,3 (42) СОСН3 СОСНз снзу 1 | V > с (СН2)3 СООС2Н5 (85) ОН3 v / | СООСзНз СНз C2HSOOC—(74) СН (СООС2Н5)2 СНз С2Н5ООС— of\/— С(СООС2Н5)2 (78) СНз транс (?) -2-Этил-1О-метилдекалии- дион-1,3 СНз (20) ИЗ0-С3Н7 0-Камфорилиденпропионовая кисло- та (50) 686 237 686 453 20 155 103 684, 103 687 688 204 103 241 388
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
-Оксиметиленкамфора и
Циануксусная кислота • Без катализатора Нитрил ₽-камфорилиденпропионовой кислоты (80) СН3 388
10-Метил-2-кето-2,3,4, Б, 6,10-гекса- гидронафталин и Малоновый эфир 2-Оксиметиленциклодеканон и C2H6ONa (33) \/ СН <СООС2Н=Ь 206
Диэтиловый эфир ацетон-1,3-дикар- боновой кислоты 2-Фенилциклопентен-2-он и CsHsONa Этиловый эфир 3-оксибици'кло[8. 4. 0]- тетрадека-1 (6), 2,4-триеи-2,4-дикар- боиовой кислоты (60) 450
Малоновый эфир C2HEONa Этиловый эфир 2-фенилциклопеитан- он(1)-3-малоновой кислоты (67) 689
Дибензиловый эфир малоновой кис- лоты 1-Бензоилциклопентен и трет-СаНзОК 3-Кето-2-фенилциклопентан-1-уксусная кислота 8 (53) 690
Дибензиловый эфир малоновой кис- лоты 2-Фенилциклогексен-2-он и трет-С4Н&ОК транс (?) -2-Бензоилциклопентилмалоно- вая кислота 691
Малоновый эфир C2H5ONa Этиловый эфир транс-2-фенилцикло- гексанои(1)-3-малоиовой кислоты (96) 117, 118, 692, 693
Дибензиловый эфир малоновой кис- лоты трет-С4НдОК Дибензиловый эфир транс-2-фенил- циклогексанон(1)-3-малоновой кис- лоты (96) 120, 693
Метиловый эфир циануксусной кис- #оты - „ CH3ONa Метиловый эфир 2-фенилциклогексан- ои(1)-3-циануксусной кислоты (80) 118, 692
Бензиловый эфир циануксусной кис- лоты Нитрометан rper-CdHgOK [C6HeCH2N(CH3)3]OCH3
Метиловый эфир нитроуксусной кис- лоты [C6HsCH2N(CH3)3]OCH3
6-Фенилциклогексен-2-он и
Дибензиловый эфир малоновой кис- лоты 8 трет-С4Н9ОК
4-Фенилциклогексен-2-он и
Дибензиловый эфир малоновой кис- лоты 8 Циклогексилиденциклогексанон и rper-CiHgOK
g Циаиацетамид 1-Бутирил-2,6-диметилциклогексен и C2HsONa
Малоновый эфир 2-Гидринданилиденацетон и C2HsONa
Малоновый эфир C2HsONa
Цианацетамид C2HEONa
транс-З-Цианметил-2-фенилциклогексан-
он-1 (86)
2-Фенил-3-нитрометилциклогексанон-1
(80)
Метиловый эфир транс-2-фенилцикло-
гексанон (1) -3-нитроуксусной кисло-
ты (90)
транс-6-Феиилциклогексанон-З-уксус-
ная кислота 9
тракс-4-Фенилциклогексанон-З-уксус-
ная кислота 8
Соединение C15H20N2O
транс (?) -2-Этил-8, 10-диметнлдекалин-
дион-1,3
120
118, 692
118, 692
119
119
694
103
239
56
Продолжение табл. VII
Реагирующие вещества
Катализатор
Продукт реакции (выход, %)
Литература
1,10-Диметил-2-кето-2,3,4,5,6,10-
гексагидронафталин и
Малоновый эфир
C2H5ONa
Метилмалоновый эфир
1-Бензоилциклогексен и Дибензиловый эфир малоновой кис- лоты трет-СШзОК
2-Фенилциклогептен-2-он и Дибензиловый эфир малоновой кис- лоты rper-GHsOK
1-Ацетил-9-метил-6-кето-3,4,6, 7,8,9- гексагидронафталин и
Днэтнловый эфир а-ацетиладипино- Na
вой £ислоты
1 -Ацетил-6-метокси-З,4-дигид ронаф-
талин и
Ацетоуксусный эфвр
Циклогександион-1,2
Метил-а-гидринданилиденэтилкетон и
Малоновый эфир
C2HsONa
Na
СН3
(С2НЕООС)2
\/|\z
СНз
СНз
СНз | о
НООСНС—I I I
транс (?) -2-Бензоилциклогексилмалоно-
вая кислота (64)
Дибеизиловый эфир 2-фенилциклогеп-
танон(1)-3-малоновой кислоты (90)
°Ч/Ч/СНз
Н3С | |^СООС2Н5
|/х|/х|/\сн2)з СООС2Н6
и
695
696
691
120
Продолжение табл. VII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
2-Оксиметиленцик.лододеканон и
Диэтиловый эфир ацетон-1,3-дикар- боновой кислоты 2-(2', 3'-Диметоксифенил) циклогек- сен-2-он и C2HsONa Диэтиловый эфир 3-оксибицикло- [10.4.0J-1 (6), 2,4-триен-2,4-дикарбо- новой кислоты О СН3О ОСН3 II \ / Z\ 450
Диметиловый эфир малоновой кис- CHsONa ЛСН(СООСН3)2 (97) 118, 692
ЛОТЫ
Малоновый эфир C2H5ONa ЛСН(СООС2Н5)2 (94) 118, 692
Дибензилрвый эфир малоновой кис- трет-С4Н8ОК ЛСН(СООСН2С6Н5)2 (88)) 120, 693
ЛОТЫ
Метиловый эфир циануксусной кис- CH3ONa ЛСН(СК)СООСН3 (95) 118, 692
ЛОТЫ
Циануксусный эфир C2H5ONa ЛСН(СК)СООС2Н5 (90) 118, 692
Бензиловый эфир циануксусной кис- zpez-QHgOK ЛСНгС№° (82) 120, 693
ЛОТЫ
Метиловый эфир нитроуксусной кис- [СбН6СН2ЩСН3)з]ОСН3 ЛСНШО2)СООСН3 (90) 118, 692
1-Бензоилциклогептен и
Дибензиловый эфир малоновой кис-
лоты
rper-CiHgOK
транс (?)'-2-Бензоилциклогептилмалоно- 691
вая кислота 11 (46)
2-Пзопропоксиметилентетралон-1 и
Монодиметилкеталь диацетила Na
О
II
сн=снсососн3
\/\/
(69)12
2-(2’, 3', 4'-Триметоксифенил)цикло-
гептен-2-он и
Малоновый эфир
Зерумбон
О
Циануксусный эфир
трет-С4Н8ОК
699
З-Кето-2- (2', 3', 4'-триметоксифенил) - 700
циклогептан-1-уксусная кислота 9 (72)
Соединение C2sH36N2Os
701
I
Продолжение табл. VII
Реагирующие вещества . Катализатор Продукт реакции (выход, %) Литература
2-Изопропоксиметиленбензосуберон и Монодиметилкеталь диацетила Na о сн=снсососн3 ^\Л\ (35)12 1 II' > \z\_Z 699
Циклопентадецен-2-он и Малоновый эфир C2H6ONa Этиловый эфир циклопентандекан- он (1)-3-малоновой кислоты (41) 555
,ор 2-Оксиметиленциклопентадеканон и Диэтиловый эфир ацетон-1, 3-дикар- боновой кислоты C2H5ONa Диэтиловый эфир 3-оксибицикло- [13.4. 0]нонадека-1 (6) ,2,4-триен-2,4- дикарбоновой кислоты (79) 450
2-Оксиметиленциклогексадеканон и Диэтиловый эфир ацетон-1, 3-дикар- боновой кислоты C2H8ONa Диэтиловый эфир 3-оксибицикло- [14.4.0]эйкоса-1 (6),2,4-триен-2,4-ди- карбоновой кислоты (35) 450
Холеста-3,5-диен-7-он и Малоновый эфир C2H5ONa; пиперидин Этиловый эфир 7-кетохолестен(5)-3- малоновой кислоты (50) 702
СН,
СН2СООС2НЕ
—СНз ''сН,
C6HEN(CHs)MgBr
Н3С СООС2Н5«
СН3
сн2
СООС2Н6
СН
СН
687
• Этот продукт реакции получен после гидролиза и декарбоксилирования.
В этих опытах использовался 2-оксиметилпиклогексанон.
’ Использовалась смесь циклогексанона и формальдегида.
4 При проведении реакции при 0° образуется етиловый эфир 9-оксн-2-метил-5, 6, 7, 8, 9, 10-гексагидрохинолин-З-карбоновой кислоты.
8 Получено также соединение | || СОСН2 f ( выходом 50%, Другие авторы [409]
указывают, что это соединение является
единственным продуктом реакции.
£
Кроме того, получено соединение | | с выходом 46%.
4 н8с о
Этот продукт реакции образуется из промежуточного соединения
которое, одиако, не было выделено.
8 В этом опыте использовалась смесь 4- и 6-фенн л циклогексен-2- о но в.
8 Продукт реакции получен после гидролиза и частичного декарбоксилирования.
w Этот продукт реакции получен после частичного гидролиза и декарбоксилирования.
11 Продукт реакции получен после гидролиза.
“ Этот продукт реакции образуется в результате самопроизвольной дегидрогенизации или диспропорционирования ожидаемого соединения
" Эта реакция протекает при обработке соединения г г и соединении.
COCH, СОСИ.
CHS I )
\/\------CCH/LHjCHjCOOCjH,
Ci
COOCjlL
?™7яТтоияИ B ',езультате конденсации 1-ацетил 6,6 диметилциклогексена-1 с этиловым эфиром я-аиетиладипиновой кислоты в присутствии
Таблица VIII
а, Р-НЕНАСЫЩЕННЫЕ КЕТОНЫ В КОНДЕНСАЦИИ МИХАЭЛЯ (ВИДОИЗМЕНЕНИЕ РОБИНСОНА)
Заместитель R в CH3COCH2CH2R Присоединяемое соединение Катализатор Продукт реакции (выход, %) а=сн3сосн5сн2- Литера- тура
(CH3)2N СН2(СООС2Н6)2 C2HEONa АСН(СООС2Нб)2 703
(C2H6)2N • CHsl C6HSCH(COOC2HE)2 NaNH2 С6Н5С(Л) (СООС2Н6)2 704
(CH3)2N СН3СОСН2СООС2НБ C2H5ONa 4-Карбэтокси-З-метилцикло- гексен-2-он 653, 705
(CH3)2N-CH3I CH3COCH (СНз) СООС2Н5 — 3,6-Диметилциклогексен-2-он 706
(C2H5)2N-CH3I СНзСОСН (СН2СеН5) СООС2Н6 Этиловый эфир изобутирил- уксусной кислоты C2H6ONa 6-Бензил-З-метилциклогексен- 2-он Этиловый эфир 2-изобутирил- 5-кетогексановой кислоты (65) 707 708
cf \ • CHSI Этиловый эфир а-ацетилизо- валериановой кислоты C2H5ONa ,6-Изопропил-З-метилцикло- гексен-2-он1 (50); 107
XC2H5)2N • CH3I Диэтил овый эфир а-метил- оксалилуксусной кислоты C2HsONa Этиловый эфир 1-метил-2,4- дикетоциклогексав-1-пиро- виноградной кислоты О 709
Диметиловый эфир а-метил- Р-кетоадипиновой кислоты CHsONa, пиридин II /\ (8) 1 J—СН2СН2СООСН3 СН3 СООСНз 710
(C2Hs)2N 2-Карбэтоксициклогексанон C2HsONa, пиридин 2- (р-Ацетилэтил) -2-карбэт- оксициклогексанон 247
[(C2H5)2N • СНз!
N • СНЭ1
2-Карбэтоксициклогексанон С2НБО№
2-Карбометоксициклогеп- танои 2-Карбэтоксициклооктанон CH3ONa CHsONa
2-КарбэтоксицИклононанон CHsONa
2-Карбометоксициклопента- деканон CHsONa
Метиловый эфир 1-кето- 1,2,3, 4-тетрагидрофен- антрен-2-карбоновой кис- лоты CH3ONa
Метиловый эфир 1 кето- 1, 2, 3, 4-тетрагидрофенан- трен-2-карбоновой кислоты CH3ONa
Метиловый эфир 4-кето- 1,2, 3,4-тетрагидрофенан- | трен-3-карбоновой кислоты 1 CHsONa
I
СООС2Н6
(70) 75.246
2- (Р-Ацетилэтил) -2-карбомет- оксициклогептанон (86) 712
2- (Р-Ацетилэтил) -2-карбэт- оксициклооктанон (78) 713, 714
2- (Р-Ацетилэтил) -2-карбэт- оксициклононаион (80)) 713,714
2- (Р-Ацетилэтил) -2-карбомет- оксипиклопентадеканои (78) 713
| ^СООСНз ох° 508
| Р^СООСНэ (95) А СООСН3 555
S' оэ ^-€> ° / \ 556
Продолжение табл. VIII
ьо
Заместитель R в CHsCOCH2CH2R Присоединяемое соединение Катализатор Продукт реакции (выход, %) Л = СН3СОСН2СН2— Литера- тура
(CaHsJaN (C2H5)2N • CHsl СНзСОСНз Циклопентанон 2-Метилциклопентанон 2-Метилциклогексанон 2-Формилпиклогексанон 5-Карбометоксиметил-2- м е- тилциклогексанон 2-Апетил-3,3-диметилцикло- гексаион транс-Декалон-2 Без катализатора » » NaNH2; C2HEONa NaNH2 грег-^НдОК (CEHE) зСЦа КОН, С2Н5ОН CH3ONa CHsONa CH3ONa NaNHa CH3ONa NaNH2 З-Метилциклогексен-2-он (16) О II сн3 rh СНз /\|/\ (35—40, 10—15) СН3 Z\|Z\ (28) 1 1 1 СНз /\|/\ (26-30) 1 1 1 СН3 СН3 /\|/\ (И) /\/\ (68) 1 1 1 О^'М'Х/ СНз Z\l/X (12) X/—СН2СООСНз СНз /\|/\ (12) оАА/-СН2СООСНз о Л/л ЧСОСНз /СНз хХ 715 715 246,247 246,711 711 716 717 688,206 718 708 708 719 246
Продолжение табл. VIII
Заместитель R в СНЯСОСН2СН,И Присоединяемое соединение Катализатор Продукт реакции (выход, %* Д==СНЯСОСН2СН2- Литера- тура
,(C2H5)2N • СНз! О II 2 СНзОИа О II /У) OAJ . 560
8 о II • m г/-ух> СНз CHsONa О СН3Л 560
1 -Мети лдекалон-2 NaNH2 Н3С 1Y 720
1О-Метилдекалон-2 NaNHa сн3 /\|/\/\ III \Z\ZV4o 247
1,4-Диокси-8-метилдекалон-7 [(C6HsCH2N(CH3)s]OH
(CH3)2N 2-Фенилциклогексанои NaNH2
(C2H5)2N • СНз! 1 -Метил-6-метоксидекалои-2 NaNHj
§ 1-Метил-5-метокситетралон-2 NaNHa
С2Н5ОК
2-Кето-10-фенил-2,3,4,5,6,
7,8,10-октагидронафталин
(42)
ОУ\А\/
563
125
716
722
338
КОН, C2HSOH
717
Продолжение табл. VIII
£
CJ
Cn
Заместитель R в CHaCOCH2CHaR Присоединяемое соединение Катализатор Продукт реакции (выход, X) Д=СН,СОСН1СН2- Литера- тура
(C2H5)2N • CHsI
Води. КОН
717
5-Окси-1 -метил-8-метокситет-
ралон-2
5,8-Диметокси-1-метилтетра-
лои-2
4-Циклогексил-2-оксимети-
ленциклогексанон
2-Оксиметилеи-4. (транс-4'-
оксициклогексил) циклогек-
санон
NaNHa
CHsONa
CH3ONa
(C2HS)2N 2-Оксиметилен-4- (транс-4'- CHsONa
оксициклогексил) циклогек-
санон
(C2H5)2N-CHSI
(CaHs)aN
(C2H5)2N • CH3I
2-Оксиметилеи-4- (цис-4'-кето-
никлогексил) циклогексанон
2-Оксиметилен-4- (цис-4'-кето-
циклогексил) циклогексанон
2-Оксиметилен-4- (4'-кетоцик-
логексил)циклогексанон
6-Карбэтокси-1-метилдека-
лон-2
CHsONa
CHsONa
rH3ONa
NaNH2
(30)
O^\Z\Z
(35)*
716
555
716
555,716
721
723
724
555
Продолжение табл. VIII
2-Оксиметилен-4- (4'-ка рбо-
метоксифенил) циклогекса-
нон
CH3ONa
6H4COOCH3-n
(51)
(C2H5)2N • CH3I
О
(смесь изомеров)
NaNH2
суГХ/
{CHshN- СН31
2-Оксиметилен-1-кето-1, 2,3,4-
тетрагидрофенантрен
3-Оксиметилен-4-кето-1, 2, 3,4-
тетрагидрофенантрен
- 2, 2'-Диметоксидезоксибензоин
NaNH2
CH3ONa
CH3ONa
CsHsONa
I
CH3
A
3,4-Ди-(2-метоксифенил)цик-
логексен-2-он (52—56)
726
727
728
555
556
729
Продолжение табл. VIII
Заместитель R в СН,СОСН2СНоР Присоединяемое соединение Катализатор Продукт реакции (выход, %) А - CHjCOCHsCHj — Литера- тура
(C2Hb)2N - СН»! 1 -Оксиметилен-З-метиланили- нометилен-транс-декалои-2 CH3ONa О /\/А | |хсн3 1—1=0 (37) 1 ( i (24) :н3 718
- 2-Метилциклопеитандион-1,3 Циклогександиой-1,3 2 Метилциклогександион-1, 3 CHaONa Пиперидин Без катализатора и f4 .Г'"7 о !1 /чгл 0 |хсна он 551, 730 555 687
CH3ONa; NaNH2; (C2Hb)2NH; пиридин; C2H5ONa 1 1 11 СН 687,730, 731
CaH6ONa \Ао °с 8 551
(C2Hb)2N 8? 2-Метилциклогександион-1,3 Без катализатора ' 561
(C2HB)2N-CH3I 2-Метилциклогексаидион-1,3 CHsONa он Н3С—СН2СН2СООН хУ-сн, 732,733
(C2He)2N 5,5-Диметилциклогексан- дион-1,3 Без катализатора о я СНзч/\—А Сн/\/Х0 561
(CHs)2N Нитрометан C2H5ONa ДСНаИОа 734
(CaHsJaN .2-Нитропропан NaOH (CH3)2CG4)NO2 (85) 715
Продолжение табл. VIII
Заместитель R в СН8СОСН2СВД Присоединяемое соединение Катализатор Продукт реакции (выход, %) Л=СН,СОСН2СН2- Литера- тура
(C2H5)2N • СН31 NaNH2 ОСН3 1 735
О \-СН31 Метиловый эфир флуорен- КОН ь г сн>°ДААЛ° Метиловый эфир 9-(0-аце- 567
\ / 9-карбоновой кислоты тилэтил) флуорен-9-карбо- новой кислоты (45)
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
о=<^ \ch3ch3i и A = (CH3)2NCH2CH2COCH2CH2—
Малоновый эфир С2НБОК ACH(COOC2Hs)2 (25) 705
Ацетоуксусный эфир 2-Карбэтоксициклопентанон СгНбОК с2н5ок CHsCOCH(A) COOC2Hc о <5) 1 1\coocshs 705 705
2-Карбэтоксициклогексанон СаНБОК о 11 A (70) !^J\cOOC5H5 705
О=<^ \ -СН31 и A = CH3SCH2CH2COCH2CH2—
Малоновый эфир Диметиловый эфир р-кето-а-метиладипиио- CjHsOK CHjOK ACH(COOC2HS)2 (42) CHsOOC(CH2)2COC(A) (CHs)COOCHa (70) 736 736
вой кислоты 2-Карбэтоксициклопентанон 2-Нитропропан С2НБОК CjHsOK О k/A c58) 1—|\COOCaH6 (CHs)sC(A)NO2 (41) CH, 736 736
СЯ3СЯ2СОСЯ2СД2М(С2НБ)2-СЯ3/ и 2-Карбэтоксициклогексаиои 7 CaHsONa 248
( :оос2н5
Метиловый эфир 1-кето-1,2,3,4-тетра- гидрофенантреи-2-карбоновой кислоты Метиловый эфир 4-кето-1,2, 3,4-тетрагид- рофенантрен-3-карбоиовой кислоты CHsONa CH3ONa Метиловый эфир 1 -кето-2- (p-пропиоиил- этил)-1,2,3,4-тетрагидрофеиантрен- 2-карбоиовой кислоты (96) Метиловый эфир 4-кето-З- (р-пропио- нилэтил)-!, 2, 3,4-тетрагидрофенантрен- 3-карбоиовой кислоты (87) ОН 555 556
Циклогександион-1,3 (C2Hs)sN А CHj Z 1 (енол) 127,555
Продолжение табл. VIJI
Реагирующие вещества
Катализатор
Продукт реакции (выход, %,
Литера-
тура
СН3СНгСОСН2СН2Ы-
(C2HS)2-CH3I
2-Окс ициклогексано»
Без катализатора
§
2-Метилциклогексанон NaNHs
2-Ацетоксициклогекса нов CHaONa
Карвенои
737
738
737
738
(+) -Дигидрокарвон
NaNH2
8
.(—) -Днгндрокарвов
NaNHa
740
738
741
Продолжение табл. VIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
СНзСНгСОСНгСН2Н(СгНз)г СНз! 5-(а-Карбометоксиэтил2-2-метилциклогек- саион CHaONa НООССН (СНз)—' СНз 'хА^0 СНз (15 •, 7010) 688, 742
NaNH2 НООССН (СНз)— СНз 1 /|\ / 0 (45, 10) 204, 742
СНз
(CeHt)3CNa НООССН (СНз)- СН3 СНз (23") 203
9-Метнлгидринданои-6 NaNH2 / СНз лхЬ СН8 ИЛИ Н3С— 0^ СНз 247
СН3СОСН (СН3) CH2N > • CH3I и
Этиловый эфир изобутирилуксусной КИС-
ЛОТЫ
«30-С3Н7
(карвеиои)
708
Этиловый эфир а-ацетилпропионовой кис-
C2H5ONa
3,4,6-Триметилциклогексеи-2-он (65)
107
лоты
•Оксиметилеикарвотанаиетон
C2HsONa
«зо-С3Н7
744
СНзСОСН[СН2Н(СНз)г • С2Н3Ц2 и
СН2
II
А - СН8СОССН2—
2-Карбэтоксициклогексанов
2-Карбэтокснциклогептаион
.2-Карбометоксицнклооктанон
CHsONa
CH3ONa
CH3ONa
(74, конверсия 65 *2)
(67)
713
713
(66, конверсия 89 12)
713
Продолжение табл. VIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
2-Карбометоксициклононанон CHsONa :о 713
- (СН2)7 (70) /А '\СООСН8
2-Карбометоксициклодеканон CHaONa (СН^)з DO (70, конверсия 87 ,2) '/А ^СООСН, 713
2-Карбометоксициклопентадеканон CH3OCH2COCH2CH2N(C2H5)2 и СНзСОСН(ОСН2)CH2N(C2H5)2 (смесь) и CHaONa (СНг)1а :о (54, конверсия 28 ,2) у А ^СООСНз Н3С° HSC° 712
2-Метилциклогександион-1,3 Пиридин CHSO—/у > < ж \ 1 И III z o^y4^ осн, 745
24 Зак. 794
Заместитель R в (CHS)2 СНСОСН2СВД Присоединяемое соединение Катализатор Продукт реакции (выход, %) Литера- тура
(CHahN Ацетоуксусный эфир — З-Изопропилциклогек- сен-2-он 746
• СН81 Метилацетоуксусный эфир CaHaONa Карвенон (43) 107
Реагирующие вещеста Катализатор Продукт реакции (выход, %) Литера- тура
(CH3)aCHCH2COCH2CH2N ЧО • СН31 и Ацетоуксусный эфир C2HsONa З-Изобутилциклогексен-2-он (45) 1 107
(СЯ8)з CCOCH^CH^N Ъ • СГ131 и Ацетоуксусный эфир CsHsONa З-трет-Бутилциклогексеи-2-ои (45) 107
Иодометилат 2-диэтиламинометил-5-метил- циклопентанона и Ацетоуксусный эфир C2HsONa CaHjOOC\/\/\ 246
1 । । СН, снз
Продолжение табл. VIII
Заместитель R в q-° 'CHaR Присоединяемое соединение Катализатор Продукт реакции (выход, %) О a=Q-ch«- Литера- тура
(CH3)2N (CH8)2N-CH31 (CH3)2N CO ° (CH3)2N-CH3I K> •£- « (CH8)2N »—* • Малоновый эфир Малоновый эфир Ацетоуксусный эфир Метилацетоуксусный эфир Этил ацетоуксусный эфир н-Пропилацетоуксус- ный эфир Аллилацетоуксусиый эфир Фенилацетоуксусиый эфир Бензилацетоуксусный эфир Ацетил ацетон Циклопентанон Гексаидиои-2,5 Циклогексанон Нитрометан Нитроэтан 1-Нитропропан 2-Нитропропан C2HsONa C2HsONa CHsONa СгНвОЫа; uao-CaHrONa CsHsONa; uao-CsHiONa QHsONa C2H6ONa CaHsONa C2HsONa Без катализатора C2H6ONa CiHcONa NaOH NaOH ACH(COOC2Hs)2 (60—66) ACH(COOC2Hs)2 (60—66) OH 1^^-0000^5 (70) |/Y4i~CH3 + /\/\-СН3 \Z\ZXO (40—55) C2Hs (35—40) \ZX/4O —С3Н7-н \ЛЛО <«> /\|/\-СН2СН=СН2 (20) \ZXZ4o СНзСОС (А) (С6Н6) СООС2Н6 \ СН2С6Н5 (35_40) Х/Х/%0 ZWV0 /впч СОСНз (60) О II /у_Л (73) /904 сн2сосн3 (29) 0 II 0~л (бз) ACH2NO2 АСЩСНз^Ог ACH(C2Hs)NO2 (78)) (CH3)2C(A)NO2 (81) 126,747 126,747 748 749 749 749 750 749 749 715 715 715 715 734 750 715 715
Продолжение табл. VIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Иодометилат 2-диэтиламинометил-6-метил- циклогексанона и Малоновый эфир CiHsONa О II Н3С—/X—СН2СН (СООС2Н5)2 (42) 126
Ацетоуксусный эфир Иодометилат 2-диэтиламинометил-4-метил- циклогексанона и Малоновый эфир CjHsONa C2H6ONa сн3 Г / | (60) о О А 11 (У~СН2СН (СООС2Н6)2 /X—СН2СН2СООС2Н5 246 126
Иодометилат 2-диэтиламинометил-4-меток- сициклогексанона и Ацетоуксусный эфир CsHsONa X (4о> 1 сн, СН3 /\^\^° сн3 (28) 721
Этиловый эфир ₽-кетов(алер Пановой кис- лоты О (^^3)2 U CaHeONa СНаО— 721
Малоновый эфир CaH6ONa Диэтиловый эфир 2-(2'-кетоциклогептил)этан- 1,1-дикарбоиовой кислоты 751
О
II
j/4j—CH,N (CHa)2 CHJ и
Ацетоуксусный эфир
Иодометилат 6-диметиламинометил-З-ме-
тилциклогексен-2-она и
Ацетоуксусный эфир
Этиловый эфир пропискилуксусной кис-
лоты
£3
со
Этиловый эфир 7-пиперидино-5-кетогепта-
новой кислоты и
2-Метилцнклогександион-1,3
C2HsONa /"ХА (69) VAA© 751,752
— H,(/V\Ao 706
— m н,с/Х/учо сн3 °сн3 со (СН2)з СООС2Н5 (50-55) Х/^О сн3 о сн3 JL (3—4*3) Al/Х (низкий) (г° 1 П=О 1^—сн2сн2соон Х/Х/ Jh2ch2ch2cooh СН2СН2СООС2Н6 706
Пиридин 732
Продолжение табл. VTTT
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Хлоргидрат $-диметиламиноэтилциклогек- силкетона и Метиловый эфир ацетоуксусной кислоты трет-СчНдОК З-Циклогексилциклогексен-2-он (30) 753
Хлоргидрат 1-($-диметиламинопропионил )- циклогексена-1 и Метиловый эфир ацетоуксусной кислоты zper-CiHgOK 4-Ацетил-4-карбометоксидекалон-1 (47) 753
Иодометилат 1-( ф-морфолинопропионил)- цикло гексена-1 и Малоновый эфир CaHsONa О II qq CaHjOOC^ СООС2Н5 107
Заместитель R в RCH2CH2COC6HS Присоединяемое соединение Катализатор Продукт реакции (выход, %) А = —СН?СН2СОС6Н5 Литера- тура
!(CH3)2N • НС1 Метиловый эфир ацето- уксусной кислоты rper-CiHsOK З-Фенилциклогексен-2-ои (60) 753
Ацетоуксусный эфир трет-С4Н9ОК З-Феиилциклогексеи-2-ои (60) 754
(CH3)2N Ацетоуксусный эфир C2HsONa 6-Карбэтокси-З-фенилцнклогексен- 2-он 598
о22^-снэ1 Ацетоуксусный эфир CaHsONa З-Фенилциклогексен-2-ои (60); 107
,<CH3)2N Циклопентанои Без катализатора О II 715
/\ А (95) 1 I
Циклопентанон > > О Д-А <83> 715
(CH3)2N Ацетилацетон » » б-Ацетил-З-фенилциклогексен-2-oH.Q) 715
Циклогексанон NaOH, СгНбОН О II (5°) 755
<л Циклогексанон Без катализатора Без катализатора о II (95) О II |/Х|-Л (73) 715 715
(CH3)2N Гександион-2,5 > > 6-Ацетонил-З-фенилциклогексен- 715
Ацетофенон Дезоксибензоии Нитрометан » » QjHsONa 2-он (22) ДСН2СОСвНв (40) СбНвСН(Д)СОСбН5 (9) АСНгИОг, (A)2CHNO2, (A)3CNO2 715 715 734
Продолжение табл. VII
Заместитель R в RCH2CH2COCeH6 Присоединяемое соединение Катализатор Продукт реакции (выход, %) Л=—CH2CH2COC6H6 Литера- тура
;(сн»)8к Нитрометан NaOH 4CH2NO2 (13) 715
Без катализатора ACH2NO2 (15) 715
(C2HB)2N Нитроэтан NaOH 4CH(CH3)NO2 (7) и A2C(CH3)NO2 (50) 715
о Нитроэтан NaOH A2C(CH3)NO2 (30) 715
C2HsONa XCH(CHs)NO2 (48) и A2C (CH3) NO2 (30) 715
(CHs)sN 1-Нитропропан NaOH 4CH(C2Hs)NO2 (80) 715
{CaHshN 1-Нитропропан C2HsONa 4CH(C2Hs)NO2 (60) 715
(CH8)2N 2-Нитропропан NaOH (CH3)2C(A)NO2 (12) 715
q 2-Нитропропан NaOH (CH3)2C(4)NO2 (84) 715
(Ch3)2n 1-Нитро-2-феиилэтан NaOH CbHsCH^H^JNOs, (68) и CeH5CH2CM)2NO2 (7) 715
A COOCH8
(CsH5)2N • (CH3)2SO4 Метиловый эфир флу- орен-9-карбоновой кислоты KOH 0^0 (83) 567
Реагирующие вещества Катализатор Продукт реакции (выход, %) О II r’-A-r’ С.Н.ОН-п Литера- тура
Хлоргидрат fi-диметиламино-п-оксипропио-
фенона и Ацетоуксусный эфир трет-С4Н9ОК R' = R" = Н (30) 753
Этилаиетоуксусиый эфир трет-С4Н9ОК R' = ОгНб, R" = H (71) 753
Изопропилапетоуксусиый эфир трет-С4Н9ОК R' = (CH3)2CH и СООС2Н5, R" = Н (30) 753
Этиловый эфир а-пропиоиилпропиоиовой трет-С4Н9ОК R' = R" = CH3 (56) 753
кислоты
Этиловый эфир а. у-дифенилацетоуксусиой трет-С4Н9ОК R' = R" = CeHs (15) 753
КИСЛОТЫ
Апетилапетон Иодометилат 4-карбэтокси-2-диэтиламино- метилциклогексанона и трет-С4Н9ОК R' - СНзСО, R" - H (12) CH3 1,0 753
Этиловый эфир Р-кетовалериаиовой кис- лоты C2HBONa c^ooc-l^J 721
Иодометила т 2-морфолинометилгидрин- дона-1 и
Ацетоуксусный эфир CgHgONa 1 II I 1 \/\cOOC2H8 756
Продолжение табл. VIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) О II R-fit Х/ХС„Н<ОСНл-л Литера- тура
Хлоргидрат $-диметиламиноэтил-п-метокси- фенилкетона и Ацетоуксусный эфир rpe/QHgOK R = Н (40) 753
Этилацетоуксусный эфир трет-С4Н9ОК R = С2НЕ (64) 753
Изопропилацетоуксусный эфир трет-С4Н9ОК R = (СНз)2СН (30) 753
Ацетилацетон трет-С4Н9ОК R = СН3СО (36) 753
Нитрометан 14 трет-С4Н9ОК п-Метокси-со-нитробутирофенон 734
Хлоргидрат р-диметиламиноизопропил- . фенилкетона и Ацетоуксусный эфир трет-С4Н9ОК 4-Метил-3-фенилциклогексен-2-он 753, 754
^-Морфолино-а-фенилэтилметилкетон и (40, 38)
2-Нитропропан NaOH 2-Метил-2-нитро-4-фенилгексаиои-5 (89) 715
Иодометилат 6-иэопропил-З-метил-2-морфо- линометилциклогексанона и изо-С3Н7
Ацетоуксусный эфир C2H5ONa Аа//° 1 1 1 757
(82)
СН3
2-Диметиламинометилтетралон-! и
Ацетоуксусный эфир
Метилацетоуксусный эфир
Иодометилат ^-диметиламино-а- (п-мет-
оксифенил)этилметилк.етона и
2-Оксиметилен-6-метокситетралои-1
3,4-Диметоксифенил-$-диметиламиноэтил-
кетон и
Нитрометан
Диметиламино-0- (п-метоксифенил )этил-
. метилкетон и
Нитрометан
$-Диметиламино-$-(3,4-диметоксифенил)-
этилметилкетон и
Нитрометан
$-Диметиламино-$-(3,4-метилендиоксифе-
нил)этилметилкетон и
Нитрометан
C2HsONa
C2H5ONa
CH3ONa
C2HsONa
C2HsONa
C2H5ONa
C2HsONa
О
R = H
R = CH3
748
748
2- (п-Метоксифенил) -З-кето-7-метокси- 758
1,2, 3,9,10,10а-гексагидрофеиаитрен
l-(3', 4'-Диметоксифенил) -4-нитробу- 734
такой-1
4- (n-Метоксифенил) -5-ннтропентанон-2 734
4- (3', 4'-Диметоксифенил) -5-иитропеи- 734
танон-2
4-(3', 4'-Метилендиоксифенил)-5-нитро- 734
пентанои-2
Продолжение табл. VIII
Со оо Реагирующн е вещества Катализатор Продукт реакции (выход, %) Литера- тура
2-ДиметиламинометшЛ Монодиметилкеталь ди Хлоргидрат $-дим( окси-2-нафтилкетона Метиловый эфир ацет< (Ь-Диметиламино-£>-фен 4,5-диметоксифенши Нитрометан ъензосуберон и ацетила тгламиноэтил-б-мет- и эуксусной кислоты илэт ил-2-нит ро- сетон и Na-Еиолят КОН, (СН3)2СНОН C2H6ONa п СНСН2СОСОСН3 //\/ \ 1 U > (небольшой) 3- (6'-Метокси-2'-нафтил) циклогексеи- он-1 (70) 4-Нитро-1- (2'-нитро-4', б'-диметокси- фенил) -3-феиилбутанон-1 416 759 734
Заместитель R в CH2R 1 II 1 Присоединяемое соединение Катализатор Продукт реакции (выход, %) Литера- тура
C2H5S О \ C2H5S Малоновый эфир Ацетамидомалоновый эфир Дибензо илметан 2-Нитропропан Индол кон кон НС1, С2Н5ОН NaOH КОН АА 1 1 <\ХЧО (68) о 1 ТО СН2С (ЫНСОСНз) (СООС2Н8)! /ОН fYY <е> и QHgOOC NHCOCH8 Xz° 1 i (42) i^YY CH2CH (COCeH6)2 aV°h \z\z CH2C (NO2) (CH3)2 jQ^^—oh (56) CH1 YzO*54 170 170 760, ср. 761, 762 170 170
Продолжение табл. VIII
Заместитель R в RCH2CH (NO2) сн3 Присоединяемое соединение Катализатор Продукт реакции (выход, %) A=CHSCH (NO2) ch2- Литера- тура
(U3O-C3H7)2N Малоновый эфир H-CiHsONa ACH(COOC2Hs)2 (37) 269
C2HsONa АСН(СООС2Ш)2 (25) 269
[C6H5CH2N(CH3)3]OH ACH(COOC2H5)2 (47) 269
Малоновый эфир H-CjHgONa ACH(COOC2Hs)2 (13) 269
(изо-С3Н7) 2N Ацетоуксусный эфир C2HsONa; n-C4HgONa CH3COCH(A)COOC2Hs (46) 269
со / XN СО \ / Ацетоуксусный эфир H-C4HgONa CH3COCH(A)COOC2H6 (17) 269
(uso-C3H7)2N Этиловый эфир сс-аце- тилянтарной кислоты H-C4HgONa C2HSOOCC(A) (СОСНз) CH2COOC2H5 (72) 269
О Этиловый эфир а-аце- тилянтарной кислоты H-C4HgONa C2H6OOCC(A) (СОСНз) CH2COOC2H8 (8) 269
Xu3O-C3H7)2N 1-Нитропропан [C6H5CH2N(CH3)3]OH NaOH CH3CH2CH(A)NO2 (33) CH3CH2CH(A)NO2 (50) 269 269
Заместитель R в RCH2CH(NO2)CH2- CHs 2-Нитропропан [C6H5CH2N(CH3)3]OH NaOH (CH3)2C(A)NO2 (52) (CH3)2C(A)NO2 (43) A = CH3CH2CH(NO2)CH2- 269 269
(CHa)2N 1-Нитропропан NaOH СНзСНаСН (А ШОд (341!. 269. 763
(C2H5)2N 1 1-Нитропропан NaOH CH3CH2CH(A)NO2 (18) 269.763
(w3O-C3H7)2N 1-Нитропропан [C6HSCH2N(CH3)3]OH CH3CH2CH(A)NO2 (15) 269
NaOH CH3CH2CH(A)NO2 (18) 269,763
i(CH3)2N 2-Нитропропан NaOH (CHs)2C(A)NO2 (55) 269
;(«3o-c3h7)2n 2-Нитропропан [C6H5CH2N(CH3)3]OH (CH3)2C(A)NO2 (50) 269
NaOH (CH3)2C(A)NO2 (44) 269
1 Этот продукт реакции (пиперитон) получен после гидролиза и декарбоксилирования.
2 Фактически применявшееся соедииеиие было изомером строения
со ЛАО
8 Использовалась смесь этого соединения с изомером строения
н,с-^у^о
О^\/
Часть вещества подверглась дегидрогенизации до 6-окси-5-метилтетралоиа-1.
4 Этот продукт реакции получен в результате циклизации первичного продукта реакции, который ие был выделен.
£ Строение продукта реакции, предполагаемое авторами.
6 Это соединение образуется в результате размыкания цикла первичного продукта реакции.
7 В этом случае вместо четвертичного иодометилата использовалось третичное основание.
8 Это соедииеиие получают, обрабатывая неочищенный первичный продукт реакции кипящим раствором едкого кали.
8 Около 65% кетоэфира не вступило в реакцию.
10 25% кетоэфира можно извлечь в неизмененном виде.
11 Сложный эфир, полученный в реакции, был омылеи.
12 В реакцию вступило лишь указанное количество кетоэфира; остальное количество можно извлечь в неизмененном виде.
18 Это соедииеиие образуется в результате размыкания цикла первичного продукта реакции и новой циклизации. Если использовались
иодометилат этилового эфира 7-пиперидино-5-кетогептановой кислоты _и метилат натрия, то основным продуктом реакции была двухосновная
кислота.
и Вместо хлоргидрата использовалось свободное основание.
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С ХИНОНАМИ И ИХ ПРОИЗВОДНЫМИ
Таблица IX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
п-Бензохинон и /z х ГАНС Н
Ацетоуксусный эфир ZnCI2 (!) П V | |1 I V. U U ЦП5 и\Лснз 274
Н-С- \ rnnr н
П3Ь- !| | || || -сиицпь С2НБООС—“ ^Д. 0/—СНз
СНзС (=NH) СН (СНз) СООС2Н5 Без катализатора ~ /С (СН3) (СООС2НБ) С (=NH) СН3 н°—I II 399
1 II ^/\он (31)
C2H5OC(=NH)CH2COOC2H5 Циануксусный эфир NH3, С2Н5ОН Этиловый эфир 2-ЭТОКСИ-5-ОКСИНДОЛ- 3-карбоновой кислоты (38) СН (CN) СООС2Н6 Н0\Д 399 270
(15) у ЧЭН
Цианацетамид Z NH3, С2Н6ОН СН (CN) СООС2Н6 СН (CN) CONHj Н<\А кА <|6' у ЧЭН 270
CHtCNLCCMH...
Нитрил малоновой кислоты
NH3, СаНвОН
25 Зак. 794
Ацетилацетон
о! 2,6-Дихлорбензохинон и
Ацетоуксусный эфир
Пиридин
Пиридин
270
764
765
291
Продолжение табл. IX
Метоксибензохинон и
СНзС (=NH) СН (СНз) СООС2Н8
С2Н5ОС (=NH) СН2СООС2Н5
n-Ксилохинон и
Малоновый эфир
Без катализатора
C2H8ONa
2-Бром-З. 5-диметилбензохинон и
Малоновый эфир
C2H5ONa
(72)
С(СНз) (СООС2Н5) С (=NH)CH3
Этиловый эфир 2-этокси-5-окси-6-мет-
оксиндол-3-карбоновой кислоты2 (46)
О—СО
Н3С—СНСООС2НБ
NLcH, <41)
I
он
Н3С-.
С2НБООСНС—I
О—СО
• СНСООС2НБ
I J—сн3
ОС—О
(небольшой)
399
399
766
О—СО
Вг—
Н3С-
ОН
снсоос2нБ
СНз <26)
767
Продолжение табл. ТХ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
3,5-Дибром-2,6-диметилбензохинон и
Малоновый эфир Na
768
Триметилбензохинон и
Малоновый эфир
Ацетоуксусный эфир
Этиловый эфир пальмитоилуксусной
кислоты
C2HsONa
CaHsONa; Na
CsHsONa
C2HBONa
271, 769
A, R = СОСНз
A, R = СОС1ВНз1-н
(55)
(20) 769
769
770
Этиловый эфир стеароилуксусной кислоты C2HsONa 1 Д R = COCi?H35-« (27) 770
Изобутирилмалоновый эфир C2H5ONa; (СгНьО^М^ A, R = COOC2HB (56) • i 271
Циануксусный эфир Na i I Этиловый эфир триметилгидрохинонциаи- уксусноД кислоты (32) СН3 СН3 410
Триметилбензохинон и «о i i । НзС—^'у>о\=° Н3С-’/Х-ОН л=но_М1. Lr *=ho-!L-R' 1 1 СНз СНз СНз 1 ' Н3С—nh2 НО—I II 1—CN или |
Цианацетамид CH3ONa СНз СНз 1 Н H3C-^VN\=O НО—!^JI 1—CN <74—83) 1 СНз 410
Цианистый бензил CH3ONa A, R = С6Н5 (32) 410
ЛЦетнлацеюн ’ ‘ ' * CsHjONa - • •• В, R' - СНзСОСНСОСНз 1721 277
Продолжение табл. [X
Go
8
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Изобутирилацетон C2HBONa 1 В, R' = СН3СОСНСОСН(СН3)2 (81) 277
2,6-Диметилгептаидион-3,5 С2НбО№ 1 В, R'= (СН3)2СНСОСНСОСН(СН3)2 (76) 278
Гепта декандион-2,4 C2H5ONa 1 В, R' = СНзСОСНСОС^Нэт-н (14) 272
СН3
5,9,13,17-Тетраметилоктадекаи- дион-2,4 CsHgONa H3C_^V0\-CH <СНз)<СН=)з СН(СНз)(СН2)3- НО 1 II II СН (СН,) (СН2), СН (СН,)2 I (21) СН, 272
Ацетомезитилеи Бромтриметилбензохинон и Броммаг- нийенолят В, R' = СН2СОС6Н2(СН3)з (90) fir 271
Малоновый эфир CjHsONa н3с-А/°\^° 1 F 1 НО—СООС2Н, (25) 801
СН,
Дурохинон и 1 I 1 \ сн3
Hr J\/<v0
Малоновый эфир Ацетоуксусный эфир Метиловый эфир циаиуксусной кис- лоты Триметилэтилбензохинон и Na Na Na CH, R = COOC2H5 R = СОСНз (25) R = CN (26) CH, CH, 217, ср. 772,773 281 280
Малоновый эфир Na a-c i iz°Y° НО-Ц^Х^-СООСзНз но_ух/1_соос2н6 774
С2НБ CH, c2HB
H3C-A/°X^°
HO—J—СООС2НБ
1,4-Н шЬтохинон и 1 СНз (смесь, 90) о СООС2НБ °н
Малоновый эфир Пиридин лу? । <i5> 4 II соос2нБ^/х'^ о он 1 285
Продолжение табл. IX
Сз СО К СО СО СО Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
1,4-Нафтохинон и Ацетоуксусный эфир Бензоилуксусный эфир 1,4-Нафтохинон-2-сульфонат калия и Малоновый эфир *\ ’< >'' *Я.\ 4 1* Ч .ь Ацетоуксусный эфир 2-Бром-1,4-нафтохинон и Ацетоуксусный эфир ,к .. . II 2, 3-Дихлор-1,4-нафтохинон и Диметиловый эфир малоновой кис- лоты Малоновый эфир Метиловый эфир ацетоуксусной кис- лоты NaOH, С2НБОН Пиридин, хлоргидрат пиридина Пиридин, хлоргидрат пиридина Пиридин (СНзЬИОН КОН, водн. С2НБОН Хинолии, хлоргидрат хинолина Пиридин Хинолин, хлоргидрат хинолина Пиридин, хлоргидрат пиридина о II —сн2сосн3 цДч2-сн2соос2нб (25) II О ? л /\Z\zN\Z j J (И) 1г О О Z\ II 1 II 'iLcOOCHs (16) II 0 У соос2нБ °н 00 । ' Qu : Z Y COOCjHs.y о OH QZ\ CH2COCH3 i ^Ду!-сн2СООС2НБ (40) и о 0 II . QYQi—CH2COCH3 А\/ СН2СООС2НБ (32) II 0 ° ° 'ASi A=u\Az N\Z в=uAv NA II II о о В, R = СООСНз (20) A, R = СООС2НБ (6) В, R = COOC2H5 (11) A, R = СООСНз (51) 284 284 288 л 285 284 284 284 288 284 284
Продолжение табл. IX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Метиловый эфир ацетоуксусной кис- Хинолин, хлоргидрат в, R = СООСНз (39) 284
лоты хинолина
Ацетоуксусный эфир Пиридин, хлоргидрат A, R = СООС2Н5 (49, 62) или 284,288
пиридина О
II
СН2СО СНз Ц/’ху!- СН2СООС2Н5 t50) 284
II О
Хинолин, хлоргидрат в, R = СООС2НБ (45) 284
хинолина
Ацетоацетанилид Пиридин A, R = СОСНз (31) и A, R = CONHCeHs 290, 291
(8)
Ацетоацет-о-хлоранилид A, R = СОСНз 290, 291
Ацетоацет-о-толуид A, R = СОСНз 290, 291
2- (Ацетоацетамидо) -6-этоксибензо- A, R = СОСНз 290, 291
тиазол
Ацетилацетон A, R = СОСНз (36) 288
Ацетофенон » A, R = COC6HS (13)' 292
Дибензоилметаи A, R = COCsHs (3) 292
СН^ II Г СООС2НБ
Малоновый эфир Na (небольшой) 283
2, S-Диметил-!, 4-нафтохинОн и
Малоновый эфир
ЛГСОС6Н6
Na
NHCOC6H6
ns
Со
СО
Сл
ПСОСеН5
Малоновый эфир
Ацетилацетон
NSO2CeH5*
CH3ONa
CH3ONa
^НСОС6НБ
ACH(COOC2Hs)2 (76)
СН3СОСН(А)СОСН3 (75)
NHSO2C6H5
NSOiCJh
Малоновый эфир
Ацетоуксусный эфир
2-Карбэтоксициклопентанон
CH3ONa
CH3ONa
CH3ONa
NHSO2C6H6
ACH(COOC2Hs)2 (57)
СН3СОСН(А)СООС2Нб (неочищенный 90)
О
(неочищенный 97)
1__iXCOOC2H5
776
776.
777
777
777
и
и
Продолжение табл IX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литера- тура
Бензоилуксусный эфир CH3ONa СвНвСОСН(А)СООС2Нв (неочищенный 94) 777
Ацетилацетон CHaONa CH3COCH (A) COCH, (неочищенный О II 25) 777
Циклогексаидион-1,3 NSO^C^H^ II ci— 1 II « II MSO2C6HB CHaONa /X Л (76) \/=° NHSO2CbH5 о_А А= • |^|_ NHSO2C6HB 777
Малоновый эфир CH3ONa АСН(СООС2Нв)2 (62) 777
Ацетоуксусный эфир CHaONa СНзСОСН(А)СООС2Нв (неочищенный 97) 777
Ацетилацетон NSO2C6Hb II II К8О2С6Нь CH3ONa СНзСОСН (А) СОСНз (неочищенный NHSO2CBHB л = н‘с~Л_ 1 NHSO2C6Hb 94) 777
Малоновый эфир CHaONa АСН(СООС2Нв)2 (82) 777
Ацетоуксусный эфир ' i" - CH3ONa СН3СОСН (А)СООС2НВ (неочищенный 95) 777
Ацетилацетон NSO2C6Hb CH3ONa СНзСОСН (A )COCH3 (79) NHSO2CBHB in
Л = 1 1 J
\/\/ II 1
NSO^C^ NHSO2CbHb 778
Малоновый эфир (C2HB)3N ACH(COOC2Hb)2 (83)
Бензоилуксусиый эфир (C2Hb)3N C6HsCOCH(A)COOC2Hb (90) 778
Ацетилацетон (C2Hb)3N СНзСОСН (А) СОСНз (84) 778
Нитрометан (C2Hs)3N (A)2CHNO2 (84) 778
Нитроэтан (C2H5)aN ACH(CH3)NO2 (64) 778
f'y=NCOC6Hi l^^NCOCtHb <^\-NHCOCeHB NHCOCeHB 779
Малоновый эфир CH3ONa ACH(COOC2Hb) 5 (96)
$9 Ацетилацетон CH3ONa СН3СОСН(Д)СОСНзБ (99) 779
. С1—|^Ч:=МСОСвНв' f
Ц^АГСОСаЯа U Cl—NHCOCBHB
Ацетилацетон CHaONa Ml-NHCOCeHB (97) ( 779
1 CH(COCH3)25
1 Это формула, предполагаемая автором.
з Положение метоксильной группы ие определялось.
* Этот хинои вводили в виде его димера. „
4 При взаимодействии этого соединения с циануксусным эфиром, нитрилом малоновой кислоты, нитрометаном, иитроэтаном и z-нитроиро-
паном образуются только продукты осмолеиия.
« Положение, в котором происходило замещение, ие определялось.
• При взаимодействии этого соединения с малоновым эфиром образуется только маслянистый продукт реакции.
Т а б л и и я Y
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С АКРИЛОНИТРИЛОМ'
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литерат «
А. Углеводороды А = —CH2CH2CN
Циклопентадиен [C6H5CH2N(CH3)3]OH Гекса- (Р-цианэтил) циклопеитадиен (9) 307
Инден [C6H5CH2N(CH3)3]OH х, х-бис- (р-Цианэтил) инден (14) 1, 1,3-тр«с-(р-Циаиэтил)инден (35) 307
1 -Изопропилиденинден [C6H6CH2N(CH3)3]OH /А //\ 1 II II 1 II II W или /СНз (22) С (CH3)S Л С^СН2 307
Флуорен [CeH6CH2N(CH3)3]OH 9,9-Ди- (р-цианэтил) флуореи (74) 307, 780
1 -Метилфлуорен [C6H5CH2N(CH3)3]OH 9,9-Ди- (Р-цианэтил) -1 -метилфлуорен (70) 505
2-Нитрофлуорен [С6НбСН2К(СН3)з]ОН 9,9-Ди- (Р-цианэтил) -2-иитрофлуорен (70) 307
2,7-Дибромфлуорен He указан 2,7-Дибром-9,9-ди- (Р-цианэтил) флуорен 781
4, 5-Метиленфенантрен [C6H5CH2N(CH3)3]OH 4,5 -[Ди- (Р-цианэтил) метилен]фенаитрен 781, 782
9-Фенилфлуорен [C6HsCH2N(CH3)3]OH 9- (р-Цианэтил) -9-фенилфлуорен (73) 308
9-Флуоренол [C6HbCH2N(CH3)3]OH 9- (р-Цианэтил) -9-флуоренол 308
1, 2,3,4-Тетрагидрофлуорантен [C6HsCH2N(CH3)3]OH 1-(£-Цианэтил)-1,2, 3,4-тетрагидрофлусэ- ра нтен 781, 782
2,2, 4-Триметил-1,2-дигидро- флуорантен Б. Альдегиды [CbH6CH2N(CH3)s]OH 1-(р-Цианэтил)-2, 2,4-триметил-1, 2-ди- гидрофлуорантен А = —CH2CH2CN 781, 782
Ацетальдегид — (А)2СНСНО, (А)3ССНО 783
Пропионовый альдегид — СНзСН(А)СНО, СН3С(А)2СНО 783
Изомасляный альдегид Полимер четвертичной соли винилпиридина; водн. KCN (СНз)2С(А)СНО (40, 79) 501, 783, 784
Диэтилацетальдегид 2-Этилгексеи-2-аль 2-Этилгексаналь «-Фенилпропионовый альдегид В. Кетоны КОН, СНзОН кон КОН, СНзОН кон (С2Нб)2С(А)СНО (75—80) СН3СН2СН=СНС(А)(С2Нб)СНО (50) С4Н8С(А)(С2Нб)СНО (75, 80) (С6НБ) (СН3) С (А) СНО (74) А = —CH2CH2CN 297, 303 303 297, 303 785
Ацетон Полимер четвертичной соли винилпиридина СНзСОСН2А (19) и СН3СОС(А)3 (32) 501
NaOH СН3СОСН2Л (8), СН3СОСН(Д)2 (14), СНзСОС (А) з (24); 786
[C6H5CH2N(CH3)3]OH СН3СОС(А)3 (75—80) и (А)2СНСОС(А)3 787, 788
[С6Н5СН2Н(СН3)з]ОН СНзСОСН2А (18) 2 789
Метилэтилкетон Na; [C6HBCH2N(CH3)3]OH СНзСОС(Д)2СНз (51, 90) и (А)2СНСОС(А)2СН3 790. 788
KOH, С2НБОН; СНзСОСН (А)СНз (6, 20) и 294, 297
СО «о [C6H5CH2N(CH3)3]OH СНзСОС (А) 2СНз3 (47) 789
[C6H6CH2N(CH3)3]OH СН3СОСН(А)СН3 и СНзСОС(А)2СН32 (24—30)
Поливинилпиридин СН3СОСН(А)СНз и СНзСОС (А) 2СН3 (общий 47), 501
Метил-Р-цианэтилкетон Водн. KCN CH3COC(A)2CH2CN (82) 135
Метил-н-пропилкетон KOH, C2HsOH; СН3СОСН(А)С2Нб (15, 20), 294, 297,
[CeH5CH3N(CH3)3]OH; СНзСОС (А) 2С2НБ (14, 43) и 501, 788
полимер четвертичной соли винилпиридина АСН2СОС(А)2С2НБ 294
Метилизопропилкетон КОН, C2HsOH; [C6H5CH2N(CH3)3]OH СНзСОС(А) (СНз)2 3 (54)
Диэтилкетои [CeH5CH2N(CH3)3]OH СН3СН(А)СОС(А)2СНз (31) 788
Метилизобутилкетои KOH, C2H6OH; [C6HbCH2N(CH3)3]OH СНзСОСН(А)СН(СНз)2 (17) и СН3СОС(А)2СН(СНз)23 (15) 294, 788
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
В. Кетоны 1 л=—ch2ch2cn
Окись мезитила [СбН5СН2ЩСН3)3]ОН СНзСОС(Л)8С(СН)3=СН2 (35, 74) и СН3СОС(Л)=С(СН3)2 (10—15) 791, 302
Метил-н-амилкетон КОН. C2HSOH; [C6H5CH2N(CH3)3]OH СН3СОСН(Л)С4Н9-н (19) и СНзСОС(А)2С4Нв-« (40) 8 294, 788
Диизопропилкетон [C6HsCH2N(CH3)3]OH (СН3)2С(Л)СОСН(СН3)2 (40, 10) и (СНз)2С(Л)СОС(Л)(СНз)28 (1) 293, 294, 792
Метилгексилкетои Водн. NaOH (СН3)2С(Л)СОСН(СН3)2 (28) и (СН3)2С(Л)СОС(Л) (СНз)2 (небольшой) 793
[СбНБСН2Ц(СН3)3]ОН; КОН, С2НБОН СН3СОСН(Л)СБНи-н (19) и СН3СОС(Л)2С5Нц-к8 (31) 294, 788
Диизобутилкетон КОН, С2Н5ОН; [C6HbCH2N(CH3)3]OH (СН3)2СНСН(Л)СОСН2СН(СН3)2 (35) и (СНз)2СНСН(Л)СОСН(Л)СН(СНз)28 (19) 294
Изопропил-н-амилкетон КОН, СН3ОН н-СбН11СОС(Л)(СН3)2 295
Изопропил-м-нонилкетон КОН, СНзОН н-С9Н19СОС(Л) (СНз) 2 295
Ацетилацетон [СбН5СН2Н(СН3)3]ОН или -ОС«Н8-н СН3СОС(Л)2СОСН3 (49—55) 296
Ацетонилацетон [CeHsCHsN (СН3)3]ОН или -OC4Hs-h СНзСОС (Л )2СН2СОСН3 (46—50) 296
Циклопентанон [С6НбСН2Ц(СН3)3]0Н; КОН 2,2, 5, 5-Тетра-(Р-цианэтил) циклопеитанон (97) 788
[C6HsCH2N(CH3)3]OH; [CeHsN (СНз) 3]ОС2Н5 2,2, 5, 5-Тетра-(Р-цианэтил)циклопентанои (95—97) 794
Циклогексанон КОН, С2НБОН; 2-(р-Цианэтил) циклогексанои (16—19) и 126, 251,
[C6HsCH2N(CH3)3]OH 2, 2-ди- (р-цианэтил) циклогексанон 8 (44) 294
[C6H5CH2N(CH3)3]OH 2-(р-Цианэтил)циклогексанон (47) или 2,2-ди- (Р-цианэтил)циклогексанон (18—20) 789, 184
NaNH2 2, 2, 6,6-Тетра-(р-циаиэтил)циклогексанон 294, 303
26 Зак. 794.
Na; [С6НбСН2Н(СН3)3]ОН; КОН
NaOH
Енамии кетона с пирролидином
C2HsONa
Циклогександион-1,3 кон CH3ONa
2,4-Диметилциклопентан- он кон
2,4-Диметилциклопентен- 2-он Не указан
3,5-Диметилциклопеитеи- 2-он
2-Метилциклогексанон [C6H5CH2N(CH3)3]OH [С6Н5СН2Н(СН3)3]ОН; КОН
2,2, 6, 6-Тетра-( Р-цианэтил) циклогексанон.
(81, 80 95)
2-(Р-Цианэтил) циклогексанон (20) и
2,2-ди- (Р-цианэтил) циклогексанон (40),
2-(р-Цианэтил) циклогексанон (80)
2-(Р-Цианэтил)циклогексанон (5), 2, 2-ДИ-
(р-пианэтил) циклогексанон (5) и
2,2, 6, 6-тетра-(р-цианэтил)циклогекса-
нон
2-(Р-Цианэтил) циклогексанон (29) и
2,2-ди- (р-цианэтил) циклогексанои (26)
2- (Р-Цианэтил) циклогександион-1,3 (23)
О
А/Л (73)
хсн3
н3с——j
о
II
/\_ л (12)
|| |
н3с—11——сн3
о
II л
i| |\ (неочищенный 24)
хсн3
н3с——1
2-Метил-2- (р-цианэтил) циклогексанон (80)
2-Метил-2,6,6-три- (р-цианэтил) циклогек-
санон (38)
788, 790
795
558
793
796
797
796
796
796
126
788
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
В. Кетоны 4-Метилциклогексанон 2-Метилииклогександион-1,3 Циклогептанон 2-Цианциклогептанон 5, 5-Диметилциклогексан- ё дион-1,3 «о Изофорон ю ст. « о Со 4-трет-Амнлцнклогексанон 2- (Циклогексен- Г-нл) цикло- гексанон 4-Циклогекснлцнклогексанон Нитрил З-кето-2-фенилцикло- гексилуксусной кислоты [C6HSCH2N(CH3)3]OH CH3ONa C2HsONa Енамин кетона КОН, СН3ОН CH3ONa C2H5ONa NaNHs [C6H5CH2N(CH3)3]OH rper-CsHnONa [C6H5CH2N(CH3)3]OH; KOH [СбН5СН2М(СН3)з]ОН; KOH [C6H5CH2N(CH3)3]OH; KOH [C6H5CH2N(CH3)3]OH A=— CH2CH2CN 2- (Р-Цианэтил) -4-метилциклогексанон (21) 2- (Р-Цианэтил) -2-метилциклогексан- дион-1,36 (82) 1-Карбэтокси-7-циан-5-метилгептанон-4 (63) 2- (Р-Цианэтил) циклогептанон 2- (Р-Цнанэтил) -2-цнанциклогептанон (65); А А А °%/А° °ОА° ’ | (56) или (8 ) Н3С сн3 Н3С сн3 А А %Х//° (83)7 н3с СН3 А А ч» 1 1 * Н3С СН3 СН3 8 1 снзчР|-л (9) СН3/\/^О СН3 СН3 А/л А/л СН3. | (22) СН3\| |\л (1) СН3/\/^О СН3/Х|/^О А сн3 1 /Ч_д сн3\| | А СН3/\/^О 2, 2, 6, 6-Тетра-(Р-цианэтил)-4-трет-амил- циклогексанон (80—95) 2-Циклогексен-1 '-нл-2- (Р-цнанэтил) цикло- гексанон (50) и 2-циклогсксен-lz-и л- 2,6, 6-три-( Р-цианэтил) циклогексанон (29) 2,2, 6,6-Тетра- (Р-цнанэтил) -4-цик- логексилциклогексанон (80—95) А С6Н5 °О\ У ch2cn (16) л\| 1 126 796 798 558 799 796 251 251 304 305» 788 298 788 120
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
В. Кетоны 2-Фенилциклогексанон NaNH2 А=— CH2CH2CN 2- (Р-Цианэтил) -2-фенилциклогексанон 124
[С6Н6СН2М(СНз)з]ОН (63—70) 2- (Р-Цианэтил) -2-фенил циклогексанон 125
Na 2- (Р-Цианэтил)-2-фенилцнклогексанон (60) 800
4- (а, а, у, у-Тетраметилбутнл)- [CeH5CH2N(CH3)3]OH 2,2, 6, 6-Тетра- (Р-цианэтил) -4- (а, а, у, у- 788
циклогексанов 2-Бензнлнден-6-фенилцикло- [C6H5CH2N(CH3)3]OH тетраметилбутил) циклогексанон (80—95) 2-Бензилиден-6- (Р-цианэтил) -6-фенилцик- 124
гексанон а-Тетралон [C6H5CH2N (СНз) з]ОН; КОН логексанон (83) О " Л 788
1-Метил-ч«с-декалон-2 [С6Н5СН2Ы(СН3)з]ОН •1 1 р \/\/ н3с сн2снгсоон 390
1 -Метил-транс-декалон-2 [C6HSCH2N(CH3)3]OH <5О)9 H3QH (40)9 390
XcHjCHjCOOH
3- (Метилаиилинометилеи) -1-
метил-транс-декалои-2
[С6Н5СН2М(СН3)з1ОН
[С6Н5СН2М(СНз)з1ОН
[С6Н5рн2М(СНз)з]ОН
[C6HSN (СНз) з]ОН
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
В. Кетоны сн3 ^/^^СНЩСНзЭСвНе Н3С С8Н|7 HaC^Y/—! ОА/ (кетой Иихоффена) Н3С С8Н17 НзС\хС 1 1 o^Y CHN (СН3) CBHB [С6Н5М(СНз)з]ОН [C6HBN(CH3)3]OH :CeHBN(CH3)3]OH А = —CH2CH2CN Н3С СН2СН2СООН HsCYY^0 (22) НзС сян17 801 390 390, 802
нг 1 zS
YY (Ц> °С\ HOOCCHjCHj, СН2СН2СООН НзС с»н17 Нзс\/С— НООССН2СН2/| 1 О^\/ (кислота Виндауса)
НС I8"” 1 JL (|| \(СНз)з н,С\ A > < / YY >oz CHN(CH3)C6H5 Ацетофенон § 4-Хлорацетофеиои 4-Бромацетофенон 4-Метилацетофенои [CeHs N (СНз) з]ОН [C6H5CH2N(CH3)3]OH или [СвНвСН2К(СНз)з]- OCiHe-н Води. KCN [С6Н5К'(СНз)зЮС2Н6 [СвН5СНзЫ(СНз)з1- ОС4Н9-Н [С6Н5СН2Н(СНз)з]ОН [СвНвСН2Ь1(СН3)з]ОН; КОН [С6Н5СН2М(СН3)з]ОН; кон [С6Н5СН2М(СНз)з]ОН; кон Н3С нзс\Х/ нооссн2сн2/|^ (а-изомер 33, | С6НвСОС(А)з (57—64 СвНвСОСН(А)2 (30} (небольшой) С6Н5СОС(Л)3 (65) С.НВСОС(А)3 (64) С6Н6СОС(А)з (57J п-С1С6Н4СОС(А)з п-ВгС6Н4СОС(А)з п-СН3С6Н4СОС(А)3 СзН17 z Г С(СН3)2 ^о^ 1-изомер 46) ) и С.Н5СОС(Л)3 574 296, 298, 788 803 794 794 794 788 788 788
Продолжение табл. X
Реагирующие вещества
В. Кетоны
4-Метоксиацетофенон
Пропноферон ,
Фенилацетон
Изобутирофенон
Бензоилацетон
2, 4, 6-Трнметилацетофенои
Изопропилбензилкетон
Метил- Р-нафтилкетон
а-я-Бутилпропиофеиои
а-я-Пропилбутирофенои
Дезоксибензоин
Антрон
Катализатор
Продукт реакции (выход, %)
Литера-
тура
4-Фенилацетофенон
Дибензилкетон
а-я-Октилпропиофенон
Метил-а-фенилноиилкетон
2-Ацетилфуран. ''
[C6HsCH2N(CH3)3]OH; КОН
[C6H5CH2N(CH3)3]OH; КОН
[С6Н5СН2М(СНз)з]ОН; кон
Na-Енолят
КОН, СНзОН
[С6Н5СН2М(СНз)з]ОН или
[CeHsCH2N (СН3)3]ОС4Нв-я
[C6H5CH2N(CH3)3]OH; КОН
КОН, СНзОН
[C6HsCH2N(CH3)3]OH
КОН, СНзОН
кон; СНзОН
[C6HSCH2N(CH3)3]OH; КОН
[С6Н5СН2Н(СНз).з]рН
rper-CflsOK :
А=—CH2CH2CN
я-СН3ОС6Н4СОС(А)3
СбН8СОС(А)2СНз (количественный)
С6Н6С(А)2СОСН3 (86)
С6Н6СН(А)СОСНз (80)
С6Н5СОС(А) (СН3)2
С6Н5СОС(Л)2СОСНз
2,4,6- (СНз) зСвН2СОС (А ) з (30)
С6Н5СН2СОС (А| (СНз) 2
Р-СюНтСОС (А) з
С6Н5СОС(А) (СН3)С4Н9-я
С6Н5СОС(А)(С2Н8)СзН7-я Ь
С6Н5С(А)2СОС6Н5 (80)'
9,9-Ди- (Р-цианэтил) -10-аитрон (89)
О
788
788
788
119
295
296
Г»
788
295
788
295
295
788
307
{C6H5CH2N(CH3)3]OH; КОН
[СбН5СН2Н(СН3)3]ОН; КОН
, КОН, СНзОН
КОН, СНзОН
[СбН5СН2М(СНз)'з]ОН или
[CeHsCH2N (СНз) з]ОС4На-я.
(90-95)"
н/\н2сн2соон
4-СбН5С6Н4СОС(А)з
С6НБС (А) 2СОСН (А) С6НБ
СвНзСОС(А) (СНз)СвН17-я, '
СНзСОС(А) (я-С8Н17)С6Н5
\Лсо<М4к
804
788
788
295
295
296, 298
2-Ацетил-5-метилфуран i [С6Н5СН2М(СН3)з]ОН
2-Пропионилфуран (C6H5CH2N(CH8)3]OH
З-Ацетил-2,5-диметилфураи [C6H5CH2N(CH3)3]OH
2-Пропионил-5-метнлфураи [C6HsCH2N(CH3)3]OH
2-я-Бутирилфураи [C6HsCH2N(CH3)3]OH
2, 5-Диметил-З-пропионнлфу- *ран [C6H5CH2N(CH3)3]OH
2-я-Бутирил-5-метилфуран [C6HsCH2N(CH3)3]OH
З-я-Бутнрил-2, 5-диметилфу- ран [C6H6CH2N(CH3)3]OH
11 k HsC/Vx^COC (A)3 (71) 805
. Ji II 298
\оАсос(А)2сНз (колич™иый)
/СОС (А)з II г (16) 805
НзС/^о/^СНз || |р 805
НзС^ко/Хсос (А)2СНз (62)
. || || (70) 298
\о/\сос (А)2 сн2сн3
/COCH (А) СНз А А • (27) 805
НзС/Хх^СНз /СОС (А)2 СНз А 1 (45);
H3CZ \о/хСН3 . . II II 805
НзС/^о/^СОСН (А) С2Н5 (23)
11 А НзС/\о/ХСОС (А)2 С2Н5 (47)
/СОС (А)2 С2Н5 II II (54) 805
Н3С/\о/ХСН3 -
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (-выход, X) Литература
В. Кетоны А=—CH2CH2CN
2-Ацетилтиофеи [CeHsCHjN (СНз) з]ОН или II II 296, 298
[CeH5CH2N(CH3) 3]ОС<Н,-я \s/\coc(A)3 (й/-ЬУ)
2-Ацетил-5-метилтиофен (C6H5CH2N(CH3)s]OH н,с/ ^\s/^COC (А)3 <80) 805
2-Пропионил тиофен [CeH5CH2N(CH3)3]OH s/\coc (Л)2 сн3 (98) 298
5-Метил-2-пропиоиилтиофеи (С6Н5СНгН(СНз)з]ОН 11 11 H3c/\s/\coc (Л)2 сн3 ( °' 805
2-н-Бутирилтиофен [C8HsCH2N (СНз) з]ОН 1 в COCH (А) С2НБ (36) СОС(А)5С3Н5 (48) 805
2-Анетоксианетилтиофен [C6HsCH2N(CH3)3]OH ^s/AcoC (А), ОСОСНз (4o) 296
5-Метил-2-я-бутирилтиофен [C6HsCH2N(CH3)3]OH НзС^б/Асоси (Л) CjiHs (43) A A (27) H3C/ Xs/ XCOC (A)2 C2H5 ' ’ о \ А /А zOXcH’ (90) CH3 O 805
1,2,5-Триметилпиперидои-4 КОН 796
2,5-Диметил-1-этилпиперид- он-4 кон Д/л дДсНз (90) НзС/4*/ с2н5 о 796
1,2,3,6-Тетраметилпиперид- он-4 кон Нзс/ 11 Л /\/ I | Хсн3 (70) ху/\сн3 СНз 1 о II 796
1,2-Диметилоктагидрохинол- ои-4 (1Н) кон Д (91) ху/\сн3 сн3 796
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, X) Литература
А=—CH2CH2GN
В. Кетоны
к>
2, 2-Диметилпнранон-4
Койеная кислота
З-Кето-2,2,5, 5-тетраметил-
тетрагидрофуран
З-Этил-1 -.метилркррндрд,
Г. Сложные эфиры и амиды
Малоновый эфир
КОН
[QH5CH2N(CH3)3]OH
[CeH6CH2N(CH3)3]OH;
[CjH6CH2N(CH3)3]OH
C2H5ONa; Na
[С6Н5СН2М(СН3)з]ОН
[C6HsN(CH3)3]OC2Hs
КОН
(25)
ОН
СНзЧ
СН3/Чо/ -А
О
НОН2С/ХО /XcHjCHjCOOH
О:
СНз.
•л
СН3
(63)
'з
хс2н5
!=о
(71)
(50)
(47)9
СНз
ЛСН(СООС2Н5)2 (57—63);
(Л)2С(СООС2Н5)2 (12)
(Л)2С(СООС2Н5)2 (82)
ЛСН(СООС2Н5)2 (27); (Л)2С(СООС2Н5)
(10)»
796
186
788
806
807, 808
307, 809
307
794
2
Амид малоновой кислоты [C6H5CH2N(CH,)3]OH (A)2C(CONH2)2 (14) 301
Метилмалоновый эфир [С6Н5СН2№(СНз)з]ОН АС(СНз)(СООС2Н5)2 (93) 810
КОН, СНзОН а-Метилглутаровая кислота 9 811
я-Пропилмалоновый эфир КОН, СНзОН а-Пропилглутаровая кислота 9 811
я-Бутилмалоновый эфир КОН, СНзОН а-я-Бутилглутаровая кислота 9 811
Na; CH3ONa; C2H5ONa; я-С4Н9С(А)(СООС2Н6)2 (87—94) 301, 808,
[С6Н6СН2Н(СНз)з]ОН 812
н-Гексилмалоновый эфир CHsONa; C2H5ONa «-С6Н13С(Л)(СООС2Н5)2 (82) 812
я-Октилмалоновый эфир CH3ONa; C2H5ONa я-С8НпС(А) (СООС2Н5)2 (90) 812
я-Децилмалоновый эфир CHsONa; C2H5ONa я-СюН21С (А) (СООС2Н5) г (89) 812
я-Додецнлмалоновый эфир CH3ONa; C2HsONa я-С12Н25С(А) (СООС2Н6)2 (92) 812
я-Тетрадецилмалоновый эфир CHsONa; C2H5ONa я-СиН29С(А)(СООС2Н5)2 (86) 812
Цетилмалоновый эфир CH3ONa; C2HsONa я-С16Нзз(А)(СООС2НБ)2 (89) 812
Тетраэтиловый эфир этаи- [CeH5CH2N (CH3) 3]OH (C2HSOOC)2C(A)CH(COOCSHS)2 (77) 389
1, 1,2,2-тетракарбоновой
кислоты
Феннлмалоновый эфир KOH, СНзОН а-Фенилглутаровая кислота 9 811
C2H5ONa С6Н5С(А)(СООС2Н5)2 (72) 813
Бензнлмалоновый эфир KOH, СНзОН а-Бензилглутаровая кислота 9 811
[СвН5СН2Н(СНз)з]ОЦ С6Н5СН2С(А)(СООС2Н6)2 (81) 302
Феннлэтилмалоновын эфир KOH, СНзОН а-Фенилэтилглутаровая кислота 9 811
1-Нафтнлмалоновый эфир КОН, СНзОН а- (1 -Нафтил) глутаровая кислота 9 811
2-Нафтнлмалоновый эфир КОН, СНзОН а-(2-Нафтил) глутаровая кислота 9 811
(1 -Нафтилметил) малоновый КОН, СНзОН а- (1 -Нафтилметил) глутаровая кислота 9 811
эфир (2-Нафтнлметнл) малоновый. КОН, СНзОН а-(2-Нафтнлметнл)глутаровая кислота 9 811
эфир (Р-1 -Нафтилэтил) малоновый КОН, СНзОН а-(₽-1-Нафтнлэтил)глутароваи кислота9 811
эфир
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Г. Сложные эфиры и амиды (р-2-Нафтилэтил) малоновый ’ эфир Амид винилуксусной кислоты (или амид кротоновой кис- лоты) КОН, СНзОН [C6H5CH2N(CH3)3]OH Л=—CH2CH2CN a- (р-2-Нафтилэтил) глутаровая кислота 9 CH2=CHC(A)2CONH2 (18) CH2CH2CHCOOH 811 302
Этиловый эфир Р-(4-метокси- 1 -нафтил) этн лма лоновой кислоты КОН, СНзОН, (СНз)зСОН сн2сн2соон 1 JI 1 (40)9 814
осн3 сн2сн2снсоон
Этиловый эфир р~ (5-метоксн- 1 -нафтил) этилмалоновой кислоты КОН, СНзОН, (СНз)зСОН сн2сн2соон (32)9 814
осн3 сн2сн,снсоон
Этиловый эфир Р-(6-метоксн- 1 -нафтил) этилмалоновой кислоты КОН, СНзОН, (СНз)зСОН 1 1 YY' CH2CH2COOH (61) 9 СН3с/^/\^ СН2СН2СНСООН 9 814
Этиловый эфир Р-(7-метокси- 1 -нафтил) этнлма лоновой кислоты КОН, СНзОН, (СН3)3СОН СНз°\^\/^ СН2СН2СООН 814
Этиловый эфир формамидо- малоновон кислоты Этиловый эфир ацетамидома- лоновой кислоты Этиловый эфир циануксусной кислоты Циаиацетамид Этиловый эфир а-изопропил- циануксусной кислоты Этиловый эфир а-метил- а'-циаиянтарной кислоты Этиловый эфир а, Р-дициан- Р-метилмасляной кислоты Этиловый эфир а-циаи-Р, Р-ди- метилглутаровой кислоты Диэтиловый эфир 3,4-дициан- З-метилбутан-1,4-дикарбо- новой кислоты Этиловый эфир фенилцианук- сусной кислоты Диэтиловый эфир 1, 2-дицнан- 2-метилпентан-1, 5-дикарбо- новой кислоты Метиловый эфир этилфеннл- уксусной кислоты Метиловый эфир н-пропнлфе- нплуксусной кислоты C2H3ONa C2H5ONa Водн. NaOH [C6H5CH2N(CH3)3]OH NaCN [C6H5CH2N(CH3)3]OH KOH, СНзОН CHsONa [C6H6CH2N(CH3)3]OH He указан [C6H5CH2N(CH3)3]OH KOH, СНзОН [C6H5CH2N(CH3)3]OH CH3ONa CH3ONa Глутаминовая кислота 9 (55). CH3CONHC (Л) (СООС2Н5) 2 (95) НССН(Л)СООС2Н5, NCC(A)2COOC2Hs NCC(A)2COOC2H5 (количественный) ИССН(Л)СООС2Н5 и немного NCC(4)2COOC2H5 NCC(4)2CONH2 (56) a-Изопропилглутаровая кислота 9 С2Н5ООССН (CH3)C(CN) (Л)СООС2Н5 (94) (CH3)4C(CN)C(A)(CN)COOC2H6 (89) С2Н5ООССН2С (СНз) 2с (Л) (CN)COOC2Hs (72) ЛС (CN)(COOC2Hs)C (CN) (СН3)- СН2СН2СООС2Н5 (83) C6H5C(A)(CN)(COOC2H5) (69—83)' C2H5OOC(CH2)3C(CN) (СН3)С(Л) (CNJ- СООС2Н5 (99) (C6H5)(C2HS) С (Л )СООСН3 (С6Н6)(н-СзН7) С (Л) СООСНз . 481 480 492 389, 301 492 301 811 815 816, 817 818 819 820 821 822 822
Продолжение табл.. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
7~ Сложные эфиры и амиды Метиловый эфир я-бутнлфе- CH3ONa А CH2CH2CN (C6HS) (я-С4Н9)С(А)СООСНз 822
иилуксусной кислоты
Метиловый эфир изобутилфе- CHaONa СеНз (ЫЗО-С4Н9) С (А) СООСНз 822
иилуксусной кислоты
Метиловый эфир дифенилук- CHaONa (С6Н5)2С (А) СООСНз 822
сусной кислоты
Метиловый эфир флуорен- кон 9-Карбометокси-9-(Р-цианэтил) флуорен 823
9-карбоновой кислоты Этиловый эфир 1-метилфлуо- NaOH, пиридин (94) 9-Карбэтокси-9- (р-цианэтил) -1 -метилфлу- 505
рен-9-карбоновой кислоты Этиловый эфир 2,7-дибром- [C6H5CH2N(CH3)3]OH орен (78) 9-Карбэтокси-9- (Р-цнанэтил) -2, 7-дибром- 824
флуорен-9-карбоновой кис- флуорен (93)
ЛОТЫ
Метиловый эфир 4-циклопен- [C6H5CH2N(CH3)3]OH СН2СН2СООН н //XZXZ (90) 825
та[с(е/]фенантрен-4-карбо- \/\^
НОВОЙ кислоты
Этиловый эфир а-фурилуксус- ной кислоты [СвН6СН2Н(СНз)з]ОН или [CeH6CH2N (СНз) з]ОС*Нв-я хо/\с (Л)2 СООС2Н5 (25) 296
Этиловый эфир а-тиеннлук- сусной кислоты [CeH5CH2N(CH3)3]OH или [CeHsCH2N (СНз) з]ОС4Н9-я ^Sz\c (Л)2 СООС2Н5 (32) 296
Этиловый эфир 2-пирндилук- Na
(72)
826
27 Зак. 794.
сусной кислоты
Д. Кетоэфиры и амиды Метиловый эфир ацетоуксус- [СбН6СН2Н(СНз)з]ОН
ной кислоты
Ацетоуксусный эфир [СвН6СН2Н(СН3)з]ОН или [C6H6CH2N (СНз) з]ОС4Н9-я
[CeH6CH2N (СН3) з]ОС2Н5 C2H5ONa
Метилацетоуксусный эфир КОН, СНзОН, (СНз)зСОН
C2H5ONa
—
Этил ацето уксусный эфир КОН, СНзОН, (СНз)зСОН
я-Пропилацетоуксусный эфир КОН, СНзОН, (СНз)зСОН
Изопропилаиетоуксусный эфир КОН, СНзОН, (СНз)зСОН
Аллилацетоуксусный эфир КОН, СНзОН, (СНз)зСОН
н-Бутилацетоуксусный эфир КОН, СНвОН, (СНз)зСОН
СНзСОС (А )2СООСНз (49).
СНзСОС (А )2СООС2Н5 (79—80) или
СНзСОСН (4) СООС2Н5 (79—80)
СНзСОС (Л )2СООС2Н5 (83)
СНзСОСН (А )СООС2Н5 (40)
СНзСОС (СНз) (А )СООС2Н5 (58. 57)
а-Метилглутаровая кислота9 (51)
СНзСОС (СНз) (Л )СООС2Н5 (61)
СН3СОСН(Л)СНз9 (34)
СНзСОС (С2Н5) (Л) СООС2Н5 (62)
а-Этнлглутаровая кислота 9 (62)
СН3СОСН(Л)СН2СНз9 (43)
СНзСОС (н-СзН7) (Л) СООС2Н5 (88)
а-н-Пропилглутаровая кислота 9 (88)
СНзСОСН (Л) СН2СН2СНз 9 (36)
СНзСОС(ызо-СзН?) (Л)СООС2Н5 (37, 43)
а-Изопропилглутаровая кислота 9 (43)
СНзСОС (С3Н5) (Л )СООС2Н5 (76)
а-Аллилглутаровая кислота9 (76)
СНзСОС (Н-С4Н9) (Л)СООС2Н5 (74—75)
а-я-Бутилглутаровая кислота 9 (75),
СНзСОСН (Л) СН2СН2СН2СН3 9 (35)
787, 788
296, 787,
788, 794
794
827
793, 828
828
810
829
828
828
829
828
828
829
615, 828
828
828
828
131, 828
828
829
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Д Кетоэфиры и амиды А=— CH2CH2CN
«-Амилацетоуксусный эфир КОН, СНзОН, (СНз)зСОН; СНзСОС(н-С5Н11)(А)СООС2Н5 (71) 808, 828
Na а-н-Амилглутаровая кислота 9 (71) 828
— СН3СОСН(Л) (СН2)4СН3 9 (32) 829
Изоамилацетоуксусный эфир КОН, СНзОН, (СНз)зСОН СНзСОС(ызо-СЕНц) (А)СООС2Н5 (72) 828
н-Гексилацетоуксусный эфир а-Изоамилглутаровая кислота 9 (72) 828
КОН, СНзОН, (СНз)зСОН СНзСОС (w-C6Hi3) (А) СООС2Н5 (84) 828
а-н-Гексилглутаровая кислота9 (84)) 828
Фенилацетоуксусный эфир C2H5ONa; КОН, СН3ОН, СНзСОС(С6Н5) (А)СООС2Н5 (27) 830
(СНз)зСОН
Бензнлацетоуксусный эфир C2H5ONa СНзСОС (СН2С6Н5) (А )СООС2Н5 (85) 605
КОН, СНзОН, (СНз)зСОН СНзСОС (СН2С6Н5) (А )СООС2Н6 (66) 828
а-Бензнлглутаровая кислота9 (66) 828
— СН3СОСН(А)СН2С6Н59 (31) 829
Этиловый эфир н-бутирил- [CeHsCHjN (СНз)з]ОН нли н-С3Н7СОС(А)2СООС2Н5 (34—36, 74) 234, 131
уксусной кислоты [C6H5CH2N (СНз) з]ОС4Н9-н
Этиловый эфир изобутнрил- C2H5ONa н-СзН,СОСН(Д)СООС2Н6 (52) 827
[C6H5CH2N(CH3)3]OH нлн (СНз)2СНСОС(А)2СООС2Н5 (65—68) 296
уксусной кислоты Этиловый эфир изовалерил- [C6H5CH2N (СНз) 3]OCtH9-H C2H5ONa (СНз) зСНСОСН (А) СООС2Н5 (53) 827
CgHsONa zz3o-C4H9COCH(A)COOC2Hs (46) 827
уксусной кислоты Этиловый эфир гекса ноилук- CsHsONa н-С5Н1,СОСН(А)СООС2Н5 (38, 67) 827, 831
сусной кислоты Этиловый эфир гептаноилук- CjHsONa н-С6НisCOCH (А) СООС2Н5 (35) 827
сусной кислоты
Этиловый эфир бензоилуксус- ной кислоты Этиловый эфир 2-фуроилук- сусной кислоты [C6H5CH2N(CH3)3]OH или [CeH6CH2N (СНз) 3]OC4He-w C2H5ONa C2H6ONa С6Н5СОС(А)2СООС2Н5 (53) С6Н5СОСН(А)СООС2Н5 (86, 43) Чо/х (37) ^СИХсосН (А) СООС2Н5 296 605, 827 827
Этиловый эфир 2-тенонлук- сусиой кислоты C2H5ONa II il ,64х XS/\COCH (А) СООС;Н8 k ’ О JxzCOOCjHg IJ\A 827
2-Карбэтоксицнклогексанон КОН, С2Н5ОН; C2H5ONa; NaNH2; [С6Н5СН2М(СНз)зЮН 131, 133, 718
Метиловый эфир камфор- 3-карбоновой кислоты 2-Ка рбометокситетра лои-1 кон, С2Н5ОН [С6Н5СН2М(СНз)з]ОН З-Карбометокси-З- (Р-цнанэтил) камфора (78) О //\/\/СООСНз (92) 1 II 1\а \/\/ 131 832
Ацетоацетанилид [С6Н;,СН2К(СНз)з]ОН СНзСОС (А) 2CONHC6H6 787
Ацетоацет-2-хлоранилид [С6НзСН2Н(СНз)з]ОН СНзСОС (А) 2CONHC6H4C1-o 787
Ацетоацет-2, 5-дихлоранилид [СбН6СН2К(СНз)з]ОН СНзСОС (A )2CONHCbH3C12-2, 5 787
Ацетобутнролактон C2H5ONa 2-Ацето-2- (Р-цианэтил) бутиролактон (86—92) 605
Е. Нитрилы
Цианистый аллил (или нитрил кротоновой кислоты) [CeH6CH2N(CH3)3]OH CH3CH=C(A)CN (9) CH2=CHC(A)2CN (23) 302
Цианистый нзопропенил (нли Р, Р-диметилакрилонитрил) [C6H5CH2N(CH3)3]OH (CH3)2C=C(A)CN (5) CH2=C(CH3)C(A)2CN (11) 302
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Е. Нитрилы л=—ch2ch2cn
Цианистый бензил Водн. NaCN [C6H5CH2N(CH3)3]OH C2H5ONa КОН, СНзОН, (СНз)зСОН [СвН5Н(СН3)з]ОС2Н5 C6H5CH(4)CN (80) CeH5Cp4)2CN (94) CeH5C64)2CN (46) C6H6C(4)2CN (70) C6H5CG4)2CN (90) 492 301 833 794 794
Цианистый л-нитробензнл [C6H6CH2N (СНз) з]ОН n-O2NC6H4C(4)2CN (90) 301
Цианистый о-хлорбензнл КОН, СНзОН, (СНз)зСОН o-C1C6H4C0)2CN (47) 835
Цианистый льхлорбензил КОН, СНзОН, (СНз)зСОН Л1-С1С6Н4С(Л)2СН (64) 835
Цианистый п-хлорбензил КОН n-ClC6H4C0)2CN (80) 836
Цианистый ти-бромбснзнл КОН, СНзОН, (СНз)зСОН льВгС6Н4С(Л)2СН (89) 835
Цианистый п-бромбензпл КОН, СНзОН, (СНз)зСОН n-BrC6H4C(4)2CN (84) 835
Цианистый л1-метилбензил КОН, СНзОН, (СНз)зСОН л!-СНзС6Н4С(Л)2СН (88) 835
Цианистый и-метилбензнл КОН, СНзОН, (СНз)зСОН и-СНзС6Н4С(Л)2СН (95) 835
Нитрил а-феннлпропионовой кислоты КОН, СНзОН, (СНз)зСОН (C6HS)(CH3)C(71)CN (55; 785
Цианистый п-нзопропилбензил кон n- (СНз) 2CHC6H4C (Л) 2CN 836
Нитрил циклогексенилуксус- ной кислоты [C6H5CH2N(CH3)3]OH С (Л)2 CN (37) 302
Цианистый а-(2-тненнл) бен- зил [С6Н5СН2М(СНз)з|ОН 11 k XS/\C (Л) (C6H6) CN 837
Нитрил а-нафтнлуксусной кислоты [СвН5СН2М(СНз)з]ОН a-Ci0H7C(4)2CN (55) 836
Цианистый a- (1 -цнклогексе- ннл)бензил 1-Цнан-2-бензоил-1, 2-дигидро- изохинолин [C6H5CH2N(CH3)3]OH Li-Соль (Л) (С6н6) CN 837 834
\conh2
Ж. Нитросоединения
Нитрометан CH3ONa; водн. К2СО3 (4)2CHNO2 (низкий); (/1)3CNO2 (52) 129, 300
[С6Н5СН2Н(СНз)з]ОН (4)3CNO2 (45) 301
Нитроэтан (C2Hs)2NH; CH3ONa СНзСН(Л)ИО2 (30) 129. 299
Водн. К2СО3 СН3С(Л)2ИО2 (67) 300
2-Нитропропан Водн. КОН (CH3)2C(4)NO2 (78) 129
ft Нитропнклогексан Водн. КОН 1 -Нитро-1 - (Р-цнанэтил) циклогексан (40) 129
O2NCH=NO2K Водный раствор G4)2C(NO2)2 (34); G4)3CNO2 (12) 838
СН3ООССН2СН2С (NO2) = Водный раствор 4C(NO2)2CH2CH2COOCH3 839
=NO2Na
n-Бромфеннлннтрометан [С6Н5СН2Н(СНз)з1ОН n-BrC6H4CH)2NO2 (15) 129
Метил-2-нитро-1 -фенилпро- Водн. NaOH Нитрил 3-нитро-3-метил-4-метоксн-4-фе- 129
лиловый эфир нилвалериановой кислоты (30)
я-Бутил-З-нитро-н-бутилсуль- [CHsN (С2Нв)з]ОН Нитрил З-нитро-З-метил-5- (бутнлсульфо- 129
фон нил)-1 -пентанкарбоновой кислоты
Нитроуксусный эфир КОН, С2Н5ОН Этиловый эфир а-нитро-у-цианмасляной 840
кислоты (19)
[CeHsCH2N(CH3)3]OH O2NCH (Л)СООС2Н5 (52) 841
O2NC(4)2COOC2H5 (80) 841
Продолжение табл. X
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Ж. Нитросоединения Нитроуксусный эфир Метиловый эфир 7,7-динитро- масляной кислоты (C2H5)2NH 1 Na-Производиое в воде А = — CH2CH2CN O2NCH(A)COOC2I [5 (соль диэтиламина) (81) Метиловый эфир 6-циан-4,4-динитрока- проновой кислоты (51) 646 839
Эндо- (нитроэтилен)антрацен CH3ONa >А 842
3. Сульфоны Фенилбензилсульфон Аллил-и-толилсульфон n-CH3C6H4SO2CH2COOC2H5 Фенил-л-хлорбензилсульфон 12 И. Фосфонацетаты Триэтиловый эфир фосфон- уксусной кислоты [CeH5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH КОН, СН3ОН [C6H5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH C2HsONa (48) C6H5SO2C(A)2C6Hs (60) n-CH3CeH4SO2CH (А)СН=СН2 и n-CH3CcH4SO2C (А) 2СН=СН2 n-CH3CeH4SO2C (А) 2СООС2Н5 n-ClC6H4C(A)2SO2C6H5 (60) (С2Н5О)2Р(О)С(А)2СООС2Н5 (87) (С2Н3О)2Р(О)СН(А)СООС2Н5 (28) 298, 843 843 843 844 845
Na (С2Н5О)2Р(О)С(А)2СООС2Н5 (27) (С2Н5О)2Р(О)СН(А)СООС2Н5 (40) (С2Н5О)2Р(О)С(Л)2СООС2Н5 (19) 136 846
К (С2Н5О)2Р(О)С(А)2СООС2Н5 (68) 846
Этиловый эфир цианметан- [C6H5CH2N(CH3)3]OH (C2H5O)2P(O)C(CN)(A2) (90) 845
фосфоновой кислоты к (C2H5O)2P(O)C(CN)(A)2 (80) 846
Триэтиловый эфир а-фосфон- C2HcONa (С2Н5О) 2Р (О) С (СН3) (А) СООС2Н5 (58), 136
пропионовой кислоты Триэтиловый эфир а-фосфон- C2H5ONa (С2Н5О) 2Р (О) С (н-С4Н9) (А) СООС2Н5 (71) 136
капроновой кислоты К (C2HsO)2P(O)C(h-C4H9) (А)СООС2Н5 (73) 846
со 1 2 * 4 * 6 7 8 * 10 11 12 Сравни с обзором, составленным Брусоном [293] *.
2 В этом опыте использовался большой избыток кетона.
s В опытах, описанных в работе [294], акрилонитрил получен in situ из Р-хлорпропионитрила.
4 Акрилонитрил получен in situ из иодометилата цианистого 2-диэтиламиноэтила.
Б В более жестких условиях этот продукт гидролизуется до 7-циан-5-метил-4-кетоэн антовой кислоты [74].
6 В более жестких условиях часть продукта гидролизуется до 5-(Р-цианэтил)-7-циан-2,2-диметил-4-кетоэнантовой кислоты.
7 Регенерировано 34% дикетона. Прн использовании вместо акрилонитрила p-хлорпропионитрила выход составил 21%, при этом было
регенерировано 52% дикетона.
8 Такое строение доказано [305] озонированием до 3,3-диметил-5-кетокапроновой кислоты. В работе [304[ формула изомера CHS
I
сн=\| I
CHZ
А
была неправильно приписана монозаме ще иному продукту реакции.
8 Этот продукт реакции выделен после омыления аддукта.
10 Акрилонитрил получен in situ из p-хлорпропионитрила.
11 Вместо акрилонитрила использовался р-этоксипропионитрил.
12 Орто- и л<£етш-изомеры вступают в аналогичные реакции. Из о- и лс-метилбеизилфеиилсгльфонов образовались только маслянистые ве-
щества, строение которых не было определено; лярп-изомер в реакцию ие вступил.
* См. также обзор по реакциям цианэтилирования А. П. Терентьева и ’А. Н. Коста в сборнике «Реакции и методы исследования органи-
ческих соединений», кн. 2, ГНТИ, М.-Л., 1952. — Прим. ред.
Таблица XI
' РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С НИТРИЛАМИ НЕПРЕДЕЛЬНЫХ СОЕДИНЕНИИ
(кроме акрилонитрила)
Реагирующие вещества Катализатор Продукт реакции (выход, Литера- тура
Нитрил кротоновой кислоты (или цианистый аллил) и Циануксусный эфир Этиловый эфир а-цианпропионовой кислоты Цианистый бензил 1-Нитропропан 2-Нитропропан C2H5ONa C2H5ONa C2H5ONa; CH3ONa Водн. NaOH [CH3N(C2H5)3]OH 4 = CH3CHCH2CN 1 /4CHi(CN)COOC2H5 (90) CH3C(4)(CN)COOC2H5 C6H5CH0)CN (76) C2H5CHG4)NO2 (80) (СН3)2С(Л)КО2 (80) Н\/Л 84 84 34 129 129
Флуорен [CeH5CH2N (CH3) 3]OH ПГП <51> X/ \Y Л\/СООСН3 301
Метиловый эфир флуорен-9-карбо- иовой кислоты KOH YX/X/X (73) 1 II II 1 X/ \Y Д\/СООС?Н6 310
Этиловый эфир флуорен-9-карбоно- вой кислоты Нитрил метакриловой кислоты и кон 310
1,2,3. 4-Тетрагидрофлуорантен [C6H5CH2N(CH3)3]OH 1-(Р-Цианпропил)-1, 2,3,4-тетрагидро- флуорантен 781, 782
Нитрил у-метоксикротоновой кис-
лоты и
Малоновый эфир
Этилмалоновый эфир
Этиловый эфир Р-метоксиэтилмало-
новой кислоты
Этиловый эфир Р-этоксиэтилмалоно-
вой кислоты
З-Циан-1,2,5,6-тетрагид ропиридин и
Малоновый эфир
4=CH3OCH2CHCH2CN
C2H5ONa
C2H5ONa
C2H5ONa
C2H5ONa
C2H5ONa
4*
to
СЛ
Циклопентилиденацетонитрил и
Циаиацетамид C2H5ONa
1-Циан-2-метилциклогексен-1 и
Малоновый эфир
Циклогексилиденацетонитрил и
Цианацетамид
C2H5ONa
C2H5ONa
ЛСН(СООС2Н5)2 (74)
^C(C2H5)(COOC2H5)2 (36)
ЛС(СН2СН2ОСН3)(СООС2Н5)2 (40—50)
ЛС(СН2СН2ОС2Н5) (СООС2Н5)2 (42)
СН2СООН
I
соон
н
(цинхолойпоноваи кислота, два изомера)
СН
Диэтиловый эфир (2-циан-1-метилцикло-
гексил)малоновой кислоты (низкий)
/—\ /~vNH
/ NH (63)
847, ср. 848
849
849
849
94
850
851
850
Продолжение табл. ХГ
Реагирующие вещества Катализатор / Продукт реакции (выход, %) Литера- тура
( 3-Метилциклогексилиден) ацетони- трил и Цианацетамид C2H5ONa z-\ Z-^NH < >< NH \_Z \_ZO (25) 425
(4-Метилциклогексилиден Ацетони- трил и Цианацетамид СгНбОМа । । CH3 CN \ /—^NH H3C—< >< NH \_Z \Zo (25) 425
Нитрил коричной кислоты и Малоновый эфир C2H5ONa CN a=c6h5chch2cn 1 ACH(COOC2H5)2 (83) 309
Фенилуксусный эфир C2H5ONa; CH3ONa CcH5CH(A)COOC2H5 (50) 34
Цианистый бензил C2H5ONa; CH3ONa C6HSCH(A)CN (80—87) 34, 833
Цианистый п-метоксибензил C2H5ONa, CH3ONa n-CH3OC6H4CH(A)CN (23) 34
Цианистый .м-аминобензил C2H5ONa; CH3ONa ти-Н2НСбН4СН (A)CN (два изомера: 17,30) 34
Флуорен [C6H5CH2N(CH3)3]OH Н А Z\X/\ (-50) 1 II II 1 308
Нитрил п-метоксикоричной кислоты и Цианистый бензил C2H5ONa; CH3ONa \Z С6Н6СН (CN) СН (C6H4OCH3-n) CH2CN (72) 34
2-Гидринданилиденацетонитрил 'и Цианацетамид C2H5ONa £O и
Нитрил а-фенилкоричной кислоты и Нитрометан (C2H5)2NH CN х^^/СНгСИ J\ch (CN)CONH2 A = СбНзСНСН (СбН5) CN ACH2NO2 (11) 129
Нитроэтан (C2H5)2NH CH3CH(A)NO2 (57) 129
Нитрил а-(п-бромфенил)коричной кислоты и 129
Нитроэтан Пиперидин C6H5CH[CH (CH3) NO2]CH (CN) C6H4Br-n
1-Цианбутадиен-1,3 и Малоновый эфир [C6H5CH2N(CH3)3]OH A=— CH2CH=CHCH2CN (A)2C(COOC2Hs)2 (13) 98
Ацетоуксусный эфир [C6H5CH2N(CH3)3]OH СНзСОС (A)2COOC2H5 (28) 98
Циануксусный эфир [C6H5CH2N(CH3)3]OH (A)2C(CN)COOC2H5 98
Ацетилацетон [C6H5CH2N(CH3)3]OH (A)2C(COOCH3)2 (22) 98
Нитрометан [C6H5CH2N(CH3)3]OH (A)3CNO2 312
Нитроэтан [C6H5CH2N(CH3)3]OH CH3CH(A)NO2 и CH3C(A)2NO2 312
1-Нитропропаи [C6H5CH2N(CH3)3]OH (общий 65) C2H5CH(A)NO2 312
2-Нитропропан [C6H5CH2N(CH3)3]OH (CH3)2C(A)NO2 (77) 312
Нитроциклогексан [C6H5CH2N(CH3)3]OH /\/NO2 312
_ _ 1
1 Этот продукт реакции получен после гидролиза и частичного декарбоксилирования.
Таблица ХП
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С АКРИЛАМИДОМ [315) И МЕТАКРИЛАМИДОМ [852|
Реагирующие вещества Катализатор Продукт реакции (выход, %)
Акриламид и
Циклогексанон NaH 2-Кето-1. 2, 3. 4.5.6. 7. 8-октагидрохинолин (10)
Ацетофенон трет-С4Н9ОК у-Бензоилмасляная кислота 1 2 (20)
Дибензилкетои трет-СДЬОК [С6Н5СН (CH2CH2CONH2) ]2СО (48)
2-Фенилциклогексанои трет-С4Н9ОК с н (39) | | V\ Н\/ II о
NaNHs Qzc6h5 <29> Н\/ II о
2-Фенилциклогептаион трет-С4Н9ОК Лактам ₽-(2-кето-1-феиилциклогептил) пропионовой кислоты (31)'
NaNHs Лактам ₽- (2-кето-1 -фенилциклогептил) пропионовой кислоты (22)
4-Кето-1, 2, 3, 4, 9, 10, 11, 12-окта-
гидрофенантрен
4,9-Дикето-1, 2,3, 4,9, 10, И, 12-окта-
гидрофенантрен
трет-СзНдОК
трет-С4Н9ОК
4^ ГО О NaH
Метакриламид и Д иф енил ацетонитр ил C2H5ONa
(50) 3
(23)
(41) 3
(35)
1 Этот продукт реакции получен после гидролиза.
2 Выход лактама 23%; выход соответствующей кислоты после гидролиза оставшейся реакционной смеси 27%.
8 Выход лактама 57%; в результате дальнейшей обработки маточного раствора дополнительно получено 16% лактама.
Таблица ХПГ
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ ПРОИЗВОДНЫХ АЛИФАТИЧЕСКИХ
о, ₽-НЕНАСЫЩЕННЫХ КАРБОНОВЫХ КИСЛОТ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир акриловой кис- A = —СН2СН2СООСН3
лоты и
Малоновый эфир Na ACH(COOC2H-5)2 (76) 548
Этиловый эфир ацетамндомалоно- C2H5ONa Глутаминовая кислота 1 (64) 485
ВОЙ кислоты
Ацетоуксусный эфир C2H5ONa; Na СН3СОСН(А)СООС2Н5 (73, 38) 853, 548
Этиловый эфир 5-этокси-З-кетовале- Na Метиловый эфир 5-кетогептен-6-овой кис- 561
риановой кислоты лоты2 (19)
Этиловый эфир бензоилуксусной [C6H5CH2N(CH3)3]OH С6Н5СОСН (А) СООС2Н5 (52) 559
КИСЛОТЫ
Этиловый эфир циануксусной кис- C2HsONa NCCH(A)COOC2H5 (73) 854
ЛОТЫ
Нитрил малоновой кислоты [C6H5CH2N(CH3)3]OH (A)2C(CN)2 R55
Диэтиловый эфир 1,2-дициан-2-ме- c2h5ok (А) С(CN) (СООС2Н5)С(CN) (СН3) СН2- 891
тилпентан-1,5-дикарбоновой кис- СН2СН2СООС2Н5 (65)
ЛОТЫ
Цианистый бензил CH3ONa; NaNH2 C6H5CH(A)CN (20—24) 34
Нитрил а-фенилпропионовой кис- CH3ONa C6H5C(A)(CH3)CN (43) 785
ЛОТЫ
Нитрил а-фенилмасляной кислоты [C6H5CH2N(CH3)3]OH C6H5C(A)(C2H5)CN 837
Цианистый а-изопропилбензил [C6HsCH2N(CH3)3]OH С6Н5С(А) (U3o-C3H7)CN 837
Цианистый а-изобутилбензил [C6H5CH2N(CH3)3]OH С6Н5С(А) (U3o-C4H9)CN 837
Цианистый а- (2-тиенил) бензил [C6HsCH2N(CH3)3]OH C6H5C(A)(C4H3S)CN 837
Цианистый а-н-амилбензил [C6HsCH2N(CH3)3]OH C6HsC(A) (h-CsHh)CN 837
Цианистый а- (3-метилбутил) бензил [C6HsCH2N(CH3)3]OH С6Н3С(А) (CN)CH2CH2CH(CH3)2 837 Цианистый а-(2-пиридил)бензил [СбНзСН2Н(СН3)з]ОН СбН3С(А) (C3H4N)CN 837 Цианистый а-(2-пиридил)-n-хлор- [CeHsCHaN(СН3)3]ОН и-С1СеН4С (A) (C3H4N)CN 837 бензил Цианистый а-(циклогексен-1-ил) бен- [СеНзСНгЩСНзЩОН СеН5С(А) (C6H9)CN 837 зил Цианистый а-циклогексилбензил [C6H5CH2N(CH3)3]OH CeHgC(A) (C6Hn)CN 837 Дифенилацетонитрил CH3ONa (СбН3)2С(А)СН 852 Цианистый а-(п-хлорфенил) бензил [CcH5CH2N(CH3)3]OH CeHsC(A) (CeH4Cl-n)CN 837 С (A) (CN) СООС2Н5 (57) Этиловый эфир (а-тетралилиден) - C2H3ONa 856 циануксусной кислоты 3 \/\/ О . (40) - II А £ 2-(Циклогексен-1'-ил) циклогексанон [C5H5CH2N(CH3)3]OCH3 \> 857 Оксиндол C2H5ONa /СН2СН2СООН4 858
| || |\сн2сн2соон ^/\N/4O н 1-Метилоксиндол C2H3ONa /СН2СН2СООН (93)4 394 | |\сн2сн2соон X/xn/^o СН3 1
П родолжение табл. XIII
'28 Зак. 794.
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир акриловой кисло- ты и 1-Этилоксиндол C2H5ONa А =—СН2СН2СООСН3 /СН2СН2СООН 1 II f\CH2CH2COOH 'WXN/4O 1 (71) 4 858
Метиловый эфир оксиндол-3-про- C2H5ONa С2н6 ZCH2CH2COOH (66) 4 858
пионовой кислоты I II |\сн2сн2соон н
Этиловый эфир оксиндол-3-пропио- новой кислоты C2H5ONa /СН2СН2СООН 1 || |\сн2сн2соон н (17) 4 394
Нитрометан Нитроэтан 1-Нитропропан 2-Нитропропан 1-Нитробутан 2-Метил-1 -нитропропан [C6H5CH2N(CH3)3]OH [C6H5CH2N (СН3)з]ОН; (C2H5)3N (C2H5)3N (C2H5)3N [C6H5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH 0)CH2NO2 (35) (A)2CHNO2 CH3CH(X)NO2 (66) C2H5CH(Z)NO2 (80) (CH3)2C(A)NO2 (81) (CH3)2C(4)NO2 (80—86) h-C3H7CH0)NO2 (51) h-C3H7C(4)2NO2 (36)' (CH3)2CHCH(A)NO2 (59) (CH3)2CHC(4)2NO2 (9) 479, 859 860 861,859,862 861 861 859,863,804 475 475
Динитрометан ₽, Р-Динитроэтанол 5 5 (A)2C(NO2)2 (60) G4)C(NO2)2CH2OH (20) 838 838,839,865 866
Метиловый эфир у, у-динитромасля- ной кислоты Метиловый эфир у-изопропил-у-ни- тромасляной кислоты 6 (C2H5)2NH [C6H5CH2N(CH3)3]OH 4C(NO2)2CH2CH2CO0CH3 (45 (CH3)2CHC0)2NO2 (41) (CH3)2CHC(A)2NO2 (20) :н2 839 475
Эндо, (нитроэтилен) антрацен CH3ONa (51) хА '4NOJ 842
Триэтиловый эфир фосфонуксусной кислоты Триэтиловый эфир а-фосфонкапро- новой кислоты Малоновый эфир Метилмалоновый эфир Этилмалоновый эфир 7 C2H5ONa Na (небольшое коли- чество) К (молярное количе- ство) C2H5ONa К (молярное количе- ство) C2H5ONa Анионообмеиная смо- ла C2H5ONa C2H5ONa (C2H5O)2P(О)CH (Л)COOC2HS (40)1 (C2H5O)2P(O)CH(A)COOC2H5 (53) (С2Н5О)2Р(О)С(Л)2СООС2Н5 (67) (C2HSO)2P(O)C(A) (h-C4H9)COOC2H5 (64) (C2H6O)2P(O)C(A) (m-C4H9)COOC2H5 (73) ЛСН(СООС2Н3)2 ЛСН(СООС2Н5)2; (Л)2С(СООС2Н5)2 ЛС(СН3)(СООС2Н3)2 (74) ЛС(С2Н5)(СООС2Н5)2 (79) 136 846 846 136 846 73 503 73 867
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир акриловой кисло- A=—CH2CH2COOCH3 —
ты и
н-Бутилмалоновый эфир 8 C2H5ON а AC(h-C4H9)(COOC2H5)2 (88), 867
н-Гексилмалоиовый эфир 7 C2H5ON а AC(h-C6HI3)(COOC2H5)2 (83) 867
н-Октилмалоновый эфир 7 C2H3ONa AC(h-C8H17)(COOC2H5)2 (81) 867
н-Децилмалоновый эфир 7 C2H6ONa AC(h-Ci0H2i) (COOC2H5)2 (79) 867
Этиловый эфир акриловой кис- A =—CH2CH2COOC2H5
лоты и
н-Додецилмалоновый эфир 7 C2H5ONa АС(н-С]2Н25) (COOC2H5)2 (80) 867
н-Тетрадецилмалоновый эфир 7 C2H5ONa АС(н-С|4Н29) (COOC2H5)2 (80) 867
н-Гексадецилмалоновый эфир7 C2H6ONa АС(н-С)бНзз) (COOC2H5)2 (83) 867
CH (A) COOC2H5 (69)
Этиловый эфир 1-метил-1, 2,5, 6-те- NaH 490
тр аги дропир и д ин -4-у ксусно й кислоты \n/
1 CH3
Ацетоуксусный эфир C2H6ONa; NaOH CH3COCH(A)COOC2HS (80, 67) 868, 131, 37
О
:2-Ка рбэтокси-3,3-диметилциклогек- C2H5ONa /\ /A (49) 869
санон \looc2h5
/СН3
'ч/\сн3
Циануксусный эфир CsHeONa ACH(CN)COOC2H5 870, 871s
Цианацетамид Na-Производное З-Циан-2,6-дикетопипериднн 872
8
Циклогександион-1, 3 2-Этилциклогександион-1, 3 2-Аллилциклогександион-1, 3 2-Бензилциклогександион-1, 3 Окси идол C2H5ONa C2H5ONa C2H5ONa QHsONa C2H5ONa Диэтиловый эфир З-(Р-карбэтоксиэтил)- 4-кетогептан-1,7-дикарбоновой кисло- ты 10 (64) Диэтиловый эфир З-этил-4-кетогептан- 1,7-дикарбоновой кислоты 10 (61) Диэтиловый эфир З-аллил-4-кетогептаи- 1,7-дикарбоновой кислоты 10 (66) Диэтиловый эфир З-бензил-4-кетогептан- 1,7-дикарбоновой кислоты 10 (61) /А 873 873 798 873 874
\ |ГТм н
1-Метилоксиидол C2H5ONa । 875
1,3-Диметилоксиндол C2H5ONa -СН8 ~ /А (73) \ II |\сн3 1 875
Нитрометан Нитроэтаи 1-Нитропропан 2-Нитропропан t Р, р-Динитроэтанол [C6H5CH2N(CH3)3]OH [СбНБСН2К(СН3)3]ОН [C6H5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH 5 сн3 (A)2CHNO2 ACH(CH3)NO2 (60) или (A)2C(CH3)NO2 C2H5CH(A)NO2 C2H5C(A)2NO2 (CH3)2C(A)NO2 (NO2)2C(A)CH2OH (35) 474 859, 474 859 859 859 866
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир акриловой кисло- ты и Нитроуксусный эфир Этиловый эфир р-метил-у-нитро- масляной кислоты Этиловый эфир у-нитро-Р-н-пропил- масляной кислоты Этиловый эфир у-ацетокси-Р-нитро- метилмасляной кислоты Этиловый эфир Р-нитроизопропил- малоновой кислоты 2-Бензоил-1 -циан-1, 2-дигидроизохи- нолин [C6H5CH2N(CH3)3]OH [С6Н5М(СНз)з]ОН [C6H5CH2N(CH3)3]OH (w30-C3H7)2NH [С6Н5СН2М(СНз)3]ОН [С6Н5СН2М(СНз)з]ОН [С6Н5СН2Н(СНз)з]ОН Li-Соль Д=—СН2СН2СООСНз ЛСН(НО2)СООС2Н5 (55) Л2С(ИО2)СООС2Н5 (22) ЛСН (NO2)COOC2H5 (11) ЛСН(НО2)СООС2Н5 ЛСН(НО2)СН(СН3)СН2СООС2Н5 (63) ЛСН(НО2)СН(СН3)СН2СООС2Н5 (46) ЛСН (NO2) СН (н-С3Н7) СН2СООС2Н5 (53) ЛСН (NO2)CH (СН2ОСОСНз) СН2СООС2Н5 (67) лен (N О2) СН (СНз) СН (СООС2Н5) 2 (65) (58) со 477 477 840 876 478 478 128 479 479 834
н-Бутиловый эфир акриловой кисло- ты и Метил- Р-’циа нэтилкетон Р, Р-Динитроэтанол Лактон у-оксикротоновой кислоты и Водн. KCN 5 СН2СН (СОС6Н6) СООС2Н5 л = —СН2СН2СООС4Н9-н СНзСОСН(Д)СН2СН иСН3СОС(Л)2СН2СН ЛС(ИО2)2СН2ОН (23) /СН (СООС2Н6) СОСН2ОС2Н5 135 866
у-Этоксиапетоуксусный эфир Na 1 1 877
Этиловый эфир р-оксиакриловой кислоты и Нитрометан Нитроэтан 1-Нитропропан Этиловый эфир fi-этоксиакриловой кислоты и Малоновый эфир Енолят » C2H5ONa Этиловый эфир р-окси-у-нитромасляиой кислоты (количественный) Этиловый эфир р-окси-у-нитровалериа- новой кислоты (66) Этиловый эфир р-окси-у-нитрокапроно- вой кислоты (54) ОН c2h5oocxJx/cooc2h5 (И) V 569 569 569 327
[CeH5CH2N (СН3)з]ОС2Н5 СООС2Н5 С2Н5ООСх/х/СООС2Н5 (25) ¥ 327
Метилмалоновый эфир [C6H5CH2N (СНз) з]ОС2Н6 C2H5ONa СООС2Н6 Диэтиловый эфир З-этоксибутан-2,4-ди- карбоновой кислоты (19) и этиловый эфир угольной кислоты; диэтиловый эфнр бутен-1-дикарбоновой-1.3 кислоты (18); Н3СХ ХХ/СООС2Н5 (47) 1 II Но/^|/ 327 327
СООС2Н5 С2Н5ООСХ/Х/СООС2Н6
1 (небольшой)
j СООС2Н5
Продолжение табл. ХПГ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Кротоновая кислота и Койевая кислота N аНСОз о /ОН (63) 878
Этиловый эфир кротоновой кислоты и Малоновый эфир CsHsONa 1 II НОН2СГ °/ХчСН (СН3) СН2СООН А = —СН(СН3)СН2СООС2Н5 ЛСН(СООС2Н5)г (38, 53, 95, 98) 5, 880, 57,
Со со Метилмалоновый эфир C2H6ONa (*/6 моля) 2-Метилбутан-1,3, 3-трнкарбоновая кис- 879, 7, 8 57, ср. 631
Этиловый эфир фенилуксусной кис- C2H5ONa (1 моль) К лота 4 и 2-метилбутан-1, 1,3-трикарбоно- вая кислота 4 (9:1, 90) 2-Метилбутан-1, 1,3-трикарбоновая кис- лота 4 (60) С6Н5СН(Д)СООС2Н5 (22) 57, ср. 631 881
ЛОТЫ Этиловый эфир 3, 4-диметоксифенил- C2H5ONa 3,4-(СН3О)2С6Н3СН(Л)СООС2НВ (76) 882
уксусной кислоты Ацетоуксусный эфир CsHsONa СНзСОСН (А )СООС2Н5 (60) 810
2-Карбэтоксициклопентанон с2н5ок °YY° ^/NlOOQHs <80’ 65> СН, U (55) 1 сн3 О /\хл 196, 883 884 '885—887
2-Карбэтокси-5-метилциклопентанон С2НЕОК |\соос2н6 и триэтиловый эфир 2-метилгексан- 1,3,6-трикарбоновой кислоты 11 О НгС\А/Л (66) 324, 325
& -С0 Этиловый эфир а-циануксусной кис- C2H5ONa | |\соос2н6 ZCH(CN)COOC2Hs12 888, 889
лоты Этиловый эфир а-цианпропионовой C2H5ONa СН3С(Д)(СМ)СООС2Н5 (50) 84, 87
кислоты Этиловый эфир а-цианмасляной кис- C2H5ONa С2Н5С(Л)(СМ)СООС2Н5 (33) 84
лоты Этиловый эфир а-циангидрокорич- C2H5ONa С6Н5СН2С(Л) (CN)COOC2H5 87
ной кислоты Цианацетамид Na-Енолят З-Циан-2, 6-дикето-4-метилпиперидин 372
Цианистый бензил C2H5ONa CeHsCH(A)CN (63—68) 34
Продолжение табл. ХП1
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир кротоновой кисло- ты и А =—СН (СН3) СН2СООС2Н5
A CH2CHi2N.(iC2H3>2
1 - (р-Д иметиламииоэтил)тетралон-2 C2H6ONa (23) 890
Нитрометан Триэтиловый эфир фосфонуксусной кислоты Этиловый эфир а-хлоркротоновой [С^СНгЩСНзЬЮСЛр (CsHshNH («3O-C3Ht)2NH К \=/ 1 CH2CH2N(C2H,&)2 ACH2NO2 (55) ACH2NO2 (15) ACH2NO2 (25) (C2H5O)2P(O)CH(A)COOC2H5 (66) H3CX ^COOCjHg 478 478 478 846
кислоты и Ацетоуксусный эфир Этиловый эфир Р-оксикротоновой кислоты и Цианацетамид Na-Енолят Пиперидин с2н5оос/^ о/\сн3 3-Циан-6-окси-4-метилпиридон-2 891 400
Этиловый эфир Р-аминокротоновой кислоты и Амид малоновой кислоты » 1 Амид 6-окси-4-метилпиридон-2-карбоно- 400
вой-3 кислоты 413
Цианацетамид Этиловый эфир р-этоксикротоновой » 3-Циан-6-окси-4-метилпиридон-2
кислоты и 3-Циан-6-окси-4-метилпиридон-2 400
Цианацетамид Этиловый эфир у ацетоксикротоно- »
вой кислоты и 479
Нитрометан Этиловый эфир у, у, у-трифторкрото- [C6H5CH2N(CH3)3]OC4H9 СН3СООСН2СН (CH2NO2) СН2СООС2Н5 (65)
новой кислоты и 892
Нитрометан (C2Hs)3N CF3CH(CH2NO2)CH2COOC2H5 (68))
Метиловый эфир метакриловой кис- А = —СН2СН(СН3)СООСНз
лоты и 893
Метилмалоновый эфир C2H5ONa Триэтиловый эфир пентан-2,2,4-трикар-
боновой кислоты (66) 810
Ацетоуксусный эфир C2H5ONa СН3СОСН(СООС2Н5)СН2СН(СН3)СООСН3
О
2-Карбэтоксициклопентанон CH3ONa /Д\/СН2СН (СН3) СООС2Н5 (70) I |\соос2н5 894
Дифенилацетонитрил C2H5ONa (C6H5)2C(A)CN (80) 852
А
2- (Циклогексен- Г-ил) циклогексанон [C6HSCH2N(CH3)3]OCH3 ГЬО <з1> 857
2-Ннтропропан (C2Hs)2NH (CH3)2C(A)NO2 (35) 861
Продолжение табл. ХПГ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир метакриловой кис- А =—СН2СН (СНз) СООСНз
лоты и
Триэтиловый эфир фосфонуксусной кислоты C2HEONa (С2Н5О)2 Р (О) СН(СООС2НЕ)СН2СН(СНз)СООСНз (42) 136
Триэтиловый эфир а-фосфонкапро- новой кислоты Этиловый эфир метакриловой кис- C2HEONa (С2Н5О)2Р (О)С(С4Н9) (СООС2НЕ) СН2СН- (СНз) СООСНз (75) А = —СН2СН(СНз)СООС2Н5 136
лоты и
Метилмалоновый эфир C2HEONa АС(СН3) (СООС2Н5)2 895
Ацетоуксусный эфир C2HEONa СН3СОСН(А)СООС2НЕ (24) 896
Этиловый эфир изобутирилуксусной C2HEONa СНзСН (СООС2НЕ) СН2СН (СООС2НЕ) СН (СН3)2 340
кислоты
О
2-Карбэтоксициклопентанон 13 К 11 А /\/ (17) | I^COOQH.; 894
Циануксусный эфир Na; C2HEONa ACH(CN)COOC2H5 85, ср. 889
Этиловый эфир fi-оксиметакриловой кислоты и
Малоновая кислота Пиридин, пиперидин транс-а-Метилглутаконовая кислота 1 (47) 388, 897
Цнануксусная кислота Пиридин, пиперидин Этиловый эфир 4-циан-2-метилбуТен-2-овой кислоты 388
Нитрометан Диметиловый эфир метиленмалоно- Енолят эфира Этиловый эфир а-метил-(3-окси-у-нитромасляиой кислоты 569
вой кислоты и 898
о-Нитрофенилуксусная кислота Na 3, 3-Дикарбометокси-1-(о-нитрофенил) масляная кислота (58)
Метиленмалоновый эфир >* и 899
Малоновый эфир кон, С2НЕОН (С2Н5ООС) 2СНСНгСН (СООС2Н5) 2 (количествен- ный)
Тетраэтиловый эфир пропан- кон, С2Н5ОН Гексаэтиловый эфир пентан-1,1,3,3, 5, 5- 899
1, 1,3, 3-тетракарбоновой кислоты гексакарбоновой кислоты 90°, 8'8, 901
Этиловый эфир о-нитрофенилуксус- ной кислоты C2H5ONa 0-O2NC6H4 (СООС2Не) СН2СН (СООС2Н5) 2 (60)
Ацетоуксусный эфир C2HEONa Триэтиловый эфир 2-кетопентан-3,5, 5-три- карбоновой кислоты (38) 896
Диметиловый эфир малеиновой кис- лоты и
н-Бутилмалоновый эфир Не указан н-С4Н9СН(СООН)СН(СООН)СН2СООН 1 902
Изоамилмалоновый эфир » » изо-СЕНцСН (СООН) СН (СООН) СН2 СООН 1 н-С6Н13СН(СООН)СН(СООН)СН2СООН 1 902
н-Гексилмалоновый эфир » » 902
Циклогексилмалоновый эфир » » С6НпСН(СООН)СН(СООН)СН2СООН 1 902
Изооктилмалоновый эфир » » шо-С8Н17СН (СООН) СН (СООН) СН2СООН • 902
Цианистый бензил CH3ONa СсНЕСН (CN) СН (СООСНз) СН2СООСН3 (50) 34
Диметиловый эфир малеино- вой кислоты и 861
2-Нитропропан 16 (C2HE)2NH • СНзСООН (СНз) 2С (NO2) СН (СООСНз) СНзСООСНз (69)
C2H5NH2 (СНз)2С(NO2)СН(СООСНз)СН2СООСНз (80); (СНз)2С=С (СООСНз) СН2СООСНз (16) 861
(C2H5)2NH (СНз) 2С (NO2) СН (СООСНз) СН2СООСНз (85) 861
Триэтиловый эфир фосфонук- сусной кислоты C2H5ONa (С2Н5О)2 Р (О) СН (СООС2Н5) СН(СООСН3)- СН2СООСНз (13) 136
Продолжение табл. ХШ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир малеиновой А = —CH(COOC2HE)CH2COOC2HS
кислоты и Малоновый эфир Этиловый эфир фенилуксус- ной кислоты Ацетоуксусный эфир Na; КОН, ацеталь CsHsONa КОН, ацеталь АСН(СООС2НЕ)2 (72) С6НЕСН(А)СООС2НЕ СН3СОСН(А)СООС2Не (72) 505, 6, 540, 541 903 55
Na; C2H6ONa °yy° 336, 904
\|/ХчСООС2Н5
2-Карбэтоксициклопентанон Пиперидин СООС2Н6 О II А /\У (60) 1 |\зоос2н5 905
Цианистый бензил 2-Метилциклогександион-1, 3 Диметиловый эфир фумаро- вой кислоты и С2НЕОК CHsONa; C2HEONa КОН, ацеталь C2H5ONa Тетраэтиловый эфир гексан-1, 2,3,4-тетракарбо- новой кислоты 11 (96) C6HECH(A)CN (52—58) C6H6CH(A)CN (74) Триэтиловый эфир 3-метил-4-кетогептан-1.2,7- трикарбоновой кислоты 11 (62) А СН (СООСНз) СН2СООСН3 . АСНЮООСзНе) £5) л 905 34 505,540,541 873 18
445
Циануксусный эфир 2-Нитропропан (C2H5)2NH (C2H6)2NH; (C2He)3N ACH(CN)COOC2H5 (10) (CH3)2C(A)NO2 (80—85) 18 861
Этиловый эфир фумаровой кислоты и A = —CH(COOC2HE)CH2COOC2HE
Малоновый эфир Na; C2HEONa ACH(COOC2He)2 (90, 55) 84,5, 7, 8, 6, 906, 907
Метилмалоновый эфир C2H5ONa AC (СНз) (COOC2HE)2 84,907,7, 8
Этилмалоновый эфир C2H5ONa AC(C2He)(COOC2He)2 (61, 80) 5, 908, 7, 8, 84, 907
Изопропилмалоновый эфир C2HEONa АС(Цзо-СзНт) (COOC2HE)2 7, 907
Бензилмалоновый эфир C2HEONa AC(CH2C6He)(COOC2H5)2 (23—31) I6 63, 909
Ацетоуксусный эфир Na; C2H5ONa СНзСОСН(А)СООС2Н5 и °\/\^° \|/ХчСООС2Н0 COOC2H5 • 904
Метилацетоуксусный эфир C2HEONa СНзСОС (СНз) (A) COOC2HE и °yv° 1 |/снз 'у'^СООСгНв COOC2H5 336, 907
Этилацетоуксусный эфир C2HEONa СНзСОС (C2HE) (А)СООС2Не 904
Этиловый эфир пропионил- уксусной кислоты C2HEONa С2НЕСОСН (А) СООС2Н5 908
Бензилацетоуксусный эфир C2HEONa СНзСОС(СН2С6НЕ) (А)СООС2Н5 904
Циануксусный эфир Na NCCH(A)COOH; NCCH(A)COOC2H6 336
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый 'эфир фумаровой кислоты и Цианистый бензил C2HsONa А =—СН (СООС2Н5) СН2СООС2Н5 ,CN С6Н5СН (CN) С—, .< II 1 о сснЕ 0 \/ II о 910
2-Нитропропан (С2Н5) 2NH (0,2 моля) (CH3)2C(A)NO2 (90) 861
Этиловый эфир хлорфумаро- вой кислоты и (C2HE)2NH (1,25 моля) (CH3)2C=C(COOC2Hs)CH2COOC2Hs (83) 861
Ацетоуксусный эфир C2H5ONa СНзСОС (СООС2Н5) =С (СООС2Н5) CH2COOC2HS о 911—914
Метилацетоуксусиый эфир C2H5ON а 1 /Сн3 | |\соос2нЕ (21) О^\^\СООС2Н5 О 18 Н/СН2С6Н6 911, 912, 914, 881
Бензилацетоуксусный эфир Этиловый эфир р, fi-диметил- акриловой кислоты и СгНзОЫа 1 |\соос2н5 O^\^\cOOC2Hs А = (СНз)2ССН2СООС2Н5 881
Малоновый эфир С2НБОК; C2H5ONa АСН(СООС2Н5)2 (35) 915, 11, 31
Ацетоуксусный эфир Na О II CH3\fXi СНз/^/^0 COOC2HS 437
Этиловый эфир а-циаипропио- новой кислоты Na СНзС(A) (CN)COOC2Hs 19 30
Цианистый бензил Этиловый эфир тиглиновой кислоты и CsHfiONa C6HsCH(A)CN (43)' A = —CH(CH3)CH(CH3)COOC2H3 34
Малоновый эфир C2HEONa ACH(COOC2Hb)2 (15, 63) 57, 66, ср. 916
Этилмалоновый эфир C2H5ONa AC(C2H6)(COOC2Hs)2 (14) 66
Этиловый эфир фенилуксус- ной кислоты К СбН5СН(Л)СООС2Н5 881
Этиловый эфир циануксусной кислоты Этиловый эфир а-этилакрило- вой кислоты и Na-Енолят ACH(CN)COOC2Hs (42, 65) 57, 916, 917
Ацетоуксусный эфир Диметиловый эфир глутаконо- вой кислоты и C2HeON a СНзСОСН (COOC2HS) CH2CH (C2H5) COOC2HS (20), этиловый эфир а-этилглутаровой кислоты А = —СН(СН2СООСН3)2 918
Метиловый эфир циануксус- ной кислоты CH3ONa ACH(CN)COOCH3 (46) 919
Этиловый эфир циануксусной кислоты Na; CH3ONa; C2HEONa ACH(CN)COOC2H5 (64) 919, 414
Нитрометан [C6HsCH2N(CH3)3]OH ACH2NO2 (51) 920
7родолжение табл. ХГТТ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Диметиловый эфир этилиден- малоновой кислоты и
Дезоксибензоин Этилиденмалоновый эфир и СН3О№ СеН6СОСН (С6н5) СН (СН3) СН2СООН (55) А = СН3СНСН(СООС2НЕ)г 178
Малоновый эфир 20 Без катализатора; Na АСН(СООС2Не)2 (95) О 921, 922
Ацетоуксусный эфир C2H5ONa ♦ C2HSOOC\ I сн3/\/^о СООС2Н6 14
Нитрометан Этиловый эфир полуамида этилиденмалоновой кисло- ты21 и [C6HECH2N(CH3)3]OH ACH2NO2 (69) 479
Этиловый эфир полуамида малоновой кислоты Этилиденцианацетамид 21 и КОН; (C2Hs)2NH CH3CH[CH(COOC2H5)CONH2]2 (73) 924
Цианацетамид КОН CHSCH[CH (CONH2) CN]2, CH3 NC^/k^/CONHj, O^N/^nh H 925
29 Зак. 794,
Нитрил этилиденмалоновой кислоты21 и Нитрил малоновой кислоты Пиперидин CH3CH[CH(CN)2]2 926
Этиловый эфир а-этилкрото- A = CH3CHCH(C2H5)COOC2H5
новой кислоты и J
Малоновый эфир C2HEONa /ICH(COOC2HE)2 (48) 66
Этилмалоновый эфир C2H5ONa AC(C2H5)(COOC2HE)2 (39) 66
Циануксусный эфир C2HsONa ACH(CN)COOC2H5 (60) 84
Этиловый эфир р-н-пропил- о
акриловой кислоты и
Ацетоуксусный эфир C2HEONa н-С3Н7—lyl=O 927
COOC2H5
Нитрометан Этиловый эфир $-изопропил- [C6HECH2N(CH3)3]OC4H9 h-C3H7CH(CH2NO2)CH2COOC2He (71) 128
акриловой кислоты и Малоновый эфир Этиловый эфир а-н-бутил- C2HEONa K3o-C.3H7CH (CH2COOC2HS) CH (COOC2HE) 2 915
акриловой кислоты и Циануксусный эфир Метиловый эфир Р-н-амил- C2H5ONa CNCH (COOC2HE) CH2CH (H-C4H9) COOC2HE (54) 918
акриловой кислоты и О
Ацетоуксусный эфир C2HsONa II 196
(7i) н-С6Н1/Y^O
COOC2HS
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Диметиловый эфир 1,2-ди- гид ромуконовой кислоты и Этиловый эфир циануксусной C2H5ONa (Р-Карбоксиметил) адипиновая кислота1 (79)) 928
КИСЛОТЫ Этиловый эфир фенилэтил- C2HSOK СеН5СН2СН2 C(CN) (СООС2Н5) СН- 928
циануксусной кислоты Этиловый эфир 1,2-дигидро- муконовой кислоты и Малоновый эфир C2HEONa (СН2СООС2Н5) СН2СН2СООС2Н5 (46) С2Н5ООССН2СН2 СН (СН2СООС2Н5) сн- 929
Этиловый эфир 4,4,5,5,6,6,6- гептафторгексен-2-овой кис- лоты и Нитрометан (С2НЕ) 3N (СООС2НЕ)2 (50), О Л <25> С2Н5ООС—/ V-СООС2Н5 1 !—СН2СООС2Н5 Этиловый эфир 4,4, 5, 5,6, 6, 6-гептафтор-З-нит- 892
Пропилиденмалоновый эфир и Малоновый эфир Енолят рометилкапроновой кислоты (64) С2НЕСН[СН (СООС2Н6) 2]2 (количественный) 930
Пропилиденцианацетамид 21 и Цианацетамид КОН C2H5CH[CH(CONH2)CN]2 и С2Н5 925
Изопропилиденмалоновый эфир и Малоновый эфир C2HEONa; еиолят HzNOQ^/k^CN (CH3)2C[CH(COOC2HS)2]2 (95, 30, 8) 930—933
Ацетоуксусный эфир C2HEONa СН3СОСН (COOC2HS) С (CH3) 2СН (СООС2Н5)2, 934, 437
Цианацетон 22 C2HEONa 0^ ^COOCsHj / \/СНз \ /хсн3 О'? \соос2н5 о. хоос,н5 437
Ацетилацетон C2HsONa ю , Е • сч о хх 2 X 437
Этиловый эфир изопропил- иденциануксусной кислоты21 и Циануксусный эфир (G2HB)2NH чсн3 (СНз) 2С [CH (CN) СООС2НЕ]2 (10) 935
NH3 Р, Р-Диметилглутаримид (количественный) 850
Нитрометан CH3ONa Этиловый эфир а-циан-Р, р-диметил-у-нитромас- 936
Этиловый эфир 4-этоксиме- тилгексен-2-овой кислоты и Малоновый эфир Na ляной кислоты (74)) С2НЕСН (СН2ОС2НЕ) СН (СН2СООС2Н5) СН- 937
(С00С2НЕ)2 (79)
Продолжение табл. XIП
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир 4,4-диэтокси- метилгексен-2-овой кислоты и Малоновый эфир н-Бутилиденцианацетамид21 и Цианацетамид 4- СП ю Изобутилиденмалоновый эфир2! и Малоновый эфир Этиловый эфир изобутилиден- циануксусной кислоты и Ацетоуксусный эфир Изобутилиденцианацетамид2! и Цианацетамид Этиловый эфир итаконовой кислоты и Малоновый эфир Метилмалоновый эфир & Тетраэтиловый эфир бутан- 1,1, 2, 3-тетракарбоновой кислоты 23 Ацетоуксусный эфир 2-Карбэтоксициклопентанон Циануксусный эфир23 C2HsONa кон Пиперидин; (C2HS)2NH C2H5ONa (C2H5)2NH C2H5ONa C2H5ONa C2H5ONa C2H5ONa [C6H5CH2N(CH3)3]OH C2H5ONa C2H5CH [СН (ОС2Н5)2] СН (СН2СООС2Н6)- СН (СООС2Н6)2 (48) h-C3H7CH[CH(CN)CONH]2 и CN О \ // н-СзН,—NH / С conh2 о (СН3)2СНСН[СН(СООС2Н5)2]2 (41) СНдС2Н5 NC—СООС2Н5 (CH3)2CHCH[CH(CN)CONH2]2 (79) CN О \ 7/ «зо-С3Н7—A NH (небольшой) / С CONH2 NH А = —CH2CH(COOC2HS)CH2COOC2H5 ЛСН (СООС2Н5)2, триэтиловый эфир циклопен- танон-2, 3, 5-трикарбоновой кислоты, этиловый эфир циклопентанон-3-карбоновой кислоты, диэтиловый эфир циклопентанон-2,4- (или 2, 3-) дикарбоновой кислоты, СН (СООС2Н5)2 1/СООС2Н5 1 1—соос2н5, C2HSOOCCH2CH (СООС2Н5) СН2СН2СООС2Н6 о А /СНз С2Н5ООС—7 х С2Н5ООС—11 СООС2Н5 и АС (СН3) (СООС2Н5)2 (небольшой) о II А С2Н6ООС— С2Н5ООС—! 1хсоос2н6 CHsCOCH (А) СООС2Н5 о и А /\У (неочищенный 90) | |\зоос2н5 ACH(CN)COOC2H5 938 925 923 • 437 939 8, 337, 940, 941 337, 429 940 336 942 336
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир итаконовой кислоты и Нитрометан Нитроэтан Этиловый эфир мезаконовой кислоты и (C2HB)2NH; (U30-C3H7) 2nh (изо-СзН?)2МН А =—СН2СН (СООС2Н5) СН2СООС2Н5 ACH2NO2 (25) CH3CH(A)NO2 (40) 920 920
Малоновый эфир Этиловый эфир цитраконо- вой кислоты и C2HBONa C2HSOOCCH (СНз) СН (COOC2HS) СН (СООСгНз) г (60—75) 6, 337
Малоновый эфир Na-Енолят C2HBONa C2H5ONa C2HBONa С2Н5ООССН2С (СНз) (СООС2Н6) СН (СООСгНз) г (72) С2Н5ООССН2СН (СООС2НВ) СНгСН (СООСгНз) 2 (50) 24 2,3, 5-Трикарбэтоксициклопентанон Этиловый эфир итаконовой кислоты, этиловый эфир мезаконовой кислоты, 3-карбэтоксицик- лопентанон, 2,3-(или 3,4-)дикарбэтоксицикло- пентанон, 2,3,5-трикарбэтоксициклопентанон, СН (СООС2Н6)2 X—СООС2НВ 1 1—СООС2НВ /СООСгНз 336, 337 336 336 337,941, ср. 5, 6, 8, 940
Этилмалоновый эфир Na-Енолят °~ \сн3 /С2НВ С2НВООС— ( \соос2нв 5
Ацетоуксусный эфир Na; сухой C2H5ONa CH3COCH (COOC2H5) С (СНз) (СООС2Н5)- СН2СООС2Н5; °Ч/\Х 1 СООС2Н5 СНз СООС2Н5 336
Метилацетоуксусный эфир Na СНзСОС(СНз) (СООС2НВ) С (СНз) (СООС2НВ)- СН2СООС2Н5; %/\Х 1 1/СНз ^><^\соос2н5 СНз СООС2Н5 336
C2HBONa СНзСОС (СН,) (СООС2НВ) СН2СН (СООС2Н5)- СН2СООС2Н5 24, ПЛ 24 H3C.I I X J—СН2СООС2НВ С2НВООС/ 336
Циаиуксусный эфир Триметиловый эфир аконито- вой кислоты25 и Диметиловый эфир малоновой кислоты Малоновый эфир Na C2HsONa Na-Енолят Na-Енолят NCCH(COOC2Hs)C(CH3) (СООС2Нв) СНгСООСгНз NCCH2CH2CH (СООСгНз) СНгСООСгНз 24 А = СНзООССНгСН (СООСНз) СНСООСНз АСН (СООСНз) г АСН (СООСгНз) г 336 336 943 943
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Триметиловый эфир аконито- вой25 кислоты и Ацетоуксусный эфир Na-Енолят А =СН3ООССН2СН (СООСНз) СНСООСНз 1 А СНзСОСН (А) СООС2Н5 943
Триэтиловый эфир аконито- вой кислоты и Малоновый эфир Сухой CjHsONa Пентаэтиловый эфир бутан-1,1,2, 3,4-пентакар- 944, 907
Na боновой кислоты Тетраэтиловый эфир бутан-1,2,3,4-тетракарбо- 7, 9, 10
Ацетоуксусный эфир Na-Енолят .новой кислоты, 2,4-дикарбэтоксициклопента- нои Тетраэтиловый эфир 2-кетогексан-З, 4,5, 6-тетра- 904
Триэтиловый эфир изоакони- товой кислоты и Циануксусный эфир Na карбоновой кислоты Этиловый эфир а-цианглутаконовой кислоты и 945
.Этиловый эфир этилиденглут- аконовой кислоты и Этиловый эфир глутаконо- (C2H5)2NH малоновый эфир Тетраэтиловый эфир этилиден-бцс-глутаконо- 946
вой кислоты Изоамилиденмалоновый эфир21 и Малоновый эфир Na-Еиолят; пиперидин; вой кислоты «зо-С4Н9СН[СН(СООС2Н5)2]2 (63) 923, 907,
Изоамилиденциануксусная кислота 21 и Цнануксусная кислота (C2HS)2NH Пиперидин а, а'-Дициан-Р-изобутилглутаровая кислота 947, 948 947
Изоамилиденцианацетамид 2> и Циаиацетамид (C2H5)2NH СН2СН (СН3)2 1 H2NOC——CN (небольшой) hn^xn/%o н 939
Этиловый эфир (3-пентил- иден )циануксусной кисло- ты 21 и Циануксусный эфир NH3 Р, Р-Диэтилглутаримид (количественный) 850
Гептилиденмалоновый эфир21 и Малоновый эфир Пиперидин; (C2Hs)2NH H-CJTiaCH [ СН(СООСгНз) 2]2 923
Гептилиденциануксусная кис- лота11 и & Циануксусная кислота Пиперидин н-СеН13СН (CH(CN)COOHh 947
Гептилиденцианацетамид21 и Цианацетамид » h-C6H13CH[CH(CN)CONH2]2 (87). 939
Триэтиловый эфир этилентри- карбоновой кислоты и Малоновый эфир C2HsONa н-С6Н13 H2NOC——CN (небольшой) HN^N^O н (С2Н5ООС) гСНСН (COOC2HS) СН (СООС2Н5) 2 907, 949
Продолжение табл. XIII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Триэтиловый эфир пропен- 1-трикарбоновой-1,1,2 кис- лоты и
Малоновый эфир Триэтиловый эфир пропен- 1-трикарбоновой-2,3, 3 кис- лоты и Na-Енолят (С2Н5ООС) 2СНС (СНз) (СООС2Н5)СН (СООС2Н5)г (43—49) 950
Малоновый эфир & СО Тетраэтиловый эфир этилен- тетракарбоновой кислоты и Na-Енолят (С2Н5ООС) 2СНСН (СООС2Н5)СН2СН (СООС2НЕ)2 (61) 950
Малоновый эфир Тетраэтиловый эфир пропен- 1-тетракарбоновой-1,1,3,3 кислоты и Na Трикарбаллиловая кислота1 922, 907
Циануксусный эфир Пиперидин Этиловый эфир у-карбэтокси-а-цианглутаконо- вои кислоты и малоновый эфир 951
Триэтиловый эфир 3-цианпро- пен-1 -трикарбоновой-1,1,3 кислоты и C2HsONa Этиловый эфир у-карбэтокси-а-цианглутаконо- вой кислоты, малоновый эфир, этиловый эфир а, у-дицианглутаровой кислоты 945
Циануксусный эфир Тетраэтиловый эфир бутен- 1-тетракарбоновой-1,1,3,3 кислоты и C2H5ONa Этиловый эфир а, у-дицианглутакоиовой кис- лоты и малоновый эфир 945
Циануксусный эфир CsHsONa Этиловый эфир у-карбэтокси-а-цианглутаконо- вой кислоты и метилмалоновый эфир 945
1 Эта кислота выделена после гидролиза и частичного декарбоксилирования.
2 Это соединение выделено после частичного гидролиза и декарбоксилирования, которые сопровождались отщеплением одной молекулы
этилового спирта.
8 Это соединение вступает в реакцию в таутомерной ₽, у ненасыщенной форме.
* Это соединение выделено после омыления.
6 Динитросо единение использовалось в виде калиевой соли в водном растворе: другой катализатор не применяли.
6 Дииитросоедииение использовалось в виде «ци-натриевой соли в водном растворе.
1 В этом опыте в качестве исходного вещества использовался метиловый эфир акриловой кислоты; этот эфир был /прп«с-этерифицирован
в растворе катализатора. ос.
8 При использовании метилового эфира акриловой кислоты и этилата натрия получено соединение н-С4Н8С (а) (СООС2Нв)2 с выходом 85%.
9 В этом опыте продукт конденсации, ие выделяя из реакционной смеси, непосредственно обрабатывали этиловым эфиром а-бромизомас-
ляной кислоты.
ю Этот продукт реакции образуется в результате гидролитического раскрытия циклогексанового кольца.
11 Этот продукт реакции был получен гидролитическим раскрытием алициклического кольца.
12 Этот продукт реакции, ие выделяя из реакционной смеси, конденсировали с этиловым эфиром ₽-хлорпропионовой кислоты (888] и с эти-
ловым эфиром бромуксусиой кислоты [889].
18 Этиловый эфир метакриловой кислоты образовался in situ из этилового эфира а-бромизомасляной кислоты.
14 Вместо ненасыщенного эфира использовался диметиловый эфир метоксиметилмалоновой кислоты.
18 При этой реакции происходит предварительная изомеризация этилового эфира малеиновой кислоты в этиловый эфир фумаровой кислоты.
18 Гарднер и Райдои (65—68] приписывали этому продукту реакции изомерное строение СеНБСН2СН (СООС2НБ) СН(СООС2Н5) СН (СООС2Н5)2.
оос____________________________________________________________—______соос н
Доказано, что первоначально предложенная формула 26 II I 24 [911, 912], неправильна.
HjC^O-^COOCsHj
18 По аналогии со свойствами метилацетоуксусного эфира эта формула более вероятна, чем предложенная ранее формула
С2Н5ООС—[-----------------------------------------------------jj—СООС2Н8
CjHBoocZ4 о/Чусн2сен5
18 Продукт реакции, ие выделяя из реакционной смеси, подвергали непосредственно метилированию.
, 20 Та же реакция происходит, когда ацетальдегид и малоновый эфир вступают в реакцию в присутствии вторичных аминов; выход 11—55%
[916, 923].
21 Вещество получено in situ из альдегида или кетона и производного малоновой или циаиуксусной кислоты.
22 Вместо пиаиацетоиа использовался а-метилизоксазол.
28 Вместо этилового эфира итаконовой кислоты использовался этиловый эфир цитраконовой кислоты, который в условиях опыта изомери-
зуется.
24 Эфир цитраконовой кислоты изомеризуется в эфир итаконовой кислоты.
28 Вместо триметилового эфира аконитовой кислоты использовался триметиловый эфир хлортрикарбаллилсвой кислоты.
Таблица XIV
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С ЭТИЛОВЫМ ЭФИРОМ ЭТОКСИМЕТИЛЕНЦИАНУКСУСНОЙ КИСЛОТЫ,
ЭТИЛОВЫМ ЭФИРОМ ЭТОКСИМЕТИЛЕНМАЛОНОВОЙ КИСЛОТЫ И ЭТИЛОВЫМ ЭФИРОМ АМИНОМЕТИЛЕНМАЛОНОВОЙ КИСЛОТЫ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир этоксимети- ленциануксусной кислоты и Ацетоуксусный эфир C2H5ONa С2Н5ООС COOC2HS II 1 НзС^О^О 330
Этиловый эфир этоксимети- ленмалоновой кислоты и Малоновый эфир C2H5ONa (С2НЕООС)2С=СНСН (COOC2HS)2 952
Этиловый эфир фенилуксусной кислоты C2H5ONa Диэтиловый эфир 1-оксинафталин-2,4-дикарбо- новой кислоты 1 328
Этиловый эфир п-хлорфенил- уксусной кислоты C2HEONa Диэтиловый эфир 7-хлор-1-оксииафталин-2,4- дикарбоновой кислоты1 (7) и а-(п-хлорфе- нил)глутаконовая кислота 2 (И) 329
Этиловый эфир п-бромфенил- уксусной кислоты QHsONa Диэтиловый эфир 7-бром-1-оксинафталин-2, 4-ди- карбоновой кислоты1 (11) и 7-бром-1 -окси- нафталин-2, 4-дикарбоновая кислота2 (13) 329
Этиловый эфир а-нафтил- уксусной кислоты C2HEONa 1-Оксифенантрен-2,4-дикарбоновая кислота2 (5) и а-(1-нафтил)глутаконовая кислота2 329
СООСН3
Метиловый эфир 2-пиридил- Без катализатора
уксусной кислоты
—СООС2НЕ (26)
‘ЙЗ
Этиловый эфир 2-пиридил-
уксусной кислоты
СООС2НЕ
^НХ/-СООС2НЕ (52)
II
О
953
$
►-*
Этиловый эфир 6-метил-2-пи-
ридилуксусной кислоты
Ацетоуксусный эфир
C2HsONa
СООС2НЕ
L Nx/- COOC2HS (80)
1 II
СНз О
СООС2Н6
°^!-СООС2НЕ
I
СНз
954
330
Продолжение табл. XIV
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир этоксимети-
ленмалоновой кислоты и
Этиловый эфир Р-аминокрото- новой кислоты Без катализатора С2Н6ООС—[KS—СООС2Н6 H3C4NJ-OH 463
Диэтиловый эфир 2-аминоэти-
лен-Г, 1-дикарбоновой кис-
лоты и он
Ацетоуксусный эфир НС! СООС2Н5 463
\NJ- СНз
он
Na-Енолят С2Н6ООС—/Ц— соос2н5 463
Ц-СНз
этого продукта реакции установлено, что он состоит из этилового эфира ^ка^этоксн-^^и^^^юЖ^с^37®”1' ПрЯМОГО гиЧ>олиза
. _ С2Н5ООССН (СеН5) СН=С (СООС2Н5)2.
Эта кислота находилась в неочищенном продукте реакции в виде эфира, но она ие была выделена.
Таблица XV
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ СО СЛОЖНЫМИ ЭФИРАМИ ДИЕНОВЫХ И ТРИЕНОВЫХ КАРБОНОВЫХ КИСЛОТ
АЛИФАТИЧЕСКОГО РЯДА
Реагирующие вещества- Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир бута-
диен(1,3)-1-карбоновой кис- A=— CH2CH=CHCH2COOCH3 ЛСН (СООСНз) 2 (75)
лоты и Диметиловый эфир малоно- CHaONa; Na 419, 955, 956
вой кислоты
Этиловый эфир а-цианпро- CH3ONa (1/8 моля! СН3С(Л) (CN)COOC2H5 956
ПИОНОВОЙ кислоты
Метиловый эфир сорбиновой А=СН3СНСН=СНСН2СООСНз
кислоты и Диметиловый эфир малоновой CH3ONa ЛСН (СООСНз) 2 и СНзСН=СНСНСН2СООСНз 955—957, 189
кислоты СН (СООСНз) 2
(смесь 9:1; 60—70, 80) 956
Этиловый эфир а-цианпро- CH3ONa (1/8 моля! ЛС(СН3)(СЫ)СООС2Н5 (60—70)
пионовой кислоты Нитрометан (U3O-C3H7)2NH ACH2NO2 (21) 128
Метиловый эфир у-нитромас- (ЫЗО-С3Н7) sNH O2NCH(A)CH2CH2COOCH3 (32) 128
ЛЯНОЙ кислоты
Этиловый эфир сорбиновой
кислоты и НООССН2СН=СНСН(СН3)СООН 1 958 1
Малоновый эфир Na
Продолжение табл. XV
Реагирующие вещества Катализатор Продукт реакции (выход, % Литература
Этиловый эфир сорбиновой кислоты и Циануксусиый эфир C2H6ONa СН3СНСН=СНСН2СООС2Н5 1 419
Ацетоуксусный эфир rper-CiHgOK CH(CN)(COOC2H5) (77) и СНзСН=СНСНСН2СООС2Н6 CH(CN)COOC2H5 (9) СНзСНСН=СНСН2СООС2Н6 511
Этиловый эфир а-метилсор- биновой кислоты и Циаиуксусный эфир C2H6ONa СН (СОСНз) СООС2Н5 (75) СНзСНСН=СНСН (СНз) СООСгНб 419
Этиловый эфир fi-метилсорби- новой кислоты и Малоновый эфир СгН6ОНа CH(CN)COOC2H5 (67) СНзСНСН=С(СНз) CH2COOC2Hs 189
« СН(СООС2Н5)2 и СНзСН=СНС (СНз) СН2СООС2Н5 СН(СООС2Н5)2 (смесь 9:1; 39—42)
Этиловый эфир циануксусной
кислоты
Этиловый эфир •у-метилсорби-
новой кислоты и
Этиловый эфир циануксус-
ной кислоты
Метиловый эфир гексатриен-
1,3,5-карбоновой-1 кислоты
и
Диметиловый эфир малоно-
вой кислоты
Метиловый эфир гептатриен-
1,3,5-карбоновой-1 кис-
лоты и
Диметиловый эфир малоно-
вой кислоты
C2H5ONa
CsHsONa
C2H5ONa
СНзСЖа
СН3СНСН=С (СНз) СН2СООС2Н5
I
CH(CN)COOC2H5 и
СНзСН=СНС (СНз) СН2СООС2Н5
CH(CN)COOC2H6 (65)
СНзСНС(СНз) =СНСН2СООС2Н5
I
CH(CN)COOC2H5 и
СН3СН=С (СНз) СНСН2СООС2Н5
CH(CN)COOC2H6
(смесь 1: 3; 18—40)
Смесь изомеров CuHieOe (44)
СН3СНСН=СНСН=СНСН2СООСНз
I
СН(СООСНз)2 И
СНзСН=СНСН=СНСНСН2СООСНз
I
СН(СООСН3)2
(смесь 7:1; 74)
419
189
959
960
Продолжение табл. XV
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Диметиловый эфир пента- диен-1,3-дикарбоновой-1,1 кислоты и Метиловый эфир циануксус- CH3ONa СН3СНСН=СНСН (СООСНз) 2 401
ной кислоты Метиловый эфир а-карбомет- окси-б-метилсорбиновой ст. кислоты и Диметиловый эфир малоно- CH3ONa CH(CN) СООСНз и СН3СН=СНСНСН (СООСНз) 2 CH(CN) СООСНз (СНз) 2С=СНСН[СН (СООСНз) 2]2 (83) 403
вой кислоты Этиловый эфир муконовой кислоты и Малоновый эфир Na С2Н5ООССН2СН2С (=СНСООС2Н5) сн- 961, 346
CsHgONa (небольшое (СООС2Н5) г (32, 90) С2Н5ООССН2СН=ССН2СООС2Н5 (70) 962
Этиловый эфир циануксусной количество) CsHgONa 1 СН(СООС2Н5)2 СгНзООССНгСНгС (=СНСООС2Н5) сн- 346
КИСЛОТЫ (CN) СООСгНз (901
Этот продукт реакции получен после гидролиза и частичного декарбоксилирования.
Таблица XVI
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С п, ^-НЕНАСЫЩЕННЫМИ ЭФИРАМИ КАРБОНОВЫХ КИСЛОТ АЛИЦИКЛИЧЕСКОГО РЯДА
8 Катализатор Продукт реакции (выход, %) Литература
Реагирующие вещества
Метиловый эфир циклобутен- 1-карбоновой-1 кислоты и Малоновый эфир трет-СгНдОК Этиловый эфир (2-карбометоксициклобутил)ма- 963
Этиловый эфир циаиуксусиой трет-С4Н9ОК лоновой кислоты (54) Этиловый эфир (2-карбометоксициклобутил)- 963
§ кислоты Метиловый эфир 3,3-диметил- циклобутен-1 -карбоновой-1 кислоты и Малоновый эфир трет-CJIgOK циаиуксусиой кислоты (52) Этиловый эфир (4-карбометокси-2,2-диметил- 963
Этиловый эфир циануксусной трет-С4Н9О К циклобутил)малоновой кислоты (57) Этиловый эфир (4-карбометокси-2 2-диметил- 963
КИСЛОТЫ Этиловый эфир циклопентен- 1 -карбоновой-1 кислоты и Малоновый эфир C2H5ONa циклобутил}циануксусной кислоты (9) /к .СООСгНз Л = | I АСН(СООС2Н5)2 (80—85) 99
Ацетоуксусный эфир C2H5ONa АСНгСООСгНз (23), СНзСОСН(А)СООС2Н5 (8) 100
Этиловый эфир циаиуксусиой C2HEONa ACH(CN)COOC2H5 (30—35) 99, 964,
КИСЛОТЫ ^^СООСгНз • — СН (CN) СООН 965
Продолжение табл. XVI
Реагирующие вещества
Катализатор
Продукт реакции (выход, %)
Литература
Этиловый эфир 2-оксицикло-
пентен-1-карбоновой-1 кис-
лоты и
Этиловый эфир циануксусной
кислоты
Пиперидин; C2HsOK
Цнанацетамид
Пиперидин
да Этиловый эфир циклогексен-
1-карбоновой-1 кислоты и
Малоновый эфир C2H5ONa
Метилмалоновый эфир C2H5ONa
Этиловый эфир циануксусной CjHsONa; С2Н5ОК;
кислоты пиперидин
C2H6ONa
Этиловый эфир 2-оксицикло-
гексен-1-карбоновой-1 кис-
лоты и
Цианацетамид Пиридин
Этиловый эфир 2-аминоцикло- гексен-1-карбоновой-1 кис- лоты и Цианацетамид Без катализатора
Амид малоновой кислоты Пиперидин
Этиловый эфир 4-метилцикло- гексен-1-карбоновой-1 кис- лоты и Этиловый эфир циануксусной кислоты Этиловый эфир (3-метилцикло- пентилиден)циануксусной кислоты3 и Этиловый эфир циаиуксусной кислоты C2H6ONa NH3
Этиловый эфир циклогексили- денциануксусной кислоты 3 и Этиловый эфир циануксусной кислоты C2H5ONa
—СН (CN) СООС2Н6
—СООС2Н5
<50, 59)
966
967
NC-
ОН
А =
1—ОН
(38)
ЛСН(СООС2Н5)2 (40)
А С (СН3) (СОООНз), (6))
ACH(CN)(COOC2H5) (74, 35, 18)
AC(CN) (СООС2Н5)СН2СООС2Н61
CN
он
НО CN
4-Циан-1-оксн-3-кето-2, 3,5, 6, 7,8-гексагидроизо-
хинолнн
Амид 1-окси-3-кето-2, 3,5,6,7,8-гексагидроизо-
хинолнн-4-карбоновой кислоты
Этиловый эфир 1-карбэтоксн-4-метилцикло-
гексан-2-циануксусной кислоты 2
СН (CN) СО
>NH
СН (CN) СО
(50)
Циклогексан-1, 1-диуксусная кислота
66, 968
66
969
970
420
971
420
413
972
973
238
Продолжение табл. XVI
Реагирующие вещества Катализатор
Этиловый эфир (З-метил-2-ци- клогексенилиден ) циануксус- ной кислоты 3 и
Этиловый эфир циануксусной кислоты Этиловый эфир (З-этил-2-ци- клогексенилиден )циануксус- ной кислоты3 и NH3
Этиловый эфир циануксусной кислоты Этиловый эфир (цис-2-гидрин- данилиден)циануксусной кислоты3 и NH3
Этиловый эфир циануксусной кислоты Этиловый эфир (транс-2-ги- дринданилиден) циануксус- ной кислоты 3 и NH3
Этиловый эфир циануксусной кислоты NH3
(цис-2-Гидринданилиден) циан- ацетамид и Цианацетамид Пиперидин
\транс-2-Гидринданилиден)ци- анацетамид4 и Цианацетамид Пиперидин
Этиловый эфир (цис-2-дека-
•и лилиден) циануксусной кис-
лоты и
Этиловый эфир циануксусной
кислоты
Этиловый эфир (транс-2-дека-
лилиден)циануксусной кис-
лоты6 и
Этиловый эфир циануксусной
кислоты
Продукт реакции (выход. %)
(37)
(60)
Литература
673
673
97
NH3
NH3
1 Это соединение Получили, непосредственно обработав продукт конденсации этиловым эфиром бромуксусной кислоты.
2 Этот продукт реакции подвергался дальнейшей конденсации с этиловым эфиром бромуксусной кислоты или с этиловым эфиром (3-хлор-
пропионовой кислоты.
8 Это соединение получено in situ из этилового эфира циануксусной кислоты и соответствующего кетона.
4 Это соединение получено in situ из цианацетамида и соответствующего кетоиа.
5 Если это соединение получали in situ, из этилового эфира циаиуксусной кислоты и траяс-декалона-2, то выход того же продукта кон-
денсации составлял 60%.
Т а б л н ц а XVII
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С ЭФИРАМИ а, Р-НЕНАСЫШЕННЫХ КИСЛОТ АРОМАТИЧЕСКОГО РЯДА
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир (2-фурил)- акриловой кислоты и Малоновый эфир Этиловый эфир (4-пиридил)- акриловой кислоты и Малоновый эфир Метиловый эфир коричной кислоты и Цианистый бензил Ацетофенон Этиловый эфир коричной кис- лоты и Малоновый эфир 2 Метилмалоновый эфир C2HsONa C2H5ONa СН3ОК Сухой CsHsONa NaNH2 C2H3ONa C2H5ONa (каталитиче- ское количество) CsHcONa (1 экв) \o/~CH (CH2COOC2H5) CH (COOC2H5)2 CH (CH2COOC2H6) CH (COOC2H6)2 A и C6H5CH(CH2COOCH3)CH(CeH5)CN (59) CaHsCH (CH2COOCH3) CH (C6H5) CN C6H6CH(CH2COOH)CH2COC6H5 (49)1 A = C6H5CHCH2COOC2H5 1 ACH(COOC2Hs)2 (количественный) AC(CH3) (COOC2Hs)2 (50) C6H5CHCH (СНз) COOC2HS (49) (94) 975 976 90 90 357 2, 31, 907, 977 57
Этиловый эфир изомасляной кислоты Этиловый эфир янтарной кис- лоты Этиловый эфир фенилуксус- ной кислоты C2HEONa (C6H5)3CNa C2H5ONa CsHsONa (C6H5)3CN'a CH(COOC2H5)2 (смесь двух изомеров, 40)) (СНз)2С(А)СООС2Н5 (50) (СНа)2С(Д)СООС2Н5 (20) 2-Фенилбутан-1, 3,4-трикарбоновая кислота 1 (24) CeHsCH (А) СООС2Н3 (количественный)! CeHsCH(A)COOC2Hs (10) _____ j 57 491 491 978 88, 89 491
Ацетоуксусный эфир 3 Этиловый эфир цнануксусной кислоты Цианацетамид Этиловый эфир а-цианмасля- ной кислоты Этиловый эфир а-цианизова- лериановой кислоты Этиловый эфир а-циангидро- коричной кислоты Цианистый бензил (C6Hs)3CNa C2H6ONa Na-Енолят C2HEONa C2H6ONa C2H6ONa C2HsONa Сухой C2H5ONa CH3ONa Сухой NaOH СН3СОСН(Д)СООС2Н5 (60) I NCCH(A)COOC2H5 (два изомера, 85) З-Циан-2,6-дикето-4-фенилпиперидин NCC(C2HS) (Д)СООС2Н5 NCC(h-C3H7) (Д)СООС2Н5 NCC(CH2C6H5) (Д)СООС2Н5 CeHsCH(A)CN (два изомера: общий 27; об- щий 50; 32 + 12 или общий 44) C6H5CH(A)CN (80); С6НЕСН (CN) СН (С6Н5) СН2СООН (небольшой); О /U^/COOCjHs | | (небольшой) н5с/'Х^'СбНз CN ХсвН5 О JI СООС2Н8 | | (43, 66) Н Н 5 CN СбНб С6Н5СН (CN) СН (С6Н5) СН2СООСН3 C6H6CH(A)CN (33); C6H5CH(CN)CH(C6H:,)CH2COOH (35); C6H5CH(A)CONH2 (12) 491 309, 86, 87, 979 872 87 87 87 34, 90, 982, 91 980 90, 982, 981 90 980
Продолжение табл. XVII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир коричной кис- лоты и Нитрил у-бензоил-а, р-дифе- нилмасляной кислоты Пинаколин Ацетофенон Нитрометан Этиловый эфир нитроуксусной кислоты 2-Хинальдин Триэтиловый эфир фосфон- уксусной кислоты Этиловый эфир 4-нитрокорич- ной кислоты и Циаиацетамид Этиловый эфир р-оксикорич- ной кислоты и СН8С (=NH) СН2СООС2Н5 C2H5ONa NaNH2 NaNH2 [CeHsCH2N (СН3) 3]- ОС4Н9-Н [CeH5CH2N(CH3)3]OH C2H5ONa; К Na-Енолят Без катализатора А=С6Н5СНСН2СООС2Н5 1 О /\/СООС2Н5 нсААсн °’ ПбСб /к CN ХС6Н5 АСН2СОС(СН3)з (64): ДСНгСОСбНв (19) или СбН5СОСН2СН(С6Н5)СН2СООН (37—66) ACH2NO2 (76) ACH(NO2)COOC2H5 (66) 1 II 1 (10)1 \ N^CH2CH (С6Н5) сн2соон (С2Н5О)2Р(О)СН(А)(СООС2Н5) (24, 50) З-Циан-2, 6-дикето-4- (и-нитрофенил) пиперидин 6-Окси-2-метил-4-фенилпиридин-3-карбоновая кислота^1 (25) 982 357 357, 983 47 167 396 136, 846 872 984
Этиловый эфир атроповой
кислоты (а-фенилакриловой
кислоты) и
Триэтиловый эфир этан-1, 1,2-
трикарбоновой кислоты
Этиловый эфир р-метокси-
а-фенилакриловой кислоты и
Цианацетамид
Нитрил р-метокси-а-фенил-
акриловой кислоты и
Циаиацетамид
Этиловый эфир р-этокси-а-
(п-хлорфенил)акриловой
кислоты и
«• Циаиацетамид
Этиловый эфир р-изобутокси-
а-ф>енилакриловой кислоты и
Циаиацетамид
Нитрил р-изобутокси-а-фенил-
акриловой кислоты и
Циаиацетамид
C2H5ONa
C2H5ONa
C2H5ONa
C2H5ONa
C2H6ONa
*
C2H5ONa
С2Н5ООССН (С6Н5)СН2С(СООС2Н5) 2- СН2СООС2Н, 63
2,6-Диокси-З-фенилпиридин (28) 985
N Ск ?CSHS II 1 (78) Ho/^N^Xnh,, 985
985
|| | (33) или
но/х №*\он
H2NOC\/z^/C6H4Cl-n
HO/^N^OH
2, 6-Диокси-З-фенилпиридин (31) 985
N Сч /Ч^/СеНб 985
|| 1 (81)
HO/'N^NHj,
Продолжение табл. XVII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир п-метилкорич- ной кислоты и
Этиловый эфир а-цианпро- пионовой кислоты Этиловый эфир а~метилкорич- ной кислоты и C2HsONa CH3C(CN) (СООС2Н5)СН(С6Н4СН3-п)- СН2СООС2Н5 87
Этиловый эфир циануксусной кислоты Этиловый эфир оксиметилен- фенилуксусной кислоты и СгНвОНа NCCH (СООС2Н5) СН (C6HS) СН (СН3) СООС2Н5 (два изомера, 58) 57, 87
Малоновая кислота Без катализатора а-Фенилглутаконовая кислота 1 (75) 388
Цнануксусная кислота Этиловый эфир р-бензилакри- ловой кислоты и Этиловый эфир 4-циан-2-фенилбутен-2-овой кислоты (47) А=С6Н5СН2СНСН2СООС2Н5 388
Малоновый эфир Na-Енолят ЛСН(СООС2Н5)2 (51) 986
Метилмалоновый эфир 4 C2H5ONa ДС(СНз)(СООС2Н5)2 (42) 84
Этиловый эфир циануксусной кислоты 4 fi-И зобутокси-а-фенилкрото- нонитрил и C2H5ONa ACH(CN)COOC2Hs (67) сн3 84
Цианацетамид C2HsONa NC4 /к ZC6H5 Х/'У 5 (33) Ho/4n^\nH2 985
Диметиловый эфир бензил- иденмалоновой кислоты и Изомасляный альдегид Дезокснбензоин Антрон CH3ONa CH3ONa CHsONa
Нитрометан CH3ONa
Диметиловый эфир м-нитро- бензилиденмалоновой кис- лоты и £$ Антрон Пиперидин
Фенилнитрометан CH3ONa
Диметиловый эфир о-хлорбен- зилиденмалоновой кислоты и Антрон Пиперидин
А = С6Н6СНСН (СООСНз) 2
(СН3)2С(Л)СНО (80)
СбН6СОСН(Л)СвН5 (44)
О
Н А
ACH2NO2 (95)
О
Н СН (C6H4NO2-J£) СН (СООСН3)2
С6Н6СН (NO2) СН (СеН,,ЫО2-Л1) СН (СООСН3)2
(78)
о
Н СН (С6Н4С1-о) СН (СООСН3)2
987
178
178
349
988
989
990
Продолжение табл. XVII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Бензилиденмалоновый эфир и А=С6НЕСНСН (СООС2Н6) 2 930 991
Малоновый эфир Ацетоуксусный эфир Na-Енолят C2H5ONa А СН (СООС2НВ) 2 (количественный) СНзСОСН(А)СООС2Н5 (81) свнв
СНзС (=NH) СН2СООС2Н5 Без катализатора С2Н5ООСХ Л /СООС2Н5 Y у р6) H3c/Xn 992. 604, 993
Этиловый эфир изобутирил- уксусной кислоты C2HsONa (СНз)гСНСОСН(А)СООС2НБ (65) О 994
Антрон Пиперидин; (C2Hb)2NH 11 (71, ,91) Н А 53, 990
Дезоксибензоин C2H5ONa C6H6COCH(A)C6HS 438
Феннлнитрометан (C2H5)2NH; C2HsONa CeH5CH(A)NO2 (86, 52) 36, 995
Этиловый эфир нитроуксус- иой кислоты (C2Hb)2NH ACH(NO2)COOC2H6 (99) 36
Замещенные бензилиденмалоновые эфиры
Заместители в СвНБСН=С (СООС2Н8)2 Присоединяемое соединение Катализатор Продукт реакции (выход, %) Литера- тура
2-Хлор Антрон Пиперидин О II 990
З-Нитро Малоновый эфир Na-Енолят (73) Н СН (С6Н4 С1-2) СН (СООС2Н5)2 (С2Н5ООС) 2СНСН (C6H4NO2-3) СН (СООС2Н5) 2 930
Антрон Пиперидин О II х' II 11 1 988
Нитрометан C2H5ONa 1 1 Н СН (C6H4NO2-3) СН (СООС2Н5)2 O2NCH2CH (C6H4NO2-3) СН (СООС2Н5) s 996
4-Нитро Малоновый эфир Na-Енолят (С2Н5ООС) 2СНСН (C6H4NO2-4) СН (СООС2Н5) 2 930
Нитрометан C2H6ONa O2NCH2CH (C6H4NO2-4) СН (COOC2H5) 2 996
4-Метокси Дезоксибензоин CsHsONa C6H5COCH (C6H5) CH (C6H4OCH3-4) - 438
4-Диметиламино C2H5ONa CH(COOC2Hs)2 C6H5COCH (C6H5) CH [C6H4N (СНз) 2-4] CH- 438
3,4-Метилендиокси C2H5ONa (COOC2HS)2 CeHsCOCH (C6H5) CH[C6H3 (O2CH2) -3,4]- 438
1 CH(COOC2H5)2
Продолжение табл. XVII
Заместители в C6HSCH=C (СООС2НБ)2 Присоединяемое соедииеиие Катализатор Продукт реакции (выход, %) Литера- тура
СООС2Н5 ь°
4-Ацетокси Ацетоуксусный эфир C2H5ONa 4-СН3СООС6Н4—/ У СООС2Н5 СООС2Н5 \у/° 997
Этиловый эфир про- пионилуксусной кис- лоты C2H5ONa n-CH3COOC6H4-Z СН3 СООС2Н5 СООС2Н5 1 Z 448
З-Метокси-4-ацетокси Ацетоуксусный эфир C2H5ONa СН3СОО—/—\ / 1 1 ОСН3 1 СООС2Н6 998
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
\ Этиловый эфир бензилиден- циануксусной кислоты и Этиловый эфир циануксусной (QHshNH С6Н5 NC\Z\/CN 999
t кислоты C6H6C(=NH)CH2CN (C2H5)2NH । I (диэтиламмониевая соль, 60) Н 3,5-Дициан-4,6-дифенилпиперидон-2 (5) 351
Этиловый эфир (а-фенилэтил- иден)циануксусной кисло- ты и § Ацетоуксусный эфир C2H6ONa %/\Z 437
Бензилиденцианацетамид и Циаиацетамид КОН NcZ^Z^COO^He СНз С6Н5 C6H5CH2CH(CN)CONH2 или 925
» CeH5CH=C(CN)CONH2 с6н6 NC\/\j/CN О An/Чо н
Продолжение табл. XVII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир циннамилиден- уксусной кислоты и Малоновый эфир C2HsONa Р-Стирилглутаровая кислота 1 * * 4 (38) 210, 211
Этиловый эфир 3,4-дигидро- нафтойной кислоты и Ацетоуксусный эфир — %/\^° 1000
Этиловый эфир 4-фенилпен- тен-2-овой кислоты и Этиловый эфир циануксусной \/\/ С6Н5СН (СНз) СН (СН2СООС2Н5) СН (CN) - 84
кислоты Этиловый эфир 3-пиридилме- ' тиленмалоновой кислоты и Фенилнитрометан (C2H6)2NH СООС2Н5 (561 /^/СН [СН (COOC2HE)2J СН (С6НЕ) NO2 (84) 36
Этиловый эфир нитроуксус- (C2H6)2NH у^/СН [СН (СООС2НБ)2] СН (NO2) СООС2НБ 36
ной кислоты ( 1 (91)
Оо * Диметиловый эфир циннами- лиденмалоновой кислоты и Диметиловый эфир малоновой кислоты 1 CH3ONa С6НЕСН[СН (СООСНз) 2]СН2СН[СН (СООСНз) 2]2 5 63, 1001
Нитрометан . CH3ONa С6Н5СН=СНСН (CH2NO2) СН (СООСНз) 2 (87) 349
Этиловый эфир бенэилиденян- тарной кислоты и Малоновый эфир C2HSOK 2-Фенилбутан-1,1,3, 4-тетракарбоновая кислота,' 2-фенилбутан-1,3,4-трикарбоновая кислота 1 978
Ф- ОО со Этиловый эфир а-циан-у, у-ди- фенилкротоновой кислоты и Этиловый эфир циануксусной кислоты 6 (C2H6)2NH Р-Бензгидрилглутаровая кислота 1 (12—21) 1002
1 Этот продукт реакции выделен после омыления.
2 Согласно данным работы J87J, амиды и нитрил коричной кислоты реагируют аналогичным образом. При гидролизе первичного продукта конден-
сации в результате частичного декарбоксилирования образуется Р-фенилглутаровая кислота. Первичным продуктом реакции, полученным из
амида коричной кислоты, является соединение С6Н5
,COOC2Ht
СГ х N z ХХО
8 Использовался уксусноэти левый эфир; до реакции с этиловым эфиром коричной кислоты он был превращен в ацетоуксусный
эфир.
4 Вместо этилового эфира 0-бензилакриловой кислоты применялся этиловый эфир стирилуксусной кислоты.
5 Это формула ожидавшегося продукта конденсации; фактически выделен пентаметиловый эфир. То же соединение получено при конден-
сации коричного альдегида с диметиловым эфиром малоновой кислоты в присутствии метилата натрия с выходом 97%.
6 Ненасыщенный эфир получен in situ из дифенилацетальдегида и этилового эфира циануксусной кислоты.
Таблица XVIII
РЕАКЦИИ ВНУТРИМОЛЕКУЛЯРНОЙ КОНДЕНСАЦИИ МИХАЭЛЯ С ЭФИРАМИ
а, НЕНАСЫЩЕННЫХ КИСЛОТ АРОМАТИЧЕСКОГО РЯДА
Реагирующее вещество Катализатор Продукт реакции (выход, %) Литература
сн=снсоос2нЕ ^JLoch2cooc2he ♦ CH=CHCOOCSH5 L J—ОСН2СООС2Н5 co V OCH3 CH—CHCOOCH3 ^Jl—SCH2COOCH3 o2N—сн—снсоосНз Ml—NHCH2COOCH3 CH3 n^V-C (CH3)-=CHCOOC2HS H3C—OCH2COOC2HE C2HEONa C2H5ONa CHsONa СН2СООС2Н5 СООС2Н5 1 ’ СН2СООС2Н5 (65) СООС2Н5 ’ :н2соосн3 'ООСН3 1004,1003 1003 352
С 1 о г II z\o/
II- Z4O^ СНз \ ,— /•
1 г
CH3ONa СН2СООСН3 _ СООСНз ( } сн2соос2н5 СООС2НЕ (90) :н3 352
1 у с II Z\N/ Н,Н С - :н
C -aHsONa нзС-^ н3с—• НзС—! ( II о/ — с 1003,1004
H>c-v kz c 8 H.c-0 0 0 —OCH2COOC2HE 5 C2HEONa CjHsONa CHsONa CHsONa C2H5ONa CH3ONa ч/ ^ч ч/ ч/ ч/ 0 1 \о/ СП (С2Г15)СОС»С2Г15 —СООС2Н5 1 ) 1004 1004,1003 352 352 1004 352
Ci C2П5 —OCH2COOC2HE - CH=- С (C(,H5) СООСНз —OCH2COOCH3 и и с СООСаНь —СООС2Н6 -СН (С6НЕ) СООСНз —СООСНз 1 ’ «6^5
—OCH2COOCH3 —CH-CHCN —OCH2COOC2HE —CH=CHCOOCH3 —NHCOCH2CeHe Чо/ —СН2СООСНз —СООСНз
1 VjI < 1—СООС2Н5 Чо/ СН2СООСНз /^Ч-СеНз (71) 4n/4o н
Таблица XIX
РЕАКЦИЯ КОНДЕНСАЦИИ МИХАЭЛЯ С ЭФИРАМИ а, ^-НЕНАСЫЩЕННЫХ КЕТОНОКИСЛОТ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Натриевая соль метиленацето-
уксусной кислоты 1 и
2-Карбоксициклогексанон 2-Карбэтоксициклогексанон NaOH NaOH |ZXj-CH2CH2COCHs и (/Х|/Х| \Z%O СООС2Н6 fYl и 551 551
2-Метилциклопентандион-1,3 NaOH, пиперидин 8-Окси-9-метилгидриндандион-3, 6 551
2-Метилциклогександион-1,3 NaOH 2- (Р-Ацетилэтил)-2-метилциклогександион-1, 3 551
Метиленацетоуксусный эфир2 и
Ацетоуксусный эфир NaOH, втор-амин 4-Карбэтокси-3-метилциклогексен-2-он 551
2-Карбэтоксициклогексанон NaOH Ю-Карбэтокси-2-кето-2, 3, 4, 5,6,7,8,10-окта- гидронафталин °Н^\ /,\ 551
2-Карбэтокситетралон NaOH СООС2НЕ . СООС2Н5 551
2-Формилциклогексанон NaOH 2- (р-Ацетил-р-карбэтоксиэтил) -2-формилцикло- гексанон (37) 551
Натриевая соль метиленаце- тондикарбоновой кислоты 3 и сн3
2-Метилциклопентандион-1, 3 NaOH os\s\/ СН3 О 551
2-Метилциклогександион-1, 3 Этиловый эфир а-(аминоме- тилен)ацетоуксусной кис- лоты и NaOH /\/\ oAz\? 551
Ацетоуксусный эфир Без катализатора Диэтиловый эфир 2, 6-диметилпиридин-3,5-ди- карбоновой кислоты (30) 132
Ацетон Этиловый эфир 2, 5, 6-триметилпиридин-З-карбо- новой кислоты (8) 132
Циклогексанон Этиловый эфир ^-ацетилакри- ловой кислоты и Этиловый эфир 2-метил-5,6,7,8-тетрагидрохи- нолин-3-карбоновой кислоты (20—30) 132
Малоновый эфир Этиловый эфир fi-ацетил-а- оксиакриловой кислоты (ацетилпировиноградной кислоты) и C2HEONa СН3СОСН2СН (СООС2Н5) СН (СООС2Н5) 2 1005
Циаиацетамид NH3; (C2He)2NH Пиперидин CH3ONa К2СО3 4-Карбэтокси-3-циан-6-метилпиридон-2 4-Карбэтокси-3-циан-6-метилпиридон-2 (15) 4-Карбэтокси-3-циан-6-метилпнридон-2 (65) 4-Карбэтокси-3-циан-6-метилпиридон-2 (82) 396 1006 1006 1006, 1007
СН3С (=NH) СН2СООС2Н6 Без катализатора Диэтиловый эфир 2,6-диметилпиридин-3,4-ди- карбоновой кислоты (90) 1008, 1009
Продолжение табл. XIX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир р-ацетил-а- этоксиакриловой кислоты и Цианацетамид KsCOs 2-Карбэтокси-5-циан-4-метилпиридон-6 (73) 106
Этиловый эфир 3-кетопентен- 4-овой кислоты и 2-Метилциклогександион-1, 3 CH3ONa °сн3 /\|—СН2СН2СОСН2СООС2Н5 (30) 561
Этиловый эфир а-ацетил-^-ок- сикротоновой кислоты (ди- ацетилуксусной кислоты) и Цианацетамид Пиридин \/%о °сн, fl^l (30) Vy^o СООС2Н6 3-Циан-4-метил-6-оксипиридон-2 4 420
Метиловый эфир 5-кетогептен- 6-овой кислоты и 2-Метилциклогександион-1, 3 CHsONa :н3 о II 1 561
о^у сн 2СН2СООС2Н6
33 Зак. 794.
Этиловый эфир (5-пропионил-
а-оксиакриловой кислоты
(пропионилпировиноградной
кислоты) и
Цианацетамид
а-Этилиденацетоуксусный
эфир и
Ацетоуксусный эфир 5
Пиперидин
Этиловый эфир 3-циан-6-этил-2-оксипиридин-
4-карбоновой кислоты (58)
1010
CsHsONa,; пиперидин
Тетралон-1 NaNH2
Этилиденацетоацетанилид и
Ацетоацетанилид Пиридин Без катализатора Пиридин
Этилиденацетоацет-о-толуид и
Ацетоацет-о-толуид
Пиридин
Этиловый эфир а, а'-диацетил-р-метилглутаро-
вой кислоты (93)
CH3CH[CH(COCH3)CONHC6H5]2 (50)
СН3СН[СН (СОСНз) CONHC6H6]2 (60)
О
но\| I
Н3Су^'Чч|'//
—CONHC6He6
—сн3
CONHC6He
CONHC6H4CH3-o
1011—1013
222
1014
1014
1014
1014
Продолжение табл. XIX
8
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этилиденацетоацет-п-толуид и Ацетоацет-п-толунд Без катализатора СН3СН[СН (СОСНз) CONHC6H4CH3-n]2 0 1014
Пиридив II но CONHC6H4CH3-n« 1014
X 1—СН3
H3CZ у
CONHC6H4 СНз-п
Этиловый эфир а-метоксиме- тиленацетоуксусной кисло- ты и
Циаиацетамид C2H6ONa КС-/\СООС=^ (70) 350
3
Этиловый эфир а-этоксимети- ленацетоуксусной кислоты и Малоновый эфир C2H5ONa С2Н5ООС— —СООС2Н5 330
НзС-Д > =о
Этиловый эфир циануксусной кислоты C2H5ONa С2Н5ООС— Нзс \ —СООС2Н5 =0 330
Этиловый эфир ^-н-бутирил- а-оксиакриловой кислоты (н-бутирилпировиноградной кислоты) и Цианацетамид Этиловый эфир ^-изобутирил- а-оксиакриловой кислоты (изобутирилпировиноград- ной кислоты) и Цианацетамид 4-Харбометокси-З-метилцикло- гексен-2-он и Пиперидин К2СО3 Этиловый эфир 3-циан-2-окси-6-пропилпиридин- 4-карбоновой кислоты (51) Этиловый эфир 3-циан-2-окси-6-изопропилпири- дин-4-карбоновой кислоты (70) СН (СООС2НЕ)2 1015 1007
Малоновый эфир Na-Енолят 1 /СНз 0—1 1\соосн3 (27)7 1016
а-П ропилиденацетоуксусный эфир и Ацетоуксусный эфир C2HEONa; (C2HS)2NH Этиловый эфир а, а'-диацетил-Р-этилглутаровой кислоты О 1012, 1013, 1017
а-П ропилидена цетоацетани- . лид5 и Пиперидин II НЕС2—СН3 (66) 1012
Ацетоацетанилид Без катализатора Пиридин С2Н5СН[СН (СОСНз) CONHC6He]2 0 II Ho^A-CONHCeHs® /\ /—с2н5 НзС/ Y 1014 1014
CONHC6H5
Продолжение табл. XIX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
а-Изопропилиденацетоуксус- ный эфир 5 и Ацетоуксусный эфир C2H5ONa; (СН3)3СОК 4-Карбэтокси-3,5,5-триметилциклогексен-2-он (80—94, 76) 1019, 1020, 1018
Этиловый эфир fi-изовалерил- а-оксиакриловой кислоты ( изовалерилпировиноград- ной кислоты) и Цианацетамид КаСОз Этиловый эфир 3-циан-2-окси-6-изобутилпири- дин-4-карбоновой кислоты (65) 1007
Этиловый эфир р-пивалоил- а-оксиакриловой кислоты (пивалоилпировиноградной кислоты) и Цианацетамид КаСОз Этиловый эфир 3-циан-2-окси-6-трет-бутилпири- дин-4-карбоновой кислоты (70) 1007
а-н-Бутилиденацетоуксусный эфир 6 и Ацетоуксусный эфир Пиперидин О II и-С3Н7—QkСН3 1011
а-Изоб утилиденацетоуксусный эфир 6 и Ацетоуксусный эфир C2H5ONa; (C2He)2NH \ Этиловый эфир а, а'-диацетил-₽-нзопропилглу- таровой кислоты 1011, 1021
Пиперидин
Этил-6-карбэтокси-6-метил-
циклогексен-2-он и
Малоновый эфир
C2H5ONa
Этиловый эфир (2-кетоцикло-
гексил)глиоксалевой кисло-
ты (енольная форма) и
СН3С (=NH) CH2COOGH5
8
Цианацетамид
Без катализатора
Пиперидин; C2H5ONa
Диэтиловый эфир ацетон- Na-Енолят
1,3-дикарбоновой кислоты
Метиловый эфир fi-бензоил-
акриловой кислоты и
Нитрометан CH3ONa
Этиловый эфир а-окси-^-бен-
зоилакриловой.кислоты и
Цианацетамид................ . (CSHE)2NH
О
А/СНз
<С=Н.ООС),НС-И\00
(71)
; Диэтиловый эфир 2-метил-9-окси-5.6, 7, 8,9,10-
гексагидрохинолин-3,4-дикарбоновой кис-
лоты (36)
СООС2Н5
Триэтиловый эфир 6-окситетралин-5,7,8-три-
карбоновой кислоты (72)
C6HeCOCH2CH(COOC2He)CH2NO2 (92)
| 4-Карбэтокси-3-циан-6-фенилпиридон-2
1011
1022
676
1007. 616
449
349
618
Продолжение табл. XIX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литературе
а-Изопентилиденацетоуксус- ный эфир и Ацетоуксусный эфир Этиловый эфир (2-кето-З-ме- тилциклогексил)глиоксале- вой кислоты и СНзС (=NH) СНгСООСзНв Этиловый эфир (2-кето-4-ме- тилциклогексил Глиоксале- вой кислоты и СНзС (=NH)CH2COOC2HB Этиловый эфир (2-кето-5-ме- тилциклогексил Глиоксале- вой кислоты и СНзС (=NH) СН2СООС2Н5 Этиловый эфир метиленбензо- илуксусной кислоты 5 и Этиловый эфир бензоилуксус- ной кислоты Этиловый эфир ^-бензоил-а- оксиакриловой кислоты (бензоилпировиноградной кислоты) и Цианацетамид "[-Бензилиденацетоуксусный эфир и Дезоксибензоин а-Б ензилиденацетоуксусный эфир и Ацетоуксусный эфир 5 Этиловый эфир циануксусной кислоты i (C2H5)2NH; пиперидин Без катализатора » » » » (C2Hs)2NH 1 Пиперидин C2H6ONa Пиперидин (C2HS)2NH Водн. (C2Hs)2NH Этиловый эфир а, а'-диацетил-р-изобутилглута- ровой кислоты Диэтиловый эфир 2,8-диметил-9-окси-5,6, 7,8, 9,10-гексагидрохинолнн-3,4-дикарбоновой кис- лоты Диэтиловый эфир 2, 7-диметил-9-окси-5,6,7,8, 9, 10-гексагидрохинолин-З,4-дикарбоиовой кис- лоты Диэтиловый эфир 2,6-диметил-9-окси-5,6, 7,8, 9,10-гексагидрохинолин-3,4-дикарбоновой кис- лоты СН2[СН (COC6HS) СООС2Н6]2 Этиловый эфир 3-циан-2-окси-6-фенилпиридин- 4-карбоновой кислоты J30) 3, 4, 5-Трифенилциклогексен-2-он О II С2Н5ООС-/\ /Un НзСо-^Д | СН3 (три стереоизомера) С2НБООС с6н5. 1 NC—СООС2Н5 О_1 Ь. (И) \ц/\он н C2H5OOCCH(COCH3)CH(CeH5)CH(CN)CONH25; CeHs NC—| у-СООС2Н5 0=1 1/СНз ЧчН'/Ч)Н Н 1021 676 676 676 1023 1007 1024 1012 999 999
Продолжение табл. XIX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
а-Бензилиденацетоуксусный эфир и С6н5
CH3C(=NH)CH2CN (C2He)2NH > i N С—СООС2Н5 /СН3 или Н3С—II X ХОН Н 462
с6нЕ
1 NC—СООС2Н5 Н3С—1 J-CH3
C6H5C(=NH)CH2CN CH3ONa I Этиловый эфир 5-циан-4,6-дифенил-2-метилпи- ридин-3-карбоновой кислоты 8 351
n-CH3C6H4C(=NH)CH2CN CH3ONa Этиловый эфир 5-циан-2-метил-4-фенил-6-п-то- лилпиридин-3-карбоновой кислоты 351
n-CH3OC6H4C (= NH) CH2CN CH3ONa Этиловый эфир 5-циан-6-п-метоксифенил-2-ме- тил-4-фенилпиридин-З-карбоновой кислоты 351
Феаилайвтадьдагид.
О II ООО (8з)
Антрон C2HEONa 178
'Фенилнитрометан (C2H5)2NH С6Н5СНСН (СОСН3) СООС2Н5 3-Карбэтокси-5-нитро-4,5-дифенилпентанон-2 (78) 36
Замещенные a-бензилиденацетоуксусные эфиры
J8 Заместители в СН,СОССООС2Н6 II СН 1 6/% и 4 Присоединяемое соединение Катализатор Продукт реакции (выход, %) Литература
З-Нитро Ацетоуксусный эфир8 Дезоксибензоин Пиперидин C2HEONa о II но (/\-СООС2Н5 X J-C8H«N°2-3 НзС/ Y СООС2Н6 3-O2NC6H4CHCH (СОСНз) СООС2Н8 1 С6Н5СНСОС6Н5 1012, 1025 438
Продолжение табл. XIX
$ Со 8 Заместители в СН,СОССООС,Н, II сн О 4 Присоединяемое соединение Катализатор Продукт реакции (выход, %) Литература
* '4-Нитро 2-Метокси З-Циан 4-Циан 3,4-Метилендиокси 3,4-Диметокси Ацетоуксусный эфир 6 То же > » > > > > » > Пиперидин 1 C2H6ONa Пиридин » [С6Н5СН2Ь1(СНз)з]ОН [CeHaCHjNjCH^aJOH о II j-jO —соос2н5 X J—C6H4NO2-4 НзС/у СООС2Н6 о 11 j_[q СООС2Н6 X J—С6Н4ОСНз-2 НзС/ Y СООС2Н5 3-NCC6H4CH[CH (СОСНз) СООС2Н5]г (77) 4-NCC6H4CH[CH (СОСНз) СООС2Н5]2 (77) О II ноч А-соос2н5 х J—С6Нз(О2СН2)-3,4 ' ’ НзС/ Y СООСЕН, о HOxfYCOO^Hs (14) X J—С6Н3 (ОСН3)2-3,4 Н3С/ Y СООС2НЕ о II —СООС2Н5 Н3С—11^—С6Н3 (ОСНз)2-3,4 СООС2Н6 (смесь стереоизомеров, 34) 1012, 1025 1012, ср. 1026 1027 1027 559 559
Реагирующие вещества Катализатор Продукт реакции (выход. %) Литература
а-н-Гептилиденацет эфир и Ацетоуксусный эфи оуксусный Р6 CzHsONa; (C2HS)2NH Пиперидин Этиловый эфир а, а'- диацетил-₽-я-гекси л глута- ровой кислоты О И-CgH J 8 СНд 1021 10Ц
Продолжение табл. XIX
§
g
Реагирующие вещества Катализатор Продукт реакции (выход,! %) Литература
а-н-Г ептилиденацетоацетани- лидв и Ацетоацетанилид Без катализатора н-СвН13СН[СН (СОСНз) CONHC6H5]2 О II но —conhc6h5 ® X J-C6H18-h HgC' jp 1014
Пиридин 1014
а-н-Г ептилиденацетоацет-е-то- луид$ и CONHC6H5 0 II HO CONHC6H4CH3-oe НзС>у СбН,*’Н
Ацетоацет-о-толуид > 1014
а-н-Гептилиденацетоацет-п-то- луид5 и CONHCsH4CH8-o
о
Ацето ацет-п-толуид » п HO |/Xj—CONHC6H4CH3-n 6 /—C6H 13-w HgC'^ jp CQNH<^H4CH^ 1014
Этиловый эфир $-циннамоил- а-оксиакриловой кислоты (циннамоилпировиноград- ной кислоты) и СН3С (=NH) СН2СООС2НЕ Без катализатора Диэтиловый эфир 2-метил-6-стирилпиридин- 3,4-дикарбоновой кислоты (48) 984
Этиловый эфир а-бензилиден- изобутирилуксусной кисло- ты и Малоновый эфир QiHsONa С6Н5СНСН (СООС2Н6) СОСН (СН3)2 1 (72) СН (СООС2Н5)2 994
Цитрилиденацетоуксусный эфир 6 и Ацетоуксусный эфир Пиперидин Этиловый эфир цитрилиден-бис-ацетоуксусной кислоты (61) 1028
Этиловый эфир бензилиден- бензоилуксусной кислоты и Фенилнитрометан (C2He)2NH Этиловый эфир а-бензоил-у-нитро-Р, у-дифенил- масляной кислоты (71) 36
иатрийацетоуксусиого эфира и формальдегида.
ацетоуксусного эфира и формальдегида.
натриевой соли аиетоидикарбоиовой кислоты и формальдегида.
1 Использовалась смесь
2 Использовалась смесь
•Использовалась смесь
4 В этой реакции выделяется уксусноэтиловый эфир.
8 Ненасыщенное соединение получено in situ из соответствующего альдегида и производного кетонокислоты.
8 Этот продукт реакции образуется при проведении реакции в кипящем пиридине
7 Такое строение соединения предполагается авторами.
• Часть С6НБС (=NH) CH2CN путем самокоиденсапии превращается в 3,5-дициан-2,4,6-трифеннлдигидропиридии.
Таблица XX
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С а, ^-НЕНАСЫЩЕННЫМИ ЭФИРАМИ КАРБОНОВЫХ КИСЛОТ С АЦЕТИЛЕНОВОЙ СВЯЗЬЮ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метиловый эфир пропиоловой кислоты и
Тетралон-1 Этиловый эфир пропиоловой NaNH2, жидк. NH, Метиловый эфир тетралон-1-акриловой-2 кис- лоты 1 А = —CH=CHCOOC2HS 1029
кислоты и
Метилмалоновый эфир Na СН3С(А)(СООС2Н5)2 (14) 353
Ацетоуксусный эфир C2HsONa CH3COCH(A)COOC2HS О 1030
6-Метокситетра лон-1 NaNH2, жидк. NH3 II СН3О—А /\/л 1029
1 -Кето-1,2, 3,4-тетр а гидрофе- нантрен NaNH2, жидк. NH3 1 1 1 II 1 ° (83) 1029
Нитрил а-фенилмасляной кис- [CeHsCH2N (СНз)з]ОН CH3CHJC(C6H5)(A)CN (35) 1031
ЛОТЫ
Нитрил у-диэтиламино-а-фе- [C6H5CH2N(CH3)3]OH (C2H5)2NCH2CH2C(C6H5)(A)CN (59) 1031
нилмасляной кислоты
Дифенилацетонитрил Этиловый эфир тетроловой кислоты и [C6H5CH2N(CH3)3] OH (C6H5)2C(A)CN (92) А = СН3С=СНСООС2Н5 1 1031
Малоновый эфир • CaHfiONa АСН(СООС2Н5)2 121, 1032, 1033
СН3 сн3 СНз^СНз
СН=СНС (СН3)=СН- C2H3ONa Z\_ CH=CHC(CH3)=CHCOC(A)(COOC2HS)2 1034, 1035
l^J-СНз ^Д-СНз
СОСН (СООС2Н6)2
Нитрил тетроловой кислоты и СНз СНз \ / СНЗ/СНз
СН=СНС (СН3)=СН- IJ!-CH3 C2HsONa /у-СН=СНС (CH3)=CHCOC (COOC2HS)2 1 L СНз 1 1034
\Z 3 CH3C=CHCN
СОСН (СООС2Н8)2 C6H5 1
сл Этиловый эфир фенилпропио- 1
8 левой кислоты и A = C6H6C=CHCOOC2HS> В = Rt—if 1 R2-\o/=o
Малоновый эфир Na; C2HsONa ACH(COOC2Hs)2 32, 33, 907, 1036
Р-Фенилглутаконовая кислота s 1037—1039
Метилмалоновый эфир Na; СгНзОИа CH3C(A)(COOC2Hs)2 (14) 353, 32, 33, cp. 354
Бензилмалоновый эфир C2H5ONa C6HsCH2C(A) (COOC2Hs)2 453
Ацетоуксусный эфир C2HsONa B, R1 = COOC2H5, R2 = СНз (14) 452. 453
«-Пропилацетоуксусный эфир C2H5ONa СНзСОС(А) (н-С3Нт)СООС2Н5 455
Этиловый эфир щавелевоук- C2H5ONa B, Rj = R2 = COOC2H6 455
сусной кислоты Этиловый эфир бензоилуксус- C2H5ONa B, R» = COOC2HS, R2 = C6H5 453
ной кислоты
Продолжение табл. XX
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир фенилпропио- новой кислоты и Этиловый эфир циануксусной кислоты Ацетилацетон Бензоилацетон Дезоксибензоин Этиловый эфир флоурен-9-кар- боновой кислоты Этиловый эфир п-нитрофенил- пропиоловой кислоты и Ацетоуксусный эфир "Этиловый эфир бензоилуксус- ной кислоты Этиловый эфир 2,3-димет- оксифенилпропиоловой кис- лоты и .Ацетоуксусный эфир Ацетилацетон Нитрил 2,3-диметоксифенил- пропиоловой кислоты и Ацетилацетон ’ Диэтиловый эфир ацетиленди- карбоновой кислоты и Малоновый эфир Метилмалоновый эфир Триэтиловый эфир этан-1,1,2- трикарбоновой кислоты Тетраэтиловый эфир этан- 1,1, 2,2-тетракарбоновой кислоты Ацетоуксусный эфир Этиловый эфир бензоилуксус- ной кислоты Na C2H5ONa C2H5ONa C2H5ONa Na-Енолят C2H5ONa C2H5ONa C2H5ONa C2H5ONa • C2H5ONa Na Na; C2HsONa C2H5ONa C2H5ONa C2HsONa C2HsONa NCCH(A)COOC2H5 CH3COCH(A)COCH3; В, Ri = СОСН3, R2 = СН3 В, R] = Н, R2 = СНз В, R, = СОСНз, R2 = С6Н5 A, Ri = R2 — С6Н5 Этиловый эфир Р-(9-флуоренил) коричной кис- лоты (28) C6H4NO2-n с2н5оос-/^ НзСЛо>° 1 C6H4NO2-n С2Н5ООС—/"Ч Н5С6-1 Lo XOZ 5-Карбэтокси-4- (2', З'-диметоксифенил) -6-метил- а-пирон (71) „ , 2,3- (СН3О)2С6Н3С=СНСООС2Н5 СНзСОС=С(ОН)СНз (33),3 2,3- (CH3O)2C6H3C=CHCN СНзСОС=С(ОН)СНз (43),3 А = С2Н5ООССН=ССООС2Н5 1 АСН(СООС2Н5)2 (30) СН3С(А) (СООС2Н5)2 Пентаэтиловый эфир бутен-1-пентакарбоновой- 1,2, 3, 3,4 кислоты Гексаэтиловый эфир бутен-1-гексакарбоновой- 1, 2,3,3,4,4 кислоты 4 (16) СН3СОСН(А)СООС2Н5 С6Н5СОСН(А)СООС2Н5 32 454 455 454, 455 1040 1041 455 455 1042 1042 1042 353 353 345 345, 512 455, 1043 455, 1043
1 Продукт реакции был восстановлен непосредственно до метилового эфира тетралон-1-пропиоиовой-2 кислоты.
2 Этот продукт реакции получен после гидролиза и частичного декарбоксилирования.
8 Фактически выделена свободная кислота, соответствующая этому продукту реакции.
4 Первоначально [512] было высказано предположение, что этот продукт реакции является производным циклобутана, образующимся в ре-
«ультате вторичной, внутримолекулярной реакции Михаэля. В настоящее время такое предположение опровергнуто [345].
Таблица XXI
РЕАКЦЦИ КОНДЕНСАЦИИ МИХАЭЛЯ С а, ^-НЕНАСЫЩЕННЫМИ НИТРОСОЕДИНЕНИЯМИ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Лите- ратура
J -Нитропропен-1 и Ацетоуксусный эфир СНзС (=NCH3) СН2СООС2Н5 :g СН3С [=NCH (СН3)2] СН2СООС2Н5 СН3С [=NCH (СН3) CH2NO2] СН2СООС2Н5 2-Нитропропен-1 и 2-Нитропропан Метил-2-нитропропиловый эфир Метил-2-нитропропилсульфид Нитромалоновый альдегид (оксиметилен- нитроацетальдегид) и Ацетоуксусный эфир Цианацетамид Левулиновая кислота Ацетондикарбоновая кислота Ацетон Метилэтилкетон Анетонилацегон Метилбензилкетон Дибензилкетон Циклооктанон Циклононанон Циклодеканон Циклоундеканон g Циклододеканон Циклотридеканон Циклотетрадекаион Циклопентадеканон Циклогексадеканон Циклогептадеканон Циклооктадеканон Циклононадеканон Циклоэйкозанон Циклогенэйкозанон Циклотриаконтанон 1 -Нитробутен-1 и ' . н-Пропилацетоуксусный эфир Этиловый эфир а-циаиамасляной кис- , лоты C2H5ONa Без катализатора » » » » C2H5ONa C2H5ONa. CH3ONa Щелочь [С6Н5СН2ЩСНз)з]ОН Щелочь » » » Na-Енолят » » » » » » » » » » Na CaHsONa O2NCH2CH (СН3) СН (СОСНз) СООС2Н5 (31) 1044 1044 1044 1044 1045 1045 1045 123 123 123 123 360 123 1046, 1047 123,361, 362 123,361, 362 363, 364 363 363 364 363 363 363 363 363 363 363 364 363 363 363 1048 1049
1 м г* \N/ 1 СН Lch, ™ 3
U Г' 1 Lch, <и> 1 СН (СН3)2
• 1 Lch, <“> Хц/ 1 СН (СН3) CH2NO2 1 А = CH3CH(NO2)CH2— AC(CH3)2NO2 (20) AC(NO2)(CH3)CH2OCH3 (50) AC(NO2)(CH3)CH2SCH3 (30) 5-Нитросалициловая кислота 3-Циан-5-нитропиридон-2 (93) 2-Окси-5-нитрофенилуксусная кислота (82) 2-Окси-5-нитробензол-1,3-дикарбоновая кислота п-Нитрофенол 2-Метил-4-нитрофенол (90) Метил-2-окси-5-нитробензилкетон, 2, 2'-ди- окси-5, б'-динитробифенил 2-Окси-5-нитробифенил 2,6-Дифенил-4-нитрофенол (94) 2,6-Пентаметилен-4-нитрофенол 1 (10) 2,6- Гекса метилен-4- нитрофенол (62) 2,6-Гептаметилен-4-нитрофенол (6) 2,6-Октаметилен-4-нитрофенол (2) 2,6-Нонаметилен-4-нитрофенол (28) 2,6-Декаметилен-4-нитрофенол (70) 2,6-Ундекаметилен-4-нитрофенол (64) 2,6-Додекаметилен-4-нитрофенол (74)1 2, 6-Тридекаметилен-4-нитрофенол (63) 2,6-Тетрадекаметилен-4-нитрофенол (67) 2,6-Пентадекаметилен-4-нитрофенол (40) 2, 6-Гексадекаметилен-4-нитрофенол (43) 2, 6-Гептадекаметилен-4-нитрофенол (47) 2, 6-Октадекаметилеи-4-нитрофенол (16) 2,6-Гептакосаметилен-4-нитрофенол А = CH3CH2CHCH2NO2 1 СН3СОС (А) (н-С3Н7) СООС2Н6 CHaCHsCfCN) (А)СООС2Н3
Продолжение табл. XXI
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
1-Нитробутен-1 и A=CH3CH2CHCH2NO2
Цианистый бензил2 грет-С5НцОК C6HsCH(A)CN 1049
Ацетилацетон Na CH3COCH(A)COCH3 (30) 1050
2-Нитробутен-1 и A = CH3CH2CH(NO2)CHs—
Малоновый эфир C2H6ONa ACH (COOCsHs) s 1051»
Фенилмалоновый Эфир CsHsONa C6H5C(A) (COOCsHs)s (13) 1051
Ацетоуксусный эфир Na CH3COCH (A) COOCsHs (25) 1048
Метиловый Эфир циануксус- Без катализатора ACH(CN) СООСНз (23) 1052
ной кислоты 4
Этиловый эфир циануксусной CsHsONa ACH(CN) COOCsHs (неочищенный 16) 1049, 1052
кислоты Б
1-Нитропропан 6 NaOH CH3CHsCH(A)NOs (18) 1052
2-Нитропропан 6 NaOH (CH3)sC(A))NOs (55) 1052
Ацетилацетон Na CH3COCH(A)COCH3 1050
2-Нитробутен-2 и A = CH3CHCH(NOs)CH3
Цианистый бензил CH3ONa C6H6CH(A)CN 92
Нитроэтан [CeHsCH2N(CH3)3]OH; CH3CH(A)NOs (28) 1045
C2HfiONa; пиперидин
2-Нитропропан C2HsONa (CH3)2C(A)NO2 (47) 1045
2-Мет,ил-1-нитропропен-1 и A = (CH3)2 CCHsNOs |
Малоновый эфир CsHsONa ACH(COOCsH6)s (72) 1051
Ацетоуксусный эфир Na CHaCOCH (A) COOCsHs 1048
Этиловый эфир циаиуксусиой (c2hs)»n >, ACH(CN) COOCsHs 1049
кислоты _ e. , t s
Цианистый бензил Цианистый n-бромбензил Ацетон трет-СвНцОК трет-СБНцОК Na C6HsCH(A)CN (60) n-BrCeH4CH(A)CN (70) 4CHsCOCH3 92 92 1053
1-Хлор-3-нитробутен-2 и 2-Нитропропан 1-Нитропентен-1 и Малоновый эфир CsH6ONa Na O<-l^f ^CH., II 1 (35-40) H3CC CHC (CH3)2 no2 (CH3)sC(NOs)C(CH3)sNOs (10—12) CH3C(NOs)=CHCH=C(CH3)s (3) CH3CHsCHsCH (CHsNOs) CH (COOCsHs) s (95J 1054 1051
3,3,4,4,5,5,5-Гептафтор-1 -ни- тропентен-1 и Нитрометан S Малоновый эфир CHsONa CsHsONa A = CFaCFsCFsCHCHsNOs 1 ACHsNOs (68) ACH (COOCsHs) s (54) 892 892
З-Нитроеексен-З и Малоновый эфир CsHsONa CHaCHsCH (NOs) CH (C2H5) CH (COOCsHs) 2 1051
Этиловый эфир а-нитро-у,у,у- трихлоркротоновой кислоты и Этиловый эфир нитроуксусной кислоты (CsHs)sNH 1 C13CCH [CH(NO2)COOC2H5]2 (34) 1055
1-Нитроциклогексен и Цианистый п-бромбензил грет-СвНцОК —CH (CN) C6H4Br-n (смесь изомеров, 8) 92
no2
Продолжение табл. XXI
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
1-Нитроциклогексен а
2-Нитропропан C2H6ONa 1045
(j- с (СНз)2 no2 (16)
no2
Метиловый эфир 2-нитропен- A = CH3CH2CHCH(NO2) СООСНз
тен-2-овой кислоты и
1,1-Динитроэтан NaOH, води. СНзОН AC(NO2)2CH3 (61) 842
Метиловый эфир 2,2-динитро- Na-Производное, вода (NO2)2C (А) СН2СН2СООСНз 842
масляной кислоты
1-(а-Фурил)-2-нитроэтилен и
Этиловый эфир нитроуксус- (C2Hs)2NH Этиловый эфир 3-(а-фурил)-2, 4-динитробутано- 646
НОЙ кислоты вой кислоты (95),
<й-Нитростирол и А = C6H5CHCH2NO2
Диметиловый эфир малоновой Na АСН (СООСНз) 2 349
КИСЛОТЫ /
Малоновый эфир C2H5ONa АСН(СООС2Н5)2 (51) 1056
Ацетоуксусный эфир Na; (C2He)8N СНзСОСН (А)СООС2Н5 (98) 1048, 1056
Этиловый эфир бензоилуксус- Na СбНзСОСН (А)СООС2Н5 1048
НОЙ кислоты
Ацетилацетон Na; (C2H5)3N СНзСОСН(А)СОСНз (78)) 1050, 1056
Бензоилацетон (C2H5)3N СбНзСОСН (А)СОСНз (86) 1056
Этиловый эфир нитроуксус- (C2Hj)2NH ACH(NO2)COOC2H5 (97) 6 167
НОЙ кислоты
Фенилнитрометан - (C2H6)2NH СбНзСН(А)НО2 (94) 646
ю-Нитростирол и
Диметиловый эфир малоно-
вой кислоты
Малоновый эфир
Этилмалоновый эфир
Метиловый эфир ацетоуксус-
ной кислоты
Ацетоуксусный эфир
w-Бутилацетоуксусный эфир
Метиловый эфир циануксус-
ной кислоты
Этиловый эфир циануксусной
кислоты
Цианацетамид
п-Нитростирол и
Диметиловый эфир малоновой
кислоты
Малоновый эфир
Этилмалоновый эфир
Метиловый эфир ацетоуксус-
ной кислоты
Ацетоуксусный эфир
«-Бутилацетоуксусный эфир
Метиловый эфир циануксус-
ной кислоты
Этиловый эфир циануксусной
кислоты
Цианацетамид
Нитрил малоновой кислоты
СНзОЫа
C2HsONa
C2H5ONa
CH3ON.a
C2H5ONa
C2H5ONa
CH3ONa
C2H5ONa
C2H5ONa
CH3ONa
C2H5ONa
C2HsONa
CH3ONa
C2H5ONa
C2H5ONa
CH3ONa
C2H5ONa
C2HsONa
C2H5ONa
А = o-O2NC6H4CH2CH2—
АСН(СООСНз)2 (49); (Л)2С(СООСН3)2 (2)
АСН(СООС2Н5)2 (72)
С2Н5С(А)(СООС2Н5)2 (44)
СНзСОСН (А) СООСНз (32)
СНзСОСН (А )СООС2Н5 (42)
СНзСОС (н-С4Н9) (А )СООС2Н5 (61)
ACH(CN) СООСНз (69)
ACH(CN)COOC2Hs (78)
(A)2C(CN)CONH2 (42)'
А = n-O2NC6H4CH2CH2—
АСН(СООСН3)2 (43), (А)2С(СООСНз)2 (32)
АСН(СООС2Н5)2 (45), (A)2C(COOC2HS)2 (34)'
АС(С2Н5)(СООС2Н5)2 (56)
СНзСОСН (А) СООСНз (38),
СНзСОС(А)2СООСН3 (24)1
СНзСОСН (А) СООС2Н5 (47),
СНзСОС (А)2СООС2Н5 (19)
СНзСОС (н-С4Н9) (А) СООС2Н6 (57)
(A)2C(CN)COOCH3 (79)
(A)2C(CN)COOC2H5 (80)
(A)2C(CN)CONH2 (73)
(A)2C(CN)2 (36)j
365
365
365
365
365
365
365
365
365
365
365
365
365
365
365
365
365
365
365
Продолжение табл. XXI
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
$-Метил-$-нитростирол и .Малоновый эфир Этиловый эфир $-(2-фурил)-а- нитроакриловой кислоты 9 и Этиловый эфир нитроуксусной кислоты ф. Этиловый эфир а-нитро-$-(2- •S3 пиридил)акриловой кисло- ты9 и Этиловый эфир нитроуксусной кислоты Этиловый эфир а-нитро-$-(3- пиридил)акриловой кисло- ты 9 и Этиловый эфир нитроуксусной кислоты Метиловый эфир а-нитроко- ричной кислоты 9 и .Метиловый эфир нитроуксус- ной кислоты Этиловый эфир а-нитрокорич- ной кислоты и Малоновый эфир Ацетоуксусный эфир Цианистый бензил Этиловый эфир нитроуксус- ной кислоты 9 Фенилнитрометан Этиловый эфир а, 2-динитро- коричной кислоты 9 и Этиловый эфир нитроуксус- ной кислоты Этиловый эфир а, 3-динитро- коричной кислоты 9 и Этиловый эфир нитроуксусной 2 кислоты сс Этиловый эфир а, 4-динитро- коричной кислоты и Ацетоуксусный эфир Этиловый эфнр нитроуксусной кислоты 9 Этиловый эфир 2-окси-а-нит- рокоричной кислоты 9 и Этиловый эфир нитроуксусной кислоты Этиловый эфир 4-окси-а-нит- рокоричной кислоты 9 и Этиловый эфир нитроуксусной кислоты Na-Енолят (C2H5)2NH (C2Hs)2NH (C2H5)2NH CH3NH2; (C2H5)2NH (C2H5)2NH (GH^NH (C2H5)2NH (C2H5)2NH (C2H5)2NH (C2H5)2NH (C2Hs)2NH (C2H5)2NH (C2H6)2NH (C2H6)2NH (C2Hs)2NH Диэтиловый эфир 3-нитро-2-фечилбутан-1, 1-лицарбоновой кислоты 71 8 (79) J—СН [СН (NO2) COOC2Hs]2 (83, 88)6 /ч СН [СН (NO2) COOC2Hs]2 (82. 84) 9 s'" /Ч_сн [СН (NO2) СООС2Н5]2 (55)9 \N^ C6H5CH[CH(NO2)COOCH3b (76) А = C6H5CHCH(NO2)COOC2HS Диэтиламид 3, 3-дикарбэтокси-1-нитро-2-фенилмасляной кислоты (82) СНзСОСН (А )СООС2Н5 (85) C6H5CH(A)CN (83) ACH(NO2)COOC2H5 (80, 84—98, 74) 9 CeHsCH(A)NO2 (82) 2-O2NC6H4CH[CH(NO2)COOC2Hs]2 (82, 68) 9 3-O2NC6H4CH[CH(NO2)COOC2H5]2 (90—95, 66)e СНзСОСН (COOC2H5)CH (C6H4NO2-4)CH (NO2)COOC2H5 (65) 4-O2NC6H4CH[CH(NO2)COOC2Hs]2 (82, 60, 38) 9 2-HOC6H4CH[CH(NO2)COOC2H5]2 (90, 98) 9 4-HOC6H4CH[CH(NO2)COOC2H5]2 (64) 9 93 167, 1055 167, 1055 167 1055 1057 1057 1057 167, 1055, 1057 1057 167, 1055 167. 1055 1057 167, 1055, 1057 167, 1055 167
Продолжение табл. XXI
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир 2-хлор-а-ни- трокоричной кислоты 9 и Этиловый эфир нитроуксусной (C2H5)2NH 2-ClC6H4CH[CH(NO2)COOC2H5]2 (97) в 167, 1055
кислоты Этиловый эфир 4-хлор-а-ни- трокоричной кислоты и Ацетоуксусный эфир (C2H5)2NH CHsCOCH (СООСгНз) CH (С6Н4С1-4) CH- 1057
Этиловый эфир циануксусной (C2H5)2NH (NO2) СООСгНз (85) NCCH (COOC2H5) CH (C6H4Cl-4) CH (NO2) - 1057
КИСЛОТЫ Этиловый эфир нитроуксусной (C2H5)2NH COOC2H5 (85) 4-ClC6H4CH [CH(NO2)COOC2H5]2(97) 6 167, 1055
кислоты 9 Этиловый эфир 4-метокси-а- нитрокоричной кислоты 9 и Этиловый эфир нитроуксусной (C2Hs)2NH 4-СН3ОСбН4СН[СН(МО2)СООСгН5]2 (72) 6 167
кислоты Этиловый эфир р-метил-а-ни- трокоричной кислоты 9 и Этиловый эфир нитроуксусной [C6H5CH2N(CH3)3]- .S' Этиловый эфир 1,3-динитро-2-метил-2-фенил- 167
кислоты Этиловый эфир циклогексил- иденнитроуксусной кисло- ты 10 и Этиловый эфир нитроуксусной OC4H9-H [C6H5CH2N (CHS) 3]- глутаровой кислоты (70) х^/СН (NO2) СООС2Н5 167
кислоты Этиловый эфир а-нитро-р-про- пилакриловой кислоты 9 и Этиловый эфир нитроуксусной OC4H9-H (C2H5)2NH |^\сн (NO2) СООС2Н5 (61) Этиловый эфир 1,З-динитро-2-н-пропилглута- 646
кислоты ________ ровой кислоты 6 (95)
Этиловый эфир р-изопропил- а-нитроакриловой кислоты9 и Этиловый эфир нитроуксусной кислоты (C2H5)2NH Этиловый эфир 1,З-динитро-2-изопропилглута- ровой кислоты 6 646
Этиловый эфир р-изобутил- а-нитроакриловой кислоты 9 и 646
Этиловый эфир нитроуксусной кислоты 2-Нитро-2-фенил-1-(3'-пири- д ил) этилен1' и (C2Hs)2NH Этиловый эфир 1, З-динитро-2-изобутилглута- ровой кислоты 6 (90)
Фенилнитрометан а-Нитростильбен и ch3nh2 1, З-Динитро-1, 3-дифенил-2-(3'-пиридил) про- пан (48) А = С6Н5СНСН (NO2) С6Н5 36
Диметиловый эфир малоно- 21 вой кислоты CH3ONa АСН (СООСНз)2 (85) 995
01 Малоновый эфир C2H5ONa АСН (СООСгНз) 2 (29) АСН (СООС2Н5) 2 (два изомера, 87) 12 36, 995 93
Ацетоуксусный эфир C2H5ONa СНзСОСН (А) СООСгНз (42) 36
Этиловый эфир циануксусной кислоты C2H5ONa СбНзСНгГЮг и CeH5CH=C(CN)COOC2H5 (60) 36
Ацетилацетон C2H5ONa СНзСОСН (А) СОСНз (11) 36
Фенилацетон C2H5ONa C6HSCH(A)COCH3 (13); С6Н5СН2МОг и С6Н5СН=С (С6Нз) СОСНз 36
Бензоилацетон C2H5ONa С6НзСОСН(А)СОСН3 (21)1 36
Фенилнитрометан 13 З-Нитро-1,4-дифенилбутен-З-он и CH3NH2 СбН5СН(А)ЬЮ2; 1-нитро-1, 2, 3-трифенилпро- пен-1; 3, 4,5-трифенилизоксазол 1058
Диметиловый эфир малоновой кислоты CH3ONa С6Н5СОСН2СН (NO2>CH (С6Н5) СН (СООСНз)г (65)14 1059
Продолжение табл. XXI
Сл
5
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
р-Н итробензилиденацетофенон и
Диметиловый эфир малоновой кислоты С6Н3СОСД=СГАО2)СД2С6/73 и Малоновый эфир CH3ONa \ CH3ONa с6н5 j^V-СООСНз (5) НбСАо>° или С6Н5СН=С [СН (СООСН3)2] СОС6Н5 СН2С6Н6 у/ —СООС2Н6 Н5сД 1=0 (небольшой) \О/ (20) 1060 1060
-ОЛ.
2 Ab®tracts ?т° соединение описано как 9-нитробицикло[5.3.1]гендека-1(11) 4 9-триен-11-(
» В этом !1»н”р»бутеиа‘’ №"°льзовался ₽-нитроИзопропиловый эфир уксусной кислоты
4 Вместо 2 н,™пй™МИ?аеТСЯ рЯД подоб1ных продуктов конденсаций Михаэля.
Вместо 2-нитробутеиа-1 использовался 1-диметиламино-2-нитробутан.
выход был^н^скольк^вышТ3'1 "спользовался >-Диэтиламино-2-нитробутан. При использовании соответствующего 1-диметиламиносоедииення
1 р<Е?ДуКТ РеакЧии был выделен в виде д-иэтиламмониевой соли дци-формы соединения.
и Это “Единение получено in situ из пиридин-З-карбомальдегида и фенилнитрометаиа. ' кетона.
» Эта пеякпмяИпоо2с2^ИЗОМерОВ пмучен1-' чистые соединения с выходами 47 и 17% соответственно.
ч™„Р^аКЦИЯ пРотекает при конденсации бензальдегида и фенилнитрометаиа в присутствии метиламина
Таблица XXII
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С “> Р-НЕНАСЫШЕННЫМИ СУЛЬФОНАМИ
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Метилвинилсулъфон и Малоновый эфир Фенилмалоновый эфир Ацетоуксусный эфир Этиловый эфир циануксусной кислоты Цианистый бензил Ацетилацетон Фенилацетон Нитрометан л-Бромфенилнитрометан Фенапил-п-толилсульфон бис- (Бензолсульфонил) метан бис- (Метансульфонил) метан Винил-н-бутилсулъфон и Нитроэтан 1-Нитропропан Винилизобутилсульфон и л-Бромфенилнитрометан Дивинилсульфон и 2-Нитроиропан [C6H5CH2N(CH3)3]OH [CcHeCH2N(CH3)3] ОН [C3H5CH2N(CH3)3]OH [C3H5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH [CcH5CH2N(CH3)3]OH [C6H5CH2N(CH3)3]OH Водн. KOH [CH3N(C2H5)3]OH [CeH5CH2N(CH3)3] OH [СбН5СН2М(СН3)3] OH [C6H5CH2N(CH3)3]OH Водн. NaOH Водн. KOH Водн. NaOH NaOH Водн. KOH A = СНзБОгСНгСНг— (A)2C(COOC2HE)2 (61) AC(CEHE)(COOC2H5)2 (58) CH3COC (A) 2COOC2H5 (7(^ NCC(A)2COOC2Hs (81) ЦСС(А)2СбН6 (68) СНзСОС (А)2COCH3 (36)\ СНзСОСН (А)2 (24) С6Н5СН(А)СОСНз (61) (A)3CNO2 (50) n-BrC6H4CH(A)NO2 (50)' СбНзСОСН (A) SO2C6H4CH3-n (61) (A)2C(SO2C6H5)2 (82) (A)2C(SO2CH3)2 (84)) А = h-C4H9SO2CH2CH2— ACH(CH3)NO2 (45), (A)2C(CH3)NO2 (13) (A)2C(CH3)NO2 (75) ACH(C2H5)NO2 и A2C(C2H5)NO2 (16), U3O-C4H9SO2CH2CH2CH (NO2) C6H4Br-n (30) O2S [CH2CH2C(CH3)2NOal2 130 130 130 130 130 130 130 1061 1061 130 130 130 1061 1061 1061 1061 1061
Продолжение табл. XXII
Реагирующие вещества Катализатор Продукт реакции (выход, %) Литература
Винил-п-толилсульфон и Нитрометан CH3ONa А = п-СНзСвН48О2СН2СН2— (A)2CHNO2 (91) 1062
1-Нитропропан Водн. КОН (Л) 2С (C2Hs) no2 1061
2-Нитропропан Водн. КОН (СНз)2С(Л)ИО2 1061
Фенилстирилсульфон и Малоновый эфир Na C6HsSO2CH2CH (С6Н5) СН (СООСгНз) 2 (97) 1062
п-Толилстирилсульфон и Малоновый эфир Na n-CH3CeH4SO2CH2CH (С6Н5) СН (СООС2Нз)2 1063
Дистирилсульфон и Малоновый эфир Na (количественный) O2S[CH2CH (СеН5) СН (СООС2Н5) 2]2 (74) 1064
N-Этиланилид винилсульфо- новой кислоты, и Нитрометан КОН, СНзОН А = CH2CH2SO2N (СгНз) СвНз (Л)зСИО2 (38—48) 381
Избыток КОН, СНзОН (Л)2СНИО2 (18) 381
Нитроэтан КОН, СНзОН (Л)2С(ИО2)СНз (18—61), ЛСН(ИО2)СН3 381
1-Нитропропан КОН, СНзОН (31—44) (Л)2С(ИО2)СН2СНз (31), ЛСН(ИО2)СН2СНз (35—40) (СНз)2С(Л)ИО2 (83) 381
2-Ннтропропан кон, СНзОН 381
Бромистый винилдиметилсуль- фоний и Малоновый эфир Водн. NaOH Соль 3, 3-дикарбэтоксипропилдиметилсульфония 22
Метиловый эфир ацетоуксус- Водн. NaOH (48) Бромистый (З-ацетил-З-карбометоксипропил) ди- 22
ной кислоты метилсульфоиий (68)
Таблица ХХ111
РЕАКЦИИ КОНДЕНСАЦИИ МИХАЭЛЯ С 2- и 4-ВИНИЛПИРИДИНАМИ, С АНАЛОГАМИ 2-ВИНИЛПИРИДИНА
и С ЭТИЛОВЫМ ЭФИРОМ ВИНИЛФОСФИНОВОЙ кислоты
Донор Катализатор Продукт реакции (выход, %) Литература
Малоновый эфир Этилмалоновый эфир Этиловый эфир изомасляной кислоты Этиловый эфир фенилуксус- ной кислоты Этиловый эфир 2-пиридил- уксусной кислоты Ацетоуксусный эфир н-Бутилацетоуксусный эфир 2-Карбэтоксициклопента нон А. 2-Е Na C2H5ONa Na Na [С6Н5СН2Н(СНз)з]ОН C2HsONa Na; C2H5ONa Na Na инилпиридин Л=Ч J—СН2СН2— \N^ ЛСН(СООС2Н5)2 (53) ЛСН(СООС2Нз)2 (84, 42—43, 62) (Л)2С(СООС2Н5)2 (42—43) ЛС(С2Н5)(СООС2Н5)2 (39) (СНз)2С(Л)СООС2НЕ (48) С6Н5СН(Л)СООС2Н5 11 1—СН (Л) СООС2Н5 (41, 61) \n^ СНзСОСН (Л) СООС2Нз (58, 50) СНзСОС(Н-С4Н9) (Л)СООСгНз (3) О [2ХсООС2Н6 (42) 1065 1066—1068 1068, 1066 1066 1069 1069 1070, 1071 1065, 1066 1069 1072
Продолжение табл. XXIII
Донор Катализатор Продукт реакции (выход, %) Литература
Этиловый эфир бензоилуксус- Na CeHsCOCH (A) COOC2HS (70) 513
НОЙ кислоты [CeH5CH2N(CH3)3lOH CeHsCOCH (A) COOC2H5 1069
у-Ацетил-у-бутиролактон Na О II 513
Этиловый эфир циануксусной Na L \/A (40) \cochs ACH(CN) COOCsHs (48) 826
кислоты Пропионитрил Na ‘ CH3CH(A)CN (19), CH3C(A)2CN (39) 1069
Цианистый бензил Na C6H5CH(A)CN (77) 826
Метилэтйлкето н Без катализатора CH3CH(A)COCH3 1073
[CeHsCH2N(CH3)31 OH CH3CH(A)COCH3 (53), СНзС(А)2СОСН3 (31) 1069
Na CHSCOCH(A)CH3 (71), СН3СОС(А)2СНз (31), 1069
Диэтилкетон Na АСН2СОС(А)2СНз (16) СНзСН2СОСН(А)СНз (53), СНзСН2СОС(А)2СНз (32) 1069
Ацетилацетон C2H5ONa СНзСОСН (А) СОСНз (16), СН3СОС(А)2СОСНз(7) 1066
Метилизопропилкетон Na СНзСОС(А) (СНз)2 (65), АСН2СОС(А)(СН3)2 1069
Метил изобутилкетон Na (31), (A)2CHCOC(A)(CHs)2 (39) СНзСОСН (А )СН (СНз) 2 (20), 1Ьб9
Диизопропилкетон Na СНзСОС(А)2СН(СН3)2 (34), АСН2СОС(А)2СН(СНз)2 (13) (СНз)2СНСОС(А)(СНз)2 (72)', 1069
Метил-н-амилкетон Na (СНз)2С(А)СОС(А) (СН3)2 (5) СНзСОСН (А )С4Н9-н (39), СНзСОС (А )2С4Н9-н (19) СНзСОСН(А)С4Н9-н (3) 1069
[C6HsCH2N(CH3)3]OH 1069
Д иизо бутилкетон
2,5,6-Триметилгептен-4-он-3 1
Ацетофенон
Фенилацетон
Пропиофенон
Дезоксибензоин
2-Ацетил фуран
2-Пиколин
й
4-Оксикумарин
З-Метил-4-оксикумарин
1-Циан-2-бензоил-1,2-дигидро-
изохинолин
Na
Na
Na
[CeH5CH2N(CH3)3lOH
C2H5ONa
Na
Na
[C6H5CH2N(CH3)3]OH
C2H5ONa
[C6H5CH2N(CH3)3]OH
Na
Na
Na
Li-Соль
(CH3)2CHCH2COCH(A)CH(CH3)2 (63),
(СН3)2СНСН2СОС(А)2СН(СН3)2 (14)
(СН3)2С (А) СОСН=С (СН3) СН (СН3)s (29)
С9Н5СОСН2А (8), С6Н5СОСН(А)2 (53)
С6Н5СОСН2А (11)
СНзСОСН (A)CeHs (32)
СНзСОСН (А)С6Н5 (44)
С6Н5СОСН(А)СНз (43), С6Н5СОС(А)2СНз (45)
С6Н5СОСН(А)СН3 (59)
С6Н5СОСН(А)С6Н5 (46)
. II J!—СОСН2А (5)
1, З-Ди-(а-пиридил) пропан (33)
ОН
2СН2СН (СН3) СОС6Н4ОН-2 (90)
СОС6Н6
(50)
1069
1069
1069
1069
1072
1069
1069
1069
1072
1069
476
513
513
834
П родолжение табл. XXII!
Донор Катализатор Продукт реакции (выход, %) Литература
Б. 4-Винилпиридин
Этиловый эфир бензоилуксус- ной кислоты у-Пиколин Na К 1-Бензоил-3-(у-пиридил) пропан 2 (51) 1, З-Ди-(у-пиридил) пропан (44) 1072 507 ।
В. Аналоги 2-винилгшридина
£2 Реагирующие вещества ю Катализатор Продукт реакции (выход, %) Литература
2-Винилхинолин 3 и Малоновый эфир Ацетоуксусный эфир Этиловый эфир бензоилуксус- ной кислоты 1-Винилизохинолин4 и Малоновый эфир C2H6ONa C2H6ONa C2H6ONa C2H6ONa . Z\Z4 Л — I || I ("'ll (-L1 ЛСН(СООС2Н5)2 (43) СНзСОСН (А)СООС2Н5 (44) С6Н5СОСН(А)СООС2Н5 (33) Z\Z\ 1 I i w \z\z 1. CHSCH2CH (CQOC₽H6), r 1074 1074 1074 1075
Г. Этиловый эфир винилфосфиновой кислоты [1076]
Катализатор C2H6ONa
Донор Продукт реакции (выход, %)
Малоновый эфир Метилмалоновый эфир Этилмалоновый эфир н-Пропилмалоновый эфир н-Бутилмалоновый эфир Ацетоуксусный эфир н-Пропилацетоуксусный эфир Этиловый эфир циануксусной кислоты Этиловый эфир метилциан- уксусной кислоты Этиловый эфир этилциан- уксусной кислоты Этиловый эфир изопропил- циануксусной кислоты Этиловый эфир н-бутилциан- уксусной кислоты Цианистый бензил Л=(С2Н6О)2Р(О)СН2СН2— ЛСН(СООС2Н6)2 (80) СНзС(Л) (СООС2Н6)2 (79) С2Н5С(Л)(СООС2Н5)2 (59) н-С3Н7С(Л)(СООС2Н6)2 (78) н-С4Н9С(Л)(СООС2Н6)2 (86) СНзСОСН (Л )СООС2Н5 (15) СН3СОС (А) (н-С3Н7) СООС2Н5 (16) ЦССН(Л)СООС2Н5 (16); ЦСС(Л)2СООС2Н5 (18) NCC(X) (СН3)СООС2Н6 (89) МСС(Л)(С2Н5)СООС2Н6 (66) ИСС(Л) (изо-СзН7)СООС2Н6 (84) НСС(Л)(н-С4Н9)СООС2Н5 (78) С6Н6С(Л)2СН (8)
1 Этот кетон образовывался и вступал в реакцию, когда метилизопропилкетон вводился вместе с металлическим натрием и 2-винилпиридином.
2 Этот продукт реакции получен после гидролиза и декарбоксилирования.
* Это соединение получено in situ из метосульфата 2-(£-диэтиламиноэтил)хинолина.
4 Если это соединение получали in situ из иодометилата 1-(р-д им ети ламиноэтил)изохинолина, то образовывались более сложные продукты
реакции.
Таблица XXIV
ДОНОРЫ, ПРИМЕНЯЕМЫЕ в РЕАКЦИЯХ КОНДЕНСАЦИИ МИХАЭЛЯ
Эфиры малоновой кислоты RCH(COOC2H6)2: R=H, Cl, Вг, NO2, метил,
этил, н-пропил, н-бутил, н-гексил, н-октил, н-децил, н-додецил, н-тетрадецил,
н-гексадецпл, Р-метоксиэтил, Р-этоксиэтил, фенил, бензил, фенилэтил, 1-наф-
тил, 1-нафтилметил, Р-(1-нафтилэтил), 2-нафтил, 2-нафтилметпл, Р-(2-нафтил-
этил), Р-альдегидоэтил, Р-альдегидопропил, ацетокси, формамидо, ацетамидо,
фталимидо, R'OOCCH2—, (R'OOC)2CH—, R'OOCH(CH3)CH(COOR')—,
CH2=C(COOC21I5)—, Р-иоиилиденацетил, пзобутирил.
Дибензиловый эфир малоновой кислоты, амид малоновой кислоты, эти-
ловый эфир полуамида малоновой кислоты, этиловый эфир амидиномалоно-
вой кислоты, диэтиловый эфир а-циан-р-метилянтарной кислоты, диэтиловый
эфир а-циан-Р, Р-диметилглутаровой кислоты.
Эфиры циануксусной кислоты RCH(CN)COOC2HS: R = H, метил, этил,
изопропил, н-бутил, фенил, фенилэтил, Р-альдегидоэтил, ацетамидо,
Р'ООС(СН2)зС(СНз) (CN)—.
Эфиры ацетоуксусной кислоты CH3COCHRCOOC2H5: R = H, метил,
этил, н-пропил, изопропил, н-бутил, изоамил, гексил, фенил, бензил,
аллил; ацетоацетанилид. Этиловый эфир иминоацетоуксусиой кислоты
CH3C( = NH)CH2COOC2H5 и его N-метильное производное; этиловый эфир
иминометилацетоуксусной кислоты CH3C( = NH)CH(CH3)COOC2H5.
Другие эфиры кетонокислот: этиловый эфир пропионилуксусной кислоты,
этиловый эфир бутирилуксусной кислоты, этиловый эфир изобутирилуксусной
кислоты, этиловый эфир гексаноилуксусной кислоты, у-этоксиацетоуксусный
эфир, этиловый эфир пальмитоилуксусной кислоты, этиловый эфир стеароил-
уксусной кислоты, диэтиловый эфир ацетон-1,3-дикарбоновой кислоты,
этиловый эфир изобутирилизомасляной кислоты, этиловый эфир
а-ацетилянтарной кислоты, этиловый эфир а-ацетиладипиновой кислоты,
С2И6ООССН2СН2СОСН (СНз) СООС2Н6, этиловый эфир бензоилуксусной кис-
лоты, этиловый эфир циклогексанонкарбоновой-2 кислоты и его 3-метильное
производное, этиловый эфир циклопентанонкарбоновой-2 кислоты и его 5-ме-
тильное производное, высшие эфиры циклоалканонкарбоновых-2 кислот,
2-карбометокситетралон-1, метиловый эфир 1-кето-1, 2, 3, 4-тетрагидрофенан-
тренкарбоновой-2 кислоты, ’ этиловый эфир камфоркарбоновой-3 кислоты,
З-этоксн-5,5-диметил-6-карбэтоксициклогексен-2-он, этиловый эфир фенилпи-
ровиноградной кислоты (а-кетоэфир).
Эфиры монокарбоновых кислот: уксусноэтиловый эфир, этиловый эфир
изомасляной кислоты, диэтиловый эфир глутаконовой кислоты, диэтиловый
эфир итаконовой кислоты, этиловый эфир фенилуксусной кислоты (а также
jm-NO2-, h-NO2-, С1-, Вг- и С2Н5-аналоги) и его аэтильное, н-пропильное,
н-бутильное, нзобутильное производные, этиловый эфир фуран-2-уксусной
кислоты, этиловый эфир тиофен-2-уксусной кислоты, этиловый эфир а-нафтил-
524
уксусной кислоты, метиловый эфир дифенилуксусной кислоты, этиловый эфир
а-пиридилуксусной кислоты, триэтиловый эфир фосфонуксусной кислоты,
триэтиловый эфир а-фосфонкапроновой кислоты.
Кетоны: ацетон, метилэтилкетон, метил-н-пропилкетон >, метилизопропил-
кетон *, метилизобутилкетон 1, пинаколин, метил-н-бутилкетоп *, метил-н-амил-
кетон ', диизопропилкетон *, диизобутплкетон, изопропил-н-амилкетон ’, изо-
пропил-н-нонилкетон *, метил-Р-цианэтилкетон, р, Р-диэтоксиэтилалкилкетоны,
ацетилацетон, ацетонилацетон ’, гептадекаидион-2,4, октадекандион-2,4, изо-
бутирилацетон, диизобутирилметан, циклопентанон, 2-метилциклопентан-
дион-1,3, циклогексанон, 2-метилциклогексанон, 3-метилциклогексанон, 4-ме-
тилциклогексанон, карвенон, дигидрокарвон, тетрагидрокарвон, карвотан-
апетон, циклогександион-1,2, 2-оксициклогексаион, 2-ацетоксициклогексанон,
циклогександион-1,3 и его 2-алкильные производные, 5, 5-диметилциклогексан-
дион-1,3, циклогексенилциклогексанон, 2-метил-6-изопропеиилциклогексанон,
2-альдегидоциклогексанон, 2-альдегидо-4-(п-карбоксициклогексил) циклогекса-
нон, 2-альдегидо-4- (п-карбометоксициклогексил) циклогексанон, высшие цикло-
алканоны, тетралон-1, 2-метилтетралон-1, 6-метокситетралон-1, 2-(Р-диэтил-
аминоэтил)тетралон-1, 2-оксиметилен-6-метокситетралон-1, тронс-декалон-2,
цпс-1-метилдекалоп-2, транс- 1-метилдекалон-2 и их 5-метокси-, 6-метокси-,
5,6-диметокси- и 6-карбэтоксипроизводные, 10-метилдекалон-2, 9-метилги-
дриндаион-8, антрон, 4-кето-1,2,3,4-тетрагидрофенантрен, 4-кето-1,2,3,4,9,
10,11,12-октагидрофенантрен >, 4,9-дикето-1,2, 3,4, 9,10,11,12-октагидрофенан-
трен *,
Н3С
Ацетофенон, фенилацетон, пропиофенон, нзобутирофенон, беизоилацетон,
дибензилкетон, дезоксибензоин, n-фенилацетилбифенил, дибензоилметан,
1,2-дибензоилэтан, а-метил-а-н-бутилацетофенон *, а-метил-а-н-октилацетофе-
нон *, а-этил-а-н-пропилацетофенон *, нзопропилбензилкетон ’, а-фенил-
а-я-октилацетон 2-фенилциклогексанон и его 6-бензилиденовое производ-
ное *, 2-альдегидо-4-(п-карбокси) циклогексанон, 2-альдегидо-4-(п-карбометокси-
фенил) циклогексанон, 2 -фенилциклогептанон.
2-Ацетилфуран *, 5-метил-2-ацетилфуран *, 2-пропиоиилфуран *, 5-метил-
2-пропиоиилфуран *, 2,5-диметил-З-ацетилфуран *, 2, 5-диметил-З-пропионил-
фуран *, 2-бутилфуран *, 2, 5-диметил-З-бутирилфуран *, 2-ацетилтиофен, 2-про-
пионилтиофен, 2-бутирилтиофен и их 5-метильные производные *, 2-ацетоаце-
тилтиофен *,
Ацетилацетонимин, бензоилацетонимин, (п-метплбензоил) ацетонимин.
Альдегиды: ацетальдегид пропионовый альдегид *, масляный альдегид,
изомасляный альдегид, диэтилацетальдегид *, гептальдегид, 2-этилгексаналь,
диэтилацетальдегид, фенилацетальдегид, а-фенилпропионовый альдегид *,
35 Зак. 794
525
Нитрилы: нитрил малоновой кислоты, ацетонитрил, пропионитрил, циан-
ацетамид и его N-алкильные производные, цианистый бензил и его произ-
водные с заместителем в ядре (о-С1, л-С1, Вг, СН3, ОСНз, NH2, n-Вг, NO2);
цианистый бензил с заместителем в a-положении [метил, этил, изопропил,
н-бутил, н-амил, 3-метилбутил, (1-циклогексенил), циклогексил, (и-хлорфе-
нил)', (2-тиенил), (2-пиридил) и Р-диэтиламиноэтил]; дифенилацетонитрил;
диэтиловый эфир цианметанфосфиновой кислоты, 2-цианциклогептанон,
CH3C(=NH)CH2CN, C6H6C(=NH)CH2CN.
Нитросоединения: нитрометан, нитроэтан, 1-нитропропан, 2-нитропропан,
1-нитробутан, 1-нитроизобутан, Р, Р-диннтроэтанол, метил-2-нитропропиловый
эфир, метил-2-нитропропилсульфид, бутил-3-нитробутилсульфон, нитроцикло-
гексан, динитрометан, фенилнитрометан и его n-бромпроизводное, метил-
2-нитро-1-фенилпропиловый эфир, метиловый и этиловый эфиры нитроуксусной
кислоты, метиловый эфир у,у-динитромасляной кислоты, нитромалоновый
эфир, 1,1-динитроэтан.
Сульфоны: фенилбензилсульфон, п-толилбензилсульфон, аллил-и-толил-
сульфон, этиловый эфир n-толуолсульфоуксусной кислоты, феиацил-п-толил-
сульфон, бис- (бензолсульфонил)метан, бис-(метансульфонил) метан.
Углеводороды и их производные: циклопентадиен, дивинилметан, ннден,
1-изопропилиденинден, флуорен, 2-нитрофлуорен *, 2,7-дибромфлуорен, 1-ме-
тилфлуорен, 9-фенилфлуорен, 9-оксифлуорен, эфиры флуорен-9-карбоновой
кислоты, этиловый эфир 1-метилфлуорен-9-карбоновой кислоты, 1,2,3,4 тетра-
гидрофлуорантен, 2,3,4-триметил-1, 2-дигидрофлуорантен, 4, 5-метиленфенан-
трен, метиловый эфир 4-циклопента[йе[]фенантрен-4-карбоновой кислоты.
Различные доноры (применявшиеся в отдельных случаях): а-ацето-у-бу-
тиролактон, этиловый эфир щавелевоуксусной кислоты и его а-метильное
производное, этиловый эфир p-метил-у-нитромасляной кислоты, диэтиловый
эфир янтарной кислоты, изофорон, 1-формил-2-кето-10-метил-Д3.6-гексагидро-
нафталин, а-нафтол (кетоформа), этиловый эфир 4-окси-2, 3-бензофуран-
5-карбоновой кислоты (кетоформа), 4-оксикумарин (кетоформа), 2-окси-
1,4-нафтохинон (кетоформа), 2-ацетилциклогексен-5-он, этиловый эфир
(3,4-дигидро-1-нафтил)циануксусной кислоты, этиловый эфир (1-метил-
1,2, 5,6-тетрагидро-4-пиридил)уксусной кислоты, а-пиколин, у-пиколин, а-хин-
альдин, у-хинальдин, роданин, кетон Инхоффена, койевая кислота, 1-метил-
оксиндол, 1,3-диметилоксиндол, метиловый эфир оксиндол-3-пропионовой кис-
лоты, 2,3-дигидро-2-фенилбензо-у-пирон.
1 Конденсируется только с акрилонитрилом в качестве акцептора.
Литература
527
ЛИТЕРАТУРА
1. Michael, J. prakt. Chem., [2] 35, 349 (1887).
2. Michael, Am. Chem. J., 9, 115 (1887).
3. Michael, J. prakt. Chem., [2] 49, 20 (1894).
4. Michael, Ber., 27, 2126 (1894).
5. Michael, Ber., 33, 3731 (1900).
6. Michael, Schulthess, J. prakt. Chem., [2] 45, 55 (1892),
7. Auwers, Ber., 24, 307 (1891).
8. Auwers, Roehner, Meyenburg, Ber., 24, 2887 (1891).
9. Auwers, Ber., 26, 364 (1893).
10. Auwers, Jacob, Ber., 27, 1115 (1894).
11. Auwers, Ber., 28, 1130 (1895).
12. Knoevenagel, Ann,, 281, 25 (1894), особенно стр. 33.
13. Knoevenagel, Ann., 281, 25 (1894), особенно стр. 53.
14. Knoevenagel, Ann., 289, 131 (1896), особенно стр. 170.
15. Knoevenagel, Ann., 297, 185 (1897).
16. Merling, Ber., 38, 979 (1905).
17. Knoevenagel, Schwartz, Ber., 39, 3441 (1906).
18. Knoevenagel, Mottek, Ber., 37, 4464 (1904).
19. Knoevenagel, Speyer, Ber., 35, 395 (1902).
20. С о п п о r, McClellan, J. Org. Chem., 3, 570 (1938).
21. H eneck a H., Chemie der Beta-Dicarbonyl-Verbindungen, Berlin —
Goettingen — Heidelberg, 1950.
22. Doering, Schreiber, J. Am. Chem. Soc., 77, 514 (1955).
23. Bohlmann, Inhoffen, Politt, Ann., 604, 207- (1957).
24. Dimroth, Criegee, Chem. Ber., 90, 2207 (1957).
25. Kroehnke, Honig, Chem. Ber., 90, 2215 (1957).
26. Kroehnke, Vogt, Ann., 600, 211 (1956); Chem. Ber., 90, 2227
(1957).
27. Kaufmann, Chem. Zentr., 1912, II, 978.
28. Leonard, Leubner, J. Am. Chem. Soc., 71, 3405 (1949).
29. Leonard, Leubner, Burk, J. Org. Chem., (5. 979 (1950).
30. Thorpe, Young, J. Chem. Soc., 77, 940 (1900).
31. Ingold, Powell, J. Chem. Soc., 119, 1976 (1921).
32. G i d v a n i, К о n, J. Chem. Soc., 1932, 2443.
33. G i d v a n i, К о n, Wright, J. Chem. Soc., 1932, 1027.
34. Koelsch, J. Am. Chem. Soc., 65, 437' (1943).
35. Gfob, Baumann, Helv. Chim. Acta, 38, 594 (1955).
36. Dor now, В oberg, Ann., 578, 101 (1952).
37. Vorlaender, Knoetzsch, Ann., 294, 317 (1897), особенно стр. 334.
38. Eschenmoser, Fuerst, Experientia, 7, 290 (1951).
39. Wallach, Ann., 388, 49 (1912).
40. Woodward, Brutschy, Baer, J. Am. Chem. Soc., 70, 4216 (1948).
44, Julia, Eschenmoser, Heusser, Tarkoy, Helv, Chim. Acta, 36,
1885 (1953).
35*
528
Литература
42. Achtermann, Hoppe-Seyler’s Z physiol. Chem., 225, 141 (1934).
43. Laucht, Hoppe-Seyler’s Z. physiol. Chem., 237, 236 (1935).
44. Cornforth, Hunter, Popjak, Biochem. J., 54, 590 (1953).
45. H i 11, J. Chem. Soc., 1928, 256.
46. Leonard, Simon, Felley, J. Am. Chem. Soc., 73, 857 (1951).
47. Vorlaender, Ber., 33, 3185 (1900).
48. Vorlaender, Koethner, Ann., 345, 158 (1906).
49. Me er wei n, Ber., 53, 1829 (1920).
50. Smith, Engelhardt, J. Am. Chem. Soc., 71, 2676 (1949).
51. Cornelson, Kostanecki, Ber., 29, 240 (1896).
52. Kostanecki, Rossbach, Ber., 29, 1488 (1896).
53. Me e r we i n, J. prakt. Chem., [2] 97, 225 (1918).
54. Arigoni, Viterbo, Duennenberger, Jeger, Ruzicka, Helv.
Chim. Acta, 37, 2306 (1954).
55. Schlenk, Hillemann, Rodloff, Ann., 487, 135 (1931).
56. Cp, Michael, Ross, J. Am. Chem. Soc., 53, 1150 (1931).
57. Michael, Ross, J. Am. Chem. Soc., 52, 4598 (1930).
58. Holden, Lapworth, J. Chem. Soc., 1931, 2368.
59. Ingold, J. Chem. Soc., 119, 305 (1921).
60. Ingold, J. Chem. Soc., 119, 951 (1921).
61. He neck a, Fortschr. chem. Forsch., 1, 685 (1950).
62. Michael, Ross, J. Am. Chem. Soc., 55, 1632 (1933).
63. Duff, Ingold, J. Chem. Soc., 1934, 87.
64. R у d о n, J. Chem. Soc., 1935, 420.
65. Gardner, R у d о n, J. Chem. Soc., 1938, 45.
66. Gardner, R у d о n, J. Chem. Soc., 1938, 48.
67. Gardner, Ry don, J. Chem. Soc., 1938, 42.
68. Cp. Ingold, R у d о n, J. Chem. Soc., 1935, 857.
69. S h a f e r P. R., Диссертация, Висконсинский университет, 1951.
70. Shafer, Loeb, Johnson, J. Am. Chem. Soc., 75, 5963 (1953).
71. Tsuruta, Yasuhara, Furukawa, J. Org. Chem., 18, 1246 (1953).
72. Simamura, Inamoto, Suehiro, Bull. Chem. Soc. Japan, 27, 221
(1954) [C. A., 49, 7494 (1955)].
73. Swan, J. Chem. Soc., 1955, 1039.
74. Samuel, Ginsburg, J. Chem. Soc., 1955, 1288.
75. Cp. Baker, Rothstein, Chem. a. Ind., 1955, 776.
76. Farmer, Ross, J. Chem. Soc., 127, 2358 (1925).
77. Farmer, Ross, J. Chem. Soc., 1926, 3233.
78. Q u d r a t -1 - Kh u d a, J. Indian Chem. Soc., 8, 215 (193i) [C. A., 26,
123 (1932)].
79. Kohler, Allen, J. Am. Chem. Soc., 46, i522 (1924).
80. Stobbe, Ann., 314, 111 (1901).
81. Connor, Fleming, Clayton, J. Am. Chem. Soc., 58, 1386 (1936).
82. Kohler, Am. Chem. J., 46, 474 (1911).
83. Kohler, Davis, J. Am. Chem. Soc., 41, 992 (1919).
84. Michael, Ross, J. Am. Chem. Soc., 53, 1150 (1931).
Литература
529
85. Howies, Thorpe, Udall, J. Chem. Soc., 77, 942 (1900),
86. Carter, Lawrence, Proc. Chem. Soc., 16, 178 (1900).
87. Avery, McGrew, J. Am. Chem. Soc., 57, 208 (1935).
88. Badger, Campbell, Cook, J. Chem. Soc.. 1949, 1084.
89. Borsche, Ber., 42, 4496 (1909).
90. Avery, J. Am. Chem. Soc., 50, 2512 (1928).
91. Avery, McDole, J. Am. Chem. Soc., 30, 1423 (1908).
92. Buckley, Hunt, Lowe, J. Chem. Soc., 1947, 1504!.
93. Bo b e г g, Schultze, Chem. Ber., 88, 74 (1955).
94. Wohl, Losanitsch, Ber., 40. 4698 (1907).
95. MacMillan, Mulholland, Dawkins, Ward, J. Chem. Soc., 1954,
429.
96. Colong e, Dreux, Kehlstadt, Compt. rend., 238, 693 (1954).
97. К a nd i ah, J. Chem. Soc., 1931, 922.
98. Charlish, Davies, Rose, J. Chem. Soc., 1948, 232.
99. Cook, L i n s t e a d, J. Chem. Soc., 1934, 956.
100. Barrett, Cook, Linstead, J. Chem. Soc., 1935, 1065.
101. Chuang, Tien, Ber., 69, 25 (1936).
102. Kon, Qudrat-I-Khuda, J. Chem. Soc., 1926, 3071.
103. Ruzicka, Koolhaas, Wind, Helv. Chim. Acta, 14, 1151 (1931).
104. Jones, Koch, J. Chem. Soc., 1942, 393.
105. Rapson, Robinson, J. Chem. Soc., 1935, 1285; Hawthorne,
Robinson, J. Chem. Soc., 1936, 763.
106. Peak, Robinson, J. Chem. Soc., 1936, 759.
107. Downes, Gill, Lions, J. Am. Chem. Soc., 72, 3464 (1950); Australian
J. Sci., 10, 147 (1948).
108. Kohler, Graustein, Merrill, J. Am. Chem. Soc., 44, 2536 (1922).
109. Colong e, Dreux, Kehlstadt, Bull. Soc. chim. France, 1954, 1404.
110. Howe, McQuillin, J. Chem. Soc., 1955, 2423.
111. Abe, Harukawa, Ishikawa, Miki, Sami, Proc. Japan Acad., 30,
116, 119 (1954) [C. A., 49, 14715 (1955)].
112. Corey, J. Am. Chem. Soc., 77, 1044 (1955).
113. Alder, Wirtz, Ann., 601, 138 (1956).
114. Helfer, Helv. Chim. Acta, 9, 814 (1926).
115. Johnson, Chem. a. Ind., 1956, 167.
116. Wettstein, Heusler, Ueberwasser, Wieland, Helv. Chim,
Acta, 40, 323 (1957).
117. Bachmann, Fornefeld, J. Am. Chem. Soc., 72, 5529 (195.0).
118. Ginsburg, Pappo, J. Chem. Soc., 1951, 938.
119. : В e r g m a n n, S z m u s z к о vi c z, J. Am. Chem. Soc., 75, 3226 (1953).
120. Ginsburg, Pappo, J. Chem. Soc., 1953, 1524.
121. Friedmann, J. prakt. Chem., [2] 146, 79 (1936).
122. Moe, Warner, Buckley, J. Am. Chem. Soc., 73, 1062 (1951).
123. Hill, Am. Chem. J., 24, 1 (1900).
124. Bachmann, Wick, J. Am. Chem. Soc., 72, 3388 (1950),
125. Boekelheide, J. Am. Chem, Soc., 69, 790 (1947).
530
Литература
126. Frank, Pieri е, J. Am. Chem. Soc., 73, 724 (1951),
127. Wilds, Ralls, Wildman, McCaleb. J. Am. Chem. Soc., 72, 5794
(1950).
128. Leonard, Felley, Nicolaides, J. Am. Chem. Soc., 74, 1700 (1952).
129. Buckley, Elliott, Hunt, Lowe, J. Chem. Soc., 1947, 1505.
130. Truce, Wellisch, J. Am. Chem. Soc, 74, 2881 (1952).
131. Henecka, Chem. Ber., 81, 197 (1948).
132. Henecka, Chem. Ber., 82, 41 (1949).
133. Henecka, Chem. Ber., 82, 104 (1949).
134. Henecka, Chem. Ber., 82, 112 (1949).
135. Chem. Werke Huels, пат. ФРГ 811231 [С. A., 47, 11234 (1953)].
136. Пудовик, Лебедева, ЖОХ, 22, 2128 (1952).
137. Connor, Andrews, J. Am. Chem. Soc, 56, 2713 (1934).
138. McAlpine, Ongley, Anal. Chem., 27, 55 (1955).
139. Arndt, Scholz, Frobel, Ann., 521, 111 (1936).
140. Thorpe, J. Chem. Soc., 95, 1901 (1909).
141. Mitchell, Thorpe, J. Chem. Soc, 97, 997 (1910).
142. Bone, Perkin, Jr., J. Chem. Soc., 67, 108 (1895).
143. Cp. Fittig, Roeder, Ann., 227, 13 (1885).
144. Cp. Best, Thorpe, J. Chem. Soc, 95, 697, 699 (1909).
145. Radulescu, Ber., 44, 1018 (1911).
146. Kierstead, Linstead, Weedon, J Chem. Soc., 1952, 3616.
147. Cp. Klotz, J. Am. Chem. Soc., 66, 88 (1944); Roberts, Green, J. Am.
Chem. Soc, 68, 214 (1946); Rogers, J. Am. Chem. Soc., 69, 2544 (1947);
cp. [137].
148. Kierstead, Linstead, Weedon, J. Chem. Soc, 1952, 3610.
149. Mariella, Peterson, Ferris, J. Am. Chem. Soc, 70, 1494 (1948).
150. Smith, Rogier, J. Am. Chem. Soc., 73, 3831 (1951).
151. Smith, Rogier, J. Am. Chem. Soc., 73, 3840 (1951).
152. Mariella, Raube, J. Org. Chem., 18, 282 (1953).
153. Greenfield, Friedel, Orchin, J. Am. Chem. Soc., 76, 1258 (1954).
154. Per old, J. S. African Chem. Inst, 6, 22 (1953) [C. A., 48, 4314 (1954)].
155. Eastman, J. Am. Chem. Soc., 76, 4115 (1954).
156. Eastman, Selover, J. Am. Chem. Soc., 76, 4118 (1954).
157. Kierstead, Linstead, Weedon, J. Chem. Soc, 1953, 1799.
158. Adams, Reifschneider, Bull. soc. chim. France, 1958, 23.
159. Caldwell, J. Chem. Soc, 1952, 2035.
160. Mu mm, Bergell, Ber., 45, 3040 (1912).
161. Schiff, Bertini, Ber., 30, 601 (1897).
162. Schiff, Ber., 31, 205 (1898).
163. Schiff, Ber., 31, 601 (1898).
164. Philpott, Jones, J. Chem. Soc., 1938, 337.
165. Betti, Gazz. chim. ital., 30, II, 301 (1900).
166. Lazzareschi, Gazz. chim. ital., 67, 371 (1937).
167. Dor now, Frese, Ann., 578, 122 (1952).
168. Krimm, пат. СЦ1А 2768962 [C. A„ 51, 6684 (1957)].
Литература
531
169. Haring, Wagner-Juareg, Helv. Chim. Acta, 40, 852 (1957),
170. Poppelsdorf, Holt, J. Chem. Soc., 1954, 4094.
171. Noland, Christensen, Sauer, Dutton, J. Am. Chem. Soc., 77,
456 (1955).
172. Farmer, Meth a, J. Chem. Soc., 1931, 2561.
173. Staudinger, Ruzicka, Nelv. Chim. Acta, 7, 442 (1924).
174. Warner, Moe, J. Am. Chem. Soc., 70. 3470 (1948).
175. Warner, Moe, J. Am. Chem. Soc., 71, 2586 (1949); пат. США 2468352
[С. A., 43, 7505 (1949)].
176. Warner, Мое, пат. США 2506050 (С. A., 44, 8946 (1950)].
177. Cope, Synerholm, J. Am. Chem. Soc., 72, 5228 (1950).
178. Me er we in, J. prakt. Chem., [2] 97, 225 (1918).
179. Haeusermann, Nelv. Chim. Acta, 34, 1482 (1951).
180. Meerwein, Ber., 53, 1829 (1920).
181. Nielsen, J. Am. Chem. Soc., 79, 2518, 2524 (1957).
182. Dor now, Ber., 72, 1548 (1939). Cp. Baumgarten, Dor now, Ber.,
72, 563 (1939).
183. Spaeth, Burger, Monatsh., 49, 265 (1928).
184. Miller, Robinson, J. Chem. Soc., 1934, 1535.
185. Ikawa, Stahmann, Link, J. Am. Chem. Soc., 66, 902 (1944).
186. Woods, J. Am. Chem. Soc., 74, 3959 (1952).
187. Tracy, E 1 d e r f i e 1 d, J. Org. Chem., 6, 63 (1941),
188. Joshi, Kaushal, Deshapande, J. Indian Chem. Soc., 18, 479
(1941) [C. A., 36, 4482 (1942)].
189. Farmer, Meth a, J. Chem. Soc., 1931, 1904.
190. Назаров, Терехова, Изв. АН СССР, ОХН, 1946, 201.
191. Vorlaender, Gaertner, Ann., 304, 1 (1899).
192. Komppa, Вег-., 32, 1421 (1899).
193. Шрайнер, Тодд, Синт. орг. пред., сб. 2, Издатинлит, 1949, стр. 220.
194. Vorlaender, Ann.. 294, 273 (1897).
195. Vorlaender, Erig, Ann., 294, 302 (1897).
196. Anker, Cook, J. Chem. Soc., 1945, 311.
197. Bardhan, J. Chem. Soc., 1929, 2223.
198. Kohler, J. Am. Chem. Soc., 44, 379 (1922).
199. Bickel, J. Am. Chem. Soc., 72, 1022 (1950).
200. Barat, J. Indian Chem. Soc., 7, 851 (1930) [C. A., 25, 2145 (1931)].
201. Smith, Kelly, J. Am. Chem. Soc., 74, 3305 (1952).
202. Woodward, Singh, J. Am. Chem. Soc., 72, 494 (1950),
203. С 1 e m о, M c Q u i 11 i n, J. Chem. Soc., 1952, 3839.
204. Gunstone, Tulloch, J. Appl. Chem., 4, 291 (1954).
205. Abe, Harukawa, Ishikawa, Miki, Sumi, Toga, Proc. Japan
Acad, 28, 425 (1952) [C. A, 48, 1317 (1954)].
206. G u n s t о n e, H e g g i e, J. Chem. Soc, 1952, 1437.
207. Иванов, Иванов, Вег, 76, 988 (1943).
208. Иванов, Иванов, Вег, 76, 1148 (1943),
209. Meerwein, Вег., 77, 229 (1944).
532
Литература
210. Vorlaender, Ber., 36, 2339 (1903).
211. Vorlaender, Groebel, Ann., 345, 155 (1906), особенно стр. 206.
212. Vo г 1 a e n d e r, Staudinger, Ann., 345, 155 (1906), особенно
стр. 217.
213. Wittig, Kos ack, Ann., 529, 167 (1937).
214. Kohler, Dewey, J. Am. Chem. Soc., 46, 1267 (1924).
215. Kohler, Helmkamp, J. Am. Chem. Soc., 46, 1018 (1924).
216. Marvel, Moore, J. Am. Chem. Soc., 71, 28 (1949).
217. Heilbron, Hill, J. Chem. Soc., 1928, 2863.
218. Heilbron, Forster, J. Chem. Soc., 125, 2064 (1924).
219. Heilbron, Hill, J. Chem. Soc., 1927, 918.
220. Jennings, McGookin, J. Chem. Soc., 1934, 1741.
221. H e i 1 b г о n, Forster, Whitworth, J. Chem. Soc., 127, 2159
(1925).
222. Peak, Robinson, J. Chem. Soc., 1937, 1581.
223. Andrews, Connor, J. Am. Chem. Soc., 57, 895 (1935),
224. Drake, Gilbert, J. Am. Chem. Soc., 52, 4965 (1930).
225. Kloetzel, J. Am. Chem. Soc., 69, 2271 (1947).
226. Turner, J. Am. Chem. Soc., 73, 1284 (1951).
227. Koelsch, Sundet, J. Am. Chem. Soc., 72, 1681 (1950).
228. Koelsch, Sundet, J. Am. Chem. Soc., 72, 1844 (1950).
229. Sastri, Seshadri, Proc. Indian Acad. Sci., 16A, 29 (1942) [C. A.,
37, 880 (1943)].
230. Pause, Shah, Wheeler, J. Indian Chem. Soc., 18, 453 (1941) [C. A.,
36, 4507 (1942)].
231. Pause, Shah, Wheeler, J. Univ. Bombay, 10, Part 3, 83 (1941)
[C. A., 36, 4507 (1942)].
232. Woodward R. В., частное сообщение.
233. Bradsher, Brown, Grantham, J. Am. Chem. Soc., 73, 5377
(1951).
234. Hawthorne, Robinson, J. Chem. Soc., 1936, 763.
235. Hewett, J. Chem. Soc., 1936, 50.
236. К a n d i a h, J. Chem. Soc., 1931, 952.
237. 'К on, Thakur, J. Chem. Soc., 1930, 2217.
238. Norris, Thorpe, J. Chem. Soc., 119, 1199 (1921).
239. Thakur, J. Chem. Soc., 1932, 2147.
240. Thakur, J. Chem. Soc., 1932, 2157.
241. Sen-Gupta, J. Chem. Soc., 107, 1347 (1915).
242. Taylor, Chem. a. Ind., 1954, 252. Cp, Cole, Chem. a- Ind., 1954, 661.
243. Briggs, Colebrook, Chem. a. Ind., 1955, 200.
244. Ayer, Taylor, J. Chem. Soc., 1955, 2227.
245. Allen, Bell, Can. J. Research, 11, 40 (1934) [C. A., 29, 150 (1935)].
246. Du Feu, McQuillin, Robinson, J. Chem. Soc., 1937, 53.
247. M c Q u i 11 i n, Robinson, J. Chem. Soc., 1938, 1097,
248. McQuillin, Robinson, J. Chem. Soc., 1941, 586.
249, Блик, Органические реакции, сб. 1, Госиноиздат, 1948, гл, 10,
Литература
533
250. Брестер, Элиель, Органические реакции, сб. 7, Издатинлит, 1956,
гл. HI.
251. Brad ford, Meek, Turnbull, Wilson, Chem. a. Ind., 1951, 839.
252. Eliel, Murphy, J. Am. Chem. Soc., 75, 3589 (1953).
253. Dornow, Theis, Ann., 581, 219 (1953).
254. Holland, N а у 1 e r, J. Chem. Soc., 1953, 280.
255. Gray, J. Am. Chem. Soc., 75, 1252 (1953).
256. Kissman, Witkop, J. Am. Chem. Soc., 75, 1967 (1953).
257. Atkinson, Poppelsdorf, Williams, J. Chem. Soc., 1953, 580.
258. Jones, Kornfeld, пат. США 2621187 [С. A., 47, 10557 (1953)].
259. Kutscher, Klamerth, Chem. Ber., 86, 352 (1953).
260. Бресте p, Элиель, Органические реакции, сб. 7, Издатинлит, 1956,
стр. 150.
261. Th esing, Chem. Ber., 87, 692 (1954).
262. Atkinson, J. Chem. Soc., 1954, 1329.
263. H e 11 m a n n, Hallman n, Lingen s, Chem. Ber., 86, 1346 (1953),
264. H a г d e g g e r, Cor rod i, Helv. Chim. Acta, 38, 468 (1955).
265. Albertson, Archer, Suter, J. Am. Chem. Soc., 66, 500 (1944).
266. Snyder, Smith, J. Am. Chem. Soc., 66, 350 (1944).
267. Lyttle, Weisblat, J. Am. Chem. Soc., 69, 2118 (1947).
268. Hegediis, Helv. Chim. Acta, 29, 1499 (1946).
269. Shoemaker, Keown, J. Am. Chem. Soc., 76, 6374 (1954).
270. Wood, Colburn, Jr., Cox, G a r 1 a n d, J. Am. Chem. Soc., 66, 1540
(1944).
271. Smith, Prichard, J. Org. Chem., 4, 342 (1939).
272. Smith, Boy ack, J. Am. Chem. Soc., 70, 2690 (1948).
273. Pechmann, Ber., 21, 3005 (1888).
274. Ikuta, J. prakt. Chem., [2] 45, 78 (1892).
275. Graebe, Levy, Ann., 283, 245 (1894).
276. Nenitzescu, Bull. Soc. Chim. Romania, 11, 37 (1929) [C. A., 24, 110
(1930)].
277. Smith, Kaiser, J. Am. Chem. Soc., 62, 133 (1940).
278. Smith, King, J. Am. Chem. Soc., 65, 441 (1943).
279. Smith, Dobrovolny, J. Am. Chem. Soc., 48, 1693 (1926).
280. Smith, Kaiser, J. Am. Chem. Soc., 62, 138 (1940).
281. Smith, Tenenbaum, J. Am. Chem. Soc., 59, 667 (1937).
282. Smith, Tess, Ullyot, J. Am. Chem. Soc.. 66, 1320 (1944).
283. Smith, Horner, Jr., J. Am. Chem. Soc., 60, 676 (1938)
284. Pratt, Luckenbaugh, Erickson, J. Org Chem, 19. 176
285. Pratt, Boehm e, J. Am. Chem. Soc., 73, 444 (1951).
286. Pratt, Rice, Luckenbaugh, J. Am Chem. Soc.,
287. Michel, Ber., 33, 2402 (1900).
288. Suryanarayana, Tilak, Proc. Indian Acad. Sci.,
[C. A., 49, 12411 (1955)].
' 289. Suryanarayana, Tilak, Proc. Indian Acad. Sci.,
(1954).
(1957).
(1954)
(1953)
79, 1212
39A, 185
38A, 534
[C. A., 49, 2396 (1955)].
534
Литература
290. Suryanarayana, Til а к, Current Sci. India, 22, 171 (1953) [C. A.,
48, 14212 (1954)].
291. Acharya, Tilak, Venkiteswaran, J. Sci. Ind. Research India, 14B,
250 (1955) [C. A., 50, 15531 (1956)].
292. Acharya, Suryanarayana, Tilak, J. Sci. Ind. Research India,
14B, 394 (1955) [C. A., 50, 12971 (1956)].
293. Bru son, Organic Reactions, Vol. 5, p. 79, 1949. См. также пат. США
2386736 [С. А., 40, 7234 (1946)].
294. Barkley, Levine, J. Am. Chem. Soc., 72, 3699 (1950).
295. C a m p b e 11, Carter, Slater, J. Chem. Soc., 1948, 1741.
296. Zellars, Levine, J. Org. Chem., 13, 911 (1948).
297. Bruson, N i e d er h a u ser, пат. США 2437906 [С. A., 42, 4196 (1948)].
298. Bruson, Riener, J. Am. Chem. Soc., 70, 214 (1948).
299. Thurston, канад. пат. 443713 [С. A., 42, 205 (1948)].
300. Wulff, Hopff, Wiest, герм. пат. 728531 (С. A., 38, 376 (1944)].
301. Bruson, Riener, J. Am. Chem. Soc., 65, 23 (1943).
302. Bruson, Riener, J. Am. Chem. Soc., 64, 2850 (1942),
303. Bruson, Riener, J. Am. Chem. Soc., 66, 56 (1944).
304. Bruson, Riener, J. Am. Chem. Soc., 75, 3585 (1953).
305. Julia, Compt. rend., 237, 913 (1953).
306. С о n i a, Bull. soc. chim. France, 1954, 690.
307. Bruson, J. Am. Chem. Soc., 64, 2457 (1942).
308. Campbell, Fairfull, J. Chem. Soc., 1949, 1239.
309. Koelsch, J. Am. Chem. Soc., 65, 2459 (1943).
310. Tucker, J. Chem. Soc., 1949, 2182.
311. Bruson, пат. США 2484683 [С. A., 44, 5904 (1950)].
312. Charlish, Davies, Rose, J. Chem. Soc., 1948, 227.
313. Bruson, пат. США 2370142 [С. A., 39, 3544 (1945)].
314. Herrmann, Vorlaender, Chem. Zentr., 1899, I, 730.
315. E 1 a d, Ginsburg, J. Chem. Soc., 1953, 4137.
316. Ingold, J. Chem. Soc., 119, 329 (1921).
317. Higson, Thorpe, J. Chem. Soc., 89, 1455 (1906),
318. Pechmann, Ber., 33, 3323 (1900).
319. Pechmann, Roehm, Ber., 34, 427 (1901).
320. Bergmann, Chem. Revs., 29, 529 (1941).
321. P ech m a n n, Bauer, Ober miller, Ber., 37, 2113 (1904).
322. Blaise, Compt. rend., 136, 692 (1903); Bull. soc. chim. France, [3] 29,
1028 (1903).
323. Baker, J. Chem. Soc., 1935, 188.
324. Sen-Gupta, Chakraborti, Bhattacharayya, J. Indian Chem.
Soc., 24, 249 (1947) [C. A., 43, 2584 (1949)].
325. Bhattacharayya В. K-, частное сообщение.
326. Koller, Krakauer, Monatsh., 53—54, 931 (1929).
327. Croxal, Fegley, J. Am. Chem. Soc., 72, 970 (1950).
328. Menon, J. Chem. Soc., 1935, 1061.
329. Menon, J. Chem. Soc., 1936, 1775,
Литература
535
330. Simonsen, J. Chem. Soc., 93, 1022 (1908).
331. Hurd, Sherwood, Jr., J. Org. Chem., 13, 471 (1948).
332. Knoevenagel, Fries, Ber., 31, 767 (1898).
333. Kooyman, Wibaut, Rec. trav. chim., 65, 10 (1946).
334. Wibaut, Kooyman, Rec. trav. chim., 63, 231 (1944).
335. Crossley, J. Chem. Soc., 79, 138 (1901); Proc. Chem. Soc., 16, 90
(1900).
336. Mitter, Roy, J. Indian Chem. Soc., 5, 33 (1928) [C. A., 22, 3882 (1928)].
337. Hope, J. Chem. Soc., 101, 892 (1912).
338. Cornforth, Robinson, J. Chem. Soc., 1949, 1855.
339. Cox, Me El vain, J. Am. Chem. Soc., 56, 2459 (1934).
340. Cox, Kroeker, McElvain, J. Am. Chem. Soc., 56, 1173 (1934).
341. Guthzeit, Ber., 34, 675 (1901).
342. Ingold, Perren, Thorpe, J. Chem. Soc., 121, 1765 (1922), особенно
стр. 1788.
343. Verka de, Verslag. Akad. Wetenschappen Amsterdam, 27, 1130 (1919)
[C. A., 13, 3149 (1919)].
344. Overberger, Kabasakalian, J. Am. Chem. Soc., 75, 6058 (1953).
345. Reid, Chem. a. Ind., 1953, 846.
346. Farmer, J. Chem. Soc., 121, 2015 (1922). '
347. Hauser, Yost, Ringler, J. Org. Chem., 14, 261 (1949).
348. Ryan, Dunlea, Proc. Roy. Irish Acad., 32B, 1 (1913) [Chem. Zentr.,
1913, II, 2039].
349. Kohler, Engelbrecht, J. Am. Chem. Soc., 41, 764 (1919),
350. Errera, Ber., 33, 2969, 3469 (1900).
351. Pa lit, J. Indian Chem. Soc., 14, 354 (1937) [C. A., 32, 561 (1938)].
352. Koelsch, Stephens, Jr., J. Am. Chem. Soc., 72, 2209 (1950),
353. F a r m e r, G h о s a 1, К о n, J. Chem. Soc., 1936, 1804.
354. Michael, J. Org. Chem., 2, 303 (1938).
355. Diels, Alder et al., Ann., 498, 16 (1932).
356. D i e I s, К e c h, Ann., 519, 140 (1935).
357. Diels, Pis tor, Ann., 530, 87 (1937).
358. Diels, Alder, Ann., 498, 16 (1932); 505, 103 (1933); 510, 87 (1934).
359. Diels, Kock, Ann., 556, 38 (1944).
360. Hill, Torrey, Jr., Am. Chem. J., 22, 89 (1899).
361. Hill, Hale, Am. Chem. J., 33, 1 (1905).
362. Hill, Ber., 33, 1241 (1900).
363. Prelog, Wiesner, Helv. Chim. Acta, 30, 1465 (1947).
364. Prelog, Wiesner, Ingold, Haefliger, Helv. Chim. Acta, 31,
1325 (1948).
365. Dale, Strobel, J. Am. Chem. Soc., 76, 6172 (1954).
366. Samuel, J. Chem. Phys., 12, 380 (1944); 13, 572 (1945).
367. Bergmann, Tschudnowsky, Ber., 65, 457 (1932).
368. Lister, Sutton, Trans. Faraday Soc., 35, 495 (1939). Cm. Arndt,
Eistert, Ber., 74, 423 (1941),
536
Литература
369. Koch, J. Chem. Soc., 1950, 2892.
370. Karr er, Antia, Schwyzer, Helv. Chim. Acta, 34, 1392 (1951),
371. Varsanyi, Ladik, Acta Chim. Acad. Sci. Hung., 3, 243 (1953) [C. A.,
47, 11000 (1953)].
372. Kloosterziel, Backer, Rec. trav. chim., 72, 185 (1953).
373. Z о 11 i n g e r, Buechler, Wittwer, Helv. Chim. Acta, 36, 1711
(1953).
374. В or dwell, Andersen, J. Am. Chem. Soc., 75, 6019 (1953).
375. Jaffe, J. Phys. Chem., 58, 185 (1954).
376. Price, Morita, J. Am. Chem. Soc., 75, 4747 (1953).
377. Price, Gillis, J. Am. Chem. Soc., 75, 4750 (1953).
378. Truce, McManimie, J. Am. <?hern. Soc., 75, 1672 (1953).
379. Truce, Simms, Hill, J. Am. Chem. Soc., 75, 5411 (1953).
380. Potter, J. Am. Chem. Soc., 76, 5472 (1954).
381. Buess, Jones, J. Am. Chem. Soc., 76, 5558 (1954).
382. Pullman, Berthier, Pullman, Bull. soc. chim. France, 1950, 1097.
383. Bergmann, Fischer, Bull. soc. chim. France, 1950, 1084.
384. Pi nek, Hilbert, J. Am. Chem. Soc., 68, 2014 (1946).
385. Pinck, Hilbert, J. Am. Chem. Soc., 68, 2739 (1946).
386. Schlenck, Mark, Ber., 55, 2296 (1922).
387. Bergmann, L a v i e, J. Am. Chem. Soc., 74, 3173 (1952).
388. Borsche, Niemann, Ber., 69, 1993 (1936).
389. Blood, Linstead, J. Chem. Soc., 1952, 2255.
390. Pinder, Robinson, J. Chem. Soc., 1952, 1224.
391. Colonge, Dreux, Bull. soc. chim. France, 1952, 47.
392. Basu, J. Indian Chem. Soc., 7, 815 (1930) [C. A., 25, 1528 (1931)].
393. В a r d h a n, J. Chem. Soc., 1929, 2223.
394. Julian, Printy, J. Am. Chem. Soc., 75, 5301 (1953).
395. Kloetzel, J. Am. Chem. Soc., 70, 3571 (1948).
396. Weiss, Hauser, J. Am. Chem. Soc., 71, 2026 (1949).
397. Smith, Norton, Ballard, J. Am. Chem. Soc., 75, 3316 (1953).
398. Taylor, Connor, J. Org. Chem., 6, 696 (1941).
399. Beer, Davenport, Robertson, J. Chem. Soc., 1953, 1262.
400. Acheson, J. Chem. Soc., 1952, 3415.
401. Julian, Printy, Ketcham, Doone, J. Am. Chem. Soc., 75, 5305
(1953).
402. Назаров. Завьялов, Изв. АН СССР, ОХН, 1952, 437.
403. Reid, Sause, J. Chem. Soc., 1954, 516.
404. Bagchi, Banerjee, J. Indian Chem. Soc., 23, 397 (1946) [C. A., 42,
1601 (1948)].
405. Dimroth, Angew. Chem., 59, 215 (1947).
406. Huber, Ber., 71, 725 (1938).
407. Johnson, Szmuszkovicz, Miller, J. Am. Chem. Soc., 72, 3726
(1950).
408. L u d e v i t z, Диссертация, Гёттинген, 1944.
409. Turner, Voitle, J. Am. Chem. Soc., 72, 4166 (1950).
Литература
537
410. Smith, Dale, J. Org. Chem., 15, 832 (1950).
411. Hills, M c Q u i 11 i n, J. Chem. Soc., 1953, 4060.
412. К о n, J. Chem. Soc., 1926, 1792.
413. Ba su, J. Indian Chem. Soc., 12, 299 (1935) (C. A, 29, 6878 (1935)].
414. Thorpe, Wood, J. Chem. Soc., 103, 1579 (1913).
415. Peak, Robinson, Walker, J. Chem. Soc., 1936, 752.
416. Tarbell, Wilson, 011, J. Am. Chem. Soc., 74, 6263 (1952).
417. Woods, J. Am. Chem. Soc., 69, 2549 (1947).
418. De Benneville, Clagett, Connor, J. Org. Chem., 6, 690 (1941).
419. Bloom, Ingold, J. Chem. Soc., 1931, 2765.
420. Basu, J. Indian Chem. Soc., 8, 319 (1931) [C. A., 26, 458 (1932)].
421. Smith, Davis, Jr., Sogn, J. Am. Chem. Soc., 72, 3651 (1950).
422. A11 e п, V a n A 11 a n, J. Org. Chem., 18, 882 (1953).
423. Braude, Wheeler, J. Chem. Soc., 1955, 329.
424. Talukdar, Bagchi, J. Org. Chem., 20, 13 (1955),
425. Kandiah, Linstead, J. Chem. Soc., 1929, 2139.
426. Connor, J. Am. Chem. Soc., 55, 4597 (1933).
427. Kohler, Conant, J. Am. Chem. Soc., 39, 1404 (1917).
428. Guthzeit, Weiss, Schaefer, J. prakt. Chem., [2] 80, 393 (1909),
429. To i von en, John, Saini o, Kuusinen, Suomen Kemistilehti, 8B, 46
(1935) (C. A., 30, 2185 (1936)].
430. Mannich, Koch, Borkowsky, Ber., 70, 355 (1937),
431. Rapson, J. Chem. Soc., 1936, 1626.
432. Claisen, Ann., 297, 1 (1897), особенно стр. 49.
433. Liebermann, Ber., 39, 2071 (1906) и предыдущие работы.
434. Feist, Delfs, Langenkamp, Ber., 59, 2958 (1926).
435. Feist, Janssen, Chen, Ber., 60, 199 (1927).
436. Beringer, Kuntz, J. Am. Chem. Soc., 73, 364 (1951).
437. Scheiber, Mei sei, Ber., 48, 238 (1915).
438. lonescu, Popescu, Bull. soc. chim. France, 51, 1215 (1932).
439. Warner, Мое, пат. США 2575376 [С. A., 46, 5082 (1952)].
440. Colonge, Dreux, Compt. rend., 231, 1504 (1950).
441. Ebel, Pest а, герм. пат. 714314 [С. A., 38, 1754 (1944)].
442. Deco mb e, Compt. rend., 205, 680 (1937).
443. Rabe, Weilinger, Ber., 36, 227 (1903).
444. Hinkel, Aylin g, Dippy, Angel, J. Chem. Soc., 1931, 814.
445. Mat tar, Hastings, Walker, J. Chem. Soc., (930, 2455.
446. Chuang, Ma, Tien, Ber., 68, 1946 (1935).
447. Vorlaender, Ann., 294, 253 (1897).
448. Papadakis, Scigliano, J. Am. Chem. Soc., 73, 5483 (1951).
449. Prelog, Metzler, Jeger, Helv. Chim. Acta, 30, 675 (1947).
450. Prelog, Ruzicka, Metzler, Helv. Chim. Acta, 30, 1883 (1947).
451. Meerwein, Schuermann, Ann., 398, 196 (1913), особенно стр. 223;
Meerwein et al., J. prakt. Chem., [2] 104, 161 (1922).
452. Feist, Pomme, Ann., 370, 72 (1909).
453. Ruhemann, J. Chem. Soc., 75, 245 (1899),
538
Литература
454. Ruhemann, J. Chem. Soc., 75, 411 (1899).
455. Ruhemann, Cunnington, J. Chem. Soc., 75, 778 (1899).
456. Forster, Heilbron, J. Chem. Soc., 125, 340 (1924).
457. Хаузер, Свэмер, Адамс, Органические реакции, сб. 8, Издатинлит,
1958, гл. 3. См. табл. XVI и XVII.
458. Paran j ре, Phalnikar, Bhide, Nargund, Current Sci. India, 12,
150 (1943) [C, A., 37, 6671 (1943)].
459. Dovey, Robinson, J. Chem. Soc., 1935, 1389.
460. Elder field, King, J. Am. Chem. Soc., 76, 5437 (1954).
461. Barat, J. Indian Chem. Soc., 7, 321 (1930) [C. A., 24, 4786 (1930)].
462. Ch after jee, J. Indian Chem. Soc., 29, 323 (1952) [C. A., 47, 9972
(1953)].
463. Ochiai, Ito, Ber., 74, Jill (1941).
464. Basu, Banerjee, J. Indian Chem. Soc., 12, 665 (1935) [C. A., 30,
2194 (1936)].
465. Basu, Ann., 512, 131 (1934).
466. Dornow, Machens, Chem. Ber., 80, 502 (1947).
467. Basu, Science and Culture India, 2, 466 (1937) [C. A., 31, 3919
(1937)].
468. Basu, Banerjee, Ann., 516, 243 (1935).
469. В er son, Br own, J. Am. Chem. Soc., 77, 444 (1955).
470. Clarke, Lapworth, J. Chem. Soc., 91, 694 (1907).
471. Miller, Ploechl, Ber., 31, 2718 (1898),
472. Bodforss, Ber., 64, 1111 (1931).
473, Freibs, Derr a, Ann., 589, 176 (1954).
474. Leonard, Hruda, Long, J. Am. Chem. Soc., 69, 690 (1947).
475. Leonard, Beck, J. Am. Chem. Soc., 70, 2504 (1948).
476. Leonard, Boyer, J. Am. Chem. Soc., 72, 4818 (1950).
477. Leonard, Shoemaker, J. Am. Chem. Soc., 71, 1762 (1949),
478 Leonard, Felley, J. Am. Chem. Soc., 71, 1758 (1949).
479. Leonard, Felley, J. Am. Chem. Soc., 72, 2537 (1950).
480. Albertson, Archer, J. Am. Chem. Soc., 67, 2043 (1945).
481, Gal at, J. Am. Chem. Soc., 69, 965 (1947).
482. Moe, Warner, J. Am. Chem. Soc., 70, 2763 (1948).
483. Rinderknecht, Niemann, J. Am. Chem. Soc., 72, 2296 (1950).
484. Van Zyl, Van Tamelen, Zuidema, J. Am. Chem. Soc., 73, 1765
(1951).
485. Snyder, Shekleton, Lewis, J. Am. Chem. Soc., 67, 310 (1945),
486. Moe, Warner, пат. США 2508927 [С. A., 44, 8374 (1950)].
487. Robinson, Proc. Univ. Durham Phil. Soc., 8, Part 1, 14 (1927—1928)
[C. A., 23, 1883 (1929)].
488. Bergmann E. D., неопубликованные данные.
489. Fishman, Zuffanti, J. Am. Chem. Soc., 73, 4466 (1951).
490. McElvain, Lyle, Jr., J. Am. Chem. Soc., 72, 384 (1950).
491. Hauser, Abramovitch, J. Am. Chem. Soc., 62, 1763 (1940),
492. Rogers, пат, США 2460536 [С. A., 43, 3446 (1949)],
Литература
539
493. Терентьев, Клабуновский, Будовский, Сборник статей
по общей химии, 2, 1612 (1953).
494. Hauser, J. Am. Chem. Soc., 60, 1957 (1938).
495. Hauser, В res low, J. Am. Chem. Soc., 62, 2389 (1940).
496. Берлин, Шерли и, ЖОХ, 8, 16 (1938).
497. Treibs. Michl, Ann., 589, 163 (1954).
498. Treibs, Herrmann, Ann., 592, 1 (1955).
499. Phalnikar, Nargund, J. Univ. Bombay, 4, 106 (1935) [C. A., 30,
5186 (1936)].
500. Harris, Stiller, Foikers, J. Am. Chem. Soc., 6(, 1242 (1939).
501. Howk, Langkammerer, пат. США 2579580 [С. A., 46, 7114 (1952)].
502. Bergmann, Korett, J. Org. Chem., 21, 107 (1956); 23, 1507
(1958).
503. Schmidle, Mansfield, пат. США 2658070 [С. A., 48, 13715 (1954)].
504. Wachs, Hedenburg, J. Am. Chem. Soc., 70, 2695 (1948).
505. Kloetzel, Mertel, J. Am. Chem. Soc., 72, 4786 (1950).
506. W e i z m a n n, Bergmann, Sulzbacher, J. Org. Chem., 15, 918
(1950).
507. Jampolsky, Baum, Kaiser, Sternbach, Goldberg, J. Am.
Chem. Soc., 74, 5222 (1952).
508. Wilds, Shunk, J. Am. Chem. Soc., 65, 469 (1943).
509. Feuer, Hass, Warren, J. Am. Chem. Soc., 71, 3078 (1949).
510. Croxall, Schneider, J. Am. Chem. Soc., 71, 1257 (1949). Cp.
Meisenheimer, Ann., 397, 295 (1913).
511. Ames, Bowman, J. Chem. Soc., 1950, 329.
512. Reid, Sack, J. Am. Chem. Soc., 73, 1985 (1951).
513. Boekelheide, Agnello, J. Am. Chem. Soc., 72, 5005 (1950).
514. Warner, Мое, пат. США 2520666 [С. A., 45, 643 (1951)].
515. Warner, Мое, пат. США 2575375 [С. A., 46, 5081 (1952)].
516. Moe, Warner, пат. США 2540053 [С. А., 45, 5720 (1951)].
517. Warner, Мое, пат. США 2523746 [С. А., 45, 5719 (1591)].
518. Warner, Мое, пат. США 2523743 [С. А., 45, 5718 (1951)].
519. Yamada, Chibat a, Tsurui, J. Pharm. Soc. Japan, 73, 123 (1953)
[C. A., 47, 11132 (1953)].
520. Warner, Мое, пат. США 2546958 [С. A„ 45, 8035 (1951)].
521. Jacquier, Zagdoun, Fontaine, Bull. soc. chim. France, 1953, 25.
522. Mousseron, Jacquier, Fontaine, Zagdoun, Bull. soc. chim.
France, 1954, 1246.
523. Moe, Warner, пат. США 2610204 [С. A., 47, 5961 (1953)].
524. Jacquier, Fontaine, Bull. soc. chim. France, 1952. 248.
525. Warner, Мое, пат. США 2532047 [С. A„ 45, 2971 (1951)].
526. Warner. Мое, пат. США 2532048 [С. A„ 45, 2971 (1951)].
527. Moe, Warner, пат. США 2551566 [С. А., 46, 133 (1952)].
528. Smith, пат. США 2516729 [С. А., 45, 6217 (1951)].
529. Shechter, Ley, Zeldin, J. Am. Chem. Soc., 74, 3664 (1952).
530- Warner, Moe, J. Am. Chem. Soc., 74, 1064 (1952),
540
Литература
531. N. V. de Bataafsche Petroleum Maatschappij, англ. пат. 666623 [С. A.,
46, 11230 (1952)].
532. Moe, Warner, пат. США 2599653 [С. А., 47, 3339 (1953)].
533. Мое. Warner, пат. США 2546960 [С. А., 45, 8036 (1951)].
534. Мое, Warner, пат. США 2540054 [С. А., 45, 5720 (1951)].
535. Mukherjee, Bhattacharyya, J. Indian Chem. Soc., 23, 451 (1946)
(C. A., 42, 128 (1948)].
536. Distillers Company Ltd., англ. пат. 706176 [С. A., 49, 9030 (1955)].
537. Dornow, Karlson, Ber., 73, 542 (1940).
538. Baumgarten, Dornow, Ber., 72, 563 (1939).
539. Fischer, Hultzsch, Ber., 68, 1726 (i935).
540. W e i z m а п п, англ. пат. 594182 [С. A., 42, 2986 (1948)].
541. Weizmann, пат. США 2472135 [С. А., 43, 6664 (1949)].
542. Мое, Warner, пат. США 2523710 [С. А., 45, 5717 (1951)].
543. Мое, Warner, пат. США 2628980 [С. А., 48, 724 (1954)].
544. Dornow, Н а г g е sh е i m er, Chem. Вег., 86, 461 (1953).
545. Kress, пат. США 2540267 [С. А., 45, 5720 (1951)].
546. Tsuruta, Bull. Inst. Chem. Research, Kyoto Univ., 31, 190 (1953)
[C. A., 49, 6183 (1955)].
547. Rhinesmith, J. Am. Chem. Soc., 58, 596 (1936).
548. Назаров, Завьялов, Изв. АН СССР, ОХН, 1952, 300.
549. Boehmе, Mundlos, Chem. Ber., 86, 1414 (1953).
550. Walker, J. Chem. Soc., 1935, 1585.
551. Wieland, Mi escher, Helv. Chim. Acta, 33, 2215 (1950).
Cp. Miescher, Wieland, Helv. Chim. Acta, 33, 1847 (1950).
552. Dauben, Tweit, Maclean, J. Am. Chem. Soc., 77, 48 (1955).
553. Dreiding, Tomasewski, J. Am. Chem. Soc., 77, 411 (1955).
554. Stork, Bull. soc. chim. France, 1955, 256.
555. Wilds, Werth, J. Org. Chem., 17, 1149 (1952).
556. Wilds, Werth, J. Org. Chem., 17, 1154 (1952).
557. Chem. Werke Huels, пат. ФРГ 833645 [С. A., 47, 2205 (1953)].
558. Stork, Terrell, Szmuszkovicz, J. Am. Chem. Soc., 76, 2029
(1954).
559. Walker, J. Am. Chem. Soc., 77, 3664 (1955).
560. Ralls, Wildman, McCaleb, Wilds, пат. США 2674627 [С. A.,
49, 1813 (1955)].
561. Назаров, Завьялов, ЖОХ, 23, 1703 (1953).
562. Wendler, Slates, пат. США 2542223 [С. А., 45, 7599 (1951)].
563. Poos, Arth, Beyle г, Sarett, J. Am. Chem. Soc., 75, 422 (1953).
564. Sarett, Beyle г, пат. США 2617828 [С. A., 47, 9365 (1953)].
565. Wieland, Ueberwasser, A n n er, Miescher, Helv. Chim. Acta,
36, 1231 (1953).
566. British Celanese Ltd., англ. пат. 671412 [С. A., 47, 2198 (1953)].
567. Stubbs, Tucker, J. Chem. Soc., 1950, 3288.
568. D a п n e n b e r g, D a n n e nb e r g - D r e s 1 er, Ann., 593, 232 (1955).
569. Leonard, Simon, J. Org. Chem., 17, 1262 (1952),
Литература
541
570. Маряелла, Синт. орг. преп., сб. 4, Издатинлит, 1953, стр. 553.
571. Wilds, Djerassi, J. Am. Chem. Soc., 68, 1715 (1946).
572. Blaise, Maire, Bull. soc. chim. France, [4] 3, 421 (1908),
573. Blaise, Maire, Bull. soc. chim. France, [4] 3, 413 (1908).
574. Woodward, Sondheimer, Taub, Heusler, McLamore, J.
Am. Chem. Soc., 74, 4223 (1952).
575. Dreux, Bull. soc. chim. France, 1954, 1443.
576. Wagtendon k, Wibaut, Rec. trav. chim., 61, 728 (1942).
577. Mariella, Leech, J. Am. Chem. Soc., 71, 331 (1949).
578. Guareschi, Chem. Zentr., 1899, I, 289
579. Moir, J. Chem. Soc., 81, 113 (1902).
580. Basu, J. Indian Chem. Soc., 12, 289 (1935) [C. A., 29, 6891 (1935)].
581. Steiner, Willhalm, Helv. Chim. Acta, 35, 1752 (1952).
582. Stobbe, Ber., 34, 1955 (1901).
583. Qudrat-I-Khuda, J. Chem. Soc., 1929, 201.
584. Smith, Engelhardt, J. Am. Chem. Soc., 71, 2671, 2676 (1949).
585. France, Maitland, Ticker, J. Chem. Soc., 1937, 1739.
586. Prelog, Komzak, Moor, Helv. Chim. Acta, 25, 1654 (1942).
587. Oparina, Ber., 64, 569 (1931).
588. Кочетков, ДАН СССР, 84, 289 (1952).
589. Eccott, Linstead, J. Chem. Soc., 1930, 905.
590. Qudrat-I-Khuda, J. Chem. Soc., 1929, 1913.
591. Frank, Hall, Jr., J. Am. Chem. Soc., 72, 1645 (1950).
592. Crossley, Proc. Chem. Soc., 17, 172 (1901).
593. В a r d h a n, J. Chem. Soc., 1928, 2604.
594. К on, Linstead, J. Chem. Soc., 127, 815 (1925).
595. К on, Let on, J. Chem. Soc., 1931, 2496.
596. Birch, Robinson, J. Chem. Soc., 1942, 488.
597. Allen, Cressman, J. Am. Chem. Soc., 55, 2953 (1933).
598. Abdullah, J. Indian Chem. Soc., 12, 62 (1935) [C. A., 29, 3995 (1935)].
599. Allen, Barker, J. Am. Chem. Soc., 54, 736 (1932).
600. Allen, Bridgess, J. Am. Chem. Soc., 51, 2151 (1929).
601. Walker, J. Chem. Soc., 1939, 120.
602. R о s e n m u n d, Herzberg, Schiitt, Chem. Ber., 87, 1258 (1954).
603. Vorlaender, Ber., 27, 2053 (1894).
604. Goh des, J. prakt. Chem., [2] 123, 169 (1929).
605. Albertson, J. Am. Chem. Soc., 72, 2594 (1950).
606. В a d d a r, Warren, J. Chem. Soc., 1939, 944.
607. Z augg, J. Am. Chem. Soc., 71, 1890 (1949).
608. Seidman, Robertson, Link, J. Am. Chem. Soc., 72, 5193 (1950).
609. Starr, Haber, пат. США 2666064 [С. A., 49, 380 (1955)].
610. Kuhn, Weiser, Chem. Ber., 88, 1601 (1955).
611. H ink el. Ay ling, Dippy, J. Chem. Soc., 1935, 539.
612. Horning, Field, J. Am. Chem. Soc., 68, 387 (1946),
613. Friedmann, J. prakt. Chem., [2] 146, 71 (1936),
614. Hinkel, Dippy, J, Chem. Soc., 1930, 1387,
542
Литература
615. Barat, J. Indian Chem. Soc., 8, 699 (1931) [C. A., 26, 1608 (1932)].
616. Basu, J. Indian Chem. Soc., 7, 481 (1930) [C. A., 24, 5752 (1930)].
617. Linstead, Williams, J. Chem. Soc., 1926, 2753.
618. Basu, J. Indian Chem. Soc., 8, 119 (1931) [C. A., 25, 4881 (1931)].
619. Friedmann, J. prakt Chem., [2] 146, 65 (1936).
620. Mukherji, Science and Culture India, 13, 39 (1947). [C. A., 42, 2957
(1948)].
621. Profit, Runge, Jumar, J. prakt. Chem., [4] 1, 57 (1954).
622. H i 11, J. Am. Chem. Soc., 49, 566 (1927).
623. Vorlaender, Kai коw, Ber., 30, 2268 (1897).
624. Avery, Biswell, Liston, J. Am. Chem. Soc., 54, 229 (1932).
625. Kohler, Rao, J. Am. Chem. Soc., 41, 1697 (1919).
626. Badger, Cook, Walker, J. Chem. Soc., 1948, 2011.
627. Vorlaender, Kunze, Ber., 59, 2078 (1926).
628. Mehr, Becker, Spoerri, J. Am. Chem. Soc., 77, 984 (1955).
629. Wislicenus, Carpenter, Ann., 302, 223 (1898).
630. Ziegler, Schnell, Ann., 445, 266 (1925).
631. Michael, Ross, J. Am. Chem. Soc., 54, 407 (1932); cm. Michael,
Ross, J. Am. Chem. Soc., 52, 4598 (1930).
632. Allen, Massey, Nicholls, J. Am. Chem. Soc., 59, 679 (1937).
633. Kohler, Graustein, Merrill, J. Am. Chem. Soc., 44, 2536 (1922),
634. Kohler, Souther, J. Am. Chem. Soc., 44, 2903 (1922).
635. Rupe, Stern, Helv. Chim. Acta, 10, 859 (1927).
636. Upson, Maxwell, Parmelee, J. Am. Chem. Soc., 52, 1971 (1930).
637. A 1 1 e n, S a 11 a n s, Can. J. Research, 9, 574 (1933) [C. A., 28, 2006
(1934)].
638. Kaplash, Shah, Wheeler, J. Indian Chem. Soc., 19, 117 (1942)
[C. A., 37, 375 (1943)].
639. Kaplash, Shah, Wheeler, Current Sci. India, 8, 512 (1939) [C. A.,
34, 5830 (1940)].
640. Stobbe, J. prakt. Chem., [2] 86, 209 (1912).
641. Cope, Fawcett, Munn, J. Am. Chem. Soc., 72, 3399 (1950).
642. Михайлов, ЖОХ, 7, 2950 (1937).
643. Kohler, J. Am. Chem. Soc., 46, 503 (1924).
644. Kohler, J. Am. Chem. Soc., 38, 889 (1916).
645. Worrall, Brad way, J. Am. Chem. Soc., 58, 1607 (1936),
646. Dornow, Frese, Ann., 581, 211 (1953).
647. Tucker, Whalley, J. Chem. Soc., 1949, 50.
648. Kohler, Hill, Bigelow, J. Am. Chem. Soc., 39, 2405 (1917).
649. Kohler, Williams, J. Am. Chem. Soc., 41, 1644 (1919).
650. Hill, J. Chem. Soc., 1935, 1115.
651. Kohler, Conant, J. Am. Chem. Soc., 39, 1699 (1917).
652. Pet row, Ber., 63, 898 (1930).
653. Dilthey, Tros ken, Plum, Schommer, J. prakt. Chem., [2] 141,
331 (1934).
(554. Retrow, Anzus, Ber,, 66, 420 (1933),
Литература
543
655. Allen, Scarrow, Can. J. Research, 11, 395 (1934) [C. A., 29, 121
(1935)].
656. Hedenburg, Wachs, J. Am. Chem. Soc., 70, 2216 (1948).
657. Hedenburg, пат. США 2524107 [С. A., 45, 811 (1951)].
658. Lutz, Palmer, J. Am. Chem. Soc., 57, 1947 (1935).
659. Garden, Gunstone, J. Chem. Soc., 1952, 2650.
660. Fuson, Mange, J. Org. Chem., 19, 806 (1954).
661. Polonovski, Pesson, Polmanss, Bull. soc. chim. France, 1953,
200.
662. Kwartler, Lindwall, J. Am. Chem. Soc., 59, 524 (1937).
663. S e s h a d г 1, Venkateswarlu, Proc. Indian Acad. Sci., 15A, 424
(1942) [C. A., 36, 7015 (1942)].
664. Lo, Cr ox a 11, J. Am. Chem. Soc., 76, 4166 (1954).
665. Wes too, Acta Chem. Scand., 7, 355 (1953) [C. A., 48, 3349 (1954)].
666. Bartlett, Woods, J. Am. Chem. Soc., 62, 2933 (1940).
667. McCoubrey, J. Chem. Soc., 1951, 2931.
668. Rosenfelder, Ginsburg, J. Chem. Soc., 1954, 2955.
669. Colo nge, Dreux, Delplace, Compt. rend., 238, 1237 (1954).
670. С о 1 о n g e, Bull. soc. chim. France, 1955, 250.
671. Shafer, Loeb, Johnson, J. Am. Chem. Soc., 75, 5963 (1953),
672. Rabe, Ber., 37, 1671 (1904).
673. Crony n, Riesser, J. Am. Chem. Soc., 75, 1664 (1953).
674. N i gh t i n g a 1 e, Erickson, Shackelford, J. Org. Chem., 17, 1005
(1952).
675. Robinson, Saxton, J. Chem. Soc., 1953, 2596.
676. Basu, Ann., 530, 131 (1937).
677. Basu, Ann., 514, 292 (1934).
678. Eistert, Reiss, Chem. Ber., 87, 92 (1954).
679. Назаров, Завьялов, Изв. АН СССР, ОХН, 1952, 437.
680. Robinson, Walker, J. Chem. Soc., 1935, 1530.
681. Rabe, Appuhn, Ber., 76, 982 (1943). Cp. Rabe, Ann., 360, 1005
(1952).
682. Desai, J. Indian Chem. Soc., 10, 257 (1933) [C. A., 27, 5310 (1933)].
683. Stauffacher, Schinz, Helv. Chim. Acta, 37, 1207 (1954).
684. Rosenmund, Herzberg, Chem. Ber., 87, 1575 (1954).
685. Eschenmoser, Schreiber, Julia, Helv. Chim. Acta, 36, 482
(1953),
686. Q u dr a t-1 - Khu d a, Mukherji, J. Chem. Soc., 1936, 570.
687. Friedmann, Robinson, Chem. a. Ind., 1951, 777.
688. Gunstone, Tulloch, J. Chem. Soc., 1955, 1130.
689. Winternitz, Mousseron, Rouzier, Bull. soc. chim. France, 1954,
316.
690. Amiel, Loeffler, Ginsburg, J. Am. Chem. Soc., 76, 3625 (1954).
691. Ginsburg, J. Chem. Soc., 1954, 2361.
692. Pappo, Ginsburg, Bull. Research Council Israel, 1, Part 1—2, 145
(1951) [C. A., 46, 7064 (1952)].
36*
544
Литература
693. Papp о, Ginsburg, Bull. Research Council Israel, 1, Part 3, 121
(1951) [C. A., 47, 2161 (1953)].
694. Sen, Neogi, J. Indian Chem. Soc., 7, 305 (1930) [C. A., 24, 4767
(1930)].
695. McQuillin, Chem. a. Ind., 1954, 311.
696. Dutt a, Chakravarti, Dutt a, Chem. a. Ind., 1955, 170.
697. Mukharji, Rah a, Science and Culture India, 19, 569 (1954) [C. A.,
49, 5414 (1955)].
698. Birch, Quartey, Chem. a. Ind., 1953, 489.
699. Ott, Tarbell, J. Am. Chem. Soc., 74, 6266 (1952).
700. Ginsburg, J. Am. Chem. Soc., 76, 3628 (1954).
701. Parihar, Dutt, Indian Soap J„ 16, 154 (1950) [C. A., 46, 8066 (1952)].
702. Ralls, J. Am. Chem. Soc., 75, 2123 (1953).
703. Mannich, Fourneau, Ber., 71, 2090 (1938).
704. Bardhan, Chem. a. Ind., 1940, 369.
705. Cardwell, McQuillin, J. Chem. Soc., 1949, 708.
706. Jacquier, Boyer, Bull. soc. chim. France, 1955, 8.
707. Jacquier, Boyer, Bull. soc. chim. France, 1954, 717.
708. Roy, Science and Culture India, 19, 156 (1953) [C. A., 48, 13660 (1954)].
709. Martin, Robinson, J. Chem. Soc., 1949, 1866.
710. Robinson, Sei jo, J. Chem. Soc., 1941, 582.
711. Hussey, Liao, Baker, J. Am. Chem. Soc., 75, 4727 (1953).
712. Prelog, Wirth, Ruzicka, Helv. Chim. Acta, 29, 1425 (1946).
713. Prelog, Barman, Zimmermann, Helv. Chim. Acta, 32, 1284
(1949).
714. Pre log, Ruzicka, Barman, Frenkiel, Helv. Chim. Acta, 31,
92 (1948).
715. Gill, James, Lions, Potts, J. Am. Chem. Soc., 74, 4293 (1952).
716. Wilds, Hoffman, Pearson, J. Am. Chem. Soc., 77, 647 (1955).
717. Johnston, Holly, пат. США 2671808 [С. A., 49, 3264 (1955)].
718. Banerjee, Chatterjee, Bhattacharya, J. Am. Chem. Soc., 77,
408 (1955).
719. Buechi, Jeger, Ruzicka, Helv. Chim. Acta, 31, 241 (1948).
720. Robinson, Weygand, J. Chem. Soc., 1941, 386.
721. Cook, Robinson, J. Chem. Soc., 1941, 391.
722. Cornfort h, Robinson, J. Chem. Soc., 1946, 676.
723. Grob, Jundt, Helv. Chim. Acta, 31, 1691 (1948).
724. Shunk, Wilds, J. Am. Chem. Soc., 71, 3946 (1949).
725. Ghosh, Robinson, J. Chem. Soc., 1944, 506.
726. Wilds, Shunk, J. Am. Chem. Soc., 72, 2388 (1950).
727. Martin, Robinson, J. Chem. Soc., 1943, 491.
728. Mu kh ar j i, J. Indian Chem. Soc., 24, 91 (1947) [C. A., 42, 1312
(1948)].
729. Huang, J. Chem. Soc., 1954, 3655.
730. Wieland, Miescher, Helv. Chim. Acta, 33, 2215 (1950).
731. CIBA, швейц, пат. -293104 (С. A., 49, 3263 (1955)].
Литература
545
732. Chaudhuari, Mukharji, Science and Culture India, 18, 602 (1953)
[C. A., 48, 7592 (1954)].
733. Wendler, Slates, Tishler, J. Am. Chem. Soc., 73, 3816 (1951).
734. Reichert, Poseman n, Arch. Pharm., 275, 67 (1937) [C. A., 31,
3984 (1937)].
735. В a r 11 г о p, J. Chem. Soc., 1946, 958.
736. Cardwell, J. Chem. Soc., 1949, 715.
737. Szmuszkovicz, Born, J. Am. Chem. Soc., 75, 3350 (1953).
738. McQuillin, J. Chem. Soc., 1955, 528.
739. Roy, Chem. a. Ind., 1954, 1393.
740. Howe, McQuillin, J. Chem. Soc., 1955, 2423.
741. Adamson, McQuillin, Robinson, Simonsen, J. Chem. Soc.,
1937, 1576.
742. Abe, Harukawa, Ishikawa, Miki, Sumi, Toga, J. Am. Chem.
Soc., 75, 2567 (1953).
743. Abe, Harukawa, Ishikawa, Miki, Sumi, Toga, Proc. Japan
Acad., 29, 113 (1953) [C. A., 48, 10706 (1954)].
744. Roy, Science and Culture India, 19, 266 (1953) [C. A., 49, 1676 (1955)].
745. Szmuszkowicz, J. Org. Chem., 19, 1424 (1954).
746. Jacquier, Boyer, Bull. soc. chim. France, 1954, 442.
747. Mannich, Koch, Ber., 75, 803 (1942).
748. Mannich, Koch, Borkowsky, Ber., 70, 355 (1937).
749. Logan, Marvell, La Pore, Bush, J. Am. Chem. Soc., 76, 4127
(1954).
750. Jacquier, Lanet, Bull. soc. chim. France, 1953, 795.
751. Treibs, Muehlstaedt, Chem. Ber., 87, 407 (1954).
752. J a c q u i e r, Christo], Bull. soc. chim. France, 1954, 556.
753. Noveilo, Christy, Sprague, J. Am. Chem. Soc., 75, 1330 (1953).
754. Noveilo F. С., частное сообщение.
755. Cope, Hermann, J. Am. Chem. Soc., 72, 3405 (1950).
756. Harradence, Lions, J. Proc. Roy. Soc. N. S. Wales, 72, 284 (1939)
[C. A., 33, 6825 (1939)].
757. Gill, Lions, J. Am. Chem. Soc., 72, 3468 (1950).
758. J u d a y, J. Am. Chem. Soc., 75, 4071 (1953).
759. Noveilo, Christy, J. Am. Chem. Soc., 75, 5431 (1953).
760. Lieberman, Wagner, J. Org. Chem., 14, 1001 (1949).
761. Dalgliesh, J. Am. Chem. Soc., 71, 1697 (1949).
762. Eliel, J. Am. Chem. Soc., 73, 43 (1951).
763. Snyder, Hamlin, J. Am. Chem. Soc., 72, 5082 (1950).
764. Bernatek, Acta Chem. Scand., 7, 677 (1953) [C. A., 48, 4501 (1954)].
765. lonescu, Bull. soc. chim. France, [4] 41, 1094 (1927).
766. Smith, Nichols, J. Am. Chem. Soc., 65, 1739 (1943).
767. Smith, Wiley, J. Am. Chem. Soc., 68, 894 (1946).
768. Smith, Byers, J. Am. Chem. Soc., 63, 612 (1941).
769. Smith, MacMullen, J. Am. Chem. Soc., 58, 629 (1936).
770. В er gel, Jacob, Todd, Work, J. Chem. Soc., 1938, 1375.
546
Литература
771. Smith, Johnson, J. Am. Chem. Soc., 59, 673 (1937),
772. Smith, J. Am. Chem. Soc., 56, 472 (1934).
773, Smith, Denyes, J. Am. Chem. Soc., 58, 304 (1936)..
774. Smith, О p i e, J. Am. Chem. Soc., 63, 932 (1941).
775. Smith, Webster, J. Am. Chem. Soc., 59, 662 (1937).
776. Adams, Acker, J. Am. Chem. Soc., 74, 5872 (19Э2).
777. Adams, Blomstrom, J. Am. Chem. Soc., 75, 3404 (1953).
778. Adams, Moje, J. Am. Chem. Soc., 74, 5557 (1952),
779. Adams, Way, J. Am. Chem. Soc., 76, 2763 (1954).
780. CIBA, швейц, пат. 276141 [С. A., 47, 7546 (1953)].
781. CIBA, англ. пат. 666713 [С. А., 47, 7546 (1953)].
782. Н о f f m a n n, T a g m a n n, Helv. Chim. Acta, 32, 1470 (1949).
783. E. I. du Pont de Nemours and Co., англ. пат. 576427 [С. A., 42,2269 (1948)],
784. Hoch, Karrer, Helv. Chim. Acta, 37, 397 (1954),
785. Fuson, Mili er, J. Org. Chem., 17, 886 (1952).
786. Терентьев, Гурвич, Вестник Московского университета, 5, № 5
(1950).
787. Bruson, пат. США 2383444 [С. А., 40, 351 (1946)].
788. Bruson, Riener, J. Am. Chem. Soc., 64, 2850 (1942).
789. Baumgarten, Eifert, J. Am. Chem. Soc., 75, 3015 (1953).
790. Wiest, Glaser, пат. США 2403570 [С. A., 40, 6498 (1946)].
791. Frank, McPherson, Jr., J. Am. Chem. Soc., 71, 1387 (1949).
792. Bruson, пат. США 2386736 [С. A., 40, 7234 (1946)].
793. Терентьев, Гурвич, Сборник статей по общей химии, 1,
404 (1953).
794. Терентьев, Кост, Гурвич, ЖОХ, 22, 1977 (1952).
795. Левина, Шушерина, Каминская, ДАН СССР, 86, 79 (1952).
796. Назаров, Швехгеймер, Руденко, ЖОХ, 24, 319 (1954).
797. Назаров, Завьялов, ЖОХ, 24, 469 (1954).
798. S tetter, Соепеп, Chem. Вег., 87, 990 (1954).
799. I w а п о f f, Chem. Ber., 87, 1600 (1954).
800, Boekelheide, J. Am. Chem. Soc., 69, 790 (1947).
801, Barkley, Farrar, Knowles, Raffelson, Thompson, J. Am.
Chem. Soc., 76, 5014 (1954).
802. P i n d er, R ob i n s о n, Nature, 167,484 (1951).
803. Chem. Werke Huels, пат. ФРГ 811350 [С. A, 47, 3337 (1953)].
804. Daub, Doyle, J. Am. Chem. Soc., 74, 4449 (1952).
805. Ac a г a, Levine, J. Am. Chem. Soc., 72, 2864 (1950).
806. Horning, Rutenberg, J. Am. Chem. Soc., 72, 3534 (1950).
807. Albertson, Fillman, J. Am. Chem. Soc., 71, 2818 (1949),
808. Mikesk а, пат. США 2461336 [С. A., 43, 4689 (1949)].
809. Hesse, Buecking, Ann., 563, 31 (1949).
810. Smrt, Sorm, Collections Czechoslov. Chem. Communs, 18, 131 (1953)
[C. A., 48, 3903 (1954)].
811. Ansell, Hey, J. Chem. Soc., 1950, 1683.
812. Floyd, J. Am. Chem. Soc., 71, 1746 (1949).
Литература
547
813. Wideqvist, Arkiv Kemi, 3, 59 (1951) [C. A., 45, 10217 (1951)],
814. Green, Hey, J. Chem. Soc., 1954, 4306.
815. Newman, McPherson, J. Org. Chem., 19, 1717 (1954).
816. T a I u к d a r, Bagchi, Science and Culture India, 19, 201 (1953)
[C. A., 49, 1656 (1955)].
817. Talukdar, Bagchi, J. Org. Chem., 20, 21 (1955).
818. T a 1 u к d a r, Bagchi, Science and Culture India. 18, 503 (1953)
[C. A., 48, 8180 (1954)].
819. Raha, Mukharji, J. Org. Chem., 19, 1376 (1954).
820. Horning, Finelli, J. Am. Chem. Soc., 71, 3204 (1949); Синт. opr,
прей., сб. 4, Издатинлит, 1955.
821. Banerjee, Shafer, J. Am. Chem. Soc., 72, 1931 (1950).
822. Walter, Barry, пат. CHIA 2524643 [C. A., 45, 7154 (1951)].
823. Campbell, Tucker, J. Chem. Soc., 1949, 2623.
824. Holbro, Tagman n, Helv. Chim. Acta, 33, 2178 (1950).
825. C a m p b e 11, R e i d, J. Chem. Soc., 1952, 3281.
826. Boekelheide, Linn, O’Grady, Lamborg, J. Am. Chem. Soc.,
75, 3243 (1953).
827. Y о h o, Levine, J. Am. Chem. Soc., 74, 5597 (1952).
828. Misra, S h u к 1 a, J. Indian Chem. Soc., 29, 455 (1952).
829. Misra, S h u к I a, J. Indian Chem. Soc.,. 30, 37 (1953).
830. Koelsch, Walker, J. Am. Chem. Soc., 72, 346 (1950).
831. Nakazawa, Matsuura, J. Pharm. Soc. Japan, 72, 51 (1952) [C. A.,
46, 11142 (1952)].
832. Bachmann, Johnson, J. Am. Chem. Soc., 71, 3463 (1949).
833. Кост, Терентьев, ЖОХ, 22, 655 (1952).
834. Boekelheide, Godfrey, J. Am. Chem. Soc., 75, 3679 (1953).
835. Misra, S h u к 1 a, J. Indian Chem. Soc., 29, 201 (1952).
836. Rubin, Wishinsky, J. Am. Chem. Soc., 68, 828 (1946).
837. Ta gm an n, Sury, Hoffmann, Helv. Chim. Acta, 35, 1541 (1952).
838. Herzog, Gold, Geckler, J. Am. Chem. Soc., 73, 749 (1951).
839. KI a ger, J. Org. Chem., 16, 161 (1951).
840. Boyd, Leshin, J. Am. Chem. Soc., 74, 2675 (1952).
841. Родионов, Беликов, ДАН СССР, 93, 827 (1953).
842. Klager, J. Org. Chem., 20, 650 (1955).
843. Bruson, пат. США 2435552 [С. A., 42, 3778 (1948)].
844. Asthana, Misra, J. Indian Chem. Soc., 31, 459 (1954),
845. Ladd, пат. США 2632019 [С. A., 48, 1418 (1954)].
846. Fiszer, Michalski, Roczniki Chem., 28, 185 (1954) [C, A., 49,
9493 (1955)].
847. Koelsch, J. Am. Chem. Soc., 65, 2460 (1943),
848. Koelsch, J. Am. Chem. Soc., 68, 146 (1946).
849. Koelsch, Rolfson, J. Am. Chem. Soc., 72, 1871 (1950).
850. Birch, К on, J. Chem. Soc., 123, 2440 (1923).
851, Linstead, Millidge, J. Chem. Soc., 1936, 478.
548
Литература
852. Oesterr. Stickstoffwerke A. G., австр. пат. 176845 [С. A., 48, 10772
(1954)].
853. Albertson, J. Am. Chem. Soc., 70, 669 (1948).
854. Koelscb, J. Am. Chem. Soc., 65, 2458 (1943).
855. Sury, Hoffmann, Helv. Chim. Acta, 36, 1815 (1953). Ср. T a g m a n n,
Sury, Hoffmann, Helv. Chim. Acta, 35, 1235, 1541 (1952).
856. Johnson, Johnson, Petersen, J. Am. Chem. Soc., 68, 1926
(1946).
857. Schneider, Riener, Bruson, J. Am. Chem. Soc., 72, 1486 (1950).
858. Lloyd, Horning, J. Am. Chem Soc., 76, 3651 (1954).
859. Bruson, пат. США 2390918 [С. A., 40, 2456 (1946)].
860. Micheel, Albers, Ann., 581, 225 (1953).
861. Kloetzel, J. Am. Chem. Soc., 70, 3571 (1948).
862. Theil acker, Wendtland, Ann., 570, 33 (1950).
863. Моффетт, Синт. огр. преп., сб. 4, Издатинлит, 1953.
864. Brown, Gulick, J. Am. Chem. Soc., 77, 1079 (1955).
865. KI a ger, пат. США 2640072 [С. A., 48, 7626 (1954)].
866. KI a ger, пат. США 2668176 [С. A., 49, 4013 (1955)].
867. Floyd, Miller, J. Org. Chem., 16, 882 (1951).
868. Kappeler, Stauffacher, Eschenmoser, Schinz, Helv. Chim.
Acta, 37, 957 (1954).
869. S t a u f f a c h er, S ch i n z,‘Helv. Chim. Acta, 37, 1223 (1954).
870. Perkin, Jr., Thorpe, J. Chem. Soc., 85, 128 (1904).
871. Plattner, Fuerst, Meyer, Keller, Helv. Chim. Acta, 37, 266
(1954).
872. Barat, J. Indian Chem. Soc., 8, 37 (1931).
873. Stetter, Buentgen, Coenen, Chem. Ber., 88, 77 (1955).
874. Horner, Ann., 548, 117 (1941).
875. Palazzo, Rosnati, Gazz. chim. ital., 82, 584 (1952).
876. Weisblat, Lyttle, пат. США 2606921 [С. A., 47, 4903 (1953)].
877. Дрямова, Завьялов, Преображенский, ЖОХ, 18, 1733
(1948).
878. Woods, J. Am. Chem. Soc., 75, 1510 (1953).
879. Hunsdiecker, 75, 1197 (1942).
880. Komppa, Rohrman n, Ann. Acad. Sci. Fennicae, A44, Ns 3 (1935)
]C. A., 30, 2949 (1936)].
881. Scheibler, Emden, Neubner, Ber., 63, 1557 (1930).
882. Edwards, Jr., Cash aw, J. Am. Chem. Soc., 76, 6188 (1954).
883. Schilling, Vorlaender, Ann., 308, 184 (1899).
884. Blanchard, Goering, J. Am. Chem. Soc., 73, 5863 (1951).
885. Bhattacharyya, J. Indian Chem. Soc., 22, 214 (1945).
886. В h a 11 a c h a г у у a. Science and Culture India, 8, 426 (1943) [C. A.,
37, 5031 (1943)].
887. Herz, J. Org. Chem., 20, 1062 (1955).
888. Chakravarti, J. Indian Chem. Soc., 21, 319 (1944).
889. Hope, Perkin, Jr., J. Chem. Soc., 99, 762 (1911).
Литература
549
890. В а г 11 г о р, J. Chem. Soc., 1947, 399.
891. Ruhemann, Wolf, J. Chem. Soc., 69, 1383 (1896).
892. Cook, Pierce, McBee, J. Am. Chem. Soc., 76, 83 (1954).
893. Nolle r, Pannell, J. Am. Chem. Soc., 77, 1862 (1955).
894. Talukdar, Bagchi, J. Org. Chem., 20, 25 (1955).
895. Auwers, Ko eb n e r, Ber., 24, 1935 (1891).
896. Ruzicka, Helv. Chim. Acta, 2, 144 (1919).
897. Phalnikar, N ar gu nd, J. Univ. Bombay, 4, 106 (1935) [C. A., 30,
5186 (1936)].
898. Miwa, Ohsuka, Sakan, J. Chem. Soc. Japan, Pure Chem. Sect., 74,
113 (1953) [C. A., 48, 9962 (1954)].
899. Welch, J. Chem. Soc., 1930, 257.
900. Kotak e, Sakan, Miwa, J. Am. Chem. Soc., 72, 5085 (1950).
901. Romeo, Corrodi, Hardegger, Helv. Chim. Acta, 38, 463 (1955).
902. Phalnikar, J. Univ. Bombay, 19, Sect. A, Part 3, Sci. Ns 28, 62
(1950) (C. A., 47, 1606 (1953)].
903 Aoki, J. Pharm. Soc. Japan, 66, 51 (1946) [C. A., 45, 6173 (1951)].
904. R u h e m a n n, Browning, J. Chem. Soc., 73, 727 (1898).
905. Ghosh, J. Indian Chem. Soc., 24, 45 (1947).
906. Staudinger, Ann., 341, 99 (1905).
907. Ruhemann, Cunnington, J. Chem. Soc., 73, 1006 (1898).
908. Challenger, Fishwick, J. Inst. Petroleum, 39, 220 (1953) [C. A.,
48, 9355 (1954)].
909. M a I a ch о w s к i, Bilbel, Bilinski-Tarasowicz, Ber., 69, 1295
(1936).
910. Henze. Ber., 33, 966 (1900).
911. Ruhemann, J. Chem. Soc., 71, 325 (1897).
912. R u hem a n n, Stapleton, J. Chem. Soc., 77, 804 (1900).
913. Ruhemann, Tyler, J. Chem. Soc., 69, 530 (1896).
914. Woodward, Reed, J. Am. Chem. Soc., 65, 1569 (1943).
915. Perkin, Jr., J. Chem. Soc., 69, 1472 (1896).
916. Ray, J. Am. Chem. Soc., 50, 558 (1928).
917. Blaise, Compt. rend., 136, 243 (1903).
918. Blaise, Luttringer, Bull. soc. chim. France, [3] 33, 760 (1905).
919. Kohler, Reid, J. Am. Chem. Soc., 47, 2803 (1925).
920. Leonard, Shoemaker, J. Am. Chem. Soc., 71, 1876 (1949).
921. Komnenos, Ann., 218, 145 (1883).
922. Koetz, Stalmann, J. prakt. Chem., [2] 68, 156 (1903).
923. Knoevenagel, Ber., 31, 2585 (1898).
924. Gupta, J. Chem. Soc., 119, 298 (1921).
925. Day, Thorpe, J. Chem. Soc., 117, 1469 (1920).
926. Diels, Gaertner, Kaack, Ber., 55, 3439 (1922).
927. Sonn, Ber., 61, 2479 (1928).
928. Robinson, Thompson, J. Chem. Soc., 1938, 2009
929. Farmer, J. Chem. Soc., 123, 3324 (1923).
930, Koetz, J. prakt. Chem., [2] 75, 433 (1907).
550
Литература
931. Gai nd, Guha, J. Indian Chem. Soc., 11, 421 (1934).
932. Cl emo, Welch, J. Chem. Soc., 1928, 2621.
933. Kerr, J. Am. Chem. Soc., 51, 614 (1929).
934. Mayuranathan, Guha, J. Indian Inst. Sci., 15A, 131 (1932) [C. A.,
27, 3211 (1933)].
935. Komppa, Ber., 33, 3530 (1900).
936. Brown, Gulick, J. Am. Chem. Soc., 77, 1083 (1955).
937. Захаркин, Преображенский, ЖОХ, 22, 1890 (1952).
938. Б айнов а, Евстигнеева, Лившиц, Кузьмина, Преобра-
женский, ЖОХ, 23, 149 (1953).
939. Curtis, Day, Kimmins, J. Chem. Soc., 123, 3131 (1923).
940. Ingold, Shoppee, J. Chem. Soc., 1926, 1912.
941. Ingold, Shoppee, Thorpe, J. Chem. Soc., 1926, 1477.
942. Arnold, Amidon, Dodson, J. Am. Chem. Soc., 72, 2871 (1950),
943. Bertram, Ber., 36, 3291 (1903).
941. R a n g a n a th a n. Current Sci. India, 9, 276 (1940) [C, A., 34, 7861
(1940)].
945. Ingold, Perren, J. Chem. Soc., 119, 1582 (1921).
946. Henrich, Ber., 35, 1663 (1902).
947. Knoevenagel, герм. пат. 156560 [Chem. Zentr., 1905, I, 56].
948. Ruhemann, Cunnington, J. Chem. Soc., 75, 778 (1899).
949. Traube, Ber., 40, 4942 (1907).
950. Malachowski, Czornodola, Ber., 68, 363 (1935).
951. Ingold, Perren, J. Chem. Soc., 121, 1414 (1922).
952. Claisen, Ann., 297, 1 (1897), особенно стр. 88.
953. Boekelheide, Lodge, Jr., J. Am. Chem. Soc., 73, 3681 (1951)
954. Boekelheide, Gall, J. Org. Chem., 19, 499 (1954).
955. Kohler, Butler, J. Am. Chem. Soc., 48, 1036 (1926).
956. Farmer, Healey, J. Chem. Soc., 1927, 1065.
957. Farmer, Mehta, J. Chem. Soc., 1930, 1610.
958. Vorlaender, Weissheimer, Sponnagel, Ann., 345’, 227 (1906).
959. Cairns, Engelhardt, Jackson, Kalb, Sauer, J. Am. Chem.
Soc., 74, 5636 (1952).
960. Farmer, Martin, J. Chem. Soc., 1933, 1960.
961. Blood, Cartwright, Linstead, J. Chem. Soc., 1952, 2268.
962. Farmer, Mehta, J. Chem. Soc., 1931, 1762.
963. Campbell, Rydon, J. Chem. Soc., 1953, 3002.
964. Bardhan, Banerji, J. Chem. Soc., 1935, 474.
965. Sircar, J. Chem. Soc., 1927, 1252.
966. К on, Nanji, J. Chem. Soc., 1932, 2426.
967. Pre log, Metzler, Helv. Chim. Acta, 29, 1170 (1946).
968. Helfer, Helv. Chim. Acta, 9, 814 (1926).
969. Bhattacharyya, J. Indian Chem. Soc., 22, 85 (1945).
970. Chatterjee, J. Indian Chem. Soc., 14, 417 (1937).
971. Sen, Bose, J. Indian Chem. Soc., 4, 51 (1927).
972, Bardhan, Banerji, J. Chem. Soc., 1935, 476.
Литература
551
973. Vogel, J. Chem. Soc., 1931, 907.
974. Rao, J. Chem. Soc., 1929, 1954.
975. Reich st ein, Zschokke, Gehring, Ron a, Helv. Chim. Acta,
15, 1118 (1932).
976. Рубцов, Михлина, ДАН СССР, 88, 1003 (1953).
977. Herrmann, Vorlaender, Abhandl. naturforsch. Ges. Halle, 21, 251
(1899).
978. Stobbe, Ann., 315, 219 (1901).
979. Desai, J. Chem. Soc., 1932, 1079.
980. Barr, Cook, J. Chem. Soc., 1945, 438.
981. Erlenmeyer, Jr., Ber., 33, 2006 (1900).
982. Helmkamp, Tanghe, Plati, J. Am. Chem. Soc., 62, 3215 (1940).
983. Stobbe, Ber., 34, 653 (1901).
984. Lawson, Perkin, Jr., Robinson, J. Chem. Soc., 125, 626 (1924).
985. Chase, Walker, J. Chem. Soc., 1953, 3548.
986. Vorlaender, Strunck, Ann., 345, 233 (1906).
987. Meerwein et al., J. prakt. Chem., [2] 116, 229 (1927).
• 988. Vachon, Gagnon, Kane, Can. J. Research, 11, 644 (1934) [C. A., 29,
1087 (1935)].
989. Kohler, Darling, J. Am. Chem. Soc., 52, 1174 (1930).
990. Gravel, Naturaliste can., 57, 181 (1931) [C. A., 28, 169 (1934)].
991. Bredt, Ber., 24, 603 (1891).
992. Knoevenagel, Fries, Ber., 31, 761 (1898).
993. Knoevenagel, Brunswig, Ber., 35, 2177 (1902).
994. Kroeker, McElvain, J. Am. Chem. Soc., 56, 1171 (1934).
995. Kohler, Barrett, J. Am. Chem. Soc., 48, 1773 (1926).
996. Kohler, Darling, J. Am. Chem. Soc., 52, 424 (1930).
997. Papadakis, J. Am. Chem. Soc., 67, 1799 (1945).
998. Papadakis, Scigliano, Chin, Adrian, J. Am. Chem. Soc., 72,
4256 (1950).
999. Pa lit, J. Indian Chem. Soc., 14, 219 (1937).
1000. Rabe, Ber., 31, 1896 (1898).
1001. Meerwein, Ann., 360, 323 (1908).
1002. Newman, Joshel, J. Am. Chem. Soc., 60, 485 (1938).
1003. Koelsch, пат. США 2507473 [С. A., 44, 7883 (1950)].
1004. Koelsch, J. Am. Chem. Soc., 67, 569 (1945).
1005. Emery, J. prakt. Chem., [2] 53, 308 (1896).
1006. H eneck a, Chem. Ber., 82, 36 (1949).
1007. Isler, Gutmann, Straub, Fust, Bohni, Studer, Helv. Chim.
Acta, 38, 1033 (1955).
1008. Mumm, Hueneke, Ber., 50, 1568.(1917).
1009. Mumm, Hueneke, Ber., 51, 150 (1918).
1010. Tracy, Elderfield, J. Org. Chem., 6, 70 (1941).
1011. Horning, Denekas, Field, J. Org. Chem., 9, 547 (1944).
1012. Rabe, El ze, Ann., 323, 83 (1902).
1013, West, J. Biol. Chem., 66, 63 (1923),
552
Литература
1014. Ра stour, Compt. rend., 237, 1094 (1935).
1015. Gruber, Schloegl, Monatsh., 81, 83 (1950).
1016. Назаров, Завьялов, Изв. АН СССР, ОХН, 1952, 703.
1017. Wallach, Ann., 323, 135 (1902).
1018. Мег 11 ng, Ber., 38, 979 (1905).
1019. Merlin g, We Ide, Ann., 366, 119 (1909).
1020. Jeger, Buechi, Helv. Chim. Acta, 31, 134 (1948). 1021. Knoevenagel, Ann., 288, 323 (1895).
1022. Mukherji, Science and Culture India, 8, 190 (1942) [C. A., 37, 1994
(1943)].
1023. Knoevenagel, Ann., 281, 25 (1894).
1024. С о r n u b e r t, Borrel, de Demo, Garnier, Humeau, Le
Bi han, Sarkis, Bull. soc. chim. France, [5] 2, 195 (1935).
1025. Knoevenagel, Ann., 303, 223 (1898).
1026. Schilling, Vorlaender, Ann., 308, 184 (1899).
1027. Dyer, Kidd, Walker, J. Chem. Soc., 1952, 4778.
1028. Knoevenagel, J. prakt. Chem., [2] 97, 288 (1918).
1029. Bachmann, Fujimoto, Raunio, J. Am. Chem. Soc., 72, 2533
(1950).
1030. Simonsen, J. Chem. Soc., 97, 1910 (1910).
1031. Urech, Tagman n, Sury, Hoffmann, Helv. Chim. Acta, 36, 1809
(1953).
1032. Feist, Ann., 345, 100 (1906).
1033. Feist, Ann., 345, 60 (1906).
1034. Milas, пат. США 2369158 [С. A., 39, 5044 (1945)].
1035. Milas, пат. США 2432921 [С. А., 42, 2278 (1948)].
1036. Thorpe, Wood, J. Chem. Soc., 103, 1569 (1913),
1037. Feist, Ann., 428, 25 (1922).
1038. Feist, Ann., 428, 40 (1922).
1039. Haerdi, Thorpe, J. Chem. Soc., 127, 1237 (1925).
1040. Ruhemann, J. Chem. Soc., 97, 457 (1910).
1041. Ruhemann, Ber., 53, 287 (1920).
1042. Walker, J. Am. Chem. Soc., 76, 309 (1954).
1043. Ruhemann, Stapleton, J. Chem. Soc., 77, 239 (1900).
1044. Grob, Camenisch, Helv. Chim. Acta, 36, 49 (1953).
1045. Lambert, Piggott, J. Chem. Soc., 1947, 1489.
1046. Hale, Robertson, Am. Chem. J., 39, 685 (1908). Cp. Hale, Ber.,
45, 1600 (1912).
1047. Fanta, Stein, J. Am. Chem. Soc., 77, 1045 (1955).
1048. В ah пег, пат. США 2425276 [С. А., 41, 7410 (1947)].
1049. Bahr.er, пат. США 2426158, [С. А., 41, 7410 (1947)].
1050. В ah пег, пат. США 2447626 [С. А., 42, 8819 (1948)].
1051. В ah пег, пат. США 2431451 [С. А., 42, 2615 (1948)].
1052. Snyder, Hamlin, J. Am. Chem. Soc., 72, 5082 (1950).
1053. Bourland J. F., Диссертация, Университет Пардью, 1941; Hass,
Riley, Chem, Revs., 32, 414 (1943),
Литература
553
1054. Shechter, Conrad, J. Am. Chem. Soc., 76, 2716 (1954).
1055. Dornow, Wiehler, Ann., 578, 113 (1952).
1056. Перекалив, Сопова, ЖОХ, 24, 513 (1954); ДАН СССР, 95, 993
(1954).
1057. Dornow, Menzel, Ann., 588, 40 (1954).
1058. Heim, Ber., 44, 2016 (1911).
1059. Smith, Kelly, J Am. Chem. Soc., 74, 3300 (1952).
1060. Smith, Davis, J. Am. Chem. Soc., 76, 5376 (1954).
1061. В u c k 1 e y, Charlish, Rose, J. Chem. Soc., 1947, 1514.
1062. Smith, Davis, J. Org. Chem., 15, 824 (1950).
1063. Kohler, Potter, J. Am. Chem. Soc., 57, 1316 (1935).
1064. Backer, Rec. trav. chim., 72, 119 (1953).
1065. Doering, Weil, J. Am. Chem. Soc., 69, 2461 (1947).
1066. Boekelheide, Rothchild, J. Am. Chem. Soc., 71, 879 (1949).
1067. Winterfeld, Heinen, Ann., 573, 85 (1951); 578, 171 (1952).
1068. Boekelheide, Rothchild, J. Am. Chem. Soc., 69, 3149 (1947).
1069. Wilt, Levine, J. Am. Chem. Soc., 75, 1368 (1953).
1070. Winterfeld, Wald, Rink, Ann., 588, 125 (1954).
1071. Winterfeld, Wald, Rink, Naturwiss., 41, 230 (1954) [C. A., 49,
14759 (1955)].
1072. Boekelheide, Mason, J. Am. Chem. Soc., 73, 2356 (1951).
1073. Clifford, пат. США 2579419 [С. A., 46, 7593 (1952)].
1074. Boekelheide, Marinetti, J. Am. Chem. Soc., 73, 4015 (1951),
1075. Boekelheide, Sieg, J. Org. Chem., 19, 587 (1954),
1076. Пудовик, Гришина, ЖОХ, 23, 267 (1953).
СОДЕРЖАНИЕ
Or редакции...........................................• ... 5
I. СОЧЕТАНИЕ СОЛЕЙ ДИАЗОНИЯ С СОЕДИНЕНИЯМИ
АЛИФАТИЧЕСКОГО РЯДА
Введение..................•....................•.............. 7
Механизм реакции.............................................. 8
Область применения реакции.................................... 11
Кетоны..................................................... 11
Р-Кетокислоты, сложные эфиры и амиды...................... 13
Малоновые кислоты, нх эфиры и амиды....................... 16
Арилуксусные кислоты и их эфиры........................... 18
Нитрилы................................................. 19
Сульфоны................................................... 21
Нитросоединения ........................................... 22
Углеводороды............................................... 23
Гидразоны................................................. 26
Гетероциклические соединения............................... 28
Применение в синтезах......................................... 29
Циннолины.................................................. 29
Индазолы................................................... 30
Соли тетразолия............................................ 31
Тиокарбазоны............................................... 31
Амидразоны................................................ 32
Амины...................................................... 32
Экспериментальные условия..................................... 32
Соли диазония.............................................. 32
Растворители •............................................. 33
pH среды .................................................. 33
Соотношения реагентов..................................... 34
Продолжительность реакции.................................. 34
Препаративные синтезы......................................... 34
Таблицы по реакциям сочетания солей диазония с соединениями алифа-
тического ряда............................................. 37
Литература ..................................................135
II. РЕАКЦИЯ ЯППА — КЛИНГЕМАНА
Введение......................................................148
Механизм реакции . . , , ............. . . . ........... 149
Содержание
555
Область применения реакции.........................................
Экспериментальные условия..........................................
Препаративные синтезы..........................................162
Таблицы по реакции Яппа — Клингемана...............................
Литература ........................................................
III. РЕАКЦИЯ МИХАЭЛЯ
Введение-......................................................181
Механизмы процессов, протекающих при реакции Михаэля...........182
Нормальная реакция..........................................182
Природа аннона аддукта .................................... 184
Конкурирующая побочная реакция..............................186
Обратная реакция............................................186
«Аномальная» конденсация Михаэля............................191
Промежуточные соединения с мостиком в пара-положении .... 197
Стереохимия конденсации Михаэля.............................200
Область применения реакции.....................................203
Доноры......................................................203
Реакции с производными циклопропана.........................205
Система С=С—C=N.............................................206
Акцепторы...................................................209
Системы, не вступающие в реакцию конденсации................242
Применение в синтезах..........................................244
Синтез циклических систем...................................244
Синтез аминокислот..........................................260
Экспериментальные условия......................................260
Препаративные синтезы..........................................263
Таблицы соединений, полученных по реакции конденсации Михаэля . . 267
Литература.....................................................527
Стр. Строка Напечатано Должно быть
80 4 сн. (З-л-Ннтрофенил-1,2, 4-оксадиа- золил-5)ацетонитрил 4-Диэтиламино 4-Диэтиламино (З-м-Нитрофенил-1,2,4-оксадиа- золил-5)ацетонитрил 4-Днэтиламино 4-Диэгиламино
96 9 сн. -Пнколнн а-Пиколин
297 13 сн. 1-Фенпл-2-метилбутен-3-он-1 и 1-Фенил-2-метилбутен-2-он-1 и
349 1 св. 1 >-СН3 О- YVCH3
СНз\ А / снИ | \/ с :оос2н5 СН ' СНз\/\/| СНз/^J соос2н5
403 5 сн. 2-(Никлогексен-1- ил)1 [C6H5CH2N (CH3)3J ОН; КОН циклогексанон | 2-(Циклогексен-1-ил)цик- 1 [C6HSCH2N (СН3)3] ОН логексанон |